Канцероматоз большого сальника: HIPEC. Годы жизни вместо месяцев при злокачественных опухолях брюшной полости / Хабр
НМИЦ онкологии им. Н.Н. Блохина
Вот уже почти 70 лет Онкоцентр – это уникальный симбиоз науки и клинической практики, мультидисциплинарный подход к лечению онкологических больных, хирургическая школа, известная далеко за пределами России. Здесь изучаются и совершенствуются морфологические, иммунологические и генетические методы диагностики.Специалисты Блохина – авторы клинических рекомендаций по онкологии.
Ежегодно в Онкоцентре противоопухолевое лечение проходят более 35 тысяч пациентов всех возрастов. Еще почти 6 000 граждан России получают помощь дистанционно – посредством телемедицинских консультаций.
Онкоцентр – это:
- Комбинированное лечение пациентов
- Собственное производство химио- и радиофармацевтических препаратов
- Собственные методы иммунотерапии опухолей
- Передовые технологии реабилитации онкопациентов
- «Центры компетенций» по различным нозологиям, в том числе первый в России центр компетенций по лечению пациентов с опухолями без выявленного первичного очага
- Собственное отделение переливания крови, доноры которого снабжают кровью и ее компонентами исключительно пациентов Онкоцентра
- Первый и единственный онкологический центр, имеющий в своем составе специализированное отделение реабилитации для онкопациентов
- Крупнейшая педагогическая школа в области онкологии в России
На протяжении многих лет Онкоцентр является членом Международного Противоракового Союза (UICC) при Всемирной организации здравоохранения (ВОЗ) и членом Ассоциации Европейских Онкологических Институтов (OECI) в Женеве.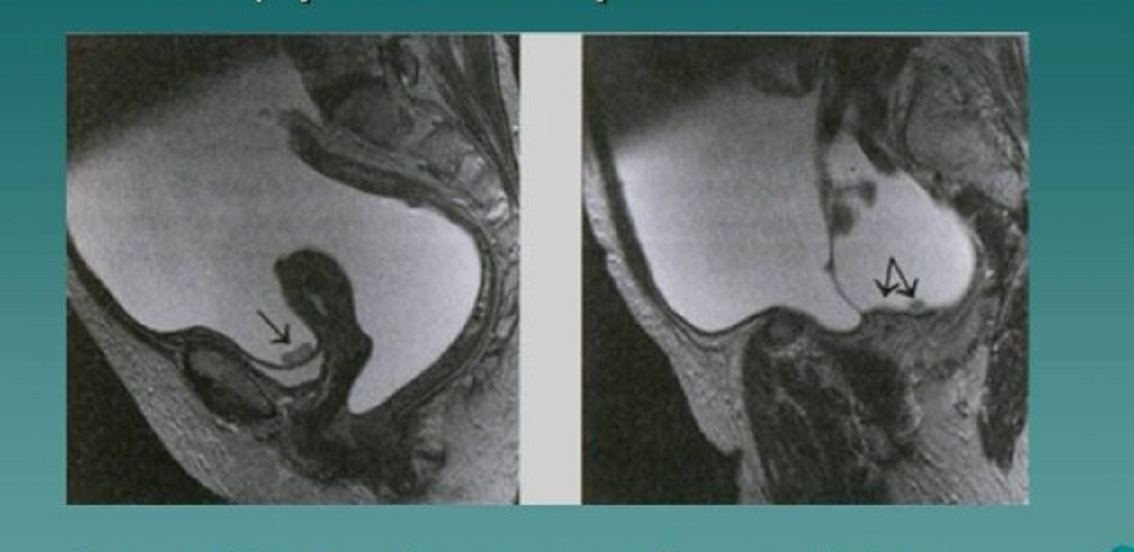
В 2019 году НИИ детской онкологии и гематологии НМИЦ онкологии им. Н.Н. Блохина стал полноправным членом ведущей мировой организации, которая объединяет трансплантационные центры Европы и мира — Европейской группы по трансплантации крови и костного мозга (EBMT).
НМИЦ онкологии им. Н.Н. Блохина:
- Онкологическая помощь мирового уровня, доступная каждому
- Инновации в онкологии
- Уникальный опыт для коллег
причины, симптомы, диагностика, лечение, профилактика
Представляет собой вторичное злокачественное поражение брюшины, возникающее в следствие диссеминации эпителиальных опухолей желудочно-кишечного тракта, репродуктивной системы, реже – первичных перитонеальных новообразований.
ПричиныКанцероматоз брюшины представляет собой вторичное опухолевое поражение, которое возникает на фоне прогрессирования рака различной локализации. Чаще всегопоражение брюшины осложняется раком желудка, тонкого кишечника, поджелудочной железы, злокачественной опухолью яичников, матки, маточных труб, печеночноклеточного рака, реже – первичной опухоли брюшины. Иногда первичный очаг остается неустановленным.
Иногда первичный очаг остается неустановленным.
Развитие канцероматоза брюшины – это поэтапный процесс. Первый этап, характеризуется распространением опухолевых клеток из первичного очага поражения, что связано с нарушением межклеточного взаимодействия и приобретением клетками опухоли подвижности. При этом эпителиальные клетки изменяют фенотип на мезенхимальный, что сопровождается деградацией межклеточного матрикса. Распространение опухолевых клеток может возникать в процессе хирургического вмешательства. Их механическое отделение может возникать при повреждении лимфатических или кровеносных сосудов. Проникшие в брюшную полость клетки опухоли мигрируют под действием силы тяжести, сокращений внутренних органов и имплантируются в места повышенной резорбции, например, большом сальнике, в области слепой кишки, дугласовых карманах.
На следующей стадии опухолевые клетки взаимодействуют с мезотелием брюшины. Механизмы адгезии определяются природой клеток, особенностями морфологии брюшины, а также наличием областей ее повреждения.
Канцероматоз брюшины – это вторичное поражение, в связи с этим его клиническая картина во многом определяется проявлениями первичной опухоли. Типичным симптомом данной патологии считается выраженный выпот в брюшную полость, что приводит к развитию асцита. В большинстве случаев асцитический синдром, возникает на фоне обструкции лимфатического дренажа и может являться единственным симптомом заболевания, в связи с этим такие больные поступают в медицинское учреждение для определения причин асцита. У таких больных определяется тяжелое состояние, характерна значительная потеря веса. Неспецифическими признаками патологии являются тошнота, рвота, выраженная слабость, утомляемость. При наличии крупных метастазов их можно прощупать через брюшную стенку.
У таких больных определяется тяжелое состояние, характерна значительная потеря веса. Неспецифическими признаками патологии являются тошнота, рвота, выраженная слабость, утомляемость. При наличии крупных метастазов их можно прощупать через брюшную стенку.
Канцероматоз брюшины характеризуется развитием неспецифической клинической картины, однако специалист может предположить наличие патологии на основании симптомов и физикальных данных. Лабораторные анализы малоинформативны. Диагностическая программа включает ультразвуковое обследование органов брюшной полости и малого таза, которые позволяют обнаружить распространенное поражение. Также больным назначается цитологическое исследование асцитической жидкости. При необходимости больному может быть назначена лапароскопия с осмотром перитонеума, дугласова пространства, диафрагмы, с обязательным проведение биопсии.
ЛечениеХирургическое лечение канцероматоза основывается на удалении первичной опухоли с регионарными метастазами и отсевами по брюшине. Циторедуктивная операция выполняется в объеме перитонэктомии и может сочетаться с удалением матки и придатков, сигмовидной кишки, желчного пузыря. После хирургического удаления опухоли больному назначается курс химиотерапии.
Циторедуктивная операция выполняется в объеме перитонэктомии и может сочетаться с удалением матки и придатков, сигмовидной кишки, желчного пузыря. После хирургического удаления опухоли больному назначается курс химиотерапии.
Не разработано профилактики данной формы поражения брюшины, в терапии заболевания важную роль играет своевременность выявления и назначение адекватного лечения первичных опухолей.
Лечение рака яичников — Онкогинекология
Симптомы и диагностика рака яичников
Часть женщин отмечает появление периодических болей внизу живота разного характера, потерю аппетита и слабость.
Если процесс обнаруживается на ранней I стадии, то это, как правило, случайная находка, выявленная по данным УЗИ малого таза при обследовании, например, по поводу миомы матки.
Даже наличие в нашем арсенале опухолевых маркеров, таких как СА-125, НЕ – 4 не всегда помогает в диагностике опухолей яичников на ранних стадиях, так как последние не обладают 100% специфичностью.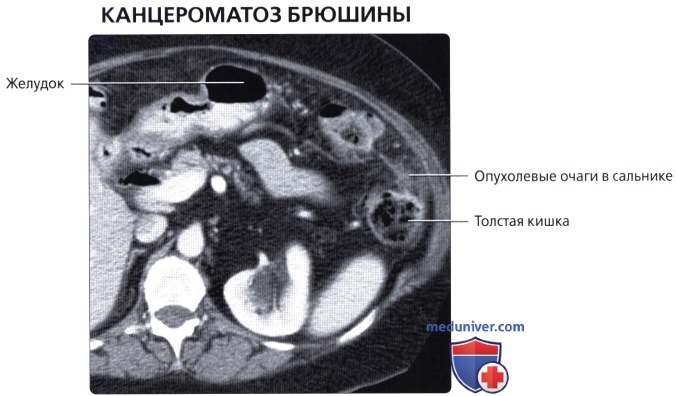
Большую роль в данной ситуации играет магнито-резонансная томография (МРТ) малого таза — метод, который позволяет достаточно точно описать изменения, происходящие в малом тазу с целью стадирования процесса, и помогающий врачу правильно спланировать дальнейшую тактику лечения. В настоящее время при стадировании опухолевого процесса помогает диагностическая лапароскопия, а выполняемая при этом исследовании биопсия новообразования дает понимание о гистотипе имеющейся опухоли. Это очень важно для планирования полихимиотерапии в адъювантном или неоадъювантном режиме.
Операция по удалению рака яичников
Несомненно, основным методом лечения больных раком яичников является хирургический. Так в отношении злокачественных опухолей яичников объем оперативного вмешательства должен быть наиболее полный и включает в себя удаление матки с маточными трубами и яичниками с двух сторон в сочетании с резекцией большого сальника, который является первым этапом метастазирования опухоли.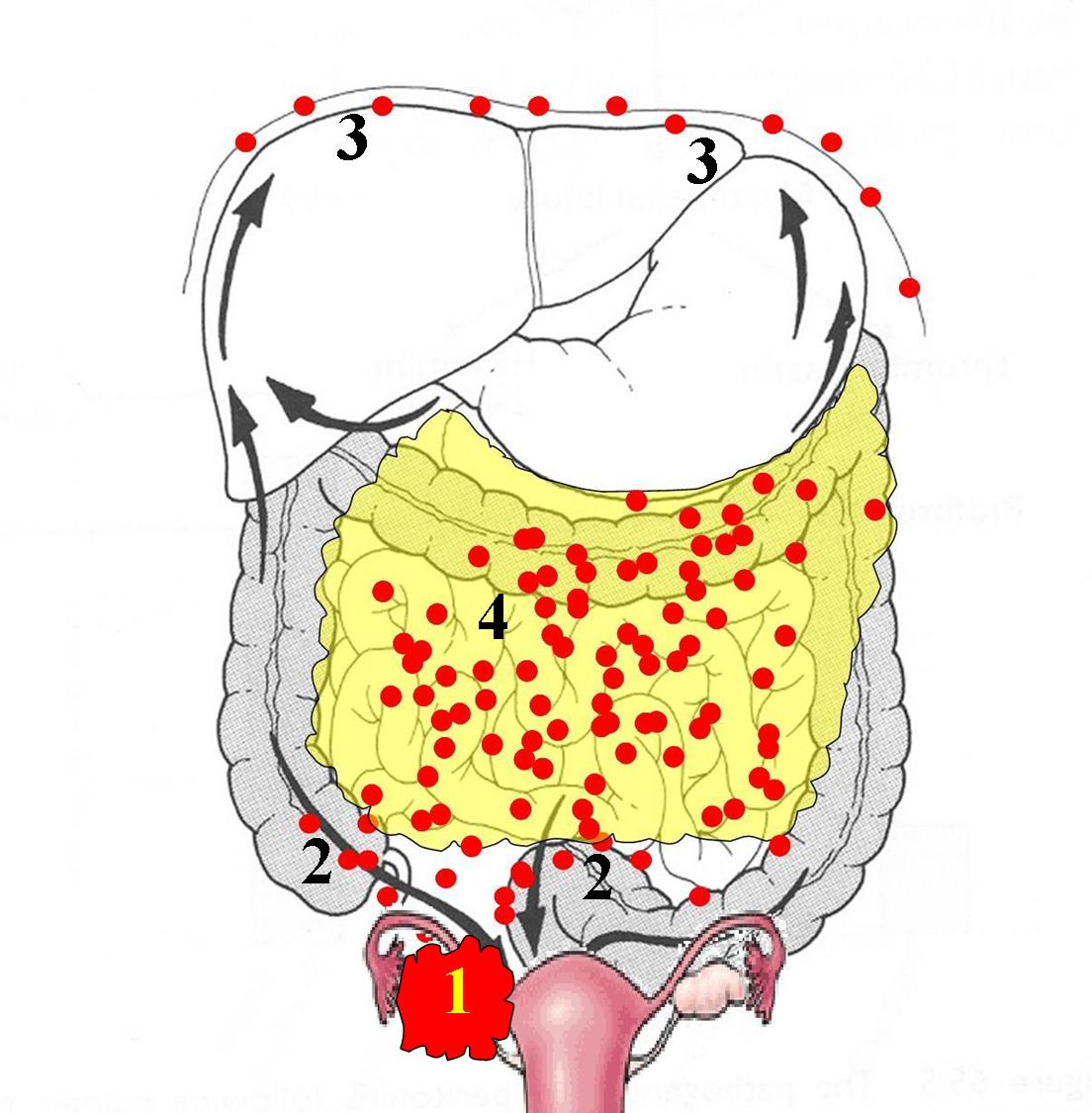
Операция может быть проведена как посредством чревосечения (лапаротомии), так и из лапароскопического доступа, если этого позволяет небольшая распространенность процесса и незначительные размеры опухоли. В последнем случае это важно, так как при лапароскопическом доступе препарат должен быть удален через влагалище единым блоком без кускования.
При проведении лапароскопии представляется возможность тщательно осмотреть всю брюшную полость и малый таз, висцеральную и париетальную брюшину под многократным увеличением на предмет микрометастазов как проявления канцероматоза. Это одно из важных преимуществ лапароскопического доступа, которое позволяет правильно осуществить стадирование процесса и определиться с объемом операции при необходимости проведения органосохраняющего лечения у пациенток молодого возраста с нереализованной репродуктивной функцией.
Лечение рака яичников проводится комплексно, при условии последующего химиотерапевтического лечения.
При выявлении у больной распространенного опухолевого процесса при выполнении диагностической лапароскопии, производится биопсия опухоли с последующим назначением адекватной предоперационной полихимиотерапии с учетом гистотипа, с целью уменьшения объема опухолевых масс и достижения частичного регресса или отграничения опухоли.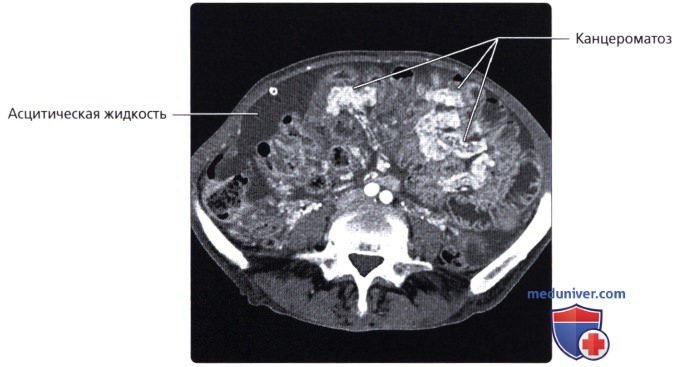 Что позволит в дальнейшем создать условия для проведения радикального оперативного лечения. Кроме того лапароскопия может быть использована в дальнейшем как операция «second-look» для контроля за состоянием клинической ремиссии после комбинированного лечения.
Что позволит в дальнейшем создать условия для проведения радикального оперативного лечения. Кроме того лапароскопия может быть использована в дальнейшем как операция «second-look» для контроля за состоянием клинической ремиссии после комбинированного лечения.
По сравнению с чревосечением, лапароскопия является куда более щадящей для больной. Таким образом, лапароскопический доступ может быть успешно использован на всех этапах обследования и лечения больных раком яичников как для диагностики, так и для лечения.
Вместе с тем нельзя забывать и о важности традиционного доступа (лапаротомии) позволяющего удалить опухолевые массы большого объема, особенно при проведении циторедуктивных операций, когда проведение радикального хирургического лечения не представляется возможным из-за выраженного распространения опухолевого процесса.
Опухоли брюшины — причины, симптомы, диагностика и лечение, прогноз
Различают три основные группы новообразований брюшины:
- Доброкачественные опухоли брюшины (ангиомы, нейрофибромы, фибромы, липомы, лимфангиомы)
- Первичные злокачественные опухоли брюшины (мезотелиомы)
- Вторичные злокачественные опухоли брюшины, возникающие при распространении злокачественных клеток из другого органа.

Существуют также слизеобразующие новообразования (псевдомиксомы), которые одни исследователи рассматривают, как первичные, а другие – как вторичные опухоли брюшины различной степени злокачественности. В большинстве случаев вторичное поражение брюшины развивается в результате агрессивного местного роста новообразований и имплантационного распространения раковых клеток из органов, расположенных интраперитонеально, мезоперитонеально или экстраперитонеально.
Опухоли брюшины, возникшие в результате имплантационного метастазирования, могут выявляться при раке желудка, тонкого и толстого кишечника, печени, поджелудочной железы, желчного пузыря, почки, тела матки, шейки матки, яичников, предстательной железы, передней брюшной стенки и т. д. Реже наблюдается лимфогенное распространение метастазов опухолей грудной клетки (например, рака легких), обусловленное ретроградным движением лимфы по лимфатическим путям.
Доброкачественные опухоли брюшины
Являются очень редкой патологией. Причины развития неизвестны. Болезнь может годами протекать бессимптомно. В отдельных случаях опухоли брюшины достигают огромных размеров, не оказывая существенного влияния на состояние пациента. В литературе описан случай удаления липомы сальника весом 22 килограмма. При крупных узлах выявляется увеличение живота. Иногда доброкачественные опухоли брюшины становятся причиной сдавления близлежащих органов. Боли нехарактерны. Асцит возникает исключительно редко. Диагноз устанавливается по результатам лапароскопии. Показанием к операции является компрессионное воздействие новообразования на соседние органы.
Причины развития неизвестны. Болезнь может годами протекать бессимптомно. В отдельных случаях опухоли брюшины достигают огромных размеров, не оказывая существенного влияния на состояние пациента. В литературе описан случай удаления липомы сальника весом 22 килограмма. При крупных узлах выявляется увеличение живота. Иногда доброкачественные опухоли брюшины становятся причиной сдавления близлежащих органов. Боли нехарактерны. Асцит возникает исключительно редко. Диагноз устанавливается по результатам лапароскопии. Показанием к операции является компрессионное воздействие новообразования на соседние органы.
Первичные злокачественные опухоли брюшины
Мезотелиомы брюшины встречаются редко. Обычно обнаруживаются у мужчин старше 50 лет. Фактором риска является длительный контакт с асбестом. Проявляются болевым синдромом, снижением массы тела и симптомами сдавления близлежащих органов. При достаточно крупных опухолях брюшины может выявляться асимметричное выпячивание в области живота. При пальпации обнаруживаются одиночные или множественные опухолевидные образования различного размера.
При пальпации обнаруживаются одиночные или множественные опухолевидные образования различного размера.
Характерно быстрое прогрессирование симптоматики. При сдавлении воротной вены развивается асцит. Из-за отсутствия специфических признаков диагностика злокачественных опухолей брюшины затруднительна. Нередко диагноз выставляется только после иссечения новообразования и последующего гистологического исследования удаленных тканей. Прогноз неблагоприятный. Радикальное удаление возможно только при ограниченных процессах. В остальных случаях пациенты с опухолями брюшины погибают от кахексии или от осложнений, обусловленных нарушением функций органов брюшной полости.
Псевдомиксома брюшины
Возникает при разрыве цистаденомы яичника, псевдомуцинозной кисты аппендикса или дивертикула кишечника. Слизеобразующие эпителиальные клетки распространяются по поверхности брюшины и начинают производить густую желеобразную жидкость, заполняющую брюшную полость..jpg) Обычно темпы развития этой опухоли брюшины соответствуют низкой степени злокачественности. Болезнь прогрессирует в течение нескольких лет. Желеобразная жидкость постепенно вызывает фиброзные изменения тканей. Наличие слизи и опухолевидного образования препятствует деятельности внутренних органов.
Обычно темпы развития этой опухоли брюшины соответствуют низкой степени злокачественности. Болезнь прогрессирует в течение нескольких лет. Желеобразная жидкость постепенно вызывает фиброзные изменения тканей. Наличие слизи и опухолевидного образования препятствует деятельности внутренних органов.
Реже выявляются опухоли брюшины высокой степени злокачественности, способные к лимфогенному и гематогенному метастазированию. При отсутствии лечения во всех случаях наступает летальный исход. Причиной гибели пациентов становятся кишечная непроходимость, истощение и другие осложнения. О наличии слизеобразующей опухоли брюшины свидетельствует увеличение размеров живота при снижении массы тела, нарушения пищеварения и желеобразные выделения из пупка.
Диагноз устанавливается на основании КТ, лапароскопии, гистологического и иммуногистохимического исследования. При злокачественных опухолях брюшины может использоваться позитронно-эмиссионная томография. При доброкачественном варианте болезни данное исследование неинформативно. Тактика лечения опухолей брюшины определяется индивидуально. В ряде случаев возможно хирургическое иссечение пораженных участков в сочетании с интраперитонеальной внутриполостной химиотерапией. При своевременном начале лечения прогноз достаточно благоприятный, особенно – при опухолях брюшины низкой степени злокачественности.
Тактика лечения опухолей брюшины определяется индивидуально. В ряде случаев возможно хирургическое иссечение пораженных участков в сочетании с интраперитонеальной внутриполостной химиотерапией. При своевременном начале лечения прогноз достаточно благоприятный, особенно – при опухолях брюшины низкой степени злокачественности.
Одиночные вторичные злокачественные опухоли брюшины
Поражение возникает при прорастании злокачественных опухолей, расположенных в органах, частично или полностью покрытых брюшиной. Появление опухолей брюшины сопровождается усилением болевого синдрома и ухудшением состояния больного. При пальпации живота могут выявляться опухолевидные образования. При распаде очага в полом органе (желудке, кишечнике) наблюдаются явления прободного перитонита. В отдельных случаях первичная опухоль одновременно прорастает стенку полого органа, листки брюшины и переднюю брюшную стенку. При распаде образовавшегося конгломерата возникает флегмона мягких тканей.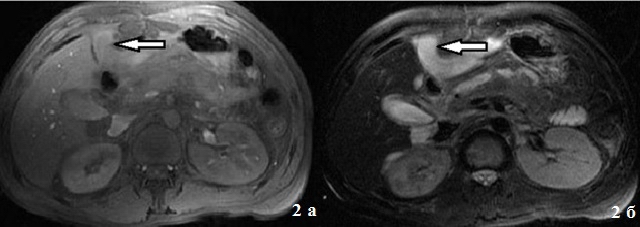
Опухоли брюшины диагностируются на основании анамнеза (имеется злокачественное новообразование органа, покрытого брюшиной), клинических проявлений, данных УЗИ брюшной полости и других исследований. При ограниченном процессе возможно радикальное иссечение первичной опухоли вместе с пораженным участком брюшины. При наличии отдаленных метастазов проводится симптоматическая терапия. Пациентам с опухолями брюшины назначают обезболивающие препараты, при накоплении жидкости в брюшной полости выполняют лапароцентез и т. д. Прогноз зависит от распространенности процесса.
Канцероматоз брюшины
Злокачественные клетки, попадающие в брюшную полость, быстро распространяются по брюшине и образуют множественные мелкие очаги. На момент постановки диагноза «рак желудка» канцероматоз брюшины выявляется у 30-40% пациентов. При раке яичников вторичные опухоли брюшины обнаруживаются у 70% больных. Патология сопровождается появлением обильного выпота в брюшной полости. Больные истощены, выявляются слабость, утомляемость, нарушения стула, тошнота и рвота. Крупные опухоли брюшины могут пальпироваться через брюшную стенку.
Больные истощены, выявляются слабость, утомляемость, нарушения стула, тошнота и рвота. Крупные опухоли брюшины могут пальпироваться через брюшную стенку.
Различают три степени канцероматоза: локальный (выявляется одна зона поражения), с поражением нескольких участков (очаги поражения чередуются с зонами неизмененной брюшины) и распространенный (обнаруживаются множественные вторичные опухоли брюшины). При недиагностированной первичной опухоли и множественных узлах брюшины клиническая диагностика в ряде случаев представляет затруднения из-за сходства с картиной туберкулезного перитонита. В пользу вторичных опухолей брюшины свидетельствует геморрагический характер выпота и быстрое повторное возникновение асцита после проведения лапароцентеза.
Диагноз устанавливается с учетом анамнеза, клинических проявлений, данных УЗИ органов брюшной полости, МСКТ брюшной полости с контрастированием, цитология асцитической жидкости, полученной при проведении лапароцентеза, и гистологического исследования образца ткани опухоли брюшины, взятого в ходе лапароскопии. В качестве дополнительной диагностической методики может применяться тест на онкомаркеры, позволяющий более точно определять прогноз, своевременно выявлять рецидивы и оценивать эффективность терапии.
В качестве дополнительной диагностической методики может применяться тест на онкомаркеры, позволяющий более точно определять прогноз, своевременно выявлять рецидивы и оценивать эффективность терапии.
При возможности полного удаления первичного новообразования и опухолей брюшины выполняют радикальные операции. В зависимости от локализации первичного очага осуществляют перитонэктомию в сочетании с колэктомией, резекцией желудка или гастрэктомией, пангистерэктомией и другими хирургическими вмешательствами. Из-за опасности обсеменения брюшной полости раковыми клетками и возможного наличия визуально неопределяемых опухолей брюшины в процессе операции или после ее окончания осуществляют интреперитонеальную гипертермическую химиотерапию. Процедура позволяет обеспечить мощное локальное воздействие на раковые клетки при минимальном токсическом действии химиопрепаратов на организм пациента.
Несмотря на использование новых методов лечения, прогноз при диссеминированных вторичных опухолях брюшины пока остается неблагоприятным.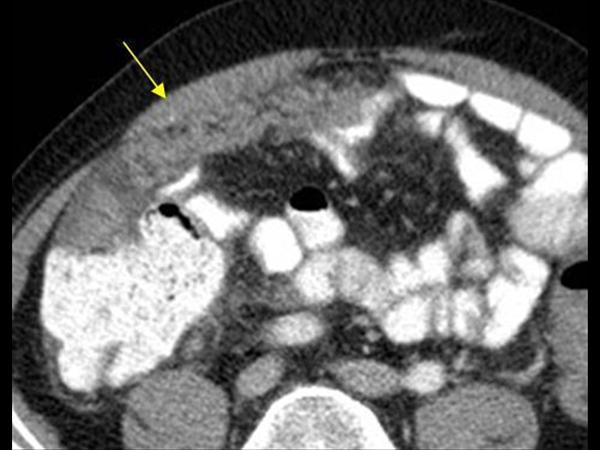 Канцероматоз является одной из основных причин гибели больных с онкологическими поражениями брюшной полости и малого таза. Средняя выживаемость больных с раком желудка в сочетании с опухолями брюшины составляет около 5 месяцев. Рецидивы после радикальных хирургических вмешательств по поводу вторичных новообразований брюшины возникают у 34% больных. Специалисты продолжают поиск новых, более эффективных методов лечения вторичных опухолей брюшины. Используются новые химиопрепараты, иммунохимиотерапия, радиоиммунотерапия, генная антисенс-терапия, фотодинамическая терапия и другие методики.
Канцероматоз является одной из основных причин гибели больных с онкологическими поражениями брюшной полости и малого таза. Средняя выживаемость больных с раком желудка в сочетании с опухолями брюшины составляет около 5 месяцев. Рецидивы после радикальных хирургических вмешательств по поводу вторичных новообразований брюшины возникают у 34% больных. Специалисты продолжают поиск новых, более эффективных методов лечения вторичных опухолей брюшины. Используются новые химиопрепараты, иммунохимиотерапия, радиоиммунотерапия, генная антисенс-терапия, фотодинамическая терапия и другие методики.
Способ ранней диагностики перитонеального рецидива рака яичников после оптимальных циторедуктивных операций
Изобретение относится к медицине, онкологии и может быть использовано для ранней диагностики перитонеального рецидива рака яичников после оптимальных циторедуктивных операций.В настоящее время существуют единичные источники информации, отражающие возможности ультразвуковой диагностики перитонеальной диссеминации, наблюдения в которых изложены фрагментарно и не отражают в полном объеме особенности перитонеальной диссеминации при ранней диагностики рецидивов рака яичников после оптимальных циторедуктивных операций.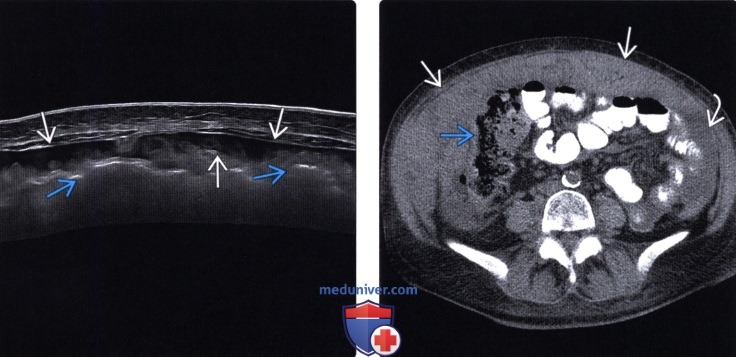
Несмотря на применение современных схем химиотерапии, объемов расширенных оперативных вмешательств рецидив рака яичников в течение 5 лет возникает у 60-70% больных [Журнал «Ультразвуковая и функциональная диагностика», №2, 2007, стр. 40-48. Чекалова М.А.].
Перитонеальный канцероматоз является одним из распространенных и труднодиагностируемых путей метастазирования рецидивов рака яичников. [Петровская Н.А. Перитонеальный канцероматоз: обзор клинических и экспериментальных данных. Онкологический журнал, 2009. — Т3. — №2. — С. 99-105]. Прогрессирование заболевания в 87,2% случаев имеет имплантационный путь метастазирования, а ложноотрицательные результаты обусловлены мелкоочаговым поражением брюшины при отсутствии свободной жидкости. В 50,6% превалируют метастазы только по брюшине малого таза. [Журнал «Ультразвуковая и функциональная диагностика», 2007 г., №2 стр. 40-48, Особенности ранней диагностики рецидивов рака яичников ультразвуковым методом. М.А. Чекалова, М.
Актуальной проблемой остается доступность различных методов диагностики в выявлении диссеминации по брюшине при рецидивах рака яичников из-за нарушения топографо-анатомических особенностей после оперативных вмешательств, особенно при минимальном скоплении свободной жидкости в брюшной полости и малом тазу, отсутствие алгоритмов ультразвуковой диагностики при раннем проявлении перитонеального канцероматоза. Недостаточно изучены топометрические, качественные и количественные динамические параметры при мониторинге перитонеальной диссеминации в процессе лечения, особенно после циторедуктивных операций в оптимальном объеме. Не существует определенных допплерографических критериев для диагностики перитонеального канцероматоза при рецидиве рака яичников, что в свою очередь затрудняет раннее его выявление и своевременное назначение противоопухолевой терапии.
В 30,9% случаев ультрасонография дает возможность обнаружить возврат болезни в доклинической стадии [Журнал «РОАГ, онкогинекология», №2, 2010 г. Ультразвуковая диагностика рецидивов рака яичников, Е.Л. Стецюк. Стр. 45-48].
Ультразвуковое исследование перитонеальной диссеминации представляет собой высокоэффективный метод диагностики у больных раком яичников [Журнал «Лучевая диагностика и терапия», №3 (4), 2013 г.].
В настоящее время разработана эхографическая классификация перитонеального канцероматоза при различных опухолевых патологиях, но в ней неполностью отражены топометрические, качественные и количественные показатели опухолевой гемодинамики перитонеальной диссеминации при рецидиве рака яичников [Журнал «Лучевая диагностика и терапия», №3 (4), 2013 г., стр. 66-70. Визуализация перитонеальной диссеминации при ультразвуковом исследовании. С.О. Степанов, Л.А. Митина, О.В. Гуц, П.Д. Беспалов]. Авторами предложены 5 эхо-типов канцероматоза брюшины.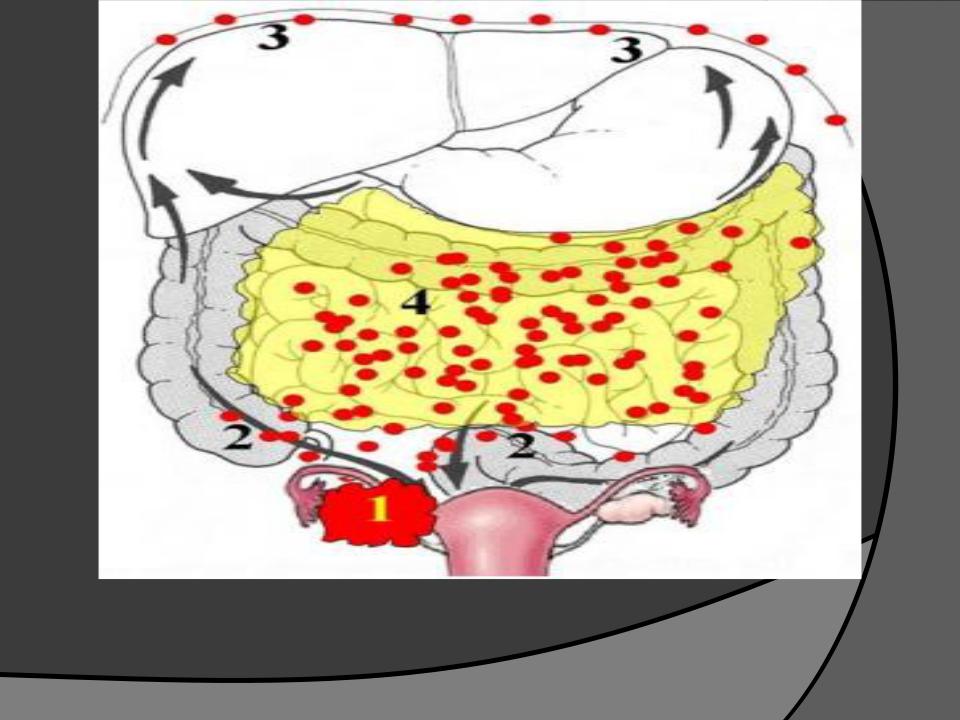 При раке яичников чаще всего перитонеальная диссеминация представлена отдельными узловыми образованиями на брюшине с четкими ровными контурами, гипоэхогенной или почти анэхогенной гетерогенной структуры, в то же время по данным некоторых авторов при рецидиве рак яичников может проявляться только в виде изолированной диссеминации [Журнал «Вопросы онкологии», №3, том 60, 2014, стр. 323-326. Н.С Бакланова, Л.А. Коломиец, И.Г. Фролова, Н.В. Вяткина, С.Э. Красильников].
При раке яичников чаще всего перитонеальная диссеминация представлена отдельными узловыми образованиями на брюшине с четкими ровными контурами, гипоэхогенной или почти анэхогенной гетерогенной структуры, в то же время по данным некоторых авторов при рецидиве рак яичников может проявляться только в виде изолированной диссеминации [Журнал «Вопросы онкологии», №3, том 60, 2014, стр. 323-326. Н.С Бакланова, Л.А. Коломиец, И.Г. Фролова, Н.В. Вяткина, С.Э. Красильников].
Наиболее близким к предлагаемому является «Способ ультразвуковой диагностики локальных рецидивов рака яичников » [Патент №2498773, опубликован 20.11.2013 г.], который заключается в том, что до и после проведения стандартной противоопухолевой химиотерапии проводят ультразвуковое исследование органов брюшной полости и забрюшинного пространства и малого таза по традиционной методике с тугим наполнением мочевого пузыря в В-режиме и при использовании допплеровского картирования выявляют: увеличение размеров рецидивных опухолей яичников, изменение сосудистой ангиоархитектоники по гиперинтенсивному, гиперваскулярному типу с увеличением количества опухолевых сосудов в контрольном допплеровском объеме при ЦДК и ЭДК, при этом состояние органов брюшной полости остается стабильным, либо выявляют признаки распространенности вторичных метастатических изменений: очаговое поражение паренхимы печени, асцит, метастатические изменения большого сальника, узлы в заднем своде или по брюшине, то идентифицируют отрицательную динамику или резистентность опухоли к проведению терапии. Если в результате проведенной стандартной противоопухолевой химиотерапии состояние органов брюшной полости и забрюшинного пространства не изменяются, размеры ангио-архитектоника резидуальной опухоли при ЦДК и ЭДК существенно не изменяются, то констатируют стабилизацию процесса. Положительную динамику и чувствительность локальных опухолей рака яичников к проводимой терапии индентифицируют при совокупности таких характеристик в динамики, как уменьшение размеров, либо полную регрессию локальных опухолей, изменение эхогенности опухоли от солидно-кистозных до кистозных или изоэхогенных, гиповаскуляризацию, либо деваскуляризацю опухолей при ЦДК и ЭДК, стабильный сонографический статус органов брюшной полости и забрюшинного пространства.
Если в результате проведенной стандартной противоопухолевой химиотерапии состояние органов брюшной полости и забрюшинного пространства не изменяются, размеры ангио-архитектоника резидуальной опухоли при ЦДК и ЭДК существенно не изменяются, то констатируют стабилизацию процесса. Положительную динамику и чувствительность локальных опухолей рака яичников к проводимой терапии индентифицируют при совокупности таких характеристик в динамики, как уменьшение размеров, либо полную регрессию локальных опухолей, изменение эхогенности опухоли от солидно-кистозных до кистозных или изоэхогенных, гиповаскуляризацию, либо деваскуляризацю опухолей при ЦДК и ЭДК, стабильный сонографический статус органов брюшной полости и забрюшинного пространства.
Недостатки данного способа заключаются в отсутствии показателей изменений эхо-структуры диссеминатов париетальной брюшины при рецидиве рака яичников, таких как васкуляризации, а именно о типах и интенсивности кровоснабжения. Не определены критерии раннего выявления изолированной перитонеальной диссеминации после оптимальных циторедуктинвых операций.
Новый технический результат — повышение точности способа.
Для достижения нового технического результата в способе ранней диагностики перитонеального рецидива рака яичников после оптимальных циторедуктивных операций, включающем комплексный динамический ультразвуковой мониторинг с использованием трансабдоминального и трансвагинального доступов, оценку топометрических и качественных гемодинамических параметров эхо-структуры, отличающийся тем, что проводят исследование на наличие диссеминатов париетальной брюшины с помощью высокочастотного линейного датчика и при толщине диссеминатов париетальной брюшины от 6,0 до 10,0 мм и более в виде равномерного утолщения или напластований гипоэхогенной структуры с высокой и средней степенью васкуляризации и смешанным типом кровоснабжения либо при наличии единичных гипоэхогенных овальных или округлых включений по париетальной брюшине размерами от 3,5-8,0 мм и более аваскулярных или с наличием единичных локусов кровотока и периферическим или центральным типами кровоснабжения, наличии допплеровской кривой при триплексном сканировании диагностируют ранний рецидив рака яичников в виде перитонеальной диссеминации, исследование осуществляют ежемесячно в первый год после первичного специализированного лечения. Также трансабдоминальное исследование проводят в положении стоя и лежа на спине при форсированном брюшном дыхании и с его задержкой. Также трансабдоминальное исследование проводят в положении лежа на спине при форсированном брюшном дыхании и с его задержкой с наружной абдоминальной пальпацией.
Также трансабдоминальное исследование проводят в положении стоя и лежа на спине при форсированном брюшном дыхании и с его задержкой. Также трансабдоминальное исследование проводят в положении лежа на спине при форсированном брюшном дыхании и с его задержкой с наружной абдоминальной пальпацией.
Способ осуществляют следующим образом.
На первом этапе проводят комплексное УЗИ органов брюшной полости, малого таза и забрюшинного пространства конвексным датчиком при триплексном сканировании для оценки состояния листков брюшины в положении лежа на спине при тугом наполнении мочевого пузыря.
После опорожнения мочевого пузыря выполняют трансвагинальную эхографию с триплескным сканированием с подробной эхолокацией париетальной брюшины.
При подозрении на наличие диссеминатов париетальной брюшины дополнительно используют следующие приемы.
Для визуализации диссеминатов париетальной брюшины брюшной полости трансабдоминально используют линейный датчик 3-9 Гц. Осмотр осуществляют в положении лежа на спине и стоя с форсированным брюшным дыханием и его задержкой, что облегчает визуализацию при минимальном скоплении свободной жидкости в брюшной полости. При наличии локусов кровотока используют триплексное сканирование и получают допплеровскую кривую, что позволяет дифференцировать диссеминаты париетальной брюшины от петель кишечника и спаечного процесса.
Осмотр осуществляют в положении лежа на спине и стоя с форсированным брюшным дыханием и его задержкой, что облегчает визуализацию при минимальном скоплении свободной жидкости в брюшной полости. При наличии локусов кровотока используют триплексное сканирование и получают допплеровскую кривую, что позволяет дифференцировать диссеминаты париетальной брюшины от петель кишечника и спаечного процесса.
Для визуализации диссеминатов париетальной брюшины малого таза трансвагинальным доступом осмотр проводят в положении лежа на спине при форсированном брюшном дыхании и его задержкой, используя наружную абдоминальную пальпацию малого таза, что облегчает визуализацию при минимальном скоплении свободной жидкости в малом тазу. При наличии локусов кровотока также применяют триплексное сканирование и получают допплеровскую кривую, что позволяет дифференцировать диссеминаты париетальной брюшины от петель кишечника и спаечного процесса.
Результаты вносят в протокол эхографического исследования. На этапах динамического наблюдения в процессе и после противоопухолевой терапии обязательным является сопоставление данных ультразвуковых исследований с результатами предыдущих протоколов, уровня онкомаркеров, бимануального исследования.
На этапах динамического наблюдения в процессе и после противоопухолевой терапии обязательным является сопоставление данных ультразвуковых исследований с результатами предыдущих протоколов, уровня онкомаркеров, бимануального исследования.
Трансвагинальное исследование проводят с наружной абдоминальной пальпацией и при диссеминатах париетальной брюшины от 6,0 до 10,0 мм и более в виде равномерного утолщения или напластований гипоэхогенной структуры с высокой и средней степенью васкуляризации и смешанным типом кровоснабжения, либо наличии единичных гипоэхогенных овальных или округлых включений по париетальной брюшине размерами от 3,5- 8,0 мм и более аваскулярных или с наличием единичных локусов кровотока, периферическим или центральным типами кровоснабжения, наличии допплеровской кривой при триплексном сканировании диагностируют ранний рецидив рака яичников в виде перитонеального канцероматоза, причем осмотры проводят первый год ежемесячно после первичного специализированного лечения, учитывая риск рецидивирования.
Предлагаемый способ основан на анализе данных клинических наблюдений. Под наблюдением находились 21 пациентка с рецидивом рака яичников III стадии после комбинированной терапии: оперативного лечения в оптимальном объеме (экстирпация матки с придатками и резекция большого сальника) и 6 курсов полихимиотерапии по схеме ТС. Мониторинг осуществлялся после первичного специализированного лечения, учитывая риск рецидивирования с целью раннего выявления рецидивов и прогрессирования первый год ежемесячно, 2 и 3 год — 1 раз в 3 месяца, 4 и 5 год — 1 раз в 6 месяцев и после 5 года — 1 раз в год. Все больные проходили комплексное ультразвуковое обследование органов брюшной полости, малого таза и забрюшинного пространства на аппаратах экспертного класса с использованием мультичастотных датчиков (конвексный 5-1 МГц, полостной 3-10 МГц, линейный 3-9 МГц) и триплексного сканирования (одновременное применение В-режима, цветового допплеровского картирования (ЦДК) и ультразвуковая спектральная допплерография (УЗДГ)), наличие допплеровской кривой.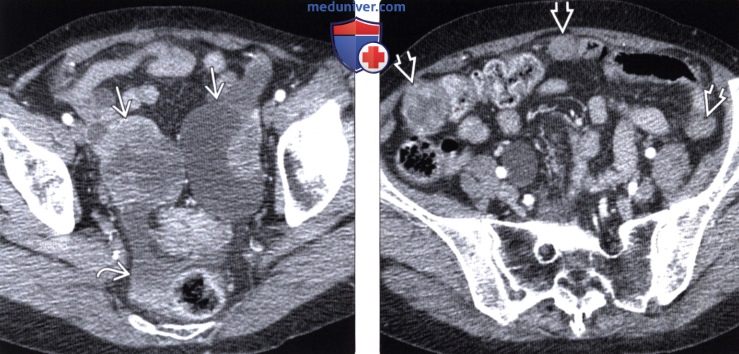 С топической объективизации состояния диссеминатов париетальной брюшины измерения проводят в двух проекциях по максимально удаленным точкам. При ультразвуковом исследовании особое внимание уделялось анализу состояния диссеминатов париетальной брюшины. Оценивались размеры, эхо-структура, эхогенность диссеминатов, особенности интенсивности васкуляризяции по количеству цветовых локусов при ЭДК и ЦДК (высокой, средней и низкой степени васкуляризации) и типов кровоснабжения (периферический, центральный, смешанный), а также наличие допплеровской кривой при триплексном сканировании.
С топической объективизации состояния диссеминатов париетальной брюшины измерения проводят в двух проекциях по максимально удаленным точкам. При ультразвуковом исследовании особое внимание уделялось анализу состояния диссеминатов париетальной брюшины. Оценивались размеры, эхо-структура, эхогенность диссеминатов, особенности интенсивности васкуляризяции по количеству цветовых локусов при ЭДК и ЦДК (высокой, средней и низкой степени васкуляризации) и типов кровоснабжения (периферический, центральный, смешанный), а также наличие допплеровской кривой при триплексном сканировании.
Предлагаемым способом при динамическом наблюдении осмотрено 21 пациентка с диагнозом рецидив рака яичников после комбинированного лечения. Изолированный перитонеальный канцероматоз диагностирован у 11 (53,2%) больных, смешанная форма канцероматоза (локальные образования малого таза и перитонеальная диссеминация) — 10 (47,6%) больных. Учитывая размеры и характер диссеминатов париетальной брюшины, в основу работы положены результаты наблюдения 11 пациенток с изолированной перитонеальной диссеминацией, которые разделены на 2 группы.
Первая группа — больные, у которых диссеминаты по париетальной брюшине выявлены в виде равномерного утолщения или напластований толщиной 6,0-10,0 мм и более — 6 (54,5%) пациенток.
Вторая группа — пациенты, у которых диссеминаты париетальной брюшины представлены единичными включениями размерами от 3,5-8 мм и более — 5 (45,4%) больных.
У пациентов 1 группы диссеминаты париетальной брюшины толщиной от 6,0-10,0 мм и более в виде равномерного утолщения 2 (18,1%) или напластований 4 (36,3%). Эхо-структура гомогенная, солидная в 36,3% случаев. Локализация — преимущественно в проекции заднего Дугласа и прикультевой зоне. При ЭДК и ЦДК с высокой и средней степенью васкуляризации, смешанным типом кровоснабжения и наличием допплеровской кривой. После проведения курсов XT у пациентов данной группы был получен положительный эффект, заключающийся в отсутствии диссеминатов в 36,3% случаев или уменьшении размеров диссеминатов париетальной брюшины у 2 (18,1%) больных. Также изменения типа кровотока на периферический с низкой степенью васкуляризации или полное отсутствие цветовых локусов в ЭДК и ЦДК (фиг. 1-5).
Также изменения типа кровотока на периферический с низкой степенью васкуляризации или полное отсутствие цветовых локусов в ЭДК и ЦДК (фиг. 1-5).
У пациентов 2 группы диссеминаты париетальной брюшины представлены единичными солидными гипоэхогенными овальными или округлыми включениями, расположены преимущественно в прикультевой зоне размерами от 3,5-8,0 мм и у 3 (27,2%) больных аваскулярные в 18,1% случаев или с наличием единичных локусов кровотока в ЦДК и ЭДК с периферическим или центральным типами кровоснабжения, наличием допплеровской кривой. После проведения курсов XT у всех пациентов данной группы получен положительный эффект — отсутствие диссеминатов париетальной брюшины и кровотока (фиг. 6-11).
Клинические наблюдения
Пример 1
Больная К., 61 год, Диагноз: Са ovarii III с st T3N0M0.
Первым этапом комбинированной терапии в 2010 г. выполнена циторедуктивная операция в оптимальном объеме без видимых определяемых остаточных опухолей (Лапаротомия. Ревизия органов брюшной полости и малого таза. Экстирпация матки с придатками, резекция большого сальника).
Ревизия органов брюшной полости и малого таза. Экстирпация матки с придатками, резекция большого сальника).
Гистологическое заключение №41101-41122 — папиллярная умеренно-дифференцированная аденокарцинома яичников, железисто-кистозная гиперплазия эндометрия, большой сальник без патологии, канцероматоз брюшной полости.
В послеоперационном периоде вторым этапом комбинированной терапии проведено 6 курсов XT по схеме ТС (таксаны 175 мг/м2, препараты платина 75 мг/м2).
В течение двух лет при комплексном динамическом исследовании по данным бимануального осмотра, ультразвукового исследования, опухолевых маркеров изменений не было. Через 32 месяца при очередном контрольном осмотре выявлено увеличение опухолевого маркера СА-125 до 80 МЕ/ мл.
Проведено исследование согласно предлагаемому способу. При бимануальном осмотре локальных образований не отмечено, но при ультразвуковом исследовании органов брюшной полости и малого таза в прикультевой зоне выявлен диссеминат по париетальной брюшине пониженной эхогенности 8,6 мм × 24,3 мм без четких контуров в ЦДК и ЭДК единичные локусы кровотока по периферии с наличием допплеровской кривой. Свободная жидкость в малом тазу и брюшной полости в незначительном количестве (фиг. 12, 13).
Свободная жидкость в малом тазу и брюшной полости в незначительном количестве (фиг. 12, 13).
С целью верификации рецидива заболевания проведено цитологическое исследование смывов из заднего свода, выявлены клетки аденокарциномы.
Учитывая платиночувствительный рецидив были поведены курсы ПХТ по схеме ТС (таксаны 175 мг/м2, препараты платина 75 мг/м2) с положительным эффектом.
Контрольный осмотр через 4 курса XT: уровень онкомаркера СА-125 3,4 МЕ/мл, при контрольном ультразвуковом исследовании патологии в брюшной полости и забрюшинном пространстве не выявлено. При ультразвуковом исследовании малого таза диссеминат париетальной брюшины лоцируется в виде линейнной гиперэхогенной аваскулярной структуры с четкими контурами размерами 3,0×12,5 мм.
Таким образом, учитывая наличие диссемината париетальной брюшины пониженной эхогенности и наличие локусов кровотока в ЦДК, ЭДК и допплеровской кривой, а также увеличение уровня онкомаркера СА-125, позволило расценить диссеминацию по брюшине малого таза как ранний признак рецидивирования рака яичников после оптимальных циторедуктивных операций, подтвержденных данными цитологического исследования, а также положительным эффектом от проведенной XT (уменьшение размеров диссемината, отсутствие кровотока, снижение уровня онкомаркеров).
Пример 2
Больная К., 67 лет. Диагноз: Са ovarii III с st Т3N0M0.
Первым этапом комбинированной терапии в 2012 г. проведена циторедуктивная операция в оптимальном объеме без видимых определяемых остаточных опухолей (Лапаротомия. Ревизия органов брюшной полости и малого таза. Экстирпация матки с придатками, резекция большого сальника).
Гистологическое исследование №26600-26636 умеренно-дифференцированная аденокарцинома яичников, метастатического поражения большого сальника нет, канцероматоз брюшной полости.
В послеоперационном периоде вторым этапом комбинированной терапии проведено 6 курсов XT по схеме ТС (таксаны 175 мг/м2, препараты платина 75 мг/м2).
В течение 12 месяцев при комплексном динамическом исследовании по данным бимануального осмотра, ультразвукового исследования изменений не было, опухолевый маркер СА-125 не превышал 26 МЕ/мл.
Через 15 месяцев при очередном контрольном осмотре выявлено увеличение опухолевого маркера СА-125 до 83,5 МЕ/ мл.
Проведено исследование согласно предлагаемому способу. При бимануальном осмотре пальпируется инфильтрат в заднем Дугласе размерами около 2,0×2,5 см плотно-эластичной консистенции, при ультразвуковом исследовании органов брюшной полости и забрюшинного пространства — без патологии. При ультразвуковом исследовании органов малого таза выявлен диссеминат по париетальной брюшине в виде единичного гипоэхогенного солидного образования размерами до 10,7×15,4 мм без четких контуров гиперваскулярный в ЭДК и ЦДК со смешанным типом кровоснабжения и наличием допплеровской кривой (фиг 14). Свободная жидкость в малом тазу.
С целью верификации рецидива заболевания проведено цитологическое исследование смывов из заднего свода, получены клетки аденокарциномы, что подтверждало рецидив рака яичников.
Учитывая платиночувствительный рецидив, проведена противорецидивная ПХТ по схеме ТС (таксаны 175 мг/м2, препараты платина 75 мг/м2) с положительным эффектом.
Контрольный осмотр через 4 курса XT: уровень онкомаркера СА-125-1,8 МЕ/мл, при бимануальном осмотре и контрольном ультразвуковом исследовании брюшной полости и забрюшинного пространства согласно предлагаемому способу патологии не выявлено. При ультразвуковом исследовании малого таза диссеминат париетальной брюшины 4,0 мм×7,0 мм в виде гипоэхогенной аваскулярной солидной структуры, уменьшение свободной жидкости в малом тазу (фиг. 15), что свидетельствовало о положительном эффекте противорецидивной терапии и целесообразности ее продолжения. После 6 курса ПХТ: уровень онкомаркера СА-125-1,2 МЕ/мл, при бимануальном осмотре и контрольном ультразвуковом исследовании брюшной полости и забрюшинного пространства согласно предлагаемому способу патологии не выявлено. При ультразвуковом исследовании малого таза диссеминат париетальной брюшины не определялся, свободной жидкости нет.
Таким образом, предлагаемый способ позволяет своевременно выявить ранний перитонеальный рецидив рака яичников, оценить эффективность противорецидивной терапии и определить дальнейшую тактику лечения этих больных.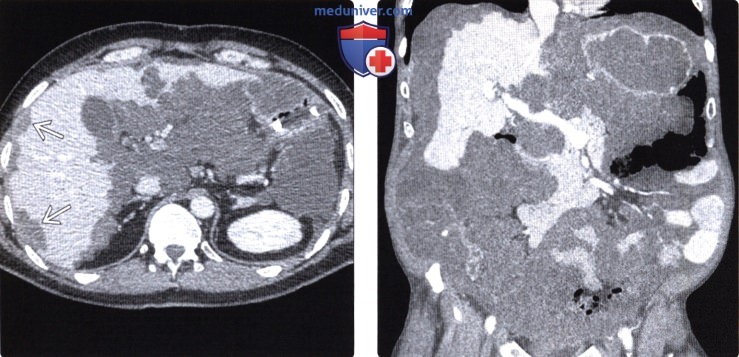
Приложение
1 фигура — гипоэхогенный диссеминат в виде напластования в проекции заднего дугласа 27×11 мм;
2 фигура — гипоэхогенный диссеминат в виде напластования с высокой степенью васкуляризации;
3 фигура — гипоэхогенный диссеминат по париетальной брюшине толщиной до 6.9 мм;
4 фигура — гипоэхогенный диссеминат в париетальной брюшине в проекции заднего Дугласа в виде равномерного утолщения;
5 фигура — диссеминат париетальной брюшины в проекции заднего Дугласа с средней степенью васкуляризации и наличием допплеровской кривой;
6 фигура — гипоэхогенный диссеминат в прикультевой зоне без четких контуров размерами 6.3 мм;
7 фигура — округлый гипоэхогенный диссеминат по париетальной брюшине в прикультевой зоне без четких контуров размерами 4.2×4.4 мм с периферическим типом кровотока;
8 фигура — гипоэхогенный диссеминат по париетальной брюшине без четких контуров размерами 5,8×2,7 мм на фоне асцита;
9 фигура — округлый диссеминат в прикультевой зоне без четких контуров с высокой степенью васкуляризации;
10 фигура — гипоэхогенный округлый диссеминат в прикультевой зоне без четких контуров 7,6×12,0 мм на фоне асцита;
11 фигура — округлый гипоэхогенный диссеминат в прикультевой зоне без четких контуров с периферическим типом кровотока на фоне асцита;
12 фигура — диссеминат по париетальной брюшине пониженной эхогенности 8,6 мм×24,3 мм без четких контуров до лечения;
13 фигура — диссеминат по париетальной брюшине в ЦДК и ЭДК единичные локусы кровотока по периферии с наличием допплеровской кривой до лечения;
14 фигура — диссеминат по париетальной брюшине в виде гипоэхогенного образования размерами до 10,7×15,4 мм без четких контуров гиперваскулярный в ЭДК и ЦДК со смешанным типом кровоснабжения и наличием допплеровской кривой до лечения;
15 фигура — после лечения диссеминат 4,0 мм×7,0 мм в виде гипоэхогенной аваскулярной структуры.
Опухоли сальника — StatPearls — NCBI Bookshelf
Программа непрерывного образования
Сальник состоит из клеток мезотелиального происхождения. Сальник проявляет ангиогенную, фиброзную, стволовые клетки и иммунную активность, ответственную за стимуляцию васкуляризации, ускоренное заживление и ограничение инфекции в брюшной полости. Эти действия также могут привести к патологическим изменениям, таким как образование опухоли сальника. В этой статье описаны эпидемиология, проявления, гистопатология, исследования и лечение первичных опухолей сальника.В этом мероприятии рассматривается оценка и лечение опухолей сальника и подчеркивается роль межпрофессиональной группы в оценке и улучшении ухода за пациентами с этим заболеванием.
Цели:
Определите эпидемиологию первичных опухолей сальника.
Опишите оценку первичных опухолей сальника.
Объясните возможные варианты лечения первичных опухолей сальника.

Пересмотреть стратегии межпрофессиональной бригады для улучшения координации помощи и коммуникации, чтобы улучшить лечение первичных опухолей сальника и улучшить результаты.
Введение
Сальник состоит из клеток мезотелиального происхождения. Говорят, что это тип висцеральной жировой ткани с общей площадью поверхности 1500 см2. Он висит перед органами брюшной полости, как фартук, а также связан с селезенкой, желудком, поджелудочной железой и толстой кишкой. Сальник проявляет ангиогенную, фиброзную, стволовые клетки и иммунную активность, ответственную за стимуляцию васкуляризации, ускоренное заживление и ограничение инфекции в брюшной полости.Эти действия также могут привести к патологическим изменениям, таким как образование опухоли сальника и метастазирование.[1] Первичные солидные опухоли большого сальника встречаются редко, всего 42 зарегистрированных случая; однако перитонеальные метастазы довольно распространены при некоторых опухолях, таких как стромальные опухоли желудочно-кишечного тракта и рак яичников.
Этиология
Эти опухоли являются спорадическими, и этиологические факторы, ответственные за такие опухоли, неизвестны.
Эпидемиология
Это редкие поражения, каждое из которых связано со скрытым началом.[3]
Липосаркома большого сальника — редкая опухоль; до июля 2019 г. в литературе описано 19 случаев. Девять случаев с 1936 по 2003 г., 10 случаев с 2003 по 2018 г. и один в 2019 г. Средний возраст возраст пациентов в этих отчетах о случаях был 51,1 года.[4]
Лейомиосаркома большого сальника является редкой опухолью, и до октября 2016 г. в литературе было зарегистрировано 23 случая. Клинически эти опухоли проявляются на 5-м десятилетии жизни.[5] В то время как в другом исследовании было зарегистрировано 27 случаев.Средний возраст в этих случаях составлял 51 год, и это было немного чаще у мужчин.
Согласно сообщениям о случаях SFT (солитарных фиброзных опухолей) большого сальника, эта опухоль возникает на пятом-седьмом десятилетии жизни с соотношением мужчин и женщин 1:1.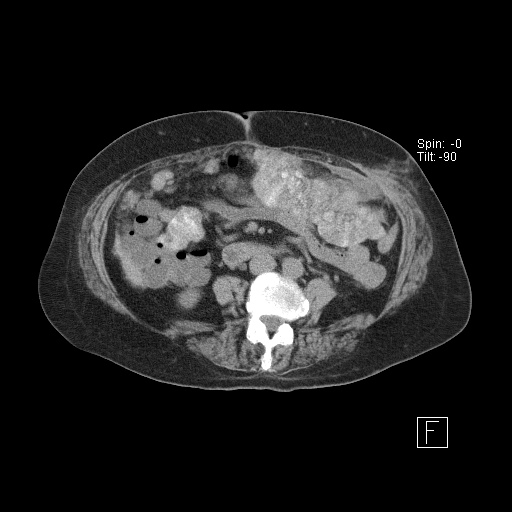 [7]
[7]
Сообщалось о 54 случаях сальниковых EGIST (внежелудочно-кишечных стромальных опухолей), и, согласно этим случаям, средний возраст на момент постановки диагноза составляет шестьдесят пять лет, а соотношение мужчин и женщин составляет 1 : 1.[8]
Патофизиология
Сальник называется депо висцерального жира. Его роль как «полицейского брюшной полости» была признана британским хирургом в начале 1900-х годов благодаря его свойствам перемещаться по брюшной полости и ограничивать инфекции и воспаления. Сальник содержит множество иммунных агрегатов, называемых «млочными пятнами», функция которых в значительной степени неизвестна. Говорят, что как свободные иммунные клетки, так и опухолевые клетки связываются с этими агрегатами.[9]
Все первичные опухоли сальника являются спорадическими и обычно злокачественными.[10] Но метастатические поражения распространены. Сообщаемые первичные опухоли сальника включают фибросаркому, веретеноклеточную саркому, липосаркому, лейомиому, гемангиоперицитому, липому и десмоидную опухоль, фиброму, мезотелиому, миосаркому, рабдомиосаркому, лейомиобластому и эндотелиому. Эти опухоли происходят из различных элементов, из которых состоит сальник, таких как жировая ткань, сосуды и лимфатическая ткань.
Эти опухоли происходят из различных элементов, из которых состоит сальник, таких как жировая ткань, сосуды и лимфатическая ткань.
Первичная лейомиосаркома сальника — очень редкая опухоль; чаще лейомиосаркомы возникают в гладкомышечных клетках желудочно-кишечного тракта, забрюшинного пространства и мочеполового тракта.[10] Из-за низкой частоты лейомиосаркомы сальника мало что известно о происхождении и поведении этих опухолей.[5]
Солитарная фиброзная опухоль (SFT), ранее называвшаяся гемангиоперицитомой, представляет собой редкую мезенхимальную опухоль [7], часто происходящую из плевры; вовлечение сальника очень редко. От 78% до 88% этих опухолей являются доброкачественными, а от 12% до 22% злокачественными.[12] До 2015 года в литературе было описано только 6 случаев SFT, возникающих из большого или малого сальника.[13]
GIST (желудочно-кишечные стромальные опухоли) представляют собой мезенхимальные опухоли, возникающие из стенки желудочно-кишечного тракта, в основном из желудка. Однако редко они могут возникать из сальника, что обозначается как экстрагастроинтестинальные стромальные опухоли (EGIST). GIST и EGIST сходны гистопатологически и иммуногистохимически; оба экспрессируют мутации KIT/PDGFRA с усилением функции. Поскольку эти опухоли являются спорадическими, их злокачественный потенциал установить невозможно.[14] Сакураи и др. сообщили о клетках Кахаля, таких как клетки CD117+ и CD34+, в нормальном сальнике, из которых теоретически могут возникать EGIST.
Однако редко они могут возникать из сальника, что обозначается как экстрагастроинтестинальные стромальные опухоли (EGIST). GIST и EGIST сходны гистопатологически и иммуногистохимически; оба экспрессируют мутации KIT/PDGFRA с усилением функции. Поскольку эти опухоли являются спорадическими, их злокачественный потенциал установить невозможно.[14] Сакураи и др. сообщили о клетках Кахаля, таких как клетки CD117+ и CD34+, в нормальном сальнике, из которых теоретически могут возникать EGIST.
Липосаркомы обычно возникают из глубоких мягких тканей конечностей, и это наиболее распространенная саркома мягких тканей.[15] Интраабдоминальные локализации редки, и они редко исходят из большого сальника.
Злокачественная мезотелиома обычно возникает из плевры и брюшной полости, но редко может возникать из большого сальника. Его связь с асбестом менее очевидна по сравнению с мезотелиомой плевры.[11]
Гистопатология
Гистопатология зависит от типа опухоли. Эмбриологическое происхождение этих опухолей различается, поскольку сальник состоит из различных тканей, таких как сосуды, лимфатические и жировые ткани.
Первичная лейомиосаркома сальника при гистологическом исследовании может показать длинные веретенообразные клетки с высоким митотическим индексом наряду с участками коагуляционного некроза опухоли и миксоидными изменениями; иммуногистохимия может быть положительной для десмина и актина гладких мышц и резко отрицательной для S100 и CD34, как при лейомиосаркоме.[5][6]
SFT получают из мезенхимальных клеток; он в основном состоит из веретенообразных клеток и пучков коллагена. В литературе существует путаница в отношении происхождения и классификации SFT, поскольку гемангиоперицитомы (HPC) и SFT имеют много общих патологических находок; теперь они считаются частью одного и того же объекта.[17] При иммуногистохимическом окрашивании эти опухоли оказались отрицательными по следующим маркерам CD117, цитокератину, кальретинину, CD99, CD68, десмину, F8, S-100, антигену эпителиальной мембраны.Эти опухоли положительны по CD34, α-актину гладких мышц (α-SMA), BCL-2 и виментину (VIM) [12]. CD34 является полезным положительным биомаркером для SFT; несколько исследований показали 100% положительный результат.[13]
CD34 является полезным положительным биомаркером для SFT; несколько исследований показали 100% положительный результат.[13]
По данным ВОЗ, липосаркома подразделяется на пять типов: высокодифференцированная, плеоморфная, круглоклеточная, миксоидная и дедифференцированная.[15] Липосаркома часто может иметь доброкачественные и злокачественные участки.[4] Прогноз этих опухолей зависит от гистологического типа [16]; дедифференцированный подтип имеет худший прогноз и высокую частоту рецидивов.[18] Хорошо дифференцированная липосаркома имеет толстые перегородки, размер поражения >10 см, содержит глобулярные нежировые области и компонент поражения <75% жира.[4]
Происхождение экстрагастроинтестинальных стромальных опухолей (EGIST) полностью не известно, но их гистология и иммунофенотип сходны с GIST. Считается, что это GIST, которые были отделены от желудочно-кишечного тракта, или они могут возникать из мезенхимальных клеток сальника [8]. EGIST, как и GIST, обычно положительны для KIT, альфа-актина гладких мышц и отрицательны для десмина и белка s-100. Показано, что эти опухоли, сходные с ГИСО, состоят из удлиненных веретенообразных клеток, эпителиоидных клеток или смешанных клеток с высокой клеточностью и низкой митотической активностью.[19]
Показано, что эти опухоли, сходные с ГИСО, состоят из удлиненных веретенообразных клеток, эпителиоидных клеток или смешанных клеток с высокой клеточностью и низкой митотической активностью.[19]
Гистологическое исследование мезотелиомы сальника может выявить эпителиальную, саркоматоидную или двухфазную структуру. Опухоли эпителиального типа составляют 75% случаев и варьируют от хорошо дифференцированных с тубуло-папиллярным рисунком до сплошных пластов круглых или полигональных клеток. Такие опухоли могут имитировать карциному, и бывает трудно отличить эпителиоидную мезотелиому от метастатической карциномы, особенно аденокарциномы.Опухоли саркоматоидного типа могут быть неотличимы от фибросарком только по гистологическим данным. Иммуногистохимия может помочь дифференцировать саркому и аденокарциному. Эти опухолевые клетки положительны на кальретинин, цитокератин и антиген эпителиальной мембраны и отрицательны на белок S-100, Leu-M1, CEA, тромбомодулин и плацентарную щелочную фосфатазу, положительная иммунореактивность на кальретинин значительно повышает точность диагноза.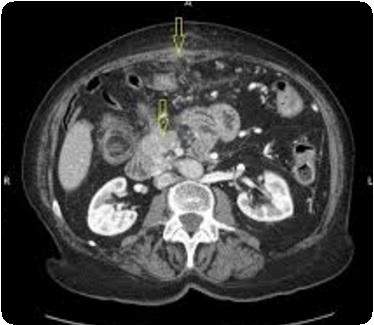
Анамнез и физикальное исследование
Первичные опухоли сальника в основном протекают бессимптомно, но у большинства пациентов отмечают дискомфорт в животе, пальпируемое образование в животе, тошноту, быстрое чувство насыщения и потерю веса.[11] Другие симптомы, основанные на различных сообщениях о случаях, представленных в литературе, включают боль в животе, вздутие живота, запор, анорексию, рвоту и лихорадку.[4][6][12][7] Физикальное обследование может выявить пальпацию безболезненного образования в брюшной полости, баллотируемого сбоку, на основании описаний случаев в доступной литературе; масса может пальпироваться в эпигастрии, гипогастрии, верхнем или нижнем правом или левом квадранте или вовлекать всю брюшную полость. [17]
У пациентов также может наблюдаться болезненность новообразования, и при осмотре живота может наблюдаться настороженность.[21] В некоторых отчетах о случаях у пациентов также был асцит.[6] Пациенты с асцитом, потерей веса и перитонеальными имплантатами обычно указывают на злокачественное новообразование.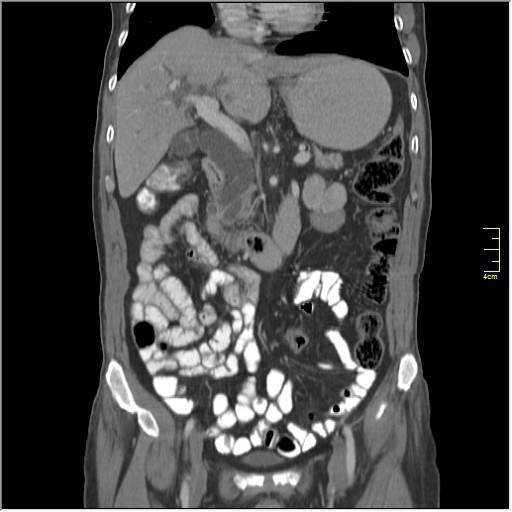 Наиболее частыми клиническими проявлениями первичной опухоли сальника являются абдоминальный дискомфорт (56%) и объемное образование (35%) [2]. В одном отчете о случае у пациента была диффузная боль в животе без пальпируемого образования при физикальном обследовании , в то время как в другом отчете о случае пациент с первичной лейомиосаркомой имел необъяснимые геморрагические псевдоасциты.[5][22] Хотя симптомы в значительной степени неспецифичны, они также могут проявляться как случайные находки при визуализации.[5] EGIST сальника могут оставаться клинически бессимптомными, несмотря на огромный размер опухоли.[8]
Наиболее частыми клиническими проявлениями первичной опухоли сальника являются абдоминальный дискомфорт (56%) и объемное образование (35%) [2]. В одном отчете о случае у пациента была диффузная боль в животе без пальпируемого образования при физикальном обследовании , в то время как в другом отчете о случае пациент с первичной лейомиосаркомой имел необъяснимые геморрагические псевдоасциты.[5][22] Хотя симптомы в значительной степени неспецифичны, они также могут проявляться как случайные находки при визуализации.[5] EGIST сальника могут оставаться клинически бессимптомными, несмотря на огромный размер опухоли.[8]
Оценка
Диагностика липосаркомы является сложной задачей, и ее трудно дифференцировать от других опухолей. Внешний вид хорошо дифференцированной липосаркомы на КТ и МРТ похож на жировую и другие опухоли брюшной полости.[4]
Дооперационный диагноз первичной лейомиосаркомы сальника затруднен, и диагноз обычно ставится после операции. Точный диагноз ставится только при гистологическом исследовании опухоли.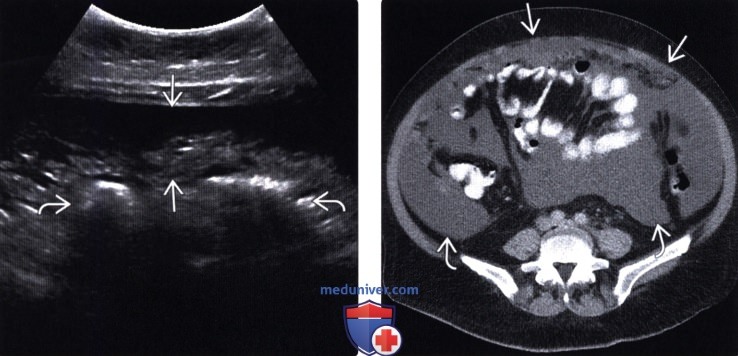 [6]
[6]
Внутривенная КТ брюшной полости и таза и МРТ являются лучшими методами визуализации для диагностики лейомиосаркомы сальника. Он может дать точную информацию о происхождении опухоли. Эти поражения в большинстве случаев имеют сходные визуализационные характеристики, представляя собой солидно-кистозную и многодольчатую опухоль [5]. Ультразвук может обнаружить опухоль и показать внутреннюю структуру поражения, но не может определить происхождение. Иногда эти опухоли сопровождаются асцитом и повышенным уровнем СА-125, что может свидетельствовать о раке яичников.[6]
Рентгенологические особенности сальниковых ЭГИСТ, не имеющих миогенной и нейрогенной дифференцировки, не установлены. Они могут быть похожи на сальниковую лейомиому и лейомиосаркому. Большинство ГИСО с миогенными признаками гиперваскуляризированы и имеют четкие границы на КТ и ангиографии.[8]
Согласно Ishida (1998), компьютерная томография является методом выбора при больших оментальных опухолях. На КТ такие опухоли обычно многодольчатые, плоские, блинообразные, с усилением солидной и мультикистозной плотности.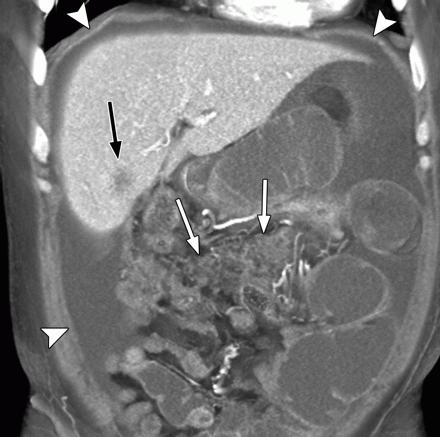 Ангиография является полезным исследованием в диагностике опухолей сальника. Диагноз опухоли сальника ставится, когда артерия, питающая опухоль, отходит от сальникового кровоснабжения. Высоковаскулярное поражение с неоваскуляризацией, скорее всего, означает злокачественную опухоль.[6]
Ангиография является полезным исследованием в диагностике опухолей сальника. Диагноз опухоли сальника ставится, когда артерия, питающая опухоль, отходит от сальникового кровоснабжения. Высоковаскулярное поражение с неоваскуляризацией, скорее всего, означает злокачественную опухоль.[6]
Окончательный диагноз можно поставить с помощью лапароскопии или открытой операции с биопсией. Гистология и иммуногистохимия используются для диагностики и дифференциации мезотелиомы от аденокарциномы и саркомы.
УЗИ и компьютерная томография могут быть использованы для отслеживания рецидивов.[12]
КТ и МРТ являются лучшими диагностическими методами для диагностики солитарных фиброзных опухолей сальника. Они помогают выявить разрастание фиброзной ткани в брюшной полости, оценить соотношение между опухолью и окружающими структурами и принять решение об удалении опухоли. Однако КТ и МРТ не могут отличить SFT от мезенхимальных опухолей. Поэтому его можно ошибочно диагностировать как стромальную опухоль./18/18_1.jpg) Аспирация иглой не помогает в диагностике, потому что опухоль состоит из бесклеточной и гиперклеточной частей и не дает достаточного количества ткани для цитологического анализа.Эппл и др. сообщили, что точный диагноз может быть поставлен с помощью тонкоигольной аспирации, но у многих пациентов это требует исследования. Образцы опухоли могут быть собраны через трубку Райла при небольших опухолях и с помощью диагностической лапаротомии при больших опухолях.[12]
Аспирация иглой не помогает в диагностике, потому что опухоль состоит из бесклеточной и гиперклеточной частей и не дает достаточного количества ткани для цитологического анализа.Эппл и др. сообщили, что точный диагноз может быть поставлен с помощью тонкоигольной аспирации, но у многих пациентов это требует исследования. Образцы опухоли могут быть собраны через трубку Райла при небольших опухолях и с помощью диагностической лапаротомии при больших опухолях.[12]
Диагностика SFT сальника затруднена, поскольку она напоминает другие опухоли, такие как лейомиома и мезотелиома. Более того, если опухоль на ножке возникает из сальника, ее можно принять за другие опухоли таза. Иммуногистохимия помогает установить диагноз.Эти опухоли положительны по CD34, CD99 и BCL-2, а иногда и по SMA, но обычно отрицательны по S-100, десмину и цитокератинам. SFT выглядит как сильно васкуляризированная солидная опухоль с четко очерченными краями на ультразвуковом изображении, и КТ-сканирование может показать те же результаты.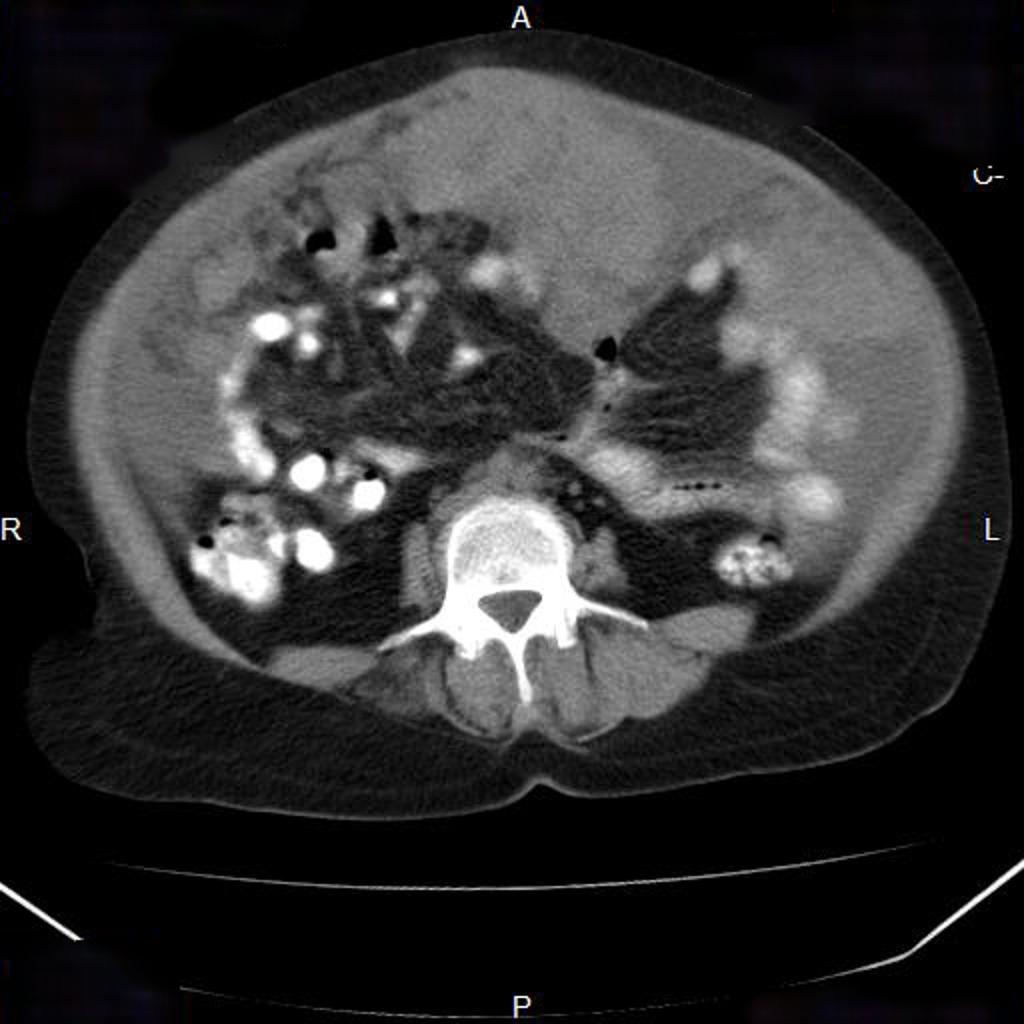 Однако визуализация не является специфическим исследованием, и дооперационная диагностика становится невозможной.[7]
Однако визуализация не является специфическим исследованием, и дооперационная диагностика становится невозможной.[7]
Лечение/управление
Радикальная резекция опухоли рекомендуется при липосаркомах; адъювантная терапия не была признана эффективным методом лечения.[4]
Полное удаление опухоли дает хороший прогноз при лейомиосаркоме сальника. Некоторые авторы использовали нестандартизированные схемы химиотерапии при нерезектабельном заболевании с переменными результатами. У пациентов с диссеминированным заболеванием также применялась мультимодальная терапия. Из-за агрессивного характера таких опухолей часто возникают рецидивы, а долгосрочная выживаемость неизвестна.[5]
SFT, как правило, доброкачественные. От 15 до 20% из них являются злокачественными, особенно опухоли размером более 10 см.Гистологические признаки, такие как высокая клеточность, высокая митотическая активность, плеоморфизм, атипия, некроз опухоли и кровоизлияние, указывают на злокачественность. Размер опухоли и митотическая активность играют важную роль в прогнозировании SFT, исходящей из сальника. Такие характеристики, как размер опухоли, митотическая активность, клеточность и плеоморфизм для прогнозирования поведения SFT, могут использоваться для оценки риска. Злокачественные факторы связаны с высокой частотой рецидивов и метастазирования.[12] Методом выбора является хирургическая резекция, однако злокачественные опухоли могут рецидивировать даже через несколько лет после операции.Полезная роль адъювантной терапии еще не установлена, но в некоторых сообщениях предполагается адъювантная лучевая терапия и показан ответ на химиотерапию, но их эффективность не доказана. Размер опухоли является хорошим прогностическим фактором, но высокая митотическая активность связана с плохим прогнозом.[7]
Размер опухоли и митотическая активность играют важную роль в прогнозировании SFT, исходящей из сальника. Такие характеристики, как размер опухоли, митотическая активность, клеточность и плеоморфизм для прогнозирования поведения SFT, могут использоваться для оценки риска. Злокачественные факторы связаны с высокой частотой рецидивов и метастазирования.[12] Методом выбора является хирургическая резекция, однако злокачественные опухоли могут рецидивировать даже через несколько лет после операции.Полезная роль адъювантной терапии еще не установлена, но в некоторых сообщениях предполагается адъювантная лучевая терапия и показан ответ на химиотерапию, но их эффективность не доказана. Размер опухоли является хорошим прогностическим фактором, но высокая митотическая активность связана с плохим прогнозом.[7]
Радикальная резекция является методом выбора при ГИСО сальника; адъювантная терапия иматинибом после хирургической резекции при ограниченном заболевании также проводится [8]. Адъювантная терапия иматинибом может предотвратить рецидив и увеличить долгосрочную выживаемость.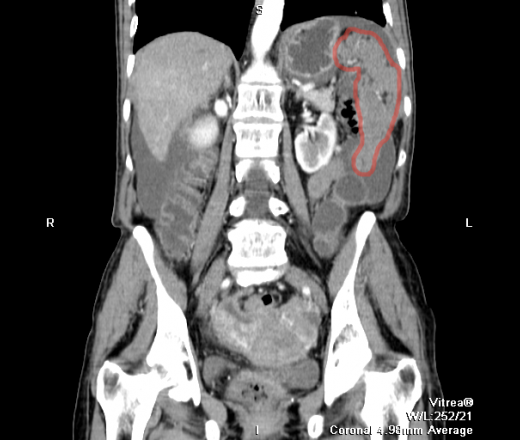 [14]
[14]
В отношении мезотелиомы сальника в нескольких независимых исследованиях первой и второй фаз применялась стратегия интенсивного локально-регионарного лечения, включая циторедуктивную хирургию, дополненную периоперационной гипертермической внутрибрюшинной химиотерапией. К ней также может быть добавлена ранняя послеоперационная внутрибрюшинная химиотерапия. Сообщается, что эта форма лечения в результате улучшила медиану выживаемости. Фогельзанг и др. провели многоцентровое контролируемое рандомизированное исследование III фазы, и показано, что пеметрексед-цисплатин является золотым стандартом в случае неоперабельной злокачественной мезотелиомы плевры.Это лечение дало объективный ответ при мезотелиоме сальника [11].
Окончательным методом лечения SFT сальника является хирургическая резекция опухоли с отрицательным краем. Послеоперационное длительное наблюдение имеет важное значение, поскольку эти опухоли часто рецидивируют. Злокачественные опухоли агрессивны, локально инвазивны с усиленным ростом и метастазированием.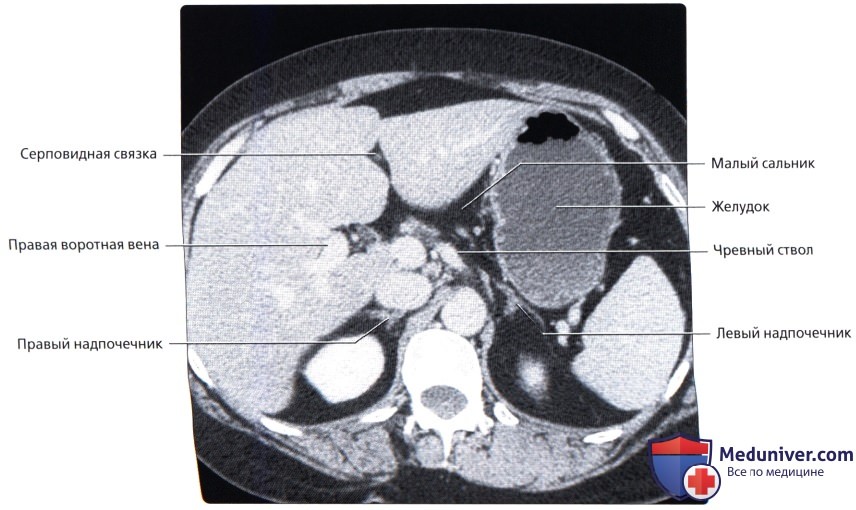 Поэтому при злокачественных опухолях рекомендуется послеоперационная химиотерапия. Кроме того, половина злокачественных SFT были положительными для c-kit, и ингибиторы тирозинкиназы, такие как иматиниб и сунитиниб, которые также эффективны для GIST, также использовались для SFT.[12] Опухоль размером более 10 см имеет повышенный злокачественный потенциал, худший исход для метастазирования и повышенное количество рецидивов.[13]
Поэтому при злокачественных опухолях рекомендуется послеоперационная химиотерапия. Кроме того, половина злокачественных SFT были положительными для c-kit, и ингибиторы тирозинкиназы, такие как иматиниб и сунитиниб, которые также эффективны для GIST, также использовались для SFT.[12] Опухоль размером более 10 см имеет повышенный злокачественный потенциал, худший исход для метастазирования и повышенное количество рецидивов.[13]
Дифференциальный диагноз
Дифференциальный диагноз первичных опухолей Omentum
FibrosarComa
1
1
Липосаркома
Leioomyoma
1Lipoma
90044
Mesothelioma
Desmoid опухоль
1
Leiomyoblastoma
Эти опухоли могут быть приняты за опухоли таза, опухолей яичников и цистов.
Прогноз
Прогноз при липосаркомах туловища, в том числе внутрибрюшной области, хуже, чем при липосаркомах конечностей. В одном исследовании средняя 5-летняя выживаемость при липосаркоме туловища составила 41,9% по сравнению с конечностями, где она составила 66,7%. Прогноз также зависит от гистологического подтипа липосаркомы. Пятилетняя безрецидивная выживаемость хуже для опухолей группы высокой степени злокачественности (дедифференцированные, круглоклеточные и плеоморфные), чем для групп опухолей низкой степени злокачественности (высокодифференцированные и миксоидного типа).[4]
Из-за редкости сальниковых EGIST их злокачественный потенциал и общий прогноз трудно установить.[14] По сравнению с обычным GIST, EGIST имеет менее благоприятный прогноз, поскольку такие опухоли сопровождаются высокими митотическими индексами, большими размерами и отдаленными метастазами.[19]
Прогноз при злокачественной мезотелиоме сальника крайне неблагоприятный, поскольку эффективного лечения до сих пор не существует.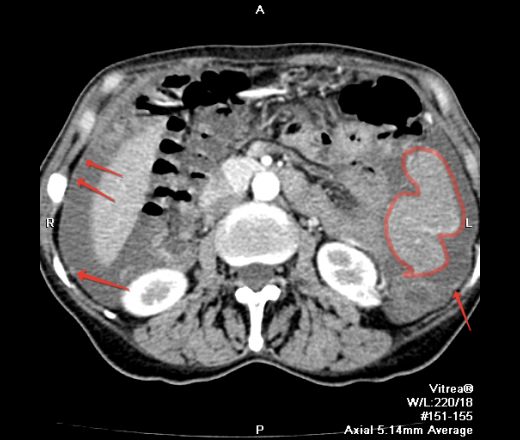 Большинство пациентов умирают в течение одного года после постановки диагноза. По данным некоторых ретроспективных исследований, медиана выживаемости после операций, направленных на паллиативное лечение в сочетании с системной или внутрибрюшинной химиотерапией, составляет около одного года.У пациентов, которым была проведена агрессивная хирургия с гипертермической внутрибрюшинной химиотерапией, медиана выживаемости приблизилась к пяти годам [11].
Большинство пациентов умирают в течение одного года после постановки диагноза. По данным некоторых ретроспективных исследований, медиана выживаемости после операций, направленных на паллиативное лечение в сочетании с системной или внутрибрюшинной химиотерапией, составляет около одного года.У пациентов, которым была проведена агрессивная хирургия с гипертермической внутрибрюшинной химиотерапией, медиана выживаемости приблизилась к пяти годам [11].
Осложнения
У некоторых пациентов был отмечен внутрибрюшной разрыв опухоли, приводящий к острому животу.[7]
Сдерживание и просвещение пациентов
Поскольку первичные опухоли сальника встречаются редко, знаний о поведении таких опухолей все еще недостаточно, и требуется больше случаев и исследований.
Улучшение результатов медицинского персонала
Первичные опухоли сальника — это спорадические опухоли.Эти опухоли либо бессимптомны, либо признаки и симптомы проявления неспецифичны, что проявляется поздно из-за массового эффекта опухоли. Методы визуализации, такие как компьютерная томография, в значительной степени диагностируют их. Для лечения таких опухолей и улучшения результатов необходимы дополнительные исследования, чтобы узнать об этиологии, прогрессировании и лучших вариантах лечения таких опухолей. Хотя хирурги являются основными лицами, осуществляющими уход за такими пациентами, рентгенологи играют жизненно важную роль в диагностике пациентов с этими редкими опухолями.Другие задействованные медицинские работники — это поставщики медицинских услуг, занимающиеся сопутствующими заболеваниями пациентов, если они есть, медсестры, фельдшеры и реабилитационные работники, а также социальные работники, которые помогают пациентам в послеоперационном периоде.
Методы визуализации, такие как компьютерная томография, в значительной степени диагностируют их. Для лечения таких опухолей и улучшения результатов необходимы дополнительные исследования, чтобы узнать об этиологии, прогрессировании и лучших вариантах лечения таких опухолей. Хотя хирурги являются основными лицами, осуществляющими уход за такими пациентами, рентгенологи играют жизненно важную роль в диагностике пациентов с этими редкими опухолями.Другие задействованные медицинские работники — это поставщики медицинских услуг, занимающиеся сопутствующими заболеваниями пациентов, если они есть, медсестры, фельдшеры и реабилитационные работники, а также социальные работники, которые помогают пациентам в послеоперационном периоде.
Ссылки
- 1.
- Меза-Перес С., Рэндалл Т.Д. Иммунологические функции сальника. Тренды Иммунол. 2017 июль; 38 (7): 526-536. [Бесплатная статья PMC: PMC5812451] [PubMed: 28579319]
- 2.
- Schwartz RW, Reames M, McGrath PC, Letton RW, Appleby G, Kenady DE.
 Первичные солидные новообразования большого сальника. Операция. 1991 г., апрель; 109 (4): 543-9. [PubMed: 2008659]
Первичные солидные новообразования большого сальника. Операция. 1991 г., апрель; 109 (4): 543-9. [PubMed: 2008659] - 3.
- Weinberger HA, Ahmed MS. Мезенхимальные солидные опухоли сальника и брыжейки: отчет о четырех случаях. Операция. 1977 г., ноябрь; 82 (5): 754-9. [PubMed:5]
- 4.
- Hashimoto S, Arai J, Nishimuta M, Matsumoto H, Fukuoka H, Muraoka M, Nakashima M, Yamaguchi H. Резекция липосаркомы большого сальника: отчет о клиническом случае и обзор литературы. Представитель Int J Surg.2019;61:20-25. [Бесплатная статья PMC: PMC6626973] [PubMed: 31306901]
- 5.
- Brañes A, Bustamante C, Valbuena J, Pimentel F, Quezada N. Первичная лейомиосаркома большого сальника: отчет о болезни. Отчет по делу Int J Surg 2016; 28:317-320. [Бесплатная статья PMC: PMC5079381] [PubMed: 27771602]
- 6.
- Barel O, Qian C, Manolitsas T. Первичная лейомиосаркома сальника, представляющая собой карциному яичника, клинический случай и обзор литературы.
 Gynecol Oncol Rep. 2016 Aug;17:75-8.[Бесплатная статья PMC: PMC4949497] [PubMed: 27489871]
Gynecol Oncol Rep. 2016 Aug;17:75-8.[Бесплатная статья PMC: PMC4949497] [PubMed: 27489871] - 7.
- Rodriguez Tarrega E, Hidalgo Mora JJ, Paya Amate V, Vega Oomen O. Солитарная фиброзная опухоль большого сальника, имитирующая опухоль яичника у молодой женщины. Gynecol Oncol Rep. 2016 Aug; 17:16-9. [Бесплатная статья PMC: PMC4899079] [PubMed: 27354994]
- 8.
- Fagkrezos D, Toulumis Z, Giannila M, Penlidis C, Papaparaskeva K, Triantopoulou C. Внежелудочно-кишечная стромальная опухоль сальника: отчет о редком случае и Обзор литературы.Редкие опухоли. 2012 26 июня; 4(3):e44. [PMC бесплатная статья: PMC3475951] [PubMed: 23087800]
- 9.
- Соренсен Э.В., Гербер С.А., Седлачек А.Л., Рыбалко В.Ю., Чан В.М., Лорд Э.М. Сальниковые иммунные агрегаты и метастазы опухоли в брюшную полость. Иммунол Рез. 2009 декабрь; 45 (2-3): 185-94. [Бесплатная статья PMC: PMC28
] [PubMed: 19253004]
- 10.
- Joe DH, Yang JM, Kim HS, Kim SS, Choi SW, Choi SH, Lee S, Lim KW.
 Случай первичной лейомиосаркомы малого сальника. Корейский J Intern Med.1999 янв.; 14(1):88-90. [Бесплатная статья PMC: PMC4531912] [PubMed: 10063320]
Случай первичной лейомиосаркомы малого сальника. Корейский J Intern Med.1999 янв.; 14(1):88-90. [Бесплатная статья PMC: PMC4531912] [PubMed: 10063320] - 11.
- Shin MK, Lee OJ, Ha CY, Min HJ, Kim TH. Злокачественная мезотелиома большого сальника, имитирующая инфаркт сальника: клинический случай. Мир J Гастроэнтерол. 2009 14 октября; 15 (38): 4856-9. [Бесплатная статья PMC: PMC2761569] [PubMed: 19824125]
- 12.
- Zong L, Chen P, Wang GY, Zhu QS. Гигантская солитарная фиброзная опухоль, возникающая из большого сальника. Мир J Гастроэнтерол. 2012 28 ноября; 18 (44): 6515-20.[Бесплатная статья PMC: PMC3508650] [PubMed: 23197901]
- 13.
- Урабе М., Ямагата Ю., Айкоу С., Мори К., Ямасита Х., Номура С., Шибахара Дж., Фукаяма М., Сето Ю. Солитарная фиброзная опухоль большой сальник, имитирующий гастроинтестинальную стромальную опухоль тонкой кишки: клинический случай. инт сург. 2015 май; 100(5):836-40. [Бесплатная статья PMC: PMC4452971] [PubMed: 26011203]
- 14.

- Тодороки Т., Сано Т., Сакураи С., Сегава А., Сайтох Т., Фудзикава К., Ямада С., Хирахара Н., Цусима Й., Мотодзима Р., Мотодзима Т. .Первичная стромальная опухоль желудочно-кишечного тракта (GIST). World J Surg Oncol. 2007 12 июня; 5:66. [Бесплатная статья PMC: PMC1924523] [PubMed: 17565683]
- 15.
- Ватс М., Пандей Д., Ахлават Х., Ахтар А., Сингх Н. Множественная первичная дедифференцированная липосаркома брыжейки тощей кишки: отчет о клиническом случае и обзор литературы. J Clin Diagn Res. 2016 Январь;10(1):XD01-XD04. [Бесплатная статья PMC: PMC4740692] [PubMed: 26894164]
- 16.
- Суфи М., Мдагри Дж., Бенамр С., Лахлоу М.К., Массрури Р., Эссадель А., Мохаммадин эль-Х., Таги А., Сеттаф А., Чад Б.Гигантская липосаркома сальника, имитирующая опухоль яичника. Отчет о случае. Индийский Дж. Сург. 2012 окт; 74 (5): 425-7. [Бесплатная статья PMC: PMC3477403] [PubMed: 24082602]
- 17.
- Bouhabel S, Leblanc G, Ferreira J, Leclerc YE, Dubé P, Sidéris L.
 Солитарная фиброзная опухоль, возникающая в брыжейке: клинический случай. World J Surg Oncol. 2011 31 октября; 9:140. [Бесплатная статья PMC: PMC3225306] [PubMed: 22035205]
Солитарная фиброзная опухоль, возникающая в брыжейке: клинический случай. World J Surg Oncol. 2011 31 октября; 9:140. [Бесплатная статья PMC: PMC3225306] [PubMed: 22035205] - 18.
- Meloni F, Feo CF, Profili S, Cossu ML, Meloni GB. Хорошо дифференцированная липосаркома сальника: данные УЗИ, КТ и МРТ.Int J Biomed Sci. 2009 г., сен; 5(3):302-4. [Статья бесплатно PMC: PMC3614784] [PubMed: 23675151]
- 19.
- Саваки А. Редкие желудочно-кишечные стромальные опухоли (GIST): сальник и забрюшинное пространство. Перевод Гастроэнтерол Гепатол. 2017;2:116. [Бесплатная статья PMC: PMC5762994] [PubMed: 29354773]
- 20.
- Исида Дж., Исида Х., Конно К., Комацуда Т., Абэ К. Первичная лейомиосаркома большого сальника. Дж. Клин Гастроэнтерол. 1999 март; 28(2):167-70. [PubMed: 10078829]
- 21.
- Цуцуми Х., Овада С., Такеёси И., Изуми М., Огава Т., Фукусато Т., Моришита Ю. Первичная липосаркома сальника с перекрутом: отчет о клиническом случае.
 Гепатогастроэнтерология. 1999 май-июнь;46(27):2110-2. [PubMed: 10430407]
Гепатогастроэнтерология. 1999 май-июнь;46(27):2110-2. [PubMed: 10430407] - 22.
- Dixon AY, Reed JS, Dow N, Lee SH. Первичная сальниковая лейомиосаркома, маскирующаяся под геморрагический асцит. Хум Патол. 1984 март; 15 (3): 233-7. [PubMed: 6698542]
Опухоли сальника — StatPearls — NCBI Bookshelf
Непрерывное образование
Сальник состоит из клеток мезотелиального происхождения.Сальник проявляет ангиогенную, фиброзную, стволовые клетки и иммунную активность, ответственную за стимуляцию васкуляризации, ускоренное заживление и ограничение инфекции в брюшной полости. Эти действия также могут привести к патологическим изменениям, таким как образование опухоли сальника. В этой статье описаны эпидемиология, проявления, гистопатология, исследования и лечение первичных опухолей сальника. В этом мероприятии рассматривается оценка и лечение опухолей сальника и подчеркивается роль межпрофессиональной группы в оценке и улучшении ухода за пациентами с этим заболеванием.
Цели:
Определите эпидемиологию первичных опухолей сальника.
Опишите оценку первичных опухолей сальника.
Объясните возможные варианты лечения первичных опухолей сальника.
Пересмотреть стратегии межпрофессиональной бригады для улучшения координации помощи и коммуникации, чтобы улучшить лечение первичных опухолей сальника и улучшить результаты.
Введение
Сальник состоит из клеток мезотелиального происхождения. Говорят, что это тип висцеральной жировой ткани с общей площадью поверхности 1500 см2. Он висит перед органами брюшной полости, как фартук, а также связан с селезенкой, желудком, поджелудочной железой и толстой кишкой. Сальник проявляет ангиогенную, фиброзную, стволовые клетки и иммунную активность, ответственную за стимуляцию васкуляризации, ускоренное заживление и ограничение инфекции в брюшной полости.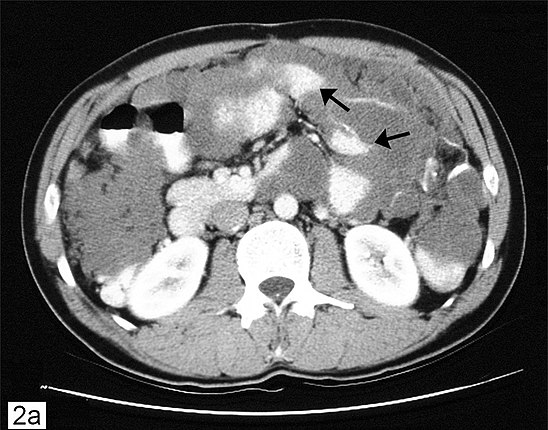 Эти действия также могут привести к патологическим изменениям, таким как образование опухоли сальника и метастазирование.[1] Первичные солидные опухоли большого сальника встречаются редко, всего 42 зарегистрированных случая; однако перитонеальные метастазы довольно распространены при некоторых опухолях, таких как стромальные опухоли желудочно-кишечного тракта и рак яичников.
Эти действия также могут привести к патологическим изменениям, таким как образование опухоли сальника и метастазирование.[1] Первичные солидные опухоли большого сальника встречаются редко, всего 42 зарегистрированных случая; однако перитонеальные метастазы довольно распространены при некоторых опухолях, таких как стромальные опухоли желудочно-кишечного тракта и рак яичников.
Этиология
Эти опухоли являются спорадическими, и этиологические факторы, ответственные за такие опухоли, неизвестны.
Эпидемиология
Это редкие поражения, каждое из которых связано со скрытым началом.[3]
Липосаркома большого сальника — редкая опухоль; до июля 2019 г. в литературе описано 19 случаев. Девять случаев с 1936 по 2003 г., 10 случаев с 2003 по 2018 г. и один в 2019 г. Средний возраст возраст пациентов в этих отчетах о случаях был 51,1 года.[4]
Лейомиосаркома большого сальника является редкой опухолью, и до октября 2016 г. в литературе было зарегистрировано 23 случая. Клинически эти опухоли проявляются на 5-м десятилетии жизни.[5] В то время как в другом исследовании было зарегистрировано 27 случаев.Средний возраст в этих случаях составлял 51 год, и это было немного чаще у мужчин.
Клинически эти опухоли проявляются на 5-м десятилетии жизни.[5] В то время как в другом исследовании было зарегистрировано 27 случаев.Средний возраст в этих случаях составлял 51 год, и это было немного чаще у мужчин.
Согласно сообщениям о случаях SFT (солитарных фиброзных опухолей) большого сальника, эта опухоль возникает на пятом-седьмом десятилетии жизни с соотношением мужчин и женщин 1:1.[7]
Сообщалось о 54 случаях сальниковых EGIST (внежелудочно-кишечных стромальных опухолей), и, согласно этим случаям, средний возраст на момент постановки диагноза составляет шестьдесят пять лет, а соотношение мужчин и женщин составляет 1 : 1.[8]
Патофизиология
Сальник называется депо висцерального жира. Его роль как «полицейского брюшной полости» была признана британским хирургом в начале 1900-х годов благодаря его свойствам перемещаться по брюшной полости и ограничивать инфекции и воспаления. Сальник содержит множество иммунных агрегатов, называемых «млочными пятнами», функция которых в значительной степени неизвестна.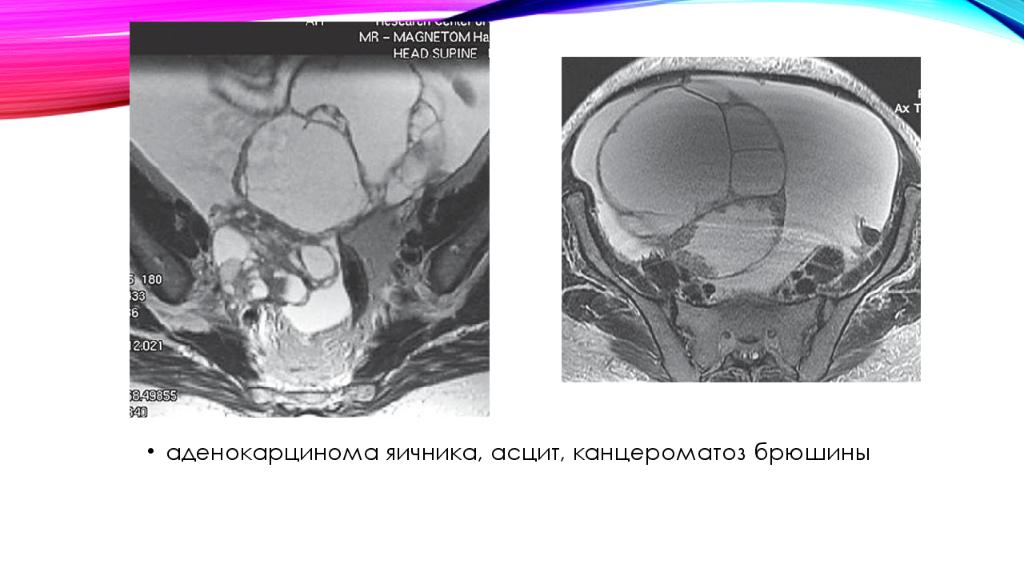 Говорят, что как свободные иммунные клетки, так и опухолевые клетки связываются с этими агрегатами.[9]
Говорят, что как свободные иммунные клетки, так и опухолевые клетки связываются с этими агрегатами.[9]
Все первичные опухоли сальника являются спорадическими и обычно злокачественными.[10] Но метастатические поражения распространены. Сообщаемые первичные опухоли сальника включают фибросаркому, веретеноклеточную саркому, липосаркому, лейомиому, гемангиоперицитому, липому и десмоидную опухоль, фиброму, мезотелиому, миосаркому, рабдомиосаркому, лейомиобластому и эндотелиому. Эти опухоли происходят из различных элементов, из которых состоит сальник, таких как жировая ткань, сосуды и лимфатическая ткань.
Первичная лейомиосаркома сальника — очень редкая опухоль; чаще лейомиосаркомы возникают в гладкомышечных клетках желудочно-кишечного тракта, забрюшинного пространства и мочеполового тракта.[10] Из-за низкой частоты лейомиосаркомы сальника мало что известно о происхождении и поведении этих опухолей.[5]
Солитарная фиброзная опухоль (SFT), ранее называвшаяся гемангиоперицитомой, представляет собой редкую мезенхимальную опухоль [7], часто происходящую из плевры; вовлечение сальника очень редко.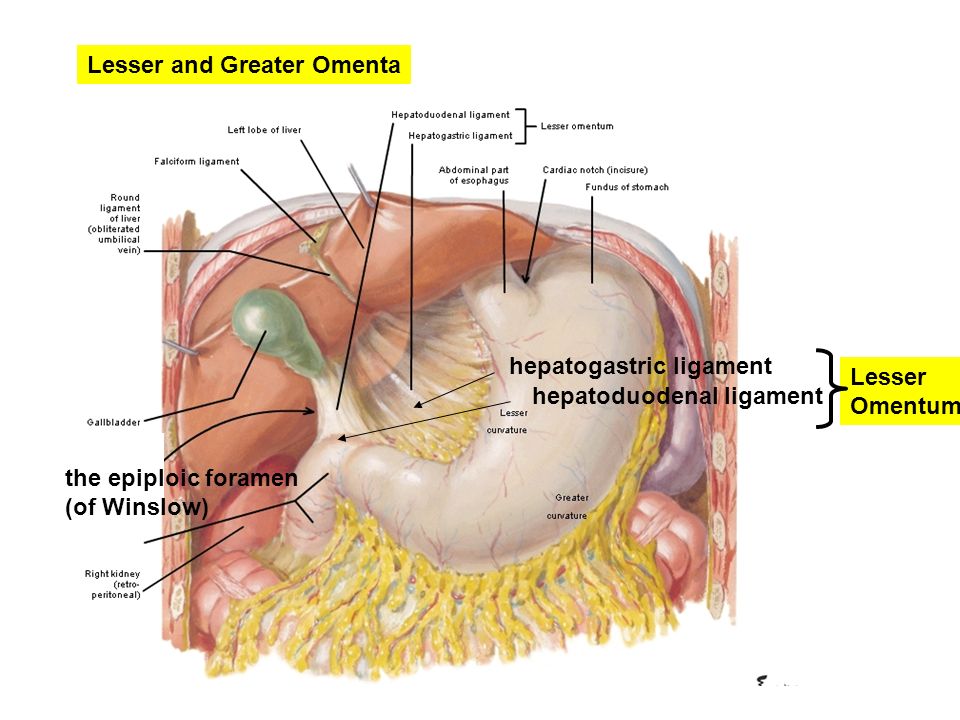 От 78% до 88% этих опухолей являются доброкачественными, а от 12% до 22% злокачественными.[12] До 2015 года в литературе было описано только 6 случаев SFT, возникающих из большого или малого сальника.[13]
От 78% до 88% этих опухолей являются доброкачественными, а от 12% до 22% злокачественными.[12] До 2015 года в литературе было описано только 6 случаев SFT, возникающих из большого или малого сальника.[13]
GIST (желудочно-кишечные стромальные опухоли) представляют собой мезенхимальные опухоли, возникающие из стенки желудочно-кишечного тракта, в основном из желудка. Однако редко они могут возникать из сальника, что обозначается как экстрагастроинтестинальные стромальные опухоли (EGIST). GIST и EGIST сходны гистопатологически и иммуногистохимически; оба экспрессируют мутации KIT/PDGFRA с усилением функции. Поскольку эти опухоли являются спорадическими, их злокачественный потенциал установить невозможно.[14] Сакураи и др. сообщили о клетках Кахаля, таких как клетки CD117+ и CD34+, в нормальном сальнике, из которых теоретически могут возникать EGIST.
Липосаркомы обычно возникают из глубоких мягких тканей конечностей, и это наиболее распространенная саркома мягких тканей.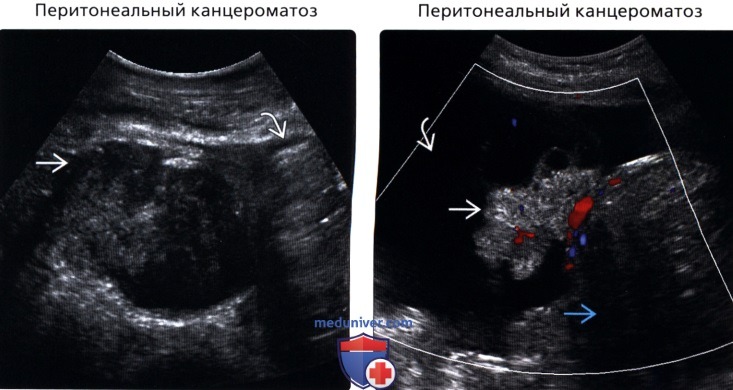 [15] Интраабдоминальные локализации редки, и они редко исходят из большого сальника.
[15] Интраабдоминальные локализации редки, и они редко исходят из большого сальника.
Злокачественная мезотелиома обычно возникает из плевры и брюшной полости, но редко может возникать из большого сальника. Его связь с асбестом менее очевидна по сравнению с мезотелиомой плевры.[11]
Гистопатология
Гистопатология зависит от типа опухоли. Эмбриологическое происхождение этих опухолей различается, поскольку сальник состоит из различных тканей, таких как сосуды, лимфатические и жировые ткани.
Первичная лейомиосаркома сальника при гистологическом исследовании может показать длинные веретенообразные клетки с высоким митотическим индексом наряду с участками коагуляционного некроза опухоли и миксоидными изменениями; иммуногистохимия может быть положительной для десмина и актина гладких мышц и резко отрицательной для S100 и CD34, как при лейомиосаркоме.[5][6]
SFT получают из мезенхимальных клеток; он в основном состоит из веретенообразных клеток и пучков коллагена. В литературе существует путаница в отношении происхождения и классификации SFT, поскольку гемангиоперицитомы (HPC) и SFT имеют много общих патологических находок; теперь они считаются частью одного и того же объекта.[17] При иммуногистохимическом окрашивании эти опухоли оказались отрицательными по следующим маркерам CD117, цитокератину, кальретинину, CD99, CD68, десмину, F8, S-100, антигену эпителиальной мембраны.Эти опухоли положительны по CD34, α-актину гладких мышц (α-SMA), BCL-2 и виментину (VIM) [12]. CD34 является полезным положительным биомаркером для SFT; несколько исследований показали 100% положительный результат.[13]
В литературе существует путаница в отношении происхождения и классификации SFT, поскольку гемангиоперицитомы (HPC) и SFT имеют много общих патологических находок; теперь они считаются частью одного и того же объекта.[17] При иммуногистохимическом окрашивании эти опухоли оказались отрицательными по следующим маркерам CD117, цитокератину, кальретинину, CD99, CD68, десмину, F8, S-100, антигену эпителиальной мембраны.Эти опухоли положительны по CD34, α-актину гладких мышц (α-SMA), BCL-2 и виментину (VIM) [12]. CD34 является полезным положительным биомаркером для SFT; несколько исследований показали 100% положительный результат.[13]
По данным ВОЗ, липосаркома подразделяется на пять типов: высокодифференцированная, плеоморфная, круглоклеточная, миксоидная и дедифференцированная.[15] Липосаркома часто может иметь доброкачественные и злокачественные участки.[4] Прогноз этих опухолей зависит от гистологического типа [16]; дедифференцированный подтип имеет худший прогноз и высокую частоту рецидивов. [18] Хорошо дифференцированная липосаркома имеет толстые перегородки, размер поражения >10 см, содержит глобулярные нежировые области и компонент поражения <75% жира.[4]
[18] Хорошо дифференцированная липосаркома имеет толстые перегородки, размер поражения >10 см, содержит глобулярные нежировые области и компонент поражения <75% жира.[4]
Происхождение экстрагастроинтестинальных стромальных опухолей (EGIST) полностью не известно, но их гистология и иммунофенотип сходны с GIST. Считается, что это GIST, которые были отделены от желудочно-кишечного тракта, или они могут возникать из мезенхимальных клеток сальника [8]. EGIST, как и GIST, обычно положительны для KIT, альфа-актина гладких мышц и отрицательны для десмина и белка s-100.Показано, что эти опухоли, сходные с ГИСО, состоят из удлиненных веретенообразных клеток, эпителиоидных клеток или смешанных клеток с высокой клеточностью и низкой митотической активностью.[19]
Гистологическое исследование мезотелиомы сальника может выявить эпителиальную, саркоматоидную или двухфазную структуру. Опухоли эпителиального типа составляют 75% случаев и варьируют от хорошо дифференцированных с тубуло-папиллярным рисунком до сплошных пластов круглых или полигональных клеток. Такие опухоли могут имитировать карциному, и бывает трудно отличить эпителиоидную мезотелиому от метастатической карциномы, особенно аденокарциномы.Опухоли саркоматоидного типа могут быть неотличимы от фибросарком только по гистологическим данным. Иммуногистохимия может помочь дифференцировать саркому и аденокарциному. Эти опухолевые клетки положительны на кальретинин, цитокератин и антиген эпителиальной мембраны и отрицательны на белок S-100, Leu-M1, CEA, тромбомодулин и плацентарную щелочную фосфатазу, положительная иммунореактивность на кальретинин значительно повышает точность диагноза.
Такие опухоли могут имитировать карциному, и бывает трудно отличить эпителиоидную мезотелиому от метастатической карциномы, особенно аденокарциномы.Опухоли саркоматоидного типа могут быть неотличимы от фибросарком только по гистологическим данным. Иммуногистохимия может помочь дифференцировать саркому и аденокарциному. Эти опухолевые клетки положительны на кальретинин, цитокератин и антиген эпителиальной мембраны и отрицательны на белок S-100, Leu-M1, CEA, тромбомодулин и плацентарную щелочную фосфатазу, положительная иммунореактивность на кальретинин значительно повышает точность диагноза.
Анамнез и физикальное исследование
Первичные опухоли сальника в основном протекают бессимптомно, но у большинства пациентов отмечают дискомфорт в животе, пальпируемое образование в животе, тошноту, быстрое чувство насыщения и потерю веса.[11] Другие симптомы, основанные на различных сообщениях о случаях, представленных в литературе, включают боль в животе, вздутие живота, запор, анорексию, рвоту и лихорадку. [4][6][12][7] Физикальное обследование может выявить пальпацию безболезненного образования в брюшной полости, баллотируемого сбоку, на основании описаний случаев в доступной литературе; масса может пальпироваться в эпигастрии, гипогастрии, верхнем или нижнем правом или левом квадранте или вовлекать всю брюшную полость. [17]
[4][6][12][7] Физикальное обследование может выявить пальпацию безболезненного образования в брюшной полости, баллотируемого сбоку, на основании описаний случаев в доступной литературе; масса может пальпироваться в эпигастрии, гипогастрии, верхнем или нижнем правом или левом квадранте или вовлекать всю брюшную полость. [17]
У пациентов также может наблюдаться болезненность новообразования, и при осмотре живота может наблюдаться настороженность.[21] В некоторых отчетах о случаях у пациентов также был асцит.[6] Пациенты с асцитом, потерей веса и перитонеальными имплантатами обычно указывают на злокачественное новообразование. Наиболее частыми клиническими проявлениями первичной опухоли сальника являются абдоминальный дискомфорт (56%) и объемное образование (35%) [2]. В одном отчете о случае у пациента была диффузная боль в животе без пальпируемого образования при физикальном обследовании , в то время как в другом отчете о случае пациент с первичной лейомиосаркомой имел необъяснимые геморрагические псевдоасциты.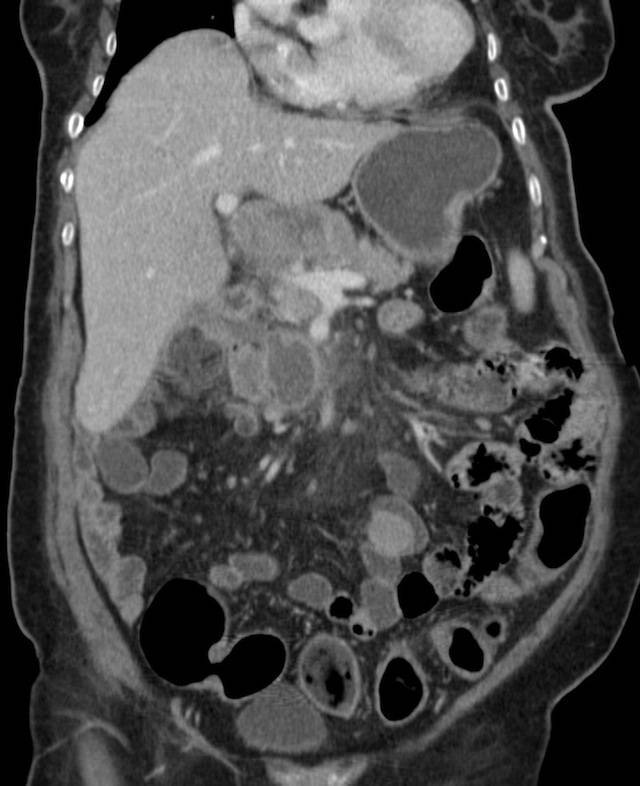 [5][22] Хотя симптомы в значительной степени неспецифичны, они также могут проявляться как случайные находки при визуализации.[5] EGIST сальника могут оставаться клинически бессимптомными, несмотря на огромный размер опухоли.[8]
[5][22] Хотя симптомы в значительной степени неспецифичны, они также могут проявляться как случайные находки при визуализации.[5] EGIST сальника могут оставаться клинически бессимптомными, несмотря на огромный размер опухоли.[8]
Оценка
Диагностика липосаркомы является сложной задачей, и ее трудно дифференцировать от других опухолей. Внешний вид хорошо дифференцированной липосаркомы на КТ и МРТ похож на жировую и другие опухоли брюшной полости.[4]
Дооперационный диагноз первичной лейомиосаркомы сальника затруднен, и диагноз обычно ставится после операции. Точный диагноз ставится только при гистологическом исследовании опухоли.[6]
Внутривенная КТ брюшной полости и таза и МРТ являются лучшими методами визуализации для диагностики лейомиосаркомы сальника. Он может дать точную информацию о происхождении опухоли. Эти поражения в большинстве случаев имеют сходные визуализационные характеристики, представляя собой солидно-кистозную и многодольчатую опухоль [5]. Ультразвук может обнаружить опухоль и показать внутреннюю структуру поражения, но не может определить происхождение. Иногда эти опухоли сопровождаются асцитом и повышенным уровнем СА-125, что может свидетельствовать о раке яичников.[6]
Ультразвук может обнаружить опухоль и показать внутреннюю структуру поражения, но не может определить происхождение. Иногда эти опухоли сопровождаются асцитом и повышенным уровнем СА-125, что может свидетельствовать о раке яичников.[6]
Рентгенологические особенности сальниковых ЭГИСТ, не имеющих миогенной и нейрогенной дифференцировки, не установлены. Они могут быть похожи на сальниковую лейомиому и лейомиосаркому. Большинство ГИСО с миогенными признаками гиперваскуляризированы и имеют четкие границы на КТ и ангиографии.[8]
Согласно Ishida (1998), компьютерная томография является методом выбора при больших оментальных опухолях. На КТ такие опухоли обычно многодольчатые, плоские, блинообразные, с усилением солидной и мультикистозной плотности.Ангиография является полезным исследованием в диагностике опухолей сальника. Диагноз опухоли сальника ставится, когда артерия, питающая опухоль, отходит от сальникового кровоснабжения. Высоковаскулярное поражение с неоваскуляризацией, скорее всего, означает злокачественную опухоль.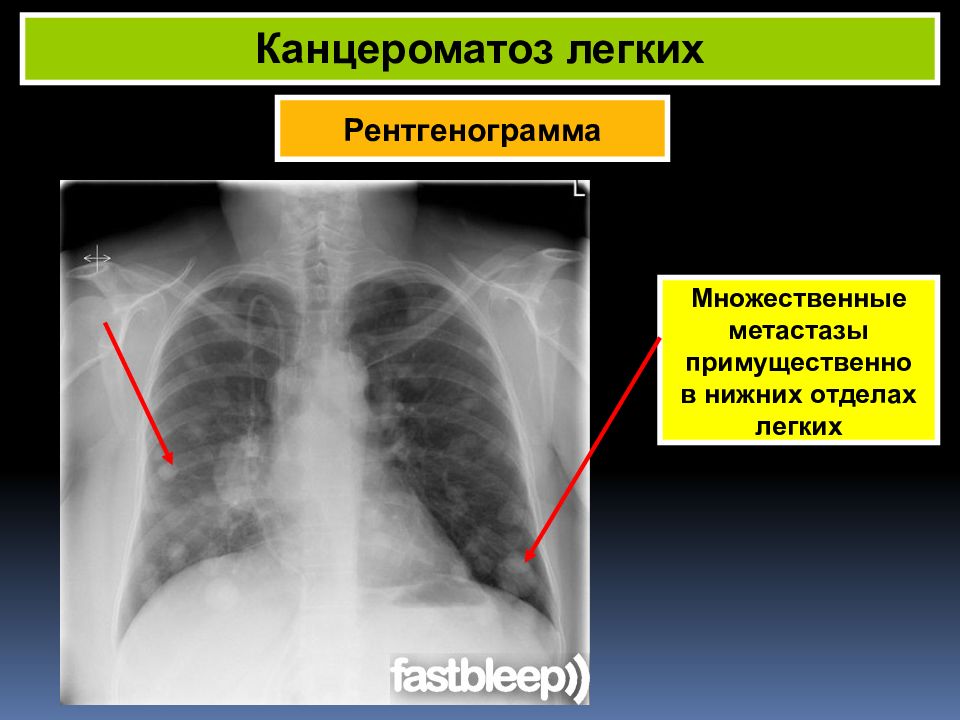 [6]
[6]
Окончательный диагноз можно поставить с помощью лапароскопии или открытой операции с биопсией. Гистология и иммуногистохимия используются для диагностики и дифференциации мезотелиомы от аденокарциномы и саркомы.
УЗИ и компьютерная томография могут быть использованы для отслеживания рецидивов.[12]
КТ и МРТ являются лучшими диагностическими методами для диагностики солитарных фиброзных опухолей сальника. Они помогают выявить разрастание фиброзной ткани в брюшной полости, оценить соотношение между опухолью и окружающими структурами и принять решение об удалении опухоли. Однако КТ и МРТ не могут отличить SFT от мезенхимальных опухолей. Поэтому его можно ошибочно диагностировать как стромальную опухоль. Аспирация иглой не помогает в диагностике, потому что опухоль состоит из бесклеточной и гиперклеточной частей и не дает достаточного количества ткани для цитологического анализа.Эппл и др. сообщили, что точный диагноз может быть поставлен с помощью тонкоигольной аспирации, но у многих пациентов это требует исследования.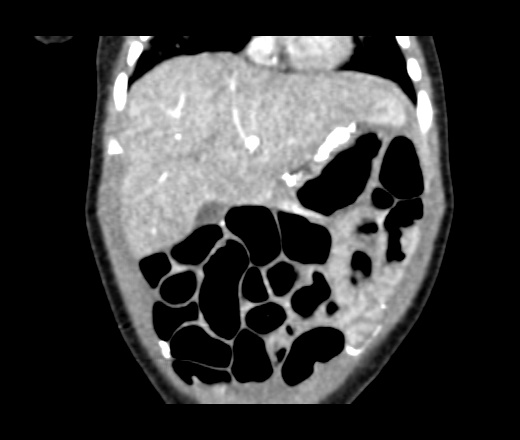 Образцы опухоли могут быть собраны через трубку Райла при небольших опухолях и с помощью диагностической лапаротомии при больших опухолях.[12]
Образцы опухоли могут быть собраны через трубку Райла при небольших опухолях и с помощью диагностической лапаротомии при больших опухолях.[12]
Диагностика SFT сальника затруднена, поскольку она напоминает другие опухоли, такие как лейомиома и мезотелиома. Более того, если опухоль на ножке возникает из сальника, ее можно принять за другие опухоли таза. Иммуногистохимия помогает установить диагноз.Эти опухоли положительны по CD34, CD99 и BCL-2, а иногда и по SMA, но обычно отрицательны по S-100, десмину и цитокератинам. SFT выглядит как сильно васкуляризированная солидная опухоль с четко очерченными краями на ультразвуковом изображении, и КТ-сканирование может показать те же результаты. Однако визуализация не является специфическим исследованием, и дооперационная диагностика становится невозможной.[7]
Лечение/управление
Радикальная резекция опухоли рекомендуется при липосаркомах; адъювантная терапия не была признана эффективным методом лечения.[4]
Полное удаление опухоли дает хороший прогноз при лейомиосаркоме сальника. Некоторые авторы использовали нестандартизированные схемы химиотерапии при нерезектабельном заболевании с переменными результатами. У пациентов с диссеминированным заболеванием также применялась мультимодальная терапия. Из-за агрессивного характера таких опухолей часто возникают рецидивы, а долгосрочная выживаемость неизвестна.[5]
Некоторые авторы использовали нестандартизированные схемы химиотерапии при нерезектабельном заболевании с переменными результатами. У пациентов с диссеминированным заболеванием также применялась мультимодальная терапия. Из-за агрессивного характера таких опухолей часто возникают рецидивы, а долгосрочная выживаемость неизвестна.[5]
SFT, как правило, доброкачественные. От 15 до 20% из них являются злокачественными, особенно опухоли размером более 10 см.Гистологические признаки, такие как высокая клеточность, высокая митотическая активность, плеоморфизм, атипия, некроз опухоли и кровоизлияние, указывают на злокачественность. Размер опухоли и митотическая активность играют важную роль в прогнозировании SFT, исходящей из сальника. Такие характеристики, как размер опухоли, митотическая активность, клеточность и плеоморфизм для прогнозирования поведения SFT, могут использоваться для оценки риска. Злокачественные факторы связаны с высокой частотой рецидивов и метастазирования.[12] Методом выбора является хирургическая резекция, однако злокачественные опухоли могут рецидивировать даже через несколько лет после операции. Полезная роль адъювантной терапии еще не установлена, но в некоторых сообщениях предполагается адъювантная лучевая терапия и показан ответ на химиотерапию, но их эффективность не доказана. Размер опухоли является хорошим прогностическим фактором, но высокая митотическая активность связана с плохим прогнозом.[7]
Полезная роль адъювантной терапии еще не установлена, но в некоторых сообщениях предполагается адъювантная лучевая терапия и показан ответ на химиотерапию, но их эффективность не доказана. Размер опухоли является хорошим прогностическим фактором, но высокая митотическая активность связана с плохим прогнозом.[7]
Радикальная резекция является методом выбора при ГИСО сальника; адъювантная терапия иматинибом после хирургической резекции при ограниченном заболевании также проводится [8]. Адъювантная терапия иматинибом может предотвратить рецидив и увеличить долгосрочную выживаемость.[14]
В отношении мезотелиомы сальника в нескольких независимых исследованиях первой и второй фаз применялась стратегия интенсивного локально-регионарного лечения, включая циторедуктивную хирургию, дополненную периоперационной гипертермической внутрибрюшинной химиотерапией. К ней также может быть добавлена ранняя послеоперационная внутрибрюшинная химиотерапия. Сообщается, что эта форма лечения в результате улучшила медиану выживаемости. Фогельзанг и др. провели многоцентровое контролируемое рандомизированное исследование III фазы, и показано, что пеметрексед-цисплатин является золотым стандартом в случае неоперабельной злокачественной мезотелиомы плевры.Это лечение дало объективный ответ при мезотелиоме сальника [11].
Фогельзанг и др. провели многоцентровое контролируемое рандомизированное исследование III фазы, и показано, что пеметрексед-цисплатин является золотым стандартом в случае неоперабельной злокачественной мезотелиомы плевры.Это лечение дало объективный ответ при мезотелиоме сальника [11].
Окончательным методом лечения SFT сальника является хирургическая резекция опухоли с отрицательным краем. Послеоперационное длительное наблюдение имеет важное значение, поскольку эти опухоли часто рецидивируют. Злокачественные опухоли агрессивны, локально инвазивны с усиленным ростом и метастазированием. Поэтому при злокачественных опухолях рекомендуется послеоперационная химиотерапия. Кроме того, половина злокачественных SFT были положительными для c-kit, и ингибиторы тирозинкиназы, такие как иматиниб и сунитиниб, которые также эффективны для GIST, также использовались для SFT.[12] Опухоль размером более 10 см имеет повышенный злокачественный потенциал, худший исход для метастазирования и повышенное количество рецидивов. [13]
[13]
Дифференциальный диагноз
Дифференциальный диагноз первичных опухолей Omentum
FibrosarComa
1
1
Липосаркома
Leioomyoma
1Lipoma
90044
Mesothelioma
Desmoid опухоль
1
Leiomyoblastoma
Эти опухоли могут быть приняты за опухоли таза, опухолей яичников и цистов.
Прогноз
Прогноз при липосаркомах туловища, в том числе внутрибрюшной области, хуже, чем при липосаркомах конечностей. В одном исследовании средняя 5-летняя выживаемость при липосаркоме туловища составила 41,9% по сравнению с конечностями, где она составила 66,7%. Прогноз также зависит от гистологического подтипа липосаркомы. Пятилетняя безрецидивная выживаемость хуже для опухолей группы высокой степени злокачественности (дедифференцированные, круглоклеточные и плеоморфные), чем для групп опухолей низкой степени злокачественности (высокодифференцированные и миксоидного типа). [4]
[4]
Из-за редкости сальниковых EGIST их злокачественный потенциал и общий прогноз трудно установить.[14] По сравнению с обычным GIST, EGIST имеет менее благоприятный прогноз, поскольку такие опухоли сопровождаются высокими митотическими индексами, большими размерами и отдаленными метастазами.[19]
Прогноз при злокачественной мезотелиоме сальника крайне неблагоприятный, поскольку эффективного лечения до сих пор не существует. Большинство пациентов умирают в течение одного года после постановки диагноза. По данным некоторых ретроспективных исследований, медиана выживаемости после операций, направленных на паллиативное лечение в сочетании с системной или внутрибрюшинной химиотерапией, составляет около одного года.У пациентов, которым была проведена агрессивная хирургия с гипертермической внутрибрюшинной химиотерапией, медиана выживаемости приблизилась к пяти годам [11].
Осложнения
У некоторых пациентов был отмечен внутрибрюшной разрыв опухоли, приводящий к острому животу.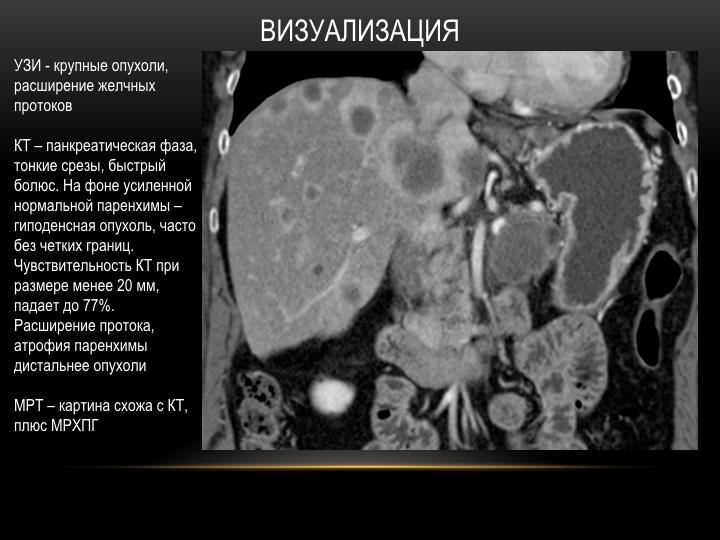 [7]
[7]
Сдерживание и просвещение пациентов
Поскольку первичные опухоли сальника встречаются редко, знаний о поведении таких опухолей все еще недостаточно, и требуется больше случаев и исследований.
Улучшение результатов медицинского персонала
Первичные опухоли сальника — это спорадические опухоли.Эти опухоли либо бессимптомны, либо признаки и симптомы проявления неспецифичны, что проявляется поздно из-за массового эффекта опухоли. Методы визуализации, такие как компьютерная томография, в значительной степени диагностируют их. Для лечения таких опухолей и улучшения результатов необходимы дополнительные исследования, чтобы узнать об этиологии, прогрессировании и лучших вариантах лечения таких опухолей. Хотя хирурги являются основными лицами, осуществляющими уход за такими пациентами, рентгенологи играют жизненно важную роль в диагностике пациентов с этими редкими опухолями.Другие задействованные медицинские работники — это поставщики медицинских услуг, занимающиеся сопутствующими заболеваниями пациентов, если они есть, медсестры, фельдшеры и реабилитационные работники, а также социальные работники, которые помогают пациентам в послеоперационном периоде..jpg)
Ссылки
- 1.
- Меза-Перес С., Рэндалл Т.Д. Иммунологические функции сальника. Тренды Иммунол. 2017 июль; 38 (7): 526-536. [Бесплатная статья PMC: PMC5812451] [PubMed: 28579319]
- 2.
- Schwartz RW, Reames M, McGrath PC, Letton RW, Appleby G, Kenady DE.Первичные солидные новообразования большого сальника. Операция. 1991 г., апрель; 109 (4): 543-9. [PubMed: 2008659]
- 3.
- Weinberger HA, Ahmed MS. Мезенхимальные солидные опухоли сальника и брыжейки: отчет о четырех случаях. Операция. 1977 г., ноябрь; 82 (5): 754-9. [PubMed:5]
- 4.
- Hashimoto S, Arai J, Nishimuta M, Matsumoto H, Fukuoka H, Muraoka M, Nakashima M, Yamaguchi H. Резекция липосаркомы большого сальника: отчет о клиническом случае и обзор литературы. Представитель Int J Surg.2019;61:20-25. [Бесплатная статья PMC: PMC6626973] [PubMed: 31306901]
- 5.
- Brañes A, Bustamante C, Valbuena J, Pimentel F, Quezada N. Первичная лейомиосаркома большого сальника: отчет о болезни.
 Отчет по делу Int J Surg 2016; 28:317-320. [Бесплатная статья PMC: PMC5079381] [PubMed: 27771602]
Отчет по делу Int J Surg 2016; 28:317-320. [Бесплатная статья PMC: PMC5079381] [PubMed: 27771602] - 6.
- Barel O, Qian C, Manolitsas T. Первичная лейомиосаркома сальника, представляющая собой карциному яичника, клинический случай и обзор литературы. Gynecol Oncol Rep. 2016 Aug;17:75-8.[Бесплатная статья PMC: PMC4949497] [PubMed: 27489871]
- 7.
- Rodriguez Tarrega E, Hidalgo Mora JJ, Paya Amate V, Vega Oomen O. Солитарная фиброзная опухоль большого сальника, имитирующая опухоль яичника у молодой женщины. Gynecol Oncol Rep. 2016 Aug; 17:16-9. [Бесплатная статья PMC: PMC4899079] [PubMed: 27354994]
- 8.
- Fagkrezos D, Toulumis Z, Giannila M, Penlidis C, Papaparaskeva K, Triantopoulou C. Внежелудочно-кишечная стромальная опухоль сальника: отчет о редком случае и Обзор литературы.Редкие опухоли. 2012 26 июня; 4(3):e44. [PMC бесплатная статья: PMC3475951] [PubMed: 23087800]
- 9.
- Соренсен Э.В., Гербер С.А., Седлачек А.Л.
 , Рыбалко В.Ю., Чан В.М., Лорд Э.М. Сальниковые иммунные агрегаты и метастазы опухоли в брюшную полость. Иммунол Рез. 2009 декабрь; 45 (2-3): 185-94. [Бесплатная статья PMC: PMC28
, Рыбалко В.Ю., Чан В.М., Лорд Э.М. Сальниковые иммунные агрегаты и метастазы опухоли в брюшную полость. Иммунол Рез. 2009 декабрь; 45 (2-3): 185-94. [Бесплатная статья PMC: PMC28] [PubMed: 19253004]
- 10.
- Joe DH, Yang JM, Kim HS, Kim SS, Choi SW, Choi SH, Lee S, Lim KW. Случай первичной лейомиосаркомы малого сальника. Корейский J Intern Med.1999 янв.; 14(1):88-90. [Бесплатная статья PMC: PMC4531912] [PubMed: 10063320]
- 11.
- Shin MK, Lee OJ, Ha CY, Min HJ, Kim TH. Злокачественная мезотелиома большого сальника, имитирующая инфаркт сальника: клинический случай. Мир J Гастроэнтерол. 2009 14 октября; 15 (38): 4856-9. [Бесплатная статья PMC: PMC2761569] [PubMed: 19824125]
- 12.
- Zong L, Chen P, Wang GY, Zhu QS. Гигантская солитарная фиброзная опухоль, возникающая из большого сальника. Мир J Гастроэнтерол. 2012 28 ноября; 18 (44): 6515-20.[Бесплатная статья PMC: PMC3508650] [PubMed: 23197901]
- 13.
- Урабе М., Ямагата Ю.
 , Айкоу С., Мори К., Ямасита Х., Номура С., Шибахара Дж., Фукаяма М., Сето Ю. Солитарная фиброзная опухоль большой сальник, имитирующий гастроинтестинальную стромальную опухоль тонкой кишки: клинический случай. инт сург. 2015 май; 100(5):836-40. [Бесплатная статья PMC: PMC4452971] [PubMed: 26011203]
, Айкоу С., Мори К., Ямасита Х., Номура С., Шибахара Дж., Фукаяма М., Сето Ю. Солитарная фиброзная опухоль большой сальник, имитирующий гастроинтестинальную стромальную опухоль тонкой кишки: клинический случай. инт сург. 2015 май; 100(5):836-40. [Бесплатная статья PMC: PMC4452971] [PubMed: 26011203] - 14.
- Тодороки Т., Сано Т., Сакураи С., Сегава А., Сайтох Т., Фудзикава К., Ямада С., Хирахара Н., Цусима Й., Мотодзима Р., Мотодзима Т. .Первичная стромальная опухоль желудочно-кишечного тракта (GIST). World J Surg Oncol. 2007 12 июня; 5:66. [Бесплатная статья PMC: PMC1924523] [PubMed: 17565683]
- 15.
- Ватс М., Пандей Д., Ахлават Х., Ахтар А., Сингх Н. Множественная первичная дедифференцированная липосаркома брыжейки тощей кишки: отчет о клиническом случае и обзор литературы. J Clin Diagn Res. 2016 Январь;10(1):XD01-XD04. [Бесплатная статья PMC: PMC4740692] [PubMed: 26894164]
- 16.
- Суфи М., Мдагри Дж., Бенамр С., Лахлоу М.К., Массрури Р.
 , Эссадель А., Мохаммадин эль-Х., Таги А., Сеттаф А., Чад Б.Гигантская липосаркома сальника, имитирующая опухоль яичника. Отчет о случае. Индийский Дж. Сург. 2012 окт; 74 (5): 425-7. [Бесплатная статья PMC: PMC3477403] [PubMed: 24082602]
, Эссадель А., Мохаммадин эль-Х., Таги А., Сеттаф А., Чад Б.Гигантская липосаркома сальника, имитирующая опухоль яичника. Отчет о случае. Индийский Дж. Сург. 2012 окт; 74 (5): 425-7. [Бесплатная статья PMC: PMC3477403] [PubMed: 24082602] - 17.
- Bouhabel S, Leblanc G, Ferreira J, Leclerc YE, Dubé P, Sidéris L. Солитарная фиброзная опухоль, возникающая в брыжейке: клинический случай. World J Surg Oncol. 2011 31 октября; 9:140. [Бесплатная статья PMC: PMC3225306] [PubMed: 22035205]
- 18.
- Meloni F, Feo CF, Profili S, Cossu ML, Meloni GB. Хорошо дифференцированная липосаркома сальника: данные УЗИ, КТ и МРТ.Int J Biomed Sci. 2009 г., сен; 5(3):302-4. [Статья бесплатно PMC: PMC3614784] [PubMed: 23675151]
- 19.
- Саваки А. Редкие желудочно-кишечные стромальные опухоли (GIST): сальник и забрюшинное пространство. Перевод Гастроэнтерол Гепатол. 2017;2:116. [Бесплатная статья PMC: PMC5762994] [PubMed: 29354773]
- 20.
- Исида Дж.
 , Исида Х., Конно К., Комацуда Т., Абэ К. Первичная лейомиосаркома большого сальника. Дж. Клин Гастроэнтерол. 1999 март; 28(2):167-70. [PubMed: 10078829]
, Исида Х., Конно К., Комацуда Т., Абэ К. Первичная лейомиосаркома большого сальника. Дж. Клин Гастроэнтерол. 1999 март; 28(2):167-70. [PubMed: 10078829] - 21.
- Цуцуми Х., Овада С., Такеёси И., Изуми М., Огава Т., Фукусато Т., Моришита Ю. Первичная липосаркома сальника с перекрутом: отчет о клиническом случае. Гепатогастроэнтерология. 1999 май-июнь;46(27):2110-2. [PubMed: 10430407]
- 22.
- Dixon AY, Reed JS, Dow N, Lee SH. Первичная сальниковая лейомиосаркома, маскирующаяся под геморрагический асцит. Хум Патол. 1984 март; 15 (3): 233-7. [PubMed: 6698542]
Опухоли сальника — StatPearls — NCBI Bookshelf
Непрерывное образование
Сальник состоит из клеток мезотелиального происхождения.Сальник проявляет ангиогенную, фиброзную, стволовые клетки и иммунную активность, ответственную за стимуляцию васкуляризации, ускоренное заживление и ограничение инфекции в брюшной полости. Эти действия также могут привести к патологическим изменениям, таким как образование опухоли сальника. В этой статье описаны эпидемиология, проявления, гистопатология, исследования и лечение первичных опухолей сальника. В этом мероприятии рассматривается оценка и лечение опухолей сальника и подчеркивается роль межпрофессиональной группы в оценке и улучшении ухода за пациентами с этим заболеванием.
В этой статье описаны эпидемиология, проявления, гистопатология, исследования и лечение первичных опухолей сальника. В этом мероприятии рассматривается оценка и лечение опухолей сальника и подчеркивается роль межпрофессиональной группы в оценке и улучшении ухода за пациентами с этим заболеванием.
Цели:
Определите эпидемиологию первичных опухолей сальника.
Опишите оценку первичных опухолей сальника.
Объясните возможные варианты лечения первичных опухолей сальника.
Пересмотреть стратегии межпрофессиональной бригады для улучшения координации помощи и коммуникации, чтобы улучшить лечение первичных опухолей сальника и улучшить результаты.
Введение
Сальник состоит из клеток мезотелиального происхождения. Говорят, что это тип висцеральной жировой ткани с общей площадью поверхности 1500 см2. Он висит перед органами брюшной полости, как фартук, а также связан с селезенкой, желудком, поджелудочной железой и толстой кишкой. Сальник проявляет ангиогенную, фиброзную, стволовые клетки и иммунную активность, ответственную за стимуляцию васкуляризации, ускоренное заживление и ограничение инфекции в брюшной полости.Эти действия также могут привести к патологическим изменениям, таким как образование опухоли сальника и метастазирование.[1] Первичные солидные опухоли большого сальника встречаются редко, всего 42 зарегистрированных случая; однако перитонеальные метастазы довольно распространены при некоторых опухолях, таких как стромальные опухоли желудочно-кишечного тракта и рак яичников.
Сальник проявляет ангиогенную, фиброзную, стволовые клетки и иммунную активность, ответственную за стимуляцию васкуляризации, ускоренное заживление и ограничение инфекции в брюшной полости.Эти действия также могут привести к патологическим изменениям, таким как образование опухоли сальника и метастазирование.[1] Первичные солидные опухоли большого сальника встречаются редко, всего 42 зарегистрированных случая; однако перитонеальные метастазы довольно распространены при некоторых опухолях, таких как стромальные опухоли желудочно-кишечного тракта и рак яичников.
Этиология
Эти опухоли являются спорадическими, и этиологические факторы, ответственные за такие опухоли, неизвестны.
Эпидемиология
Это редкие поражения, каждое из которых связано со скрытым началом.[3]
Липосаркома большого сальника — редкая опухоль; до июля 2019 г. в литературе описано 19 случаев. Девять случаев с 1936 по 2003 г., 10 случаев с 2003 по 2018 г. и один в 2019 г. Средний возраст возраст пациентов в этих отчетах о случаях был 51,1 года.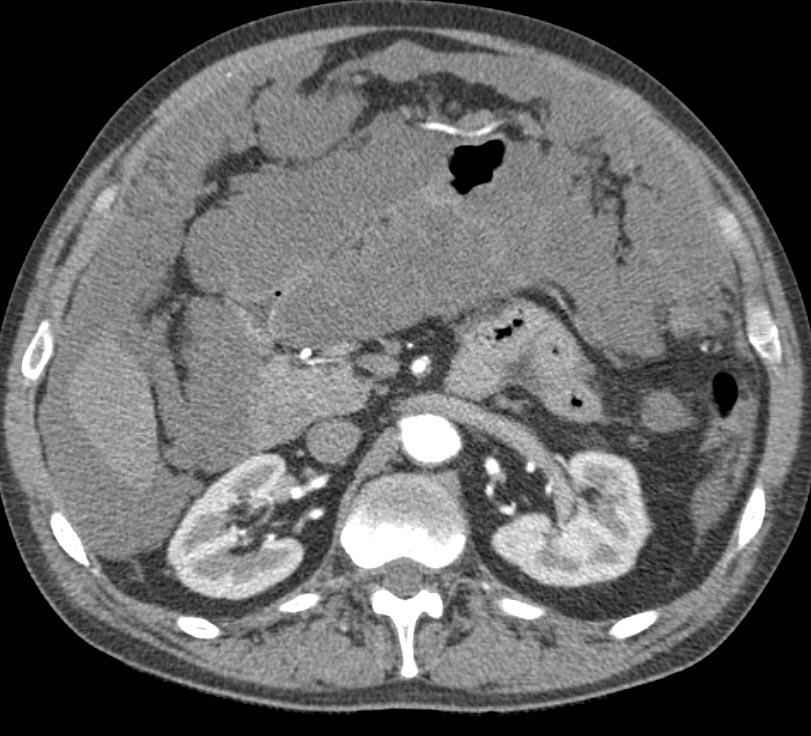 [4]
[4]
Лейомиосаркома большого сальника является редкой опухолью, и до октября 2016 г. в литературе было зарегистрировано 23 случая. Клинически эти опухоли проявляются на 5-м десятилетии жизни.[5] В то время как в другом исследовании было зарегистрировано 27 случаев.Средний возраст в этих случаях составлял 51 год, и это было немного чаще у мужчин.
Согласно сообщениям о случаях SFT (солитарных фиброзных опухолей) большого сальника, эта опухоль возникает на пятом-седьмом десятилетии жизни с соотношением мужчин и женщин 1:1.[7]
Сообщалось о 54 случаях сальниковых EGIST (внежелудочно-кишечных стромальных опухолей), и, согласно этим случаям, средний возраст на момент постановки диагноза составляет шестьдесят пять лет, а соотношение мужчин и женщин составляет 1 : 1.[8]
Патофизиология
Сальник называется депо висцерального жира. Его роль как «полицейского брюшной полости» была признана британским хирургом в начале 1900-х годов благодаря его свойствам перемещаться по брюшной полости и ограничивать инфекции и воспаления. Сальник содержит множество иммунных агрегатов, называемых «млочными пятнами», функция которых в значительной степени неизвестна. Говорят, что как свободные иммунные клетки, так и опухолевые клетки связываются с этими агрегатами.[9]
Сальник содержит множество иммунных агрегатов, называемых «млочными пятнами», функция которых в значительной степени неизвестна. Говорят, что как свободные иммунные клетки, так и опухолевые клетки связываются с этими агрегатами.[9]
Все первичные опухоли сальника являются спорадическими и обычно злокачественными.[10] Но метастатические поражения распространены. Сообщаемые первичные опухоли сальника включают фибросаркому, веретеноклеточную саркому, липосаркому, лейомиому, гемангиоперицитому, липому и десмоидную опухоль, фиброму, мезотелиому, миосаркому, рабдомиосаркому, лейомиобластому и эндотелиому. Эти опухоли происходят из различных элементов, из которых состоит сальник, таких как жировая ткань, сосуды и лимфатическая ткань.
Первичная лейомиосаркома сальника — очень редкая опухоль; чаще лейомиосаркомы возникают в гладкомышечных клетках желудочно-кишечного тракта, забрюшинного пространства и мочеполового тракта.[10] Из-за низкой частоты лейомиосаркомы сальника мало что известно о происхождении и поведении этих опухолей. [5]
[5]
Солитарная фиброзная опухоль (SFT), ранее называвшаяся гемангиоперицитомой, представляет собой редкую мезенхимальную опухоль [7], часто происходящую из плевры; вовлечение сальника очень редко. От 78% до 88% этих опухолей являются доброкачественными, а от 12% до 22% злокачественными.[12] До 2015 года в литературе было описано только 6 случаев SFT, возникающих из большого или малого сальника.[13]
GIST (желудочно-кишечные стромальные опухоли) представляют собой мезенхимальные опухоли, возникающие из стенки желудочно-кишечного тракта, в основном из желудка. Однако редко они могут возникать из сальника, что обозначается как экстрагастроинтестинальные стромальные опухоли (EGIST). GIST и EGIST сходны гистопатологически и иммуногистохимически; оба экспрессируют мутации KIT/PDGFRA с усилением функции. Поскольку эти опухоли являются спорадическими, их злокачественный потенциал установить невозможно.[14] Сакураи и др. сообщили о клетках Кахаля, таких как клетки CD117+ и CD34+, в нормальном сальнике, из которых теоретически могут возникать EGIST.
Липосаркомы обычно возникают из глубоких мягких тканей конечностей, и это наиболее распространенная саркома мягких тканей.[15] Интраабдоминальные локализации редки, и они редко исходят из большого сальника.
Злокачественная мезотелиома обычно возникает из плевры и брюшной полости, но редко может возникать из большого сальника. Его связь с асбестом менее очевидна по сравнению с мезотелиомой плевры.[11]
Гистопатология
Гистопатология зависит от типа опухоли. Эмбриологическое происхождение этих опухолей различается, поскольку сальник состоит из различных тканей, таких как сосуды, лимфатические и жировые ткани.
Первичная лейомиосаркома сальника при гистологическом исследовании может показать длинные веретенообразные клетки с высоким митотическим индексом наряду с участками коагуляционного некроза опухоли и миксоидными изменениями; иммуногистохимия может быть положительной для десмина и актина гладких мышц и резко отрицательной для S100 и CD34, как при лейомиосаркоме. [5][6]
[5][6]
SFT получают из мезенхимальных клеток; он в основном состоит из веретенообразных клеток и пучков коллагена. В литературе существует путаница в отношении происхождения и классификации SFT, поскольку гемангиоперицитомы (HPC) и SFT имеют много общих патологических находок; теперь они считаются частью одного и того же объекта.[17] При иммуногистохимическом окрашивании эти опухоли оказались отрицательными по следующим маркерам CD117, цитокератину, кальретинину, CD99, CD68, десмину, F8, S-100, антигену эпителиальной мембраны.Эти опухоли положительны по CD34, α-актину гладких мышц (α-SMA), BCL-2 и виментину (VIM) [12]. CD34 является полезным положительным биомаркером для SFT; несколько исследований показали 100% положительный результат.[13]
По данным ВОЗ, липосаркома подразделяется на пять типов: высокодифференцированная, плеоморфная, круглоклеточная, миксоидная и дедифференцированная.[15] Липосаркома часто может иметь доброкачественные и злокачественные участки.[4] Прогноз этих опухолей зависит от гистологического типа [16]; дедифференцированный подтип имеет худший прогноз и высокую частоту рецидивов. [18] Хорошо дифференцированная липосаркома имеет толстые перегородки, размер поражения >10 см, содержит глобулярные нежировые области и компонент поражения <75% жира.[4]
[18] Хорошо дифференцированная липосаркома имеет толстые перегородки, размер поражения >10 см, содержит глобулярные нежировые области и компонент поражения <75% жира.[4]
Происхождение экстрагастроинтестинальных стромальных опухолей (EGIST) полностью не известно, но их гистология и иммунофенотип сходны с GIST. Считается, что это GIST, которые были отделены от желудочно-кишечного тракта, или они могут возникать из мезенхимальных клеток сальника [8]. EGIST, как и GIST, обычно положительны для KIT, альфа-актина гладких мышц и отрицательны для десмина и белка s-100.Показано, что эти опухоли, сходные с ГИСО, состоят из удлиненных веретенообразных клеток, эпителиоидных клеток или смешанных клеток с высокой клеточностью и низкой митотической активностью.[19]
Гистологическое исследование мезотелиомы сальника может выявить эпителиальную, саркоматоидную или двухфазную структуру. Опухоли эпителиального типа составляют 75% случаев и варьируют от хорошо дифференцированных с тубуло-папиллярным рисунком до сплошных пластов круглых или полигональных клеток. Такие опухоли могут имитировать карциному, и бывает трудно отличить эпителиоидную мезотелиому от метастатической карциномы, особенно аденокарциномы.Опухоли саркоматоидного типа могут быть неотличимы от фибросарком только по гистологическим данным. Иммуногистохимия может помочь дифференцировать саркому и аденокарциному. Эти опухолевые клетки положительны на кальретинин, цитокератин и антиген эпителиальной мембраны и отрицательны на белок S-100, Leu-M1, CEA, тромбомодулин и плацентарную щелочную фосфатазу, положительная иммунореактивность на кальретинин значительно повышает точность диагноза.
Такие опухоли могут имитировать карциному, и бывает трудно отличить эпителиоидную мезотелиому от метастатической карциномы, особенно аденокарциномы.Опухоли саркоматоидного типа могут быть неотличимы от фибросарком только по гистологическим данным. Иммуногистохимия может помочь дифференцировать саркому и аденокарциному. Эти опухолевые клетки положительны на кальретинин, цитокератин и антиген эпителиальной мембраны и отрицательны на белок S-100, Leu-M1, CEA, тромбомодулин и плацентарную щелочную фосфатазу, положительная иммунореактивность на кальретинин значительно повышает точность диагноза.
Анамнез и физикальное исследование
Первичные опухоли сальника в основном протекают бессимптомно, но у большинства пациентов отмечают дискомфорт в животе, пальпируемое образование в животе, тошноту, быстрое чувство насыщения и потерю веса.[11] Другие симптомы, основанные на различных сообщениях о случаях, представленных в литературе, включают боль в животе, вздутие живота, запор, анорексию, рвоту и лихорадку. [4][6][12][7] Физикальное обследование может выявить пальпацию безболезненного образования в брюшной полости, баллотируемого сбоку, на основании описаний случаев в доступной литературе; масса может пальпироваться в эпигастрии, гипогастрии, верхнем или нижнем правом или левом квадранте или вовлекать всю брюшную полость. [17]
[4][6][12][7] Физикальное обследование может выявить пальпацию безболезненного образования в брюшной полости, баллотируемого сбоку, на основании описаний случаев в доступной литературе; масса может пальпироваться в эпигастрии, гипогастрии, верхнем или нижнем правом или левом квадранте или вовлекать всю брюшную полость. [17]
У пациентов также может наблюдаться болезненность новообразования, и при осмотре живота может наблюдаться настороженность.[21] В некоторых отчетах о случаях у пациентов также был асцит.[6] Пациенты с асцитом, потерей веса и перитонеальными имплантатами обычно указывают на злокачественное новообразование. Наиболее частыми клиническими проявлениями первичной опухоли сальника являются абдоминальный дискомфорт (56%) и объемное образование (35%) [2]. В одном отчете о случае у пациента была диффузная боль в животе без пальпируемого образования при физикальном обследовании , в то время как в другом отчете о случае пациент с первичной лейомиосаркомой имел необъяснимые геморрагические псевдоасциты. [5][22] Хотя симптомы в значительной степени неспецифичны, они также могут проявляться как случайные находки при визуализации.[5] EGIST сальника могут оставаться клинически бессимптомными, несмотря на огромный размер опухоли.[8]
[5][22] Хотя симптомы в значительной степени неспецифичны, они также могут проявляться как случайные находки при визуализации.[5] EGIST сальника могут оставаться клинически бессимптомными, несмотря на огромный размер опухоли.[8]
Оценка
Диагностика липосаркомы является сложной задачей, и ее трудно дифференцировать от других опухолей. Внешний вид хорошо дифференцированной липосаркомы на КТ и МРТ похож на жировую и другие опухоли брюшной полости.[4]
Дооперационный диагноз первичной лейомиосаркомы сальника затруднен, и диагноз обычно ставится после операции. Точный диагноз ставится только при гистологическом исследовании опухоли.[6]
Внутривенная КТ брюшной полости и таза и МРТ являются лучшими методами визуализации для диагностики лейомиосаркомы сальника. Он может дать точную информацию о происхождении опухоли. Эти поражения в большинстве случаев имеют сходные визуализационные характеристики, представляя собой солидно-кистозную и многодольчатую опухоль [5]. Ультразвук может обнаружить опухоль и показать внутреннюю структуру поражения, но не может определить происхождение. Иногда эти опухоли сопровождаются асцитом и повышенным уровнем СА-125, что может свидетельствовать о раке яичников.[6]
Ультразвук может обнаружить опухоль и показать внутреннюю структуру поражения, но не может определить происхождение. Иногда эти опухоли сопровождаются асцитом и повышенным уровнем СА-125, что может свидетельствовать о раке яичников.[6]
Рентгенологические особенности сальниковых ЭГИСТ, не имеющих миогенной и нейрогенной дифференцировки, не установлены. Они могут быть похожи на сальниковую лейомиому и лейомиосаркому. Большинство ГИСО с миогенными признаками гиперваскуляризированы и имеют четкие границы на КТ и ангиографии.[8]
Согласно Ishida (1998), компьютерная томография является методом выбора при больших оментальных опухолях. На КТ такие опухоли обычно многодольчатые, плоские, блинообразные, с усилением солидной и мультикистозной плотности.Ангиография является полезным исследованием в диагностике опухолей сальника. Диагноз опухоли сальника ставится, когда артерия, питающая опухоль, отходит от сальникового кровоснабжения. Высоковаскулярное поражение с неоваскуляризацией, скорее всего, означает злокачественную опухоль.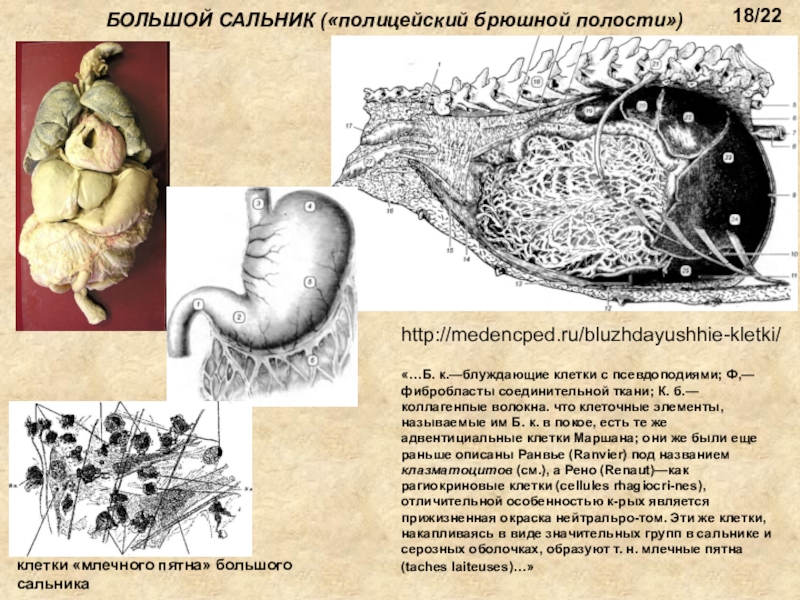 [6]
[6]
Окончательный диагноз можно поставить с помощью лапароскопии или открытой операции с биопсией. Гистология и иммуногистохимия используются для диагностики и дифференциации мезотелиомы от аденокарциномы и саркомы.
УЗИ и компьютерная томография могут быть использованы для отслеживания рецидивов.[12]
КТ и МРТ являются лучшими диагностическими методами для диагностики солитарных фиброзных опухолей сальника. Они помогают выявить разрастание фиброзной ткани в брюшной полости, оценить соотношение между опухолью и окружающими структурами и принять решение об удалении опухоли. Однако КТ и МРТ не могут отличить SFT от мезенхимальных опухолей. Поэтому его можно ошибочно диагностировать как стромальную опухоль. Аспирация иглой не помогает в диагностике, потому что опухоль состоит из бесклеточной и гиперклеточной частей и не дает достаточного количества ткани для цитологического анализа.Эппл и др. сообщили, что точный диагноз может быть поставлен с помощью тонкоигольной аспирации, но у многих пациентов это требует исследования. Образцы опухоли могут быть собраны через трубку Райла при небольших опухолях и с помощью диагностической лапаротомии при больших опухолях.[12]
Образцы опухоли могут быть собраны через трубку Райла при небольших опухолях и с помощью диагностической лапаротомии при больших опухолях.[12]
Диагностика SFT сальника затруднена, поскольку она напоминает другие опухоли, такие как лейомиома и мезотелиома. Более того, если опухоль на ножке возникает из сальника, ее можно принять за другие опухоли таза. Иммуногистохимия помогает установить диагноз.Эти опухоли положительны по CD34, CD99 и BCL-2, а иногда и по SMA, но обычно отрицательны по S-100, десмину и цитокератинам. SFT выглядит как сильно васкуляризированная солидная опухоль с четко очерченными краями на ультразвуковом изображении, и КТ-сканирование может показать те же результаты. Однако визуализация не является специфическим исследованием, и дооперационная диагностика становится невозможной.[7]
Лечение/управление
Радикальная резекция опухоли рекомендуется при липосаркомах; адъювантная терапия не была признана эффективным методом лечения.[4]
Полное удаление опухоли дает хороший прогноз при лейомиосаркоме сальника. Некоторые авторы использовали нестандартизированные схемы химиотерапии при нерезектабельном заболевании с переменными результатами. У пациентов с диссеминированным заболеванием также применялась мультимодальная терапия. Из-за агрессивного характера таких опухолей часто возникают рецидивы, а долгосрочная выживаемость неизвестна.[5]
Некоторые авторы использовали нестандартизированные схемы химиотерапии при нерезектабельном заболевании с переменными результатами. У пациентов с диссеминированным заболеванием также применялась мультимодальная терапия. Из-за агрессивного характера таких опухолей часто возникают рецидивы, а долгосрочная выживаемость неизвестна.[5]
SFT, как правило, доброкачественные. От 15 до 20% из них являются злокачественными, особенно опухоли размером более 10 см.Гистологические признаки, такие как высокая клеточность, высокая митотическая активность, плеоморфизм, атипия, некроз опухоли и кровоизлияние, указывают на злокачественность. Размер опухоли и митотическая активность играют важную роль в прогнозировании SFT, исходящей из сальника. Такие характеристики, как размер опухоли, митотическая активность, клеточность и плеоморфизм для прогнозирования поведения SFT, могут использоваться для оценки риска. Злокачественные факторы связаны с высокой частотой рецидивов и метастазирования.[12] Методом выбора является хирургическая резекция, однако злокачественные опухоли могут рецидивировать даже через несколько лет после операции. Полезная роль адъювантной терапии еще не установлена, но в некоторых сообщениях предполагается адъювантная лучевая терапия и показан ответ на химиотерапию, но их эффективность не доказана. Размер опухоли является хорошим прогностическим фактором, но высокая митотическая активность связана с плохим прогнозом.[7]
Полезная роль адъювантной терапии еще не установлена, но в некоторых сообщениях предполагается адъювантная лучевая терапия и показан ответ на химиотерапию, но их эффективность не доказана. Размер опухоли является хорошим прогностическим фактором, но высокая митотическая активность связана с плохим прогнозом.[7]
Радикальная резекция является методом выбора при ГИСО сальника; адъювантная терапия иматинибом после хирургической резекции при ограниченном заболевании также проводится [8]. Адъювантная терапия иматинибом может предотвратить рецидив и увеличить долгосрочную выживаемость.[14]
В отношении мезотелиомы сальника в нескольких независимых исследованиях первой и второй фаз применялась стратегия интенсивного локально-регионарного лечения, включая циторедуктивную хирургию, дополненную периоперационной гипертермической внутрибрюшинной химиотерапией. К ней также может быть добавлена ранняя послеоперационная внутрибрюшинная химиотерапия. Сообщается, что эта форма лечения в результате улучшила медиану выживаемости. Фогельзанг и др. провели многоцентровое контролируемое рандомизированное исследование III фазы, и показано, что пеметрексед-цисплатин является золотым стандартом в случае неоперабельной злокачественной мезотелиомы плевры.Это лечение дало объективный ответ при мезотелиоме сальника [11].
Фогельзанг и др. провели многоцентровое контролируемое рандомизированное исследование III фазы, и показано, что пеметрексед-цисплатин является золотым стандартом в случае неоперабельной злокачественной мезотелиомы плевры.Это лечение дало объективный ответ при мезотелиоме сальника [11].
Окончательным методом лечения SFT сальника является хирургическая резекция опухоли с отрицательным краем. Послеоперационное длительное наблюдение имеет важное значение, поскольку эти опухоли часто рецидивируют. Злокачественные опухоли агрессивны, локально инвазивны с усиленным ростом и метастазированием. Поэтому при злокачественных опухолях рекомендуется послеоперационная химиотерапия. Кроме того, половина злокачественных SFT были положительными для c-kit, и ингибиторы тирозинкиназы, такие как иматиниб и сунитиниб, которые также эффективны для GIST, также использовались для SFT.[12] Опухоль размером более 10 см имеет повышенный злокачественный потенциал, худший исход для метастазирования и повышенное количество рецидивов. [13]
[13]
Дифференциальный диагноз
Дифференциальный диагноз первичных опухолей Omentum
FibrosarComa
1
1
Липосаркома
Leioomyoma
1Lipoma
90044
Mesothelioma
Desmoid опухоль
1
Leiomyoblastoma
Эти опухоли могут быть приняты за опухоли таза, опухолей яичников и цистов.
Прогноз
Прогноз при липосаркомах туловища, в том числе внутрибрюшной области, хуже, чем при липосаркомах конечностей. В одном исследовании средняя 5-летняя выживаемость при липосаркоме туловища составила 41,9% по сравнению с конечностями, где она составила 66,7%. Прогноз также зависит от гистологического подтипа липосаркомы. Пятилетняя безрецидивная выживаемость хуже для опухолей группы высокой степени злокачественности (дедифференцированные, круглоклеточные и плеоморфные), чем для групп опухолей низкой степени злокачественности (высокодифференцированные и миксоидного типа). [4]
[4]
Из-за редкости сальниковых EGIST их злокачественный потенциал и общий прогноз трудно установить.[14] По сравнению с обычным GIST, EGIST имеет менее благоприятный прогноз, поскольку такие опухоли сопровождаются высокими митотическими индексами, большими размерами и отдаленными метастазами.[19]
Прогноз при злокачественной мезотелиоме сальника крайне неблагоприятный, поскольку эффективного лечения до сих пор не существует. Большинство пациентов умирают в течение одного года после постановки диагноза. По данным некоторых ретроспективных исследований, медиана выживаемости после операций, направленных на паллиативное лечение в сочетании с системной или внутрибрюшинной химиотерапией, составляет около одного года.У пациентов, которым была проведена агрессивная хирургия с гипертермической внутрибрюшинной химиотерапией, медиана выживаемости приблизилась к пяти годам [11].
Осложнения
У некоторых пациентов был отмечен внутрибрюшной разрыв опухоли, приводящий к острому животу. [7]
[7]
Сдерживание и просвещение пациентов
Поскольку первичные опухоли сальника встречаются редко, знаний о поведении таких опухолей все еще недостаточно, и требуется больше случаев и исследований.
Улучшение результатов медицинского персонала
Первичные опухоли сальника — это спорадические опухоли.Эти опухоли либо бессимптомны, либо признаки и симптомы проявления неспецифичны, что проявляется поздно из-за массового эффекта опухоли. Методы визуализации, такие как компьютерная томография, в значительной степени диагностируют их. Для лечения таких опухолей и улучшения результатов необходимы дополнительные исследования, чтобы узнать об этиологии, прогрессировании и лучших вариантах лечения таких опухолей. Хотя хирурги являются основными лицами, осуществляющими уход за такими пациентами, рентгенологи играют жизненно важную роль в диагностике пациентов с этими редкими опухолями.Другие задействованные медицинские работники — это поставщики медицинских услуг, занимающиеся сопутствующими заболеваниями пациентов, если они есть, медсестры, фельдшеры и реабилитационные работники, а также социальные работники, которые помогают пациентам в послеоперационном периоде.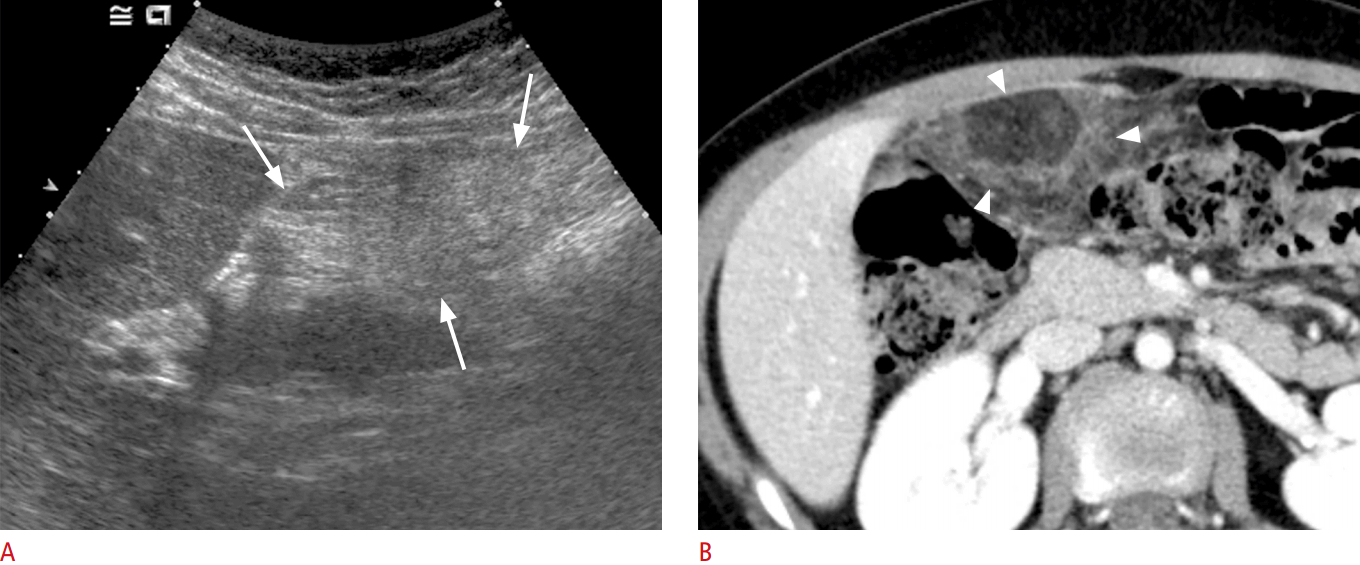
Ссылки
- 1.
- Меза-Перес С., Рэндалл Т.Д. Иммунологические функции сальника. Тренды Иммунол. 2017 июль; 38 (7): 526-536. [Бесплатная статья PMC: PMC5812451] [PubMed: 28579319]
- 2.
- Schwartz RW, Reames M, McGrath PC, Letton RW, Appleby G, Kenady DE.Первичные солидные новообразования большого сальника. Операция. 1991 г., апрель; 109 (4): 543-9. [PubMed: 2008659]
- 3.
- Weinberger HA, Ahmed MS. Мезенхимальные солидные опухоли сальника и брыжейки: отчет о четырех случаях. Операция. 1977 г., ноябрь; 82 (5): 754-9. [PubMed:5]
- 4.
- Hashimoto S, Arai J, Nishimuta M, Matsumoto H, Fukuoka H, Muraoka M, Nakashima M, Yamaguchi H. Резекция липосаркомы большого сальника: отчет о клиническом случае и обзор литературы. Представитель Int J Surg.2019;61:20-25. [Бесплатная статья PMC: PMC6626973] [PubMed: 31306901]
- 5.
- Brañes A, Bustamante C, Valbuena J, Pimentel F, Quezada N. Первичная лейомиосаркома большого сальника: отчет о болезни.
 Отчет по делу Int J Surg 2016; 28:317-320. [Бесплатная статья PMC: PMC5079381] [PubMed: 27771602]
Отчет по делу Int J Surg 2016; 28:317-320. [Бесплатная статья PMC: PMC5079381] [PubMed: 27771602] - 6.
- Barel O, Qian C, Manolitsas T. Первичная лейомиосаркома сальника, представляющая собой карциному яичника, клинический случай и обзор литературы. Gynecol Oncol Rep. 2016 Aug;17:75-8.[Бесплатная статья PMC: PMC4949497] [PubMed: 27489871]
- 7.
- Rodriguez Tarrega E, Hidalgo Mora JJ, Paya Amate V, Vega Oomen O. Солитарная фиброзная опухоль большого сальника, имитирующая опухоль яичника у молодой женщины. Gynecol Oncol Rep. 2016 Aug; 17:16-9. [Бесплатная статья PMC: PMC4899079] [PubMed: 27354994]
- 8.
- Fagkrezos D, Toulumis Z, Giannila M, Penlidis C, Papaparaskeva K, Triantopoulou C. Внежелудочно-кишечная стромальная опухоль сальника: отчет о редком случае и Обзор литературы.Редкие опухоли. 2012 26 июня; 4(3):e44. [PMC бесплатная статья: PMC3475951] [PubMed: 23087800]
- 9.
- Соренсен Э.В., Гербер С.А., Седлачек А.Л.
 , Рыбалко В.Ю., Чан В.М., Лорд Э.М. Сальниковые иммунные агрегаты и метастазы опухоли в брюшную полость. Иммунол Рез. 2009 декабрь; 45 (2-3): 185-94. [Бесплатная статья PMC: PMC28
, Рыбалко В.Ю., Чан В.М., Лорд Э.М. Сальниковые иммунные агрегаты и метастазы опухоли в брюшную полость. Иммунол Рез. 2009 декабрь; 45 (2-3): 185-94. [Бесплатная статья PMC: PMC28] [PubMed: 19253004]
- 10.
- Joe DH, Yang JM, Kim HS, Kim SS, Choi SW, Choi SH, Lee S, Lim KW. Случай первичной лейомиосаркомы малого сальника. Корейский J Intern Med.1999 янв.; 14(1):88-90. [Бесплатная статья PMC: PMC4531912] [PubMed: 10063320]
- 11.
- Shin MK, Lee OJ, Ha CY, Min HJ, Kim TH. Злокачественная мезотелиома большого сальника, имитирующая инфаркт сальника: клинический случай. Мир J Гастроэнтерол. 2009 14 октября; 15 (38): 4856-9. [Бесплатная статья PMC: PMC2761569] [PubMed: 19824125]
- 12.
- Zong L, Chen P, Wang GY, Zhu QS. Гигантская солитарная фиброзная опухоль, возникающая из большого сальника. Мир J Гастроэнтерол. 2012 28 ноября; 18 (44): 6515-20.[Бесплатная статья PMC: PMC3508650] [PubMed: 23197901]
- 13.
- Урабе М., Ямагата Ю.
 , Айкоу С., Мори К., Ямасита Х., Номура С., Шибахара Дж., Фукаяма М., Сето Ю. Солитарная фиброзная опухоль большой сальник, имитирующий гастроинтестинальную стромальную опухоль тонкой кишки: клинический случай. инт сург. 2015 май; 100(5):836-40. [Бесплатная статья PMC: PMC4452971] [PubMed: 26011203]
, Айкоу С., Мори К., Ямасита Х., Номура С., Шибахара Дж., Фукаяма М., Сето Ю. Солитарная фиброзная опухоль большой сальник, имитирующий гастроинтестинальную стромальную опухоль тонкой кишки: клинический случай. инт сург. 2015 май; 100(5):836-40. [Бесплатная статья PMC: PMC4452971] [PubMed: 26011203] - 14.
- Тодороки Т., Сано Т., Сакураи С., Сегава А., Сайтох Т., Фудзикава К., Ямада С., Хирахара Н., Цусима Й., Мотодзима Р., Мотодзима Т. .Первичная стромальная опухоль желудочно-кишечного тракта (GIST). World J Surg Oncol. 2007 12 июня; 5:66. [Бесплатная статья PMC: PMC1924523] [PubMed: 17565683]
- 15.
- Ватс М., Пандей Д., Ахлават Х., Ахтар А., Сингх Н. Множественная первичная дедифференцированная липосаркома брыжейки тощей кишки: отчет о клиническом случае и обзор литературы. J Clin Diagn Res. 2016 Январь;10(1):XD01-XD04. [Бесплатная статья PMC: PMC4740692] [PubMed: 26894164]
- 16.
- Суфи М., Мдагри Дж., Бенамр С., Лахлоу М.К., Массрури Р.
 , Эссадель А., Мохаммадин эль-Х., Таги А., Сеттаф А., Чад Б.Гигантская липосаркома сальника, имитирующая опухоль яичника. Отчет о случае. Индийский Дж. Сург. 2012 окт; 74 (5): 425-7. [Бесплатная статья PMC: PMC3477403] [PubMed: 24082602]
, Эссадель А., Мохаммадин эль-Х., Таги А., Сеттаф А., Чад Б.Гигантская липосаркома сальника, имитирующая опухоль яичника. Отчет о случае. Индийский Дж. Сург. 2012 окт; 74 (5): 425-7. [Бесплатная статья PMC: PMC3477403] [PubMed: 24082602] - 17.
- Bouhabel S, Leblanc G, Ferreira J, Leclerc YE, Dubé P, Sidéris L. Солитарная фиброзная опухоль, возникающая в брыжейке: клинический случай. World J Surg Oncol. 2011 31 октября; 9:140. [Бесплатная статья PMC: PMC3225306] [PubMed: 22035205]
- 18.
- Meloni F, Feo CF, Profili S, Cossu ML, Meloni GB. Хорошо дифференцированная липосаркома сальника: данные УЗИ, КТ и МРТ.Int J Biomed Sci. 2009 г., сен; 5(3):302-4. [Статья бесплатно PMC: PMC3614784] [PubMed: 23675151]
- 19.
- Саваки А. Редкие желудочно-кишечные стромальные опухоли (GIST): сальник и забрюшинное пространство. Перевод Гастроэнтерол Гепатол. 2017;2:116. [Бесплатная статья PMC: PMC5762994] [PubMed: 29354773]
- 20.
- Исида Дж.
 , Исида Х., Конно К., Комацуда Т., Абэ К. Первичная лейомиосаркома большого сальника. Дж. Клин Гастроэнтерол. 1999 март; 28(2):167-70. [PubMed: 10078829]
, Исида Х., Конно К., Комацуда Т., Абэ К. Первичная лейомиосаркома большого сальника. Дж. Клин Гастроэнтерол. 1999 март; 28(2):167-70. [PubMed: 10078829] - 21.
- Цуцуми Х., Овада С., Такеёси И., Изуми М., Огава Т., Фукусато Т., Моришита Ю. Первичная липосаркома сальника с перекрутом: отчет о клиническом случае. Гепатогастроэнтерология. 1999 май-июнь;46(27):2110-2. [PubMed: 10430407]
- 22.
- Dixon AY, Reed JS, Dow N, Lee SH. Первичная сальниковая лейомиосаркома, маскирующаяся под геморрагический асцит. Хум Патол. 1984 март; 15 (3): 233-7. [PubMed: 6698542]
Солидные опухоли сальника: основы практики, анатомия, патофизиология
Исида Х., Исида Дж.Первичные опухоли большого сальника. Евро Радиол . 1998. 8 (9): 1598-601. [Медлайн].
Имачи М., Цукамото Н., Цукимори К., Фунакоши К., Накано Х., Шигемацу Т. и др. Злокачественная гемангиоперицитома сальника в виде опухоли яичника. Гинекол Онкол . 1990 39 ноября (2): 208-13. [Медлайн].
Гинекол Онкол . 1990 39 ноября (2): 208-13. [Медлайн].
Хашимото С., Араи Дж., Нишимута М., Мацумото Х., Фукуока Х., Мураока М. и др. Резекция липосаркомы большого сальника: клинический случай и обзор литературы. Дело J Surg Rep . 2019. 61:20-25. [Медлайн]. [Полный текст].
Окамото К., Окада Ю., Оно К., Яги Т., Цукамото М., Акаханэ Т. и др. Редкий случай периваскулярной эпителиоидно-клеточной опухоли (ПЭКома) большого сальника. World J Surg Oncol . 2018 19 июня. 16 (1): 113. [Медлайн]. [Полный текст].
Тераи Т., Накагава К., Накамура К., Дои С., Морита К., Обаяши С. и др. Нейроэндокринная опухоль, возникающая из большого сальника, леченная лапароскопической резекцией опухоли: клинический случай. Респ. кейса Surg . 2021 1 июня 7 (1): 132. [Медлайн]. [Полный текст].
фон Мерен М., Уотсон Дж.К. Гастроинтестинальные стромальные опухоли. Hematol Oncol Clin North Am . 2005 19 июня (3): 547-64, vii. [Медлайн].
Ислам С., Хосейн Д., Бхим В., Харнараян П. Первичный ГИСО большого сальника с острым внутрибрюшным кровотечением. BMJ Case Rep . 2017 18 июля. 2017: [Medline].
Нанджо К., Нисимута Ю., Миясака М., Шинозаки К., Цурумару Д., Исигами К.Случай КИТ-негативной внежелудочной стромальной опухоли, возникшей в большом сальнике с преимущественным кистозным образованием. Кейс Radiol Rep . 2021 16 августа (8): 2315-2318. [Медлайн]. [Полный текст].
Кимура Х., Маэда К., Кониси К., Цунэда А., Тадзава К., Эраши М. и др. Первичная лейомиосаркома, возникающая в малом мешочке: отчет о случае. Surg Сегодня . 1997. 27 (7): 672-5. [Медлайн].
Surg Сегодня . 1997. 27 (7): 672-5. [Медлайн].
Нива К., Хашимото М., Хирано С., Мори Х., Тамая Т.Первичная лейомиосаркома, возникающая из большого сальника у 15-летней девочки. Гинекол Онкол . 1999 авг. 74 (2): 308-10. [Медлайн].
Исида Дж., Исида Х., Конно К., Комацуда Т., Абэ К. Первичная лейомиосаркома большого сальника. J Клин Гастроэнтерол . 1999 28 марта (2): 167-70. [Медлайн].
Рао С.Р., Рао Р.С., Сампат МБ. Гемангиоперицитома большого сальника. Индийский J Гастроэнтерол . 2000 январь-март.19 (1):33-5. [Медлайн].
Шиба Х., Мисава Т., Кобаяши С., Ёкота Т., Сон К., Янага К. Гемангиоперицитома большого сальника. J Gastrointest Surg . 2007 11 апреля (4): 549-51. [Медлайн].
Биб М.М., Смит М.Д.Сальниковая липобластома. J Pediatr Surg . 1993 28 декабря (12): 1626-7. [Медлайн].
Алам К., Махешвари В., Сабир Ф., Хак М.Е., Сиддики Ф.А., Мефузуддин С. Гломусная опухоль малого сальника — клинический случай. Indian J Pathol Microbiol . 2007 г. 50 июля (3): 543-4. [Медлайн].
Наик Р., Балига П.Б., Пай М.Р., Наяк К.С., Шанкарнараянан. Доброкачественная тератома малого сальника — клинический случай. Indian J Pathol Microbiol . 2003 июль.46 (3): 461-3. [Медлайн].
Бавискар Б.П., Донгре С. Д., Карле Р.Р., Севликар В.Н. Тератома малого сальника у младенца мужского пола. J Postgrad Med . 2006 окт.-дек. 52 (4): 304-5. [Медлайн]. [Полный текст].
Д., Карле Р.Р., Севликар В.Н. Тератома малого сальника у младенца мужского пола. J Postgrad Med . 2006 окт.-дек. 52 (4): 304-5. [Медлайн]. [Полный текст].
Каннеганти А., Бхадираджу П., Тонг П.С.И. Внегонадные тератомы у женщин и девочек-подростков: систематический обзор. Eur J Obstet Gynecol Reprod Biol . 2021 июль 262: 134-141. [Медлайн].
Герцану Ю., Мендельсон Д.Б., Мюррей Дж.Ф.Лейомиобластома сальника. Отчет о случае. S Afr Med J . 1982, 21 августа. 62(9):297-8. [Медлайн].
Mahon DE, Carp NZ, Goldhahn RT Jr, Schmutzler RC 3rd. Первичная лейомиосаркома большого сальника: клинический случай и обзор литературы. Am Surg . 1993 март 59 (3): 160-3. [Медлайн].
Мацуо С., Сусуму С., Цуцуми Р., Адзума Т. , Обата С., Хаяши Т. Гломусная опухоль сальника: история болезни. J Surg Oncol .2007 1 декабря. 96 (7): 633-6. [Медлайн].
, Обата С., Хаяши Т. Гломусная опухоль сальника: история болезни. J Surg Oncol .2007 1 декабря. 96 (7): 633-6. [Медлайн].
Ruan CW, Lee CL, Yen CF, Wang CJ, Soong YK. Огромная миома матки весом 6,2 кг, совпадающая с лейомиосаркомой сальника: клинический случай. Чанген И Сюэ За Чжи . 1999 22 декабря (4): 639-42. [Медлайн].
Рай Б.А., Кристиансен Э., Ларсен Л.Г. Острое кровотечение из лейомиобластомы большого сальника. Отчет о случае. Тумори . 1989 30 июня. 75 (3): 296-8. [Медлайн].
Цуцуми Х., Овада С., Такеёси И., Изуми М., Огава Т., Фукусато Т. и др.Первичная липосаркома сальника с перекрутом: клинический случай. Гепатогастроэнтерология . 1999 май-июнь. 46 (27): 2110-2. [Медлайн].
Бхандаркар Д., Гуге А. , Кадакиа Г., Шах Р. Лапароскопическое иссечение сальниковой лейомиомы с гигантским кистозным компонентом. JSLS . 2011 июль-сен. 15 (3): 409-11. [Медлайн]. [Полный текст].
, Кадакиа Г., Шах Р. Лапароскопическое иссечение сальниковой лейомиомы с гигантским кистозным компонентом. JSLS . 2011 июль-сен. 15 (3): 409-11. [Медлайн]. [Полный текст].
Цао Л., Ху С., Чжан И., Сунь Х.Т. Млечные пятна в сальнике при скрининге стволовых клеток рака желудка. Новообразование .2011. 58 (1): 20-6. [Медлайн].
Миядзава М., Наритака Ю., Мияки А., Асака С., Исохата Н., Ямагути К. и др. Миофибробластическая саркома низкой степени злокачественности в брюшной полости. Противораковый состав . 2011 31 сентября (9): 2989-94. [Медлайн].
Кацулис И.Е., Цорцопулу А., Циаку П., Арногианнаки Н., Костоглу-Афанассиу И., Липас Г. и другие. Внежелудочная стромальная опухоль малого сальника: клинический случай и обзор литературы. Дело J Surg Rep .2017. 37:17-21. [Медлайн].
Ивахаши Н., Дегучи Ю., Хориучи Ю., Ино К., Фурукава К. Сальниковая синовиальная саркома, имитирующая злокачественное новообразование яичников: клинический случай. Мол Клин Онкол . 2017 май. 6 (5): 688-690. [Медлайн]. [Полный текст].
Brañes A, Bustamante C, Valbuena J, Pimentel F, Quezada N. Первичная лейомиосаркома большого сальника: клинический случай. Дело J Surg Rep . 2016. 28:317-320. [Медлайн]. [Полный текст].
Barel O, Qian C, Manolitsas T. Первичная лейомиосаркома сальника, представляющая собой рак яичника, отчет о клиническом случае и обзор литературы. Gynecol Oncol Rep . 2016 авг. 17:75-8. [Медлайн]. [Полный текст].
Хебра А., Браун М.Ф., МакГихин К.М., Росс А.Дж. 3-й. Мезентериальные, сальниковые и забрюшинные кисты у детей: клиническое исследование 22 случаев. Южный Мед J . 1993 фев. 86 (2): 173-6. [Медлайн].
Южный Мед J . 1993 фев. 86 (2): 173-6. [Медлайн].
О’Брайен Дж. Г., Аллен Дж. Э., Королева Т. А.Лейомиома сальника у ребенка. J Pediatr Surg . 1986 21 ноября (11): 981-2. [Медлайн].
Ли Дж.Т., Ким М.Дж., Ю К.С., Су Дж.Х., Леонг Х.Дж. Первичная лейомиосаркома большого сальника: данные КТ. J Comput Assist Томогр . 1991 январь-февраль. 15 (1):92-4. [Медлайн].
Канбаз Ф., Селик Х., Кефели М., Тосун М. Рак шейки матки в виде сальникового пирога. Клин Нукл Мед . 2018 Ноябрь 43 (11): e417-e418. [Медлайн].
Перес А.А., Любнер М.Г., Пикхардт П.Дж. Биопсия сальника под ультразвуковым контролем: диагностическая ценность и связь с функциями КТ на основе 18-летней серии исследований одного учреждения. AJR Am J Рентгенол . 2021 11 авг. 217:1-10. [Медлайн]. [Полный текст].
2021 11 авг. 217:1-10. [Медлайн]. [Полный текст].
Кадоу С., Амери А.Х. Первичная липосаркома сальника: редкая внутрибрюшная опухоль. Br J Clin Pract . 1989 Декабрь 43 (12): 460-2. [Медлайн].
Окадзима Ю., Нисикава М., Охи М., Фукумото Ю., Курода К., Шимомукай Х.Первичная липосаркома сальника. Постград Мед J . 1993 февраль 69 (808): 157-8. [Медлайн].
Вонг П.П., Ягода А. Химиотерапия злокачественной гемангиоперицитомы. Рак . 1978 апр. 41 (4): 1256-60. [Медлайн].
Patel SR, Wong P. Эффективность иматиниба при неоперабельных гастроинтестинальных стромальных опухолях. US Oncol Rev . 2009. 5 (1): 61-4. [Полный текст].
Окуно С. Использование ингибиторов тирозинкиназы при желудочно-кишечных стромальных опухолях (GIST). OncLive. Доступно на http://www.onclive.com/publications/contemporary-oncology/2011/spring-2011/the-use-of-tyrosine-kinase-inhibitors-for-желудочно-кишечные-стомал-туморы-gist. 15 марта 2011 г.; Доступ: 20 августа 2021 г.
OncLive. Доступно на http://www.onclive.com/publications/contemporary-oncology/2011/spring-2011/the-use-of-tyrosine-kinase-inhibitors-for-желудочно-кишечные-стомал-туморы-gist. 15 марта 2011 г.; Доступ: 20 августа 2021 г.
Генетические вариации опухолей ЖКТ определяют эффективность лекарств. Новости генной инженерии и биотехнологии. Доступно на http://www.genengnews.com/gen-news-highlights/genetic-variations-in-gi-tumors-determine-what-medications-are-efficacious/45436906.13 ноября 2008 г .; Доступ: 20 августа 2021 г.
Йоэнсуу Х., Эрикссон М., Холл К.С., Хартманн Дж.Т., Пинк Д., Шютте Дж. и др. Факторы риска рецидива гастроинтестинальной стромальной опухоли у пациентов, получавших адъювантную терапию иматинибом. Рак . 2014 1 августа. 120 (15): 2325-33. [Медлайн].
Система визуализации-отчетности и данных большого сальника: определение степени доброкачественных и злокачественных поражений большого сальника с помощью ультразвукового исследования | Визуализация рака
Исследовательская когорта
Был проведен ретроспективный анализ ультрасонограмм и ультразвуковых отчетов 883 пациентов, прошедших обследование сальника в отделении ультразвуковой диагностики Первой дочерней больницы Китайского медицинского университета с октября 2009 г. по октябрь 2019 г.В исследование вошли 598 женщин и 285 мужчин (13–88 лет, медиана 59 лет). Все 883 пациента соответствовали требованиям к пункту и были получены результаты патологии под контролем УЗИ. Все методы проводились в соответствии с рекомендациями, изложенными в Хельсинкской декларации. Все пациенты дали устное или письменное информированное согласие на участие в нашем исследовании до проведения биопсии. Те, кто моложе 18 лет, получили информированное согласие от их родителей или законных опекунов.
по октябрь 2019 г.В исследование вошли 598 женщин и 285 мужчин (13–88 лет, медиана 59 лет). Все 883 пациента соответствовали требованиям к пункту и были получены результаты патологии под контролем УЗИ. Все методы проводились в соответствии с рекомендациями, изложенными в Хельсинкской декларации. Все пациенты дали устное или письменное информированное согласие на участие в нашем исследовании до проведения биопсии. Те, кто моложе 18 лет, получили информированное согласие от их родителей или законных опекунов.
Инструменты
Используемые нами диагностические инструменты: Preirus® (датчик с линейной матрицей = 5–12 МГц; датчик с выпуклой матрицей = 3–7 МГц; Hitachi, Токио, Япония) и AixPlorer® (датчик с линейной матрицей = 4–15 МГц ; конвексный матричный датчик = 3–7 МГц; Supersonic, Франция).
Методы обследования
Для УЗИ брюшины основным положением является положение на спине, сканирование до мечевидного отростка, вниз до пупка. При сканировании брюшины вокруг печени или селезенки предпочтительнее положение лежа на правом или левом боку. С помощью конвексного матричного датчика сканировали всю брюшную полость. Регистрировали положение поражений сальника, толщину сальника, объем асцита, наличие разделения в асците и гомогенность асцитического эха. Затем мы переключились на линейный датчик и записали эхо, структуру и кровоток в сальнике, а также наличие узелков или мезентериальных лимфатических узлов. Глубину, усиление и фокус сканирования регулировали в соответствии с физическим состоянием.
С помощью конвексного матричного датчика сканировали всю брюшную полость. Регистрировали положение поражений сальника, толщину сальника, объем асцита, наличие разделения в асците и гомогенность асцитического эха. Затем мы переключились на линейный датчик и записали эхо, структуру и кровоток в сальнике, а также наличие узелков или мезентериальных лимфатических узлов. Глубину, усиление и фокус сканирования регулировали в соответствии с физическим состоянием.
Критерии диагностики (таблица 1)
Толщина сальника
Salman et al.[6] предположили, что толщина сальника ≤ 19 мм является предиктором доброкачественных поражений сальника. Поэтому мы разделили толщину сальника на > 19 мм и ≤ 19 мм.
Таблица 1 Количество пациентов с различными ультразвуковыми признаками и их распределениеУчасток сальникового проявления
Участок сальникового проявления был разделен на «полное отображение» и «локальное отображение» живота.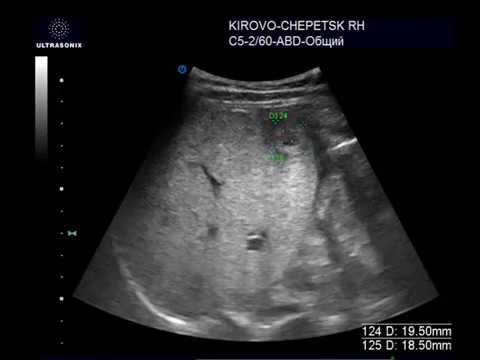 Во время сканирования было задокументировано наличие утолщенного сальника в правом верхнем, левом верхнем, правом нижнем или левом нижнем отделе живота.
Во время сканирования было задокументировано наличие утолщенного сальника в правом верхнем, левом верхнем, правом нижнем или левом нижнем отделе живота.
Сальниковое эхо
В болезненном состоянии сальниковое эхо может быть увеличено диффузно или быть в основном гиперэхогенным. Последнее может включать наличие гипоэхогенных узлов на фоне гиперэхогенных сигналов, а доля гиперэхогенного сальника составляет > 50% (рис. 1а), что предполагает гиперэхогенный сценарий. В болезненном состоянии сальниковая эхогенность может быть снижена равномерно или преимущественно гипоэхогенна (доля гипоэхогенного сальника > 50%), что свидетельствует о гипоэхогенном состоянии (рис.1б). Если в утолщенном сальнике нет очевидной области высокого или низкого среза эхосигнала, а пропорция высокого и низкого эхосигнала сальника близка, это свидетельствует о смешанном эхосигнале высокого и низкого уровня (рис. 1c).
Рис. 1 Сальниковое эхо. a Мужчина, 49 лет, сальниковое эхо: гиперэхогенное. Патологические результаты: туберкулез сальника. b Женщина, 54 года, сальниковое эхо: гипоэхогенное. Патологические результаты: метастазы в сальник (метастазы рака яичников). c Мужчина, 23 года, сальниковое эхо: смешанное высокое и низкое эхо.Патологоанатомические результаты: туберкулез сальника
Патологические результаты: туберкулез сальника. b Женщина, 54 года, сальниковое эхо: гипоэхогенное. Патологические результаты: метастазы в сальник (метастазы рака яичников). c Мужчина, 23 года, сальниковое эхо: смешанное высокое и низкое эхо.Патологоанатомические результаты: туберкулез сальника
Структура сальника
Утолщенный сальник может выглядеть «изъеденным молью» (рис. 2а) или в утолщенном сальнике может быть ретикулярное распределение неэхогенной области (рис. 2б) . Последнее является характерным признаком псевдомиксомы сальника. Структуру сальника можно разделить на «плотную» (рис. 2с) и «рыхлую» (рис. 2d) с помощью визуализации с использованием линейного датчика.
Рис. 2 Структура сальника. a Женщина, 58 лет, строение сальника: изъедено молью.Патологический результат: метастазы в сальник (метастазы рака яичников). b Женщина, 63 года, строение сальника: ретикулярное распределение неэхогенной области в утолщенном сальнике. Патологический результат: сальниковая псевдомиксома. c Женщина, 71 год, структура сальника: плотная. Патологический результат: злокачественный (неясный источник). d Мужчина, 38 лет, структура сальника: рыхлая. Патологические результаты: туберкулез сальника
Патологический результат: сальниковая псевдомиксома. c Женщина, 71 год, структура сальника: плотная. Патологический результат: злокачественный (неясный источник). d Мужчина, 38 лет, структура сальника: рыхлая. Патологические результаты: туберкулез сальника
Сальниковый кровоток
По ходу кровотока и различным участкам сканирования его можно разделить на «точка-полоска» (рис.3а) и «ветвистый» (рис. 3б) кровоток.
Рис. 3Сальниковый кровоток и узлы. a Женщина, 56 лет, сальниковый кровоток: точечный кровоток. Патологические результаты: метастазы в сальник (метастазы рака яичников). b Женщина, 68 лет, сальниковый кровоток: ветвевой кровоток. Патологические результаты: метастазы в сальник (метастазы рака яичников). c Женщина, 48 лет, сальниковый узел: множественный. Патологические результаты: метастазы в сальник (метастазы рака яичников). d Мужчина, 65 лет, сальниковый узел: единственный патологический результат: аденокарцинома (источник пищеварительного тракта)
Узелки в сальнике
Более крупные узлы можно обнаружить при визуализации с помощью конвексного матричного датчика.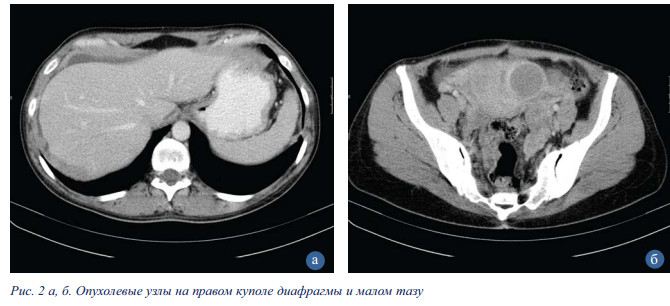 Для более мелких узелков необходим линейный матричный датчик, а узелки могут быть множественными (рис. 3с) или одиночными (рис. 3г). Этот признак можно разделить на «с» или «без» узелков.
Для более мелких узелков необходим линейный матричный датчик, а узелки могут быть множественными (рис. 3с) или одиночными (рис. 3г). Этот признак можно разделить на «с» или «без» узелков.
Объем асцита
Максимальная глубина тазового асцита при УЗИ ≤3.0 см классифицировали как «небольшое количество», 3-10 см как «среднее количество» и ≥ 10 см как «большое количество» асцита.
Разделение асцита
При асците могут наблюдаться «полосообразные» гиперэхогенные признаки. Он может «плавать» при асците и соединяться между внутренней боковой стенкой живота и брыжейкой. Разделение может быть интенсивным и множественным (рис. 4а) или одиночным (рис. 4б). Этот признак можно разделить на «с» или «без» разделения.
Рис. 4 Разделение асцита и эхо. a Мужчина, 39 лет, множественные выделения в асците. Патологические результаты сальника: туберкулез. b Женщина, 25 лет, единичные выделения в асците. Патологические результаты сальника: туберкулез. c Женщина, 74 года, множественные хлопьевидные эхо при асците. Патологические результаты сальника: метастатическая карцинома (метастаз рака яичников)
c Женщина, 74 года, множественные хлопьевидные эхо при асците. Патологические результаты сальника: метастатическая карцинома (метастаз рака яичников)
Асцит-эхо
Асцит-эхо можно разделить на «гомогенное» и «гетерогенное» (рис.4с). Первый относится к однородному безэховому сигналу, тогда как второй включает «хлопьевидное эхо при асците» и «желеобразный асцит».
Агрегация кишечной трубки
Агрегация кишечной трубки относится к скоплению кишечной трубки в определенном участке брюшной полости (рис. 5а), а не к одному кишечному тракту, «плавающему» в асците.
Рис. 5 Агрегация кишечной трубки, мезентериального лимфатического узла и стенки брюшины. а Женщина, 66 лет, скопление кишечной трубки в нижних отделах брюшной полости слева.Патологические результаты сальника: метастатическая карцинома (метастаз рака яичников). b Женщина, 46 лет, брыжеечный лимфатический узел. Патологические результаты сальника: воспаление. c Женщина, 62 года, утолщение стенки брюшины. Патологические результаты сальника: туберкулез
c Женщина, 62 года, утолщение стенки брюшины. Патологические результаты сальника: туберкулез
Брыжеечный лимфатический узел
Брыжеечный лимфатический узел (рис. 5б) можно разделить на «отображаемый» и «неотображаемый».
Париетальная брюшина
Утолщенная стенка брюшины, выявляемая при УЗИ, классифицируется как «перитонеальное проявление» (рис.5в). Самый тонкий перитонеальный дисплей в нашем исследовании составлял 1,5 мм.
Метод отнесения
Если отношение шансов (ОШ) < 0,3, корреляция со злокачественным новообразованием отсутствовала. Если 0,3 < OR ≤ 3, значимой корреляции со злокачественным новообразованием не было. Если 3 < OR ≤ 10, имелась сильная корреляция со злокачественным новообразованием. Если ОШ > 10, была чрезвычайно сильная корреляция со злокачественным новообразованием. Из четырех сценариев, упомянутых выше, присвоение составляло 0, 1, 2 или 3 балла соответственно.
В настоящем исследовании ИЛИ толщины сальника (> 19 мм/≤19 мм), места проявления сальника (вся брюшная полость/локально), кровотока в сальниках (пунктирная полоса/разветвления), объема асцита (отсутствует, небольшой, средний или большое количество), кишечно-трубная агрегация (с/без) – 0. 3–3, что свидетельствует об отсутствии значимой корреляции между этими ультразвуковыми признаками и характером поражений сальника. Все признаки этой части оцениваются в 1 балл, и результаты не являются статистически значимыми. Поэтому автор исключил и отказался от присвоения этой части знаков.
3–3, что свидетельствует об отсутствии значимой корреляции между этими ультразвуковыми признаками и характером поражений сальника. Все признаки этой части оцениваются в 1 балл, и результаты не являются статистически значимыми. Поэтому автор исключил и отказался от присвоения этой части знаков.
Следовательно, только прямые признаки (сальниковое эхо, сальниковая структура и сальниковые узлы) и косвенные признаки (сопровождается ли асцит выделением, гомогенное асцитическое эхо, визуализируются мезентериальные лимфатические узлы, париетальная брюшина утолщена) поражения сальника были оценены.
Статистические методы
Мы использовали SPSS v22 (IBM, Армонк, Нью-Йорк, США). Данные измерений представляют собой среднее значение ± стандартное отклонение. Количество пациентов в каждой группе рассчитывали и распределяли после расчета ОШ. Присвоенное значение было введено в данные для каждого пациента, и была рассчитана окончательная оценка сальникового сустава. Последний был проанализирован статистически.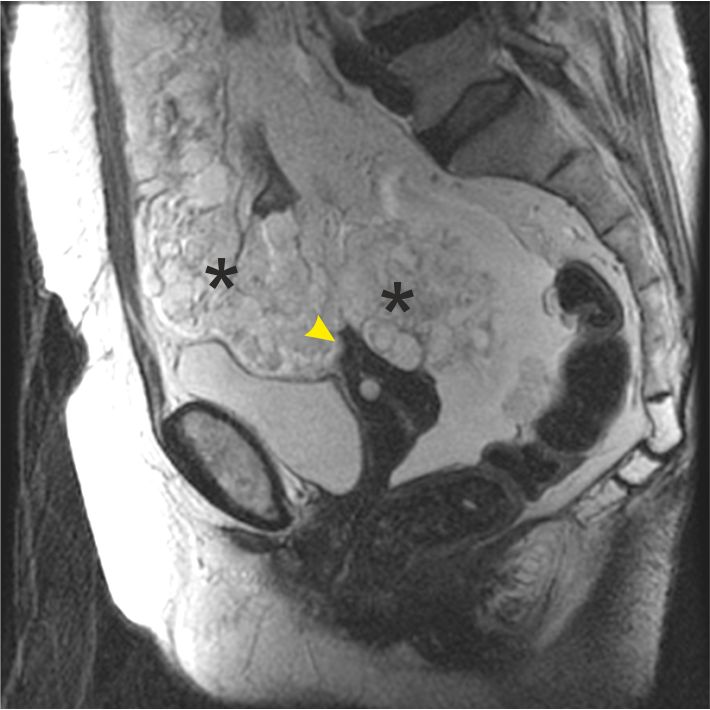 Кривая рабочих характеристик приемника (ROC) была построена для расчета наилучшей диагностической точки отсечки. Было разделено соотношение доброкачественных и злокачественных образований.Рассчитывали площадь под ROC-кривой (AUC). Значения P измеряли с использованием теста Стьюдента t между каждой группой. P < 0,05 считалось значимым.
Кривая рабочих характеристик приемника (ROC) была построена для расчета наилучшей диагностической точки отсечки. Было разделено соотношение доброкачественных и злокачественных образований.Рассчитывали площадь под ROC-кривой (AUC). Значения P измеряли с использованием теста Стьюдента t между каждой группой. P < 0,05 считалось значимым.
Важность AUC
AUC, находится между 0 и 1. Чем ближе AUC к 1, тем лучше диагностический эффект. Точность AUC низкая от 0,5 до 0,7, определенная точность составляет 0,7–0,9, а более высокая точность превышает 0,9. Если AUC ≤ 0,5, метод не имеет диагностической ценности.
Млечные пятна: сальниковые функциональные единицы и очаги метастазирования рака брюшины
Yang XJ, Huang CQ, Suo T, Mei LJ, Yang GL, Cheng FL, et al. Циторедуктивная хирургия и гипертермическая внутрибрюшинная химиотерапия улучшают выживаемость пациентов с перитонеальным карциноматозом от рака желудка: окончательные результаты рандомизированного клинического исследования фазы III. Энн Сург Онкол. 2011;18:1575–81.
Энн Сург Онкол. 2011;18:1575–81.
ПабМед ПабМед Центральный Статья Google Scholar
Tang L, Mei LJ, Yang XJ, Huang CQ, Zhou YF, Yonemura Y и др. Циторедуктивная хирургия плюс гипертермическая внутрибрюшинная химиотерапия улучшают выживаемость при раке желудка с карциноматозом брюшины: данные экспериментального исследования. J Transl Med. 2011;9:53.
КАС пабмед ПабМед Центральный Статья Google Scholar
Glockzin G, Piso P. Современное состояние и будущие направления в лечении рака желудка с перитонеальной диссеминацией.Surg Oncol Clin N Am. 2012;21:625–33.
ПабМед Статья Google Scholar
Huang CQ, Yang XJ, Yu Y, Wu HT, Liu Y, Yonemura Y, et al. Циторедуктивная хирургия плюс гипертермическая внутрибрюшинная химиотерапия улучшают выживаемость пациентов с карциноматозом брюшины от колоректального рака: исследование II фазы, проведенное китайским центром. ПЛОС Один. 2014;9:e108509.
ПЛОС Один. 2014;9:e108509.
ПабМед ПабМед Центральный Статья КАС Google Scholar
Lengyel E. Развитие рака яичников и метастазирование. Ам Джей Патол. 2010; 177:1053–64.
ПабМед ПабМед Центральный Статья Google Scholar
Yonemura Y, Endou Y, Shinbo M, Sasaki T, Hirano M, Mizumoto A, et al. Безопасность и эффективность двунаправленной химиотерапии при лечении больных с перитонеальной диссеминацией рака желудка: выбор циторедуктивной хирургии. Дж. Хирург Онкол. 2009; 100:311–6.
КАС пабмед Статья Google Scholar
Танака Т., Кумагаи К., Симидзу К., Масуо К., Ямагата К. Перитонеальные метастазы рака желудка с особым упором на лимфатическое продвижение; экстранодальная инвазия является значительным фактором риска перитонеальных метастазов. Дж. Хирург Онкол. 2000; 75: 165–71.
2000; 75: 165–71.
КАС пабмед Статья Google Scholar
Yonemura Y, Kawamura T, Bandou E, Tsukiyama G, Endou Y, Miura M. Естественная история свободных раковых клеток в брюшной полости.Недавние результаты Cancer Res. 2007; 169:11–23.
ПабМед Google Scholar
Dunn GP, Bruce AT, Ikeda H, Old LJ, Schreiber RD. Иммуноредактирование рака: от иммунологического надзора к избеганию опухоли. Нат Иммунол. 2002; 3: 991–8.
КАС пабмед Статья Google Scholar
Хагивара А., Такахаши Т., Савай К., Танигучи Х., Симоцума М., Окано С. и др. Млечные пятна как место имплантации злокачественных клеток при перитонеальной диссеминации у мышей.Рак рез. 1993; 53: 687–92.
КАС пабмед Google Scholar
Хан С.М., Функ Х. М., Тиоллой С., Лотан Т.Л., Хиксон Дж., Принс Г.С. и др. In vitro метастатическая колонизация клеток рака яичников человека в сальник. Clin Exp Метастаз. 2010;27:185–96.
М., Тиоллой С., Лотан Т.Л., Хиксон Дж., Принс Г.С. и др. In vitro метастатическая колонизация клеток рака яичников человека в сальник. Clin Exp Метастаз. 2010;27:185–96.
ПабМед Статья Google Scholar
Соренсен Э.В., Гербер С.А., Седлачек А.Л., Рыбалко В.Ю., Чан В.М., Лорд Э.М.Сальниковые иммунные агрегаты и метастазы опухоли в брюшную полость. Иммунол Рез. 2009;45:185–94.
КАС пабмед Статья Google Scholar
Cao L, Hu X, Zhang Y. Сальниковые молочные пятна — высокоэффективный «естественный фильтр» для скрининга стволовых клеток рака желудка. Мед Гипотезы. 2009;73:1017–8.
ПабМед Статья Google Scholar
Плателл С., Купер Д., Пападимитриу Дж.М., Холл Дж.С. Сальник. Мир J Гастроэнтерол. 2000; 6: 169–76.
ПабМед ПабМед Центральный Google Scholar
Ву С.Д., Ма Ю.С., Фан Ю., Лю Л.Л., Фу Д., Шэнь XZ. Роль микроокружения в развитии и прогрессировании гепатоцеллюлярной карциномы. Cancer Treat Rev. 2012; 38: 218–25.
КАС пабмед Статья Google Scholar
Ханахан Д., Вайнберг Р.А. Отличительные признаки рака: следующее поколение. Клетка. 2011; 144:646–74.
КАС пабмед Статья Google Scholar
Фридл П., Александр С. Раковая инвазия и микроокружение: пластичность и реципрокность. Клетка. 2011; 147:992–1009.
КАС пабмед Статья Google Scholar
Фанг М., Юань Дж.П., Пэн К.В., Панг Д.В., Ли Ю.Молекулярная визуализация динамических изменений коллагена IV во время инвазии рака на основе квантовых точек. Биоматериалы. 2013; 34:8708–17.
КАС пабмед Статья Google Scholar

Цудзимото Х., Хагивара А., Симоцума М., Сакакура С., Осаки К., Сасаки С. и др. Роль молочных пятен как избирательных мест имплантации злокачественных клеток при перитонеальной диссеминации у мышей. J Cancer Res Clin Oncol. 1996; 122:590–5.
КАС пабмед Статья Google Scholar
Von Recklinghausen F. Über eiter-bindegewebskörperchen. Арка Вирхова Патол Анат. 1863; 28: 157–66.
Артикул Google Scholar
Ranvier L. Du dévelopment et de l’accroissement desvaiseaux sanguins. Арх Физиол Норм Патол. 1874; 6: 429–46.
Google Scholar
Koten JW, den Otter W. Являются ли сальниковые млечные пятна вилочковой железой кишечника? Ланцет. 1991; 338:1189–90.
КАС пабмед Статья Google Scholar
Krist LF, Eestermans IL, Steenbergen JJ, Hoefsmit EC, Cuesta MA, Meyer S, et al. Клеточный состав млечных пятен большого сальника человека: иммунохимическое и ультраструктурное исследование. Анат Рек. 1995; 241:163–74.
Клеточный состав млечных пятен большого сальника человека: иммунохимическое и ультраструктурное исследование. Анат Рек. 1995; 241:163–74.
КАС пабмед Статья Google Scholar
Wijffels JF, Hendrickx RJ, Steenbergen JJ, Eestermans IL, Beelen RH.Молочные пятна в сальнике мышей могут играть важную роль в происхождении перитонеальных макрофагов. Рез Иммунол. 1992; 143:401–9.
КАС пабмед Статья Google Scholar
Rangel-Moreno J, Moyron-Quiroz JE, Carragher DM, Kusser K, Hartson L, Moquin A, et al. Млечные пятна в сальниках развиваются в отсутствие клеток-индукторов лимфоидной ткани и поддерживают В- и Т-клеточный ответ на перитонеальные антигены. Иммунитет. 2009;30:731–43.
КАС пабмед ПабМед Центральный Статья Google Scholar
Мебиус RE. Лимфоидные органы на иммунный ответ брюшной полости: пятна молочного цвета. Иммунитет. 2009;30:670–2.
КАС пабмед Статья Google Scholar
Panasco MS, Pelajo-Machado M, Lenzi HL. Сальниковые и плевральные млечные пятна: различные модели реактивности у мышей, инфицированных Schistosoma mansoni, выявляют целомическую компартментализацию.Мем Инст Освальдо Круз. 2010; 105:440–4.
ПабМед Статья Google Scholar
Крист Л.Ф., Керреманс М., Брокхейс-Флуитсма Д.М., Эстерманс И.Л., Мейер С., Белен Р.Х. Млечные пятна в большом сальнике являются преобладающими местами локальной пролиферации опухолевых клеток и скопления их в брюшной полости. Рак Иммунол Иммунотер. 1998; 47: 205–12.
КАС пабмед Статья Google Scholar
Цудзимото Х., Тахаши Т., Хагивара А., Симоцума М., Сакакура С., Осаки К. и др. Сайт-специфическая имплантация в молочные пятна злокачественных клеток при перитонеальной диссеминации: иммуногистохимическое наблюдение у мышей, инокулированных внутрибрюшинно меченными бромдезоксиуридином клетками. Бр Дж Рак. 1995; 71: 468–72.
КАС пабмед ПабМед Центральный Статья Google Scholar
Гербер С.А., Рыбалко В.Ю., Бигелоу С.Е., Лугаде А.А., Фостер Т.Х., Фрелингер Д.Г., и соавт.Преимущественное прикрепление перитонеальных метастазов опухоли к сальниковым иммунным агрегатам и возможная роль уникального сосудистого микроокружения в метастатическом выживании и росте. Ам Джей Патол. 2006; 169:1739–52.
КАС пабмед ПабМед Центральный Статья Google Scholar
Imai Y, Takahashi K, Matsuda M. Электронно-микроскопическое исследование перитонеальных макрофагов и молочных пятен в сальнике. Rec Adv Res. 1997; 11:54–84.
Google Scholar
Krist LF, Koenen H, Calame W, van der Harten JJ, van der Linden JC, Eestermans IL, et al. Онтогенез млечных пятен в большом сальнике человека: иммунохимическое исследование. Анат Рек. 1997; 249: 399–404.
КАС пабмед Статья Google Scholar
Shimotsuma M, Takahashi T, Kawata M, Dux K. Клеточные подмножества молочных пятен в большом сальнике человека.Сотовые Ткани Res. 1991; 264: 599–601.
КАС пабмед Статья Google Scholar
Wang LW, Qu AP, Yuan JP, Chen C, Sun SR, Hu MB, et al. Компьютерные исследования изображений опухолевых гнезд математических характеристик рака молочной железы и их клинического прогностического значения. ПЛОС Один. 2013;8:e82314.
ПабМед ПабМед Центральный Статья Google Scholar
Van Vugt E, Van Rijthoven EAM, Kamperdijk EWA, Beelen RHJ. Млечно-сальниковые пятна при местном иммунном ответе в брюшной полости у крыс. Анат Рек. 1996; 244: 235–45.
ПабМед Статья Google Scholar
Белен РХ. Большой сальник: физиология и иммунологические концепции. Нет Дж. Сург. 1991; 43: 145–9.
КАС пабмед Google Scholar
Сакки Г., Ди Паоло Н., Венеция Ф., Росси А., Николаи Г.А., Гарози Г. Возможная роль молочных пятен в мезотелиальной трансплантации. Int J Artif Organs. 2007; 30: 520–6.
КАС пабмед Google Scholar
Liebermann-Meffert D, White H. Большой сальник: анатомия, физиология, патология, хирургия, с историческим обзором. Нью-Йорк: Спрингер; 1983. с. 1–369.
Книга Google Scholar
Коллинз Д., Хоган А.М., О’Ши Д., Винтер, округ Колумбия. Сальник: анатомические, метаболические и хирургические аспекты. J Gastrointest Surg. 2009; 13:1138–46.
ПабМед Статья Google Scholar
Cui L, Johkura K, Liang Y, Teng R, Ogiwara N, Okouchi Y, et al. Биозащитная функция сальниковых пятен за счет молекул клеточной адгезии и пролиферации лейкоцитов. Сотовые Ткани Res. 2002; 310:321–30.
КАС пабмед Статья Google Scholar
Симоцума М., Симпсон-Морган М.В., Такахаши Т., Хагивара А. Активация сальниковых млечных пятен и макрофагов млечных пятен путем внутрибрюшинного введения стрептококкового препарата, ОК-432. Рак рез. 1992; 52:5400–2.
КАС пабмед Google Scholar
Кришнан В., Стадик Н., Кларк Р., Бейнер Р., Венерис Дж.Т., Хан С. и др. Использование функции подавления метастазирования MKK4 для выявления и анализа взаимодействий раковых клеток и микроокружения во время метастатической колонизации.Метастазы рака, ред. 2012; 31:605–13.
КАС пабмед Статья Google Scholar
Окамура А., Ядзава С., Нисимура Т., Танака С., Такай И., Кудо С. и др. Новый метод определения адгезии раковых клеток к большому сальнику и его применение для оценки антиадгезионной активности химически синтезированных олигосахаридов. Clin Exp Метастаз. 2000; 18:37–43.
КАС пабмед Статья Google Scholar
Симоцума М., Кавата М., Хагивара А., Такахаши Т. Млечные пятна в большом сальнике человека: макроскопическая и гистологическая идентификация. Акта Анат (Базель). 1989; 136: 211–6.
КАС Статья Google Scholar
Di Paolo N, Sacchi G, Garosi G, Sansoni E, Bargagli L, Ponzo P, et al. Млечные пятна в сальнике и перитонеальный диализ — обзор и личный опыт. Перит Наберите внутр. 2005; 25:48–57.
ПабМед Google Scholar
Clark R, Krishnan V, Schoof M, Rodriguez I, Theriault B, Chekmareva M, et al. Млечные пятна способствуют метастатической колонизации перитонеального жира в экспериментальных моделях рака яичников. Ам Джей Патол. 2013; 183: 576–91.
КАС пабмед ПабМед Центральный Статья Google Scholar
Абэ Х., Ина К., Китамура Х., Сумиёси Х., Тацукава С., Йошиока Х. и др. Роль оси CXCL12/CXCR4 в молочных пятнах крыс с гепатомой асцитного типа.Анат Научный Международный 2009; 84: 226–36.
КАС пабмед Статья Google Scholar
Beelen RH, Eestermans IL, Döpp EA, Dijkstra CD. Иммунологическая характеристика млечных пятен в сальнике крыс. Adv Exp Med Biol. 1988; 237: 745–50.
КАС пабмед Статья Google Scholar
Седлачек А.Л., Гербер С.А., Рэндалл Т.Д., ван Ройен Н., Фрелингер Дж.Г., Лорд Э.М.Генерация двойственного противоопухолевого иммунного ответа в брюшной полости. Ам Джей Патол. 2013; 183:1318–28.
КАС пабмед ПабМед Центральный Статья Google Scholar
Oosterling SJ, van der Bij GJ, Bögels M, van der Sijp JR, Beelen RH, Meijer S, et al. Недостаточная способность молочных пятен сальника препятствовать разрастанию опухоли брюшины поддерживает оментэктомию при минимальной резидуальной болезни. Рак Иммунол Иммунотер.2006; 55: 1043–51.
КАС пабмед Статья Google Scholar
Ароэйра Л.С., Агилера А., Санчес-Томеро Х.А., Бахо М.А., дель Песо Г., Хименес-Хеффернан Х.А. и др. Эпителиально-мезенхимальный переход и недостаточность перитонеальной мембраны у пациентов на перитонеальном диализе: патологическое значение и потенциальные терапевтические вмешательства. J Am Soc Нефрол. 2007; 18:2004–13.
КАС пабмед Статья Google Scholar
Дукс К. Анатомия большого и малого сальника мыши с некоторыми физиологическими последствиями. В: Goldsmith HS, редактор. Сальник: исследование и клиническое применение. Нью-Йорк: Спрингер; 1990. с. 19–43.
Глава Google Scholar
Beelen RH, Fluitsma DM, Hoefsmit EC. Пероксидативная активность мононуклеарных фагоцитов развивается в молочных пятнах сальника. J Ретикулоэндотели Soc. 1980; 28: 601–9.
КАС пабмед Google Scholar
Mandache E, Moldoveanu E, Savi G. Участие сальника и его млечных пятен в динамике перитонеальных макрофагов. Морфол Эмбриол (Букур). 1985; 31: 137–42.
КАС Google Scholar
Zhu H, Naito M, Umezu H, Moriyama H, Takatsuka H, Takahashi K, et al. Дифференцировка макрофагов и экспрессия колониестимулирующего фактора макрофагов в млечных пятнах и сальнике мышей после элиминации макрофагов. Лейкок Биол.1997; 61: 436–44.
КАС Google Scholar
Чжан К.С., Маговерн С.Дж., Мак К.А., Буденбендер К.Т., Ко В., Розенгарт Т.К. Фактор роста эндотелия сосудов является основным ангиогенным фактором в сальнике: механизм опосредованного сальником ангиогенеза. J Surg Res. 1997; 67: 147–54.
КАС пабмед Статья Google Scholar
Гарсия-Гомес И., Голдсмит Х.С., Ангуло Дж., Прадос А., Лопес-Эрвас П., Куэвас Б. и др.Ангиогенная способность сальниковых стволовых клеток человека. Нейрол Рез. 2005; 27:807–11.
ПабМед Статья Google Scholar
Logmans A, Schoenmakers CH, Haensel SM, Koolhoven I, Trimbos JB, van Lent M, et al. Высокая концентрация тканевого фактора в сальнике, возможная причина его кровоостанавливающих свойств. Евро Джей Клин Инвест. 1996; 26:82–3.
КАС пабмед Статья Google Scholar
Бикфалви А., Альтерио Дж., Иньянг А.Л., Дюпюи Э., Лоран М., Хартманн М.П. и др. Экспрессия основного фактора роста фибробластов в эндотелиальных клетках микрососудов сальника человека и эффект форболового эфира. J Cell Physiol. 1990; 144:151–8.
КАС пабмед Статья Google Scholar
Сингх А.К., Патель Дж., Литбарг Н.О., Гудехитлу К.П., Сетупати П., Арруда Дж.А. и др. Стромальные клетки, культивированные из сальника, экспрессируют плюрипотентные маркеры, продуцируют большое количество VEGF и приживаются к поврежденным участкам.Сотовые Ткани Res. 2008; 332:81–8.
КАС пабмед Статья Google Scholar
Цао Л, Ху С, Чжан И, Сун ХТ. Млечные пятна в сальнике при скрининге стволовых клеток рака желудка. Новообразование. 2011;58:20–6.
КАС пабмед Статья Google Scholar
Литбарг Н.О., Гудехитлу К.П., Сетупати П., Арруда Дж.А., Дунеа Г., Сингх А.К. Активированный сальник обогащается факторами, способствующими заживлению и регенерации тканей.Сотовые Ткани Res. 2007; 328: 487–97.
КАС пабмед Статья Google Scholar
Льюис К.Э., Поллард Дж.В. Различная роль макрофагов в различных опухолевых микроокружениях. Рак рез. 2006; 66: 605–12.
КАС пабмед Статья Google Scholar
Мердок К., Яннудис А., Льюис К.Э. Механизмы регуляции рекрутирования макрофагов в гипоксические зоны опухолей и других ишемизированных тканей.Кровь. 2004; 104: 2224–34.
КАС пабмед Статья Google Scholar
Murray PJ, Allen JE, Biswas SK, Fisher EA, Gilroy DW, Goerdt S, et al. Активация и поляризация макрофагов: номенклатура и экспериментальные принципы. Иммунитет. 2014;41:14–20.
КАС пабмед ПабМед Центральный Статья Google Scholar
Сивен К.С., Куттан Г.Роль макрофагов в опухолевой прогрессии. Иммунол Летт. 2009; 123:97–102.
КАС пабмед Статья Google Scholar
Солинас Г., Джермано Г., Мантовани А., Аллавена П. Опухолеассоциированные макрофаги (ТАМ) как основные участники воспаления, связанного с раком. Дж. Лейкок Биол. 2009; 86: 1065–73.
КАС пабмед Статья Google Scholar
Сика А.Роль ассоциированных с опухолью макрофагов в воспалении, связанном с раком. Эксп Онкол. 2010;32:153–158.
КАС пабмед Google Scholar
Martinez FO, Gordon S. Парадигма M1 и M2 активации макрофагов: время для переоценки. F1000Prime Rep. 2014; 6:13.
ПабМед ПабМед Центральный Статья КАС Google Scholar
Алхамеси Н.А., Зиприн П., Пфистермюллер К., Пек Д.Х., Дарзи А.В.Опосредованный ICAM-1 перитонеальный карциноматоз, цель терапевтического вмешательства. Clin Exp Метастаз. 2005; 22: 449–59.
КАС пабмед Статья Google Scholar
Ксязек К., Микула-Петрасик Дж., Катар Р., Дворацкий Г., Винцкевич М., Фридрихович М. и др. Зависимое от окислительного стресса увеличение экспрессии ICAM-1 способствует адгезии колоректального рака и рака поджелудочной железы к стареющему мезотелию брюшины. Инт Джей Рак.2010; 127: 293–303.
КАС пабмед Google Scholar
Slack-Davis JK, Atkins KA, Harrer C, Hershey ED, Conaway M. Молекула адгезии сосудистых клеток-1 является регулятором перитонеального метастазирования рака яичников. Рак рез. 2009; 69: 1469–76.
КАС пабмед Статья Google Scholar
Burleson KM, Casey RC, Skubitz KM, Pambuccian SE, Oegema Jr TR, Skubitz AP.Сфероиды асцитной карциномы яичников прилипают к компонентам внеклеточного матрикса и монослоям мезотелиальных клеток. Гинекол Онкол. 2004;93:170–81.
КАС пабмед Статья Google Scholar
Бурлесон К.М., Хансен Л.К., Скубитц А.П. Сфероиды карциномы яичников распадаются на коллаген I типа и проникают в монослои живых мезотелиальных клеток человека. Clin Exp Метастаз. 2004; 21: 685–97.
КАС пабмед Статья Google Scholar
Цукада Т., Фусида С., Харада С., Яги Ю., Киносита Дж., Ояма К. и др. Роль мезотелиальных клеток брюшины человека в фиброзе и прогрессировании рака желудка. Int J Oncol. 2012;41:476–82.
КАС пабмед ПабМед Центральный Google Scholar
Mutsaers SE. Мезотелиальная клетка. Int J Biochem Cell Biol. 2004; 36:9–16.
КАС пабмед Статья Google Scholar
Liu XY, Miao ZF, Zhao TT, Wang ZN, Xu YY, Gao J и др. Макрофаги молочного пятна, ремоделированные клетками рака желудка, способствуют повреждению мезотелиальных клеток брюшины. Biochem Biophys Res Commun. 2013; 439: 378–83.
КАС пабмед Статья Google Scholar
Курашиге Дж., Мима К., Савада Г., Такахаши Ю., Эгучи Х., Сугимати К. и др. Эпигенетическая модуляция и репрессия миР-200b ассоциированными с раком фибробластами способствуют инвазии рака и перитонеальной диссеминации при раке желудка.Канцерогенез. 2015;36:133–41.
КАС пабмед Статья Google Scholar
Tommelein J, Verset L, Boterberg T, Demetter P, Bracke M, De Wever O. Связанные с раком фибробласты соединяют связь, способствующую метастазированию, при колоректальном раке. Фронт Онкол. 2015;5:63.
ПабМед ПабМед Центральный Статья Google Scholar
Cai J, Tang H, Xu L, Wang X, Yang C, Ruan S, et al.Фибробласты в сальнике, активированные опухолевыми клетками, способствуют росту, адгезии и инвазивности рака яичников. Канцерогенез. 2012;33:20–9.
КАС пабмед Статья Google Scholar
Льюис Дж. С., Ландерс Р. Дж., Андервуд Дж. К., Харрис А. Л., Льюис К. Э. Экспрессия сосудистого эндотелиального фактора роста макрофагами повышается в плохо васкуляризированных областях карциномы молочной железы. Джей Патол. 2000; 192:150–8.
КАС пабмед Статья Google Scholar
Берк Б., Джанноудис А., Корк К.П., Гилл Д., Уэллс М., Зиглер-Хейтброк Л. и др. Вызванная гипоксией экспрессия генов в макрофагах человека: значение для ишемических тканей и генная терапия, регулируемая гипоксией. Ам Джей Патол. 2003; 163:1233–43.
КАС пабмед ПабМед Центральный Статья Google Scholar
Нисидзука И., Итикава Ю., Исикава Т., Камияма М., Хасэгава С., Момияма Н. и др. Матрилизин стимулирует синтез ДНК культивируемых эндотелиальных клеток сосудов и индуцирует ангиогенез in vivo.Рак Летт. 2001; 173:175–82.
КАС пабмед Статья Google Scholar
Miao ZF, Wang ZN, Zhao TT, Xu YY, Gao J, Miao F, et al. Перитонеальные молочные пятна служат гипоксической нишей и способствуют перитонеальной диссеминации стволовых/прогениторных клеток рака желудка посредством индуцируемого гипоксией фактора 1α. Стволовые клетки. 2014; 32:3062–74.
КАС пабмед ПабМед Центральный Статья Google Scholar
Эшли Н., Йенг Т.М., Бодмер В.Ф. Дифференцировка стволовых клеток и формирование просвета в клеточных линиях колоректального рака и первичных опухолях. Рак рез. 2013;73:5798–809.
КАС пабмед Статья Google Scholar
Пистоллато Ф., Рампаццо Э., Персано Л., Аббади С., Фрассон С., Денаро Л. и др. Взаимодействие индуцируемого гипоксией фактора-1α и передачи сигналов Notch регулирует пролиферацию и судьбу предшественников медуллобластомы. Стволовые клетки.2010; 28:1918–29.
КАС пабмед ПабМед Центральный Статья Google Scholar
Wilkosz S, Ireland G, Khwaja N, Walker M, Butt R, de Giorgio-Miller A, et al. Сравнительное исследование строения большого сальника человека и мыши. Анат Эмбриоль (Берл). 2005; 209: 251–61.
Артикул Google Scholar
Хаунер Х. Новая концепция функции жировой ткани.Физиол Поведение. 2004; 83: 653–8.
КАС пабмед Статья Google Scholar
Шерер ЧП. Жировая ткань: от хранилища липидов до эндокринного органа. Сахарный диабет. 2006; 55: 1537–45.
КАС пабмед Статья Google Scholar
Nieman KM, Kenny HA, Penicka CV, Ladanyi A, Buell-Gutbrod R, Zillhardt MR, et al. Адипоциты способствуют метастазированию рака яичников и обеспечивают энергию для быстрого роста опухоли.Нат Мед. 2011;17:1498–503.
КАС пабмед ПабМед Центральный Статья Google Scholar
Carmignani CP, Sugarbaker TA, Bromley CM, Sugarbaker PH. Внутрибрюшинная диссеминация рака: механизмы закономерностей распространения. Метастазы рака, ред. 2003; 22:465–72.
ПабМед Статья Google Scholar
Айантунде А.А., Парсонс С.Л. Паттерн и прогностические факторы у пациентов со злокачественным асцитом: ретроспективное исследование.Энн Онкол. 2007; 18: 945–9.
КАС пабмед Статья Google Scholar
Williams R, White H. Большой сальник: его применимость в хирургии рака и терапии рака. Текущая пробл. 1986; 23: 789–865.
КАС пабмед Статья Google Scholar
Zeng WJ, Peng CW, Yuan JP, Cui R, Li Y. Мультиплексная визуализация злокачественного асцита на основе квантовых точек: новая модель классификации злокачественного асцита.Int J Наномедицина. 2015;10:1759–68.
ПабМед ПабМед Центральный Google Scholar
Наора Х., Монтелл Д.Дж. Метастазы рака яичников: интеграция идей из разрозненных модельных организмов. Нат Рев Рак. 2005; 5: 355–66.
КАС пабмед Статья Google Scholar
Witz CA, Montoya-Rodriguez IA, Cho S, Centonze VE, Bonewald LF, Schenken RS.Состав внеклеточного матрикса брюшины. J Soc Gynecol Investig. 2001; 8: 299–304.
КАС пабмед Статья Google Scholar
Остерлинг С.Дж., ван дер Бий Г.Дж., ван Эгмонд М., ван дер Сийп М.Р. Хирургическая травма и перитонеальный рецидив колоректального рака. Eur J Surg Oncol. 2005; 31: 29–37.
КАС пабмед Статья Google Scholar
Кассис Дж., Кломинек Дж., Кон Э.К. Микроокружение опухоли: чему нас могут научить выпоты? Диагностика Цитопатол. 2005; 33: 316–9.
ПабМед Статья Google Scholar
Kulbe H, Chakravarty P, Leinster DA, Charles KA, Kwong J, Thompson RG, et al. Динамическая воспалительная цитокиновая сеть в микроокружении рака яичников человека. Рак рез. 2012;72:66–75.
КАС пабмед Статья Google Scholar
Robinson-Smith TM, Isaacson I, Mercer CA, Zhou M, Van Rooijen N, Husseinzadeh N, et al. Макрофаги опосредуют усиленное воспалением метастазирование опухолей яичников у мышей. Рак рез. 2007; 67: 5708–16.
КАС пабмед Статья Google Scholar
Мочизуки Ю., Наканиси Х., Кодера Ю., Ито С., Ямамура Ю., Като Т. и др. TNF-альфа способствует прогрессированию перитонеального метастазирования, что было продемонстрировано с использованием клеточной линии рака желудка человека, меченной зеленым флуоресцентным белком (GFP).Clin Exp Метастаз. 2004; 21:39–47.
КАС пабмед Статья Google Scholar
Stadlmann S, Raffeiner R, Amberger A, Margreiter R, Zeimet AG, Abendstein B, et al. Нарушение целостности мезотелия брюшины человека интерлейкином-1бета и фактором некроза опухоли-альфа. Арка Вирхова. 2003; 443: 678–85.
КАС пабмед Статья Google Scholar
Жировые клетки в брюшной полости способствуют распространению рака яичников
Подобный процесс может стимулировать рост других видов рака
30 октября 2011 г.
Большой слой жировых клеток, который простирается от желудка и покрывает кишечник, обеспечивает питательными веществами, которые способствуют распространению и росту рака яичников, сообщает исследовательская группа из Чикагский университет в журнале Nature Medicine , опубликованном в Интернете 30 октября 2011 года.
Рак яичников, пятая по значимости причина смертности от рака у женщин, имеет тенденцию распространяться в брюшную полость, а не в отдаленные органы. У 80 процентов женщин к тому времени, когда диагностируется рак яичников, он распространяется на слой жировых клеток, называемый сальником. Часто рост рака в сальнике превышает рост исходного рака яичника.
«Эта жировая ткань, которая необычайно богата высококалорийными липидами, действует как стартовая площадка и источник энергии для вероятного смертельного распространения рака яичников», — сказал автор исследования Эрнст Ленгель, доктор медицинских наук, профессор акушерства и гинекологии. в Чикагском университете.«Клетки, составляющие сальник, содержат биологический эквивалент реактивного топлива. Они питают раковые клетки, позволяя им быстро размножаться. Лучшее понимание этого процесса может помочь нам узнать, как его разрушить».
Исследователи провели серию экспериментов, чтобы определить роль этих жировых клеток в качестве основных медиаторов метастазирования рака яичников. Первым шагом было понимание биологических сигналов, которые привлекают клетки рака яичников к сальнику и используют их для быстрого роста.
Распространение клеток рака яичников на сальник может происходить быстро. Клетки рака яичников, введенные в брюшную полость здоровых мышей, попадают в сальник в течение 20 минут. Исследователи обнаружили, что белковые сигналы, излучаемые сальником, могут привлекать опухолевые клетки. Ингибиторы, нарушающие эти сигналы, уменьшали это притяжение по крайней мере на 50 процентов.
Как только раковые клетки яичников достигают сальника, они быстро разрабатывают инструменты, чтобы пожирать пищу, обеспечиваемую этой жировой тканью, перепрограммируя свой метаболизм, чтобы процветать за счет липидов, полученных из жировых клеток.Рак яичников может быстро превратить весь сальник, мягкую жировую прослойку, в твердую массу раковых клеток.
«Этот механизм может не ограничиваться раковыми клетками яичников», — отмечают авторы. Метаболизм жиров также может способствовать развитию рака в других средах, где много жировых клеток, например, при раке молочной железы.
Белок, известный как белок, связывающий жирные кислоты (FABP4), переносчик жира, может иметь решающее значение для этого процесса и может быть мишенью для лечения.
Когда исследователи сравнили ткань первичного рака яичников с тканью рака яичников, которая распространилась на сальник, они обнаружили, что опухолевые клетки рядом с жировыми клетками сальника продуцируют высокие уровни FABP4.Раковые клетки, отдаленные от жировых клеток, не продуцировали FABP4.
Когда они ингибировали FABP4, резко снижался перенос питательных веществ из жировых клеток в раковые. Ингибирование FABP4 также уменьшало рост опухоли и способность опухолей генерировать новые кровеносные сосуды.
«Поэтому, — писали авторы, — FABP4 становится отличной мишенью для лечения внутрибрюшных диссеминирующих опухолей, которые предпочтительно метастазируют в жировую ткань, таких как рак яичников, желудка и толстой кишки.
Исследование было поддержано Национальным институтом здравоохранения, Burroughs Wellcome Fund, Комитетом по биологии рака Чикагского университета и Bears Care, благотворительным бенефициаром футбольного клуба Chicago Bears.


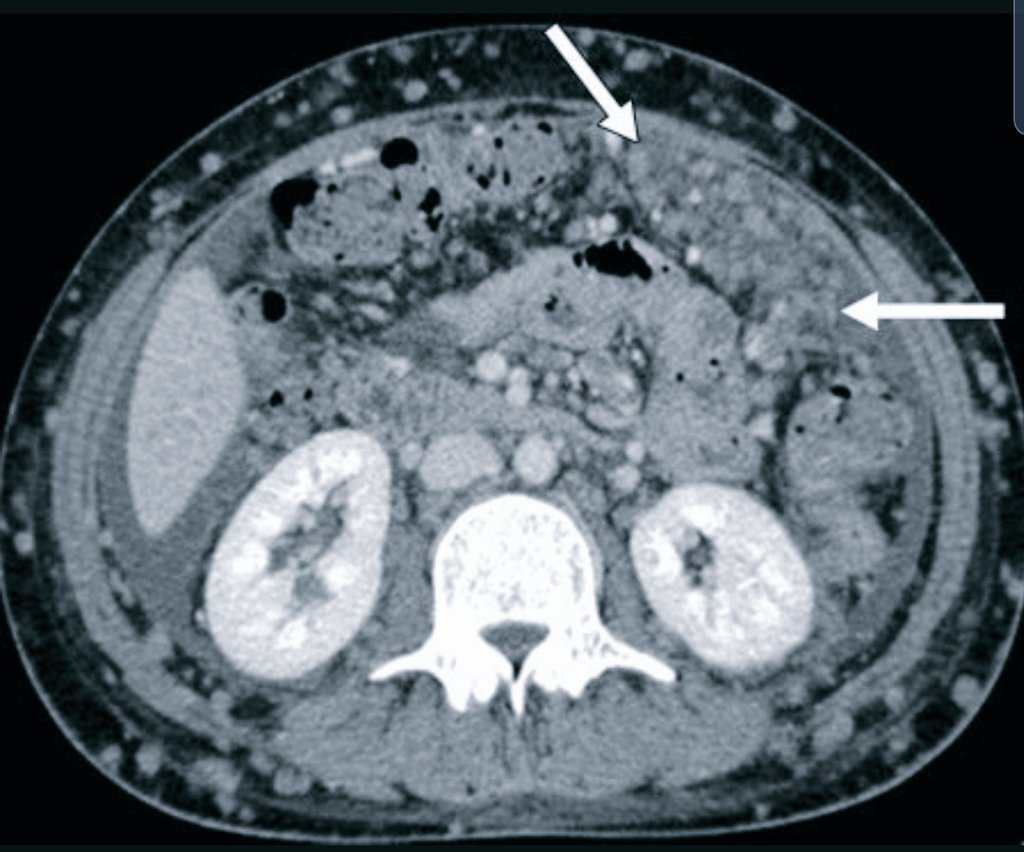 Первичные солидные новообразования большого сальника. Операция. 1991 г., апрель; 109 (4): 543-9. [PubMed: 2008659]
Первичные солидные новообразования большого сальника. Операция. 1991 г., апрель; 109 (4): 543-9. [PubMed: 2008659]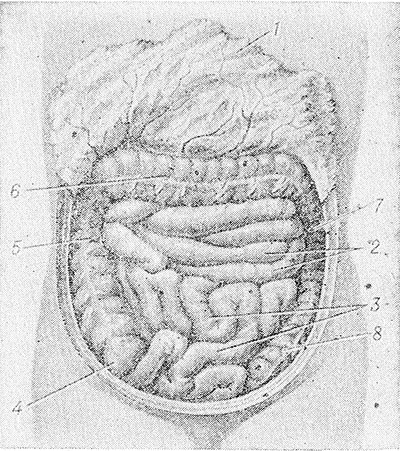 Gynecol Oncol Rep. 2016 Aug;17:75-8.[Бесплатная статья PMC: PMC4949497] [PubMed: 27489871]
Gynecol Oncol Rep. 2016 Aug;17:75-8.[Бесплатная статья PMC: PMC4949497] [PubMed: 27489871] Случай первичной лейомиосаркомы малого сальника. Корейский J Intern Med.1999 янв.; 14(1):88-90. [Бесплатная статья PMC: PMC4531912] [PubMed: 10063320]
Случай первичной лейомиосаркомы малого сальника. Корейский J Intern Med.1999 янв.; 14(1):88-90. [Бесплатная статья PMC: PMC4531912] [PubMed: 10063320]
 Солитарная фиброзная опухоль, возникающая в брыжейке: клинический случай. World J Surg Oncol. 2011 31 октября; 9:140. [Бесплатная статья PMC: PMC3225306] [PubMed: 22035205]
Солитарная фиброзная опухоль, возникающая в брыжейке: клинический случай. World J Surg Oncol. 2011 31 октября; 9:140. [Бесплатная статья PMC: PMC3225306] [PubMed: 22035205]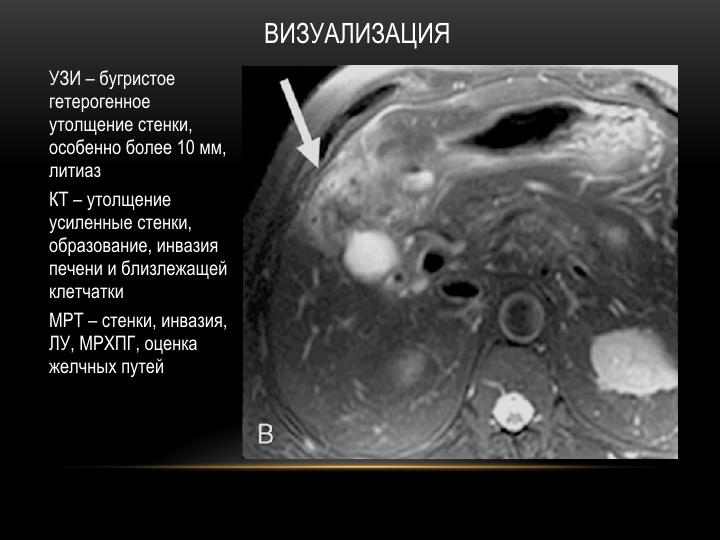 Гепатогастроэнтерология. 1999 май-июнь;46(27):2110-2. [PubMed: 10430407]
Гепатогастроэнтерология. 1999 май-июнь;46(27):2110-2. [PubMed: 10430407]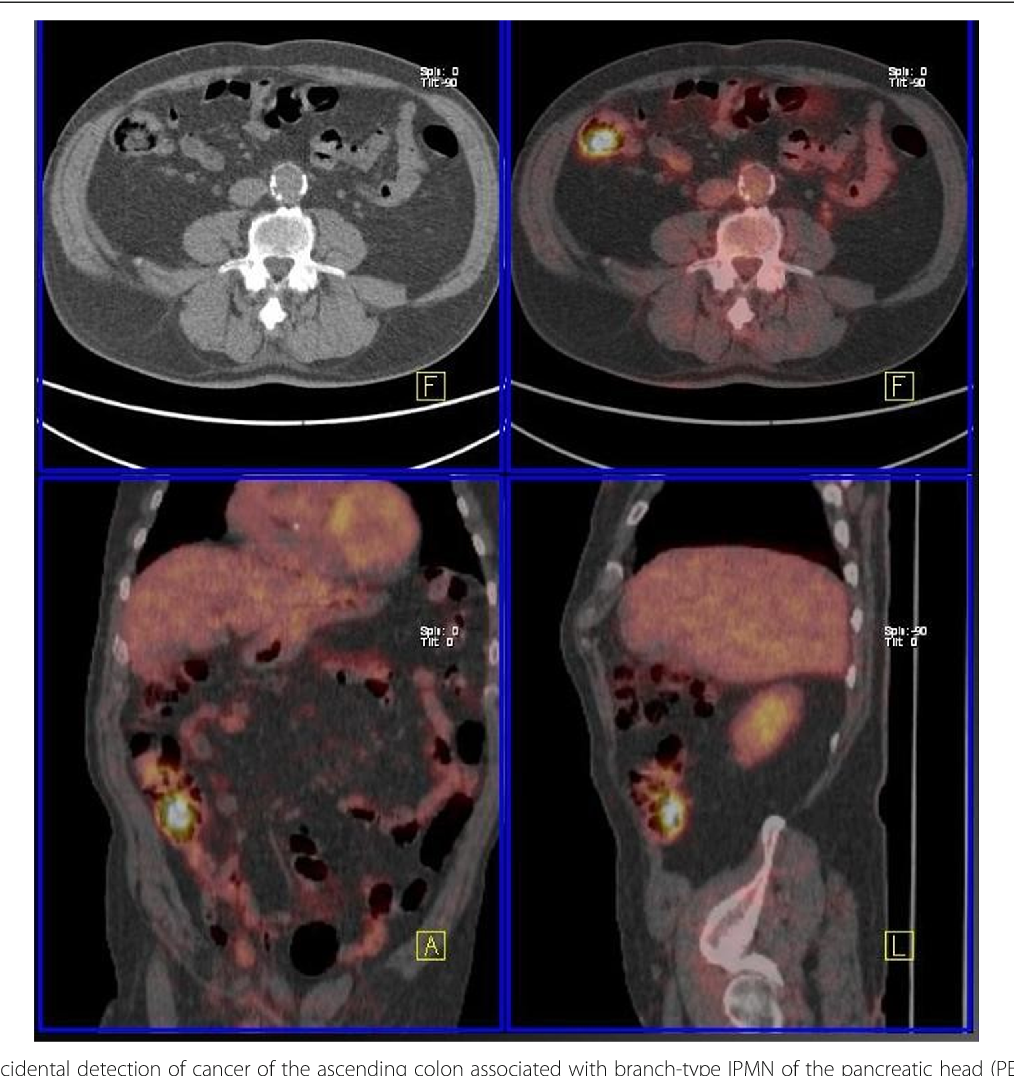 Отчет по делу Int J Surg 2016; 28:317-320. [Бесплатная статья PMC: PMC5079381] [PubMed: 27771602]
Отчет по делу Int J Surg 2016; 28:317-320. [Бесплатная статья PMC: PMC5079381] [PubMed: 27771602] , Рыбалко В.Ю., Чан В.М., Лорд Э.М. Сальниковые иммунные агрегаты и метастазы опухоли в брюшную полость. Иммунол Рез. 2009 декабрь; 45 (2-3): 185-94. [Бесплатная статья PMC: PMC28
, Рыбалко В.Ю., Чан В.М., Лорд Э.М. Сальниковые иммунные агрегаты и метастазы опухоли в брюшную полость. Иммунол Рез. 2009 декабрь; 45 (2-3): 185-94. [Бесплатная статья PMC: PMC28 , Айкоу С., Мори К., Ямасита Х., Номура С., Шибахара Дж., Фукаяма М., Сето Ю. Солитарная фиброзная опухоль большой сальник, имитирующий гастроинтестинальную стромальную опухоль тонкой кишки: клинический случай. инт сург. 2015 май; 100(5):836-40. [Бесплатная статья PMC: PMC4452971] [PubMed: 26011203]
, Айкоу С., Мори К., Ямасита Х., Номура С., Шибахара Дж., Фукаяма М., Сето Ю. Солитарная фиброзная опухоль большой сальник, имитирующий гастроинтестинальную стромальную опухоль тонкой кишки: клинический случай. инт сург. 2015 май; 100(5):836-40. [Бесплатная статья PMC: PMC4452971] [PubMed: 26011203]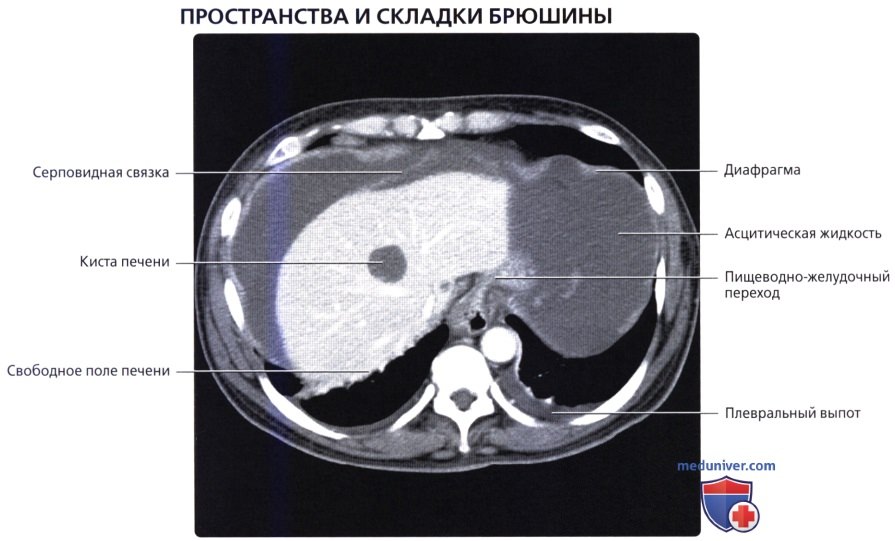 , Эссадель А., Мохаммадин эль-Х., Таги А., Сеттаф А., Чад Б.Гигантская липосаркома сальника, имитирующая опухоль яичника. Отчет о случае. Индийский Дж. Сург. 2012 окт; 74 (5): 425-7. [Бесплатная статья PMC: PMC3477403] [PubMed: 24082602]
, Эссадель А., Мохаммадин эль-Х., Таги А., Сеттаф А., Чад Б.Гигантская липосаркома сальника, имитирующая опухоль яичника. Отчет о случае. Индийский Дж. Сург. 2012 окт; 74 (5): 425-7. [Бесплатная статья PMC: PMC3477403] [PubMed: 24082602] , Исида Х., Конно К., Комацуда Т., Абэ К. Первичная лейомиосаркома большого сальника. Дж. Клин Гастроэнтерол. 1999 март; 28(2):167-70. [PubMed: 10078829]
, Исида Х., Конно К., Комацуда Т., Абэ К. Первичная лейомиосаркома большого сальника. Дж. Клин Гастроэнтерол. 1999 март; 28(2):167-70. [PubMed: 10078829] , Рыбалко В.Ю., Чан В.М., Лорд Э.М. Сальниковые иммунные агрегаты и метастазы опухоли в брюшную полость. Иммунол Рез. 2009 декабрь; 45 (2-3): 185-94. [Бесплатная статья PMC: PMC28
, Рыбалко В.Ю., Чан В.М., Лорд Э.М. Сальниковые иммунные агрегаты и метастазы опухоли в брюшную полость. Иммунол Рез. 2009 декабрь; 45 (2-3): 185-94. [Бесплатная статья PMC: PMC28 , Айкоу С., Мори К., Ямасита Х., Номура С., Шибахара Дж., Фукаяма М., Сето Ю. Солитарная фиброзная опухоль большой сальник, имитирующий гастроинтестинальную стромальную опухоль тонкой кишки: клинический случай. инт сург. 2015 май; 100(5):836-40. [Бесплатная статья PMC: PMC4452971] [PubMed: 26011203]
, Айкоу С., Мори К., Ямасита Х., Номура С., Шибахара Дж., Фукаяма М., Сето Ю. Солитарная фиброзная опухоль большой сальник, имитирующий гастроинтестинальную стромальную опухоль тонкой кишки: клинический случай. инт сург. 2015 май; 100(5):836-40. [Бесплатная статья PMC: PMC4452971] [PubMed: 26011203] , Эссадель А., Мохаммадин эль-Х., Таги А., Сеттаф А., Чад Б.Гигантская липосаркома сальника, имитирующая опухоль яичника. Отчет о случае. Индийский Дж. Сург. 2012 окт; 74 (5): 425-7. [Бесплатная статья PMC: PMC3477403] [PubMed: 24082602]
, Эссадель А., Мохаммадин эль-Х., Таги А., Сеттаф А., Чад Б.Гигантская липосаркома сальника, имитирующая опухоль яичника. Отчет о случае. Индийский Дж. Сург. 2012 окт; 74 (5): 425-7. [Бесплатная статья PMC: PMC3477403] [PubMed: 24082602]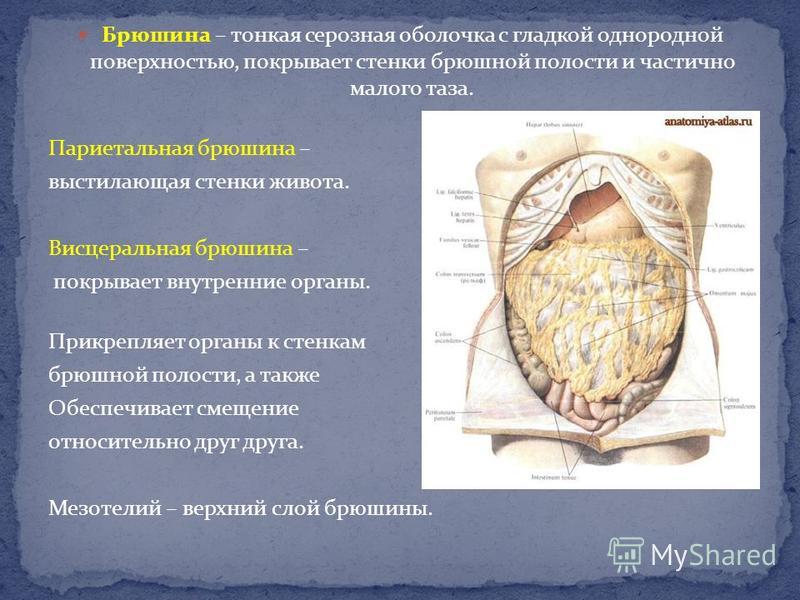 , Исида Х., Конно К., Комацуда Т., Абэ К. Первичная лейомиосаркома большого сальника. Дж. Клин Гастроэнтерол. 1999 март; 28(2):167-70. [PubMed: 10078829]
, Исида Х., Конно К., Комацуда Т., Абэ К. Первичная лейомиосаркома большого сальника. Дж. Клин Гастроэнтерол. 1999 март; 28(2):167-70. [PubMed: 10078829]