Бластоциста имплантация: Что такое бластоциста. Какие преимущества у пересадки 5-дневного эмбриона?
ПЕРЕДАЧА БЛАСТОЦИСТА — Fertillife
ПЕРЕДАЧА БЛАСТОЦИСТА
Эмбрион, в котором яйцеклетка имеет две разные формы клеток, которые развиваются и созревают через 5 дней после оплодотворения спермой, называется бластоцистой. Поверхностные клетки называются трофектродермой и в конечном итоге становятся плацентой и внутренними клетками, термин «внутренняя клеточная масса» позже станет плодом. Для здорового переноса бластоциста удаляется из оболочки (блестящая оболочка) и переносится в матку на 5-й день, после чего проводится имплантация. Согласно тому, что известно из естественной беременности, оплодотворенная яйцеклетка развивается путем деления в фаллопиевых трубах во время своего путешествия, которое длится несколько дней, а в конце 4-го дня оно попадает в матку и имплантируется в эндометрий. Это наиболее близкий к естественному циклу перенос эмбриона.
Перенос «бластоцисты» в лечение ЭКО
В первые годы лечения ЭКО эмбрионы не могли выжить позже из-за недостаточного количества персонала, оборудования и лабораторных условий.
Как эмбриологические лаборатории Fertillife Health Group, мы осуществляем перенос эмбрионов на 5-й день, независимо от возраста женщины и количества эмбрионов. Когда эти эмбрионы, которые мы выбрали для лечения экстракорпорального оплодотворения, вводятся в матку с помощью специальных катетеров, происходит прикрепление и наступает беременность. Кроме того, наличие других бластоцист, которые можно заморозить, увеличивает шансы семей, у которых нет беременности или которые хотят позже завести второго ребенка.
Преимущества переноса бластоцисты
— Среди эмбрионов, длительное время наблюдаемых в лаборатории, отбираются те, которые имеют высокое качество и наиболее подходят для имплантации. Таким образом, вероятность беременности увеличивается при переносе эмбрионов, которые развиваются намного лучше, чем другие. При сравнении результатов переноса эмбрионов на 3-й и 5-й дни было показано, что частота наступления беременности была значительно выше у тех, кто перенес перенос бластоцисты.
При сравнении результатов переноса эмбрионов на 3-й и 5-й дни было показано, что частота наступления беременности была значительно выше у тех, кто перенес перенос бластоцисты.
-Эмбрионы переносятся максимально близко к естественному процессу, происходящему в женском организме. Таким образом, эндометрий обеспечивает лучшую среду, в которой эмбрион на стадии бластоцисты может удерживаться в матке. Короче говоря, эмбрион и матка готовятся к беременности одновременно.
При переносе бластоцисты вероятность имплантации и беременности выше и, следовательно, высокая вероятность беременности достигается при переносе небольшого количества эмбрионов. Это снижает риск многоплодной беременности.
Ученые создали эмбрион из клеток кожи человека. Это настоящий зародыш?
https://ria.ru/20210321/embrion-1602041479.html
Ученые создали эмбрион из клеток кожи человека. Это настоящий зародыш?
Ученые создали эмбрион из клеток кожи человека. Это настоящий зародыш? — РИА Новости, 21.03.2021
Это настоящий зародыш? — РИА Новости, 21.03.2021
Ученые создали эмбрион из клеток кожи человека. Это настоящий зародыш?
На этой неделе сразу два коллектива ученых заявили, что создали модель человеческого эмбриона без яйцеклетки и сперматозоида. Имитацию бластоцисты — ранней… РИА Новости, 21.03.2021
2021-03-21T08:00
2021-03-21T08:00
2021-03-21T08:10
наука
сша
нидерланды
великобритания
кембриджский университет
мичиганский университет
здоровье
биология
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/155554/30/1555543033_0:257:2730:1793_1920x0_80_0_0_64ab4d3e90cd4b0345d027db6be9b49c.jpg
МОСКВА, 21 мар — РИА Новости, Альфия Еникеева. На этой неделе сразу два коллектива ученых заявили, что создали модель человеческого эмбриона без яйцеклетки и сперматозоида. Имитацию бластоцисты — ранней стадии развития зародыша — вырастили из фибробластов, перепрограммированных клеток соединительной ткани. Это позволит обойти запрет на подобные опыты в большинстве стран. РИА Новости разбирается, насколько «настоящий» получился зародыш и какое будущее ждет эти открытия. Зачатие без оплодотворенияОбычно эмбрионы в лабораторных условиях выращивают из донорских оплодотворенных яйцеклеток. В случае клонирования от сперматозоидов можно отказаться. Начиная с середины десятых годов стало понятно, что вырастить зародыши в пробирке можно без участия половых клеток вообще. Бластоциста состоит из трех типов клеток, из которых потом формируются ткани плода, плацента и желточный мешок. А получают все это из стволовых клеток. Впервые создать “зародыш без родителей” удалось в 2017-м ученым из Кембриджского университета (Великобритания). Они взяли эмбриональные и экстраэмбриональные трофобластные стволовые клетки (из них образуется плацента) мыши и поместили их на трехмерный внеклеточный матрикс. Там они самоорганизовались в структуру, которая по строению напоминала обычный мышиный зародыш. Однако на четвертый день эксперимента его развитие остановилось — не было доступа к питательным веществам, как в организме матери.
Это позволит обойти запрет на подобные опыты в большинстве стран. РИА Новости разбирается, насколько «настоящий» получился зародыш и какое будущее ждет эти открытия. Зачатие без оплодотворенияОбычно эмбрионы в лабораторных условиях выращивают из донорских оплодотворенных яйцеклеток. В случае клонирования от сперматозоидов можно отказаться. Начиная с середины десятых годов стало понятно, что вырастить зародыши в пробирке можно без участия половых клеток вообще. Бластоциста состоит из трех типов клеток, из которых потом формируются ткани плода, плацента и желточный мешок. А получают все это из стволовых клеток. Впервые создать “зародыш без родителей” удалось в 2017-м ученым из Кембриджского университета (Великобритания). Они взяли эмбриональные и экстраэмбриональные трофобластные стволовые клетки (из них образуется плацента) мыши и поместили их на трехмерный внеклеточный матрикс. Там они самоорганизовались в структуру, которая по строению напоминала обычный мышиный зародыш. Однако на четвертый день эксперимента его развитие остановилось — не было доступа к питательным веществам, как в организме матери. Беременность стволовыми клеткамиНа следующий год эксперимент повторили исследователи из Утрехтского университета (Нидерланды). Как и британские коллеги, они создали мышиный эмбрион из стволовых клеток двух типов — эмбриональных и трофобластных. Однако голландцы продвинулись дальше. У выращенной ими бластоцисты сформировались все типы клеток, необходимые для дальнейшего развития. Более того, при имплантации в матку животного бластоциста вызывала беременность. Правда, авторы работы подчеркивали, что у них получился не совсем настоящий зародыш и потому самка не смогла бы его выносить и родить. В 2019 году ученые из Института биологических исследований Солка (США) также инициировали беременность у мышей, пересадив им эмбрионы, полученные всего из одной соматической клетки. Ее взяли из организма взрослого животного, перепрограммировали и размножили — таким образом появилась культура зародышевых стволовых клеток. Затем их перепрограммировали еще раз, превратив в так называемые улучшенные плюропотентные клетки, и обработали коктейлем из специальных сигнальных веществ — тех, которые при естественном эмбриональном развитии вызывают дифференцировку трофобласта (из него формируется плацента) и внутренней клеточной массы (из нее образуются ткани зародыша).
Беременность стволовыми клеткамиНа следующий год эксперимент повторили исследователи из Утрехтского университета (Нидерланды). Как и британские коллеги, они создали мышиный эмбрион из стволовых клеток двух типов — эмбриональных и трофобластных. Однако голландцы продвинулись дальше. У выращенной ими бластоцисты сформировались все типы клеток, необходимые для дальнейшего развития. Более того, при имплантации в матку животного бластоциста вызывала беременность. Правда, авторы работы подчеркивали, что у них получился не совсем настоящий зародыш и потому самка не смогла бы его выносить и родить. В 2019 году ученые из Института биологических исследований Солка (США) также инициировали беременность у мышей, пересадив им эмбрионы, полученные всего из одной соматической клетки. Ее взяли из организма взрослого животного, перепрограммировали и размножили — таким образом появилась культура зародышевых стволовых клеток. Затем их перепрограммировали еще раз, превратив в так называемые улучшенные плюропотентные клетки, и обработали коктейлем из специальных сигнальных веществ — тех, которые при естественном эмбриональном развитии вызывают дифференцировку трофобласта (из него формируется плацента) и внутренней клеточной массы (из нее образуются ткани зародыша). В результате в 15 процентах случаев из них вырастали бластоиды — структуры, аналогичные бластоцистам по клеточному составу и экспрессии генов. Когда полученные бластоиды переносили в матку мышей, то примерно семи процентам удавалось там прикрепиться. Как отмечали исследователи, в организме самок они развивались еще около недели, но существенно отставали от обычных зародышей, а затем замирали. Имитация человекаГипотетически подобный фокус должен был сработать и с человеческими клетками. Полученный таким образом эмбрион позволил бы обойти нынешние довольно суровые правила, напрямую запрещающие создавать зародыши человека в исследовательских целях. А без этого невозможно разобраться, что на самом деле происходит на ранних стадиях развития. И вот 12 марта группа ученых из Калифорнийского технологического (США) и Кембриджского университетов сообщила, что они вырастили человеческие эмбрионы, используя только стволовые и соматические клетки взрослых людей. Фактически исследователи усовершенствовали методику, по которой в 2017-м создали первого в мире мышиного “зародыша без родителей”.
В результате в 15 процентах случаев из них вырастали бластоиды — структуры, аналогичные бластоцистам по клеточному составу и экспрессии генов. Когда полученные бластоиды переносили в матку мышей, то примерно семи процентам удавалось там прикрепиться. Как отмечали исследователи, в организме самок они развивались еще около недели, но существенно отставали от обычных зародышей, а затем замирали. Имитация человекаГипотетически подобный фокус должен был сработать и с человеческими клетками. Полученный таким образом эмбрион позволил бы обойти нынешние довольно суровые правила, напрямую запрещающие создавать зародыши человека в исследовательских целях. А без этого невозможно разобраться, что на самом деле происходит на ранних стадиях развития. И вот 12 марта группа ученых из Калифорнийского технологического (США) и Кембриджского университетов сообщила, что они вырастили человеческие эмбрионы, используя только стволовые и соматические клетки взрослых людей. Фактически исследователи усовершенствовали методику, по которой в 2017-м создали первого в мире мышиного “зародыша без родителей”. Однако их результаты появились только на сайте препринтов bioRxiv и пока не прошли процедуру рецензирования. Две другие работы — биологов из США и Австралии — вышли одновременно 18 марта в Nature. И тем, и другим удалось вырастить из клеток соединительной ткани взрослого человека структуру, которая по свойствам, форме и размерам похожа на человеческую бластоцисту. Как и в экспериментах с мышами, ее назвали бластоидом. Американцы сначала перепрограммировали клетки фибробластов в плюрипотентные стволовые. А затем поместили их в специальную трехмерную чашку для культивирования, где воздействовали на них сигнальными веществами. В результате сформировался эмбрион. Подобно настоящей человеческой бластоцисте, он содержал три типа клеток, из которых впоследствии должны сформироваться плацента, желточный мешок и ткани самого зародыша. Австралийцы пошли иным путем. Они перепрограммировали клетки взрослого человека таким образом, что несколько важных генов экспрессировались в них так же, как в трех типах клеток, содержащихся в бластоцисте.
Однако их результаты появились только на сайте препринтов bioRxiv и пока не прошли процедуру рецензирования. Две другие работы — биологов из США и Австралии — вышли одновременно 18 марта в Nature. И тем, и другим удалось вырастить из клеток соединительной ткани взрослого человека структуру, которая по свойствам, форме и размерам похожа на человеческую бластоцисту. Как и в экспериментах с мышами, ее назвали бластоидом. Американцы сначала перепрограммировали клетки фибробластов в плюрипотентные стволовые. А затем поместили их в специальную трехмерную чашку для культивирования, где воздействовали на них сигнальными веществами. В результате сформировался эмбрион. Подобно настоящей человеческой бластоцисте, он содержал три типа клеток, из которых впоследствии должны сформироваться плацента, желточный мешок и ткани самого зародыша. Австралийцы пошли иным путем. Они перепрограммировали клетки взрослого человека таким образом, что несколько важных генов экспрессировались в них так же, как в трех типах клеток, содержащихся в бластоцисте. Затем поместили в трехмерную чашку, где обрабатывали коктейлем из сигнальных веществ. Через шесть-восемь дней они получили модель человеческого эмбриона. В обоих экспериментах в бластоиды превращалось всего около 20 процентов перепрограммированных клеток, что сравнимо с результатами опытов с мышами. Кроме того, ученые сымитировали перенос получившихся зародышей в матку — по понятным причинам провести такую процедуру в реальности нельзя. Псевдоимплантация прошла успешно, однако уже на десятый-одиннадцатый день зародыши останавливались в развитии. Как пояснил в разговоре с РИА Новости заведующий лабораторией генетики нарушений репродукции ФГБНУ «Медико-генетический научный центр имени академика Н. П. Бочкова» Вячеслав Черных, в исследованиях речь идет о не вполне «настоящем» зародыше человека. “Хотя в искусственно созданной бластоцисте есть необходимые элементы (наружный слой клеток, полость — бластоцель — и часть, напоминающая внутреннюю клеточную массу), отмечаются и некоторые эмбриологические недостатки.
Затем поместили в трехмерную чашку, где обрабатывали коктейлем из сигнальных веществ. Через шесть-восемь дней они получили модель человеческого эмбриона. В обоих экспериментах в бластоиды превращалось всего около 20 процентов перепрограммированных клеток, что сравнимо с результатами опытов с мышами. Кроме того, ученые сымитировали перенос получившихся зародышей в матку — по понятным причинам провести такую процедуру в реальности нельзя. Псевдоимплантация прошла успешно, однако уже на десятый-одиннадцатый день зародыши останавливались в развитии. Как пояснил в разговоре с РИА Новости заведующий лабораторией генетики нарушений репродукции ФГБНУ «Медико-генетический научный центр имени академика Н. П. Бочкова» Вячеслав Черных, в исследованиях речь идет о не вполне «настоящем» зародыше человека. “Хотя в искусственно созданной бластоцисте есть необходимые элементы (наружный слой клеток, полость — бластоцель — и часть, напоминающая внутреннюю клеточную массу), отмечаются и некоторые эмбриологические недостатки.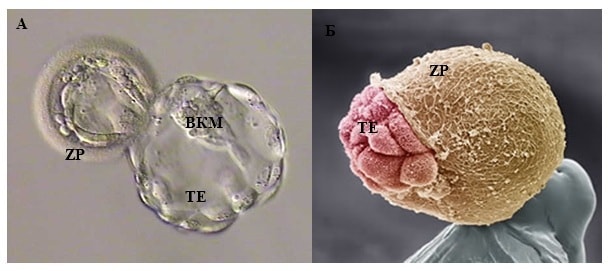 В частности, нарушения динамики и синхронности развития, морфологические различия строения структур эмбриона, генетические и эпигенетические несоответствия и прочее”, — отметил он.Не совсем человекВполне вероятно, что общество в целом будет относиться к исследованиям на таких моделях более терпимо, чем к опытам над настоящими эмбрионами, считают в редакционной статье Nature исследователи из Мичиганского университета (США). Пока главный этический вопрос, который стоит решить, — применимо ли к ним правило 14 дней. Сегодня человеческие эмбрионы, полученные экспериментально, уничтожают через 14 дней после оплодотворения. В одних странах нарушение этой нормы карается законодательно, в других — опыты с подобными зародышами отклоняют этические комитеты и лишают финансирования. “Поскольку подобное «клеточное создание» получено искусственно, то не вполне запрещено его выращивать. Однако переносить его в полость матки женщины точно нельзя и это должно быть запрещено! Возможно, их имеет смысл делать для фундаментальных исследований механизмов развития человека на ранних стадиях после оплодотворения яйцеклетки.
В частности, нарушения динамики и синхронности развития, морфологические различия строения структур эмбриона, генетические и эпигенетические несоответствия и прочее”, — отметил он.Не совсем человекВполне вероятно, что общество в целом будет относиться к исследованиям на таких моделях более терпимо, чем к опытам над настоящими эмбрионами, считают в редакционной статье Nature исследователи из Мичиганского университета (США). Пока главный этический вопрос, который стоит решить, — применимо ли к ним правило 14 дней. Сегодня человеческие эмбрионы, полученные экспериментально, уничтожают через 14 дней после оплодотворения. В одних странах нарушение этой нормы карается законодательно, в других — опыты с подобными зародышами отклоняют этические комитеты и лишают финансирования. “Поскольку подобное «клеточное создание» получено искусственно, то не вполне запрещено его выращивать. Однако переносить его в полость матки женщины точно нельзя и это должно быть запрещено! Возможно, их имеет смысл делать для фундаментальных исследований механизмов развития человека на ранних стадиях после оплодотворения яйцеклетки. Тем более, если не будет запрета, что подобные эмбрионоиды могут быть культивированы больше 14 дней», — пояснил Вячеслав Черных. Если же в отношении бластоидов запрет отменят, то ученым, вероятно, удастся разобраться не только с причинами выкидышей и неудачами при ЭКО, но и выяснить механизмы целого ряда наследственных патологий — в том числе сердечно-сосудистых заболеваний и некоторых типов диабета.
Тем более, если не будет запрета, что подобные эмбрионоиды могут быть культивированы больше 14 дней», — пояснил Вячеслав Черных. Если же в отношении бластоидов запрет отменят, то ученым, вероятно, удастся разобраться не только с причинами выкидышей и неудачами при ЭКО, но и выяснить механизмы целого ряда наследственных патологий — в том числе сердечно-сосудистых заболеваний и некоторых типов диабета.
https://ria.ru/20200611/1572793091.html
https://ria.ru/20190908/1558438867.html
https://ria.ru/20190731/1557040939.html
сша
нидерланды
великобритания
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2021
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.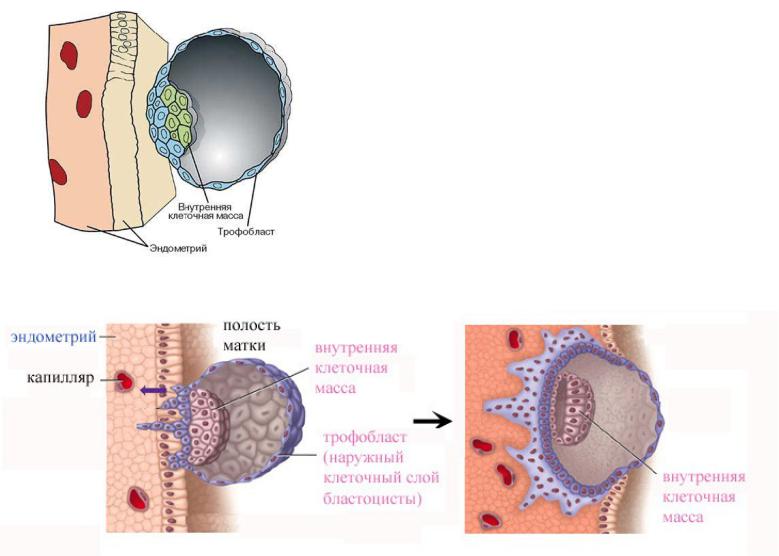 html
html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdnn21.img.ria.ru/images/155554/30/1555543033_0:0:2730:2048_1920x0_80_0_0_aa30e05111128b73a6d2d0339194672c.jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
сша, нидерланды, великобритания, кембриджский университет, мичиганский университет, здоровье, биология, эмбрионы
МОСКВА, 21 мар — РИА Новости, Альфия Еникеева. На этой неделе сразу два коллектива ученых заявили, что создали модель человеческого эмбриона без яйцеклетки и сперматозоида. Имитацию бластоцисты — ранней стадии развития зародыша — вырастили из фибробластов, перепрограммированных клеток соединительной ткани. Это позволит обойти запрет на подобные опыты в большинстве стран. РИА Новости разбирается, насколько «настоящий» получился зародыш и какое будущее ждет эти открытия.
Это позволит обойти запрет на подобные опыты в большинстве стран. РИА Новости разбирается, насколько «настоящий» получился зародыш и какое будущее ждет эти открытия.
Зачатие без оплодотворения
Обычно эмбрионы в лабораторных условиях выращивают из донорских оплодотворенных яйцеклеток. В случае клонирования от сперматозоидов можно отказаться. Начиная с середины десятых годов стало понятно, что вырастить зародыши в пробирке можно без участия половых клеток вообще. Бластоциста состоит из трех типов клеток, из которых потом формируются ткани плода, плацента и желточный мешок. А получают все это из стволовых клеток.
Впервые создать “зародыш без родителей” удалось в 2017-м ученым из Кембриджского университета (Великобритания). Они взяли эмбриональные и экстраэмбриональные трофобластные стволовые клетки (из них образуется плацента) мыши и поместили их на трехмерный внеклеточный матрикс. Там они самоорганизовались в структуру, которая по строению напоминала обычный мышиный зародыш.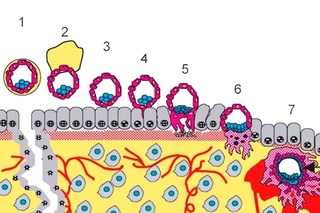
Однако на четвертый день эксперимента его развитие остановилось — не было доступа к питательным веществам, как в организме матери.
Беременность стволовыми клетками
На следующий год эксперимент повторили исследователи из Утрехтского университета (Нидерланды). Как и британские коллеги, они создали мышиный эмбрион из стволовых клеток двух типов — эмбриональных и трофобластных. Однако голландцы продвинулись дальше. У выращенной ими бластоцисты сформировались все типы клеток, необходимые для дальнейшего развития.Более того, при имплантации в матку животного бластоциста вызывала беременность. Правда, авторы работы подчеркивали, что у них получился не совсем настоящий зародыш и потому самка не смогла бы его выносить и родить.
11 июня 2020, 12:01НаукаУченые собрали из стволовых клеток модель эмбриона человекаВ 2019 году ученые из Института биологических исследований Солка (США) также инициировали беременность у мышей, пересадив им эмбрионы, полученные всего из одной соматической клетки.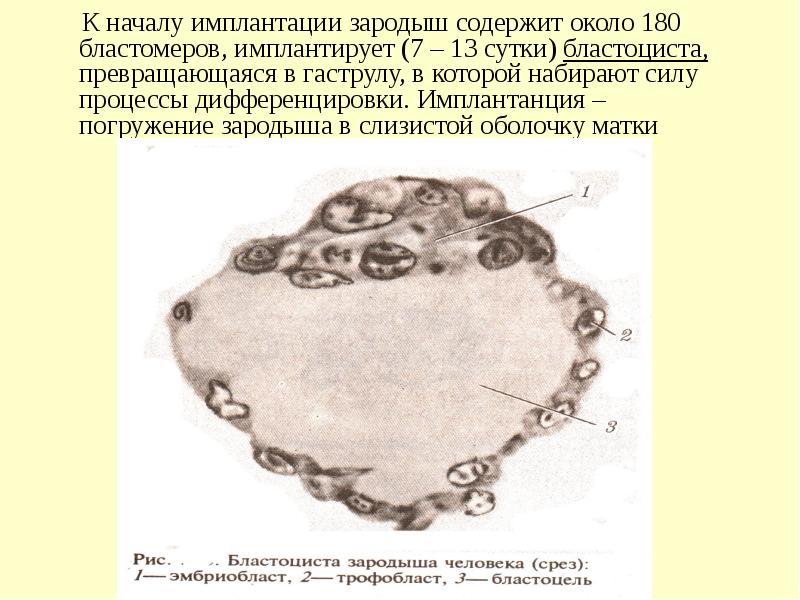 Ее взяли из организма взрослого животного, перепрограммировали и размножили — таким образом появилась культура зародышевых стволовых клеток.
Ее взяли из организма взрослого животного, перепрограммировали и размножили — таким образом появилась культура зародышевых стволовых клеток. Затем их перепрограммировали еще раз, превратив в так называемые улучшенные плюропотентные клетки, и обработали коктейлем из специальных сигнальных веществ — тех, которые при естественном эмбриональном развитии вызывают дифференцировку трофобласта (из него формируется плацента) и внутренней клеточной массы (из нее образуются ткани зародыша). В результате в 15 процентах случаев из них вырастали бластоиды — структуры, аналогичные бластоцистам по клеточному составу и экспрессии генов.
Когда полученные бластоиды переносили в матку мышей, то примерно семи процентам удавалось там прикрепиться. Как отмечали исследователи, в организме самок они развивались еще около недели, но существенно отставали от обычных зародышей, а затем замирали.
8 сентября 2019, 03:42НаукаУченый раскритиковал искусственное программирование пола эмбриона человекаИмитация человека
Гипотетически подобный фокус должен был сработать и с человеческими клетками. Полученный таким образом эмбрион позволил бы обойти нынешние довольно суровые правила, напрямую запрещающие создавать зародыши человека в исследовательских целях. А без этого невозможно разобраться, что на самом деле происходит на ранних стадиях развития. И вот 12 марта группа ученых из Калифорнийского технологического (США) и Кембриджского университетов сообщила, что они вырастили человеческие эмбрионы, используя только стволовые и соматические клетки взрослых людей. Фактически исследователи усовершенствовали методику, по которой в 2017-м создали первого в мире мышиного “зародыша без родителей”. Однако их результаты появились только на сайте препринтов bioRxiv и пока не прошли процедуру рецензирования. Две другие работы — биологов из США и Австралии — вышли одновременно 18 марта в Nature. И тем, и другим удалось вырастить из клеток соединительной ткани взрослого человека структуру, которая по свойствам, форме и размерам похожа на человеческую бластоцисту. Как и в экспериментах с мышами, ее назвали бластоидом.
Полученный таким образом эмбрион позволил бы обойти нынешние довольно суровые правила, напрямую запрещающие создавать зародыши человека в исследовательских целях. А без этого невозможно разобраться, что на самом деле происходит на ранних стадиях развития. И вот 12 марта группа ученых из Калифорнийского технологического (США) и Кембриджского университетов сообщила, что они вырастили человеческие эмбрионы, используя только стволовые и соматические клетки взрослых людей. Фактически исследователи усовершенствовали методику, по которой в 2017-м создали первого в мире мышиного “зародыша без родителей”. Однако их результаты появились только на сайте препринтов bioRxiv и пока не прошли процедуру рецензирования. Две другие работы — биологов из США и Австралии — вышли одновременно 18 марта в Nature. И тем, и другим удалось вырастить из клеток соединительной ткани взрослого человека структуру, которая по свойствам, форме и размерам похожа на человеческую бластоцисту. Как и в экспериментах с мышами, ее назвали бластоидом.
Американцы сначала перепрограммировали клетки фибробластов в плюрипотентные стволовые. А затем поместили их в специальную трехмерную чашку для культивирования, где воздействовали на них сигнальными веществами. В результате сформировался эмбрион. Подобно настоящей человеческой бластоцисте, он содержал три типа клеток, из которых впоследствии должны сформироваться плацента, желточный мешок и ткани самого зародыша.
Австралийцы пошли иным путем. Они перепрограммировали клетки взрослого человека таким образом, что несколько важных генов экспрессировались в них так же, как в трех типах клеток, содержащихся в бластоцисте. Затем поместили в трехмерную чашку, где обрабатывали коктейлем из сигнальных веществ. Через шесть-восемь дней они получили модель человеческого эмбриона.
В обоих экспериментах в бластоиды превращалось всего около 20 процентов перепрограммированных клеток, что сравнимо с результатами опытов с мышами.
Кроме того, ученые сымитировали перенос получившихся зародышей в матку — по понятным причинам провести такую процедуру в реальности нельзя. Псевдоимплантация прошла успешно, однако уже на десятый-одиннадцатый день зародыши останавливались в развитии.
Псевдоимплантация прошла успешно, однако уже на десятый-одиннадцатый день зародыши останавливались в развитии.
Как пояснил в разговоре с РИА Новости заведующий лабораторией генетики нарушений репродукции ФГБНУ «Медико-генетический научный центр имени академика Н. П. Бочкова» Вячеслав Черных, в исследованиях речь идет о не вполне «настоящем» зародыше человека. “Хотя в искусственно созданной бластоцисте есть необходимые элементы (наружный слой клеток, полость — бластоцель — и часть, напоминающая внутреннюю клеточную массу), отмечаются и некоторые эмбриологические недостатки. В частности, нарушения динамики и синхронности развития, морфологические различия строения структур эмбриона, генетические и эпигенетические несоответствия и прочее”, — отметил он.
Не совсем человек
Вполне вероятно, что общество в целом будет относиться к исследованиям на таких моделях более терпимо, чем к опытам над настоящими эмбрионами, считают в редакционной статье Nature исследователи из Мичиганского университета (США).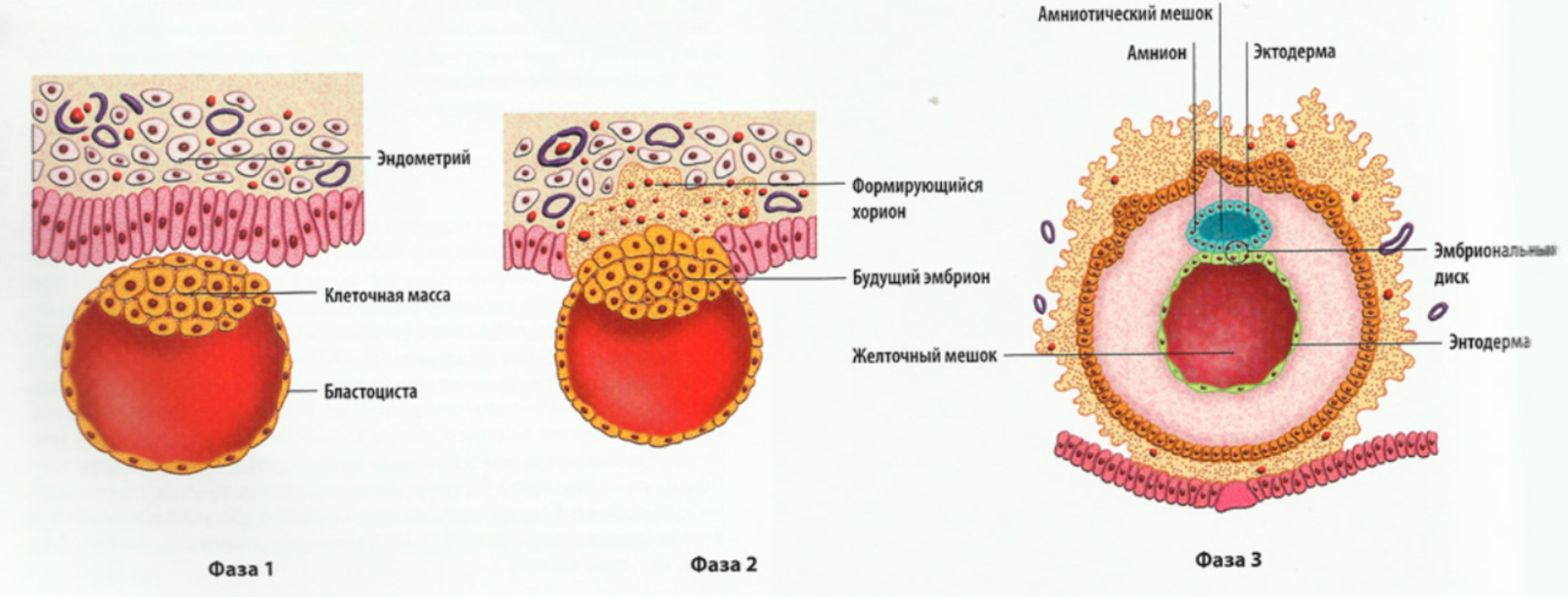 Пока главный этический вопрос, который стоит решить, — применимо ли к ним правило 14 дней. Сегодня человеческие эмбрионы, полученные экспериментально, уничтожают через 14 дней после оплодотворения. В одних странах нарушение этой нормы карается законодательно, в других — опыты с подобными зародышами отклоняют этические комитеты и лишают финансирования.
Пока главный этический вопрос, который стоит решить, — применимо ли к ним правило 14 дней. Сегодня человеческие эмбрионы, полученные экспериментально, уничтожают через 14 дней после оплодотворения. В одних странах нарушение этой нормы карается законодательно, в других — опыты с подобными зародышами отклоняют этические комитеты и лишают финансирования. “Поскольку подобное «клеточное создание» получено искусственно, то не вполне запрещено его выращивать. Однако переносить его в полость матки женщины точно нельзя и это должно быть запрещено! Возможно, их имеет смысл делать для фундаментальных исследований механизмов развития человека на ранних стадиях после оплодотворения яйцеклетки. Тем более, если не будет запрета, что подобные эмбрионоиды могут быть культивированы больше 14 дней», — пояснил Вячеслав Черных.
Если же в отношении бластоидов запрет отменят, то ученым, вероятно, удастся разобраться не только с причинами выкидышей и неудачами при ЭКО, но и выяснить механизмы целого ряда наследственных патологий — в том числе сердечно-сосудистых заболеваний и некоторых типов диабета.
Сделать вспомогательный хэтчинг для повышения эффективности ЭКО в Москве, цена
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначить только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Прецизионная лазерная технология безопасного и эффективного вспомогательного хетчинга — повышение результативности ЭКО.
Физиологический хетчинг
Одной из причин нарушения имплантации является неспособность эмбриона выйти из окружающей его оболочки, чтобы затем прикрепиться к стенке матки. Яйцеклетка, а затем и эмбрион, окружена так называемой блестящей оболочкой (zona pellucida, зона пеллюцида), которая выполняет две основные функции — препятствует проникновению в яйцеклетку более чем одного сперматозоида, а также удерживает вместе бластомеры — клетки развивающегося эмбриона.
Вспомогательный хетчинг
В случае необходимости специалисты-эмбриологи Клинического госпиталя на Яузе успешно используют эффективный метод вспомогательного лазерного хэтчинга. Его суть состоит в рассечении либо истончении оболочки эмбриона с помощью специальных точных лазерных микроманипуляций. При наличии соответствующих показаний вспомогательный хетчинг повышает эффективность экстракорпорального оплодотворения, помогая эмбриону выбраться из оболочки, как птенцу из скорлупы, и облегчает его имплантацию.
Показания к проведению вспомогательного хэтчинга
Вспомогательный хэтчинг можно порекомендовать в следующих случаях:
- после неудачных попыток ЭКО
- если возраст пациентки больше 38 лет
- при низком качестве эмбрионов
- после криоконсервации эмбриона
Методики вспомогательного хетчинга
При механическом хэтчинге зона пеллюцида частично рассекается специальными микроинструментами, благодаря чему бластоциста может быстрее выйти из оболочки.
Химический хэтчинг подразумевает воздействие на оболочку раствором кислоты, после чего зародыш обрабатывают, чтобы нейтрализовать агрессивное воздействие химических веществ.
Возможно также проведение хэтчинга по пьезо-методике. Его суть в том, что оболочка эмбриона истончается благодаря углублениям, которые делаются с помощью аппарата с высокочастотной микровибрацией — пьезоэлектрического микроманипулятора.
Воздействие на зону пеллюцида может оказываться тончайшем лазерным лучом. Сегодня существует два варианта лазерного хэтчинга — сквозное повреждение оболочки и ее локальное истончение. Последний метод считается наиболее безопасным и эффективным.
Решение о проведении вспомогательного хэтчинга, а также о его методике принимается репродуктологами и эмбриологами Клинического госпиталя на Яузе в индивидуальном порядке в каждом отдельном случае. Во избежание риска повреждения эмбриона процедуру должны проводить только специалисты с большим опытом в данной области.
Цены на услуги Вы можете посмотреть в прайсе или уточнить по телефону, указанному на сайте.
Статья проверена врачом акушером-гинекологом, д.м.н. Шабадашем В.В., носит общий информационный характер, не заменяет консультацию специалиста.
Для рекомендаций по диагностике и лечению необходима консультация врача.
Перенос эмбриона на стадии бластоцисты по сравнению с переносом на стадии дробления при искусственном оплодотворении
Вопрос обзора
Мы пытались выяснить, повышает ли перенос эмбриона на стадии бластоцисты (5-6 день) частоту живорождения при «свежем» переносе и общую частоту наступления беременности (как после «свежего», так и после криопереноса) в сравнении с переносом на стадии дробления (2-3 день).
Актуальность
При применении вспомогательных репродуктивных технологий (ВРТ), таких как экстракорпоральное оплодотворение (ЭКО), интрацитоплазматическая инъекция сперматозоида (ИКСИ), криоконсервация эмбрионов, осуществляется перенос эмбрионов в матку как на стадии дробления (2-3 день после взятия яйцеклетки), так и на стадии бластоцисты (5-6 день после взятия яйцеклетки).
Характеристика исследований
Мы включили 27 рандомизированных контролируемых испытаний (РКИ), в которых приняли участие 4031 женщина. Доказательства актуальны по апрель 2016 года.
Основные результаты
Были найдены доказательства низкого качества относительно более высоких показателей живорождения и доказательства умеренного качества относительно большей частоты наступления клинической беременности при «свежем» переносе на стадии бластоцисты по сравнению со «свежим» переносом на стадии дробления. Если при переносе на стадии дробления живорождения удавалось достичь у 29% женщин, то при переносе на стадии бластоцисты – у 32-42%. Доказательных различий между группами по общей/кумулятивной частоте наступления беременности ( как при «свежем», так и при криопереносе после процедуры взятия яйцеклетки) не было, однако качество данных по этому исходу очень низкое.
Качество доказательств
Для большинства исходов качество доказательств было низким. Основными причинами этому стали серьезный риск смещения (необъективности), связанный с недостаточным описанием методов рандомизации, и не уточненный или высокий риск смещения, связанный с выбыванием (потерей) части участников.
1-4 недели беременности
От крошечного зародыша до маленького человека организм ребенка развивается всего за 9 месяцев. Какие перемены происходят с будущей мамой и какие изменения наблюдаются у нее внутри в течение этого непростого и радостного периода жизни?
Какие перемены происходят с будущей мамой и какие изменения наблюдаются у нее внутри в течение этого непростого и радостного периода жизни?
Каждая новая жизнь начинается с объединения яйцеклетки и сперматозоида. Зачатие – это процесс, в ходе которого сперматозоид проникает вовнутрь яйцеклетки и оплодотворяет ее.
Следует отметить, что эмбриональный и акушерский сроки отличаются. Все дело в том, что среди специалистов принято считать срок с первого дня последней менструации, т. е. акушерский срок включает в себя и период подготовки к беременности. Вот и получается, что зародыш только появился, а срок беременности уже составляет две недели. Именно акушерский срок указывается во всех документах женщины и является для специалистов единственным отчетным периодом.
До момента встречи сперматозоид и яйцеклетки прожили определенное время, находясь в стадии развития и созревания. От качества данных процессов существенно зависит развитие будущего плода.
Первая неделя
Рост и созревание яйцеклетки начинается с первого дня цикла. Зрелая яйцеклетка включает 23 хромосомы в качестве генетического материала для будущего зародыша, а также содержит все необходимые для начала его развития питательные вещества. В ней располагаются запасы углеводов, белков и жиров, предназначенные для поддержки зародыша в период первых дней после его возникновения.
Зрелая яйцеклетка включает 23 хромосомы в качестве генетического материала для будущего зародыша, а также содержит все необходимые для начала его развития питательные вещества. В ней располагаются запасы углеводов, белков и жиров, предназначенные для поддержки зародыша в период первых дней после его возникновения.
Определенное количество яйцеклеток закладывается в каждом яичнике девочки еще до ее рождения. В течение детородного периода они только растут и развиваются, процесса их образования не происходит. К моменту появления девочки на свет количество клеток, из которых в будущем могут развиться яйцеклетки, достигает миллиона, но в течение жизни это количество в значительной степени уменьшается. Так, к моменту полового созревания их остается несколько сотен тысяч, а к зрелости – около 500.
Яичник ежемесячно дает возможность развиться чаще всего одной яйцеклетке, созревание которой происходит внутри пузырька с жидкостью, называемого фолликулом. С первого дня цикла и слизистая матки начинает готовиться к вероятной беременности. Для имплантации, т. е. внедрения образовавшегося зародыша в стенку матки, создается оптимальная среда. Для этого вследствие влияния гормонов происходит утолщение эндометрия, он покрывается сетью сосудов и накапливает необходимые для будущего зародыша питательные вещества.
Для имплантации, т. е. внедрения образовавшегося зародыша в стенку матки, создается оптимальная среда. Для этого вследствие влияния гормонов происходит утолщение эндометрия, он покрывается сетью сосудов и накапливает необходимые для будущего зародыша питательные вещества.
Мужские половые клетки образуются в половых железах – в яичках или семенниках. Дозревание сперматозоидов происходит в придатках семенников, в которые они перемещаются после образования. Жидкая структура спермы образуется вследствие выделения семенных пузырьков и предстательной железы. Жидкая среда необходима для хранения созревших сперматозоидов и создания для их жизни благоприятных условий.
Количество сперматозоидов достаточно велико: десятки миллионов в одном миллилитре. Несмотря на такое значительное количество, только один из них сможет оплодотворить яйцеклетку. В сперматозоидах находится исключительно генетический материал – 23 хромосомы, которые необходимы для появления зародыша.
Сперматозоидам свойственна высокая подвижность.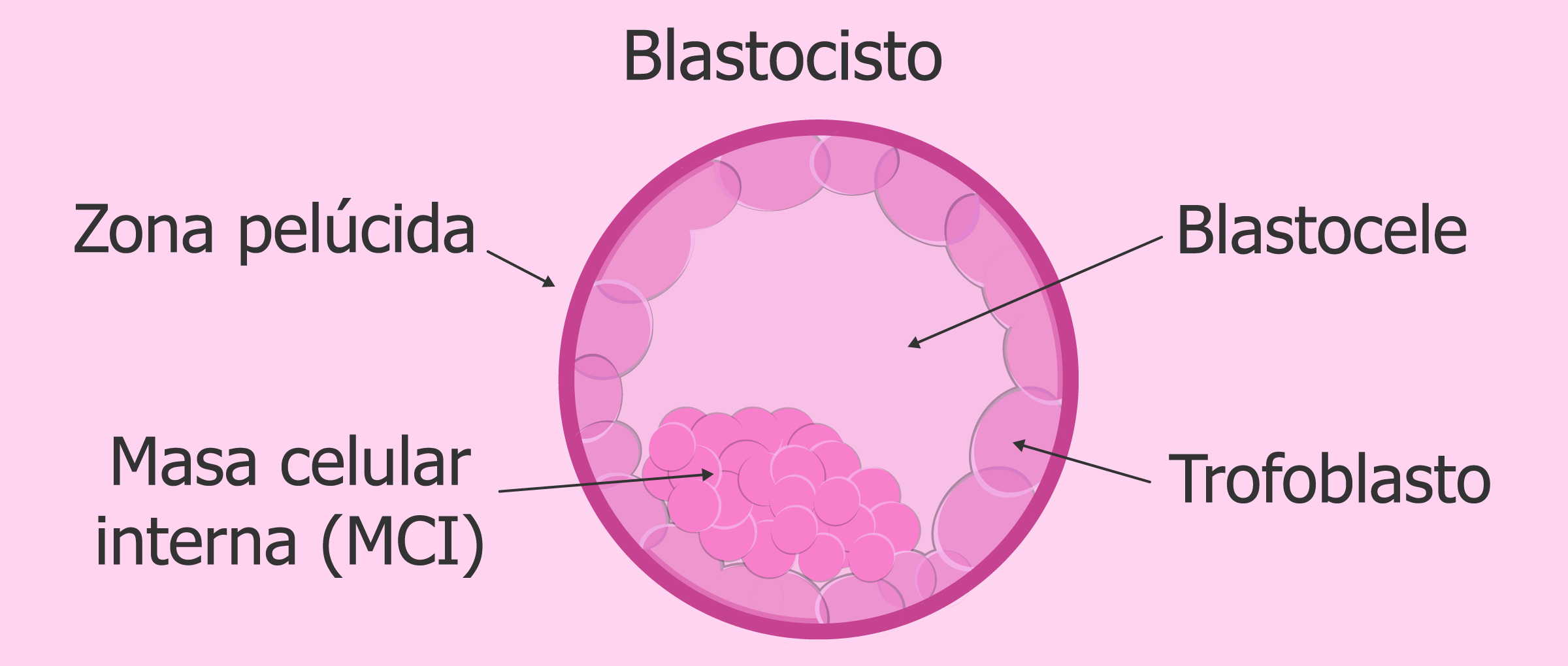 Попадая в женские половые пути, они начинают свое движение навстречу яйцеклетке. Всего полчаса-час проходит от момента семяизвержения, когда сперматозоиды проникают в полость матки. На проникновение в наиболее широкую часть, которая называется ампулой, у сперматозоидов уходит полтора-два часа. Большинство сперматозоидов гибнет на пути к яйцеклетке, встречая складки эндометрия, попадая во влагалищную среду, цервикальную слизь.
Попадая в женские половые пути, они начинают свое движение навстречу яйцеклетке. Всего полчаса-час проходит от момента семяизвержения, когда сперматозоиды проникают в полость матки. На проникновение в наиболее широкую часть, которая называется ампулой, у сперматозоидов уходит полтора-два часа. Большинство сперматозоидов гибнет на пути к яйцеклетке, встречая складки эндометрия, попадая во влагалищную среду, цервикальную слизь.
Вторая неделя
В середине цикла яйцеклетка полностью созревает и покидает яичник. Она входит в брюшную полость. Данный процесс называется овуляцией. При регулярном цикле продолжительностью 30 дней овуляция наступает на пятнадцатый. Самостоятельно двигаться яйцеклетка не способна. Когда она покидает фолликул, бахромки маточной трубы обеспечивают ее проникновение внутрь. Маточные трубы характеризуются продольной складчатостью, они заполнены слизью. Мышечные движения труб имеют волнообразный характер, что при существенном множестве ресничек создает оптимальные условия для транспортировки яйцеклетки.
Посредством труб яйцеклетка попадает в наиболее широкую их часть, которая называется ампулярной. Именно в этом месте и происходит оплодотворение. Если встречи со сперматозоидом не произошло, яйцеклетка погибает, а женский организм получает соответствующий сигнал о необходимости запуска нового цикла. Происходит отторжение слизистой оболочки, которая была создана маткой. Проявлением такого отторжения являются кровянистые выделения, которые называются менструацией.
Срок ожидания оплодотворения яйцеклеткой короток. В среднем он занимает не более суток. Оплодотворение вероятно в день овуляции и максимум на следующий. У сперматозоидов более длительный срок жизни, в среднем он составляет три-пять дней, в некоторых случаях – семь. Соответственно, если сперматозоид до овуляции попал в женские половые пути, существует вероятность, что он сможет дождаться появления яйцеклетки.
Когда яйцеклетка находится в состоянии ожидания оплодотворения, происходит выделение определенных веществ, которые предназначены для ее обнаружения. Если сперматозоиды находят яйцеклетку, они начинают выделять специальные ферменты, способные разрыхлить ее оболочку. Как только один из сперматозоидов проникает внутрь яйцеклетки, другие этого уже сделать не могут вследствие восстановления плотности ее оболочки. Таким образом, одна яйцеклетка может быть оплодотворена только одним сперматозоидом.
Если сперматозоиды находят яйцеклетку, они начинают выделять специальные ферменты, способные разрыхлить ее оболочку. Как только один из сперматозоидов проникает внутрь яйцеклетки, другие этого уже сделать не могут вследствие восстановления плотности ее оболочки. Таким образом, одна яйцеклетка может быть оплодотворена только одним сперматозоидом.
После оплодотворения происходит слияние хромосомных наборов родителей – по 23 хромосомы от каждого. В результате из двух различных клеток образуется одна, которая носит название зигота. Пол будущего ребенка зависит от того, какая из хромосом, Х или Y, была у сперматозоида. Яйцеклетки содержат только Х хромосомы. При сочетании ХХ на свет появляются девочки. Если же сперматозоид содержат Y хромосому, т. е. при сочетании ХY, рождаются мальчики. Как только в организме образовывается зигота, в нем происходит запуск механизма, направленного на сохранение беременности. Происходят изменения гормонального фона, биохимических реакций, иммунных механизмов, поступления нервных сигналов.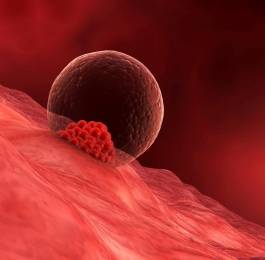 Женский организм создает все необходимые условия для безопасного развития плода.
Женский организм создает все необходимые условия для безопасного развития плода.
Третья неделя
Как только пройдут сутки после образования зародыша, ему понадобится совершить свой первый путь. Движения ресничек и сокращение мышц трубы направляют его в полость матки. В течение этого процесса внутри яйцеклетки происходит дробление на одинаковые клеточки.
По прошествии четырех дней меняется внешний вид яйцеклетки: она теряет круглую форму и становится гроздевидной. Данная стадия называется морула, начинается эмбриогенез – важный этап развития зародыша, на протяжении которого происходит формирование зачатков органов и тканей. Дробление клеток продолжается несколько дней, на пятый образуются их комплексы, которым присущи различные функции. Центральное скопление образует непосредственно эмбрион, наружное, называемое трофобласт, предназначено для расплавления эндометрия – внутреннего слоя матки.
5-7 дней уходит у зародыша на путь к матке. Когда происходит имплантация в ее слизистую оболочку, количество клеточек доходит до ста. Термин имплантация обозначает процесс внедрения эмбриона в слой эндометрия.
Термин имплантация обозначает процесс внедрения эмбриона в слой эндометрия.
После оплодотворения на седьмой или восьмой день происходит имплантация. Первым критическим периодом беременности является данный этап, поскольку эмбриону впервые придется продемонстрировать свою жизнеспособность.
В течение имплантации происходит активное деление наружных клеток эмбриона, а сам процесс занимает порядка сорока часов. Количество клеток снаружи эмбриона резко увеличивается, они вытягиваются, происходит проникновение в слизистую оболочку матки, а внутри образуются тончайшие кровеносные сосуды, которые необходимы для поступления к эмбриону питательных веществ. Пройдет время, и эти сосуды преобразуются сначала в хорион, а впоследствии и в плаценту, которая сможет снабжать плод всем необходимым вплоть до появления младенца на свет.
Эмбрион на данном этапе жизни называется бластоциста. Он контактирует с эндометрием, расплавляет своей деятельностью клетки эндометрия, создает для себя дорожку к более глубоким слоям. Происходит сплетение кровеносными сосудами эмбриона с организмом мамы, что позволяет ему сразу же начать добывать полезные и нужные для развития вещества. Это жизненно необходимо, поскольку к данному времени запас, который несла в себе зрелая яйцеклетка, оказывается исчерпанным.
Происходит сплетение кровеносными сосудами эмбриона с организмом мамы, что позволяет ему сразу же начать добывать полезные и нужные для развития вещества. Это жизненно необходимо, поскольку к данному времени запас, который несла в себе зрелая яйцеклетка, оказывается исчерпанным.
Далее начинается производство клетками трофобласта, т. е. наружными клетками хорионического гонадотропина человека, – гормона ХГЧ. Распространение данного гормона по всему организму оповещает его о наступлении беременности, что обуславливает запуск активной гормональной перестройки и начало соответствующих изменений в организме.
После оплодотворения и до запуска ХГЧ проходит, как правило, восемь или девять дней. Поэтому уже с десятого дня после оплодотворения становится возможным определение данного гормона в крови матери. Такой анализ является наиболее достоверным подтверждением наступления беременности. Тесты, которые предлагаются сегодня для определения беременности, основываются на выявлении данного гормона в моче женщины.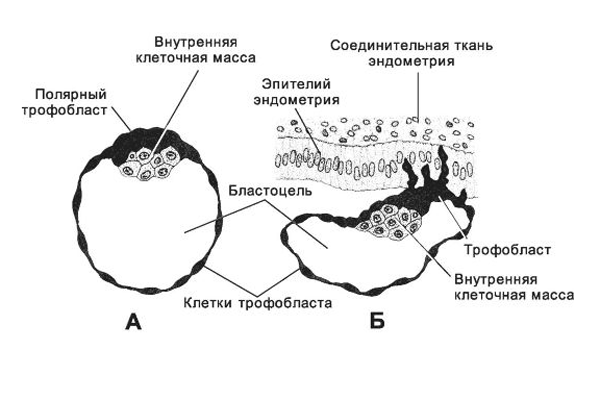 После первого дня задержки менструации при ее регулярном цикле уже возможно определить беременность с помощью теста самостоятельно.
После первого дня задержки менструации при ее регулярном цикле уже возможно определить беременность с помощью теста самостоятельно.
Что происходит с женщиной на третьей неделе беременности
Если женщина планирует беременность, 21-24 дни при условии регулярного цикла должны стать для нее важными. Это период возможной имплантации, когда собственному образу жизни следует уделить особенное внимание. Нежелательны в данный период тепловые воздействия и чрезмерные физические нагрузки, также следует предотвратить влияние различного рода излучений.
Женщина ничего не ощущает на данном этапе, т. к. имплантация не имеет внешних признаков. Если собственный образ жизни скорректировать в соответствии с простыми правилами, перечисленными выше, получится создать оптимальные условия для успешной имплантации.
Четвертая неделя
На четвертой акушерской неделе или второй неделе жизни зародыша его организм состоит из двух слоев. Эндобласт – клетки внутреннего слоя – станут началом пищеварительной и дыхательной систем, эктобласт – клетки внешнего слоя – дадут старт развитию нервной системы и кожи.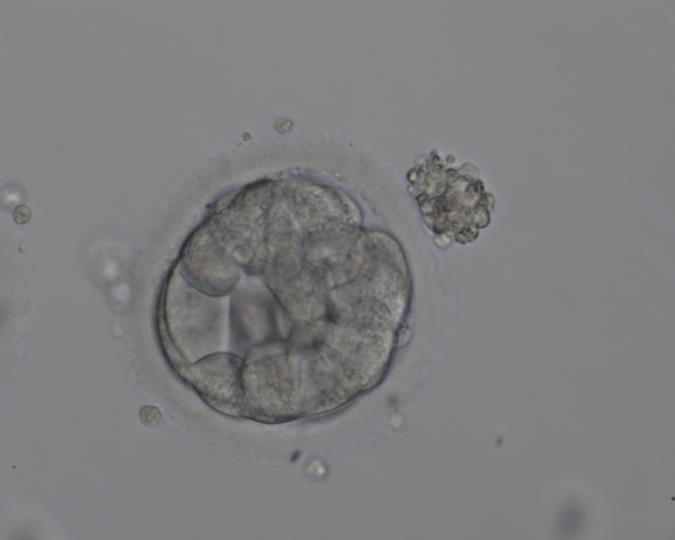
Размер эмбриона на данной стадии составляет 1,5 мм. Плоское расположение клеточек обусловило название зародыша данного возраста – диск.
Четвертая неделя характеризуется интенсивным развитием внезародышевых органов. Такие органы должны окружить зародыш и создать для его развития максимально благоприятные условия. Будущие плодные оболочки на данном этапе называются амниотический пузырь, также развиваются хорион, который впоследствии станет плацентой, и желточный мешок, являющийся складом питательных веществ, необходимых зародышу.
Что происходит с женщиной на четвертой неделе беременности
Если на четвертой неделе с женщиной и происходят изменения, то они являются совсем незначительными. Пока гормоны не достигли того уровня, чтобы оказать существенное влияние на состояние ее здоровья. Вероятны сонливость, перепады настроения, увеличение чувствительности молочных желез.
Основными помощниками будущей мамы на четвертой неделе, как и в течение всей беременности, являются свежий воздух, правильно подобранное питание и хорошее настроение.
Анализ рецептивности эндометрия (Endometrial Receptivity Analysis, ERA)
Имплантация эмбриона в полости матки — многоступенчатый процесс, регуляция которого осуществляется путем межмолекулярных и межклеточных взаимодействий, а успех во многом зависит от синхронности развития эмбриона и эндометрия. В результате их взаимодействия экспрессируется большое количество сигнальных молекул, которые осуществляют паракринно (действие свободных растворимых форм регуляторных молекул, которые секретируются одной клеткой, действуют путем местной диффузии в клетки-мишени, которые находятся непосредственно у клеток-продуцентов), аутокринно (действие свободных растворимых форм регуляторных молекул непосредственно на клетки-продуценты), интракринну (регуляторная молекула производится в клетке, действует внутри нее через специфические рецепторы) и юкстакринну (разновидность паракринной действия; регуляторные молекулы не поступают в межклеточную жидкость, а передают свой сигнал через плазматическую мембрану рядом расположенной другой клетки ) регуляцию внутри- и межклеточных взаимодействий. Эти взаимодействия модулируют дальнейшее развитие и «поведение» бластоцисты, распознавание беременности и адаптацию к ней организма матери.
Одним из основных факторов, определяющих фертильность женщины, является рецептивность эндометрия. Когда приближается период рецептивности эндометрия, бластоциста входит в полость матки, происходит ее хетчинг и появление адгезивных элементов на ее апикальных эпителиальных поверхностях, затем — прикрепление эмбриона к эндометрию. Эмбрион может имплантироваться в любом месте человеческого организма, кроме нерецептивного эндометрия. Поверхность эндометрия рассматривается как барьер для имплантации, за исключением короткого периода окна имплантации (И.А. Судорога, 2006; В. К. Чайка, 2011; И.Д. Гюльмамедова 2013; Grewal et al., 2008; Cakmak, Taylor. 2010). У женщин с бесплодием наблюдается нарушение рецептивности эндометрия. В период окна имплантации морфофункциональная трансформация эндометрия сопровождается непрерывным и хорошо организованной экспрессией специфических генов, которые как облегчают, так и ограничивают способность бластоцисты и трофобласта углубляться в поверхность матки. На сегодняшний день для оценки рецепторных свойств эндометрия предложен целый ряд потенциальных биомаркеров.
Гены, принятые по «золотой стандарт» как биомаркеры рецептивности эндометрия (избранные гены, экспрессия которых была значительно снижена или повышена при рецептивной фазы) (Patricia Dıaz-Gimeno et al., 2011)
Обобщенный анализ результатов предыдущих исследований позволил выделить совокупность генов, определяющих рецептивность эндометрия. Существуют подгруппы генов, экспрессия которых в эндометрии повышается или снижается на седьмой день после пика ЛГ в естественном цикле с ровно противоположным характером регуляции в циклах контролируемой стимуляции яичников и невосприимчивыми эндометрии. Набор этих генов позволяет создать объективный инструмент для геномной диагностики рецептивности эндометрия.
К генов «золотого стандарта» относятся гены, кодирующие следующие белки (избранное):
CAPN6 — кальпаин-6
Кальпаины — это семья кальцийзависимых, цистеиновых протеаз, которые являются медиаторами апоптоза, их эффект наиболее выражен при индукции апоптоза перекисью водорода. Члены этого семейства участвуют в таких процессах, как клеточная миграция, цитоскелетного ремоделирования, клеточная дифференциация и апоптоз. Активация кальпаина наблюдается также при таких патологических состояниях, как мышечная дистрофия, сердечная и церебральная ишемия, агрегация эритроцитов, нейродегенеративные болезни, катаракта и болезнь Альцгеймера (Khorchid, Ikura, 2002). Нарушение механизмов регуляции экспрессии и / или активности кальпаина ведет к патологическим изменениям, таких как эмбриональная летальность, ошибки нейрогенеза, половой детерминации, дефектов роста и дифференциации клеток и др. (Гребиник Д.М., 2012). Кальпаин 6 (CAPN6) является тканеспецифичним геном, поскольку экспрессируется преимущественно в плаценте и эмбриональных мышцах.
Было показано 4.8-кратное снижение экспрессии CAPN6 гена при рецептивной фазы (Patricia Dıaz-Gimeno et al., 2011)
CTNNA2 — А2-Катенин
Катенину — семья внутриклеточных белков (альфа (А) -катенин, Р-Катенин, р120-Катенин и др.), Которые участвуют в адгезии клеток, обеспечивают непосредственный физический связь с актиновых цитоскелетом, взаимодействуют с сигнальными молекулами, регулирующих актиновых цитоскелет, и непосредственно контролируют адгезивный состояние внеклеточного связующего домена адгезивных белков кадгеринив (молекул клеточной адгезии). Потеря или снижение уровня экспрессии А-Катенину ведет к разрушению межклеточных контактов. А2-Катенин регулирует клеточную адгезию, а также морфологическое пластичность синапсов во время развития (Horcajadas et al., 2007).
Было показано 8-кратное снижение экспрессии CTNNA2 гена при рецептивной фазы (Patricia Dıaz-Gimeno et al., 2011).
HLA-DOB — главный комплекс гистосовместимости II класса, DO beta
HLA-DOB — HLA ген II класса. Молекулы HLA-DO совместно с молекулами HLA-DM участвуют в генетической рестрикции (ограничения иммунного ответа на уровне макрофагов, представляющие антиген) при распознавании антигена, лежит в основе механизма распознавания «своего» и «чужого. Молекулы DO находятся в лизосомах B клеток и образуют стабильные комплексы с молекулами DM, транспорт молекул DO с эндоплазматического ретикулума возможен только в составе таких комплексов (Mika et al., 2018).
Было показано 11.1-кратное снижение экспрессии HLA-DOB гена при рецептивной фазы (Patricia Dıaz-Gimeno et al., 2011).
CLU — кластерин
Кластерин (Апо J) — гетеродимерний белок, который экспрессируется в эпителии многих органов и вовлечен в обмен липидов между различными липопротеинами. Функции этого белка связаны с регулированием апоптоза. Он антиапоптотичного свойства и способствует клеточной адгезии и агрегации, участвует в ряде процессов, включая регуляцию опосредованного комплементом лизиса клетки, круговорот (рециклювання) мембран и т.д., служит ингибитором мембранно-атакующего комплекса комплемента. Ген CLU экспрессируется в матке (Brown et al., 1995), исследования на модельном организме (мышь) показали, что ген также экспрессируется в ткани эндометрия и является маркером имплантации бластоцисты (Brown et al., 1996). Кластерин подавляет мембраноатакуючий комплекс белков системы комплемента, активизированных в результате воспаления (Murphy et al., 1988; Choi et al., 1989; Jenne and Tschopp, 1989; McDonald and Nelsestuen, 1997) и взаимодействует с иммуноглобулином G, увеличивая скорость образования нерастворимых иммунных комплексов (Wilson et al., 1991). Поскольку экспрессия данного гена в эндометрии возрастает во время рецептивной фазы по сравнению с пререцептивною фазой, Кластерин может быть модулятором иммунной системы эндометрия, играя иммуносупрессивную роль при рецептивной фазы.
Наблюдалось 4,7-кратное повышение экспрессии CLU гена при рецептивной фазы (Patricia Dıaz-Gimeno et al., 2011).
EDNRB — рецептор эндотелина типа В
Дисфункция эндотелия является ведущим звеном патогенеза в развитии плацентарной дисфункции, преэклампсии, формировании синдрома задержки внутриутробного развития плода. Установлено повышение уровня содержания полипептида группы эндотелина (биологически активных пептидов широкого спектра действия, которые являются одним из важнейших регуляторов функционального состояния эндотелия, морфологически связанных с кровью, с одной стороны, и с мышечной стенкой сосудов — с другой. Их вазоконстрикторными эффекты сопровождаются изменениями системной и регионарной гемодинамики) эндотелина-1 в крови беременных с преэклампсией, а также развитие дисфункции эндотелия в сосудах плаценты при данной патологии. Вазоконстрикторный и метаболические эффекты эндотелина-1, а также потенцирование ним роста и дифференцировки тканей реализуются путем активации двух типов рецепторов — А и В. Рецептор В не имеет специфичности по изоформ эндотелина и экспрессируется преимущественно в эндотелиальных клетках. Рецепторы эндотелина типа В определяются в дистальной части венечных сосудов, гладкомышечных клетках сосудов, кардиомиоцитах и т.д. (Critchley et al., 2006; Sherwin et al., 2006)
Наблюдалось 4.9-кратное повышение экспрессии EDNRB гена при рецептивной фазы (Patricia Dıaz-Gimeno et al., 2011).
TAGLN — трансгелин
Трансгелин (TAGLN) представляет собой актинзвьязуючий белок, вовлеченный в организацию актина, вызывая его гелеобразования. TAGLN является маркером для клеток гладкой мускулатуры, включая гладкую мышечную ткань (р., Матку). TAGLN является репрессором протеолитической активности матричной металлопептидазы 9 (MMP9), которая играет роль в ремоделировании ткани эндометрия матки. Повышенная экспрессия TAGLN была обнаружена в очагах поражения эндометриозом по сравнению с еутопичним эндометрием как в пролиферативной, так и секреторной фазах менструального цикла, поэтому TAGLN — вероятный биомаркер эндометриоза (Santos Hidalgo, G. et al., 2011).
Было показано 5.7-кратное повышение экспрессии TAGLN гена при рецептивной фазы (Patricia Dıaz-Gimeno et al., 2011).
PAEP — прогестаген ассоциированный эндометриальный протеин
Гликоделин или альфа-2-микроглобулин фертильности (АМГФ, гликоделин, PAEP, pp14) — белок, секретируется в здоровых женщин эпителиоцитами маточных желез на 5-6 день после овуляции и зависит от степени функциональной реакции эндометрия на продукты секреции желтого тела яичника. Низкий уровень продукции гликоделина позволяет рассматривать его дефицит в предгравидарному эндометрии как один из патогенетических механизмов. АМГФ — главный прогестерон-связывающий липокаин репродуктивной сети, модулирует действие прогестерона, влияет на пролиферацию и дифференцировку клеток. АМГФ имеет мощную иммуносупрессивную активность, в частности, подавляя активность NK-клеток, обеспечивая локальное подавление иммунного ответа. Также участвует в связывании сперматозоида с ооцитом (Kämäräinen et al., 1993; Luddi et al., 2019).
Было показано 31.4-кратное повышение экспрессии PAEP гена при рецептивной фазы (Patricia Dıaz-Gimeno et al., 2011).
GPX3 — глутатионпероксидаза-3
Ферменты группы глутатионпероксидазы (GPX) рядом с пероксиредоксинамы составляют семью тиолпероксидаз — ферментов, которые катализируют тиолзалежне восстановления h3O2 и органических гидропероксидов. Наибольшее число фактов, подтверждающих большое значение GPX в функционировании эндометрия матки, относятся к ферменту GPX3 (секретируется GPX). Ген GPX3 содержит более вероятных прогестерон-чувствительных элементов чем эстроген-чувствительных; экспрессия гена GPX3 в эндометрии усиливается после овуляции и во время беременности. Подтверждено, что GPX3 снижает концентрацию h3O2 в эндометрии при беременности и децидуализации in vitro. Предполагается уязвимость репродуктивной функции при физиологического стресса при недостаточной экспрессии GPX3 в эндометрии. Сложившаяся гипотеза о возможной эффективности препаратов, содержащих селен, для повышения рецептивности эндометрия и поддержания нормального развития эмбриона (особенно в условиях физиологического стресса) усиления посттранскрипционная этапа синтеза GPX3 в эндометрии. Вероятно, экспрессия GPX3 в эндометрии может быть увеличена также путем применения гестагенных стероидных препаратов (усиления транскрипции гена GPX3) (Riesewijk et al., 2003; Bhagwat et al., 2013).
Было показано 35.5-кратное повышение экспрессии GPX3 гена при рецептивной фазы (Patricia Dıaz-Gimeno et al., 2011).
Список литературы:
Судорога И. А. Причины неэффективности лечения бесплодия методом экстракорпорального оплодотворения у больных аденомиозом / И. А. судорога // Украинский медицинский журнал. — 2006. — № 6 — С. 83-87.
Гюльмамедова И. Д. Современные взгляды на диагностику и коррекцию имплантационной рецептивности эндометрия (обзор литературы) / И. Д. Гюльмамедова, А. С. Доценко, А. А. Гюльмамедова // Таврический медико-биологический вестник. — 2013. — № 2. — С. 169-175.
В. К. Чайка, А. В. Чайка, Е. Н. Носенко [и др.] Рецептивности эндометрия в пациенток с бесплодием / Донецк: Изд-во Ноулидж, Донецкое отделение, 2011. — 243 с
Grewal S, Carver JG, Ridley AJ, Mardon HJ. Implantation of the human embryo requires Rac1-dependent endometrial stromal cell migration. Proc Natl Acad Sci U S A. 2008 Oct 21; 105 (42): 16189-94.
Cakmak H, Taylor HS. Implantation failure: molecular mechanisms and clinical treatment. Hum Reprod Update. 2011 Mar-Apr; 17 (2): 242-53.
Díaz-Gimeno P, Horcajadas JA, Martínez-Conejero JA, Esteban FJ, Alamá P, Pellicer A, Simón C. A genomic diagnostic tool for human endometrial receptivity based on the transcriptomic signature. Fertil Steril. 2011 Jan; 95 (1): 50-60, 60.e1-15.
Khorchid, A. and Ikura, M. (2002). How calpain is activated by calcium. Nature Struct. Biol. 9, 239-241.
Гребиник Д. М. Структурно-видовые особенности кальпаинив как основа их классификации // Физика живого. 2012. №2.
Horcajadas JA, Pellicer A, Simon C. Wide genomic analysis of human endometrial receptivity: new times, new opportunities. Hum Reprod Update 2007, 13: 77 -86.
Mika KM, Li X, DeMayo FJ, Lynch VJ. An Ancient Fecundability-Associated Polymorphism Creates a GATA2 Binding Site in a Distal Enhancer of HLA-F. Am J Hum Genet. 2018; 103 (4): 509-521. doi: 10.1016 / j.ajhg.2018.08.009
Brown TL, Moulton BC, Baker VV, Mira J, Harmony JA. Expression of apolipoprotein J in the uterus is associated with tissue remodeling. Biol Reprod. 1995 May; 52 (5): 1038-49.
Brown TL, Moulton BC, Witte DP, Swertfeger DK, Harmony JA. Apolipoprotein J / clusterin expression defines distinct stages of blastocyst implantation in the mouse uterus. Biol Reprod. 1996 Oct; 55 (4): 740-7.
Murphy BF, Kirszbaum L, Walker ID, d’Apice AJ. SP-40,40, a newly identified normal human serum protein found in the SC5b-9 complex of complement and in the immune deposits in glomerulonephritis, J Clin Invest, 1988, vol. 81 (pg. 1858-1864)
Choi NH, Mazda T, Tomita M. A serum protein SP40,40 modulates the formation of membrane attack complex of complement on erythrocytes, Mol Immunol, 1989, vol. 26 (pg. 835-840)
Jenne DE, Tschopp J. Molecular structure and functional characterization of a human complement cytolysis inhibitor found in blood and seminal plasma: identity to sulfated glycoprotein 2, a constituent of rat testis fluid, Proc Natl Acad Sci USA, 1989, vol. 86 (pg. 7123-7127)
McDonald JF, Nelsestuen GL. Potent inhibition of terminal complement assembly by clusterin: characterization of its impact on C9 polymerization, Biochemistry, 1997, vol. 36 (pg. 7464-7473)
Wilson MR, Roeth PJ, Easterbrook-Smith SB. Clusterin enhances the formation of insoluble immune complexes, Biochem Biophys Res Commun, 1991, vol. 177 (pg. 985-990)
Critchley HO, Robertson KA, Forster T, Henderson TA, Williams AR, Ghazal P. Gene expression profiling of mid to late secretory phase endometrial biopsies from women with menstrual complaint. Am J Obstet Gynecol. 2006 Aug; 195 (2): 406.e1-16.
Sherwin R, Catalano R, Sharkey A. Large-scale gene expression studies of the endometrium: what have we learnt? Reproduction. 2006 Jul; 132 (1): 1-10.
Dos Santos Hidalgo G, Meola J, Rosa E Silva JC, Paro de Paz CC, Ferriani RA. TAGLN expression is deregulated in endometriosis and may be involved in cell invasion, migration, and differentiation. Fertil Steril. 2011 Sep; 96 (3): 700-3.
Kämäräinen M, Leivo I, Julkunen M, Seppälä M. Localization of progesterone-associated endometrial protein mRNA by in-situ hybridization in human pregnancy decidua, endometriosis and borderline endometrioid adenoma. J Mol Endocrinol. 1993 Feb; 10 (1): 71-7.
Luddi A, Zarovni N, Maltinti E, Governini L, Leo V, Cappelli V, Quintero L, Paccagnini E, Loria F, Piomboni P. Clues to Non-Invasive Implantation Window Monitoring: Isolation and Characterisation of Endometrial Exosomes. Cells. 2019 Aug 1, 8 (8): 811.
Riesewijk A, Martín J, van Os R, Horcajadas JA, Polman J, Pellicer A, Mosselman S, Simón C. Gene expression profiling of human endometrial receptivity on days LH + 2 versus LH + 7 by microarray technology. Mol Hum Reprod. 2003 May; 9 (5): 253-64.
Bhagwat SR, Chandrashekar DS, Kakar R, Davuluri S, Bajpai AK, Nayak S, et al. (2013) Endometrial Receptivity: A Revisit to Functional Genomics Studies on Human Endometrium and Creation of HGEx-ERdb. PLoS ONE 8 (3): e58419.
УЗИ при беременности
Однако есть и другие причины, просто обязывающие и врачей, и пациенток к проведению УЗИ при задержке менструации и первых признаках беременности раннего срока (БРС). Основные из них таковы:- необходимо исключить внематочную беременность и убедиться, что она — маточная;
- необходимо исключить пузырный занос, по всем клиническим и лабораторным признакам похожий на беременность, однако являющийся опасным заболеванием;
- при наличии маточной беременности необходимо определить качество гестационного процесса, в случае выявления патологии беременности необходимо своевременно выяснить причины патологии и своевременно начать лечение;
- УЗИ с достоверностью определяет срок беременности: эта информация определяет и срок родов;
- в том случае, если задержка менструации происходит, но беременность не выявлена, УЗИ поможет определить гинекологическое заболевание, явившееся причиной задержки месячных.
Таким образом, УЗИ при беременности на раннем сроке совершенно необходимо, однако до сих пор бытуют представления о вреде УЗИ. Тем не менее, безопасность медицинского ультразвука доказана и отражена в международных документах. Рекомендации к сокращению продолжительности каждого исследования БРС, носят этический характер, учитывающий опасения будущих мам в отношении УЗИ.
Итак, каковы же возможности ультразвука? При задержке месячных всего на 3-5 дней ультразвуковой сканер с трансвагинальным датчиком может зарегистрировать маточную беременность сроком 2,5-3 недели от момента зачатия. УЗИ при беременности на раннем сроке позволяет определить эмбриологический срок беременности, т.е. срок, исчисляемый от момента слияния половых клеток.
Принятый в акушерстве отсчет от первого дня последней менструации может быть неточным, по нему сложно определить предполагаемый момент родов. Чтобы перевести эмбриологический срок беременности в акушерский, необходимо к эмбриологическому сроку прибавить 2-2,5 недели. В сроке 2,5-3 недель завершается процесс имплантации бластоцисты в слизистую оболочку матки.
С этого момента она называется плодным яйцом и становится доступной для исследования. В этом сроке бластоциста или эмбриональная камера выглядит как темное округлое или каплевидное образование, 4-5 мм в диаметре. Эмбриональная камера окружена оболочкой и не отражает ультразвуковых волн, т.е. она эхонегативна. Эмбрион и внезародышевые органы имеют микроскопическое строение и пристеночную локализацию, поэтому пока не видны при помощи ультразвука: в этом сроке плодное яйцо выглядит как однородная жидкость. Место имплантации плодного яйца чаще всего находится в области одного из трубных углов, но иногда локализация плодного яйца расположена низко, ближе к перешейку. Такая проксимальная локализация происходит в том случае, если бластоциста перемещается в полости матки в течение нескольких дней после выхода из маточной трубы и лишь потом имплантируется в стенку матки.
Если при задержке менструации в матке с помощью УЗИ не обнаруживается плодное яйцо, необходимо пройти обследование через одну-две недели, чтобы плодное яйцо увеличилось в размерах. Отсутствие плодного яйца при повторном обследовании должно насторожить врача: в таком случае возможна внематочная беременность. Однако диагноз внематочной беременности невозможно установить только лишь с помощью УЗИ, необходимо более тщательное обследование.
В некоторых случаях, когда в полости матки обнаруживается округлое жидкостное образование, но лабораторные и клинические данные не подтверждают наличие беременности, повторное обследование поможет диагностировать наличие железистого полипа, кисты или миоматозного узелка, выдающегося в полость матки. Округлое жидкостное образование может оказаться небольшим. Подобные проблемы необходимо решать только в специализированном учреждении, имеющим лицензию на работу с беременными. Там же необходимо проходить и УЗИ БРС (и любого другого срока беременности).
В женской консультации, родильном доме, перинатальном центре только профессионал – врач-эхоскопист – компетентен в области физиологии и патологии женской половой сферы, акушерства и прикладной эмбриологии. В настоящее время очень распространены центры, оказывающие услуги по принципу «УЗИ всего на свете» – эти центры не обеспечивают профессиональное обследование на должном уровне и допускают большое количество ошибок при постановке диагноза.
Итак, беременность обнаружена, плодное яйцо имплантировалось в стенку матки и очень быстро увеличивается в размерах. 17-20 мм – такой диаметр плодного яйца в четыре недели беременности. Плодное яйцо становится овальным, размеры матки немного увеличиваются, и появляется асимметрия ее стенок — одна стенка становится толще другой. Эмбрион станет виден только в 5 недель беременности, а пока хорошо различается желточный мешок, в котором хранится запас питательных веществ для развивающегося эмбриона. Продолговатый 5-недельный эмбрион имеет в длину несколько мм, к внутренней поверхности плодного яйца от эмбриона тянется амниотическая ножка – будущая пуповина. С этого момента эмбрион может свободно передвигаться в жидкости эмбриональной камеры – он покидает свое пристеночное положение.
При 5-недельной беременности уже можно определить, один эмбрион или два поселились в эмбриональной камере. Количество и строение амниотических оболочек и хориона — будущей плаценты – определяют вид будущей двойни. Если зародышевый материал в бластоцисте удвоен – развивается однояйцевая (монохориальная) двойня с полностью идентичным набором хромосом. Дети из такой двойни всегда однополые и абсолютно похожи друг на друга.
Но если перед зачатием в разных яичниках овулируют два фолликула, то сливаются две пары половых клеток и образуются две бластоцисты, которые имплантируются и формируется два плодных яйца с двумя эмбрионами. В таком случае образуется разнояйцевая двойня – бихориальная или дихориальная. Такие дети не являются близнецами в строгом смысле слова, потому что у них разные наборы хромосом, они могут быть разного пола и ничуть не похожими друг на друга. 70% родившихся двоен являются разнояйцевыми. Но, кроме двоен, существуют еще тройни, и вообще многоплодная беременность. Возможны различные варианты сочетаний амниотических оболочек и хорионов: так, тройня может состоять их двух близнецов и одного разнояйцевого с ними ребенка. УЗИ БРС легко идентифицирует тип двойни или тройни, но на поздних сроках это сделать труднее, т.к. эмбриональные камеры заполнят всю полость матки. Но кроме двоен и троен такого типа (каждый эмбрион находится в отдельной эмбриональной камере), существует патологический вариант многоплодной беременности (монамниотическая монохориальная беременность), когда эмбрионы не разделены межамниотической перегородкой. В этом случае возможен вариант появления сросшихся (сиамских) близнецов и развития генетически неполноценного плода. Такую беременность необходимо прервать на самом раннем сроке и предотвратить развитие подобной катастрофы. Именно УЗИ БРС позволяет предвидеть и предотвращать трагическое развитие беременности.
Поскольку развитие би-двойни происходит вследствие овуляции двух фолликулов, в яичниках находится два желтых тела (ЖТ).
Что же такое желтое тело?
ЖТ возникает в яичнике на месте овулировавшего фолликула: ЖТ — это временный гормональный орган. ЖТ отвечает за продукцию прогестерона – основного гормона беременности, при УЗИ ЖТ выглядит как округлое образование из неоднородных мягких тканей. По изображению, полученному при УЗИ, невозможно определить прогестероновую недостаточность, однако клинические, лабораторные исследования вполне дают возможность диагностировать эту недостаточность.
При развитии беременности в ЖТ иногда могут образовываться кисты. Причина образования кист заключается в том, что желтое тело вырабатывает небольшие количества жидкости. Часть этой жидкости резорбируется кровеносными сосудами яичника, а часть — остается внутри яичника, образуя пузырьки, которые и формируют кисты (от греческого корня «cyst» — «пузырек»). К 10-15 неделе беременности киста ЖТ полностью рассасывается, поскольку уменьшается и само ЖТ. Кисты ЖТ не представляют угрозы для беременности, но иногда женщина может ощущать боли внизу живота, принимая их за симптом угрожающего выкидыша.
Может ли УЗИ определить признаки угрожающего выкидыша?
При выкидыше происходит отслоение плодного яйца от внутренней стенки матки и в результате сокращения миометрия изгнание его из полости матки. Этот процесс делится на фазы: угрожающий выкидыш, начавшийся, «в ходу» и свершившийся. Избыточное напряжение (гипертонус) мышц матки определяются УЗИ.
Каковы УЗ-признаки начинающегося выкидыша?
- УЗ-признак, показывающий утолщение одной из стенок матки, может быть обманчив, так как существует физиологическая асимметрия стенок матки, обнаруживаемая еще при УЗИ БРС. Кратковременное сокращение матки может возникнуть из-за давления вагинального датчика на область перешейка матки. Такое кратковременное сокращение может быть принято за признак угрожающего выкидыша. Длительный гипертонус от кратковременного различается с помощью трансабдоминального датчика с пустым мочевым пузырем. Застойный гипертонус, свидетельствующий об угрозе выкидыша, существует долго, а кратковременный скоро исчезает.
- Изменение конфигурации плодного яйца, превращение ее формы в ладьевидную или каплеобразную, изменение наружного контура матки (над ровным контуром матки приподнят бугорок над сократившимся участком миометрия).
- Самый грозный признак угрожающего и начавшегося выкидыша – кровянистые выделения, образующиеся из-за того, что в полость матки изливается некоторое количество крови рядом с плодным яйцом — субхориальная гематома (гравидарная гематометра). Плодное яйцо при инвазии в стенку матки разрушает мелкие сосуды, при этом увеличивающаяся гематома оказывает давление на плодное яйцо, в результате чего теряется связь меж ним и стенкой матки. УЗИ определяет объем и локализацию гравидарной гематометры, время ее образования и тенденцию к прогрессированию. Таким образом, причина болей и кровянистых выделений при угрожающем выкидыше может быть определена ультразвуком, что поможет спланировать стратегию лечения (при гипертонусе матки с гематомой и без нее она будет разной и даже взаимоисключающей). Но при отсутствии болей внизу живота, кровянистых выделений и других признаков угрожающего выкидыша ультразвуковые данные, свидетельствующие об угрозе, необходимо интерпретировать, как чисто аппаратный феномен. Аналогом выражения «угроза по УЗИ» может быть выражение «головная боль по анализу мочи».
Однако самопроизвольный выкидыш бывает без болей и гипертонуса. Этот случай носит название несостоявшийся выкидыш («анэмбриония», «неразвивающаяся» или «замершая беременность»). При замершей беременности жизнедеятельности эмбриона прекращается, а сократительная деятельность матки, направленная на изгнание нежизнеспособного плодного яйца из ее полости, отсутствует.
Эмбрион и все элементы эмбрионального комплекса при УЗИ на 5 неделе беременности в случае анэмбрионии не визуализируются. Это свидетельствует о том, что развитие зародыша прекратилось до того, как эмбрион достиг размеров в 1-2 мм. Повторное исследование с интервалом в неделю при подозрении на анэмбрионию позволит уточнить диагноз. Когда эмбрион отчетливо виден (например, при короткой амниотической ножке и пристеночном расположении эмбриона), возникает возможность исключить анэибрионию, при которой плодное яйцо растет из-за накапливающейся в нем жидкости, но изображения эмбриона получить по-прежнему не удается.
В случае анэмбрионии одного из плодных яиц при двойне, так называемой биамниотической монэмбриональной беременности, один из эмбрионов не развивается (несостоявшаяся двойня). Рядом с нормальной обнаруживается «пустая» амниотическая полость, затем, по мере роста плодного яйца, она серповидно огибает изображение нормальной амниотической полости и затем сливается с ней полностью. УЗ-феномен, описывающийся как «двойной контур плодного яйца» или «амниотическая нить в полости матки» – это признак несостоявшейся двойни. Этот признак не нарушает течения одноплодной беременности.
Несостоявшийся выкидыш в сроке 5 и более недель носит название замершей беременности. При замершей беременности эмбриональный комплекс виден (в отличие от анэмбрионии). Однако эмбриональный комплекс состоит из слабодифференцируемых линейных объектов, в котором отсутствуют признаки жизнедеятельности — сердцебиение и двигательная активность, характерные для нормального эмбриона при прогрессирующей беременности.
В норме при 5-недельной беременности эмбрион достигает размеров 7-8 мм, при 6-недельной — 12-13 мм и 18-19 мм — при 7 недельной беременности. «Рост» эмбриона называется копчико-теменным размером (КТР). Увеличивается и «окружность талии» эмбриона — от 2-3 мм до 6-8 за две недели. «Пульсация эмбриона» — сердечные сокращения определяются, начиная от 5 недели, но сердце на экране пока различить невозможно. На 5-6 неделе беременности частота сокращений — 120-130 уд/мин, к 7-8 неделе она достигает до 200 уд/мин. В этом сроке при УЗИ уже видны разгибательные движения эмбриона.
Головной конец от тазового можно отличить уже к 5 неделе от зачатия, а к 6 неделе на месте будущих конечностей появляются бугорки. После 8 недели беременности видны внутренние органы плод, позвоночник и кости черепа видны к концу 7 недели. Живой, здоровый и подвижный эмбрион встретится с будущей мамой и врачом в кабинете УЗ-диагностики в сроке 10-14 акушерских недель (то есть 8-12 неделе от зачатия). Рассказ об этой встрече еще впереди. В течение беременности эмбриона ждет много событий и опасностей, которых он успешно избежит с помощью помощи мамы, врача и, конечно, медицинского ультразвука. Вскоре он станет не эмбрионом, а плодом, а несколько позже — и новорожденным!
Наше оборудование
В своей работе мы используем последние достижения мировой практики. Наши врачи проводят УЗИ исследования на аппаратах экспертного уровня, таких как GE LOGIQ E9, GE VIVID 9, GE VOLUSON E8, GE VOLUSON E10.
УЗИ-аппарат VOLUSON E10 оснащен особым электронным датчиком, позволяющим докторам с максимальной точностью проводить диагностику пороков развития плода, оценку риска наследственной патологии, осложнений беременности.
Уже с самых ранних сроков, используя уникальные режимы Radience Flow, можно с максимальной точностью оценить структуры сердца плода, исключить пороки развития, а широчайший спектр возможностей 3D и 4D, в том числе, режим HD life визуализации, дает возможность не только детально оценить анатомию внутренних органов плода, но и с максимальной реалистичностью увидеть своего малыша с самого начала беременности.
Ведение беременности
Когда долгожданная беременность наступает, нужно найти по-настоящему своего врача. Это должен быть человек, которому можно будет доверять, с которым легко получится найти взаимопонимание, который с уважением относится к приватности и конфиденциальности. Именно такие акушеры-гинекологи работают в «Скандинавии», чтобы беременность протекала как можно легче, а рождение малыша осталось радостным воспоминанием.
С нашими программами ведения беременности вы можете ознакомиться здесь.
Отделение патологии беременности
Несмотря на всю естественность процесса, не всякая беременность проходит гладко, и к этому нужно быть готовыми. Поэтому в «Скандинавии» круглосуточно работает отделение патологии беременности : сюда можно обратиться с возникшими симптомами или осложнениями и рассчитывать на своевременную и качественную помощь.
Наши врачи
Цены на услуги:
Услуга доступна
+7 (812) 600-77-77
Санкт-Петербург, 197372, ул. Ильюшина, 4, к. 1
Комендантский проспект
+7 (812) 600-78-25 (взрослое отделение) +7 (812) 600-78-52 (детское отделение)
Санкт-Петербург, 194354, Учебный пер., 2
+7 (812) 600-77-77
Санкт-Петербург, 191014, Литейный пр., 55А
Гостиный двор
Маяковская
+7 (812) 600-77-77
Санкт-Петербург, 196066, Московский пр., 193/2
Концепция: как это работает | Обучение пациентов
Чтобы забеременеть, необходимо выполнить следующие действия:
Эти шаги описаны ниже.
Транспортировка спермы
Транспортировка спермы зависит от нескольких факторов:
- Сперма должна быть способна продвигаться через среду женского влагалища и шейки матки.
- Эта среда, которая находится под циклическим гормональным контролем, должна быть благоприятной для приема сперматозоидов без их разрушения.
- Сперма должна обладать способностью преобразовываться в форму, способную проникать через клеточную мембрану яйцеклетки (капситация).
После эякуляции сперма образует гель, который защищает ее от кислой среды влагалища. Гель разжижается в течение 20-30 минут ферментами предстательной железы. Это разжижение важно для высвобождения сперматозоидов, поэтому может произойти транспортировка. Семенная плазма остается во влагалище.
Защищенные сперматозоиды с наибольшей подвижностью проходят через слои цервикальной слизи, которые охраняют вход в матку.Во время овуляции этот барьер становится тоньше и меняет кислотность, создавая более дружелюбную среду для сперматозоидов. Слизь шейки матки действует как резервуар для длительного выживания сперматозоидов.
После того, как сперматозоид попал в матку, сокращение продвигает сперму вверх по фаллопиевым трубам. Первые сперматозоиды попадают в пробирки через несколько минут после эякуляции. Однако первая сперма, скорее всего, не является оплодотворяющей спермой. Подвижные сперматозоиды могут сохраняться в женских половых путях до пяти дней.
Транспортировка яиц
Транспортировка яйца начинается при овуляции и заканчивается, когда яйцо достигает матки. После овуляции бахромчатый или похожий на палец конец маточной трубы проходит над яичником. Адгезивные участки на ресничках, которые расположены на поверхности фимбрий, отвечают за захват и перемещение яиц в трубку. Реснички внутри трубки и мышечные сокращения, возникающие в результате движения яйца, создают движение вперед. Транспортировка по трубке занимает около 30 часов.
Такие состояния, как инфекции органов малого таза и эндометриоз, могут необратимо нарушать функцию маточных труб из-за рубцевания или повреждения фимбрий.
Оплодотворение и развитие эмбрионов
После овуляции яйцеклетка способна к оплодотворению только от 12 до 24 часов. Контакт между яйцеклеткой и спермой носит случайный характер.
Как только яйцо достигает определенного участка трубки, называемого ампулярно-истмическим переходом, оно остается в покое еще на 30 часов.В этой части трубки происходит оплодотворение — соединение сперматозоидов с яйцеклеткой. Затем оплодотворенная яйцеклетка начинает быстро спускаться в матку. Период покоя в трубке, по-видимому, необходим для полного развития оплодотворенной яйцеклетки и для подготовки матки к приему яйца.
Дефекты маточной трубы могут нарушить транспорт и увеличить риск трубной беременности, также называемой внематочной беременностью.
Оболочка, окружающая яйцо, называемая zona pellucida, выполняет две основные функции при оплодотворении.Во-первых, блестящая оболочка содержит рецепторы сперматозоидов, специфичные для человеческой спермы. Во-вторых, после проникновения сперматозоидов мембрана становится непроницаемой для проникновения других сперматозоидов.
После проникновения серия событий подготовила почву для первого деления клеток. Одноклеточный зародыш называется зиготой. В течение следующих семи дней человеческий эмбрион претерпевает множественные деления клеток в процессе, называемом митозом. В конце этого переходного периода эмбрион становится массой очень организованных клеток, называемой бластоцистой.Сейчас считается, что по мере взросления женщины этот процесс раннего развития эмбриона все больше нарушается из-за ухудшения качества яйцеклеток.
Имплантация
Когда эмбрион достигает стадии бластоцисты, примерно через пять-шесть дней после оплодотворения, он вылупляется из блестящей оболочки и начинает процесс имплантации в матку.
В природе 50 процентов всех оплодотворенных яйцеклеток теряются до прекращения менструации. В процессе экстракорпорального оплодотворения (ЭКО) эмбрион также может начать развиваться, но не дожить до стадии бластоцисты — первой стадии, на которой эти клетки, которым суждено стать плодом, отделяются от тех, которые станут плацентой.Бластоциста может имплантироваться, но не расти, или бластоциста может расти, но перестать развиваться до истечения двух недель, когда беременность может быть обнаружена. Восприимчивость матки и здоровье эмбриона важны для процесса имплантации.
Дорожная карта имплантации эмбриона: подсказки на моделях мышей
Carson, D. D. et al. Имплантация эмбриона. Dev. Биол. 223 , 217–237 (2000).
CAS PubMed Статья Google Scholar
Дей, С.K. et al. Молекулярные сигналы к имплантации. Endocr. Ред. 25 , 341–373 (2004).
CAS PubMed Статья Google Scholar
Париа, Б. К., Риз, Дж., Дас, С. К. и Дей, С. К. Расшифровка перекрестных разговоров об имплантации: достижения и проблемы. Наука 296 , 2185–2188 (2002).
CAS PubMed Статья Google Scholar
Рэд-Хорс, К.и другие. Дифференциация трофобластов во время имплантации эмбриона и формирование границы раздела матери и плода. J. Clin. Вкладывать деньги. 114 , 744–754 (2004).
CAS PubMed PubMed Central Статья Google Scholar
Эндерс, А. К. и Шлафке, С. Морфологический анализ ранних стадий имплантации у крысы. Am. J. Anat. 120 , 195–226 (1967).
Артикул Google Scholar
Нотиас, Дж.Ю., Маджумдер, С., Канеко, К. Дж. И ДеПамфилис, М. Л. Регулирование экспрессии генов в начале развития млекопитающих. J. Biol. Chem. 270 , 22077–22080 (1995).
CAS PubMed Статья Google Scholar
Латам К. Э., Гаррелс Дж. И., Чанг С. и Солтер Д. Количественный анализ синтеза белка в эмбрионах мыши. I. Обширное репрограммирование на одно- и двухклеточной стадиях. Разработка 112 , 921–932 (1991).
CAS PubMed PubMed Central Google Scholar
Shi, C.Z. et al. Базы данных белков для компактных восьмиклеточных эмбрионов и эмбрионов мышей на стадии бластоцисты. Мол. Репрод. Dev. 37 , 34–47 (1994).
CAS PubMed Статья Google Scholar
Циммерманн, Дж.W. & Schultz, R.M. Анализ экспрессии генов в эмбрионе мыши перед имплантацией: использование дифференциального отображения мРНК. Proc. Natl Acad. Sci. USA 91 , 5456–5460 (1994).
CAS PubMed Статья Google Scholar
Ko, M. S. et al. Широкомасштабный анализ кДНК выявляет поэтапные паттерны экспрессии генов во время доимплантационного развития мышей. Разработка 127 , 1737–1749 (2000).
PubMed Google Scholar
Хаматани Т., Картер М. Г., Шаров А. А. и Ко М. С. Динамика глобальных изменений экспрессии генов во время доимплантационного развития мышей. Dev. Ячейка 6 , 117–131 (2004). Это исследование вместе с работой, описанной в ссылке 12, показывает, что доимплантационное развитие эмбрионов мышей представляет собой динамический молекулярный процесс, который регулируется волнами экспрессии генов.
CAS PubMed Статья Google Scholar
Wang, Q. T. et al. Полногеномное исследование активности генов выявляет сигнальные пути развития у доимплантационного эмбриона мыши. Dev. Ячейка 6 , 133–144 (2004).
CAS PubMed Статья Google Scholar
Цзэн, Ф., Болдуин, Д. А. и Шульц, Р.М. Профилирование транскриптов во время преимплантационного развития мышей. Dev. Биол. 272 , 483–496 (2004).
CAS PubMed Статья Google Scholar
Тонг, З. Б. и др. Mater , ген материнского эффекта, необходимый для раннего эмбрионального развития мышей. Nature Genet. 26 , 267–268 (2000).
CAS PubMed Статья Google Scholar
Джонсон, М.Х. и МакКоннелл, Дж. М. Распределение линий и полярность клеток во время эмбриогенеза мышей. Семин. Cell Dev. Биол. 15 , 583–597 (2004).
CAS PubMed Статья Google Scholar
Россант, Дж. Развитие линии и полярные асимметрии в периимплантационной бластоцисте мыши. Семин. Cell Dev. Биол. 15 , 573–581 (2004).
PubMed PubMed Central Статья Google Scholar
Николс, Дж.и другие. Формирование плюрипотентных стволовых клеток в эмбрионе млекопитающих зависит от фактора транскрипции POU Oct4. Cell 95 , 379–391 (1998). Это исследование показывает, что экспрессия Oct4 во внутренних клетках доимплантационных эмбрионов мыши необходима для генерации плюрипотентных клеток. Др. Ключевые молекулы для дифференцировки клеточных клонов во время преимплантационного развития описаны в ссылках 18-24.
CAS PubMed PubMed Central Статья Google Scholar
Авильон, А.A. et al. Клоны мультипотентных клеток в раннем развитии мышей зависят от функции SOX2. Genes Dev. 17 , 126–140 (2003).
CAS PubMed PubMed Central Статья Google Scholar
Нива, Х., Миядзаки, Дж. И Смит, А. Г. Количественная экспрессия Oct-3/4 определяет дифференцировку, дедифференцировку или самообновление ES-клеток. Nature Genet. 24 , 372–376 (2000).
CAS PubMed PubMed Central Статья Google Scholar
Mitsui, K. et al. Гомеопротеин Nanog необходим для поддержания плюрипотентности эпибласта мыши и ES-клеток. Cell 113 , 631–642 (2003).
CAS PubMed Статья Google Scholar
Chambers, I. et al. Клонирование функциональной экспрессии Nanog, фактора поддержания плюрипотентности в эмбриональных стволовых клетках. Cell 113 , 643–655 (2003).
CAS PubMed Статья Google Scholar
Boyer, L.A. et al. Основные схемы регуляции транскрипции в эмбриональных стволовых клетках человека. Cell 122 , 947–956 (2005).
CAS PubMed PubMed Central Статья Google Scholar
Strumpf, D. et al. Cdx2 необходим для правильной спецификации клеточной судьбы и дифференцировки трофэктодермы в бластоцисте мыши. Разработка 132 , 2093–2102 (2005).
CAS PubMed Статья Google Scholar
Russ, A. P. et al. Эомезодермин необходим для развития трофобластов мыши и образования мезодермы. Nature 404 , 95–99 (2000).
CAS PubMed Статья Google Scholar
Paria, B.C., Huet-Hudson, Y.М. и Дей, С. К. Состояние активности бластоцисты определяет «окно» имплантации в восприимчивую матку мыши. Proc. Natl Acad. Sci. USA 90 , 10159–10162 (1993). Это исследование, в котором используется модель мыши с отсроченной имплантацией, впервые показало, что только восприимчивое состояние матки недостаточно для успешной имплантации, но что бластоцисты также должны обладать способностью к имплантации. Дифференциальные роли эстрогенов и катехолоэстрогенов в установлении окна имплантации освещены в ссылках 26 и 32.
CAS PubMed Статья Google Scholar
Ма, У. Г., Сонг, Х., Дас, С. К., Париа, Б. К. и Дей, С. К. Эстроген является критическим фактором, определяющим продолжительность окна восприимчивости матки к имплантации. Proc. Natl Acad. Sci. USA 100 , 2963–2968 (2003).
CAS PubMed Статья Google Scholar
Лопес, Ф.Л., Десмаре, Дж. А. и Мерфи, Б. Д. Эмбриональная диапауза и ее регуляция. Репродукция 128 , 669–678 (2004).
CAS PubMed Статья Google Scholar
Ренфри, М. Б. и Шоу, Г. Диапауза. Annu. Rev. Physiol. 62 , 353–375 (2000).
CAS PubMed Статья Google Scholar
Хаматани, Т.и другие. Глобальный анализ экспрессии генов идентифицирует молекулярные пути, различающие состояние покоя и активацию бластоцисты. Proc. Natl Acad. Sci. США 101 , 10326–10331 (2004). Это исследование анализирует глобальную экспрессию генов в спящих и активированных бластоцистах мыши, обеспечивая доказательства того, что паттерны экспрессии генов различны в этих двух различных физиологических состояниях эмбриона.
CAS PubMed Статья Google Scholar
Пария, Б.К., Дас, С. К., Эндрюс, Г. К. и Дей, С. К. Экспрессия гена рецептора эпидермального фактора роста регулируется в бластоцистах мыши во время отсроченной имплантации. Proc. Natl Acad. Sci. USA 90 , 55–59 (1993).
CAS PubMed Статья Google Scholar
Raab, G. et al. Преимплантационные бластоцисты мыши прикрепляются к клеткам, экспрессирующим трансмембранную форму гепарин-связывающего EGF-подобного фактора роста. Разработка 122 , 637–645 (1996).
CAS PubMed Google Scholar
Paria, B.C. et al. Координация дифференциальных эффектов первичного эстрогена и катехолестрогена на две разные мишени опосредует имплантацию эмбриона мыши. Эндокринология 139 , 5235–5246 (1998).
CAS PubMed Статья Google Scholar
Гуо, Ю.и другие. N-ацилфосфатидилэтаноламин-гидролизующая фосфолипаза D является важным фактором, определяющим уровни анандамида в матке во время имплантации. J. Biol. Chem. 280 , 23429–23432 (2005).
CAS PubMed Статья Google Scholar
Париа, Б. К., Дас, С. К. и Дей, С. К. Преимплантационный эмбрион мыши является мишенью для передачи сигналов каннабиноидный лиганд-рецептор. Proc. Natl Acad. Sci.США 92 , 9460–9464 (1995). Эта работа предоставила первое доказательство присутствия каннабиноидных рецепторов CB1 и CB2, связанных с G-белком, в доимплантационных эмбрионах мыши. Дифференциальная роль эндоканнабиноидов во взаимодействиях между эмбрионом и маткой во время имплантации дополнительно проиллюстрирована в ссылках 33 и 35–37.
CAS PubMed Статья Google Scholar
Wang, H. et al.Аберрантная каннабиноидная передача сигналов нарушает транспорт эмбрионов по яйцеводам. Nature Med. 10 , 1074–1080 (2004).
CAS PubMed Статья Google Scholar
Wang, H. et al. Дифференциальная передача сигналов каннабиноидного рецептора, связанного с G-белком, анандамидом направляет активацию бластоцисты для имплантации. Proc. Natl Acad. Sci. США 100 , 14914–14919 (2003).
CAS PubMed Статья Google Scholar
Пария, Б.C. et al. Нарушение регуляции каннабиноидных сигналов нарушает восприимчивость матки к имплантации эмбриона. J. Biol. Chem. 276 , 20523–20528 (2001).
CAS PubMed Статья Google Scholar
Wang, J., Mayernik, L., Schultz, JF & Armant, DR. Ускорение дифференцировки трофобластов гепарин-связывающим EGF-подобным фактором роста зависит от стадии специфической активации притока кальция рецепторами ErbB в развивающиеся бластоцисты мыши. Разработка 127 , 33–44 (2000).
CAS PubMed Google Scholar
Stachecki, J. J. & Armant, D. R. Кратковременное высвобождение кальция из инозитол-1,4,5-трифосфат-специфичных хранилищ регулирует доимплантационное развитие мышей. Разработка 122 , 2485–2496 (1996).
CAS PubMed Google Scholar
Ван, Ю.и другие. Весь путь митоген-активируемой протеинкиназы (MAPK) присутствует в доимплантационных эмбрионах мыши. Dev. Дин. 231 , 72–87 (2004).
CAS PubMed Статья Google Scholar
Райли, Дж. К. и др. Путь PI3K / Akt присутствует и функционирует в доимплантационном эмбрионе мыши. Dev. Биол. 284 , 377–386 (2005).
CAS PubMed Статья Google Scholar
Любан, Д.B. et al. Изменение репродуктивной функции, но не пренатального полового развития после инсерционного нарушения гена рецептора эстрогена мыши. Proc. Natl Acad. Sci. USA 90 , 11162–11166 (1993).
CAS PubMed Статья Google Scholar
Curtis, S. W., Clark, J., Myers, P. & Korach, K. S. Нарушение передачи сигналов эстрогена не предотвращает действие прогестерона на рецептор эстрогена, нокаутирующий матку мыши. Proc. Natl Acad. Sci. USA 96 , 3646–3651 (1999).
CAS PubMed Статья Google Scholar
Париа, Б.С., Тан, Дж., Любан, Д. Б., Дей, С. К. и Дас, С. К. Децидуальная реакция матки возникает у мышей с дефицитом рецептора эстрогена. Эндокринология 140 , 2704–2710 (1999).
CAS PubMed PubMed Central Статья Google Scholar
Лайдон, Дж.P. et al. У мышей, лишенных рецептора прогестерона, наблюдаются плейотропные репродуктивные аномалии. Genes Dev. 9 , 2266–2278 (1995).
CAS PubMed Статья Google Scholar
Mulac-Jericevic, B., Mullinax, R.A., DeMayo, F.J., Lydon, J.P. и Conneely, O.M. Подгруппа репродуктивных функций прогестерона, опосредованная B-изоформой рецептора прогестерона. Наука 289 , 1751–1754 (2000).
CAS PubMed Статья Google Scholar
Song, H., Lim, H., Das, SK, Paria, BC & Dey, SK Нарушение регуляции факторов роста семейства EGF и COX-2 в матке во время реакций предварительного прикрепления и прикрепления бластоцисты с просветный эпителий коррелирует с неудачей имплантации у мышей с дефицитом LIF. Мол. Эндокринол. 14 , 1147–1161 (2000).
CAS PubMed Статья Google Scholar
Стюарт, К.L. et al. Имплантация бластоцисты зависит от материнской экспрессии фактора ингибирования лейкемии. Nature 359 , 76–79 (1992). Это исследование предоставило первые доказательства того, что Lif экспрессируется в маточных железах мыши и имеет важное значение для имплантации. Стромальная экспрессия Lif , окружающая бластоцисту во время прикрепления, также оказалась важной для имплантации, как описано в ссылке 47.
CAS PubMed PubMed Central Статья Google Scholar
Ernst, M. et al. Дефектный gp130-опосредованный преобразователь сигнала и активатор передачи сигналов транскрипции (STAT) приводит к дегенеративному заболеванию суставов, язве желудочно-кишечного тракта и неудачной имплантации матки. J. Exp. Med. 194 , 189–203 (2001).
CAS PubMed PubMed Central Статья Google Scholar
Бенсон, Г.V. et al. Механизмы снижения фертильности у мутантных мышей Hoxa-10 : маточный гомеоз и потеря материнской экспрессии Hoxa-10 . Разработка 122 , 2687–2696 (1996).
CAS PubMed Google Scholar
Се-Ли, Х. М. и др. Hoxa 11 Структура , обширная антисмысловая транскрипция и функция при мужской и женской фертильности. Разработка 121 , 1373–1385 (1995).
CAS PubMed Google Scholar
Лим, Х., Ма, Л., Ма, У. Г., Маас, Р. Л. и Дей, С. К. Hoxa-10 регулирует чувствительность стромальных клеток матки к прогестерону во время имплантации и децидуализации у мышей. Мол. Эндокринол. 13 , 1005–1017 (1999).
CAS PubMed Статья Google Scholar
Сатоката, И., Бенсон, Г. и Маас, Р. Фенотипы половой диморфной стерильности у мышей с дефицитом Hoxa10 и . Nature 374 , 460–463 (1995). В этой статье впервые было показано женское бесплодие у мышей, у которых отсутствует Hoxa10 . Позже было показано, что дефектная децидуализация является причиной женского бесплодия, как описано в ссылках 50 и 52.
CAS PubMed PubMed Central Статья Google Scholar
Дайкоку, Т.и другие. Передача сигналов Msx-1 и Wnt4 в матке становится аберрантной у мышей с потерей фактора ингибирования лейкемии или Hoxa-10 : доказательства новой передачи сигналов цитокин-гомеобокс-Wnt при имплантации. Мол. Эндокринол. 18 , 1238–1250 (2004). Эта работа была первой, предоставившей доказательства того, что цитокины, гомеотические белки и морфогены в матке мыши составляют молекулярную схему, которая имеет решающее значение для имплантации.
CAS PubMed Статья Google Scholar
Гендрон, Р.L. et al. Аномальная стромальная и железистая функция матки, связанная с материнскими репродуктивными дефектами у Hoxa-11 нулевых мышей. Biol. Репрод. 56 , 1097–1105 (1997).
CAS PubMed Статья Google Scholar
Taylor, H. S., Arici, A., Olive, D. & Igarashi, P. HOXA10 экспрессируется в ответ на половые стероиды во время имплантации в эндометрий человека. J. Clin. Вкладывать деньги. 101 , 1379–1384 (1998).
CAS PubMed PubMed Central Статья Google Scholar
Wang, W., Van De Water, T. & Lufkin, T. Внутреннее ухо и материнские репродуктивные дефекты у мышей, лишенных гена гомеобокса Hmx3 . Разработка 125 , 621–634 (1998).
CAS PubMed Google Scholar
Бортвик, Дж.M. et al. Определение транскрипционного профиля эндометрия человека. Мол. Гм. Репрод. 9 , 19–33 (2003).
CAS PubMed Статья Google Scholar
Carson, D. D. et al. Изменения в экспрессии генов во время перехода от ранней к средней лютеиновой (рецептивной фазе) в эндометрии человека обнаруживаются с помощью скрининга микрочипов высокой плотности. Мол. Гм. Репрод. 8 , 871–879 (2002).
CAS PubMed Статья Google Scholar
Kao, L.C. et al. Глобальное профилирование генов в эндометрии человека в период имплантации. Эндокринология 143 , 2119–2138 (2002).
CAS PubMed Статья Google Scholar
Миркин С. и др. В поисках генов-кандидатов, критически экспрессируемых в эндометрии человека во время окна имплантации. Гум. Репрод. 20 , 2104–2117 (2005).
CAS PubMed Статья Google Scholar
Riesewijk, A. et al. Профили экспрессии генов восприимчивости эндометрия человека в дни LH + 2 по сравнению с LH + 7 с помощью технологии микрочипов. Мол. Гм. Репрод. 9 , 253–264 (2003).
CAS PubMed Статья Google Scholar
Сатоката, И.& Maas, R. Мыши с дефицитом Msx1 обнаруживают волчью пасть и аномалии черепно-лицевого развития и развития зубов. Nature Genet. 6 , 348–356 (1994).
CAS Статья PubMed Google Scholar
Такамото, Н., Чжао, Б., Цай, С. Ю. и Де Майо, Ф. Дж. Идентификация индийского ежа как гена, чувствительного к прогестерону, в матке мыши. Мол. Эндокринол. 16 , 2338–2348 (2002).
CAS PubMed Статья Google Scholar
Мацумото, Х., Чжао, X., Дас, С. К., Хоган, Б. Л. и Дей, С. К. Индийский еж как прогестерон-чувствительный фактор, опосредующий эпителиально-мезенхимные взаимодействия в матке мыши. Dev. Биол. 245 , 280–290 (2002).
CAS PubMed Статья Google Scholar
Пария, Б.C. et al. Клеточные и молекулярные реакции матки на имплантацию эмбриона могут быть вызваны локально применяемыми факторами роста. Proc. Natl Acad. Sci. USA 98 , 1047–1052 (2001). В этой статье дается исчерпывающий отчет об экспрессии морфогенов, включая передачу сигналов HH, BMP, WNT и FGF в матке мыши во время периимплантационного периода. Доказательства того, что передача сигналов HH в маточном эпителиально-мезенхимальном взаимодействии важна для имплантации, позже было сообщено в ссылках 64 и 65.
CAS PubMed Статья Google Scholar
Парр Б. А. и МакМахон А. П. Для полового диморфного развития репродуктивного тракта млекопитающих требуется Wnt-7a. Nature 395 , 707–710 (1998).
CAS PubMed Статья Google Scholar
Daikoku, T. et al. Протеомный анализ идентифицирует иммунофилин FK506, связывающий белок 4 (FKBP52) как нижележащую мишень Hoxa10 в периимплантационной матке мыши. Мол. Эндокринол. 19 , 683–697 (2005).
CAS PubMed Статья Google Scholar
Tranguch, S. et al. Кохапероновый иммунофилин FKBP52 имеет решающее значение для восприимчивости матки к имплантации эмбриона. Proc. Natl Acad. Sci. США 102 , 14326–14331 (2005).
CAS PubMed Статья Google Scholar
Дас, С.K. et al. Ген связывающего гепарин EGF-подобного фактора роста индуцируется в матке мыши временно бластоцистой только в месте его приложения: возможный лиганд для взаимодействия с EGF-рецептором бластоцисты при имплантации. Разработка 120 , 1071–1083 (1994). Роль HB-EGF как раннего инициатора молекулярного взаимодействия между бластоцистой и маткой до прикрепления была впервые проиллюстрирована в этом исследовании.
CAS PubMed Google Scholar
Ивамото, Р.и другие. Гепарин-связывающий EGF-подобный фактор роста и передача сигналов ErbB важны для работы сердца. Proc. Natl Acad. Sci. США 100 , 3221–3226 (2003).
CAS PubMed Статья Google Scholar
Чоботова К. и др. Гепарин-связывающий эпидермальный фактор роста и его рецептор ErbB4 опосредуют имплантацию бластоцисты человека. мех. Dev. 119 , 137–144 (2002).
CAS PubMed Статья Google Scholar
Генбацев, О.D. et al. L-селектин-опосредованная адгезия трофобласта на границе раздела матери и плода. Наука 299 , 405–408 (2003). Это исследование показывает, что у людей лиганды олигосахаридов селектина экспрессируются в рецептивной слизистой оболочке матки, в то время как поверхность Tr-клеток украшена L-селектином. Дальнейшие данные указывают на то, что эта передача сигналов лиганд-рецептор важна для имплантации человеку.
CAS PubMed Статья Google Scholar
Фулади-Наша, А.A. et al. Характеристика фенотипа матки во время периимплантационного периода для мышей линии LIF-null, линии MF1. Dev. Биол. 281 , 1–21 (2005).
CAS PubMed Статья Google Scholar
Lim, H. et al. Множественные репродуктивные нарушения самок у мышей с дефицитом циклооксигеназы 2. Cell 91 , 197–208 (1997). Это исследование показывает, что овуляция, оплодотворение, имплантация и децидуализация являются дефектными у мышей, лишенных простагландинов, производных от COX2.
CAS PubMed Статья Google Scholar
Lim, H. et al. Простациклин, производный от циклооксигеназы-2, опосредует имплантацию эмбриона мыши через PPARδ. Genes Dev. 13 , 1561–1574 (1999).
CAS PubMed PubMed Central Статья Google Scholar
Wang, H. et al. Спасение женского бесплодия от потери циклооксигеназы-2 за счет компенсаторной активации циклооксигеназы-1 является функцией генетической структуры. J. Biol. Chem. 279 , 10649–10658 (2004).
CAS PubMed Статья Google Scholar
Kim, J. J. et al. Экспрессия циклооксигеназы-1 и -2 в эндометрии павиана во время менструального цикла и беременности. Эндокринология 140 , 2672–2678 (1999).
CAS PubMed Статья Google Scholar
Песня, H.и другие. Цитозольная фосфолипаза A2α имеет решающее значение для «своевременной» имплантации эмбриона, которая направляет последующее развитие. Разработка 129 , 2879–2889 (2002). Эта работа показывает, что матки мышей, в которых отсутствует cPLA2α, временно откладывают своевременную имплантацию, создавая неблагоприятный волновой эффект на протяжении всей беременности и приводя к плохому исходу беременности. Сходный фенотип наблюдается у мышей lpA3 -null, как описано в ссылке 80.Важность своевременной имплантации в исходе беременности у человека представлена в ссылке 81.
CAS PubMed Google Scholar
Ye, X. et al. LPA3-опосредованная передача сигналов лизофосфатидной кислоты при имплантации эмбрионов и интервале между ними. Nature 435 , 104–108 (2005).
CAS PubMed PubMed Central Статья Google Scholar
Уилкокс, А.Дж., Бэрд, Д. Д. и Вайнберг, К. Р. Время имплантации концепта и потеря беременности. N. Engl. J. Med. 340 , 1796–1799 (1999).
CAS PubMed Статья Google Scholar
Хоган Б.Л. Морфогенетические белки костей: многофункциональные регуляторы развития позвоночных. Genes Dev. 10 , 1580–1594 (1996).
CAS PubMed PubMed Central Статья Google Scholar
Пфендлер, К.C., Yoon, J., Taborn, G.U., Kuehn, M. R. & Iannaccone, P. M. Nodal и костный морфогенетический белок 5 взаимодействуют при образовании и имплантации мезодермы мыши. Бытие 28 , 1–14 (2000).
CAS PubMed Статья Google Scholar
Арикава Т., Омура К. и Морита I. Регулирование экспрессии костного морфогенетического белка-2 эндогенным простагландином E2 в мезенхимальных стволовых клетках человека. J. Cell. Physiol. 200 , 400–406 (2004).
CAS PubMed Статья Google Scholar
Мацумото, Х. и др. Циклооксигеназа-2 по-разному направляет ангиогенез матки во время имплантации мышам. J. Biol. Chem. 277 , 29260–29267 (2002). Это исследование показывает, что простагландины, производные от COX2, координируют передачу сигналов VEGF и ангиопоэтина во время ангиогенеза в децидууме мыши — процесс, который необходим для установления беременности.
CAS PubMed Статья Google Scholar
Париа, Б. К. и Дей, С. К. Преимплантационное развитие эмбриона in vitro : кооперативные взаимодействия между эмбрионами и роль факторов роста. Proc. Natl Acad. Sci. США 87 , 4756–4760 (1990).
CAS PubMed Статья Google Scholar
Лич, Р.E. et al. Преэклампсия и экспрессия гепарин-связывающего EGF-подобного фактора роста. Ланцет 360 , 1215–1219 (2002).
CAS PubMed Статья Google Scholar
Национальные институты здравоохранения. Стволовые клетки: научный прогресс и направления будущих исследований. Stem Cell Information [онлайн], http://stemcells.nih.gov/info/scireport (2001).
Гарднер, Р. Л.Спецификация эмбриональных осей начинается до расщепления при нормальном развитии мыши. Разработка 128 , 839–847 (2001).
CAS PubMed PubMed Central Google Scholar
Fujimori, T., Kurotaki, Y., Miyazaki, J. & Nabeshima, Y. Анализ клеточных линий в двух- и четырехклеточных эмбрионах мыши. Разработка 130 , 5113–5122 (2003).
CAS PubMed Статья Google Scholar
Пиотровска, К., Wianny, F., Pedersen, R.A. & Zernicka-Goetz, M. Бластомеры, возникающие в результате первого деления дробления, имеют различную судьбу в нормальном развитии мыши. Разработка 128 , 3739–3748 (2001).
CAS PubMed Google Scholar
Пиотровска, К. и Зерницка-Гетц, М. Роль сперматозоидов в формировании пространственного паттерна ранних эмбрионов мыши. Nature 409 , 517–521 (2001).
CAS PubMed PubMed Central Статья Google Scholar
Gardner, R. L. Ранняя бластоциста билатерально симметрична, и ее ось симметрии совмещена с осью зиготы животного-растительного происхождения у мыши. Разработка 124 , 289–301 (1997). Эта статья предлагает концепцию эмбриональной оси и клеточной полярности во время преимплантационного развития мышей. Продолжающиеся дискуссии по этому вопросу дополнительно освещаются в ссылках 89–92,96,101,107 и 108.
CAS PubMed Google Scholar
Piotrowska-Nitsche, K., Perea-Gomez, A., Haraguchi, S. & Zernicka-Goetz, M. Бластомеры мышей на четырехклеточной стадии обладают различными характеристиками развития. Разработка 132 , 479–490 (2005).
CAS PubMed Статья Google Scholar
Пиотровска-Ниче, К. и Зерницка-Гетц, М.Пространственное расположение отдельных бластомеров на стадии 4 клеток и порядок, в котором они генерируются, коррелируют с паттерном бластоцисты у эмбриона мыши. мех. Dev. 122 , 487–500 (2005).
CAS PubMed Статья Google Scholar
Plusa, B. et al. Первое расщепление зиготы мыши предсказывает ось бластоцисты. Природа 434 , 391–395 (2005).
CAS PubMed PubMed Central Статья Google Scholar
Сурани, М.А. и Бартон, С. С. Пространственное распределение бластомеров зависит от порядка деления клеток и взаимодействий в морулах мыши. Dev. Биол. 102 , 335–343 (1984).
CAS PubMed Статья Google Scholar
Гарбутт, К. Л., Джонсон, М. Х. и Джордж, М. А. Когда и как порядок деления клеток влияет на распределение клеток во внутренней клеточной массе бластоцисты мыши? Разработка 100 , 325–332 (1987).
CAS PubMed Google Scholar
Аларкон, В. Б. и Марикава, Ю. Беспристрастный вклад первых двух бластомеров в развитие бластоцист у мышей. Мол. Репрод. Dev. 72 , 354–361 (2005).
CAS PubMed Статья Google Scholar
Chroscicka, A., Komorowski, S. & Maleszewski, M. Оба бластомера двухклеточного эмбриона мыши вносят вклад в эмбриональную часть бластоцисты. Мол. Репрод. Dev. 68 , 308–312 (2004).
CAS PubMed Статья Google Scholar
Motosugi, N., Bauer, T., Polanski, Z., Solter, D. & Hiiragi, T. Полярность эмбриона мыши устанавливается на бластоцисте и не подвергается предварительной паттернированию. Genes Dev. 19 , 1081–1092 (2005).
CAS PubMed PubMed Central Статья Google Scholar
Россант, Дж.И Там, П. П. Возникающая асимметрия и формирование эмбрионального паттерна в раннем развитии мышей. Dev. Ячейка 7 , 155–164 (2004).
CAS PubMed PubMed Central Статья Google Scholar
Zernicka-Goetz, M. Первые решения судьбы клетки и формирование пространственного паттерна в раннем эмбрионе мыши. Семин. Cell Dev. Биол. 15 , 563–572 (2004).
CAS PubMed PubMed Central Статья Google Scholar
Плюса, Б., Grabarek, J. B., Piotrowska, K., Glover, D. M. & Zernicka-Goetz, M. Сайт предыдущего деления мейоза определяет ориентацию дробления в эмбрионе мыши. Nature Cell Biol. 4 , 811–815 (2002).
CAS PubMed Статья Google Scholar
Plusa, B., Piotrowska, K. & Zernicka-Goetz, M. Положение входа спермы обеспечивает поверхностный маркер для первой плоскости деления зиготы мыши. Бытие 32 , 193–198 (2002).
PubMed Статья Google Scholar
Дэвис Т. Дж. И Гарднер Р. Л. Плоскость первого дробления не связана с распределением компонентов сперматозоидов у мыши. Гум. Репрод. 17 , 2368–2379 (2002).
CAS PubMed Статья Google Scholar
Хиираги, Т.& Солтер, Д. Первая плоскость деления яйца мыши не предопределена, а определяется топологией двух соприкасающихся пронуклеусов. Природа 430 , 360–364 (2004).
CAS PubMed Статья Google Scholar
Louvet-Vallee, S., Vinot, S. & Maro, B. Митотические веретена и плоскости дробления ориентированы случайным образом в двухклеточном эмбрионе мыши. Curr. Биол. 15 , 464–469 (2005).
CAS PubMed Статья Google Scholar
Эйн, Р., Дай, Г., Данмор, Дж. Х., Годвин, А. Р. и Соарес, М. Дж. Паралог семейства пролактинов регулирует репродуктивную адаптацию к физиологическому стрессору. Proc. Natl Acad. Sci. USA 101 , 16543–16548 (2004).
CAS PubMed Статья Google Scholar
Cheon, Y.P. et al. Геномный подход для выявления новых путей, регулируемых рецепторами прогестерона, в матке во время имплантации. Мол. Эндокринол. 16 , 2853–2871 (2002).
CAS PubMed Статья Google Scholar
Риз, Дж. И др. Анализ глобальной экспрессии генов для определения молекулярных маркеров восприимчивости матки и имплантации эмбриона. J. Biol. Chem. 276 , 44137–44145 (2001).
CAS PubMed Статья Google Scholar
Рейзер, М. Л. и Каприоли, Р. М. MALDI масс-спектрометрия для прямого анализа тканей: новый инструмент для открытия биомаркеров. J. Proteome Res. 4 , 1138–1142 (2005).
CAS PubMed Статья Google Scholar
Ральстон А. и Россант Дж. Генетическая регуляция происхождения стволовых клеток в эмбрионе мыши. Clin. Genet. 68 , 106–112 (2005).
CAS PubMed Статья Google Scholar
Бранфорд, В. В., Бенсон, Г. В., Ма, Л., Маас, Р. Л. и Поттер, С. С. Характеристика трансгетерозигот Hoxa-10 / Hoxa-11 выявляет функциональную избыточность и регуляторные взаимодействия. Dev. Биол. 224 , 373–387 (2000).
CAS PubMed Статья Google Scholar
Мерицкая, М., Kitajewski, J. & Sassoon, D. Wnt5a необходим для правильных эпителиально-мезенхимальных взаимодействий в матке. Разработка 131 , 2061–2072 (2004).
CAS PubMed Статья Google Scholar
Shindo, T. et al. ADAMTS-1: металлопротеиназа-дезинтегрин, необходимый для нормального роста, фертильности, а также морфологии и функции органов. J. Clin. Вкладывать деньги. 105 , 1345–1352 (2000).
CAS PubMed PubMed Central Статья Google Scholar
Simmen, R.C. et al. Субфертильность, гипоплазия матки и частичная резистентность к прогестерону у мышей, лишенных гена Kruppel-подобного фактора 9 / основного белка-1, связывающего элемент транскрипции ( Bteb1 ). J. Biol. Chem. 279 , 29286–29294 (2004).
CAS PubMed Статья Google Scholar
Фаулер, К.J. et al. Дисфункция матки и генетические модификаторы у мышей с дефицитом белка центромеры B. Genome Res 10 , 30–41 (2000).
CAS PubMed PubMed Central Google Scholar
Panda, D. K. et al. Нацеленная абляция фермента 25-гидроксивитамин D 1α-гидроксилазы: свидетельство скелетной, репродуктивной и иммунной дисфункции. Proc. Natl. Acad Sci. USA 98 , 7498–7503 (2001).
CAS PubMed Статья Google Scholar
Baker, J. et al. Влияние нулевой мутации гена Igf1 на репродукцию мышей. Мол. Эндокринол. 10 , 903–918 (1996).
CAS PubMed Google Scholar
Smith, C. L. et al. Генетическое устранение коактиватора стероидных рецепторов-убиквитинлигазы, E6-AP, приводит к тканевой селективной резистентности к стероидным гормонам и дефектам репродукции. Мол. Cell Biol. 22 , 525–535 (2002).
CAS PubMed PubMed Central Статья Google Scholar
Yoshizawa, T. et al. У мышей, лишенных рецептора витамина D, после отъема наблюдается нарушение формирования костей, гипоплазия матки и задержка роста. Nature Genet. 16 , 391–396 (1997).
CAS Статья PubMed Google Scholar
Игакура, Т.и другие. Нулевая мутация в basigin , члене суперсемейства иммуноглобулинов, указывает на его важную роль в развитии периимплантации и сперматогенезе. Dev. Биол. 194 , 152–165 (1998).
CAS PubMed Статья Google Scholar
Куно Н. и др. Бесплодие у самок мышей, лишенных гена базигина , который кодирует трансмембранный гликопротеин, принадлежащий к суперсемейству иммуноглобулинов. FEBS Lett. 425 , 191–194 (1998).
CAS PubMed Статья Google Scholar
Барак Ю. и др. Влияние рецептора δ, активируемого пролифератором пероксисом, на плацентацию, ожирение и колоректальный рак. Proc. Natl Acad. Sci USA 99 , 303–308 (2002).
CAS PubMed Статья Google Scholar
Робб Л.и другие. Бесплодие у самок мышей, лишенных рецептора интерлейкина 11, происходит из-за неправильной реакции матки на имплантацию. Nature Med 4 , 303–308 (1998).
CAS PubMed Статья Google Scholar
Bilinski, P., Roopenian, D. & Gossler, A. Функция материнского IL-11Rα необходима для нормального развития децидуальной оболочки и фетоплаценты у мышей. Genes Dev. 12 , 2234–2243 (1998).
CAS PubMed PubMed Central Статья Google Scholar
Meissner, A. & Jaenisch, R. Получение плюрипотентных ES-клеток, полученных с переносом ядра, из клонированных бластоцист с дефицитом Cdx2 . Природа 439 , 212–215 (2006).
CAS PubMed PubMed Central Статья Google Scholar
Нива, Х.и другие. Взаимодействие между Oct3 / 4 и Cdx2 определяет дифференцировку трофэктодермы. Cell 123 , 917–929 (2005).
CAS PubMed Статья Google Scholar
Гор, А.В. и др. Спинная ось рыбок данио очевидна на стадии четырех клеток. Природа 438 , 1030–1035 (2005).
CAS PubMed PubMed Central Статья Google Scholar
Границы | Секретированные микроРНК для прогнозирования результатов имплантации эмбриона: от исследований к применению в клинической диагностике
Введение
Бесплодие поражает каждую шестую супружескую пару во всем мире (Wilcox et al., 1988) и может быть разрушительным состоянием для пар, поскольку неспособность зачать ребенка считается основной причиной психологического стресса, депрессии, низкой самооценки и домашнего насилия (Chachamovich et al., 2010; Cui, 2010). Основным фактором бесплодия является неспособность бластоцист к имплантации, на которую приходится> 50% всех неудачных беременностей (Craciunas et al., 2019). Хотя оплодотворение in vitro и оплодотворение (ЭКО) все чаще помогает парам зачать ребенка, показатели успеха остаются на прежнем уровне, около 50% бластоцист хорошего качества не могут имплантироваться (Gardner and Balaban, 2016).Имплантация — это очень сложный биологический процесс, который требует координации между здоровым эмбрионом и восприимчивым эндометрием. Процесс начинается с оплодотворения здорового ооцита, которое происходит в фаллопиевой трубе. Во время оплодотворения женский репродуктивный тракт служит системой естественного отбора, гарантирующей, что сперма лучшего качества достигает ооцита и оплодотворяет его (Ralt et al., 1991). После оплодотворения зигота проходит через фаллопиевы трубы и достигает стадии морулы, когда достигает полости матки.Эмбрион на стадии морулы продолжает развиваться до стадии бластоцисты в полости матки перед имплантацией (Norwitz et al., 2001). Это может занять до 72 часов, в течение которых эмбрион и эндометрий связываются через секретируемые факторы и факторы клеточной поверхности, чтобы подготовиться к начальной адгезии и прикреплению (Ashary et al., 2018). Как только внешний слой эмбриона, а именно трофэктодерма, прочно прикрепляется к просветному эпителию эндометрия, начинается имплантация. Отсутствие прочной адгезии приводит к неудаче имплантации.
Успешная имплантация основана на совокупном успехе вышеуказанных событий. На имплантацию могут влиять многие факторы, включая качество спермы и ооцитов, раннее развитие эмбриона, эндометрий и реципрокную связь между бластоцистами и эндометрием. В клинических условиях ЭКО качество эмбриона обычно оценивается путем оценки морфологии, разрастания и вылупления, развития внутренней клеточной массы и формирования слоя трофэктодермы (Giorgetti et al., 1995; Gardner et al., 2000). Перенос эмбрионов, оцененных как хорошие или «переносимые», может улучшить имплантацию и исход беременности (Giorgetti et al., 1995; Gardner et al., 2000). Однако эти морфологические критерии не обязательно коррелируют с потенциалом имплантации. Эмбрионы со схожими морфологически хорошими баллами, оцененными как пригодные для передачи от пожилых женщин (> 38 лет), имеют значительно более низкий уровень беременности по сравнению с эмбрионами более молодых женщин (<38 лет) (Giorgetti et al., 1995). По оценкам, в целом 50% эмбрионов хорошего качества не могут имплантироваться (Gardner and Balaban, 2016). Помимо оценок, основанных на морфологии, в некоторых клиниках ЭКО также используется предимплантационное генетическое тестирование. Это тестирование требует сбора клеток трофэктодермы для оценки плоидности бластоцист и может выявить один из многих признаков, которые могут повлиять на имплантацию. Другой клинический подход к повышению успешности имплантации - оценка восприимчивости эндометрия. Текущий клинический тест, называемый набором рецептивности эндометрия, используется для оценки того, находится ли эндометрий в фазе или рецептивен (Díaz-Gimeno et al., 2011). Однако этот метод является инвазивным, поскольку он требует биопсии эндометрия и не диагностирует нарушенный или нерегулируемый эндометрий, и, хотя он многообещающий, все еще существует необходимость в разработке неинвазивных методов для распознавания нарушенного эндометрия (Díaz-Gimeno et al., 2011). Помимо эндометрия, качество спермы также может повлиять на имплантацию. Текущий клинический анализ качества сперматозоидов основан на основных оценках морфологии и подвижности сперматозоидов, которые не обязательно отражают их способность способствовать развитию и имплантации эмбрионов.
Несмотря на доступные тесты, аномалии сперматозоидов, ооцитов, нарушенного эндометрия и взаимодействия эмбриона с эндометрием, которые способствуют неудачам имплантации, не могут быть эффективно определены, и неудачи имплантации остаются значительным узким местом для лечения ЭКО. Чтобы улучшить это, новая работа сосредоточена на оценке биомаркеров в образцах, которые можно собирать относительно неинвазивно, и изучении того, отражают ли они потенциал имплантации. Хотя было предложено множество различных классов потенциальных биомаркеров, микроРНК (miR) выделяются как многообещающие биомаркеры для определения качества сперматозоидов, ооцитов, эмбрионов и эндометрия, которые можно использовать для прогнозирования результатов имплантации.miRs представляют собой небольшие некодирующие РНК, которые регулируют экспрессию генов и продукцию белков (Bushati and Cohen, 2007). Секретированные или внеклеточные miR очень стабильны в жидкостях организма, отражают болезненные состояния и легко обнаруживаются в короткие сроки, что делает их очень подходящими для обнаружения биомаркеров (Cuman et al., 2015). Новые данные убедительно свидетельствуют о том, что miR регулируют имплантацию эмбриона человека (Paul et al., 2019). Недавние исследования подтверждают их использование в качестве неинвазивных биомаркеров качества сперматозоидов, ооцитов и бластоцист, восприимчивости эндометрия и взаимодействий бластоцисты и эндометрия (Cuman et al., 2015; Machtinger et al., 2017; Ли и др., 2019; Абу-Халима и др., 2020). Этот обзор направлен на обсуждение использования miR для скрининга качества бластоцист и потенциала имплантации, уделяя особое внимание использованию человеческих образцов, которые можно собирать относительно неинвазивно.
Лабораторная идентификация miR с трансляционным потенциалом для предсказания имплантации
Стандартное лечение ЭКО в целом требует извлечения яйцеклеток, сбора спермы, ЭКО и культивирования эмбрионов перед переносом. Сбор кумулюсных клеток и фолликулярной жидкости возможен во время извлечения яйцеклетки, не влияя на ЭКО (рис. 1).Анализ экспрессии генов и miR в фолликулярной жидкости и кумулюсных клетках указывает на качество ооцитов и эмбрионов, таким образом, потенциал имплантации с точки зрения эмбриона (Hamel et al., 2008; Fu et al., 2018). Эмбрионы обычно культивируют до 5–6 дней для достижения стадии бластоцисты перед переносом (рис. 1). Эмбрионы секретируют специфические профили miR, которые могут отражать их качество и потенциал имплантации (Kropp et al., 2014; Capalbo et al., 2016). Эпителий эндометрия секретирует факторы в полость матки, чтобы регулировать имплантацию и маточную жидкость, или смывы маточного лаважа потенциально могут использоваться для обнаружения miR в качестве биомаркеров для прогнозирования восприимчивости и имплантации (Boomsma et al., 2009). Кровь содержит внеклеточные miR, уровни экспрессии некоторых miR положительно коррелируют с уровнями эндометрия и потенциально могут указывать на то, является ли эндометрий дисрегулируемым или восприимчивым (Kresowik et al., 2014). Аномалии сперматозоидов способствуют развитию и качеству бластоцисты (Yuan et al., 2016), что может повлиять на имплантацию. На мышах было показано, что сперма передает эпигенетическую информацию ооциту во время оплодотворения и влияет на преимплантационный эмбрион и развитие потомства (Sharma et al., 2016). Разработка неинвазивных биомаркеров стимулировала обширные исследования в этой области с общей целью повышения эффективности имплантации и лечения ЭКО.
Рис. 1. Схема образцов, которые могут быть собраны неинвазивным способом во время лечения in vitro и оплодотворения (ЭКО). Характеристика профилей семенных экзосом и микроРНК (miR) сперматозоидов может определять качество сперматозоидов для прогнозирования потенциала развития эмбриона и исхода ЭКО.Анализ экспрессии miR в фолликулярной жидкости и кумулюсных клетках может указывать на качество ооцитов и эмбрионов и возможность имплантации с точки зрения эмбриона. Профили miR в BCM также, вероятно, отражают качество эмбриона, которое нельзя отличить с помощью оценки на основе морфологии. Клетки эндометрия высвобождают miR в крови, и уровни экспрессии по крайней мере некоторых miR эндометрия отражаются в крови. Оценка циркулирующих miR в крови может предсказать восприимчивость эндометрия и исход имплантации.Уровни miR в маточной жидкости отражают «локальную» секрецию miR эндометрия и могут быть собраны без ущерба для переноса эмбриона, чтобы предоставить информацию о восприимчивости эндометрия. Эти образцы обрисованы в общих чертах. BCM, питательная среда для бластоцист.
Кумулюсные клетки и фолликулярная жидкость
Кумулюсные клетки участвуют в развитии и компетентности ооцитов (Huang and Wells, 2010). В дополнение к непосредственному взаимодействию с ооцитом для облегчения созревания, кумулюсные клетки также находятся в одной и той же фолликулярной среде во время созревания ооцита, таким образом, они могут сохранять отпечаток, отражающий его качество и потенциал для формирования жизнеспособного эмбриона (Рисунок 1; Patrizio et al., 2007). Было доказано, что кумулированные клетки полезны для неинвазивной диагностики качества ооцитов (Hamel et al., 2008; Devjak et al., 2016). Секвенирование следующего поколения на кумулюсных клетках человека показало, что miR представляют собой основной тип малых РНК, составляя до 71% от общего количества малых РНК (Xu et al., 2015). В качестве способа взаимодействия было показано, что бычьи кумулюсные клетки и ооциты взаимно влияют на количество miRs в каждом клеточном компартменте (Abd El Naby, 2012), и эти miRs легко контролируют экспрессию генов с обширными последующими функциональными последствиями.Исследования экспрессии генов на кумулюсных клетках человека выявили транскрипты, которые могут участвовать в созревании, имплантации и беременности ооцитов, причем их регуляторные miRs только начинают реализовываться (Gasca et al., 2007; Hamel et al., 2008). Во время лечения ЭКО кумулюсные клетки извлекаются, будучи все еще прочно прикрепленными к каждому ооциту, и поэтому их сбор может происходить из отдельных ооцитов и, таким образом, является показателем потенциала развития отдельных ооцитов.
Фолликулярная жидкость также собирается во время извлечения ооцитов; однако, в отличие от кумулюсных клеток, фолликулярная жидкость, обычно собираемая во время стимуляции ЭКО, представляет собой пул из нескольких ооцитов, а не из одного ооцита, чтобы избежать множественных вагинальных проколов.Несмотря на это ограничение, одно исследование с использованием объединенной фолликулярной жидкости от отдельных пациенток выявило различия в экспрессии miR между группами с разными исходами беременности (Scalici et al., 2016). В этом исследовании был проведен скрининг пяти miR и установлено, что экспрессия hsa-miR-29a в фолликулярной жидкости может прогнозировать исход беременности со специфичностью 53,5% и имеет более высокую способность распознавания по сравнению с прогнозированием с использованием оценок морфологии эмбриона (Scalici et al., 2016). Еще два исследования собирали фолликулярную жидкость из одного фолликула и использовали микроматрицы для скрининга miR, которые могли предсказать разницу между бластоцистами хорошего и плохого качества.Хотя hsa-miR-663b был идентифицирован как обычная miR, которая обратно пропорциональна бластоцистам хорошего качества (Machtinger et al., 2017; Fu et al., 2018), метод дискриминации по качеству бластоцист, использованный в двух исследованиях, основан на рутинная морфологическая оценка. Следовательно, использование hsa-miR-663b в качестве маркера бластоцист хорошего качества можно аналогичным образом определить с помощью рутинной морфологической оценки и, вероятно, обеспечивает ограниченный потенциал применения для прогнозирования исхода имплантации эмбриона. В условиях клинического ЭКО, как правило, за один раз извлекается несколько ооцитов, и вполне вероятно, что они различаются по качеству и способности развиваться в жизнеспособные бластоцисты.Это может ограничить широкое применение фолликулярной жидкости, поскольку ее нельзя использовать для оценки miR, выделяемых отдельными ооцитами.
Семенная плазма и сперма
Нарушение функции сперматозоидов широко признано одним из основных факторов бесплодия. В физиологических условиях сперматозоиды приобретают функциональную способность во время прохождения через придаток яичка и женские репродуктивные пути. На этом пути происходят как биофизические, так и биохимические изменения, в конечном итоге приводящие к способности сперматозоидов подвергаться акросомной реакции, распознавать ооцит и вносить вклад в развитие эмбриона (Zhou et al., 2018). Ряд недавних исследований на мышах предоставил доказательства того, что поглощение miRs из просвета придатка яичка наделяет сперматозоиды способностью вносить вклад в раннее эмбриональное развитие и, таким образом, имплантацию при доставке в ооцит (Yuan et al., 2016; Conine et al., 2018, 2019). При сравнении профилей miR между caput спермой мыши и сперматозоидом хвоста было выявлено 27 miR, которые специфически обогащены сперматозоидами хвоста по сравнению со спермой caput (Nixon et al., 2015; Sharma et al., 2018). Микроинъекция miR, обогащенных спермой хвоста, в эмбрионы, полученные из головки, спасают дефекты экспрессии генов перед имплантацией мышам (Conine et al., 2019). Дальнейшие исследования выявили зависимый от эпидидимосомы механизм избирательной доставки miR в сперматозоиды во время их транзита в придатке яичка мышей (Reilly et al., 2016; Trigg et al., 2019; Zhou et al., 2019). У людей различия в профилях экспрессии miR были зарегистрированы как в семенной плазме, так и в сперме в зависимости от качества эмбрионов и исходов беременности (Mokánszki et al., 2019; Абу-Халима и др., 2020; Сюй и др., 2020). Анализ секвенирования miR на образцах сперматозоидов, сгруппированных в соответствии с различным качеством эмбрионов, выявил более высокие уровни экспрессии hsa-miR-191 в группе сперматозоидов с лучшим результатом для развития эмбриона (Xu et al., 2020). hsa-miR-19b-3p имеет более низкую экспрессию в сперматозоидах, что связано с успешным исходом беременности (Abu-Halima et al., 2020). Другое недавнее исследование выбрало 11 miR, связанных со сперматогенезом, и показало, что hsa-let-7a, hsa-miR-7-1-3p, hsa-miR-141, hsa-miR-200a и hsa-miR-429 были значительно повышены, в то время как hsa-miR-15b, hsa-miR-34b и hsa-miR-122 были значительно подавлены как в семенной плазме, так и в сперме бесплодных пациентов мужского пола с нарушенной выработкой спермы, по сравнению с мужчинами с нормальной фертильностью (Mokánszki et al., 2019). В семенной плазме обнаружена обогащенная популяция эпидидимосомоподобных пузырьков, а именно семенные экзосомы (Vojtech et al., 2014). Ограничение использования семенных экзосом состоит в том, что они представляют собой смешанную популяцию внеклеточных везикул, происходящих не только из придатка яичка, но также из предстательной железы и семенных пузырьков (Rolland et al., 2013). Необходимо, чтобы профили miR в этих пузырьках коррелировали с качеством спермы. изучение. Тем не менее, семенные экзосомы участвуют в передаче груза сперматозоидам, что способствует их подвижности, способности к увеличению емкости и полному экзоцитозу акросом, следовательно, влияя на качество сперматозоидов (Tompkins et al., 2015). Кроме того, экзосомы, выделенные из семенной плазмы, могут модулировать иммунный ответ и изменения экспрессии генов в женском репродуктивном тракте (Robertson and Sharkey, 2016; Bai et al., 2018), что в конечном итоге облегчает имплантацию и беременность у людей. Такие функции, по крайней мере, опосредуются через miRs, переносимые семенными экзосомами (Machtinger et al., 2016), и подобно эпидидимосомам семенные экзосомы несут отличительные профили miRs (Vojtech et al., 2014). Улучшенная характеристика профилей miR семенной плазмы и сперматозоидов может быть полезна не только с точки зрения раскрытия причинной основы дисфункции мужских гамет, но также для обеспечения срочно необходимых биомаркеров качества спермы для надежного прогнозирования результатов лечения ЭКО.
Израсходованная питательная среда для бластоцист
В условиях ЭКО оплодотворенный ооцит обычно культивируют in vitro в течение 5–6 дней до стадии бластоцисты перед переносом. Отработанные питательные среды можно собирать во время смены среды, не влияя на качество эмбриона. Было продемонстрировано, что более 96% miR, присутствующих в отработанной культуральной среде, происходят из трофэктодермы и могут быть последовательно обнаружены после бластуляции в условиях культивирования ЭКО (Capalbo et al., 2016). Возникает соблазн предположить, что секретируемые бластоцистами miRs участвуют в регуляции взаимодействий трофэктодерма-эндометриальный просвет эпителия, следовательно, имплантации. В соответствии с этим представлением было установлено, что эмбрионы с разными результатами имплантации (имплантированные и не имплантированные) секретируют разные профили miR в культуральную среду (Cuman et al., 2015; Borges et al., 2016; Capalbo et al. ., 2016). Повышенная экспрессия hsa-miR-142-3p и сниженная экспрессия hsa-miR-20a и hsa-miR-30c были идентифицированы в неимплантированной культуральной среде бластоцисты (BCM) по сравнению с имплантированной BCM (Таблица 1; Borges et al. ., 2016; Capalbo et al., 2016). Кроме того, скрининг микроматриц выявил список miR, обнаруживаемых исключительно в имплантированном или не имплантированном BCM (Таблица 1; Cuman et al., 2015; Capalbo et al., 2016). Профили miR в BCM также, вероятно, отражают качество эмбриона и общий результат ЭКО, как обобщено в таблице 1 (McCallie et al., 2010; Rosenbluth et al., 2014; Abu-Halima et al., 2020).
Таблица 1. Идентифицированные микроРНК (miR) в культуральной среде бластоцисты (BCM) с диагностическим потенциалом.
Предыдущее исследование показало, что пока преимплантационный эмбрион находится в полости матки, он упаковывает регуляторные miR во внеклеточные пузырьки (Ashary et al., 2018). Они также предполагают, что упакованные miRs захватываются эпителиальными клетками просвета эндометрия и изменяют их функцию, чтобы подготовиться к имплантации. Инкубация первичных эпителиальных клеток эндометрия человека (HEEC) с BCM, собранным из имплантированных эмбрионов, увеличивает их адгезионную способность к сфероидам, образованным линией клеток трофобласта (Cuman et al., 2013). Другие известные примеры включают hsa-miR-661, который секретируется исключительно бластоцистами, которые не могут имплантироваться (Cuman et al., 2015). Секретируемый hsa-miR-661 из неимплантированного BCM захватывается HEEC и снижает их адгезию к сфероидам, образованным клетками трофобласта (Cuman et al., 2015). Недавнее исследование также демонстрирует, что инкубация HEEC с BCM из имплантированных эмбрионов по сравнению с эмбрионами, которые не были имплантированы во время ЭКО, приводит к существенному изменению экспрессии длинных некодирующих РНК в HEEC (Takamura et al., 2019). PTENP1 является одной из самых уменьшенных длинных некодирующих РНК в HEEC после обработки BCM из эмбрионов, которые не могут имплантироваться (Takamura et al., 2019). Функционально, нокдаун PTENP1 нарушает адгезию HEEC посредством miR-зависимого механизма, подавляя генные мишени, необходимые для восприимчивости (Takamura et al., 2019).
Имплантированные и не имплантированные эмбрионы, из которых был взят BCM, имели неотличимую морфологию на основе имеющихся в настоящее время оценок качества эмбрионов.Таким образом, miR в BCM могут служить многообещающими неинвазивными биомаркерами для повышения диагностической точности качества эмбриона и потенциала имплантации. Очевидная проблема для достижения этого — определить, какие когорты miR присутствуют в образцах BCM, которые коррелируют с результатом имплантации, в частности, независимо от условий культивирования эмбрионов. Хотя некоторые miR, такие как hsa-miR-19b-3p и hsa-miR-372, были идентифицированы по крайней мере в двух независимых исследованиях (Таблица 1), сравнение секретируемых miR в BCM с различными исходами имплантации продемонстрировало в целом противоречивый результат среди различные исследования (McCallie et al., 2010; Розенблут и др., 2014; Cuman et al., 2015; Borges et al., 2016; Capalbo et al., 2016; Абу-Халима и др., 2020). Факторы, способствующие этому несоответствию, включают различные условия культивирования эмбрионов в разных клиниках ЭКО, нестандартные протоколы, ручное воздействие на выделение РНК и обнаружение miR (Belandres et al., 2019). Кроме того, очевидным фактором, препятствующим связыванию miR в BCM с неудачным исходом имплантации, являются потенциальные эффекты эндометрия. Неудачная группа имплантации, из которой был взят BCM, могла быть связана с плохим качеством эмбриона, нарушением регуляции эндометрия или измененным окном восприимчивости.Связь между эмбрионом и эндометрием остается «черным ящиком», и возможно примечательно, что не все секретируемые miRs захватываются эпителиальными клетками просвета эндометрия, чтобы регулировать имплантацию. Для будущих диагностических целей необходимо определить, какие miR поглощаются эндометрием, и их действие на эндометрий. Вероятно, будет включена панель miR, при этом функциональные последствия каждого отдельного miR при имплантации будут подтверждены в идеале как на людях ( in vitro, ), так и на доклинических моделях животных ( in vivo ).Подробные функциональные исследования охватили лишь небольшую часть идентифицированных miR (Таблица 2; Chu et al., 2015; Cuman et al., 2015; Kang et al., 2015; Kottawatta et al., 2015; Vilella et al. , 2015; Zhang et al., 2015; Cai et al., 2016; Chen et al., 2016; Zheng et al., 2017; Sirohi et al., 2018; Winship et al., 2018; Balaguer et al., 2019; Griffiths et al., 2019; Takamura et al., 2019).
Таблица 2. miR, которые регулируют имплантацию эмбриона.
Кровь
микроРНК также легко секретируются в кровь.Циркулирующие miR упакованы в мембраносвязанные везикулы, прикреплены к липопротеинам высокой плотности или связаны с РНК-связывающими белками, что придает им поразительную стабильность в крови (Schwarzenbach et al., 2014). Эндометрий человека отличается обильным кровоснабжением и обязан обеспечивать оптимальную среду, способствующую восприимчивости и имплантации (Farrer-Brown et al., 1970). Клетки эндометрия могут секретировать / транспортировать некоторое количество miR к месту действия ткани через кровь, и исследования показывают, что уровни экспрессии эндометрия по крайней мере некоторых miR отражаются в крови (Kresowik et al., 2014; Ди Пьетро и др., 2018). Циркулирующие miR в крови могут предсказывать восприимчивость эндометрия и имплантацию. В предыдущем исследовании использовалась цельная кровь и парная ткань эндометрия в средней секреторной фазе, чтобы определить, могут ли циркулирующие miR отличить фертильных пациентов от пациентов с повторяющейся неудачной имплантацией (Rekker et al., 2018). miR-30a-5p был идентифицирован как дифференциально экспрессируемый в цельной крови между двумя группами; однако это различие не отразилось на парной ткани эндометрия (Rekker et al., 2018). Одно из возможных объяснений состоит в том, что клетки крови экспрессируют miR (Jickling et al., 2014), которые могут маскировать miR, секретируемые тканью эндометрия. Недавняя работа с использованием парной сыворотки и эндометрия в средней секреторной фазе исследовала пять miR и идентифицировала положительную корреляцию уровней экспрессии hsa-miR-31 между сывороткой и тканью эндометрия (Kresowik et al., 2014). Альтернативно, уровни внеклеточной экспрессии miR не обязательно отражают уровни клеточной экспрессии. Имеют ли биомаркеры miR критические функции в рецептивности эндометрия, также необходимо определить экспериментально, поскольку дифференциально выраженные циркулирующие miR у женщин с нормальной фертильностью и бесплодием могут не все иметь функциональное значение для рецептивности или имплантации.Функциональные исследования идентифицированных циркулирующих и клеточных miR в моделях восприимчивости и имплантации могут предоставить доказательства в поддержку их потенциального применения в качестве биомаркеров и целей лечения. Например, экспрессия hsa-miR-200c повышена в сыворотке крови пациентов с бесплодием и абортами по сравнению со здоровыми женщинами (Zheng et al., 2017). Функциональный анализ с использованием как линий клеток эндометрия человека, так и модели на мышах демонстрирует, что сверхэкспрессия hsa-miR-200c ухудшает восприимчивость клеток эндометрия у обоих видов (Zheng et al., 2017).
Очевидная проблема для прогнозирования результата имплантации с использованием miR в крови будет заключаться в том, чтобы отличить miR, секретируемые эндометрием, от miR, секретируемых другими тканями. Следует отметить, что процесс имплантации эмбриона несколько напоминает процесс метастазирования раковых клеток. Оба процесса имеют общие клеточные механизмы в клеточной адгезии, инвазии и ангиогенезе (Murray and Lessey, 1999). miR, такие как hsa-miR-29c (Griffiths et al., 2019) и hsa-miR-125b (Chen et al., 2016), которые не регулируются в эндометрии у бесплодных женщин, также связаны с раком желудка и эндометрия (Shang et al., al., 2012; Wang et al., 2019). Раковые клетки, выделяющие miR в кровь, могут затруднять обнаружение miR, секретируемых эндометрием. В связи с этим важной особенностью эндометрия является то, что он восстанавливается при каждом менструальном цикле. Эндометрий восприимчив к имплантирующемуся эмбриону только в течение очень короткого промежутка времени в средней секреторной фазе (Ashary et al., 2018). Такое функциональное переключение опосредуется скоординированными изменениями экспрессии miR (Vilella et al., 2015). Эти фазозависимые изменения, в свою очередь, могут наделять секретируемые эндометрием miR с уникальными зависимыми от цикла отпечатками экспрессии, которые можно использовать для отличия от фона других потенциально секретируемых тканью miR.Эта теория подтверждается предыдущим исследованием, сравнивающим экспрессию miR между фазой пролиферации и средней секреторной фазой в парной сыворотке и ткани эндометрия от фертильных женщин. hsa-miR-31 был идентифицирован как потенциальный биомаркер, уровень которого повышен как в сыворотке, так и в эндометрии в средней секреторной фазе по сравнению с пролиферативной фазой (Kresowik et al., 2014). Также важно исследовать соответствующие средства контроля от различных патологий в качестве сравнительных групп. Прогностическое применение miR в крови при имплантации, вероятно, будет основано на множественных измерениях экспрессии miR на разных фазах менструального цикла.
Другая проблема использования уровней miR в крови для целей биомаркеров была выявлена при диагностике рака. В предыдущем исследовании было отобрано 79 твердых биомаркеров miR, циркулирующих в крови, и определены уровни их экспрессии в клетках крови. 46 из 79 miR были высоко экспрессированы в клетках крови (Pritchard et al., 2012). Плазма, выделенная из крови с различным количеством клеток крови или гемолизом, влияла на уровни экспрессии выбранных miR (Pritchard et al., 2012). Также наблюдалась несогласованность между уровнями miR в плазме и сыворотке между беременными и небеременными группами пациентов после переноса эмбрионов (Yang et al., 2018). Для повышения точности прогноза необходима панель miR, как было предложено для диагностики рака (Madhavan et al., 2013). Для достижения этой цели необходимо исследование уровней miR у больших групп женщин с различной этиологией бесплодия и других патологий для их потенциального использования в качестве биомаркеров. Ранее мы идентифицировали нарушение регуляции механизма процессинга miR в эндометрии когорты бесплодных пациентов, которое могло бы иметь общее влияние на секрецию miR из-за нарушения процессинга miR в клетке (Loke et al., 2019). Секреция miR в этой когорте может отличаться по сравнению с другими когортами бесплодия, вызванными другой этиологией. Определение того, какие miR ответственны за обеспечение рецептивности эндометрия, также необходимо для определения того, могут ли биомаркеры также быть полезными в качестве мишеней лечения дисрегулируемой рецептивности эндометрия.
Маточная жидкость
Маточная жидкость выделяется эндометрием человека в качестве косвенного средства связи с эмбрионом для подготовки к имплантации.По сравнению с другими жидкостями организма маточная жидкость представляет собой более «местную» секрецию и, таким образом, может предоставить прямую информацию при оценке биомаркеров для имплантации. Детальный анализ состава показал, что маточная жидкость содержит miR и белки с измененными профилями в течение менструального цикла (Scotchie et al., 2009; Ng et al., 2013). Функциональный анализ доказал, что клетки эндометрия секретируют miR, такие как hsa-miR-30d, которые захватываются эмбрионом через трофэктодерму и регулируют адгезию in vitro (Vilella et al., 2015). Дальнейшие исследования демонстрируют, что секретируемые miRs в маточной жидкости нацелены на множество генов, связанных с имплантацией (Ng et al., 2013). Следует отметить, что миР в маточной жидкости могут быть получены из различных клеток эндометрия и крови. Это можно определить с помощью гибридизации in situ и на срезах эндометрия, как это было сделано для белка с помощью иммуноокрашивания (Hannan et al., 2010). Маточную жидкость можно собирать путем аспирации или лаважа без ущерба для имплантации (Hannan et al., 2012). Однако, насколько нам известно, большинство доступных в настоящее время исследований маточной жидкости сосредоточено на сравнении белков между фертильными и бесплодными пациентами (Hannan et al., 2010; Salamonsen et al., 2013). В настоящее время существует ограниченное количество исследований, изучающих возможность использования miR в маточной жидкости в качестве диагностического метода имплантации.
Общие проблемы использования секретных miR для прогнозирования имплантации
Хотя miRs очень желательны в качестве неинвазивных биомаркеров для прогнозирования имплантации, эта область исследований несколько затруднена из-за общей несогласованности уровней экспрессии miR в разных исследованиях.Было установлено, что ряд факторов, включая системы выделения и обнаружения РНК, могут способствовать этому несоответствию. Недавно опубликованная работа одной лаборатории, в которой использовались разные коммерческие наборы для выделения РНК, продемонстрировала, что извлечение РНК варьировалось в зависимости от коммерческих наборов (El-Khoury et al., 2016; Wright et al., 2020). Кроме того, выбор эндогенных контролей для нормализации целевых уровней экспрессии miR напрямую влияет на результаты, и некоторые исследования пренебрегли такой важностью.Для нормализации miR идеальный эндогенный контроль должен стабильно выражаться в жидкости организма с минимальными биологическими вариациями, и экспрессия не должна изменяться при различных результатах имплантации. Известно, что в жидкостях организма экспрессия некоторых клеточных эндогенных контролей может варьироваться в разных образцах, что приводит к отклонениям в нормализации. Это важный первый шаг, чтобы сравнить вариабельность экспрессии ряда кандидатов в эндогенный контроль в данной жидкостной системе организма и подтвердить их стабильность.Это не проводилось в некоторых исследованиях и, возможно, способствовало изменчивости экспрессии miR. Был предложен рабочий процесс для определения наилучшего контроля нормализации (Schwarzenbach et al., 2015). Все эти шаги по введению импакт-факторов требуют стандартизации, прежде чем можно будет сделать твердый вывод.
К этой проблеме добавляется наблюдение, что внутренние различия между женщинами вместе с разными протоколами ЭКО могут приводить к различным паттернам экспрессии miR в эндометрии человека.Исследование на микроматрицах выявило, что лютеиновая поддержка после контролируемой стимуляции яичников оказывает глубокое влияние на профиль miR в эндометрии (Zhao et al., 2012). В частности, добавление прогестерона связано со значительным увеличением экспрессии miR в эндометрии по сравнению с группой, не принимавшей стероидные добавки, после контролируемой стимуляции яичников (Zhao et al., 2012). Полученные данные согласуются с предыдущим отчетом об идентификации паттернов дифференциальной экспрессии miR между естественными и стимулированными циклами ЭКО (Sha et al., 2011). Кроме того, у пациентов, получающих одно и то же лечение ЭКО с разными уровнями прогестерона в сыворотке, были выявлены разные паттерны экспрессии miR в ткани эндометрия, полученные через 6 дней после получения ооцитов (Li et al., 2011). Анализ микроматрицы эндометрия выявил четыре miR (hsa-miR-451, hsa-miR-424, hsa-miR-125b и hsa-miR-30b), которые были уменьшены в группе с высоким уровнем прогестерона в сыворотке (Li et al., 2011 ). При сравнении данных различных исследований необходимо учитывать эффекты контролируемой стимуляции яичников и поддержки лютеиновой фазы.
Заключение
Измерение miR в образцах, которые могут быть собраны без ущерба для переноса эмбриона в том же менструальном цикле, открывает новые перспективы для диагностики возможности имплантации эмбриона. К сожалению, наше понимание механизмов того, как дисрегуляция miR влияет на имплантацию и как это соответственно влияет на секрецию miR, остается далеко не полным. Интерпретация результатов исследования затруднена нестандартной оценкой miR в данной жидкости организма.Решение этих вопросов окажет большое влияние на разработку биомаркеров и клиническую практику врачей-репродуктологов и ученых. Это включает в себя оптимизацию отбора эмбрионов для переноса во время ЭКО, улучшение показателей успешности имплантации и минимизацию многоплодных беременностей. Вероятно, что комбинация образцов, которые могут быть собраны либо неинвазивно, либо относительно неинвазивно, как обобщено в этом обзоре, будет полезна для оценки потенциала имплантации на разных этапах становления и развития концепта.Это основано на исследованиях по поиску биомаркеров miR, связанных с регулированием имплантации, и разработке новых технологий для улучшения обнаружения miR. Недавно было разработано несколько микрофлюидных устройств с большей емкостью, позволяющей включать больше miR и сокращать время анализа. Улучшенная диагностика имплантации эмбриона может иметь огромное влияние на психологическое и финансовое благополучие женщин и пар, проходящих лечение ЭКО.
Авторские взносы
Оба автора внесли существенный вклад в концепцию этого обзора и критическую оценку обобщенной литературы, написали рукопись и одобрили окончательную версию этой статьи перед подачей на рассмотрение.
Финансирование
Эта работа была поддержана грантом проекта (APP1120689) и стипендией старшего научного сотрудника (# 550905) от Национального совета здравоохранения и медицинских исследований Австралии (NHMRC) для ED. WZ был поддержан грантом для начинающих исследователей и грантом на инновации отделения акушерства и гинекологии (Университет Мельбурна).
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
Абд Эль Наби, В. С. Х. (2012). Анализ экспрессии регуляторных микроРНК в кумулюсных ооцитах крупного рогатого скота и доимплантационных эмбрионах. Зигота 21, 31–51. DOI: 10,1017 / s0967199411000566
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Абу-Халима, М., Хайзаран, З. А., Айеш, Б. М., Фишер, У., Хайзаран, С. А., Аль-Баттах, Ф. и др. (2020). МикроРНК в комбинированных отработанных питательных средах и сперме связаны с качеством эмбриона и исходом беременности. Fertil. Стерил. 113, 970.e2–980.e2.
Google Scholar
Бай Р., Латифи З., Кусама К., Накамура К., Шимада М. и Имакава К. (2018). Индукция экспрессии связанных с иммунитетом генов семенными экзосомами в эндометрии свиней. Biochem. Биофиз. Res. Commun. 495, 1094–1101. DOI: 10.1016 / j.bbrc.2017.11.100
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Балагер, Н., Морено, И., Эрреро, М., Гонсалес-Монфорт, М., Вилелла, Ф., и Симон, К. (2019). Дефицит MicroRNA-30d в период до зачатия влияет на восприимчивость эндометрия, снижая частоту имплантации и нарушая рост плода. Am. J. Obstet. Гинеколь. 221, 46.e1–46.e16.
Google Scholar
Беландрес Д., Шамонки М. и Аррач Н. (2019). Текущий статус проведенных исследований среды эмбриона для преимплантационного генетического тестирования. J. Assist. Репрод. Genet. 36, 819–826. DOI: 10.1007 / s10815-019-01437-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Boomsma, C., Kavelaars, A., Eijkemans, M., Lentjes, E., Fauser, B., Heijnen, C., et al. (2009). Анализ секреции эндометрия определяет профиль цитокинов, позволяющий прогнозировать беременность при ЭКО. Гум. Репрод. 24, 1427–1435. DOI: 10.1093 / humrep / dep011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Борхес, Э. мл., Сетти, А. С., Брага, Д. П., Джеральдо, М. В., Фигейра, Р. Д. С. С. и Яконелли, А. мл. (2016). miR-142-3p как биомаркер неудачной имплантации бластоцисты — пилотное исследование. JBRA Assist. Репрод. 20, 200–205. DOI: 10.5935 / 1518-0557.20160039
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бушати, Н., Коэн, С. М. (2007). функции микроРНК. Annu. Rev. Cell Dev. Биол. 23, 175–205.
Google Scholar
Cai, J. L., Liu, L. L., Hu, Y., Jiang, X. M., Qiu, H. L., Sha, A.-G., et al. (2016). Полихлорированные бифенилы нарушают восприимчивость эндометрия in vitro посредством регуляции экспрессии mir-30d и эпителиального мезенхимального перехода. Токсикология 365, 25–34. DOI: 10.1016 / j.tox.2016.07.017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Capalbo, A., Ubaldi, F. M., Cimadomo, D., Noli, L., Khalaf, Y., Farcomeni, A., et al. (2016). МикроРНК в отработанной культуральной среде бластоцисты получают из клеток трофэктодермы и могут быть исследованы для оценки репродуктивной компетентности человеческого эмбриона. Fertil. Стерил. 105, 225–235. DOI: 10.1016 / j.fertnstert.2015.09.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чачамович, Я.Р., Чачамович, Э., Эзер, Х., Флек, М. П., Кнаут, Д., и Пассос, Э. П. (2010). Изучение качества жизни и качества жизни, связанного со здоровьем, при бесплодии: систематический обзор. J. Psychosom. Акушерство. Gynaecol. 31, 101–110. DOI: 10.3109 / 0167482x.2010.481337
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чен, К., Чжао, Ю., Ю, Ю., Ли, Р., и Цяо, Дж. (2016). MiR-125b регулирует восприимчивость эндометрия, воздействуя на MMP26 у женщин, подвергающихся ЭКО-ЭТ с повышенным уровнем прогестерона в день примирования ХГЧ. Sci. Отчет 6: 25302.
Google Scholar
Чу, Б., Чжун, Л., Доу, С., Ван, Дж., Ли, Дж., Ван, М., и др. (2015). miRNA-181 регулирует имплантацию эмбриона мышам, воздействуя на фактор ингибирования лейкемии. J. Mol. Cell Biol. 7, 12–22. DOI: 10.1093 / jmcb / mjv006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Конин, К. К., Сан, Ф., Сонг, Л., Ривера-Перес, Дж. А., и Рандо, О. Дж. (2018). Небольшие РНК, полученные во время эпидидимального транзита сперматозоидов, необходимы для эмбрионального развития мышей. Dev. Ячейка 46, 470–480. DOI: 10.1016 / j.devcel.2018.06.024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Конин, К. К., Сан, Ф., Сонг, Л., Ривера-Перес, Дж. А., и Рандо, О. Дж. (2019). МикроРНК, отсутствующие в сперме caput, необходимы для нормального эмбрионального развития. Dev. Ячейка 50, 7–8. DOI: 10.1016 / j.devcel.2019.06.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Крациунас, Л., Галлос, И., Чу, Дж., Борн, Т., Quenby, S., Brosens, J. J., et al. (2019). Обычные и современные маркеры рецептивности эндометрия: систематический обзор и метаанализ. Гум. Репрод. Upd. 25, 202–223. DOI: 10.1093 / humupd / dmy044
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Cuman, C., Menkhorst, E., Rombauts, L., Holden, S., Webster, D., Bilandzic, M., et al. (2013). Преимплантационные бластоцисты человека выделяют факторы, которые по-разному изменяют адгезию эпителиальных клеток эндометрия и экспрессию генов в зависимости от успеха ЭКО. Гум. Репрод. 28, 1161–1171. DOI: 10.1093 / humrep / det058
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Куман, К., Ван Синдерен, М., Гантье, М. П., Райнчук, К., Сорби, К., Ромбаутс, Л. и др. (2015). МикроРНК, секретируемая бластоцистами человека, регулирует адгезию эпителиальных клеток эндометрия. eBio Med. 2, 1528–1535. DOI: 10.1016 / j.ebiom.2015.09.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Девяк, Р., Паплер, Т.Б., Верденик И., Тацер К. Ф., Бокал Е. В. (2016). Модели прогнозирования качества эмбриона на основе экспрессии генов кумулюсных клеток. Balkan J. Med. Genet. 19, 5–12. DOI: 10.1515 / bjmg-2016-0001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ди Пьетро, К., Карузо, С., Батталья, Р., Ираси Сарери, М., Ла Ферлита, А., Стрино, Ф. и др. (2018). MiR-27a-3p и miR-124-3p, активированные в эндометрии и сыворотке женщин, страдающих хроническим эндометритом, являются новыми потенциальными молекулярными маркерами рецептивности эндометрия. Am. J. Reprod. Иммунол. 80: e12858. DOI: 10.1111 / aji.12858
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Диас-Химено, П., Хоркахадас, Дж. А., Мартинес-Конехеро, Дж. А., Эстебан, Ф. Дж., Алама, П., Пеллисер, А. и др. (2011). Инструмент геномной диагностики восприимчивости эндометрия человека на основе транскриптомной подписи. Fertil. Стерил. 95, 50–60. DOI: 10.1016 / j.fertnstert.2010.04.063
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эль-Хури, В., Пирсон, С., Каома, Т., Бернардин, Ф., и Беркем, Г. (2016). Оценка восстановления клеточной и циркулирующей миРНК: влияние метода выделения РНК и количества входящего материала. Sci. Реп. 6: 19529.
Google Scholar
Фаррер-Браун, Г., Бейлби, Дж., И Тарбит, М. (1970). Кровоснабжение матки: 1. Артериальная сосудистая сеть . J. Obstet. Gynaecol. Br. Общий. 77, 673–681. DOI: 10.1111 / j.1471-0528.1970.tb03592.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фу, Дж., Qu, R.G., Zhang, Y.J., Gu, R.H., Li, X., Sun, Y.J., et al. (2018). Скрининг miRNA в фолликулярной жидкости человека показывает обратную зависимость между экспрессией microRNA-663b и образованием бластоцист. Репродукция. Биомед. Онлайн 37, 25–32. DOI: 10.1016 / j.rbmo.2018.03.021
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гарднер, Д. К., Балабан, Б. (2016). Оценка развития человеческого эмбриона с использованием морфологических критериев в эпоху покадровой съемки, алгоритмов и «OMICS»: все еще важно хорошо выглядеть? Мол.Гм. Репрод. 22, 704–718. DOI: 10,1093 / мольхр / gaw057
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гарднер, Д. К., Лейн, М., Стивенс, Дж., Шленкер, Т., и Скулкрафт, В. Б. (2000). Оценка бластоцисты влияет на имплантацию и исход беременности: в сторону однократного переноса бластоцисты. Fertil. Стерил. 73, 1155–1158. DOI: 10.1016 / s0015-0282 (00) 00518-5
CrossRef Полный текст | Google Scholar
Gasca, S., Pellestor, F., Assou, S., Loup, V., Anahory, T., Dechaud, H., et al. (2007). Идентификация новых маркерных генов ооцитов человека: подход с использованием микрочипов. Репродукция. Биомед. Интернет 14, 175–183. DOI: 10.1016 / s1472-6483 (10) 60785-7
CrossRef Полный текст | Google Scholar
Джорджетти, К., Терриу, П., Окье, П., Ханс, Э., Спак, Дж. Л., Зальцманн, Дж. И др. (1995). Имплантация: оценка эмбриона для прогнозирования имплантации после экстракорпорального оплодотворения: на основе 957 переносов отдельных эмбрионов. Гум. Репрод. 10, 2427–2431. DOI: 10.1093 / oxfordjournals.humrep.a136312
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гриффитс, М., Ван Зиндерен, М., Райнчук, К., и Димитриадис, Э. (2019). Сверхэкспрессия miR-29c и подавление COL4A1 в бесплодном эндометрии человека снижает адгезионную способность эпителиальных клеток эндометрия in vitro, что подразумевает их роль в восприимчивости. Sci. Отчет 9: 8644.
Google Scholar
Хамель, М., Дюфорт, И., Роберт, К., Gravel, C., Leveille, M.C., Leader, A., et al. (2008). Идентификация дифференциально экспрессируемых маркеров в фолликулярных клетках человека, связанных с компетентными ооцитами. Гум. Репрод. 23, 1118–1127. DOI: 10.1093 / humrep / den048
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ханнан, Н. Дж., Ни, Г., Райнцчук, А., Ромбаутс, Л., и Саламонсен, Л. А. (2012). Промывание матки или аспират: какой вид внутриматочной среды? Репродукция. Sci. 19, 1125–1132.DOI: 10.1177 / 19337143879
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ханнан, Н. Дж., Стивенс, А. Н., Райнчук, А., Хинкс, К., Ромбаутс, Л. Дж., И Саламонсен, Л. А. (2010). Анализ секрета эндометрия человека методом 2D-DiGE выявляет различия между рецептивными и невосприимчивыми состояниями у фертильных и бесплодных женщин. J. Proteome Res. 9, 6256–6264. DOI: 10.1021 / pr1004828
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хуанг, З.и Уэллс Д. (2010). Взаимосвязь человеческих ооцитов и кумулюсных клеток: новые выводы из транскриптома кумулюсных клеток. Мол. Гм. Репрод. 16, 715–725. DOI: 10,1093 / мольчр / gaq031
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джиклинг, Г. К., Андер, Б. П., Чжан, X., Ноблетт, Д., Стамова, Б., и Лю, Д. (2014). экспрессия микроРНК в клетках периферической крови после острого ишемического инсульта и их предполагаемые генные мишени. PLoS One 9: e99283.DOI: 10.1371 / journal.pone.0099283
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Канг, Ю. Дж., Лиз, М., Мэтьюз, Л. К., Кимбер, С. Дж., Форбс, К., и Аплин, Дж. Д. (2015). miR-145 подавляет эмбрио-эпителиальную juxtacrine коммуникацию при имплантации путем модуляции материнского IGF1R. J. Cell Sci. 128, 804–814. DOI: 10.1242 / jcs.164004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Коттаватта, К. С., Со, К. Х., Кодитувакку, С.П., Нг, Э. Х., Йунг, В. С., Ли, К. Ф. (2015). МикроРНК-212 регулирует экспрессию ольфактомедина 1 и C-концевого связывающего белка 1 в эпителиальных клетках эндометрия человека для усиления прикрепления сфероидов in vitro. Biol. Репрод. 93: 109.
Google Scholar
Кресовик, Дж. Д., Девор, Э. Дж., Ван Вурхис, Б. Дж., И Лесли, К. К. (2014). Уровень микроРНК-31 значительно повышен как в эндометрии человека, так и в сыворотке крови во время периода имплантации: это потенциальный биомаркер для оптимальной восприимчивости. Biol. Репрод. 91:17.
Google Scholar
Ли, Р., Цяо, Дж., Ван, Л., Ли, Л., Чжэнь, X., Лю, П. и др. (2011). Массив микроРНК и оценка микроматрицы восприимчивости эндометрия у пациентов с высоким уровнем прогестерона в сыворотке крови в день введения ХГЧ. Репродукция. Биол. Эндокринол. 9:29. DOI: 10.1186 / 1477-7827-9-29
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли Т., Гринблатт Э. и Чан К. (2019).Выделение и профилирование внеклеточных пузырьков в маточной жидкости для определения новых маркеров рецептивности эндометрия. Fertil. Стерил. 112: e314. DOI: 10.1016 / j.fertnstert.2019.07.911
CrossRef Полный текст | Google Scholar
Локе, Х., Райнчук, К., и Димитриадис, Э. (2019). Механизм биогенеза микроРНК не регулируется в эндометрии бесплодных женщин, что позволяет предположить его роль в восприимчивости и бесплодии. J. Histochem. Cytochem. 67, 589–599.DOI: 10.1369 / 0022155419854064
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Machtinger, R., Laurent, L.C., and Baccarelli, A.A. (2016). Внеклеточные везикулы: роль в созревании гамет, оплодотворении и имплантации эмбриона. Гум. Репрод. Upd. 22, 182–193.
Google Scholar
Machtinger, R., Rodosthenous, R. S., Adir, M., Mansour, A., Racowsky, C., Baccarelli, A. A., et al. (2017). Внеклеточные микроРНК в фолликулярной жидкости и их потенциальная связь с оплодотворением ооцитов и качеством эмбриона: предварительное исследование. J. Assist. Репрод. Genet. 34, 525–533. DOI: 10.1007 / s10815-017-0876-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мадхаван, Д., Цук, К., Бурвинкель, Б., и Янг, Р. (2013). Диагностика рака и прогноз расшифровываются с помощью циркулирующих в крови сигнатур микроРНК. Фронт. Genet. 4: 116. DOI: 10.3389 / fgene.2013.00116
PubMed Аннотация | CrossRef Полный текст | Google Scholar
МакКалли, Б., Скулкрафт, В. Б., и Кац-Джаффе, М.Г. (2010). Аберрация экспрессии микроРНК бластоцисты связана с бесплодием человека. Fertil. Стерил. 93, 2374–2382. DOI: 10.1016 / j.fertnstert.2009.01.069
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мокански А., Мольнар З., Варга Тотне Э., Боднар Б., Якаб А., Балинт Б. Л. и др. (2019). Изменены уровни экспрессии микроРНК в сперме и семенной плазме у пациентов с бесплодным эякулятом по сравнению с нормозооспермией мужчин. Гум.Fertil. [Epub перед печатью].
Google Scholar
Мюррей М. Дж. И Лесси Б. А. (1999). Имплантация эмбриона и метастазирование опухоли: общие пути инвазии и ангиогенеза, Semin Reprod Endocrinol. Нью-Йорк, Нью-Йорк: издательство Thieme Medical Publishers, 275–290.
Google Scholar
Ng, Y.H., Rome, S., Jalabert, A., Forterre, A., Singh, H., Hincks, C.L., et al. (2013). Экзосомы / микровезикулы эндометрия в микросреде матки: новая парадигма перекрестного взаимодействия эмбриона и эндометрия при имплантации. PLoS One 8: e58502. DOI: 10.1371 / journal.pone.0058502
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Никсон Б., Стангер С. Дж., Михалас Б. П., Рейли Дж. Н., Андерсон А. Л., Тьяги С. и др. (2015). Сигнатура микроРНК сперматозоидов мыши существенно изменяется во время созревания придатка яичка. Biol. Репрод. 93:91.
Google Scholar
Патрицио П., Фрагули Э., Бьянки В., Борини А. и Уэллс Д. (2007).Молекулярные методы выбора идеального ооцита. Репродукция. Биомед. Online 15, 346–353. DOI: 10.1016 / s1472-6483 (10) 60349-5
CrossRef Полный текст | Google Scholar
Пол, А. Б., Садек, С. Т., и Махесан, А. М. (2019). Роль микроРНК в имплантации человеческого эмбриона: обзор. J. Assist. Репрод. Genet. 36, 179–187. DOI: 10.1007 / s10815-018-1326-y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Причард, К.К., Кро, Э., Вуд, Б., Арройо, Дж. Д., Догерти, К. Дж., Мияджи, М. М. и др. (2012). Происхождение циркулирующих микроРНК из клеток крови: предостережение для исследований биомаркеров рака. Рак Пред. Res. 5, 492–497. DOI: 10.1158 / 1940-6207.capr-11-0370
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ральт Д., Гольденберг М., Феттерольф П., Томпсон Д., Дор Дж., Машиах С. и др. (1991). Привлечение сперматозоидов к фолликулярному фактору (факторам) коррелирует с оплодотворяемостью яйцеклеток человека. Proc. Natl. Акад. Sci. США 88, 2840–2844. DOI: 10.1073 / pnas.88.7.2840
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рейли, Дж. Н., Маклафлин, Э. А., Стангер, С. Дж., Андерсон, А. Л., Хатчеон, К., Черч, К. и др. (2016). Характеристика эпидидимосом мышей выявляет сложный профиль микроРНК и потенциальный механизм модификации эпигенома сперматозоидов. Sci. Реп. 6, 1–15.
Google Scholar
Реккер, К., Альтмяэ, С., Сухорущенко, М., Петерс, М., Мартинес-Бланч, Дж. Ф., Кодоньер, Ф. М. и др. (2018). Двухкогортное исследование RNA-seq выявило изменения miRNome эндометрия и крови у фертильных и бесплодных женщин. Гены 9: 574. DOI: 10.3390 / genes74
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Rolland, A. D., Lavigne, R., Dauly, C., Calvel, P., Kervarrec, C., Freour, T., et al. (2013). Идентификация маркеров половых путей в семенной плазме человека с использованием подхода интегративной геномики. Гум. Репрод. 28, 199–209. DOI: 10.1093 / humrep / des360
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Розенблют, Э. М., Шелтон, Д. Н., Уэллс, Л. М., Спаркс, А. Э., и Ван Вурхис, Б. Дж. (2014). Человеческие эмбрионы секретируют микроРНК в питательную среду — потенциальный биомаркер для имплантации. Fertil. Стерил. 101, 1493–1500. DOI: 10.1016 / j.fertnstert.2014.01.058
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Саламонсен, Л.A., Edgell, T., Rombauts, L.J., Stephens, A. N., Robertson, D.M., Rainczuk, A., et al. (2013). Протеомика эндометрия и маточной жидкости человека: путь к открытию биомаркеров. Fertil. Стерил. 99, 1086–1092. DOI: 10.1016 / j.fertnstert.2012.09.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Скалици Э., Травер С., Маллет Т., Молинари Н., Ферьерес А., Брюне К. и др. (2016). Циркуляция микроРНК в фолликулярной жидкости — мощные инструменты для изучения процесса экстракорпорального оплодотворения. Sci. Реп. 6: 24976.
Google Scholar
Шварценбах, Х., Да Силва, А. М., Калин, Г., и Пантель, К. (2015). Стратегии нормализации данных для количественной оценки микроРНК. Clin. Chem. 61, 1333–1342. DOI: 10.1373 / Clinchem.2015.239459
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шварценбах, Х., Нишида, Н., Калин, Г.А., и Пантель, К. (2014). Клиническая значимость циркулирующих бесклеточных микроРНК при раке. Nat.Преподобный Clin. Онкол. 11, 145–156. DOI: 10.1038 / nrclinonc.2014.5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Скотчи, Дж. Г., Фриц, М. А., Мокану, М., Лесси, Б. А., и Янг, С. Л. (2009). Протеомный анализ секретома лютеинового эндометрия. Репродукция. Sci. 16, 883–893. DOI: 10.1177 / 193371
37165
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ша, А.Г., Лю, Дж. Л., Цзян, X. М., Рен, Дж. З., Ма, К.H., Lei, W., et al. (2011). Полногеномная идентификация микро-рибонуклеиновых кислот, связанных с восприимчивостью эндометрия человека в естественных и стимулированных циклах, путем глубокого секвенирования. Fertil. Стерил. 96, 150–155. DOI: 10.1016 / j.fertnstert.2011.04.072
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шан, К., Лу, Ю. М., и Мэн, Л. Р. (2012). Понижающая регуляция MicroRNA-125b опосредует инвазию рака эндометрия, воздействуя на ERBB2. Med. Sci. Монит. 18, BR149 – BR155.
Google Scholar
Шарма, У., Конин, К. К., Ши, Дж. М., Боскович, А., Дерр, А. Г., Бинг, X. Y. и др. (2016). Биогенез и функция фрагментов тРНК во время созревания и оплодотворения сперматозоидов у млекопитающих. Наука 351, 391–396. DOI: 10.1126 / science.aad6780
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шарма, У., Сан, Ф., Конин, К. К., Райххольф, Б., Кукрея, С., Херцог, В. А., и др. (2018).Небольшие РНК переносятся из придатка яичка в развивающуюся сперму млекопитающих. Dev. Cell 46, 481–494. DOI: 10.1016 / j.devcel.2018.06.023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сирохи В. К., Гупта К., Кумар Р., Шукла В. и Двиведи А. (2018). Селективный модулятор рецептора эстрогена ормелоксифен подавляет имплантацию эмбриона, индуцируя miR-140 и воздействуя на рецептор инсулиноподобного фактора роста 1 в матке крысы. J. Steroid Biochem.Мол. Биол. 178, 272–282. DOI: 10.1016 / j.jsbmb.2018.01.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Такамура, М., Чжоу, В., Ромбаутс, Л., и Димитриадис, Э. (2019). Длинная некодирующая РНК PTENP1 регулирует адгезивную способность эпителия эндометрия человека in vitro: влияние на бесплодие. Biol. Репрод. 102, 53–62. DOI: 10.1093 / biolre / ioz173
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Томпкинс, А.J., Chatterjee, D., Maddox, M., Wang, J., Arciero, E., Camussi, G., et al. (2015). Возникновение внеклеточных пузырьков в урологии: фертильность, рак, биомаркеры и таргетная фармакотерапия. J. Extracell. Везикулы 4: 23815. DOI: 10.3402 / jev.v4.23815
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тригг, Н. А., Именс, А. Л., и Никсон, Б. (2019). Вклад эпидидимосом в профиль малой РНК сперматозоидов. Репродукция 157, R209 – R223.
Google Scholar
Вилелла, Ф., Морено-Моя, Дж. М., Балагер, Н., Грассо, А., Эрреро, М., Мартинес, С., и др. (2015). Hsa-miR-30d, секретируемый эндометрием человека, поглощается предимплантационным эмбрионом и может модифицировать его транскриптом. Разработка 142, 3210–3221. DOI: 10.1242 / dev.124289
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Войтех Л., Ву С., Хьюз С., Леви К., Баллвебер Л., Саутерауд Р. П. и др.(2014). Экзосомы в сперме человека несут особый набор небольших некодирующих РНК с потенциальными регуляторными функциями. Nucleic Acids Res. 42, 7290–7304. DOI: 10.1093 / nar / gku347
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wang, L., Yu, T., Li, W., Li, M., Zuo, Q., Zou, Q., et al. (2019). Ось miR-29c-KIAA1199 регулирует миграцию рака желудка путем связывания с WBP11 и PTP4A3. Онкоген 38, 3134–3150. DOI: 10.1038 / s41388-018-0642-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уилкокс, А.Дж., Вайнберг, К. Р., О’Коннор, Дж. Ф., Бэрд, Д. Д., Шлаттерер, Дж. П., Кэнфилд, Р. Е. и др. (1988). Частота преждевременного прерывания беременности. N. Engl. J. Med. 319, 189–194.
Google Scholar
Виншип, А., Тон, А., Ван Зиндерен, М., Менкхорст, Э., Райнчук, К., Гриффитс, М., и др. (2018). Подавление активности двойного минутного гомолога 2 (MDM2) мыши с помощью miR-661 нарушает адгезивную способность эпителиальных клеток эндометрия человека. Репродукция. Fertil. Dev. 30, 477–486.DOI: 10.1071 / rd17095
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Райт, К., де Сильва, К., Парди, А. К., и Плейн, К. М. (2020). Сравнение методов выделения и количественного определения miRNA из плазмы овцы. Sci. Отчет 10: 825.
Google Scholar
Сюй Б., Чжан Ю. В., Тонг X. Х. и Лю Ю. С. (2015). Характеристика профиля микроРНК в клетках гранулезного кумулюса человека: идентификация микроРНК, которые регулируют передачу сигналов Notch и связаны с СПКЯ. Мол. Клетка. Эндокринол. 404, 26–36. DOI: 10.1016 / j.mce.2015.01.030
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Xu, H., Wang, X., Wang, Z., Li, J., Xu, Z., Miao, M., et al. (2020). Анализ профиля экспрессии микроРНК в сперме показывает, что hsa-mir-191 является благоприятным предзнаменованием для оплодотворения in vitro. BMC Genomics 21: 165. DOI: 10.1186 / s12864-020-6570-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ян, К., Gu, W. W., Gu, Y., Yan, N. N., Mao, Y. Y., Zhen, X. X., et al. (2018). Связь уровней циркулирующих микроРНК в периферической крови с повторным невынашиванием беременности и исходами переноса эмбрионов в процессе экстракорпорального оплодотворения. J. Transl. Med. 16: 186.
Google Scholar
Юань, С., Шустер, А., Тан, К., Ю, Т., Ортогеро, Н., Бао, Дж. И др. (2016). Переносимые через сперматозоиды miRNAs и endo-siRNAs важны для оплодотворения и доимплантационного эмбрионального развития. Разработка 143, 635–647. DOI: 10.1242 / dev.131755
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zhang, Q., Zhang, H., Jiang, Y., Xue, B., Diao, Z., Ding, L., et al. (2015). МикроРНК-181a участвует в регуляции децидуализации стромальных клеток эндометрия человека путем ингибирования Krüppel-подобного фактора 12. Reprod. Биол. Эндокринол. 13:23.
Google Scholar
Чжао, Ю., Закур, Х., Чидл, К., Нин, Н., Фань, Дж., и Влахос, Н. Ф. (2012). Влияние поддержки лютеиновой фазы на экспрессию микроРНК эндометрия после контролируемой стимуляции яичников. Репродукция. Биол. Эндокринол. 10:72. DOI: 10.1186 / 1477-7827-10-72
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zheng, Q., Zhang, D., Yang, Y.U., Cui, X., Sun, J., Liang, C., et al. (2017). MicroRNA-200c нарушает формирование рецептивности матки, воздействуя на FUT4 и α 1,3-фукозилирование. Смерть клетки. Отличаются. 24, 2161–2172.DOI: 10.1038 / cdd.2017.136
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжоу В., Де Юлис Г. Н., Дун М. Д. и Никсон Б. (2018). Характеристики среды просвета придатка яичка, ответственной за созревание и хранение сперматозоидов. Фронт. Эндокринол. 9:59. DOI: 10.3389 / fendo.2018.00059
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжоу, В., Стангер, С. Дж., Андерсон, А. Л., Бернштейн, И. Р., Де Юлис, Г. Н., McCluskey, A., et al. (2019). Механизмы привязки и переноса груза при взаимодействии эпидидимосомы со спермой. BMC Biol. 17:35. DOI: 10.1186 / s12915-019-0653-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Различные роли простагландинов в имплантации бластоцисты
Простагландины (PG), производные арахидоновой кислоты, играют незаменимую роль при имплантации эмбрионов. Сообщалось, что PG участвуют в увеличении проницаемости сосудов, децидуализации стромы, росте и развитии бластоцист, привлечении лейкоцитов, транспорте эмбрионов, инвазии трофобластов и ремоделировании внеклеточного матрикса во время имплантации.Нарушение синтеза и действий PG приведет к неудаче имплантации. В этом обзоре обобщена современная литература о роли PG в имплантации бластоцисты, которая может дать широкую перспективу для направления дальнейших исследований в этой области.
1. Введение
PG производятся из арахидоновой кислоты, которая высвобождается из фосфолипидов мембран под действием фермента фосфолипаза A 2 [1]. Арахидоновая кислота превращается в PGH 2 PG-эндопероксидсинтазами (PTGS), также известными как циклооксигеназа (COX).ЦОГ — ключевой фермент в биосинтезе PG, действующий как диоксигеназа, так и пероксидаза [2]. В настоящее время существует два идентифицированных изофермента PTGS: конститутивный PTGS1 (COX-1) и индуцибельный PTGS2 (COX-2), которые различаются по своей экспрессии и распределению в тканях [3]. Димер ЦОГ может быть обнаружен как в эндоплазматическом ретикулуме, так и в ядерной мембране [2].
PGH 2 представляет собой нестабильный промежуточный продукт, который быстро превращается в различные другие простаноиды с помощью специфических концевых PG-синтаз.Последние включают PGE-синтазу (PGES), PGIS, PGDS, PGFS и тромбоксансинтазу (TXS), которые образуют PGE 2 , PGI 2 , PGD 2 , PGF 2 α и TXA 2. из PGH 2 соответственно [4]. PGES состоит из микросомальных (m) PGES-1, mPGES-2 и цитозольных (c) PGES [5]. Между тем, альфа-кеторедуктаза (AKR) 1A1 и AKR1BI были идентифицированы как функциональные PGFS у людей [6]. PGI 2 , также известный как простациклин, неферментативно метаболизируется до более стабильной формы, 6-кето PGF 1 α [7].PGF 2 может быть синтезирован непосредственно из PGH 2 или косвенно через PGE 2 , в то время как PGI 2 может быть получен либо непосредственно из PGH 2 , либо косвенно через PGD 2 [8].
PG действуют посредством связывания с его различными рецепторами, связанными с G-белками (GPCR), которые включают четыре подтипа рецептора PGE (EP) (EP1, EP2, EP3 и EP4) [9], рецептора PGF (FP), PGI 2 рецептора (IP) и рецептора PGD 2 (DP), которые состоят из DP1 и DP2 [10].Кроме того, PGI 2 может действовать через ядерный рецептор, активируемый пролифератором пероксисом — δ (PPAR- δ ) [11], ядерный рецептор, активируемый лигандом. Недавно сообщалось, что PGE 2 взаимодействует с PPAR- δ [12]. Связывание PG со своим специфическим рецептором активирует серию внутриклеточного сигнального каскада. Активация EP1 связана с мобилизацией Ca 2+ и запуском EP2 и EP4, в то время как EP3 ингибирует аденилатциклазу [13].Между тем, активация FP связана с фосфолипазным C-инозитолтрисфосфатным путем (IP 3 ) и мобилизацией Ca 2+ [14].
PG играют незаменимую роль при имплантации эмбриона. Об экспрессии ЦОГ-1 и -2 [15], cPGES [16], mPGES-1 и -2 [17] и простациклинсинтазы [18] сообщалось в месте имплантации у мышей, крыс и людей. PGE 2 S и PGF 2 α S были локализованы в эпителии эндометрия человека с увеличением концентрации PGE 2 и PGF 2 α в маточной жидкости во время периода окна имплантации [19] .Между тем, COX-1 экспрессируется в просветном и железистом эпителии, тогда как COX-2 экспрессируется в просветном эпителии и периваскулярных клетках во время периода окна имплантации у людей [20]. Самки мышей, лишенные ЦОГ-2, были бесплодны со специфическими дефектами оплодотворения, имплантации и децидуализации [21]. Самки мышей с дефицитом СОХ-1 были фертильными; однако у них развивается специфический дефект родов [21]. Сообщалось, что у мышей с дефицитом рецептора PG, в частности EP2, нарушены репродуктивные функции [22].Сообщалось, что у грызунов PGE 2 и PGF 2 α играют важную роль в расположении бластоцист, имплантации и децидуализации, в то время как PGI 2 (простациклин) участвует в имплантации и децидуализации с участием PPAR- δ. [23]. Сообщалось также, что PGE 2 и PGF 2 α участвуют в сокращении круговых мышц миометрия грызунов, что облегчает транспортировку эмбрионов и расстояние между ними [24].
Синтез PG и его ферментов биосинтеза в женских половых путях может регулироваться гормонами и паракринными факторами. У людей экспрессия ЦОГ-1 в железистом эпителии и экспрессия ЦОГ-2 в эпителии просвета были значительно снижены после лечения мифепристоном, антагонистом рецепторов прогестерона, что указывает на то, что прогестерон может влиять на экспрессию ЦОГ [20]. На ранних сроках беременности у мышей ген COX-1 в матке может регулироваться стероидами яичников, тогда как ген COX-2 может регулироваться имплантирующейся бластоцистой [25].Сообщалось также, что в синтезе PG участвуют несколько других гормонов и цитокинов. Было обнаружено, что хорионический гонадотропин (ХГ) регулирует продукцию PGE 2 эпителием эндометрия человека и приматов [26]. Сообщалось, что IL-1 α индуцирует секрецию PGE 2 и PGF 2 α стромальными клетками матки мыши in vitro [27]. Сообщалось, что лизофосфатидная кислота (LPA), биоактивное липидное производное, усиливает синтез PGE 2 и экспрессию COX-2 в матке крысы [28].Активация эпителиального канала Na + (ENaC) в эпителии эндометрия мыши с помощью высвобождаемой эмбрионом сериновой протеазы, трипсина, как недавно сообщалось, запускает приток Ca 2+ , который может привести к высвобождению PGE 2 , фактор транскрипции CREB фосфорилирование и активация фермента ЦОГ-2 [29].
Понимание роли PG в имплантации бластоцисты далеко не полное. В связи с этим мы стремимся обобщить литературу, относящуюся к роли PG в имплантации, особенно у людей и грызунов, чтобы представить широкую перспективу для направления дальнейших исследований в этой области.
2. Роль PG в повышенной проницаемости сосудов и ангиогенезе в месте имплантации
Повышенная проницаемость сосудов и отек стромы — два из самых ранних признаков прикрепления бластоцисты [30]. У мышей повышенная проницаемость сосудов может быть замечена на 4,5 день эстрального цикла, что подтверждается исследованиями с контрастированием (CE) -MRI и флуоресцентной микроскопией [31]. Изменения проницаемости сосудов сопровождаются прогрессивным усилением ангиогенеза [31].Сообщалось, что половые стероиды оказывают различное влияние на эти изменения, при этом эстроген увеличивает проницаемость, но сильно ингибирует ангиогенез in vivo , в то время как прогестерон стимулирует ангиогенез, но мало влияет на проницаемость [32].
Изменения проницаемости сосудов и ангиогенеза во время имплантации эмбриона были вызваны дифференциальной экспрессией проангиогенного фактора в матке, который включает фактор роста эндотелия сосудов (VEGF) и его рецепторы [33].VEGF вместе с ангиопоэтином (Ang) -1 и Ang-2 направляют ангиогенез во время децидуализации. Ang-1 в сотрудничестве с VEGF вызывает созревание сосудов и поддерживает их герметичность, тогда как Ang-2 вызывает дестабилизацию сосудов, необходимую для дальнейшего прорастания [34]. Сообщалось об экспрессии гена Ang-подобного 4 в матке во время децидуализации в ответ на агонист PPAR [35], тогда как недавно сообщалось, что ангиомотин (Amot-2), белок, связанный с сосудистым ангиогенезом, экспрессируется в строма эндометрия под действием прогестерона [36].
PG и фактор активации тромбоцитов (PAF) являются важными паракринными факторами, участвующими в увеличении проницаемости сосудов в месте имплантации эмбриона [37]. МРНК рецептора PAF (PAF-R) была обнаружена в железах эндометрия во время секреторной фазы менструального цикла [37]. Взаимодействие между PAF и его рецептором привело к быстрому высвобождению оксида азота (NO), мощного вазодилататора, увеличения экспрессии VEGF и активации киназы фокальной адгезии, FAKpp125 [38]. Вызванное PAF высвобождение NO зависело от протеинкиназы C (PKC) и внеклеточного Ca 2+ [39].
PGE 2 оказался более эффективным, чем простациклин (PGI 2 ), PPAR- δ и ретиноевая кислота (RXRA) в повышении проницаемости сосудов эндометрия у крыс [40]. PGE 2 опосредует эффект половых стероидов на экспрессию VEGF и ангиопоэтина [34], что приводит к увеличению проницаемости сосудов и ангиогенезу во время имплантации и децидуализации соответственно [41]. Напротив, активность синтазы оксида азота (NOS), фермента, ответственного за продукцию NO, которая, как сообщается, является максимальной в месте имплантации эмбриона [42], ингибировалась PGE 2 [43], что позволяет предположить, что PGE 2 может также участвовать в контроле степени проницаемости сосудов, индуцированной NO.С другой стороны, сообщалось, что сам индуцибельный NO влияет на активность ЦОГ-2 и, таким образом, может влиять на синтез PG [44].
Участие PGF 2 α в синтезе NO и кровотоке к месту имплантации относительно неизвестно; однако было обнаружено, что PGF 2 α вызывает резкое увеличение кровотока к желтому телу за счет стимуляции активности эпителиальной синтазы оксида азота (eNOS) [45]. Кроме того, было обнаружено, что PGF 2 α влияет на ангиогенез, как сообщалось в ткани аденокарциномы эндометрия [46].Сообщалось, что простациклин (PGI 2 ), мощный вазодилататор, играет важную роль в увеличении проницаемости сосудов в месте имплантации. Уровень простациклина увеличивается на ранних сроках беременности и является основным эйкозаноидом, продуцируемым эндотелием гладкомышечных артерий параллельно с увеличением экспрессии PGIS [47]. Простациклин связывается с IP в железистых эпителиальных клетках, что приводит к быстрой активации киназы, регулируемой внеклеточным сигналом (ERK) 1/2, а также к индукции экспрессии проангиогенных генов, основного фактора роста фибробластов (bFGF) и Ang-1 и -2. посредством перекрестного взаимодействия с рецептором эпидермального фактора роста (EGF-R) [48].
3. Роль PG в децидуализации
Децидуализация — наиболее важное событие, приписываемое PG, которое определяется как дифференцировка удлиненных стромальных фибробластов в секреторные, эпителиоидоподобные децидуальные клетки. У грызунов этот процесс инициируется имплантирующейся бластоцистой [34], тогда как у людей децидуализация начинается сразу после овуляции, достигает пика в середине лютеиновой фазы менструального цикла [49] в ответ на прогестерон и не зависит от сигнал бластоцисты [50].Преобразование стромальных фибробластов в децидуальные клетки сначала можно увидеть вблизи концевых спиральных артерий, которые затем распространяются по компартменту эндометрия. Децидуализированные стромальные клетки, непосредственно окружающие имплантирующуюся бластоцисту, перестают пролиферировать и образуют первичную децидуальную зону (PDZ) [51, 52]. Клетки, окружающие PDZ, продолжают пролиферировать и дифференцироваться в полиплоидные децидуальные клетки, которые образуют вторичную децидуальную зону (SDZ) [34]. Децидуализация связана с полиплоидией, то есть образованием многоядерных (одно- и двухъядерных) и гигантских клеток [53, 54] из-за измененной экспрессии и функциональной активности регуляторных молекул клеточного цикла [55], таких как циклин D 3 , который может быть индуцирован гепарин-связывающим фактором роста эпидермиса (HB-EGF) [54].
Децидуализация характеризуется повышенной продукцией белка-1, связывающего инсулиноподобный фактор роста (IGFBP-1), пролактина (dPRL) и фактора транскрипции вилки (FOXO1) в ответ на гормональную стимуляцию [49, 56]. Экспрессия децидуальных специфических генов, которые кодируют эти белки, требует цАМФ [57], прогестерона [58] и недавно идентифицированной передачи сигналов ERK1 / 2 [59]. Связывание пептидных гормонов и простаноидов с GPCR приведет к активации аденилатциклазы, фермента, участвующего в синтезе цАМФ [60].цАМФ затем будет фосфорилировать протеинкиназу A (PKA), которая состоит из регуляторных и каталитических субъединиц [61]. Связывание цАМФ с регуляторной субъединицей приведет к высвобождению и активации каталитической субъединицы, которая будет фосфорилировать молекулы-мишени в цитоплазме или факторы транскрипции в ядре [62]. Устойчивое повышение уровня внутриклеточного цАМФ необходимо для поддержания децидуализированного фенотипа [63], при котором отмена цАМФ заставляет децидуализированные стромальные клетки повторно приобретать недифференцированный фенотип [64].
PKA фосфорилирует белок, связывающий элемент ответа цАМФ (CREB) [58] и родственный модулятор элемента ответа цАМФ (CREM) [65]. Фосфорилирование также задействует коактиватор CREB-связывающего белка (CBP) в промоторной области генов-мишеней [50], облегчая транскрипцию ДНК [66]. Повышение внутриклеточного цАМФ заставляет Ca 2+ проникать в клетку через канал TRPC1, который важен для инициации децидуализации [67]. Процесс децидуализации может подавляться несколькими факторами, включая трансформирующий фактор роста (TGF) — β 1 [68] и фактор транскрипции Krüppel-подобного фактора 12 [69].Фосфодиэстеразы, фермент, расщепляющий цАМФ до АМФ, что приводит к снижению уровня цАМФ, также ингибируют децидуализацию [70].
Пептидные гормоны, участвующие в процессе децидуализации, включают релаксин [71], лютеинизирующий гормон / хорионический гонадотропин человека (LH / hCG) [72] и кортикотропин-рилизинг-гормон (CRH) [73], в то время как PGE 2 является единственным простаноидом. вовлечены [74]. Другие факторы включают инсулин и инсулиноподобный фактор роста (IGF-I и II) [75], трансформирующий фактор роста (TGF) — β [76], эпидермальный фактор роста (EGF) и фактор роста тромбоцитов (PDGF). ) [77].Сообщалось, что PGE 2 вызывает повышение внутриклеточного уровня цАМФ и стимулирует активность щелочной фосфатазы (ЩФ) [78] через рецепторы EP2 и EP4 [79]. Между тем, PGE 2 и релаксин, частично через цАМФ / PKA-зависимый путь, как сообщается, стимулируют секрецию IL-11, что вызывает прямое повышение уровня цАМФ [80].
Децидуальные клетки синтезируют и секретируют PGs [81] и экспрессируют рецепторы PG [82]. PG также могут транспортироваться в эти клетки через транспортер простагландина (PGT).Доказательства увеличения синтеза PG включают активацию экспрессии COX-1, COX-2, cPGES и mPGES у мышей [16, 83], крыс [18, 84], морских свинок [85] и людей [86, 87]. ] и активация AKR1B1, высокофункциональной синтазы PGF, ответственной за продукцию PGF 2 α у человека [88]. На ранних сроках беременности у крыс экспрессия ЦОГ-2 увеличивается между 2 и 5 днями [89], указывая на то, что PG необходимы в процессе децидуализации стромальных клеток. В то время как PGE 2 и PGF 2 α являются основными вовлеченными PG, простациклин (PGI 2 ) также участвует в децидуализации, поскольку у мышей экспрессия PGIS значительно увеличивается на 5-й день и постепенно снижается. после этого [90].Помимо повышенной экспрессии ферментов биосинтеза PG, сообщенное увеличение экспрессии EP2 и PPAR- δ в децидуальных клетках мышей дополнительно свидетельствует об участии PGs в этом процессе [91].
Прогестерон необходим для децидуализации как у людей, так и у грызунов. Прогестерон проявляет свой эффект через связывание с ядерным рецептором прогестерона-A (PR-A), который взаимодействует с факторами транскрипции, включая CCAAT / связывающий энхансер белок β (C / EBP β ) [92], белки вилки [92]. 93], а также преобразователь сигнала и активатор транскрипции 5 (STAT5) [94].Белок, взаимодействующий с рецептором прогестерона (PR), Krüppel-подобный фактор (KLF) 9, экспрессия которого высока в преддецидуальной строме, взаимодействует с костным морфогенетическим белком 2 (BMP2) для поддержания чувствительности стромальных клеток к прогестерону [95]. C / EBP β также важен для передачи сигналов цАМФ [96]. C / EBP β опосредует активацию децидуального промотора PRL, что приводит к транскрипции гена dPRL [50]. У людей функциональная связь между C / EBP β и STAT3 оказалась критической в регуляции дифференцировки стромальных клеток эндометрия [97].
Помимо dPRL, PR также участвует в регуляции транскрипции гена IGFBP-1 [98]. PR может участвовать в регуляции Snail, репрессора транскрипции, который, как недавно было установлено, играет центральную роль в эпителиально-мезенхимальном переходе, при котором его экспрессия, как сообщается, индуцируется HB-EGF через сигнальный путь EGFR-ERK-STAT3 [ 99]. HOXA-10, ген гомеобокса абдоминального типа, который, как сообщается, участвует в процессе децидуализации, также может находиться под влиянием PR, где потеря функции Hoxa-10 у мышей, как сообщается, приводит к бесплодию [100].
Задокументировано участие PG в индуцированной прогестероном децидуализации. Сообщалось, что COX-2 регулирует экспрессию репрессора транскрипции Snail [99]. Нарушение регуляции экспрессии EGF и COX-2 в матке мышей во время периимплантационного периода, связанное с высоким уровнем прогестерона в плазме, привело к неудаче имплантации [101]. Между тем было обнаружено, что прогестерон усиливает экспрессию EP2 [102], в то время как прогестерон и HOXA-10, как сообщается, повышают экспрессию EP3 и EP4 в строме [100].Кроме того, другие роли PG в этих процессах остаются неизвестными.
Внеклеточный матрикс (ЕСМ) состоит из коллагенов, неколлагеновых мультиадгезивных гликопротеинов, эластина, гиалуронана, протеогликанов и гликозаминогликанов [103]. На ранних сроках беременности ЭЦМ матки играет важную роль в децидуализации, прикреплении эмбриона, инвазии трофобластов и поддержании беременности [104]. Сообщается, что ECM подвергается обширному ремоделированию при подготовке к адгезии бластоцисты, инвазии трофобластов и плацентации.Изменения в составе ВКМ характеризуются фагоцитозом и ферментативным перевариванием коллагеновых фибрилл, увеличением диаметра коллагеновых фибрилл, отложением белков базальной мембраны, синтезом и секрецией сульфатированных гликозаминогликанов и уменьшением количества эластичных фибрилл, окружающих созревшие децидуальные клетки [105].
Сообщалось о том, что половые стероиды, цитокины, PG и факторы роста влияют на состав эндометрия ECM на ранних сроках беременности [106]. О динамических изменениях ECM свидетельствуют пространственно-временные изменения экспрессии фермента матриксной металлопротеиназы (MMP) и тканевого ингибитора изоформ металлопротеиназы (TIMP) на протяжении всего цикла течки и на ранних сроках беременности.Эти два фермента участвуют в деградации и ремоделировании ЕСМ. Экспрессия мРНК MMP-2 наблюдалась в строме между 3 и 5 днями и во вторичной децидуальной зоне на 6 день, тогда как мРНК MMP-9 экспрессировалась в гигантских клетках трофобласта на 8 день беременности у мышей [107]. Между тем, экспрессия TIMP-1, 2 и 3 была обнаружена в первичной децидуальной зоне на 2–5 дни и в первичной и вторичной децидуальной зоне на 6–8 дни ранней беременности у мышей [107] и крыс [108]. , 109].Предполагается, что ТИМП регулируют степень инвазии трофобластов [110]. Стромальные клетки эндометрия человека секретируют TIMP-3, который играет важную роль в ранней имплантации, модулируя инвазию трофобластов [111].
Прогестерон [112, 113], 17 β -эстрадиол [114], активатор урокиназы-плазминогена [115], фактор ингибирования лейкемии (LIF) [116], фактор некроза опухоли (TNF) и интерферон- γ [ 117], трансформирующий фактор роста бета (TGF β ), интерлейкин-1 и интерлейкин-6 (IL-1, IL-6) [118], липополисахариды [119], эпидермальный фактор роста (EGF) [120], инсулин -подобный фактор роста (IGF) и белок-1, связывающий инсулиноподобный фактор роста (IGFBP-1) [121], а также факторы трофобласта, включая ХГЧ [122], как сообщается, влияют на экспрессию и активность MMP и TIMP.Однако влияние PG на деградацию и ремоделирование ECM матки изучено плохо. Ограниченные наблюдения позволяют предположить, что PGF 2 α может участвовать в обороте ECM посредством воздействия на экспрессию MMP2, катепсина L, TIMP2 и TIMP3, ингибитора активатора плазминогена 1 (PAI1), активатора плазминогена тканевого типа (tPA), активатора плазминогена урокиназы ( uPA), эндотелин 1, кальпонин, карбоксипептидаза D и кальпониновая кислота [123]. Между тем, в шейке матки PGE 2 через EP2 и EP4, как сообщается, стимулирует синтез гиалуронана при ремоделировании цервикального ECM [124], в то время как PGF 2 α и IL-1 α сообщается. для стимуляции секреции ММП-1, который играет важную роль в деградации внеклеточного коллагена I и III типов [125].
5. Роль PG в лейкоцитарной инфильтрации
Для успешной имплантации необходим значительный приток маточных естественных киллеров (NK) и макрофагов [126, 127]. В децидуальных мышах NK-клетки постепенно инактивируются PGE 2 , продуцируемым децидуальными клетками и децидуальными макрофагами [128]. Между тем, секреция PGE 2 децидуальной оболочкой человека в первом триместре беременности блокирует активацию материнских децидуальных лейкоцитов с потенциальной функцией киллера антитрофобластов путем ингибирования in situ генерации рецептора IL-2 и продукции IL-2 [129].PGF 2 α может участвовать в воспалительной реакции, регулируя хемотаксис нейтрофилов, как сообщается в ткани аденокарциномы эндометрия [130].
6. Роль PGs в транспорте эмбрионов
Транспортировка гамет и эмбрионов, которая включает как сокращение мышц, так и активность ресничек, является важной функцией фаллопиевых труб [131]. Прогестерон необходим для нормального транспорта эмбриона по яйцеводам [132, 133]. PGs, известный медиатор мышечной сократимости, давно задокументированы как участвующие в транспорте эмбрионов по яйцеводам [134].PGs опосредуют сокращение [135] и расслабление [136] гладких мышц. PGs эпителиального происхождения активируют рецепторы DP, EP2, EP4 и IP, которые вызывают повышение внутриклеточного уровня цАМФ, что приводит к расслаблению гладких мышц [137]. С другой стороны, активация EP1 и FP, которая сочетается с мобилизацией Ca 2+ , приводит к сокращению гладких мышц [138].
Различные изоформы EP, которые были идентифицированы в женских половых путях, с их активацией могут вызывать либо повышенный, либо пониженный внутриклеточный цАМФ, либо повышенный уровень внутриклеточного Ca 2+ , хотя обычно это приводит к сокращению гладких мышц [139].Сообщалось об экспрессии EP и FP в фаллопиевых трубах человека как свидетельство увеличения сокращения гладких мышц после обработки PGF 2 α и PGE 2 [140]. Сообщалось также, что рецепторы COX-2, PGIS и IP экспрессируются в фаллопиевых трубах человека [141], которые могут служить аутокринным регулятором сокращения гладких мышц яйцевода [142].
7. Роль PG в росте и развитии бластоцисты
Скоординированный рост и развитие эмбрионов от 2 до 4, а затем 8 клеток на стадии морулы и бластоцисты является предпосылкой для успешной имплантации [143].Во время развития бластоциста экспрессирует множество факторов и их рецепторов в ответ на половые стероиды и факторы роста, которые, в свою очередь, регулируют рост бластоцисты и участвуют в обмене сигналами с рецептивным эндометрием. Выраженные гормоны и факторы включают преимплантационный фактор (PIF) [144], хорионические гонадотропины (cG) [145], лейкемический фактор ингибирования (LIF) [146], гепарин-связывающий фактор роста эпидермиса (HB-EGF) [147] и PGs [148].
Простациклин (PGI 2 ) представляет собой наиболее распространенные PG, продуцируемые бластоцистами мыши.Кроме того, стадии 8 клеток, морулы и бластоцисты также синтезируют PGE 2 [149]. PGI 2 связывается с рецептором IP и участвует в регуляции развития эмбриона [150]. Между тем, COX-1, COX-2 и PGIS, как сообщается, также экспрессируются в эмбрионах на 4-клеточной стадии и за ее пределами, а также во внутренней клеточной массе и трофэктодерме бластоцист мышей [151]. У золотых хомячков экспрессия COX-2 в эмбрионах на 8-клеточной стадии через вылупившиеся бластоцисты была локализована в основном в трофэктодерме бластоцист, что было критическим для вылупления бластоцист [152].Также сообщалось, что PGI 2 регулирует апоптоз клеток бластоцисты, действуя как антиапоптотический фактор [149]. Между тем, экспрессия EP2 и FP, которые были обнаружены в трофэктодерме бластоцист мыши и внутренней клеточной массе, участвовала в адгезии эмбрионов [19].
Помимо PGI 2 , PGE 2 также играет важную роль в развитии эмбриона [148]. мРНК mPGES была обнаружена на всех стадиях доимплантационного развития эмбриона [83], в то время как экспрессия cPGES была обнаружена на стадиях 2, 4 и 8 клеток, морулы и бластоцисты [16] у мышей.Преимплантационные мышиные эмбрионы также экспрессируют PPAR- δ , который необходим для усиления эффекта PGI 2 на вылупление бластоцист, когда у эмбрионов с дефицитом PPAR- δ сообщалось о нарушении образования и вылупления бластоцист [153].
8. Роль PG в инвазии трофобластов
После адгезии бластоцисты клетки трофобласта дифференцируются и приобретают инвазивный фенотип [154]. Роль PG в облегчении инвазии трофобластов в значительной степени неизвестна; однако несколько свидетельств указывают на его участие в этом процессе.Сообщалось, что PGE 2 и агонист EP2 увеличивают адгезию линии клеток трофобласта человека HTR-8 / SVneo (линия клеток, происходящих из трофобласта человека) с ECM через сигнальный путь MEK / MAPK, а также повышают экспрессию клеточной адгезии. белок, такой как киназа фокальной адгезии, и молекула межклеточной адгезии, такая как интегрины [155]. Кроме того, экспрессия EP2 также описана в трофобласте, который может стимулироваться PGE 2 посредством аутокринной передачи сигналов [155].
Экспрессия COX-2 и PGE 2 синтазы также была обнаружена в клетках HTR-8 / SVneo человека [156]. Совместная стимуляция LIF и IL-1 β индуцировала продукцию большего количества PGE 2 и дальнейшую миграцию этих клеток [157]. Факторы, производные децидуальной оболочки, включая PG, как сообщается, увеличивают инвазивность клеток трофобласта за счет снижения TIMP1 и TIMP3, однако повышают экспрессию TIMP2, увеличивают экспрессию мРНК интегрина-5 и интегрина-6, но не интегрина- α V субъединицы , повышают экспрессию мРНК MMP2, MMP3 и MMP9 и повышают активность MMP2 и MMP9 [158].Между тем, противоречивый отчет показал, что PGE 2 ингибирует функции вневорсинчатых клеток трофобласта, что может помочь предотвратить чрезмерную пролиферацию и миграцию трофобластов [159].
9. Заключение
Понимание роли PG в имплантации бластоцисты и ранней беременности далеко не полное. Хотя большая часть информации была получена в результате исследований на животных, особенно на грызунах, необходимо провести дополнительные исследования на людях, чтобы дополнительно изучить механизмы, лежащие в основе разнообразного действия PG на множественные процессы имплантации.
Конфликт интересов
Автор заявляет об отсутствии конфликта интересов.
Благодарность
Эта работа была поддержана грантом UMRG (RG404 / 12HTM), Университет Малайи, Куала-Лумпур, Малайзия.
Культура бластоцисты и имплантация — Лондонская женская клиника
Культура, перенос и имплантация бластоцист
Исторически перенос эмбриона после ЭКО или ИКСИ происходил через два или три дня после сбора яйцеклеток, когда эмбрион содержит от шести до восьми клеток.Однако лабораторный прогресс означает, что теперь мы можем культивировать эмбрионы в течение пяти или шести дней. На этой стадии зародыши имеют множество клеток (примерно 80–100) и начинают формировать два отдельных слоя. Эмбрионы тогда называют бластоцистами.
Культивирование эмбрионов в лаборатории на пятый или шестой день дает эмбрионам больше возможностей доказать свой потенциал развития. Некоторые оплодотворенные яйцеклетки могут даже задержаться (перестать развиваться) до 5-го дня. Этот « естественный отбор» позволяет эмбриологу более точно выбрать лучший эмбрион для переноса, который дает наиболее высокую вероятность беременности.
Оценка бластоцисты
Классификация или качество бластоцисты определяется путем оценки внешнего кольца клеток, известного как трофэктодерма или трофобластические клетки, которые в конечном итоге образуют плаценту; внутренняя клеточная масса или ICM, состоящая из стволовых клеток, из которых будет развиваться ребенок.
Оценка бластоцист — это несовершенная наука, и некоторые очень красивые бластоцисты не обязательно вызывают беременность. Однако основное практическое правило состоит в том, что лучшие эмбрионы достигают стадии бластоцисты и, следовательно, имеют больше статистических шансов на продолжение беременности, чем эмбрионы более низкого качества.
Имплантация бластоцисты
При имплантации бластоцисты, в отличие от эмбриона третьего дня, который должен продолжать развиваться после переноса эмбриона, перенесенная бластоциста имплантируется намного быстрее. Научные данные показывают, что показатели успешного переноса бластоцисты выше, чем при переносе эмбрионов на третий день.
Культура бластоцист в LWC
Лондонская женская клиника теперь использует культивирование бластоцист как часть своих стандартных лабораторных процедур. На следующий день после сбора яйцеклеток позвонит эмбриолог, чтобы обсудить скорость оплодотворения и время, когда может произойти перенос.
Процедура переноса бластоцисты
Заключительный этап процесса — перенос эмбриона в матку. Катетер, удерживающий эмбрион, осторожно вводят в цервикальный канал и в полость матки под контролем ультразвука. Затем катетер удаляется и проверяется, чтобы убедиться, что эмбрион перенесен. После переноса вы можете вернуться к нормальному состоянию, когда эмбрион находится в полной безопасности в матке. После переноса эмбриона бластоцисты тест на беременность обычно назначается через двенадцать дней.В это время лучше избегать физических нагрузок и подъема тяжестей.
Витрификация / замораживание бластоцисты
Лондонская женская клиника продвигает eSET (выборочный перенос одного эмбриона) в соответствии с рекомендациями Управления по оплодотворению и эмбрионам человека (HFEA). Это означает, что после переноса эмбриона часто остаются дополнительные бластоцисты. Если бластоцисты хорошего качества, их можно хранить для использования в цикле замены замороженных эмбрионов (FET или FERC) в более поздний срок.Процесс замораживания известен как остекловывание. В настоящее время научные отчеты показывают, что шансы на беременность при использовании витрифицированных бластоцист почти равны шансам, которые используются в цикле переноса свежих эмбрионов.
ученых выяснили, что заставляет человеческий эмбрион прикрепляться к матке
Исследовательская группа под руководством UCSF определила первый молекулярный шаг, который позволяет человеческому эмбриону недельного возраста прикрепиться к матке. Ожидается, что это открытие станет новым инструментом для диагностики и лечения бесплодия и раннего невынашивания беременности, сообщают ученые.
Исследователи нашли убедительные доказательства того, что процесс молекулярного прилипания останавливает путешествие эмбриона по стенке матки и начинает прикреплять его к стенке — это первая стадия имплантации. Невозможность имплантации эмбриона является причиной примерно трех четвертей потерянных беременностей.
Исследование опубликовано в номере журнала SCIENCE от 17 января. Также в номере публикуется перспективная статья об исследовании.
Команда обнаружила, что примерно через шесть дней после оплодотворения молекулы на поверхности эмбриона взаимодействуют с молекулами на стенке матки матери, создавая липкую среду — ту же комбинацию молекул, которая, как известно, останавливает движение борющихся с болезнями лейкоцитов, мигрирующих по кровеносным сосудам. и позволить им прикрепиться к стенкам кровеносных сосудов в очагах воспаления.
«Это похоже на теннисный мяч, катящийся по покрытой сиропом поверхности», — сказала Сьюзан Фишер, доктор философии, профессор стоматологии, анатомии и фармацевтической химии UCSF и старший автор отчета SCIENCE. «Путешествие эмбриона по стенке матки задерживается липким взаимодействием».
Имплантация человеческого эмбриона недостаточно изучена, и причины многих связанных с имплантацией заболеваний неизвестны. По словам Фишера, открытие молекулярной основы первого шага имплантации может оказаться полезным для лечения бесплодия и дать представление об общих проблемах беременности.
UCSF подала заявку на патент на использование L-селектина для диагностики способности женщины забеременеть и выявления причин бесплодия.
Фишер и ее коллеги обнаружили, что, когда подходит время для имплантации, внешние клетки раннего эмбриона или бластоцисты экспрессируют белок, известный как L-селектин, в то время как матка обогащается углеводами. L-селектин обычно кратковременно связывается с такими углеводами, поэтому постоянное прилипание и отрывание между белком и углеводами может постепенно замедлять продвижение эмбриона вдоль стенки матки.Когда эмбрион приходит в состояние покоя, создается почва для его прикрепления к стенке матки, где он устанавливает питательную кровь от матери через плаценту.
Около десяти лет назад был обнаружен такой механизм прилипания белков к углеводам, позволяющий лейкоцитам полностью остановиться и начать прикрепляться к стенкам кровеносных сосудов, когда они достигают области воспаления.
В своем исследовании ученые собрали биопсию эндометрия, взятую до и после периода, когда матка наиболее восприимчива к имплантации.Используя антитела, которые распознают часть ключевого углевода, они обнаружили резкое увеличение количества углеводов, которые взаимодействуют с L-селектином, когда матка восприимчива к имплантации.
Исследователь из частной клиники экстракорпорального оплодотворения, участник исследования, обнаружил, что во время имплантации внешний слой бластоцисты, известный как трофобласт, экспрессирует L-селектин. Фишер объяснил, что трофобласт обычно становится «детской частью» плаценты.Клетки трофобласта проникают в артериальные стенки матки, вытесняя собственные клетки матери.
Исследование, проведенное в частной клинике, проводилось на частные средства.
Чтобы подтвердить связь между процессом прилипания и подготовкой эмбриона к имплантации, ученые покрыли латексные шарики углеводами, которые обычно связывают L-селектин, и продемонстрировали, что шарики связываются с клетками трофобласта плацентарной ткани в условиях матки.
Они также показали, что изолированные клетки трофобласта плаценты, экспрессирующие L-селектин, гораздо сильнее прикрепляются к углеводам на эпителиальных клетках матки, собранных, когда матка восприимчива к имплантации, чем в периоды невосприимчивости — убедительное подтверждение взаимодействия L-селектина с углеводами, поскольку известно, что имплантация обычно происходит, когда эти маточные клетки взаимодействуют с клетками трофобласта.
«Исследование может способствовать пониманию преэклампсии, наиболее частой причины материнской смертности в промышленно развитых странах», — сказал Фишер. По ее словам, в этом состоянии, которое встречается почти в каждой десятой первой беременности, плацента не прикрепляется должным образом к стенке матки, что лишает плод кислорода и угрожает жизни матери. По словам Фишера, поскольку именно внешний слой эмбриона — трофобласт — дает начало плаценте, этот процесс, как и замедление раннего эмбриона вдоль стенки матки, вероятно, включает взаимодействие L-селектина и углеводов.
Ведущий автор статьи — Ольга Дмитриевна Генбацева, кандидат биологических наук, клеточный биолог в стоматологии UCSF. Соавторы: Акрапорн Пракобпхол, доктор стоматологических наук и доктор философии, стоматолог-исследователь, и Душко Илич, доктор медицинских наук, клеточный биолог-исследователь, оба в стоматологии, UCSF; Рассел А. Фоулк, доктор медицины, директор Центра репродуктивной медицины Невады, Рино; Ана Р. Кртолика, доктор философии, научный сотрудник Национальной лаборатории Лоуренса Беркли; Чжи-Цян Ян, аспирант, и Лаура Л. Кисслинг, доктор философии, профессор химии и биологии, оба из Университета Висконсин-Мэдисон; Метки.Певец, исследователь анатомии, и Стивен Д. Розен, доктор философии, профессор анатомии, оба в UCSF.
Поддержка исследований включает гранты Национальных институтов здравоохранения.
###
Имплантация эмбриона и формирование плаценты — стенограмма видео и урока
Имплантация
Как только бластоциста достигает матки, она использует фермент, переваривающий белок, или протеазу , чтобы проделать отверстие в окружающей блестящей оболочке.Затем он протискивается через отверстие, чтобы вылупиться из блестящей оболочки. Белки на внешней поверхности бластоцисты связываются с внеклеточным матриксом стенки матки и позволяют бластоцисте прикрепиться. Прикрепившись, бластоциста секретирует ряд различных протеаз, которые переваривают внеклеточный матрикс матки и позволяют бластоцистам проникать в стенку матки. Этот процесс, при котором бластоциста связывается со стенкой матки, а затем зарывается в нее, известен как имплантация .
Миграция трофобластов
По мере имплантации бластоцисты трофобласты, составляющие внешний слой клеток, размножаются в количестве и проникают глубже в стенку матки. Они поддерживают защитный барьер между материнскими клетками и развивающимся эмбрионом. Как вы, возможно, помните, трофобласты — это клетки, которые в конечном итоге сформируют хорион или часть плаценты, происходящую от эмбриона. По мере того, как количество трофобластов увеличивается в количестве и распространяется дальше в стенку, они встречаются и окружают материнские кровеносные сосуды, которые уже существуют в материнской ткани матки.Эти материнские кровеносные сосуды затем сливаются с промежутками между трофобластами, образуя сеть синусов, заполненных материнской кровью.
Несмотря на то, что кровь поступает из системы кровообращения матери, протекает через пазухи, а затем снова попадает в кровеносные сосуды матери, важно отметить, что пазухи не являются кровеносными сосудами, потому что они не имеют эндотелиальной выстилки. клетки, содержащие кровь.Вместо этого кровь вступает в прямой контакт с эмбриональными клетками трофобласта. Эти трофобласты, перемежающиеся с наполненными кровью пазухами, окружают весь развивающийся эмбрион. В конце концов, наполненные кровью синусы расширяются, и трофобласты образуют структуры, похожие на пальцы, называемые ворсинками хориона . Эти пальцеобразные структуры плаценты, состоящие из трофобластов эмбриона, окружаются материнской кровью в том, что сейчас называется межворсинчатым пространством.
Эмбриональная циркуляция
Тем временем сам эмбрион продолжает расти и развиваться.При этом одна из самых первых систем органов, которая развивается, — это система кровообращения. Всего через три недели после имплантации у эмбриона уже есть основная система кровообращения, которая, помимо роста внутри самого эмбриона, также растет и распространяется на ворсинки хориона. Эти эмбриональные кровеносные сосуды растут очень близко к межворсинчатому пространству, что позволяет питательным веществам диффундировать из материнской крови через трофобласты в эмбриональный кровоток. В то время как питательные вещества попадают в кровоток эмбриона, продукты жизнедеятельности диффундируют из кровеносных сосудов эмбриона в трофобласты и, наконец, в материнскую кровь, которая уносит их от эмбриона.
После того, как система кровообращения эмбриона сформировалась, непрерывное поступление питательных веществ позволяет эмбриону фактически начать увеличиваться в размерах и массе. По мере того, как он растет и расширяется, он отталкивает ворсинки хориона, наиболее удаленные от материнского кровоснабжения, в полость матки. Эти ворсинки, оказавшиеся в полости, со временем дегенерируют, и кровоснабжение матери также прекращается из этих областей.Это оставляет функционирующие ворсинки хориона и материнскую кровь только на одной стороне эмбриона. Эта составная структура эмбриональных и материнских тканей, которая поставляет питательные вещества развивающемуся эмбриону, называется плацентой .
Итоги урока
Давайте рассмотрим. В то время как ранний эмбрион млекопитающих развивается по фаллопиевым трубам, он все еще окружен пеллюцидной зоной , которая представляет собой слой внеклеточного матрикса, окружающий зрелый ооцит, оплодотворенную зиготу и предимплантационную бластоцисту.Пеллюцидная зона окружает развивающийся эмбрион на протяжении всего его пути через маточную трубу и предотвращает преждевременное прикрепление эмбриона к стенке маточной трубы.
Как только бластоциста достигает матки, она использует фермент, переваривающий белок, или протеазу , чтобы проделать отверстие в окружающей блестящей оболочке. Затем он протискивается через отверстие, чтобы вылупиться из блестящей оболочки. Белки на внешней поверхности бластоцисты связываются с внеклеточным матриксом стенки матки и позволяют бластоцисте прикрепиться.Прикрепившись, бластоциста секретирует ряд различных протеаз, которые переваривают внеклеточный матрикс матки и позволяют бластоцистам проникать в стенку матки. Этот процесс, при котором бластоциста связывается со стенкой матки, а затем зарывается в нее, известен как имплантация .
По мере того, как бластоцисты имплантируются, трофобласты, составляющие внешний слой клеток, увеличиваются в количестве и проникают глубже в стенку матки. При этом они сталкиваются и окружают материнские кровеносные сосуды, которые уже существуют в материнской ткани матки.Эти материнские кровеносные сосуды затем сливаются с промежутками между трофобластами, образуя сеть синусов, заполненных материнской кровью.
В конце концов, наполненные кровью синусы расширяются, и трофобласты образуют пальцевидные структуры, называемые ворсинками хориона . Эти пальцеобразные структуры плаценты, состоящие из трофобластов эмбриона, окружаются материнской кровью в том, что сейчас называется межворсинчатым пространством. Эмбриональные кровеносные сосуды прорастают в ворсинки хориона, очень близко к межворсинчатому пространству, что позволяет питательным веществам диффундировать из материнской крови через трофобласты в эмбриональный кровоток.Эта составная структура эмбриональных и материнских тканей, которая поставляет питательные вещества развивающемуся эмбриону, называется плацентой . Именно плацента снабжает развивающийся эмбрион питательными веществами и позволяет ему расти в размерах.
Результаты обучения
После просмотра этого урока вы должны уметь:
- Определить различные области, в которые попадает эмбрион млекопитающего после оплодотворения
- Объясните, как происходит имплантация
- Понять важность плаценты
