Цитологическое исследование молочной железы: Цитологическое исследование пунктатов молочной железы
Цитология молочной железы, пунктат молочной железы в лаборатории
Показанием к цитологическому исследованию служат узловые образования в молочной железе, наличие выделений из соска, эрозивных или язвенных поверхностей. Выявление узловых образований возможно при пальпации, ультразвуковом исследовании, маммографии.
Особенно важно выполнять пункцию узловых образований молочной железы, в т. ч. непальпируемых, при наличии факторов риска рака, к которым относится: возраст (женщины старше 40 лет), нарушение гормонального баланса, раннее начало менструаций (раньше 12 лет) и позднее окончание (позже 50 лет), отсутствие родов и кормления ребенка, избыточная жировая клетчатка, особенно при быстром наборе веса, в сочетании с гиперплазией эпителия протоков, генетические особенности – наиболее часто предрасположенность к раку молочной железы и яичников передается по материнской линии (ген BRCA1), нарушение менструального цикла вследствие длительного лечения гормонами, особенно эстрогенами, наличия гормонально активных опухолей яичника и эндометрия, гормональная контрацепция при неправильном применении и гормональная заместительная терапии в климактерическом периоде, рентгеновское облучение.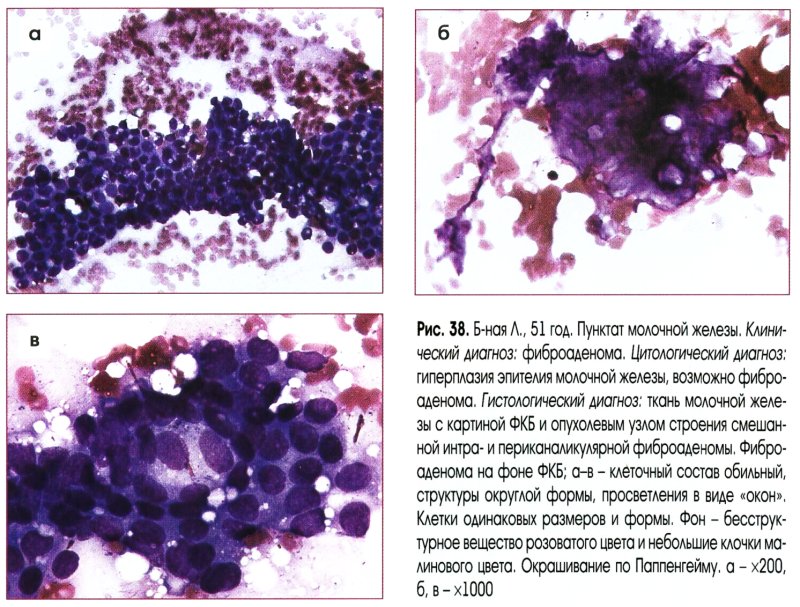
Получение материала
Материал получают с помощью диагностической пункции – тонкоигольной аспирационной биопсии (ТАБ), отпечатков с трепанобиоптата (core biopsy) или эрозивных поверхностей, при наличии выделений из соска – сцеживания отделяемого. Возможна также интраоперационная диагностика по соскобу с ткани (или опухоли) молочной железы, удаленной во время операции.
Если предполагается использовать метод жидкостной цитологии и/или дополнительные молекулярные исследования – после ТАБ и приготовления стандартного мазка для получения клеточной суспензии иглу промывают в небольшом количестве стабилизирующего раствора, предназначенного для соответствующего исследования, в контейнере (или пробирке типа Эппендорф).
Приготовление препаратов
При получении небольшого количества жидкости (из кист, выделений из соска), препараты готовят как мазки крови: каплю выделений помещают на стекло, каплю из иглы выдувают, и с помощью специального стекла с шлифованным краем или пластикового шпателя для приготовления мазков крови делают препарат. Капля следует (тянется) за стеклом (шпателем) до образования на крае препарата “щеточки”, которой заканчивается мазок.
Капля следует (тянется) за стеклом (шпателем) до образования на крае препарата “щеточки”, которой заканчивается мазок.
При наличии объемных жидкостных образований весь полученный материал помещают в пробирку и доставляют в лабораторию. При получении жидкости она должна быть полностью эвакуирована; в этом случае пункция молочной железы может быть и диагностической и лечебной процедурой. Наличие прозрачной жидкости чаще всего свидетельствует о доброкачественном процессе (кистозной полости). Мутная или кровянистая жидкость является достаточно серьезным основанием к поиску признаков опухолевого процесса. Любая полученная жидкость должна быть исследована цитологическим методом.
Жидкий материал или клеточная суспензия в контейнере (жидкостная цитология) подлежат дальнейшей обработке в лаборатории. Можно готовить “традиционные” мазки из жидкостей после их центрифугирования или стандартные тонкослойные препараты методом жидкостной цитологии. Если клеточная суспензия богата материалом, а также содержит небольшие клочки ткани, возможно приготовление из нее клеточных блоков (цитоблоки, вариант гистологического исследования).
Окрашивание можно проводить любым методом. При необходимости выполняют молекулярное исследование (проточная цитометрия, иммуноцитохимическое, молекулярно-генетическое исследования и др.).
Трактовка цитологического заключения
Цитологическое заключение о гиперплазии эпителия молочной железы (с предположительным или уверенным заключением о кисте, фиброзно-кистозной болезни или фиброаденоме) позволяет клиницисту планировать лечебную тактику.
При уверенном заключении о злокачественном процессе, установленном квалифицированными специалистами, цитологический диагноз может служить основанием для планирования лечения. При необходимости цитологический диагноз дополняется молекулярными исследованиями.
Если врач-цитолог не может судить о патологическом процессе вследствие недостаточного количества материала, некротических изменений и других причин, желательно повторить ТАБ с более тщательным выбором участка для пункции, нескольких пассов иглой в разных направлениях.
При цитологическом диагнозе дисплазии, тяжелой дисплазии, гиперплазии с атипией (или гиперплазии с атипией отдельных клеток), а также при предположительном цитологическом заключении о злокачественном процессе при небольшом количестве клеточного материала, возможно уточнение диагноза с помощью повторной пункции тонкой иглой или гистологического исследования (трепанобиопсия или секторальная резекция со срочным гистологическим исследованием).
Интеграция различных лабораторных методов
Определение рецепторов эстрогенов и прогестерона, рецепторов HER2/neu в пунктатах молочной железы – исследования, которые при раке молочной железы должны быть выполнены у каждой больной для определения лечебной тактики.
Опухоли с наличием рецепторов к эстрогенам отличаются хорошим прогнозом, ответом на гормональную терапию. Опухоли с положительной реакцией на HER2/neu и отрицательной на рецепторы эстрогенов отличаются плохим прогнозом и низкой продолжительностью жизни, однако возможен хороший ответ на таргетную терапию трастузумабом. Рак с базальноклеточным фенотипом и отрицательной реакцией на рецепторы эстрогенов характеризуется плохим прогнозом, низкой продолжительностью жизни и отсутствием ответа на терапию.
Рак с базальноклеточным фенотипом и отрицательной реакцией на рецепторы эстрогенов характеризуется плохим прогнозом, низкой продолжительностью жизни и отсутствием ответа на терапию.
Цитологический метод в диагностике опухолей и опухолеподобных процессов
Цитопатология, клиническая или диагностическая цитология, изучает клеточный состав патологических процессов. В качестве отдельной медицинской специальности официально признана в 1941 г. после работ Папаниколау Г. и Траута Н. К чести нашей страны разработка цитологического метода диагностики начата в 1938 г. в клинико-диагностической лаборатории Московского научно-исследовательского онкологического института им. П.А. Герцена. В 1941 г. профессор Н.Н. Шиллер-Волкова на сессии института доложила о первых результатах по исследованию выделений из влагалища, мокроты и пунктатов. В развитии цитологии можно выделить три основных этапа: эксфолиативная, в основном гинекологическая цитопатология; аспирационная цитология, бурный расцвет которой начинается с 80-х годов и связан с внедрением ультразвуковой диагностики, и современный этап развития определяется применением иммуноцитохимических и молекулярных методов исследования, а также автоматизированного скрининга в гинекологической цитологии.
Цитологический метод технически прост, быстр, сравнительно дешев, малотравматичен. Однако «легкость» цитологического метода обманчива, так как цитологическое исследование должно заканчиваться формулировкой заключения, основываясь на котором разрабатывается тактика лечения.
По способу получения материала цитологию можно подразделить на дооперационную (эксфолиативную, абразивную, аспирационную) и интраоперационную. Эксфолиативная цитология включает в себя исследование вагинальных мазков, мокроты, мочи, плевральной, перитонеальной, перикардиальной, цереброспинальной, синовиальной жидкости и т.д. Этот раздел цитологии отличается простотой техники получения большого количества различного типа клеток, в том числе воспалительного ряда. Клеточный материал может быть не очень хорошо сохранен. Для получения информативного материала с поверхности патологического очага удаляют гноевидные массы, корочки, некротический налет. Если полученный материал представляет жидкость, то в нее добавляется цитрат натрия, чтобы жидкость не свернулась.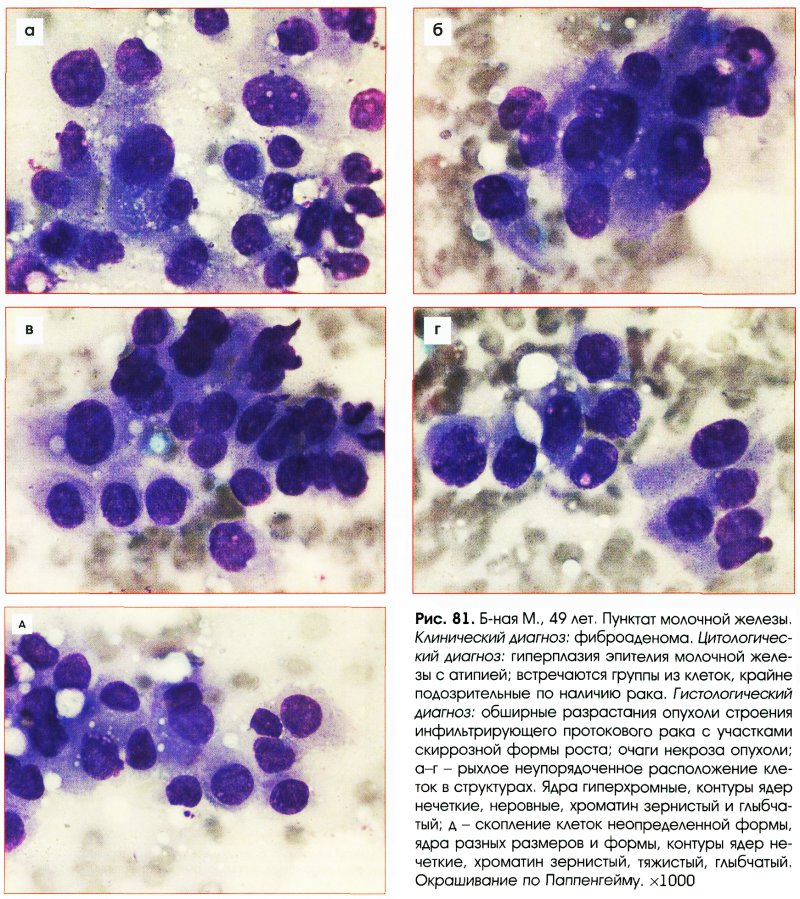
Абразивная цитология получает материал из определенного участка внутренних органов, в том числе исследуются субэпителиальные поражения с помощью фиброоптических инструментов. При таком взятии материала клетки хорошо сохраняются, и препараты легко интерпретировать. Материал получают из шейки матки, вагины, эндометрия, респираторного, желудочно-кишечного, мочеполового тракта.
Тонкоигольная биопсия в настоящее время позволяет получить материал практически из любого органа. Метод постоянно совершенствуется и дает оптимальные результаты, что делает его в плане диагностики высокоэффективным и экономичным.
Взятый для цитологического исследования материал помещают на край предметного стекла и другим предметным или покровным стеклом равномерно, сильно не надавливая, тонким слоем распределяют по всей поверхности препарата.
В последние годы помимо рутинных цитологических мазков для получения качественных монослойных цитологических препаратов используется жидкостная система: пунктаты вносятся в специальную среду накопления, после чего центрифугируются в режиме 1000 оборотов в течение 5 минут при среднем ускорении на центрифуге (Суtospin-3, Суtospin-4). Применение методики жидкостной цитологии имеет ряд преимуществ: обеспечивает сохранность клеточных структур, уменьшает фон, клетки сосредотачиваются в одном месте – «окошке», что сокращает время просмотра препарата и значительно экономит дорогие сыворотки при проведении иммуноцитохимического исследова-
Применение методики жидкостной цитологии имеет ряд преимуществ: обеспечивает сохранность клеточных структур, уменьшает фон, клетки сосредотачиваются в одном месте – «окошке», что сокращает время просмотра препарата и значительно экономит дорогие сыворотки при проведении иммуноцитохимического исследова-
Влажная фиксация препарата в спирте сразу после взятия мазков применяется при окраске по Папаниколау. В остальных случаях мазки высушивают на воздухе, а затем фиксируют уже в лаборатории. Наиболее распространенный способ фиксации – в равных объемах спирта и эфира (смесь Никифорова). Для иммуноцитохимического исследования применяют фиксацию ацетоном. При окраске мазков используют панхромную окраску азур-эозином по методу Романовского – Гимза в различных модификациях (Лейшмана, Паппенгейма), а также окраска гематоксилином и эозином, особенно при исследовании гинекологического материала используется окраска по Папаниколау.
Цитологическая диагностика основана на следующих принципах:
- Разница клеточного состава в норме и патологии.
- Оценка не одной отдельно взятой клетки, а совокупности клеток, большое значение придается фону препарата.
- Цитолог должен иметь патологоанатомический базис.
- Каждое исследование завершается формулировкой заключения.
Критерии цитологической диагностики злокачественных новообразований составляются из оценки клетки, ядра и ядрышка.
Клетка:
– увеличена в размере, иногда гигантская, редко размер близок к норме, что затрудняет цитологическую диагностику, например, при коллоидном, тубулярном раке, маститоподобном варианте долькового рака молочной железы, фолликулярном раке щитовидной железы, карциноиде, почечноклеточном светлоклеточном раке, высокодифференцированных веретеноклеточных саркомах;
– изменение формы и полиморфизм клеточных элементов;
– нарушение соотношения ядра и цитоплазмы в сторону увеличения доли ядра;
– диссоциация степени зрелости ядра и цитоплазмы, например, молодое ядро в ороговевшей цитоплазме при высокодифференцированном плоскоклеточном раке.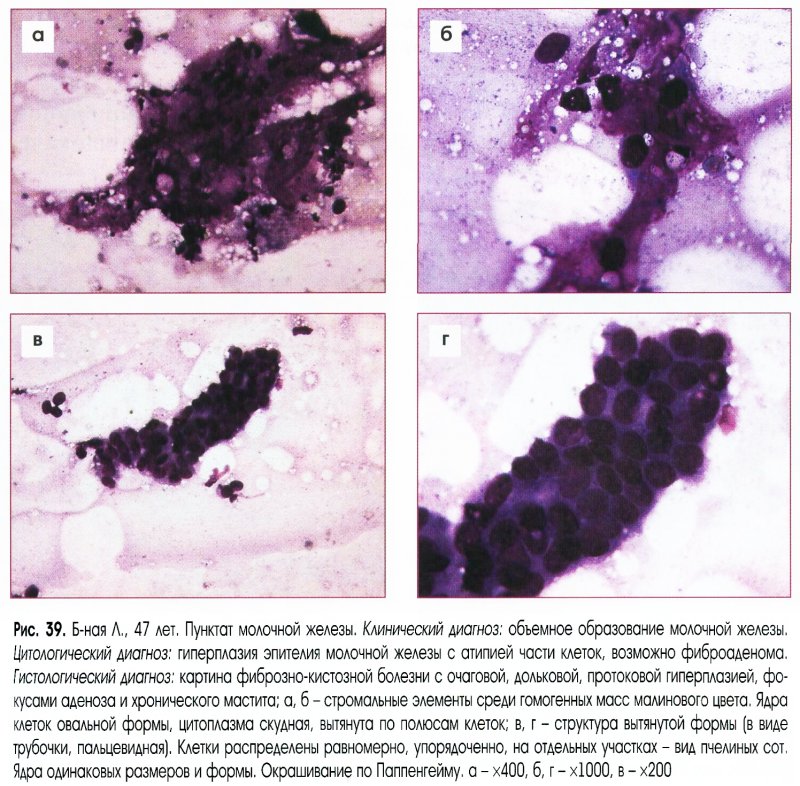
Ядро:
– увеличение размера, полиморфизм, бугристость, неравномерный рисунок хроматина, наиболее постоянный признак – неровность контуров, гиперхромия, фигуры клеточного деления в цитологических препаратах сравнительно редки.
Ядрышко:
– число ядрышек больше, чем в нормальной клетке, ядрышки увеличены в размере, неправильной формы.
Несмотря на присутствие критериев злокачественности у подавляющего большинства клеток, в некоторых клетках рака эти критерии могут отсутствовать или быть выражены в неполном объеме. Необходимо обращать внимание на особенности взаимного расположения клеток, характер межклеточных связей. Заключение формулируют по совокупности признаков при достаточном количестве клеточного материала. Попытка оценить мазок по неадекватно взятому материалу – наиболее частая причина ошибочных заключений.
Основные задачи цитологической диагностики состоят в следующем:
- Формулировка заключения до лечения.

- Интраоперационная срочная диагностика.
- Контроль эффективности лечения.
- Оценка важнейших факторов прогноза течения заболевания.
Цитологическое заключение до лечения включает:
- определение гистогенеза новообразований;
- установление степени дифференцировки опухолевого процесса;
- уточнение степени распространенности опухоли;
- изучение фоновых изменений;
- определение некоторых факторов прогноза;
- возможность исследования бактериальной флоры.
Современное цитологическое заключение не только констатирует наличие рака, но и указывает гистологический тип опухоли и степень дифференцировки согласно общепринятым международным классификациям (МКБ-О и ВОЗ).
Критериями достоверности цитологического метода являются результаты сопоставления с плановым гистологическим исследованием. Наибольший процент совпадений цитологического заключения с окончательным гистологическим заключением наблюдается при исследовании образований кожи, молочной, щитовидной железы, при метастатическом поражении лимфатических узлов.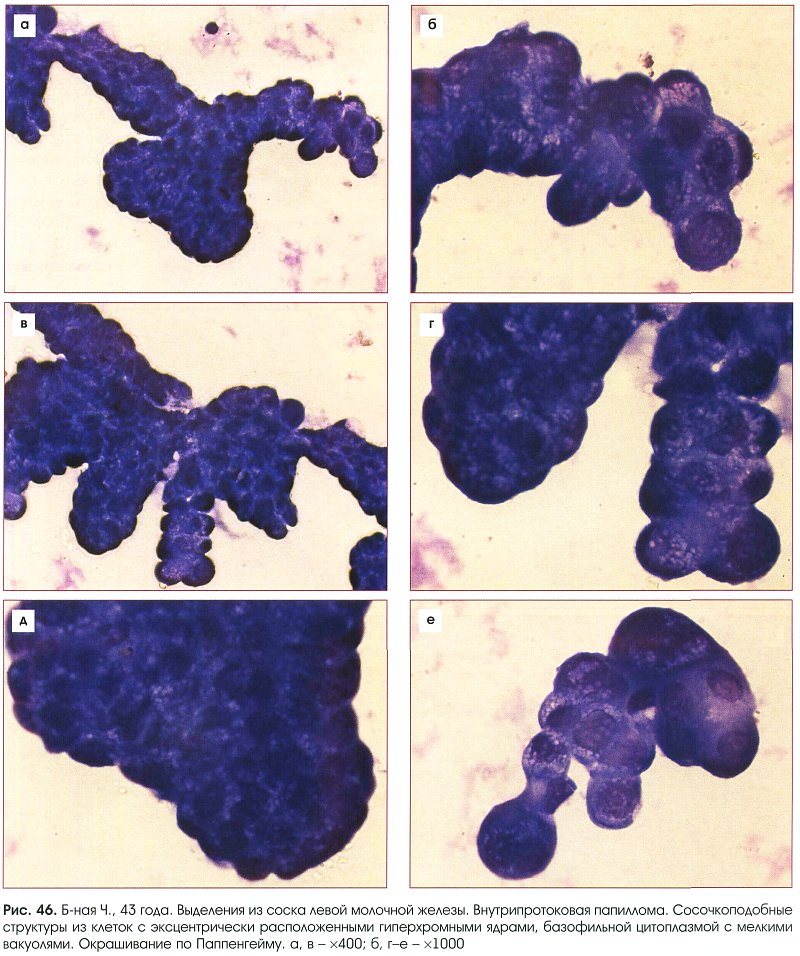 Результаты исследования гиперпластических процессов в эндометрии неудовлетворительны (достоверность 30–50%) и заставляют искать пути совершенствования диагностики. Достоверность цитологической диагностики патологии шейки матки составляет 75–90%. 3–24% исследований, в зависимости от локализации и способа получения материала, оказываются неудачными из-за неадекватно полученного, неинформативного материала.
Результаты исследования гиперпластических процессов в эндометрии неудовлетворительны (достоверность 30–50%) и заставляют искать пути совершенствования диагностики. Достоверность цитологической диагностики патологии шейки матки составляет 75–90%. 3–24% исследований, в зависимости от локализации и способа получения материала, оказываются неудачными из-за неадекватно полученного, неинформативного материала.
Таблица 1. Достоверность цитологических исследований
опухолей различных локализаций.
| Локализация | % совпадения цитологического и гистологического диагноза | % совпадения по данным литературы | % неудавшихся пункций |
|---|---|---|---|
| Легкое | 95,5-97 | 79-98 | 2,9-3,0 |
| Молочная железа | 95,8-97,4 | 90-96 | 2,6-8,3 |
| Лимфатические узлы | 98,4-98,7 | 90 | 1,6-10,7 |
| Кожа | 91,2-92,7 | 90-98 | 2,4-12,5 |
| Мягкие ткани (без указания гистологического типа опухоли) |
90,2-93,8 | 65-93,4 | 5-12,3 |
| Желудочно-кишечный тракт | 92,3-97,5 | 73-93,6 | 2,5-4,4 |
| Щитовидная железа | 85,5-93,2 | 57-94 | 1,6-4,2 |
| Шейка матки | 89,5-93,2 | 65-90 | 3,5-4,5 |
| Эндометрий | 78,9-84,8 | 30-90 | 3,8-15,4 |
| Почка | 86,2-89,3 | 76,4-91,3 | 7,1-11,5 |
| Экссудаты | 95,7-100 | – | 1,2-2,7 |
Уверенное цитологическое заключение о наличии злокачественного новообразования, совпадающее с клиническими симптомами и данными других диагностических исследований, расценивается как морфологическое подтверждение диагноза злокачественной опухоли.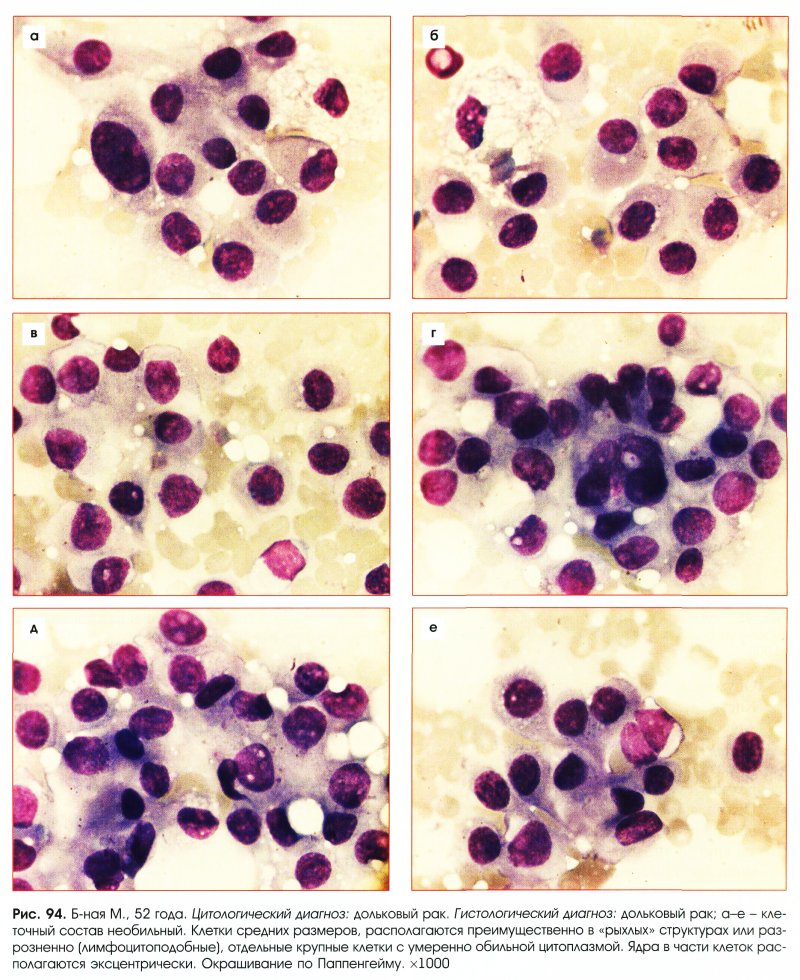 Это предъявляет к цитологическому методу высокие требования и заставляет искать пути предупреждения возможных ошибок. По характеру ошибки цитологов можно разделить на две большие группы: ложноотрицательные и ложноположительные. Ложноотрицательные заключения преобладают и приводят к гиподиагностике опухолевого процесса, чаще всего из-за небольшого количества информативного материала в пунктате. Имеются и объективные трудности в оценке изменений, связанные чаще с высокой дифференцировкой опухоли, например, практически невозможно диагностировать фолликулярный рак щитовидной железы с минимальной инвазией, трудно диагностируется тубулярный, маститоподобная форма долькового рака молочной железы.
Это предъявляет к цитологическому методу высокие требования и заставляет искать пути предупреждения возможных ошибок. По характеру ошибки цитологов можно разделить на две большие группы: ложноотрицательные и ложноположительные. Ложноотрицательные заключения преобладают и приводят к гиподиагностике опухолевого процесса, чаще всего из-за небольшого количества информативного материала в пунктате. Имеются и объективные трудности в оценке изменений, связанные чаще с высокой дифференцировкой опухоли, например, практически невозможно диагностировать фолликулярный рак щитовидной железы с минимальной инвазией, трудно диагностируется тубулярный, маститоподобная форма долькового рака молочной железы.
Гипердиагностика опухолей на нашем материале многие годы не превышает 1%, однако может служить причиной ненужного, а иногда и калечащего лечения. Истинная гипердиагностика, то есть ложное цитологическое заключение о наличии опухоли, объясняется несколькими наиболее типичными причинами.
Выраженная пролиферация клеточных элементов является наиболее частой причиной гипердиагностики рака. Например, пролиферация эпителия протоков и долек молочной железы при фиброаденоме и пролиферирующем аденозе, особенно при укрупнении ядер, наиболее часто приводит к гипердиагностике рака молочной железы. Правильной диагностике помогает анализ ядерных характеристик клеток опухоли: наличие ровных контуров ядра и равномерное распределение хроматина.
Реактивные изменения эпителия служат также нередкой причиной неадекватной цитологической диагностики. Наиболее тяжелые ошибки встречаются при ангиомиолипоме почки, при которой реактивные изменения почечного эпителия с укрупнением и полиморфизмом ядер приводят к ошибочному диагнозу высокодифференцированного почечноклеточного светлоклеточного рака. Диагностике ангиомиолипомы помогает обнаружение сосудистых структур и веретенообразных клеток, экспрессирующих виментин, десмин, НМВ-45.
Хронический аутоиммунный тиреоидит типа Хашимото сопровождается образованием сосочковоподобных структур, к оценке которых необходимо подходить осторожно и помнить, что при этом процессе реактивные изменения эпителия можно ошибочно принять за папиллярный рак щитовидной железы.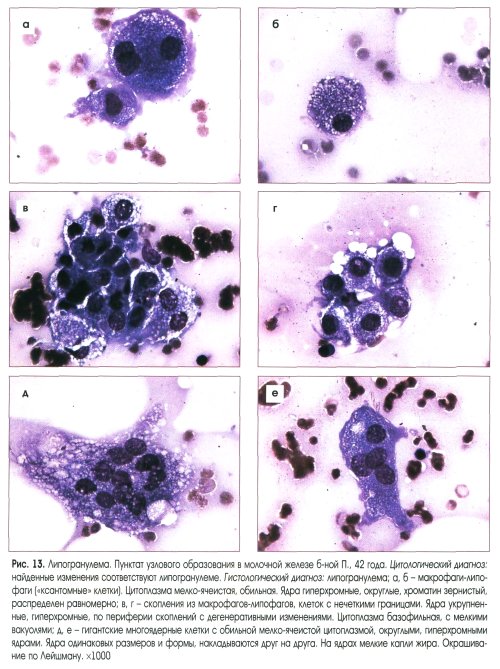 Для хронических дерматитов, язв характерны атипические реактивные разрастания многослойного плоского эпителия, нередко представляющие непреодолимые трудности в дифференциальной диагностике с высокодифференцированным плоскоклеточным раком.
Выраженные дистрофические изменения клеток являются также одной из причин ошибочной цитологической диагностики. Например, выраженная жировая дистрофия гепатоцитов может привести к гипердиагностике метастаза почечноклеточного светлоклеточного рака, особенно при уже состоявшемся диагнозе рака почки.
Для хронических дерматитов, язв характерны атипические реактивные разрастания многослойного плоского эпителия, нередко представляющие непреодолимые трудности в дифференциальной диагностике с высокодифференцированным плоскоклеточным раком.
Выраженные дистрофические изменения клеток являются также одной из причин ошибочной цитологической диагностики. Например, выраженная жировая дистрофия гепатоцитов может привести к гипердиагностике метастаза почечноклеточного светлоклеточного рака, особенно при уже состоявшемся диагнозе рака почки.
Большую проблему цитологии представляет дифференциальная диагностика различных степеней диспластических изменений эпителия и внутриэпителиального рака. Присутствие при тяжелой дисплазии полиморфных крупных клеток с большими неправильно округлыми ядрами, иногда с увеличенными ядрышками, двуядерных клеток с тяжистым рисунком хроматина может быть неверно расценено как рак. При диспластических изменениях плоского эпителия необходимо учесть, что большинство клеток сходны с клетками глубоких слоев, крупные атипические клетки находятся в тесной связи с клетками без признаков атипии, имеются клетки стромы. Для объективизации дифференциальной диагностики различных степеней дисплазии и внутриэпителиального рака желательно проведение морфометрии клеток и ядер, что позволяет значительно снизить процент ошибочных заключений.
Для объективизации дифференциальной диагностики различных степеней дисплазии и внутриэпителиального рака желательно проведение морфометрии клеток и ядер, что позволяет значительно снизить процент ошибочных заключений.
Нередко причиной гипердиагностики метастатического поражения в лимфатических узлах являются комплексы клеток укрупненного эндотелия и гистиоцитов, образующих эпителиоподобные структуры, а также наличие макрофагов с содержанием бурого пигмента. При затруднениях диагностики помогает иммуноцитохимическое исследование с небольшим набором антител (VIII фактор, цитокератины, ЭМА, НМВ-45), позволяющее подтвердить или отвергнуть наличие метастазов рака или меланомы.
Во избежание ошибок морфологической диагностики большое значение имеет четкое указание на характер проведенного лечения. Например, прием довольно распространенного антибиотика тетрациклина приводит к накоплению в клетках щитовидной железы бурого пигмента и ошибочному диагнозу метастаза меланомы. Прием мерказолила при зобе сопровождается резким полиморфизмом фолликулярного эпителия, что служит причиной цитологической и даже гистологической гипердиагностики фолликулярного рака. Проведение лучевой терапии вызывает выраженные изменения не только опухолевых клеток, но и нормального эпителия: укрупнение, полиморфизм клеток, патологическое ороговение, что является причиной гипердиагностики рака.
Прием мерказолила при зобе сопровождается резким полиморфизмом фолликулярного эпителия, что служит причиной цитологической и даже гистологической гипердиагностики фолликулярного рака. Проведение лучевой терапии вызывает выраженные изменения не только опухолевых клеток, но и нормального эпителия: укрупнение, полиморфизм клеток, патологическое ороговение, что является причиной гипердиагностики рака.
Имеются и объективные диагностические проблемы, например, в дифференциальной диагностике между эндометриоидной высокодифференцированной аденокарциномой и атипической гиперплазией эндометрия, себоррейной (базальноклеточной) кератомой и базально-клеточным раком, инфекционным мононуклеозом и болезнью Ходжкина, где достаточно высокий процент ошибочных заключений и требуется дальнейшая разработка цитологических критериев диагностики.
Знание клинической картины, характера проведенного лечения, применение современных методик морфологической диагностики с использованием иммуноцитохимии и морфометрии способствует сведению случаев гипердиагностики к нулю.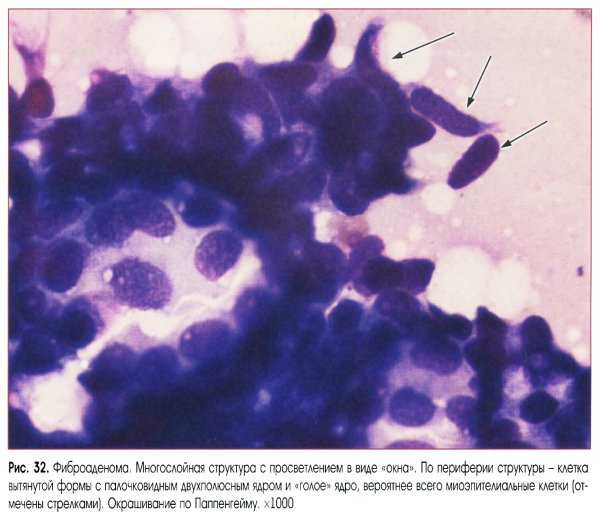
Вместе с истинной цитологической гипердиагностикой существует ложная гипердиагностика, когда цитолог дает уверенное заключение о злокачественном процессе, а при гистологическом исследовании опухоли не обнаруживается, то есть фактически имеет место гистологическая гиподиагностика. Пересмотр цитологических препаратов несколькими высококвалифицированными специалистами, повторное взятие биопсии, клиническое течение заболевания в дальнейшем подтверждают результаты цитологического исследования. Больше всего ложной цитологической гипердиагностики относится к исследованию биопсийного материала из бронхов и гортани, а также при исследовании лимфатическиих узлов, когда при цитологическом исследовании выявлялись единичные комплексы анаплазированных клеток, несомненно принадлежащих раку. При приготовлении гистологических препаратов эти комплексы теряются в готовых гистологических препаратах. Реальная потеря немногочисленных опухолевых клеток при приготовлении гистологических препаратов не допускает игнорирования клиницистом данных цитологического исследования и приводит к «золотому» стандарту – совместному цитологическому и гистологическому исследованию биоптата.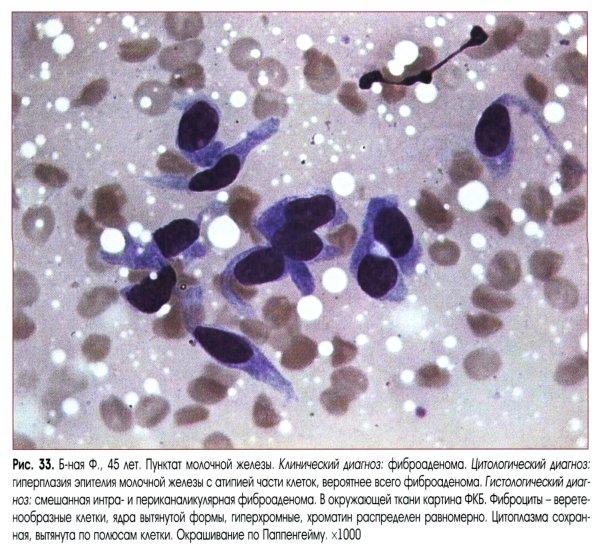
Интраоперационная цитологическая диагностика – одно из основных направлений цитологического метода исследования. Во время операции, используя цитологический метод, уточняется характер патологического процесса, степень распространенности с выявлением метастазов в лимфатические узлы, печень и другие органы, производится контроль радикальности выполненной операции с исследованием краев резекции. Роль цитологии возрастает при разработке показаний к расширенным лимфоаденэктомиям и при определении так называемых «сторожевых», или «сигнальных», лимфатических узлов, которых может быть шесть, и применение гистологического метода невозможно из-за длительности исследования. По данным ведущих клиник, ошибка срочного гистологического исследования «сторожевых» лимфатических узлов составляет 25%, поэтому они рекомендуют использовать интраоперационное цитологическое исследование отпечатков с поверхности разрезанного лимфатического узла. По нашим данным, достоверность срочного цитологического исследования по выявлению метастатического поражения лимфатических узлов составляет 97-99%.
Надо отметить, что к срочному морфологическому исследованию могут быть противопоказания. Срочное интраоперационное морфологическое исследование не рекомендуется выполнять при подозрении на внутриэпителиальный рак с ограниченным очагом поражения из-за того, что не останется материала для планового гистологического исследования. Цитологические критерии внутриэпителиального рака только разрабатываются, и цитолог может дать заключение о раке, не указывая, что это Carcinoma in situ. При внутрипротоковых папилломах небольшого размера срочное гистологическое исследование лучше не выполнять, а цитологическое исследование достоверно поможет установить характер процесса.
При срочной морфологической диагностике существенно помогает макроскопическое исследование операционного материала. Опытный морфолог при визуальном исследовании уже может поставить диагноз, но для подтверждения диагноза необходимо микроскопическое исследование. Например, опухолевый узел классической звездчатой формы может быть при трех совершенно разных процессах: при раке, склерозирующем аденозе с центром Семба и липогранулеме. И только микроскопическое исследование позволяет правильно поставить диагноз.
И только микроскопическое исследование позволяет правильно поставить диагноз.
Цитологический метод позволяет в динамике, не травмируя пациента, изучать лечебный патоморфоз при химиолучевой и фотодинамической терапии.
XX столетие названо в медицинских кругах веком цитопатологии. Оценивая возможности цитологического метода, можно сказать, что есть еще возможности его развития в комбинации с другими дисциплинами и методами.
Иммуноцитохимическое исследование нередко является решающим в дифференциальной диагностике новообразований, когда при рутинном исследовании возникают непреодолимые трудности для установления гистогенеза отдельных опухолей, определения источника метастазирования, трактовки первично-множественных поражений.
За последние годы достигнут огромный прогресс в клиническом использовании различных биологических маркеров. В отличие от сывороточных маркеров, клеточные маркеры определяются непосредственно в опухолевых клетках ИЦХ исследованием, в основе которого лежит реакция антиген-антитело. В их числе онкогены, рецепторы эстрогенов и прогестерона, молекулы, опосредующие апоптоз, рецепторы факторов роста и т. д. Все эти показатели позволяют более детально изучить молекулярно-биологические особенности опухолевых клеток, ассоциированные со степенью дифференцировки, способностью к инвазии и метастазированию, чувствительностью к химиотерапии, и, следовательно, с особенностями течения и прогнозом заболевания в каждом конкретном случае.
В их числе онкогены, рецепторы эстрогенов и прогестерона, молекулы, опосредующие апоптоз, рецепторы факторов роста и т. д. Все эти показатели позволяют более детально изучить молекулярно-биологические особенности опухолевых клеток, ассоциированные со степенью дифференцировки, способностью к инвазии и метастазированию, чувствительностью к химиотерапии, и, следовательно, с особенностями течения и прогнозом заболевания в каждом конкретном случае.
Специфических маркеров дифференциальной диагностики злокачественных и доброкачественных опухолевых процессов не существует, но на сегодняшний день активно ведутся научные изыскания в решении этой проблемы. Так, равномерное окрашивание герминативных центров лимфоидных фолликулов с использованием антител bcl-2 указывает на фолликулярную лимфосаркому, в то время как негативная реакция свидетельствует о доброкачественном гиперпластическом процессе; реакция с антителами HBME-1 при ИЦХ исследовании опухолей щитовидной железы часто положительная в злокачественных новообразованиях и практически отсутствует при доброкачественных, в дифференциальной диагностике широко применяют галектин-3, экспрессирующийся карциномами щитовидной железы из А-клеток (папиллярный, фолликулярный) с отсутствием экспрессии в фолликулярных аденомах, зобах и нормальной ткани щитовидной железы.
Для установления гистогенеза и дифференциальной диагностики опухолей разработаны и постоянно совершенствуются, схемы C.R.Taylor и R.J. Cote (1994 г.). Разнообразие моноклональных антител, используемых в иммуноцитохимических исследованиях тонкоигольных пунктатов, в каждом конкретном случае позволяет ответить на вопрос, имеет ли данная опухоль эпителиальное происхождение или является саркомой, меланомой, лимфомой. Иммуноцитохимия широко применяется для иммунофенотипирования злокачественных лимфом, без чего, по современным канонам, невозможно начать лечение.
Иммуноцитохимическое исследование помогает в определении источника метастазирования при невыявленном первичном очаге. К сожалению, органоспецифических маркеров не так уж и много. К их числу могут быть отнесены специфический антиген предстательной железы (ПСA), позволяющий идентифицировать метастазы рака простаты более чем в 95% случаев; тиреоглобулин, экспрессирующийся в 92–98% фолликулярного и папиллярного рака щитовидной железы, и кальцитонин, экпрессирующийся в 80% медуллярных раков щитовидной железы В некоторых случаях рак щитовидной железы может экспрессировать и кальцитонин, и тиреоглобулин, что только с помощью иммуноферментной диагностики позволяет диагностировать диморфные А-С-клеточные раки.
Одним из первых показателей, вошедших в практику лечения больных раком молочной железы (РМЖ), и относящихся к категории клеточных маркеров, были рецепторы стероидных гормонов. Рецепторы стероидных гормонов – это белки, специфически и избирательно связывающие соответствующие стероиды после их проникновения в клетку.
По данным ВОЗ (2003 г.), экспрессия рецепторов эстрогенов (РЭ+) и прогестерона (РП+) в инвазивных протоковых раках составляет 70-80%; инвазивный дольковый рак в 70-95% экспрессирует РЭ, в 60-70% -РП, 100% экспрессия РЭ отмечена в инвазивном криброзном, муцинозных опухолях молочной железы. Эдокринная терапия наиболее эффективна у больных с первичными опухолями с высоким уровнем рецепторов стероидов. При метастатических поражениях степень реакции на эндокринную терапию также зависит от наличия РЭ и РП в опухоли: её эффективность составляет около 10–15% при гормонотрицательных опухолях, 27% при опухоли с РЭ+ и РП-, 46% при статусе РЭ- и РП+ и 75% при опухолях, содержащих РЭ+ и РП+. Рецепторположительные опухоли молочной железы имеют более высокую дифференцировку и более благоприятный прогноз.
Рецепторположительные опухоли молочной железы имеют более высокую дифференцировку и более благоприятный прогноз.
Необходимо отметить, что рецепторы гормонов в доброкачественных образованиях молочной железы еще мало изучены. Отмечено повышение числа РЭ+ клеток в нормальной ткани молочной железы с увеличением возраста, а также при склерозирующем аденозе, папилломах, фиброаденомах и листовидных опухолях. Коэкспрессия РЭ+/Ki-67+ с разной степенью выраженности и соотношения большей частью выявлялась в патологии, связанной с риском развития РМЖ.
Рецепторы эстрогенов экспрессируются в клетках рака эндометрия, яичников, шейки матки, щитовидной железы, кишечника, нейроэндокринных опухолей, в том числе карциноидов.
Иммуноцитохимическое исследование позволяет на дооперационном этапе установить важнейшие факторы прогноза опухолевого процесса и скоррегировать схемы лечения. Пролиферативная активность многих новообразований оценивается с помощью антител Ki-67 в злокачественных лимфомах, опухолях молочной, предстательной, поджелудочной железы, легких, гипофиза, толстой кишки. Обнаружена связь между значениями индекса пролиферации и степенью гистологической дифференцировки опухоли и клиническим прогнозом при раке эндометрия, яичников, легкого, молочной железы, мочевого пузыря, лимфомах, опухолях нервной системы.
Обнаружена связь между значениями индекса пролиферации и степенью гистологической дифференцировки опухоли и клиническим прогнозом при раке эндометрия, яичников, легкого, молочной железы, мочевого пузыря, лимфомах, опухолях нервной системы.
Гиперэкспрессия онкопротеина C-erbB-2(HER2/neu), являющегося рецептором эпидермального фактора роста 2-го типа, придающего клеткам свойство неограниченного деления, служит фактором риска рецидива заболевания для ряда опухолей: рака молочной железы, толстой кишки, лёгкого и др. Экспрессия онкобелка C-erbB-2 при ИГХ исследовании обнаруживается в 15–40% РМЖ. Выявление онкопротеина C-erbB-2, по мнению некоторых авторов, ассоциируется с высокой степенью злокачественности опухоли, отсутствием РЭ и РП, высокой митотической активностью, устойчивостью к химиотерапии и требует назначение герцептина.
Наличие метастазов в лимфатических узлах при опухолевом поражении является главным дискриминирующим прогностическим признаком. С помощью иммуноцитохимического исследования можно выявить единичные циркулирующие кератин-положительные клетки РМЖ в костном мозге и периферической крови. Применение ИЦХ исследования повышает выявляемость микрометастазов в лимфатических узлах на 3,2–24%.
С помощью иммуноцитохимического исследования можно выявить единичные циркулирующие кератин-положительные клетки РМЖ в костном мозге и периферической крови. Применение ИЦХ исследования повышает выявляемость микрометастазов в лимфатических узлах на 3,2–24%.
Иммуноцитохимические реакции оцениваются как качественно при уточнении гистогенеза опухоли, наличии метастаза в лимфатическом узле или другом органе, иммунофенотипировании лимфом, так и количественно – при оценке пролиферативной активности, экспрессии рецепторов гормонов в опухоли, онкопротеина С-erbB-2 и т.д. Иммуноцитохимическая реакция может быть ядерной, цитоплазменной и мембранной. Ядерная реакция проявляется интенсивным окрашиванием ядра и бывает при определении РЭ и РП, Ki–67, PCNA, p53 и т.д. Цитоплазменная реакция характеризуется диффузным окрашиванием цитоплазмы или отложением гранул в виде грубых пятен и зерен. Цитоплазменное окрашивание дают хромогранин, синаптофизин, белок S-100, виментин, десмин, тиреоглобулин, кальцитонин, цитокератины, bcl-2 и т. д. Оценка этой реакции требует большой осторожности и контроля, так как фоновое окрашивание цитоплазмы клеток может быть принято за истинную реакцию. Мембранное окрашивание наблюдается при проведении реакции с онкопротеином C-erbB-2 и ЭМА (эпителиальным мембранным антигеном). Окрашивание в таких случаях только цитоплазмы не должно учитываться как экспрессия антигена. Маркер крупноклеточной анаплазированной лимфомы CD-30 может экспрессироваться как в цитоплазме, так и на мембране клетки.
д. Оценка этой реакции требует большой осторожности и контроля, так как фоновое окрашивание цитоплазмы клеток может быть принято за истинную реакцию. Мембранное окрашивание наблюдается при проведении реакции с онкопротеином C-erbB-2 и ЭМА (эпителиальным мембранным антигеном). Окрашивание в таких случаях только цитоплазмы не должно учитываться как экспрессия антигена. Маркер крупноклеточной анаплазированной лимфомы CD-30 может экспрессироваться как в цитоплазме, так и на мембране клетки.
Для количественной оценки экспрессии маркера Мс. Carthy и соавторы разработали систему подсчета Histo score (H.S.). Система подсчета включает интенсивность иммуноцитохимической окраски, оцениваемую по 4-балльной шкале, и долю окрашенных клеток и представляет собой сумму произведений процентов, отражающих долю клеток с различной интенсивностью окраски на балл, соответствующий интенсивности реакции. Интенсивность окраски в баллах: 0 – нет окрашивания, 1 – слабое окрашивание, 2 – умеренное окрашивание, 3 – сильное, 4 – очень сильное окрашивание. Формула подсчета:
Формула подсчета:
Histochemical score = ∑ P(i)×i (гистосчет),
где i – интенсивность окрашивания, выраженная в баллах от 0 – 4,
Р(i) – процент клеток, окрашенных с разной интенсивностью.
Максимальное количество Histo score соответственно должно быть 400. Подсчет проводится в трех когортах по 100 опухолевых клеток в различных полях зрения (объектив х 40).
В практической работе допустимо использование полуколичественной оценки. Реакция считается отрицательной при полном отсутствии или экспрессии антигена менее 5%–10% опухолевых клеток, слабоположительной – от 5%–10% до 24% клеток, умеренно положительной – в 25%–75%, выраженной – более чем в 75% клеток. При оценке иммуноферментной реакции принимают во внимание интенсивность и полноту окрашивания цитолеммы клеток в центре опухолевого очага. Так, яркая, мембранная, беспрерывная по контуру клетки реакция обозначает выраженную экспрессию белка С-erbB-2 (+++), что в 95% случаев подтверждается амплификацией гена С-erbB-2, выявляемой с помощью FISH (флуоресцентной гибридизацией in situ).
Сопоставляя данные иммуноцитохимических исследований различных опухолей с целью уточнения гистогенетической принадлежности и результатов послеоперационных морфологических заключений, получены следующие результаты: 89% совпадений при анализе опухолей щитовидной железы, 83% при уточнении гистогенеза первичной опухоли и метастазах в лимфатических узлах, 89% – при опухолях мягких тканей и кожи и 100% – при исследовании биологических жидкостей. При определении гормонального статуса РМЖ процент совпадения ИЦХ и ИГХ исследований составляет 88,3%, при исследовании пролиферативной активности – 83%, при определении онкопротеина C-erbB-2 – 93,2%.
При сравнении возможностей ИЦХ исследования при выполнении пункционной биопсии и ИГХ исследования при трепанобиопсии преимущества ИЦХ, на наш взгляд, несомненны. Пункционная биопсия – более простая процедура, не сопровождается такими осложнениями, как воспаление, кровотечение, и позволяет получить полноценный клеточный материал. При неудачной пункции и попадании в некроз, строму опухоли, окружающие ткани можно практически безболезненно повторить процедуру. Кроме того, отсутствует потеря и маскировка антигенов при проводке и депарафинизации материала с использованием агрессивных химических реагентов.
При неудачной пункции и попадании в некроз, строму опухоли, окружающие ткани можно практически безболезненно повторить процедуру. Кроме того, отсутствует потеря и маскировка антигенов при проводке и депарафинизации материала с использованием агрессивных химических реагентов.
Использование иммуноцитохимического исследования позволяет расширить возможности морфологических методов и на дооперационном этапе уточнить гистогенез, диагностировать первично-множественные поражения, степень распространения и оценить некоторые показатели прогноза и чувствительность опухоли к химиогормонотерапии.
На современном этапе развития в цитологии используются методы молекулярной и генной диагностики: гибридизация in situ, Southern Blotting, Nothern Blooting, Western Blotting, DNK Microarray и т.д) В научной и практической работе цитологи применяют проточную цитофотометрию.
Одним из путей совершенствования цитологического метода исследования является применение морфометрии, что позволяет получать объективные количественные параметры.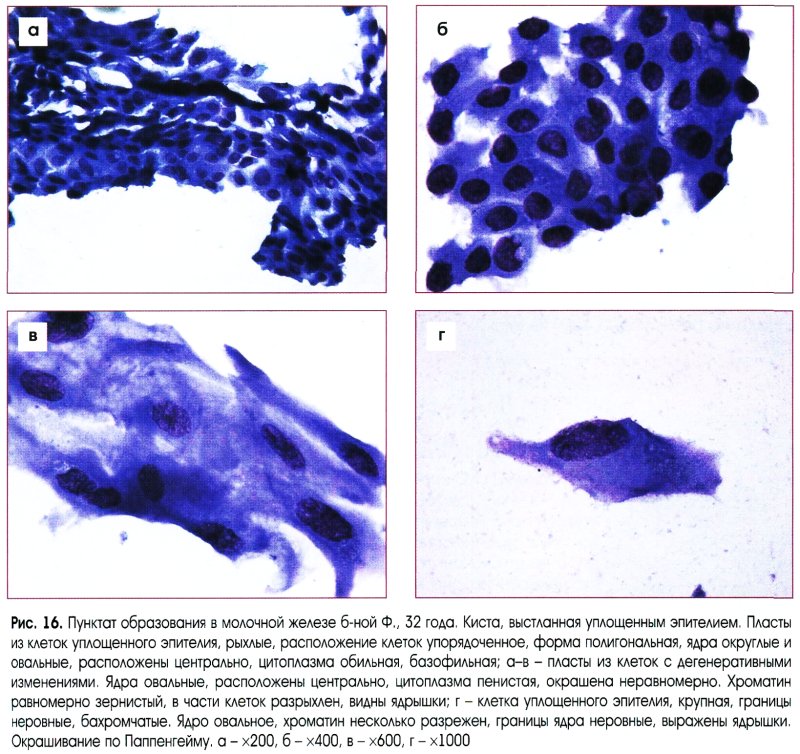 Например, при обработке на компьютере выделены наиболее информативные морфометрические признаки, относящиеся к параметрам ядра с использованием основных диагностических морфометрических признаков: площадь, периметр, оптической плотности, коэффициент поляризации ядер, числа ядрышек, их площади и периметра. Разработаны объективные морфометрические признаки различных степеней дисплазии при дисгормонально-гиперпластических процессах молочной железы, шейки матки, что уменьшило долю субъективизма в определении различных степеней дисплазии.
Например, при обработке на компьютере выделены наиболее информативные морфометрические признаки, относящиеся к параметрам ядра с использованием основных диагностических морфометрических признаков: площадь, периметр, оптической плотности, коэффициент поляризации ядер, числа ядрышек, их площади и периметра. Разработаны объективные морфометрические признаки различных степеней дисплазии при дисгормонально-гиперпластических процессах молочной железы, шейки матки, что уменьшило долю субъективизма в определении различных степеней дисплазии.
Развиваются новые методы микроскопии: фазово-контрастная, флюоресцентная, конфокальная и т.д. Создание компьютерных систем обучения, развитие метода телеконсультации также предъявляют новые требования и, несомненно, будут способствовать развитию и совершенствованию цитологического метода диагностики.
Волченко Надежда Николаевна
д.м.н., профессор, руководитель отделения
онкоцитологии МНИОИ им.П.А.Герцена
Методы обследования молочных желез и показания к ним — Маммология — Центры — Поликлиника
Приглашаем Вас в СПб больницу РАН, Тореза 72. Доверьте свое здоровье нашим профессиональным и внимательным специалистам.
Доверьте свое здоровье нашим профессиональным и внимательным специалистам.
Лучшие академические традиции — в современную медицину
Осмотр
Визуальный осмотр молочной железы – это первичный метод обследования, который проводит онколог — маммолог. Опытный врач даже при визуальном осмотре может увидеть патологические изменения, на которые женщина может не обращать внимания: некоторая асимметрия контуров молочной железы, изменение размеров, появление отека, снижение эрекции соска, сухость одного из сосков и др.
Пальпация
Пальпация молочных желез помогает выявить проблемные зоны, на которые следует обратить внимание и исследовать с помощью маммографии и УЗИ. Пальпация молочных желез проводится в разных положениях пациентки (лежа и стоя), что позволяет получить полную картину и, в ряде случаев, сразу и с вероятностью до 90%, определить злокачественный характер образования или изменений в молочной желез.
Маммография (цифровая)
Маммография – это рентгенография молочной железы, позволяющая получить изображение органа в нескольких проекциях.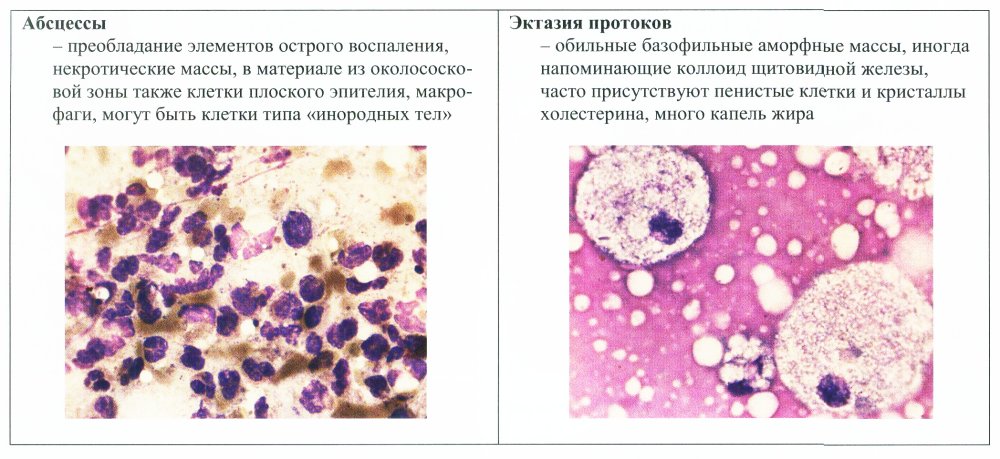 Это один из самых информативных видов исследования, позволяющий выявить непальпируемые новообразования (например, скопления кальцинатов, что может быть признаком злокачественной опухоли уже на ранних стадиях), оценить степень распространенности процесса в молочной железе и его многоочаговость. Этот метод дает возможность дифференцировать узловые и диффузные заболевания молочной железы, выполнить более точные пункции кист и образований, выполнить предоперационную внутритканевую маркировку непальпируемых образований. Маммография — единственный метод дифференциальной и топической диагностики внутрипротоковых заболеваний. А цифровая маммография имеет преимущества перед простой маммографией, так как повышает качество исследования, позволяет увеличить изображения и рассмотреть мельчайшие подробности независимо от различной плотности тканей. Недостатком этого метода является получение низкой дозы облучения.
Это один из самых информативных видов исследования, позволяющий выявить непальпируемые новообразования (например, скопления кальцинатов, что может быть признаком злокачественной опухоли уже на ранних стадиях), оценить степень распространенности процесса в молочной железе и его многоочаговость. Этот метод дает возможность дифференцировать узловые и диффузные заболевания молочной железы, выполнить более точные пункции кист и образований, выполнить предоперационную внутритканевую маркировку непальпируемых образований. Маммография — единственный метод дифференциальной и топической диагностики внутрипротоковых заболеваний. А цифровая маммография имеет преимущества перед простой маммографией, так как повышает качество исследования, позволяет увеличить изображения и рассмотреть мельчайшие подробности независимо от различной плотности тканей. Недостатком этого метода является получение низкой дозы облучения.
Маммография выполняется на специальном аппарате – маммографе в 2-х стандартных проекциях (прямой и косой). Косая проекция дает возможность исследовать подмышечную область, которая на прямой маммограмме не визуализируется. В настоящее время на рентгеномаммографию направляются женщины, имеющие изменения в молочной железе (с анамнезом или без) с 20 до 34 лет, старше 35 лет – без жалоб.
Косая проекция дает возможность исследовать подмышечную область, которая на прямой маммограмме не визуализируется. В настоящее время на рентгеномаммографию направляются женщины, имеющие изменения в молочной железе (с анамнезом или без) с 20 до 34 лет, старше 35 лет – без жалоб.
Для женщин с сохраненной менструальной функцией лучше записаться на прием к нашим специалистам в 1-ю фазу менструального цикла – с 5-го по 12-й дня цикла. В других случаях – в любое удобное для пациентки время.
УЗИ молочных желез и региональных лимфатических узлов
Ультразвуковой исследование – еще один высокоинформативный метод, позволяющий выявить очаги воспаления при высокой плотности ткани молочной железы. Он безопасен для здоровья и может применяться при беременности и у кормящих пациенток. Иногда УЗИ применяется при проведении биопсии молочной железы, что обеспечивает точную навигацию.
К сожалению, эффективность этого метода исследования ниже при больших размерах железы и ее жировой инволюции, не видно скопления кальцинатов, характерных для начальных стадий рака молочной железы.
Пункционная биопсия тонкоигольная с исследованием клеточного материала (тонкоигольная аспирационная биопсия)
Биопсия молочной железы представляет собой процедуру забора образца клеток из больной молочной железы пациентки для проведения исследования на клеточном уровне. Этот метод применяется для подтверждения точного диагноза при подозрении на наличие онкозаболевания в молочной железе. Биопсию проводят в случаях, когда другие современные методы исследования не дают полноценной картины характера изменений, происходящих в тканях молочной железы, для определения вида опухоли (доброкачественной либо злокачественной).
В ряде случаев при наличии кист в молочной железе, используется введение склерозирующего вещества в просвет кисты, чтобы склеить ее стенки и снизить риск рецидива кисты.
Цитологическое и иммуноцитохимическое исследование содержимого кисты молочной железы или образований
Цитологическое исследование материала молочной железы – это диагностический метод, основанный на оценке и изучении клеточного материала.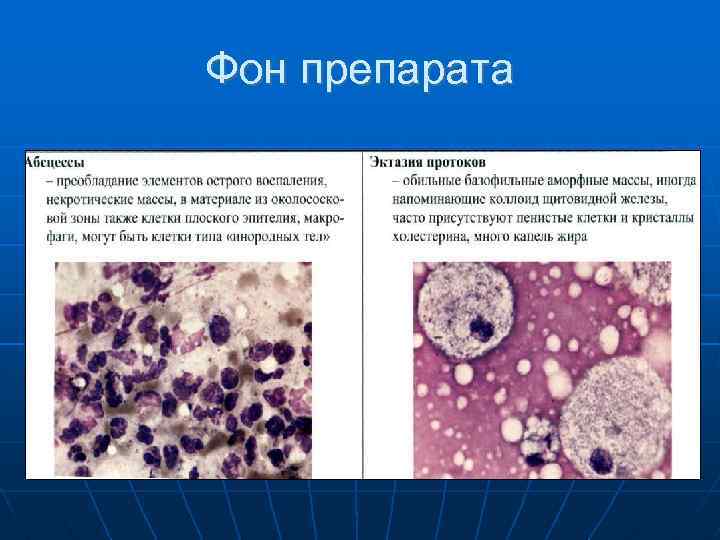 Наличие атипических клеток является серьезной предпосылкой для углубленного обследования и исключения злокачественного процесса в молочной железе.
Наличие атипических клеток является серьезной предпосылкой для углубленного обследования и исключения злокачественного процесса в молочной железе.
Трепан-биопсия молочной железы с изучением столбика ткани молочной железы
Для получения большего по объему клеточного материала применяется трепан-биопсия. Производится специальной иглой с резьбой, под местной анестезией и ультразвуковой навигацией. Данный вид диагностики позволяет выявить онкологию с точностью порядка 95%, определить вид опухоли. Результаты этого исследования должны быть интерпретированы лечащим врачом.
Гистологическое и /или иммуногистохимическое исследование ткани молочной железы
Гистологическое исследование — это исследование тканей молочной железы. Иммуногистохимическое исследование — особый вид исследования ткани, который предполагает использование специальных реактивов. Использование этих методов позволяет максимально повысить точность диагноза, выявить потенциал новообразований, агрессивность, степень злокачественности или дифференцировки опухоли.
МРТ-магнитно-резонансная маммография
МРТ молочных желез не является заменой маммографии или ультразвукового исследования, а дополняет данные методики, используется как скрининг группы риска (возраст, семейный анамнез). При постановке диагноза «рак молочной железы» позволяет определить размер опухоли и метастазы, исследовать лимфатические узлы, дифференцировать друг от друга рубцовую ткань и очаг рецидива рака молочной железы, выявить опухоль за молочной железой на передней грудной стенке. МРТ применяется при подозрении на мультифокальное поражение молочных желез, дляоценки динамики лечения опухолей молочной железы после химиотерапии и лучевой терапии.
Этот метод безопасен для пациенток юного возраста и беременных женщин. Позволяет пройти обследование женщинам с имплантатами, с молочными железами большого объема, при ярко выраженном болевой синдроме.
Этот метод, к сожалению, не подходит для пациенток с любыми вживленными электронными системами и устройствами (кардиостимуляторами, протезированными суставами, ферромагнитными клапанами сердца), пациенткам, страдающим клаустрофобией и заболеваниями, при которых пациентка не может сохранять неподвижность в течение 15-20 мин.
Мазки-отпечатки отделяемого из соска или с язвенной поверхности на молочной железе
Выделения из соска указывают на изменения в протоках молочной железы (рак, папилломы, расширения, кисты). Для проведения цитологического исследования в целях точного диагностирования болезни берется мазок — отпечаток.
Эксцизионная биопсия регионального лимфоузла
В некоторых случаях выявить опухоль стандартными методами обследования не представляется возможным, но первыми признаками заболевания могут стать увеличенные лимфатические узлы. В этом случае проводят эксцизионную биопсию (полное удаление) лимфатического узла. Узел отправляется на гистологическое и/или иммуногистологическое исследование, и диагноз становится ясен.
Секторальная резекция со срочным гистологическим исследованием
Когда все методы диагностики исчерпаны, но нет однозначного ответа, прибегают к хирургическому иссечению образования молочной железы, и если подтверждается рак молочной железы, объем оперативного вмешательства расширяется.
ТАПБ молочной железы в Сургуте
Тонкоигольная аспирационная биопсия молочной железы под контролем УЗИ с цитологическим исследованием
По статистике ВОЗ в мире ежегодно регистрируют до 1 миллиона новых случаев заболевания раком молочной железы, который чаще всего протекает бессимптомно и выявляется при УЗИ молочной железы. Именно поэтому для раннего выявления патологии молочных желез рекомендуется начиная с 18 лет проходить УЗИ — 1 раз в год, а с 40 лет — УЗИ ежегодно, а маммографию 1 раз в 2 года. С 50-летнего возраста и УЗИ и маммография — ежегодно.
Если во время проведения УЗИ или маммографии молочной железы обнаружилось новообразование (киста, узел …) не расстраивайтесь, но помните, что для исключения злокачественного новообразования лечащий врач может назначить дальнейшую диагностику — Тонкоигольную аспирационную биопсию молочной железы под контролем УЗИ с цитологическим исследованием (ТАПБ). ТАПБ — метод, способный дать ответ: доброкачественная опухоль или злокачественная.
ТАПБ — метод, способный дать ответ: доброкачественная опухоль или злокачественная.
Показания для проведения ТАПБ
- нарушение структуры тканей молочной железы
- плотное образование в тканях молочной железы
- любой участок патологически изменённой ткани.
Методика проведения ТАПБ молочной железы под контролем УЗИ в «НАДЖА»
Как происходит забор материала:
- Пациент ложится в удобную позу на кушетку.
- Над областью молочной железы устанавливается датчик ультразвукового аппарата. Изображение органа выводится на экран. Врач выбирает точку под наиболее безопасным, удобным углом и доступом.
- Дальше выполняется прокол тонкой иглой и забор материала в шприц (аспирация).
- Игла извлекается, содержимое узла (пунктат) наносится на предметные стёкла, а место прокола заклеивается стерильным пластырем на 1,5 – 2 часа.

- Полученный материал направляется в собственную цитологическую лабораторию для исследования врачом-гистологом.
Цитологическое исследование пунктата в собственной медицинской «Лаборатории гистологии и цитологии»
Цитологическое исследование пунктата позволяет определить тип строения подозрительного новообразования и сформулировать рекомендации по дальнейшему ведению пациента.
Хирургическое лечение требуется далеко не всегда, а показания к оперативному вмешательству четко определены. Поэтому, в зависимости от заключения, хирург онколог-маммолог, на последующей очной консультации, определяет тактику лечения.
Имеются противопоказания. Требуется консультация специалиста.
Записаться на диагностику ТАПБ и консультацию хирурга маммолога-онколога можно
- по телефону (3462) 771-003
- через Директ нашего Инстаграмма или
- при помощи обратной формы на сайте
Цитологическое исследование препарата тканей молочной железы
АНМО «Ставропольский краевой клинический консультативно-диагностический центр»:
355017, г. Ставрополь, ул. Ленина 304
Ставрополь, ул. Ленина 304 (8652) 951-951, (8652) 35-61-49 (факс)
(8652) 951-951, (8652) 31-51-51 (справочная служба)
Посмотреть подробнееОбособленное подразделение «Диагностический центр на Западном обходе»:
355029 г. Ставрополь, ул. Западный обход, 64(8652) 951-951, (8652) 31-51-51 (контактный телефон)
(8652) 31-68-89 (факс)
Посмотреть подробнееКлиника семейного врача:
355017 г. Ставрополь, пр. К. Маркса, 110 (за ЦУМом)(8652) 951-951, (8652) 31-51-51 (контактный телефон)
(8652) 31-50-60 (регистратура)
Посмотреть подробнееНевинномысский филиал:
357107, г. Невинномысск, ул. Низяева 1(86554) 95-777, 8-962-400-57-10 (регистратура)
Посмотреть подробнееОбособленное структурное подразделение в г. Черкесске :
Черкесске :
8(8782) 26-48-02, +7-988-700-81-06 (контактные телефоны)
Посмотреть подробнееОбособленное структурное подразделение в г. Элисте :
358000, г. Элиста, ул. Республиканская, 478(989) 735-42-07 (контактные телефоны)
Посмотреть подробнееЗАО «Краевой клинический диагностический центр»:
355017 г. Ставрополь, ул. Ленина 304(8652) 951-951, (8652) 35-61-49 (факс)
(8652) 951-951, (8652) 31-51-51 (справочная служба)
Посмотреть подробнееОбособленное структурное подразделение на ул. Савченко, 38 корп. 9:
355021, г. Ставрополь, ул. Савченко, 38, корп. 98 (8652) 316-847 (контактный телефон)
Посмотреть подробнееОбособленное структурное подразделение на ул. Чехова, 77 :
Чехова, 77 :
8(8652) 951-943 (контактный телефон)
Посмотреть подробнееОбособленное структурное подразделение в г. Михайловске:
358000, г. Михайловск, ул. Ленина, 201 (в новом жилом районе «Акварель»).8(988) 099-15-55 (контактный телефон)
Посмотреть подробнееРТМ-диагностика молочной железы в Калининграде — Медцентр «Надежда»
Комплексная диагностика заболеваний молочных желез.
(воспалительные заболевания, доброкачественные и злокачественные опухоли)
- Радиотермометрия (РТМ-диагностика) молочных желез
- УЗИ молочных желез
- Пункционная тонкоигольная аспирационная биопсия (ПТАБ) молочных желез
- Цитологическое исследование
- Анализ крови на онкомаркеры
Лечение заболеваний молочной железы:
- Предменструальный синдром (ПМС)
- Диффузная мастопатия
- Узловая мастопатия
- Киста молочной железы
- Фиброаденома
- Внутрипротоковая папиллома
- Нелактационные и лактационные маститы
Рак молочной железы устойчиво занимает первое место среди заболеваний у женщин.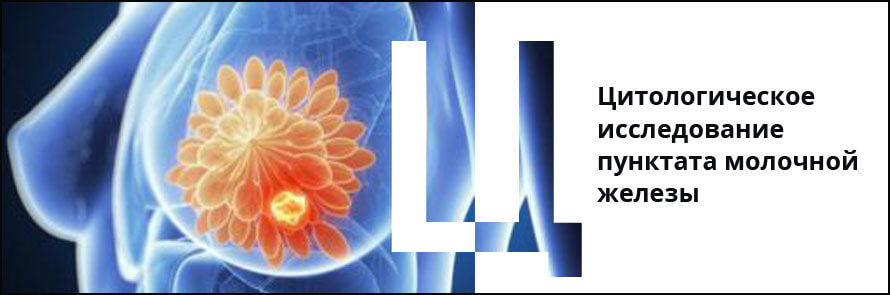 Каждая женщина хотя бы раз в год должна быть осмотрена маммологом, который поможет и научит Вас, как уберечь себя от рака молочной железы!
Каждая женщина хотя бы раз в год должна быть осмотрена маммологом, который поможет и научит Вас, как уберечь себя от рака молочной железы!
Радиотермометрия молочных желез (РТМ-диагностика)
- Выявление температурных изменений на стадии предшествующей злокачественному росту
- Отсутствие лучевой нагрузки
- Температура злокачественной опухоли определяется ее темпом роста
- Абсолютная безвредность и безболезненность для врача и для пациента
- Комфортность процедуры
- Точность метода не зависит от возрастной группы
- Обследование проводится в смотровом кабинете без специальной подготовки пациента.
Применение:
- Проведение профилактических осмотров
- Выявление и наблюдение дисгормональных состояний молочных желез
- Контроль за ходом лечения доброкачественных заболеваний
- Раннее выявление быстрорастущих злокачественных новообразований
- Оценка агрессивности опухолей
- Дополнительный метод в затруднительных случаях диагностики
- Обследование молочных желез у молодых и беременных женщин
Для исключения противопоказаний необходима консультация специалиста.
Диагностика и лечение доброкачественных образований кожи и мягких тканей
Удаление родинок, папилом, бородавок, родимых пятен и т.п.
В нашем медицинском центре вы можете получить квалифицированную консультацию врача онколога-маммолога.
Биопсия образований молочных желез | Семейный медицинский центр в Солнцево, Ново-Переделкино, Переделкино Ближнее, Солнцево Парк, г. Московском, пос. Западный
Спектр заболеваний молочных желез является довольно широким, от фиброзно-кистозной мастопатии до злокачественных опухолей.
Для выявления и распознавания заболеваний молочных желез используются различные методы диагностики, такие как УЗИ, маммография, дуктография, МРТ и т.д.
Одним из основных методов, позволяющих уточнить характер процесса в молочной железе, и выбрать адекватную тактику лечения пациента, является биопсия. Это процедура, в ходе которой получают клеточный материал, либо фрагменты ткани из патологического (или сомнительного) очага в молочной железе.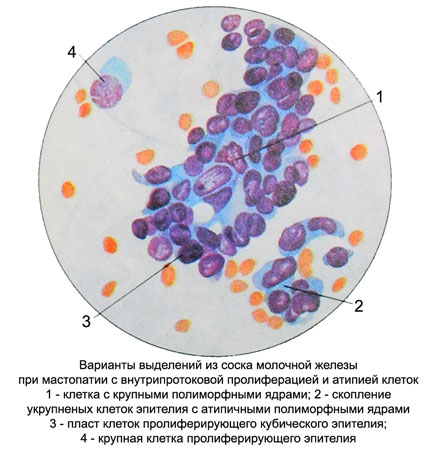 После специальной обработки полученного материала проводится его цитологическое, либо гистологическое исследование.
После специальной обработки полученного материала проводится его цитологическое, либо гистологическое исследование.
Существует 2 основных варианта биопсии очагов в молочной железе:
- Тонкоигольная аспирационная биопсия (ТАБ). При ТАБ получают клеточный материал, либо жидкость (к примеру, содержимое кисты) и проводят цитологическое исследование (цитология).
- Трепан биопсия (Cor-биопсия). Данный вид биопсии позволяет получить столбики ткани из патологического очага в молочной железе и провести гистологическое исследование (гистология), что является существенно более информативным. Также, возможно проведение иммуногистохимического исследования материала полученного при трепан биопсии, что является крайне важным для адекватного подбора лечения у пациентов со злокачественными опухолями молочной железы.
Биопсия молочных желез проводится под местной анестезией. В значительной части случаев при проведении процедуры используется УЗ-навигация (УЗИ контроль), что позволяет взять материал точно из патологического очага, тем самым существенно повысить информативность исследования.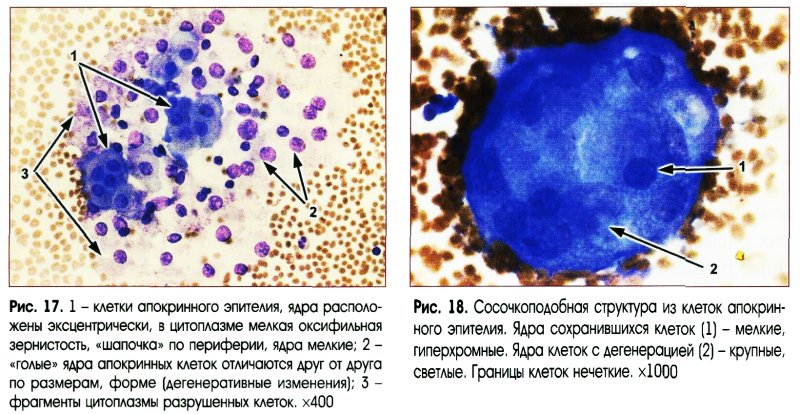
Проведение биопсии в большинстве случаев позволяет поставить точный диагноз, выявить предраковые заболевания молочных желез, а также распознать злокачественный процесс на начальных его стадиях.
Для определения показаний к выполнению биопсии, а также для выбора наиболее адекватной в конкретном случае методики ее проведения необходимо проконсультироваться у онколога-маммолога, а также, в большинстве случае, провести на первом этапе неинвазивные методы диагностики (УЗИ молочных желез, маммография).
Для жителей Московской области и иногородних граждан возможно проведение биопсии по полису ОМС.
Типы цитологических тестов, используемых для выявления рака
Диагностика заболеваний путем изучения отдельных клеток и небольших кластеров клеток называется цитология или цитопатология . Это важная часть диагностики некоторых видов рака.
По сравнению с биопсией ткани, образец цитологического исследования обычно:
- Проще получить
- Доставляет меньше дискомфорта пациенту
- Меньше вероятность серьезных осложнений
- Стоит меньше
Недостатком является то, что в некоторых случаях результат биопсии ткани более точен, но во многих случаях цитологический раствор может быть таким же точным.
Цитологические тесты могут использоваться для диагностики или скрининга:
- Диагностический тест используется только для людей, у которых есть признаки, симптомы или есть другие основания подозревать, что у них может быть определенное заболевание (например, рак). Диагностический тест определяет наличие болезни и, если да, то точно и точно классифицирует болезнь.
- Скрининговый тест используется для выявления людей, у которых может быть определенное заболевание, еще до того, как у них появятся симптомы.Ожидается, что скрининговый тест найдет почти всех людей, которые могут болеть этим заболеванием, но скрининговый тест не всегда доказывает наличие болезни.
Часто диагностический тест используется, если результат скринингового теста положительный (т. Е. Если в скрининговом тесте что-то обнаружено). Некоторые цитологические тесты, такие как Пап-тест, в основном используются для скрининга, в то время как другие могут точно идентифицировать рак (см. «Цитология соскоба или кисти» ниже). Когда результаты цитологического исследования показывают рак, часто перед началом лечения также проводится биопсия, чтобы убедиться в этом.
«Цитология соскоба или кисти» ниже). Когда результаты цитологического исследования показывают рак, часто перед началом лечения также проводится биопсия, чтобы убедиться в этом.
Аспирация тонкой иглой
Тонкоигольная аспирация (FNA) иногда считается цитологическим тестом, а иногда — биопсией. Это обсуждается в разделе «Типы биопсии, используемые для выявления рака».
Цитологические исследования жидкостей организма
Жидкости, взятые из полостей (пространств) в организме, можно тестировать на наличие раковых клеток. Вот некоторые из жидкостей полости тела, протестированных таким образом:
- Моча
- Мокрота (мокрота)
- Спинномозговая жидкость, также известная как спинномозговая жидкость или CSF (из пространства, окружающего головной и спинной мозг)
- Плевральная жидкость (из пространства вокруг легких)
- Перикардиальная жидкость (из мешочка, окружающего сердце)
- Асцитная жидкость, также называемая асцит или перитонеальная жидкость (из пространства в области живота)
Цитология соскоба или щетки
Другой метод цитологии состоит в том, чтобы аккуратно соскоблить или очистить некоторые клетки исследуемого органа или ткани. Самый известный цитологический тест, позволяющий брать образцы клеток таким образом, — это мазок Папаниколау. Небольшой шпатель и / или щеточка используются для удаления клеток из шейки матки (нижняя часть матки или матки) для мазка Папаниколау. Другие области, которые можно чистить щеткой или царапать, включают пищевод (трубку для глотания), желудок, бронхи (дыхательные трубки, ведущие в легкие) и рот.
Самый известный цитологический тест, позволяющий брать образцы клеток таким образом, — это мазок Папаниколау. Небольшой шпатель и / или щеточка используются для удаления клеток из шейки матки (нижняя часть матки или матки) для мазка Папаниколау. Другие области, которые можно чистить щеткой или царапать, включают пищевод (трубку для глотания), желудок, бронхи (дыхательные трубки, ведущие в легкие) и рот.
Цитологическая оценка поражений груди у пациентов с симптомами, поступающих в Национальную больницу Кеньятта, Кения: ретроспективное исследование
BMC Womens Health.2015; 15: 118.
, , , иКен Мунене Нконге
Медицинский факультет Университета Найроби, P.O. Box 19676, Найроби, Кения
Эмили Адхиамбо Рогена
Кафедра патологии человека, Школа медицины, Университет Найроби, P.O. Box 19676, Найроби, Кения
Эдвин Овино Валонг
Кафедра патологии человека, Школа медицины, Университет Найроби, П.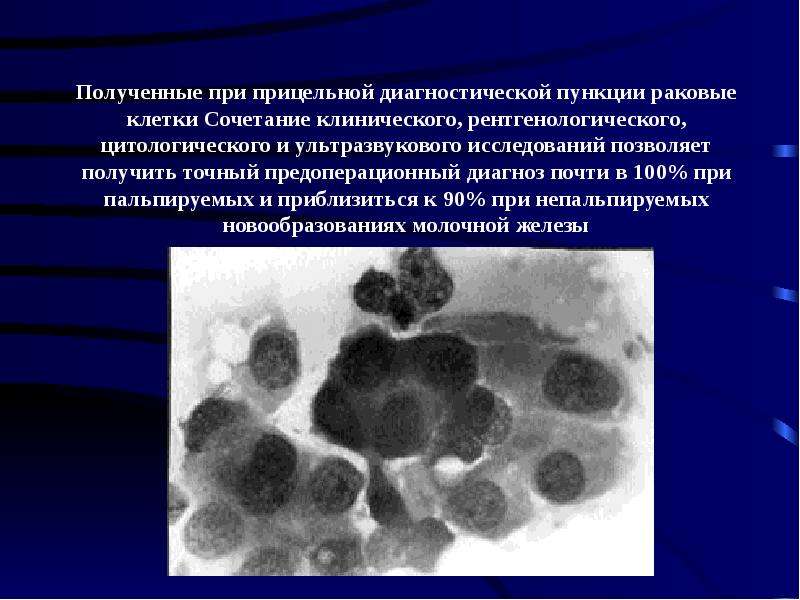 O. Box 19676, Найроби, Кения
O. Box 19676, Найроби, Кения
Деннис Карани Нконге
Медицинский факультет Университета Найроби, P.O. Box 19676, Найроби, Кения
Школа медицины, Университет Найроби, P.O. Box 19676, Найроби, Кения
Кафедра патологии человека, Школа медицины, Университет Найроби, P.O. Box 19676, Найроби, Кения
Автор, ответственный за переписку.Поступило 19 декабря 2014 г .; Принята к печати 12 декабря 2015 г.
Открытый доступ Эта статья распространяется на условиях Creative Commons Attribution 4.0 Международная лицензия (http://creativecommons.org/licenses/by/4.0/), которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе, при условии, что вы укажете соответствующую ссылку на первоначального автора (авторов) и источник, предоставьте ссылку на лицензию Creative Commons и укажите, были ли внесены изменения. Отказ Creative Commons Public Domain Dedication (http://creativecommons.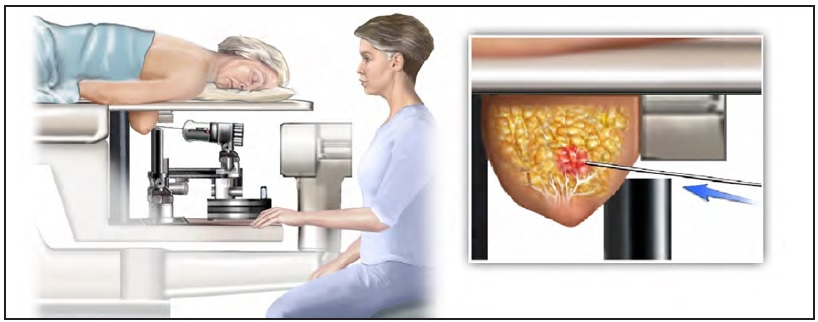 org/publicdomain/zero/1.0/) распространяется на данные, представленные в этой статье, если не указано иное. Эта статья цитируется в других статьях PMC.
org/publicdomain/zero/1.0/) распространяется на данные, представленные в этой статье, если не указано иное. Эта статья цитируется в других статьях PMC.Abstract
Предпосылки
Пальпируемое уплотнение в груди, боль в груди и выделения из сосков являются частыми симптомами заболевания груди. Цитология молочных желез (тонкоигольная аспирация, мазок выделений из сосков и подготовка на ощупь) точно определяет доброкачественные, атипичные и злокачественные патологические изменения в образцах молочных желез. Это исследование направлено на определение типов поражений молочных желез, диагностируемых цитологическим исследованием молочных желез, и оценку клинической адекватности описательных отчетов о результатах цитологического исследования молочных желез.
Методы
Ретроспективно оценивались медицинские карты 390 пациентов, обратившихся в клиники хирургии груди или общей хирургии в Национальной больнице Кеньятта, Найроби, Кения, в период с января 2010 года по март 2014 года.
Результаты
Из 390 диагностированных поражений груди 89,7% ( n = 350) произошли у женщин, в то время как 10,3% ( n = 40) произошли у мужчин, что привело к соотношению женщин и мужчин 8,8: 1. Новообразования груди ( n = 296) составили 75.9%, в то время как неопухолевые поражения груди ( n = 94) составили 24,1% всех диагностированных поражений груди. Неопластические поражения были классифицированы как 72,3% ( n = 214) доброкачественных и 27,7% ( n = 82) злокачественных, что привело к соотношению доброкачественных и злокачественных образований 2,6: 1. Фиброаденома ( n = 136) и гинекомастия ( n = 33) были наиболее часто диагностируемыми поражениями груди у женщин и мужчин, соответственно.
Выводы
Цитологическое исследование молочной железы эффективно диагностирует неопластические и неопухолевые поражения молочной железы.Неопластические поражения груди чаще встречались у женщин, тогда как неопухолевые поражения чаще встречались у мужчин. Чтобы устранить ограничения, связанные с повествовательной отчетностью о результатах цитологии груди, больнице рекомендуется принять синоптический формат отчета, включающий диагностические категории Программы скрининга груди Национальной службы здравоохранения Соединенного Королевства (от C1 до C5).
Чтобы устранить ограничения, связанные с повествовательной отчетностью о результатах цитологии груди, больнице рекомендуется принять синоптический формат отчета, включающий диагностические категории Программы скрининга груди Национальной службы здравоохранения Соединенного Королевства (от C1 до C5).
Ключевые слова: Грудь, цитопатология, фиброаденома, гинекомастия, синоптическое сообщение [1–4].Методы, используемые для диагностики поражений груди, включают клиническое обследование груди, визуализацию груди и цитологию груди [2, 4]. Цитология тонкоигольной аспирации является наиболее надежным компонентом этого тройного теста для оценки поражений груди из-за ее высокой чувствительности, специфичности, отрицательной прогностической ценности и положительной прогностической ценности [3, 5].
Злокачественные и доброкачественные заболевания груди распространены у девочек и женщин в странах Африки к югу от Сахары [6, 7], что подтверждается тремя исследованиями, проведенными в Национальной больнице Кеньятты (KNH), специализированной специализированной больнице в Найроби, Кения. Гистологическое исследование 1501 образца груди, проведенное Bjerregaard и Kung’u, показало, что доброкачественные и злокачественные образования составляют 72,2% и 27,8% диагностированных поражений груди, соответственно [8]. Ретроспективное исследование 1172 историй болезни пациентов, выполненное Otieno et al. обнаружили, что фиброаденома (33,2%) и протоковая карцинома (17,4%) были наиболее часто диагностируемыми типами поражений, и 98,9% всех поражений груди приходились на пациентов женского пола [9]. Наконец, проспективное поперечное исследование 166 пациентов с раком груди, проведенное Otieno et al.обнаружили, что 98,8% пациентов, у которых диагностирован рак груди, были женщинами, а 24,1% пациентов были неверно уверены, что их болезнь доброкачественная, до того, как им был поставлен диагноз «рак груди» [10].
Гистологическое исследование 1501 образца груди, проведенное Bjerregaard и Kung’u, показало, что доброкачественные и злокачественные образования составляют 72,2% и 27,8% диагностированных поражений груди, соответственно [8]. Ретроспективное исследование 1172 историй болезни пациентов, выполненное Otieno et al. обнаружили, что фиброаденома (33,2%) и протоковая карцинома (17,4%) были наиболее часто диагностируемыми типами поражений, и 98,9% всех поражений груди приходились на пациентов женского пола [9]. Наконец, проспективное поперечное исследование 166 пациентов с раком груди, проведенное Otieno et al.обнаружили, что 98,8% пациентов, у которых диагностирован рак груди, были женщинами, а 24,1% пациентов были неверно уверены, что их болезнь доброкачественная, до того, как им был поставлен диагноз «рак груди» [10].
Основная цель этого исследования заключалась в определении типа и полового распределения поражений груди, диагностированных путем цитологической оценки образцов груди от пациентов, обращающихся в KNH с жалобами на грудь в течение четырехлетнего периода. Вторичной целью этого исследования была оценка клинической адекватности описательной отчетности о результатах цитологии молочных желез.
Вторичной целью этого исследования была оценка клинической адекватности описательной отчетности о результатах цитологии молочных желез.
Методы
Медицинские записи в виде отчетов о цитологическом исследовании молочных желез от 443 последовательных пациентов, обращавшихся в клиники хирургии груди или в клиники общей хирургии в KNH в период с 5 января 2010 г. по 6 марта 2014 г. с пальпируемым уплотнением груди, выделениями из сосков, болью в груди данные о ретракции сосков, изменениях кожи или подмышечной лимфаденопатии были получены из регистрационного отдела цитологической лаборатории KNH и исследованы на соответствие критериям. В исследование были включены отчеты с указанием возраста и пола пациентов, клинического описания, техники взятия образцов цитологического исследования молочных желез, результатов микроскопии и окончательного цитологического диагноза молочных желез.Отчеты, содержащие серьезные типографские ошибки, историю болезни рака груди, цитологический диагноз вторичных заболеваний груди и неубедительные результаты цитологии груди, были исключены из исследования. Критериям отбора соответствовали 390 отчетов о цитологии молочных желез. Все данные были проанализированы с помощью Microsoft Excel 2013, а результаты описаны с использованием сводной статистики. Это отдельное исследование было одобрено Комитетом по этике и исследованиям Национальной больницы Кеньятта / Университета Найроби (Ссылка: KNH-ERC / UA / 189).KNH-ERC отказался от необходимости в письменном или устном информированном согласии.
Критериям отбора соответствовали 390 отчетов о цитологии молочных желез. Все данные были проанализированы с помощью Microsoft Excel 2013, а результаты описаны с использованием сводной статистики. Это отдельное исследование было одобрено Комитетом по этике и исследованиям Национальной больницы Кеньятта / Университета Найроби (Ссылка: KNH-ERC / UA / 189).KNH-ERC отказался от необходимости в письменном или устном информированном согласии.
Результаты
Жалобы и диагностированные поражения груди
Средний возраст обследованных пациенток составлял 36,0 ± 16,7 (диапазон от 10 до 90) лет, а средний возраст по полу составлял 34,6 ± 16,2 (диапазон от 10 до 90). лет для женщин и 48,6 ± 16,2 (диапазон 15–78) лет для мужчин. Поражения груди чаще всего диагностировались у женщин в возрасте 20–24 лет ( n = 91) и старше 50 лет ( n = 65), а также у мужчин в возрасте 50+ лет ( n = 25).Поданные жалобы сведены в Табл. Пальпируемое уплотнение в груди было наиболее частым (96,7%; n = 377), в то время как ретракция соска была наименее распространенной (1,3%; n = 5) жалоб. Средняя продолжительность предъявления жалоб у пациентов составляла 11 месяцев для женщин и 4,5 месяца для мужчин.
Средняя продолжительность предъявления жалоб у пациентов составляла 11 месяцев для женщин и 4,5 месяца для мужчин.
Таблица 1
Жалобы исследуемой популяции ( n = 390)
| Подача жалобы | Женщины | Мужчины | Всего | |||
|---|---|---|---|---|---|---|
| Пальпируемая опухоль груди 902 | 377 | |||||
| Выделения из сосков | 29 | 0 | 29 | |||
| Боль в груди | 19 | 8 | 27 | |||
| 229 | Пальпируемый подмышечный лимфатический узел (узлы) | 15 | 0 | 15 | ||
| Втяжение соска | 5 | 0 | 5 | |||
| 1110 | 11 месяцев5 | 8 |
Распределение частот всех диагностированных поражений груди показано на рис. Фиброаденома ( n = 136) и фиброзно-кистозные изменения ( n = 38) были наиболее часто диагностируемыми доброкачественными поражениями молочной железы, тогда как протоковая карцинома ( n = 68) была наиболее часто диагностируемым злокачественным поражением груди. Другие часто диагностируемые поражения молочной железы включали гинекомастию ( n = 33), доброкачественные поражения груди, если не указано иное ( n = 20), галактоцеле ( n = 12), внутрипротоковую папиллому ( n = 12) и жировой некроз ( n = 12).
Фиброаденома ( n = 136) и фиброзно-кистозные изменения ( n = 38) были наиболее часто диагностируемыми доброкачественными поражениями молочной железы, тогда как протоковая карцинома ( n = 68) была наиболее часто диагностируемым злокачественным поражением груди. Другие часто диагностируемые поражения молочной железы включали гинекомастию ( n = 33), доброкачественные поражения груди, если не указано иное ( n = 20), галактоцеле ( n = 12), внутрипротоковую папиллому ( n = 12) и жировой некроз ( n = 12).
Цитологический профиль поражений груди, диагностированных у женщин и мужчин ( n = 390). Гистограмма представляет собой частотное распределение всех поражений груди, диагностированных с января 2010 года по март 2014 года. БДУ: не указано иное
Типы диагностированных поражений груди и их распределение по полу
Из 390 диагностированных поражений груди 75,9% ( n = 296) были неопластическими и 24,1% ( n = 94) были неопухолевыми. О неопластических поражениях груди, 72.3% ( n = 214) были доброкачественными и 27,7% ( n = 82) злокачественными. Таким образом, соотношение доброкачественных и злокачественных было 2,6: 1. Из неопухолевых поражений груди 48,9% ( n = 46) были связаны с воспалением, тогда как 51,1% ( n = 48) не были связаны с воспалением.
О неопластических поражениях груди, 72.3% ( n = 214) были доброкачественными и 27,7% ( n = 82) злокачественными. Таким образом, соотношение доброкачественных и злокачественных было 2,6: 1. Из неопухолевых поражений груди 48,9% ( n = 46) были связаны с воспалением, тогда как 51,1% ( n = 48) не были связаны с воспалением.
Распределение поражений молочной железы по полу, диагностированных цитологическим исследованием молочных желез (таблица), показывает, что 98% неопластических и 63,8% неопухолевых поражений молочной железы произошли у женщин.Фиброаденома (38,9%), протоковая карцинома (18%) и фиброзно-кистозные изменения (10,9%) были наиболее часто диагностируемыми поражениями груди у женщин. Фиброаденома поражала женщин в возрасте 10–57 лет, протоковая карцинома поражала женщин в возрасте 21–90 лет, а фиброзно-кистозные изменения поражали женщин в возрасте 21–67 лет. Дольковая карцинома поражала женщин в возрасте 37–83 лет и составляла 1,7% всех поражений груди, диагностированных у женщин.
Таблица 2
Распределение поражений груди по полу, диагностированных цитологическим исследованием груди
| Цитологические диагнозы | Женщины | Мужчины | Всего | |
|---|---|---|---|---|
| n (%) | n (%) n (%) n (%) (%) | |||
| А.Неопластические | ||||
| Протоковая карцинома | 63 (18%) | 5 (12,5%) | 68 (17,4%) | |
| Фиброаденома | 136 (38,9%) | 0 (38,9%) | 0 (38,9%) | 0 136 (34,9%) |
| Фиброзно-кистозные изменения | 38 (10,9%) | 0 (0%) | 38 (9,7%) | |
| Доброкачественное поражение груди, БДУ | 19 (5,4%) | 1 (2,5%) | 20 (5,1%) | |
| Внутрипротоковая папиллома | 12 (3. 4%) 4%) | 0 (0%) | 12 (3,1%) | |
| Дольчатая карцинома | 6 (1,7%) | 0 (0%) | 6 (1,5%) | |
| Злокачественная грудь поражение | 5 (1,4%) | 0 (0%) | 5 (1,3%) | |
| С подозрением на злокачественное новообразование | 3 (0,9%) | 0 (0%) | 3 (0,8%) | |
| Фиброаденоматоз | 2 (0,6%) | 0 (0%) | 2 (0.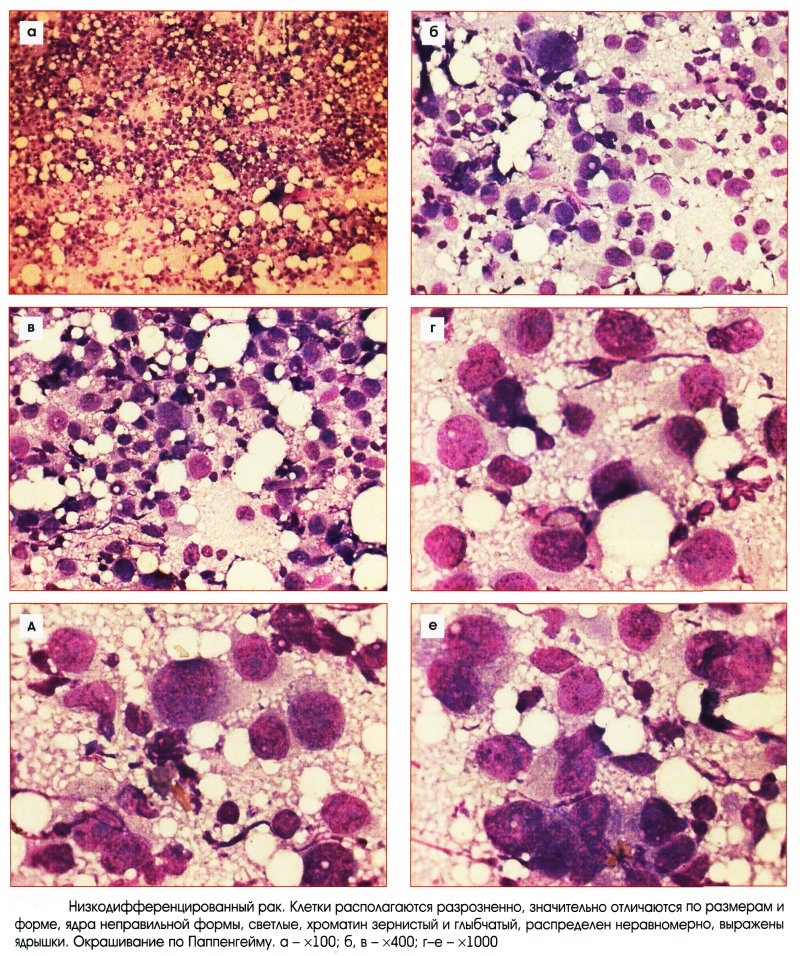 5%) 5%) | |
| Внутрипротоковая папиллома с фиброзно-кистозными изменениями | 2 (0,6%) | 0 (0%) | 2 (0,5%) | |
| Фиброаденома с гранулематозным маститом 1 | 902 0 (0%) | 1 (0,3%) | ||
| Гиперплазия протоков | 1 (0,3%) | 0 (0%) | 1 (0,3%) | |
| Доброкачественное поражение груди с атипией | 1 (0,3%) | 0 (0%) | 1 (0.3%) | |
| Доброкачественное пролиферативное заболевание груди | 1 (0,3%) | 0 (0%) | 1 (0,3%) | |
B.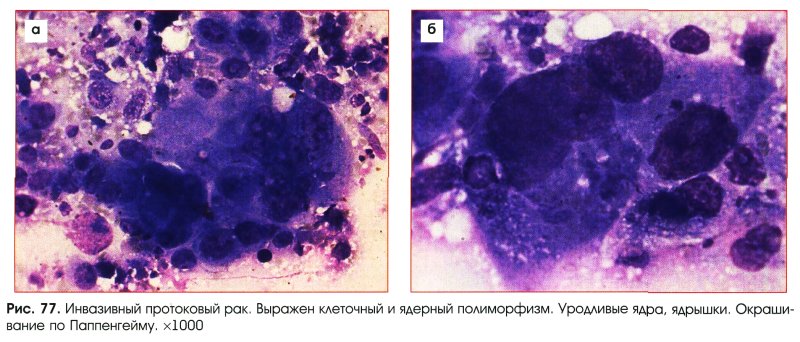 Неопухолевый Неопухолевый | ||||
| Гинекомастия | 0 (0%) | 33 (82,5%) | 33 (8,5%) | |
| Galactocele | 12 (3,4%) | 0 (0%)0 (0%) (3,1%) | ||
| Некроз жира | 12 (3,4%) | 0 (0%) | 12 (3.1%) | |
| Абсцесс груди | 9 (2,6%) | 0 (0%) | 9 (2,3%) | |
| Воспалительное поражение груди | 9 (2,6%) | 1 (2,5%) ) | 10 (2,6%) | |
| Эктазия протока молочной железы | 8 (2,3%) | 0 (0%) | 8 (2,1%) | |
| Острый мастит | 3 (0,9%) | 0 (0%) | 3 (0,8%) | |
| Кистозная масса груди | 3 (0. 9%) 9%) | 0 (0%) | 3 (0,8%) | |
| Гранулематозный мастит | 3 (0,9%) | 0 (0%) | 3 (0,8%) | |
| Язва груди | 1 (0,3%) | 0 (0%) | 1 (0,3%) | |
У мужчин 2% поражений груди были неопластическими, тогда как 36,2% неопластическими. Гинекомастия (82,5%) была наиболее частым поражением груди у мужчин и диагностировалась у мужчин в возрасте 17–67 лет. Протоковая карцинома (12.5%) было единственным неопластическим поражением груди и диагностировалось у мужчин в возрасте 52–68 лет. Взятые вместе, 89,7% ( n = 350) поражений груди произошли у женщин, в то время как 10,3% ( n = 40) поражений груди возникли у мужчин, что привело к соотношению женщин и мужчин 8,8: 1. .
.
Клиническая адекватность описательных отчетов о результатах цитологии молочных желез
Результаты 390 оцененных цитологических отчетов молочных желез были представлены в описательной повествовательной форме. Основываясь на результатах обзора Абати и Симсира [11] критериев консенсусной группы Национального института рака 1996 года для оптимальной производительности и отчетности по тонкоигольной аспирации молочной железы [12], отчеты цитологического исследования молочных желез от KNH были признаны клинически неадекватными и нуждающимися в улучшении.Во всех отчетах отсутствовала стандартизированная диагностическая терминология и не было четкого описания клинических данных и результатов визуализации, техники локализации поражения, адекватности образцов, результатов оценки тройного теста и рекомендаций постцитологии. Для устранения этих ограничений был разработан синоптический формат отчетности (рис.), Который рекомендуется для принятия KNH. Рекомендуемый синоптический формат отчета четко показывает клинические результаты и результаты визуализации, технику локализации поражения, оценку тройного теста и пост-цитологические рекомендации, а также включает диагностические категории цитологии груди Национальной службы здравоохранения (NHSBSP): неадекватные (C1), доброкачественные (C2), атипия, вероятно, доброкачественная (C3), подозрительная на злокачественность (C4) и злокачественная (C5) [13, 14].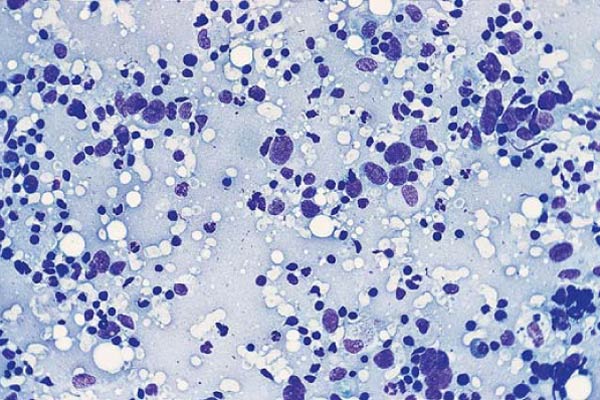 В частности, ожидается, что интеграция результатов тройного теста в рекомендуемый синоптический формат отчетности будет способствовать принятию клинических решений за счет разделения пациентов на три группы, основанные на фактических данных [4, 15]: пациенты, подходящие для планового последующего наблюдения с визуализацией груди на основе результатов тройного теста. из 3–4 пациентов, подходящих для эксцизионной биопсии и цитохистологической корреляции на основании результатов тройного теста 5–7, и пациентов, подходящих для немедленного хирургического вмешательства или окончательной терапии на основании баллов тройного теста 8–9 и общего клинического впечатления.
В частности, ожидается, что интеграция результатов тройного теста в рекомендуемый синоптический формат отчетности будет способствовать принятию клинических решений за счет разделения пациентов на три группы, основанные на фактических данных [4, 15]: пациенты, подходящие для планового последующего наблюдения с визуализацией груди на основе результатов тройного теста. из 3–4 пациентов, подходящих для эксцизионной биопсии и цитохистологической корреляции на основании результатов тройного теста 5–7, и пациентов, подходящих для немедленного хирургического вмешательства или окончательной терапии на основании баллов тройного теста 8–9 и общего клинического впечатления.
Рекомендуемый синоптический формат отчета для записи результатов цитологии молочных желез. Рекомендуемый синоптический формат отчета состоит из клинически значимых параметров в форме контрольного списка с минимальным использованием описательной части и включает стандартизированную диагностическую терминологию. FNA: тонкоигольная аспирация; LIQ: нижний внутренний квадрант; LOQ: нижний внешний квадрант; UIQ: верхний внутренний квадрант; UOQ: верхний внешний квадрант
Обсуждение
Основная цель настоящего исследования заключалась в определении типа и распределения поражений груди, диагностированных цитологическим анализом груди у кенийских пациентов, обращающихся в специализированную больницу в течение четырехлетнего периода.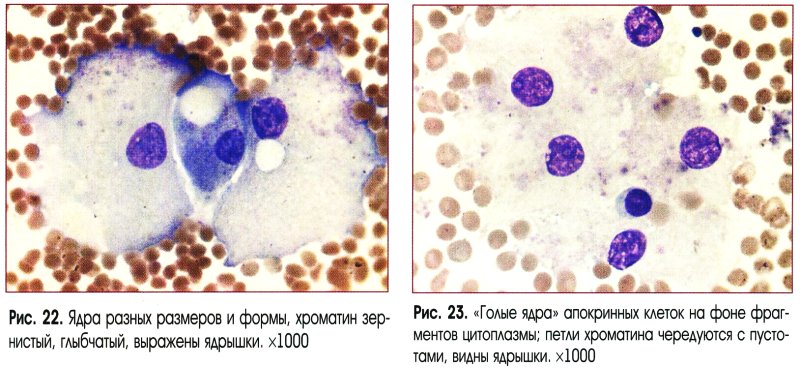 Из общего числа диагностированных поражений груди 72,3% были доброкачественными, что согласуется с выводами Bjerregaard и Kung’u [8] и Panjvani et al. [16]. Фиброаденома была наиболее часто диагностируемым поражением у женщин в пременопаузе, в то время как гинекомастия была наиболее часто диагностируемым поражением у мужчин, что согласуется с проспективными и ретроспективными исследованиями, проведенными в Уганде [7], Индии [16] и Пакистане [17]. Пальпируемое уплотнение в груди (377 пациентов) было наиболее частой жалобой, что согласуется с предыдущими данными, полученными в Кении [10] и других странах [2, 17, 18].Выделения из сосков (29 пациентов) были второй по частоте жалобой. Хотя выделения из сосков часто указывают на злокачественное новообразование груди, если они односторонние, кровянистые или связанные с опухолью [1, 19, 20], их диагностическая ценность спорна [2, 19–22]. Следовательно, необходимы дополнительные исследования, чтобы установить пригодность оценки тройного теста для диагностической оценки пациентов с выделениями из сосков.
Из общего числа диагностированных поражений груди 72,3% были доброкачественными, что согласуется с выводами Bjerregaard и Kung’u [8] и Panjvani et al. [16]. Фиброаденома была наиболее часто диагностируемым поражением у женщин в пременопаузе, в то время как гинекомастия была наиболее часто диагностируемым поражением у мужчин, что согласуется с проспективными и ретроспективными исследованиями, проведенными в Уганде [7], Индии [16] и Пакистане [17]. Пальпируемое уплотнение в груди (377 пациентов) было наиболее частой жалобой, что согласуется с предыдущими данными, полученными в Кении [10] и других странах [2, 17, 18].Выделения из сосков (29 пациентов) были второй по частоте жалобой. Хотя выделения из сосков часто указывают на злокачественное новообразование груди, если они односторонние, кровянистые или связанные с опухолью [1, 19, 20], их диагностическая ценность спорна [2, 19–22]. Следовательно, необходимы дополнительные исследования, чтобы установить пригодность оценки тройного теста для диагностической оценки пациентов с выделениями из сосков. Наконец, несмотря на согласованность настоящих результатов с существующей литературой, распространенность заболеваний груди в Кении может быть недооценена ретроспективным дизайном исследования.Поэтому необходимы популяционные исследования, чтобы полностью охарактеризовать эпидемиологию заболеваний груди в Кении.
Наконец, несмотря на согласованность настоящих результатов с существующей литературой, распространенность заболеваний груди в Кении может быть недооценена ретроспективным дизайном исследования.Поэтому необходимы популяционные исследования, чтобы полностью охарактеризовать эпидемиологию заболеваний груди в Кении.
Вторичной целью этого исследования была оценка клинической адекватности описательной отчетности результатов цитологии молочных желез. Во всех отчетах о цитологии молочных желез, оцениваемых в этом исследовании, использовался нестандартный описательный формат повествования вместо стандартного синоптического формата на основе контрольных списков [23]. Синоптические отчеты о результатах патологии получают все большее распространение в Азии и Северной Америке.Синоптический отчет был недавно разработан и использован в Японии для точного отчета о результатах цитологии груди в серии из 3439 случаев [24]. Кроме того, проект сообщения о раке, проведенный в Онтарио, Канада, Srigley et al. обнаружили, что внедрение синоптического формата отчетности в масштабах провинции позволяет получать более полные отчеты и приводит к увеличению количества сообщений о раке [25]. Наши выводы, наряду с выводами других исследователей, предполагают, что синоптическая отчетность, основанная на фактах, в сочетании с активным мониторингом результатов может превзойти традиционную описательную отчетность.Таким образом, ожидается, что принятие KNH рекомендованного формата синоптических отчетов повысит клиническую ценность диагностической цитологии груди и будет способствовать стандартизации практики патологии груди в Кении.
обнаружили, что внедрение синоптического формата отчетности в масштабах провинции позволяет получать более полные отчеты и приводит к увеличению количества сообщений о раке [25]. Наши выводы, наряду с выводами других исследователей, предполагают, что синоптическая отчетность, основанная на фактах, в сочетании с активным мониторингом результатов может превзойти традиционную описательную отчетность.Таким образом, ожидается, что принятие KNH рекомендованного формата синоптических отчетов повысит клиническую ценность диагностической цитологии груди и будет способствовать стандартизации практики патологии груди в Кении.
Выводы
Это исследование показало, что цитологическое исследование груди эффективно диагностирует неопластические и неопухолевые поражения груди. Неопластические поражения груди чаще встречались у женщин, в то время как неопухолевые поражения чаще встречались у мужчин. Чтобы устранить ограничения, связанные с описательной отчетностью результатов цитологии молочных желез, KNH следует принять рекомендуемый формат синоптической отчетности.
Аббревиатуры
| KNH | Национальная больница Кеньятта |
| KNH-ERC | Национальная больница Кеньятта / Программа исследований и этики Университета Найроби |
Сноски
Конкурирующие интересы
Авторы заявляют об отсутствии финансовых или нефинансовых конкурирующих интересов.
Вклад авторов
EOW и KMN разработали исследование и его дизайн. KMN и DKN собрали данные, проанализировали и интерпретировали результаты, подготовили рисунки и таблицы, провели обзор литературы и составили рукопись. EAR и EOW критически рассмотрели рукопись. Все авторы прочитали и одобрили окончательный вариант рукописи.
Ссылки
1. Barry M. Выделения из сосков. В: Walker K, Hall D, Hurst JW, редакторы. Клинические методы: анамнез, физикальные и лабораторные исследования. 3. Бостон: Баттервортс; 1990. С. 820–821. [Google Scholar] 2. Зальцман Б., Флигл С., Талли А.С. Общие проблемы с грудью. Я семейный врач. 2012; 86: 343–349. [PubMed] [Google Scholar] 3. Нгото Дж., Гитайга Дж., Кайша В. Пальпируемые дискретные образования груди у молодых женщин: два компонента модифицированного тройного теста могут быть адекватными. S Afr J Surg. 2013; 51: 58–60. DOI: 10.7196 / sajs.1176. [PubMed] [CrossRef] [Google Scholar] 4. Моррис А., Поммьер Р.Ф., Шмидт В.А., Ши Р.Л., Александр П.В., Ветто Дж. Т.. Точная оценка пальпируемых образований груди по результатам тройного теста.Arch Surg. 1998; 133: 930–934. DOI: 10.1001 / archsurg.133.9.930. [PubMed] [CrossRef] [Google Scholar] 5. Мучири Л.В., Пеннер Д.В., Адвок Дж., Рана Ф.С. Роль тонкоигольной аспирационной биопсии в диагностике опухолей груди в Национальной больнице Кеньятты. East Afr Med J. 1993; 70: 31–33. [PubMed] [Google Scholar] 6. Эдмунд Д.М., Наэдер С.Б., Тетти Ю., Гьяси Р.К. Рак груди у женщин Ганы: что изменилось? Am J Clin Pathol.
3. Бостон: Баттервортс; 1990. С. 820–821. [Google Scholar] 2. Зальцман Б., Флигл С., Талли А.С. Общие проблемы с грудью. Я семейный врач. 2012; 86: 343–349. [PubMed] [Google Scholar] 3. Нгото Дж., Гитайга Дж., Кайша В. Пальпируемые дискретные образования груди у молодых женщин: два компонента модифицированного тройного теста могут быть адекватными. S Afr J Surg. 2013; 51: 58–60. DOI: 10.7196 / sajs.1176. [PubMed] [CrossRef] [Google Scholar] 4. Моррис А., Поммьер Р.Ф., Шмидт В.А., Ши Р.Л., Александр П.В., Ветто Дж. Т.. Точная оценка пальпируемых образований груди по результатам тройного теста.Arch Surg. 1998; 133: 930–934. DOI: 10.1001 / archsurg.133.9.930. [PubMed] [CrossRef] [Google Scholar] 5. Мучири Л.В., Пеннер Д.В., Адвок Дж., Рана Ф.С. Роль тонкоигольной аспирационной биопсии в диагностике опухолей груди в Национальной больнице Кеньятты. East Afr Med J. 1993; 70: 31–33. [PubMed] [Google Scholar] 6. Эдмунд Д.М., Наэдер С.Б., Тетти Ю., Гьяси Р.К. Рак груди у женщин Ганы: что изменилось? Am J Clin Pathol.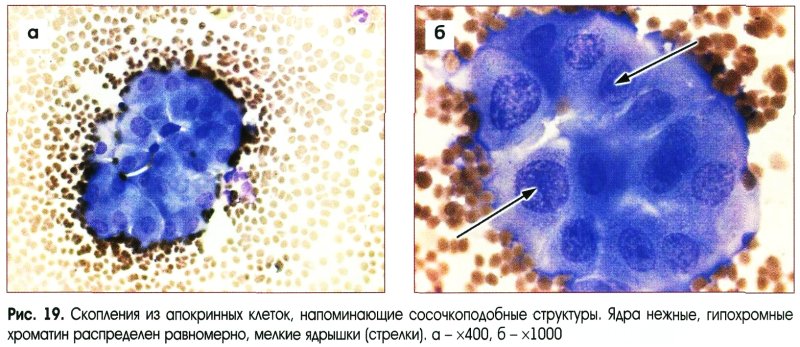 2013; 140: 97–102. DOI: 10.1309 / AJCPW7TZLS3BFFIU. [PubMed] [CrossRef] [Google Scholar] 7.Окот С, Галуканде М., Джомбве Дж, Вамала Д. Доброкачественные пролиферативные заболевания груди у пациенток в больнице третьего уровня в Африке к югу от Сахары: перекрестное исследование. BMC Surg. 2013; 13: 9. DOI: 10.1186 / 1471-2482-13-9. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 8. Бьеррегаард Б., Кунгу А. Доброкачественные поражения груди в Кении: гистологическое исследование. East Afr Med J. 1992; 69: 231–235. [PubMed] [Google Scholar] 9. Отиено Э.С., Кименде С.К., Михени Дж. Н.. Картина заболеваний груди в Национальной больнице Кеньятта.Анналы африканской хирургии. 2008; 2: 97–101. [Google Scholar] 10. Отиено Э.С., Михени Дж. Н., Кименде С.К., Мутаи К.К. Задержка обращения пациентов с раком груди. East Afr Med J. 2010; 87: 147–150. [PubMed] [Google Scholar] 11. Абати А., Симсир А. Аспирационная биопсия молочной железы тонкой иглой: преобладающие рекомендации и современные практики.
2013; 140: 97–102. DOI: 10.1309 / AJCPW7TZLS3BFFIU. [PubMed] [CrossRef] [Google Scholar] 7.Окот С, Галуканде М., Джомбве Дж, Вамала Д. Доброкачественные пролиферативные заболевания груди у пациенток в больнице третьего уровня в Африке к югу от Сахары: перекрестное исследование. BMC Surg. 2013; 13: 9. DOI: 10.1186 / 1471-2482-13-9. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 8. Бьеррегаард Б., Кунгу А. Доброкачественные поражения груди в Кении: гистологическое исследование. East Afr Med J. 1992; 69: 231–235. [PubMed] [Google Scholar] 9. Отиено Э.С., Кименде С.К., Михени Дж. Н.. Картина заболеваний груди в Национальной больнице Кеньятта.Анналы африканской хирургии. 2008; 2: 97–101. [Google Scholar] 10. Отиено Э.С., Михени Дж. Н., Кименде С.К., Мутаи К.К. Задержка обращения пациентов с раком груди. East Afr Med J. 2010; 87: 147–150. [PubMed] [Google Scholar] 11. Абати А., Симсир А. Аспирационная биопсия молочной железы тонкой иглой: преобладающие рекомендации и современные практики.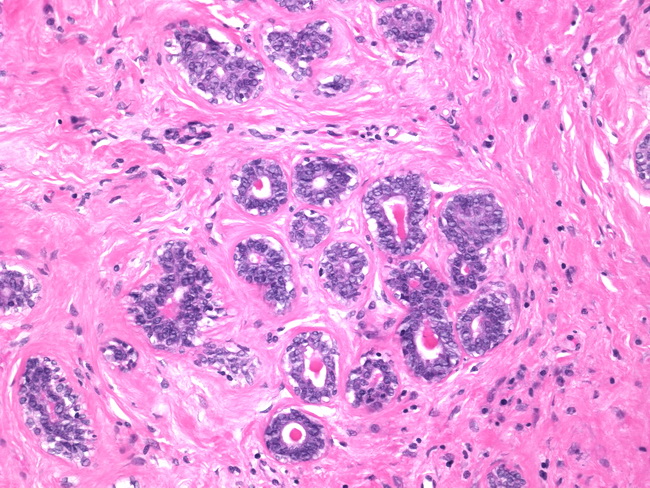 Clin Lab Med. 2005; 25: 631–654. DOI: 10.1016 / j.cll.2005.08.003. [PubMed] [CrossRef] [Google Scholar] 12. Тонкоигольная аспирационная биопсия груди Национального института рака подкомитетов семинара по изучению рака Единый подход к тонкоигольной аспирационной биопсии груди.Diagn Cytopathol. 1997. 16: 295–311. DOI: 10.1002 / (SICI) 1097-0339 (1997) 16: 4 <295 :: AID-DC1> 3.0.CO; 2-D. [PubMed] [CrossRef] [Google Scholar] 13. Подгруппа по цитологии Национального координационного комитета по скринингу рака молочной железы. Рекомендации по цитологическим процедурам и отчетности при скрининге рака груди. Шеффилд: Программа скрининга рака Национальной службы здравоохранения; 2001. [PubMed] [Google Scholar] 14. Коцян Г., Бургейн С., Фассина А., Хагмар Б., Герберт А., Капила К. и др. Роль груди FNAC в диагностике и клиническом ведении: обзор современной практики.Цитопатология. 2008. 19: 271–278. DOI: 10.1111 / j.1365-2303.2008.00610.x. [PubMed] [CrossRef] [Google Scholar] 15. Вай С.Дж., Аль-Мубарак Дж.
Clin Lab Med. 2005; 25: 631–654. DOI: 10.1016 / j.cll.2005.08.003. [PubMed] [CrossRef] [Google Scholar] 12. Тонкоигольная аспирационная биопсия груди Национального института рака подкомитетов семинара по изучению рака Единый подход к тонкоигольной аспирационной биопсии груди.Diagn Cytopathol. 1997. 16: 295–311. DOI: 10.1002 / (SICI) 1097-0339 (1997) 16: 4 <295 :: AID-DC1> 3.0.CO; 2-D. [PubMed] [CrossRef] [Google Scholar] 13. Подгруппа по цитологии Национального координационного комитета по скринингу рака молочной железы. Рекомендации по цитологическим процедурам и отчетности при скрининге рака груди. Шеффилд: Программа скрининга рака Национальной службы здравоохранения; 2001. [PubMed] [Google Scholar] 14. Коцян Г., Бургейн С., Фассина А., Хагмар Б., Герберт А., Капила К. и др. Роль груди FNAC в диагностике и клиническом ведении: обзор современной практики.Цитопатология. 2008. 19: 271–278. DOI: 10.1111 / j.1365-2303.2008.00610.x. [PubMed] [CrossRef] [Google Scholar] 15. Вай С.Дж., Аль-Мубарак Дж. , Гомер М.Дж., Голдкамп А., Саменфельд-Шпехт М., Ли Й. и др. Модифицированный тройной тест на пальпируемые новообразования груди: значение УЗИ и биопсии стержневой иглой. Энн Сург Онкол. 2013; 20: 850–855. DOI: 10.1245 / s10434-012-2710-у. [PubMed] [CrossRef] [Google Scholar] 16. Панджвани С.И., Парих Б.Дж., Парих С.Б., Чаудхари Б.Р., Патель К.К., Гупта Г.С. и др. Применение тонкоигольной аспирационной цитологии при оценке поражений груди.J Clin Diagn Res. 2013; 7: 2777–2779. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Аслам Х.М., Салим С., Шейх Х.А., Шахид Н., Могхал А., Ума Р. Клинико-патологический профиль пациентов с заболеваниями груди. Diagn Pathol. 2013; 8: 77. DOI: 10.1186 / 1746-1596-8-77. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 18. Уокер С., Хайд С., Гамильтон В. Риск рака груди у женщин с симптомами в системе первичной медико-санитарной помощи: исследование случай-контроль с использованием электронных записей. Br J Gen Pract. 2014; 64: e788 – e793.
, Гомер М.Дж., Голдкамп А., Саменфельд-Шпехт М., Ли Й. и др. Модифицированный тройной тест на пальпируемые новообразования груди: значение УЗИ и биопсии стержневой иглой. Энн Сург Онкол. 2013; 20: 850–855. DOI: 10.1245 / s10434-012-2710-у. [PubMed] [CrossRef] [Google Scholar] 16. Панджвани С.И., Парих Б.Дж., Парих С.Б., Чаудхари Б.Р., Патель К.К., Гупта Г.С. и др. Применение тонкоигольной аспирационной цитологии при оценке поражений груди.J Clin Diagn Res. 2013; 7: 2777–2779. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Аслам Х.М., Салим С., Шейх Х.А., Шахид Н., Могхал А., Ума Р. Клинико-патологический профиль пациентов с заболеваниями груди. Diagn Pathol. 2013; 8: 77. DOI: 10.1186 / 1746-1596-8-77. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 18. Уокер С., Хайд С., Гамильтон В. Риск рака груди у женщин с симптомами в системе первичной медико-санитарной помощи: исследование случай-контроль с использованием электронных записей. Br J Gen Pract. 2014; 64: e788 – e793.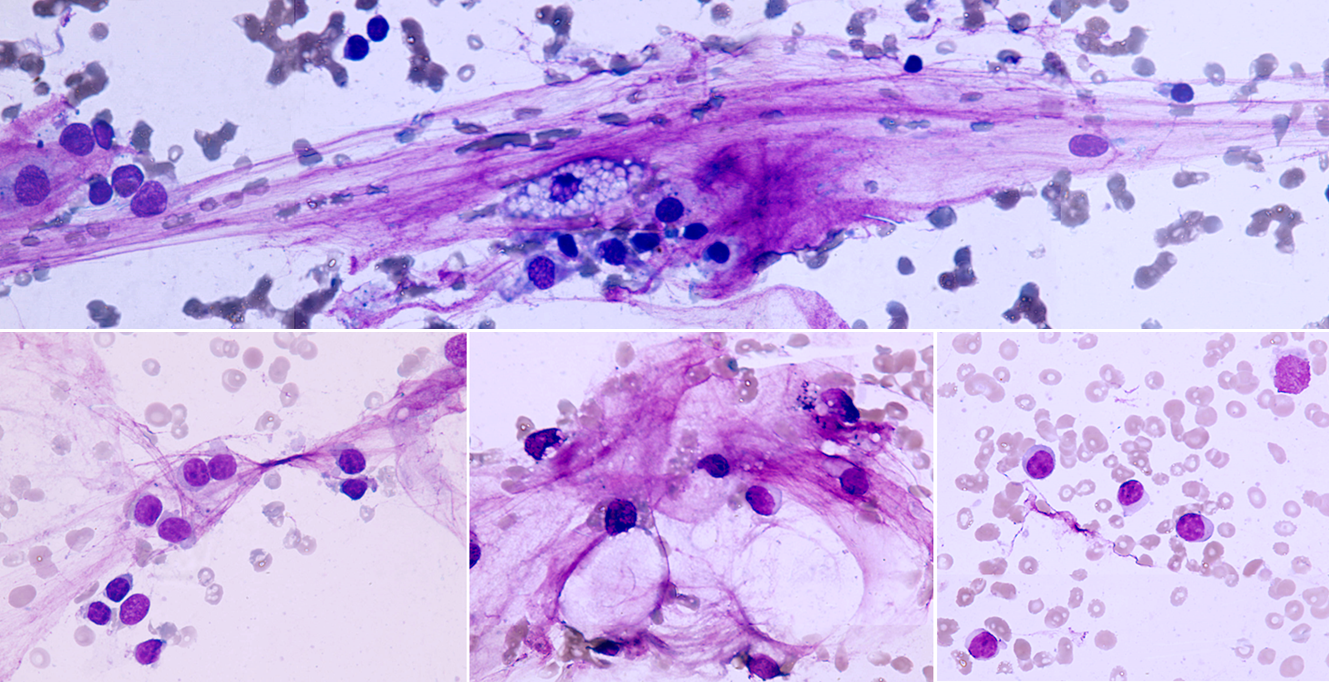 DOI: 10.3399 / bjgp14X682873.[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 19. Montroni I, Santini D, Zucchini G, Fiacchi M, Zanotti S, Ugolini G и др. Выделения из сосков: полностью ли изучено их значение как фактора риска рака груди? Наблюдательное исследование с участием 915 последовательных пациентов, которым было выполнено выборочное иссечение протока. Лечение рака груди Res. 2010; 123: 895–900. DOI: 10.1007 / s10549-010-0815-1. [PubMed] [CrossRef] [Google Scholar] 20. Гупта Р.К., Гаскелл Д., Доул С.С., Симпсон Дж.С., Кинг Б.Р., Наран С. и др.Роль цитологии выделений из сосков в диагностике заболеваний груди: исследование 1948 мазков выделений из сосков у 1530 пациентов. Цитопатология. 2004. 15: 326–330. DOI: 10.1111 / j.1365-2303.2004.00169.x. [PubMed] [CrossRef] [Google Scholar] 21. Lang JE, Kuerer HM. Секреция протоков молочной железы: клинические особенности, потенциальное использование и возможные применения. Борьба с раком. 2007. 14: 350–359. [PubMed] [Google Scholar] 22.
DOI: 10.3399 / bjgp14X682873.[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 19. Montroni I, Santini D, Zucchini G, Fiacchi M, Zanotti S, Ugolini G и др. Выделения из сосков: полностью ли изучено их значение как фактора риска рака груди? Наблюдательное исследование с участием 915 последовательных пациентов, которым было выполнено выборочное иссечение протока. Лечение рака груди Res. 2010; 123: 895–900. DOI: 10.1007 / s10549-010-0815-1. [PubMed] [CrossRef] [Google Scholar] 20. Гупта Р.К., Гаскелл Д., Доул С.С., Симпсон Дж.С., Кинг Б.Р., Наран С. и др.Роль цитологии выделений из сосков в диагностике заболеваний груди: исследование 1948 мазков выделений из сосков у 1530 пациентов. Цитопатология. 2004. 15: 326–330. DOI: 10.1111 / j.1365-2303.2004.00169.x. [PubMed] [CrossRef] [Google Scholar] 21. Lang JE, Kuerer HM. Секреция протоков молочной железы: клинические особенности, потенциальное использование и возможные применения. Борьба с раком. 2007. 14: 350–359. [PubMed] [Google Scholar] 22.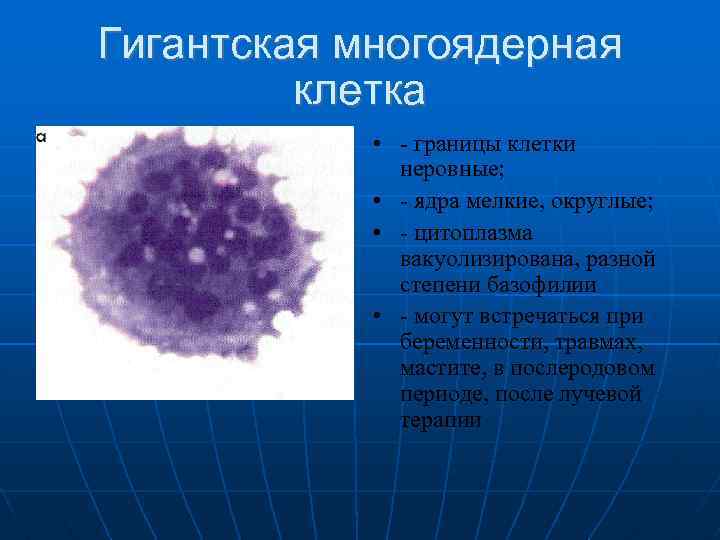 Долан Р. Т., Батлер Дж. С., Келл М. Р., Гори Т. Ф., Стокс Массачусетс. Выделения из сосков и эффективность цитологии протоков в оценке риска рака груди.Хирург. 2010. 8: 252–258. DOI: 10.1016 / j.surge.2010.03.005. [PubMed] [CrossRef] [Google Scholar] 23. Casati B, Haugland HK, Barstad GM, Bjugn R. Факторы, влияющие на внедрение и использование электронных шаблонов для гистопатологической отчетности по раку. Патология. 2014; 46: 165–168. DOI: 10.1097 / PAT.0000000000000065. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 24. Цучия С., Акияма Ф., Мория Т., Цуда Х., Умемура С., Катаяма Ю. и др. Новая форма отчетности по цитологии молочных желез. Рак молочной железы.2009; 16: 202–206. DOI: 10.1007 / s12282-009-0128-6. [PubMed] [CrossRef] [Google Scholar] 25. Сригли Дж. Р., Макгоуэн Т., Маклин А., Рэби М., Росс Дж., Крамер С. и др. Стандартизированная синоптическая отчетность по патологии рака: популяционный подход. J Surg Oncol. 2009; 99: 517–524. DOI: 10.1002 / jso.21282. [PubMed] [CrossRef] [Google Scholar]
Долан Р. Т., Батлер Дж. С., Келл М. Р., Гори Т. Ф., Стокс Массачусетс. Выделения из сосков и эффективность цитологии протоков в оценке риска рака груди.Хирург. 2010. 8: 252–258. DOI: 10.1016 / j.surge.2010.03.005. [PubMed] [CrossRef] [Google Scholar] 23. Casati B, Haugland HK, Barstad GM, Bjugn R. Факторы, влияющие на внедрение и использование электронных шаблонов для гистопатологической отчетности по раку. Патология. 2014; 46: 165–168. DOI: 10.1097 / PAT.0000000000000065. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 24. Цучия С., Акияма Ф., Мория Т., Цуда Х., Умемура С., Катаяма Ю. и др. Новая форма отчетности по цитологии молочных желез. Рак молочной железы.2009; 16: 202–206. DOI: 10.1007 / s12282-009-0128-6. [PubMed] [CrossRef] [Google Scholar] 25. Сригли Дж. Р., Макгоуэн Т., Маклин А., Рэби М., Росс Дж., Крамер С. и др. Стандартизированная синоптическая отчетность по патологии рака: популяционный подход. J Surg Oncol. 2009; 99: 517–524. DOI: 10.1002 / jso.21282. [PubMed] [CrossRef] [Google Scholar]Цитология аспирации молочной железы тонкой иглой: доброкачественные категории
В настоящее время точная диагностика поражений груди зависит от тройного подхода к оценке, включающего клинические, визуализационные и патологические исследования. Аспирационная цитология с тонкой иглой (FNAC) широко используется для оценки патологии из-за ее точности и простоты использования. Хотя много написано об атипичных и злокачественных категориях диагностики FNAC, мало что касается категории, не связанной с злокачественными новообразованиями, которая представляет собой абсолютное число во всех случаях FNAC. Более того, любой ложноотрицательный диагноз в незлокачественных случаях может привести к пропущенному диагнозу рака. В этой статье обсуждаются вопросы адекватности мазка, цитологические особенности доброкачественных образований молочной железы и дилемма ложноотрицательного аспирата.Было высказано много предположений о критерии адекватности мазка, включая количественную оценку эпителиальных кластеров, в то время как другие выступают за обоснование адекватности на качественном уровне использования неклеточных характеристик FNAC. В FNAC можно легко диагностировать различные доброкачественные образования; однако они имеют цитологические особенности, частично совпадающие со злокачественными новообразованиями.
Аспирационная цитология с тонкой иглой (FNAC) широко используется для оценки патологии из-за ее точности и простоты использования. Хотя много написано об атипичных и злокачественных категориях диагностики FNAC, мало что касается категории, не связанной с злокачественными новообразованиями, которая представляет собой абсолютное число во всех случаях FNAC. Более того, любой ложноотрицательный диагноз в незлокачественных случаях может привести к пропущенному диагнозу рака. В этой статье обсуждаются вопросы адекватности мазка, цитологические особенности доброкачественных образований молочной железы и дилемма ложноотрицательного аспирата.Было высказано много предположений о критерии адекватности мазка, включая количественную оценку эпителиальных кластеров, в то время как другие выступают за обоснование адекватности на качественном уровне использования неклеточных характеристик FNAC. В FNAC можно легко диагностировать различные доброкачественные образования; однако они имеют цитологические особенности, частично совпадающие со злокачественными новообразованиями. Ложноотрицательность FNAC действительно имеет место; это может быть вызвано либо «истинными» ложноотрицательными случаями, связанными с неоптимальной техникой отбора проб, плохой локализацией новообразований или непальпируемых поражений, либо «ложными» ложноотрицательными случаями из-за ошибок интерпретации.Хотя ложноположительные случаи встречаются реже, они также будут кратко рассмотрены.
Ложноотрицательность FNAC действительно имеет место; это может быть вызвано либо «истинными» ложноотрицательными случаями, связанными с неоптимальной техникой отбора проб, плохой локализацией новообразований или непальпируемых поражений, либо «ложными» ложноотрицательными случаями из-за ошибок интерпретации.Хотя ложноположительные случаи встречаются реже, они также будут кратко рассмотрены.
1. Введение
Тонкоигольная аспирационная цитология (FNAC) стала популярной как ценный инструмент для предоперационной оценки новообразований груди, и она показывает высокую точность, чувствительность и специфичность. Он завоевал популярность благодаря быстрому и простому подходу, недорогой процедуре и выполнению с небольшими осложнениями. Отличить доброкачественные образования от злокачественных — одна из основных целей FNAC.При оценке новообразований молочной железы проверенная временем тройная оценка сочетает в себе клиническую, радиологическую и патологическую информацию, а FNAC вместе с биопсией стержневой иглы являются первичными методами патологического исследования. Этому подходу было оказано большое доверие, поскольку он позволяет избежать стандартной эксцизионной биопсии, когда все три компонента тройного теста однозначно отрицательны или положительны [1]. Тем не менее, при FNAC поражений груди есть случаи, когда дифференциация доброкачественных и злокачественных поражений невозможна.Эта проблема возникает, когда наблюдается нехватка образцов или имеется морфологическое совпадение между доброкачественными и злокачественными образованиями (например, атипичная гиперплазия и низкосортная карцинома in situ или при папиллярных поражениях). В результате и для учета этих проблемных областей используются категории цитологической отчетности, чтобы объективно описать их особенности в цитологических терминах и включить группы с неопределенностями. Наиболее часто используемая категоризация — это пятиуровневая система с категориями от недостаточного количества материалов (C1), доброкачественных (C2), атипичных (C3), подозрительных на злокачественные новообразования (C4) или откровенно злокачественных (C5) (Таблица 1) [ 2].
Этому подходу было оказано большое доверие, поскольку он позволяет избежать стандартной эксцизионной биопсии, когда все три компонента тройного теста однозначно отрицательны или положительны [1]. Тем не менее, при FNAC поражений груди есть случаи, когда дифференциация доброкачественных и злокачественных поражений невозможна.Эта проблема возникает, когда наблюдается нехватка образцов или имеется морфологическое совпадение между доброкачественными и злокачественными образованиями (например, атипичная гиперплазия и низкосортная карцинома in situ или при папиллярных поражениях). В результате и для учета этих проблемных областей используются категории цитологической отчетности, чтобы объективно описать их особенности в цитологических терминах и включить группы с неопределенностями. Наиболее часто используемая категоризация — это пятиуровневая система с категориями от недостаточного количества материалов (C1), доброкачественных (C2), атипичных (C3), подозрительных на злокачественные новообразования (C4) или откровенно злокачественных (C5) (Таблица 1) [ 2]. Эта категоризация помогает цитопатологам определить неопределенные области, а клиницистам разумно предложить дальнейшие исследования, такие как эксцизионная биопсия. Эта категоризация была инициирована национальным координационным комитетом по скринингу груди и национальной программой скрининга груди Великобритании и служит общим диалектом среди всех специалистов по грудному вскармливанию, участвующих в лечении груди.
Эта категоризация помогает цитопатологам определить неопределенные области, а клиницистам разумно предложить дальнейшие исследования, такие как эксцизионная биопсия. Эта категоризация была инициирована национальным координационным комитетом по скринингу груди и национальной программой скрининга груди Великобритании и служит общим диалектом среди всех специалистов по грудному вскармливанию, участвующих в лечении груди.
В соответствии с этой категорией, C1 означает неадекватный аспирационный мазок из-за гипоцеллюлярности, ошибок аспирации, размазывания или окрашивания. Чаще всего недостаточной является степень клеточности эпителиальных клеток [2] (рис. 2. Соответствие FNAC Адекватность FNAC зависит от множества факторов. Частота неадекватной аспирации колеблется от 0,7% до 25,3% (таблица 2), и это зависит от характера поражения, доступных технологий, а также опыта и предпочтений оператора [2].Сообщалось, что характер поражения был наиболее частой причиной неадекватности FNAC, на которую приходилось 68% неадекватных аспиратов, за которым следовал опыт аспиратора, на который приходилось 32% случаев неадекватности [3].
Единого определения адекватности образца молочной железы FNAC пока не достигнуто. Определение адекватности, данное Национальным институтом рака (NCI), привело к решению проблемы, связанной с поражением груди конкретного пациента [7]. Это определение было несколько расплывчатым, лишенным пункта, поддающегося количественной оценке, но имело то преимущество, что оно было очень гибким и давало аспиратору полный мандат на принятие решения о том, согласуются ли цитологические характеристики аспирата с клиническими данными и считаются ли они адекватными [8]. Большинство цитопатологов согласны с тем, что ряд взаимосвязанных параметров являются важными детерминантами адекватности FNAC груди, и они включают клинические данные и результаты визуализации, размер поражения, характеристики аспирации, опыт аспиратора и количество проходов иглы [ 9]. Тем не менее, многие авторы считали кластеры эпителиальных клеток наиболее важным критерием адекватности.Исследования показали, что соответствующее количество кластеров эпителиальных клеток может быть важным фактором в снижении количества ложноотрицательных диагнозов при пальпируемых и непальпируемых образованиях молочной железы [9–13]. Далее было высказано предположение, что отсечение шести кластеров эпителиальных клеток может обеспечить разумный баланс между сокращением ложноотрицательных мазков FNAC и увеличением частоты неадекватных мазков [13]. Поскольку диагностика злокачественных новообразований включает оценку цитологических характеристик эпителиальных клеток, количественная оценка эпителиальных клеток в мазках, скорее всего, полезна [9]. На самом деле проблема не в том, чтобы выбрать, к какой школе мысли следует присоединиться при определении адекватной клеветы. Более практичный подход — учесть результаты тройного теста и появление эпителиальных скоплений. 3. Доброкачественный FNAC Большая часть диагнозов FNAC молочной железы является доброкачественной, что составляет 24–77,5% случаев (Таблица 3). Фиброзно-кистозные изменения представляют собой спектр гистологических особенностей, которые иногда могут быть связаны с кальцификацией.Кистозные изменения представляют собой частую находку. Характерно, что размер кисты варьируется между консультациями, что дает клиницисту дополнительную информацию о ее доброкачественном характере, особенно в сочетании с визуализационными исследованиями.
Другой потенциальный источник путаницы возникает, когда на заднем плане присутствует белковая жидкость, связанная с крупными эпителиальными клетками. с увеличенными ядрами, эозинофильными ядрышками и вакуолизированной тонкой цитоплазмой. Ядерные особенности могут показаться тревожными. Тем не менее, необходимо также следить за изменениями в лактации и собирать соответствующий анамнез, чтобы избежать ложноположительного диагноза [2].FNA играет важную роль, когда дискретный узелок появляется во время беременности или кормления грудью. Это избавляет беременную пациентку от боли и осложнений после удаления. В более ярких примерах утолщение стенки из-за папиллярного апокринного изменения может вызывать присутствие папиллярных кластеров с такими же цитоплазматическими и ядерными деталями [2]. Не все мазки из аспирата кисты легко поддаются оценке. Апокринные клетки, когда они дегенерируют, будут чаще всего казаться атипичными, особенно если они со временем прогрессируют до фазы слипания хроматина с ассоциированным анионуклеозом [2], и они потенциально могут быть помечены как подозрительные (Рисунок 3).При инфицировании или предшествующем разрыве кисты аспирированная жидкость может быть мутной или молочной. Такие аспираты часто содержат дегенерированные клетки и мусор на обильном фоне воспалительных клеток. В этой ситуации его необходимо дифференцировать от редкой плоскоклеточной карциномы, которая может иметь признаки, похожие на воспаленную кисту. Среди солидных поражений груди фиброаденома наиболее распространена, особенно у женщин моложе 40 лет. Клиническая картина очень характерна, и зачастую можно поставить правильный клинический диагноз. FNAC диагностика фиброаденомы очень точная. Lopez-Ferrer сообщил о 79,3% прогностической ценности из 362 аспиратов фиброаденомы, при этом большинство диагностических ошибок приходится на старшую возрастную группу [15].Цитологически аспираты являются гиперклеточными с характерными однослойными слоями доброкачественных эпителиальных клеток, смешанных с миоэпителиальными клетками. Эти листы часто называют «оленьими рогами», имеющими по краям роговидную форму (рис. 4). Этот паттерн отражает конфигурацию протоков, наблюдаемую на гистологических срезах [2, 16]. В мазке из аспирата часто оценивают клеточную когезию. Эпителиальные клетки сопровождают фибриллярные стромальные материалы, клеточность которых может различаться, а иногда и миксоидные изменения (рис. В целом FNAC показал высокую чувствительность до 68–97% в фиброаденомах [15, 17], и было продемонстрировано, что общая клеточность, количество биполярных ядер количество и структура эпителия, апокринная метаплазия, перекрытие ядер и плеоморфизм, пенистые клетки и строма являются важными цитологическими параметрами при различении фиброаденом от папиллом, некроза жира, фиброзно-кистозных изменений и эктазии протоков [16]. Выделения из сосков — одна из тревожных жалоб, которая побуждает пациентов обращаться за медицинской помощью. Обычно это папиллярное поражение одного из основных млечных протоков [2]. Внутрипротоковые папилломы обычно единичны и чаще всего обнаруживаются в субареолярной области. Это относительно часто, составляя 2,5% всех доброкачественных иссечения груди [16]. Он рассматривается как четко выраженная масса, которая рентгенологически представляет собой массу мягких тканей с низкой плотностью без окружающих архитектурных искажений или реакции ткани.Кальцификация, если она присутствует, обычно бывает дистрофического и криволинейного типа [2]. Кроме того, в папилломах также можно увидеть сосочковые листья, напоминающие скопления оленьего рога. Было обнаружено, что пенистые клетки в ассоциации с этими листочками являются одним из наиболее специфических признаков дифференциации папилломы от фиброаденомы [2, 16]. Папилломы в FNAC могут вызывать диагностические проблемы. Точность FNAC в диагностике папиллярных поражений и дифференциации доброкачественных и злокачественных папиллярных поражений низкая [20]. 4. Ложноотрицательный FNACFNAC неопровержимо и значительно способствовал сокращению количества эксцизионных биопсий при оценке поражений груди, особенно в контексте тройной оценки [24].Тем не менее, по-прежнему существует значительный уровень ложноотрицательных результатов для FNAC в диапазоне 1,2–10,6% (Таблица 4). Это может привести к пропущенной / поздней диагностике и лечению [25], иногда с неблагоприятным клиническим исходом. Это стало серьезной проблемой, побудившей лаборатории и патолога к переоценке ограничений адекватности, системы направлений и методов обработки. Предыдущие исследования показали, что чувствительность, специфичность и точность FNAC молочной железы варьировались от 77% до 100% [24, 26–29].
Причины, лежащие в основе ложного отрицания ошибки и истинно ложноотрицательные факторы. Непальпируемые поражения составляют особую категорию поражений, обнаруживаемых на экране. В одном исследовании 21% ложноотрицательных результатов FNAC молочной железы был вызван непальпируемыми опухолями [31]. Основной проблемой, связанной с FNAC непальпируемых поражений, была непостоянная, но иногда неприемлемо высокая частота [32] неадекватности.
5. Ложноположительный FNACЛожноположительный диагноз при аспирационной цитологии значительно ниже по частоте по сравнению с ложноотрицательными случаями. Судя по предыдущим отчетам, ложноположительные случаи варьируются от 0% до 2% (таблица 6), в большинстве исследований сообщается о 100% положительной прогностической ценности. Среди зарегистрированных случаев наиболее частым поражением, дающим ложноположительный результат аспирации, является гиперплазия протока или дольчатая гиперплазия.Этот вывод также согласуется с предыдущими сообщениями о том, что фиброзно-кистозные изменения и связанные с беременностью новообразования в груди являются причиной ложноположительных результатов [25]. В большинстве рассмотренных случаев рентгенологические данные в большинстве случаев не определяют рак груди и требуют подтверждения гистологией.
6.Резюме FNAC является важным компонентом предоперационного лечения поражений груди. Его точность, простота использования и доступность — факторы, которые обуславливают его популярность. Появление технологии визуализации вместе с клиническим опытом клиницистов способствовало повышению ее чувствительности. Распределение поражений груди, диагностированных цитологическим исследованием у пациентов с симптомами в Эритрейской национальной лаборатории здравоохранения, Асмэра, Эритрея: ретроспективное исследование | BMC Women’s Health Заболеваемость раком груди во всем мире растет тревожными темпами, что создает угрозу общественному здоровью и оказывает неблагоприятное косметическое воздействие преимущественно на женщин [19,20,21,22].Цитология тонкоигольной аспирации зарекомендовала себя как важный инструмент в оценке поражений груди с тех пор, как она была впервые представлена Мартином и Эллисом в первой половине двадцатого века. Это предпочтительный метод предоперационной диагностики патологий груди в областях, где ресурсы ограничены [3, 10, 11, 12]. В этом ретроспективном исследовании из 905 пациентов 874 (96,6%) были женщинами, как и в исследованиях Otieno et al. [23] и Nwafor et al. [24], где женщины составляли 98% исследуемой популяции. Средняя продолжительность симптомов заболевания на момент обращения составила семь месяцев, что аналогично сообщениям других африканских исследований, таких как Гана [25] и Кения [23]. Задержка обращения в медицинское учреждение не редкость, по-видимому, в результате социальных барьеров, ограниченного доступа к медицинским услугам, недостаточной осведомленности и других индивидуальных факторов, которые могут привести к поздней диагностике, что отрицательно сказывается на исходах заболевания [26]. При обращении за медицинской помощью наиболее частыми клиническими симптомами у наших пациентов были пальпируемое уплотнение в груди с последующей масталгией, что аналогично результатам Salzman et al. [4] и Nkonge et al. [5]. Пациенты с поражением груди также могут иметь несколько симптомов одновременно. Исследование, проведенное в Гане [25], показало, что пациенты, у которых наблюдалась только боль в груди, имели более низкую частоту злокачественных новообразований груди по сравнению с комбинированными симптомами боли и уплотнения в груди или выделений из сосков (16% и 1%).24% соответственно). Следовательно, следует проявлять большую осторожность при оценке пациентов с множественными симптомами по сравнению с пациентами с одним симптомом. Правильный подход к диагностике поражений молочной железы в цитологии предполагает соответствующее взаимодействие между экспертами из различных дисциплин, включая медицинскую онкологию, хирургию, радиологию и цитопатологию [9, 27]. Использование FNAC в качестве начального теста, сопровождаемого стандартизованной системой отчетности, очень важно, поскольку оно поддерживает согласованность в различных условиях практики. Что касается диагнозов, зависящих от пола, два наиболее часто наблюдаемых доброкачественных поражения груди у женщин — это фиброаденома и фиброзно-кистозная болезнь груди, что согласуется с исследованиями, проведенными Pudasaini et al.[30], Джамал [31] и Панджвани и др. [3]. В соответствии с этими исследованиями, наши результаты документально подтвердили, что протоковая карцинома груди была наиболее часто диагностируемым злокачественным поражением груди у пациентов старше 40 лет. Однако среди мужского населения гинекомастия представляет собой наиболее частое поражение. Следовательно, сходство наших результатов с результатами, о которых сообщается в других источниках, позволяет предположить, что паттерны поражений груди у населения Эритреи, вероятно, не отличаются от остального мира. После применения системы классификации IAC Yokohama мы обнаружили значительную связь между повышенным риском злокачественных новообразований груди и возрастом пациентки старше 40 лет ( p <0,001). Было обнаружено, что более четверти всех поражений груди (26%) в возрастном диапазоне от 41 до 50 лет являются злокачественными (как показано в Таблице 4). Несмотря на то, что точный предельный возраст для «молодых женщин» в онкологии груди является спорным [32], у значительного числа субъектов нашего исследования были злокачественные результаты FNAC на четвертом и пятом десятилетиях жизни.Исследование, проведенное в Испании [33], показало, что заболеваемость раком груди неуклонно увеличивалась среди женщин в возрасте 25–44 лет в течение 25 лет (1980–2004 гг.). Точно так же Bouchardy et al. Сообщили о значительном увеличении частоты злокачественных новообразований груди у молодых женщин. с 1995 по 2004 год (с 19,7 до 53,9 на 100 000 соответственно). Напротив, документально подтверждено, что злокачественные новообразования груди реже встречаются у женщин в возрасте до 40 лет, а общий риск достигает примерно 0. Однако, когда рак груди возникает у молодых женщин, это сложно и разрушительно с плохим прогнозом, главным образом из-за риска местных и отдаленных метастазов, ведущих к плохой выживаемости пациентов [35,36,37,38]. Таким образом, клинические и патологические особенности рака груди, встречающегося у молодых пациентов, отличаются от тех, что диагностированы в пожилом возрасте. Рак молочной железы, диагностированный у молодых женщин, имеет больший размер опухоли, более высокий индекс пролиферации, повышенную скорость метастазов в лимфатические узлы и лимфо-сосудистую инвазию, а также более плохую гистологическую дифференциацию [39].Более того, повышенная частота трижды отрицательного рака груди наблюдается у молодых женщин со злокачественными новообразованиями груди [40]. Взятые вместе, эти факты указывают на то, что рак груди у молодых женщин является тяжелым заболеванием, имеющим не только неблагоприятные медицинские исходы, но и негативные психосоциальные последствия, поскольку болезнь может возникать на пике их репродуктивного возраста, что делает пациентов недееспособными из-за борьбы за баланс между семьей. Общая тенденция поражений молочной железы, классифицированных системой IAC в течение периода исследования, показана на рис. 2. Наибольшая величина для всех диагностических категорий (злокачественные, подозрительные, атипичные и доброкачественные) была зарегистрирована в 2014 г., а наименьшее число в каждой. категория наблюдалась в 2015 году.У нас не могло быть никаких явных причин для таких колебаний количества случаев за исследуемый период. Относительно большой размер выборки и тот факт, что исследование проводилось в испытательном центре, который является единственным национальным центром цитологической диагностики образцов, отражают потенциальные сильные стороны нашего исследования.
Советы из других журналов — Американский семейный врачСоветы из других журналов Am Fam Physician. Дифференцировать кисту от твердого поражения груди с помощью УЗИ может быть сложно, особенно если киста содержит легкие эхогенные белковые частицы. Некоторые специалисты рекомендуют плановое цитологическое исследование жидкости из кист груди, в то время как другие считают, что это бесполезно. Однако большинство авторов рекомендуют цитологический анализ, если жидкость кровоточит. Предыдущие исследования полезности цитологического анализа жидкости из кист груди проводились у женщин с пальпируемыми образованиями груди.Смит и его коллеги изучали полезность цитологического исследования жидкости из непальпируемых новообразований молочной железы с сонографическим проявлением простых кист. Ретроспективно проанализированы результаты цитологического исследования у 583 женщин (660 непальпируемых кист груди) за 42 месяца. Жидкость получали с помощью пункционной аспирации под сонографическим или маммографическим контролем. При цитологическом исследовании жидкости из 541 кисты (82% кист) злокачественные клетки не обнаружены. Кровянистая жидкость была получена из 42 кист.Три имели темный цвет, что указывало на старую кровь, но при цитологическом исследовании атипичных клеток не было обнаружено. Из оставшихся 39 кист с кровянистой жидкостью в пяти при цитологическом исследовании были обнаружены атипичные клетки. Четверо из этих пяти пациентов прошли биопсию, и все результаты были доброкачественными. Авторы приходят к выводу, что если жидкость, полученная в результате аспирации непальпируемых кист молочной железы под рентгенологическим контролем, не кровоточит, обычное цитологическое исследование не требуется, если другие рентгенологические данные не указывают на злокачественность. Аспирация тонкой иглой | Диагностика рака грудиТонкоигольная аспирация (FNA) — это способ взятия образца клеток из ткани груди. Ваш врач использует тонкую иглу и шприц для взятия клеток. Затем образцы можно исследовать под микроскопом. Его также называют тонкоигольной аспирационной цитологией или FNAC. Вы можете пройти этот тест в амбулаторном отделении больницы.Или у вас может быть это в универсальной клинике груди после других тестов, таких как рентген груди (маммограмма) или УЗИ груди. Подготовка к аспирации тонкой иглойВы можете нормально есть и пить перед FNA. Принимайте лекарства как обычно. Но если вы принимаете какие-либо разжижающие кровь лекарства, возможно, вам придется отменить их до обследования. Ваш врач или медсестра скажут вам, когда следует остановиться. Что происходит? Ваш врач или медсестра предоставят вам информацию о тесте. Аспирация с помощью тонкой иглы занимает несколько минут, но вы будете с врачом около 15 минут. Часть этого времени — убедиться, что вы понимаете процедуру и чувствуете себя комфортно. Вы лежите на кушетке, и врач или медсестра делает УЗИ вашей груди. Это найдет нужное место для взятия пробы. Врач очищает область груди. Затем они осторожно вводят небольшую иглу в вашу грудь и берут образец жидкости и клеток.Вы можете почувствовать давление на грудь, но это не должно быть слишком болезненно. Сообщите врачу, если вам больно. Когда у них есть образец клеток, они удаляют иглу. На тестовую площадку накладывают небольшой пластырь. Образец отправляется в лабораторию, где врач-специалист внимательно изучает клетки. После аспирации тонкой иглойВы можете одеться и сразу же пойти домой или вернуться на работу. Пластырь можно снять через пару часов. Вы можете принять парацетамол, если у вас болезненная или болезненная грудь. Иногда можно заметить синяк в этой области, это нормально. Пойдет через неделю-две. Получение результатовВы должны получить результаты в течение 1-2 недель на контрольном приеме. Ожидание результатов тестирования может быть очень тревожным временем. У вас могут быть контактные данные медсестры-специалиста, к которой вы можете обратиться за информацией в случае необходимости.Может быть полезно поговорить с близким другом или родственником о том, что вы чувствуете. Вы также можете связаться с медсестрами по исследованию рака в Великобритании по бесплатному телефону 0808 800 4040 для получения информации и поддержки. Очереди открыты с 9:00 до 17:00 с понедельника по пятницу. Обратитесь к врачу, который назначил анализ, если вы ничего не услышите через пару недель. Возможные риски Аспирация тонкой иглой — очень безопасная процедура, но медсестра / медбрат скажет вам, к кому обратиться, если у вас возникнут какие-либо проблемы после теста.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

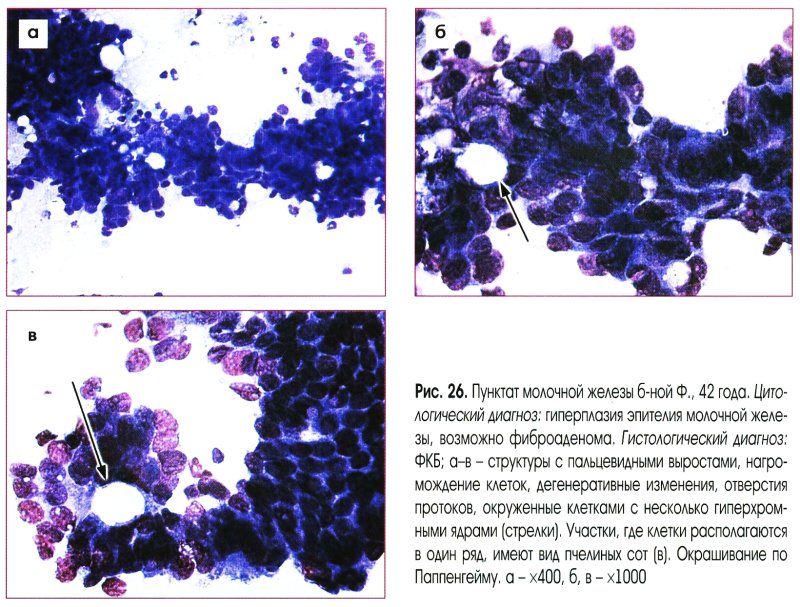

 1). Точное определение того, что составляет неадекватный аспират, остается загадкой, и этот субъективный вопрос лучше всего определяется интерпретатором аспирата, независимо от того, можно ли поставить достоверный диагноз на основе количества аспирированных материалов.Категория C2 предназначена для мазков, которые обычно являются клеточными, показывающими характерные образцы различных доброкачественных образований. Нет атипичных или злокачественных признаков. Обычно видны конфигурации протоков, миоэпителиальные клетки и биполярные ядра. Часто встречается воспалительный фон. Напротив, C3 и C4 — серые зоны. C3 представляет характеристики доброкачественного мазка, но есть особенности, которые обычно не видны в явно доброкачественных образцах, такие как скученность клеток, плеоморфизм и дискогезия.C4 зарезервирован для аспирата, где атипичные признаки очевидны, но присутствуют такие факторы, как плохая сохранность, гипоцеллюлярность или компоненты доброкачественного мазка, что препятствует постановке точного диагноза злокачественного новообразования.
1). Точное определение того, что составляет неадекватный аспират, остается загадкой, и этот субъективный вопрос лучше всего определяется интерпретатором аспирата, независимо от того, можно ли поставить достоверный диагноз на основе количества аспирированных материалов.Категория C2 предназначена для мазков, которые обычно являются клеточными, показывающими характерные образцы различных доброкачественных образований. Нет атипичных или злокачественных признаков. Обычно видны конфигурации протоков, миоэпителиальные клетки и биполярные ядра. Часто встречается воспалительный фон. Напротив, C3 и C4 — серые зоны. C3 представляет характеристики доброкачественного мазка, но есть особенности, которые обычно не видны в явно доброкачественных образцах, такие как скученность клеток, плеоморфизм и дискогезия.C4 зарезервирован для аспирата, где атипичные признаки очевидны, но присутствуют такие факторы, как плохая сохранность, гипоцеллюлярность или компоненты доброкачественного мазка, что препятствует постановке точного диагноза злокачественного новообразования. Эта двусмысленность показывает важность корреляции с другими дисциплинами. Также подчеркивается, что результат FNAC не должен выходить за рамки возможностей и опыта интерпретатора, чтобы уменьшить как положительные, так и отрицательные ошибки [2]. Категория C5 состоит из клеточного аспирата с явно злокачественными цитологическими признаками.Поскольку много обсуждалось об атипичных, подозрительных и злокачественных категориях, эта статья будет ограничена адекватными (или неадекватными) и доброкачественными категориями вместе с ложноотрицательными и ложноположительными случаями.
Эта двусмысленность показывает важность корреляции с другими дисциплинами. Также подчеркивается, что результат FNAC не должен выходить за рамки возможностей и опыта интерпретатора, чтобы уменьшить как положительные, так и отрицательные ошибки [2]. Категория C5 состоит из клеточного аспирата с явно злокачественными цитологическими признаками.Поскольку много обсуждалось об атипичных, подозрительных и злокачественных категориях, эта статья будет ограничена адекватными (или неадекватными) и доброкачественными категориями вместе с ложноотрицательными и ложноположительными случаями.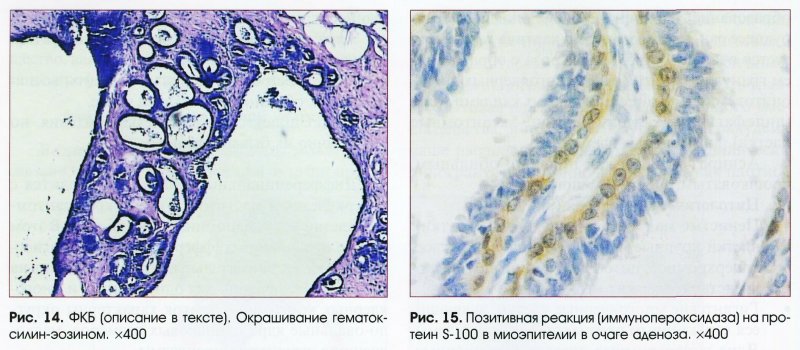 Во время процедуры ценно сотрудничество пациента, и хорошо информированный пациент с хорошими отношениями с оператором FNAC значительно облегчит процедуру и улучшит результат с точки зрения адекватности. Таким образом, каждая процедура должна быть структурирована и ограничена клинически и радиологически подходящими сценариями [2].Некоторые исследования утверждали, что в идеале аспиратор и интерпретатор должны быть одинаковыми, поскольку количество неадекватных аспиратов было намного ниже, а точность диагноза была выше, когда один и тот же человек делал аспирацию и сообщал об образцах [2, 4, 5]. Средняя частота неудовлетворительной аспирации у непатолога была вдвое выше, чем у патолога [6].
Во время процедуры ценно сотрудничество пациента, и хорошо информированный пациент с хорошими отношениями с оператором FNAC значительно облегчит процедуру и улучшит результат с точки зрения адекватности. Таким образом, каждая процедура должна быть структурирована и ограничена клинически и радиологически подходящими сценариями [2].Некоторые исследования утверждали, что в идеале аспиратор и интерпретатор должны быть одинаковыми, поскольку количество неадекватных аспиратов было намного ниже, а точность диагноза была выше, когда один и тот же человек делал аспирацию и сообщал об образцах [2, 4, 5]. Средняя частота неудовлетворительной аспирации у непатолога была вдвое выше, чем у патолога [6]. [38]
[38] Это было бы особенно полезно, когда и аспиратор, и интерпретатор образца были одинаковыми.
Это было бы особенно полезно, когда и аспиратор, и интерпретатор образца были одинаковыми. Однако другие авторы предложили не требовать минимального количества эпителиальных клеток протока в качестве критерия адекватности, и оценка больше полагалась на неклеточные характеристики FNA, такие как уверенность и опыт клинициста или оператора в отношении размещения иглы, сопротивление масса иглы и корреляция с клиническими и физическими данными [8], то есть с использованием подхода тройной оценки. Аргументом в пользу этого подхода было то, что если применить определенное количество кластеров эпителиальных клеток протоков [3–10], до 35–40% истинно отрицательных FNAC с использованием неколичественного метода станут неудовлетворительными, что вынудит пациентов пройти более дорогостоящее лечение. и, возможно, ненужные тренировки [8].Типичными примерами могут быть кисты молочной железы, при которых аспираты обычно дают гистиоциты без эпителиальных клеток. Неадекватный диагноз для аспирата, который разрушил кисту с выделением значительного количества серозной жидкости, затруднит корреляцию с клиническими параметрами.
Однако другие авторы предложили не требовать минимального количества эпителиальных клеток протока в качестве критерия адекватности, и оценка больше полагалась на неклеточные характеристики FNA, такие как уверенность и опыт клинициста или оператора в отношении размещения иглы, сопротивление масса иглы и корреляция с клиническими и физическими данными [8], то есть с использованием подхода тройной оценки. Аргументом в пользу этого подхода было то, что если применить определенное количество кластеров эпителиальных клеток протоков [3–10], до 35–40% истинно отрицательных FNAC с использованием неколичественного метода станут неудовлетворительными, что вынудит пациентов пройти более дорогостоящее лечение. и, возможно, ненужные тренировки [8].Типичными примерами могут быть кисты молочной железы, при которых аспираты обычно дают гистиоциты без эпителиальных клеток. Неадекватный диагноз для аспирата, который разрушил кисту с выделением значительного количества серозной жидкости, затруднит корреляцию с клиническими параметрами. Аналогичные ситуации наблюдаются в рубцах после мастэктомии с фиброзом, когда затвердевшая фиброзная область дает очень низкий выход, а маркировка, такая как неадекватная, может вызвать беспокойство у пациентов и побудить к ненужным последующим исследованиям или иссечениям.
Аналогичные ситуации наблюдаются в рубцах после мастэктомии с фиброзом, когда затвердевшая фиброзная область дает очень низкий выход, а маркировка, такая как неадекватная, может вызвать беспокойство у пациентов и побудить к ненужным последующим исследованиям или иссечениям.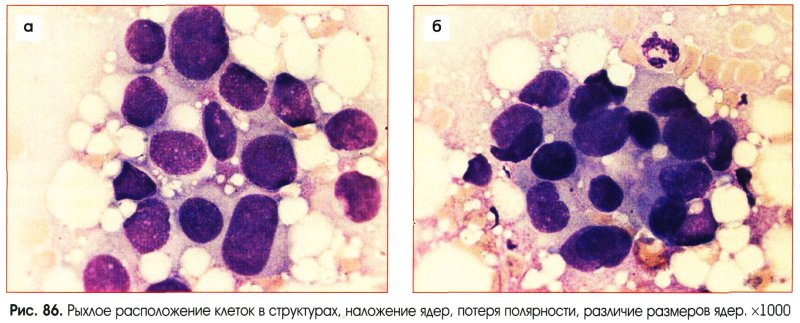 В большинстве ситуаций аспирированную жидкость кисты нельзя обычно сдавать на цитологическую оценку, за исключением тех случаев, когда жидкость окрашена кровью, мутная или мутная или когда образования остаются несжатыми и пальпируются после аспирации. В большинстве случаев мазки показывают только макрофаги, смешанные с другими воспалительными клетками, что подтверждает кистозный характер поражения.Протоковые эпителиальные и миоэпителиальные клетки также часто видны в аспирате кисты, в основном в виде небольших шариков и скоплений, смешанных с макрофагами (рис. 2). Апокринные клетки, выстилающие полость кисты, могут расслаиваться, показывая характерную эозинофильную цитоплазму и круглые ядра с отчетливыми ядрышками. Приведенные выше данные об апокринных клетках, макрофагах и протоковых клетках являются характерными чертами непролиферативного типа фиброзно-кистозных изменений, по которым материалов мало. Когда имеется значительный компонент пролиферации эпителия, обычно видны пласты и плотные скопления клеток.
В большинстве ситуаций аспирированную жидкость кисты нельзя обычно сдавать на цитологическую оценку, за исключением тех случаев, когда жидкость окрашена кровью, мутная или мутная или когда образования остаются несжатыми и пальпируются после аспирации. В большинстве случаев мазки показывают только макрофаги, смешанные с другими воспалительными клетками, что подтверждает кистозный характер поражения.Протоковые эпителиальные и миоэпителиальные клетки также часто видны в аспирате кисты, в основном в виде небольших шариков и скоплений, смешанных с макрофагами (рис. 2). Апокринные клетки, выстилающие полость кисты, могут расслаиваться, показывая характерную эозинофильную цитоплазму и круглые ядра с отчетливыми ядрышками. Приведенные выше данные об апокринных клетках, макрофагах и протоковых клетках являются характерными чертами непролиферативного типа фиброзно-кистозных изменений, по которым материалов мало. Когда имеется значительный компонент пролиферации эпителия, обычно видны пласты и плотные скопления клеток. Присутствие атипии в этих клеточных кластерах может быть дополнительно оценено на основании клеточного и ядерного расстояния, множественных ядрышек и характера материалов хроматина. Когда встречаются эти цитологические особенности, следует исключить внутрипротоковую папиллому и фиброаденому. Внутрипротоковая папиллома, хотя цитологически неотличима от пролиферативных фиброзно-кистозных изменений, часто сопровождается выделениями из сосков и пальпируемыми субареолярными образованиями.
Присутствие атипии в этих клеточных кластерах может быть дополнительно оценено на основании клеточного и ядерного расстояния, множественных ядрышек и характера материалов хроматина. Когда встречаются эти цитологические особенности, следует исключить внутрипротоковую папиллому и фиброаденому. Внутрипротоковая папиллома, хотя цитологически неотличима от пролиферативных фиброзно-кистозных изменений, часто сопровождается выделениями из сосков и пальпируемыми субареолярными образованиями. [39]
[39]
 Радиологически он описывается как масса низкой плотности с четко выраженными границами. Кальцификация может не часто присутствовать при фиброаденоме, особенно в молодой возрастной группе, но для пожилого населения характерна кальцификация попкорна [14]. Множественные фиброаденомы выявляются в 15–20% случаев [2].
Радиологически он описывается как масса низкой плотности с четко выраженными границами. Кальцификация может не часто присутствовать при фиброаденоме, особенно в молодой возрастной группе, но для пожилого населения характерна кальцификация попкорна [14]. Множественные фиброаденомы выявляются в 15–20% случаев [2]. 5).Обычно фон аспирата состоит из множества обнаженных / биполярных ядер (рис. 6). Это один из характерных цитологических признаков фиброаденомы. Дополнительное присутствие большого количества биполярных ядер на фоне мазка — надежный признак в пользу фиброаденомы [2]. Есть аспираты, на которых рога рога могут быть менее выражены, но это может быть образец фиброаденомы с периканаликулярным рисунком. Ветвление эпителиальных пластинок чаще встречается, если аспирированный образец взят из интраканаликулярной формы (рис. 7).Наиболее часто встречающимися цитологическими признаками фиброаденомы являются фибромиксоидная строма, скопления оленьего рога и многочисленные одиночные голые ядра, которые наблюдаются в 92,7%, 73,6% и 73,6% случаев соответственно [17]. Эти данные составляют диагностическую триаду фиброаденомы. Есть случаи, когда диагноз фиброаденомы при цитологическом исследовании не является прямым. Отсутствие каких-либо компонентов диагностической триады и низкая клеточность — частые причины ошибок при пропущенной цитодиагностике фиброаденомы [17] (таблица 3).
5).Обычно фон аспирата состоит из множества обнаженных / биполярных ядер (рис. 6). Это один из характерных цитологических признаков фиброаденомы. Дополнительное присутствие большого количества биполярных ядер на фоне мазка — надежный признак в пользу фиброаденомы [2]. Есть аспираты, на которых рога рога могут быть менее выражены, но это может быть образец фиброаденомы с периканаликулярным рисунком. Ветвление эпителиальных пластинок чаще встречается, если аспирированный образец взят из интраканаликулярной формы (рис. 7).Наиболее часто встречающимися цитологическими признаками фиброаденомы являются фибромиксоидная строма, скопления оленьего рога и многочисленные одиночные голые ядра, которые наблюдаются в 92,7%, 73,6% и 73,6% случаев соответственно [17]. Эти данные составляют диагностическую триаду фиброаденомы. Есть случаи, когда диагноз фиброаденомы при цитологическом исследовании не является прямым. Отсутствие каких-либо компонентов диагностической триады и низкая клеточность — частые причины ошибок при пропущенной цитодиагностике фиброаденомы [17] (таблица 3). Гигантские клетки редко встречаются в фиброаденомах (рис. 8). В отчете Коллура и Эль Хага он показал повышенную заболеваемость, присутствуя в 31,8% случаев с аспирацией [17]. Эти гигантские клетки изменчивы по внешнему виду, считаются стромальными по происхождению [18, 19] и имеют небольшое прогностическое значение. В большинстве исследований сообщалось о наличии этих гигантских стромальных клеток, присутствующих в фиброэпителиальных поражениях молочной железы, но чаще встречающихся в опухолях филлодий, чем в фиброаденомах [18, 19].Иногда гигантские клетки могут указывать на внеопухолевый реактивный процесс в окружающей ткани груди, который может быть следствием пальпаторной гранулемы или некроза жира [17]. Известно, что фиброаденому трудно отличить от опухоли филлодий с помощью аспирационной цитологии, но есть некоторые особенности, которые более характерны для опухолей филлодий, которые подтверждают ее цитологический диагноз. Клеточный аспират с многочисленными пухлыми и веретенообразными ядрами, ярко выраженная гиперцеллюлярность стромальных фрагментов и наличие атипии являются ключевыми моментами, которые подтверждают диагноз филлодарной опухоли по сравнению с фиброаденомами.
Гигантские клетки редко встречаются в фиброаденомах (рис. 8). В отчете Коллура и Эль Хага он показал повышенную заболеваемость, присутствуя в 31,8% случаев с аспирацией [17]. Эти гигантские клетки изменчивы по внешнему виду, считаются стромальными по происхождению [18, 19] и имеют небольшое прогностическое значение. В большинстве исследований сообщалось о наличии этих гигантских стромальных клеток, присутствующих в фиброэпителиальных поражениях молочной железы, но чаще встречающихся в опухолях филлодий, чем в фиброаденомах [18, 19].Иногда гигантские клетки могут указывать на внеопухолевый реактивный процесс в окружающей ткани груди, который может быть следствием пальпаторной гранулемы или некроза жира [17]. Известно, что фиброаденому трудно отличить от опухоли филлодий с помощью аспирационной цитологии, но есть некоторые особенности, которые более характерны для опухолей филлодий, которые подтверждают ее цитологический диагноз. Клеточный аспират с многочисленными пухлыми и веретенообразными ядрами, ярко выраженная гиперцеллюлярность стромальных фрагментов и наличие атипии являются ключевыми моментами, которые подтверждают диагноз филлодарной опухоли по сравнению с фиброаденомами.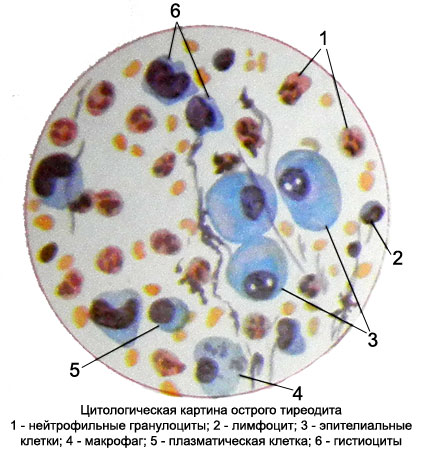 Однако эти отличительные особенности могут присутствовать не во всех случаях. Присутствие большего количества стромальных фрагментов над эпителиальными фрагментами (более высокое соотношение стромального эпителия) и присутствие одиночных столбчатых клеток на заднем плане являются одними из «мягких признаков», сообщаемых для идентификации филлодарной опухоли над фиброаденомой. В чрезвычайно редких случаях, когда встречается злокачественная филлодическая опухоль, саркомные веретенообразные клетки внутри клеточных стромальных фрагментов могут быть решающими для постановки диагноза.Фиброаденомы также необходимо дифференцировать от папиллом в силу того факта, что последние показывают наличие небольших клеточных клубков или скоплений в мазках либо оленьего рога, либо папиллярной конфигурации.
Однако эти отличительные особенности могут присутствовать не во всех случаях. Присутствие большего количества стромальных фрагментов над эпителиальными фрагментами (более высокое соотношение стромального эпителия) и присутствие одиночных столбчатых клеток на заднем плане являются одними из «мягких признаков», сообщаемых для идентификации филлодарной опухоли над фиброаденомой. В чрезвычайно редких случаях, когда встречается злокачественная филлодическая опухоль, саркомные веретенообразные клетки внутри клеточных стромальных фрагментов могут быть решающими для постановки диагноза.Фиброаденомы также необходимо дифференцировать от папиллом в силу того факта, что последние показывают наличие небольших клеточных клубков или скоплений в мазках либо оленьего рога, либо папиллярной конфигурации.
 Среди аспиратов с диагнозом атипичность внутрипротоковая папиллома составляет около 6% [21]. Для папиллом типичная картина FNAC, состоящая из папиллярных листочков, клеточных клубков и столбчатых клеток, не может быть полностью видна в аспирате, что также может быть осложнено геморрагическим фоном (Рисунки 9 и 10). При такой цитологической картине возможно наличие злокачественного новообразования. Проблемы также возникают, когда папилломы осложняются эпителиальной гиперплазией, гиалинизацией или апокринными изменениями, поскольку они могут давать гипоцеллюлярные или гиперклеточные мазки с плеоморфными клетками, показывающими заметные и фоновые некротические остатки [22, 23].На сегодняшний день не существует четко определенных цитологических критериев, позволяющих дифференцировать доброкачественные и злокачественные папиллярные поражения. Их значительное совпадение с точки зрения архитектуры и цитологической атипии является основными причинами, по которым их не дифференцируют цитологически [20, 21].
Среди аспиратов с диагнозом атипичность внутрипротоковая папиллома составляет около 6% [21]. Для папиллом типичная картина FNAC, состоящая из папиллярных листочков, клеточных клубков и столбчатых клеток, не может быть полностью видна в аспирате, что также может быть осложнено геморрагическим фоном (Рисунки 9 и 10). При такой цитологической картине возможно наличие злокачественного новообразования. Проблемы также возникают, когда папилломы осложняются эпителиальной гиперплазией, гиалинизацией или апокринными изменениями, поскольку они могут давать гипоцеллюлярные или гиперклеточные мазки с плеоморфными клетками, показывающими заметные и фоновые некротические остатки [22, 23].На сегодняшний день не существует четко определенных цитологических критериев, позволяющих дифференцировать доброкачественные и злокачественные папиллярные поражения. Их значительное совпадение с точки зрения архитектуры и цитологической атипии является основными причинами, по которым их не дифференцируют цитологически [20, 21].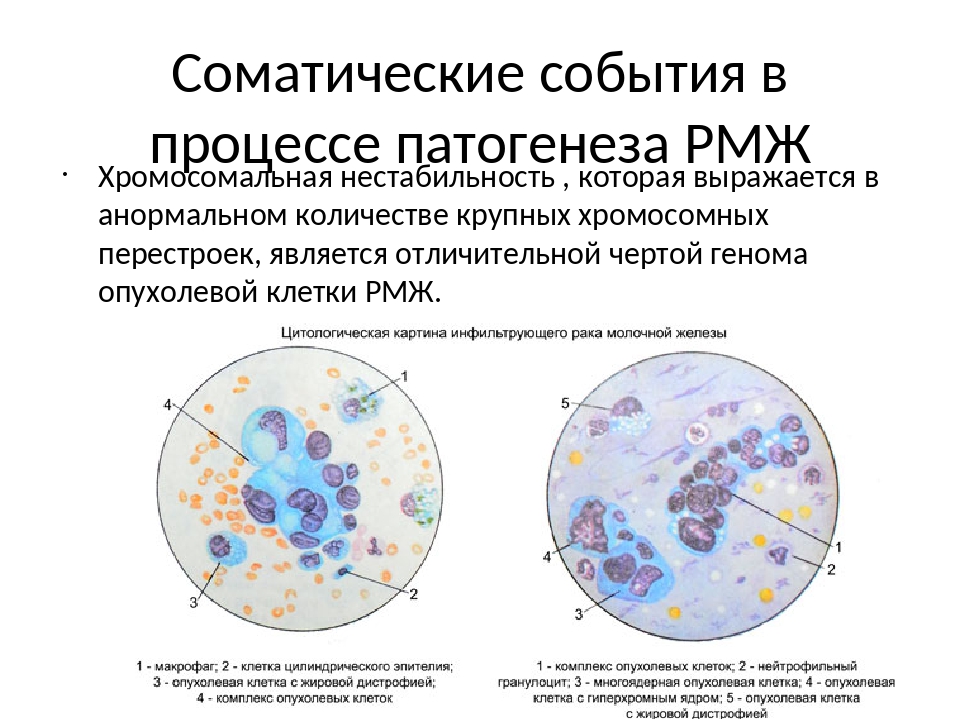
 [39]
[39]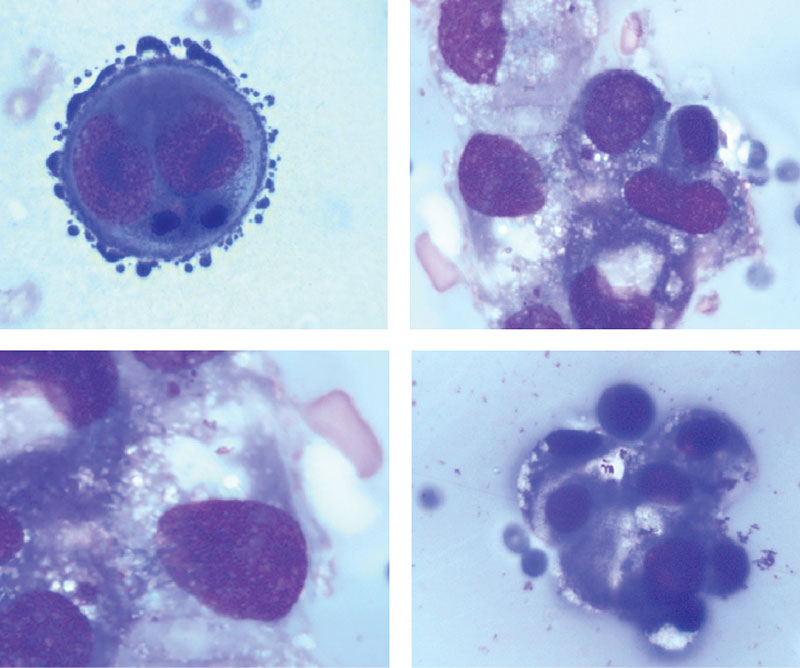 Диагностические ошибки могут быть связаны с недостаточной подготовкой, чрезмерным количеством случаев и несовпадением с клиническими и рентгенологическими данными пациента [6]. В случае истинно ложноотрицательных факторов знаменателями являются плохая методика отбора проб, неправильная локализация опухоли или наличие четко определенной опухоли, демонстрирующей минимальную атипию [29, 30]. Широкое распространение скрининга молочных желез и прогресс в методах визуализации также привели к обнаружению небольших поражений, и понятно, что FNAC этих небольших поражений имеет значительный риск пропустить эти поражения, что приводит к потенциально ложноотрицательным результатам.
Диагностические ошибки могут быть связаны с недостаточной подготовкой, чрезмерным количеством случаев и несовпадением с клиническими и рентгенологическими данными пациента [6]. В случае истинно ложноотрицательных факторов знаменателями являются плохая методика отбора проб, неправильная локализация опухоли или наличие четко определенной опухоли, демонстрирующей минимальную атипию [29, 30]. Широкое распространение скрининга молочных желез и прогресс в методах визуализации также привели к обнаружению небольших поражений, и понятно, что FNAC этих небольших поражений имеет значительный риск пропустить эти поражения, что приводит к потенциально ложноотрицательным результатам.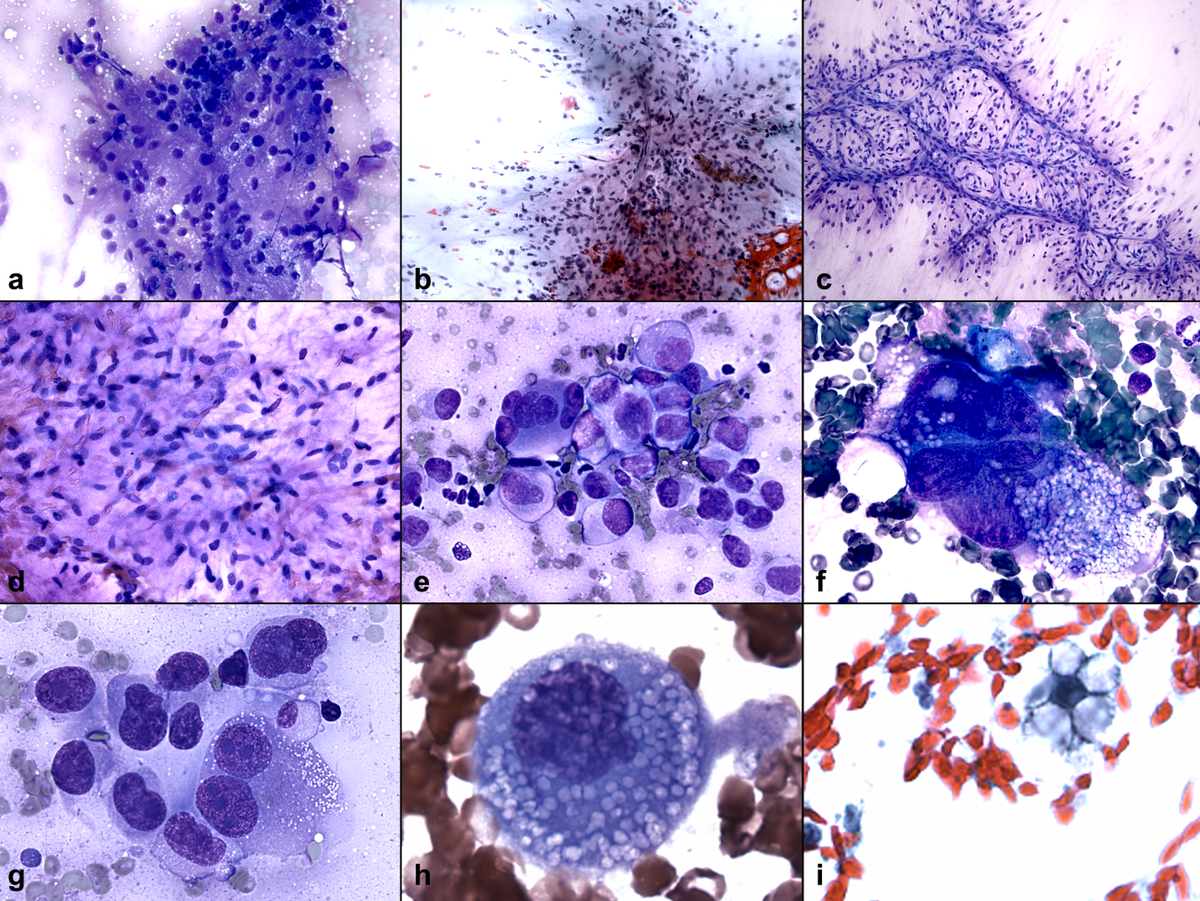 Ранее сообщалось о уровне неадекватности 34–58% [33, 34], а самый низкий уровень неадекватности был около 10% [35, 36]. Достижение адекватности аспирата этих непальпируемых очагов представляет собой большую проблему из-за их небольших размеров во многих случаях, а также из-за наличия фиброзного компонента.В настоящее время лечение этих поражений всегда включает КТ или ультразвуковое наблюдение, чтобы лучше определить и локализовать поражение при аспирации. Помимо размера опухоли, степень злокачественности опухоли также была важным фактором риска ложноотрицательных FNAC (Таблица 5). В отчете Bulgaresi о ложноотрицательных сообщениях FNAC, 24,3% приходились на особые типы опухолей, 39% из которых были опухолями низкой степени злокачественности [31]. Сходство лобулярной карциномы с лимфоцитами и ее тонкая цитологическая атипия — хорошо известные диагностические проблемы.Протоковая карцинома, не указанный подтип (БДУ), составляла 2/3 ложноотрицательных случаев в другой серии [37]. В результате непальпируемые поражения составляют особую «слепую зону», не поддающуюся лечению FNAC, и действительно, большинство авторов рекомендуют биопсию стержневой иглой для обработки таких поражений [32].
Ранее сообщалось о уровне неадекватности 34–58% [33, 34], а самый низкий уровень неадекватности был около 10% [35, 36]. Достижение адекватности аспирата этих непальпируемых очагов представляет собой большую проблему из-за их небольших размеров во многих случаях, а также из-за наличия фиброзного компонента.В настоящее время лечение этих поражений всегда включает КТ или ультразвуковое наблюдение, чтобы лучше определить и локализовать поражение при аспирации. Помимо размера опухоли, степень злокачественности опухоли также была важным фактором риска ложноотрицательных FNAC (Таблица 5). В отчете Bulgaresi о ложноотрицательных сообщениях FNAC, 24,3% приходились на особые типы опухолей, 39% из которых были опухолями низкой степени злокачественности [31]. Сходство лобулярной карциномы с лимфоцитами и ее тонкая цитологическая атипия — хорошо известные диагностические проблемы.Протоковая карцинома, не указанный подтип (БДУ), составляла 2/3 ложноотрицательных случаев в другой серии [37]. В результате непальпируемые поражения составляют особую «слепую зону», не поддающуюся лечению FNAC, и действительно, большинство авторов рекомендуют биопсию стержневой иглой для обработки таких поражений [32].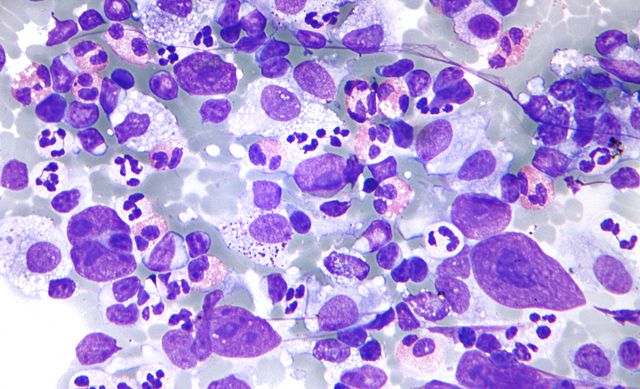
 Значение тонкоигольной аспирационной биопсии в диагностике и прогностической оценке пальпируемых поражений груди.
Значение тонкоигольной аспирационной биопсии в диагностике и прогностической оценке пальпируемых поражений груди.  [39]
[39]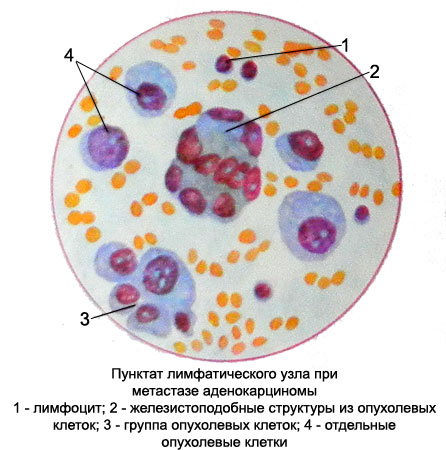 На адекватность мазков влияет характер поражения, опыт использования аспиратора и доступность доступных методов визуализации. Адекватный мазок может быть определен количественными или качественными методами, сторонники любого подхода.Тем не менее, опыт и уверенность операторов в сопоставлении с клиническими и радиологическими данными, клеточностью мазков и методикой аспирации всегда полезны. Исключение составляют кистозные и фиброзные поражения, которые неизбежно являются гипоцеллюлярными. Дегенеративные изменения затрудняют интерпретацию мазка. Доброкачественные новообразования груди обычно легко диагностировать, когда их характерные цитологические образцы очевидны. Гипоцеллюлярность, дегенерированные апокринные клетки, некроз и гиперплазия эпителия — вот некоторые из факторов, с которыми можно столкнуться при оценке сложного мазка, имитирующего атипичные или злокачественные образования.Ложноотрицательные случаи при FNAC молочной железы, хотя и немногочисленные, обычно связаны с плохой техникой отбора проб, плохой локализацией опухоли и наличием хорошо дифференцированной гистологии опухоли.
На адекватность мазков влияет характер поражения, опыт использования аспиратора и доступность доступных методов визуализации. Адекватный мазок может быть определен количественными или качественными методами, сторонники любого подхода.Тем не менее, опыт и уверенность операторов в сопоставлении с клиническими и радиологическими данными, клеточностью мазков и методикой аспирации всегда полезны. Исключение составляют кистозные и фиброзные поражения, которые неизбежно являются гипоцеллюлярными. Дегенеративные изменения затрудняют интерпретацию мазка. Доброкачественные новообразования груди обычно легко диагностировать, когда их характерные цитологические образцы очевидны. Гипоцеллюлярность, дегенерированные апокринные клетки, некроз и гиперплазия эпителия — вот некоторые из факторов, с которыми можно столкнуться при оценке сложного мазка, имитирующего атипичные или злокачественные образования.Ложноотрицательные случаи при FNAC молочной железы, хотя и немногочисленные, обычно связаны с плохой техникой отбора проб, плохой локализацией опухоли и наличием хорошо дифференцированной гистологии опухоли. Небольшой размер опухоли и непальпируемые поражения груди также часто связаны с ложноотрицательными результатами и недостаточностью аспирата. Таким образом, при интерпретации FNAC груди необходимо учитывать все эти факторы, прежде чем будет поставлен доброкачественный диагноз.
Небольшой размер опухоли и непальпируемые поражения груди также часто связаны с ложноотрицательными результатами и недостаточностью аспирата. Таким образом, при интерпретации FNAC груди необходимо учитывать все эти факторы, прежде чем будет поставлен доброкачественный диагноз.
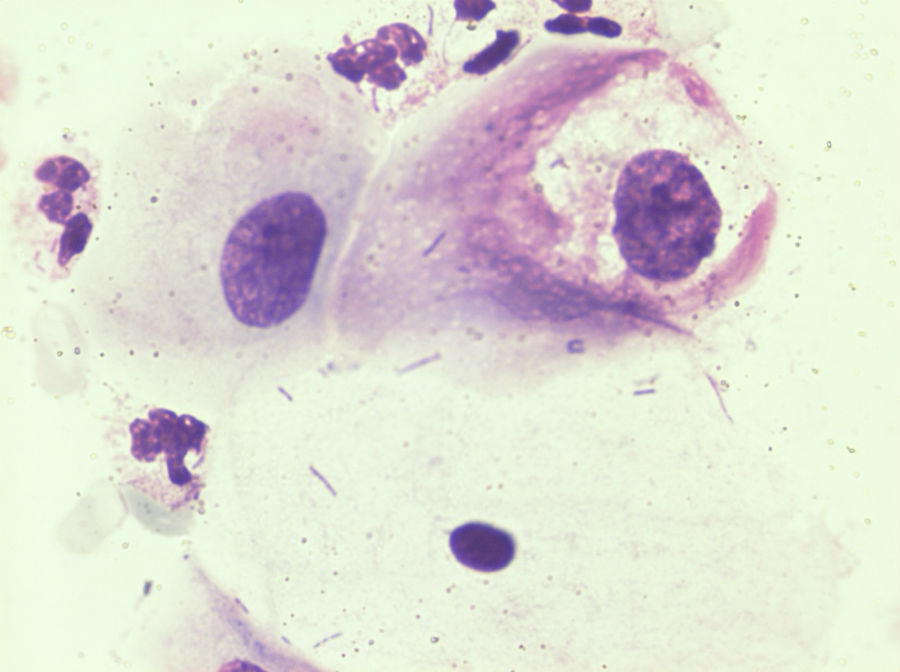 FNAC остается идеальным выбором для диагностики поражений груди и приобретает огромную популярность, особенно в тех областях, где оборудование для визуализации недоступно. В этом исследовании мы описали распределение поражений груди в соответствии с их конкретным диагнозом, а также на основе системы классификации IAC Yokohama.
FNAC остается идеальным выбором для диагностики поражений груди и приобретает огромную популярность, особенно в тех областях, где оборудование для визуализации недоступно. В этом исследовании мы описали распределение поражений груди в соответствии с их конкретным диагнозом, а также на основе системы классификации IAC Yokohama.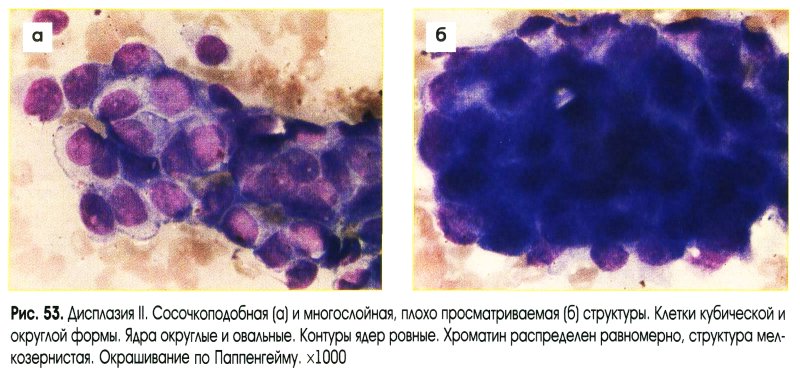
 5% [34].
5% [34]. жизнь и работа. Кроме того, они становятся жертвами рецидивов болезни или долгосрочных последствий терапевтического вмешательства.Важно отметить, что молодые женщины с раком груди чаще страдают от психологического стресса из-за большей заботы о своей красоте [41]. Для смягчения вышеупомянутых последствий рака груди, особенно у молодых женщин, решающее значение имеет раннее выявление поражений груди, особенно у лиц с высоким риском, путем использования регулярных программ скрининга.
жизнь и работа. Кроме того, они становятся жертвами рецидивов болезни или долгосрочных последствий терапевтического вмешательства.Важно отметить, что молодые женщины с раком груди чаще страдают от психологического стресса из-за большей заботы о своей красоте [41]. Для смягчения вышеупомянутых последствий рака груди, особенно у молодых женщин, решающее значение имеет раннее выявление поражений груди, особенно у лиц с высоким риском, путем использования регулярных программ скрининга. Однако ограничения все же неоспоримы. Благодаря ретроспективному характеру собираемых данных на объем и качество данных может влиять характер системы записи, которая была нашим единственным источником.В некоторых случаях клиническая информация в медицинской карте не содержала подробностей. Отсутствие единообразия в отношении терминологии отчетности, используемой в окончательном цитологическом диагнозе, было еще одним ограничением, которое могло повлиять на наши выводы. Чтобы решить все вышеупомянутые проблемы, необходимо принять стандартизированную форму запроса пациента, а также стандартизированные диагностические категории для отчетности. Использование стандартизированного формата формы запроса на цитологическое исследование может подтвердить наличие надежных данных.И что еще более важно, соблюдение стандартных руководящих принципов по отчетности улучшает взаимодействие в многопрофильной команде и обеспечивает сравнение результатов из других центров. Результаты нашего исследования могут быть использованы в качестве основы для проведения крупномасштабного проспективного исследования предмета в будущем.
Однако ограничения все же неоспоримы. Благодаря ретроспективному характеру собираемых данных на объем и качество данных может влиять характер системы записи, которая была нашим единственным источником.В некоторых случаях клиническая информация в медицинской карте не содержала подробностей. Отсутствие единообразия в отношении терминологии отчетности, используемой в окончательном цитологическом диагнозе, было еще одним ограничением, которое могло повлиять на наши выводы. Чтобы решить все вышеупомянутые проблемы, необходимо принять стандартизированную форму запроса пациента, а также стандартизированные диагностические категории для отчетности. Использование стандартизированного формата формы запроса на цитологическое исследование может подтвердить наличие надежных данных.И что еще более важно, соблюдение стандартных руководящих принципов по отчетности улучшает взаимодействие в многопрофильной команде и обеспечивает сравнение результатов из других центров. Результаты нашего исследования могут быть использованы в качестве основы для проведения крупномасштабного проспективного исследования предмета в будущем.

 15 февраля 1998; 57 (4): 792-797.
15 февраля 1998; 57 (4): 792-797.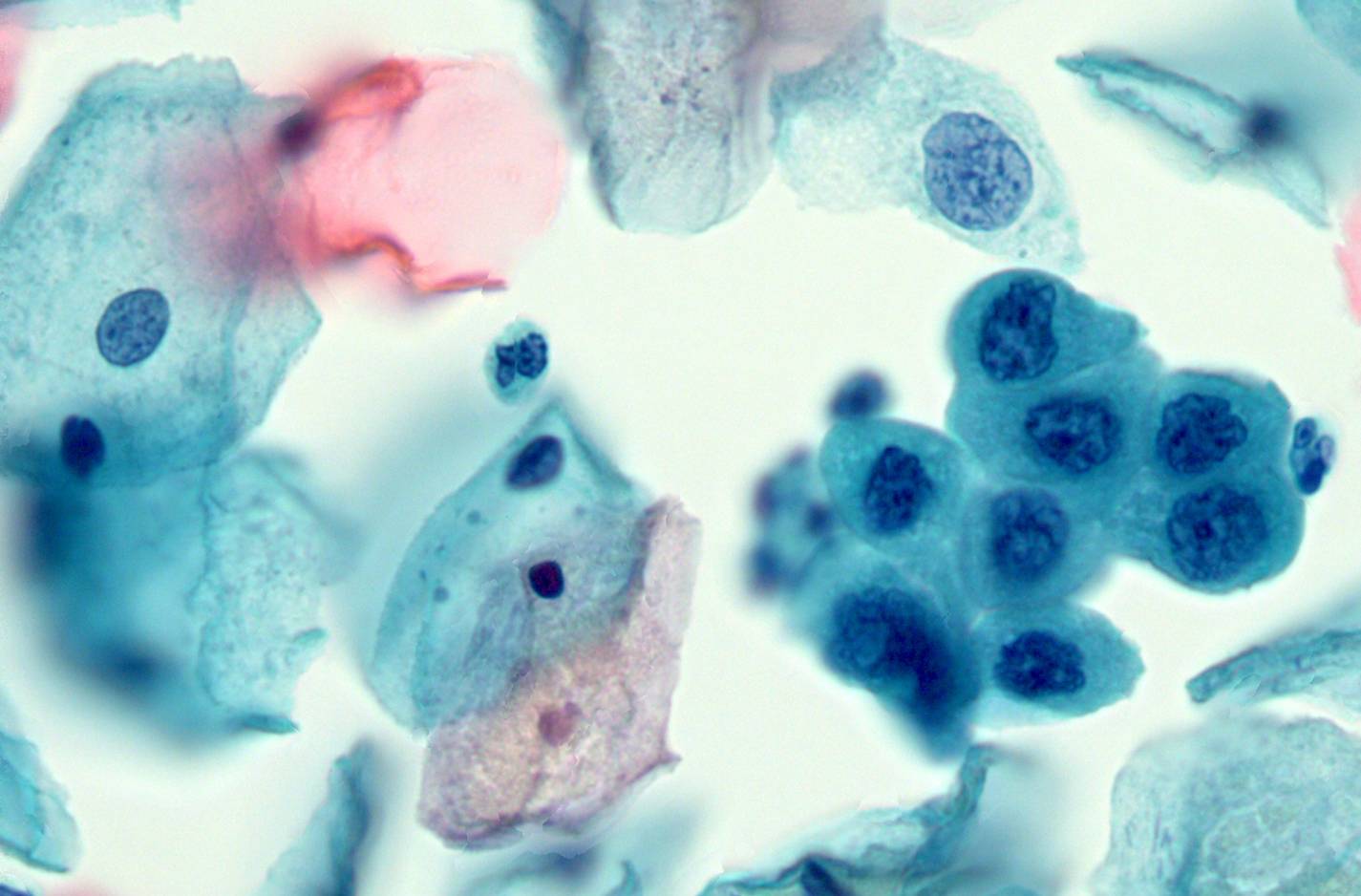 Недостаточно материала было получено из 86 кист (13% кист). В 33 кистах (5%) при цитологическом исследовании выявлены атипичные клетки. Хирургическая биопсия была выполнена девяти из этих пациентов; гистология выявила фиброзно-кистозные изменения у восьми пациентов и внутрипротоковую папиллому у одного пациента. Остальные 24 пациента проходили периодические контрольные осмотры, и все поражения казались меньше или не наблюдались во время контрольного осмотра.
Недостаточно материала было получено из 86 кист (13% кист). В 33 кистах (5%) при цитологическом исследовании выявлены атипичные клетки. Хирургическая биопсия была выполнена девяти из этих пациентов; гистология выявила фиброзно-кистозные изменения у восьми пациентов и внутрипротоковую папиллому у одного пациента. Остальные 24 пациента проходили периодические контрольные осмотры, и все поражения казались меньше или не наблюдались во время контрольного осмотра.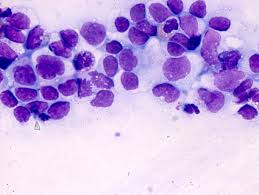 Авторы рекомендуют отправлять сильно кровянистую жидкость на цитологический анализ, хотя результат оказался невысоким.
Авторы рекомендуют отправлять сильно кровянистую жидкость на цитологический анализ, хотя результат оказался невысоким. Это хорошее время, чтобы задать любые вопросы, которые у вас есть.
Это хорошее время, чтобы задать любые вопросы, которые у вас есть. И вы можете принять душ или ванну как обычно.
И вы можете принять душ или ванну как обычно.