Дефект аортолегочной перегородки: Коррекция дефекта аортолегочной перегородки III типа в сочетании с перерывом дуги аорты типа А
Дефект аортолегочной перегородки — причины, симптомы, диагностика и лечение
Дефект аортолегочной перегородки – врожденная сердечная аномалия, заключающаяся в наличии сообщения между восходящей аортой и прилегающей к ней легочной артерией. Дефект аортолегочной перегородки проявляется в раннем возрасте одышкой, отставанием в физическом развитии, повторными пневмониями, формированием «сердечного горба», цианозом. Выявление дефекта аортолегочной перегородки осуществляется на основании данных ЭхоКГ, катетеризации сердца, аортографии, ЭКГ, ФКГ, рентгенографии, аускультации. При данном пороке показано кардиохирургическое лечение — закрытие аортолегочного окна путем ушивания или пластики дефекта.
Общие сведения
Дефект аортолегочной перегородки (аортолегочное окно, аортопульмональный септальный дефект, аортолегочный свищ или фенестрация) обусловлен наличием отверстия, посредством которого аорта и ствол легочной артерии сообщаются между собой. Дефект аортолегочной перегородки – редкая аномалия, составляющая в кардиологии 0,2−0,3% случаев всех врожденных пороков сердца.
Дефект аортолегочной перегородки – редкая аномалия, составляющая в кардиологии 0,2−0,3% случаев всех врожденных пороков сердца.
Локализация патологического сообщения может быть различной: дефект аортолегочной перегородки может располагаться на любом участке между прилегающими отделами восходящей аорты и ствола легочной артерии. Дефекты аортолегочной перегородки различаются по форме и величине и могут достигать диаметра от 2 до 30 мм. Почти в половине случаев дефект аортолегочной перегородки сочетается с другими врожденными аномалиями сердца – дефектом межжелудочковой перегородки, открытым артериальным протоком, тетрадой Фалло, коарктацией аорты, подклапанным стенозом аорты, стенозом легочной артерии и др.
Дефект аортолегочной перегородки
Причины дефекта аортолегочной перегородки
Аотролегочное окно является следствием нарушения эмбриогенеза, в результате которого не формируется полноценная аортолегочная перегородка. Разделение эмбрионального артериального ствола на аорту и легочный ствол происходит между 6-7 неделями внутриутробного развития плода. Нарушение этого процесса приводит к возникновению дефекта аортолегочной перегородки.
Нарушение этого процесса приводит к возникновению дефекта аортолегочной перегородки.
Причины развития дефекта аортолегочной перегородки аналогичны таковым при формировании других врожденных пороков сердца. Факторами, нарушающими формирование сердца плода на ранних этапах внутриутробного развития, могут выступать инфекции беременной (краснуха, ветряная оспа, герпес, грипп, сифилис и др.), прием алкоголя и токсичных лекарственных препаратов, соматические заболевания матери (сахарный диабет), патологическое течение беременности (угроза самопроизвольного прерывания, сильные токсикозы), наследственность, ионизирующее излучение и пр.
Особенности гемодинамики при дефекте аортолегочной перегородки
Морфологическими критериями дефекта аортолегочной перегородки являются: патологическое сообщение между смежными отделами восходящей аорты и легочного ствола, наличие обособленных фиброзных колец аортального и легочного клапанов и сформированных выводных отделов обоих желудочков.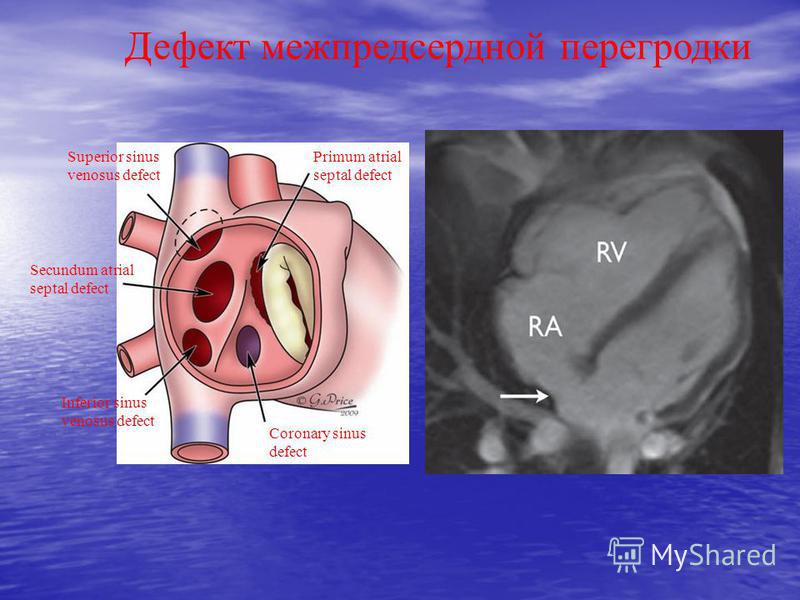 Последний признак отличает данный порок от общего артериального ствола. Сам дефект в аортолегочной перегородке представляет овальное или округлое отверстие с внутриперикардиальным расположением между левой стенкой восходящей аорты и правой стенкой легочного ствола.
Последний признак отличает данный порок от общего артериального ствола. Сам дефект в аортолегочной перегородке представляет овальное или округлое отверстие с внутриперикардиальным расположением между левой стенкой восходящей аорты и правой стенкой легочного ствола.
Выраженность нарушения гемодинамики при дефекте аортолегочной перегородки зависит от размера сообщения, места его расположения, соотношения общелегочного и периферического сосудистого сопротивления.
При дефекте аортолегочной перегородки кровь под большим давлением поступает из восходящей аорты в легочную артерию. Выраженный артериовенозный (лево-правый) сброс рано приводит к развитию легочной гипертензии, которая присутствует у большинства больных с дефектом аортолегочной перегородки. Когда сопротивление в малом и большом круге кровообращения выравнивается, возникает перекрестный, а затем и веноартериальный (право-левый) сброс крови, что сопровождается развитием цианоза.
Классификация дефекта аортолегочной перегородки
С учетом критериев локализации, формы отверстия и его отношения к легочным артериям различают следующие анатомические типы дефекта аортолегочной перегородки (В. И. Бураковский и соавт., НЦССХ им. А. Н. Бакулева):
И. Бураковский и соавт., НЦССХ им. А. Н. Бакулева):
I тип – дефект имеет форму протока с хорошо выраженными полюсами; расположен в середине аортолегочной перегородки в удалении от синусов Вальсальвы. Левая и правая легочные артерии отходят дистальнее аортолегочного дефекта.
II тип – дефект имеет форму окна; расположен в проксимальной (нижней) части аортолегочной перегородки над синусами Вальсальвы. Аортолегочная перегородка частично сформирвоана в своей дистальной части; ветви легочной артерии отходят нормально, дистальнее дефекта.
III тип — дефект имеет форму окна; расположен в дистальной (верхней) части аортолегочной перегородки в удалении от синусов Вальсальвы. Аортолегочная перегородка частично сформирвоана в своей проксимальной части. Ветви легочной артерии отходят в зоне вершины дефекта.
IV тип – дефект имеет форму окна; расположен в дистальной (верхней) части аортолегочной перегородки, на уровне отхождения правой ветви легочного ствола.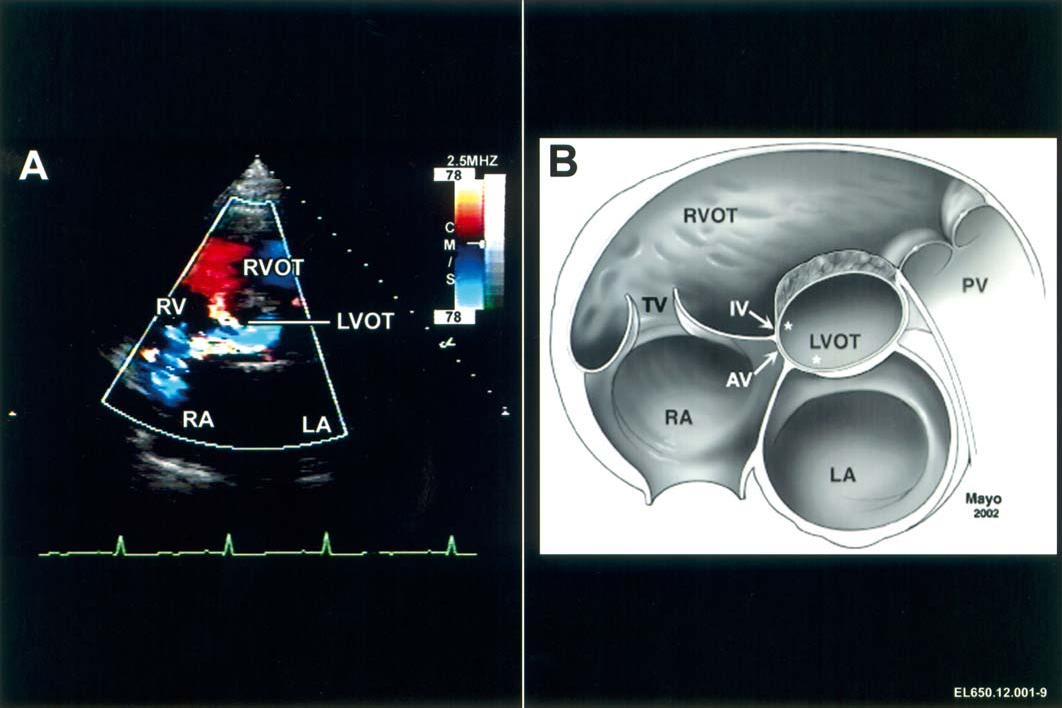 При данном типе дефекта аортолегочной перегородки аорта сообщается как с правой легочной артерией, так и с общим легочным стволом.
При данном типе дефекта аортолегочной перегородки аорта сообщается как с правой легочной артерией, так и с общим легочным стволом.
V тип – полное отсутствие аортолегочной перегородки, однако клапаны аорты и легочной артерии сформированы и разобщены. Легочные артерии отходят от общего магистрального сосуда, берущего начало от основания сердца.
Симптомы дефекта аортолегочной перегородки
У детей первых месяцев жизни ранним симптомом дефекта аортолегочной перегородки служит одышка по типу тахипноэ. Характерно отставание в физическом развитии, быстрая утомляемость, частые ОРВИ, повторные пневмонии.
На стадии преимущественного артериовенозного сброса кожные покровы физиологической окраски или несколько бледные. Небольшой цианоз может появляться при крике, плаче, явлениях сердечной и дыхательной недостаточности. При развитии перекрестного и веноартериального сброса крови цианоз кожи и видимых слизистых становится выраженным и постоянным. У 70% пациентов с дефектом аортолегочной перегородки обнаруживается деформация грудной клетки по типу «сердечного горба», формирование которого связано с увеличением правого желудочка, работающего в режиме гиперфункции.
У 70% пациентов с дефектом аортолегочной перегородки обнаруживается деформация грудной клетки по типу «сердечного горба», формирование которого связано с увеличением правого желудочка, работающего в режиме гиперфункции.
При дефекте аортолегочной перегородки небольшого диаметра и у детей длительное время сохраняется удовлетворительное состояние. При больших дефектах рано развивается легочная гипертензия. Продолжительность жизни больных с дефектом аортолегочной перегородки зависит от размеров отверстия и составляет от нескольких месяцев до 30-40 лет (в среднем — 14 лет).
Диагностика дефекта аортолегочной перегородки
При осмотре пациентов с дефектом аортолегочной перегородки отмечается отставание в массе и росте, выпячивание грудной клетки в виде сердечного горба. Перкуторно выявляется расширение границ сердечной тупости в обе стороны; при аускультации выслушивается систолический шум с диастолическим компонентом, изменение сердечных тонов; пальпаторно определяется систолическое дрожание во II-III межреберье.
С помощью фонокардиографии зафиксируется аускультативная картина, изложенная выше. Электрокардиография выявляет признаки перегрузки правых отделов сердца, гипертрофию обоих желудочков, отклонение ЭОС вправо. Рентгенологическая картина при дефекте аортолегочной перегородки типична: увеличение тени сердца, расширение тени аорты и легочной артерии, усиление легочного рисунка в ранний период заболевания и его обеднение при развитии легочной гипертензии. С помощью эхокардиографии обнаруживается дефект в аортолегочной перегородке, устанавливается расположение окна, его размеры, исключаются сопутствующие пороки сердца.
Путем зондирования полостей сердца определяется выраженность легочной гипертензии, величина сброса крови, исследуется степень насыщения крови кислородом в легочной артерии. Диагностическим признаком дефекта аортолегочной перегородки является возможность проведения катетера из легочной артерии через отверстие в начальные отделы восходящей аорты. При выполнении аортографии видно попадание контрастного вещества из восходящей аорты в ствол легочной артерии. Дифференциальная диагностика при дефекте аортолегочной перегородки проводится с ДМЖП, общим артериальным стволом, открытым артериальным протоком.
При выполнении аортографии видно попадание контрастного вещества из восходящей аорты в ствол легочной артерии. Дифференциальная диагностика при дефекте аортолегочной перегородки проводится с ДМЖП, общим артериальным стволом, открытым артериальным протоком.
Лечение дефекта аортолегочной перегородки
Поскольку спонтанное закрытие дефекта аортолегочной перегородки невозможно, единственным способом лечения врожденного порока сердца является кардиохирургическая операция. При большом дефекте аортолегочной перегородки операция выполняется в ранние сроки — до 1 года.
Закрытие аортолегочного окна производится путем ушивания или пластики дефекта с помощью заплаты доступами через просвет аорты или легочной артерии, либо с обеих сторон. Операция выполняется в условиях ИК, гипотермии и фармакохолодовой кардиоплегии.
При дефекте аортолегочной перегородки I типа производится перевязка протока. Невозможность выполнения радикальной операции при легочной гипертензии диктует необходимость выполнения двухэтапного вмешательства: 1 — сужение легочного ствола или легочной артерии; 2 — снятие суживающей манжетки и радикальная операция.
Интраоперационная летальность составляет 3%; послеоперационная достигает 15-20%.
Прогноз при дефекте аортолегочной перегородки
Большие размеры дефекта аортолегочной перегородки обусловливают злокачественное течение порока: 25-30% пациентов погибают в течение первого полугода жизни. Причинами смерти пациентов с дефектом аортолегочной перегородки обычно служат сердечная недостаточность, разрыв аневризмы легочной артерии в полость перикарда, тампонада сердца (гемоперикард), тромбоэмболии, бактериальный эндокардит.
У выживших больных отсутствие хирургического лечения приводит к развитию необратимых изменений в легких, делающих невозможным хирургическое лечение в более поздние сроки. В литературе встречаются единичные указания на больных с дефектом аортолегочной перегородки, доживших до 35−40 лет.
Дефект аортолегочной перегородки — причины, симптомы, диагностика и лечение
Дефект аортолегочной перегородки – врожденная сердечная аномалия, заключающаяся в наличии сообщения между восходящей аортой и прилегающей к ней легочной артерией. Дефект аортолегочной перегородки проявляется в раннем возрасте одышкой, отставанием в физическом развитии, повторными пневмониями, формированием «сердечного горба», цианозом. Выявление дефекта аортолегочной перегородки осуществляется на основании данных ЭхоКГ, катетеризации сердца, аортографии, ЭКГ, ФКГ, рентгенографии, аускультации. При данном пороке показано кардиохирургическое лечение — закрытие аортолегочного окна путем ушивания или пластики дефекта.
Дефект аортолегочной перегородки проявляется в раннем возрасте одышкой, отставанием в физическом развитии, повторными пневмониями, формированием «сердечного горба», цианозом. Выявление дефекта аортолегочной перегородки осуществляется на основании данных ЭхоКГ, катетеризации сердца, аортографии, ЭКГ, ФКГ, рентгенографии, аускультации. При данном пороке показано кардиохирургическое лечение — закрытие аортолегочного окна путем ушивания или пластики дефекта.
Общие сведения
Дефект аортолегочной перегородки (аортолегочное окно, аортопульмональный септальный дефект, аортолегочный свищ или фенестрация) обусловлен наличием отверстия, посредством которого аорта и ствол легочной артерии сообщаются между собой. Дефект аортолегочной перегородки – редкая аномалия, составляющая в кардиологии 0,2−0,3% случаев всех врожденных пороков сердца.
Локализация патологического сообщения может быть различной: дефект аортолегочной перегородки может располагаться на любом участке между прилегающими отделами восходящей аорты и ствола легочной артерии. Дефекты аортолегочной перегородки различаются по форме и величине и могут достигать диаметра от 2 до 30 мм. Почти в половине случаев дефект аортолегочной перегородки сочетается с другими врожденными аномалиями сердца – дефектом межжелудочковой перегородки, открытым артериальным протоком, тетрадой Фалло, коарктацией аорты, подклапанным стенозом аорты, стенозом легочной артерии и др.
Дефекты аортолегочной перегородки различаются по форме и величине и могут достигать диаметра от 2 до 30 мм. Почти в половине случаев дефект аортолегочной перегородки сочетается с другими врожденными аномалиями сердца – дефектом межжелудочковой перегородки, открытым артериальным протоком, тетрадой Фалло, коарктацией аорты, подклапанным стенозом аорты, стенозом легочной артерии и др.
Дефект аортолегочной перегородки
Причины дефекта аортолегочной перегородки
Аотролегочное окно является следствием нарушения эмбриогенеза, в результате которого не формируется полноценная аортолегочная перегородка. Разделение эмбрионального артериального ствола на аорту и легочный ствол происходит между 6-7 неделями внутриутробного развития плода. Нарушение этого процесса приводит к возникновению дефекта аортолегочной перегородки.
Причины развития дефекта аортолегочной перегородки аналогичны таковым при формировании других врожденных пороков сердца. Факторами, нарушающими формирование сердца плода на ранних этапах внутриутробного развития, могут выступать инфекции беременной (краснуха, ветряная оспа, герпес, грипп, сифилис и др. ), прием алкоголя и токсичных лекарственных препаратов, соматические заболевания матери (сахарный диабет), патологическое течение беременности (угроза самопроизвольного прерывания, сильные токсикозы), наследственность, ионизирующее излучение и пр.
), прием алкоголя и токсичных лекарственных препаратов, соматические заболевания матери (сахарный диабет), патологическое течение беременности (угроза самопроизвольного прерывания, сильные токсикозы), наследственность, ионизирующее излучение и пр.
Особенности гемодинамики при дефекте аортолегочной перегородки
Морфологическими критериями дефекта аортолегочной перегородки являются: патологическое сообщение между смежными отделами восходящей аорты и легочного ствола, наличие обособленных фиброзных колец аортального и легочного клапанов и сформированных выводных отделов обоих желудочков. Последний признак отличает данный порок от общего артериального ствола. Сам дефект в аортолегочной перегородке представляет овальное или округлое отверстие с внутриперикардиальным расположением между левой стенкой восходящей аорты и правой стенкой легочного ствола.
Выраженность нарушения гемодинамики при дефекте аортолегочной перегородки зависит от размера сообщения, места его расположения, соотношения общелегочного и периферического сосудистого сопротивления.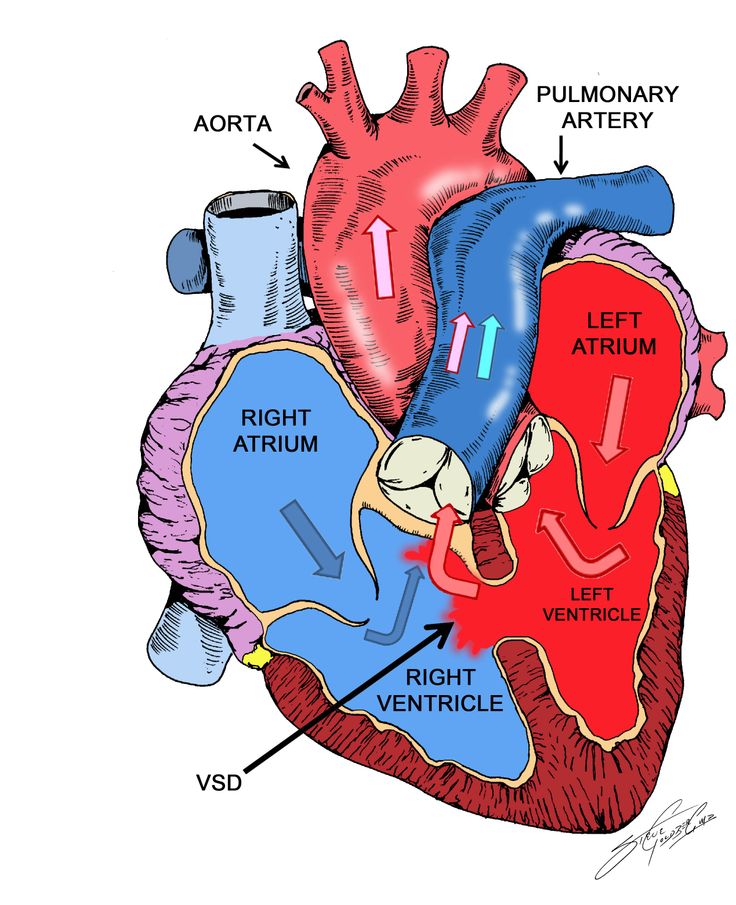
При дефекте аортолегочной перегородки кровь под большим давлением поступает из восходящей аорты в легочную артерию. Выраженный артериовенозный (лево-правый) сброс рано приводит к развитию легочной гипертензии, которая присутствует у большинства больных с дефектом аортолегочной перегородки. Когда сопротивление в малом и большом круге кровообращения выравнивается, возникает перекрестный, а затем и веноартериальный (право-левый) сброс крови, что сопровождается развитием цианоза.
Классификация дефекта аортолегочной перегородки
С учетом критериев локализации, формы отверстия и его отношения к легочным артериям различают следующие анатомические типы дефекта аортолегочной перегородки (В. И. Бураковский и соавт., НЦССХ им. А. Н. Бакулева):
I тип – дефект имеет форму протока с хорошо выраженными полюсами; расположен в середине аортолегочной перегородки в удалении от синусов Вальсальвы. Левая и правая легочные артерии отходят дистальнее аортолегочного дефекта.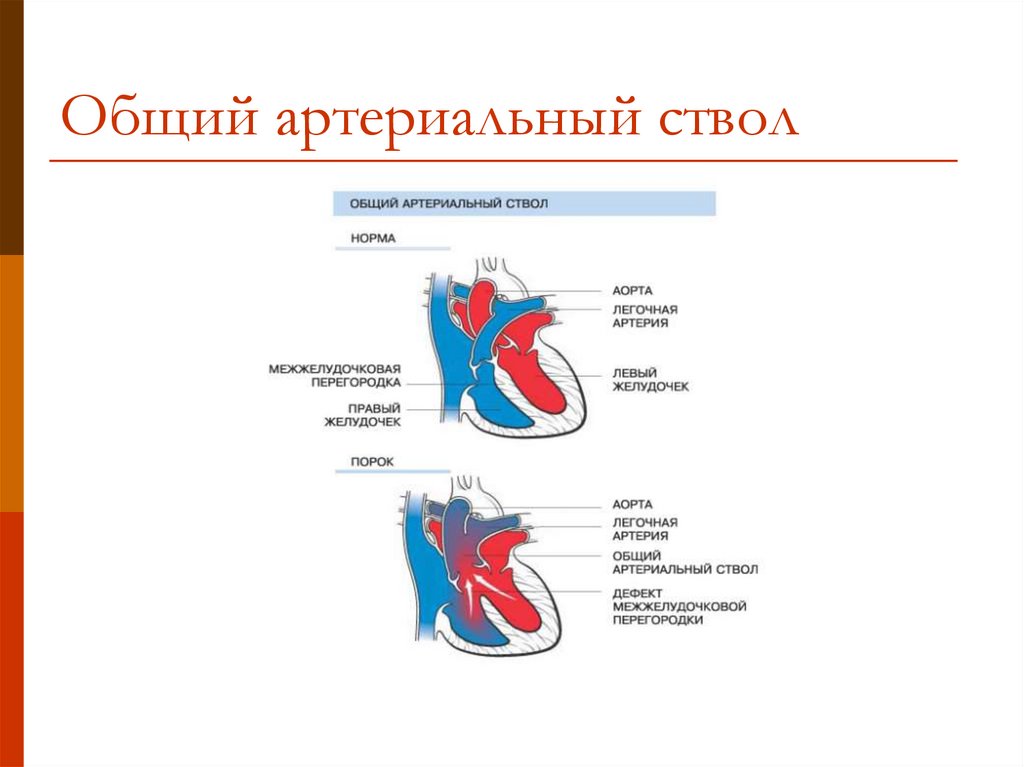
II тип – дефект имеет форму окна; расположен в проксимальной (нижней) части аортолегочной перегородки над синусами Вальсальвы. Аортолегочная перегородка частично сформирвоана в своей дистальной части; ветви легочной артерии отходят нормально, дистальнее дефекта.
III тип — дефект имеет форму окна; расположен в дистальной (верхней) части аортолегочной перегородки в удалении от синусов Вальсальвы. Аортолегочная перегородка частично сформирвоана в своей проксимальной части. Ветви легочной артерии отходят в зоне вершины дефекта.
IV тип – дефект имеет форму окна; расположен в дистальной (верхней) части аортолегочной перегородки, на уровне отхождения правой ветви легочного ствола. При данном типе дефекта аортолегочной перегородки аорта сообщается как с правой легочной артерией, так и с общим легочным стволом.
V тип – полное отсутствие аортолегочной перегородки, однако клапаны аорты и легочной артерии сформированы и разобщены. Легочные артерии отходят от общего магистрального сосуда, берущего начало от основания сердца.
Легочные артерии отходят от общего магистрального сосуда, берущего начало от основания сердца.
Симптомы дефекта аортолегочной перегородки
У детей первых месяцев жизни ранним симптомом дефекта аортолегочной перегородки служит одышка по типу тахипноэ. Характерно отставание в физическом развитии, быстрая утомляемость, частые ОРВИ, повторные пневмонии.
На стадии преимущественного артериовенозного сброса кожные покровы физиологической окраски или несколько бледные. Небольшой цианоз может появляться при крике, плаче, явлениях сердечной и дыхательной недостаточности. При развитии перекрестного и веноартериального сброса крови цианоз кожи и видимых слизистых становится выраженным и постоянным. У 70% пациентов с дефектом аортолегочной перегородки обнаруживается деформация грудной клетки по типу «сердечного горба», формирование которого связано с увеличением правого желудочка, работающего в режиме гиперфункции.
При дефекте аортолегочной перегородки небольшого диаметра и у детей длительное время сохраняется удовлетворительное состояние. При больших дефектах рано развивается легочная гипертензия. Продолжительность жизни больных с дефектом аортолегочной перегородки зависит от размеров отверстия и составляет от нескольких месяцев до 30-40 лет (в среднем — 14 лет).
При больших дефектах рано развивается легочная гипертензия. Продолжительность жизни больных с дефектом аортолегочной перегородки зависит от размеров отверстия и составляет от нескольких месяцев до 30-40 лет (в среднем — 14 лет).
Диагностика дефекта аортолегочной перегородки
При осмотре пациентов с дефектом аортолегочной перегородки отмечается отставание в массе и росте, выпячивание грудной клетки в виде сердечного горба. Перкуторно выявляется расширение границ сердечной тупости в обе стороны; при аускультации выслушивается систолический шум с диастолическим компонентом, изменение сердечных тонов; пальпаторно определяется систолическое дрожание во II-III межреберье.
С помощью фонокардиографии зафиксируется аускультативная картина, изложенная выше. Электрокардиография выявляет признаки перегрузки правых отделов сердца, гипертрофию обоих желудочков, отклонение ЭОС вправо. Рентгенологическая картина при дефекте аортолегочной перегородки типична: увеличение тени сердца, расширение тени аорты и легочной артерии, усиление легочного рисунка в ранний период заболевания и его обеднение при развитии легочной гипертензии. С помощью эхокардиографии обнаруживается дефект в аортолегочной перегородке, устанавливается расположение окна, его размеры, исключаются сопутствующие пороки сердца.
С помощью эхокардиографии обнаруживается дефект в аортолегочной перегородке, устанавливается расположение окна, его размеры, исключаются сопутствующие пороки сердца.
Путем зондирования полостей сердца определяется выраженность легочной гипертензии, величина сброса крови, исследуется степень насыщения крови кислородом в легочной артерии. Диагностическим признаком дефекта аортолегочной перегородки является возможность проведения катетера из легочной артерии через отверстие в начальные отделы восходящей аорты. При выполнении аортографии видно попадание контрастного вещества из восходящей аорты в ствол легочной артерии. Дифференциальная диагностика при дефекте аортолегочной перегородки проводится с ДМЖП, общим артериальным стволом, открытым артериальным протоком.
Лечение дефекта аортолегочной перегородки
Поскольку спонтанное закрытие дефекта аортолегочной перегородки невозможно, единственным способом лечения врожденного порока сердца является кардиохирургическая операция. При большом дефекте аортолегочной перегородки операция выполняется в ранние сроки — до 1 года.
При большом дефекте аортолегочной перегородки операция выполняется в ранние сроки — до 1 года.
Закрытие аортолегочного окна производится путем ушивания или пластики дефекта с помощью заплаты доступами через просвет аорты или легочной артерии, либо с обеих сторон. Операция выполняется в условиях ИК, гипотермии и фармакохолодовой кардиоплегии.
При дефекте аортолегочной перегородки I типа производится перевязка протока. Невозможность выполнения радикальной операции при легочной гипертензии диктует необходимость выполнения двухэтапного вмешательства: 1 — сужение легочного ствола или легочной артерии; 2 — снятие суживающей манжетки и радикальная операция.
Интраоперационная летальность составляет 3%; послеоперационная достигает 15-20%.
Прогноз при дефекте аортолегочной перегородки
Большие размеры дефекта аортолегочной перегородки обусловливают злокачественное течение порока: 25-30% пациентов погибают в течение первого полугода жизни. Причинами смерти пациентов с дефектом аортолегочной перегородки обычно служат сердечная недостаточность, разрыв аневризмы легочной артерии в полость перикарда, тампонада сердца (гемоперикард), тромбоэмболии, бактериальный эндокардит.
Причинами смерти пациентов с дефектом аортолегочной перегородки обычно служат сердечная недостаточность, разрыв аневризмы легочной артерии в полость перикарда, тампонада сердца (гемоперикард), тромбоэмболии, бактериальный эндокардит.
У выживших больных отсутствие хирургического лечения приводит к развитию необратимых изменений в легких, делающих невозможным хирургическое лечение в более поздние сроки. В литературе встречаются единичные указания на больных с дефектом аортолегочной перегородки, доживших до 35−40 лет.
Дефект аортопульмональной перегородки — StatPearls
Непрерывное обучение
Дефект аортопульмональной перегородки/аортопульмонального окна — один из самых редких врожденных пороков сердца. Этот дефект развивается эмбриологически при неполной перегородке магистральных артерий. Это может происходить изолированно или как часть более серьезного синдрома, включающего множественные пороки сердца. Невылеченные дефекты аортопульмональной перегородки обычно вызывают заболеваемость и смертность от большого сброса крови слева направо и легочной гипертензии. В этом мероприятии рассматривается оценка и лечение дефектов аорто-легочной перегородки и подчеркивается роль межпрофессиональной команды в уходе за пациентами с этим заболеванием.
В этом мероприятии рассматривается оценка и лечение дефектов аорто-легочной перегородки и подчеркивается роль межпрофессиональной команды в уходе за пациентами с этим заболеванием.
Цели:
Опишите патофизиологию дефектов аортолегочной перегородки как причины застойной сердечной недостаточности у младенцев.
Обзор эпидемиологии пациентов с диагнозом дефекты аорто-легочной перегородки.
Опишите план обследования пациента с вероятным дефектом аорто-легочной перегородки.
Объясните лечение и ведение пациентов с дефектами аорто-легочной перегородки.
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Введение
Дефект аортолегочной (ПД) перегородки, также известный как АП окно, является одним из самых редких врожденных пороков сердца, на который приходится менее 0,5 % форм врожденных пороков сердца. [1] Этот дефект может возникать изолированно или одновременно с другими формами врожденных пороков сердца, такими как дефект межжелудочковой перегородки, разрыв дуги аорты, тетрада Фалло и очень редко аномалии коронарных артерий.[2][3][4][ 5][6] По определению, переднезаднее окно представляет собой прямое соединение «бок в бок» восходящей аорты с основной легочной артерией, но с формированием нормального аортального клапана и выходного тракта правого желудочка, что отличает его от артериального ствола [7]. Эмбриологически переднезаднее окно развивается при неполной септации магистральных артерий.
[1] Этот дефект может возникать изолированно или одновременно с другими формами врожденных пороков сердца, такими как дефект межжелудочковой перегородки, разрыв дуги аорты, тетрада Фалло и очень редко аномалии коронарных артерий.[2][3][4][ 5][6] По определению, переднезаднее окно представляет собой прямое соединение «бок в бок» восходящей аорты с основной легочной артерией, но с формированием нормального аортального клапана и выходного тракта правого желудочка, что отличает его от артериального ствола [7]. Эмбриологически переднезаднее окно развивается при неполной септации магистральных артерий.
Этиология
Дефекты аортопульмонального окна составляют значительно менее 0,5% всех врожденных пороков сердца.[1] Примерно в 50% случаев они связаны с другими врожденными пороками сердца, такими как другие дефекты конотрункуса (например, тетрада Фалло, прерванная дуга аорты, D-транспозиция магистральных артерий), коарктация аорты, дефект межжелудочковой перегородки, коронарная артерия аномалии и атрезия трикуспидального клапана. Хотя этот дефект может показаться эмбриологически похожим на другие пороки развития конотрунка, существует удивительно низкая связь с синдромом Ди Джорджи. Это предполагает, что это не связано с аномалией сердечного нервного гребня.[11]
Хотя этот дефект может показаться эмбриологически похожим на другие пороки развития конотрунка, существует удивительно низкая связь с синдромом Ди Джорджи. Это предполагает, что это не связано с аномалией сердечного нервного гребня.[11]
Эпидемиология
Как обсуждалось выше, окно AP представляет собой редкий врожденный порок сердца, встречающийся менее чем в 0,5% всех врожденных пороков сердца.[1] Были идентифицированы генетические ассоциации, такие как VACTERL и Bohring-Opitz ; однако не было обнаружено, что конкретное воздействие на мать является ассоциативной причиной.
Патофизиология
Переднезаднее окно возникает в эмбриональном периоде, когда имеется неполная перегородка общего артериального ствола, что приводит к аномальному соединению между восходящей аортой и главной легочной артерией. В изолированном переднезаднем окне два отдельных полулунных клапана (аортальный и легочный) обычно формируются нормально.[13] Расположение оконного дефекта – между полулунными клапанами и ветвями легочных артерий. Выделяют три типа переднезаднего окна: тип I (проксимальный), возникающий между задней стенкой восходящей аорты и латеральной стенкой основной легочной артерии; тип II (дистальный), возникающий между задней стенкой восходящей аорты и передней стенкой места отхождения правой легочной артерии; и тип III, представляющий собой комбинацию типов I и II. Тип I — наиболее распространенный тип окна AP.[13] Размер соединения варьирует, но обычно он большой, неограниченный и гемодинамически значимый. Менее чем в 10 % случаев окно AP маленькое и ограничивает давление.[14]
Выделяют три типа переднезаднего окна: тип I (проксимальный), возникающий между задней стенкой восходящей аорты и латеральной стенкой основной легочной артерии; тип II (дистальный), возникающий между задней стенкой восходящей аорты и передней стенкой места отхождения правой легочной артерии; и тип III, представляющий собой комбинацию типов I и II. Тип I — наиболее распространенный тип окна AP.[13] Размер соединения варьирует, но обычно он большой, неограниченный и гемодинамически значимый. Менее чем в 10 % случаев окно AP маленькое и ограничивает давление.[14]
Анамнез и физикальное исследование
Несмотря на то, что можно диагностировать изолированное окно АП внутриутробно с помощью эхокардиографии плода, более типичным проявлением является неонатальный период или ранний младенческий возраст.[15][16][17] Типичными признаками и симптомами, связанными с окном AP, являются легочная избыточная циркуляция, возникающая по мере того, как сопротивление легочных сосудов падает в течение первых нескольких недель жизни. Обычно это приводит к большому сбросу крови слева направо, а симптомы включают потоотделение (особенно при кормлении), тахипноэ, тахикардию, плохую прибавку в весе и усиление респираторных симптомов при вирусных инфекциях. Прекордиальная часть часто гипердинамична, можно оценить шум митрального клапана. Пульс часто учащается, так как системное диастолическое артериальное давление снижается вследствие реверсирования аортального кровотока в диастолу. В редких случаях отмечается непрерывный шум, так как соединение между аортой и легочной артерией обычно велико, что не позволяет развиться значительному градиенту давления (рестрикции).
Обычно это приводит к большому сбросу крови слева направо, а симптомы включают потоотделение (особенно при кормлении), тахипноэ, тахикардию, плохую прибавку в весе и усиление респираторных симптомов при вирусных инфекциях. Прекордиальная часть часто гипердинамична, можно оценить шум митрального клапана. Пульс часто учащается, так как системное диастолическое артериальное давление снижается вследствие реверсирования аортального кровотока в диастолу. В редких случаях отмечается непрерывный шум, так как соединение между аортой и легочной артерией обычно велико, что не позволяет развиться значительному градиенту давления (рестрикции).
Как отмечалось выше, окно AP может быть связано с другими типами врожденных пороков сердца, и ассоциированный дефект может изменить представление. При тетраде Фалло можно отметить шум изгнания легочной артерии и щелчок клапана легочной артерии. Когда окно AP возникает с прерванной дугой аорты, у новорожденного может возникнуть шок, поскольку артериальный проток сужается. Иногда окно АД может быть рестриктивным и сопровождаться менее выраженными симптомами гиперциркуляции. В этом случае можно отметить непрерывный шум в сердце. В редких случаях диагноз окна AP ставится только в более позднем детстве или даже во взрослой жизни. Это может проявляться признаками синдрома Эйзенменгера, в том числе цианозом и клубами.[18][19]][20] Однако поздняя манифестация окна AP по-прежнему требует подробной гемодинамической оценки, поскольку некоторые пациенты все еще могут быть кандидатами на восстановление, если имеется приемлемое сопротивление легочных сосудов или соответствующий ответ на тестирование сосудорасширяющих средств.[21][22]
Иногда окно АД может быть рестриктивным и сопровождаться менее выраженными симптомами гиперциркуляции. В этом случае можно отметить непрерывный шум в сердце. В редких случаях диагноз окна AP ставится только в более позднем детстве или даже во взрослой жизни. Это может проявляться признаками синдрома Эйзенменгера, в том числе цианозом и клубами.[18][19]][20] Однако поздняя манифестация окна AP по-прежнему требует подробной гемодинамической оценки, поскольку некоторые пациенты все еще могут быть кандидатами на восстановление, если имеется приемлемое сопротивление легочных сосудов или соответствующий ответ на тестирование сосудорасширяющих средств.[21][22]
Оценка
У детей с переднезадним окном рентгенограмма грудной клетки покажет кардиомегалию и усиление легочных сосудистых отметин. Электрокардиограмма продемонстрирует тахикардию и повышенный вольтаж справа и слева. Диагноз AP-окна ставится с помощью эхокардиографии при подозрении на большой сброс крови слева направо. Поскольку связь обычно без существенных ограничений, цветная допплеровская эхокардиография не обнаружит высокоскоростную цветную струю. Когда подозрения высоки, 2D-изображений обычно достаточно для измерения связи окна AP. Если изображения эхокардиограммы недостаточно, компьютерная томография может потенциально очертить соединение AP.
Когда подозрения высоки, 2D-изображений обычно достаточно для измерения связи окна AP. Если изображения эхокардиограммы недостаточно, компьютерная томография может потенциально очертить соединение AP.
Эхокардиография должна полностью оценить оставшиеся структуры сердца, включая оценку других сердечных заболеваний, таких как тетрада Фалло, разрыв дуги аорты, и следует позаботиться о выявлении коронарных артерий. Если диагноз не установлен поздно или не может быть поставлен с помощью менее инвазивных методов, катетеризация сердца мало что добавляет к диагностическому лечению. Когда диагноз ставится после младенчества или даже во взрослом возрасте, особенно если отмечается цианоз, катетеризация может быть использована для оценки легочного сосудистого сопротивления, поскольку может развиться синдром Эйзенменгера. Если имеется заболевание легочных сосудов, во время катетеризации необходимо провести тест на реактивность, чтобы определить целесообразность закрытия [22].
Лечение/управление
Как правило, лечение большого окна AP заключается в закрытии хирургической заплатой, и результаты, как правило, хорошие, когда восстановление происходит в раннем младенчестве. [23][24] Небольшие дефекты можно закрыть хирургическим путем, в первую очередь, с помощью двойной перевязки или наложения швов. Логично предположить, что сопутствующий врожденный порок сердца усложняет хирургическое лечение и ухудшает результаты.[23][26] Закрытие устройства для катетеризации с помощью окклюдеров с двойным диском (дефект межпредсердной перегородки и открытый артериальный проток) было описано в сообщениях о случаях дефектов, которые обычно являются рестриктивными, что позволяет закрыть их в более позднем детстве.
[23][24] Небольшие дефекты можно закрыть хирургическим путем, в первую очередь, с помощью двойной перевязки или наложения швов. Логично предположить, что сопутствующий врожденный порок сердца усложняет хирургическое лечение и ухудшает результаты.[23][26] Закрытие устройства для катетеризации с помощью окклюдеров с двойным диском (дефект межпредсердной перегородки и открытый артериальный проток) было описано в сообщениях о случаях дефектов, которые обычно являются рестриктивными, что позволяет закрыть их в более позднем детстве.
Противозастойные препараты, такие как диуретики (например, фуросемид и хлоротиазид) и дигоксин, могут обеспечить временное улучшение симптомов, но не должны существенно изменить течение заболевания. Снижение постнагрузки можно рассматривать при ингибировании АПФ. К медикаментозной терапии следует подходить с осторожностью, так как может быть нарушение почечной перфузии. Хирургическое вмешательство следует рассмотреть во время постановки диагноза, так как при такой физиологии рост, вероятно, будет незначительным, и существует риск развития необратимой легочной гипертензии с течением времени. Кроме того, окно АД не ограничивается и не становится гемодинамически менее значимым с течением времени. Как правило, хирургическое вмешательство включает разделение магистральных артерий либо с разделением швов, либо с закрытием аорты и легочной артерии заплатой с низкой хирургической смертностью.
Кроме того, окно АД не ограничивается и не становится гемодинамически менее значимым с течением времени. Как правило, хирургическое вмешательство включает разделение магистральных артерий либо с разделением швов, либо с закрытием аорты и легочной артерии заплатой с низкой хирургической смертностью.
Катетеризацию можно рассматривать, когда дефект достаточно мал, чтобы можно было закрыть устройство, не вызывая стеноза магистральных артерий или вмешательства в работу полулунных клапанов. При наличии других пороков сердца очевидно, что восстановление или паллиативное лечение других пороков должно производиться во время той же операции. Послеоперационный стеноз аорты, реже, и стеноз легочной артерии в основной и ответвленной легочных артериях, чаще, может возникнуть. Если этот стеноз гемодинамически важен, в будущем можно использовать катетеризацию сердца с баллонной ангиопластикой или имплантацией стента. Кроме того, в условиях прерванной пластики дуги аорты могут потребоваться транскатетерные вмешательства на аорте по поводу остаточной обструкции дуги [26].
Дифференциальный диагноз
Артериальный ствол является наиболее частым поражением, которое путают с окном AP, но имеет магистральный клапан вместо двух полулунных клапанов. Ранняя патофизиология аналогична.
Открытый артериальный проток (ОАП) имеет аналогичную физиологию. ОАП типа «окно» представляет собой соединение проксимального отдела нисходящей аорты и левой легочной артерии вблизи бифуркации. Переднезаднее окно представляет собой соединение восходящей аорты и главной легочной артерии.
Большой дефект межжелудочковой перегородки имеет аналогичную физиологию, но его легко отличить от окна AP.
Прогноз
Прогноз для изолированного окна AP хороший при раннем лечении с хирургическим закрытием и предотвращением развития заболевания легочных сосудов [24]. Поздняя диагностика может быть связана с развитием легочной гипертензии/синдрома Эйзенменгера, что имеет неблагоприятный прогноз. Связанное окно AP с другими врожденными пороками сердца увеличивает сложность операции.
Осложнения
Осложнения неправильного диагноза включают развитие синдрома Эйзенменгера.[29] Восстановление может быть связано с остаточными дефектами, включая стеноз ветви легочной артерии и остаточное окно AP, которые, возможно, потребуют решения в будущем. С осторожностью следует использовать баллонную ангиопластику, поскольку окно AP теоретически может повториться при агрессивной ангиопластике. Следует заподозрить рецидивирующее повреждение гортанного нерва, если после операции отмечается охриплость голоса или поперхивание при кормлении [31].
Консультации
Лечение окна AP требует подхода межпрофессиональной команды. Как правило, для оптимизации результатов следует проконсультироваться с кардиологом, кардиохирургом и кардиологом.
Pearls and Other Issues
Диагноз окна AP обычно ставится с помощью эхокардиографии. Нельзя не подчеркнуть, что сильное клиническое подозрение на большой шунт слева направо и скачкообразный импульс должны побуждать к эхокардиограмме, сфокусированной на оценке окна АД. Несвоевременное восстановление переднезаднего окна сопряжено с риском сохранения значительной легочной гипертензии, поэтому перед поздним восстановлением переднезаднего окна рекомендуется предоперационная катетеризация. Должен быть низкий порог послеоперационной катетеризации сердца для оценки легочного сосудистого сопротивления. В целом, раннее восстановление окна AP дает отличный долгосрочный прогноз.
Несвоевременное восстановление переднезаднего окна сопряжено с риском сохранения значительной легочной гипертензии, поэтому перед поздним восстановлением переднезаднего окна рекомендуется предоперационная катетеризация. Должен быть низкий порог послеоперационной катетеризации сердца для оценки легочного сосудистого сопротивления. В целом, раннее восстановление окна AP дает отличный долгосрочный прогноз.
Улучшение результатов команды здравоохранения
Окно для диагностики и лечения ОП требует участия межпрофессиональной команды, в которую входят педиатр, кардиолог, кардиохирург, реаниматолог и рентгенолог. Расстройство обычно лечится хирургическим путем, но главное, чтобы у ребенка не было других сопутствующих врожденных пороков сердца. После того, как операция выполнена, младенец обычно находится под наблюдением кардиолога или медсестры интенсивной терапии. Если это изолированный порок, исходы хорошие и, как правило, хорошие, даже если они связаны с другими врожденными пороками сердца. Фармацевты должны пересматривать дозировку лекарств и обучать семьи пациентов. Специализированные медсестры помогают координировать уход и информируют команду об изменениях в состоянии пациента. После успешного восстановления рекомендуется неопределенное длительное наблюдение у кардиолога для скрининга поздних аномалий, таких как стеноз ветви легочной артерии.
Фармацевты должны пересматривать дозировку лекарств и обучать семьи пациентов. Специализированные медсестры помогают координировать уход и информируют команду об изменениях в состоянии пациента. После успешного восстановления рекомендуется неопределенное длительное наблюдение у кардиолога для скрининга поздних аномалий, таких как стеноз ветви легочной артерии.
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Рисунок
2D-изображение окна AP, видимое из подреберных проекций. Предоставлено Pushpa Shivaram, MD
Рисунок
Эхокардиограмма и цветное изображение окна AP, демонстрирующее поток между аортой и легочной артерией. Предоставлено Pushpa Shivaram MD
Figure
КТ 3D-реконструкция, демонстрирующая переднезаднее окно. Существует также большой артериальный проток в условиях тяжелой коарктации. Предоставлено Марком Лоу, доктором медицины
Ссылки
- 1.

Саманек М., Ворискова М. Врожденный порок сердца среди 815 569 детей, родившихся между 1980 и 1990 годами, и их 15-летняя выживаемость: проспективное исследование выживания в Богемии. Педиатр Кардиол. 1999 ноябрь-декабрь; 20(6):411-7. [PubMed: 10556387]
- 2.
Прабху С., Кешав М., Рамачандра П., Радж В., Джон С., Карл Т.Р. Тетрада Фалло с легочной атрезией и аортопульмональным окном может имитировать общий артериальный ствол. Кардиол Янг. 2022 март; 32(3):410-414. [В паблике: 34134806]
- 3.
Sondhi S, Negi PC, Sharma R, Mehta A. Аортопульмональное окно с легочной атрезией с дефектом межжелудочковой перегородки с D-транспозицией крупных артерий: крайне редкая аномалия. BMJ Case Rep. 2018 Jun 13; 2018 [бесплатная статья PMC: PMC6011482] [PubMed: 29898907]
- 4.
Bin-Moallim M, Hamadah HK, Alhabshan F, Alghamdi AA, Kabbani MS. Аортопульмональное окно: типы, сопутствующие сердечно-сосудистые аномалии и исход хирургического вмешательства.
 Ретроспективный анализ опыта одного центра. J Саудовская ассоциация сердца 2020;32(2):127-133. [Бесплатная статья PMC: PMC7640542] [PubMed: 33154906]
Ретроспективный анализ опыта одного центра. J Саудовская ассоциация сердца 2020;32(2):127-133. [Бесплатная статья PMC: PMC7640542] [PubMed: 33154906]- 5.
Алахфаш А.А., Тагельден М., Альмеснед А., Алкваи А. Аортопульмональное окно с аномальным отхождением правой коронарной артерии от легочной артерии. Отчет о клиническом случае и обзор литературы. Кардиол Янг. 2020 янв;30(1):47-49. [PubMed: 31854282]
- 6.
Grünenfelder J, Zünd G, Vogt PR, Turina MI. Аортопульмональное окно с аномальным отхождением правой коронарной артерии. Энн Торак Серг. 1999 г., январь; 67 (1): 233-5. [PubMed: 10086558]
- 7.
Раджагопал Р., Синха М., Пандей Н.Н., Бхамбри К., Кумар С. Тетрада фалло с легочной атрезией и аорто-легочным окном: или это артериальный ствол? J Cardiovasc Comput Tomogr. 2020 сен-октябрь;14(5):e20-e21. [PubMed: 30385324]
- 8.
Trowitzsch E, Schneider M, Urban A, Asfour B. Врожденная легочная перевязь, аорто-легочное окно и обструкция легочных вен как диагностическая и терапевтическая проблема у младенца с ассоциацией VACTERL.
 Клин Рез Кардиол. 2006 июнь; 95(6):338-43. [PubMed: 16598388]
Клин Рез Кардиол. 2006 июнь; 95(6):338-43. [PubMed: 16598388]- 9.
Милованович В., Стефанович И., Илич С. Атрезия трехстворчатого клапана, связанная с аортопульмональным окном: диагностические и терапевтические дилеммы. Кардиол Янг. 2017 апр; 27 (3): 580-583. [PubMed: 27680574]
- 10.
Van Mierop LH, Kutsche LM. Сердечно-сосудистые аномалии при синдроме Ди Джорджи и значение нервного гребня как возможного патогенетического фактора. Ам Джей Кардиол. 1 986 июля 01; 58 (1): 133-7. [В паблике: 3728313]
- 11.
Куче Л.М., Ван Мироп Л.Х. Анатомия и патогенез дефекта аортолегочной перегородки. Ам Джей Кардиол. 1987 г., 15 февраля; 59(5):443-7. [PubMed: 3812313]
- 12.
Верма Б., Абхинай А., Сингх А., Кумар М. Двойной выход из правого желудочка и аортопульмональное окно у новорожденного с синдромом Боринга-Опица (Оберклайда-Данкса): отчет о первом случае. J Family Med Prim Care. 2019 март;8(3):1279-1281.
 [Бесплатная статья PMC: PMC6482752] [PubMed: 31041292]
[Бесплатная статья PMC: PMC6482752] [PubMed: 31041292]- 13.
Джейкобс Дж.П., Квинтессенза Дж.А., Гейнор Дж.В., Берк Р.П., Маврудис С. Номенклатура хирургии врожденного сердца и проект базы данных: аортопульмональное окно. Энн Торак Серг. 2000 г., апрель; 69 (4 Дополнение): S44-9. [PubMed: 10798415]
- 14.
Авасти Н., Джавид С.А. Аортопульмональное окно с перекрещивающимися легочными артериями: анатомический тип 1, физиологический тип 2. J Cardiovasc Echogr. 2017 окт.-дек.; 27(4):143-144. [Бесплатная статья PMC: PMC5672687] [PubMed: 29142813]
- 15.
Тонгпрасерт Ф., Ситтивангкул Р., Джатаван П., Тонгсонг Т. Пренатальная диагностика аортопульмонального окна: серия случаев и обзор литературы. J УЗИ Мед. 2017 авг; 36 (8): 1733-1738. [PubMed: 28393388]
- 16.
Collinet P, Chatelet-Cheront C, Houze de l’Aulnoit D, Rey C. Пренатальная диагностика аорто-легочного окна с помощью эхокардиографии плода.
 Диагностика плода Тер. 2002 г., сен-октябрь; 17(5):302-7. [PubMed: 12169817]
Диагностика плода Тер. 2002 г., сен-октябрь; 17(5):302-7. [PubMed: 12169817]- 17.
Демир И.Х., Эрдем А., Сарыташ Т., Демир Ф., Эрол Н., Юджел И.К., Айдемир Н.А., Челеби А. Диагностика, лечение и исходы у пациентов с аортопульмональным окном. Balkan Med J. 2013 Jun;30(2):191-6. [Бесплатная статья PMC: PMC4115960] [PubMed: 25207099]
- 18.
Chen J, Guo J, Cao S. Необъяснимая легочная гипертензия: пропущенное аортопульмональное окно. Eur Heart J. 2020 14 марта; 41 (11): 1217. [PubMed: 32034904]
- 19.
Майерс П.О., Ладор Ф., Хачулла А.Л., Бушарди Дж., Ноубл С., Ликер М., Паш Дж.К., Калимановаска-Острич Д., Джукич М., Калангос А., Бегетти М. Нерестриктивное аортопульмональное окно: Экстремальное представление как не Эйзенменгер в 30 -Летний пациент. Тираж. 2016 10 мая; 133(19):1907-10. [PubMed: 27166350]
- 20.
Дев М., Шарма М., Рана Н. Большое нелеченное аортопульмональное окно, проявляющееся во взрослом возрасте.
 Curr Cardiol Rev. 2020;16(1):73-76. [Бесплатная статья PMC: PMC7393594] [PubMed: 31092183]
Curr Cardiol Rev. 2020;16(1):73-76. [Бесплатная статья PMC: PMC7393594] [PubMed: 31092183]- 21.
Талвар С., Сиддхарт Б., Гупта С.К., Чоудхари С.К., Котари С.С., Джунжа Р., Саксена А., Айран Б. Аортопульмональное окно: результаты восстановления после младенчества. Interact Cardiovasc Thorac Surg. 2017 01 ноября; 25 (5): 740-744. [PubMed: 28633352]
- 22.
Зографос П.М., Протопапас Э.М., Хаким Н.И., Алексопулос С., Саррис Г.Э. Удивительно все еще ремонтируемое большое аортопульмональное окно у взрослого пациента. World J Pediatr Congenit Heart Surg. 2020 янв; 11 (1): 117-119. [PubMed: 31755375]
- 23.
Gangana CS, Malheiros AF, Alves EV, de Azevedo MA, Bernardes RM, Simões LC. Аортопульмональное окно — влияние сопутствующих поражений на результаты хирургического вмешательства. Arq Bras Кардиол. 2007 г., апрель; 88 (4): 402-7. [PubMed: 17546268]
- 24.
Gowda D, Gajjar T, Rao JN, Chavali P, Sirohi A, Pandarinathan N, Desai N.
 Хирургическое лечение аортопульмонального окна: 24-летний опыт и извлеченные уроки. Interact Cardiovasc Thorac Surg. 2017 01 августа; 25 (2): 302-309. [PubMed: 28475712]
Хирургическое лечение аортопульмонального окна: 24-летний опыт и извлеченные уроки. Interact Cardiovasc Thorac Surg. 2017 01 августа; 25 (2): 302-309. [PubMed: 28475712]- 25.
Talwar S, Agarwal P, Choudhary SK, Kothari SS, Juneja R, Saxena A, Airan B. Аортопульмональное окно: морфология, диагностика и долгосрочные результаты. J Card Surg. 2017 фев; 32 (2): 138-144. [PubMed: 28139013]
- 26.
Константинов И.Е., Карамлоу Т., Уильямс В.Г., Куэгебеур Дж.М., дель Нидо П.Дж., Спрей Т.Л., Кальдарон К.А., Блэкстоун Э.Х., МакКриндл Б.В., Общество кардиохирургов врожденных заболеваний. Хирургическое лечение аортопульмонального окна, связанного с прерванной дугой аорты: исследование Общества врожденных кардиохирургов. J Грудной сердечно-сосудистый хирург. 2006 г., май; 131(5):1136-1141.e2. [В паблике: 16678601]
- 27.
Учар Т., Карагозлю С., Рамоглу М.Г., Тутар Э. Транскатетерное закрытие аортопульмонального окна окклюдером протока Амплатцера II: дополнительный размер.
 Кардиол Янг. 2020 март; 30 (3): 424-426. [PubMed: 31928548]
Кардиол Янг. 2020 март; 30 (3): 424-426. [PubMed: 31928548]- 28.
Трехан В., Нигам А., Тьяги С. Чрескожное закрытие нерестриктивного аортопульмонального окна у трех младенцев. Катетер Cardiovasc Interv. 2008 15 февраля; 71 (3): 405-11. [PubMed: 18288731]
- 29.
Эль Дик Дж., Эль-Расси И., Тайех С., Битар Ф., Араби М. Аортопульмональное окно у взрослых: редкое заболевание, приводящее к синдрому Эйзенменгера. Эхокардиография. 2019 июнь;36(6):1173-1178. [PubMed: 31116466]
- 30.
Барнс М.Е., Митчелл М.Е., Тведделл Дж.С. Аортопульмональное окно. Semin Thorac Cardiovasc Surg Pediatr Card Surg Annu. 2011;14(1):67-74. [PubMed: 21444051]
- 31.
Кондон Л.М., Катков Х., Сингх А., Хелсет Х.К. Кардиовокальный синдром в младенчестве. Педиатрия. 1985 июля; 76 (1): 22-5. [PubMed: 4011354]
Аортопульмональный дефект перегородки — StatPearls
Continuing Education Activity
Аортопульмональный дефект или дефект перегородки/аортопульмональное окно является одним из самых редких врожденных пороков сердца. Этот дефект развивается эмбриологически при неполной перегородке магистральных артерий. Это может происходить изолированно или как часть более серьезного синдрома, включающего множественные пороки сердца. Невылеченные дефекты аортопульмональной перегородки обычно вызывают заболеваемость и смертность от большого сброса крови слева направо и легочной гипертензии. В этом мероприятии рассматривается оценка и лечение дефектов аорто-легочной перегородки и подчеркивается роль межпрофессиональной команды в уходе за пациентами с этим заболеванием.
Этот дефект развивается эмбриологически при неполной перегородке магистральных артерий. Это может происходить изолированно или как часть более серьезного синдрома, включающего множественные пороки сердца. Невылеченные дефекты аортопульмональной перегородки обычно вызывают заболеваемость и смертность от большого сброса крови слева направо и легочной гипертензии. В этом мероприятии рассматривается оценка и лечение дефектов аорто-легочной перегородки и подчеркивается роль межпрофессиональной команды в уходе за пациентами с этим заболеванием.
Цели:
Опишите патофизиологию дефектов аортолегочной перегородки как причины застойной сердечной недостаточности у младенцев.
Обзор эпидемиологии пациентов с диагнозом дефекты аорто-легочной перегородки.
Опишите план обследования пациента с вероятным дефектом аорто-легочной перегородки.
Объясните лечение и ведение пациентов с дефектами аорто-легочной перегородки.

Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Введение
Дефект аортолегочной (ПД) перегородки, также известный как АП окно, является одним из самых редких врожденных пороков сердца, на который приходится менее 0,5 % форм врожденных пороков сердца.[1] Этот дефект может возникать изолированно или одновременно с другими формами врожденных пороков сердца, такими как дефект межжелудочковой перегородки, разрыв дуги аорты, тетрада Фалло и очень редко аномалии коронарных артерий.[2][3][4][ 5][6] По определению, переднезаднее окно представляет собой прямое соединение «бок в бок» восходящей аорты с основной легочной артерией, но с формированием нормального аортального клапана и выходного тракта правого желудочка, что отличает его от артериального ствола [7]. Эмбриологически переднезаднее окно развивается при неполной септации магистральных артерий.
Этиология
Дефекты аортопульмонального окна составляют значительно менее 0,5% всех врожденных пороков сердца. [1] Примерно в 50% случаев они связаны с другими врожденными пороками сердца, такими как другие дефекты конотрункуса (например, тетрада Фалло, прерванная дуга аорты, D-транспозиция магистральных артерий), коарктация аорты, дефект межжелудочковой перегородки, коронарная артерия аномалии и атрезия трикуспидального клапана. Хотя этот дефект может показаться эмбриологически похожим на другие пороки развития конотрунка, существует удивительно низкая связь с синдромом Ди Джорджи. Это предполагает, что это не связано с аномалией сердечного нервного гребня.[11]
[1] Примерно в 50% случаев они связаны с другими врожденными пороками сердца, такими как другие дефекты конотрункуса (например, тетрада Фалло, прерванная дуга аорты, D-транспозиция магистральных артерий), коарктация аорты, дефект межжелудочковой перегородки, коронарная артерия аномалии и атрезия трикуспидального клапана. Хотя этот дефект может показаться эмбриологически похожим на другие пороки развития конотрунка, существует удивительно низкая связь с синдромом Ди Джорджи. Это предполагает, что это не связано с аномалией сердечного нервного гребня.[11]
Эпидемиология
Как обсуждалось выше, окно AP представляет собой редкий врожденный порок сердца, встречающийся менее чем в 0,5% всех врожденных пороков сердца.[1] Были идентифицированы генетические ассоциации, такие как VACTERL и Bohring-Opitz ; однако не было обнаружено, что конкретное воздействие на мать является ассоциативной причиной.
Патофизиология
Переднезаднее окно возникает в эмбриональном периоде, когда имеется неполная перегородка общего артериального ствола, что приводит к аномальному соединению между восходящей аортой и главной легочной артерией. В изолированном переднезаднем окне два отдельных полулунных клапана (аортальный и легочный) обычно формируются нормально.[13] Расположение оконного дефекта – между полулунными клапанами и ветвями легочных артерий. Выделяют три типа переднезаднего окна: тип I (проксимальный), возникающий между задней стенкой восходящей аорты и латеральной стенкой основной легочной артерии; тип II (дистальный), возникающий между задней стенкой восходящей аорты и передней стенкой места отхождения правой легочной артерии; и тип III, представляющий собой комбинацию типов I и II. Тип I — наиболее распространенный тип окна AP.[13] Размер соединения варьирует, но обычно он большой, неограниченный и гемодинамически значимый. Менее чем в 10 % случаев окно AP маленькое и ограничивает давление.[14]
В изолированном переднезаднем окне два отдельных полулунных клапана (аортальный и легочный) обычно формируются нормально.[13] Расположение оконного дефекта – между полулунными клапанами и ветвями легочных артерий. Выделяют три типа переднезаднего окна: тип I (проксимальный), возникающий между задней стенкой восходящей аорты и латеральной стенкой основной легочной артерии; тип II (дистальный), возникающий между задней стенкой восходящей аорты и передней стенкой места отхождения правой легочной артерии; и тип III, представляющий собой комбинацию типов I и II. Тип I — наиболее распространенный тип окна AP.[13] Размер соединения варьирует, но обычно он большой, неограниченный и гемодинамически значимый. Менее чем в 10 % случаев окно AP маленькое и ограничивает давление.[14]
Анамнез и физикальное исследование
Несмотря на то, что можно диагностировать изолированное окно АП внутриутробно с помощью эхокардиографии плода, более типичным проявлением является неонатальный период или ранний младенческий возраст. [15][16][17] Типичными признаками и симптомами, связанными с окном AP, являются легочная избыточная циркуляция, возникающая по мере того, как сопротивление легочных сосудов падает в течение первых нескольких недель жизни. Обычно это приводит к большому сбросу крови слева направо, а симптомы включают потоотделение (особенно при кормлении), тахипноэ, тахикардию, плохую прибавку в весе и усиление респираторных симптомов при вирусных инфекциях. Прекордиальная часть часто гипердинамична, можно оценить шум митрального клапана. Пульс часто учащается, так как системное диастолическое артериальное давление снижается вследствие реверсирования аортального кровотока в диастолу. В редких случаях отмечается непрерывный шум, так как соединение между аортой и легочной артерией обычно велико, что не позволяет развиться значительному градиенту давления (рестрикции).
[15][16][17] Типичными признаками и симптомами, связанными с окном AP, являются легочная избыточная циркуляция, возникающая по мере того, как сопротивление легочных сосудов падает в течение первых нескольких недель жизни. Обычно это приводит к большому сбросу крови слева направо, а симптомы включают потоотделение (особенно при кормлении), тахипноэ, тахикардию, плохую прибавку в весе и усиление респираторных симптомов при вирусных инфекциях. Прекордиальная часть часто гипердинамична, можно оценить шум митрального клапана. Пульс часто учащается, так как системное диастолическое артериальное давление снижается вследствие реверсирования аортального кровотока в диастолу. В редких случаях отмечается непрерывный шум, так как соединение между аортой и легочной артерией обычно велико, что не позволяет развиться значительному градиенту давления (рестрикции).
Как отмечалось выше, окно AP может быть связано с другими типами врожденных пороков сердца, и ассоциированный дефект может изменить представление. При тетраде Фалло можно отметить шум изгнания легочной артерии и щелчок клапана легочной артерии. Когда окно AP возникает с прерванной дугой аорты, у новорожденного может возникнуть шок, поскольку артериальный проток сужается. Иногда окно АД может быть рестриктивным и сопровождаться менее выраженными симптомами гиперциркуляции. В этом случае можно отметить непрерывный шум в сердце. В редких случаях диагноз окна AP ставится только в более позднем детстве или даже во взрослой жизни. Это может проявляться признаками синдрома Эйзенменгера, в том числе цианозом и клубами.[18][19]][20] Однако поздняя манифестация окна AP по-прежнему требует подробной гемодинамической оценки, поскольку некоторые пациенты все еще могут быть кандидатами на восстановление, если имеется приемлемое сопротивление легочных сосудов или соответствующий ответ на тестирование сосудорасширяющих средств.[21][22]
При тетраде Фалло можно отметить шум изгнания легочной артерии и щелчок клапана легочной артерии. Когда окно AP возникает с прерванной дугой аорты, у новорожденного может возникнуть шок, поскольку артериальный проток сужается. Иногда окно АД может быть рестриктивным и сопровождаться менее выраженными симптомами гиперциркуляции. В этом случае можно отметить непрерывный шум в сердце. В редких случаях диагноз окна AP ставится только в более позднем детстве или даже во взрослой жизни. Это может проявляться признаками синдрома Эйзенменгера, в том числе цианозом и клубами.[18][19]][20] Однако поздняя манифестация окна AP по-прежнему требует подробной гемодинамической оценки, поскольку некоторые пациенты все еще могут быть кандидатами на восстановление, если имеется приемлемое сопротивление легочных сосудов или соответствующий ответ на тестирование сосудорасширяющих средств.[21][22]
Оценка
У детей с переднезадним окном рентгенограмма грудной клетки покажет кардиомегалию и усиление легочных сосудистых отметин. Электрокардиограмма продемонстрирует тахикардию и повышенный вольтаж справа и слева. Диагноз AP-окна ставится с помощью эхокардиографии при подозрении на большой сброс крови слева направо. Поскольку связь обычно без существенных ограничений, цветная допплеровская эхокардиография не обнаружит высокоскоростную цветную струю. Когда подозрения высоки, 2D-изображений обычно достаточно для измерения связи окна AP. Если изображения эхокардиограммы недостаточно, компьютерная томография может потенциально очертить соединение AP.
Электрокардиограмма продемонстрирует тахикардию и повышенный вольтаж справа и слева. Диагноз AP-окна ставится с помощью эхокардиографии при подозрении на большой сброс крови слева направо. Поскольку связь обычно без существенных ограничений, цветная допплеровская эхокардиография не обнаружит высокоскоростную цветную струю. Когда подозрения высоки, 2D-изображений обычно достаточно для измерения связи окна AP. Если изображения эхокардиограммы недостаточно, компьютерная томография может потенциально очертить соединение AP.
Эхокардиография должна полностью оценить оставшиеся структуры сердца, включая оценку других сердечных заболеваний, таких как тетрада Фалло, разрыв дуги аорты, и следует позаботиться о выявлении коронарных артерий. Если диагноз не установлен поздно или не может быть поставлен с помощью менее инвазивных методов, катетеризация сердца мало что добавляет к диагностическому лечению. Когда диагноз ставится после младенчества или даже во взрослом возрасте, особенно если отмечается цианоз, катетеризация может быть использована для оценки легочного сосудистого сопротивления, поскольку может развиться синдром Эйзенменгера. Если имеется заболевание легочных сосудов, во время катетеризации необходимо провести тест на реактивность, чтобы определить целесообразность закрытия [22].
Если имеется заболевание легочных сосудов, во время катетеризации необходимо провести тест на реактивность, чтобы определить целесообразность закрытия [22].
Лечение/управление
Как правило, лечение большого окна AP заключается в закрытии хирургической заплатой, и результаты, как правило, хорошие, когда восстановление происходит в раннем младенчестве.[23][24] Небольшие дефекты можно закрыть хирургическим путем, в первую очередь, с помощью двойной перевязки или наложения швов. Логично предположить, что сопутствующий врожденный порок сердца усложняет хирургическое лечение и ухудшает результаты.[23][26] Закрытие устройства для катетеризации с помощью окклюдеров с двойным диском (дефект межпредсердной перегородки и открытый артериальный проток) было описано в сообщениях о случаях дефектов, которые обычно являются рестриктивными, что позволяет закрыть их в более позднем детстве.
Противозастойные препараты, такие как диуретики (например, фуросемид и хлоротиазид) и дигоксин, могут обеспечить временное улучшение симптомов, но не должны существенно изменить течение заболевания. Снижение постнагрузки можно рассматривать при ингибировании АПФ. К медикаментозной терапии следует подходить с осторожностью, так как может быть нарушение почечной перфузии. Хирургическое вмешательство следует рассмотреть во время постановки диагноза, так как при такой физиологии рост, вероятно, будет незначительным, и существует риск развития необратимой легочной гипертензии с течением времени. Кроме того, окно АД не ограничивается и не становится гемодинамически менее значимым с течением времени. Как правило, хирургическое вмешательство включает разделение магистральных артерий либо с разделением швов, либо с закрытием аорты и легочной артерии заплатой с низкой хирургической смертностью.
Снижение постнагрузки можно рассматривать при ингибировании АПФ. К медикаментозной терапии следует подходить с осторожностью, так как может быть нарушение почечной перфузии. Хирургическое вмешательство следует рассмотреть во время постановки диагноза, так как при такой физиологии рост, вероятно, будет незначительным, и существует риск развития необратимой легочной гипертензии с течением времени. Кроме того, окно АД не ограничивается и не становится гемодинамически менее значимым с течением времени. Как правило, хирургическое вмешательство включает разделение магистральных артерий либо с разделением швов, либо с закрытием аорты и легочной артерии заплатой с низкой хирургической смертностью.
Катетеризацию можно рассматривать, когда дефект достаточно мал, чтобы можно было закрыть устройство, не вызывая стеноза магистральных артерий или вмешательства в работу полулунных клапанов. При наличии других пороков сердца очевидно, что восстановление или паллиативное лечение других пороков должно производиться во время той же операции. Послеоперационный стеноз аорты, реже, и стеноз легочной артерии в основной и ответвленной легочных артериях, чаще, может возникнуть. Если этот стеноз гемодинамически важен, в будущем можно использовать катетеризацию сердца с баллонной ангиопластикой или имплантацией стента. Кроме того, в условиях прерванной пластики дуги аорты могут потребоваться транскатетерные вмешательства на аорте по поводу остаточной обструкции дуги [26].
Послеоперационный стеноз аорты, реже, и стеноз легочной артерии в основной и ответвленной легочных артериях, чаще, может возникнуть. Если этот стеноз гемодинамически важен, в будущем можно использовать катетеризацию сердца с баллонной ангиопластикой или имплантацией стента. Кроме того, в условиях прерванной пластики дуги аорты могут потребоваться транскатетерные вмешательства на аорте по поводу остаточной обструкции дуги [26].
Дифференциальный диагноз
Артериальный ствол является наиболее частым поражением, которое путают с окном AP, но имеет магистральный клапан вместо двух полулунных клапанов. Ранняя патофизиология аналогична.
Открытый артериальный проток (ОАП) имеет аналогичную физиологию. ОАП типа «окно» представляет собой соединение проксимального отдела нисходящей аорты и левой легочной артерии вблизи бифуркации. Переднезаднее окно представляет собой соединение восходящей аорты и главной легочной артерии.
Большой дефект межжелудочковой перегородки имеет аналогичную физиологию, но его легко отличить от окна AP.

Прогноз
Прогноз для изолированного окна AP хороший при раннем лечении с хирургическим закрытием и предотвращением развития заболевания легочных сосудов [24]. Поздняя диагностика может быть связана с развитием легочной гипертензии/синдрома Эйзенменгера, что имеет неблагоприятный прогноз. Связанное окно AP с другими врожденными пороками сердца увеличивает сложность операции.
Осложнения
Осложнения неправильного диагноза включают развитие синдрома Эйзенменгера.[29] Восстановление может быть связано с остаточными дефектами, включая стеноз ветви легочной артерии и остаточное окно AP, которые, возможно, потребуют решения в будущем. С осторожностью следует использовать баллонную ангиопластику, поскольку окно AP теоретически может повториться при агрессивной ангиопластике. Следует заподозрить рецидивирующее повреждение гортанного нерва, если после операции отмечается охриплость голоса или поперхивание при кормлении [31].
Консультации
Лечение окна AP требует подхода межпрофессиональной команды. Как правило, для оптимизации результатов следует проконсультироваться с кардиологом, кардиохирургом и кардиологом.
Как правило, для оптимизации результатов следует проконсультироваться с кардиологом, кардиохирургом и кардиологом.
Pearls and Other Issues
Диагноз окна AP обычно ставится с помощью эхокардиографии. Нельзя не подчеркнуть, что сильное клиническое подозрение на большой шунт слева направо и скачкообразный импульс должны побуждать к эхокардиограмме, сфокусированной на оценке окна АД. Несвоевременное восстановление переднезаднего окна сопряжено с риском сохранения значительной легочной гипертензии, поэтому перед поздним восстановлением переднезаднего окна рекомендуется предоперационная катетеризация. Должен быть низкий порог послеоперационной катетеризации сердца для оценки легочного сосудистого сопротивления. В целом, раннее восстановление окна AP дает отличный долгосрочный прогноз.
Улучшение результатов команды здравоохранения
Окно для диагностики и лечения ОП требует участия межпрофессиональной команды, в которую входят педиатр, кардиолог, кардиохирург, реаниматолог и рентгенолог. Расстройство обычно лечится хирургическим путем, но главное, чтобы у ребенка не было других сопутствующих врожденных пороков сердца. После того, как операция выполнена, младенец обычно находится под наблюдением кардиолога или медсестры интенсивной терапии. Если это изолированный порок, исходы хорошие и, как правило, хорошие, даже если они связаны с другими врожденными пороками сердца. Фармацевты должны пересматривать дозировку лекарств и обучать семьи пациентов. Специализированные медсестры помогают координировать уход и информируют команду об изменениях в состоянии пациента. После успешного восстановления рекомендуется неопределенное длительное наблюдение у кардиолога для скрининга поздних аномалий, таких как стеноз ветви легочной артерии.
Расстройство обычно лечится хирургическим путем, но главное, чтобы у ребенка не было других сопутствующих врожденных пороков сердца. После того, как операция выполнена, младенец обычно находится под наблюдением кардиолога или медсестры интенсивной терапии. Если это изолированный порок, исходы хорошие и, как правило, хорошие, даже если они связаны с другими врожденными пороками сердца. Фармацевты должны пересматривать дозировку лекарств и обучать семьи пациентов. Специализированные медсестры помогают координировать уход и информируют команду об изменениях в состоянии пациента. После успешного восстановления рекомендуется неопределенное длительное наблюдение у кардиолога для скрининга поздних аномалий, таких как стеноз ветви легочной артерии.
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Рисунок
2D-изображение окна AP, видимое из подреберных проекций. Предоставлено Pushpa Shivaram, MD
Предоставлено Pushpa Shivaram, MD
Рисунок
Эхокардиограмма и цветное изображение окна AP, демонстрирующее поток между аортой и легочной артерией. Предоставлено Pushpa Shivaram MD
Figure
КТ 3D-реконструкция, демонстрирующая переднезаднее окно. Существует также большой артериальный проток в условиях тяжелой коарктации. Предоставлено Марком Лоу, доктором медицины
Ссылки
- 1.
Саманек М., Ворискова М. Врожденный порок сердца среди 815 569 детей, родившихся между 1980 и 1990 годами, и их 15-летняя выживаемость: проспективное исследование выживания в Богемии. Педиатр Кардиол. 1999 ноябрь-декабрь; 20(6):411-7. [PubMed: 10556387]
- 2.
Прабху С., Кешав М., Рамачандра П., Радж В., Джон С., Карл Т.Р. Тетрада Фалло с легочной атрезией и аортопульмональным окном может имитировать общий артериальный ствол. Кардиол Янг. 2022 март; 32(3):410-414. [В паблике: 34134806]
- 3.
Sondhi S, Negi PC, Sharma R, Mehta A.
 Аортопульмональное окно с легочной атрезией с дефектом межжелудочковой перегородки с D-транспозицией крупных артерий: крайне редкая аномалия. BMJ Case Rep. 2018 Jun 13; 2018 [бесплатная статья PMC: PMC6011482] [PubMed: 29898907]
Аортопульмональное окно с легочной атрезией с дефектом межжелудочковой перегородки с D-транспозицией крупных артерий: крайне редкая аномалия. BMJ Case Rep. 2018 Jun 13; 2018 [бесплатная статья PMC: PMC6011482] [PubMed: 29898907]- 4.
Bin-Moallim M, Hamadah HK, Alhabshan F, Alghamdi AA, Kabbani MS. Аортопульмональное окно: типы, сопутствующие сердечно-сосудистые аномалии и исход хирургического вмешательства. Ретроспективный анализ опыта одного центра. J Саудовская ассоциация сердца 2020;32(2):127-133. [Бесплатная статья PMC: PMC7640542] [PubMed: 33154906]
- 5.
Алахфаш А.А., Тагельден М., Альмеснед А., Алкваи А. Аортопульмональное окно с аномальным отхождением правой коронарной артерии от легочной артерии. Отчет о клиническом случае и обзор литературы. Кардиол Янг. 2020 янв;30(1):47-49. [PubMed: 31854282]
- 6.
Grünenfelder J, Zünd G, Vogt PR, Turina MI. Аортопульмональное окно с аномальным отхождением правой коронарной артерии.
 Энн Торак Серг. 1999 г., январь; 67 (1): 233-5. [PubMed: 10086558]
Энн Торак Серг. 1999 г., январь; 67 (1): 233-5. [PubMed: 10086558]- 7.
Раджагопал Р., Синха М., Пандей Н.Н., Бхамбри К., Кумар С. Тетрада фалло с легочной атрезией и аорто-легочным окном: или это артериальный ствол? J Cardiovasc Comput Tomogr. 2020 сен-октябрь;14(5):e20-e21. [PubMed: 30385324]
- 8.
Trowitzsch E, Schneider M, Urban A, Asfour B. Врожденная легочная перевязь, аорто-легочное окно и обструкция легочных вен как диагностическая и терапевтическая проблема у младенца с ассоциацией VACTERL. Клин Рез Кардиол. 2006 июнь; 95(6):338-43. [PubMed: 16598388]
- 9.
Милованович В., Стефанович И., Илич С. Атрезия трехстворчатого клапана, связанная с аортопульмональным окном: диагностические и терапевтические дилеммы. Кардиол Янг. 2017 апр; 27 (3): 580-583. [PubMed: 27680574]
- 10.
Van Mierop LH, Kutsche LM. Сердечно-сосудистые аномалии при синдроме Ди Джорджи и значение нервного гребня как возможного патогенетического фактора.
 Ам Джей Кардиол. 1 986 июля 01; 58 (1): 133-7. [В паблике: 3728313]
Ам Джей Кардиол. 1 986 июля 01; 58 (1): 133-7. [В паблике: 3728313]- 11.
Куче Л.М., Ван Мироп Л.Х. Анатомия и патогенез дефекта аортолегочной перегородки. Ам Джей Кардиол. 1987 г., 15 февраля; 59(5):443-7. [PubMed: 3812313]
- 12.
Верма Б., Абхинай А., Сингх А., Кумар М. Двойной выход из правого желудочка и аортопульмональное окно у новорожденного с синдромом Боринга-Опица (Оберклайда-Данкса): отчет о первом случае. J Family Med Prim Care. 2019 март;8(3):1279-1281. [Бесплатная статья PMC: PMC6482752] [PubMed: 31041292]
- 13.
Джейкобс Дж.П., Квинтессенза Дж.А., Гейнор Дж.В., Берк Р.П., Маврудис С. Номенклатура хирургии врожденного сердца и проект базы данных: аортопульмональное окно. Энн Торак Серг. 2000 г., апрель; 69 (4 Дополнение): S44-9. [PubMed: 10798415]
- 14.
Авасти Н., Джавид С.А. Аортопульмональное окно с перекрещивающимися легочными артериями: анатомический тип 1, физиологический тип 2.
 J Cardiovasc Echogr. 2017 окт.-дек.; 27(4):143-144. [Бесплатная статья PMC: PMC5672687] [PubMed: 29142813]
J Cardiovasc Echogr. 2017 окт.-дек.; 27(4):143-144. [Бесплатная статья PMC: PMC5672687] [PubMed: 29142813]- 15.
Тонгпрасерт Ф., Ситтивангкул Р., Джатаван П., Тонгсонг Т. Пренатальная диагностика аортопульмонального окна: серия случаев и обзор литературы. J УЗИ Мед. 2017 авг; 36 (8): 1733-1738. [PubMed: 28393388]
- 16.
Collinet P, Chatelet-Cheront C, Houze de l’Aulnoit D, Rey C. Пренатальная диагностика аорто-легочного окна с помощью эхокардиографии плода. Диагностика плода Тер. 2002 г., сен-октябрь; 17(5):302-7. [PubMed: 12169817]
- 17.
Демир И.Х., Эрдем А., Сарыташ Т., Демир Ф., Эрол Н., Юджел И.К., Айдемир Н.А., Челеби А. Диагностика, лечение и исходы у пациентов с аортопульмональным окном. Balkan Med J. 2013 Jun;30(2):191-6. [Бесплатная статья PMC: PMC4115960] [PubMed: 25207099]
- 18.
Chen J, Guo J, Cao S. Необъяснимая легочная гипертензия: пропущенное аортопульмональное окно.
 Eur Heart J. 2020 14 марта; 41 (11): 1217. [PubMed: 32034904]
Eur Heart J. 2020 14 марта; 41 (11): 1217. [PubMed: 32034904]- 19.
Майерс П.О., Ладор Ф., Хачулла А.Л., Бушарди Дж., Ноубл С., Ликер М., Паш Дж.К., Калимановаска-Острич Д., Джукич М., Калангос А., Бегетти М. Нерестриктивное аортопульмональное окно: Экстремальное представление как не Эйзенменгер в 30 -Летний пациент. Тираж. 2016 10 мая; 133(19):1907-10. [PubMed: 27166350]
- 20.
- Дев М., Шарма М., Рана Н. Большое нелеченное аортопульмональное окно, проявляющееся во взрослом возрасте. Curr Cardiol Rev. 2020;16(1):73-76. [Бесплатная статья PMC: PMC7393594] [PubMed: 31092183]
- 21.
Талвар С., Сиддхарт Б., Гупта С.К., Чоудхари С.К., Котари С.С., Джунжа Р., Саксена А., Айран Б. Аортопульмональное окно: результаты восстановления после младенчества. Interact Cardiovasc Thorac Surg. 2017 01 ноября; 25 (5): 740-744. [PubMed: 28633352]
- 22.
Зографос П.М., Протопапас Э.М., Хаким Н.И.
 , Алексопулос С., Саррис Г.Э. Удивительно все еще ремонтируемое большое аортопульмональное окно у взрослого пациента. World J Pediatr Congenit Heart Surg. 2020 янв; 11 (1): 117-119. [PubMed: 31755375]
, Алексопулос С., Саррис Г.Э. Удивительно все еще ремонтируемое большое аортопульмональное окно у взрослого пациента. World J Pediatr Congenit Heart Surg. 2020 янв; 11 (1): 117-119. [PubMed: 31755375]- 23.
Gangana CS, Malheiros AF, Alves EV, de Azevedo MA, Bernardes RM, Simões LC. Аортопульмональное окно — влияние сопутствующих поражений на результаты хирургического вмешательства. Arq Bras Кардиол. 2007 г., апрель; 88 (4): 402-7. [PubMed: 17546268]
- 24.
Gowda D, Gajjar T, Rao JN, Chavali P, Sirohi A, Pandarinathan N, Desai N. Хирургическое лечение аортопульмонального окна: 24-летний опыт и извлеченные уроки. Interact Cardiovasc Thorac Surg. 2017 01 августа; 25 (2): 302-309. [PubMed: 28475712]
- 25.
Talwar S, Agarwal P, Choudhary SK, Kothari SS, Juneja R, Saxena A, Airan B. Аортопульмональное окно: морфология, диагностика и долгосрочные результаты. J Card Surg. 2017 фев; 32 (2): 138-144. [PubMed: 28139013]
- 26.

Константинов И.Е., Карамлоу Т., Уильямс В.Г., Куэгебеур Дж.М., дель Нидо П.Дж., Спрей Т.Л., Кальдарон К.А., Блэкстоун Э.Х., МакКриндл Б.В., Общество кардиохирургов врожденных заболеваний. Хирургическое лечение аортопульмонального окна, связанного с прерванной дугой аорты: исследование Общества врожденных кардиохирургов. J Грудной сердечно-сосудистый хирург. 2006 г., май; 131(5):1136-1141.e2. [В паблике: 16678601]
- 27.
Учар Т., Карагозлю С., Рамоглу М.Г., Тутар Э. Транскатетерное закрытие аортопульмонального окна окклюдером протока Амплатцера II: дополнительный размер. Кардиол Янг. 2020 март; 30 (3): 424-426. [PubMed: 31928548]
- 28.
Трехан В., Нигам А., Тьяги С. Чрескожное закрытие нерестриктивного аортопульмонального окна у трех младенцев. Катетер Cardiovasc Interv. 2008 15 февраля; 71 (3): 405-11. [PubMed: 18288731]
- 29.
Эль Дик Дж., Эль-Расси И., Тайех С., Битар Ф., Араби М. Аортопульмональное окно у взрослых: редкое заболевание, приводящее к синдрому Эйзенменгера.

