Enterococcus faecalis лечение бактериофаги: Интестифаг® бактериофаг поливалентный
Российские ученые нашли замену антибиотикам при лечении энтерококковых инфекций
Российские исследователи открыли два новых вида бактериофагов — антимикробных препаратов природного происхождения, которые могут стать оптимальными кандидатами для лечения энтерококковых инфекций. Открытие совершили специалисты Института экспериментальной медицины (ИЭМ) — участника Научного центра мирового уровня (НЦМУ) «Центр персонализированной медицины».
Энтерококки — это бактерии, которые чаще всего вызывают инфекции у больных, находящихся на лечении в стационарах. Такие бактерии уже выработали устойчивость к антибиотикам, поэтому ученые предлагают в качестве средства для лечения и профилактики энтерококковых инфекций использовать бактериофаги. Это особые вирусы, которые размножаются только в присутствии конкретного вида болезнетворных бактерий. В отличие от антибиотиков, бактериофаги не затрагивают полезную микрофлору организма, они безопасны и нетоксичны. Однако изменчивость популяционной структуры патогенов требует постоянного обновления состава лечебных препаратов и включения в них новых разновидностей бактериофагов.
Ученые Института экспериментальной медицины под руководством доктора медицинских наук, заведующего лабораторией функциональной геномики и протеомики микроорганизмов ИЭМ Артемия Гончарова открыли два новых вида бактериофагов — вирулентных хвостатых бактериофагов, обладающих литической активностью в отношении бактерий Enterococcus faecalis и E. Faecium.
Литический цикл жизни бактериофагов напоминает отношения «хищник-жертва»: вирус прикрепляется к бактериальной клетке и вводит в нее свой генетический материал, из-за чего клетка начинает воспроизводить новые вирусные частицы и разрушается изнутри. А высвободившиеся бактериофаги в организме либо ищут новые бактериальные клетки, либо выводятся без вреда для организма. Действующие таким образом бактериофаги называют вирулентными.
«Наша научная группа проводит поиск бактериофагов, исходя из анализа эпидемиологической ситуации с внутрибольничными инфекциями, складывающейся в российских стационарах.
Один из впервые описанных бактериофагов, названный SSsP-1, принадлежит к роду Saphexavirus семейства Siphoviridae (вирусы, поражающие прокариоты), а другой бактериофаг — GVEsP-1 — к роду Schiekvirus семейства Herelleviridae (вирусы, поражающие бактерии).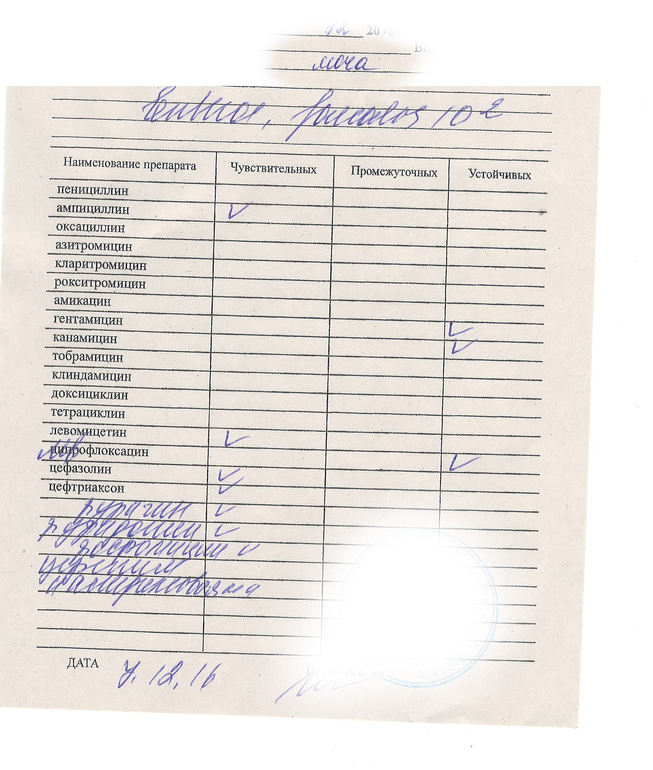
Эксперименты на лабораторных мышах показали высокую эффективность новых бактериофагов при лечении системной энтерококковой инфекции. Геномы описанных бактериофагов содержат участки, кодирующие факторы противодействия бактериальной системе антивирусного иммунитета CRISPR-CAS. Это объясняет их высокую вирулентность (инфекционность, способность к колонизации) по отношению к бактериям-хозяевам. Эти наблюдения свидетельствуют о перспективах успешного применения новых бактериофагов.
Работа поддержана Минобрнауки России. Научная статья опубликована в журнале Viruses (SJR Q1).
Электронная микрофотография (просвечивающая электронная микроскопия) вирионов нового фага Enterococcus phage GVEsP-1 (А) и Enterococcus phage SSsP-1 (В). Указана шкала 100 nm.
основы производства, требования и контроль качества
Бактериофаги, как универсальные солдаты, находят свое применение в
ветеринарии, сельском хозяйстве, экологической безопасности, пищевой промышленности и даже генной
инженерии. На службе у медицины они находятся уже давно, но в последнее десятилетие интерес к ним
особенно возрос.
На службе у медицины они находятся уже давно, но в последнее десятилетие интерес к ним
особенно возрос.
Долгое бесконтрольное назначение антибиотиков привело к появлению устойчивых (резистентных) к воздействию этих препаратов микроорганизмов у большого количества людей – как результат, произошел рост числа инфекций, которые трудно поддаются лечению. Одно из решений данной проблемы – бактериофаги.
Чаще всего проявляют резистентность к антибиотикам бактерии группы ESСAPE – возбудители госпитальных (внутрибольничных) инфекций. Бактериофаги способны разрушать патогенные микроорганизмы, которые относятся к этой группе.
ESСAPE – аббревиатура из названий бактерий: Enterococcus faecium (энтерококки), Staphylococcus aureus (золотистый стафилококк), Klebsiella pneumoniae (клебсиелла пневмонии), Escherichia coli (кишечная палочка), Acinetobacter baumannii (ацинетобактер), Pseudomonas aeruginosa (синегнойная палочка), Enterobacter spp (энтеробактер).
В Великобритании и Бангладаше успешно провели эксперименты по лечению бактериофагами хронического отита, вызванного нечувствительной к антибиотикам синегнойной палочкой Pseudomonas aeruginosa. Медицинские центры Франции, Бельгии и Швейцарии проводят клинические испытания коктейля фагов для предотвращения инфекций при ожогах. Об испытаниях собственных оригинальных коктейлей фагов для лечения широкого спектра заболеваний сообщают и американские компании. Правда, ни одно из этих масштабных клинических испытаний пока не доведено до конца.
Добились успехов в лечении бактериофагами и даже вышли на уровень промышленного производства пять стран: Россия, Грузия, Польша, Украина и Узбекистан.
В России изучают и применяют бактериофаги на практике уже более 100 лет. В настоящий момент производством лекарственных бактериофагов в стране занимается только компания ОАО «НПО «Микроген».
Как и где производят лекарственные препараты бактериофагов? Расскажем об этом подробнее.
Производство фагов
Сегодня в промышленных масштабах бактериофагами занимаются три российских завода ОАО «НПО «Микроген»: в Нижнем Новгороде, Уфе и Перми.
В производстве бактериофагов есть несколько важных этапов.
Первый этап – это выделение штаммов бактерий и бактериофагов из объектов внешней среды или от больного.
На втором этапе происходит приготовление питательных сред, посевной бактериальной культуры и посевных (маточных) бактериофагов.
Для получения маточных бактериофагов питательные среды засеивают штаммами бактерий. После этого туда же добавляют в небольшом количестве вирулентные бактериофаги – такие, которые способны разрушать клетки бактерий.
Следующий этап – приготовление фаголизатов, очистка и сведение.
Питательную среду с бактериальными клетками и маточными бактериофагами помещают в реакторы, где происходит культивирование.
Применение аэрации на этапе культивирования стимулирует развитие микроорганизмов
На следующем этапе происходит ультрафильтрация – очищение полученной суспензии бактериофага от остатков бактериальных клеток и среды выращивания. Полученный промежуточный продукт называют фаголизатом.
Использование метода ультрафильтрации при производстве бактериофагов в АО «НПО «Микроген» обеспечило безопасность всех выпускаемых препаратов. А реакторная технология культивирования позволяет получить большие объемы фаговых препаратов, используя по минимуму ручной труд.
После ультрафильтрации фаголизат концентрируют. Далее препарат стерилизуют – это является залогом отсутствия в нем посторонних микроорганизмов. На завершающем этапе контролируют активность и эффективность полученного препарата.
Полученный препарат – прозрачную жидкость насыщенно- или светло-желтого цвета – разливают во флаконы. Их плотно закрывают в атмосфере инертного газа, благодаря чему внутрь не могут проникнуть посторонние вещества, способные нарушить стерильность или повлиять на свойства препарата. После чего проверяют, насколько прочно закупорены все флаконы.
Их плотно закрывают в атмосфере инертного газа, благодаря чему внутрь не могут проникнуть посторонние вещества, способные нарушить стерильность или повлиять на свойства препарата. После чего проверяют, насколько прочно закупорены все флаконы.
Требования и контроль качества
Все этапы производства, начиная с оценки качества сырья, реактивов, питательных сред и заканчивая готовым продуктом, находятся под строгим контролем. Не менее 30 % производственных штаммов бактерий ежегодно обновляют.
При отборе бактериофагов для включения в состав маточных фагов определяют их характеристики методом электронной микроскопии и методами молекулярной биологии. Производственные штаммы бактериофагов ежегодно обновляют путем выделения новых или путем адаптации уже имеющихся бактериофагов к свежевыделенным бактериальным культурам. Выращивают бактериофаги в среде, которая не содержит аллергенов и антибиотиков.
Полученные на производстве бактериофаги – это чистые фильтраты фаголизатов определенных бактерий. В конечном фаговом препарате не содержится токсинов, продуцируемых бактериями, и белковых компонентов питательной среды.
В конечном фаговом препарате не содержится токсинов, продуцируемых бактериями, и белковых компонентов питательной среды.
Готовый фаговый препарат соответствует всем требованиям, предъявляемым к лечебно-профилактическим препаратам бактериофагов Государственной фармакопеей Российской Федерации, необходимым биологическим характеристикам: он нетоксичен, имеет высокую литическую активность, широкий антибактериальный спектр, стабильность на протяжении всего срока годности.
На сегодня «Микроген» производит 11 различных фаговых препаратов, которые используют для лечения распространенных бактериальных инфекций. Препараты бактериофагов выпускают в форме раствора – универсальной и наиболее удобной для потребителя. Жидкий фаговый препарат можно принимать внутрь, использовать для полоскания полости рта, орошений, аппликаций, клизм, спринцеваний, а также обработки ран.
Бактериофаги – прекрасная альтернатива «сметающим все на своем пути» антибиотикам. Воздействуя только на определенный штамм бактерии, они сохраняют полезную микрофлору и безопасны при лечении как взрослых, так и маленьких детей.
Выделение и характеристика двух вирулентных фагов для борьбы с Staphylococcus aureus и Enterococcus faecalis, вызывающими кариес зубов
Бактерии и тестирование на чувствительность к антибиотикам
с кариесом и кариесом. Изоляты были идентифицированы биохимически с использованием обычных методов (таблица S1, дополнительные данные) и подтверждены системой Vitek 2.
Тест на чувствительность к антибиотикам был проведен для двух выделенных бактерий против выбора из двенадцати антибиотиков (рис. S1, дополнительные данные). Качественные данные антибиотикограмм (таблица 1) показали, что как S. aureus EG-AE3, так и E. faecalis EF01 были устойчивы по крайней мере к восьми антибиотикам с процентом устойчивости 75% и 66% против тестируемых антибиотиков, соответственно. . S. aureus устойчив к нитрофурантоину, амоксициллину, гентамицину, норфлоксацину, пенициллину-G, ванкомицину, цефтазидиму, цефотаксиму и амикацину, но чувствителен к хлорамфениколу и азтреонаму. E. faecalis EF01 устойчив к хлорамфениколу, гентамицину, норфлоксацину, пенициллину-G, цефтазидиму, азтреонаму, цефотаксиму и амикацину. В то же время этот изолят был чувствителен к нитрофурантоину, амоксициллину, ципрофлоксацину и ванкомицину.
E. faecalis EF01 устойчив к хлорамфениколу, гентамицину, норфлоксацину, пенициллину-G, цефтазидиму, азтреонаму, цефотаксиму и амикацину. В то же время этот изолят был чувствителен к нитрофурантоину, амоксициллину, ципрофлоксацину и ванкомицину.
Таблица (1):
Характер чувствительности к антибиотикам выделенных бактерий кариеса зубов по отношению к выбору из двенадцати антибиотиков.
| Бактерии |
Ф |
ТОПОР |
С |
СИП |
Общий |
НО |
Р |
ВА |
КАЗ |
Банкомат |
СТХ |
АК |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| S. |
Р* |
Р |
С* |
И* |
Р |
Р |
Р |
Р |
Р |
С |
Р |
Р |
| E. faecalis EF01 |
С |
С |
Р |
С |
Р |
Р |
Р |
С |
Р |
Р |
Р |
Р |
Нитрофурантоин (F, 10 мкг), амоксициллин (AX, 25 мкг), хлорамфеникол (C 30 мкг), ципрофлоксацин (CIP 5 мкг), гентамицин (GN, 10 мкг), норфлоксацин (NOR, 10 мкг), Пенициллин-G (P, 10 мкг), ванкомицин (V, 30 мкг), цефтазидим (CAZ, 30 мкг), азтреонам (ATM, 30 мкг), цефотаксим (CTX, 30 мкг) и амикацин (AK, 30 мкг).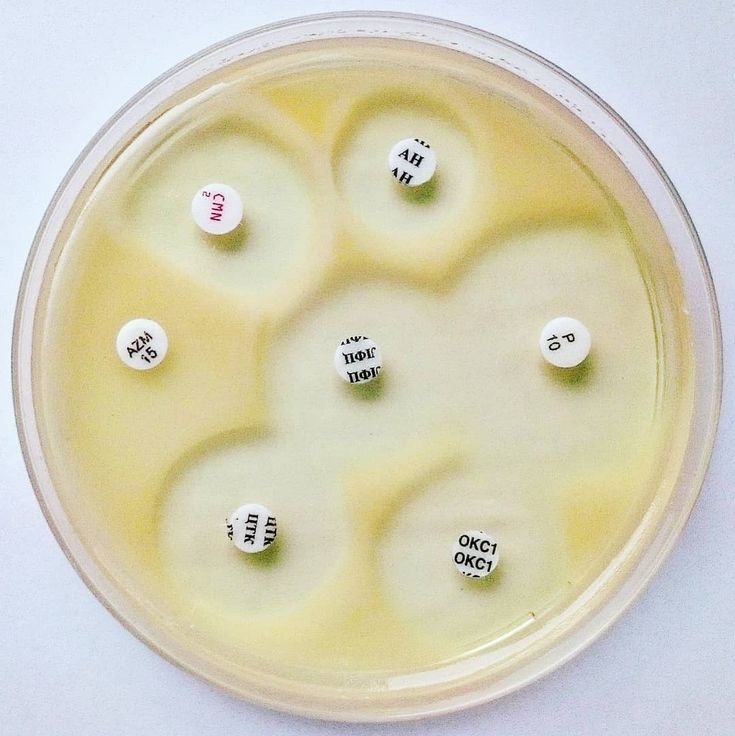 * Обозначает устойчивый (R), промежуточный (I) и чувствительный (S).
* Обозначает устойчивый (R), промежуточный (I) и чувствительный (S).
Морфология бактериофагов
Два фага с различной морфологией зубного налета (рис. 1A и B), нацеленные на бактерии, вызывающие кариес, S. aureus и E. faecalis были успешно получены после скрининга 100 образцов слюны . Последовательные анализы с двойным мягким слоем агара привели к выделению чистых фагов, титрованию и обработке при 4°C. На рис. 1 показаны прозрачные бляшки, продуцируемые vB_SauM-EG-AE3 и vB_EfaP-EF01 на S. aureus EG-AE3 и 9.0006 E. faecalis EF01 в качестве штаммов-хозяев соответственно. Фаг vB_SauM-EG-AE3 продуцирует большие круглые прозрачные бляшки диаметром 4 мм, а большие круглые прозрачные бляшки были образованы vB_EfaP-EF01, но диаметром 3 мм. Концентрации фагов составляли от 2,5×10 10 БОЕ/мл до 3,1×10 9 БОЕ/мл для vB_EfaP-EF01 и vB_SauM-EG-AE3 соответственно.
Рис. 1. Фенотипы бляшек и TEM морфология выделенных фагов. (A-B) Изображения бактериальных бляшек, образованных изолированным фагом на газонах с верхним агаром S. aureus EG-AE3 и E. faecalis EF01, появление бляшек было обнаружено и отображено через 48 часов культивирования на их хозяевах. (C-D) ПЭМ-микрофотографии фагов vB_SauM-EG-AE3 и vB_EfaP-Ef01 были отрицательно окрашены 0,2% уранилацетатом, как описано в разделе «Материалы и методы». Масштабная линейка = 100 нм.
(A-B) Изображения бактериальных бляшек, образованных изолированным фагом на газонах с верхним агаром S. aureus EG-AE3 и E. faecalis EF01, появление бляшек было обнаружено и отображено через 48 часов культивирования на их хозяевах. (C-D) ПЭМ-микрофотографии фагов vB_SauM-EG-AE3 и vB_EfaP-Ef01 были отрицательно окрашены 0,2% уранилацетатом, как описано в разделе «Материалы и методы». Масштабная линейка = 100 нм.
Просвечивающая электронная микроскопия (рис. 1C и D) позволила нам сделать вывод, что vB_SauM-EG-AE3 и vB_EfaP-EF01 таксономически относятся к отряду Caudovirales. Размеры выделенных фагов были измерены и суммированы в таблице 2. Частица vB_SauM-EG-AE3 имела сократительный хвост длиной 75 ± 2 нм и головку диаметром около 67 ± 1 нм, типичный представитель семейства Myoviridae. В то время как vB_EfaP-EF01 был членом семейства Podoviridae, тогда как длина хвоста составляла около 9 ± 0,5 нм, а диаметр головы около 58 ± 2 нм.
Таблица (2):
Размеры выделенных фагов.
| Фаг |
Бактериальный хозяин |
Диаметр бляшек (мм) |
Диаметр головки (нм) |
Длина хвоста (нм) |
Предлагаемая семья |
|---|---|---|---|---|---|
| vB_SauM-EG-AE3 |
S. aureus EG-AE3 |
4 |
67 ± 1 |
75 ± 2 |
Миовирусы |
| vB_EfaP-Ef01 |
E. |
3 |
58 ± 2 |
9 ± 0,5 |
Podoviridae |
Кинетика роста и круг хозяев
Одностадийная кинетика роста выделенных фагов (рис. 2) демонстрирует типичную кинетику роста большинства бактериофагов. Фаги vB_SauM-EG-AE3 и vB_EfaP-EF01 давали размер вспышки 78,87 и 113,55 БОЕ/клетку соответственно с латентными периодами 25 и 30 минут. Был оценен диапазон хозяев выделенных фагов, и результаты были обобщены в таблице 3. Оба фага продемонстрировали узкий спектр литической активности.
Таблица (3):
Диапазоны хозяев изолированных фагов.
| Виды | Идентификационный номер штамма | Лизис бактериофагом | |
|---|---|---|---|
| vB_SauM-EG-AE3 | vB_EfaP-Ef01 | ||
S. aureus aureus |
EG-AE3 | + | – |
| EG-AE1 | + | – | |
| ЭГ-АЕ2 | – | – | |
| СА101 | – | – | |
| СА1Е | – | – | |
| БУХ | – | – | |
| E. faecalis | Ef01 | – | – |
| Etfc1 | – | + | |
| Etfc2 | – | + | |
| Etfc3 | – | – | |
| Enterococcus faecium | 1 | – | – |
| 2 | – | – | |
| 3 | – | – | |
| Acinetobacter baumannii | Акцент1 | – | – |
| Акинт2 | – | – | |
| Акцент3 | – | – | |
| Кишечная палочка | ВЕ1 | – | – |
| ВЕ2 | – | – | |
| ВЕ3 | – | – | |
Proteus spp. |
Пр1 | – | – |
| Salmonella spp. | Sa1 | – | – |
| Shigella spp. | Ш2 | – | – |
«–», нет сброса; «+», совершенно ясно.
Рис. 2. Одноэтапные кривые роста фагов vB_SauM-EG-AE3 (A) и vB_EfaP-Ef01 (B) на соответствующих им хозяевах. Показанные данные являются средним значением для трех повторов, а планки погрешностей показывают отклонения в значениях.
Термическая и рН-стабильность
Термическая и рН-стабильность фагов vB_SauM-EG-AE3 и vB_EfaP-EF01 были протестированы на основе остаточных титров фагов после инкубации при различных значениях рН и температурах (рис. 3). 9Фаг 0006 S. aureu s (vB_SauM-EG-AE3) был термостабильным в диапазоне температур от 10 до 60 °C, но после нагревания при ≥70 °C в течение 60 мин жизнеспособные фаги не обнаруживались. Фаг vB_SauM-EG-AE3 устойчив к диапазону рН от 4 до 11 в течение 1 часа. Точно так же не наблюдалось значительного снижения количества фага E. faecalis (vB_EfaP-EF01) при температуре от 10 до 60°C. Но после нагревания при 70°С в течение 60 мин титры фагов снижались на 60%, а после нагревания при 80°С в течение 60 мин жизнеспособные фаги не обнаруживались. Что касается стабильности pH, было обнаружено, что фаги vB_SauM-EG-AE3 и vB_EfaP-EF01 устойчивы в диапазоне pH 4-11 через 60 минут при 37 °C ч (рис. 3C-D).
Фаг vB_SauM-EG-AE3 устойчив к диапазону рН от 4 до 11 в течение 1 часа. Точно так же не наблюдалось значительного снижения количества фага E. faecalis (vB_EfaP-EF01) при температуре от 10 до 60°C. Но после нагревания при 70°С в течение 60 мин титры фагов снижались на 60%, а после нагревания при 80°С в течение 60 мин жизнеспособные фаги не обнаруживались. Что касается стабильности pH, было обнаружено, что фаги vB_SauM-EG-AE3 и vB_EfaP-EF01 устойчивы в диапазоне pH 4-11 через 60 минут при 37 °C ч (рис. 3C-D).
Рис. 3. Термический и рН-толерантный тест фагов vB_SauM-EG-AE3 и vB_EfaP-Ef01. (A-B) Термическая устойчивость и (C-D) pH-стабильность фагов vB_SauM-EG-AE3 и vB_EfaP-Ef01 соответственно. Температурные эксперименты проводили в течение 1 ч при рН 7. Толерантность к рН проводили в течение 60 мин при 37°С. Данные показали процентное содержание оставшихся фагов после каждой обработки, нормализованное относительно контроля. Показанные данные являются средним значением для трех повторов, а планки погрешностей показывают отклонения в значениях.
Показанные данные являются средним значением для трех повторов, а планки погрешностей показывают отклонения в значениях.
Профили структурных белков
Молекулярная масса структурных полипептидов бактериофагов варьировала от 10 до 81 кДа (рис. 4А). Фаги vB_SauM-EGAE3 и vB_EfaP-Ef01 содержали основные структурные белки массой 39 и 44 кДа соответственно. Кроме того, в каждом фаге наблюдали четыре второстепенных структурных белка, три из которых показали сходные профили в vB_SauM-EGAE3 и vB_EfaP-Ef01, причем каждый фаг демонстрировал уникальную специфическую полосу в различных положениях 81 кДа и 32 кДа для vB_SauM-EGAE3 и vB_EfaP-. EF01 соответственно.
Рис. 4. гелеобразные изображения биоанализатора Agilent (A) электрофоретические профили структурных белков vB_SauM-EG-AE3 и vB_EfaP-Ef01 в SDS-полиакриламидном геле. Дорожка 1: лестница в диапазоне от 6 кДа до 240 кДа, дорожки 2-3: профили структурных белков vB_SauM-EG-AE3 и vB_EfaP-Ef01 соответственно, красные ряды представляют основные капсидные белки выделенных фагов. (B) Профили рестрикционного переваривания фагов vB_SauM-EG-AE3 и vB_EfaP-Ef01 после переваривания ДНК BamHI, EcoRI, DraI, PstI и KpnI. Дорожки, как показано на рисунке, Лестница от 50 п.н. до 10380 п.н.
(B) Профили рестрикционного переваривания фагов vB_SauM-EG-AE3 и vB_EfaP-Ef01 после переваривания ДНК BamHI, EcoRI, DraI, PstI и KpnI. Дорожки, как показано на рисунке, Лестница от 50 п.н. до 10380 п.н.
Профили рестрикционного переваривания
Фаги vB_SauM-EGAE3 и vB_EfaP-EGAE1 демонстрируют разные профили рестрикционного переваривания (рис. 4В). Эндонуклеазы рестрикции BamHI, EcoRI, DraI и PstI были способны переваривать два генома. В то время как KpnI не удалось разрезать оба генома (рис. S2, дополнительные данные), расщепление геномов бактериофагов с помощью DraI показало наиболее скученный рисунок с общим количеством фрагментов из 15 полос для vB_EfaP-EGAE1 и 9 полос для vB_SauM-EGAE3. С другой стороны, BamHI показал самый низкий профиль расщепления с 3 полосами для vB_SauM-EGAE3 и 4 полосами для vB_EfaP-EGAE1. Паттерны рестрикционных ферментов подтвердили, что эти фаги представляют собой двухцепочечные ДНК-вирусы. Для каждого фага размер генома был предсказан с учетом суммы размеров всех фрагментов, продуцируемых рестрикционными ферментами (таблица S3, дополнительные данные).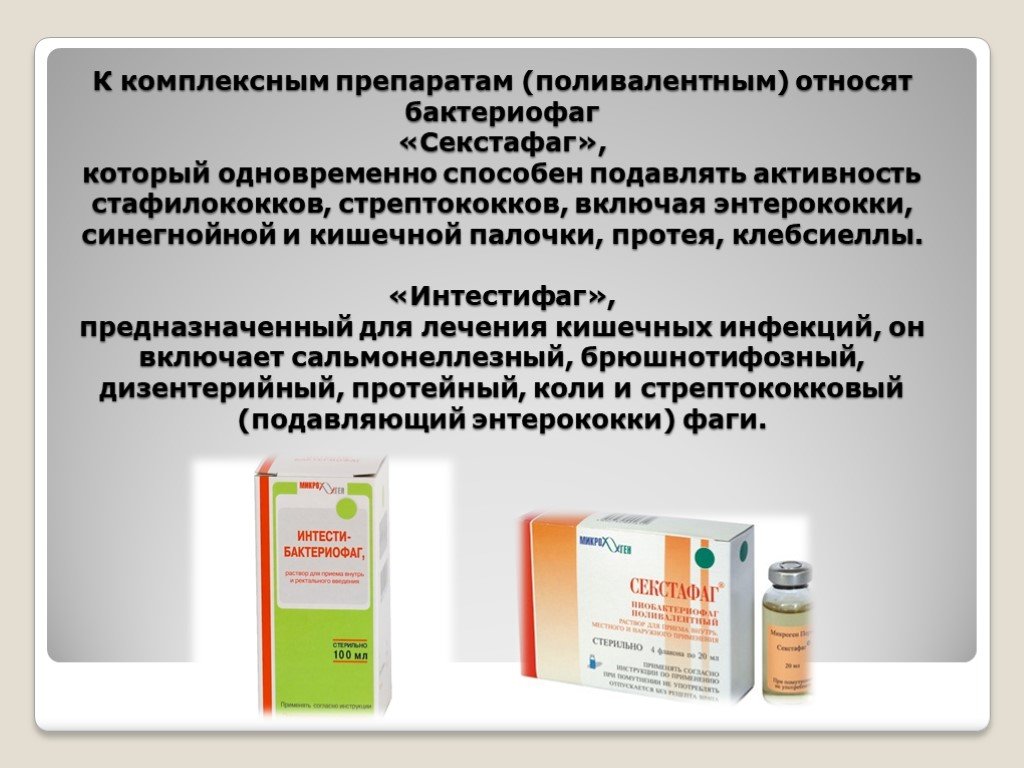 Размеры генома были ок. 13,30 Кб и 15,60 Кб для фагов vB_SauM-EGAE3, vB_EfaP-Ef01 соответственно.
Размеры генома были ок. 13,30 Кб и 15,60 Кб для фагов vB_SauM-EGAE3, vB_EfaP-Ef01 соответственно.
Биоконтроль бактерий, вызывающих кариес, с помощью бактериофагов
В текущем исследовании для контроля над целевыми патогенами в бульонной среде использовались различные MOI (рис. 5). Высокие значения MOI использовались, чтобы быть более достаточными для заражения бактериальных клеток и снижения вероятности повторного роста бактериальных клеток. В бульонной среде полное ингибирование роста бактерий было достигнуто с использованием фагов с более высокими и более низкими MOI 10 3 , 10 2 и 10 через 1, 3, 5 и 24 часа при 37°C по сравнению с контролем. На основании стабильности и литической активности выделенных фагов в отношении S. aureus и E. faecalis , их применяли для борьбы с такими хозяевами в бульонной среде с использованием различных MOI. Результаты показали, что МВД 10 3 , 10 2 и 10 оказались эффективными для искоренения роста бактерий и предотвращения их повторного роста в бульонной среде. Таким образом, использование этих фагов в терапии может быть перспективным в качестве альтернативы антибиотикам.
Таким образом, использование этих фагов в терапии может быть перспективным в качестве альтернативы антибиотикам.
Рис. 5. Анализ биоконтроля in vitro выделенных фагов на соответствующих хозяевах при различных MOI. (A) Литическая активность фага vB_SauM-EGAE3 на S. aureus EG-AE3 и (B) Литическая активность фага vB_EfaP-Ef01 на E. faecalis EF01. Каждую бактерию заражали соответствующим фагом при различных MOI 10, 102 и 103. Бактериальный рост определяли путем измерения оптической плотности при 600 нм.
Фаговая терапия обещает не только лечение инфекций
Стефани Стратди держит изображение бактериофага; ее муж, Том Паттерсон, держит рендеринг A. baumannii, бактерии, которая чуть не убила его.
Исследователи впервые используют бактериофаги у мышей для лечения состояния, не считающегося классической бактериальной инфекцией: алкогольной болезни печени.
Бактериофаги — это вирусы, которые специфически уничтожают бактерии. В начале 20 века исследователи экспериментировали с фагами как с потенциальным методом лечения бактериальных инфекций. Но затем появились антибиотики, и фаги потеряли популярность. Однако с ростом инфекций, устойчивых к антибиотикам, исследователи возобновили интерес к фаговой терапии.
В начале 20 века исследователи экспериментировали с фагами как с потенциальным методом лечения бактериальных инфекций. Но затем появились антибиотики, и фаги потеряли популярность. Однако с ростом инфекций, устойчивых к антибиотикам, исследователи возобновили интерес к фаговой терапии.
Медицинская школа Калифорнийского университета в Сан-Диего последние несколько лет находится в авангарде разработки фаготерапии. В марте 2016 года Том Паттерсон, профессор психиатрии Медицинской школы Калифорнийского университета в Сан-Диего, стал первым известным человеком в Соединенных Штатах, который прошел внутривенную фаговую терапию для лечения бактериальной инфекции с множественной лекарственной устойчивостью с экстренного разрешения Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США. . Почти сразу же он начал поправляться, выйдя из многомесячной комы. После долгого выздоровления Паттерсон полностью восстановился и вернулся к работе.
С тех пор семь дополнительных пациентов с опасными для жизни инфекциями в UC San Diego Health прошли курс экспериментальной фаговой терапии. Для дальнейшего продвижения этой работы в июне 2018 года Медицинская школа Калифорнийского университета в Сан-Диего открыла Центр инновационных приложений и терапии фагов (IPATH), первый такой центр в Северной Америке.
Для дальнейшего продвижения этой работы в июне 2018 года Медицинская школа Калифорнийского университета в Сан-Диего открыла Центр инновационных приложений и терапии фагов (IPATH), первый такой центр в Северной Америке.
Исследователи Медицинской школы Калифорнийского университета в Сан-Диего и их сотрудники впервые успешно применили фаговую терапию у мышей при заболевании, которое не считается классической бактериальной инфекцией: алкогольной болезни печени.
Исследование опубликовано в номере журнала Nature от 13 ноября.
На этой микрофотографии в искусственных цветах бактериофаг (оранжевый) прикрепляется к мембране бактериальной клетки (синий).
«Мы не только связали конкретный бактериальный токсин с худшими клиническими исходами у пациентов с алкогольной болезнью печени, мы нашли способ разорвать эту связь путем точного редактирования кишечной микробиоты с помощью фагов», — сказал старший автор доктор Бернд Шнабл, профессор медицины. и гастроэнтеролог в Медицинской школе Калифорнийского университета в Сан-Диего и директор Исследовательского центра заболеваний пищеварительного тракта Сан-Диего, финансируемого Национальным институтом здравоохранения.
До 75 процентов пациентов с тяжелым алкогольным гепатитом, наиболее серьезной формой связанного с алкоголем заболевания печени, умирают в течение 90 дней после постановки диагноза. Это состояние чаще всего лечат кортикостероидами, но они не очень эффективны. Ранняя трансплантация печени является единственным методом лечения, но она предлагается только в некоторых медицинских центрах ограниченному числу пациентов. На самом деле, по данным Американского фонда печени, ежегодно в Соединенных Штатах проводится только около 8000 трансплантаций печени по разным причинам, а список ожидания составляет около 14 000 человек.
Алкоголь сам по себе может повредить клетки печени. Но Шнабл и его команда ранее обнаружили, что алкоголь также вреден для печени по второй причине: он уменьшает естественные кишечные антибиотики, делая мышей более склонными к росту бактерий в печени и усугубляя вызванное алкоголем заболевание печени.
В этом последнем исследовании команда Шнабла, включая многих сотрудников по всему миру, ответила на два основных вопроса: как кишечные бактерии способствуют повреждению печени? И можно ли использовать фаги для уменьшения количества бактерий и, таким образом, облегчения алкогольной болезни печени?
Исследователи обнаружили, что клетки печени повреждаются цитолизином, токсином, выделяемым Enterococcus faecalis , типом бактерий, которые обычно обнаруживаются в небольшом количестве в здоровом кишечнике человека. Они также обнаружили, что у людей с алкогольным гепатитом в кишечнике больше продуцирующих цитолизин E. faecalis , чем у здоровых людей. Чем больше присутствует E. faecalis , тем тяжелее заболевание их печени. У людей с алкогольной болезнью печени более пяти процентов фекальных бактерий были 9.0669 Enterococcus , по сравнению с почти отсутствием у здоровых людей или людей с алкогольным расстройством. Приблизительно у 80% больных алкогольным гепатитом в фекалиях живут E. faecalis , а у 30% положительный результат на цитолизин.
Они также обнаружили, что у людей с алкогольным гепатитом в кишечнике больше продуцирующих цитолизин E. faecalis , чем у здоровых людей. Чем больше присутствует E. faecalis , тем тяжелее заболевание их печени. У людей с алкогольной болезнью печени более пяти процентов фекальных бактерий были 9.0669 Enterococcus , по сравнению с почти отсутствием у здоровых людей или людей с алкогольным расстройством. Приблизительно у 80% больных алкогольным гепатитом в фекалиях живут E. faecalis , а у 30% положительный результат на цитолизин.
Кроме того, исследователи обнаружили, что почти 90 процентов цитолизин-положительных пациентов с алкогольным гепатитом умерли в течение 180 дней после госпитализации по сравнению с примерно 4 процентами цитолизин-отрицательных пациентов.
«Основываясь на этом открытии, мы считаем, что обнаружение гена цитолизина в фекалиях пациентов с алкогольным гепатитом может быть очень хорошим биомаркером тяжести заболевания печени и риска смерти», — сказал Шнабл. «Однажды мы сможем выбирать пациентов для индивидуальной терапии на основе их цитолизинового статуса».
«Однажды мы сможем выбирать пациентов для индивидуальной терапии на основе их цитолизинового статуса».
Затем ученые перенесли фекалии цитолизин-положительных и цитолизин-отрицательных людей с алкогольным гепатитом на мышей. У мышей с цитолизин-положительным гуманизированным микробиомом кишечника развивалось более тяжелое алкогольное заболевание печени, и они выживали меньше, чем мыши без цитолизина.
Чтобы исследовать потенциал фаговой терапии, исследователи выделили из сточных вод четыре различных фага, которые специально нацелены на продуцирующие цитолизин штаммы E. faecalis . Когда они обработали мышей фагами-мишенями, бактерии были уничтожены, а вызванное алкоголем заболевание печени исчезло. Контрольные фаги, нацеленные на другие бактерии, или нецитолитические E. faecalis не оказали никакого действия.
«Эта фаготерапия пока тестировалась только на мышах, и потребуются клинические испытания, чтобы проверить безопасность этого подхода и подтвердить наши выводы у пациентов с алкогольным гепатитом», — сказал Шнабл.

 aureus штамм EG-AE3
aureus штамм EG-AE3  faecalis EF01
faecalis EF01