Гемигепатэктомия это: Гемиколэктомия — Клиника 29
Лапароскопическая гемигепатэктомия — лапароскопическая операция, лапароскопия [Видео]
Поиск по категориям
МетодикаРезекция печениЛапароскопическая гемигепатэктомияЛапароскопическая резекция
СпециалистПучков К.В.Пучков Д. К.Галлямов Э.А.
БрендEthiconMEDTRONIC-COVIDIENKARL STORZ
ИнструментHarmonic Scalpel EthiconWeck Hem-o- LockEndo GIA Harmonic ScalpelГемостатик PerClot
ЗаболеванияОпухоль печениРак вульвыРак желудкаРак ободочной кишкиРак поджелудочной железыРак почкиРак прямой кишкиРак холедохаРак шейки матки Рак эндометрияРак яичникаСимультанные операции в онкологии
Лапароскопическая резекция печени (2-3 сегменты, ФНГ 7 см)
youtube.com/embed/y_IbuXfcRzc» title=»YouTube video player» frameborder=»0″ allow=»accelerometer; autoplay; clipboard-write; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»>Автор: Галямов Э.А.
Теги: Пучков К.В. Галлямов Э.А. Пучков Д. К. KARL STORZ MEDTRONIC-COVIDIEN Ethicon Гемостатик PerClot Harmonic Scalpel Endo GIA Лапароскопическая резекция Weck Hem-o- Lock Лапароскопическая диссекция Мастер-класс Опухоль печени Резекция печени Лапароскопическая резекция печени
Лапароскопическая резекция печени (2-3 сегменты, ФНГ 7 см)
Оперирует профессор Э. А. Галлямов, модерирует профессор К. В. Пучков, ассистирует к.м.н. Д. К. Пучков (2018 г).
А. Галлямов, модерирует профессор К. В. Пучков, ассистирует к.м.н. Д. К. Пучков (2018 г).
Мастер-класс 6.07. с комментариями, г. Дербент.
В фильме показана техника резекции печени ( 2,3 сегментов), с сохранением 4 сегмента при фокальной нодулярной гиперплазией (7 см). Мобилизация печени проводится с помощью 5 мм инструмента Harmonic Scalpel Ethicon и инструментами Компании Karl Storz, с последовательным пересечением круглой и серповидной связок. Намечается линия резекции. Далее последовательно гармоническим скальпелем и биполярным пинцетом выполняется диссекция печёночной паренхимы до секреторной ножки и вены 2 и 3 сегментов. Эти образования выделяются печеночным диссектором (Aesculap), лигируются системой Hem-o-lock и пересекаются между клипсами. Затем выделяется левая печеночная вена, которая берётся на держалку, прошивается и пересекается аппаратом Endo GIA MEDTRONIC COVIDIEN сосудистой белой кассетой 45 мм. Окончательный точечный гемостаз выполняется биполяром и гемостатиком PerClot (Italy).
Лапароскопическая левосторонняя гемигепатэктомия
Автор: А. Форджионе
Теги: А. Форджионе Endo GIA Harmonic Scalpel Ethicon Лапароскопическая гемигепатэктомия Опухоль печени
Лапароскопическая левосторонняя гемигепатэктомия. Оперирует профессор А. ФОРДЖИОНЕ (2017)
Оперирует профессор А. ФОРДЖИОНЕ (2017)
Операция проводится по поводу метастаза в левую долю печени. В видео показана техника лапароскопической левосторонней гемигепатэктомии с помощью 5 мм инструмента Harmonic Scalpel Ethicon , биполяра, клипирования сосудистых структур и желчных протоков, прошивания и пересечения вены аппаратом Endo GIA MEDTRONIC COVIDIEN белой кассетой 45 мм. Препарат погружается в специальный пластиковый контейнер MEDTRONIC COVIDIEN, который в конце операции извлекается через расширенный доступ.
Левосторонняя гемигепатэктомия с тромбэктомией из нижней полой вены и правого предсердия в условиях нормотермического параллельного искусственного кровообращения у пациента с гепатоцеллюлярным раком
Введение
Гепатоцеллюлярный рак (ГЦР) во всем мире занимает пятое место среди причин смерти от онкологических заболеваний [1]. В большинстве случаев ГЦР развивается при циррозе печени, причинами которого чаще всего являются вирусные гепатиты, алкогольная болезнь печени, неалкогольный стеатоз печени [1, 2].
ГЦР характеризуется агрессивным течением и метастазирует в регионарные лимфатические узлы, легкие и кости, а также может распространяться на сосудисто-секреторные структуры печени с образованием опухолевых тромбов [1, 2].
Прогрессия ГЦР с образованием опухолевого тромба в нижней полой вене и распространением в правое предсердие встречается редко и является проявлением крайней формы заболевания с плохим прогнозом и отсутствием общепринятой стратегии и тактики лечения [3].
Комбинированная резекция печени с тромбэктомией является на сегодняшний день единственной альтернативой продлить жизнь пациентов, поскольку наличие тромба в правом предсердии ведет к высокому риску тромбоэмболии легочной артерии, а также окклюзии трикуспидального клапана опухолевым тромбом с развитием острой сердечно-сосудистой недостаточности и внезапной смерти. Продолжительность жизни пациентов без хирургического лечения не превышает трех месяцев [4].
В то же время опыт хирургического лечения подобной категории пациентов совсем небольшой и, по данным мировой литературы, не превышает тридцати наблюдений [5].
Нами представлено наблюдение хирургического лечения пациента с ГЦР и опухолевым тромбозом нижней полой вены и правого предсердия, а также продемонстрирована возможность мультидисциплинарного подхода в лечении таких пациентов.
Клиническое наблюдениеПациент С., 59 лет, поступил в отделение гепатопанкреатобилиарной хирургии Московского клинического научного центра с жалобами на тянущие боли постоянного характера в эпигастральной и левой подреберной областях. С 2000 г. страдает вирусным гепатитом С. В ноябре 2016 г. у пациента была выявлена гепатоцеллюлярная карцинома по результатам УЗИ, компьютерной томографии и биопсии печени. Пациенту была выполнена трансартериальная химиоэмболизация доксорубицином сосудов левой доли печени. Однако в дальнейшем отмечено прогрессирование заболевания. При ультразвуковом исследовании органов брюшной полости и КТ-исследовании брюшной и грудной полостей было выявлено гигантское опухолевое образование размером 25×30 см, тотально замещающее левую долю печени с переходом на 8-й сегмент печени, с опухолевыми тромбами левой и средней печеночных вен в нижней полой вене и в правом предсердии (рис.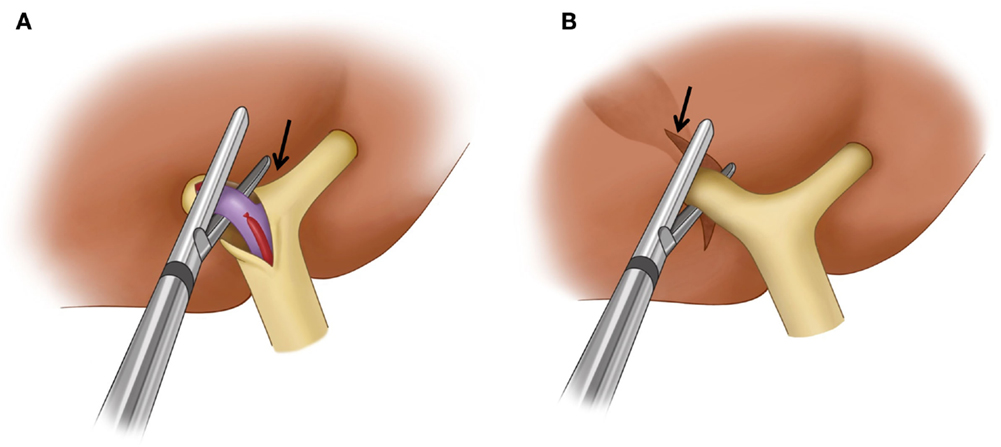
Рис. 1. Опухолевый тромб в нижней полой вене и правом предсердии.
После мультидисциплинарного консилиума с участием онколога, гепатохирурга, гепатолога, кардиохирурга, кардиолога, анестезиолога и реаниматолога, решено было выполнить операцию — левостороннюю гемигепатэктомию с резекцией 8-го сегмента печени с последующим химиотерапевтическим лечением.
В Клинике аортальной и сердечно-сосудистой хирургии Первого МГМУ им. И.М. Сеченова двумя бригадами хирургов: гепатохирурги (Р.Б. Алиханов, П.П. Ким, Н.И. Елизарова), кардиохирурги (Р.Н. Комаров, С.В. Чернявский) выполнено одномоментное комбинированное хирургическое вмешательство на печени и сердце.
Под эндотрахеальным наркозом в положении пациента на спине выполнена стернолапаротомия с иссечением мечевидного отростка. При ревизии было выявлено, что в брюшной полости свободной жидкости нет, левая доля печени темно-бордового цвета, увеличена в размерах за счет замещения опухолью размером 30×25×20 см. Опухоль плотной консистенции, плохо смещаемая. Правая доля печени обычного цвета, мягкоэластической консистенции. Гепатодуоденальная связка не инфильтрирована. Доступные визуализации абдоминальный отдел пищевода, желудок, петли толстой и тонкой кишки без патологических изменений. По диафрагмальной поверхности в проекции правой доли печени в области 8-го сегмента печени подкапсульно определялся аналогичный очаг, по консистенции схожий с основной опухолью размером 12×11 мм — сателлитный очаг. Выполнена холецистэктомия. Далее произведена лимфоаденэктомия гепатодуоденальной связки по ходу общей печеночной артерии. Выделены и взяты на держалку общий ствол средней и левой печеночных вен. Левая печеночная артерия, левая ветвь воротной вены перевязаны, пересечены. Далее по линии Рекса—Кантля намечена линия резекции печени, которая выполнена антеградным доступом без предварительной мобилизации левой доли печени. При помощи биполярной коагуляции аппаратом Ligasure выполнено разделение паренхимы печени до уровня нижней полой вены и впадения средней и левой печеночных вен.
Опухоль плотной консистенции, плохо смещаемая. Правая доля печени обычного цвета, мягкоэластической консистенции. Гепатодуоденальная связка не инфильтрирована. Доступные визуализации абдоминальный отдел пищевода, желудок, петли толстой и тонкой кишки без патологических изменений. По диафрагмальной поверхности в проекции правой доли печени в области 8-го сегмента печени подкапсульно определялся аналогичный очаг, по консистенции схожий с основной опухолью размером 12×11 мм — сателлитный очаг. Выполнена холецистэктомия. Далее произведена лимфоаденэктомия гепатодуоденальной связки по ходу общей печеночной артерии. Выделены и взяты на держалку общий ствол средней и левой печеночных вен. Левая печеночная артерия, левая ветвь воротной вены перевязаны, пересечены. Далее по линии Рекса—Кантля намечена линия резекции печени, которая выполнена антеградным доступом без предварительной мобилизации левой доли печени. При помощи биполярной коагуляции аппаратом Ligasure выполнено разделение паренхимы печени до уровня нижней полой вены и впадения средней и левой печеночных вен.
Рис. 2. Печень разделена по линии Рекса-Кантля, левая доля печени с опухолью мобилизована.
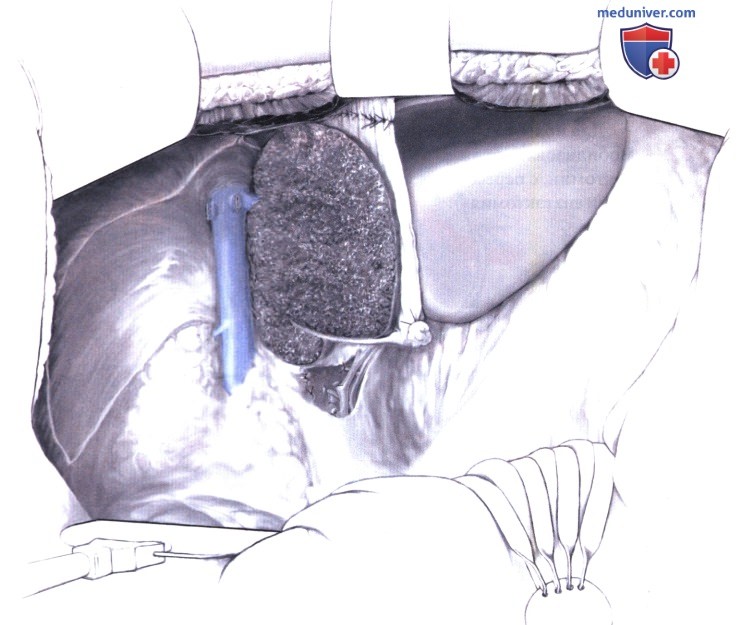
Вскрыт перикард и взят на держалки, в полости сердечной сумки отмечено небольшое количество серозного выпота. Диафрагма рассечена до НПВ. Наложены кисетные швы на восходящую аорту, верхнюю и нижнюю полую вену дистальнее впадения печеночных вен. После введения гепарина выполнена канюляция по схеме восходящая аорта — полые вены (рис. 3). Начало искусственного кровообращения (ИК). Правосторонняя атриотомия с переходом на НПВ. В просвете предсердия и НПВ визуализирован опухолевый тромб, занимающий 100% диаметра вены. Левая доля печени удалена вместе с опухолевым тромбом. Разрез правого предсердия и НПВ ушит непрерывным обвивным швом нитью пролен 5/0. Согревание больного. По достижении 37 °C остановка ИК, деканюляция, введение протамина.
Рис. 3. Схема канюляции магистральных сосудов.
Выполнена атипичная резекция 8-го сегмента печени. На область резекции правой доли печени и шов НПВ уложены губки Тахокомб. Контроль гемо и холестаза — сухо. Установлен дренаж к области среза культи правой доли печени, выведенный через отдельный доступ передней брюшной стенки, два дренажа в перикард и переднее средостение. К передней поверхности правого желудочка и листку перикарда подшиты миокардиальные электроды. Диафрагма ушита непрерывным швом нитью пролен 2/0. Наложено 8 проволочных швов на грудину. Контроль инородных тел. Рана послойно ушита. Швы на кожу. Асептическая повязка.
Кровопотеря при разделении паренхимы печени составила 300 мл.
В послеоперационном периоде пациенту с целью снижения риска пострезекционной печеночной недостаточности и снижения портального кровотока и отека остатка печени вводился октреотид в дозе 800 мкг в сутки внутривенно в течение трех дней.
К третьим суткам отмечена нормализация всех биохимических показателей. Пациент выписан в удовлетворительном состоянии на 6-е сутки после операции для проведения химиотерапии.
Пациент выписан в удовлетворительном состоянии на 6-е сутки после операции для проведения химиотерапии.
При морфологическом исследовании выявлена гепатоцеллюлярная карцинома с опухолевыми тромбами в печеночных венах и нижней полой вене (рис. 4). Опухолевых клеток в лимфатических узлах и крае резекции выявлено не было.
Рис. 4. Левая доля печени с тромбом в средней и левой печеночной венах.
Обсуждение
ГЦР с образованием опухолевых тромбов в НПВ и распространением в правое предсердие встречается редко и составляет по данным аутопсий 2,4—4,6% [5].
В настоящее время, несмотря на плохой прогноз течения ГЦР, осложненного опухолевыми тромбами в НПВ и правом предсердии, хирургическое лечение сопровождается лучшими отдаленными результатами. По данным разных авторов, медиана выживаемости при хирургическом лечении составляет 12—19 мес, при трансартериальной химиоэмболизации и симптоматическом лечении не превышает 5 мес [3—5].
Однако частота подобных успешных хирургических вмешательств во всем мире не превышает тридцати наблюдений, что подчеркивает сложность подобных вмешательств и необходимость мультидисциплинарного подхода как до операции, так и в периоперационном периоде.
Технически исполнение такой операции стало возможно благодаря внедрению и применению аппарата И.К. Так, гемодинамическая нестабильность без использования сердечно-легочного обхода не позволит провести хирургическую интервенцию ввиду того, что для эвакуации опухолевого тромба необходимо провести вскрытие правого предсердия и НПВ. К тому же кровопотеря при атриотомии может достигать 2000 мл в минуту, что несовместимо с жизнью, если в операционной не применяются системы реинфузии. Однако, даже используя аппарат Cellsaver, добиться стабильной гемодинамики крайне проблематично. Но И.К. позволяет решить эти проблемы и, невзирая на огромную кровопотерю из магистрального сосуда и полостей сердца, гемодинамическую стабильность обеспечивает перфузиолог, что позволяет хирургам сконцентрироваться на качестве и скорости наложения сосудистого шва. Это в свою очередь уменьшает время ишемии печени и тем самым снижает риск развития послеоперационной печеночной недостаточности.
В данном случае опухолевый тромб без усилий эвакуирован из полости сосуда и сердца, однако в случае инвазии в стенку НПВ или предсердия возможно выполнение резекции последних с дальнейшей пластикой ПТФЕ-заплатой, либо патчем из ксеноперикарда.
Учитывая сегодняшнюю бесперспективность применения консервативных методов лечения у пациентов с представленным заболеванием, дальнейшее изучение проблемы и накопление хирургического опыта представляются нам крайне интересными.
Авторы заявляют об отсутствии конфликта интересов.
[Гемигепатэктомия] — PubMed
. 1989 г., февраль; 126 (2): 103–13.
[Статья в французский]
G Лоримье 1 , А Талха, М. Гунц
принадлежность
- 1 Clinique Chirurgicale A, C.H.U. Анже.
- PMID: 2715223
[Статья в французский]
G Lorimier et al.
Дж. Шир (Париж).
1989 фев.
Шир (Париж).
1989 фев.
. 1989 г., февраль; 126 (2): 103–13.
Авторы
Г Лоримье 1 , А Талха, М Гунц
принадлежность
- 1 Clinique Chirurgicale A, C.H.U. Анже.
- PMID: 2715223
Абстрактный
Контролируемая правосторонняя гемигепатэктомия является крупной операцией, предназначенной для первичных или вторичных злокачественных опухолей, нескольких очень крупных доброкачественных опухолей и, реже, разрыва правой доли печени. Хирургическая техника гемигепатэктомии соблюдает несколько общих правил, касающихся положения пациента, хирургического разреза, гемостаза различных ножек, стаза желчи и дренирования. Обсуждаются шесть технических вариантов вместе с их преимуществами и недостатками и соответствующими показаниями в зависимости от размера, характера и положения поражения по отношению к глиссоновой и гепатокавальной ножкам. На основе этой очень подробной базовой методики предлагаются тактические модальности в зависимости от особенностей поражения: вне- или внутрипеченочный контроль ножек, начальное или терминальное вскрытие срединной щели, начальная или терминальная мобилизация правого полушария. печень, тотальное поражение сосудов. Контролируемая левосторонняя гемигепатэктомия является менее сложной операцией, которая может быть выполнена по тактическому варианту, аналогичному описанному для правосторонней гемигепатэктомии, но полное отключение сосудов редко бывает необходимым.
Обсуждаются шесть технических вариантов вместе с их преимуществами и недостатками и соответствующими показаниями в зависимости от размера, характера и положения поражения по отношению к глиссоновой и гепатокавальной ножкам. На основе этой очень подробной базовой методики предлагаются тактические модальности в зависимости от особенностей поражения: вне- или внутрипеченочный контроль ножек, начальное или терминальное вскрытие срединной щели, начальная или терминальная мобилизация правого полушария. печень, тотальное поражение сосудов. Контролируемая левосторонняя гемигепатэктомия является менее сложной операцией, которая может быть выполнена по тактическому варианту, аналогичному описанному для правосторонней гемигепатэктомии, но полное отключение сосудов редко бывает необходимым.
Похожие статьи
Интермиттирующая полная сосудистая изоляция печени при гепатэктомии: техника и показания.

Элиас Д., Дюбе П., Бонвало С., Дебанн Б., Плауд Б., Лассер П. Элиас Д. и соавт. Гепатогастроэнтерология. 1998 март-апрель;45(20):389-95. Гепатогастроэнтерология. 1998. PMID: 9638412
Расширенная гепатэктомия слева путем пересечения всех крупных печеночных вен с реконструкцией правой печеночной вены.
Сакамото Ю., Ямамото Дж., Косугэ Т., Сугавара Ю., Секи М., Кокудо Н., Азекура К., Ямагути Т., Муто Т., Макуучи М. Сакамото Ю. и др. Серж сегодня. 2004;34(5):482-4. doi: 10.1007/s00595-003-2742-9. Серж сегодня. 2004. PMID: 15108097
Рутинное использование тотальной печеночной сосудистой эксклюзии при обширной гепатэктомии не является необходимым.
Фаргес О.
 , Существительное Р., Сованет А., Джани С., Белгити Дж.
Фаргес О. и др.
Гепатогастроэнтерология. 1998 март-апрель;45(20):370-5.
Гепатогастроэнтерология. 1998.
PMID: 9638409
Клиническое испытание.
, Существительное Р., Сованет А., Джани С., Белгити Дж.
Фаргес О. и др.
Гепатогастроэнтерология. 1998 март-апрель;45(20):370-5.
Гепатогастроэнтерология. 1998.
PMID: 9638409
Клиническое испытание.Сосудистая окклюзия для уменьшения кровопотери при резекции печени.
Диксон Э., Фоллмер К.М. младший, Бате О.Ф., Сазерленд Ф. Диксон Э. и др. Am J Surg. 2005 июл; 190(1):75-86. doi: 10.1016/j.amjsurg.2004.10.007. Am J Surg. 2005. PMID: 15972177 Обзор.
Методы разделения тканей печени при резекции печени.
Журавлев В.А. Журавлев В.А. Вестн Хир Им И И Грек. 1990 янв; 144(1):140-2. Вестн Хир Им И И Грек. 1990. PMID: 2165300 Обзор.
 Русский.
Аннотация недоступна.
Русский.
Аннотация недоступна.
Посмотреть все похожие статьи
Типы публикаций
термины MeSH
Лапароскопическая правосторонняя гемигепатэктомия после новой оптимизированной эмболизации воротной вены: видеоотчет о клиническом случае | BMC Gastroenterology
- История болезни
- Открытый доступ
- Опубликовано:
- Лэй Лю 1 ,
- Вэньбинь Дин 1 ,
- Сюэ Лю 2 ,
- Вэйпин Чжоу 9 0007 1 и
- …
- Шэнсянь Юань 1
BMC Гастроэнтерология том 22 , Номер статьи: 284 (2022) Процитировать эту статью
690 доступов
1 Альтметрика
Детали показателей
Абстрактный
Фон
Эта статья является первым отчетом о лапароскопической большой гепатэктомии гепатоцеллюлярной карциномы (ГЦК) после оптимизированной эмболизации воротной вены (ОПВЭ).
Описание случая
У пациента был диагностирован одиночный ГЦР размером 3 × 3,5 см, расположенный в сегментах 5 и 8, обнаруженный с помощью расширенной компьютерной томографии и магнитно-резонансной томографии. Поражение прилегало к правой передней и задней воротным венам, что затрудняло подтверждение адекватного функционального остаточного объема печени, хирургического края и резекции R0. Кроме того, цирроз печени, вызванный длительным анамнезом хронического гепатита В, увеличивает потенциальный риск послеоперационной печеночной недостаточности и рефрактерного асцита. Поэтому мы провели лапароскопическую операцию после oPVE, благодаря которой был обеспечен безопасный край опухоли и улучшен результат операции. Больная выписана на седьмые сутки после операции. АФП постепенно снижался до нормального уровня в течение 9 дней.0-дневное наблюдение.
Заключение
Этот клинический случай демонстрирует, что в опытных руках у отдельных пациентов лапароскопическая гепатэктомия после эмболизации воротной вены осуществима и может быть альтернативой открытой резекции печени.
Отчеты экспертной оценки
Исходная информация
Лапароскопическая гепатэктомия как терапия для лечения опухолей печени в последние годы стала более распространенной. Наряду с развитием методов визуализации, хирургических устройств и навыков лапароскопическая резекция печени расширила свои показания от малых до больших гепатэктомий, таких как правосторонняя гемигепатэктомия [1]. Ряд исследований продемонстрировал аналогичную безрецидивную выживаемость (БРВ) и общую выживаемость (ОВ) у пациентов с ГЦК, перенесших либо лапароскопическую резекцию печени (ЛРП), либо открытую операцию [1,2,3]. Кроме того, преимущества LLR, такие как меньшее компрессионное повреждение печени за счет его минимально инвазивного характера и более быстрое время восстановления, приносят больше клинических преимуществ пациентам [4].
Предоперационная оценка функции и объема печени имела решающее значение для снижения риска заболеваемости и смертности при обширной гепатэктомии [5]. Считалось, что PVE обеспечивает больший функциональный объем остатка печени, когда ожидался дефицит послеоперационного зарезервированного объема печени [6]. Кроме того, он может помочь гарантировать операционный край > 1 см, что считается важным для благоприятного исхода операции. В предыдущих исследованиях сообщалось, что средний интервал между ЭПК и хирургическим вмешательством составляет 21–24 дня [3, 6]. Потенциальная частота выбывания пациентов из-за недостаточной гипертрофии печени и прогрессирования заболевания является недостатком традиционной ЭПК. В качестве альтернативы мы применили oPVE с полной окклюзией ветви и основной воротной вены, чтобы получить более быструю регенерацию зарезервированной печени. Учитывая вышеизложенное, мы запланировали лапароскопическую правостороннюю гемигепатэктомию (дополнительный видеофайл показывает процедуру более подробно [см. Дополнительный файл 1]) после oPVE. Насколько нам известно, не было сообщений о результатах лапароскопической большой резекции печени после оптимизированной ЭПК.
Считалось, что PVE обеспечивает больший функциональный объем остатка печени, когда ожидался дефицит послеоперационного зарезервированного объема печени [6]. Кроме того, он может помочь гарантировать операционный край > 1 см, что считается важным для благоприятного исхода операции. В предыдущих исследованиях сообщалось, что средний интервал между ЭПК и хирургическим вмешательством составляет 21–24 дня [3, 6]. Потенциальная частота выбывания пациентов из-за недостаточной гипертрофии печени и прогрессирования заболевания является недостатком традиционной ЭПК. В качестве альтернативы мы применили oPVE с полной окклюзией ветви и основной воротной вены, чтобы получить более быструю регенерацию зарезервированной печени. Учитывая вышеизложенное, мы запланировали лапароскопическую правостороннюю гемигепатэктомию (дополнительный видеофайл показывает процедуру более подробно [см. Дополнительный файл 1]) после oPVE. Насколько нам известно, не было сообщений о результатах лапароскопической большой резекции печени после оптимизированной ЭПК.
Описание случая
57-летний мужчина (рост 173 см, вес 75 кг) поступил в наш центр с диагнозом асимптоматическая ГЦК. Поражение располагалось в сегментах 5 и 8, которые находились рядом с правой передней и задней воротными венами (рис. 1А). Другой медицинской истории не было, кроме 20-летнего анамнеза ВГВ при нормальном уровне ДНК ВГВ.
Рис. 1A Магнитно-резонансная томография (МРТ) перед ПВЭ в разные фазы; B Ангиография воротной вены перед эмболией; C Ангиография воротной вены после эмболии
Изображение полного размера
В анализе крови общий билирубин 17,9 мкмоль/л, АЛТ 47 ЕД/л, АСТ 43 ЕД/л, АФП 175,8 нг/мл и PIVKA 79 мАЕ/мл. Количество тромбоцитов составляло 180 × 10 9 /л, а гемоглобина — 160 г/л. Трехмерное реконструкционное исследование показало, что объем левого полушария составляет 468 мл. Остаточный объем печени к общему объему печени (RLV-TLV) составлял 42,01%, а отношение RLV к массе тела (RLV-BWR) составляло 0,6% [7, 8]. Исходя из вышеизложенного, мы сочли необходимым провести гемигепатэктомию, чтобы обеспечить резекцию R0 и адекватный хирургический край, а ЭВЭ перед операцией было необходимо для обеспечения большего объема остаточной печени из соображений хирургической безопасности.
Исходя из вышеизложенного, мы сочли необходимым провести гемигепатэктомию, чтобы обеспечить резекцию R0 и адекватный хирургический край, а ЭВЭ перед операцией было необходимо для обеспечения большего объема остаточной печени из соображений хирургической безопасности.
Оптимизированная чрескожная чреспеченочная эмболизация воротной вены (чПВЭ) выполнялась контралатеральным доступом под местной и седативной анестезией. После введения антибиотиков была пунктирована перипортальная левая вена, чтобы обеспечить доступ к целевым сосудам. Эмболический материал представлял собой н-бутил-2-цианоакрилат (Compont, Beijing Compont medical devices CO., LTD.), йодированное масло и спираль Interlock (14 мм * 30 см, Boston Scientific Corporation). Через катетер 5F в самое глубокое положение в ответвлении правой воротной вены вводили микрокатетер. Соотношение компонента и йодированного масла составляло от 1:3 до 1:4. Смесь вводили через микрокатетер. Такую же процедуру проделали с другими ветвями и в правую воротную вену вставили блокировочную спираль. Время операции 30 мин. На портограммах хорошо выполнена эмболизация правой воротной вены и ее ветвей (рис. 1Б, С). Больной без других осложнений, кроме жалоб на боли в верхней части живота, выписан на 3-и сутки после операции.
Время операции 30 мин. На портограммах хорошо выполнена эмболизация правой воротной вены и ее ветвей (рис. 1Б, С). Больной без других осложнений, кроме жалоб на боли в верхней части живота, выписан на 3-и сутки после операции.
Через девять дней пациент снова посетил пациента для дальнейшего обследования перед следующей резекцией. Объем левой половины печени значительно увеличился до 726 мл (RLV-TLV 56,80%; RLV-BWR 0,97%). АФП повысился до 380 нг/мл, а ПИВКА был на уровне 90 мАЕ/мл. Размер опухоли почти не изменился. На основании оценки функции и объема печени больному выполнена операция под комбинированной внутривенно-ингаляционной анестезией (КИВИА). Пациента укладывали в положение на позвоночнике. Через пупок ввели первый троакар для лапароскопа. Основному оператору под правую реберную дугу устанавливали один 5-мм и один 12-мм троакар. Один 10-мм троакар был установлен под правую реберную дугу и один 5-мм троакар в верхней части живота для ассистента. Во-первых, мобилизация печени включала разрез связки и рассечение надпочечника. Затем перед полой веной обнажают правый передний отрезок, перерезают и перевязывают короткие печеночные вены. Выполнен прием Прингла через подготовленный жгут. После общей холецистэктомии вскрывали прикорневую пластинку и обнажали корень правой воротной вены. Сосуд перевязывали нитью, демаркационную линию можно было увидеть на поверхности печени. Наряду с линией широко вскрыта паренхима печени до обнажения правой глиссоновой ножки. Глиссонову ножку вырезали линейным сшивающим аппаратом через 12-мм троакар. Разделение продолжалось в сторону печеночной вены, чтобы выявить среднюю печеночную вену (MHV). Корень правой и средней печеночной вены (RHV & MHV) можно было идентифицировать в глубоком положении вместе с MHV. Наконец, мы использовали линейный степлер для рассечения RHV и MHV в каждом начале и удалили резецированную печень. Разрез под правой реберной дугой был расширен до 7 см, образец был собран в пакет для образцов и перемещен за пределы тела. Время операции составило 185 мин, кровопотеря около 200 мл.
Затем перед полой веной обнажают правый передний отрезок, перерезают и перевязывают короткие печеночные вены. Выполнен прием Прингла через подготовленный жгут. После общей холецистэктомии вскрывали прикорневую пластинку и обнажали корень правой воротной вены. Сосуд перевязывали нитью, демаркационную линию можно было увидеть на поверхности печени. Наряду с линией широко вскрыта паренхима печени до обнажения правой глиссоновой ножки. Глиссонову ножку вырезали линейным сшивающим аппаратом через 12-мм троакар. Разделение продолжалось в сторону печеночной вены, чтобы выявить среднюю печеночную вену (MHV). Корень правой и средней печеночной вены (RHV & MHV) можно было идентифицировать в глубоком положении вместе с MHV. Наконец, мы использовали линейный степлер для рассечения RHV и MHV в каждом начале и удалили резецированную печень. Разрез под правой реберной дугой был расширен до 7 см, образец был собран в пакет для образцов и перемещен за пределы тела. Время операции составило 185 мин, кровопотеря около 200 мл. (см. Дополнительный файл 1: https://figshare.com/s/a31b1478f8e8f8f00e35). Хирургический край был отрицательным и находился на расстоянии 1,2 см от опухоли. Больная выписана на седьмые сутки без осложнений. Функция печени нормализовалась на четвертый день после процедуры.
(см. Дополнительный файл 1: https://figshare.com/s/a31b1478f8e8f8f00e35). Хирургический край был отрицательным и находился на расстоянии 1,2 см от опухоли. Больная выписана на седьмые сутки без осложнений. Функция печени нормализовалась на четвертый день после процедуры.
Обсуждение и выводы
Недостаточный будущий остаток печени (FLR) всегда является ахиллесовой пятой обширной резекции печени. В последнее время для увеличения FLR были выбраны многие стратегии лечения, такие как PVE, перевязка воротной вены (PVL), ассоциированная перегородка печени и перевязка воротной вены для поэтапной гепатэктомии (ALPPS) и двухэтапная гепатэктомия (TSH) [9,10,11]. ]. Похоже, что PVE может привести к увеличению объема печени при незначительном повреждении и снижению послеоперационной заболеваемости и смертности на основе предыдущих исследований [12]. Тем не менее описанный выше недостаток обычного ПВЭ по-прежнему ограничивал его применение в клинике. В данном случае мы применили смесь йодированного масла и н-бутил-2-цианоакрилата вместо традиционного эмболического материала, такого как микросферы и частицы желатиновой губки. Это обеспечивало лучшую эмболизацию и более короткий интервал, а катушка, расположенная в правой воротной вене, предотвращала затекание смеси в противоположную сторону. Время облучения составляло около 5 минут, а стоимость госпитализации также была ниже, чем при обычном лечении.
Это обеспечивало лучшую эмболизацию и более короткий интервал, а катушка, расположенная в правой воротной вене, предотвращала затекание смеси в противоположную сторону. Время облучения составляло около 5 минут, а стоимость госпитализации также была ниже, чем при обычном лечении.
В прошлом PVE всегда применялся в качестве пассивного отбора при недостаточном уровне FLR. В данном случае мы активно проводили PVE, чтобы преследовать предпочтительный хирургический результат. PVE используется не только для больших опухолей, которые приводят к недостаточному FLR, но также может применяться к небольшим центрально расположенным опухолям, для которых необходимо гарантировать достаточный хирургический край [13, 14].
Предоперационная трехмерная визуализация печени позволяет более точно оценить ее объем. В нашем центре он обычно используется перед обширной гепатэктомией [15]. Наряду с совершенствованием лапароскопической хирургической техники и аппаратуры ЛЛР характеризуется низкой послеоперационной заболеваемостью и летальностью, сходной БРВ и ОВ с открытой резекцией печени и короткой госпитализацией [1, 3, 4]. В LLR после oPVE есть несколько моментов, на которые необходимо обратить внимание. Во-первых, воспаление и морфологическое изменение печени, вызванное парвовирусным энцефалитом, может негативно сказаться на ходе операции. Во-вторых, очень важно определить положение катушек в воротной вене с помощью КТ или МРТ перед ЛЛР. В данном случае спирали располагались дистальнее бифуркации воротной вены, и правая ножка ворот могла быть пересечена линейным сшивающим аппаратом непосредственно, однако, если спирали располагались близко к бифуркации, следует провести интратекальную процедуру: открытую правую воротную вену, убирают витки и сшивают концы сосудов.
В LLR после oPVE есть несколько моментов, на которые необходимо обратить внимание. Во-первых, воспаление и морфологическое изменение печени, вызванное парвовирусным энцефалитом, может негативно сказаться на ходе операции. Во-вторых, очень важно определить положение катушек в воротной вене с помощью КТ или МРТ перед ЛЛР. В данном случае спирали располагались дистальнее бифуркации воротной вены, и правая ножка ворот могла быть пересечена линейным сшивающим аппаратом непосредственно, однако, если спирали располагались близко к бифуркации, следует провести интратекальную процедуру: открытую правую воротную вену, убирают витки и сшивают концы сосудов.
Лапароскопическая правосторонняя гемигепатэктомия после ОПВЭ безопасна и выполнима для отдельных пациентов. Минимально инвазивная процедура, более короткий интервал между oPVE и LLR и более короткая госпитализация в совокупности делают ее приемлемой для пациентов. В будущем она может стать эффективной альтернативой традиционной открытой резекции печени.
Доступность данных и материалов
Наборы данных, использованные и/или проанализированные в текущем исследовании, можно получить у соответствующего автора по обоснованному запросу.
Сокращения
- HCC:
Гепатэктомия при гепатоцеллюлярной карциноме
- ОПВЭ:
Оптимизированная эмболизация воротной вены
- КТ:
Компьютерная томография
- МРТ:
Магнитно-резонансная томография
- ВГВ:
Вирус гепатита В
- РФС:
Безрецидивная выживаемость
- ОС:
Общая выживаемость
- LLR:
Лапароскопическая резекция печени
- RLV-TLV:
Отношение остаточного объема печени к общему объему печени
- RLV-BWR:
Отношение объема остаточной печени к массе тела
- ГРАЖДАНСКАЯ ИНФОРМАЦИЯ:
Комбинированная внутривенно-ингаляционная анестезия
- Правый и средний пассажирский транспорт:
Правая и средняя печеночная вена
- ФЛР:
Будущий остаток печени
- ПВЛ:
Перевязка воротной вены
- АЛЬПЫ:
Сопутствующая перегородка печени и перевязка воротной вены для поэтапной гепатэктомии
- ТШ:
Двухэтапная резекция печени
- ТАСЕ:
Трансартериальная химиоэмболизация
Ссылки
- «>
Беппу Т., Вакабаяси Г., Хасегава К. и др. Отдаленные и периоперационные результаты лапароскопической и открытой резекции печени по поводу метастазов колоректального рака в печень с сопоставлением оценок предрасположенности: многоцентровое японское исследование. J Hepatobiliary Pancreat Sci. 2015;22(10):711–20.
Артикул Google Scholar
Goumard C, Komatsu S, Brustia R, Fartoux L, Soubrane O, Scatton O. Техническая осуществимость и безопасность лапароскопической правосторонней гепатэктомии при гепатоцеллюлярной карциноме после последовательной TACE-PVE: сравнительное исследование.
 Surg Endosc. 2017;31(5):2340–9.
Surg Endosc. 2017;31(5):2340–9.Артикул Google Scholar
Морис З. Развитие и перспективы лапароскопической резекции печени в лечении гепатоцеллюлярной карциномы. Серж сегодня. 2019;49(8):649–55.
Артикул Google Scholar
Хаяши Х., Беппу Т., Окабе Х. и др. Функциональная оценка по сравнению с традиционной объемной оценкой в прогнозировании исходов операции после обширной гепатэктомии. Операция. 2015;157(1):20–6.
Артикул Google Scholar
Беппу Т., Окабе Х., Окуда К. и др. Эмболизация воротной вены с последующей правосторонней гемигепатэктомией у пациентов с гепатоцеллюлярной карциномой: японское многоучрежденческое исследование. J Am Coll Surg. 2016;222(6):1138–48.
Артикул Google Scholar
«>Труант С., Оберлин О., Сержент Г. и др. Отношение объема остаточной печени к массе тела > или = 0,5%: новое пороговое значение для оценки послеоперационных рисков после расширенной резекции печени без цирроза. J Am Coll Surg. 2007;204(1):22–33.
Артикул Google Scholar
Адам Р., Лоран А., Азулай Д., Кастен Д., Висмут Х. Двухэтапная гепатэктомия: плановая стратегия лечения нерезектабельных опухолей печени. Энн Сург. 2000;232(6):777–85.
Артикул КАС Google Scholar
Цзяо Л.
 Р., Фахардо Пуэрта А.Б., Галл Т. и др. Быстрая индукция регенерации печени при обширной гепатэктомии (REBIRTH): рандомизированное контролируемое исследование эмболизации воротной вены по сравнению с ALPPS с радиочастотной поддержкой. Раки. 2019;11(3):302.
Р., Фахардо Пуэрта А.Б., Галл Т. и др. Быстрая индукция регенерации печени при обширной гепатэктомии (REBIRTH): рандомизированное контролируемое исследование эмболизации воротной вены по сравнению с ALPPS с радиочастотной поддержкой. Раки. 2019;11(3):302.Артикул Google Scholar
Панданабояна С., Белл Р., Идальго Э. и др. Систематический обзор и метаанализ лигирования воротной вены в сравнении с эмболизацией воротной вены при плановой резекции печени. Операция. 2015;157(4):690–8.
Артикул Google Scholar
Нарула Н., Алоя Т.А. Эмболизация воротной вены при расширенной резекции печени. Langenbecks Arch Surg. 2017;402(5):727–35.
Артикул Google Scholar
Су К.М., Чжоу К.С., Ян Т.Х., Линь Ю.Дж. Сравнение анатомических и неанатомических резекций при очень ранней стадии гепатоцеллюлярной карциномы: важность ширины хирургического края резекции при неанатомической резекции.
 Сур Онкол. 2021; 36:15–22.
Сур Онкол. 2021; 36:15–22.Артикул Google Scholar
Аоки Т., Кубота К., Хасегава К. и др. Значение хирургического края резекции печени у пациентов с одиночной гепатоцеллюлярной карциномой. Бр Дж Сур. 2020;107(1):113–20.
Артикул КАС Google Scholar
Ли П., Ван М., Ян Ю и др. Предоперационная трехмерная оценка по сравнению с двухмерной при оценке пациентов, перенесших обширную резекцию печени по поводу гепатоцеллюлярной карциномы: исследование сопоставления показателей предрасположенности. Энн Трансл Мед. 2020;8(5):182.
Артикул Google Scholar
Takahara T, Wakabayashi G, Konno H, et al. Сравнение лапароскопической большой гепатэктомии с оценкой предрасположенности соответствовало открытым случаям из Национальной клинической базы данных в Японии. J Hepatobiliary Pancreat Sci. 2016;23(11):721–34.
Артикул Google Scholar
Линь С.Дж., Ян Дж., Чен С.Б., Чжан М., Сюй М.К. Критическое значение отношения объема остаточной печени к массе тела для оценки постгепатэктомической печеночной недостаточности у пациентов с циррозом печени. J Surg Res. 2014;188(2):489–95.
Артикул Google Scholar
Ссылки на скачивание
Благодарности
Неприменимо.
Финансирование
Неприменимо.
Информация об авторе
Авторы и организации
Третье отделение хирургии печени, Восточная больница гепатобилиарной хирургии, 225 Changhai Road, Shanghai, 200438, China
Lei Liu, Wenbin Ding , Вэйпин Чжоу и Шэнсянь Юань
Отделение радиоактивного вмешательства, Восточная больница гепатобилиарной хирургии, Шанхай, 200438, Китай
Сюэ Лю
Авторы
- Лэй Лю 900 04 Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Wenbin Ding
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Академия
- Сюэ Лю
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Weiping Zhou
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Shengxian Yuan
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
Contributions
LL: оформление статьи, сбор данных, написание рукописи, критическая доработка рукописи. WD: оформление статьи, сбор данных, критическая доработка рукописи. XL: оформление статьи, сбор данных, оператор PVE, критическая доработка рукописи. SY и WZ: разработка протокола терапии, сбор данных, анализ и интерпретация данных, написание рукописи, критический пересмотр рукописи и окончательное утверждение статьи. Все авторы прочитали и одобрили окончательный вариант рукописи.
WD: оформление статьи, сбор данных, критическая доработка рукописи. XL: оформление статьи, сбор данных, оператор PVE, критическая доработка рукописи. SY и WZ: разработка протокола терапии, сбор данных, анализ и интерпретация данных, написание рукописи, критический пересмотр рукописи и окончательное утверждение статьи. Все авторы прочитали и одобрили окончательный вариант рукописи.
Авторы переписки
Переписка с Вейпин Чжоу или Шэнсянь Юань.
Декларация этики
Одобрение этики и согласие на участие
От пациента было получено письменное информированное согласие на публикацию этого отчета о клиническом случае и любых сопровождающих изображений.
Согласие на публикацию
Согласие на публикацию получено от пациента. Пациент дал письменное согласие на публикацию личных и клинических данных вместе с идентифицирующими изображениями в этом исследовании. Форма согласия была доступна по запросу.
Конкурирующие интересы
Авторы заявляют об отсутствии конкурирующих интересов.
Дополнительная информация
Примечание издателя
Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Дополнительная информация
Доп. файл 1 : Видео лапароскопической правосторонней гепатэктомии. Была выполнена лапароскопическая правосторонняя гепатэктомия после новой эмболии воротной вены.
Права и разрешения
Открытый доступ Эта статья находится под лицензией Creative Commons Attribution 4.0 International License, которая разрешает использование, совместное использование, адаптацию, распространение и воспроизведение на любом носителе или в любом формате, при условии, что вы укажете соответствующую ссылку на оригинальный автор(ы) и источник, предоставьте ссылку на лицензию Creative Commons и укажите, были ли внесены изменения. Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons на статью, если иное не указано в кредитной строке материала.


 , Существительное Р., Сованет А., Джани С., Белгити Дж.
Фаргес О. и др.
Гепатогастроэнтерология. 1998 март-апрель;45(20):370-5.
Гепатогастроэнтерология. 1998.
PMID: 9638409
Клиническое испытание.
, Существительное Р., Сованет А., Джани С., Белгити Дж.
Фаргес О. и др.
Гепатогастроэнтерология. 1998 март-апрель;45(20):370-5.
Гепатогастроэнтерология. 1998.
PMID: 9638409
Клиническое испытание. Русский.
Аннотация недоступна.
Русский.
Аннотация недоступна. Surg Endosc. 2017;31(5):2340–9.
Surg Endosc. 2017;31(5):2340–9. Р., Фахардо Пуэрта А.Б., Галл Т. и др. Быстрая индукция регенерации печени при обширной гепатэктомии (REBIRTH): рандомизированное контролируемое исследование эмболизации воротной вены по сравнению с ALPPS с радиочастотной поддержкой. Раки. 2019;11(3):302.
Р., Фахардо Пуэрта А.Б., Галл Т. и др. Быстрая индукция регенерации печени при обширной гепатэктомии (REBIRTH): рандомизированное контролируемое исследование эмболизации воротной вены по сравнению с ALPPS с радиочастотной поддержкой. Раки. 2019;11(3):302. Сур Онкол. 2021; 36:15–22.
Сур Онкол. 2021; 36:15–22.