Герпетический ганглионеврит: Герпетический неврит лечение консультация ID-CLINIC Санкт-Петербург
Герпетический неврит лечение консультация ID-CLINIC Санкт-Петербург
Герпетический неврит лечение консультация ID-CLINIC Санкт-ПетербургПрием врачей
- Сифилидолог
- ИНФЕКЦИОНИСТ
- Дерматолог
- Терапевт
- Кардиолог
- Онколог
- Эндокринолог
- Невролог
- Медицинские справки
- Ультразвуковая диагностика — УЗИ
- Функциональная диагностика
- Уролог
- Венеролог
- Паразитолог
- Маммолог
- Все услуги
Диагностика
- Гинекология
- Дерматовенерология
- Кардиология
- Неврология
- Онкология
- Терапия
- Урология
- Эндокринология
- Инфектология
Лечение
- А
- Б
- В
- Г
- Д
- Е
- Ё
- Ж
- З
- И
- Й
- К
- Л
- М
- Н
- О
- Р
- С
- Т
- У
- Ф
- Х
- Ц
- Ч
- Ш
- Щ
- Э
- Ю
- Я
COVID
Полный спектр медицинской помощи при вирусной инфекции COVID
CHECK-UP
Полный спектр комплексной медицинской диагностики
Анализы
сдать анализы по доступным ценам
Препараты
специализированная аптека
Online
специализированная консультация
СКИДКИ
Только выгодные предложения для Вас!
Санкт-Петербург, ул. Ивана Черных, 25А
Ивана Черных, 25А
пн.-сб. с 9:00 — 20:00, вс. с 10:00 — 18:00
- Главная
- •
- Лечение
- •
- Г
- •
- Герпетический неврит
ЭКСПЕРТНАЯ ПОМОЩЬ
- герпесвирусы
- вирус папилломы человека
- вирусные гепатиты
- микобактериоз
- ВИЧ-инфекция
- внутриутробные, паразитарные и другие инфекционные заболевания
Герпетическая инфекция — одна из наиболее актуальных медицинских проблем, которой страдают более 20 млн людей. Всего известно 8 типов вирусов герпеса, причем первые 6 из них имеют сродство к нервной ткани и способны вызывать неврологические заболевания. В Санкт-Петербурге ежегодно определяется до 25 тыс. случаев герпетических невритов и других поражений нервной системы. Чаще всего их причиной становится вирус Varicella zoster (вызывает опоясывающий герпес).
Всего известно 8 типов вирусов герпеса, причем первые 6 из них имеют сродство к нервной ткани и способны вызывать неврологические заболевания. В Санкт-Петербурге ежегодно определяется до 25 тыс. случаев герпетических невритов и других поражений нервной системы. Чаще всего их причиной становится вирус Varicella zoster (вызывает опоясывающий герпес).
Причины патологии
При реактивации вируса Varicella zoster симптоматика вызвана прямым повреждающим влиянием на нервные структуры. Герпетический ганглионеврит развивается в среднем у 2 пациентов на 1000 населения, а в возрастной группе старше 75 лет распространенность патологии увеличивается в 5 раз. При заражении вирусами простого герпеса 1 и 2 типов, вирусом Эпштейна-Барр и цитомегаловирусом невриты могут возникать по аутоиммунному механизму.
Опасность герпетических невритов
Вирусы герпеса склонны к распространению по нервам к структурам ЦНС, поэтому они могут вызывать энцефалиты, менингиты, энцефаломиелиты. В редких случаях ганглионевриты сопровождаются гранулематозным ангиитом, который чреват тромбозами и инфарктами головного мозга.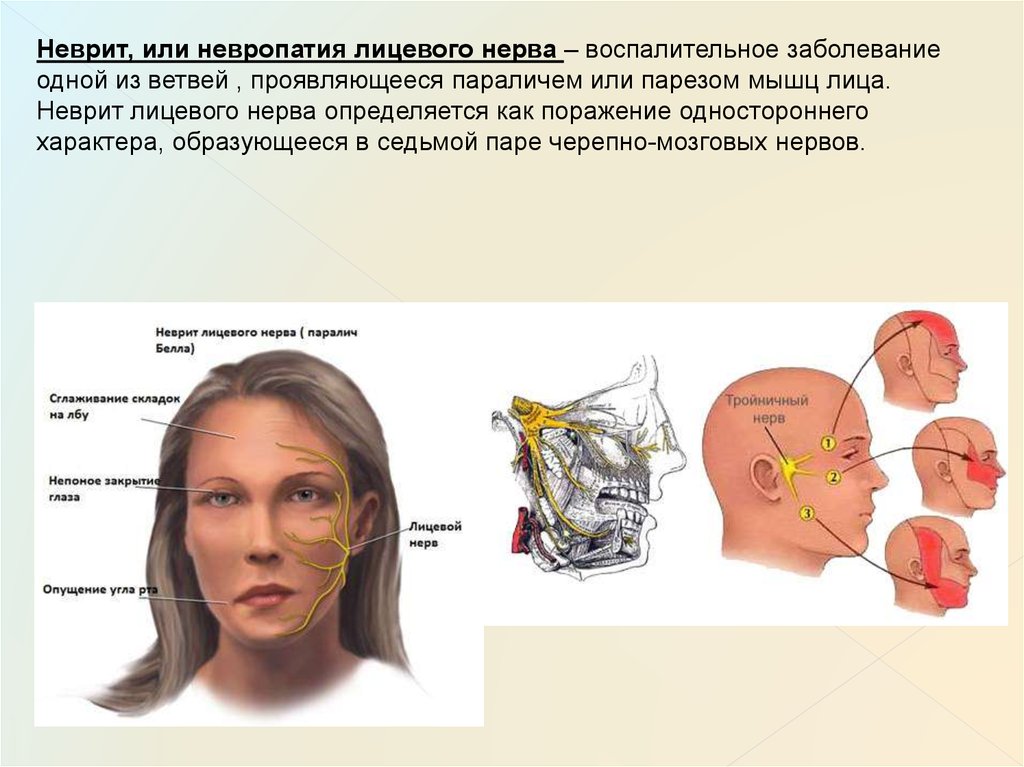 При поражении вирусом опоясывающего лишая существует риск постгерпетической невралгии: заболеванию особенно подвержены пациенты старше 70 лет, люди с иммунодефицитами.
При поражении вирусом опоясывающего лишая существует риск постгерпетической невралгии: заболеванию особенно подвержены пациенты старше 70 лет, люди с иммунодефицитами.
Неврит лицевого нерва
Лицевой нерв проходит в узком канале, где он легко подвержен ущемлению на фоне воспалительного процесса. Заболевание обычно возникает постепенно: сначала пациента беспокоит сильная боль в заушной области, а спустя 24-48 часов развивается асимметрия лица вследствие паралича мышц. На стороне поражения сглаживается носогубная складка, не смыкаются веки, нарушается подвижность губ. Также пациент страдает от головных болей, сухости глаза, слюнотечения.
Запиcаться на прием
Санкт-Петербург, ул.Ивана Черных, 25А
Пн-Сб 09.00-20.00, Вс 10.00-18.00
Нажимая на кнопку «Записаться» вы соглашаетесь на обработку персональных данных
Online консультация
Удобным способом,
в удобное для Вас время
Нажимая на кнопку «Записаться» вы соглашаетесь на обработку персональных данных
Неврит тройничного нерва
Еще один характерный вариант герпетического поражения, который встречается с частотой 2-4 случая на 10 тыс. взрослого населения. Неврит проявляется приступами резкой лицевой боли, которая ощущается как “удар током”, “прострел”. Боли распространяются по всей половине лица, длятся несколько минут, после чего исчезают. Характерно поведение пациента: он замирает, задерживает дыхание, не кричит и не стонет, неподвижно дожидаясь окончания пароксизма.
взрослого населения. Неврит проявляется приступами резкой лицевой боли, которая ощущается как “удар током”, “прострел”. Боли распространяются по всей половине лица, длятся несколько минут, после чего исчезают. Характерно поведение пациента: он замирает, задерживает дыхание, не кричит и не стонет, неподвижно дожидаясь окончания пароксизма.
Неврит седалищного нерва
В этом случае очаг боли локализован в области ягодицы, распространяется по ходу нервов на заднюю поверхность бедра, голень и стопу. Пациенты жалуются на жгучие или простреливающие боли по всей ноге, из-за чего они начинают хромать или вовсе не могут самостоятельно передвигаться. Болевой синдром сопровождается онемением кожи голени и стопы, чувством покалывание или ползания мурашек, нарушением сгибания колена.
Диагностика герпетического неврита
Клиническая картина поражения определенного нерва настолько характерна, что у невролога ID-Clinic не остается сомнений в постановке диагноза. Однако болезнь может быть вызвана разными причинами, поэтому требуется дополнительное обследование под руководством инфекциониста.
Лечение герпетического неврита
При поражении нервной системы обязательно назначаются противовирусные препараты в таблетированных или инъекционных формах. Вид лекарства, дозу и длительность применения врач подбирает индивидуально с учетом клинической картины у конкретного больного. Для купирования болевых ощущений назначаются антиконвульсанты, анальгетики, седативные средства, лечебные блокады. Усилить обезболивающее действие помогают методы физиотерапии.
Профилактика герпетической инфекции
Всем людям, которые не болели ветрянкой, рекомендуется сделать прививку “Варилрикс” от вируса Varicella zoster. Иммунизация надежно защищает человека от опоясывающего герпеса и постгерпетической невралгии. При часто рецидивирующих герпетических инфекциях 1 и 2 типа рекомендована специальная вакцина “Витагерпавак” , которая формирует стойкий иммунитет, уменьшает частоту и длительность обострений у 90% привитых.
Записаться к врачу
Чтобы проконсультироваться с неврологом ID-Clinic в клинике или онлайн, оставьте заявку в форме обратной связи. Мы перезвоним вам и подберем удобную дату и время врачебного приема.
Стоимость услуг клиники
Осмотр
Получить услугу
| B01.014.001.001 | Прием (осмотр, консультация) врача-инфекциониста первичный | 3000 ₽ |
| B01.023.001 | Прием (осмотр, консультация) врача-невролога первичный | 3000 ₽ |
| B04.014.004.005 | Вакцинация против вируса герпеса 1-2 типа (Витагерпавак) | 2000 ₽ |
Online консультация врача-инфекциониста | 3000 ₽ | |
Online консультация врача-невролога | 3000 ₽ |
Анализы
Получить услугу
| 030701 | Вирус простого герпеса I и II типа (Herpes simplex virus I-II), качественное определение ДНК | 360,00 ₽ |
| 030601 | Цитомегаловирус (Cytomegalovirus, CMV), качественное определение ДНК | 360,00 ₽ |
| 031001 | Вирус Варицелла-Зостер (Varicella-Zoster virus,VZV), качественное определение ДНК | 390,00 ₽ |
| 030901 | Вирус Эпштейна-Барр (Epstein-Barr virus, EBV), качественное определение ДНК | 365,00 ₽ |
| 042101 | Вирус герпеса VI типа (Human herpes virus), IgG, полуколичественное определение | 725,00 ₽ |
Другие услуги клиники
Прививка от ветряной оспы
Прививка от герпеса
Онлайн консультация невролога
Онлайн консультация инфекциониста
СавченкоМихаил Андреевич
Инфекционист,
Гепатолог,
Врач первой категории,
Кандидат медицинских наукЗаписаться на прием
ЕфимовГеоргий Александрович
Инфекционист,
ПаразитологЗаписаться на прием
КорнееваТатьяна Сергеевна
Инфекционист,
Гепатолог,
Врач УЗИ,
Кандидат медицинских наукЗаписаться на прием
СизоваНаталия Владимировна
Инфекционист,
Врач высшей категории,
Доктор медицинских наук,
ПрофессорЗаписаться на прием
МайороваСветлана Олеговна
Инфекционист,
Врач высшей категории,
Кандидат медицинских наукЗаписаться на прием
ЗвонцоваСветлана Александровна
Инфекционист,
ПаразитологЗаписаться на прием
ЛавренчукДмитрий Вадимович
Инфекционист,
Гепатолог,
Терапевт,
Кандидат медицинских наукЗаписаться на прием
ФадеевКирилл Александрович
Инфекционист,
Гепатолог,
Паразитолог,
Врач высшей категории,
Кандидат медицинских наукЗаписаться на прием
КиселеваЛюдмила Ивановна
Терапевт,
Пульмонолог,
Врач УЗИ,
СомнологЗаписаться на прием
БаландинаАнна Борисовна
Инфекционист,
Гепатолог,
Паразитолог,
РабиологЗаписаться на прием
ЮзефовичТатьяна Сергеевна
Невролог,
Эпилептолог,
Врач функциональной диагностики,
Врач высшей категорииЗаписаться на прием
СеливановаМарина Андреевна
Инфекционист,
Гепатолог,
Паразитолог,
РабиологЗаписаться на прием
Все специалисты
Читать отзывы
Акции и спецпредложения
Истории и отзывы наших пациентов
Продокторов
Была здесь и раньше, а сегодня привела маму и заодно сдала кровь на антитела к ковид-19. У меня не самые хорошие вены, но медсестра просто волшебница. Быстро, безболезненно! Мама была на приеме у инфекциониста Савченко М.А. Врачи грамотные, администраторы вежливые, обстановка прекрасная.
У меня не самые хорошие вены, но медсестра просто волшебница. Быстро, безболезненно! Мама была на приеме у инфекциониста Савченко М.А. Врачи грамотные, администраторы вежливые, обстановка прекрасная.
Продокторов
Это, пожалуй, самое лучшее платное лечебное учреждение, где я когда-либо была) Была в очень дорогих и известных, и Эйч-Клиник реально топ. Понравилось абсолютно все. Подход, в том числе и к проблемным конфликтным клиентам типа меня, персонал подобран идеально, здесь все только ради вас, причем нет никаких натянутых лживых улыбок и прочего. Люди реально и от души помогают. Врач — инфекционист Базюк, врач по призванию. Даже медбрат (темненький с тату) сделал с большой отдачей прививку (чувствую такие вещи) . Я очень благодарна вам всем. Клиника чистая, сервис на 5+, есть зарядка, можно попросить второй кофе с двойными сливками, есть даже презервативы в вазе (взяла в подарок школьникам)
НаПоправку
В октябре записывался в H-Clinic для сдачи анализа крови на ТТГ. В целом, могу сказать, что посещением я остался доволен. Заранее по телефону администратор проинформировала о подготовке, собственно, она была стандартная, кровь нужно было сдавать натощак. Кровь сдал быстро, пришёл ко времени записи, и меня сразу пригласили в процедурный кабинет. В процедурном кабинете было чисто, аккуратно, кровь взяли не больно. Клинику эту посещал впервые, обстановка там приятная, к обслуживанию персонала вопросов тоже никаких не возникло, были соблюдены все противоковидные меры. Думаю, что услугами данной клиники буду пользоваться и в будущем. Единственное — немного смутило расположение клиники, не очень удобное, на мой взгляд, и в целом, место, где она находится, несимпатичное. Но этот фактор не имеет отношение к самому качеству обслуживания. Всё остальное было в порядке.
В целом, могу сказать, что посещением я остался доволен. Заранее по телефону администратор проинформировала о подготовке, собственно, она была стандартная, кровь нужно было сдавать натощак. Кровь сдал быстро, пришёл ко времени записи, и меня сразу пригласили в процедурный кабинет. В процедурном кабинете было чисто, аккуратно, кровь взяли не больно. Клинику эту посещал впервые, обстановка там приятная, к обслуживанию персонала вопросов тоже никаких не возникло, были соблюдены все противоковидные меры. Думаю, что услугами данной клиники буду пользоваться и в будущем. Единственное — немного смутило расположение клиники, не очень удобное, на мой взгляд, и в целом, место, где она находится, несимпатичное. Но этот фактор не имеет отношение к самому качеству обслуживания. Всё остальное было в порядке.
Пользователь (СберЗдоровье)
Выбрала этого доктора, потому что была свободная запись в этот же день, что было важно. Врач объяснила все вопросы, которые меня интересовали и поставила хорошее лечение. Прием начался без задержек.
Прием начался без задержек.
Специалист: Корнеева Татьяна Сергеевна
Пользователь НаПоправку
Делала в клинике вакцину Превинар -13. Все прошло идеально! Врач тщательно осмотрела, дала необходимые рекомендации. После вакцинации в течении 20 минут сидела в клинике, предложили кофе, постоянно интересовались самочувствием. В общем, мне очень все понравилось! Спасибо большое персоналу, врачу, старшей медсестре за Ваш профессионализм и замечательное отношение!
Продокторов
Мы Татьяну Сергеевну посетили впервые. Выбрали именно её, потому что для записи было то время, которое нам нужно. В принципе нас всё устроило. Доктор провела осмотр, проконсультировала, назначила анализы. Она смогла ответить на все наши вопросы, рассказала всё как есть. С Татьяной Сергеевной очень комфортно разговаривать. Сама консультация длилась ориентировочно минут 50, может час. Времени было достаточно. Всем довольны, вопросов нет. Если появится необходимость, обратимся к доктору повторно. Могу порекомендовать к посещению данного специалиста.
Могу порекомендовать к посещению данного специалиста.
Специалист: Корнеева Татьяна Сергеевна
Наталья
Прекрасный человек и врач, отзывчивый и понимающий. Одно удовольствие быть у него на приеме. Квалифицированный специалист, который спокойно ответит на все волнующие вопросы. Спасибо вам, Георгий Александрович.
Специалист: Ефимов Георгий Александрович
Виктория
К доктору я записалась потому что она имеет отношение к моему хроническому заболеванию. Я не ошиблась, что записалась именно к ней. Она помогла разобраться с моим вопросом и подсказала что нужно делать. Мне очень понравился прием и ее отношение к своей работе, потому что все внимание было уделено мне и моей проблеме, поэтому прием прошел просто прекрасно.
Специалист: Тесля Ольга Владимировна
Наталья Наталья
Обращаемся всей семьей не первый раз, основное сдача анализов, администраторы всегда приветливые, никаких очередей, лишних вопросов и траты времени. Приехали, сдали, результат получили на почту. Всегда быстро, предельно вежливо. Цены не завышены. Всегда в срок и даже быстрее. Очень довольны продолжим обращаться. При необходимости можно обратится к узкопрофильным специалистам. Очень порадовало что есть хороший Пульмонолог. Для меня это крайне важно.
Приехали, сдали, результат получили на почту. Всегда быстро, предельно вежливо. Цены не завышены. Всегда в срок и даже быстрее. Очень довольны продолжим обращаться. При необходимости можно обратится к узкопрофильным специалистам. Очень порадовало что есть хороший Пульмонолог. Для меня это крайне важно.
Местоположение отличное, никаких проблем с ожиданием, все просто и понятно по звонку. Никаких туманных историй «Идите на сайт», все решается по телефону. Никаких вопросов в духе «А вам точно это надо, а может это и еще это и то и вон то для надежности…?» Точно быстро просто. Радует профессионализм, компетенция, тактичность, уровень безопасности.
Аноним
Обратились к Николаю Ивановичу полгода назад. Он очень тщательно и с пониманием отнёсся к нам. После разговора мы осознали нашу проблему и решили наблюдаться у доктора. Объяснил все нюансы нашего диагноза и начал лечение. Дочь стала меняться буквально с первого приема. Перестала употреблять, и уже пол года не замечена. Стала исправлять учебу в школе и поменяла круг друзей. После каждого приема приходит с новыми, правильными мыслями и реализует их. Лечение назначено грамотно. Были страхи побочных явлений от препаратов, но их не оказалось, за это особое спасибо, что учли наше пожелание и страхи. Спасибо Николаю Ивановичу!
После каждого приема приходит с новыми, правильными мыслями и реализует их. Лечение назначено грамотно. Были страхи побочных явлений от препаратов, но их не оказалось, за это особое спасибо, что учли наше пожелание и страхи. Спасибо Николаю Ивановичу!
Специалист: Унгурян Николай Иванович
Показать больше отзывов
Имеются противопоказания,
необходима консультация специалиста
Постгерпетическая тригеминальная невралгия – возможности предупреждения и лечения | Камчатнов П.Р., Евзельман М.А., Чугунов А.В.
Герпетический ганглионит гассерова узла (синонимы: «опоясывающий лишай», «опоясывающий герпес») – достаточно распространенное инфекционное заболевание, проявляющееся возникновением серозных высыпаний в области иннервации отдельных ветвей тройничного нерва. Вызывается вирусом Varicella zoster из группы вирусов герпеса. Как свидетельствуют результаты эпидемиологических исследований, сведения, полученные при анализе статистических данных об обращениях за амбулаторной медицинской помощью, в США ежегодно регистрируется примерно 500 тыс. случаев заболевания [2]. Заболеваемость составляет порядка 2–3 случаев на 1000 человек в год [3]. Убедительно доказано, что частота случаев развития опоясывающего герпеса нарастает с возрастом. Так, в популяции старше 80 лет частота его составляет уже 10 на 100 человек в год [5].
случаев заболевания [2]. Заболеваемость составляет порядка 2–3 случаев на 1000 человек в год [3]. Убедительно доказано, что частота случаев развития опоясывающего герпеса нарастает с возрастом. Так, в популяции старше 80 лет частота его составляет уже 10 на 100 человек в год [5].
В основе заболевания лежит реактивация вируса Varicella zoster, способного на протяжении длительного периода времени персистировать в ганглиях заднего рога. Соответственно, в отношении тройничного нерва областью их нахождения является гассеров узел. В случае возникновения определенных условий, благоприятных для активации вируса, развивается заболевание. Считается, что факторами риска для его реактивации являются пожилой возраст или, наоборот, инфицирование в детском возрасте (до 18 мес.), состояние иммуносупрессии различного происхождения (приобретенный иммунодефицит, онкологические заболевания, иммуносупрессивная терапия), внутриутробный контакт с вирусом ветряной оспы. Заболевание реализуется в условиях снижения клеточного иммунитета, обусловленного различными причинами.
Вирус герпеса может передаваться от человека к человеку, в частности, в тех случаях, когда индивидуум не переносил ветряной оспы или не был своевременно вакцинирован по поводу данной инфекции. Заболевание не склонно к рецидивированию. Считается, что рецидивы наблюдаются примерно у 6% пациентов, причем период от первого эпизода до рецидива может составлять несколько десятилетий [5]. Клинический опыт свидетельствует о том, что рецидив может быть обусловлен возникшим у пациента заболеванием, наличие которого негативным образом сказывается на состоянии и характере иммунного ответа.
Клинические проявления
Развитию заболевания предшествует продромальный период, который характеризуется лихорадкой, тошнотой, диффузной головной болью, которые, нарастая, могут наблюдаться на протяжении нескольких суток. Характерным является нарастание локальных болей, которые имеют характер нейропатических, а также неприятный жгучий, колющий оттенок зуда, способных сопровождаться аллодинией, гиперестезией и гиперпатией. Как правило, такого рода боли локализованы в области последующих высыпаний и ограничиваются зоной одного или нескольких соответствующих дерматомов. В подавляющем большинстве случаев указанные проявления носят односторонний характер, хотя у отдельных пациентов они могут распространяться и на противоположную половину туловища [8]. Боль может носить исключительно интенсивный характер, что нередко симулирует ряд соматических заболеваний, в частности плеврит, острый инфаркт миокарда, почечную колику. Поражение гассерова узла может вызвать трудности при проведении дифференциальной диагностики со стоматологическими заболеваниями, поражением придаточных пазух носа.
Как правило, такого рода боли локализованы в области последующих высыпаний и ограничиваются зоной одного или нескольких соответствующих дерматомов. В подавляющем большинстве случаев указанные проявления носят односторонний характер, хотя у отдельных пациентов они могут распространяться и на противоположную половину туловища [8]. Боль может носить исключительно интенсивный характер, что нередко симулирует ряд соматических заболеваний, в частности плеврит, острый инфаркт миокарда, почечную колику. Поражение гассерова узла может вызвать трудности при проведении дифференциальной диагностики со стоматологическими заболеваниями, поражением придаточных пазух носа.
На фоне указанных симптомов появляются гиперемия и множественные макулопапулярные высыпания, которые впоследствии приобретают характер везикулярных. Пузырьки заполнены прозрачным бесцветным серозным содержимым. В случаях благоприятного течения заболевания высыпания могут быль локализованы только в отдельной части дерматома. Появление новых высыпаний возможно на протяжении 5–7 дней. Через несколько суток от момента появления первых высыпаний содержимое их становится мутным (так называемая стадия пустуляции). В последующем, при отсутствии осложнений, на месте имевшихся высыпаний образуются сухие корочки, которые отпадают через 2–3 нед. В этих зонах могут оставаться рубцовые изменения или зоны измененной пигментации. Заболевание, как правило, имеет благоприятный прогноз, характеризуется монофазным течением и в незначительной степени обладает тенденцией к рецидивированию.
Появление новых высыпаний возможно на протяжении 5–7 дней. Через несколько суток от момента появления первых высыпаний содержимое их становится мутным (так называемая стадия пустуляции). В последующем, при отсутствии осложнений, на месте имевшихся высыпаний образуются сухие корочки, которые отпадают через 2–3 нед. В этих зонах могут оставаться рубцовые изменения или зоны измененной пигментации. Заболевание, как правило, имеет благоприятный прогноз, характеризуется монофазным течением и в незначительной степени обладает тенденцией к рецидивированию.
Диагностика может быть затруднена до появления характерных высыпаний. После их возникновения правильная постановка диагноза обычно не вызывает трудностей. Подтверждение диагноза возможно при проведении полимеразной цепной реакции, позволяющей выявить ДКН вируса Varicella zoster в содержимом имеющихся высыпаний.
Осложнения
Среди возможных осложнений следует отметить локальные инфекционные поражения, обусловленные инфицированием поврежденных кожных покровов стрептококком или стафилококком, вплоть до развития целлюлита. При вовлечении в патологический процесс офтальмической ветви тройничного нерва возможно развитие кератита, способного привести к тяжелым последствиям в виде поражения роговицы, вплоть до монокулярной слепоты. Редко встречаются поражения герпетической инфекцией ткани головного мозга (с развитием энцефалита) или его оболочек с возникновением серозного менингита.
При вовлечении в патологический процесс офтальмической ветви тройничного нерва возможно развитие кератита, способного привести к тяжелым последствиям в виде поражения роговицы, вплоть до монокулярной слепоты. Редко встречаются поражения герпетической инфекцией ткани головного мозга (с развитием энцефалита) или его оболочек с возникновением серозного менингита.
Одним из наиболее частых и достаточно тяжелых осложнений ганглионита гассерова узла, обусловленного герпетической инфекцией, является постгерпетическая невралгия. Патогенез указанного состояния достаточно сложен и включает в себя по меньшей мере два основных механизма [5]. Во-первых, в его развитии принимает участие повышение возбудимости первичных афферентов вследствие поражения периферических нейронов. В результате этого возникают избыточная возбудимость ноцицепторов и, как следствие, формирование центральной сенситизации. Клинически такая совокупность патофизиологических процессов проявляется возникновением боли и развитием аллодинии. Во-вторых, вследствие дегенерации ноцицептивных нейронов возникает деафферентация вышерасположенных сенсорных систем, обусловливающая их гиперактивность. В результате этого наблюдается формирование боли, которая, однако, не сопровождается аллодинией. По мнению авторов, у одного пациента возможно сочетание обоих механизмов, с чем связано своеобразие болевого синдрома и различий в эффективности проводимой терапии.
Во-вторых, вследствие дегенерации ноцицептивных нейронов возникает деафферентация вышерасположенных сенсорных систем, обусловливающая их гиперактивность. В результате этого наблюдается формирование боли, которая, однако, не сопровождается аллодинией. По мнению авторов, у одного пациента возможно сочетание обоих механизмов, с чем связано своеобразие болевого синдрома и различий в эффективности проводимой терапии.
Данное патологическое состояние характеризуется всеми типичными для нейропатического болевого синдрома клиническими характеристиками. Установление диагноза возможно в том случае, если боль сохраняется на протяжении не менее 30 сут после наступления полного заживления имеющихся высыпаний.
Факторами риска развития постгерпетической тригеминальной невралгии являются возраст старше 60 лет, женский пол, наличие продромального периода, множественность высыпаний, а также высокая интенсивность болевого синдрома в дебюте заболевания [6]. По мнению авторов исследования, болевой синдром умеренной интенсивности, не сопровождающийся развитием в последующем постгерпетической невралгии, наблюдается у более молодых пациентов и, вероятно, связан с обширным локальным повреждением тканей и воспалительным процессом при наличии множественных высыпаний. Следует подчеркнуть значимость возрастного фактора как важного предиктора развития болевого синдрома – у пациентов, перенесших опоясывающий герпес в возрасте старше 90 лет, постгерпетическая невралгия возникает примерно в половине случаев [5]. Неблагоприятным прогностическим фактором развития болевого синдрома является выявление вируса Varicella zoster в крови.
Следует подчеркнуть значимость возрастного фактора как важного предиктора развития болевого синдрома – у пациентов, перенесших опоясывающий герпес в возрасте старше 90 лет, постгерпетическая невралгия возникает примерно в половине случаев [5]. Неблагоприятным прогностическим фактором развития болевого синдрома является выявление вируса Varicella zoster в крови.
Как и в отношении подавляющего большинства хронических нейропатических болевых синдромов, исключительно важную роль в развитии постгерпетической невралгии играет совокупность психосоциальных факторов. Наличие предшествующих депрессивных и тревожных расстройств, недостаточная социальная адаптированность пациента, нарушение социальных связей, проживание вне семьи и др. могут повышать вероятность развития болевого синдрома.
Течение постгерпетической невралгии может быть различным. У части пациентов наблюдается значительный регресс или полное исчезновение имеющегося болевого синдрома за период времени около полугода. К сожалению, возможно менее доброкачественное течение, когда болевой синдром приобретает хронический характер и приводит к инвалидизации пациента и резкому снижению качества его жизни [10]. Риск возникновения тяжелого болевого синдрома нарастает с возрастом, так, более чем у 5% пожилых больных интенсивный болевой синдром сохраняется более 12 мес. [5]. Особенности течения заболевания могут быть связаны с различиями патогенеза болевого синдрома, направленностью и интенсивностью компенсаторных реакций организма, а также с эффективностью и адекватностью проводимой терапии, в частности, ее своевременным началом.
К сожалению, возможно менее доброкачественное течение, когда болевой синдром приобретает хронический характер и приводит к инвалидизации пациента и резкому снижению качества его жизни [10]. Риск возникновения тяжелого болевого синдрома нарастает с возрастом, так, более чем у 5% пожилых больных интенсивный болевой синдром сохраняется более 12 мес. [5]. Особенности течения заболевания могут быть связаны с различиями патогенеза болевого синдрома, направленностью и интенсивностью компенсаторных реакций организма, а также с эффективностью и адекватностью проводимой терапии, в частности, ее своевременным началом.
Достаточно часто наряду с развитием постгерпетической невралгии у пациентов наблюдаются двигательные нарушения в виде периферических парезов черепных нервов (наиболее часто – лицевого нерва) [1]. Данная форма герпетической инфекции известна в качестве синдрома Рамсея Ханта. Не получено убедительных данных о прогностической значимости моторных нарушений в отношении частоты и длительности болевого синдрома.
Лечение
Наиболее эффективным методом лечения пациентов с опоясывающим герпесом является применение противововирусных препаратов. В настоящее время убедительно продемонстрирована высокая эффективность валацикловира (Вирдел, фармацевтическая компания «Штада») при лечении пациентов с опоясывающим герпесом, интерес представляет рекомендация применения правила «50-50-50» [8]. Показано, что максимальная эффективность противовирусной терапии наблюдается при ее начале не позже чем через 50 ч от момента появления высыпаний, у пациентов в возрасте старше 50 лет и при наличии не менее 50 элементов высыпаний. При соблюдении указанного правила возможно сокращение сроков заживления имеющихся кожных повреждений, а также снижение риска развития постгерпетической невралгии [9]. Авторы этого исследования продемонстрировали, что в данной ситуации все применяемые критерии оценки эффективности терапии (вероятность развития болевого синдрома, сроки его наступления, интенсивность боли) свидетельствовали о несомненном преимуществе своевременного начала терапии валацикловиром и адекватного выбора показаний для его проведения. Более позднее начало противовирусной терапии (более чем через 72 ч после появления высыпаний) обеспечивает незначительное сокращение сроков заживления [11]. Применение противовирусных препаратов в случае малого количества высыпаний (менее 50) также не связано с достоверным снижением вероятности развития нейропатического болевого синдрома.
Более позднее начало противовирусной терапии (более чем через 72 ч после появления высыпаний) обеспечивает незначительное сокращение сроков заживления [11]. Применение противовирусных препаратов в случае малого количества высыпаний (менее 50) также не связано с достоверным снижением вероятности развития нейропатического болевого синдрома.
Вероятно, несоблюдение указанного правила привело к тому, что результаты систематизированного обзора, посвященного изучению результатов противовирусной терапии, не смогли подтвердить ее эффективность в отношении предупреждения развития невралгии через 4 и 6 мес. после появления высыпаний [7]. Эти данные свидетельствуют о необходимости правильного выбора пациентов для достижения желаемого эффекта и своевременного начала лечения.
Для достижения терапевтического эффекта в виде уменьшения риска развития постгерпетической невралгии необходимо применение валацикловира (Вирдел) в суточной дозе 1000 мг 3 раза на протяжении 7 сут. Возможно использование и местных лекарственных форм противовирусных препаратов, но достижение терапевтического эффекта возможно только при их системном введении в адекватных суточных дозировках и достаточном сроке лечения. Препарат Вирдел хорошо переносится, возможно его одновременное применение с другими лекарственными средствами.
Возможно использование и местных лекарственных форм противовирусных препаратов, но достижение терапевтического эффекта возможно только при их системном введении в адекватных суточных дозировках и достаточном сроке лечения. Препарат Вирдел хорошо переносится, возможно его одновременное применение с другими лекарственными средствами.
В качестве средства, потенцирующего лечебные эффекты валацикловира, предлагается одновременное назначение глюкокортикоидов. Имеются данные о том, что комбинированная терапия способна снизить интенсивность болевого синдрома в острой стадии заболевания [12]. Менее убедительны сведения о способности глюкокортикоидов уменьшить риск формирования постгерпетической невралгии. Авторы проведенных в этом направлении исследований указывают на то, что использование глюкокортикоидов ассоциировано с повышенным риском развития нежелательных побочных эффектов, в частности, обострения язвенной болезни желудка, гипергликемии, присоединения локального инфекционного процесса, причем частота такого рода осложнений повышается с возрастом.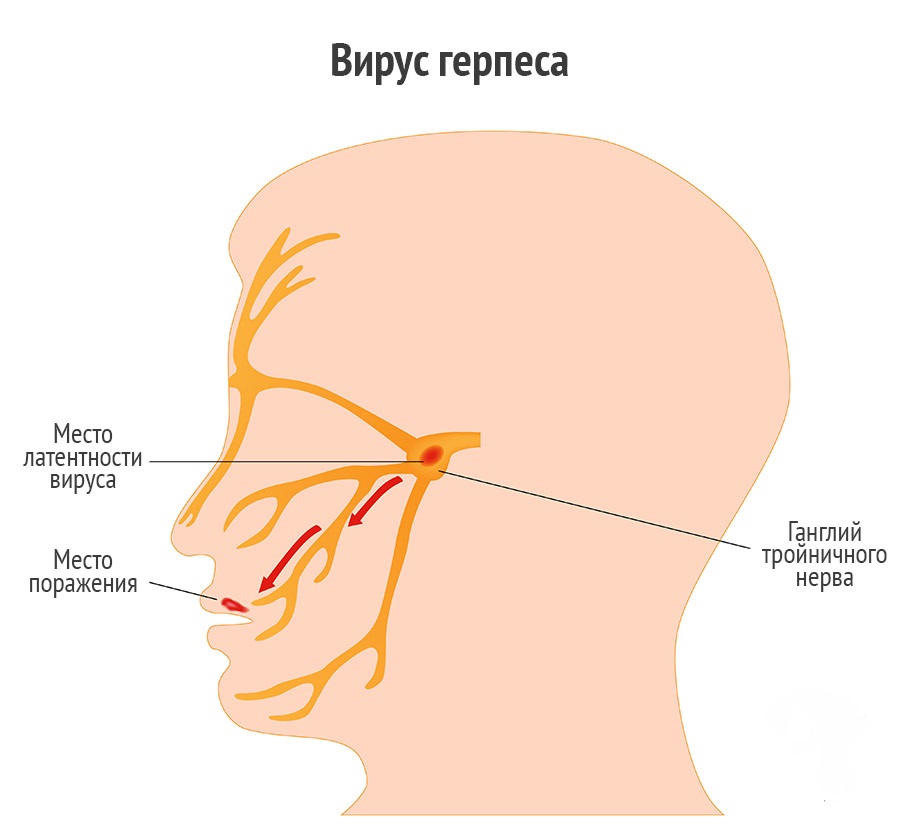 Несомненно, что проведение комбинированной терапии требует всестороннего учета возможного положительного ее эффекта и связанного с лечением риска побочных реакций, обусловленного состоянием конкретного пациента.
Несомненно, что проведение комбинированной терапии требует всестороннего учета возможного положительного ее эффекта и связанного с лечением риска побочных реакций, обусловленного состоянием конкретного пациента.
В том случае, если у больного имеется стойкая постгерпетическая невралгия, наблюдающаяся в отдаленном периоде после заживления высыпаний, лечение больного требует других подходов. В данной ситуации могут быть использованы представители трициклических антидепрессантов (амитриптилин, нортриптилин), которые обладают достаточно высокой эффективностью. Вместе с тем, несмотря на хороший противоболевой эффект, широкое применение этих препаратов ограничивается частым возникновением нежелательных побочных реакций, в особенности при их назначении в высоких дозировках. Достижение противоболевого эффекта при снижении риска побочных эффектов возможно за счет назначения антидепрессантов, обладающих способностью ингибировать обратный захват как серотонина, так и норадреналина. Следует отметить, что противоболевой эффект антидепрессантов при постгерпетической невралгии, как и при других нейропатических болевых синдромах, не связан только с их антидепрессивным эффектом.
Следует отметить, что противоболевой эффект антидепрессантов при постгерпетической невралгии, как и при других нейропатических болевых синдромах, не связан только с их антидепрессивным эффектом.
Для лечения пациентов с постгерпетической невралгией традиционной широко применяются противоэпилептические препараты, в частности карбамазепин. В настоящее время распространение получили новые лекарственные средства, фармакологические эффекты которых реализуются вследствие взаимодействия с рецепторами гамма-аминомасляной кислоты – основного тормозного медиатора в центральной нервной системе (габапентин, прегабалин). Отмечается их лучшая переносимость по сравнению с противоэпилептическими препаратами предыдущих поколений. В ряде стран при постгерпетической невралгии используются слабые или даже сильные опиоиды.
Интерес представляет возможность применения локальных форм лекарственных препаратов. Так, показано, что местное использование препаратов лидокаина может быть целесообразным при наличии болевого синдрома, сопровождающегося аллодинией. Имеются также сведения о возможной эффективности капсаицина у пациентов с постгерпетической невралгией. Следует отметить, что его широкое применение ограничивается не всегда удовлетворительной переносимостью терапии.
Имеются также сведения о возможной эффективности капсаицина у пациентов с постгерпетической невралгией. Следует отметить, что его широкое применение ограничивается не всегда удовлетворительной переносимостью терапии.
Таким образом, имеющиеся сведения об эффективности использования валацикловира (Вирдел) у пациентов с опоясывающим герпесом позволяют рекомендовать его широкое применение у данного контингента больных. Своевременное начало лечения, правильный отбор больных для назначения препарата способны повысить эффективность проводимой терапии, профилактировать развитие постгерпетической невралгии.
Литература
Вирусный ганглионеврит морского ушка (AVG)
Категория
Категория 3 (Хозяин не в Канаде)
Общепринятые, общепринятые названия организма или возбудителя болезни
Вирус герпеса морского ушка (AbHV), вирусный ганглионеврит морского ушка (AVG).
Научное название или таксономическая принадлежность
Вирус герпеса морского ушка (AbHV) является этиологическим агентом вирусного ганглионеврита морского ушка (AVG), заразной болезни морских ушек в Австралии (Hooper и др. 2007, Эллард и др. 2009 г., МЭБ 2012 г., Corbeil и др. 2012а). Савин и др. (2010) указано, что этот нейротропный вирус герпеса имеет общее происхождение с вирусом герпеса устриц (OsHV-1) и вирусом герпеса, связанным с геномом амфиоксуса ( Branchiostoma floridae , беспозвоночное хордовое). Чен и др. (2012) предположили, что AbHV и OsHV-1 могут представлять собой два вида вирусов, первый из которых заражает брюхоногих моллюсков, а второй заражает двустворчатых моллюсков. Тем не менее, AbHV предварительно был назначен вторым членом 9-го0015 Malacoherpesviridae , как описано Davison et al. (2009 г.) в отряде Herpesvirales (Savin et al. 2010 г., OIE 2012 г. , Arzul et al. 2017 г.).
, Arzul et al. 2017 г.).
Икосаэдрический вирус, описанный Chang et al. (2005) в качестве предполагаемого вируса герпеса из выращенного на ферме Haliotis diversicolor supertexta на Тайване (Китайский Тайбэй), вероятно, был AbHV (Burge 2010, OIE 2012). Однако Chen et al. (2012, 2014) указали на различия в патологии по сравнению с AbHV у австралийского морского ушка. В частности, клинические признаки австралийского морского морского ушка включают опухание рта и выпадение одонтофора (Hooper 9).0015 и др. 2007), в то время как у тайваньского больного морского ушка наблюдалась рецессия мантии и жесткость мышц (Chang et al. 2005), но не было поражений полости рта, наблюдаемых в Австралии (Hooper et al. 2007, Chen et al. 2012). Неизвестно, связаны ли такие различия с разной реакцией видов-хозяев на один и тот же патоген или были вовлечены разные патогены (Hooper et al. 2007). Тем не менее, Corbeil et al. (2010) указано, что ПЦР-анализ TaqMan, разработанный как специфический и чувствительный метод обнаружения AbHV, позволяет обнаруживать ДНК тайваньского герпесоподобного вируса морского ушка, что указывает на связь между тайваньским и австралийским вирусами. Однако анализ последовательности генома показал, что в Австралии присутствует ряд генотипических вариантов (Cowley и др. 2011) и дальнейший генетический анализ Chen et al. (2012) предположил, что тайваньский изолят вируса (Taiwan/2004) отличался от австралийского изолята AbHV (Victoria/AUS/2007).
(2010) указано, что ПЦР-анализ TaqMan, разработанный как специфический и чувствительный метод обнаружения AbHV, позволяет обнаруживать ДНК тайваньского герпесоподобного вируса морского ушка, что указывает на связь между тайваньским и австралийским вирусами. Однако анализ последовательности генома показал, что в Австралии присутствует ряд генотипических вариантов (Cowley и др. 2011) и дальнейший генетический анализ Chen et al. (2012) предположил, что тайваньский изолят вируса (Taiwan/2004) отличался от австралийского изолята AbHV (Victoria/AUS/2007).
Обратите внимание, что вирус, связанный с AVG, отличается от вирусных инфекций глиомы, вызывающих Amyotrophia of Abalone в Японии. Однако вирусы, рассматриваемые в двух отчетах из Японии (например, Otsu and Sasaki 1997 и Nakatsugawa et al. 1999) были включены в качестве герпесоподобных вирусных патогенов Chen et al. (2012). Кроме того, связь между AbHV и различными сообщениями о вирусных инфекциях морских ушек в Китае неизвестна, хотя есть предположение, что по крайней мере некоторые из них могут быть связаны с AbHV (Burge 2010; OIE 2012; Chen et al. 2012). , 2014).
2012). , 2014).
Географическое распространение
Австралия (Виктория (Hooper et al. 2007) и, возможно, Тасмания (Ellard и др. , 2009)) В отличие от ситуации в штате Виктория, AVG не наблюдался ни у выращиваемых морских ушек в Тасмании, ни у диких морских ушек в открытых водах Тасмании (Crane et al. 2009a). Однако после активного наблюдения за AVG на фермах по разведению морских ушек и в популяциях диких морских ушек в период с июня 2006 г. по июль 2008 г. и последующего обширного тестирования стад диких морских ушек в сентябре-декабре 2009 г. (1780 морских ушек) с помощью ПЦР и гистопатологии только один образец оказался положительным, что привело к предположение, что очень низкие уровни субклинических инфекций AVG могут присутствовать у диких животных Тасмании (Ellard и др. 2009 г.). Аналогичная и, возможно, такая же болезнь морских ушек была зарегистрирована на Тайване (Chang et al. 2005).
Виды-хозяева
Haliotis laevigata , Haliotis rubra и их гибриды (МЭБ 2012) и Haliotis conicopora (Corbeil et al. 2016) в Австралии. И, возможно, Haliotis diversicolor supertexta на Тайване, где совместное проживание Haliotis discus оставалось нормальным (Chang и др. 2005 г.).
Влияние на хост
Вспышки AVG как в выращиваемых, так и в диких популяциях морских ушек в Виктории, Австралия, были связаны с быстрым началом и высокими показателями смертности (до 90%) во всех возрастных группах (Corbeil et al. 2010). Болезнь была впервые обнаружена у выращиваемых на ферме морских ушек в Виктории, Австралия, в декабре 2005 г., а затем в дикой популяции в мае 2006 г. (Hooper et al. 2007, Appleford et al. 9).0016 2008). Уровни смертности обычно варьировались от 30 до 90% в зависимости от рифов и внутри них (Appleford et al. 2018). Аналогичным образом, на Тайване во время эпизоотии у разводимого H. diversicolor (температура воды 16–19°C) от болезни пострадали как взрослые, так и молодые морские ушки с совокупной смертностью от 70 до 80% (Chang et al. 2005). Чанг и др. (2005) сообщается, что гибель всех морских ушек в пруду может произойти в течение 3 дней после появления клинических признаков. Схожая картина заболевания наблюдалась при экспериментальных инфекциях (Chang и др. 2005 г., Кран и др. 2009a, МЭБ 2012).
2018). Аналогичным образом, на Тайване во время эпизоотии у разводимого H. diversicolor (температура воды 16–19°C) от болезни пострадали как взрослые, так и молодые морские ушки с совокупной смертностью от 70 до 80% (Chang et al. 2005). Чанг и др. (2005) сообщается, что гибель всех морских ушек в пруду может произойти в течение 3 дней после появления клинических признаков. Схожая картина заболевания наблюдалась при экспериментальных инфекциях (Chang и др. 2005 г., Кран и др. 2009a, МЭБ 2012).
Исследования передачи показали, что AbHV передается при прямом контакте и через воду, при этом инфекционность легко снижается при разбавлении, и AbHV, вероятно, перемещается на возбудителях, когда перемещается в полевых условиях на несколько километров (Appleford et al. 2008). Корбейл и др. (2011, 2012a) определили, что морское ушко, экспериментально купавшееся в морской воде, в которую больное морское ушко выбросило инфекционные вирусные частицы, дало положительный результат на наличие вирусной ДНК с помощью ПЦР в реальном времени уже через 36 часов после заражения. Анализ ISH обнаружил вирус в тканях уже через 48 часов после воздействия, а подвергшееся воздействию морское ушко начало проявлять явные признаки AVG через 60 часов после погружения. Кроме того, результаты экспериментов по воздействию показали, что выжившие дикие морские ушки из географического ареала AVG не были устойчивы к AbHV и, вероятно, не подвергались воздействию патогенных доз вируса во время первоначальной вспышки, начавшейся в 2006 г. и распространившейся вдоль побережья Виктории. , Австралия (Кран и др. 2013). Корбейл и др. (2016) определили, что пять известных вариантов AbHV вызывали заболевание и смертность у всех протестированных популяций морских ушек ( H. laevigata , H. rubra и H. conicopora ).
Анализ ISH обнаружил вирус в тканях уже через 48 часов после воздействия, а подвергшееся воздействию морское ушко начало проявлять явные признаки AVG через 60 часов после погружения. Кроме того, результаты экспериментов по воздействию показали, что выжившие дикие морские ушки из географического ареала AVG не были устойчивы к AbHV и, вероятно, не подвергались воздействию патогенных доз вируса во время первоначальной вспышки, начавшейся в 2006 г. и распространившейся вдоль побережья Виктории. , Австралия (Кран и др. 2013). Корбейл и др. (2016) определили, что пять известных вариантов AbHV вызывали заболевание и смертность у всех протестированных популяций морских ушек ( H. laevigata , H. rubra и H. conicopora ).
Данг и др. (2013) охарактеризовали иммунные параметры гибридного морского ушка ( Haliotis laevigata X Haliotis rubra ) после заражения AbHV. Выполненные измерения включали общее количество гемоцитов (THC), обнаружение супероксидного аниона (SO) и противовирусную активность против вируса простого герпеса 1 (HSV-1). Эти параметры исследовали у практически здоровых (субклинически) и умирающих морских ушек после контрольного заражения. Присутствие AbHV в морском ушке отрицательно коррелирует с уровнями ТГК и SO. Анти-ВПГ-1 активность плазмы морского ушка не превышала исходный уровень в ответ на экспериментальную инфекцию AbHV (Arzul и др. 2017). В заключение Dang et al. (2013) предположили, что морские ушки вызывают первоначальный клеточный иммунный ответ на инфекцию AbHV, но этот ответ не может поддерживаться при высоких вирусных нагрузках, что приводит к смертности.
Эти параметры исследовали у практически здоровых (субклинически) и умирающих морских ушек после контрольного заражения. Присутствие AbHV в морском ушке отрицательно коррелирует с уровнями ТГК и SO. Анти-ВПГ-1 активность плазмы морского ушка не превышала исходный уровень в ответ на экспериментальную инфекцию AbHV (Arzul и др. 2017). В заключение Dang et al. (2013) предположили, что морские ушки вызывают первоначальный клеточный иммунный ответ на инфекцию AbHV, но этот ответ не может поддерживаться при высоких вирусных нагрузках, что приводит к смертности.
Хотя генетические признаки резистентности к вирусам у брюхоногих моллюсков подробно не исследовались, некоторые семейные линии H. laevigata продемонстрировали небольшое повышение устойчивости к заражению вирусом герпеса морского ушка (Arzul и др. 2017).
Методы диагностики
Наличие AbHV следует заподозрить, если пораженные морские ушки проявляют клинические признаки и патологию, как описано ниже. В дополнение к клиническим признакам и последовательной патологии наличие AbHV может быть подтверждено с помощью молекулярных анализов. В частности, вирус положительно идентифицируется в срезах тканей с помощью гибридизации in situ и/или с помощью ПЦР в реальном времени (TaqMan) или обычной ПЦР с последующим анализом последовательности ампликона для подтверждения идентичности вируса (Crane и др. 2009а).
В дополнение к клиническим признакам и последовательной патологии наличие AbHV может быть подтверждено с помощью молекулярных анализов. В частности, вирус положительно идентифицируется в срезах тканей с помощью гибридизации in situ и/или с помощью ПЦР в реальном времени (TaqMan) или обычной ПЦР с последующим анализом последовательности ампликона для подтверждения идентичности вируса (Crane и др. 2009а).
Общие наблюдения : В Австралии у различной части пораженных морских ушек может наблюдаться неравномерное периферическое вогнутое возвышение стопы, опухшие набухшие части рта, выступающие вперед по отношению к педальной мышце (Crane et al. 2009a). В тяжелых случаях радула выступала из выпавшего рта, и были видны очертания двух одонтофоров (хрящевых пластинок, обычно находящихся внутри рта). У некоторых пораженных морских ушек радула была полностью вывернута и безвольно свисала (Hooper 9).0015 и др. 2007 г.). Грубые признаки пустул и волдырей, наблюдаемые на ногах инфицированных животных, также считаются признаком вирусного ганглионеврита морского ушка (Arzul et al. 2017). В полевых условиях активные признаки вирусной инфекции включают: инфицированные животные теряют мышечный контроль, минимальные движения педальной мышцы, избыточное выделение слизи, отсутствие заметного разгибания стопы, проявляющееся в восстанавливающем рефлексе, когда здоровое морское ушко переворачивается на спину. и уменьшенное сцепление педали с основанием (кран и др. 2009а). В районах с высокой смертностью типичными признаками болезни были большое количество неповрежденных умирающих морских ушек, блестящие пустые раковины и разбросанное в воде мясо (Prince 2007). Эллард и др. (2009) отмечается, что у H. laevigata и H. rubra с побережья Тасмании, содержащихся в резервуарах для содержания животных, наблюдался паралич, скованность мышц и мантии и чрезмерное выделение слизи, но не повышенная смертность. На Тайване клинические признаки заболевания у H. diversicolor supertexta , рецессия мантии и жесткость мышц были связаны с высокой смертностью (Chang et al.
2017). В полевых условиях активные признаки вирусной инфекции включают: инфицированные животные теряют мышечный контроль, минимальные движения педальной мышцы, избыточное выделение слизи, отсутствие заметного разгибания стопы, проявляющееся в восстанавливающем рефлексе, когда здоровое морское ушко переворачивается на спину. и уменьшенное сцепление педали с основанием (кран и др. 2009а). В районах с высокой смертностью типичными признаками болезни были большое количество неповрежденных умирающих морских ушек, блестящие пустые раковины и разбросанное в воде мясо (Prince 2007). Эллард и др. (2009) отмечается, что у H. laevigata и H. rubra с побережья Тасмании, содержащихся в резервуарах для содержания животных, наблюдался паралич, скованность мышц и мантии и чрезмерное выделение слизи, но не повышенная смертность. На Тайване клинические признаки заболевания у H. diversicolor supertexta , рецессия мантии и жесткость мышц были связаны с высокой смертностью (Chang et al. 2005).
2005).
Гистология : Основным гистопатологическим поражением является ганглионеврит (пролиферация гемоцитов или инфильтрация, ограниченная нервной тканью, начинающаяся в сером веществе и распространяющаяся на белое вещество и периневральную оболочку) и, возможно, ассоциированный клеточный некроз (Crane et al. 2009a, Corbeil и др. 2012a, Арзул и др. 2016). Нервная ткань, включающая церебральные, плеевропедальные и буккальные ганглии, является наилучшей тканью для исследования на наличие поражений, при этом поражения не всегда выявляются в не-нервных тканях (МЭБ, 2012 г.). Могут быть поражены ганглии и окружающая нейрилемма, а также спайка головного мозга. и в некоторых случаях периферические нервы (Hooper et al. 2007, OIE 2012). Иногда нейроны имели ядра с выемчатым хроматином с морфологическими признаками, свидетельствующими о внутриядерных вирусных включениях, но не наблюдалось включений типа А Каудри (Hooper 9). 0015 и др. 2007 г.). На Тайване также сообщалось, что нервная система инфицированного морского ушка является основной тканью-мишенью (Chang et al. 2005).
0015 и др. 2007 г.). На Тайване также сообщалось, что нервная система инфицированного морского ушка является основной тканью-мишенью (Chang et al. 2005).
Электронная микроскопия : Инфицированные клетки (гемоциты и, возможно, глиальные клетки) могут показать повреждение ядерной мембраны, отек митохондрий и пролиферацию эндоплазматического ретикулума. Вирус реплицируется в ядре, а созревание происходит в цитоплазме инфицированных клеток. Внутриядерные вирусные капсиды (диаметром 70-100 нм) встречаются в ядре и оболочечных вирионах (90-165 нм в диаметре с двухслойной оболочкой (8-10 нм)) собраны в цитоплазме (Corbeil et al. 2012a, Arzul et al. 2017). Тан и др. (2008) очистили вирус от H. laevigata , H. rubra и гибридов путем ультрацентрифугирования в градиенте сахарозы, приготовленном в морской воде. Трансмиссионная электронная микроскопия отрицательно окрашенной очистки выявила вирусные частицы с икосаэдрическим капсидом, окруженным оболочкой с многочисленными шипами на внешней поверхности. Капсид колеблется от 92-109 нм в диаметре, а вирус в оболочке имел диаметр около 150 нм (Tan et al. 2008). Сходные вирусы типа герпеса были зарегистрированы в H. diversicolor supertexta на Тайване (Chang et al. 2005, Chen et al. 2012).
Капсид колеблется от 92-109 нм в диаметре, а вирус в оболочке имел диаметр около 150 нм (Tan et al. 2008). Сходные вирусы типа герпеса были зарегистрированы в H. diversicolor supertexta на Тайване (Chang et al. 2005, Chen et al. 2012).
ДНК-зонды : Для обнаружения инфекции AbHV при отсутствии клинического заболевания был секвенирован геном AbHV, а также были разработаны и утверждены чувствительные методы молекулярной диагностики (Crane и др. 2009а). Описана обычная полимеразная цепная реакция (ПЦР) для идентификации AbHV у клинически пораженных животных; был разработан метод ПЦР в реальном времени (TaqMan), который может обнаруживать AbHV в субклинически инфицированных морских ушках; и тест гибридизации in situ (ISH) был разработан для локализации вируса, связанного с гистопатологией, в срезах тканей (Crane et al. 2009a, b; Fegan et al. 2009; Corbeil et al. ). 2010, 2012а; Мохаммад и др. 2011; МЭБ 2012 г.). Эти тесты использовались для оценки географического ареала AbHV, который включает регионы Виктории и Тасмании, даже несмотря на то, что болезнь не наблюдалась в открытых водах или на фермах Тасмании (Crane et al. 2009a). Однако Cowley et al. (2011) указали, что изменение последовательности произошло в области генома, на которую направлена ПЦР TaqMan, потому что в тесте не удалось амплифицировать штамм AbHV, в котором: патология соответствовала AVG, изолят был индуцирован в экспериментальных биологических анализах, вирус был связан с тканью поражения на гибридизация in situ , и с помощью электронной микроскопии был обнаружен герпесоподобный вирус. Дальнейший анализ показал, что по крайней мере 2 дискретных генотипических варианта встречались у тасманского морского ушка, и эти варианты отличались от очевидно однородных изолятов из разных мест Виктории, собранных в разное время (Cowley et al.
2010, 2012а; Мохаммад и др. 2011; МЭБ 2012 г.). Эти тесты использовались для оценки географического ареала AbHV, который включает регионы Виктории и Тасмании, даже несмотря на то, что болезнь не наблюдалась в открытых водах или на фермах Тасмании (Crane et al. 2009a). Однако Cowley et al. (2011) указали, что изменение последовательности произошло в области генома, на которую направлена ПЦР TaqMan, потому что в тесте не удалось амплифицировать штамм AbHV, в котором: патология соответствовала AVG, изолят был индуцирован в экспериментальных биологических анализах, вирус был связан с тканью поражения на гибридизация in situ , и с помощью электронной микроскопии был обнаружен герпесоподобный вирус. Дальнейший анализ показал, что по крайней мере 2 дискретных генотипических варианта встречались у тасманского морского ушка, и эти варианты отличались от очевидно однородных изолятов из разных мест Виктории, собранных в разное время (Cowley et al. 2011). Хотя ПЦР-анализ TaqMan, описанный Corbeil et al. (2010 г.) удалось обнаружить ДНК тайваньского морского герпеса вируса Chen 9.0015 и др. (2012) разработали классическую основанную на ПЦР процедуру для выявления герпесвирусной инфекции H. diversicolor supertexta на Тайване. Чен и др. (2014) разработали процедуру петлевой изотермической амплификации (LAMP), которая амплифицирует нуклеиновые кислоты вируса герпеса H. diversicolor supertexta с высокой специфичностью, чувствительностью и скоростью в изотермических условиях.
2011). Хотя ПЦР-анализ TaqMan, описанный Corbeil et al. (2010 г.) удалось обнаружить ДНК тайваньского морского герпеса вируса Chen 9.0015 и др. (2012) разработали классическую основанную на ПЦР процедуру для выявления герпесвирусной инфекции H. diversicolor supertexta на Тайване. Чен и др. (2014) разработали процедуру петлевой изотермической амплификации (LAMP), которая амплифицирует нуклеиновые кислоты вируса герпеса H. diversicolor supertexta с высокой специфичностью, чувствительностью и скоростью в изотермических условиях.
Методы контроля
Зараженное морское ушко не следует перевозить в районы, о которых известно, что болезнь свободна. Например, в Западной Австралии Джонс и Флетчер (2012) рекомендовали стратегии снижения риска интродукции AVG в запасы диких морских ушек путем выпуска молоди морского ушка из инкубаторов. МЭБ (2012 г.) рекомендует ввести высокие уровни биобезопасности на фермах и в животноводческих комплексах, а также региональные ограничения на передвижение. Эпплфорд и др. В Постановлении № (2008 г.) указано, что специальные протоколы биобезопасности были разработаны и внедрены в результате исследований, направленных на биобезопасность, восстановление поголовья и эпидемиологию. Департамент первичной промышленности и водных ресурсов Тасмании опубликовал листовку с информацией о вирусе и инструкциями по перемещению морского морского ушка и дезинфекции, стирке и сушке всего оборудования и одежды для водных видов спорта и т. Д. В качестве полностью активной попытки остановить распространение вируса на Тасманию, а также см.: Вирусный ганглионеврит морского ушка (AVG).
Эпплфорд и др. В Постановлении № (2008 г.) указано, что специальные протоколы биобезопасности были разработаны и внедрены в результате исследований, направленных на биобезопасность, восстановление поголовья и эпидемиологию. Департамент первичной промышленности и водных ресурсов Тасмании опубликовал листовку с информацией о вирусе и инструкциями по перемещению морского морского ушка и дезинфекции, стирке и сушке всего оборудования и одежды для водных видов спорта и т. Д. В качестве полностью активной попытки остановить распространение вируса на Тасманию, а также см.: Вирусный ганглионеврит морского ушка (AVG).
На фермах по выращиванию морского ушка в Австралии роль факторов стресса, включая высокую плотность, период нереста и температуру воды, вызывала высокий уровень смертности (Hooper et al. 2007, Arzul et al. 2017). Корбейл и др. (2012b) указано, что стабильность AbHV в толще воды модулируется температурой, а инфекционность/патогенность снижается на 100% в течение нескольких дней в экспериментальных условиях. В частности, вирус выдерживали при 4, 15 или 25 °C в течение 1, 5 и 12 дней перед заражением иммерсионным морским ушком (выращенные гибриды H. rubra x H. laevigata ). Кривые смертности свидетельствовали о том, что при выдерживании в течение суток в морской воде при температуре 4 °С и 15 °С вирус оставался инфекционным и высокопатогенным. Кроме того, вирус сохранял частичную инфекционность после 5 дней выдерживания при 4 °C, но в других экспериментальных условиях было обнаружено лишь несколько не связанных с болезнью случаев гибели морского ушка (Corbeil et al. 2012b). Корбейл и др. (2016) предположил, что варианты тасманийского вируса остаются субклиническими у тасманийских диких морских ушек, потому что условия окружающей среды (например, температура воды) благоприятствуют латентной или персистирующей инфекции.
В частности, вирус выдерживали при 4, 15 или 25 °C в течение 1, 5 и 12 дней перед заражением иммерсионным морским ушком (выращенные гибриды H. rubra x H. laevigata ). Кривые смертности свидетельствовали о том, что при выдерживании в течение суток в морской воде при температуре 4 °С и 15 °С вирус оставался инфекционным и высокопатогенным. Кроме того, вирус сохранял частичную инфекционность после 5 дней выдерживания при 4 °C, но в других экспериментальных условиях было обнаружено лишь несколько не связанных с болезнью случаев гибели морского ушка (Corbeil et al. 2012b). Корбейл и др. (2016) предположил, что варианты тасманийского вируса остаются субклиническими у тасманийских диких морских ушек, потому что условия окружающей среды (например, температура воды) благоприятствуют латентной или персистирующей инфекции.
Анализы, предназначенные для оценки эффективности химической обработки, показали, что йодофоры (например, бафодин в концентрации 50 частей на миллион) и неионогенное поверхностно-активное вещество (например, моющее средство «Импресс» в концентрации 1 %) полностью инактивируют вирус через 10 мин. воздействие, в то время как гипохлорит кальция (20 частей на миллион свободного хлора) продемонстрировал лишь частичную инактивацию по оценке путем инъекции в наивное морское ушко (выращенные гибриды H. rubra x H. laevigata ) после воздействия AbHV одним из трех соединений (Corbeil 9).0015 и др. 2011, 2012b). Однако гипохлорит кальция (от 10 до 15 частей на миллион, чтобы получить от 1,5 до 2,0 частей на миллион остаточного хлора) инактивировал AbHV (1,67 x 10 6 копий вирусного генома (v.g.c.)/мл) при оценке иммерсионным заражением наивного морского ушка (выращенные гибриды ). H. rubra x H. laevigata ) в течение 15 минут (Corbeil et al. 2011, 2012b). Таким образом, йодофор Буффодин и неионогенное поверхностно-активное вещество «Импресс» являются очень эффективными вирулицидными агентами в экспериментальных условиях, в то время как гипохлорит кальция также эффективен, но при более низких концентрациях вируса (Corbeil 9).
воздействие, в то время как гипохлорит кальция (20 частей на миллион свободного хлора) продемонстрировал лишь частичную инактивацию по оценке путем инъекции в наивное морское ушко (выращенные гибриды H. rubra x H. laevigata ) после воздействия AbHV одним из трех соединений (Corbeil 9).0015 и др. 2011, 2012b). Однако гипохлорит кальция (от 10 до 15 частей на миллион, чтобы получить от 1,5 до 2,0 частей на миллион остаточного хлора) инактивировал AbHV (1,67 x 10 6 копий вирусного генома (v.g.c.)/мл) при оценке иммерсионным заражением наивного морского ушка (выращенные гибриды ). H. rubra x H. laevigata ) в течение 15 минут (Corbeil et al. 2011, 2012b). Таким образом, йодофор Буффодин и неионогенное поверхностно-активное вещество «Импресс» являются очень эффективными вирулицидными агентами в экспериментальных условиях, в то время как гипохлорит кальция также эффективен, но при более низких концентрациях вируса (Corbeil 9). 0015 и др. 2012b).
0015 и др. 2012b).
Хранение AbHV в жидком азоте сохраняло инфекционность и патогенность вируса в течение как минимум 21 месяца, тогда как изоляты, хранившиеся при -80°C, частично теряли жизнеспособность к 12 месяцам, а изоляты при -20°C к этому времени утратили значительную жизнеспособность (Williams et al. 2009 г.).
Ссылки
Эпплфорд, П., М. Доруди и П. Харди-Смит. 2008. Вирусный ганглионеврит морского ушка в Южной Австралии – тревожный сигнал. Журнал исследований моллюсков 27: 986. (Аннотация).
Арзул, И., С. Корбей, Б. Морга и Т. Рено. 2017. Вирусы, поражающие морских моллюсков. Журнал патологии беспозвоночных 147: 118-135.
Бердж, Калифорния 2010. Изучение роли окружающей среды, хозяина и патогена в отношениях хозяин-патоген между вирусом герпеса устриц и тихоокеанской устрицей. Докторская диссертация. Вашингтонский университет.
Чанг, П.Х., С.Т. Куо, С.Х. Лай, Х.С. Ян, Ю.Ю. Тинг, К.Л. Хсу и Х.К. Чен. 2005. Герпесоподобная вирусная инфекция, вызывающая гибель культивируемых морских ушек Haliotis diversicolor supertexta на Тайване. Болезни водных организмов 65: 23-27.
Чен, М.Х., С.Т. Куо, Т. Рено, К.С. Фридман и П.Х. Чанг. 2012. Разработка полимеразной цепной реакции для выявления герпесвирусной инфекции морского ушка на основе гена ДНК-полимеразы. Журнал вирусологических методов 185: 1-6.
Чен, М.Э., С.Т. Куо, Т. Рено и П.Х. Чанг. 2014. Разработка метода петлевой изотермической амплификации для быстрого и чувствительного обнаружения ДНК вируса герпеса морского ушка. Журнал вирусологических методов 197: 199-203.
Корбейл, С., А. Коллинг, Л. М. Уильямс, Ф.Ю.К. Вонг, К. Савин, С. Уорнер, Б. Мердок, Н.О.И. Коган, Т. И. Соубридж, М. Феган, И. Мохаммад, А. Сунарто, Дж. Хэндлингер, С. Пайкрофт, М. Дуглас, П.Х. Чанг и М.Ст.Дж. Кран. 2010. Разработка и валидация ПЦР-анализа TaqMan® для австралийского герпесоподобного вируса морского ушка. Болезни водных организмов 92: 1-10.
И. Соубридж, М. Феган, И. Мохаммад, А. Сунарто, Дж. Хэндлингер, С. Пайкрофт, М. Дуглас, П.Х. Чанг и М.Ст.Дж. Кран. 2010. Разработка и валидация ПЦР-анализа TaqMan® для австралийского герпесоподобного вируса морского ушка. Болезни водных организмов 92: 1-10.
Корбейл, С., К.А. Макколл, Л.М. Уильямс, И. Мохаммад, Дж. Бергфельд, А.Д. Хаятт, Э. Маккей, С.Г. Крамери, М. Феган и М.Ст.Дж. Кран. 2011. Раннее выявление герпесвирусной инфекции у австралийского морского ушка и чувствительность вируса к химической обработке. В: Материалы первой Австралазийской научной конференции FRDC по здоровью водных животных в Кэрнсе, Австралия, 5–8 июля 2011 г.
Корбейл, С., К.А. МакКолл, Л.М. Уильямс, И. Мохаммад, А.Д. Хаятт, С.Г. Крамери, М. Феган и М.Ст.Дж. Кран. 2012а. Вирусный ганглионеврит морского ушка: создание и использование экспериментальной системы иммерсионного заражения для изучения инфекций вируса герпеса морского ушка у австралийского морского ушка. Вирусные исследования 165: 207-213.
Вирусные исследования 165: 207-213.
Корбейл С., Л. М. Уильямс, Дж. Бергфельд и М. Ст. Дж. Кран. 2012б. Устойчивость вируса герпеса морского ушка в морской воде и чувствительность к химическим дезинфицирующим средствам. Аквакультура 326–329: 20-26.
Корбейл, С., Л. М. Уильямс, К. А. МакКолл и М.Ст.Дж. Кран. 2016. Австралийские морские ушки ( Haliotis laevigata , H. rubra и H. conicopora ) восприимчивы к инфекции несколькими генотипами герпесвируса морских ушек. Болезни водных организмов 119: 101-106.
Коули, Дж. А., С. Корбейл, Х. Чен, Д. Булах, Ф. Вонг, Н. Дж. Муди, К. Эллард, М. Феган, К. Савин, С. Уорнер и М.С.Дж. Кран. 2011. Вариации последовательности среди штаммов герпесоподобного вируса морского ушка (AbHV) дают представление о его происхождении в Виктории и Тасмании. В: Материалы первой Австралазийской научной конференции FRDC по здоровью водных животных, Кэрнс, Австралия, 5-8 июля 2011 г.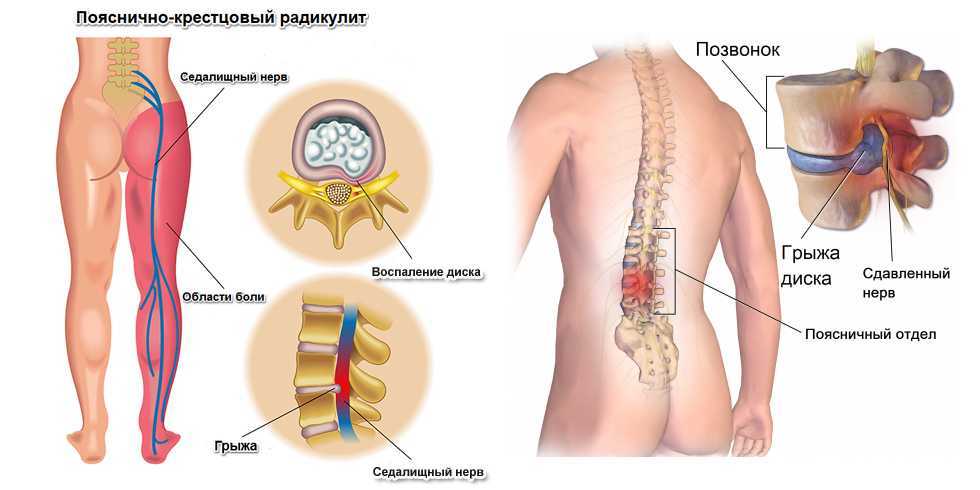
Крейн, M.St.J., С. Корбейл, М. Феган и С. Уорнер. 2009а. Заключительный отчет: Подпрограмма по охране здоровья водных животных: Разработка процедур молекулярной диагностики для обнаружения и идентификации герпесоподобного вируса морского ушка ( Haliotis spp.), Корпорация по исследованиям и развитию рыболовства, номер проекта 2007/006. 79 стр.
Crane, M.St.J., S. Corbeil, A. Colling, L.M. Williams, F. Wong, K. Savin, N. Cogan, M. Fegan, I. Mohammad, A. Sunarto, J. Handlinger, С. Пайекрофт, М. Дуглас, Б. Мердок и С. Уорнер. 2009б. Разработка и валидация метода ПЦР в реальном времени (TaqMan) для обнаружения и идентификации герпесоподобного вируса морского ушка (AbHV). В: Крейн, М., Дж. Слейтер (ред.) Труды Четвертой национальной научной конференции по здоровью водных животных FRDC (Кэрнс, Австралия). 22–24 июля 2009 г..
Crane, M.St.J., S. Corbeil, L.M. Williams, K.A. МакКолл и В. Гэннон. 2013. Оценка устойчивости к вирусному ганглионевриту морского ушка среди популяций диких морских ушек на викторианском побережье Австралии. Журнал исследований моллюсков 32: 67-72.
МакКолл и В. Гэннон. 2013. Оценка устойчивости к вирусному ганглионевриту морского ушка среди популяций диких морских ушек на викторианском побережье Австралии. Журнал исследований моллюсков 32: 67-72.
Данг, В.Т., К. Бенкендорф, С. Корбейл, Л.М. Уильямс, Дж. Хоад, М.С.Дж. Крейн и П. Спек. 2013. Иммунологические изменения в ответ на герпесвирусную инфекцию у морских ушек Haliotis laevigata и Гибриды Haliotis rubra . Иммунология рыбы и моллюсков 34: 688-691.
Дэвисон, А.Дж., Р. Эберле, Б. Элерс, Г.С. Хейворд, Д.Дж. МакГеоч, А.С. Минсон, П.Е. Пеллетт, Б. Ройзман, М. Дж. Стаддерт и Э. Тири. 2009. Отряд Herpesvirales. Архив вирусологии 154: 171-177.
Эллард, К., С. Пайкрофт, Дж. Хэндлингер и Р. Эндрюарта. 2009. Результаты исследований заболеваний после недавнего обнаружения AVG в Тасмании. В: Крейн, М., Дж. Слейтер (ред.) Труды Четвертой национальной научной конференции по здоровью водных животных FRDC (Кэрнс, Австралия). 22–24 июля 2009 г..
22–24 июля 2009 г..
Феган М., Н. Квальхейм, Ф. Вонг, К. Савин, М. Ланкастер, С. Корбейл, М. Крейн и С. Уорнер. 2009. Разработка гибридизационного анализа in situ для обнаружения и идентификации герпесоподобного вируса морского ушка. В: Крейн, М., Дж. Слейтер (ред.) Труды Четвертой национальной научной конференции по здоровью водных животных FRDC (Кэрнс, Австралия). 22-24 июля 2009 г.
Хупер, К., П. Харди-Смит и Дж. Хэндлингер. 2007. Ганглионеврит, вызывающий высокую смертность у выращиваемых на фермах австралийских морских ушек ( Haliotis laevigata и Haliotis rubra ). Австралийский ветеринарный журнал 85: 188-193.
Джонс, Дж. Б. и У. Дж. Флетчер. 2012. Оценка рисков, связанных с выпуском морского морского ушка, полученного из рыбоводных заводов морского морского ушка, для улучшения или морского выращивания в открытых океанских районах Западной Австралии. Департамент рыболовства, Западная Австралия, Отдел исследований рыболовства, Отчет об исследованиях рыболовства № 227, 24 стр.
Департамент рыболовства, Западная Австралия, Отдел исследований рыболовства, Отчет об исследованиях рыболовства № 227, 24 стр.
Мохаммад И., С. Уорнер, Н. Квальхейм, М. Крейн, С. Корбейл, Л. Уильямс и М. Феган. 2011. Разработка гибридизационного анализа in situ для обнаружения и идентификации герпесоподобного вируса морского ушка. В: Материалы первой Австралазийской научной конференции FRDC по здоровью водных животных, Кэрнс, Австралия, 5-8 июля 2011 г.
Накацугава Т., Т. Нагаи, К. Хия, Т. Нисидзава и К. Мурога. 1999. Вирус, выделенный из молоди японского черного морского ушка Nordotis discus discus с амиотрофией. Болезни водных организмов 36: 159-161.
Не, З. и С. Ван. 2004. Состояние культуры морских ушек в Китае. Журнал исследований моллюсков 23: 941-945.
МЭБ (Всемирная организация по охране здоровья животных). 2012. Глава 2. 4. 1. Заражение морским герпесвирусом. В: Руководство по диагностическим тестам для водных животных (2016).
4. 1. Заражение морским герпесвирусом. В: Руководство по диагностическим тестам для водных животных (2016).
Оцу, Р. и К. Сасаки. 1997. Вирусоподобные частицы, обнаруженные у молодых морских ушек ( Nordotis discus discus ), выращенных с эпизоотическим смертельным истощением. Журнал патологии беспозвоночных 70: 167-168.
Prince, J. 2007. Обзор вспышки герпесоподобного вируса среди морских ушек в западной зоне Виктория и уроки, которые необходимо извлечь. Biospherics P/L POB 168, South Fremantle, WA 6162.
Савин К.В., Б.Г. Кокс, Ф. Вонг, Т. Соубридж, Н. Коган, Д. Сэвидж и С. Уорнер. 2010. Нейротропный вирус герпеса, поражающий брюхоногих моллюсков, морское ушко, имеет общее происхождение с вирусом герпеса устриц и вирусом герпеса, ассоциированным с геномом амфиокса. Журнал вирусологии 7: Статья № 308, 9 стр.
Тан, Дж. , М. Ланкастер, А. Хаятт, Р. ван Дриэль, Ф. Вонг и С. Уорнер. 2008. Очистка герпесоподобного вируса от морского ушка ( Haliotis spp.) с ганглионевритом и обнаружение с помощью просвечивающей электронной микроскопии. Журнал вирусологических методов 149: 338-341.
, М. Ланкастер, А. Хаятт, Р. ван Дриэль, Ф. Вонг и С. Уорнер. 2008. Очистка герпесоподобного вируса от морского ушка ( Haliotis spp.) с ганглионевритом и обнаружение с помощью просвечивающей электронной микроскопии. Журнал вирусологических методов 149: 338-341.
Уильямс, Л.М., С. Корбейл, М.Ст.Дж. Крейн и К.А. МакКолл. 2009. Вирусный ганглионеврит морского ушка (AVG): жизнеспособность герпесоподобного вируса морского ушка (AbHV) при трех температурах хранения в течение 21 месяца. В: Крейн, М., Дж. Слейтер (ред.) Труды Четвертой национальной научной конференции по здоровью водных животных FRDC (Кэрнс, Австралия). 22-24 июля 2009 г.
Информация о цитировании
Бауэр, С.М. (2017) : Краткий обзор инфекционных болезней и паразитов промысловых моллюсков: вирусный ганглионеврит морского ушка (AVG).
Дата последней редакции : декабрь 2017 г.
Комментарии к Susan Bower
- Дата изменения:
Вирусный ганглионеврит морского ушка | FRDC
Что такое AVG?
Вирусный ганглионеврит морского ушка (AVG) вызывается инфекцией вирусом герпеса морского ушка (AbHV), также известным как галиотидный вирус герпеса 1 (HaHV-1). AVG вызвал значительную смертность диких и выращиваемых морских ушек в западной Виктории. Этот вирус поражает нервную систему морского ушка и приводит к искривлению стопы и отеку рта, что приводит к слабости и, в конечном итоге, к гибели морского ушка. AVG воздействует на Blacklip Abalone ( Haliotis rubra ), зеленогубое морское ушко ( H. laevigata ), бурогубое морское ушко ( H. conicopora ) и гибриды ( H. rybra X H. laevigata ). HaHV может быть обнаружен при отсутствии клинического заболевания, что позволяет осуществлять эпиднадзор и мониторинг во время вспышек заболевания, а также последующий мониторинг и зонирование в целях управления.
AVG зарегистрирован в Виктории и Тасмании. В штате Виктория AVG наблюдался у выращиваемых и диких морских ушек. В Тасмании болезнь не наблюдалась в популяциях диких морских ушек. Однако AbHV был обнаружен у диких морских ушек, морских ушек, содержащихся на фермах по разведению морских ушек в штате Виктория. AVG был искоренен на викторианских фермах по разведению морских ушек в 2006 г., но в 2011 г. он был распространен в популяциях диких морских ушек вдоль более чем 200 км береговой линии в Западной Виктории, от залива Дискавери до мыса Отуэй (Anon, 2014).
В штате Виктория AVG наблюдался у выращиваемых и диких морских ушек. В Тасмании болезнь не наблюдалась в популяциях диких морских ушек. Однако AbHV был обнаружен у диких морских ушек, морских ушек, содержащихся на фермах по разведению морских ушек в штате Виктория. AVG был искоренен на викторианских фермах по разведению морских ушек в 2006 г., но в 2011 г. он был распространен в популяциях диких морских ушек вдоль более чем 200 км береговой линии в Западной Виктории, от залива Дискавери до мыса Отуэй (Anon, 2014).
Значительная вспышка AVG произошла среди диких и выращиваемых морских ушек в Виктории в декабре 2005 г./январе 2006 г. С 2010 г. по май 2021 г. повторных случаев AVG среди диких морских ушек не было, когда дайвер, работавший у побережья мыса Нельсон, Портленд, Виктория наблюдала мертвое морское ушко с черной губой, инфицирование которого было подтверждено AVG. Была введена контрольная зона, охватывающая рифы, где в рамках программы наблюдения были выявлены зараженные морские ушки.
Каково влияние AVG на отрасль австралийского морского морского ушка?
Компания AVG способствовала сокращению промысла в дикой природе с 1614 тонн в 2004/05 г. до 827 тонн в 2010/11 г. в штате Виктория. Впоследствии объем производства восстановился до 1196 тонн в 2012/13 году (Corbeil etdseyt6666 al., 2016). На рифах, ранее зараженных AVG, наблюдалось естественное пополнение. HaHV был успешно ликвидирован на фермах после вспышек AVG путем полного сокращения поголовья и тщательной дезактивации помещений. Эти объекты были пополнены морским ушком без повторения AVG.
Что было сделано в прошлом для решения проблемы с AVG?
Лечение AVG не существует. Больные морские ушки и инфекционные отходы являются основным источником HaHV в окружающей среде и представляют наибольший риск распространения инфекции. Вирус может распространяться через воду от зараженного морского ушка или продукта морского ушка (потроха, раковины или слизь) и рыболовного снаряжения (например, гидрокостюмы, якоря, ловушки для каменных омаров и веревки), которые вступали в контакт с зараженными морскими ушками или со средой обитания на морском дне.
Распространение AVG из зараженных зон сводится к минимуму за счет установления карантинных зон (т. е. зараженных, ограниченных, контролируемых и свободных зон), а также введения и обеспечения соблюдения мер контроля за перемещением (т. е. запретов и ограничений). Поскольку HaHV передается через толщу воды и другими переносчиками, маловероятно, что распространение HaHV можно контролировать в природных системах. Следовательно, с распространением болезни можно справиться только путем сдерживания, контроля и зонирования, а также обеспечения соблюдения. Ликвидация HaHV была достигнута за счет сокращения поголовья, обеззараживания и выдерживания паров на полузакрытых (т.
Роль FRDC
FRDC помогает рыбакам и фермерам, занимающимся морским промыслом, лучше понимать эпидемиологию HaHV, разрабатывать диагностические тесты, определять восстановление запасов морских ушек, разрабатывать планы биобезопасности, понимать иммунный ответ на HaHV и исследовать генетический ответ популяции диких морских ушек.
Anon. Департамент сельского хозяйства. 2014. Стратегия заболевания: вирусный ганглионеврит морского ушка (версия 1.0). В: Австралийский план действий в чрезвычайных ситуациях в водной ветеринарии (AQUAVETPLAN), Министерство сельского хозяйства Австралии, Канберра, ACT. 52 стр.
Corbeil, S., Williams, L.M., Cowley, J.A., Moody, NJG, Crane, M. 2016. Подпрограмма здоровья водных животных: определение восприимчивости различных видов и популяций морских ушек к различным известным генотипам AbHV. Проект FRDC 2013-001. 36 стр.
Дополнительная информация
Австралийский план действий в чрезвычайных ситуациях для водной ветеринарии
Связанные проекты
2008-077 Фонд тактических исследований: разработка экономически эффективных и надежных Рифы, затронутые AVG
2009-075 Марк Сент-Джей Крейн, Серж Корбей, Линетт Уильямс и Вин Гэннон. 2012. Определение восприимчивости остаточных популяций морских ушек, ранее подвергшихся воздействию AVG
2009-032 Корбейл, С./152-1.jpg) , Уильямс, Л.М., Уорнер, С., Феган, М., Муди, Нью-Джерси, Мохаммад, И., Эллард , К., Карагуэль, К., Девени, М., Коули Дж. и Крейн М. 2014. Подпрограмма по охране здоровья водных животных: характеристика герпесоподобных вирусных инфекций морского морского ушка.
, Уильямс, Л.М., Уорнер, С., Феган, М., Муди, Нью-Джерси, Мохаммад, И., Эллард , К., Карагуэль, К., Девени, М., Коули Дж. и Крейн М. 2014. Подпрограмма по охране здоровья водных животных: характеристика герпесоподобных вирусных инфекций морского морского ушка.
2011-033 Иеродиакону Д., Миллер А.Д., Рэттрей А., Уикс А.Р., Горфин Х.К., Питерс Х., Ван Ройен А., Джалали М.А., Белл Дж.Д., Уортингтон Д. 2014. Пространственные закономерности, ландшафтная генетика и поствирусное восстановление черногубого морского ушка, Haliotis rubra (Leach) в западной зоне коммерческого рыболовства штата Виктория.
2012-236 Фонд тактических исследований: Разработка процесса принятия решений для установления ОДУ для морского морского ушка в Виктории, особенно в отношении восстановления рифов, пострадавших от AVG.
2013-001 Corbeil, S., Williams, L.M., Cowley, J.A., Moody, NJG, Crane, M. 2016. Подпрограмма по охране здоровья водных животных: определение восприимчивости различных видов и популяций морских ушек к различным известным генотипам AbHV.
