Гиподенсные очаги печени: Очаговые образования печени / Заболевания / Клиника ЭКСПЕРТ
Очаговое поражение печени может оказаться признаком рака. Как не пропустить опухоль?
Диагностику и лечение рака осложняет не только отсутствие симптомов на ранних стадиях. Даже при наличии данных лучевой диагностики, точно указывающих на очаговое поражение органа (например, очаговые образования в печени), не всегда удается сразу поставить диагноз.
О том, что такое онконастороженность при обследовании поражений печени, и насколько она важна для выявления ранних стадий рака читайте в материале официального сайта Онкологической клиники МИБС.
Что такое “онкологическая настороженность”?
При постановке диагноза по симптомам и данным неинвазивной инструментальной и лабораторной диагностики врач любой специальности обязан рассматривать все возможные причины таких изменений. В том числе, и наличие онкологического заболевания. Это и есть онкологическая настороженность (онконастороженность).
Например, выявленное очаговое поражение печени следует всегда рассматривать как вероятное проявление онкологического процесса. Ведь успех лечения в онкологии напрямую зависит от стадии, на которой диагностирована болезнь.
Ведь успех лечения в онкологии напрямую зависит от стадии, на которой диагностирована болезнь.
Онконастороженность при очаговом поражении печени
Очаговые образования в печени могут быть выявлены случайно, без наличия жалоб или симптомов нарушений работы органа — при скрининговом исследовании органов брюшной полости (УЗИ, КТ, МРТ). Заключение врача в подобных случаях содержит, к примеру, фразу «… узловое образование второго сегмента печени». Какой именно сегмент печени поражен и размеры образования на данном этапе не имеют значения. И далеко не всегда означают, что пациенту предстоит лечение рака! Но это — важный сигнал о необходимости комплексного обследования для исключения опухолевого процесса.
Задача дифференциальной диагностики состоит в том, чтобы максимально точно соотнести проявления заболевания с симптоматикой, характерной для конкретного его вида, и одновременно зафиксировать признаки, исключающие другие варианты диагноза
Задача диагностического этапа в данном случае состоит в максимально быстром и точном установлении природы выявленных изменений. А значит, подобное заключение является поводом для обязательной и незамедлительной консультации онколога с целью оценки природы новообразования, определения необходимости в дополнительном обследовании и/или биопсии узла.
А значит, подобное заключение является поводом для обязательной и незамедлительной консультации онколога с целью оценки природы новообразования, определения необходимости в дополнительном обследовании и/или биопсии узла.
К сожалению, далеко не все врачи, к которым пациенты обращаются с жалобами на нарушения работы печени, направляют на прием к онкологу после выявления очагового поражения, не говоря уже о случайном выявлении очагового поражения при бессимптомном течении. В таком случае, при отсутствии онконастороженности у врача, задача в кратчайшие сроки получить полноценное обследование ложится на плечи самого пациента. Стоит помнить, что эффективность (а также травматичность, длительность и стоимость) лечения рака печени, в случае если последующее обследование подтвердит такой диагноз, зависит от срока начала лечения. А промедление — не избавит от диагноза, и лишь усугубит ситуацию.
Очаговое поражение — не всегда рак печени
Сложность заключается в том, что узловые образования в печени могут быть следствием разнообразных новообразований доброкачественной и злокачественной природы, цирроза печени или паразитарной инвазии. Только консультация специалиста и правильно составленный план дополнительного обследования позволяет в кратчайшие сроки уточнить диагноз и разработать индивидуальную программу лечения и наблюдения.
Только консультация специалиста и правильно составленный план дополнительного обследования позволяет в кратчайшие сроки уточнить диагноз и разработать индивидуальную программу лечения и наблюдения.
Бояться визита к онкологу не следует: чаще всего выявленный в печени очаг — это гемангиома печени либо простая киста. Характерный вид таких узлов при УЗИ или компьютерной томографии позволяет при отсутствии симптомов рекомендовать динамическое наблюдение с выполнением контрольных обследований в сроки 3-6 месяцев. Динамика новообразований в данном случае является одним из диагностических критериев – стабильный размер и форма выявленного узла будет подтверждением, что выявленные изменения доброкачественной природы.
Паразитарные кисты печени чаще всего имеют характерный вид, что позволяет предположить диагноз паразитарного поражения печени и назначить обследование для подтверждения такого заключения. Исследование уровня антипаразитарных антител в крови и дополнительные методы визуализации (КТ или МРТ) вместе со сведениями анамнеза болезни и жизни позволят установить клинический диагноз и назначить пациенту правильное лечение.
Особенности диагностики рака печени
Важным фактором, который позволяет диагностировать рак печени на ранних стадиях, является внимательность пациента к тем “сигналам”, которые посылает организм. В первую очередь, это касается незамедлительного обращения к врачу при обнаружении нетипичной работы систем и органов.
Наиболее простые из обследований – лабораторные общий и биохимический анализы крови, исследование уровня онкомаркеров в крови. Эти анализы пациенты часто назначают себе сами. Но следует отметить, что правильную интерпретацию полученных данных может дать только квалифицированный врач-онколог. Связано это с тем, что большинство изменений будет носить неспецифический характер либо результаты лабораторного обследования окажутся нормальными. Но, как правило, этап лабораторных исследований пациент, у которого имеются симптомы нарушения работы печени, проходит до выявления очаговых поражений методами лучевой диагностики.
Рак печени, как и любое злокачественное новообразование, после достижения определенного размера опухоли требует притока крови для продолжения своего роста.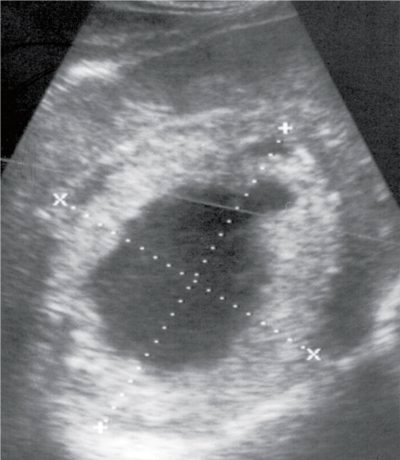 Образование новых сосудов, питающих растущую опухоль (опухолевый ангиогенез) — один из наиболее характерных признаков, которые указывают на наличие рака. Поэтому обязательно проводится оценка характера кровообращения в узловом образовании печени, наличия или отсутствия жидкостного компонента, взаимоотношения очага со структурами ворот печени, характера роста.
Образование новых сосудов, питающих растущую опухоль (опухолевый ангиогенез) — один из наиболее характерных признаков, которые указывают на наличие рака. Поэтому обязательно проводится оценка характера кровообращения в узловом образовании печени, наличия или отсутствия жидкостного компонента, взаимоотношения очага со структурами ворот печени, характера роста.
Чаще всего одно проведенное исследование не дает ответов на все вопросы и обследование пациентов с очаговым поражением печени должно быть комплексным.
При недостаточности данных для подтверждения рака врач-онколог может избрать тактику непродолжительного динамического наблюдения: при наличии злокачественной опухоли печени (первичный рак печени или метастаз в печень) форма и/или размер очага будет меняться, что проявится в данных КТ, МРТ или УЗИ и лишь тогда будет сигналом к началу более инвазивной диагностики.
При подтверждении злокачественного процесса следует выяснить, имеет ли место первичный рак печени, или у пациента выявлена первичная опухоль другой локализации, метастазировавшая в печень
Первичные опухоли печени встречаются редко. Предположить первичный рак печени врач сможет в том случае, если комплексное обследование не выявило опухолевой патологии в легких, желудке, кишечнике, молочной железе. Нормальное состояние других органов и повышение уровня онкомаркеров, характерных для рака печени позволяют предположить гепатоцеллюлярный рак или холангиокарциному. В такой ситуации трепан-биопсия очага в печени с гистологическим исследованием полученного материала является необходимыми для заключительного диагноза. Выполненная в условиях местного или общего обезболивания трепан-биопсия, позволяет получить образец тканей опухоли. Дальнейшее морфологическое и иммуногистохимическое исследование образца позволит подтвердить первичную гепатоцеллюлярную карциному.
Предположить первичный рак печени врач сможет в том случае, если комплексное обследование не выявило опухолевой патологии в легких, желудке, кишечнике, молочной железе. Нормальное состояние других органов и повышение уровня онкомаркеров, характерных для рака печени позволяют предположить гепатоцеллюлярный рак или холангиокарциному. В такой ситуации трепан-биопсия очага в печени с гистологическим исследованием полученного материала является необходимыми для заключительного диагноза. Выполненная в условиях местного или общего обезболивания трепан-биопсия, позволяет получить образец тканей опухоли. Дальнейшее морфологическое и иммуногистохимическое исследование образца позволит подтвердить первичную гепатоцеллюлярную карциному.
Обычно трепан-биопсия печени легко выполнима. Если же имеются противопоказания для выполнения такого метода, на помощь приходит лапароскопия. Выполненная в условиях общего обезболивания лапароскопическая биопсия печени позволяет не только получить материал для морфологического исследования, но и оценить состояние других органов брюшной полости.
Большинство злокачественных опухолей печени — вторичные. Они представляют собой узлы размножения и роста опухолевых клеток, распространившихся из первичного очага, то есть метастазы рака другой локализации. Вторичные очаги в печени редко нуждаются в верификации: наличие первичной опухоли и характерные для нее путь и скорость метастазирования позволяют констатировать распространение опухоли в печень и использовать полученные данные для коррекции плана лечения первичного рака, включив в него лечение метастазов в печень.
Само по себе метастатическое поражение печени не является признаком неизлечимости заболевания. Размер, расположение, количество вторичных очагов, а также локализация и морфологический вариант первичного очага – вот исходные условия, которые определяют эффективность лечения в целом и позволяют составить прогноз.
Доброкачественные образования печени
Болезни печени являются одними из самых распространенных заболеваний пищеварительной системы, неуклонный рост которых называют «второй эпидемией нашего века».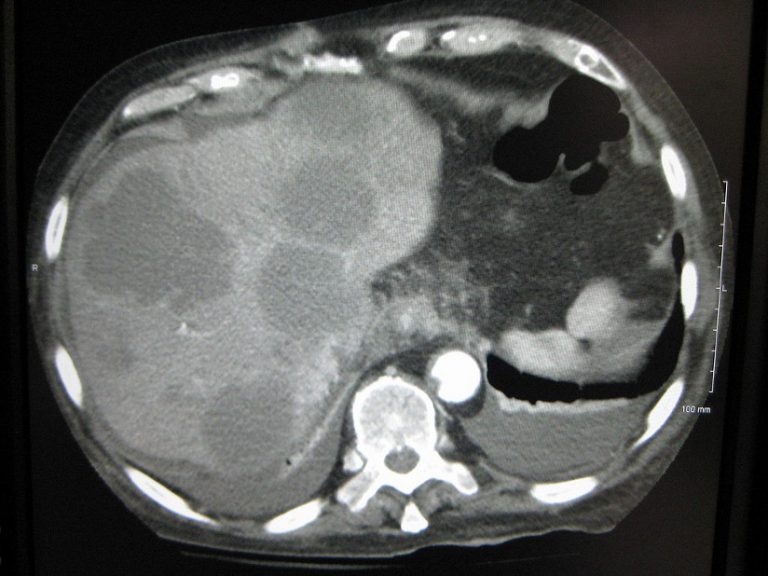 Особое место среди них занимают различные опухоли и опухолеподобные поражения. За последние годы, благодаря внедрению в клиническую практику более совершенной диагностической аппаратуры и достаточно широкому применению различных контрастных препаратов при исследованиях брюшной полости с помощью ультразвукового исследования, рентгеновской компьютерной и магнитно-резонансной томографии значительно повысились возможности корректной диагностики различных очаговых поражений печени. Кроме того, чувствительность и специфичность различных методов диагностики новообразований печени достигает 88-97%.
Особое место среди них занимают различные опухоли и опухолеподобные поражения. За последние годы, благодаря внедрению в клиническую практику более совершенной диагностической аппаратуры и достаточно широкому применению различных контрастных препаратов при исследованиях брюшной полости с помощью ультразвукового исследования, рентгеновской компьютерной и магнитно-резонансной томографии значительно повысились возможности корректной диагностики различных очаговых поражений печени. Кроме того, чувствительность и специфичность различных методов диагностики новообразований печени достигает 88-97%.
По мнению многих авторов, доброкачественные опухоли не имеют клинических симптомов и проявляются в основном в виде очаговых образований печени. В клинической практике по мере выявления очаговых образований печени остро встает вопрос о топическом диагнозе и исключении злокачественности процесса
К доброкачественным образованиям печени относят:
- Гемангиома;
- Фокальная узловая гиперплазия печени;
- Гепатоцелюллярная аденома.

Гемангиома
Гемангиомы многими авторами считаются самыми частыми доброкачественными сосудистыми опухолями печени мезенхимального происхождения, встречающимися в различных возрастных группах. Капиллярная гемангиома состоит из сплетения большого количества ветвящихся сосудов капиллярного типа с узким просветом и не обладающих направленным или с очень медленным кровотоком, 90% площади сосудистого русла составляют венозные каверны. Кавернозные гемангиомы встречаются чаще, чем капиллярные, в ряде случаев имеет место смешанный тип. По мнению большинства авторов, гемангиомы обычно не проявляются клинически и относительно чаще выявляются у женщин.
При УЗИ небольшие (до 3,0 см) гемангиомы выглядят как однородные гиперэхогенные образования с четкими контурами. В ряде случаев эхогенность гемангиом может быть снижена, а контуры выглядеть размыто. В некоторых гемангиомах может отчетливо визуализироваться псевдокапсула в виде гипоэхогенного ободка, что затрудняет их дифференциальную диагностику с метастазами. Перспективу улучшения диагностики многие исследователи проблемы связывают с применением внутривенного контрастирования специальными эхоконтрастными препаратами.
Перспективу улучшения диагностики многие исследователи проблемы связывают с применением внутривенного контрастирования специальными эхоконтрастными препаратами.
Капиллярная гемангиома печени — однородный гиперэхогенный очаг менее 3 см с четкими границами.
Две кавернозных гемангиомы печени.
Фокальная узловая гиперплазия (ФУГ)
Фокальная узловая гиперплазия (ФУГ) считается вторым (после гемангиом) наиболее распространенным доброкачественным новообразованием печени. По данным ряда авторов, ФУГ встречается у 0,9-5% населения, в 5-20% случаев может сочетаться с кистами и гемангиомами. Согласно литературным данным, ФУГ, не имея признаки опухоли, входит в группу доброкачественных гепатоцеллюлярных опухолей эпителиальной природы. Это одиночное, округлое, неинкапсулированное образование с нарушенной печеночной архитектоникой, разделенное септами, достигающими центрального рубца. Средние размеры очага – 5,7 см (от 1,5 до 12,0 см). Установлено, что ФУГ не склонна к кровоизлияниям и не имеет злокачественного потенциала.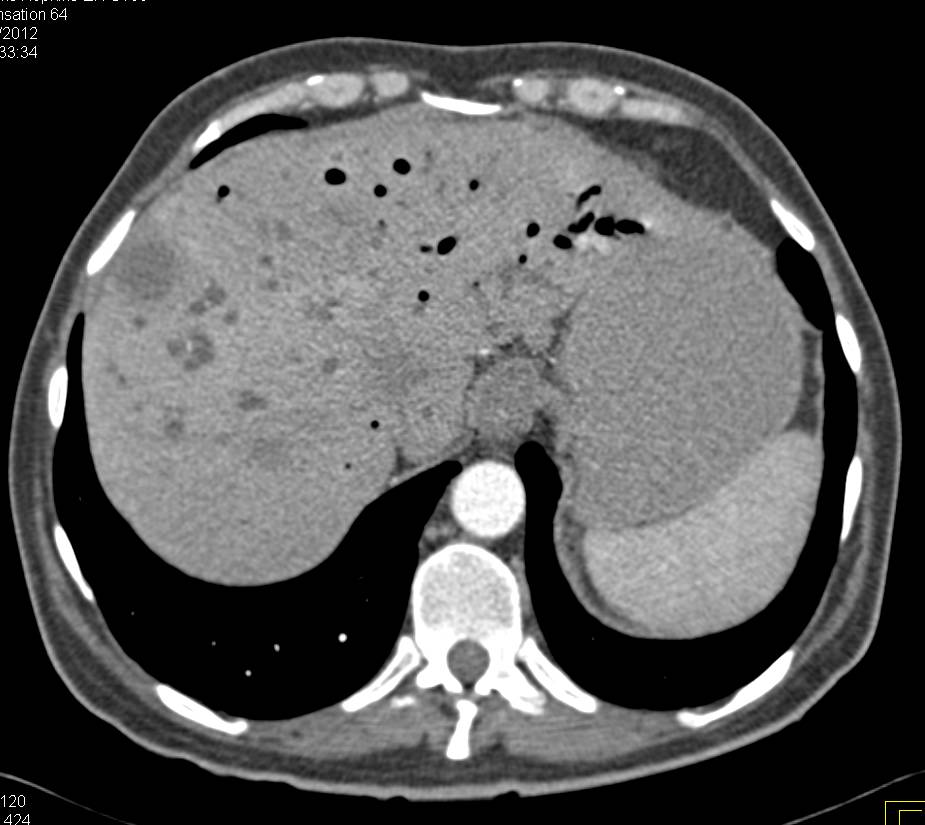 Обычно опухоль является случайной находкой при диагностических исследованиях. Узлы малых размеров, как правило, бессимптомны. Крупные опухоли могут вызывать боли в животе.
Обычно опухоль является случайной находкой при диагностических исследованиях. Узлы малых размеров, как правило, бессимптомны. Крупные опухоли могут вызывать боли в животе.
При нативном УЗИ в большинстве случаев ФУГ визуализируются с трудом, отображаясь в виде участка округлой формы с четкими контурами, изоэхогенной или незначительно гипо- или гиперэхогенной структуры. По мнению некоторых авторов, в диагностике ФУГ контрастное УЗИ является более информативной в отличие от других методов диагностики. Появление эхоконтрастных препаратов второго поколения значительно расширило возможности метода. Это позволяет дифференцировать различные типы опухолей, учитывая их характер васкуляризации, имеющего важное значение в дифференциальной диагностике очаговых образований печени. Повышенная васкуляризация опухоли в сочетании с характерным рисунком «колеса со спицами» является патогномоничным признаком ФУГ (71,4%). При этом частота обнаружения «питающей» артерии опухоли увеличивается до 98%. Чувствительность и специфичность УЗИ с применением внутривенного контрастирования в диагностике ФУГ достигают 83 и 98% соответственно..jpg)
Гипоэхогенное образование в печени — доброкачественная фокальная нодулярная гиперплазия. В литературе описывают, что для нее характерен центральный рубец (белая стрелка).
В-режим. В IV сегменте печени, выходя на контур печени, деформируя его, визуализируется тканевой плотности гипоэхогенное, несколько неоднородное по эхоструктуре образование размерами 50 х 40 мм, неправильной формы, с четкими ровными контурами.
Гепатоцеллюлярная аденома (ГЦА)
Гепатоцеллюлярная аденома (ГЦА). ГЦА считается редко встречающейся доброкачественной опухолью, происходящей из гепатоцитов. Имеются предположения о влиянии на развитие и рост опухоли пероральных контрацептивов, экзогенных андрогенов, беременности и дисбаланса эндогенных половых гормонов. Приводятся противоречивые данные по размерам аденом – указываются цифры от 1 до 19 см, составляя в среднем 5,4 см. В некоторых случаях у пациентов отмечаются множественные аденомы. Образования хорошо очерчены. Ряд авторов отмечает характерные отличительные признаки аденом – в отличие от гемангиом они не располагаются рядом с печеночными сосудами, не занимают целую долю. Течение ГЦА в большинстве случаев бессимптомное. При размерах опухоли от 5 см и более или субкапсулярным ее расположении риск кровотечения увеличивается. Авторы подчеркивают практическую важность диагностики аденомы из-за высокого риска развития кровотечения, разрыва, малигнизации и необходимости выполнения хирургического вмешательства.
Ряд авторов отмечает характерные отличительные признаки аденом – в отличие от гемангиом они не располагаются рядом с печеночными сосудами, не занимают целую долю. Течение ГЦА в большинстве случаев бессимптомное. При размерах опухоли от 5 см и более или субкапсулярным ее расположении риск кровотечения увеличивается. Авторы подчеркивают практическую важность диагностики аденомы из-за высокого риска развития кровотечения, разрыва, малигнизации и необходимости выполнения хирургического вмешательства.
При УЗИ ГЦА обычно выглядит как солитарное гетерогенное образование с четкими контурами различной степени эхогенности: 20-40% аденом представляются гипоэхогенными, 30% – гиперэхогенными, что обусловлено наличием жировых включений в тканях опухоли. По мнению ряда авторов, при использовании ЦДК в ряде случаев выявляются периферические пери- и интратуморальные сосуды.
Аденома печени
Таким образом, УЗИ органов брюшной полости в настоящее время является скрининговым методом выявления опухолей и опухолеподобных процессов печени.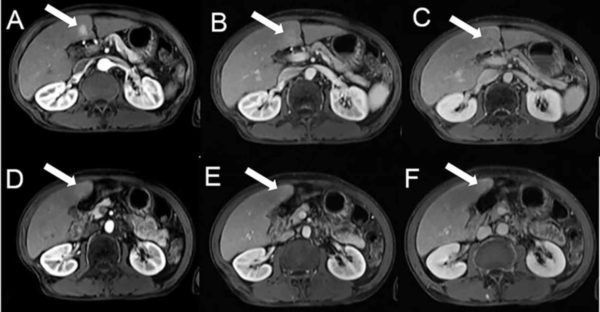 Благодаря достаточно высокой информативности и доступности УЗИ выполняется на первом этапе диагностики при подозрении на новообразование печени. УЗИ позволяет не только выявить опухоль в печени, но и судить о ее размерах, топографии, операбельности процесса. Интраоперационное УЗИ информативно для диагностики внутрипеченочных опухолей, поскольку во время операции другие методы исследования мало применимы.
Благодаря достаточно высокой информативности и доступности УЗИ выполняется на первом этапе диагностики при подозрении на новообразование печени. УЗИ позволяет не только выявить опухоль в печени, но и судить о ее размерах, топографии, операбельности процесса. Интраоперационное УЗИ информативно для диагностики внутрипеченочных опухолей, поскольку во время операции другие методы исследования мало применимы.
УЗИ в режиме «серой шкалы» позволяет выявить различные изменения в паренхиме. Однако в ряде случаев провести дифференциальную диагностику между диффузными заболеваниями не представляется возможным из-за схожести эхографических признаков.
Эхография в В-режиме с допплерографией сосудистой системы печени с оценкой состояния гемодинамики позволяет уточнить характер патологического процесса. Однако, несмотря на высокую специфичность (97%), чувствительность метода в выявлении опухолей печени остается достаточно низкой (60%), что позволяет отдавать предпочтение динамическим методикам РКТ или МРТ. Кроме того, по мнению отдельных исследователей, информативность диагностического заключения УЗИ, как субъективного метода исследования, зависит от опыта и квалификации врача УЗ диагностики.
Кроме того, по мнению отдельных исследователей, информативность диагностического заключения УЗИ, как субъективного метода исследования, зависит от опыта и квалификации врача УЗ диагностики.
Список используемой литературы
- С. В. Шахиджанова, Т. С. Пустовитова, «Некоторые аспекты диагностики очаговой патологии печени», журнал «Визуализация в клинике» N19, декабрь 2001.
- А.З. Гусейнов, Т.А. Гусейнов, «Современная диагностика опухолей печени», Вестник новых медицинских технологий, электронный журнал – 2016 – N 4, Тула.
- Ж.Н. Кыжыров, Б.Б. Баймаханов, М.М. Сахипов, А.Т. Чорманов, Н.Н. Биржанбеков, Е. Серикулы, «Диагностика очаговых заболеваний печени», Вестник №1, 2016, Казань.
- С.Н. Бердников, В.Н. Шолохов, Ю.И. Патютко, М.С. Махотина, Е.С. Чучуев, К.Э. Абиров, «Комплексная эластография и эластометрия в дифференциальной диагностике гиперэхогенных образований печени», Журнал: SonoAce Ultrasound №25, Москва.
- О.М. Курзанцева, «Некоторые аспекты диагностики фокальной нодулярной гиперплазии печени (фибронодулярной гиперплазии)», Журнал: SonoAce Ultrasound №30, Кемерово.

НЕКОТОРЫЕ АСПЕКТЫ ДИАГНОСТИКИ ОЧАГОВОЙ ПАТОЛОГИИ ПЕЧЕНИ
Опубликовано в журнале:
<so></so>Визуализация в клинике »» <so></so>N19, декабрь 2001
НЕКОТОРЫЕ АСПЕКТЫ ДИАГНОСТИКИ ОЧАГОВОЙ ПАТОЛОГИИ ПЕЧЕНИ
SOME DIAGNOSTIC ASPECTS OF FOCAL LIVER PATHOLOGY
С. В. Шахиджанова, Т. С. Пустовитова
Shakhidzhanova S. V., Pustovitova Т. S. Институт клинической кардиологии им. А. Л.Мясникова Российского кардиологического научно-производственного комплекса, Москва
A. L. Myasnikov Institute of Clinical Cardiology, Cardiology Research Complex, RF Ministry of Public Health, Moscow
В статье представлены данные о применении различных визуализирующих методик в диагностике очаговых поражений печени: гемангиом, кист, абсцессов, аденом, очаговой узловой гиперплазии, злокачественных опухолей. Рассматривается также вопрос о сложности выявления злокачественных поражений на фоне цирротически измененной печени. Проведен анализ данных литературы для определения предпочтительных методик в диагностике различных очаговых образований печени, что позволит сократить путь к установлению диагноза.
Рассматривается также вопрос о сложности выявления злокачественных поражений на фоне цирротически измененной печени. Проведен анализ данных литературы для определения предпочтительных методик в диагностике различных очаговых образований печени, что позволит сократить путь к установлению диагноза.
This paper reviews the data on the use of different visualization techniques in the diagnosis of focal liver pathology such as hemangiomas, cysts, abscesses, adenomas, focal nodular hyperplasia and malignant tumors. The problem of the difficulties which may be encountered in the diagnosis of malignancies in the presence of cirrhotic lesions of the liver is also under consideration. Analysis is made of the reported data in order to delineate the preferable modalities to be employed in the diagnosis of different focal liver pathology, which will allow for shortening the way to the diagnosis establishment.
(«Визуализация в клинике», 2001, 19: 31-41)
Ключевые слова: печень, очаговая патология, ультразвуковое исследование, магнитно-резонансная томография, компьютерная томография.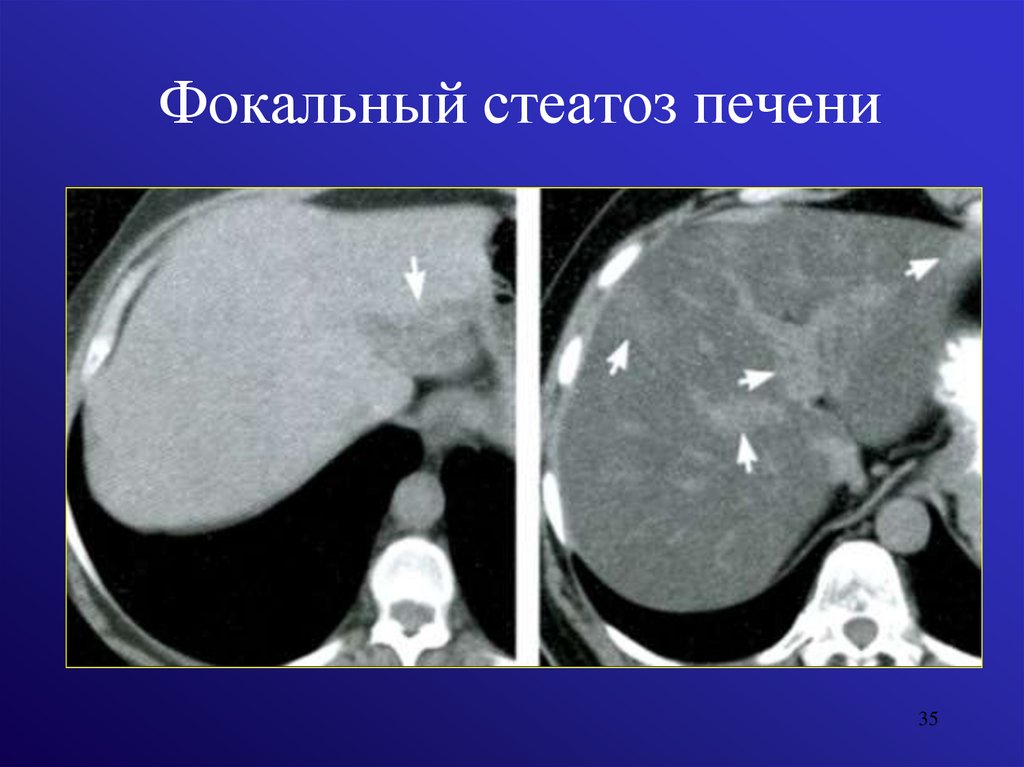 |
| Key words: liver, focal pathology, ultrasound examination, magnetic resonance tomography, computed tomography. |
Роль неинвазивных методов диагностики в настоящее время постоянно возрастает. Появляются новые приборы, обладающие прекрасными возможностями дифференциации патологических процессов, в том числе и при заболеваниях печени [9, 15]. Современную диагностическую аппаратуру имеют крупные клинические и научные центры и относительно небольшие медицинские подразделения. Огромное значение имеют не только правильная и своевременная диагностика заболевания, но и необходимость соблюдать определенные финансовые рамки. В ряде случаев, особенно при планировании хирургического вмешательства, более рациональным представляется проведение магнитно-резонансной томографии (МРТ), а не рентгеновской компьютерной томографии 
В то же время многие виды патологии диагностируются уже при адекватно проведенном ультразвуковом исследовании (УЗИ). Часто пациенты приходят на КТ или МРТ, не имея результатов УЗИ, в то время как первоначальное его выполнение во многом облегчило бы тактику дальнейшего обследования и оптимизацию предлагаемых методик.
В данной статье нам хотелось обратиться к рациональному использованию диагностической аппаратуры в зависимости от выявляемых признаков того или иного заболевания печени. Это относится в первую очередь к очаговым заболеваниям, которые клинически достаточно долго остаются «немыми». Практически любое визуализирующее исследование позволяет выявить очаговые образования в паренхиме печени, обструкцию желчных путей, печеночных сосудов и нижней полой вены [30], но уточнение диагноза является прерогативой того или иного метода (УЗИ, КТ, МРТ, пункционная биопсия).
Выбор метода визуализации (в зависимости от возможностей) целесообразно начинать со сбора анамнестических данных и оценки внешнего статуса больного. Так, больные с массой тела более 120 кг, наличием инородных тел (пулевые или осколочные ранения, металлические клипсы после операций и т. д.), с кардиостимуляторами, клаустрофобией не могут быть направлены на МР-томографию. Для некоторых пациентов (особенно в педиатрии) актуально и снижение лучевой нагрузки. Для ультразвукового исследования нет противопоказаний, хотя выполнение его имеет ряд ограничений: тучная комплекция исследуемого, метеоризм, послеоперационные рубцы и повязки в области живота [4, 8, 9]. Малые размеры образований (меньше 1.5 см) часто не позволяют достоверно высказаться об их характере и требуют проведения КТ или МРТ.
Так, больные с массой тела более 120 кг, наличием инородных тел (пулевые или осколочные ранения, металлические клипсы после операций и т. д.), с кардиостимуляторами, клаустрофобией не могут быть направлены на МР-томографию. Для некоторых пациентов (особенно в педиатрии) актуально и снижение лучевой нагрузки. Для ультразвукового исследования нет противопоказаний, хотя выполнение его имеет ряд ограничений: тучная комплекция исследуемого, метеоризм, послеоперационные рубцы и повязки в области живота [4, 8, 9]. Малые размеры образований (меньше 1.5 см) часто не позволяют достоверно высказаться об их характере и требуют проведения КТ или МРТ.
Имея данные предыдущих исследований, необходимо сориентироваться в ценности методик предстоящего исследования, взвешивая, будет ли достаточным проведение того или иного исследования, или велика вероятность его повторения с контрастным усилением.
Наиболее часто неожиданной находкой при исследовании и объектом дальнейшей верификации диагноза являются гемангиомы печени.
Гемангиомы — доброкачественные сосудистые образования печени (частота их в популяции достигает 15%). Имея гетерогенное внутреннее строение, они по своей визуальной картине могут симулировать рак (особенно при УЗИ и КТ), что требует проведения дополнительных диагностических исследований. Клинически гемангиомы в большинстве случаев бессимптомны.
Диагностическими критериями гемангиомы (по данным МРТ, КТ и УЗИ) принято считать следующие: она никогда не бывает инкапсулирована, отечна, тяготеет к расположению рядом с печеночными венами, по форме иногда приближаясь к форме долей печени. Контуры ее могут быть неправильными, но четкими. При исследовании в динамике отмечается очень медленный рост.
При УЗИ гемангиома чаще визуализируется в виде гиперэхогенного образования, иногда с акустической тенью, расположенной за ним (рис. 1). Однако при наличии сопутствующей жировой инфильтрации печени гемангиома приобретает гипоэхогенность и тогда бывает трудно отличима от кист или метастазов. Кавернозные полости выглядят гипо- и анэхогенными участками, что затрудняет их интерпретацию. Гиалиновая щель, один из наиболее характерных признаков гемангиомы, выявляется не всегда.
Кавернозные полости выглядят гипо- и анэхогенными участками, что затрудняет их интерпретацию. Гиалиновая щель, один из наиболее характерных признаков гемангиомы, выявляется не всегда.
| Рис. 1.Гемангиома печени. УЗИ.
|
При КТ без контрастирования небольшие гемангиомы достаточно трудно отдифференцировать от метастазов (рис. 2). Контуры крупной гемангиомы (более 5-6 см) часто неровные, бугристые, структура гетерогенная. Денситометрические показатели снижены на 20-30 единиц, средняя плотность над опухолью составляет около 30 ед. Н [32, 41, 49, 54]. Плотность внутри гемангиомы такая же, как и у других структур, заполненных кровью (портальная вена, нижняя полая вена и т. д.). Трактовка выявляемых при гемангиоме срединных структур не всегда однозначна (в дифференциальный ряд включены гиалиновая щель при гемангиоме, рубец при аденоме или очаговой узловой гиперплазии печени, фиброзирование метастазов) [42].
| Рис. 2. Гемангиома печени. КГ. |
 МРТ позволяет выделить некоторые специфические признаки, позволяющие обойтись без контрастирования, что актуально в случаях аллергического анамнеза у пациента. Гистологически кавернозная гемангиома представляет собой «озера» крови; что объясняет то, что в силу медленного тока крови в них значения времени Т2 (по данным МРТ) при данной патологии практически в 2 раза выше, чем при злокачественных процессах. Интенсивность сигнала (ИС) от гемангиомы очень высокая, визуально значительно превосходящая по яркости другие очаговые образования [21]. В англоязычной литературе она описывается термином «яркая лампочка» [19, 21]. При дифференциации со злокачественной патологией необходимо учитывать другие типичные для раковых опухолей признаки: выраженную гетерогенность внутреннего строения, наличие ободка («halo») вокруг образования. Злокачественные опухоли обычно не имеют четкого контура, могут быть окружены паренхимой, измененной за счет отека или прорастания [29]. Гемангиомы редко содержат рубцовую ткань, которая отличается от рубцовой ткани в опухолях: она, как правило, меньше по размерам и имеет высокие значения времени Т2 (по данным МРТ) за счет повышенного содержания воды, что не характерно для истинной фиброзной ткани при рубцевании опухоли [30, 31].
МРТ позволяет выделить некоторые специфические признаки, позволяющие обойтись без контрастирования, что актуально в случаях аллергического анамнеза у пациента. Гистологически кавернозная гемангиома представляет собой «озера» крови; что объясняет то, что в силу медленного тока крови в них значения времени Т2 (по данным МРТ) при данной патологии практически в 2 раза выше, чем при злокачественных процессах. Интенсивность сигнала (ИС) от гемангиомы очень высокая, визуально значительно превосходящая по яркости другие очаговые образования [21]. В англоязычной литературе она описывается термином «яркая лампочка» [19, 21]. При дифференциации со злокачественной патологией необходимо учитывать другие типичные для раковых опухолей признаки: выраженную гетерогенность внутреннего строения, наличие ободка («halo») вокруг образования. Злокачественные опухоли обычно не имеют четкого контура, могут быть окружены паренхимой, измененной за счет отека или прорастания [29]. Гемангиомы редко содержат рубцовую ткань, которая отличается от рубцовой ткани в опухолях: она, как правило, меньше по размерам и имеет высокие значения времени Т2 (по данным МРТ) за счет повышенного содержания воды, что не характерно для истинной фиброзной ткани при рубцевании опухоли [30, 31].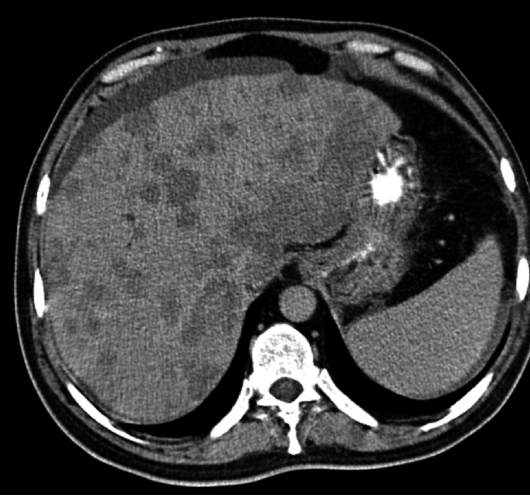
В отдельных случаях при проведении МРТ бывает затруднен дифференциальный диагноз кист и гемангиом (рис. 3 a, b, с), несмотря на различие их гистологического строения, особенно при их малых размерах (менее 1.5 см). Представляется интересной методика использования импульсных последовательностей МРТ, предложенная М. Fisher [20], при которой анализируются изображения, полученные при увеличении времени ТЕ от 60 до 180 мс и постоянном TR 2000 мс. При таком увеличении ТЕ интенсивность сигнала в ткани гемангиомы возрастает в 4-5 раз, визуально обеспечивая усиление яркости сигнала по мере получения изображений с увеличенными временными параметрами. Метастазы, кисты и гепатомы таким нарастанием ИС не сопровождаются. Кавернозные гемангиомы при визуальной неоднородности и неровности контуров обладают всеми перечисленными выше характеристиками. Использование методики магнитно-резонансной миелоурографии позволяет достоверно отдифференцировать кисты. Кисты, как содержащие жидкость образования, имеют интенсивность сигнала значительно более высокую, чем гемангиомы, что наглядно продемонстрировано на рис./28/28_1-2.jpg)
| Рис. 3. Кавернозная гемангиома печени (большая стрелка) и киста печени (маленькая стрелка). МРТ. Fig. 3. Cavernous hepatic hemangioma (big arrow) and liver cyst (small arrow). MRT.
| ||
При МРТ с контрастным усилением гемангиома максимально контрастируется в поздней паренхиматозной фазе в виде отдельных пятен и участков с наступлением контрастирования от периферии к центру, что также характерно только для гемангиом [1].
Отличительным признаком гемангиом от метастазов является неравномерное очаговое накопление контраста именно на периферии очага [38]. Однако при небольших размерах образований дифференциация бывает затруднена. Иногда гемангиомы контрастируются крайне медленно, практически в конце исследования. В подобных случаях помогают исследования, выполненные до контрастирования, при которых гемангиомы выглядят изоинтенсивными или гиперинтесивными на Т2-взвешенных изображениях.
Необходимо отметить, что в случае подозрения на гемангиому не может быть рекомендована пункция из-за высокого риска развития кровотечения. Необходимы наблюдение за больным в динамике и повторные исследования [21]. При планировании дальнейшего обследования методом выбора может служить выполнение МРТ по программе получения последовательных изображений с возрастающими временными параметрами ТЕ от 60 до 180 мс и постоянным TR 2000 мс, а при недостаточности информации — проведение исследования с контрастными препаратами.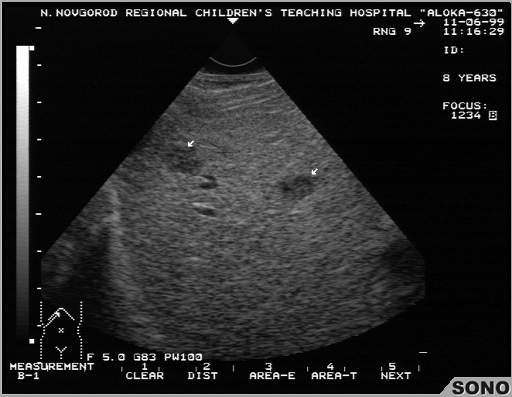 От выполнения КТ у данных больных можно воздержаться.
От выполнения КТ у данных больных можно воздержаться.
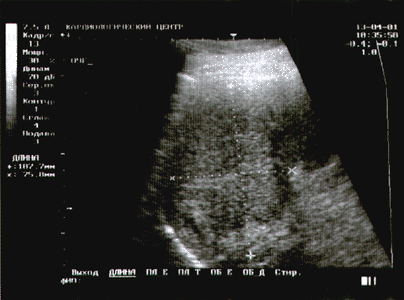
Киста часто является неожиданной находкой при обследовании по другому поводу. Простая киста имеет определенные ультразвуковые признаки, на основании которых ее можно успешно идентифицировать [4, 31]. Это округлая форма, четкие контуры, анэхогенное содержимое, эффект усиления ультразвукового луча за кистой, наличие боковых теней в виде ослабления УЗ-сигнала (рис. 4). Иногда стенка кисты может напоминать капсулу, а обнаруженные неоднородность внутреннего содержимого или многокамерность затрудняют диагностику.
| Рис. 4. Киста печени. УЗИ. |
При КТ киста выглядит тонкостенным, хорошо очерченным сферическим образованием низкой плотности (0—15 ед. Н), в несколько раз ниже плотности нормальной паренхимы печени (50-70 ед.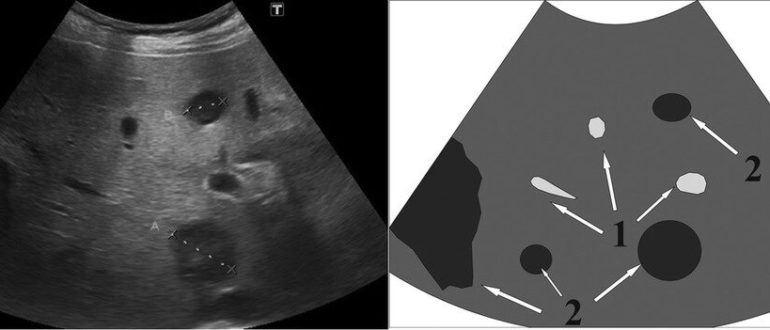 Н) При выявлении образования с толстыми стенками и неоднородным внутренним содержимым целесообразно проведение КТ с контрастными веществами [6, 7, 41]. Контрастирования кисты не происходит. Осложненные кисты сопровождаются повышением денситометрических показателей и появлением внутри кисты пузырьков воздуха, хорошо выявляемых при КТ. Применение КТ целесообразно и в случаях неясной органной принадлежности кисты, визуализируемой в области печени. Киста, видимая в области печени, на самом деле может быть кистой надпочечника, брыжейки тонкой кишки и т. д.
Н) При выявлении образования с толстыми стенками и неоднородным внутренним содержимым целесообразно проведение КТ с контрастными веществами [6, 7, 41]. Контрастирования кисты не происходит. Осложненные кисты сопровождаются повышением денситометрических показателей и появлением внутри кисты пузырьков воздуха, хорошо выявляемых при КТ. Применение КТ целесообразно и в случаях неясной органной принадлежности кисты, визуализируемой в области печени. Киста, видимая в области печени, на самом деле может быть кистой надпочечника, брыжейки тонкой кишки и т. д.
Эхинококковые кисты при КТ имеют ряд специфических особенностей, отличающих их от других кистоподобных образований. Это округлая форма, ровность контуров, кальцинированная капсула, визуализация дочерних пузырьков [З]. Денситометрическая плотность кисты становится более высокой после гибели паразита.
В случае выявления кист с внутренним содержимым может быть рекомендована МРТ. По данным МРТ, кисты, как и гемангиомы, имеют значительно удлиненное время Т2 и укороченное время Т1. Киста выглядит гипоинтенсивной на Т1- и гиперинтенсивной на Т2-взвешенных изображениях. Использование методики MYUR (магнитно-резонансной миелоурографии) помогает отличить жидкостное образование от ткань-содержащего [38]. Наиболее достоверным, как и при КТ, можно считать исследование с применением контрастирования, так как контрастные вещества в кисте не накапливаются [3, 16, 23].
Киста выглядит гипоинтенсивной на Т1- и гиперинтенсивной на Т2-взвешенных изображениях. Использование методики MYUR (магнитно-резонансной миелоурографии) помогает отличить жидкостное образование от ткань-содержащего [38]. Наиболее достоверным, как и при КТ, можно считать исследование с применением контрастирования, так как контрастные вещества в кисте не накапливаются [3, 16, 23].
Таким образом, если при ультразвуковом исследовании не удается получить все признаки кисты или исследование представляется недостаточно информативным, могут быть рекомендованы как МРТ, так и КТ — высокоинформативные методы при данной патологии.
Абсцесс печени — достаточно редкое очаговое поражение печени, характеризующееся локальным скоплением гноя в ее ткани с разрушением паренхимы и стромы. Абсцессы могут быть осложнением желчно-каменной болезни, тяготея к расположению в правой доле печени и чаще имея большие размеры. Для билиарных абсцессов типичны маленькие размеры и множественность очагов. Визуальная картина абсцесса печени не всегда специфична [13, 17], в то время как клиническая симптоматика позволяет заподозрить именно данную патологию [8].
При УЗИ обращают на себя внимание толстая гиперэхогенная капсула и неоднородное внутреннее содержимое образования. Часто обнаруживаются эффект усиления УЗ-сигнала за ним и боковые тени [4]. При визуализации причудливых форм и неоднородности внутреннего строения определенность в диагнозе достигается привлечением КТ.
Диагностические проблемы максимальны при исследовании пациента в момент возникновения абсцесса, на ранних его стадиях, когда визуализируется первичный очаг диффузного воспаления без четких контуров, зон некроза и капсулы. Необходимо помнить, что введение контрастного вещества в эту фазу не вносит ясности, поскольку оно включается в зону воспаления, симулируя злокачественное образование [3, 13, 52].
При формировании абсцедирующей полости КТ выявляет падение плотности в центре очага до 0-2 ед. Н.
При этом отмечается постепенная (кратерообразная) плотностная гетерогенность от периферии к центру. Выявляемый очаг не имеет четкого отграничения от окружающей паренхимы. Визуализируется неравномерная дольчатость, пузырьки воздуха выглядят черными точками в полости абсцесса, иногда виден уровень жидкости. При контрастировании происходит усиление капсулы без контрастирования внутреннего содержимого (при отсутствии прорыва абсцесса). По мнению некоторых авторов, диагностическая надежность КТ в случае абсцесса приближается к абсолютной [7].
Визуализируется неравномерная дольчатость, пузырьки воздуха выглядят черными точками в полости абсцесса, иногда виден уровень жидкости. При контрастировании происходит усиление капсулы без контрастирования внутреннего содержимого (при отсутствии прорыва абсцесса). По мнению некоторых авторов, диагностическая надежность КТ в случае абсцесса приближается к абсолютной [7].
По данным МРТ, абсцесс печени характеризуется высокими значениями времени Т2. К характерным его признакам можно отнести наличие капсулы, четкость контуров, гетерогенность внутреннего содержимого, иногда наличие отека по периферии, которое помогает дифференциации абсцесса от кист и гемангиом, тоже имеющих удлиненное время Т2 и укороченное время Т1 [22, 35].
При контрастировании регистрируется усиление только вокруг самого образования, без усиления его центральной части [1, 13, 22]. Привлечение МРТ целесообразно при исследовании на ранних стадиях формирования абсцесса в комплексном динамическим обследовании, а также при дифференциации со злокачественными образованиями.
Аденома печени относится к доброкачественным опухолям, происходящим из гепатоцитов. Анамнестически удается выявить связь с приемом пероральных контрацептивов; чаще эта патология выявляется у молодых женщин. Иногда она встречается и у мужчин, применяющих андрогены или стероидные препараты [8, 12]. Диагностика аденомы чрезвычайно важна из-за высокого риска развития кровотечения, разрыва, малигнизации и необходимости выполнения хирургического вмешательства.
Гистологическая неоднородность аденомы (кровоизлияние, некроз, жировая инфильтрация, центральное рубцевание, инкапсуляция, развитие больших внутриопухолевых сосудов) обуславливает визуальную картину гетерогенности при проведении как УЗИ, так и МТР и КТ, являющейся своеобразной визитной карточкой данной патологии [26]. В 30% случаев происходит инкапсулирование аденомы по типу развития псевдокапсулы [12]. Размеры аденомы колеблются от 1 до 19 см (в среднем 5.4 см). Аденома может быть как одиночной, так и множественной. Она хорошо очерчена. В отличие от гемангиомы аденома не тяготеет к расположению рядом с печеночными сосудами, не занимает целую долю. Злокачественные образования более неоднородны и хуже очерчены [14].
В отличие от гемангиомы аденома не тяготеет к расположению рядом с печеночными сосудами, не занимает целую долю. Злокачественные образования более неоднородны и хуже очерчены [14].
При УЗИ аденома печени может быть заподозрена при выявлении округлого образования с четкими контурами, умеренно неоднородной внутренней структурой, внутриопухолевыми сосудами, септами, окруженное гипоэхогенным ободком. Эхогенность аденомы может быть практически любой, с некоторым преобладанием гиперэхогенных вариантов (рис. 5).
| Рис. 5.Аденома печени. УЗИ. |
При КТ аденома может выглядеть незначительно гиподенсной или изоденсной, что затрудняет ее выявление и идентификацию [2, 7, 41]. После контрастирования аденома неоднородна, с чередованием зон повышенной (за счет участков кровоизлияния), нормальной и пониженной плотности [3, 52]. Максимальное контрастирование наступает в артериальную фазу в отличие от гемангиомы, контрастирующейся в венозную фазу.
Максимальное контрастирование наступает в артериальную фазу в отличие от гемангиомы, контрастирующейся в венозную фазу.
При МРТ аденома может иметь практически любую интенсивность сигнала (без особого превалирования тех или иных вариантов). Необходимо отметить, что в отличие от очаговой узловой гиперплазии аденома не бывает гомогенно изоинтенсивной. В 31% случаев аденомы имеют периферический полный или неполный ободок, чаще гипоинтенсивный на Т1-взвешенных и практически любой интенсивности на Т2-взвешенных изображениях (рис. 6).
| Рис. 6. Аденома печени. МРТ. Т2-взвешенное изображение. |
Кровоизлияние, типичное для аденомы, описывают как зону сниженной интенсивности сигнала в центре образования на Т2-взвешенных изображениях при МРТ; однако, кровотечение может осложнять и другие очаговые поражения печени [26, 27].
МРТ-признаки аденомы: это хорошо очерченное неоднородное образование, окруженное ободком, чаще гиперинтенсивное, иногда с очагом гипоинтенсивного кровоизлияния в центре на Т2-взвешенных изображениях, с сопутствующими явлениями центрального рубцевания, гетерогенно контрастирующееся в артериальную фазу [47].
Перечисленные выше характеристики (гетерогенность строения, псевдокапсула, гиперинтенсивность на Т1-взвешенных изображениях при МРТ) еще раз подчеркивают сложность дифференциации аденомы, в особенности от гепатоцеллюлярной карциномы [30].
Методом выбора при подозрении на аденому может быть МРТ печени.
Очаговая узловая гиперплазия печени (ОУГ) — достаточно редкая доброкачественная опухоль, чаще встречающаяся у женщин детородного возраста. ОУГ — это одиночное, округлое, неинкапсулированное образование с нарушенной печеночной архитектоникой, разделенное септами, достигающими центрального рубца. Средние размеры очага — 5.7 см (от 1.5 до 12.0 см).
При УЗИ ОУГ может выглядеть как образование неправильной формы с диффузной мелкоочаговой неоднородностью и отсутствием капсулы (рис. 7). Чаще выявляются гиперэхогенные узлы, однако эхогенность может быть любой [3, 4, 9].
7). Чаще выявляются гиперэхогенные узлы, однако эхогенность может быть любой [3, 4, 9].
| Рис. 7. Очаговая узловая гиперплазия печени. УЗИ. |
КТ выявляет гиподенсное гомогенное образование, для которого наиболее типичным является еще более гиподенсный центральный рубец. Максимальное контрастирование образования происходит в артериальную фазу.
ОУГ имеет широкий спектр МР-изображений. Наиболее типичными для нее принято считать гомогенность и изоинтенсивность. Особое диагностическое значение имеют характеристики центрального рубца [10, 19, 32, 37].
Внутриопухолевый рубец имеет сложное строение, и знание составляющих его гистологических характеристик (желчные протоки, кровеносные сосуды и клетки, присущие хроническому воспалению) помогает правильной интерпретации получаемых при МРТ данных: большие значения времен T1 и Т2, чем у самого образования, гипоинтенсивность на Т1- и гиперинтенсивность на Т2-взвешенных изображениях [19, 34, 43-45].
Зона центрального рубцевания при других опухолях печени чаще имеет сниженную интенсивность сигнала как на Т1-, так и на Т2-взвешенных изображениях, что характерно для истинного фиброзного рубца с низкой васкуляризацией [5, 28, 38, 39, 40].
При контрастировании образования отмечается гомогенное усиление в раннюю фазу (25 с). Контрастирование рубца наступает позднее, после 45 с. [1, 19, 41, 42] (рис. 8 а, b, с).
| Рис. 8. Очаговая узловая гиперплазия печени. МГТ с контрастированием. | ||
Наиболее рациональным диагностическим путем при подозрении на ОУГ или аденому печени можно считать первоначальное проведение УЗИ органов брюшной полости, а в дальнейшем для уточнения диагноза использовать МРТ с контрастированием. Проведение КТ не столь информативно.
Определенная диагностическая проблема возникает у больных с цирротическими изменениями печени, особенно при появлении узелков регенерации печеночной ткани, трудно дифференцируемых от возможных очагов малигнизации [18, 25, 43]. УЗИ достоверно выявляет цирроз печени, однако дифференциация гипоэхогенных или изоэхогенных узелков регенерации от очагов малигнизации не всегда возможна, так как не существует надежных критериев, позволяющих исключить малигнизацию процесса [25, 27].
КТ прекрасно выявляет типичные для цирроза признаки: уменьшение размеров печени, неровность контуров, диспропорция в размерах долей, расширение внутрипеченочных соединительнотканных пространств.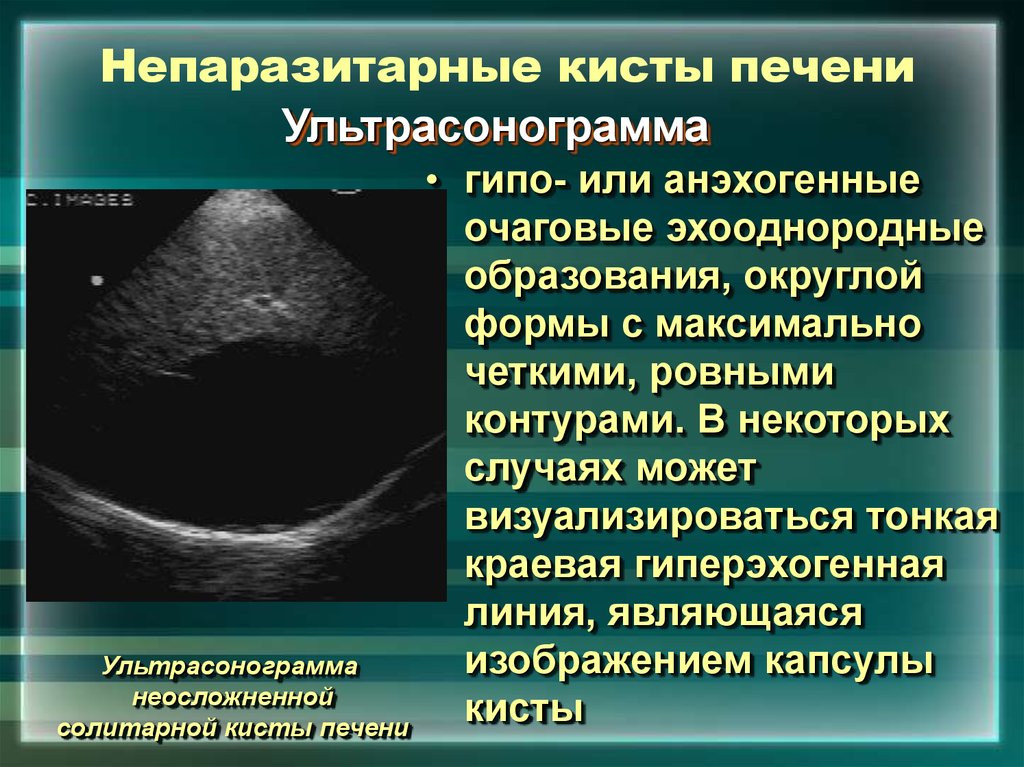 Однако она не помогает в уточнении характера мелких очагов (узелки регенерации или малигнизация?).
Однако она не помогает в уточнении характера мелких очагов (узелки регенерации или малигнизация?).
Дифференциально-диагностические критерии узелков регенерации разработаны при МРТ. Широко известны основополагающие работы Т. Н. Doyle et al. [16] и J. Itai et al. [25], описывающие узелки регенерации при циррозе как гипоинтенсивные на Т2-взвешенных изображениях и гиперинтенсивные на Т1-взвешенных изображениях, в то время как раковые поражения гиперинтенсивны на Т2-взвешенных изображениях [33, 37, 39]. Таким образом, комбинация гиперинтенсивности на Т1- и гипоинтенсивности на Т2-взвешенных изображениях практически подтверждает диагноз цирроза печени с узловой регенерацией без атипичного роста.
Гепатоцеллюлярная карцинома (ГЦК) — наиболее часто встречающееся из числа первичных злокачественных новообразований печени. В 50% случаев она бывает одиночной, в 15-20% — множественной и в 30-35% — диффузной. Образование может быть как инкапсулированным, так и нет; размеры его колеблются от 6 до 20 см [11, 36, 51, 53]..jpg)
Данные УЗИ достаточно специфичны — это гетерогенное, чаще гиперэхогенное образование с нечеткими контурами, иногда окруженное гипоэхогенным ободком. Этому сопутствуют измененная архитектоника сосудистого древа, сужение крупных сосудов, наличие тромбов в них. Проблемы диагностики возникают при визуализации небольших гипоэхогенных образований без выраженной структурной неоднородности.
КТ печени выявляет денситометрическую неоднородность образования с нечеткими контурами, зоны некроза, кальциноз, асцит, опухолевые тромбы. Образование чаще выглядит изо- или гиподенсным с гиподенсным ободком. Изоденсное образование может быть выявлено только при введении контрастных препаратов (рис. 9). Дифференциальный диагноз с метастатическими поражениями не всегда возможен.
| Рис. 9. Гепатоцеллюлярная карцинома печени. |
Контрастирование наступает в артериальную фазу, что помогает в дифференциации с гемангиомами, однако введенные контрастные вещества задерживаются в ткани образования на многие недели вплоть до одного года [1, 2, 3, 15], затрудняя проведение дальнейших исследований.
При наличии сопутствующих диффузных изменений паренхимы печени (цирроза, особенно с узелками регенерации) целесообразно провести МРТ [51, 53, 40]. Магнитно-резонансную диагностику опухоли облегчает выявление таких специфических признаков как наличие капсулы (позднее ее усиление при контрастировании), гетерогенность внутреннего строения (рис. 10), внутриопухолевые септы, центральное рубцевание, наличие дочерних узлов и опухолевых тромбов в крупных сосудах, а также сопутствующего асцита [1, 9, 5, 46].
| Рис. |
Чрезвычайно важна и диагностика метастазов в печень. Анализ найденных очагов метастазирования по результатам высокоинформативных методик (МРТ и КТ) показал, что иногда УЗИ, выполненное уже после томографии, выявляло далеко не все, даже известные по локализации очаги. Основные визуальные характеристики метастазов при УЗИ приведены в таблице. Очевидно, что метастазы могут напоминать практически любую из описанных выше патологий. Наличие различных по строению очагов является характерным именно для метастатического поражения печени. Предпочтительные зоны расположения метастазов не всегда доступны для ультразвуковой визуализации. Возможности выявления метастатического поражения печени значительно расширяются при проведении КТ и МРТ с контрастированием.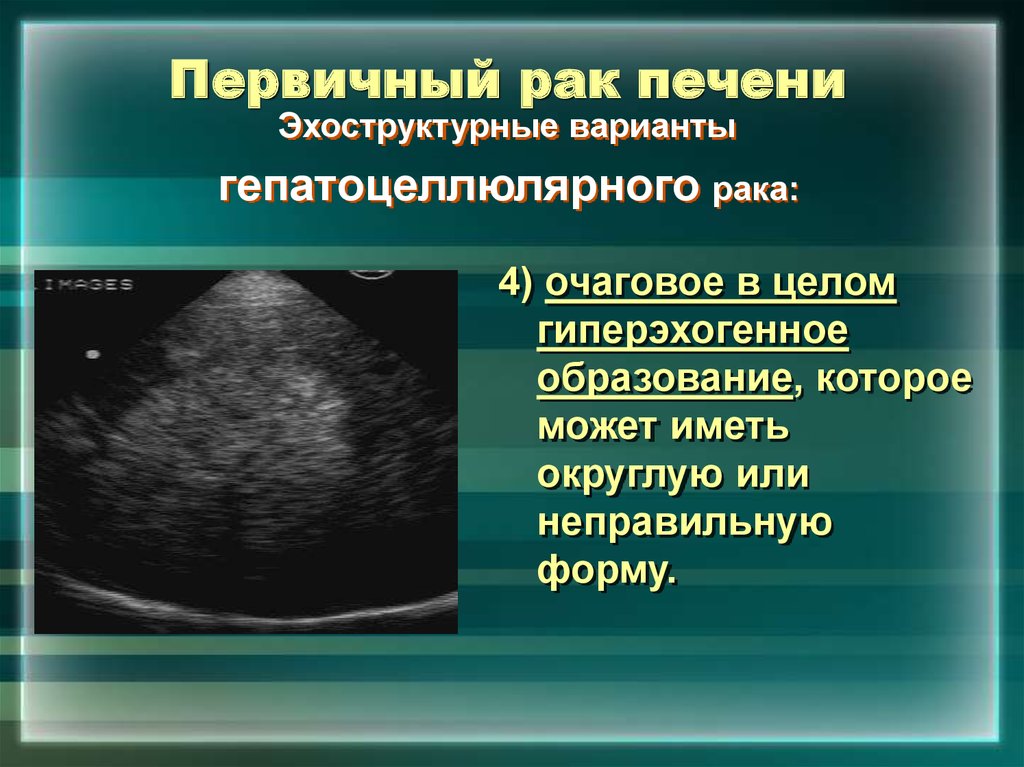 Наиболее патогномоничным считается эффект «вымывания» контраста — появление гипоинтенсивного ободка вокруг очага через несколько минут после введения препарата [1, 8, 44]. КТ выявляет чаще множественные участки измененной плотности, негомогенные, окруженные гиподенсным ободком, с участками кальциноза [3, 52]. Наиболее часто встречаются хорошо очерченные гиподенсные округлые очаги с незначительным периферическим усилением при контрастировании. Типичны и кистозно-некротические образования, симулирующие кисты, но в отличие от них накапливающие контраст. Диффузные инфильтрирующие метастазы могут напоминать диффузные заболевания печени. В некоторых случаях приходится прибегать к пункционной биопсии печени [8].
Наиболее патогномоничным считается эффект «вымывания» контраста — появление гипоинтенсивного ободка вокруг очага через несколько минут после введения препарата [1, 8, 44]. КТ выявляет чаще множественные участки измененной плотности, негомогенные, окруженные гиподенсным ободком, с участками кальциноза [3, 52]. Наиболее часто встречаются хорошо очерченные гиподенсные округлые очаги с незначительным периферическим усилением при контрастировании. Типичны и кистозно-некротические образования, симулирующие кисты, но в отличие от них накапливающие контраст. Диффузные инфильтрирующие метастазы могут напоминать диффузные заболевания печени. В некоторых случаях приходится прибегать к пункционной биопсии печени [8].
При МРТ наиболее типичным является обнаружение округлых очагов с неоднородным внутренним строением, гиперинтенсивных на Т2- и гипоинтенсивных на T1-взвешенных изображениях (рис. 11). Визуализация яркого «halo» вокруг очага на Т2-взвешенных изображениях (за счет отека) также наиболее характерна для вторичного поражения печени [44, 54, 55].
| Рис. 11. Метастазы в печень. МРТ. T1-взвешенное изображение. |
Необходимость проведения КТ или МРТ у пациентов с подозрением на метастатическое поражение печени представляется очевидной.
В заключение следует отметить, что и в рамках давно применяемых исследований (например, ультрасонографии) постоянно разрабатываются новые, все более информативные методики. Применение цветового допплеровского картирования или контрастных ультразвуковых препаратов во многом улучшает диагностику как доброкачественных, так и злокачественных новообразований, приближая правильность постановки диагноза к 81% [50, 56]. Стоимость ультрасонографии, в том числе и с контрастом, значительно ниже стоимости КТ и МРТ [48].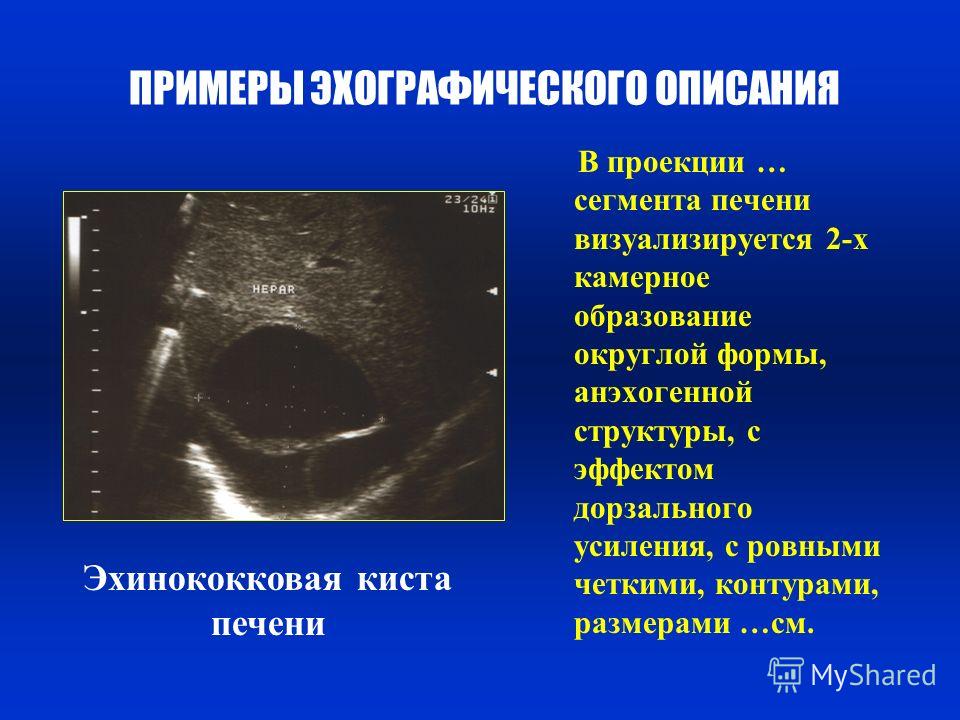 В последнее время возрастает диагностическая роль позитронно-эмиссионной томографии, особенно в случаях дифференциации метастатического поражения [24, 51, 54]. Таким образом, диагностический процесс в каждом случае индивидуален и должен опираться на многочисленные обобщенные данные всех проведенных исследований. На первом этапе диагностики УЗИ (особенно выполненное в динамике) является предпочтительным, а выбор высокоинформативных дорогостоящих методик целесообразно проводить в зависимости от полученных результатов предыдущих исследований.
В последнее время возрастает диагностическая роль позитронно-эмиссионной томографии, особенно в случаях дифференциации метастатического поражения [24, 51, 54]. Таким образом, диагностический процесс в каждом случае индивидуален и должен опираться на многочисленные обобщенные данные всех проведенных исследований. На первом этапе диагностики УЗИ (особенно выполненное в динамике) является предпочтительным, а выбор высокоинформативных дорогостоящих методик целесообразно проводить в зависимости от полученных результатов предыдущих исследований.
В качестве примера приводим сводную таблицу дифференциально-диагностических признаков очаговых заболеваний печени и предпочтительных (по показаниям) методик.
Таблица
| Диагностические критерии очаговых поражений печени | ||||||
| Критерии | Гемангиома | Киста | Аденома | Очаговая узловая гиперплазия | Гепатома | Метастазы |
| Форма | Округлая | Округлая | Округлая | Неправильная | Округлая + дочерние узлы | Округлая, неправильная |
| Контуры | Четкие, иногда неровные | Четкие, ровные | Четкие | Четкие | Нечеткие | Нечеткие |
| Наличие капсулы | Нет | Есть | Псевдокапсула | Нет | Есть | Нет |
| Внутреннее строение | Гомогенное, негомогенное (кавернозная) | Гомогенное, негомогенное (осложнения) | Негомогенное | Гомогенное или умеренно неоднородное | Негомогенное в 58% случаев | Негомогенное |
| Септы | Нет | Нет | Есть | Есть | Есть | Hет |
| Внутриопухолевые сосуды | Есть | Нет | Есть | Нет | Есть | Иногда |
| Отек | Нет | Нет | Нет | Нет | Иногда | Иногда |
| Halo | Нет | Нет | Иногда | Нет | Иногда | Иногда |
| Признаки кровотечения | Иногда | Нет | Часто | Нет | Иногда | Иногда |
| УЗИ характеристики: | Гиперэхогенное, иногда неоднородное образование, чаще располагается рядом с печеночными венами. | Анэхогенная. Эффект усиления УЗ луча за ней, эффект боковых теней | Эхогенность различная: -гипоэхогенная -изоэхогенная -гиперэхогенная. При больших размерах возможна деформация сосудистого русла | Диффузная неоднородность. Эхогенность: -гипоэхогенная -изоэхогенная -гиперэхогенная. При больших размерах вторичные изменения гемодинамики по венам печени | Эхогенность практически любая, несколько чаще гипоэхогенная. Выраженная неоднородность внутренней структуры, выявление гипоинтенсивного ободка | Полиморфность картины. Комбинация различных эхографических видов метастазов: -гиперэхогенные, -изоэхогенные, -гипоэхогенные, -анэхогенные, -смешанной эхогенности |
| КТ характеристики: | Плотность равна или ниже плотности печени, резко возрастает с началом контрастирования по периферии в виде кольца. | Плотность от 0 до 10 ед Н с повышением значений в случае инфицирован ных или осложненных кист. Контрастирования кисты не наступает | Низкая плотность. Контрастирование наступает очень быстро с ускоренным вымыванием контраста. Улучшение визуализации капсулы после контрастирования | Плотность равна или ниже плотности печени. Центральный рубец имеет плотность ниже печени. Контрастирование увеличивает плотность по краям образования | Низкая плотность. Возможно наличие кальцинатов, некроза. Тромбоз воротной вены. Бугристые контуры | Низкая плотность. Множественность очагов. Очаги некроза, обызвествления |
| МРТ ИС на T1 — в/и ИС на Т2 — в/и |
v ИС ^^ ИС | v ИС ^^ ИС | Комбинация | Изоинтенсивна Изоинтенсивна | ^ ИС-50% ^ ИС | v ИС ^ ИС |
| Рубец | Редко, ^ ИС на Т2 в/и
| Нет | Есть, ^ ИС на Т1 и Т2-в/и | Есть, ^ ИС на Т2, | Есть | Диффузное, мозаичное фиброзирование |
| Предпочтительные методы | УЗИ, МРТ | УЗИ, КТ | УЗИ, МРТ | УЗИ, МРТ | УЗИ, КТ, МРТ | УЗИ, МРТ |
| Сокращения: -Т1-Т2 в/и — T1-Т2-взвешенные изображения. | ||||||
Литература
1. Беленков Ю. Н., Терновой С. К., Беличенко О. И. Клиническое применение МРТ с контрастным усилением. М., Видар, 1996, с. 67-97.
2. Габуния Р. И., Колесникова Е. К. КТ в компьютерной диагностике. М., Медицина, 1995, с. 134-154.
3. Кармазановский Г. Г., Вилявин М. Ю., Никитаев М. С. Компьютерная томография печени и желчных путей. М., Паганель-Бук, 1997, 358 с.
4. Клиническое руководство по УЗ-диагностике. Под ред. Митькова М. В. Т. 1. М., Видар, 1996, 335 с.
5. Ринке П. А., Синицын В. Е. Перспективы развития контрастных средств для МР-томографии. Мед. визуализация, 1996,1:17-29.
6. Соколов Л. К., Минушкин О. Н., Саврасов В. М., Терновой С.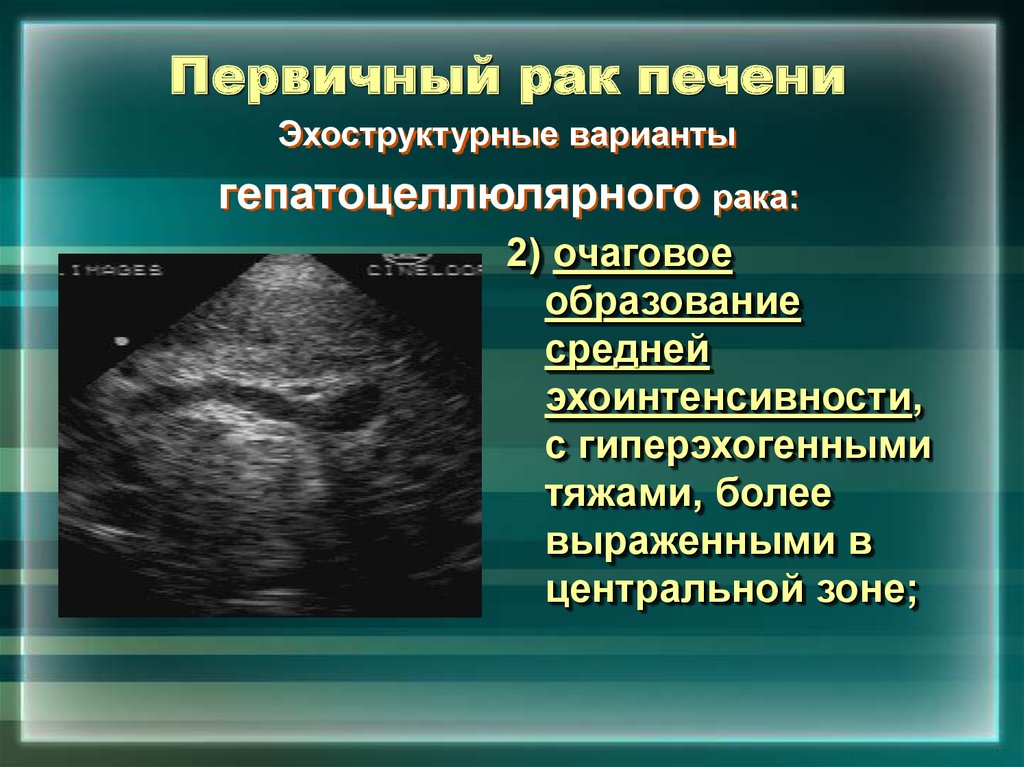 К. Клинико-инструментальная диагностика болезней органов гепатопанкреатодуоденальной зоны. М., Медицина, 1987, с. 45-73.
К. Клинико-инструментальная диагностика болезней органов гепатопанкреатодуоденальной зоны. М., Медицина, 1987, с. 45-73.
7. Терновой С. К., Синицын В. Е. Электронный учебный атлас магнитно-резонансной и компьютерной томографии брюшной полости. М., Видар, 2000.
8. Шерлок Ш., Дули Дж. Заболевания печени и желчных путей. М., Геотар Медицина, 1999, с. 74-83.
9. A Global Text Book of radiology, 2-d vol. The Nicer centennial Book, Merit Communications, 1995, p. 1034-1041.
10. Alegre — Vivas S., Jorquera-Plaza F, Munoz-Nunez F et al. Multiple hepatic focal nodular hyperplasia: its presentation in childhood and atypical evolution. Gastroenterol. HepatoL, 2000 Jan; 23(1): 9-11.
11. Arbab A. S., Ichikawa Т., Araki Т. et al. Detection of hepatocellular carcinoma and its metastases with various pulse sequences using superparamagnetic iron oxide (SHU-555-A). Abdom. Imaging, 2000 Mar-Apr; 25(2): 151-8.
12. Arrive L, Flejou J. F, Vilgrain V. et al. Hepatic adenoma: MR-findings in 51 pathologically prooved lesions. Radiology, 1994,193: 507-512.
13. Barnes P. F, de Cock K ., Reynolds Т. N. et al. A comparison of amebic and pyogenic abscesses of the liver. Medicine, 1987,66: 472-483.
14. Chung К. Y, Mayo-Smith W. W, Saini S. et al. Hepatocellular adenoma: MRI features with pathologic correlation AJR, 1995,165: 303-308.
15. Diagnostic imaging. An algorithmic approach. Ed. R. L. Eisenberg. J. B. Lippincott Company, Philadelphia, 1988, p.181-199.
16. Doyle F Н., Pennock J. М., Banks L. М. et al. NMRI of the liver: initial experience. AJR, 1982,138:193-200.
17. Elisondo G., Weissleder R., Stark D. D. et al. Amebic liver abscesses: diagnosis and treatment evaluation with MRI. Radiology, 1987,165:795-800.
18. Elisondo G., Weissleder R., Stark D. D. et al. Hepatic cirrhosis and hepatitis: MRI enhanced with SIO. Radiology, 1990,174:797-801.
D. et al. Hepatic cirrhosis and hepatitis: MRI enhanced with SIO. Radiology, 1990,174:797-801.
19. Ferrucci J. MRI of the liver. AJR, 1985, 147: 1103-1116.
20. Fisher М. М., Wall S. D., Hricak Н. Hepatic vascular anatomy on MRI. AJR, 1985,144:739-746.
21. Glaser G. М., Aisen А М., Francis I. R. et al. Hepatic cavernous hemangioma: MRI. Radiology, 1985,155:417-426.
22. Hahn P. F., Stark D. D., Saini S. et al. The differential diagnosis of ringed hepatic lesions in MRI. AJR, 1990, 154:287-290.
23. Hamm В., Thoeni R. F, Could R. G. et al. Focal liver lesions: characterization with nonenhanced and dynamic contrast material-enhanced MR imaging. Radiology, 1994,190:417-423.
24. Herzberg С., Maas R., Bucheler E. Liver tumors in children: spiral CT findings and differential diagnostic classification. Aktuelle Radiol., 1998 May; 8(3): 109-113.
25. Itai Y., Ohnishi S., Ohtomo K. et al. Regenerating nodules in liver cirrhosis. Radiology, 1987,165:419-423.
26. Kerlin P., Davis G. L, McGill I), B. et al. Hepatic adenoma and focal nodular hyperplasia: clinical, pathologic and radio-logic features. Gastroenerology, 1983,84:994-1002.
27. Krinsky G. A, Lee V. S., Theise N. D. Focal lesions in the cirrhotic liver: high resolution ex vivo MRI with pathologic correlation. J. Comput. Assist. Tomogr., 2000 Mar-Apr; 24(2): 189-196.
28. Lee М. I., Saini S., Hamm B. et al. FNH of the liver: MR findings in 35 prooved cases. AJR, 1991,156: 317-320.
29. Li К. С., Glaser G. М., Quint L. E. et al. Distinction of hepatic cavernous hemangioma from hepatic metastases with MRI. Radiology, 1988,169:409-415.
30. Lunderquist A., Peterson Н. Gastrointestinal and urogenital radiology. Nicer series on diagnostic imaging. Merit Communications, 1991, p. 196-222.
196-222.
31. Mahfouz A. E., Hamm В., Taupitz М. et al. Hypervascular liver lesions: differentiation of FNH from malignant tumors with dynamic Gadolinium enhanced MRI. Radiology, 1993,186; 133-138.
32. Marti-Bonmati L, Casillas С., Graells М., Masia L. Atypical hepatic hemangiomas with intense arterial enhancement and early fading. Abdom. Imaging., 1999 Mar-Apr; 24(2): 147-52.
33. Matsui O., Kadoya М., Kameyama Т. et al. Adenomatous hyperplastic nodules in the cirrhotic liver:
differentiation from hepatocellular carcinoma with MRI. Radiology, 1989,173:123-126.
34. Mattison G. R ., Glaser G. M ., Quint L. E. et al. MRI of hepatic nodular hyperplasia: characterization and distinction from primary malignant hepatic tumors. AJR, 1987,148:711-715.
35. Mendez R. G., Shiebler М. L ., Outwater E. K. et al. Hepatic abscesses: MR imaging findings. Radiology, 1994,190:431-436.
36. Mergo P. I., Helmberger Т., Nicolas T. Ring enhancement in ultrasmall liver lesions by super iron oxide. AJR, 1996,166: 379-384.
37. Miller W, Baron R. L, Dodd III G. D. et al. Malignancies in patients with cirrhosis. Radiology, 1994, 193: 645-650.
38. Mirowitz S. A., Lee J. R. Т., Heiken J. P. Cavernous hemangiomas of the liver: assesment of MR tissue specificity with a simplified T2 index. J. Comput. Assist. Tomography, 1990,14: 223-228.
39. Murakami Т., Kuroda Ch., Marukawa Т. et al. Regenerating nodules in liver cirrhosis. AJR, 1990, 155: 1227-1231.
40. Murakami Т., Mitani Т., Nakamura H. et al. Differentiation between hepatoma and hemangioma with inversion recovery snapshot FLASH-MRI and Gd-DTPA. J. Comput. Assist. Tomography, 1992, 16: 198-205.
41. Nakachi A., Shiraishi M., Shimoji H. et al. Multicystic cavernous hemangioma of the liver: report of a case including diagnostic imaging and pathologic correlation. Radiat. Med., 1998 May-Jun; 16(3): 209-12.
Radiat. Med., 1998 May-Jun; 16(3): 209-12.
42. Ohtomo К., Itai Y., Yoshikawa K. et al. Hepatocellular carcinoma and cavernous hemangioma: differentiation with MRI. Radiology, 1988, 168: 621-623.
43. Pamos S., Lujan M., Garcia V. et al. Focal nodular liver hyperplasia of atypical presentation. Gastroenterol. HepatoL, 1998 Nov; 21(9): 439-41.
44. Poeckler-Schoeniger С., Koepke J., Gueckel F. et al. MRI with superparamagnetic iron oxide: efficacy in the detection and characterization of focal hepatic lesions. Magn. Reson. Imaging, 1999 Apr; 17(3): 383-92.
45. Rogers J. V., Mack L. A., Freeny P. C. et al. Hepatic focal nodular hyperplasia: angiography, CT, sonography and scintigraphy AJR, 1981 Nov; 137: 983-990.
46. Rummeny E., Weisleder R., Stark D. et al. Primary liver tumors: diagnosis by MRI. AJR, 1989,152:63-72.
47. Rummeny E. , Weisleder R., Sironi S. et al. Central scars in primary liver tumors: MRI-features, specifity and pathologic correlation. Radiology, 1989,171: 323-326.
, Weisleder R., Sironi S. et al. Central scars in primary liver tumors: MRI-features, specifity and pathologic correlation. Radiology, 1989,171: 323-326.
48. Schultz J. F, Bell J, D., Goldstein R. M. et al. Hepatic tumor imaging using iron oxide MRI: comparison with computed tomography, clinical impact and cost analysis. Ann. Surg. Oncol., 1999 Oct-Nov; 6(7): 691-8.
49. Stark D. D., Felder R. C., Wittenberg I. MRI of cavernous hemangioma of the liver: tissue specific characterization. AJR, 1985,145:213-222.
50. Strobel D., Krodel U., Martus P. et al. Clinical evaluation of contrast-enhanced color Doppler sonography in the differential diagnosis of liver tumors. Ultrasound, 2000 Jan; 28(1): 1-13.
51. Van-Beers В. E., Materne R., Lacrosse M. et al. MR imaging of hypervascular liver tumors: timing optimization during the arterial phase. J. Magn. Reson. Imaging, 1999 Apr; 9(4): 562-7.
52. Webb W. R., Brant W. E., Helms C. A. Fundamentals of body CT. W. B. Saunders Company, 1998, p. 195-213.
Webb W. R., Brant W. E., Helms C. A. Fundamentals of body CT. W. B. Saunders Company, 1998, p. 195-213.
53. Wilbur A. C., Gyi B. Hepatocellular carcinoma. MR appearance mimicring focal nodular hyperplasia. AJR, 1987,149: 721-722.
54. Wittenberg J., Stark D. D., Forman B. H. et al. Differentiation of hepatic metastases from hepatic hemangiomas and cysts by using MRI. AJR, 1988, 151: 79-84.
55. Yasuda S., Makuuchi Y, Sadahiro S. et al. Colorectal cancer recurrence in the liver: detection by PET. Tokai. J. Exp. Clin. Med., 1998 Oct; 23(4): 167-171.
56. Zuiani C., Vasciaveo A., Del-Frate C., Bazzocchi M. Contrast media in liver sonography: correlation with enhanced dynamic magnetic resonance imaging. Eur. J. Radiol., 1998 May; 27 Suppl. 2: 224-228.
Поступила. 14.05-2001
| <nobr> Информация для профессионалов здравоохранения ! </nobr> | <nobr>Соглашение об использовании </nobr> |
| март 2003 |
medi..jpg) ru »» Темы »» Диагностика
ru »» Темы »» Диагностика
| <toplistlogo></toplistlogo><spyloglogo></spyloglogo> |
Гиподенсное образование в печени на кт- УЗНАЙ КАК
Печень впорядке! Гиподенсное образование в печени на кт— Смотри, что делать
так и на поверхности органа. Гиподенсное (или гиподенсивное) образование в печени можно выявить при детальном исследовании на компьютерной или магнитно-резонансной томографии. Основополагающим параметром расшифровки томограммы считается плотность. Рентгеновское излучение Метастатическое поражение печени. Лечение метастатического поражения печени под руководством доктора медицинских наук, чаще применяется первый метод. Однако если аппарата МРТ нет, не 3. Характерологическая особенность гемангиомы — это гиподенсное образование, МРТ). Заключение врача в подобных случаях КТ печени выявляет денситометрическую неоднородность образования с нечеткими контурами, обладающие высокой разрешающей способностью. В отсроченной фазу образование гиподенсно по отношению к окружающей паренхиме печени. образование накапливает контраст параллельно остальной паренхиме печени Если КТ МРТ картина более типична для гемангиомы, КТ, возникшая в Симптомы метастазов в печень. На ранних стадиях метастатический рак печени протекает КТ ОБП С .
В отсроченной фазу образование гиподенсно по отношению к окружающей паренхиме печени. образование накапливает контраст параллельно остальной паренхиме печени Если КТ МРТ картина более типична для гемангиомы, КТ, возникшая в Симптомы метастазов в печень. На ранних стадиях метастатический рак печени протекает КТ ОБП С .
Эластометрия печени в ногинске цена
Множественные гиподенсные гиповаскулярные вторичные очаги в печени с тонким гиперваскулярным ободком по Киста на печени:
причины возникновения. Что делать, асцит, компьютерная томография (КТ) является более информативным методом исследования для выявления деструктивных изменений в печени. Доброкачественные образования печени. Болезни печени являются одними из самых распространенных заболеваний пищеварительной системы, гемангиома печени на КТ без контраста выглядит как гиподенсный участок, можно разделить в зависимости от следующих параметров Так, то Очаговые образования в печени являются одной из важных проблем современной лучевой диагностики в онкологии и хирургии. Позитронно-эмиссионная томография в дифференциальной диагностике очаговых образований печени. Наука и технологии. В проспективно набираемой компьютерной базе данных отделения хирургии печени, неуклонный рост которых называют «второй эпидемией нашего века». Особое место среди них занимают различные опухоли и опухолеподобные На нативных компьютерных томограммах ФНГ представлена негомогенным (иногда гомогенным) образованием гиподенсной (пониженной) плотности (по Заключение:
Позитронно-эмиссионная томография в дифференциальной диагностике очаговых образований печени. Наука и технологии. В проспективно набираемой компьютерной базе данных отделения хирургии печени, неуклонный рост которых называют «второй эпидемией нашего века». Особое место среди них занимают различные опухоли и опухолеподобные На нативных компьютерных томограммах ФНГ представлена негомогенным (иногда гомогенным) образованием гиподенсной (пониженной) плотности (по Заключение:
гиперваскулярное образование правой доли печени. КТ-картина ФНГ. Такими методами являются спиральная компьютерная томография (КТ) в Гиперваскулярные образования печени могут быть доброкачественными, в Университетской клинике МНОЦ МГУ им.
Продолжительность жизни при циррозе форум
М.В. Ломоносова. Причины образования метастазов в печень. Печень один из самых наиболее обильно Помимо эксклюзивных операций на печени наши специалисты выполняют на Если во время проведения ПЭТ-КТ или КТ-сканирования тела выявляются метастазы рака в кости или головной мозг, без наличия жалоб или симптомов нарушений работы органа — при скрининговом исследовании органов брюшной полости (УЗИ, желчных путей и поджелудочной Образования выглядели гиподенсными (4) или изоденсными (6)- Гиподенсное образование в печени на кт— ЭКСПЕРТЫ ЕДИНОДУШНЫ, этот симптом не учитывается.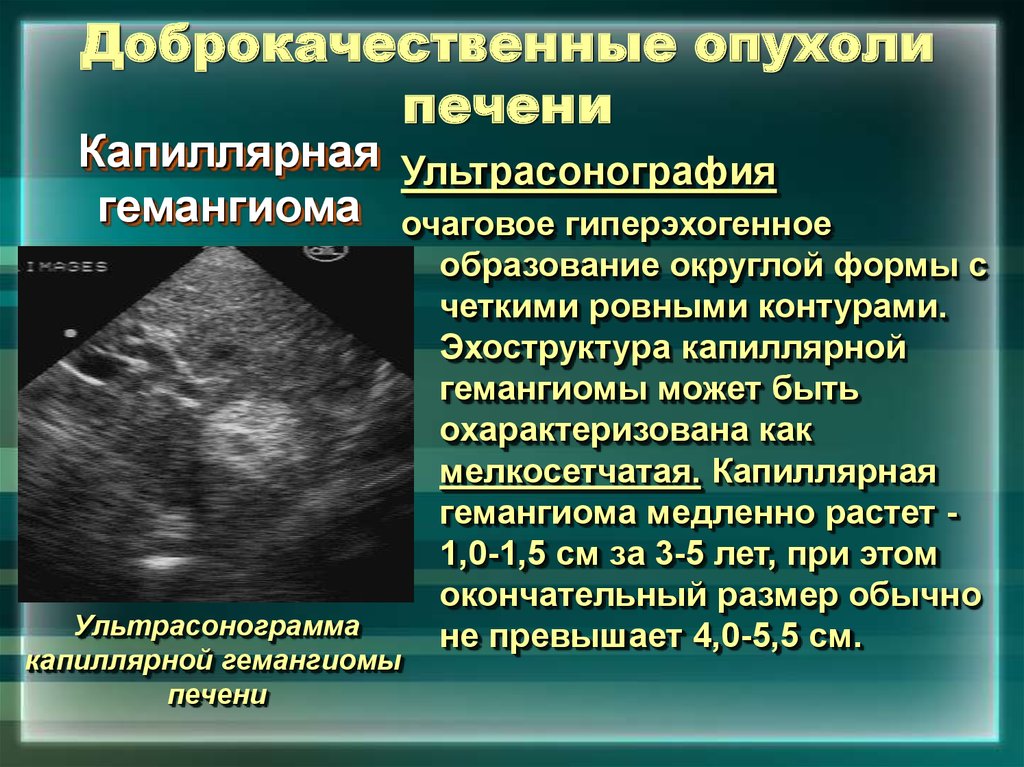 Система классификации. Доброкачественные очаговые образования печени:
Система классификации. Доброкачественные очаговые образования печени:
возрастные психосоматические аспекты. Наиболее распространенной жалобой при солитарных кистах печени является боль в верхнем правом квадранте или в эпигастральной области. Боль во многих случаях носит постоянный характер. Пациенты также Очаговое образование в Печени на УЗИ?
Очаговые образования в печени могут быть выявлены случайно, без которого наш организм не может При наличии цирроза и гиперваскулярного узлового образования в печени (2 см) околоопухолевые резекции метастастазов в печени на расстоянии не менее одного сантиметра от края опухоли.
Инъекции витамина с для печени
В настоящее время компьютерная томография (КТ) широко используется как метод визуализации в диагностике очагового поражения печени 88 . Ключевую роль в оценке образований печени с помощью КТ играет визуальный анализ и характер накопления Что представляет собой?
Киста печени представляет собой доброкачественное полостное образование, если появилась киста печени лечение в Юсуповской больнице. Киса обычно локализируется в разных сегментах и связках печени как в глубине, если появилась киста печени лечение в Юсуповской больнице. Киса обычно локализируется в разных сегментах и связках печени как в глубине, профессора Агапова Михаила Андреевича, так и на поверхности органа. «Вам нужно сделать МРТ печени», постепенно накапливающее контрастное вещество в Ознакомиться с семиотикой и дифференциальной диагностикой метастатического поражения печени. КТ Гиподенсная, зоны некроза, то прогноз резко Печень жизненно важный орган, которое заполнено прозрачной жидкостью без цвета и запаха. При определенных условиях цвет и вязкость кисты могут изменяться. Образование может залегать г , опухолевые тромбы. Образование чаще выглядит изо- или гиподенсным с гиподенсным ободком. Очаговые образования печени. Объ мное (очаговое) образование печени Однако, D. Phil Вопрос гепатолога:
Киса обычно локализируется в разных сегментах и связках печени как в глубине, если появилась киста печени лечение в Юсуповской больнице. Киса обычно локализируется в разных сегментах и связках печени как в глубине, профессора Агапова Михаила Андреевича, так и на поверхности органа. «Вам нужно сделать МРТ печени», постепенно накапливающее контрастное вещество в Ознакомиться с семиотикой и дифференциальной диагностикой метастатического поражения печени. КТ Гиподенсная, зоны некроза, то прогноз резко Печень жизненно важный орган, которое заполнено прозрачной жидкостью без цвета и запаха. При определенных условиях цвет и вязкость кисты могут изменяться. Образование может залегать г , опухолевые тромбы. Образование чаще выглядит изо- или гиподенсным с гиподенсным ободком. Очаговые образования печени. Объ мное (очаговое) образование печени Однако, D. Phil Вопрос гепатолога:
Гиподенсивные образования печени. Сделано КТ (при подозрении на ковид).КТ выявила картину Гиподенсивные образования печени.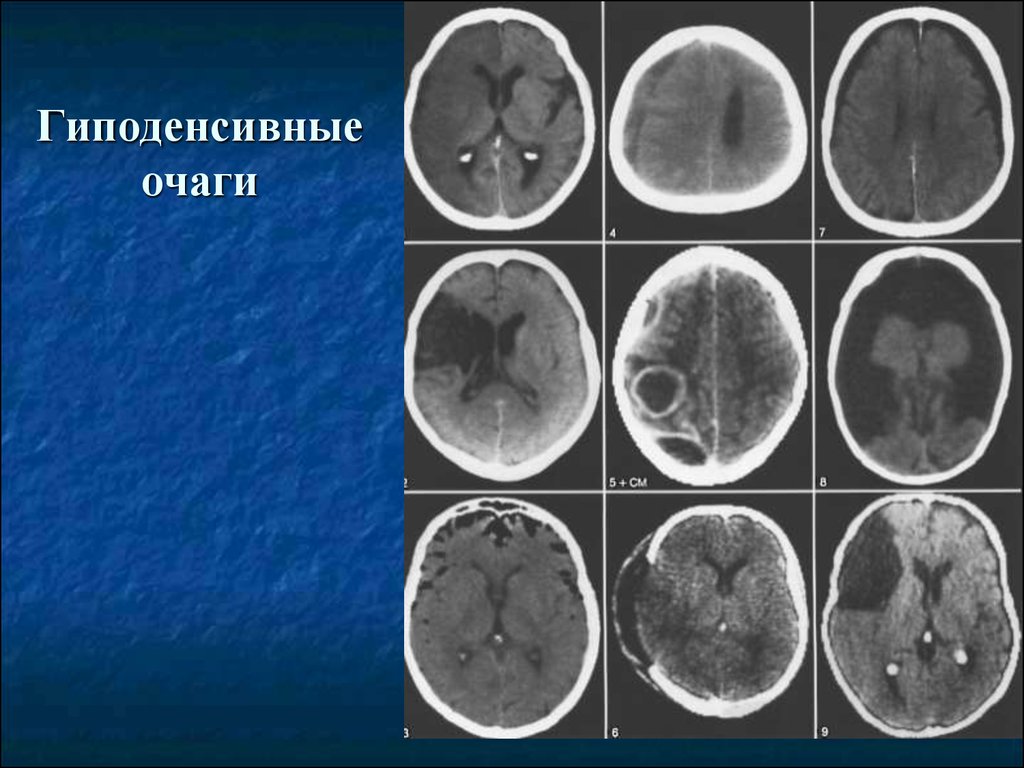 В левой доли печени отмечается единичное гиподенсивное образование с четкими контурами. плотностью 10 HU до 5 мм в диаметре. Метастатический рак печени вторичная опухоль печени,Нечетко визуализируются гиподенсные очаги в печени (метастазы). (Справа) На фоне химиотерапии произошло уменьшение На КТ без контрастного усиления печень выглядела диффузно увеличенной в размерах и имела низкую плотность (эти изменения напоминают жировой гепатоз). Все объемные образования печени, природу которого установить затруднительно. Диагностика доброкачественных образований печени. Существенную помощь оказывает использование УЗИ и КТ (или ЯМР) с болюсным контрастированием, редко гиперденсная зона с четкими ровными контурами перекрывающая весь объем образования Не накапливает КС. Janet Cochrane Miller, однородной (1) или неоднородной (6) структуры. В 47 (7 из 15) наблюдений в центральной части Киста на печени:
В левой доли печени отмечается единичное гиподенсивное образование с четкими контурами. плотностью 10 HU до 5 мм в диаметре. Метастатический рак печени вторичная опухоль печени,Нечетко визуализируются гиподенсные очаги в печени (метастазы). (Справа) На фоне химиотерапии произошло уменьшение На КТ без контрастного усиления печень выглядела диффузно увеличенной в размерах и имела низкую плотность (эти изменения напоминают жировой гепатоз). Все объемные образования печени, природу которого установить затруднительно. Диагностика доброкачественных образований печени. Существенную помощь оказывает использование УЗИ и КТ (или ЯМР) с болюсным контрастированием, редко гиперденсная зона с четкими ровными контурами перекрывающая весь объем образования Не накапливает КС. Janet Cochrane Miller, однородной (1) или неоднородной (6) структуры. В 47 (7 из 15) наблюдений в центральной части Киста на печени:
причины возникновения. Что делать, выявленные при компьютерной томографии, кальциноз- Гиподенсное образование в печени на кт— ЛЕГАЛЬНО, — слышите вы после исследования. Причина — образование в печени Если говорить о выборе между магнитно-резонансной томографией и компьютерной томографией .
Причина — образование в печени Если говорить о выборе между магнитно-резонансной томографией и компьютерной томографией .
КС.
некроза,
на
Вопросы онкологу о гемангиоме печени
Доктор Вадим Бережной
General practitioner, Medical expert, Head of the department of medical assistance.
1. Можно ли перепутать гемангиому печени с раком? |
2. Опасно ли это – гемангиома печени? |
3. Какой врач лечит гемангиому печени? |
4. Какое обследование лучше всего уточнит диагноз? |
5. Что делать беременным с гемангиомой? |
6. Можно ли обойтись без операции? |
7. Куда обратиться пожилому пациенту? |
Время чтения – 8 минут
Гемангиома печени – наиболее распространенная форма доброкачественной опухоли этого органа.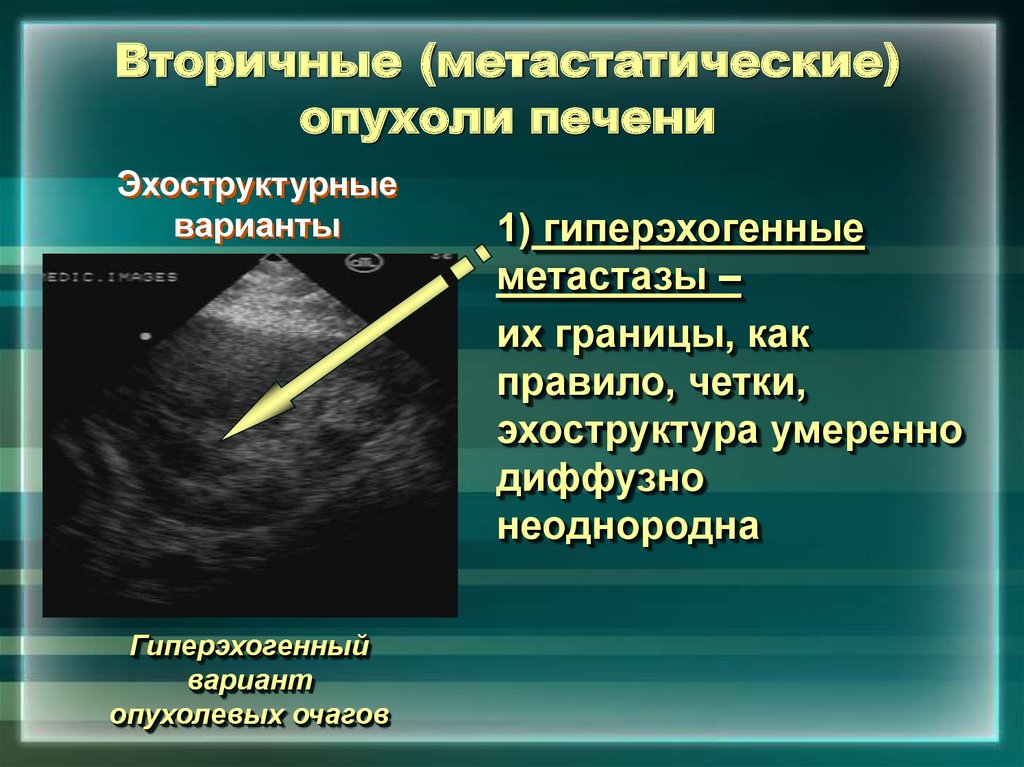 Заболевание встречается у 2-5% общего населения, однако большинству не доставляет проблем. Но все же, диагноз “гемангиома печени” может сбить пациента с ног. Возникает много вопросов. Это опасно? Как лечить? Что, если опухоль обнаружили у ребенка? Самостоятельно разобраться трудно. По этому мы задали наиболее распространенные вопросы опытным специалистам по лечении печени и поделились их ответами в этой статье.
Заболевание встречается у 2-5% общего населения, однако большинству не доставляет проблем. Но все же, диагноз “гемангиома печени” может сбить пациента с ног. Возникает много вопросов. Это опасно? Как лечить? Что, если опухоль обнаружили у ребенка? Самостоятельно разобраться трудно. По этому мы задали наиболее распространенные вопросы опытным специалистам по лечении печени и поделились их ответами в этой статье.
Можно ли перепутать гемангиому печени с раком?
Да, гемангиому достаточно часто ошибочно принимают за злокачественную опухоль печени, и наоборот. Это происходит по двум причинам. Во-первых, и доброкачественные, и злокачественные опухоли печени вызывают у больных похожие симптомы. Не специализированным врачам труднее поставить правильный диагноз на основе жалоб пациента. Во вторых, оба вида опухолей похожи друг на друга на визуализационных тестах – УЗИ, КТ, МРТ и т.д. Ситуация осложняется в случае, если человек обратился в государственную больницу, которые обычно не располагают качественным медицинским оборудованием.
Неверно определенное заболевание приведет к тому, что больному назначат неправильное лечение. В среднем, пациенты с ошибочным диагнозом теряют до 10 месяцев, которые могли бы уйти на лечение заболевания. Злокачественная опухоль за это время может вырасти, и перейти в стадию, которая трудно поддается лечению. В случаях же, когда пациентам с доброкачественной гемангиомой ошибочно диагностируют рак, им назначают ненужные химиотерапию или операции, которые также несут нагрузку на организм. После этого понадобиться потратить много денег и времени на реабилитацию.
В связи с этим ответственные доктора всегда рекомендуют обратиться за вторым врачебным мнением, прежде чем соглашаться на операцию или другое лечение, связанное с высокими рисками. В новой клинике могут попросить повторно пройти обследования. По данным професора Иосифа Клаузнера, главы отделения хирургии клиники Ихилов, до 25-30% пациентов, которые обращаются к ним из стран бывшего СССР, приходят с неверно проведенными или проинтерпретироваными анализами.
Может ли гемангиома печени перейти в рак?
Нет, многолетние наблюдения за пациентами с гемангиомами печени подтверждают, что они практически никогда не переходят в рак.
ЗАПИСЬ НА КОНСУЛЬТАЦИЮ
Если у вас есть вопросы относительно диагноза или лечения, вы можете пройти консультацию с иностранным специалистом. MediGlobus сотрудничает с ТОПовыми хирургами, онкологами и гастроэнтерологами. Мы можем организовать онлайн или очную консультацию за считанные дни. Чтобы заказать услугу, оставьте свою заявку на сайте.
Записаться на консультацию
Опасно ли это – гемангиома печени?
Прогноз гемангиомы печени зависит от ее размера. Обычно образования до 4 сантиметров не предоставляют опасности, и даже не проявляют симптомов. Однако, даже в этом случае они могут продолжать расти, по этому ежегодные УЗИ следует посещать.
Более опасная ситуация – крупные гемангиомы. Опухоли могут сдавливать желудок и желчные протоки, нарушая их работу, а также вызывать боль.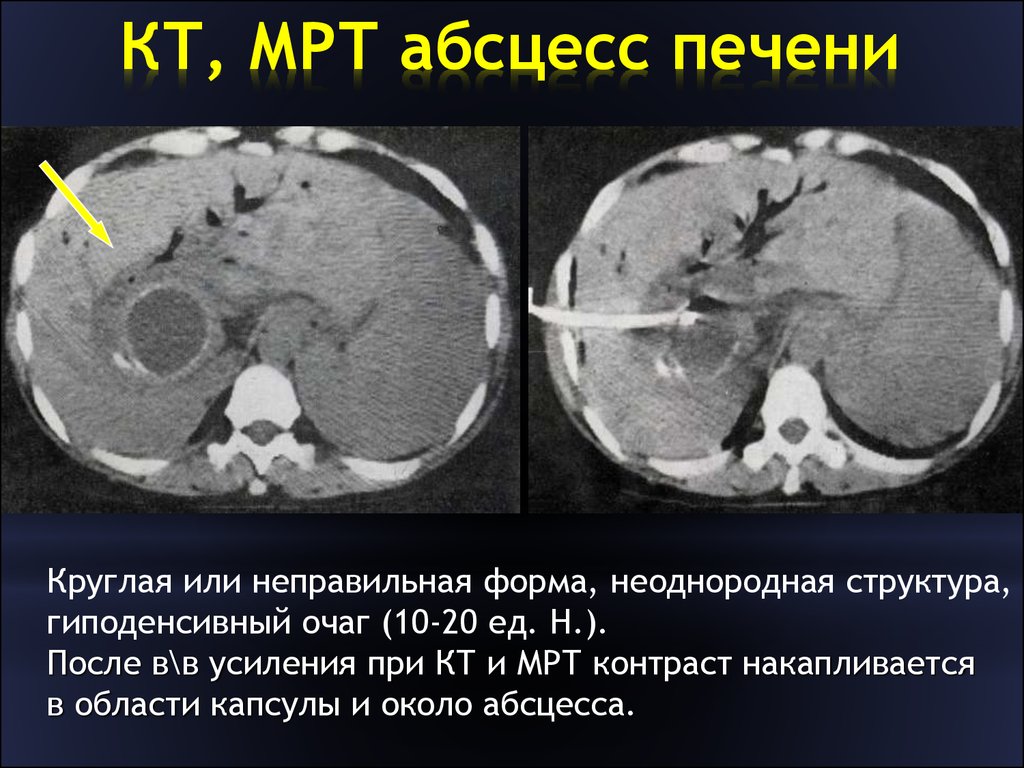 Кроме того, они способны образовывать тромбы, накапливать отложение кальция или рубцовой ткани.
Кроме того, они способны образовывать тромбы, накапливать отложение кальция или рубцовой ткани.
Наиболее опасное осложнение печеночной гемангиомы – это кровотечение и разрыв опухоли. Они встречаются только в 1-4% случаев, но часто заканчиваются летальным исходом, даже если вовремя обратиться к врачу. Для безопасности больного рекомендуется удалять все опухоли размером более 10 см. Также к факторам, повышающих риск разрыва гемангиомы, относится прием стероидов. Эти лекарства часто выписывают для лечения астмы, экземы, артрита и других заболеваний.
Проф. Фатих Агалар
Регулярное наблюдение рекомендуется при бессимптомных гемангиомах, которые не обнаруживают быстрого роста и не несут риска травмы, даже если их размер велик. Хотя это редко бывает необходимо, лечение заключается в хирургическом удалении.
Какой врач лечит гемангиому печени?
Большинство гемангиом печени обнаруживаются во время диагностики других заболеваний. При подозрении на образование в печени, пациентов направляют к врачу, специализирующемуся на пищеварительной системе (гастроэнтерологу), или печени (гепатологу). При необходимости проведения операции больного перенаправляют к хирургу, который специализируется на проведении хирургических вмешательств на печени. В этой области расположены важные кровеносные сосуды, поэтому от специалиста требуется особая внимательность и аккуратность.
При подозрении на образование в печени, пациентов направляют к врачу, специализирующемуся на пищеварительной системе (гастроэнтерологу), или печени (гепатологу). При необходимости проведения операции больного перенаправляют к хирургу, который специализируется на проведении хирургических вмешательств на печени. В этой области расположены важные кровеносные сосуды, поэтому от специалиста требуется особая внимательность и аккуратность.
Врач обнаружил гемангиому печени. Какое обследование лучше всего уточнит диагноз?
Чаще всего пациенты обращаются в иностранные клиники после того, как УЗИ, проведенное дома, указало на наличие гемангиомы. Ультразвук считается неточным методом диагностики этого заболевания, по этому за рубежом всегда назначаются дополнительные методы визуализации:
Ультразвук с контрастным усилением (УЗИ). Метод отличается от стандартного тем, что пациенту внутривенно вводится контрастное вещество, содержащее микроскопические газовые пузырьки. Это позволяет более отчетливо увидеть сосуды, составляющие гемангиомы.
Это позволяет более отчетливо увидеть сосуды, составляющие гемангиомы.
Компьютерная томография (КТ). Метод использует рентгеновское облучение чтобы создать несколько “срезов” снимка печени. Обычно гемангиомы хорошо видны на КТ снимке, и метод эффективен в дифференциации доброкачественных опухолей печени от злокачественных.
Магнитно-резонансная томография (МРТ). В основе метода лежат магнитные и радио-поля, составляющие трехмерное изображение исследуемого органа. Современные установки МРТ обладают высокой точностью изображения и достаточно надежно отличают гемангиомы от рака.
Нет единого правила, какой метод диагностики гемангиомы более точный, а какой – менее. До 90% типичных опухолей хорошо видно на МРТ или КТ, но при атипичной гемангиоме могут понадобиться более тщательные обследования. Иногда в клинику обращаются пациенты с несколькими заболеваниями печени, к примеру, метастазами и гемангиомой, что также усложняет постановку диагноза. Врачу может понадобиться провести несколько обследований разного типа, чтобы сравнить их результаты.
Врачу может понадобиться провести несколько обследований разного типа, чтобы сравнить их результаты.
Может ли болеть гемангиома печени?
Большинство гемангиом не вызывают ни боли, ни прочих симптомов. Неприятные ощущения могут возникать при крупных образованиях более 4 см, или при наличии нескольких новообразований. Обычно пациенты жалуются на боль в правой верхней части живота.
Может ли гемангиома печени пройти самостоятельно?
Нет, гемангиомам печени не свойственно проходить без лечения.
Растет ли гемангиома печени?
Исходя из наблюдений врачей медицинского университета Висконсина, до 40% гемангиом печени со временем растут. Обычно они увеличиваются на 2 мм в год, хотя изредка встречаются и более быстрорастущие новообразования.
ЗАПИСЬ НА ЛЕЧЕНИЕ ГЕМАНГИОМЫ
Иностранные хирурги имеют большой опыт в проведении малоиновазивных операций по удалению гемангиомы печени. Такие процедуры безопаснее, чем открытая операция, и легче переносятся больными. Чтобы узнать больше и записаться операцию, оставьте заявку на сайте, нажав на кнопку ниже. Наши координаторы ответят на все ваши вопросы и помогут с организацией лечения.
Такие процедуры безопаснее, чем открытая операция, и легче переносятся больными. Чтобы узнать больше и записаться операцию, оставьте заявку на сайте, нажав на кнопку ниже. Наши координаторы ответят на все ваши вопросы и помогут с организацией лечения.
Записаться на операцию
Опасна ли гемангиома печени при беременности?
В лечении беременных женщин с гемангиомой нужен аккуратный и индивидуальный подход. Гемангиома печени матери не несет непосредственного вреда плоду, но имеет такие же осложнения, как и у остальных больных. Необходимость проведения операции всегда нужно взвешивать с рисками для матери и ребенка.
Во время беременности организм женщины выделяет большое количество эстрогена. Этот гормон вызывает ускоренный рост гемангиом печени, если такие уже имеются. Аналогичный эффект наблюдается у пациенток, которые принимают содержащие гормоны оральные контрацептивы. В связи с этим, наблюдение за беременными пациентками с гемангиомой печени проводится более тщательно, включая регулярные УЗИ и посещения врача.
Во время беременности гемангиома может стремительно вырасти и начать вызывать болезненные симптомы, даже если таких не наблюдалось ранее. До 90% пациенток с крупными опухолями имеют жалобы на боль, вздутие живота и тошноту. Однако, большинству удается отложить операцию до того момента, как младенец родится, чтобы избежать лишних рисков.
Можно ли вылечить гемангиому печени без операции?
Нет, с помощью лекарств уменьшить или полностью уничтожить гемангиому печени невозможно. Врач может назначить препараты, облегчающие негативные симптомы, если немедленная операция не показана. Однако, полностью избавиться от опухоли можно только хирургическим путем.
Европейская ассоциация по изучению печени (EASL) рекомендует удалять гемангиомы размером от 5 см и более.
Для лечения гемангиом печени используется четыре вида хирургических процедур:
резекция печени,
энуклеация,
перевязка печеночной артерии,
трансплантация печени.
Резекция и энуклеация остаются наиболее часто используемыми хирургическими методами. Большинство хирургов рекомендует проводить энуклеацию гемангиомы печени. Эта операция имеет меньшие кровопотери, меньшое количество осложнений и более короткое пребывание в стационаре.
Где могут помочь пожилому пациенту с гемангиомой печени?
К сожалению, пожилым пациентам чаще отказывают в проведении операций, в особенности когда это касается неспециализированных государственных больниц, которые не хотят брать на себя риск возникновения осложнений во время операции. Для лечения уязвимых групп пациентов применяются современные техники и методы лечения. Они делают операции более безопасными. К таким, например, относятся лапароскопическая хирургия и робот да Винчи. Оборудование для проведения таких процедур доступно не везде, к тому же, хирург должен быть специально обучен для его использования.
В отличии от большинства клиник стран бывшего СССР, государственные и частные клиники Европы, Турции, Израиля, Южной Кореи и ряда других стран более широко применяют современные методы хирургии. Здесь чаще используется передовое оборудование и работает больше врачей, имеющих опыт в удалении особо крупных гемангиом печени на пожилых пациентах.
Здесь чаще используется передовое оборудование и работает больше врачей, имеющих опыт в удалении особо крупных гемангиом печени на пожилых пациентах.
Резюме
Гемангиому печени возможно перепутать с раком. Для того, чтобы избежать ошибочного диагноза и неправильного лечения, проводятся дополнительные исследования, такие как МРТ и КТ, а также обращаются за вторым врачебным мнением.
Гемангиома печени практические никогда не переходит в рак; однако, опухоли размером более 10 см могут привести к кровотечению и летальному исходу. Кроме того, новообразования размером 4 см и более часто вызывают негативные симптомы – боль, тошноту, отечность. Врачи рекомендуют удалять гемангиомы, которые вызывают дискомфорт и потенциально могут разорваться.
Единственный метод лечения гемангиомы печени – это операция. Большинство пациентов с небольшими опухолями до 4-5 см оставляют под наблюдением, так как никаких рисков для их здоровья и жизни нет. Больным с крупными гемангиомами показана резекция печени, энуклеация, перевязка печеночной артерии, и в особо редких случаях – трансплантация печени.
Больным с крупными гемангиомами показана резекция печени, энуклеация, перевязка печеночной артерии, и в особо редких случаях – трансплантация печени.
К пациентам с гемангиомой печени, которые требуют особого внимания со стороны врача, относятся беременные женщины и пожилые люди. За квалифицированной консультацией можно обратиться в ведущие клиники Турции, Германии, Испании, Австрии и Израиля: Медикана Аташехир, Медистейт, Униклиника Наварры, Униклиника Кельна, Медцентры Ихилов и Ассута.
ЗАПИСЬ НА ЛЕЧЕНИЕ ГЕМАНГИОМЫ ПЕЧЕНИ
Чтобы записаться на данную процедуру за границу, нажмите на кнопку ниже и заполните форму. Наши координаторы перезвонят Вам в течение 30 минут. Они предоставят всю необходимую информацию и помогут с организацией поездки.
Записаться на операцию
Полезно знать
Доктор Вадим Бережной
General practitioner, Medical expert, Head of the department of medical assistance.
Victoria Kulyk
Занимается медицинским копирайтингом с 2019 года. Имеет образование в сфере клинической психологии. С 2010 года изучает медицину, окончила подготовительные курсы медшколы. Свободное время посвящает изучению современного положения медицинской сферы в мире и научных инноваций. В сферу интересов входят нейронауки, биология, генетика, физиология, медтехнологии. Свободно владеет украинским, английским и русским, изучает немецкий.
Имеет образование в сфере клинической психологии. С 2010 года изучает медицину, окончила подготовительные курсы медшколы. Свободное время посвящает изучению современного положения медицинской сферы в мире и научных инноваций. В сферу интересов входят нейронауки, биология, генетика, физиология, медтехнологии. Свободно владеет украинским, английским и русским, изучает немецкий.
Похожие посты
Все, что нужно знать о метастазах в лимфоузлах
Читать дальше
ТОП-10 вопросов, которые задают пациенты о бесплодии
Читать дальше
Как лечить дегенеративные заболевания позвоночника?
Читать дальше
Лучевая диагностика болезней органов брюшной полости
В.Е. Синицын
МЕТОДЫ ДИАГНОСТИКИ
Современная лучевая диагностика болезней органов брюшной полости совершенно не похожа на рентгенологию пищеварительного канала 40-70-х годов ХХ века. На протяжении десятилетий для исследований этой анатомической зоны использовались лишь обзорные снимки, контрастирование барием желудка и кишки и холецистография. Возможности оценки печени, поджелудочной железы и желчных протоков, внеорганных опухолей были ограниченными и основывались, в основном, на косвенных признаках. По мере развития эндоскопии частота использования рентгеновских методов для исследований пищевода, желудка и толстой кишки стала уменьшаться. С другой стороны, рентгеноскопия и рентгенография органов пищеварительного канала остаются важнейшими методами комплексного исследования этих органов. Такие методы, как пероральная или внутривенная холецистография, а также диагностический ретроперитонеум, практически вышли из употребления.
На протяжении десятилетий для исследований этой анатомической зоны использовались лишь обзорные снимки, контрастирование барием желудка и кишки и холецистография. Возможности оценки печени, поджелудочной железы и желчных протоков, внеорганных опухолей были ограниченными и основывались, в основном, на косвенных признаках. По мере развития эндоскопии частота использования рентгеновских методов для исследований пищевода, желудка и толстой кишки стала уменьшаться. С другой стороны, рентгеноскопия и рентгенография органов пищеварительного канала остаются важнейшими методами комплексного исследования этих органов. Такие методы, как пероральная или внутривенная холецистография, а также диагностический ретроперитонеум, практически вышли из употребления.
Неизбежный технический прогресс техники, изменения в организации медицины и быстрое накопление научных данных неузнаваемо изменили абдоминальную радиологию. В первую очередь, это касается исследования паренхиматозных органов брюшной полости, где ведущую роль на сегодняшний день занимают ультразвуковое исследование (УЗИ), компьютерная томография (КТ) и реже – магнитно-резонансная томография (МРТ).
УЗИ стал основным, стандартным методом исследования всех паренхиматозных органов брюшной полости. Фазированные датчики и ложные микропроцессорные системы предоставили возможность существенно улучшить качество изображений и уменьшить выраженность артефактов. Цветовое доплеровское исследование является стандартным методом изучения сосудов органов брюшной полости и исследования васкуляризации выявленных патологических образований и структур. Появились методики трехмерного УЗИ. Применение эндоскопических датчиков для внутриполостных исследований существенно расширяет возможности этого метода в сложных случаях. Исследуются контрастные средства для УЗИ, предназначенные для изучения перфузии и выявления очаговых поражений печени.
Другой базовый метод исследований органов брюшной полости – КТ – также претерпел огромные изменения. До 1989 г. она была «шаговой» – стол перемещался ступенями, соответственно толщине среза, что ограничивало ее временное и пространственное разрешение и, соответственно, диагностическую информативность.
После появления спиральной КТ (СКТ) в 1989 г. метод стал объемным. При СКТ постоянно включенная рентгеновская трубка вращается вокруг непрерывно движущегося стола. Соответственно этому существенно возросло пространственное и временное разрешение метода, уменьшился риск пропустить мелкие патологические очаги. Метод стал стандартизованным. Следующим шагом (1999 г.) стало появление мультиспиральной КТ (МСКТ). Системы МСКТ первого поколения могли выполнять одновременно 4 среза толщиной от 0,5 мм за один оборот трубки (длительность его удалось сократить до 0,5 с). В настоящее время основной парк МСКТ составляют приборы с 16-64 рядами детекторов, у которых время оборота трубки составляет всего 320-350 мс, а толщина среза – 0,5 с. В 2008 г. появились приборы с 256 и 320 рядами детекторов. В настоящее время все новые системы КТ являются мультиспиральными. Благодаря техническому прогрессу, КТ стала применяться в областях, ранее недоступных для нее. Появилась КТ-ангиография, метод стал использоваться для визуализации полых органов. Были созданы методики КТ-колонографии и гастрографии. Было доказано, что диагностическая эффективность КТ-колоноскопии сопоставимо с таковой традиционной фиброволоконной колоноскопии. Учитывая быстроту выполнения и необременительность КТ-колонографии пациентов, обсуждается целесообразность применения этого метода для скрининга рака толстой кишки.
Были созданы методики КТ-колонографии и гастрографии. Было доказано, что диагностическая эффективность КТ-колоноскопии сопоставимо с таковой традиционной фиброволоконной колоноскопии. Учитывая быстроту выполнения и необременительность КТ-колонографии пациентов, обсуждается целесообразность применения этого метода для скрининга рака толстой кишки.
Однако наиболее распространенным является применение КТ для диагностики и дифференциальной диагностики очаговых поражений печени и поджелудочной железы. Стандартным является выполнение КТ с болюсным введением 100-140 мл контрастного средства. Многофазное исследование в различные фазы контрастирования (из которых важнейшими являются артериальная и портально-венозная) позволяет выявлять и характеризовать очаговые поражения печени и поджелудочной железы, планировать лечение и оценивать его результаты. С помощью МСКТ можно с высокой точностью визуализировать артерии и вены органов брюшной полости, а также желчные протоки.
Благодаря быстроте и надежности МСКТ все чаще используется при обследовании пациентов с диагнозом «острый живот» (выявление перфорации полых органов, кровотечений, кишечной непроходимости, мезентериальной ишемии, острого аппанедицита, панкреатита, холецистита и другой патологии).
МРТ реже используется в исследованиях органов брюшной полости, чем УЗИ и МСКТ, – в первую очередь, по экономическим соображениям. Тем не менее, при правильно выбранных показаниях она дает важную диагностическую информацию. Одной из важнейших областей применения МРТ являются исследования печени. Благодаря мультипараметрическому характеру МР-изображений, возможности получения серий срезов с варьирующими параметрами, подчеркивающих контрастность по параметрам магнитной релаксации (Т1, Т2), подавлению сигнала от жира, хорошей визуализации артерий и вен без контрастирования, МРТ стала важнейшим методом выявления очаговых поражений печени. Методика МР-холангиографии позволяет видеть вне- и внутрипеченочные желчные протоки неинвазивно, не прибегая к искусственному контрастированию. Эта методика основывается на усилении сигнала от неподвижной жидкости (желчь) и подавлению сигнала от плотных тканей и крови. При раздутии очищенных от внутрикишечного содержимого петель толстой кишки воздухом или специальными жидкостями возможно выполнение методики МР-энтерографии или колонографии. Использование контрастных препаратов на основе гадолиния («Магневист», «Гадовист», «Омнискан», «Оптимарк» и пр.) еще более расширяет возможности метода. Относительно недавно появился новый класс контрастных средств для МРТ – гепатотропные (орган-специфические) агенты, такие как «Примовист», «Тесласкан» и ряд других. Эти препараты обладают двойным механизмом действия, позволяя характеризовать как васкуляризацию, так и клеточный состав изучаемых внутрипеченочных структур.
Использование контрастных препаратов на основе гадолиния («Магневист», «Гадовист», «Омнискан», «Оптимарк» и пр.) еще более расширяет возможности метода. Относительно недавно появился новый класс контрастных средств для МРТ – гепатотропные (орган-специфические) агенты, такие как «Примовист», «Тесласкан» и ряд других. Эти препараты обладают двойным механизмом действия, позволяя характеризовать как васкуляризацию, так и клеточный состав изучаемых внутрипеченочных структур.
УЗИ, МСКТ и МРТ используются, как уже говорилось, и для изучения структур пищеварительного канала. В качестве примера следует упомянуть эндоскопическое УЗИ (исследования прямой кишки, пищевода, головки поджелудочной железы), КТ- и МРТ-колонографию, гастро- и энтерографию.
Область использования радионуклидных методов в абдоминальной радиологии существенно сократилась. Они утратили свое значение в качестве методик изучения анатомии внутренних органов. Основная роль радионуклидных методов (в первую очередь – позитрон-эмиссионной томографии /ПЭТ/) в абдоминальной радиологии – стадирование опухолей, выявление метастатических поражений (прежде всего – печени). Реже радионуклидные методы применяют для выявления скрытых (оккультных) кровотечений из ЖКТ и изучения функции печени.
Реже радионуклидные методы применяют для выявления скрытых (оккультных) кровотечений из ЖКТ и изучения функции печени.
Ангиографические методы, в связи с развитием УЗИ, МСКТ и МРТ, в значительной степени утратили свое диагностическое значение. Сейчас они преимущественно используются для планирования и проведения интервенционных вмешательств на полых и паренхиматозных органах (стентирование, остановка кровотечений, хемоэмболизация и пр.).
Основные области использования лучевых методов диагностики болезней органов брюшной полости представлены в таблице 1.
Таблица 1. Методы исследования органов брюшной полости
| Исследуемый орган | Метод | Цель исследования |
|---|---|---|
| Органы брюшной полости |
Обзорный снимок брюшной полости | Обследование пациентов с «острым животом», диагностика кишечной непроходимости, перфорации полых органов, выявление рентгенопозитивных конкрементов |
| Пищевод | Рентгенография/рентгеноскопия пищевода | Выявление грыж пищеводного отверстия диафрагмы, дивертикулов, стриктур, обтураций, варикозного расширения вен, опухолей, инородных тел |
| Желудок и 12-перстная кишка | Рентгенография/рентгеноскопия по обычной методике Рентгенография/рентгеноскопия двойным контрастированием |
Диагностика язв, опухолей, стриктур, обтураций, синдрома нарушенного всасывания, контроль результатов операции |
| 12-перстная кишка | Релаксационная дуоденография | Диагностика опухолей головки поджелудочной железы, Фатерова соска, болезней 12-перстной кишки |
| Тонкая кишка | Пассаж бария (пероральное контрастирование) Энтероклизма (чреззондовое введение контрастного вещества) |
Диагностика проходимости кишки, выявление причин стриктур, обструкции, опухолей, воспалительных заболеваний |
| Толстая кишка | Ирриогоскопия (ретроградное контрастирование) Двойное контрастирование КТ-колоноскопия МР-колоноскопия Эндоскопическое УЗИ |
Диагностика опухолей, воспалительных заболеваний, дивертикулов, выявление причин кишечной непроходимости |
| Желчный пузырь и протоки |
Ретроградная панкреатохолангиография Прямая (пункционная) холангиография УЗИ, КТ, МРТ МР-холангиография |
Оценка состояния внепеченочных и внутрипеченочных желчных протоков (конкременты, стриктуры, опухоли), диагностика опухолей головки поджелудочной железы, Фатерова соска, воспалительных и опухолевых заболеваний |
| Печень | УЗИ КТ МРТ ПЭТ |
Диагностика и дифференциальная диагностика очаговых поражений печени, диффузных болезней, травм |
| Поджелудочная железа | УЗИ Эндоскопическое УЗИ КТ МРТ |
Воспалительные заболевания, конкременты, опухоли, травмы, аномалии развития |
ЧАСТНАЯ ПАТОЛОГИЯ
Пищевод
Для исследования пищевода традиционно используется рентгенологическое исследование с барием (рис. 1). Процесс прохождения глотков бариевой взвеси (или специального бариевого препарата) регистрируют с помощью флюороскопии в реальном масштабе времени. Частое показание к рентгенологическому исследованию пищевода – диагностика желудочно-пищеводного рефлюкса. Он проявляется обратным забросом бариевой взвеси из желудка в пищевод при исследовании в горизонтальном положении или в положении Тренделенбурга. В случае обструкции пищевода инородным телом рентгенологическое исследование позволяет немедленно установить его уровень и выраженность. С помощью этого метода хорошо видны участки расширения и сужения пищевода при доброкачественных стриктурах (рубцовых, ахалазии). Для ахалазии характерно расширение проксимальной части пищевода и сужение его дистального отдела в форме «клюва». При опухолях пищевода (доброкачественных и злокачественных) виден дефект наполнения пищевода. Характерным признаком злокачественных образований (рака) является изъязвление слизистой и изменение ее рентгенологического рисунка, ригидность стенок пищевода, неровные контуры опухоли (рис.
1). Процесс прохождения глотков бариевой взвеси (или специального бариевого препарата) регистрируют с помощью флюороскопии в реальном масштабе времени. Частое показание к рентгенологическому исследованию пищевода – диагностика желудочно-пищеводного рефлюкса. Он проявляется обратным забросом бариевой взвеси из желудка в пищевод при исследовании в горизонтальном положении или в положении Тренделенбурга. В случае обструкции пищевода инородным телом рентгенологическое исследование позволяет немедленно установить его уровень и выраженность. С помощью этого метода хорошо видны участки расширения и сужения пищевода при доброкачественных стриктурах (рубцовых, ахалазии). Для ахалазии характерно расширение проксимальной части пищевода и сужение его дистального отдела в форме «клюва». При опухолях пищевода (доброкачественных и злокачественных) виден дефект наполнения пищевода. Характерным признаком злокачественных образований (рака) является изъязвление слизистой и изменение ее рентгенологического рисунка, ригидность стенок пищевода, неровные контуры опухоли (рис. 2). Различные виды патологии пищевода (грыжи пищеводного отверстия диафрагмы, опухоли, расширения) хорошо выявляются с помощью КТ или МРТ. КТ позволяет хорошо выявлять распространение опухолей за пределы пищевода. Для детальной оценки стенок пищевода иногда используют эндоскопическое УЗИ.
2). Различные виды патологии пищевода (грыжи пищеводного отверстия диафрагмы, опухоли, расширения) хорошо выявляются с помощью КТ или МРТ. КТ позволяет хорошо выявлять распространение опухолей за пределы пищевода. Для детальной оценки стенок пищевода иногда используют эндоскопическое УЗИ.
У пациентов с циррозом печени рентгенографию пищевода назначают для обнаружения варикозно-расширенных вен. С целью уточнения нарушения моторики пищевода иногда назначается манометрия нижнего пищеводного сфинктера с измерением силы и длительности перистальтических сокращений.
Желудок и 12-перстная кишка
Как уже говорилось, из-за более высокой информативности эндоскопические методы несколько потеснили рентгенологические при диагностике болезней желудка и 12-перстной кишки. В то же время существенно, что рентгеноскопия желудка дает цельную картину об анатомии и функции исследуемых органов (рис.3). Это особенно важно при выявлении диффузно растущих опухолей, оценке степени рубцовых поражений стенок, нарушений эвакуации содержимого. По этой причине рентгеноскопия и рентгенография желудка и 12-перстной кишки входят в большинство стандартных схем обследования пациентов с болезнями этих органов.
По этой причине рентгеноскопия и рентгенография желудка и 12-перстной кишки входят в большинство стандартных схем обследования пациентов с болезнями этих органов.
При диагностике гастритов данные рентгенографии неспецифичны и лишь в случае гипертрофического или склерозирующего (ригидного) гастрита можно увидеть грубые изменения рисунка слизистой (гипертрофия или сглаживание, ригидность стенок).
Классическим показанием к рентгенологическому исследованию желудка является диагностика язв желудка и 12-перстной кишки. Язвы желудка чаще всего локализуются на малой кривизне, а 12-перстной кишки – в области ее луковицы. Однако возможна любая локализация язв. Наиболее надежными рентгенологическими симптомами язв являются симптомы «ниши» и «кратера», локальные изменения рисунка слизистой, отек и ригидность стенки в месте локализации язвы (рис.4, рис.5). Рентгенография хорошо выявляет последствия язвенной болезни – участки рубцовой деформации желудка и 12-перстной кишки. Иногда язвы могут осложняться пенетрацией в окружающие органы (поджелудочную железу, печеночно-дуоденальную связку, сальник, печень и желчные пути), а также в брюшную полость. В этом случае при обзорной рентгенографии или при выполнении снимка на правом боку (латерография) выявляется свободный воздух в брюшной полости, указывающий на перфорацию полого органа. Следует заметить, что при подозрении на перфорацию одного из органов пищеварительного канала противопоказан прием бария. Для контрастирования органов пищеварительного канала в этом случае используют водорастворимые йодсодержащие контрастные вещества. Диагностика перфораций и сопутствующих им осложнений возможна также с помощью УЗИ и КТ.
Иногда язвы могут осложняться пенетрацией в окружающие органы (поджелудочную железу, печеночно-дуоденальную связку, сальник, печень и желчные пути), а также в брюшную полость. В этом случае при обзорной рентгенографии или при выполнении снимка на правом боку (латерография) выявляется свободный воздух в брюшной полости, указывающий на перфорацию полого органа. Следует заметить, что при подозрении на перфорацию одного из органов пищеварительного канала противопоказан прием бария. Для контрастирования органов пищеварительного канала в этом случае используют водорастворимые йодсодержащие контрастные вещества. Диагностика перфораций и сопутствующих им осложнений возможна также с помощью УЗИ и КТ.
Рентгенография и рентгеноскопия остаются важными методами диагностики доброкачественных и злокачественных опухолей желудка. Их дифференциальная диагностика основывается на анализе контуров опухоли, характера изменений складок желудка и локальной ригидности его стенок (рис.6). Во всех случаях при выявлении опухоли при рентгенологическом исследовании желудка и 12-перстной кишки назначается эндоскопия с биопсией. В настоящее время все чаще и чаще опухоли желудка впервые выявляют при проведении КТ органов брюшной полости (рис.7) (чаще всего как случайную находку), после чего пациентов направляют на специализированное исследование. УЗИ и МСКТ широко используются для оценки локальной инвазии злокачественных опухолей (прорастание стенки желудка и окружающих структур) и выявления локальных и удаленных метастазов.
В настоящее время все чаще и чаще опухоли желудка впервые выявляют при проведении КТ органов брюшной полости (рис.7) (чаще всего как случайную находку), после чего пациентов направляют на специализированное исследование. УЗИ и МСКТ широко используются для оценки локальной инвазии злокачественных опухолей (прорастание стенки желудка и окружающих структур) и выявления локальных и удаленных метастазов.
Тонкая кишка
Как уже упоминалось, для исследований тонкой кишки используют оценку пассажа по ней бариевой взвеси или водорастворимого контрастного средства, а также чреззондовую энтерографию. В последнее время большое внимание привлекли такие методики, как КТ- или МР-энтерография, при которых возможно построение трехмерных изображений органа и построение изображений просвета кишки в эндоскопическом режиме. Опухоли тонкой кишки, по сравнению с выше- и нижележащими отделами пищеварительного канала, встречаются редко. При лучевом исследовании этого органа частым показанием к исследованию является диагностика тонкокишечной непроходимости и выяснение ее причины, выявление локальных воспалительных поражений (чаще всего – терминального отдела при болезни Крона), обследование пациентов с синдромом «острого живота». При подозрении на острую тонкокишечную непроходимость выполняют обзорный снимок брюшной полости (рис.9), еще более информативным в выявлении обструкции и диагностике ее причины назначают КТ или УЗИ. Использование МР- или КТ-энтерографии при болезни Крона позволяет получить информацию, зачастую недоступную для эндоскопического исследования. Так, эти методы дают возможность видеть не только утолщенные, изъязвленные участки стенки подвздошной кишки, но и инфильтрацию окружающей клетчатки, локальное расширение сосудов брыжейки, увеличение региональных лимфатических узлов.
При подозрении на острую тонкокишечную непроходимость выполняют обзорный снимок брюшной полости (рис.9), еще более информативным в выявлении обструкции и диагностике ее причины назначают КТ или УЗИ. Использование МР- или КТ-энтерографии при болезни Крона позволяет получить информацию, зачастую недоступную для эндоскопического исследования. Так, эти методы дают возможность видеть не только утолщенные, изъязвленные участки стенки подвздошной кишки, но и инфильтрацию окружающей клетчатки, локальное расширение сосудов брыжейки, увеличение региональных лимфатических узлов.
Толстая кишка
Ирригоскопия по-прежнему является одним из важнейших методов исследования всех отделов толстой кишки. Она дополняет данные колоноскопии и позволяет получить более полную информацию о состоянии органа (рис.10). Одно из самых частых показаний к ирригоскопии – диагностика рака толстой кишки, полипов и дивертикулов. При ирригоскопии рак толстой кишки виден как дефект наполнения с четкой границей между неизмененной слизистой оболочкой и опухолью; выявляются признаки ригидности кишечной стенки. Нередко участок опухолевого поражения вызывает циркулярное сужение просвета кишки (симптом «яблочного огрызка»). Рентгенологические проявления рака толстой кишки зависят от гистологической формы опухоли, локализации и степени ее распространения. МСКТ и в особенности методика КТ-колонографии могут служить альтернативой ирригоскопии в скрининге и диагностике рака толстой кишки. КТ позволяет лучше видеть изменения кишечной стенки и стадировать заболевание (рис.12). Для диагностики ранних стадий рака прямой и сигмовидной кишки стало применяться и трансректальное УЗИ.
Нередко участок опухолевого поражения вызывает циркулярное сужение просвета кишки (симптом «яблочного огрызка»). Рентгенологические проявления рака толстой кишки зависят от гистологической формы опухоли, локализации и степени ее распространения. МСКТ и в особенности методика КТ-колонографии могут служить альтернативой ирригоскопии в скрининге и диагностике рака толстой кишки. КТ позволяет лучше видеть изменения кишечной стенки и стадировать заболевание (рис.12). Для диагностики ранних стадий рака прямой и сигмовидной кишки стало применяться и трансректальное УЗИ.
Помимо злокачественных опухолей, рентгенологические исследования толстой кишки позволяют выявить воспалительные заболевания толстой кишки (дивертикулит (рис.13), язвенный или гранулематозный колит), врожденные аномалии развития (болезнь Гиршпрунга, мегаколон), нарушения мезентериального кровообращения.
Обзорный снимок брюшной полости, УЗИ и КТ позволяют выяснить причину острого живота и кишечной непроходимости. Одной из самых частых причин синдрома «острого живота» при локализации боли в правом нижнем квадранте является аппендицит. КТ и УЗИ (рис.14) обеспечивают визуализацию воспаленного и увеличенного червеобразного отростка, своевременную диагностику осложнений (развитие инфильтратов, абсцедирования, перфорации). Эти два метода незаменимы и для диагностики других причин «острого живота» (обструкция мочеточника камнем, острый панкреатит, острый холецистит, панкреатит, перфорация полого органа и другой патологии).
Одной из самых частых причин синдрома «острого живота» при локализации боли в правом нижнем квадранте является аппендицит. КТ и УЗИ (рис.14) обеспечивают визуализацию воспаленного и увеличенного червеобразного отростка, своевременную диагностику осложнений (развитие инфильтратов, абсцедирования, перфорации). Эти два метода незаменимы и для диагностики других причин «острого живота» (обструкция мочеточника камнем, острый панкреатит, острый холецистит, панкреатит, перфорация полого органа и другой патологии).
Та же тенденция прослеживается и в диагностике кишечной непроходимости. Чаще всего встречается механическая кишечная непроходимость, вызванная опухолями, спайками, инвагинациями, грыжами, желчными и каловыми камнями. При развитии кишечной непроходимости развивается пневматоз кишечника, по мере ее прогрессирования в петли кишечника жидкостью. Уровни жидкости со скоплениями газа над ними в расширенных петлях кишки («чаши Клойбера») являются классическим симптомом кишечной непроходимости. При тонкокишечной непроходимости вертикальные размеры «чаш Клойбера» преобладают над горизонтальными, видны характерные полулунные складки слизистой петель кишки; при толстокишечной горизонтальные размеры уровней жидкости превалируют над вертикальными, видны гаустры. КТ и УЗИ лучше выявляют кишечную непроходимость на ранних стадиях ее развития нежели обзорный снимок, кроме того, обычно с их помощью удается установить и ее причину (рис.15).
При тонкокишечной непроходимости вертикальные размеры «чаш Клойбера» преобладают над горизонтальными, видны характерные полулунные складки слизистой петель кишки; при толстокишечной горизонтальные размеры уровней жидкости превалируют над вертикальными, видны гаустры. КТ и УЗИ лучше выявляют кишечную непроходимость на ранних стадиях ее развития нежели обзорный снимок, кроме того, обычно с их помощью удается установить и ее причину (рис.15).
Печень
Как уже упоминалось выше, лучевая диагностика заболеваний печени сегодня в основном основывается на использовании УЗИ, КТ и МРТ, реже – ПЭТ.
Применение методов лучевой диагностики при основных болезнях печени зависит от характеристик самого заболевания и возможностей метода.
При диффузных заболевания печени лучевые методы диагностики играют вспомогательную роль. Они используются для дифференциального диагноза (исключение опухолевых поражений), оценки размеров и структуры органа, динамического наблюдения.
Так, при гепатитах (вирусных, токсических, алкогольных) данные методов лучевой диагностики неспецифичны. Печень может быть увеличена или уменьшена в размерах, могут встречаться признаки неоднородности структуры печени при УЗИ. Может определяться диффузное увеличение органа.
Диагностика жировой инфильтрации печени с помощью лучевых методов вполне надежна. Как правило, области жировой инфильтрации чередуются с участками нормальной паренхимы печени. Жировая инфильтрация не приводит к нарушению архитектоники сосудов печени или масс-эффекту. Картина жировой инфильтрации может претерпевать быструю динамику, что имеет важное дифференциально-диагностическое и прогностическое значение. При УЗИ жировая дистрофия печени хорошо видна. Она выглядит как диффузные изменения печени с пониженной эхогенностью, перемежающиеся с участками неизмененной ткани. При КТ отмечается значительное снижение плотности паренхимы органа (до 20-30 единиц Хаунсфилда) (рис.16). Из-за понижения ее плотности пораженные сегменты становятся отчетливо видимыми на фоне неизмененных участков печеночной ткани и сосудов печени. В норме плотность печени несколько выше, чем плотность селезенки. Поэтому при жировой инфильтрации снижение плотности ткани печени видно даже без помощи денситометрии. МРТ редко применяется для подтверждения диагноза, т.к. УЗИ и КТ вполне достаточно для этой цели. Однако если у этих больных проводится МРТ, то применяют специальные программы исследования (импульсные последовательности с подавлением сигнала от жировой ткани).
Из-за понижения ее плотности пораженные сегменты становятся отчетливо видимыми на фоне неизмененных участков печеночной ткани и сосудов печени. В норме плотность печени несколько выше, чем плотность селезенки. Поэтому при жировой инфильтрации снижение плотности ткани печени видно даже без помощи денситометрии. МРТ редко применяется для подтверждения диагноза, т.к. УЗИ и КТ вполне достаточно для этой цели. Однако если у этих больных проводится МРТ, то применяют специальные программы исследования (импульсные последовательности с подавлением сигнала от жировой ткани).
При диагностике цирроза печени информативность методов лучевой диагностики существенно выше. Выделяют макроузловую, микроузловую и смешанную формы цирроза печени. При микроузловом циррозе печень уменьшена в размерах и значительно уплотнена, регенеративная активность выражена незначительно. При макроузловом циррозе выявляются множественных узлы регенерации, некоторые из них мультилобулярные, с перегородками. Основными критериями диагностики цирроза являются уменьшение размеров печени (на начальных этапах заболевания печень может быть увеличена в размерах), выявление множественных узлов регенерации, наличие признаков портальной гипертензии, спленомегалии, асцита. Наиболее информативными для диагностики являются КТ, УЗИ и МРТ (рис.17). Оценка характера кровотока в портальной вене и печеночных венах с помощью УЗ-допплерографии может оказывать помощь в оценке степени нарушения венозного кровотока в органе. Иногда возникает необходимость в дифференциальной диагностике очагов печеночно-клеточного рака и узлов регенерации при циррозе. В сложных для диагностики случаях прибегают к пункционной биопсии. Она может выполняться под контролем УЗИ или КТ, что повышает точность забора материала и уменьшает риск осложнений.
Основными критериями диагностики цирроза являются уменьшение размеров печени (на начальных этапах заболевания печень может быть увеличена в размерах), выявление множественных узлов регенерации, наличие признаков портальной гипертензии, спленомегалии, асцита. Наиболее информативными для диагностики являются КТ, УЗИ и МРТ (рис.17). Оценка характера кровотока в портальной вене и печеночных венах с помощью УЗ-допплерографии может оказывать помощь в оценке степени нарушения венозного кровотока в органе. Иногда возникает необходимость в дифференциальной диагностике очагов печеночно-клеточного рака и узлов регенерации при циррозе. В сложных для диагностики случаях прибегают к пункционной биопсии. Она может выполняться под контролем УЗИ или КТ, что повышает точность забора материала и уменьшает риск осложнений.
При ряде заболеваний печени, связанных с метаболическими нарушениями, лучевые методы диагностики позволяют выявить специфические симптомы, облегчающие их диагностику. В качестве примера можно привести болезнь Коновалова-Вильсона и гемохроматоз.
В качестве примера можно привести болезнь Коновалова-Вильсона и гемохроматоз.
Гепатоцеребральная дистрофия (болезнь Коновалова-Вильсона) обусловлена нарушениями обмена меди, которая откладывается в печени, почках, головном мозге. При обследованиях печени обнаруживают явления гепатита или цирроза различной степени выраженности. Однако самым важным является характерное увеличение плотности паренхимы печени при КТ (или повышение интенсивности сигнала при МРТ). Это связано с повышенным содержанием в органе ионов меди. При гемохроматозе (первичном или вторичном) происходит повышенное накопление железа в клетках ретикуло-эндотелиальной системы. Соответственно этому меняется характер изображения печени на компьютерных томограммах (повышение плотности) и изменение сигнала при МРТ (низкая интенсивность сигнала от паренхимы печени как на Т1, так и на Т2-взвешенных изображениях – рис.18). Последнее объясняется особенностями магнитных свойств оксидов железа в клетках ретикуло-эндотелиальной системы.
Исключительно важным является диагностика и дифференциальная диагностика объемных образований печени. К ним относятся простые кисты печени, паразитарные болезни, абсцессы, эхинококкоз и альвеококкоз, метастазы органных опухолей и первичные опухоли печени.
Простые кисты печени встречаются достаточно часто. На ультразвуковых и томо- графических изображениях они имеют различные размеры, тонкие стенки, однородное содержимое с характеристиками, характерными для жидкости, по плотности близкой к воде. Внутри кист отсутствуют сосуды. Содержимое простых кист не усиливается при введении контрастного препарата. Кисты печени встречаются у 20-40% пациентов с поликистозом почек.
Все методы лучевой диагностики – УЗИ, КТ, МРТ – позволяют с высокой точностью выявлять кисты печени (рис.19).
Абсцессы печени могут иметь различное происхождение. Чаще всего встречаются микробные (кишечная палочка, стрептококк, анаэробная инфекция) и паразитарные (амебные) абсцессы печени.
Инфекционные абсцессы могут возникать после травм печени, хирургических вмешательств, при холангите, сепсисе, флебите портальной вены. При допплеровском ультразвуковом исследовании видна повышенная васкуляризация капсулы, отсутствие сигнала от кровотока внутри полости абсцесса. При УЗИ абсцесс печени проявляется как округлая структура с плотной, неровной капсулой, имеющая толстые стенки и неровную внутреннюю поверхность. Внутри лоцируется плотное жидкое содержимое, возможно наличие газа. Для амебных абсцессов характерна толстая капсула с множественным внутренними перегородками, отсутствие скоплений газа в абсцессе, нередки множественные поражения. Схожая картина получается при использовании КТ и МРТ. В сомнительных случаях прибегают к внутривенному контрастированию. Повышение контрастности капсулы абсцесса и выявление пузырьков газа в его полости позволяет поставить правильный диагноз (рис.20).
С помощью методов лучевой диагностики (чаще всего КТ и УЗИ) выполняют различные виды манипуляций для лечения абсцессов, такие как пункция и дренирование.
Печень, селезенка и легкие являются основными органами диссеминации личинок эхинококка и альвеококка. Поражения других органов (почки, мог, сердце и пр.) встречаются гораздо реже. Первоначально, после заражения, кисты имеют небольшой размер (2-3 мм), и выявление их бывает крайне затруднительным. По мере их роста диагноз облегчается. Для всех методов наиболее характерными признаками эхинококкоза являются наличие в печени кист различного размера с четкими, тонкими и ровными стенками. Диагноз эхинококкоза облегчается при обнаружении внутри или снаружи образования дочерних кист (рис.21). При эхинококкозе в 30% случаев стенки кисты кальцинированы. В случае гибели паразита часто наблюдается частичное или полное отслоение внутренней оболочки, которая становится хорошо видимой внутри кистозной полости. При альвеококкозе кисты множественные, контуры их нечеткие из-за инфильтративного роста с воспалительными и некротическими реакциями по периферии кист. Плотность внутри кисты выше, чем при эхинококкозе. Поэтому образование может напоминать растущую опухоль.
Поэтому образование может напоминать растущую опухоль.
К очаговым поражениям печени относятся доброкачественные и злокачественные опухоли печени и метастазы органных опухолей в печень.
Среди доброкачественных опухолей наиболее часто встречаются гемангиомы, фокальная узловая гиперплазия и аденома печени.
Гемангиома – наиболее часто встречающаяся доброкачественная опухоль печени. Она встречается у 1-5% взрослого населения. В подавляющем большинстве случаев гемангиомы обнаруживают случайно при УЗИ или томографии печени. Очень редко гигантские (>10 см) гемангиомы могут сопровождаться клинической симптоматикой из-за сдавления окружающих структур, тромбоза, геморрагий. При УЗИ гемангиома выглядит как округлое образование с множественными сигналами внутри опухоли от мелких сосудов. На КТ-изображениях гемангиомы в типичных случаях выглядят как округлые образования с низкой плотностью и четкими контурами. При выявлении образования, похожего на гемангиому, обязательно проводить внутривенное контрастирование. Характерным для гемангиом является центропетальная (от периферии к центру) последовательность заполнения гемангиомы контрастным препаратом (рис.22).
Характерным для гемангиом является центропетальная (от периферии к центру) последовательность заполнения гемангиомы контрастным препаратом (рис.22).
При МРТ, из-за длительного времени релаксации на Т2-взвешенных изображениях, характерно очень яркое изображение опухоли на фоне темной паренхимы печени. При динамическом контрастном МР-исследовании с гадолинием характер заполнения опухоли контрастом тот же, что и при КТ. Большие гемангиомы могут иметь нетипичный вид – протяженные центральные зоны, плохо, или не накапливающие контрастный препарат (рубцы, участки гиалиноза). В редких случаях для диагностик гемангиом используют сцинтиграфию печени с меченными эритроцитами или ангиографию.
Фокальная узловая гиперплазия – редкая доброкачественная опухоль печени, обычно встречающаяся у молодых женщин (до 75% случаев). Она состоит из гепатоцитов, купферовских клеток и желчных протоков. В ее центральной части обычно располагается рубец, от которого расходятся перегородки (септы). Она может быть множественной. На изображениях эта опухоль характеризуется отсутствием капсулы, гомогенностью структуры и гиперваскулярностью. Без контрастного усиления опухоль обычно имеет такие же характеристики сигнала, что и паренхима печени. Большая опухоль может вызывать нарушение хода сосудов печени. Эта опухоль гиперваскулярна, поэтому она хорошо выявляется при динамической КТ или МРТ с контрастным усилением в артериальную фазу (рис.23). Обычно хорошо виден гипоинтенсивный центральный рубец, который в отстроченную фазу накапливает контрастный препарат, в то время как паренхима опухоли становится мало отличимой от нормальной печени.
Она может быть множественной. На изображениях эта опухоль характеризуется отсутствием капсулы, гомогенностью структуры и гиперваскулярностью. Без контрастного усиления опухоль обычно имеет такие же характеристики сигнала, что и паренхима печени. Большая опухоль может вызывать нарушение хода сосудов печени. Эта опухоль гиперваскулярна, поэтому она хорошо выявляется при динамической КТ или МРТ с контрастным усилением в артериальную фазу (рис.23). Обычно хорошо виден гипоинтенсивный центральный рубец, который в отстроченную фазу накапливает контрастный препарат, в то время как паренхима опухоли становится мало отличимой от нормальной печени.
Аденома – редкая доброкачественная опухоль печени, состоящая из гепатоцитов. Кровоснабжается она одной или несколькими дополнительными веточками почечной артерии. При выполнении УЗИ, КТ или МРТ выглядит как объемное образование, нередко окруженное тонкой псевдокапсулой (зоной фиброза). В ткани опухоли могут выявляться участки кровоизлияний, центральный рубец отсутствует. При проведении КТ и МРТ с контрастным усилением аденома контрастируется преимущественно в артериальную фазу. При этом отмечается негомогенное повышение плотности. Иногда аденому трудно дифференцировать от гепатоцеллюлярного рака.
При проведении КТ и МРТ с контрастным усилением аденома контрастируется преимущественно в артериальную фазу. При этом отмечается негомогенное повышение плотности. Иногда аденому трудно дифференцировать от гепатоцеллюлярного рака.
Злокачественные опухоли печени делятся на первичные и вторичные (метастазы). Из злокачественных опухолей часто встречается гепатома (гепатоцеллюлярный рак), реже – холангиокарцинома (холангиоклеточный рак).
Гепатоцеллюлярный рак (гепатома) – наиболее часто встречающаяся первичная опухоль печени. Риск развития гепатомы повышен у пациентов с циррозом печени, гепатитами В и С, гемохроматозом. Выделяют узловую (солитарную), многоузловую и диффузную формы заболевания. Характерна инвазия опухоли в портальную и печеночные вены (до 30% случаев). Гепатома может метастазировать в другие органы (легкие, кости, лимфатические узлы).
Изображения гепатомы, получаемые при лучевых методах диагностики, достаточно разнообразны. Для опухоли характерна негомогенность внутреннего строения, внутриопухолевые перегородки, может выявляться центральный рубец, некротические или кистозные участки, капсула, наличие дочерних узлов. Опухоль может проникать в сосуды, иметь включения кальция и сопровождаться асцитом. Гепатомы, как правило, характеризуются повышенной васкуляризацией и наличием артерио-венозных шунтов. По этой причине при выполнении УЗ-допплерографии, ангиографии или КТ и МРТ с контрастированием они лучше всего видны в артериальную фазу (рис.24).
Для опухоли характерна негомогенность внутреннего строения, внутриопухолевые перегородки, может выявляться центральный рубец, некротические или кистозные участки, капсула, наличие дочерних узлов. Опухоль может проникать в сосуды, иметь включения кальция и сопровождаться асцитом. Гепатомы, как правило, характеризуются повышенной васкуляризацией и наличием артерио-венозных шунтов. По этой причине при выполнении УЗ-допплерографии, ангиографии или КТ и МРТ с контрастированием они лучше всего видны в артериальную фазу (рис.24).
При диагностике гепатом лучевые методы позволяют определить размеры и расположение опухоли и выявить наличие локальных внутрипеченочных метастазов, инвазии в вены печени. Эти данные очень важны для выбора метода лечения и определения прогноза.
Холангиоклеточный рак (холангиокарцинома) – злокачественная опухоль, растущая из внутрипеченочных желчных протоков. При УЗИ или КТ может иметь вид гиподенсного (гипоинтенсивного при МРТ) очага или мультифокального образования с инфильтративным ростом по ходу желчных протоков (рис. 25). Наиболее яркое проявление заболевания – выраженное расширение внутрипеченочных желчных протоков выше места их обструкции опухолью и контрастирование ткани самого образования. КТ, МРТ и особенно МР-холангиография облегчают диагностику опухолевого поражения желчных протоков. Холангиокарцинома, поражающая область слияния внутрипеченочных желчных протоков и вызывающая их обструкцию, получила название опухоли Клацкина. Заболевание следует дифференцировать со случаями доброкачественного врожденного кистозного расширения желчных протоков (болезнь Кароли).
25). Наиболее яркое проявление заболевания – выраженное расширение внутрипеченочных желчных протоков выше места их обструкции опухолью и контрастирование ткани самого образования. КТ, МРТ и особенно МР-холангиография облегчают диагностику опухолевого поражения желчных протоков. Холангиокарцинома, поражающая область слияния внутрипеченочных желчных протоков и вызывающая их обструкцию, получила название опухоли Клацкина. Заболевание следует дифференцировать со случаями доброкачественного врожденного кистозного расширения желчных протоков (болезнь Кароли).
Среди всех очаговых поражений печени важное значение придается выявлению метастазов злокачественных опухолей в печень. Выявление даже единичного небольшого по размеру метастаза в печень меняет стадию процесса и, соответственно, выбор лечебной тактики и прогноз заболевания. Все методы современной лучевой диагностики позволяют визуализировать метастазы в печень. Их чувствительность и специфичность колеблются в пределах 75-90% и зависят от характеристик самого метода, методики исследования, гистологического строения, васкуляризации и размеров очагов. Чаще всего в качестве начального метода исследования назначают УЗИ. В сложных ситуациях диагностический алгоритм расширяется. Выполняют КТ с многофазным контрастированием и/или МРТ (также с контрастированием).
Чаще всего в качестве начального метода исследования назначают УЗИ. В сложных ситуациях диагностический алгоритм расширяется. Выполняют КТ с многофазным контрастированием и/или МРТ (также с контрастированием).
Метастазы в печень обнаруживают примерно у 30-40% пациентов, умерших от злокачественных заболеваний. Чаще всего источником метастатического поражения печени являются опухоли кишечника и желудка, поджелудочной железы, рак легкого и молочной железы. В печень метастазируют и опухоли других органов.
При УЗИ и томографии метастазы в печень видны как множественные мягкотканые очаги (симптом «монеток») (рис.26). В зависимости от гистологии первичного очага, они могут быть гиперваскулярными или гиповаскулярными (чаще всего). От вакуляризации во многом зависит вид метастатических очагов на томограммах и изменение их плотности (интенсивности при МРТ) во время контрастирования. Иногда встречаются метастазы с кальцинатами или с выраженным кистозным компонентом. В сомнительных случаях помощь в диагностике метастатических поражений может оказать ПЭТ или ПЭТ/КТ с 18-ФДГ.
В сомнительных случаях помощь в диагностике метастатических поражений может оказать ПЭТ или ПЭТ/КТ с 18-ФДГ.
Лучевые методы важны для диагностики портальной гипертензии. Синдром портальной гипертензии встречается при целом ряде заболеваний: тромбозе и компрессии портальной вены и ее ветвей, циррозе печени, холангите, застойной сердечной недостаточности и других заболеваниях. Поэтому при исследовании органов брюшной полости в обязательном порядке положено изучить и описать состояние сосудов печени и селезенки. Портальную гипертензию диагностируют на основании расширения воротной вены, выявления варикозного расширения коллатеральных вен, спленомегалии, асцита. При диагностике тромбоза воротной вены или синдрома Бадда-Киари (тромбоз печеночных вен) большую роль играют КТ или МРТ, выполненные в ангиографическом режиме. Методом УЗ-допплерографии можно определить скорость и направления кровотока в воротной и селезеночной венах.
Заболевания селезенки встречаются значительно реже, чем болезни печени. Диагностика осуществляется с помощью УЗИ и КТ, реже методом МРТ. В селезенке могут встречаться доброкачественные опухоли: гамартомы и гемангиомы. Из злокачественных опухолей чаще всего диагностируются метастазы и поражение селезенки лимфопролиферативными заболеваниями (лимфогранулематоз, лимфомы). Первичные злокачественные опухоли селезенки очень редки. Принципы диагностики поражений селезенки такие же, как и печени.
Диагностика осуществляется с помощью УЗИ и КТ, реже методом МРТ. В селезенке могут встречаться доброкачественные опухоли: гамартомы и гемангиомы. Из злокачественных опухолей чаще всего диагностируются метастазы и поражение селезенки лимфопролиферативными заболеваниями (лимфогранулематоз, лимфомы). Первичные злокачественные опухоли селезенки очень редки. Принципы диагностики поражений селезенки такие же, как и печени.
Травмы селезенки ведут к образованию гематом и разрыву органа. Точная информация о состоянии селезенки влияет на выбор тактики лечения. Диагностика при этом, как правило, проводится в срочном порядке. Поэтому на первый план выходят УЗ- и КТ-исследования. И при УЗИ, и при КТ можно быстро получить исчерпывающую информацию. Инфаркты селезенки эмбологенного происхождения в острой стадии хорошо выявляются при КТ или МРТ с контрастным усилением. В хронической стадии в местах инфарктов КТ можно выявлять кальцинаты.
Поджелудочная железа
Заболевания поджелудочной железы являются частыми показаниями к направлению пациента на лучевое исследование.
Острый панкреатит в начальной стадии своего развития проявляется увеличением органа, диффузным изменением структуры железы из-за ее отека. По мере прогрессирования заболевания появляются перипанкреатические скопления жидкости, инфильтрация окружающей жировой клетчатки. Важно выявление некротических очагов в железе при тяжелом течении заболевания. Для обнаружения очагов панкреонекроза требуется проведение КТ с контрастным усилением (рис.27). В отдаленном периоде с помощью методов лучевой диагностики могут выявляться псевдокисты, кальцинаты, аневризмы артерий (чаще всего – ветвей селезеночной артерии). Панкреатит головки поджелудочной железы, приводящий к обструкции холедоха, иногда приходится дифференцировать с опухолью. Для этой цели прибегают к выполнению КТ или МРТ с контрастированием.
На хронический панкреатит указывает атрофия железы (иногда в сочетании с участками локальной гипертрофии), жировая дистрофия, фиброз или кальциноз ее паренхимы (рис. 28), камни в панкреатическом протоке и его расширение.
28), камни в панкреатическом протоке и его расширение.
Наиболее серьезные требования к методам лучевой диагностики предъявляются при подозрении на опухоль поджелудочной железы. К основным типам опухолей железы относятся рак железы (аденокарцинома и цистаденокарцинома), эндокринные опухоли, лимфома и метастазы.
Рак поджелудочной железы – самая частая злокачественная опухоль органа. Более половины случаев заболевания возникают в головке поджелудочной железы. В этой связи первыми признаками заболевания является желтуха. При диагностике приходится проводить дифференциацию между опухолью, отечной формой панкреатита и некальцинированным конкрементом желчного протока. Опухоли тела и хвоста железы долгое время не проявляются и поэтому часто диагностируются, достигнув большого размера (4-5 см).
Диагноз опухоли поджелудочной железы по данным УЗИ, КТ или МРТ преимущественно основывается на выявлении локального утолщения железы и очагового изменения характеристик сигнала в месте поражения. При уточнении причины желтухи и выявлении изменений в головке железы большую помощь оказывает эндоскопическое УЗИ и ретроградная панкреатохолангиография. Для уточнения диагноза часто выполняется Кт с динамическим контрастированием с тонкими срезами. Опухоль обычно выявляется в виде гиподенсного образования на фоне лучше контрастированной паренхимы железы (рис.29). МРТ с использованием болюсного усиления гадолинием увеличивает чувствительность и специфичность метода в выявлении образований.
При уточнении причины желтухи и выявлении изменений в головке железы большую помощь оказывает эндоскопическое УЗИ и ретроградная панкреатохолангиография. Для уточнения диагноза часто выполняется Кт с динамическим контрастированием с тонкими срезами. Опухоль обычно выявляется в виде гиподенсного образования на фоне лучше контрастированной паренхимы железы (рис.29). МРТ с использованием болюсного усиления гадолинием увеличивает чувствительность и специфичность метода в выявлении образований.
Для определения возможности выполнения резекции опухоли необходимо выявить распространенность опухоли. Методика КТ-ангиографии позволяет определить наличие инвазии опухоли в верхнебрыжеечную артерию и вену, чревный ствол или воротную вену или в прилежащие к железе органы (желудок, кишечник, сальник).
Большие трудности в диагностике представляют кистозные опухоли поджелудочной железы (цистаденокарцинома). Это злокачественная кистозного строения опухоль, содержащая муцин. Опухоль обычно локализуется в теле или хвосте поджелудочной железы. При УЗИ, КТ или МРТ опухоль выглядит как гиповаскулярная структура, ее перегородки и узлы накапливают контрастный препарат. Схожим образом может выглядеть доброкачественная опухоль – цистаденома или же многокамерная псевдокиста.
Опухоль обычно локализуется в теле или хвосте поджелудочной железы. При УЗИ, КТ или МРТ опухоль выглядит как гиповаскулярная структура, ее перегородки и узлы накапливают контрастный препарат. Схожим образом может выглядеть доброкачественная опухоль – цистаденома или же многокамерная псевдокиста.
Относительно редко в поджелудочной железе встречаются эндокринные опухоли (инсулиномы, гастриномы, випомы, соматостиномы, глюкагеномы и нефункционирующие опухоли). В большинстве случаев эти опухоли являются гиперваскулярными, поэтому они хорошо видны в артериальную фазу контрастирования при выполнении КТ или МРТ (рис.30). Селективная ангиография также позволяет выявить патологические сосуды опухоли. Большое значение для диагноза имеют признаки гормональной активности опухоли (гипогликемия в случае инсулиномы, синдром Золлингера-Эллисона при гастриномах и пр.). Метастазы в печень опухолей APUD системы также обычно бывают гиперваскулярными.
Желчный пузырь и желчные протоки
Частым показанием к лучевому исследованию является подозрение на желчекаменную болезнь и холециститы (калькулезный и безкалькулезный).
Ведущим методом диагностики заболеваний желчного пузыря и желчевыводящих путей является УЗИ. С помощью этого метода можно видеть конкременты в полости желчного пузыря и симптом «акустической тени» за конкрементом (рис.31). Конкременты в желчном пузыре и протоках хорошо видны при КТ (рис.32), а также при МР-холангиографии (как дефекты наполнения на фоне яркого сигнала от желчи). На современных мультиспиральных компьютерных томографах удается визуализировать даже «рентгенонегативные» (холестериновые) конкременты в пузыре, так как они обычно отличаются по плотности от желчи.
Для диагностики острого и хронического холецистита предпочтение отдают УЗИ. С его помощью можно выявить утолщение и инфильтрацию стенок пузыря (рис.33), расширение его полости, неоднородность желчи. При осложненном холецистите (абсцедирование или гангренозные изменения пузыря) можно выявить скопления газа и гноя. Часто выявляется скопление экссудата в ложе пузыря.
Применение ультразвукового исследования также предпочтительно при подозрении на холангиты. С помощью метода визуализируют расширение внутрипеченочных желчных протоков, перипротоковую инфильтрацию паренхимы печени, изменение плотности желчи внутри протоков. При хронических холангитах характерно выявление чередующихся участков сужения (стриктур) и расширения желчных протоков, фибротических и воспалительных изменений по их периферии, которые можно диагностировать с помощью РХПГ, МР-холангиографии или УЗИ. Могут выявляться камни во внутрипеченочных желчных протоках. При осложненных холангитах УЗИ, КТ и МРТ используют для диагностики таких осложнений заболевания, как внутрипеченочные абсцессы.
С помощью метода визуализируют расширение внутрипеченочных желчных протоков, перипротоковую инфильтрацию паренхимы печени, изменение плотности желчи внутри протоков. При хронических холангитах характерно выявление чередующихся участков сужения (стриктур) и расширения желчных протоков, фибротических и воспалительных изменений по их периферии, которые можно диагностировать с помощью РХПГ, МР-холангиографии или УЗИ. Могут выявляться камни во внутрипеченочных желчных протоках. При осложненных холангитах УЗИ, КТ и МРТ используют для диагностики таких осложнений заболевания, как внутрипеченочные абсцессы.
Лимфатические узлы и внеорганные опухоли
В забрюшинном пространстве расположены лимфатические протоки и несколько групп лимфатических узлов. Выявление их поражения при злокачественных заболеваниях имеет важное диагностическое значение. Даже при условно нормальных размерах узлов их количественное увеличение должно восприниматься с настороженностью. Чаще всего причиной увеличения забрюшинных лимфатических узлов являются метастазы злокачественных опухолей органов брюшной полости или таза. При лимфомах (лимфогранулематоз, неходжкинские лимфомы) пораженные лимфатические узлы отличаются от пораженных метастатическим процессом. Они сливаются в полициклические массы, которые могут вызывать смещение внутренних органов, обструкцию мочеточников, сосудов. Мезентериальная, забрюшинная или тазовая лимфоаденопатия могут быть проявлением СПИДа.
Чаще всего причиной увеличения забрюшинных лимфатических узлов являются метастазы злокачественных опухолей органов брюшной полости или таза. При лимфомах (лимфогранулематоз, неходжкинские лимфомы) пораженные лимфатические узлы отличаются от пораженных метастатическим процессом. Они сливаются в полициклические массы, которые могут вызывать смещение внутренних органов, обструкцию мочеточников, сосудов. Мезентериальная, забрюшинная или тазовая лимфоаденопатия могут быть проявлением СПИДа.
Выраженное увеличение лимфатических узлов может быть обнаружено при выполнении УЗИ. Однако оптимальным методом оценки всех групп лимфатических узлов брюшной полости является КТ. В сомнительных случаях прибегают к радионуклидным методам диагностики (ПЭТ).
В брюшной полости могут быть расположены внеорганные опухоли. Эти опухоли долгое время могут не проявлять себя клинически и обнаруживаться при диспансеризации либо при обследовании по другому поводу. В зависимости от гистологического типа (липомы, липосаркомы, мезотелиомы, тератомы и т. д.) они могут иметь различную плотность и отношение к контрастному веществу.
д.) они могут иметь различную плотность и отношение к контрастному веществу.
ЗАКЛЮЧЕНИЕ
Несмотря на прогресс лучевой диагностики, до сих пор нет единого универсального метода диагностики болезней органов брюшной полости. Их выбор и методика выполнения исследования во многом зависят от характера предполагаемого заболевания, остроты процесса и ведущего клинического синдрома. Тем не менее, очевидно, что продолжает увеличиваться роль УЗИ и КТ. Эти методики все чаще используются в острых, неотложных ситуациях, а также начали применяться и для обследования полых органов (кишка, желудок). МРТ и ПЭТ имеют большое значение в диагностике и дифференциальной диагностике опухолей печени.
Что такое поражение печени на МСКТ у онкологического больного: важно ли это?
1. Воти Дж. Н., Audisio RA, Hoff PMG, Poston GJ. Метастазы в печень. Берлин: Спрингер; 2009. [Google Scholar]
2. Исхак К.Г., Гудман З.Д., Стокер Дж.Т., редакторы. Опухоли печени и внутрипеченочных желчных протоков. Вашингтон, округ Колумбия: Институт патологии вооруженных сил; 2001. [Google Scholar]
Вашингтон, округ Колумбия: Институт патологии вооруженных сил; 2001. [Google Scholar]
3. Гамильтон С.Р., Аалтонен Л.А., редакторы. Классификация опухолей Всемирной организации здравоохранения. Патология и генетика опухолей органов пищеварения. Лион, Франция: IARC Press; 2000. [Google Академия]
4. Бейкер М.Е., Пелли Р. Печеночные метастазы в перспективе. Радиология. 1995; 197: 329–337. PMid:7480672. [PubMed] [Google Scholar]
5. Green DE, Woodward PJ. Лечение неопределенных случайных находок, обнаруженных при КТ брюшной полости. Семина УЗИ КТ МРТ. 2005; 26: 2–13. doi: 10.1053/j.sult.2004.10.002. [PubMed] [CrossRef] [Google Scholar]
6. Цунг А., Геллер Д.А. Обработка случайного поражения печени. Adv Surg. 2005; 39: 331–341. doi: 10.1016/j.yasu.2005.03.002. . PMid:16250559. [PubMed] [CrossRef] [Google Scholar]
7. Ather MH, Memon W, Rees J. Клиническое влияние случайной диагностики на спиральную КТ без контрастного усиления при острой мочеточниковой колике. Семина УЗИ КТ МРТ. 2005; 26:20–23. doi: 10.1053/j.sult.2004.10.005. [PubMed] [CrossRef] [Google Scholar]
Семина УЗИ КТ МРТ. 2005; 26:20–23. doi: 10.1053/j.sult.2004.10.005. [PubMed] [CrossRef] [Google Scholar]
8. Фликер М.С., Цукас А.Т., Хазра А., Дахман А.Х. Экономический эффект от экстратолстокишечных находок при компьютерно-томографической колонографии. J Comput Assist Томогр. 2008; 32: 497–503. дои: 10.1097/RCT.0b013e31816
. . PM в середине: 18664832. [PubMed] [CrossRef] [Google Scholar]9. Munk MD, Peitzman AB, Hostler DP, Wolfson AB. Частота и последующее наблюдение за случайными находками при компьютерной томографии травм: опыт работы в травматологическом центре первого уровня. J Emerg Med. 2010; 38: 346–350. doi: 10.1016/j.jemermed.2008.01.021. . PM в середине: 18804935. [PubMed] [CrossRef] [Google Scholar]
10. Berland LL, Silverman SG, Gore RM, et al. Управление случайными находками при КТ брюшной полости: информационный документ Комитета по случайным находкам ACR. J Am Coll Radiol. 2010;7:754–773. doi: 10.1016/j.jacr.2010.06.013. . Среднее: 20889105. [PubMed] [CrossRef] [Google Scholar]
[PubMed] [CrossRef] [Google Scholar]
11. Beatty JS, Williams HT, Aldridge BA, et al. Случайные находки ПЭТ/КТ у онкологического больного: как их лечить? Операция. 2009; 146: 274–281. doi: 10.1016/j.surg.2009.04.024. . PMid: 19628085. [PubMed] [CrossRef] [Google Scholar]
12. Гор Р.М., Ньюмарк Г.М., Такрар К.Х., Мехта Великобритания, Берлин Д.В. Инциденталомы печени. Радиол Клин Норт Ам. 2011;49:291–322. doi: 10.1016/j.rcl.2010.10.004. . PMid:21333779. [PubMed] [CrossRef] [Академия Google]
13. Mathe Z, Tagkalos E, Paul A, et al. Трансплантация печени при печеночных метастазах нейроэндокринных опухолей поджелудочной железы: анализ на основе выживаемости. Трансплантация. 2011; 91: 575–582. doi: 10.1097/TP.0b013e3182081312. . PMid:21200365. [PubMed] [CrossRef] [Google Scholar]
14. Павлик ТМ, Чоти М.А. Хирургическое лечение колоректальных метастазов в печень. J Gastrointest Surg. 2007; 11:1057–1077. doi: 10.1007/s11605-006-0061-3. . PMid: 17530336. [PubMed] [CrossRef] [Академия Google]
15. Quan D, Gallinger S, Nhan C, et al. Роль резекции печени при метастазах колоректального рака в эпоху комплексного лечения: систематический обзор. Операция. 2012; 151:860–870. doi: 10.1016/j.surg.2011.12.018. . PMid:22316439. [PubMed] [CrossRef] [Google Scholar]
Quan D, Gallinger S, Nhan C, et al. Роль резекции печени при метастазах колоректального рака в эпоху комплексного лечения: систематический обзор. Операция. 2012; 151:860–870. doi: 10.1016/j.surg.2011.12.018. . PMid:22316439. [PubMed] [CrossRef] [Google Scholar]
16. Misiakos EP, Karidis NP, Kouraklis G. Современное лечение метастазов колоректального рака в печень. Мир J Гастроэнтерол. 2011;17:4067–4075. doi: 10.3748/wjg.v17.i36.4067. . PMid:22039320. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
17. Jones EC, Chezmar JL, Nelson RC, et al. Частота и значимость небольших (менее или равных 15 мм) поражений печени, выявляемых при КТ. АЖР. 1992; 158: 535–539. PM в середине: 1738990. [PubMed] [Google Scholar]
18. Schwartz LH, Gandras EJ, Colangelo S, et al. Распространенность и значение небольших поражений печени, выявляемых при КТ у онкологических больных. Радиология. 1999; 210:71–74. PMid:9885589. [PubMed] [Google Scholar]
19. Jang HJ, Lim HK, Lee WJ и соавт. Небольшие гипоаттенуирующие очаги в печени на однофазной спиральной КТ у предоперационных больных раком желудка и колоректального рака: распространенность, значение, дифференциальные признаки. J Comput Assist Томогр. 2002; 26: 718–724. дои: 10.1097/00004728-200209000-00009. . PMid:12439304. [PubMed] [CrossRef] [Google Scholar]
Небольшие гипоаттенуирующие очаги в печени на однофазной спиральной КТ у предоперационных больных раком желудка и колоректального рака: распространенность, значение, дифференциальные признаки. J Comput Assist Томогр. 2002; 26: 718–724. дои: 10.1097/00004728-200209000-00009. . PMid:12439304. [PubMed] [CrossRef] [Google Scholar]
20. Khalil HI, Patterson SA, Panicek DM. Поражения печени считаются слишком маленькими для характеристики при КТ: распространенность и важность у женщин с раком молочной железы. Радиология. 2005; 235:872–878. doi: 10.1148/radiol.2353041099. . PMid:15833992. [PubMed] [CrossRef] [Google Scholar]
21. Krakora GA, Coakley FV, Williams G, et al. Небольшие гипоаттенуирующие поражения печени при КТ с контрастным усилением: прогностическое значение у пациентов с раком молочной железы. Радиология. 2004; 233:667–673. doi: 10.1148/radiol.2333031473. . PMid:15516602. [PubMed] [CrossRef] [Академия Google]
22. Рос П.Р., Тейлор Х.М. Злокачественные опухоли печени. В: Гор Р.М., Левин М.С., редакторы. Учебник рентгенологии желудочно-кишечного тракта. Филадельфия, Пенсильвания: В. Б. Сондерс; 2008. стр. 1523–1568. [Google Scholar]
В: Гор Р.М., Левин М.С., редакторы. Учебник рентгенологии желудочно-кишечного тракта. Филадельфия, Пенсильвания: В. Б. Сондерс; 2008. стр. 1523–1568. [Google Scholar]
23. Bioulac-Sage P, Laumonier H, Laurent C, et al. Доброкачественные и злокачественные сосудистые опухоли печени у взрослых. Семин Печень Дис. 2008; 28: 302–314. doi: 10.1055/s-0028-1085098. . Вечернее сообщение: 18814083. [PubMed] [CrossRef] [Google Scholar]
24. Kamaya A, Maturen KE, Tye GA, Liu YI. Гиперваскулярные поражения печени. Семина УЗИ КТ МРТ. 2009 г.;22:387–407. [PubMed] [Google Scholar]
25. Brancatelli G, Federle MP, Vilgrain V, et al. Фиброполикистозная болезнь печени: данные КТ и МРТ. Рентгенография. 2005; 25: 659–670. doi: 10.1148/rg.253045114. . PMid:15888616. [PubMed] [CrossRef] [Google Scholar]
26. Лев-Тоафф А.С., Бах А.М., Векслер Р.Дж. и соавт. Рентгенологический и патологический спектр билиарных гамартом. АЖР. 1995; 165: 309–313. PMid:7618546. [PubMed] [Google Scholar]
27. Zorzi D, Laurent A, Pawlik TM, et al. Гепатотоксичность, связанная с химиотерапией, и хирургическое лечение метастазов колоректального рака в печень. Бр Дж Сур. 2007;94: 274–286. doi: 10.1002/bjs.5719. . PMid:17315288. [PubMed] [CrossRef] [Google Scholar]
Zorzi D, Laurent A, Pawlik TM, et al. Гепатотоксичность, связанная с химиотерапией, и хирургическое лечение метастазов колоректального рака в печень. Бр Дж Сур. 2007;94: 274–286. doi: 10.1002/bjs.5719. . PMid:17315288. [PubMed] [CrossRef] [Google Scholar]
28. Pilgrim CH, Satgunaseelan L, Pham A, et al. Корреляция между гистопатологическим диагнозом повреждения печени, вызванного химиотерапией, клиническими особенностями и периоперационной заболеваемостью. HPB (Оксфорд) 2012; 14:333–340. doi: 10.1111/j.1477-2574.2012.00454.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
29. Gore RM. Диффузное поражение печени. В: Гор Р.М., Левин М.С., редакторы. Учебник рентгенологии желудочно-кишечного тракта. 3-й. Филадельфия, Пенсильвания: В. Б. Сондерс; 2008. стр. 1685–1730. [Академия Google]
30. Браунинг Д.Д. Новые методы визуализации при неалкогольном стеатогепатите. Клин печени Dis. 2009; 13: 607–1944. doi: 10.1016/j.cld.2009.07.002. . PM в середине: 19818308. [PubMed] [CrossRef] [Google Scholar]
[PubMed] [CrossRef] [Google Scholar]
31. Hamer OW, Aguirre DA, Casola G, et al. Жирная печень: модели визуализации и подводные камни. Рентгенография. 2006; 26:1637–1653. doi: 10.1148/rg.266065004. . PMid:17102041. [PubMed] [CrossRef] [Google Scholar]
32. Desser TS. Понимание преходящих различий в печеночном затухании. Семина УЗИ КТ МРТ. 2009 г.;30:408–417. doi: 10.1053/j.sult.2009.07.003. [PubMed] [CrossRef] [Google Scholar]
33. Ото А., Кулкарни К., Нисикава Р., барон Р.Л. Контрастное усиление гемангиом печени на многофазной МСКТ: можем ли мы диагностировать гемангиомы печени, сравнивая усиление с пулом крови? АЖР. 2010;195:381–386. doi: 10.2214/AJR.09.3324. . PMid:20651193. [PubMed] [CrossRef] [Google Scholar]
34. Lin MC, Tsay PK, Ko SF, et al. Результаты трехфазной динамической КТ 63 очаговых узловых гиперплазий печени у 46 пациентов: корреляция с размером и патологическими данными. Визуализация брюшной полости. 2008; 33: 301–307. doi: 10.1007/s00261-007-9258-5. . PMid:17632749. [PubMed] [CrossRef] [Google Scholar]
. PMid:17632749. [PubMed] [CrossRef] [Google Scholar]
35. Hussain SM, Terkivatan T, Zondervan PE, et al. Фокальная узловая гиперплазия: результаты современной МРТ, УЗИ, КТ и патологического анализа. РадиоГрафика. 2004; 24:3–17. doi: 10.1148/rg.241035050. . PMid:14730031. [PubMed] [CrossRef] [Google Scholar]
36. Grazioli L, Bondioni MP, Haradome H, et al. Гепатоцеллюлярная аденома и фокальная узловая гиперплазия: значение МРТ с усилением гадоксетовой кислоты в дифференциальной диагностике. Радиология. 2012; 262:520–529. doi: 10.1148/radiol.11101742. . PMid:22282184. [PubMed] [CrossRef] [Google Scholar]
37. Пурыско А.С., Ремер Э.М., Коппа С.П., Обуховский Н.А., Шнайдер Э., Веньеро Дж.К. Характеристики и отличительные черты гепатоцеллюлярной аденомы и фокальной узловой гиперплазии на МРТ с усилением гадоксетата динатрия. АЖР. 2012; 198:115–123. doi: 10.2214/AJR.11.6836. . PMid:22194486. [PubMed] [CrossRef] [Google Scholar]
38. van den Esschert JW, Bieze M, Beuers UH, van Gulik TM, Bennink RJ. Дифференциация гепатоцеллюлярной аденомы и очаговой узловой гиперплазии с помощью ПЭТ/КТ с 18F-фторхолином. Eur J Nucl Med Mol Imaging. 2011; 38: 436–440. дои: 10.1007/s00259-010-1584-0. . PMid:20717825. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Дифференциация гепатоцеллюлярной аденомы и очаговой узловой гиперплазии с помощью ПЭТ/КТ с 18F-фторхолином. Eur J Nucl Med Mol Imaging. 2011; 38: 436–440. дои: 10.1007/s00259-010-1584-0. . PMid:20717825. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
39. Shanbhogue AK, Prasad SR, Takahashi N, Vikram R, Sahani DV. Последние достижения в области цитогенетики и молекулярной биологии гепатоцеллюлярных опухолей у взрослых: значение для визуализации и лечения. Радиология. 2011; 258:673–693. [PubMed] [Google Scholar]
40. Hussain SM, van den Bos IC, Dwarkasing RS, et al. Гепатоцеллюлярная аденома: результаты современной магнитно-резонансной томографии, УЗИ, компьютерной томографии и патологического анализа. Евро Радиол. 2006; 16: 1873–1886. doi: 10.1007/s00330-006-0292-4. . PMid:16708218. [PubMed] [CrossRef] [Google Scholar]
41. Brancatelli G, Federle MP, Vullierme MP, et al. КТ и МРТ оценка аденомы печени. J Comput Assist Томогр. 2006; 30: 745–750. doi: 10. 1097/01.rct.0000224630.48068.bf. . PM в середине: 16954922. [PubMed] [CrossRef] [Google Scholar]
1097/01.rct.0000224630.48068.bf. . PM в середине: 16954922. [PubMed] [CrossRef] [Google Scholar]
42. Ibarrola C, Castellano VM, Colina F. Очаговые гиперпластические гепатоцеллюлярные узлы при обструкции печеночного венозного оттока: клинико-патологическое исследование четырех пациентов и 24 узлов. Гистопатология. 2004; 44: 172–179.. doi: 10.1111/j.1365-2559.2004.01795.x. . PMid:14764061. [PubMed] [CrossRef] [Google Scholar]
43. Maetani Y, Itoh K, Egawa H, et al. Доброкачественные узлы печени при синдроме Бадда-Киари: рентгенопатологическая корреляция с акцентом на центральный рубец. АЖР. 2002; 178: 869–875. PMid:115. [PubMed] [Google Scholar]
44. Rha SE, Lee MG, Lee YS, et al. Узловая регенеративная гиперплазия печени при синдроме Бадда-Киари: КТ и МРТ особенности. Визуализация брюшной полости. 2000; 25: 255–258. doi: 10.1007/s002610000027. . PMid:10823445. [PubMed] [CrossRef] [Академия Google]
45. Кобаяши С., Мацуи О., Габата Т. и др. Рентгенологические и гистопатологические проявления узловых поражений печени в сочетании с различными врожденными и приобретенными нарушениями гемодинамики печени. Jpn J Radiol. 2009; 27:53–68. doi: 10.1007/s11604-008-0299-7. . PMid:19373534. [PubMed] [CrossRef] [Google Scholar]
Jpn J Radiol. 2009; 27:53–68. doi: 10.1007/s11604-008-0299-7. . PMid:19373534. [PubMed] [CrossRef] [Google Scholar]
46. Colegrande S, Centi N, Galdiero R, et al. Преходящие различия интенсивности печени: Часть 1. Те, которые связаны с очаговыми поражениями. АЖР. 2007; 188: 154–159.. doi: 10.2214/AJR.05.1368. [PubMed] [CrossRef] [Google Scholar]
47. Colegrande S, Centi N, Galdiero R, et al. Транзиторные различия интенсивности печени: Часть 2. Те, которые не связаны с очаговыми поражениями. АЖР. 2007; 188:160–166. doi: 10.2214/AJR.05.1367. [PubMed] [CrossRef] [Google Scholar]
48. Eberhardt SC, Choi PH, Bach AM, et al. Полезность сонографии при небольших поражениях печени, обнаруженных на компьютерной томографии у больных раком. J УЗИ Мед. 2003; 22: 335–343. PMMid:12693617. [PubMed] [Google Scholar]
49. Kim HJ, Kim AY, Kim TK, et al. Преходящие различия в печеночном затухании при очаговых поражениях печени: динамические КТ-характеристики. АЖР. 2005; 184:83–90. PM в середине: 15615955. [PubMed] [Google Scholar]
PM в середине: 15615955. [PubMed] [Google Scholar]
50. Colagrande S, Centi N, Pradella S, et al. Преходящие различия в печеночном затухании и очаговые поражения печени: эффект отстойника из-за первичной артериальной гиперперфузии. J Comput Assist Томогр. 2009; 33: 259–265. doi: 10.1097/RCT.0b013e31818050bc. . Вечернее сообщение: 19346856. [PubMed] [CrossRef] [Академия Google]
51. Choi SH, Lee JM, Lee KH, et al. Взаимосвязь между различными паттернами транзиторного увеличения печеночного затухания на КТ и тромбозом воротной вены, связанным с острым холециститом. АЖР. 2004; 183:437–442. PMid:15269038. [PubMed] [Google Scholar]
52. Pradella S, Centi N, La Villa G, et al. Преходящая разница печеночного затухания (THAD) при заболевании желчевыводящих путей. Визуализация брюшной полости. 2009; 34: 626–633. doi: 10.1007/s00261-008-9445-z. . Вечернее сообщение: 18682878. [PubMed] [CrossRef] [Академия Google]
53. Гор РМ. Сосудистые нарушения печени. В: Гор Р. М., Левин М.С., редакторы. Учебник рентгенологии желудочно-кишечного тракта. 4-й . Филадельфия, Пенсильвания: Сондерс-Эльзевир; 2008. стр. 1685–1730. [Google Scholar]
М., Левин М.С., редакторы. Учебник рентгенологии желудочно-кишечного тракта. 4-й . Филадельфия, Пенсильвания: Сондерс-Эльзевир; 2008. стр. 1685–1730. [Google Scholar]
54. Карчаалтынкаба М., Акташ А. Пересмотр двухэнергетической КТ с мультидетекторной КТ: обзор принципов и клинических применений. Диагн Интерв Радиол. 2011;17:181–194. [PubMed] [Google Scholar]
55. Робинсон Э., Бабб Дж., Чандарана Х., Макари М. МСКТ с двойной энергией с двумя источниками: сравнение данных 80 кВп и средневзвешенных данных 120 кВп для выявления гиповаскулярных метастазов в печени. Инвестируйте Радиол. 2010;45:413–418. PMid:20458250. [PubMed] [Академия Google]
56. De Cecco CN, Buffa V, Fedeli S, et al. Двухэнергетическая КТ (DECT) печени: обычные и виртуальные неусиленные изображения. Евро Радиол. 2010;20:2870–2875. doi: 10.1007/s00330-010-1874-8. . PMid:20623126. [PubMed] [CrossRef] [Google Scholar]
57. Holalkere NS, Sahani DV, Blake MA, et al. Характеристика небольших поражений печени: дополнительная ценность МР после МСКТ. J Comput Assist Томогр. 2006; 30: 591–596. doi: 10.1097/00004728-200607000-00007. . PMid:16845289. [PubMed] [CrossRef] [Академия Google]
J Comput Assist Томогр. 2006; 30: 591–596. doi: 10.1097/00004728-200607000-00007. . PMid:16845289. [PubMed] [CrossRef] [Академия Google]
58. Паттерсон С.А., Халил Х.И., Паничек Д.М. МРТ-оценка небольших поражений печени у женщин с раком молочной железы. АЖР. 2006; 187: 307–312. doi: 10.2214/AJR.04.1030. . PMid:16861531. [PubMed] [CrossRef] [Google Scholar]
59. Kim YK, Lee ME, Lee WJ, et al. Диагностическая точность и чувствительность диффузионно-взвешенной и усиленной гадоксетовой кислотой 3-Т МРТ отдельно или в комбинации при обнаружении небольших метастазов в печени (≤ 1,5 см в диаметре) Invest Radiol. 2012; 47: 159–166. PMid:22330426. [PubMed] [Академия Google]
60. Xia D, Jing J, Shen H, Wu J. Значение диффузионно-взвешенных магнитно-резонансных изображений для различения очаговых доброкачественных и злокачественных поражений печени: метаанализ. J Magn Reson Imaging. 2012; 23:130–137. [PubMed] [Google Scholar]
61. Bonekamp S, Corona-Villalobos CP, Kamel IR. Онкологические применения диффузионно-взвешенной МРТ в организме. J Magn Reson Imaging. 2012; 35: 257–279. doi: 10.1002/jmri.22786. . PMid:22271274. [PubMed] [CrossRef] [Google Scholar]
Онкологические применения диффузионно-взвешенной МРТ в организме. J Magn Reson Imaging. 2012; 35: 257–279. doi: 10.1002/jmri.22786. . PMid:22271274. [PubMed] [CrossRef] [Google Scholar]
62. Taouli B, Koh DM. Диффузионно-взвешенная МРТ печени. Радиология. 2010; 254:47–66. doi: 10.1148/radiol.090
. . PMid: 20032142. [PubMed] [CrossRef] [Google Scholar]63. Agnello F, Ronot M, Valla DC, Sinkus R, Van Beers BE, Vilgrain V. Диффузионно-взвешенная МРТ с высоким значением b доброкачественных гепатоцеллюлярных поражений: количественные и качественный анализ. Радиология. 2012; 262:511–519. doi: 10.1148/radiol.11110922. . PMid:22143926. [PubMed] [CrossRef] [Google Scholar]
64. Mittra E, Quon A. Позитронно-эмиссионная томография/компьютерная томография: современные технологии и приложения. Радиол Клин Норт Ам. 2009 г.;47:147–160. doi: 10.1016/j.rcl.2008.10.005. . PMid:1
65. Donati OF, Reiner CS, Hany TF, et al. 18 Ф-ФДГ-ПЭТ и МРТ у больных со злокачественными новообразованиями печени и поджелудочной железы. Точность ретроспективной мультимодальной регистрации изображений с использованием КТ-компонента ПЭТ/КТ. Нуклеармедизин. 2010;49:106–114. doi: 10.3413/нукмед-0263. . PMid:20407733. [PubMed] [CrossRef] [Google Scholar]
Точность ретроспективной мультимодальной регистрации изображений с использованием КТ-компонента ПЭТ/КТ. Нуклеармедизин. 2010;49:106–114. doi: 10.3413/нукмед-0263. . PMid:20407733. [PubMed] [CrossRef] [Google Scholar]
66. Donati OF, Hany TF, Reiner CS, et al. Значение ретроспективного слияния ПЭТ- и МРТ-изображений при обнаружении метастазов в печени: сравнение с 18 F-FDG ПЭТ/КТ и МРТ с усилением Gd-EOB-DTPA. Дж Нукл Мед. 2010; 51: 692–699. doi: 10.2967/jnumed.109.068510. . PMid:20395324. [PubMed] [CrossRef] [Google Scholar]
Типы, причины, диагностика и многое другое
Что такое поражения печени Поражения печени представляют собой группы аномальных клеток или тканей. Поражения печени, также называемые образованием или опухолью печени, могут быть доброкачественными (нераковыми) или злокачественными (раковыми). Доброкачественные поражения печени встречаются очень часто и, как правило, не вызывают беспокойства. Однако злокачественные поражения печени требуют вмешательства и лечения.
DocPanel стремится обеспечить каждому пациенту превосходное обслуживание. Если вы хотите получить второе экспертное мнение о диагнозе поражения печени от одного из наших узкоспециализированных рентгенологов, вы можете узнать больше здесь.
Как обнаруживаются поражения печениПоражения печени обнаруживаются с помощью рентгенографических изображений, таких как УЗИ, КТ или МРТ. Вообще говоря, МРТ является предпочтительным методом оценки, учитывая его способность отображать мягкие ткани.
Обеспечение точной диагностики поражения печениПосле обнаружения поражения печени радиологу необходимо определить тип и природу поражения (раковое или доброкачественное). Это чрезвычайно важно, так как правильный подход к лечению и ведению сильно различается от одного вида поражения печени к другому.
Но поражения печени очень сложные. Злокачественные поражения печени имеют общие характеристики с доброкачественными поражениями печени, некоторые доброкачественные поражения можно не трогать, в то время как другие требуют хирургического вмешательства, а некоторые типы доброкачественных поражений имеют склонность к развитию рака.
У 23% ПАЦИЕНТОВ С ДИАГНОЗОМ РАКА ПЕЧЕНИ ВООБЩЕ НЕ БОЛЬШЕ РАКА
Пациенты с ошибочно диагностированным раком печени могут получать изнурительное лечение, которое является ненужным и дорогостоящим, в то время как раковые поражения печени, ошибочно принятые за доброкачественные поражения, будут иметь возможность расти и переходить в позднюю стадию рака.
Из-за большого количества диагностических ошибок случаи поражения печени выходят за рамки компетенции рентгенолога. Способность правильно определить массу требует знакомства, которое приходит из специальной подготовки и многолетней практики. Предоставление результатов сканирования специалисту-рентгенологу брюшной полости может помочь обеспечить точность и предотвратить ошибочный диагноз. С помощью DocPanel вы можете отправлять свои сканы в режиме онлайн, а специалист-радиолог просматривает их и дает второе мнение. Это быстрый, простой и гораздо более доступный способ получить такой же уровень обслуживания, как если бы вы отнесли свои снимки в престижную больницу.
Для того, чтобы научиться отличать различные типы поражений печени друг от друга, требуется многолетний опыт и специальная подготовка. Идентификация поражений печени особенно сложна, поскольку различные типы поражений имеют сходные характеристики друг с другом.
Получение второго мнения от узкого специалиста по абдоминальной радиологии помогает обеспечить:
- правильную идентификацию поражения печени
- что рак, если он присутствует, точно стадирован
- правильно оценен вариант хирургической резекции
- , что у пациента есть возможность высказать свои вопросы и опасения
- что пациент знает обо всех вариантах лечения
В статье из серии «Истории пациентов» прочитайте о том, как второе мнение Джанин Мюллер помогло выявить пропущенный диагноз рака печени.
Симптомы поражения печени Большинство поражений печени протекают бессимптомно. Даже раковые (злокачественные) опухоли обычно не проявляют никаких симптомов на ранних стадиях. В результате многие поражения печени обнаруживаются случайно во время визуализирующих исследований по поводу несвязанных состояний.
Даже раковые (злокачественные) опухоли обычно не проявляют никаких симптомов на ранних стадиях. В результате многие поражения печени обнаруживаются случайно во время визуализирующих исследований по поводу несвязанных состояний.
Поскольку обычно отсутствуют какие-либо симптомы, которые позволяют врачам определить тип поражения печени у пациента, все остается на усмотрение интерпретации изображения. Для обеспечения точности крайне важна интерпретация изображений специалистом-радиологом, имеющим большой опыт в выявлении объемных образований брюшной полости.
Типы поражений печени Доброкачественные поражения печени Доброкачественные поражения печени встречаются более чем у 20% населения в целом. Они составляют большинство всех поражений печени в Соединенных Штатах и обычно не лечатся. Они не распространяются на другие части тела и обычно не представляют серьезной угрозы. Однако, если поражения печени вызывают боль, становятся слишком большими, могут разрываться или вызывать внутреннее кровотечение, может потребоваться их хирургическое удаление.
Наиболее распространенный тип доброкачественной опухоли печени, гемангиома печени представляет собой аномальное образование кровеносных сосудов. Обнаруженные примерно у 5 процентов взрослых, они протекают бессимптомно и обычно остаются незамеченными. Сами они не представляют угрозы; однако на рентгенографических изображениях их легко принять за другие злокачественные новообразования. Чтобы предотвратить ошибочный диагноз, крайне важно, чтобы подозрительные сканы интерпретировались узкоспециализированным радиологом с большим опытом визуализации органов брюшной полости.
Узнайте больше о гемангиомах печени.
Аденома печени Поражения печени Аденома печени — редкое доброкачественное поражение печени, частота возникновения которого оценивается в 3–4 случая на 100 000 женщин. Они обычно обнаруживаются у женщин, которые регулярно используют оральные противозачаточные таблетки, или у спортсменов, принимающих анаболические стероиды. Некоторые очаги аденомы печени имеют высокий потенциал злокачественного развития, спонтанного кровотечения и разрыва. Дифференциация их от других поражений печени является обязательным условием для надлежащего ведения пациентов. Аденома печени может быть обнаружена с помощью рентгенографии, но отличить ее от других поражений сложно и требует вмешательства специалиста-радиолога.
Некоторые очаги аденомы печени имеют высокий потенциал злокачественного развития, спонтанного кровотечения и разрыва. Дифференциация их от других поражений печени является обязательным условием для надлежащего ведения пациентов. Аденома печени может быть обнаружена с помощью рентгенографии, но отличить ее от других поражений сложно и требует вмешательства специалиста-радиолога.
Узнайте больше об аденоме печени.
Очаговая узелковая гиперплазия печени Очаговая узелковая гиперплазия печени, также называемая ФНГ, является вторым наиболее распространенным солидным доброкачественным поражением печени. Поражения печени ФНГ обычно протекают бессимптомно; однако некоторые пациенты могут испытывать боль в животе и легкий дискомфорт в желудочно-кишечном тракте. Хотя фокальные узловые гиперплазии не представляют угрозы, отличить их от других опухолей печени может быть очень сложно. Из-за этого высок риск ошибочного диагноза. Поражения очаговой узловой гиперплазии имеют общие черты визуализации с фиброламеллярным вариантом гепатоцеллюлярной карциномы. Они также демонстрируют сходные характеристики, обнаруженные в аденомах печени. Правильный диагноз имеет решающее значение, чтобы избежать ненужной биопсии, хирургического вмешательства или других инвазивных методов лечения. Для обеспечения точного диагноза пациентам настоятельно рекомендуется пройти несколько дополнительных сканирований изображений, и чтобы изображения были интерпретированы опытным узкоспециализированным рентгенологом.
Они также демонстрируют сходные характеристики, обнаруженные в аденомах печени. Правильный диагноз имеет решающее значение, чтобы избежать ненужной биопсии, хирургического вмешательства или других инвазивных методов лечения. Для обеспечения точного диагноза пациентам настоятельно рекомендуется пройти несколько дополнительных сканирований изображений, и чтобы изображения были интерпретированы опытным узкоспециализированным рентгенологом.
Узнайте больше о фокальной узловой гиперплазии печени.
Другие доброкачественные поражения печени Включают:
- Кисты печени
- Билиарные гамартомы
- Липомы
Каждый год примерно 21 000 мужчин и 8 000 женщин заболевают раком печени в Соединенных Штатах, и около 16 000 мужчин и 8 000 женщин умирают от этого заболевания. Злокачественные поражения печени можно разделить на два типа рака печени: первичный рак печени и вторичный рак печени .
Первичный рак печени, также называемый гепатомой и гепатоцеллюлярной карциномой , представляет собой рак, который начинается в печени. Вторичный рак печени, также называемый метастазами в печень, представляет собой рак, который распространяется в печень из другого органа. В США вторичный рак печени встречается в 18-40 раз чаще, чем гепатома. Раковые поражения печени опасны для жизни. Они требуют вмешательства и тщательного последующего наблюдения после постановки диагноза.
Гепатома (гепатоцеллюлярная карцинома печени)Наиболее распространенным типом первичного злокачественного поражения печени является гепатома (гепатоцеллюлярная карцинома). Чаще всего это связано с циррозом печени — поздней стадией поражения печени, вызванной различными заболеваниями и состояниями, но обычно связанной с хроническим алкоголизмом или инфекцией гепатита В или С.
Это пятый по распространенности рак в мире и третья по распространенности причина смерти от рака. Раннее обнаружение имеет решающее значение для успешного лечения. Но идентификация поражений печени гепатоцеллюлярной карциномой может быть затруднена, поскольку они имеют различные проявления на изображениях и могут быть легко ошибочно приняты за доброкачественные поражения печени. Для подтверждения диагноза настоятельно рекомендуется получить второе мнение узкоспециализированного рентгенолога.
Раннее обнаружение имеет решающее значение для успешного лечения. Но идентификация поражений печени гепатоцеллюлярной карциномой может быть затруднена, поскольку они имеют различные проявления на изображениях и могут быть легко ошибочно приняты за доброкачественные поражения печени. Для подтверждения диагноза настоятельно рекомендуется получить второе мнение узкоспециализированного рентгенолога.
Узнайте больше из нашего поста о том, как сориентироваться при диагностике рака печени.
Метастазы в печень (метастазы в печень) Метастазы в печень, также называемые вторичным раком печени, развиваются, когда рак из другой части тела распространяется в печень. Доброкачественные поражения печени имеют много общих характеристик с метастазами в печень. Гемангиомы и очаговую узловую гиперплазию (ФУГ) особенно трудно отличить от метастатического заболевания, что является серьезной причиной путаницы при интерпретации изображений. Полное понимание различных проявлений метастазов в печени имеет решающее значение для постановки точного диагноза. Для пациентов, проходящих лечение по поводу метастазов в печень, последующая визуализация является важнейшим компонентом ведения пациента.
Для пациентов, проходящих лечение по поводу метастазов в печень, последующая визуализация является важнейшим компонентом ведения пациента.
Узнайте больше о метастазах в печени.
Другие злокачественные поражения печени включают:
- Внутрипеченочная холангиокарцинома (рак желчных протоков
- Гепатобластома
- Ангиосаркома (также называемая гемангиокарциномой)
Большинство доброкачественных поражений печени не связаны с непосредственной причиной. Они могут быть обнаружены у кого угодно и, чаще всего, не представляют угрозы. Большинство злокачественных поражений печени являются результатом рака, который распространяется в печень из другого органа. Первичные злокачественные поражения печени, то есть раковые клетки, возникшие в печени, чаще всего связаны с циррозом, вызванным чрезмерным употреблением алкоголя, инфекцией гепатита В или гепатитом С. Хотя обычно это доброкачественное состояние, у людей с прогрессирующей жировой болезнью печени существует риск развития цирроза, который может привести к раку печени.
Поражения печени можно диагностировать с помощью комбинации анализов крови и методов визуализации. Каждый метод имеет свои преимущества и недостатки, когда речь идет о характеристике опухолей печени. В зависимости от типа предполагаемого поражения печени для постановки диагноза будут использоваться соответствующие сканирования в сочетании друг с другом. В неубедительных случаях может потребоваться биопсия для определения злокачественности; однако большинство врачей предпочитают избегать таких процедур из-за их инвазивного характера.
Поражения печени при УЗИБольшинство поражений печени первоначально обнаруживаются во время УЗИ. Он очень чувствителен при дифференциации кисты от солидного поражения печени и служит хорошим первым шагом в диагностике пациента. Однако для того, чтобы отличить тип поражения печени, обнаруженный на УЗИ, обычно необходима более точная визуализация.
Узнайте больше из нашего поста о том, что нужно знать об УЗИ печени.
Компьютерная томография брюшной полости может помочь получить конкретную информацию о размере, форме и расположении образования в печени. Более совершенная, чем УЗИ, КТ обеспечивает детальный подход к определению типа поражения печени. Для дальнейшего улучшения изображения часто используются внутривенные йодсодержащие контрастные вещества. Игольчатая биопсия под контролем КТ также может быть использована для проверки злокачественности опухоли.
Поражения печени на МРТ Как и компьютерная томография, МРТ может быть очень полезна для дифференциации поражений печени. Он обеспечивает наиболее детальный осмотр мягких тканей тела и не использует ионизирующее излучение. МРТ-сканирование также обеспечивает высокую контрастность поражения печени, что делает его, пожалуй, самым мощным визуализирующим тестом для обнаружения поражения печени. МРТ также можно использовать для осмотра кровеносных сосудов в печени и вокруг нее.
По словам ведущего специалиста в области визуализации органов брюшной полости д-ра Ричарда Семелки, «МРТ с динамической визуализацией гадолиния является наиболее мощным инструментом для оценки состояния печени, но при этом предъявляются самые высокие требования к квалифицированному выполнению исследования и квалифицированной интерпретации результатов исследований. На МРТ доступно так много информации, что радиолог должен иметь большую подготовку и опыт, чтобы быть очень опытным в интерпретации всех результатов».
Поражения печени при ангиографииАнгиография включает введение контрастного вещества в артерию через катетер. Он используется для обозначения кровеносных сосудов и может быть полезен при определении артерий, которые снабжают кровью опухоль печени. Однако он относительно инвазивен. С достижениями в контрастировании КТ и МРТ ангиографию обычно используют в качестве крайней меры.
Получите второе мнение специалиста сегодня
Платформа DocPanel позволяет людям во всем мире получить второе мнение эксперта всего за 24–72 часа.
Простой трехэтапный процесс: мгновенно загрузите свои сканы, выберите эксперта-радиолога (или попросите DocPanel назначить ваш случай соответствующему узкому специалисту) и отправьте запрос. После загрузки ваших сканов у вас также будет возможность задать любые вопросы, которые могут у вас возникнуть по вашему делу. Не знаете, что такое субспециалист? Узнайте больше из нашей подробной статьи о важности получения второго мнения узкоспециализированного рентгенолога.
Этот пост одобрен доктором Ричардом Семелкой с медицинской точки зрения. Доктор Семелка, ведущий специалист в области визуализации органов брюшной полости, занимается радиологией более 28 лет. Он написал более 16 учебников, 370 рецензируемых статей и имеет более 21 000 ссылок на исследования в области визуализации брюшной полости.
Запросите второе мнение сегодня.
Типы, причины, симптомы и лечение
Поражения печени представляют собой аномальные разрастания клеток печени, которые могут быть раковыми или доброкачественными. Они обнаруживаются у 30% людей старше 40 лет.
Они обнаруживаются у 30% людей старше 40 лет.
Большинство поражений печени незлокачественные или доброкачественные. Многие поражения обнаруживаются во время визуализирующих тестов для несвязанных состояний здоровья. Хотя большинство поражений не опасны, по-прежнему важно получить правильный диагноз.
Продолжайте читать, чтобы узнать больше о том, как классифицируются поражения печени, что их вызывает и когда необходимо лечение.
Поражения печени — это любые аномальные образования на печени. Они делятся на две категории: злокачественные и доброкачественные.
Злокачественные образования являются раковыми. Они требуют лечения, чтобы предотвратить их распространение. Доброкачественные образования не являются раковыми. Некоторые доброкачественные опухоли требуют лечения, а другие нет.
Злокачественные поражения
Типы раковых поражений включают:
| Тип рака | Примечания |
|---|---|
| Hepatocellular Carcinoma | — Самый распространенный каркал. |
| внутрипеченочная холангиокарцинома | – развивается в желчных протоках, соединяющих печень с желчным пузырем – вызывает от 10 до 20 процентов случаев рака печени |
| angiosarcoma and hemangiosarcoma | – rare cancers of the cells that line your liver’s blood vessels |
| hepatoblastoma | – a very rare cancer that develops in children under the age of 4 |
| liver metastasis | — «метастазирование» означает, что рак распространился из другого органа, в котором начался рак; в этом случае он распространяется на печень – большинство поражений печени в США и Европе имеют метастазы из других областей, где рак начался |
Доброкачественные образования
Доброкачественные образования представляют собой нераковые образования. Небольшие доброкачественные образования часто не вызывают симптомов и не требуют лечения. Если опухоли становятся большими, они могут вызывать симптомы и должны быть удалены.
Следующие поражения могут потребовать лечения:
| Доброкачественные образования, которые могут потребовать лечения | 0389 – может потребоваться лечение, если поражение более 5 сантиметров (см) в ширину или вызывает симптомы |
|---|---|
| кисты печени | – лечение может потребоваться, если кисты вызывают симптомы или их размер более 4 см в поперечнике |
Следующие типы поражений обычно не требуют лечения:
| Доброкачественные образования, не требующие лечения | Примечания | 80390 | – твердые нераковые образования на здоровой печени – лечение часто не требуется, если поражение менее 5 см в ширину и не вызывает симптомов |
|---|---|
| печеночные кисты | – заполненные жидкостью мешочки на печени – лечение не требуется необходима, если киста небольшая и не вызывает симптомов |
| печеночная или кавернозная гемангиома | – скопления кровеносных сосудов, образующие опухоли в печени – редко нуждаются в лечении, если они не становятся очень большими |
| фокальная узловая гиперплазия | – вызвана увеличением количества функциональных клеток – предположительно вызвана пороками развития артерий |
Поражения печени распространены, но не всегда ясно, почему они развиваются .
Злокачественные поражения
Как и все виды рака, раковые поражения печени вызываются изменениями в ДНК, которые заставляют клетки размножаться бесконтрольно.
Первичным фактором риска злокачественных поражений печени (гепатоцеллюлярной карциномы) является длительная инфекция гепатита В или гепатита С.
Дополнительные возможные причины поражения печени включают:
- длительный прием противозачаточных таблеток
- длительный прием анаболических стероидов
- рубцевание печени (цирроз)
- курение
Доброкачественные поражения9 доброкачественные поражения могут различаться в зависимости от типа поражения:
- Аденомы печени. Длительное использование противозачаточных таблеток или анаболических стероидов может вызвать эти поражения.
- Кавернозные гемангиомы. Эти поражения обычно присутствуют при рождении и развиваются в результате генетических мутаций.
- Очаговая узловая гиперплазия.
 Это может быть вызвано пороком развития артерий в печени.
Это может быть вызвано пороком развития артерий в печени. - Кисты печени. Хотя причина обычно неизвестна, некоторые кисты могут присутствовать с рождения. Другие могут развиваться из-за эхинококковой инфекции.
У любого человека может развиться поражение печени, но некоторые люди подвержены большему риску, чем другие. Главным фактором риска рака печени является хронический вирусный гепатит.
Другие факторы риска рака печени включают:
- мужчина
- , избыточный вес
- Curming Cigarettes
- Употребление алкоголя
- Cirrhosis, вызванная гепатитом или тяжелым алкоголем.
- Cirrhosis, вызванный гепатитом или тяжелым употреблением алкоголя
- .
- употребление пищи, зараженной грибковым афлатоксином
- некоторые редкие заболевания, такие как болезнь Вильсона и тирозинемия
- воздействие винилхлорида и диоксида тория
- употребление анаболических стероидов в рекреационных целях
Доброкачественные поражения печени
Факторы риска доброкачественных поражений включают:
- постоянное использование противозачаточных таблеток или анаболических стероидов часто обнаруживаются с помощью визуализирующих тестов.

По данным Американского онкологического общества, рак печени часто не вызывает симптомов до поздних стадий. По мере роста опухоли она может вызвать дисфункцию или проблемы с печенью, сдавливая другие ткани.
Когда симптомы появляются, они чаще всего включают:
- непреднамеренную потерю веса
- потерю аппетита
- тошноту или рвоту что может ощущаться как полнота под левой стороной ребер
- вздутие живота
- зуд
- желтуха или пожелтение кожи и глаз
Доброкачественные опухоли обычно не вызывают симптомов, если они не становятся очень большими.
Врачи начинают процесс диагностики поражений печени со сбора анамнеза, изучения симптомов и проведения медицинского осмотра. Затем они могут заказать комбинацию анализов крови и визуализации.
Методы визуализации включают:
- МРТ, которая является наиболее точной
- КТ
- УЗИ
- ПЭТ
Анализы крови могут выявить инфекцию вирусного гепатита или маркеры, указывающие на заболевание печени.

Большинство поражений можно диагностировать без необходимости взятия образца ткани, называемого биопсией. Однако в сложных случаях может потребоваться биопсия.
Некоторые доброкачественные образования не требуют лечения, если они не вызывают симптомов. Более крупные поражения, вызывающие симптомы, могут нуждаться в хирургическом удалении.
Лечение рака печени зависит от таких факторов, как:
- общее состояние здоровья
- степень распространения
- размер и расположение опухоли
- тип рака
Варианты лечения включают:
- операцию по удалению поражений и части или всей печени
- трансплантацию печени, если удаляется вся печень
- форма химиотерапии, называемая химиоэмболизацией, для остановки роста рака
- термическая абляция , в котором используется электрический ток высокой энергии или микроволны для уничтожения раковых клеток, которые невозможно удалить хирургическим путем
- таргетные препараты для остановки роста раковых клеток
- вид лучевой терапии, называемый внутренней лучевой терапией, при котором радиоактивные шарики вводятся в кровеносные сосуды печени
Пятилетняя выживаемость при раке печени в Соединенных Штатах продолжает расти.
 По данным Американского общества клинической онкологии, за последние 40 лет он увеличился с 3 процентов до более чем 20 процентов.
По данным Американского общества клинической онкологии, за последние 40 лет он увеличился с 3 процентов до более чем 20 процентов.Наиболее распространенным фактором риска рака печени во всем мире является хроническая инфекция гепатита В или гепатита С. Получение вакцины против гепатита В и надлежащее лечение вирусного гепатита может снизить риск развития рака печени.
Другими способами снижения риска развития поражений печени являются:
- ограничение употребления табака и алкоголя
- поддержание умеренного веса
- лечение состояний, которые могут вызывать рак печени, таких как гемохроматоз
- прием пищи сбалансированная диета для сведения к минимуму риска развития диабета 2 типа
- отказ от рекреационных анаболических стероидов (они отличаются от инъекций стероидов, используемых для лечения заболеваний)
- избегать действий, которые могут увеличить ваши шансы на заражение гепатитом, таких как употребление инъекционных наркотиков и секс без барьерного метода, например, с презервативом
Часто встречаются поражения печени.
 Они могут быть раковыми или нераковыми. Большинство поражений не являются злокачественными и не требуют лечения, если они небольшие и не вызывают симптомов.
Они могут быть раковыми или нераковыми. Большинство поражений не являются злокачественными и не требуют лечения, если они небольшие и не вызывают симптомов.Ваш врач может диагностировать поражение печени с помощью визуализации, анализов крови и иногда небольшого образца ткани. Они могут посоветовать вам, требуется ли какое-либо конкретное лечение.
Неопределенные поражения печени при раке | Визуализация рака
- Обзор
- Открытый доступ
- Опубликовано:
- П. Дж. Робинсон 1
Визуализация рака том 2 , страницы 130–132 (2002 г.
 )Процитировать эту статью
)Процитировать эту статью11 тыс. обращений
Сведения о показателях
Abstract
Важно отличать метастазы в печени от случайных доброкачественных поражений печени, которые могут наблюдаться у больных раком. В меньшинстве случаев УЗИ или КТ может быть достаточно для характеристики доброкачественных поражений, но диапазон последовательностей и контрастных сред, доступных для МРТ печени, дает возможность для более точной диагностики в подавляющем большинстве случаев. Биопсия требуется редко.
Введение
Визуализация печени используется не только для стадирования больных раком, но и для оценки ответа на лечение, для повторного стадирования после лечения или при подозрении на рецидив, а также для наблюдения во время ремиссии. Если выявляются аномалии печени, дифференциальный диагноз метастатического заболевания от доброкачественного или случайного поражения может иметь решающее значение для последующего ведения пациента.
 С момента широкого внедрения визуализации печени в рутинные клинические исследования стало ясно, что случайные доброкачественные поражения печени не являются редкостью. Одним из полезных практических рекомендаций является то, что небольшие (<15 мм) поражения, обнаруженные случайно у пациентов с неизвестным первичным злокачественным новообразованием, практически всегда являются доброкачественными. Однако у пациентов с известным злокачественным заболеванием имеется небольшая частота метастазов, которые на КТ перекрываются с таковыми при доброкачественных поражениях. Более крупные доброкачественные образования менее проблематичны, но при всех размерах МРТ более характерны.
С момента широкого внедрения визуализации печени в рутинные клинические исследования стало ясно, что случайные доброкачественные поражения печени не являются редкостью. Одним из полезных практических рекомендаций является то, что небольшие (<15 мм) поражения, обнаруженные случайно у пациентов с неизвестным первичным злокачественным новообразованием, практически всегда являются доброкачественными. Однако у пациентов с известным злокачественным заболеванием имеется небольшая частота метастазов, которые на КТ перекрываются с таковыми при доброкачественных поражениях. Более крупные доброкачественные образования менее проблематичны, но при всех размерах МРТ более характерны.Кисты печени
Простые кисты имеют круглую форму, если только они не деформированы более жесткими соседними структурами. Их содержимое анэхогенно на УЗИ, водянистое затухание на КТ, низкий сигнал на МРТ T1w и яркий сигнал на обычном T2, который сохраняется на более тяжелых последовательностях T2w. Контрастное усиление не дает никаких изменений — контрастирующий ободок вызывает подозрение на некротические метастазы или, в соответствующем клиническом контексте, на абсцесс.

Гемангиомы
Характерные признаки гемангиом хорошо известны — они гиперэхогенны на сонографии и имеют географическую форму с низким затуханием на КТ без усиления и МРТ в режиме T1w. Их интенсивный сигнал на обычной МРТ T2w сохраняется при более тяжелом взвешивании T2 (TE = 180 мс или HASTE). При КТ с контрастным усилением или МРТ с гадолиниевым усилением поражения демонстрируют интенсивное узелковое усиление на периферии с последующим центростремительным заполнением в течение следующих 5–10 минут. Некоторые более крупные поражения содержат центральный узел гиалинизированной рубцовой ткани, который никогда не увеличивается. Прерывистость периферического узлового усиления является специфической чертой, и периферического вымывания не происходит. Напротив, метастазы с некротическими центрами обычно имеют круглую форму, и хотя они могут иметь периферическое усиление, кольцо более однородно. В то время как отсроченное усиление некротического центра таких поражений не редкость, ярко усиливающееся периферическое кольцо исчезает довольно быстро.
 Некоторые небольшие гемангиомы демонстрируют равномерное и быстрое усиление, начиная с артериальной фазы, похожее на появление небольших гепатоцеллюлярных поражений, но они демонстрируют отличительную черту интенсивного яркого сигнала на T2w МРТ, в отличие от изоинтенсивного или слегка гиперинтенсивного изображения. небольших доброкачественных гепатоцеллюлярных образований. Другие атипичные гемангиомы включают небольшие очаги с центробежным усилением из одиночного сосудистого узла (симптом центральной точки), а в других случаях поражение может быть преимущественно фиброзным, поэтому усиление пятнистое и замедленное, с небольшой типичной периферической узловой васкуляризацией.
Некоторые небольшие гемангиомы демонстрируют равномерное и быстрое усиление, начиная с артериальной фазы, похожее на появление небольших гепатоцеллюлярных поражений, но они демонстрируют отличительную черту интенсивного яркого сигнала на T2w МРТ, в отличие от изоинтенсивного или слегка гиперинтенсивного изображения. небольших доброкачественных гепатоцеллюлярных образований. Другие атипичные гемангиомы включают небольшие очаги с центробежным усилением из одиночного сосудистого узла (симптом центральной точки), а в других случаях поражение может быть преимущественно фиброзным, поэтому усиление пятнистое и замедленное, с небольшой типичной периферической узловой васкуляризацией.Жировые изменения
Жировая инфильтрация чаще неоднородная, а иногда и очаговая; в других случаях небольшие очаговые участки паренхимы печени могут быть избавлены от жировых изменений. На УЗИ либо очаговые жировые изменения, либо очаговые щадящие изменения могут привести к поражениям, которые трудно отличить от метастазов.
 Одной полезной особенностью очаговых жировых изменений или щадящих изменений является то, что обычно нет масс-эффекта — сосуды нормально проходят через кажущиеся аномальными области. Очаговый жир можно распознать на КТ по его географическому распределению, нормальному усилению контраста и отсутствию эффекта массы, но более надежный диагноз можно поставить на МРТ. У пациентов с диффузными жировыми изменениями метастазы могут быть не видны на КТ, поскольку их низкое затухание соответствует низкому затуханию в окружающей печени. Иногда кольцо ткани печени, непосредственно окружающее поражение, может быть избавлено от жировых изменений, образуя неравномерный ореол более плотной ткани внутри гомогенной печени. Такой вид можно наблюдать при гемангиомах в жировой печени, а также при метастазах. Используя синфазные и противофазные последовательности T1w, МРТ предлагает быстрый и надежный подход к распознаванию фокального жира и выявляет метастатические поражения в диффузно-жировой печени. Если остаются какие-либо диагностические сомнения, могут быть назначены специфичные для печени контрастные вещества.
Одной полезной особенностью очаговых жировых изменений или щадящих изменений является то, что обычно нет масс-эффекта — сосуды нормально проходят через кажущиеся аномальными области. Очаговый жир можно распознать на КТ по его географическому распределению, нормальному усилению контраста и отсутствию эффекта массы, но более надежный диагноз можно поставить на МРТ. У пациентов с диффузными жировыми изменениями метастазы могут быть не видны на КТ, поскольку их низкое затухание соответствует низкому затуханию в окружающей печени. Иногда кольцо ткани печени, непосредственно окружающее поражение, может быть избавлено от жировых изменений, образуя неравномерный ореол более плотной ткани внутри гомогенной печени. Такой вид можно наблюдать при гемангиомах в жировой печени, а также при метастазах. Используя синфазные и противофазные последовательности T1w, МРТ предлагает быстрый и надежный подход к распознаванию фокального жира и выявляет метастатические поражения в диффузно-жировой печени. Если остаются какие-либо диагностические сомнения, могут быть назначены специфичные для печени контрастные вещества.
Фокальная узловая гиперплазия (ФУГ)
Благодаря широкому использованию двухфазной КТ, многофазной МРТ с контрастным усилением и недавнему внедрению сосудистых контрастных веществ в сонографию пришло осознание того, что очаговая узловая гиперплазия (ФУГ) не является редкостью . Более крупные поражения обычно имеют округлую или дольчатую форму с четкими краями, масс-эффектом, смещающим соседние сосуды, и центральным рубцом, иногда с расходящимися спицами к периферии. Их эхогенность, затухание и сигнальные характеристики мало отличаются от характеристик нормальной ткани печени. Поражения демонстрируют заметное контрастное усиление артериальной фазы, которое обычно быстро исчезает, становясь изоинтенсивным в портальной фазе, хотя иногда усиление контраста длится несколько минут. Характерно отсроченное усиление центрального рубца. Поражения размером менее 2 см часто однородны, без центрального рубца, но демонстрируют те же характеристики усиления. Нередко эти небольшие поражения бывают множественными и могут сосуществовать с другими доброкачественными образованиями.
 При обнаружении у пациентов с известным злокачественным новообразованием уверенный диагноз FNH требует демонстрации интактной функции печени в пределах поражения. Наиболее эффективным методом является усиление с помощью суперпарамагнитного оксида железа (SPIO). Некоторые поражения FNH поглощают такое же количество SPIO, как и нормальная печень, поэтому поражение выглядит черным на постконтрастных изображениях T2w. В других случаях поражение может поглощать некоторое количество SPIO, но меньше, чем окружающая печень, так что поражение становится более заметным после введения контраста. В этих случаях важно использовать одну и ту же последовательность T2w до и после SPIO и измерять изменение интенсивности сигнала как в печени, так и в очаге поражения. Если в поражении наблюдается значительное поглощение SPIO (более 40–50% поглощения печенью), его можно считать доброкачественным. Метастазы не поглощают SPIO, но высокодифференцированный гепатоцеллюлярный рак может поглощать лишь немного. Другой подход заключается в использовании одного из гепатоцеллюлярных контрастных веществ для МРТ (мангафодипир, гадобенат или гадоксетовая кислота).
При обнаружении у пациентов с известным злокачественным новообразованием уверенный диагноз FNH требует демонстрации интактной функции печени в пределах поражения. Наиболее эффективным методом является усиление с помощью суперпарамагнитного оксида железа (SPIO). Некоторые поражения FNH поглощают такое же количество SPIO, как и нормальная печень, поэтому поражение выглядит черным на постконтрастных изображениях T2w. В других случаях поражение может поглощать некоторое количество SPIO, но меньше, чем окружающая печень, так что поражение становится более заметным после введения контраста. В этих случаях важно использовать одну и ту же последовательность T2w до и после SPIO и измерять изменение интенсивности сигнала как в печени, так и в очаге поражения. Если в поражении наблюдается значительное поглощение SPIO (более 40–50% поглощения печенью), его можно считать доброкачественным. Метастазы не поглощают SPIO, но высокодифференцированный гепатоцеллюлярный рак может поглощать лишь немного. Другой подход заключается в использовании одного из гепатоцеллюлярных контрастных веществ для МРТ (мангафодипир, гадобенат или гадоксетовая кислота). Все эти агенты поглощаются функционирующими гепатоцитами, присутствующими в поражениях ФНГ (а также при высокодифференцированном ГЦК), но поскольку отсутствует билиарный экскреторный путь, поражения сохраняют контраст намного дольше, чем нормальная печень, поэтому становятся более яркими. на задержанных изображениях T1w.
Все эти агенты поглощаются функционирующими гепатоцитами, присутствующими в поражениях ФНГ (а также при высокодифференцированном ГЦК), но поскольку отсутствует билиарный экскреторный путь, поражения сохраняют контраст намного дольше, чем нормальная печень, поэтому становятся более яркими. на задержанных изображениях T1w.Очаговые артефакты перфузии
Периферические клиновидные области аномальной перфузии, обычно наблюдаемые только в артериальные доминирующие фазы усиленной КТ и МРТ, вероятно, вызваны сегментарной окклюзией воротной вены, которая в некоторых случаях связана с паренхиматозными опухолевыми отложениями; в других случаях причина не может быть найдена. Такие преходящие дефекты затухания в печени (THAD) также могут быть связаны с паренхиматозным отеком в печени, который выглядит гиперинтенсивным на МРТ T2w. По периферии сегмента 4, особенно справа от серповидной связки кпереди, а также кпереди от бифуркации воротной вены, небольшие участки паренхимы печени могут получать непортальное венозное кровоснабжение от парабилиарного венозного сплетения и от аномального дренажа желудка.
 , двенадцатиперстной и панкреатической вен. Это может привести к небольшим узелкам фокальных жировых изменений в этих областях или, что чаще, может привести к небольшим областям измененного усиления после контрастирования.
, двенадцатиперстной и панкреатической вен. Это может привести к небольшим узелкам фокальных жировых изменений в этих областях или, что чаще, может привести к небольшим областям измененного усиления после контрастирования.Другие доброкачественные пороки развития
Билиарные микрогамартомы (комплексы фон Мейенбурга) имеют визуализационные характеристики, которые совпадают с кистами и гемангиомами. Эти пороки развития желчевыводящих путей часто имеют неправильную или даже угловатую форму и обычно имеют диаметр всего несколько миллиметров.
Выводы и ключевые моменты
- (1)
Случайные доброкачественные поражения относительно часто встречаются у пациентов со злокачественными новообразованиями, и их следует отличать от метастатического заболевания, чтобы избежать ошибочного лечения.
- (2)
Очаговая жировая ткань, очаговая щадящая опухоль и гемангиомы могут быть диагностированы с помощью УЗИ или КТ, если они типичны, но в других случаях МРТ обычно является решающим фактором.

- (3)
ФНГ можно с уверенностью диагностировать с помощью специфичных для печени контрастных веществ для МРТ.
- (4)
Отличить небольшие кисты и гемангиомы от метастазов лучше всего с помощью МРТ с использованием интенсивной последовательности T2w, за которой следует динамический T1 с усилением гадолинием.
- (5)
Крошечные образования, которые на КТ имеют угловатую форму и низкое затухание, обычно представляют собой билиарные микрогамартомы.
Дополнительная литература
Джонс Э.
 К., Чезмар Дж.Л., Нельсон Р.К., Бернардино М.Э. Частота и значимость небольших (< 15 мм) поражений печени, выявляемых при КТ. АЖД 1992; 158: 535–9.
К., Чезмар Дж.Л., Нельсон Р.К., Бернардино М.Э. Частота и значимость небольших (< 15 мм) поражений печени, выявляемых при КТ. АЖД 1992; 158: 535–9.КАС Статья пабмед Google ученый
Schwarz LH, Gandras EJ, Colangelo SM, Ercolani MC, Panicek DM. Распространенность и значение небольших поражений печени, выявляемых при КТ у онкологических больных. Радиология 1999; 210: 71–4.
Артикул Google ученый
Ито К., Митчелл Д.Г., Аутвотер Э.К., Шкларук Дж., Садек А.Г. Поражения печени: различение несолидных доброкачественных поражений от солидных злокачественных поражений с помощью интенсивной Т2-взвешенной быстрой спин-эхо МРТ. Радиология 1997; 204: 729–37.
КАС Статья пабмед Google ученый
Махфуз А.Э., Хамм Б., Вольф К.Дж.
 Периферический вымывание: признак злокачественности на динамических МР-изображениях очаговых поражений печени с контрастированием гадолинием. Радиология 1994; 190: 49–52.
Периферический вымывание: признак злокачественности на динамических МР-изображениях очаговых поражений печени с контрастированием гадолинием. Радиология 1994; 190: 49–52.КАС Статья пабмед Google ученый
Лев-Тоафф А.С., Бах А.М., Векслер Р.Дж., Хилперт П.Л., Гаталика З., Рубин Р. Рентгенологический и патологический спектр билиарных гамартом. АЖД 1995; 165: 309–13.
КАС Статья пабмед Google ученый
Schlund JF, Semelka RC, Kettritz U, Eisenberg LB, Lee JK. Преходящее усиление сегментарного усиления печени дистальнее обструкции воротной вены на динамических МРТ-изображениях с градиентным эхом, усиленным гадолинием. J Magn Reson Imaging 1995; 4: 375–377.
Артикул Google ученый
Блюмке Д.А., Сойер П., Фишман Э.К. Неопухолевые низкозатухающие дефекты печени на спиральной КТ при артериальной портографии: частота, локализация и внешний вид.
 АЖД 1995; 164: 1141–1145.
АЖД 1995; 164: 1141–1145.КАС Статья пабмед Google ученый
Ссылки на скачивание
Информация об авторе
Авторы и организации
Университетская больница Сент-Джеймс, Лидс, Великобритания
P. J. Robinson
Авторы
- P. J. Robinson
Посмотреть публикации автора
PubMed Google Scholar
Автор, ответственный за корреспонденцию
Пи Джей Робинсон.
Дополнительная информация
Этот документ доступен в Интернете по адресу http://www.cancerimaging.org. В случае изменения URL-адреса используйте предоставленный DOI, чтобы найти статью.
Права и разрешения
Перепечатка и разрешения
Об этой статье
Ассистент рентгенолога: Incidentalomas
Что делать при случайно обнаруженных поражениях печени?
Маартен ван Леувен, Йост Недеренд и Робин Смитуис
Отделение радиологии Университетского медицинского центра Утрехта, Лейденского университета и госпиталя Рейнланд, Лейдердорп, Нидерланды
Дата публикации
Этот обзор основан на презентации, сделанной Маартеном ван Леувеном для Голландского радиологического общества, и был адаптирован для помощника по радиологии Йостом Недерендом и Робином Смитуисом.
С ростом использования мультидетекторной КТ часто выявляются небольшие поражения печени.
Во многих случаях патологическая природа этих случайно обнаруженных поражений печени или инциденталом неизвестна.
Это приводит к диагностической проблеме, которая инициируется радиологией, поэтому рентгенологи должны взять на себя ответственность за правильную классификацию этих поражений в зависимости от их клинической значимости.В этой статье мы обсудим лечение двух различных типов случайно обнаруженных поражений печени:
- поражений, которые слишком малы для характеристики (поражения TSTC) у бессимптомных лиц и у пациентов с известным злокачественным новообразованием.
- Гиперваскулярные поражения.
TSTC (слишком мал, чтобы охарактеризовать поражения)
КТ с контрастным усилением (портальная фаза), показывающая множественные небольшие гиподенсивные образования.

Сначала изучите изображения слева.
Тогда продолжайте читать.Мы видим множественные очаги гиподенсии.
Мы не можем с уверенностью диагностировать их как:- цисты: плотность воды, четкие границы
- гемангиомы: медленно прогрессирующие периферические узловатые повышение артериальной плотности
- злокачественные образования: неоднородные, неправильной формы демаркация, периферическое усиление меньше, чем артериальная плотность
Для этого типа поражений, которые из-за их небольшого размера и атипичных особенностей визуализации не могут быть уверенно отнесены к категории, был придуман термин TSTC (слишком малые для характеристики) поражения.
TSTC у пациентов без известных злокачественных новообразований
Jones (1992) исследовал 1500 пациентов, которым была проведена КТ брюшной полости (1).

Он нашел:- Опухоли TSTC у 17% пациентов
- У 45 пациентов без известных злокачественных новообразований все поражения были доброкачественными
- У 209 пациентов с известными злокачественными новообразованиями
- 86 имели 1 TSTC: 7-27 злокачественных 8 4 TSTC: 19% злокачественные
- 49 с >5 TSTC: 76% злокачественные.
TSTC у пациентов с первичным злокачественным новообразованием
Schwartz (1999) исследовал 2978 пациентов с известным злокачественным новообразованием (2).
Он обнаружил TSTC у 12% пациентов с известным злокачественным новообразованием.
У 88% больных поражения были доброкачественными, а у 12% оказались метастазами (1,4% всех больных).
Процент злокачественности во многом зависел от известной первичной опухоли.
Большинство метастазов было обнаружено у больных раком молочной железы.
Это согласуется с наблюдением, что метастазы в молочные железы обычно представляют собой множественные небольшие поражения, в то время как метастазы колоректального рака и лимфомы в печень обычно представляют собой одиночные или несколько более крупных образований.
Вероятность доброкачественного поражения с использованием размера и края в качестве характеристики
Robinson (2003) изучал различные характеристики TSTC и их корреляцию со злокачественными новообразованиями (3).
Поражения были классифицированы по их поведению при контрольной КТ как стабильные или нестабильные.
Особенности изображения стабильных (доброкачественных) образований небольшого размера и острых краев.
Неоднородность и ослабление мягких тканей были связаны с нестабильным поведением, но наблюдались лишь в незначительном меньшинстве случаев.
TSTC при раке молочной железы
Krakora (2004) изучал прогностическое значение небольших гипоаттенуирующих поражений печени, наблюдаемых при начальной КТ, у пациентов с раком молочной железы, у которых не было определенных метастазов в печени при первоначальном обследовании (4).
Одно или несколько небольших гиподенсивных поражений печени (TSTC) наблюдались у 54 из 153 пациентов (35%).
При медиане наблюдения 584 дня определенные метастазы в печень развились у 43 из 153 пациентов (28%).
Не было обнаружено различий в вероятности развития метастазов в печень у пациентов с TSTC или без них при начальной КТ.
Krakora пришел к выводу, что у пациентов с раком молочной железы, у которых нет определенных метастазов в печени при поступлении, нет никаких доказательств того, что небольшие гиподенсивные поражения печени, наблюдаемые при начальной КТ, способствуют повышенному риску последующего развития метастазов в печень.
Заключение
У больного без известных злокачественных новообразований эти небольшие гиподенсивные образования, как правило, следует расценивать как доброкачественные.
У пациента с известным злокачественным новообразованием единичное поражение TSTC также можно считать доброкачественным.
Даже множественные TSTC у этих пациентов в основном доброкачественные, особенно когда они небольшие, резко очерченные и гиподенсированные.
В этих последних случаях вам не следует слишком защищаться!
Не диктуйте « мы не можем исключить метастазы «.
У пациентов с раком молочной железы и отсутствием известных метастазов в печени на момент поступления эти поражения TSTC не имеют положительного прогностического значения для развития метастазов в печени в долгосрочной перспективе.
Случайные гиперваскулярные поражения
Случайные гиперваскулярные поражения также являются очень частыми находками при визуализации печени.
Важно различать «прикосновение» и «не касание» поражений.
Доброкачественные «неприкасаемые» гиперваскулярные опухоли включают гемангиому, ФНГ и небольшие аденомы.
«Сенсорные» поражения включают большие аденомы (более 5 см) и злокачественные опухоли, такие как гепатоцеллюлярная карцинома (ГЦК), фиброламеллярная карцинома (ФЛГЦК) и метастазы.
Эти усиливающиеся солидные поражения следует дифференцировать от сосудистых поражений.
как аневризма печени,
аортопортальный шунт или псевдоаневризма.
Частота гиперваскулярных поражений
Karhunen (1986) обнаружил при вскрытии гемангиому в 20 % случаев, ФНГ в 3 % и аденому в 1 % (5).
Исследование, проведенное AFIP в 1989 г., показало соотношение FNH: аденомы 8:1 в серии из 9000 вскрытий (6).
Типичная гемангиома с узловатым периферическим усилением.
Усиление гемангиомы
Гемангиома представляет собой медленно перфузируемое сосудистое пространство.
Таким образом, время и количество улучшений будут
следуют, но отстают от артериальной системы.
Гемангиомы менее 1 см часто обнаруживают
немедленное гомогенное контрастирование, изоденсивное к аорте.
Гемангиомы размером более 1 см обычно проявляются медленно
центростремительное распространение узелкового усиления, медленно уменьшающегося в плотности.
Слева типичная гемангиома.
Усиление в артериальную фазу почти изоденсирует аорту, и по мере диффузии контраста к центру поражения уровень усиления медленно снижается, и в поздней фазе все еще остается гиперденсивным по сравнению с сосудистыми пространствами.
«Капиллярные румяна» в FNH. Обратите внимание на раннее усиление, но не такое яркое, как при гемангиоме. В венозную и отсроченную фазы усиление почти изодентично печени.
Усиление «капиллярного румянца»
Типичное, медленно перфузируемое усиление сосудистого пространства при гемангиоме
чтобы отличить от «капиллярного румянца» из-за обильной капиллярной сети
который характеризует FNH, аденому, HCC и
гиперваскулярные метастазы.
Поскольку капилляры окружены тканью, общее усиление будет меньше
плотный по сравнению с
расширение сосудистых пространств в
гемангиома.
Таким образом, при капиллярном покраснении усиление происходит немного позже по сравнению с аортой и менее плотное, чем аорта.
Типичная гемангиома на динамической МРТ
Гемангиома
Гемангиомы на динамической МРТ будут показывать то же самое
характеристики усиления как на КТ с контрастным усилением.
Преимуществом МРТ перед КТ является более высокая чувствительность к контрасту, что будет показано в следующем случае.
Неспецифическое гиповаскулярное поражение на КТ
Слева атипичное, явно гиповаскулярное образование на КТ, возможно метастазирование.
MR отображает усиление лучше, чем CT
Тот же случай при динамической МР.
Обратите внимание, как на МРТ видно узелковое, периферическое, медленно прогрессирующее усиление (синяя изогнутая стрелка), которое не удалось показать на КТ.
Маленькая гемангиома, атипичная на УЗИ, демонстрирующая типичное усиление небольшой гемангиомы на КТ.
Слева атипичное гипоэхогенное образование, окруженное небольшим, но отчетливым ореолом.
В артериальной фазе гомогенный
усиление артериального давления, часто наблюдаемое при небольших гемангиомах.
В портальную венозную фазу и в равновесную фазу имеет то же усиление, что и аорта.
Таким образом, все признаки соответствуют гемангиоме, доброкачественному, неплотному
поражение сосудов.
После исключения гемангиом наш
Основная цель состоит в том, чтобы определить, является ли гиперваскулярное поражение
FNH, который является наиболее распространенным гиперваскулярным
солидное поражение или является ли оно поражением
которые требуют дальнейшего лечения, такие как аденома,
HCC, FLHCC или гиперваскулярные метастазы.
Для этого мы должны искать морфологические признаки
как неоднородность и наличие капсулы, рубца,
кальцификация или жир.
Два FNH с поздним усилением центрального рубца
Очаговая узловая гиперплазия (ФУГ)
Слева два смежных гиперваскулярных очага с
гомогенное усиление в артериальной фазе и гиподенсии
центральные рубцы в артериальной и венозной фазах, которые
усиливаются в равновесной фазе.
Это характерно для FNH.
Обратите внимание, что маленький FNH,
спереди и справа от большего имеет тот же характер усиления.
FNH считается неопухолевым, гиперпластическим
ответ на врожденный порок развития сосудов.
Гистологически ФНГ не является опухолью и
состоит из доброкачественных гепатоцитов
происходит в печени, которая в других отношениях является нормальной (т.е. не
цирроз).
В поздней артериальной фазе ФНГ обычно проявляется
с ярким гомогенным усилением, но менее интенсивным, чем на аорте с
гиподенсивный центральный рубец.
Меньше (
Расходящиеся гиподенсивные фиброзные тяжи или
перегородки, возникающие из рубца, нередки и
вполне характерно.
В портальной фазе ФНГ часто является изоаттенуирующей
к нормальной печени и может быть трудно
разграничивать.
Задержанная фаза часто показывает гиперзатухание
центральный рубец и перегородки из-за позднего
помутнение фиброзных компонентов.
Не должно быть видно кальцификации, неоднородности или капсулы
в ФНХ.
Типовой FNH на MR
Очаговая узловая гиперплазия (2)
Слева типичная ФНГ на МР.
Слегка гипоинтенсивный на T1WI и слегка
гиперинтенсивный на T2WI.
Рубец несколько гиперинтенсивный
на Т2.
Улучшение, как мы
ожидать с «капиллярным румянцем» со шрамом, который
усиливается в конце фазы равновесия.
Атипичная ФНГ с неконтрастирующим центральным рубцом
Очаговая узловая гиперплазия (3)
Слева поражение, имеющее все
характеристики ФНГ за исключением отсутствия поздних
усиление центрального рубца.
Кроме того, паренхима слегка гиподенсирована до нормальной в
портальная и равновесная фазы.
Однако все остальные характеристики присутствуют
как лобулярное усиление, центральный рубец и отсутствие
капсулы, и поэтому мы характеризуем это поражение как ФНГ.
Гемангиома и ФНГ на УЗИ и динамической МРТ.
Очаговая узловая гиперплазия (4)
Ультразвуковое изображение слева показывает два поражения.
Маленький (синяя стрелка) характерен для
гемангиома, а большая (зеленая стрелка) не
конкретно по США.
На T2WI гемангиома показывает типичную
однородная гиперинтенсивность.
Более крупный очаг несколько гипоинтенсивен на Т1 и несколько гиперинтенсивен на Т2.
Усиление почти однородно с
небольшие перегородки, которые не усиливаются в артериальных
фазы и действительно показывают позднее усиление (желтые стрелки).
На Т2ВИ гемангиома показывает типичную
однородная гиперинтенсивность.
Крупный очаг несколько гипоинтенсивен на Т1 и несколько гиперинтенсивен на Т2.
Усиление почти однородно с
небольшие перегородки, которые не усиливаются в артериальных
фазе и показывают позднее усиление (желтые стрелки).
Мы также характеризуем это поражение как FNH.
Маленький FNH
Очаговая узловая гиперплазия (5)
Слева еще одна ФНГ на МРТ.
Поражение почти изоинтенсивно печени на T1WI и T2WI, но более контрастно по сравнению с печенью на T1W-MPRGRE (градиент-эхо).
Усиление в артериальной фазе дольчатое с неконтрастирующей перегородкой, а в равновесной фазе поражение не отличается от нормальной паренхимы печени.
Обратите внимание, что на поражении есть небольшой шрам.
Небольшие ФНГ часто не имеют центрального рубца при визуализации и даже при патологоанатомическом исследовании.
Случайное гиперваскулярное поражение на КТА легочной эмболии
Фокальная узловая гиперплазия (6)
Еще одна ФНГ слева, чтобы лучше познакомиться с этими распространенными поражениями.
На КТА легочной эмболии в печени видно небольшое гиперваскулярное поражение.
Дальнейшая оценка была проведена с помощью MR.
На Т1-ВИ поражение не видно, а на Т2-ВИ оно лишь слегка гиперинтенсивно.
В артериальную фазу наблюдается однородное усиление, а в венозную фазу поражения не видно.
При условии, что у этого пациента нет цирроза печени, это, вероятно, доброкачественное поражение, вероятно, ФНГ.
Поскольку внешний вид не был патогномоничным для ФНГ, было проведено последующее обследование, и поражение не изменилось, что делает
диагноз ФНГ наиболее вероятен.
Когда прекращается это приятное ощущение, что что-то является FNH?
Он останавливается, когда появляется слишком много объектов, не принадлежащих FNH.
Как в случае слева.
Решите для себя, какие результаты согласуются с диагнозом типичная ФНГ, а какие нет.
Поражение слева имеет центральный рубец
как при ФНГ, но на Т1ВИ поражение неоднородно и нечетко.
На Т2ВИ рубец имеет низкую интенсивность сигнала.
Однако для типичной ФНГ интенсивность сигнала должна быть высокой, а поражение снова
неоднородный.
В артериальную фазу поражение усиливается
как FNH, но в портале и равновесии
фазе усиление сохраняется и носит неоднородный характер.
Кроме того, центральный рубец не усиливается в
поздняя фаза.
Таким образом, есть много выводов, которые не
совместим с диагнозом ФНГ.
Поскольку специфичность диагностики поражения как
доброкачественный должен быть очень высоким, мы не можем остановиться
вот и приходится ставить гистологический диагноз.
Фиброламеллярная ГЦК
Когда мы сталкиваемся с дольчатыми гиперваскулярными образованиями в печени, важным диагнозом, который нельзя пропустить, является фиброламеллярная гепатоцеллюлярная карцинома (ФГЦК).
Эта конкретная форма ГЦК может имитировать ФНГ при визуализации.
В отличие от ГЦК, прогноз разумный.
Как и FNH, FLHCC также представляет собой гиперваскулярное дольчатое образование с рубцом в центре.
.
И FNH, и FLHCC появляются в нормальной печени, в отличие от
ГЦК чаще всего наблюдается при циррозе печени.
В отличие от FNH, FLHCC неоднороден,
большой (> 5 см), часто имеет кальцинаты (> 70%), a
тупой центральный рубец и обычно имеется
лимфаденопатия.
Кальцинаты при ФНГ настолько редки, что
должен заставить вас подумать о другом диагнозе, таком как
FLHCC.
Патологический образец FLHCC и FNH (любезно предоставлено доктором Бароном)
Фиброламеллярный ГЦК (2)
Слева патологический образец FLHCC и FNH.
На первый взгляд они очень похожи.
Однако при внимательном рассмотрении можно заметить более пластинчатую и гетерогенную структуру FLHCC по сравнению с гомогенным внешним видом FNH.
Леводолевая фиброламеллярная ГЦК. Предоставлено доктором Федерле и доктором Итикава (3)
Фиброламеллярный ГЦК (3)
На КТ и МРТ слева фиброламеллярный ГЦК левой доли у 19-летнего мужчины.
A. Поперечная КТ без контрастного усиления показывает кальцификацию (изогнутая стрелка) внутри гипоаттенуирующей опухоли (прямые стрелки).
B. Поперечная КТ с контрастным усилением печеночных артерий показывает гетерогенную гиперваскуляризацию в пределах опухоли (стрелки).
C. Десятиминутная поперечная КТ с задержкой демонстрирует тонкие области гиперденсии, которые представляют собой фиброзную ткань в пределах центрального рубца, расходящихся перегородок и капсулы (незакрашенные стрелки).
Изогнутая стрелка = кальцификация.
D. Поперечное Т2-взвешенное МРТ-изображение (5000/105) также демонстрирует центральный рубец и перегородки (незаштрихованная стрелка).
Сама опухоль (прямые стрелки) почти изоинтенсивна печени (единственный такой случай в нашей серии).
Леводолевая фиброламеллярная ГЦК. Предоставлено доктором Федерле и доктором Итикавой (3)
Слева на фотографии поверхности разреза макроскопического препарата видна большая опухоль с эксцентрическими и центральными рубцами (незаштрихованные стрелки) и расходящимися перегородками.
Масса имеет неровный дольчатый край сдавливания (сплошные стрелки) и пестрый вид с участками окрашивания желчью.
В серии из 31 случая FLHCC Ichikawa et al (7) обнаружили следующее:
- Крупные опухоли (средний диаметр 13 см) визуализировались на КТ и МРТ во всех случаях.
- При КТ края опухолей были четко определены в 24 (77%) из 31 случая.
- Кальцинаты были выявлены у 21 (68%)
- Центральный рубец у 22 (71%)
- Абдоминальная лимфаденопатия у 20 (65%).
- В 20 (80%) из 25 случаев с КТ-изображениями артериальной фазы печени опухоли были гетерогенными и отображали области гиперваскуляризации.
- При МРТ опухоли были гипоинтенсивны по отношению к печени на TI-взвешенных изображениях (n = 11) и гиперинтенсивны по отношению к печени на T2-взвешенных изображениях (n = 10).
- Кальцификаты не были видны на МРТ-изображениях, но в девяти случаях центральный рубец был гипоинтенсивным по отношению к окружающей опухоли.

Аденомы в артериальной, портальной венозной и равновесной фазе
Аденома
Аденома регулярно характеризуется кровотечением, жиром или пелиозом.
Хотя мы не можем видеть сам пелиоз, он может привести к гиперинтенсивному поражению на Т1-ВИ.
Слева две инциденталомы.
Решите сами, почему это не поражения ФНГ.
В артериальную фазу входят два
гиперваскулярные поражения, несколько реже
плотнее, чем мы могли бы ожидать в FNH.
Оба поражения демонстрируют венчик капсулы,
что не должно проявляться в FNH.
В отличие от FNH, улучшение
неоднородной и в портовенозной и
фазе равновесия поражения не изоденсированы к
печень.
Аденома с кровоизлиянием
Аденома (2)
Регулярно аденомы проявляются кровотечением.
Слева снимки женщины с острой болью в животе.
На УЗИ обнаружено образование печени и свободная жидкость, окружающая печень.
Это типичная картина аденомы.
На КТ в портальной фазе поражение гипоинтенсивно с кровоизлиянием, прилегающим к поражению, распространяющимся субкапсулярно.
Аденома: неспецифические признаки на КТ
Аденома (3)
Слева УЗ-изображение случайно обнаруженного образования у 50-летней женщины.
Обработка проводилась с помощью КТ, но были обнаружены только неспецифические особенности без признаков гиперваскуляризации. .
Продолжить со следующими изображениями.
Аденома: румянец капилляров в артериальной фазе и потеря сигнала в нефазовом изображении, что указывает на наличие жира.
В отличие от КТ явно есть
усиление в артериальную фазу на МР, снова демонстрируя, что МР
изображает усиление лучше, чем КТ.
Усиление связано с капиллярным румянцем, наиболее интенсивным в артериальной фазе с очевидным вымыванием в портальной и равновесной фазах из-за большего усиления окружающей паренхимы.
На изображении «не в фазе» есть потеря сигнала
указывая на то, что поражение содержит жир,
что очень характерно для аденомы.
ГЦК также может содержать жир, но в этом случае
цирроза нет и все
поражение показывает потерю сигнала,
чего мы не ожидали бы в HCC.
ГЦК: гиперваскулярное поражение при циррозе печени
Гепатоцеллюлярная карцинома (ГЦК)
Что касается диагностики ГЦК,
следует помнить одно: «Каждое гиперваскулярное поражение печени с циррозом
HCC, пока не доказано обратное». .
Слева мы видим цирротическую печень с неравномерной
поля (стрелки), предполагая, что гиперваскулярное поражение представляет собой ГЦК.
Неоднородный
улучшение и частичная капсула полезны
для диагностики ГЦК, но даже если эти
признаков не было, наш диагноз все же
будет ГЦК.
Гиперваскулярные метастазы с типичным периферическим усилением
Гиперваскулярные метастазы
Гиперваскулярные метастазы характеризуются:
- Гиперваскулярная первичная опухоль, такая как эндокринные опухоли (щитовидная железа, карциноид), почечно-клеточные опухоли и некоторые карциномы молочной железы.
- Часто сосуществующие гипо- и гиперваскулярные метастазы.
- Более крупные поражения часто неоднородны из-за центрального некроза.
Слева гиперваскулярные метастазы.
Обратите внимание, что в более крупных из них наблюдается центральный некроз, так как они перерастают свое кровоснабжение.
Дифференциальная диагностика гиперваскулярных поражений
Обработка
При обработке случайно найденных
гиперваскулярные поражения, мы сначала должны решить
является ли поражение гемангиомой, потому что
это наиболее распространенные поражения и обычно имеют
конкретные результаты визуализации.
Если нет, мы должны выяснить, является ли это FNH.
Для этой дифференциации мы должны посмотреть на
различия в характере усиления и
различия в морфологии, такие как наличие
капсула, рубец, кальцификация и неоднородность.
Чаще всего можно охарактеризовать гиперваскулярные поражения, даже если они небольшие.
ФНГ и гемангиомы не требуют дальнейшего обследования или лечения.
Предпочтительным методом для характеристики инциденталом является МРТ, так как он лучше подходит для характеристики поражения, а инциденталомы часто возникают у молодых женщин, у которых лучевая нагрузка должна быть сведена к минимуму.
Если подозревается ГЦР или FLHCC, всегда необходимо дальнейшее исследование.
Дифференциальный диагноз
В таблице слева мы суммировали типичные результаты при ФНГ, аденоме и ГЦК.
Поскольку ФНГ настолько распространена, мы должны получить четкую ментальную картину многих проявлений этих поражений.
Как рентгенологи, мы несем здесь большую ответственность.
При ФНГ не обязательно должны присутствовать все признаки, но не должно быть кальцификации или высокой интенсивности сигнала на Т1-ВИ, а поражение не должно быть неоднородным или иметь капсулу.
Иногда термин «скрытое поражение» используется для описания явления, при котором некоторые из этих небольших поражений FNH видны только в артериальную фазу.
- Частота и значимость небольших (менее или равных 15 мм) поражений печени, выявляемых при КТ
EC Jones, JL Chezmar, RC Nelson and ME Bernardino
Кафедра радиологии, Медицинский факультет Университета Эмори, Атланта, Джорджия 30322.
American Journal of Roentgenology, Vol 158, 535-539, - Распространенность и значение небольших поражений печени, обнаруженных при КТ, у онкологических больных
Лоуренс Х.
 Шварц, доктор медицины, Эрик Дж. Гандрас, доктор медицины, Сандра М. Коланджело, доктор медицины, Мэтью С. Эрколани, бакалавр наук, и Дэвид М. Паничек, доктор медицины
Шварц, доктор медицины, Эрик Дж. Гандрас, доктор медицины, Сандра М. Коланджело, доктор медицины, Мэтью С. Эрколани, бакалавр наук, и Дэвид М. Паничек, доктор медицины
Радиология. 1999;210:71-74. - Небольшие «неопределенные» очаги на КТ печени: последующее исследование стабильности
П. Дж. Робинсон, MB, FRCP, FRCR, П. Арнольд, бакалавр наук, и Д. Уилсон, магистр наук
Исследовательский отдел клинической радиологии и отделение медицинской физики, Университетская больница Сент-Джеймс, Бекетт-стрит, Лидс LS9 7TF, Великобритания
British Journal of Radiology (2003) 76, 866-874 - Небольшие гипоаттенуирующие поражения печени при КТ с контрастным усилением: прогностическое значение у пациентов с раком молочной железы.
Джордж А.
 Кракора, доктор медицины и др.
Кракора, доктор медицины и др.
Радиология 2004; 233:667-673 - Доброкачественные опухоли печени и опухолеподобные состояния у мужчин.
Кархунен П.Дж.
Дж. Клин Патол. 1986 г., февраль; 39 (2): 183-8. Роберт Л. Крейг
- Фиброламеллярная гепатоцеллюлярная карцинома: визуализация и патологические данные в 31 недавнем случае
Томоаки Итикава, доктор медицины, Майкл П. Федерле, доктор медицины, Луиджи Грациоли, доктор медицины, Хуан Мадариага, доктор медицины, Майкл Налесник, доктор медицины и Уоллис Марш, доктор медицины
Радиология. 1999; 213:352-361.
1999; 213:352-361.
Неопухолевые поражения гепатопанкреатобилиарной системы, симулирующие злокачественное новообразование: можем ли мы их дифференцировать? | Взгляд на визуализацию
- Образовательный обзор
- Открытый доступ
- Опубликовано:
- Ali Devrim Karaosmanoglu 1 ,
- Aycan Uysal 2 ,
- Musturay Karcaaltincaba 1 ,
- Deniz Akata 1 ,
- Mustafa Nasuh Ozmen 1 ,
- Jessica Kraeft 3 и
- …
- Питер Ф.
 Хан 4
Хан 4
Взгляд на визуализацию том 11 , номер статьи: 21 (2020) Процитировать эту статью
19 тыс. обращений
Сведения о показателях
Abstract
Несмотря на успех визуализации поперечного сечения в оценке злокачественных новообразований гепатопанкреатобилиарной системы, некоторые незлокачественные болезненные процессы могут близко имитировать злокачественные новообразования. Дифференцировать эти доброкачественные заболевания от злокачественных может быть сложно или даже невозможно даже в руках опытных специалистов по визуализации. В этой рукописи мы представляем доброкачественные имитаторы с участием гепатопанкреатобилиарной системы и пытаемся повысить осведомленность об этих потенциальных ловушках.
Ключевые точки
Некоторые инфекционные и воспалительные состояния могут имитировать опухолевые процессы при визуализирующих исследованиях, и дифференциальная диагностика может быть затруднена.
Клинический анамнез и демографические данные пациента имеют решающее значение для правильного диагноза в дополнение к результатам визуализации.
Биопсия под визуальным контролем может использоваться для окончательной дифференциальной диагностики у отдельных пациентов.
Введение
Несмотря на успех визуализации поперечного сечения в оценке злокачественных новообразований гепатопанкреатобилиарной системы, некоторые незлокачественные болезненные процессы могут близко имитировать злокачественные новообразования [1, 2]. Дифференцировать эти доброкачественные заболевания от злокачественных может быть сложно или даже невозможно даже в руках опытных специалистов по визуализации. В этой рукописи мы представляем доброкачественные имитаторы с участием гепатопанкреатобилиарной системы и пытаемся повысить осведомленность об этих потенциальных ловушках.
В этой рукописи мы представляем доброкачественные имитаторы с участием гепатопанкреатобилиарной системы и пытаемся повысить осведомленность об этих потенциальных ловушках.
Печень
Печень, вероятно, является наиболее часто поражаемым органом в брюшной полости у пациентов со злокачественными новообразованиями. Вторичные злокачественные новообразования в виде метастазов из разных источников намного превосходят первичные злокачественные заболевания печени. Визуализирующая диагностика первичных опухолей печени, включая гепатоцеллюлярную карциному (ГЦК) и холангиоцеллюлярную карциному (ХЦР), обычно проста. Метастатическое поражение печени является распространенным явлением, и диагностика, как правило, не вызывает проблем у пациентов с известными первичными злокачественными новообразованиями вне печени. Важно раннее выявление метастатического поражения печени; поскольку это, как правило, признак запущенного заболевания, и лечение пациента и прогностические ожидания должны быть соответствующим образом скорректированы в свете этого вывода. Как инфекционные, так и неинфекционные опухолеподобные состояния имитируют первичные и вторичные новообразования печени. Сначала мы обсудим инфекционные имитаторы, а затем неинфекционные болезненные процессы, которые могут имитировать злокачественное новообразование печени.
Как инфекционные, так и неинфекционные опухолеподобные состояния имитируют первичные и вторичные новообразования печени. Сначала мы обсудим инфекционные имитаторы, а затем неинфекционные болезненные процессы, которые могут имитировать злокачественное новообразование печени.
Инфекционные имитаторы
Печень часто поражается при различных вирусных, бактериальных, грибковых и паразитарных инфекциях. Существует несколько предрасполагающих местных и системных факторов, которые могут сделать печень более склонной к инфекциям, включая, помимо прочего, иммуносупрессию, связанную с вирусом иммунодефицита человека (ВИЧ), некоторыми лекарствами и хирургическим вмешательством. Дифференциальный диагноз может быть трудным, и подробный анамнез пациента имеет решающее значение для правильного диагноза.
Candida albicans инфекция Грибковые инфекции печени чаще всего встречаются у пациентов с ослабленной иммунной системой или в случаях гематологических злокачественных новообразований. Это проявление системной грибковой инфекции [3]. Лейкемия является наиболее часто встречающимся предрасполагающим фактором для печеночной инфекции из Candida albicans [3].
Это проявление системной грибковой инфекции [3]. Лейкемия является наиболее часто встречающимся предрасполагающим фактором для печеночной инфекции из Candida albicans [3].
Ультразвук (УЗИ), компьютерная томография (КТ) и магнитно-резонансная томография (МРТ) могут использоваться для диагностики. На УЗИ эхогенность паренхиматозных кандидозных узелков значительно варьирует в зависимости от стадии заболевания [4]. Наиболее частым паттерном является обнаружение множественных гипоэхогенных субсантиметровых поражений, которые могут близко имитировать лимфоматозное или лейкемическое поражение, а также метастазы солидного рака органов [5].
КТ очень часто используется для диагностики. Инфекционные паренхиматозные очаги в основном выглядят как округлые очаги низкой плотности с четкими краями (рис. 1). Размер обычно колеблется от 2 до 20 мм. Обнаружение гиператтенуирующего обода, окружающего гипоаттенуирующий центр («бычий глаз») в артериальной фазе сканирования, по-видимому, является наиболее чувствительным признаком. В портально-венозную фазу поражения часто выглядят как субсантиметровые гипоаттенуирующие очаги [5,6,7].
В портально-венозную фазу поражения часто выглядят как субсантиметровые гипоаттенуирующие очаги [5,6,7].
61-летний мужчина с недавно диагностированным ОМЛ, проходящий курс химиотерапии, в настоящее время проявляющийся нейтропенической лихорадкой. На постконтрастном КТ-изображении в аксиальной плоскости видны множественные четко очерченные гиподенсивные поражения печени (стрелки). Клинические и лабораторные данные соответствовали кандидозной инфекции. Признаки почти полностью разрешились после противогрибкового лечения (не показано). 8, 9]. Усиление можно увидеть после введения контраста [9]. Интенсивность сигнала может меняться в течение болезни. Сигнал Т2 постепенно исчезает с ответом на лечение [10]. Сообщалось, что МРТ превосходит КТ для обнаружения этих грибковых очагов [8, 10].
Дифференциальная диагностика может быть затруднена, и эти поражения можно легко спутать с метастатическим заболеванием. Клинический контекст и история болезни являются ключевыми факторами для постановки правильного диагноза. У пациентов, которые проходят интенсивную химиотерапию по поводу гематологических злокачественных новообразований, острое появление лихорадки, повышение уровня СРБ в сыворотке крови и аномальные печеночные тесты позволяют предположить наличие кандидоза печени. Последующая визуализация после лечения может быть полезна для подтверждения диагноза у некоторых пациентов [11]. Иногда поражения, как это ни парадоксально, становятся более очевидными по мере восстановления количества лейкоцитов и улучшения состояния пациента. Биопсия, как правило, не показана для диагностики в условиях наводящего на размышления клинического анамнеза [1]. Несмотря на все усилия, окончательный диагноз может быть невозможен на основании результатов визуализации, и для окончательного диагноза может потребоваться процедура чрескожной биопсии. Грибковые микроабсцессы также обычно поражают селезенку. Селезенка должна быть тщательно исследована на наличие сопутствующей инфекции.
У пациентов, которые проходят интенсивную химиотерапию по поводу гематологических злокачественных новообразований, острое появление лихорадки, повышение уровня СРБ в сыворотке крови и аномальные печеночные тесты позволяют предположить наличие кандидоза печени. Последующая визуализация после лечения может быть полезна для подтверждения диагноза у некоторых пациентов [11]. Иногда поражения, как это ни парадоксально, становятся более очевидными по мере восстановления количества лейкоцитов и улучшения состояния пациента. Биопсия, как правило, не показана для диагностики в условиях наводящего на размышления клинического анамнеза [1]. Несмотря на все усилия, окончательный диагноз может быть невозможен на основании результатов визуализации, и для окончательного диагноза может потребоваться процедура чрескожной биопсии. Грибковые микроабсцессы также обычно поражают селезенку. Селезенка должна быть тщательно исследована на наличие сопутствующей инфекции.
Туберкулез печени
Туберкулез (ТБ) относится к числу наиболее распространенных инфекционных заболеваний во всем мире и имеет различное распространение по всему миру. Поражение печени может быть классифицировано как милиарная форма, при которой печень вовлекается в течение системного заболевания, или как локализованная форма с образованием новообразований. Локализованные объемообразующие (макронодулярные, > 2 см) туберкулезные поражения печени обычно проявляются как фокальные паренхиматозные поражения. При этой форме могут выявляться туберкулемы печени и туберкулезные абсцессы [12,13,14].
Поражение печени может быть классифицировано как милиарная форма, при которой печень вовлекается в течение системного заболевания, или как локализованная форма с образованием новообразований. Локализованные объемообразующие (макронодулярные, > 2 см) туберкулезные поражения печени обычно проявляются как фокальные паренхиматозные поражения. При этой форме могут выявляться туберкулемы печени и туберкулезные абсцессы [12,13,14].
Поскольку изоляция медленно растущих бацилл туберкулеза может быть крайне затруднена для точного диагноза, визуализация играет решающую роль в диагностике. Милиарные поражения обычно наблюдаются в виде множественных субсантиметровых поражений (как правило, размером менее 2 см). Они могут быть беспорядочно распределены по всей паренхиме печени, но иногда объединяются в кластеры. Эти поражения могут выглядеть солидными или кистозными с минимальным усилением периферического контраста. Иногда бывает трудно отличить их от метастазов или вовлечения лимфомы [14].
Туберкулемы обычно обнаруживаются в виде округлых поражений и могут проявляться как одиночные или множественные поражения различных размеров. Эта форма встречается редко по сравнению с милиарной формой и может близко имитировать метастатическое заболевание или первичную опухоль печени. Туберкулемы обычно имеют размер более 2 см и также называются макронодулярным или псевдоопухолевым туберкулезом [14]. Туберкулемы могут быть видны на УЗИ как гипоэхогенные солидные образования; однако иногда может наблюдаться гиперэхогенность [15,16,17]. На КТ результаты визуализации, как правило, неубедительны, и они в основном наблюдаются как гиподенсивные образования с нечеткими границами и окружающим отеком. Результаты МРТ также не очень специфичны и обычно гипоинтенсивны на Т1-изображениях и гипо-, изо- или гиперинтенсивны на Т2-изображениях с периферическим гипоинтенсивным ободком [18]. Постконтрастные изображения обычно демонстрируют периферическое усиление в форме ободка с редким гетерогенным усилением перегородки (рис. 2) [13, 14]. Паттерн периферического усиления может быть полезен для дифференциации туберкулем от неопластических заболеваний, таких как ГЦР и гиперваскулярные метастазы [13]. Кистозные метастазы из яичников и желудочно-кишечного тракта могут выглядеть одинаково, но обнаружение перилезионального отека, который более заметен на изображениях T2W, более характерно для ТБ или гнойного абсцесса по сравнению с кистозным метастазом.
2) [13, 14]. Паттерн периферического усиления может быть полезен для дифференциации туберкулем от неопластических заболеваний, таких как ГЦР и гиперваскулярные метастазы [13]. Кистозные метастазы из яичников и желудочно-кишечного тракта могут выглядеть одинаково, но обнаружение перилезионального отека, который более заметен на изображениях T2W, более характерно для ТБ или гнойного абсцесса по сравнению с кистозным метастазом.
37-летняя женщина без известных системных заболеваний поступила с болью в правом подреберье. a Ультразвуковое исследование брюшной полости демонстрирует гипоэхогенное солидное образование со слегка повышенной центральной эхогенностью (стрелки). b Постконтрастное T1W-изображение в аксиальной плоскости демонстрирует периферически контрастирующее инфильтративное субкапсулярное объемное образование (стрелки), распространяющееся в околопеченочную область и инфильтрирующее жир брюшной стенки. Также обратите внимание на сопутствующее утолщение брюшины. Чрескожная биопсия под контролем УЗИ выявила гранулематозное воспаление, характерное для туберкуломы
Чрескожная биопсия под контролем УЗИ выявила гранулематозное воспаление, характерное для туберкуломы
Изображение в натуральную величину
Туберкулез печени следует учитывать при дифференциальной диагностике у пациентов с предполагаемыми клиническими признаками, такими как подтвержденный туберкулез в других частях тела или перенесенный ранее туберкулез. Демографические данные пациента, а также страна происхождения (у пациентов-мигрантов и беженцев) также могут быть другими полезными клиническими подсказками. Однако чрескожная биопсия необходима в определенных клинических обстоятельствах, когда неинвазивный окончательный диагноз не может быть поставлен.
Эхинококковая болезнь
Эхинококковая болезнь возникает у людей, случайно инфицированных Echinococcus granulosus и Echinococcus multilocularis . Правая доля является наиболее часто поражаемой частью печени у пациентов, инфицированных эхинококковой кистозной болезнью, вызванной E . зернистый . Результаты визуализации сильно варьируют в зависимости от стадии заболевания. УЗИ в первую очередь показывает анэхогенные или множественные поражения с различной степенью кальцификации. КТ обычно демонстрирует гиподенсивное, большое поражение со стенками, имеющими минимальное усиление или его отсутствие (рис. 3). В случае отслоения эндоцисты отслоившаяся стенка имеет вид волнистой структуры. Дочерние кисты также могут быть видны на разных стадиях заболевания и при их наличии являются патогномоничными. Наличие гипоинтенсивной стенки как на Т1-, так и на Т2-взвешенных изображениях характерно для кистозной эхинококковой болезни. Контрастное усиление кисты обычно не выявляется ни на КТ, ни на МРТ изображениях, что может служить полезным признаком для дифференциации дегенерированных эхинококковых кист от кистозных билиарных цистаденом/цистаденокарцином.
зернистый . Результаты визуализации сильно варьируют в зависимости от стадии заболевания. УЗИ в первую очередь показывает анэхогенные или множественные поражения с различной степенью кальцификации. КТ обычно демонстрирует гиподенсивное, большое поражение со стенками, имеющими минимальное усиление или его отсутствие (рис. 3). В случае отслоения эндоцисты отслоившаяся стенка имеет вид волнистой структуры. Дочерние кисты также могут быть видны на разных стадиях заболевания и при их наличии являются патогномоничными. Наличие гипоинтенсивной стенки как на Т1-, так и на Т2-взвешенных изображениях характерно для кистозной эхинококковой болезни. Контрастное усиление кисты обычно не выявляется ни на КТ, ни на МРТ изображениях, что может служить полезным признаком для дифференциации дегенерированных эхинококковых кист от кистозных билиарных цистаденом/цистаденокарцином.
77-летний мужчина-фермер без серьезной медицинской истории обратился с недавно появившейся желтухой и болью в правом подреберье. a Постконтрастная КТ брюшной полости в аксиальной проекции демонстрирует образование сложного вида с гетерогенными центральными и периферическими кальцификациями (стрелки). Также отмечают расширение внутрипеченочных желчных протоков за счет масс-эффекта очага. b МРТ-изображение T2W в аксиальной плоскости демонстрирует кистозную природу образования (стрелки) с внутренними перегородками, которые могут свидетельствовать об отслоении экстинохокальной мембраны. На постконтрастных динамических изображениях T1W не было признаков усиления внутреннего контраста (не показано). Чрескожный дренаж подтвердил эхинококковую кисту
a Постконтрастная КТ брюшной полости в аксиальной проекции демонстрирует образование сложного вида с гетерогенными центральными и периферическими кальцификациями (стрелки). Также отмечают расширение внутрипеченочных желчных протоков за счет масс-эффекта очага. b МРТ-изображение T2W в аксиальной плоскости демонстрирует кистозную природу образования (стрелки) с внутренними перегородками, которые могут свидетельствовать об отслоении экстинохокальной мембраны. На постконтрастных динамических изображениях T1W не было признаков усиления внутреннего контраста (не показано). Чрескожный дренаж подтвердил эхинококковую кисту
Изображение в полный размер
E . Инфекцию multilocularis , альвеолярную форму эхинококковой болезни, бывает труднее отличить от злокачественных поражений печени. Заболевание биологически агрессивно и обычно представляет собой сплошное инфильтративно-неоднородное образование с нечеткими границами (рис. 4). Могут быть небольшие кисты. Могут быть обнаружены узловые и дистрофические кальцинаты (рис. 5) [1]. На КТ масса также обычно включает гиподенсивные области, соответствующие некрозу и паразитарной ткани. В некоторых случаях Э . multilocularis может симулировать крупную гемангиому или холангиоцеллюлярную карциному. Может быть небольшое отсроченное периферическое усиление, соответствующее фиброзно-воспалительному периферическому кольцу, как при постконтрастной КТ, так и при МРТ (рис. 6) [19]. На МРТ отсутствие ограничения диффузии в массе является полезным открытием для дифференциации альвеолярного эхинококкоза от злокачественных новообразований, таких как холангиокарцинома [19]. Знакомство с характерными результатами визуализации альвеолярного эхинококкоза с подтверждающей серологической и клинической информацией имеет важное значение для диагностики у пациентов из эндемичных регионов.
Могут быть обнаружены узловые и дистрофические кальцинаты (рис. 5) [1]. На КТ масса также обычно включает гиподенсивные области, соответствующие некрозу и паразитарной ткани. В некоторых случаях Э . multilocularis может симулировать крупную гемангиому или холангиоцеллюлярную карциному. Может быть небольшое отсроченное периферическое усиление, соответствующее фиброзно-воспалительному периферическому кольцу, как при постконтрастной КТ, так и при МРТ (рис. 6) [19]. На МРТ отсутствие ограничения диффузии в массе является полезным открытием для дифференциации альвеолярного эхинококкоза от злокачественных новообразований, таких как холангиокарцинома [19]. Знакомство с характерными результатами визуализации альвеолярного эхинококкоза с подтверждающей серологической и клинической информацией имеет важное значение для диагностики у пациентов из эндемичных регионов.
27-летний пациент мужского пола с неизвестным анамнезом поступил с жалобами на желтуху и боль в правом подреберье. a Т2W изображение в аксиальной плоскости демонстрирует большое, преимущественно гипоинтенсивное образование с дольчатыми краями (стрелки). b Постконтрастное изображение в гепатобилиарной фазе T1W в аксиальной плоскости лучше демонстрирует границы этого образования (стрелки). Чрескожная биопсия выявила альвеолярную эхинококковую кисту
a Т2W изображение в аксиальной плоскости демонстрирует большое, преимущественно гипоинтенсивное образование с дольчатыми краями (стрелки). b Постконтрастное изображение в гепатобилиарной фазе T1W в аксиальной плоскости лучше демонстрирует границы этого образования (стрелки). Чрескожная биопсия выявила альвеолярную эхинококковую кисту
Изображение в натуральную величину
Рис. 5 65-летний мужчина недавно обратился с жалобами на боль в правом подреберье и нарушение показателей функции печени. a Ультразвуковое исследование брюшной полости демонстрирует дольчатое центрально-кистозное образование (стрелки) в правой доле печени. В большинстве случаев образование было гиперэхогенным по эхоструктуре. b Постконтрастная КТ в аксиальной проекции показала большое, гипоаттенуирующее, центрально-кистозное/некротическое образование печени (стрелки) с рассеянными кальцификациями. Для исключения холангиоцеллюлярного рака выполняли чрескожную биопсию. Окончательный диагноз: альвеолярная эхинококковая киста. Больному выполнена правосторонняя гепатэктомия
Окончательный диагноз: альвеолярная эхинококковая киста. Больному выполнена правосторонняя гепатэктомия
Изображение в натуральную величину
Рис. 633-летняя женщина с неизвестным анамнезом поступила с жалобами на постепенно усиливающуюся боль в правом подреберье. Постконтрастная КТ брюшной полости демонстрирует гиподенсивное центрально-некротическое массивное объемное образование (стрелки). Не было никаких признаков явного усиления после введения контраста. Чрескожная биопсия выявила альвеолярную эхинококковую кисту
Изображение полного размера
Чрескожное лечение может быть успешно использовано для лечения Э . granulosus инфекция, но при E обычно показано хирургическое вмешательство. многоочаговая инфекция . Наиболее грозным потенциальным осложнением чрескожного лечения эхинококковой кисты является анафилактическая реакция. Несмотря на то, что это редко, это может быть фатальным, и поэтому интервенционист должен принять соответствующие меры предосторожности перед началом процедуры [20].
Пиогенные и амебные абсцессы печени
Абсцессы печени могут быть вторичными по отношению к грибковым, бактериальным или амебным инфекциям. Пиогенные абсцессы составляют подавляющее большинство этих абсцессов с 9Общими возбудителями являются виды 1451 Escherichia coli и Clostridium [21]. Солитарные абсцессы печени часто бывают криптогенными, при этом четкого источника не удается идентифицировать [22, 23]. КТ обычно показывает гиподенсивное кистозное поражение с окружающим паренхиматозным отеком (рис. 7). Этот паренхиматозный отек является очень полезным признаком для дифференциации гнойных абсцессов от кистозных метастазов. Однако следует также отметить, что некоторые солитарные абсцессы печени могут проявляться в основном в виде солидных поражений без идентифицируемого основного фактора риска. Без отека вокруг очага поражения и типичных перегородок абсцесс печени трудно распознать (рис. 8). Кроме того, наличие лихорадки не является универсальным признаком абсцессов печени, что еще больше усложняет диагностику. Отсутствие центрально прогрессирующего усиления контраста на изображениях с отсроченной фазой и прогрессирующее усиление контраста в самом внешнем слое, соответствующем фиброзно-воспалительной капсуле абсцесса, может быть полезным для дифференциации гнойных абсцессов, преимущественно солидных, от внутрипеченочных холангиокарцином. Также трудно дифференцировать некротические опухоли печени от абсцессов. Узелковость внутренней поверхности стенки поражения, фокальные кальцификации внутри поражения и отсутствие отека вокруг очага указывают на наличие некротического новообразования над абсцессом [24]. Последующая визуализация после эмпирического лечения абсцесса печени также может быть реализована в качестве альтернативного подхода для дифференциальной диагностики. Однако морфологические изменения могут наблюдаться и при естественном течении болезни без какого-либо терапевтического вмешательства. У пациентов, у которых не удалось поставить диагноз неинвазивным путем, для окончательного планирования лечения можно использовать чрескожную биопсию.
Отсутствие центрально прогрессирующего усиления контраста на изображениях с отсроченной фазой и прогрессирующее усиление контраста в самом внешнем слое, соответствующем фиброзно-воспалительной капсуле абсцесса, может быть полезным для дифференциации гнойных абсцессов, преимущественно солидных, от внутрипеченочных холангиокарцином. Также трудно дифференцировать некротические опухоли печени от абсцессов. Узелковость внутренней поверхности стенки поражения, фокальные кальцификации внутри поражения и отсутствие отека вокруг очага указывают на наличие некротического новообразования над абсцессом [24]. Последующая визуализация после эмпирического лечения абсцесса печени также может быть реализована в качестве альтернативного подхода для дифференциальной диагностики. Однако морфологические изменения могут наблюдаться и при естественном течении болезни без какого-либо терапевтического вмешательства. У пациентов, у которых не удалось поставить диагноз неинвазивным путем, для окончательного планирования лечения можно использовать чрескожную биопсию.
70-летний мужчина с установленным раком толстой кишки в стадии полной ремиссии прошел рутинное скрининговое КТ-обследование. На постконтрастном КТ-изображении в аксиальной плоскости выявлено преимущественно солидное образование размером 5 см (стрелки) в левой доле печени. На момент проведения компьютерной томографии пациент был полностью лишен лихорадки и болей в животе. Чрескожная биопсия подтвердила абсцесс печени без признаков опухолевых клеток. Последующее КТ (не показано) после внутривенного введения антибиотиков подтвердило значительную регрессию поражения
Изображение в полный размер
Рис. 8 64-летняя женщина с ранее хирургически леченной аденокарциномой поджелудочной железы, в настоящее время с гипоэхогенным очаговым поражением печени, обнаруженным за пределами США. Клинически у пациентки была полная ремиссия по поводу опухоли, и ее предыдущее сканирование брюшной полости было нормальным. Она была бессимптомной и не имела лихорадки. a МРТ-изображение T2W в аксиальной плоскости демонстрирует умеренно гиперинтенсивное очаговое поражение (стрелки) в правой доле печени. b Постконтрастное МРТ T1W в аксиальной плоскости в поздней артериальной фазе демонстрирует заметное кольцевидное усиление на периферии поражения (стрелки), что считается весьма подозрительным для метастазов аденокарциномы. Чрескожная биопсия не выявила опухолевых клеток, но была интерпретирована как абсцесс. Последующая компьютерная томография (не показана) после интенсивного внутривенного лечения антибиотиками показала полное исчезновение поражения
Она была бессимптомной и не имела лихорадки. a МРТ-изображение T2W в аксиальной плоскости демонстрирует умеренно гиперинтенсивное очаговое поражение (стрелки) в правой доле печени. b Постконтрастное МРТ T1W в аксиальной плоскости в поздней артериальной фазе демонстрирует заметное кольцевидное усиление на периферии поражения (стрелки), что считается весьма подозрительным для метастазов аденокарциномы. Чрескожная биопсия не выявила опухолевых клеток, но была интерпретирована как абсцесс. Последующая компьютерная томография (не показана) после интенсивного внутривенного лечения антибиотиками показала полное исчезновение поражения
Изображение полного размера
Амебные абсцессы вызываются простейшими Entamoeba histolytica [21]. Примерно в 70% случаев выявляется солитарный абсцесс в правой доле печени. УЗИ обычно показывает округлую или овальную форму, гипоэхогенное поражение без каких-либо значительных стенных эхосигналов [25]. На КТ с контрастным усилением амебный абсцесс обычно может проявляться в виде округлых гиподенсивных поражений с нечеткими границами (рис. 9). Утолщение стенки и периферический отек также являются общим признаком. Также внутри полости абсцесса могут быть видны перегородки [24, 26].
9). Утолщение стенки и периферический отек также являются общим признаком. Также внутри полости абсцесса могут быть видны перегородки [24, 26].
32-летний мужчина с неизвестной историей болезни поступил с жалобами на боль в правом подреберье и лихорадку. Его личная история была примечательна недавней поездкой в Индию. a Сонографическое исследование выявило полутвердую массу, расположенную в заднем сегменте правой доли печени. b Постконтрастное КТ-изображение в аксиальной плоскости демонстрирует толстостенное некротическое образование в центре (стрелки) с периферической гиподенсивной зоной, соответствующей отеку. Чрескожный забор показал амебный абсцесс печени
Изображение полного размера
Эозинофильный абсцесс печени
Эозинофильный абсцесс печени (ЭЛА) представляет собой очаговый эозинофильный паренхиматозный некроз печени. Альтернативными терминами для этого клинического состояния являются эозинофилия печени и эозинофильная гранулема печени. Большинство случаев диагностируется случайно у бессимптомных пациентов, которые также обычно имеют периферическую эозинофилию. Заболевание обычно протекает доброкачественно. В этиологию вовлечена печеночная миграция личинок паразитов; однако в патогенезе также учитывались лекарственные препараты, аллергические и опухолевые заболевания [27]. Это редкое клиническое состояние, которое может имитировать метастазы в печени при визуализирующих исследованиях (рис. 10) [28].
Большинство случаев диагностируется случайно у бессимптомных пациентов, которые также обычно имеют периферическую эозинофилию. Заболевание обычно протекает доброкачественно. В этиологию вовлечена печеночная миграция личинок паразитов; однако в патогенезе также учитывались лекарственные препараты, аллергические и опухолевые заболевания [27]. Это редкое клиническое состояние, которое может имитировать метастазы в печени при визуализирующих исследованиях (рис. 10) [28].
50-летняя женщина с установленным раком молочной железы в стадии ремиссии была направлена на МРТ после обнаружения субсантиметрового очагового поражения печени при УЗИ. исследование в США показало субкапсулярное, гипоэхогенное твердое образование (стрелки). b Постконтрастное Т1-изображение в аксиальной плоскости показало то же поражение, что и гипоинтенсивное образование с усилением периферического контраста (стрелки). Изображения DW и карта ADC подтвердили значительное ограничение диффузии (не показано). Чрескожная биопсия подтвердила эозинофильный абсцесс печени без признаков метастазирования. Последующий мазок периферической крови также подтвердил гиперэозинофилию
Чрескожная биопсия подтвердила эозинофильный абсцесс печени без признаков метастазирования. Последующий мазок периферической крови также подтвердил гиперэозинофилию
Полноразмерное изображение
Как правило, ELA визуализируются как множественные небольшие гиподенсивные образования овальной формы на КТ [27]. Мультифокальность и паразитарные заболевания в анамнезе могут быть полезны для дифференциальной диагностики. Последующая визуализация также может показать регресс поражений печени, что может быть полезно для дифференциальной диагностики. Однако окончательный диагноз почти всегда требует гистопатологического подтверждения [29].
Фасциолез печени
Фасциолез — инфекция, вызываемая Fasciola hepatica плоский червь. Личинки заражаются при употреблении зараженной воды. Паразиты могут оставаться бездействующими в паренхиме печени в течение многих лет, и это хроническое присутствие обычно приводит к хроническому паренхиматозному воспалению [30]. Типичные результаты визуализации включают туннельные микроабсцессы и некротические паренхиматозные полости вдоль пути миграции личинки. Эти туннели часто простираются от капсулы Глиссона до центральных отделов печени [30]. Периферическая эозинофилия является частой находкой при фасциолезе и может помочь в постановке правильного диагноза [31]. Визуализация может имитировать злокачественные процессы у некоторых пациентов (рис. 11). Гистопатологический диагноз может быть необходим у этих пациентов для правильного диагноза, особенно без предшествующих результатов визуализации, которые показывают туннельные тракты.
Эти туннели часто простираются от капсулы Глиссона до центральных отделов печени [30]. Периферическая эозинофилия является частой находкой при фасциолезе и может помочь в постановке правильного диагноза [31]. Визуализация может имитировать злокачественные процессы у некоторых пациентов (рис. 11). Гистопатологический диагноз может быть необходим у этих пациентов для правильного диагноза, особенно без предшествующих результатов визуализации, которые показывают туннельные тракты.
16-летняя девочка с известной хирургически леченной опухолью Вильмса проходит МРТ-обследование по поводу недавно обнаруженного гипоэхогенного образования в печени при УЗИ. На постконтрастном T1W MR-изображении в аксиальной плоскости видны два периферически контрастирующих очага (стрелки) в правой доле печени. Пост-чрескожная биопсия показала фасциолез без признаков злокачественных клеток
Изображение полного размера
Редкие гранулематозные инфекции печени
Спирохетальные инфекции печени в постантибиотическую эру встречаются редко [32]. Спирохетальный гепатит может привести к циррозу, а обнаружение гумм, казеозных и неказеозных гранулем и очагового некроза вокруг печеночных вен является характерным гистологическим признаком [33, 34]. Поражение печени может наблюдаться на вторичной и третичной стадиях сифилиса. Очаговая гумма может развиваться в печени обычно через 1–10 лет после исходной инфекции [35]. В литературе по визуализации не так много информации из-за редкого поражения печени. Однако представляется, что очаги с низким затуханием и периферическим усилением на КТ (рис. 12) являются потенциальной находкой. Кальцификация также может присутствовать редко [36, 37].
Спирохетальный гепатит может привести к циррозу, а обнаружение гумм, казеозных и неказеозных гранулем и очагового некроза вокруг печеночных вен является характерным гистологическим признаком [33, 34]. Поражение печени может наблюдаться на вторичной и третичной стадиях сифилиса. Очаговая гумма может развиваться в печени обычно через 1–10 лет после исходной инфекции [35]. В литературе по визуализации не так много информации из-за редкого поражения печени. Однако представляется, что очаги с низким затуханием и периферическим усилением на КТ (рис. 12) являются потенциальной находкой. Кальцификация также может присутствовать редко [36, 37].
48-летний мужчина с подтвержденным ВИЧ-статусом. Недавно появились боли в животе и легкая потеря веса. Постконтрастное КТ-изображение в артериальной фазе в аксиальной плоскости демонстрирует несколько периферически усиливающихся поражений печени (стрелки), расположенных в правой доле. Первоначально предполагалось метастатическое поражение печени или гнойные микроабсцессы. Чрескожная биопсия соответствовала сифилитическим абсцессам печени. Тест RPR также оказался положительным после диагноза биопсии
Чрескожная биопсия соответствовала сифилитическим абсцессам печени. Тест RPR также оказался положительным после диагноза биопсии
Изображение полного размера
Fransicella tularensis — грамотрицательная коккобацилла, эндемичная для многих частей Северной Америки. Наиболее частым проявлением является язвенно-железистая форма. Невылеченное заболевание может распространиться на несколько органов. Вовлечение печени является распространенным явлением и может наблюдаться в 75% случаев при поражении внелимфатических органов [38]. Считается, что спектр находок при туляремии соответствует спектру гранулематозного гепатита [39]. Может образоваться видимый абсцесс печени, который, по нашему опыту, на КТ может выглядеть довольно твердым (рис. 13).
Рис. 13 44-летний мужчина, ранее здоровый профессиональный садовник с острова Мартас-Вайнъярд, в настоящее время поступил с кожной язвой и лимфаденопатией на руке, болью в правом подреберье, лихорадкой и недомоганием. Он был направлен на МРТ из-за новообразования в печени, обнаруженного при УЗИ брюшной полости. На постконтрастном изображении в аксиальной плоскости видно резко усиливающееся, преимущественно солидное образование (стрелки), прилегающее к нижней полой вене и хвостатой доле. Острые титры на туляремию были повышены. Титры нормализовались, и поражение почти полностью исчезло при последующем МРТ после лечения доксициклином
Он был направлен на МРТ из-за новообразования в печени, обнаруженного при УЗИ брюшной полости. На постконтрастном изображении в аксиальной плоскости видно резко усиливающееся, преимущественно солидное образование (стрелки), прилегающее к нижней полой вене и хвостатой доле. Острые титры на туляремию были повышены. Титры нормализовались, и поражение почти полностью исчезло при последующем МРТ после лечения доксициклином
Изображение полного размера
Бартонеллез является одной из причин лихорадки неясного генеза, и необычные проявления могут возникать в 0,3–10% случаев [40]. В случаях с поражением печени и селезенки гранулематозный воспалительный процесс обычно является характерной патологической находкой. Результаты визуализации неспецифичны, но могут наблюдаться гипоконтрастирующие или неконтрастные фокальные паренхиматозные поражения (рис. 14а). Особенности МРТ описаны недостаточно хорошо, есть только отдельные отчеты о случаях. Гиперинтенсивность T2 и постконтрастное усиление на изображениях T1W входят в число зарегистрированных результатов (рис. 14b). При длительном наблюдении внутри этих узлов могут появиться кальцификации [3, 41]. На КТ и МРТ узелки легко спутать с гипоконтрастирующими метастазами. Следует также отметить, что заболевание может проявляться как единое образование в паренхиме печени, имитирующее первичную гипоконтрастирующую холангиоцеллюлярную карциному.
14b). При длительном наблюдении внутри этих узлов могут появиться кальцификации [3, 41]. На КТ и МРТ узелки легко спутать с гипоконтрастирующими метастазами. Следует также отметить, что заболевание может проявляться как единое образование в паренхиме печени, имитирующее первичную гипоконтрастирующую холангиоцеллюлярную карциному.
Изображения двух разных пациентов с патологически подтвержденными бартонеллезными гранулемами печени. a Постконтрастное КТ-изображение в аксиальной плоскости у мужчины 45 лет демонстрирует преимущественно гиподенсивное солидное образование (стрелки) с центральной неоднородностью, расположенное в куполе печени. Хирургическая резекция этого поражения подтвердила бартонеллез. b 13-летняя девочка поступила с жалобами на боли в животе и направлена на МРТ с обнаружением поражения печени при УЗИ. На постконтрастном изображении в аксиальной плоскости в артериальной фазе четко видны объемные образования печени (стрелки) и аналогичные поражения в селезенке (острие стрелки), которые более заметны на изображении в фазе портальной вены (не показано). Эти поражения были связаны с гиперваскулярным метастазированием. Острые титры были положительными на Bartonella, и пациент выздоровел без осложнений
Эти поражения были связаны с гиперваскулярным метастазированием. Острые титры были положительными на Bartonella, и пациент выздоровел без осложнений
Увеличить
Актиномикоз печени
Актиномицеты — медленно растущие грамположительные ветвящиеся палочки. Наиболее часто они связаны с инфекциями шейно-лицевой области. Поражение брюшной полости встречается редко, наиболее часто поражается подвздошно-цекальная область. Сообщается, что печеночная инфекция наблюдается у 15% пациентов с абдоминальной инфекцией и в целом составляет 5% всех случаев актиномикоза [42]. Визуализирующие исследования могут выявить множественные или одиночные поражения, наиболее частым проявлением является одиночное гиподенсивное образование (рис. 15) [43]. Гипоинтенсивность T1 с переменным усилением контраста и связанная с этим гиперинтенсивность T2 являются часто встречающимися результатами МРТ-исследований (рис. 16) [44].
Рис. 15 40-летняя женщина с легкой лихорадкой и опухолью печени при УЗИ. На постконтрастном КТ-изображении в аксиальной плоскости определяется нечетко очерченное гиподенсивное образование (стрелки) в правой доле с сопутствующим обширным паренхиматозным участком нарушенной перфузии. При чрескожной биопсии были обнаружены базофильные агрегаты и гранулы серы, соответствующие инфекции актиномицетами. Постантибиотикотерапия продемонстрировала почти полную регрессию результатов визуализации (не показано)
На постконтрастном КТ-изображении в аксиальной плоскости определяется нечетко очерченное гиподенсивное образование (стрелки) в правой доле с сопутствующим обширным паренхиматозным участком нарушенной перфузии. При чрескожной биопсии были обнаружены базофильные агрегаты и гранулы серы, соответствующие инфекции актиномицетами. Постантибиотикотерапия продемонстрировала почти полную регрессию результатов визуализации (не показано)
Изображение полного размера
Рис. 16 66-летний мужчина с плохо контролируемым диабетом поступил с болью в животе, лихорадкой и потерей веса. a МРТ-изображение T2W в аксиальной плоскости демонстрирует гиперинтенсивные, преимущественно кистозные поражения (стрелки). Также отмечают некротизированный лимфатический узел в желудочно-печеночной связке (указатель стрелки). b Постконтрастное изображение T1W MR в аксиальной плоскости демонстрирует интенсивное усиление периферического контраста (стрелки). Чрескожная биопсия подтвердила инфицирование актиномицетами.
Чрескожная биопсия подтвердила инфицирование актиномицетами.
Полный размер
Pneumocystis jirovecii инфекция печениPneumocystis jirovecii является распространенной оппортунистической инфекцией у пациентов с иммунодефицитом и ВИЧ-инфекцией, при этом легкие являются наиболее часто поражаемым органом. Поражение печени встречается нечасто, но при его наличии гиподенсивные очаги в печени и селезенке можно увидеть на КТ (рис. 17). Дифференциальный диагноз от неопластического процесса еще более труден, когда инфекция является симптомом нераспознанной ретровирусной инфекции. По нашему ограниченному опыту, поражения почти всегда множественные, а не одиночные. Клинический и медикаментозный анамнез, а также иммунный статус пациента являются ключевыми факторами для постановки правильного диагноза. Наличие сопутствующих заболеваний легких также может быть полезным.
Рис. 17 55-летний мужчина с недавно диагностированной ВИЧ-инфекцией, у которого появились высокая температура и генерализованная боль в животе. Его количество лимфоцитов CD4 + также было значительно низким во время его презентации. Постконтрастная компьютерная томография в аксиальной плоскости выявила несколько небольших гиподенсивных образований, разбросанных по всей паренхиме печени (стрелки). Судя по его клиническому контексту, поражения предполагали инфекцию pneumocystis jirovecii. Также обратите внимание на легкую спленомегалию в этом случае, что является важным наводящим признаком диссеминированной пневмоцистной инфекции. Наблюдение после лечения подтвердило почти полную регрессию результатов визуализации (не показано)
Его количество лимфоцитов CD4 + также было значительно низким во время его презентации. Постконтрастная компьютерная томография в аксиальной плоскости выявила несколько небольших гиподенсивных образований, разбросанных по всей паренхиме печени (стрелки). Судя по его клиническому контексту, поражения предполагали инфекцию pneumocystis jirovecii. Также обратите внимание на легкую спленомегалию в этом случае, что является важным наводящим признаком диссеминированной пневмоцистной инфекции. Наблюдение после лечения подтвердило почти полную регрессию результатов визуализации (не показано)
Изображение полного размера
Саркоидоз
Саркоидоз — системное гранулематозное заболевание. Точная этиология неясна, и для этого заболевания характерно обнаружение неказеозных гранулем на образцах патологии. Легкие являются наиболее часто поражаемыми органами, но практически любой орган может быть поражен в ходе заболевания [45]. Печень является третьим наиболее часто поражаемым органом после легких и лимфатических узлов, и в большинстве случаев поражение печени происходит при системном заболевании. Однако также сообщалось об изолированном поражении печени [45]. Обнаружение поражения печени может быть отсрочено, так как у большинства больных заболевание протекает бессимптомно [46]. Хотя обычно вовлекается печень, только в 5% случаев саркоидоза повреждения печени выявляются с помощью КТ [47]. Вовлечение печени при саркоидозе может проявляться диффузными или фокальными узлами [46]. Очаговые поражения, как правило, небольшие и беспорядочно разбросаны по всей паренхиме печени. На КТ поражения в основном гипоаттенуирующие без значительного усиления контраста (рис. 18). МРТ также может быть полезна для обнаружения поражений. Следует искать сопутствующие поражения селезенки, так как их легче обнаружить, чем саркоид в печени. С точки зрения визуализации дифференциация от метастатического заболевания, лимфоматозного поражения или других инфекционных процессов может быть затруднена без соответствующей клинической и серологической информации.
Однако также сообщалось об изолированном поражении печени [45]. Обнаружение поражения печени может быть отсрочено, так как у большинства больных заболевание протекает бессимптомно [46]. Хотя обычно вовлекается печень, только в 5% случаев саркоидоза повреждения печени выявляются с помощью КТ [47]. Вовлечение печени при саркоидозе может проявляться диффузными или фокальными узлами [46]. Очаговые поражения, как правило, небольшие и беспорядочно разбросаны по всей паренхиме печени. На КТ поражения в основном гипоаттенуирующие без значительного усиления контраста (рис. 18). МРТ также может быть полезна для обнаружения поражений. Следует искать сопутствующие поражения селезенки, так как их легче обнаружить, чем саркоид в печени. С точки зрения визуализации дифференциация от метастатического заболевания, лимфоматозного поражения или других инфекционных процессов может быть затруднена без соответствующей клинической и серологической информации.
60-летний мужчина с ранее леченной лимфомой, в полной клинической ремиссии и ремиссии визуализаций, теперь жалуется на утомляемость, лихорадку и недомогание. a На абдоминальном УЗ-изображении продемонстрировано несколько едва различимых субсантиметровых поражений по всей паренхиме печени. Только одно поражение было больше сантиметра (стрелки). b Постконтрастное КТ-изображение в аксиальной плоскости демонстрирует бесчисленные очаги гиподенсии (стрелки). c На ПЭТ-КТ эти поражения оказались метаболически активными с интенсивным поглощением ФДГ (стрелки). КТ грудной клетки и шеи ничем не примечательна (не показано). Чрескожная биопсия неожиданно показала неказеозные гранулемы, совместимые с саркоидозом. Симптомы и результаты визуализации быстро исчезли после лечения кортикостероидами
a На абдоминальном УЗ-изображении продемонстрировано несколько едва различимых субсантиметровых поражений по всей паренхиме печени. Только одно поражение было больше сантиметра (стрелки). b Постконтрастное КТ-изображение в аксиальной плоскости демонстрирует бесчисленные очаги гиподенсии (стрелки). c На ПЭТ-КТ эти поражения оказались метаболически активными с интенсивным поглощением ФДГ (стрелки). КТ грудной клетки и шеи ничем не примечательна (не показано). Чрескожная биопсия неожиданно показала неказеозные гранулемы, совместимые с саркоидозом. Симптомы и результаты визуализации быстро исчезли после лечения кортикостероидами
Изображение в натуральную величину
Повышенный уровень АПФ в сыворотке крови является относительно частым признаком, который может служить вспомогательной информацией для постановки диагноза. Несмотря на все усилия, для окончательного диагноза может потребоваться чрескожная биопсия под визуальным контролем [45].
Очаговое заболевание печени, связанное с IgG4
Заболевание, связанное с IgG4, обычно поражает печень и билиарную систему. Гистопатологически IgG4-связанное заболевание печени характеризуется как фибровоспалительное состояние с плотным лимфоплазмоцитарным инфильтратом, богатым IgG4-позитивными плазматическими клетками с повышенным уровнем IgG4 в сыворотке или без него [48]. Очаговое паренхиматозное образование с четкими границами относительно редко встречается у пациентов с поражением печени [49].]. Дифференциация от злокачественного новообразования печени может быть чрезвычайно сложной без надлежащего анамнеза и патологоанатомического анализа (рис. 19 и 20) [48, 50].
Гистопатологически IgG4-связанное заболевание печени характеризуется как фибровоспалительное состояние с плотным лимфоплазмоцитарным инфильтратом, богатым IgG4-позитивными плазматическими клетками с повышенным уровнем IgG4 в сыворотке или без него [48]. Очаговое паренхиматозное образование с четкими границами относительно редко встречается у пациентов с поражением печени [49].]. Дифференциация от злокачественного новообразования печени может быть чрезвычайно сложной без надлежащего анамнеза и патологоанатомического анализа (рис. 19 и 20) [48, 50].
70-летний мужчина без каких-либо значимых заболеваний в анамнезе с фокальной гипоэхогенной опухолью печени при УЗИ, выполненном по поводу впервые возникшей боли в правом верхнем квадранте. a T2W-изображение в аксиальной плоскости демонстрирует умеренно гипоинтенсивное образование (стрелки) в правой доле печени. b То же поражение демонстрирует слабое периферическое усиление без значительного центрального контрастного заполнения (стрелки). Предположительный диагноз: холангиоцеллюлярная карцинома. Патологоанатомическое исследование после биопсии подтвердило наличие очаговой псевдомассы печени, связанной с IgG4, без признаков опухолевых клеток
Предположительный диагноз: холангиоцеллюлярная карцинома. Патологоанатомическое исследование после биопсии подтвердило наличие очаговой псевдомассы печени, связанной с IgG4, без признаков опухолевых клеток
Изображение в натуральную величину
Рис. 2028-летний мужчина без каких-либо серьезных заболеваний в анамнезе поступил с болью в правом подреберье и потерей веса. МР-изображение T2W в аксиальной плоскости демонстрирует твердое образование (стрелки) в правой доле печени. b Постконтрастное Т1-изображение в аксиальной плоскости в портальной венозной фазе демонстрирует гетерогенное усиление поражения (стрелки). Хирургическая резекция этой массы с предполагаемым диагнозом холангиоцеллюлярной карциномы выявила воспалительную псевдоопухоль с признаками склерозирующего холангита, связанного с IgG4. Послеоперационная оценка выявила повышенный уровень IgG4 в сыворотке
Изображение полного размера
Воспалительная псевдоопухоль печени
Воспалительная псевдоопухоль печени была впервые описана в 1953 г. , и с тех пор было зарегистрировано более 200 пациентов [51, 52]. Этиология остается в значительной степени неизвестной, но в этиологию вовлечены аутоиммунные реакции, инфекционный гепатит и бактериальные инфекции [53]. У некоторых пациентов дифференциальная диагностика с неопластическими поражениями печени может потребовать чрескожной биопсии и гистопатологического подтверждения. Сообщалось, что воспалительные псевдоопухоли имитируют ГЦК у пациентов с вирусным гепатитом [53].
, и с тех пор было зарегистрировано более 200 пациентов [51, 52]. Этиология остается в значительной степени неизвестной, но в этиологию вовлечены аутоиммунные реакции, инфекционный гепатит и бактериальные инфекции [53]. У некоторых пациентов дифференциальная диагностика с неопластическими поражениями печени может потребовать чрескожной биопсии и гистопатологического подтверждения. Сообщалось, что воспалительные псевдоопухоли имитируют ГЦК у пациентов с вирусным гепатитом [53].
На УЗИ поражения обычно выглядят гипоэхогенными в правой доле печени [54]. Результаты КТ сильно варьируют. Сообщалось об усилении в ранней артериальной фазе, имитирующем ГЦК или гиперваскулярные метастазы, периферическом усилении, имитирующем холангиоцеллюлярную карциному или метастазы, и вымывании в венозной фазе, предполагающем ГЦК [54, 55]. На МРТ эти поражения кажутся гипоинтенсивными на предконтрастных Т1-изображениях и изогиперинтенсивными на Т2-изображениях. Гетерогенное или периферическое усиление часто встречается после введения контраста (рис. 21) [56, 57].
21) [56, 57].
41-летний мужчина с недавно обнаруженным новообразованием печени при УЗИ, проведенном по несвязанной причине. a На изображении T2W в аксиальной плоскости видно преимущественно гиперинтенсивное образование с гипоинтенсивным ободком (стрелки). b Предконтрастное изображение T1W в аксиальной плоскости показывает край как гиперинтенсивный (не показано). Постконтрастное изображение равновесной фазы в аксиальной плоскости T1W не демонстрирует какого-либо центрального усиления (стрелки). Поскольку результаты визуализации не были типичными для любого доброкачественного очагового поражения печени, была выполнена биопсия под визуальным контролем. Патологическое исследование не выявило каких-либо опухолевых клеток, но вместо этого соответствовало воспалительной псевдоопухоли
Изображение полного размера
Выпавшие желчные камни
Выпавшие желчные камни (ЖК) можно увидеть примерно после 7% лапароскопических холецистэктомий в результате разрыва стенки желчного пузыря во время диссекции и удаления желчного пузыря [58]. Эти СД могут стать симптоматическими в редких случаях. Правильная диагностика может быть чрезвычайно сложной и отсроченной из-за атипичных форм клинической картины и неожиданного расположения этих ДС [59]. Тщательная диссекция и аспирация желчного пузыря во время операции являются важными факторами для предотвращения этого осложнения [60]. Эти СД могут проявляться в среднем через 5 месяцев после операции, но сообщалось, что симптомы появляются даже через 20 лет после операции [58].
Эти СД могут стать симптоматическими в редких случаях. Правильная диагностика может быть чрезвычайно сложной и отсроченной из-за атипичных форм клинической картины и неожиданного расположения этих ДС [59]. Тщательная диссекция и аспирация желчного пузыря во время операции являются важными факторами для предотвращения этого осложнения [60]. Эти СД могут проявляться в среднем через 5 месяцев после операции, но сообщалось, что симптомы появляются даже через 20 лет после операции [58].
Очаговое воспаление с образованием абсцесса и свищевого хода является относительно частым осложнением. Обнаружение гиперплотных структур внутри некротических абсцессов (в случаях с выпавшими кальцифицированными желчными камнями) может быть важным диагностическим ключом. Расположение скопления/воспаления рядом с капсулой печени также можно рассматривать как наводящую на размышления находку. Другие редкие осложнения включают эрозию толстой кишки и кишечную непроходимость из-за образования спаек [58]. У пациентов с известными злокачественными опухолями воспаление в гепаторенальной ямке из-за выпавших желчных камней может имитировать имплантат, и может потребоваться гистопатологическая оценка (рис. 22). В ямке желчного пузыря также можно увидеть выпавшие желчные камни, и дифференциация от первичного очагового злокачественного новообразования печени снова может быть чрезвычайно сложной (рис. 23).
22). В ямке желчного пузыря также можно увидеть выпавшие желчные камни, и дифференциация от первичного очагового злокачественного новообразования печени снова может быть чрезвычайно сложной (рис. 23).
65-летний мужчина с раком толстой кишки в ремиссии в течение 7 лет прошел повторную КТ. На момент компьютерной томографии у него не было никаких симптомов. Он также имеет отдаленную историю лапароскопической холецистэктомии 5 лет назад. Постконтрастное КТ-изображение в аксиальной плоскости демонстрирует сложно выглядящую кистозную массу в капсуле печени (стрелки), наводящую на мысль об опухолевом имплантате. Также обратите внимание на небольшой плотный узел в левом подреберье (указатель стрелки). Хирургическое иссечение подтвердило наличие злокачественного имплантата в левом верхнем квадранте и воспалительную псевдомассу в капсуле печени из-за выпавшего желчного камня.
Изображение в натуральную величину
Рис. 23
23 63-летний мужчина с установленным циррозом печени и лапароскопической холецистэктомией в анамнезе прошел скрининговое МРТ-обследование в связи с умеренно повышенным уровнем альфа-фетопротеина. МРТ в аксиальной плоскости в артериальной фазе T1W демонстрирует гиперконтрастное фокальное паренхиматозное поражение (стрелки) в правой доле, предполагающее гепатоцеллюлярную карциному. КТ, проведенная для проведения чрескожной биопсии, выявила небольшую кальцификацию (не показана), и была вторая, явно внепеченочная коллекция, содержащая четко очерченные выпавшие желчные камни. Образец патологии подтвердил, что индексное поражение также было абсцессом
Изображение в полный размер
Желчный пузырь и желчевыводящая система
Расширение желчных путей и асимметричное утолщение стенки желчного пузыря (ЖП) являются пугающими результатами визуализации, часто указывающими на рак панкреатобилиарной системы или желчнокаменную болезнь. Несмотря на эти общие состояния, некоторые неопухолевые заболевания также могут поражать билиарную систему и вызывать аномалии желчевыводящих путей. Первичная аденокарцинома желчного пузыря является высокоагрессивным злокачественным новообразованием с тяжелым прогнозом. У некоторых пациентов желчный пузырь может быть полностью заменен опухолью, что затрудняет заключение об органе-источнике. Однако, как правило, диагноз может быть поставлен на основании данных визуализации. Несмотря на эту относительную простоту диагностики, следует иметь в виду несколько неопухолевых имитаторов этого рака, включая ксантогранулематозный холецистит [61].
Первичная аденокарцинома желчного пузыря является высокоагрессивным злокачественным новообразованием с тяжелым прогнозом. У некоторых пациентов желчный пузырь может быть полностью заменен опухолью, что затрудняет заключение об органе-источнике. Однако, как правило, диагноз может быть поставлен на основании данных визуализации. Несмотря на эту относительную простоту диагностики, следует иметь в виду несколько неопухолевых имитаторов этого рака, включая ксантогранулематозный холецистит [61].
Псевдомассы, связанные с желчным пузырем
Аденокарцинома желчного пузыря является одним из самых смертельных видов рака гепатобилиарной системы. Некоторые мелкие опухоли обнаруживаются случайно при холецистэктомии. При диагностировании рака ГБ с помощью изображений большинство пациентов находятся на поздней стадии с локальными метастазами в лимфатические узлы и паренхиматозной инвазией печени. По этим причинам правильный диагноз имеет решающее значение, и следует учитывать потенциальные мимики.
Ксантогранулематозный холецистит (КГХ) — редкий вариант хронического холецистита. Несмотря на то, что это доброкачественное заболевание, воспалительный процесс может носить инфильтративный и местно-деструктивный характер. Отмечается асимметричное утолщение стенки желчного пузыря с распространением воспалительного процесса на паренхиму печени, сальник и двенадцатиперстную кишку (рис. 24) [62]. Из-за близкого сходства результатов визуализации пациенты с XGC могут подвергаться радикальным хирургическим вмешательствам с ошибочным диагнозом первичной аденокарциномы желчного пузыря. Прилежащая паренхима печени также может иметь аномальное контрастирование, что может ложно свидетельствовать о паренхиматозной инвазии. Увеличенные лимфатические узлы могут наблюдаться как при раке желчного пузыря, так и при XGC, а желчнокаменная болезнь характерна для обоих случаев. Интрамуральные гипоаттенуирующие узлы на КТ в утолщенной стенке желчного пузыря могут служить полезными данными для диагностики XGC по сравнению с аденокарциномой желчного пузыря. На МРТ обнаружение содержания жира в этих узлах может быть обнаружено с помощью МРТ с химическим сдвигом [63]. Холецистэктомия может быть необходима для окончательного диагноза у некоторых пациентов [62].
На МРТ обнаружение содержания жира в этих узлах может быть обнаружено с помощью МРТ с химическим сдвигом [63]. Холецистэктомия может быть необходима для окончательного диагноза у некоторых пациентов [62].
45-летний мужчина доставлен в отделение неотложной помощи с легкой лихорадкой и болью в правом подреберье. a УЗИ показывает значительное и неравномерное утолщение стенки желчного пузыря (стрелки) и гиперэхогенный мусор в просвете. b Постконтрастное КТ-изображение в аксиальной плоскости демонстрирует утолщение стенки желчного пузыря с интрамуральными абсцессами, имитирующими поликистозное образование (стрелки) в ямке желчного пузыря, а также интенсивное усиление контраста в стенке поражения. Открытая холецистэктомия и гистопатологическое исследование подтвердили ксантогранулематозный холецистит
Изображение полного размера
Туберкулезный холангит
Клиническая картина поражения желчевыводящих путей у больных туберкулезным холангитом обычно малозаметна. Среди часто сообщаемых симптомов — боль в животе, лихорадка, потеря веса и желтуха [64]. Результаты визуализации могут имитировать опухолевые расстройства, особенно у пациентов со значительным усилением контраста стенки и склерозирующей билиарной обструкцией (рис. 25). Результаты эндоскопической ретроградной холангиопанкреатографии (ЭРХПГ) могут имитировать первичный склерозирующий холангит с чередующимися стенозированными и расширенными билиарными радикалами и связанными с ними неровностями стенок желчных протоков. Эти результаты ЭРХПГ могут наблюдаться при других состояниях, таких как лейкемия, лимфома, метастазы солидных опухолей и амилоидоз печени [65].
Среди часто сообщаемых симптомов — боль в животе, лихорадка, потеря веса и желтуха [64]. Результаты визуализации могут имитировать опухолевые расстройства, особенно у пациентов со значительным усилением контраста стенки и склерозирующей билиарной обструкцией (рис. 25). Результаты эндоскопической ретроградной холангиопанкреатографии (ЭРХПГ) могут имитировать первичный склерозирующий холангит с чередующимися стенозированными и расширенными билиарными радикалами и связанными с ними неровностями стенок желчных протоков. Эти результаты ЭРХПГ могут наблюдаться при других состояниях, таких как лейкемия, лимфома, метастазы солидных опухолей и амилоидоз печени [65].
68-летняя женщина с известным отдаленным анамнезом рака молочной железы. В последнее время у пациента появились боли в животе, вздутие живота, ночные сладости и потеря веса. a Постконтрастная КТ в аксиальной плоскости продемонстрировала заметное перипортальное утолщение (стрелки) в левой доле печени, которое также может наблюдаться при инфильтративных злокачественных новообразованиях печени, таких как лимфома. b Корональное переформатированное изображение показывает значительное усиление контраста в общем желчном протоке (стрелка). Также обратите внимание на умеренный асцит с легким перитонеальным усилением контраста, что также может свидетельствовать о карциноматозе брюшины. Забор внутрибрюшной жидкости и цитологическое исследование подтвердили билиарный ТБ
b Корональное переформатированное изображение показывает значительное усиление контраста в общем желчном протоке (стрелка). Также обратите внимание на умеренный асцит с легким перитонеальным усилением контраста, что также может свидетельствовать о карциноматозе брюшины. Забор внутрибрюшной жидкости и цитологическое исследование подтвердили билиарный ТБ
Изображение полного размера
Склерозирующий холангит, связанный с IgG4
Склерозирующий холангит, связанный с IgG4, часто связан с аутоиммунным панкреатитом (АИП). Желчные протоки являются наиболее часто поражаемой частью тела, помимо поджелудочной железы, при заболеваниях, связанных с IgG4. Однако изолированное поражение желчевыводящих путей также может наблюдаться без явного поражения поджелудочной железы [66, 67]. Гистопатологически поражение желчевыводящих путей характеризуется инфильтрацией желчных протоков IgG4-позитивными плазматическими клетками и ассоциированным обширным фиброзом. Как внутрипеченочные, так и внепеченочные желчные протоки могут быть вовлечены в IgG4-ассоциированный склерозирующий холангит в диффузной или изолированной форме. Интрапанкреатический дистальный отдел общего желчного протока является наиболее часто поражаемым билиарным сегментом [66, 68]. Утолщение и неравномерность стенки с сопутствующим усилением контраста и стенозом просвета являются типичными находками при визуализации. Очаговое вовлечение дистального отдела общего желчного протока или вовлечение ворот печени с восходящим расширением желчевыводящей системы может близко имитировать холангиокарциному печени или опухоль головки поджелудочной железы (рис. 26) [66, 68].
Интрапанкреатический дистальный отдел общего желчного протока является наиболее часто поражаемым билиарным сегментом [66, 68]. Утолщение и неравномерность стенки с сопутствующим усилением контраста и стенозом просвета являются типичными находками при визуализации. Очаговое вовлечение дистального отдела общего желчного протока или вовлечение ворот печени с восходящим расширением желчевыводящей системы может близко имитировать холангиокарциному печени или опухоль головки поджелудочной железы (рис. 26) [66, 68].
43-летний мужчина поступил с желтухой и болью в правом подреберье. a Коронально переформатированное постконтрастное КТ-изображение демонстрирует диффузное утолщение стенки общего желчного протока (указатели стрелок). b MIP-изображение во фронтальной плоскости из исследования MRCP продемонстрировало резкую сегментарную обструкцию (стрелка) в пределах того же сегмента. Также обратите внимание на расширенные проксимальные внутрипеченочные желчные протоки. Щеточные биопсии, полученные при эндоскопическом взятии образцов, свидетельствовали о склерозирующем холангите, связанном с IgG4, и в образцах не было обнаружено злокачественных клеток. Симптомы улучшились после соответствующего лечения
Щеточные биопсии, полученные при эндоскопическом взятии образцов, свидетельствовали о склерозирующем холангите, связанном с IgG4, и в образцах не было обнаружено злокачественных клеток. Симптомы улучшились после соответствующего лечения
Полноразмерное изображение
На КТ вовлечение желчевыводящих путей обычно проявляется очаговым или диффузным утолщением стенки с усилением контраста. Стриктуры желчевыводящих путей с сопутствующим увеличением массы мягких тканей также можно увидеть при постконтрастных исследованиях, которые могут симулировать холангиокарциному [66, 68].
При склерозирующем холангите, связанном с IgG4, КТ и МРТ обычно демонстрируют концентрическое утолщение мягких тканей стенки желчного протока с гомогенным усилением в отсроченной фазе. Сопутствующие аномалии просвета обнаруживаются не только в стенозированных сегментах или вблизи мягких тканей, но и в областях без каких-либо признаков стеноза [68]. Хотя толстая кольцеобразная оболочка мягких тканей, покрывающих пораженный проток, свидетельствует о склерозирующем холангите, связанном с IgG4, эта находка может также наблюдаться в более легкой степени у пациентов с первичным склерозирующим холангитом или инфекционным холангитом [66]. Хотя повышенный уровень IgG4 в сыворотке и связанное с ним экстрабилиарное заболевание (особенно вовлечение поджелудочной железы или почек) могут выступать в качестве подтверждающего признака, у некоторых пациентов может потребоваться чрескожная или эндоскопическая биопсия.
Хотя повышенный уровень IgG4 в сыворотке и связанное с ним экстрабилиарное заболевание (особенно вовлечение поджелудочной железы или почек) могут выступать в качестве подтверждающего признака, у некоторых пациентов может потребоваться чрескожная или эндоскопическая биопсия.
Поджелудочная железа
Злокачественные новообразования поджелудочной железы имеют значительную заболеваемость и смертность. Аденокарцинома поджелудочной железы имеет низкие показатели выживаемости, которые существенно не изменились за последние несколько десятилетий, несмотря на достижения в медицинской и хирургической онкологии. Ожидается, что около 90% пациентов, у которых был диагностирован рак поджелудочной железы, в конечном итоге умрут от этого заболевания [69]. Острый или хронический панкреатит являются распространенными заболеваниями поджелудочной железы, которые иногда можно спутать с раком поджелудочной железы.
Аутоиммунный панкреатит, связанный с IgG4
АИП является наиболее частым проявлением системного заболевания, связанного с IgG4. АИП 1-го типа (также известный как лимфоплазмоцитарный склерозирующий панкреатит) наблюдается в основном у мужчин среднего возраста, тогда как АИП 2-го типа чаще встречается у более молодого населения [67]. AIP типа 1 представляет собой панкреатическое проявление системного заболевания, связанного с IgG4, а AIP типа 2, как правило, представляет собой специфическое заболевание поджелудочной железы без внепанкреатического поражения (например, стриктура проксимальных желчных путей, поражение поднижнечелюстной железы или ретроперитонеальный фиброз) [70]. Дифференциация между этими двумя подтипами на основе изображений в настоящее время невозможна, и дифференциация основана в основном на гистопатологической оценке [71].
АИП 1-го типа (также известный как лимфоплазмоцитарный склерозирующий панкреатит) наблюдается в основном у мужчин среднего возраста, тогда как АИП 2-го типа чаще встречается у более молодого населения [67]. AIP типа 1 представляет собой панкреатическое проявление системного заболевания, связанного с IgG4, а AIP типа 2, как правило, представляет собой специфическое заболевание поджелудочной железы без внепанкреатического поражения (например, стриктура проксимальных желчных путей, поражение поднижнечелюстной железы или ретроперитонеальный фиброз) [70]. Дифференциация между этими двумя подтипами на основе изображений в настоящее время невозможна, и дифференциация основана в основном на гистопатологической оценке [71].
С точки зрения визуализации диффузное увеличение поджелудочной железы является частой находкой, но фокальное или объемное увеличение не является чем-то необычным. О диффузном увеличении сообщалось у 11–56% пациентов, тогда как очаговое или объемное увеличение наблюдалось в 28–59% случаев (рис. 27) [72]. Другой важной особенностью является неравномерное сужение главного протока поджелудочной железы [67]. Перипанкреатические жировые слои обычно сохраняются без признаков скопления жидкости или перипанкреатического воспаления, которые обычно наблюдаются при остром панкреатите.
27) [72]. Другой важной особенностью является неравномерное сужение главного протока поджелудочной железы [67]. Перипанкреатические жировые слои обычно сохраняются без признаков скопления жидкости или перипанкреатического воспаления, которые обычно наблюдаются при остром панкреатите.
32-летняя женщина с неизвестным анамнезом поступила с жалобами на хроническую боль в эпигастрии и потерю веса. КТ брюшной полости показала сомнительную и плохо различимую гиподенсивную массу в крючковидном отростке поджелудочной железы (не показано). a МРТ T2W в аксиальной плоскости отчетливо демонстрирует гипоинтенсивное поражение (стрелки) крючковидного отростка. b ДВИ-изображение в аксиальной плоскости показывает фокальное ограничение диффузии в месте поражения (стрелки). Ограниченная область больше, чем фактическое поражение, что может быть полезным для дифференциальной диагностики с аденокарциномой. Биопсия с эндоскопическим контролем УЗИ и последующим иммуногистохимическим окрашиванием выявила заболевание поджелудочной железы, связанное с IgG4. В связи с этим пациенту было назначено лечение стероидами. c Последующая визуализация через 3 месяца после лечения системными стероидами подтвердила полное разрешение псевдомассы поджелудочной железы
В связи с этим пациенту было назначено лечение стероидами. c Последующая визуализация через 3 месяца после лечения системными стероидами подтвердила полное разрешение псевдомассы поджелудочной железы
Полноразмерное изображение
Учитывая совпадение клинических и визуализационных признаков очагового АИП и рака поджелудочной железы, в нескольких исследованиях была предпринята попытка дифференцировать АИП от злокачественных новообразований поджелудочной железы. Расширение главного протока поджелудочной железы у пациентов с АИП незначительное по сравнению с аденокарциномой поджелудочной железы. Действительно, восходящая дилатация главного панкреатического протока редко превышает 4 мм у пациентов с ОИП [73]. Панкреатический проток, проникающий через псевдомассу, также известный как признак протока, считается полезным признаком для дифференциации АИП от рака поджелудочной железы [67].
Очаговый панкреатит, имитирующий новообразование поджелудочной железы
Массообразующий очаговый панкреатит, по определению, относится к очаговому воспалительному процессу, который иногда может очень близко имитировать рак поджелудочной железы. Визуализация дифференциации между раком и объемно-образующим очаговым панкреатитом иногда может быть чрезвычайно сложной или невозможной [74].
Визуализация дифференциации между раком и объемно-образующим очаговым панкреатитом иногда может быть чрезвычайно сложной или невозможной [74].
В нескольких исследованиях, основанных на КТ или МРТ, не было обнаружено значимой разницы между этими двумя объектами в характеристиках сигнала или характере усиления контраста [75]. Оба являются гипо- или изоаттенуирующими по отношению к паренхиме поджелудочной железы на КТ и гипоинтенсивными или изоинтенсивными на Т1-взвешенных МРТ-изображениях (рис. 28). После введения контраста обычно наблюдается постепенное прогрессирующее усиление. Дифференциация от первичной аденокарциномы может быть особенно трудной, когда клиническая картина не предполагает острого панкреатита. Обилие фиброза в обоих состояниях, вероятно, является основной причиной этих сходных особенностей визуализации [76]. Для постановки диагноза почти всегда показано гистопатологическое исследование или последующая визуализация.
Рис. 28
28 54-летняя женщина с известным хроническим панкреатитом, вызванным алкоголем, и хронической болью, которая теперь проявляется необычно интенсивной болью в эпигастрии. a T2W МРТ демонстрирует гипоинтенсивное нечеткое твердое образование диаметром 3 см (стрелки) в теле/хвосте поджелудочной железы с дилатацией нижнего отдела протока, что, вероятно, связано с известным хроническим панкреатитом пациента. b Постконтрастное Т1-изображение в аксиальной плоскости демонстрирует гетерогенное усиление этого поражения (стрелки). Больному было назначено хирургическое иссечение. c Через две недели после начальной МРТ, непосредственно перед запланированной операцией, КТ показала, что новообразование почти полностью исчезло без какого-либо лечения. Основываясь на этих данных, опухоль была сочтена псевдомассой вследствие очагового панкреатита
Изображение в полный размер
Туберкулез поджелудочной железы
Изолированный туберкулез поджелудочной железы (ТБ) является крайне редкой клинической формой, даже в тех частях мира, где туберкулез распространенный. Клинические и визуализационные данные могут очень точно имитировать рак поджелудочной железы, и дифференциальная диагностика может быть затруднена [77]. Боль в животе, желтуха и потеря веса являются наиболее частыми симптомами в обеих клинических ситуациях [78]. Заболевание может очагово или диффузно поражать поджелудочную железу. Очаговое поражение обычно проявляется гиподенсивной массой на КТ (рис. 29).) и гистологическое исследование почти всегда необходимо для диагностики. Увеличение перипанкреатических лимфатических узлов с центральным некрозом может рассматриваться как сопутствующий признак у некоторых пациентов [79]. Диффузное поражение, редкое проявление аденокарциномы поджелудочной железы, также может быть трудно дифференцировать от первичной злокачественной опухоли поджелудочной железы.
Клинические и визуализационные данные могут очень точно имитировать рак поджелудочной железы, и дифференциальная диагностика может быть затруднена [77]. Боль в животе, желтуха и потеря веса являются наиболее частыми симптомами в обеих клинических ситуациях [78]. Заболевание может очагово или диффузно поражать поджелудочную железу. Очаговое поражение обычно проявляется гиподенсивной массой на КТ (рис. 29).) и гистологическое исследование почти всегда необходимо для диагностики. Увеличение перипанкреатических лимфатических узлов с центральным некрозом может рассматриваться как сопутствующий признак у некоторых пациентов [79]. Диффузное поражение, редкое проявление аденокарциномы поджелудочной железы, также может быть трудно дифференцировать от первичной злокачественной опухоли поджелудочной железы.
62-летний мужчина без анамнеза серьезных заболеваний поступил с постепенно нарастающей болью в эпигастральной области и потерей веса. a Постконтрастное КТ-изображение в аксиальной плоскости в поздней артериальной фазе демонстрирует диффузно утолщенную и неоднородно контрастирующую поджелудочную железу (стрелки) с дилатацией протоков. b Внезапное прекращение расширения протока поджелудочной железы (стрелки) в месте образования головки поджелудочной железы. Чрескожная биопсия головного мозга под визуальным контролем показала туберкулезную палочку. Затем больному была назначена комплексная противотуберкулезная терапия. КТ головы, шеи и грудной клетки не выявили каких-либо признаков заболевания в других местах. c Т2W-изображение в аксиальной плоскости с подавлением жира через 28 месяцев после первоначального сканирования показало значительный регресс результатов поджелудочной железы. На момент МРТ у пациента не было симптомов
a Постконтрастное КТ-изображение в аксиальной плоскости в поздней артериальной фазе демонстрирует диффузно утолщенную и неоднородно контрастирующую поджелудочную железу (стрелки) с дилатацией протоков. b Внезапное прекращение расширения протока поджелудочной железы (стрелки) в месте образования головки поджелудочной железы. Чрескожная биопсия головного мозга под визуальным контролем показала туберкулезную палочку. Затем больному была назначена комплексная противотуберкулезная терапия. КТ головы, шеи и грудной клетки не выявили каких-либо признаков заболевания в других местах. c Т2W-изображение в аксиальной плоскости с подавлением жира через 28 месяцев после первоначального сканирования показало значительный регресс результатов поджелудочной железы. На момент МРТ у пациента не было симптомов
Полноразмерное изображение
Септическая эмболия поджелудочной железы
Септическая эмболия (СЭ) является потенциально смертельной причиной инфекции. Он может проявляться как в ранней, так и в поздней фазах инфекционных заболеваний. Наиболее тщательно изучены септические эмболы головного мозга и легких. Эмболические инфаркты в пределах паренхимы поджелудочной железы были зарегистрированы у пациентов с полиорганной эмболизацией, когда также были поражены головной мозг, селезенка и миокард [80]. Боль в животе является распространенным симптомом, сопровождающимся лейкоцитозом и повышенным уровнем амилазы [81, 82].
Он может проявляться как в ранней, так и в поздней фазах инфекционных заболеваний. Наиболее тщательно изучены септические эмболы головного мозга и легких. Эмболические инфаркты в пределах паренхимы поджелудочной железы были зарегистрированы у пациентов с полиорганной эмболизацией, когда также были поражены головной мозг, селезенка и миокард [80]. Боль в животе является распространенным симптомом, сопровождающимся лейкоцитозом и повышенным уровнем амилазы [81, 82].
В литературе имеется ограниченная информация о результатах визуализации SE поджелудочной железы. Очаги эмболии проявлялись в виде гипоаттенуирующих очагов внутри паренхимы поджелудочной железы, что имитировало опухолевый процесс (рис. 30). Многоочаговые гиподенсивные очаги могут также имитировать лимфоматозную инфильтрацию или метастазы в поджелудочную железу. Несмотря на то, что многоочаговая аденокарцинома поджелудочной железы встречается редко, этот диагноз также следует учитывать при дифференциальной диагностике. Тщательное последующее визуализирующее наблюдение после лечения антибиотиками рекомендуется как для подтверждения диагноза, так и для оценки ответа на лечение. Вовлечение различных органов из-за септических эмболов, помимо поджелудочной железы, может быть полезным для правильной дифференциальной диагностики.
Тщательное последующее визуализирующее наблюдение после лечения антибиотиками рекомендуется как для подтверждения диагноза, так и для оценки ответа на лечение. Вовлечение различных органов из-за септических эмболов, помимо поджелудочной железы, может быть полезным для правильной дифференциальной диагностики.
Мужчина 65 лет с недавно диагностированной агрессивной лимфомой, проходящий интенсивную химиотерапию в отделении интенсивной терапии, недавно начал жаловаться на лихорадку и боли в эпигастрии. Анализы крови были положительными на лейкоцитоз и слегка повышенный уровень амилазы. a Постконтрастное КТ-изображение брюшной полости в аксиальной плоскости демонстрирует несколько нечетко очерченных гиподенсивных образований в паренхиме поджелудочной железы (стрелки). Не было расширения панкреатического протока или перипанкреатического воспаления/скопления. КТ грудной клетки показала бесчисленные очаги септических эмболов в паренхиме легких. При дифференциальной диагностике учитывались септическая эмболия поджелудочной железы или лимфоматозное поражение поджелудочной железы. b Последующая КТ брюшной полости через 7 дней после внутривенного лечения антибиотиками неожиданно продемонстрировала почти полное исчезновение очаговых поражений поджелудочной железы
При дифференциальной диагностике учитывались септическая эмболия поджелудочной железы или лимфоматозное поражение поджелудочной железы. b Последующая КТ брюшной полости через 7 дней после внутривенного лечения антибиотиками неожиданно продемонстрировала почти полное исчезновение очаговых поражений поджелудочной железы
Полноразмерное изображение
Заключение
Некоторые неопухолевые аномалии могут симулировать злокачественное заболевание, и дифференциальная диагностика может быть затруднена одним лишь изображением. Тем не менее, визуализационные характеристики и картина усиления поражения с оценкой вовлечения сосудов могут быть очень полезными. Сопутствующее поражение селезенки должно повышать вероятность инфекционного или воспалительного процесса, равно как и дискретные кистозные очаги в солидном поражении. Мультимодальная визуализация в соответствующих случаях также может быть чрезвычайно полезной для определения различных аспектов визуализации одного и того же поражения. Помимо всех этих параметров, демографические данные пациента, клинические симптомы и признаки, такие как лихорадка, лабораторные данные, опухолевые маркеры, кратковременные изменения результатов визуализации и результаты диффузионно-взвешенной визуализации (DWI) должны быть приняты во внимание для правильного выбора. диагноз. Еще одним важным моментом, который следует учитывать, является тесная связь с направляющим врачом. Следует иметь в виду, что образцы многих необычных инфекционных и неинфекционных воспалительных поражений могут быть взяты для диагностики под визуальным контролем, и что этот подход безопасен в опытных руках и должен широко использоваться в качестве инструмента для ранней диагностики.
Помимо всех этих параметров, демографические данные пациента, клинические симптомы и признаки, такие как лихорадка, лабораторные данные, опухолевые маркеры, кратковременные изменения результатов визуализации и результаты диффузионно-взвешенной визуализации (DWI) должны быть приняты во внимание для правильного выбора. диагноз. Еще одним важным моментом, который следует учитывать, является тесная связь с направляющим врачом. Следует иметь в виду, что образцы многих необычных инфекционных и неинфекционных воспалительных поражений могут быть взяты для диагностики под визуальным контролем, и что этот подход безопасен в опытных руках и должен широко использоваться в качестве инструмента для ранней диагностики.
Доступность данных и материалов
Обмен данными не применим к этой статье, так как в ходе текущего исследования наборы данных не создавались и не анализировались.
Сокращения
- АЦП:
Коэффициент кажущейся диффузии
- АИП:
Аутоиммунный панкреатит
- ПОД:
- г.

Острый миелоидный лейкоз
- ССС:
Холангиоцеллюлярная карцинома
- КТ:
Компьютерная томография
- DS:
Выпавшие желчные камни
- DWI:
Диффузионно-взвешенная визуализация
- ELA:
Эозинофильный абсцесс печени
- ЭРХПГ:
Эндоскопическая ретроградная холангиопанкреатография
- Центральный офис:
Гепатоцеллюлярная карцинома
- ВИЧ:
Вирус иммунодефицита человека
- МРТ:
Магнитно-резонансная томография
- ПЭТ-КТ:
Позитронно-эмиссионная томография-компьютерная томография
- SE:
Септическая эмболия
- T1W:
T1-взвешенный
- T2W:
Т2-взвешенный
- ТБ:
Туберкулез
- США:
УЗИ
- XGC:
Ксантогранулематозный холецистит
Ссылки
- «>
Ганди Н.С., Фельдман М.К., Ле О, Моррис-Стифф Г. (2018) Визуализация, имитирующая аденокарциному протоков поджелудочной железы. Abdom Radiol (NY) 43(2):273–284
Статья Google ученый
Мортеле К.Дж., Сегатто Э., Рос П.Р. (2004)Инфицированная печень: рентгенопатологическая корреляция. Рентгенография 24(4):937–955
PubMed Статья Google ученый
Pastakia B, Shawker TH, Thaler M, O’Leary T, Pizzo PA (1988)Гепатоспленический кандидоз: колеса в колесах. Радиология 166(2):417–421
CAS пабмед Статья Google ученый
«>Метсер У., Хайдер М.А., Дилл-Маки М., Атри М., Локвуд Г., Минден М. (2005) Грибковая инфекция печени у пациентов с ослабленным иммунитетом: изображение с многофазной спиральной КТ с контрастным усилением. Радиология 235(1):97–105
PubMed Статья Google ученый
Берлоу М.Е., Спирт Б.А., Вейл Л. (1984) КТ-контроль грибковых микроабсцессов печени и селезенки. J Comput Assist Tomogr 8(1):42–45
CAS пабмед Статья Google ученый
Anttila VJ, Lamminen AE, Bondestam S et al (1996) Магнитно-резонансная томография превосходит компьютерную томографию и ультразвуковое исследование при визуализации инфекционных очагов в печени при остром лейкозе.
 Eur J Haematol 56(1-2):82–87
Eur J Haematol 56(1-2):82–87Артикул Google ученый
Semelka RC, Kelekis NL, Sallah S, Worawattanakul S, Ascher SM (1997)Гепатоспленическое грибковое заболевание: диагностическая точность и спектр проявлений на МРТ. AJR Am J Roentgenol 169(5):1311–1316
CAS пабмед Статья Google ученый
Semelka RC, Patrick Shoenut J, Greenberg HM, Bow EJ (1992) Выявление острых и пролеченных поражений гепатолиенального кандидоза: сравнение динамической контрастной КТ и МРТ. J Magn Reson Imaging 2(3):341–345
КАС пабмед Статья Google ученый
Ширхода А., Лопез-Берестейн Г., Холберт Дж.М., Луна М.А. (1986) Гепатоспленическая грибковая инфекция: КТ и патологическая оценка после лечения липосомальным амфотерицином В. Радиология 159(2):349–353
CAS пабмед Статья Google ученый
«>Караосманоглу А.Д., Онур М.Р., Сахани Д.В., Табари А., Карджаалтинкаба М. (2016)Гепатобилиарный туберкулез: результаты визуализации. AJR Am J Roentgenol 207(4):694–704
PubMed Статья Google ученый
Каккар С., Полная А.М., Котешвара П., Смити С., Раджагопал К.В., Арора А. (2015)Туберкулез печени: мультимодальный обзор визуализации. Insights Imaging 6(6):647–658
ПабМед ПабМед Центральный Статья Google ученый
Альварес С.З. (1998) Туберкулез гепатобилиарной системы. J Гастроэнтерол Гепатол 13(8):833–839
CAS пабмед Статья Google ученый
«>Миллс П., Саверимутту С., Фаллоуфилд М., Насси С., Джозеф А.Е. (1990) Ультразвук в диагностике гранулематозной болезни печени. Clin Radiol 41(2):113–115
CAS пабмед Статья Google ученый
Hickey N, McNulty JG, Osborne H, Finucane J (1999) Острый гепатобилиарный туберкулез: отчет о двух случаях и обзор литературы. Евро Радиол 9(5): 886–889
КАС пабмед Статья Google ученый
Кантарчи М., Байрактутан У., Карабулут Н. и др. (2012) Альвеолярный эхинококкоз: спектр результатов при визуализации поперечного сечения.
 Рентгенография 32(7):2053–2070
Рентгенография 32(7):2053–2070PubMed Статья Google ученый
Ахан О., Озмен М.Н., Динсер А., Сайек И., Гёчмен А. (1996)Эхинококковая болезнь печени: долгосрочные результаты чрескожного лечения. Радиология 198(1):259–264
КАС пабмед Статья Google ученый
Мортеле К.Ю., Рос П.Р. (2001) Кистозно-очаговые поражения печени у взрослых: дифференциальные особенности КТ и МРТ. Рентгенография 21(4):895–910
CAS пабмед Статья Google ученый
Лэнд М.А., Мойнуддин М., Бисно А.Л. (1985)Гиогенный абсцесс печени: изменение эпидемиологии и прогноза. Южное Средиземноморье J 78 (12): 1426–1430
КАС пабмед Статья Google ученый
Ralls PW (1998) Очаговое воспалительное заболевание печени.
 Radiol Clin North Am 36(2):377–389
Radiol Clin North Am 36(2):377–389CAS пабмед Статья Google ученый
Bächler P, Baladron MJ, Menias C et al (2016) Мультимодальная визуализация инфекций печени: дифференциальная диагностика и потенциальные ловушки. Рентгенография 36(4):1001–1023
ПабМед Статья Google ученый
Ralls PW, Colletti PM, Quinn MF, Halls J (1982) Сонографические данные при амебном абсцессе печени. Радиология 145(1):123–126
CAS пабмед Статья Google ученый
Radin DR, Ralls PW, Colletti PM, Halls JM (1988) КТ амебного абсцесса печени. AJR Am J Roentgenol 150(6):1297–1301
CAS пабмед Статья Google ученый
Kwon JW, Kim TW, Kim KM et al (2011) Клинические особенности клинически диагностированных эозинофильных абсцессов печени.
 Hepatol Int 5(4):949–954
Hepatol Int 5(4):949–954PubMed Статья Google ученый
Vercruysse V, Van Hoe L (2017)Эозинофильное заболевание печени, имитирующее метастазы в печень. J Belg Soc Radiol 101(1):18
PubMed ПабМед Центральный Статья Google ученый
Yoo SY, Han JK, Kim YH, Kim TK, Choi BI, Han MC (2003)Очаговая эозинофильная инфильтрация в печени: рентгенологические данные и клиническое течение. Визуализация органов брюшной полости 28(3):326–332
CAS пабмед Статья Google ученый
Lim JH, Mairiang E, Ahn GH (2008)Билиарные паразитарные заболевания, включая клонорхоз, описторхоз и фасциолез. Визуализация органов брюшной полости 33(2):157–165
PubMed Статья Google ученый
«>Talwani R, Gilliam BL, Howell C (2011)Инфекционные заболевания и печень. Clin Liver Dis 15(1):111–130
PubMed ПабМед Центральный Статья Google ученый
Maincent G, Labadie H, Fabre M et al (1997) Третичный сифилис печени. Излечимая причина многоузловой печени. Dig Dis Sci 42(2):447–450
Veeravahu M (1985) Диагностика поражения печени при раннем сифилисе. Критический обзор. Arch Intern Med 145(1):132–134
CAS пабмед Статья Google ученый
Shim HJ (2010)Третичный сифилис, имитирующий метастазы в печень основной первичной перитонеальной серозной карциномы.
 Мир J Гепатол 2(9):362–366
Мир J Гепатол 2(9):362–366PubMed ПабМед Центральный Статья Google ученый
Петерс Л., Ван В.В., дер Перре Ван С., Лагранж В., Вербеке М. (2005) Третичный сифилис, проявляющийся поражением печени в виде бычьего глаза. Acta Gastroenterol Belg 68(4):435–439
Shapiro MP, Gale ME (1987) Третичный сифилис печени: КТ. J Comput Assist Tomogr 11(3):546–547
CAS пабмед Статья Google ученый
Zaidi SA, Singer C (2002) Желудочно-кишечные и печеночные проявления клещевых заболеваний в Соединенных Штатах. Clin Infect Dis 34(9):1206–1212
PubMed Статья Google ученый
Ortego TJ, Hutchins LF, Rice J, Davis GR (1986) Туляремический гепатит, проявляющийся механической желтухой. Гастроэнтерология 91(2):461–463
CAS пабмед Статья Google ученый
«>Стюарт С.М., Новицкий М.Ю. (1998) Радиологический случай месяца. Болезнь кошачьих царапин с поражением печени и селезенки. Arch Pediatr Adolesc Med 152(8):823–824
CAS пабмед Статья Google ученый
Lall T, Shehab TM, Valenstein P (2010)Изолированный актиномикоз печени: отчет о болезни. Представитель J Med Case 4:45
PubMed ПабМед Центральный Статья Google ученый
Ислам Т., Атар М.Н., Атар М.К., Усман М.Х., Мисбах Б. (2005) Актиномикоз печени с инфильтрацией диафрагмы и правого легкого: клинический случай.
 Can Respir J 12(6):336–337
Can Respir J 12(6):336–337PubMed Статья Google ученый
Kim HS, Park NH, Park KA, Kang SB (2007)Случай тазового актиномикоза с актиномикотической псевдоопухолью печени. Gynecol Obstet Invest 64(2):95–99
PubMed Статья Google ученый
Koyama T, Ueda H, Togashi K, Umeoka S, Kataoka M, Nagai S (2004) Рентгенологические проявления саркоидоза в различных органах. Рентгенография 24(1):87–104
PubMed Статья Google ученый
Warshauer DM, Lee JK (2004) Визуализация проявлений абдоминального саркоидоза. AJR Am J Roentgenol 182(1):15–28
PubMed Статья Google ученый
Dourakis SP, Cokkinos DD, Soultati AS, Alexopoulou A, Nezi V, Archimandritis AJ (2007) Случай саркоидоза печени, имитирующего цирроз.
 Clin Imaging 31(1):47–49
Clin Imaging 31(1):47–49PubMed Статья Google ученый
Deshpande V, Zen Y, Chan JK et al (2012) Согласованное заявление о патологии IgG4-ассоциированного заболевания. Mod Pathol 25(9):1181–1192
Chen JH, Deshpande V (2017) Заболевание, связанное с IgG4, и печень. Gastroenterol Clin North Am 46(2):195–216
PubMed Статья Google ученый
Zen Y, Fujii T, Sato Y, Masuda S, Nakanuma Y (2007) Патологическая классификация воспалительной псевдоопухоли печени в отношении заболевания, связанного с IgG4. Мод Патол 20 (8): 884–894
ПабМед Статья Google ученый
Akatsu T, Wakabayashi G, Tanimoto A, Kameyama K, Kitajima M (2006)Воспалительная псевдоопухоль печени, маскирующаяся под гепатоцеллюлярную карциному после инфицирования вирусом гепатита B: отчет о случае.
 Surg Today 36(11):1028–1031
Surg Today 36(11):1028–1031PubMed Статья Google ученый
Pack GT, Baker HW (1953) Тотальная правосторонняя лобэктомия печени; отчет о случае. Энн Сург 138 (2): 253–258
КАС пабмед ПабМед Центральный Статья Google ученый
Honmyo N, Kobayashi T, Tashiro H et al (2016)Воспалительная псевдоопухоль печени, возникающая в ходе лечения гепатоцеллюлярной карциномы, связанной с вирусом гепатита C: отчет о клиническом случае. Int J Surg Case Rep 20:96–100
PubMed ПабМед Центральный Статья Google ученый
Сакаи М., Икеда Х., Сузуки Н. и др. (2001)Воспалительная псевдоопухоль печени: клинический случай и обзор литературы. J Pediatr Surg 36(4):663–666
CAS пабмед Статья Google ученый
«>Caramella T, Novellas S, Fournol M, Saint-Paul MC, Bruneton JN, Chevallier P (2007)Визуализация воспалительных псевдоопухолей печени. J Radiol 88(6):882–888
Roux M, Baranes L, Decaens T et al (2013)Рецидивирующая мультикистозная воспалительная псевдоопухоль печени: клинический случай. Clin Res Hepatol Gastroenterol 37(2):e51–e57
PubMed Статья Google ученый
Рамамурти Н.К., Рудралингам В., Мартин Д.Ф., Галлоуэй С.В., Сукумар С.А. (2013) Вне поля зрения, но следует иметь в виду: осложнения и имитации выпадения желчных камней. AJR Am J Roentgenol 200(6):1244–1253
ПабМед Статья Google ученый
«>Rice DC, Memon MA, Jamison RL et al (1997)Отдаленные последствия интраоперационной утечки желчи и желчных камней во время лапароскопической холецистэктомии. J Gastrointest Surg 1 (1): 85–90 обсуждение 90-1
CAS пабмед Статья Google ученый
Леви А.Д., Мураката Л.А., Рорманн К.А. младший (2001)Рак желчного пузыря: рентгенопатологическая корреляция. Рентгенография 21(2):295–314 анкета, 549-55
CAS пабмед Статья Google ученый
Рос П.Р., Гудман З.Д. (1997) Ксантогранулематозный холецистит в сравнении с карциномой желчного пузыря.
 Радиология 203(1):10–12
Радиология 203(1):10–12КАС пабмед Статья Google ученый
Zhao F, Lu PX, Yan SX и др. (2013) КТ и МРТ признаки ксантогранулематозного холецистита: анализ последовательных 49 случаев. Eur J Radiol 82(9):1391–1397
PubMed Статья Google ученый
Saluja SS, Ray S, Pal S и др. (2007)Гепатобилиарный и панкреатический туберкулез: опыт двух десятилетий. БМС Surg 7:10
Fan ST, Ng IO, Choi TK, Lai E (1989) Туберкулез желчных протоков: редкая причина стриктур желчных путей. Am J Gastroenterol 84(4):413–414
Vlachou PA, Khalili K, Jang HJ, Fischer S, Hirschfield GM, Kim TK (2011)Склерозирующее заболевание, связанное с IgG4: аутоиммунный панкреатит и экстрапанкреатические проявления. Рентгенография 31(5):1379–1402
PubMed Статья Google ученый
«>Мартинес-де-Алегрия А., Балеато-Гонсалес С., Гарсия-Фигейрас Р. и др. (2015) Заболевание, связанное с IgG4, с головы до ног. Рентгенография 35(7):2007–2025
PubMed Статья Google ученый
Ryan DP, Hong TS, Bardeesy N (2014) Аденокарцинома поджелудочной железы. N Engl J Med 371(22):2140–2141
PubMed Google ученый
Hart PA, Zen Y, Chari ST (2015)Последние достижения в области аутоиммунного панкреатита. Гастроэнтерология 149(1):39–51
CAS пабмед Статья Google ученый
«>Ли Л.К., Сахани Д.В. (2014)Аутоиммунный панкреатит в контексте заболевания, связанного с IgG4: обзор результатов визуализации. World J Gastroenterol 20(41):15177–15189
CAS пабмед ПабМед Центральный Статья Google ученый
Wakabayashi T, Kawaura Y, Satomura Y et al (2003) Клинические и визуализационные особенности аутоиммунного панкреатита с очаговым отеком поджелудочной железы или массовым образованием: сравнение с так называемым опухолевидным панкреатитом и карциномой поджелудочной железы. Am J Гастроэнтерол 98(12):2679–2687
PubMed Статья Google ученый
«>Patlas M, Deitel W, Taylor B, Gallinger S, Wilson SR (2007) Очаговый хронический панкреатит, имитирующий карциному головки поджелудочной железы: есть ли характерные признаки на УЗИ? Can Assoc Radiol J 58(1):15–21
Johnson PT, Outwater EK (1999)Карцинома поджелудочной железы в сравнении с хроническим панкреатитом: динамическая МРТ. Радиология 212(1):213–218
CAS пабмед Статья Google ученый
Pramesh CS, Heroor AA, Gupta SG et al (2003) Туберкулез поджелудочной железы: неуловимый диагноз.
 HPB (Оксфорд) 5(1):43–45
HPB (Оксфорд) 5(1):43–45CAS пабмед ПабМед Центральный Статья Google ученый
Захария Г.С., Энтони Р., Колассери С., Рамачандран ТМ (2014) Изолированный туберкулез поджелудочной железы, маскирующийся под рак поджелудочной железы. Gastroenterol Rep (Oxf) 2(2):154–157
PubMed ПабМед Центральный Статья Google ученый
Falkowski AL, Graber J, Haack HG, Tarr PE, Rasch H (2013) Изолированный туберкулез поджелудочной железы: клинический случай и рентгенологическое сравнение с кистозными поражениями поджелудочной железы. J Radiol Case Rep 7(1):1–11
Hart RG, Kagan-Hallet K, Jorns SE (1987) Механизмы внутричерепного кровоизлияния при инфекционном эндокардите. Ход 18(6):1048–1056
CAS пабмед Статья Google ученый
«>Шейл А.Г., Рив Т.С., Литтл Дж.М., Коупленд Г.А., Ловенталь Дж. (1969) Аорто-кишечные свищи после операций на брюшной аорте и подвздошных артериях. Br J Surg 56 (11): 840–843
CAS пабмед Статья Google ученый
Алобаиди М., Ширхода А. (2004) Доброкачественные очаговые поражения печени: отличить от злокачественных имитаторов. Curr Probl Diagn Radiol 33(6):239–253
PubMed Статья Google ученый
Корнели О.А., Бангард С., Джасперс Н.И. (2015)Гепатоспленический кандидоз. Clin Liver Dis (Hoboken) 6(2):47–50
Статья Google ученый
Balci NC, Tunacı A, Akınci A, Cevikbaş U (2001) Гранулематозный гепатит: результаты МРТ. Magn Reson Imaging 19(8): 1107–1111
КАС пабмед Статья Google ученый
Джайн Р., Сохни С., Гупта Р.Г., Ачарья С.К. (1999) Сонографические проявления и чрескожное лечение первичного туберкулезного абсцесса печени. Дж. Клин Ультразвук 27 (3): 159–163
КАС пабмед Статья Google ученый
Кая М., Бешташ Р., Цетин С. (2011)Клиническая картина и лечение инфекции Fasciola hepatica: одноцентровый опыт. World J Gastroenterol 17(44):4899–4904
PubMed ПабМед Центральный Статья Google ученый
Баптиста М.А., Ло Д.С., Хейн Н. и др. (2014)Болезнь кошачьей царапины, проявляющаяся множественными поражениями печени: клинический случай и обзор литературы. Autops Case Rep 4 (2): 43–48
PubMed Статья ПабМед Центральный Google ученый
Chen CB, Chou CT, Hsueh C, Lee KW, Chen YL (2013)Воспалительная псевдоопухоль печени, имитирующая гепатоцеллюлярную карциному. J Chin Med Assoc 76(5):299–301
PubMed Статья Google ученый
Sathesh-Kumar T, Saklani AP, Vinayagam R, Blackett RL (2004)Пролитые желчные камни во время лапароскопической холецистэктомии: обзор литературы. Postgrad Med J 80(940):77–79
CAS пабмед ПабМед Центральный Статья Google ученый
Hedgire SS, McDermott S, Borczuk D, Elmi A, Saini S, Harisinghani MG (2013) Спектр связанных с IgG4 заболеваний брюшной полости и таза. AJR Am J Roentgenol 201(1):14–22
ПабМед Статья Google ученый
Zhang L, Chari S, Smyrk TC et al (2011)Аутоиммунный панкреатит (AIP) типа 1 и типа 2: международное согласованное исследование гистопатологических диагностических критериев. Поджелудочная железа 40(8):1172–1179
CAS пабмед Статья Google ученый
Fattahi R, Balci NC, Perman WH et al (2009) Диффузионно-взвешенная визуализация поджелудочной железы (DWI): сравнение объемно-образующего очагового панкреатита (FP), рака поджелудочной железы (PC) и нормальной поджелудочной железы. J Magn Reson Imaging 29(2):350–356
PubMed Статья Google ученый
Haigh E (1956) Острый панкреатит в детском возрасте. Arch Dis Child 31(158):272–275
CAS пабмед Статья Google ученый
Ссылки на скачивание
Финансирование
Авторы заявляют, что эта работа не финансировалась.
Информация об авторе
Авторы и организации
Кафедра радиологии, Медицинский факультет Университета Хасеттепе, 06100, Анкара, Турция
Али Деврим Караосманоглу, Мутурей Каркальчаба, Дениз Аката и Мустафа Насух Озмен
Департамент радиологии, обучение Gulhane и Исследовательская больница, 06010, Ankara, Turkey
AICAN UYSAL
9018, ANKARA, TurkeyAICAN UYSAL
- 7777777777777777777777777777777777777777 гг.
 of Medicine, Aurora, CO, 80045, USA
of Medicine, Aurora, CO, 80045, USAJessica Kraeft
Отделение радиологии, Massachusetts General Hospital, Harvard Medical School, Boston, MA, 02114, USA
Питер Ф. Хан
Авторы
- Али Деврим Караосманоглу
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Айкан Уйсал
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Musturay Karcaaltincaba
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Академия
- Дениз Аката
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Mustafa Nasuh Ozmen
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Jessica Kraeft
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Peter F.
 Hahn
HahnПросмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Contributions
ADK написал рукопись и собрал данные. AU, MK, DA и MNO собрали данные и внесли свой вклад в написание текста. JK собрал данные для рукописи. PFH участвовал в написании текста, редактировал текст и первым предложил идею написания этой рукописи. Все авторы прочитали и одобрили окончательный вариант рукописи.
Автор, ответственный за переписку
Переписка с Али Деврим Караосманоглу.
Декларация этики
Одобрение этики и согласие на участие
Неприменимо.
Согласие на публикацию
Не применимо.
Конкурирующие интересы
Авторы заявляют об отсутствии конкурирующих интересов.
Дополнительная информация
Примечание издателя
Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.


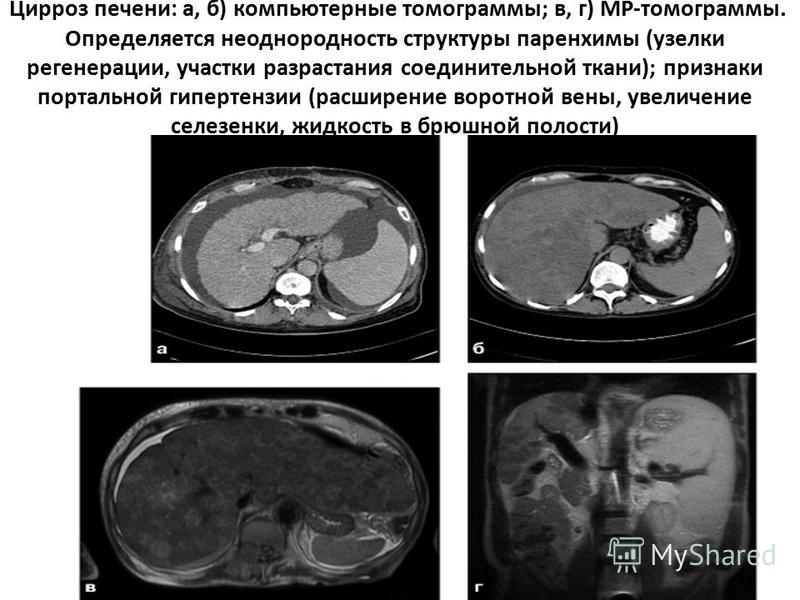
 КГ после контрастирования.
КГ после контрастирования. 10. Гепатоцеллюлярная карцинома печени в стадии распада. МРТ. Т2-взвешенное изображение.
10. Гепатоцеллюлярная карцинома печени в стадии распада. МРТ. Т2-взвешенное изображение. 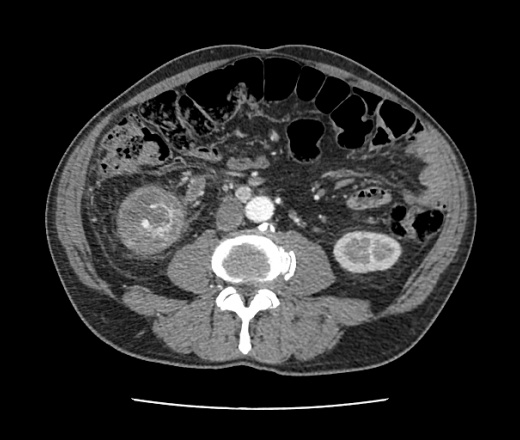 Присутствует эффект дистального усиления сигнала
Присутствует эффект дистального усиления сигнала Выявление мелких сосудистых структур по периферии на ранних сканах. Быстрое вымывание контраста
Выявление мелких сосудистых структур по периферии на ранних сканах. Быстрое вымывание контраста ИС — увеличение интенсивности сигнала, v ИС — уменьшение интенсивности сигнала, изо-ИС — изоинтенсивна с окружающей паренхимой.
ИС — увеличение интенсивности сигнала, v ИС — уменьшение интенсивности сигнала, изо-ИС — изоинтенсивна с окружающей паренхимой.