Иммуномодулирующие препараты это: Сервис обновляется
Проведение иммуномодулирующей терапии в многопрофильной клинике Синай
2015-03-05
Иммуномодулирующая терапия — это эффективная методика регулирования работы иммунной системы организма. Она позволяет повысить сопротивляемость инфекциям, устойчивость к воздействию вирусных и грибковых заболеваний. Современные иммуномодулирующие препараты обладают направленным действием, что позволяет активировать одни функции иммунной системы (иммуностимуляторы) и угнетать другие (иммунодепрессанты). В некоторых случаях подавление иммунной функции является жизненно важной задачей и позволяет успешно справиться с тяжелыми заболеваниями.
Показания к проведению иммуномодулирующей терапии
· Аллергические заболевания (поллиноз, бронхиальная астма)
· Эндометриоз
· Онкологические заболевания
· Хронические заболевания инфекционного и воспалительного характера
· Иммунодефицтные состояния
· Аутоиммунные заболвания
· Трансплантация органов
Виды иммуномодулирующих препаратов
Иммуномодулирующая терапия основана в первую очередь на приеме подобранных специалистом препаратов. «Назначать» их себе самостоятельно нельзя: тонкая иммунная система человека чутко реагирует на внешнее вмешательство, и неправильный подбор медикаментов негативно скажется на ее работе. Наши опытные врачи проведут все необходимые диагностические мероприятия и составят схему лечения. Могут использоваться как синтетически синтезированные лекарства, так и натуральные препараты растительного и животного происхождения.
«Назначать» их себе самостоятельно нельзя: тонкая иммунная система человека чутко реагирует на внешнее вмешательство, и неправильный подбор медикаментов негативно скажется на ее работе. Наши опытные врачи проведут все необходимые диагностические мероприятия и составят схему лечения. Могут использоваться как синтетически синтезированные лекарства, так и натуральные препараты растительного и животного происхождения.
1. Иммуномодулирующие препараты — восстанавливают баланс и функции иммунной системы человека
2. Иммунокорректоры — обладают избирательным, точечным действием и нормализуют работу отдельных сегментов системы
3. Иммуностимулирующие препараты — препараты, активизирующие работу иммунной системы и мобилизующие защитные силы организма
4. Иммуносупрессоры (иммунодепрессанты) — группа препаратов, угнетающих активность иммунной системы
Иммуномодулирующая терапия в клинике «Синай»
Многопрофильный медицинский центр «Синай» — это уникальная клиника, расположенная на западе столицы. На протяжении многих лет мы успешно сочетаем достижения современной науки и проверенные временем методики восточной медицины. Передовое диагностическое оборудование и собственная лаборатория позволяют врачам нашей клиники максимально оперативно и точно ставить диагноз. Наряду с медикаментами мы применяем гомеопатические, фитотерапевтические препараты, а также традиционные методики китайской медицины, акупунктуру и гирудотерапию.
На протяжении многих лет мы успешно сочетаем достижения современной науки и проверенные временем методики восточной медицины. Передовое диагностическое оборудование и собственная лаборатория позволяют врачам нашей клиники максимально оперативно и точно ставить диагноз. Наряду с медикаментами мы применяем гомеопатические, фитотерапевтические препараты, а также традиционные методики китайской медицины, акупунктуру и гирудотерапию.
Клиника «Синай» — эффективная и недорогая иммуномодулирующая терапия в Москве.
классификация, фармакологическое действие, клиническое применение
Иммуномодуляторы — лекарственные препараты, восстанавливающие при применении в терапевтических дозах функции иммунной системы. Рассматривается классификация иммуномодуляторов (микробные, тимические, костно-мозговые, цитокины, нуклеиновые кислоты и химически чистые), приводится информация о представителях различных поколений иммуномодулирующих средств. Обсуждаются механизмы фармакологического действия иммуномодуляторов. Формулируются основные принципы их клинического применения.
Формулируются основные принципы их клинического применения.
Иммуномодуляторы – это лекарственные препараты, восстанавливающие при применении в терапевтических дозах функции иммунной системы (эффективную иммунную защиту).
Классификация иммуномодуляторов
В настоящее время мы выделяем по происхождению 6 основных групп иммуномодуляторов: микробные, тимические, костно-мозговые, цитокины, нуклеиновые кислоты и химически чистые. В известной степени эта классификация базируется на основных принципах функционирования иммунной системы. Главными активаторами врожденного и индукторами приобретенного иммунитета в организме человека и высших животных являются антигены микробных клеток, с которых и начались поиск, изучение и создание иммунотропных препаратов. Формирование иммунного ответа происходит под контролем ряда иммунорегуляторных молекул. Поэтому другим направлением в разработке иммунотропных лекарственных препаратов стал поиск, выделение и изучение комплекса тех веществ и молекул, которые синтезируются в организме при развитии иммунного ответа и осуществляют его регуляцию.
Иммуномодуляторы микробного происхождения условно можно разделить на три поколения. Первым препаратом, разрешенным в начале 1950 гг. в США и странах Европы к медицинскому применению в качестве иммуностимулятора, была вакцина БЦЖ, обладающая выраженной способностью усиливать факторы как врожденного, так и приобретенного иммунитета. К микробным препаратам первого поколения можно отнести и такие лекарственные средства, как пирогенал и продигиозан, представляющие собой полисахариды бактериального происхождения. В настоящее время из-за пирогенности и других побочных эффектов они применяются редко.
К микробным препаратам второго поколения относятся лизаты (Бронхо-мунал *, ИРС-19 *, Имудон *, появившийся на российском фармацевтическом рынке новый препарат Бронхо-Ваксом *) и рибосомы (Рибомунил *) бактерий, относящихся в основном к числу возбудителей респираторных инфекций: Klebsiella pneumoniae, Streptococcus pneumoniae, Streptococcus pyogenes, Haemophilus influezae и др.
При изучении клеточных компонентов БЦЖ было установлено, что наибольшим иммуностимулирующим эффектом обладал мурамил-дипептид (МДП) – минимальный компонент пептидогликана клеточной стенки бактерий. В силу высокой пирогенности МДП не нашел применения в клинике, однако в России и за рубежом были синтезированы его аналоги, сохраняющие иммуностимулирующие свойства, но не обладающие пирогенной активностью. Одним из них является Ликопид, который можно отнести к микробным препаратам третьего поколения. Он состоит из природного дисахарида – глюкозаминилмурамила и присоединенному к нему синтетического дипептида – L-аланил-D-изоглютамина.
Иммуномодуляторы эндогенного происхождения можно условно разделить на иммунорегуляторные пептиды и цитокины. Как известно, центральными органами иммунитета является тимус и костный мозг, регулирующие развитие клеточного и гуморального иммунного ответа соответственно.
Родоначальником тимических препаратов первого поколения в России стал Тактивин, представляющий собой комплекс пептидов, экстрагированных из тимуса крупного рогатого скота. К препаратам, содержащим комплекс тимических пептидов, относятся также Тималин, Тимоптин и др., а к содержащим экстракты тимуса – Тимостимулин * и Вилозен.
Клиническая эффективность тимических препаратов первого поколения не вызывает сомнения, но у них есть один недостаток: они представляют собой неразделенную смесь биологически активных пептидов, достаточно трудно поддающихся стандартизации.
Прогресс в области лекарственных средств тимического происхождения шел по линии создания препаратов II и III поколений – синтетических аналогов природных гормонов тимуса (альфа1-тимозин и тимопоэтин) или фрагментов этих гормонов, обладающих биологической активностью. Последнее направление оказалось наиболее продуктивным, особенно в отношении тимопоэтина. На основе одного из фрагментов, включающего аминокислотные остатки активного центра тимопоэтина, были созданы Тимопентин, зарегистроированный на Западе, и синтетический гексапептид Иммунофан – аналог участка 32–36 тимопоэтина, одобренный к медицинскому применению в России.
Другим направлением в создании синтетических тимических препаратов стал анализ активных начал комплекса пептидов и экстрактов из тимуса. Так, при изучении состава лекарственного препарата Тималин был выявлен дипептид, состоящий из триптофана и глютамина. Этот дипептид обладал выраженной иммунотропной активностью и стал основой для создания синтетического препарата Тимоген, представляющего собой L-глютамил-L-триптофан.
Родоначальником препаратов костно-мозгового происхождения является Миелопид, в состав которого входит комплекс биорегуляторных пептидных медиаторов – миелопептидов (МП) с молекулярной массой 500–3000 D, продуцируемых клетками костного мозга свиньи. В настоящее время установлено, что Миелопид включает 6 МП, каждый из которых обладает определенным биологическим эффектом. Первоначально предполагалось, что препараты из костного мозга будут преимущественно воздействовать на развитие гуморального иммунитета. В дальнейшем было установлено, что различные МП влияют на разные звенья иммунной системы. Так, МП-1 повышает функциональную активность Т-хелперов; МП-2 подавляет пролиферацию злокачественных клеток и существенно снижает способность опухолевых клеток продуцировать токсические субстанции; МП-3 стимулирует фагоцитарную активность лейкоцитов. Аминокислотный состав МП полностью расшифрован, что послужило предпосылкой для разработки новых синтетических препаратов костно-мозгового происхождения.
Регуляция развившегося иммунного ответа осуществляется цитокинами – сложным комплексом эндогенных иммунорегуляторных молекул, которые по-прежнему являются основой для создания большой группы как естественных, так и рекомбинантных иммуномодулирующих препаратов. К первой группе относятся Лейкинферон и Суперлимф, ко второй – Беталейкин, Ронколейкин и Лейкомакс (молграмостим) *. Лейкинферон – это комплекс цитокинов 1 фазы иммунного ответа в их естественном соотношении, который получают
Суперлимф также является комплексом естественных цитокинов, продуцируемых in vitro при индукции мононуклеаров периферической крови свиней Т-митогеном – фитогемагглютинином. Препарат содержит ИЛ-1, ИЛ-2, ИЛ-6, ИЛ-8, ФНО, MIF, трансформирующий фактор роста-бета. Суперлимф предназначен прежде всего для местного применения и является практически первым цитокиновым препаратом, используемым для локальной иммунокоррекции.
Препарат содержит ИЛ-1, ИЛ-2, ИЛ-6, ИЛ-8, ФНО, MIF, трансформирующий фактор роста-бета. Суперлимф предназначен прежде всего для местного применения и является практически первым цитокиновым препаратом, используемым для локальной иммунокоррекции.
Ронколейкин представляет собой лекарственную форму рекомбинантного ИЛ-2, являющегося одним из центральных регуляторных цитокинов иммунной системы человека. Препарат получают с помощью методов иммунной биотехнологии из клеток-продуцентов – рекомбинантного штамма непатогенных пекарских дрожжей, в генетический аппарат которых встроен ген человеческого ИЛ-2.
Беталейкин – лекарственная форма рекомбинантного ИЛ-1бета, играющего важную роль в активации факторов врожденного иммунитета, развитии воспаления и на первых этапах иммунного ответа. Препарат получают с помощью методов иммунной биотехнологии из клеток-продуцентов – рекомбинантного штамма кишечной палочки, в генетический аппарат которых встроен ген человеческого ИЛ-1бета.
Группу химически чистых иммуномодуляторов можно разделить на две подгруппы: низкомолекулярные и высокомолекулярные. К первым относится ряд известных лекарственных средств, дополнительно обладающих иммунотропной активностью. Их родоначальником стал левамизол (Декарис) – фенилимидотиазол, известное противоглистное средство, у которого в последующем были выявлены выраженные иммуностимулирующие свойства. Другим перспективным лекарственным средством из подгруппы низкомолекулярных иммуномодуляторов является Галавит – производное фталгидразида. Особенность этого препарата заключается в наличии не только иммуномодулирующих, но и выраженных противовоспалительных свойств. К подгруппе низкомолекулярных иммуномодуляторов также относятся три синтетических олигопептида: гепон, Глутоксим и Аллоферон.
К первым относится ряд известных лекарственных средств, дополнительно обладающих иммунотропной активностью. Их родоначальником стал левамизол (Декарис) – фенилимидотиазол, известное противоглистное средство, у которого в последующем были выявлены выраженные иммуностимулирующие свойства. Другим перспективным лекарственным средством из подгруппы низкомолекулярных иммуномодуляторов является Галавит – производное фталгидразида. Особенность этого препарата заключается в наличии не только иммуномодулирующих, но и выраженных противовоспалительных свойств. К подгруппе низкомолекулярных иммуномодуляторов также относятся три синтетических олигопептида: гепон, Глутоксим и Аллоферон.
К высокомолекулярным, химически чистым иммуномодуляторам, полученным с помощью направленного химического синтеза, относится препарат Полиоксидоний. Он представляет собой N-оксидированное производное полиэтиленпиперазина с молекулярной массой около 100 kD. Препарат обладает фармакологическим действием широкого спектра на организм: иммуномодулирующим, детоксицирующим, антиоксидантным и мембранопротекторным.
К лекарственным средствам, характеризующимся выраженными иммуномодулирующими свойствами, следует отнести интерфероны и индукторы интерферонов. Мы считаем необходимым выделить эти препараты в отдельную группу, так как их главным фармакологическим свойством является противовирусный эффект. Однако интерфероны, как составная часть общей цитокиновой сети организма, являются иммунорегуляторными молекулами, оказывающими действие на все клетки иммунной системы.
Фармакологическое действие иммуномодуляторов
Иммуномодуляторы микробного происхождения
В организме главной мишенью для иммуномодуляторов микробного происхождения являются фагоцитарные клетки. Под влиянием этих препаратов усиливаются функциональные свойства фагоцитов (повышаются фагоцитоз и внутриклеточный киллинг поглощенных бактерий), возрастает продукция провоспалительных цитокинов, необходимых для инициации гуморального и клеточного иммунитета. В результате может увеличиваться продукция антител, активироваться образование антигенспецифических Т-хелперов и Т-киллеров. Наиболее полно изучено фармакологическое действие на иммунитет полусинтетического иммуномодулятора Ликопида, являющегося минимальным компонентом клеточной стенки всех бактерий.
Наиболее полно изучено фармакологическое действие на иммунитет полусинтетического иммуномодулятора Ликопида, являющегося минимальным компонентом клеточной стенки всех бактерий.
Иммуномодуляторы тимического происхождения
Естественно, что в соответствии с названием главной мишенью для иммуномодуляторов тимического происхождения являются Т-лимфоциты. При исходно пониженных показателях препараты этого ряда повышают количество Т-клеток и их функциональную активность. Фармакологическое действие синтетического тимусного дипептида Тимогена состоит в повышении уровня циклических нуклеотидов по аналогии с эффектом тимусного гормона тимопоэтина, что ведет к стимуляции дифференцировки и пролиферации предшественников Т-клеток в зрелые лимфоциты. При этом нормализуется иммунорегуляторный индекс (соотношение CD4/CD8), повышается способность Т-клеток давать пролиферативный ответ на Т-митогены и возрастает продукция соответствующих цитокинов. В результате усиливается функциональная активность факторов врожденного иммунитета – нейтрофилов, моноцитов/макрофагов и NK-клеток. В частности, повышается способность моноцитов и нейтрофилов захватывать бактерии и образовывать активные формы кислорода.
В частности, повышается способность моноцитов и нейтрофилов захватывать бактерии и образовывать активные формы кислорода.
Фармакологическое действие синтетического иммуномодулятора тимического происхождения Имунофана включает:
- восстановление продукции тимического гормона тимулина у тимэктомированных мышей до значений, характерных для нормальных животных;
- усиление в опытах in vivo и in vitro продукции ИЛ-2 лимфоцитами, стимулированными Т-митогенами;
- иммуномодулирующее действие на продукцию провоспалительного цитокина ФНО: повышение пониженного и понижении повышенного его образование;
- стимуляцию in vitro образования IgG, IgA, IgM, причем усиление синтеза IgA происходит в культуре лимфоцитов, полученных от больных с селективным IgA-дефицитом;
- возрастание поглощения и гибели бактерий, захваченных бактерий;
- ингибицию in vitro образования IgE в культурах лимфоцитов, полученных из периферической крови больными с аллергиями;
- адьювантный эффект, что проявляется в повышении иммуногенности вакцин против клещевого энцефалита и гепатита А.

Помимо иммунологических эффектов, Имунофан способен усиливать антиоксидантную защиту организма путем стимуляции синтеза церулоплазмина и лактоферрина, а также активности каталазы. Имунофан нормализует перекисное окисление липидов, подавляет распад фосфолипидов в мембране клеток и образование арахидоновой кислоты. При этом снижается продукция медиаторов воспаления.
Иммуномодуляторы костно-мозгового происхождения
Фармакологическое действие иммуномодулятора костно-мозгового происхождения Миелопида многогранно. В организме мишенью этого препарата считаются В-лимфоциты. При нарушении иммуно- или гемопоэза введение Миелопида ведет к усилению общей митотической активности клеток костного мозга и направлению их дифференцировки в сторону зрелых В-лимфоцитов. Усиливается экспрессия пан-В-клеточных антигенов, HLA-DR-антигенов, снижается экспрессия ранних В-клеточных маркеров (Sc-1 антиген). В силу наличия в составе Миелопида компонента МП-1, действующего на Т-хелперы, под его влиянием усиливается и дифференцировка костно-мозговых клеток в сторону зрелых Т-лимфоцитов.
С компонентом МП-3, действующим на фагоцитоз, связано вызываемое препаратом повышение гранулоцитопоэза и функциональной активности фагоцитарных клеток. В результате реализации всех указанных свойств введение Миелопида обеспечивает возрастания числа Т- и В-клеток, а также фагоцитов в периферической крови. Повышение их функциональной активности проявляется в способности Миелопида стимулировать гуморальный иммунный ответ, существенно повышая уровень антител. Введение препарата восстанавливает антителообразование у животных, подвергнутых облучению, воздействию цитостатиков и антибиотиков.
Цитокины
Для цитокиновых препаратов естественного происхождения – Лейкинферона и Суперлимфа – содержащих достаточно большой набор цитокинов воспаления и первой фазы иммунного ответа, характерно многогранное воздействие на организм человека. Эти препараты действуют на клетки, участвующие в воспалении, процессах регенерации и иммунном ответе.
Фармакологический эффект Суперлимфа состоит в преимущественном воздействии на клетки-эффекторы врожденного иммунитета – нейтрофилы, моноциты/макрофаги и NK-клетки, что, по всей видимости, обусловлено способностью препарата повышать уровень внутриклеточного кальция – одного из главных медиаторов активации клеток. Препарат регулирует миграцию фагоцитов в воспалительный очаг, усиливает поглощение лейкоцитами бактерий и их внутриклеточную гибель, повышает цитотоксические свойства макрофагов, оказывая тем самым противоопухолевый эффект, наблюдаемый в эксперименте. Усиливая продукцию моноцитами/макрофагами ИЛ-1 и ФНО, Суперлимф активирует механизмы как клеточного, так и гуморального иммунитета.
Препарат регулирует миграцию фагоцитов в воспалительный очаг, усиливает поглощение лейкоцитами бактерий и их внутриклеточную гибель, повышает цитотоксические свойства макрофагов, оказывая тем самым противоопухолевый эффект, наблюдаемый в эксперименте. Усиливая продукцию моноцитами/макрофагами ИЛ-1 и ФНО, Суперлимф активирует механизмы как клеточного, так и гуморального иммунитета.
Отечественные рекомбинантные цитокиновые препараты Беталейкин и Ронколейкин, которые содержат только один цитокин, так же как и комплексные по цитокиновому составу естественные препараты Лейкинферон и Суперлимф, обладают плейотропным воздействием на организм человека.
Главным фармакологическим свойством Беталейкина является усиление лейкопоэза и восстановление костно-мозгового кроветворения после применения цитостатиков и рентгеновского облучения. Этот эффект препарата обусловлен его способностью стимулировать синтез колониестимулирующих факторов – главных индукторов лейкопоэза и стимуляторов иммунитета. Беталейкин обладает выраженным иммуностимулирующим действием, так как ИЛ-1бета является активатором всех клеток врожденного иммунитета и одновременно инициатором развития первых фаз приобретенного иммунитета.
Беталейкин обладает выраженным иммуностимулирующим действием, так как ИЛ-1бета является активатором всех клеток врожденного иммунитета и одновременно инициатором развития первых фаз приобретенного иммунитета.
Главным фармакологическим свойством Ронколейкина, содержащего ИЛ-2 – основной фактор роста и дифференцировки Т- и NK-клеток – является активация и индукция пролиферации клеток-мишеней – Т-, В- и NK-клеток, содержащих рецептор CD25. На другие клетки иммунной системы Ронколейкин действует опосредованно через цитокины, синтезируемые клетками-мишенями.
Химически чистые иммуномодуляторы
Механизмы действия этих препаратов лучше всего рассматривать на примере Полиоксидония. Этот высокомолекулярный иммуномодулятор характеризуется широким спектром фармакологического действия на организм, включая иммуномодулирующий, антиоксидантный, детоксицирующий и мембранопротекторный эффекты.
Иммуномоделирующее действие Полиоксидония определяется:
Детоксицирующие свойства Полиоксидония проявляются в его способности понижать в крови концентрацию токсических веществ, например уровень липополисахарида энтеробактерий, у больных с ожоговой болезнью. У пациентов с острым панкреонекрозом Полиоксидоний существенно снижает уровень малонового диальдегида и диеновых кислот. Детоксицирующие свойства препарата связаны с его высокой молекулярной массой и наличием на поверхности молекулы большого количества различных активных групп. Поэтому он интенсивно адсорбирует циркулирующие в крови растворимые токсические субстанции и микрочастицы.
У пациентов с острым панкреонекрозом Полиоксидоний существенно снижает уровень малонового диальдегида и диеновых кислот. Детоксицирующие свойства препарата связаны с его высокой молекулярной массой и наличием на поверхности молекулы большого количества различных активных групп. Поэтому он интенсивно адсорбирует циркулирующие в крови растворимые токсические субстанции и микрочастицы.
Клиническое применение иммуномодуляторов
Наиболее обоснованным применение иммуномодуляторов представляется при иммунодефицитах, проявляющихся повышенной инфекционной заболеваемостью. Возникает вопрос о целесообразности использования иммуномодулирующих препаратов при первичных иммунодефицитах, в основе которых лежит генетический дефект. Естественно, что с помощью этих лекарств исправить генетический дефект невозможно. Однако антиинфекционная защита многокомпонентна и можно ожидать, что при некотором повышении с помощью иммуномодуляторов функциональной активности нормально работающего фрагмента иммунной системы будет скомпенсирована, хотя бы частично, “плохая работа” ее дефектного составляющего.
Существенное улучшение клинического состояния и показателей иммунного статуса у больных с пониженным уровнем всех классов иммуноглобулинов (общая вариабельная иммунологическая недостаточность) наблюдается при их лечении иммуномодулирующими препаратами, активирующими фагоцитоз, в частности Полиоксидонием. Поэтому хорошо продуманное применение иммуномодулирующей терапии у больных с первичными иммунодефицитами может дать хороший клинический результат.
Главной мишенью иммуномодулирующих препаратов остаются вторичные иммунодефициты, которые проявляются частыми рецидивирующими, трудно поддающимися лечению инфекционно-воспалительными заболеваниями всех локализаций и любой этиологии. В основе каждого хронического инфекционно-воспалительного процесса лежат изменения в иммунной системе, которые являются одной из причин персистенции этого процесса. Исследование параметров иммунной системы не всегда может выявить эти изменения. Поэтому при наличии хронического инфекционно-воспалительного процесса иммуномодулирующие препараты можно назначать даже в том случае, если иммунодиагностическое исследование не выявит существенных отклонений в иммунном статусе.
Как правило, при таких процессах, в зависимости от вида возбудителя, врач назначает антибиотики, противогрибковые, противовирусные или другие химиотерапевтические препараты. Мы считаем, что во всех случаях, когда противомикробные средства используются при явлениях вторичной иммунологической недостаточности, целесообразно назначать и иммуномодулирующие препараты.
Ниже приведены некоторые общие принципы применения иммуномодуляторов у больных с вторичной иммунологической недостаточностью.
- Иммуномодуляторы назначают в комплексной терапии одновременно с антибиотиками, противогрибковыми, противопротозойными или противовирусными средствами.
- Целесообразно как можно раньше, с первого дня применения химиотерапевтического этиотропного средства, назначать иммуномодуляторы.
- Иммуномодуляторы, действующие на фагоцитарное звено иммунитета, можно назначать больным как с выявленными, так и с невыявленными нарушениями иммунного статуса, т. е. основанием для их применения является клиническая картина.

- При наличии в данном лечебно-профилактическом учреждении соответствующей материально-технической базы применять иммуномодуляторы целесообразно на фоне иммунологического мониторинга, который следует осуществлять вне зависимости от наличия или отсутствия исходных изменений в иммунной системе.
- При проведении иммунореабилитационных мероприятий, в частности при неполном выздоровлении после перенесенного острого инфекционного заболевания, иммуномодуляторы можно применять в виде монотерапии.
- Понижение какого-либо параметра иммунитета, выявленнoe при иммунодиагностическом исследовании у практически здорового человека, не обязательно является основанием для назначения ему иммуномодулирующей терапии.
Механизм действия иммуномодулирующих препаратов (IMiDS) при множественной миеломе
van Rhee F, Dhodapkar M, Shaughnessy Jr JD, Anaissie E, Siegel D, Hoering A et al .
 Первое клиническое испытание талидомида при множественной миеломе: десятилетие. Кровь 2008; 112 : 1035–1038.
Первое клиническое испытание талидомида при множественной миеломе: десятилетие. Кровь 2008; 112 : 1035–1038.КАС Google Scholar
Галустян С., Лабарт М.С., Бартлетт Д.Б., Далглиш А.Г. Иммуномодулирующие препараты на основе талидомида как терапевтические средства. Exp Opin Biolog Ther 2004; 4 : 1963–1970.
КАС Google Scholar
Лайер Г . Координируемое ВОЗ краткосрочное двойное слепое исследование талидомида при лечении острых реакций лепры у мужчин с лепроматозом. Bull Всемирная организация здравоохранения 1971; 45 : 719–732.
Google Scholar
Сампайо Э.П., Сарно Э.Н., Галилли Р., Кон З.А., Каплан Г. . Талидомид селективно ингибирует продукцию фактора некроза опухоли альфа стимулированными моноцитами человека.
 J Exp Med 1991; 173 : 699–703.
J Exp Med 1991; 173 : 699–703.КАС Google Scholar
Д’Амато Р.Дж., Лофнан М.С., Флинн Э., Фолкман Дж. Талидомид является ингибитором ангиогенеза. Proc Natl Acad Sci USA 1994; 91 : 4082–4085.
Google Scholar
Haslett PA, Corral LG, Albert M, Kaplan G . Талидомид ко-стимулирует первичные Т-лимфоциты человека, преимущественно индуцируя пролиферацию, продукцию цитокинов и цитотоксические реакции в субпопуляции CD8+. J Exp Med 1998; 187 : 1885–1892.
КАС Google Scholar
Коррал Л.Г., Мюллер Г.В., Морейра А.Л., Чен Ю., Ву М., Стирлинг Д. и др. . Подбор новых аналогов талидомида с повышенной ингибирующей активностью в отношении фактора некроза опухоли альфа. Mol Med (Кембридж, Массачусетс) 1996; 2 : 506–515.

КАС Google Scholar
Muller GW, Corral LG, Shire MG, Wang H, Moreira A, Kaplan G и др. . Структурные модификации талидомида дают аналоги с повышенной ингибирующей активностью в отношении фактора некроза опухоли. J Med Chem 1996; 39 : 3238–3240.
КАС Google Scholar
Corral LG, Haslett PA, Muller GW, Chen R, Wong LM, Ocampo CJ и др. . Дифференциальная модуляция цитокинов и активация Т-клеток двумя различными классами аналогов талидомида, которые являются мощными ингибиторами ФНО-альфа. J Иммунол 1999; 163 : 380–386.
КАС Google Scholar
Цзоу В . Иммуносупрессивные сети в опухолевой среде и их терапевтическое значение. Nat Rev 2005; 5 : 263–274.
КАС Google Scholar
Урасима М.
 , Огата А., Чаухан Д., Хатзиянни М., Видриалес М.Б., Дедера Д.А. и др. . Трансформирующий фактор роста-бета1: дифференциальное воздействие на множественную миелому по сравнению с нормальными В-клетками. Кровь 1996; 87 : 1928–1938.
, Огата А., Чаухан Д., Хатзиянни М., Видриалес М.Б., Дедера Д.А. и др. . Трансформирующий фактор роста-бета1: дифференциальное воздействие на множественную миелому по сравнению с нормальными В-клетками. Кровь 1996; 87 : 1928–1938.КАС Google Scholar
Бримнес М.К., Сване И.М., Йонсен Х.Е. Нарушенная функциональность и фенотипический профиль дендритных клеток больных множественной миеломой. Clin Exp Immunol 2006; 144 : 76–84.
КАС Google Scholar
Смит М.Дж., Годфри Д.И., Трапани Дж.А. Свежий взгляд на иммунный надзор за опухолью и иммунотерапию. Нат Иммунол 2001; 2 : 293–299.
КАС Google Scholar
Браун Р.Д., Поуп Б., Мюррей А., Эсдейл В., Се Д.М., Гибсон Дж. и др. .
 Дендритные клетки пациентов с миеломой численно нормальные, но функционально дефектные, поскольку они не могут повышать экспрессию CD80 (B7-1) после стимуляции huCD40LT из-за ингибирования трансформирующим фактором роста-бета1 и интерлейкином-10. Кровь 2001; 98 : 2992–2998.
Дендритные клетки пациентов с миеломой численно нормальные, но функционально дефектные, поскольку они не могут повышать экспрессию CD80 (B7-1) после стимуляции huCD40LT из-за ингибирования трансформирующим фактором роста-бета1 и интерлейкином-10. Кровь 2001; 98 : 2992–2998.КАС Google Scholar
Rawstron AC, Davies FE, Owen RG, English A, Pratt G, Child JA и др. . Супрессия В-лимфоцитов при множественной миеломе является обратимым явлением, характерным для нормальных В-клеток-предшественников и предшественников плазматических клеток. BrJ Haematol 1998; 100 : 176–183.
КАС Google Scholar
Огавара Х., Ханда Х., Ямадзаки Т., Тода Т., Йошида К., Нисимото Н. и др. . Высокое соотношение Th2/Th3 у больных множественной миеломой. Leukemia Res 2005; 29 : 135–140.

КАС Google Scholar
Куах Х., Ричи Д., Нисон П., Харрисон С., Тай Т., Тейнтон К. и др. . Регуляторные Т-клетки (Treg) подавлены у пациентов с рецидивирующей/рефрактерной множественной миеломой (ММ) и увеличиваются до нормального уровня у пациентов, реагирующих на лечение леналидомидом (LEN) [аннотация]. Кровь 2008; 112 : 1696а.
Google Scholar
Maecker B, Anderson KS, von Bergwelt-Baildon MS, Weller E, Vonderheide RH, Richardson PG et al . Вирусный антиген-специфический ответ CD8+ Т-клеток нарушен при множественной миеломе. BrJ Haematol 2003; 121 : 842–848.
Google Scholar
Джарахян М., Ватцль К., Исса И., Альтевогт П., Момбург Ф. . Блокада лизиса, опосредованного естественными клетками-киллерами, с помощью NCAM140, экспрессируемого на опухолевых клетках.
 Int J Рак 2007; 120 : 2625–2634.
Int J Рак 2007; 120 : 2625–2634.КАС Google Scholar
Дходапкар М.В., Геллер М.Д., Чанг Д.Х., Симидзу К., Фуджи С., Дходапкар К.М. и др. . Обратимый дефект функции Т-клеток естественных киллеров характеризует прогрессирование предраковой множественной миеломы в злокачественную. J Exp Med 2003; 197 : 1667–1676.
КАС Google Scholar
Ратта М., Фаньони Ф., Курти А., Весковини Р., Сансони П., Оливьеро Б. и др. . Дендритные клетки функционально дефектны при множественной миеломе: роль интерлейкина-6. Кровь 2002; 100 : 230–237.
КАС Google Scholar
Такахаси А., Коно К., Ичихара Ф., Сугай Х., Фуджи Х., Мацумото Ю. . Сосудистый эндотелиальный фактор роста ингибирует созревание дендритных клеток, индуцированное липополисахаридом, но не провоспалительными цитокинами.
 Рак Иммунол Иммунотер 2004; 53 : 543–550.
Рак Иммунол Иммунотер 2004; 53 : 543–550.КАС Google Scholar
Прабхала Р. Х., Нери П., Бэ Дж. Э., Тассон П., Шаммас М. А., Аллам К. К. и др. . Дисфункциональные Т-регуляторные клетки при множественной миеломе. Кровь 2006; 107 : 301–304.
КАС Google Scholar
Куриэль Т.Дж. Tregs и переосмысление иммунотерапии рака. J Clin Invest 2007; 117 : 1167–1174.
КАС Google Scholar
Куриэль Т.Дж. Развитие регуляторных Т-клеток: решает ли Foxp3? Nat Med 2007; 13 : 250–253.
КАС Google Scholar
Ян З.З., Новак А.Дж., Цисмер С.К., Витзиг Т.Е., Анселл С.М. Ослабление функции CD8(+) Т-клеток регуляторными Т-клетками CD4(+)CD25(+) при В-клеточной неходжкинской лимфоме.
 Рак Res 2006; 66 : 10145–10152.
Рак Res 2006; 66 : 10145–10152.КАС Google Scholar
Тржонковски П., Шмит Э., Мысливска Дж., Добыщук А., Мысливски А. . CD4+CD25+ Т-регуляторные клетки ингибируют цитотоксическую активность Т-CD8+ и NK-лимфоцитов при прямом межклеточном взаимодействии. Clin Immunol (Орландо, Флорида) 2004; 112 : 258–267.
КАС Google Scholar
Бейер М., Шульце Дж.Л. Регуляторные Т-клетки при раке. Кровь 2006; 108 : 804–811.
КАС Google Scholar
Джошуа Д.Э., Браун Р.Д., Хо П.Дж., Гибсон Дж. Регуляторные Т-клетки и множественная миелома. Клин Лимфома Миелома 2008; 8 : 283–286.
КАС Google Scholar
Каррерас Х.
 , Лопес-Гильермо А., Фокс Б.К., Коломо Л., Мартинес А., Ронкадор Г. и др. . Большое количество инфильтрирующих опухоль FOXP3-позитивных регуляторных Т-клеток связано с улучшением общей выживаемости при фолликулярной лимфоме. Кровь 2006; 108 : 2957–2964.
, Лопес-Гильермо А., Фокс Б.К., Коломо Л., Мартинес А., Ронкадор Г. и др. . Большое количество инфильтрирующих опухоль FOXP3-позитивных регуляторных Т-клеток связано с улучшением общей выживаемости при фолликулярной лимфоме. Кровь 2006; 108 : 2957–2964.КАС Google Scholar
Alvaro T, Lejeune M, Salvado MT, Bosch R, Garcia JF, Jaen J и др. . Исход лимфомы Ходжкина можно предсказать по наличию сопутствующих цитотоксических и регуляторных Т-клеток. Clin Cancer Res 2005; 11 : 1467–1473.
Google Scholar
Беттелли Э., Кэрриер Ю., Гао В., Корн Т., Стром Т.Б., Оукка М. и др. . Реципрокные пути развития образования патогенных эффекторных Th27 и регуляторных Т-клеток. Природа 2006; 441 : 235–238.
КАС Google Scholar
Бейер М.
 , Кочанек М., Гизе Т., Эндл Э., Вайраух М.Р., Кнолле П.А. и др. . In vivo периферическая экспансия наивных CD4+CD25high FoxP3+ регуляторных Т-клеток у пациентов с множественной миеломой. Кровь 2006; 107 : 3940–3949.
, Кочанек М., Гизе Т., Эндл Э., Вайраух М.Р., Кнолле П.А. и др. . In vivo периферическая экспансия наивных CD4+CD25high FoxP3+ регуляторных Т-клеток у пациентов с множественной миеломой. Кровь 2006; 107 : 3940–3949.КАС Google Scholar
Фейлер С., фон Лилиенфельд-Тоал М., Ярмин С., Марлес Л., Роустрон А., Эшкрофт А.Дж. и др. . CD4(+)CD25(+)FoxP3(+) регуляторные Т-клетки повышены, в то время как CD3(+)CD4(-)CD8(-)alphabetaTCR(+) двойные отрицательные Т-клетки снижены в периферической крови пациентов с множественной миеломой, которые коррелирует с бременем болезни. BrJ Haematol 2009; 144 : 686–695.
Google Scholar
Davies FE, Raje N, Hideshima T, Lentzsch S, Young G, Tai YT и др. . Талидомид и иммуномодулирующие производные усиливают цитотоксичность естественных клеток-киллеров при множественной миеломе.
 Кровь 2001; 98 : 210–216.
Кровь 2001; 98 : 210–216.КАС Google Scholar
Леблан Р., Хидешима Т., Кэтли Л.П., Шрингарпуре Р., Бургер Р., Митсиадес Н. и др. . Иммуномодулирующий препарат ко-стимулирует Т-клетки через путь B7-CD28. Кровь 2004; 103 : 1787–1790.
КАС Google Scholar
Коррал Л.Г., Каплан Г. Иммуномодуляция талидомидом и аналогами талидомида. Энн Реум Дис 1999; 58 (Приложение 1): 1107–1113.
Google Scholar
Шафер П.Х., Ганди А.К., Лавленд М.А., Чен Р.С., Ман Х.В., Шнеткамп, стр. и др. . Усиление продукции цитокинов и транскрипционной активности АР-1 в Т-клетках иммуномодулирующими препаратами, связанными с талидомидом. J Pharmacol Exp Therap 2003; 305 : 1222–1232.
КАС Google Scholar
Дредж К.
 , Марриотт Дж. Б., Тодрик С. М., Мюллер Г. В., Чен Р., Стерлинг Д. И. и др. . Защитный противоопухолевый иммунитет, индуцируемый костимулирующим аналогом талидомида в сочетании с вакцинацией цельными опухолевыми клетками, опосредуется усилением иммунитета Th2-типа. J Иммунол 2002; 168 : 4914–4919.
, Марриотт Дж. Б., Тодрик С. М., Мюллер Г. В., Чен Р., Стерлинг Д. И. и др. . Защитный противоопухолевый иммунитет, индуцируемый костимулирующим аналогом талидомида в сочетании с вакцинацией цельными опухолевыми клетками, опосредуется усилением иммунитета Th2-типа. J Иммунол 2002; 168 : 4914–4919.КАС Google Scholar
Исследование CC-4047-1398/142: Фаза 1, одинарное слепое, плацебо-контролируемое, возрастающая однократная пероральная доза, безопасность, переносимость, фармакокинетические и фармакодинамические исследования у здоровых мужчин. Брошюра исследователей помалидомида, Celgene Corporation , 2008 г.; версия 11: 1–164.
Лу Дж., Палмер Б.Д., Кестелл П., Броветт П., Бэгулей Б.К., Мюллер Г. и др. . Метаболиты талидомида у мышей и пациентов с множественной миеломой. Clin Cancer Res 2003; 9 : 1680–1688.
КАС Google Scholar
Куах Х.
 , Ричи Д., Нисон П., Тай Т., Тейнтон К., Линч К. и др. . Подмножества лимфоидных клеток и профили регуляторных Т-клеток у пациентов с рецидивирующей множественной миеломой в подгруппе пациентов, включенных в исследование REVLITE [аннотация]. Ежегодное научное собрание гематологического общества Австралии и Новой Зеландии, Перт, Австралия 2008.
, Ричи Д., Нисон П., Тай Т., Тейнтон К., Линч К. и др. . Подмножества лимфоидных клеток и профили регуляторных Т-клеток у пациентов с рецидивирующей множественной миеломой в подгруппе пациентов, включенных в исследование REVLITE [аннотация]. Ежегодное научное собрание гематологического общества Австралии и Новой Зеландии, Перт, Австралия 2008.Шафер П., Ганди А.К., Чжан Л., Канг Дж., Капоне Л., Бартлетт Дж.Б. Противоположные эффекты дексаметазона на активность леналидомида при множественной миеломе: аддитивные/синергические эффекты на антипролиферативную активность в отношении клеток миеломы и антагонистические эффекты на иммунную функцию [аннотация]. Кровь 2008; 112 : 2761а.
Google Scholar
Куах Х., Хсу А., Ричи Д., Нисон П., Линч К., Харрисон С. и др. . In Vivo Антагонистические эффекты дексаметазона на активацию NK-клеток, индуцированную леналидомидом [аннотация].
 51-е ежегодное собрание Американского общества гематологов, Новый Орлеан, Лос-Анджелес, , 2009 г.: Аннотация 1639. Иммуномодулирующие препараты (IMiDs) увеличивают выработку IL-2 стимулированными Т-клетками за счет усиления активации PKC-тета и усиления ДНК-связывающей активности AP-1, но не NF-kappaB, OCT-1 или NF-AT. J Interferon Cytokine Res 2005; 25 : 604–616.
51-е ежегодное собрание Американского общества гематологов, Новый Орлеан, Лос-Анджелес, , 2009 г.: Аннотация 1639. Иммуномодулирующие препараты (IMiDs) увеличивают выработку IL-2 стимулированными Т-клетками за счет усиления активации PKC-тета и усиления ДНК-связывающей активности AP-1, но не NF-kappaB, OCT-1 или NF-AT. J Interferon Cytokine Res 2005; 25 : 604–616.КАС Google Scholar
Хаяси Т., Хидешима Т., Акияма М., Подар К., Ясуи Х., Радже Н. и др. . Молекулярные механизмы активации иммуномодулирующими препаратами естественных клеток-киллеров: клиническое применение. BrJ Haematol 2005; 128 : 192–203.
КАС Google Scholar
Ганди А.К., Роговиц А., Лопес-Хирона А., Менди Д., Питер Х.С. Стимуляция Т-клеток леналидомидом включает предполагаемый белок, связывающий леналидомид, Cd3-эпсилон-ассоциированный белок и GDP-маннозопирофосфорилазу [аннотация].
 Кровь 2008; 112 : 2606а.
Кровь 2008; 112 : 2606а.Google Scholar
Галустян С., Мейер Б., Лабарт М.С., Дредж К., Клашка Д., Генри Дж. и др. . Противораковые агенты леналидомид и помалидомид ингибируют пролиферацию и функцию Т-регуляторных клеток. Рак Иммунол Иммунотер 2009; 58 : 1033–1045.
КАС Google Scholar
Alsayed Y, Ngo H, Runnels J, Leleu X, Singha UK, Pitsillides CM и др. . Механизмы регуляции CXCR4/SDF-1 (CXCL12)-зависимой миграции и возвращения при множественной миеломе. Кровь 2007; 109 : 2708–2717.
КАС Google Scholar
Галустян С., Клашка Д., Лабарт М.С., Бартлетт Д.Б., Далглиш А.Г. Иммуномодулирующий препарат (IMID(R)) CC-4047 усиливает пролиферацию и противоопухолевую функцию гамма-дельта Т-клеток.
 Дж Иммунотер 2004; 27 : S50.
Дж Иммунотер 2004; 27 : S50.Google Scholar
Кроненберг М . К пониманию биологии NKT-клеток: прогресс и парадоксы. Энн Рев Иммунол 2005; 23 : 877–900.
КАС Google Scholar
Фуджи С., Симидзу К., Штейнман Р.М., Додапкар М.В. Обнаружение и активация человеческих Т-клеток естественных киллеров Valpha24+ с использованием дендритных клеток с альфа-галактозилцерамидом. J Immunolog Methods 2003; 272 : 147–159.
КАС Google Scholar
Карно К., Ли Д., Доннарс О., Парк С.Х., Бивис А., Коэдзука И. и др. . Передовой опыт: взаимодействие между клетками врожденной иммунной системы: NKT-клетки быстро активируют NK-клетки. J Иммунол 1999; 163 : 4647–4650.
КАС Google Scholar
Ву Л.
 , Адамс М., Картер Т., Чен Р., Мюллер Г., Стирлинг Д. и др. . леналидомид усиливает опосредованную моноцитами антителозависимую клеточную цитотоксичность клеток-киллеров CD20+, обработанных ритуксимабом. Clin Cancer Res 2008; 14 : 4650–4657.
, Адамс М., Картер Т., Чен Р., Мюллер Г., Стирлинг Д. и др. . леналидомид усиливает опосредованную моноцитами антителозависимую клеточную цитотоксичность клеток-киллеров CD20+, обработанных ритуксимабом. Clin Cancer Res 2008; 14 : 4650–4657.КАС Google Scholar
Tai YT, Li XF, Catley L, Coffey R, Breitkreutz I, Bae J и др. . Иммуномодулирующий препарат леналидомид (CC-5013, IMiD3) усиливает анти-CD40-SGN-40-индуцированную цитотоксичность при множественной миеломе человека: клинические последствия. Исследование рака 2005; 65 : 11712–11720.
КАС Google Scholar
Лапаломбелла Р., Ю. Б., Триантафиллоу Г., Лю К., Бучар Дж. П., Лозански Г. и др. . Леналидомид подавляет антиген CD20 и противодействует прямой и антителозависимой клеточной цитотоксичности ритуксимаба в отношении клеток первичного хронического лимфоцитарного лейкоза.
 Кровь 2008; 112 : 5180–5189.
Кровь 2008; 112 : 5180–5189.КАС Google Scholar
Рода Дж.М., Парихар Р., Магро С., Нуово Г.Дж., Тридандапани С., Карсон III В.Е. Естественные клетки-киллеры продуцируют рекрутирующие Т-клетки хемокины в ответ на опухолевые клетки, покрытые антителами. Рак Res 2006; 66 : 517–526.
КАС Google Scholar
Хидешима Т., Чаухан Д., Хаяши Т., Подар К., Акияма М., Гупта Д. и др. . Биологические последствия фактора-1альфа, полученного из стромальных клеток, при множественной миеломе. Mol Cancer Therap 2002; 1 : 539–544.
КАС Google Scholar
Ли З.В., Чен Х., Кэмпбелл Р.А., Бонавида Б., Беренсон Дж.Р. NF-kappaB в патогенезе и лечении множественной миеломы. Curr Opin Hematol 2008; 15 : 391–399.

КАС Google Scholar
Хидешима Т., Чаухан Д., Шлоссман Р., Ричардсон П., Андерсон К.С. Роль фактора некроза опухоли альфа в патофизиологии множественной миеломы человека: терапевтическое применение. Онкоген 2001; 20 : 4519–4527.
КАС Google Scholar
Чаухан Д., Утияма Х., Акбарали Ю., Урасима М., Ямамото К., Либерманн Т.А. и др. . Индуцируемая адгезией клеток множественной миеломы экспрессия интерлейкина-6 в стромальных клетках костного мозга включает активацию NF-каппа B. Кровь 1996; 87 : 1104–1112.
КАС Google Scholar
Данкбар Б., Падро Т., Лео Р., Фельдманн Б., Кропфф М., Местерс Р.М. и др. . Сосудистый эндотелиальный фактор роста и интерлейкин-6 в паракринных взаимодействиях опухолевых стромальных клеток при множественной миеломе.
 Кровь 2000; 95 : 2630–2636.
Кровь 2000; 95 : 2630–2636.КАС Google Scholar
Гупта Д., Треон С.П., Сима Ю., Хидешима Т., Подар К., Тай Ю.Т. и др. . Прилипание клеток множественной миеломы к стромальным клеткам костного мозга повышает секрецию фактора роста эндотелия сосудов: терапевтическое применение. Лейкемия 2001; 15 : 1950–1961.
КАС Google Scholar
Огата А., Чаухан Д., Тео Г., Треон С.П., Урасима М., Шлоссман Р.Л. и др. . IL-6 запускает рост клеток через каскад Ras-зависимых митоген-активируемых протеинкиназ. J Иммунол 1997; 159 : 2212–2221.
КАС Google Scholar
Чаухан Д., Харбанда С., Огата А., Урасима М., Тео Г., Робертсон М. и др. . Интерлейкин-6 ингибирует Fas-индуцированный апоптоз и активацию стресс-активируемой протеинкиназы в клетках множественной миеломы.
 Кровь 1997; 89 : 227–234.
Кровь 1997; 89 : 227–234.КАС Google Scholar
Хидешима Т., Чаухан Д., Ричардсон П., Митсиадес С., Митсиадес Н., Хаяши Т. и др. . NF-каппа B как терапевтическая мишень при множественной миеломе. J Biol Chem 2002; 277 : 16639–16647.
КАС Google Scholar
Утияма Х., Барут Б.А., Чаухан Д., Каннистра С.А., Андерсон К.С. Характеристика молекул адгезии на клеточных линиях миеломы человека. Кровь 1992; 80 : 2306–2314.
КАС Google Scholar
Милешкин Л., Хонеманн Д., Гэмбелл П., Триветт М., Хаякава Ю., Смит М. и др. . Пациенты с множественной миеломой, получавшие талидомид: оценка клинических параметров, цитокинов, ангиогенных маркеров, тучных клеток и цитотоксических Т-клеток CD57+ костного мозга как предикторов исхода.
 Гематологический 2007; 92 : 1075–1082.
Гематологический 2007; 92 : 1075–1082.КАС Google Scholar
Dredge K, Marriott JB, Macdonald CD, Man HW, Chen R, Muller GW и др. . Новые аналоги талидомида проявляют антиангиогенную активность независимо от иммуномодулирующего действия. Br J Рак 2002; 87 : 1166–1172.
КАС Google Scholar
Прайс Д.К., Андо Ю., Крюгер Э.А., Вайс М., Фигг В.Д. 5′-ОН-талидомид, метаболит талидомида, ингибирует ангиогенез. Ther Drug Monit 2002; 24 : 104–110.
КАС Google Scholar
Дредж К., Хорсфолл Р., Робинсон С.П., Чжан Л.Х., Лу Л., Тан Ю. и др. . При пероральном введении леналидомид (CC-5013) оказывает антиангиогенное действие in vivo и ингибирует миграцию эндотелиальных клеток и фосфорилирование Akt in vitro .
 Микроваскулярный рез 2005; 69 : 56–63.
Микроваскулярный рез 2005; 69 : 56–63.КАС Google Scholar
Кост В., Портье М., Лу З.И., Росси Дж.Ф., Батай Р., Кляйн Б. Интерлейкин-1 при множественной миеломе: клетки-продуценты и их роль в контроле продукции ИЛ-6. BrJ Гематол 1998; 103 : 1152–1160.
КАС Google Scholar
Masferrer JL, Leahy KM, Koki AT, Zweifel BS, Settle SL, Woerner BM и др. . Антиангиогенная и противоопухолевая активность ингибиторов циклооксигеназы-2. Рак Res 2000; 60 : 1306–1311.
КАС Google Scholar
Принц Х.М., Милешкин Л., Робертс А., Ганджу В., Андерхилл С., Каталано Дж. и др. . Многоцентровое исследование фазы II талидомида и целекоксиба у пациентов с рецидивирующей и рефрактерной множественной миеломой.
 Clin Cancer Res 2005; 11 : 5504–5514.
Clin Cancer Res 2005; 11 : 5504–5514.КАС Google Scholar
Хинсон Р.М., Уильямс Дж.А., Шактер Э. Повышенный уровень интерлейкина 6 индуцируется простагландином Е2 в мышиной модели воспаления: возможная роль циклооксигеназы-2. Proc Natl Acad Sci USA 1996; 93 : 4885–4890.
КАС Google Scholar
Чжан М., Абэ Ю., Мацусима Т., Нисимура Дж., Навата Х., Мута К. . Селективный ингибитор циклооксигеназы 2 NS-398 индуцирует апоптоз в клетках миеломы через независимый от Bcl-2 путь. Лейк-лимфома 2005; 46 : 425–433.
КАС Google Scholar
Пайванди Ф., Ву Л., Хейли М., Шафер П.Х., Чжан Л.Х., Чен Р.С. и др. . Иммуномодулирующие препараты ингибируют экспрессию циклооксигеназы-2 из ФНО-альфа, ИЛ-1бета и ЛПС-стимулированных РВМС человека частично зависимым от ИЛ-10 образом.
 Селл Иммунол 2004; 230 : 81–88.
Селл Иммунол 2004; 230 : 81–88.КАС Google Scholar
Мюллер Г.В., Чен Р., Хуанг С.И., Коррал Л.Г., Вонг Л.М., Паттерсон Р.Т. и др. . Аминозамещенные аналоги талидомида: мощные ингибиторы продукции ФНО-альфа. Bioorg Med Chem Lett 1999; 9 : 1625–1630.
КАС Google Scholar
Акобенг А.К., Stokkers PC . Талидомид и аналоги талидомида для поддержания ремиссии при болезни Крона . Системная версия Кокрановской базы данных, 2009 г.(2): стр CD007351.
Гейц Х., Хандт С., Цвингенбергер К. . Талидомид избирательно модулирует плотность молекул клеточной поверхности, участвующих в каскаде адгезии. Иммунофармакология 1996; 31 : 213–221.
КАС Google Scholar
Хидешима Т.
 , Бергсагель П.Л., Кюль В.М., Андерсон К.С. Достижения в области биологии множественной миеломы: клиническое применение. Кровь 2004; 104 : 607–618.
, Бергсагель П.Л., Кюль В.М., Андерсон К.С. Достижения в области биологии множественной миеломы: клиническое применение. Кровь 2004; 104 : 607–618.КАС Google Scholar
Брайткройц И., Рааб М.С., Валлет С., Хидешима Т., Радже Н., Митсиадес С. и др. . Леналидомид ингибирует остеокластогенез, факторы выживания и маркеры ремоделирования кости при множественной миеломе. Лейкемия 2008; 22 : 1925–1932.
КАС Google Scholar
Rieman DJ, McClung HA, Dodds RA, Hwang SM, Holmes MW, James IE и др. . Биосинтез и процессинг катепсина К в культивируемых остеокластах человека. Кость 2001; 28 : 282–289.
КАС Google Scholar
Андерсон Г., Грис М., Курихара Н., Хонджо Т., Андерсон Дж.
 , Донненберг В. и др. . Производное талидомида CC-4047 ингибирует образование остеокластов путем подавления PU.1. Кровь 2006; 107 : 3098–3105.
, Донненберг В. и др. . Производное талидомида CC-4047 ингибирует образование остеокластов путем подавления PU.1. Кровь 2006; 107 : 3098–3105.КАС Google Scholar
Хайдер У., Кайзер М., Мюллер С., Якоб С., Заврски И., Шульц С.О. и др. . Бортезомиб повышает активность остеобластов у больных миеломой независимо от ответа на лечение. Евро J Гематол 2006; 77 : 233–238.
КАС Google Scholar
Хидешима Т., Чаухан Д., Сима Й., Радже Н., Дэвис Ф.Е., Тай Ю.Т. и др. . Талидомид и его аналоги преодолевают лекарственную устойчивость клеток множественной миеломы человека к традиционной терапии. Кровь 2000; 96 : 2943–2950.
КАС Google Scholar
Пеллагатти А., Ядерстен М.
 , Форсблом А.М., Каттан Х., Кристенссон Б., Эмануэльссон Э.К. и др. . Леналидомид ингибирует злокачественный клон и активирует картирование гена SPARC в часто делетируемой области у пациентов с синдромом 5q. Proc Natl Acad Sci USA 2007; 104 : 11406–11411.
, Форсблом А.М., Каттан Х., Кристенссон Б., Эмануэльссон Э.К. и др. . Леналидомид ингибирует злокачественный клон и активирует картирование гена SPARC в часто делетируемой области у пациентов с синдромом 5q. Proc Natl Acad Sci USA 2007; 104 : 11406–11411.КАС Google Scholar
Чу З.Л., McKinsey TA, Лю Л., Джентри Дж.Дж., Малим М.Х., Баллард Д.В. Подавление индуцированной фактором некроза опухоли гибели клеток с помощью ингибитора апоптоза c-IAP2 находится под контролем NF-kappaB. Proc Natl Acad Sci USA 1997; 94 : 10057–10062.
КАС Google Scholar
Кройц С., Зигмунд Д., Шойрих П., Вайант Х. Индукторы NF-kappaB активируют cFLIP, чувствительный к циклогексимиду ингибитор передачи сигналов рецептора смерти. Мол Селл Биол 2001; 21 : 3964–3973.
КАС Google Scholar
Митсиадес Н.
 , Митсиадес К.С., Пулаки В., Андерсон К.С., Треон С.П. Внутриклеточная регуляция связанного с фактором некроза опухоли апоптоза, индуцирующего лиганд-индуцированный апоптоз в клетках множественной миеломы человека. Кровь 2002; 99 : 2162–2171.
, Митсиадес К.С., Пулаки В., Андерсон К.С., Треон С.П. Внутриклеточная регуляция связанного с фактором некроза опухоли апоптоза, индуцирующего лиганд-индуцированный апоптоз в клетках множественной миеломы человека. Кровь 2002; 99 : 2162–2171.КАС Google Scholar
Ван С.И., Мэйо М.В., Корнелюк Р.Г., Геддел Д.В., Болдуин-младший А.С. Антиапоптоз NF-kappaB: индукция TRAF1 и TRAF2 и c-IAP1 и c-IAP2 для подавления активации каспазы-8. Science (Нью-Йорк, штат Нью-Йорк) 1998 г.; 281 : 1680–1683.
КАС Google Scholar
Митсиадес Н., Митсиадес К.С., Пулаки В., Чаухан Д., Ричардсон П.Г., Хидешима Т. и др. . Передача сигналов апоптоза, индуцированная иммуномодулирующими аналогами талидомида в клетках множественной миеломы человека: терапевтические последствия. Кровь 2002; 99 : 4525–4530.

КАС Google Scholar
Скачать ссылки
Иммуномодулирующие агенты | DrugBank Online
All categories
- Name
- Immunomodulatory Agents
- Accession Number
- DBCAT003615
- Description
Not Available
- Drugs
Drug Описание препарата Интерферон бета-1а Форма рекомбинантного человеческого интерферона, применяемая для замедления прогрессирования заболевания и снижения частоты клинических симптомов у пациентов с рецидивирующим рассеянным склерозом. Натализумаб Моноклональное антитело против интегрина, которое связывается с субъединицей альфа-4 интегринов для предотвращения миграции иммунных клеток и используется для лечения болезни Крона или рассеянного склероза. 
Даклизумаб Моноклональное антитело к CD25, которое блокирует рецептор интерлейкина-2, который используется для лечения рецидивирующих форм рассеянного склероза. Талидомид Лекарство, используемое для лечения рака, особенно недавно диагностированной множественной миеломы и узловатой лепрозной эритемы. Глатирамер Иммуномодулятор, применяемый для снижения частоты рецидивов рассеянного склероза (РС). Терифлуномид Ингибитор синтеза пиримидина с противовоспалительными и иммуномодулирующими свойствами, используемый для лечения пациентов с рецидивирующе-ремиттирующей формой рассеянного склероза. Окрелизумаб Моноклональное антитело, специфичное к CD20, используемое для лечения рецидивирующе-ремиттирующего рассеянного склероза. Устекинумаб Таргетная терапия антителами, используемая для лечения воспалительных состояний, таких как бляшечный псориаз, псориатический артрит, болезнь Крона и язвенный колит. 
Финголимод Модулятор рецептора сфингозин-1-фосфата, используемый для лечения пациентов с рецидивирующе-ремиттирующей формой рассеянного склероза (РС) и изученный для лечения легочных осложнений COVID-19. Сипонимод Препарат, используемый для лечения рецидивирующего рассеянного склероза. Озанимод Модулятор рецептора сфингозин-1-фосфата изучается для лечения рассеянного склероза (РС) и воспалительного заболевания кишечника (ВЗК). Диметилфумарат Препарат, используемый для лечения пациентов с рецидивирующе-ремиттирующей формой рассеянного склероза. Понесимод Модулятор сфингозин-1-фосфатных рецепторов, предназначенный для лечения рецидивирующего рассеянного склероза. Darvadstrocel Усовершенствованная терапия мезенхимальными стволовыми клетками, используемая для лечения сложных перианальных свищей у взрослых с неактивной или умеренно активной люминальной болезнью Крона после неадекватного ответа по крайней мере на одно стандартное лечение. 
- Шауки ахмадович ондос: Ондос Шауки Ахмадович — 8 отзывов | Москва
- Симптомы после потери девственности: Ощущения после потери девственности — Гинекология — 7.07.2018



 Первое клиническое испытание талидомида при множественной миеломе: десятилетие. Кровь 2008; 112 : 1035–1038.
Первое клиническое испытание талидомида при множественной миеломе: десятилетие. Кровь 2008; 112 : 1035–1038. J Exp Med 1991; 173 : 699–703.
J Exp Med 1991; 173 : 699–703.
 , Огата А., Чаухан Д., Хатзиянни М., Видриалес М.Б., Дедера Д.А. и др. . Трансформирующий фактор роста-бета1: дифференциальное воздействие на множественную миелому по сравнению с нормальными В-клетками. Кровь 1996; 87 : 1928–1938.
, Огата А., Чаухан Д., Хатзиянни М., Видриалес М.Б., Дедера Д.А. и др. . Трансформирующий фактор роста-бета1: дифференциальное воздействие на множественную миелому по сравнению с нормальными В-клетками. Кровь 1996; 87 : 1928–1938. Дендритные клетки пациентов с миеломой численно нормальные, но функционально дефектные, поскольку они не могут повышать экспрессию CD80 (B7-1) после стимуляции huCD40LT из-за ингибирования трансформирующим фактором роста-бета1 и интерлейкином-10. Кровь 2001; 98 : 2992–2998.
Дендритные клетки пациентов с миеломой численно нормальные, но функционально дефектные, поскольку они не могут повышать экспрессию CD80 (B7-1) после стимуляции huCD40LT из-за ингибирования трансформирующим фактором роста-бета1 и интерлейкином-10. Кровь 2001; 98 : 2992–2998.
 Int J Рак 2007; 120 : 2625–2634.
Int J Рак 2007; 120 : 2625–2634. Рак Иммунол Иммунотер 2004; 53 : 543–550.
Рак Иммунол Иммунотер 2004; 53 : 543–550. Рак Res 2006; 66 : 10145–10152.
Рак Res 2006; 66 : 10145–10152. , Лопес-Гильермо А., Фокс Б.К., Коломо Л., Мартинес А., Ронкадор Г. и др. . Большое количество инфильтрирующих опухоль FOXP3-позитивных регуляторных Т-клеток связано с улучшением общей выживаемости при фолликулярной лимфоме. Кровь 2006; 108 : 2957–2964.
, Лопес-Гильермо А., Фокс Б.К., Коломо Л., Мартинес А., Ронкадор Г. и др. . Большое количество инфильтрирующих опухоль FOXP3-позитивных регуляторных Т-клеток связано с улучшением общей выживаемости при фолликулярной лимфоме. Кровь 2006; 108 : 2957–2964. , Кочанек М., Гизе Т., Эндл Э., Вайраух М.Р., Кнолле П.А. и др. . In vivo периферическая экспансия наивных CD4+CD25high FoxP3+ регуляторных Т-клеток у пациентов с множественной миеломой. Кровь 2006; 107 : 3940–3949.
, Кочанек М., Гизе Т., Эндл Э., Вайраух М.Р., Кнолле П.А. и др. . In vivo периферическая экспансия наивных CD4+CD25high FoxP3+ регуляторных Т-клеток у пациентов с множественной миеломой. Кровь 2006; 107 : 3940–3949. Кровь 2001; 98 : 210–216.
Кровь 2001; 98 : 210–216. , Марриотт Дж. Б., Тодрик С. М., Мюллер Г. В., Чен Р., Стерлинг Д. И. и др. . Защитный противоопухолевый иммунитет, индуцируемый костимулирующим аналогом талидомида в сочетании с вакцинацией цельными опухолевыми клетками, опосредуется усилением иммунитета Th2-типа. J Иммунол 2002; 168 : 4914–4919.
, Марриотт Дж. Б., Тодрик С. М., Мюллер Г. В., Чен Р., Стерлинг Д. И. и др. . Защитный противоопухолевый иммунитет, индуцируемый костимулирующим аналогом талидомида в сочетании с вакцинацией цельными опухолевыми клетками, опосредуется усилением иммунитета Th2-типа. J Иммунол 2002; 168 : 4914–4919. , Ричи Д., Нисон П., Тай Т., Тейнтон К., Линч К. и др. . Подмножества лимфоидных клеток и профили регуляторных Т-клеток у пациентов с рецидивирующей множественной миеломой в подгруппе пациентов, включенных в исследование REVLITE [аннотация]. Ежегодное научное собрание гематологического общества Австралии и Новой Зеландии, Перт, Австралия 2008.
, Ричи Д., Нисон П., Тай Т., Тейнтон К., Линч К. и др. . Подмножества лимфоидных клеток и профили регуляторных Т-клеток у пациентов с рецидивирующей множественной миеломой в подгруппе пациентов, включенных в исследование REVLITE [аннотация]. Ежегодное научное собрание гематологического общества Австралии и Новой Зеландии, Перт, Австралия 2008. 51-е ежегодное собрание Американского общества гематологов, Новый Орлеан, Лос-Анджелес, , 2009 г.: Аннотация 1639. Иммуномодулирующие препараты (IMiDs) увеличивают выработку IL-2 стимулированными Т-клетками за счет усиления активации PKC-тета и усиления ДНК-связывающей активности AP-1, но не NF-kappaB, OCT-1 или NF-AT. J Interferon Cytokine Res 2005; 25 : 604–616.
51-е ежегодное собрание Американского общества гематологов, Новый Орлеан, Лос-Анджелес, , 2009 г.: Аннотация 1639. Иммуномодулирующие препараты (IMiDs) увеличивают выработку IL-2 стимулированными Т-клетками за счет усиления активации PKC-тета и усиления ДНК-связывающей активности AP-1, но не NF-kappaB, OCT-1 или NF-AT. J Interferon Cytokine Res 2005; 25 : 604–616. Кровь 2008; 112 : 2606а.
Кровь 2008; 112 : 2606а. Дж Иммунотер 2004; 27 : S50.
Дж Иммунотер 2004; 27 : S50. , Адамс М., Картер Т., Чен Р., Мюллер Г., Стирлинг Д. и др. . леналидомид усиливает опосредованную моноцитами антителозависимую клеточную цитотоксичность клеток-киллеров CD20+, обработанных ритуксимабом. Clin Cancer Res 2008; 14 : 4650–4657.
, Адамс М., Картер Т., Чен Р., Мюллер Г., Стирлинг Д. и др. . леналидомид усиливает опосредованную моноцитами антителозависимую клеточную цитотоксичность клеток-киллеров CD20+, обработанных ритуксимабом. Clin Cancer Res 2008; 14 : 4650–4657. Кровь 2008; 112 : 5180–5189.
Кровь 2008; 112 : 5180–5189.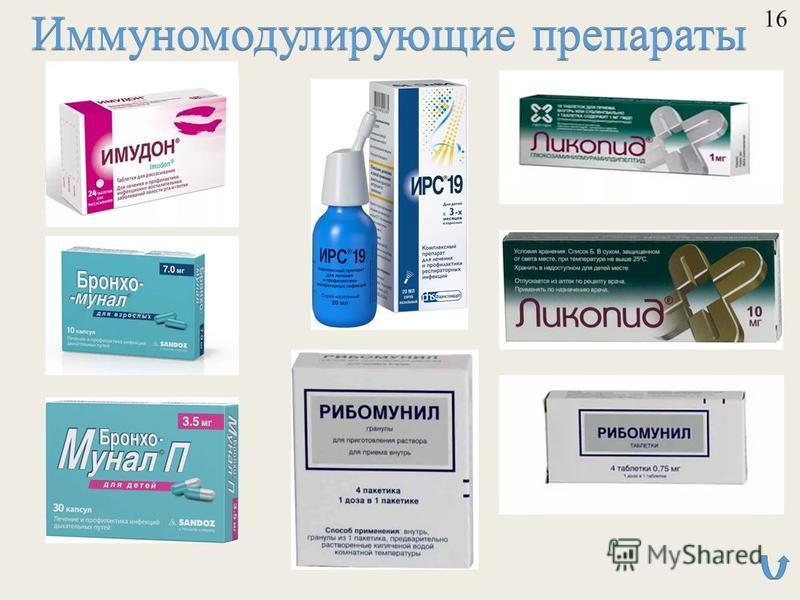
 Кровь 2000; 95 : 2630–2636.
Кровь 2000; 95 : 2630–2636. Кровь 1997; 89 : 227–234.
Кровь 1997; 89 : 227–234. Гематологический 2007; 92 : 1075–1082.
Гематологический 2007; 92 : 1075–1082.