Инвитро йод: Инвитро. Йод, узнать цены на анализы и сдать в Москве
Йод в сыворотке (Iodine, serum)
Метод определения Масс-спектрометрия c источником ионов в виде индуктивно связанной плазмы (ИСП-МС).
Исследуемый материал Сыворотка крови
Доступен выезд на дом
Йод (126,9 а.е.м.) – жизненно необходимый элемент, который входит в состав тиреоидных гормонов: тироксина (Т4 – см. тест №55) и трийодтиронина (Т3 – см. тест №53). Выраженный дефицит йода может приводить к патологии щитовидной железы (зоб, гипотиреоз, кретинизм при выраженном дефиците в период внутриутробного и неонатального развития), замедленному развитию детей, снижению фертильности (невынашивание беременности, мертворождения, врожденные аномалии).
Большая часть поступающего с пищей йода, в конечном счете, выводится почками. Исследование уровня йода в сыворотке может быть использовано в качестве показателя адекватного потребления или перегрузки организма йодом, в особенности при использовании йодсодержащих лекарственных препаратов (например, амиодарона).
Йод, моча (Iodine, Urine) — узнать цены на анализ и сдать в Москве
Метод определения Масс-спектрометрия c источником ионов в виде индуктивно связанной плазмы (ИСП-МС).
Исследуемый материал Моча (предпочтительно утренняя, средняя порция, собранная в специальный контейнер).
Доступен выезд на дом
Йод (I, атомная масса 127) − жизненно важный элемент, необходимый для синтеза тиреоидных гормонов: тироксина (Т4 – см. тест №55) и трийодтиронина (Т3 – см. тест №53). Щитовидная железа, в которой образуются эти гормоны, аккумулирует йод и является основным депо данного микроэлемента в организме. Выраженный дефицит йода в пище может приводить к выработке недостаточного количества гормонов щитовидной железы и йоддефицитным нарушениям. В их числе − зоб и гипотиреоз, замедленное развитие детей (крайнее его проявление при выраженном дефиците йода в период внутриутробного и неонатального развития – кретинизм), невынашивание беременности, мертворождения и врожденные аномалии плода, нарушение умственных способностей у взрослых. Йод поступает в организм преимущественно с пищей и водой. В высоких концентрациях он присутствует в морепродуктах, поскольку в морской воде содержится много йода. В регионах, где уровень данного элемента в почве и воде низок, вода и местные продукты сельского хозяйства также имеют пониженное содержание йода. Население таких регионов в большей степени подвержено риску развития йоддефицитных состояний. Для профилактики и лечения йоддефицитных заболеваний щитовидной железы широко применяют искусственное добавление йода в пищу (йодированная соль, йодированное масло и пр.
Выраженный дефицит йода в пище может приводить к выработке недостаточного количества гормонов щитовидной железы и йоддефицитным нарушениям. В их числе − зоб и гипотиреоз, замедленное развитие детей (крайнее его проявление при выраженном дефиците йода в период внутриутробного и неонатального развития – кретинизм), невынашивание беременности, мертворождения и врожденные аномалии плода, нарушение умственных способностей у взрослых. Йод поступает в организм преимущественно с пищей и водой. В высоких концентрациях он присутствует в морепродуктах, поскольку в морской воде содержится много йода. В регионах, где уровень данного элемента в почве и воде низок, вода и местные продукты сельского хозяйства также имеют пониженное содержание йода. Население таких регионов в большей степени подвержено риску развития йоддефицитных состояний. Для профилактики и лечения йоддефицитных заболеваний щитовидной железы широко применяют искусственное добавление йода в пищу (йодированная соль, йодированное масло и пр.
Помимо продуктов и воды, йод может поступать в организм при использовании йодсодержащих лекарственных препаратов наружного и внутреннего применения. Повышенное количество йода содержат различные пищевые добавки и витамины. Некоторые варианты «фаст фуда» могут включать количество йода, превышающее его суточную потребность. Избыток микроэлемента, как и его дефицит, может быть опасен для здоровья. При длительном поступлении йода в организм в повышенных (фармакологических) дозах, например, при неконтролируемом применении пищевых добавок с высоким содержанием йода, лекарственных йодсодержащих препаратов, увеличивается вероятность развития патологии щитовидной железы. Наиболее восприимчивы к этому лица с уже имеющимися нарушениями функции щитовидной железы, плод в период беременности, новорожденные, пожилые люди, пациенты с другими факторами риска.
Большая часть поступающего с пищей йода, в конечном счете, выводится почками, поэтому его экскреция с мочой служит хорошим маркером уровня недавнего потребления йода. Но уровень данного элемента в моче у конкретного человека может широко варьировать даже в течение одного дня. Поэтому сам по себе этот показатель не служит основой для оценки обеспеченности человека йодом, для этого нужен осмотр клинициста, оценка размеров щитовидной железы, при необходимости − использование лабораторных тестов, отражающих состояние щитовидной железы (в т. ч. ТТГ и тиреоглобулин – см. тесты №56, №197).
Но уровень данного элемента в моче у конкретного человека может широко варьировать даже в течение одного дня. Поэтому сам по себе этот показатель не служит основой для оценки обеспеченности человека йодом, для этого нужен осмотр клинициста, оценка размеров щитовидной железы, при необходимости − использование лабораторных тестов, отражающих состояние щитовидной железы (в т. ч. ТТГ и тиреоглобулин – см. тесты №56, №197).
Изучение уровня этого микроэлемента в моче обычно используют для общей эпидемиологической оценки обеспеченности йодом популяции данного региона. Групповые популяционные исследования этого показателя у населения сглаживают его вариативность. Результат исследования как утренней, так и случайной порции мочи (и для детей, и для взрослых), предоставляет адекватный материал для оценки уровня потребления йода в соответствующей популяции (при условии достаточного числа обследуемых). В связи с широким разбросом индивидуальных показателей, итоги таких эпидемиологических наблюдений рекомендуют оценивать не по среднему арифметическому результату, а по медиане.
KDL. Тяжелые металлы и микроэлементы. Анализы и цены
Алергология. ImmunoCAP. Индивидуальные аллергены, IgE
Аллергокомпоненты ImmunoCAP
Аллергокомпоненты деревьев
Аллергокомпоненты животных и птиц
Аллергокомпоненты плесени
Аллергокомпоненты трав
Пищевые аллергокомпоненты
Аллергология. ImmunoCAP. Комплексные исследования IgE (результат по каждому аллергену)
Аллергология. ImmunoCAP. Панели аллергенов IgE, скрининг (результат СУММАРНЫЙ)
Аллергология.
Аллергология. Immulite. Индивидуальные аллергены
Аллергены гельминтов, IgE
Аллергены грибов (кандида и плесневых), IgE
Аллергены деревьев, IgE
Аллергены животных и птиц, IgE
Аллергены клещей домашней пыли, IgE
Аллергены лекарств и химических веществ, IgE
Аллергены насекомых, IgE
Аллергены пыли, IgE
Аллергены ткани, IgE
Аллергены трав, IgE
Бактериальные аллегены (стафилококк), IgE
Пищевые аллергены, IgE
Пищевые аллергены, IgG
Аллергология. Immulite. Комплексы аллергенов, IgE (результат по каждому аллргену)
Аллергология. Immulite. Панели аллергенов, скрининг (результат СУММАРНЫЙ)
Аллергены деревьев, IgE (панель)
Аллергены животных и птиц, IgE (панель)
Аллергены трав, IgE (панель)
Ингаляционные аллергены, IgE (панель)
Пищевые аллергены, IgE (панель)
Аллергология. Immulite. Панели пищевых аллергенов IgG (результат СУММАРНЫЙ)
Аллергология. ImmunoCAP. Индивидуальные аллергены, IgE
ImmunoCAP. Индивидуальные аллергены, IgE
Аллергены бактерий
Аллергены гельминтов, IgE
Аллергены грибов и плесени
Аллергены деревьев, IgE
Аллергены животных и птиц, IgE
Аллергены лекарств и химических веществ, IgE
Аллергены насекомых, IgE
Аллергены пыли, IgE
Аллергены трав, IgE
Пищевые аллергены, IgE
Аллергология. ImmunoCap. Индивидуальные аллергены, IgE
Аллергология. RIDA. Комплексы аллергенов, IgE
Аллергология. RIDA. Комплексы аллергенов, IgE (результат по каждому аллргену)
Аллергология. Местные анестетики, IgE
Биохимические исследования крови
Диагностика анемий
Липидный обмен
Обмен белков
Обмен пигментов
Обмен углеводов
Специфические белки
Ферменты
Электролиты и микроэлементы
Биохимические исследования мочи
Разовая порция мочи
Суточная порция мочи
Витамины, аминокислоты, жирные кислоты
Гематология
Гемостаз (коагулограмма)
Генетические исследования
HLA-типирование
Исследование генетических полиморфизмов методом пиросеквенирования
Исследование генетических полиморфизмов методом ПЦР
Молекулярно-генетический анализ мужского бесплодия
Гистологические исследования
Гистологические исследования лаборатории UNIM
Гормоны биологических жидкостей
Гормоны гипофиза и гипофизарно-адреналовой системы
Гормоны крови
Гормоны гипофиза и гипофизарно-адреналовой системы
Маркеры остеопороза
Пренатальная диагностика
Ренин-альдостероновая система
Тесты репродукции
Функция органов пищеварения
Функция щитовидной железы
Гормоны мочи
Диагностика методом ПЦР
COVID-19
Андрофлор, иследование биоценоза (муж)
Вирус герпеса VI типа
Вирус Варицелла-Зостер (ветряной оспы)
Вирус герпеса VI типа
Вирус простого герпеса I, II типа
Вирус Эпштейна-Барр
Вирусы группы герпеса
Возбудитель туберкулеза
ВПЧ (вирус папилломы человека)
Грибы рода кандида
Листерии
Парвовирус
Респираторные инфекции
Стрептококки (вкл. S.agalactie)
S.agalactie)
Токсоплазма
Урогенитальные инфекции, ИППП
Урогенитальные инфекции, комплексные исследования
Урогенитальные инфекции, условные патогены
Фемофлор, исследование биоценоза (жен)
Флороценоз, иследование биоценоза (жен)
Цитомегаловирус
Диагностика методом ПЦР, кал
Кишечные инфекции
Диагностика методом ПЦР, клещ
Клещевые инфекции
Диагностика методом ПЦР, кровь.
Вирус Варицелла-Зостер (ветряной оспы)
Вирус герпеса VI типа
Вирус краснухи
Вирус простого герпеса I, II типа
Вирус Эпштейна-Барр
Вирусы группы герпеса
ВИЧ
Возбудитель туберкулеза
Гепатит D
Гепатит G
Гепатит А
Гепатит В
Гепатит С
Листерии
Парвовирус
Токсоплазма
Цитомегаловирус
Жидкостная цитология
Изосерология
Иммуногистохимические исследования
Иммунологические исследования
Иммунограмма (клеточный иммунитет)
Интерфероновый статус, базовое исследование
Интерфероновый статус, чувствительность к препаратам
Оценка гуморального иммунитета
Специальные иммунологические исследования
Исследование абортуса
Исследование мочевого камня
Исследование парапротеинов. Скрининг и иммунофиксация
Скрининг и иммунофиксация
Исследования мочи
Легионеллез
Исследования слюны
Исследования слюны
Комплексные исследования
Лекарственный мониторинг
Маркеры аутоиммунных заболеваний
Антифосфолипидный синдром (АФС)
Аутоиммунные заболевания легких и сердца
Аутоиммунные неврологические заболевания
Аутоиммунные поражения ЖКТ и целиакия
Аутоиммунные поражения печени
Аутоиммунные поражения почек и васкулиты
Аутоиммунные эндокринопатии и бесплодие
Диагностика артритов
Пузырные дерматозы
Системные ревматические заболевания
Эли-тесты
Микробиологические исследования (посевы)
Посев крови на стерильность
Посев на гемофильную палочку
Посев на грибы (Candida)
Посев на грибы (возбудители микозов кожи и ногтей)
Посев на дифтерию
Посев на микоплазмы и уреаплазмы
Посев на пиогенный стрептококк
Посев на стафилококк
Посевы кала
Посевы мочи
Посевы на микрофлору (конъюнктива)
Посевы на микрофлору (отделяемое)
Посевы на микрофлору (урогенитальный тракт женщины)
Посевы на микрофлору (урогенитальный тракт мужчины)
Посевы на микрофлору ЛОР-органы)
Ускоренные посевы с расширенной антибиотикограммой
Неинвазивная диагностика болезней печени
Программы неинвазивной диагностики болезней печени
Неинвазивный пренатальный ДНК-тест (НИПТ)
Неинвазивный пренатальный тест (пол/резус плода)
Общеклинические исследования
Исследование назального секрета
Исследование секрета простаты
Исследования кала
Исследования мочи
Исследования эякулята
Микроскопическое исследование биологических жидкостей
Микроскопия на наличие патогенных грибов и паразитов
Микроскопия отделяемого урогенитального тракта
Онкогематология
Иммунофенотипирование при лимфопролиферативных заболеваниях
Миелограмма
Молекулярная диагностика миелопролиферативных заболеваний
Цитохимические исследования клеток крови и костного мозга
Онкогенетика
Онкомаркеры
Пищевая непереносимость, IgG4
Полногеномные исследования и панели наследственных заболеваний
Пренатальный скрининг
Серологические маркеры инфекций
Аденовирус
Бруцеллез
Вирус HTLV
Вирус Варицелла-Зостер (ветряной оспы)
Вирус герпеса VI типа
Вирус Коксаки
Вирус кори
Вирус краснухи
Вирус эпидемического паротита
Вирус Эпштейна-Барр
Вирусы простого герпеса I и II типа
ВИЧ
Гепатит D
Гепатит А
Гепатит В
Гепатит Е
Гепатит С
Грибковые инфекции
Дифтерия
Кишечные инфекции
Клещевые инфекции
Коклюш и паракоклюш
Коронавирус
Менингококк
Паразитарные инвазии
Парвовирус
Респираторные инфекции
Сифилис
Столбняк
Токсоплазма
Туберкулез
Урогенитальные инфекции
Хеликобактер
Цитомегаловирус
Специализированные лабораторные исследования.
Дыхательный тест
Микробиоценоз по Осипову
Тяжелые металлы и микроэлементы
Тяжелые металлы и микроэлементы в волосах
Тяжелые металлы и микроэлементы в крови
Тяжелые металлы и микроэлементы в моче
Услуги
COVID-19
Выезд на дом
ЭКГ
Установление родства
Химико-токсикологические исследования
Хромосомный микроматричный анализ
Цитогенетические исследования
Цитологические исследования
Чекап
Эффективность повидон-йодного назального антисептика in vitro для быстрой инактивации SARS-CoV-2 | Глобальное здоровье | JAMA Отоларингология – Хирургия головы и шеи
Ключевые моментыВопрос Какое минимальное время контакта повидон-йодного (PVP-I) назального антисептика необходимо для инактивации коронавируса тяжелого острого респираторного синдрома 2 (SARS-CoV-2) in vitro?
Выводы В этом контролируемом лабораторном исследовании in vitro тестовые среды, инфицированные SARS-CoV-2, продемонстрировали полную инактивацию SARS-CoV-2 при таких низких концентрациях назального антисептика PVP-I, как 0. 5% после 15 секунд контакта, что измеряется логарифмическим значением снижения более чем на 3 log 10 50% инфекционной дозы вируса в клеточной культуре.
5% после 15 секунд контакта, что измеряется логарифмическим значением снижения более чем на 3 log 10 50% инфекционной дозы вируса в клеточной культуре.
Значение Интраназальный PVP-I быстро инактивирует SARS-CoV-2 и может играть дополнительную роль в снижении передачи вируса помимо средств индивидуальной защиты.
Важность Необходимы исследования, чтобы продемонстрировать эффективность назального повидон-йода (PVP-I) против тяжелого острого респираторного синдрома коронавируса 2 (SARS-CoV-2).
Цель Оценить in vitro эффективность назального антисептика PVP-I для инактивации SARS-CoV-2 при клинически значимом времени контакта 15 и 30 секунд.
Вмешательства Штамм вируса SARS-CoV-2, USA-WA1/2020, штамм вируса был протестирован против назальных антисептических растворов, состоящих из водного PVP-I в качестве единственного активного ингредиента. Повидон-йод тестировали в разведенных концентрациях 0,5%, 1,25% и 2,5% и сравнивали с контролями.Тестовые растворы и вирус инкубировали при средней (SD) комнатной температуре 22 (2) °C в течение периодов времени 15 и 30 секунд.
Повидон-йод тестировали в разведенных концентрациях 0,5%, 1,25% и 2,5% и сравнивали с контролями.Тестовые растворы и вирус инкубировали при средней (SD) комнатной температуре 22 (2) °C в течение периодов времени 15 и 30 секунд.
Дизайн и установка В этом контролируемом лабораторном исследовании in vitro использовались 3 различные концентрации исследуемого раствора и 70% этанола в качестве положительного контроля на тестовых средах, инфицированных SARS-CoV-2. В 2 пробирки с соединениями добавляли тестовую среду без вируса для контроля токсичности и нейтрализации. Этанол, 70%, тестировали параллельно в качестве положительного контроля и только воду в качестве отрицательного контроля.
Основные результаты и показатели Первичным измерением результатов исследования был логарифмический показатель снижения после 15 секунд и 30 секунд данного лечения. Выживший вирус из каждого образца количественно определяли с помощью стандартного анализа разведения по конечной точке, и логарифмическое значение снижения каждого соединения сравнивали с отрицательным контролем (вода).
Результаты Повидон-йодные назальные антисептики в концентрациях (0,5%, 1,25% и 2,5%) полностью инактивировали SARS-CoV-2 в течение 15 секунд после контакта, что измеряется по логарифмическому значению снижения более 3 log 10 50% клеточной культуры заразная доза вируса.Этанол, 70%, положительный контроль не полностью инактивировал SARS-CoV-2 после 15 секунд контакта. Испытанные назальные антисептики показали лучшие результаты, чем стандартный положительный контроль, обычно используемый для оценки in vitro агентов против SARS-CoV-2, при времени контакта 15 секунд. После контакта с каждым из испытанных назальных антисептиков не наблюдалось цитотоксического действия на клетки.
Выводы и актуальность Назальные антисептические растворы повидон-йода в концентрациях до 0.5% быстро инактивируют SARS-CoV-2 за время контакта всего 15 секунд. Интраназальное использование PVP-I продемонстрировало безопасность при концентрациях 1,25% и ниже и может играть дополнительную роль в смягчении передачи вируса помимо средств индивидуальной защиты.
Коронавирус тяжелого острого респираторного синдрома 2 (SARS-CoV-2), вирус, вызывающий коронавирусную болезнь 2019 (COVID-19), является новым коронавирусом из того же семейства, что и коронавирус тяжелого острого респираторного синдрома (SARS-CoV) и Ближнего Востока. респираторный синдром.Высокие вирусные нагрузки SARS-CoV-2 были обнаружены в носоглотке и ротоглотке у симптомных пациентов и бессимптомных носителей. 1 Носовые бокаловидные и реснитчатые клетки имеют самую высокую экспрессию ангиотензинпревращающего фермента 2 (ACE2), который является основным рецептором SARS-CoV-2. 2 Многие отоларингологические процедуры могут образовывать аэрозоли, которые могут сохраняться в воздухе до 3 часов без быстрой фильтрации. 3 -5 Недавно Hou et al. 6 показали, что реснитчатые клетки с экспрессией ACE2 были клетками, наиболее восприимчивыми к инфекции, а не подслизистыми железистыми клетками. Инфекционность этих клеток была намного выше, чем у клеток нижних дыхательных путей. Это исследование выявило путь передачи вируса, который включает заражение реснитчатых клеток верхних дыхательных путей в носу в качестве доминирующего места инфекции с последующей аспирацией и посевом в легкие. Назо-ротофарингеальная ось включает выделения из носа, сметаемые в ротоглотку за счет мукоцилиарного клиренса с последующей аспирацией инфицированной жидкости в нижние дыхательные пути. Предполагается, что этот маршрут верхних и нижних дыхательных путей может объяснить наблюдаемые различия между обнаружением, сохранением вирусной нагрузки и динамикой передачи, наблюдаемые между предыдущими вспышками SARS-CoV и текущей пандемией COVID-19.Считается, что этот процесс также может играть роль в вариабельном выражении клинической тяжести. 7 Следует отметить, что в недавней работе 8 о динамике передачи гриппа А также приводится пример этой носо-орофарингеальной оси с последующим обсеменением легких, что приводит к респираторному заболеванию.
Инфекционность этих клеток была намного выше, чем у клеток нижних дыхательных путей. Это исследование выявило путь передачи вируса, который включает заражение реснитчатых клеток верхних дыхательных путей в носу в качестве доминирующего места инфекции с последующей аспирацией и посевом в легкие. Назо-ротофарингеальная ось включает выделения из носа, сметаемые в ротоглотку за счет мукоцилиарного клиренса с последующей аспирацией инфицированной жидкости в нижние дыхательные пути. Предполагается, что этот маршрут верхних и нижних дыхательных путей может объяснить наблюдаемые различия между обнаружением, сохранением вирусной нагрузки и динамикой передачи, наблюдаемые между предыдущими вспышками SARS-CoV и текущей пандемией COVID-19.Считается, что этот процесс также может играть роль в вариабельном выражении клинической тяжести. 7 Следует отметить, что в недавней работе 8 о динамике передачи гриппа А также приводится пример этой носо-орофарингеальной оси с последующим обсеменением легких, что приводит к респираторному заболеванию.
Снижение передачи в отоларингологическом сообществе в основном сосредоточено на использовании физических барьеров и средств индивидуальной защиты. Маски стали стандартной формой средств индивидуальной защиты, которые почти повсеместно используются в медицинских учреждениях для защиты пациентов, персонала и медицинских работников.Деконтаминанты для носа рекомендуются для стерилизации носовой полости у пациентов и медицинских работников для уменьшения передачи инфекции. Появилось несколько протоколов, рекомендующих интраназальное использование повидон-йода (PVP-I) у пациентов и медицинских работников. 9 -12 Повидон-йод был выбран благодаря доказанной in vitro эффективности против SARS-CoV и ближневосточного респираторного синдрома при концентрациях всего 0,23%. 13 ,14 Эффективность перорального антисептического раствора PVP-I была недавно продемонстрирована in vitro специально против SARS-CoV-2 при таких низких концентрациях, как 0. 5% для времени контакта менее 15 секунд. 15 Мы стремимся исследовать in vitro эффективность интраназального препарата PVP-I против SARS-CoV-2 при различных концентрациях и времени контакта, чтобы информировать сообщество отоларингологов о его использовании в клиниках и операционных для смягчения передачи вируса. .
5% для времени контакта менее 15 секунд. 15 Мы стремимся исследовать in vitro эффективность интраназального препарата PVP-I против SARS-CoV-2 при различных концентрациях и времени контакта, чтобы информировать сообщество отоларингологов о его использовании в клиниках и операционных для смягчения передачи вируса. .
Все лабораторные работы с SARS-CoV-2 проводились в лабораториях уровня биобезопасности 3 в Институте противовирусных исследований Университета штата Юта в соответствии с установленными стандартными операционными процедурами, одобренными Комитетом по биологическим опасностям Университета штата Юта.Институциональный наблюдательный совет Университета штата Юта одобрил это исследование. Штамм SARS-CoV-2, USA-WA1/2020, запас вируса перед тестированием готовили путем выращивания в клетках Vero 76. Культуральные среды для подготовленного запаса (тестовые среды) представляли собой минимальную основную среду с 2% фетальной бычьей сывороткой и 50 мкг/мл гентамицина. Антисептический раствор для полоскания носа состоял из различных концентраций водного PVP-I в качестве единственного активного ингредиента (Veloce BioPharma). Концентрации PVP-I в каждом растворе при поставке и после разбавления 1:1 приведены в таблице 1.Тестируемые соединения смешивали непосредственно с раствором вируса, так что конечная концентрация составляла 50% каждого отдельного тестируемого соединения и 50% раствора вируса. Одну концентрацию тестировали в трех повторностях. В 2 пробирки с соединениями добавляли тестовую среду без вируса для контроля токсичности и нейтрализации. Этанол 70% тестировали параллельно в качестве положительного контроля и только воду в качестве отрицательного контроля. Тестовые растворы и вирус инкубировали при средней (SD) комнатной температуре 22 (2) °С в течение 15 и 30 секунд.Затем раствор нейтрализовали разведением 1/10 в минимальной основной среде, 2% эмбриональной бычьей сыворотке, 50 мкг/мл гентамицина. Выживший вирус из каждого образца количественно определяли с помощью стандартного анализа конечной точки разведения.
Антисептический раствор для полоскания носа состоял из различных концентраций водного PVP-I в качестве единственного активного ингредиента (Veloce BioPharma). Концентрации PVP-I в каждом растворе при поставке и после разбавления 1:1 приведены в таблице 1.Тестируемые соединения смешивали непосредственно с раствором вируса, так что конечная концентрация составляла 50% каждого отдельного тестируемого соединения и 50% раствора вируса. Одну концентрацию тестировали в трех повторностях. В 2 пробирки с соединениями добавляли тестовую среду без вируса для контроля токсичности и нейтрализации. Этанол 70% тестировали параллельно в качестве положительного контроля и только воду в качестве отрицательного контроля. Тестовые растворы и вирус инкубировали при средней (SD) комнатной температуре 22 (2) °С в течение 15 и 30 секунд.Затем раствор нейтрализовали разведением 1/10 в минимальной основной среде, 2% эмбриональной бычьей сыворотке, 50 мкг/мл гентамицина. Выживший вирус из каждого образца количественно определяли с помощью стандартного анализа конечной точки разведения. Нейтрализованные образцы объединяли и серийно разбавляли, используя 8 логарифмических разведений в тестовой среде. Затем по 100 мкл каждого разведения помещали в лунки 96-луночного планшета, содержащие от 80% до 90% конфлюэнтных клеток Vero 76, в четырех повторах. Контроль токсического эффекта добавляли в дополнительные 4 лунки клеток Vero 76, и 2 из этих лунок при каждом разведении были инфицированы вирусом, чтобы служить в качестве контроля нейтрализации, гарантируя, что остаточный образец в планшете для анализа титра не ингибирует рост и обнаружение вируса. выживший вирус.Планшеты инкубировали при средней (SD) температуре 37 (2) °C с 5% углекислым газом в течение 5 дней. Затем каждую лунку оценивали на наличие или отсутствие инфекционного вируса. Титры измеряли с использованием стандартного анализа конечной точки разведения 50% инфекционной дозы клеточной культуры (CCID 50 ), рассчитанного с использованием уравнения Рида-Мюнха, и логарифмического значения снижения (LRV) каждого соединения по сравнению с отрицательным (водным) контролем.
Нейтрализованные образцы объединяли и серийно разбавляли, используя 8 логарифмических разведений в тестовой среде. Затем по 100 мкл каждого разведения помещали в лунки 96-луночного планшета, содержащие от 80% до 90% конфлюэнтных клеток Vero 76, в четырех повторах. Контроль токсического эффекта добавляли в дополнительные 4 лунки клеток Vero 76, и 2 из этих лунок при каждом разведении были инфицированы вирусом, чтобы служить в качестве контроля нейтрализации, гарантируя, что остаточный образец в планшете для анализа титра не ингибирует рост и обнаружение вируса. выживший вирус.Планшеты инкубировали при средней (SD) температуре 37 (2) °C с 5% углекислым газом в течение 5 дней. Затем каждую лунку оценивали на наличие или отсутствие инфекционного вируса. Титры измеряли с использованием стандартного анализа конечной точки разведения 50% инфекционной дозы клеточной культуры (CCID 50 ), рассчитанного с использованием уравнения Рида-Мюнха, и логарифмического значения снижения (LRV) каждого соединения по сравнению с отрицательным (водным) контролем. был рассчитан. 16
был рассчитан. 16
Титры вируса и LRV SARS-CoV-2 при инкубации с различными концентрациями соединений производителя в течение 15 секунд суммированы в таблице 1.После 15-секундного контакта все испытанные антисептики для полоскания носа PVP-I были эффективны в снижении более чем 3 log 10 CCID 50 инфекционного вируса с 3,67 log 10 CCID 50 /0,1 мл до 0,67 log 10 CCID 50 /0,1 мл или меньше. В таблице 2 суммированы титры вируса и LRV SARS-CoV-2, когда вирус инкубировали в течение 30 секунд с каждым из тестируемых соединений в соотношении 50/50. В течение 30-секундного времени контакта все протестированные антисептики для полоскания носа PVP-I были эффективны в снижении более чем на 3.33 log 10 CCID 50 инфекционный вирус, от 4,0 log 10 CCID 50 /0,1 мл до 0,67 log 10 CCID 50 /0,1 мл или меньше. Никаких цитотоксических эффектов не наблюдалось ни для одного из тестируемых соединений. Положительный контроль был эффективен при уменьшении инфекционного вируса более чем на 3 log 10 CCID 50 за 30 секунд, что сопоставимо с антисептиками для полоскания носа PVP-I. Однако при 15-секундном контакте положительный контроль был эффективен при снижении только 2.17 log 10 CCID 50 инфекционный вирус, который менее эффективен, чем антисептик для полоскания носа PVP-I. Отрицательный контроль только с водой не был эффективен для снижения вирусной нагрузки.
Никаких цитотоксических эффектов не наблюдалось ни для одного из тестируемых соединений. Положительный контроль был эффективен при уменьшении инфекционного вируса более чем на 3 log 10 CCID 50 за 30 секунд, что сопоставимо с антисептиками для полоскания носа PVP-I. Однако при 15-секундном контакте положительный контроль был эффективен при снижении только 2.17 log 10 CCID 50 инфекционный вирус, который менее эффективен, чем антисептик для полоскания носа PVP-I. Отрицательный контроль только с водой не был эффективен для снижения вирусной нагрузки.
Это исследование демонстрирует быструю инактивацию SARS-CoV-2 с помощью PVP-I при концентрациях всего 0,5% всего за 15 секунд контакта. Эти результаты согласуются с результатами предыдущего исследования, изучавшего эффективность перорального раствора в том же классе антисептиков PVP-I против SARS-CoV-2. 15 Известно, что растворы PVP-I оказывают зависящее от концентрации влияние на частоту биения ресничек (CBF) при изучении модельных систем in vitro. 17 В экспериментальных моделях растворы ПВП-I до 1,25% не проявляли ингибирующего действия на CBF. Это говорит о том, что растворы ПВП-I до 1,25% хорошо переносятся носовым эпителием при кратковременном применении. 17 ,18 Клинические исследования показали, что более низкие концентрации можно вводить сразу и в течение нескольких месяцев без побочных эффектов. 19 Повторное применение разбавленного 0,08% PVP-I через день у пациентов с хроническим риносинуситом в течение до 7 недель не приводило к каким-либо неблагоприятным воздействиям на мукоцилиарный клиренс или обоняние. 20 ,21 При интраназальном введении у людей происходит эффективное разведение применяемой лекарственной формы, поскольку она сразу соединяется с имеющимися выделениями из носа. 22 Помимо 95% водного компонента назального секрета, интраназально применяемый PVP-I также сталкивается с продуктами муцина, высвобождаемыми из бокаловидных клеток и подслизистых желез, включая гликопротеины, протеогликаны и липиды.
17 В экспериментальных моделях растворы ПВП-I до 1,25% не проявляли ингибирующего действия на CBF. Это говорит о том, что растворы ПВП-I до 1,25% хорошо переносятся носовым эпителием при кратковременном применении. 17 ,18 Клинические исследования показали, что более низкие концентрации можно вводить сразу и в течение нескольких месяцев без побочных эффектов. 19 Повторное применение разбавленного 0,08% PVP-I через день у пациентов с хроническим риносинуситом в течение до 7 недель не приводило к каким-либо неблагоприятным воздействиям на мукоцилиарный клиренс или обоняние. 20 ,21 При интраназальном введении у людей происходит эффективное разведение применяемой лекарственной формы, поскольку она сразу соединяется с имеющимися выделениями из носа. 22 Помимо 95% водного компонента назального секрета, интраназально применяемый PVP-I также сталкивается с продуктами муцина, высвобождаемыми из бокаловидных клеток и подслизистых желез, включая гликопротеины, протеогликаны и липиды. Существуют также физиологические буферы, внеклеточные остатки дегенерирующих клеток и фрагменты внеклеточных нуклеиновых кислот. Весь этот биологический мусор может действовать как поглотитель йода и может снижать эффективную концентрацию PVP-I, доставляемого в очаг инфекции. 23 ,24 По этим причинам важно выбирать концентрации PVP-I ниже порога ухудшения CBF in vitro, но выше минимального эффективного биоцидного уровня для учета потребления йода и физиологической буферизации.Мы внедрили использование интраназального PVP-I в нашей практике и обновили все наши протоколы, включив в них использование 1,25% водных составов PVP-I, доставляемых в каждую полость носа у пациентов перед любой интраназальной процедурой.
Существуют также физиологические буферы, внеклеточные остатки дегенерирующих клеток и фрагменты внеклеточных нуклеиновых кислот. Весь этот биологический мусор может действовать как поглотитель йода и может снижать эффективную концентрацию PVP-I, доставляемого в очаг инфекции. 23 ,24 По этим причинам важно выбирать концентрации PVP-I ниже порога ухудшения CBF in vitro, но выше минимального эффективного биоцидного уровня для учета потребления йода и физиологической буферизации.Мы внедрили использование интраназального PVP-I в нашей практике и обновили все наши протоколы, включив в них использование 1,25% водных составов PVP-I, доставляемых в каждую полость носа у пациентов перед любой интраназальной процедурой.
Это исследование показывает, что времени контакта 15 секунд достаточно для инактивации вируса. Широкое использование назального антисептика PVP-I у пациентов перед интраназальными процедурами может значительно снизить риск передачи вируса воздушно-капельным и аэрозольным путем.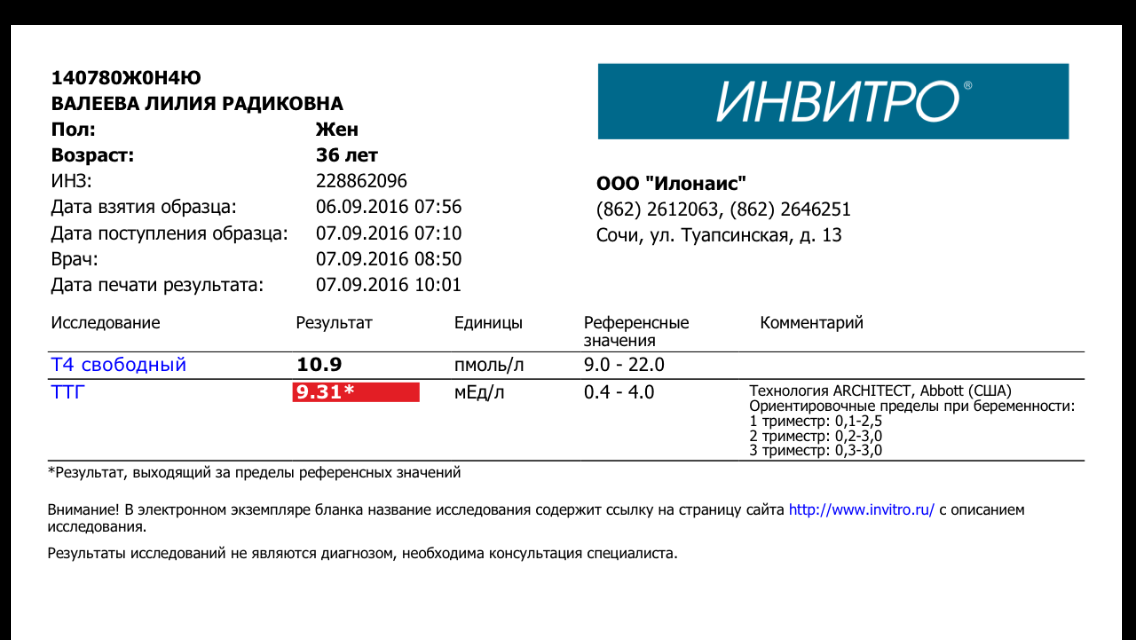 Медицинские работники могут также рассмотреть возможность инструктирования пациентов о проведении деконтаминации носа с помощью PVP-I до поступления на процедуру, что может еще больше снизить интраназальную вирусную нагрузку и предотвратить распространение вируса в залах ожидания и других местах общего пользования.
Медицинские работники могут также рассмотреть возможность инструктирования пациентов о проведении деконтаминации носа с помощью PVP-I до поступления на процедуру, что может еще больше снизить интраназальную вирусную нагрузку и предотвратить распространение вируса в залах ожидания и других местах общего пользования.
Назальные промывания PVP-I следует дополнительно рассматривать для использования медицинскими работниками в профилактических целях. Слизистая оболочка полости рта, обеззараженная PVP-I, остается стерилизованной до 4 часов. 25 Хотя это еще не было доказано на слизистой оболочке носа, медицинские работники должны рассмотреть возможность использования каждые 4 часа или каждый раз, когда надевают или снимают маску в условиях высокого риска, до 4 раз в день.При концентрации 1,25% абсорбция йода незначительна. Эти простые, небуферизованные, слегка кислые комплексные растворы ПВП-I еще больше ограничат любую абсорбцию молекулярного йода через слизистую оболочку, обеспечивая лишь минимальный теоретический риск абсорбции йода. Даже если некоторое количество некомплексированного йода абсорбируется через слизистую оболочку, оно все равно будет на несколько порядков меньше среднего общего суточного потребления йода для здорового взрослого человека, составляющего 150 мкг. 19 Использование 0,08% назального PVP-I через день в течение 7 недель не приводит к клиническому заболеванию щитовидной железы. 20 ,21 Тем не менее, при регулярном назначении PVP-I пациентам в течение более 3 месяцев следует рассмотреть вопрос о проверке функции щитовидной железы. Использование интраназального PVP-I противопоказано пациентам с аллергией на йод, беременным, пациентам с активным заболеванием щитовидной железы и пациентам, проходящим терапию радиоактивным йодом. 26 -28
Даже если некоторое количество некомплексированного йода абсорбируется через слизистую оболочку, оно все равно будет на несколько порядков меньше среднего общего суточного потребления йода для здорового взрослого человека, составляющего 150 мкг. 19 Использование 0,08% назального PVP-I через день в течение 7 недель не приводит к клиническому заболеванию щитовидной железы. 20 ,21 Тем не менее, при регулярном назначении PVP-I пациентам в течение более 3 месяцев следует рассмотреть вопрос о проверке функции щитовидной железы. Использование интраназального PVP-I противопоказано пациентам с аллергией на йод, беременным, пациентам с активным заболеванием щитовидной железы и пациентам, проходящим терапию радиоактивным йодом. 26 -28
Рандомизированные клинические испытания еще не проводились, чтобы доказать, что передача вируса снижается при интраназальном применении PVP-I, хотя эти исследования уже проводятся. Точно так же безопасность интраназального применения PVP-I в отношении тиреотропного гормона, обоняния и мукоцилиарного клиренса была конкретно продемонстрирована только при концентрациях до 0,08% в течение периода времени до 7 недель. Безопасность была сделана на основе исследований in vitro, но в настоящее время проводятся исследования переносимости in vivo, доказывающие безопасность PVP-I до 1,25% при длительном применении. Медицинские работники должны либо использовать коммерчески доступные растворы PVP-I в соответствующем диапазоне концентраций, либо использовать свежеприготовленные разбавленные растворы.Рекомендуется соблюдать осторожность при разбавлении коммерческих препаратов, так как многие из них содержат детергенты, буферы, противоионы, подщелачивающие агенты, поверхностно-активные вещества и другие химические вспомогательные вещества, которые, возможно, не были изучены или одобрены для интраназального применения. Большинство распространенных составов антисептических продуктов, предназначенных для кератинизированных поверхностей кожи, включая многие предоперационные скрабы и наборы для подготовки PVP-I, могут содержать вспомогательные вещества и добавки, которые могут быть токсичными при интраназальном введении.
Точно так же безопасность интраназального применения PVP-I в отношении тиреотропного гормона, обоняния и мукоцилиарного клиренса была конкретно продемонстрирована только при концентрациях до 0,08% в течение периода времени до 7 недель. Безопасность была сделана на основе исследований in vitro, но в настоящее время проводятся исследования переносимости in vivo, доказывающие безопасность PVP-I до 1,25% при длительном применении. Медицинские работники должны либо использовать коммерчески доступные растворы PVP-I в соответствующем диапазоне концентраций, либо использовать свежеприготовленные разбавленные растворы.Рекомендуется соблюдать осторожность при разбавлении коммерческих препаратов, так как многие из них содержат детергенты, буферы, противоионы, подщелачивающие агенты, поверхностно-активные вещества и другие химические вспомогательные вещества, которые, возможно, не были изучены или одобрены для интраназального применения. Большинство распространенных составов антисептических продуктов, предназначенных для кератинизированных поверхностей кожи, включая многие предоперационные скрабы и наборы для подготовки PVP-I, могут содержать вспомогательные вещества и добавки, которые могут быть токсичными при интраназальном введении. 29 ,30 Свежеразведенные растворы следует готовить каждый день, хранить в холодильнике в течение дня и немедленно выбрасывать в конце каждого дня.Коммерческие растворы PVP-I с концентрацией воды от 5% до 10% могут стать химически нестабильными, если их просто разбавить до более низких концентраций дополнительным количеством воды, физиологического раствора или других обычных клинических растворителей. Водные и спиртовые растворы ПВП-I нестабильны при низких концентрациях. Они легко вступают в непредсказуемые реакции диспропорционирования в составляющие равновесные соединения с чувствительной зависимостью от pH, температуры, воздействия света, содержания противоионов, упаковочного материала, атмосферного давления, содержания сополимера и множества других факторов, которые могут быть трудными для индивидуального здравоохранения. профессиональный контроль.Чтобы убедиться, что разбавленный раствор, приготовленный из высококонцентрированного (т.е. 5%-10%) продукта ПВП-I, безопасен для введения в полость носа, должен быть проведен анализ химических ингредиентов каждого свежеприготовленного раствора.
29 ,30 Свежеразведенные растворы следует готовить каждый день, хранить в холодильнике в течение дня и немедленно выбрасывать в конце каждого дня.Коммерческие растворы PVP-I с концентрацией воды от 5% до 10% могут стать химически нестабильными, если их просто разбавить до более низких концентраций дополнительным количеством воды, физиологического раствора или других обычных клинических растворителей. Водные и спиртовые растворы ПВП-I нестабильны при низких концентрациях. Они легко вступают в непредсказуемые реакции диспропорционирования в составляющие равновесные соединения с чувствительной зависимостью от pH, температуры, воздействия света, содержания противоионов, упаковочного материала, атмосферного давления, содержания сополимера и множества других факторов, которые могут быть трудными для индивидуального здравоохранения. профессиональный контроль.Чтобы убедиться, что разбавленный раствор, приготовленный из высококонцентрированного (т.е. 5%-10%) продукта ПВП-I, безопасен для введения в полость носа, должен быть проведен анализ химических ингредиентов каждого свежеприготовленного раствора. в соответствии с методом Фармакопеи США для анализа PVP-I, 31 , или только коммерческие препараты PVP-I в соответствующей дозе (если доступны).
в соответствии с методом Фармакопеи США для анализа PVP-I, 31 , или только коммерческие препараты PVP-I в соответствующей дозе (если доступны).
Hou et al. 6 недавно продемонстрировали, что SARS-CoV-2 первоначально инфицирует цилиарные клетки слизистой оболочки носа и что это может представлять собой доминирующее исходное место для инфекции.Затем вирус распространяется через назально-орофарингеальную ось в легкие посредством микроаспирации, что приводит к повреждающим респираторным инфекциям, наблюдаемым при COVID-19. Различная степень тяжести, наблюдаемая во время пандемии COVID-19, может быть связана с различной передачей SARS-CoV-2 из полости носа в легкие у пациентов с положительным результатом теста на вирус. Таким образом, трансназальная инактивация вируса может не только предотвратить распространение SARS-CoV-2 от человека к человеку, но и уменьшить тяжесть заболевания у пациентов за счет ограничения распространения и снижения вирусной нагрузки, поступающей в легкие. Промывание носа повидон-йодом может быть полезным для населения в целом в качестве дополнения к маске в качестве средства смягчения последствий вируса.
Промывание носа повидон-йодом может быть полезным для населения в целом в качестве дополнения к маске в качестве средства смягчения последствий вируса.
Принято к публикации: 29 июля 2020 г.
Автор, ответственный за переписку: Саманта Франк, доктор медицинских наук, отделение отоларингологии – хирургии головы и шеи, хирургическое отделение Медицинской школы Университета Коннектикута, 263 Farmington Ave, Farmington, CT 06030 ([email protected]).
Опубликовано в Интернете: 17 сентября 2020 г.doi:10.1001/jamaoto.2020.3053
Вклад авторов: Доктора Франк, Каприотти и Тессема имели полный доступ ко всем данным исследования и несут ответственность за целостность данных и точность анализа данных.
Концепция и дизайн: Все авторы.
Сбор, анализ или интерпретация данных: Frank, Capriotti, Westover, Tessema.
Составление рукописи: Франк, Каприотти, Пеллетье, Тессема.
Критическая проверка рукописи на предмет важного интеллектуального содержания: Фрэнк, Браун, Каприотти, Вестовер, Тессема.
Статистический анализ: Каприотти, Вестовер.
Получено финансирование: Capriotti.
Административная, техническая или материальная поддержка: Brown, Capriotti, Westover, Tessema.
Надзор: Браун, Каприотти, Вестовер, Пеллетье, Тессема.
Раскрытие информации о конфликте интересов: Д-р Браун сообщил о личных финансовых вложениях в Halodine, помимо представленной работы.Доктор Каприотти является исполнительным директором Veloce BioPharma и сообщил о патенте на несколько родственных препаратов, выпущенных и лицензированных Veloce BioPharma. Д-р Пеллетье является консультантом Veloce BioPharma и сообщил о долевом участии как в Veloce BioPharma, так и в Halodine. Д-р Тессема сообщил о личных финансовых вложениях в Halodine помимо представленной работы, и у него есть патент на несколько лекарственных препаратов. Других раскрытий не поступало.
Других раскрытий не поступало.
Финансирование/поддержка: Финансирование лабораторных материалов, использованных в этом исследовании, было предоставлено Veloce BioPharma.
Роль спонсора/спонсора: Veloce BioPharma не участвовала в разработке и проведении исследования; сбор, управление, анализ и интерпретация данных; подготовка, рецензирование или утверждение рукописи; и решение представить рукопись для публикации. Тем не менее, перечисленные отдельные авторы, имеющие отношение к Veloce BioPharma, действительно помогали с дизайном исследования и рецензированием рукописи.
2.Сунгнак В, Хуан Н, Бекавин С, и другие; Биологическая сеть легких HCA.Факторы проникновения SARS-CoV-2 в высокой степени экспрессируются в эпителиальных клетках носа вместе с генами врожденного иммунитета. Nat Med . 2020;26(5):681-687. doi: 10.1038/s41591-020-0868-6PubMedGoogle ScholarCrossref 4. Балакришнан
К, Шехтман
С, Огикян
Н.Д., Тео
АЙБ, МакГрат
Б, Бреннер
МДж. Пандемия COVID-19: что должен знать каждый отоларинголог-хирург головы и шеи для безопасного управления дыхательными путями. Отоларингол для хирургии головы и шеи .2020;162(6):804-808. doi:10.1177/0194599820919751PubMedGoogle ScholarCrossref 5.Workman
AD, Веллинг
ДБ, Картер
БС,
и другие. Эндоназальные инструменты и риск аэрозолизации в эпоху COVID-19: моделирование, обзор литературы и предлагаемые стратегии смягчения последствий. Int Forum Allergy Rhinol . 2020;10(7):798-805. doi:10.1002/alr.22577PubMedGoogle ScholarCrossref 9.Tessema
Б, Фрэнк
С, Бидра
А. Инактивация вируса SARS-CoV-2 с использованием низких доз повидон-йода для полоскания рта — немедленное применение в ортопедической практике. J Протез .
Балакришнан
К, Шехтман
С, Огикян
Н.Д., Тео
АЙБ, МакГрат
Б, Бреннер
МДж. Пандемия COVID-19: что должен знать каждый отоларинголог-хирург головы и шеи для безопасного управления дыхательными путями. Отоларингол для хирургии головы и шеи .2020;162(6):804-808. doi:10.1177/0194599820919751PubMedGoogle ScholarCrossref 5.Workman
AD, Веллинг
ДБ, Картер
БС,
и другие. Эндоназальные инструменты и риск аэрозолизации в эпоху COVID-19: моделирование, обзор литературы и предлагаемые стратегии смягчения последствий. Int Forum Allergy Rhinol . 2020;10(7):798-805. doi:10.1002/alr.22577PubMedGoogle ScholarCrossref 9.Tessema
Б, Фрэнк
С, Бидра
А. Инактивация вируса SARS-CoV-2 с использованием низких доз повидон-йода для полоскания рта — немедленное применение в ортопедической практике. J Протез . 2020. doi:10.1111/jopr.13207PubMedGoogle Scholar10.Mady
LJ, Кубик
МВ, Баддур
К, Снайдерман
CH, Роуэн
НР. Рассмотрение повидон-йода в качестве вмешательства общественного здравоохранения в связи с COVID-19: использование в качестве «средства индивидуальной защиты» для передовых поставщиков медицинских услуг, подвергающихся высокому риску лечения онкологических заболеваний головы и шеи и основания черепа. Онкол для полости рта . 2020;105:104724. doi:10.1016/j.oraloncology.2020.104724PubMedGoogle Scholar11.Пархар
ХС, Таше
К, Броуди
РМ,
и другие. Препараты для местного применения для уменьшения аэрозолизации SARS-CoV-2 при хирургии слизистых оболочек головы и шеи. Шея головы . 2020;42(6):1268-1272. doi:10.1002/hed.26200PubMedGoogle ScholarCrossref 13.Eggers
М, Кобургер-Янссен
Т, Эйкман
М, Цорн
Дж. In vitro бактерицидная и вирулицидная эффективность повидон-йодной жидкости для полоскания/полоскания рта против патогенов дыхательных путей и ротовой полости.
2020. doi:10.1111/jopr.13207PubMedGoogle Scholar10.Mady
LJ, Кубик
МВ, Баддур
К, Снайдерман
CH, Роуэн
НР. Рассмотрение повидон-йода в качестве вмешательства общественного здравоохранения в связи с COVID-19: использование в качестве «средства индивидуальной защиты» для передовых поставщиков медицинских услуг, подвергающихся высокому риску лечения онкологических заболеваний головы и шеи и основания черепа. Онкол для полости рта . 2020;105:104724. doi:10.1016/j.oraloncology.2020.104724PubMedGoogle Scholar11.Пархар
ХС, Таше
К, Броуди
РМ,
и другие. Препараты для местного применения для уменьшения аэрозолизации SARS-CoV-2 при хирургии слизистых оболочек головы и шеи. Шея головы . 2020;42(6):1268-1272. doi:10.1002/hed.26200PubMedGoogle ScholarCrossref 13.Eggers
М, Кобургер-Янссен
Т, Эйкман
М, Цорн
Дж. In vitro бактерицидная и вирулицидная эффективность повидон-йодной жидкости для полоскания/полоскания рта против патогенов дыхательных путей и ротовой полости. Заразить Dis Ther .2018;7(2):249-259. doi: 10.1007/s40121-018-0200-7PubMedGoogle ScholarCrossref 14.Kariwa
Х, Фудзи
Н, Такашима
я. Инактивация коронавируса SARS с помощью повидон-йода, физических условий и химических реагентов. Дерматология . 2006; 212 (доп. 1): 119–123. doi:10.1159/000089211PubMedGoogle ScholarCrossref 15.Bidra
А.С., Пеллетье
JS, Вестовер
Джей Би, Фрэнк
С, Браун
СМ, Тессема
Б. Быстрая инактивация in vitro коронавируса тяжелого острого респираторного синдрома 2 (SARS-CoV-2) с использованием повидон-йодного орального антисептического ополаскивателя. J Протез . 2020;29(6):529-533. doi:10.1111/jopr.13209PubMedGoogle Scholar17.Reimer
К., Вихельхаус
Т.А., Шефер
В,
и другие. Антимикробная эффективность повидон-йода и последствия для новых областей применения.
Заразить Dis Ther .2018;7(2):249-259. doi: 10.1007/s40121-018-0200-7PubMedGoogle ScholarCrossref 14.Kariwa
Х, Фудзи
Н, Такашима
я. Инактивация коронавируса SARS с помощью повидон-йода, физических условий и химических реагентов. Дерматология . 2006; 212 (доп. 1): 119–123. doi:10.1159/000089211PubMedGoogle ScholarCrossref 15.Bidra
А.С., Пеллетье
JS, Вестовер
Джей Би, Фрэнк
С, Браун
СМ, Тессема
Б. Быстрая инактивация in vitro коронавируса тяжелого острого респираторного синдрома 2 (SARS-CoV-2) с использованием повидон-йодного орального антисептического ополаскивателя. J Протез . 2020;29(6):529-533. doi:10.1111/jopr.13209PubMedGoogle Scholar17.Reimer
К., Вихельхаус
Т.А., Шефер
В,
и другие. Антимикробная эффективность повидон-йода и последствия для новых областей применения. Дерматология . 2002; 204 (прил. 1): 114–120. doi:10.1159/000057738PubMedGoogle ScholarCrossref 19.Frank
С, Каприотти
Дж, Браун
СМ, Тессема
Б. Использование повидон-йода в синоназальной и ротовой полостях: обзор безопасности в эпоху COVID-19. Ухо Нос Горло J . Опубликовано в Интернете 10 июня 2020 г. PubMedGoogle Scholar20.Panchmatia
R, Паянде
Дж., Аль-Салман
Р,
и другие. Эффективность разбавленных местных полосканий повидон-йодом при лечении упорного хронического риносинусита: проспективное когортное исследование. Eur Arch Оториноларингол . 2019;276(12):3373-3381. doi: 10.1007/s00405-019-05628-wPubMedGoogle ScholarCrossref 21.Mullings
W, Панчматия
Р, Самой
К, Хабиб
А, Тамбу
А, Аль-Салман
Р,
и др. Местное применение повидон-йода в качестве дополнительного лечения упорного хронического риносинусита.
Дерматология . 2002; 204 (прил. 1): 114–120. doi:10.1159/000057738PubMedGoogle ScholarCrossref 19.Frank
С, Каприотти
Дж, Браун
СМ, Тессема
Б. Использование повидон-йода в синоназальной и ротовой полостях: обзор безопасности в эпоху COVID-19. Ухо Нос Горло J . Опубликовано в Интернете 10 июня 2020 г. PubMedGoogle Scholar20.Panchmatia
R, Паянде
Дж., Аль-Салман
Р,
и другие. Эффективность разбавленных местных полосканий повидон-йодом при лечении упорного хронического риносинусита: проспективное когортное исследование. Eur Arch Оториноларингол . 2019;276(12):3373-3381. doi: 10.1007/s00405-019-05628-wPubMedGoogle ScholarCrossref 21.Mullings
W, Панчматия
Р, Самой
К, Хабиб
А, Тамбу
А, Аль-Салман
Р,
и др. Местное применение повидон-йода в качестве дополнительного лечения упорного хронического риносинусита. Eur J Rhinol Allergy 2019;2(2):45–50. doi:10.5152/ejra.2019.166Google ScholarCrossref 25.Доминго
Массачусетс, Фарралес
МС, Лойя
РМ, Пура
Массачусетс, Уй
Х. Влияние 1% повидон-йода в качестве ополаскивателя перед процедурой у 20 пациентов с разной степенью гигиены полости рта. J Philipp Dent Assoc . 1996;48(2):31-38.PubMedGoogle Scholar26.Foley
ТП
младший. Связь между аутоиммунным заболеванием щитовидной железы и потреблением йода: обзор. Эндокринол Поль . 1992; 43 (доп. 1): 53–69. PubMedGoogle Scholar.
Eur J Rhinol Allergy 2019;2(2):45–50. doi:10.5152/ejra.2019.166Google ScholarCrossref 25.Доминго
Массачусетс, Фарралес
МС, Лойя
РМ, Пура
Массачусетс, Уй
Х. Влияние 1% повидон-йода в качестве ополаскивателя перед процедурой у 20 пациентов с разной степенью гигиены полости рта. J Philipp Dent Assoc . 1996;48(2):31-38.PubMedGoogle Scholar26.Foley
ТП
младший. Связь между аутоиммунным заболеванием щитовидной железы и потреблением йода: обзор. Эндокринол Поль . 1992; 43 (доп. 1): 53–69. PubMedGoogle Scholar.In vitro вирулицидная активность повидон-йодной жидкости для полоскания рта и жидкости для полоскания рта против SARS-CoV-2: последствия для стоматологической практики
Всемирная организация здравоохранения. Временные рекомендации по обязательной гигиене рук для предотвращения передачи COVID-19. 2020. Доступно в Интернете по адресу https://www.who.int/publications/m/item/interim-recommendations-on-obligatory-hand-hygiene-against-transmission-of-covid-19 (по состоянию на ноябрь 2020 г.).
2020. Доступно в Интернете по адресу https://www.who.int/publications/m/item/interim-recommendations-on-obligatory-hand-hygiene-against-transmission-of-covid-19 (по состоянию на ноябрь 2020 г.).
Вакс Р. С., Кристиан, доктор медицинских наук. Практические рекомендации для бригад интенсивной терапии и анестезиологов, ухаживающих за пациентами с новым коронавирусом (2019-nCoV). Can J Anaesth 2020; 67: 568-576.
Моравска Л., Цао Дж. Передача SARS-CoV-2 воздушно-капельным путем: мир должен смотреть правде в глаза. Environ Int 2020; 139: 105730.
Уилсон Н.М., Нортон А., Янг Ф.П., Коллинз Д.В. Воздушная передача тяжелого острого респираторного синдрома коронавируса-2 работникам здравоохранения: описательный обзор. Анестезия 2020; 75: 1086-1095.
Мик П., Мерфи Р. Аэрозолеобразующие отоларингологические процедуры и необходимость усиленных СИЗ во время пандемии COVID-19: обзор литературы. J Отоларингол Head Neck Surg 2020; 49: 29.
J Отоларингол Head Neck Surg 2020; 49: 29.
Hoffmann M, Kleine-Weber H, Schroeder S et al. Проникновение в клетку SARS-CoV-2 зависит от ACE2 и TMPRSS2 и блокируется клинически проверенным ингибитором протеазы. Сотовый 2020; ДОИ: 10.1016/j.cell.2020.02.052.
To K K-W, Tsang O T-Y, Yip C C-Y и др. Стабильное обнаружение нового коронавируса 2019 года в слюне. Clin Infect Dis 2020; 71: 841-843.
То К.К., Цанг О.Т.Ю., Леунг В.С. и др. Временные профили вирусной нагрузки в образцах слюны из задней части ротоглотки и ответы сывороточных антител во время инфекции SARS-CoV-2: наблюдательное когортное исследование. Ланцет Infect Dis 2020; 20: 565-574.
Yoon J G, Yoon J, Song J Y и др. Клиническое значение высокой вирусной нагрузки SARS-CoV-2 в слюне. J Korean Med Sci 2020; DOI: 10. 3346/jkms.2020.35.e195.
3346/jkms.2020.35.e195.
Пэн Х, Сюй Х, Ли Ю, Ченг Л, Чжоу Х, Рен Б . Пути передачи 2019-nCoV и контроль в стоматологической практике. Int J Oral Sci 2020; 12: 9.
Центры по контролю и профилактике заболеваний. Временное руководство по профилактике и контролю инфекций для стоматологических учреждений во время пандемии коронавирусной болезни 2019 (COVID-19).2020. Доступно по адресу https://www.cdc.gov/coronavirus/2019-ncov/hcp/dental-settings.html (по состоянию на ноябрь 2020 г.).
Ганди М., Йокоэ Д.С., Хавлир Д.В. Бессимптомная передача, ахиллесова пята современных стратегий борьбы с Covid-19. N Engl J Med 2020; 382: 2158-2160.
Бай Ю, Яо Л, Вэй Т и др. Предполагаемое бессимптомное носительство COVID-19. ЯМА 2020; 323: 1406-1407.
Австралийская стоматологическая ассоциация. Руководство по управлению COVID-19. 2020. Доступно по адресу https://www.ada.org.au/Covid-19-Portal/Cards/Dental-Profesionals/Infection-Control/Transmission-Based-Precautions (по состоянию на ноябрь 2020 г.).
Руководство по управлению COVID-19. 2020. Доступно по адресу https://www.ada.org.au/Covid-19-Portal/Cards/Dental-Profesionals/Infection-Control/Transmission-Based-Precautions (по состоянию на ноябрь 2020 г.).
Challacombe S J, Kirk-Bayley J, Sunkaraneni V S, Combes J. Повидон-йод. Бр Дент J 2020; 228: 656-657.
Фогт П.М., Хаузер Дж., Мюллер С., Боссе Б., Хопп М. Эффективность обычного и липосомального повидон-йода в инфицированных сетчатых кожных трансплантатах: предварительное исследование. Infect Dis Ther 2017; 6: 545-555.
Эггерс М., Кобургер-Янссен Т., Эйкманн М., Цорн Дж. Бактерицидная и вирулицидная эффективность in vitro повидон-йодного полоскания/жидкости для полоскания рта против патогенов дыхательных путей и полости рта. Infect Dis Ther 2018; 7: 249-259.
Кавана Р., Китамура Т. , Накагоми О и др. Инактивация вирусов человека повидон-йодом по сравнению с другими антисептиками. Дерматология 1997; 195 Приложение 2: 29-35.
, Накагоми О и др. Инактивация вирусов человека повидон-йодом по сравнению с другими антисептиками. Дерматология 1997; 195 Приложение 2: 29-35.
Карива Х., Фуджи Н., Такашима И. Инактивация коронавируса SARS с помощью повидон-йода, физических условий и химических реагентов. Дерматология 2006; 212 Приложение 1: 119-123.
Эггерс М., Эйкманн М., Цорн Дж. Быстрая и эффективная вирулицидная активность продуктов повидон-йода против ближневосточного респираторного синдрома Коронавирус (БВРС-КоВ) и модифицированного вируса осповакцины Анкара (МВА). Infect Dis Ther 2015; 4: 491-501.
Андерсон Д.Э., Сивалингам В., Канг А.Е.З. и др. . Повидон-йод демонстрирует быструю вирулицидную активность in vitro против SARS-CoV-2, вируса, вызывающего болезнь COVID-19. Infect Dis Ther 2020; 9: 669-675.
Бидра А.С., Пеллетье Дж.С., Вестовер Дж.Б., Фрэнк С., Браун С.М., Тессема Б. . Быстрая инактивация in-vitro тяжелого острого респираторного синдрома коронавируса 2 (SARS-CoV-2) с использованием антисептического ополаскивателя для полости рта с повидон-йодом. J Протез 2020; 29: 529-533.
Всемирная организация здравоохранения. План исследований и разработок ВОЗ COVID 19: экспериментальные методы лечения . 2020. Доступно по адресу https://www.who.int/docs/default-source/coronaviruse/covid-classification-of-treatment-types-rev.pdf (по состоянию на ноябрь 2020 г.).
Европейский комитет по стандартизации. Химические дезинфицирующие средства и антисептики. Количественный суспензионный тест для оценки вирулицидной активности в медицинской сфере.Метод испытаний и требования (Этап 2/Шаг 1). 2015. Доступно по адресу https://infostore.saiglobal.com/preview/98702935197.pdf (по состоянию на ноябрь 2020 г. ).
).
Спирмен С. Метод «правильных и неправильных случаев» («постоянных стимулов») без формул Гаусса. BrJ Psychol 1908; 2: 227-242.
Kärber G. Beitrag zur kollektiven Behandlung Behandlung pharmakologischer Reihenversuche. Архив Экспер Патол Фармакол 1931; 162: 480-483.
Хассандарвиш П., Тионг В., Сазали А.Б. и др. Повидон-йод для полоскания рта и жидкости для полоскания рта. Бр Дент J 2020; 228: 900.
Канагалингам Дж., Фелисиано Р., Ха Дж. Х., Лабиб Х., Ле Т. А., Лин Дж.-К. . Практическое применение повидон-йодного антисептика для поддержания здоровья полости рта, профилактики и лечения распространенных инфекций ротоглотки. Int J Clin Pract 2015; 69: 1247-1256.
Фаллахи Х.Р., Кейхан С.О., Зандиан Д., Ким С.Г., Чешми Б. Стоматолог на передовой во время пандемии Covid-19: обзор литературы. Maxillofac Plast Reconstr Surg 2020; 42: 12.
Стоматолог на передовой во время пандемии Covid-19: обзор литературы. Maxillofac Plast Reconstr Surg 2020; 42: 12.
Harrel S K, Molinari J. Аэрозоли и брызги в стоматологии: краткий обзор литературы и последствия инфекционного контроля. J Am Dent Assoc 2004; 135: 429-437.
Gui D, Pepe G, Magalini S. Еще одна гигиеническая практика в связи с COVID-19. Eur Rev Med Pharmacol Sci 2020; 24: 3438-3439.
Бертон М. Дж., Кларксон Дж. Э., Гулао Б. и др. Использование противомикробных жидкостей для полоскания рта (полоскание) и назальных спреев медицинскими работниками для их защиты при лечении пациентов с подозреваемой или подтвержденной инфекцией COVID-19. Cochrane Database Syst Rev 2020; DOI: 10.1002/14651858.CD013626.pub2.
Burton M J , Clarkson J E, Goulao B et al. Противомикробные жидкости для полоскания рта (полоскания) и назальные спреи для защиты медицинских работников при проведении аэрозоль-генерирующих процедур (АГП) у пациентов без подозрения или подтвержденной инфекции COVID-19. Cochrane Database Syst Rev 2020; DOI: 10.1002/14651858.CD013628.pub2.
Противомикробные жидкости для полоскания рта (полоскания) и назальные спреи для защиты медицинских работников при проведении аэрозоль-генерирующих процедур (АГП) у пациентов без подозрения или подтвержденной инфекции COVID-19. Cochrane Database Syst Rev 2020; DOI: 10.1002/14651858.CD013628.pub2.
Атер А., Патель Б., Рупарел Н. Б., Диоген А., Харгривз К. М. Коронавирусная болезнь 19 (COVID-19): последствия для клинической стоматологической помощи. J Endod 2020; 46: 584-595.
О’Доннелл В. Б., Томас Д., Стэнтон Р. и др. Возможная роль ополаскивателей для полости рта, воздействующих на липидную оболочку вируса при инфекции SARS-CoV-2. Функция 2020; ДОИ: 10.1093/функция/zqaa002.
Мэди Л.Дж., Кубик М.В., Баддур К., Снайдерман С.Х., Роуэн Н.Р. Рассмотрение повидон-йода в качестве меры общественного здравоохранения при COVID-19: использование в качестве «средств индивидуальной защиты» для передовых поставщиков услуг, подвергающихся высокому риску лечение онкологии головы и шеи и основания черепа. Онкол для полости рта 2020; 105: 104724.
Онкол для полости рта 2020; 105: 104724.
Kirk-Bayley J, Challacombe S, Sunkaraneni S, Combes J. Использование назального спрея с повидон-йодом и жидкости для полоскания рта во время текущей пандемии COVID-19 может защитить медицинских работников и уменьшить перекрестную инфекцию.2020. Доступно в Интернете по адресу https://papers.ssrn.com/sol3/papers.cfm?abstract_id=3563092 (по состоянию на ноябрь 2020 г.).
Fine PD. Клиническое исследование по сравнению действия двух антисептических жидкостей для полоскания рта на воспаление десен. J Hosp Infect 1985; 6 Приложение А: 189-193.
Эггерс М., Кобургер-Янссен Т., Уорд Л.С., Ньюби С., Мюллер С. Бактерицидная и вирулицидная активность чистящих средств на основе повидон-йода и хлоргексидина-глюконата в клиническом симуляционном исследовании гигиены рук in vivo. Infect Dis Ther 2018; 7: 235-247.
Повидон-йод демонстрирует быструю вирулицидную активность in vitro против SARS-CoV-2, вируса, вызывающего болезнь COVID-19
Мы благодарим сотрудников Медицинской школы Duke-NUS ABSL3 за управление логистикой и помощь.
Финансирование
Это исследование, редакционная поддержка и плата за быстрое обслуживание за публикацию этой рукописи финансировались Mundipharma Singapore Holding Pte.Ограниченное.
Редакционная помощь
Редакционную помощь в подготовке этой статьи оказал Сен Кван Тай из Tech-Observer Asia-Pacific Pte Ltd.
Авторство
Все названные авторы соответствуют критериям Международного комитета редакторов медицинских журналов (ICMJE) для авторства этой статьи, несут ответственность за целостность работы в целом и дали свое согласие на публикацию этой версии.
Авторские взносы
Даниэль Э. Андерсон, Марен Эггерс, Харша Арумугам, Абхишек Анантанараянан, Тимоти М. Дженкинс и Ясин Хаджиат разработали исследование и руководили им. Даниэль Э. Андерсон, Велрадж Сивалингам и Адриан Энг Чжэн Канг провели эксперименты. Даниэль Э. Андерсон, Велрадж Сивалингам и Адриан Энг Чжэн Канг провели анализ. Абхишек Анантанараянан, Харша Арумугам, Ясин Хаджиат, Тимоти М. Дженкинс, Марен Эггерс и Даниэль Э.Андерсон написал газету.
Андерсон, Марен Эггерс, Харша Арумугам, Абхишек Анантанараянан, Тимоти М. Дженкинс и Ясин Хаджиат разработали исследование и руководили им. Даниэль Э. Андерсон, Велрадж Сивалингам и Адриан Энг Чжэн Канг провели эксперименты. Даниэль Э. Андерсон, Велрадж Сивалингам и Адриан Энг Чжэн Канг провели анализ. Абхишек Анантанараянан, Харша Арумугам, Ясин Хаджиат, Тимоти М. Дженкинс, Марен Эггерс и Даниэль Э.Андерсон написал газету.
Предыдущая презентация
Версия этой статьи без рецензирования доступна на сервере препринтов с 10 июня 2020 г. (ResearchSquare: https://www.researchsquare.com/article/rs-34544/v1).
Раскрытие информации
Абхишек Анантанараянан, Харша Арумугам, Тимоти М. Дженкинс и Ясин Хаджиат являются сотрудниками Mundipharma. Даниэль Э.Андерсон, Велрадж Сивалингам и Адриан Энг Чжэн Канг получили контракт на оказание услуг от Mundipharma для проведения исследования. Марен Эггерс занимается консультированием и привлечением спикеров для Mundipharma.
Марен Эггерс занимается консультированием и привлечением спикеров для Mundipharma.
Соблюдение этических норм
Эта статья не содержит исследований с участием людей или животных, проведенных кем-либо из авторов.
Доступность данных
Все данные, полученные или проанализированные в ходе этого исследования, включены в опубликованную статью или в виде дополнительных информационных файлов.
Нацеливание in vitro и in vivo меченных йодом-123 или йодом-131 моноклональных антител 14C5 на модели немелкоклеточного рака легкого и карциномы толстой кишки | Клинические исследования рака
Антитела. Гибридома, продуцирующая антитела 14C5, была получена путем слияния клеток миеломы NSO с клетками селезенки мышей BALB/c, иммунизированных линией клеток карциномы молочной железы человека SK-BR-3 (14). Гибридомные клетки продуцировали mAb 14C5 в колбах Integra CL 350 (Elscolab, Kruibeke, Бельгия), содержащих безбелковую гибридомную среду (Invitrogen, Merelbeke, Бельгия).mAb 14C5 очищали от белка G (Amersham Biosciences Europe, Roosendaal, Нидерланды) из концентрированного супернатанта и подвергали диализу против PBS (pH 7,4). Чистоту антитела оценивали с помощью SDS-PAGE с использованием восстанавливающих и невосстанавливающих условий. 9E10 mAb (анти-c-myc, мышиный IgG1, Becton Dickinson, Erembodegem-Aalst, Бельгия) использовали в качестве контроля связывания специфического рецептора Fc во время анализа с помощью проточной цитометрии. Во время проточной цитометрии и конфокальной лазерной сканирующей микроскопии использовали конъюгированное с Alexa Fluor 488 козье антитело против IgG мыши (Invitrogen).Антиинтегриновые mAb β 1 (IgG1, Becton Dickinson) использовали в качестве контроля неспецифического связывания в исследованиях биораспределения.
Гибридомные клетки продуцировали mAb 14C5 в колбах Integra CL 350 (Elscolab, Kruibeke, Бельгия), содержащих безбелковую гибридомную среду (Invitrogen, Merelbeke, Бельгия).mAb 14C5 очищали от белка G (Amersham Biosciences Europe, Roosendaal, Нидерланды) из концентрированного супернатанта и подвергали диализу против PBS (pH 7,4). Чистоту антитела оценивали с помощью SDS-PAGE с использованием восстанавливающих и невосстанавливающих условий. 9E10 mAb (анти-c-myc, мышиный IgG1, Becton Dickinson, Erembodegem-Aalst, Бельгия) использовали в качестве контроля связывания специфического рецептора Fc во время анализа с помощью проточной цитометрии. Во время проточной цитометрии и конфокальной лазерной сканирующей микроскопии использовали конъюгированное с Alexa Fluor 488 козье антитело против IgG мыши (Invitrogen).Антиинтегриновые mAb β 1 (IgG1, Becton Dickinson) использовали в качестве контроля неспецифического связывания в исследованиях биораспределения.
Клеточные линии. HT-29, LoVo, Capan-1, Capan-2 и C32 были любезным подарком J&J Pharmaceutical Research & Development (Beerse, Бельгия). HT-1080, A2058, A549, AsPC-1 и MDA-MB-231 были получены из Лаборатории опухолей и биологии развития (Льежский университет, Льеж, Бельгия).OVCAR-3, HeLa, K-562 и BT-20 были получены из Отдела молекулярных биомедицинских исследований (Фландрский институт биотехнологии, Гент, Бельгия). SK-BR-3, MCF-7, T-47D, LN-229, Colo16, 791T и MOLT-4 были получены из Института патологии им. Н. Гурмати Гентского университета (г. Гент, Бельгия). Все клеточные линии культивировали в стандартной среде с добавками в соответствии с рекомендациями Американской коллекции типовых культур (Манассас, Вирджиния), за исключением Colo16, K-562 и MOLT-4, выращенных в среде RPMI 1640, содержащей 10 ммоль/л HEPES и 10% фетального бычьей сыворотки (Cambrex, Вервье, Бельгия) и 791T, выращенных в среде DMEM, содержащей 10% эмбриональной бычьей сыворотки.Все клетки культивировали при 37°C в увлажненном инкубаторе с 5% CO 2 и пассировали с 0,05% трипсином-0,02% EDTA.
HT-29, LoVo, Capan-1, Capan-2 и C32 были любезным подарком J&J Pharmaceutical Research & Development (Beerse, Бельгия). HT-1080, A2058, A549, AsPC-1 и MDA-MB-231 были получены из Лаборатории опухолей и биологии развития (Льежский университет, Льеж, Бельгия).OVCAR-3, HeLa, K-562 и BT-20 были получены из Отдела молекулярных биомедицинских исследований (Фландрский институт биотехнологии, Гент, Бельгия). SK-BR-3, MCF-7, T-47D, LN-229, Colo16, 791T и MOLT-4 были получены из Института патологии им. Н. Гурмати Гентского университета (г. Гент, Бельгия). Все клеточные линии культивировали в стандартной среде с добавками в соответствии с рекомендациями Американской коллекции типовых культур (Манассас, Вирджиния), за исключением Colo16, K-562 и MOLT-4, выращенных в среде RPMI 1640, содержащей 10 ммоль/л HEPES и 10% фетального бычьей сыворотки (Cambrex, Вервье, Бельгия) и 791T, выращенных в среде DMEM, содержащей 10% эмбриональной бычьей сыворотки.Все клетки культивировали при 37°C в увлажненном инкубаторе с 5% CO 2 и пассировали с 0,05% трипсином-0,02% EDTA.
Иммуноцитохимическое исследование. Конфлюэнтные линии опухолевых клеток собирали путем соскоба клеток и дважды промывали PBS. Клетки цитоцентрифугировали в течение 5 минут при 180× г и фиксировали в ацетоне в течение 10 минут. Для иммуноцитохимического выявления применяли авидин-биотиновую систему (DakoCytomation, Heverlee, Бельгия).mAb 14C5 (1 мкг/мл) инкубировали в течение 1 часа в PBS с 5% бычьим сывороточным альбумином (BSA; Sigma-Aldrich, Борнем, Бельгия) при комнатной температуре. Затем образец инкубировали с биотинилированными антимышиными иммуноглобулинами в течение 15 минут; авидин-пероксидазный комплекс добавляли на 15 минут, а затем 3-амино-9-этилкарбозол (DakoCytomation) на 10 минут в качестве хромогена. Между каждым этапом клетки дважды промывали PBS. Клетки контрастировали гематоксилином Майера и заключали в среду для заливки Aquatex (VWR International, Левен, Бельгия). Отрицательные контрольные клетки получали путем исключения первичного антитела.
Отрицательные контрольные клетки получали путем исключения первичного антитела.
Проточная цитометрия. Конфлюэнтные клетки собирали с использованием буфера для диссоциации клеток (Invitrogen). Аликвоты 2×10 5 клеток инкубировали с mAb 14C5 (10 нмоль/л) в PBS-0,5% BSA-0,02% (вес/объем) азида натрия (Sigma-Aldrich) на льду. После промывания клеток PBS-0,5% BSA-0,02% азидом натрия клетки инкубировали с Alexa Fluor 488, конъюгированным с козьими антимышиными антителами, на льду в течение 1 часа.Клетки снова промывали PBS-0,5% BSA-0,02% азидом натрия и суспендировали в конечном объеме 300 мкл PBS-0,5% BSA-0,02% азида натрия. В контрольных образцах первичное антитело отсутствовало. Для изотипического контроля использовали mAb 9E10 (10 нмоль/л) вместо mAb 14C5.
Проточный цитометрический анализ проводили с использованием проточного цитометра FACScan (Becton Dickinson). Популяции опухолевых клеток были отобраны на основе переменных прямого и бокового рассеяния. Анализ данных проводился с помощью WinMDI (Joseph Trotter).
Популяции опухолевых клеток были отобраны на основе переменных прямого и бокового рассеяния. Анализ данных проводился с помощью WinMDI (Joseph Trotter).
Радиойодирование и контроль качества. mAb 14C5 и антиинтегрин β 1 IgG1 метили 123 I, 125 I или 131 I. Изотопы были получены от Bristol-Myers Squibb (Брюссель, Бельгия). Радиойодирование проводили по методу Йодо-Ген (22). Нанесение реагента для йодирования Iodo-Gen проводили в соответствии с инструкциями производителя (Perbio, Erembodegem, Бельгия).
Для радиойодирования смесь йодида и mAb 14C5, растворенных в 0,1 моль/л калий-фосфатного буфера (pH 8,5), добавляли в реакционный флакон, покрытый Iodo-Gen, на 10 минут при комнатной температуре. Связанный с белком йодид отделяли от свободного йодида пропусканием через колонку PD-10 (Amersham Biosciences Europe), уравновешенную PBS-1% BSA. Контроль качества меченных радиоактивным изотопом антител осуществляли методом эксклюзионной высокоэффективной жидкостной хроматографии с использованием колонки Ultrahydrogel 120 6 мкм (7.8 × 300 мм ГПК; Waters, Брюссель, Бельгия) и 0,01 моль/л калий-фосфатного буфера (рН 7,4) элюента при скорости потока 0,8 мл/мин.
Контроль качества меченных радиоактивным изотопом антител осуществляли методом эксклюзионной высокоэффективной жидкостной хроматографии с использованием колонки Ultrahydrogel 120 6 мкм (7.8 × 300 мм ГПК; Waters, Брюссель, Бельгия) и 0,01 моль/л калий-фосфатного буфера (рН 7,4) элюента при скорости потока 0,8 мл/мин.
Исследование связывания при насыщении. Исследования связывания с насыщением проводили с 125 I-мечеными mAb 14C5 с использованием клеток LoVo и A549. Двенадцать испытуемых растворов (в повторах), содержащих возрастающие количества меченных радиоактивным изотопом моноклональных антител 14С5 и 0,5 × 10 6 клеток в общем объеме 3 мл клеточной среды, инкубировали при 4°С в течение 2 с.5 часов. Затем супернатант удаляли центрифугированием (8 минут, 180× г , 4°C) и клетки промывали 3 мл охлажденного льдом PBS. Для каждого образца определяли неспецифическое связывание в присутствии 167 нмоль/л немеченого mAb 14C5. Радиоактивность подсчитывали с помощью гамма-счетчика (Cobra II, Perkin-Elmer, Югесхайм, Германия). Значения K d определяли с помощью программного обеспечения GraphPad Prism 3.1 (Сан-Диего, Калифорния).
Радиоактивность подсчитывали с помощью гамма-счетчика (Cobra II, Perkin-Elmer, Югесхайм, Германия). Значения K d определяли с помощью программного обеспечения GraphPad Prism 3.1 (Сан-Диего, Калифорния).
| Как крупный международный издатель академических и исследовательских журналов, Science Alert публикует и разрабатывает игры в партнерстве с самыми престижные научные общества и издательства.Наша цель заключается в проведении высококачественных исследований в максимально широком аудитория. | ||||||
Мы прилагаем все усилия, чтобы поддержать исследователей
которые публикуются в наших журналах. Существует огромное количество информации
здесь, чтобы помочь вам опубликоваться у нас, а также ценные
услуги для авторов, которые уже публиковались у нас. Существует огромное количество информации
здесь, чтобы помочь вам опубликоваться у нас, а также ценные
услуги для авторов, которые уже публиковались у нас. | ||||||
| Цены 2022 уже доступны. Ты может получить личную / институциональную подписку на перечисленные журналы непосредственно из Science Alert. В качестве альтернативы вы возможно, вы захотите связаться с предпочитаемым агентством по подписке. Пожалуйста, направляйте заказы, платежи и запросы в службу поддержки клиентов в службу поддержки клиентов журнала Science Alert. | ||||||
Science Alert гордится своим
тесные и прозрачные отношения с обществом. В виде
некоммерческий издатель, мы стремимся к самому широкому
возможное распространение материалов, которые мы публикуем, и
на предоставление услуг самого высокого качества нашим
издательские партнеры. В виде
некоммерческий издатель, мы стремимся к самому широкому
возможное распространение материалов, которые мы публикуем, и
на предоставление услуг самого высокого качества нашим
издательские партнеры. | ||||||
| Здесь вы найдете ответы на наиболее часто задаваемые вопросы (FAQ), которые мы получили по электронной почте или через контактную веб-форму.В соответствии с характером вопросов мы разделили часто задаваемые вопросы на разные категории. | ||||||
Азиатский индекс научного цитирования (ASCI)
обязуется предоставлять авторитетный, надежный и
значимая информация путем охвата наиболее важных
и влиятельные журналы для удовлетворения потребностей глобального
научное сообщество. База данных ASCI также предоставляет ссылку
до полнотекстовых статей до более чем 25 000 записей с
ссылка на цитируемые источники. База данных ASCI также предоставляет ссылку
до полнотекстовых статей до более чем 25 000 записей с
ссылка на цитируемые источники. | ||||||
In vitro вирулицидный эффект повидон-йода против SARS-CoV-2 — Корейский университет
@article{14d33b7aed9c48d799b393366c5a5961,
title = «In vitro вирулицидный эффект повидон-йода против SARS-
», 5RS-
2 SA abstract = «По состоянию на сентябрь 2020 года SARS-CoV-2 заразил более 30 миллионов человек во всем мире, а число погибших возросло до 950 000 человек.Учитывая, что повидон-йод (PVP-I) последовательно демонстрировал вирулицидную эффективность против различных типов вирусов, таких как SARS-CoV, MERS-CoV и Эбола, мы провели это исследование, чтобы выяснить вирулицидный эффект против SARS-CoV.
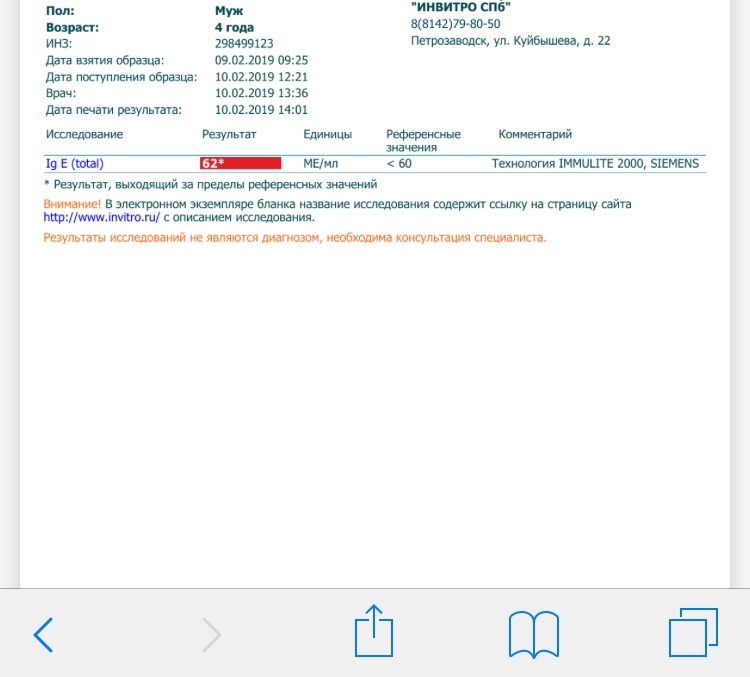 -2 с помощью анализа вирусных бляшек. Мы провели анализы Kill-Time для оценки вирусной инактивации загрязнителей SARS-CoV-2 после применения продукта PVP-I (бетадин {\ textregistered} спрей для горла, PVP-I 0,45%). Этот тест состоял из чистых и грязных условий и был разработан для проверки титров вируса при времени контакта 60 секунд, которые оценивались по скорости уменьшения бляшек в клетках Vero.Этот продукт PVP-I полностью достиг снижения титров вируса на ≥4 log10 как в чистых, так и в грязных условиях. Этот уровень снижения титров вируса ≥4 log10 (99,99%) считается эффективным с точки зрения вирулицидной эффективности в соответствии с европейскими стандартами EN14476. Это исследование выявило вирулицидную эффективность спрея для горла Бетадин против вируса SARS-CoV-2. Учитывая удобство и доступность этого продукта, мы считаем, что он может способствовать ингибированию вирусной инфекции и трансмиссивности в качестве активного типа средств индивидуальной защиты (СИЗ) путем управления гигиеной пациентов и медицинских работников.
-2 с помощью анализа вирусных бляшек. Мы провели анализы Kill-Time для оценки вирусной инактивации загрязнителей SARS-CoV-2 после применения продукта PVP-I (бетадин {\ textregistered} спрей для горла, PVP-I 0,45%). Этот тест состоял из чистых и грязных условий и был разработан для проверки титров вируса при времени контакта 60 секунд, которые оценивались по скорости уменьшения бляшек в клетках Vero.Этот продукт PVP-I полностью достиг снижения титров вируса на ≥4 log10 как в чистых, так и в грязных условиях. Этот уровень снижения титров вируса ≥4 log10 (99,99%) считается эффективным с точки зрения вирулицидной эффективности в соответствии с европейскими стандартами EN14476. Это исследование выявило вирулицидную эффективность спрея для горла Бетадин против вируса SARS-CoV-2. Учитывая удобство и доступность этого продукта, мы считаем, что он может способствовать ингибированию вирусной инфекции и трансмиссивности в качестве активного типа средств индивидуальной защиты (СИЗ) путем управления гигиеной пациентов и медицинских работников. «,
«,ключевых слов = «COVID-19, зубной налет, повидон-йод, SARS-CoV-2, вирулицидный эффект»,
автор = «Шин, {Кён Рёль} и Кёнхи Квак, Чунгуанг Цуй и Бэ, {Джун Ён } и Woosung Hong and Park, {Man Seong}»,
note = «Авторские права издателя: {\textcopyright} 2020 Journal of Bacteriology and Virology.»,
year = «2020»,
doi = «10.4167/jbv .2020.50.3.195»,
language = «English»,
volume = «50»,
pages = «195—202»,
journal = «Journal of Bacteriology and Virology»,
issn = » 1598-2467″,
издатель = «Медицинская школа национального университета Чоннам»,
номер = «3»,
}
Йодсодержащие контрастные вещества не влияют на функцию обогащенной тромбоцитами плазмы в ранние сроки in vitro | Журнал экспериментальной ортопедии
Комитет по этике учреждения одобрил исследованиеПодписанное информированное согласие было получено для всех пациентов, принимавших участие .
Пациенты
С мая 2016 г.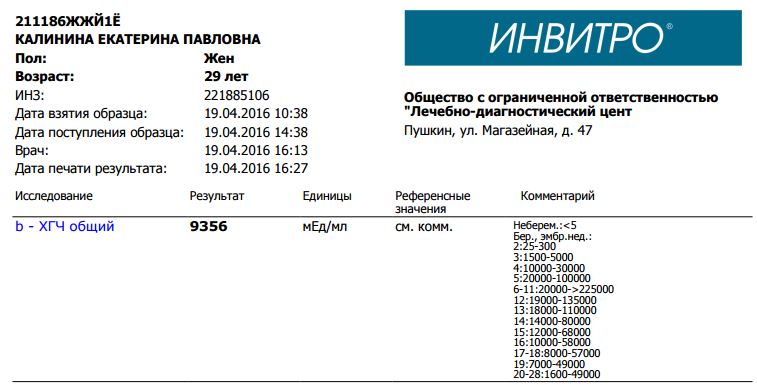 по январь 2017 г. в исследование были проспективно включены 137 последовательных пациентов. Критериями включения были: возраст (< 18 лет), рентгенологически подтвержденный ОА в пателлофеморальном отделе симптоматического коленного сустава (2 и 3 степень по классификации Келлгрена-Лоуренса), диагноз первичного ОА, подтвержденный не менее чем за 3 месяца до исследования. , безуспешность консервативного лечения, проведенного не менее чем за 6 недель до исследования (реабилитация с использованием обезболивающей физиотерапии и эксцентрической работы), показания для внутрисуставной инъекции PRP, подтвержденные врачом спортивной медицины или хирургом-ортопедом, инфильтрация, выполненная в нашем мышечно- Институт скелетной интервенционной радиологии.Критериями исключения были: беременность, инфекции, предшествующее лечение кортикостероидами, дисфункция тромбоцитов и иммунодефицит. Ни один из 137 пациентов не соответствовал критериям исключения. В исследование были включены 78 мужчин и 59 женщин (средний возраст: 45 лет, диапазон 28–64 лет).
по январь 2017 г. в исследование были проспективно включены 137 последовательных пациентов. Критериями включения были: возраст (< 18 лет), рентгенологически подтвержденный ОА в пателлофеморальном отделе симптоматического коленного сустава (2 и 3 степень по классификации Келлгрена-Лоуренса), диагноз первичного ОА, подтвержденный не менее чем за 3 месяца до исследования. , безуспешность консервативного лечения, проведенного не менее чем за 6 недель до исследования (реабилитация с использованием обезболивающей физиотерапии и эксцентрической работы), показания для внутрисуставной инъекции PRP, подтвержденные врачом спортивной медицины или хирургом-ортопедом, инфильтрация, выполненная в нашем мышечно- Институт скелетной интервенционной радиологии.Критериями исключения были: беременность, инфекции, предшествующее лечение кортикостероидами, дисфункция тромбоцитов и иммунодефицит. Ни один из 137 пациентов не соответствовал критериям исключения. В исследование были включены 78 мужчин и 59 женщин (средний возраст: 45 лет, диапазон 28–64 лет).
Подготовка PRP
Пациенты были направлены к клиническому патологу. У каждого пациента брали 22 мл венозной крови в шприц, содержащий 1,5 мл цитратного антикоагулянта. Кровь центрифугировали при 570 g в течение 8 мин и конечном объеме 3.5 мл PRP было извлечено в нижнем слое плазмы. Фактор концентрации тромбоцитов в конечном объеме составлял 2,5, что подтверждается подсчетом тромбоцитов с помощью автоматического гематологического анализатора клеток (ABX Pentra 60, Horiba, Киото, Япония). Количество тромбоцитов и лейкоцитов контролировали в каждом образце PRP Dallaudière et al. (2014). Наконец, перед внутрисуставной инъекцией PRP отбирали образцы 500 мкл аутологичной PRP от каждого пациента.
Количественная оценка in vitro
После анонимизации образцов PRP 500 мкл PRP случайным образом смешивали с 50 мкл различных ICA (PRP + ICA): Йодиксанол 270 мг I/мл (Visipaque270®, GE Healthcare, ChICAgo, Illinois) , США) ( n = 58) или йопамидол 200 мг в/мл (Iopamiron200®, визуализация Bracco, Милан, Италия) ( n = 69). Visipaque270® представляет собой неионогенный гексаиодированный раствор (йодиксанол) с осмоляльностью 290 мОсм/кг, вспомогательными веществами которого являются трометанол, хлористый натрий, хлористый кальций, эдетат натрия, кальций, вода и хлоргидриновая кислота. Iopamiron200® представляет собой неионогенный трийодсодержащий раствор с осмоляльностью 413 мОсм/кг, вспомогательными веществами которого являются трометанол, гидроксид натрия, эдетат натрия, кальций, вода и хлоргидриновая кислота.
Visipaque270® представляет собой неионогенный гексаиодированный раствор (йодиксанол) с осмоляльностью 290 мОсм/кг, вспомогательными веществами которого являются трометанол, хлористый натрий, хлористый кальций, эдетат натрия, кальций, вода и хлоргидриновая кислота. Iopamiron200® представляет собой неионогенный трийодсодержащий раствор с осмоляльностью 413 мОсм/кг, вспомогательными веществами которого являются трометанол, гидроксид натрия, эдетат натрия, кальций, вода и хлоргидриновая кислота.
Количественно определяли концентрацию тромбоцитов (Г/л) только в пределах PRP ( t = 0mn) и PRP + ICA при нескольких задержках инкубации (а именно, 5, 10, 15, 20, 30mn).«Тридцать минут» были произвольно выбраны в качестве последнего момента времени, потому что PRP всегда проникает в течение этой задержки в нашем учреждении и из-за отсутствия достаточного количества PRP после этой задержки для статистических сравнений. Кроме того, in vivo , рекомендуется делать рентгеновские снимки в течение 30 минут после инфильтрации ВСА, поскольку концентрация ВСА постоянно снижается, поскольку она, вероятно, поглощается синовиальной оболочкой (Obermann et al.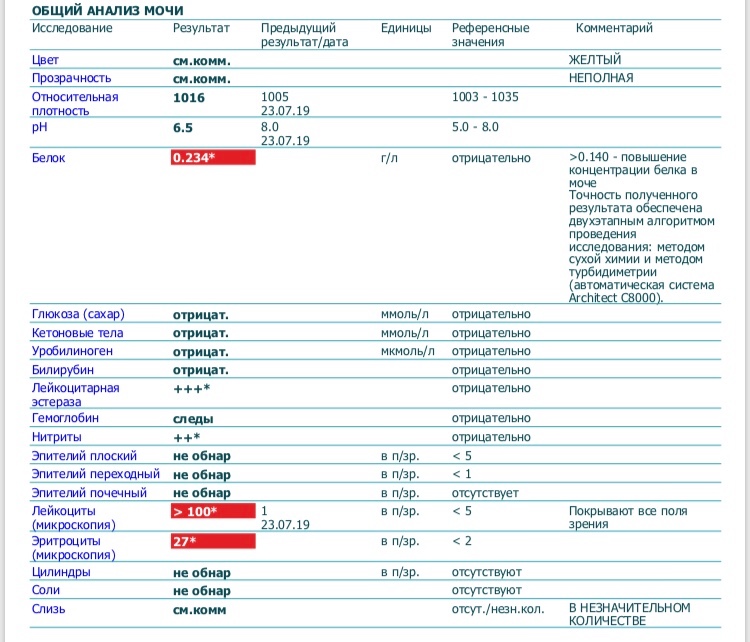 , 1989; Omoumi et al., 2009). ). Таким образом, взаимодействие между PRP и ICA также должно уменьшиться после этой инкубационной задержки.Затем патологоанатом подсчитывал количество тромбоцитов в каждом образце при каждой задержке инкубации (с помощью автоматического клеточного анализатора) и анализировал морфологию тромбоцитов (с помощью оптического микроскопа с увеличением 40), не обращая внимания на клинические данные. Соотношение PRP определяли как концентрацию PRP в смеси PRP + ICA в данный момент времени, деленную на исходную концентрацию PRP (отношение PRP = [PRP](t)/[PRP](0mn)).
, 1989; Omoumi et al., 2009). ). Таким образом, взаимодействие между PRP и ICA также должно уменьшиться после этой инкубационной задержки.Затем патологоанатом подсчитывал количество тромбоцитов в каждом образце при каждой задержке инкубации (с помощью автоматического клеточного анализатора) и анализировал морфологию тромбоцитов (с помощью оптического микроскопа с увеличением 40), не обращая внимания на клинические данные. Соотношение PRP определяли как концентрацию PRP в смеси PRP + ICA в данный момент времени, деленную на исходную концентрацию PRP (отношение PRP = [PRP](t)/[PRP](0mn)).
Качественная оценка in vitro
Во-первых, нашей целью было сравнить функцию тромбоцитов между двумя разными ИКА (Visipaque270®, Iopamiron200®) и контрольным раствором (фосфатный буферный раствор, PBS).В эту часть исследования были включены пять пациентов. Их образцы PRP были разделены на три равные части и смешаны с 50 мкл PBS, Visipaque270® и Iopamiron200®. Для каждой смеси (PRP + PBS, PRP + Visipaque270®, PRP + Iopamiron200®) агрегацию тромбоцитов оценивали в соответствии с 4 тестами после задержки инкубации на 30 минут с использованием: (i) 10 мкмоль/л аденозиндифосфата (АДФ, Sigma Aldrich Chimie, Лион, Франция), (ii) 1 ммоль/л арахидоновой кислоты (AA, Nu-Chek-Prep, Elysian, Миннесота, США), (iii) 25 мкмоль/л пептида, активирующего рецептор тромбина (TRAP, NeosystemSA, Страсбург, Франция) и (iv) 2 мкг/мкл коллагена сухожилий лошади (коллаген Horm-Chemie, Nycomed Pharma, Мюнхен, Германия). Тесты проводились на агрегометре (APACT® 4004, ELITechGroup, Салон-де-Прованс, Франция) в соответствии со стандартными процедурами и в течение времени теста на агрегацию 300 с.
Тесты проводились на агрегометре (APACT® 4004, ELITechGroup, Салон-де-Прованс, Франция) в соответствии со стандартными процедурами и в течение времени теста на агрегацию 300 с.
Во-вторых, мы исследовали, может ли другая концентрация йода для одной и той же молекулы ICA изменить функцию тромбоцитов. Для этого мы сравнили функцию тромбоцитов двух смесей: PRP + PBS и PRP + Visipaque320® (йодиксанол 320 мг I/мл вместо 270 мг I/мл) с теми же тестами на агрегацию у пяти других пациентов.
В-третьих, сравнивали экспрессию Р-селектина на клеточной поверхности, который является маркером высвобождения альфа-гранул, в смесях Visipaque270® и Iopamiron200®. Измерения проводились на образцах PRP 5 дополнительных пациентов до и после добавления ICA с использованием Vh20, который представляет собой мышиное моноклональное антитело, произведенное нашей группой Cattaneo et al. (2013). Среднюю интенсивность флуоресценции P-селектина измеряли на покоящихся тромбоцитах и после стимуляции 25 мкМ TRAP, что позволило рассчитать коэффициент экспрессии P-селектина (определяемый как отношение средней интенсивности флуоресценции P-селектина после стимуляции TRAP и до стимуляции TRAP ).
Статистический анализ
Распределение Гаусса проверено с помощью критерия нормальности Шапиро-Уилка. Начальные концентрации PRP (задержка инкубации t = 0мин) в присутствии различных ICA сравнивались с использованием критерия Манна-Уитни. Влияние как ICA, так и задержки инкубации на соотношение PRP оценивали с помощью двухфакторного дисперсионного анализа (с апостериорным тестом Тьюки для множественных сравнений). Влияние ICA и тестов агрегации на процент агрегации тромбоцитов оценивали с помощью двустороннего дисперсионного анализа с повторными измерениями (с апостериорным тестом Сидака для множественных сравнений).Соотношения P-селектина между смесями PRP + Visipaque270® и PRP + Iopamiron® сравнивали с использованием непараметрического рангового критерия Уилкоксона для согласованных пар.
Данные представлены как среднее ± стандартное отклонение. Значение p менее 0,05 считалось значительным. Статистический анализ проводили с использованием статистического программного обеспечения SPSS (версия 21.
