Инвитро проба реберга: Проба Реберга (клиренс эндогенного креатинина, скорость клубочковой фильтрации, Glomerular filtration rate, GFR)
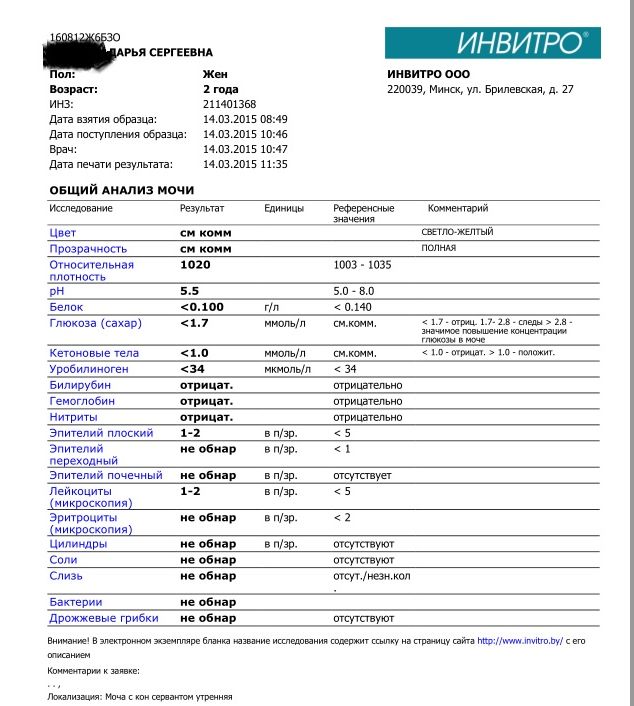
Требования к подготовке пациентов к процедуре сдачи мочи
D Сбор мочи для общего анализаВ Медицинском офисе ИНВИТРО получите контейнер с белой крышкой и пробирку с переходником. Накануне сдачи анализа рекомендуется не употреблять овощи и фрукты, которые могут изменить цвет мочи (свекла, морковь и пр.), не принимать диуретики. Перед сбором мочи надо произвести тщательный гигиенический туалет половых органов. Женщинам не рекомендуется сдавать анализ мочи во время менструации.
Соберите примерно 50 мл утренней мочи в контейнер (с белой крышкой). Для правильного проведения исследования при первом утреннем мочеиспускании небольшое количество мочи (первые 1 — 2 секунды) выпустить в унитаз, а затем, не прерывая мочеиспускания, подставить контейнер для сбора мочи, в который собрать приблизительно 50 мл мочи.
Сразу после сбора мочи плотно закройте контейнер завинчивающейся крышкой.
Доставить пробирку с мочой в Медицинский офис ИНВИТРО необходимо в течение дня (по графику приёма биоматериала). Если нет возможности сразу доставить мочу в Медицинский офис ИНВИТРО, то пробирку с мочой до доставки в лабораторию следует хранить при температуре +2…+8°С.
D Сбор суточной мочи для биохимического анализа Собирается моча за сутки. Первая утренняя порция мочи удаляется, засекается время. Все последующие порции мочи, выделенные в течение дня, ночи и утреннюю порцию, собранную через 24 часа, в аналогичное время следующего дня, собирают в одну чистую ёмкость, которая хранится в прохладном месте (+4…+8°С) в течение всего времени сбора.
До 10 утра (1-я 
Для проведения исследования необходимо получить в Медицинском офисе ИНВИТРО порошок-консервант и контейнер для мочи. Перед плановым сбором мочи в течение 3-х дней нельзя применять препараты, содержащие раувольфию, теофиллин, нитроглицерин, кофеин, этанол, если возможно, не принимать другие лекарственные средства, а также пищевые продукты, содержание серотонин (шоколад, сыры и другие молочные продукты, бананы), не употреблять алкоголь. Избегать физической нагрузки, стрессов, курения, болевых воздействий, которые вызывают физиологический подъём катехоламинов. Предварительно на дно чистой ёмкости, в которую будет собираться моча, высыпают консервант- порошок из полученной в Медицинском офисе ИНВИТРО пробирки. Опорожняют мочевой пузырь (эту порцию выливают), засекают время и собирают мочу в ёмкость с консервантом ровно в течение суток, последнее мочеиспускание в сосуд должно быть через 24 часа от засечённого времени (например, с 8.
В Медицинском офисе ИНВИТРО получите контейнер СКК (стерильный контейнер с крышкой, 30 мл). Моча должна быть собрана в чистый, не использованный ранее контейнер. Примеси гипохлорита, моющих средств и других веществ могут искажать результат.
Внимание! Немедленно после сбора, моча должна быть помещена в контейнер с плотной крышкой (СКК), предотвращающей испарение и окисление. Контейнер для сбора мочи следует заполнить полностью для предотвращения испарения под крышкой. Доставить контейнер в Медицинский офис ИНВИТРО в течение дня. Если нет возможности сразу доставить мочу в Медицинский офис ИНВИТРО, то контейнер с мочой следует хранить в холодильнике при +2…+8°С (не более 36 часов).
Доставить контейнер в Медицинский офис ИНВИТРО в течение дня. Если нет возможности сразу доставить мочу в Медицинский офис ИНВИТРО, то контейнер с мочой следует хранить в холодильнике при +2…+8°С (не более 36 часов).
Для сбора мочи обязательно проводится гигиеническая процедура. Открутить крышку и извлечь аппликатор с тампоном. Опустить губчатый тампон в образец мочи на 5 секунд, пока губка полностью не пропитается мочой или непосредственно помочиться на тампон. Вернуть аппликатор с тампоном в пробирку и плотно её закрыть. Произвести маркировку пробы на этикетке, находящейся на пробирке. Материал хранить при комнатной температуре. Внимание! Губку, находящуюся в пробирке не отжимать.
Проба Реберга (клиренс эндогенного креатинина)
Определение клиренса эндогенного креатинина – исследование, применяемое для оценки уровня клубочковой фильтрации.
Синонимы русские
Скорость клубочковой фильтрации, СКФ.
Синонимы английские
Test of renal function, creatinine clearance test, Rehberg test.
Метод исследования
Кинетический метод (метод Яффе).
Единицы измерения
Мкмоль/л (микромоль на литр), ммоль/сут. (миллимоль в сутки), мл (миллилитр), мл/мин. (миллилитр в минуту), % (проценты).
Какой биоматериал можно использовать для исследования?
Венозную кровь, суточную мочу.
Как правильно подготовиться к исследованию?
- Исключить из рациона алкоголь за 24 часа до исследования.
- Не принимать пищу в течение 12 часов до исследования.

- Не принимать мочегонные препараты в течение 48 часов до сбора мочи (по согласованию с врачом).
- Исключить физическое и эмоциональное перенапряжение за 24 часа до исследования.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Вся кровь человека сотни раз в день проходит через почки. Они пропускают жидкую часть крови через крохотные фильтры (нефроны), затем большая часть жидкости реабсорбируется обратно в кровь. Жидкие отходы, которые не реабсорбируются почками, удаляются из организма с мочой.
Креатинин (от греческого kreas – «плоть») – продукт распада креатинфосфата в мышечной ткани. Количество его в организме достаточно постоянно и зависит от мышечной массы человека. По химической структуре он является циклическим производным креатина.
Креатинин фильтруется из крови почками, и небольшое его количество активно выделяется с мочой. Канальцевая реабсорбция креатинина минимальна. Если фильтрующая способность почек недостаточна, то уровень креатинина в крови увеличивается. Зная уровни креатинина в моче и крови, можно вычислить клиренс креатинина, который отражает уровень клубочковой фильтрации. Клиренс креатинина (от англ. clearance – «очищение», т. е. очищение от креатинина, его выведение) – количество крови, которое почки могут очистить от креатинина за одну минуту. У здорового молодого человека он составляет около 125 мл в минуту, это значит, что его почки каждую минуту очищают от креатинина 125 мл крови.
Если фильтрующая способность почек недостаточна, то уровень креатинина в крови увеличивается. Зная уровни креатинина в моче и крови, можно вычислить клиренс креатинина, который отражает уровень клубочковой фильтрации. Клиренс креатинина (от англ. clearance – «очищение», т. е. очищение от креатинина, его выведение) – количество крови, которое почки могут очистить от креатинина за одну минуту. У здорового молодого человека он составляет около 125 мл в минуту, это значит, что его почки каждую минуту очищают от креатинина 125 мл крови.
Уровень клубочковой фильтрации – сумма уровней фильтрации во всех функционирующих нефронах. Этот показатель позволяет определить количество этих нефронов в почках. Он имеет важное клиническое значение, поскольку является основной характеристикой функции почек.
В случаях тяжелого нарушения функции почек клиренс креатинина повышается, поскольку при активной секреции креатинина выделяется его более крупная фракция.
Кетоновые кислоты, циметидин и триметоприм ограничивают канальцевую секрецию креатинина и снижают точность определения клубочковой фильтрации, особенно при тяжелой почечной недостаточности.
Клиренс креатинина можно определить двумя способами: измерением количества креатинина в крови человека и суточной моче. На практике чаще применяется анализ крови, поскольку это исследование удобнее для пациента.
Если у пациента низкий уровень клубочковой фильтрации, то лечащий врач разработает программу дополнительного обследования для выяснения причины этого патологического состояния. Основными причинами хронических болезней почек являются артериальная гипертония и сахарный диабет. Если они не выявлены, то необходимо дальнейшее обследование для выяснения причины заболевания почек.
Систематическое определение клиренса креатинина позволяет доктору следить за изменением функции почек пациента в динамике и корректировать медикаментозную терапию в зависимости от полученных данных.
Для чего используется исследование?
- Для оценки функции почек;
- для оценки динамики течения почечных заболеваний;
- для оценки функции почек у пациентов, принимающих нефротоксичные препараты;
- для выявления тяжелой дегидратации.

Когда назначается исследование?
- При выявлении у пациента болей в области почек, отеков вокруг глаз и на лодыжках, гипертонической болезни, пониженного количества мочи или проблем с мочеиспусканием, темной мочи, примеси крови в моче, синдрома Альпорта, амилоидоза, хронической почечной недостаточности, синдрома Кушинга, дерматомиозита, сахарного диабета, интоксикации сердечными гликозидами, генерализованных приступов тонико-клонических судорог, синдрома Гудпасчера, гемолитического уремического синдрома, гепаторенального синдрома, интерстициального нефрита, волчаночного нефрита, злокачественной артериальной гипертензии, мембранопролиферативного гломерулонефрита, тромбоцитопенической пурпуры, опухоли Вильмса (все вышеперечисленное – факторы, оказывающие влияние на работу почек).
Что означают результаты?
Референсные значения
Проба Реберга
- Креатинин в сыворотке
|
Пол |
Возраст |
Референсные значения |
|
Мужской |
Меньше 1 месяца |
21 — 75 мкмоль/л |
|
1 мес. |
15 — 37 мкмоль/л |
|
|
1-3 года |
21 — 36 мкмоль/л |
|
|
3-5 лет |
27 — 42 мкмоль/л |
|
|
5-7 лет |
28 — 52 мкмоль/л |
|
|
7-9 лет |
35 — 53 мкмоль/л |
|
|
9-11 лет |
34 — 65 мкмоль/л |
|
|
11-13 лет |
46 — 70 мкмоль/л |
|
|
13-15 лет |
50 — 77 мкмоль/л |
|
|
Больше 15 лет |
62 — 106 мкмоль/л |
|
|
Женский |
Меньше 1 месяца |
21 — 75 мкмоль/л |
|
1 мес. |
15 — 37 мкмоль/л |
|
|
1-3 года |
21 — 36 мкмоль/л |
|
|
3-5 лет |
27 — 42 мкмоль/л |
|
|
5-7 лет |
28 — 52 мкмоль/л |
|
|
7-9 лет |
35 — 53 мкмоль/л |
|
|
9-11 лет |
34 — 65 мкмоль/л |
|
|
11-13 лет |
46 — 70 мкмоль/л |
|
|
13-15 лет |
50 — 77 мкмоль/л |
|
|
Больше 15 лет |
44 — 80 мкмоль/л |
- Креатинин в суточной моче
|
Пол |
Референсные значения |
|
Женский |
5,3 — 15,9 ммоль/сут. |
|
Мужской |
7,1 — 17,7 ммоль/сут. |
- Клиренс креатинина
|
Пол |
Референсные значения |
|
Женский |
75 — 115 мл/мин. |
|
Мужской |
95 — 145 мл/мин. |
- Канальцевая реабсорбция: 95 — 99 %.
-
Скорость клубочковой фильтрации (CKD-EPI): > 60 мл/мин./1,73 м2.
-
Скорость клубочковой фильтрации (MDRD): > 60 мл/мин./1,73 м2.
-
Скорость клубочковой фильтрации (Коккфрофт-Гальт): > 60 мл/мин./1,73 м2.
-
Скорость клубочковой фильтрации (SCHWARTZ): > 60 мл/мин.
 /1,73 м2.
/1,73 м2.
Причины пониженного клиренса креатинина:
- острая почечная недостаточность,
- блок оттока мочи на уровне выходного отверстия мочевого пузыря,
- застойная сердечная недостаточность,
- дегидратация,
- хроническая почечная недостаточность,
- гломерулонефрит,
- шок,
- блок почек.
Причины повышенного клиренса креатинина:
- беременность,
- сахарный диабет, до развития диабетической нефропатии;
- большое количество белка в рационе.
Что может влиять на результат?
- Клиренс креатинина может увеличиваться при интенсивной физической нагрузке, предшествовавшей исследованию.
- Некоторые лекарственные препараты способствуют снижению клиренса креатинина (циметидин, триметаприм, прокаинамид, цефалоспорины, аминогликозиды и хинидин).
Важные замечания
- Клиренс креатинина снижается с возрастом (на 6,5 мл/мин.
 каждые 10 лет у людей старше 40 лет).
каждые 10 лет у людей старше 40 лет). - Кетоновые кислоты, циметидин и триметоприм ограничивают канальцевую секрецию креатинина и снижают точность определения клубочковой фильтрации, особенно при тяжелой почечной недостаточности.
- Для корректных результатов анализа очень важен полный сбор мочи.
Также рекомендуется
- Клинический и биохимический анализ крови — основные показатели
- Креатинин в сыворотке
- Креатинин в суточной моче
- Мочевина в сыворотке
- Мочевина в суточной моче
Кто назначает исследование?
Врач общей практики, терапевт, нефролог, уролог.
Литература
- Post TW, Rose BD: Assessment of renal function: plasma creatinine; BUN; and GFR. In UpTo Date 9.1. Edited by BD Rose. 2001
- Kasiske BL, Keane WF: Laboratory assessment of renal disease: clearance, urinalysis, and renal biopsy.
 In The Kidney. Sixth edition. Edited by BM Brenner. Philadelphia, WB Saunders Company, 2000, pp 1129-1170
In The Kidney. Sixth edition. Edited by BM Brenner. Philadelphia, WB Saunders Company, 2000, pp 1129-1170 - Landry DW, Bazari H. Approach to the patient with renal disease. In: Goldman L, Schafer AI, eds. Cecil Medicine. 24th ed. Philadelphia, Pa: Saunders Elsevier; 2011:chap 116.
- Pagana KD, Pagana TJ (2010). Mosby’s Manual of Diagnostic and Laboratory Tests, 4th ed. St. Louis: Mosby Elsevier.
Грудная клетка стабилизирует грудной отдел позвоночника человека: исследование in vitro с использованием ступенчатого уменьшения структур грудной клетки
Рисунок 1.
Шесть условий образца для биомеханического тестирования и анализа движения.
Препараты исследовали в интактном состоянии (1), после удаления межреберных мышц (2), после срединной стернотомии (3), после удаления передней части грудной клетки до культей (4), после удаления правой шестой, седьмой и головки восьмого ребра (5), а также после снятия всех головок ребра (6).
Подробнее »
РасширятьРис 2.
Экспериментальная тестовая установка.
Чистые моменты 2 Нм применялись при сгибании/разгибании, боковом изгибе и осевом вращении с использованием специально изготовленного тестера позвоночника [18]. Анализ движения выполнялся с помощью оптической системы слежения за движением с шестью камерами.
Подробнее »
РасширятьРис 3.
Процесс анализа движения.
Оптические маркеры были перенесены в облако точек. Относительные движения определяли путем ручной маркировки.
Подробнее »
РасширятьРис 4.
ВД грудного отдела позвоночника (Т1-12, n = 6) при чистом изгибающем моменте 2 Нм.
org»> ROM показан как среднее значение со стандартным отклонением для каждого неповрежденного состояния с целой грудной клеткой и состояния без целой грудной клетки во всех направлениях нагрузки.Подробнее »
РасширятьТаблица 1.
Диапазоны движений (ROM) и нейтральные зоны (NZ) грудного отдела позвоночника (T1-T12) показаны для условий одиночного препарата (IC = интактное состояние, W/o IM = без межреберных мышц, MST = после срединной стернотомии, W /o ARC = без передней грудной клетки, без RH 6–8 = без головок 6-8 правых ребер, без RH = без головок всех ребер) в плоскостях одиночного движения для чистого изгибающего момента 2 Нм (n = 6 ).
Подробнее »
РасширятьТаблица 2.
Диапазоны движений показаны для интактного состояния (= IC) и состояния без всей грудной клетки (= без RC) в отдельных плоскостях движения для всех функциональных единиц позвоночника и чистого изгибающего момента 2 Нм (n = 6). .
.
Подробнее »
РасширятьТаблица 3.
Объем движений грудного отдела позвоночника в паре (T1-T12, n = 6) показан для интактного состояния (= IC) и состояния без всей грудной клетки (= без RC) в шести основных направлениях нагрузки.
Подробнее »
РасширятьТаблица 4.
Сравнение прироста объема движений (%) после удаления передней части грудной клетки до культей ребер относительно интактного состояния с литературными данными.
Подробнее »
РасширятьТаблица 5.
Сравнение моносегментарного ПЗУ с литературными данными.
Подробнее »
РасширятьМетоды in vitro и другие альтернативы испытаниям на животных
Во время заседания правительства по поводу финансирования исследований бывший директор Национального института здравоохранения США д-р Элиас Зерхуни признался своим коллегам, что эксперименты на животных с целью помочь людям потерпели серьезную неудачу:
«Мы отказались от изучения человека болезнь у человека.
… Мы все выпили Kool-Aid, включая меня. … Проблема в том, что [тестирование на животных] не сработало, и нам пора перестать плясать вокруг этой проблемы. … Нам необходимо переориентировать и адаптировать новые методологии для использования на людях, чтобы понять биологию заболеваний у людей». — Д-р. Элиас Зерхуни
Сегодня, поскольку эксперименты на животных жестоки, отнимают много времени и, как правило, неприменимы к людям, самые дальновидные ученые мира разрабатывают и используют методы без использования животных, которые действительно имеют отношение к здоровью человека, для изучения болезней и тестирования. товары. Эти альтернативы испытаниям на животных включают сложные тесты с использованием клеток и тканей человека (также известные как методы in vitro ), передовые методы компьютерного моделирования (часто называемые in silico моделей) и исследования с участием добровольцев. Этим и другим методам, не использующим животных, не мешают различия видов, которые затрудняют или делают невозможным применение результатов испытаний на животных к людям, и обычно для их выполнения требуется меньше времени.
PETA и наши членские организации финансируют разработку многих из этих альтернатив испытаниям на животных, активно продвигают их использование среди правительств и компаний по всему миру и публикуют исследования об их превосходстве над традиционными испытаниями на животных.
Вот лишь несколько примеров многочисленных современных методов без использования животных и их продемонстрированных преимуществ: ”, которые содержат клетки человека, выращенные в современной системе, имитирующей структуру и функции органов и систем органов человека. Чипы можно использовать вместо животных в исследованиях болезней, тестировании лекарств и тестировании на токсичность, и было показано, что они более точно воспроизводят физиологию человека, болезни и реакцию на лекарства, чем грубые эксперименты на животных. Некоторые компании, такие как AlveoliX, MIMETAS и Emulate, Inc., уже превратили эти чипы в продукты, которые другие исследователи могут использовать вместо животных.
 Например, EpiDerm™ Tissue Model от MatTek Life Sciences представляет собой трехмерную модель, полученную из клеток человека, которую можно использовать вместо кроликов в болезненных, длительных экспериментах, которые традиционно использовались для оценки химических веществ на предмет их способности разъедать или раздражать кожу. кожа.
Например, EpiDerm™ Tissue Model от MatTek Life Sciences представляет собой трехмерную модель, полученную из клеток человека, которую можно использовать вместо кроликов в болезненных, длительных экспериментах, которые традиционно использовались для оценки химических веществ на предмет их способности разъедать или раздражать кожу. кожа. С помощью аппаратов VITROCELL клетки человека подвергаются воздействию переносимого по воздуху химического вещества с одной стороны, а с другой стороны получают питательные вещества из похожей на кровь жидкости, имитируя то, что на самом деле происходит, когда химическое вещество попадает в легкие человека. Эти устройства, а также EpiAlveolar могут заменить нынешний метод заключения крыс в крошечные трубки и принуждения их вдыхать токсичные вещества в течение нескольких часов, прежде чем они в конечном итоге погибнут.
С помощью аппаратов VITROCELL клетки человека подвергаются воздействию переносимого по воздуху химического вещества с одной стороны, а с другой стороны получают питательные вещества из похожей на кровь жидкости, имитируя то, что на самом деле происходит, когда химическое вещество попадает в легкие человека. Эти устройства, а также EpiAlveolar могут заменить нынешний метод заключения крыс в крошечные трубки и принуждения их вдыхать токсичные вещества в течение нескольких часов, прежде чем они в конечном итоге погибнут.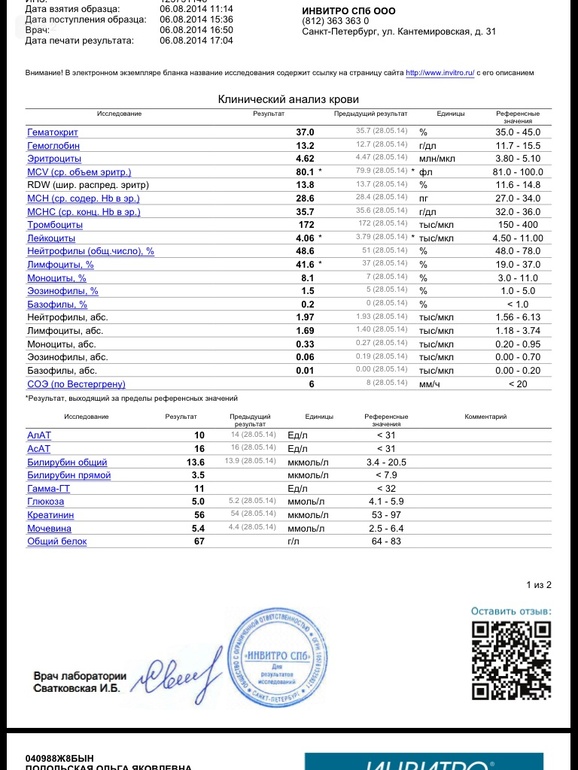
Попробуйте наш опыт дополненной реальности, чтобы узнать скрытую стоимость экспериментов на животных.
Начало опыта
Компьютер ( в силиконе ) Моделирование- Исследователи разработали широкий спектр сложных компьютерных моделей, которые имитируют биологию человека и развитие развивающихся заболеваний. Исследования показывают, что эти модели могут точно предсказать, как новые лекарства будут реагировать в организме человека, и заменят использование животных в поисковых исследованиях и во многих стандартных тестах на наркотики.

- Количественные соотношения структура-активность (QSAR) — это компьютерные методы, которые могут заменить тесты на животных путем проведения сложных оценок вероятности опасности того или иного вещества на основе его сходства с существующими веществами и наших знаний о биологии человека. Компании и правительства все чаще используют инструменты QSAR, чтобы избежать испытаний химических веществ на животных.
- Метод под названием «микродозирование» может предоставить жизненно важную информацию о безопасности экспериментального препарата и о том, как он метаболизируется у людей перед крупномасштабными испытаниями на людях. Добровольцам дают очень маленькую разовую дозу лекарства, и используются сложные методы визуализации для наблюдения за тем, как лекарство ведет себя в организме. Микродозирование может заменить определенные тесты на животных и помочь отсеять лекарственные соединения, которые не будут работать на людях, чтобы их никогда не тестировали на животных.

- Усовершенствованные методы визуализации и записи мозга, такие как функциональная магнитно-резонансная томография (фМРТ), с участием людей-добровольцев можно использовать для замены архаичных экспериментов, в которых крысам, кошкам и обезьянам повреждали мозг. Эти современные методы позволяют безопасно изучать мозг человека вплоть до уровня отдельного нейрона (как в случае внутричерепной электроэнцефалографии), и исследователи могут даже временно и обратимо вызывать нарушения мозга с помощью транскраниальной магнитной стимуляции.
Этот усовершенствованный симулятор TraumaMan был подарен PETA для замены использования животных в обучении Advanced Trauma Life Support.
- Поразительно реалистичные компьютеризированные симуляторы человека-пациента, которые дышат, истекают кровью, бьются в конвульсиях, разговаривают и даже «умирают», лучше обучают студентов физиологии и фармакологии, чем грубые упражнения, связанные с разделкой животных.
 Самые высокотехнологичные тренажеры имитируют болезни и травмы и дают соответствующую биологическую реакцию на медицинские вмешательства и инъекции лекарств. Все медицинские школы в США, Канаде и Индии полностью заменили использование лабораторий на животных в медицинском обучении симуляторами, а также системами виртуальной реальности, компьютерными симуляторами и контролируемым клиническим опытом.
Самые высокотехнологичные тренажеры имитируют болезни и травмы и дают соответствующую биологическую реакцию на медицинские вмешательства и инъекции лекарств. Все медицинские школы в США, Канаде и Индии полностью заменили использование лабораторий на животных в медицинском обучении симуляторами, а также системами виртуальной реальности, компьютерными симуляторами и контролируемым клиническим опытом. - Для более продвинутого медицинского обучения такие системы, как TraumaMan, которые имитируют дышащий, истекающий кровью человеческий торс и имеют реалистичные слои кожи и тканей, ребер и внутренних органов, широко используются для обучения неотложным хирургическим процедурам и, как показали многочисленные исследования, лучше обучать навыкам спасения жизней, чем на курсах, требующих, чтобы учащиеся разделывали живых свиней, коз или собак.
Несмотря на то, что ученые располагают самыми современными и эффективными методами, не связанными с животными, экспериментаторы все равно продолжают пытать бесчисленное количество животных.



 – 1 год
– 1 год – 1 год
– 1 год
 /1,73 м2.
/1,73 м2. каждые 10 лет у людей старше 40 лет).
каждые 10 лет у людей старше 40 лет).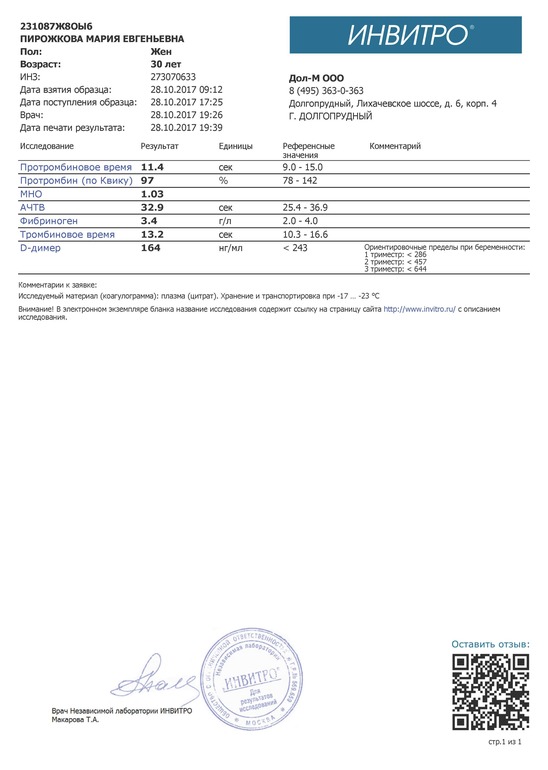 In The Kidney. Sixth edition. Edited by BM Brenner. Philadelphia, WB Saunders Company, 2000, pp 1129-1170
In The Kidney. Sixth edition. Edited by BM Brenner. Philadelphia, WB Saunders Company, 2000, pp 1129-1170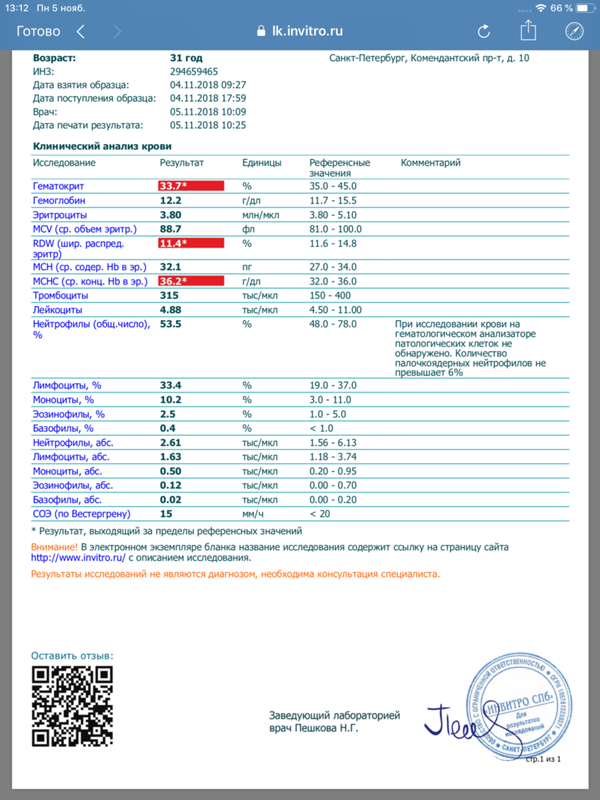 … Мы все выпили Kool-Aid, включая меня. … Проблема в том, что [тестирование на животных] не сработало, и нам пора перестать плясать вокруг этой проблемы. … Нам необходимо переориентировать и адаптировать новые методологии для использования на людях, чтобы понять биологию заболеваний у людей». — Д-р. Элиас Зерхуни
… Мы все выпили Kool-Aid, включая меня. … Проблема в том, что [тестирование на животных] не сработало, и нам пора перестать плясать вокруг этой проблемы. … Нам необходимо переориентировать и адаптировать новые методологии для использования на людях, чтобы понять биологию заболеваний у людей». — Д-р. Элиас Зерхуни 

 Самые высокотехнологичные тренажеры имитируют болезни и травмы и дают соответствующую биологическую реакцию на медицинские вмешательства и инъекции лекарств. Все медицинские школы в США, Канаде и Индии полностью заменили использование лабораторий на животных в медицинском обучении симуляторами, а также системами виртуальной реальности, компьютерными симуляторами и контролируемым клиническим опытом.
Самые высокотехнологичные тренажеры имитируют болезни и травмы и дают соответствующую биологическую реакцию на медицинские вмешательства и инъекции лекарств. Все медицинские школы в США, Канаде и Индии полностью заменили использование лабораторий на животных в медицинском обучении симуляторами, а также системами виртуальной реальности, компьютерными симуляторами и контролируемым клиническим опытом.