Кахексия это в медицине: Кахексия при раке — описание и причины
Кахексия – статьи о здоровье
Кахексия представляет собой крайнее истощение организма. Для такого заболевания характерна резкая потеря веса. Оно встречается при различных состояниях и патологиях. Кахексия бывает первичной и вторичной.
Зачастую кахексия выступает в качестве осложнения других болезней. Но и она может привести к появлению тяжелых последствий, таких как: дефицит витаминов, который приводит к нарушению зрения, сухости кожных покровов и слизистых оболочек, снижению костной плотности (высокий уровень травматизма), появлению кровотечений. А также кома, заражение крови с нарушением работы разных внутренних органов и систем организма ребёнка.
На фоне почечной и сердечной недостаточности, кровотечений в желудке и кишечнике также может развиться кахексия.
Причины и симптомы
Существует несколько факторов, которые приводят к развитию кахексии. Это голодание, отсутствие аппетита, нервная анорексия, приём низкокалорийной пищи, например, при диете, посте, онкологические болезни, новообразования, которые имеют разную локализацию, болезни, которые связаны с нарушением поступления пищи. Также причиной могут быть болезни желудочно-кишечного тракта, в результате которых еда не всасывается должным образом, отравление тяжёлой формы, условия жизни, психические болезни, которые связаны с приёмом пищи, болезни эндокринной системы, хронические патологии почек, лёгких, сердца, воспалительные процессы в печени.
Также причиной могут быть болезни желудочно-кишечного тракта, в результате которых еда не всасывается должным образом, отравление тяжёлой формы, условия жизни, психические болезни, которые связаны с приёмом пищи, болезни эндокринной системы, хронические патологии почек, лёгких, сердца, воспалительные процессы в печени.
Для заболевания характерно уменьшение веса. У ребёнка нарушается режим сна, появляется слабость, снижается работоспособность. Также возникает слабость в мышцах, что приводит к снижению работоспособности. Ребёнку становится трудно заниматься спортом, физкультурой. Больной часто инфицируется. Витамины поступают в организм в маленьком количестве.
Диагностика
Анализируется история заболевания, собираются жалобы. Диагноз нередко ставиться на основе физикального осмотра. Измеряется масса и индекс массы тела. Также определяется, насколько толстая жировая клетчатка. У ребёнка оценивается тугость кожи, слизистых оболочек. Делаются измерения мышечной силы.
Используются инструментальные и точные лабораторные методы. Проводятся такие исследования, как: анализ крови, посев крови при наличии заражения, анализ мочи, УЗИ, МРТ, КТ, рентген.
Проводятся такие исследования, как: анализ крови, посев крови при наличии заражения, анализ мочи, УЗИ, МРТ, КТ, рентген.
В процессе обследования ребёнка может консультировать невролог, гастроэнтеролог.
Лечение
Лечение подбирается в индивидуальном порядке и зависит от того, что привело к заболеванию, возраста и общего состояния пациента. В первую очередь больной должен получать полноценное питание. Врач может назначить специальные смеси, которые в большом количестве содержат питательные вещества, комплекс витаминов, полезные микроэлементы. Вводиться они могут разными способами.
Энтеральный путь, в процессе которого пища поступает сразу в детский желудок.Парентеральный путь – вливание смесей внутривенно. Он применяется при ярко выраженном истощении, онкологических болезнях и других тяжёлых патологиях.
Медикаментозное лечение является одним из основных направлений в борьбе с заболеванием. Ребенку назначаются препараты для возмещения недостатка витаминов в организме пациента. Ферментные средства для улучшения пищеварительного процесса. При наличии инфекционного процесса приписываются антибактериальные лекарства.
Ферментные средства для улучшения пищеварительного процесса. При наличии инфекционного процесса приписываются антибактериальные лекарства.
В терапию может входить курс гормонов роста, специальные медикаменты, провоцирующие аппетит.
Могут проводиться занятия с психотерапевтом и психологом. При нарушении работы внутренних органов, назначается курс для восстановления и нормализации их работы.
Профилактика
В первую очередь должны вовремя и эффективно лечиться все болезни, которые предрасполагают к кахексии. Родителям рекомендуется пропагандировать здоровый образ жизни и здоровое питание. Ребёнок должен знать, как эти факторы важны. Правильно и сбалансировано питаясь, можно избежать истощения.
причины, симптомы, диагностика и лечение
Кахексия – это крайняя степень истощения, комплексный метаболический синдром, который проявляется уменьшением объема мышечной ткани с или без потери жировой ткани. Заболевание возникает под действием экзогенных факторов ‒ дефицита поступления нутриентов либо эндогенных причин (тяжелые формы соматических патологий, психические расстройства). Помимо резкого похудения, при кахексии наблюдается мышечная слабость, потеря трудоспособности, астенический синдром. Диагностика включает антропометрию и лабораторные анализы. Лечение требует индивидуальной схемы нутритивной поддержки, комплексной этиопатогенетической терапии основного заболевания.
Помимо резкого похудения, при кахексии наблюдается мышечная слабость, потеря трудоспособности, астенический синдром. Диагностика включает антропометрию и лабораторные анализы. Лечение требует индивидуальной схемы нутритивной поддержки, комплексной этиопатогенетической терапии основного заболевания.
Общие сведения
Кахексию диагностируют при снижении массы тела на 30% и более от идеальной для человека данного возраста и роста, либо при значении индекса массы тела (ИМТ) менее 16-17 кг/м2. Она признана мультидисциплинарной проблемой, встречается среди пациентов любого профиля и значительно осложняет течение основного заболевания. Смертность госпитализированных больных с соматической патологией и истощением увеличивается на 50% при прочих равных условиях. В медицине также используются синонимичные термины: гипотрофия, нутритивная или белково-энергетическая недостаточность.
Кахексия
Причины кахексии
Истощение считается первичным заболеванием, когда оно формируется вследствие недостатка питательных компонентов, либо вторичным синдромом, который возникает при разнообразных соматических и психических болезнях. Первичная форма кахексии связана с вынужденным или осознанным голоданием, тяжелыми авитаминозами, низкой калорийностью рациона у вегетарианцев, соблюдающих религиозные посты, желающих быстро снизить вес. Другие экзогенные факторы:
Первичная форма кахексии связана с вынужденным или осознанным голоданием, тяжелыми авитаминозами, низкой калорийностью рациона у вегетарианцев, соблюдающих религиозные посты, желающих быстро снизить вес. Другие экзогенные факторы:
- тяжелая физическая работа, особенно в условиях жаркого климата и недостатка калорийности питания;
- продолжительное психоэмоциональное напряжение, потеря аппетита на фоне постоянных переживаний, повышенной тревожности;
- вредные привычки – употребление наркотических и токсических веществ, бытовое пьянство и алкоголизм.
- Инфекционные заболевания.
 Чаще всего к истощению приводит острые кишечные инфекции, гельминтозы, хроническая малярия. Потеря веса типична для туберкулеза с поражением брыжеечных лимфоузлов, сифилиса, терминальных стадий ВИЧ-инфекции. Длительная высокая лихорадка при отсутствии медицинской помощи также чревата кахексией.
Чаще всего к истощению приводит острые кишечные инфекции, гельминтозы, хроническая малярия. Потеря веса типична для туберкулеза с поражением брыжеечных лимфоузлов, сифилиса, терминальных стадий ВИЧ-инфекции. Длительная высокая лихорадка при отсутствии медицинской помощи также чревата кахексией. - Злокачественные опухоли. Истощение со временем развивается у всех онкологических пациентов, причем у половины из них наблюдается жизнеугрожающий синдром CACS (cancer anorexia-cachexia syndrome). При новообразованиях ЖКТ риск раковой кахексии составляет 80%, бронхолегочной системы – до 60%, молочной железы – около 40%.
- Болезни ЖКТ. Проблема связана с невозможностью поступления пищи на фоне стриктуры пищевода, эзофагита, пилоростеноза. Зачастую встречается синдром мальабсорбции и мальдигестии, вызванный хроническим энтероколитом, гепатитом, панкреатитом. Реже истощение обусловлено болезнью Крона, неспецифическим язвенным колитом, болезнью Уиппла.

- Эндокринные нарушения. Резкое похудение является ключевым симптомом послеродового гипопитуитаризма, гипофизарной кахексии, тиреотоксического зоба. Истощение развивается при декомпенсированном сахарном диабете 1 типа, диабетической энтеропатии, хронической надпочечниковой недостаточности.
- Другие соматические болезни. Распространенными причинами проблемы считаются кардиоваскулярные болезни, хроническая почечная недостаточность (ХПН), ХОБЛ и сердечно-легочная недостаточность. Около 60% больных ревматоидным артритом сталкиваются с кахексией, вызванной постоянным избытком цитокинов в сыворотке крови.
- Психогенные факторы. Вторичная анорексия и связанная с ней кахексия считаются типичным проявлением эндогенной депрессии, истерии, шизофрении и шизоаффективных расстройств. Состояние связано с нарушениями центральной регуляции процессов голода и насыщения, разнообразными метаболическими расстройствами.
Патогенез
В развитии кахексии выделяют несколько механизмов, которые зачастую сочетаются и осложняют течение заболевания. Помимо дефицита поступления питательных компонентов извне, недостаток нутриентов может быть вызван нарушениями переваривания пищи при гастроэнтерологических патологиях, патологически ускоренным катаболизмом, повышенными энергозатратами.
Помимо дефицита поступления питательных компонентов извне, недостаток нутриентов может быть вызван нарушениями переваривания пищи при гастроэнтерологических патологиях, патологически ускоренным катаболизмом, повышенными энергозатратами.
Инициальную роль в потере веса играет активация провоспалительных цитокинов и гуморальный дисбаланс, при котором в организме активируются катаболические гормоны: катехоламины, глюкокортикоиды, глюкагон. Они угнетают синтез белка, вызывают стероидную миопатию, нарушают толерантность глюкозе. Повышенный уровень цитокинов усугубляет гиперкатаболические процессы.
В результате при кахексии наблюдается мобилизация всех видов энергоресурсов из жировых депо и мышечной ткани, усиливаются глюконеогенез, липолиз и свободно-радикальное окисление. На фоне снижения уровня нейропептида Y подавляются пластические процессы, ресурсы перераспределяются в пользу инсулиннезависимых тканей: структур ЦНС, глазных яблок, мозгового вещества надпочечников.
Наблюдаются нозологические особенности, характерные для первичной соматической патологии. При хронической сердечной недостаточности состояние усугубляется вследствие мальабсорбции на фоне венозного застоя в кишечнике, катаболически-анаболического дисбаланса и дигиталисного отравления. Значимой причиной истощения при онкопатологии является метаболическое обкрадывание организма, при ХПН ключевую роль играет уремическая интоксикация.
Кахексия
Классификация
Согласно критериям W. J. Evans (2008), для диагностики заболевания необходима потеря веса свыше 5% от исходного значения за последние 12 месяцев, что сопровождается снижением мышечной силы, постоянной усталостью, отсутствием аппетита. По причинам возникновения кахексия подразделяется на сердечную, гипофизарную, алиментарную и лекарственную. В отдельную группу выделяют раковую кахексию, которая имеет 3 стадии (Fearon, 2011):
- Прекахексия. Проявляется потерей веса более 5% в течение полугода при наличии анорексии и негативных метаболических изменений.

- Кахексия. Диагностируется при похудении на 5% от исходного веса за 6 месяцев, либо при ИМТ менее 20 кг/м2 и потере веса >2%, либо при саркопении и снижении веса >2%. Симптоматика дополняется системным воспалительным синдромом.
- Рефрактерная кахексия. Проявляется критическим похудением при наличии выраженного синдрома катаболизма, отсутствии эффекта противоопухолевого лечения, низкой оценке общего состояния (ECOG).
Симптомы кахексии
Настораживающим признаком считается снижение веса на 5% от исходного значения, если это происходит без видимой причины. Люди, которые не следят за массой тела и не проводят регулярное взвешивание, замечают проблему только при выраженном похудении на один размер и более по изменению отражения в зеркале, слишком свободной посадке одежды. При этом черты лица заостряются, выступают кости ключиц, ребер, таза.
При кахексии кожа становится сухой и морщинистой, принимает желтушный или землисто-серый оттенок, может покрываться пигментными пятнами. Нутритивная недостаточность сопровождается выпадением волос, ломкостью и замедленным ростом ногтей. Наблюдается стремительная потеря жировой и мышечной массы, быстро уменьшаются объемы тела.
Нутритивная недостаточность сопровождается выпадением волос, ломкостью и замедленным ростом ногтей. Наблюдается стремительная потеря жировой и мышечной массы, быстро уменьшаются объемы тела.
Человек ощущает постоянную слабость и снижение работоспособности, быстро утомляется при незначительных физических нагрузках, замечает резкое уменьшение мышечной силы. На фоне нутритивной недостаточности развивается головокружение, сонливость, предобморочные состояния. Характерны парестезии в руках или ногах, повышенная чувствительность холоду, постоянно пониженная температура тела на 1-1,5°С.
Кахексия зачастую сопровождается симптомами поражения ЖКТ, такими как снижение или полное отсутствие аппетита, тошнота и рвота, метеоризм. Нарушения стула проявляются по типу тяжелой или хронической диареи, продолжительных запоров, изменения цвета, консистенции и запаха каловых масс. Состояние усугубляется костными и суставными болями, дискомфортом в области сердца, артериальной гипотензией.
Клиническая картина при кахексии разнообразна и определяется первопричиной данного синдрома. Резкое похудение на фоне относительного здоровья — типичное проявление эндокринных синдромов, медленно прогрессирующее снижение веса более характерно для соматических заболеваний в стадии декомпенсации. При первичном истощении возможно парадоксальное повышение массы тела вследствие массивных отеков (квашиоркор).
Осложнения
Кахексия признана неблагоприятным прогностическим фактором для госпитализированных пациентов. Доказано, что при снижении веса на 5% длительность стационарного лечения возрастает в 2 раза, вероятность появления осложнений — в 3,3 раза. При уменьшении ИМТ менее 19 кг/м2 смертность резко увеличивается во всех возрастных группах больных, быстрая потеря массы тела на 45-50% от нормы является фатальной.
Патологическое похудение сопровождается уменьшением массы внутренних органов вследствие тяжелых дистрофических изменений. Сокращаются висцеральные жировые запасы, нарушается минеральный обмен, развивается тяжелый остеопороз и остеомаляция. При кахексии падает сердечный выброс, снижается сила сокращений миокарда, возникает интерстициальный отек сердца.
Сокращаются висцеральные жировые запасы, нарушается минеральный обмен, развивается тяжелый остеопороз и остеомаляция. При кахексии падает сердечный выброс, снижается сила сокращений миокарда, возникает интерстициальный отек сердца.
Опасным осложнениям является угнетение иммунной системы: уменьшение числа и активности Т-лимфоцитов, изменение свойств В-лимфоцитов, дисфункция системы комплемента. Наряду с потерей веса возникают неврологические симптомы: глазодвигательные нарушения, подкорковые гиперкинезы, расстройства функций органов малого таза. У взрослых наблюдается ухудшение когнитивных возможностей, у детей — задержка роста и психомоторного развития.
Диагностика
Обследование пациентов проводится врачом-терапевтом либо узкопрофильным специалистом с учетом основного заболевания. Диагностический поиск начинают со сбора жалоб и анамнеза, выяснения характера питания и условий проживания, детального физикального осмотра больного. На первом этапе для установления факта истощения назначаются следующие методы исследования:
- Антропометрия.
 Быстрая оценка нутритивного статуса проводится с помощью определения ИМТ. Дополнительно применяются измерения окружности мышц плеча, толщины подкожно-жировой складки, оценка количества тощей массы тела и жировой ткани, которая в норме составляет до 23% от общего веса.
Быстрая оценка нутритивного статуса проводится с помощью определения ИМТ. Дополнительно применяются измерения окружности мышц плеча, толщины подкожно-жировой складки, оценка количества тощей массы тела и жировой ткани, которая в норме составляет до 23% от общего веса. - Лабораторные анализы. При кахексии определяется снижение уровня альбуминов менее 35 г/л, уменьшение абсолютного количества лимфоцитов <1,6х10*9/л. Характерно снижение экскреции креатинина менее 70% от нормы. Для исключения эндокринных причин выполняется расширенный гормональный профиль.
Второй этап диагностического поиска – обнаружение первопричины кахексии. С этой целью назначаются инструментальные методы: УЗИ органов брюшной полости и малого таза, ЭКГ и ЭхоКГ, компьютерная и магнитно-резонансная томография. Для уточнения этиологии могут использовать эндоскопию (ЭФГДС, колоноскопия), диагностическую лапароскопию. По показаниям к обследованию привлекают гастроэнтеролога, эндокринолога, невролога и психиатра.
Нутритивная поддержка при кахексии
Лечение кахексии
Нутритивная поддержка
Восполнение дефицита питательных веществ является обязательным элементом лечебных мероприятий. С помощью коррекции питания удается восстановить метаболические и структурно-функциональные процессы в организме, нормализовать гомеостаз, пополнить адаптационные резервы. В зависимости от конкретной клинической ситуации назначаются следующие виды нутритивной поддержки:
- Базисная. Проводится для обеспечения человека основными макро- и микронутриентами с учетом индивидуальных физиологических потребностей.
- Актуальная. Предполагает применение насыщенных питательных смесей, которые ускоряют нормализацию пищевого статуса.
- Вспомогательная. Направлена на ликвидацию авитаминозов и микроэлементного дефицита, которые встречаются у всех больных с кахексией.
Методом выбора является энтеральное питание как наиболее физиологичный способ попадания пищевых веществ в организм. При неспособности пациента принимать пищу используются назогастральные зонды. Ведение больных в крайне тяжелом состоянии предполагает парентеральное питание путем внутривенного введения инфузионных растворов. Для нутритивной поддержки используются полуэлементные или высокомолекулярные сбалансированные смеси.
При неспособности пациента принимать пищу используются назогастральные зонды. Ведение больных в крайне тяжелом состоянии предполагает парентеральное питание путем внутривенного введения инфузионных растворов. Для нутритивной поддержки используются полуэлементные или высокомолекулярные сбалансированные смеси.
Фармакотерапия
Эффективное лечение вторичной кахексии невозможно без коррекции ее первопричины, поэтому одновременно с нутритивной поддержкой применяется этиотропная терапия. Программа лечения назначается индивидуально с учетом выявленных соматических нарушений, общего состояния пациента, наличия неврологических осложнений. В дополнение к этиопатогенетическим препаратам используются следующие лекарства:
- Стимуляторы аппетита. Средства показывают хорошую эффективность у больных раковой и старческой кахексией, кратковременные курсы назначаются пациентам с терминальной ВИЧ-инфекцией.
- Анаболические препараты. Для снижения темпов потери массы тела и нормализации метаболических реакций используется инсулин, аденозинтрифосфат, некоторые половые стероиды.

- Ингибиторы цитокинов. Лекарства применяются в рамках экспериментальной терапии для угнетения свободно-радикальных реакций, коррекции патогенетических механизмов кахексии. Иногда с этой целью назначают селективные НПВС.
- Ингибиторы АПФ. Препараты повышают уровень инсулиноподобного фактора роста 1 (ИФР-1), что важно для увеличения мышечной силы, улучшения белкового обмена в тканях.
Прогноз и профилактика
Нутритивная поддержка при кахексии дает временный эффект в виде повышения качества жизни пациентов. При первичной форме истощения своевременная медицинская помощь позволяет полностью устранить проблему. При вторичном патологическом похудении прогноз определяется степенью тяжести основного заболевания. Профилактика кахексии заключается в своевременной диагностике и коррекции соматических патологий.
Лечение кахексии в онкологии
1. Evans WJ, Morley JE, Argiles J, Bales C, Baracos V, Guttridge D, et al. Кахексия: новое определение. Клин Нутр. 2008; 27: 793–9. [PubMed] [Google Scholar]
Кахексия: новое определение. Клин Нутр. 2008; 27: 793–9. [PubMed] [Google Scholar]
2. Томас Д.Р. Потеря массы скелетных мышц при старении: изучение взаимосвязи голодания, саркопении и кахексии. Клин Нутр. 2007; 26: 389–99. [PubMed] [Google Scholar]
3. Boddaert MS, Gerritsen WR, Pinedo HM. На пути к таргетной терапии кахексии при раке? Curr Opin Oncol. 2008;18:335–40. [PubMed] [Академия Google]
4. Loprinzi CL, Ellison NM, Schaid DJ, Krook JE, Athmann LM, Dose AM, et al. Контролируемое исследование мегестрола ацетата для лечения раковой анорексии и кахексии. J Natl Cancer Inst. 1998; 82: 1127–32. [PubMed] [Google Scholar]
5. Loprinzi CL, Kugler JW, Sloan JA, Mailliard JA, Krook JE, Wilwerding MB, et al. Рандомизированное сравнение мегестрола ацетата, дексаметазона и флуоксиместерона для лечения раковой анорексии/кахексии. Дж. Клин Онкол. 1999;17:3299–306. [PubMed] [Академия Google]
6. Jatoi A, Windschitl HE, Loprinzi CL, Sloan JA, Dakhil SR, Mailliard JA, et al. Дронабинол против мегестрола ацетата против комбинированной терапии анорексии, связанной с раком: исследование Северной центральной группы по лечению рака. Дж. Клин Онкол. 2002; 20: 567–73. [PubMed] [Google Scholar]
Дронабинол против мегестрола ацетата против комбинированной терапии анорексии, связанной с раком: исследование Северной центральной группы по лечению рака. Дж. Клин Онкол. 2002; 20: 567–73. [PubMed] [Google Scholar]
7. Mantovani G, Maccio A, Massa E, Madeddu C. Лечение анорексии/кахексии, связанной с раком. Наркотики. 2001; 61: 499–514. [PubMed] [Google Scholar]
8. Mantovani G, Macciò A, Bianchi A, Curreli L, Ghiani M, Santona MC, et al. Мегестрола ацетат при неопластической анорексии/кахексии: клиническая оценка и сравнение уровней цитокинов у пациентов с карциномой головы и шеи, получавших неоадъювантную химиотерапию. Int J Clin Lab Res. 1995;25:135–41. [PubMed] [Google Scholar]
9. Mantovani G, Macciò A, Esu S, Lai P, Santona MC, Massa E, et al. Медроксипрогестерона ацетат снижает in vitro продукцию цитокинов и серотонина, участвующих в анорексии/кахексии и рвоте мононуклеарными клетками периферической крови онкологических больных. Евр Джей Рак. 1999; 33: 602–7. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
10. Simons JP, Schols AM, Hoefnagels JM, Westerterp KR, ten Velde GP, Wouters EF. Влияние ацетата медроксипрогестерона на потребление пищи, состав тела и расход энергии в состоянии покоя у пациентов с прогрессирующим, нечувствительным к гормонам раком: рандомизированное плацебо-контролируемое исследование. Рак. 1998;82:553–60. [PubMed] [Google Scholar]
11. Беренштейн Э.Г., Ортиз З. Мегестрола ацетат для лечения синдрома анорексиикахексии. Кокрановская система базы данных, ред. 2005: CD004310. [PubMed] [Google Scholar]
12. Femia RA, Goyette RE. Наука о доставке ацетата мегестрола: потенциал для улучшения исходов при кахексии. Биопрепараты. 2005; 19: 179–87. [PubMed] [Google Scholar]
13. Moertel CG, Schutt AJ, Reitemeier RJ, Hahn RG. Кортикостероидная терапия претерминального рака желудочно-кишечного тракта. Рак. 1974;33:1607–1609. [PubMed] [Google Scholar]
14. Willox JC, Corr J, Shaw J, Richardson M, Calman KC, Drennan M. Преднизолон как стимулятор аппетита у больных раком. Br Med J (Clin Res Ed) 1984; 288:27. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Преднизолон как стимулятор аппетита у больных раком. Br Med J (Clin Res Ed) 1984; 288:27. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. Fearon KC, Von Meyenfeldt MF, Moses AG, Van Geenen R, Roy A, Gouma DJ, et al. Влияние пероральной добавки, обогащенной белком и жирными кислотами N-3, на потерю веса и мышечной ткани при раковой кахексии: рандомизированное двойное слепое исследование. Кишка. 2003;52:1479–86. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Jatoi A, Rowland K, Loprinzi CL, Sloan JA, Dakhil SR, MacDonald N, et al. Добавка эйкозапентаеновой кислоты по сравнению с ацетатом мегестрола по сравнению с обоими для пациентов с истощением, связанным с раком: совместные усилия Северо-центральной группы по лечению рака и Национального института рака Канады. Дж. Клин Онкол. 2004; 22:2469–76. [PubMed] [Google Scholar]
17. Fearon KC, Barber MD, Moses AG, Ahmedzai SH, Taylor GS, Tisdale MJ, et al. Двойное слепое плацебо-контролируемое рандомизированное исследование диэфира эйкозапентаеновой кислоты у больных раковой кахексией. Дж. Клин Онкол. 2006; 24:3401–7. [PubMed] [Академия Google]
Дж. Клин Онкол. 2006; 24:3401–7. [PubMed] [Академия Google]
18. Dewey A, Baughan C, Dean T, Higgins B, Johnson I. Эйкозапентаеновая кислота (EPA, жирная кислота омега-3 из рыбьего жира) для лечения раковой кахексии. Кокрановская система базы данных, ред. 2007: CD004597. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Strasser F, Luftner D, Possinger K, Ernst G, Ruhstaller T, Meissner W, et al. Сравнение перорально вводимого экстракта каннабиса и дельта-9-тетрагидроканнабинола при лечении пациентов с синдромом анорексии-кахексии, связанным с раком: многоцентровое рандомизированное двойное слепое плацебо-контролируемое клиническое исследование фазы III исследования Cannabis-In-Cachexia. -Группа. Дж. Клин Онкол. 2006;24:3394–400. [PubMed] [Google Scholar]
20. Jatoi A, Alberts SR, Foster N, Morton R, Burch P, Block M, et al. Бортезомиб, ингибитор протеасом, эффективен при лечении потери веса, связанной с раком? Предварительные результаты Северо-центральной группы по лечению рака. Поддержите уход за раком. 2005; 13: 381–6. [PubMed] [Google Scholar]
Поддержите уход за раком. 2005; 13: 381–6. [PubMed] [Google Scholar]
21. Wiedenmann B, Malfertheiner P, Friess H, Ritch P, Arseneau J, Mantovani G, et al. Многоцентровое исследование фазы II комбинации инфликсимаба и гемцитабина при кахексии рака поджелудочной железы. J Поддержка Онкол. 2008; 6:18–25. [PubMed] [Академия Google]
22. Гордон Дж. Н., Треббл Т. М., Эллис Р. Д., Дункан Х. Д., Джонс Т., Гоггин П. М. Талидомид в лечении раковой кахексии: рандомизированное плацебо-контролируемое исследование. Кишка. 2005; 54: 540–5. [Бесплатная статья PMC] [PubMed] [Google Scholar]
23. Lai V, George J, Richey L, Kim HJ, Cannon T, Shores C, et al. Результаты пилотного исследования влияния целекоксиба на раковую кахексию у больных раком головы, шеи и желудочно-кишечного тракта. Шея головы. 2008; 30: 67–74. [PubMed] [Академия Google]
24. ДеБоер, доктор медицины. Появление грелина для лечения синдромов кахексии. Питание. 2008; 24:806–14. [PubMed] [Google Scholar]
25. Strasser F, Lutz TA, Maeder MT, Thuerlimann B, Bueche D, Tschöp M, et al. Безопасность, переносимость и фармакокинетика внутривенного введения грелина при анорексии/кахексии, связанной с раком: рандомизированное, плацебо-контролируемое, двойное слепое, двойное перекрестное исследование. Бр Дж Рак. 2008; 98:300–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Strasser F, Lutz TA, Maeder MT, Thuerlimann B, Bueche D, Tschöp M, et al. Безопасность, переносимость и фармакокинетика внутривенного введения грелина при анорексии/кахексии, связанной с раком: рандомизированное, плацебо-контролируемое, двойное слепое, двойное перекрестное исследование. Бр Дж Рак. 2008; 98:300–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. Neary NM, Small CJ, Wren AM, Lee JL, Druce MR, Palmieri C, et al. Грелин увеличивает потребление энергии у онкологических больных с нарушением аппетита: острое, рандомизированное, плацебо-контролируемое исследование. J Clin Endocrinol Metab. 2004;89: 2832–6. [PubMed] [Google Scholar]
27. Garcia J. Рандомизированное плацебо-контролируемое двойное слепое исследование II фазы эффективности и безопасности RC-1291 (RC) для лечения раковой кахексии. Дж. Клин Онкол. 2007; 25: 5679–88. [Google Scholar]
28. Lundholm K, Körner U, Gunnebo L, Sixt-Ammilon P, Fouladiun M, Daneryd P, et al. Лечение инсулином при раковой кахексии: влияние на выживаемость, обмен веществ и физическое функционирование. Клин Рак Рез. 2007; 13: 2699–706. [PubMed] [Академия Google]
Клин Рак Рез. 2007; 13: 2699–706. [PubMed] [Академия Google]
29. Лавиано А., Мускаритоли М., Каскино А., Прециоза И., Инуи А., Мантовани Г. и соавт. Аминокислоты с разветвленной цепью: лучший компромисс для достижения анаболизма? Curr Opin Clin Nutr Metab Care. 2005; 8: 408–14. [PubMed] [Google Scholar]
30. Eley HL, Russell ST, Tisdale MJ. Влияние аминокислот с разветвленной цепью на мышечную атрофию при раковой кахексии. Биохим Дж. 2007;407:113–20. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. van Norren K, Kegler D, Argilés JM, Luiking Y, Gorselink M, Laviano A, et al. Пищевые добавки со специальной комбинацией высокого содержания белка, лейцина и рыбьего жира улучшают мышечную функцию и повседневную активность у кахектичных мышей с опухолями. Бр Дж Рак. 2009 г.;100:713–22. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Lesser G, Case D, Ottery F, et al. Встреча АСКО. Рандомизированное исследование фазы III, сравнивающее влияние оксандролона (Ox) и мегестрола ацетата (Meg) на безжировую массу тела (LBM), вес (wt) и качество жизни (QOL) у пациентов с солидными опухолями и потерей веса, получающих химиотерапию. Proc Am Soc Clin Onc. 2008;26:505с. [Google Scholar]
Proc Am Soc Clin Onc. 2008;26:505с. [Google Scholar]
33. Braiteh F, Dalal S, Khuwaja A, David H, Bruera E, Kurzrock R. Фаза I пилотного исследования безопасности и переносимости оланзапина (ОЗА) для лечения кахексии у пациентов с распространенным раком. . Дж. Клин Онкол. 2008;26:196–203. [Google Scholar]
34. Argiles JM, Lopez-Soriano FJ, Busquets S. Новые подходы к лечению кахексии. Наркотиков Дисков сегодня. 2008; 13:73–78. [PubMed] [Google Scholar]
35. Cerchietti LC, Navigante AH, Peluffo GD, Diament MJ, Stillitani I, Klein SA, et al. Влияние целекоксиба, медроксипрогестерона и диетического вмешательства на системные синдромы у пациентов с аденокарциномой легкого на поздних стадиях: пилотное исследование. J Управление симптомами боли. 2004; 27:85–95. [PubMed] [Академия Google]
36. Cerchietti LC, Navigante AH, Castro MA. Влияние эйкозапентаеновой и докозагексаеновой n-3 жирных кислот из рыбьего жира и преимущественное ингибирование ЦОГ-2 на системные синдромы у пациентов с распространенным раком легких. Нутр Рак. 2007; 59:14–20. [PubMed] [Google Scholar]
Нутр Рак. 2007; 59:14–20. [PubMed] [Google Scholar]
37. Mantovani G, Madeddu C, Macciò A, Gramignano G, Lusso MR, Massa E, et al. Связанный с раком синдром анорексии/кахексии и окислительный стресс: инновационный подход, выходящий за рамки текущего лечения. Эпидемиологические биомаркеры рака Prev. 2004; 13:1651–9.. [PubMed] [Google Scholar]
38. Mantovani G, Macciò A, Madeddu C, Gramignano G, Lusso MR, Serpe R, et al. Исследование фазы II с антиоксидантами, как в рационе, так и в добавках, фармакопитательной поддержке, прогестагене и антициклооксигеназе-2, показало эффективность и безопасность у пациентов с анорексией/кахексией, связанной с раком, и окислительным стрессом. Эпидемиологические биомаркеры рака Prev. 2006;15:1030–4. [PubMed] [Google Scholar]
39. Mantovani G, Macciò A, Madeddu C, Mura L, Gramignano G, Lusso MR, et al. Воздействие различных антиоксидантных агентов по отдельности или в комбинации на активные формы кислорода, антиоксидантные ферменты и цитокины у ряда больных раком на поздней стадии в разных локализациях: корреляция с прогрессированием заболевания. Свободный Радик Рез. 2003; 37: 213–23. [PubMed] [Академия Google]
Свободный Радик Рез. 2003; 37: 213–23. [PubMed] [Академия Google]
40. Mantovani G, Macciò A, Madeddu C, Mura L, Gramignano G, Lusso MR, et al. Антиоксидантные агенты эффективны в индукции прогрессирования лимфоцитов в клеточном цикле у больных раком на поздних стадиях: оценка наиболее важных лабораторных показателей кахексии и окислительного стресса. Дж. Мол Мед. 2003; 81: 664–73. [PubMed] [Google Scholar]
41. Mantovani G, Macciò A, Madeddu C, Mura L, Massa E, Gramignano G, et al. Активные формы кислорода, антиоксидантные механизмы и уровни цитокинов в сыворотке крови у онкологических больных: влияние антиоксидантной терапии. J Environ Pathol Toxicol Oncol. 2003; 22:17–28. [PubMed] [Академия Google]
42. Mantovani G, Madeddu C, Gramignano G, Lusso MR, Mocci M, Massa E, et al. Подкожный интерлейкин-2 в сочетании с ацетатом медроксипрогестерона и антиоксидантами у пациентов с распространенным раком, ответивших на предыдущую химиотерапию: исследование фазы II, оценивающее клинические, качество жизни и лабораторные параметры. J Exp Ther Oncol. 2003; 3: 205–19. [PubMed] [Google Scholar]
J Exp Ther Oncol. 2003; 3: 205–19. [PubMed] [Google Scholar]
43. Mantovani G, Macciò A, Madeddu C, Mulas C, Massa E, Astara G, et al. Исследование фазы II подкожно вводимого интерлейкина-2 в сочетании с ацетатом медроксипрогестерона и антиоксидантными агентами в качестве поддерживающей терапии у больных с прогрессирующим раком, ответивших на предыдущую химиотерапию. Онкол Респ. 2002;9: 887–96. [PubMed] [Google Scholar]
44. Mantovani G, Macciò A, Madeddu C, Serpe R, Massa E, Gramignano G, et al. Селен эффективен в индукции прогрессирования лимфоцитов через клеточный цикл у больных раком: потенциальные механизмы его активности. J Exp Ther Oncol. 2004; 4: 69–78. [PubMed] [Google Scholar]
45. Higdon JV, Frei B. Катехины и полифенолы чая: влияние на здоровье, метаболизм и антиоксидантные функции. Crit Rev Food Sci Nutr. 2003;43:89–143. [PubMed] [Академия Google]
46. Beller E, Tattersall M, Lumley T, Levi J, Dalley D, Olver I, et al. Улучшение качества жизни с помощью мегестрола ацетата у пациентов с распространенным раком, нечувствительным к эндокринной системе: рандомизированное плацебо-контролируемое исследование. Австралазийская совместная исследовательская группа по ацетату мегестрола. Энн Онкол. 1997; 8: 277–83. [PubMed] [Google Scholar]
Австралазийская совместная исследовательская группа по ацетату мегестрола. Энн Онкол. 1997; 8: 277–83. [PubMed] [Google Scholar]
47. Bruera E, Macmillan K, Kuehn N, Hanson J, MacDonald RN. Контролируемое исследование влияния мегестрола ацетата на аппетит, потребление калорий, состояние питания и другие симптомы у пациентов с запущенным раком. Рак. 1990;66:1279–82. [PubMed] [Google Scholar]
48. Чекмедян Н.С., Хикман М., Сиау Дж., Греко Ф.А., Келлер Дж., Браудер Х. и соавт. Мегестрола ацетат при раке, анорексии и похудении. Рак. 1992; 69: 1268–74. [PubMed] [Google Scholar]
49. Loprinzi CL, Michalak JC, Schaid DJ, Mailliard JA, Athmann LM, Goldberg RM, et al. Оценка фазы III четырех доз мегестрола ацетата в качестве терапии для пациентов с раковой анорексией и/или кахексией. Дж. Клин Онкол. 1993; 11: 762–7. [PubMed] [Академия Google]
50. Барбер М.Д., Вигмор С.Дж., Росс Дж.А., Фирон К.С. Эйкозапентаеновая кислота ослабляет кахексию, связанную с прогрессирующим раком поджелудочной железы. Простагландины Leukot Essent Fatty Acids. 1997; 57:204. [Google Scholar]
Простагландины Leukot Essent Fatty Acids. 1997; 57:204. [Google Scholar]
51. Фальконер Дж. С., Росс Дж. А., Фирон К. С., Хокинс Р. А., О’Риордейн М. Г., Картер Д. С. Влияние эйкозапентаеновой кислоты и других жирных кислот на рост in vitro клеточных линий рака поджелудочной железы человека. Бр Дж Рак. 1994; 69: 826–32. [Бесплатная статья PMC] [PubMed] [Google Scholar]
52. Бек С.А., Смит К.Л., Тисдейл М.Дж. Антикахектический и противоопухолевый эффект эйкозапентаеновой кислоты и ее влияние на белковый обмен. Рак Рез. 1991; 51: 6089–93. [PubMed] [Google Scholar]
53. Barber MD, Ross JA, Voss AC, Tisdale MJ, Fearon KC. Влияние пероральной пищевой добавки, обогащенной рыбьим жиром, на потерю веса у пациентов с раком поджелудочной железы. Бр Дж Рак. 1999;81:80–6. [Бесплатная статья PMC] [PubMed] [Google Scholar]
54. Pettegrew JW, Levine J, McClure RJ. Физико-химические, метаболические и терапевтические свойства ацетил-L-карнитина: значение его действия при болезни Альцгеймера и гериатрической депрессии. Мол Психиатрия. 2000;5:616–32. [PubMed] [Академия Google]
Мол Психиатрия. 2000;5:616–32. [PubMed] [Академия Google]
55. Mantovani G, Macciò A, Madeddu C, Gramignano G, Serpe R, Massa E, et al. Рандомизированное клиническое исследование фазы III пяти различных групп лечения пациентов с раковой кахексией: промежуточные результаты. Питание. 2008; 24:305–13. [PubMed] [Google Scholar]
56. Триха М., Коррингем Р., Кляйн Б., Росси Дж. Ф. Таргетная терапия моноклональными антителами против интерлейкина-6 при раке: обзор обоснования и клинических данных. Клин Рак Рез. 2003; 9: 4653–65. [Бесплатная статья PMC] [PubMed] [Google Scholar]
57. Фигерас М., Бускетс С., Карбо Н., Баррейро Э., Альмендро В., Аргилес Дж. М. и др. Интерлейкин-15 способен подавлять повышенную фрагментацию ДНК, связанную с атрофией мышц у крыс с опухолями. ФЭБС лат. 2004; 569: 201–6. [PubMed] [Google Scholar]
58. Harcourt LJ, Holmes AG, Gregorevic P, Schertzer JD, Stupka N, Plant DR, et al. Введение интерлейкина-15 улучшает патологию и функцию мышц диафрагмы у мышей MDX с дистрофией. Ам Джей Патол. 2005; 166:1131–41. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Ам Джей Патол. 2005; 166:1131–41. [Бесплатная статья PMC] [PubMed] [Google Scholar]
59. Fuster G, Busquets S, Ametller E, Olivan M, Almendro V, de Oliveira CC, et al. Участвуют ли рецепторы, активируемые пролифератором пероксисом, в истощении скелетных мышц во время экспериментальной раковой кахексии? Роль бета2-адреномиметиков. Рак Рез. 2007; 67: 6512–9. [PubMed] [Google Scholar]
60. Evans W, Smith M, Morley J, et al. Ostarine увеличивает мышечную массу тела и улучшает физическую работоспособность у здоровых пожилых людей: последствия для пациентов с раковой кахексией. Дж. Клин Онкол. 2007; 25:4536–41. [Академия Google]
61. Ачария С., Гаттридж, округ Колумбия. Пути передачи сигналов раковой кахексии продолжают появляться, но многое еще указывает на протеасомы. Клин Рак Рез. 2007; 13:1356–61. [PubMed] [Google Scholar]
62. Дебур М.Д., Маркс Д.Л. Кахексия: уроки антагонизма меланокортина. Тенденции Эндокринол Метаб. 2006; 17: 199–204. [PubMed] [Google Scholar]
63. Tan BH, Deans DA, Skipworth RJ, Ross JA, Fearon KC. Биомаркеры раковой кахексии: есть ли генетический компонент кахексии? Поддержите уход за раком. 2008;16:229–34. [PubMed] [Google Scholar]
Tan BH, Deans DA, Skipworth RJ, Ross JA, Fearon KC. Биомаркеры раковой кахексии: есть ли генетический компонент кахексии? Поддержите уход за раком. 2008;16:229–34. [PubMed] [Google Scholar]
64. Фирон К.С. Раковая кахексия: разработка мультимодальной терапии многогранной проблемы. Евр Джей Рак. 2008;44:1124–32. [PubMed] [Google Scholar]
Лечение кахексии — Holland-Frei Cancer Medicine
Окончательным методом лечения раковой кахексии является удаление вызывающей ее опухоли. Для достижения этой цели были предприняты различные меры с ограниченным успехом.
Поддерживающая терапия
Пациенты с анорексией, вызванной снижением физической активности, сопутствующей инфекцией и токсичностью желудочно-кишечного тракта в результате химиотерапии и лучевой терапии, лечатся симптоматически для поддержания нутритивного статуса и качества жизни. Такое лечение включает использование жидкости для полоскания рта при стоматите, частое кормление небольшим объемом, противорвотные средства, антибиотики, переливание компонентов крови и/или пероральные и парентеральные пищевые добавки. Учет предпочтений пациента в еде и подача блюд в атмосфере столовой также могут иметь важное значение для стимуляции аппетита. Когда пациент не может придерживаться обычной диеты для получения адекватного питания, пищевые добавки, как домашние, так и имеющиеся в продаже, являются эффективным средством обеспечения дополнительными калориями, белками, жирами, витаминами и минералами, хотя общее потребление может незначительно увеличиться. В определенных случаях, таких как синдром мальабсорбции, вторичный по отношению к карциноме поджелудочной железы, экзогенный экстракт поджелудочной железы улучшает всасывание жиров и белков. 63
Учет предпочтений пациента в еде и подача блюд в атмосфере столовой также могут иметь важное значение для стимуляции аппетита. Когда пациент не может придерживаться обычной диеты для получения адекватного питания, пищевые добавки, как домашние, так и имеющиеся в продаже, являются эффективным средством обеспечения дополнительными калориями, белками, жирами, витаминами и минералами, хотя общее потребление может незначительно увеличиться. В определенных случаях, таких как синдром мальабсорбции, вторичный по отношению к карциноме поджелудочной железы, экзогенный экстракт поджелудочной железы улучшает всасывание жиров и белков. 63
Влияние частых консультаций по вопросам питания на пероральное потребление пищи, массу тела, скорость ответа, выживаемость и качество жизни изучалось у больных раком, проходящих химиотерапию. 240 В то время как консультирование увеличило ежедневное потребление энергии и белка, а также измерения кожной складки трицепса, частота ответов и общая выживаемость не отличались от контрольных пациентов, которые не получали никакого вмешательства.
Фармакологическое лечение
В попытках замедлить или остановить прогрессирующую кахексию у онкологических больных применялись различные препараты. Кроме того, ряд агентов в настоящее время изучается на животных. Эти агенты расположены в зависимости от их основного механизма действия. Следует отметить, что каждый из этих агентов проявляет множество других фармакологических активностей.
Таблица 144-2
Фармакологическое лечение раковой кахексии.
Кортикостероиды
В ряде неконтролируемых исследований показано, что кортикостероиды могут облегчать такие симптомы, как анорексия, астения и боль у больных раком. Механизм действия неизвестен. Предположения включают эйфориальную активность, ингибирование метаболизма простагландинов и ингибирующее действие на ИЛ-1. В рандомизированных исследованиях при применении преднизолона, метилпреднизолона или дексаметазона сообщалось о значительном улучшении аппетита и улучшении самочувствия. 7, 241–243 К сожалению, улучшения не были длительными, и после завершения исследований все параметры питания вернулись к исходному уровню.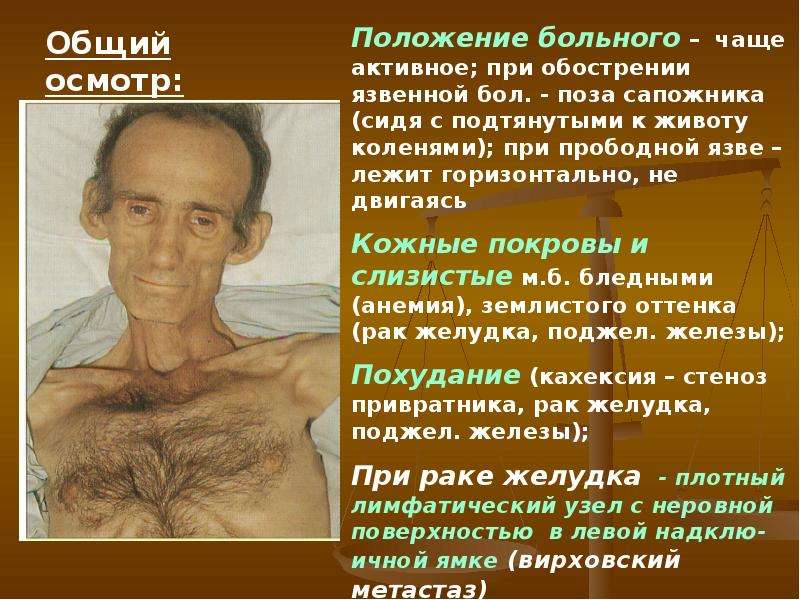 Не было различий в уровне смертности или выживаемости. При рандомизированном сравнении дексаметазона и мегестрола ацетата оба препарата вызывали одинаковую степень усиления аппетита и сходные изменения нежидкого веса, но дексаметазон оказался менее благоприятным. 244 Дексаметазон имел большую токсичность кортикостероидного типа и более высокий уровень прекращения приема препарата из-за токсичности и/или отказа пациента, чем ацетат мегестрола.
Не было различий в уровне смертности или выживаемости. При рандомизированном сравнении дексаметазона и мегестрола ацетата оба препарата вызывали одинаковую степень усиления аппетита и сходные изменения нежидкого веса, но дексаметазон оказался менее благоприятным. 244 Дексаметазон имел большую токсичность кортикостероидного типа и более высокий уровень прекращения приема препарата из-за токсичности и/или отказа пациента, чем ацетат мегестрола.
Мегестрола ацетат
Этот гестагенный препарат часто используется при лечении пациентов с метастатическим раком молочной железы. Обычно он хорошо переносится, за исключением того, что может вызвать нежелательное увеличение веса. Впоследствии было показано, что мегестрола ацетат вызывал увеличение массы тела у различных пациентов с кахектическим раком. Значительное снижение сывороточных уровней ИЛ-1α и β, ИЛ-2, ИЛ-6 и ФНО-α наблюдалось у больных раком, получавших мегестрола ацетат, что может иметь отношение к механизму улучшения аппетита и увеличения массы тела. 245
245
Недавно были проанализированы 15 рандомизированных клинических испытаний, в которых участвовало более 2000 пациентов, в отношении влияния мегестрола на аппетит и увеличение веса у онкологических больных. 246 Было выявлено статистически значимое преимущество высоких доз прогестинов в отношении улучшения аппетита. Хотя влияние высоких доз прогестинов на массу тела было менее впечатляющим, для этого исхода также была достигнута статистическая значимость. Заболеваемость при лечении была низкой из-за короткого периода лечения в большинстве исследований. Таким образом, было ясно продемонстрировано влияние высоких доз прогестинов на аппетит и массу тела.
Было обнаружено, что увеличение веса, вызванное мегестрола ацетатом, в основном связано с увеличением запасов жира в организме, а не с увеличением мышечной ткани. 247, 248 Утверждалось, что прирост жировой ткани по сравнению с мышечной тканью во время лечения мегестрола ацетатом, хотя и субоптимальный, не должен считаться изначально отрицательным, поскольку истощение жировых отложений обычно является нежелательным результатом рака.
Добавление мегестрола ацетата к химиотерапии у пациентов с меланомой привело к высокому объективному ответу и увеличению средней выживаемости по сравнению с контрольной группой, получавшей только химиотерапию. 249 Недавнее исследование сочетания стимулирующих аппетит свойств мегестрола ацетата и противовоспалительных свойств ибупрофена показало, что это сочетание стабилизировало качество жизни и приводило к увеличению веса у пациентов с распространенным раком желудочно-кишечного тракта. 250 Необходимы дополнительные контролируемые исследования, чтобы установить, что добавление мегестрола отдельно или комбинации мегестрола с ибупрофеном сопровождается повышением толерантности к лечению рака и улучшением выживаемости.
Ацетат медроксипрогестерона
Ацетат медроксипрогестерона является более широко используемым синтетическим прогестагеном. Медроксипрогестерон снижает выработку цитокинов и серотонина, которые участвуют в развитии анорексии/кахексии у онкологических больных. 251 Сообщалось о двух плацебо-контролируемых рандомизированных исследованиях, результатом которых стало повышение аппетита. 252, 253 В одном исследовании сообщалось о значительном увеличении количества белков с быстрым обменом, таких как преальбумин, связывающий щитовидную железу, и белок, связывающий ретинол. 252 Несмотря на повышенный аппетит, ни в одном из исследований не наблюдалось увеличения веса.
251 Сообщалось о двух плацебо-контролируемых рандомизированных исследованиях, результатом которых стало повышение аппетита. 252, 253 В одном исследовании сообщалось о значительном увеличении количества белков с быстрым обменом, таких как преальбумин, связывающий щитовидную железу, и белок, связывающий ретинол. 252 Несмотря на повышенный аппетит, ни в одном из исследований не наблюдалось увеличения веса.
Каннабиноиды (дронабинол)
При использовании дронабинола в качестве противорвотного средства было обнаружено, что это средство усиливает аппетит у здоровых людей и у онкологических больных. Для дальнейшего изучения этого явления у больных раком было проведено открытое исследование диапазона доз. 254, 255 Все пациенты сообщили об улучшении аппетита. Более высокие дозы, 5,0 или 7,5 мг/сутки, были более эффективны, чем низкие дозы 2,5 мг/сутки. Пациенты во всех группах продолжали терять вес, хотя скорость потери веса снижалась на фоне терапии. Следует отметить, что эти эффекты наблюдались при более низких дозах, чем вызывающие противорвотное действие, и без явных психотропных симптомов.
Следует отметить, что эти эффекты наблюдались при более низких дозах, чем вызывающие противорвотное действие, и без явных психотропных симптомов.
Недавно было проведено рандомизированное исследование, чтобы определить, является ли дронабинол, вводимый отдельно или с ацетатом мегестрола, более, менее или равным по эффективности монотерапии ацетатом мегестрола для облегчения анорексии, связанной с раком. 256 Мегестрола ацетат обеспечивал лучшее паллиативное лечение анорексии у пациентов с запущенным раком по сравнению с одним дронабинолом. Комбинация мегестрола и дронабинола, по-видимому, не давала дополнительных преимуществ.
Ципрогептадин
Ципрогептадин является антагонистом серотонина. В нескольких клинических ситуациях агент вызывал увеличение веса. Рандомизированное исследование у пациентов с запущенными злокачественными новообразованиями показало, что ципрогептадин вызывает уменьшение тошноты и умеренное повышение аппетита. Тем не менее, препарат не уменьшал прогрессирующую потерю веса у этих пациентов. 257
257
Метоклопрамид и цизаприд
У больных раком на поздних стадиях с замедленным опорожнением желудка или гастропарезом показано, что пероральное введение прокинетика, метоклопрамида, по 10 мг перорально 4 раза в день перед едой и перед сном эффективно стимулирует аппетит купирование других диспептических симптомов, связанных с анорексией. 258, 259 Препарат с контролируемым высвобождением оказывается более эффективным, чем препарат с немедленным высвобождением, поскольку он контролирует тошноту, связанную с прогрессирующим раком, даже без продемонстрированных аномалий желудочно-кишечного тракта (ЖКТ). 260 Не сообщалось, было ли у пациентов, принимавших метоклопрамид, улучшение массы тела или выживаемости. Пациенты с раком головы и шеи, проходящие лучевую терапию, были рандомизированы в три группы: мегестрола ацетат, цизаприд и плацебо. Мегестрол значительно предотвращал потерю массы тела и ухудшение аппетита, в то время как цизаприд не обладал этими клиническими преимуществами. 261
261
Анаболические стероиды
Анаболические андрогенные стероиды используются спортсменами для стимулирования роста мышц и силы. У мышей с саркомой MCG101 и прогрессирующей кахексией введение нандролона пропионата приводило к значительному увеличению веса. 262 Однако прибавка в весе в основном была связана с задержкой воды, и это не повлияло на потребление пищи и выживаемость. Анаболический стероид не повлиял на рост опухоли. Сообщалось о положительных эффектах анаболических стероидных гормонов у пациентов, проходящих химиотерапию. 263 Были проведены рандомизированные клинические испытания, чтобы проверить, влияют ли добавки деканоата нандролона на исход химиотерапии у пациентов с немелкоклеточным раком легкого. 264, 265 Хотя у получавших лечение наблюдалась меньшая потеря веса, ответ на химиотерапию и выживаемость были сопоставимы. В клиническом исследовании фазы III, состоящем из трех групп, группа флуоксиместерона продемонстрировала значительно меньшее усиление аппетита и не имела благоприятного профиля токсичности по сравнению с группами мегестрола ацетата и дексаметазона. 244
244
Гидразинсульфат
Гидразинсульфат, ингибитор фермента фосфоенолпируваткарбоксикиназы, прерывает глюконеогенез у животных. 266 Это наблюдение привело к клиническим исследованиям сульфата гидразина в попытках предотвратить или обратить вспять связанную с раком кахексию и потерю веса. Три недавних многоцентровых групповых исследования были проведены у пациентов с немелкоклеточным раком легкого или колоректальным раком. 267–269 Все три исследования не показали положительного влияния на аппетит, массу тела, качество жизни или выживаемость при применении сульфата гидразина.
Пентоксифиллин и лизофиллин
Эти препараты являются аналогами метилксантина, обладающими противовоспалительными свойствами. Они обладают выраженным стимулирующим действием на выработку эндотелием сосудов невоспалительных простагландинов I 2 и E 2 , ингибируя выработку TNF-α. Пентоксифиллин блокировал накопление мРНК TNF-α. 270 Пентоксифиллин также предотвращал мышечную атрофию и подавлял повышенный распад белка у крыс с опухолями путем ингибирования активации нелизосомного Ca 2+ -независимый убиквитин-протеасомный протеолитический путь. 271 Пентоксифиллин подавлял повышенную экспрессию убиквитина, убиквитин-конъюгирующего фермента E2 с молекулярной массой 14 кДа и субъединицы протеасомы C2 20S в мышцах раковых крыс.
270 Пентоксифиллин также предотвращал мышечную атрофию и подавлял повышенный распад белка у крыс с опухолями путем ингибирования активации нелизосомного Ca 2+ -независимый убиквитин-протеасомный протеолитический путь. 271 Пентоксифиллин подавлял повышенную экспрессию убиквитина, убиквитин-конъюгирующего фермента E2 с молекулярной массой 14 кДа и субъединицы протеасомы C2 20S в мышцах раковых крыс.
Профилактическое пероральное введение пентоксифиллина реципиентам аллотрансплантатов вместе с химиотерапией и лучевой терапией привело к значительному снижению частоты и тяжести связанных с лечением осложнений: мукозита, печеночной веноокклюзионной болезни, почечной недостаточности и частоты реакции «трансплантат против хозяина». 272 В начальном исследовании у онкологических больных пентоксифиллин подавлял уровни мРНК TNF-α, улучшал самочувствие, улучшал аппетит и улучшал способность выполнять повседневные действия. Пациенты с нормальным уровнем ФНО также имели прибавку в весе.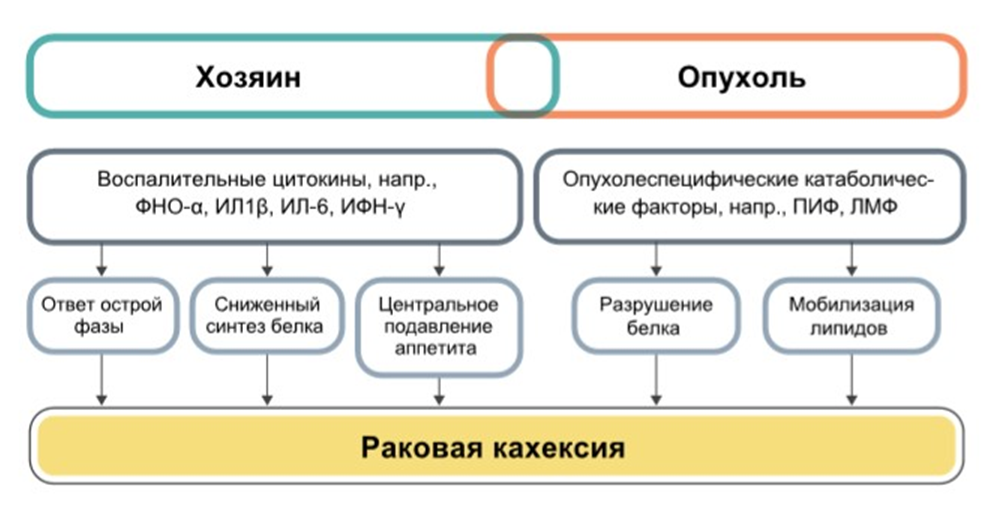 Однако в рандомизированном контролируемом исследовании у пациентов с солидными опухолями пентоксифиллин не смог обеспечить улучшение аппетита или массы тела по сравнению с группой плацебо. 273 Аналогичным образом, у пациентов с острым миелоцитарным лейкозом или миелодиспластическим синдромом после полной ремиссии химиотерапии идарубицином/ara-C лизофиллин не давал благоприятных эффектов с точки зрения частоты инфекций, общей смертности или результатов. 274 Лизофиллин не изменяет токсичность высоких доз ИЛ-2 и, таким образом, не влияет на общую интенсивность дозы при лечении распространенного рака почки и злокачественной меланомы. 275
Однако в рандомизированном контролируемом исследовании у пациентов с солидными опухолями пентоксифиллин не смог обеспечить улучшение аппетита или массы тела по сравнению с группой плацебо. 273 Аналогичным образом, у пациентов с острым миелоцитарным лейкозом или миелодиспластическим синдромом после полной ремиссии химиотерапии идарубицином/ara-C лизофиллин не давал благоприятных эффектов с точки зрения частоты инфекций, общей смертности или результатов. 274 Лизофиллин не изменяет токсичность высоких доз ИЛ-2 и, таким образом, не влияет на общую интенсивность дозы при лечении распространенного рака почки и злокачественной меланомы. 275
Талидомид
Талидомид обладает иммуномодулирующей активностью, а также антиангиогенными свойствами. Талидомид также ингибирует продукцию TNF-α у больных проказой, туберкулезом, СПИДом и раком. 276–278 У пациентов с ВИЧ и туберкулезом улучшение прибавки массы тела при приеме талидомида было связано со снижением уровня ФНО-α в сыворотке. 278 В предварительном исследовании 72 онкологических больных с анорексией и потерей веса получали талидомид в дозе 100 мг/сут. 279 К 10-му дню от 50% до 70% из 37 пациентов, поддающихся оценке, сообщили об уменьшении интенсивности различных симптомов, включая анорексию, тошноту, утомляемость и улучшение самочувствия. Необходимы рандомизированные исследования для определения роли талидомида в раковой кахексии.
278 В предварительном исследовании 72 онкологических больных с анорексией и потерей веса получали талидомид в дозе 100 мг/сут. 279 К 10-му дню от 50% до 70% из 37 пациентов, поддающихся оценке, сообщили об уменьшении интенсивности различных симптомов, включая анорексию, тошноту, утомляемость и улучшение самочувствия. Необходимы рандомизированные исследования для определения роли талидомида в раковой кахексии.
Цитокины, антицитокиновые антитела и другие ингибиторы цитокинов
Помимо пентоксифиллина и талидомида существует ряд других ингибиторов цитокинов.
Введение очищенного rIL-6 человека отдельно или в комбинации с субтерапевтическими дозами TNF было эффективным против сингенных опухолей у мышей и крыс. 107 Сообщалось, что антитела к TNF-α, антитела к IL-1 и антитела к рецептору IL-1 ослабляли кахексию, вызванную хроническим введением TNF-α или имплантацией опухоли экспериментальным животным. 42, 90, 280 Введение антител к TNF-α крысам с опухолями снижало скорость деградации белка в скелетных мышцах, сердце и печени по сравнению с контролем; однако антитело не могло предотвратить снижение массы тела. 281 Уменьшение деградации белка в скелетных мышцах под действием антител к TNF-α, по-видимому, вызвано ингибированием вызванного опухолью увеличения экспрессии гена убиквитина в мышцах. 282 Введение антитела к ИЛ-6 у пациентов, серопозитивных к вирусу иммунодефицита человека-1 и страдающих иммунобластной или полиморфной крупноклеточной лимфомой, приводило к частичной ремиссии или стабилизации заболевания. 283 Нейтрализующий эффект анти-ИЛ-6-антитела, измеренный по уровням С-реактивного белка в сыворотке, сопровождался исчезновением клинических симптомов В, включая лихорадку и кахексию. Необходимы дальнейшие исследования для определения терапевтической роли таких антицитокиновых антител.
281 Уменьшение деградации белка в скелетных мышцах под действием антител к TNF-α, по-видимому, вызвано ингибированием вызванного опухолью увеличения экспрессии гена убиквитина в мышцах. 282 Введение антитела к ИЛ-6 у пациентов, серопозитивных к вирусу иммунодефицита человека-1 и страдающих иммунобластной или полиморфной крупноклеточной лимфомой, приводило к частичной ремиссии или стабилизации заболевания. 283 Нейтрализующий эффект анти-ИЛ-6-антитела, измеренный по уровням С-реактивного белка в сыворотке, сопровождался исчезновением клинических симптомов В, включая лихорадку и кахексию. Необходимы дальнейшие исследования для определения терапевтической роли таких антицитокиновых антител.
TNF-α первоначально экспрессируется в виде прикрепленного к мембране предшественника из 233 аминокислот, который расщепляется ферментами, подобными матриксной металлопротеиназе, с образованием зрелого цитокина из 157 аминокислот. 284 Этот процесс был специально предотвращен синтетическими ингибиторами металлопротеиназы на основе гидроксамовой кислоты. 285
285
All- транс--ретиноевая кислота ингибировала продукцию TNF активированными перитонеальными макрофагами. 286 Сурамин, антитрипаносомальный полианион, предотвращает связывание IL-6 с субъединицами его рецептора клеточной поверхности in vitro и ингибирует раковую кахексию, опосредованную толстой кишкой-26, у мышей. 287
ИЛ-12 снижает уровень ИЛ-6 в сыворотке у мышей с карциномой толстой кишки 26 и предотвращает развитие кахексии. Активность IL-12 зависела от Т-клеток, а эффект антикахексии возникал в результате повышения уровня IFN-α. 288 У пациентов с раком желудка и колоректальным раком продукция IL-12 мононуклеарными клетками периферической крови, стимулированными фитогемагглютинином или Staphylococcus aureus , значительно снижалась по мере прогрессирования заболевания и была самой низкой у пациентов с отдаленными метастазами и кахексией. 289
Аналогичным образом, перенос гена IL-10, другого ингибитора IL-6, предотвратил кахексию на той же животной модели. 290 ИЛ-12 и ИЛ-10 могут играть роль антикахектических средств при опухолях, продуцирующих ИЛ-6.
290 ИЛ-12 и ИЛ-10 могут играть роль антикахектических средств при опухолях, продуцирующих ИЛ-6.
Обработка IL-15 частично ингибировала атрофию скелетных мышц у крыс, несущих AH-130, за счет снижения скорости деградации белка до значений, даже более низких, чем те, которые наблюдались у животных без опухолей. 291 Эти изменения скорости распада белка были связаны с ингибированием АТФ-убиквитин-зависимого протеолитического пути. Цитокин не изменял уровни кортикостерона и инсулина в плазме у носителей опухоли.
Аминокислоты с разветвленной цепью
Аминокислоты с разветвленной цепью, используемые скелетными мышцами, но не печенью, обладают уникальной эффективностью в регулировании баланса азота в мышцах за счет снижения катаболизма белка и увеличения синтеза белка как у травмированных животных, так и у животных с опухолями. . Рандомизированные исследования показывают улучшение удержания азота, улучшение использования белка и увеличение синтеза белка и альбумина у пациентов, получавших парентеральное питание с высоким содержанием аминокислот с разветвленной цепью. 292, 293 Напротив, было проведено рандомизированное исследование, в котором изучалось влияние сбалансированного раствора аминокислот с добавлением или без добавления α-кетоизокапроата или раствора аминокислот с разветвленной цепью у пациентов с раком желудочно-кишечного тракта, перенесших операцию. 294 Сбалансированный раствор аминокислот сам по себе при адекватном энергетическом обеспечении имел оптимальный азотсберегающий эффект. Аминокислоты с разветвленной цепью или α-кетоизокапроат не улучшали баланс азота и не уменьшали деградацию белка.
292, 293 Напротив, было проведено рандомизированное исследование, в котором изучалось влияние сбалансированного раствора аминокислот с добавлением или без добавления α-кетоизокапроата или раствора аминокислот с разветвленной цепью у пациентов с раком желудочно-кишечного тракта, перенесших операцию. 294 Сбалансированный раствор аминокислот сам по себе при адекватном энергетическом обеспечении имел оптимальный азотсберегающий эффект. Аминокислоты с разветвленной цепью или α-кетоизокапроат не улучшали баланс азота и не уменьшали деградацию белка.
Интересно, что поглощение триптофана мозгом конкурирует с усвоением аминокислот с разветвленной цепью. Попытка уменьшить поглощение триптофана за счет повышения уровня аминокислот с разветвленной цепью в плазме крови привела к снижению частоты анорексии у онкологических больных. 295
Эйкозапентаеновая кислота
ω-3 Полиненасыщенные жирные кислоты являются важным компонентом рациона и участвуют в синтезе эйкозаноидов (простагландинов, лейкотриенов и тромбоксанов), а также в функционировании мембран, рецепторов и ферментов. Эйкозапентаеновая кислота (EPA), полиненасыщенная жирная кислота ω-3, обнаруженная в жирной рыбе, такой как сардины, лосось и скумбрия, обладает противоопухолевой, а также антикахексической активностью в моделях кахексии у животных. 296, 297 EPA-индуцированное ингибирование потери веса сопровождалось увеличением общего жира и мышечной массы. Введение ЭПК приводило к ингибированию потери веса, вызванной фактором, индуцирующим протеолиз (PIF), у мышей и снижению использования глюкозы скелетными мышцами. 298 EPA, по-видимому, оказывает свое действие, препятствуя производству вторичных мессенджеров PIF, особенно высвобождению арахидоновой кислоты и ее превращению в эйкозаноиды. EPA также ингибирует липолиз в адипоцитах, предотвращая синтез простагландинов и повышение уровня циклического аденозинмонофосфата (цАМФ) в ответ на фактор мобилизации липидов. 299 EPA снижает острофазовый ответ, опосредованный подавлением IL-6. 300
Эйкозапентаеновая кислота (EPA), полиненасыщенная жирная кислота ω-3, обнаруженная в жирной рыбе, такой как сардины, лосось и скумбрия, обладает противоопухолевой, а также антикахексической активностью в моделях кахексии у животных. 296, 297 EPA-индуцированное ингибирование потери веса сопровождалось увеличением общего жира и мышечной массы. Введение ЭПК приводило к ингибированию потери веса, вызванной фактором, индуцирующим протеолиз (PIF), у мышей и снижению использования глюкозы скелетными мышцами. 298 EPA, по-видимому, оказывает свое действие, препятствуя производству вторичных мессенджеров PIF, особенно высвобождению арахидоновой кислоты и ее превращению в эйкозаноиды. EPA также ингибирует липолиз в адипоцитах, предотвращая синтез простагландинов и повышение уровня циклического аденозинмонофосфата (цАМФ) в ответ на фактор мобилизации липидов. 299 EPA снижает острофазовый ответ, опосредованный подавлением IL-6. 300
У пациентов с раком поджелудочной железы, получавших капсулы с рыбьим жиром (ЭПК и докозагексаеновая кислота), наблюдалось увеличение массы тела, сопровождавшееся значительным снижением продукции белка в острой фазе и стабилизацией расхода энергии в состоянии покоя. 301 В то время как пищевая добавка сама по себе не замедляла развитие потери веса у пациентов с кахексией, пищевая добавка, обогащенная ЭПК, приводила к значительному увеличению веса. 302 Значительное увеличение безжировой массы тела, отмеченное при анализе состава тела, заслуживает внимания среди различных сообщаемых терапевтических вмешательств. Было проведено рандомизированное контролируемое исследование для изучения влияния пищевых добавок ЭПК и витамина Е на иммунную систему и выживаемость хорошо питающихся и недоедающих онкологических больных. 303 ЭПК оказывает значительное иммуномодулирующее действие за счет увеличения соотношения Т-хелперов и Т-супрессоров в подгруппе пациентов с истощением. EPA продлила выживаемость обеих групп пациентов. Необходимы дополнительные клинические исследования, чтобы выяснить, повышает ли EPA толерантность к хирургическому вмешательству, химиотерапии или лучевой терапии, приводя к улучшению выживаемости у пациентов с раковой кахексией.
301 В то время как пищевая добавка сама по себе не замедляла развитие потери веса у пациентов с кахексией, пищевая добавка, обогащенная ЭПК, приводила к значительному увеличению веса. 302 Значительное увеличение безжировой массы тела, отмеченное при анализе состава тела, заслуживает внимания среди различных сообщаемых терапевтических вмешательств. Было проведено рандомизированное контролируемое исследование для изучения влияния пищевых добавок ЭПК и витамина Е на иммунную систему и выживаемость хорошо питающихся и недоедающих онкологических больных. 303 ЭПК оказывает значительное иммуномодулирующее действие за счет увеличения соотношения Т-хелперов и Т-супрессоров в подгруппе пациентов с истощением. EPA продлила выживаемость обеих групп пациентов. Необходимы дополнительные клинические исследования, чтобы выяснить, повышает ли EPA толерантность к хирургическому вмешательству, химиотерапии или лучевой терапии, приводя к улучшению выживаемости у пациентов с раковой кахексией.
Следует отметить недавний отчет, указывающий на значительное увеличение метастазов рака толстой кишки в печень у крыс, которых кормили ЭПК. 304
Индометацин и ибупрофен
Эти препараты являются ингибиторами синтеза простагландинов. В клинических испытаниях индометацин уменьшал лихорадку и гранулоцитоз, а также, как утверждалось, улучшал самочувствие больных раком. 305, 306 Сообщалось, что у пациентов с кахектическим раком ибупрофен снижает уровень С-реактивного белка, вызывает увеличение массы тела и улучшает выживаемость. 307–309
Мелатонин
Мелатонин представляет собой индоламин, который в основном секретируется шишковидной железой в темное время суток. Функции мелатонина неясны, но утверждается, что он модулирует сон, сердечный ритм, сексуальное поведение, репродуктивную систему и иммунологические функции, а также обладает антиоксидантной и противовоспалительной активностью. Мелатонин снижал уровень циркулирующего TNF у пациентов с распространенным раком и уменьшал вызванное химиотерапией недомогание и астению, а также тромбоцитопению. 310–312 На основании наблюдений, что мелатонин усиливает индуцированный ИЛ-2 противоопухолевый эффект у животных, было проведено рандомизированное исследование у пациентов с метастатическими солидными опухолями, в котором сравнивали комбинацию низких доз ИЛ-2 плюс мелатонин с наилучшей поддерживающей терапией. 313 В группе, получавшей лечение, процент пациентов с улучшенным функциональным состоянием, а также общая выживаемость были значительно выше, чем в контрольной группе. Другое рандомизированное исследование химиотерапии цисплатином плюс этопозид плюс и/или минус мелатонин проводилось у пациентов с распространенным немелкоклеточным раком легкого с неблагоприятным клиническим статусом. 314 Значимых различий в выживаемости между группами не было, но в группе мелатонина реже наблюдались миелосупрессия, невропатия и кахексия. Необходимы дополнительные клинические исследования для определения роли мелатонина в лечении раковой кахексии.
310–312 На основании наблюдений, что мелатонин усиливает индуцированный ИЛ-2 противоопухолевый эффект у животных, было проведено рандомизированное исследование у пациентов с метастатическими солидными опухолями, в котором сравнивали комбинацию низких доз ИЛ-2 плюс мелатонин с наилучшей поддерживающей терапией. 313 В группе, получавшей лечение, процент пациентов с улучшенным функциональным состоянием, а также общая выживаемость были значительно выше, чем в контрольной группе. Другое рандомизированное исследование химиотерапии цисплатином плюс этопозид плюс и/или минус мелатонин проводилось у пациентов с распространенным немелкоклеточным раком легкого с неблагоприятным клиническим статусом. 314 Значимых различий в выживаемости между группами не было, но в группе мелатонина реже наблюдались миелосупрессия, невропатия и кахексия. Необходимы дополнительные клинические исследования для определения роли мелатонина в лечении раковой кахексии.
Гормон роста и GHRP-2
Анаболические свойства гормона роста были исследованы на животных. Введение гормона роста крысам с опухолями приводило к увеличению мышечной массы, содержания мышечного белка и сохранению состава тела хозяина. 315–317 Гормон роста не стимулировал рост опухоли. 318 Влияние комбинации инсулина, гормона роста и соматостатина на рост опухоли, метастазирование и метаболизм хозяина изучали на крысах с опухолью молочной железы MAC-33. 319 Тройная терапия поддерживала анаболизм хозяина и ингибировала кинетику роста опухоли. Однако известно, что один только соматостатин обладает противоопухолевой активностью, и вклад каждого компонента в наблюдаемые изменения неясен. Гормон роста еще не изучался у больных раковой кахексией.
Введение гормона роста крысам с опухолями приводило к увеличению мышечной массы, содержания мышечного белка и сохранению состава тела хозяина. 315–317 Гормон роста не стимулировал рост опухоли. 318 Влияние комбинации инсулина, гормона роста и соматостатина на рост опухоли, метастазирование и метаболизм хозяина изучали на крысах с опухолью молочной железы MAC-33. 319 Тройная терапия поддерживала анаболизм хозяина и ингибировала кинетику роста опухоли. Однако известно, что один только соматостатин обладает противоопухолевой активностью, и вклад каждого компонента в наблюдаемые изменения неясен. Гормон роста еще не изучался у больных раковой кахексией.
Грелин является эндогенным стимулятором секреции гормона роста, в основном секретируемым железами желудка; он способен стимулировать ожирение у грызунов. Ежедневные подкожные инъекции более стабильного синтетического агониста грелиновых рецепторов GHRP-2 (высвобождающий гормон роста пептид-2) вызывали дозозависимое увеличение потребления пищи и массы тела. 320 Анализ состава тела до и после лечения показал увеличение жировой и костной массы, но не мышечной массы. Индуцированный GHRP-2 положительный энергетический баланс, приводящий к набору жира, происходил без участия гипоталамических нейронов NPY. Агонисты рецепторов грелина могут предложить вариант лечения таких синдромов, как нервная анорексия, раковая кахексия или синдром приобретенного иммунодефицита (СПИД).
320 Анализ состава тела до и после лечения показал увеличение жировой и костной массы, но не мышечной массы. Индуцированный GHRP-2 положительный энергетический баланс, приводящий к набору жира, происходил без участия гипоталамических нейронов NPY. Агонисты рецепторов грелина могут предложить вариант лечения таких синдромов, как нервная анорексия, раковая кахексия или синдром приобретенного иммунодефицита (СПИД).
Кленбутерол
Кленбутерол является агонистом β 2 -адренорецепторов. Это предотвратило потерю мышечного белка у животных с опухолями и увеличило мышечную массу и функцию у здоровых животных. 321–323 Не было никаких изменений в потреблении пищи или росте опухоли. У пациентов после операции на колене кленбутерол смог улучшить мышечную силу в рандомизированном исследовании. 324 Его влияние на сохранение мышц, по-видимому, происходит без необходимости физических упражнений. Кленбутерол еще не изучался у больных раковой кахексией.
Энтеральное и парентеральное питание
Раковая кахексия отличается от простого голодания тем, что энтеральное или парентеральное питание имеет лишь ограниченное значение. Следовательно, для коррекции недостаточности питания, связанной с раком, энтеральное и парентеральное введение питательных растворов следует использовать осторожно. У пациентов с дисфункцией ротоглотки из-за новообразований головы и шеи или непроходимости пищевода смешанная пища и жидкие добавки часто могут обеспечить адекватный уровень питательного насыщения. При необходимости чрескожная гастростомия или еюностомия предлагает шунтирующее питание. Для пациентов, которые не могут переносить использование желудочно-кишечного тракта из-за тошноты, рвоты, обструкции, мальабсорбции или отсутствия, может быть необходимо начать полное парентеральное питание (ППП, «гипералиментация»).
Потребности в нутритивной поддержке онкологических больных во время прогрессирования опухоли и роль ППП в онкологической хирургии, химиотерапии и лучевой терапии следует рассматривать на нескольких различных уровнях. 18 Преимущества ППП у пациентов, перенесших операцию по поводу рака, включали улучшение заживления ран, снижение частоты инфекций, меньшее количество серьезных осложнений и снижение послеоперационной смертности. Однако в других исследованиях не было обнаружено преимуществ ТПП; в одном отчете описано увеличение частоты серьезных послеоперационных осложнений.
18 Преимущества ППП у пациентов, перенесших операцию по поводу рака, включали улучшение заживления ран, снижение частоты инфекций, меньшее количество серьезных осложнений и снижение послеоперационной смертности. Однако в других исследованиях не было обнаружено преимуществ ТПП; в одном отчете описано увеличение частоты серьезных послеоперационных осложнений.
Однако у пациентов, получающих химиотерапию и/или лучевую терапию, не было продемонстрировано значительного преимущества ППП с точки зрения переносимости лечения, ответа на химиотерапию или лучевую терапию или выживаемости. 18, 327–329 Кроме того, другие авторы сообщают о вреде ППП. Были рассмотрены споры, связанные с ТПП при лечении раковой кахексии. 330–332
18, 327–329 Кроме того, другие авторы сообщают о вреде ППП. Были рассмотрены споры, связанные с ТПП при лечении раковой кахексии. 330–332
Из-за ограниченных запасов питательных веществ дети с онкологическими заболеваниями чаще страдают от недоедания, чем взрослые с новообразованиями. Таким образом, комбинированные протоколы химиотерапии/лучевой терапии для детей с нейробластомой и опухолью Вильмса часто включают парентеральное и энтеральное питание. В последнее время энтеральное питание стало более популярным, чем ППП, в основном по экономическим причинам. Разработан алгоритм нутритивной поддержки, требующий убедительного обоснования выбора парентеральной поддержки вместо энтеральной у детей с функциональным желудочно-кишечным трактом. 333 Такой план приводит к расширению выбора энтерального питания.
Постоянные субмаксимальные упражнения с целью увеличения мышечной массы, введение гормона роста, глутамина, кленбутерола и ацивицина (антиметаболит глутамина) предлагались в качестве дополнения к ППП. 292, 293, 322, 334–337 Необходимы клинические исследования, чтобы задокументировать точную роль этих дополнительных методов лечения.
292, 293, 322, 334–337 Необходимы клинические исследования, чтобы задокументировать точную роль этих дополнительных методов лечения.
Парентеральная нутритивная поддержка — это интенсивный метод клинической помощи, требующий участия врачей, фармацевтов, диетологов и опытных медсестер, которые вместе должны проводить ежедневные обходы для оценки состояния питания и выявления осложнений. Осложнения от парентерального питания могут быть множественными (). Среди них осложнения от инфекции являются наиболее проблематичными при использовании длительной нутритивной поддержки. Кроме того, расходы на питательные растворы, длительную госпитализацию и/или частые визиты в специальную клинику или кабинет являются огромным медицинским и финансовым бременем. По этим причинам перед началом парентерального питания необходим тщательный отбор пациентов. Парентеральная нутритивная поддержка у пациентов с неизлечимой формой рака остается весьма спорной и должна решаться в каждом конкретном случае.

 Чаще всего к истощению приводит острые кишечные инфекции, гельминтозы, хроническая малярия. Потеря веса типична для туберкулеза с поражением брыжеечных лимфоузлов, сифилиса, терминальных стадий ВИЧ-инфекции. Длительная высокая лихорадка при отсутствии медицинской помощи также чревата кахексией.
Чаще всего к истощению приводит острые кишечные инфекции, гельминтозы, хроническая малярия. Потеря веса типична для туберкулеза с поражением брыжеечных лимфоузлов, сифилиса, терминальных стадий ВИЧ-инфекции. Длительная высокая лихорадка при отсутствии медицинской помощи также чревата кахексией.

 Быстрая оценка нутритивного статуса проводится с помощью определения ИМТ. Дополнительно применяются измерения окружности мышц плеча, толщины подкожно-жировой складки, оценка количества тощей массы тела и жировой ткани, которая в норме составляет до 23% от общего веса.
Быстрая оценка нутритивного статуса проводится с помощью определения ИМТ. Дополнительно применяются измерения окружности мышц плеча, толщины подкожно-жировой складки, оценка количества тощей массы тела и жировой ткани, которая в норме составляет до 23% от общего веса.