Какой иммуномодулятор лучше: Синтетические иммуномодуляторы
Синтетические иммуномодуляторы
Следующая большая группа – синтетические препараты.
Полиоксидоний – иммуномодулятор отечественного производства. Основной механизм иммуномодулирующего действия – прямое воздействие на моноцитарно-макрофагальные клетки, нейтрофилы и естественные киллеры (NK-клетки), вызывая повышение их функциональной активности при исходно сниженных показателях. Механизм активации реализуется на уровне плазматической мембраны и связан с повышением ее проницаемости для ионов кальция. Повышает устойчивость мембран клеток к цитотоксическому действию лекарственных препаратов и химических веществ, что является основой детоксикационной активности препарата. Усиливает кооперацию Т- и В-лимфоцитов, стимулирует пролиферацию Т-лимфоцитов. Выброс большого количества цитокинов макрофагами активирует всю иммунную систему. Стимулирует антителообразование [39]. Полиоксидоний обладает способностью связывать на своей поверхности различные токсические вещества, в том числе бактерии, усиливая их выведение из организма [40]. Полиоксидоний удаляет из организма кислотные радикалы, снижая тем самым их повреждающее действие [41,49].
Используется при хронических рецидивирующих воспалительных заболеваниях любой этиологии, аллергических заболеваниях [42]. Если Полиоксидоний вводить через день по 6-12 мг 10 раз, то мембраностабилизирующая и детоксикационная активность позволяет снизить гепато- и нефротоксичность во время химиотерапии. Препарат способствует быстрому восстановлению онкологических больных после операций и существенному улучшению их самочувствия [134].
Для профилактики иммунодепрессивного влияния опухоли, коррекции нарушений препарат можно принимать 1-2 раза в неделю 2-3 месяца по 6 мг или в форме суппозиториев 6-12 мг 2 раза в неделю от 2-3 месяцев до года.
Иммуномодулятор с системным цитопротективным действием Глутоксим
относится к классу тиопоэтинов.
Оказывает модулирующее действие на внутриклеточный обмен тиола, играющего важную роль в регуляции метаболических процессов. Новый уровень окислительно-восстановительных процессов и динамики фосфорилирования белков систем, передающих сигналы, и факторов транскрипции иммунокомпетентных клеток определяет иммуномодулирующий и цитопротективный эффект препарата. В нормальных клетках Глутоксим стимулирует процессы пролиферации и дифференцировки, в трансформиро-ванных индуцирует апоптоз. Обладает высокой тропностью к клеткам центральных органов иммунологической защиты и лимфоидной ткани. Усиливает костно-мозговое кроветворение, активизирует фагоцитоз, восстанавливает функциональную активность макрофагов, инициирует систему цитокинов, эритропоэтина.
Предназначен для профилактики и лечения вторичных иммунодефицитов, как гепатопротектор – при вирусных гепатитах, потенцирует эффект антибактериальной терапии, улучшает переносимость химиотерапии [43]. Профилактическая доза 10 мг ежедневно 10 дней.
Галавит – следующий представитель синтетических иммуномодуляторов, производное аминофталгидрозида.
Нормализует функциональное состояние макрофагов, ингибирует их на 6-8 часов при гиперактивности, уменьшает этим избыточный синтез ФНО и ИЛ-1, снижая степень выраженности воспалительной реакции [142]. Стимулирует микробицидную функцию нейтрофильных гранулоцитов при ее дефиците, регулирует пролиферативную активность Т-лимфоцитов, стимулирует активность NK-клеток при ее недостаточности, усиливает фагоцитоз и повышает неспецифическую резистентность организма к инфекциям [140,142]. Ингибирует образование перекисных соединений, определяющих развитие диарейного и токсического синдрома, поэтому эффективен при острых кишечных инфекциях, сопровождающихся диареей и интоксикацией, воспалительных заболеваниях ЖКТ [147].
Применяется при инфекционных заболеваниях, гнойно-септических процессах, иммунодефицитах различной этиологии [146]. Препарат ускоряет репарацию раневых поверхностей, язв и эрозий кожи и слизистых [140]. У больных диссеминированным раком молочной железы не только улучшил иммунный статус, но и позитивно влиял на качество жизни [141]. В онкологии для иммунокоррекции Галавит назначают по 100 мг через день 5 раз, далее один раз в 3 дня до 20 введений или ректально в суппозиториях.
Препарат ускоряет репарацию раневых поверхностей, язв и эрозий кожи и слизистых [140]. У больных диссеминированным раком молочной железы не только улучшил иммунный статус, но и позитивно влиял на качество жизни [141]. В онкологии для иммунокоррекции Галавит назначают по 100 мг через день 5 раз, далее один раз в 3 дня до 20 введений или ректально в суппозиториях.
Тимоген – низкомолекулярный синтетический пептид, оказывающий регулирующее влияние на реакции клеточного и гуморального иммунитета, а также на неспецифическую резистентность. Синтез тимогена явился последовательным событием, вытекающим из изучения биологических экстрактов тимуса, когда выяснилось, что за биологическое действие отвечает не вся молекула экстрагированного вещества, а только часть ее. Активность большой молекулы, состоящей из нескольких десятков или сотен аминокислотных остатков, попытались воспроизвести короткими пептидными последовательностями из 2-4 аминокислот, которые обозначили как тимомиметики. Первым тимометиком стал тимоген, внедренный в медицинскую практику в 1987 г. Тимоген не является фрагментом гормона тимуса, дипептид глутамил-триптофана (Glu-Trp), на основе которого он изготовлен, входит также в состав молекул цитокинов, сывороточных иммуноглобулинов.
Иммуномодулирующие свойства тимогена реализуются путем передачи содержащегося в Glu-Trp сигнала через систему вторичных посредников. В результате этого изменяются структура и функциональные свойства ядерного хроматина, что активизирует процессы транскрипции, повышается подвижность клеток крови. Тимоген усиливает дифференцировку лимфоидных клеток за счет экспессии на Т-лимфоцитах дифференцировочных антигенов. Проявляет сродство к мембранным рецепторам тимоцитов и вызывает экспрессию на их мембранах CD- и DR-молекул. Препарат нормализует соотношение Т-хелперов и Т-супрессоров при иммунодефицитных состояниях, а также оказывает воздействие на колониестимулирующую активность костного мозга.
Используется при комплексной терапии инфекционно-воспалительных заболеваний, вызванных снижением показателей клеточного иммунитета, для профилактики инфекций, в процессе проведения лучевой и химиотерапии. Вводится внутримышечно по 50-100 мкг один раз в день, курсовая доза 300-1000 мкг, можно применять интраназально по 2-5 капель в каждую ноздрю 2-3 раза в день.
Тамерит – синтетическое производное фталгидразина – обладает противовоспалительным, иммуномодулирующим и антиоксидантным действием. Противовоспалительное действие обусловлено способностью препарата ингибировать избыточную продукцию макрофагами ФНО, ИЛ-1, нитросоединений активных форм кислорода на 10-12 часов.
Иммуномодулирующие свойства проявляются в восстановлении нормальной антиген-презентирующей и секреторной функции клеток моноцитарно-макрофагальной системы, стимуляции микробицидной системы нейтрофильных гранулоцитов и цитотоксической активности естественных киллеров.
Антиоксидантное действие реализуется за счет уменьшения потребления кислорода гиперактивированными макрофагами с последующим снижением генерации свободных радикалов.
Тамерит стимулирует репарацию тканей, активирует рост грануляций, ускоряет заживление инфицированных ран [44]. Применяется при воспалительных заболеваниях, септических состояниях, послеоперационных осложнениях. При вторичной иммунной недостаточности, вызванной химиотерапией, Тамерит вводят по 100 мг один раз в день два дня подряд, далее 100 мг один раз в три дня курсом до 15-20 инъекций.
Имунофан – гексапептид, в организме разрушается до естественных аминокислот: аргинина, тирозина, валила, лизила. Обладает иммунорегулирующим, детоксикационным, гепатопротективным и антиоксидантным действиями.
Обладает иммунорегулирующим, детоксикационным, гепатопротективным и антиоксидантным действиями.
Действие препарата проходит несколько фаз и продолжается 4 месяца. В течение быстрой фазы, начинающейся через 2-3 часа после введения и длящейся 2-3 суток, вследствие стимуляции продукции церуллоплазмина и лактоферрина усиливается антиоксидантная защита, нормализуется перекисное окисление липидов, ингибируется распад фосфолипидов клеточных мембран. В течение средней фазы, 2-3 – 7-10 суток, происходит усиление фагоцитоза. Во время этой фазы происходит гибель внутриклеточных бактерий и вирусов, и воспаление несколько усиливается за счет персистенции вирусных и бактериальных антигенов. В медленную фазу, от 7-10 дней до 4 месяцев, проявляется иммуномодулирующее действие – нарушение восстановление показателей клеточного и гуморального иммунитета путем восстановления иммунорегуляторного индекса, активирования пролиферации и дифференцировки Т-клеток за счет усиления продукции ИЛ-2, увеличения продукции специфических антител [45].
Имунофан применяют для профилактики и лечения иммунодефицитных состояний различной этиологии. При токсическом и инфекционном поражении печени препарат предотвращает цитолиз, снижает активность трансаминаз и уровень билирубина в сыворотке крови. В онкологии Имунофан используется: перед операцией 1 мл 0,005% раствора 2-3 инъекции подкожно или внутримышечно; перед химио- или лучевой терапией 3-5 введений через день; в стадии генерализации опухоли 5-7 раз через день каждые три недели трижды [46].
5-тикратное использование Имунофана по 2 мл через день на фоне химиотерапии у 375 больных не только улучшило переносимость последней – на 17% реже возникала лейкопения и в 1,5-2 раза проявления гепатотоксичности; но и у 80% по сравнению с 63% в контроле отмечено быстрое восстановление лейкоцитов, достоверно увеличился процент эффективности химиотерапии на 7 [76].
Неовир – оригинальный отечественный препарат, при введении вызывает быстрое образование в организме интерферонов, идентифицированных как ранний альфа- и бета-интерфероны.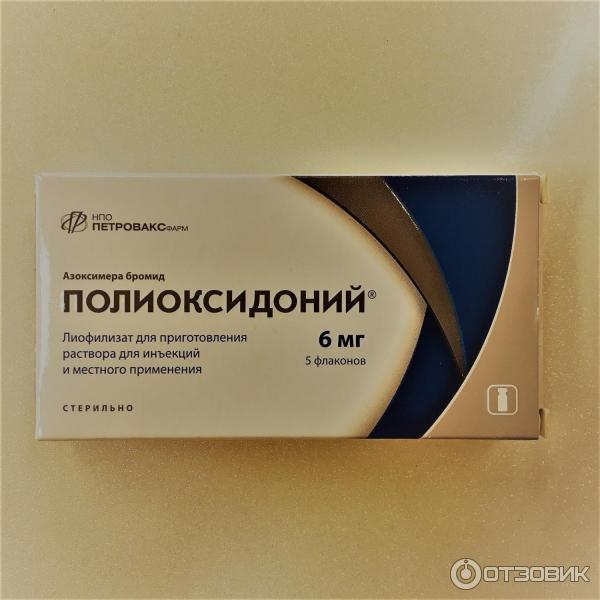 Этот препарат индуцирует реакции, направленные на уничтожение вируса, а также готовит иммунокомпетентные клетки к повышенному выбросу интерферона в ответ на последующее воздействие болезнетворного агента. По динамике сывороточного титра интерферона доза Неовира 250 мг эквивалентна 6-9 млн. МЕ реаферона.
Этот препарат индуцирует реакции, направленные на уничтожение вируса, а также готовит иммунокомпетентные клетки к повышенному выбросу интерферона в ответ на последующее воздействие болезнетворного агента. По динамике сывороточного титра интерферона доза Неовира 250 мг эквивалентна 6-9 млн. МЕ реаферона.
Иммуностимулирующее действие обусловлено активацией стволовых клеток костного мозга, Т-лимфоцитов и макрофагов системы полиморфно-ядерных лейкоцитов, нормализацией баланса между субпопуляциями Т-хелперов и Т-супрессоров.
Эффективен при некоторых РНК- и ДНК-геномных вирусах (вирусы группы Herpes, гриппа), инфицировании хламидиями, кандидозе слизистых. При ВИЧ и герпесе снижает продукцию ФНО, повышает способность лейкоцитов к синтезу альфа-интерферона, стимулирует образование активных форм кислорода.
Отмечена способность препарата купировать вторичную резистентность к тамоксифену при гормонозависимом раке молочной железы, что обусловлено увеличением экспрессии рецепторов прогестина и эстрогена и элиминацией рецептор-негативного пула.
При опухолевых заболеваниях считается, что Неовир усиливает активность естественных киллеров и нормализует продукцию ФНО, что должно сказываться на качестве жизни, предотвращая кахексию. Но это показание применения не нашло из-за проявлений токсичности (гриппоподобный синдром, болезненность в месте инъекции) и высокой стоимости препарата. Для терапии кахексии также малоприемлема инъекционная форма введения лекарственного средства.
Попытки терапии чувствительных к интерферонам злокачественных опухолей также дали неубедительные результаты. Дело в том, что при использовании индукторов интерферона рано или поздно клетка вступает в фазу гипореактивности, когда повторное введение препарата не вызывает ответной продукции интерферона, либо она настолько низка, что не вызывает какого-либо значимого ответа. Неовир может включаться в качестве дополнительного средства в комплексную терапию распространенных почечно-клеточного рака или меланомы. Вводится внутримышечно по 250 мг раз в день №5, терапия не из дешевых.
Вводится внутримышечно по 250 мг раз в день №5, терапия не из дешевых.
Низкомолекулярный индуктор альфа- вета- и гамма-интерферона Амиксин стимулирует его образование клетками эпителия кишечника, гепатоцитами, Т-лимфоцитами и гранулоцитами; стимулирует стволовые клетки костного мозга, увеличивает продукцию Ig M, Ig A и Ig G, восстанавливает соотношение Т-хелперов и Т-супрессоров.
Амиксин использовался в комплексном лечении больных с железисто-кистозной гиперплазией эндометрия. Исходное снижение продукции всех интерферонов отмечено у 80%, угнетение функциональной активности Т-лимфоцитов со снижением соотношения Т-хелперы и Т-супрессоры. После амиксина только у 20% осталась сниженной продукция интерферонов, Т-лимфоциты нормализовались у всех больных [74]. При приеме препарата до начала гормональной терапии отмечался более быстрый и полный клинико-морфологический эффект.
В результате индукции эндогенного интерферона оказывает антипролиферативное действие на опухолевые клетки.
Активен против гепато-, герпес- и миксовирусов [115]. Широко используется для профилактики гриппа и ОРВИ. В первые два дня внутрь принимается 1-2 таблетки после еды, следующие приемы – через 48 часов по 1 таблетке. Продолжительность курса от 1 до 4 недель зависит от нозологической формы.
Синтетический пептид Гепон также является индуктором альфа- и бета-интерферона, активирует макрофаги, ограничивает выработку ИЛ-1, ИЛ-6, ИЛ-8, ответственных за воспаление, и ФНО. Препарат привлекает моноциты в зону воспаления, усиливает синтез антител против антигенов инфекционной природы. У больных с ослабленным иммунитетом Гепон частично или полностью восстанавливает количество иммунокомпетентных клеток в истощенных популяциях лейкоцитов и лимфоцитов, повышает функции отдельных звеньев иммунитета [139].
Эффективен при ВИЧ и герпесе, так как подавляет репликацию вируса непосредственно в инфицированных клетках и одновременно активирует иммунные реакции [47]. При курсовом применении предупреждает рецидивы оппортунистических инфекций в течение 3-6 месяцев. Местное орошение Гепоном подавляет рост Candida, так как препарат хорошо всасывается и активирует местный иммунитет [139]. Выпускается в виде порошка для растворения и приема внутрь или орошения слизистых.
При курсовом применении предупреждает рецидивы оппортунистических инфекций в течение 3-6 месяцев. Местное орошение Гепоном подавляет рост Candida, так как препарат хорошо всасывается и активирует местный иммунитет [139]. Выпускается в виде порошка для растворения и приема внутрь или орошения слизистых.
Левамизол (декарис) кроме основного антигельминтного действия оказывает комплексное влияние на иммунную систему: увеличивает выработку антител на различные антигены; усиливает Т-клеточный ответ, активируя Т-лимфоциты и стимулируя их пролиферацию; повышает способность к адгезии, хемотаксису и фагоцитозу моноцитов, макрофагов и нейтрофилов. Препарат ослабляет сильную иммунную реакцию, усиливает слабую и не изменяет нормальную. Признаки клинического улучшения следует ожидать через 8-12 недель, а окончательное суждение об эффективности препарата можно вынести к 3 месяцу.
В отличие от других иммуномодуляторов, обладает широким спектром токсических реакций у 25-30% больных: диспепсия, энцефалитоподобный синдром, агранулоцитоз. Усиливает действие алкоголя (антабусподобный синдром) и непрямых антикоагулянтов. Запрещен при ревматоидном артрите с позитивным HLA-B 27.
Для стимуляции иммунитета Левамизол назначают по 150 мг 1 раз в сутки три дня подряд или по 150 мг 1 раз в неделю с обязательным контролем лейкоцитов. При раке ободочной кишки на 7 день после резекции по 50 мг 3 раза в день в течение трех дней каждые 2 недели на протяжении года.
Мещерякова Н.Г.
Витбиомед+ | Сеть клиник в Москве
Названия этих групп препаратов похожи, но сами лекарства могут обладать противоположным действием. Разберемся, в чем разница между иммуномодуляторами и иммуностимуляторами.
Понять нужно одно: иммуномодуляторы – это лекарства, которые воздействуют на иммунную систему, влияя на ее функционирование. Иммуномодуляторы могут как стимулировать иммунную систему, так и подавлять ее. Иммуностимуляторы стимулируют иммунитет, а иммунодепрессанты его подавляют.
Иммуностимуляторы стимулируют иммунитет, а иммунодепрессанты его подавляют.
Иммунодепрессанты позволяют снижать избыточный иммунный ответ, что часто требуется при аутоиммунных заболеваниях, когда иммунная система атакует клетки собственного организма, при трансплантации органов, чтобы избежать отторжения пересаженного органа.
Иммуностимуляторы: что нужно знать
Иммуностимуляторы – это вещества, которые усиливают работу иммунной системы, прямо или опосредованно повышая активность любого из ее компонентов: они усиливают как врожденный, так и приобретенный иммунитет. Иммуностимуляторы применяют при вирусных, грибковых инфекциях, иммунодефицитных состояниях, некоторых онкологических заболеваниях. Иммуностимуляторы могут быть как природного, так и синтетического происхождения.
Иммуностимуляторы повышают сопротивляемость организма при помощи различных механизмов. Они увеличивают окислительные способности нейтрофилов, помогая им бороться с чужеродными клетками, повышают поглощающую способность фагоцитов, стимулируют цитотоксические клетки, которые помогают организму справляться с вирусами.
Иммуностимуляторы классифицируют в зависимости от их природы и способа действия. К ним относят бактериальные препараты, сложные углеводы, цитокины, лекарственные препараты, экстракты животного и растительного происхождения. Так, к иммуностимуляторам – сложным углеводам относятся глюканы, в том числе бета-глюканы, такие как лентинан, бестатин, склероглюкан и другие. Эти вещества природного происхождения обладают минимумом побочных действий, тогда как их эффективность для активации местного и системного иммунитета была подтверждена многократными исследованиями. На их основе создаются медицинские препараты.
Другая группа природных иммуностимуляторов – это витамины, каротиноиды, различные липиды, селен. Эти вещества поступают в организм с пищей или в виде биодобавок.
Среди иммуностимуляторов животного происхождения выделяют хитозан – его получают из панцирей ракообразных. Много иммуностимуляторов имеют растительное происхождение: к ним относятся такие известные растения, как имбирь, алоэ вера, зеленый чай, базилик тонкоцветный, эхинацея.
Много иммуностимуляторов имеют растительное происхождение: к ним относятся такие известные растения, как имбирь, алоэ вера, зеленый чай, базилик тонкоцветный, эхинацея.
К иммуностимуляторам относятся цитокины – маленькие белковые молекулы, такие как фактор некроза опухоли, интерлейкин-2.
Существует и группа лекарственных препаратов, которые стимулируют разные компоненты иммунной системы. Они могут обладать серьезными побочными эффектами, поэтому не стоит принимать их без назначения врача. Серьезное вмешательство в иммунную систему должно проходить под контролем специалиста: эта система слишком сложна. И не стоит употреблять иммуностимуляторы «для профилактики, на всякий случай». Если вы более редко, значит, ваш иммунитет в порядке. Если же вы болеете чаще, чем хотелось бы, стоит обратиться к врачу и выяснить, почему это происходит.
смысла пить иммуномодуляторы сейчас нет, но обезопасить себя нужно
Коронавирус — инфекция для нас новая, и вопросов в отношении ее немало. Работают ли здесь классические меры укрепления иммунитета? Почему у одних она протекает незаметно, а других укладывает на больничную койку? Что можно предпринять прямо сейчас, чтобы усилить естественную защиту организма? Эти и другие вопросы мы задали клиническому иммунологу, заведующему кафедрой пропедевтики внутренних болезней БГМУ профессору Эдуарду Доценко.— Что сейчас известно об иммунном ответе на коронавирус? Может ли организм с ним справиться самостоятельно?
— Известно очень мало. Это новая инфекция, особенности иммунного ответа на нее изучаются. По всей видимости, к вирусу вырабатываются антитела — сейчас в мире разрабатываются диагностические тест-системы, основанные на обнаружении антител к коронавирусу. Но насколько приобретенный иммунитет может защитить человека и как долго, влияет ли на него изменчивость антигенной структуры вируса, неизвестно. Это зависит как от человека, так и от свойств вируса, которые изучаются.
Есть еще одна проблема, которая активно исследуется. Возможно, участие иммунной системы в патологическом процессе двоякое: с одной стороны, на начальных этапах активная иммунная система — это благо, вырабатываются защитные факторы. Но потом у части пациентов — и это тяжелые пациенты — развивается гиперстимуляция иммунной системы, так называемый цитокиновый шторм, неконтролируемый выброс различных иммунных субстанций, которые усиливают повреждение легких. Но еще раз подчеркиваю: это все на уровне гипотез.
У большинства инфицированных коронавирусом болезнь протекает бессимптомно, в легкой или среднетяжелой форме. Опыт Италии, Испании говорит о том, что все случаи делятся приблизительно так: 80 процентов — легкое и среднетяжелое течение, 15 процентов — тяжелое, требующее кислородной поддержки, и 5 процентов — крайне тяжелое, требующее искусственной вентиляции легких.
— Звучат предположения, что к вирусу нечувствительны лица, вакцинированные БЦЖ. Как вы к этому относитесь?
— Есть отдельные (!) наблюдения, что у вакцинированных БЦЖ заболевание протекает легче. То есть они болеют, но чаще в бессимптомной и легкой формах. Например, частота заражения в Германии, возможно, зависит от региона: в бывшей Восточной Германии, где проводили вакцинацию БЦЖ по модели СССР, случаев коронавирусной инфекции регистрируется меньше, чем в Западной Германии, где такую иммунизацию не проводили. Некоторые исследователи говорят о таком же эффекте и в отношении вакцинации против кори. Но пока это предположения, научные гипотезы, окончательно не доказанные. Требуется дальнейший анализ данных.
— Есть ли смысл сейчас принимать иммуностимулирующие препараты типа иммунала?
— Нет. Абсолютно никакого. Инфекция новая, высококонтагиозная (заразная), какой бы иммунитет у вас ни был — при контакте с вирусоносителем вы заболеете.
— Может быть, поддержать иммунитет поможет витамин D? Какие витамины вообще стоит принимать для поддержки организма в этот период?
— Витамин D имеет смысл принимать только в случае его нехватки, гиповитаминоза. При нормальном его содержании прием ничего не даст. Что касается других витаминов, то я сторонник естественного их поступления в организм при полноценном питании: хлеб, мясо, рыба, фрукты, овощи — в этом случае мы получаем все необходимое. Конечно, принимать витамины тоже можно, в этом случае следует отдать предпочтение поливитаминам.
При нормальном его содержании прием ничего не даст. Что касается других витаминов, то я сторонник естественного их поступления в организм при полноценном питании: хлеб, мясо, рыба, фрукты, овощи — в этом случае мы получаем все необходимое. Конечно, принимать витамины тоже можно, в этом случае следует отдать предпочтение поливитаминам.
— Резко взлетели цены на имбирь, лимоны, чеснок, которым народная молва приписала антикоронавирусные свойства. Есть ли в этом мнении рациональное зерно?
— Нет. Если вы любите чай с имбирем — пейте на здоровье, но помните, что от коронавируса это не спасет. Более того, повышается риск заражения вирусом, поскольку любой поход в магазин, на рынок (за имбирем) повышает вероятность инфицирования.
БУДЬТЕ В КУРСЕ
• Регулярно обрабатывайте руки спиртосодержащим средством или мойте их с мылом.
• Держитесь на расстоянии не менее полутора-двух метров от кашляющих или чихающих людей.
• Не прикасайтесь руками к глазам, носу и рту (губам), поскольку мы трогаем множество предметов, на которые мог попасть вирус.
• При кашле или чихании прикрывайте рот и нос сгибом локтя или салфеткой, которую после использования стоит сразу же выбросить.
• Почувствовав недомогание, оставайтесь дома. Обратитесь за медицинской помощью, если у вас повысилась температура, появился кашель или затруднилось дыхание.
Автор: Юлия Василишина
Советская Белоруссия: 8 апреля 2020
Мифы и правда об укреплении иммунитета
- Дарья Прокопик
- для ВВС Украина
Автор фото, Sean Gallup/Getty Images
Болеть никто не любит. Мы все мечтаем иметь настолько крепкий иммунитет и хорошее здоровье, что медицинская реформа в Украине нас перестанет интересовать. Можно ли укрепить иммунитет и что может его ослабить?
Можно ли укрепить иммунитет и что может его ослабить?
Иммунитет это искусство дискриминации и толерантности. Дискриминации и уничтожения вредоносного — инфекций и опухолей, и толерантности к неопасному — нашим же тканям, пище и непатогенным микробам, например.
Иммунная система — это органы и клетки, которые различаются по ролям. А иммунитет — это результат слаженной работы иммунной системы, огромной корпорации, в которой есть несколько главных офисов, множество отделов, сеть тренинговых центров, полиция и спецназ. И хорошие бонусы для преданных сотрудников. Поэтому нельзя говорить об иммунитете, как о чем-то едином и однообразном.
Миф №1. Стрессы ослабляют иммунную систему
Сначала стресс почти никак не влияет на организм, потом ослабляет его, а после этого иммунная система привыкает к стрессовой реакции.
Острый стресс никак не влияет на врожденный иммунитет — тот, который первым принимает инфекции и всегда с нами. Приобретенный, он же специфический иммунитет, на острый стресс реагирует определенным ослаблением.
Стресс средней продолжительности подавляет клеточный иммунитет. Он борется с опухолями или пораженными вирусами клетками. Но наша способность образовывать антитела остается неизменной. Антитела — это белки крови, которые специфически обезвреживают вирусы, токсины и облегчают уничтожение бактерий.
Хронический стресс очень плохо влияет на наш организм в целом. Однако иммунная система учится с ним жить и не терять реактивности. Длительное воздействие гормонов стресса заставляет клетки иммунной системы прятать рецепторы к ним и становиться нечувствительными.
Ученые предупреждают, что стресс страшен для иммунитета прежде всего изменением привычек — нехваткой сна, употреблением алкоголя и неправильным питанием.
Миф №2. Купание в проруби или обливание ледяной водой укрепляют здоровье
Самое полезное — приучить себя к холоду и свежему воздуху.
Одноразовое купание на Крещение — это тоже острый стресс. Гормоны помогают приспособиться к низкой температуре, но иммунная система работает, как и раньше.
Регулярные обливания или купание в ледяной воде усиливают «провоспалительный фон» и активируют некоторые звенья врожденного иммунитета. С одной стороны — это хорошо. А с другой — воспаление без причины нам не нужно.
Почему же тогда люди чувствуют себя лучше, если закаляются?
Холод приучает нашу периферическую нервную систему и сосуды быстро и правильно реагировать на изменения температур. Как результат, мы лучше переносим холод и создаем худшие условия для размножения риновирусов — возбудителей насморка и некоторых ОРЗ.
Миф №3. Для укрепления здоровья необходимо принимать иммуномодуляторы и витамины
Иммуномодуляторы следует принимать только по рецепту врача.
С вопросом об использовании иммуномодуляторов мы обратились к специалисту. Вот что говорит Вера Гаевская, врач-иммунолог: «По международным протоколам, иммуномодуляторы можно применять только при определенных тяжелых состояниях. Это аутоиммунные заболевания, СПИД, онкология, трансплантация органов».
По ее словам, иммунная система состоит из трех основных ступеней защиты, которые, в свою очередь, содержат тысячи веществ. Вмешательство в работу этого чрезвычайно сложного механизма является нецелесообразным. Работа всех компонентов иммунного ответа регулируется самостоятельно. При правильном образе жизни и сбалансированном питании, иммунитет сам наладит свою работу.
«Таким образом, применение иммуномодуляторов для укрепления иммунной системы выглядит, как попытка залить бензин в современный электромобиль», — добавляет Гаевская.
Мультивитамины или привычные нам высокие дозы витамина С вряд ли наладят иммунитет. Роль витамина С в улучшении иммунного ответа и борьбе с инфекциями не доказана клинически. Польза мультивитаминов для иммунной системы и других показателей здоровья также не доказана. А избыток витаминов А, D и Е даже является токсичным.
Польза мультивитаминов для иммунной системы и других показателей здоровья также не доказана. А избыток витаминов А, D и Е даже является токсичным.
Миф №4. Антибиотики ослабляют иммунитет
Антибиотики иногда необходимы, а иммунитет ослабляет неправильный протокол лечения.
Антибиотики нужны для специфического и эффективного уничтожения бактериальной инфекции. Если врач прописал курс антибиотиков, и перед этим определил чувствительность бактерий к ним, следует пропить все.
Почему же иногда после лечения антибиотиками нам плохо, а у женщин часто развивается кандидоз?
Антибиотики могут уничтожать не только плохие бактерии, но и нужную нам нормофлору. Значительная ее гибель освобождает пространство для условно-патогенных микроорганизмов, например, грибков. Поэтому, согласно протоколам лечения, антибиотики следует прописывать с противогрибковыми препаратами, говорит иммунолог Вера Гаевская.
Миф №5. Грудное вскармливание и развитие ребенка на природе защищает детей от заболеваний
Грудное вскармливание и нестерильные условия роста младенца — это действительно хорошо для иммунитета. Но этого недостаточно, чтобы остановить любую болезнь.
С рождения ребенок имеет неспецифический иммунитет и наследует долю иммунитета мамы, а именно — такие же антитела. Они проходят через плаценту и есть в составе грудного молока.
Но антитела долго не живут, их количество ограничено, и это лишь одна из составляющих иммунной системы. Поэтому впоследствии ребенок должен развить собственный специфический иммунитет.
Доказано, что дети, которые в течение первого года жизни росли на фермах, или играли с домашними животными, реже страдали от аллергии. Собаки привносят в дом много уличной грязи, с которым знакомится иммунная система ребенка. Наличие в доме кота существенно снижает шансы развития астмы у генетически предрасположенных детей.
Впрочем, чтобы хорошо противостоять инфекционным болезням, следует с ними ознакомиться — переболеть или пройти вакцинацию. Иначе иммунная система никак не может научиться заранее их узнавать и останавливать.
Миф № 6. Мытье рук, особенно антибактериальным мылом, защищает нас от болезней
Мытье рук эффективно предотвращает распространение многочисленных инфекций. Но антибактериальное мыло приносит больше вреда, чем пользы.
Центры Контроля Заболеваний (Сenters of Disease Control, CDC, США) советуют мыть руки с мылом, чтобы предотвратить попадание бактерий и вирусов с ладоней на кожу лица, в глаза и внутрь организма. Мытье рук считают эффективным профилактическим средством против гриппа и кишечных инфекций.
Однако противобактериальные вещества, мыло или антисептики вредны. Во-первых, они будут уничтожать нормофлору кожи. Во-вторых, бактерии быстро привыкают, и поэтому регулярное применение антисептиков для рук выведет на коже устойчивые бактерии. Наконец, распространенный антисептик триклозан вреден для здоровья людей: он ослабляет иммунитет и нарушает синтез гормонов.
Что же является эффективным средством активизации иммунитета?
Иммунную систему не надо стимулировать искусственно. Ее чрезмерная активность проявляется не в устойчивости к инфекциям, а в появлении аллергии и аутоиммунных заболеваний.
Полноценный сон дарит нам гормон мелатонин, который способствует хорошему восстановлению и поддерживает здоровье иммунной системы.
Потребление овощей, фруктов и масел обеспечивает нас витаминами, антиоксидантами и растительными волокнами. Все это предотвращает воспаление, снабжает иммунную систему необходимыми витаминами и микроэлементами, и способствует здоровью кишечника.
Физические нагрузки эффективно снижают вредоносные процессы воспаления в организме, при ревматоидном артрите, например, и возвращают работу иммунной системы в здоровое русло.
Самыми полезными для иммунной системы явля.тся не дорогие лекарства, а бесплатные вещи.
Содержание этой статьи предназначено только для общей информации и не должно рассматриваться в качестве замены медицинских советов вашего лечащего врача или любого другого специалиста из сферы здравоохранения. ВВС не несет ответственности и не может быть привлечено к таковой за любой диагноз, который может поставить пользователь на основании содержания этого сайта. ВВС не может привлекаться к ответственности за содержание внешних интернет-сайтов, указанных в этой публикации. Она не предлагает какие-либо коммерческие продукты или услуги, упоминаемые или рекомендуемые на этих сайтах. Всегда обращайтесь за консультацией к вашему врачу, если у вас возникают опасения по поводу вашего здоровья.
Иммунолог — о борьбе иммунитета против коронавируса – Газета.uz
Издание Anhor.uz опубликовало интервью с кандидатом медицинских наук, клиническим иммунологом-инфекционистом Азизой Ходжаевой о том, как защищается организм от коронавируса, нужно ли вмешиваться в этот процесс и какую роль в формировании иммунитета играют карантинные ограничения.
Ввиду важности темы и мнения врача-иммунолога о лечении иммуностимуляторами «Газета.uz» с разрешения редакции Anhor.uz перепечатывает интервью полностью.
— COVID-19 — совершенно новый вид инфекции, и поэтому у нас нет к ней иммунитета?
— Это верно, но лишь отчасти. Важно понимать: информация об инфекции сравнительно свежая. С момента вспышки заболевания в китайском Ухане мы учимся, получаем новые данные, сравниваем со старыми, и поэтому сейчас в головах у очень многих думающих врачей своего рода винегрет. Коронавирусная инфекция COVID-19, конечно, новая. Но это не значит, что коронавирус как инфект (возбудитель инфекции — ред.) неизвестен нашему организму. Мы в той или иной степени непременно сталкивались с каким-либо из коронавирусов, даже если переносили его под видом ОРВИ-подобного заболевания.
COVID-19 — это быстрая инфекция. Это означает, что у него короткий инкубационный срок, быстрое развитие болезни, высокая контагиозность и сравнительно быстрое течение. К этому типу относятся грипп, ОРВИ, ОРЗ. Вирусы имеют способность быстро мутировать и изменять участки в своём строении, но всегда остаются и те структуры, которые не меняются, и новая коронавирусная инфекция имеет одинаковые с другими коронавирусными инфектами участки. Поэтому утверждать, что это заболевание для нас совершенно новое, было бы неправильно. При этом у COVID-19 есть структуры, с которыми человеческий организм действительно раньше не сталкивался. В силу этого у нас нет антител, и поэтому мы не всегда уверены в том, кто и как будет болеть.
— Как формируется иммунитет к COVID-19?
— Думаю, ответ на этот вопрос появится через год или два. Речь ведь идет не только о формировании быстрого иммунного ответа, при котором иммуноглобулины класса М (IgM) появляются уже на четвертый-пятый день с момента инфицирования и ранние иммуноглобулины класса G (IgG) — якобы на 14-й день.
По законам иммунологии, качественные иммуноглобулины класса G формируются не ранее чем через три месяца, а вовсе не через две недели с момента мнимого выздоровления. Но как долго они будут оставаться в организме — год, два, пять лет — мы еще не знаем. Это покажут научные исследования, которые будут проводиться. Все, чем мы сейчас располагаем, это информация шести месяцев. Для того чтобы сделать резюме отдаленного характера этого мало.
— В интернете много рекомендаций по тому, как укреплять и помогать иммунитету бороться с COVID-19. Стоит ли вмешиваться в этот процесс, на каких этапах и в чем эта помощь должна заключаться?
— Прежде чем ответить на вопрос, расскажу, что такое иммунитет. Это способность организма сопротивляться «чужим»: вирусам, простейшим, бактериям. Изначально иммунитет сформировался как противовес мутирующим клеткам, то есть, по сути, природа снабдила нас противоопухолевой защитой.
По мере эволюции иммунная система училась противостоять всем угрозам, которые встречались биологическим объектам, в том числе человеческому организму. Сейчас мы обладаем мощной защитной системой с внутренними резервами, которые включаются, как только в тело попадает возбудитель.
К примеру, люди часто жалуются на то, что поднялась температура. Это не что иное как работа иммунитета, в которой принимает участие иммунная и нейроэндокринная системы. Мы не видим и не подозреваем, что в организм попал «чужой», но его чувствуют наши клетки. Они моментально начинают метить врага, показывая другим клеткам, кого нужно уничтожить. Повышается температура, вырабатывается особое вещество интерферон, и вирус оказывается в условиях, в которых не выживет.
Мы подходим к ключевому моменту в ответе на вопрос, стоит ли вмешиваться в работу иммунитета, и необходимо объяснить, что существует несколько вариантов иммунного ответа: гиперэргичный, нормаэргичный и гипоэргичный. Человеческий организм реагирует на возбудителя по-разному: излишне (гиперэргично), умеренно (нормаэргично) и слабо (гипоэргично).
У больного с очень повышенной реактогенностью поднимается очень высокая температура. Как правило, мы сразу стараемся ее сбить — нам некомфортно. Однако до определенных показателей (например, до 38 градусов) сбивать температуру нежелательно, чтобы не блокировать нашу естественную борьбу. Желание облегчить себе жизнь мешает иммунитету работать.
К сожалению, есть у нас и другой крен. На мой взгляд, очень неправильный, особенно применительно к COVID-19. У нас почему-то стараются назначать препараты для иммунитета, а это категорически неверная позиция. Объясню, почему. Патогенез (суть — ред.) коронавирусной инфекции COVID-19 — васкулит. Это особое заболевание с аутоиммунным механизмом, которое приводит к воспалению эндотелия сосудов. Представьте, что пациентом может оказаться человек, у которого от природы гиперэргическая реакция, то есть он всегда отвечает на введение в организм «чужого» очень бурно. Наш «чужой» (COVID-19) обладает тропностью (привязанностью — ред.) к тканям верхних и нижних дыхательных путей и эндотелию сосудов. Он прикрепляется к этой ткани, которая выстилает внутреннюю поверхность кровеносных, лимфатических сосудов, сердечных полостей.
Наш «чужой» (COVID-19) обладает тропностью (привязанностью — ред.) к тканям верхних и нижних дыхательных путей и эндотелию сосудов. Он прикрепляется к этой ткани, которая выстилает внутреннюю поверхность кровеносных, лимфатических сосудов, сердечных полостей.
Иммунная система, пытаясь избавить тело от вируса, атакует этот эндотелий и приводит к мощному воспалению. Так называемый цитокиновый шторм это по сути своей защитная реакция организма, но способная этот организм погубить. Если эту атаку усилить препаратом, который заставит клетки индуцировать интерферон, то больного можно потерять.
Лечение иммуностимуляторами — это большая проблема, на которую я и мои коллеги в Facebook-группе «Врачи Ташкента» пытаемся обратить внимание. Нельзя давать больным такие препараты, потому что никогда не знаешь, как поведет себя организм. Есть риск попасть на человека, который дает избыточный ответ на попадание в организм вируса. Если этот ответ усилить иммуностимулятором, то можно привести больного к тому самому васкулиту, от которого хотели его спасти. Во всем мире людей не лечат стимуляторами иммунитета, боятся этого делать.
— Можно ли проверить иммунитет на эту реакцию перед началом лечения?
— Во время острого заболевания этого делать не нужно, потому что карта иммунологического обследования покажет активацию иммунных клеток. Это естественный процесс, он обязан быть. Есть и риск неправильной трактовки информации. Поэтому думающие врачи всегда ориентируются на клинику.
Практически 75−80% людей перенесут COVID-19 в бессимптомной, легкой и среднетяжелой форме. А вот у 20−25% пациентов заболевание будет протекать по гиперэргичному сценарию. Необходимо просто наблюдать за человеком, с тем чтобы оказать ему наиболее правильную помощь, с учетом его преморбидного состояния. Преморбидное состояние — это все фоновые заболевания, с которыми человек может жить: сахарный диабет, гипертоническая болезнь и многие другие, протекающие в хронической форме.
— Что такое коллективный иммунитет, и почему многие страны решили выбрать именно эту стратегию борьбы с вирусом?
— Не все страны дают возможность жителям встретиться с инфектом. Такой путь выбрали Швеция и Беларусь. Но так или иначе, встретившись с возбудителем, организм выработает антитела, и примерно 70% населения страны, у которых уже есть антитела, смогут обеспечить относительную защиту для тех, у кого этих антител нет.
Объясню на примере иммунизации детей. Мы вакцинируем детей, чтобы, во-первых, они сами не заболели, а, во-вторых, чтобы не встретились с инфектом те дети, которые не могут быть иммунизированы в силу того, что у них есть, к примеру, первичный иммунодефицит. Коллективный иммунитет и этих неиммунизированных детей тоже спасает.
Делаем вывод: если у человека есть иммунитет, то он не будет инфицирован. Стало быть, не станет переносчиком вируса и не сможет его передавать. Мы же сейчас наблюдаем большое количество людей, у которых нет антител. Они — воспринимающее звено, которое при встрече с носителем коронавирусной инфекции заражается и заболевает. По сути, эту цепочку Минздрав пытается прервать с помощью карантинных мер, а по факту сражается с ветряными мельницами.
— Что происходит в случае введения карантинных ограничений, к которым Узбекистан вернулся после апрельского режима, и есть ли в них смысл?
— Жесткий карантин в апреле сохранил внутреннюю популяцию в Узбекистане малоинфицированной, то есть большая прослойка населения не встретилась с вирусом.
К сожалению, на этот неиммунизированный фон сейчас легла огромная вирусная нагрузка в лице бессимптомных носителей коронавирусной инфекции, в том числе среди тех, кто вернулся из «красных» стран. Понимаю, что людей нельзя было оставлять далеко и в неизвестности, но, к сожалению, мы не были готовы в плане иммунитета противостоять огромному количеству инфицированных.
Другая проблема — это справки с ложноотрицательным результатом, которые выдают носителям вируса. Происходит это в результате неправильного забора биоматериала, когда мазки берут обычной ватной палочкой вместо специального тупфера (стерильного зонда-тампона).
Происходит это в результате неправильного забора биоматериала, когда мазки берут обычной ватной палочкой вместо специального тупфера (стерильного зонда-тампона).
По этим причинам то, что Россия прошла в марте-мае, мы проходим сейчас. До пика еще не дошли. В Узбекистане, с точки зрения инфекционного процесса, идет подъем, каждый день прибавляется количество пациентов. Положительное во всей ситуации то, что все, у кого сейчас выявляется заболевание, создают для остальных иммунизированную подушку. Эти люди уже инфицированы, и у них формируются антитела.
Я как специалист не вижу смысла в возвращении строгого карантина. Считаю, что нужно было оставить умеренные меры, которые у нас и были. Слышала, что ректор ТашИУВ (профессор Хабибулла Акилов, представитель штаба по борьбе с коронавирусом — ред.) сказал о том, что все койки заняты — возможно, усиление карантина связано именно с этим. Мы боимся за пациентов, которых можем не спасти. Ради них вводится карантин, растягивается во времени инфицирование, чтобы обойтись без резких пиков.
— О каких именно пациентах идет речь?
— В зоне риска находятся пациенты, у которых есть преморбидный фон — фоновые заболевания, с которыми люди живут. Это метаболический синдром, сахарный диабет, гипертония, ишемическая болезнь сердца и другие. С ними можно научиться жить, контролируя заболевания таблетками, диетами, образом жизни. К сожалению, эти пациенты уязвимы, и по наблюдениям врачей именно они болеют тяжелее, и смертность у них выше. Кстати, давно известно, что, к примеру, и вирус гриппа прежде всего уносит тех, у кого отягощенный преморбидный фон.
В случае с COVID-19 в начале говорили, что молодые либо не болеют, либо болеют легко. В этом есть некий дуализм. У нас молодые люди тоже, к сожалению, не абсолютно здоровы, и у них уже к 20−25 годам есть какой-то преморбидный фон. Такие пациенты переносят заболевание сложнее.
— Как вы, с позиции инфекциониста, оцениваете сами карантинные меры: ношение масок, перчаток, тоннели с хлором? Насколько они адекватные?
— Я за ношение масок. У части людей заболевание проходит в бессимптомной форме, но они при этом выделяют вирус. И если человек в правильной маске, а не в тряпочке, которую сейчас на носу носят, чтобы не оштрафовали, то у него больше шансов никого не заразить.
У части людей заболевание проходит в бессимптомной форме, но они при этом выделяют вирус. И если человек в правильной маске, а не в тряпочке, которую сейчас на носу носят, чтобы не оштрафовали, то у него больше шансов никого не заразить.
Я за то, чтобы люди носили перчатки. Не одну пару, а две. Так как я имею представление об инфекционном процессе, ношу именно так: сначала надеваю перчатки, которые плотно прилегают к рукам, поверх — перчатки посвободнее. Объясню, почему. Когда хожу на улице, так или иначе дотрагиваюсь до всего. То же самое делают бессимптомные носители. Вероятность подцепить вирус, прикоснувшись к ручке двери, есть всегда. При этом не везде есть возможность обработать руки антисептиком. Поэтому ни в коем случае не касаюсь лица. Когда возвращаюсь домой, наношу антисептик на верхнюю пару перчаток, смываю. Потом иду в ванную, снимаю их, мою руки и только потом снимаю вторую пару. Считайте это профессиональной деформацией.
Распыление хлорки — метод борьбы из области фантастики, но в то же время это хоть какая-то профилактика других микробов. У меня есть тема-триггер, к которой я периодически возвращаюсь в социальных сетях. У нас огромное количество людей, которые плюются прямо на асфальт. Вместе со слюной выделяется множество микробов. Вот тут хлорка очень уместна — она хорошо обеззараживает дороги, бордюры и прочие плоскости.
Главное — я за умеренность. Дело не в том, маска или перчатки — это плохо. Неправильное ношение — вот что по-настоящему плохо. Неадекватные меры — это плохо. Если человек идет по улице в пять утра и рядом с ним никого нет, кроме собаки, которую выгуливает, не нужно надевать маску. Это нормально — не носить маску, если рядом никого нет. В том случае, если рядом толпа, маску лучше надеть. Ещё лучше, когда у каждого на носу маска — риск инфицирования снижается.
То же самое с хлоркой — неправильно опрыскивать людей при входе на базар, в банк. Ей можно чистить асфальт, прилавки. Человеку для защиты достаточно быть в маске и перчатках. Есть и другие, альтернативные меры, которые я хотела бы озвучить. В крупных учреждениях, типа банков, супермаркетов, вместо дезинфицирующих тоннелей можно установить особое оборудование — рециркуляторы, которые в течение дня обеззараживают воздух и безвредны для людей. Этим следовало бы озаботиться.
Есть и другие, альтернативные меры, которые я хотела бы озвучить. В крупных учреждениях, типа банков, супермаркетов, вместо дезинфицирующих тоннелей можно установить особое оборудование — рециркуляторы, которые в течение дня обеззараживают воздух и безвредны для людей. Этим следовало бы озаботиться.
— Лечение COVID-19 — такая же спорная тема, как карантин. Вы рассказали о вреде иммуностимуляторов, однако в некоторых странах, включая нашу, их продолжают выписывать. Например, «Плаквинил», который тяжело найти в аптеках. Много споров вокруг «Дексаметазона». Почему это происходит?
— Потому что нет прямого противовирусного препарата против данного вируса. В мире врачи стараются пользоваться препаратами, которые являются ингибиторами РНК-содержащих вирусов, то есть способны воздействовать на инфект напрямую. Лечение препаратами, которые воздействуют на вирус опосредованно, стимулируя человеческий иммунитет, — это всегда риск.
Тема лечения для меня очень важна, поскольку я — клинический иммунолог, который занимается вопросами иммунологии инфекционных процессов. В самом начале пандемии ко мне в руки попал китайский справочник. Его срочно перевели, и я была удивлена тому, что там везде фигурировал «Плаквинил». Я знала, что его применяют не только при малярии, но и ревматологи прописывают пациентам для того, чтобы подавлять иммунный ответ. Этот препарат является иммуносупрессором. Он подавляет иммунитет. Дать его человеку с гиперэргической реакцией организма значит не дать ему умереть. Но и в этом существует дуализм: с одной стороны, человек остался жив, с другой — вмешательство не позволило организму сформировать адекватные антитела, и через какое-то время он опять будет уязвим. Поэтому со временем от этого препарата стали отказываться. В медицине это называется «не показал своей эффективности».
«Дексаметазон» — это другая история. Он является системным кортикостероидным гормоном. С 60-х годов его применяли при аутоиммунных ревматоидных процессах. У кортикостероидных гормонов очень широкий план показателей: противоаллергический, противоотечный (что важно при COVID-19), противовоспалительный. По сравнению с иммуноподавляющим «Плаквинилом», который относится к категории С препараторов (очень слабых), «Дексаметазон» оказался более успешным.
У кортикостероидных гормонов очень широкий план показателей: противоаллергический, противоотечный (что важно при COVID-19), противовоспалительный. По сравнению с иммуноподавляющим «Плаквинилом», который относится к категории С препараторов (очень слабых), «Дексаметазон» оказался более успешным.
Другое отличие — длительность иммуносупрессии, то есть подавления иммунного ответа. У «Плаквинила» она длительная, поэтому его ревматологи прописывали хроникам. У «Дексаметазона» короткая. Его делают раз в сутки. По истечении этого времени гормона уже может и не быть в теле — легко вводится и выводится. При этом успешно снять гиперэргическую реакцию с отеком легких он тоже может. Поэтому иногда не нужно придумывать велосипед, а стоит просто вспомнить, что делали наши предшественники.
В медицине всегда работаешь по факту. Важный момент: официальных диагнозов значительно меньше, чем патологических процессов, которые реализуются в теле человека. Врач смотрит на организм, анализы, и понимает, как он реагирует. Действует, исходя из клиники: не хватает белка — восполняет и так далее.
Процесс познания новой коронавирусной инфекции идет все эти месяцы. Все время возникают временные протоколы. Временные, потому что как только врачи видят, что схема недостаточно успешна, они ее меняют. Одни препараты, как «Плаквинил», «Кагоцел», выводятся, а другие включают. Эти протоколы периодически обновляются за счет новых знаний.
Я видела временное клиническое руководство по ведению пациентов с легкой формой COVID-19 на дому. Конечно, оно должно было появиться на два месяца раньше. Могу сказать, что это хорошее пособие, но, повторюсь, временное — по истечении определенного срока рекомендации, которые там приводятся, перестанут быть актуальными. Появятся новые данные. Нашей системе здравоохранения важно следить за этим процессом, анализировать информацию, а не упорствовать в рамках ложного «сценария». Даже если для его реализации два-три месяца назад закупили препараты. Протоколы пересматриваются, и многих лекарственных средств там уже нет, поскольку исследования показали, что они неуместны и даже вредны.
— Правда ли, что после перенесенного COVID-19 возможны сбои в работе иммунитета?
— Сбои в работе иммунной системы наблюдаются у многих пациентов, которые перенесли какое-либо заболевание. COVID-19 в этом плане не исключение. Известный факт, что после перенесенной кори, краснухи, ветрянки, вирусных заболеваний возникает так называемый «иммунный хвост». Он может длится от трех до шести месяцев. Это закономерно. Когда человек болел, иммунитет приложил все усилия, чтобы спасти своего хозяина. Так как он работал на усиление, ему нужно время, чтобы восстановиться.
— В качестве профилактики новой коронавирусной инфекции рекомендуется принимать витамины. Например, С и D — в ударных дозах. Насколько это безопасно? Нужно ли пить витамин D жителям нашей страны, которые буквально живут под солнцем?
— Пить витамины в профилактических дозах гораздо безопаснее, чем принимать индукторы интерферона и иммуностимуляторы.
Витамин С (аскорбиновая кислота) укрепляет стенки сосудов и считается антиоксидантом. Чтобы уберечь клетки от преждевременной гибели, назначают витамин С как антиоксидант. Я не сторонница ударных доз, потому что витамин С иногда усугубляет мочекислый диатез и другие состояния. А в обычных дозах — почему нет?
Витамин D вырабатывается в организме под воздействием ультрафиолетового спектра излучения. Но дело в том, что часов в 9−10 утра это самое излучение уже заканчивается и начинается инфракрасное, под которым мы все живем. Оно очень вредное. Во-вторых, ультрафиолет не сможет одолеть препятствие в виде нашей одежды. Как показывает статистика, у большинства людей есть дефицит витамина D, поэтому его надо принимать извне. Учитывая, что у него есть токсические дозы, уровень лучше мониторить. Можно сдать анализы и определить необходимую дозу. У людей с нормальным уровнем витамина D в организме заболевание проходит значительно легче.
Цинк и селен — микроэлементы, которые очень хорошо работают с иммунным статусом. Причем не с гипо- и не с гипер-, а именно с нормоэргирующими свойствами, поэтому это самые безобидные рекомендации, которые можно было бы дать. Цинк и селен, к сожалению, в лабораториях не определяют, но их считают пищевыми добавками. Это то, что помогает и не вредит. Цинк пить длительное время не нужно — максимум месяц, потом перерыв. Селен содержится в чесноке — можно есть его (но много чеснока не съешь, поэтому как вариант — принимать препараты с содержанием селена и цинка).
Причем не с гипо- и не с гипер-, а именно с нормоэргирующими свойствами, поэтому это самые безобидные рекомендации, которые можно было бы дать. Цинк и селен, к сожалению, в лабораториях не определяют, но их считают пищевыми добавками. Это то, что помогает и не вредит. Цинк пить длительное время не нужно — максимум месяц, потом перерыв. Селен содержится в чесноке — можно есть его (но много чеснока не съешь, поэтому как вариант — принимать препараты с содержанием селена и цинка).
Важно пить побольше жидкости. Мы наполнены жидкостью, это форма существования наших клеток. Если мы не употребляем воду, то наши клетки фактическим образом погибают. Когда человек инфицируется, вирус попадает в носоглотку и какое-то время там сидит, чтобы набрать силу и броситься вниз. Употребляя жидкость, инфект механически смывается туда, где он не выживет, а именно в кислую среду желудка.
Самое важное правило — перестать себя накручивать и ни в коем случае не заниматься самолечением по рекомендациям в интернете. В них встречаются препараты, которые просто небезопасны. Оценить состояние человека и назначить адекватное лечение может только врач.
— Прокомментируйте, пожалуйста, интернет-советы про пользу «лимонада» из лимона и бикарбоната, а также сна на животе.
— Лимон и сода с точки зрения защиты от вируса просто бесполезны. Навредить этим «лимонадом» можно только тем, у кого и так субатрофический гастрит и не вырабатывается соляная кислота. Выпьют соды и подавят даже то, что есть. А соляная кислота у нас очень хороший защитник желудочно-кишечного тракта от других микробов, не только от коронавирусов. Гораздо лучше есть продукты, которые ощелачивают.
Что касается сна, то спать надо так, как удобно. То, что применимо к пациенту с COVID-19, не подходит здоровому человеку. Больных с симптомами коронавирусной инфекции врачи действительно кладут на живот. Это так называемое парадоксальное дыхание, при котором улучшается состояние пациента. Живот при этом находится на пике, под углом 45 градусов, голова и ноги располагаются ниже. Это правильная позиция для стационаров, но не в быту.
Живот при этом находится на пике, под углом 45 градусов, голова и ноги располагаются ниже. Это правильная позиция для стационаров, но не в быту.
— Стоит ли сейчас покупать пульсоксиметры (приборы для измерения уровня кислорода в крови —
ред.)? Сложно ли будет пользоваться ими в быту?— Пульсоксиметр не очень сложный в использовании, и я считаю, что имеет смысл иметь его дома. При необходимости он может помочь.
Многие звонят мне и спрашивают: «Что делать?» Один из главных моментов — это правильно измерять сатурацию (уровень кислорода в крови). Бывают случаи, когда ПЦР-тест не показывает инфект при наличии клиники COVID-19 (таких симптомов, как отсутствие обоняния, вкуса или наличие странного вкуса в полости рта, сильная слабость, ломота в костях и мышцах, клиника ОРВИ). Плохая сатурация внешне никак не проявляется — человек может что-то делать, например, сидеть и разговаривать. Поэтому нужно просто за ней следить и фиксировать показатели, независимо от признаков.
Лечение COVID-19: есть ли надежда на существующие лекарства? | События в мире — оценки и прогнозы из Германии и Европы | DW
На сегодняшний день во всем мире начаты и проводятся около 70 исследований по созданию вакцины против коронавируса SARS-Cov-2. Однако даже если ее разработают уже в 2020 году, провести массовую вакцинацию населения в ближайшее время вряд ли удастся. Поэтому пока для борьбы с коронавирусом есть, по сути дела, только две возможности: либо продление действия карантинных мер, либо лечение этого заболевания уже существующими медикаментами.
Три группы лекарств против коронавируса
В данный момент ученые тестируют три группы препаратов, которые, возможно, способны помочь пациентам с COVID-19. Это противовирусные лекарства, иммуномодуляторы и респираторные средства.
Противовирусные препараты призваны предотвратить проникновение вируса в клетки легких
Противовирусные препараты предотвращают проникновение вируса в клетки легких или препятствуют их размножению внутри клетки. Такие лекарства применяются при лечении обычного гриппа, гепатита С, а также ВИЧ-инфекции, лихорадки Эбола и, что немаловажно, атипичной пневмонии (SARS) и ближневосточного респираторного синдрома (MERS), возбудителями которых также являются коронавирусы.
Такие лекарства применяются при лечении обычного гриппа, гепатита С, а также ВИЧ-инфекции, лихорадки Эбола и, что немаловажно, атипичной пневмонии (SARS) и ближневосточного респираторного синдрома (MERS), возбудителями которых также являются коронавирусы.
Вторую группу лекарств — иммуномодуляторы — используют для ограничения чрезмерной реакции иммунной системы, которая сама по себе может стать опасной для жизни. Такие препараты, к примеру, применяют при лечении артрита или воспалительных заболеваний кишечника.
В третью группу входят лекарства, позволяющие легким продолжать снабжать кровь достаточным количеством кислорода. Их используют, в частности, для лечения идиопатического легочного фиброза — патологического процесса, при котором в стенках альвеол (легочных пузырьков) происходит разрастание соединительных тканей. Из-за этого пациент испытывает хроническую нехватку кислорода, у него развивается учащенное дыхание, одышка и сухой рефлекторный кашель.
Противовирусные препараты Remdesivir и Avigan
Одно из лекарств, на который ученые возлагают надежды, — американский противовирусный препарат Remdesivir, применявшийся при лечении Эболы, а также доказавший свою эффективность в борьбе с возбудителями SARS и MERS. Китайские специалисты теперь пытаются выяснить, способен ли этот медикамент помочь и в борьбе с COVID-19. Первые результаты исследований должны быть обнародованы в апреле.
Препарат Remdesivir тестируют и в Гамбурге
В США аналогичные исследования начаты Небрасским университетом в Омахе, а Пентагон в рамках собственных испытаний использует данное средство для лечения от коронавируса американских военнослужащих. Кроме того, тестировать Remdesivir собираются и три немецкие больницы — в Мюнхене, Дюссельдорфе и Гамбурге.
В центре внимания специалистов находится и японский противовирусный препарат Avigan с действующим веществом фавипиравиром, который используют при тяжелых формах гриппа. Препарат также успешно применялся при лечении лихорадки Эбола. В данный момент ученые в разных странах мира проверяют его эффективность против COVID-19. Директор Института вирусологии при берлинской клинике Charite Кристиан Дростен (Christian Drosten) назвал предварительные результаты исследований обнадеживающими. Несмотря на то, что до окончательных выводов еще далеко, многие страны уже обратились к Японии с просьбой об оптовой поставке этого медикамента.
В данный момент ученые в разных странах мира проверяют его эффективность против COVID-19. Директор Института вирусологии при берлинской клинике Charite Кристиан Дростен (Christian Drosten) назвал предварительные результаты исследований обнадеживающими. Несмотря на то, что до окончательных выводов еще далеко, многие страны уже обратились к Японии с просьбой об оптовой поставке этого медикамента.
Эффективность противомалярийных лекарств под вопросом
Тем временем немецкий фармакологический концерн Bayer AG переоснащает заводы в Европе для выпуска препарата от малярии Resochin с активным веществом хлорохин. Предприятие планирует не только снабжать этим лекарством немецкие больницы, но и безвозмездно поставлять его в другие страны. Клиническое исследование, проведенное в одной из больниц Марселя, показало эффективность применения хлорохина для лечения пневмонии COVID-19. До сих пор медикамент под торговой маркой Resochin производился только в Пакистане.
Между тем власти Индии запретили экспорт другого противомалярийного препарата гидроксихлорохина. Эксперты в ряде стран также испытывают его как средство для лечения больных, заразившихся коронавирусом.
Впрочем, ряд вирусологов, в том числе и Кристиан Дростен из Charite, не уверены в достоверности результатов марсельского исследования. С похожими сомнениями выступило также Министерство здравоохранения и социальных служб США после того, как президент страны Дональд Трамп высказался в пользу использования хлорохина и гидроксихлорохина при лечении пациентов с COVID-19.
Лекарства против ВИЧ, рака и MERS
Ученые допускают, что эффективной может оказаться и комбинация ритонавира и лопинавира — лекарств, используемых для подавления репликации ВИЧ. Препарат «Калетра» (торговое название сочетания этих веществ) американской фармацевтической компании AbbVie уже применялся для экспериментального лечения COVID-19 в Китае, Таиланде и Сингапуре. Результаты клинических тестов, впрочем, пока выглядят неубедительно.
Результаты клинических тестов, впрочем, пока выглядят неубедительно.
Кроме того, тестирование проходят и ряд других активных веществ, которые могут подойти для лечения коронавируса. В их число входят леронлимаб, который применяется в лечении пациентов с ВИЧ и метастатическим раком молочной железы, антитела, первоначально разработанные против MERS, а также препарат Brilacidin, который используют при воспалительных заболеваниях кишечника и слизистой оболочки полости рта.
Смотрите также:
-
Руки прочь: от каких поверхностей можно заразиться коронавирусом
Вирусы на дверных ручках
Известные науке коронавирусы выживают на поверхностях типа дверных ручек от 4 до 5 дней, оставаясь заразными. Как и прочие инфекции, распространяющиеся воздушно-капельным путем, SARS-CoV-2 может передаваться через руки и поверхности, до которых часто дотрагиваются. По крайней мере, эксперты полагают, что эти особенности уже изученных коронавирусов свойственны и новому типу инфекции.
-
Руки прочь: от каких поверхностей можно заразиться коронавирусом
Столовые приборы
Чтобы не заразиться коронавирусом в кафе или столовой, нужно соблюдать меры предосторожности. В теории вирус может попасть на столовые приборы, если инфицированный человек на них чихнет или закашляется. Тем не менее, по данным немецкого Федерального ведомства по оценке рисков (BfR), случаев передачи вируса SARS-CoV-2 через столовые приборы до сих пор не зафиксировано.
-
Руки прочь: от каких поверхностей можно заразиться коронавирусом
Товары из Китая
Может ли ребенок заразиться коронавирусом через китайские игрушки? По данным BfR, до сих пор случаев заражения через товары «made in China» не было. Согласно первым исследованиям, на картонной поверхности коронавирус остается заразным в течение 24 часов. На поверхностях из пластика и нержавеющей стали — три дня.
-
Руки прочь: от каких поверхностей можно заразиться коронавирусом
Посылки из-за границы
На сухих поверхностях передающиеся человеку коронавирусы долго не выживают.
 Поскольку жизнеспособность вируса вне человеческого организма зависит от многих факторов, в том числе температуры и влажности воздуха, ведомство BfR называет заражение SARS-CoV-2 через почтовые отправления маловероятным. Правда, с оговоркой: точных данных на этот счет пока нет.
Поскольку жизнеспособность вируса вне человеческого организма зависит от многих факторов, в том числе температуры и влажности воздуха, ведомство BfR называет заражение SARS-CoV-2 через почтовые отправления маловероятным. Правда, с оговоркой: точных данных на этот счет пока нет. -
Руки прочь: от каких поверхностей можно заразиться коронавирусом
Домашние животные
Могу ли я заразиться коронавирусом от своей собаки? А собака от меня? Риск того, что домашний питомец будет инфицирован SARS-CoV-2, эксперты считают очень невысоким, но и не исключают его. При этом животные не проявляют симптомов болезни. Однако, если они заражены коронавирусом, то могут распространять его через дыхание или экскременты.
-
Руки прочь: от каких поверхностей можно заразиться коронавирусом
Овощи с рынка
Заражение коронавирусом SARS-CoV-2 через продукты питания маловероятно, подобных случаев пока зарегистрировано не было. Тем не менее, перед готовкой нужно тщательно вымыть руки — независимо от эпидемии коронавируса. Поскольку вирусы плохо переносят высокие температуры, подогрев пищи может еще больше снизить риск заражения.
-
Руки прочь: от каких поверхностей можно заразиться коронавирусом
Замороженные продукты
Известные медицине коронавирусы типов SARS- и MERS- не любят высоких температур, однако довольно устойчивы к низким. При температуре -20 градусов по Цельсию они могут оставаться заразными до двух лет! Тем не менее, по данным ведомства BfR, случаев передачи коронавируса SARS-CoV-2 через продукты питания — в том числе замороженные — зарегистрировано не было.
-
Руки прочь: от каких поверхностей можно заразиться коронавирусом
Есть диких животных запрещено!
Из-за пандемии коронавируса в Китае запретили употреблять в пищу диких животных. Многое указывает на то, что коронавирус передался человеку от летучей мыши — конечно, против ее воли. Вероятно, произошло это на одном из рынков в китайском городе Ухань.

Автор: Юлия Вергин, Елена Гункель
Иммуномодулирующая терапия: вопросы и ответы. В фокусе бактериальные лизаты (ОМ-85) | #09/18
Широко применяемым в клинической практике классом лекарственных средств являются иммуномодулирующие препараты. Однако непонимание механизмов действия, низкая степень информированности по направленности воздействия на иммунопатологию представителей разных классов иммуномодуляторов порождает мифы и кривотолки о неэффективности, опасности, «подделках»… Сложившаяся ситуация в итоге приводит к беспорядочному необоснованному применению современных препаратов из группы иммуномодулирующих средств, которые становятся в лучшем случае абсолютно бесполезными, а в худшем случае могут формировать и ряд побочных явлений. Для выбора индивидуальной лечебной траектории при наличии показаний для использования иммуномодуляторов принципиально важно следовать принципам рациональной фармакотерапии:
1) достаточный уровень доказательств эффективности;
2) достаточный уровень доказательств безопасности;
3) понятные точки приложения действия препарата на иммунную систему;
4) удобство применения (комплаентность).
При правильном выборе иммуномодулирующая терапия демонстрирует высокую клиническую эффективность, действуя избирательно на дефект системы иммунитета, не меняя его нормальных показателей.
Иммуномодулятор ОМ-85. Общие положения
Системные механизмы, инициирующие системы врожденного и адаптивного иммунитета, обуславливают эффективность перорального стандартизованного лиофилизата лизатов 8 видов бактерий ОМ-85 (Haemophilus influenzae, Streptococcus pneumoniae, Streptococcus viridans, Streptococcus pyogenes, Klebsiella pneumoniae, Klebsiella ozaenae, Staphylococcus aureus, Moraxella catarrhalis) [1]. Механизм инициации начинается с доставки бактериальных антигенов (АГ) и ассоциированных с микробами молекулярных паттернов (МАМП) к первичным мишеням, М-клеткам пейеровых бляшек кишечника, которые обеспечивают доставку АГ и паттернов и активируют дендритные клетки. Далее идет активация Т- и В?лимфоцитов либо в самих бляшках, либо в брыжеечных лимфатических узлах. Активация адаптивного иммунитета приводит к увеличению продукции секреторных иммуноглобулинов А (sIgA) не только в желудочно-кишечном тракте, но и в верхних и нижних дыхательных путях. Этот феномен описан как солидарность слизистых. Пероральные бактериальные лизаты, помимо стимуляции мукозального sIgA-опосредованного адаптивного иммунитета в дыхательных путях, повышают уровень системно циркулирующих антител разных изотипов к соответствующим бактериальным антигенам. После приема ОМ-85 формируется ответ гораздо более широкой направленности, и не только по отношению к патогенам, лизаты которых входят в состав этого иммуномодулятора. ОМ-85 в течение первых часов после перорального приема стимулирует врожденные звенья иммунного ответа — активность макрофагов, натуральных киллеров, синтез интерферонов альфа, бета и гамма [22, 23], действие которых направлено против любых патогенов вне зависимости от их таксономической принадлежности [1], в результате чего происходит эпигенетическое репрограммирование клеток врожденного иммунитета [2] и создается стойкая толерантность по отношению к разным вирусным и бактериальным инфекциям.
Далее идет активация Т- и В?лимфоцитов либо в самих бляшках, либо в брыжеечных лимфатических узлах. Активация адаптивного иммунитета приводит к увеличению продукции секреторных иммуноглобулинов А (sIgA) не только в желудочно-кишечном тракте, но и в верхних и нижних дыхательных путях. Этот феномен описан как солидарность слизистых. Пероральные бактериальные лизаты, помимо стимуляции мукозального sIgA-опосредованного адаптивного иммунитета в дыхательных путях, повышают уровень системно циркулирующих антител разных изотипов к соответствующим бактериальным антигенам. После приема ОМ-85 формируется ответ гораздо более широкой направленности, и не только по отношению к патогенам, лизаты которых входят в состав этого иммуномодулятора. ОМ-85 в течение первых часов после перорального приема стимулирует врожденные звенья иммунного ответа — активность макрофагов, натуральных киллеров, синтез интерферонов альфа, бета и гамма [22, 23], действие которых направлено против любых патогенов вне зависимости от их таксономической принадлежности [1], в результате чего происходит эпигенетическое репрограммирование клеток врожденного иммунитета [2] и создается стойкая толерантность по отношению к разным вирусным и бактериальным инфекциям.
Высокий уровень и степень доказательности эффективности ОМ-85 в отношении числа и степени тяжести респираторных инфекций у взрослых и детей зафиксирован в множестве клинических испытаний и метаанализов [3–6]. В свете критериев рациональной фармакотерапии не вызывает сомнений высокая эффективность ОМ-85 как одного из наиболее хорошо изученных иммуномодуляторов. Целесообразность выбора этого препарата для лечения и профилактики респираторных инфекций, а также для предотвращения/снижения тяжести обострений хронических заболеваний легких определяется эффективным составом, раскрытыми и понятными молекулярными механизмами действия, неопровержимой доказательной базой и физиологичностью влияния на ход противоинфекционного иммунного ответа [3].
Однако, несмотря на многолетний и успешный опыт применения ОМ-85, существует ряд острых вопросов, будоражащих умы практического здравоохранения и формирующих противоположные мнения.
Целесообразно ли назначение бактериальных лизатов в лечении острых респираторных инфекций и может ли дополнительное назначение иммуностимулятора при ОРИ «перестимулировать» иммунитет?
Ошибочная терминология «простимулировать», «поднять» достаточно широко используется в отношении назначения иммуномодулирующей терапии при разных нарушениях в системе иммунитета и пациентами, и врачами. Еще принято говорить об «сниженном иммунитете», совершенно не вдаваясь в подробности, что каждый раз идет речь о различных дефектах в системе иммунитета и лишь понимание патологии может помочь в стратегии выбора эффективного иммуномодулятора.
Итак, почему действительно целесообразно использование ОМ-85 при острых респираторных инфекциях?
ОМ-85 в течение первых часов после приема стимулирует врожденный иммунитет, запуская ответную реакцию в отношении любых патогенов [1]. В подтверждение обоснованности применения ОМ-85 в терапии острых респираторных заболеваний (ОРЗ) можно привести тот факт, что многие живые патогены способны уклоняться от иммунного ответа и даже подавлять иммунный ответ [24, 25].
Использование ОМ-85 в остром периоде инфекции верхних и нижних дыхательных путей актуально, когда необходима быстрая стимуляция противоинфекционной защиты. Целесообразность назначения ОМ-85 в первые часы ОРЗ обоснована еще и тем, что стартовые возможности адаптивных (антителозависимых) составляющих фармакологического действия ОМ-85 начнут работать на 4–5 сутки от начала приема, что будет совпадать со стадией заболевания, когда наиболее высок риск развития вторичных бактериальных инфекций [3].
Действие бактериальных лизатов
Механизм действия ОМ-85, описанный в литературе, основан на стимуляции дендритных клеток через TLR2, TLR4 [7, 8], задача которых захватить и уничтожить патогены, а также представить их антигены лимфоцитам. Дендритные клетки после стимуляции продуцируют ИФН-α и ИФН-β, обладающие прямой виростатической активностью, и способствуют повышению секреции ИФН-γ и ИЛ-2 [10], тем самым стимулируя клеточные противовирусные реакции. Кроме того, ОМ-85 способствует выработке антител, нейтрализующих вирусы, в частности вирусы гриппа [11]. Описаны свойства ОМ-85 подавлять репликацию риновирусов в культуре бронхиальных эпителиальных клеток и увеличивать жизнеспособность зараженных клеток за счет снижения экспрессии инфицированными эпителиоцитами молекул межклеточной адгезии ICAM-1, которые риновирус использует для проникновения в клетку [12].
Кроме того, ОМ-85 способствует выработке антител, нейтрализующих вирусы, в частности вирусы гриппа [11]. Описаны свойства ОМ-85 подавлять репликацию риновирусов в культуре бронхиальных эпителиальных клеток и увеличивать жизнеспособность зараженных клеток за счет снижения экспрессии инфицированными эпителиоцитами молекул межклеточной адгезии ICAM-1, которые риновирус использует для проникновения в клетку [12].
Из описанных иммунологических воздействий чрезвычайно важным является воздействие ОМ-85 на систему мукозального иммунитета за счет увеличения концентрации IgA, IgG, ИФН-γ и hBD-1 (антимикробный пептид в эпителиальных тканях, играющий важную роль в формировании резистентности к вирусам, бактериям на поверхности слизистых оболочек) и снижения содержания ИЛ-4 и NF-κB в сыворотке крови [13].
Таким образом, данные как доклинических, так и клинических исследований демонстрируют способность бактериального лизата ОМ-85 повышать сопротивляемость организма респираторным вирусам.
Как часто можно назначать ОМ-85 в течение одного года как с целью профилактики, так и в комплексном лечении ОРЗ?
По вопросу длительности и кратности применения иммуномодулирующей терапии в ходе многочисленных дискуссий в профессиональном сообществе сложилось уверенное мнение, отдающее решение этого вопроса на откуп лечащему врачу, однако с учетом позиций инструкции к препарату. Эффективность применения в профилактической схеме доказана многочисленными клиническими исследованиями. По данным исследований, применение ОМ-85 курсом 3 месяца приводит к повышению уровня IgA в слюне и сохраняется как минимум в течение 100 дней, повышенный уровень IgG и IgM в крови сохраняется как минимум в течение 5 месяцев, что позволяет рекомендовать профилактический курс в среднем 1 раз в полгода [26]. Назначение препарата в комплексной терапии острых респираторных инфекций (ОРИ) возможно на любой стадии заболевания и направлено на снижение продолжительности заболевания, тяжести симптомов и риска присоединения бактериальной инфекции. Минимальный курс приема составляет 10 дней. Затем можно продолжить применение ОМ-85 профилактическим курсом.
Минимальный курс приема составляет 10 дней. Затем можно продолжить применение ОМ-85 профилактическим курсом.
Чрезвычайно важным является следующее утверждение, имеющее отношение и к ОМ-85: после неоднократного применения иммуномодулятора его эффективность увеличивается, а не снижается (из принципов использования иммуномодулирующей терапии).
Цель включения ОМ-85 в схему терапии ОРЗ у ребенка и категория пациентов, у которой оправдано такое назначение
Особую актуальность иммуномодулирующая терапия ОМ-85 приобретает в группе иммунокомпрометированных пациентов в силу имеющихся у этого контингента нарушений в работе мукозального иммунитета, слабости «барьеров» и колонизации слизистых респираторного тракта условно-патогенными и патогенными микроорганизмами.
К основным целям назначения ОМ-85 относятся восстановление нарушенных параметров иммунитета слизистых, снижение фармаконагрузки на пациента, сокращение сроков заболевания, снижение риска осложнений ОРИ. Ожидаемые результаты — ускоренное клиническое выздоровление, эффективная элиминация возбудителя инфекции, предотвращение рецидивов и осложнений инфекции, сохраненное качество жизни у иммунокомпрометированного пациента и его семьи.
Может ли применение иммуномодуляторов у детей-аллергиков привести к обострению/утяжелению аллергического заболевания?
Согласно последним данным литературы, количество лиц, страдающих аллергопатологией, в разных регионах составляет от 15% до 40% населения. В среднем каждый третий житель планеты страдает тем или иным видом аллергии. Поэтому чрезвычайно важным является аспект безопасности назначения бактериальных лизатов в этой группе пациентов. В литературе описана способность системных бактериальных лизатов повышать не только специфический иммунный ответ, но и активизировать неспецифическую защиту, что позволяет их успешно применять в группе детей с аллергопатологией. Профилактическое назначение бактериальных лизатов снижает процент осложнений у «сложных» пациентов с аллергией, достоверно способствует клиническому улучшению основного заболевания, уменьшается потребность в базовой фармаконагрузке. При этом наблюдается увеличение уровня ИФН-γ, снижение общего IgE и циркулирующих иммунных комплексов в крови. Установлено, что у детей с аллергией достоверно увеличивается соотношение Th2/Th3, что является важным фактом, позволяющим контролировать аллергическое воспаление [14, 15].
При этом наблюдается увеличение уровня ИФН-γ, снижение общего IgE и циркулирующих иммунных комплексов в крови. Установлено, что у детей с аллергией достоверно увеличивается соотношение Th2/Th3, что является важным фактом, позволяющим контролировать аллергическое воспаление [14, 15].
Какой способ получения бактериальных лизатов — механический или химический (Бронхо-мунал®) — позволяет получить препарат с большей эффективностью и переносимостью?
Лизаты бактерий получают путем механического или химического лизиса с последующей лиофилизацией и смешиванием в заданных пропорциях. Химический лизис подразумевает денатурацию клеточной стенки. Механический способ заключается в разрушении клеточной стенки при помощи высокого давления или ультразвукового воздействия без химических веществ, что, по мнению ряда авторов, лучше сохраняет иммуногенность бактериальных лизатов [16]. Однако убедительных данных, свидетельствующих о преимуществах бактериального лизата, полученного химическим или механическим способом, нет. Наоборот, высокая доказательная база категории А у препаратов ОМ-85 (Бронхо-мунал®, Бронхо-Ваксом®) подтверждает высокую иммуногенность препарата и его эффективную работу как с врожденной системой иммунитета, так и с адаптивным иммунитетом [1–13].
Нужен ли иммуномодулятор при ОРЗ или достаточно назначать противовирусные средства в случае вирусной инфекции и противобактериальные препараты при бактериальной инфекции?
Особенностями этиопатогенетической структуры ОРЗ на современном этапе является участие вирусно-бактериальной ассоциации в формировании патологии. В качестве возбудителей ОРЗ сегодня рассматривается до 200 патогенов [17, 18], поэтому крайне затруднительным является выбор эффективного противовирусного препарата и к тому же далеко не всегда в лечении ОРЗ используются антибактериальные средства. Основной удар патогенов при ОРЗ наносится именно по системе иммунитета слизистых, и от ее состоятельности зависит сам факт развития респираторной патологии. Учитывая заинтересованность мукозального иммунитета и слабость барьерных структур, которая развивается при ОРЗ, крайне важным для выздоровления пациента является восстановление нарушенных барьерных функций системы иммунитета слизистых. Единственным классом лекарственных средств, которые способны восстановить нарушенные функции иммунной системы, являются иммуномодуляторы, и одним из эффективных лекарственных средств, принимающих участие в коррекции патологии мукозального иммунитета, являются бактериальные лизаты. Следует отметить, что применение противовирусных средств в терапии ОРЗ эффективно при своевременном назначении. Но, к сожалению. целесообразность назначения этой группы препаратов ограничена 24–48 часами с момента инфицирования [27].
Учитывая заинтересованность мукозального иммунитета и слабость барьерных структур, которая развивается при ОРЗ, крайне важным для выздоровления пациента является восстановление нарушенных барьерных функций системы иммунитета слизистых. Единственным классом лекарственных средств, которые способны восстановить нарушенные функции иммунной системы, являются иммуномодуляторы, и одним из эффективных лекарственных средств, принимающих участие в коррекции патологии мукозального иммунитета, являются бактериальные лизаты. Следует отметить, что применение противовирусных средств в терапии ОРЗ эффективно при своевременном назначении. Но, к сожалению. целесообразность назначения этой группы препаратов ограничена 24–48 часами с момента инфицирования [27].
О полипрагмазии
При построении индивидуальной лечебной траектории пациента с ОРЗ необходимо использовать ряд терапевтических воздействий, укладывающихся в современную стратегию терапии ОРЗ. Наряду с симптоматической, патогенетической, этиотропной терапией, необходимой и эффективной составляющей комплексного лечения является иммуномодулирующая терапия, позволяющая при своевременном подходе существенно снизить общую фармаконагрузку на пациента с ОРЗ, уменьшить продолжительность эпизода ОРЗ, предотвратить развитие осложнений и улучшить качество жизни пациента [17–21]. Доказано, что ОМ-85 способствует сокращению назначения антибиотиков, что можно рассматривать как серьезный аргумент ОМ-85 в отношении снижения медикаментозной нагрузки [28]. Бактериальные лизаты, имеющие высокую доказательную базу (к ним относится ОМ-85), являются одной из групп иммуномодулирующих препаратов, прочно занимающих лидирующие позиции в терапии ОРЗ.
Разница в показаниях между бактериальными лизатами и пероральными вакцинами
Если говорить о вакцинации, то прежде всего хотелось бы отметить ее основные задачи: нацеленность на формирование специфического иммунного ответа против конкретных возбудителей заболевания, наряду с профилактическим эффектом. Использование вакцинации невозможно с целью терапевтического или лечебного действия в разгар заболевания. Возвращаясь к огромному спектру возбудителей ОРЗ, очевидно невозможным является создание специфичного ответа против всех возбудителей. Несмотря на высочайшую эффективность метода вакцинопрофилактики, против большинства респираторных патогенов вакцин не создано. В основе такой ситуации лежит характерная для респираторных патогенов высокая вариабельность, наряду с непродолжительностью и нестойкостью специфического иммунитета. Поскольку цель вакцинации — профилактика, то для получения более предсказуемого профилактического эффекта вакцинация не рекомендуется при острых заболеваниях. В отличие от вакцин, назначение ОМ-85 в комплексном лечении имеет именно лечебное назначение, с целью уменьшения продолжительности заболевания, снижения риска возникновения бактериальных осложнений. Учитывая механизм действия ОМ-85, его влияние на факторы врожденного и приобретенного иммунитета, возможность и эффективность использования не только с целью профилактики, но и в остром периоде и в периоде выздоровления, можно утверждать, что ОМ-85 является иммунотропным средством, имеющим прямые показания для применения в комплексной терапии ОРЗ.
Использование вакцинации невозможно с целью терапевтического или лечебного действия в разгар заболевания. Возвращаясь к огромному спектру возбудителей ОРЗ, очевидно невозможным является создание специфичного ответа против всех возбудителей. Несмотря на высочайшую эффективность метода вакцинопрофилактики, против большинства респираторных патогенов вакцин не создано. В основе такой ситуации лежит характерная для респираторных патогенов высокая вариабельность, наряду с непродолжительностью и нестойкостью специфического иммунитета. Поскольку цель вакцинации — профилактика, то для получения более предсказуемого профилактического эффекта вакцинация не рекомендуется при острых заболеваниях. В отличие от вакцин, назначение ОМ-85 в комплексном лечении имеет именно лечебное назначение, с целью уменьшения продолжительности заболевания, снижения риска возникновения бактериальных осложнений. Учитывая механизм действия ОМ-85, его влияние на факторы врожденного и приобретенного иммунитета, возможность и эффективность использования не только с целью профилактики, но и в остром периоде и в периоде выздоровления, можно утверждать, что ОМ-85 является иммунотропным средством, имеющим прямые показания для применения в комплексной терапии ОРЗ.
Выводы
ОМ-85 является наиболее изученным средством среди препаратов группы иммуномодуляторов, применяемым уже на протяжении более 30 лет. Это позволяет ожидать от ОМ-85 предсказуемые эффективность и безопасность. ОМ-85 повышает иммунитет как против вирусов, так и против бактерий, что оправдывает целесообразность применения препарата как в схемах профилактики рецидивирующих респираторных инфекций, так и в схемах лечения ОРИ.
Литература
-
De Benedetto F., Sevieri G. Prevention of respiratory tract infections with bacterial lysate OM-85 bronchomunal in children and adults: a state of the art // Multidisciplinary Respiratory Medicine. 2013; 8 (1): Art. 33. DOI: 10.1186/2049–6958–8–33.

- Калюжин О. В. Феномен тренированного иммунитета и механизмы действия неспецифических иммуномодуляторов // Российский аллергологический журнал. 2015. № 4. С. 45–51.
- Калюжин О. В. ОМ-85 в профилактике/лечении респираторных инфекций и обострений хронических заболеваний легких: критерии выбора, механизмы и доказательства // Лечащий Врач. 2018, № 3.
- De Benedetto F., Sevieri G. Prevention of respiratory tract infections with bacterial lysate OM-85 bronchomunal in children and adults: a state of the art // Multidisciplinary Respiratory Medicine. 2013; 8 (1): Art. 33. DOI: 10.1186/2049–6958–8–33.
- Schaad U. B. OM-85 BV, an immunostimulant in pediatric recurrent respiratory tract infections: a systematic review // World J. Pediatr. 2010; 6: 5–12. DOI: 10.1007/s12519–010–0001x.
- Del-Rio-Navarro B. E., Espinosa-Rosales F. J., Flenady V., Sienra-Mongen J. J. L. Immunostimulants for preventing respiratory tract infection in children // Evid. Based Child Health. 2012; 7: 629–717. DOI: 10.1002/ebch.1833.31.
- Yin J., Xu B., Zeng X., Shen K. Broncho-Vaxom in pediatric recurrent respiratory tract infections: A systematic review and meta-analysis // Int. Immunopharmacol. 2018 Jan; 54: 198–209. DOI: 10.1016/j.intimp.2017.10.032.
- Parola C., Salogni L., Vaira X. et al. Selective Activation of Human Dendritic Cells by OM-85 through a NF-kB and MAPK Dependent Pathway // PLoS ONE. 2013; 8 (12): e82867. DOI: 10.1371/journal.pone.0082867.
- Zelle-Rieser C., Ramoner R., Bartsch G., Thurnher M. A clinically approved oral vaccine against pneumotropic bacteria induces the terminal maturation of CD83+ immunostimulatory dendritic cells // Immunol. Lett. 2001; 76 (1): 63–67.
-
Huber M., Mossmann H., Bessler W. G. Th-1 orientated immunological properties of the bacterial extract OM-85 BV // Eur.
 J. Med. Res. 2005; 10 (5): 209–217.
J. Med. Res. 2005; 10 (5): 209–217. - Pasquali C., Salami O., Taneja M. et al. Enhanced Mucosal Antibody Production and Protection against Respiratory Infections Following an Orally Administered Bacterial Extract // Frontiers in Medicine. 2014; 1: 41. DOI: 10.3389/fmed.2014.00041.
- Roth M., Pasquali C., Stolz D., Tamm M. Broncho Vaxom (OM-85) modulates rhinovirus docking proteins on human airway epithelialcells via Erk1/2 mitogen activated protein kinase and cAMP // PLoS ONE. 2017; 12 (11): e0188010. DOI: 10.1371/journal.pone.0188010.
- Liu Y. W., Dong S. H., Zhan G. Y., Tan H. Z., Peng Y. Q., Wei F. Analysis of the effect of bacterial lysate and the immunologic mechanism in treating infant bronchiolitis // Eur. Rev. Med.Pharmacol. Sci. 2017; 21 (14): 3332–3336.
- Зайцева О. Н. Рекуррентные респираторные инфекции: можно ли предупредить? // Педиатрия. 2015. Т. 94, 32, с. 185–192.
- Гусева Е. Д., Файзулина Р. М. Особенности мукозального иммунитета у детей с аллергическим ринитом // Вестник оториноларингологии. 2012, № 6, с. 33–35.
- Рязанцев С. В., Коноплев О. И., Сапова К. И. Бактериальные лизаты в лечении заболеваний дыхательных путей и ЛОР-органов // РМЖ. 2015, № 23, с. 1387–1390.
- Калюжин О. В. Острые респираторные вирусные инфекции: современные вызовы, противовирусный ответ, иммунопрофилактика и иммунотерапия. М.: Медицинское информационное агентство, 2014. 144 с.
- Татаурщикова Н. С. Острое респираторное заболевание у больного аллергией, ключевые участники и проблемы: как быть и что делать // Фарматека. 2016, № 18, с. 23–29.
- Татаурщикова Н. С., Сепиашвили Р. И. Современные подходы к использованию иммуномодуляторов в аллергологической практике. Учебно-методическое пособие. М., 2012. С. 40.
-
Сепиашвили Р. И. Классификация и основные принципы применения иммуномодулирующих препаратов в клинической практике // Аллергология и иммунология.
 2002. Т. 3, № 3, с. 325–331.
2002. Т. 3, № 3, с. 325–331. - Хаитов Р. М., Пинегин Б. В. Современные иммуномодуляторы. Классификация, механизм действия // Российский аллергологический журнал. 2005. № 4. С. 30–43.
- Kearney S. C., Dziekiewicz M., Feleszko W. Immunoregulatory and immunostimulatory responses of bacterial lysates in respiratory infections and asthma // Annals of Allergy, Asthma & Immunology. 2015. Т. 114. №. 5. С. 364–369.
- Esposito S. et al. Nonspecific immunomodulators for recurrent respiratory tract infections, wheezing and asthma in children: a systematic review of mechanistic and clinical evidence // Current opinion in allergy and clinical immunology. 2018. Т. 18. №. 3. С. 198–209.
- Avondt K. V. et al. Bacterial Immune Evasion through Manipulation of Host Inhibitory Immune Signaling // PLoS Pathog. 2015, Mar; 11 (3).
- Valle J., Latasa C., Gil C., Toledo-Arana A., Solano C., Penadés J. R. et al. Bap, a Biofilm Matrix Protein of Staphylococcus aureus Prevents Cellular Internalization through Binding to GP96 Host Receptor // PLoS Pathogens. 2012, 8 (8): e1002843. DOI: 10.1371/journal.ppat.1002843.
- Mauël J. Stimulation of immunoprotective mechanisms by OM-85 BV. A review of results from in vivo and in vitro studies // Respiration. 1994; 61. Suppl 1: 8–15.
- Баранов А. А., Лобзин Ю. В. Федеральные клинические рекомендации по оказанию медицинской помощи детям с острой респираторной вирусной инфекцией (острый назофарингит), 2015.
- Gutiérrez-Tarango M. D. et al. Safety and efficacy of two courses of OM-85 in the prevention of respiratory tract infections in children during 12 months // Chest. 2001; 119, 1: 742–748.
RU1809883743
Н. С. Татаурщикова, доктор медицинских наук, профессор
ФГАОУ ВО РУДН, Москва
Контактная информация: tataurshchikova_ns@pfur. ru
ru
Иммуномодулирующая терапия: вопросы и ответы. В фокусе бактериальные лизаты (ОМ 85)/ Н. С. Татаурщикова
Для цитирования: Лечащий врач № 9/2018; Номера страниц в выпуске: 78-81
Теги: антитела, врожденный иммунитет, стимуляция, патогены
BWH Центр Крона и колита
Иммуномодуляторы успокаивают чрезмерно активный иммунный ответ, который приводит к воспалению, которое приводит к болезни Крона и язвенному колиту. Иммуномодуляторы, используемые для лечения IBD, включают 6MP, азатиерприн (Imuran) и метотрексат.
Иммуномодуляторы были первоначально разработаны для лечения рака, но они использовались для лечения ВЗК в течение десятилетий, хотя и в гораздо более низких дозах, чем те, которые используются для лечения рака. Благодаря долгому опыту работы у нас есть много информации о безопасности и эффективности иммуномодуляторов.
| Общий | Фирменное наименование |
| 6-МП (6-меркаптопурин) | Пуринетол |
| азатиоприн | Имуран |
| метотекстрат | Продается как дженерик (преимущественно используется при болезни Крона) |
Как работают иммуномодуляторы?
Иммуномодуляторы работают, подавляя чрезмерно активный иммунный ответ, который возникает при ВЗК.6MP и азатиоприн (Imuran) являются близкородственными препаратами, поскольку азатиоприн превращается в 6MP в организме.
Как это осуществляется?
И 6MP, и азатиоприн (имуран) выпускаются в форме таблеток и вводятся перорально. Азатиоприн назначают в больших дозах, чем 6МП.
Метотрексат обычно вводится еженедельно. Инъекции подкожные; они переходят в жировую клетчатку под кожей. Метотрексат также выпускается в форме таблеток и может вводиться перорально, но скорость всасывания варьируется, поэтому дозирование затруднено.
Когда мне станет лучше?
6MP и азатиоприн (имуран) действуют медленно, и для достижения максимального эффекта может потребоваться от двух до шести месяцев. Около 85% людей с язвенным колитом имеют клинический ответ (их состояние улучшается) на 6МП или азатиорприн (имуран). У людей с болезнью Крона частота клинического ответа на два препарата составляет около 65%.
Некоторые люди испытывают облегчение симптомов через шесть-восемь недель после начала приема метотрексата.Полный эффект может не наступить в течение нескольких месяцев.
Побочные эффекты
6MP и азатиоприн (Имуран)
- Повышенный риск заражения
- Нарушение функции печени
- Панкреатит
- Пониженное количество тромбоцитов
- Тошнота и рвота
- Сыпь
- Диарея
- Лимфома (0,04%; средняя популяция 0,02%)
6MP и азатиоприн (имуран) подвергают людей риску заражения, поскольку они уменьшают количество лейкоцитов.Если вы принимаете один из этих двух препаратов, количество лейкоцитов будет тщательно контролироваться, чтобы они не стали слишком низкими и не оставили вас беззащитными перед бактериями, вирусами и другими источниками инфекции. Полный анализ крови (ОАК), который включает количество лейкоцитов, проводится каждые две недели в течение первых месяцев лечения. Затем CBC проводятся ежемесячно. Если через год показатели стабильны, анализы проводят реже. Дозировка может быть скорректирована, если количество лейкоцитов становится слишком низким.
Метотрексат
- Тошнота, рвота и потеря аппетита
- Повышенные ферменты печени (поражены 15% пациентов)
- Рубцевание печени (до 7%)
- Выпадение волос (от 0,5% до 10%)
- Повышенная инфекция
- Пневмонит (1%)
- Лимфома
Возможные лекарственные взаимодействия
Сообщите своему врачу, если вы принимаете какие-либо из следующих лекарств:
- Ингибиторы АПФ (Лизиноприл, Эналоприл, Вазотек, Моноприл, Униретик, Зесторетик)
- Аллопуринол (Цилоприм)
- Циклоспорин
- Метотрексат
- Антикоагулянты (Кумадин, Гепарин, Ловенокс, Плавикс)
- Нервно-мышечные блокаторы (Тубокуранин, Панкурониум, Павалон)
Дополнительно нельзя получать «живые» вакцины на иммуномодуляторах.
Как долго мне нужно принимать иммуномодуляторы?
Эти иммуномодуляторы могут быть высокоэффективными в поддержании ремиссии без стероидов при умеренных и тяжелых случаях ВЗК. В отличие от стероидов, эти лекарства можно безопасно использовать в течение длительного времени и предназначены для лечения, направленного на предотвращение и лечение обострений вашего заболевания.
Многие люди с ВЗК принимают иммуномодулирующие препараты в течение многих лет. Важно принимать иммуномодуляторы, даже если вы чувствуете себя хорошо и у вас мало симптомов, если таковые имеются, потому что они являются профилактическими препаратами, предотвращающими появление обострений.
Прием иммуномодуляторов во время беременности
6MP и азатиоприн (Имуран)
Женщинам, планирующим беременность, следует обсудить варианты лечения со своим лечащим врачом. В большинстве случаев женщинам рекомендуется продолжать лечение поддерживающим иммуномодулятором на протяжении всей беременности, поскольку неконтролируемое обострение болезни может быть более вредным для плода, чем 6MP или азатиоприн (Imuran).
Исследования на животных не показали увеличения побочных эффектов для плода от приема 6MP или азатиоприна во время беременности.
Метотрексат
Известно, что метотрексат вызывает врожденные дефекты. Вам не следует принимать этот препарат, если вы или ваш партнер планируете забеременеть.
Использование двух форм контроля над рождаемостью, чтобы избежать беременности, пока вы принимаете это лекарство, и делайте это в течение как минимум 3 месяцев после окончания лечения.
Немедленно позвоните в медицинскую бригаду, если вы или ваш партнер забеременеете, если вы принимаете метотрексат или принимали его недавно.
Проблемы безопасности лекарств, связанные с иммуномодуляторами
US Pharm. 2016; 41 (6): HS2-HS8.
РЕЗЮМЕ: Количество лекарств, используемых для лечения аутоиммунных заболеваний, резко увеличилось. Эти агенты — иммуномодуляторы — привели к улучшению результатов лечения пациентов и, в некоторых случаях, к замедлению прогрессирования заболевания. Несмотря на эти достижения, иммуномодуляторы также связаны с серьезными проблемами безопасности лекарств. Потенциал побочных реакций на лекарства, серьезных осложнений, связанных с лекарствами, и ошибок приема лекарств весьма значителен.Фармацевты должны четко осознавать сложность иммуномодуляторов и связанный с ними потенциал побочных эффектов. Внимание ко всем аспектам процесса использования лекарств — закупке и хранению, назначению, отпуску, введению и мониторингу — необходимо для обеспечения того, чтобы эти агенты использовались наиболее безопасным и эффективным способом.
Эти агенты — иммуномодуляторы — привели к улучшению результатов лечения пациентов и, в некоторых случаях, к замедлению прогрессирования заболевания. Несмотря на эти достижения, иммуномодуляторы также связаны с серьезными проблемами безопасности лекарств. Потенциал побочных реакций на лекарства, серьезных осложнений, связанных с лекарствами, и ошибок приема лекарств весьма значителен.Фармацевты должны четко осознавать сложность иммуномодуляторов и связанный с ними потенциал побочных эффектов. Внимание ко всем аспектам процесса использования лекарств — закупке и хранению, назначению, отпуску, введению и мониторингу — необходимо для обеспечения того, чтобы эти агенты использовались наиболее безопасным и эффективным способом.
Аутоиммунные расстройства включают широкий спектр болезненных состояний и состояний, которые проще всего описать как реакцию иммунной системы на компоненты ее собственного тела.Соответственно, огромное количество лекарств, используемых для лечения этих расстройств, либо подавляют, либо стимулируют какой-либо элемент иммунной системы, преодолевая разрушительные эффекты иммуноопосредованного заболевания. Эти лекарства, называемые иммуномодуляторами или иммуномодуляторами , привели к улучшению результатов лечения пациентов и, в некоторых случаях, замедлению прогрессирования заболевания. Несмотря на их вклад в лечение заболеваний, эти мощные агенты часто усугубляют осложнения, а их сложность приводит к проблемам с безопасностью лекарств.Обсуждение всех иммуномодуляторов выходит за рамки настоящего обзора; скорее, будут определены категории связанных нежелательных явлений (НЯ) и необходимые меры предосторожности при использовании этого класса лекарств.
Классификация агентов
В целом иммуномодуляторы можно разделить на две категории: иммунодепрессанты и иммуностимуляторы. В каждой категории есть несколько типов лекарств, каждый из которых имеет уникальные механизмы действия, иммунные мишени и показания (как маркированные, так и немаркированные).
Безопасность лекарств, побочные эффекты и процесс использования лекарств
В сфере безопасности лекарств фармацевты должны сосредоточить внимание на побочных реакциях на лекарства, а также на ошибках в лечении. Побочные реакции являются неожиданными по своей природе и подразумевают неспособность предсказать, у каких пациентов произойдет событие. Например, при отсутствии анамнеза трудно определить, у какого пациента может быть реакция гиперчувствительности на моноклональные антитела (Mab). Однако, если данный агент имеет высокую вероятность инфузионных реакций, эти реакции можно свести к минимуму с помощью предварительной обработки и инициирования при более медленных скоростях инфузии. Ошибки при приеме лекарств считаются предотвратимыми (например, неправильная доза или лекарство), и крайне важно проявлять бдительность в улучшении процесса использования лекарств, чтобы избежать распространенных ошибок при приеме лекарств. В этом обзоре будут определены этапы процесса использования лекарств для иммуномодуляторов и меры безопасности, которые могут быть реализованы, чтобы минимизировать побочные реакции на лекарства и избежать ошибок при приеме лекарств.
Приобретение и хранение лекарств
Потенциальная возможность ошибочного приема лекарств начинается с покупки и хранения этой сложной группы лекарств.Похожая / звуковая (LASA) номенклатура и упаковка создают потенциальную путаницу между продуктами. Полезно узнавать известные препараты LASA и использовать такие стратегии, как надписи с изображением высокого человека и предупреждающие таблички в местах хранения. Институт безопасной практики приема лекарств (ISMP) регулярно обновляет свой список часто путающих названий лекарств и является отличным источником профилактических стратегий в начале процесса использования лекарств. 1 См. ТАБЛИЦА 1 .
Также важно регулярно проверять требования к хранению.Хотя большинство иммуномодуляторов стабильны при комнатной температуре, проверка маркировки упаковки с учетом особых требований и недопущение резких скачков температуры сохранят целостность продукта и защитят финансовые вложения.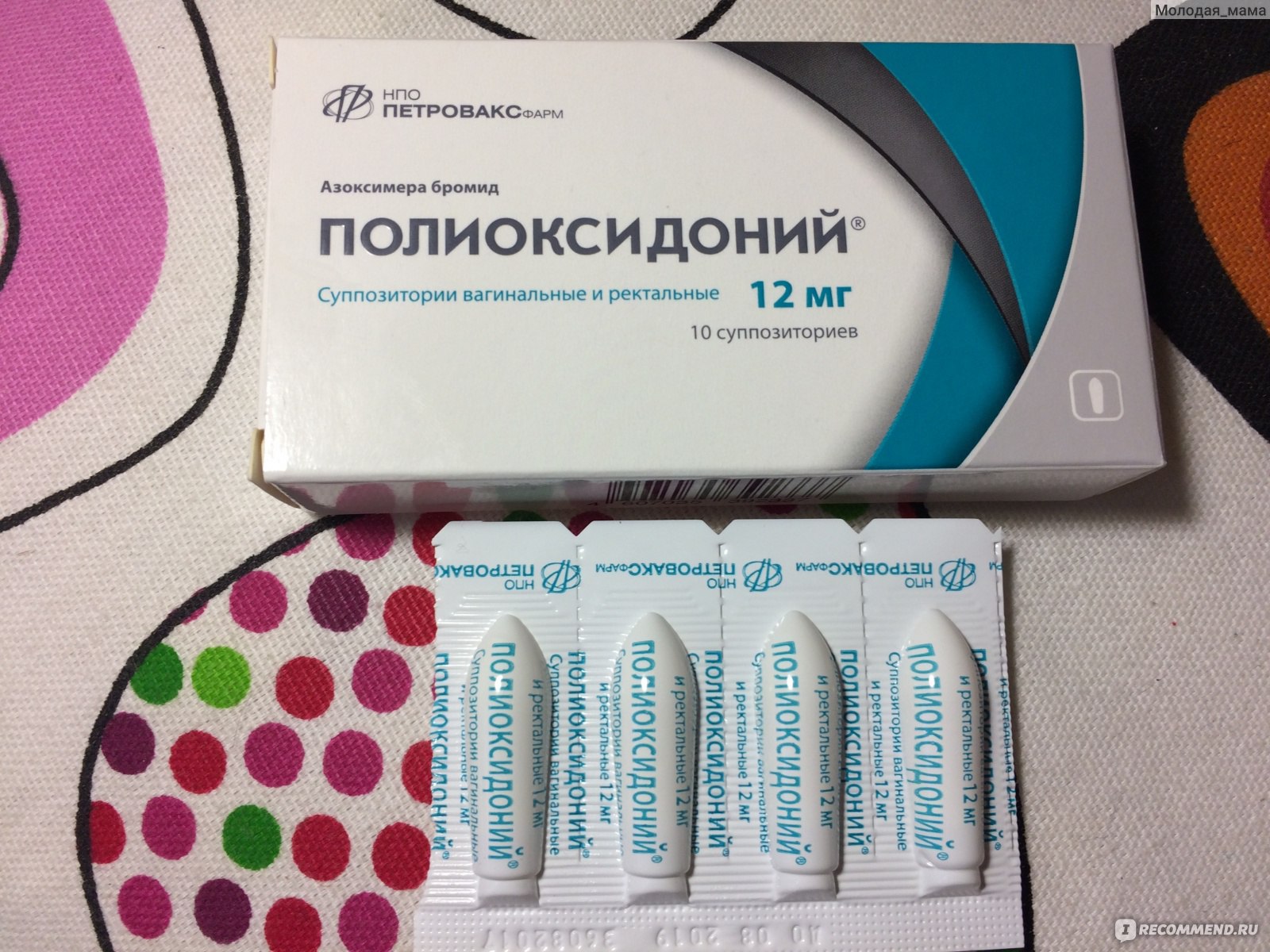
Назначение
Одной из самых серьезных проблем для пациентов, получающих иммуномодуляторы, является риск инфекции, как первичной, так и реактивации латентных инфекций. Проблемы включают реактивацию вирусов гепатита В и С, скрытого туберкулеза (ТБ), инвазивных грибковых инфекций, пневмонии Pneumocystis jiroveci, пневмонии (PJP), вирусов герпеса, ВИЧ и прогрессирующей мультифокальной лейкоэнцефалопатии (PML).Перед началом лечения пациенты должны пройти скрининг на факторы риска или историческое воздействие патогенов, связанных с этими инфекциями. В некоторых случаях профилактика (например, триметоприм-сульфаметоксазол для PJP), сопутствующая терапия (например, лечение латентного туберкулеза) или иммунизация перед терапией (например, вакцина против опоясывающего лишая за 2-4 недели до терапии у пациентов в возрасте ≥60 лет) может быть указано. Во многих случаях отсутствуют руководящие принципы, основанные на фактических данных, и решение о начале или продолжении терапии иммуномодуляторами является соотношением риска и пользы. 2,3
ПМЛ, серьезное демиелинизирующее заболевание головного мозга, вызываемое полиомавирусом JC (JCV), представляет собой серьезную проблему, о которой сообщалось у пациентов, получающих отдельные препараты, 4,5 , что побуждает к интенсивному обучению пациентов и мониторингу. Пациентам-кандидатам на лечение натализумабом рекомендуется тестирование на антитела к JCV. Если результат отрицательный, значит, пациент не подвергался воздействию и, как считается, подвергается незначительному риску развития ПМЛ. Несмотря на этот недавний прогресс, бдительный мониторинг признаков и симптомов ПМЛ остается критически важным. 6
Хотя фармацевту системы здравоохранения непрактично быть в курсе появляющихся данных о риске инфицирования множества имеющихся в настоящее время иммуномодуляторов, фармацевт должен работать с ревматологами системы здравоохранения, неврологами и другими, чтобы убедитесь, что существует стратегия скрининга и мониторинга пациентов на предмет потенциального риска инфицирования.
Что касается профилактики инфекций, фармацевт должен играть активную роль в обеспечении того, чтобы пациенты получали профилактические инактивированные вакцины (например,г., грипп, пневмококк). Использование живых вакцин не является абсолютным противопоказанием; однако, как правило, иммуномодуляторная терапия должна быть отменена в течение 3 месяцев. Исключение составляют пациенты, получающие глюкокортикоиды, и в этом случае рекомендуется период вымывания в течение 1 месяца. 7
Учитывая обширный профиль АЕ, связанный с классом иммуномодуляторов ( ТАБЛИЦА 2 ), также важно измерить соответствующие исходные лабораторные параметры и следить за ними до начала приема лекарства.Некоторые реакции невозможно предотвратить (например, повышение уровня трансаминаз, изменения артериального давления, липидные аномалии), но при тщательном наблюдении за пациентом можно принять решение относительно возможных альтернатив, соотношения риска и пользы или дополнительных лекарств для управления побочными эффектами.
Известно, что несколько иммуномодуляторов (например, митоксантрон, терифлуномид) являются тератогенными, с категориями беременности D и X ( ТАБЛИЦА 2 ). Тесты на беременность и консультации по вариантам контрацепции имеют первостепенное значение до начала приема лекарств.
Одна из простых мер предосторожности при назначении — не поощрять использование сокращений. Сложный характер многих названий лекарств и графиков приема увеличивает вероятность использования сокращенных инструкций; история, однако, учит, что такая практика может привести к ошибкам в лечении. Например, ISMP сообщил, что один пациент прописал адалимумаб «qoweek» (тогда как предполагалось «раз в две недели») получил удвоенную дозу адалимумаба каждую неделю в течение> 9 месяцев. 8
Наконец, очень важны скрининг взаимодействия с наркотиками и соответствующие предупреждения о безопасности в электронных системах.Одновременное введение нескольких иммуномодуляторов, как правило, не рекомендуется (за исключением глюкокортикоидов), и пациенты не должны получать живые вакцины. Также следует избегать других межлекарственных взаимодействий, специфичных для отдельных препаратов. Ключевым инструментом обеспечения безопасности лекарств для фармацевтов при использовании иммуномодуляторов является надежный эталон лекарственного взаимодействия.
Также следует избегать других межлекарственных взаимодействий, специфичных для отдельных препаратов. Ключевым инструментом обеспечения безопасности лекарств для фармацевтов при использовании иммуномодуляторов является надежный эталон лекарственного взаимодействия.
Выдача
Во-первых, фармацевты должны взять на себя обязательство тщательно изучить вышеупомянутые вопросы безопасности при назначении до проверки или отпуска иммуномодуляторов.Еще одним соображением является осторожное обращение, чтобы избежать профессионального риска для медицинских работников и сохранить целостность продукта. Национальный институт безопасности и гигиены труда регулярно публикует руководящие документы и процедуры по безопасному обращению с опасными лекарствами во избежание профессионального риска. 9 Кроме того, некоторые лекарства из класса Mab требуют бережного обращения или без встряхивания, чтобы избежать пенообразования и других проблем, связанных с целостностью продукта. По этим причинам такие лекарства следует регулярно помещать в список «Не использовать трубку» в учреждениях, где для доставки лекарств используются системы пневматических трубок.
Администрирование
Существует несколько соображений по поводу безопасности лекарств в административной части процесса использования лекарств. Финголимод, например, связан с брадикардией при первой дозе и требует тщательного наблюдения в течение> 6 часов после первого приема. 10
Лекарства, вводимые подкожно, часто вызывают реакции в месте инъекции и боль. На блокаторы фактора некроза опухоли альфа адалимумаб и этанерцепт приходилось> 10 000 реакций в месте инъекции в недавнем ежеквартальном сводке отчетов о травмах, полученных FDA. 11 Возникновение немедленных постинъекционных реакций при п / к введении глатирамера хорошо задокументировано. 12
Пациенты и медперсонал должны быть обучены методам минимизации реакций в месте инъекции — например, ротации мест, теплых или холодных компрессов и меньших объемов введения лекарств. Есть много веб-сайтов и блогов, особенно в сообществе рассеянного склероза (РС), которые посвящены боли или реакциям в месте инъекции и предлагают средства для улучшения, хотя не все эти ресурсы научно обоснованы.Также критически важно повысить приверженность пациента лечению. Пациенты, получающие терапию интерфероном для лечения рассеянного склероза, часто сообщают о реакциях в месте инъекции и побочных эффектах, таких как усталость, гриппоподобные симптомы и ригидность мышц, как о причинах прекращения приема препарата. 13 Реакции в месте инъекции и симптомы гриппа, как правило, уменьшаются через 1 год; Если у пациента клиническая реакция, полезно по возможности побудить его или ее продолжить терапию. 14 Также сообщалось о более низкой частоте реакций в месте инъекции при еженедельном внутримышечном введении по сравнению с трехкратным еженедельным подкожным введением интерферона. 15
Есть много веб-сайтов и блогов, особенно в сообществе рассеянного склероза (РС), которые посвящены боли или реакциям в месте инъекции и предлагают средства для улучшения, хотя не все эти ресурсы научно обоснованы.Также критически важно повысить приверженность пациента лечению. Пациенты, получающие терапию интерфероном для лечения рассеянного склероза, часто сообщают о реакциях в месте инъекции и побочных эффектах, таких как усталость, гриппоподобные симптомы и ригидность мышц, как о причинах прекращения приема препарата. 13 Реакции в месте инъекции и симптомы гриппа, как правило, уменьшаются через 1 год; Если у пациента клиническая реакция, полезно по возможности побудить его или ее продолжить терапию. 14 Также сообщалось о более низкой частоте реакций в месте инъекции при еженедельном внутримышечном введении по сравнению с трехкратным еженедельным подкожным введением интерферона. 15
Другая проблема безопасности связана с инфузионно-ассоциированными реакциями (IAR) на иммуномодуляторы, вводимые внутривенно. Реакции включают головную боль, крапивницу, лихорадку, озноб, гипотензию, брадикардию, тахикардию и анафилаксию. Лекарства для управления реакциями должны быть легко доступны вместе с рекомендациями или алгоритмами лечения. Премедикация антигистаминными, жаропонижающими, противорвотными и / или анальгетиками может быть показана в зависимости от лекарства и истории болезни пациента.Замедление скорости инфузии может свести к минимуму незначительные реакции; Однако в тяжелых случаях вливания следует прекратить. Фармацевты должны играть активную роль в разработке соответствующих протоколов и оптимизации процедур для управления IAR. 16,17
И, наконец, аллергия на латекс или повышенная чувствительность могут быть проблемой для некоторых продуктов. Адалимумаб, этанерцепт, голимумаб и секукинумаб расфасовываются в предварительно заполненные шприцы с колпачками для игл, которые содержат латекс. 18-21 Некоторые реакции в месте инъекции могут быть результатом чувствительности к латексу, и в этом случае обследование и обучение пациентов могут помочь свести к минимуму побочные эффекты.
Мониторинг
К основным вопросам безопасности, связанным с мониторингом пациентов, относятся те, которые рассматриваются в разделе Назначение , при этом внимание сосредоточено на принятии решений относительно альтернативной терапии, полипрагмазии для лечения НЯ или методов минимизации побочных эффектов. Постоянные пользователи терапии иммуномодуляторами подвергаются особому риску инфекций, вторичных злокачественных новообразований, нефротоксичности, гепатотоксичности и нарушения гликемического контроля. Последние предварительные данные показывают, что взрослые, госпитализированные с некоторыми аутоиммунными заболеваниями, имеют на 20% повышенный риск венозной тромбоэмболии (ВТЭ).Хотя необходимы дополнительные исследования, пристальное внимание к оценке риска и профилактике ВТЭ особенно важно в этой популяции пациентов. 22
Заключение
Класс препаратов иммуномодуляторов постоянно развивается, представляя как большие риски, так и большие преимущества для пациентов с тяжелыми хроническими заболеваниями. Фармацевт играет решающую роль в обеспечении безопасного и эффективного использования этих лекарств. Системы, обеспечивающие безопасный и соответствующий выбор лекарств, а также их выдачу и введение, должны быть на месте и оптимизированы там, где это возможно.Наконец, очень важны постоянный мониторинг и постоянное консультирование пациентов, которое включает напоминания о подходящих контрацептивах, иммунизациях (где это необходимо) и бдительность в отношении лабораторных оценок.
СПРАВОЧНАЯ ИНФОРМАЦИЯ
1. Институт безопасной медицинской практики (ISMP). Список запутанных названий лекарств ISMP. www.ismp.org/tools/confuseddrugnames.pdf. По состоянию на 29 февраля 2016 г.
2. Водопивец И., Милославский Е.М., Коттон С.Н., Чо Т.А. Руководство невролога по безопасному использованию иммуномодулирующих препаратов. Семин Нейрол . 2014; 34: 467-478.
3. Вингерчук Д.М., Картер Ж.Л. Рассеянный склероз: современные и новые методы лечения и стратегии лечения, изменяющие болезнь. Mayo Clin Proc . 2014; 89: 225-240.
Рассеянный склероз: современные и новые методы лечения и стратегии лечения, изменяющие болезнь. Mayo Clin Proc . 2014; 89: 225-240.
4. FDA. Тисабри (натализумаб): информация о безопасности лекарств — новый фактор риска прогрессирующей мультифокальной лейкоэнцефалопатии (ПМЛ). www.fda.gov/safety/medwatch/safetyinformation/safetyalertsforhumanmedicalproducts/ucm288602.htm. По состоянию на 20 марта 2016 г.
5. FDA. Сообщение FDA о безопасности лекарств: FDA предупреждает о случаях редкой инфекции головного мозга препаратом Gilenya (финголимод) в головном мозге у двух пациентов, ранее не принимавших иммунодепрессанты.www.fda.gov/Drugs/DrugSafety/ucm456919.htm. По состоянию на 20 марта 2016 г.
6. Jeffery DR. Последние достижения в лечении рассеянного склероза: эффективность, риски и место в терапии. Ther Adv Chronic Dis . 2013; 4: 45-51.
7. Орлика К., Барнс Э., Калвер ЭЛ. Профилактика инфекций, вызванных иммунодепрессантами в гастроэнтерологии. Ther Adv Chronic Dis. 2013; 4: 167-185.
8. ISMP. QOWEEK. www.ismp.org/newsletters/ambulatory/archives/200612_2.asp. По состоянию на 5 марта 2016 г.
9. Коннор Т.Х., Маккензи Б.А., ДеБорд Д.Г. и др. Список NIOSH противоопухолевых и других опасных препаратов в медицинских учреждениях, 2014 г. Цинциннати, Огайо: Национальный институт профессиональной безопасности и здоровья; 2014. Номер публикации 2014-138.
10. Информация о продукте Галеня (финголимод). Восточный Ганновер, Нью-Джерси: Novartis Pharmaceuticals Corp; Февраль 2016.
11. ISMP. Годовой отчет QuarterWatch 2014: сигналы для блокаторов TNF, антикоагулянтов, липитора, гормона роста. www.ismp.org/newsletters/acutecare/showarticle.aspx? id = 119. По состоянию на 5 марта 2016 г.,
12. Андерсон Г., Мейер Д., Херрман С.Э. и др. Переносимость и безопасность полмиллилитрового препарата глатирамера для подкожной инъекции: открытое многоцентровое рандомизированное сравнительное исследование. Дж. Нейрол . 2010; 257: 1917-1923.
2010; 257: 1917-1923.
13. Догерти К.К., Батлер Дж. С., Мэттингли М., Райан М. Факторы, побуждающие пациентов прекратить лечение рассеянного склероза. J Am Pharm Assoc (2003). 2005; 45: 371-375.
14. Каппос Л., Полман С.Х., Фридман М.С. и др.Лечение интерфероном бета-1b задерживает преобразование в клинически определенный и рассеянный склероз Макдональда у пациентов с клинически изолированными синдромами. Неврология . 2006; 67: 1242-1249.
15. Panitch H, Goodin DS, Francis G, et al. Рандомизированное сравнительное исследование схем лечения интерфероном бета-1а при РС: испытание EVIDENCE. Неврология. 2002; 59: 1496-1506.
16. McEwan L, Caon C, Chieffe C., et al. Лучшие практики применения алемтузумаба: практические рекомендации по инфузии у пациентов с рассеянным склерозом. Дж Инфус Нурс . 2016; 39: 93-104.
17. Намей М., Халпер Дж., О’Лири С. и др. Лучшие практики при рассеянном склерозе: реакции на инфузию в сравнении с гиперчувствительностью, связанной с биологической терапией. Дж Инфус Нурс . 2010; 33: 98-111.
18. Информация о продукте Humira (адалимумаб). Северный Чикаго, Иллинойс: AbbVie Inc; March 2016.
19. Информация о продукте Энбрел (этанерцепт). Таузенд-Оукс, Калифорния: Amgen, Inc; March 2015.
20. Информация о продукте Simponi (голимумаб). Хоршам, Пенсильвания: Centocor Ortho Biotech; 2009 г.
21. Информация о продукте Cosentyx (секукинумаб). Восточный Ганновер, Нью-Джерси: Novartis Pharmaceuticals Corp; Январь 2016.
22. Юсуф Х.Р., Хупер В.К., Бекман М.Г. и др. Риск венозной тромбоэмболии среди госпитализированных взрослых с отдельными аутоиммунными заболеваниями. J Тромб Тромболизис . 2014; 38: 306-313.
23. Райан М., Дено С., Цвибель Х.Л. Обзор клинических дебатов относительно вмешательств при рассеянном склерозе. Дж. Манаг Кэр Фарм . 2009; 15 (доп. S-b): S1-S17.
24.Харт И.К., Сатхасивам С., Шаршар Т. Иммунодепрессанты при миастении. Кокрановская база данных Syst Rev . 2007; (4): CD005224.
2007; (4): CD005224.
25. Агарвал С.К., Фархин К., Одерда Г.М. и др. Стратегии управляемой помощи для улучшения результатов пациентов при ревматоидном артрите. Дж. Манаг Кэр Фарм . 2011; 17 (приложение 9-б): С3-С8.
26. Cheng FK, McLean LP, Cross RK. Какова роль ведолизумаба в эпоху анти-TNF агентов? Энн Трансл Мед . 2014; 2: 1-4.
27. Roubille C, Haraoui B.Интерстициальные заболевания легких, вызванные или обостренные DMARDS и биологическими агентами при ревматоидном артрите: систематический обзор литературы. Semin Arthritis Rheum. 2014; 43: 613-626.
28. Micromedex Healthcare Series [Интернет-база данных]. Версия 5.1. Гринвуд-Виллидж, Колорадо: Thomson Micromedex; 2016.
Чтобы прокомментировать эту статью, свяжитесь с [email protected].
Отсутствие влияния сопутствующей иммуномодуляторной терапии на эффективность биопрепаратов, не являющихся антагонистами фактора некроза опухоли, у пациентов с воспалительными заболеваниями кишечника: метаанализ с биологическими препаратами, не являющимися антагонистами фактора некроза опухоли (такими как ведолизумаб или устекинумаб), следует проводить сопутствующее лечение иммуномодуляторами.Мы провели метаанализ, чтобы сравнить эффективность и безопасность сопутствующей терапии иммуномодуляторами с монотерапией ведолизумабом или устекинумабом.
Методы
В ходе систематического поиска публикаций до 31 июля 2019 г. мы выявили 33 исследования (6 рандомизированных контролируемых исследований и 27 когортных исследований) пациентов с ВЗК, получавших ведолизумаб или устекинумаб. Первичным результатом была клиническая польза, включая клиническую ремиссию, клинический ответ или общую оценку врачом у пациентов, которые получали или не получали комбинированную терапию с иммуномодулятором.Вторичными результатами были эндоскопическое улучшение и безопасность. Мы выполнили метаанализ случайных эффектов и оценили отношение шансов (OR) и 95% доверительный интервал.
Результаты
В целом, комбинированная терапия не была связана с лучшими клиническими результатами у пациентов, получавших ведолизумаб (16 исследований: OR 0,84; 95% ДИ 0,68–1,05; I2 = 13,9%; Q-тест P = 0,17) или устекинумаб. (15 исследований: OR 1,1; 95% ДИ 0,87–1,38; I2 = 11%; Q-тест P = 0,28). Результаты были согласованы в анализах подгрупп, без разницы в клинической ремиссии или ответе в исследованиях индукции и поддерживающей терапии или у пациентов с болезнью Крона и язвенным колитом в исследованиях ведолизумаба.Комбинированная терапия не была связана с лучшими эндоскопическими результатами у пациентов, получавших ведолизумаб (3 исследования: OR, 1,13; 95% ДИ, 0,48–2,68; I2 = 0; Q-тест P = 0,96) или устекинумаб (2 исследования: OR, 0,58; 95% ДИ 0,21–1,16; I2 = 47%; Q-тест P = 0,17). Комбинированная терапия не была связана с увеличением побочных эффектов во время терапии ведолизумабом (4 исследования: OR 1,17; 95% ДИ 0,75–1,84; I2 = 0; Q-тест P = 0,110).
Выводы
В метаанализе данных исследований пациентов с ВЗК мы обнаружили, что сочетание ведолизумаба или устекинумаба с иммуномодулятором не более эффективно, чем монотерапия для индукции или поддержания ремиссии.
Ключевые слова
Ингибитор интегрина
Интерлейкин
Анти-IL12-23
CD
UC
Аббревиатуры, используемые в этой статье
IBDвоспалительное заболевание кишечника
RCTстатьи )
Просмотреть полный текст© 2020 Институтом AGA
Рекомендуемые статьи
Цитирование статей
Какие лекарства из класса иммуномодуляторов используются при лечении болезни Бехчета?
Давачи Ф., Чамс-Давачи С., Шамс Х., Шахрам Ф., Наджи А., Ахлаги М. и др.Болезнь Бехчета: эпидемиология, клинические проявления и диагностика. Эксперт Рев Клин Иммунол . 2017 13 января (1): 57-65. [Медлайн].
Международная группа по изучению болезни Бехчета. Критерии диагностики болезни Бехчета.Международная исследовательская группа по болезни Бехчета. Ланцет . 1990 May 5. 335 (8697): 1078-80. [Медлайн].
Adamantiades B. Случай рецидивирующего ирита с гипопионом. Афинское медицинское общество . 1930. 586-93.
Behcet H. Uber rezidiverendeaphthose durch ein virus verursachte Geschwure am Mund, am Auge, und an den Genitalien. Dermatol Wochenschr . 1937. 105: 1152-7.
Эмми Л., Бругноло Ф, Сальвати Г. и др.Иммунопатологические аспекты болезни Бехчета. Clin Exp Rheumatol . 1995 ноябрь-декабрь. 13 (6): 687-91. [Медлайн].
Канеко С., Сузуки Н., Ямасита Н., Нагафучи Н., Накадзима Т., Вакисака С. и др. Характеристика Т-клеток, специфичных для эпитопа человеческого белка теплового шока (hsp) массой 60 кДа, у пациентов с болезнью Бехчета (BD) в Японии. Клин Экспер Иммунол . 1997 Май. 108 (2): 204-12. [Медлайн].
Хасан А., Форчун Ф, Уилсон А., Уорр К., Шинник Т., Мидзусима Ю. и др.Роль гамма-дельта Т-клеток в патогенезе и диагностике болезни Бехчета. Ланцет . 1996, 23 марта. 347 (9004): 789-94. [Медлайн].
Фэн Р., Чао К., Чен С.Л., Сунь СН, Цю И, Чен Б.Л. и др. Семейство белков теплового шока Член 6 в сочетании с клиническими характеристиками для дифференциальной диагностики кишечной болезни Бехчета. J Dig Dis . 2018 июня 19 (6): 350-358. [Медлайн].
J Dig Dis . 2018 июня 19 (6): 350-358. [Медлайн].
Сузуки Ю., Хоши К., Мацуда Т. и др.Повышенная гамма-дельта + Т-лимфоциты периферической крови и естественные клетки-киллеры при болезни Бехчета. Дж. Ревматол. . 1992, 19 апреля (4): 588-92. [Медлайн].
Direskeneli H, Eksioglu-Demiralp E, Kibaroglu A, Yavuz S, Ergun T, Akoglu T. Расширения олигоклональных Т-клеток у пациентов с болезнью Бехчета. Клин Экспер Иммунол . 1999 июл.117 (1): 166-70. [Медлайн]. [Полный текст].
Direskeneli H, Eksioglu-Demiralp E, Yavuz S, Ergun T, Shinnick T., Lehner T, et al.Т-клеточные ответы на пептиды, полученные из белка теплового шока 60/65 кДа, у турецких пациентов с болезнью Бехчета. Дж. Ревматол. . 2000 марта, 27 (3): 708-13. [Медлайн].
Frassanito MA, Dammacco R, Cafforio P, Dammacco F. Th2-поляризация иммунного ответа при болезни Бехчета: предполагаемая патогенетическая роль интерлейкина-12. Rheum артрита . 1999 сентябрь 42 (9): 1967-74. [Медлайн].
Суги-Икай Н., Накадзава М., Накамура С., Оно С., Минами М.Повышенная частота Т-клеток, продуцирующих интерлейкин-2 и интерферон гамма, у пациентов с активной болезнью Бехчета. Инвест офтальмол Vis Sci . 1998 Май. 39 (6): 996-1004. [Медлайн].
Hamzaoui K, Berraies A, Kaabachi W, Ammar J, Hamzaoui A. Легочные проявления при болезни Бехчета: нарушение активности естественных клеток-киллеров. Многопрофильный Респир Мед . 2013 г. 4. 8 (1): 29. [Медлайн].
Халлетт М.Б., Ллойдс Д.Прайминг нейтрофилов: сигналы клеток, которые говорят «янтарный», но не «зеленый». Иммунол Сегодня . 1995 Июнь 16 (6): 264-8. [Медлайн].
Иммунол Сегодня . 1995 Июнь 16 (6): 264-8. [Медлайн].
Сакане Т., Такено М., Сузуки Н., Инаба Г. Болезнь Бехчета. N Engl J Med . 1999, 21 октября. 341 (17): 1284-91. [Медлайн].
Сакане Т., Сузуки Н., Такено М. Врожденный и приобретенный иммунитет при болезни Бехчета. 8-й Международный конгресс по болезни Бехчета. Реджо-Эмилия, Италия, 7-9 октября 1998 г.Программа и тезисы: 56.
Такено М., Шимаяно Ю., Сузуки Н., Сакане Т. Продолжительное выживание нейтрофилов с автоприготовлением у пациентов с болезнью Бехчета: 8-й Международный конгресс по болезни Бехчета. Реджо-Эмилия, Италия, 7-9 октября 1998 г. Программа и тезисы: 57.
Koné-Paut I, Geisler I, Wechsler B, et al. Семейная агрегация при болезни Бехчета: высокая частота у братьев и сестер и родителей детских пробандов. Дж. Педиатр .1999 Июль 135 (1): 89-93. [Медлайн].
de Menthon M, Lavalley MP, Maldini C, Guillevin L, Mahr A. HLA-B51 / B5 и риск болезни Бехчета: систематический обзор и метаанализ исследований генетических ассоциаций случай-контроль. Rheum артрита . 2009 15 октября. 61 (10): 1287-96. [Медлайн].
Puccetti A, Fiore PF, Pelosi A, Tinazzi E, Patuzzo G, Argentino G, et al. Профилирование экспрессии генов при болезни Бехчета указывает на аутоиммунный компонент в патогенезе заболевания и открывает новые возможности для адресной терапии. Дж. Иммунол Рес . 2018. 2018: 4246965. [Медлайн]. [Полный текст].
Greco A, De Virgilio A, Ralli M, Ciofalo A, Mancini P, Attanasio G, et al. Болезнь Бехчета: новые взгляды на патофизиологию, клинические особенности и варианты лечения. Аутоиммунная Ред. . 2018 июн.17 (6): 567-575. [Медлайн].
Аутоиммунная Ред. . 2018 июн.17 (6): 567-575. [Медлайн].
Кирино Ю., Чжоу К., Исигацубо Ю., Мизуки Н., Тугал-Туткун И. и др. При целевом пересеквенировании задействованы ген семейной средиземноморской лихорадки MEFV и ген toll-подобного рецептора 4 TLR4 при болезни Бехчета. Proc Natl Acad Sci U S A . 2013 14 мая. 110 (20): 8134-9. [Медлайн]. [Полный текст].
Кирино Ю., Берциас Г., Исигацубо Ю., Мизуки Н., Тугал-Туткун И., Сеяхи Е. и др. Полногеномный ассоциативный анализ выявляет новые локусы восприимчивости к болезни Бехчета и эпистазу между HLA-B * 51 и ERAP1. Нат Генет . 2013 Февраль 45 (2): 202-7. [Медлайн]. [Полный текст].
Кираз С., Эртенли И., Озтюрк М.А. и др. Патологический гемостаз и «протромботическое состояние» при болезни Бехчета. Тромб Рес . 2002 15 января. 105 (2): 125-33. [Медлайн].
Бекатти М., Эмми Г., Беттиол А., Сильвестри Е., Ди Скала Г., Таддеи Н. и др. Синдром Бехчета как инструмент анализа механизмов тромбовоспалительного процесса: клинические и патогенетические аспекты. Клин Экспер Иммунол . 2018 25 ноября. [Medline].
Краузе И., Янкевич А., Фрейзер А., Рознер И., Мадер Р., Зисман Д. и др. Распространенность и клинические аспекты болезни Бехчета на севере Израиля. Clin Rheumatol . 2007 26 апреля (4): 555-60. [Медлайн].
Calamia KT, Wilson FC, Icen M, Crowson CS, Gabriel SE, Kremers HM. Эпидемиология и клинические характеристики болезни Бехчета в США: популяционное исследование. Rheum артрита . 2009 15 мая. 61 (5): 600-4. [Медлайн]. [Полный текст].
Саадун Д., Векслер Б., Дессо К. и др. Смертность при болезни Бехчета. Rheum артрита . 2010 сентябрь 62 (9): 2806-12.[Медлайн].
Акман-Демир Г., Сердароглу П., Таши Б. Клинические модели неврологического поражения при болезни Бехчета: оценка 200 пациентов. Исследовательская группа Neuro-Behçet. Мозг . 1999, ноябрь 122 (Pt 11): 2171-82. [Медлайн].
Гунгор А.Н., Калкан Г., Огуз С., Сен Б., Озогуз П., Такчи З. и др. Болезнь Бехчета и беременность. Clin Exp Obstet Gynecol . 2014. 41 (6): 617-9. [Медлайн].
Alpsoy E, Zouboulis CC, Ehrlich GE.Кожно-слизистые поражения при болезни Бехчета. Йонсей Мед Дж. . 2007 31 августа. 48 (4): 573-85. [Медлайн].
Calamia KT, Schirmer M., Melikoglu M. Вовлечение крупных сосудов в болезнь Бехчета. Curr Opin Rheumatol . 2005 17 января (1): 1-8. [Медлайн].
Кобаяши К., Уэно Ф., Бито С. и др. Разработка согласованных положений по диагностике и лечению кишечной болезни Бехчета с использованием модифицированного подхода Дельфи. Дж Гастроэнтерол .2007 Сентябрь 42 (9): 737-45. [Медлайн].
Hemmen T, Perez-Canto A, Distler A, et al. IgA-нефропатия у пациента с синдромом Бехчета — клинический случай и обзор литературы. Br J Ревматол . 1997 июн. 36 (6): 696-9. [Медлайн].
Хашимото Т., Тоя Ю., Кихара М., Ябана М., Инаяма Ю., Танака К. и др. Болезнь Бехчета, осложненная IgA-нефропатией с нефротическим синдромом. Клин Эксперимент Нефрол . 2008 июн. 12 (3): 224-7.[Медлайн].
Акполат Т., Аккоюнлу М., Акполат И. и др. Почечная болезнь Бехчета: совокупный анализ. Сывороточный артрит . 2002 г., 31 (5): 317-37. [Медлайн].
Коктурк А. Клинические и патологические проявления при дифференциальной диагностике болезни Бехчета. Патолог Res Int . 2012. 2012: 6. [Медлайн]. [Полный текст].
Аревало Дж. Ф., Ласаве А.Ф., Аль-Джиндан М.Ю., Аль-Сабаани Н.А., Аль-Махмуд А.М., Аль-Захрани Ю.А. и др.Увеит при болезни Бехчета в третичном центре более 25 лет: Исследовательская группа по исследованию увеита KKESH. Ам Дж. Офтальмол . 2015 Январь 159 (1): 177-184.e2. [Медлайн].
Саадун Д., Векслер Б., Реш-Ригон М., Трад С., Ле Тхи Хыонг Д., Сбаи А. и др. Церебральный венозный тромбоз при болезни Бехчета. Rheum артрита . 2009 15 апреля. 61 (4): 518-26. [Медлайн].
Шен Й, Ма ХФ, Луо Д., Цай Дж. Ф., Цзоу Дж., Гуань Дж. Л.. Высокая частота язв желудочно-кишечного тракта и цитогенетической аберрации трисомии 8 как типичных признаков болезни Бехчета, связанной с миелодиспластическим синдромом: серия из 16 последовательных китайских пациентов из Шанхайской базы данных болезней Бехчета и сравнение с литературой. Биомед Рес Инт . 2018. 2018: 8535091. [Медлайн].
Сеяхи Э., Чакмак О.С., Тутар Б., Арслан С., Дикичи А.С., Сут Н. и др. Клиническая и ультразвуковая оценка тромбоза вен нижних конечностей при синдроме Бехчета: обсервационное исследование. Медицина (Балтимор) . 2015 ноябрь 94 (44): e1899. [Медлайн].
Октайоглу П., Мете Н., Чаглаян М., Бозкурт М., Бозан Т., Эм С. и др. Повышенный уровень кальпротектина (MRP8 / MRP14) в сыворотке крови у пациентов с болезнью Бехчета и его связь с активностью заболевания и качеством жизни. Сканд Дж. Клин Лаб Инвест . 2014 Декабрь 4. 1-7. [Медлайн].
Hatemi G, Silman A, Bang D и др. Рекомендации EULAR по лечению болезни Бехчета. Энн Рум Дис . 2008 декабрь 67 (12): 1656-62. [Медлайн].
[Рекомендации] Хатеми Г., Кристенсен Р., Банг Д., Бодаги Б., Челик А.Ф. и др. Обновление рекомендаций EULAR по лечению синдрома Бехчета в 2018 г. Энн Рум Дис . 2018 июн.77 (6): 808-818.[Медлайн]. [Полный текст].
Aktulga E, Altac M, Muftüoglu A, et al. Двойное слепое исследование колхицина при болезни Бехчета. Haematologica . 1980 июн. 65 (3): 399-402. [Медлайн].
Калис М., Атес Ф, Язычи С., Козе К., Кирнап М., Демир М. и др. Уровни фермента аденозиндезаминазы, их связь с активностью заболевания и влияние колхицина на уровни аденозиндезаминазы у пациентов с болезнью Бехчета. Ревматол Инт .2005 25 августа (6): 452-6. [Медлайн].
Markomichelakis N, Delicha E, Masselos S, Sfikakis PP. Интравитреальный инфликсимаб при угрожающем зрении рецидивирующем увеите при болезни Бехчета: пилотное исследование с участием 15 пациентов. Ам Дж. Офтальмол . 2012 Сентябрь 154 (3): 534-541.e1. [Медлайн].
Кейно Х., Окада А.А., Ватанабе Т., Таки В. Снижение воспалительных приступов глаз и фоновой утечки сосудов сетчатки и диска у пациентов с болезнью Бехчета на терапии инфликсимабом. Br J Офтальмол . 2011 Сентябрь 95 (9): 1245-50. [Медлайн].
Umazume A, Kezuka T, Usui Y, Suzuki J, Goto H. Оценка эффективности инфликсимаба при васкулите сетчатки и экстраокулярных симптомах при болезни Бехчета. Jpn J Ophthalmol . 2018 май. 62 (3): 390-397. [Медлайн].
Леви-Кларк Дж., Джабс Д. А., Рид Р. У., Розенбаум Дж. Т., Витале А., Ван Гельдер Р. Н.. Рекомендации экспертной группы по применению биологических агентов против фактора некроза опухолей у пациентов с воспалительными заболеваниями глаз. Офтальмология . 2014 Март 121 (3): 785-96.e3. [Медлайн].
Deuter CM, Zierhut M, Mohle A, et al. Длительная ремиссия после прекращения лечения интерфероном-А у пациентов с тяжелым увеитом, вызванным болезнью Бехчета. Rheum артрита . 2010 сентябрь 62 (9): 2796-805. [Медлайн].
Селикер Х., Казокоглу Х., Дирескенели Х. Обычная иммуносупрессивная терапия при тяжелом увеите Бехчета: переход на биологические агенты. BMC Офтальмол . 2018 5 октября 2018 г. 18 (1): 261. [Медлайн].
Nuñez-Sotelo CM, Gutiérrez-Gonzalez LA, Rodriguez MA. Быстрый, полный и устойчивый ответ на терапию кортикостероидами и пульс-циклофосфамидом у пациента с бехчетом и заболеванием центральной нервной системы. Маэдика (Бухар) . 2012 Декабрь 7 (4): 348-51. [Медлайн]. [Полный текст].
Borhani Haghighi A, Pourmand R, Nikseresht AR. Болезнь Нейро-Бехчета. Обзор. Невролог .2005 г., 11 (2): 80-9. [Медлайн].
Sfikakis PP, Markomichelakis N, Alpsoy E, et al. Анти-TNF терапия в лечении болезни Бехчета — обзор и основание для рекомендаций. Ревматология (Оксфорд) . 2007 май. 46 (5): 736-41. [Медлайн].
McNally TW, Damato EM, Murray PI, Denniston AK, Barry RJ. Обновленная информация об использовании биологических методов лечения увеита при болезни Бехчета: всесторонний обзор. Орфанет J Редкие Dis .17 июля 2017 г. 12 (1): 130. [Медлайн]. [Полный текст].
Уэда А., Такено М., Ишигацубо Ю. Адалимумаб в лечении болезни Бехчета. Центр управления рисками Ther Clin Risk Manag . 2015. 11: 611-9. [Медлайн].
Меликоглу М., Фреско И., Мат С., Озязган Ю., Гогус Ф., Юрдакуль С. и др. Краткосрочное испытание этанерцепта при болезни Бехчета: двойное слепое плацебо-контролируемое исследование. Дж. Ревматол. . 2005, 32 января (1): 98-105. [Медлайн].
Vallet H, et al; Французская сеть Behçet.Эффективность анти-TNF альфа при тяжелой и / или рефрактерной болезни Бехчета: многоцентровое исследование с участием 124 пациентов. J Аутоиммунный . 2015 Август 62: 67-74. [Медлайн].
Такаяма К., Исикава С., Эноки Т., Кодзима Т., Такеучи М. Успешное лечение инфликсимабом болезни Бехчета во время беременности. Воспаление Ocul Immunol . 2013 25 апреля. [Medline].
Давачи Ф., Шамс Х., Резайпур М., Садеги-Абдоллахи Б., Шахрам Ф., Наджи А. и др.Ритуксимаб при трудноизлечимых поражениях глаз при болезни Бехчета; рандомизированное одинарное слепое контрольное исследование (пилотное исследование). Int J Rheum Dis . 2010 13 августа (3): 246-52. [Медлайн].
Sadreddini S, Noshad H, Molaeefard M, Noshad R. Лечение васкулита сетчатки при болезни Бехчета ритуксимабом. Mod Rheumatol . 2008. 18 (3): 306-8. [Медлайн].
Перес-Пампин Э., Кампос-Франко Дж., Бланко Дж., Мера А. Индукция ремиссии в случае рефрактерной болезни Бехчета с помощью алемтузумаба. Дж. Клин Ревматол . 2013 марта 19 (2): 101-3. [Медлайн].
Мескида М., Виктория Эрнандес М., Льоренс В. и др. Связанный с болезнью Бехчета увеит успешно лечится голимумабом. Воспаление Ocul Immunol . 2013 21 апреля (2): 160-2. [Медлайн].
Atienza-Mateo B, Martín-Varillas JL, Calvo-Río V, et al. Сравнительное исследование инфликсимаба и адалимумаба при рефрактерном увеите, вызванном болезнью Бехчета: национальное многоцентровое исследование 177 случаев. Ревматический артрит . 2019 декабрь 71 (12): 2081-2089. [Медлайн]. [Полный текст].
Hatemi G, Melikoglu M, Tunc R, Korkmaz C, Turgut Ozturk B, Mat C, et al. Апремиласт при синдроме Бехчета — плацебо-контролируемое исследование 2 фазы. N Engl J Med . 2015 16 апреля. 372 (16): 1510-8. [Медлайн].
Hatemi G, Mahr A, Ishigatsubo Y, Song YW, Takeno M, Kim D и др. Испытание апремиласта при язве в полости рта при синдроме Бехчета. N Engl J Med .2019 14 ноября. 381 (20): 1918-1928. [Медлайн]. [Полный текст].
Di Scala G, Bettiol A, Cojan RD, Finocchi M, Silvestri E, Emmi G. Эффективность секукинумаба против IL 17 при рефрактерном синдроме Бехчета: предварительное исследование. J Аутоиммунный . 2019 Февраль 97: 108-113. [Медлайн].
Fagni F, Bettiol A, Talarico R, Lopalco G, Silvestri E, Urban ML и др. Долгосрочная эффективность и безопасность секукинумаба для лечения рефрактерной слизистой оболочки и суставного фенотипа Бехчета: многоцентровое исследование. Энн Рум Дис . 2020 79 августа (8): 1098-1104. [Медлайн].
границ | Отмена лечения с помощью биологических препаратов или иммуномодуляторов при воспалительном заболевании кишечника
Введение
Лекарство от болезни логически рассматривается как основная ситуация, когда можно принять решение о прекращении лечения. Однако в настоящее время нет лекарства от воспалительного заболевания кишечника (ВЗК). В нашей нынешней концепции это многофакторные полигенные заболевания (1). Следовательно, излечение маловероятно.Мы могли представить себе возможность достаточно изменить окружающую среду, чтобы остановить продолжающийся иммуно-воспалительный процесс (2). У этой возможности есть два ограничения: во-первых, будет установлено самовоспроизводство воспаления и будет невозможно остановить даже получение триггеров окружающей среды, а во-вторых, совокупное повреждение тканей вызовет симптомы. Этот второй момент не должен быть препятствием для отмены лечения, а скорее потребует дополнительного симптоматического лечения.Помимо этого, прекращение лечения также имеет смысл, если польза от лечения ниже, чем его риск и / или стоимость. Чаще всего считается, что стоимость — это политическая система здравоохранения или прагматичное решение страховой компании, которое не может быть принято на уровне отдельных пациентов. Ситуация, когда это может быть решено на индивидуальной основе пациента, — это когда пациент не покрывается своими медицинскими сборами и должен сам решать, как потратить деньги, в том числе на медицинское обслуживание.Такая ситуация очень редка в Западной Европе. Тем не менее, государственные или частные учреждения здравоохранения должны принять важное решение в этой области. Для них соотношение выгод и затрат, безусловно, актуально, и его следует принимать во внимание. Таким образом, для врача обычно преобладает соотношение польза / риск. Оценить это — непростая задача, поскольку врачу, таким образом, необходимо интегрировать и вычислять одновременно риск продолжающейся лекарственной терапии и пользу от этой терапии. Кроме того, риск, связанный с отменой лечения, не ограничивается риском рецидива.Мы также должны учитывать вероятность быстрого восстановления ремиссии после повторного лечения и, если ответ на повторное лечение был неадекватным, последствия обострения заболевания, включая риск хирургической резекции. Это еще более сложно, поскольку врач также должен учитывать предпочтения и приоритеты пациента. Действительно, принятие риска побочных эффектов и риска прогрессирования заболевания может варьироваться от пациента к пациенту.
Цели этой обзорной статьи — проиллюстрировать наиболее важные факторы, которые следует учитывать при рассмотрении вопроса о прекращении лечения при ВЗК, и предложить способ интеграции этих различных факторов.Соотношения польза / риск и польза / стоимость месалазина были недавно пересмотрены и, вероятно, останутся положительными с течением времени (3). Поэтому мы сосредоточимся на отмене биопрепаратов и иммуномодуляторов. Что касается биологической терапии, в настоящее время имеются существенные данные о противоопухолевом факторе некроза (анти-TNF) и об иммуномодуляторах, в основном пуринах.
Риск рецидива после отмены лечения при ВЗК
Риск рецидива после отмены лечения, вероятно, лучше всего задокументирован.В целом, как при болезни Крона (БК), так и при язвенном колите (ЯК) риск рецидива после прекращения приема анти-TNF составляет около 50% в течение 1-2 лет (4, 5). Вероятно, он увеличивается со временем наблюдения и был описан примерно в 70–80% при БК через 7–8 лет (6). Отмена иммуномодулятора, по-видимому, связана с более медленным риском рецидива (7). По оценкам, через 1-2 года он составит около 20–30%. Однако и здесь она со временем прогрессирует и через 5 лет достигает> 50% (8). После повторного лечения в течение короткого времени большинство пациентов реагируют на возобновление приема как анти-TNF, так и иммуномодулятора (4, 5, 9).Что касается анти-TNF, небольшая часть со временем теряет ответ, но значительное количество из них все еще эффективно лечится тем же препаратом более чем через 5 лет (6). При ЯК до 10% исключенных пациентов могут быть подвергнуты колэктомии в течение 1 года после отмены анти-TNF (10), в то время как эта доля кажется ниже при БК — также 10–15%, но только в течение 7–8 лет (6). . Эти риски слишком высоки, чтобы предлагать отмену лечения всем пациентам, достигшим стойкой ремиссии без стероидов при ВЗК. Это утверждение подтверждается опросом пациентов, подчеркивающим тот факт, что среди них большинство согласилось бы с максимальным риском рецидива только в 25% (11).В соответствии с этим мы должны попытаться определить субпопуляцию с риском рецидива ниже 25%. Предикторы рецидива изучались во многих исследованиях с анти-TNF и иммуномодуляторами. Нет данных по ведолизумабу или устекинумабу. Эти предикторы недавно подверглись обширному обзору, и результаты неоднородны (3–5, 12). Эта неоднородность объясняется неоднородностью исследуемых популяций, в том числе различиями между проспективными исследованиями и ретроспективным анализом популяций рутинной практики.В рутинной практике отбор популяции для отмены лечения является более строгим, фокусируясь, например, на пациентах с эндоскопической ремиссией, в то время как проспективные испытания также могут включать пациентов, все еще имеющих эндоскопические поражения. Определенная неоднородность также может быть объяснена предикторами, которые были изучены, особенно в ретроспективных исследованиях, где было доступно лишь ограниченное количество переменных. Результаты также различались при рассмотрении отмены анти-TNF или иммуномодулятора и при БК или при ЯК.В общем, предикторы было труднее раскрыть в UC, чем в CD. В самом крупном ретроспективном исследовании, проведенном на сегодняшний день, можно было найти ряд предикторов для CD, но для UC не было найдено ни одного. Среди наиболее заметных предикторов — прямые или косвенные признаки персистирующей активности заболевания: эндоскопические поражения, повышенные маркеры воспаления в крови (С-реактивный белок) и повышенные маркеры воспаления в стуле (калпротектин) (3-5). Другие важные предикторы связаны с продолжающимся лечением: совместное лечение иммуномодулятором и низкий или неопределяемый минимальный уровень анти-TNF были связаны с более низким риском рецидива при прекращении приема этого анти-TNF (3–5).В соответствии с этим, стойкие эндоскопические поражения и минимальный уровень препарата часто рассматриваются как ключевые факторы, которые врачи должны оценивать в клинической практике, прежде чем рассматривать вопрос об отмене препарата. Хотя они и важны, они представляют собой лишь часть проблемы. Действительно, в когорте STORI, даже у пациентов с полным эндоскопическим заживлением, частота рецидивов после отмены инфликсимаба составляла 30% в течение 1 года (по сравнению с 45% в общей популяции и 10% в группе низкого риска). Точно так же низкий или неопределяемый минимальный уровень инфликсимаба был связан со снижением риска рецидива после отмены.Это имеет смысл и, вероятно, соответствует ситуациям, когда инфликсимаб оказывает незначительное влияние на поддержание ремиссии. Однако это не так просто, так как низкая доза не обязательно означает отсутствие эффекта от препарата. Этот препарат все еще может вызывать релевантную экспозицию, связанную с пиковой концентрацией и площадью под кривой этой концентрации в течение 4-8 недель. В когорте STORI уровень инфликсимаба не был связан с риском рецидива в одномерном анализе, а был выбран только в многомерной модели.Были предложены и другие факторы, но они либо косвенно отражают текущую активность заболевания или текущее лечение, либо их труднее объяснить и требуют подтверждения. Курение, которое часто было связано с плохим исходом при БК, было обнаружено только в одном исследовании как прогностическое средство для рецидива после прекращения приема анти-TNF (3). Гистологическая ремиссия, которая становится важным исходом при ЯК и ставится под сомнение при БК, недостаточно изучена в качестве предиктора после отмены лечения при ВЗК.Согласно этим результатам, лучшими кандидатами на отмену анти-TNF будут пациенты с клинически, биологически и эндоскопически неактивным заболеванием и с одновременным лечением иммуномодуляторами и / или с низким или необнаруживаемым уровнем биологического препарата (таблица 1). В когорте STORI он составлял 15–20% пациентов, включенных в исследование (9). Это дает оценку доли пациентов среди тех, у кого наблюдается длительная ремиссия без стероидов при комбинированной терапии, с низким риском рецидива.Однако, поскольку повторное лечение при рецидиве кажется безопасным и эффективным и поскольку значительному количеству пациентов может помочь, по крайней мере, временная отмена препарата, кандидатов на временную отмену может быть больше.
Таблица 1 . Наиболее важные факторы, способствующие отмене лечения ВЗК.
Последствия рецидива после отмены лечения при ВЗК
Рецидив после отмены лечения биологическими препаратами или иммуномодуляторами был бы незначительной проблемой, если бы ремиссия могла быть быстро восстановлена и без прогрессирования заболевания, ведущего к необходимости хирургической резекции.Ситуация, очевидно, сильно отличается, если рецидив связан с развитием осложнения, такого как стриктура, абсцесс или свищ при БК, и с острым тяжелым колитом при ЯК. Для ЯК возникновение такого острого тяжелого колита остается непредсказуемым и не помогает принять решение (13). Однако в некоторых исследованиях частота колэктомии составляла до 20% пациентов с рецидивом и, таким образом, является важным ограничением для этой стратегии (10). Пациенты с БК, уже имеющие в анамнезе перианальные свищи, стриктуры кишечника, свищ и абсцесс брюшной полости, имеют риск рецидива (12, 14).Аналогичным образом, пациенты, уже прооперированные, имеют значительное повреждение кишечной ткани, и врач должен быть очень осторожен, чтобы не увеличить его, особенно когда существует риск короткой кишки или риск субтотальной колэктомии или стомы (15). В опубликованных исследованиях риск рецидива был особенно высок у пациентов с предшествующим перианальным фистулизирующим заболеванием (14). Вероятно, объясняя это, предыдущие исследования продемонстрировали, что пациенты, испытывающие полное клиническое закрытие перианальных свищей при лечении анти-TNF, обычно сохраняют признаки активного воспаления в своих свищевых следах и что полное заживление и исчезновение этих свищевых свищей очень редки (16, 17).Аналогичным образом, предыдущие исследования показали возможный повышенный риск рецидива у пациентов с анамнезом кишечных стриктур или свищей (12). В этих исследованиях риск развития новых стриктур, свищей или абсцесса после отмены иммуномудулятора анти-TNF четко не указывался, но в долгосрочном наблюдении когорты STORI со средним сроком наблюдения 7 лет. только у 18% пациентов развились серьезные осложнения, включая необходимость хирургической резекции кишечника и новые сложные перианальные свищи.В соответствии с этим, лучшими кандидатами на отмену лечения будут пациенты без сложных перианальных заболеваний в анамнезе; отсутствие значительных и недавних стриктур, свищей или внутрибрюшных абсцессов; и отсутствие обширной хирургической резекции при БК (Таблица 1). Точно так же пациенты с левосторонним ЯК или проктитом могут быть лучшими кандидатами, чем пациенты с панколитом. Также важно учитывать возраст, поскольку молодые пациенты должны будут жить дольше со своим заболеванием и, таким образом, подвергаются повышенному риску осложнений и кумулятивного повреждения тканей кишечника.
Ключевым элементом в случае рецидива после отмены лечения является возможность повторно зафиксировать ремиссию с помощью того же препарата. Это может быть поставлено под угрозу из-за иммуногенности лекарственного средства для биопрепаратов и развития антител против лекарственного средства. Эти антитела против лекарств были связаны с преходящей отменой лекарств, особенно инфликсимаба. Это было особенно ярко выражено на ранних этапах применения инфликсимаба, когда проводилось только индукционное лечение, за которым следовала терапия по требованию. Плановое лечение и совместное лечение иммуномодуляторами явно снизили иммуногенность, и в исследовании STORI только у нескольких пациентов развились антитела к лекарствам, и ни у одного из них не возникла острая тяжелая инфузионная реакция при возобновлении терапии (9).Однако в исследовании STORI из-за этого теоретического риска аллергической реакции при возобновлении приема инфликсимаба инфузия стероидов проводилась перед возобновлением приема инфликсимаба, а первые инфузии проводились в более медленном темпе с введением небольшого количества препарата в течение первого часа. . Это все еще наша практика, хотя ни одно контролируемое клиническое исследование не подтвердило эту стратегию. Риск иммуногенности более свежих биопрепаратов в контексте временной отмены лекарств менее хорошо документирован.
Риск продолжения лечения ВЗК
Риск и переносимость продолжающегося лечения в первую очередь зависят от возраста и сопутствующих заболеваний (18). Было показано, что риск тяжелой инфекции при терапии анти-TNF значительно выше у пациентов старше 65 лет (19). Аналогичным образом, аналоги против TNF и пуринов связаны с повышенным риском лимфомы (20). Относительный риск оценивается около 2 для анти-TNF и около 2–4 для пуриновых аналогов, в то время как он достиг высшей точки на уровне 4–6 при комбинированной терапии (20).Однако этот риск возрастает с возрастом, что приводит к тому, что у значительного числа (хотя и небольшого в абсолютном выражении) пациентов старше 65 лет на фоне приема этих препаратов развивается лимфома (21). Пурины также были связаны с другими формами рака, включая рак кожи и рак мочевыводящих путей (22, 23). По этим причинам большинство клиницистов сейчас стараются сократить использование аналогов пурина после 60–65 лет. Влияние анти-TNF и других биопрепаратов на другие виды рака недостаточно хорошо документировано, за исключением рака кожи и, возможно, меланомы под действием анти-TNF (24).Тем не менее, из-за повышенного риска рака у пожилых людей препараты с системным иммунодепрессивным действием следует применять с осторожностью. Некоторые сопутствующие заболевания также могут потребовать внимания. Он включает хроническую обструктивную болезнь легких, которая связана с повышенным риском бронхолегочной суперинфекции (25). Опять же, это может быть увеличено лекарствами, имеющими системный иммунодепрессивный эффект.
Другой аспект — легкая непереносимость препарата, как некоторые кожные проявления при терапии анти-TNF (26).Чаще всего этих проявлений недостаточно per se , чтобы прервать лечение, если польза от лечения остается значительной (27). Однако в некоторых ситуациях он может представлять собой один из множества аргументов, которые могут повлиять на решение.
Таким образом, с этой точки зрения, лучшими кандидатами на отмену лечения будут пациенты с некоторой степенью непереносимости препарата, или пожилые пациенты (обычно старше 60–65 лет), или пациенты с сопутствующими заболеваниями, повышающими риск заражения или заражения. рак (таблица 1).
Стоимость продолжающихся стратегий лечения или прекращения лечения
Стоимость продолжающегося лечения будет сильно варьироваться в зависимости от его характера: биологическая терапия, биоаналог или иммуномодулятор. Хотя недавние исследования продемонстрировали, что растущая часть затрат на лечение ВЗК была связана с биологической терапией, при этом не учитывались сэкономленные затраты из-за уменьшения количества госпитализаций или операций (28). В ранних исследованиях инфликсимаба этот препарат считался рентабельным при БК, но только в течение одного или нескольких лет терапии, при этом экономическая эффективность не была продемонстрирована за пределами этого срока (29).В более недавнем исследовании специально изучалась экономическая эффективность стратегии циклов биологической терапии, включая периоды отмены, когда пациенты находились в длительной ремиссии (30). Это исследование показало, что рентабельность непрерывной терапии была благоприятной при некоторых пороговых значениях стоимости лекарств. Интересно, что в случае биоподобных препаратов эти пороговые значения были недавно достигнуты в нескольких европейских странах. Ситуация с биологическими препаратами, оплачиваемыми по полной цене, иная, и для них непрерывное лечение, как правило, менее рентабельно, чем циклы биологического лечения.Цена аналогов пурина обычно настолько низка, что непрерывная терапия чаще всего оказывается рентабельной.
Предпочтения и приоритеты пациентов
Из-за личного взгляда на болезнь и методы ее лечения пациенты могут быть более склонны мириться с последствиями или осложнениями лечения или самого заболевания. Например, выбор между медикаментозной терапией и хирургической терапией (которая может быть следствием отмены терапии) может варьироваться среди пациентов. В специальном опросе пациентов было показано, что риск тяжелой инфекции или лимфомы, которые пациент согласился бы находиться в стадии ремиссии, будет очень сильно варьироваться, но обычно будет выше, чем тот, который принимают их врачи (31).Более конкретно, что касается отмены лечения, было показано, что пациенты обычно предпочитают прекратить лечение иммуномодулятором, чем биологическим лечением, и что основной причиной прекращения терапии будет страх перед побочными эффектами и особенно раком (11). Что касается риска рецидива, с которым пациенты согласились бы, чтобы иметь возможность прекратить один из своих курсов лечения, большинство согласились бы с риском рецидива до 25% и до 5% времени с активным заболеванием, чтобы иметь возможность остановить один из своих лечение (биологическое или иммуномодуляторное) (11).Эти цифры могут служить ориентирами при рассмотрении вопроса о прекращении лечения. Однако некоторые пациенты не приняли бы никакого риска рецидива, в то время как другие были бы готовы согласиться на очень высокий риск, чтобы уменьшить свою терапию (11). Эти вопросы следует специально задать пациентам, прежде чем рассматривать вопрос о прекращении лечения.
Беременность представляет собой особую ситуацию, при которой прекращение лечения часто рассматривается или, по крайней мере, обсуждается. Беременная пациентка обычно очень хочет прекратить терапию еще до начала беременности.Однако, несмотря на относительно небольшое количество доказательств, в большинстве руководств считается, что почти все виды лечения можно продолжать во время беременности, за исключением метотрексата (32). Все согласны с тем, что худшее для беременности как для плода, так и для матери — это неконтролируемое заболевание, и что необходимо сделать все, чтобы сохранить ремиссию во время беременности.
С этой точки зрения лучшими кандидатами на отмену лечения будут те, кто после четкой информации и понимания не только рисков, связанных с отменой лечения, но и последствий продолжения терапии, решит прекратить это лечение (Таблица 1 ).
Интегративная модель для руководства по отмене лечения при ВЗК
Решение о прекращении лечения ВЗК — непростое и, безусловно, многомерное. Есть несколько способов попытаться интегрировать эти разные измерения. Наиболее сложный вариант включает разработку системы поддержки принятия клинических решений (33). Такие инструменты были разработаны для других хронических заболеваний и могут объединять несколько параметров и позиции нескольких субъектов, участвующих в процессе принятия решения, включая пациентов.В эти инструменты можно включить искусственный интеллект для оптимизации решения. Их еще предстоит разработать в области ВЗК. Простой инструмент может включать грубое и полуколичественное взвешивание различных факторов и графическое представление силы аргументов в пользу прекращения или продолжения терапии (4). Эта модель была предложена и проиллюстрирована в предыдущей публикации, посвященной отмене лечения при БК. В качестве альтернативы, что проще, можно создать типичные профили пациентов, для которых решение о прекращении или продолжении лечения может быть оптимальным выбором (34).Другой относительно простой способ продолжить — создать алгоритм, включающий различные параметры, определяющие выбор лечения. Для этого потребуется иерархия между различными измерениями, позволяющая построить алгоритм, управляемый последовательными вопросами. Пример такого алгоритма представлен на рисунке 1.
Рисунок 1 . Предлагаемый алгоритм решения об отмене лечения при воспалительном заболевании кишечника (ВЗК). Этот алгоритм может обеспечить иерархию вопросов и факторов, которые необходимо оценить при рассмотрении вопроса о прекращении лечения при ВЗК.Некоторые факторы, такие как стоимость и возмещение, могут быть специфическими для некоторых систем здравоохранения и юрисдикции.
Выводы
Систематическая отмена биологической терапии или иммуномодулятора, когда цель лечения была достигнута, не основывается на доказательствах и не рекомендуется. Тем не менее, для некоторых подгрупп пациентов это может представлять собой вариант, связанный с оптимальным соотношением польза-риск и польза-стоимость. Решение о прекращении лечения пациентов с ВЗК в стадии ремиссии, таким образом, должно быть индивидуальным подходом, в основном с учетом прошлой клинической истории пациента, текущего состояния болезни, переносимости и риска побочных эффектов, а также предпочтений и приоритетов пациентов.Для оптимальной интеграции всех этих аспектов могут потребоваться специальные инструменты, включающие искусственный интеллект. Более простые алгоритмы также могут помочь врачу в повседневной практике.
Взносы авторов
EL задумал, написал и подготовил рукопись.
Финансирование
Работа выполнена при финансовой поддержке исследовательской и инновационной программы Европейского Союза Horizon 2020 в рамках грантового соглашения № 633168 — BIOCYCLE (PHC-13-2014).
Конфликт интересов
EL получил гонорары за: Грант на исследования: Takeda, Pfizer; Образовательный грант: Abbvie, Takeda, Janssen; Гонорары докладчиков: Abbvie, Ferring, MSD, Falk, Takeda, Hospira, Janssen, Pfizer, Celgene; Консультативный совет: Abbvie, Ferring, MSD, Takeda, Celgene, Hospira, Janssen; Консультант: Эбви.Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Список литературы
2. Коэн Л.Дж., Чо Дж. Х., Геверс Д., Чу Х. Генетические факторы и микробиом кишечника определяют развитие методов лечения воспалительных заболеваний кишечника на основе микробов. Гастроэнтерология. (2019) 156: 2174–89. DOI: 10.1053 / j.gastro.2019.03.017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
3.Доэрти Дж., Катсанос К. Х., Буриш Дж., Аллез М., Папамикл К., Столлмах А. и др. Тематический обзор Организации Крона и Колита по отмене лечения [«Стратегии выхода»] при воспалительном заболевании кишечника. Дж. Колит Крона . (2018) 12: 17–31. DOI: 10.1093 / ecco-jcc / jjx101
PubMed Аннотация | CrossRef Полный текст | Google Scholar
4. Торрес Дж., Бояпати Р.К., Кеннеди Н.А., Луис Э., Коломбел Дж. Ф., Сатсанги Дж. Систематический обзор эффектов отмены иммуномодуляторов или биологических агентов у пациентов с воспалительным заболеванием кишечника. Гастроэнтерология . (2015) 149: 1716–30. DOI: 10.1053 / j.gastro.2015.08.055
CrossRef Полный текст | Google Scholar
5. Кеннеди Н.А., Уорнер Б., Джонстон Е.Л., Фландерс Л., Хенди П., Динг Н.С. и др. Рецидив после отмены анти-TNF терапии воспалительного заболевания кишечника: обсервационное исследование, а также систематический обзор и метаанализ. Алимент Фармакол Тер . (2016) 43: 910–23. DOI: 10.1111 / apt.13547
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6.Reenaers C, Mary JY, Nachury M, Bouhnik Y, Laharie D, Allez M и др. Результаты через 7 лет после отмены инфликсимаба для пациентов с болезнью Крона в стойкой ремиссии. Клин Гастроэнтерол Гепатол . (2018) 16: 234–43. DOI: 10.1016 / j.cgh.2017.09.061
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7. Леманн М., Мэри Дж. Я., полковник Дж. Ф., Дюкло Б., Соул Дж. К., Леребур Э. и др. Рандомизированное двойное слепое контролируемое исследование отмены азатиоприна у пациентов с болезнью Крона в длительной ремиссии. Гастроэнтерология . (2005) 128: 1812–8. DOI: 10.1053 / j.gastro.2005.03.031
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Treton X, Bouhnik Y, Mary JY, Colombel JF, Duclos B, Soule JC и др. Отмена азатиоприна у пациентов с болезнью Крона, находящихся в длительной ремиссии: высокий риск рецидива. Клин Гастроэнтерол Гепатол . (2009) 7: 80–5. DOI: 10.1016 / j.cgh.2008.08.028
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9.Луи Э., Мэри Дж. Я., Вернье-Массуй Дж., Гримо Дж. К., Бухник Ю., Лахари Д. и др. Поддержание ремиссии у пациентов с болезнью Крона, получающих антиметаболитную терапию, после терапии инфликсимабом прекращается. Гастроэнтерология . (2012) 142: 63–70. DOI: 10.1053 / j.gastro.2011.09.034
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Фаркас К., Лакатос П.Л., Надь Ф., Сепес З., Михеллер П., Папп М. и др. Предикторы рецидива у пациентов с язвенным колитом в стадии ремиссии после одного года терапии инфликсимабом. Сканд Дж Гастроэнтерол . (2013) 48: 1394–8. DOI: 10.3109 / 00365521.2013.845906
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Сигел С., Томпсон К.Д., Уоллс Д., Голлинз Дж., Бьюиссон А., Олимпи А. и др. DOP032 Перспективы пациентов с болезнью Крона в отношении снижения уровня иммуносупрессивной терапии: сравнительное исследование во Франции и США. Конгресс ECCO . (2018) 12: S053. DOI: 10.1093 / ecco-jcc / jjx180.069
CrossRef Полный текст | Google Scholar
12.Казанова М.Дж., Чапарро М., Гарсия-Санчес В., Нант О, Лео Е., Рохас-Ферия М. и др. Эволюция после отмены анти-TNF у пациентов с воспалительным заболеванием кишечника: многоцентровое долгосрочное последующее исследование. Ам Дж. Гастроэнтерол . (2017) 112: 120–31. DOI: 10.1038 / ajg.2016.569
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Cesarini M, Collins GS, Rönnblom A, Santos A., Wang LM, Sjöberg D, et al. Прогнозирование индивидуального риска острого тяжелого колита при постановке диагноза. Дж. Колит Крона . (2017) 11: 335–41. DOI: 10.1093 / ecco-jcc / jjw159
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Domènech E, Hinojosa J, Nos P, Garcia-Planella E, Cabré E, Bernal I, et al. Клиническая эволюция люминальной и перианальной болезни Крона после достижения ремиссии инфликсимабом: как долго следует лечить пациентов? Алимент Фармакол Тер . (2005) 22: 1107–13. DOI: 10.1111 / j.1365-2036.2005.02670.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15.Париенте Б., Мэри Дж. Я., Данезе С., Човерс Й., Де Круз П., Д’Хаенс Дж. И др. Разработка индекса Леманна для оценки поражения пищеварительного тракта у пациентов с болезнью Крона. Гастроэнтерология . (2015) 148: 52–63. DOI: 10.1053 / j.gastro.2014.09.015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Ван Аше Г., Ванбекевоорт Д., Билен Д., Корманс Г., Аерден И., Номан М. Магнитно-резонансная томография эффектов инфликсимаба на перианальные свищи болезни Крона. Ам Дж. Гастроэнтерол . (2003) 98: 332–9. DOI: 10.1111 / j.1572-0241.2003.07241.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Кармирис К., Билен Д., Ванбекевоорт Д., Вермейр С., Корманс Г., Рутгиртс П. и др. Долгосрочный мониторинг терапии инфликсимабом при перианальной фистулии болезни Крона с помощью магнитно-резонансной томографии. Клин Гастроэнтерол Гепатол . (2011) 9: 130–6. DOI: 10.1016 / j.cgh.2010.10.022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18.Папамикл К., Манцарис Г.Дж., Пейрин-Бируле Л. Оценка безопасности альфа-терапии противоопухолевым фактором некроза для лечения болезни Крона. Экспертное заключение Drug Saf . (2016) 15: 493–501. DOI: 10.1517 / 14740338.2016.1145653
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19. Коттон М., Кон А., Даперно М., Армуцци А., Гуиди Л. и др. Пожилой возраст является независимым фактором риска тяжелых инфекций и смертности у пациентов, получающих терапию противоопухолевым фактором некроза по поводу воспалительного заболевания кишечника. Клин Гастроэнтерол Гепатол . (2011) 9: 30–5. DOI: 10.1016 / j.cgh.2010.09.026
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Леметр М., Кирхгеснер Дж., Рудничи А., Каррат Ф., Зурейк М., Карбоннель Ф. и др. Связь между использованием тиопуринов или антагонистов фактора некроза опухолей по отдельности или в комбинации и риском лимфомы у пациентов с воспалительным заболеванием кишечника. ДЖАМА . (2017) 318: 1679–86. DOI: 10.1001 / jama.2017.16071
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21.Beaugerie L, Brousse N, Bouvier AM, Colombel JF, Lémann M, Cosnes J, et al. Лимфопролиферативные расстройства у пациентов, получающих тиопурины по поводу воспалительного заболевания кишечника: проспективное наблюдательное когортное исследование. Ланцет . (2009) 374: 1617–25. DOI: 10.1016 / S0140-6736 (09) 61302-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Peyrin-Biroulet L, Khosrotehrani K, Carrat F, Bouvier AM, Chevaux JB, Simon T, et al. Повышенный риск немеланомного рака кожи у пациентов, получающих тиопурины по поводу воспалительного заболевания кишечника. Гастроэнтерология . (2011) 141: 1621–28. DOI: 10.1053 / j.gastro.2011.06.050
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23. Бурье А., Каррат Ф., полковник Дж. Ф., Бувье А. М., Абитбол В., Марто П. и др. Повышенный риск рака мочевыводящих путей у пациентов, получающих тиопурины по поводу воспалительного заболевания кишечника: проспективное наблюдательное когортное исследование. Алимент Фармакол Тер . (2016) 43: 252–61. DOI: 10.1111 / apt.13466
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24.Мерсер Л.К., Асклинг Дж., Раашу П., Диксон В.Г., Дрейер Л., Хетланд М.Л. и др. Риск инвазивной меланомы у пациентов с ревматоидным артритом, получающих биопрепараты: результаты совместного проекта 11 европейских биологических регистров. Энн Рум Дис . (2017) 76: 386–91. DOI: 10.1136 / annrheumdis-2016-209285
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25. Реннард С., Фогарти С., Келсен С., Лонг В., Рамсделл Дж., Эллисон Дж. И др. Безопасность и эффективность инфликсимаба при умеренной и тяжелой хронической обструктивной болезни легких. Am J Respir Crit Care Med. (2007) 175: 926–34. DOI: 10.1164 / rccm.200607-995OC
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Райер Дж. Ф., Буш С., Пейрин-Бируле Л., Бухник И., Дюкло Б., Луи Э. и др. Тяжелые поражения кожи заставляют пациентов с воспалительным заболеванием кишечника прекращать терапию фактором некроза опухоли. Клин Гастроэнтерол Гепатол . (2010) 8: 1048–55. DOI: 10.1016 / j.cgh.2010.07.022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27.Cleynen I, Van Moerkercke W, Billiet T, Vandecandelaere P, Vande Casteele N, Breynaert C и др. Характеристики поражений кожи, связанных с терапией противоопухолевым фактором некроза у пациентов с воспалительным заболеванием кишечника: когортное исследование. Энн Интерн Мед. . (2016) 164: 10–22. DOI: 10.7326 / M15-0729
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. van der Valk ME, Mangen MJ, Leenders M, Dijkstra G, van Bodegraven AA, Fidder HH, et al. Затраты на лечение воспалительных заболеваний кишечника сместились с госпитализации и хирургического вмешательства на терапию анти-TNFα: результаты исследования COIN. Кишка . (2014) 63: 72–9. DOI: 10.1136 / gutjnl-2012-303376
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29. Боджер К., Кикучи Т., Хьюз Д. Экономическая эффективность биологической терапии болезни Крона: когортный анализ Маркова, включающий данные о затратах на уровне пациента в Соединенном Королевстве. Алимент Фармакол Тер . (2009) 30: 265–74. DOI: 10.1111 / j.1365-2036.2009.04033.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
30.Болин К., Хертервиг Э., Луи Э. Экономическая эффективность циклов биологической терапии при лечении болезни Крона. J Crohns Colitis. (2019) 13: 1323–33. DOI: 10.1093 / ecco-jcc / jjz063
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Джонсон Ф. Р., Оздемир С., Мэнсфилд С., Хасс С., Миллер Д. В., Сигел С. А. и др. Предпочтения пациентов с болезнью Крона «риск-польза»: риски серьезных нежелательных явлений по сравнению с эффективностью лечения. Гастроэнтерология .(2007) 133: 769–79. DOI: 10.1053 / j.gastro.2007.04.075
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Магро Ф, Джиончетти П., Элиаким Р., Ардиццоне С., Армуцци А., Баррейро-де Акоста М. и др. Третий европейский консенсус по диагностике и лечению язвенного колита, основанный на фактических данных. часть 1: определения, диагностика, внекишечные проявления, беременность, наблюдение за раком, хирургия и заболевания подвздошно-анального мешка. J Crohns Colitis. (2017) 11: 649–70.DOI: 10.1093 / ecco-jcc / jjx008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Пауэн Нью-Йорк, Луи Э., Сигел С., Коломбел Дж. Ф., Макк Дж. Интегрированная помощь при болезни Крона: призыв к разработке систем поддержки принятия клинических решений. Дж. Колит Крона . (2018) 12: 1499–504. DOI: 10.1093 / ecco-jcc / jjy128
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Что такое иммуномодулятор и как он помогает поддерживать иммунитет?
Иммуномодуляторы и их влияние на иммунитет — это тема в авангарде растущих исследований того, как дрожжевые бета-глюканы могут поддерживать здоровье иммунной системы.Присоединяйтесь к Соне Нодланд, ведущему научному сотруднику Wellmune ® , в вопросах и ответах об иммуномодуляторах и последних новостях о том, как они влияют на здоровье иммунной системы.
Q: Расскажите немного о себе и о том, почему для вас важно здоровье иммунной системы.
A: У меня есть степень магистра клеточной биологии Вашингтонского университета в Сент-Луисе и докторская степень по программе микробиологии, иммунологии и биологии рака в Университете Миннесоты. Мои академические исследования были посвящены изучению того, как различные типы иммунных клеток (в основном В-клетки и нейтрофилы) «рождаются» и развивают нормальные функции в организме человека.С того времени мои научные интересы расширились, включив макрофаги, а также то, как на нашу иммунную систему влияет наша диета и микроорганизмы, присутствующие в нашем организме.
Одна тема, проходящая через все эти темы, заключается в том, что здоровая иммунная система имеет решающее значение для общего физического здоровья, и мы обнаруживаем, что она также может способствовать психическому здоровью. Из-за той центральной роли, которую иммунное здоровье играет в нашем общем здоровье и качестве жизни, эта тема меня очень интересует.
Q: Что такое иммуномодуляторы?
A: Иммуномодуляторы — это вещества, которые могут помочь поддерживать иммунную функцию, изменяя, как правило, положительным образом реакцию иммунной системы на угрозу.
Посмотрите видео, чтобы узнать больше о том, как бета-глюканы поддерживают иммунную систему.
Q: Как они работают для поддержки иммунитета?
A: Когда вы впервые сталкиваетесь с патогеном, иммунная система сначала реагирует быстро и неспецифично благодаря своей врожденной иммунной функции.Симптомы, связанные с этой реакцией, такие как боль и отек, являются результатом воспалительной реакции организма.
За этим следует более медленный, специфический ответ на патоген, выполняемый адаптивной стороной иммунной системы. Адаптивная иммунная система — это часть иммунной системы, которая обладает долговременной памятью и предотвращает заражение многих патогенов более чем один раз.
Иммуномодулирующие молекулы, некоторые из которых могут потребляться с пищей, могут помочь организму защищаться от патогенов, регулируя нормальный иммунный ответ для более эффективного ответа при обнаружении патогена.
Q: Как дрожжевой бета-глюкан действует как иммуномодулятор?
A: Определенные типы бета-глюканов дрожжевого происхождения влияют на воспалительную и антимикробную активность нейтрофилов и макрофагов, клеток, которые являются частью врожденной иммунной системы. Появляются доказательства того, что бета-глюканы дрожжей могут «тренировать» иммунные клетки организма, чтобы они реагировали более эффективно при обнаружении патогена.
Q: Что означает «тренировать иммунную систему»?
A: Тренировка иммунной системы организма — это недавно признанный феномен, который возникает, когда клетки врожденного иммунитета сталкиваются с определенными частями микробов (живых или неживых), заставляя клетки принимать более эффективный ответ на будущую угрозу.По сути, это означает, что клетки врожденного иммунитета после переживания одного из этих тренировочных стимулов сохраняют «память» об этом опыте, что позволяет им реагировать более быстро и эффективно при встрече с другим патогеном.
Вопрос: Чем тренировка врожденного иммунитета отличается от традиционной иммунной памяти?
A: Ключевое различие между тренировкой врожденного иммунитета и традиционной иммунной памятью заключается в том, насколько широка тренированная реакция. В традиционной иммунной памяти иммунная система встречает патоген (например, корь) в результате болезни или вакцинации, а адаптивная иммунная система создает несколько типов специфических молекул, чтобы распознать этот патоген (корь) в будущем и заблокировать заражение организма.
Напротив, при тренированном иммунитете встреча врожденной иммунной системы с живыми или неживыми микробами («тренерские» стимулы) регулирует врожденный иммунный ответ, позволяя более эффективно реагировать на патогены, не связанные с «тренером». ” Этот более общий эффект важен для иммунной защиты, потому что полезно иметь некоторый уровень защиты от патогенов, с которыми вы никогда раньше не сталкивались.
Тренированный иммунитет, вызванный первоначальной встречей с тренировочным стимулом, таким как бета-глюкан дрожжей, приводит к усиленному ответу на последующие инфекции.Несколько различных функций иммунных клеток ориентированы на более быструю активацию этого процесса, включая производство противомикробных молекул.
На этом рисунке показано, что происходит, когда иммунная система «тренируется» как иммуномодулятор.
В: Способствует ли Wellmune
® , ведущий бета-глюкан естественных дрожжей, тренировке врожденного иммунитета для поддержания иммунного здоровья?A: Как упоминалось ранее, в последнее десятилетие появились новые доказательства того, что дрожжевой бета-глюкан может быть тренировочным стимулом для иммунной системы.Хотя это еще не научный факт, текущие данные указывают в этом направлении. Кроме того, некоторые наблюдения из ранее опубликованных исследований, изучающих механизм действия Wellmune, согласуются с тем, как действует тренер врожденного иммунитета. Это активная область исследований среди тех, кто работает над тренировкой врожденного иммунитета, и я ожидаю, что в ближайшие пару лет мы узнаем гораздо больше. Между тем портфель клинических исследований Wellmune является убедительным доказательством его иммуномодулирующих свойств.
Q: Существуют ли разные типы дрожжевых бета-глюканов? Какая разница в том, как они поддерживают здоровье иммунной системы?
A: Исследования подтверждают иммуномодулирующие свойства дрожжевого бета-глюкана, но не все дрожжевые бета-глюканы из видов Saccharomyces cerevisiae одинаковы. Пекарские дрожжи и пивные дрожжи — это два штамма Saccharomyces cerevisiae, которые продуцируют бета-1,3 / 1,6-глюканы, но бета-глюканы, извлеченные из клеточных стенок пекарских дрожжей, имеют молекулярную структуру, отличную от той, что извлекается из пивных дрожжей.
Кроме того, процесс очистки может повлиять на структуру дрожжевого бета-глюкана. Поскольку в научных статьях хорошо задокументировано, что молекулярная структура влияет на иммуномодулирующие свойства бета-глюкана, источник бета-глюкана имеет значение. В связи с этим важно учитывать исследования, специально проводимые с интересующим бета-глюканом. Результаты исследований с использованием конкретных бета-глюканов, полученных из пекарских дрожжей, нельзя отнести к каким-либо другим типам бета-глюканов дрожжевого происхождения, таким как пивные дрожжи или бета-глюканы пекарских дрожжей, очищенные с помощью различных производственных процессов.
Q: Как выбрать эффективный дрожжевой бета-глюкановый ингредиент?
A: При выборе ингредиента для иммунного здоровья ваше внимание должно быть сосредоточено на качестве ингредиента. Качество сводится к трем критериям обоснованности преимуществ. На Wellmune было опубликовано более десятка клинических испытаний на людях, демонстрирующих его эффективность в поддержке иммунной системы человека. Было доказано, что Wellmune помогает улучшить общее иммунное здоровье и поддерживать общее состояние здоровья.Wellmune также может помочь защитить от вредного воздействия стресса и способствовать здоровому уровню энергии и ясности ума.
Ранняя анти-TNF / иммуномодуляторная терапия связана с лучшими долгосрочными клиническими результатами у азиатских пациентов с болезнью Крона с плохими прогностическими факторами
Цитата: Oh EH, Oh K, Han M, Seo H, Chang K, Lee SH , и другие. (2017) Ранняя терапия анти-TNF / иммуномодуляторами связана с лучшими долгосрочными клиническими результатами у азиатских пациентов с болезнью Крона с плохими прогностическими факторами.PLoS ONE 12 (5): e0177479. https://doi.org/10.1371/journal.pone.0177479
Редактор: Джон Грин, Университетская больница Лландо, СОЕДИНЕННОЕ КОРОЛЕВСТВО
Поступила: 9 января 2017 г .; Принята к печати: 27 апреля 2017 г .; Опубликовано: 23 мая 2017 г.
Авторские права: © 2017 Oh et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в документе.
Финансирование: Авторы не получали специального финансирования на эту работу.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Болезнь Крона (БК) — хроническое системное воспалительное заболевание, которое в основном поражает желудочно-кишечный тракт, хотя также имеет множество внекишечных проявлений [1].БК относительно распространена в западных странах, с распространенностью до 0,5% среди населения в целом [2]. Хотя это заболевание не так распространено в азиатских странах, его заболеваемость и распространенность в странах Восточной Азии заметно выросли за последние десятилетия и, как ожидается, будут расти еще больше в будущем [3, 4].
Введение агентов против фактора некроза опухолей (TNF) сильно изменило парадигму лечения пациентов с воспалительным заболеванием кишечника (IBD), включая CD. Эти агенты эффективны для индукции и поддержания клинической ремиссии активной ВЗК [5–9].Заживление слизистой оболочки, вызванное этими препаратами, связано с лучшими клиническими результатами [10, 11]. Более того, эффективность агентов против TNF может быть выше, если они используются на ранних стадиях заболевания и в комбинации с иммуномодуляторами (IM) [12–14].
Несмотря на эти преимущества препаратов против TNF, они не показаны для всех пациентов с CD из-за их побочных эффектов и стоимости [15, 16]. Следовательно, необходимо отобрать пациентов, которым эти более сильные агенты будут полезны как для контроля активности заболевания, так и для предотвращения его прогрессирования [17, 18].Несколько факторов связаны с плохим прогнозом у пациентов с БК, включая молодой возраст на момент постановки диагноза, перианальное заболевание на момент постановки диагноза, поражение верхних отделов желудочно-кишечного тракта, ранняя потребность в системных кортикостероидах и курение [19, 20]. Эти факторы можно использовать для отбора пациентов, которым требуется лечение анти-TNF, даже если эти пациенты проявляют умеренную активность заболевания при постановке диагноза. Предложена концепция «нисходящей терапии», при которой эффективные биопрепараты запускаются при первом приступе заболевания у пациентов с плохими прогностическими факторами [21].
Большинство исследований терапевтических стратегий лечения БК было проведено в западных странах. Применение этих стратегий к азиатским пациентам с CD требует дополнительных доказательств эффективности раннего использования анти-TNF агентов и IM в азиатских когортах. Таким образом, это исследование ретроспективно проанализировало влияние ранней терапии анти-TNF или IM на отдаленные результаты у корейских пациентов с CD и плохими прогностическими факторами.
Материалы и методы
Исследуемая популяция
Это ретроспективное одноцентровое исследование включало обзор медицинских карт пациентов в возрасте ≥18 лет, которым был поставлен окончательный диагноз БК и которые лечились в центре ВЗК Медицинского центра Асан, специализированной больницы в Сеуле, Корея, в период с января 1997 года по июль. 2016 г.Окончательный диагноз БК был поставлен на основании клинических характеристик пациента, лабораторных данных, эндоскопических характеристик, рентгенологических характеристик, гистологических данных, результатов визуализирующих исследований и результатов хирургического вмешательства [22]. Пациенты включались в исследование, если у них было по крайней мере два из следующих факторов риска прогрессирования; диагноз в возрасте <40 лет, необходимость в системных кортикостероидах <3 месяцев после постановки диагноза и перианальный свищ на момент постановки диагноза [19, 20, 23]. Пациенты, находившиеся под наблюдением в течение <36 месяцев после постановки диагноза, и пациенты с недостаточным количеством медицинских записей до направления к специалистам, были исключены, как и пациенты, которые никогда не получали анти-TNF / IM или у которых были доказательства строгих и / или сквозных осложнений до или во время диагностика БК (рис. 1).
Сбор данных
Были просмотрены медицинские карты всех пациентов. Зарегистрированные факторы включали исходные характеристики (возраст на момент постановки диагноза БК, пол, статус курения на момент постановки диагноза, семейный анамнез ВЗК и продолжительность последующего наблюдения после постановки диагноза), характеристики заболевания (местонахождение болезни в Монреале без учета поражения верхних отделов ЖКТ и поведения при постановке диагноза) [ 22] и предикторы плохого прогноза (необходимость в системных кортикостероидах <3 месяцев после постановки диагноза и перианальный свищ на момент постановки диагноза).Другие зарегистрированные факторы включали лекарства (время до первого применения системных кортикостероидов, агентов против TNF и IM) и исходы (хирургия кишечника, прогрессирование поведения, осложнения строгого режима, проникающие осложнения, развитие колоректального рака и смертность). Первичной переменной результата было хирургическое вмешательство на кишечнике, включая резекцию кишечника и строгую пластику после начала лечения анти-TNF или внутримышечно. Вторичные переменные результата включали прогрессирование поведения, осложнения строгого контроля, проникающие осложнения, колоректальный рак и смертность после начала лечения анти-TNF или внутримышечно.Прогрессия поведения определялась как развитие строгих или проникающих осложнений у пациентов с не строгим, непроникающим поведением (B1) [22].
Разделение больных на группы
Пациенты были разделены на три группы в зависимости от времени терапии анти-TNF / IM. Ранняя группа анти-TNF состояла из пациентов, начавших лечение анти-TNF, с или без IM в течение 2 лет после постановки диагноза CD; группа раннего IM состояла из пациентов, начавших лечение IM без анти-TNF в течение 2 лет после постановки диагноза CD; и группа поздней терапии состояла из пациентов, начавших лечение анти-TNF и / или IM> 2 года после постановки диагноза CD.
Поскольку продолжительность и комбинацию препаратов нельзя контролировать в ретроспективном исследовании, пациенты были исключены из исследования, если они продолжали принимать анти-TNF / IM в течение <1 года по таким причинам, как нежелательные явления, затраты, проблемы с возмещением, плохое соблюдение режима лечения. к лечению или хирургическому вмешательству, поскольку влияние терапии на долгосрочные результаты не может быть гарантировано краткосрочным лечением [6, 24].
Пациенты, которым начали IM в течение 2 лет после постановки диагноза CD, но были повышены до препаратов против TNF, были исключены из группы раннего IM, тем самым исключив влияние анти-TNF на течение заболевания.Комбинированное использование анти-TNF и IM было разрешено в группах ранней анти-TNF и поздней терапии (рис. 1).
Пациенты, которые были разделены на 3 группы, но которым потребовалось хирургическое вмешательство на кишечнике и / или у которых развились кишечные осложнения (строгие или проникающие осложнения) до начала терапии анти-TNF / IM, были исключены из анализа результатов (рис. 1).
Протокол исследования был одобрен институциональным наблюдательным советом медицинского центра Асан (IRB № 2016–1119).
Статистический анализ
Демографические и исходные характеристики были обобщены с использованием описательной статистики.Категориальные или номинальные переменные описывались в виде чисел и процентов, а непрерывные переменные — в виде среднего ± стандартное отклонение (SD) или медианы (межквартильный размах [IQR]), где это необходимо. Различия между тремя группами сравнивали с использованием критериев хи-квадрат, линейно-линейной ассоциации или ANOVA (дисперсионный анализ). Метод Каплана-Мейера использовался для оценки времени от начала употребления наркотиков до развития исходных событий, при этом группы сравнивались с помощью логарифмических ранговых тестов. Регрессионный анализ пропорциональных рисков Кокса также был проведен для оценки факторов риска, связанных с исходами.Переменные с P <0,1 по результатам одномерного анализа были включены в многомерный анализ. Статистическая значимость была определена как значение P <0,05. Все статистические анализы были выполнены с использованием SPSS statistics версии 23.0 для Windows (IBM, Нью-Йорк, Нью-Йорк, США).
Результаты
Из 2915 пациентов, которым был поставлен окончательный диагноз БК в течение периода исследования, 813 были исключены, пять из них были моложе 18 лет на момент включения в исследование, 678 из-за того, что за ними наблюдали в течение <36 месяцев, и 130 из-за их медицинских записей. были неполными.Из оставшихся 2102 пациентов у 1321 были два или более неблагоприятных прогностических фактора. Из последних 312 были исключены, потому что они показали строгие и / или проникающие осложнения при диагностике БК, и 79 были исключены, потому что они никогда не лечились анти-TNF или IM. Остальные 930 пациентов были разделены на три группы: группы раннего анти-TNF (n = 104), раннего IM (n = 483) и позднего лечения (n = 343). Из них 25, 197 и 38 пациентов, соответственно, были исключены, поскольку они получали лечение в течение <1 года или переходили на анти-TNF.Наконец, были включены 670 пациентов, 79 из которых были в группе раннего анти-TNF, 286 - в ранней группе IM и 305 - в группе поздней терапии (рис. 1).
Исходная характеристика групп пациентов
Исходные характеристики пациентов представлены в таблице 1. Из 670 пациентов 498 (74,3%) были мужчинами. Их средний возраст на момент постановки диагноза БК составил 21,8 ± 6,3 года (таблица 1). Группы раннего анти-TNF, раннего IM и позднего лечения значительно различались по семейному анамнезу ВЗК (15,2% против 7,0% vs.5,2%, P = 0,009), использование системных кортикостероидов (82,3% против 68,9% против 77,7%, P <0,001), лечение IM (91,1% против 100% против 95,4%, P <0,001), и лечение агентами против TNF (100% против 0% против 50,5%, P <0,001). Их средние интервалы времени до первого использования системных кортикостероидов (1,74 ± 7,63 месяца против 2,35 ± 8,64 месяца против 19,85 ± 38,52 месяца, P <0,001) и IM (5,97 ± 14,35 месяца против 5,02 ± 6,27 месяца против 71,08 ± 44.12 месяцев, P <0,001) значительно различались, как и время до первого использования анти-TNF пациентами в группах ранней анти-TNF и поздней терапии (11,56 ± 6,28 месяцев против 109,40 ± 58,34 месяцев, P < 0,001) (таблицы 1 и 2).
Таблица 2. Характеристики 507 пациентов с болезнью Крона и плохими прогностическими факторами, у которых не было хирургического вмешательства на кишечнике и / или кишечных осложнений до начала лечения анти-TNF / IM.
https: // doi.org / 10.1371 / journal.pone.0177479.t002
Сравнение переменных результатов между группами
Из пациентов в группах ранней анти-TNF, ранней IM и поздней терапии 8, 17 и 138 пациентов, соответственно, были исключены из анализа результатов из-за хирургического вмешательства на кишечнике или кишечных осложнений до начала анти-TNF / IM. терапия, которая указывает на то, что болезнь уже перешла в запущенную или осложненную форму. Из оставшихся 507 пациентов (таблица 2) 83 перенесли операции на кишечнике (12 в группе ранней анти-TNF, 26 в группе ранней IM и 45 в группе поздней терапии), в том числе 82 перенесли резекцию кишечника и один перенес только строгая пластика тонкой кишки.Поведенческая прогрессия, осложнение строгости и проникающее осложнение развивались в каждой группе следующим образом; 13, 10 и 8 в ранней группе анти-TNF, 66, 57 и 22 в ранней группе IM и 73, 56 и 47 в группе поздней терапии. После начала терапии анти-TNF / IM у двух пациентов, все из группы поздней терапии, был диагностирован колоректальный рак, и четыре пациента умерли во время последующего наблюдения, в том числе двое, которые умерли по причинам, не связанным с CD; один в группе раннего IM (опухоль головного мозга) и один в группе поздней терапии (дорожно-транспортное происшествие).Два пациента в группе поздней терапии умерли от причин, связанных с CD; один септический шок и один рак прямой кишки.
Время до результатов по группам
Анализ Каплана-Мейера показал, что от начала лечения анти-TNF / IM время до развития всех исходов значительно различались среди трех групп, включая совокупную частоту хирургических вмешательств на кишечнике ( P < 0,001), поведенческую прогрессию ( P < 0,001), осложнения строгого режима ( P = 0.008) и проникающие осложнения ( P < 0,001). Значительные различия также наблюдались при сравнении групп ранних анти-TNF / IM с группой поздней терапии с точки зрения кумулятивной частоты хирургических вмешательств на кишечнике ( P < 0,001), поведенческого прогрессирования ( P < 0,001), осложнений строгого контроля ( P = 0,002) и проникающие осложнения ( P < 0,001) от начала применения анти-TNF / IM. Хотя кумулятивная вероятность развития всех исходов была значительно выше в группе поздней терапии, чем в группах раннего анти-TNF и / или раннего IM, не было устойчивых различий между ранней анти-TNF и ранней группами IM (рис. 2a, 2b, 2c и 2d).
Рис. 2. Анализ выживаемости Каплана-Мейера для ключевых переменных исхода от начала лечения анти-TNF / IM.
(A) Кумулятивная вероятность хирургического вмешательства на кишечнике (ранние группы анти-TNF / IM по сравнению с группой поздней терапии, P <0,001), (B) Кумулятивная вероятность поведенческого прогрессирования (ранние группы анти-TNF / IM по сравнению с группой поздней терапии, P <0,001), (C) Кумулятивная вероятность развития осложнения строгости (ранние группы анти-TNF / IM vs.группа поздней терапии, P = 0,002) и (D) Кумулятивная вероятность развития проникающего осложнения (ранние группы анти-TNF / IM по сравнению с группой поздней терапии, P <0,001) от начала анти-TNF / IM.
https://doi.org/10.1371/journal.pone.0177479.g002
Отношения рисков (HR) для переменных, влияющих на результаты
Одномерный анализ показал, что мужской пол в значительной степени связан с поведенческим прогрессом (отношение рисков [HR]: 0.695, 95% доверительный интервал [ДИ]: 0,488–0,991, P = 0,044) и осложнения строгого режима (ОР: 0,641, 95% ДИ: 0,436–0,943, P = 0,024). Заболевание толстой кишки (L2) также было связано с поведенческим прогрессированием (HR: 0,241, 95% CI: 0,083–0,701, P = 0,009) и осложнениями строгого режима (HR: 0,248, 95% CI: 0,073–0,849, P = 0,026). Кроме того, поздняя терапия была в значительной степени связана с хирургическим вмешательством на кишечнике (ОР: 2,318, 95% ДИ: 1,503–3,577, P < 0.001), поведенческое прогрессирование (HR: 2,044, 95% CI: 1,486–2,813, P < 0,001), осложнения строгости (HR: 1,732, 95% CI: 1,213–2,473, P = 0,003) и проникающие осложнения (HR: 3,315, 95% ДИ: 2,094–5,249, P < 0,001), от начала анти-TNF / IM (таблицы 3–6).
Многофакторный регрессионный анализ Кокса показал, что от начала анти-TNF / IM поздняя терапия была независимо связана с операцией на кишечнике (скорректированный HR [aHR]: 2,321; 95% ДИ: 1.503–3,584; P < 0,001), поведенческое развитие (aHR: 2,001; 95% ДИ: 1,449–2,763; P < 0,001) и осложнения строгого режима (aHR: 1,736; 95% ДИ: 1,209–2,493; P = 0,003 ). Заболевание толстой кишки (L2) было отрицательно связано с поведенческим прогрессированием (aHR: 0,213; 95% ДИ: 0,073–0,623; P = 0,005) и осложнениями строгого режима (aHR: 0,212; 95% ДИ: 0,062–0,731; P = 0,014), а мужской пол также отрицательно связан с осложнениями строгого контроля (aHR: 0.655; 95% ДИ: 0,443–0,969; P = 0,034) (Таблицы 3–6).
Обсуждение
Целью этого исследования было проверить реальную эффективность ранней терапии анти-TNF или IM для улучшения отдаленных результатов у пациентов с БК и плохими прогностическими факторами, которые не были наивны как в хирургии кишечника, так и в кишечной хирургии. осложнения. Начиная с лечения анти-TNF / IM, развитие всех исходов значительно различается среди трех групп пациентов, причем раннее лечение анти-TNF / IM неизменно ассоциируется с лучшими отдаленными результатами, о чем свидетельствуют задержки в хирургии кишечника и кишечнике. осложнения.Многофакторный анализ также показал, что поздняя анти-TNF / IM терапия была независимо связана с кишечной хирургией и кишечными осложнениями от начала анти-TNF / IM. Мы также обнаружили, что поражение толстой кишки было отрицательно связано с поведенческим прогрессированием и строгими осложнениями, подтверждая связь поражения подвздошной кишки с поведенческим прогрессированием и плохими результатами [23, 25].
Анти-TNF эффективны для индукции клинической ремиссии у пациентов с БК со средней и тяжелой активностью заболевания [14] и для поддержания клинической ремиссии [6, 8].До введения анти-TNF пациенты с БК обычно получали симптоматическую терапию, которая не меняла долгосрочного курса БК, что в конечном итоге приводило к строгим и / или проникающим осложнениям [26]. Однако, поскольку было ясно показано, что анти-TNF контролируют активность CD, парадигмы лечения изменились, с акцентом на предотвращение структурных повреждений и улучшение течения заболевания за счет стимулирования заживления слизистой оболочки.
В исследовании SONIC было показано, что комбинированная терапия инфликсимабом и азатиоприном превосходит монотерапию инфликсимабом или азатиоприном в плане достижения клинической ремиссии без кортикостероидов и более частого заживления слизистой оболочки, при этом не увеличивая значительно риски инфекционных осложнений [27].В исследовании «нисходящий» и «поэтапный» индукционная терапия с комбинированной иммуносупрессией у пациентов, ранее не получавших кортикостероиды, приводила к более высокой вероятности ремиссии без системной кортикостероидной терапии или хирургического вмешательства через 26 и 52 недели, чем при традиционном лечении [28]. Более того, скорость заживления слизистой оболочки через 2 года была выше в группе ранней комбинированной иммуносупрессии, чем в группе обычного лечения [28]. Недавно исследование REACT также показало, что частота хирургических вмешательств на кишечнике, госпитализации и серьезных осложнений, связанных с заболеванием, была значительно ниже через 24 недели у пациентов, получавших раннюю комбинированную иммунотерапию, при этом не увеличивая серьезных побочных эффектов, связанных с лекарственными препаратами, по сравнению с пациентами, получавшими обычную терапию. терапия [29].Эти результаты, показывающие эффективность ранней анти-TNF терапии, особенно в сочетании с IM, в улучшении прогноза пациентов с CD, привели к концепции нисходящей или ранней интенсивной терапии для этих пациентов [18, 30].
Недавние рандомизированные контролируемые исследования из Франции и Испании показали, что ранняя внутримышечная терапия не превосходила традиционную терапию у пациентов с CD [13, 31]. Напротив, реальные когортные исследования из Венгрии и Южной Кореи показали, что ранняя внутримышечная терапия значительно снижает вероятность хирургического вмешательства на кишечнике и осложнений [32, 33].
Несмотря на свою клиническую эффективность, анти-TNF и IM связаны с неприятными побочными эффектами, включая инфекции, злокачественные новообразования, гепатотоксичность и аллергические реакции [15, 16]. Поскольку стратегии лечения должны быть индивидуализированы, в зависимости от сопутствующих заболеваний и прогноза каждого пациента [20], лекарства следует выбирать на основе баланса между их эффективностью и безопасностью [34]. Некоторым пациентам может потребоваться ранняя интенсивная терапия для предотвращения прогрессирования заболевания и неблагоприятных исходов, тогда как другим может потребоваться хорошо контролируемая активность болезни без ранней интенсивной терапии [35, 36].
Молодой возраст на момент постановки диагноза, перианальный свищ на момент постановки диагноза, ранняя потребность в системных кортикостероидах, поражение подвздошной кишки и курение были определены как факторы, предсказывающие неблагоприятные исходы БК [17, 37]. Эти факторы можно использовать для отбора пациентов, которым может быть полезна более агрессивная терапия [38]. В настоящем исследовании в качестве критериев включения использовались первые три фактора, поскольку многие исследования показали, что они связаны с плохим прогнозом, а информацию об их наличии или отсутствии получить легко [39–42].
Это исследование имело несколько сильных сторон. Насколько нам известно, это крупнейшее на сегодняшний день реальное исследование пациентов с CD из азиатских стран. Хотя несколько исследований показали эффективность ранней терапии анти-TNF / IM у западных пациентов, характеристики заболевания и медицинская среда заметно различаются между западными и азиатскими пациентами. Следовательно, результаты, полученные в западных популяциях, могут быть неприменимы к азиатским пациентам. Более того, большинство предыдущих исследований были рандомизированными контролируемыми испытаниями, которые имеют ограничения по продолжительности исследования и могут не отражать реальные жизненные ситуации [24, 27–29].Настоящее исследование включало большое количество пациентов и длительное наблюдение в реальных клинических ситуациях, что позволило нам сравнить отдаленные результаты среди групп пациентов, которые различались по времени начала приема анти-TNF / IM.
Второй сильной стороной этого исследования было включение пациентов в одноцентровое исследование, стандартизация стратегий лечения среди субъектов исследования. Клинические данные были также получены из хорошо известного реестра пациентов с ВЗК нашего центра [33].
В-третьих, в исследование были включены только пациенты с плохими прогностическими факторами, что позволило проанализировать эффективность ранней анти-TNF / IM терапии только у этих пациентов.Поскольку ранняя интенсивная терапия должна назначаться только пациентам, у которых преимущества перевешивают недостатки, эти результаты могут предоставить информацию об эффективности ранней интенсивной терапии у пациентов, которые действительно в ней нуждаются [17, 37, 38].
В-четвертых, в исследование входили только те, у кого не строгий и непроникающий характер (B1), а также те, кто не подвергался хирургической операции на кишечнике. В большинство исследований, оценивающих эффективность анти-TNF, включали пациентов со строгими (B2) или проникающими (B3) осложнениями, а также без этих осложнений [6, 8, 18].Ожидается, что пациенты, уже страдающие кишечными осложнениями или перенесшие операцию на кишечнике, будут хуже реагировать на сильнодействующие препараты, поскольку структурные повреждения уже развились. Ограничив исследуемых пациентов пациентами с воспалительным поведением, не подвергавшимися ранее хирургическим вмешательствам на кишечнике, мы смогли подтвердить превосходство ранней терапии анти-TNF / IM в группах пациентов без явных осложнений. Однако, несмотря на отсутствие явных осложнений, скрытое повреждение кишечника и / или некоторые необратимые патофизиологические изменения могли уже прогрессировать в группе поздней терапии, тем самым снижая эффективность терапии анти-TNF / IM у этих пациентов.Таким образом, это исследование показало, что ранняя анти-TNF / IM-терапия должна быть начата у пациентов с плохими прогностическими факторами, несмотря на отсутствие явных осложнений.
Основным потенциальным ограничением этого исследования была возможная предвзятая классификация пациентов на три группы, так как пациенты с более высокой активностью заболевания во время раннего течения заболевания могли быть отнесены к ранней группе анти-TNF / IM, а не к поздней. терапевтическая группа. Обычная повышающая терапия применяется для лечения пациентов с ВЗК в Корее, а анти-ФНО показаны и возмещаются государством для использования у пациентов со средней и тяжелой активностью заболевания после неэффективности обычных лекарств [20, 43].По сравнению с пациентами из группы поздней терапии, пациенты из группы ранних анти-TNF / IM, возможно, потребовали более интенсивного лечения после неэффективности обычных лекарств во время раннего течения болезни. То есть течение болезни у пациентов в группе поздней терапии могло быть относительно спокойным, с меньшей потребностью в более интенсивной терапии. Поскольку их ранняя активность заболевания была выше, можно было ожидать, что пациенты в ранних группах анти-TNF / IM будут иметь худшие результаты. Это объяснение подтверждается различиями в средних интервалах времени до первого применения системных кортикостероидов среди групп, которые представлены в таблице 1.Тем не менее, наши результаты показали, что все неблагоприятные исходы были менее распространены в группах ранних анти-TNF / IM, чем в группе поздней терапии. Этот результат указывает на то, что ожидаемые более неблагоприятные долгосрочные результаты в ранних группах INF / IM были преодолены ранней терапией анти-TNF / IM, несмотря на их более высокую раннюю активность заболевания. Чтобы преодолеть наше ограничение, может быть предложена идея корректировки активности заболевания среди групп с использованием таких индексов, как индекс активности болезни Крона (CDAI) или уровень С-реактивного белка в сыворотке.Однако это было невозможно, поскольку информация на момент постановки диагноза или начала лечения не могла быть получена у всех пациентов, поскольку большинство субъектов исследования были направлены из других больниц. Следовательно, если тяжесть заболевания и исходные характеристики должны контролироваться среди групп для более точных сравнений, проспективные рандомизированные контролируемые испытания были бы идеальными, даже несмотря на то, что они имеют ограничения в оценке долгосрочных результатов.
Второе ограничение заключалось в том, что мы не показали разницы между ранним использованием анти-TNF и IM.Поскольку анти-TNFs более эффективны, чем IM в контроле активности заболевания у пациентов с ВЗК [12, 14], мы ожидали, что раннее использование анти-TNFs даст лучшие результаты, чем раннее использование только IM. Однако пациенты с более агрессивным ранним заболеванием могли быть отнесены к ранней группе анти-TNF, а не к ранней группе IM по причинам, указанным в предыдущем абзаце. Кроме того, поскольку «нисходящая анти-TNF терапия» не возмещается в Корее, ни один пациент в этом исследовании не получал «нисходящую анти-TNF терапию».Пациентам в ранней группе анти-TNF давали анти-TNF после неэффективности или непереносимости IM, а не лечили первоначально анти-TNF. Хотя пациенты в ранней группе анти-TNF имели более высокую раннюю активность заболевания, не контролируемую IM, результаты не всегда были хуже в ранней группе анти-TNF, чем в ранней группе IM. Эти результаты предполагают, что применение «нисходящей анти-TNF терапии» к ранней группе анти-TNF, а не лечение анти-TNF после неэффективности или непереносимости IM, дало бы лучшие результаты, чем только ранние IM.Следовательно, необходимы крупномасштабные долгосрочные рандомизированные контролируемые исследования, сравнивающие стратегии анти-TNF «сверху вниз», «ускоренное повышение» и классическое «повышение» у пациентов с БК с плохими прогностическими факторами [28, 29, 44].
Третьим ограничением был ретроспективный дизайн этого исследования, несмотря на проспективное включение пациентов в наш регистр пациентов с ВЗК. Однако фактические данные поддерживались специалистами по IBD, которые обновляли клиническую информацию, когда происходили определенные события, тем самым повышая надежность наших данных.Поскольку это исследование носило ретроспективный характер, некоторая информация зависела от отзыва пациентов, особенно в отношении событий до направления в нашу больницу.
Четвертым ограничением могло быть предвзятое отношение к специалистам, поскольку все включенные пациенты были зарегистрированы из одной специализированной специализированной больницы. Однако, поскольку большинство пациентов с БК в Южной Корее постоянно и регулярно наблюдаются в специализированных центрах, а не в первичных или вторичных медицинских учреждениях, пациенты в этом исследовании могут представлять общую популяцию пациентов с БК в Южной Корее.
Наконец, распределение пациентов по группам различается по годам постановки диагноза БК. Из 91 пациента с диагнозом CD в период с 1985 по 1999 год 86 (94,5%) были включены в группу поздней терапии и ни одного — в группу ранней терапии анти-TNF. Напротив, из 391 пациента, диагностированного с 2000 по 2009 год, 36 (9,0%) были включены в группу раннего анти-TNF и 149 (38,1%) — в группу раннего IM; и из 188 пациентов, которым был поставлен диагноз после 2010 г., 176 (93,6%) были отнесены к ранним группам анти-TNF / IM. Различия в соотношении пациентов между тремя группами в зависимости от года постановки диагноза могут отражать недоступность анти-TNF до 2000 года.Кроме того, исследования, показывающие эффективность анти-TNF / IM, изменили парадигмы лечения CD, что, вероятно, повлияло на назначение пациентов.
В заключение, начиная с лечения анти-TNF или IM, пациенты с CD с плохими прогностическими факторами, которые получают лечение на ранней стадии, будут иметь больше времени, чтобы испытать свою первую операцию на кишечнике и первые кишечные осложнения, по сравнению с теми, кто получает позднее лечение анти-TNF или IM.

 Поскольку жизнеспособность вируса вне человеческого организма зависит от многих факторов, в том числе температуры и влажности воздуха, ведомство BfR называет заражение SARS-CoV-2 через почтовые отправления маловероятным. Правда, с оговоркой: точных данных на этот счет пока нет.
Поскольку жизнеспособность вируса вне человеческого организма зависит от многих факторов, в том числе температуры и влажности воздуха, ведомство BfR называет заражение SARS-CoV-2 через почтовые отправления маловероятным. Правда, с оговоркой: точных данных на этот счет пока нет.

 J. Med. Res. 2005; 10 (5): 209–217.
J. Med. Res. 2005; 10 (5): 209–217. 2002. Т. 3, № 3, с. 325–331.
2002. Т. 3, № 3, с. 325–331.