Канцероматоз большого сальника: Перитонеальный канцероматоз-симпотмы , признаки.
Перитонеальный канцероматоз-симпотмы , признаки.
Главная
Пациентам
Онкологические заболевания и программы лечения рака
Программа против рака Желудочно-кишечного тракта
Перитонеальный канцероматоз
Перитонеальный канцероматозВам поставили диагноз: перитонеальный канцероматоз (опухоль брюшины)
Наверняка вы задаётесь вопросом: что же теперь делать? Подобный диагноз всегда делит жизнь на «до» и «после». Все эмоциональные ресурсы пациента и его родных брошены на переживания и страх. Но именно в этот момент необходимо изменить вектор «за что» на вектор «что можно сделать». Очень часто пациенты чувствуют себя безгранично одинокими вначале пути. Но вы должны понимать — вы не одни. Мы поможем вам справиться с болезнью и будем идти с Вами рука об руку через все этапы вашего лечения.
Предлагаем Вашему вниманию краткий, но очень подробный обзор перитонеального канцероматоза.
МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
ВведениеПеритонеальный канцероматоз (опухоль брюшины) — одно из самых грозных вариантов прогрессирования целого ряда онкологических заболеваний. Канцероматоз является формой метастазирования, при которой опухолевые клетки распространяются по внутренней выстилке анатомической полости (брюшной или плевральной) и формируют на ней мелкие узелки, так называемые диссеминаты. Ее возникновение в большинстве случаев подразумевает IV стадию заболевания, и сопряжено с неблагоприятным прогнозом для пациента. Лечение пациентов с перитонеальным канцероматозом является одной из самых сложных задач в онкологии. Наиболее часто он развивается при злокачественных новообразованиях желудочно-кишечного тракта, дыхательной системы и женских репродуктивных органов. При каких опухолях может развиваться перитонеальный канцероматоз? При раке желудка, раке легкого, раке толстой и тонкой кишки, раке яичников, муцинозных опухолях червеобразного отростка. мезотелиоме брюшины или плевры, раке поджелудочной железы, саркоме брюшной полости (саркоматоз).
мезотелиоме брюшины или плевры, раке поджелудочной железы, саркоме брюшной полости (саркоматоз).
Согласно данным статистики, перитонеальный канцероматоз встречается у 20-35% пациентов с онкопатологией: в 40% случаев данное осложнение формируется при опухолях желудочно-кишечного тракта, в 30% — при раке яичников (причем на момент верификации диагноза рака яичников у подавляющего большинства пациенток уже имеет место поражение брюшины). Перитонеальный канцероматоз (опухоль брюшины) является неблагоприятным прогностическим фактором; данная форма прогрессирующего опухолевого поражения практически не поддается хирургическому лечению, а применение только системной химиотерапии улучшает состояние лишь на некоторое время.
Причины возникновения перитонеального канцероматозаПеритонеальный канцероматоз является вторичным опухолевым поражением, результатом прогрессирования рака различной локализации. Наиболее часто поражение брюшины осложняется раком желудка, тонкого кишечника, поджелудочной железы, злокачественными опухолями яичников, матки, маточных труб, печеночноклеточным раком, реже — первичными опухолями брюшины (перитонеальная мезотелиома).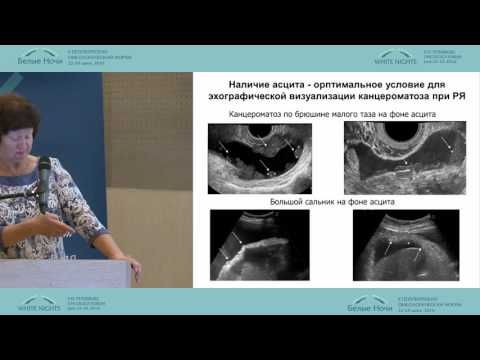 В ряде случаев первичный очаг остается неустановленным.
В ряде случаев первичный очаг остается неустановленным.
Развитие перитонеального канцероматоза является поэтапным процессом. Первый этап – распространение опухолевых клеток из первичного очага поражения. Это связано с нарушением межклеточного взаимодействия и приобретением клетками опухоли подвижности. При этом эпителиальные клетки меняют фенотип на мезенхимальный, происходит деградация межклеточного матрикса. Распространение опухолевых клеток может происходить в ходе оперативного вмешательства. Их механическое отделение возможно при повреждении лимфатических или кровеносных сосудов. Попавшие в брюшную полость клетки опухоли мигрируют под действием силы тяжести, сокращений внутренних органов, имплантируются в местах повышенной резорбции: большом сальнике, в области слепой кишки, дугласовых карманах.
На втором этапе опухолевые клетки взаимодействуют с мезотелием брюшины. Механизмы адгезии определяются природой клеток, особенностями морфологии брюшины, а также наличием участков ее повреждения. Далее клетки закрепляются в мезотелии, происходит их горизонтальное распространение по поверхности перитонеума, а затем инвазивный рост – прорастание в базальную мембрану, соединительную ткань. Следующим этапом является стимуляция неоангиогенеза – обязательного фактора развития опухоли. Морфопатогенетические механизмы формирования канцероматоза брюшины еще недостаточно изучены, в связи с чем отсутствуют радикальные методы лечения.
Далее клетки закрепляются в мезотелии, происходит их горизонтальное распространение по поверхности перитонеума, а затем инвазивный рост – прорастание в базальную мембрану, соединительную ткань. Следующим этапом является стимуляция неоангиогенеза – обязательного фактора развития опухоли. Морфопатогенетические механизмы формирования канцероматоза брюшины еще недостаточно изучены, в связи с чем отсутствуют радикальные методы лечения.
Частота развития канцероматоза брюшины зависит не только от первичной локализации опухоли, но и от ее размеров, глубины инвазии, гистотипа, степени дифференцировки (недифференцированный рак желудка осложняется поражением брюшины в 60% случаев, ограниченный – в 15%).
Классификация перитонельного канцероматозаЕдиная классификация данного заболевания отсутствует, поскольку характеристики первичных опухолей, приводящих к поражению брюшины, весьма разнообразны. Наиболее распространена классификация перитонеального канцероматоза брюшины в зависимости от числа, локализации метастазов, которая предусматривает три степени:
Р1 – локальное поражение брюшины
Р2 – несколько областей канцероматоза, разделенных здоровыми участками брюшины
Р3 – многочисленные очаги поражения
Также используется метод определения индекса канцероматоза брюшины: суммируются баллы измерения максимальных очагов поражения (0-3 балла) в каждой из 13 наиболее вероятных областей поражения брюшины.
Перитонеальный канцероматоз брюшины является вторичным поражением, поэтому его клиническая картина во многом определяется проявлениями первичной опухоли. Характерным признаком является обильный выпот в брюшную полость – формирование асцита. Зачастую асцитический синдром, развивающийся вследствие обструкции лимфатического дренажа, является единственным признаком заболевания, и пациенты могут поступать в отделение гастроэнтерологии или терапии для диагностики причин асцита. Состояние больных тяжелое, характерна значительная потеря веса. Неспецифическими признаками являются тошнота, рвота, выраженная слабость, утомляемость. При наличии крупных метастазов возможно их прощупывание через брюшную стенку.
Диагностика перитонеального канцероматозаПеритонельный канцероматоз имеет неспецифическую клиническую картину, однако консультация гастроэнтеролога или онколога позволяет предположить данное заболевание на основании симптомов и физикальных данных. Лабораторные анализы не выявляют специфических изменений: определяется лейкоцитоз, ускорение СОЭ. Диагностическая программа обязательно должна включать УЗИ органов брюшной полости и малого таза, позволяющее обнаружить распространенное поражение, а также МСКТ брюшной полости с контрастированием. Обязательно проводится цитологическое исследование асцитической жидкости, полученной при лапароцентезе, которое дает возможность впервые установить или подтвердить диагноз, а также определить гистогенез клеток опухоли.
Лабораторные анализы не выявляют специфических изменений: определяется лейкоцитоз, ускорение СОЭ. Диагностическая программа обязательно должна включать УЗИ органов брюшной полости и малого таза, позволяющее обнаружить распространенное поражение, а также МСКТ брюшной полости с контрастированием. Обязательно проводится цитологическое исследование асцитической жидкости, полученной при лапароцентезе, которое дает возможность впервые установить или подтвердить диагноз, а также определить гистогенез клеток опухоли.
Информативным методом диагностики перитонеального канцероматоза является лапароскопия с осмотром перитонеума, дугласова пространства, диафрагмы, сопровождающаяся биопсией. Высокой специфичностью обладает обратнотранскриптазная полимеразная цепная реакция (ОТ-ПЦР), которая позволяет определить источник диссеминации даже при малом количестве опухолевых клеток.
Сложности диагностики возникают при наличии перитонеального канцероматоза без выявленного первичного очага. Данная форма заболевания, встречающаяся в 3-5 % случаев, проявляется клинически только при уже сформировавшемся поражении брюшины. При этом первичный очаг может иметь настолько малые размеры, что его прижизненное обнаружение невозможно.
При этом первичный очаг может иметь настолько малые размеры, что его прижизненное обнаружение невозможно.
В качестве дополнительных методов может использоваться определение онкомаркеров (кислой фосфатазы, раково-эмбрионального антигена, альфа-фетопротеина, бета-субъединицы ХГЧ). Такая диагностика не обладает высокой специфичностью, но применяется для оценки прогноза, раннего выявления диссеминации, рецидивов, а также для контроля эффективности лечения.
Лечение перитонеального канцероматозаХирургическое лечение канцероматоза включает удаление первичной опухоли с регионарными метастазами и отсевами по брюшине. Циторедуктивная операция выполняется в объеме перитонэктомии, может сочетаться с удалением матки и придатков, сигмовидной кишки, желчного пузыря. После проведения операции оценивается индекс полноты циторедукции: СС-0: после проведения хирургического лечения очаги поражения визуально не определяются; СС-1: имеются неудаленные очаги диаметром до 2,5 мм; СС-2: очаги диаметром 2,5 мм – 2,5 см; СС-3: очаги поражения более 2,5 см в диаметре. Однако даже при определении индекса СС-0 нельзя полностью исключить возможность диссеминации, поэтому обязательно проводится химиотерапия.
Однако даже при определении индекса СС-0 нельзя полностью исключить возможность диссеминации, поэтому обязательно проводится химиотерапия.
Эффективные подходы к лечению, как правило, подразумевают проведение комбинированной терапии, например, сочетания хирургического вмешательства и системной химиотерапии. Одним из наиболее эффективных методов является локальная химиотерапия. Идея локальной химиотерапии состоит в том, чтобы обеспечить доставку лекарственного препарата непосредственно к опухолевым клеткам, находящимся на внутренней выстилке анатомической полости. Из-за крайне низкой проницаемости этой области для лекарственных препаратов, например, при внутривенном их введении или приеме в виде таблеток, доставка препаратов в виде аэрозоля под давлением углекислого газа даёт накопление препарата в опухоли в значительно больших концентрациях.
Методы лечения перитонеального канцероматозаДлительное время канцероматоз брюшины и плевры считали терминальной стадией болезни, не подлежащей специальному лечению. Разработка методик непосредственного воздействия на брюшину и плевру позволила улучшить прогноз при этом состоянии. МНИОИ им. П.А. Герцена обладает уникальными возможностями лечения больных с канцероматозом, имея в арсенале весь комплекс новейших методов терапии.
Разработка методик непосредственного воздействия на брюшину и плевру позволила улучшить прогноз при этом состоянии. МНИОИ им. П.А. Герцена обладает уникальными возможностями лечения больных с канцероматозом, имея в арсенале весь комплекс новейших методов терапии.
Это методика, при которой во время операции в брюшную или плевральную полость вводится подогретый до 42,5С, высококонцентрированный раствор химиотерапевтических препаратов, что обеспечивает их воздействие непосредственно на раковые клетки в брюшной (плевральной) полости при минимальном воздействии на другие органы. Сеанс проводится в течение часа, что позволяет разрушить опухолевые клетки, оставшиеся после так называемой циторедуктивной операции.
Внутрибрюшная (внутриплевральная) аэрозольная химиотерапия под давлением (PIРAC)Это новейший инновационный метод лечения перитонеального канцероматоза, который обеспечивает доставку лекарственного препарата непосредственно к опухолевым клеткам, находящимся на внутренней выстилке анатомической полости. Метод совсем недавно появился в России. Процедуру проводят посредством лапароскопии (торакоскопии). В брюшной или плевральной полости под давлением углекислого газа распыляют аэрозоль химиопрепаратов и оставляют в течение 30 мин. При таком способе введения химиопрепаратов их воздействие на опухоль многократно возрастает при полном отсутствии системной токсичности. Ноу-хау МНИОИ имени П.А. Герцена в этом методе лечения стала разработка собственной специальной форсунки, которая формирует поток мелкодисперсного аэрозоля с размером капель от 1 до 40 мкм. Изделие выполнено из специализированных материалов и не уступает по качеству импортному аналогу, а по ряду технических характеристик его превосходит.
Метод совсем недавно появился в России. Процедуру проводят посредством лапароскопии (торакоскопии). В брюшной или плевральной полости под давлением углекислого газа распыляют аэрозоль химиопрепаратов и оставляют в течение 30 мин. При таком способе введения химиопрепаратов их воздействие на опухоль многократно возрастает при полном отсутствии системной токсичности. Ноу-хау МНИОИ имени П.А. Герцена в этом методе лечения стала разработка собственной специальной форсунки, которая формирует поток мелкодисперсного аэрозоля с размером капель от 1 до 40 мкм. Изделие выполнено из специализированных материалов и не уступает по качеству импортному аналогу, а по ряду технических характеристик его превосходит.
Программа лечения перитонеального канцероматоза определяется междисциплинарным консилиумом врачей, в который входят специалисты экспертного класса ФГБУ «НМИЦ радиологии» Минздрава России. Метод применения аэрозольной химиотерапии под давлением (PIPAC) был впервые испытан в Германии, а Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал «НМИЦ радиологии» Минздрава России еще в 2013 году стал вторым в мире центром, приступившим к изучению и внедрению данной методики. Проведённая за истекшие 6 лет масштабная научно-практическая работа позволила институту занять лидирующие позиции в этой области и первым в мире доказать целесообразность применения аэрозольной химиотерапии в качестве одного из основных методов лечения у пациентов, страдающих перитонеальным канцероматозом.
Метод применения аэрозольной химиотерапии под давлением (PIPAC) был впервые испытан в Германии, а Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал «НМИЦ радиологии» Минздрава России еще в 2013 году стал вторым в мире центром, приступившим к изучению и внедрению данной методики. Проведённая за истекшие 6 лет масштабная научно-практическая работа позволила институту занять лидирующие позиции в этой области и первым в мире доказать целесообразность применения аэрозольной химиотерапии в качестве одного из основных методов лечения у пациентов, страдающих перитонеальным канцероматозом.
COVID
19
COVID
19
+7(800)444-31-02
Канцероматоз
Канцероматоз представляет собой процесс, в ходе которого происходит метастазирование клеток с измененным состоянием в серозных оболочках, что в дальнейшем приводит к поражению различных органов в организме человека. Такой процесс часто наблюдается на последних стадиях онкологии. Он проявляется в виде поражения таких органов, как брюшная полость и плевра.
Такой процесс часто наблюдается на последних стадиях онкологии. Он проявляется в виде поражения таких органов, как брюшная полость и плевра.
Данный вид патологии специалисты не относят к самостоятельному новообразованию, а считают продолжением предыдущих раковых образований.
Клетки, подвергшиеся изменениям, передвигаются внутри организма по крови (гематогенно) или используя лимфы. Такое перемещение становится возможным из-за того, что мутировавшие клетки не обладают межклеточной памятью. Поэтому они не связаны с другими похожими по строению клетками. Передвигаясь по плевре или брюшной полости, измененные клетки проникают в серозную оболочку, что приводит к губительным последствиям для других органов, независимо от того, где они расположены.
Современные исследования демонстрируют следующую статистику: в 35% случаев раковые опухоли приводят к развитию канцероматоза брюшины. При этом специалисты пока не могут определить причины столь широкого распространения патологии. В большинстве случаев доктора, наблюдая канцероматоз, диагностируют, что у пациента тяжелая форма рака, вылечить которую очень сложно.
Метастазы на плевре в основном наблюдаются в процессе развития онкологии молочных желез или легких. Периодически встречаются случаи поражения канцероматозом полости груди.
Канцероматоз брюшной полости также наблюдается очень часто. Ему сопутствует развитие новообразований в печени, поджелудочной железе, матке, яичниках, кишечнике, желудке.
Поражение такой формой болезни головного мозга происходит в 10% случаев онкологии. При таком развитии заболевания опухоль распространяется по крови, заполняя верхнюю часть оболочки мозга. Измененные клетки, проникая внутрь головного или спинного мозга, вызывают нарушение в процессе циркуляции мозговых жидкостей, что в конечном итоге приводит к гидроцефалии.
Причины появления канцероматоза
Канцероматоз представляет вторичный этап развития онкологии. Он возникает из-за ускоренного развития раковых клеток. Обладая большой активностью, эти клетки начинают мигрировать внутри организма, распространяя тем самым патологию.
Чаще всего канцероматоз развивается при таких онкологиях, как:
- рак желудка;
- желчевыводящих органов;
- поджелудочной железы;
- яичников;
- кишечника тонкого.

Также большой риск развития канцероматоза есть у людей, страдающих от рака печени. Во всех случаях основной причиной возникновения осложнений является первичное заболевание. Хотя это трудно выявить при обследованиях.
Злокачественные процессы, развивающиеся внутри кишечника или желудка, приводят к тому, что раковые клетки врастают в органы, что приводит к развитию недифференцированных форм рака.
У представительниц женского пола канцероматоз чаще всего развивается на фоне онкологии яичников или матки.
Оказавшись внутри брюшной полости, измененные клетки проникают внутрь брюшных складок. Они оказываются в пространстве между кольцами кишечника.
Прикрепившись к здоровому органу, злокачественные клетки моментально начинают процесс деления и развития, закрывая собой орган. Чем больше развивается опухоль, тем хуже работают органы. Наглядным последствием патологии становится асцит, при котором в брюшине начинает скапливаться жидкость.
Канцероматоз плевры в основном образуется на фоне таких онкологий, как:
- рак плевры;
- желудка;
- молочной железы;
- легких.

На первой стадии опухоль прирастает к легким, а уже позже переходит полость плевры. Поэтому провокатором канзероматоза плевры чаще всего становиться рак легких на поздней стадии. Количество возникших в процессе заболевания метастаз зависит от того, насколько эффективное лечение получает больной, а также от скорости перемещения измененных клеток в организме конкретного человека.
Развитие патологии
Онкологический канцероматоз протекает в несколько этапов.
- Первый этап – возникновение клеток и их постепенное распространение по организму. Причем следует отметить, что спровоцировать процесс развития патологии могут не только измененные клетки, но и определенные вмешательства в организм, например, операция или травма внутренних органов. Оказавшись внутри брюшины, клетки начинают передвигаться в ходе сокращения органов. Именно поэтому болезнь часто проявляется в нижней части брюшной полости.
- Второй этап. В этот момент измененные клетки начинают прирастать к внутренним органам, закрепляясь в серозных тканях.
 Особенно часто клетки, подвергшиеся мутации, скапливаются в прямой кишке, в сальнике, в слепой кишке. При этом они начинают активно размножаться. Процесс ускоряется из-за соприкосновений брюшины и пораженных органов с кровеносными сосудами.
Особенно часто клетки, подвергшиеся мутации, скапливаются в прямой кишке, в сальнике, в слепой кишке. При этом они начинают активно размножаться. Процесс ускоряется из-за соприкосновений брюшины и пораженных органов с кровеносными сосудами.
Симптомы болезни
Главным симптомом развития данной болезни является наличие опухлости пораженного органа. Были случаи, когда появившиеся симптомы сразу указывали врачам на развитие канцероматоза. В такой ситуации докторам действовать намного проще, – они могут сразу определить проблему и назначить терапию.
Среди основных симптомов заболевания следует выделить:
- периодические или постоянные спазмы в районе живота;
- быстро увеличивается объем живота из-за скопления жидкости;
- появляется рвота, часто тошнит;
- колики в области живота;
- высокая температура;
- одышка и боли в районе грудной клетки;
- аритмия.
При этом нужно понимать, что симптомы различаются по интенсивности в зависимости от стадии болезни.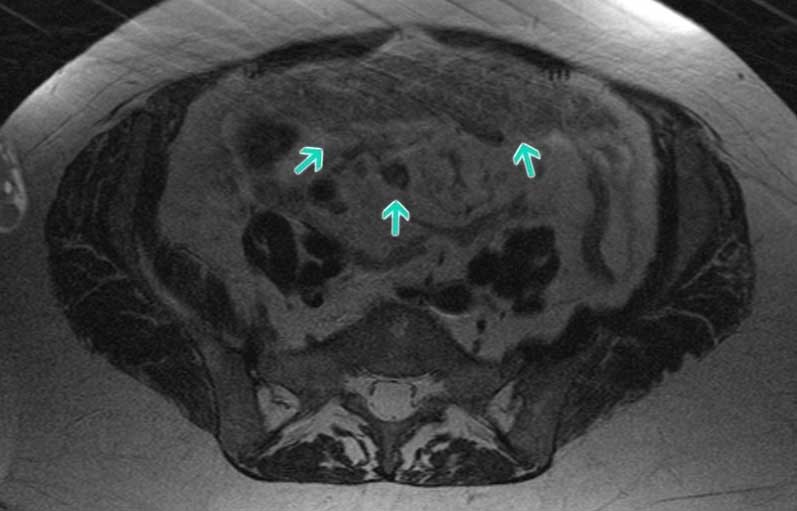
Когда нужно идти к врачу
Даже далекие от медицины люди слышали об онкологических заболеваниях. Специалисты, работающие в области медицины, которая борется с последствиями рака, знают – чем раньше будет выявлена патология, тем эффективней будет ее лечение. Поэтому люди должны знать, что в случае возникновения вышеописанных симптомов им стоит обратиться к врачам и пройти обследование.
Пройти диагностику, определить стадию канцероматоза, а также начать лечение канцероматоза можно в онкоцентре София, которая расположена в центре Москвы. Опытные специалисты, работающие в нашем центре, смогут понять, какая степень канцероматоза у пациента и предложат ему курс эффективной терапии.
Стадии заболевания
Внутри брюшной полости человека находится множество важнейших органов. При этом они не имеют четких границ. Именно поэтому диагностировать и определить стадию канцераматоза сложно даже опытному специалисту. Важную роль в такой ситуации играет первичное заболевание, из-за которого в дальнейшем развивается канцероматоз.
Чаще всего определить обширность поражения полости доктор может, оценив состояние серозной оболочки.
Сейчас специалисты отмечают три стадии определение диагноза кацероматоза:
- контур опухоли имеет один пораженный участок серозной ткани;
- поражены несколько участков, между которым находится здоровая оболочка;
- в полости наблюдаются сильные изменения, поражен большой участок ткани. В основном это происходит на 4 стадии онкологии.
Диагностика болезни
Диагностировать канцероматоз крайне сложно. В этом случае многое зависит от врача, который до этого наблюдал развитие опухоли у пациента. Информация приходит постепенно в ходе нескольких обследований. Причем обследования должны проводить разные специалисты, что позволит понять полную картину патологии.
Диагностировать заболевание и определить стадию канцероматоза можно в онкоцентре София, которая расположена в центральном округе Москвы. В этом центре применяется самое современное оборудование, с помощью которого специалисты могут определить степень канцероматоза у пациента.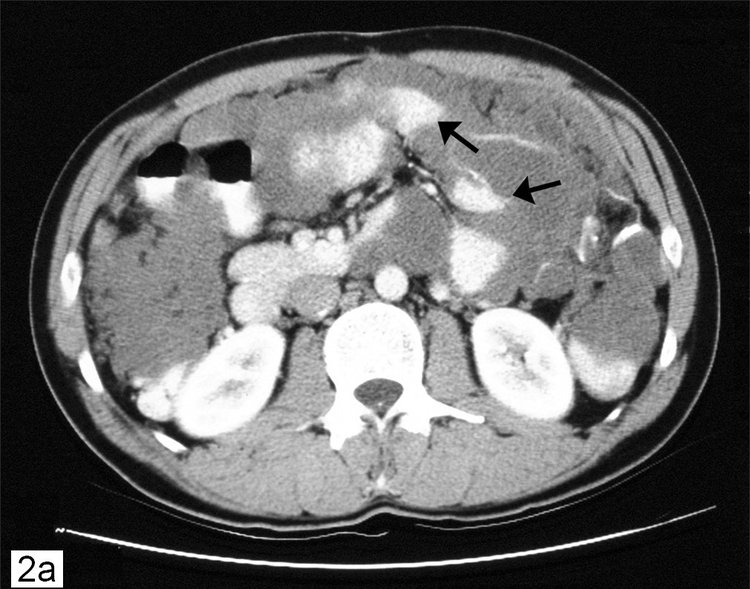
Личный осмотр
Опытный онколог может определить заболевание даже в процессе первичного осмотра пациента. Применяя специальные приемы, осуществляя нажимы на брюшную полость, врач старается понять, где скопилась жидкость и какие размеры имеет опухоль.
Обследование с помощью оборудования
Современные медицинские аппараты позволяют с высокой эффективностью ставить диагноз по онкологическим заболеваниям.
К таким аппаратам относится:
- рентген;
- УЗИ внутренних органов;
- КТ;
- МСКТ, МРТ;
- биопсия;
- лапароскопия.
Лабораторные исследования
С помощью проведенных в лаборатории анализов врачи могут с высокой вероятностью определить состояние организма человека, а также понять, как работают его внутренние органы, есть ли сбой.
Лечение болезни
Сегодня используется множество методик лечения канцероматоза. Благодаря новым технологиям и современному оборудованию доктора могут помочь даже пациентам с запущенной стадией рака.
Среди основных методик лечения следует выделить: химиотерапию, оперативное вмешательство. Также лечение включает послеоперационную реабилитацию
Сейчас в центре Москвы все желающие могут пройти обследование в онкоцентре София. При выявлении и заболевания пациент сможет пройти курс лечения канцероматоза в клинике.
Прогноз
Прогноз эффективного лечения канцероматоза определяется в каждом конкретном случае. Все зависит от общего состояния пациента и стадии канцероматоза. Получить точный прогноз сейчас можно в онкологическом центре София, которая расположена в центральном округе.
Как попасть к специалистам онкоцентра София
Записаться к специалистам онкоцентра София можно, воспользовавшись формой обратной связи на сайте. Сделать это можно и по телефону +7 (495) 995-00-34. Мы располагаемся по адресу: Москва, 2-й Тверской-Ямской переулок, дом 10, метро «Маяковская».
Полезно знать
ГлавнаяПолезно знатьПолезно знать
Бактериологические исследования мочи
Просмотров: 72
Проникшие в мочу микроорганизмы быстро размножаются, и возникает воспалительный процесс. При подозрении на инфекцию мочевыводящих путей (ИМП), для диагностики и мониторинга её течения, а также оценки эффективности лечения пациенту предлагают провести бактериологическое исследование мочи.
При подозрении на инфекцию мочевыводящих путей (ИМП), для диагностики и мониторинга её течения, а также оценки эффективности лечения пациенту предлагают провести бактериологическое исследование мочи.
Подробнее
О чем говорит общий анализ мочи?
Просмотров: 241
Исследование мочи используют не только для выявления патологии в мочевой системе, но и для оценки состояния организма в целом, применяя иммунологические, бактериологические, молекулярно-биологические, иммунохроматографические и многие другие методы исследований. Среди многообразия методов, пожалуй, самым востребованным остается общий анализ мочи.
Подробнее
Осложнения противоопухолевого лекарственного лечения: кожная токсичность
Просмотров: 2526
Кожная токсичность – результат токсического воздействия лекарственных средств на быстро делящиеся клетки, к которым, помимо опухолевых клеток, относятся также клетки кожи и ее придатков..jpg)
Подробнее
Рак кожи: профилактика, диагностика, лечение
Просмотров: 1695
Рак кожи редко возникает на «пустом месте». Предраковые состояния (предшественники рака) из-за совокупности неблагоприятных факторов могут патологически изменяться, озлокачествляться: актинический кератоз, кожный рог, трофические язвы, кератоакантома.
Подробнее
О чем говорит общий (клинический) анализ крови?
Просмотров: 1194
Анализы крови, пожалуй, самые часто сдаваемые анализы. Это неотъемлемый элемент любого обследования как на этапе постановки диагноза, так и во время лечения. Что значат показатели общего анализа крови?
Подробнее
О чем говорит коагулограмма?
Просмотров: 1126
Этот анализ с трудно произносимым названием обязателен для госпитализации в онкологический стационар. Что показывает коауголограмма, о чем говорят многочисленные аббревиатуры?
Что показывает коауголограмма, о чем говорят многочисленные аббревиатуры?
Подробнее
Особенности вакцинации онкологических пациентов: рекомендации для детей и взрослых
Просмотров: 4476
Можно ли делать прививку при онкологии? Наталья Александровна Ефремова, врач-онколог, научный сотрудник научного отдела онкоиммунологии НМИЦ онкологии им. Н.Н. Петрова, ответила на ряд важных вопросов о вакцинации онкологических пациентов.
Подробнее
Что такое трахеостома и как за ней ухаживать в домашних условиях?
Просмотров: 12634
Ольга Сергеевна Корнеева, медицинская сестра отделения опухоли головы и шеи НМИЦ онкологии им. Н.Н. Петрова, рассказала о важных правилах самостоятельного ухода за трахеостомой и необходимых для этого инструментах и приспособлениях.
Рак в молодом возрасте: выросла ли заболеваемость?
Просмотров: 2231
Давайте разберемся, почему это не так, вместе с Анной Николаевной Малковой, руководителем информационно-сервисной службы и отдела телемедицинских технологий НМИЦ онкологии им. Н.Н. Петрова
Подробнее
Излечим ли рак?
Просмотров: 28622
Можно вылечить рак или это смертельное заболевание, реально ли избавиться от диагноза навсегда?
Подробнее
Защитить врача от клеветы и оскорбления Медицинский юрист Наталья Косолапова рассказала, как наказать обидчика
Просмотров: 815
Профессиональная медицинская деятельность связана с постоянным общением с пациентами. К сожалению, не всегда это общение проходит в спокойной обстановке. Нередко пациенты проявляют не только неуважение, но и самую настоящую агрессию к медперсоналу.
К сожалению, не всегда это общение проходит в спокойной обстановке. Нередко пациенты проявляют не только неуважение, но и самую настоящую агрессию к медперсоналу.
Подробнее
Хирургическое лечение перитонеального канцероматоза (канцероматоза брюшины)
Просмотров: 19153
Современная стратегия хирургического лечения перитонеального канцероматоза заключается в проведении оперативных вмешательств, цель которых — максимально полное удаление всех видимых проявлений опухоли.
Подробнее
Взаимоотношения онкологических пациентов с персоналом медицинских учреждений и родственниками
Просмотров: 5757
Онкологический пациент может быть особенно чувствителен к взаимодействию с окружающими – членами семьи, работниками медицинских учреждений.
Подробнее
Рак предстательной железы
Просмотров: 9581
Рак простаты является одним из самых распространённых онкологических заболеваний, и заболеваемость в России с каждым годом увеличивается.
Подробнее
Как справиться с эмоциональным перенапряжением при онкологическом заболевании
Просмотров: 20340
Онкологический диагноз – это всегда психологическая травма, причем не только для самого больного, но и для его семьи, близких. Предлагаем несколько рекомендаций психолога, как справиться со стрессом в ситуации онкологического заболевания.
Подробнее
Лимфома Ходжкина
Просмотров: 138506
Это опухолевое заболевание лимфатической системы, которым болеют люди любого возраста. Заболеваемость в России составляет 2,3 на 100 000 населения.
Заболеваемость в России составляет 2,3 на 100 000 населения.
Подробнее
Влияние социально-психологических характеристик онкологических пациентов на их качество жизни
Просмотров: 2705
В НИИ онкологии им. Н.Н. Петрова проводилось исследование с целью установления связи качества жизни с социально-психологическими характеристиками и особенностями отношения к диагнозу у пациенток с онкогинекологической патологией.
Подробнее
Современная лучевая диагностика. Часть I
Просмотров: 15880
На наиболее часто встречающиеся вопросы пользователей сайта отвечает заведующий отделением лучевой диагностики НИИ онкологии им. Н.Н. Петрова, д.м.н., профессор Андрей Владимирович Мищенко
Подробнее
Санаторно-курортное лечение для онкологических пациентов
Просмотров: 82417
Онкологическим пациентам, к сожалению, знакомы ситуации, когда им необоснованно отказывают в направлении на санаторно-курортное лечение.
Подробнее
Чрескожная эндоскопическая гастростомия
Просмотров: 38848
Формирование гастростомы — это наиболее распространенный метод ведения пациентов, лишенных возможности перорального питания на протяжении длительного срока.
Подробнее
Вопрос-ответ Правила посещения пациентов Клинические исследования Памятки в помощь пациентам
Канцероматоз брюшины при раке яичников: лечение, прогноз и выживаемость
Как и большинство злокачественных опухолей, рак яичников делится на 4 стадии. В этой статье мы расскажем о проявлениях каждой стадии, возможностях лечения и прогнозе.
Рак яичников — это разнородная группа заболеваний: они могут отличаться по морфологическому строению, скорости роста, проявлениям и прогнозу.
Большинство случаев рака яичника развивается из маточной трубы. Этот факт был установлен не так давно.
Из-за этого к «раку яичников» добавлен рак маточной трубы и первичная карцинома брюшины — в настоящее время эти заболевания рассматриваются как одно.
Для описания прогноза мы будем говорить о пятилетней выживаемости. Этот показатель говорит о том, сколько процентов пациентов с определенной стадией живут 5 лет и дольше.
Например, 5-летняя выживаемость 70% говорит о том, что 7 из 10 пациентов с данной стадией живут 5 лет и больше. Важно понимать, что 5 лет и больше — это может быть как 6, так и 30 лет. Основной недостаток такого описания — мы не можем сказать, что ждет конкретного пациента.
Мы говорим о целой группе пациентов, объединенных одной стадией. Кто-то из них живет долго без признаков заболевания.
У других заболевание может рецидивировать достаточно рано.
Сказать заранее, в какую группу попадет конкретный пациент практически невозможно — это самый большой недостаток. И именно поэтому многие врачи избегают разговоров о прогнозе — практически наверняка он не сбудется.
Рак яичников 1 стадия
I стадия рака яичников — опухоль располагается в одном или обоих яичниках
1а стадия — опухоль расположена в одном яичнике, не распространяется прорастает на поверхность яичника, в смывах из брюшной полости нет опухолевых клеток.
На этой стадии достаточно хирургического лечения — удаления придатков с одной стороны.
Кроме этого, необходимо полное стадирование опухоли — взятие кусочкой тканей из разных участков брюшной полости, для того, чтобы исключить более высокую стадию.
Такие образом, лечение 1 стадии рака яичников — хирургическое. Пациенткам не проводится химиотерапия, при этой стадии возможно сохранение репродуктивной функции..jpg)
Прогноз при 1а стадии — 90% пациенток живут 5 лет и более.
1b стадия рака яичников — распространение опухоли только в оба яичника или маточные трубы.
Опухоль ограничена обоими яичниками, не прорастает их капсулу. Нет опухолевых клеток в смывах из брюшной полости.
Как и для 1а стадии — лечение IB стадии рака яичников хирургическое — удаление придатков с двух сторон. Обычно химиотерапия не проводится.
Прогноз IB стадии рака яичников — пятилетняя выживаемость 85%.
IC стадия рака яичников — опухоль прорастает капсулу яичников, произошел разрыв опухоли во время операции или обнаружены опухолевые клетки в смывах из брюшной полости. Самый частый сценарий — второй — произошел разрыв опухоли во время операции, по результату гистологического исследования обнаружен рак.
Лечение 1С стадии рака яичников — операция в объеме удаления матки с трубами и яичниками, резекция большого сальника, лимфаденэктомия и множественные биопсии брюшины. После операции обычно проводится химиотерапия.
После операции обычно проводится химиотерапия.
Прогноз при IC стадии рака яичника — 83%.
Рак яичников 2 стадия
II 2 стадия рака яичников — опухоль ограничена малым тазом. При этом она может поражать прямую или сигмовидную кишку, мочевой пузырь, но без признаков распространения за пределы малого таза.
IIA стадия рака яичников — опухоль распространяется на тело матки
Прогноз для IIA стадии рака яичников — 70%. Другими словами, 7 из 10 пациентов живут 5 лет и больше.
2B стадия рака яичников — опухоль распространяется на прямую кишку, сигмовидную кишку или мочевой пузырь, но не выходит за пределы малого таза.
Прогноз при IIB стадии рака яичников — 65%.
Рак яичников 3 стадия
Это самая распространенная стадия, при которой выявляется рак яичников. К сожалению, большинство случаев протекает бессимптомно. Первые признаки рака яичников — увеличение живота, появление тяжесть и дискомфорта в животе — появляются на поздней стадии — III или IV.
Около 70% впервые выявленного рака яичников относятся к 3 стадии.
При 3 стадии рака яичников опухоль распространяется по брюшной полости или поражает лимфатические узлы.
Зеленым цветом показаны лимфатические узлы — в них могут метастазировать опухолевые клетки, что является показателем 3 стадии рака яичинков.
- В зависимости от размера, выделяют подстадии:
- IIIA стадия — опухолевые депозиты не видны глазом, но обнаружены во время гистологического исследования.
- IIIB стадия — размер перитонеальных очагов не превышает двух сантиметров.
- IIIC стадия — опухолевые очаги размером более 2 см.
Опухолевые депозиты распространяются за пределы малого таза. Обычно в таких случаях выявляется канцероматоз брюшины при раке яичников.
Лечение 3 стадии рака яичников заключается в удалении всех видимых очагов — циторедуктивная операция. Она может занимать 6 часов и более, в зависимости от выраженности канцероматоза брюшины..jpg)
Исследования показали, что проведение гипертермической химиоперфузии брюшной полости в конце операции — HIPEC — значимо улучшает результаты лечения. В послеоперационном периоде проводится курс химиотерапии.
Обычно он включает 6 циклов химиотерапии по схеме карбоплатин + паклитаксел.
В ряде случаев первичная циторедуктивная операция невозможна из-за распространения опухоли. В таких случаях проводится 3 цикла химиотерапии, затем интервальная циторедукция, а после — еще 3 цикла химиотерапии.
Прогноз при 3 стадии рака яичников зависит от многих факторов. В первую очередь, распространение заболевания на момент лечения пациентки. Если размер опухолевых очагов был небольшим — пятилетняя выживаемость составляет 46%. В случае IIIC стадии рака яичников — когда размер опухолевых депозитов превышает 2 см — пятилетняя выживаемость составляет 30%.
Именно для третьей стадии рака яичников получены самые драматичные результаты циторедуктивной хирургии. Более половины пациентов, которым была выполнена полная циторедукция плюс HIPEC, а затем химиотерапия, жили 4 лет и более. Если же лечение проводилось в центрах, где не выполняются циторедуктивные операции — пятилетняя выживаемость не превышает 30%.
Если же лечение проводилось в центрах, где не выполняются циторедуктивные операции — пятилетняя выживаемость не превышает 30%.
4 стадия рака яичников
Признаки IV стадии рака яичников — выявление выпота в плевральных полостях, в котором обнаружены опухолевые клетки, либо метастазы в печени, селезенке, отдаленных лимфоузлах и др.
Лечение 4 стадии рака яичников — медикаментозное. Рак яичников хорошо отвечает на лечение химиотерапевтическими препаратами, после начала терапии исчезает асцит и плеврит. Пациент начинает чувствовать себя лучше.
В ряде случаев возможна циторедуктивная операция. Она проводится в случаях, когда имеются изолированные метастазы в печени или селезенке, которые можно удалить хирургически.
Прогноз при 4 стадии рака яичников — пятилетняя выживаемость составляет 20%.
Еще раз хотим напомнить, что прогноз — это очень неточный показатель. Он позволяет оценить, сколько живут пациенты в среднем, но практически не применим к конкретному человеку.
Очень многое зависит от качества выполненной операции: полноты циторедукции и проведения гипертермической перфузии.
Поэтому мы рекомендуем обращаться за лечением в центры, которые имеют опыт выполнения подобных процедур.
Сорокин Павел
Канцероматоз брюшины при раке яичников: лечение, прогноз и выживаемость
Злокачественные новообразования яичников являются распространенным заболеванием, поражающим женщин разного возраста. Канцероматоз брюшины при раке яичников считается вторичной патологией, существенно ухудшающей прогноз на излечение. При сопутствующем канцероматозе нередко выявляется асцит, требующий проведения специфической терапии.
Что такое канцероматоз брюшины
Канцероматоз брюшины – следствие развития опухоли и распространения метастазирования. Зачастую канцероматоз брюшины наблюдается при раке яичников 3 и 4 стадии.
При канцероматозе клеточные элементы основной опухоли отделяются по мере её роста и распространяются по брюшине вместе с током лимфы и крови. Явление происходит в результате потери опухолевыми клетками адекватной адгезии. При раке яичников 3, 4 стадии канцероматоз яичников наблюдается в 40% случаев.
Явление происходит в результате потери опухолевыми клетками адекватной адгезии. При раке яичников 3, 4 стадии канцероматоз яичников наблюдается в 40% случаев.
Канцероматоз брюшины считается неблагоприятным осложнением, которое сопутствует раку яичников. Это связано с отсутствием возможности хирургического лечения. Химиотерапия носит лишь паллиативный характер.
Причины
Канцероматоз брюшины является тяжелой патологией. Ее появление обусловлено развитием злокачественных опухолей, например, рака яичников.
Канцероматоз, наблюдаемый в брюшине, носит поэтапный характер:
- Непосредственное распространение клеток опухоли из основного очага, что становится возможным благодаря приобретению подвижности. Отмечаются также процессы деградации матрикса. Распространение клеток рака яичников может осуществляться в процессе операций, в случае повреждения сосудов. Прорастание клеточных происходит в зоне слепой кишки или в области дугласовых карманов.
- Взаимодействие клеток и мезотелия брюшины.
 Отмечается распространение клеток по горизонтали и их инвазивный рост в мембрану, а также соединительную ткань.
Отмечается распространение клеток по горизонтали и их инвазивный рост в мембрану, а также соединительную ткань. - Стимуляция неангиогенеза. Это условие является важным фактором последующего прогрессирования рака яичников.
Важно! Механизмы развития канцероматоза брюшины изучены в недостаточной степени.
Симптомы и классификация
Поскольку канцероматоз считается вторичной патологией, клиническая картина обусловлена течением рака яичников. Отличительным признаком называют значительный выпот, а также формирование асцита. Иногда асцит является единственным симптомом, указывающим на патологию брюшины.
Как правило, состояние пациенток характеризуется как тяжелое. Отмечается потеря веса, рвота и тошнота, нарастающая слабость. При раке яичников специалист может прощупать отдельные метастазы.
Общая классификация не разработана. Гинекологи указывают следующую классификацию, которая подразумевает численность, локализацию метастаз:
- Р1. Местное поражение области брюшины.

- Р2. Отмечается несколько участков канцероматоза брюшины, которые отделены здоровыми зонами.
- Р3. Наблюдаются множественные очаги.
Используется также метод суммирования баллов, при котором измеряются максимальные очаги в зоне поражения.
Диагностика
Клиническая картина не отличается специфичностью, что вызывает определенные сложности в диагностике. Как правило, диагноз подтверждает онколог после основных исследований:
- лабораторные методы определяют повышение СОЭ и лейкоцитоз;
- ультразвуковое исследование органов малого таза способствует выявлению рака яичников.
При наличии асцита обязательно проводят анализ жидкости, что возможно благодаря выполнению лапароцентеза. Существенное значение имеет лапароскопия, включающая осмотр дугласова пространства, перитонеума и диафрагмы.
Важно! В некоторых случаях возникают сложности с выявлением источника причины вторичной патологии из-за малых размеров злокачественной опухоли. Определение уровня онкомаркеров не всегда информативно.
Определение уровня онкомаркеров не всегда информативно.
Лечение при канцероматозе яичников
Лечение канцероматоза представляет собой сложную задачу. Как правило, специалисты используют сочетание нескольких методик.
Химиотерапия
Метод имеет как преимущества, так и недостатки. Наиболее результативным способом является так называемая интраперитонеальная химиотерапия. Это связано с тем, что в случае локального введения препаратов эффективность терапии повышается. Тем более, отмечается возможность использования веществ в высоких дозировках, что зачастую необходимо для достижения успешности лечения.
Среди преимуществ метода специалисты называют достаточно длительное нахождение лекарственного вещества в полости брюшины. Данный вид химиотерапии рекомендуется к применению либо в процессе операции, либо после ее осуществления.
Агент химиотерапии необходимо подогреть до 40-43 градусов. Раствор циркулирует приблизительно 90 минут.
В современной гинекологии также используются альтернативные методики лечения, например, ФДТ (фотодинамическая терапия), которая может осуществляться с местным или системным введением применяемого фотосенсибилизатора. Воздействие оказывается при непосредственном участии лазерной установки, повреждающей мембрану клеток рака яичников. Однако эффективность метода не является существенной.
Воздействие оказывается при непосредственном участии лазерной установки, повреждающей мембрану клеток рака яичников. Однако эффективность метода не является существенной.
Симптоматическая терапия
Симптоматическая или паллиативная терапия является вспомогательным элементом лечения. Необходимость ее использования связана с купированием болевого синдрома и коррекции психоэмоционального состояния. С этой целью применяются противовоспалительные и обезболивающие препараты, антидепрессанты и другие противотревожные средства. При нарушениях сна показан прием снотворных препаратов.
Лечение первичного очага
Канцероматоз брюшины – патология вторичного характера. Специалисту необходимо определить источник злокачественной опухоли. В гинекологической практике причиной канцерматоза брюшины зачастую является рак яичников 3 и 4 стадии.
Тактика лечения определяется размером и локализацией опухоли, наличием метастазирования. Обычно лечебные мероприятия имеют комплексный характер и сочетают радиотерапию, химиотерапию и хирургическое вмешательство. В некоторых случаях выполнение операции невозможно в связи с особенностями злокачественной опухоли. С целью лечения применяется интенсивное лучевое облучение и химиотерапия.
В некоторых случаях выполнение операции невозможно в связи с особенностями злокачественной опухоли. С целью лечения применяется интенсивное лучевое облучение и химиотерапия.
Хирургическое лечение
В рамках хирургического вмешательства производят удаление злокачественной опухоли первичного характера. Обязательным является иссечение региональных лимфоузлов и образовавшихся метастазов. Иногда рак яичников провоцирует асцит после операции.
Объем хирургического вмешательства зависит от степени распространения канцероматоза брюшины. В некоторых случаях требуется ампутация яичников, матки, придатков, желчного пузыря и сигмовидной кишки.
Важно! Операция при раке яичника с асцитом сопровождается высоким риском развития осложнений. С целью предупреждения рецидивов рака проводится химиотерапия.
Осложнения
При отсутствии своевременного лечения канцероматоз брюшины вызывает прогрессирование злокачественной опухоли и распространение раковых клеток. Определенную сложность представляет своевременное выявление первичного очага, что нередко становится причиной осложнений.
Асцит при раке яичников
Асцитом называют вторичную патологию, при которой происходит накопление жидкого экссудата (транссудата) в брюшине. Зачастую асцит наблюдается при раке яичников и связан с разрывом органа. Осложнение указывает на злокачественную опухоль 3, 4 стадии.
Накопление жидкого содержимого проявляется увеличением общего объема живота, чувством распирания, тяжестью. Пациентка испытывает боли, отмечает одышку, ограничение движений, ложные позывы к мочеиспусканию и дефекации, рвоту и тошноту. Осложнение может приводить к появлению грыжи, геморрою, а также выпадению кишки.
Асцит брюшной полости при онкологии яичников приводит к повышению давления, оттеснению купола диафрагмы в область грудной полости.
Возникает нарушения функционирования внутренних органов, работы сердечно-сосудистой системы. Из осложнений также выделяют сердечную и дыхательную недостаточность, обменные расстройства.
Патология может провоцировать лимфогенное распространение раковых клеток и формирование новых метастазов.
Внимание! Иногда появляется асцит при кисте яичников. На ранней стадии визуально определить патологию не представляется возможным. Необходима инструментальная диагностика, которая позволяет выявить асцит и начать лечение рака яичников.
Канцероматоз брюшины при раке яичников: прогноз выживаемости
Рак яичников, осложненный канцероматозом, является серьезной патологией. Несмотря на различные варианты сочетания тактик лечения, не существует эффективной методики полного излечения. Как правило, после проведенной терапии наблюдаются рецидивы рака. Это связано также с недостаточной изученностью патологии.
Рак яичников 4 стадия, асцит — сколько живут
Злокачественная опухоль яичников последней стадии считается тяжелой патологией с низкой выживаемостью. Канцероматоз и рак яичников с асцитом существенно ухудшают прогноз. Обычно на 4 стадии рака наблюдаются множественные метастазы, представляющие островки из злокачественных клеток.
Выживаемость зависит от общего состояния организма, степени вовлечения в онкологический процесс различных органов. Средний показатель составляет до 10%.
Средний показатель составляет до 10%.
Рак яичников 3 стадия, асцит — сколько живут
Образования на яичниках с асцитом имеет сравнительно благоприятный прогноз при условии комплексного своевременного лечения. При выявлении метастазов и канцероматоза брюшины шансы существенно снижаются. Обычно выживаемость при раке не превышает 50%.
Заключение
Канцероматоз брюшины при раке яичников требует проведения комплекса лечебных мероприятий, направленных на повышение выживаемости и улучшение качества жизни. Прогноз существенно зависит от своевременности выявления патологии.
Канцероматоз брюшины: лечение, срок жизни, симптомы и диагностика
Канцероматоз брюшины – это вторичные метастазы, поражающие плевру с брюшиной. Вторичный очаг считается опасным проявлением злокачественной патологии, снижающим шанс на выздоровление больному.
Канцероматоз не относят к отдельному заболеванию. Болезнь является серьезным последствием злокачественного новообразования в печени, поджелудочной железе либо матке.
Проявляется выраженными признаками онкологической интоксикации, потерей веса и асцитом.
Характеристика заболевания
Канцероматоз брюшной полости – это вторичный онкологический очаг, возникающий как следствие злокачественного процесса органов брюшины. Вторичный злокачественный процесс провоцирует метастазирование опухоли, развивающейся в органе малого таза или другого участка. Первичный очаг патологии при разрастании выпускает множественные метастазы в отдаленные участки организма.
Лимфогенный перенос аномальных клеток провоцирует развитие канцероматоза в брюшной полости и плевры с выраженными признаками интоксикации. Новообразование прорастает в эпителиальный слой брюшины.
Раковый патоген проникает в серозный слой и закрепляется на стенках полости. Диссеминация сопровождается последующим формированием злокачественных узелков, напоминающих зерно. Узелки увеличиваются в размерах и постепенно сливаются, образуя опухоль большого размера.
Внутрибрюшная оболочка, пораженная злокачественным новообразованием, не способна выполнять экссудативную и резорбтивную функции.
В связи с этим в полости накапливается жидкость, развивается асцит.
Чаще всего патология развивается у людей с наличием раковой опухоли органов пищеварительного тракта – желудка, толстой кишки, кишечника, поджелудочной железы. Кишечный и желудочный недуг развивается стремительно, вовлекая в процесс жизненно важные системы организма. Спровоцировать заболевание у женщин может рак матки или яичников.
Поражение брюшной полости злокачественным процессом вторичного характера считается врачами неблагоприятным прогнозом течения. Болезнь плохо поддаётся терапии, что значительно усложняет жизнь пациента.
Карцинома в ткани лёгкого может спровоцировать вторичный очаг – канцероматоз лёгких. Встречаются единичные образования и множественные. Может формироваться в одном органе или сразу в обоих.
Развитие протекает стремительно, что негативно сказывается на лечении и выздоровлении больного. Курсы химиотерапии останавливают увеличение опухоли на короткий период времени.
Но после курса химиотерапии злокачественная клетка увеличивается в размерах ещё быстрее.
Заболевание встречается у 35% больных раком. Из этого количества у 40% первичный очаг присутствовал в органах пищеварительного тракта – желудка и поджелудочной железы. Но в медицинской практике есть примеры развития патологии из-за злокачественного процесса совершенно другого участка.
Код по МКБ-10 болезнь имеет С78.6 «Вторичное злокачественное новообразование брюшины и забрюшинного пространства. Злокачественный асцит».
Причины развития заболевания
Главной причиной развития канцероматоза считается первичный очаг злокачественного процесса. Раковая опухоль способна формировать метастазные ростки, которые проникают в ближайшие и отдалённые участки человеческого тела. Происходит это обычно на последней стадии болезни.
Распространение метастазов по организму происходит:
- С кровью либо лимфой.
- Первичный раковый очаг проникает в брюшную полость с последующим закреплением на стенках полости.

- После хирургического удаления первой раковой опухоли.
Внутрибрюшная полость совместно с серозной оболочкой имеет площадь равную 2 м2. Раковые ростки, проникая в данную область, способны сформироваться на огромном участке. Стенки и складки органа соприкасаются друг с другом, что увеличивает скорость развития патологии.
Стремительное формирование патологии провоцирует наличие сопутствующих факторов:
- Брюшная полость находится в опасной близости с органами желудочно-кишечного тракта.
- Внутренние складки постоянно соприкасаются друг с другом.
- Присутствует огромное количество кровеносных и лимфатических сосудов.
Формирование новообразований происходит на участках, не подверженных перистальтике кишечника. Размер первичного очага влияет на риск развития канцероматоза. Чем крупнее опухоль, тем быстрее и глубже происходит проникание метастазов в ткани брюшины.
Недифференцированный рак желудка всегда сопровождается формированием канцероматоза.
Признаки патологии
При раке первичного очага у больного присутствуют выраженные симптомы поражения конкретного органа. Но в некоторых ситуациях первые признаки опасного заболевания появляются при канцероматозе. Именно это позволяет заподозрить болезнь и поставить правильный диагноз.
Патология обнаруживает следующие признаки:
- Появляются приступообразные болевые спазмы в области живота – постоянные или периодические, с ноющим характером.
- У больного резко увеличивается живот при заметной общей потере веса – в брюшной полости происходит накопление жидкости.
- Наблюдаются приступы тошноты с ротными позывами.
- Болевые ощущения с коликами в области живота.
- Сбой в работе кишечника – длительный запор сменяет диарея.
- Отмечается выраженная мышечная слабость.
- Температура тела принимает термальные показатели на фоне яркого озноба.
- Усиленное потоотделение.
- Сильные головные боли и боли в мышцах.
Болезнь протекает на фоне стремительного ухудшения самочувствия больного. Человек доставляется по скорой в отделение хирургии или гастроэнтерологии. В стационаре после диагностирования ставится правильный и точный диагноз.
Человек доставляется по скорой в отделение хирургии или гастроэнтерологии. В стационаре после диагностирования ставится правильный и точный диагноз.
Классификация болезни
Канцероматоз брюшной полости классифицируют согласно расположению метастазных отростков и их количеству:
- Стадия Р1 характеризуется локальным расположением узла с одним злокачественным поражением.
- На стадии Р2 присутствует несколько раковых участков, подтверждающих болезнь. Между пораженными очагами выявляются участки здоровых тканей.
- Стадия Р3 соответствует 4 степени злокачественности. Выявляется множество злокачественных новообразований с признаками слияния в единый очаг.
Диагностика заболевания
Выявить болезнь без проведения обследования врач может у пациента онкологического центра с терапией раковой болезни. В остальных случаях требуется проведение расширенного обследования организма больного. Диагностика включает следующие процедуры:
- На УЗИ исследуют органы брюшины с малым тазом.
 Здесь же выявляется первичный очаг с признаками внутренних изменений в ткани органа. Врач определяет размер, форму и точную локализацию образования.
Здесь же выявляется первичный очаг с признаками внутренних изменений в ткани органа. Врач определяет размер, форму и точную локализацию образования. - При помощи компьютерной томографии изучают орган структурно. По КТ определяются все злокачественные участки, структура с локализацией.
- МРТ и МСКТ проводят с использованием контраста – это позволяет обнаружить отдаленные метастазы и степень поражения лимфатических узлов.
- Лапароскопия требуется для внутреннего изучения поражённых стенок брюшины и получения биологического образца. Образец исследуется в лаборатории биопсическим методом.
- Кровь изучается анализом ОТ-ПЦР. Врачи на основе данного анализа точно выясняет место первичного очага болезни.
Порой установить первичный участок развития патологии не удаётся. В остальных случаях методы диагностики дают подробную информацию о заболевании. Обследование позволяет установить степень поражения организма и назначить адекватное лечение.
Лечение заболевания
Процесс лечения пациента с диагнозом канцероматоза брюшины долгий и сложный. Результат может быть положительным и отрицательным. Неблагоприятный результат терапии случается чаще.
Результат может быть положительным и отрицательным. Неблагоприятный результат терапии случается чаще.
Болезнь можно вылечить на ранних сроках развития и с применением новейших методик и аппаратуры в медицине. В основном применяется хирургическое иссечение злокачественного уплотнения с курсами химиотерапии.
В последние годы разработано много новых эффективных методов борьбы с онкологией. Медицина не останавливается на этом и ищет новые варианты лечения.
Удаление опухоли хирургическим методом проводится с иссечением первичного очага, больных лимфатических узлов. Также возможно удаление органов, поражённых раковыми клетками – матки, желчного пузыря, участка толстого или тонкого кишечника и сигмовидной кишки.
Химиотерапия применяется как отдельное лечение, так и совместное с оперативным методом. В последнее время врачи предпочитают использовать перитонеальный гипертермический способ химиотерапии. Основа метода характеризуется вводом лекарственных препаратов в брюшную полость при помощи горячего воздуха. Иногда это делают сразу после операции или в период проведения операции.
Иногда это делают сразу после операции или в период проведения операции.
Противоопухолевый раствор держат в полости 60 мин. Затем выводят. За это время происходит непрерывная циркуляция лечебного раствора, который уничтожает злокачественные патогены.
Выявление первичного очага патологии считается первоочередной задачей врачей. Обнаружение болезни с точными размерами и степенью развития позволяет провести полное лечение. Это повышает шанс пациента на выздоровление.
Локализация патологии в доступном и операбельном месте позволяет провести хирургическое иссечение узла. После операции назначаются курсы химиотерапии и облучения гамма-лучами. Дозировки и курсы подбираются индивидуально согласно физическим показателям и медицинским исследованиям пациента.
Параллельно основным способам лечения используется симптоматическое купирование негативных симптомов болезни:
- Делается специальный прокол для вывода лишней жидкости из брюшины.
- Болевой синдром блокируется приемом обезболивающих препаратов.

- Назначаются пробиотики для улучшения перистальтики органов пищеварения.
- Вводятся капельницы с физрастворами для восполнения витаминного и минерального дефицита.
- Мочегонные средства способствуют выводу лишней жидкости.
- Корректируется питание – назначается специальная диета.
Пациент постоянно находится под наблюдением лечащего врача. После курса терапии проводится повторное диагностирование организма. Требуется это для корректировки терапии.
Прогноз лечения
Срок жизни больного зависит от степени поражения организма онкологическим процессом. Сколько проживёт человек, врач сказать не сможет точно. Зависит это от физических показателей и психологического настроя больного.
Поражение незначительного участка брюшины – процент выживаемости выше у пациентов. Продолжительность жизни составляет до 3 лет и более. Если первичный очаг поддаётся лечению, шансы увеличиваются.
При поражении большей площади органа прогноз для пациента неблагоприятный.
Летальный исход диагностируется через несколько месяцев. Применяется паллиативная терапия для купирования болевых синдромов и психологического дискомфорта.
При данном заболевании всё зависит от срока выявления и психологического настроя пациента. Доказано учёными, что позитивный настрой на выздоровление значительно увеличивал шансы на выздоровление и долгую жизнь.
Канцероматоз брюшины при раке яичников: симптомы, причины возникновения, лечение, прогноз
Рак яичников относится к злокачественным заболеваниям и часто сопровождается различного рода осложнениями. Одним из них является канцероматоз брюшины. Заболевание имеет свои особенности и характеризуется неблагоприятным прогнозом.
Общие сведения
Канцероматоз брюшины относится к одному из последствий рака, когда патологический процесс затрагивает ткани яичников. Заболевание проявляется часто.
Патология характеризуется формированием большого количества метастатических поражений в области брюшной полости. При раке яичников канцероматоз отличается стремительным течением и выраженными симптомами.
При раке яичников канцероматоз отличается стремительным течением и выраженными симптомами.
Частота возникновения
В соответствии со статистическими данными, канцероматоз брюшины при раке яичников развивается в 30-40% случаев.
Это обусловлено тем, что первичная опухоль длительное время не проявляет признаков. Но патологический процесс распространяется и поражает большие участки органов.
Женщины часто обращаются к специалисту уже на поздних стадиях, когда рак сопровождается метастатическими поражениями и канцероматозом.
Вероятность развития осложнения в виде множественного поражения органов брюшной полости увеличивают отсутствие терапии основного заболевания на ранних стадиях и неправильно подобранная терапия.
Причины возникновения
Брюшная полость расположена близко по отношению к яичникам. Именно поэтому патологический процесс часто распространяется на ткани полости. По данным статистики, рак матки значительно реже становится причиной канцероматоза.
Одной из причин развития патологии является оперативное вмешательство, направленное на удаление злокачественного образования на тканях яичников. Это обусловлено тем, что атипичные клетки способны перемещаться и при операции они мигрируют в ближайшие структуры и закрепляются на тканях.
Спустя некоторое время происходит стремительное и бесконтрольное деление, в результате чего начинают формироваться метастатические поражения. Подобный процесс приводит к постепенному заполнению брюшной полости очагами патологического процесса.
Канцероматоз брюшины при раке яичников чаще возникает на последних стадиях развития первичной опухоли. В брюшной полости расположено множество жизненно важных органов и сосудов. Мутированные клетки проникают в кровоток, распространяются по всему организму, поражают мягкие ткани.
Признаки
Вторичное раковое поражение имеет ряд общих симптомов различной степени выраженности. Но они проявляются только при достижении очагов патологического процесса значительных размеров.
Одним из первых признаков заболевания является асцит, который проявляется в виде скопления жидкости в брюшной полости.
Заболевание считается главным и единственным специфическим признаком канцероматоза. Именно он становится частым поводом для обращения к специалисту. При этом патологический процесс развит, имеются обширные поражения яичников и органов брюшной полости.
Среди общих симптомов при канцероматозе наблюдается тошнота, сопровождающаяся рвотой, стремительная потеря веса. Пациенты отмечают слабость, а при проведении пальпаторного исследования живота выявляются узловые образования.
Канцероматоз характеризуется множественным поражением, которое распространяется на большую площадь. В результате специфические признаки патологии отсутствуют. Классификация заболевания представляет затруднения, так как очаги патологического процесса не имеют четких границ.
Определение степени развития болезни осуществляется на основе размера и особенностей течения первичного новообразования. Канцероматоз чаще наблюдается при 3 или 4 степени.
Канцероматоз чаще наблюдается при 3 или 4 степени.
Диагностика
В первую очередь врач проводит осмотр пациентки, изучает анамнез и устанавливает время возникновения симптомов.
УЗИ
Для определения точного диагноза назначается ряд диагностических мероприятий. Основным способом диагностики является ультразвуковое исследование. Методика позволяет определить степень поражения органов, распространенность патологического процесса.
МРТ
Для получения более точных данных специалист может назначить МРТ с использованием контрастного вещества.
Магнитно-резонансная томография позволяет провести послойное сканирование тканей и определить наличие очагов патологического процесс даже незначительного размера.
Лапароскопия
Получить точные данные и провести визуальное исследование позволяет лапароскопия. С помощью специального оборудования, которое вводят через проколы в брюшной полости, специалист устанавливает степень изменения слизистых органов брюшной полости.
При проведении лапароскопии осуществляется забор участка измененной слизистой с целью последующего проведения гистологического исследования. Анализ биопата позволяет установить злокачественность процесса.
Пациенту также назначается анализ крови и мочи. Лабораторные исследования необходимы для выявления наличия онкомаркеров, воспалительных процессов в организм.
Лечение
Канцероматоз брюшины является вторичным заболеванием и возникает чаще при уже имеющемся злокачественном поражении яичников. Лечение проводится комплексно.
Химиотерапия
Терапия при помощи химиотерапевтических препаратов может проводиться несколькими способами.
Самым распространенным является интраперитонеальный. Данный метод предполагает локальное введение средств. Преимуществом является возможность применения препаратов в больших дозировках, что увеличивает эффективность лечения.
При интраперитонеальном методе лекарственное средство длительное время находится в брюшной полости. Данный способ используется при проведении оперативного вмешательства или после него.
Данный способ используется при проведении оперативного вмешательства или после него.
Симптоматическая терапия
Не относится к основным способам лечения, но позволяет купировать выраженные симптомы заболевания.
Используются препараты для снижения болезненных ощущений и нормализации психоэмоционального состояния. Пациенту назначаются обезболивающие и противовоспалительные средства. В случаях нарушения сна используются снотворные.
Лечение первичного заболевания
Канцероматоз относится к вторичным патологиям. Когда заболевание развивается в результате рака яичников, проводятся лечебные мероприятия по лечению злокачественного образования.
Чаще всего используется хирургическое вмешательство в комплексе с химиотерапией и лучевой терапий. Это обусловлено тем, что канцероматоз возникает на 3 и 4 стадии течения рака яичников, когда присутствуют метастазы.
Операция проводится с целью удаления основной опухоли. Пораженных лимфатических узлов, метастазов.
Но проведение хирургического вмешательства не всегда возможно, так как имеются множественные метастатические поражения.
Лучевая терапия
Методика применяется в качестве дополнительного способа воздействия на очаг патологического процесса с помощью радиоактивного облучения.
Лучевая терапия позволяет уничтожить мутированные клетки и улучшить прогноз. Чаще используется в комплексе с химиотерапией.
Осложнения
Канцероматоз при раке яичников не является самостоятельным заболеванием. Он возникает в результате метастазирования первичной злокачественной опухоли.
Но, несмотря на это, способен привести к иным осложнениям и последствиям. Канцероматоз характеризуется распространением множественных метастаз в брюшной полости. Отсутствие лечения приводит к поражению больших участков тканей и органов.
В результате у пациентов возникают почечная, сердечная, печеночная недостаточность. Общее самочувствие ухудшается с каждым днем.
Наблюдается развитие заболеваний органов пищеварительной, мочеполовой систем. На последней стадии первичное образование начинает распадаться, что провоцирует сильную интоксикацию организма.
На последней стадии первичное образование начинает распадаться, что провоцирует сильную интоксикацию организма.
Если пациент не получал лечения, то спустя некоторое время наступает летальный исход.
Именно поэтому не стоит откладывать поход к врачу, особенно при установленном раке яичников.
Прогноз
Канцероматоз, причиной которого стало раковое поражения яичников, возникает на 3 или 4 стадии развития первичной патологии. При проведении диагностических мероприятий в данном случае устанавливается обширное поражение внутренних органов.
Единственным способом получения более благоприятного прогноза является своевременное лечение первичного заболевания. Но его установление вызывает некоторые затруднения.
Это обусловлено тем, что рак яичников способен длительное время не проявлять себя. Поводом для обращения к врачу становится асцит.
Осуществление комплексного лечения позволяет только продлить жизнь пациента не более чем на 3-10 месяцев. Химиотерапия и лучевая терапия позволяет только улучшить общее состояние и замедлить распространение патологического процесса.
Таким образом, прогноз в случае развития канцероматоза при раке яичников неблагоприятный. В течение пяти лет выживает не более 5% пациентов. Это связано с обширным поражением и невозможностью в некоторых случаях провести оперативное удаление опухолей.
Канцероматоз брюшной полости, который развивается на фоне рака яичников, считается опасным осложнением. Лечение не позволяет добиться положительного результата.
С целью исключения возникновения канцероматоза важно своевременно проходить лечение основного заболевания. Терапия должна быть проведена до того, как начнут распространяться метастазы. Это позволит значительно снизить риск развития осложнений и предотвратить летальный исход.
Канцероматоз брюшины: причины развития, сопутствующие симптомы, способы лечения, прогноз выживаемости
Канцероматоз брюшной полости представляет собой вторичное онкологическое образование. Клетки опухолей метастазируют из других очагов поражения.
Согласно медицинской статистике, узнать, что такое канцероматоз брюшной полости, приходиться 35% пациентам с онкологией. В большинстве случаев это люди, с раковыми образованиями в органах желудочно-кишечного тракта и яичников.
В большинстве случаев это люди, с раковыми образованиями в органах желудочно-кишечного тракта и яичников.
Последнее говорит о том, что женская половина подвержена патологии больше мужской.
Канцероматоз брюшины
Из-за вторичности заболевания, изначально у человека присутствуют первичные симптомы рака в виде боли и нарушенного пищеварения. Одним из признаков канцероматоза и чаще всего единственным является асцит брюшины, что это такое пациенты узнают при осложнении онкологии органов и циррозе.
Заболевание проявляет себя скоплением жидкости в животе, давящей на органы. Исходя из статистики, каждый третий пациент умирает от водянки. При наличии больших метастаз, врач может их прощупать.
В стационар человек при канцероматозе поступает в тяжелом состоянии, у него увеличен живот, наблюдается:
- потеря веса;
- тошнота, рвота;
- головная боль;
- низкая или
высокая температура; - вялость.
Канцероматоз брюшной полости входит в международный класс мкб 10. Целью классифицирования является сбор статистики данных о ситуации со здоровьем групп населения, подсчете смертности и влиянии различных факторов.
Целью классифицирования является сбор статистики данных о ситуации со здоровьем групп населения, подсчете смертности и влиянии различных факторов.
Причины возникновения
Концероматоз брюшной
полости вызывает распространение раковых клеток от других органов, что
происходит через лимфатическую и кровеносною систему или после операции по удалению первичной опухоли.
Стремительному распространению способствует:
- Тесный контакт брюшины с пищеварительными органами.
- Соприкосновение складок живота друг с другом.
- Внушительное количество лимфоузлов и кровеносных сосудов в области.
Методы мсследования
Диагностировать заболевание врач начинает с изучения анамнеза, симптомов, и после сдачи анализов. При подозрениях на канцероматоз, пациенту назначают аппаратное исследование, оно помогает выявить расположение новообразования, оценить состояние брюшной полости.
Компьютерная томография
Эффективные методы диагностики также включают в себя:
- компьютерную томографию;
- цитологическое исследование жидкости;
- анализ крови ОТ-ПЦР;
- лапароскопию;
- МСКТ.

В 3-5% ситуаций размеры первичного образования настолько малы, что затрудняют диагностику или не выявляются. В таких случаях клиника канцероматоза брюшной полости наблюдается уже при обширном поражении, что делает лечение неэффективным, а состояние пациента контролируют паллиативной терапией.
Медицинская помощь
Лечение канцероматоза брюшной полости длительное и сложное. Медикам приходится бороться за жизнь пациента. К больному применяют химиотерапию, делают операцию, снимают острые симптомы. Дополнить лечение канцероматоза можно нетрадиционной медициной, несмотря на то что, она не доказана научно, сами врачи рекомендуют некоторые рецепты, но только в комплексе с основной терапией.
Хирургическое лечение
Операция проводится в случаях, если позволяет стадия канцеромотоза и локализация поражения. Она направлена на иссечение первичной опухоли, поврежденных лимфатических узлов, метастаз в области живота.
Так как первичные очаги раковых клеток при канцероматозе в большинстве случаев образуются в пищеварительных органах и яичниках, хирурги могут удалить желчный пузырь, сигмовидную кишку, доли толстого или тонкого кишечника, матку, придатки.
Химиотерапия
Прогноз для пациентов 4 степени канцероматоза неутешителен. Операцию в таких случаях не проводят, лечат обычной химиотерапией, снимают симптомы, при асците удаляют жидкость.
В современных клиниках, введение лекарств осуществляют посредством горячего воздуха в пораженную область. На ранних стадиях канцероматоза брюшной полости, процедуру можно осуществить в процессе оперативного вмешательства.
При таком способе, жидкость убивает онкологические клетки на протяжении 60 минут, в дальнейшем усиливает эффективность лечения.
Симптоматическая терапия
Чтоб облегчить жизнь больному, задача врачей – снять клинику канцероматоза брюшной области и асцита, для этого прибегают к следующим методам:
- Прокалывают область живота, чтоб выпустить скопившуюся воду.
- Сильные боли притупляют путем инъекций с наркотическим анальгетиком.
- Интоксикацию снимают капельницами.
- Для вывода жидкости также используют мочегонные препараты (Фурациллин).

Народные средства
Перед тем как использовать народные методы лечения канцероматоза брюшной полости, врачи настоятельно рекомендуют обсудить рецепты, в противном случае можно усугубить ситуацию и уменьшить продолжительность жизни. Опасения связаны с индивидуальностью каждого человека, сопутствующими заболеваниями, противопоказаниями, возможными осложнениями и отравлениями после употребления составов.
Чаще всего в составе противораковых рецептов преобладают:
- пижма;
- полынь;
- сабельник;
- сныть;
- ромашка;
- мята;
- подорожник;
- чистотел;
- тысячелистник и другие.
На основе трав готовят отвары и настои, в отсутствии противопоказаний составы можно употреблять в целях профилактики. При канцероматозе брюшной области эффективны следующие рецепты.
Пеларгония с коньяком
Для этого рецепта при канцероматозе необходимо 2 листа пеларгонии, которые заливают 50 мл кипятка и настаивают сутки в термосе. Полученную жидкость соединяют с 500 мл конька, 3 суповыми ложками сока алое, 2 каплями йода. Лекарство пьют с утра и перед сном.
Полученную жидкость соединяют с 500 мл конька, 3 суповыми ложками сока алое, 2 каплями йода. Лекарство пьют с утра и перед сном.
Настойка болиголова
Растение ядовитое, поэтому важно соблюдать дозировку. Лекарство можно купить в готовом виде или сделать самостоятельно.
В приготовлении понадобиться 0,5 л спирта и 50 г сухого болиголова, которые ставят на 14 дней в темное место и регулярно перемешивают.
Средство при канцероматозе употребляют: 4 дня подряд по 1 капле, 4 раза в сутки; с 5 по 8 день количество капель 2; на 9 день 3 капли;на 10 сутки 4 капли; на 11 день 5 капель. Готовую настойку пьют при канцеромотозе по 2 капли перед приемом пищи в 1 сутки, на следующий день 3 капли.
Количество капель увеличивают на 1 каждый день, пока не дойдут до 20, после чего прием идет в обратном порядке на уменьшение. Закончив курс, организму дают время на отдых, через 2 недели схему повторяют. В год разрешено не более 3 курсов.
Настой картофельных цветов
В лечении канцероматоза эффективны соцветия картофеля. Собранные цветы высушивают без воздействия солнца. Смесь в количестве 2 горстей заливают 0,5 л спирта и оставляют на 2 недели в темном месте. Далее жидкость процеживают, разводят в пропорции 7 капель на 50 мл воды и пьют 3 раза в сутки.
Собранные цветы высушивают без воздействия солнца. Смесь в количестве 2 горстей заливают 0,5 л спирта и оставляют на 2 недели в темном месте. Далее жидкость процеживают, разводят в пропорции 7 капель на 50 мл воды и пьют 3 раза в сутки.
Травяной сбор №1
Для лекарства от канцеромотоза нужны почки черного тополя в количестве 5 г, аир 8 г, 25 г соцветий лопуха и 35 г корня, цветы полевого бодяка 50 г. Смесь заливают 0,9 мл кипятка, настаивают и пьют перед едой, разделив на 3 суточных приема.
Травяной сбор №2
Следующий рецепт при канцероматозе включает экстракты чаги и столетника по 200 г, шиповник, тысячелистник, сосновые шишки по 50 г, полынь 5 г, коньяк 250 г, мед 500 г. Ингредиенты заливают 3 литрами кипятка, варят 2 часа, настаивают сутки, употребляют по 1 большой ложке перед приемами пищи на протяжении 2 недель.
Настойка полыни
Трава хорошо зарекомендовала себя в лечении онкологии, на ее основе делается одно из противораковых лекарство Артемизинин. При канцероматозе можно пить аптечную настойку полыни в количестве 15 капель, не более 3 раз в сутки, курсом 14 дней.
При канцероматозе можно пить аптечную настойку полыни в количестве 15 капель, не более 3 раз в сутки, курсом 14 дней.
Настойка одуванчика
Корни растения промывают и оставляют обсыхать, используют после прекращения выделения молока. Траву подсушивают при температуре 40-50 градусов, берут в количестве 3 суповых ложек, заливают 500 мл кипятка, варят на медленном огне 20 минут. Процеженную жидкость употребляют при канцероматозе после еды, 2 раза в день по 250 мл.
Продолжительность и прогноз жизниКанцероматоз брюшной полости имеет неблагоприятный прогноз жизни, учитывая, что заболевание – это уже метостазы, а его симптомы обычно проявляются, когда клетки достаточно распространились.
Продолжительность жизни пациентов при канцероматозе брюшной полости 4 степени менее 12 месяцев, начальные стадии имеют прогноз 5-летней выживаемости 10%, таким образом, сколько точно живут пациенты, определяет своевременная диагностика и лечение.
Канцероматоз брюшной полости — прогноз, лечение, причины
Канцероматозом брюшины называется один из вариантов метастазов, поражающих, обычно, плевру и брюшину. При наличии диагноза рака, независимо от места локализации опухоли, может возникнуть метастазирование, а в случае у пациента наличия вторичных очагов поражения, его шансы на излечения значительно уменьшаются.
Канцероматоз не является отдельной болезнью, а относится к серьезным осложнениям других злокачественных раковых заболеваний, например, таких как рак поджелудочной железы, печени или матки, с весьма неблагоприятным прогнозом.
Что такое канцероматоз
В онкологии канцероматоз брюшной полости — один из вариантов метастазирования злокачественных новообразований, независимо от их локализации, при котором происходит поражение серозной оболочки – брюшины.
Патология характеризуется отделением злокачественных клеток от локализации первичного очага заболевания с последующим их распространением с серозной жидкостью в брюшину.
Очаги диаметром могут быть от нескольких миллиметров, до нескольких сантиметров, при этом их расположение может быть единичным или сливаться воедино.
В ходе развития болезни и распространения опухолевых клеток, может образоваться асцит — уменьшение общей массы тела и нарастающая интоксикация с выделением жидкости в брюшную полость. Что такое канцероматоз знают немногие.
Стоит отметить, что прогнозы на выздоровление для пациентов с канцероматозом сводятся к минимуму, так как патология практически не подлежит хирургическому лечению, а химиотерапия может только временно поддерживать жизнедеятельность больных.
Исходя из статистических исследований, канцероматоз диагностируется у 20-35% случаев злокачественных форм рака, из них в 40% случаев патология возникает у пациентов с опухолью в области органов пищеварения, в частности поджелудочной железы. Рак яичников вызывает канцероматоз в 30% случаев. Также причиной образования канцероматоза может стать злокачественная опухоль с другой локализацией.
Причины возникновения
Канцероматоз (карциноматоз) брюшины представляет собой вторичное раковое поражение, возникающее вследствие прогрессирования злокачественной опухоли, независимо от ее места расположения. Чаще всего возникновение этой патологии наблюдается:
К развитию канцероматоза более склонны пациенты с наличием злокачественных опухолей в области печени. Главной причиной канцероматоза брюшины является наличие первичной опухоли. Нередко исходный очаг поражения установить не удается.
Развитие канцероматоза происходит в несколько этапов:
- Первый этап — злокачественные клетки распространяются от первичного ракового очага, что обусловлено приобретением клеток собственной подвижности, при этом возникает деградация межклеточного матрикса. Спровоцировать распространение клеток может внешнее механическое воздействие, например, оперативное вмешательство или повреждение лимфатической системы и кровеносных сосудов. После попадания раковых клеток в область брюшины, их распространение обусловливается силой тяжести и сокращениями внутренних органов.

- Второй этап — злокачественные раковые клетки начинают взаимодействовать с оболочками брюшины, при этом механизм взаимодействия зависит от природы клеток и морфологических особенностей брюшины. Постепенно клетки укрепляются в мезотелии, развивается их горизонтальное распространение с последующим инвазивным ростом.
- Третий этап — происходит стимуляция неоангиогенеза (возникновение кровеносных сосудов питающих опухоль), что в свою очередь стимулирует активный рост ракового новообразования.
В связи с недостаточно изученным морфологическим развитием канцероматоза, результативных методов его лечения пока нет.
Ускоренное развитие канцероматоза может быть вызвано следующими факторами:
- регулярное соприкосновение брюшинных складок;
- соприкосновение брюшины с другими органами пищеварительной системы;
- поражение раковыми клетками органа, содержащего обширные сети кровеносных сосудов.
Также вероятность развития канцероматоза во многом зависит от размеров исходной злокачественной опухоли и степени ее прорастания вглубь пораженного органа.
Классификация
В онкологии для классификации канцероматоза брюшины применяется классификация, в зависимости от места расположения метастазов и их количества. Перитонеальный канцероматоз имеет следующую единую классификацию:
- P1 — метастазы поражают один участок брюшины;
- P2 — у пациентов обнаруживают несколько очагов, между которыми находятся здоровые участки брюшины;
- P3 — большое количество очагов канцероматоза, сливающихся вместе.
Канцероматоз брюшины и асцит характеризуются тяжелым для пациента состоянием, с ярко выраженной клинической картиной. Такие пациенты нуждаются в немедленной госпитализации в специализированное медицинское учреждение.
Основные симптомы
Так как канцероматоз представляет собой уже вторичное поражение, то его клиническая картина, в первую очередь, зависит от исходной раковой опухоли. В случае образования канцероматоза брюшины, симптомы могут быть следующими:
- возникновение болевого синдрома ноющего характера;
- резкое уменьшение массы тела с увеличением живота;
- нарушенная работа системы пищеварения, в частности кишечника;
- интоксикация.

Характерным признаком канцероматоза брюшины является образование асцита, в связи с чем, пациенты изначально поступают в гастроэнтерологическое отделение, где врачи определяют причину вызванного асцита.
Диагностика
Когда возникают симптоматические проявления, связанные с болями в животе и стремительной потерей массы тела, состояние больных может указывать на канцероматоз только в том случае, когда у пациентов уже диагностировано раковое заболевание. Диагностика канцероматоза брюшины проводится посредством следующих процедур:
- ультразвуковое исследование (УЗИ) — позволяет выявить место локализации исходной раковой опухоли, а также изменения в брюшной полости, расположения очагов поражения и их размеры;
- компьютерная томография (КТ) — необходима для исследования всех слоев брюшной области, выявления очагов поражения и определения их структуры;
- лапароскопия — проводится для осмотра брюшины и исследования асцитической жидкости, полученной в процессе проведения процедуры;
- анализ крови ОТ-ПЦР — детализированное определение локализации первичного очага.

Анализ асцитической жидкости, полученной при помощи лапароскопии или пункции серозной полости, необходим для изучения на предмет наличия опухолевых клеток. Иногда, примерно в 5% из всех случаев болезни, диагностика не позволяет определить первичную опухоль, так как она может иметь очень маленький размер. Бывают случаи, когда диагностика раковой опухоли выполняется уже посмертно.
Способы лечения
После проведения всех диагностических мероприятий лечение канцероматоза проводится достаточно трудно, и не всегда результативно. Если у пациента есть шансы на излечение, ему может быть назначена операция, после которой проводят химиотерапию.
Иногда пациенты пытаются лечить канцероматоз брюшины народными средствами, что так же не дает желаемого результата.
Сейчас в медицине применяется множество разных методик для противоракового лечения, возможно в ближайшем будущем ученые смогут найти эффективный способ для терапии злокачественного поражения брюшины.
Хирургическое лечение
При диагностированном канцероматозе брюшины, лечение при помощи хирургического вмешательства подразумевает удаление опухоли, продуцирующей раковые клетки, а также очагов канцероматоза и пораженных лимфоузлов.
Нередко во время проведения такой операции проводится удаление других органов, пораженных клетками опухоли, например, частей толстого и тонкого кишечника, матки и ее придатков или мочевого пузыря.
Химиотерапия
В процессе лечения канцероматоза брюшиной полости сейчас актуально применение интраперитонеальной гипертермической химиотерапии, которую можно проводить непосредственно в процессе операции.
Метод основан на введение химических препаратов посредством горячего воздуха, поток которого направляется непосредственно в брюшину.
Раствор, содержащий необходимые химические средства, находится в брюшине один час, в течение которого он уничтожает злокачественные клетки.
Лечение первичного очага
Важно при диагностированном канцероматозе выявить первичных очаг и определить стадию его развития, место расположения и уровень метастазирования.
После проведения всех диагностических манипуляций врачи определяют способы лечения злокачественного новообразования.
Если стадия развития опухоли и ее локализация позволяют провести операцию, новообразование удаляют при помощи хирургического вмешательства, после которого пациенту назначается комплекс лучевой и химической терапии.
Симптоматическая терапия
Проведение симптоматической терапии направлено на то, чтобы устранить или хотя бы снизить основную симптоматику заболевания. Обычно проводится:
- лечение асцита — удаление скопившейся жидкости посредством пункции брюшной стенки;
- устранение болевого синдрома — если у пациента наблюдаются сильнейшие боли, ему могут быть назначены болеутоляющие средства с наркотическим содержимым;
- улучшение работы пищеварительной системы — необходимо для улучшения усвоения организмом пищи;
- внутривенное вливание растворов — направлено на дезинтоксикацию и нормализацию состава крови;
- использование мочегонных средств — необходимо для выведения избытков жидкости в организме.

Также пациентам могут быть назначены и другие лекарственные средства, необходимые для улучшения функциональности сердечной мышцы или сосудистой системы. Пациенты обязательно должны находиться в условиях стационара под наблюдением медицинских сотрудников.
Прогноз
Обычно вовлечение брюшиной оболочки характеризует раковую опухоль 3-4 степени. Прогнозы для пациентов с диагностированным канцероматозом брюшины не самые благоприятные.
Точно сказать, сколько жить больным с этим диагнозом, нельзя, так как многое зависит от размеров пораженной области и распространенности метастазов.
В случае, когда поражена небольшая область брюшины, можно провести ее удаление, что позволит увеличить продолжительность жизни больного на несколько лет.
Если канцероматоз поражает обширную часть брюшины, срок жизни составляет всего несколько месяцев. Таким больным назначают паллиативную терапию, которая предусматривает поддержание жизнедеятельности пациента в течение этого периода.
Таким больным назначают паллиативную терапию, которая предусматривает поддержание жизнедеятельности пациента в течение этого периода.
Канцероматоз брюшины: лечение, срок жизни, симптомы и диагностика
Канцероматоз брюшины – это вторичные метастазы, поражающие плевру с брюшиной. Вторичный очаг считается опасным проявлением злокачественной патологии, снижающим шанс на выздоровление больному.
Канцероматоз не относят к отдельному заболеванию. Болезнь является серьезным последствием злокачественного новообразования в печени, поджелудочной железе либо матке.
Проявляется выраженными признаками онкологической интоксикации, потерей веса и асцитом.
Характеристика заболевания
Канцероматоз брюшной полости – это вторичный онкологический очаг, возникающий как следствие злокачественного процесса органов брюшины. Вторичный злокачественный процесс провоцирует метастазирование опухоли, развивающейся в органе малого таза или другого участка. Первичный очаг патологии при разрастании выпускает множественные метастазы в отдаленные участки организма.
Лимфогенный перенос аномальных клеток провоцирует развитие канцероматоза в брюшной полости и плевры с выраженными признаками интоксикации. Новообразование прорастает в эпителиальный слой брюшины.
Раковый патоген проникает в серозный слой и закрепляется на стенках полости. Диссеминация сопровождается последующим формированием злокачественных узелков, напоминающих зерно. Узелки увеличиваются в размерах и постепенно сливаются, образуя опухоль большого размера.
Внутрибрюшная оболочка, пораженная злокачественным новообразованием, не способна выполнять экссудативную и резорбтивную функции. В связи с этим в полости накапливается жидкость, развивается асцит.
Чаще всего патология развивается у людей с наличием раковой опухоли органов пищеварительного тракта – желудка, толстой кишки, кишечника, поджелудочной железы. Кишечный и желудочный недуг развивается стремительно, вовлекая в процесс жизненно важные системы организма. Спровоцировать заболевание у женщин может рак матки или яичников.
Поражение брюшной полости злокачественным процессом вторичного характера считается врачами неблагоприятным прогнозом течения. Болезнь плохо поддаётся терапии, что значительно усложняет жизнь пациента.
Карцинома в ткани лёгкого может спровоцировать вторичный очаг – канцероматоз лёгких. Встречаются единичные образования и множественные. Может формироваться в одном органе или сразу в обоих.
Развитие протекает стремительно, что негативно сказывается на лечении и выздоровлении больного. Курсы химиотерапии останавливают увеличение опухоли на короткий период времени. Но после курса химиотерапии злокачественная клетка увеличивается в размерах ещё быстрее.
Заболевание встречается у 35% больных раком. Из этого количества у 40% первичный очаг присутствовал в органах пищеварительного тракта – желудка и поджелудочной железы. Но в медицинской практике есть примеры развития патологии из-за злокачественного процесса совершенно другого участка.
Код по МКБ-10 болезнь имеет С78. 6 «Вторичное злокачественное новообразование брюшины и забрюшинного пространства. Злокачественный асцит».
6 «Вторичное злокачественное новообразование брюшины и забрюшинного пространства. Злокачественный асцит».
Причины развития заболевания
Главной причиной развития канцероматоза считается первичный очаг злокачественного процесса. Раковая опухоль способна формировать метастазные ростки, которые проникают в ближайшие и отдалённые участки человеческого тела. Происходит это обычно на последней стадии болезни.
Распространение метастазов по организму происходит:
- С кровью либо лимфой.
- Первичный раковый очаг проникает в брюшную полость с последующим закреплением на стенках полости.
- После хирургического удаления первой раковой опухоли.
Внутрибрюшная полость совместно с серозной оболочкой имеет площадь равную 2 м2. Раковые ростки, проникая в данную область, способны сформироваться на огромном участке. Стенки и складки органа соприкасаются друг с другом, что увеличивает скорость развития патологии.
Стенки и складки органа соприкасаются друг с другом, что увеличивает скорость развития патологии.
Стремительное формирование патологии провоцирует наличие сопутствующих факторов:
- Брюшная полость находится в опасной близости с органами желудочно-кишечного тракта.
- Внутренние складки постоянно соприкасаются друг с другом.
- Присутствует огромное количество кровеносных и лимфатических сосудов.
Формирование новообразований происходит на участках, не подверженных перистальтике кишечника. Размер первичного очага влияет на риск развития канцероматоза. Чем крупнее опухоль, тем быстрее и глубже происходит проникание метастазов в ткани брюшины.
Недифференцированный рак желудка всегда сопровождается формированием канцероматоза.
Признаки патологии
При раке первичного очага у больного присутствуют выраженные симптомы поражения конкретного органа. Но в некоторых ситуациях первые признаки опасного заболевания появляются при канцероматозе. Именно это позволяет заподозрить болезнь и поставить правильный диагноз.
Именно это позволяет заподозрить болезнь и поставить правильный диагноз.
Патология обнаруживает следующие признаки:
- Появляются приступообразные болевые спазмы в области живота – постоянные или периодические, с ноющим характером.
- У больного резко увеличивается живот при заметной общей потере веса – в брюшной полости происходит накопление жидкости.
- Наблюдаются приступы тошноты с ротными позывами.
- Болевые ощущения с коликами в области живота.
- Сбой в работе кишечника – длительный запор сменяет диарея.
- Отмечается выраженная мышечная слабость.
- Температура тела принимает термальные показатели на фоне яркого озноба.
- Усиленное потоотделение.
- Сильные головные боли и боли в мышцах.
Болезнь протекает на фоне стремительного ухудшения самочувствия больного. Человек доставляется по скорой в отделение хирургии или гастроэнтерологии. В стационаре после диагностирования ставится правильный и точный диагноз.
Классификация болезни
Канцероматоз брюшной полости классифицируют согласно расположению метастазных отростков и их количеству:
- Стадия Р1 характеризуется локальным расположением узла с одним злокачественным поражением.
- На стадии Р2 присутствует несколько раковых участков, подтверждающих болезнь. Между пораженными очагами выявляются участки здоровых тканей.
- Стадия Р3 соответствует 4 степени злокачественности. Выявляется множество злокачественных новообразований с признаками слияния в единый очаг.
Диагностика заболевания
Выявить болезнь без проведения обследования врач может у пациента онкологического центра с терапией раковой болезни. В остальных случаях требуется проведение расширенного обследования организма больного. Диагностика включает следующие процедуры:
- На УЗИ исследуют органы брюшины с малым тазом. Здесь же выявляется первичный очаг с признаками внутренних изменений в ткани органа. Врач определяет размер, форму и точную локализацию образования.

- При помощи компьютерной томографии изучают орган структурно. По КТ определяются все злокачественные участки, структура с локализацией.
- МРТ и МСКТ проводят с использованием контраста – это позволяет обнаружить отдаленные метастазы и степень поражения лимфатических узлов.
- Лапароскопия требуется для внутреннего изучения поражённых стенок брюшины и получения биологического образца. Образец исследуется в лаборатории биопсическим методом.
- Кровь изучается анализом ОТ-ПЦР. Врачи на основе данного анализа точно выясняет место первичного очага болезни.
Порой установить первичный участок развития патологии не удаётся. В остальных случаях методы диагностики дают подробную информацию о заболевании. Обследование позволяет установить степень поражения организма и назначить адекватное лечение.
Лечение заболевания
Процесс лечения пациента с диагнозом канцероматоза брюшины долгий и сложный. Результат может быть положительным и отрицательным. Неблагоприятный результат терапии случается чаще.
Неблагоприятный результат терапии случается чаще.
Болезнь можно вылечить на ранних сроках развития и с применением новейших методик и аппаратуры в медицине. В основном применяется хирургическое иссечение злокачественного уплотнения с курсами химиотерапии.
В последние годы разработано много новых эффективных методов борьбы с онкологией. Медицина не останавливается на этом и ищет новые варианты лечения.
Удаление опухоли хирургическим методом проводится с иссечением первичного очага, больных лимфатических узлов. Также возможно удаление органов, поражённых раковыми клетками – матки, желчного пузыря, участка толстого или тонкого кишечника и сигмовидной кишки.
Химиотерапия применяется как отдельное лечение, так и совместное с оперативным методом. В последнее время врачи предпочитают использовать перитонеальный гипертермический способ химиотерапии. Основа метода характеризуется вводом лекарственных препаратов в брюшную полость при помощи горячего воздуха. Иногда это делают сразу после операции или в период проведения операции.
Иногда это делают сразу после операции или в период проведения операции.
Противоопухолевый раствор держат в полости 60 мин. Затем выводят. За это время происходит непрерывная циркуляция лечебного раствора, который уничтожает злокачественные патогены.
Выявление первичного очага патологии считается первоочередной задачей врачей. Обнаружение болезни с точными размерами и степенью развития позволяет провести полное лечение. Это повышает шанс пациента на выздоровление.
Локализация патологии в доступном и операбельном месте позволяет провести хирургическое иссечение узла. После операции назначаются курсы химиотерапии и облучения гамма-лучами. Дозировки и курсы подбираются индивидуально согласно физическим показателям и медицинским исследованиям пациента.
Параллельно основным способам лечения используется симптоматическое купирование негативных симптомов болезни:
- Делается специальный прокол для вывода лишней жидкости из брюшины.
- Болевой синдром блокируется приемом обезболивающих препаратов.

- Назначаются пробиотики для улучшения перистальтики органов пищеварения.
- Вводятся капельницы с физрастворами для восполнения витаминного и минерального дефицита.
- Мочегонные средства способствуют выводу лишней жидкости.
- Корректируется питание – назначается специальная диета.
Пациент постоянно находится под наблюдением лечащего врача. После курса терапии проводится повторное диагностирование организма. Требуется это для корректировки терапии.
Прогноз лечения
Срок жизни больного зависит от степени поражения организма онкологическим процессом. Сколько проживёт человек, врач сказать не сможет точно. Зависит это от физических показателей и психологического настроя больного.
Поражение незначительного участка брюшины – процент выживаемости выше у пациентов. Продолжительность жизни составляет до 3 лет и более. Если первичный очаг поддаётся лечению, шансы увеличиваются.
При поражении большей площади органа прогноз для пациента неблагоприятный.
Летальный исход диагностируется через несколько месяцев. Применяется паллиативная терапия для купирования болевых синдромов и психологического дискомфорта.
При данном заболевании всё зависит от срока выявления и психологического настроя пациента. Доказано учёными, что позитивный настрой на выздоровление значительно увеличивал шансы на выздоровление и долгую жизнь.
Канцероматоз брюшины: лечение, срок жизни и симптомы. Продолжительность жизни пациентов с канцероматозом брюшной полости
При любых злокачественных образованиях могут развиться метастазы. При наличии вторичных очагов опухоли шансы пациента на выздоровление снижаются. Многие пациенты, которые обращаются к врачам-онкологам, интересуются, что такое канцероматоз брюшины и может ли он развиться при онкологии.
Канцероматоз брюшины является вторичным онкологическим заболеванием, прогноз которого в большинстве случаев неблагоприятен.
Пациентам с данным диагнозом назначается паллиативное лечение, методы которого направлены на поддержание жизнедеятельности.
Лечение канцероматоза брюшной полости осуществляется в Юсуповской больнице, опытные специалисты которой принимают даже тех пациентов, от которых отказались в других клиниках.
Канцероматоз брюшины: что это такое
Канцероматоз брюшной полости является онкологическим заболеванием, формирование которого происходит из-за распространения раковых клеток из первичного очага. Лечение данного заболевания предполагает оперативное вмешательство с последующим проведением химиотерапии.
Данное заболевание может развиваться на фоне злокачественной опухоли любого органа, у женщин диагностируется канцероматоз брюшины при раке яичников.
Врачами-онкологами при постановке диагноза применяется классификация в зависимости от локализации и количества метастазов:
- степень Р1 – локальное развитие онкологического процесса;
- степень Р2 –несколько пораженных участков серозной оболочки;
- степень Р3 – множественные очаги пораженной ткани.
Если у пациента диагностирован канцероматоз брюшины, продолжительность жизни сокращается. Опытные врачи-онкологи Юсуповской больницы при лечении пациентов проводят полную диагностику для определения текущего состояния, разрабатывают программу лечения. Современное оборудование, которым оснащена Юсуповская больница, позволяет проводить комплексное обследование.
Опытные врачи-онкологи Юсуповской больницы при лечении пациентов проводят полную диагностику для определения текущего состояния, разрабатывают программу лечения. Современное оборудование, которым оснащена Юсуповская больница, позволяет проводить комплексное обследование.
Вопросы многих пациентов связаны с лечением канцероматоза брюшины. Благоприятность прогноза при данном онкологическом процессе зависит от степени поражения и выбранного лечения. Для установления степени поражения проводится лабораторно-инструментальное обследование.
Признаки канцероматоза брюшины
Канцероматоз брюшины, лечение которого требует пребывания пациента в стационаре и круглосуточного наблюдения, является вторичным заболеванием. Клиническая картина при данном диагнозе определяется признаками первичного злокачественного образования. Канцероматоз брюшины при раке характеризуется формированием асцита – скоплением в брюшной полости свободной жидкости.
Основные признаки канцероматоза брюшины:
- быстро снижается масса тела и увеличивается живот;
- нарушение пищеварения;
- обильное потоотделение;
- тупые, сильные боли в области живота;
- характеризуют канцероматоз брюшины боли под грудью;
- у больного отмечаются признаки сильной интоксикации;
- жидкий стул, в котором может присутствовать кровь;
По мере прогрессирования онкологического процесса у больного может происходить потеря сознания и наблюдаться состояние бреда. Канцероматоз брюшины при раке требует незамедлительного лечения, поэтому Юсуповская больница принимает пациентов в тяжелом состоянии ежедневно 24 часа в сутки.
Канцероматоз брюшины при раке требует незамедлительного лечения, поэтому Юсуповская больница принимает пациентов в тяжелом состоянии ежедневно 24 часа в сутки.
Канцероматоз и асцит могут угрожать жизни больного, поэтому люди, находящиеся в зоне риска, должны знать симптомы болезни, чтобы своевременно обратиться к врачу-онкологу. Специалисты Юсуповской больницы отвечают на вопросы пациентов: канцероматоз брюшной полости — что это такое, какие способы лечения существуют и какова продолжительность жизни.
Канцероматоз брюшины (на КТ): причины развития
Канцероматоз брюшины, лечение которого сочетает оперативное вмешательство и химиотерапию, формируется на фоне имеющегося первичного очага. Раковые клетки при развитии становятся подвижными, поэтому они начинают отделяться от опухоли и распространяться по организму.
Канцероматоз брюшины и асцит распространяется стремительно, так как перемещение раковых клеток осуществляется несколькими путями:
- с током крови и лимфатической жидкости;
- при удалении первичной раковой опухоли, например, канцероматоз брюшины при раке яичников;
- при прорастании злокачественной опухоли в брюшину.

Масштаб поражения при данном заболевании может быть достаточно большим, так как площадь брюшины может достигать двух квадратных метров. Канцероматоз брюшины, лечение и срок жизни при котором взаимосвязаны, быстро распространяется из-за анатомического строения брюшной полости. Канцероматоз брюшины с гиперметаболизмом сопровождается такими же симптомами.
Обратитесь в Юсуповскую больницу, если у Вас диагностирован канцероматоз брюшины, лечение онкологического процесса осуществляется в клинике онкологии. Специалисты клиники онкологии, входящей в состав Юсуповской больницы, помогают даже тем пациентам, у которых выявлен канцероматоз брюшины 4 стадии.
Канцероматоз брюшной полости: диагностика заболевания
Актуальные вопросы пациентов, у которых выявлен канцероматоз брюшины, включают лечение и продолжительность жизни. Заподозрить онкологический процесс способен врач при взаимодействии с пациентами, имеющими раковое заболевание.
Если у пациента происходит снижение массы тела и присутствуют признаки интоксикации, врач назначает обследование, чтобы опровергнуть или подтвердить диагноз.
Диагностические меры при подозрении на канцероматоз брюшины и асцит:
- ультразвуковое исследование органов малого таза и брюшной полости;
- анализ крови;
- проведение лапароскопии для осмотра брюшины и забора тканей для биопсии;
- компьютерная томография;
- МСКТ с контрастным веществом позволяет выявить поражение лимфатических узлов.
Канцероматоз брюшины, продолжительность жизни при котором зависит от степени поражения тканей, может вызвать сложности при диагностике в том случае, если не определен первичный очаг. Врачи-онкологи Юсуповской больницы при консультации пациента оценивают прогноз на основе имеющихся данных обследования, назначают терапию и регулярно контролируют ее эффективность.
Лечение канцероматоза брюшной полости
Канцероматоз брюшной полости, прогноз при котором во многом зависит от адекватности терапии, серьезно отражается на здоровье пациента. Первым этапом лечения злокачественной опухоли является выявление первичного очага, его расположение и стадию. Терапия при патологии назначается только после получения специалистом необходимых данных.
Терапия при патологии назначается только после получения специалистом необходимых данных.
Хирургические методы терапии применимы в том случае, когда это позволяет стадия и расположение раковой опухоли. Канцероматоз брюшной полости 4 степени, прогноз при котором неблагоприятен, не предполагает оперативного вмешательства. Канцероматоз брюшины и асцит требуют лечения химиотерапией.
При данном заболевании проводится симптоматическая терапия, которая предполагает обезболивание, удаление скопившейся жидкости, предотвращение интоксикации, вывод лишней жидкости и улучшение пищеварения.
Многие пациенты, у которых диагностирован канцероматоз брюшины, лечение народными средствами рассматривают в качестве метода, который способен улучшить их состояние. Врачи-онкологи Юсуповской больницы не рекомендуют использовать народные методы, так как некоторые из них могут ухудшать состояние и вызывать прогрессирование болезни.
Канцероматоз брюшины: продолжительность жизни
Канцероматоз брюшины и асцит, прогноз при которых зависит от многих факторов, может затрагивать небольшую часть брюшины. Если операция проведена своевременно, то прогноз является относительно благоприятным. Однако для этого больному необходимо строго придерживаться рекомендаций врача-онколога.
Если операция проведена своевременно, то прогноз является относительно благоприятным. Однако для этого больному необходимо строго придерживаться рекомендаций врача-онколога.
Если онкологическое заболевание распространилось на большую площадь серозной оболочки, в течение нескольких месяцев может наступить летальный исход. Однако качественная паллиативная терапия способна улучшить прогноз и облегчить состояние больного.
Канцероматоз брюшины при раке: что это такое, симптомы, причины канцероматоза брюшной полости, прогноз
Канцероматоз брюшины — опухолевое поражение листков слизистой оболочки, покрывающей органы и внутреннюю стенку живота. Преимущественно обусловлен разрастанием метастазов рака в брюшной полости, иногда возможно развитие первичного злокачественного процесса — мезотелиомы в самой брюшине.
Метастатическое поражение правильнее называть «карциноматоз», поскольку карцинома — синоним рака. Аналогично метастазы саркомы в брюшину именуют «саркоматоз».
Частое, но не обязательное проявление перитонеального канцероматоза — выработка асцитической жидкости. С асцитом или без, но поражение брюшины злокачественным процессом всегда угрожает жизни больного и требует очень непростого лечения.
Причины канцероматоза брюшины
Не всякая оторвавшаяся от материнской раковой опухоли клетка способна стать метастазом, в кровеносном русле погибает львиная доля циркулирующих злокачественных клеток. Для обретения способности стать метастазом раковая клетка должна измениться внутренне — научиться вырабатывать вещества, позволяющие самостоятельно жить и внедриться в другом месте, подавляя нормальные клетки.
Оторвавшиеся от узла клетки мигрируют на большие расстояния, раздвигая нормальные клетки, имплантируются в брюшную слизистую, способны даже внедряться внутрь других клеток. После закрепления на местности, начинается размножение и образование целой клеточной колонии.
Кроме переноса метастатических клеток по крови и лимфе, распространение идёт и внутри полости живота — трансцеломически.
Не совсем ясно почему злокачественные клетки задерживаются в брюшине, предполагается благотворное действие микроклимата.
Большинство метастазов находят в местах с более спокойной обстановкой и слабой перистальтикой органов, или там, где активно всасывается внутрибрюшная жидкость.
Часто клетки «разбрасываются» во время операции, причём при лапароскопическом вмешательстве вероятность обсеменения вдвое ниже, чем при классической хирургии.
Во время операции обязательно проводится профилактика раковой диссеминации путём неоднократной обработки специальными растворами, но самый эффективный способ очищения от диссеминатов — внутриполостная химиотерапия на фоне гипертермии (HIPEC).
При каких заболеваниях развивается
Перитонеальный канцероматоз диагностируют у каждого третьего пациента с новообразованием желудочно-кишечного тракта. Метастазы по брюшине характерны для карцином желудка и поджелудочной железы — поражается до 40% пациентов.
При раке кишечника канцероматоз обнаруживают только у десятой части больных.
Максимально высокий процент обусловлен злокачественными процессами яичников — на момент выявления болезни две из трёх пациенток уже имеют опухолевые узлы на брюшине.
Вероятность канцероматоза зависит от степени агрессивности раковых клеток и величины первичной опухоли, так при тотальном инфильтративном раке желудка его выявляют чаще, чем при локальном процессе, не разрушившем наружную серозную оболочку органа.
Тем не менее, ни при одном из злокачественных процессов любой локализации, будь то рак молочной железы или простаты, лёгкого или носоглотки, не исключается внутрибрюшинное метастазирование. Посмертно канцероматозные изменения выявляют у каждого третьего, погибшего от прогрессирования заболевания.
Для сарком такая локализация метастазов нетипична, саркоматоз брюшины констатируется едва ли у трёх из сотни больных. В редчайших случаях совершенно доброкачественные по гистологии муцинозные аденома аппендикса и цистаденома яичников тоже способны привести к обсеменению брюшины с выработкой гелеобразного секрета.
У одного из миллиона, и много чаще это будет женщина, выявляют муцинозную аденому аппендикса или муцинозную цистаденому яичников, в последующем часто приводящие к обсеменению брюшины. Распространение аденомуцинозных клеток в полости живота с выработкой гелеобразного секрета именуют уже «псевдомиксома», зачастую при в этой стадии заболевания не удаётся определить первоисточник опухоли.
Диагностика канцероматоза брюшины
Не представляет трудности выявление опухолевого поражения брюшины при асците, в отсутствии выработки патологического секрета диагностика опирается на визуализацию — УЗИ и КТ с контрастированием.
При УЗИ на внутреннем листке, прилежащем к мышцам брюшной стенки, в норме очень тонком и незаметном, можно увидеть напластования толщиной в несколько сантиметров, практически не прослеживаются только мелкие узелки.
КТ с контрастным усилением много информативнее УЗИ, способно выявить сантиметровые образования. Наиболее точный диагностический метод — лапароскопия.
Это обследование обязательно при карциноме желудка, при раке яичников предпочтительна операция — диагностика и лечение одновременно.
Для точного определения первоисточника злокачественного процесса исследуется асцитическая жидкость, получаемая при лапароскопии или пункции. Из экссудата выделяют осадок, который изучают под микроскопом и проводят специфические реакции — ПЦР и ИГХ.
На этапе первичной диагностики ПЭТ не всегда информативна, поскольку далеко не все злокачественные клетки легкого, печени, почек способны накапливать изотопы.
Вне всяких сомнений, самый оптимальный метод диагностики — получение кусочка опухолевой ткани для исследования. Биопсия не целесообразна при известном источнике метастазов и после недавнего лечения первичного рака.
Стадии канцероматоза брюшной полости
Стадирование перитонеального канцероматоза нельзя назвать точным, все классификации приблизительны в определении объёма повреждений и не уточняют локализацию узлов.
Зачастую, стадирование даёт общее представление о прогнозе эффективности лечебных мероприятий, нежели информирует о настоящем состоянии внутри полости живота.
Разработанная японскими специалистами градация опухолевого распространения по трём степеням, учитывает общий объём поражения, без числа и размеров очагов:
- P1 — ограниченное;
- P2 — разделённые нормальной тканью очаги;
- P3 — множество узлов.
Во время операции хирурги определяют индекс перитонеального канцероматоза (РСI), измеряя узелки в 13 регионах полости, общая сумма баллов влияет на тактику лечения, в первую очередь, на возможность удаления брюшины — перитонэктомию и целесообразность внутриполостной химиотерапии. При некоторых злокачественных процессах прибегают к сложным формулам расчёта РСI.
Наибольшее представление о размерах ракового повреждения даёт стадирование по степеням:
- 0 — в полости чисто;
- I — в одной анатомической зоне узелки до 5 мм;
- II — множественные узелки до 5 мм;
- III — локальное поражение 0.
 5–2 см;
5–2 см; - IV — 2-сантиметровые узелки
Течение канцероматоза определяется не столько размером метастатического узла, сколь клеточной потенцией к прогрессии и выработке асцитической жидкости, общей площадью опухолевой трансформации и клиническими проявлениями.
Симптомы канцероматоза брюшной полости
Перитонеальный канцероматоз небольшой протяжённости может не проявлять себя симптомами, особенно в отсутствии выработки асцитической жидкости. С другой стороны, жидкость может продуцироваться и при отсутствии видимых метастазов.
Как правило, симптоматика неспецифична и в разном наборе могут отмечаться:
- меняющие локализацию болезненные ощущения, а чаще — непонятный дискомфорт в полости живота;
- нарастающая слабость до утраты работоспособности;
- потеря веса при стабильном диетическом режиме;
- прогрессирующее снижение аппетита;
- функциональные нарушения со стороны органов ЖКТ.
Дальнейшее нарастание раковых повреждений сопровождается опухолевой интоксикацией, сдавление желудка опухолевыми узлами осложняется тошнотой и рвотой, кишечника — запорами и поносами с усугублением частичной непроходимости. Распад крупных узлов может вызывать боли и повышение температуры.
Распад крупных узлов может вызывать боли и повышение температуры.
Асцит нарушает процесс дыхания и вызывает сердечную недостаточность с постоянными отёками, а частая эвакуация патологической жидкости приводит к белковой недостаточности.
Как лечат канцероматоз брюшины
Ни один из современных методов лечения канцероматоза не гарантирует радикального удаления опухоли, не способен излечить, но может улучшить состояние и существенно продлить жизнь.
Хирургическое лечение канцероматоза технически сложное для оперирующей бригады и трудно переносимое пациентом, поскольку предполагает удаление первичного рака, увеличенных лимфатических узлов, сальниковых сумок и всех видимых опухолевых образований вместе с брюшиной.
Перитонэктомия — многоэтапное вмешательство, включающее удаление нескольких органов и отделов брюшной полости. В результате операции пациент может остаться без селезёнки, желчного пузыря, части кишечника, матки с придатками.
Стандарт терапии канцероматоза — химиотерапия системная и локальная — внутрибрюшинная после удаления асцита или через лапаропорт, установленный во время операции. Эффективность лекарственной терапии невысокая, за исключением случаев первичного рака яичников. Таргетные и иммуно-онкологические препараты только изучаются в клинических испытаниях.
Эффективность лекарственной терапии невысокая, за исключением случаев первичного рака яичников. Таргетные и иммуно-онкологические препараты только изучаются в клинических испытаниях.
Какие методики терапии дают лучший результат
Наиболее высокий эффект демонстрирует комбинация 3 методов лечения рака:
- операция с максимально возможным удалением злокачественных новообразований — циторедукция;
- локальная внутрибрюшинная гипертермия;
- внутриполостное введение химиопрепаратов.
Использование во время хирургического вмешательства интраперитонеальной гипертермической химиотерапии (ИГХТ или HIPEC) позволяет максимально долго поддерживать очень высокую концентрацию цитостатика непосредственно в зоне поражения и усилить лекарственное воздействие нагреванием тканей.
При весьма скромных исторических результатах хирургического вмешательства устойчивой к цитостатикам псевдомиксомы только HIPEC открывает пациентам перспективу на долгую жизнь.
Технология ИГХТ такова: в течение полутора часов внутрь брюшной полости под давлением подаётся нагретый химиопрепарат в дозе, существенно превышающей максимально разрешённую для внутривенного введения.
За счёт локального использования изменяется спектр токсических реакций, исключается опасное для жизни повреждение кроветворения, но возможна боль в животе и временное нарушение функционирования органов ЖКТ.
Интраоперационная фотодинамическая терапия (ФДТ), когда на выявленные с помощью фотосенсибилизатора очаги опухоли воздействуют лазером, уступает HIPEC по результативности, поскольку лазером невозможно проникнуть во все «закоулки» брюшной полости. Тем не менее, целесообразно использование фотодинамический терапии при крупных и немногочисленных раковых узлах.
Прогноз при канцероматозном поражении
На течение процесса влияет объём поражения на момент начала терапии, степень злокачественности опухоли, в свою очередь определяющая чувствительность к химиотерапии. Основополагающее влияние оказывает талант и опыт хирурга, и несомненно, правильность выбора лечебной тактики.
Однозначно революционные результаты в клинических испытаниях показала только HIPEC.
После интраоперационной гипертермической ХТ пятилетняя выживаемость при канцероматозе рака желудка выросла максимально до 20%, все прочие методы исключали столь долгое дожитие.
При раке толстой кишки с метастазами по брюшине каждый третий пациент прожил более 5 лет, при карциноме слепой кишки и аппендикса — шестеро из десяти вступили во вторую пятилетку жизни.
Канцероматоз брюшины — причины, симптомы, диагностика и лечение
Канцероматоз брюшины – вторичное злокачественное поражение брюшины, являющееся следствием диссеминации эпителиальных опухолей желудочно-кишечного тракта, репродуктивной системы, реже – первичных перитонеальных новообразований. Признаками канцероматоза брюшины являются асцитический синдром, прогрессирующее снижение веса, тошнота, слабость. Диагностика основана на визуализации очагов поражения при проведении МСКТ, УЗИ органов брюшной полости, лапароскопии, цитологическом анализе асцитической жидкости. Лечение включает хирургическое удаление первичного очага с метастазами по брюшине и химиотерапию. Прогноз неблагоприятный.
Прогноз неблагоприятный.
Общие сведения
Канцероматоз брюшины – наиболее часто встречающийся вариант метастазирования онкологических заболеваний различной локализации. Согласно имплантационной теории развития данной патологии, источником поражения являются опухолевые клетки, которые отделились от первичного очага и попали в брюшную полость с серозной жидкостью. Основным пусковым механизмом данного процесса является утрата клетками опухоли факторов межклеточной адгезии.
Согласно данным статистики, канцероматоз брюшины встречается у 20-35% пациентов с онкопатологией: в 40% случаев данное осложнение формируется при опухолях желудочно-кишечного тракта, в 30% — при раке яичников (причем на момент верификации диагноза рака яичников у подавляющего большинства пациенток уже имеет место поражение брюшины). Канцероматоз брюшины является неблагоприятным прогностическим фактором; данная форма прогрессирующего опухолевого поражения практически не поддается хирургическому лечению, а химиотерапия улучшает состояние лишь на некоторое время.
Канцероматоз брюшины
Причины канцероматоза
Канцероматоз брюшины является вторичным опухолевым поражением, результатом прогрессирования рака различной локализации. Наиболее часто поражением брюшины осложняется рак желудка, тонкого кишечника, поджелудочной железы, злокачественные опухоли яичников, матки, маточных труб, печеночноклеточный рак, реже — первичные опухоли брюшины (перитонеальная мезотелиома). В ряде случаев первичный очаг остается неустановленным.
Развитие канцероматоза брюшины является поэтапным процессом. Первый этап – распространение опухолевых клеток из первичного очага поражения. Это связано с нарушением межклеточного взаимодействия и приобретением клетками опухоли подвижности. При этом эпителиальные клетки меняют фенотип на мезенхимальный, происходит деградация межклеточного матрикса. Распространение опухолевых клеток может происходить в ходе оперативного вмешательства. Их механическое отделение возможно при повреждении лимфатических или кровеносных сосудов. Попавшие в брюшную полость клетки опухоли мигрируют под действием силы тяжести, сокращений внутренних органов, имплантируются в местах повышенной резорбции: большом сальнике, в области слепой кишки, дугласовых карманах.
Попавшие в брюшную полость клетки опухоли мигрируют под действием силы тяжести, сокращений внутренних органов, имплантируются в местах повышенной резорбции: большом сальнике, в области слепой кишки, дугласовых карманах.
На втором этапе опухолевые клетки взаимодействуют с мезотелием брюшины. Механизмы адгезии определяются природой клеток, особенностями морфологии брюшины, а также наличием участков ее повреждения. Далее клетки закрепляются в мезотелии, происходит их горизонтальное распространение по поверхности перитонеума, а затем инвазивный рост – прорастание в базальную мембрану, соединительную ткань. Следующим этапом является стимуляция неоангиогенеза – обязательного фактора развития опухоли. Морфопатогенетические механизмы формирования канцероматоза брюшины еще недостаточно изучены, в связи с чем отсутствуют радикальные методы лечения.
Частота развития канцероматоза брюшины зависит не только от первичной локализации опухоли, но и от ее размеров, глубины инвазии, гистотипа, степени дифференцировки (недифференцированный рак желудка осложняется поражением брюшины в 60% случаев, ограниченный – в 15%).
Классификация
Единая классификация данного заболевания отсутствует, поскольку характеристики первичных опухолей, приводящих к поражению брюшины, весьма разнообразны. Наиболее распространена классификация канцероматоза брюшины в зависимости от числа, локализации метастазов, которая предусматривает три степени:
- Р1 – локальное поражение брюшины
- Р2 – несколько областей канцероматоза, разделенных здоровыми участками брюшины
- Р3 – многочисленные очаги поражения
Также используется метод определения индекса канцероматоза брюшины: суммируются баллы измерения максимальных очагов поражения (0-3 балла) в каждой из 13 наиболее вероятных областей поражения брюшины.
Симптомы канцероматоза
Канцероматоз брюшины является вторичным поражением, поэтому его клиническая картина во многом определяется проявлениями первичной опухоли. Характерным признаком является обильный выпот в брюшную полость – формирование асцита. Зачастую асцитический синдром, развивающийся вследствие обструкции лимфатического дренажа, является единственным признаком заболевания, и пациенты могут поступать в отделение гастроэнтерологии или терапии для диагностики причин асцита. Состояние больных тяжелое, характерна значительная потеря веса. Неспецифическими признаками являются тошнота, рвота, выраженная слабость, утомляемость. При наличии крупных метастазов возможно их прощупывание через брюшную стенку.
Зачастую асцитический синдром, развивающийся вследствие обструкции лимфатического дренажа, является единственным признаком заболевания, и пациенты могут поступать в отделение гастроэнтерологии или терапии для диагностики причин асцита. Состояние больных тяжелое, характерна значительная потеря веса. Неспецифическими признаками являются тошнота, рвота, выраженная слабость, утомляемость. При наличии крупных метастазов возможно их прощупывание через брюшную стенку.
Диагностика
Канцероматоз брюшины имеет неспецифическую клиническую картину, однако консультация гастроэнтеролога или онколога позволяет предположить данное заболевание на основании симптомов и физикальных данных. Лабораторные анализы не выявляют специфических изменений: определяется лейкоцитоз, ускорение СОЭ. Диагностическая программа обязательно должна включать УЗИ органов брюшной полости и малого таза, позволяющее обнаружить распространенное поражение, а также МСКТ брюшной полости с контрастированием. Обязательно проводится цитологическое исследование асцитической жидкости, полученной при лапароцентезе, которое дает возможность впервые установить или подтвердить диагноз, а также определить гистогенез клеток опухоли.
Обязательно проводится цитологическое исследование асцитической жидкости, полученной при лапароцентезе, которое дает возможность впервые установить или подтвердить диагноз, а также определить гистогенез клеток опухоли.
Информативным методом диагностики канцероматоза брюшины является лапароскопия с осмотром перитонеума, дугласова пространства, диафрагмы, сопровождающаяся биопсией. Высокой специфичностью обладает обратнотранскриптазная полимеразная цепная реакция (ОТ-ПЦР), которая позволяет определить источник диссеминации даже при малом количестве опухолевых клеток.
Сложности диагностики возникают при наличии канцероматоза брюшины без выявленного первичного очага. Данная форма заболевания, встречающаяся в 3-5 % случаев, проявляется клинически только при уже сформировавшемся поражении брюшины. При этом первичный очаг может иметь настолько малые размеры, что его прижизненное обнаружение невозможно.
В качестве дополнительных методов может использоваться определение онкомаркеров (кислой фосфатазы, раково-эмбрионального антигена, альфа-фетопротеина, бета-субъединицы ХГЧ). Такая диагностика не обладает высокой специфичностью, но применяется для оценки прогноза, раннего выявления диссеминации, рецидивов, а также для контроля эффективности лечения.
Такая диагностика не обладает высокой специфичностью, но применяется для оценки прогноза, раннего выявления диссеминации, рецидивов, а также для контроля эффективности лечения.
Лечение канцероматоза брюшины
Хирургическое лечение канцероматоза включает удаление первичной опухоли с регионарными метастазами и отсевами по брюшине. Циторедуктивная операция выполняется в объеме перитонэктомии, может сочетаться с удалением матки и придатков, сигмовидной кишки, желчного пузыря. После проведения операции оценивается индекс полноты циторедукции: СС-0: после проведения хирургического лечения очаги поражения визуально не определяются; СС-1: имеются неудаленные очаги диаметром до 2,5 мм; СС-2: очаги диаметром 2,5 мм – 2,5 см; СС-3: очаги поражения более 2,5 см в диаметре. Однако даже при определении индекса СС-0 нельзя полностью исключить возможность диссеминации, поэтому обязательно проводится химиотерапия.
Системная химиотерапия при канцероматозе брюшины имеет определенные недостатки. На сегодняшний день эффективным методом лечения является интраперитонеальная химиотерапия. При местном введении цитостатических препаратов есть возможность применения высоких дозировок, которые при системной терапии слишком токсичны. Использование гипертермии усиливает поступление активных веществ в опухолевые клетки. Существенным преимуществом является длительное нахождение препарата в брюшной полости. Гипертермическая внутрибрюшная химиотерапия проводится в ходе операции или после ее завершения; химиотерапевтический агент (чаще препараты платины) вводится подогретым до температуры 40-43 градуса. Время циркуляции раствора составляет 30-90 минут.
На сегодняшний день эффективным методом лечения является интраперитонеальная химиотерапия. При местном введении цитостатических препаратов есть возможность применения высоких дозировок, которые при системной терапии слишком токсичны. Использование гипертермии усиливает поступление активных веществ в опухолевые клетки. Существенным преимуществом является длительное нахождение препарата в брюшной полости. Гипертермическая внутрибрюшная химиотерапия проводится в ходе операции или после ее завершения; химиотерапевтический агент (чаще препараты платины) вводится подогретым до температуры 40-43 градуса. Время циркуляции раствора составляет 30-90 минут.
Альтернативным методом лечения канцероматоза брюшины является фотодинамическая терапия с локальным или системным введением фотосенсибилизатора. Данная методика основана на интраоперационном световом воздействии с применением лазера, которое приводит к прямому повреждению мембран опухолевых клеток. Но такое лечение не устраняет процессы ангиогенеза, поэтому его эффективность недостаточно высока.
Ни один из существующих на сегодняшний день методов лечения канцероматоза брюшины не вызывает полную регрессию опухолевых диссеминантов, а также не предупреждает рецидивирование заболевания, поэтому разработка оптимального лечения продолжается. Исследуется таргетная терапия, целью которой являются молекулярные мишени. Низкая эффективность противоопухолевой терапии обусловлена отсутствием достаточного понимания морфологии и патогенеза заболевания, унифицированной классификации, разнородностью первичных опухолей.
Прогноз и профилактика
Развитие канцероматоза брюшины при злокачественных новообразованиях всегда является неблагоприятным прогностическим признаком. Средняя продолжительность жизни пациентов составляет не более 12 месяцев, а пятилетняя выживаемость – до 10%. Не существует специфической профилактики данной формы поражения брюшины, важную роль играет своевременность выявления и адекватного лечения первичных опухолей. Однако во многих случаях симптомы канцероматоза брюшины возникают уже при значительной диссеминации раковых клеток по брюшной полости.
Опухоли сальника — StatPearls — NCBI Bookshelf
Непрерывное обучение
Сальник состоит из клеток мезотелиального происхождения. Сальник проявляет ангиогенную, фиброзную, стволовые клетки и иммунную активность, ответственную за стимуляцию васкуляризации, ускоренное заживление и ограничение инфекции в брюшной полости. Эти действия также могут привести к патологическим изменениям, таким как образование опухоли сальника. В этой статье описаны эпидемиология, проявления, гистопатология, исследования и лечение первичных опухолей сальника. В этом мероприятии рассматривается оценка и лечение опухолей сальника и подчеркивается роль межпрофессиональной группы в оценке и улучшении ухода за пациентами с этим заболеванием.
Цели:
Определите эпидемиологию первичных опухолей сальника.
Опишите оценку первичных опухолей сальника.
Объясните возможные варианты лечения первичных опухолей сальника.
Обзор стратегий межпрофессиональной бригады для улучшения координации помощи и коммуникации для улучшения лечения первичных опухолей сальника и улучшения результатов.

Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Введение
Сальник состоит из клеток мезотелиального происхождения. Говорят, что это тип висцеральной жировой ткани с общей площадью поверхности 1500 см2. Он висит перед органами брюшной полости, как фартук, а также связан с селезенкой, желудком, поджелудочной железой и толстой кишкой. Сальник проявляет ангиогенную, фиброзную, стволовые клетки и иммунную активность, ответственную за стимуляцию васкуляризации, ускоренное заживление и ограничение инфекции в брюшной полости. Эти действия также могут привести к патологическим изменениям, таким как образование опухоли сальника и метастазирование.[1] Первичные солидные опухоли большого сальника встречаются редко, всего 42 зарегистрированных случая; однако перитонеальные метастазы довольно распространены при некоторых опухолях, таких как стромальные опухоли желудочно-кишечного тракта и рак яичников.
Этиология
Эти опухоли являются спорадическими, и этиологические факторы, ответственные за такие опухоли, неизвестны.
Эпидемиология
Это редкие поражения, каждое из которых связано со скрытым началом.[3]
Липосаркома большого сальника — редкая опухоль; до июля 2019 г. в литературе описано 19 случаев. Девять случаев с 1936 по 2003 г., 10 случаев с 2003 по 2018 г. и один в 2019 г. Средний возраст пациентов в эти истории болезни составили 51,1 года.[4]
Лейомиосаркома большого сальника является редкой опухолью, и до октября 2016 г. в литературе было зарегистрировано 23 случая. Клинически эти опухоли проявляются на 5-м десятилетии жизни.[5] В то время как в другом исследовании было зарегистрировано 27 случаев. Средний возраст в этих случаях составлял 51 год, и это было немного чаще у мужчин.
Согласно сообщениям о случаях SFT (солитарных фиброзных опухолей) большого сальника, эта опухоль возникает на пятом-седьмом десятилетии жизни с соотношением мужчин и женщин 1:1. [7] 9[8]
[7] 9[8]
Патофизиология
Сальник называется депо висцерального жира. Его роль как «полицейского брюшной полости» была признана британским хирургом в начале 1900-х годов благодаря его свойствам перемещаться по брюшной полости и ограничивать инфекции и воспаления. Сальник содержит множество иммунных агрегатов, называемых «млочными пятнами», функция которых в значительной степени неизвестна. Говорят, что как свободные иммунные клетки, так и опухолевые клетки связываются с этими агрегатами.[9]]
Все первичные опухоли сальника спорадические и обычно злокачественные.[10] Но метастатические поражения распространены. Сообщаемые первичные опухоли сальника включают фибросаркому, веретеноклеточную саркому, липосаркому, лейомиому, гемангиоперицитому, липому и десмоидную опухоль, фиброму, мезотелиому, миосаркому, рабдомиосаркому, лейомиобластому и эндотелиому. Эти опухоли происходят из различных элементов, из которых состоит сальник, таких как жировая ткань, сосуды и лимфатическая ткань.
Первичная лейомиосаркома сальника — очень редкая опухоль; чаще лейомиосаркомы возникают в гладкомышечных клетках желудочно-кишечного тракта, забрюшинного пространства и мочеполового тракта. Из-за низкой частоты лейомиосаркомы сальника мало что известно о происхождении и поведении этих опухолей.
Солитарная фиброзная опухоль (SFT), ранее называвшаяся гемангиоперицитомой, представляет собой редкую мезенхимальную опухоль[7], часто происходящую из плевры; вовлечение сальника очень редко. От 78% до 88% этих опухолей являются доброкачественными, а от 12% до 22% злокачественными.[12] До 2015 г. в литературе было описано только 6 случаев SFT, возникающих из-за большого или малого сальника [13].
ГИСО (желудочно-кишечные стромальные опухоли) представляют собой мезенхимальные опухоли, возникающие из стенки желудочно-кишечного тракта, в основном из желудка. Однако редко они могут возникать из сальника, что обозначается как экстрагастроинтестинальные стромальные опухоли (EGIST). GIST и EGIST сходны гистопатологически и иммуногистохимически; оба экспрессируют мутации KIT/PDGFRA с усилением функции. Поскольку эти опухоли являются спорадическими, их злокачественный потенциал установить невозможно.[14] Сакураи и др. сообщил о клетках Кахаля, таких как клетки CD117+ и CD34+, в нормальном сальнике, из которых теоретически могут возникать EGIST.
GIST и EGIST сходны гистопатологически и иммуногистохимически; оба экспрессируют мутации KIT/PDGFRA с усилением функции. Поскольку эти опухоли являются спорадическими, их злокачественный потенциал установить невозможно.[14] Сакураи и др. сообщил о клетках Кахаля, таких как клетки CD117+ и CD34+, в нормальном сальнике, из которых теоретически могут возникать EGIST.
Липосаркомы обычно возникают из глубоких мягких тканей конечностей, и это наиболее распространенная саркома мягких тканей.[15] Интраабдоминальные локализации редки, и они редко исходят из большого сальника.
Злокачественная мезотелиома обычно возникает из плевры и брюшной полости, но редко может возникать из большого сальника. Его связь с асбестом менее очевидна по сравнению с мезотелиомой плевры.
Гистопатология
Гистопатология зависит от типа опухоли. Эмбриологическое происхождение этих опухолей варьируется, поскольку сальник состоит из различных тканей, таких как сосуды, лимфатические и жировые ткани.
Первичная лейомиосаркома сальника при гистологическом исследовании может показать длинные веретенообразные клетки с высоким митотическим индексом наряду с участками коагуляционного некроза опухоли и миксоидными изменениями; иммуногистохимия может быть положительной для десмина и актина гладких мышц и резко отрицательной для S100 и CD34, как при лейомиосаркоме.
SFT получают из мезенхимальных клеток; он в основном состоит из веретенообразных клеток и пучков коллагена. В литературе существует путаница в отношении происхождения и классификации SFT, поскольку гемангиоперицитомы (HPC) и SFT имеют много общих патологических находок; теперь они считаются частью одного и того же объекта.[17] При иммуногистохимическом окрашивании эти опухоли оказались отрицательными по следующим маркерам CD117, цитокератину, кальретинину, CD99, CD68, десмину, F8, S-100, антигену эпителиальной мембраны. Эти опухоли положительны по CD34, α-актину гладких мышц (α-SMA), BCL-2 и виментину (VIM) [12]. CD34 является полезным положительным биомаркером для SFT; несколько исследований показали 100% положительный результат.[13]
CD34 является полезным положительным биомаркером для SFT; несколько исследований показали 100% положительный результат.[13]
Согласно ВОЗ, липосаркома подразделяется на пять типов: высокодифференцированная, плеоморфная, круглоклеточная, миксоидная и дедифференцированная.[15] Липосаркома часто может иметь доброкачественные и злокачественные участки.[4] Прогноз этих опухолей зависит от гистологического типа [16]; дедифференцированный подтип имеет худший прогноз и высокую частоту рецидивов.[18] Хорошо дифференцированная липосаркома имеет толстые перегородки, размер поражения> 10 см, содержит глобулярные нежировые области и компонент поражения <75% жира.
Происхождение экстрагастроинтестинальных стромальных опухолей (EGIST) полностью не известно, но их гистология и иммунофенотип сходны с GIST. Считается, что это GIST, которые были отделены от желудочно-кишечного тракта, или они могут возникать из мезенхимальных клеток сальника [8]. EGIST, как и GIST, обычно положительны для KIT, альфа-актина гладких мышц и отрицательны для десмина и белка s-100. Показано, что эти опухоли, сходные с ГИСО, состоят из удлиненных веретенообразных клеток, эпителиоидных клеток или смешанных клеток с высокой клеточностью и низкой митотической активностью [19].]
Показано, что эти опухоли, сходные с ГИСО, состоят из удлиненных веретенообразных клеток, эпителиоидных клеток или смешанных клеток с высокой клеточностью и низкой митотической активностью [19].]
Гистологическое исследование мезотелиомы сальника может выявить эпителиальную, саркоматоидную или двухфазную структуру. Опухоли эпителиального типа составляют 75% случаев и варьируют от хорошо дифференцированных с тубуло-папиллярным рисунком до сплошных пластов круглых или полигональных клеток. Такие опухоли могут имитировать карциному, и бывает трудно отличить эпителиоидную мезотелиому от метастатической карциномы, особенно аденокарциномы. Опухоли саркоматоидного типа могут быть неотличимы от фибросарком только по гистологическим данным. Иммуногистохимия может помочь дифференцировать саркому и аденокарциному. Эти опухолевые клетки положительны на кальретинин, цитокератин и антиген эпителиальной мембраны и отрицательны на белок S-100, Leu-M1, CEA, тромбомодулин и плацентарную щелочную фосфатазу, положительная иммунореактивность на кальретинин значительно повышает точность диагноза.
Анамнез и физикальное исследование
Первичные опухоли сальника в основном протекают бессимптомно, но у большинства пациентов отмечают дискомфорт в животе, пальпируемое образование в животе, тошноту, быстрое чувство насыщения и потерю веса.[11] Другими симптомами, основанными на различных описаниях случаев, представленных в литературе, являются боль в животе, вздутие живота, запор, анорексия, рвота и лихорадка. Физикальное обследование может выявить пальпацию безболезненного образования в брюшной полости, баллотируемого сбоку, на основании описаний случаев в доступной литературе; масса может пальпироваться в эпигастрии, гипогастрии, верхнем или нижнем правом или левом квадранте или вовлекать всю брюшную полость. [17]
У пациентов также может наблюдаться болезненность новообразования, и при осмотре живота может наблюдаться настороженность.[21] В некоторых отчетах о случаях у пациентов также был асцит.[6] Пациенты с асцитом, потерей веса и перитонеальными имплантатами обычно указывают на злокачественное новообразование. Наиболее частыми клиническими проявлениями первичной опухоли сальника являются абдоминальный дискомфорт (56%) и объемное образование (35%) [2]. В одном отчете о случае у пациента была диффузная боль в животе без пальпируемого образования при физикальном обследовании , в то время как в другом отчете о случае пациент с первичной лейомиосаркомой имел необъяснимые геморрагические псевдоасциты.[5][22] Хотя симптомы в значительной степени неспецифичны, они также могут проявляться как случайные находки при визуализации. EGIST сальника могут оставаться клинически бессимптомными, несмотря на огромные размеры опухоли.[8]
Наиболее частыми клиническими проявлениями первичной опухоли сальника являются абдоминальный дискомфорт (56%) и объемное образование (35%) [2]. В одном отчете о случае у пациента была диффузная боль в животе без пальпируемого образования при физикальном обследовании , в то время как в другом отчете о случае пациент с первичной лейомиосаркомой имел необъяснимые геморрагические псевдоасциты.[5][22] Хотя симптомы в значительной степени неспецифичны, они также могут проявляться как случайные находки при визуализации. EGIST сальника могут оставаться клинически бессимптомными, несмотря на огромные размеры опухоли.[8]
Оценка
Диагностика липосаркомы является сложной задачей, и ее трудно дифференцировать от других опухолей. Внешний вид хорошо дифференцированной липосаркомы на КТ и МРТ похож на жировую и другие опухоли брюшной полости.[4]
Дооперационный диагноз первичной лейомиосаркомы сальника затруднен, и диагноз обычно ставится после операции. Точный диагноз ставится только при гистопатологическом исследовании опухоли. [6]
[6]
Внутривенная КТ брюшной полости и таза и МРТ являются лучшими методами визуализации для диагностики лейомиосаркомы сальника. Он может дать точную информацию о происхождении опухоли. Эти поражения в большинстве случаев имеют сходные визуализационные характеристики, представляя собой солидно-кистозную и многодольчатую опухоль [5]. Ультразвук может обнаружить опухоль и показать внутреннюю структуру поражения, но не может определить происхождение. Иногда эти опухоли сопровождаются асцитом и повышенным уровнем СА-125, что может свидетельствовать о раке яичников.[6]
Рентгенологические особенности сальниковых ЭГИСТ, не имеющих миогенной и нейрогенной дифференцировки, не установлены. Они могут быть похожи на сальниковую лейомиому и лейомиосаркому. Большинство ГИСО с миогенными признаками гиперваскуляризированы и имеют четкие границы на КТ и ангиографии.[8]
Согласно Ishida (1998), компьютерная томография является методом выбора при больших оментальных опухолях. На КТ такие опухоли обычно многодольчатые, плоские, блинообразные, с усилением солидной и мультикистозной плотности. Ангиография является полезным исследованием в диагностике опухолей сальника. Диагноз опухоли сальника ставится, когда артерия, питающая опухоль, отходит от сальникового кровоснабжения. Высоковаскулярное поражение с неоваскуляризацией, скорее всего, означает злокачественную опухоль.[6]
Ангиография является полезным исследованием в диагностике опухолей сальника. Диагноз опухоли сальника ставится, когда артерия, питающая опухоль, отходит от сальникового кровоснабжения. Высоковаскулярное поражение с неоваскуляризацией, скорее всего, означает злокачественную опухоль.[6]
Окончательный диагноз можно поставить с помощью лапароскопии или открытой операции с биопсией. Гистология и иммуногистохимия используются для диагностики и дифференциации мезотелиомы от аденокарциномы и саркомы.
Ультразвук и компьютерная томография могут быть использованы для отслеживания рецидивов.[12]
КТ и МРТ являются лучшими методами диагностики солитарных фиброзных опухолей сальника. Они помогают выявить разрастание фиброзной ткани в брюшной полости, оценить соотношение между опухолью и окружающими структурами и принять решение об удалении опухоли. Однако КТ и МРТ не могут отличить SFT от мезенхимальных опухолей. Поэтому его можно ошибочно диагностировать как стромальную опухоль. Аспирация иглой не помогает в диагностике, потому что опухоль состоит из бесклеточной и гиперклеточной частей и не дает достаточного количества ткани для цитологического анализа. Эппл и др. сообщили, что точный диагноз может быть поставлен с помощью тонкоигольной аспирации, но у многих пациентов это требует исследования. Образцы опухоли могут быть собраны через трубку Райла при небольших опухолях и с помощью диагностической лапаротомии при больших опухолях.[12]
Аспирация иглой не помогает в диагностике, потому что опухоль состоит из бесклеточной и гиперклеточной частей и не дает достаточного количества ткани для цитологического анализа. Эппл и др. сообщили, что точный диагноз может быть поставлен с помощью тонкоигольной аспирации, но у многих пациентов это требует исследования. Образцы опухоли могут быть собраны через трубку Райла при небольших опухолях и с помощью диагностической лапаротомии при больших опухолях.[12]
Диагностика SFT сальника затруднена, поскольку она напоминает другие опухоли, такие как лейомиома и мезотелиома. Более того, если опухоль на ножке возникает из сальника, ее можно принять за другие опухоли таза. Иммуногистохимия помогает установить диагноз. Эти опухоли положительны по CD34, CD99 и BCL-2, а иногда и по SMA, но обычно отрицательны по S-100, десмину и цитокератинам. SFT выглядит как сильно васкуляризированная солидная опухоль с четко очерченными краями на ультразвуковом изображении, и КТ-сканирование может показать те же результаты. Однако визуализация не является специфическим исследованием, и дооперационная диагностика становится невозможной.[7]
Однако визуализация не является специфическим исследованием, и дооперационная диагностика становится невозможной.[7]
Лечение/управление
Радикальная резекция опухоли рекомендуется при липосаркомах; адъювантная терапия не была признана эффективным методом лечения.[4]
Полное удаление опухоли дает хороший прогноз при лейомиосаркоме сальника. Некоторые авторы использовали нестандартизированные схемы химиотерапии при нерезектабельном заболевании с переменными результатами. У пациентов с диссеминированным заболеванием также применялась мультимодальная терапия. Из-за агрессивного характера таких опухолей часто возникают рецидивы, а долгосрочная выживаемость неизвестна.[5]
SFT, как правило, доброкачественные. От 15 до 20% из них являются злокачественными, особенно опухоли размером более 10 см. Гистологические признаки, такие как высокая клеточность, высокая митотическая активность, плеоморфизм, атипия, некроз опухоли и кровоизлияние, указывают на злокачественность. Размер опухоли и митотическая активность играют важную роль в прогнозировании SFT, исходящей из сальника. Такие характеристики, как размер опухоли, митотическая активность, клеточность и плеоморфизм для прогнозирования поведения SFT, могут использоваться для оценки риска. Злокачественные факторы связаны с высокой частотой рецидивов и метастазирования.[12] Методом выбора является хирургическая резекция, однако злокачественные опухоли могут рецидивировать даже через несколько лет после операции. Полезная роль адъювантной терапии еще не установлена, но в некоторых сообщениях предполагается адъювантная лучевая терапия и показан ответ на химиотерапию, но их эффективность не доказана. Размер опухоли является хорошим прогностическим фактором, но высокая митотическая активность связана с плохим прогнозом.[7]
Размер опухоли и митотическая активность играют важную роль в прогнозировании SFT, исходящей из сальника. Такие характеристики, как размер опухоли, митотическая активность, клеточность и плеоморфизм для прогнозирования поведения SFT, могут использоваться для оценки риска. Злокачественные факторы связаны с высокой частотой рецидивов и метастазирования.[12] Методом выбора является хирургическая резекция, однако злокачественные опухоли могут рецидивировать даже через несколько лет после операции. Полезная роль адъювантной терапии еще не установлена, но в некоторых сообщениях предполагается адъювантная лучевая терапия и показан ответ на химиотерапию, но их эффективность не доказана. Размер опухоли является хорошим прогностическим фактором, но высокая митотическая активность связана с плохим прогнозом.[7]
Радикальная резекция является методом выбора при ГИСО сальника; адъювантная терапия иматинибом после хирургической резекции при ограниченном заболевании также проводится [8]. Адъювантная терапия иматинибом может предотвратить рецидив и увеличить долгосрочную выживаемость [14].
Что касается мезотелиомы сальника, в нескольких независимых исследованиях фазы 1 и 2 была принята интенсивная местно-регионарная стратегия лечения, включая циторедуктивную хирургию, дополненную периоперационной гипертермической внутрибрюшинной химиотерапией. К ней также может быть добавлена ранняя послеоперационная внутрибрюшинная химиотерапия. Сообщается, что эта форма лечения в результате улучшила медиану выживаемости. Фогельзанг и др. провели многоцентровое контролируемое рандомизированное исследование III фазы, и показано, что пеметрексед-цисплатин является золотым стандартом в случае неоперабельной злокачественной мезотелиомы плевры. Это лечение дало объективный ответ при мезотелиоме сальника [11].
Окончательным методом лечения SFT сальника является хирургическая резекция опухоли с отрицательным краем. Послеоперационное длительное наблюдение имеет важное значение, поскольку эти опухоли часто рецидивируют. Злокачественные опухоли агрессивны, локально инвазивны с усиленным ростом и метастазированием. Поэтому при злокачественных опухолях рекомендуется послеоперационная химиотерапия. Более того, половина злокачественных SFT были положительными для c-kit, и ингибиторы тирозинкиназы, такие как иматиниб и сунитиниб, которые также эффективны для GIST, также использовались для SFT. Опухоль более 10 см имеет повышенный злокачественный потенциал, худший исход для метастазирования и повышенное количество рецидивов.[13]
Поэтому при злокачественных опухолях рекомендуется послеоперационная химиотерапия. Более того, половина злокачественных SFT были положительными для c-kit, и ингибиторы тирозинкиназы, такие как иматиниб и сунитиниб, которые также эффективны для GIST, также использовались для SFT. Опухоль более 10 см имеет повышенный злокачественный потенциал, худший исход для метастазирования и повышенное количество рецидивов.[13]
Differential Diagnosis
The differential diagnosis of primary tumors of omentum is
Fibrosarcoma
Spindle cell sarcoma
Liposarcoma
Leiomyoma
Hemangiopericytoma
Lipoma
Десмоидная опухоль
Фиброма
Мезотелиома
Миосаркома
Рабдомиосаркома
Лейомиобластома
Эндотелиома.[6][11]
Эти опухоли могут быть ошибочно приняты за опухоли таза, опухоли яичников и ГИСО.
Прогноз
Прогноз при липосаркомах туловища, в том числе внутрибрюшной области, хуже, чем при липосаркомах конечностей. В одном исследовании средняя 5-летняя выживаемость при липосаркоме туловища составила 41,9% по сравнению с конечностями, где она составила 66,7%. Прогноз также зависит от гистологического подтипа липосаркомы. Пятилетняя безрецидивная выживаемость хуже для опухолей группы высокой степени злокачественности (дедифференцированные, круглоклеточные и плеоморфные), чем для групп опухолей низкой степени злокачественности (высокодифференцированные и миксоидного типа) [4].
Из-за редкости сальниковых EGIST их злокачественный потенциал и общий прогноз трудно установить.[14] По сравнению с обычным GIST, EGIST имеет менее благоприятный прогноз, поскольку такие опухоли сопровождаются высокими митотическими индексами, большими размерами и отдаленными метастазами.[19]
Прогноз при злокачественной мезотелиоме сальника крайне неблагоприятный, поскольку эффективного лечения до сих пор не существует. Большинство пациентов умирают в течение одного года после постановки диагноза. По данным некоторых ретроспективных исследований, медиана выживаемости после операций, направленных на паллиативное лечение в сочетании с системной или внутрибрюшинной химиотерапией, составляет около одного года. У пациентов, которым была проведена агрессивная хирургия с гипертермической внутрибрюшинной химиотерапией, медиана выживаемости приблизилась к пяти годам [11].
Большинство пациентов умирают в течение одного года после постановки диагноза. По данным некоторых ретроспективных исследований, медиана выживаемости после операций, направленных на паллиативное лечение в сочетании с системной или внутрибрюшинной химиотерапией, составляет около одного года. У пациентов, которым была проведена агрессивная хирургия с гипертермической внутрибрюшинной химиотерапией, медиана выживаемости приблизилась к пяти годам [11].
Осложнения
У некоторых пациентов был отмечен внутрибрюшной разрыв опухоли, приводящий к острому животу.[7]
Сдерживание и просвещение пациентов
Поскольку первичные опухоли сальника встречаются редко, знаний о поведении таких опухолей все еще недостаточно, и требуется больше случаев и исследований.
Улучшение результатов медицинского персонала
Первичные опухоли сальника — это спорадические опухоли. Эти опухоли либо бессимптомны, либо признаки и симптомы проявления неспецифичны, что проявляется поздно из-за массового эффекта опухоли. Методы визуализации, такие как компьютерная томография, в значительной степени диагностируют их. Для лечения таких опухолей и улучшения результатов необходимы дополнительные исследования, чтобы узнать об этиологии, прогрессировании и лучших вариантах лечения таких опухолей. Хотя хирурги являются основными лицами, осуществляющими уход за такими пациентами, рентгенологи играют жизненно важную роль в диагностике пациентов с этими редкими опухолями. Другие задействованные медицинские работники — это поставщики медицинских услуг, занимающиеся сопутствующими заболеваниями пациентов, если они есть, медсестры, фельдшеры и реабилитационные работники, а также социальные работники, которые помогают пациентам в послеоперационном периоде.
Методы визуализации, такие как компьютерная томография, в значительной степени диагностируют их. Для лечения таких опухолей и улучшения результатов необходимы дополнительные исследования, чтобы узнать об этиологии, прогрессировании и лучших вариантах лечения таких опухолей. Хотя хирурги являются основными лицами, осуществляющими уход за такими пациентами, рентгенологи играют жизненно важную роль в диагностике пациентов с этими редкими опухолями. Другие задействованные медицинские работники — это поставщики медицинских услуг, занимающиеся сопутствующими заболеваниями пациентов, если они есть, медсестры, фельдшеры и реабилитационные работники, а также социальные работники, которые помогают пациентам в послеоперационном периоде.
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Меза-Перес С., Рэндалл Т.Д. Иммунологические функции сальника.
 Тренды Иммунол. 2017 июль; 38 (7): 526-536. [Бесплатная статья PMC: PMC5812451] [PubMed: 28579319]
Тренды Иммунол. 2017 июль; 38 (7): 526-536. [Бесплатная статья PMC: PMC5812451] [PubMed: 28579319]- 2.
Schwartz RW, Reames M, McGrath PC, Letton RW, Appleby G, Kenady DE. Первичные солидные новообразования большого сальника. Операция. 1991 апреля; 109 (4): 543-9. [PubMed: 2008659]
- 3.
Вайнбергер Х.А., Ахмед М.С. Мезенхимальные солидные опухоли сальника и брыжейки: отчет о четырех случаях. Операция. 1977 г., ноябрь; 82 (5): 754-9. [PubMed: 918865]
- 4.
Hashimoto S, Arai J, Nishimuta M, Matsumoto H, Fukuoka H, Muraoka M, Nakashima M, Yamaguchi H. Резекция липосаркомы большого сальника: история болезни и литература обзор. Отчет по делу Int J Surg, 2019; 61:20-25. [Бесплатная статья PMC: PMC6626973] [PubMed: 31306901]
- 5.
Brañes A, Bustamante C, Valbuena J, Pimentel F, Quezada N. Первичная лейомиосаркома большого сальника: клинический случай. Отчет по делу Int J Surg 2016; 28:317-320.
 [Бесплатная статья PMC: PMC5079381] [PubMed: 27771602]
[Бесплатная статья PMC: PMC5079381] [PubMed: 27771602]- 6.
Barel O, Qian C, Manolitsas T. Первичная лейомиосаркома сальника, представляющая собой рак яичника, отчет о клиническом случае и обзор литературы. Gynecol Oncol Rep. 2016 Aug;17:75-8. [Бесплатная статья PMC: PMC4949497] [PubMed: 27489871]
- 7.
Rodriguez Tarrega E, Hidalgo Mora JJ, Paya Amate V, Vega Oomen O. Солитарная фиброзная опухоль большого сальника, имитирующая опухоль яичника у молодой женщины. Gynecol Oncol Rep. 2016 Aug; 17:16-9. [Статья бесплатно PMC: PMC4899079] [PubMed: 27354994]
- 8.
Fagkrezos D, Touloumis Z, Giannila M, Penlidis C, Papaparaskeva K, Triantopoulou C. Внежелудочно-кишечная стромальная опухоль сальника: редкий случай отчет и обзор литературы. Редкие опухоли. 2012 26 июня; 4(3):e44. [Бесплатная статья PMC: PMC3475951] [PubMed: 23087800]
- 9.
Соренсен Э.В., Гербер С.А., Седлачек А.Л., Рыбалко В.
 Ю., Чан В.М., Лорд Э.М. Сальниковые иммунные агрегаты и метастазы опухоли в брюшную полость. Иммунол Рез. 2009 декабрь; 45 (2-3): 185-94. [Бесплатная статья PMC: PMC28] [PubMed: 19253004]
Ю., Чан В.М., Лорд Э.М. Сальниковые иммунные агрегаты и метастазы опухоли в брюшную полость. Иммунол Рез. 2009 декабрь; 45 (2-3): 185-94. [Бесплатная статья PMC: PMC28] [PubMed: 19253004]- 10.
Joe DH, Yang JM, Kim HS, Kim SS, Choi SW, Choi SH, Lee S, Lim KW. Случай первичной лейомиосаркомы малого сальника. Корейский J Intern Med. 1999 янв; 14 (1): 88-90. [Бесплатная статья PMC: PMC4531912] [PubMed: 10063320]
- 11.
Shin MK, Lee OJ, Ha CY, Min HJ, Kim TH. Злокачественная мезотелиома большого сальника, имитирующая инфаркт сальника: клинический случай. Мир J Гастроэнтерол. 2009 14 октября; 15 (38): 4856-9. [Бесплатная статья PMC: PMC2761569] [PubMed: 19824125]
- 12.
Цзун Л., Чен П., Ван Г.Ю., Чжу К.С. Гигантская солитарная фиброзная опухоль, возникающая из большого сальника. Мир J Гастроэнтерол. 2012 28 ноября; 18 (44): 6515-20. [Бесплатная статья PMC: PMC3508650] [PubMed: 23197901]
- 13.

Urabe M, Yamagata Y, Aikou S, Mori K, Yamashita H, Nomura S, Shibahara J, Fukayama M, Seto Y. Солитарная фиброзная опухоль большого сальника, имитирующая гастроинтестинальную стромальную опухоль тонкая кишка: история болезни. инт сург. 2015 май; 100(5):836-40. [Бесплатная статья PMC: PMC4452971] [PubMed: 26011203]
- 14.
Тодороки Т., Сано Т., Сакураи С., Сегава А., Сайтох Т., Фудзикава К., Ямада С., Хирахара Н., Цусима Ю., Мотодзима Р., Мотожима Т. Первичная стромальная опухоль желудочно-кишечного тракта (GIST). World J Surg Oncol. 2007 12 июня; 5:66. [Бесплатная статья PMC: PMC1924523] [PubMed: 17565683]
- 15.
Ватс М., Панди Д., Ахлават Х., Ахтар А., Сингх Н. Множественная первичная дедифференцированная липосаркома брыжейки тощей кишки: клинический случай и обзор литературы. J Clin Diagn Res. 2016 Январь;10(1):XD01-XD04. [Бесплатная статья PMC: PMC4740692] [PubMed: 26894164]
- 16.
Суфи М.
 , Мдагри Дж., Бенамр С., Лахлоу М.К., Массрури Р., Эссадель А., Мохаммадин эль-Х., Таги А., Сеттаф А., Чад Б. Гигантская липосаркома сальника, имитирующая опухоль яичника. Отчет о случае. Индийский Дж. Сург. 2012 окт; 74 (5): 425-7. [Бесплатная статья PMC: PMC3477403] [PubMed: 24082602]
, Мдагри Дж., Бенамр С., Лахлоу М.К., Массрури Р., Эссадель А., Мохаммадин эль-Х., Таги А., Сеттаф А., Чад Б. Гигантская липосаркома сальника, имитирующая опухоль яичника. Отчет о случае. Индийский Дж. Сург. 2012 окт; 74 (5): 425-7. [Бесплатная статья PMC: PMC3477403] [PubMed: 24082602]- 17.
Bouhabel S, Leblanc G, Ferreira J, Leclerc YE, Dubé P, Sidéris L. Солитарная фиброзная опухоль, возникающая в брыжейке: клинический случай. World J Surg Oncol. 2011 31 октября; 9:140. [Бесплатная статья PMC: PMC3225306] [PubMed: 22035205]
- 18.
Meloni F, Feo CF, Profili S, Cossu ML, Meloni GB. Хорошо дифференцированная липосаркома сальника: данные УЗИ, КТ и МРТ. Int J Biomed Sci. 2009 г., сен; 5(3):302-4. [Бесплатная статья PMC: PMC3614784] [PubMed: 23675151]
- 19.
Саваки А. Редкие гастроинтестинальные стромальные опухоли (GIST): сальник и забрюшинное пространство. Перевод Гастроэнтерол Гепатол. 2017;2:116. [Бесплатная статья PMC: PMC5762994] [PubMed: 29354773]
- 20.

Исида Дж., Исида Х., Конно К., Комацуда Т., Абэ К. Первичная лейомиосаркома большого сальника. Дж. Клин Гастроэнтерол. 1999 март; 28(2):167-70. [PubMed: 10078829]
- 21.
Цуцуми Х., Овада С., Такеёси И., Изуми М., Огава Т., Фукусато Т., Морисита Ю. Первичная липосаркома сальника с перекрутом: клинический случай. Гепатогастроэнтерология. 1999 май-июнь;46(27):2110-2. [PubMed: 10430407]
- 22.
Dixon AY, Reed JS, Dow N, Lee SH. Первичная сальниковая лейомиосаркома, маскирующаяся под геморрагический асцит. Хум Патол. 1984 март; 15 (3): 233-7. [PubMed: 6698542]
Опухоли сальника — StatPearls — NCBI Bookshelf
Продолжение обучения
Сальник состоит из клеток мезотелиального происхождения. Сальник проявляет ангиогенную, фиброзную, стволовые клетки и иммунную активность, ответственную за стимуляцию васкуляризации, ускоренное заживление и ограничение инфекции в брюшной полости. Эти действия также могут привести к патологическим изменениям, таким как образование опухоли сальника. В этой статье описаны эпидемиология, проявления, гистопатология, исследования и лечение первичных опухолей сальника. В этом мероприятии рассматривается оценка и лечение опухолей сальника и подчеркивается роль межпрофессиональной группы в оценке и улучшении ухода за пациентами с этим заболеванием.
В этой статье описаны эпидемиология, проявления, гистопатология, исследования и лечение первичных опухолей сальника. В этом мероприятии рассматривается оценка и лечение опухолей сальника и подчеркивается роль межпрофессиональной группы в оценке и улучшении ухода за пациентами с этим заболеванием.
Цели:
Определите эпидемиологию первичных опухолей сальника.
Опишите оценку первичных опухолей сальника.
Объясните возможные варианты лечения первичных опухолей сальника.
Обзор стратегий межпрофессиональной бригады для улучшения координации помощи и коммуникации для улучшения лечения первичных опухолей сальника и улучшения результатов.
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Введение
Сальник состоит из клеток мезотелиального происхождения. Говорят, что это тип висцеральной жировой ткани с общей площадью поверхности 1500 см2. Он висит перед органами брюшной полости, как фартук, а также связан с селезенкой, желудком, поджелудочной железой и толстой кишкой. Сальник проявляет ангиогенную, фиброзную, стволовые клетки и иммунную активность, ответственную за стимуляцию васкуляризации, ускоренное заживление и ограничение инфекции в брюшной полости. Эти действия также могут привести к патологическим изменениям, таким как образование опухоли сальника и метастазирование.[1] Первичные солидные опухоли большого сальника встречаются редко, всего 42 зарегистрированных случая; однако перитонеальные метастазы довольно распространены при некоторых опухолях, таких как стромальные опухоли желудочно-кишечного тракта и рак яичников.
Он висит перед органами брюшной полости, как фартук, а также связан с селезенкой, желудком, поджелудочной железой и толстой кишкой. Сальник проявляет ангиогенную, фиброзную, стволовые клетки и иммунную активность, ответственную за стимуляцию васкуляризации, ускоренное заживление и ограничение инфекции в брюшной полости. Эти действия также могут привести к патологическим изменениям, таким как образование опухоли сальника и метастазирование.[1] Первичные солидные опухоли большого сальника встречаются редко, всего 42 зарегистрированных случая; однако перитонеальные метастазы довольно распространены при некоторых опухолях, таких как стромальные опухоли желудочно-кишечного тракта и рак яичников.
Этиология
Эти опухоли являются спорадическими, и этиологические факторы, ответственные за такие опухоли, неизвестны.
Эпидемиология
Это редкие поражения, каждое из которых связано со скрытым началом.[3]
Липосаркома большого сальника — редкая опухоль; до июля 2019 г. в литературе описано 19 случаев. Девять случаев с 1936 по 2003 г., 10 случаев с 2003 по 2018 г. и один в 2019 г. Средний возраст пациентов в эти истории болезни составили 51,1 года.[4]
в литературе описано 19 случаев. Девять случаев с 1936 по 2003 г., 10 случаев с 2003 по 2018 г. и один в 2019 г. Средний возраст пациентов в эти истории болезни составили 51,1 года.[4]
Лейомиосаркома большого сальника является редкой опухолью, и до октября 2016 г. в литературе было зарегистрировано 23 случая. Клинически эти опухоли проявляются на 5-м десятилетии жизни.[5] В то время как в другом исследовании было зарегистрировано 27 случаев. Средний возраст в этих случаях составлял 51 год, и это было немного чаще у мужчин.
Согласно сообщениям о случаях SFT (солитарных фиброзных опухолей) большого сальника, эта опухоль возникает на пятом-седьмом десятилетии жизни с соотношением мужчин и женщин 1:1.[7] 9[8]
Патофизиология
Сальник называется депо висцерального жира. Его роль как «полицейского брюшной полости» была признана британским хирургом в начале 1900-х годов благодаря его свойствам перемещаться по брюшной полости и ограничивать инфекции и воспаления. Сальник содержит множество иммунных агрегатов, называемых «млочными пятнами», функция которых в значительной степени неизвестна. Говорят, что как свободные иммунные клетки, так и опухолевые клетки связываются с этими агрегатами.[9]]
Сальник содержит множество иммунных агрегатов, называемых «млочными пятнами», функция которых в значительной степени неизвестна. Говорят, что как свободные иммунные клетки, так и опухолевые клетки связываются с этими агрегатами.[9]]
Все первичные опухоли сальника спорадические и обычно злокачественные.[10] Но метастатические поражения распространены. Сообщаемые первичные опухоли сальника включают фибросаркому, веретеноклеточную саркому, липосаркому, лейомиому, гемангиоперицитому, липому и десмоидную опухоль, фиброму, мезотелиому, миосаркому, рабдомиосаркому, лейомиобластому и эндотелиому. Эти опухоли происходят из различных элементов, из которых состоит сальник, таких как жировая ткань, сосуды и лимфатическая ткань.
Первичная лейомиосаркома сальника — очень редкая опухоль; чаще лейомиосаркомы возникают в гладкомышечных клетках желудочно-кишечного тракта, забрюшинного пространства и мочеполового тракта. Из-за низкой частоты лейомиосаркомы сальника мало что известно о происхождении и поведении этих опухолей.
Солитарная фиброзная опухоль (SFT), ранее называвшаяся гемангиоперицитомой, представляет собой редкую мезенхимальную опухоль[7], часто происходящую из плевры; вовлечение сальника очень редко. От 78% до 88% этих опухолей являются доброкачественными, а от 12% до 22% злокачественными.[12] До 2015 г. в литературе было описано только 6 случаев SFT, возникающих из-за большого или малого сальника [13].
ГИСО (желудочно-кишечные стромальные опухоли) представляют собой мезенхимальные опухоли, возникающие из стенки желудочно-кишечного тракта, в основном из желудка. Однако редко они могут возникать из сальника, что обозначается как экстрагастроинтестинальные стромальные опухоли (EGIST). GIST и EGIST сходны гистопатологически и иммуногистохимически; оба экспрессируют мутации KIT/PDGFRA с усилением функции. Поскольку эти опухоли являются спорадическими, их злокачественный потенциал установить невозможно.[14] Сакураи и др. сообщил о клетках Кахаля, таких как клетки CD117+ и CD34+, в нормальном сальнике, из которых теоретически могут возникать EGIST.
Липосаркомы обычно возникают из глубоких мягких тканей конечностей, и это наиболее распространенная саркома мягких тканей.[15] Интраабдоминальные локализации редки, и они редко исходят из большого сальника.
Злокачественная мезотелиома обычно возникает из плевры и брюшной полости, но редко может возникать из большого сальника. Его связь с асбестом менее очевидна по сравнению с мезотелиомой плевры.
Гистопатология
Гистопатология зависит от типа опухоли. Эмбриологическое происхождение этих опухолей варьируется, поскольку сальник состоит из различных тканей, таких как сосуды, лимфатические и жировые ткани.
Первичная лейомиосаркома сальника при гистологическом исследовании может показать длинные веретенообразные клетки с высоким митотическим индексом наряду с участками коагуляционного некроза опухоли и миксоидными изменениями; иммуногистохимия может быть положительной для десмина и актина гладких мышц и резко отрицательной для S100 и CD34, как при лейомиосаркоме.
SFT получают из мезенхимальных клеток; он в основном состоит из веретенообразных клеток и пучков коллагена. В литературе существует путаница в отношении происхождения и классификации SFT, поскольку гемангиоперицитомы (HPC) и SFT имеют много общих патологических находок; теперь они считаются частью одного и того же объекта.[17] При иммуногистохимическом окрашивании эти опухоли оказались отрицательными по следующим маркерам CD117, цитокератину, кальретинину, CD99, CD68, десмину, F8, S-100, антигену эпителиальной мембраны. Эти опухоли положительны по CD34, α-актину гладких мышц (α-SMA), BCL-2 и виментину (VIM) [12]. CD34 является полезным положительным биомаркером для SFT; несколько исследований показали 100% положительный результат.[13]
Согласно ВОЗ, липосаркома подразделяется на пять типов: высокодифференцированная, плеоморфная, круглоклеточная, миксоидная и дедифференцированная.[15] Липосаркома часто может иметь доброкачественные и злокачественные участки.[4] Прогноз этих опухолей зависит от гистологического типа [16]; дедифференцированный подтип имеет худший прогноз и высокую частоту рецидивов. [18] Хорошо дифференцированная липосаркома имеет толстые перегородки, размер поражения> 10 см, содержит глобулярные нежировые области и компонент поражения <75% жира.
[18] Хорошо дифференцированная липосаркома имеет толстые перегородки, размер поражения> 10 см, содержит глобулярные нежировые области и компонент поражения <75% жира.
Происхождение экстрагастроинтестинальных стромальных опухолей (EGIST) полностью не известно, но их гистология и иммунофенотип сходны с GIST. Считается, что это GIST, которые были отделены от желудочно-кишечного тракта, или они могут возникать из мезенхимальных клеток сальника [8]. EGIST, как и GIST, обычно положительны для KIT, альфа-актина гладких мышц и отрицательны для десмина и белка s-100. Показано, что эти опухоли, сходные с ГИСО, состоят из удлиненных веретенообразных клеток, эпителиоидных клеток или смешанных клеток с высокой клеточностью и низкой митотической активностью [19].]
Гистологическое исследование мезотелиомы сальника может выявить эпителиальную, саркоматоидную или двухфазную структуру. Опухоли эпителиального типа составляют 75% случаев и варьируют от хорошо дифференцированных с тубуло-папиллярным рисунком до сплошных пластов круглых или полигональных клеток. Такие опухоли могут имитировать карциному, и бывает трудно отличить эпителиоидную мезотелиому от метастатической карциномы, особенно аденокарциномы. Опухоли саркоматоидного типа могут быть неотличимы от фибросарком только по гистологическим данным. Иммуногистохимия может помочь дифференцировать саркому и аденокарциному. Эти опухолевые клетки положительны на кальретинин, цитокератин и антиген эпителиальной мембраны и отрицательны на белок S-100, Leu-M1, CEA, тромбомодулин и плацентарную щелочную фосфатазу, положительная иммунореактивность на кальретинин значительно повышает точность диагноза.
Такие опухоли могут имитировать карциному, и бывает трудно отличить эпителиоидную мезотелиому от метастатической карциномы, особенно аденокарциномы. Опухоли саркоматоидного типа могут быть неотличимы от фибросарком только по гистологическим данным. Иммуногистохимия может помочь дифференцировать саркому и аденокарциному. Эти опухолевые клетки положительны на кальретинин, цитокератин и антиген эпителиальной мембраны и отрицательны на белок S-100, Leu-M1, CEA, тромбомодулин и плацентарную щелочную фосфатазу, положительная иммунореактивность на кальретинин значительно повышает точность диагноза.
Анамнез и физикальное исследование
Первичные опухоли сальника в основном протекают бессимптомно, но у большинства пациентов отмечают дискомфорт в животе, пальпируемое образование в животе, тошноту, быстрое чувство насыщения и потерю веса.[11] Другими симптомами, основанными на различных описаниях случаев, представленных в литературе, являются боль в животе, вздутие живота, запор, анорексия, рвота и лихорадка. Физикальное обследование может выявить пальпацию безболезненного образования в брюшной полости, баллотируемого сбоку, на основании описаний случаев в доступной литературе; масса может пальпироваться в эпигастрии, гипогастрии, верхнем или нижнем правом или левом квадранте или вовлекать всю брюшную полость. [17]
Физикальное обследование может выявить пальпацию безболезненного образования в брюшной полости, баллотируемого сбоку, на основании описаний случаев в доступной литературе; масса может пальпироваться в эпигастрии, гипогастрии, верхнем или нижнем правом или левом квадранте или вовлекать всю брюшную полость. [17]
У пациентов также может наблюдаться болезненность новообразования, и при осмотре живота может наблюдаться настороженность.[21] В некоторых отчетах о случаях у пациентов также был асцит.[6] Пациенты с асцитом, потерей веса и перитонеальными имплантатами обычно указывают на злокачественное новообразование. Наиболее частыми клиническими проявлениями первичной опухоли сальника являются абдоминальный дискомфорт (56%) и объемное образование (35%) [2]. В одном отчете о случае у пациента была диффузная боль в животе без пальпируемого образования при физикальном обследовании , в то время как в другом отчете о случае пациент с первичной лейомиосаркомой имел необъяснимые геморрагические псевдоасциты. [5][22] Хотя симптомы в значительной степени неспецифичны, они также могут проявляться как случайные находки при визуализации. EGIST сальника могут оставаться клинически бессимптомными, несмотря на огромные размеры опухоли.[8]
[5][22] Хотя симптомы в значительной степени неспецифичны, они также могут проявляться как случайные находки при визуализации. EGIST сальника могут оставаться клинически бессимптомными, несмотря на огромные размеры опухоли.[8]
Оценка
Диагностика липосаркомы является сложной задачей, и ее трудно дифференцировать от других опухолей. Внешний вид хорошо дифференцированной липосаркомы на КТ и МРТ похож на жировую и другие опухоли брюшной полости.[4]
Дооперационный диагноз первичной лейомиосаркомы сальника затруднен, и диагноз обычно ставится после операции. Точный диагноз ставится только при гистопатологическом исследовании опухоли.[6]
Внутривенная КТ брюшной полости и таза и МРТ являются лучшими методами визуализации для диагностики лейомиосаркомы сальника. Он может дать точную информацию о происхождении опухоли. Эти поражения в большинстве случаев имеют сходные визуализационные характеристики, представляя собой солидно-кистозную и многодольчатую опухоль [5]. Ультразвук может обнаружить опухоль и показать внутреннюю структуру поражения, но не может определить происхождение. Иногда эти опухоли сопровождаются асцитом и повышенным уровнем СА-125, что может свидетельствовать о раке яичников.[6]
Ультразвук может обнаружить опухоль и показать внутреннюю структуру поражения, но не может определить происхождение. Иногда эти опухоли сопровождаются асцитом и повышенным уровнем СА-125, что может свидетельствовать о раке яичников.[6]
Рентгенологические особенности сальниковых ЭГИСТ, не имеющих миогенной и нейрогенной дифференцировки, не установлены. Они могут быть похожи на сальниковую лейомиому и лейомиосаркому. Большинство ГИСО с миогенными признаками гиперваскуляризированы и имеют четкие границы на КТ и ангиографии.[8]
Согласно Ishida (1998), компьютерная томография является методом выбора при больших оментальных опухолях. На КТ такие опухоли обычно многодольчатые, плоские, блинообразные, с усилением солидной и мультикистозной плотности. Ангиография является полезным исследованием в диагностике опухолей сальника. Диагноз опухоли сальника ставится, когда артерия, питающая опухоль, отходит от сальникового кровоснабжения. Высоковаскулярное поражение с неоваскуляризацией, скорее всего, означает злокачественную опухоль. [6]
[6]
Окончательный диагноз можно поставить с помощью лапароскопии или открытой операции с биопсией. Гистология и иммуногистохимия используются для диагностики и дифференциации мезотелиомы от аденокарциномы и саркомы.
Ультразвук и компьютерная томография могут быть использованы для отслеживания рецидивов.[12]
КТ и МРТ являются лучшими методами диагностики солитарных фиброзных опухолей сальника. Они помогают выявить разрастание фиброзной ткани в брюшной полости, оценить соотношение между опухолью и окружающими структурами и принять решение об удалении опухоли. Однако КТ и МРТ не могут отличить SFT от мезенхимальных опухолей. Поэтому его можно ошибочно диагностировать как стромальную опухоль. Аспирация иглой не помогает в диагностике, потому что опухоль состоит из бесклеточной и гиперклеточной частей и не дает достаточного количества ткани для цитологического анализа. Эппл и др. сообщили, что точный диагноз может быть поставлен с помощью тонкоигольной аспирации, но у многих пациентов это требует исследования. Образцы опухоли могут быть собраны через трубку Райла при небольших опухолях и с помощью диагностической лапаротомии при больших опухолях.[12]
Образцы опухоли могут быть собраны через трубку Райла при небольших опухолях и с помощью диагностической лапаротомии при больших опухолях.[12]
Диагностика SFT сальника затруднена, поскольку она напоминает другие опухоли, такие как лейомиома и мезотелиома. Более того, если опухоль на ножке возникает из сальника, ее можно принять за другие опухоли таза. Иммуногистохимия помогает установить диагноз. Эти опухоли положительны по CD34, CD99 и BCL-2, а иногда и по SMA, но обычно отрицательны по S-100, десмину и цитокератинам. SFT выглядит как сильно васкуляризированная солидная опухоль с четко очерченными краями на ультразвуковом изображении, и КТ-сканирование может показать те же результаты. Однако визуализация не является специфическим исследованием, и дооперационная диагностика становится невозможной.[7]
Лечение/управление
Радикальная резекция опухоли рекомендуется при липосаркомах; адъювантная терапия не была признана эффективным методом лечения.[4]
Полное удаление опухоли дает хороший прогноз при лейомиосаркоме сальника. Некоторые авторы использовали нестандартизированные схемы химиотерапии при нерезектабельном заболевании с переменными результатами. У пациентов с диссеминированным заболеванием также применялась мультимодальная терапия. Из-за агрессивного характера таких опухолей часто возникают рецидивы, а долгосрочная выживаемость неизвестна.[5]
Некоторые авторы использовали нестандартизированные схемы химиотерапии при нерезектабельном заболевании с переменными результатами. У пациентов с диссеминированным заболеванием также применялась мультимодальная терапия. Из-за агрессивного характера таких опухолей часто возникают рецидивы, а долгосрочная выживаемость неизвестна.[5]
SFT, как правило, доброкачественные. От 15 до 20% из них являются злокачественными, особенно опухоли размером более 10 см. Гистологические признаки, такие как высокая клеточность, высокая митотическая активность, плеоморфизм, атипия, некроз опухоли и кровоизлияние, указывают на злокачественность. Размер опухоли и митотическая активность играют важную роль в прогнозировании SFT, исходящей из сальника. Такие характеристики, как размер опухоли, митотическая активность, клеточность и плеоморфизм для прогнозирования поведения SFT, могут использоваться для оценки риска. Злокачественные факторы связаны с высокой частотой рецидивов и метастазирования.[12] Методом выбора является хирургическая резекция, однако злокачественные опухоли могут рецидивировать даже через несколько лет после операции. Полезная роль адъювантной терапии еще не установлена, но в некоторых сообщениях предполагается адъювантная лучевая терапия и показан ответ на химиотерапию, но их эффективность не доказана. Размер опухоли является хорошим прогностическим фактором, но высокая митотическая активность связана с плохим прогнозом.[7]
Полезная роль адъювантной терапии еще не установлена, но в некоторых сообщениях предполагается адъювантная лучевая терапия и показан ответ на химиотерапию, но их эффективность не доказана. Размер опухоли является хорошим прогностическим фактором, но высокая митотическая активность связана с плохим прогнозом.[7]
Радикальная резекция является методом выбора при ГИСО сальника; адъювантная терапия иматинибом после хирургической резекции при ограниченном заболевании также проводится [8]. Адъювантная терапия иматинибом может предотвратить рецидив и увеличить долгосрочную выживаемость [14].
Что касается мезотелиомы сальника, в нескольких независимых исследованиях фазы 1 и 2 была принята интенсивная местно-регионарная стратегия лечения, включая циторедуктивную хирургию, дополненную периоперационной гипертермической внутрибрюшинной химиотерапией. К ней также может быть добавлена ранняя послеоперационная внутрибрюшинная химиотерапия. Сообщается, что эта форма лечения в результате улучшила медиану выживаемости. Фогельзанг и др. провели многоцентровое контролируемое рандомизированное исследование III фазы, и показано, что пеметрексед-цисплатин является золотым стандартом в случае неоперабельной злокачественной мезотелиомы плевры. Это лечение дало объективный ответ при мезотелиоме сальника [11].
Фогельзанг и др. провели многоцентровое контролируемое рандомизированное исследование III фазы, и показано, что пеметрексед-цисплатин является золотым стандартом в случае неоперабельной злокачественной мезотелиомы плевры. Это лечение дало объективный ответ при мезотелиоме сальника [11].
Окончательным методом лечения SFT сальника является хирургическая резекция опухоли с отрицательным краем. Послеоперационное длительное наблюдение имеет важное значение, поскольку эти опухоли часто рецидивируют. Злокачественные опухоли агрессивны, локально инвазивны с усиленным ростом и метастазированием. Поэтому при злокачественных опухолях рекомендуется послеоперационная химиотерапия. Более того, половина злокачественных SFT были положительными для c-kit, и ингибиторы тирозинкиназы, такие как иматиниб и сунитиниб, которые также эффективны для GIST, также использовались для SFT. Опухоль более 10 см имеет повышенный злокачественный потенциал, худший исход для метастазирования и повышенное количество рецидивов. [13]
[13]
Differential Diagnosis
The differential diagnosis of primary tumors of omentum is
Fibrosarcoma
Spindle cell sarcoma
Liposarcoma
Leiomyoma
Hemangiopericytoma
Lipoma
Десмоидная опухоль
Фиброма
Мезотелиома
Миосаркома
Рабдомиосаркома
Лейомиобластома
Эндотелиома.[6][11]
Эти опухоли могут быть ошибочно приняты за опухоли таза, опухоли яичников и ГИСО.
Прогноз
Прогноз при липосаркомах туловища, в том числе внутрибрюшной области, хуже, чем при липосаркомах конечностей. В одном исследовании средняя 5-летняя выживаемость при липосаркоме туловища составила 41,9% по сравнению с конечностями, где она составила 66,7%. Прогноз также зависит от гистологического подтипа липосаркомы. Пятилетняя безрецидивная выживаемость хуже для опухолей группы высокой степени злокачественности (дедифференцированные, круглоклеточные и плеоморфные), чем для групп опухолей низкой степени злокачественности (высокодифференцированные и миксоидного типа) [4].
Пятилетняя безрецидивная выживаемость хуже для опухолей группы высокой степени злокачественности (дедифференцированные, круглоклеточные и плеоморфные), чем для групп опухолей низкой степени злокачественности (высокодифференцированные и миксоидного типа) [4].
Из-за редкости сальниковых EGIST их злокачественный потенциал и общий прогноз трудно установить.[14] По сравнению с обычным GIST, EGIST имеет менее благоприятный прогноз, поскольку такие опухоли сопровождаются высокими митотическими индексами, большими размерами и отдаленными метастазами.[19]
Прогноз при злокачественной мезотелиоме сальника крайне неблагоприятный, поскольку эффективного лечения до сих пор не существует. Большинство пациентов умирают в течение одного года после постановки диагноза. По данным некоторых ретроспективных исследований, медиана выживаемости после операций, направленных на паллиативное лечение в сочетании с системной или внутрибрюшинной химиотерапией, составляет около одного года. У пациентов, которым была проведена агрессивная хирургия с гипертермической внутрибрюшинной химиотерапией, медиана выживаемости приблизилась к пяти годам [11].
Осложнения
У некоторых пациентов был отмечен внутрибрюшной разрыв опухоли, приводящий к острому животу.[7]
Сдерживание и просвещение пациентов
Поскольку первичные опухоли сальника встречаются редко, знаний о поведении таких опухолей все еще недостаточно, и требуется больше случаев и исследований.
Улучшение результатов медицинского персонала
Первичные опухоли сальника — это спорадические опухоли. Эти опухоли либо бессимптомны, либо признаки и симптомы проявления неспецифичны, что проявляется поздно из-за массового эффекта опухоли. Методы визуализации, такие как компьютерная томография, в значительной степени диагностируют их. Для лечения таких опухолей и улучшения результатов необходимы дополнительные исследования, чтобы узнать об этиологии, прогрессировании и лучших вариантах лечения таких опухолей. Хотя хирурги являются основными лицами, осуществляющими уход за такими пациентами, рентгенологи играют жизненно важную роль в диагностике пациентов с этими редкими опухолями. Другие задействованные медицинские работники — это поставщики медицинских услуг, занимающиеся сопутствующими заболеваниями пациентов, если они есть, медсестры, фельдшеры и реабилитационные работники, а также социальные работники, которые помогают пациентам в послеоперационном периоде.
Другие задействованные медицинские работники — это поставщики медицинских услуг, занимающиеся сопутствующими заболеваниями пациентов, если они есть, медсестры, фельдшеры и реабилитационные работники, а также социальные работники, которые помогают пациентам в послеоперационном периоде.
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Меза-Перес С., Рэндалл Т.Д. Иммунологические функции сальника. Тренды Иммунол. 2017 июль; 38 (7): 526-536. [Бесплатная статья PMC: PMC5812451] [PubMed: 28579319]
- 2.
Schwartz RW, Reames M, McGrath PC, Letton RW, Appleby G, Kenady DE. Первичные солидные новообразования большого сальника. Операция. 1991 апреля; 109 (4): 543-9. [PubMed: 2008659]
- 3.
Вайнбергер Х.А., Ахмед М.С. Мезенхимальные солидные опухоли сальника и брыжейки: отчет о четырех случаях.
 Операция. 1977 г., ноябрь; 82 (5): 754-9. [PubMed: 918865]
Операция. 1977 г., ноябрь; 82 (5): 754-9. [PubMed: 918865]- 4.
Hashimoto S, Arai J, Nishimuta M, Matsumoto H, Fukuoka H, Muraoka M, Nakashima M, Yamaguchi H. Резекция липосаркомы большого сальника: история болезни и литература обзор. Отчет по делу Int J Surg, 2019; 61:20-25. [Бесплатная статья PMC: PMC6626973] [PubMed: 31306901]
- 5.
Brañes A, Bustamante C, Valbuena J, Pimentel F, Quezada N. Первичная лейомиосаркома большого сальника: клинический случай. Отчет по делу Int J Surg 2016; 28:317-320. [Бесплатная статья PMC: PMC5079381] [PubMed: 27771602]
- 6.
Barel O, Qian C, Manolitsas T. Первичная лейомиосаркома сальника, представляющая собой рак яичника, отчет о клиническом случае и обзор литературы. Gynecol Oncol Rep. 2016 Aug;17:75-8. [Бесплатная статья PMC: PMC4949497] [PubMed: 27489871]
- 7.
Rodriguez Tarrega E, Hidalgo Mora JJ, Paya Amate V, Vega Oomen O. Солитарная фиброзная опухоль большого сальника, имитирующая опухоль яичника у молодой женщины.
 Gynecol Oncol Rep. 2016 Aug; 17:16-9. [Статья бесплатно PMC: PMC4899079] [PubMed: 27354994]
Gynecol Oncol Rep. 2016 Aug; 17:16-9. [Статья бесплатно PMC: PMC4899079] [PubMed: 27354994]- 8.
Fagkrezos D, Touloumis Z, Giannila M, Penlidis C, Papaparaskeva K, Triantopoulou C. Внежелудочно-кишечная стромальная опухоль сальника: редкий случай отчет и обзор литературы. Редкие опухоли. 2012 26 июня; 4(3):e44. [Бесплатная статья PMC: PMC3475951] [PubMed: 23087800]
- 9.
Соренсен Э.В., Гербер С.А., Седлачек А.Л., Рыбалко В.Ю., Чан В.М., Лорд Э.М. Сальниковые иммунные агрегаты и метастазы опухоли в брюшную полость. Иммунол Рез. 2009 декабрь; 45 (2-3): 185-94. [Бесплатная статья PMC: PMC28] [PubMed: 19253004]
- 10.
Joe DH, Yang JM, Kim HS, Kim SS, Choi SW, Choi SH, Lee S, Lim KW. Случай первичной лейомиосаркомы малого сальника. Корейский J Intern Med. 1999 янв; 14 (1): 88-90. [Бесплатная статья PMC: PMC4531912] [PubMed: 10063320]
- 11.
Shin MK, Lee OJ, Ha CY, Min HJ, Kim TH.
 Злокачественная мезотелиома большого сальника, имитирующая инфаркт сальника: клинический случай. Мир J Гастроэнтерол. 2009 14 октября; 15 (38): 4856-9. [Бесплатная статья PMC: PMC2761569] [PubMed: 19824125]
Злокачественная мезотелиома большого сальника, имитирующая инфаркт сальника: клинический случай. Мир J Гастроэнтерол. 2009 14 октября; 15 (38): 4856-9. [Бесплатная статья PMC: PMC2761569] [PubMed: 19824125]- 12.
Цзун Л., Чен П., Ван Г.Ю., Чжу К.С. Гигантская солитарная фиброзная опухоль, возникающая из большого сальника. Мир J Гастроэнтерол. 2012 28 ноября; 18 (44): 6515-20. [Бесплатная статья PMC: PMC3508650] [PubMed: 23197901]
- 13.
Urabe M, Yamagata Y, Aikou S, Mori K, Yamashita H, Nomura S, Shibahara J, Fukayama M, Seto Y. Солитарная фиброзная опухоль большого сальника, имитирующая гастроинтестинальную стромальную опухоль тонкая кишка: история болезни. инт сург. 2015 май; 100(5):836-40. [Бесплатная статья PMC: PMC4452971] [PubMed: 26011203]
- 14.
Тодороки Т., Сано Т., Сакураи С., Сегава А., Сайтох Т., Фудзикава К., Ямада С., Хирахара Н., Цусима Ю., Мотодзима Р., Мотожима Т. Первичная стромальная опухоль желудочно-кишечного тракта (GIST).
 World J Surg Oncol. 2007 12 июня; 5:66. [Бесплатная статья PMC: PMC1924523] [PubMed: 17565683]
World J Surg Oncol. 2007 12 июня; 5:66. [Бесплатная статья PMC: PMC1924523] [PubMed: 17565683]- 15.
Ватс М., Панди Д., Ахлават Х., Ахтар А., Сингх Н. Множественная первичная дедифференцированная липосаркома брыжейки тощей кишки: клинический случай и обзор литературы. J Clin Diagn Res. 2016 Январь;10(1):XD01-XD04. [Бесплатная статья PMC: PMC4740692] [PubMed: 26894164]
- 16.
Суфи М., Мдагри Дж., Бенамр С., Лахлоу М.К., Массрури Р., Эссадель А., Мохаммадин эль-Х., Таги А., Сеттаф А., Чад Б. Гигантская липосаркома сальника, имитирующая опухоль яичника. Отчет о случае. Индийский Дж. Сург. 2012 окт; 74 (5): 425-7. [Бесплатная статья PMC: PMC3477403] [PubMed: 24082602]
- 17.
Bouhabel S, Leblanc G, Ferreira J, Leclerc YE, Dubé P, Sidéris L. Солитарная фиброзная опухоль, возникающая в брыжейке: клинический случай. World J Surg Oncol. 2011 31 октября; 9:140. [Бесплатная статья PMC: PMC3225306] [PubMed: 22035205]
- 18.

Meloni F, Feo CF, Profili S, Cossu ML, Meloni GB. Хорошо дифференцированная липосаркома сальника: данные УЗИ, КТ и МРТ. Int J Biomed Sci. 2009 г., сен; 5(3):302-4. [Бесплатная статья PMC: PMC3614784] [PubMed: 23675151]
- 19.
Саваки А. Редкие гастроинтестинальные стромальные опухоли (GIST): сальник и забрюшинное пространство. Перевод Гастроэнтерол Гепатол. 2017;2:116. [Бесплатная статья PMC: PMC5762994] [PubMed: 29354773]
- 20.
Исида Дж., Исида Х., Конно К., Комацуда Т., Абэ К. Первичная лейомиосаркома большого сальника. Дж. Клин Гастроэнтерол. 1999 март; 28(2):167-70. [PubMed: 10078829]
- 21.
Цуцуми Х., Овада С., Такеёси И., Изуми М., Огава Т., Фукусато Т., Морисита Ю. Первичная липосаркома сальника с перекрутом: клинический случай. Гепатогастроэнтерология. 1999 май-июнь;46(27):2110-2. [PubMed: 10430407]
- 22.
Dixon AY, Reed JS, Dow N, Lee SH. Первичная сальниковая лейомиосаркома, маскирующаяся под геморрагический асцит.
 Хум Патол. 1984 март; 15 (3): 233-7. [PubMed: 6698542]
Хум Патол. 1984 март; 15 (3): 233-7. [PubMed: 6698542]
Опухоли сальника — StatPearls — NCBI Bookshelf
Продолжение обучения
Сальник состоит из клеток мезотелиального происхождения. Сальник проявляет ангиогенную, фиброзную, стволовые клетки и иммунную активность, ответственную за стимуляцию васкуляризации, ускоренное заживление и ограничение инфекции в брюшной полости. Эти действия также могут привести к патологическим изменениям, таким как образование опухоли сальника. В этой статье описаны эпидемиология, проявления, гистопатология, исследования и лечение первичных опухолей сальника. В этом мероприятии рассматривается оценка и лечение опухолей сальника и подчеркивается роль межпрофессиональной группы в оценке и улучшении ухода за пациентами с этим заболеванием.
Цели:
Определите эпидемиологию первичных опухолей сальника.
Опишите оценку первичных опухолей сальника.
Объясните возможные варианты лечения первичных опухолей сальника.

Обзор стратегий межпрофессиональной бригады для улучшения координации помощи и коммуникации для улучшения лечения первичных опухолей сальника и улучшения результатов.
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Введение
Сальник состоит из клеток мезотелиального происхождения. Говорят, что это тип висцеральной жировой ткани с общей площадью поверхности 1500 см2. Он висит перед органами брюшной полости, как фартук, а также связан с селезенкой, желудком, поджелудочной железой и толстой кишкой. Сальник проявляет ангиогенную, фиброзную, стволовые клетки и иммунную активность, ответственную за стимуляцию васкуляризации, ускоренное заживление и ограничение инфекции в брюшной полости. Эти действия также могут привести к патологическим изменениям, таким как образование опухоли сальника и метастазирование.[1] Первичные солидные опухоли большого сальника встречаются редко, всего 42 зарегистрированных случая; однако перитонеальные метастазы довольно распространены при некоторых опухолях, таких как стромальные опухоли желудочно-кишечного тракта и рак яичников.
Этиология
Эти опухоли являются спорадическими, и этиологические факторы, ответственные за такие опухоли, неизвестны.
Эпидемиология
Это редкие поражения, каждое из которых связано со скрытым началом.[3]
Липосаркома большого сальника — редкая опухоль; до июля 2019 г. в литературе описано 19 случаев. Девять случаев с 1936 по 2003 г., 10 случаев с 2003 по 2018 г. и один в 2019 г. Средний возраст пациентов в эти истории болезни составили 51,1 года.[4]
Лейомиосаркома большого сальника является редкой опухолью, и до октября 2016 г. в литературе было зарегистрировано 23 случая. Клинически эти опухоли проявляются на 5-м десятилетии жизни.[5] В то время как в другом исследовании было зарегистрировано 27 случаев. Средний возраст в этих случаях составлял 51 год, и это было немного чаще у мужчин.
Согласно сообщениям о случаях SFT (солитарных фиброзных опухолей) большого сальника, эта опухоль возникает на пятом-седьмом десятилетии жизни с соотношением мужчин и женщин 1:1. [7] 9[8]
[7] 9[8]
Патофизиология
Сальник называется депо висцерального жира. Его роль как «полицейского брюшной полости» была признана британским хирургом в начале 1900-х годов благодаря его свойствам перемещаться по брюшной полости и ограничивать инфекции и воспаления. Сальник содержит множество иммунных агрегатов, называемых «млочными пятнами», функция которых в значительной степени неизвестна. Говорят, что как свободные иммунные клетки, так и опухолевые клетки связываются с этими агрегатами.[9]]
Все первичные опухоли сальника спорадические и обычно злокачественные.[10] Но метастатические поражения распространены. Сообщаемые первичные опухоли сальника включают фибросаркому, веретеноклеточную саркому, липосаркому, лейомиому, гемангиоперицитому, липому и десмоидную опухоль, фиброму, мезотелиому, миосаркому, рабдомиосаркому, лейомиобластому и эндотелиому. Эти опухоли происходят из различных элементов, из которых состоит сальник, таких как жировая ткань, сосуды и лимфатическая ткань.
Первичная лейомиосаркома сальника — очень редкая опухоль; чаще лейомиосаркомы возникают в гладкомышечных клетках желудочно-кишечного тракта, забрюшинного пространства и мочеполового тракта. Из-за низкой частоты лейомиосаркомы сальника мало что известно о происхождении и поведении этих опухолей.
Солитарная фиброзная опухоль (SFT), ранее называвшаяся гемангиоперицитомой, представляет собой редкую мезенхимальную опухоль[7], часто происходящую из плевры; вовлечение сальника очень редко. От 78% до 88% этих опухолей являются доброкачественными, а от 12% до 22% злокачественными.[12] До 2015 г. в литературе было описано только 6 случаев SFT, возникающих из-за большого или малого сальника [13].
ГИСО (желудочно-кишечные стромальные опухоли) представляют собой мезенхимальные опухоли, возникающие из стенки желудочно-кишечного тракта, в основном из желудка. Однако редко они могут возникать из сальника, что обозначается как экстрагастроинтестинальные стромальные опухоли (EGIST). GIST и EGIST сходны гистопатологически и иммуногистохимически; оба экспрессируют мутации KIT/PDGFRA с усилением функции. Поскольку эти опухоли являются спорадическими, их злокачественный потенциал установить невозможно.[14] Сакураи и др. сообщил о клетках Кахаля, таких как клетки CD117+ и CD34+, в нормальном сальнике, из которых теоретически могут возникать EGIST.
GIST и EGIST сходны гистопатологически и иммуногистохимически; оба экспрессируют мутации KIT/PDGFRA с усилением функции. Поскольку эти опухоли являются спорадическими, их злокачественный потенциал установить невозможно.[14] Сакураи и др. сообщил о клетках Кахаля, таких как клетки CD117+ и CD34+, в нормальном сальнике, из которых теоретически могут возникать EGIST.
Липосаркомы обычно возникают из глубоких мягких тканей конечностей, и это наиболее распространенная саркома мягких тканей.[15] Интраабдоминальные локализации редки, и они редко исходят из большого сальника.
Злокачественная мезотелиома обычно возникает из плевры и брюшной полости, но редко может возникать из большого сальника. Его связь с асбестом менее очевидна по сравнению с мезотелиомой плевры.
Гистопатология
Гистопатология зависит от типа опухоли. Эмбриологическое происхождение этих опухолей варьируется, поскольку сальник состоит из различных тканей, таких как сосуды, лимфатические и жировые ткани.
Первичная лейомиосаркома сальника при гистологическом исследовании может показать длинные веретенообразные клетки с высоким митотическим индексом наряду с участками коагуляционного некроза опухоли и миксоидными изменениями; иммуногистохимия может быть положительной для десмина и актина гладких мышц и резко отрицательной для S100 и CD34, как при лейомиосаркоме.
SFT получают из мезенхимальных клеток; он в основном состоит из веретенообразных клеток и пучков коллагена. В литературе существует путаница в отношении происхождения и классификации SFT, поскольку гемангиоперицитомы (HPC) и SFT имеют много общих патологических находок; теперь они считаются частью одного и того же объекта.[17] При иммуногистохимическом окрашивании эти опухоли оказались отрицательными по следующим маркерам CD117, цитокератину, кальретинину, CD99, CD68, десмину, F8, S-100, антигену эпителиальной мембраны. Эти опухоли положительны по CD34, α-актину гладких мышц (α-SMA), BCL-2 и виментину (VIM) [12]. CD34 является полезным положительным биомаркером для SFT; несколько исследований показали 100% положительный результат.[13]
CD34 является полезным положительным биомаркером для SFT; несколько исследований показали 100% положительный результат.[13]
Согласно ВОЗ, липосаркома подразделяется на пять типов: высокодифференцированная, плеоморфная, круглоклеточная, миксоидная и дедифференцированная.[15] Липосаркома часто может иметь доброкачественные и злокачественные участки.[4] Прогноз этих опухолей зависит от гистологического типа [16]; дедифференцированный подтип имеет худший прогноз и высокую частоту рецидивов.[18] Хорошо дифференцированная липосаркома имеет толстые перегородки, размер поражения> 10 см, содержит глобулярные нежировые области и компонент поражения <75% жира.
Происхождение экстрагастроинтестинальных стромальных опухолей (EGIST) полностью не известно, но их гистология и иммунофенотип сходны с GIST. Считается, что это GIST, которые были отделены от желудочно-кишечного тракта, или они могут возникать из мезенхимальных клеток сальника [8]. EGIST, как и GIST, обычно положительны для KIT, альфа-актина гладких мышц и отрицательны для десмина и белка s-100. Показано, что эти опухоли, сходные с ГИСО, состоят из удлиненных веретенообразных клеток, эпителиоидных клеток или смешанных клеток с высокой клеточностью и низкой митотической активностью [19].]
Показано, что эти опухоли, сходные с ГИСО, состоят из удлиненных веретенообразных клеток, эпителиоидных клеток или смешанных клеток с высокой клеточностью и низкой митотической активностью [19].]
Гистологическое исследование мезотелиомы сальника может выявить эпителиальную, саркоматоидную или двухфазную структуру. Опухоли эпителиального типа составляют 75% случаев и варьируют от хорошо дифференцированных с тубуло-папиллярным рисунком до сплошных пластов круглых или полигональных клеток. Такие опухоли могут имитировать карциному, и бывает трудно отличить эпителиоидную мезотелиому от метастатической карциномы, особенно аденокарциномы. Опухоли саркоматоидного типа могут быть неотличимы от фибросарком только по гистологическим данным. Иммуногистохимия может помочь дифференцировать саркому и аденокарциному. Эти опухолевые клетки положительны на кальретинин, цитокератин и антиген эпителиальной мембраны и отрицательны на белок S-100, Leu-M1, CEA, тромбомодулин и плацентарную щелочную фосфатазу, положительная иммунореактивность на кальретинин значительно повышает точность диагноза.
Анамнез и физикальное исследование
Первичные опухоли сальника в основном протекают бессимптомно, но у большинства пациентов отмечают дискомфорт в животе, пальпируемое образование в животе, тошноту, быстрое чувство насыщения и потерю веса.[11] Другими симптомами, основанными на различных описаниях случаев, представленных в литературе, являются боль в животе, вздутие живота, запор, анорексия, рвота и лихорадка. Физикальное обследование может выявить пальпацию безболезненного образования в брюшной полости, баллотируемого сбоку, на основании описаний случаев в доступной литературе; масса может пальпироваться в эпигастрии, гипогастрии, верхнем или нижнем правом или левом квадранте или вовлекать всю брюшную полость. [17]
У пациентов также может наблюдаться болезненность новообразования, и при осмотре живота может наблюдаться настороженность.[21] В некоторых отчетах о случаях у пациентов также был асцит.[6] Пациенты с асцитом, потерей веса и перитонеальными имплантатами обычно указывают на злокачественное новообразование. Наиболее частыми клиническими проявлениями первичной опухоли сальника являются абдоминальный дискомфорт (56%) и объемное образование (35%) [2]. В одном отчете о случае у пациента была диффузная боль в животе без пальпируемого образования при физикальном обследовании , в то время как в другом отчете о случае пациент с первичной лейомиосаркомой имел необъяснимые геморрагические псевдоасциты.[5][22] Хотя симптомы в значительной степени неспецифичны, они также могут проявляться как случайные находки при визуализации. EGIST сальника могут оставаться клинически бессимптомными, несмотря на огромные размеры опухоли.[8]
Наиболее частыми клиническими проявлениями первичной опухоли сальника являются абдоминальный дискомфорт (56%) и объемное образование (35%) [2]. В одном отчете о случае у пациента была диффузная боль в животе без пальпируемого образования при физикальном обследовании , в то время как в другом отчете о случае пациент с первичной лейомиосаркомой имел необъяснимые геморрагические псевдоасциты.[5][22] Хотя симптомы в значительной степени неспецифичны, они также могут проявляться как случайные находки при визуализации. EGIST сальника могут оставаться клинически бессимптомными, несмотря на огромные размеры опухоли.[8]
Оценка
Диагностика липосаркомы является сложной задачей, и ее трудно дифференцировать от других опухолей. Внешний вид хорошо дифференцированной липосаркомы на КТ и МРТ похож на жировую и другие опухоли брюшной полости.[4]
Дооперационный диагноз первичной лейомиосаркомы сальника затруднен, и диагноз обычно ставится после операции. Точный диагноз ставится только при гистопатологическом исследовании опухоли. [6]
[6]
Внутривенная КТ брюшной полости и таза и МРТ являются лучшими методами визуализации для диагностики лейомиосаркомы сальника. Он может дать точную информацию о происхождении опухоли. Эти поражения в большинстве случаев имеют сходные визуализационные характеристики, представляя собой солидно-кистозную и многодольчатую опухоль [5]. Ультразвук может обнаружить опухоль и показать внутреннюю структуру поражения, но не может определить происхождение. Иногда эти опухоли сопровождаются асцитом и повышенным уровнем СА-125, что может свидетельствовать о раке яичников.[6]
Рентгенологические особенности сальниковых ЭГИСТ, не имеющих миогенной и нейрогенной дифференцировки, не установлены. Они могут быть похожи на сальниковую лейомиому и лейомиосаркому. Большинство ГИСО с миогенными признаками гиперваскуляризированы и имеют четкие границы на КТ и ангиографии.[8]
Согласно Ishida (1998), компьютерная томография является методом выбора при больших оментальных опухолях. На КТ такие опухоли обычно многодольчатые, плоские, блинообразные, с усилением солидной и мультикистозной плотности. Ангиография является полезным исследованием в диагностике опухолей сальника. Диагноз опухоли сальника ставится, когда артерия, питающая опухоль, отходит от сальникового кровоснабжения. Высоковаскулярное поражение с неоваскуляризацией, скорее всего, означает злокачественную опухоль.[6]
Ангиография является полезным исследованием в диагностике опухолей сальника. Диагноз опухоли сальника ставится, когда артерия, питающая опухоль, отходит от сальникового кровоснабжения. Высоковаскулярное поражение с неоваскуляризацией, скорее всего, означает злокачественную опухоль.[6]
Окончательный диагноз можно поставить с помощью лапароскопии или открытой операции с биопсией. Гистология и иммуногистохимия используются для диагностики и дифференциации мезотелиомы от аденокарциномы и саркомы.
Ультразвук и компьютерная томография могут быть использованы для отслеживания рецидивов.[12]
КТ и МРТ являются лучшими методами диагностики солитарных фиброзных опухолей сальника. Они помогают выявить разрастание фиброзной ткани в брюшной полости, оценить соотношение между опухолью и окружающими структурами и принять решение об удалении опухоли. Однако КТ и МРТ не могут отличить SFT от мезенхимальных опухолей. Поэтому его можно ошибочно диагностировать как стромальную опухоль. Аспирация иглой не помогает в диагностике, потому что опухоль состоит из бесклеточной и гиперклеточной частей и не дает достаточного количества ткани для цитологического анализа. Эппл и др. сообщили, что точный диагноз может быть поставлен с помощью тонкоигольной аспирации, но у многих пациентов это требует исследования. Образцы опухоли могут быть собраны через трубку Райла при небольших опухолях и с помощью диагностической лапаротомии при больших опухолях.[12]
Аспирация иглой не помогает в диагностике, потому что опухоль состоит из бесклеточной и гиперклеточной частей и не дает достаточного количества ткани для цитологического анализа. Эппл и др. сообщили, что точный диагноз может быть поставлен с помощью тонкоигольной аспирации, но у многих пациентов это требует исследования. Образцы опухоли могут быть собраны через трубку Райла при небольших опухолях и с помощью диагностической лапаротомии при больших опухолях.[12]
Диагностика SFT сальника затруднена, поскольку она напоминает другие опухоли, такие как лейомиома и мезотелиома. Более того, если опухоль на ножке возникает из сальника, ее можно принять за другие опухоли таза. Иммуногистохимия помогает установить диагноз. Эти опухоли положительны по CD34, CD99 и BCL-2, а иногда и по SMA, но обычно отрицательны по S-100, десмину и цитокератинам. SFT выглядит как сильно васкуляризированная солидная опухоль с четко очерченными краями на ультразвуковом изображении, и КТ-сканирование может показать те же результаты. Однако визуализация не является специфическим исследованием, и дооперационная диагностика становится невозможной.[7]
Однако визуализация не является специфическим исследованием, и дооперационная диагностика становится невозможной.[7]
Лечение/управление
Радикальная резекция опухоли рекомендуется при липосаркомах; адъювантная терапия не была признана эффективным методом лечения.[4]
Полное удаление опухоли дает хороший прогноз при лейомиосаркоме сальника. Некоторые авторы использовали нестандартизированные схемы химиотерапии при нерезектабельном заболевании с переменными результатами. У пациентов с диссеминированным заболеванием также применялась мультимодальная терапия. Из-за агрессивного характера таких опухолей часто возникают рецидивы, а долгосрочная выживаемость неизвестна.[5]
SFT, как правило, доброкачественные. От 15 до 20% из них являются злокачественными, особенно опухоли размером более 10 см. Гистологические признаки, такие как высокая клеточность, высокая митотическая активность, плеоморфизм, атипия, некроз опухоли и кровоизлияние, указывают на злокачественность. Размер опухоли и митотическая активность играют важную роль в прогнозировании SFT, исходящей из сальника. Такие характеристики, как размер опухоли, митотическая активность, клеточность и плеоморфизм для прогнозирования поведения SFT, могут использоваться для оценки риска. Злокачественные факторы связаны с высокой частотой рецидивов и метастазирования.[12] Методом выбора является хирургическая резекция, однако злокачественные опухоли могут рецидивировать даже через несколько лет после операции. Полезная роль адъювантной терапии еще не установлена, но в некоторых сообщениях предполагается адъювантная лучевая терапия и показан ответ на химиотерапию, но их эффективность не доказана. Размер опухоли является хорошим прогностическим фактором, но высокая митотическая активность связана с плохим прогнозом.[7]
Размер опухоли и митотическая активность играют важную роль в прогнозировании SFT, исходящей из сальника. Такие характеристики, как размер опухоли, митотическая активность, клеточность и плеоморфизм для прогнозирования поведения SFT, могут использоваться для оценки риска. Злокачественные факторы связаны с высокой частотой рецидивов и метастазирования.[12] Методом выбора является хирургическая резекция, однако злокачественные опухоли могут рецидивировать даже через несколько лет после операции. Полезная роль адъювантной терапии еще не установлена, но в некоторых сообщениях предполагается адъювантная лучевая терапия и показан ответ на химиотерапию, но их эффективность не доказана. Размер опухоли является хорошим прогностическим фактором, но высокая митотическая активность связана с плохим прогнозом.[7]
Радикальная резекция является методом выбора при ГИСО сальника; адъювантная терапия иматинибом после хирургической резекции при ограниченном заболевании также проводится [8]. Адъювантная терапия иматинибом может предотвратить рецидив и увеличить долгосрочную выживаемость [14].
Что касается мезотелиомы сальника, в нескольких независимых исследованиях фазы 1 и 2 была принята интенсивная местно-регионарная стратегия лечения, включая циторедуктивную хирургию, дополненную периоперационной гипертермической внутрибрюшинной химиотерапией. К ней также может быть добавлена ранняя послеоперационная внутрибрюшинная химиотерапия. Сообщается, что эта форма лечения в результате улучшила медиану выживаемости. Фогельзанг и др. провели многоцентровое контролируемое рандомизированное исследование III фазы, и показано, что пеметрексед-цисплатин является золотым стандартом в случае неоперабельной злокачественной мезотелиомы плевры. Это лечение дало объективный ответ при мезотелиоме сальника [11].
Окончательным методом лечения SFT сальника является хирургическая резекция опухоли с отрицательным краем. Послеоперационное длительное наблюдение имеет важное значение, поскольку эти опухоли часто рецидивируют. Злокачественные опухоли агрессивны, локально инвазивны с усиленным ростом и метастазированием. Поэтому при злокачественных опухолях рекомендуется послеоперационная химиотерапия. Более того, половина злокачественных SFT были положительными для c-kit, и ингибиторы тирозинкиназы, такие как иматиниб и сунитиниб, которые также эффективны для GIST, также использовались для SFT. Опухоль более 10 см имеет повышенный злокачественный потенциал, худший исход для метастазирования и повышенное количество рецидивов.[13]
Поэтому при злокачественных опухолях рекомендуется послеоперационная химиотерапия. Более того, половина злокачественных SFT были положительными для c-kit, и ингибиторы тирозинкиназы, такие как иматиниб и сунитиниб, которые также эффективны для GIST, также использовались для SFT. Опухоль более 10 см имеет повышенный злокачественный потенциал, худший исход для метастазирования и повышенное количество рецидивов.[13]
Differential Diagnosis
The differential diagnosis of primary tumors of omentum is
Fibrosarcoma
Spindle cell sarcoma
Liposarcoma
Leiomyoma
Hemangiopericytoma
Lipoma
Десмоидная опухоль
Фиброма
Мезотелиома
Миосаркома
Рабдомиосаркома
Лейомиобластома
Эндотелиома.[6][11]
Эти опухоли могут быть ошибочно приняты за опухоли таза, опухоли яичников и ГИСО.
Прогноз
Прогноз при липосаркомах туловища, в том числе внутрибрюшной области, хуже, чем при липосаркомах конечностей. В одном исследовании средняя 5-летняя выживаемость при липосаркоме туловища составила 41,9% по сравнению с конечностями, где она составила 66,7%. Прогноз также зависит от гистологического подтипа липосаркомы. Пятилетняя безрецидивная выживаемость хуже для опухолей группы высокой степени злокачественности (дедифференцированные, круглоклеточные и плеоморфные), чем для групп опухолей низкой степени злокачественности (высокодифференцированные и миксоидного типа) [4].
Из-за редкости сальниковых EGIST их злокачественный потенциал и общий прогноз трудно установить.[14] По сравнению с обычным GIST, EGIST имеет менее благоприятный прогноз, поскольку такие опухоли сопровождаются высокими митотическими индексами, большими размерами и отдаленными метастазами.[19]
Прогноз при злокачественной мезотелиоме сальника крайне неблагоприятный, поскольку эффективного лечения до сих пор не существует. Большинство пациентов умирают в течение одного года после постановки диагноза. По данным некоторых ретроспективных исследований, медиана выживаемости после операций, направленных на паллиативное лечение в сочетании с системной или внутрибрюшинной химиотерапией, составляет около одного года. У пациентов, которым была проведена агрессивная хирургия с гипертермической внутрибрюшинной химиотерапией, медиана выживаемости приблизилась к пяти годам [11].
Большинство пациентов умирают в течение одного года после постановки диагноза. По данным некоторых ретроспективных исследований, медиана выживаемости после операций, направленных на паллиативное лечение в сочетании с системной или внутрибрюшинной химиотерапией, составляет около одного года. У пациентов, которым была проведена агрессивная хирургия с гипертермической внутрибрюшинной химиотерапией, медиана выживаемости приблизилась к пяти годам [11].
Осложнения
У некоторых пациентов был отмечен внутрибрюшной разрыв опухоли, приводящий к острому животу.[7]
Сдерживание и просвещение пациентов
Поскольку первичные опухоли сальника встречаются редко, знаний о поведении таких опухолей все еще недостаточно, и требуется больше случаев и исследований.
Улучшение результатов медицинского персонала
Первичные опухоли сальника — это спорадические опухоли. Эти опухоли либо бессимптомны, либо признаки и симптомы проявления неспецифичны, что проявляется поздно из-за массового эффекта опухоли. Методы визуализации, такие как компьютерная томография, в значительной степени диагностируют их. Для лечения таких опухолей и улучшения результатов необходимы дополнительные исследования, чтобы узнать об этиологии, прогрессировании и лучших вариантах лечения таких опухолей. Хотя хирурги являются основными лицами, осуществляющими уход за такими пациентами, рентгенологи играют жизненно важную роль в диагностике пациентов с этими редкими опухолями. Другие задействованные медицинские работники — это поставщики медицинских услуг, занимающиеся сопутствующими заболеваниями пациентов, если они есть, медсестры, фельдшеры и реабилитационные работники, а также социальные работники, которые помогают пациентам в послеоперационном периоде.
Методы визуализации, такие как компьютерная томография, в значительной степени диагностируют их. Для лечения таких опухолей и улучшения результатов необходимы дополнительные исследования, чтобы узнать об этиологии, прогрессировании и лучших вариантах лечения таких опухолей. Хотя хирурги являются основными лицами, осуществляющими уход за такими пациентами, рентгенологи играют жизненно важную роль в диагностике пациентов с этими редкими опухолями. Другие задействованные медицинские работники — это поставщики медицинских услуг, занимающиеся сопутствующими заболеваниями пациентов, если они есть, медсестры, фельдшеры и реабилитационные работники, а также социальные работники, которые помогают пациентам в послеоперационном периоде.
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Меза-Перес С., Рэндалл Т.Д. Иммунологические функции сальника.
 Тренды Иммунол. 2017 июль; 38 (7): 526-536. [Бесплатная статья PMC: PMC5812451] [PubMed: 28579319]
Тренды Иммунол. 2017 июль; 38 (7): 526-536. [Бесплатная статья PMC: PMC5812451] [PubMed: 28579319]- 2.
Schwartz RW, Reames M, McGrath PC, Letton RW, Appleby G, Kenady DE. Первичные солидные новообразования большого сальника. Операция. 1991 апреля; 109 (4): 543-9. [PubMed: 2008659]
- 3.
Вайнбергер Х.А., Ахмед М.С. Мезенхимальные солидные опухоли сальника и брыжейки: отчет о четырех случаях. Операция. 1977 г., ноябрь; 82 (5): 754-9. [PubMed: 918865]
- 4.
Hashimoto S, Arai J, Nishimuta M, Matsumoto H, Fukuoka H, Muraoka M, Nakashima M, Yamaguchi H. Резекция липосаркомы большого сальника: история болезни и литература обзор. Отчет по делу Int J Surg, 2019; 61:20-25. [Бесплатная статья PMC: PMC6626973] [PubMed: 31306901]
- 5.
Brañes A, Bustamante C, Valbuena J, Pimentel F, Quezada N. Первичная лейомиосаркома большого сальника: клинический случай. Отчет по делу Int J Surg 2016; 28:317-320.
 [Бесплатная статья PMC: PMC5079381] [PubMed: 27771602]
[Бесплатная статья PMC: PMC5079381] [PubMed: 27771602]- 6.
Barel O, Qian C, Manolitsas T. Первичная лейомиосаркома сальника, представляющая собой рак яичника, отчет о клиническом случае и обзор литературы. Gynecol Oncol Rep. 2016 Aug;17:75-8. [Бесплатная статья PMC: PMC4949497] [PubMed: 27489871]
- 7.
Rodriguez Tarrega E, Hidalgo Mora JJ, Paya Amate V, Vega Oomen O. Солитарная фиброзная опухоль большого сальника, имитирующая опухоль яичника у молодой женщины. Gynecol Oncol Rep. 2016 Aug; 17:16-9. [Статья бесплатно PMC: PMC4899079] [PubMed: 27354994]
- 8.
Fagkrezos D, Touloumis Z, Giannila M, Penlidis C, Papaparaskeva K, Triantopoulou C. Внежелудочно-кишечная стромальная опухоль сальника: редкий случай отчет и обзор литературы. Редкие опухоли. 2012 26 июня; 4(3):e44. [Бесплатная статья PMC: PMC3475951] [PubMed: 23087800]
- 9.
Соренсен Э.В., Гербер С.А., Седлачек А.Л., Рыбалко В.
 Ю., Чан В.М., Лорд Э.М. Сальниковые иммунные агрегаты и метастазы опухоли в брюшную полость. Иммунол Рез. 2009 декабрь; 45 (2-3): 185-94. [Бесплатная статья PMC: PMC28] [PubMed: 19253004]
Ю., Чан В.М., Лорд Э.М. Сальниковые иммунные агрегаты и метастазы опухоли в брюшную полость. Иммунол Рез. 2009 декабрь; 45 (2-3): 185-94. [Бесплатная статья PMC: PMC28] [PubMed: 19253004]- 10.
Joe DH, Yang JM, Kim HS, Kim SS, Choi SW, Choi SH, Lee S, Lim KW. Случай первичной лейомиосаркомы малого сальника. Корейский J Intern Med. 1999 янв; 14 (1): 88-90. [Бесплатная статья PMC: PMC4531912] [PubMed: 10063320]
- 11.
Shin MK, Lee OJ, Ha CY, Min HJ, Kim TH. Злокачественная мезотелиома большого сальника, имитирующая инфаркт сальника: клинический случай. Мир J Гастроэнтерол. 2009 14 октября; 15 (38): 4856-9. [Бесплатная статья PMC: PMC2761569] [PubMed: 19824125]
- 12.
Цзун Л., Чен П., Ван Г.Ю., Чжу К.С. Гигантская солитарная фиброзная опухоль, возникающая из большого сальника. Мир J Гастроэнтерол. 2012 28 ноября; 18 (44): 6515-20. [Бесплатная статья PMC: PMC3508650] [PubMed: 23197901]
- 13.

Urabe M, Yamagata Y, Aikou S, Mori K, Yamashita H, Nomura S, Shibahara J, Fukayama M, Seto Y. Солитарная фиброзная опухоль большого сальника, имитирующая гастроинтестинальную стромальную опухоль тонкая кишка: история болезни. инт сург. 2015 май; 100(5):836-40. [Бесплатная статья PMC: PMC4452971] [PubMed: 26011203]
- 14.
Тодороки Т., Сано Т., Сакураи С., Сегава А., Сайтох Т., Фудзикава К., Ямада С., Хирахара Н., Цусима Ю., Мотодзима Р., Мотожима Т. Первичная стромальная опухоль желудочно-кишечного тракта (GIST). World J Surg Oncol. 2007 12 июня; 5:66. [Бесплатная статья PMC: PMC1924523] [PubMed: 17565683]
- 15.
Ватс М., Панди Д., Ахлават Х., Ахтар А., Сингх Н. Множественная первичная дедифференцированная липосаркома брыжейки тощей кишки: клинический случай и обзор литературы. J Clin Diagn Res. 2016 Январь;10(1):XD01-XD04. [Бесплатная статья PMC: PMC4740692] [PubMed: 26894164]
- 16.
Суфи М.
 , Мдагри Дж., Бенамр С., Лахлоу М.К., Массрури Р., Эссадель А., Мохаммадин эль-Х., Таги А., Сеттаф А., Чад Б. Гигантская липосаркома сальника, имитирующая опухоль яичника. Отчет о случае. Индийский Дж. Сург. 2012 окт; 74 (5): 425-7. [Бесплатная статья PMC: PMC3477403] [PubMed: 24082602]
, Мдагри Дж., Бенамр С., Лахлоу М.К., Массрури Р., Эссадель А., Мохаммадин эль-Х., Таги А., Сеттаф А., Чад Б. Гигантская липосаркома сальника, имитирующая опухоль яичника. Отчет о случае. Индийский Дж. Сург. 2012 окт; 74 (5): 425-7. [Бесплатная статья PMC: PMC3477403] [PubMed: 24082602]- 17.
Bouhabel S, Leblanc G, Ferreira J, Leclerc YE, Dubé P, Sidéris L. Солитарная фиброзная опухоль, возникающая в брыжейке: клинический случай. World J Surg Oncol. 2011 31 октября; 9:140. [Бесплатная статья PMC: PMC3225306] [PubMed: 22035205]
- 18.
Meloni F, Feo CF, Profili S, Cossu ML, Meloni GB. Хорошо дифференцированная липосаркома сальника: данные УЗИ, КТ и МРТ. Int J Biomed Sci. 2009 г., сен; 5(3):302-4. [Бесплатная статья PMC: PMC3614784] [PubMed: 23675151]
- 19.
Саваки А. Редкие гастроинтестинальные стромальные опухоли (GIST): сальник и забрюшинное пространство. Перевод Гастроэнтерол Гепатол. 2017;2:116. [Бесплатная статья PMC: PMC5762994] [PubMed: 29354773]
- 20.

Исида Дж., Исида Х., Конно К., Комацуда Т., Абэ К. Первичная лейомиосаркома большого сальника. Дж. Клин Гастроэнтерол. 1999 март; 28(2):167-70. [PubMed: 10078829]
- 21.
Цуцуми Х., Овада С., Такеёси И., Изуми М., Огава Т., Фукусато Т., Морисита Ю. Первичная липосаркома сальника с перекрутом: клинический случай. Гепатогастроэнтерология. 1999 май-июнь;46(27):2110-2. [PubMed: 10430407]
- 22.
Dixon AY, Reed JS, Dow N, Lee SH. Первичная сальниковая лейомиосаркома, маскирующаяся под геморрагический асцит. Хум Патол. 1984 март; 15 (3): 233-7. [PubMed: 6698542]
Опухоли сальника — StatPearls — NCBI Bookshelf
Продолжение обучения
Сальник состоит из клеток мезотелиального происхождения. Сальник проявляет ангиогенную, фиброзную, стволовые клетки и иммунную активность, ответственную за стимуляцию васкуляризации, ускоренное заживление и ограничение инфекции в брюшной полости. Эти действия также могут привести к патологическим изменениям, таким как образование опухоли сальника. В этой статье описаны эпидемиология, проявления, гистопатология, исследования и лечение первичных опухолей сальника. В этом мероприятии рассматривается оценка и лечение опухолей сальника и подчеркивается роль межпрофессиональной группы в оценке и улучшении ухода за пациентами с этим заболеванием.
В этой статье описаны эпидемиология, проявления, гистопатология, исследования и лечение первичных опухолей сальника. В этом мероприятии рассматривается оценка и лечение опухолей сальника и подчеркивается роль межпрофессиональной группы в оценке и улучшении ухода за пациентами с этим заболеванием.
Цели:
Определите эпидемиологию первичных опухолей сальника.
Опишите оценку первичных опухолей сальника.
Объясните возможные варианты лечения первичных опухолей сальника.
Обзор стратегий межпрофессиональной бригады для улучшения координации помощи и коммуникации для улучшения лечения первичных опухолей сальника и улучшения результатов.
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Введение
Сальник состоит из клеток мезотелиального происхождения. Говорят, что это тип висцеральной жировой ткани с общей площадью поверхности 1500 см2. Он висит перед органами брюшной полости, как фартук, а также связан с селезенкой, желудком, поджелудочной железой и толстой кишкой. Сальник проявляет ангиогенную, фиброзную, стволовые клетки и иммунную активность, ответственную за стимуляцию васкуляризации, ускоренное заживление и ограничение инфекции в брюшной полости. Эти действия также могут привести к патологическим изменениям, таким как образование опухоли сальника и метастазирование.[1] Первичные солидные опухоли большого сальника встречаются редко, всего 42 зарегистрированных случая; однако перитонеальные метастазы довольно распространены при некоторых опухолях, таких как стромальные опухоли желудочно-кишечного тракта и рак яичников.
Он висит перед органами брюшной полости, как фартук, а также связан с селезенкой, желудком, поджелудочной железой и толстой кишкой. Сальник проявляет ангиогенную, фиброзную, стволовые клетки и иммунную активность, ответственную за стимуляцию васкуляризации, ускоренное заживление и ограничение инфекции в брюшной полости. Эти действия также могут привести к патологическим изменениям, таким как образование опухоли сальника и метастазирование.[1] Первичные солидные опухоли большого сальника встречаются редко, всего 42 зарегистрированных случая; однако перитонеальные метастазы довольно распространены при некоторых опухолях, таких как стромальные опухоли желудочно-кишечного тракта и рак яичников.
Этиология
Эти опухоли являются спорадическими, и этиологические факторы, ответственные за такие опухоли, неизвестны.
Эпидемиология
Это редкие поражения, каждое из которых связано со скрытым началом.[3]
Липосаркома большого сальника — редкая опухоль; до июля 2019 г. в литературе описано 19 случаев. Девять случаев с 1936 по 2003 г., 10 случаев с 2003 по 2018 г. и один в 2019 г. Средний возраст пациентов в эти истории болезни составили 51,1 года.[4]
в литературе описано 19 случаев. Девять случаев с 1936 по 2003 г., 10 случаев с 2003 по 2018 г. и один в 2019 г. Средний возраст пациентов в эти истории болезни составили 51,1 года.[4]
Лейомиосаркома большого сальника является редкой опухолью, и до октября 2016 г. в литературе было зарегистрировано 23 случая. Клинически эти опухоли проявляются на 5-м десятилетии жизни.[5] В то время как в другом исследовании было зарегистрировано 27 случаев. Средний возраст в этих случаях составлял 51 год, и это было немного чаще у мужчин.
Согласно сообщениям о случаях SFT (солитарных фиброзных опухолей) большого сальника, эта опухоль возникает на пятом-седьмом десятилетии жизни с соотношением мужчин и женщин 1:1.[7] 9[8]
Патофизиология
Сальник называется депо висцерального жира. Его роль как «полицейского брюшной полости» была признана британским хирургом в начале 1900-х годов благодаря его свойствам перемещаться по брюшной полости и ограничивать инфекции и воспаления. Сальник содержит множество иммунных агрегатов, называемых «млочными пятнами», функция которых в значительной степени неизвестна. Говорят, что как свободные иммунные клетки, так и опухолевые клетки связываются с этими агрегатами.[9]]
Сальник содержит множество иммунных агрегатов, называемых «млочными пятнами», функция которых в значительной степени неизвестна. Говорят, что как свободные иммунные клетки, так и опухолевые клетки связываются с этими агрегатами.[9]]
Все первичные опухоли сальника спорадические и обычно злокачественные.[10] Но метастатические поражения распространены. Сообщаемые первичные опухоли сальника включают фибросаркому, веретеноклеточную саркому, липосаркому, лейомиому, гемангиоперицитому, липому и десмоидную опухоль, фиброму, мезотелиому, миосаркому, рабдомиосаркому, лейомиобластому и эндотелиому. Эти опухоли происходят из различных элементов, из которых состоит сальник, таких как жировая ткань, сосуды и лимфатическая ткань.
Первичная лейомиосаркома сальника — очень редкая опухоль; чаще лейомиосаркомы возникают в гладкомышечных клетках желудочно-кишечного тракта, забрюшинного пространства и мочеполового тракта. Из-за низкой частоты лейомиосаркомы сальника мало что известно о происхождении и поведении этих опухолей.
Солитарная фиброзная опухоль (SFT), ранее называвшаяся гемангиоперицитомой, представляет собой редкую мезенхимальную опухоль[7], часто происходящую из плевры; вовлечение сальника очень редко. От 78% до 88% этих опухолей являются доброкачественными, а от 12% до 22% злокачественными.[12] До 2015 г. в литературе было описано только 6 случаев SFT, возникающих из-за большого или малого сальника [13].
ГИСО (желудочно-кишечные стромальные опухоли) представляют собой мезенхимальные опухоли, возникающие из стенки желудочно-кишечного тракта, в основном из желудка. Однако редко они могут возникать из сальника, что обозначается как экстрагастроинтестинальные стромальные опухоли (EGIST). GIST и EGIST сходны гистопатологически и иммуногистохимически; оба экспрессируют мутации KIT/PDGFRA с усилением функции. Поскольку эти опухоли являются спорадическими, их злокачественный потенциал установить невозможно.[14] Сакураи и др. сообщил о клетках Кахаля, таких как клетки CD117+ и CD34+, в нормальном сальнике, из которых теоретически могут возникать EGIST.
Липосаркомы обычно возникают из глубоких мягких тканей конечностей, и это наиболее распространенная саркома мягких тканей.[15] Интраабдоминальные локализации редки, и они редко исходят из большого сальника.
Злокачественная мезотелиома обычно возникает из плевры и брюшной полости, но редко может возникать из большого сальника. Его связь с асбестом менее очевидна по сравнению с мезотелиомой плевры.
Гистопатология
Гистопатология зависит от типа опухоли. Эмбриологическое происхождение этих опухолей варьируется, поскольку сальник состоит из различных тканей, таких как сосуды, лимфатические и жировые ткани.
Первичная лейомиосаркома сальника при гистологическом исследовании может показать длинные веретенообразные клетки с высоким митотическим индексом наряду с участками коагуляционного некроза опухоли и миксоидными изменениями; иммуногистохимия может быть положительной для десмина и актина гладких мышц и резко отрицательной для S100 и CD34, как при лейомиосаркоме.
SFT получают из мезенхимальных клеток; он в основном состоит из веретенообразных клеток и пучков коллагена. В литературе существует путаница в отношении происхождения и классификации SFT, поскольку гемангиоперицитомы (HPC) и SFT имеют много общих патологических находок; теперь они считаются частью одного и того же объекта.[17] При иммуногистохимическом окрашивании эти опухоли оказались отрицательными по следующим маркерам CD117, цитокератину, кальретинину, CD99, CD68, десмину, F8, S-100, антигену эпителиальной мембраны. Эти опухоли положительны по CD34, α-актину гладких мышц (α-SMA), BCL-2 и виментину (VIM) [12]. CD34 является полезным положительным биомаркером для SFT; несколько исследований показали 100% положительный результат.[13]
Согласно ВОЗ, липосаркома подразделяется на пять типов: высокодифференцированная, плеоморфная, круглоклеточная, миксоидная и дедифференцированная.[15] Липосаркома часто может иметь доброкачественные и злокачественные участки.[4] Прогноз этих опухолей зависит от гистологического типа [16]; дедифференцированный подтип имеет худший прогноз и высокую частоту рецидивов. [18] Хорошо дифференцированная липосаркома имеет толстые перегородки, размер поражения> 10 см, содержит глобулярные нежировые области и компонент поражения <75% жира.
[18] Хорошо дифференцированная липосаркома имеет толстые перегородки, размер поражения> 10 см, содержит глобулярные нежировые области и компонент поражения <75% жира.
Происхождение экстрагастроинтестинальных стромальных опухолей (EGIST) полностью не известно, но их гистология и иммунофенотип сходны с GIST. Считается, что это GIST, которые были отделены от желудочно-кишечного тракта, или они могут возникать из мезенхимальных клеток сальника [8]. EGIST, как и GIST, обычно положительны для KIT, альфа-актина гладких мышц и отрицательны для десмина и белка s-100. Показано, что эти опухоли, сходные с ГИСО, состоят из удлиненных веретенообразных клеток, эпителиоидных клеток или смешанных клеток с высокой клеточностью и низкой митотической активностью [19].]
Гистологическое исследование мезотелиомы сальника может выявить эпителиальную, саркоматоидную или двухфазную структуру. Опухоли эпителиального типа составляют 75% случаев и варьируют от хорошо дифференцированных с тубуло-папиллярным рисунком до сплошных пластов круглых или полигональных клеток. Такие опухоли могут имитировать карциному, и бывает трудно отличить эпителиоидную мезотелиому от метастатической карциномы, особенно аденокарциномы. Опухоли саркоматоидного типа могут быть неотличимы от фибросарком только по гистологическим данным. Иммуногистохимия может помочь дифференцировать саркому и аденокарциному. Эти опухолевые клетки положительны на кальретинин, цитокератин и антиген эпителиальной мембраны и отрицательны на белок S-100, Leu-M1, CEA, тромбомодулин и плацентарную щелочную фосфатазу, положительная иммунореактивность на кальретинин значительно повышает точность диагноза.
Такие опухоли могут имитировать карциному, и бывает трудно отличить эпителиоидную мезотелиому от метастатической карциномы, особенно аденокарциномы. Опухоли саркоматоидного типа могут быть неотличимы от фибросарком только по гистологическим данным. Иммуногистохимия может помочь дифференцировать саркому и аденокарциному. Эти опухолевые клетки положительны на кальретинин, цитокератин и антиген эпителиальной мембраны и отрицательны на белок S-100, Leu-M1, CEA, тромбомодулин и плацентарную щелочную фосфатазу, положительная иммунореактивность на кальретинин значительно повышает точность диагноза.
Анамнез и физикальное исследование
Первичные опухоли сальника в основном протекают бессимптомно, но у большинства пациентов отмечают дискомфорт в животе, пальпируемое образование в животе, тошноту, быстрое чувство насыщения и потерю веса.[11] Другими симптомами, основанными на различных описаниях случаев, представленных в литературе, являются боль в животе, вздутие живота, запор, анорексия, рвота и лихорадка. Физикальное обследование может выявить пальпацию безболезненного образования в брюшной полости, баллотируемого сбоку, на основании описаний случаев в доступной литературе; масса может пальпироваться в эпигастрии, гипогастрии, верхнем или нижнем правом или левом квадранте или вовлекать всю брюшную полость. [17]
Физикальное обследование может выявить пальпацию безболезненного образования в брюшной полости, баллотируемого сбоку, на основании описаний случаев в доступной литературе; масса может пальпироваться в эпигастрии, гипогастрии, верхнем или нижнем правом или левом квадранте или вовлекать всю брюшную полость. [17]
У пациентов также может наблюдаться болезненность новообразования, и при осмотре живота может наблюдаться настороженность.[21] В некоторых отчетах о случаях у пациентов также был асцит.[6] Пациенты с асцитом, потерей веса и перитонеальными имплантатами обычно указывают на злокачественное новообразование. Наиболее частыми клиническими проявлениями первичной опухоли сальника являются абдоминальный дискомфорт (56%) и объемное образование (35%) [2]. В одном отчете о случае у пациента была диффузная боль в животе без пальпируемого образования при физикальном обследовании , в то время как в другом отчете о случае пациент с первичной лейомиосаркомой имел необъяснимые геморрагические псевдоасциты. [5][22] Хотя симптомы в значительной степени неспецифичны, они также могут проявляться как случайные находки при визуализации. EGIST сальника могут оставаться клинически бессимптомными, несмотря на огромные размеры опухоли.[8]
[5][22] Хотя симптомы в значительной степени неспецифичны, они также могут проявляться как случайные находки при визуализации. EGIST сальника могут оставаться клинически бессимптомными, несмотря на огромные размеры опухоли.[8]
Оценка
Диагностика липосаркомы является сложной задачей, и ее трудно дифференцировать от других опухолей. Внешний вид хорошо дифференцированной липосаркомы на КТ и МРТ похож на жировую и другие опухоли брюшной полости.[4]
Дооперационный диагноз первичной лейомиосаркомы сальника затруднен, и диагноз обычно ставится после операции. Точный диагноз ставится только при гистопатологическом исследовании опухоли.[6]
Внутривенная КТ брюшной полости и таза и МРТ являются лучшими методами визуализации для диагностики лейомиосаркомы сальника. Он может дать точную информацию о происхождении опухоли. Эти поражения в большинстве случаев имеют сходные визуализационные характеристики, представляя собой солидно-кистозную и многодольчатую опухоль [5]. Ультразвук может обнаружить опухоль и показать внутреннюю структуру поражения, но не может определить происхождение. Иногда эти опухоли сопровождаются асцитом и повышенным уровнем СА-125, что может свидетельствовать о раке яичников.[6]
Ультразвук может обнаружить опухоль и показать внутреннюю структуру поражения, но не может определить происхождение. Иногда эти опухоли сопровождаются асцитом и повышенным уровнем СА-125, что может свидетельствовать о раке яичников.[6]
Рентгенологические особенности сальниковых ЭГИСТ, не имеющих миогенной и нейрогенной дифференцировки, не установлены. Они могут быть похожи на сальниковую лейомиому и лейомиосаркому. Большинство ГИСО с миогенными признаками гиперваскуляризированы и имеют четкие границы на КТ и ангиографии.[8]
Согласно Ishida (1998), компьютерная томография является методом выбора при больших оментальных опухолях. На КТ такие опухоли обычно многодольчатые, плоские, блинообразные, с усилением солидной и мультикистозной плотности. Ангиография является полезным исследованием в диагностике опухолей сальника. Диагноз опухоли сальника ставится, когда артерия, питающая опухоль, отходит от сальникового кровоснабжения. Высоковаскулярное поражение с неоваскуляризацией, скорее всего, означает злокачественную опухоль. [6]
[6]
Окончательный диагноз можно поставить с помощью лапароскопии или открытой операции с биопсией. Гистология и иммуногистохимия используются для диагностики и дифференциации мезотелиомы от аденокарциномы и саркомы.
Ультразвук и компьютерная томография могут быть использованы для отслеживания рецидивов.[12]
КТ и МРТ являются лучшими методами диагностики солитарных фиброзных опухолей сальника. Они помогают выявить разрастание фиброзной ткани в брюшной полости, оценить соотношение между опухолью и окружающими структурами и принять решение об удалении опухоли. Однако КТ и МРТ не могут отличить SFT от мезенхимальных опухолей. Поэтому его можно ошибочно диагностировать как стромальную опухоль. Аспирация иглой не помогает в диагностике, потому что опухоль состоит из бесклеточной и гиперклеточной частей и не дает достаточного количества ткани для цитологического анализа. Эппл и др. сообщили, что точный диагноз может быть поставлен с помощью тонкоигольной аспирации, но у многих пациентов это требует исследования. Образцы опухоли могут быть собраны через трубку Райла при небольших опухолях и с помощью диагностической лапаротомии при больших опухолях.[12]
Образцы опухоли могут быть собраны через трубку Райла при небольших опухолях и с помощью диагностической лапаротомии при больших опухолях.[12]
Диагностика SFT сальника затруднена, поскольку она напоминает другие опухоли, такие как лейомиома и мезотелиома. Более того, если опухоль на ножке возникает из сальника, ее можно принять за другие опухоли таза. Иммуногистохимия помогает установить диагноз. Эти опухоли положительны по CD34, CD99 и BCL-2, а иногда и по SMA, но обычно отрицательны по S-100, десмину и цитокератинам. SFT выглядит как сильно васкуляризированная солидная опухоль с четко очерченными краями на ультразвуковом изображении, и КТ-сканирование может показать те же результаты. Однако визуализация не является специфическим исследованием, и дооперационная диагностика становится невозможной.[7]
Лечение/управление
Радикальная резекция опухоли рекомендуется при липосаркомах; адъювантная терапия не была признана эффективным методом лечения.[4]
Полное удаление опухоли дает хороший прогноз при лейомиосаркоме сальника. Некоторые авторы использовали нестандартизированные схемы химиотерапии при нерезектабельном заболевании с переменными результатами. У пациентов с диссеминированным заболеванием также применялась мультимодальная терапия. Из-за агрессивного характера таких опухолей часто возникают рецидивы, а долгосрочная выживаемость неизвестна.[5]
Некоторые авторы использовали нестандартизированные схемы химиотерапии при нерезектабельном заболевании с переменными результатами. У пациентов с диссеминированным заболеванием также применялась мультимодальная терапия. Из-за агрессивного характера таких опухолей часто возникают рецидивы, а долгосрочная выживаемость неизвестна.[5]
SFT, как правило, доброкачественные. От 15 до 20% из них являются злокачественными, особенно опухоли размером более 10 см. Гистологические признаки, такие как высокая клеточность, высокая митотическая активность, плеоморфизм, атипия, некроз опухоли и кровоизлияние, указывают на злокачественность. Размер опухоли и митотическая активность играют важную роль в прогнозировании SFT, исходящей из сальника. Такие характеристики, как размер опухоли, митотическая активность, клеточность и плеоморфизм для прогнозирования поведения SFT, могут использоваться для оценки риска. Злокачественные факторы связаны с высокой частотой рецидивов и метастазирования.[12] Методом выбора является хирургическая резекция, однако злокачественные опухоли могут рецидивировать даже через несколько лет после операции. Полезная роль адъювантной терапии еще не установлена, но в некоторых сообщениях предполагается адъювантная лучевая терапия и показан ответ на химиотерапию, но их эффективность не доказана. Размер опухоли является хорошим прогностическим фактором, но высокая митотическая активность связана с плохим прогнозом.[7]
Полезная роль адъювантной терапии еще не установлена, но в некоторых сообщениях предполагается адъювантная лучевая терапия и показан ответ на химиотерапию, но их эффективность не доказана. Размер опухоли является хорошим прогностическим фактором, но высокая митотическая активность связана с плохим прогнозом.[7]
Радикальная резекция является методом выбора при ГИСО сальника; адъювантная терапия иматинибом после хирургической резекции при ограниченном заболевании также проводится [8]. Адъювантная терапия иматинибом может предотвратить рецидив и увеличить долгосрочную выживаемость [14].
Что касается мезотелиомы сальника, в нескольких независимых исследованиях фазы 1 и 2 была принята интенсивная местно-регионарная стратегия лечения, включая циторедуктивную хирургию, дополненную периоперационной гипертермической внутрибрюшинной химиотерапией. К ней также может быть добавлена ранняя послеоперационная внутрибрюшинная химиотерапия. Сообщается, что эта форма лечения в результате улучшила медиану выживаемости. Фогельзанг и др. провели многоцентровое контролируемое рандомизированное исследование III фазы, и показано, что пеметрексед-цисплатин является золотым стандартом в случае неоперабельной злокачественной мезотелиомы плевры. Это лечение дало объективный ответ при мезотелиоме сальника [11].
Фогельзанг и др. провели многоцентровое контролируемое рандомизированное исследование III фазы, и показано, что пеметрексед-цисплатин является золотым стандартом в случае неоперабельной злокачественной мезотелиомы плевры. Это лечение дало объективный ответ при мезотелиоме сальника [11].
Окончательным методом лечения SFT сальника является хирургическая резекция опухоли с отрицательным краем. Послеоперационное длительное наблюдение имеет важное значение, поскольку эти опухоли часто рецидивируют. Злокачественные опухоли агрессивны, локально инвазивны с усиленным ростом и метастазированием. Поэтому при злокачественных опухолях рекомендуется послеоперационная химиотерапия. Более того, половина злокачественных SFT были положительными для c-kit, и ингибиторы тирозинкиназы, такие как иматиниб и сунитиниб, которые также эффективны для GIST, также использовались для SFT. Опухоль более 10 см имеет повышенный злокачественный потенциал, худший исход для метастазирования и повышенное количество рецидивов. [13]
[13]
Differential Diagnosis
The differential diagnosis of primary tumors of omentum is
Fibrosarcoma
Spindle cell sarcoma
Liposarcoma
Leiomyoma
Hemangiopericytoma
Lipoma
Десмоидная опухоль
Фиброма
Мезотелиома
Миосаркома
Рабдомиосаркома
Лейомиобластома
Эндотелиома.[6][11]
Эти опухоли могут быть ошибочно приняты за опухоли таза, опухоли яичников и ГИСО.
Прогноз
Прогноз при липосаркомах туловища, в том числе внутрибрюшной области, хуже, чем при липосаркомах конечностей. В одном исследовании средняя 5-летняя выживаемость при липосаркоме туловища составила 41,9% по сравнению с конечностями, где она составила 66,7%. Прогноз также зависит от гистологического подтипа липосаркомы. Пятилетняя безрецидивная выживаемость хуже для опухолей группы высокой степени злокачественности (дедифференцированные, круглоклеточные и плеоморфные), чем для групп опухолей низкой степени злокачественности (высокодифференцированные и миксоидного типа) [4].
Пятилетняя безрецидивная выживаемость хуже для опухолей группы высокой степени злокачественности (дедифференцированные, круглоклеточные и плеоморфные), чем для групп опухолей низкой степени злокачественности (высокодифференцированные и миксоидного типа) [4].
Из-за редкости сальниковых EGIST их злокачественный потенциал и общий прогноз трудно установить.[14] По сравнению с обычным GIST, EGIST имеет менее благоприятный прогноз, поскольку такие опухоли сопровождаются высокими митотическими индексами, большими размерами и отдаленными метастазами.[19]
Прогноз при злокачественной мезотелиоме сальника крайне неблагоприятный, поскольку эффективного лечения до сих пор не существует. Большинство пациентов умирают в течение одного года после постановки диагноза. По данным некоторых ретроспективных исследований, медиана выживаемости после операций, направленных на паллиативное лечение в сочетании с системной или внутрибрюшинной химиотерапией, составляет около одного года. У пациентов, которым была проведена агрессивная хирургия с гипертермической внутрибрюшинной химиотерапией, медиана выживаемости приблизилась к пяти годам [11].
Осложнения
У некоторых пациентов был отмечен внутрибрюшной разрыв опухоли, приводящий к острому животу.[7]
Сдерживание и просвещение пациентов
Поскольку первичные опухоли сальника встречаются редко, знаний о поведении таких опухолей все еще недостаточно, и требуется больше случаев и исследований.
Улучшение результатов медицинского персонала
Первичные опухоли сальника — это спорадические опухоли. Эти опухоли либо бессимптомны, либо признаки и симптомы проявления неспецифичны, что проявляется поздно из-за массового эффекта опухоли. Методы визуализации, такие как компьютерная томография, в значительной степени диагностируют их. Для лечения таких опухолей и улучшения результатов необходимы дополнительные исследования, чтобы узнать об этиологии, прогрессировании и лучших вариантах лечения таких опухолей. Хотя хирурги являются основными лицами, осуществляющими уход за такими пациентами, рентгенологи играют жизненно важную роль в диагностике пациентов с этими редкими опухолями. Другие задействованные медицинские работники — это поставщики медицинских услуг, занимающиеся сопутствующими заболеваниями пациентов, если они есть, медсестры, фельдшеры и реабилитационные работники, а также социальные работники, которые помогают пациентам в послеоперационном периоде.
Другие задействованные медицинские работники — это поставщики медицинских услуг, занимающиеся сопутствующими заболеваниями пациентов, если они есть, медсестры, фельдшеры и реабилитационные работники, а также социальные работники, которые помогают пациентам в послеоперационном периоде.
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Меза-Перес С., Рэндалл Т.Д. Иммунологические функции сальника. Тренды Иммунол. 2017 июль; 38 (7): 526-536. [Бесплатная статья PMC: PMC5812451] [PubMed: 28579319]
- 2.
Schwartz RW, Reames M, McGrath PC, Letton RW, Appleby G, Kenady DE. Первичные солидные новообразования большого сальника. Операция. 1991 апреля; 109 (4): 543-9. [PubMed: 2008659]
- 3.
Вайнбергер Х.А., Ахмед М.С. Мезенхимальные солидные опухоли сальника и брыжейки: отчет о четырех случаях.
 Операция. 1977 г., ноябрь; 82 (5): 754-9. [PubMed: 918865]
Операция. 1977 г., ноябрь; 82 (5): 754-9. [PubMed: 918865]- 4.
Hashimoto S, Arai J, Nishimuta M, Matsumoto H, Fukuoka H, Muraoka M, Nakashima M, Yamaguchi H. Резекция липосаркомы большого сальника: история болезни и литература обзор. Отчет по делу Int J Surg, 2019; 61:20-25. [Бесплатная статья PMC: PMC6626973] [PubMed: 31306901]
- 5.
Brañes A, Bustamante C, Valbuena J, Pimentel F, Quezada N. Первичная лейомиосаркома большого сальника: клинический случай. Отчет по делу Int J Surg 2016; 28:317-320. [Бесплатная статья PMC: PMC5079381] [PubMed: 27771602]
- 6.
Barel O, Qian C, Manolitsas T. Первичная лейомиосаркома сальника, представляющая собой рак яичника, отчет о клиническом случае и обзор литературы. Gynecol Oncol Rep. 2016 Aug;17:75-8. [Бесплатная статья PMC: PMC4949497] [PubMed: 27489871]
- 7.
Rodriguez Tarrega E, Hidalgo Mora JJ, Paya Amate V, Vega Oomen O. Солитарная фиброзная опухоль большого сальника, имитирующая опухоль яичника у молодой женщины.
 Gynecol Oncol Rep. 2016 Aug; 17:16-9. [Статья бесплатно PMC: PMC4899079] [PubMed: 27354994]
Gynecol Oncol Rep. 2016 Aug; 17:16-9. [Статья бесплатно PMC: PMC4899079] [PubMed: 27354994]- 8.
Fagkrezos D, Touloumis Z, Giannila M, Penlidis C, Papaparaskeva K, Triantopoulou C. Внежелудочно-кишечная стромальная опухоль сальника: редкий случай отчет и обзор литературы. Редкие опухоли. 2012 26 июня; 4(3):e44. [Бесплатная статья PMC: PMC3475951] [PubMed: 23087800]
- 9.
Соренсен Э.В., Гербер С.А., Седлачек А.Л., Рыбалко В.Ю., Чан В.М., Лорд Э.М. Сальниковые иммунные агрегаты и метастазы опухоли в брюшную полость. Иммунол Рез. 2009 декабрь; 45 (2-3): 185-94. [Бесплатная статья PMC: PMC28] [PubMed: 19253004]
- 10.
Joe DH, Yang JM, Kim HS, Kim SS, Choi SW, Choi SH, Lee S, Lim KW. Случай первичной лейомиосаркомы малого сальника. Корейский J Intern Med. 1999 янв; 14 (1): 88-90. [Бесплатная статья PMC: PMC4531912] [PubMed: 10063320]
- 11.
Shin MK, Lee OJ, Ha CY, Min HJ, Kim TH.
 Злокачественная мезотелиома большого сальника, имитирующая инфаркт сальника: клинический случай. Мир J Гастроэнтерол. 2009 14 октября; 15 (38): 4856-9. [Бесплатная статья PMC: PMC2761569] [PubMed: 19824125]
Злокачественная мезотелиома большого сальника, имитирующая инфаркт сальника: клинический случай. Мир J Гастроэнтерол. 2009 14 октября; 15 (38): 4856-9. [Бесплатная статья PMC: PMC2761569] [PubMed: 19824125]- 12.
Цзун Л., Чен П., Ван Г.Ю., Чжу К.С. Гигантская солитарная фиброзная опухоль, возникающая из большого сальника. Мир J Гастроэнтерол. 2012 28 ноября; 18 (44): 6515-20. [Бесплатная статья PMC: PMC3508650] [PubMed: 23197901]
- 13.
Urabe M, Yamagata Y, Aikou S, Mori K, Yamashita H, Nomura S, Shibahara J, Fukayama M, Seto Y. Солитарная фиброзная опухоль большого сальника, имитирующая гастроинтестинальную стромальную опухоль тонкая кишка: история болезни. инт сург. 2015 май; 100(5):836-40. [Бесплатная статья PMC: PMC4452971] [PubMed: 26011203]
- 14.
Тодороки Т., Сано Т., Сакураи С., Сегава А., Сайтох Т., Фудзикава К., Ямада С., Хирахара Н., Цусима Ю., Мотодзима Р., Мотожима Т. Первичная стромальная опухоль желудочно-кишечного тракта (GIST).
 World J Surg Oncol. 2007 12 июня; 5:66. [Бесплатная статья PMC: PMC1924523] [PubMed: 17565683]
World J Surg Oncol. 2007 12 июня; 5:66. [Бесплатная статья PMC: PMC1924523] [PubMed: 17565683]- 15.
Ватс М., Панди Д., Ахлават Х., Ахтар А., Сингх Н. Множественная первичная дедифференцированная липосаркома брыжейки тощей кишки: клинический случай и обзор литературы. J Clin Diagn Res. 2016 Январь;10(1):XD01-XD04. [Бесплатная статья PMC: PMC4740692] [PubMed: 26894164]
- 16.
Суфи М., Мдагри Дж., Бенамр С., Лахлоу М.К., Массрури Р., Эссадель А., Мохаммадин эль-Х., Таги А., Сеттаф А., Чад Б. Гигантская липосаркома сальника, имитирующая опухоль яичника. Отчет о случае. Индийский Дж. Сург. 2012 окт; 74 (5): 425-7. [Бесплатная статья PMC: PMC3477403] [PubMed: 24082602]
- 17.
Bouhabel S, Leblanc G, Ferreira J, Leclerc YE, Dubé P, Sidéris L. Солитарная фиброзная опухоль, возникающая в брыжейке: клинический случай. World J Surg Oncol. 2011 31 октября; 9:140. [Бесплатная статья PMC: PMC3225306] [PubMed: 22035205]
- 18.

Meloni F, Feo CF, Profili S, Cossu ML, Meloni GB. Хорошо дифференцированная липосаркома сальника: данные УЗИ, КТ и МРТ. Int J Biomed Sci. 2009 г., сен; 5(3):302-4. [Бесплатная статья PMC: PMC3614784] [PubMed: 23675151]
- 19.
Саваки А. Редкие гастроинтестинальные стромальные опухоли (GIST): сальник и забрюшинное пространство. Перевод Гастроэнтерол Гепатол. 2017;2:116. [Бесплатная статья PMC: PMC5762994] [PubMed: 29354773]
- 20.
Исида Дж., Исида Х., Конно К., Комацуда Т., Абэ К. Первичная лейомиосаркома большого сальника. Дж. Клин Гастроэнтерол. 1999 март; 28(2):167-70. [PubMed: 10078829]
- 21.
Цуцуми Х., Овада С., Такеёси И., Изуми М., Огава Т., Фукусато Т., Морисита Ю. Первичная липосаркома сальника с перекрутом: клинический случай. Гепатогастроэнтерология. 1999 май-июнь;46(27):2110-2. [PubMed: 10430407]
- 22.
Dixon AY, Reed JS, Dow N, Lee SH. Первичная сальниковая лейомиосаркома, маскирующаяся под геморрагический асцит.
 Хум Патол. 1984 март; 15 (3): 233-7. [PubMed: 6698542]
Хум Патол. 1984 март; 15 (3): 233-7. [PubMed: 6698542]
Опухоли сальника — StatPearls — NCBI Bookshelf
Продолжение обучения
Сальник состоит из клеток мезотелиального происхождения. Сальник проявляет ангиогенную, фиброзную, стволовые клетки и иммунную активность, ответственную за стимуляцию васкуляризации, ускоренное заживление и ограничение инфекции в брюшной полости. Эти действия также могут привести к патологическим изменениям, таким как образование опухоли сальника. В этой статье описаны эпидемиология, проявления, гистопатология, исследования и лечение первичных опухолей сальника. В этом мероприятии рассматривается оценка и лечение опухолей сальника и подчеркивается роль межпрофессиональной группы в оценке и улучшении ухода за пациентами с этим заболеванием.
Цели:
Определите эпидемиологию первичных опухолей сальника.
Опишите оценку первичных опухолей сальника.
Объясните возможные варианты лечения первичных опухолей сальника.

Обзор стратегий межпрофессиональной бригады для улучшения координации помощи и коммуникации для улучшения лечения первичных опухолей сальника и улучшения результатов.
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Введение
Сальник состоит из клеток мезотелиального происхождения. Говорят, что это тип висцеральной жировой ткани с общей площадью поверхности 1500 см2. Он висит перед органами брюшной полости, как фартук, а также связан с селезенкой, желудком, поджелудочной железой и толстой кишкой. Сальник проявляет ангиогенную, фиброзную, стволовые клетки и иммунную активность, ответственную за стимуляцию васкуляризации, ускоренное заживление и ограничение инфекции в брюшной полости. Эти действия также могут привести к патологическим изменениям, таким как образование опухоли сальника и метастазирование.[1] Первичные солидные опухоли большого сальника встречаются редко, всего 42 зарегистрированных случая; однако перитонеальные метастазы довольно распространены при некоторых опухолях, таких как стромальные опухоли желудочно-кишечного тракта и рак яичников.
Этиология
Эти опухоли являются спорадическими, и этиологические факторы, ответственные за такие опухоли, неизвестны.
Эпидемиология
Это редкие поражения, каждое из которых связано со скрытым началом.[3]
Липосаркома большого сальника — редкая опухоль; до июля 2019 г. в литературе описано 19 случаев. Девять случаев с 1936 по 2003 г., 10 случаев с 2003 по 2018 г. и один в 2019 г. Средний возраст пациентов в эти истории болезни составили 51,1 года.[4]
Лейомиосаркома большого сальника является редкой опухолью, и до октября 2016 г. в литературе было зарегистрировано 23 случая. Клинически эти опухоли проявляются на 5-м десятилетии жизни.[5] В то время как в другом исследовании было зарегистрировано 27 случаев. Средний возраст в этих случаях составлял 51 год, и это было немного чаще у мужчин.
Согласно сообщениям о случаях SFT (солитарных фиброзных опухолей) большого сальника, эта опухоль возникает на пятом-седьмом десятилетии жизни с соотношением мужчин и женщин 1:1. [7] 9[8]
[7] 9[8]
Патофизиология
Сальник называется депо висцерального жира. Его роль как «полицейского брюшной полости» была признана британским хирургом в начале 1900-х годов благодаря его свойствам перемещаться по брюшной полости и ограничивать инфекции и воспаления. Сальник содержит множество иммунных агрегатов, называемых «млочными пятнами», функция которых в значительной степени неизвестна. Говорят, что как свободные иммунные клетки, так и опухолевые клетки связываются с этими агрегатами.[9]]
Все первичные опухоли сальника спорадические и обычно злокачественные.[10] Но метастатические поражения распространены. Сообщаемые первичные опухоли сальника включают фибросаркому, веретеноклеточную саркому, липосаркому, лейомиому, гемангиоперицитому, липому и десмоидную опухоль, фиброму, мезотелиому, миосаркому, рабдомиосаркому, лейомиобластому и эндотелиому. Эти опухоли происходят из различных элементов, из которых состоит сальник, таких как жировая ткань, сосуды и лимфатическая ткань.
Первичная лейомиосаркома сальника — очень редкая опухоль; чаще лейомиосаркомы возникают в гладкомышечных клетках желудочно-кишечного тракта, забрюшинного пространства и мочеполового тракта. Из-за низкой частоты лейомиосаркомы сальника мало что известно о происхождении и поведении этих опухолей.
Солитарная фиброзная опухоль (SFT), ранее называвшаяся гемангиоперицитомой, представляет собой редкую мезенхимальную опухоль[7], часто происходящую из плевры; вовлечение сальника очень редко. От 78% до 88% этих опухолей являются доброкачественными, а от 12% до 22% злокачественными.[12] До 2015 г. в литературе было описано только 6 случаев SFT, возникающих из-за большого или малого сальника [13].
ГИСО (желудочно-кишечные стромальные опухоли) представляют собой мезенхимальные опухоли, возникающие из стенки желудочно-кишечного тракта, в основном из желудка. Однако редко они могут возникать из сальника, что обозначается как экстрагастроинтестинальные стромальные опухоли (EGIST). GIST и EGIST сходны гистопатологически и иммуногистохимически; оба экспрессируют мутации KIT/PDGFRA с усилением функции. Поскольку эти опухоли являются спорадическими, их злокачественный потенциал установить невозможно.[14] Сакураи и др. сообщил о клетках Кахаля, таких как клетки CD117+ и CD34+, в нормальном сальнике, из которых теоретически могут возникать EGIST.
GIST и EGIST сходны гистопатологически и иммуногистохимически; оба экспрессируют мутации KIT/PDGFRA с усилением функции. Поскольку эти опухоли являются спорадическими, их злокачественный потенциал установить невозможно.[14] Сакураи и др. сообщил о клетках Кахаля, таких как клетки CD117+ и CD34+, в нормальном сальнике, из которых теоретически могут возникать EGIST.
Липосаркомы обычно возникают из глубоких мягких тканей конечностей, и это наиболее распространенная саркома мягких тканей.[15] Интраабдоминальные локализации редки, и они редко исходят из большого сальника.
Злокачественная мезотелиома обычно возникает из плевры и брюшной полости, но редко может возникать из большого сальника. Его связь с асбестом менее очевидна по сравнению с мезотелиомой плевры.
Гистопатология
Гистопатология зависит от типа опухоли. Эмбриологическое происхождение этих опухолей варьируется, поскольку сальник состоит из различных тканей, таких как сосуды, лимфатические и жировые ткани.
Первичная лейомиосаркома сальника при гистологическом исследовании может показать длинные веретенообразные клетки с высоким митотическим индексом наряду с участками коагуляционного некроза опухоли и миксоидными изменениями; иммуногистохимия может быть положительной для десмина и актина гладких мышц и резко отрицательной для S100 и CD34, как при лейомиосаркоме.
SFT получают из мезенхимальных клеток; он в основном состоит из веретенообразных клеток и пучков коллагена. В литературе существует путаница в отношении происхождения и классификации SFT, поскольку гемангиоперицитомы (HPC) и SFT имеют много общих патологических находок; теперь они считаются частью одного и того же объекта.[17] При иммуногистохимическом окрашивании эти опухоли оказались отрицательными по следующим маркерам CD117, цитокератину, кальретинину, CD99, CD68, десмину, F8, S-100, антигену эпителиальной мембраны. Эти опухоли положительны по CD34, α-актину гладких мышц (α-SMA), BCL-2 и виментину (VIM) [12]. CD34 является полезным положительным биомаркером для SFT; несколько исследований показали 100% положительный результат.[13]
CD34 является полезным положительным биомаркером для SFT; несколько исследований показали 100% положительный результат.[13]
Согласно ВОЗ, липосаркома подразделяется на пять типов: высокодифференцированная, плеоморфная, круглоклеточная, миксоидная и дедифференцированная.[15] Липосаркома часто может иметь доброкачественные и злокачественные участки.[4] Прогноз этих опухолей зависит от гистологического типа [16]; дедифференцированный подтип имеет худший прогноз и высокую частоту рецидивов.[18] Хорошо дифференцированная липосаркома имеет толстые перегородки, размер поражения> 10 см, содержит глобулярные нежировые области и компонент поражения <75% жира.
Происхождение экстрагастроинтестинальных стромальных опухолей (EGIST) полностью не известно, но их гистология и иммунофенотип сходны с GIST. Считается, что это GIST, которые были отделены от желудочно-кишечного тракта, или они могут возникать из мезенхимальных клеток сальника [8]. EGIST, как и GIST, обычно положительны для KIT, альфа-актина гладких мышц и отрицательны для десмина и белка s-100. Показано, что эти опухоли, сходные с ГИСО, состоят из удлиненных веретенообразных клеток, эпителиоидных клеток или смешанных клеток с высокой клеточностью и низкой митотической активностью [19].]
Показано, что эти опухоли, сходные с ГИСО, состоят из удлиненных веретенообразных клеток, эпителиоидных клеток или смешанных клеток с высокой клеточностью и низкой митотической активностью [19].]
Гистологическое исследование мезотелиомы сальника может выявить эпителиальную, саркоматоидную или двухфазную структуру. Опухоли эпителиального типа составляют 75% случаев и варьируют от хорошо дифференцированных с тубуло-папиллярным рисунком до сплошных пластов круглых или полигональных клеток. Такие опухоли могут имитировать карциному, и бывает трудно отличить эпителиоидную мезотелиому от метастатической карциномы, особенно аденокарциномы. Опухоли саркоматоидного типа могут быть неотличимы от фибросарком только по гистологическим данным. Иммуногистохимия может помочь дифференцировать саркому и аденокарциному. Эти опухолевые клетки положительны на кальретинин, цитокератин и антиген эпителиальной мембраны и отрицательны на белок S-100, Leu-M1, CEA, тромбомодулин и плацентарную щелочную фосфатазу, положительная иммунореактивность на кальретинин значительно повышает точность диагноза.
Анамнез и физикальное исследование
Первичные опухоли сальника в основном протекают бессимптомно, но у большинства пациентов отмечают дискомфорт в животе, пальпируемое образование в животе, тошноту, быстрое чувство насыщения и потерю веса.[11] Другими симптомами, основанными на различных описаниях случаев, представленных в литературе, являются боль в животе, вздутие живота, запор, анорексия, рвота и лихорадка. Физикальное обследование может выявить пальпацию безболезненного образования в брюшной полости, баллотируемого сбоку, на основании описаний случаев в доступной литературе; масса может пальпироваться в эпигастрии, гипогастрии, верхнем или нижнем правом или левом квадранте или вовлекать всю брюшную полость. [17]
У пациентов также может наблюдаться болезненность новообразования, и при осмотре живота может наблюдаться настороженность.[21] В некоторых отчетах о случаях у пациентов также был асцит.[6] Пациенты с асцитом, потерей веса и перитонеальными имплантатами обычно указывают на злокачественное новообразование. Наиболее частыми клиническими проявлениями первичной опухоли сальника являются абдоминальный дискомфорт (56%) и объемное образование (35%) [2]. В одном отчете о случае у пациента была диффузная боль в животе без пальпируемого образования при физикальном обследовании , в то время как в другом отчете о случае пациент с первичной лейомиосаркомой имел необъяснимые геморрагические псевдоасциты.[5][22] Хотя симптомы в значительной степени неспецифичны, они также могут проявляться как случайные находки при визуализации. EGIST сальника могут оставаться клинически бессимптомными, несмотря на огромные размеры опухоли.[8]
Наиболее частыми клиническими проявлениями первичной опухоли сальника являются абдоминальный дискомфорт (56%) и объемное образование (35%) [2]. В одном отчете о случае у пациента была диффузная боль в животе без пальпируемого образования при физикальном обследовании , в то время как в другом отчете о случае пациент с первичной лейомиосаркомой имел необъяснимые геморрагические псевдоасциты.[5][22] Хотя симптомы в значительной степени неспецифичны, они также могут проявляться как случайные находки при визуализации. EGIST сальника могут оставаться клинически бессимптомными, несмотря на огромные размеры опухоли.[8]
Оценка
Диагностика липосаркомы является сложной задачей, и ее трудно дифференцировать от других опухолей. Внешний вид хорошо дифференцированной липосаркомы на КТ и МРТ похож на жировую и другие опухоли брюшной полости.[4]
Дооперационный диагноз первичной лейомиосаркомы сальника затруднен, и диагноз обычно ставится после операции. Точный диагноз ставится только при гистопатологическом исследовании опухоли. [6]
[6]
Внутривенная КТ брюшной полости и таза и МРТ являются лучшими методами визуализации для диагностики лейомиосаркомы сальника. Он может дать точную информацию о происхождении опухоли. Эти поражения в большинстве случаев имеют сходные визуализационные характеристики, представляя собой солидно-кистозную и многодольчатую опухоль [5]. Ультразвук может обнаружить опухоль и показать внутреннюю структуру поражения, но не может определить происхождение. Иногда эти опухоли сопровождаются асцитом и повышенным уровнем СА-125, что может свидетельствовать о раке яичников.[6]
Рентгенологические особенности сальниковых ЭГИСТ, не имеющих миогенной и нейрогенной дифференцировки, не установлены. Они могут быть похожи на сальниковую лейомиому и лейомиосаркому. Большинство ГИСО с миогенными признаками гиперваскуляризированы и имеют четкие границы на КТ и ангиографии.[8]
Согласно Ishida (1998), компьютерная томография является методом выбора при больших оментальных опухолях. На КТ такие опухоли обычно многодольчатые, плоские, блинообразные, с усилением солидной и мультикистозной плотности. Ангиография является полезным исследованием в диагностике опухолей сальника. Диагноз опухоли сальника ставится, когда артерия, питающая опухоль, отходит от сальникового кровоснабжения. Высоковаскулярное поражение с неоваскуляризацией, скорее всего, означает злокачественную опухоль.[6]
Ангиография является полезным исследованием в диагностике опухолей сальника. Диагноз опухоли сальника ставится, когда артерия, питающая опухоль, отходит от сальникового кровоснабжения. Высоковаскулярное поражение с неоваскуляризацией, скорее всего, означает злокачественную опухоль.[6]
Окончательный диагноз можно поставить с помощью лапароскопии или открытой операции с биопсией. Гистология и иммуногистохимия используются для диагностики и дифференциации мезотелиомы от аденокарциномы и саркомы.
Ультразвук и компьютерная томография могут быть использованы для отслеживания рецидивов.[12]
КТ и МРТ являются лучшими методами диагностики солитарных фиброзных опухолей сальника. Они помогают выявить разрастание фиброзной ткани в брюшной полости, оценить соотношение между опухолью и окружающими структурами и принять решение об удалении опухоли. Однако КТ и МРТ не могут отличить SFT от мезенхимальных опухолей. Поэтому его можно ошибочно диагностировать как стромальную опухоль. Аспирация иглой не помогает в диагностике, потому что опухоль состоит из бесклеточной и гиперклеточной частей и не дает достаточного количества ткани для цитологического анализа. Эппл и др. сообщили, что точный диагноз может быть поставлен с помощью тонкоигольной аспирации, но у многих пациентов это требует исследования. Образцы опухоли могут быть собраны через трубку Райла при небольших опухолях и с помощью диагностической лапаротомии при больших опухолях.[12]
Аспирация иглой не помогает в диагностике, потому что опухоль состоит из бесклеточной и гиперклеточной частей и не дает достаточного количества ткани для цитологического анализа. Эппл и др. сообщили, что точный диагноз может быть поставлен с помощью тонкоигольной аспирации, но у многих пациентов это требует исследования. Образцы опухоли могут быть собраны через трубку Райла при небольших опухолях и с помощью диагностической лапаротомии при больших опухолях.[12]
Диагностика SFT сальника затруднена, поскольку она напоминает другие опухоли, такие как лейомиома и мезотелиома. Более того, если опухоль на ножке возникает из сальника, ее можно принять за другие опухоли таза. Иммуногистохимия помогает установить диагноз. Эти опухоли положительны по CD34, CD99 и BCL-2, а иногда и по SMA, но обычно отрицательны по S-100, десмину и цитокератинам. SFT выглядит как сильно васкуляризированная солидная опухоль с четко очерченными краями на ультразвуковом изображении, и КТ-сканирование может показать те же результаты. Однако визуализация не является специфическим исследованием, и дооперационная диагностика становится невозможной.[7]
Однако визуализация не является специфическим исследованием, и дооперационная диагностика становится невозможной.[7]
Лечение/управление
Радикальная резекция опухоли рекомендуется при липосаркомах; адъювантная терапия не была признана эффективным методом лечения.[4]
Полное удаление опухоли дает хороший прогноз при лейомиосаркоме сальника. Некоторые авторы использовали нестандартизированные схемы химиотерапии при нерезектабельном заболевании с переменными результатами. У пациентов с диссеминированным заболеванием также применялась мультимодальная терапия. Из-за агрессивного характера таких опухолей часто возникают рецидивы, а долгосрочная выживаемость неизвестна.[5]
SFT, как правило, доброкачественные. От 15 до 20% из них являются злокачественными, особенно опухоли размером более 10 см. Гистологические признаки, такие как высокая клеточность, высокая митотическая активность, плеоморфизм, атипия, некроз опухоли и кровоизлияние, указывают на злокачественность. Размер опухоли и митотическая активность играют важную роль в прогнозировании SFT, исходящей из сальника. Такие характеристики, как размер опухоли, митотическая активность, клеточность и плеоморфизм для прогнозирования поведения SFT, могут использоваться для оценки риска. Злокачественные факторы связаны с высокой частотой рецидивов и метастазирования.[12] Методом выбора является хирургическая резекция, однако злокачественные опухоли могут рецидивировать даже через несколько лет после операции. Полезная роль адъювантной терапии еще не установлена, но в некоторых сообщениях предполагается адъювантная лучевая терапия и показан ответ на химиотерапию, но их эффективность не доказана. Размер опухоли является хорошим прогностическим фактором, но высокая митотическая активность связана с плохим прогнозом.[7]
Размер опухоли и митотическая активность играют важную роль в прогнозировании SFT, исходящей из сальника. Такие характеристики, как размер опухоли, митотическая активность, клеточность и плеоморфизм для прогнозирования поведения SFT, могут использоваться для оценки риска. Злокачественные факторы связаны с высокой частотой рецидивов и метастазирования.[12] Методом выбора является хирургическая резекция, однако злокачественные опухоли могут рецидивировать даже через несколько лет после операции. Полезная роль адъювантной терапии еще не установлена, но в некоторых сообщениях предполагается адъювантная лучевая терапия и показан ответ на химиотерапию, но их эффективность не доказана. Размер опухоли является хорошим прогностическим фактором, но высокая митотическая активность связана с плохим прогнозом.[7]
Радикальная резекция является методом выбора при ГИСО сальника; адъювантная терапия иматинибом после хирургической резекции при ограниченном заболевании также проводится [8]. Адъювантная терапия иматинибом может предотвратить рецидив и увеличить долгосрочную выживаемость [14].
Что касается мезотелиомы сальника, в нескольких независимых исследованиях фазы 1 и 2 была принята интенсивная местно-регионарная стратегия лечения, включая циторедуктивную хирургию, дополненную периоперационной гипертермической внутрибрюшинной химиотерапией. К ней также может быть добавлена ранняя послеоперационная внутрибрюшинная химиотерапия. Сообщается, что эта форма лечения в результате улучшила медиану выживаемости. Фогельзанг и др. провели многоцентровое контролируемое рандомизированное исследование III фазы, и показано, что пеметрексед-цисплатин является золотым стандартом в случае неоперабельной злокачественной мезотелиомы плевры. Это лечение дало объективный ответ при мезотелиоме сальника [11].
Окончательным методом лечения SFT сальника является хирургическая резекция опухоли с отрицательным краем. Послеоперационное длительное наблюдение имеет важное значение, поскольку эти опухоли часто рецидивируют. Злокачественные опухоли агрессивны, локально инвазивны с усиленным ростом и метастазированием. Поэтому при злокачественных опухолях рекомендуется послеоперационная химиотерапия. Более того, половина злокачественных SFT были положительными для c-kit, и ингибиторы тирозинкиназы, такие как иматиниб и сунитиниб, которые также эффективны для GIST, также использовались для SFT. Опухоль более 10 см имеет повышенный злокачественный потенциал, худший исход для метастазирования и повышенное количество рецидивов.[13]
Поэтому при злокачественных опухолях рекомендуется послеоперационная химиотерапия. Более того, половина злокачественных SFT были положительными для c-kit, и ингибиторы тирозинкиназы, такие как иматиниб и сунитиниб, которые также эффективны для GIST, также использовались для SFT. Опухоль более 10 см имеет повышенный злокачественный потенциал, худший исход для метастазирования и повышенное количество рецидивов.[13]
Differential Diagnosis
The differential diagnosis of primary tumors of omentum is
Fibrosarcoma
Spindle cell sarcoma
Liposarcoma
Leiomyoma
Hemangiopericytoma
Lipoma
Десмоидная опухоль
Фиброма
Мезотелиома
Миосаркома
Рабдомиосаркома
Лейомиобластома
Эндотелиома.[6][11]
Эти опухоли могут быть ошибочно приняты за опухоли таза, опухоли яичников и ГИСО.
Прогноз
Прогноз при липосаркомах туловища, в том числе внутрибрюшной области, хуже, чем при липосаркомах конечностей. В одном исследовании средняя 5-летняя выживаемость при липосаркоме туловища составила 41,9% по сравнению с конечностями, где она составила 66,7%. Прогноз также зависит от гистологического подтипа липосаркомы. Пятилетняя безрецидивная выживаемость хуже для опухолей группы высокой степени злокачественности (дедифференцированные, круглоклеточные и плеоморфные), чем для групп опухолей низкой степени злокачественности (высокодифференцированные и миксоидного типа) [4].
Из-за редкости сальниковых EGIST их злокачественный потенциал и общий прогноз трудно установить.[14] По сравнению с обычным GIST, EGIST имеет менее благоприятный прогноз, поскольку такие опухоли сопровождаются высокими митотическими индексами, большими размерами и отдаленными метастазами.[19]
Прогноз при злокачественной мезотелиоме сальника крайне неблагоприятный, поскольку эффективного лечения до сих пор не существует. Большинство пациентов умирают в течение одного года после постановки диагноза. По данным некоторых ретроспективных исследований, медиана выживаемости после операций, направленных на паллиативное лечение в сочетании с системной или внутрибрюшинной химиотерапией, составляет около одного года. У пациентов, которым была проведена агрессивная хирургия с гипертермической внутрибрюшинной химиотерапией, медиана выживаемости приблизилась к пяти годам [11].
Большинство пациентов умирают в течение одного года после постановки диагноза. По данным некоторых ретроспективных исследований, медиана выживаемости после операций, направленных на паллиативное лечение в сочетании с системной или внутрибрюшинной химиотерапией, составляет около одного года. У пациентов, которым была проведена агрессивная хирургия с гипертермической внутрибрюшинной химиотерапией, медиана выживаемости приблизилась к пяти годам [11].
Осложнения
У некоторых пациентов был отмечен внутрибрюшной разрыв опухоли, приводящий к острому животу.[7]
Сдерживание и просвещение пациентов
Поскольку первичные опухоли сальника встречаются редко, знаний о поведении таких опухолей все еще недостаточно, и требуется больше случаев и исследований.
Улучшение результатов медицинского персонала
Первичные опухоли сальника — это спорадические опухоли. Эти опухоли либо бессимптомны, либо признаки и симптомы проявления неспецифичны, что проявляется поздно из-за массового эффекта опухоли. Методы визуализации, такие как компьютерная томография, в значительной степени диагностируют их. Для лечения таких опухолей и улучшения результатов необходимы дополнительные исследования, чтобы узнать об этиологии, прогрессировании и лучших вариантах лечения таких опухолей. Хотя хирурги являются основными лицами, осуществляющими уход за такими пациентами, рентгенологи играют жизненно важную роль в диагностике пациентов с этими редкими опухолями. Другие задействованные медицинские работники — это поставщики медицинских услуг, занимающиеся сопутствующими заболеваниями пациентов, если они есть, медсестры, фельдшеры и реабилитационные работники, а также социальные работники, которые помогают пациентам в послеоперационном периоде.
Методы визуализации, такие как компьютерная томография, в значительной степени диагностируют их. Для лечения таких опухолей и улучшения результатов необходимы дополнительные исследования, чтобы узнать об этиологии, прогрессировании и лучших вариантах лечения таких опухолей. Хотя хирурги являются основными лицами, осуществляющими уход за такими пациентами, рентгенологи играют жизненно важную роль в диагностике пациентов с этими редкими опухолями. Другие задействованные медицинские работники — это поставщики медицинских услуг, занимающиеся сопутствующими заболеваниями пациентов, если они есть, медсестры, фельдшеры и реабилитационные работники, а также социальные работники, которые помогают пациентам в послеоперационном периоде.
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Меза-Перес С., Рэндалл Т.Д. Иммунологические функции сальника.
 Тренды Иммунол. 2017 июль; 38 (7): 526-536. [Бесплатная статья PMC: PMC5812451] [PubMed: 28579319]
Тренды Иммунол. 2017 июль; 38 (7): 526-536. [Бесплатная статья PMC: PMC5812451] [PubMed: 28579319]- 2.
Schwartz RW, Reames M, McGrath PC, Letton RW, Appleby G, Kenady DE. Первичные солидные новообразования большого сальника. Операция. 1991 апреля; 109 (4): 543-9. [PubMed: 2008659]
- 3.
Вайнбергер Х.А., Ахмед М.С. Мезенхимальные солидные опухоли сальника и брыжейки: отчет о четырех случаях. Операция. 1977 г., ноябрь; 82 (5): 754-9. [PubMed: 918865]
- 4.
Hashimoto S, Arai J, Nishimuta M, Matsumoto H, Fukuoka H, Muraoka M, Nakashima M, Yamaguchi H. Резекция липосаркомы большого сальника: история болезни и литература обзор. Отчет по делу Int J Surg, 2019; 61:20-25. [Бесплатная статья PMC: PMC6626973] [PubMed: 31306901]
- 5.
Brañes A, Bustamante C, Valbuena J, Pimentel F, Quezada N. Первичная лейомиосаркома большого сальника: клинический случай. Отчет по делу Int J Surg 2016; 28:317-320.
 [Бесплатная статья PMC: PMC5079381] [PubMed: 27771602]
[Бесплатная статья PMC: PMC5079381] [PubMed: 27771602]- 6.
Barel O, Qian C, Manolitsas T. Первичная лейомиосаркома сальника, представляющая собой рак яичника, отчет о клиническом случае и обзор литературы. Gynecol Oncol Rep. 2016 Aug;17:75-8. [Бесплатная статья PMC: PMC4949497] [PubMed: 27489871]
- 7.
Rodriguez Tarrega E, Hidalgo Mora JJ, Paya Amate V, Vega Oomen O. Солитарная фиброзная опухоль большого сальника, имитирующая опухоль яичника у молодой женщины. Gynecol Oncol Rep. 2016 Aug; 17:16-9. [Статья бесплатно PMC: PMC4899079] [PubMed: 27354994]
- 8.
Fagkrezos D, Touloumis Z, Giannila M, Penlidis C, Papaparaskeva K, Triantopoulou C. Внежелудочно-кишечная стромальная опухоль сальника: редкий случай отчет и обзор литературы. Редкие опухоли. 2012 26 июня; 4(3):e44. [Бесплатная статья PMC: PMC3475951] [PubMed: 23087800]
- 9.
Соренсен Э.В., Гербер С.А., Седлачек А.Л., Рыбалко В.
 Ю., Чан В.М., Лорд Э.М. Сальниковые иммунные агрегаты и метастазы опухоли в брюшную полость. Иммунол Рез. 2009 декабрь; 45 (2-3): 185-94. [Бесплатная статья PMC: PMC28] [PubMed: 19253004]
Ю., Чан В.М., Лорд Э.М. Сальниковые иммунные агрегаты и метастазы опухоли в брюшную полость. Иммунол Рез. 2009 декабрь; 45 (2-3): 185-94. [Бесплатная статья PMC: PMC28] [PubMed: 19253004]- 10.
Joe DH, Yang JM, Kim HS, Kim SS, Choi SW, Choi SH, Lee S, Lim KW. Случай первичной лейомиосаркомы малого сальника. Корейский J Intern Med. 1999 янв; 14 (1): 88-90. [Бесплатная статья PMC: PMC4531912] [PubMed: 10063320]
- 11.
Shin MK, Lee OJ, Ha CY, Min HJ, Kim TH. Злокачественная мезотелиома большого сальника, имитирующая инфаркт сальника: клинический случай. Мир J Гастроэнтерол. 2009 14 октября; 15 (38): 4856-9. [Бесплатная статья PMC: PMC2761569] [PubMed: 19824125]
- 12.
Цзун Л., Чен П., Ван Г.Ю., Чжу К.С. Гигантская солитарная фиброзная опухоль, возникающая из большого сальника. Мир J Гастроэнтерол. 2012 28 ноября; 18 (44): 6515-20. [Бесплатная статья PMC: PMC3508650] [PubMed: 23197901]
- 13.

Urabe M, Yamagata Y, Aikou S, Mori K, Yamashita H, Nomura S, Shibahara J, Fukayama M, Seto Y. Солитарная фиброзная опухоль большого сальника, имитирующая гастроинтестинальную стромальную опухоль тонкая кишка: история болезни. инт сург. 2015 май; 100(5):836-40. [Бесплатная статья PMC: PMC4452971] [PubMed: 26011203]
- 14.
Тодороки Т., Сано Т., Сакураи С., Сегава А., Сайтох Т., Фудзикава К., Ямада С., Хирахара Н., Цусима Ю., Мотодзима Р., Мотожима Т. Первичная стромальная опухоль желудочно-кишечного тракта (GIST). World J Surg Oncol. 2007 12 июня; 5:66. [Бесплатная статья PMC: PMC1924523] [PubMed: 17565683]
- 15.
Ватс М., Панди Д., Ахлават Х., Ахтар А., Сингх Н. Множественная первичная дедифференцированная липосаркома брыжейки тощей кишки: клинический случай и обзор литературы. J Clin Diagn Res. 2016 Январь;10(1):XD01-XD04. [Бесплатная статья PMC: PMC4740692] [PubMed: 26894164]
- 16.
Суфи М.
 , Мдагри Дж., Бенамр С., Лахлоу М.К., Массрури Р., Эссадель А., Мохаммадин эль-Х., Таги А., Сеттаф А., Чад Б. Гигантская липосаркома сальника, имитирующая опухоль яичника. Отчет о случае. Индийский Дж. Сург. 2012 окт; 74 (5): 425-7. [Бесплатная статья PMC: PMC3477403] [PubMed: 24082602]
, Мдагри Дж., Бенамр С., Лахлоу М.К., Массрури Р., Эссадель А., Мохаммадин эль-Х., Таги А., Сеттаф А., Чад Б. Гигантская липосаркома сальника, имитирующая опухоль яичника. Отчет о случае. Индийский Дж. Сург. 2012 окт; 74 (5): 425-7. [Бесплатная статья PMC: PMC3477403] [PubMed: 24082602]- 17.
Bouhabel S, Leblanc G, Ferreira J, Leclerc YE, Dubé P, Sidéris L. Солитарная фиброзная опухоль, возникающая в брыжейке: клинический случай. World J Surg Oncol. 2011 31 октября; 9:140. [Бесплатная статья PMC: PMC3225306] [PubMed: 22035205]
- 18.
Meloni F, Feo CF, Profili S, Cossu ML, Meloni GB. Хорошо дифференцированная липосаркома сальника: данные УЗИ, КТ и МРТ. Int J Biomed Sci. 2009 г., сен; 5(3):302-4. [Бесплатная статья PMC: PMC3614784] [PubMed: 23675151]
- 19.
Саваки А. Редкие гастроинтестинальные стромальные опухоли (GIST): сальник и забрюшинное пространство. Перевод Гастроэнтерол Гепатол. 2017;2:116. [Бесплатная статья PMC: PMC5762994] [PubMed: 29354773]
- 20.

Исида Дж., Исида Х., Конно К., Комацуда Т., Абэ К. Первичная лейомиосаркома большого сальника. Дж. Клин Гастроэнтерол. 1999 март; 28(2):167-70. [PubMed: 10078829]
- 21.
Цуцуми Х., Овада С., Такеёси И., Изуми М., Огава Т., Фукусато Т., Морисита Ю. Первичная липосаркома сальника с перекрутом: клинический случай. Гепатогастроэнтерология. 1999 май-июнь;46(27):2110-2. [PubMed: 10430407]
- 22.
Dixon AY, Reed JS, Dow N, Lee SH. Первичная сальниковая лейомиосаркома, маскирующаяся под геморрагический асцит. Хум Патол. 1984 март; 15 (3): 233-7. [PubMed: 6698542]
[Рак брюшины, резецированный как массовая резекция большого сальника — отчет о выживании пациента в течение длительного времени без рецидива]
Отчеты о клинических случаях
. 2018 дек;45(13):2229-2231.
[Статья в японский]
Исао Араи 1 , Сигехару Иноуэ, Вакио Эндо, Казуя Хираока
принадлежность
- 1 Хирургическое отделение больницы Ханнань Тюо.

- PMID: 30692340
Отчеты о делах
[Статья в японский]
Исао Араи и др. Ган То Кагаку Риохо. 2018 Декабрь
. 2018 дек;45(13):2229-2231.
Авторы
Исао Араи 1 , Сигехару Иноуэ, Вакио Эндо, Кадзуя Хираока
принадлежность
- 1 Хирургическое отделение больницы Ханнань Тюо.
- PMID: 30692340
Абстрактный
Мы представляем интересный случай, в котором пациент с диагнозом первичный рак брюшины после резекции большого объема сальника достиг безрецидивной выживаемости без послеоперационной системной химиотерапии. Пациентка — 78-летняя женщина без злокачественных заболеваний в анамнезе. Ей сделали УЗИ брюшной полости в местной поликлинике, которое выявило объемную тень возле нисходящей ободочной кишки. Она была направлена к нам в мае 2014 года. Компьютерная томография брюшной полости с контрастированием показала однородно усиленное мягкотканное образование размером 9Размером 4×80×34 мм в левой нижней части живота, не сообщающейся с желудочно-кишечным трактом. В июне 2014 г. заподозрено стромальную опухоль желудочно-кишечного тракта, выполнена лапаротомия. Результаты лапаротомии предполагают опухоль, происходящую из большого сальника, и отсутствие признаков перифокальной инвазии. Опухоль резецировали с окружающим большим сальником. Патологическое исследование выявило очень низкодифференцированную аденокарциному, также соответствующую серозной аденокарциноме яичников. При до- и послеоперационном обследовании поражений других органов не выявлено, у больного диагностирован первичный рак брюшины. Поскольку пациент отказался от послеоперационной системной химиотерапии, мы решили продолжить только динамическое наблюдение.
Пациентка — 78-летняя женщина без злокачественных заболеваний в анамнезе. Ей сделали УЗИ брюшной полости в местной поликлинике, которое выявило объемную тень возле нисходящей ободочной кишки. Она была направлена к нам в мае 2014 года. Компьютерная томография брюшной полости с контрастированием показала однородно усиленное мягкотканное образование размером 9Размером 4×80×34 мм в левой нижней части живота, не сообщающейся с желудочно-кишечным трактом. В июне 2014 г. заподозрено стромальную опухоль желудочно-кишечного тракта, выполнена лапаротомия. Результаты лапаротомии предполагают опухоль, происходящую из большого сальника, и отсутствие признаков перифокальной инвазии. Опухоль резецировали с окружающим большим сальником. Патологическое исследование выявило очень низкодифференцированную аденокарциному, также соответствующую серозной аденокарциноме яичников. При до- и послеоперационном обследовании поражений других органов не выявлено, у больного диагностирован первичный рак брюшины. Поскольку пациент отказался от послеоперационной системной химиотерапии, мы решили продолжить только динамическое наблюдение. По состоянию на апрель 2018 года пациент был жив без рецидива.
По состоянию на апрель 2018 года пациент был жив без рецидива.
Похожие статьи
Стромальная опухоль желудочно-кишечного тракта с мезентериальной и ретроперитонеальной инвазией.
Энгин Г., Асоглу О., Капран Ю., Мерт Г. Энгин Г. и др. World J Surg Oncol. 2007 24 октября; 5:121. дои: 10.1186/1477-7819-5-121. World J Surg Oncol. 2007. PMID: 17958889 Бесплатная статья ЧВК.
Первичная стромальная опухоль желудочно-кишечного тракта (GIST), проявляющаяся большой массой брюшной полости и спонтанным гемоперитонеумом.
Seow-En I, Seow-Choen F, Lim TK, Leow WQ. Seow-En I и др. BMJ Case Rep. 3 ноября 2014 г .; 2014 г.: bcr2014205528. doi: 10.1136/bcr-2014-205528. Представитель BMJ, 2014 г. PMID: 25368123 Бесплатная статья ЧВК.

Первичная стромальная опухоль желудочно-кишечного тракта (GIST).
Тодороки Т., Сано Т., Сакураи С., Сегава А., Сайто Т., Фудзикава К., Ямада С., Хирахара Н., Цусима Ю., Мотодзима Р., Мотодзима Т. Тодороки Т. и др. World J Surg Oncol. 2007 12 июня; 5:66. дои: 10.1186/1477-7819-5-66. World J Surg Oncol. 2007. PMID: 17565683 Бесплатная статья ЧВК. Обзор.
Внежелудочно-кишечная стромальная опухоль большого сальника: необычный клинический случай.
Тарчули М., Бунаим А., Эссаргини М., Айтидир Б., Ломдо М., Бенмусса М., Укабли М., Айт-Али А., Саир К. Тарчули М. и соавт. J Рак желудочно-кишечного тракта. 2016 декабрь; 47 (4): 489-493. doi: 10.1007/s12029-015-9784-2. J Рак желудочно-кишечного тракта.



 Особенно часто клетки, подвергшиеся мутации, скапливаются в прямой кишке, в сальнике, в слепой кишке. При этом они начинают активно размножаться. Процесс ускоряется из-за соприкосновений брюшины и пораженных органов с кровеносными сосудами.
Особенно часто клетки, подвергшиеся мутации, скапливаются в прямой кишке, в сальнике, в слепой кишке. При этом они начинают активно размножаться. Процесс ускоряется из-за соприкосновений брюшины и пораженных органов с кровеносными сосудами..jpg) У других заболевание может рецидивировать достаточно рано.
У других заболевание может рецидивировать достаточно рано.