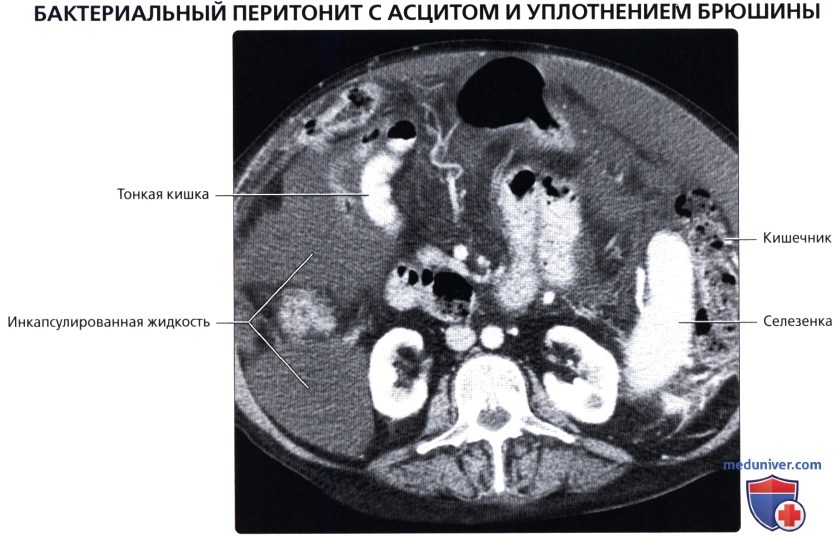
Канцероматоз брюшины при раке: Канцероматоз – один из самых неблагоприятных вариантов прогрессирования ряда онкологических заболеваний
Канцероматоз – один из самых неблагоприятных вариантов прогрессирования ряда онкологических заболеваний
Канцероматоз – один из самых неблагоприятных вариантов прогрессирования ряда онкологических заболеваний. Он представляет собой тяжёлую стадию онкологии, когда злокачественные клетки с потоком крови или лимфы передвигаются внутри организма, вовлекая в патологический процесс здоровые органы.
Чаще всего канцероматоз развивается на фоне рака желудка, желчевыводящих органов, поджелудочной железы, матки и яичников, толстого и тонкого кишечника. Часто такие пациенты считаются неоперабельными, а лечение – бесперспективным. Тем не менее, метод борьбы с заболеванием существует.
Для лечения канцероматоза в Центре хирургии и трансплантологии ФГБУ ГНЦ ФМБЦ им. А.И. Бурназяна ФМБА России используется методика гипертермической интраперитонеальной химиотерапии HIPEC в сочетании с системной химиотерапией: после хирургического вмешательства с максимально возможным удалением всех метастатических очагов пациент подключается к специальному аппарату, и в течение 60-90 минут происходит «промывание» брюшной полости растворами химиопрепаратов при температуре 42-44°C.
Процедура является завершением обширного хирургического вмешательства, при котором должен быть достигнут уровень полной циторедукции, то есть все видимые глазу опухолевые очаги должны быть удалены. На данной стадии HIPEC часто является единственным эффективным методом лечения.
С 2010 года врачи Центра выполнили свыше 300 процедур HIPEС. Процедура проводится с помощью аппарата Performer HT с использованием одноразовых стерильных наборов RanD Hang&Go HT. Во всех случаях процедура проводилась с использованием методики «Close Abdomen».
Продолжительность жизни таких пациентов без лечения составляет в среднем 6-12 месяцев. Опыт ФМБЦ им. А.И. Бурназяна ФМБА России показывает, что при использовании методики HIPEC удаётся добиться 2,5-3-летней выживаемости, 5-летняя выживаемость достигает 30%. Были случаи, когда пациенты прожили после операции 7 лет.
Показания к HIPEC:
— Рак яичников – первичная опухоль с признаками канцероматоза либо рецидивные опухоли
— Псевдомиксома брюшины
— Мезотелиома брюшины
— Опухоли аппендикса
— Рак желудка и рак ободочной кишки с канцероматозом брюшины при отсутствии других отдаленных метастазов – имеют ограничения в применении
Канцероматоз брюшной полости лечение, прогнозы и стадии
Канцероматоз брюшной полости: причины возникновения, симптомы
Данная патология возникает вследствие вторичного поражения брюшной полости раковыми образованиями, образующимися в ЖКТ (40% случаев) и системе репродукции (30%), иногда, что бывает намного реже, развивается из-за перитонеальных опухолей.
Раковые клетки попадают в брюшную полость, отделяясь от опухоли первичной, с серозной жидкостью. Начинается данный процесс с момента утраты клетками взаимодействия и способности прикрепляться к соседним клеткам (адгезия).
Причины появления заболевания
Оторвавшись от раковой опухоли, клетки способны перемещаться по крови и лимфе на значительные расстояния. Они поражают даже далеко расположенные органы, внедряются в клетки здоровые. После того как клетка закрепилась на новом для нее месте, начинается процесс бесконтрольного ее деления.
Помимо передвижения по крови и лимфе распространение раковых клеток в полости брюшины идет трансцеломически. Это происходит, видимо, оттого, что условия для них благоприятны. Значительная часть метастазов локализуется в зонах, где отмечается слабое ритмическое сокращение стенок органов либо там, где происходит чрезмерное всасывание внутрибрюшной жидкой массы.
Нередко разброс клеток ниже в процессе оперативного вмешательства и лапароскопии, чем при оперативном вмешательстве классическом. Оперативная манипуляция предполагает профилактику распространения опухолевого процесса по организму посредством применения уникальных обрабатывающих растворов. Наиболее эффективный способ очистки – HIPEC, предполагающий внутриполостную химиотерапию в сочетании с гипертермией.
Оперативная манипуляция предполагает профилактику распространения опухолевого процесса по организму посредством применения уникальных обрабатывающих растворов. Наиболее эффективный способ очистки – HIPEC, предполагающий внутриполостную химиотерапию в сочетании с гипертермией.
Заболевания, способствующие возникновению патологии
Каждый третий пациент с онкологией ЖКТ сталкивается с канцероматозом. Метастазы, поразившие брюшную полость, могут быть следствием развития карциномы поджелудочной железы и желудка. Это происходит примерно в 40% случаев. Еще у 10% наблюдается патология как следствие онкологии кишечника. Очень велика доля пациентов с онкологией яичников, почти 2/3.
На вероятность возникновения заболевания влияют два основных фактора:
- Агрессивность мутированных клеток;
- Объем первичного злокачественного новообразования.
Причинами развития патологии, кроме перечисленных выше, могут стать опухоли любого органа: простаты, легкого, молочной железы и т. д.
д.
Диагностические мероприятия
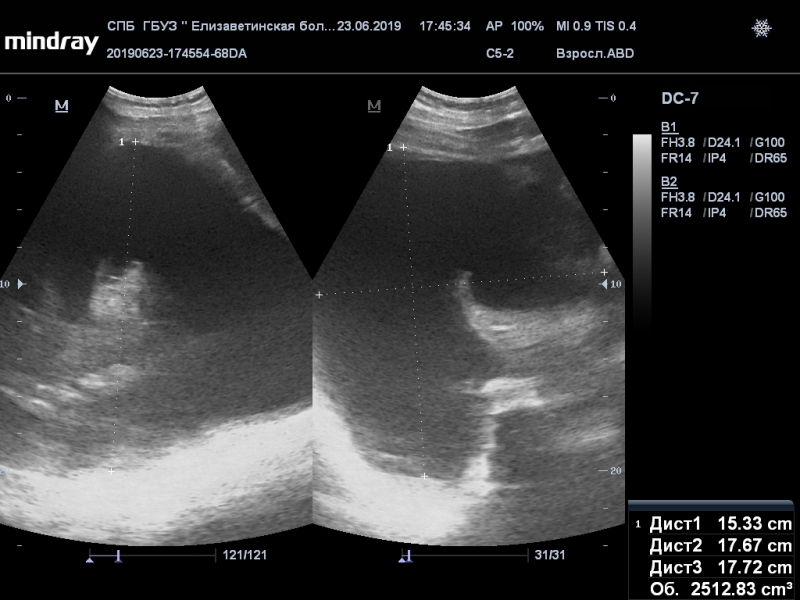
Обнаружить поражение брюшной полости при асците не представляет проблемы. Для этого применимы ультразвуковое исследование, компьютерная томография с использованием контраста.
Ультразвуковое исследование помогает обнаружить напластования, толщина которых несколько сантиметров, но обнаружить узелки мелкие не представляется возможным.
Применение компьютерной томографии с контрактом — более информативный метод диагностики, потому что обнаруживаются сантиметровые образования.
Лапароскопия еще более точна, она считается наиболее эффективным диагностическим методом. В обязательном порядке ее применяют при опухоли желудка и яичников. При этом одновременно выполняется и диагностика, и оперативное лечение.
Жидкую массу, изъятую в процессе лапароскопии либо выполнения прокола, отправляют на лабораторный анализ, который позволяет определить первоисточник онкологического процесса.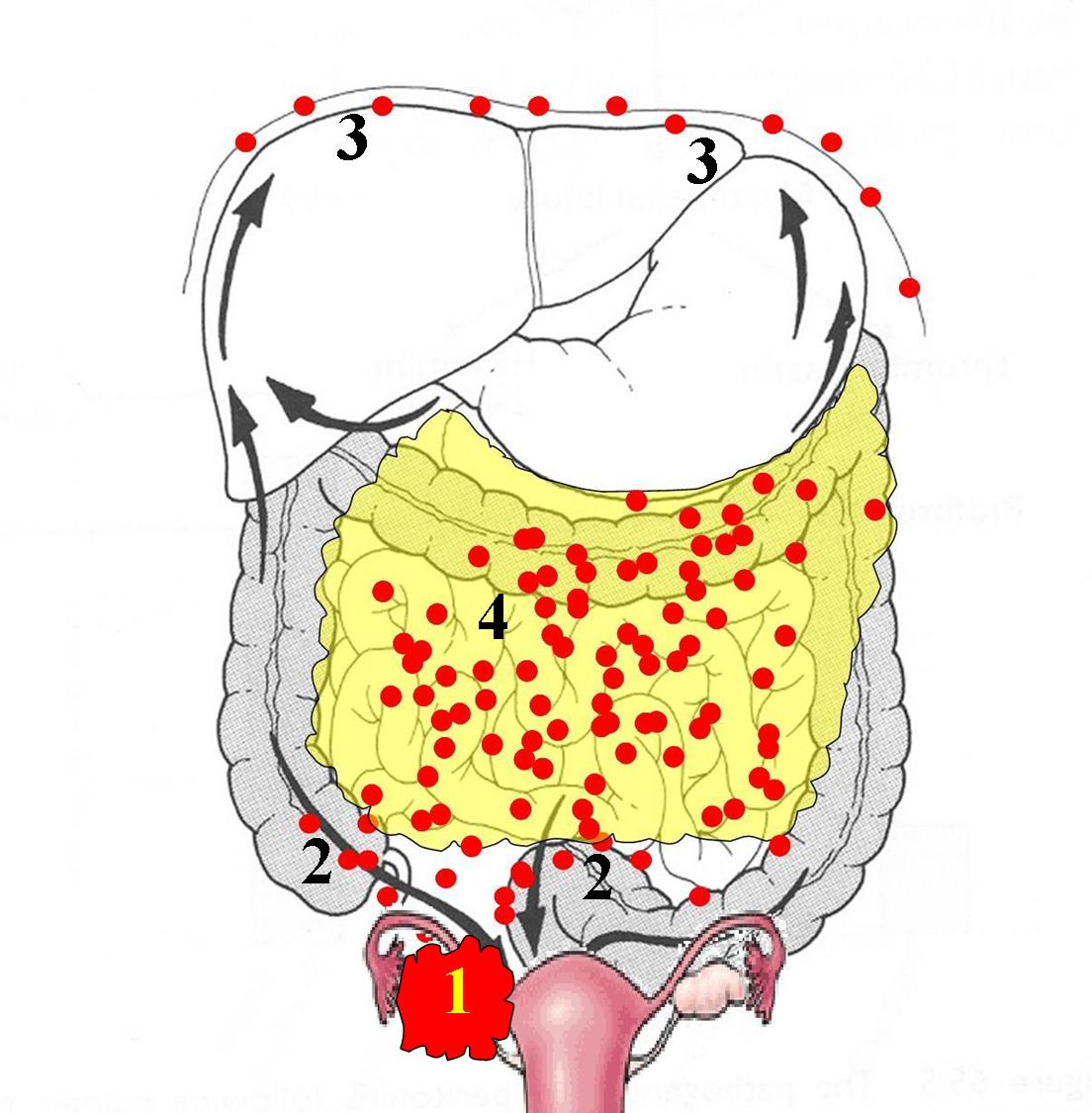
Клиническая практика показывает, что самым оптимальным диагностическим методом является биопсия, в ходе которой забирается кусочек ракового образования для дальнейшего лабораторного исследования. Однако проводить ее, зная первоисточник патологии либо пройдя в недалеком прошлом лечение первичного очага, нецелесообразно.
Классификации
Не существует единой классификации. Это связано с тем, что первичные раковые очаги, которые приводят к появлению заболевания, разные по своим характеристикам. Одной из самых распространенных градаций канцероматоза брюшной полости является та, в основу которой положены зависимость от числа метастазов и их локализация. Данная классификация выделяет 3 степени заболевания:
- Р1– поражение брюшной полости локального характера;
- Р2– выявлено несколько очагов заболевания, которые разделены здоровыми участками брюшной полости;
- Р3– наблюдается множество очагов поражения брюшной полости.

Также применима методика определения индекса канцероматоза брюшной полости, в ходе которой подсчитывается сумма баллов (от 0 до 3) измерения очагов максимального поражения в каждой из наиболее вероятных областей поражения полости брюшины.
Симптоматические проявления
Патология перитонеальная на первых этапах своего развития может никак не обнаруживать себя, в особенности, когда отсутствует излишняя жидкая масса в полости брюшины.
При этом жидкая масса может накапливаться без участия метастазов. Симптоматические проявления заболевания в большинстве случаев неспецифичны, однако, как правило, отмечаются:
- Дискомфортное состояние в животе;
- Сильная слабость;
- Необъяснимое снижение массы тела;
- Потеря веса при стабильном диетическом режиме;
- Потеря аппетита;
- Сбой в работе органов ЖКТ.
По мере развития заболевания злокачественные клетки приводят к:
- Отравлению организма;
- Сдавлению желудка опухолью;
- Состоянию тошноты, рвоты;
- Нарушениям стула;
- Поднятию температуры тела выше нормы.

Возникший асцит негативно сказывается на процессе дыхания, что приводит к сердечной недостаточности, не проходящим отекам, белковой недостаточности вследствие частой эвакуации жидкой массы.
Лечение
Радикально избавиться от опухоли невозможно, но грамотно подобранная лечебная тактика может в значительной степени улучшить состояние больного и существенно продлить его жизнь.
Традиционная хирургическая операция очень сложна и хирурга, и для пациента, поскольку в ходе нее необходимо удалить первичный опухолевый очаг, пораженные лимфоузлы, сумки сальников и все выявленные опухолевые новообразования.
Применима в лечении патологии перитонэктомия. Это вмешательство поэтапное, при котором удалению подлежат некоторые органы полости брюшины, например, селезенка либо части кишечника.
Стандартным лечением канцероматоза брюшной полости считается химиотерапия системного и локального характера.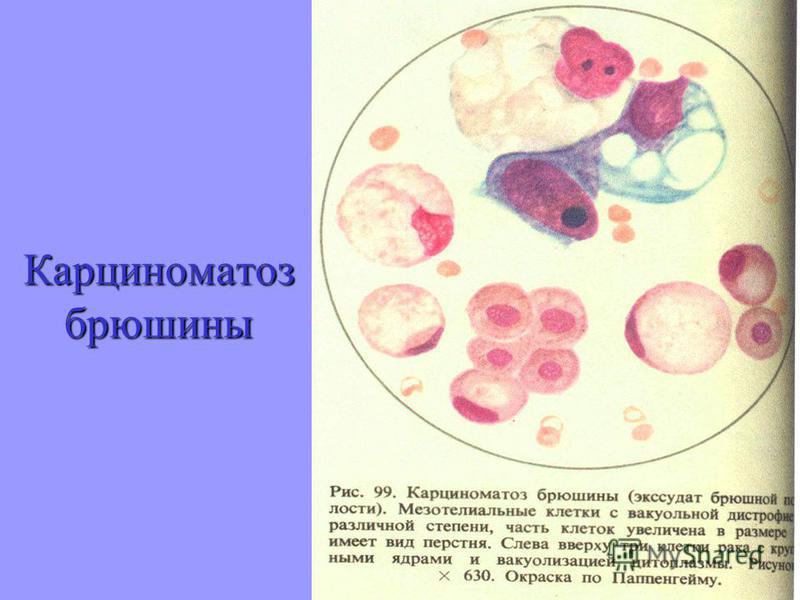 Проходит такое лечение после решения проблемы с асцитом либо посредством лапаропорта, который устанавливают в процессе оперативного вмешательства.
Проходит такое лечение после решения проблемы с асцитом либо посредством лапаропорта, который устанавливают в процессе оперативного вмешательства.
Лучшие методики
Клиническая практика показывает, что наибольший положительный эффект достигается комбинацией 3-х лечебных методов:
- Циторедукция – вмешательство, в ходе которого удаляют максимум раковых опухолей;
- Гипертермия локального характера;
- Введение внутрь полости химических препаратов.
Если в ходе операции используют интраперитонеальную гипертермическую химиотерапию (ИГХТ либо HIPEC), то возможно на долгое время добиться поддержания значительной концентрации медицинского препарата в области локации опухоли и тем самым обеспечить высокий лекарственный эффект. Перспективы такого лечения обнадеживают.
Фотодинамическая терапия интраоперационная (ФДТ) с ее воздействием на опухоль фотосенсибилизатором по положительному результату уступает HIPEC.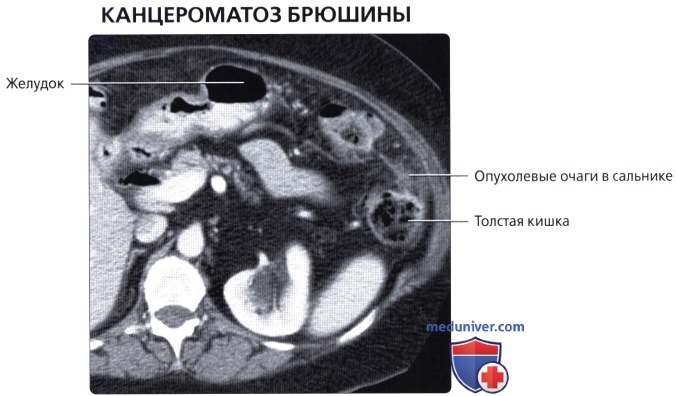 Это объясняется тем, что лазер проникает не во все зоны брюшины. Однако при опухолях значительных по объему либо опухолях немногочисленных данный метод отлично зарекомендовал себя.
Это объясняется тем, что лазер проникает не во все зоны брюшины. Однако при опухолях значительных по объему либо опухолях немногочисленных данный метод отлично зарекомендовал себя.
Прогноз
Прогноз зависит от таких факторов, как степень поражения, степень развития патологии, восприимчивость опухоли к химиотерапевтическому лечению. Конечно же, важную роль играет опыт врача и выбор адекватного лечения.
В клинике интегративной онкологии Onco.Rehab работают врачи, вошедшие в ТОП лучших онкохирургов России. Их талант и опыт помогают нашим пациентам справиться с канцероматозом брюшной полости.
Канцероматоз плевры при раке — описание и причины
Возможные осложнения
Канцероматоз плевры усугубляет проблемы с легкими. Развивается экссудативный плеврит – инфекционно-воспалительный процесс листков плевры. Особенно опасны для жизни гнойная и гнойно-гнилостная формы. При гнойном плеврите наблюдается отравление продуктами жизнедеятельности бактерий (токсемия). Завершается подобное состояние спутанностью сознания и комой.
Завершается подобное состояние спутанностью сознания и комой.
У пациента появляется синюшность кожи лица, шейные вены и межреберья выбухают. Больной чувствует себя комфортно только в вынужденном положении.
Другим осложнением канцероматоза может стать асцит – скопление жидкости в животе. Ухудшение работы сердца, кругов кровообращения приводит к застойным явлениям в брюшной полости. Пациенты жалуются на боль в животе, нарастающую одышку, отечность. Стремительно развивающийся асцит приводит к тромбозу воротной вены.
Из-за чего при раке развивается симптом
Причина первичной онкопатологии плевральных листков – работа на вредном производстве. Чаще всего развитие заболевания связывают с асбестовой промышленностью.
Вторичный процесс обусловлен метастазированием. Метастатические узелки обсеменяют листы плевральной полости при различных вариантах рака – новообразованиях легких, груди, яичников, почек.
Патологический выпот может быть вызван не только злокачественным перерождением плевральных листков, но и метастатическим поражением лимфоузлов средостения (группа органов, расположенных в плевральной полости).
При некоторых видах рака (онкопроцесс яичников) канцероматоз плевры является следствием запущенного злокачественного асцита.
Связано это с механическим нарушением лимфооттока. Избыточная жидкость при плеврите исчезает после эвакуации выпота из брюшной полости.
Практически любая онкопатология может сопровождаться поражением плевры. При этом накопление жидкости в патологическом объеме не обязательно. Также и наличие выпота не всегда связано с раковой опухолью, а может быть следствием функциональных расстройств организма.
Методы диагностики в Медскан
В диагностическом центре клиники Медскан выполняется весь необходимый комплекс лабораторно-инструментальных исследований. С их помощью специалисты в короткие сроки устанавливают диагноз, определяя дальнейший план лечения.
С их помощью специалисты в короткие сроки устанавливают диагноз, определяя дальнейший план лечения.
Обследование включает следующие пункты:
- Рентгенографическое исследование грудной клетки выявляет уровень жидкости в полости плевры.
- Компьютерная томография и магнитно-резонансная томография – довольно информативный метод, позволяющий визуализировать метастатические очаги размером пару миллиметров.
- Видеоторакоскопия. Через небольшой прокол в стенке грудной клетки вводят оптический прибор – торакоскоп. С его помощью на экране аппарата можно увидеть патологические изменения слизистой, а также взять на анализ фрагмент новообразования.
- Иммуногистохимический анализ крови выявляет особые белковые соединения – онкомаркеры.
По показаниям специалист назначает дополнительные методы исследования для постановки окончательного диагноза.
Методы лечения в Медскан
Современные технологии и оборудование помогают справиться с наиболее серьезными формами заболевания. В клинике Медскан пациенту с канцероматозом плевры проведут лечение не только пораженных легких, но и первичного патологического очага. Помогут в этом высококвалифицированные опытные специалисты Медскан, а также диагностическая и лечебная аппаратура экспертного уровня.
В клинике Медскан пациенту с канцероматозом плевры проведут лечение не только пораженных легких, но и первичного патологического очага. Помогут в этом высококвалифицированные опытные специалисты Медскан, а также диагностическая и лечебная аппаратура экспертного уровня.
К основным методам онкопомощи можно отнести:
- Химиотерапия. Применение химиотерапевтических препаратов актуально как до операции, так и после.
- Оперативное вмешательство. Удаляются первичная опухоль и метастатические очаги.
- Таргетная терапия предполагает блокировку роста атипичных клеток путем воздействия препаратов на определенные («целевые») молекулы. Несомненное преимущество этого вида лечения – его низкая токсичность на организм пациента.
В Медскан широко распространена услуга «второе мнение» от ведущих израильских специалистов, что бывает необходимо для решения спорных моментов лечения.
Опухоли брюшины | Онкологический диспансер Санкт-Петербурга
О заболевании
Опухоли брюшины — новообразования различного происхождения, локализующиеся в области висцерального и париетального листков брюшины, малого сальника, большого сальника и брыжеек полых органов.
Различают три основные группы новообразований брюшины:
- Доброкачественные опухоли брюшины
- Первичные злокачественные опухоли брюшины
- Вторичные злокачественные опухоли брюшины
Виды доброкачественных опухолей брюшины
К доброкачественным новообразованиям брюшины относятся кисты, лимфангиомы, ангиомы, липомы, фибромы и др.
Под ангиомой понимается доброкачественная опухоль, которая развивается из кровеносных сосудов.
Лимфангиома – это доброкачественная опухоль, состоящая из лимфатических сосудов. Она образуется в период эмбрионального развития и продолжает расти в раннем детстве. Чаще лимфангиома останавливается в развитии, не представляя угрозу для жизни.
Липома иначе называется жировой опухолью и представляет собой образование, практически не отличающееся от нормальной жировой ткани. Липомы развиваются медленно, не влияя на состояние больного, и могут достигать огромных размеров.
Фиброма представляет собой опухоль, состоящую из волокнистой соединительной ткани. Она имеет небольшое количество соединительнотканных веретенообразных клеток, волокон и сосудов.
Доброкачественные новообразования протекают бессимптомно, либо сопровождаются признаками сдавления близлежащих органов.
Основное лечение — хирургическое. Прогноз благоприятный.
Виды злокачественных опухолей брюшины
К первичным злокачественным новообразованиям брюшины относится мезотелиома.
Мезотелиому относят к профессиональной строительной патологии. Считается, что развитие мезотелиомы брюшины и других локализаций напрямую связано с длительным и интенсивным контактированием человека с асбестом. От начала контакта с асбестосодержащим материалом до начала болезни может пройти много лет.
К предрасполагающим факторам риска относятся:
- табакокурение;
- генетическая предрасположенность;
- ионизирующее излучение.

В начальных стадиях проявления мезотелиомы брюшины малоспецифичные. Могут отмечаться дискомфорт и боли в брюшной полости, не имеющие четкой локализации, слабость, похудание. Прогрессирование болезни характеризуется скоплением серозного или гемморагического содержимого в брюшной полости (асцит).
Набор лабораторных и инструментальных исследований, необходимых для адекватной оценки распространённости опухолевого процесса, зависит от многих факторов и определяется индивидуально в каждом конкретном случае. Лечебная тактика также строго индивидуальна и может включать все виды специального лечения: онкохирургию, химиотерапию, лучевую терапию, фотодинамическую терапию и др.
Вторичные злокачественные опухоли брюшины
Вторичные злокачественные опухоли брюшины, иначе называются карциноматозом брюшины, развиваются у пациентов с уже существующей первичной опухолью пищеварительного тракта или другой локализации.
В большинстве случаев вторичное поражение брюшины развивается в результате агрессивного местного роста новообразований и имплантационного распространения раковых клеток из органов, расположенных в брюшной полости и малом тазу.
Опухоли брюшины, возникшие в результате имплантационного метастазирования, могут выявляться при раке желудка, тонкого и толстого кишечника, печени, поджелудочной железы, желчного пузыря, почки, тела матки, шейки матки, яичников, предстательной железы, передней брюшной стенки и т. д. Реже наблюдается лимфогенное распространение метастазов опухолей грудной клетки (например, рака легких), обусловленное ретроградным движением лимфы по лимфатическим путям.
Признаки и симптомы рака брюшины
К основным признакам, указывающим на развитие злокачественного поражения брюшины, относят:
- Появление тупых, ноющих болей. Они могут быть как постоянными, так и беспокоящими больного периодами по несколько часов или дней.
- Увеличение живота на фоне резкого снижения веса. Увеличивающийся в размерах живот образуется по причине скопления в брюшной полости жидкости (асцит).
- Выраженное нарушение пищеварения. У больного появляется тошнота, боли и колики в животе, возможна рвота.
 Возникают трудности с опорожнением кишечника, нередко запор сменяется поносом.
Возникают трудности с опорожнением кишечника, нередко запор сменяется поносом. - Усиливающиеся симптомы интоксикации. Сильная слабость, проливные поты, озноб, повышение температуры, боли в мышцах и голове, больные истощены – все эти признаки характерны для развивающегося карциноматоза брюшины.
- Наличие опухоли, пальпируемой через переднюю брюшную стенку
Диагноз устанавливается с учетом анамнеза, клинических проявлений, данных лабораторных и инструментальных исследований.
Лечение больных с выявленным карциноматозом брюшины достаточно сложное. В настоящее время отсутствуют стандартные методы радикального лечения данного вида опухолей, поэтому лечение строго индивидуально.
Псевдомиксомы — слизеобразующие новообразования
Отдельно необходимо отметить слизеобразующие новообразования (псевдомиксомы), которые одни исследователи рассматривают, как первичные, а другие – как вторичные опухоли брюшины различной степени злокачественности.
Псевдомиксома брюшины — это редкое онкологическое заболевание, при котором развивается поражение брюшины, сопровождающееся выделением и накоплением слизи в брюшной полости. Характерная особенность псевдомиксомы в том, что эта опухоль не метастазирует с током крови или лимфы, а распространяется по поверхности брюшины. Наличие большого количества слизи и опухолевых тканей приводит к нарушениям в работе внутренних органов.
Патологический процесс, как правило, развивается медленно. Течение опухолевого процесса растягивается на несколько лет и редко выявляется на начальных стадиях.
Традиционным методом лечения пациентов с псевдомиксомой является хирургическое вмешательство в сочетании с химиотерапией. Лечение должно осуществляться в специализированном (онкологическом) стационаре.
Чтобы записаться на консультацию и осмотр у врача, обращайтесь к специалисту контактного центра:
Единый колл-центр: +7 (812) 607-03-03
Методы лечения карциноматоза брюшины за рубежом
Доктор Вадим Бережной Основатель платформы MediGlobus. Медицинский эксперт, Заведующий отделением врачей-координаторов.
Медицинский эксперт, Заведующий отделением врачей-координаторов.
Время чтения – 16 минут
Карциноматоз – результат метастазирования некоторых злокачественных опухолей в серозную оболочку брюшины и структуры брюшной полости. Также для определения недуга используют термин – канцероматоз.
Появление данной патологии свидетельствует о значительном прогрессировании онкологического процесса. Болезнь развивается у 20% пациентов с гинекологическими опухолями и раком желудочно-кишечного тракта.
До недавнего времени пациенты с карциноматозом имели неблагоприятные прогнозы – выживаемость больных не превышала полгода. Благодаря достижениям современной медицины люди с карциноматозом могут прожить больше 5 лет. Как за рубежом удается добиться таких результатов – узнайте из статьи!
Слушать статью:
Канцероматоз брюшины – что это?
Канцероматоз брюшины – это множественные метастазы рака 4 стадии в брюшной полости. Чаще всего данное состояние вызвано запущенными опухолями толстой кишки, яичников, желудка, прямой кишки или аппендикса.
Чаще всего данное состояние вызвано запущенными опухолями толстой кишки, яичников, желудка, прямой кишки или аппендикса.
Около 60% всех случаев карциноматоза брюшины обнаруживают при раке желудка и яичников. Симптомы патологии зависят от того, как проявляется первичная опухоль.
На ранних этапах развития болезни клиническая картина может “маскироваться” под другие заболевания или полностью отсутствовать. На более поздних стадиях канцероматоз имеет следующую симптоматику:
В 30% случаев карциноматоз брюшины осложняется асцитом – скоплением жидкости в брюшной полости. Данное состояние вызывает такие симптомы, как:
Если врач подозревает, что у пациента канцероматоз, он назначает комплекс обследований: анализ крови, КТ, МРТ и биопсию. В некоторых случаях болезнь диагностируют во время операции по удалению другого вида рака.
Методы лечения канцероматоза
Долгое время продолжительность жизни пациентов с данной болезнью составляла менее 6 месяцев. С появлением инновационных методов онкотерапии шансы на выживаемость онкобольных увеличились на 50%. Для борьбы с карциноматозом за границей используют:
С появлением инновационных методов онкотерапии шансы на выживаемость онкобольных увеличились на 50%. Для борьбы с карциноматозом за границей используют:
Циторедуктивная хирургия (CRS)
CRS подразумевает удаление первичной опухоли с регионарными метастазами и злокачественными очагами в брюшине. У 78% пациентов циторедуктивная хирургия проходит без осложнений. Период полного восстановления организма занимает от 2 до 3 месяцев.
Во время вмешательства доктор делает разрез, идущий от нижней части грудины до лобковой кости. С помощью хирургических инструментов он убирает все видимые опухоли в брюшной полости. При этом объем операции определяется размером патологического очага. Длительность хирургии составляет от 2 до 16 часов.
5-летняя выживаемость пациентов перенесших циторедуктивную операцию без дополнительного лечения составляет около 30%.
Гипертермическая химиотерапия по методу Шурайберейга (HIPEC)
Гипертермическую химиотерапию используют для уничтожения микроскопических раковых клеток, которые остаются после резекции..jpg) Процедура проводится сразу с основной операцией по удалению опухоли. Для ее выполнения пациенту в брюшную полость через катетер вводят высокую дозу химического препарата, разогретого до 42-43 градусов Цельсия. Гипертермия увеличивает цитотоксичность хим.вещества и позволяет ему проникнуть глубже в пораженные участки.
Процедура проводится сразу с основной операцией по удалению опухоли. Для ее выполнения пациенту в брюшную полость через катетер вводят высокую дозу химического препарата, разогретого до 42-43 градусов Цельсия. Гипертермия увеличивает цитотоксичность хим.вещества и позволяет ему проникнуть глубже в пораженные участки.
Лекарство циркулирует в брюшной полости с помощью специального насоса. Объем, скорость подачи и температуру раствора контролируют компьютерными датчиками. Длительность гипертермической химиотерапии составляет от 40 минут до 1,5 часа.
Поскольку HIPEC вводится в виде одноразовой дозы непосредственно в брюшную полость, у пациента отсутствуют побочные эффекты, которые возникают после приема химиотерапии в виде таблеток или капельниц.
Однако многим пациентам по-прежнему требуется внутривенная химия до или после операции. HIPEC выполняют только после прекращения действия системной химии.
5-летняя выживаемость пациентов после гипертермической химиотерапии (HIPEC) составляет от 30% до 40%.
Циторедуктивная хирургия CRS и гипертермическая химиотерапия HIPEC
“Золотым стандартом” лечения тотального канцероматоза брюшины является комплексное применение оперативного вмешательства CRS и внутрибрюшной гипертермической химии. Сочетание этих двух методик позволяет уничтожить около 90% всех онкоклеток. Оно дает самые высокие прогнозы эффективности онкотерапии данного заболевания.
В зависимости от локализации метастазов, 5-летняя выживаемость больных составляет от 31% до 50%.
На первом этапе пациенту проводят циторедуктивную хирургию во время которой удаляют большую часть опухоли. Операция необходима, чтобы устранить основной источник болезни.
После удаления злокачественных новообразований, в открытую полость пациента вводят разогретые химические препараты. Они циркулируют в брюшине некоторое время и убивают остаточные онкоклетки. Затем лекарство удаляют и максимально восстанавливают целостность кишечника. На разрез накладывают швы и повязку. Пациент находится в больнице от 7 до 14 дней.
На разрез накладывают швы и повязку. Пациент находится в больнице от 7 до 14 дней.
Согласно данным исследования университета Джонса Хопкинса в США, хирургия CRS и HIPEC эффективна при лечении пациентов с поздними стадиями рака желудочно-кишечного тракта и яичников. У каждого второго пациента после онкотерапии улучшается общее состояние и увеличивается продолжительность жизни на 3-5 лет.
Внутрибрюшинная аэрозольная химиотерапия под давлением (PIPAC)
Внутрибрюшинная аэрозольная химиотерапия под давлением (PIPAC) представляет собой новый подход к лечению карциноматоза. Во время процедуры осуществляется распыление препаратов в высоких дозах непосредственно в брюшную полость. Все манипуляции проводят под общей анестезией.
PIPAC – малоинвазивно лапароскопическое вмешательство, которое подразумевает доставку химических препаратов в аэрозольной форме. Лекарства под высоким давлением распыляются с помощью специализированного устройства CapnoPen. Этот аппарат превращает жидкий химический раствор в спрей. В такой форме лекарство достигает всех уголков брюшной полости и уничтожает онкоклетки даже в труднодоступных местах.
Этот аппарат превращает жидкий химический раствор в спрей. В такой форме лекарство достигает всех уголков брюшной полости и уничтожает онкоклетки даже в труднодоступных местах.
Процедура длится от 60 до 90 минут. После химиотерапии пациенты остаются в больнице на сутки для наблюдения. Обычно данный метод онкотерапии переносится хорошо.
Первые результаты PIPAC заметны через 3 сеанса. Для получения наибольшего эффекта необходимо около 6 повторений. Перерыв между сеансами занимает 5-6 недель. Благодаря PIPEC уничтожают 95% внутрибрюшинных опухолей. В дополнение к прямой доставке химиотерапии в патологический очаг, PIPAC имеет ряд преимуществ:
5-летний показатель выживаемости при использовании PIPEC около 50%.
Перитонэктомия
Операция по удалению брюшины называется перитонэктомией. Она является разновидностью циторедуктивной хирургии. В ходе оперативного вмешательства возможно частичное или полное удаление не только брюшины, но и других пораженных органов – тонкого кишечника, желчного пузыря, печени, желудка, поджелудочной железы и селезенки.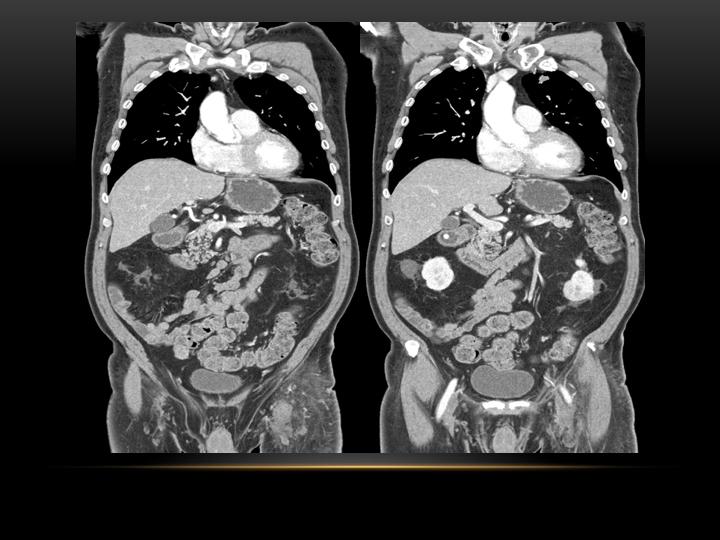
Перитонэктомия предназначена для облегчения симптомов – паллиативного лечения. Она может замедлить прогрессирование заболевания. Ремиссия после хирургии достигается у 20% пациентов.
Чтобы улучшить шансы на выживаемость и уменьшить вероятность рецидива, данную операцию сочетают с химиотерапией.
СРАВНЕНИЕ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ КАНЦЕРОМАТОЗА РАЗНЫМИ МЕТОДАМИ
| Метод лечения карциноматоза | Показатель 5-летней выживаемости пациентов |
|---|---|
| Циторедуктивная хирургия | Примерно 30% |
| Гипертермическая химиотерапия (HIPEC) | От 30% до 40% |
| Гипертермическая химиотерапия (HIPEC) и циторедуктивная операция (CRS) | От 31% до 50% |
| Внутрибрюшинная аэрозольная химиотерапия под давлением (PIPEC) | Около 50% |
| Перитонэктомия | Менее 20% |
Где лечат канцероматоз брюшины за границей?
Для борьбы с данной онкопатологией иностранные пациенты обращаются в турецкие, израильские, немецкие, испанские, китайские и корейские медучреждения. За границей эту болезнь успешно лечат в специализированных центрах и широкопрофильных клиниках. Среди них выделяются:
За границей эту болезнь успешно лечат в специализированных центрах и широкопрофильных клиниках. Среди них выделяются:
Резюме
Канцероматоз брюшины – состояние при котором в брюшной полости одновременно развивается несколько карцином. Эту патологию провоцирует 4 стадия рака яичников, матки или кишечника. 2 пациента из 10 с гинекологическими опухолями или новообразованиями ЖКТ имеют данное заболевание. Основой борьбы с карциноматозом является оперативное вмешательство и химиотерапия. Выбор методов лечения зависит от индивидуальных потребностей пациента. За границей для каждого больного подбирают персонализированную программу онкотерапии, которая соответствует международным протоколам. Прогноз выживаемости пациентов с канцероматозом брюшины при раке яичников или кишечника зависит от методов, используемых для устранения заболевания и характеристик первичной опухоли. Также на этот показатель влияет уровень медицинского центра и квалификация лечащего доктора.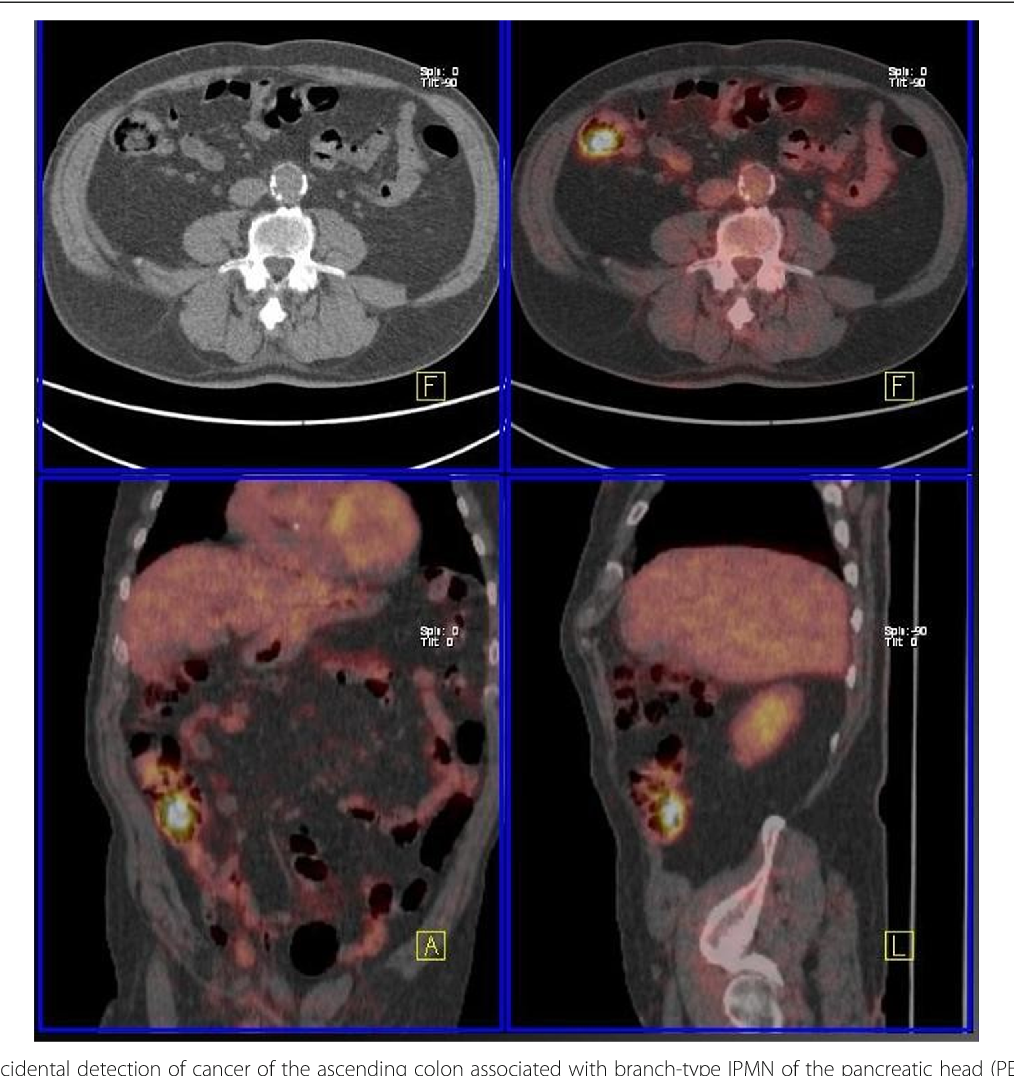 При своевременной онкотерапии около 50% больных преодолевают порог 5-летней выживаемости. Ключевые направления для лечения заболевания – Турция, Испания, Германия, Южная Корея, Израиль, Китай и Австрия. Медицинские туристы часто выбирают такие медицинские центры, как: Мемориал, Наварры, Фуда, Ихилов, СунЧонХян, Рехтс дер Изар.
При своевременной онкотерапии около 50% больных преодолевают порог 5-летней выживаемости. Ключевые направления для лечения заболевания – Турция, Испания, Германия, Южная Корея, Израиль, Китай и Австрия. Медицинские туристы часто выбирают такие медицинские центры, как: Мемориал, Наварры, Фуда, Ихилов, СунЧонХян, Рехтс дер Изар.
Больше информации о лечении канцероматоза за границей узнайте у специалистов международной медицинской платформы MediGlobus. Наши эксперты ответят на все вопросы и помогут с организацией поездки в зарубежную клинику. Обращайтесь!
Получить бесплатную консультацию
Источники:
- 1. National Center for Biotechnology Information
- 2. Medicina Universitaria
Доктор Вадим Бережной
Основатель платформы MediGlobus. Медицинский эксперт, Заведующий отделением врачей-координаторов.
Editor
Более 2 лет пишет медицинские тексты. Опыт работы в сфере копирайтинга превышает 6 лет. Имеет образование по направлению “Социально-правовая защита”. Освоила программу медицинских курсов. Изучает коммуникативные техники ведения переговоров с пациентами. В свободное время посещает тренинги и семинары по медицинской психологии.
Опыт работы в сфере копирайтинга превышает 6 лет. Имеет образование по направлению “Социально-правовая защита”. Освоила программу медицинских курсов. Изучает коммуникативные техники ведения переговоров с пациентами. В свободное время посещает тренинги и семинары по медицинской психологии.
Похожие посты
ТОП онкологов, специализирующихся на лечении рака груди
Читать дальшеРак брюшины: асцит и канцероматоз
Одно из страшных заболеваний, которому подвержены только женщины, является рак яичников. Этот диагноз уверенно занимает 5 место по числу распространения онкологии среди представительниц женского пола. Статистические данные сообщают, что это заболевание не является одним из самых распространенных, но при этом имеет тяжелые последствия и случаи летального исхода. Более того, если ранее этот диагноз встречался у женщин, возраст которых превысил 40 лет, то сегодня он заметно помолодел.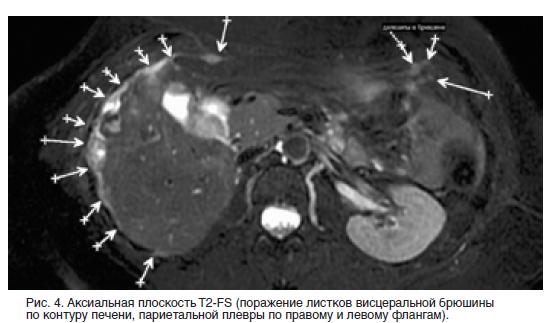 Одним из самых опасных развитий этого диагноза считается асцит при раке яичников, составляя около 60% летальных случаев от общего числа смертельных исходов при онкологии яичников.
Одним из самых опасных развитий этого диагноза считается асцит при раке яичников, составляя около 60% летальных случаев от общего числа смертельных исходов при онкологии яичников.
Асцит при раке яичников проявляется как выход жидкости в брюшину. Этот процесс и считается основной причиной воспаления, абсцесса, развития некротических процессов и смерти.
Причины и диагностика асцита
• Асцит может иметь визуальное проявление в виде серьезного отека, он может локализоваться в области живота, гениталий и ног. Очень сильные отеки сигнализируют об асците и требуют срочного медицинского вмешательства.
• Известны случаи, когда асцит сопровождается интенсивным болевым синдромом. Болевые ощущения подобны тем, которые люди испытывают при аппендиците – резкая и тянущая боль внизу живота. Чтобы справиться с мучительными ощущениями, необходимо срочно обратиться в больницу, где врачи выведут жидкость из полости брюшины с помощью специальных препаратов. Стоит отметить, что асцит может проходить безболезненно.
Стоит отметить, что асцит может проходить безболезненно.
• Наличие жидкости увеличивает размеры не только самого яичника, но и опухоли. Возникновение жидкости связано с разрушением лимфатических сосудов. Присутствие ее в яичнике является причиной его разрыва. Поставить диагноз асцит, если жидкости менее чем 140 мл визуально невозможно. В случаях, когда количество жидкости превышает эту цифру, асцит может диагностироваться врачом на осмотре и при пальпации. Кроме того, в некоторых случаях происходит очень быстрый и сильный рост живота, а также несимметричное выпирание одной части брюшины.
Все эти признаки сигнализируют об асците и требуют срочного вмешательства специалистов. Утешительным моментом этого заболевания является то, что асцит является ожидаемым, и врачи ведут постоянное наблюдение за пациенткой, чтобы при первых его проявлениях спасти больную. Такой подход исключает опасности развития болезни и смерти пациентки. При постановке диагноза асцит, жидкость обязательно берут на анализ, чтобы точно знать ее состав, а также присутствует ли в ней болезнетворная флора. Отталкиваясь от этих данных, врачи подбирают лечение больной и принимают необходимые меры, чтобы избежать летального исхода. Вся опасность состоит в том, что начавшиеся выделения жидкости из яичника в брюшную полость очень тяжело остановить, и контролировать данный процесс, чтобы учитывать количество жидкости. Поэтому единственно верным выходом для решения проблемы является химиотерапия или оперативное вмешательство.
Отталкиваясь от этих данных, врачи подбирают лечение больной и принимают необходимые меры, чтобы избежать летального исхода. Вся опасность состоит в том, что начавшиеся выделения жидкости из яичника в брюшную полость очень тяжело остановить, и контролировать данный процесс, чтобы учитывать количество жидкости. Поэтому единственно верным выходом для решения проблемы является химиотерапия или оперативное вмешательство.
Канцероматоз
Бессимптомное протекание болезни рак яичников опасно его развитием и обнаружением только на последних стадиях, когда раковые клетки разрушают не только яичник, но и смежные органы. Лечение в этом случае проходит очень тяжело и долго с применением оперативного вмешательства, а также химиотерапии и лучевой терапии. Для более, чем половины случаев характерно обнаружение заболевания на 3 или 4 стадиях, когда опухоль переходит на брюшину. Подобное разрастание в медицине называется канцероматоз брюшины при раке яичников. Такой исход болезни объясняется тем, что проявляется она в виде неспецифических симптомов: тянущая боль внизу живота, утомляемость, резкое снижение веса, а также увеличение объемов живота. Как правило, подобные признаки, не дают причин усомниться в своем здоровье и не являются поводом для беспокойства. Кроме того, исследование и диагностика с помощью самых современных и дорогих аппаратов, таких как томограф, не всегда может подтвердить наличие рака яичников на первых 2 стадиях его развития. Вся сложность в том, что опухоль локализуется в определенном месте и с помощью томографа очень тяжело обнаружить это место распространения раковых клеток.
Как правило, подобные признаки, не дают причин усомниться в своем здоровье и не являются поводом для беспокойства. Кроме того, исследование и диагностика с помощью самых современных и дорогих аппаратов, таких как томограф, не всегда может подтвердить наличие рака яичников на первых 2 стадиях его развития. Вся сложность в том, что опухоль локализуется в определенном месте и с помощью томографа очень тяжело обнаружить это место распространения раковых клеток.
Обнаружив рак яичников, врачи назначают операцию по удалению опухоли и органа или системы органов, на которых происходит развитие раковых клеток. Затем больной проходит курс химиотерапии, которая направлена на их полное удаление в организме. При правильном и своевременном лечении цель достигается и человек выздоравливает. Но самым опасным явлением при раке яичников считается возникновение рецидива, причем в этом диагнозе он встречается очень часто и является больше правилом, чем исключением. Лечение рецидивов при раке яичников малоэффективно при помощи химиотерапии, в силу высокого роста раковых клеток.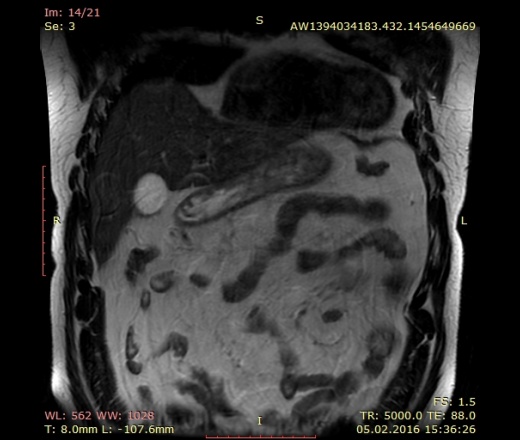 В этом случае все силы врачей и других медицинских работников направлены на поддержания жизни пациентки с помощью контроля симптомов болезни рак яичников. Метастазы начинают распространяться по другим органам, значительно сокращая шансы на выживание. Когда химиотерапевтические мероприятия не приносят результатов, показывающих положительную динамику, к рецидиву относят как к неизлечимому заболеванию. В этом случае срок жизни ограничивается периодом между 8 и 15 месяцами.
В этом случае все силы врачей и других медицинских работников направлены на поддержания жизни пациентки с помощью контроля симптомов болезни рак яичников. Метастазы начинают распространяться по другим органам, значительно сокращая шансы на выживание. Когда химиотерапевтические мероприятия не приносят результатов, показывающих положительную динамику, к рецидиву относят как к неизлечимому заболеванию. В этом случае срок жизни ограничивается периодом между 8 и 15 месяцами.
Канцероматоз брюшины при раке яичников имеет ряд явных симптомов, к которым относятся неприятные болевые ощущения в животе, асцит, высокая утомляемость, приводящая к упадку сил, а также регулярная кишечная непроходимость. Последний симптом связан с разрастанием опухоли до больших размеров, и тем самым происходит закупоривание кишечника, что в итоге приводит в смерти больной.
Но американским ученым разработана специальная методика проведения операции при рецидиве, которая позволяет спасти больную женщину. С ее помощью можно удалить любые опухолевые образования, которые локализовались в брюшной полости. Безусловно, это очень тяжелая операция, проходящая в несколько этапов и требующая специальных знаний, умений, а также осуществляемая с помощью специализированной операционной техники. Очень важно, что в ходе операции предусмотрены минимальные потери крови, а все возникшие раны при помощи электрохирургического скальпеля удается закрыть, что сводит до минимума срастание тканей и помогает избежать спайки. На первом этапе операции при диагнозе рак яичников, метастазы и видимые раковые клетки удаляются. После чего приступают к удалению пораженных органов и той части брюшины, которая была подвержена болезни. В результате этих действий все видимые раковые клетки удалены. Но этого не достаточного для полной борьбы с болезнью. Оставшиеся раковые клетки, которые не поддаются визуальному исследованию, нейтрализуются с помощью промывания брюшной полости. На 2 этапе операции специальным раствором цитостатика, который изначально подогревается, происходит истребление оставшихся раковых клеток. Таким образом, вся операция сводится к удалению больших раковых узлов и промывания брюшной полости.
Безусловно, это очень тяжелая операция, проходящая в несколько этапов и требующая специальных знаний, умений, а также осуществляемая с помощью специализированной операционной техники. Очень важно, что в ходе операции предусмотрены минимальные потери крови, а все возникшие раны при помощи электрохирургического скальпеля удается закрыть, что сводит до минимума срастание тканей и помогает избежать спайки. На первом этапе операции при диагнозе рак яичников, метастазы и видимые раковые клетки удаляются. После чего приступают к удалению пораженных органов и той части брюшины, которая была подвержена болезни. В результате этих действий все видимые раковые клетки удалены. Но этого не достаточного для полной борьбы с болезнью. Оставшиеся раковые клетки, которые не поддаются визуальному исследованию, нейтрализуются с помощью промывания брюшной полости. На 2 этапе операции специальным раствором цитостатика, который изначально подогревается, происходит истребление оставшихся раковых клеток. Таким образом, вся операция сводится к удалению больших раковых узлов и промывания брюшной полости.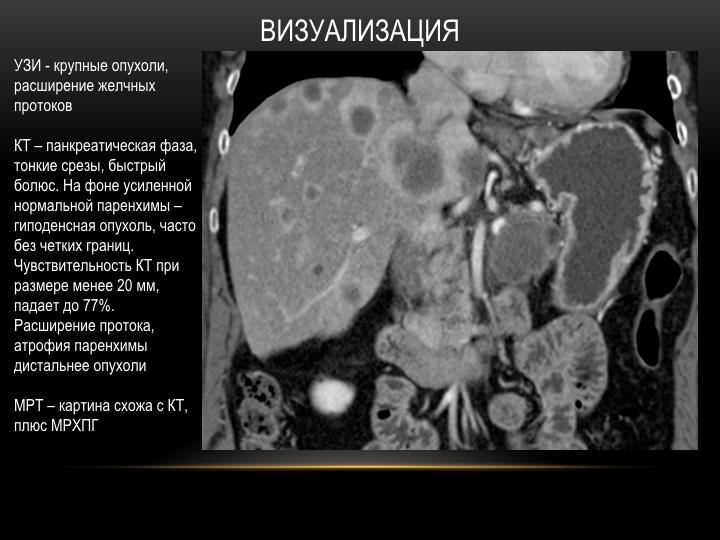 С помощью специального прибора для подогрева раствор доводят до температуры 41-42 градуса. Это условие крайне необходимо: высокая температура раствора помогает привести раковые клетки к отеку, а в здоровых клетках при этом только усилиться кровообращение. В результате раковые клетки повреждаются, и происходит некроз опухоли, от недостаточного количества кислорода начинается ее гипоксия. Кроме того, происходит меньшее поступление питательных веществ к раковым клеткам и развитие ацидоза опухоли. Совокупность этих процессов оказывает губительное воздействие только на раковые клетки организма, а здоровые остаются в неизменном состоянии. После операции, процедуры по промыванию не завершаются, а проводятся еще в течение 3 дней, но концентрация раствора намного слабее. Это необходимо для того, чтобы оградить организм от развития спаек. Безусловно, такая тяжелая и сложная операция потребует больших временных затрат, а также хорошей работы всей команды врачей и другого медицинского персонала. От приложенных усилий, а также искусства выполнения всей операции зависит человеческая жизнь, которая является самым главным приоритетом для каждого врача.
С помощью специального прибора для подогрева раствор доводят до температуры 41-42 градуса. Это условие крайне необходимо: высокая температура раствора помогает привести раковые клетки к отеку, а в здоровых клетках при этом только усилиться кровообращение. В результате раковые клетки повреждаются, и происходит некроз опухоли, от недостаточного количества кислорода начинается ее гипоксия. Кроме того, происходит меньшее поступление питательных веществ к раковым клеткам и развитие ацидоза опухоли. Совокупность этих процессов оказывает губительное воздействие только на раковые клетки организма, а здоровые остаются в неизменном состоянии. После операции, процедуры по промыванию не завершаются, а проводятся еще в течение 3 дней, но концентрация раствора намного слабее. Это необходимо для того, чтобы оградить организм от развития спаек. Безусловно, такая тяжелая и сложная операция потребует больших временных затрат, а также хорошей работы всей команды врачей и другого медицинского персонала. От приложенных усилий, а также искусства выполнения всей операции зависит человеческая жизнь, которая является самым главным приоритетом для каждого врача. После операции пациент требует не меньшего внимания для полного восстановления сил.
После операции пациент требует не меньшего внимания для полного восстановления сил.
Конечно, операция – это серьезная нагрузка на организм, поэтому чтобы восстановить силы в кратчайшие сроки необходимо дополнительное питание организма различными витаминами и полезными элементами. В этот момент идеально подойдет такой препарат, как Трансфер фактор.
Трансфер фактор являет собой особое средство, насыщенное специальными клетками, то есть носителями информации о любых заболеваниях, которые сейчас известны в мире. В основе этого продукта лежит коровье молозиво – натуральный элемент.
Следует отметить, что Трансфер фактор представляет собой неаллергический препарат. Благодаря своему натуральному составу, каждый из нас может принимать его во время обострений, а также в качестве профилактических мер.
Наш иммунитет работает только благодаря тому, что владеет специальными трансфер-клетками. При помощи Трансфер фактора кровь человека насыщается ими, тем самым увеличивая процент обнаружения различных микробов, болезней. А, как вы понимаете, чем быстрее болезнь будет обнаружена, тем скорее произойдет ее уничтожения. То есть в большинстве случаев мы даже не подозреваем о наличии какого-либо заболевания в организме, так как оно уничтожается еще до момента появления симптомов.
А, как вы понимаете, чем быстрее болезнь будет обнаружена, тем скорее произойдет ее уничтожения. То есть в большинстве случаев мы даже не подозреваем о наличии какого-либо заболевания в организме, так как оно уничтожается еще до момента появления симптомов.
Новый метод лечения канцероматоза брюшины. | Patient-mt.ru
Продление жизни пациентов на поздних стадиях рака яичников
Ежегодно во всем мире многие пациенты сталкиваются с диагнозом «канцероматоз брюшины». К ним относится целый ряд онкологических заболеваний – в том числе и пациенты с такими относительно редкими заболеваниями как злокачественная мезотелиома и псевдомиксома брюшины (ПМБ). Однако намного чаще канцероматоз брюшины возникает в результате распространения метастазов при первоначальном рака яичников или желудка, например. Еще не так давно канцероматоз брюшины было крайне сложно лечить, так как болезнь развивается агрессивно, у пациентов развивался тяжелый асцит, качество жизни значительно ухудшалось и прогноз у таких пациентов был крайне неблагоприятным.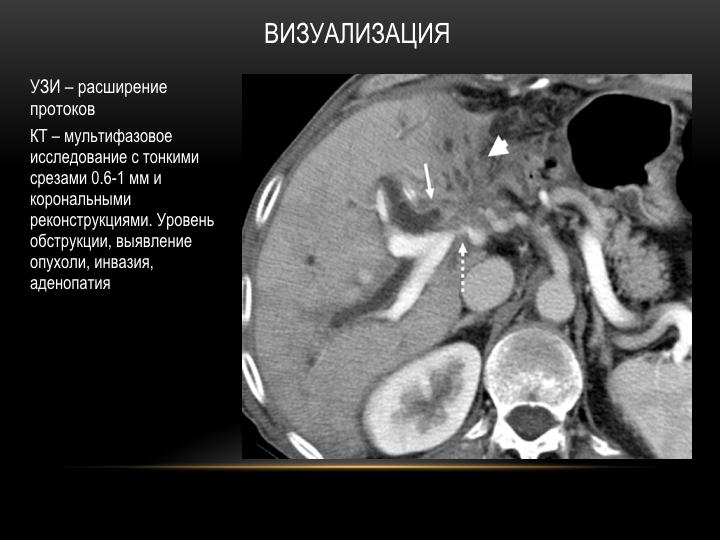
К счастью, методы лечения подобных тяжелых диагнозов, таких как эрозивный бульбит, все время развивается и совершенствуется. Один из таких новых методов лечения заключается в хирургическом удалении всей видимой опухоли из брюшной полости с последующим промыванием «горячей химиотерапией». Медицинским языком это называется «циторедуктивная операция» (ЦРО) и «гипертермическая интраперитонеальная химиотерапия» (hyperthermic intra-peritoneal chemotherapy).
Если объяснить все проще, то по сути это хирургическое удаление всех доступных (видимых) участков опухоли, а все остаточные раковые клетки затем уничтожается с помощью высокоактивной химиотерапии, которая заливается в брюшную полость, по сути это применение химиотерапии местно. Что примечательно, химический препарат подогревается до 41 градусов с помощью специального устройства, и таким образом повышается его эффективность и шанс уничтожить все раковые клетки. Благодаря такому комплексному подходу онкологи добиваются значительного увеличения продолжительности жизни и снижают риск рецидива болезни, и в некоторых случаях улучшается качество жизни пациента.
Так как HIPEC весьма агрессивная процедура, существует множество факторов, которые влияют на целесообразность применения этого протокола для каждого отдельного пациента. Именно поэтому проводить лечение должны профессионалы, специализирующие на этой процедуре, а подбирать мультидисциплинарный центр, авторизированный ее проводить, нужно доверить только компетентным медицинским координаторам.
Понятно, что HIPEC — вмешательство достаточно масштабное, длительность операции колоссальна (может занимать до 10 часов под общим наркозом) и даже само описание протокола выглядит пугающе — применяются токсичные препараты, хирургическая часть больше напоминает разбор конструктора, в процессе даже участвует электрический ток. Однако наш опыт показал, что применение HIPEC усложняет процесс восстановления после операции не критично, а долгосрочная польза для пациента очевидна – этот неоднозначный протокол может быть очень эффективным инструментом спасения жизни и здоровья даже в крайне тяжелых случаях. При этом добавление HIPEC к стандартному хирургическому лечению не приводило к росту уровня осложнений или числа смертей, связанных с проводимым лечением.
При этом добавление HIPEC к стандартному хирургическому лечению не приводило к росту уровня осложнений или числа смертей, связанных с проводимым лечением.
Для каких пациентов подходит?
HIPEC-лечение в настоящее время считается стандартом медицинской помощи во многих странах для пациентов с мезотелиомой, псевдомиксомой брюшины и пациентами с раком брюшины, первично вызванной колоректальной опухолью. Некоторые клинические центры также применяют HIPEC по другим показаниям, например, при канцероматозе брюшины при первичном раке желудка или яичников.
Видео, наглядно демонстрирующее применение HIPEC:
Ниже мы подготовили и перевели резюме исследования, которое было опубликовано в январе 2018 года в медицинском журнале The New England Journal of Medicine, результаты которого указывают на существенное повышение выживаемости пациенток с распространенным раком яичников, получавших лечение HIPEC. И по результатам, в среднем пациентки, получавшие лечение в сочетании с HIPEC, жили на 12 месяцев дольше, чем пациенты без проведения HIPEC.
И по результатам, в среднем пациентки, получавшие лечение в сочетании с HIPEC, жили на 12 месяцев дольше, чем пациенты без проведения HIPEC.
Исследование было проведено в Нидерландах доктором Виллемин ван Дрил и командой ученых, специализирующихся на данной проблеме. По словам онкохирурга доктора Игнаса де Хингх, президента Голландской группы по перитонеальной онкологии, это исследование является крупным шагом вперед в лечении рака яичников. «Это весьма обнадеживающий результат, и в настоящее время мы ищем способы внедрения данного метода лечения в голландскую систему здравоохранения».
Традиционно лечение впервые выявленного рака яичников на поздних стадиях обычно включает проведение циторедуктивной операции и системной химиотерапии. И данное исследование проводилось с целью понять, позволяет ли проведение гипертермической интраперитонеальной химиотерапии (HIPEC) в качестве дополнения к интервальной циторедуктивной операции улучшить прогнозы у пациенток, получающих неоадъювантную химиотерапию по поводу эпителиального рака яичников III стадии.
В рамках многоцентрового открытого исследования III фазы авторы рандомизировано разделили 245 пациенток (с достигнутой стабилизацией заболевания после трех циклов химиотерапии карбоплатином и паклитакселом) на проведение интервальной циторедуктивной операции с или без назначения HIPEC с применением цисплатина. Рандомизацию проводили непосредственно во время хирургического вмешательства в тех случаях, когда полагали, что в результате операции можно достичь отсутствия видимых проявлений заболевания (полная циторедукция) или сохранения лишь одного или нескольких остаточных опухолевых очагов размером 10 мм и менее в диаметре (оптимальная циторедукция). В послеоперационном периоде проводили три дополнительных цикла химиотерапии карбоплатином и паклитакселом. Первичной конечной точкой была безрецидивная выживаемость. Общая выживаемость и профиль побочных эффектов были ключевыми вторичными конечными точками.
Результаты
По результатам анализа всех включенных пациенток, рецидив заболевания или смерти были зарегистрированы у 110 из 123 (89%) пациенток с выполненной циторедуктивной операцией без HIPEC (группа хирургического вмешательства) и у 99 из 122 (81%) пациенток с выполненной циторедуктивной операцией в сочетании с HIPEC (группа хирургического вмешательства плюс HIPEC).
Медиана безрецидивной выживаемости составила 10,7 месяца в группе проведения хирургического вмешательства и 14,2 месяца в группе проведения хирургического вмешательства плюс HIPEC. При медиане последующего наблюдения 4,7 года умерли 76 (62%) пациенток из группы проведения хирургического вмешательства и 61 (50%) пациентка из группы проведения хирургического вмешательства плюс HIPEC. Медиана общей выживаемости составила 33,9 месяца в группе проведения хирургического вмешательства и 45,7 месяца в группе проведения хирургического вмешательства плюс HIPEC. Доли пациенток с нежелательными явлениями 3 или 4 степени тяжести были сходными в двух группах лечения (25% в группе проведения хирургического вмешательства и 27% в группе проведения хирургического вмешательства плюс HIPEC).
Выводы
У пациенток с эпителиальным раком яичников III стадии HIPEC в качестве дополнения к интервальной циторедуктивной операции способствовала достижению более длительной безрецидивной выживаемости и общей выживаемости по сравнению с проведением только лишь хирургического вмешательства и не приводила к повышению частоты развития побочных эффектов.
Эффективность
В процессе последующего наблюдения продолжительностью 4,7 года у 209 из 245 (85%) был зарегистрирован рецидив заболевания или смерть пациента; медиана безрецидивной выживаемости была длительнее на 3,5 месяца в группе проведения циторедуктивной операции в сочетании с HIPEC по сравнению с группой проведения только лишь хирургического вмешательства (14,2 месяца относительно 10,7 месяца).
Вероятность безрецидивной выживаемости спустя 3 года составила 8% в группе проведения хирургического вмешательства и 17% в группе проведения хирургического вмешательства плюс HIPEC.
Общая выживаемость составила 33,9 месяца в группе проведения хирургического вмешательства и 45,7 месяца в группе проведения хирургического вмешательства плюс HIPEC. Вероятность общей выживаемости спустя 3 года составила 48% в группе проведения хирургического и 62% в группе проведения хирургического вмешательства плюс HIPEC.
Безопасность и качество жизни
В целом у более чем у 95% пациенток из обеих групп возникло как минимум одно нежелательное явление вне зависимости от степени тяжести в период от момента рандомизации до 6-й недели после завершения последнего цикла химиотерапии. Но между двумя группами не было зарегистрировано значимых различий в частоте развития нежелательных явлений любой степени тяжести. Нежелательные явления 3 или 4 степени были зарегистрированы у 30 (25%) пациенток из группы проведения хирургического вмешательства и у 32 (27%) пациенток из группы проведения хирургического вмешательства плюс HIPEC. В обеих группах лечения самыми частыми нежелательными явлениями 3 или 4 степени тяжести были боль в животе, инфекция и кишечная непроходимость. В группе хирургического вмешательства был зарегистрирован один случай со смертельным исходом в пределах 30 дней после проведения операции.
Но между двумя группами не было зарегистрировано значимых различий в частоте развития нежелательных явлений любой степени тяжести. Нежелательные явления 3 или 4 степени были зарегистрированы у 30 (25%) пациенток из группы проведения хирургического вмешательства и у 32 (27%) пациенток из группы проведения хирургического вмешательства плюс HIPEC. В обеих группах лечения самыми частыми нежелательными явлениями 3 или 4 степени тяжести были боль в животе, инфекция и кишечная непроходимость. В группе хирургического вмешательства был зарегистрирован один случай со смертельным исходом в пределах 30 дней после проведения операции.
Резекция кишечника была выполнена 59 пациенткам: 30 пациенткам из группы проведения хирургического вмешательства и 29 пациенткам из группы проведения хирургического вмешательства плюс HIPEC. Среди пациенток с выполненной резекцией кишечника колостомию или илеостомию чаще проводили пациенткам из группы проведения хирургического вмешательства плюс HIPEC (21 из 29 [72%] пациенток), чем пациенткам из группы проведения хирургического вмешательства (13 из 30 [43%] пациенток).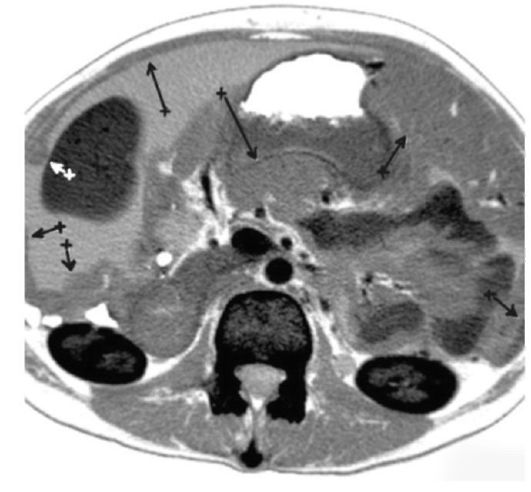
Общая длительность госпитализации составила 8 дней в группе проведения хирургического вмешательства и 10 дней в группе проведения хирургического вмешательства плюс HIPEC, включая 1 день пребывания в отделении реанимации и интенсивной терапии в соответствии с требованиями протокола. Период времени между завершением хирургического вмешательства и возобновлением химиотерапии после операции была сходной в двух группах (30 дней в группе проведения хирургического вмешательства и 33 дня в группе проведения хирургического вмешательства плюс HIPEC). Частота завершения всех трех циклов химиотерапии после хирургического вмешательства была также сходной в двух группах (90% в группе проведения хирургического вмешательства и 94% в группе проведения хирургического вмешательства плюс HIPEC соответственно).
Причина, симптомы, диагностика и лечение
Перитонеальный карциноматоз — это редкая форма рака, поражающая брюшину, тонкую оболочку, окружающую органы брюшной полости. Узнать, что он есть у вас или у вашего близкого человека, может быть сложно, и понимание этого рака может помочь вам почувствовать контроль над ситуацией.
Узнать, что он есть у вас или у вашего близкого человека, может быть сложно, и понимание этого рака может помочь вам почувствовать контроль над ситуацией.
Перитонеальный карциноматоз чаще всего развивается, когда другие абдоминальные опухоли распространяются на брюшину, приводя к множественным новым опухолям на поверхности этой оболочки. Если у вас перитонеальный карциноматоз, это обычно означает, что рак брюшной полости находится на поздней стадии.Бывают также очень редкие случаи первичного перитонеального карциноматоза, который начинается в самой брюшине. Эти случаи обычно случаются у женщин с высоким риском развития рака яичников.
Факторы риска перитонеального карциноматоза
Поскольку перитонеальный карциноматоз чаще всего развивается при распространении существующего рака, основным фактором риска являются другие распространенные виды рака, в том числе:
Первичный перитонеальный карциноматоз почти всегда встречается у женщин. Помимо пола, к другим факторам риска первичного карциноматоза брюшины относятся:
Симптомы карциноматоза брюшины
На ранних стадиях симптомы могут отсутствовать или у вас могут быть неясные симптомы, напоминающие другие состояния. На более поздних стадиях рак вызывает такие симптомы, как:
На более поздних стадиях рак вызывает такие симптомы, как:
Многие другие факторы могут вызывать эти проблемы.
Перитонеальный карциноматоз, возникающий в результате рака брюшной полости, может привести к асциту (накоплению жидкости в брюшине), что затем приводит к другим симптомам, таким как:
Как врачи диагностируют перитонеальный карциноматоз
вы можете пройти анализ крови, компьютерную томографию, МРТ или биопсию, чтобы подтвердить это. Иногда карциноматоз брюшины диагностируют во время операции по поводу другого рака, когда хирург замечает опухоли в брюшине.
Лечение карциноматоза брюшины
Поскольку карциноматоз брюшины обычно представляет собой запущенную форму инвазивного рака, который распространился из другой опухоли, его трудно лечить. Большинство опухолей перитонеального карциноматоза практически не уменьшаются или вообще не уменьшаются в ответ на химиотерапию. Из-за этого многие врачи сосредотачиваются на паллиативной помощи, чтобы справиться с симптомами, облегчить боль и улучшить качество жизни. Есть врачи, которые специализируются на паллиативной помощи, оказываемой всем, у кого серьезные заболевания.Уход в хосписе — это вариант, если заботы о конце жизни начинают становиться необходимостью.
Есть врачи, которые специализируются на паллиативной помощи, оказываемой всем, у кого серьезные заболевания.Уход в хосписе — это вариант, если заботы о конце жизни начинают становиться необходимостью.
В зависимости от вашего конкретного случая могут быть доступны и другие варианты лечения.
- Циторедуктивная хирургия. Хирург удаляет любые опухоли на брюшине и, в некоторых случаях, на близлежащих органах брюшной полости.
- Гипертермическая внутрибрюшинная химиотерапия . Часто используемый сразу после циторедуктивной хирургии, этот метод омывает внутреннюю часть вашего живота, где находится брюшина, горячими химиотерапевтическими препаратами, чтобы убить все оставшиеся раковые клетки.
- Перитонэктомия — это операция по удалению брюшины.
Рак брюшины | Кедры-Синай
Что такое рак брюшины?
Рак, который распространился на слизистую оболочку брюшной (брюшной) полости из-за рака яичников, первичного колоректального рака, рака аппендикса или мезотелиомы и псевдомиксомы брюшины, известных как перитонеальный карциноматоз, представляет собой рак, который часто называют раком брюшины. Независимо от того, начинается ли перитонеальный рак в брюшине или распространяется откуда-то еще (толстая кишка, аппендикс, яичник), он считается запущенным (стадия IV), если он находится в брюшине, и может называться перитонеальным карциноматозом.
Независимо от того, начинается ли перитонеальный рак в брюшине или распространяется откуда-то еще (толстая кишка, аппендикс, яичник), он считается запущенным (стадия IV), если он находится в брюшине, и может называться перитонеальным карциноматозом.
Кто подвержен риску рака брюшины?
Точно неизвестно, что вызывает рак брюшины, хотя процесс начинается, когда серия мутаций в клетках брюшины приводит к неконтролируемому росту. Это может быть связано с предыдущим раком, который теперь распространился на брюшину, или с другим типом рака, известным как первичный рак брюшины.
Как это лечится?
- В зависимости от типа опухоли вам может быть показана операция по удалению всей опухоли, известная как циторедукция, с последующей HIPEC. Этот метод, который сочетает хирургию с химиотерапией, произвел революцию в лечении рака абдоминальной (перитонеальной) оболочки, возникающего в результате рака толстой кишки, желудка, яичников и аппендикса, а также мезотелиомы и псевдомиксомы брюшины.
 HIPEC, по сути, представляет собой химиотерапевтическую «ванну», которая доставляет нагретую химиотерапию непосредственно в брюшную полость, где она проникает непосредственно в пораженную ткань.Этот целенаправленный контакт нагретого препарата убивает опухолевые узлы, что увеличивает абсорбцию химиотерапевтического раствора. Имеются существенные клинические доказательства того, что HIPEC является эффективным лечением пациентов с псевдомиксомой брюшины, муцинозной аденокарциномой аппендикса и мезотелиомой брюшины. Кроме того, перитонеальные метастазы рака толстой кишки можно успешно лечить у значительного числа пациентов.
HIPEC, по сути, представляет собой химиотерапевтическую «ванну», которая доставляет нагретую химиотерапию непосредственно в брюшную полость, где она проникает непосредственно в пораженную ткань.Этот целенаправленный контакт нагретого препарата убивает опухолевые узлы, что увеличивает абсорбцию химиотерапевтического раствора. Имеются существенные клинические доказательства того, что HIPEC является эффективным лечением пациентов с псевдомиксомой брюшины, муцинозной аденокарциномой аппендикса и мезотелиомой брюшины. Кроме того, перитонеальные метастазы рака толстой кишки можно успешно лечить у значительного числа пациентов. - В зависимости от типа опухоли вам может потребоваться внутривенная или пероральная химиотерапия до или после операции.Это будет определено вашей лечащей командой.
- Дополнительные методы лечения также могут быть использованы при лечении вашего конкретного типа опухоли. Таргетная терапия может использоваться для лечения некоторых запущенных форм первичной карциномы брюшины.
 Иногда препарат таргетной терапии комбинируют с химиотерапевтическим препаратом. Гормональная терапия может быть назначена в дополнение к химиотерапии для лечения распространенной первичной перитонеальной карциномы. Наконец, лучевая терапия иногда используется для лечения распространенной первичной или рецидивирующей карциномы брюшины.
Иногда препарат таргетной терапии комбинируют с химиотерапевтическим препаратом. Гормональная терапия может быть назначена в дополнение к химиотерапии для лечения распространенной первичной перитонеальной карциномы. Наконец, лучевая терапия иногда используется для лечения распространенной первичной или рецидивирующей карциномы брюшины.
Когда мне следует позвонить своему поставщику услуг?
Вам следует позвонить своему лечащему врачу, если у вас есть такие симптомы, как необъяснимая потеря веса, анорексия, боль в животе, вздутие живота, тошнота или рвота или изменения в работе кишечника.
Основные положения о раке брюшины
- Многие виды рака, которые лечат с помощью HIPEC, лечатся несколькими дисциплинами в медицине и хирургии. Важно, чтобы пациент обсудил HIPEC-терапию со своим онкологом и хирургом, которые могут правильно направить его терапию. HIPEC
- имеет ряд преимуществ перед стандартной химиотерапией:
- Это одна процедура, проводимая в операционной, вместо нескольких процедур в течение нескольких недель.

- 90% препарата остается в брюшной полости (непосредственно в области рака), уменьшая токсическое воздействие на остальные части тела.
- Позволяет проводить более интенсивную дозу химиотерапии.
- Это одна процедура, проводимая в операционной, вместо нескольких процедур в течение нескольких недель.
- Если операция невозможна из-за особенностей расположения опухолей и невозможности удаления всего видимого рака, мы будем работать с вами, чтобы порекомендовать другие варианты, которые могут включать таргетную терапию или иммунную терапию для персонализации вашего рака лечение.
© 2000-2021 The StayWell Company, LLC. Все права защищены. Эта информация не предназначена для замены профессиональной медицинской помощи. Всегда следуйте инструкциям своего лечащего врача.
Пределы диагностики и футляр для жидкой биопсии
Онкотаргет. 2017 27 июня; 8(26): 43481–43490.
James RW McMullen
1 Отделение фундаментальных наук, Центр медицинских диспропорций и молекулярной медицины, отделение биохимии, Медицинский центр Университета Лома Линда, Лома Линда, Калифорния, США
Мэтью Селлек
2 Отделение Хирургия, Отделение хирургической онкологии, Медицинский центр Университета Лома Линда, Лома Линда, Калифорния, США
Nathan R.
 Wall
Wall1 Отделение фундаментальных наук, Центр медицинских диспропорций и молекулярной медицины, отделение биохимии, Медицинский центр Университета Лома Линда, Лома Линда, Калифорния, США
Maheswari Senthil
2 Отделение хирургии, отделение Хирургическая онкология, Медицинский центр Университета Лома Линда, Лома Линда, Калифорния, США
1 Отделение фундаментальных наук, Центр медицинских диспропорций и молекулярной медицины, отделение биохимии, Медицинский центр Университета Лома Линда, Лома Линда, Калифорния, США
2 Отделение хирургии, отделение хирургической онкологии, Медицинский центр Университета Лома Линда, Лома Линда, Калифорния, США
Поступила в редакцию 21 января 2017 г.; Принято 15 марта 2017 г.
Эта статья распространяется в соответствии с лицензией Creative Commons Attribution License (CC-BY), которая разрешает неограниченное использование и распространение при условии указания автора и источника.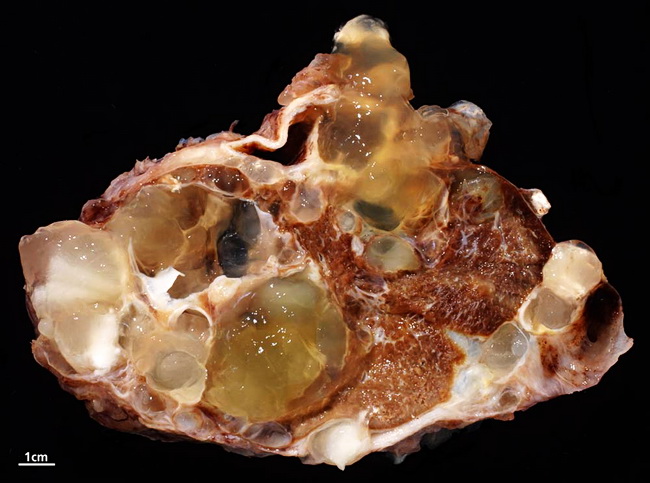 Эта статья цитируется в других статьях PMC.
Эта статья цитируется в других статьях PMC.Abstract
Карциноматоз брюшины (ПК) является поздней стадией проявления нескольких злокачественных новообразований желудочно-кишечного тракта, включая рак аппендикса, колоректальный рак и рак желудка. При РПЖ опухоли метастазируют и откладываются на поверхности брюшины, и у пациентов часто остается только паллиативное лечение.При колоректальном РПЖ медиана выживаемости составляет примерно пять месяцев, а паллиативная системная терапия может продлить ее примерно до 12 месяцев. Однако циторедуктивная хирургия с гипертермической внутрибрюшинной химиотерапией (CRS/HIPEC) с лечебной целью возможна у некоторых пациентов с ограниченной опухолевой массой. У хорошо отобранных пациентов, подвергшихся полной циторедукции, медиана выживаемости достигла 63 месяцев. Раннее выявление пациентов, которые либо находятся в группе риска, либо у которых недавно развился РПЖ, может предоставить им дополнительные варианты лечения, такие как CRS/HIPEC.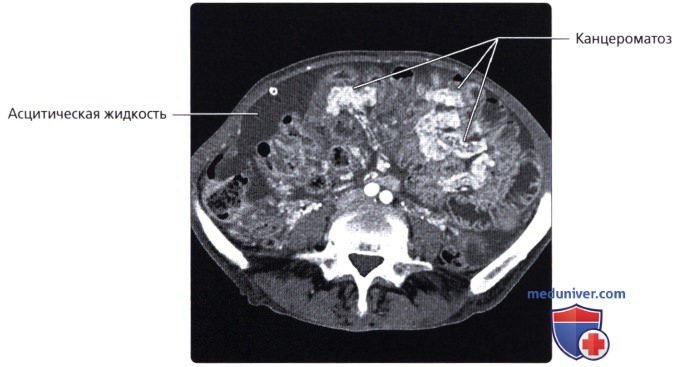 ПК диагностируется поздно по результатам визуализации или часто во время инвазивных процедур, таких как лапароскопия или лапаротомия. Чтобы улучшить результаты лечения пациентов с РПЖ, необходимо разработать минимально инвазивный, точный и специфический метод скрининга РПЖ. Используя циркулирующие биомаркеры ПК в сыворотке пациентов, можно получить «жидкую биопсию», чтобы обеспечить индивидуальный план лечения и раннее вмешательство. Экзосомы, стабильные нановезикулы, полученные от пациентов, присутствующие в крови, моче и многих других жидкостях организма, кажутся многообещающими в качестве инструмента для оценки лабильных биомаркеров.Если жидкие биопсии могут быть усовершенствованы при РПЖ, проявления этого рака можно будет лечить более эффективно, что обеспечит лучшую выживаемость.
ПК диагностируется поздно по результатам визуализации или часто во время инвазивных процедур, таких как лапароскопия или лапаротомия. Чтобы улучшить результаты лечения пациентов с РПЖ, необходимо разработать минимально инвазивный, точный и специфический метод скрининга РПЖ. Используя циркулирующие биомаркеры ПК в сыворотке пациентов, можно получить «жидкую биопсию», чтобы обеспечить индивидуальный план лечения и раннее вмешательство. Экзосомы, стабильные нановезикулы, полученные от пациентов, присутствующие в крови, моче и многих других жидкостях организма, кажутся многообещающими в качестве инструмента для оценки лабильных биомаркеров.Если жидкие биопсии могут быть усовершенствованы при РПЖ, проявления этого рака можно будет лечить более эффективно, что обеспечит лучшую выживаемость.
Ключевые слова: перитонеальный карциноматоз, жидкая биопсия, биомаркер, экзосомы
ВВЕДЕНИЕ
Перитонеальный карциноматоз (ПК) — поздняя стадия проявления ряда злокачественных новообразований желудочно-кишечного тракта, характеризующаяся диспозицией опухоли по всей поверхности брюшины [1].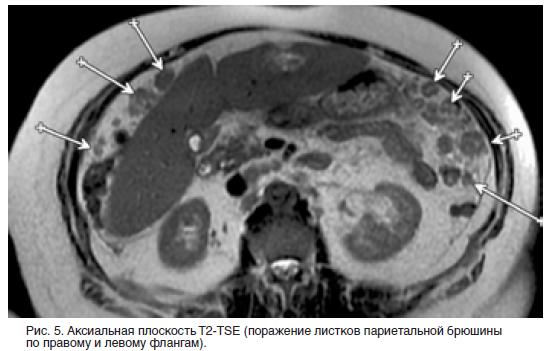 Это может быть полностью бессимптомным на ранних стадиях или по мере прогрессирования заболевания могут развиться такие симптомы, как тошнота, диарея, боль в животе, вздутие живота и потеря веса [1].Заболевание часто выявляют при развитии асцита или кишечной непроходимости, протекающих, как правило, при большей опухолевой массе, трудно поддающейся лечению [2]. Раннее выявление ПК при ограниченной опухолевой нагрузке может повысить эффективность существующих вариантов лечения [3].
Это может быть полностью бессимптомным на ранних стадиях или по мере прогрессирования заболевания могут развиться такие симптомы, как тошнота, диарея, боль в животе, вздутие живота и потеря веса [1].Заболевание часто выявляют при развитии асцита или кишечной непроходимости, протекающих, как правило, при большей опухолевой массе, трудно поддающейся лечению [2]. Раннее выявление ПК при ограниченной опухолевой нагрузке может повысить эффективность существующих вариантов лечения [3].
Колоректальный рак (КРР), третий по распространенности вид рака в мире, представляет собой хороший пример ПК. По оценкам, в 2016 году в США будет 95 270 случаев колоректального рака и почти 1.4 миллиона случаев по всему миру [4]. Синхронный РПЖ диагностируется примерно во время диагностики первичной опухоли, в то время как метахронный РПЖ диагностируется в более позднее время, обычно через несколько месяцев или лет после первоначального диагноза [5]. Частота синхронного изолированного карциноматоза брюшины у пациентов с КРР несколько варьирует в литературе от 4% до 18% [6-9]. Это может быть даже заниженной оценкой, учитывая недостаточную чувствительность визуализации для ПК и то, что она может быть не обнаружена до хирургического исследования. Между тем, метахронный РПЖ был зарегистрирован у 5-19% пациентов после окончательного лечения.
Это может быть даже заниженной оценкой, учитывая недостаточную чувствительность визуализации для ПК и то, что она может быть не обнаружена до хирургического исследования. Между тем, метахронный РПЖ был зарегистрирован у 5-19% пациентов после окончательного лечения.
ЦИТОРЕДУКТИВНАЯ ХИРУРГИЯ (CRS)
PC раньше считался смертельным заболеванием и не имел хирургического лечения. Однако растущее признание CRS с гипертермической внутрибрюшинной химиотерапией (HIPEC) дало возможность улучшить выживаемость для тщательно отобранных пациентов [3]. В этом методе используется «циторедукция» для хирургического удаления грубых видимых опухолевых отложений с последующим непосредственным контактом нагретых цитотоксических химиотерапевтических агентов для воздействия на любое остаточное заболевание.Этот протокол, применяемый во время операции, максимально увеличивает потенциальный контакт с поверхностью брюшины и сводит к минимуму системную токсичность. В частности, гипертермия между 41 и 43 градусами по Цельсию сочетается с препаратами с большой молекулярной массой, которые проникают между несколькими клетками на глубину до 3 мм, вызывая цитотоксические эффекты [10]. Доктору Полу Шугарбейкеру приписывают разработку этого варианта лечения путем объединения этих элементов в лечебный подход к перитонеальной диссеминации злокачественных новообразований желудочно-кишечного тракта [11, 12].Медиана выживаемости CRC PC без какого-либо лечения составляет примерно 4-7 месяцев, в то время как паллиативная системная терапия может увеличить этот срок до 12-23 месяцев на основе нескольких серий [13-15]. Сообщалось, что медиана общей выживаемости при CRS/HIPEC составляет от 22 до 63 месяцев с 5-летней выживаемостью 40-51% у отдельных пациентов [13, 15, 16]. На исходы CRS/HIPEC сильно влияют тщательный отбор пациентов и полная циторедукция (CC-0) (см. Таблицу) [17]. Выживаемость пациентов с колоректальным раком, которые не получают полной циторедукции (CC-1 или CC-2) или имеют более высокое бремя заболевания, на что указывает индекс перитонеального карциноматоза (PCI) (см. Резекция СС-0 [17–19].Обширное бремя болезни при выявлении часто оставляет пациентов только с паллиативными вариантами лечения [20].
Доктору Полу Шугарбейкеру приписывают разработку этого варианта лечения путем объединения этих элементов в лечебный подход к перитонеальной диссеминации злокачественных новообразований желудочно-кишечного тракта [11, 12].Медиана выживаемости CRC PC без какого-либо лечения составляет примерно 4-7 месяцев, в то время как паллиативная системная терапия может увеличить этот срок до 12-23 месяцев на основе нескольких серий [13-15]. Сообщалось, что медиана общей выживаемости при CRS/HIPEC составляет от 22 до 63 месяцев с 5-летней выживаемостью 40-51% у отдельных пациентов [13, 15, 16]. На исходы CRS/HIPEC сильно влияют тщательный отбор пациентов и полная циторедукция (CC-0) (см. Таблицу) [17]. Выживаемость пациентов с колоректальным раком, которые не получают полной циторедукции (CC-1 или CC-2) или имеют более высокое бремя заболевания, на что указывает индекс перитонеального карциноматоза (PCI) (см. Резекция СС-0 [17–19].Обширное бремя болезни при выявлении часто оставляет пациентов только с паллиативными вариантами лечения [20]. Несмотря на преимущество CRS/HIPEC, только около 25% пациентов с РПЖ будут иметь право на этот подход, учитывая позднее начало заболевания и тяжесть заболевания. Чтобы расширить список пациентов, отвечающих критериям, и предложить лечение с лечебной целью, важно раннее выявление РПЖ до того, как разовьется значительная опухолевая масса.
Несмотря на преимущество CRS/HIPEC, только около 25% пациентов с РПЖ будут иметь право на этот подход, учитывая позднее начало заболевания и тяжесть заболевания. Чтобы расширить список пациентов, отвечающих критериям, и предложить лечение с лечебной целью, важно раннее выявление РПЖ до того, как разовьется значительная опухолевая масса.
Таблица 1
6 Таблица 1CC является полнотой циторекции Оценка
| Комплектность баллов циторекции | | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Оценка | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Оценка | Размер наибольшей постхирургии Остаточная опухоль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
CC-0
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


.png) Возникают трудности с опорожнением кишечника, нередко запор сменяется поносом.
Возникают трудности с опорожнением кишечника, нередко запор сменяется поносом.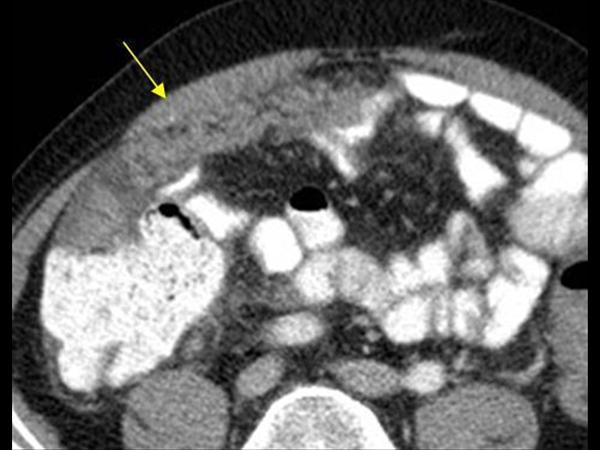 HIPEC, по сути, представляет собой химиотерапевтическую «ванну», которая доставляет нагретую химиотерапию непосредственно в брюшную полость, где она проникает непосредственно в пораженную ткань.Этот целенаправленный контакт нагретого препарата убивает опухолевые узлы, что увеличивает абсорбцию химиотерапевтического раствора. Имеются существенные клинические доказательства того, что HIPEC является эффективным лечением пациентов с псевдомиксомой брюшины, муцинозной аденокарциномой аппендикса и мезотелиомой брюшины. Кроме того, перитонеальные метастазы рака толстой кишки можно успешно лечить у значительного числа пациентов.
HIPEC, по сути, представляет собой химиотерапевтическую «ванну», которая доставляет нагретую химиотерапию непосредственно в брюшную полость, где она проникает непосредственно в пораженную ткань.Этот целенаправленный контакт нагретого препарата убивает опухолевые узлы, что увеличивает абсорбцию химиотерапевтического раствора. Имеются существенные клинические доказательства того, что HIPEC является эффективным лечением пациентов с псевдомиксомой брюшины, муцинозной аденокарциномой аппендикса и мезотелиомой брюшины. Кроме того, перитонеальные метастазы рака толстой кишки можно успешно лечить у значительного числа пациентов.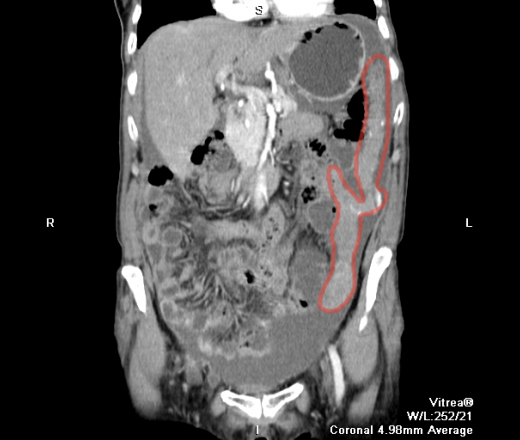 Иногда препарат таргетной терапии комбинируют с химиотерапевтическим препаратом. Гормональная терапия может быть назначена в дополнение к химиотерапии для лечения распространенной первичной перитонеальной карциномы. Наконец, лучевая терапия иногда используется для лечения распространенной первичной или рецидивирующей карциномы брюшины.
Иногда препарат таргетной терапии комбинируют с химиотерапевтическим препаратом. Гормональная терапия может быть назначена в дополнение к химиотерапии для лечения распространенной первичной перитонеальной карциномы. Наконец, лучевая терапия иногда используется для лечения распространенной первичной или рецидивирующей карциномы брюшины.
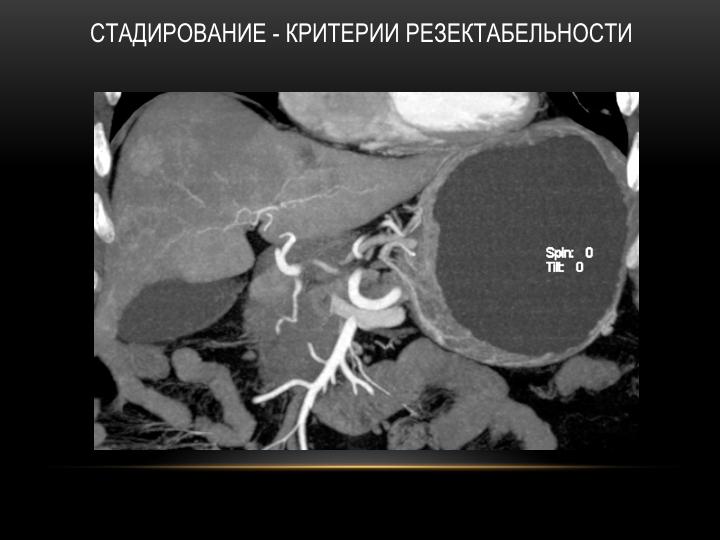 25 см
25 см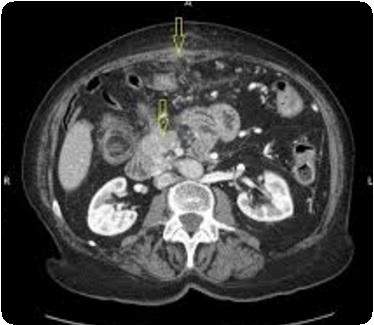 Классические компьютерно-томографические (КТ) признаки РПЖ, такие как «слипание сальника», утолщение сальника и перитонеальные узелки, не являются обычными рентгенологическими находками при «ранних» болезненных состояниях. Несколько исследований, направленных на определение специфичности и точности КТ при оценке опухолевой массы при РПЖ, показали, что КТ значительно недооценивает количество заболеваний, присутствующих в брюшной полости [21–24].Чувствительность КТ для обнаружения опухолевых узлов размером менее 0,5 см и 1 см составляет 11% и 25-50% соответственно [23]. Это особенно важно при колоректальном РПЖ, где ЧКВ является критическим фактором полной циторедукции и долгосрочных результатов [25]. В исследовании Koh et al., специально посвященном РПЖ при КРР, они определили, что КТ значительно занижает клиническое ЧКВ [23]. Фактически чувствительность поражения тонкой кишки в каждом регионе колебалась от 8 до 17%. Несмотря на это, Пятый международный семинар по злокачественным новообразованиям на поверхности брюшины в Милане определил КТ как основной метод визуализации для оценки пригодности для ХРС [26].
Классические компьютерно-томографические (КТ) признаки РПЖ, такие как «слипание сальника», утолщение сальника и перитонеальные узелки, не являются обычными рентгенологическими находками при «ранних» болезненных состояниях. Несколько исследований, направленных на определение специфичности и точности КТ при оценке опухолевой массы при РПЖ, показали, что КТ значительно недооценивает количество заболеваний, присутствующих в брюшной полости [21–24].Чувствительность КТ для обнаружения опухолевых узлов размером менее 0,5 см и 1 см составляет 11% и 25-50% соответственно [23]. Это особенно важно при колоректальном РПЖ, где ЧКВ является критическим фактором полной циторедукции и долгосрочных результатов [25]. В исследовании Koh et al., специально посвященном РПЖ при КРР, они определили, что КТ значительно занижает клиническое ЧКВ [23]. Фактически чувствительность поражения тонкой кишки в каждом регионе колебалась от 8 до 17%. Несмотря на это, Пятый международный семинар по злокачественным новообразованиям на поверхности брюшины в Милане определил КТ как основной метод визуализации для оценки пригодности для ХРС [26].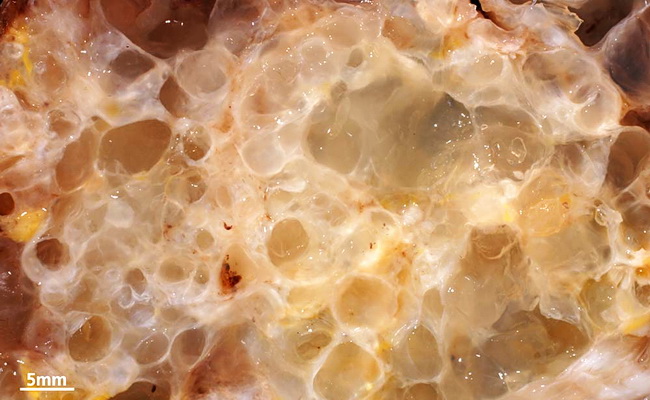 Ультразвук также имеет очень ограниченную чувствительность для обнаружения узлов РПЖ [27–29]. В проспективных исследованиях было показано, что магнитно-резонансная томография (МРТ) и, в частности, диффузионно-взвешенные изображения имеют повышенную точность обнаружения карциноматоза в определенных областях брюшной полости [30]. Однако это имеет свои ограничения из-за артефактов движения перистальтики, стоимости и необходимости в рентгенологах, обученных их интерпретации и различиям между наблюдателями. Кроме того, позитронно-эмиссионная технология (ПЭТ) может иметь повышенную чувствительность, но аналогичные ограничения и отсутствие дополнительной клинической ценности часто исключают ее использование для определения резектабельности [24, 31–33].Эти трудности, особенно ограниченная чувствительность, отсутствие значимой клинической корреляции и высокая стоимость, снижают полезность неинвазивной визуализации при раннем выявлении РПЖ. При современных технологиях часто необходима лапароскопия или диагностическая хирургия для подтверждения диагноза и степени РПЖ (см.
Ультразвук также имеет очень ограниченную чувствительность для обнаружения узлов РПЖ [27–29]. В проспективных исследованиях было показано, что магнитно-резонансная томография (МРТ) и, в частности, диффузионно-взвешенные изображения имеют повышенную точность обнаружения карциноматоза в определенных областях брюшной полости [30]. Однако это имеет свои ограничения из-за артефактов движения перистальтики, стоимости и необходимости в рентгенологах, обученных их интерпретации и различиям между наблюдателями. Кроме того, позитронно-эмиссионная технология (ПЭТ) может иметь повышенную чувствительность, но аналогичные ограничения и отсутствие дополнительной клинической ценности часто исключают ее использование для определения резектабельности [24, 31–33].Эти трудности, особенно ограниченная чувствительность, отсутствие значимой клинической корреляции и высокая стоимость, снижают полезность неинвазивной визуализации при раннем выявлении РПЖ. При современных технологиях часто необходима лапароскопия или диагностическая хирургия для подтверждения диагноза и степени РПЖ (см. Таблицу) [34].
Таблицу) [34].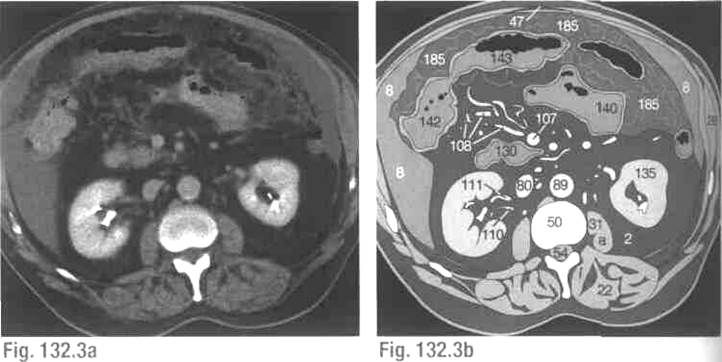 26]
26]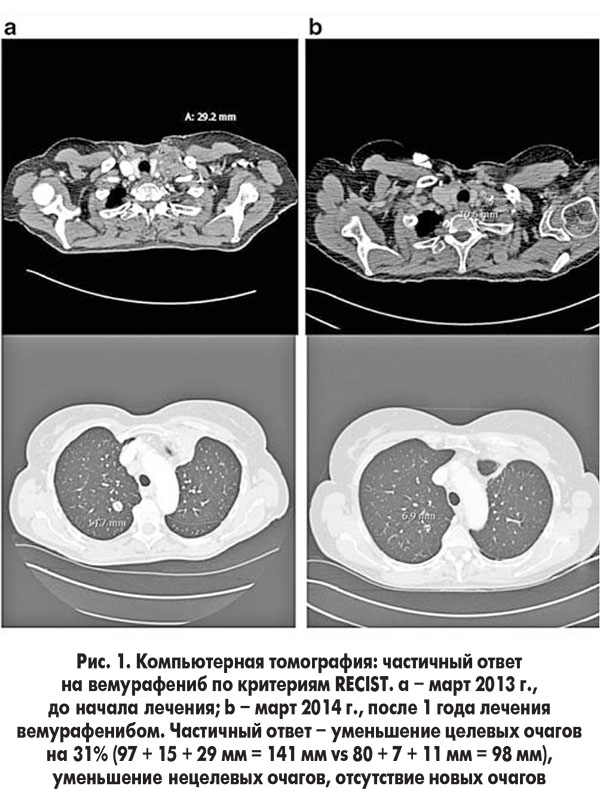 Пациенты, которые либо находятся в группе риска развития РПЖ, либо находятся на самой ранней стадии этого болезненного процесса, могут получить значительную пользу от расширенных вариантов лечения.Термин «жидкая биопсия» получил широкое распространение в связи с широкомасштабными исследованиями, направленными на выявление онкомаркеров в сыворотке. Обычно это относится к молекулярно-диагностическим исследованиям, которые проводятся на крови или биологических жидкостях, а не на самой раковой ткани [35]. Множественные сывороточные онкомаркеры: карциноэмбриональный антиген (СЕА), углеводный антиген СА 19-9 и СА 125 обычно повышены у пациентов с РПЖ, и степень повышения имеет тенденцию коррелировать со степенью РПЖ [36]. Однако эти сывороточные онкомаркеры недостаточны для раннего выявления РПЖ.Более того, им не хватает специфичности для прогнозирования наличия или риска РПЖ у пациентов с КРР. Существует острая клиническая потребность в идентификации циркулирующих опухолевых биомаркеров агрессивности, вероятности рецидива, риска метастазирования, такого как РПЖ, или даже наличия злокачественного новообразования, чтобы лучше адаптировать терапию для пациентов.
Пациенты, которые либо находятся в группе риска развития РПЖ, либо находятся на самой ранней стадии этого болезненного процесса, могут получить значительную пользу от расширенных вариантов лечения.Термин «жидкая биопсия» получил широкое распространение в связи с широкомасштабными исследованиями, направленными на выявление онкомаркеров в сыворотке. Обычно это относится к молекулярно-диагностическим исследованиям, которые проводятся на крови или биологических жидкостях, а не на самой раковой ткани [35]. Множественные сывороточные онкомаркеры: карциноэмбриональный антиген (СЕА), углеводный антиген СА 19-9 и СА 125 обычно повышены у пациентов с РПЖ, и степень повышения имеет тенденцию коррелировать со степенью РПЖ [36]. Однако эти сывороточные онкомаркеры недостаточны для раннего выявления РПЖ.Более того, им не хватает специфичности для прогнозирования наличия или риска РПЖ у пациентов с КРР. Существует острая клиническая потребность в идентификации циркулирующих опухолевых биомаркеров агрессивности, вероятности рецидива, риска метастазирования, такого как РПЖ, или даже наличия злокачественного новообразования, чтобы лучше адаптировать терапию для пациентов. Например, если известно, что пациент с недавно диагностированным колоректальным раком III стадии подвержен значительному риску перитонеального рецидива из-за наличия в его сыворотке определенного набора биомаркеров, ему может помочь профилактическая HIPEC.Это всего лишь один пример того, как может применяться эта технология.
Например, если известно, что пациент с недавно диагностированным колоректальным раком III стадии подвержен значительному риску перитонеального рецидива из-за наличия в его сыворотке определенного набора биомаркеров, ему может помочь профилактическая HIPEC.Это всего лишь один пример того, как может применяться эта технология. Однако эти микроРНК и другие типы РНК быстро деградируют в плазме [39–41].
Однако эти микроРНК и другие типы РНК быстро деградируют в плазме [39–41]. При исследовании рака яичников большее количество раковых экзосом было обнаружено в сыворотке по мере изучения более поздних стадий рака [52]. Кроме того, у пациентов с раком легкого было обнаружено примерно в четыре раза больше сывороточных экзосом по сравнению с контрольной группой без рака, а экзосомы содержали более чем в два раза больше миР [48]. В нашем исследовании мы обнаружили повышенные уровни экзосом в сыворотке у пациентов с раком предстательной железы и молочной железы по сравнению с контрольной группой без признаков заболевания [53–55]. TEX преобладают в сыворотке пациентов с несколькими типами рака и защищают лабильные биомаркеры от деградации [42, 45, 48, 53-55].
При исследовании рака яичников большее количество раковых экзосом было обнаружено в сыворотке по мере изучения более поздних стадий рака [52]. Кроме того, у пациентов с раком легкого было обнаружено примерно в четыре раза больше сывороточных экзосом по сравнению с контрольной группой без рака, а экзосомы содержали более чем в два раза больше миР [48]. В нашем исследовании мы обнаружили повышенные уровни экзосом в сыворотке у пациентов с раком предстательной железы и молочной железы по сравнению с контрольной группой без признаков заболевания [53–55]. TEX преобладают в сыворотке пациентов с несколькими типами рака и защищают лабильные биомаркеры от деградации [42, 45, 48, 53-55]. Андре и его коллеги исследовали экзосомы асцита у пациентов с РПЖ и обнаружили, что опухолеспецифические маркеры Her2/Neu, TRP1 и Mart1 присутствуют в экзосомах асцитной опухоли [56]. Tokuhisa и коллеги идентифицировали несколько РНК, присутствующих в экзосомах в перитонеальном асците, перитонеальном лаваже и метастатических клеточных линиях ПК [57]. После экзосомного скрининга miR были отобраны 5 miRNAs в качестве панели значительно дифференциально регулируемых РНК: miR 1202, 1207-5p, 1225-5p, 320c и 4270 [57]. miR 21 имела самую сильную интенсивность сигнала при злокачественном асците [57].Экзосомы из перитонеального лаважа исследовали на микроРНК 21, 1225-5p и 320c; Было обнаружено, что miR 21 и 1225-5p активируются на более поздних стадиях рака желудка и коррелируют с серозной инвазией [57]. В исследовании ткани первичного рака желудка miR 1255-5p в целом подавлялась, и было обнаружено, что она ингибирует рост раковых клеток, их подвижность, а также инвазию рака [58]. Этот явно противоречивый результат предполагает, что miR 1225-5p в перитонеальном лаваже либо высвобождается незлокачественной тканью в попытке остановить аномальный рост, либо используется раком для облегчения лучшего прикрепления к брюшине.
Андре и его коллеги исследовали экзосомы асцита у пациентов с РПЖ и обнаружили, что опухолеспецифические маркеры Her2/Neu, TRP1 и Mart1 присутствуют в экзосомах асцитной опухоли [56]. Tokuhisa и коллеги идентифицировали несколько РНК, присутствующих в экзосомах в перитонеальном асците, перитонеальном лаваже и метастатических клеточных линиях ПК [57]. После экзосомного скрининга miR были отобраны 5 miRNAs в качестве панели значительно дифференциально регулируемых РНК: miR 1202, 1207-5p, 1225-5p, 320c и 4270 [57]. miR 21 имела самую сильную интенсивность сигнала при злокачественном асците [57].Экзосомы из перитонеального лаважа исследовали на микроРНК 21, 1225-5p и 320c; Было обнаружено, что miR 21 и 1225-5p активируются на более поздних стадиях рака желудка и коррелируют с серозной инвазией [57]. В исследовании ткани первичного рака желудка miR 1255-5p в целом подавлялась, и было обнаружено, что она ингибирует рост раковых клеток, их подвижность, а также инвазию рака [58]. Этот явно противоречивый результат предполагает, что miR 1225-5p в перитонеальном лаваже либо высвобождается незлокачественной тканью в попытке остановить аномальный рост, либо используется раком для облегчения лучшего прикрепления к брюшине. Очевидно, результаты, противоречащие вышеприведенному исследованию, в клеточных линиях рака желудка и in vivo , miR 1255-5p, как правило, подавлялись, и было обнаружено, что они ингибируют рост и подвижность клеток, а также инвазию рака [58].
Очевидно, результаты, противоречащие вышеприведенному исследованию, в клеточных линиях рака желудка и in vivo , miR 1255-5p, как правило, подавлялись, и было обнаружено, что они ингибируют рост и подвижность клеток, а также инвазию рака [58]. Наблюдение, что эти миР, индивидуально или в группе, связаны с несколькими типами рака и обнаруживаются в экзосомах из брюшной полости, предполагает возможность экзосомальной диагностики РПЖ.
Наблюдение, что эти миР, индивидуально или в группе, связаны с несколькими типами рака и обнаруживаются в экзосомах из брюшной полости, предполагает возможность экзосомальной диагностики РПЖ.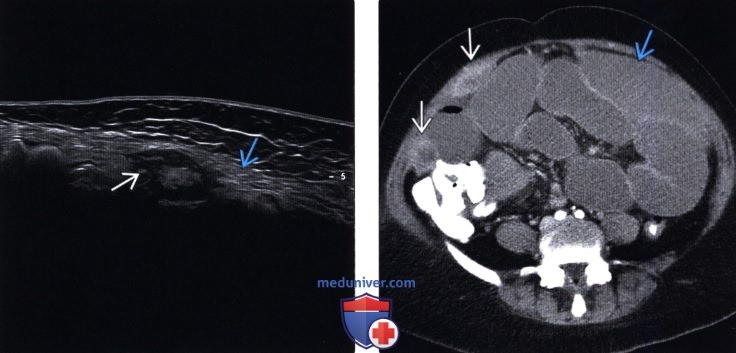 Повышенная экспрессия РНК и миР, вероятно, связана с ростом и функцией рака или реакцией организма на рак. miR 320c ингибирует рост и подвижность клеток при раке мочевого пузыря [60]. miR 1207-5p функционировала для ингибирования роста и инвазии клеток при раке печени, но увеличивала стволовость при колоректальном раке [61, 63]. Поскольку эти ассоциированные с экзосомами миР имеют известные функции в опухолях, появляется возможность адаптировать лечение РПЖ на основе того, какие биомаркеры обнаружены в экзосомах пациента.miR 320c ингибировала рост и подвижность клеток, а miR 1207-5p функционировала, ингибируя рост и инвазию клеток. Наблюдение, что эти ассоциированные с экзосомами miR имеют известные функции в опухолях, открывает возможность использования этих биомаркеров для индивидуального лечения пациентов. [60, 61]
Повышенная экспрессия РНК и миР, вероятно, связана с ростом и функцией рака или реакцией организма на рак. miR 320c ингибирует рост и подвижность клеток при раке мочевого пузыря [60]. miR 1207-5p функционировала для ингибирования роста и инвазии клеток при раке печени, но увеличивала стволовость при колоректальном раке [61, 63]. Поскольку эти ассоциированные с экзосомами миР имеют известные функции в опухолях, появляется возможность адаптировать лечение РПЖ на основе того, какие биомаркеры обнаружены в экзосомах пациента.miR 320c ингибировала рост и подвижность клеток, а miR 1207-5p функционировала, ингибируя рост и инвазию клеток. Наблюдение, что эти ассоциированные с экзосомами miR имеют известные функции в опухолях, открывает возможность использования этих биомаркеров для индивидуального лечения пациентов. [60, 61] Поскольку мы смотрим на экзосомы, чтобы получить представление об этой области, необходимо будет решить общие проблемы выделения и проверки нановезикул. Для клинического использования необходимо разработать надежные и эффективные методы, а также признанные стандарты. Будущая клиническая работа в этой области должна включать проспективный сбор образцов для ретроспективного исследования. Это будет способствовать установлению клинической достоверности и полезности. Мы надеемся, что совместная работа многих и впредь будет приносить успехи в уменьшении бремени человеческих жизней, потерянных из-за этой агрессивной болезни.
Поскольку мы смотрим на экзосомы, чтобы получить представление об этой области, необходимо будет решить общие проблемы выделения и проверки нановезикул. Для клинического использования необходимо разработать надежные и эффективные методы, а также признанные стандарты. Будущая клиническая работа в этой области должна включать проспективный сбор образцов для ретроспективного исследования. Это будет способствовать установлению клинической достоверности и полезности. Мы надеемся, что совместная работа многих и впредь будет приносить успехи в уменьшении бремени человеческих жизней, потерянных из-за этой агрессивной болезни. Кроме того, TEX продемонстрировали способность значительно увеличивать метастатическую опухоль в мышиной модели [64].Изучение TEX в контексте метастазирования является многообещающей областью. PC в настоящее время трудно обнаружить в начале. Позднее выявление РПЖ обычно оставляет болезнь неизлечимой. PC должен быть обнаружен раньше для улучшения результатов лечения пациентов. Неинвазивная визуализация нецелесообразна для раннего выявления РПЖ. Обнаружение PC с помощью маркеров в биологических жидкостях пациента, таких как «жидкая биопсия» сыворотки, было бы идеальным. И сыворотка, и асцит содержат биомаркеры, высвобождаемые PC. Экзосомы высвобождаются в сыворотку несколькими типами рака и защищают свое содержимое от деградации в крови.Это дает нам вероятный источник чувствительного и специфического диагностического метода для выявления РПЖ на самых ранних и наиболее поддающихся лечению стадиях.
Кроме того, TEX продемонстрировали способность значительно увеличивать метастатическую опухоль в мышиной модели [64].Изучение TEX в контексте метастазирования является многообещающей областью. PC в настоящее время трудно обнаружить в начале. Позднее выявление РПЖ обычно оставляет болезнь неизлечимой. PC должен быть обнаружен раньше для улучшения результатов лечения пациентов. Неинвазивная визуализация нецелесообразна для раннего выявления РПЖ. Обнаружение PC с помощью маркеров в биологических жидкостях пациента, таких как «жидкая биопсия» сыворотки, было бы идеальным. И сыворотка, и асцит содержат биомаркеры, высвобождаемые PC. Экзосомы высвобождаются в сыворотку несколькими типами рака и защищают свое содержимое от деградации в крови.Это дает нам вероятный источник чувствительного и специфического диагностического метода для выявления РПЖ на самых ранних и наиболее поддающихся лечению стадиях.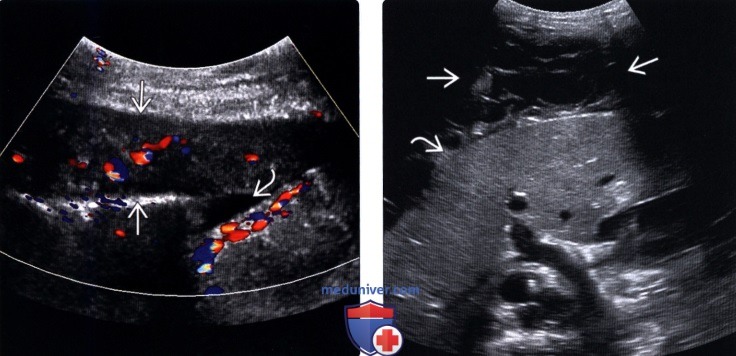 Они также хотели бы поблагодарить сотрудников Лаборатории Стены за тщательное рассмотрение этой рукописи.
Они также хотели бы поблагодарить сотрудников Лаборатории Стены за тщательное рассмотрение этой рукописи.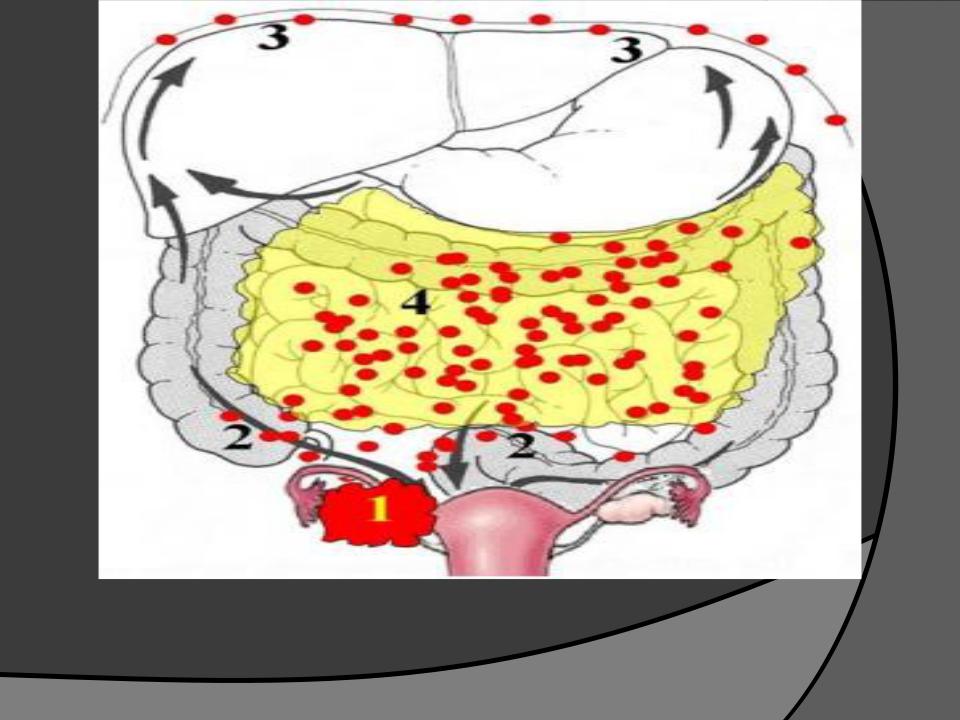 Chia CS, You B, Decullier E, Vaudoyer D, Lorimier G, Abboud K, Bereder JM, Arvieux C, Boschetti G, Glehen O, группа tBIGR Пациенты с перитонеальным карциноматозом от рака желудка, пролеченные с помощью циторедуктивной хирургии и гипертермической внутрибрюшинной химиотерапии: вылечено Возможность? Анналы хирургической онкологии.2016: 1–9. doi: 10.1245/s10434-015-5081-3. [PubMed] [CrossRef] [Google Scholar]4. Сигел Р.Л., Миллер К.Д., Джемал А. Статистика рака, 2016. CA Cancer J Clin. 2016;66:7–30. doi: 10.3322/caac.21332. [PubMed] [CrossRef] [Google Scholar]5. Мекенкамп Л.Дж., Купман М., Тиренстра С., ван Крикен Дж.Х., Мол Л., Нагтегаал И.Д., Пунт С.Дж. Клинико-патологические особенности и исходы у пациентов с распространенным колоректальным раком с синхронными и метахронными метастазами. Бр Дж Рак. 2010 (103): 159–64. doi: 10.1038/sj.bjc.6605737.[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]6. Klaver YL, Lemmens VE, Nienhuijs SW, Luyer MD, de Hingh IH. Перитонеальный карциноматоз колоректального происхождения: заболеваемость, прогноз и варианты лечения.
Chia CS, You B, Decullier E, Vaudoyer D, Lorimier G, Abboud K, Bereder JM, Arvieux C, Boschetti G, Glehen O, группа tBIGR Пациенты с перитонеальным карциноматозом от рака желудка, пролеченные с помощью циторедуктивной хирургии и гипертермической внутрибрюшинной химиотерапии: вылечено Возможность? Анналы хирургической онкологии.2016: 1–9. doi: 10.1245/s10434-015-5081-3. [PubMed] [CrossRef] [Google Scholar]4. Сигел Р.Л., Миллер К.Д., Джемал А. Статистика рака, 2016. CA Cancer J Clin. 2016;66:7–30. doi: 10.3322/caac.21332. [PubMed] [CrossRef] [Google Scholar]5. Мекенкамп Л.Дж., Купман М., Тиренстра С., ван Крикен Дж.Х., Мол Л., Нагтегаал И.Д., Пунт С.Дж. Клинико-патологические особенности и исходы у пациентов с распространенным колоректальным раком с синхронными и метахронными метастазами. Бр Дж Рак. 2010 (103): 159–64. doi: 10.1038/sj.bjc.6605737.[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]6. Klaver YL, Lemmens VE, Nienhuijs SW, Luyer MD, de Hingh IH. Перитонеальный карциноматоз колоректального происхождения: заболеваемость, прогноз и варианты лечения. Всемирный журнал гастроэнтерологии. 2012;18:5489–94. doi: 10.3748/wjg.v18.i39.5489. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]7. Клавер К.Э., Мустерс Г.Д., Бемельман В.А., Пунт С.Дж., Вервал В.Дж., Дийкграаф М.Г., Алберс А.Г., ван дер Билт Д.Д., Боерма Д., Бремерс А.Дж., Бургер Д.В., Бускенс К.Дж., Эверс П. и др.Адъювантная гипертермическая внутрибрюшинная химиотерапия (HIPEC) у больных раком толстой кишки с высоким риском перитонеального карциноматоза; рандомизированное многоцентровое исследование COLOPEC. БМК Рак. 2015:15. doi: 10.1186/s12885-015-1430-7. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]8. Митри Э., Гиу Б., Косконеа С., Джуст В., Фавр Дж., Бувье А.М. Эпидемиология, лечение и прогноз колоректального рака с метастазами в легкие: 30-летнее популяционное исследование. Кишка. 2010;59:1383–8. doi: 10.1136/кишка.2010.211557. [PubMed] [CrossRef] [Google Scholar]9. Quere P, Facy O, Manfredi S, Jooste V, Faivre J, Lepage C, Bouvier AM. Эпидемиология, лечение и выживание перитонеального карциноматоза от колоректального рака: популяционное исследование.
Всемирный журнал гастроэнтерологии. 2012;18:5489–94. doi: 10.3748/wjg.v18.i39.5489. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]7. Клавер К.Э., Мустерс Г.Д., Бемельман В.А., Пунт С.Дж., Вервал В.Дж., Дийкграаф М.Г., Алберс А.Г., ван дер Билт Д.Д., Боерма Д., Бремерс А.Дж., Бургер Д.В., Бускенс К.Дж., Эверс П. и др.Адъювантная гипертермическая внутрибрюшинная химиотерапия (HIPEC) у больных раком толстой кишки с высоким риском перитонеального карциноматоза; рандомизированное многоцентровое исследование COLOPEC. БМК Рак. 2015:15. doi: 10.1186/s12885-015-1430-7. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]8. Митри Э., Гиу Б., Косконеа С., Джуст В., Фавр Дж., Бувье А.М. Эпидемиология, лечение и прогноз колоректального рака с метастазами в легкие: 30-летнее популяционное исследование. Кишка. 2010;59:1383–8. doi: 10.1136/кишка.2010.211557. [PubMed] [CrossRef] [Google Scholar]9. Quere P, Facy O, Manfredi S, Jooste V, Faivre J, Lepage C, Bouvier AM. Эпидемиология, лечение и выживание перитонеального карциноматоза от колоректального рака: популяционное исследование. Заболевания толстой и прямой кишки. 2015;58:743–52. doi: 10.1097/DCR.0000000000000412. [PubMed] [CrossRef] [Google Scholar] 10. Yan TD, Cao CQ, Munkholm-Larsen S. Фармакологический обзор внутрибрюшинной химиотерапии при злокачественных новообразованиях брюшины. World J Gastrointest Oncol.2010;2:109–16. doi: 10.4251/wjgo.v2.i2.109. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]11. Гудман М.Д., МакПартланд С., Детелич Д., Саиф М.В. Химиотерапия для внутрибрюшинного применения: обзор гипертермической внутрибрюшинной химиотерапии и ранней послеоперационной внутрибрюшинной химиотерапии. J Гастроинтест Онкол. 2016;7:45–57. doi: 10.3978/j.issn.2078-6891.2015.111. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]12. Sugarbaker PH, Kern K, Lack E. Злокачественная псевдомиксома брюшины толстокишечного происхождения.Естественная история и презентация лечебного подхода к лечению. Расстройство прямой кишки. 1987; 30: 772–9. [PubMed] [Google Scholar] 13. Elias D, Lefevre JH, Chevalier J, Brouquet A, Marchal F, Classe JM, Ferron G, Guilloit JM, Meeus P, Goéré D, Bonastre J.
Заболевания толстой и прямой кишки. 2015;58:743–52. doi: 10.1097/DCR.0000000000000412. [PubMed] [CrossRef] [Google Scholar] 10. Yan TD, Cao CQ, Munkholm-Larsen S. Фармакологический обзор внутрибрюшинной химиотерапии при злокачественных новообразованиях брюшины. World J Gastrointest Oncol.2010;2:109–16. doi: 10.4251/wjgo.v2.i2.109. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]11. Гудман М.Д., МакПартланд С., Детелич Д., Саиф М.В. Химиотерапия для внутрибрюшинного применения: обзор гипертермической внутрибрюшинной химиотерапии и ранней послеоперационной внутрибрюшинной химиотерапии. J Гастроинтест Онкол. 2016;7:45–57. doi: 10.3978/j.issn.2078-6891.2015.111. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]12. Sugarbaker PH, Kern K, Lack E. Злокачественная псевдомиксома брюшины толстокишечного происхождения.Естественная история и презентация лечебного подхода к лечению. Расстройство прямой кишки. 1987; 30: 772–9. [PubMed] [Google Scholar] 13. Elias D, Lefevre JH, Chevalier J, Brouquet A, Marchal F, Classe JM, Ferron G, Guilloit JM, Meeus P, Goéré D, Bonastre J.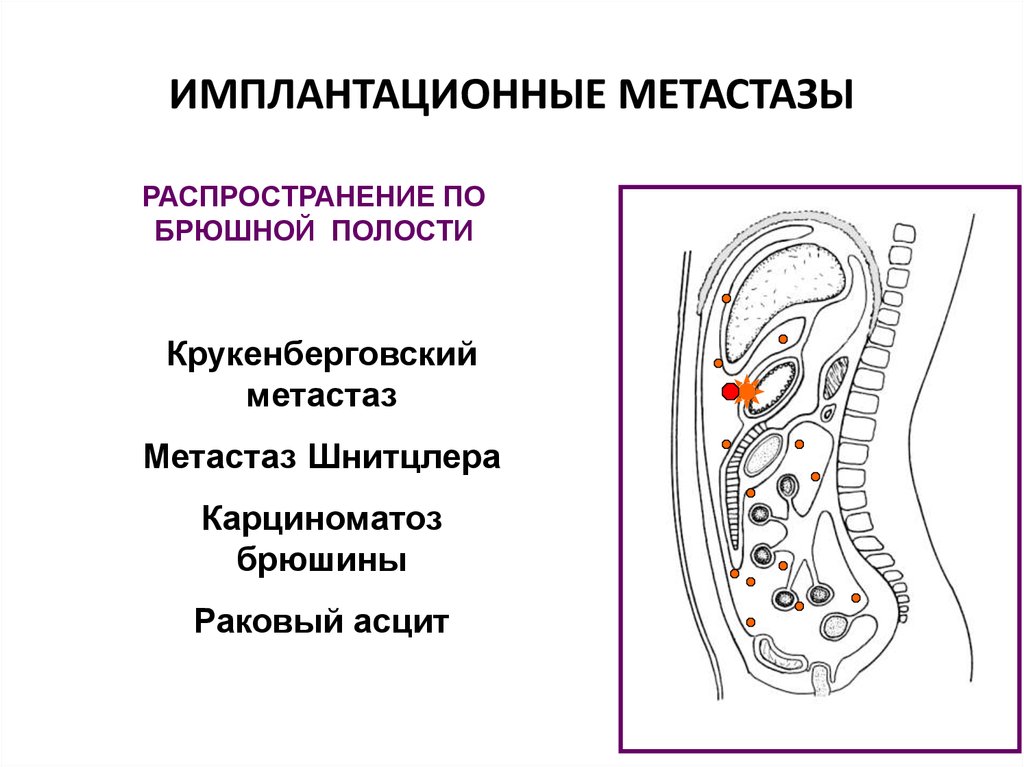 Полная циторедуктивная хирургия плюс внутрибрюшинная химиогипертермия с оксалиплатином при перитонеальном карциноматозе колоректального происхождения. Журнал клинической онкологии. 2009; 27: 681–5. doi: 10.1200/JCO.2008.19.7160. [PubMed] [CrossRef] [Google Scholar] 14.Franko J, Shi Q, Goldman CD, Pockaj BA, Nelson GD, Goldberg RM, Pitot HC, Grothey A, Alberts SR, Sargent DJ. Лечение колоректального перитонеального карциноматоза с помощью системной химиотерапии: объединенный анализ испытаний фазы III северной центральной группы лечения рака N9741 и N9841. Журнал клинической онкологии. 2012;30:263–7. doi: 10.1200/JCO.2011.37.1039. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]15. Вервал В.Дж., ван Рут С., де Бри Э., ван Слоутен Г.В., ван Тинтерен Х., Бут Х., Зутмалдер Ф.А.Рандомизированное исследование циторедукции и гипертермической внутрибрюшинной химиотерапии по сравнению с системной химиотерапией и паллиативной хирургией у пациентов с перитонеальным карциноматозом колоректального рака.
Полная циторедуктивная хирургия плюс внутрибрюшинная химиогипертермия с оксалиплатином при перитонеальном карциноматозе колоректального происхождения. Журнал клинической онкологии. 2009; 27: 681–5. doi: 10.1200/JCO.2008.19.7160. [PubMed] [CrossRef] [Google Scholar] 14.Franko J, Shi Q, Goldman CD, Pockaj BA, Nelson GD, Goldberg RM, Pitot HC, Grothey A, Alberts SR, Sargent DJ. Лечение колоректального перитонеального карциноматоза с помощью системной химиотерапии: объединенный анализ испытаний фазы III северной центральной группы лечения рака N9741 и N9841. Журнал клинической онкологии. 2012;30:263–7. doi: 10.1200/JCO.2011.37.1039. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]15. Вервал В.Дж., ван Рут С., де Бри Э., ван Слоутен Г.В., ван Тинтерен Х., Бут Х., Зутмалдер Ф.А.Рандомизированное исследование циторедукции и гипертермической внутрибрюшинной химиотерапии по сравнению с системной химиотерапией и паллиативной хирургией у пациентов с перитонеальным карциноматозом колоректального рака. Журнал клинической онкологии. 2003; 21: 3737–43. doi: 10.1200/JCO.2003.04.187. [PubMed] [CrossRef] [Google Scholar] 16. Чуа ТК. Прогресс в комбинированном лечении карциноматоза брюшины. Журнал хирургической онкологии. 2010;102:728–9. doi: 10.1002/jso.21748. [PubMed] [CrossRef] [Google Scholar] 17.Шугарбейкер РН. Успешное лечение микроскопической остаточной болезни при раке толстой кишки. Химиотерапия рака и фармакология. 1999;43:С15–С25. doi: 10.1007/s002800051093. [PubMed] [CrossRef] [Google Scholar] 18. Хармон Р.Л., Шугарбейкер Р.Х. Прогностические показатели при карциноматозе брюшины от рака желудочно-кишечного тракта. Международные семинары по хирургической онкологии. 2005; 2:3. doi: 10.1186/1477-7800-2-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]19. Вервал В.Дж., ван Рут С., Виткамп А., Бут Х., ван Слоотен Г., Зутмалдер Ф.А.Долгосрочное выживание перитонеального карциноматоза колоректального происхождения. Анналы хирургической онкологии. 2004; 12:65–71. doi: 10.
Журнал клинической онкологии. 2003; 21: 3737–43. doi: 10.1200/JCO.2003.04.187. [PubMed] [CrossRef] [Google Scholar] 16. Чуа ТК. Прогресс в комбинированном лечении карциноматоза брюшины. Журнал хирургической онкологии. 2010;102:728–9. doi: 10.1002/jso.21748. [PubMed] [CrossRef] [Google Scholar] 17.Шугарбейкер РН. Успешное лечение микроскопической остаточной болезни при раке толстой кишки. Химиотерапия рака и фармакология. 1999;43:С15–С25. doi: 10.1007/s002800051093. [PubMed] [CrossRef] [Google Scholar] 18. Хармон Р.Л., Шугарбейкер Р.Х. Прогностические показатели при карциноматозе брюшины от рака желудочно-кишечного тракта. Международные семинары по хирургической онкологии. 2005; 2:3. doi: 10.1186/1477-7800-2-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]19. Вервал В.Дж., ван Рут С., Виткамп А., Бут Х., ван Слоотен Г., Зутмалдер Ф.А.Долгосрочное выживание перитонеального карциноматоза колоректального происхождения. Анналы хирургической онкологии. 2004; 12:65–71. doi: 10. 1007/s10434-004-1167-z. [PubMed] [CrossRef] [Google Scholar] 20. Verwaal VJ, Kusamura S, Baratti D, Deraco M. Право на местно-региональное лечение злокачественных новообразований на поверхности брюшины. Журнал хирургической онкологии. 2008; 98: 220–3. doi: 10.1002/jso.21060. [PubMed] [CrossRef] [Google Scholar] 21. Дромейн К., Лебулле С., Оперин А., Гере Д., Малка Д., Лумброзо Дж., Шумбергер М., Сигал Р., Элиас Д.Стадирование перитонеального карциноматоза: усиленная КТ по сравнению с ПЭТ/КТ. Абдоминальная визуализация. 2007; 33:87–93. doi: 10.1007/s00261-007-9211-7. [PubMed] [CrossRef] [Google Scholar] 22. Esquivel J, Chua TC, Stojadinovic A, Melero JT, Levine EA, Gutman M, Howard R, Piso P, Nissan A, Gomez-Portilla A, Gonzalez-Bayon L, Gonzalez-Moreno S, Shen P, et al. Точность и клиническая значимость компьютерно-томографической интерпретации индекса рака брюшины при колоректальном раке, перитонеальном карциноматозе: многоцентровое исследование.Журнал хирургической онкологии. 2010; 102: 565–70.
1007/s10434-004-1167-z. [PubMed] [CrossRef] [Google Scholar] 20. Verwaal VJ, Kusamura S, Baratti D, Deraco M. Право на местно-региональное лечение злокачественных новообразований на поверхности брюшины. Журнал хирургической онкологии. 2008; 98: 220–3. doi: 10.1002/jso.21060. [PubMed] [CrossRef] [Google Scholar] 21. Дромейн К., Лебулле С., Оперин А., Гере Д., Малка Д., Лумброзо Дж., Шумбергер М., Сигал Р., Элиас Д.Стадирование перитонеального карциноматоза: усиленная КТ по сравнению с ПЭТ/КТ. Абдоминальная визуализация. 2007; 33:87–93. doi: 10.1007/s00261-007-9211-7. [PubMed] [CrossRef] [Google Scholar] 22. Esquivel J, Chua TC, Stojadinovic A, Melero JT, Levine EA, Gutman M, Howard R, Piso P, Nissan A, Gomez-Portilla A, Gonzalez-Bayon L, Gonzalez-Moreno S, Shen P, et al. Точность и клиническая значимость компьютерно-томографической интерпретации индекса рака брюшины при колоректальном раке, перитонеальном карциноматозе: многоцентровое исследование.Журнал хирургической онкологии. 2010; 102: 565–70.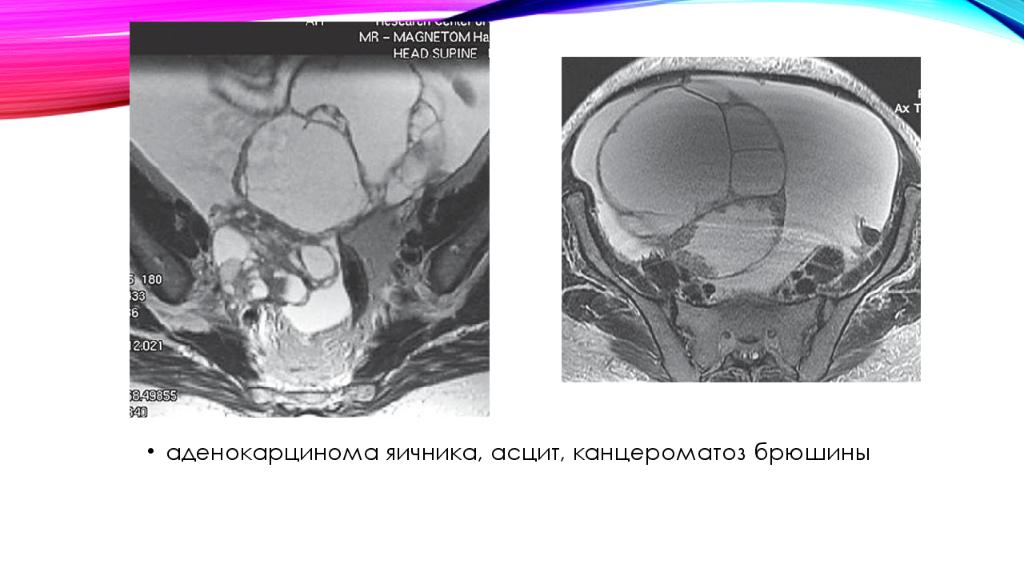 doi: 10.1002/jso.21601. [PubMed] [CrossRef] [Google Scholar] 23. Кох Дж.Л., Ян Т.Д., Гленн Д., Моррис Д.Л. Оценка предоперационной компьютерной томографии в оценке индекса перитонеального рака при колоректальном перитонеальном карциноматозе. Анналы хирургической онкологии. 2008; 16: 327–33. doi: 10.1245/s10434-008-0234-2. [PubMed] [CrossRef] [Google Scholar] 24. Low RN, Barone RM, Lucero J. Сравнение МРТ и КТ для прогнозирования индекса перитонеального рака (PCI) до операции у пациентов, которым рассматриваются циторедуктивные хирургические процедуры.Анналы хирургической онкологии. 2015; 22:1708–15. doi: 10.1245/s10434-014-4041-7. [PubMed] [CrossRef] [Google Scholar] 25. да Силва Р.Г., Sugarbaker PH. Анализ прогностических факторов у семидесяти пациентов, перенесших полную циторедукцию плюс периоперационную внутрибрюшинную химиотерапию по поводу карциноматоза колоректального рака. J Am Coll Surg. 2006; 203: 878–86. doi: 10.1016/j.jamcollsurg.2006.08.024. [PubMed] [CrossRef] [Google Scholar] 26.
doi: 10.1002/jso.21601. [PubMed] [CrossRef] [Google Scholar] 23. Кох Дж.Л., Ян Т.Д., Гленн Д., Моррис Д.Л. Оценка предоперационной компьютерной томографии в оценке индекса перитонеального рака при колоректальном перитонеальном карциноматозе. Анналы хирургической онкологии. 2008; 16: 327–33. doi: 10.1245/s10434-008-0234-2. [PubMed] [CrossRef] [Google Scholar] 24. Low RN, Barone RM, Lucero J. Сравнение МРТ и КТ для прогнозирования индекса перитонеального рака (PCI) до операции у пациентов, которым рассматриваются циторедуктивные хирургические процедуры.Анналы хирургической онкологии. 2015; 22:1708–15. doi: 10.1245/s10434-014-4041-7. [PubMed] [CrossRef] [Google Scholar] 25. да Силва Р.Г., Sugarbaker PH. Анализ прогностических факторов у семидесяти пациентов, перенесших полную циторедукцию плюс периоперационную внутрибрюшинную химиотерапию по поводу карциноматоза колоректального рака. J Am Coll Surg. 2006; 203: 878–86. doi: 10.1016/j.jamcollsurg.2006.08.024. [PubMed] [CrossRef] [Google Scholar] 26.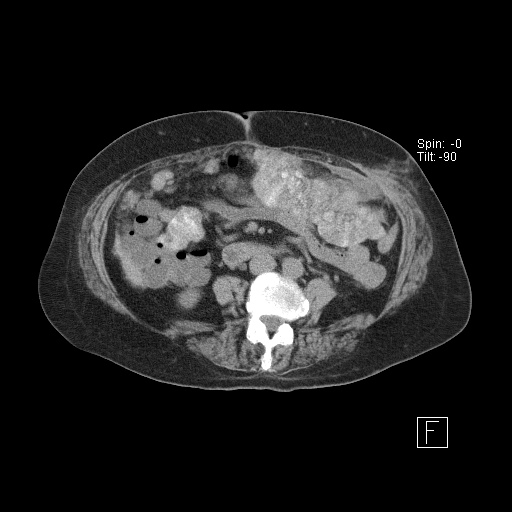 Баратти Д., Кусамура С., Дерако М. Пятый международный семинар по злокачественным новообразованиям перитонеальной поверхности (Милан, Италия, 4-6 декабря 2006 г.): методология консенсуса по конкретным заболеваниям.Журнал хирургической онкологии. 2008; 98: 258–62. doi: 10.1002/jso.21056. [PubMed] [CrossRef] [Google Scholar] 27. Реписо А., Гомес-Родригес Р., Лопес-Пардо Р., Ломбера М.М., Ромеро М., Арансана А., Абад С., Родригес-Мерло Р., Лопес Л., Карболес Х.М. Полезность эндоскопической ультрасонографии в предоперационной постановке рака желудка: диагностическая ценность и терапевтическое воздействие. Revista Española De Enfermedades Digestivas. 2010;102:413–20. [PubMed] [Google Scholar] 28. Савелли Л., Де Яко П., Чеккарони М., Ги Т., Чеккарини М., Сераккиоли Р., Какчаторе Б.Трансвагинальные сонографические признаки карциноматоза брюшины. УЗИ в акушерстве и гинекологии. 2005; 26: 552–7. doi: 10.1002/uog.2587. [PubMed] [CrossRef] [Google Scholar] 30. Фенигер Дж., Томас С., Ленгьел Э., Ляо С.
Баратти Д., Кусамура С., Дерако М. Пятый международный семинар по злокачественным новообразованиям перитонеальной поверхности (Милан, Италия, 4-6 декабря 2006 г.): методология консенсуса по конкретным заболеваниям.Журнал хирургической онкологии. 2008; 98: 258–62. doi: 10.1002/jso.21056. [PubMed] [CrossRef] [Google Scholar] 27. Реписо А., Гомес-Родригес Р., Лопес-Пардо Р., Ломбера М.М., Ромеро М., Арансана А., Абад С., Родригес-Мерло Р., Лопес Л., Карболес Х.М. Полезность эндоскопической ультрасонографии в предоперационной постановке рака желудка: диагностическая ценность и терапевтическое воздействие. Revista Española De Enfermedades Digestivas. 2010;102:413–20. [PubMed] [Google Scholar] 28. Савелли Л., Де Яко П., Чеккарони М., Ги Т., Чеккарини М., Сераккиоли Р., Какчаторе Б.Трансвагинальные сонографические признаки карциноматоза брюшины. УЗИ в акушерстве и гинекологии. 2005; 26: 552–7. doi: 10.1002/uog.2587. [PubMed] [CrossRef] [Google Scholar] 30. Фенигер Дж., Томас С., Ленгьел Э., Ляо С. , Тенни М., Ото А., Ямада С.Д. Проспективное исследование, оценивающее диффузионно-взвешенную магнитно-резонансную томографию (DW-MRI) при выявлении карциноматоза брюшины при подозрении на гинекологические злокачественные новообразования. Гинекол Онкол. 2016; 142:169–75. doi: 10.1016/j.ygyno.2016.04.018. [PubMed] [CrossRef] [Google Scholar] 31.Де Вос Н., Геталс И., Силен В. Клиническая ценность (18) F-ФДГ-ПЭТ-КТ в предоперационной постановке перитонеального карциноматоза колоректального происхождения. Acta Chirurgica Belgica. 2014; 114:370–5. [PubMed] [Google Scholar] 32. Klumpp BD, Schwenzer N, Aschoff P, Miller S, Kramer U, Claussen CD, Bruecher B, Koenigsrainer A, Pfannenberg C. Предоперационная оценка перитонеального карциноматоза: индивидуальное сравнение 18F-FDG ПЭТ/КТ и МРТ. Абдоминальная визуализация. 2012; 38:64–71. doi: 10.1007/s00261-012-9881-7.[PubMed] [CrossRef] [Google Scholar] 33. Лоу Р.Н., Бароне Р.М., Лейси С., Сигети Дж.С., Альзате Г.Д., Себрехтс С.П. Опухоль брюшины: МРТ с разбавленным раствором перорального бария и внутривенным введением контрастных веществ, содержащих гадолиний, по сравнению с МРТ без усиления и КТ.
, Тенни М., Ото А., Ямада С.Д. Проспективное исследование, оценивающее диффузионно-взвешенную магнитно-резонансную томографию (DW-MRI) при выявлении карциноматоза брюшины при подозрении на гинекологические злокачественные новообразования. Гинекол Онкол. 2016; 142:169–75. doi: 10.1016/j.ygyno.2016.04.018. [PubMed] [CrossRef] [Google Scholar] 31.Де Вос Н., Геталс И., Силен В. Клиническая ценность (18) F-ФДГ-ПЭТ-КТ в предоперационной постановке перитонеального карциноматоза колоректального происхождения. Acta Chirurgica Belgica. 2014; 114:370–5. [PubMed] [Google Scholar] 32. Klumpp BD, Schwenzer N, Aschoff P, Miller S, Kramer U, Claussen CD, Bruecher B, Koenigsrainer A, Pfannenberg C. Предоперационная оценка перитонеального карциноматоза: индивидуальное сравнение 18F-FDG ПЭТ/КТ и МРТ. Абдоминальная визуализация. 2012; 38:64–71. doi: 10.1007/s00261-012-9881-7.[PubMed] [CrossRef] [Google Scholar] 33. Лоу Р.Н., Бароне Р.М., Лейси С., Сигети Дж.С., Альзате Г.Д., Себрехтс С.П. Опухоль брюшины: МРТ с разбавленным раствором перорального бария и внутривенным введением контрастных веществ, содержащих гадолиний, по сравнению с МРТ без усиления и КТ. Радиология. 1997; 204: 513–20. doi: 10.1148/radiology.204.2.9240546. [PubMed] [CrossRef] [Google Scholar] 34. Yonemura Y, Canbay E, Endou Y, Ishibashi H, Mizumoto A, Miura M, Li Y, Liu Y, Takeshita K, Ichinose M, Takao N, Hirano M, Sako S, et al. Лечение рака брюшины.Экспертное заключение по фармакотерапии. 2014;15:623–36. doi: 10.1517/14656566.2014.879571. [PubMed] [CrossRef] [Google Scholar] 35. Кин С., Кидесс Э., Полтсайдс Г.А., Виссер Б.К., Джеффри С.С. Диагностика колоректального рака: биомаркеры, внеклеточная ДНК, циркулирующие опухолевые клетки и определение гетерогенных популяций с помощью анализа отдельных клеток. Экспертиза молекулярной диагностики. 2013; 13: 581–99. doi: 10.1586/14737159.2013.811896. [PubMed] [CrossRef] [Google Scholar] 36. Вагнер П.Л., Остин Ф., Сатайя М., Магге Д., Мадуэкве У., Рамалингам Л., Джонс Х.Л., Хольцман М.П., Арендт С.А., Зурейкат А.Х., Пингпанк Дж.Ф., Зех Х.Дж., Бартлетт Д.Л. и др.Значение уровней сывороточных опухолевых маркеров при перитонеальном карциноматозе аппендикулярного происхождения.
Радиология. 1997; 204: 513–20. doi: 10.1148/radiology.204.2.9240546. [PubMed] [CrossRef] [Google Scholar] 34. Yonemura Y, Canbay E, Endou Y, Ishibashi H, Mizumoto A, Miura M, Li Y, Liu Y, Takeshita K, Ichinose M, Takao N, Hirano M, Sako S, et al. Лечение рака брюшины.Экспертное заключение по фармакотерапии. 2014;15:623–36. doi: 10.1517/14656566.2014.879571. [PubMed] [CrossRef] [Google Scholar] 35. Кин С., Кидесс Э., Полтсайдс Г.А., Виссер Б.К., Джеффри С.С. Диагностика колоректального рака: биомаркеры, внеклеточная ДНК, циркулирующие опухолевые клетки и определение гетерогенных популяций с помощью анализа отдельных клеток. Экспертиза молекулярной диагностики. 2013; 13: 581–99. doi: 10.1586/14737159.2013.811896. [PubMed] [CrossRef] [Google Scholar] 36. Вагнер П.Л., Остин Ф., Сатайя М., Магге Д., Мадуэкве У., Рамалингам Л., Джонс Х.Л., Хольцман М.П., Арендт С.А., Зурейкат А.Х., Пингпанк Дж.Ф., Зех Х.Дж., Бартлетт Д.Л. и др.Значение уровней сывороточных опухолевых маркеров при перитонеальном карциноматозе аппендикулярного происхождения.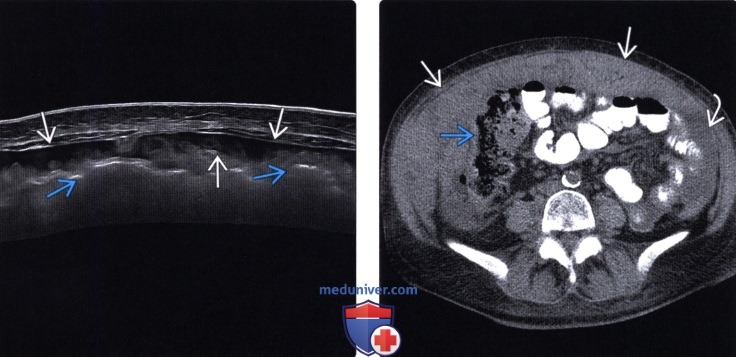 Анналы хирургической онкологии. 2013:20. doi: 10.1245/s10434-012-2627-5. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]37. Lu J, Getz G, Miska EA, Alvarez-Saavedra E, Lamb J, Peck D, Sweet-Cordero A, Ebert BL, Mak RH, Ferrando AA, Downing JR, Jacks T, Horvitz HR, et al. Профили экспрессии микроРНК классифицируют рак человека. Природа. 2005; 435:834–8. doi: 10.1038/nature03702. [PubMed] [CrossRef] [Google Scholar] 38.Yin C, Zhou X, Dang Y, Yan J, Zhang G. Потенциальная роль циркулирующей миР-21 в диагностике и прогнозировании рака пищеварительной системы: систематический обзор и метаанализ. Медицина (Балтимор) 2015; 94: e2123. doi: 10.1097/MD.0000000000002123. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]39. Chen X, Ba Y, Ma L, Cai X, Yin Y, Wang K, Guo J, Zhang Y, Chen J, Guo X, Li Q, Li X, Wang W и др. Характеристика микроРНК в сыворотке: новый класс биомаркеров для диагностики рака и других заболеваний.Клеточные исследования. 2008; 18: 997–1006. doi: 10.1038/cr.
Анналы хирургической онкологии. 2013:20. doi: 10.1245/s10434-012-2627-5. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]37. Lu J, Getz G, Miska EA, Alvarez-Saavedra E, Lamb J, Peck D, Sweet-Cordero A, Ebert BL, Mak RH, Ferrando AA, Downing JR, Jacks T, Horvitz HR, et al. Профили экспрессии микроРНК классифицируют рак человека. Природа. 2005; 435:834–8. doi: 10.1038/nature03702. [PubMed] [CrossRef] [Google Scholar] 38.Yin C, Zhou X, Dang Y, Yan J, Zhang G. Потенциальная роль циркулирующей миР-21 в диагностике и прогнозировании рака пищеварительной системы: систематический обзор и метаанализ. Медицина (Балтимор) 2015; 94: e2123. doi: 10.1097/MD.0000000000002123. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]39. Chen X, Ba Y, Ma L, Cai X, Yin Y, Wang K, Guo J, Zhang Y, Chen J, Guo X, Li Q, Li X, Wang W и др. Характеристика микроРНК в сыворотке: новый класс биомаркеров для диагностики рака и других заболеваний.Клеточные исследования. 2008; 18: 997–1006. doi: 10.1038/cr.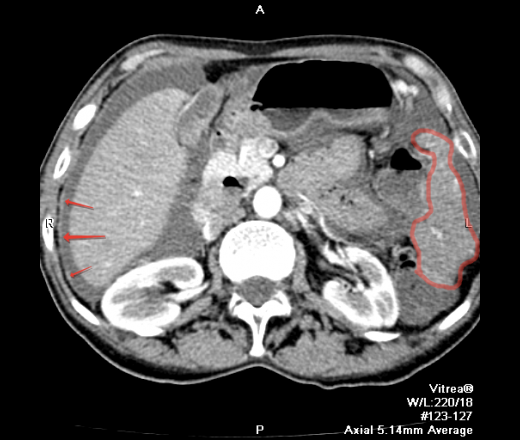 2008.282. [PubMed] [CrossRef] [Google Scholar]40. Митчелл П.С., Паркин Р.К., Крох Э.М., Фриц Б.Р., Вайман С.К., Погосова-Агаджанян Э.Л., Петерсон А., Ноутбум Дж., О’Брайант К.С., Аллен А., Лин Д.В., Урбан Н., Дрешер К.В. и др. Циркулирующие микроРНК как стабильные маркеры на основе крови для обнаружения рака. Труды Национальной академии наук. 2008; 105:10513–8. doi: 10.1073/pnas.0804549105. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]41. Цуй Н.Б., Нг Э.К., Ло Ю.М.Стабильность эндогенной и добавленной РНК в образцах крови, сыворотке и плазме. Клиническая химия. 2002; 48:1647–53. [PubMed] [Google Scholar]42. Кога А., Аояги К., Имаидзуми Т., Мияги М., Ширузу К. Сравнение линии клеток рака желудка MKN-45 и линии клеток рака желудка с высоким потенциалом перитонеальной диссеминации MKN-45P. Медицинский журнал Куруме. 2011;58:73–79. doi: 10.2739/kurumemedj.58.73. [PubMed] [CrossRef] [Google Scholar]43. Пегтел Д.М., Космопулос К., Торли-Лоусон Д.А., ван Эйндховен М.А., Хопманс Э.
2008.282. [PubMed] [CrossRef] [Google Scholar]40. Митчелл П.С., Паркин Р.К., Крох Э.М., Фриц Б.Р., Вайман С.К., Погосова-Агаджанян Э.Л., Петерсон А., Ноутбум Дж., О’Брайант К.С., Аллен А., Лин Д.В., Урбан Н., Дрешер К.В. и др. Циркулирующие микроРНК как стабильные маркеры на основе крови для обнаружения рака. Труды Национальной академии наук. 2008; 105:10513–8. doi: 10.1073/pnas.0804549105. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]41. Цуй Н.Б., Нг Э.К., Ло Ю.М.Стабильность эндогенной и добавленной РНК в образцах крови, сыворотке и плазме. Клиническая химия. 2002; 48:1647–53. [PubMed] [Google Scholar]42. Кога А., Аояги К., Имаидзуми Т., Мияги М., Ширузу К. Сравнение линии клеток рака желудка MKN-45 и линии клеток рака желудка с высоким потенциалом перитонеальной диссеминации MKN-45P. Медицинский журнал Куруме. 2011;58:73–79. doi: 10.2739/kurumemedj.58.73. [PubMed] [CrossRef] [Google Scholar]43. Пегтел Д.М., Космопулос К., Торли-Лоусон Д.А., ван Эйндховен М.А., Хопманс Э.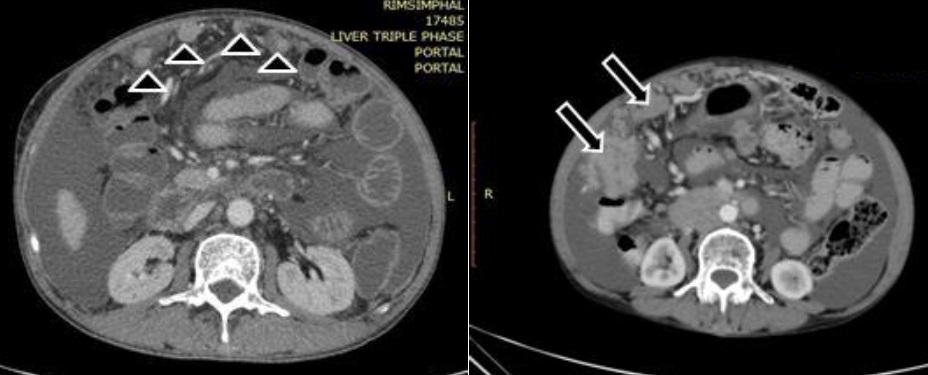 С., Линденберг Дж.Л., де Груйл Т.Д., Вюрдингер Т., Мидделдорп Дж.М.Функциональная доставка вирусных микроРНК через экзосомы. Труды Национальной академии наук Соединенных Штатов Америки. 2010;107:6328–33. doi: 10.1073/pnas.03107. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]44. Ског Дж., Вурдингер Т., ван Рейн С., Мейер Д., Гейнче Л., Сена-Эстевес М., Карри В.Т., Картер Р.С., Кричевский А.М., Брейкфилд Х.О. Микровезикулы глиобластомы транспортируют РНК и белок, которые способствуют росту опухоли и обеспечивают диагностические биомаркеры. Природа клеточной биологии. 2008;10:1470–6.дои: 10.1038/ncb1800. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]45. Валади Х., Экстрем К., Боссиос А., Шёстранд М., Ли Дж.Дж., Лётвалл Д.О. Опосредованный экзосомами перенос мРНК и микроРНК представляет собой новый механизм генетического обмена между клетками. Природа клеточной биологии. 2007; 9: 654–9. дои: 10.1038/ncb1596. [PubMed] [CrossRef] [Google Scholar]46. Ченг Л., Шарплс Р.
С., Линденберг Дж.Л., де Груйл Т.Д., Вюрдингер Т., Мидделдорп Дж.М.Функциональная доставка вирусных микроРНК через экзосомы. Труды Национальной академии наук Соединенных Штатов Америки. 2010;107:6328–33. doi: 10.1073/pnas.03107. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]44. Ског Дж., Вурдингер Т., ван Рейн С., Мейер Д., Гейнче Л., Сена-Эстевес М., Карри В.Т., Картер Р.С., Кричевский А.М., Брейкфилд Х.О. Микровезикулы глиобластомы транспортируют РНК и белок, которые способствуют росту опухоли и обеспечивают диагностические биомаркеры. Природа клеточной биологии. 2008;10:1470–6.дои: 10.1038/ncb1800. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]45. Валади Х., Экстрем К., Боссиос А., Шёстранд М., Ли Дж.Дж., Лётвалл Д.О. Опосредованный экзосомами перенос мРНК и микроРНК представляет собой новый механизм генетического обмена между клетками. Природа клеточной биологии. 2007; 9: 654–9. дои: 10.1038/ncb1596. [PubMed] [CrossRef] [Google Scholar]46. Ченг Л., Шарплс Р. А., Шиклуна Б.Дж., Хилл А.Ф. Экзосомы обеспечивают защитный и обогащенный источник микроРНК для профилирования биомаркеров по сравнению с внутриклеточной и бесклеточной кровью.J Внеклеточные везикулы. 2014; 3 doi: 10.3402/jev.v3.23743. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]48. Рабиновиц Г., Герчел-Тейлор С., Дэй Дж. М., Тейлор Д. Д., Клокер Г. Х. Экзосомальная микроРНК: диагностический маркер рака легкого. Клинический рак легкого. 2009; 10:42–6. doi: 10.3816/CLC.2009.n.006. [PubMed] [CrossRef] [Google Scholar]49. Янаихара Н., Каплен Н., Боуман Э., Сейке М., Кумамото К., Йи М., Стивенс Р.М., Окамото А., Йокота Дж., Танака Т., Калин Г.А., Лю К.Г., Кроче К.М. и др. Уникальные молекулярные профили микроРНК в диагностике и прогнозировании рака легкого.Раковая клетка. 2006; 9: 189–98. doi: 10.1016/j.ccr.2006.01.025. [PubMed] [CrossRef] [Google Scholar]50. Хан С., Аспе Дж. Р., Асумен М. Г., Альмагель Ф., Одумосу О., Асеведо-Мартинес С., Де Леон М., Лэнгридж В. Х., Уолл Н.
А., Шиклуна Б.Дж., Хилл А.Ф. Экзосомы обеспечивают защитный и обогащенный источник микроРНК для профилирования биомаркеров по сравнению с внутриклеточной и бесклеточной кровью.J Внеклеточные везикулы. 2014; 3 doi: 10.3402/jev.v3.23743. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]48. Рабиновиц Г., Герчел-Тейлор С., Дэй Дж. М., Тейлор Д. Д., Клокер Г. Х. Экзосомальная микроРНК: диагностический маркер рака легкого. Клинический рак легкого. 2009; 10:42–6. doi: 10.3816/CLC.2009.n.006. [PubMed] [CrossRef] [Google Scholar]49. Янаихара Н., Каплен Н., Боуман Э., Сейке М., Кумамото К., Йи М., Стивенс Р.М., Окамото А., Йокота Дж., Танака Т., Калин Г.А., Лю К.Г., Кроче К.М. и др. Уникальные молекулярные профили микроРНК в диагностике и прогнозировании рака легкого.Раковая клетка. 2006; 9: 189–98. doi: 10.1016/j.ccr.2006.01.025. [PubMed] [CrossRef] [Google Scholar]50. Хан С., Аспе Дж. Р., Асумен М. Г., Альмагель Ф., Одумосу О., Асеведо-Мартинес С., Де Леон М., Лэнгридж В. Х., Уолл Н. Р. Внеклеточный, проницаемый для клеток сурвивин ингибирует апоптоз, способствуя пролиферативному и метастатическому потенциалу. Бр Дж Рак. 2009; 100:1073–86. doi: 10.1038/sj.bjc.6604978. 6604978 [pii] [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]51. Хан С., Юци Дж. М., Аспе Дж. Р., МакГрегор Д. В., Нейдиг Дж. В., Уолл Н. Р.Сурвивин высвобождается из раковых клеток через экзосомы. Апоптоз. 2011; 16:1–12. doi: 10.1007/s10495-010-0534-4. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]52. Taylor DD, Gercel-Taylor C. Сигнатуры микроРНК экзосом опухолевого происхождения как диагностические биомаркеры рака яичников. Гинекологическая онкология. 2008; 110:13–21. doi: 10.1016/j.ygyno.2008.04.033. [PubMed] [CrossRef] [Google Scholar]53. Хан С., Беннит Х.Ф., Турай Д., Перес М., Миршахиди С., Юань Ю., Уолл Н.Р. Ранняя диагностическая ценность сурвивина и его альтернативных вариантов сплайсинга при раке молочной железы.БМК Рак. 2014;14:176. дои: 10.1186/1471-2407-14-176.
Р. Внеклеточный, проницаемый для клеток сурвивин ингибирует апоптоз, способствуя пролиферативному и метастатическому потенциалу. Бр Дж Рак. 2009; 100:1073–86. doi: 10.1038/sj.bjc.6604978. 6604978 [pii] [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]51. Хан С., Юци Дж. М., Аспе Дж. Р., МакГрегор Д. В., Нейдиг Дж. В., Уолл Н. Р.Сурвивин высвобождается из раковых клеток через экзосомы. Апоптоз. 2011; 16:1–12. doi: 10.1007/s10495-010-0534-4. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]52. Taylor DD, Gercel-Taylor C. Сигнатуры микроРНК экзосом опухолевого происхождения как диагностические биомаркеры рака яичников. Гинекологическая онкология. 2008; 110:13–21. doi: 10.1016/j.ygyno.2008.04.033. [PubMed] [CrossRef] [Google Scholar]53. Хан С., Беннит Х.Ф., Турай Д., Перес М., Миршахиди С., Юань Ю., Уолл Н.Р. Ранняя диагностическая ценность сурвивина и его альтернативных вариантов сплайсинга при раке молочной железы.БМК Рак. 2014;14:176. дои: 10.1186/1471-2407-14-176. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]54. Хан С., Юци Дж. М., Валенсуэла М. М., Турай Д., Аспе Дж. Р., Ашок А., Миршахиди С., Меркола Д., Лилли М. Б., Уолл Н. Р. Полученный из плазмы экзосомальный сурвивин, вероятный биомаркер для раннего выявления рака предстательной железы. ПЛОС Один. 2012;7:e46737. doi: 10.1371/journal.pone.0046737. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]55. Турай Д., Хан С., Диас Остерман С.Дж., Кертис М.П., Хайра Б., Нейдих Д.В., Миршахиди С., Касиано К.А., Уолл Н.Р.Протеомное профилирование экзосом, полученных из сыворотки, от этнически разнообразных пациентов с раком простаты. Рак Инвест. 2016; 34:1–11. doi: 10.3109/07357907.2015.1081921. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]56. Андре Ф., Шарц Н.Е., Мовассаг М., Фламент С., Потье П., Морис П., Помель С., Ломм С., Эскудье Б., Ле Шевалье Т., Турс Т., Амигорена С., Рапозо Г. и др. Злокачественные выпоты и экзосомы иммуногенного происхождения опухоли.
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]54. Хан С., Юци Дж. М., Валенсуэла М. М., Турай Д., Аспе Дж. Р., Ашок А., Миршахиди С., Меркола Д., Лилли М. Б., Уолл Н. Р. Полученный из плазмы экзосомальный сурвивин, вероятный биомаркер для раннего выявления рака предстательной железы. ПЛОС Один. 2012;7:e46737. doi: 10.1371/journal.pone.0046737. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]55. Турай Д., Хан С., Диас Остерман С.Дж., Кертис М.П., Хайра Б., Нейдих Д.В., Миршахиди С., Касиано К.А., Уолл Н.Р.Протеомное профилирование экзосом, полученных из сыворотки, от этнически разнообразных пациентов с раком простаты. Рак Инвест. 2016; 34:1–11. doi: 10.3109/07357907.2015.1081921. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]56. Андре Ф., Шарц Н.Е., Мовассаг М., Фламент С., Потье П., Морис П., Помель С., Ломм С., Эскудье Б., Ле Шевалье Т., Турс Т., Амигорена С., Рапозо Г. и др. Злокачественные выпоты и экзосомы иммуногенного происхождения опухоли. Ланцет. 2002; 360: 295–305. [PubMed] [Google Scholar]57. Токухиса М., Итикава Ю., Косака Н., Очия Т., Яширо М., Хиракава К., Косака Т., Макино Х., Акияма Х., Кунисаки К., Эндо И.Экзосомальные миРНК из жидкости лаважа брюшины как потенциальные прогностические биомаркеры перитонеального метастазирования при раке желудка. ПЛОС Один. 2015;10:e0130472. doi: 10.1371/journal.pone.0130472. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]58. Zheng H, Zhang F, Lin X, Huang C, Zhang Y, Li Y, Lin J, Chen W, Lin X. МикроРНК-1225-5p ингибирует пролиферацию и метастазирование карциномы желудка посредством подавления инсулинового рецептора субстрата-1 и активации β -катениновая сигнализация. Онкотаргет. 2015;7:4647–63.doi: 10.18632/oncotarget.6615. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]59. Хамам Р., Али А.М., Альсалех К.А., Кассем М., Альфайез М., Алдахмаш А., Алахес Н.М. Профилирование экспрессии микроРНК у отдельных пациентов с раком молочной железы идентифицирует новую панель циркулирующих микроРНК для раннего обнаружения.
Ланцет. 2002; 360: 295–305. [PubMed] [Google Scholar]57. Токухиса М., Итикава Ю., Косака Н., Очия Т., Яширо М., Хиракава К., Косака Т., Макино Х., Акияма Х., Кунисаки К., Эндо И.Экзосомальные миРНК из жидкости лаважа брюшины как потенциальные прогностические биомаркеры перитонеального метастазирования при раке желудка. ПЛОС Один. 2015;10:e0130472. doi: 10.1371/journal.pone.0130472. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]58. Zheng H, Zhang F, Lin X, Huang C, Zhang Y, Li Y, Lin J, Chen W, Lin X. МикроРНК-1225-5p ингибирует пролиферацию и метастазирование карциномы желудка посредством подавления инсулинового рецептора субстрата-1 и активации β -катениновая сигнализация. Онкотаргет. 2015;7:4647–63.doi: 10.18632/oncotarget.6615. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]59. Хамам Р., Али А.М., Альсалех К.А., Кассем М., Альфайез М., Алдахмаш А., Алахес Н.М. Профилирование экспрессии микроРНК у отдельных пациентов с раком молочной железы идентифицирует новую панель циркулирующих микроРНК для раннего обнаружения. Научные отчеты. 2016;6:25997. doi: 10.1038/srep25997. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]60. Wang X, Wu J, Lin Y, Zhu Y, Xu X, Xu X, Liang Z, Li S, Hu Z, Zheng X, Xie L. МикроРНК-320c ингибирует опухолевое поведение рака мочевого пузыря путем нацеливания на циклинзависимую киназу 6.Журнал экспериментальных и клинических исследований рака. 2014;33:69. doi: 10.1186/s13046-014-0069-6. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]61. Zhao G, Dong L, Shi H, Li H, Lu X, Guo X, Wang J. МикроРНК-1207-5p ингибирует рост и инвазию клеток гепатоцеллюлярной карциномы посредством сигнального пути Akt/mTOR, опосредованного синтазой жирных кислот. Онкологические отчеты. 2016;36:1709–1. doi: 10.3892/or.2016.4952. [PubMed] [CrossRef] [Google Scholar]62. Озата Д.М., Карамута С., Веласкес-Фернандес Д., Акчакая П., Се Х., Хёг А., Зедениус Дж., Бэкдал М., Ларссон С., Луи В.О.Роль дерегуляции микроРНК в патогенезе адренокортикальной карциномы. Рак, связанный с эндокринной системой.
Научные отчеты. 2016;6:25997. doi: 10.1038/srep25997. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]60. Wang X, Wu J, Lin Y, Zhu Y, Xu X, Xu X, Liang Z, Li S, Hu Z, Zheng X, Xie L. МикроРНК-320c ингибирует опухолевое поведение рака мочевого пузыря путем нацеливания на циклинзависимую киназу 6.Журнал экспериментальных и клинических исследований рака. 2014;33:69. doi: 10.1186/s13046-014-0069-6. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]61. Zhao G, Dong L, Shi H, Li H, Lu X, Guo X, Wang J. МикроРНК-1207-5p ингибирует рост и инвазию клеток гепатоцеллюлярной карциномы посредством сигнального пути Akt/mTOR, опосредованного синтазой жирных кислот. Онкологические отчеты. 2016;36:1709–1. doi: 10.3892/or.2016.4952. [PubMed] [CrossRef] [Google Scholar]62. Озата Д.М., Карамута С., Веласкес-Фернандес Д., Акчакая П., Се Х., Хёг А., Зедениус Дж., Бэкдал М., Ларссон С., Луи В.О.Роль дерегуляции микроРНК в патогенезе адренокортикальной карциномы. Рак, связанный с эндокринной системой.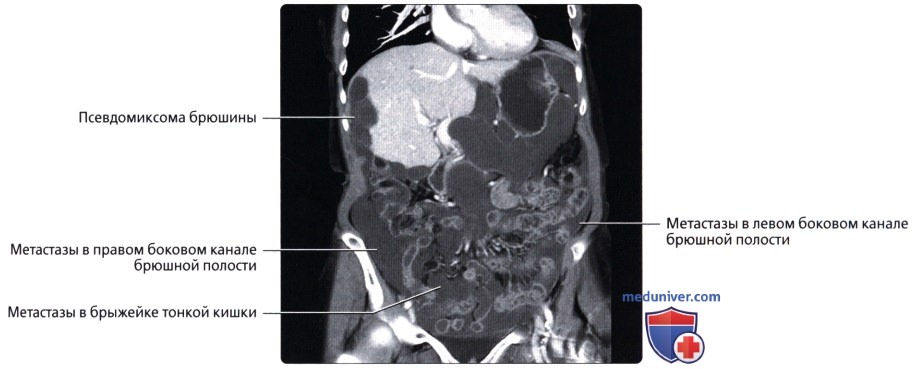 2011;18:643–55. doi: 10.1530/ERC-11-0082. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]63. Фархана Л., Антаки Ф., Анис М.Р., Нангиа-Маккер П., Джадд С., Хадден Т., Леви Э., Муршед Ф., Ю Ю., Ван Бюрен Э., Ахмед К., Дайсон Г., Маджумдар А.П. Роль раковых стволовых клеток в расовом неравенстве при колоректальном раке. Раковая медицина. 2016;5:1268–78. doi: 10.1002/cam4.690. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]64.Хошино А., Коста-Сильва Б., Шен Т.Л., Родригес Г., Хашимото А., Тесич Марк М., Молина Х., Кохсака С., Ди Джианнатале А., Седер С., Сингх С., Уильямс С., Соплоп Н. и др. Интегрины экзосом опухоли определяют органотропное метастазирование. Природа. 2015; 527:329–35. doi: 10.1038/nature15756. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]65. Paggetti J, Haderk F, Seiffert M, Janji B, Distler U, Ammerlaan W, Kim YJ, Adam J, Lichter P, Solary E, Berchem G, Moussay E. Экзосомы, высвобождаемые клетками хронического лимфоцитарного лейкоза, вызывают переход стромальных клеток в фибробласты, ассоциированные с раком.
2011;18:643–55. doi: 10.1530/ERC-11-0082. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]63. Фархана Л., Антаки Ф., Анис М.Р., Нангиа-Маккер П., Джадд С., Хадден Т., Леви Э., Муршед Ф., Ю Ю., Ван Бюрен Э., Ахмед К., Дайсон Г., Маджумдар А.П. Роль раковых стволовых клеток в расовом неравенстве при колоректальном раке. Раковая медицина. 2016;5:1268–78. doi: 10.1002/cam4.690. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]64.Хошино А., Коста-Сильва Б., Шен Т.Л., Родригес Г., Хашимото А., Тесич Марк М., Молина Х., Кохсака С., Ди Джианнатале А., Седер С., Сингх С., Уильямс С., Соплоп Н. и др. Интегрины экзосом опухоли определяют органотропное метастазирование. Природа. 2015; 527:329–35. doi: 10.1038/nature15756. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]65. Paggetti J, Haderk F, Seiffert M, Janji B, Distler U, Ammerlaan W, Kim YJ, Adam J, Lichter P, Solary E, Berchem G, Moussay E. Экзосомы, высвобождаемые клетками хронического лимфоцитарного лейкоза, вызывают переход стромальных клеток в фибробласты, ассоциированные с раком.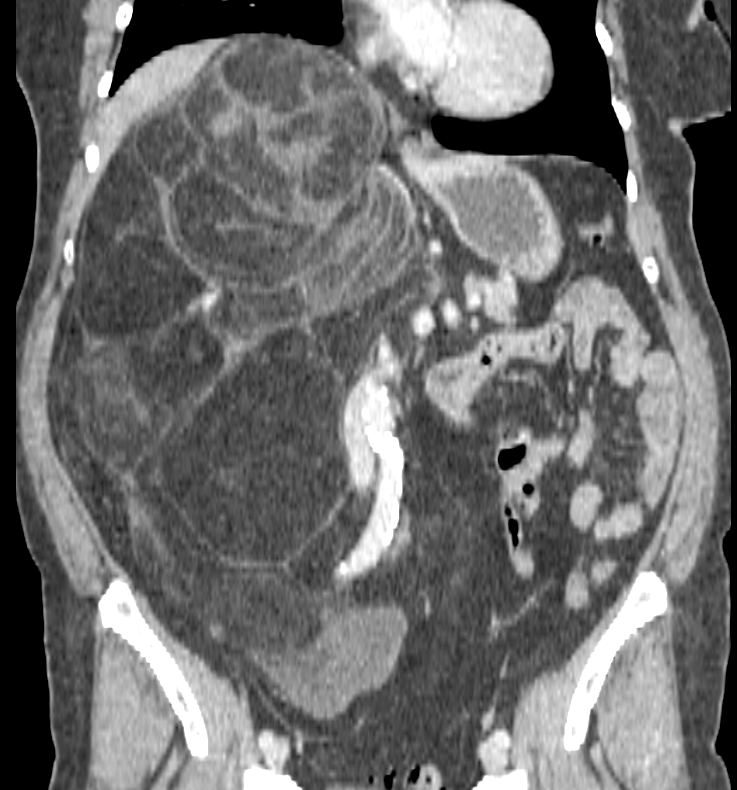 Кровь. 2015; 126:1106–17. doi: 10.1182/blood-2014-12-618025. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]66. Пейнадо Х., Алекович М., Лавоткин С., Матей И., Коста-Сильва Б., Морено-Буэно Г., Эргета-Редондо М., Уильямс К., Гарсия-Сантос Г., Гаджар К., Нитадори-Хосино А., Хоффман К., Бадал К. и др. др. Экзосомы меланомы обучают клетки-предшественники костного мозга прометастатическому фенотипу посредством MET. Нат Мед. 2012;18:883–91. doi: 10.1038/nm.2753. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]67.Franzen CA, Simms PE, Van Huis AF, Foreman KE, Kuo PC, Gupta GN. Характеристика поглощения и интернализации экзосом клетками рака мочевого пузыря. Биомед Рез Инт. 2014;2014:619829. doi: 10.1155/2014/619829. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]68. Хуан К.Х., Лан Ю.Т., Фанг В.Л., Чен Д.Х., Ло С.С., Ли А.Ф., Чиоу С.Х., Ву К.В., Шир Ю.М. Корреляция между микроРНК и метастазированием в лимфатические узлы при раке желудка. BioMed Research International 2015.
Кровь. 2015; 126:1106–17. doi: 10.1182/blood-2014-12-618025. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]66. Пейнадо Х., Алекович М., Лавоткин С., Матей И., Коста-Сильва Б., Морено-Буэно Г., Эргета-Редондо М., Уильямс К., Гарсия-Сантос Г., Гаджар К., Нитадори-Хосино А., Хоффман К., Бадал К. и др. др. Экзосомы меланомы обучают клетки-предшественники костного мозга прометастатическому фенотипу посредством MET. Нат Мед. 2012;18:883–91. doi: 10.1038/nm.2753. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]67.Franzen CA, Simms PE, Van Huis AF, Foreman KE, Kuo PC, Gupta GN. Характеристика поглощения и интернализации экзосом клетками рака мочевого пузыря. Биомед Рез Инт. 2014;2014:619829. doi: 10.1155/2014/619829. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]68. Хуан К.Х., Лан Ю.Т., Фанг В.Л., Чен Д.Х., Ло С.С., Ли А.Ф., Чиоу С.Х., Ву К.В., Шир Ю.М. Корреляция между микроРНК и метастазированием в лимфатические узлы при раке желудка. BioMed Research International 2015.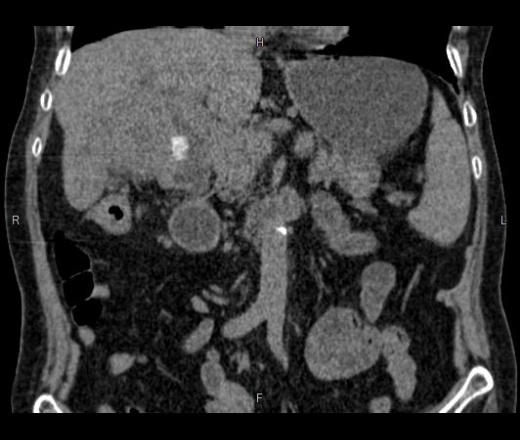 Doi 2015: 10.1155/2015/543163. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]69.Чен Л., Люй М.Х., Чжан Д., Хао Н.Б., Фан Ю.Х., Ву Ю.Ю., Ван С.М., Се Р., Фанг Д.С., Чжан Х., Ху СиДжей, Ян С.М. миР-1207-5p и миР-1266 подавляют рост и инвазию рака желудка путем нацеливания на обратную транскриптазу теломеразы. Гибель клеток и болезни. 2014;5:e1034. doi: 10.1038/cddis.2013.553. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]70. Moltzahn F, Olshen AB, Baehner L, Peek A, Fong L, Stöppler H, Simko J, Hilton JF, Carroll P, Blelloch R. Мультиплексная qRT-PCR на основе микрожидкости идентифицирует диагностические и прогностические сигнатуры микроРНК в сыворотке пациентов с раком простаты.Исследования рака. 2011;71:550–60. doi: 10.1158/0008-5472.CAN-10-1229. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]71. Zhu J, Chen L, Zou L, Yang P, Wu R, Mao Y, Zhou H, Li R, Wang K, Wang W, Hua D, Zhang X. MiR-20b, -21 и -130b ингибируют экспрессию PTEN, что приводит к в гиперэкспрессии B7-h2 при прогрессирующем колоректальном раке.
Doi 2015: 10.1155/2015/543163. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]69.Чен Л., Люй М.Х., Чжан Д., Хао Н.Б., Фан Ю.Х., Ву Ю.Ю., Ван С.М., Се Р., Фанг Д.С., Чжан Х., Ху СиДжей, Ян С.М. миР-1207-5p и миР-1266 подавляют рост и инвазию рака желудка путем нацеливания на обратную транскриптазу теломеразы. Гибель клеток и болезни. 2014;5:e1034. doi: 10.1038/cddis.2013.553. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]70. Moltzahn F, Olshen AB, Baehner L, Peek A, Fong L, Stöppler H, Simko J, Hilton JF, Carroll P, Blelloch R. Мультиплексная qRT-PCR на основе микрожидкости идентифицирует диагностические и прогностические сигнатуры микроРНК в сыворотке пациентов с раком простаты.Исследования рака. 2011;71:550–60. doi: 10.1158/0008-5472.CAN-10-1229. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]71. Zhu J, Chen L, Zou L, Yang P, Wu R, Mao Y, Zhou H, Li R, Wang K, Wang W, Hua D, Zhang X. MiR-20b, -21 и -130b ингибируют экспрессию PTEN, что приводит к в гиперэкспрессии B7-h2 при прогрессирующем колоректальном раке. Иммунология человека. 2014;75:348–53. doi: 10.1016/j.humimm.2014.01.006. [PubMed] [CrossRef] [Google Scholar]72. Фрике А., Ульрих П.В., Хайнц Дж., Пфайфер Д., Шольбер Дж., Хергет Г.В., Хаушильд О., Бронсерт П., Старк Г.Б., Баннаш Х., Эйзенхардт С.У., Брейг Д.Идентификация переносимой кровью сигнатуры миРНК синовиальной саркомы. Молекулярный рак. 2015:14. doi: 10.1186/s12943-015-0424-z. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]73. Leidinger P, Hart M, Backes C, Rheinheimer S, Keck B, Wullich B, Keller A, Meese E. Дифференциальный диагноз по крови между доброкачественной гиперплазией предстательной железы и раком предстательной железы: микроРНК как источник биомаркеров, не зависящих от уровня PSA, шкала Глисона, или статус TNM. Биология опухоли. 2016;37:10177–85. doi: 10.1007/s13277-016-4883-7.[PubMed] [CrossRef] [Google Scholar]74. He HC, Han ZD, Dai QS, Ling XH, Fu X, Lin ZY, Deng YH, Qin GQ, Cai C, Chen JH, Jiang FN, Liu X, Zhong WD. Глобальный анализ дифференциально экспрессируемых микроРНК рака предстательной железы у китайских пациентов.
Иммунология человека. 2014;75:348–53. doi: 10.1016/j.humimm.2014.01.006. [PubMed] [CrossRef] [Google Scholar]72. Фрике А., Ульрих П.В., Хайнц Дж., Пфайфер Д., Шольбер Дж., Хергет Г.В., Хаушильд О., Бронсерт П., Старк Г.Б., Баннаш Х., Эйзенхардт С.У., Брейг Д.Идентификация переносимой кровью сигнатуры миРНК синовиальной саркомы. Молекулярный рак. 2015:14. doi: 10.1186/s12943-015-0424-z. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]73. Leidinger P, Hart M, Backes C, Rheinheimer S, Keck B, Wullich B, Keller A, Meese E. Дифференциальный диагноз по крови между доброкачественной гиперплазией предстательной железы и раком предстательной железы: микроРНК как источник биомаркеров, не зависящих от уровня PSA, шкала Глисона, или статус TNM. Биология опухоли. 2016;37:10177–85. doi: 10.1007/s13277-016-4883-7.[PubMed] [CrossRef] [Google Scholar]74. He HC, Han ZD, Dai QS, Ling XH, Fu X, Lin ZY, Deng YH, Qin GQ, Cai C, Chen JH, Jiang FN, Liu X, Zhong WD. Глобальный анализ дифференциально экспрессируемых микроРНК рака предстательной железы у китайских пациентов.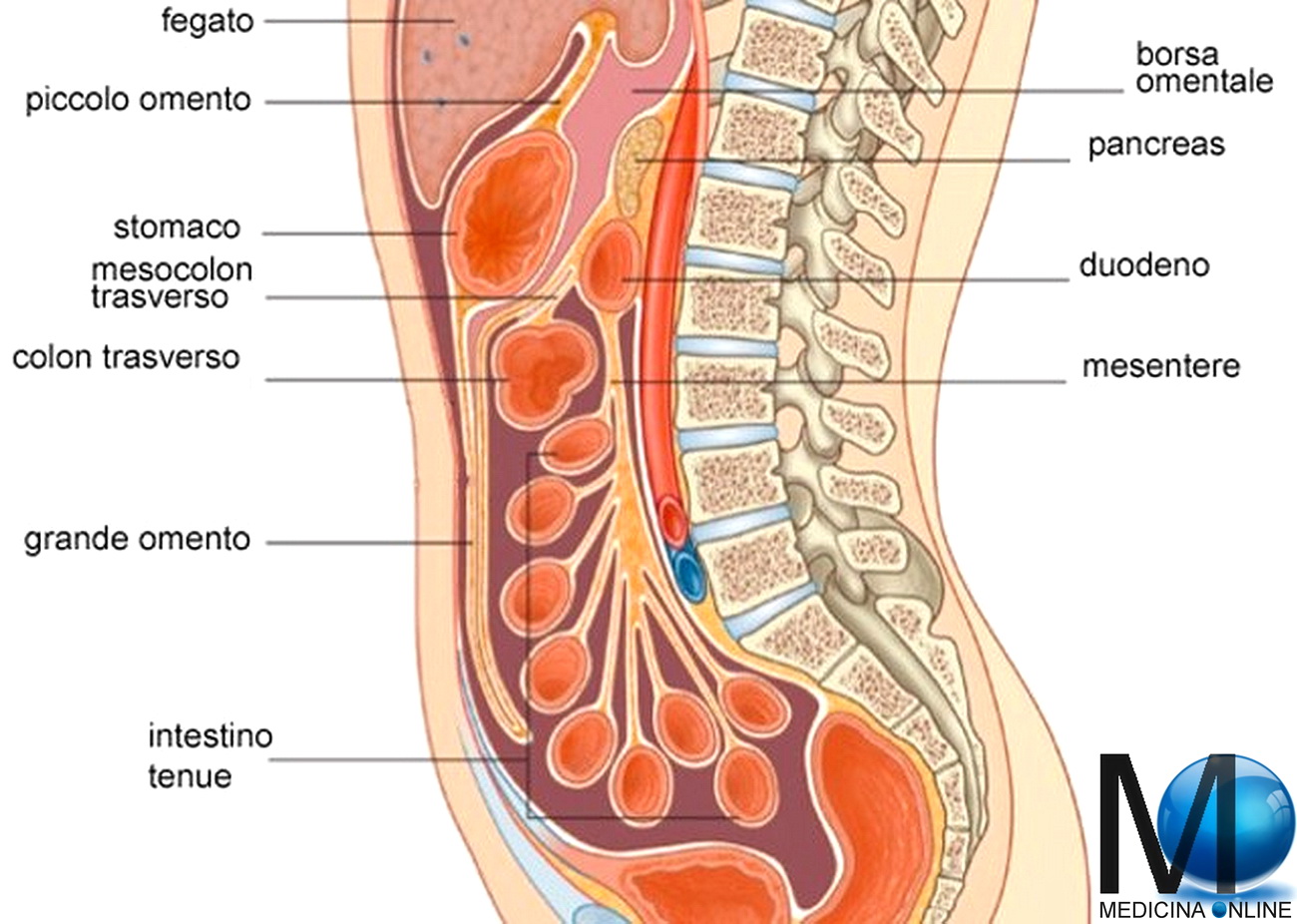 Геномика BMC. 2013;14:757. дои: 10.1186/1471-2164-14-757. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]75. Бартли А.Н., Яо Х., Баркох Б.А., Иван С., Мишра Б.М., Рашид А., Калин Г.А., Лутра Р., Гамильтон С.Р. Сложные паттерны измененной экспрессии микроРНК во время последовательности аденомы-аденокарциномы для микросателлитно-стабильного колоректального рака.Клинические исследования рака. 2011;17:7283–93. doi: 10.1158/1078-0432.CCR-11-1452. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]76. Веласкес-Фернандес Д., Карамута С., Озата Д.М., Лу М., Хёг А., Бэкдал М., Ларссон С., Луи В.О., Зедениус Дж. Паттерны экспрессии микроРНК, связанные с гиперфункциональными и негиперфункционирующими фенотипами в адренокортикальных аденомах. Европейский журнал эндокринологии. 2014;170:583–91. doi: 10.1530/EJE-13-0817. [PubMed] [CrossRef] [Google Scholar]77. Лэй Т, Чжу И, Цзян С, Ван И, Фу Дж, Фань Зи, Цинь Х.МикроРНК-320 была подавлена при немелкоклеточном раке легкого и ингибировала пролиферацию, миграцию и инвазию клеток путем нацеливания на синтазы жирных кислот.
Геномика BMC. 2013;14:757. дои: 10.1186/1471-2164-14-757. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]75. Бартли А.Н., Яо Х., Баркох Б.А., Иван С., Мишра Б.М., Рашид А., Калин Г.А., Лутра Р., Гамильтон С.Р. Сложные паттерны измененной экспрессии микроРНК во время последовательности аденомы-аденокарциномы для микросателлитно-стабильного колоректального рака.Клинические исследования рака. 2011;17:7283–93. doi: 10.1158/1078-0432.CCR-11-1452. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]76. Веласкес-Фернандес Д., Карамута С., Озата Д.М., Лу М., Хёг А., Бэкдал М., Ларссон С., Луи В.О., Зедениус Дж. Паттерны экспрессии микроРНК, связанные с гиперфункциональными и негиперфункционирующими фенотипами в адренокортикальных аденомах. Европейский журнал эндокринологии. 2014;170:583–91. doi: 10.1530/EJE-13-0817. [PubMed] [CrossRef] [Google Scholar]77. Лэй Т, Чжу И, Цзян С, Ван И, Фу Дж, Фань Зи, Цинь Х.МикроРНК-320 была подавлена при немелкоклеточном раке легкого и ингибировала пролиферацию, миграцию и инвазию клеток путем нацеливания на синтазы жирных кислот./18/18_1.jpg) Отчеты о молекулярной медицине. 2016;14:1255–62. doi: 10.3892/mmr.2016.5370. [PubMed] [CrossRef] [Google Scholar]
Отчеты о молекулярной медицине. 2016;14:1255–62. doi: 10.3892/mmr.2016.5370. [PubMed] [CrossRef] [Google Scholar] Было показано, что метод, называемый уменьшением объема опухоли или циторедуктивной хирургией (CRS), и гипертермическая внутрибрюшинная химиотерапия (HIPEC) являются эффективным вариантом лечения для некоторых пациентов со злокачественными новообразованиями поверхности брюшины.
Было показано, что метод, называемый уменьшением объема опухоли или циторедуктивной хирургией (CRS), и гипертермическая внутрибрюшинная химиотерапия (HIPEC) являются эффективным вариантом лечения для некоторых пациентов со злокачественными новообразованиями поверхности брюшины.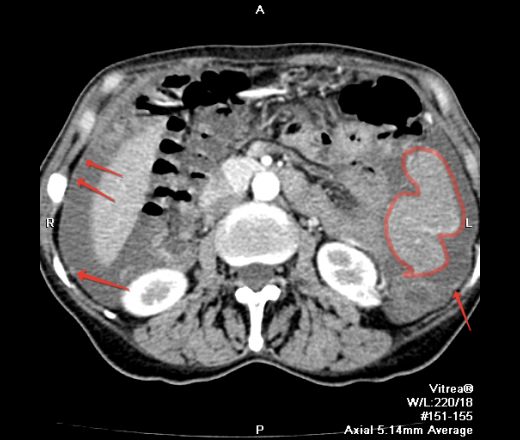 только хирургическое вмешательство для некоторых пациентов с заболеванием брюшины, потому что оно может получить доступ и убить больше раковых клеток, чем можно обнаружить невооруженным глазом.
только хирургическое вмешательство для некоторых пациентов с заболеванием брюшины, потому что оно может получить доступ и убить больше раковых клеток, чем можно обнаружить невооруженным глазом.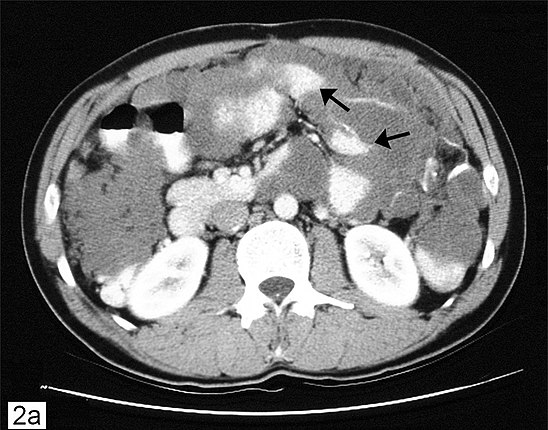 имеет опыт ухода за сложными онкологическими больными.
имеет опыт ухода за сложными онкологическими больными.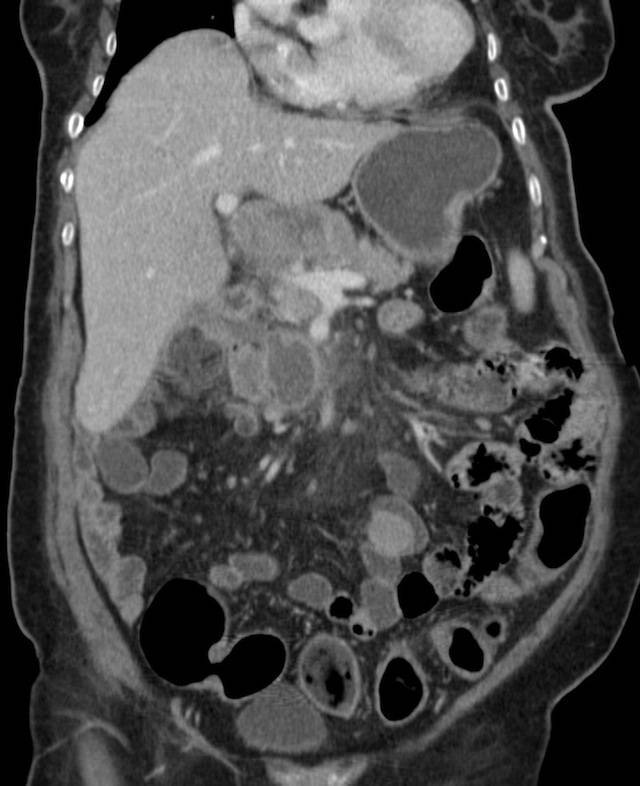

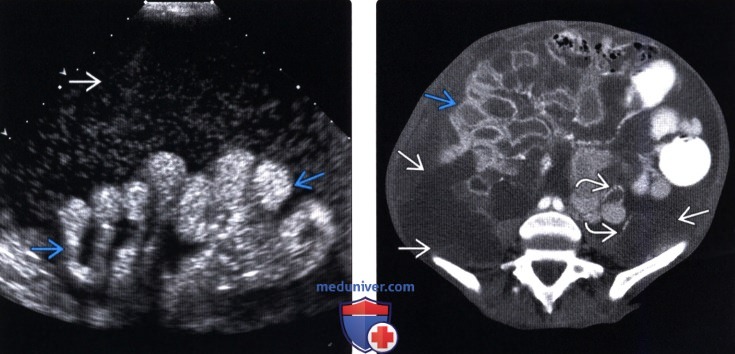 Смерть от CRC практически всегда является следствием метастатического распространения в отдаленные участки тела, такие как печень, брюшная полость и легкие. Наихудший прогноз имеют пациенты с метастазами в брюшную полость (peritoneal metastases, PM) (1, 2).
Смерть от CRC практически всегда является следствием метастатического распространения в отдаленные участки тела, такие как печень, брюшная полость и легкие. Наихудший прогноз имеют пациенты с метастазами в брюшную полость (peritoneal metastases, PM) (1, 2).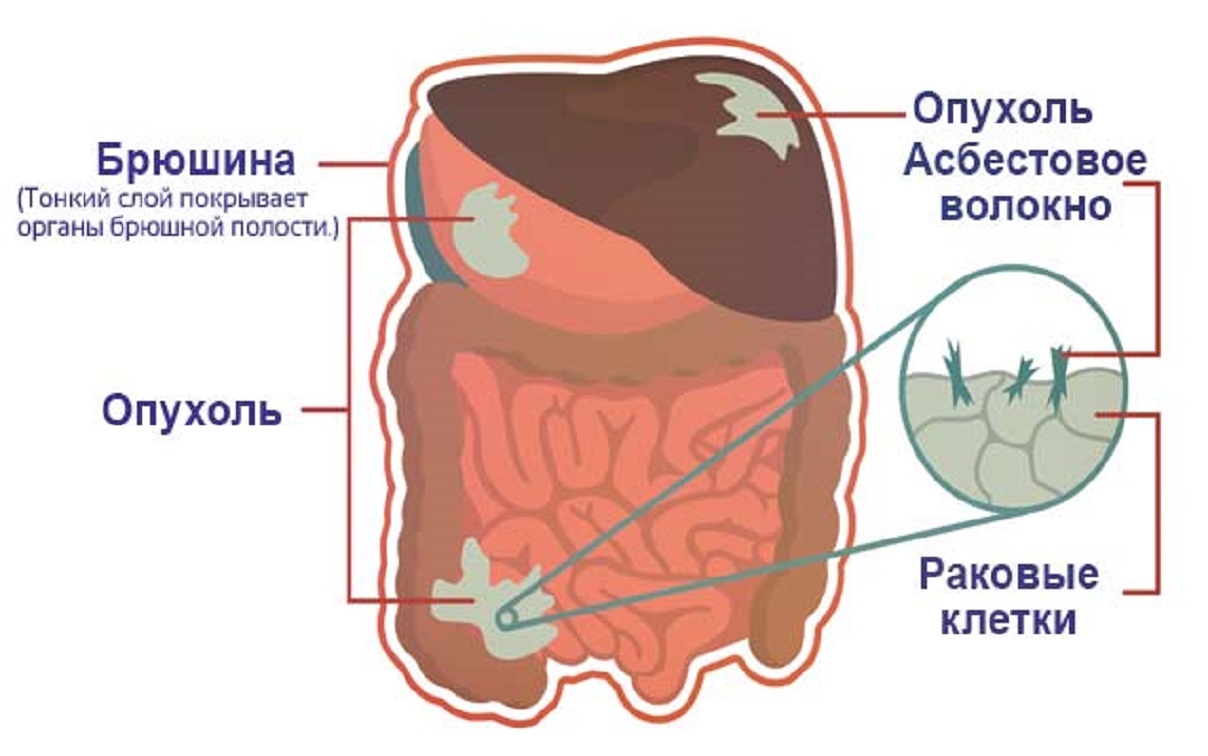 Польза системной химиотерапии резко снижается в подгруппе больных КРР с ПМ (2, 9), а их плохая визуализация затрудняет оценку их ответа на лечение.В последнее десятилетие это привело к активному исключению пациентов с ПМ из клинических испытаний (10). В совокупности КРР с ПМ является очень распространенным и крайне агрессивным, но недостаточно диагностируемым и малоизученным заболеванием.
Польза системной химиотерапии резко снижается в подгруппе больных КРР с ПМ (2, 9), а их плохая визуализация затрудняет оценку их ответа на лечение.В последнее десятилетие это привело к активному исключению пациентов с ПМ из клинических испытаний (10). В совокупности КРР с ПМ является очень распространенным и крайне агрессивным, но недостаточно диагностируемым и малоизученным заболеванием. Для этого требуется всесторонний анализ клинических параметров и (эпи)генетических особенностей опухолей и пациентов, информирующий о разработке (составных) биомаркеров.3. У 40–60% пациентов, отобранных в настоящее время для CRS HIPEC, наблюдаются быстрые рецидивы заболевания и чрезмерное лечение. Частота недостаточного лечения (пациенты, которые могли бы получить пользу, но не были отобраны) неизвестна. Улучшенный отбор пациентов требует лучших методов визуализации для надежной оценки ЧКВ в сочетании с клиническими и (эпи-)генетическими признаками, как в 2. 4. Неполная резекция оставляет остатки опухоли, которые могут инициировать внутрибрюшной рецидив. Для управления CRS необходимы новые стратегии интраоперационной визуализации.5. Используемые в настоящее время монотерапии в HIPEC вряд ли будут эффективными. Необходимо разработать новые более эффективные стратегии лечения. 6. Пациентам с ПМ меньше всего помогают современные схемы химиотерапии. Необходимо определить факторы, определяющие резистентность ПМ к системной терапии.
Для этого требуется всесторонний анализ клинических параметров и (эпи)генетических особенностей опухолей и пациентов, информирующий о разработке (составных) биомаркеров.3. У 40–60% пациентов, отобранных в настоящее время для CRS HIPEC, наблюдаются быстрые рецидивы заболевания и чрезмерное лечение. Частота недостаточного лечения (пациенты, которые могли бы получить пользу, но не были отобраны) неизвестна. Улучшенный отбор пациентов требует лучших методов визуализации для надежной оценки ЧКВ в сочетании с клиническими и (эпи-)генетическими признаками, как в 2. 4. Неполная резекция оставляет остатки опухоли, которые могут инициировать внутрибрюшной рецидив. Для управления CRS необходимы новые стратегии интраоперационной визуализации.5. Используемые в настоящее время монотерапии в HIPEC вряд ли будут эффективными. Необходимо разработать новые более эффективные стратегии лечения. 6. Пациентам с ПМ меньше всего помогают современные схемы химиотерапии. Необходимо определить факторы, определяющие резистентность ПМ к системной терапии. Эти органоиды можно использовать в исследованиях по трансплантации, создавая модели спонтанных метастазов у мышей. Анализ молекулярной ткани даст новые возможности для обнаружения и лечения ПМ, для понимания механизмов резистентности, пластичности опухолевых клеток и (эпи)генетической гетерогенности внутри и между очагами поражения. Понимание биологии ТЧ приведет к формулированию новых концепций лечения, которые впоследствии можно будет протестировать в созданных новых модельных системах ТЧ.Эти усилия должны привести к ряду доклинически подтвержденных новых стратегий лечения, возможно, ограниченных конкретными, идентифицируемыми подгруппами пациентов. Затем эти стратегии могут быть проверены в небольших исследованиях по проверке концепции для получения биологических доказательств обоснованности концепции лечения у онкологических больных, а затем в регулярных клинических испытаниях фазы 1–3. Анализ тканей из таких испытаний может впоследствии выявить потенциальные механизмы резистентности и помочь разработать доклинические исследования, направленные на дальнейшее совершенствование стратегии.
Эти органоиды можно использовать в исследованиях по трансплантации, создавая модели спонтанных метастазов у мышей. Анализ молекулярной ткани даст новые возможности для обнаружения и лечения ПМ, для понимания механизмов резистентности, пластичности опухолевых клеток и (эпи)генетической гетерогенности внутри и между очагами поражения. Понимание биологии ТЧ приведет к формулированию новых концепций лечения, которые впоследствии можно будет протестировать в созданных новых модельных системах ТЧ.Эти усилия должны привести к ряду доклинически подтвержденных новых стратегий лечения, возможно, ограниченных конкретными, идентифицируемыми подгруппами пациентов. Затем эти стратегии могут быть проверены в небольших исследованиях по проверке концепции для получения биологических доказательств обоснованности концепции лечения у онкологических больных, а затем в регулярных клинических испытаниях фазы 1–3. Анализ тканей из таких испытаний может впоследствии выявить потенциальные механизмы резистентности и помочь разработать доклинические исследования, направленные на дальнейшее совершенствование стратегии. Этот трансляционный подход с прямой связью может повлиять на клинический результат в ближайшие годы. ПМ, перитонеальные метастазы; WGS, полногеномное секвенирование; RNAseq, секвенирование РНК; (P)-протеомика, (фосфо-)протеомика.
Этот трансляционный подход с прямой связью может повлиять на клинический результат в ближайшие годы. ПМ, перитонеальные метастазы; WGS, полногеномное секвенирование; RNAseq, секвенирование РНК; (P)-протеомика, (фосфо-)протеомика. Действительно, при существующих стратегиях отбора CRS прекращается в 40% процедур из-за высокого балла PCI (12, 13).Совсем недавно было показано, что диффузионно-взвешенная МРТ (DW-MRI) превосходит другие методы визуализации в отношении чувствительности и специфичности (14–16). DW-MRI также выявляет внебрюшинные заболевания, такие как скрытые метастазы в печени, с высокой чувствительностью. Наконец, недавнее исследование использовало молекулярную визуализацию с использованием ингибитора белка активации фибробластов (FAP) (FAPI) в качестве индикатора ПЭТ для обнаружения PM и продемонстрировало превосходство над стандартным ФДГ-ПЭТ (17). Основа для обнаружения PM на основе FAP, по-видимому, связана с обычно высоким количеством FAP-позитивных рак-ассоциированных фибробластов (CAF) в этих поражениях.
Действительно, при существующих стратегиях отбора CRS прекращается в 40% процедур из-за высокого балла PCI (12, 13).Совсем недавно было показано, что диффузионно-взвешенная МРТ (DW-MRI) превосходит другие методы визуализации в отношении чувствительности и специфичности (14–16). DW-MRI также выявляет внебрюшинные заболевания, такие как скрытые метастазы в печени, с высокой чувствительностью. Наконец, недавнее исследование использовало молекулярную визуализацию с использованием ингибитора белка активации фибробластов (FAP) (FAPI) в качестве индикатора ПЭТ для обнаружения PM и продемонстрировало превосходство над стандартным ФДГ-ПЭТ (17). Основа для обнаружения PM на основе FAP, по-видимому, связана с обычно высоким количеством FAP-позитивных рак-ассоциированных фибробластов (CAF) в этих поражениях.
 Кроме того, генетические и негенетические вариации в популяции пациентов также могут определять риск развития ПМ независимо от внутренних переменных опухоли (29).В качестве альтернативы, сверхчувствительное обнаружение биологического материала опухоли (например, внеклеточной опухолевой ДНК, РНК или белка), выделяемого микроскопическими опухолевыми отложениями, также может служить биомаркером для прогнозирования рецидива. Например, обнаружение циркулирующей опухолевой ДНК (цДНК) в плазме позволяет выявить пациентов со стадией II и стадией III с высоким риском развития (любых) отдаленных метастазов (30–33). Однако уровни цтДНК в плазме чрезвычайно низки у пациентов с ПМ. Скорее, цДНК, полученную из PM, можно легко измерить в перитонеальной жидкости, предлагая альтернативный источник биомаркеров, сообщающих о потенциальном присутствии микрометастазов в брюшине (34).Действительно, присутствие раковых молекулярных биомаркеров в перитонеальной жидкости предсказывает образование ТМ при раке желудка и поджелудочной железы (35, 36).
Кроме того, генетические и негенетические вариации в популяции пациентов также могут определять риск развития ПМ независимо от внутренних переменных опухоли (29).В качестве альтернативы, сверхчувствительное обнаружение биологического материала опухоли (например, внеклеточной опухолевой ДНК, РНК или белка), выделяемого микроскопическими опухолевыми отложениями, также может служить биомаркером для прогнозирования рецидива. Например, обнаружение циркулирующей опухолевой ДНК (цДНК) в плазме позволяет выявить пациентов со стадией II и стадией III с высоким риском развития (любых) отдаленных метастазов (30–33). Однако уровни цтДНК в плазме чрезвычайно низки у пациентов с ПМ. Скорее, цДНК, полученную из PM, можно легко измерить в перитонеальной жидкости, предлагая альтернативный источник биомаркеров, сообщающих о потенциальном присутствии микрометастазов в брюшине (34).Действительно, присутствие раковых молекулярных биомаркеров в перитонеальной жидкости предсказывает образование ТМ при раке желудка и поджелудочной железы (35, 36).
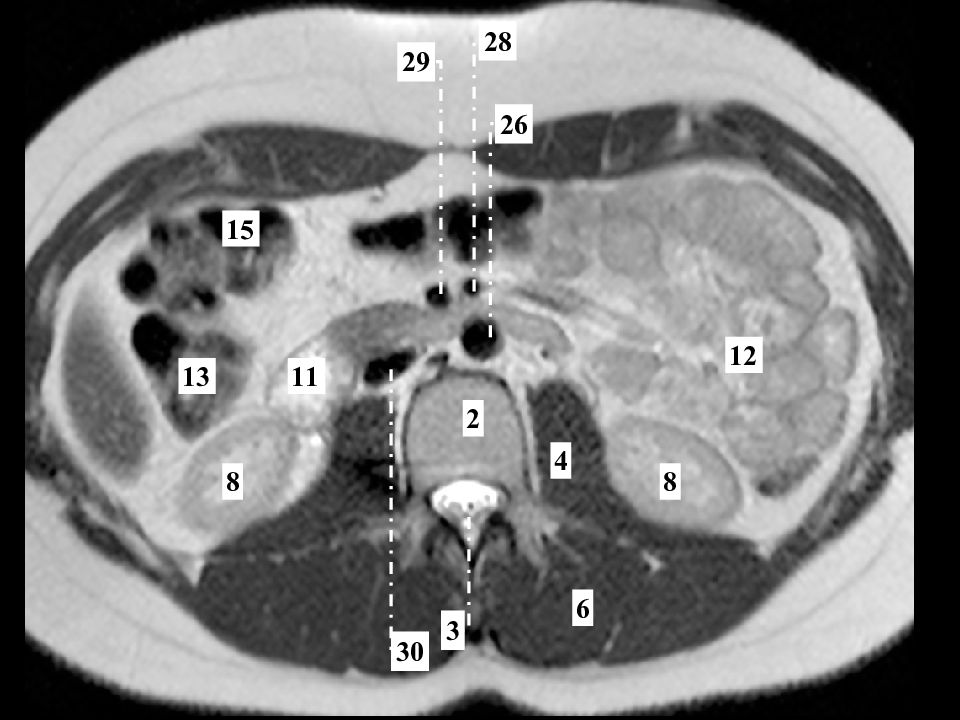 Такие режимы в настоящее время отсутствуют (рис. 1). Недавно стали доступны новые системы культивирования ТЧ, основанные на органоидной технологии, и в настоящее время они используются для разработки и тестирования новых эффективных методов лечения (37, 38). Важно отметить, что органоидная технология представляет собой единственную доступную платформу для прогнозирования ответа на терапию у отдельных пациентов с раком ЖКТ (39–43).
Такие режимы в настоящее время отсутствуют (рис. 1). Недавно стали доступны новые системы культивирования ТЧ, основанные на органоидной технологии, и в настоящее время они используются для разработки и тестирования новых эффективных методов лечения (37, 38). Важно отметить, что органоидная технология представляет собой единственную доступную платформу для прогнозирования ответа на терапию у отдельных пациентов с раком ЖКТ (39–43). CRS с HIPEC или без нее является дорогостоящей процедурой, связанной со значительными показателями заболеваемости и смертности (48, 49). Поэтому необходим тщательный отбор пациентов. Прогностические факторы, связанные с неблагоприятным исходом после ХРС, включают (i) проявления с обструкцией или перфорацией первичной опухоли, (ii) высокий уровень ЧКВ и (iii) завершенность ХРС.Используемые в настоящее время критерии включения и исключения хирургического лечения основаны исключительно на ЧКВ, оценке резектабельности и наличии отдаленных метастазов за пределами брюшины. Несмотря на эти критерии отбора, примерно у половины пациентов наблюдается быстрое прогрессирование заболевания в течение первого года после CRS-HIPEC, которое еще больше увеличивается до 70% через 2 года (50). В конце концов, рецидив после CRS-HIPEC приводит к 2- и 10-летней общей выживаемости ~ 60% и ~ 20% соответственно (50–53).
CRS с HIPEC или без нее является дорогостоящей процедурой, связанной со значительными показателями заболеваемости и смертности (48, 49). Поэтому необходим тщательный отбор пациентов. Прогностические факторы, связанные с неблагоприятным исходом после ХРС, включают (i) проявления с обструкцией или перфорацией первичной опухоли, (ii) высокий уровень ЧКВ и (iii) завершенность ХРС.Используемые в настоящее время критерии включения и исключения хирургического лечения основаны исключительно на ЧКВ, оценке резектабельности и наличии отдаленных метастазов за пределами брюшины. Несмотря на эти критерии отбора, примерно у половины пациентов наблюдается быстрое прогрессирование заболевания в течение первого года после CRS-HIPEC, которое еще больше увеличивается до 70% через 2 года (50). В конце концов, рецидив после CRS-HIPEC приводит к 2- и 10-летней общей выживаемости ~ 60% и ~ 20% соответственно (50–53). Такие переменные могут оказывать глубокое влияние на поведение опухоли и частоту рецидивов. Поэтому основной задачей является выявление биологических и/или генетических переменных, ориентированных на опухоль или пациента, которые связаны с рецидивом после CRS-HIPEC (рис. 1).
Такие переменные могут оказывать глубокое влияние на поведение опухоли и частоту рецидивов. Поэтому основной задачей является выявление биологических и/или генетических переменных, ориентированных на опухоль или пациента, которые связаны с рецидивом после CRS-HIPEC (рис. 1).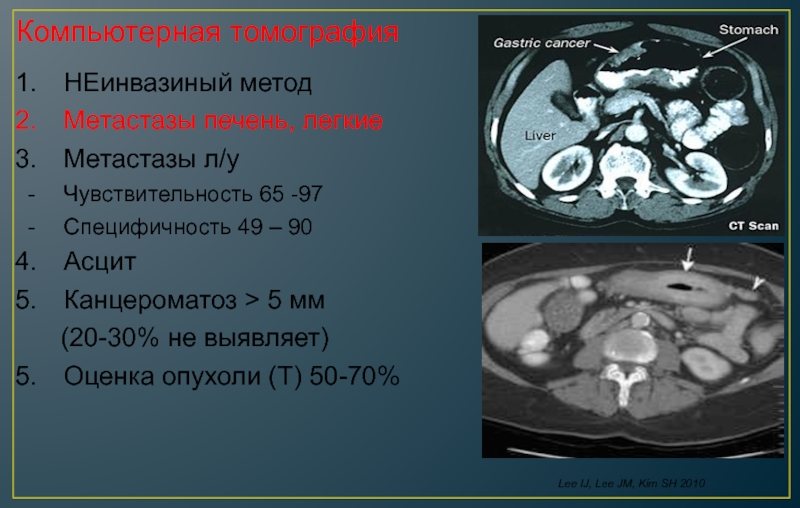 В настоящее время продемонстрирована клиническая осуществимость этого процесса (56, 57). Обнадеживает тот факт, что системное введение флуоресцентных моноклональных антител против СЕА было безопасным и позволяло последующее интраоперационное обнаружение PM. Важно отметить, что этот метод не только идентифицировал поверхностно растущие метастазы, но и более глубоко расположенные метастазы, которые в противном случае остались бы незамеченными, что привело к изменению хирургической стратегии примерно в одной трети случаев (56). Это исследование демонстрирует доказательство концепции того, что интраоперационная визуализация может улучшить полноту резекции.Использование этой технологии для улучшения клинических результатов потребует дальнейшей идентификации соответствующих мишеней, экспрессируемых на ТЧ из CRC, и оптимизации основ индикаторов, методов визуализации и путей введения (рис. 1, 2). Важный вопрос заключается в том, имеют ли микроскопические внутрибрюшинные очаги-мишени достаточно функционирующих кровеносных сосудов, чтобы их можно было обнаружить с помощью системно вводимых индикаторов.
В настоящее время продемонстрирована клиническая осуществимость этого процесса (56, 57). Обнадеживает тот факт, что системное введение флуоресцентных моноклональных антител против СЕА было безопасным и позволяло последующее интраоперационное обнаружение PM. Важно отметить, что этот метод не только идентифицировал поверхностно растущие метастазы, но и более глубоко расположенные метастазы, которые в противном случае остались бы незамеченными, что привело к изменению хирургической стратегии примерно в одной трети случаев (56). Это исследование демонстрирует доказательство концепции того, что интраоперационная визуализация может улучшить полноту резекции.Использование этой технологии для улучшения клинических результатов потребует дальнейшей идентификации соответствующих мишеней, экспрессируемых на ТЧ из CRC, и оптимизации основ индикаторов, методов визуализации и путей введения (рис. 1, 2). Важный вопрос заключается в том, имеют ли микроскопические внутрибрюшинные очаги-мишени достаточно функционирующих кровеносных сосудов, чтобы их можно было обнаружить с помощью системно вводимых индикаторов.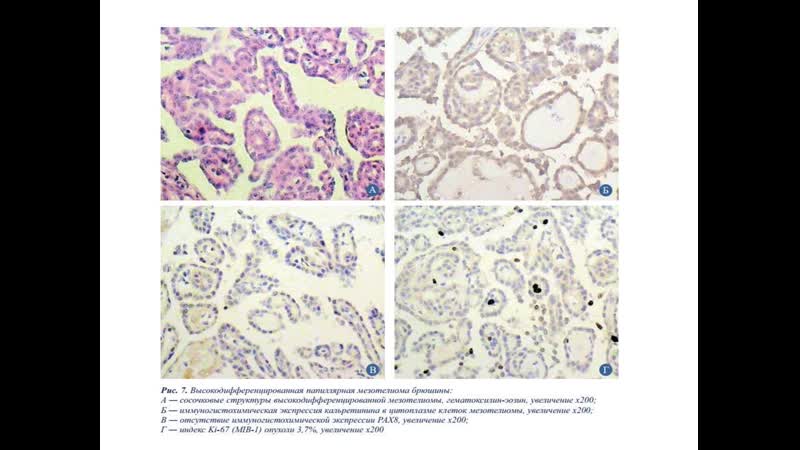
 Дополнительная ценность других режимов ГИПХ (в том числе с рационально подобранными комбинациями препаратов) у больных колоректальным раком еще не рассматривалась в рандомизированных исследованиях.
Дополнительная ценность других режимов ГИПХ (в том числе с рационально подобранными комбинациями препаратов) у больных колоректальным раком еще не рассматривалась в рандомизированных исследованиях. Кроме того, следует оценить добавленную стоимость тепла, и в случае муцинозных опухолей можно рассмотреть подход к (предварительной) очистке от слизи. Недавно была продемонстрирована осуществимость и безопасность внутрибрюшного растворения муцина при комбинированном введении бромелаина и ацетилцистеина у онкологических больных со муцинозными ПМ (61).Наконец, альтернативные лекарственные формы, которые продлевают время внутрибрюшинного введения лекарств (например, с использованием наночастиц, гидрогелей или альбумина), представляют собой привлекательный инновационный подход к повышению местной эффективности лекарств (62, 63).
Кроме того, следует оценить добавленную стоимость тепла, и в случае муцинозных опухолей можно рассмотреть подход к (предварительной) очистке от слизи. Недавно была продемонстрирована осуществимость и безопасность внутрибрюшного растворения муцина при комбинированном введении бромелаина и ацетилцистеина у онкологических больных со муцинозными ПМ (61).Наконец, альтернативные лекарственные формы, которые продлевают время внутрибрюшинного введения лекарств (например, с использованием наночастиц, гидрогелей или альбумина), представляют собой привлекательный инновационный подход к повышению местной эффективности лекарств (62, 63).
 Такие факторы могут включать специфические для участка различия в доставке лекарственного средства и проникновении в опухоль, биологию опухоли, внутреннюю резистентность [e.g., вызванный статусом CMS4 (20) или мутантным BRAF (1)], и метаболизмом лекарств. Понимание факторов, которые вызывают относительную резистентность ПМ к современным системным методам лечения, имеет центральное значение для разработки более эффективных схем системного лечения (рис. 1, 2).
Такие факторы могут включать специфические для участка различия в доставке лекарственного средства и проникновении в опухоль, биологию опухоли, внутреннюю резистентность [e.g., вызванный статусом CMS4 (20) или мутантным BRAF (1)], и метаболизмом лекарств. Понимание факторов, которые вызывают относительную резистентность ПМ к современным системным методам лечения, имеет центральное значение для разработки более эффективных схем системного лечения (рис. 1, 2).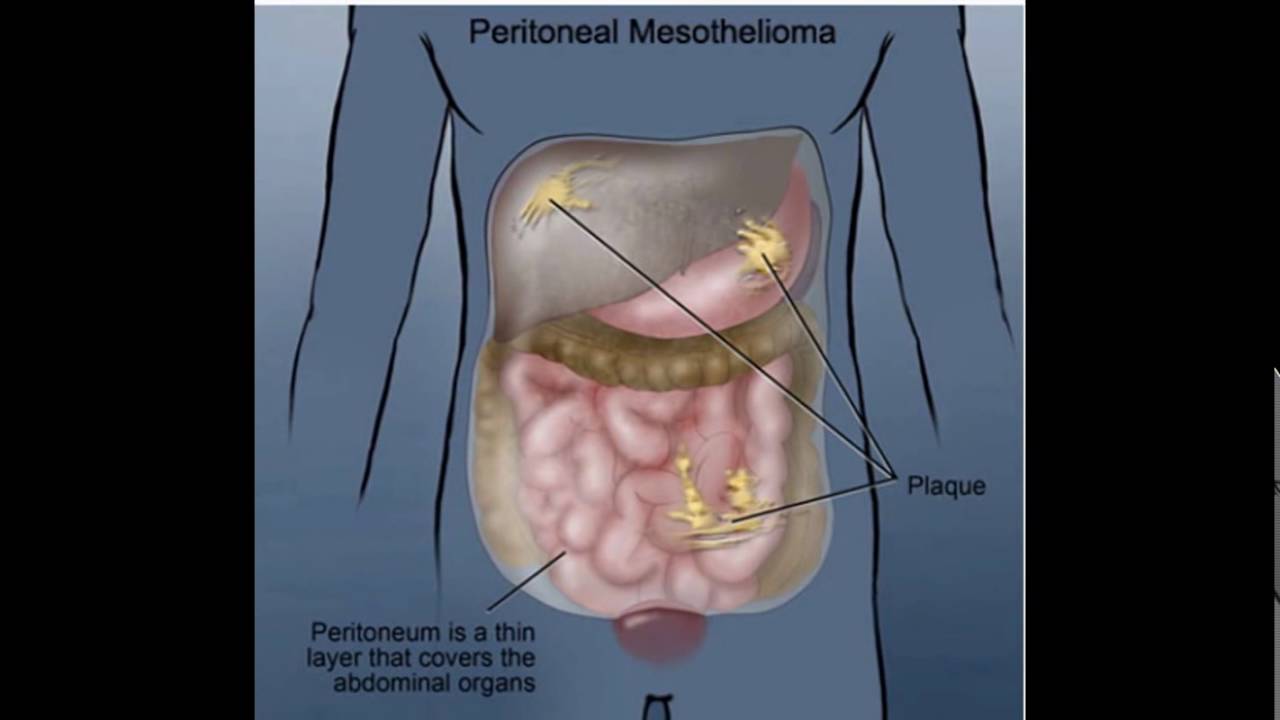

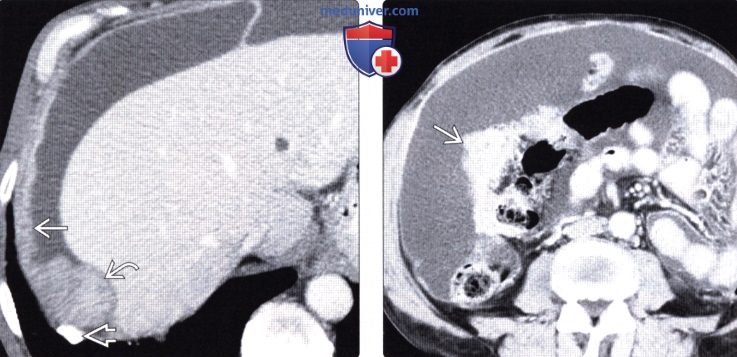 Модели эволюции опухоли описывают процессы, которые приводят к образованию способных к метастазированию клонов в первичных опухолях, сроки их диссеминации и факторы, определяющие успешный рост в отдаленных местах. Первичные опухоли, прорвавшие стенку толстой кишки, имеют непосредственный доступ в брюшную полость. Таким образом, образование ПМ может не требовать внутрисосудистого и экстравазационного этапов. Кроме того, объекты PM-посева представляют собой кластеры опухолевых клеток, которые отпочковываются от первичной опухоли (71).Связанные с раком фибробласты в микроокружении брюшины могут играть важную роль в процессе перитонеального посева раковых клеток (72). Для подробного описания роли микроокружения в формировании ТЧ мы отсылаем читателя к превосходному недавнему обзору по этой теме (73). По-видимому, при этом способе диссеминации также не требуется одноклеточная стадия. Интересно, что опухоли, которые не полностью прорывают стенку толстой кишки (т. е. Т1-Т3), также часто вызывают ПМ (74).
Модели эволюции опухоли описывают процессы, которые приводят к образованию способных к метастазированию клонов в первичных опухолях, сроки их диссеминации и факторы, определяющие успешный рост в отдаленных местах. Первичные опухоли, прорвавшие стенку толстой кишки, имеют непосредственный доступ в брюшную полость. Таким образом, образование ПМ может не требовать внутрисосудистого и экстравазационного этапов. Кроме того, объекты PM-посева представляют собой кластеры опухолевых клеток, которые отпочковываются от первичной опухоли (71).Связанные с раком фибробласты в микроокружении брюшины могут играть важную роль в процессе перитонеального посева раковых клеток (72). Для подробного описания роли микроокружения в формировании ТЧ мы отсылаем читателя к превосходному недавнему обзору по этой теме (73). По-видимому, при этом способе диссеминации также не требуется одноклеточная стадия. Интересно, что опухоли, которые не полностью прорывают стенку толстой кишки (т. е. Т1-Т3), также часто вызывают ПМ (74).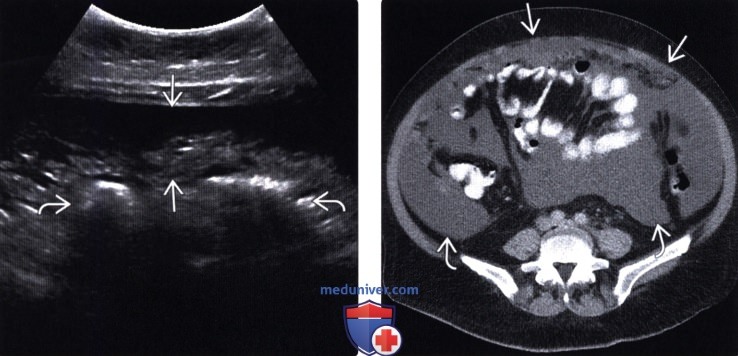 Это может быть связано с предвзятостью выборки, которая присуща гистологическому стадированию TNM. В качестве альтернативы раковые клетки могут отслоиться от первичной опухоли во время операции и впоследствии засеять брюшину. Тем не менее, также возможно существование альтернативных биологических путей образования ТЧ, которые в настоящее время неизвестны. Определение эволюционных взаимосвязей между множественными областями первичной опухоли, ПМ и метастазами в других местах даст представление об этом вопросе.
Это может быть связано с предвзятостью выборки, которая присуща гистологическому стадированию TNM. В качестве альтернативы раковые клетки могут отслоиться от первичной опухоли во время операции и впоследствии засеять брюшину. Тем не менее, также возможно существование альтернативных биологических путей образования ТЧ, которые в настоящее время неизвестны. Определение эволюционных взаимосвязей между множественными областями первичной опухоли, ПМ и метастазами в других местах даст представление об этом вопросе. Тем не менее, полногеномное секвенирование показало, что драйверные мутации в отдаленных метастазах, отличных от PM, очень однородны у отдельных пациентов, предположительно потому, что все они произошли от определенного субклона в первичной опухоли (76–78).Несмотря на это общее сходство, между метастазами КРР в печени и головном мозге существуют специфические генетические различия, влияющие на различные биологические процессы, что иллюстрирует принцип локализованной адаптации (79, 80). Очень мало известно об эволюционных процессах (мутации, изменение количества копий, эпигенетические модификации и т. д.), которые специфически формируют геном опухоли, компетентный в отношении PM. Тем не менее, специфические гистологические подтипы, в частности муцинозная аденокарцинома и перстневидно-клеточная карцинома, демонстрируют заметное предпочтение метастазирования в брюшину.Кроме того, опухоли с активирующими мутациями в BRAF и опухоли молекулярного подтипа CMS4 также склонны к формированию ПМ.
Тем не менее, полногеномное секвенирование показало, что драйверные мутации в отдаленных метастазах, отличных от PM, очень однородны у отдельных пациентов, предположительно потому, что все они произошли от определенного субклона в первичной опухоли (76–78).Несмотря на это общее сходство, между метастазами КРР в печени и головном мозге существуют специфические генетические различия, влияющие на различные биологические процессы, что иллюстрирует принцип локализованной адаптации (79, 80). Очень мало известно об эволюционных процессах (мутации, изменение количества копий, эпигенетические модификации и т. д.), которые специфически формируют геном опухоли, компетентный в отношении PM. Тем не менее, специфические гистологические подтипы, в частности муцинозная аденокарцинома и перстневидно-клеточная карцинома, демонстрируют заметное предпочтение метастазирования в брюшину.Кроме того, опухоли с активирующими мутациями в BRAF и опухоли молекулярного подтипа CMS4 также склонны к формированию ПМ.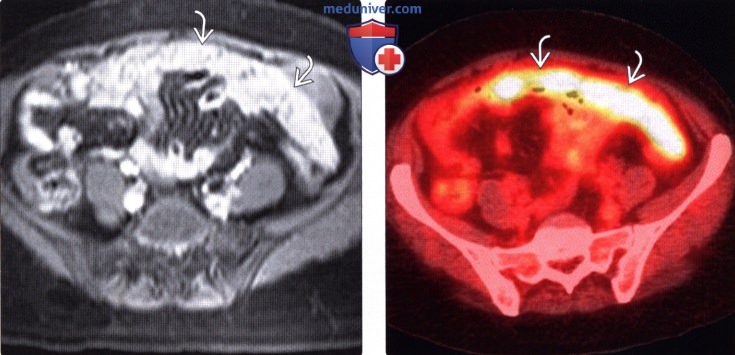 Понимание того, почему эти специфические гистологические и генетические подтипы опухолей связаны с образованием ПМ, приведет к разработке новых методов лечения и диагностических инструментов.
Понимание того, почему эти специфические гистологические и генетические подтипы опухолей связаны с образованием ПМ, приведет к разработке новых методов лечения и диагностических инструментов.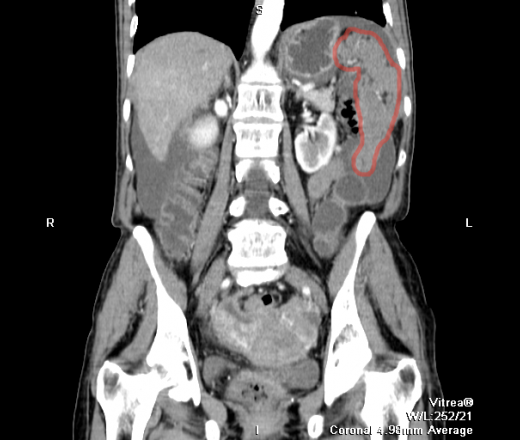 Следовательно, для полного понимания биологии ПМ потребуется (эпи-)генетический анализ как опухоли, так и пациента.
Следовательно, для полного понимания биологии ПМ потребуется (эпи-)генетический анализ как опухоли, так и пациента.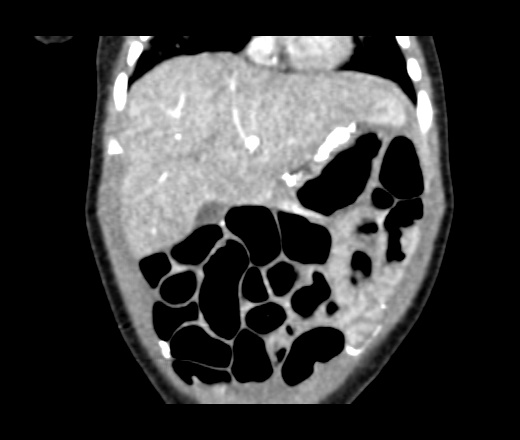 д. Эти данные станут прочной основой для разработки эффективных методов обнаружения ТЧ. и стратегии лечения.Например, обнаружение того, что PM в основном относятся к молекулярному подтипу CMS4 и часто несут активирующие мутации в онкогене BRAF, уже обеспечило два новых направления для разработки и тестирования альтернативных терапевтических подходов. Например, TGFb является центральным игроком в агрессивном CRC (83) и управляет ассоциированным с опухолью фиброзом и перекрестными помехами между фибробластами и раковыми клетками, что является отличительной чертой CMS4 CRC (83–85). В настоящее время разрабатываются несколько агентов, нацеленных на TGFb, для лечения CRC (номера испытаний: NCT03470350; NCT03436563), и они могут быть особенно эффективны для нацеливания на CMS4 CRC, включая PM.
д. Эти данные станут прочной основой для разработки эффективных методов обнаружения ТЧ. и стратегии лечения.Например, обнаружение того, что PM в основном относятся к молекулярному подтипу CMS4 и часто несут активирующие мутации в онкогене BRAF, уже обеспечило два новых направления для разработки и тестирования альтернативных терапевтических подходов. Например, TGFb является центральным игроком в агрессивном CRC (83) и управляет ассоциированным с опухолью фиброзом и перекрестными помехами между фибробластами и раковыми клетками, что является отличительной чертой CMS4 CRC (83–85). В настоящее время разрабатываются несколько агентов, нацеленных на TGFb, для лечения CRC (номера испытаний: NCT03470350; NCT03436563), и они могут быть особенно эффективны для нацеливания на CMS4 CRC, включая PM.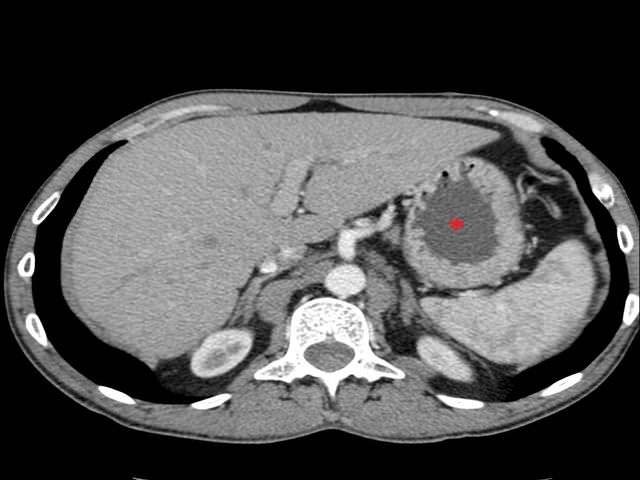 К сожалению, этот подход не принимает во внимание, что ПМ являются высокоспецифическим заболеванием с особенностями, которые не обязательно воспроизводятся в традиционных моделях клеточных линий.Более того, метод культивирования, который используется для создания традиционных клеточных линий, вызывает глубокие геномные перестройки, что приводит к росту тщательно отобранных субклонов, плохо напоминающих исходные опухоли. Таким образом, обоснованность этих моделей при изучении биологии ПМ сомнительна.
К сожалению, этот подход не принимает во внимание, что ПМ являются высокоспецифическим заболеванием с особенностями, которые не обязательно воспроизводятся в традиционных моделях клеточных линий.Более того, метод культивирования, который используется для создания традиционных клеточных линий, вызывает глубокие геномные перестройки, что приводит к росту тщательно отобранных субклонов, плохо напоминающих исходные опухоли. Таким образом, обоснованность этих моделей при изучении биологии ПМ сомнительна. Органоидные культуры фиксируют (по крайней мере, до некоторой степени) функциональную и генетическую гетерогенность, характерную для CRC (86, 87). Кроме того, органоиды также могут быть использованы для создания моделей спонтанных метастазов с использованием методов микрохирургической трансплантации (88).Технология органоидов уже доказала свою клиническую значимость при первичном и метастатическом КРР, поскольку ответ на лечение, наблюдаемый у органоидов, очень похож на наблюдаемый у онкологических больных в многочисленных независимых исследованиях (40–43). Однако до сих пор PM не были включены в эти исследования. Мы и другие недавно показали, что органоидная технология может быть использована для создания новых моделей ПМ и что эти модели могут улучшить лечение ПМ либо за счет рационального подхода к выбору и тестированию лекарств, либо за счет беспристрастного скрининга лекарств (37, 38). ).Действительно, лекарственный скрининг органоидов, полученных из ТЧ, может выявить альтернативные персонализированные варианты лечения для пациентов, у которых стандартное лечение оказалось неэффективным (37).
Органоидные культуры фиксируют (по крайней мере, до некоторой степени) функциональную и генетическую гетерогенность, характерную для CRC (86, 87). Кроме того, органоиды также могут быть использованы для создания моделей спонтанных метастазов с использованием методов микрохирургической трансплантации (88).Технология органоидов уже доказала свою клиническую значимость при первичном и метастатическом КРР, поскольку ответ на лечение, наблюдаемый у органоидов, очень похож на наблюдаемый у онкологических больных в многочисленных независимых исследованиях (40–43). Однако до сих пор PM не были включены в эти исследования. Мы и другие недавно показали, что органоидная технология может быть использована для создания новых моделей ПМ и что эти модели могут улучшить лечение ПМ либо за счет рационального подхода к выбору и тестированию лекарств, либо за счет беспристрастного скрининга лекарств (37, 38). ).Действительно, лекарственный скрининг органоидов, полученных из ТЧ, может выявить альтернативные персонализированные варианты лечения для пациентов, у которых стандартное лечение оказалось неэффективным (37).
 DW-MRI или молекулярная визуализация, основанная на экспрессии FAP, может иметь достаточную специфичность и селективность для планирования таких испытаний (14, 15). Кроме того, на основе анализа ткани PM можно определить специфические для PM маркеры или метаболические пути. Они могут послужить целями для разработки альтернативных методов обнаружения и лечения ТЧ.
DW-MRI или молекулярная визуализация, основанная на экспрессии FAP, может иметь достаточную специфичность и селективность для планирования таких испытаний (14, 15). Кроме того, на основе анализа ткани PM можно определить специфические для PM маркеры или метаболические пути. Они могут послужить целями для разработки альтернативных методов обнаружения и лечения ТЧ.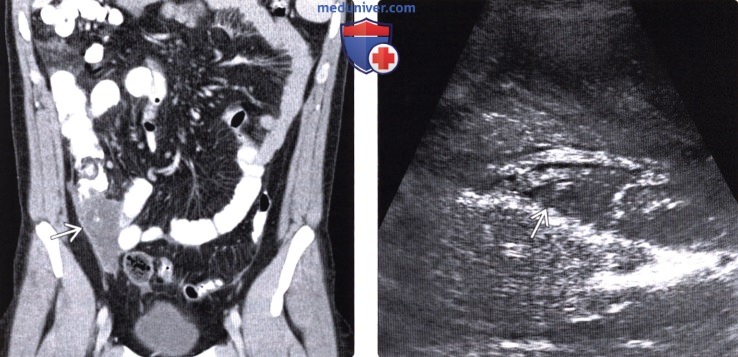 В частности, гидрогели со свойствами самовосстановления имеют большие перспективы в этой области и должны быть испытаны на доклинических моделях in vitro и in vivo с использованием органоидов, полученных из PM.
В частности, гидрогели со свойствами самовосстановления имеют большие перспективы в этой области и должны быть испытаны на доклинических моделях in vitro и in vivo с использованием органоидов, полученных из PM.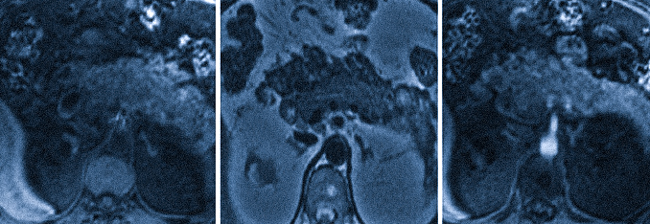 Действительно, ингибирование ATR продемонстрировало большой синергизм в уничтожении органоидов, происходящих из PM, в сочетании со стандартным лекарственным средством MMC при 42 ° C (38). Чтобы максимизировать противоопухолевые эффекты применения тепла во время HIPEC, эта и другие концепции теперь должны быть дополнительно протестированы на платформе органоидов и на доклинических животных моделях с инициируемыми органоидами PM.
Действительно, ингибирование ATR продемонстрировало большой синергизм в уничтожении органоидов, происходящих из PM, в сочетании со стандартным лекарственным средством MMC при 42 ° C (38). Чтобы максимизировать противоопухолевые эффекты применения тепла во время HIPEC, эта и другие концепции теперь должны быть дополнительно протестированы на платформе органоидов и на доклинических животных моделях с инициируемыми органоидами PM. Мы надеемся, что описанная здесь структура исследования поможет структурировать усилия по достижению этой цели.
Мы надеемся, что описанная здесь структура исследования поможет структурировать усилия по достижению этой цели. Franko J. Терапевтическая эффективность системной терапии колоректального перитонеального карциноматоза: взгляд хирурга. Плевра Брюшина . (2018) 3:20180102. doi: 10.1515/pp-2018-0102
Franko J. Терапевтическая эффективность системной терапии колоректального перитонеального карциноматоза: взгляд хирурга. Плевра Брюшина . (2018) 3:20180102. doi: 10.1515/pp-2018-0102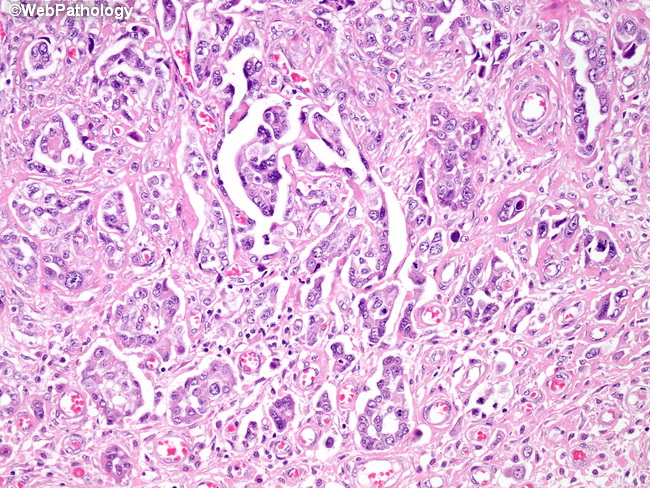 Метастатическая картина колоректального рака сильно зависит от гистологического подтипа. Энн Онкол. (2014) 25:651–7. doi: 10.1093/annonc/mdt591
Метастатическая картина колоректального рака сильно зависит от гистологического подтипа. Энн Онкол. (2014) 25:651–7. doi: 10.1093/annonc/mdt591 Рак. (2000) 88:358–63. doi: 10.1002/(sici)1097-0142(20000115)88:2<358::aid-cncr16>3.0.co;2-o
Рак. (2000) 88:358–63. doi: 10.1002/(sici)1097-0142(20000115)88:2<358::aid-cncr16>3.0.co;2-o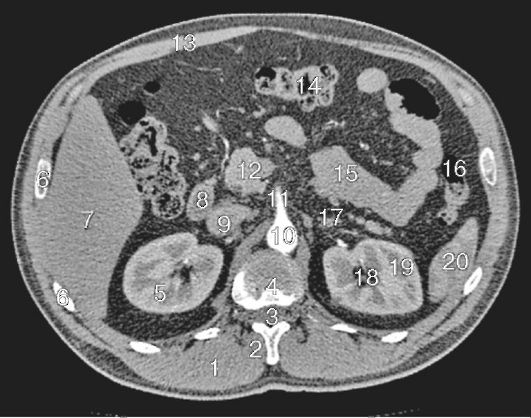 , Шарма А., Паппас С.Г., Гамблин Т.К., Турага К.К. Роль лапароскопии у пациентов с перитонеальными метастазами, рассматриваемая для циторедуктивной хирургии и гипертермической внутрибрюшинной химиотерапии (HIPEC). World J Surg Oncol. (2014) 12:270. дои: 10.1186/1477-7819-12-270
, Шарма А., Паппас С.Г., Гамблин Т.К., Турага К.К. Роль лапароскопии у пациентов с перитонеальными метастазами, рассматриваемая для циторедуктивной хирургии и гипертермической внутрибрюшинной химиотерапии (HIPEC). World J Surg Oncol. (2014) 12:270. дои: 10.1186/1477-7819-12-270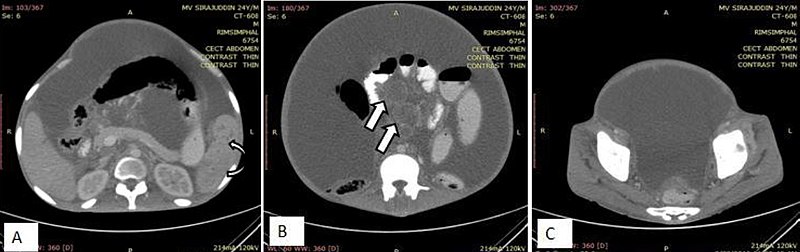 Энн Сург Онкол. (2015) 22:2958–64. doi: 10.1245/s10434-015-4387-5
Энн Сург Онкол. (2015) 22:2958–64. doi: 10.1245/s10434-015-4387-5 Евро Радиол. (2020) 30:3101–12. doi: 10.1007/s00330-019-06524-x
Евро Радиол. (2020) 30:3101–12. doi: 10.1007/s00330-019-06524-x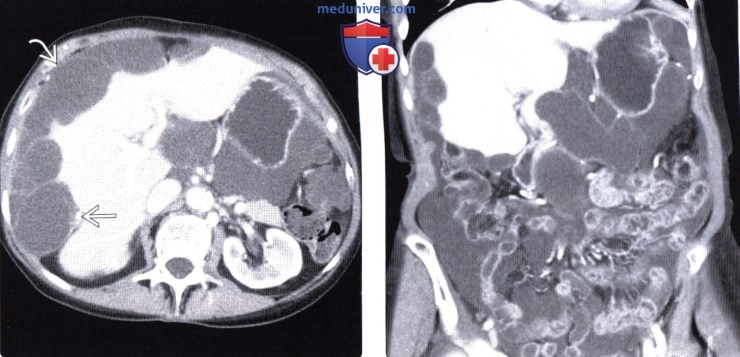 Eur J Surg Oncol. (2014) 40:963–9. doi: 10.1016/j.ejso.2013.10.001
Eur J Surg Oncol. (2014) 40:963–9. doi: 10.1016/j.ejso.2013.10.001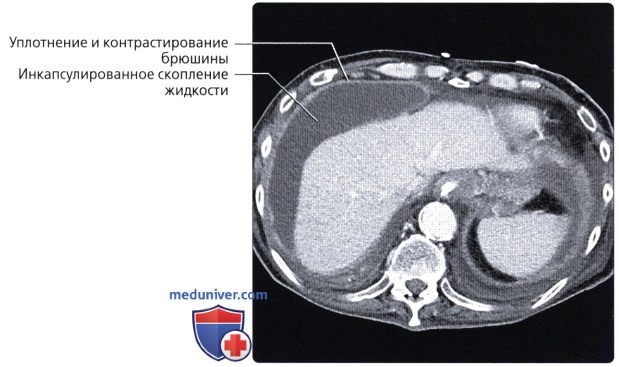 Индивидуальное прогнозирование риска метахронного перитонеального карциноматоза при колоректальном раке. Колоректальный дис. (2014) 16:359–67. doi: 10.1111/codi.12552
Индивидуальное прогнозирование риска метахронного перитонеального карциноматоза при колоректальном раке. Колоректальный дис. (2014) 16:359–67. doi: 10.1111/codi.12552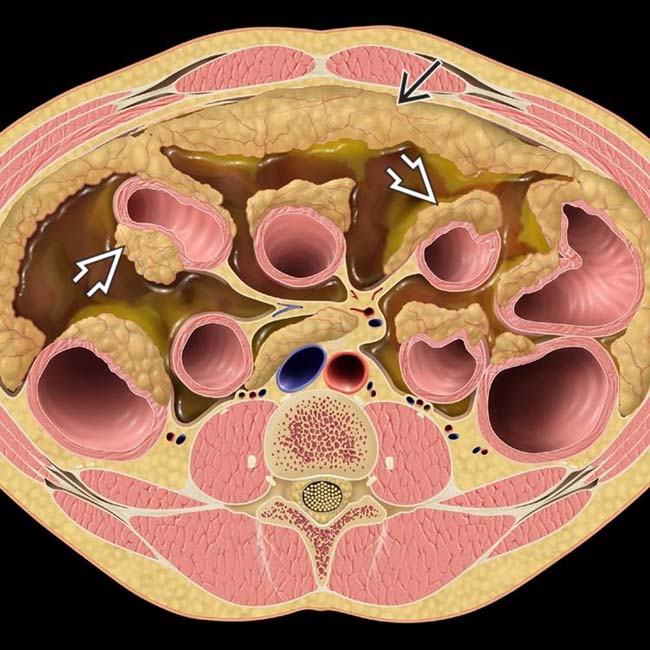 Шугарбейкер РН. Хирургия второго взгляда на колоректальный рак: пересмотренные факторы выбора и новые варианты лечения для большего успеха. Int J Surg Oncol . (2011) 2011:
Шугарбейкер РН. Хирургия второго взгляда на колоректальный рак: пересмотренные факторы выбора и новые варианты лечения для большего успеха. Int J Surg Oncol . (2011) 2011: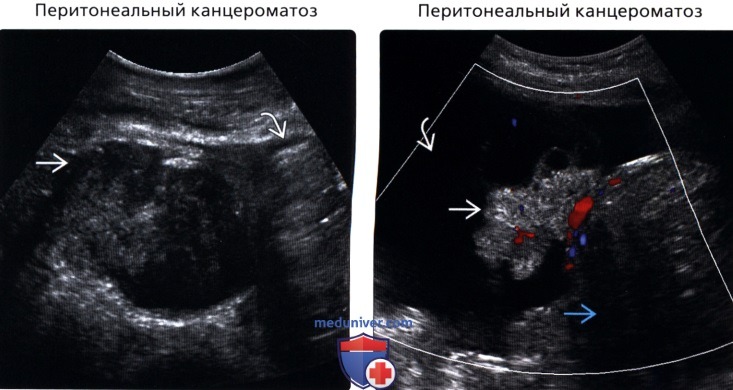 (2019) 4: 761–70. дои: 10.1016/S2468-1253(19)30239-0
(2019) 4: 761–70. дои: 10.1016/S2468-1253(19)30239-0 Анализ ДНК циркулирующей опухоли выявляет минимальное остаточное заболевание и прогнозирует рецидив у пациентов с раком толстой кишки II стадии. Sci Transl Med. (2016) 8:346ra92. doi: 10.1126/scitranslmed.aaf6219
Анализ ДНК циркулирующей опухоли выявляет минимальное остаточное заболевание и прогнозирует рецидив у пациентов с раком толстой кишки II стадии. Sci Transl Med. (2016) 8:346ra92. doi: 10.1126/scitranslmed.aaf6219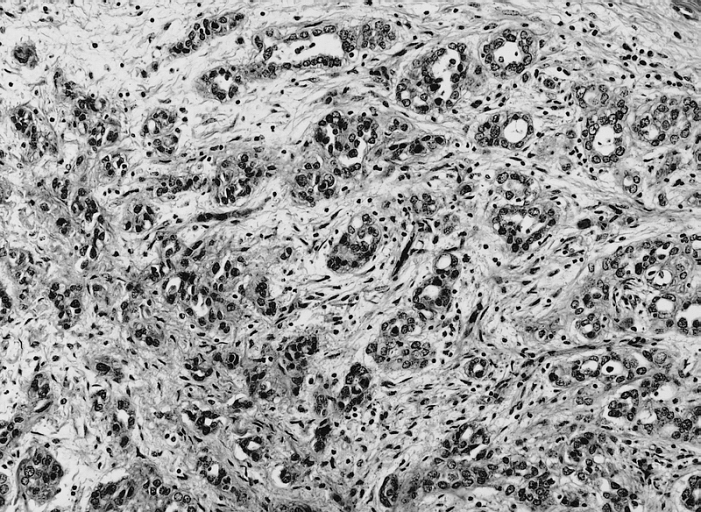 van t Erve I. Обнаружение бесклеточной ДНК опухоли из перитонеальных метастазов колоректального рака в плазме и перитонеальной жидкости. Дж. Патол . в печати (2021)
van t Erve I. Обнаружение бесклеточной ДНК опухоли из перитонеальных метастазов колоректального рака в плазме и перитонеальной жидкости. Дж. Патол . в печати (2021) Ganesh Wu C, O’Rourke KP, Szeglin BC, Zheng Y, Sauve CG, Adileh M, et al.Платформа органоидов рака прямой кишки для изучения индивидуальной реакции на химиолучевую терапию. Nat Med. (2019) 25:1607–14. doi: 10.1038/s41591-019-0584-2
Ganesh Wu C, O’Rourke KP, Szeglin BC, Zheng Y, Sauve CG, Adileh M, et al.Платформа органоидов рака прямой кишки для изучения индивидуальной реакции на химиолучевую терапию. Nat Med. (2019) 25:1607–14. doi: 10.1038/s41591-019-0584-2 Yao Y, Xu X, Yang L, Zhu J, Wan J, Shen L, et al. Органоиды, полученные от пациентов, позволяют прогнозировать реакцию химиолучевой терапии при местно-распространенном раке прямой кишки. Стволовая клетка. (2020) 26:17–26e6. doi: 10.1016/j.stem.2019.10.010
Yao Y, Xu X, Yang L, Zhu J, Wan J, Shen L, et al. Органоиды, полученные от пациентов, позволяют прогнозировать реакцию химиолучевой терапии при местно-распространенном раке прямой кишки. Стволовая клетка. (2020) 26:17–26e6. doi: 10.1016/j.stem.2019.10.010 Sugarbaker PH, Zhu BW, Sese GB, Shmookler B. Перитонеальный карциноматоз от рака аппендикса: результаты лечения 69 пациентов с помощью циторедуктивной хирургии и внутрибрюшинной химиотерапии. Рассечение прямой кишки. (1993) 36:323–9. дои: 10.1007/BF02053933
Sugarbaker PH, Zhu BW, Sese GB, Shmookler B. Перитонеальный карциноматоз от рака аппендикса: результаты лечения 69 пациентов с помощью циторедуктивной хирургии и внутрибрюшинной химиотерапии. Рассечение прямой кишки. (1993) 36:323–9. дои: 10.1007/BF02053933 (2004) 85:61–7. doi: 10.1002/jso.20013
(2004) 85:61–7. doi: 10.1002/jso.20013 Энн Сург Онкол. (2008) 15:2426–32. doi: 10.1245/s10434-008-9966-2
Энн Сург Онкол. (2008) 15:2426–32. doi: 10.1245/s10434-008-9966-2 25356
25356 Ланцет Гастроэнтерол Гепатол. (2018) 3:181–91. doi: 10.1016/S2468-1253(17)30395-3
Ланцет Гастроэнтерол Гепатол. (2018) 3:181–91. doi: 10.1016/S2468-1253(17)30395-3 JAMA Oncol. (2016) 2:1162–9. doi: 10.1001/jamaoncol.2016.2314
JAMA Oncol. (2016) 2:1162–9. doi: 10.1001/jamaoncol.2016.2314 Противораковый рез. (2015) 35:627–34.
Противораковый рез. (2015) 35:627–34.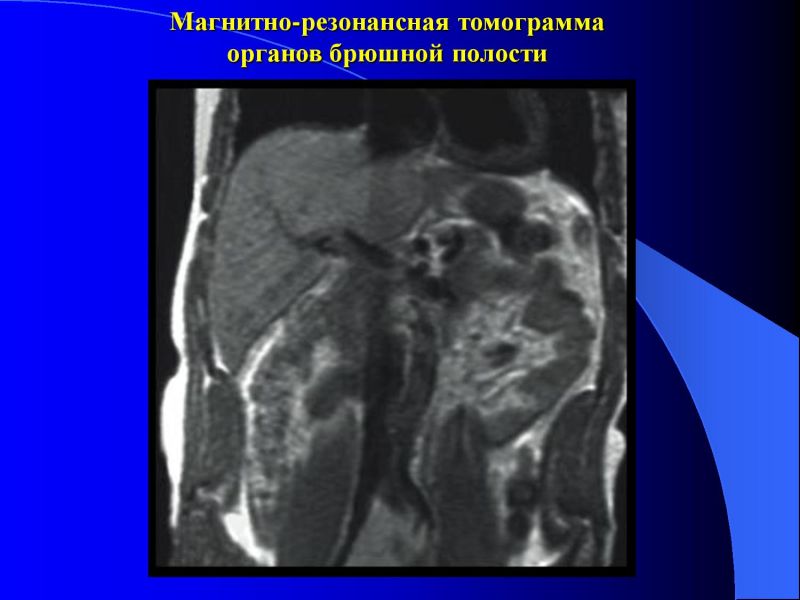 Punt CJ, Koopman M, Vermeulen L. От неоднородности опухоли к достижениям в прецизионном лечении колоректального рака. Nat Rev Clin Oncol. (2017) 14: 235–46. doi: 10.1038/nrclinonc.2016.171
Punt CJ, Koopman M, Vermeulen L. От неоднородности опухоли к достижениям в прецизионном лечении колоректального рака. Nat Rev Clin Oncol. (2017) 14: 235–46. doi: 10.1038/nrclinonc.2016.171 BMJ Открытый. (2019) 9:e034508. doi: 10.1136/bmjopen-2019-034508
BMJ Открытый. (2019) 9:e034508. doi: 10.1136/bmjopen-2019-034508 Zajac Raingeaud J, Libanje F, Lefebvre C, Sabino D, Martins I, Roy P, et al.Опухолевые сферы с инвертированной полярностью вызывают образование перитонеальных метастазов у пациентов с гиперметилированными колоректальными карциномами. Nat Cell Biol. (2018) 20: 296–306. doi: 10.1038/s41556-017-0027-6
Zajac Raingeaud J, Libanje F, Lefebvre C, Sabino D, Martins I, Roy P, et al.Опухолевые сферы с инвертированной полярностью вызывают образование перитонеальных метастазов у пациентов с гиперметилированными колоректальными карциномами. Nat Cell Biol. (2018) 20: 296–306. doi: 10.1038/s41556-017-0027-6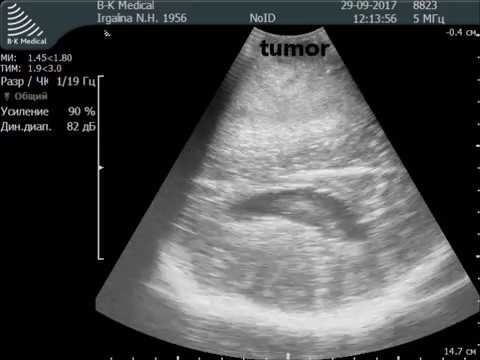 Lemmens VE, Klaver YL, Verwaal VJ, Rutten HJ, Coebergh JW, de Hingh IH. Предикторы и выживаемость синхронного карциноматоза брюшины колоректального происхождения: популяционное исследование. Int J Рак. (2011) 128:2717–25. doi: 10.1002/ijc.25596
Lemmens VE, Klaver YL, Verwaal VJ, Rutten HJ, Coebergh JW, de Hingh IH. Предикторы и выживаемость синхронного карциноматоза брюшины колоректального происхождения: популяционное исследование. Int J Рак. (2011) 128:2717–25. doi: 10.1002/ijc.25596 Yaeger R, Chatila WK, Lipsyc MD, Hechtman JF, Cercek A, Sanchez-Vega F, et al. Клиническое секвенирование определяет геномный ландшафт метастатического колоректального рака. Раковая клетка. (2018) 33:125–36e3.doi: 10.1016/j.ccell.2017.12.004
Yaeger R, Chatila WK, Lipsyc MD, Hechtman JF, Cercek A, Sanchez-Vega F, et al. Клиническое секвенирование определяет геномный ландшафт метастатического колоректального рака. Раковая клетка. (2018) 33:125–36e3.doi: 10.1016/j.ccell.2017.12.004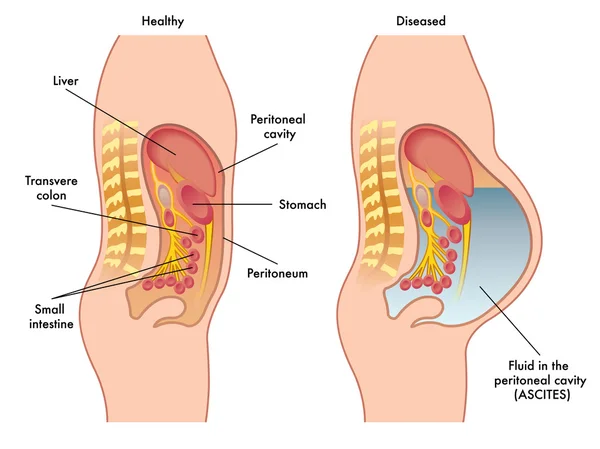 Геномные сигнатуры выявляют дефицит ответа на повреждение ДНК при метастазах колоректального рака в головной мозг. Нац.коммун. (2019) 10:3190. doi: 10.1038/s41467-019-10987-3
Геномные сигнатуры выявляют дефицит ответа на повреждение ДНК при метастазах колоректального рака в головной мозг. Нац.коммун. (2019) 10:3190. doi: 10.1038/s41467-019-10987-3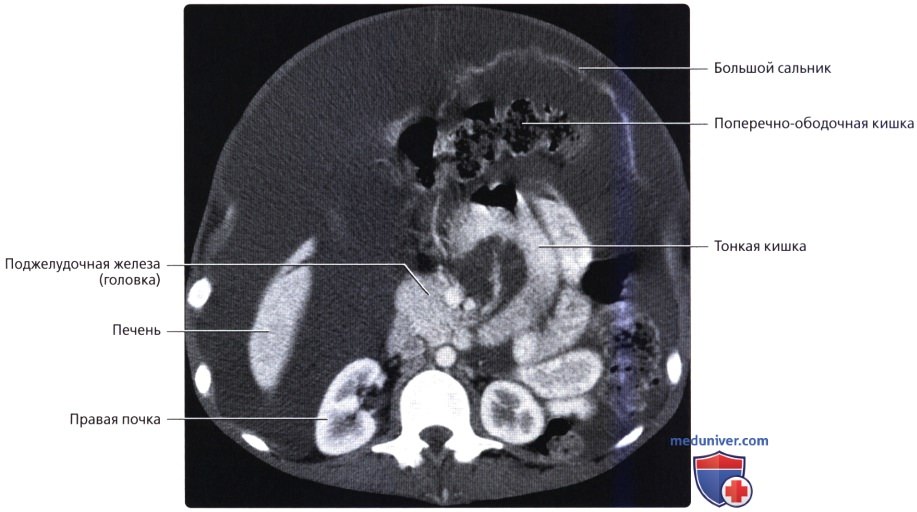 В. и др. Зависимость колоректального рака от TGF-бета-управляемой программы в стромальных клетках для инициации метастазирования. Раковая клетка. (2012) 22:571–84. doi: 10.1016/j.ccr.2012.08.013
В. и др. Зависимость колоректального рака от TGF-бета-управляемой программы в стромальных клетках для инициации метастазирования. Раковая клетка. (2012) 22:571–84. doi: 10.1016/j.ccr.2012.08.013 Внутриопухолевая диверсификация при колоректальном раке на уровне одной клетки. Природа. (2018) 556:457–62. doi: 10.1038/s41586-018-0024-3
Внутриопухолевая диверсификация при колоректальном раке на уровне одной клетки. Природа. (2018) 556:457–62. doi: 10.1038/s41586-018-0024-3 Kok HP, Cressman ENK, Ceelen W, Brace CL, Ivkov R, Grull H, et al.Нагревательная технология при злокачественных опухолях: обзор. Int J Гипертермия. (2020) 37:711–41. дои: 10.1080/02656736.2020.1779357
Kok HP, Cressman ENK, Ceelen W, Brace CL, Ivkov R, Grull H, et al.Нагревательная технология при злокачественных опухолях: обзор. Int J Гипертермия. (2020) 37:711–41. дои: 10.1080/02656736.2020.1779357.jpg) Пожалуйста, повторите попытку позже. Если у вас по-прежнему возникает эта проблема, свяжитесь с нами по адресу
Пожалуйста, повторите попытку позже. Если у вас по-прежнему возникает эта проблема, свяжитесь с нами по адресу  У него заподозрили непроходимость кишечника, и была проведена компьютерная томография брюшной полости и таза с контрастом (см. рисунки).
У него заподозрили непроходимость кишечника, и была проведена компьютерная томография брюшной полости и таза с контрастом (см. рисунки). В левой нижней части живота отмечена концевая колостомия.
В левой нижней части живота отмечена концевая колостомия.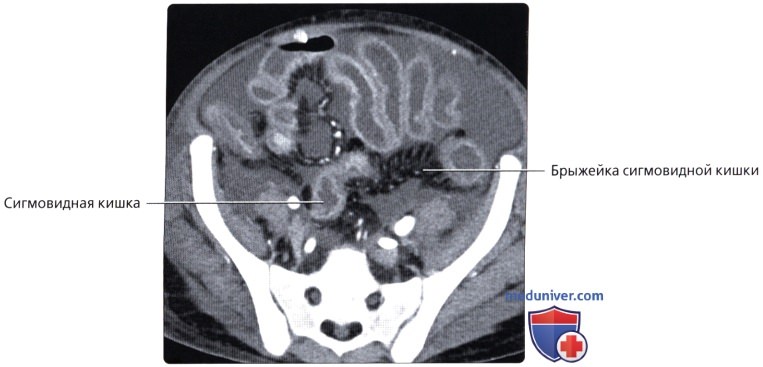
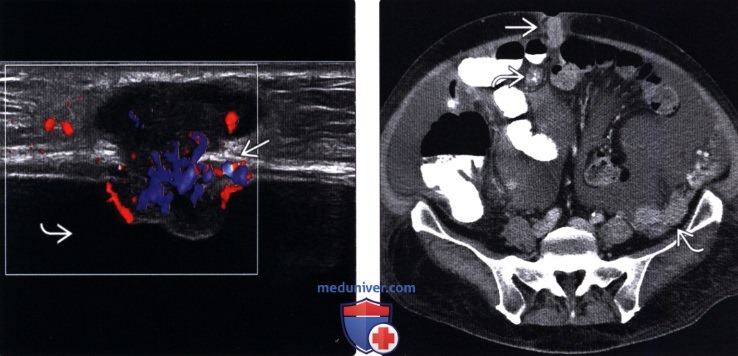

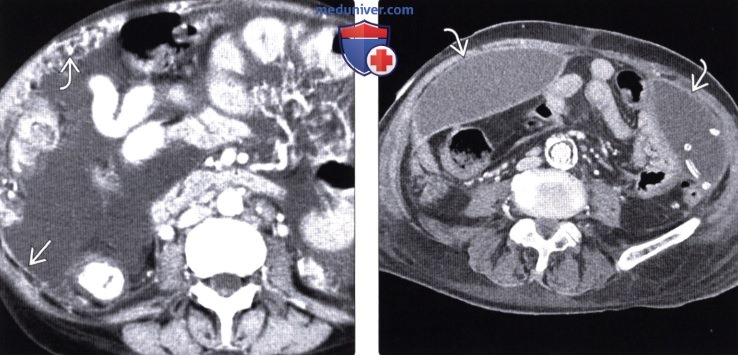
 Они сообщили о медиане выживаемости 15 месяцев по сравнению с 15 месяцами.3 месяца среди пациентов, получивших наилучшую поддерживающую терапию. Роль системной химиотерапии у пациентов с карциноматозом брюшины при раке желудка четко не определена, но есть некоторые данные, свидетельствующие об улучшении ОВ примерно до 7–10 месяцев.
Они сообщили о медиане выживаемости 15 месяцев по сравнению с 15 месяцами.3 месяца среди пациентов, получивших наилучшую поддерживающую терапию. Роль системной химиотерапии у пациентов с карциноматозом брюшины при раке желудка четко не определена, но есть некоторые данные, свидетельствующие об улучшении ОВ примерно до 7–10 месяцев. Луки-Рузвельта и Медицинском центре Бет Исраэль, адъюнкт-профессор клинической радиологии Колледжа врачей и хирургов Колумбийского университета и редактор раздела HemOnc Today .Рангасвами Чинтапатла, доктор медицинских наук, научный сотрудник в области гематологии и онкологии в Больничном центре Св. Луки-Рузвельта. Майкл Томас Старк, доктор медицинских наук, является резидентом радиологического отделения Больничного центра Св. Луки-Рузвельта. Габриэль Сара, доктор медицинских наук, лечит гематологию/онкологию в Больничном центре Св. Луки-Рузвельта. Раскрытие информации: Drs. Гесани, Чинтапатла, Старк и Сара не сообщают о соответствующих финансовых раскрытиях.
Луки-Рузвельта и Медицинском центре Бет Исраэль, адъюнкт-профессор клинической радиологии Колледжа врачей и хирургов Колумбийского университета и редактор раздела HemOnc Today .Рангасвами Чинтапатла, доктор медицинских наук, научный сотрудник в области гематологии и онкологии в Больничном центре Св. Луки-Рузвельта. Майкл Томас Старк, доктор медицинских наук, является резидентом радиологического отделения Больничного центра Св. Луки-Рузвельта. Габриэль Сара, доктор медицинских наук, лечит гематологию/онкологию в Больничном центре Св. Луки-Рузвельта. Раскрытие информации: Drs. Гесани, Чинтапатла, Старк и Сара не сообщают о соответствующих финансовых раскрытиях. Подписаться Нам не удалось обработать ваш запрос. Пожалуйста, повторите попытку позже. Если у вас по-прежнему возникает эта проблема, свяжитесь с нами по адресу
Подписаться Нам не удалось обработать ваш запрос. Пожалуйста, повторите попытку позже. Если у вас по-прежнему возникает эта проблема, свяжитесь с нами по адресу 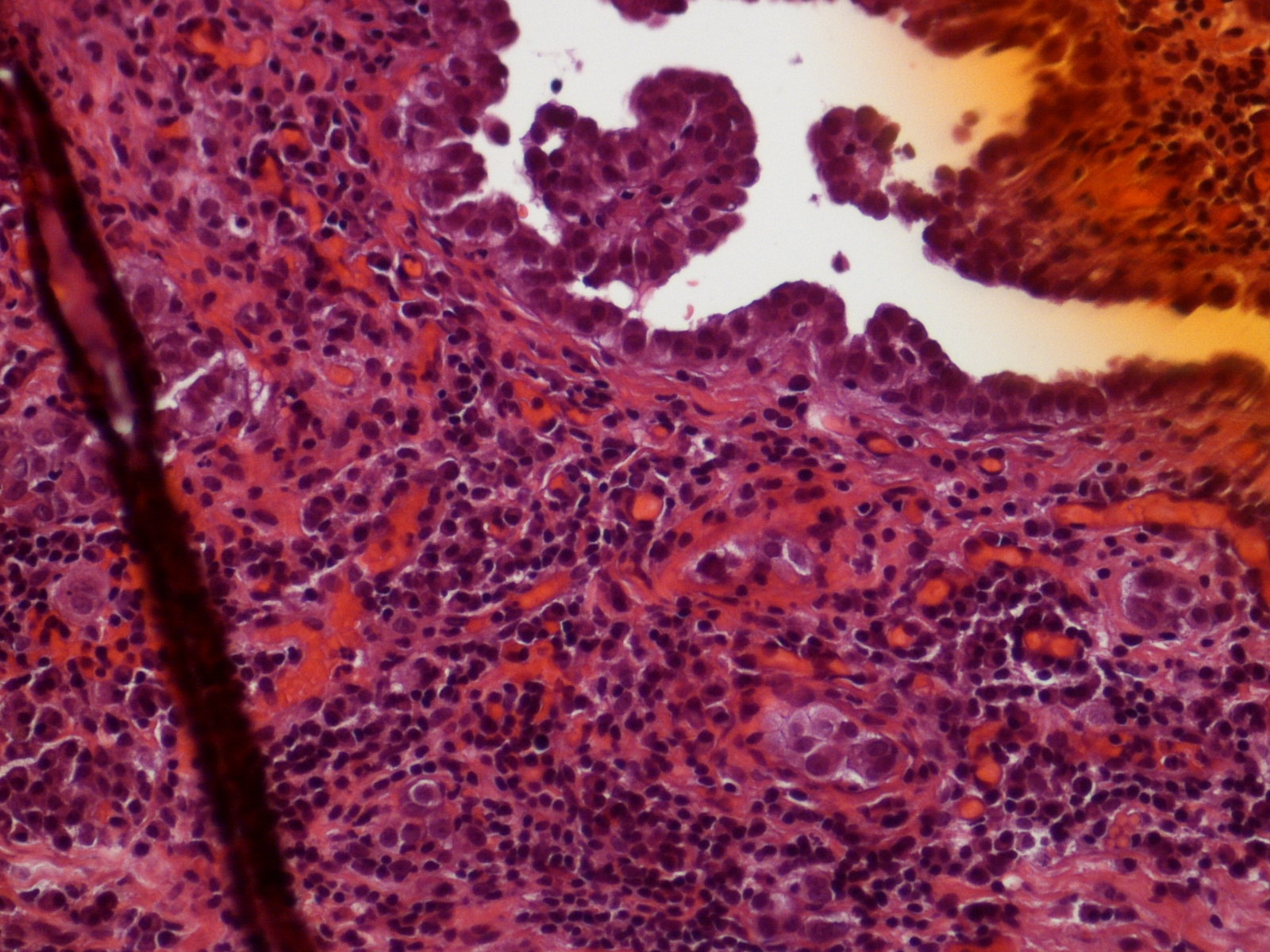 Каждая группа лечения будет сравниваться с теоретическими показателями с использованием плана с одним этапом (без промежуточного анализа основного критерия эффективности).
Каждая группа лечения будет сравниваться с теоретическими показателями с использованием плана с одним этапом (без промежуточного анализа основного критерия эффективности).