Канцероматоз кишечника: Канцероматоз – один из самых неблагоприятных вариантов прогрессирования ряда онкологических заболеваний
Перитонеальный канцероматоз — симпотмы , признаки.
Вам поставили диагноз: перитонеальный канцероматоз (опухоль брюшины)
Наверняка вы задаётесь вопросом: что же теперь делать? Подобный диагноз всегда делит жизнь на «до» и «после». Все эмоциональные ресурсы пациента и его родных брошены на переживания и страх. Но именно в этот момент необходимо изменить вектор «за что» на вектор «что можно сделать». Очень часто пациенты чувствуют себя безгранично одинокими вначале пути. Но вы должны понимать — вы не одни. Мы поможем вам справиться с болезнью и будем идти с Вами рука об руку через все этапы вашего лечения.
Предлагаем Вашему вниманию краткий, но очень подробный обзор перитонеального канцероматоза.
Введение
Перитонеальный канцероматоз (опухоль брюшины) — одно из самых грозных вариантов прогрессирования целого ряда онкологических заболеваний. Канцероматоз является формой метастазирования, при которой опухолевые клетки распространяются по внутренней выстилке анатомической полости (брюшной или плевральной) и формируют на ней мелкие узелки, так называемые диссеминаты. Ее возникновение в большинстве случаев подразумевает IV стадию заболевания, и сопряжено с неблагоприятным прогнозом для пациента. Лечение пациентов с перитонеальным канцероматозом является одной из самых сложных задач в онкологии. Наиболее часто он развивается при злокачественных новообразованиях желудочно-кишечного тракта, дыхательной системы и женских репродуктивных органов. При каких опухолях может развиваться перитонеальный канцероматоз? При раке желудка, раке легкого, раке толстой и тонкой кишки, раке яичников, муцинозных опухолях червеобразного отростка. мезотелиоме брюшины или плевры, раке поджелудочной железы, саркоме брюшной полости (саркоматоз).
Ее возникновение в большинстве случаев подразумевает IV стадию заболевания, и сопряжено с неблагоприятным прогнозом для пациента. Лечение пациентов с перитонеальным канцероматозом является одной из самых сложных задач в онкологии. Наиболее часто он развивается при злокачественных новообразованиях желудочно-кишечного тракта, дыхательной системы и женских репродуктивных органов. При каких опухолях может развиваться перитонеальный канцероматоз? При раке желудка, раке легкого, раке толстой и тонкой кишки, раке яичников, муцинозных опухолях червеобразного отростка. мезотелиоме брюшины или плевры, раке поджелудочной железы, саркоме брюшной полости (саркоматоз).
Согласно данным статистики, перитонеальный канцероматоз встречается у 20-35% пациентов с онкопатологией: в 40% случаев данное осложнение формируется при опухолях желудочно-кишечного тракта, в 30% — при раке яичников (причем на момент верификации диагноза рака яичников у подавляющего большинства пациенток уже имеет место поражение брюшины). Перитонеальный канцероматоз (опухоль брюшины) является неблагоприятным прогностическим фактором; данная форма прогрессирующего опухолевого поражения практически не поддается хирургическому лечению, а применение только системной химиотерапии улучшает состояние лишь на некоторое время.
Перитонеальный канцероматоз (опухоль брюшины) является неблагоприятным прогностическим фактором; данная форма прогрессирующего опухолевого поражения практически не поддается хирургическому лечению, а применение только системной химиотерапии улучшает состояние лишь на некоторое время.
Причины возникновения перитонеального канцероматоза
Перитонеальный канцероматоз является вторичным опухолевым поражением, результатом прогрессирования рака различной локализации. Наиболее часто поражение брюшины осложняется раком желудка, тонкого кишечника, поджелудочной железы, злокачественными опухолями яичников, матки, маточных труб, печеночноклеточным раком, реже — первичными опухолями брюшины (перитонеальная мезотелиома). В ряде случаев первичный очаг остается неустановленным.
Развитие перитонеального канцероматоза является поэтапным процессом. Первый этап – распространение опухолевых клеток из первичного очага поражения. Это связано с нарушением межклеточного взаимодействия и приобретением клетками опухоли подвижности. При этом эпителиальные клетки меняют фенотип на мезенхимальный, происходит деградация межклеточного матрикса. Распространение опухолевых клеток может происходить в ходе оперативного вмешательства. Их механическое отделение возможно при повреждении лимфатических или кровеносных сосудов. Попавшие в брюшную полость клетки опухоли мигрируют под действием силы тяжести, сокращений внутренних органов, имплантируются в местах повышенной резорбции: большом сальнике, в области слепой кишки, дугласовых карманах.
При этом эпителиальные клетки меняют фенотип на мезенхимальный, происходит деградация межклеточного матрикса. Распространение опухолевых клеток может происходить в ходе оперативного вмешательства. Их механическое отделение возможно при повреждении лимфатических или кровеносных сосудов. Попавшие в брюшную полость клетки опухоли мигрируют под действием силы тяжести, сокращений внутренних органов, имплантируются в местах повышенной резорбции: большом сальнике, в области слепой кишки, дугласовых карманах.
На втором этапе опухолевые клетки взаимодействуют с мезотелием брюшины. Механизмы адгезии определяются природой клеток, особенностями морфологии брюшины, а также наличием участков ее повреждения. Далее клетки закрепляются в мезотелии, происходит их горизонтальное распространение по поверхности перитонеума, а затем инвазивный рост – прорастание в базальную мембрану, соединительную ткань. Следующим этапом является стимуляция неоангиогенеза – обязательного фактора развития опухоли. Морфопатогенетические механизмы формирования канцероматоза брюшины еще недостаточно изучены, в связи с чем отсутствуют радикальные методы лечения.
Частота развития канцероматоза брюшины зависит не только от первичной локализации опухоли, но и от ее размеров, глубины инвазии, гистотипа, степени дифференцировки (недифференцированный рак желудка осложняется поражением брюшины в 60% случаев, ограниченный – в 15%).
Классификация перитонельного канцероматоза
Единая классификация данного заболевания отсутствует, поскольку характеристики первичных опухолей, приводящих к поражению брюшины, весьма разнообразны. Наиболее распространена классификация перитонеального канцероматоза брюшины в зависимости от числа, локализации метастазов, которая предусматривает три степени:
Р1 – локальное поражение брюшины
Р2 – несколько областей канцероматоза, разделенных здоровыми участками брюшины
Р3 – многочисленные очаги поражения
Также используется метод определения индекса канцероматоза брюшины: суммируются баллы измерения максимальных очагов поражения (0-3 балла) в каждой из 13 наиболее вероятных областей поражения брюшины.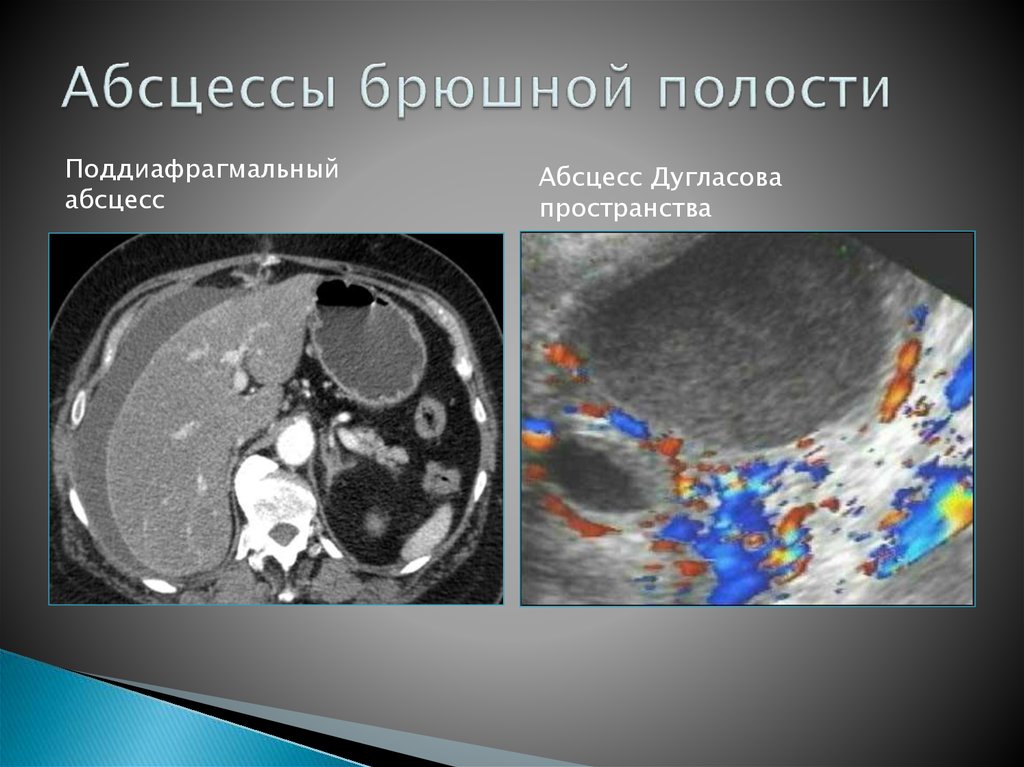
Симптомы перитонеального канцероматоза
Перитонеальный канцероматоз брюшины является вторичным поражением, поэтому его клиническая картина во многом определяется проявлениями первичной опухоли. Характерным признаком является обильный выпот в брюшную полость – формирование асцита. Зачастую асцитический синдром, развивающийся вследствие обструкции лимфатического дренажа, является единственным признаком заболевания, и пациенты могут поступать в отделение гастроэнтерологии или терапии для диагностики причин асцита. Состояние больных тяжелое, характерна значительная потеря веса. Неспецифическими признаками являются тошнота, рвота, выраженная слабость, утомляемость. При наличии крупных метастазов возможно их прощупывание через брюшную стенку.
Диагностика перитонеального канцероматоза
Перитонельный канцероматоз имеет неспецифическую клиническую картину, однако консультация гастроэнтеролога или онколога позволяет предположить данное заболевание на основании симптомов и физикальных данных. Лабораторные анализы не выявляют специфических изменений: определяется лейкоцитоз, ускорение СОЭ. Диагностическая программа обязательно должна включать УЗИ органов брюшной полости и малого таза, позволяющее обнаружить распространенное поражение, а также МСКТ брюшной полости с контрастированием. Обязательно проводится цитологическое исследование асцитической жидкости, полученной при лапароцентезе, которое дает возможность впервые установить или подтвердить диагноз, а также определить гистогенез клеток опухоли.
Лабораторные анализы не выявляют специфических изменений: определяется лейкоцитоз, ускорение СОЭ. Диагностическая программа обязательно должна включать УЗИ органов брюшной полости и малого таза, позволяющее обнаружить распространенное поражение, а также МСКТ брюшной полости с контрастированием. Обязательно проводится цитологическое исследование асцитической жидкости, полученной при лапароцентезе, которое дает возможность впервые установить или подтвердить диагноз, а также определить гистогенез клеток опухоли.
Информативным методом диагностики перитонеального канцероматоза является лапароскопия с осмотром перитонеума, дугласова пространства, диафрагмы, сопровождающаяся биопсией. Высокой специфичностью обладает обратнотранскриптазная полимеразная цепная реакция (ОТ-ПЦР), которая позволяет определить источник диссеминации даже при малом количестве опухолевых клеток.
Сложности диагностики возникают при наличии перитонеального канцероматоза без выявленного первичного очага. Данная форма заболевания, встречающаяся в 3-5 % случаев, проявляется клинически только при уже сформировавшемся поражении брюшины. При этом первичный очаг может иметь настолько малые размеры, что его прижизненное обнаружение невозможно.
При этом первичный очаг может иметь настолько малые размеры, что его прижизненное обнаружение невозможно.
В качестве дополнительных методов может использоваться определение онкомаркеров (кислой фосфатазы, раково-эмбрионального антигена, альфа-фетопротеина, бета-субъединицы ХГЧ). Такая диагностика не обладает высокой специфичностью, но применяется для оценки прогноза, раннего выявления диссеминации, рецидивов, а также для контроля эффективности лечения.
Лечение перитонеального канцероматоза
Хирургическое лечение канцероматоза включает удаление первичной опухоли с регионарными метастазами и отсевами по брюшине. Циторедуктивная операция выполняется в объеме перитонэктомии, может сочетаться с удалением матки и придатков, сигмовидной кишки, желчного пузыря. После проведения операции оценивается индекс полноты циторедукции: СС-0: после проведения хирургического лечения очаги поражения визуально не определяются; СС-1: имеются неудаленные очаги диаметром до 2,5 мм; СС-2: очаги диаметром 2,5 мм – 2,5 см; СС-3: очаги поражения более 2,5 см в диаметре. Однако даже при определении индекса СС-0 нельзя полностью исключить возможность диссеминации, поэтому обязательно проводится химиотерапия.
Однако даже при определении индекса СС-0 нельзя полностью исключить возможность диссеминации, поэтому обязательно проводится химиотерапия.
Эффективные подходы к лечению, как правило, подразумевают проведение комбинированной терапии, например, сочетания хирургического вмешательства и системной химиотерапии. Одним из наиболее эффективных методов является локальная химиотерапия. Идея локальной химиотерапии состоит в том, чтобы обеспечить доставку лекарственного препарата непосредственно к опухолевым клеткам, находящимся на внутренней выстилке анатомической полости. Из-за крайне низкой проницаемости этой области для лекарственных препаратов, например, при внутривенном их введении или приеме в виде таблеток, доставка препаратов в виде аэрозоля под давлением углекислого газа даёт накопление препарата в опухоли в значительно больших концентрациях.
Методы лечения перитонеального канцероматоза
Длительное время канцероматоз брюшины и плевры считали терминальной стадией болезни, не подлежащей специальному лечению.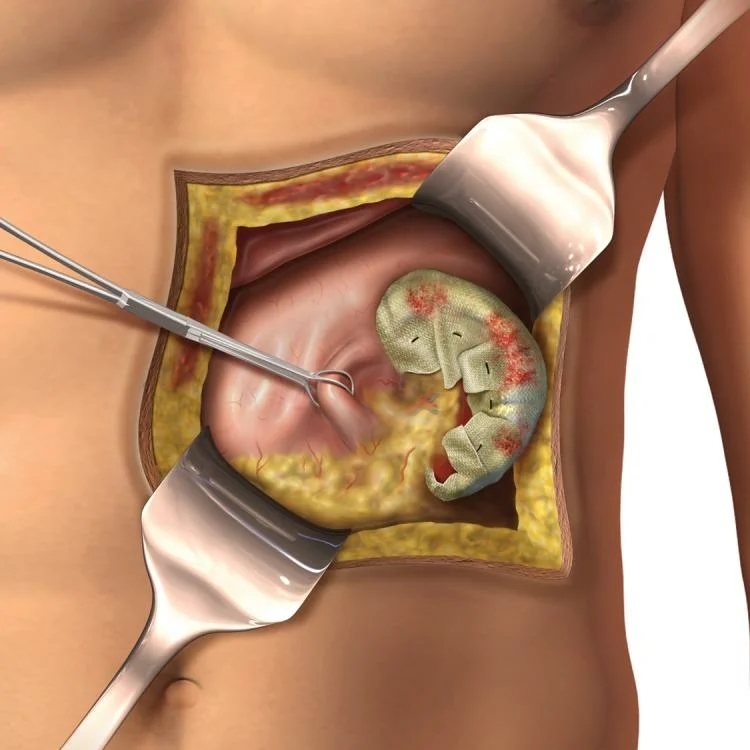 Разработка методик непосредственного воздействия на брюшину и плевру позволила улучшить прогноз при этом состоянии. МНИОИ им. П.А. Герцена обладает уникальными возможностями лечения больных с канцероматозом, имея в арсенале весь комплекс новейших методов терапии.
Разработка методик непосредственного воздействия на брюшину и плевру позволила улучшить прогноз при этом состоянии. МНИОИ им. П.А. Герцена обладает уникальными возможностями лечения больных с канцероматозом, имея в арсенале весь комплекс новейших методов терапии.
Гипертермическая интраоперационная внутрибрюшная (внутриплевральная) химиотерапия (HITEC).
Это методика, при которой во время операции в брюшную или плевральную полость вводится подогретый до 42,5С, высококонцентрированный раствор химиотерапевтических препаратов, что обеспечивает их воздействие непосредственно на раковые клетки в брюшной (плевральной) полости при минимальном воздействии на другие органы. Сеанс проводится в течение часа, что позволяет разрушить опухолевые клетки, оставшиеся после так называемой циторедуктивной операции.
Внутрибрюшная (внутриплевральная) аэрозольная химиотерапия под давлением (PIРAC)
Это новейший инновационный метод лечения перитонеального канцероматоза, который обеспечивает доставку лекарственного препарата непосредственно к опухолевым клеткам, находящимся на внутренней выстилке анатомической полости. Метод совсем недавно появился в России. Процедуру проводят посредством лапароскопии (торакоскопии). В брюшной или плевральной полости под давлением углекислого газа распыляют аэрозоль химиопрепаратов и оставляют в течение 30 мин. При таком способе введения химиопрепаратов их воздействие на опухоль многократно возрастает при полном отсутствии системной токсичности. Ноу-хау МНИОИ имени П.А. Герцена в этом методе лечения стала разработка собственной специальной форсунки, которая формирует поток мелкодисперсного аэрозоля с размером капель от 1 до 40 мкм. Изделие выполнено из специализированных материалов и не уступает по качеству импортному аналогу, а по ряду технических характеристик его превосходит.
Метод совсем недавно появился в России. Процедуру проводят посредством лапароскопии (торакоскопии). В брюшной или плевральной полости под давлением углекислого газа распыляют аэрозоль химиопрепаратов и оставляют в течение 30 мин. При таком способе введения химиопрепаратов их воздействие на опухоль многократно возрастает при полном отсутствии системной токсичности. Ноу-хау МНИОИ имени П.А. Герцена в этом методе лечения стала разработка собственной специальной форсунки, которая формирует поток мелкодисперсного аэрозоля с размером капель от 1 до 40 мкм. Изделие выполнено из специализированных материалов и не уступает по качеству импортному аналогу, а по ряду технических характеристик его превосходит.
Преимущества лечения перитонеального канцероматоза в МНИОИ имени П.А. Герцена – филиале ФГБУ «НМИЦ радиологии» Минздрава России
Программа лечения перитонеального канцероматоза определяется междисциплинарным консилиумом врачей, в который входят специалисты экспертного класса ФГБУ «НМИЦ радиологии» Минздрава России. Метод применения аэрозольной химиотерапии под давлением (PIPAC) был впервые испытан в Германии, а Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал «НМИЦ радиологии» Минздрава России еще в 2013 году стал вторым в мире центром, приступившим к изучению и внедрению данной методики. Проведённая за истекшие 6 лет масштабная научно-практическая работа позволила институту занять лидирующие позиции в этой области и первым в мире доказать целесообразность применения аэрозольной химиотерапии в качестве одного из основных методов лечения у пациентов, страдающих перитонеальным канцероматозом.
Метод применения аэрозольной химиотерапии под давлением (PIPAC) был впервые испытан в Германии, а Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал «НМИЦ радиологии» Минздрава России еще в 2013 году стал вторым в мире центром, приступившим к изучению и внедрению данной методики. Проведённая за истекшие 6 лет масштабная научно-практическая работа позволила институту занять лидирующие позиции в этой области и первым в мире доказать целесообразность применения аэрозольной химиотерапии в качестве одного из основных методов лечения у пациентов, страдающих перитонеальным канцероматозом.
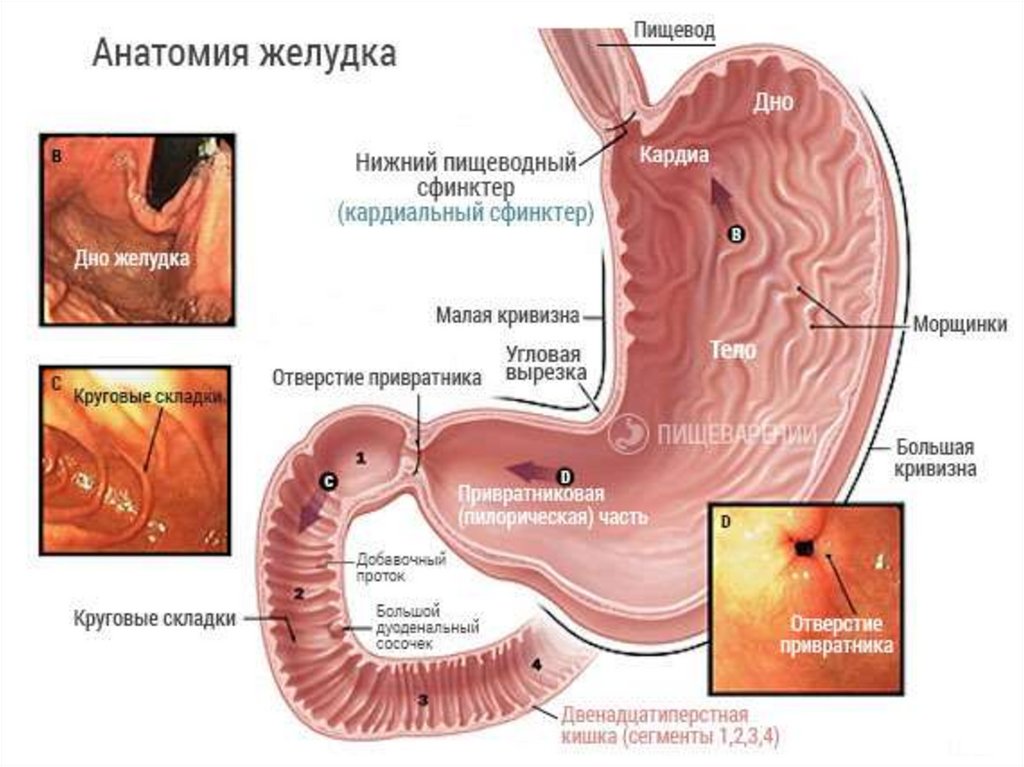
Канцероматоз брюшины при раке: что это такое, симптомы, причины канцероматозного поражения брюшной полости, прогноз
Канцероматоз брюшины — опухолевое поражение листков слизистой оболочки, покрывающей органы и внутреннюю стенку живота. Преимущественно обусловлен разрастанием метастазов рака в брюшной полости, иногда возможно развитие первичного злокачественного процесса — мезотелиомы в самой брюшине..jpg)
Можно встретить термин в двух вариантах: «карциноматоз брюшины» и «канцероматоз брюшины». Метастатическое поражение правильнее называть «карциноматоз», поскольку карцинома — синоним рака. Аналогично метастазы саркомы в брюшину именуют «саркоматоз».
Частое, но не обязательное проявление перитонеального канцероматоза, — выработка асцитической жидкости. С асцитом или без, но поражение брюшины злокачественным процессом всегда угрожает жизни больного и требует очень непростого лечения.
Причины канцероматоза брюшины
Теперь, когда мы разобрались, что такое канцероматоз брюшной полости, поговорим о том, как и почему он возникает.
Не всякая оторвавшаяся от материнской раковой опухоли клетка способна стать метастазом, в кровеносном русле погибает львиная доля циркулирующих злокачественных клеток. Для обретения способности стать метастазом раковая клетка должна измениться внутренне — научиться вырабатывать вещества, позволяющие самостоятельно жить и внедриться в другом месте, подавляя нормальные клетки.
Оторвавшиеся от узла клетки мигрируют на большие расстояния, раздвигая нормальные клетки, имплантируются в брюшную слизистую, способны даже внедряться внутрь других клеток. После закрепления на местности, начинается размножение и образование целой клеточной колонии.
Кроме переноса метастатических клеток по крови и лимфе, распространение идёт и внутри полости живота — трансцеломически. Не совсем ясно почему злокачественные клетки задерживаются в брюшине, предполагается благотворное действие микроклимата. Большинство метастазов находят в местах с более спокойной обстановкой и слабой перистальтикой органов, или там, где активно всасывается внутрибрюшная жидкость.
Часто клетки «разбрасываются» во время операции и при лапароскопическом вмешательстве вероятность обсеменения вдвое ниже, чем при классической хирургии. Во время операции обязательно проводится профилактика раковой диссеминации путём неоднократной обработки специальными растворами, но самый эффективный способ очищения от диссеминатов — внутриполостная химиотерапия на фоне гипертермии (HIPEC).
Запись на консультацию круглосуточно
+7 (495) 668-82-28
При каких заболеваниях развивается
Перитонеальный канцероматоз диагностируют у каждого третьего пациента с новообразованием желудочно-кишечного тракта. Метастазы по брюшине характерны для карцином желудка и поджелудочной железы — поражается до 40% пациентов. При раке кишечника канцероматоз обнаруживают только у десятой части больных. Максимально высокий процент обусловлен злокачественными процессами яичников — на момент выявления болезни две из трёх пациенток уже имеют опухолевые узлы на брюшине.
Вероятность канцероматоза зависит от степени агрессивности раковых клеток и величины первичной опухоли, так при тотальном инфильтративном раке желудка его выявляют чаще, чем при локальном процессе, не разрушившем наружную серозную оболочку органа.
Тем не менее, ни при одном из злокачественных процессов любой локализации, будь то рак молочной железы или простаты, лёгкого или носоглотки, не исключается внутрибрюшинное метастазирование.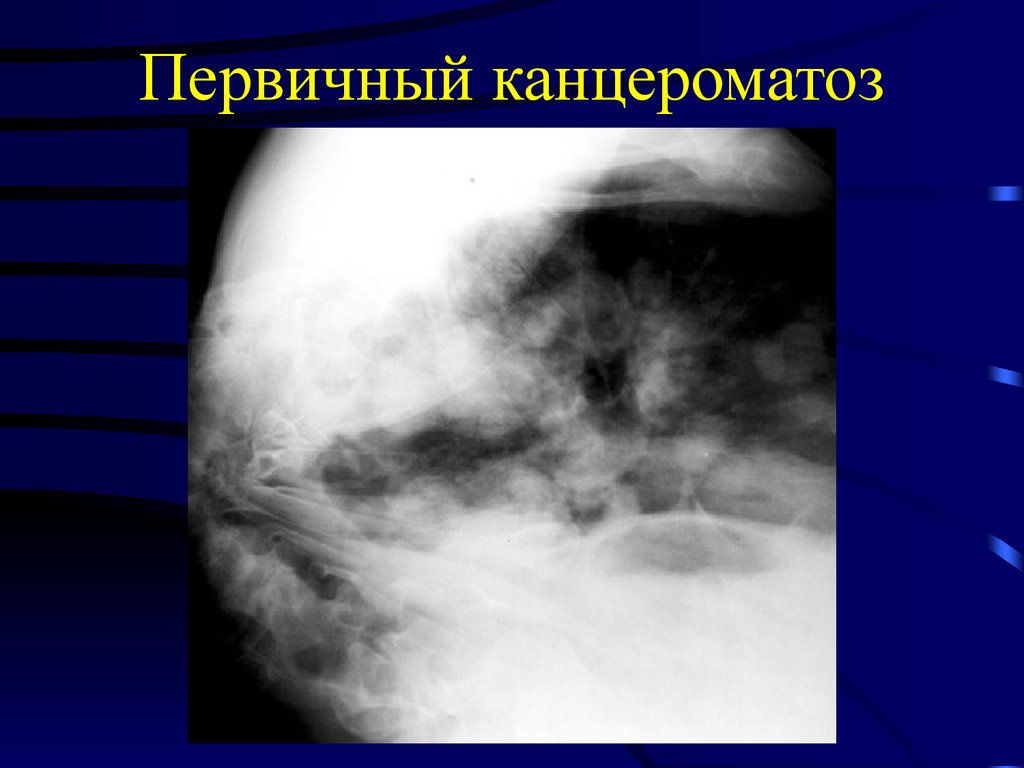 Посмертно канцероматоз брюшной полости выявляют у каждого третьего, погибшего от прогрессирования заболевания.
Посмертно канцероматоз брюшной полости выявляют у каждого третьего, погибшего от прогрессирования заболевания.
Для сарком такая локализация метастазов нетипична, саркоматоз брюшины констатируется едва ли у трёх из сотни больных. В редчайших случаях совершенно доброкачественные по гистологии муцинозные аденома аппендикса и цистаденома яичников тоже способны привести к обсеменению брюшины с выработкой гелеобразного секрета.
У одного из миллиона, и много чаще это будет женщина, выявляют муцинозную аденому аппендикса или муцинозную цистаденому яичников, в последующем часто приводящие к обсеменению брюшины. Распространение аденомуцинозных клеток в полости живота с выработкой гелеобразного секрета именуют уже «псевдомиксома», зачастую при в этой стадии заболевания не удаётся определить первоисточник опухоли.
Диагностика канцероматоза брюшины
Не представляет трудности выявление опухолевого поражения брюшины при асците, в отсутствии выработки патологического секрета диагностика опирается на визуализацию — УЗИ и КТ с контрастированием.
При УЗИ на внутреннем листке, прилежащем к мышцам брюшной стенки, в норме очень тонком и незаметном, можно увидеть напластования толщиной в несколько сантиметров, практически не прослеживаются только мелкие узелки.
КТ с контрастным усилением много информативнее УЗИ, способно выявить сантиметровые образования. Наиболее точный диагностический метод — лапароскопия. Это обследование обязательно при карциноме желудка, при раке яичников предпочтительна операция — диагностика и лечение одновременно.
При лапароскопии или пункции получают асцитическую жидкость для исследования и определения первоисточника злокачественного процесса. Из экссудата выделяют осадок, который изучают под микроскопом и проводят специфические реакции — ПЦР и ИГХ.
ПЭТ на этапе первичной диагностики не всегда информативна, поскольку далеко не все злокачественные клетки легкого, печени, почек способны накапливать изотопы.
Вне всяких сомнений, самый оптимальный метод диагностики — получение кусочка опухолевой ткани для исследования. Биопсия не целесообразна при известном источнике метастазов и после недавнего лечения первичного рака.
Биопсия не целесообразна при известном источнике метастазов и после недавнего лечения первичного рака.
Стадии канцероматоза брюшной полости
Стадирование перитонеального канцероматоза нельзя назвать точным, все классификации приблизительны в определении объёма повреждений и не уточняют локализацию узлов. Зачастую, стадирование даёт общее представление о прогнозе эффективности лечебных мероприятий, нежели информирует о настоящем состоянии внутри полости живота.
Разработанная японскими специалистами градация опухолевого распространения по трём степеням, учитывает общий объём поражения, без числа и размеров очагов:
- P1 — ограниченное;
- P2 — разделённые нормальной тканью очаги;
- P3 — множество узлов.
Во время операции хирурги определяют индекс перитонеального канцероматоза (РСI), измеряя узелки в 13 регионах полости, общая сумма баллов влияет на тактику лечения, в первую очередь, на возможность удаления брюшины — перитонэктомию и целесообразность внутриполостной химиотерапии. При некоторых злокачественных процессах прибегают к сложным формулам расчёта РСI.
При некоторых злокачественных процессах прибегают к сложным формулам расчёта РСI.
Наибольшее представление о размерах ракового повреждения даёт стадирование по степеням:
- 0 — в полости чисто,
- I — в одной анатомической зоне узелки до 5 мм,
- II — множественные узелки до 5 мм,
- III — локальное поражение 0.5–2 см,
- IV — 2-х сантиметровые узелки.
Течение канцероматоза определяется не столько размером метастатического узла, сколь клеточной потенцией к прогрессии и выработке асцитической жидкости, общей площадью опухолевой трансформации и клиническими проявлениями.
Симптомы канцероматоза брюшной полости
Перитонеальный канцероматоз небольшой протяжённости может не проявлять себя симптомами, особенно в отсутствии выработки асцитической жидкости. С другой стороны, жидкость может продуцироваться и при отсутствии видимых метастазов. Как правило, симптоматика неспецифична, и в разном наборе могут отмечаться:
- меняющие локализацию болезненные ощущения, а чаще — непонятный дискомфорт в полости живота;
- нарастающая слабость до утраты работоспособности;
- потеря веса при стабильном диетическом режиме;
- прогрессирующее снижение аппетита;
- функциональные нарушения со стороны органов ЖКТ.

Дальнейшее нарастание раковых повреждений сопровождается опухолевой интоксикацией, сдавление желудка опухолевыми узлами осложняется тошнотой и рвотой, кишечника — запорами и поносами с усугублением частичной непроходимости. Распад крупных узлов может вызывать боли и повышение температуры.
Асцит нарушает процесс дыхания и вызывает сердечную недостаточность с постоянными отёками, а частая эвакуация патологической жидкости приводит к белковой недостаточности.
Как лечат канцероматоз брюшины
Ни один из современных методов лечения канцероматоза не гарантирует радикального удаления опухоли, не способен излечить, но может улучшить состояние и существенно продлить жизнь.
Хирургическое лечение канцероматоза технически сложное для оперирующей бригады и трудно переносимое пациентом, поскольку предполагает удаление первичного рака, увеличенных лимфатических узлов, сальниковых сумок и всех видимых опухолевых образований вместе с брюшиной.
Перитонэктомия — многоэтапное вмешательство, включающее удаление нескольких органов и отделов брюшной полости. В результате операции пациент может остаться без селезёнки, желчного пузыря, части кишечника, матки с придатками.
В результате операции пациент может остаться без селезёнки, желчного пузыря, части кишечника, матки с придатками.
Стандарт терапии канцероматоза — химиотерапия системная и локальная — внутрибрюшинная после удаления асцита или через лапаропорт, установленный во время операции.
Эффективность лекарственной терапии невысокая, за исключением случаев первичного рака яичников. Таргетные и иммуно-онкологические препараты только изучаются в клинических испытаниях.
Какие методики терапии дают лучший результат
Наиболее высокий эффект демонстрирует комбинация трёх методов лечения рака:
- Локальная внутрибрюшинная гипертермия.
- Внутриполостное введение химиопрепаратов.
Использование во время хирургического вмешательства интраперитонеальной гипертермической химиотерапии (ИГХТ или HIPEC) позволяет максимально долго поддерживать очень высокую концентрацию цитостатика непосредственно в зоне поражения и усилить лекарственное воздействие нагреванием тканей. При весьма скромных исторических результатах хирургического вмешательства устойчивой к цитостатикам псевдомиксомы только HIPEC открывает пациентам перспективу на долгую жизнь.
При весьма скромных исторических результатах хирургического вмешательства устойчивой к цитостатикам псевдомиксомы только HIPEC открывает пациентам перспективу на долгую жизнь.
Технология ИГХТ такова: в течение полутора часов внутрь брюшной полости под давлением подаётся нагретый химиопрепарат в дозе, существенно превышающей максимально разрешённую для внутривенного введения. За счёт локального использования изменяется спектр токсических реакций, исключается опасное для жизни повреждение кроветворения, но возможна боль в животе и временное нарушение функционирования органов ЖКТ.
Интраоперационная фотодинамическая терапия (ФДТ), когда на выявленные с помощью фотосенсибилизатора очаги опухоли воздействуют лазером, уступает HIPEC по результативности, поскольку лазером невозможно проникнуть во все «закоулки» брюшной полости. Тем не менее, целесообразно использование фотодинамической терапии при крупных и немногочисленных раковых узлах.
Прогноз при канцероматозном поражении
На течение процесса влияет объём поражения на момент начала терапии, степень злокачественности опухоли, в свою очередь определяющая чувствительность к химиотерапии. Основополагающее влияние оказывает талант и опыт хирурга, и несомненно, правильность выбора лечебной тактики.
Основополагающее влияние оказывает талант и опыт хирурга, и несомненно, правильность выбора лечебной тактики.
Однозначно революционные результаты в клинических испытаниях показала только HIPEC. После интраоперационной гипертермической ХТ пятилетняя выживаемость при канцероматозе рака желудка выросла максимально до 20%, все прочие методы исключали столь долгое дожитие. При раке толстой кишки с метастазами по брюшине каждый третий пациент прожил более 5 лет, при карциноме слепой кишки и аппендикса — шестеро из десяти вступили во вторую пятилетку жизни.
Запись на консультацию круглосуточно
+7 (495) 668-82-28
Список литературы
- Давыдов М.И., Тер-Ованесов М.Д., Буйденок Ю.В. с соавторами/ Гипертермическая интраоперационная интраперитонеальная химиотерапия при раке желудка: существует ли реальная возможность изменить прогноз? // Вестник РОНЦ им. Н. Н. Блохина РАМН; 2010 Т. 21; № 1
- Степанов И.В., Падеров Ю.М., Афанасьев С.
 Г./ Перитонеальный канцероматоз// Сибирский онкологический журнал; 2014; № 5
Г./ Перитонеальный канцероматоз// Сибирский онкологический журнал; 2014; № 5 - Akiyama H., Yamaoka H., Tanaka K., et al./ Continuous hyperthermic peritoneal perfusion for peritoneal dissemination of gastric cancer // Hepatogastroenterology; 1998.
- Bozzetti F., Bonfanti G., Morabito A., et al/ A multifactorial approach for the prognosis of patients with carcinoma of the stomach after curative resection // Surg. Gynecol. Obstet.; 1986.
- Cotte E., Passot G., Gilly F.N., Glehen O. /Selection of patients and staging of peritoneal surface malignancies // World J. Gastrointest. Oncol.; 2010; Vol. 2.
- Chua T.C., Moran B.J., Sugarbaker P.H., et al. /Early- and longterm outcome data of patients with pseudomyxoma peritonei from appendiceal origin treated by a strategy of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy// J. Clin Oncol 2012.
- Deraco M., Santoro N., Carraro O., Inglese M.G., et al./ Peritoneal carcinomatosis: feature of dissemination.
 A review // Tumori; 1999.
A review // Tumori; 1999. - Lansom J., Alzahrani N., Liauw W., Morris D.L. /Cytoreductive Surgery and Hyperthermic Intraperitoneal Chemotherapy for Pseudomyxoma Peritonei and Appendix Tumours // Indian J Surg Oncol. 2016 Jun.
- Sugarbaker P.H./ Overview of peritoneal carcinomatosis // Cancerologia; 2008.
Рак кишечника: причины, симптомы и лечение
Нет одинаковых больных раком кишечника. Получите индивидуальное лечение.
Рак кишечника является настолько важным направлением деятельности City of Hope, что в каждой из наших больниц есть онкологический центр желудочно-кишечного тракта, специализирующийся на лечении пациентов со всеми стадиями желудочно-кишечных заболеваний. Наши гастроэнтерологи и онкологи понимают всю сложность рака кишечника и предлагают широкий выбор вариантов лечения, включая операцию Уиппла, сегментарную резекцию (гемиколэктомию) и паллиативные процедуры.
Мы также предлагаем услуги поддерживающей терапии для лечения побочных эффектов до, во время и после лечения.
- Что вызывает рак кишечника?
- Кто болеет раком кишечника?
- Типы рака кишечника
- Симптомы рака кишечника
- Диагностика рака кишечника
- Варианты лечения рака кишечника
- Диагностика и варианты лечения рака кишечника в наших онкологических центрах желудочно-кишечного тракта
Если вы считаете, что у вас могут быть симптомы рака кишечника, и хотите записаться на прием для диагностического тестирования или если вас интересует второе мнение о диагнозе рака кишечника и плане лечения, позвоните нам или пообщайтесь в онлайн-чате с член нашей команды.
Что вызывает рак кишечника?
Причина рака тонкой кишки до конца не изучена. Некоторые заболевания, практики и наследственные состояния, которые являются факторами риска заболевания, включают:
- Семейный анамнез семейного аденоматозного полипоза (FAP), наследственного неполипозного колоректального рака (HNPCC, также называемый синдромом Линча), синдрома Пейтца-Егерса (PJS) или кистозного фиброза (CF)
- Множественная эндокринная неоплазия 1-го типа (МЭН1) или дефекты в гене NF1 (нейрофиброматоз 1-го типа)
- Синдром Гарднера
- Болезнь фон Реклингхаузена
- Курение табака и употребление алкоголя
- Диета с высоким содержанием жиров
- Химическое воздействие токсинов, таких как винилхлорид, диоксины и высокие дозы гербицидов, содержащих феноксиуксусную кислоту
- Рак толстой кишки
- Целиакия
- Болезнь Крона
- Лимфома (также известная как слоновость)
Узнайте больше о факторах риска рака кишечника
Типы рака кишечника
Рак кишечника, также называемый раком тонкой кишки или раком тонкой кишки, обычно начинается в слизистой оболочке тонкой кишки и может распространяться из пищеварительной системы в другие части тела. В большинстве случаев рак кишечника развивается в двенадцатиперстной кишке или верхней части тонкой кишки.
В большинстве случаев рак кишечника развивается в двенадцатиперстной кишке или верхней части тонкой кишки.
Основные типы рака тонкой кишки включают:
- Аденокарциномы, которые обычно формируются в клетках, выстилающих стенки тонкой кишки, часто развиваются из небольших доброкачественных (нераковых) новообразований, называемых полипами
- Саркомы, развивающиеся в соединительной ткани тонкой кишки
- Стромальные опухоли желудочно-кишечного тракта, являющиеся вариантами саркомы мягких тканей
- Карциноидные опухоли, также называемые нейроэндокринными опухолями, которые образуются в слизистой оболочке кишечника и часто медленно растут
- Лимфомы, которые могут возникнуть в кишечнике
Узнайте больше о типах рака кишечника
Симптомы рака кишечника
Опухоли в тонкой кишке могут блокировать поток пищи и влиять на пищеварение. По мере того, как опухоль становится больше, закупорки могут вызывать боль в животе.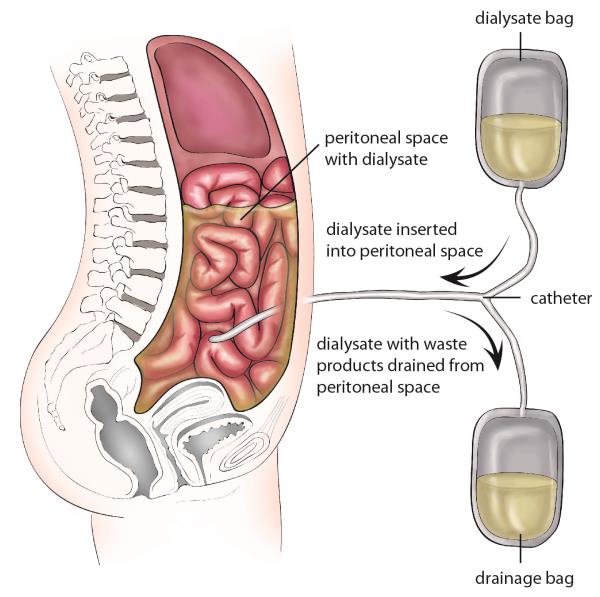 Медленно кровоточащая опухоль может привести к анемии. Переваренная кровь может привести к тому, что стул станет черным или смолистым. Непроходимость — когда поток пищи полностью заблокирован — может вызвать сильную боль, тошноту и рвоту и обычно требует немедленного хирургического вмешательства.
Медленно кровоточащая опухоль может привести к анемии. Переваренная кровь может привести к тому, что стул станет черным или смолистым. Непроходимость — когда поток пищи полностью заблокирован — может вызвать сильную боль, тошноту и рвоту и обычно требует немедленного хирургического вмешательства.
Однако в целом симптомы рака кишечника часто неопределенны и их трудно диагностировать. Небольшие опухоли на ранней стадии могут не вызывать явных симптомов до тех пор, пока рак не распространится, что затрудняет раннее обнаружение. Пациенты с высоким риском должны разработать план профилактики рака, который включает регулярные обследования.
Общие симптомы рака кишечника включают:
- Боль в животе
- Необъяснимая потеря веса
- Слабость или усталость
- Кровавые или смолистые испражнения
- Заметная шишка в животе
Узнайте больше о симптомах рака кишечника
Диагностика рака кишечника
Инструменты и процедуры, используемые для скрининга и диагностики рака кишечника, включают:
- Серия верхних отделов желудочно-кишечного тракта (ЖКТ)
- Эндоскопические процедуры
- Энтероклизис
- Бариевая клизма с рентгеном
- Компьютерная томография (КТ)
Узнайте больше о процедурах диагностики рака кишечника
Варианты лечения рака кишечника
Мы боремся с кишечными опухолями с помощью сложных методов лечения и технологий, основанных на фактических данных. Ваша междисциплинарная команда онкологов и гастроэнтерологов ответит на ваши вопросы и порекомендует варианты лечения, основанные на вашем уникальном диагнозе и потребностях. Общие методы лечения рака кишечника включают:
Ваша междисциплинарная команда онкологов и гастроэнтерологов ответит на ваши вопросы и порекомендует варианты лечения, основанные на вашем уникальном диагнозе и потребностях. Общие методы лечения рака кишечника включают:
- Операция, такая как операция Уиппла по удалению частей нескольких органов желудочно-кишечного тракта, или паллиативные процедуры, например, при введении небольшой трубки для обхода закупорки, вызванной опухолью в пищеварительном тракте
- Химиотерапия
- Лучевая терапия, включая сложные формы лучевой терапии с модулированной интенсивностью (ЛТМИ)
Узнайте больше о вариантах лечения рака кишечника
Диагностика рака кишечника и варианты лечения в наших онкологических центрах желудочно-кишечного тракта
В City of Hope мы понимаем, что рак кишечника и другие злокачественные новообразования желудочно-кишечного тракта создают уникальные проблемы для пациентов, и что варианты лечения очень специфичны для каждого заболевания. Вот почему в каждой больнице города надежды есть онкологический центр желудочно-кишечного тракта, занимающийся диагностикой, лечением и поддержанием качества жизни пациентов с раком кишечника и другими видами рака желудочно-кишечного тракта. Клиницисты в каждом из наших онкологических центров желудочно-кишечного тракта стремятся предлагать самые современные методы лечения пациентов с раком желудочно-кишечного тракта. Наша междисциплинарная команда сертифицированных медицинских онкологов, онкологов-радиологов и гастроэнтерологов работает вместе с нашими поставщиками интегративной помощи и каждым пациентом для оказания клинической помощи с подходом, ориентированным на пациента. После того, как ваш диагноз будет подтвержден, наша команда по уходу за GI Cancer Center обсудит с вами ваши варианты и поможет разработать индивидуальный план лечения с учетом ваших индивидуальных потребностей.
Вот почему в каждой больнице города надежды есть онкологический центр желудочно-кишечного тракта, занимающийся диагностикой, лечением и поддержанием качества жизни пациентов с раком кишечника и другими видами рака желудочно-кишечного тракта. Клиницисты в каждом из наших онкологических центров желудочно-кишечного тракта стремятся предлагать самые современные методы лечения пациентов с раком желудочно-кишечного тракта. Наша междисциплинарная команда сертифицированных медицинских онкологов, онкологов-радиологов и гастроэнтерологов работает вместе с нашими поставщиками интегративной помощи и каждым пациентом для оказания клинической помощи с подходом, ориентированным на пациента. После того, как ваш диагноз будет подтвержден, наша команда по уходу за GI Cancer Center обсудит с вами ваши варианты и поможет разработать индивидуальный план лечения с учетом ваших индивидуальных потребностей.
Из-за роли пищеварительного тракта в переработке пищи и отходов у многих пациентов с желудочно-кишечными заболеваниями возникают проблемы с пищеварительной функцией. Вот почему диетотерапия является ключевым компонентом подхода наших онкологических центров желудочно-кишечного тракта. В каждом центре есть специальный диетолог, который работает с пациентами над составлением плана здорового, сбалансированного и аппетитного питания. Если пациенты начинают недоедать, врач-диетолог может помочь им установить здоровый образ жизни и привычки в еде, которые помогут улучшить их состояние.
Вот почему диетотерапия является ключевым компонентом подхода наших онкологических центров желудочно-кишечного тракта. В каждом центре есть специальный диетолог, который работает с пациентами над составлением плана здорового, сбалансированного и аппетитного питания. Если пациенты начинают недоедать, врач-диетолог может помочь им установить здоровый образ жизни и привычки в еде, которые помогут улучшить их состояние.
Команды онкологического центра желудочно-кишечного тракта также тесно сотрудничают с другими клиницистами поддерживающей терапии, чтобы управлять дополнительными побочными эффектами, связанными с заболеванием и лечением, такими как тошнота и рвота. Эти специалисты по поддерживающей терапии могут включать в себя врача по обезболиванию, а также лиц, оказывающих натуропатическую, поведенческую и духовную поддержку.
Подходящим пациентам также предлагаются тщательно отобранные клинические испытания. Ваша команда по уходу обсудит, имеете ли вы право на участие в каком-либо из наших текущих клинических испытаний, и, если да, поможет вам зарегистрироваться.
Центры лечения рака Америки ® (CTCA) теперь называется City of Hope ® , объединяя усилия для расширения доступа пациентов к персонализированной комплексной помощи при раке.
Варианты лечения рака кишечника: хирургия, облучение и др.
Рак кишечника чаще всего лечится хирургическим путем, иногда в сочетании с химиотерапией или облучением. Многопрофильная группа экспертов по раку пациента ответит на вопросы и порекомендует варианты лечения рака кишечника на основе его или ее уникального диагноза и потребностей.
В состав многопрофильной бригады по лечению рака кишечника могут входить:
- Хирург-онколог для лечения рака путем хирургического вмешательства
- Онколог-радиолог лечит рак с помощью радиации.
- Врач-онколог лечит рак с помощью лекарств, таких как химиотерапия.
- Гастроэнтеролог для лечения рака, используя экспертные знания о заболеваниях и проблемах пищеварения.

Помимо основной команды врачей, пациенты, скорее всего, будут обращаться ко многим другим специалистам в области здравоохранения, включая медсестер, диетологов, консультантов и т. д., для комплексного и всестороннего ухода.
Прежде чем принять решение о плане лечения рака кишечника, лечащая бригада пациента должна определить, является ли хирургическое вмешательство безопасным и выгодным вариантом. Некоторые опухоли кишечника могут быть полностью удалены хирургическим путем, хотя тип выполняемой операции может варьироваться в зависимости от местоположения опухоли. Эти опухоли называются «резектабельными».
Опухоли, которые нельзя безопасно и полностью удалить хирургическим путем, называются «нерезектабельными» и требуют лечения другими методами. Когда опухоль неоперабельна, это обычно означает, что она более развита и распространилась на близлежащие или отдаленные части тела, что затрудняет полное удаление рака.
Способность или невозможность удаления рака хирургическим путем является одним из основных факторов, влияющих на решения о лечении рака кишечника, но врачи также учитывают общее состояние здоровья пациента и личные предпочтения. В некоторых случаях плохое общее состояние здоровья может помешать пациенту пройти операцию.
В некоторых случаях плохое общее состояние здоровья может помешать пациенту пройти операцию.
Другие важные факторы включают тип, степень и стадию рака, которые влияют на то, является ли опухоль операбельной.
Общие методы лечения рака кишечника включают:
Хирургия
Хирургия является наиболее распространенным методом лечения рака кишечника. Хирурги-онкологи проводят операции по удалению опухолей и раковой части тонкой кишки. В некоторых случаях также могут быть уместны следующие процедуры:
Операция Уиппла
Операция Уиппла чаще всего проводится для лечения рака поджелудочной железы, но ее также можно использовать для лечения рака кишечника. Эта сложная хирургическая процедура также используется для лечения рака двенадцатиперстной кишки, верхней части тонкой кишки, где развивается большинство видов рака тонкой кишки.
При операции Уиппла удаляют двенадцатиперстную кишку, часть поджелудочной железы, желчный пузырь, часть желудка, конец общего желчного протока и близлежащие лимфатические узлы. Затем соединяют оставшиеся участки поджелудочной железы, тонкой кишки и желчных протоков. Это позволяет желчи из печени продолжать стекать в тонкую кишку, обеспечивая пищеварение.
Затем соединяют оставшиеся участки поджелудочной железы, тонкой кишки и желчных протоков. Это позволяет желчи из печени продолжать стекать в тонкую кишку, обеспечивая пищеварение.
Это лечение рака кишечника связано с потенциальными рисками осложнений. Пациенты должны обращаться за лечением к онкологам-хирургам, имеющим опыт проведения этой процедуры. Некоторые из потенциальных рисков и побочных эффектов процедуры Уиппла включают:
- Отверстия и протечки из оставшихся частей различных органов (если они не будут идеально соединены во время операции)
- Кровотечение
- Проблемы с пищеварением, такие как застревание пищи в желудке
- Потеря веса
- Инфекция
- Изменения стула
Паллиативные процедуры при раке кишечника
Паллиативные процедуры могут использоваться в запущенных случаях рака тонкой кишки, когда операция по удалению рака невозможна из-за слишком широкого распространения заболевания.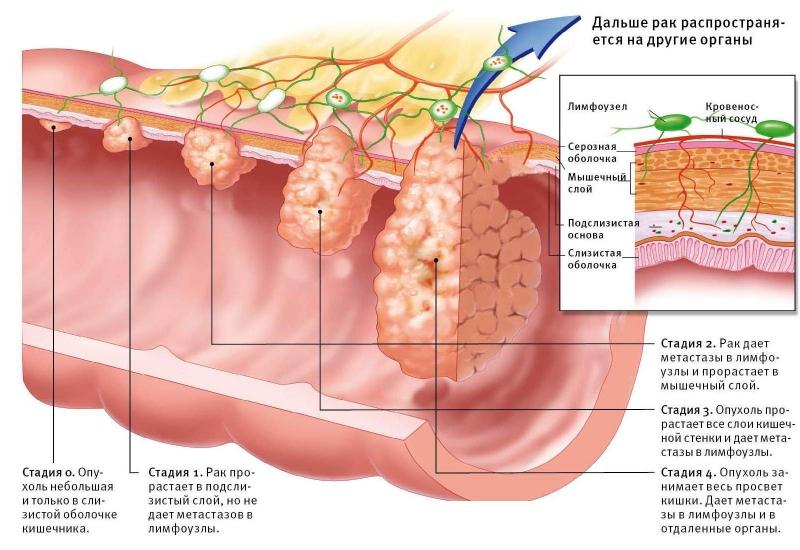 Для облегчения таких симптомов, как боль и тошнота, возникающих, когда опухоль блокирует тонкую кишку, может быть проведена паллиативная операция, чтобы помочь пациентам чувствовать себя более комфортно. Например, если опухоль блокирует проход в тонкой кишке, может быть проведена операция по введению тонкой трубки в обход опухоли, создающей проход из желудка в другой конец тонкой кишки или в толстую кишку. Это позволяет пациентам продолжать нормально питаться и переваривать пищу. Это называется установкой стента. Другая паллиативная операция, которая может быть вариантом, называется шунтированием. При этой операции хирург перенаправляет прохождение переваренной пищи в обход опухоли.
Для облегчения таких симптомов, как боль и тошнота, возникающих, когда опухоль блокирует тонкую кишку, может быть проведена паллиативная операция, чтобы помочь пациентам чувствовать себя более комфортно. Например, если опухоль блокирует проход в тонкой кишке, может быть проведена операция по введению тонкой трубки в обход опухоли, создающей проход из желудка в другой конец тонкой кишки или в толстую кишку. Это позволяет пациентам продолжать нормально питаться и переваривать пищу. Это называется установкой стента. Другая паллиативная операция, которая может быть вариантом, называется шунтированием. При этой операции хирург перенаправляет прохождение переваренной пищи в обход опухоли.
Гемиколэктомия
Гемиколэктомия или сегментарная резекция — это процедура, при которой удаляется часть кишечника, где находится опухоль. Некоторые здоровые ткани кишечника, окружающие опухоль, также удаляются. Затем хирург повторно соединяет оставшиеся концы кишки. Близлежащие лимфатические узлы также удаляются.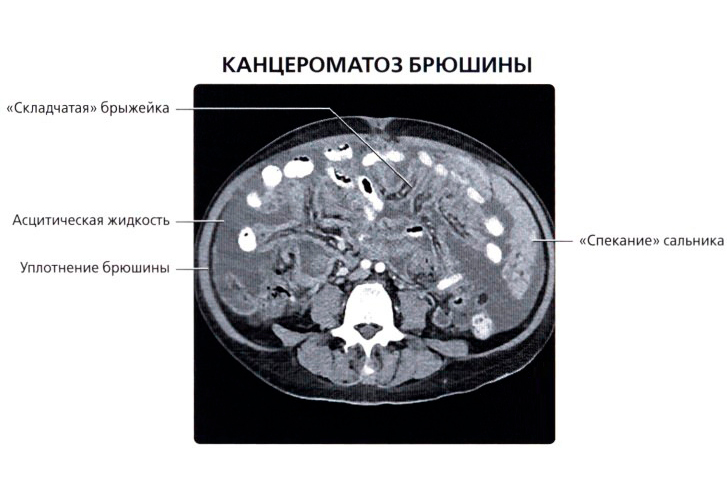 Если опухоль расположена в нижней части тонкой кишки, может потребоваться иссечение части толстой кишки (ободочной кишки).
Если опухоль расположена в нижней части тонкой кишки, может потребоваться иссечение части толстой кишки (ободочной кишки).
Гемиколэктомия обычно является «открытой» операцией, то есть хирург начинает с прорезания отверстия в брюшной полости. Иногда, если опухоль меньше, хирург может провести лапароскопическую операцию. В этом случае в разных местах живота делаются небольшие отверстия, и хирург вставляет в эти отверстия инструменты для проведения операции. Поскольку во время этой операции удаляется лишь незначительная часть кишечника, существует относительно низкий риск долговременных проблем с пищеварением по сравнению с другими типами операций на кишечнике. Тем не менее, все операции сопряжены с рисками, включая кровотечение и инфекции.
Если у пациента удалена толстая кишка, у него или нее повышается риск желудочно-кишечных осложнений. В течение нескольких дней после операции пациент может быть не в состоянии нормально пить и принимать пищу. Гемиколэктомия обычно используется при раке кишечника, расположенном в середине или конце тонкой кишки. Опухоли в верхней части тонкой кишки обычно удаляют с помощью процедуры Уиппла.
Опухоли в верхней части тонкой кишки обычно удаляют с помощью процедуры Уиппла.
Химиотерапия
Химиотерапия при раке тонкой кишки может быть назначена для лечения рака, который распространился или дал метастазы в другие области тела, или для уничтожения раковых клеток, которые могут остаться в брюшной полости после операции.
Химиотерапия редко используется для лечения аденокарциномы в тонком кишечнике, поскольку в большинстве случаев не было обнаружено, что это эффективное лечение. Тем не менее, иногда это вариант для рака кишечника, который метастазировал (широко распространился в организме), или в качестве последующего лечения после хирургического вмешательства, чтобы снизить риск того, что какой-либо рак останется позади. Внутрибрюшинная химиотерапия может быть вариантом лечения рака, распространившегося на брюшину (внутреннюю оболочку живота). Эта процедура включает введение химиотерапевтических препаратов в брюшную полость после завершения операции.
Когда химиотерапия используется для лечения рака кишечника, обычно выбирают следующие препараты:
- Капецитабин
- 5-фторурацил (5-ФУ)
- Оксалиплатин
- Иринотекан
Возможные побочные эффекты химиотерапии могут включать тошноту, рвоту, выпадение волос и язвы во рту..jpg) Бригада по уходу за пациентом может порекомендовать несколько мер, чтобы помочь уменьшить или контролировать симптомы, связанные с химиотерапией.
Бригада по уходу за пациентом может порекомендовать несколько мер, чтобы помочь уменьшить или контролировать симптомы, связанные с химиотерапией.
Перед химиотерапией при раке кишечника пациенты могут получить премедикаменты, чтобы сделать побочные эффекты более переносимыми. Во время химиотерапии команда по уходу предложит услуги поддерживающего ухода, призванные облегчить побочные эффекты и поддержать качество жизни пациента.
Лучевая терапия
Лучевая терапия может быть вариантом лечения рака кишечника. Благодаря современным системам доставки лучевой терапии онкологи-радиологи могут лучше нацеливаться на труднодоступные опухоли в тонкой кишке. Онкологи-радиологи также могут направлять более высокие дозы облучения на раковые клетки кишечника, уменьшая при этом воздействие на нормальные здоровые ткани.
Лучевая терапия может быть частью плана лечения нерезектабельного рака кишечника. В некоторых случаях пациентам с этим типом рака может быть проведена операция по устранению закупорки.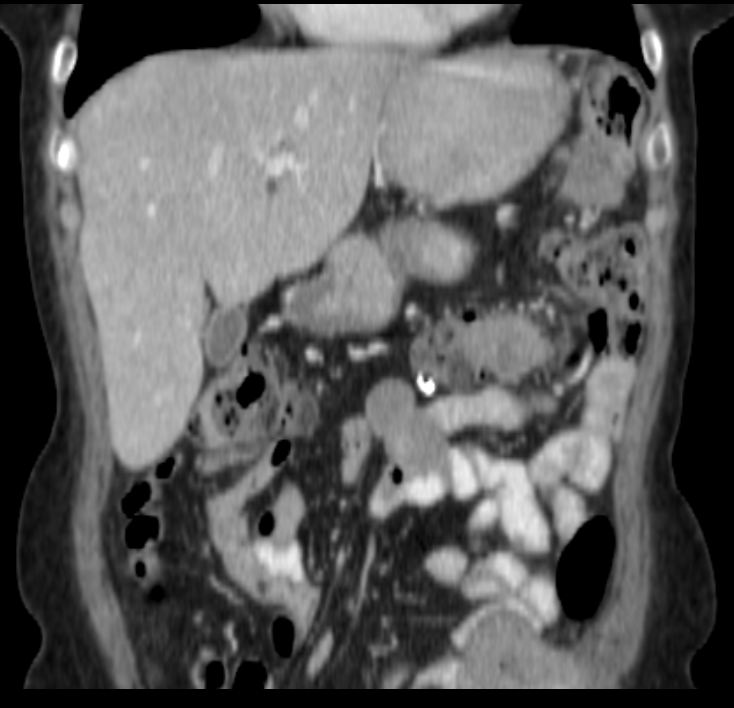 Лучевую терапию можно использовать в качестве последующего лечения после хирургического вмешательства, а также для облегчения симптомов, вызванных большой опухолью (поскольку она уменьшает размер).
Лучевую терапию можно использовать в качестве последующего лечения после хирургического вмешательства, а также для облегчения симптомов, вызванных большой опухолью (поскольку она уменьшает размер).
Когда радиация используется для лечения рака кишечника, чаще всего это дистанционная лучевая терапия (ДЛТ).
Сложные формы лучевой терапии с модулированной интенсивностью (IMRT) могут использоваться для лечения рака тонкой кишки.
Некоторые из потенциальных побочных эффектов лучевой терапии при раке кишечника включают:
- Чрезмерная усталость
- Расстройство желудка (тошнота, рвота, диарея)
- Раздражение кожи в месте обработки, включая покраснение, образование волдырей и шелушение
Иммунотерапия
Иммунотерапия, при которой используются лекарства или вещества, помогающие иммунной системе находить и атаковать раковые клетки, может быть вариантом для некоторых людей с нерезектабельным раком кишечника с метастазами.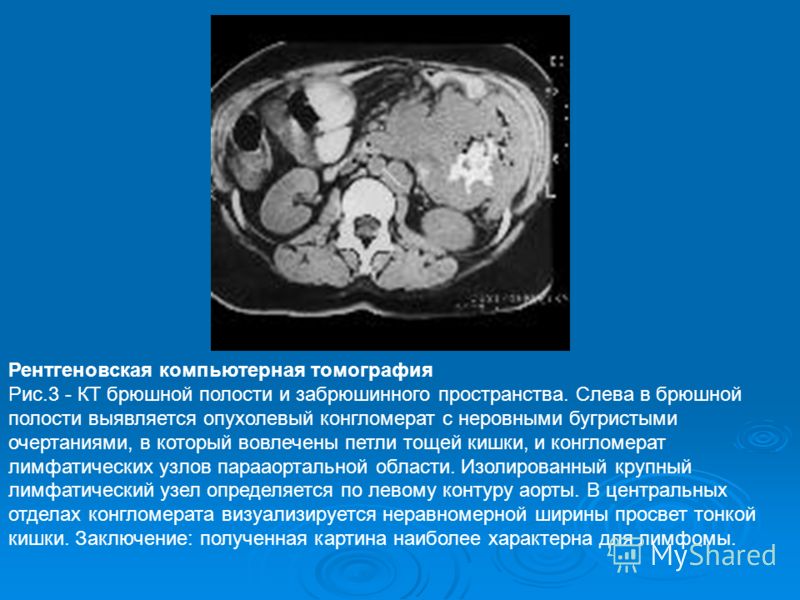 Он обычно используется для людей, чьи раковые клетки содержат определенные генетические мутации (изменения в их ДНК), которые делают их рак потенциально восприимчивым к определенным иммунотерапевтическим препаратам. Метастатический рак кишечника с этими целевыми изменениями генов может получить пользу от лечения иммунотерапией, называемой ингибиторами контрольных точек. Кейтруда (пембролизумаб) является одним из примеров ингибитора контрольной точки, который можно использовать в таких случаях.
Он обычно используется для людей, чьи раковые клетки содержат определенные генетические мутации (изменения в их ДНК), которые делают их рак потенциально восприимчивым к определенным иммунотерапевтическим препаратам. Метастатический рак кишечника с этими целевыми изменениями генов может получить пользу от лечения иммунотерапией, называемой ингибиторами контрольных точек. Кейтруда (пембролизумаб) является одним из примеров ингибитора контрольной точки, который можно использовать в таких случаях.
Лечение рецидивирующего рака кишечника
После лечения рак кишечника может вернуться. Это называется рецидивирующим раком. Рак кишечника может рецидивировать в исходном месте (кишечнике) или рядом с ним или в отдаленной части тела.
Если рак рецидивирует в тонкой кишке, его можно лечить хирургическим путем, лучевой терапией или химиотерапией — отдельно или в комбинации. В некоторых случаях лечение может быть направлено на облегчение симптомов (паллиативная терапия). Участие в клиническом испытании также может быть вариантом.
Рак кишечника, который рецидивирует в отдаленной части тела, обычно лечится в рамках клинических испытаний, поскольку на этой стадии отсутствуют стандартные варианты лечения рака. Клинические испытания для этой стадии рака обычно включают новые иммунотерапевтические препараты.
Клинические испытания
Исследования рака продолжают развиваться, и могут быть доступны новые методы лечения. Участие в клинических испытаниях — это способ получить доступ к новым методам лечения рака кишечника. Клинические испытания исследуют преимущества инновационных методов лечения рака и сравнивают их со стандартными вариантами.
Клинические испытания могут быть особенно полезными для пациентов с распространенным раком кишечника, который не может быть полностью удален хирургическим путем. На этой стадии отсутствуют стандартизированные варианты лечения рака, и участие в клинических испытаниях может предоставить альтернативу тем, кто в них нуждается.
Национальный институт рака перечисляет клинические испытания иммунотерапии и других подходов в качестве основного варианта лечения метастатического или рецидивирующего рака кишечника.


 Г./ Перитонеальный канцероматоз// Сибирский онкологический журнал; 2014; № 5
Г./ Перитонеальный канцероматоз// Сибирский онкологический журнал; 2014; № 5 A review // Tumori; 1999.
A review // Tumori; 1999.