Kell фенотипирование что это: Антигены системы Rh (C, E, c, e), Kell – фенотипирование
Антигены системы Rh (C, E, c, e), Kell – фенотипирование
Исследование включает в себя определение наличия на исследуемых эритроцитах наиболее клинически значимых антигенов системы Rh (C, E, c, e) и Kell (K).
Синонимы русские
Анализ крови на фенотип, риск гемотрансфузионных осложнений, анализ крови на эритроцитарные антигены.
Синонимы английские
Antigens of Rh (C ,E, c, e) system, Kell – phenotyping.
Метод исследования
Реакция агглютинации.
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Исключить из рациона жирную пищу в течение 24 часов до исследования.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
На поверхности красных кровяных телец-эритроцитов находится более 250 антигенов, которые разделяются на 29 генетических систем.
Резус-фактор (Rh) – одна из систем групп крови, считается наиболее важной после самой известной системы — ABO. Основным антигеном системы Rh считается антиген — D (именно по его наличию или отсутствию выставляется «положительный или отрицательный резус-фактор»), однако выделяют также антигены С и с и E и e. Два гена: RHD и RHCE кодируют Rh-белки, первый кодирует D-антиген, а второй кодирует CE антигены в различных комбинациях (ce, cE, Ce, CE).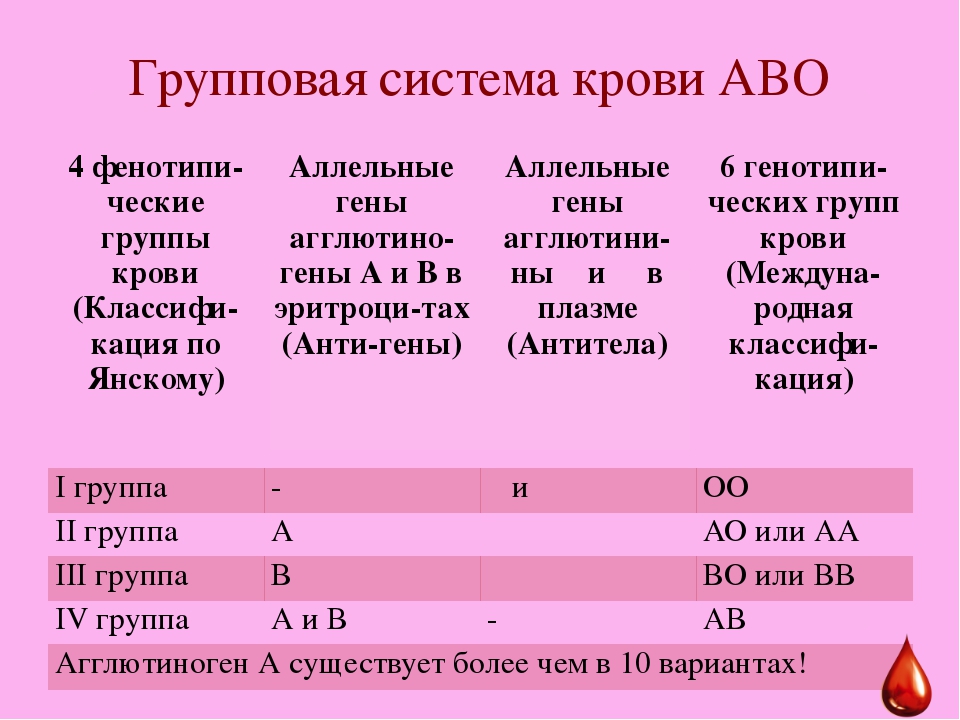
C-антиген имеет приблизительную частоту встречаемости 68% в белой популяции, с-антиген – 80%. Частота С -антигена выше в Восточной Азии, и намного ниже у населения Африки. Оба антигена (С и с) имеют значительно меньшую иммуногенность, чем D-антиген.
Е и е антигены кодируются аллелями гена RHCE и являются кодоминантными. Во всех популяциях е встречается чаще, чем Е (примерно 30% белого населения имеют Е и 98% имеют е-антигены). Е имеет более сильные иммуногенные свойства, чем
Система Kell также является одной из наиболее важных групп крови в транфузиологии и в акушерской практике. Антитела Kell считаются значительно иммуногенными. Система группы крови Kell содержит 35 антигенов, из которых K/k (KEL1/KEL2), Kpa/Kpb (KEL3/KEL4), Jsa/Jsb (KEL5/KEL6) являются наиболее важными.
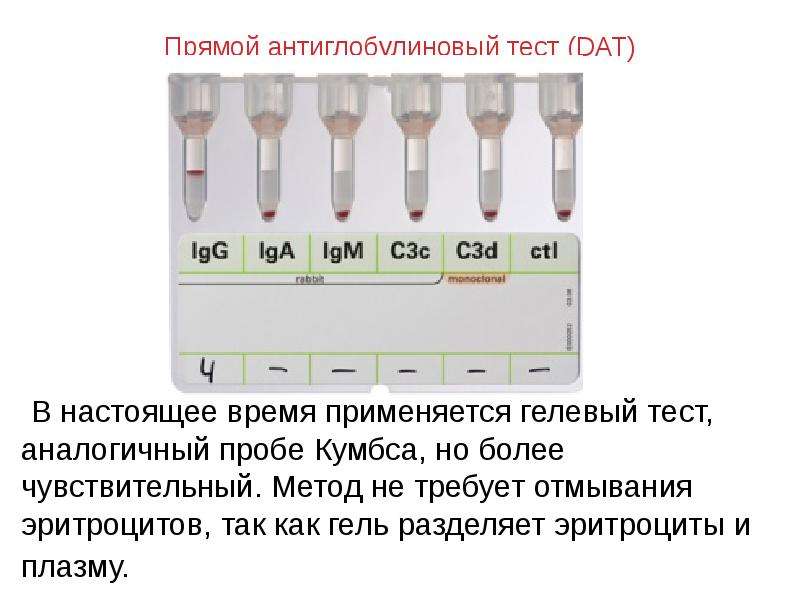
Исследование системы Rh (С, Е, с, е) и Kell успешно проводится методами реакции с моноклональными антителами и гель-фильтрацией. В первом методе используются специальные моноклональные смеси, предназначенные только для прямого тестирования и не используются в антиглобулиновом тесте. Rh-типирование также выполняется с использованием гель-фильтрации. Антисыворотка распределяется равномерно по всем частицам гелем. Антиген-положительные эритроциты реагируют с антисывороткой, при этом агглютинины связываются и не могут высвободиться из геля при центрифугировании.
Когда назначается исследование?
- Обследования перед планирующимися гемотрансфузиями в целях снижения частоты трансфузионных реакций.
- Дополнительные обследования во время беременности в целях оценки статуса по системе Rh и Kell.
- Диагностика, оценка риска возникновения гемолитической болезни новорождённых и решение о своевременном адекватном лечении данной патологии.

- Обследование всех доноров крови в соответствии с приказом МЗ РФ № 183н от 02.04.2013 г. «Об утверждении правил клинического использования донорской крови и (или) ее компонентов».
Референсные значения: «отрицательно» для всех компонентов исследования.
Система Rh имеет пять разновидностей антигенов: C, D, E, c, e. Наиболее иммуногенным является антиген D. Иммуногенность других антигенов системы «резус» существенно ниже и убывает в следующем ряду: с > Е > С > е. Фактор Kell (K) стоит на втором месте после фактора D в шкале трансфузионно опасных антигенов эритроцитов.
Наличие или отсутствие определенных белков на мембране эритроцитов (фенотип антигенов) преимущественно определяется наследованием от родителей и не меняется в течение жизни. Люди, у которых отсутствует какой-либо конкретный антиген, могут развивать иммунный ответ с образованием антител при попадании в организм эритроцитов, несущих этот антиген. Такая ситуация возможна при переливаниях донорской крови или при прохождении эритроцитов плода в кровь матери во время беременности. Клиническими следствиями появления таких «аллоантител» являются гемолитические реакции при переливании крови, которая содержит эритроциты, несущие соответствующий антиген, и гемолитическая болезнь новорождённых вследствие прохождения через плаценту материнских IgG-антител, направленных против эритроцитарных антигенов плода. В результате воздействия аллоантител, направленных против эритроцитарных антигенов, эритроциты разрушаются (происходит гемолиз эритроцитов). Риск появления аллоиммунных антител повышен при сенсибилизации предыдущими переливаниями крови, выкидышами с трансплацентарным кровотечением, предыдущими беременностями с иммунологическим конфликтом при отсутствии соответствующей терапии.
Такая ситуация возможна при переливаниях донорской крови или при прохождении эритроцитов плода в кровь матери во время беременности. Клиническими следствиями появления таких «аллоантител» являются гемолитические реакции при переливании крови, которая содержит эритроциты, несущие соответствующий антиген, и гемолитическая болезнь новорождённых вследствие прохождения через плаценту материнских IgG-антител, направленных против эритроцитарных антигенов плода. В результате воздействия аллоантител, направленных против эритроцитарных антигенов, эритроциты разрушаются (происходит гемолиз эритроцитов). Риск появления аллоиммунных антител повышен при сенсибилизации предыдущими переливаниями крови, выкидышами с трансплацентарным кровотечением, предыдущими беременностями с иммунологическим конфликтом при отсутствии соответствующей терапии.
Фенотипирование эритроцитов по антигенам системы Rh и Kell.
Метод исследования
- Реакция с моноклональными антителами
Определение группы крови, резус-принадлежности и типирование антигенов эритроцитов имеет большое значение при переливании крови для подбора совместимых пар донор-реципиент, профилактики опасных посттрансфузионных осложнений, а также для диагностики иммунологических конфликтов матери и плода во время беременности.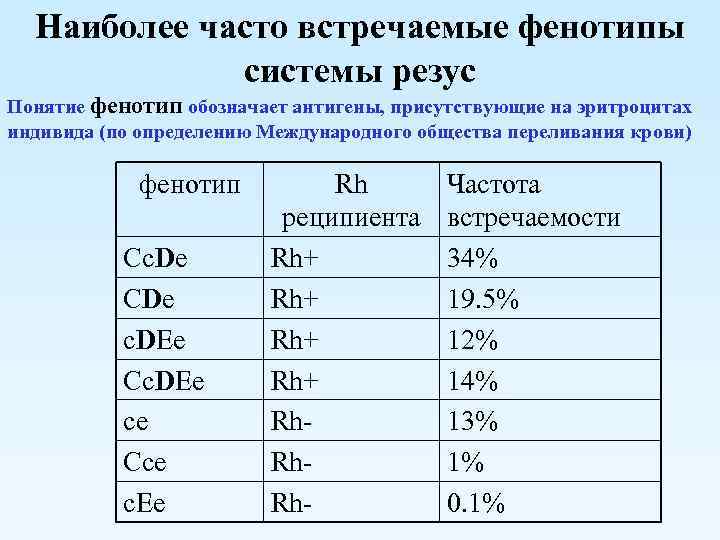
В настоящее время известно 29 систем антигенов эритроцитов. Клиническая роль многочисленных антигенов эритроцитов крови неодинакова, она определяется иммуногенностью антигенов. Иммунногенность антигенов определяется способностью вырабатывать антитела к данным антигенам с образованием комплекса антиген-антитело, что приводит к гемолизу (разрушению) эритроцитов. В этом плане первостепенное клиническое значение имеют антигены системы ABO (традиционная «группа крови») и резус (резус-фактор). Система антигенов резус в настоящее время насчитывает 48 антигенов. Но значение имеют 5 основных антигенов – D, С, с, Е, e. Наибольшее клиническое значение имеет антиген D, при наличии которого говорят о резус-положительной крови. Антиген D в 95% случаев является причиной гемолитической болезни новорожденных (ГБН) при несовместимости матери и плода, а также тяжелых посттрансфузионных осложнений. Иммуногенность других антигенов С, Е, с, е (минорных) значительно ниже, но их определение важно при индивидуальном подборе крови для многократных трансфузий, в тех случаях, когда в сыворотке реципиента обнаружены иммунные антитела к антигенам системы резус, а также у женщин детородного возраста.
Система Келл насчитывает 24 антигена, наибольшее клиническое значение при трансфузиях имеет антиген К (KELL 1). Трансфузионные реакции, вызванные анти-К антителами, могут приводить к смертельному исходу в результате внесосудистого гемолиза эритроцитов. Антигены системы Келл выявляются на фетальных эритроцитах на ранних сроках беременности и могут вызвать гемолитическую болезнь новорожденных. Анти-К антитела вызывают наиболее тяжелые формы с внутриутробной смертью и мертворождением.
Показания к исследованию:
- Обследования перед планирующимися гемотрансфузиями;
- Дополнительные обследования во время беременности с целью оценки статуса по системе резус и Kell;
- Обследование всех доноров крови в соответствии с приказом МЗ РФ № 183н от 02.04.2013г. «Об утверждении правил клинического использования донорской крови и (или) ее компонентов».
Группы крови — Служба крови
Размер шрифта А А А Цветовая схема Б Ч Г Ж З Обычная версия Дополнительно
При переливании необходимо предварительно определить группу крови и донора и пациента.
Существует 4 группы крови.
Система ABO
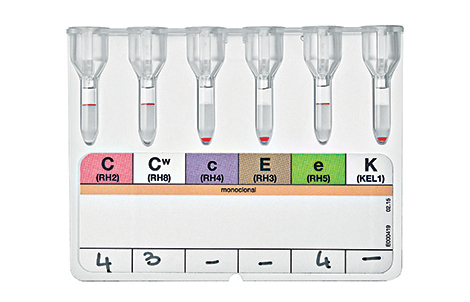
В конце XIX в. Австралийский ученый Карл Ландштайнер, проводя исследование эритроцитов, обнаружил любопытную закономерность: в красных кровяных клетках (эритроцитах) некоторых людей может быть специальный маркер, который ученый обозначил буквой А, у других — маркер В, у третьих не обнаруживались ни А, ни В. Позже выяснилось, что описанные Ландштайнером маркеры — особые белки, определяющие видовую специфичность клеток, или антигены. Фактически эти исследования поделили все человечество на 3 группы крови.
Четвертая группа была описана в 1902 году учеными Декастелло и Штурли. Совместное открытие ученых получило название системы АВО.
О (I)
первая группа крови
А (II)
вторая группа крови
В (III)
третья группа крови
АВ (IV)
четвертая группа крови
Резус-фактор
В отличие от антигенов группы крови, резус-фактор-это антиген, обнаруженный только в мембране эритроцита и не зависящий от других факторов крови.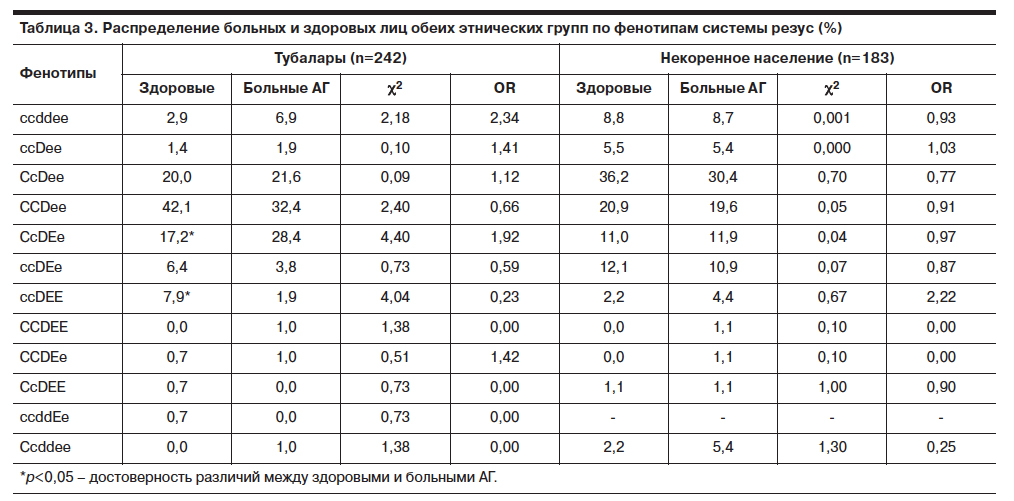 Резус-фактор передается по наследству и сохраняется в течение всей жизни человека. 85% людей, в эритроцитах которых находится резус-фактор, обладают резус-положительной кровью (Rh+), кровь остальных людей не содержит резус-фактор и называется резус-отрицательной (Rh-).
Резус-фактор передается по наследству и сохраняется в течение всей жизни человека. 85% людей, в эритроцитах которых находится резус-фактор, обладают резус-положительной кровью (Rh+), кровь остальных людей не содержит резус-фактор и называется резус-отрицательной (Rh-).
Келл-фактор
Система Kell — это система группы крови, в которую входят 25 антигенов, в том числе самый иммуногенный после А, В и D, антиген К.
На основании наличия антигена K в эритроцитах или его отсутствия все люди могут быть разделены на две группы: Kell-отрицательные и Kell-положительные. Наличие антигена К (Kell-положительный) не является патологией и передается по наследству, как и другие групповые антигены человека. В России он встречается у 7-10% жителей.
В настоящее время в учреждениях службы крови определяют наличие антигена К, как наиболее опасного для возникновения иммунологических осложнений. Описаны многие случаи гемотрансфузионных осложнений и гемолитической болезни новорожденных, причиной которых была изоиммунизация антигеном К.
Kell-отрицательным должна переливаться только кровь от доноров, не имеющих антиген К для предотвращения гемолиза. Лица же Kell-положительные являются универсальными реципиентами крови, так как у них не происходит отторжения её компонентов.
В целях профилактики посттрансфузионных осложнений, обусловленных антигеном К системы Kell, отделения и станции переливания крови выдают для переливания в лечебные учреждения эритроцитную взвесь или массу, не содержащие этого фактора. При переливании всех видов плазмы, тромбоцитного концентрата, лейкоцитного концентрата антиген К системы Kell не учитывают.
Поэтому Kell-положительным донорам рекомендуется донорство плазмы.
Читайте также
Современная эффективная деятельность Службы крови стала возможна только благодаря реализации основных направлений ее развития.Большинство людей знают о донорстве очень мало и потому доверяют самым необоснованным мифам.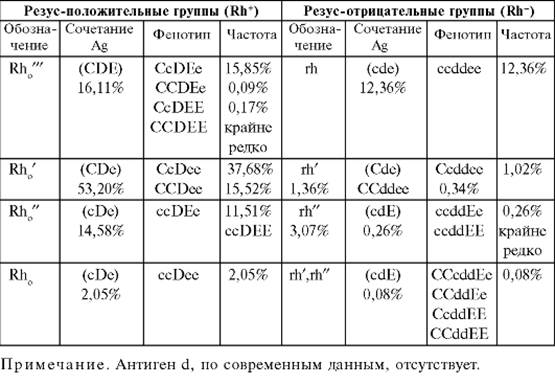 ..
..
Планируешь донацию? Расскажи об этом своим друзьям!
Фенотипирование: сдать анализ в «ГЕМОХЕЛП»
Антигены эритроцитов человека являются структурными образованиями различной химической природы (протеины, гликопротеины или гликолипиды), расположенными на внешней поверхности мембраны эритроцитов. Антигены эритроцитов наследуются от родителей и в течение жизни не меняются. В настоящее время известно более 250 антигенов эритроцитов, которые распределяются в 29 генетически независимых системах, среди них – системы АВО, Rh, Kell, Duffy, Kidd и пр. Клинически значимые из них немногие.
У людей, у которых отсутствует какой-либо антиген, при попадании в организм эритроцитов, несущих этот антиген, может развиваться иммунный ответ с образованием антител. Такая ситуация возможна при переливаниях донорской крови или при прохождении эритроцитов плода в кровь матери во время беременности. Все это приводит к возникновению гемолитической реакции. В результате воздействия аллоиммунных антител, направленных против эритроцитарных антигенов, происходит гемолиз эритроцитов — эритроциты разрушаются.
Такая ситуация возможна при переливаниях донорской крови или при прохождении эритроцитов плода в кровь матери во время беременности. Все это приводит к возникновению гемолитической реакции. В результате воздействия аллоиммунных антител, направленных против эритроцитарных антигенов, происходит гемолиз эритроцитов — эритроциты разрушаются.
Клинически наиболее важным типом аллоиммунных антител являются антитела к главному антигену генетический системы резус — D (Rh(D) фактор). По частоте клинических проявлений за ним следуют реакции, связанные с другими антигенами системы резус Rh (C, E, c, e) и антигенами системы Kell (К/k). Проявления, связанные с иными эритроцитарными антигенами, более редки.
Фенотипирование – это изосерологическое исследование на наличие тех или иных антигенов эритроцитов. В лаборатории «ГЕМОХЕЛП» определяются следующие антигены системы резус Rh (C, E, c, e) и системы Kell (К)
Показания к назначению анализа:
- при ведении беременности с целью оценки статуса по системе резус и Kell
-
подготовка к гемотрансфузии.

Необходимо воздержаться от приема пищи в течение 2-3 часов
Фенотип антигенов эритроцитов и индекс сенсибилизации у доноров компонентов крови и пациентов г. Астаны
Ж.К. Буркитбаев, Р.Б. Меирбекова, Е.Н. Курганская, Л.Л. Карп, Р.З. Магзумова
Научно-производственный центр трансфузиологии, г. Астана, Казахстан
Трансфузиология №2, 2013
Резюме
В результате проведенного исследования установлено большое разнообразие фенотипов в системе Резус, а также достаточно высокая степень сенсибилизации у реципиентов и высокий индекс сенсибилизации населения города Астаны.
Ключевые слова: антигенный состав эритроцитов.
Введение
Исследование распространенности у доноров основных клинически значимых антигенов эритроцитов, определение индекса аллоиммунизации является непременным условием адекватной профилактики посттрансфузионных реакций и осложнений гемолитического типа. Определение группы крови, резус-принадлежности и типирование антигенов эритроцитов имеет большое значение при проведении гемотрансфузий для подбора совместимых пар донор-реципиент и профилактики наиболее опасных для жизни реципиентов посттрансфузионных осложнений гемолитического типа [1–16]. Методика агглютинации в геле была разработана с целью стандартизации реакций гемагглютинации и получения достоверных результатов. Тестирование на индивидуальную совместимость крови донора и реципиента по антигенам эритроцитов не заменяет обязательное иммуногематологическое исследование, а лишь дополняет его. Использование гелевой системы позволяет также снизить риск заражения персонала даже при работе с потенциально инфицированными образцами [2]. Благодаря высокой чувствительности, стандартности и хорошей воспроизводимости результатов, методы агглютинации в геле получили широкое распространение [3].
Определение группы крови, резус-принадлежности и типирование антигенов эритроцитов имеет большое значение при проведении гемотрансфузий для подбора совместимых пар донор-реципиент и профилактики наиболее опасных для жизни реципиентов посттрансфузионных осложнений гемолитического типа [1–16]. Методика агглютинации в геле была разработана с целью стандартизации реакций гемагглютинации и получения достоверных результатов. Тестирование на индивидуальную совместимость крови донора и реципиента по антигенам эритроцитов не заменяет обязательное иммуногематологическое исследование, а лишь дополняет его. Использование гелевой системы позволяет также снизить риск заражения персонала даже при работе с потенциально инфицированными образцами [2]. Благодаря высокой чувствительности, стандартности и хорошей воспроизводимости результатов, методы агглютинации в геле получили широкое распространение [3].
Цель и задачи исследования
Целью работы явилось изучение частоты встречаемости антигенов эритроцитов и определение уровня сенсибилизации населения г.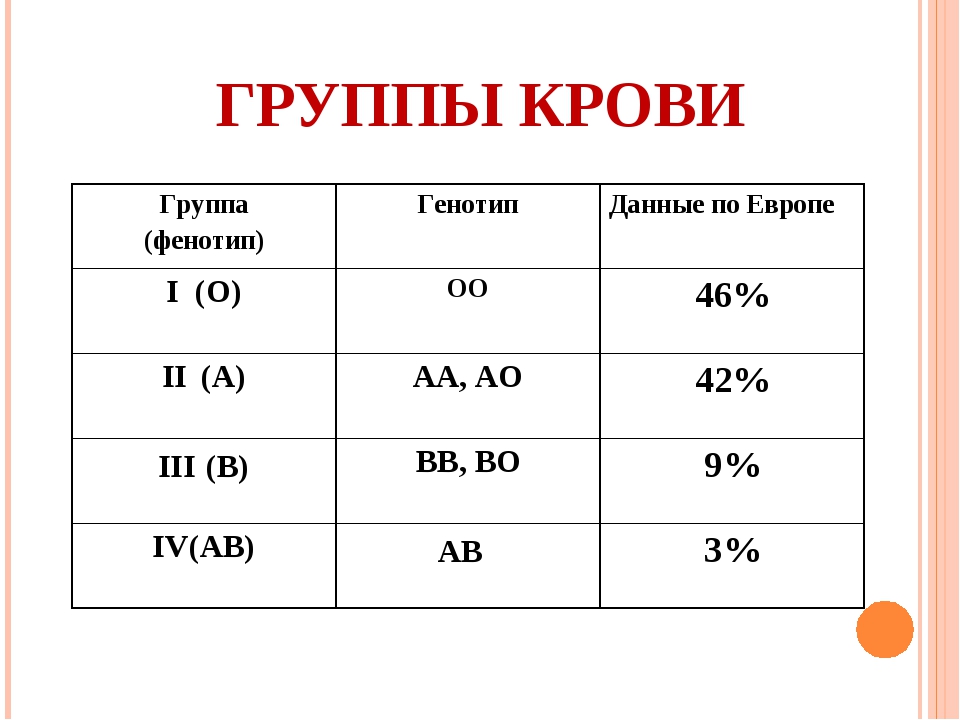 Астаны.
Астаны.
Материал и методы исследования
Материалом исследования служили 119882 образцов крови доноров и 6313 реципиентов за период 2010–2012 гг. Возраст доноров колебался от 18 до 60 лет. Средний возраст доноров составил 43,4±5,1 года. Возраст больных колебался от 0 до 77 лет. Средний возраст больных составил 37,9±9,5 года. Среди доноров было 64736 мужчин (54,0%) и 55146 – женщин (46,0%). Среди реципиентов мужчины составили 66,9%, женщины – 33,1%. Контингент обследованных пациентов: реципиенты, в анамнезе которых многократные трансфузии; беременные, входившие в группу риска по аллоиммунизации; дети с гемолитической болезнью новорожденных. Все образцы крови доноров исследовались на групповую принадлежность по системе АВО перекрестным методом с использованием моноклональных антител, стандартных эритроцитов, а также методом микроколоночной агглютинации с использованием кассет ORTHO BioVue. Образцы крови реципиентов исследовались на групповую принадлежность по системе АВО с применением гелевой методики Scangel. А нтиген D с истемы Р езус выявляли с помощью Цоликлона АнтиD Супер (ООО «Гематолог», Москва) и с применением метода микроколоночной агглютинации с использованием кассет ORTHO BioVue, дополнительно все RH(D)-отрицательные доноры (3464 из 119 тысяч) исследовались на наличие вариантных и слабых форм антигена D с помощью моноклональных антител анти-Rh2(D)/ RhW1 в реакции Кумбса с применением гелевой методики Scangel (Карты Scangel Кумбс анти-IgG, C3d), «BioRad Laboratories», США). Все образцы крови доноров тестировались на наличие антигена К системы Кell с использованием моноклональных антител анти-К Супер (ООО «Гематолог», Москва) и с помощью метода микроколоночной агглютинации с использованием ORTHO BioVue анти-К. Все RH(D)-отрицательные доноры, а также «кадровые» RH(D)-положительные доноры были фенотипированы по антигенам С, с, Е, е системы Резус с использованием метода микроколоночной агглютинации с использованием кассет RH/K ORTHO BioVue, все реципиенты были фенотипированы по антигенам С, с, Е, е системы Резус с помощью гелевого метода с использованием карт Scangel Моноклональные RH/Kell производст- ва «Bio-Rad Laboratories», США.
А нтиген D с истемы Р езус выявляли с помощью Цоликлона АнтиD Супер (ООО «Гематолог», Москва) и с применением метода микроколоночной агглютинации с использованием кассет ORTHO BioVue, дополнительно все RH(D)-отрицательные доноры (3464 из 119 тысяч) исследовались на наличие вариантных и слабых форм антигена D с помощью моноклональных антител анти-Rh2(D)/ RhW1 в реакции Кумбса с применением гелевой методики Scangel (Карты Scangel Кумбс анти-IgG, C3d), «BioRad Laboratories», США). Все образцы крови доноров тестировались на наличие антигена К системы Кell с использованием моноклональных антител анти-К Супер (ООО «Гематолог», Москва) и с помощью метода микроколоночной агглютинации с использованием ORTHO BioVue анти-К. Все RH(D)-отрицательные доноры, а также «кадровые» RH(D)-положительные доноры были фенотипированы по антигенам С, с, Е, е системы Резус с использованием метода микроколоночной агглютинации с использованием кассет RH/K ORTHO BioVue, все реципиенты были фенотипированы по антигенам С, с, Е, е системы Резус с помощью гелевого метода с использованием карт Scangel Моноклональные RH/Kell производст- ва «Bio-Rad Laboratories», США. Во всех образцах крови доноров и реципиентов был проведен скрининг антиэритроцитарных аллоантител с помощью реакции Кумбса, выполненной с применением гелевой методики Scangel (Карты Scangel Кумбс анти-IgG, C3d), с эритроцитами Scangel I-II-III производства фирмы «Bio-Rad Laboratories», США-Франция). При положительных результатах скрининга проводилась идентификация анти- тел с эритроцитами ScanPanel из 10 линий клеток, «Bio-Rad laboratories», США.
Во всех образцах крови доноров и реципиентов был проведен скрининг антиэритроцитарных аллоантител с помощью реакции Кумбса, выполненной с применением гелевой методики Scangel (Карты Scangel Кумбс анти-IgG, C3d), с эритроцитами Scangel I-II-III производства фирмы «Bio-Rad Laboratories», США-Франция). При положительных результатах скрининга проводилась идентификация анти- тел с эритроцитами ScanPanel из 10 линий клеток, «Bio-Rad laboratories», США.
Результаты и обсуждения
Нами было проанализировано распределение групп крови системы АВО у доноров и реципиентов (таблица 1).
Полученные данные свидетельствуют о том, что распределение групп крови по системе АВО у доноров и пациентов сходны. Преобладающими являются O и А группы крови. Выявленная нами частота встречаемости антигена А2 в группе крови А и АВ составляет для доноров 0,32%, а для пациентов 3,2%. Выявленное нами соотношение Rh(D)-положительных и Rh(D)-отрицательных лиц среди пациентов составило 94,39 и 5,6% соответственно. Для доноров это соотношение составило 92,43% Rh(D)-положительных и 7,57% Rh(D)-отрицательных (табл. 2).
Для доноров это соотношение составило 92,43% Rh(D)-положительных и 7,57% Rh(D)-отрицательных (табл. 2).
Полученные нами данные выявили значительно больший процент антигена D вариантного у пациентов. Возможно, это является результатом ослабления антигена D при заболеваниях. Изучение антигенного состава эритроцитов кадровых доноров и пациентов показало, что наиболее распространенным фенотипом среди Rh(D)-положительных лиц является фенотип CCDee-, далее следуют фенотипы CcDee-, CcDEe- и ccDEe- (табл. 3).
Наибольшую опасность представляют в трансфузионном отношении гомозиготные сочетания антигенов системы Резус (СС, сc, ЕЕ и ее), которые встречаются у 86% резус-положительных (D+). Всем донорам и реципиентам независимо от групповой и резус- принадлежности предварительно проводился скрининг на наличие антиэритроцитарных антител. При оценке антиэритроцитарных антител у 13,3% пациентов обнаружены иммунные антитела различной специфичности. В связи с тем, что среди контингента обследованных в лаборатории лиц превалировали беременные, входившие в группу риска по аллоиммунизации, а также больные получившие многократные трансфузии, – индекс сенсибилизации у пациентов оказался высоким. Антитела к антигенам эритроцито системы Резус появляются в организме в результате трансфузий эритроцитов доноров, содержащих антигены, отсутствующие у реципиента, а также при иммунизации матери эритроцитами плода. Частота встречаемости аллоантител к антигенам эритроцитов системы Резус различна и определяется иммуногенностью антигена и частотой встречаемости в популяции. В 31% случаев антитела не идентифицировали, что связано с сочетанной специфичностью антител или наличием антител к широко распространенным в популяции антигенам. При изучении частоты аллосенсибилизации среди RH(D)-положительных и RH(D)-отрицательных лиц, было обнаружено, что RH(D)-отрицательные люди иммунизируются в 2–2,5 раза чаще, чем RH(D)-положительные. Антитела к минорным антигенам эритроцитов чаще встречаются у резус-положительных лиц, чем у резус-отрицательных. У доноров встречаемость аллоантител составила 0,46% (табл. 4).
Антитела к антигенам эритроцито системы Резус появляются в организме в результате трансфузий эритроцитов доноров, содержащих антигены, отсутствующие у реципиента, а также при иммунизации матери эритроцитами плода. Частота встречаемости аллоантител к антигенам эритроцитов системы Резус различна и определяется иммуногенностью антигена и частотой встречаемости в популяции. В 31% случаев антитела не идентифицировали, что связано с сочетанной специфичностью антител или наличием антител к широко распространенным в популяции антигенам. При изучении частоты аллосенсибилизации среди RH(D)-положительных и RH(D)-отрицательных лиц, было обнаружено, что RH(D)-отрицательные люди иммунизируются в 2–2,5 раза чаще, чем RH(D)-положительные. Антитела к минорным антигенам эритроцитов чаще встречаются у резус-положительных лиц, чем у резус-отрицательных. У доноров встречаемость аллоантител составила 0,46% (табл. 4).
Проблема гемолитической болезни новорожденных (ГБН) для города Астана актуальна. Наиболее часто ГБН развивается вследствие конфликта по антигенам системы Резус и АВ0 (табл. 5).
Наиболее часто ГБН развивается вследствие конфликта по антигенам системы Резус и АВ0 (табл. 5).
Диагностический центр (центр лабораторных исследований)
Государственное бюджетное учреждение здравоохранения города Москвы «Диагностический центр (Центр лабораторных исследований) Департамента здравоохранения города Москвы» (далее ДЦЛИ) проводит лабораторные исследования для детского и взрослого населения ЮАО и других лечебных учреждений, прикрепленных к ДЦЛИ.
Исследования в ДЦЛИ проводятся только по направлениям врачей медицинских учреждений Департамента здравоохранения города Москвы. ДЦЛИ создан приказом ДЗМ от 25.05.2012г. № 480 для выполнения полного перечня лабораторных исследований (в том числе эксклюзивных) на самом современном уровне.
Персонал ДЦЛИ – высококвалифицированные специалисты, имеющие большой опыт работы на современном оборудовании, которое являетсяодним из последних достижений мировой науки и техники.
Установленное в ДЦЛИ оборудование, а также разработанная специализированная лабораторная информационная система (ЛИС) позволяют проводить исследования в автоматическом режиме, исключая вероятность ошибки и получать результаты исследований в течение рабочего дня.
Ключевым моментом работы ДЦЛИ является соответствие высоким международным стандартам при выполнении исследований. Центр участвует в международных программах оценки качества проводимых исследований, таких как EQAS и программе внешней оценке качества исследований ФСВОК.
ДЦЛИ в своей структуре имеет следующие подразделения:
- Информационно-аналитический отдел
- Отдел клинических исследований
- Отдел иммунологических исследований
- Отдел клинической биохимии
- Отдел клинической микробиологии
- Отдел цитологических исследований
- Отдел контроля качества
- Отдел диагностики оппортунистических инфекций
ДЦЛИ проводит:
- биохимические исследования
- ДНК-диагностику
- иммунологические исследования (исследования иммунного статуса, определение маркеров инфекционных заболеваний, аллергенов, пищевой непереносимости и др.
 )
) - ВИЧ-диагностику
- изосерологические исследования (группа крови, резус принадлежность, определение антигена Kell, фенотипирование эритроцитов, определение антирезусных антител, определение антител по системе AB0)
- общеклинические лабораторные исследования
- микробиологические исследования
ГБУЗ ДЦЛИ ДЗМ имеет действующие договора на оказание и оплату медицинской помощи по обязательному медицинскому страхованию со следующими организациями:
- АКЦИОНЕРНОЕ ОБЩЕСТВО «МЕДИЦИНСКАЯ СТРАХОВАЯ КОМПАНИЯ «УРАЛСИБ» АО «МСК «УРАЛСИБ»
- АКЦИОНЕРНОЕ ОБЩЕСТВО «МЕДИЦИНСКАЯ АКЦИОНЕРНАЯ СТРАХОВАЯ КОМПАНИЯ» АО «МАКС-М»
- ОБЩЕСТВО С ОГРАНИЧЕННОЙ ОТВЕТСТВЕННОСТЬЮ «МЕДИЦИНСКАЯ СТРАХОВАЯ КОМПАНИЯ «МЕДСТРАХ» ООО «МСК «МЕДСТРАХ»
- АКЦИОНЕРНОЕ ОБЩЕСТВО «СТРАХОВАЯ ГРУППА «СПАССКИЕ ВОРОТА-М» АО «СТРАХОВАЯ ГРУППА «СПАССКИЕ ВОРОТА-М»
- ОБЩЕСТВО С ОГРАНИЧЕННОЙ ОТВЕТСТВЕННОСТЬЮ ВТБ МЕДИЦИНСКОЕ СТРАХОВАНИЕ ООО ВТБ МС
- ОБЩЕСТВО С ОГРАНИЧЕННОЙ ОТВЕТСТВЕННОСТЬЮ»СТРАХОВАЯ МЕДИЦИНСКАЯ КОМПАНИЯ РЕСО-МЕД» (Московский филиал) ООО «СМК РЕСО-МЕД»(МОСКОВСКИЙ ФИЛИАЛ)
- АКЦИОНЕРНОЕ ОБЩЕСТВО «СТРАХОВАЯ КОМПАНИЯ «СОГАЗ-МЕД» АО «СТРАХОВАЯ КОМПАНИЯ «СОГАЗ-МЕД»
- ОБЩЕСТВО С ОГРАНИЧЕННОЙ ОТВЕТСТВЕННОСТЬЮ «СТРАХОВАЯ КОМПАНИЯ «ИНГОССТРАХ-М» ООО «СК «ИНГОССТРАХ-М»
- ОБЩЕСТВО С ОГРАНИЧЕННОЙ ОТВЕТСТВЕННОСТЬЮ «РОСГОССТРАХ-МЕДИЦИНА» ФИЛИАЛ ООО «РГС- МЕДИЦИНА»-«РОСГОССТРАХ-СТОЛИЦА-МЕДИЦИНА» ООО «РГС-МЕДИЦИНА»
Сотрудникам Центра лабораторных исследований на Ореховом бульваре достаточно одного дня, чтобы получить результаты анализов, которые проводят на высокотехнологичном оборудовании.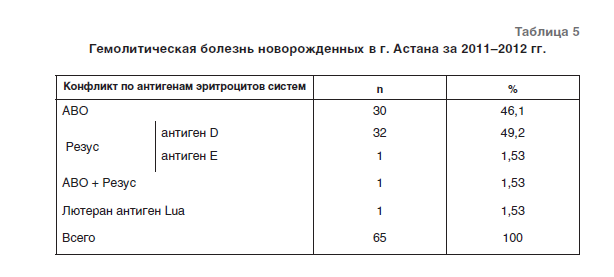
В центре используют более сотни различных аппаратов, которые позволяют диагностировать редкие инфекции.
Лаборатория обслуживает медицинские организации всего города. Большой вклад в оснащение центра внесла программа “Модернизации здравоохранения”.
В ДЦЛИ используются самые современные системы автоматизации лабораторных исследований. В том числе уникальная трекинговая система.
экспертная диагностика от лаборатории АрхиМед
Выявление антител к специфическому белку, находящемуся на поверхности эритроцитов, – резус-фактору. Данные антитела являются одной из основных причин гемолитической болезни новорожденных.Подготовка к исследованию:
- Не курить в течение 30 минут до исследования.
Повышение значений (положительный результат):
- Антитела обнаружены, есть вероятность резус-конфликта.
- Антитела не обнаружены, вероятность резус-конфликта низкая.

- Анализ на антирезусные антитела применяется главным образом для обнаружения антител на резус-фактор. Резус-отрицательная мать и резус-положительный отец могут зачать Rh+ ребенка, при этом есть вероятность, что некоторые эритроциты крови ребенка попадут в кровяное русло матери во время беременности и родов. В ответ на чужеродные эритроциты Rh+ организм матери вырабатывает антирезусные антитела. Они представляют собой угрозу для будущих детей этой матери. Каждая женщина до наступления беременности либо во время нее должна сдать анализ на резус-фактор. Он поможет определить, является ли ее кровь резус-отрицательной, а также выяснить, приобрела ли резус-отрицательная женщина антитела против эритроцитов Rh+. Беременная женщина, организм которой еще не образовал антирезусные антитела, для предотвращения их появления может воспользоваться инъекциями иммуноглобулина. Резус-отрицательной женщине при беременности следует пройти дополнительное лечение иммуноглобулинами сразу после любой ситуации, когда кровь плода могла попасть в ее кровяное русло.
 Анализ на антирезусные антитела помогает выявлять эти процессы и вовремя назначать и корректировать лечение для предотвращения резус-конфликта.
Анализ на антирезусные антитела помогает выявлять эти процессы и вовремя назначать и корректировать лечение для предотвращения резус-конфликта.
- При необходимости назначить лечение иммуноглобулиновыми инъекциями беременной женщине с отрицательным резус-фактором.
- В случае когда эритроциты плода могли попасть в кровяное русло беременной с резус-отрицательным фактором, если у нее были выкидыши, внематочная беременность, искусственные роды или аборты, пункция плодного пузыря, травмы живота, искусственное изменение положения плода.
- Анализ может быть назначен женщине с отрицательным резус-фактором, родившей ребенка с положительным резусом и прошедшей лечение инъекциями иммуноглобулинов, для того чтобы определить, есть ли у него антитела против эритроцитов Rh+.
- Антирезусные антитела иногда присутствуют в очень низких количествах, не поддающихся определению.

- Кровь маленьких детей может реагировать с антителом, даже если анализ дает негативную реакцию.
- Если матери была сделана инъекция анти-D-гамма-глобулина в течение последних шести месяцев, анализ на антитело может давать положительные результаты.
- Женщине с отрицательным резусом нет необходимости подвергаться лечению инъекциями анти-D-гамма-глобулина, если отец ребенка тоже имеет отрицательный резус-фактор, так как и у ребенка в этом случае будет отрицательный резус, так что риска возникновения гемолитической болезни не возникнет.
Метод исследования Реакция агглютинации
Срок выполнения до 2-х рабочих дней
Биоматериал Венозная кровь
Группа крови Kell — группы крови и антигены красных кровяных телец
Система групп крови Kell сложна и содержит много антигенов с высоким содержанием
иммуногенный. Эти антигены занимают третье место по активности после антигенов ABO и Rh.
группы крови, вызывающие иммунную реакцию.
Эти антигены занимают третье место по активности после антигенов ABO и Rh.
группы крови, вызывающие иммунную реакцию.
Антитела, нацеленные на антигены Kell, могут вызывать трансфузионные реакции и гемолитические реакции. болезнь новорожденного (HDN). В случае HDN несовместимость по ABO и Rh более частые причины. Однако заболевание, вызванное материнскими анти-АВО, обычно протекает в легкой форме. и заболевание, вызванное материнским анти-резус-фактором, можно в значительной степени предотвратить.Редкие случаи ГБН, вызванные иммунизацией Келла, как правило, приводят к тяжелой анемии плода потому что материнские анти-Kell нацелены на предшественники эритроцитов плода (RBC), подавляя производство эритроцитов у плода.
Кратко
Антигены группы крови Kell
Вид в собственном окне
| Количество антигенов | 25 Антиген K является одним из наиболее клинически важные антигены Kell.  |
| Антигенная специфичность | Белок Аминокислотная последовательность определяет специфичность антигенов Kell |
| Антиген-несущие молекулы | Гликопротеин с ферментативной функцией The Kell гликопротеин — это трансмембранный однопроходный белок, несущий Келлские антигены.Это фермент, превращающий эндотелин-3; Это расщепляет «большой» эндотелин-3 с образованием активной формы, которая является сильнодействующее сосудосуживающее средство (1). |
| Молекулярная основа | Ген KEL кодирует антигены Kell. KEL очень полиморфен. Имеет два основных кодоминанта аллели, k и K, которые являются результатом SNP (698C → T), и соответствующие антигены k и K отличаются одной заменой аминокислоты (Т193М).  |
| Частота антигенов Kell | ~ 100%: k, Kp b , Ku, Js b , K11,
K12, K13, K14, K18, K19, Km, K22, K26, K27 Антиген K: 2% у чернокожих, 9% у кавказцев, до 25% у арабов ~ 2%: Kp a , U1 a ~ 0.01%: Js a (0,01% у кавказцев, 20% у чернокожих), Kp c , K23 Другие: K17 (~ 0,3%), K24 (редко), VLAN (редко), K16 (неизвестно) (2) |
| Частота фенотипов Kell | K-k + у 91% кавказцев и 98% чернокожих K + k- у 0,2% кавказцев и редко у чернокожих K + k + у 8,8% кавказцев и 2% чернокожих Kp (a-b + ) у 97,7% кавказцев и 100% чернокожих Js (a-b +) у 100% европеоидов и 80% черных (2) |
Антитела, продуцируемые против антигенов Kell
Посмотреть в собственном окне
| Тип антител | IgG IgM нечасто |
| Реактивность антител | Не связывает комплемент Если гемолиз бывают, имеют внесосудистый характер.  |
| Реакция на переливание крови | Может вызвать тяжелое гемолитическое переливание
реакция Анти-К и анти-Ку способны вызывать тяжелая реакция. Более мягкую реакцию вызывают anti-k, анти-КП a , анти-КП b , анти-Js a , и анти-JS b . |
| Гемолитическая болезнь новорожденных | Может вызвать тяжелую анемию плода Келл изоиммунизация является третьей по частоте причиной ГБН после резус и ABO.Anti-Kell вызывает тяжелую анемию плода, подавляя эритроциты плода синтез (3, 4). |
Справочная информация
История
Система групп крови Келл была открыта в 1946 году. Она была названа в честь миссис Дж.
Келлехер, пациент, у которого антитела против Kell вызвали гемолитический
заболевание ее новорожденного ребенка (эритроциты ребенка экспрессировали антиген К, который
связывается анти-K в сыворотке крови матери). С этого времени в общей сложности 25 келл
были обнаружены антигены, и они экспрессируются с разной частотой в
разные популяции.Но исходный антиген K по-прежнему имеет первостепенное значение в
трансфузионная медицина и HDN.
С этого времени в общей сложности 25 келл
были обнаружены антигены, и они экспрессируются с разной частотой в
разные популяции.Но исходный антиген K по-прежнему имеет первостепенное значение в
трансфузионная медицина и HDN.
Базовая биохимия
Фенотипы обыкновенных Kell
Система групп крови Kell сложна. Локус Kell очень полиморфен и дает начало многим антигенам Kell. Однако есть два основных кодоминанта. аллельные гены, которые продуцируют два важных антигена: K и k (ранее известные как Kell и Cellano соответственно), которые отличаются одной аминокислотой. К антиген встречается чаще, чем K-антиген в большинстве популяций, K-k + фенотип обнаружен у 98% негров и 91% европеоидов (2).
Необычные фенотипы Kell
Нулевой фенотип
Система Kell имеет редкий нулевой фенотип, K o , в котором отсутствуют эритроциты.
все антигены Kell. Люди с этим фенотипом здоровы, но производят
анти-Ku, когда они сталкиваются с эритроцитами, которые действительно экспрессируют антигены Kell. Анти-Ку есть
способен вызвать реакцию переливания от легкой до тяжелой, по крайней мере, с одним
сообщается о смертельном случае (5). Следовательно, если K или людям когда-либо понадобится кровь
переливание, им следует переливать только кровь K o продукты.
Анти-Ку есть
способен вызвать реакцию переливания от легкой до тяжелой, по крайней мере, с одним
сообщается о смертельном случае (5). Следовательно, если K или людям когда-либо понадобится кровь
переливание, им следует переливать только кровь K o продукты.
Синдром Маклеода
В мембране эритроцитов гликопротеин Kell ковалентно связан с XK белок, многопроходный мембранный белок, который, как полагают, играет роль в транспорте. В отсутствие XK, состояние, называемое синдромом МакЛеода, антигены Келла являются выражены слабо, эритроциты аномальные, с шипами (акантоцитоз). Системные симптомы включают мышечную дистрофию, кардиомиопатия, психические расстройства и неврологические дефекты, такие как потеря рефлексов и двигательные расстройства (1).
Экспрессия антигенов Kell
Когда-то считалось, что антигены Kell ограничены клетками крови эритроида
происхождения (т. е. эритроцитов и их предшественников), но недавно было обнаружено, что они
экспрессироваться в миелоидных тканях (6,
7).
Антиген Kell также экспрессируется в небольшом количестве на ряде органов. включая лимфоидные органы, мышцы (как сердечные, так и скелетные) и нервную систему. система (2).
Функции гликопротеина Kell
Гликопротеин Kell представляет собой фермент, превращающий эндотелин-3.Расщепив неактивный предшественник (большой эндотелин-3), он создает активный эндотелин-3, который сильное сужение кровеносных сосудов.
Клиническое значение антител Kell
Антиген K является наиболее иммуногенным антигеном после антигенов ABO и Rh системы групп крови.
Реакции переливания
Антитела против Kell обычно относятся к классу антител IgG (IgM намного меньше
общий). Антитела, которые были причастны к переливанию крови.
реакции, которые иногда могут быть тяжелыми по своей природе, включают анти-K, анти-k,
Anti-Kp a и anti-Js b (2).Продукция анти-Ку у пациентов с
K o привело к гемолитической трансфузионной реакции со смертельным исходом (5).
Гемолитическая болезнь новорожденных
Anti-Kell — важная причина ГБН. Обычно это происходит у матерей, перенесших несколько переливаний крови в прошлом, но это также может происходить у матерей, которые были сенсибилизированы к антигену Kell во время предыдущих беременностей.
В отличие от сенсибилизации Rh и ABO, HDN, относящаяся к сенсибилизации Kell вызывается анти-K, подавляющим производство эритроцитов плодом.В отличие от Rh и ABO, Антигены Kell экспрессируются на поверхности предшественников эритроцитов, а анти-K способствует иммунному разрушению клеток-предшественников K + эритроидных клеток путем макрофаги в печени плода (а не только зрелые эритроциты плода). Поскольку Предшественники эритроцитов не содержат гемоглобина, меньше билирубина выделяется во время гемолиз, а желтуха в период новорожденности встречается реже. Тем не менее основная анемия может быть тяжелой (8).
В различных тематических исследованиях сообщалось о следующих антителах, вызывающих ГБН: anti-K
(7, 9-12), anti-k (13), anti-Kp a (14), anti-Kp b (15), anti-Js a (16, 17), anti-Js б (16, 18) и
анти-У1 а (19).
Молекулярная информация
Ген
Ген KEL находится на хромосоме 7, в 7q33, и содержит 19 экзонов, которые охватывают более 21 т.п.н. геномной ДНК. Ген KEL очень полиморфен, с различных аллелей в этом локусе, кодирующих 25 антигенов, которые определяют Kell группа крови.
Полиморфизм группы крови K / k представляет собой точечную мутацию, приводящую к аминокислотный переход с треонина 193 (в k-антигене) на метионин 193 (в антиген K) в гликопротеине Kell.Антиген K более эффективен при запускает иммунную реакцию, чем k-антиген. Его более высокий уровень антигенность может быть связана с тем, что, в отличие от других антигенов Kell, он , а не , гликозилированный по остатку 191 (20).
Другие общие полиморфизмы группы крови Kell включают Kp b / Kp a который возникает из SNP 961C → T, вызывающего замену аминокислоты R281W, и
Js b / Js a , который возникает из SNP 1910T → C
вызывая замену аминокислоты L597P (21).
Белок
Белок Kell представляет собой полипептидную цепь длиной 732 аминокислоты, которая становится гликозилирован по пяти различным сайтам.Совершает однократный проход через РБК. мембрана.
Белок Kell прикреплен к поверхности эритроцитов путем связывания с интегральный мембранный белок эритроцитов, XK, по единственной дисульфидной связи. XK — это трансмембранный белок, который 10 раз пересекает мембрану эритроцитов. Если XK отсутствует, мультисистемный синдром, синдром МакЛеода, результаты.
Белок Kell имеет как последовательность, так и структурную гомологию с большим семейством цинк-зависимые эндопептидазы (ферменты, которые расщепляют белки внутри пептида) цепи, а не рядом с N- или C-концом).Белок Kell и другие белки в это семейство содержит пентамерную последовательность, которая необходима для связывания цинка и каталитическая активность.
Источники
- 1.
- Мохандас Н., Нарла А. Антигены группы крови в здоровье и болезни.
 Curr Opin Hematol. 2005; 12: 135–40. [PubMed: 15725904]
Curr Opin Hematol. 2005; 12: 135–40. [PubMed: 15725904] - 2.
Рид М.Э. и Ломас-Фрэнсис К. Группа крови Книга фактов об антигенах. Второе изд. 2004, Нью-Йорк: Elsevier Academic Нажмите.
- 3.
- Vaughan JI, Warwick R, Letsky E, Nicolini U, Rodeck CH, Fisk NM.Подавление эритропоэза при анемии плода из-за Келла аллоиммунизация. Am J Obstet Gynecol. 1994; 171: 247–52. [PubMed: 8030708]
- 4.
- Воан Дж. И., Мэннинг М., Уорик Р. М., Летски Е. А., Мюррей Н. А., Робертс И. А.. Ингибирование эритроидных клеток-предшественников анти-Kell антитела при аллоиммунной анемии плода. N Engl J Med. 1998. 338: 798–803. [PubMed: 9504940] ,
- , 5. ,
- , Линь М., Ван Ц.Л., Чен Ф.С., Хо Л.Х. Смертельная гемолитическая трансфузионная реакция из-за анти-Ku у Пациент Кнулла.Иммуногематол. 2003; 19: 19–21. [PubMed: 15373542]
- 6.
- Wagner T, Berer A, Lanzer G, Geissler K. Келл не ограничивается эритропоэтическим происхождением, но
также экспрессируется на миелоидных клетках-предшественниках.
 Br J Haematol. 2000; 110: 409–11. [PubMed: 10971399]
Br J Haematol. 2000; 110: 409–11. [PubMed: 10971399] - 7.
- Вагнер Т., Реш Б., Рейтерер Ф., Гасснер С., Ланцер Г. Панцитопения из-за подавления кроветворения в случае фатальная гемолитическая болезнь новорожденных, связанная с анти-K поддерживаемой молекулярным типированием K1.J Pediatr Hematol Oncol. 2004; 26: 13–5. [PubMed: 14707704]
- 8.
- Daniels G, Hadley A, Green CA. Причины анемии плода при гемолитической болезни из-за анти-K. Переливание. 2003. 43: 115–6. [PubMed: 12519439]
- 9.
- де Йонге Н., Мартенс Дж. Э., Милани А. Л., Крийнен Дж. Л., ван Кримпен С., Понжи Г. А.. Гемолитическая болезнь новорожденных, вызванная анти-K антителами. Eur J Obstet Gynecol Reprod Biol. 1996. 67: 69–72. [PubMed: 8789754]
- 10.
- Фернандес-Хименес М.С., Хименес-Марко М.Т., Эрнандес Д., Гонсалес А., Оменака Ф., де ла Камара С.Лечение плазмаферезом и внутривенным иммуноглобулином
при беременности, осложненной иммунизацией против PP1Pk или против K:
отчет двух пациентов.
 Vox Sang. 2001; 80: 117–20. [PubMed: 11348543]
Vox Sang. 2001; 80: 117–20. [PubMed: 11348543] - 11.
- Collinet P, Subtil D, Puech F, Vaast P. Успешное лечение крайне тяжелой анемии плода из-за Келл-аллоиммунизация. Obstet Gynecol. 2002; 100: 1102–5. [PubMed: 12423822]
- 12.
- Ахадед А., Броссард Ю., Деббия М., Ламбин П. Количественное определение анти-K (KEL1) IgG и IgG подклассы в сыворотке крови беременных с тяжелой аллоиммунизацией ELISA.Переливание. 2000; 40: 1239–45. [PubMed: 11061862]
- 13.
- Боуман Дж. М., Харман Ф. А., Мэннинг Ч. Р., Поллок Дж. М.. Эритробластоз плода, продуцируемый anti-k. Vox Sang. 1989; 56: 187–9. [PubMed: 2728396]
- 14.
- Costamagna L, Barbarini M, Viarengo GL, Pagani A, Isernia D, Salvaneschi L. Случай гемолитической болезни новорожденного вследствие: анти-КП а . Иммуногематол. 1997; 13: 61–2. [PubMed: 15387785]
- 15.
- Dacus JV, Spinnato JA.Тяжелый эритробластоз плода, вторичный по отношению к
анти-Kp b сенсибилизация.
 Am J Obstet Gynecol. 1984; 150: 888–9. [PubMed: 6507516]
Am J Obstet Gynecol. 1984; 150: 888–9. [PubMed: 6507516] - 16.
- Gordon MC, Kennedy MS, O’Shaughnessy RW, Waheed A. Тяжелая гемолитическая болезнь новорожденных, вызванная анти-Js (b). Vox Sang. 1995; 69: 140–1. [PubMed: 8585197]
- 17.
- Левен С., Рудольфсон Ю., Шехтер Ю. Второй случай гемолитической болезни новорожденного из-за анти-Js а . Переливание. 1980; 20: 714–5.[PubMed: 7192023]
- 18.
- Стэнворт С., Флитвуд П., де Сильва М. Тяжелая гемолитическая болезнь новорожденных, вызванная анти-Js (b). Vox Sang. 2001; 81: 134–5. [PubMed: 11555475]
- 19.
- Сакума К., Сузуки Х., Ото Х., Цунэяма Х., Утикава М. Первый случай гемолитической болезни новорожденного вследствие анти-Ula антитела. Vox Sang. 1994; 66: 293–4. [PubMed: 8079454]
- 20.
- Daniels G. Молекулярная генетика полиморфизма групп крови. Transpl Immunol.2005. 14 (3-4): 143–153. [PubMed: 15982556]
- 21.
- Ли С., Руссо Д.
 , Редман С. Функциональные и структурные аспекты группы крови Келл
система. Transfus Med Rev.2000; 14 (2): 93–103. [PubMed: 10782495]
, Редман С. Функциональные и структурные аспекты группы крови Келл
система. Transfus Med Rev.2000; 14 (2): 93–103. [PubMed: 10782495]
Группа крови Kell — группы крови и антигены красных кровяных телец
Система групп крови Kell сложна и содержит много антигенов с высоким содержанием иммуногенный. Эти антигены занимают третье место по активности после антигенов ABO и Rh. группы крови, вызывающие иммунную реакцию.
Антитела, нацеленные на антигены Kell, могут вызывать трансфузионные реакции и гемолитические реакции.
болезнь новорожденного (HDN). В случае HDN несовместимость по ABO и Rh
более частые причины. Однако заболевание, вызванное материнскими анти-АВО, обычно протекает в легкой форме.
и заболевание, вызванное материнским анти-резус-фактором, можно в значительной степени предотвратить. Редкие
случаи ГБН, вызванные иммунизацией Келла, как правило, приводят к тяжелой анемии плода
потому что материнские анти-Kell нацелены на предшественники эритроцитов плода (RBC), подавляя
производство эритроцитов у плода.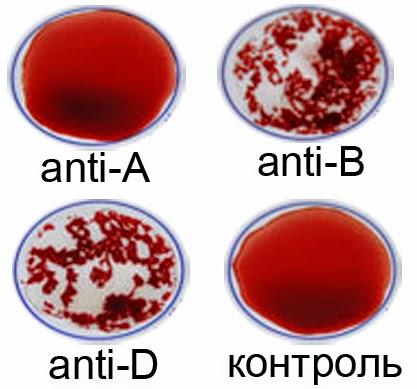
Кратко
Антигены группы крови Kell
Вид в собственном окне
| Количество антигенов | 25 Антиген K является одним из наиболее клинически важные антигены Kell. |
| Антигенная специфичность | Белок Аминокислотная последовательность определяет специфичность антигенов Kell |
| Антиген-несущие молекулы | Гликопротеин с ферментативной функцией The Kell гликопротеин — это трансмембранный однопроходный белок, несущий Келлские антигены.Это фермент, превращающий эндотелин-3; Это расщепляет «большой» эндотелин-3 с образованием активной формы, которая является сильнодействующее сосудосуживающее средство (1). |
| Молекулярная основа | Ген KEL кодирует антигены Kell. KEL очень полиморфен. Имеет два основных кодоминанта аллели, k и K, которые являются результатом SNP (698C → T), и соответствующие антигены k и K отличаются одной заменой аминокислоты (Т193М). |
| Частота антигенов Kell | ~ 100%: k, Kp b , Ku, Js b , K11,
K12, K13, K14, K18, K19, Km, K22, K26, K27 Антиген K: 2% у чернокожих, 9% у кавказцев, до 25% у арабов ~ 2%: Kp a , U1 a ~ 0.01%: Js a (0,01% у кавказцев, 20% у чернокожих), Kp c , K23 Другие: K17 (~ 0,3%), K24 (редко), VLAN (редко), K16 (неизвестно) (2) |
| Частота фенотипов Kell | K-k + у 91% кавказцев и 98% чернокожих K + k- у 0,2% кавказцев и редко у чернокожих K + k + у 8,8% кавказцев и 2% чернокожих Kp (a-b + ) у 97,7% кавказцев и 100% чернокожих Js (a-b +) у 100% европеоидов и 80% черных (2) |
Антитела, продуцируемые против антигенов Kell
Посмотреть в собственном окне
| Тип антител | IgG IgM нечасто |
| Реактивность антител | Не связывает комплемент Если гемолиз бывают, имеют внесосудистый характер.  |
| Реакция на переливание крови | Может вызвать тяжелое гемолитическое переливание
реакция Анти-К и анти-Ку способны вызывать тяжелая реакция. Более мягкую реакцию вызывают anti-k, анти-КП a , анти-КП b , анти-Js a , и анти-JS b . |
| Гемолитическая болезнь новорожденных | Может вызвать тяжелую анемию плода Келл изоиммунизация является третьей по частоте причиной ГБН после резус и ABO.Anti-Kell вызывает тяжелую анемию плода, подавляя эритроциты плода синтез (3, 4). |
Справочная информация
История
Система групп крови Келл была открыта в 1946 году. Она была названа в честь миссис Дж.
Келлехер, пациент, у которого антитела против Kell вызвали гемолитический
заболевание ее новорожденного ребенка (эритроциты ребенка экспрессировали антиген К, который
связывается анти-K в сыворотке крови матери). С этого времени в общей сложности 25 келл
были обнаружены антигены, и они экспрессируются с разной частотой в
разные популяции.Но исходный антиген K по-прежнему имеет первостепенное значение в
трансфузионная медицина и HDN.
С этого времени в общей сложности 25 келл
были обнаружены антигены, и они экспрессируются с разной частотой в
разные популяции.Но исходный антиген K по-прежнему имеет первостепенное значение в
трансфузионная медицина и HDN.
Базовая биохимия
Фенотипы обыкновенных Kell
Система групп крови Kell сложна. Локус Kell очень полиморфен и дает начало многим антигенам Kell. Однако есть два основных кодоминанта. аллельные гены, которые продуцируют два важных антигена: K и k (ранее известные как Kell и Cellano соответственно), которые отличаются одной аминокислотой. К антиген встречается чаще, чем K-антиген в большинстве популяций, K-k + фенотип обнаружен у 98% негров и 91% европеоидов (2).
Необычные фенотипы Kell
Нулевой фенотип
Система Kell имеет редкий нулевой фенотип, K o , в котором отсутствуют эритроциты.
все антигены Kell. Люди с этим фенотипом здоровы, но производят
анти-Ku, когда они сталкиваются с эритроцитами, которые действительно экспрессируют антигены Kell. Анти-Ку есть
способен вызвать реакцию переливания от легкой до тяжелой, по крайней мере, с одним
сообщается о смертельном случае (5). Следовательно, если K или людям когда-либо понадобится кровь
переливание, им следует переливать только кровь K o продукты.
Анти-Ку есть
способен вызвать реакцию переливания от легкой до тяжелой, по крайней мере, с одним
сообщается о смертельном случае (5). Следовательно, если K или людям когда-либо понадобится кровь
переливание, им следует переливать только кровь K o продукты.
Синдром Маклеода
В мембране эритроцитов гликопротеин Kell ковалентно связан с XK белок, многопроходный мембранный белок, который, как полагают, играет роль в транспорте. В отсутствие XK, состояние, называемое синдромом МакЛеода, антигены Келла являются выражены слабо, эритроциты аномальные, с шипами (акантоцитоз). Системные симптомы включают мышечную дистрофию, кардиомиопатия, психические расстройства и неврологические дефекты, такие как потеря рефлексов и двигательные расстройства (1).
Экспрессия антигенов Kell
Когда-то считалось, что антигены Kell ограничены клетками крови эритроида
происхождения (т. е. эритроцитов и их предшественников), но недавно было обнаружено, что они
экспрессироваться в миелоидных тканях (6,
7).
Антиген Kell также экспрессируется в небольшом количестве на ряде органов. включая лимфоидные органы, мышцы (как сердечные, так и скелетные) и нервную систему. система (2).
Функции гликопротеина Kell
Гликопротеин Kell представляет собой фермент, превращающий эндотелин-3.Расщепив неактивный предшественник (большой эндотелин-3), он создает активный эндотелин-3, который сильное сужение кровеносных сосудов.
Клиническое значение антител Kell
Антиген K является наиболее иммуногенным антигеном после антигенов ABO и Rh системы групп крови.
Реакции переливания
Антитела против Kell обычно относятся к классу антител IgG (IgM намного меньше
общий). Антитела, которые были причастны к переливанию крови.
реакции, которые иногда могут быть тяжелыми по своей природе, включают анти-K, анти-k,
Anti-Kp a и anti-Js b (2).Продукция анти-Ку у пациентов с
K o привело к гемолитической трансфузионной реакции со смертельным исходом (5).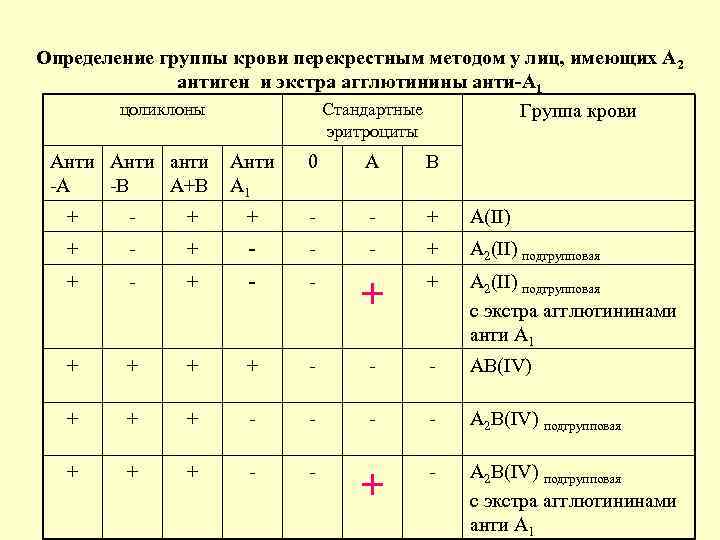
Гемолитическая болезнь новорожденных
Anti-Kell — важная причина ГБН. Обычно это происходит у матерей, перенесших несколько переливаний крови в прошлом, но это также может происходить у матерей, которые были сенсибилизированы к антигену Kell во время предыдущих беременностей.
В отличие от сенсибилизации Rh и ABO, HDN, относящаяся к сенсибилизации Kell вызывается анти-K, подавляющим производство эритроцитов плодом.В отличие от Rh и ABO, Антигены Kell экспрессируются на поверхности предшественников эритроцитов, а анти-K способствует иммунному разрушению клеток-предшественников K + эритроидных клеток путем макрофаги в печени плода (а не только зрелые эритроциты плода). Поскольку Предшественники эритроцитов не содержат гемоглобина, меньше билирубина выделяется во время гемолиз, а желтуха в период новорожденности встречается реже. Тем не менее основная анемия может быть тяжелой (8).
В различных тематических исследованиях сообщалось о следующих антителах, вызывающих ГБН: anti-K
(7, 9-12), anti-k (13), anti-Kp a (14), anti-Kp b (15), anti-Js a (16, 17), anti-Js б (16, 18) и
анти-У1 а (19).
Молекулярная информация
Ген
Ген KEL находится на хромосоме 7, в 7q33, и содержит 19 экзонов, которые охватывают более 21 т.п.н. геномной ДНК. Ген KEL очень полиморфен, с различных аллелей в этом локусе, кодирующих 25 антигенов, которые определяют Kell группа крови.
Полиморфизм группы крови K / k представляет собой точечную мутацию, приводящую к аминокислотный переход с треонина 193 (в k-антигене) на метионин 193 (в антиген K) в гликопротеине Kell.Антиген K более эффективен при запускает иммунную реакцию, чем k-антиген. Его более высокий уровень антигенность может быть связана с тем, что, в отличие от других антигенов Kell, он , а не , гликозилированный по остатку 191 (20).
Другие общие полиморфизмы группы крови Kell включают Kp b / Kp a который возникает из SNP 961C → T, вызывающего замену аминокислоты R281W, и
Js b / Js a , который возникает из SNP 1910T → C
вызывая замену аминокислоты L597P (21).
Белок
Белок Kell представляет собой полипептидную цепь длиной 732 аминокислоты, которая становится гликозилирован по пяти различным сайтам.Совершает однократный проход через РБК. мембрана.
Белок Kell прикреплен к поверхности эритроцитов путем связывания с интегральный мембранный белок эритроцитов, XK, по единственной дисульфидной связи. XK — это трансмембранный белок, который 10 раз пересекает мембрану эритроцитов. Если XK отсутствует, мультисистемный синдром, синдром МакЛеода, результаты.
Белок Kell имеет как последовательность, так и структурную гомологию с большим семейством цинк-зависимые эндопептидазы (ферменты, которые расщепляют белки внутри пептида) цепи, а не рядом с N- или C-концом).Белок Kell и другие белки в это семейство содержит пентамерную последовательность, которая необходима для связывания цинка и каталитическая активность.
Источники
- 1.
- Мохандас Н., Нарла А. Антигены группы крови в здоровье и болезни.
 Curr Opin Hematol. 2005; 12: 135–40. [PubMed: 15725904]
Curr Opin Hematol. 2005; 12: 135–40. [PubMed: 15725904] - 2.
Рид М.Э. и Ломас-Фрэнсис К. Группа крови Книга фактов об антигенах. Второе изд. 2004, Нью-Йорк: Elsevier Academic Нажмите.
- 3.
- Vaughan JI, Warwick R, Letsky E, Nicolini U, Rodeck CH, Fisk NM.Подавление эритропоэза при анемии плода из-за Келла аллоиммунизация. Am J Obstet Gynecol. 1994; 171: 247–52. [PubMed: 8030708]
- 4.
- Воан Дж. И., Мэннинг М., Уорик Р. М., Летски Е. А., Мюррей Н. А., Робертс И. А.. Ингибирование эритроидных клеток-предшественников анти-Kell антитела при аллоиммунной анемии плода. N Engl J Med. 1998. 338: 798–803. [PubMed: 9504940] ,
- , 5. ,
- , Линь М., Ван Ц.Л., Чен Ф.С., Хо Л.Х. Смертельная гемолитическая трансфузионная реакция из-за анти-Ku у Пациент Кнулла.Иммуногематол. 2003; 19: 19–21. [PubMed: 15373542]
- 6.
- Wagner T, Berer A, Lanzer G, Geissler K. Келл не ограничивается эритропоэтическим происхождением, но
также экспрессируется на миелоидных клетках-предшественниках.
 Br J Haematol. 2000; 110: 409–11. [PubMed: 10971399]
Br J Haematol. 2000; 110: 409–11. [PubMed: 10971399] - 7.
- Вагнер Т., Реш Б., Рейтерер Ф., Гасснер С., Ланцер Г. Панцитопения из-за подавления кроветворения в случае фатальная гемолитическая болезнь новорожденных, связанная с анти-K поддерживаемой молекулярным типированием K1.J Pediatr Hematol Oncol. 2004; 26: 13–5. [PubMed: 14707704]
- 8.
- Daniels G, Hadley A, Green CA. Причины анемии плода при гемолитической болезни из-за анти-K. Переливание. 2003. 43: 115–6. [PubMed: 12519439]
- 9.
- де Йонге Н., Мартенс Дж. Э., Милани А. Л., Крийнен Дж. Л., ван Кримпен С., Понжи Г. А.. Гемолитическая болезнь новорожденных, вызванная анти-K антителами. Eur J Obstet Gynecol Reprod Biol. 1996. 67: 69–72. [PubMed: 8789754]
- 10.
- Фернандес-Хименес М.С., Хименес-Марко М.Т., Эрнандес Д., Гонсалес А., Оменака Ф., де ла Камара С.Лечение плазмаферезом и внутривенным иммуноглобулином
при беременности, осложненной иммунизацией против PP1Pk или против K:
отчет двух пациентов.
 Vox Sang. 2001; 80: 117–20. [PubMed: 11348543]
Vox Sang. 2001; 80: 117–20. [PubMed: 11348543] - 11.
- Collinet P, Subtil D, Puech F, Vaast P. Успешное лечение крайне тяжелой анемии плода из-за Келл-аллоиммунизация. Obstet Gynecol. 2002; 100: 1102–5. [PubMed: 12423822]
- 12.
- Ахадед А., Броссард Ю., Деббия М., Ламбин П. Количественное определение анти-K (KEL1) IgG и IgG подклассы в сыворотке крови беременных с тяжелой аллоиммунизацией ELISA.Переливание. 2000; 40: 1239–45. [PubMed: 11061862]
- 13.
- Боуман Дж. М., Харман Ф. А., Мэннинг Ч. Р., Поллок Дж. М.. Эритробластоз плода, продуцируемый anti-k. Vox Sang. 1989; 56: 187–9. [PubMed: 2728396]
- 14.
- Costamagna L, Barbarini M, Viarengo GL, Pagani A, Isernia D, Salvaneschi L. Случай гемолитической болезни новорожденного вследствие: анти-КП а . Иммуногематол. 1997; 13: 61–2. [PubMed: 15387785]
- 15.
- Dacus JV, Spinnato JA.Тяжелый эритробластоз плода, вторичный по отношению к
анти-Kp b сенсибилизация.
 Am J Obstet Gynecol. 1984; 150: 888–9. [PubMed: 6507516]
Am J Obstet Gynecol. 1984; 150: 888–9. [PubMed: 6507516] - 16.
- Gordon MC, Kennedy MS, O’Shaughnessy RW, Waheed A. Тяжелая гемолитическая болезнь новорожденных, вызванная анти-Js (b). Vox Sang. 1995; 69: 140–1. [PubMed: 8585197]
- 17.
- Левен С., Рудольфсон Ю., Шехтер Ю. Второй случай гемолитической болезни новорожденного из-за анти-Js а . Переливание. 1980; 20: 714–5.[PubMed: 7192023]
- 18.
- Стэнворт С., Флитвуд П., де Сильва М. Тяжелая гемолитическая болезнь новорожденных, вызванная анти-Js (b). Vox Sang. 2001; 81: 134–5. [PubMed: 11555475]
- 19.
- Сакума К., Сузуки Х., Ото Х., Цунэяма Х., Утикава М. Первый случай гемолитической болезни новорожденного вследствие анти-Ula антитела. Vox Sang. 1994; 66: 293–4. [PubMed: 8079454]
- 20.
- Daniels G. Молекулярная генетика полиморфизма групп крови. Transpl Immunol.2005. 14 (3-4): 143–153. [PubMed: 15982556]
- 21.
- Ли С., Руссо Д.
 , Редман С. Функциональные и структурные аспекты группы крови Келл
система. Transfus Med Rev.2000; 14 (2): 93–103. [PubMed: 10782495]
, Редман С. Функциональные и структурные аспекты группы крови Келл
система. Transfus Med Rev.2000; 14 (2): 93–103. [PubMed: 10782495]
Фенотипирование и генотипирование антигена красных кровяных телец
Анупам Митра, MBBS, резидент по патологии, PGY2
Сара Барнхард, доктор медицинских наук, директор службы переливания крови
Основная цель тестирования перед переливанием — предоставить пациенту наиболее совместимую кровь, чтобы свести к минимуму риск гемолитических трансфузионных реакций.Тип и экран — это первые два теста, которые требуются в качестве теста перед переливанием крови. Как следует из названия, это два теста: «тип» — для определения типа ABO и резус-фактора эритроцитов пациента и «скрининг» — для обнаружения наличия антител против антигена (ов) эритроцитов. Образование комплекса антитело / антиген зависит от температурного диапазона. Антитела против антигенов эритроцитов оптимально реактивны при теплой (при температуре тела или выше) или на холоде (ниже температуры тела) тепловых амплитудах. Обычно приобретаются теплые антитела типа IgG.Они реагируют при температуре 37 ° C или выше. Холодные антитела обычно встречаются в природе и относятся к типу IgM. Они реагируют ниже 37С. 1
Обычно приобретаются теплые антитела типа IgG.Они реагируют при температуре 37 ° C или выше. Холодные антитела обычно встречаются в природе и относятся к типу IgM. Они реагируют ниже 37С. 1
1. Что такое фенотипирование эритроцитов?
Фенотип эритроцитов (фенотипирование эритроцитов) относится к определению типа антигенов, присутствующих в эритроцитах. Тип ABO / Rh в разделе «Тип и скрининг» применяется ко всем пациентам, нуждающимся в переливании крови. Однако также может быть выполнен расширенный фенотип антигена. Это определяет экспрессию антигена, отличного от антигенов A, B или D.Расширенное фенотипирование по антигену красных кровяных телец почти всегда проводится как рефлекторный тест. То есть расширенное фенотипирование обычно дополняет рутинное предтрансфузионное тестирование у пациентов с клинически значимыми аллоантителами или у пациентов, которые находятся в группе риска по выработке клинически значимых аллоантител. Четыре варианта панелей расширенного фенотипирования эритроцитов выполняются в лаборатории служб переливания крови — «холодовой фенотип»; «Полный теплый фенотип»; «Полный фенотип» и «ограниченный фенотип».
Как следует из названия, «холодовой фенотип» — это панель, которая определяет экспрессию всех антигенов с общими соответствующими реагирующими на холод антителами (M, N, P, Lea и Leb).«Полный теплый фенотип» — это панель, которая определяет экспрессию всех антигенов с общими клинически значимыми соответствующими антителами, которые реагируют на тепло (K, E, e, C, c, Fya, Fyb, Jka, Jkb, S и s) . «Полный фенотип» — это панель, которая определяет экспрессию всех антигенов с общими соответствующими антителами, либо с теплой реакцией (K, E, e, C, c, Fya, Fyb, Jka, Jkb, S и s), либо с холодной реакцией ( М, Н, П, Леа и Леб). В некоторых случаях выполняется панель «ограниченного фенотипа» для обнаружения одного или нескольких специфических антигенов.Фенотипирование эритроцитов всегда выполняется из образца перед переливанием, чтобы избежать помех от переливаемых эритроцитов. 2-3
1.1 Показания для выполнения полного теплого фенотипа по антигену эритроцитов
Полный теплый фенотип может быть выполнен в нескольких различных условиях. 2-3
2-3
1.1.1 Для предотвращения образования антител к эритроцитам — пациенты, получающие хронические переливания крови, подвергаются многократному воздействию нескольких чужеродных антигенов эритроцитов в течение длительного периода времени, что увеличивает возможность выработки новых аллоантител.Таким образом, выполнение полного теплового фенотипа перед переливанием позволяет лаборатории служб переливания крови предоставить этим пациентам единицы, полностью или частично соответствующие фенотипу, чтобы предотвратить развитие аллоантител (а). Клинические показания для полного фенотипа теплых эритроцитов перед переливанием следующие:
.- Недавно диагностированная серповидно-клеточная анемия
- Пациенты с серповидно-клеточной анемией, у которых ранее не было полного теплового фенотипа
- Другие гемоглобинопатии, зависимые от переливания крови
1.1.2 Для предотвращения образования дополнительных антител к эритроцитам — пациенты с аллоантителами эритроцитов подвергаются повышенному риску развития других аллоантител, особенно если они подвергаются воздействию большего количества иммуногенных антигенов. Выполнение фенотипирования антигена эритроцитов после выявления аллоантител имеет решающее значение для обеспечения наиболее подходящих переливаний и предотвращения образования дополнительных антител. Это выполняется либо полным теплым фенотипом, либо ограниченным фенотипом на основе пути рефлекторного тестирования.
Выполнение фенотипирования антигена эритроцитов после выявления аллоантител имеет решающее значение для обеспечения наиболее подходящих переливаний и предотвращения образования дополнительных антител. Это выполняется либо полным теплым фенотипом, либо ограниченным фенотипом на основе пути рефлекторного тестирования.
1.1.3 Для подготовки к приему лекарств, которые мешают проведению всех анализов. У пациентов, получающих анти-CD47 (например, Hu5F9), лекарство, как известно, мешает скринингу на антитела к эритроцитам. Полный теплый фенотип выполняется до введения лекарственного средства, чтобы сделать возможным переливание по фенотипу в течение периода, когда лекарство вводится, когда новые антитела не могут быть обнаружены, и, таким образом, сделать возможным безопасное переливание.
1.2 Показания для проведения холодового фенотипа антигена эритроцитов
Фенотипирование антигенов эритроцитов пациента, соответствующих обычным антителам, реактивным на холода, обычно выполняется, когда у пациента выработалось антитело, реагирующее на холод. Общие сценарии включают анти-М (встречающееся в природе антитело, часто встречающееся у детей) или анти-Льюис (встречающееся в природе антитело, распространенное при беременности).
Общие сценарии включают анти-М (встречающееся в природе антитело, часто встречающееся у детей) или анти-Льюис (встречающееся в природе антитело, распространенное при беременности).
1.3 Показания для выполнения полного фенотипа по антигену эритроцитов
Полный фенотип выполняется, когда у пациента есть несколько антител, которые реагируют как на холод, так и на тепло. Это определяет антигенный профиль пациента для антигенов K, E, e, C, c, Fya, Fyb, Jka, Jkb, S, s, M, N, Lea и Leb.
1.4 Признак наличия фенотипа с ограниченным антигеном
Ограниченный или частичный фенотип определяет один или несколько специфических антигенов эритроцитов вместо полного или полного фенотипа. Это делается в следующих ситуациях —
1.4.1 Чтобы помочь исследовать специфичность антител (у пациентов вырабатываются антитела против антигенов, которых им не хватает). Если панель антител идентифицирует одно или несколько аллоантител с неясной специфичностью, определение фенотипа ограниченного антигена может помочь определить специфичность антитела (антител).
1.4.2 У любого пациента, у которого выработалось антитело, лаборатория выполняет фенотипирование на соответствующий антиген, а также на любые более иммуногенные антигены.
1.4.3 Для оценки риска гемолитической болезни новорожденных. Типирование антигена эритроцитов отцовской или пуповинной крови определяет экспрессию антигена, которая соответствует материнскому антителу.
1.4.4 Редко выполняется после переливания для определения ожидаемого восстановления эритроцитов.Определение собственного фенотипа эритроцитов пациента в циркулирующих эритроцитах после переливания и сравнение его с типированием антигена перед трансфузией может помочь в определении восстановления эритроцитов.
1.5 Сбор образцов
Кровь собирают в пробирку с ЭДТА (верхняя часть бледно-лиловая). ЭДТА хелатирует кальций и, таким образом, действует как антикоагулянт. Плазма в образце используется для тестирования на антитела, а эритроциты — для фенотипирования антигена.
1.6 Время и метод анализа
Обычно для перечисленных фенотипических панелей требуется время тестирования, равное 1.5-2 ч. Для определения фенотипа некоторых антигенов требуется продолжительное время инкубации, в то время как другие определяются быстро. Анализы проводят с использованием известных моноклональных или поликлональных антисывороток, инкубированных с эритроцитами пациента. Реагент Кумбса требуется при использовании антисыворотки на основе моноклональных IgG для индукции агглютинации и определения наличия антигена.
1,7 Каковы клинические последствия?
У пациентов, которым требуется расширенное сопоставление фенотипа антигена, профиль антигена любых донорских единиц, которые переливаются, совпадает с ОТРИЦАТЕЛЬНЫМИ антигенами в профиле антигена пациента в дополнение к любым антителам.Если пациенту не делают хроническое переливание крови и одно или несколько антител обнаруживаются впервые, службы переливания проведут расширенное типирование антигена для высокоиммуногенных антигенов и предоставят упакованные эритроциты от донора, у которого отсутствуют соответствующие антигены. Это позволит избежать гемолитической трансфузионной реакции и образования новых антител. Если для ухода за пациентом требуются хронические переливания на протяжении всей жизни, перед всеми переливаниями выполняется фенотип полного теплого эритроцита. Иногда бывает трудно сопоставить отрицательный профиль антигена, и патологам службы переливания крови необходимо подвергнуть риску стратификацию антигенов по иммуногенности, чтобы найти наилучшее из имеющихся совпадений.Выполняя это рефлекторное тестирование и получая единицы эритроцитов донора, соответствующие расширенному фенотипу, мы предотвращаем гемолиз текущих антител и предотвращаем образование новых антител.
Это позволит избежать гемолитической трансфузионной реакции и образования новых антител. Если для ухода за пациентом требуются хронические переливания на протяжении всей жизни, перед всеми переливаниями выполняется фенотип полного теплого эритроцита. Иногда бывает трудно сопоставить отрицательный профиль антигена, и патологам службы переливания крови необходимо подвергнуть риску стратификацию антигенов по иммуногенности, чтобы найти наилучшее из имеющихся совпадений.Выполняя это рефлекторное тестирование и получая единицы эритроцитов донора, соответствующие расширенному фенотипу, мы предотвращаем гемолиз текущих антител и предотвращаем образование новых антител.
1.8 Ограничения фенотипирования эритроцитов
Фенотипирование антигена эритроцитов невозможно в определенных ситуациях:
1.8.1 Тест Кумбса положительный (DAT +). При аутоиммунной гемолитической анемии (АИГА) эритроциты пациента покрыты оболочкой IgG или IgM, что является аутоиммунным явлением. Присутствие IgG / IgM вызывает ложноположительный фенотипический тест, и, таким образом, профиль антигена не может быть надежно определен.
Присутствие IgG / IgM вызывает ложноположительный фенотипический тест, и, таким образом, профиль антигена не может быть надежно определен.
1.8.2 Больному недавно сделали переливание крови. Фенотип антигена эритроцитов определяется на образце собственных эритроцитов пациента. В условиях недавнего переливания циркулирующие эритроциты состоят из смеси эритроцитов пациента и эритроцитов донора. Таким образом, фенотипирование не будет отражать нативные эритроциты пациента. В этой ситуации очень важен клинический анамнез переливания.
1.8.3 Эритроциты покрыты лекарством и вызывают интерференцию (анти-CD47). Если эритроциты пациента покрыты лекарством, то антигенный профиль не может быть надежно определен.
2. Что такое генотипирование эритроцитов?
Как следует из названия, экспрессия антигена эритроцитов также может быть определена с помощью генетического тестирования. Текущее тестирование позволяет выделить геномную ДНК пациента и выполнить генотипирование антигена эритроцитов для прогнозирования фенотипа антигена эритроцитов для выбранных антигенов.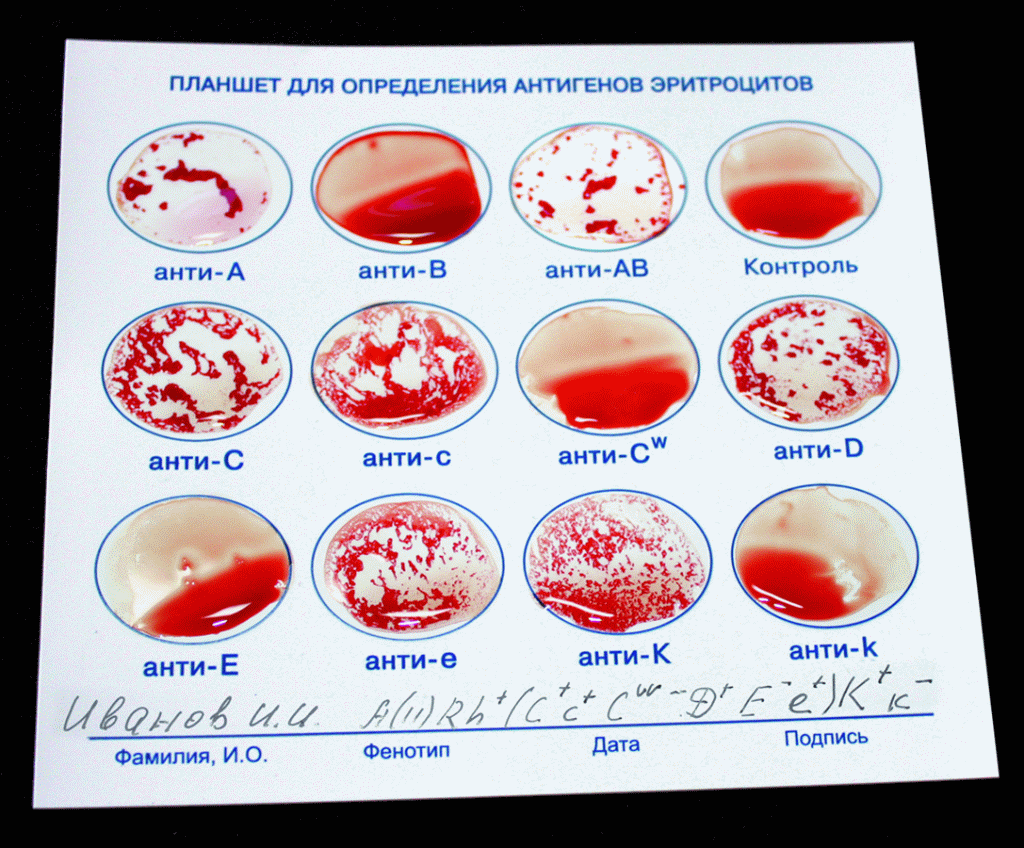 Это тест на отправку, который в настоящее время проводится в лабораториях Versiti. Доступны две панели — панель генотипирования красных клеток (44 антигена) и панель STAT (24 антигена). 4
Это тест на отправку, который в настоящее время проводится в лабораториях Versiti. Доступны две панели — панель генотипирования красных клеток (44 антигена) и панель STAT (24 антигена). 4
2.1 Указание на определение генотипа антигена эритроцитов —
- Антигены эритроцитов пациента не могут быть надежно фенотипированы из-за недавнего переливания крови в анамнезе
- До применения значительно мешающих препаратов (таких как анти-CD47)
- Для оценки генетических изменений, таких как частичные антигены, которые могут объяснять аллоантитела, но положительное фенотипирование
- В редких случаях, когда образуются необычные антитела и требуется определение профиля антигена, выходящего за рамки упомянутых общих антигенов.
2.2 Отбор проб
Кровь с ЭДТА (бледно-лиловая) — 5 мл
2.3 Методология и время оборота
Для 44-панельного анализа 72 зонда ПЦР-гибридизации используются в 36 полимеразных цепных реакциях для идентификации аллелей, связанных с 44 антигенами группы крови. Для панели STAT 32 зонда ПЦР-гибридизации используются в 16 полимеразных цепных реакциях для идентификации аллелей, связанных с 24 антигенами группы крови. 4 Время обработки панели с 44 антигенами составляет 2-5 дней, тогда как STAT (24- антигенная панель) время оборота панели составляет 24-48 часов.
Для панели STAT 32 зонда ПЦР-гибридизации используются в 16 полимеразных цепных реакциях для идентификации аллелей, связанных с 24 антигенами группы крови. 4 Время обработки панели с 44 антигенами составляет 2-5 дней, тогда как STAT (24- антигенная панель) время оборота панели составляет 24-48 часов.
2.4 Ограничения
Генотип эритроцитов определяется с использованием специальных зондов против аллелей антигена эритроцитов. Таким образом, никакие мутации за пределами целевой области не будут обнаружены. Новые мутации, приводящие к измененной или частичной экспрессии антигена и нулевым фенотипам, могут не обнаруживаться. Результаты, полученные от реципиентов трансплантата гемопоэтических стволовых клеток, могут не совпадать с генотипом, полученным из других тканей. 4
Артикул:
- Харменнинг, Дениз.Современные методы банка крови и переливания крови, 5-е издание. Филадельфия, Пенсильвания, FA Davis Company, 2005.

- Fung MK, Grossman BJ, Hillyer CD, Westhoff CM Editors. Техническое руководство AABB, 18-е издание. Bethesda MD, AABB Press, 2014.
- Рейд М.Э., Ломас-Фрэнсис С., Олссон М.Л. Книга фактов об антигенах группы крови, 3-е издание. Лондон Великобритания, Эльзевир. 2012.
- Панели генотипирования красных кровяных телец. Лаборатории Версити, Центр крови Висконсина. Информация на сайте: https://www.versiti.org / Custom / Files / Versiti / 68 / 682cf64b-4508-4714-ae29-7f1a414b7a1e.pdf
Иммуногенетика красных клеток и терминология групп крови
Разработать и поддерживать руководящие принципы по номенклатуре антигенов группы крови и аллелей для использования в трансфузионной медицине и смежных науках.
Термин «группа крови» обычно относится к индивидуальной комбинации поверхностных антигенов эритроцитов (эритроцитов). Антигены — это специфические участки на различных белках, гликопротеинах или гликолипидах, которые образуют части мембраны эритроцитов, с которыми может взаимодействовать иммунная система. Эти белки выполняют множество функций, таких как: мембранные переносчики (Диего, Кидд), рецепторы и молекулы адгезии (Даффи, Лютеран), гликопротеины, регулирующие комплемент (Cromer, Knops), ферменты (Yt, Kell, Dombrock), структурные компоненты (Diego, Gerbich ) или компоненты гликокаликса (MNS).
Эти белки выполняют множество функций, таких как: мембранные переносчики (Диего, Кидд), рецепторы и молекулы адгезии (Даффи, Лютеран), гликопротеины, регулирующие комплемент (Cromer, Knops), ферменты (Yt, Kell, Dombrock), структурные компоненты (Diego, Gerbich ) или компоненты гликокаликса (MNS).
Антигены определяются как антитела, которые возникают либо «естественным образом» из-за встречаемости антигенов, повсеместно встречающихся в окружающей среде, либо образуются в результате активной иммунизации к чужеродным антигенам эритроцитов после воздействия эритроцитов человека от другого человека.Именно наличие и отсутствие из-за наследственных вариаций поверхностных антигенов эритроцитов определяет группу крови человека.
Системы групп крови официально определены как «системы одного или нескольких антигенов, управляемые одним геном или комплексом из двух или более тесно связанных гомологичных генов». Каждая система генетически отделена от любой другой системы группы крови. Для распознавания системы групп крови и ее антигенов необходимо идентифицировать лежащую в основе генетическую вариацию, секвенировать и подтвердить, что она влияет на фенотип.
Для распознавания системы групп крови и ее антигенов необходимо идентифицировать лежащую в основе генетическую вариацию, секвенировать и подтвердить, что она влияет на фенотип.
Рабочая группа Международного общества переливания крови (ISBT) по иммуногенетике эритроцитов и терминологии групп крови (ISBT WP) ведет официальный учет всех признанных в настоящее время систем групп крови. В настоящее время существует 43 признанных системы групп крови, содержащих 345 антигенов эритроцитов (июнь 2021 г.). 43 системы генетически определены 48 генами. Для получения дополнительной информации перейдите по следующим ссылкам:
Системы групп крови
Антигены в системах
Таблицы аллелей групп крови (прокрутите вниз до сеанса терминологии группы крови)
ISBT также поддерживает три категории для антигенов, которые еще не были связаны с системами групп крови.Коллекции (серия 200) были разработаны для группирования антигенов, которые биохимически, генетически или серологически схожи, если генетическая основа еще не обнаружена.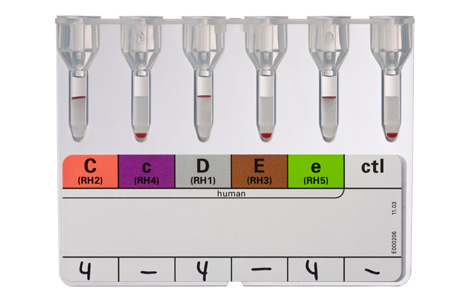 Также существует два антигенных ряда; Серия 700 содержит антигены, которые не вписываются ни в одну систему или коллекцию, частота встречаемости которых составляет <1% среди всех этнических популяций человека, а серия 901 Series содержит антигены, которые имеют частоту> 99% среди популяций разных этнических групп. происхождение.
Также существует два антигенных ряда; Серия 700 содержит антигены, которые не вписываются ни в одну систему или коллекцию, частота встречаемости которых составляет <1% среди всех этнических популяций человека, а серия 901 Series содержит антигены, которые имеют частоту> 99% среди популяций разных этнических групп. происхождение.
Частоты фенотипа систем основных групп крови (Rh, Kell, Kidd, Du
Введение
Основная функция любого банка крови — своевременно предоставлять пациентам безопасную и совместимую кровь или компоненты крови. 1 Однако эта цель может быть сложной, если пациенты были идентифицированы с аллоантителами при отсутствии местной базы данных фенотипов доноров. Международное общество переливания крови идентифицировало 346 антигенов групп крови, 308 из которых были отнесены к 36 системам групп крови, а остальные 38 антигенов были сгруппированы в коллекции, низкочастотные серии (700), высокочастотные серии (901) и коллекционная серия (200). 2 Фенотипы группы крови по-разному распределяются среди разных популяций и этнических групп, о чем сообщалось в африканских, кавказских, китайских и индийских популяциях. Однако сообщения о фенотипах групп крови в Саудовской Аравии ограничиваются системами групп крови ABO и RhD. 3–7 Нет данных о распределении фенотипов различных групп крови в восточном регионе Саудовской Аравии. Саудовская Аравия — большая многонациональная страна с разнообразным этническим происхождением, особенно на Востоке и Западе из-за ее близости к морю, что привело к долгой истории иммиграции.
2 Фенотипы группы крови по-разному распределяются среди разных популяций и этнических групп, о чем сообщалось в африканских, кавказских, китайских и индийских популяциях. Однако сообщения о фенотипах групп крови в Саудовской Аравии ограничиваются системами групп крови ABO и RhD. 3–7 Нет данных о распределении фенотипов различных групп крови в восточном регионе Саудовской Аравии. Саудовская Аравия — большая многонациональная страна с разнообразным этническим происхождением, особенно на Востоке и Западе из-за ее близости к морю, что привело к долгой истории иммиграции.
Восточный регион Саудовской Аравии имеет высокую распространенность гемоглобинопатий по сравнению с другими регионами королевства: 111,4 случая серповидно-клеточной болезни (ВСС) на 1000 человек и 23,7 случая талассемии на 1000 человек серповидно-клеточной анемии. 8 В результате пациенты с гемоглобинопатией нуждаются в многократных переливаниях крови, что составляет основную часть их режима лечения. Следовательно, получение фенотипически подобранных эритроцитов может быть проблематичным в отсутствие местной базы данных доноров.
Следовательно, получение фенотипически подобранных эритроцитов может быть проблематичным в отсутствие местной базы данных доноров.
Целью этого исследования было определение частоты встречаемости антигенов основных групп крови в восточном регионе Саудовской Аравии с использованием гелевого метода и обеспечение основы для начала разработки базы данных для добровольцев-доноров крови, чтобы обеспечить предоставление антиген-отрицательной крови. пациентам с аллоантителами. Это поможет сократить время обработки фенотипирования и перекрестного сопоставления и использовать ресурсы банка крови рентабельным образом.
Материалы и методы
Размер выборки и критерии включения
Размер выборки был рассчитан, как описано Faul et al, с использованием G * Power3.1 программное обеспечение. 9 Вкратце, с использованием программного обеспечения G * Power 3.1 размер выборки был оценен в 87 выборок. Это предполагает значительный уровень 5% и мощность 80%. Этот размер выборки можно использовать для обнаружения существенной разницы, если предполагаемая распространенность (альтернатива) отличается от нулевого значения 0,4290 на величину 0,15.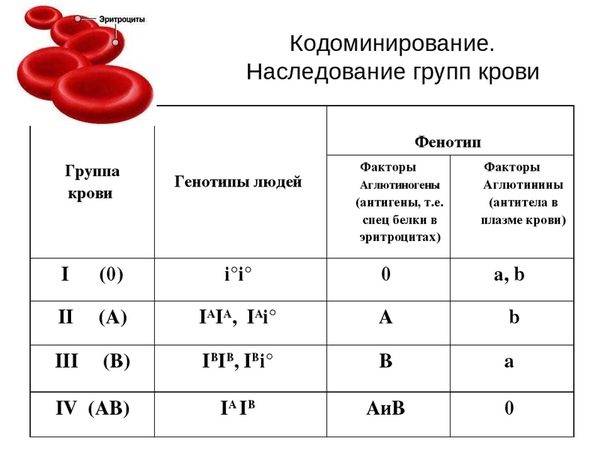 В этом исследовании размер выборки был округлен до 100 случаев.
В этом исследовании размер выборки был округлен до 100 случаев.
Критерии включения доноров
Все участники были саудовскими добровольцами-донорами крови, соответствующими национальным руководящим принципам по переливанию крови в Саудовской Аравии, включая возраст, историю болезни и критерии инфекции.
Сбор образцов и приготовление суспензии эритроцитов
От каждого донора брали образец 5 мл крови с антикоагулянтом EDTA. Были приготовлены упакованные эритроциты от каждого донора. 5% суспензия в ID-разбавителе-1 (Bromlin, DiaMed GmBH, Cressier, Швейцария) была приготовлена для антигенных профилей I и II, а 0,8% суспензия в ID-разбавителе-2 (физиологический раствор с низкой ионной силой (LISS), DiaMed GmBH, Cressier, Швейцария) получали для антигенного профиля III.
Типирование расширенного антигена красных клеток
Для подгрупп Rh + K (C, c, E, e и K) профиль антигена-I идентификационной карты (P 1 , Le a , Le b , Lu a , Lu b ) и профиль антигена ID-карты-II (k, Kp a , Kp b , Jk a , Jk b ), 5% суспензии эритроцитов в ID-Diluent-1 (Bromlin) было используется для фенотипирования в соответствии с инструкциями производителя (DiaMed GmBH).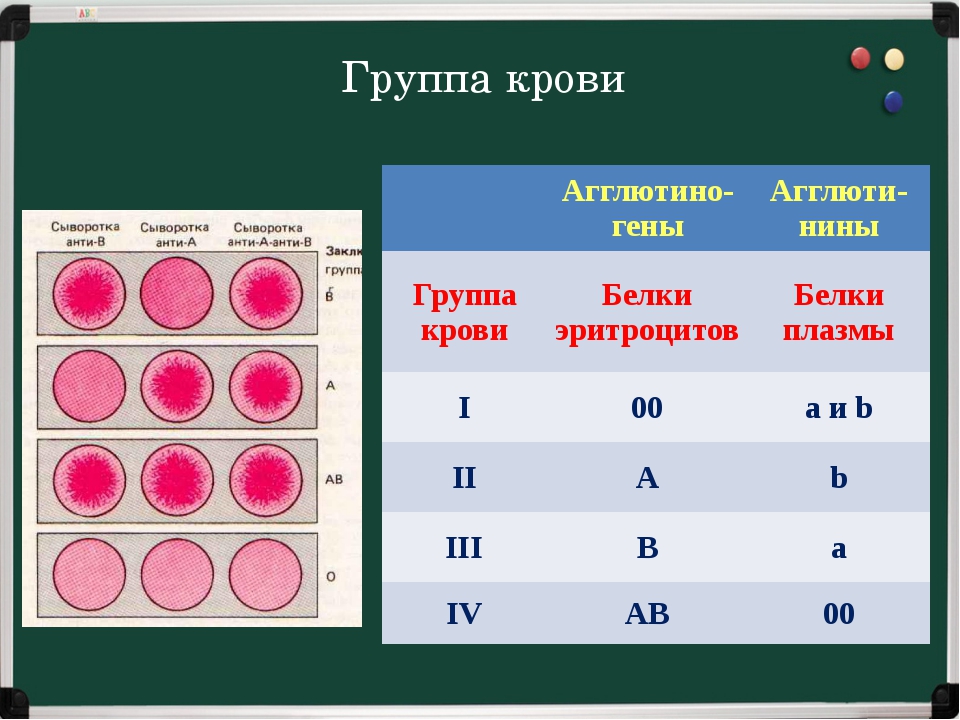 Вкратце, 12,5 мкл 5% суспензии эритроцитов пипеткой вносили во все 6 микропробирок, содержащих специфические тестируемые антисыворотки. Все карты центрифугировали в течение 10 мин при 85 × g с использованием ID-Centrifuge.
Вкратце, 12,5 мкл 5% суспензии эритроцитов пипеткой вносили во все 6 микропробирок, содержащих специфические тестируемые антисыворотки. Все карты центрифугировали в течение 10 мин при 85 × g с использованием ID-Centrifuge.
Для профиля антигена III ID-карты (M, N, S, s, Fy a , Fy b ) для типирования антигена в соответствии с инструкциями производителя (DiaMed GmBH) использовали 0,8% суспензию эритроцитов. Вкратце, 50 мкл 0,8% суспензии эритроцитов пипеткой вносили во все 6 микропробирок, а затем 50 мкл сыворотки для ID-теста добавляли в соответствующие микропробирки.ID-карты инкубировали в течение 10 минут при комнатной температуре, затем центрифугировали в течение 10 минут при 85 × g в ID-Centrifuge.
Интерпретация результатов
Положительно
Агглютинированные клетки образуют линию на поверхности микропробирки или диффундируют по всему гелю. Результаты были оценены от 4+ до 1+ в зависимости от диффузии клеток, что указывает на присутствие соответствующего антигена.
отрицательный
Накопление эритроцитов в виде компактной кнопки на дне микропробирки указывает на отсутствие соответствующего антигена.
Статистический анализ
Статистический пакет для социальных наук (SPSS для Windows версии 19. Армонк, штат Нью-Йорк, США) был использован для проведения метаанализа для сравнения результатов этого исследования с результатами других популяций. Все результаты были стандартизированы в процентах. Для определения отношения шансов (OR) использовалась бинарная логистическая регрессия, где эталонной категорией были результаты нашего исследования. Значение P считалось значимым, если оно составляло <0,05.
Результаты
Сто образцов донорской крови были типированы на антигены основных систем групп крови (резус, Келл, Кидд, Даффи, MNS, P, Льюис и лютеранский).Для системы групп крови Rh все образцы были типизированы на D, C, E, c и e. Из них 80% доноров были RhD-положительными, а 20% — RhD-отрицательными. В таблице 1 показана частота встречаемости антигенов резус-фактора. E-антиген показал самую высокую частоту 97%, за ним следовали c-антиген и D-антиген (86% и 80% соответственно).
В таблице 1 показана частота встречаемости антигенов резус-фактора. E-антиген показал самую высокую частоту 97%, за ним следовали c-антиген и D-антиген (86% и 80% соответственно).
Таблица 1 Распределение резус-антигенов у доноров крови в Восточном регионе Саудовской Аравии по сравнению с другими популяциями |
Кроме того, в таблице 1 показана двумерная связь между исследуемой выборкой и результатами из других популяций (т. Е. Индейцев, европеоидов, африканцев и китайцев).Результаты указывают на статистически значимое различие антигенов D, C и c между населением Саудовской Аравии и другими популяциями. У китайского населения шансы иметь антиген D в 24,8 раза выше, чем у саудовцев, а антиген C в 5,6 раза выше, чем у саудовского населения. В то время как африканцы имели в 7,9 раз больше шансов иметь антиген c по сравнению с саудовцами.
Таблица 2 показывает распространенность фенотипов резус-фактора, выявленных в этом исследовании, по сравнению с другими популяциями, DCCee, например, была значительно выше как в китайской, так и в индийской популяциях по сравнению с саудовской популяцией (OR = 4. 3 и 4.8 соответственно). Кроме того, вероятность наличия фенотипа Dccee у африканского населения в 7,9 раз выше, чем у саудовского населения. Все RhD-отрицательные доноры экспрессировали обычно ассоциированные антигены c и e, что видно в таблице 2. Слабый антиген D не наблюдался ни у одного из доноров в этом исследовании.
3 и 4.8 соответственно). Кроме того, вероятность наличия фенотипа Dccee у африканского населения в 7,9 раз выше, чем у саудовского населения. Все RhD-отрицательные доноры экспрессировали обычно ассоциированные антигены c и e, что видно в таблице 2. Слабый антиген D не наблюдался ни у одного из доноров в этом исследовании.
Таблица 2 Распространенность резус-фенотипов, выявленных в этом исследовании, по сравнению с другими популяциями |
Частота антигенов и фенотипы групп крови других основных групп крови также были проверены в этом исследовании.Некоторые антигены эритроцитов в текущем исследовании значительно отличаются от других популяций (например, индийских, кавказских, африканских и китайских) (Таблица 3). Например, s-антиген в 21,6 раза выше у китайского населения по сравнению с саудовским. населению Саудовской Аравии. В то время как вероятность наличия Antigen Fy b составляет 17. В 3 раза выше у кавказцев по сравнению с исследуемой популяцией.
В 3 раза выше у кавказцев по сравнению с исследуемой популяцией.
Таблица 3 Распространенность антигенов красных клеток в текущем исследовании и других популяциях |
При оценке процента групп крови Келла, Кидда и Даффи в текущем исследовании и другом исследовании было обнаружено, что существуют значительные различия (Таблица 4), а именно: K-k +, K + k +, Jk. (a + b-), Jk (a-b +), Fy (a + b-), Fy (a-b +), Fy (a + b +), Fy (ab-).Вероятность наличия фенотипа Fy (a + b-) в популяции Китая в 25,6 раза выше по сравнению с популяцией Саудовской Аравии, в то время как вероятность наличия фенотипа в популяции Индии на 3,8 раза выше по сравнению с исследуемой популяцией. Кроме того, шансы фенотипа Fy (a + b +) в популяциях Индии и Кавказа значительно отличаются от популяций Саудовской Аравии (OR = 14,3 и 18,3 соответственно). As, Fy a и Fy b были обнаружены у 22% населения в нашем исследовании (Таблица 3). Интересно, что это привело к обнаружению редкого фенотипа Fy (a-b -) у 61% доноров в исследовании (Таблица 4).
Интересно, что это привело к обнаружению редкого фенотипа Fy (a-b -) у 61% доноров в исследовании (Таблица 4).
Таблица 4 Процент фенотипов групп крови Келла, Кидда и Даффи в текущем исследовании и других популяциях |
Что касается системы групп крови MNS, M + N-S + s + и M + N + S-s + были среди наиболее распространенных фенотипов с частотой 24% и 21% соответственно, тогда как M-N + S + s + и M-N + S + s- были наименее распространенными фенотипами системы групп крови MNS с частотой 3% (таблица 5).
Таблица 5 Процент фенотипов группы крови Льюиса, лютерана и MNS в текущем исследовании и других популяциях |
Наконец, для систем групп холодной крови Lewis, Lutheran и P; 49% доноров были Le (a-b +) и 97% — Lu (a-b +). Редкие Lu (a + b +) и Lu (a-b-) были обнаружены в этом исследовании с частотой 2% и 1% соответственно (Таблица 5). Редкий фенотип Le (a + b +) наблюдался у 3% доноров.Антиген P1 наблюдался у 85% доноров в этом исследовании (таблица 3).
Редкий фенотип Le (a + b +) наблюдался у 3% доноров.Антиген P1 наблюдался у 85% доноров в этом исследовании (таблица 3).
Обсуждение / Заключение
В настоящем исследовании мы определили частоту фенотипов основных групп крови (Rh, Kell, Kidd, Duffy, MNS, P, Lewis и Lutheran) среди доноров крови в восточном регионе Саудовской Аравии с использованием гелевого метода. Исследование показало, что частота фенотипов этих групп крови различается между центральным регионом Саудовской Аравии и другими популяциями.
Поскольку в восточном регионе Саудовской Аравии наиболее высока распространенность ВСС и талассемии, местные банки крови сталкиваются с проблемой предоставления антиген-отрицательных донорских единиц для таких пациентов, которым в рамках терапевтического режима требуются частые переливания эритроцитов. 8 Следовательно, определение частот антигена у местной популяции доноров важно для облегчения повседневной практики банка крови, своевременно предоставляющей кровь пациентам, одновременно предотвращая аллоиммунизацию в будущем. 10
10
Частота антигенов в основных системах групп крови широко сообщается среди населения Кавказа, Африки, Индии и Китая. 11–14 Однако информация о частотах антигенов в Саудовской Аравии ограничена системами групп крови ABO и Rh. 3–5,7 Насколько нам известно, это первое исследование, в котором сообщается о расширенном антигенном фенотипировании основных систем групп крови в Саудовской Аравии, особенно в Восточном регионе.
Заболеваемость антигеном D варьируется в разных популяциях; в нашем исследовании было обнаружено, что антиген D присутствует у 80% населения, что сопоставимо с таковым в популяции европеоидов. Однако антиген D был высоко экспрессирован в китайском и африканском населении со значительной разницей по сравнению с результатами нашего исследования с отношением шансов (OR) 2.9 и 24, а также значимое значение p <0,05 и <0,001 соответственно (Таблица 1). Аналогичным образом частота встречаемости антигена С и С была сопоставима с популяцией европеоидной расы. Частота встречаемости антигена C в нашем исследовании была обнаружена у 59% доноров, что было значительно меньше, чем у индейцев и китайцев (p <0,001), но выше, чем у африканцев (p <0,001) (Таблица 1 ). 13,14 Похожее исследование было проведено Nomani et al. На донорах крови в центральном регионе Саудовской Аравии, где антиген D был обнаружен у 91 человека.3% по сравнению с 80% в нашем исследовании. 15 Точно так же с антигеном C, который в нашем исследовании был обнаружен на уровне 59% по сравнению с 69,2% в Центральном регионе. Эти данные подчеркивают различия в экспрессии антигенов в различных регионах Саудовской Аравии, что доказывает, что Саудовская Аравия имеет разнообразное этническое происхождение. В целом, антиген и фенотипическая экспрессия системы групп крови Rh в этом исследовании оказались ближе к таковым у европеоидной популяции, чем у любой другой популяции.
Частота встречаемости антигена C в нашем исследовании была обнаружена у 59% доноров, что было значительно меньше, чем у индейцев и китайцев (p <0,001), но выше, чем у африканцев (p <0,001) (Таблица 1 ). 13,14 Похожее исследование было проведено Nomani et al. На донорах крови в центральном регионе Саудовской Аравии, где антиген D был обнаружен у 91 человека.3% по сравнению с 80% в нашем исследовании. 15 Точно так же с антигеном C, который в нашем исследовании был обнаружен на уровне 59% по сравнению с 69,2% в Центральном регионе. Эти данные подчеркивают различия в экспрессии антигенов в различных регионах Саудовской Аравии, что доказывает, что Саудовская Аравия имеет разнообразное этническое происхождение. В целом, антиген и фенотипическая экспрессия системы групп крови Rh в этом исследовании оказались ближе к таковым у европеоидной популяции, чем у любой другой популяции.
В системе групп крови Kell наши результаты показали, что 8% наших доноров экспрессировали антиген K, что было сопоставимо с таковым в кавказской и индийской популяциях. 13,14 Антиген k (целлано) был обнаружен у 100% наших доноров, что также было сопоставимо со значениями, зарегистрированными во всех других популяциях. 12–14
13,14 Антиген k (целлано) был обнаружен у 100% наших доноров, что также было сопоставимо со значениями, зарегистрированными во всех других популяциях. 12–14
Антигены группы крови Даффи действуют как рецепторы малярийных паразитов, в частности Plasmodium vivax . Инфекции малярии, вызванные P.vivax поражает около 80 миллионов человек во всем мире. 16 Лица с нулевым фенотипом Даффи Fy (a-b-) устойчивы к малярийным инфекциям, вызываемым P. vivax , поскольку у них отсутствует рецептор, который позволяет паразитам вторгаться в эритроциты. Нулевой фенотип распространен среди африканского населения, живущего в эндемичных по малярии районах, с распространенностью примерно 68%, тогда как в других популяциях, таких как индийцы, китайцы и европейцы, этот фенотип встречается редко. 12–14 Неожиданно в нашем исследовании этот нулевой фенотип показал распространенность 61%, что аналогично африканскому населению, а также общим фенотипам системы групп крови Даффи (Таблица 4). Однако исследование, проведенное в центральном регионе Саудовской Аравии, обнаружило Fy (a-b-) только у 36% их доноров, что было ниже значения, найденного в нашем исследовании. 15 Это открытие в дополнение к различиям в экспрессии антигена Rh указывает на то, что частота фенотипов в разных регионах Саудовской Аравии варьируется в зависимости от региона, подчеркивая важность документирования фенотипов групп крови на национальном уровне, чтобы минимизировать поиск антиген-отрицательной крови при необходимости.
Однако исследование, проведенное в центральном регионе Саудовской Аравии, обнаружило Fy (a-b-) только у 36% их доноров, что было ниже значения, найденного в нашем исследовании. 15 Это открытие в дополнение к различиям в экспрессии антигена Rh указывает на то, что частота фенотипов в разных регионах Саудовской Аравии варьируется в зависимости от региона, подчеркивая важность документирования фенотипов групп крови на национальном уровне, чтобы минимизировать поиск антиген-отрицательной крови при необходимости.
Система групп холодной крови Льюис был наиболее распространенным фенотипом, обнаруженным в нашем исследовании, при этом Le (a-b +) показал распространенность 49%, что близко к значению, наблюдаемому в африканской популяции (55%). Нулевой Le (ab-) был обнаружен у 19% наших доноров, показывая аналогичную частоту как в индийском, китайском, так и в африканском населении и значительно, чем в европеоидной популяции, которая составила 6% (p <0,05). . 12–14 Для лютеранской системы групп крови наиболее частым обнаруженным фенотипом был Lu (a-b +) с частотой 97%; это значение аналогично таковым во всех других популяциях.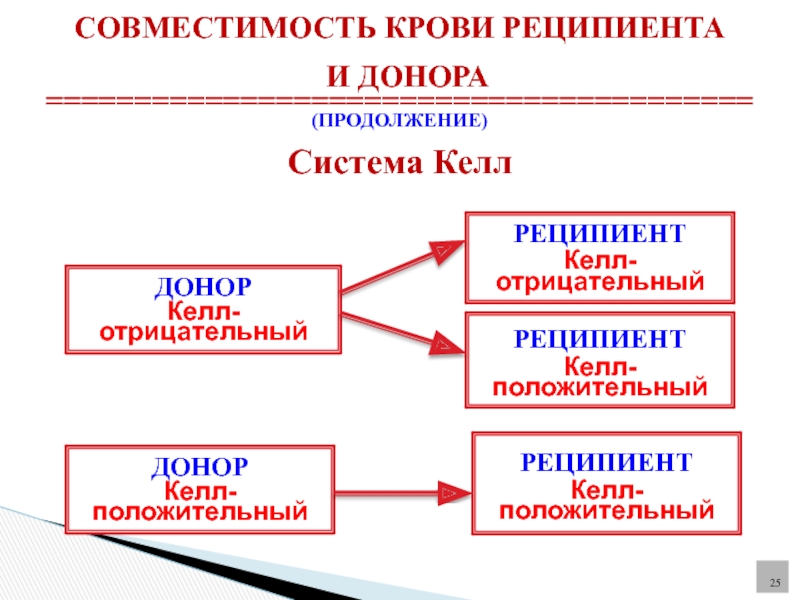
Фенотипы M + N-S + s + и M + N + S-s + из системы групп крови MNS были обнаружены у наших доноров с частотой 24% и 21% соответственно; однако они не были наиболее распространенными фенотипами MNS, наблюдаемыми в других популяциях. 12–14
Как было замечено в этом исследовании, частота основных групп крови в восточном регионе Саудовской Аравии отличается от таковой не только в других изученных популяциях, но и в центральном регионе Саудовской Аравии. Основным ограничением этого исследования является отсутствие национального реестра доноров крови, из-за чего частота этих фенотипов не может быть распространена на население Саудовской Аравии в целом, но остается ограниченной для восточного региона.
Еще одним серьезным ограничением является небольшой размер выборки, но результаты этого исследования могут быть использованы в качестве основы для создания местных реестров по всей стране, а не только в Восточном регионе. Понимание частот основных систем групп крови, отличных от систем ABO и Rh, необходимо для всех банков крови для планового тестирования и чрезвычайных ситуаций. Данные могут быть использованы, чтобы помочь банкам крови подготовить внутренние расширенные панели для идентификации антител для обнаружения неожиданных множественных антител, когда коммерческие наборы для идентификации антител не дают окончательных результатов.
Данные могут быть использованы, чтобы помочь банкам крови подготовить внутренние расширенные панели для идентификации антител для обнаружения неожиданных множественных антител, когда коммерческие наборы для идентификации антител не дают окончательных результатов.
Заявление об этике
Доноры предоставили письменное информированное согласие на участие в исследовании, и протокол исследования был одобрен институциональным наблюдательным советом Университета имама Абдулрахмана бин Фейсала (IRB-PGS-2018-03-141). Исследование соответствует Хельсинкской декларации.
Благодарность
Авторы хотели бы поблагодарить профессора Сулеймана Баха из Колледжа общественного здравоохранения Университета имама Абдулрахмана бин Фейсала, Даммам, Саудовская Аравия, за его консультацию по расчету размера выборки.Г-жа Нада Аль-Захрани, куратор банка крови из больницы Короля Фахда Университета, за предоставление нам данных о резус-фенотипе доноров.
Авторские взносы
Все авторы участвовали в анализе данных, составлении и редактировании статьи, окончательно утвердили версию, которая будет опубликована, и соглашаются нести ответственность за все аспекты работы.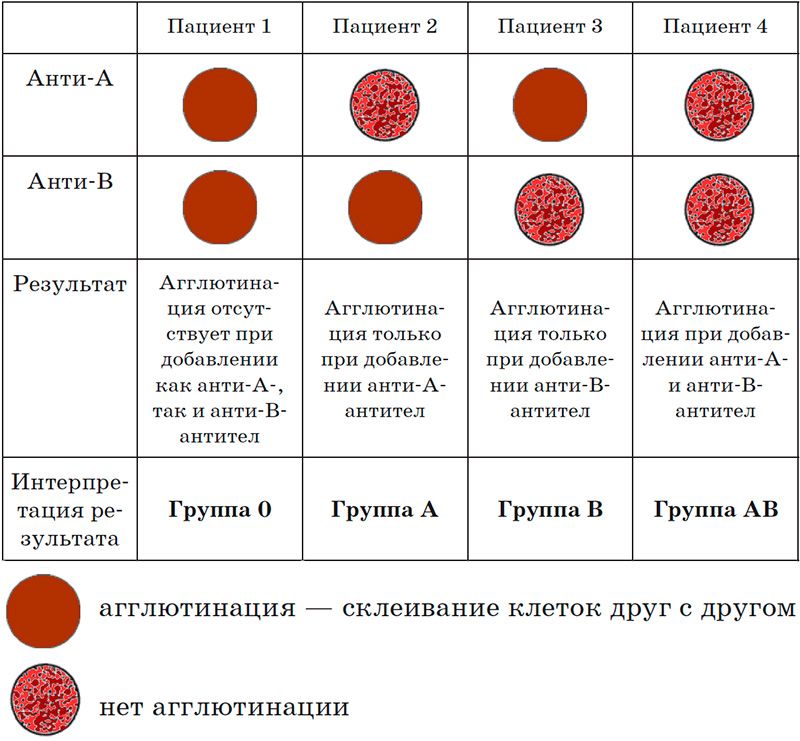
Финансирование
Это исследование финансировалось отделом исследований и аспирантуры Университета имама Абдулрахмана бин Фейсала (2018-302-CAMS).
Раскрытие информации
Авторы не заявляют о конфликте интересов.
Список литературы
1. Эшфорд П. Руководство по процедурам совместимости перед переливанием. Трансфус Мед . 1997; 7 (2): 171. DOI: 10.1046 / j.1365-3148.1997.d01-22.x
2. Сторри Дж. Р., Кастильо Л., Чен К. и др. Рабочая группа Международного общества переливания крови по иммуногенетике и терминологии эритроцитов: отчет о заседаниях в Сеуле и Лондоне. ISBT Sci Ser .2016; 11: 118–122. DOI: 10.1111 / voxs.12280
3. Башаври Л.А., Аль-Мулхим А.А., Ахмад М.С., Ахмед М.А. Частота групп крови ABO в восточном регионе Саудовской Аравии. Саудовская медицина J . 2001. 22 (11): 1008–1012.
4. Сархан МАА, Салех К.А., Бин-Даджем С.М. Распределение групп крови ABO и резус-фактора в Юго-Западной Саудовской Аравии. Саудовская медицина J . 2009. 30 (1): 116–119.
Саудовская медицина J . 2009. 30 (1): 116–119.
5. АльБилали А., Аль-Фрейди О., Аль-Харби Х. и др. Распределение групп крови ABO и резус-фактора среди регулярных доноров в Аль-Мадина Аль-Монавара, Саудовская Аравия, 2016 г. Int J Adv Res . 2017; 14 (3): 7850–7863. DOI: 10.21474 / ijar01 / 3092
6. Алсухайбани Е.С., Кизилбаш Н.А., Малик С. Гетерогенность и разнообразие генов групп крови ABO и Rh в избранных популяциях Саудовской Аравии. Genet Mol Res . 2015; 14: 7850–7863. DOI: 10.4238 / 2015. 14 июля, 11
7. Абдулла С.М. Частота групп крови ABO и Rh в Джазанской области Саудовской Аравии. Пак Дж. Медицина . 2010. 26 (4): 818–821.
8. Алсаид Э.С., Фархат Г.Н., Ассири А.М. и др.Распространение нарушений гемоглобинопатии в Саудовской Аравии на основе данных программы добрачного скрининга и генетического консультирования, 2011–2015 гг. J Epidemiol Glob Health . 2018; 7 (приложение 1): S41–7. DOI: 10.1016 / j. jegh.2017.12.001
jegh.2017.12.001
9. Фаул Ф., Эрдфельдер Э., Ланг А. Г., Бюхнер А. Г. * Power 3: гибкая программа статистического анализа мощности для социальных, поведенческих и биомедицинских наук. Методы определения поведения . 2007. 39 (2): 175–191. DOI: 10.3758 / BF03193146
10.Kacker S, Ness PM, Shirey RS, Savage WJ, King KE, Tobian AAR. Будущее снижения риска аллоиммунизации эритроцитов. Переливание крови . 2015; 55 (1): 222–224. DOI: 10.1111 / trf.12866
11. Кахар М., Патель Р. Частоты фенотипов систем групп крови (Rh, Kell, Kidd, Duffy, MNS, P, Lewis и Lutheran) у доноров крови из южного Гуджарата, Индия. Азиатский журнал J Transfus Sci . 2014; 8 (1): 51–55. DOI: 10.4103 / 0973-6247.126693
12. Yu Y, Ma C, Sun X, et al. Частота встречаемости антигенов основных групп крови и фенотипов красных кровяных телец у китайского ханьского населения материкового Китая. Инт Дж. Иммуногенет . 2016; 43 (4): 226–235. DOI: 10.1111 / iji.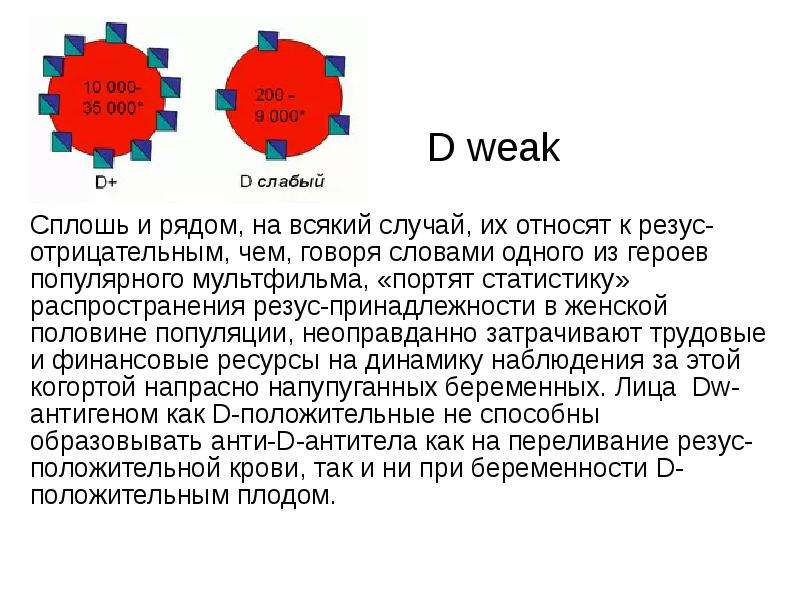 12277
12277
13. Такрал Б., Салуджа К., Шарма Р.Р., Марваха Н. Частоты фенотипов систем групп крови (резус, Келл, Кидд, Даффи, MNS, P, Льюис и лютеранец) у доноров крови из Северной Индии. Transfus Apher Sci . 2010. 43 (1): 17–22. DOI: 10.1016 / j.transci.2010.05.006
14. Рейд М.Э., Ломас-Фрэнсис К., Олссон М.Л. Книга фактов об антигенах группы крови . 3-е изд. Нью-Йорк: Academic Press; 2012. doi: 10.1016 / C2011-0-69689-9
15. LNomani SN, FS. Резюме Презентации ежегодного собрания AABB Филадельфия, Пенсильвания, 25–28 октября 2014 г. В: Transfusion. Vol 54; 2014: 15A – 268A. DOI: 10.1111 / trf.12845
16. Langhi DM, Bordin JO. Группа крови Даффи и малярия. Гематология . 2006. 11 (5): 389–398. DOI: 10.1080 / 10245330500469841
Уровень антигенов ABO, Rh и Kell у онкологических детей.
e22007
Справочная информация: Целью исследования был анализ фенотипических характеристик эритроцитов по системам AVBO, Rh и Kell у онкологических детей. Методика : определено групп крови ABO и Rh и типизированы эритроцитарные антигены (D, С, с, С w , Е, е, К, k) (AutoVue Innova, США) в образцах крови 114 детей с твердым опухоли. Результаты: Группы крови ABO распределились следующим образом: A (II)> O (I)> B (III)> AB (IV) с преобладанием A (II). Rh (D) -положительный фенотип наблюдался у 82 (71,9%) пациентов из 114: 47 (57,3%) мальчиков и 35 (42,6%) девочек. 32 (28,1%) пациента из 114 были Rh (D) -отрицательными: 15 (46.8%) мальчиков и 17 (53,1%) девочек. Только 8 (7%) детей были Kell-положительными, что было аналогично распространенности антигена в европейской популяции. 4 фенотипа эритроцитов наиболее часто встречались у Rh (D) -позитивных пациентов: СсDееK- (34,1%), ССDееK- (22,0%), ccDEeK- (13,4%) и СсDЕеK- (11,0%). То есть более половины детей с онкопатологиями (56,1%) имели Kell-отрицательные фенотипы, СсDееK− и ССDееK−. 86,4% Rh (D) -позитивных пациентов имели гомозиготные комбинации резус-антигенов, вызывающих трансфузионные реакции — СС, сc, ЕЕ и ее.
Методика : определено групп крови ABO и Rh и типизированы эритроцитарные антигены (D, С, с, С w , Е, е, К, k) (AutoVue Innova, США) в образцах крови 114 детей с твердым опухоли. Результаты: Группы крови ABO распределились следующим образом: A (II)> O (I)> B (III)> AB (IV) с преобладанием A (II). Rh (D) -положительный фенотип наблюдался у 82 (71,9%) пациентов из 114: 47 (57,3%) мальчиков и 35 (42,6%) девочек. 32 (28,1%) пациента из 114 были Rh (D) -отрицательными: 15 (46.8%) мальчиков и 17 (53,1%) девочек. Только 8 (7%) детей были Kell-положительными, что было аналогично распространенности антигена в европейской популяции. 4 фенотипа эритроцитов наиболее часто встречались у Rh (D) -позитивных пациентов: СсDееK- (34,1%), ССDееK- (22,0%), ccDEeK- (13,4%) и СсDЕеK- (11,0%). То есть более половины детей с онкопатологиями (56,1%) имели Kell-отрицательные фенотипы, СсDееK− и ССDееK−. 86,4% Rh (D) -позитивных пациентов имели гомозиготные комбинации резус-антигенов, вызывающих трансфузионные реакции — СС, сc, ЕЕ и ее. 18 (22,0%) Rh (D) -позитивных пациентов были гомозиготными по антигену C и 64 (78,0%), т.е. каждый третий пациент, имел антиген c. Дети с антигеном C могут быть сенсибилизированы к антигену c при переливании крови с последующим развитием гемолитических осложнений. Антиген K (Cellano) был обнаружен у всех детей, из них 93% имели фенотип kk, а 7% — Kk. Антиген С w (Willis) выявлен только у 5 (6,0%) Rh (D) -позитивных пациентов с редкими фенотипами — C w CceeK-, C w ccEeK-, C w CcEEK-, C w CcEeK-.Подбор донора для пациентов с одним из этих фенотипов может вызвать проблемы. Выводы: Изучение фенотипических характеристик эритроцитов необходимо для обеспечения успешного переливания крови, особенно у детей, Kell-положительных по антигену K, у детей, гомозиготных по антигену C с фенотипом ССDееК- и у детей с С w. Антиген и фенотипы С w СсееК-, С w ссЕеК-, С w СсЕЕК- и С w СсЕеК-.
18 (22,0%) Rh (D) -позитивных пациентов были гомозиготными по антигену C и 64 (78,0%), т.е. каждый третий пациент, имел антиген c. Дети с антигеном C могут быть сенсибилизированы к антигену c при переливании крови с последующим развитием гемолитических осложнений. Антиген K (Cellano) был обнаружен у всех детей, из них 93% имели фенотип kk, а 7% — Kk. Антиген С w (Willis) выявлен только у 5 (6,0%) Rh (D) -позитивных пациентов с редкими фенотипами — C w CceeK-, C w ccEeK-, C w CcEEK-, C w CcEeK-.Подбор донора для пациентов с одним из этих фенотипов может вызвать проблемы. Выводы: Изучение фенотипических характеристик эритроцитов необходимо для обеспечения успешного переливания крови, особенно у детей, Kell-положительных по антигену K, у детей, гомозиготных по антигену C с фенотипом ССDееК- и у детей с С w. Антиген и фенотипы С w СсееК-, С w ссЕеК-, С w СсЕЕК- и С w СсЕеК-.
Методы определения антигенов группы крови: анализ экономической эффективности фенотипирования и генотипирования
ВведениеВыявление антигенов группы крови имеет важное значение в практике переливания крови для предотвращения аллоиммунизации, особенно у пациентов, которым переливали много крови. Антитела к эритроцитам представляют собой клинически значимую проблему в медицине переливания крови, поскольку они могут привести к острым реакциям при переливании крови и гемолитической болезни плода и новорожденного, увеличивая заболеваемость и смертность пациентов.Кроме того, аллоиммунизация может отсрочить локализацию совместимого мешка с кровью.1–3 Вероятность того, что человек вырабатывает одно или несколько антиэритроцитарных антител, составляет примерно 1% на единицу перелитой крови, а у пациентов, которым постоянно переливали кровь, уровень аллоиммунизации может достигать 50% .4–6
Системы групп крови характеризуются наличием или отсутствием антигенов на поверхности эритроцитов.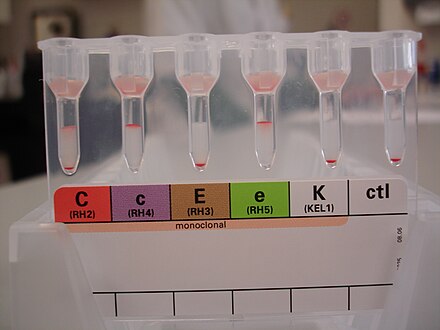 5 В настоящее время описано 36 систем эритроцитов.7 В дополнение к совместимости по ABO и Rh для предотвращения гемолитические реакции, могут быть рассмотрены другие иммуногенные антигены группы крови, особенно C, c, E и e систем Rh и Kell, Kidd, Duffy и MNS.8
5 В настоящее время описано 36 систем эритроцитов.7 В дополнение к совместимости по ABO и Rh для предотвращения гемолитические реакции, могут быть рассмотрены другие иммуногенные антигены группы крови, особенно C, c, E и e систем Rh и Kell, Kidd, Duffy и MNS.8
Известно несколько методик обнаружения антигенов эритроцитов. Классическим методом является фенотипирование, которое в настоящее время выполняется с помощью тестов гемагглютинации, которые определяют продукт гена путем связывания антисыворотки со специфическими антигенами. Ограничением серологических тестов является поиск специфических антител к редким антигенам эритроцитов.9 Кроме того, они не всегда могут определить фенотип из-за более низкой экспрессии антигена на поверхности эритроцитов или недавних переливаний крови (10
Достижения в молекулярной биологии имеют позволил внедрить и усовершенствовать новые методики для повышения безопасности переливания крови.Было показано, что в некоторых случаях генотипирование является эффективным и выгодным по отношению к фенотипированию, поскольку оно обеспечивает средства для прогнозирования фенотипа на основе геномной ДНК с высокой степенью точности. 11,12 Было описано несколько применений молекулярных методов генотипирования эритроцитов, Среди них типирование ДНК плода, определение группы крови недавно перелитого пациента, скрининг доноров крови для выявления фенотипов редких групп крови, определение частоты полиморфизмов групп крови в популяции и определение группы крови пациентов с аутоиммунной гемолитической анемией. и доноры для аллоиммунизированных пациентов.12,13
11,12 Было описано несколько применений молекулярных методов генотипирования эритроцитов, Среди них типирование ДНК плода, определение группы крови недавно перелитого пациента, скрининг доноров крови для выявления фенотипов редких групп крови, определение частоты полиморфизмов групп крови в популяции и определение группы крови пациентов с аутоиммунной гемолитической анемией. и доноры для аллоиммунизированных пациентов.12,13
Молекулярная основа большинства эритроцитарных антигенов известна, и были разработаны многочисленные методологии анализа ДНК, все из которых основаны на ПЦР. Однонуклеотидный полиморфизм (SNP) может быть определен с помощью различных методов генотипирования, включая ПЦР с специфическим для последовательности праймером (ПЦР-SSP) с использованием рестрикционных ферментов (ПЦР-ПДРФ) и ПЦР в реальном времени на основе аллель-специфического удлинения и секвенирования. Он также может связать метод PCR-SSP с мультиплексом, чтобы облегчить обнаружение нескольких аллелей одновременно, если изучаемые аллели имеют продукты разного размера. Самым современным методом анализа ДНК является микроматрица, метод крупномасштабного генотипирования эритроцитов.9,14,15
Самым современным методом анализа ДНК является микроматрица, метод крупномасштабного генотипирования эритроцитов.9,14,15
ПЦР-SSP использует специфические праймеры для обнаружения нуклеотидной последовательности полиморфных аллелей.16,17 ПЦР- RFLP характеризуется расщеплением ампликонов специфическими эндонуклеазами, генерирующими профили рестрикции. Генотипирование микроматрицы основано на обнаружении цветового спектра, созданного при контакте целевой ДНК с флуоресцентно меченными олигонуклеотидными зондами, нанесенными на планшет с помощью автоматизированной системы, которая предоставляет результаты в виде графиков или таблиц.14,18
Учитывая преимущества и недостатки каждого метода, доступного для обнаружения эритроцитарных антигенов, и стремясь минимизировать затраты и оперативность отчетов, составляемых без потери процедуры безопасности, целью данного исследования было сравнение метод центрифугирования с гемагглютинацией в геле, методы ПЦР-ПДРФ, микрочипов и ПЦР-SSP в отношении стоимости, времени реакции и надежности результатов.
Это исследование было одобрено и проведено в соответствии с нормами, рекомендованными Комитетом по этике исследований на людях Государственного университета Маринга (CAAE: 0402.0,093,000-11).
Изученные методики сравнивались для определения антигенов RHCE (RHCE * E, RHCE * e), Kell (KEL * 01, KEL * 02), Duffy (FY * 01, FY * 02) и Kidd (JK * 01, JK * 02), поскольку они были протестированы всеми анализируемыми методами.
Для разработки всех методологий генотипирования (ПЦР-ПДРФ, ПЦР-SSP и Microarray) требуется первый этап экстракции ДНК, который выполнялся с помощью мини-набора QIAamp® DNA Blood Mini Kit (Qiagen, Валенсия, Калифорния, США) , согласно рекомендациям производителя.
Генотипирование с помощью ПЦР-SSP проводили согласно Liu et al., 16 с изменениями температуры цикла и концентрации MgCl2. Концентрация MgCl2 составляла 1,5 мМ для RHCE * E, KEL * 01 и KEL * 02, 1,0 мМ для FY * 01 и FY * 02 и 0,8 мМ для JK * 01, JK * 02 и RHCE * e.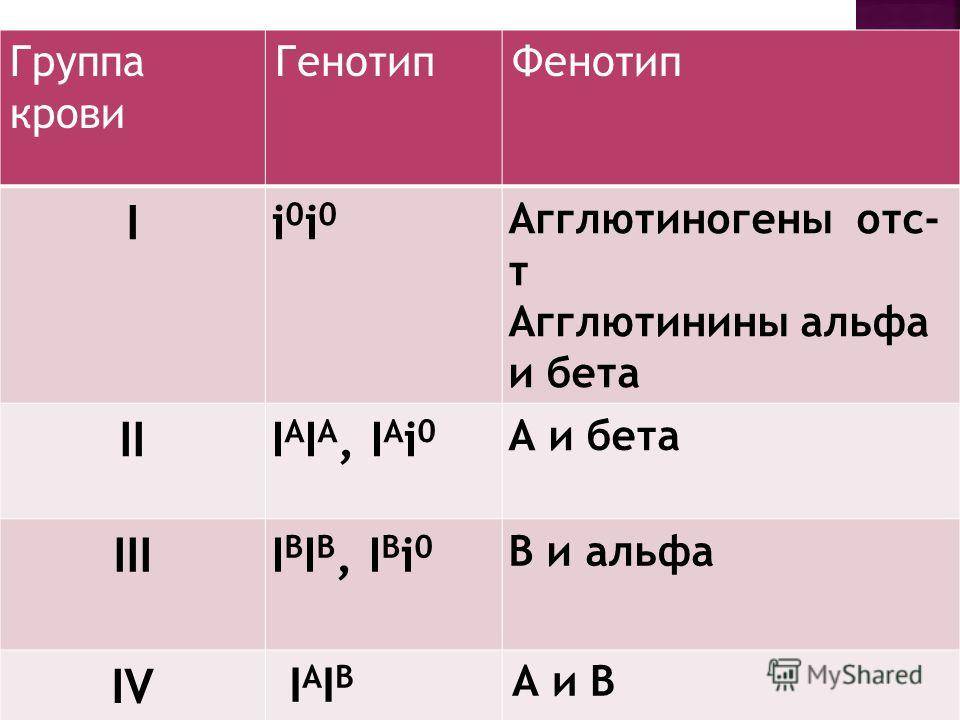 Предлагаемые условия цикла для этих аллелей включали этап начальной денатурации при 94 ° C в течение 2 минут, за которым следовали 30 циклов 30-секундной денатурации при 94 ° C, 1-минутный отжиг при 72 ° C и 30-секундное удлинение при 72 ° C, а также заключительный этап элонгации. наносили при 72 ° C в течение 5 минут.ПЦР-ПДРФ выполняли согласно протоколам, ранее описанным в литературе, 19–21 с некоторыми модификациями. 22 Платформа микрочипов HEA beadChipTM (Human Erythrocyte Antigen) (BioArray Solutions Ltd., Уоррен, штат Нью-Джерси, США) использовалась для крупных — масштабное генотипирование. Фенотипирование проводили методом гель-центрифугирования в соответствии с рекомендациями производителя (DiaMed Latino América S. A., Lagoa Santa, MG, Brazil).
Предлагаемые условия цикла для этих аллелей включали этап начальной денатурации при 94 ° C в течение 2 минут, за которым следовали 30 циклов 30-секундной денатурации при 94 ° C, 1-минутный отжиг при 72 ° C и 30-секундное удлинение при 72 ° C, а также заключительный этап элонгации. наносили при 72 ° C в течение 5 минут.ПЦР-ПДРФ выполняли согласно протоколам, ранее описанным в литературе, 19–21 с некоторыми модификациями. 22 Платформа микрочипов HEA beadChipTM (Human Erythrocyte Antigen) (BioArray Solutions Ltd., Уоррен, штат Нью-Джерси, США) использовалась для крупных — масштабное генотипирование. Фенотипирование проводили методом гель-центрифугирования в соответствии с рекомендациями производителя (DiaMed Latino América S. A., Lagoa Santa, MG, Brazil).
Фенотипирование было выполнено в отделении распределения крови регионального центра крови Маринга, ПЦР в лаборатории иммуногенетики государственного университета Маринга (LIG-UEM) и микроматрица в лаборатории молекулярной биологии центра гематологии и гемотерапии государственного университета Кампинаса. (UNICAMP).
(UNICAMP).
После оценки реагентов, используемых для исследуемых методов, были запрошены оценки от трех разных поставщиков. Для определения общего значения каждого реагента использовали среднее значение, полученное из оценок. Общие затраты на все методологии, такие как вода, перчатки, наконечники, пипетки и микропробирки, а также косвенные затраты, такие как оборудование, электричество и персонал, не были приняты во внимание.
Для расчета стоимости каждого реагента использовалось следующее уравнение:
RT представляет собой стоимость реагента и пропорционально количеству, используемому для набора одного пациента; B — стоимость брутто каждого реагента; и p — значение, относящееся к проценту использования каждого реагента.Сумма всех затрат на реагенты, использованных для набора одного пациента, представляет собой общую переменную стоимость для каждого метода.
Для методов генотипирования значения положительного, отрицательного и холостого контролей (без ДНК) были включены в общую стоимость в дополнение к образцу.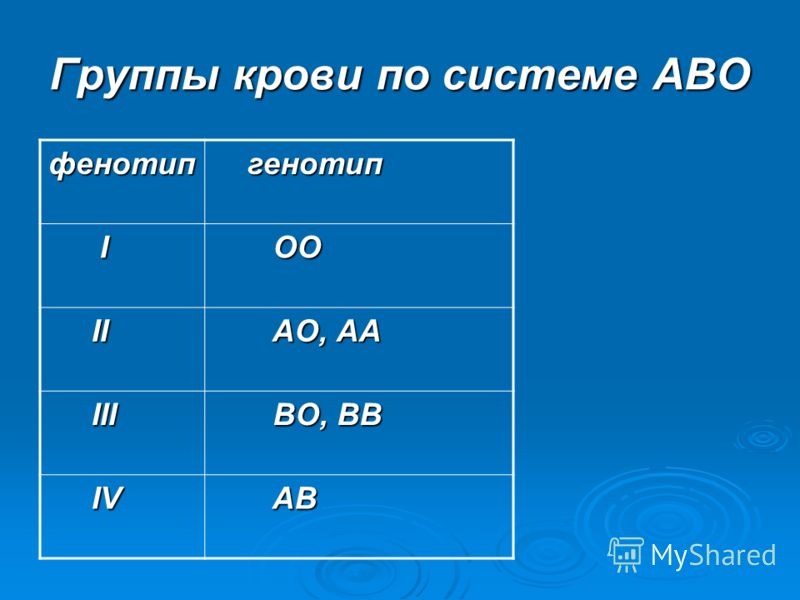
Для определения времени, необходимого для разработки метода, фенотипирование отслеживалось в Региональном центре крови Маринга в соответствии со стандартными рабочими процедурами, а также методами ПЦР-ПДРФ и ПЦР-SSP в LIG- UEM.Время реакции микроматрицы было получено на основе информации, предоставленной непосредственно лабораторией молекулярной биологии Центра гематологии и гемотерапии UNICAMP. Общее время выполнения каждой техники определялось суммой времени каждого шага.
Анализ и сравнение результатов Чтобы гарантировать результаты, полученные разными методами, был проведен отбор образцов, которые ранее были фенотипированы или генотипированы в других гематологических центрах. Таким образом, фенотипы с редкой, нулевой и низкой экспрессией не были включены.Результаты фенотипирования и микроматрицы были получены в центрах крови Francisco Beltrão Hemonucleo, Hemepar, Paraná и Campinas, Unicamp, Campinas, Сан-Паулу, соответственно, а результаты PCR-RFLP и PCR-SSP были получены в проектах, ранее разработанных в LIG. -UEM. Мы отобрали 16 образцов, генотипированных методом PCR-SSP. Среди них восемь образцов также были типизированы с помощью ПЦР-ПДРФ и серологии, а еще восемь — с помощью микрочипа. Результаты всех отобранных образцов были занесены в электронную таблицу и сопоставлены для проверки.
-UEM. Мы отобрали 16 образцов, генотипированных методом PCR-SSP. Среди них восемь образцов также были типизированы с помощью ПЦР-ПДРФ и серологии, а еще восемь — с помощью микрочипа. Результаты всех отобранных образцов были занесены в электронную таблицу и сопоставлены для проверки.
Фенотипирование антигенов эритроцитов RHCE, Келла, Даффи и Кидда проводили методом гель-центрифугирования, и время проявления составляло приблизительно 25 мин (рис. 1). Используемые реагенты и их соответствующие затраты описаны в таблице 1. Общие переменные затраты составили приблизительно 32,45 доллара США за образец.
Методы генотипированияМетод ПЦР-ПДРФ требует 4 этапа: экстракция ДНК, амплификация, расщепление рестрикционными ферментами и электрофорез.Время, необходимое для выполнения техники, составило 19 ч 40 мин. Методика ПЦР-SSP была проведена через 3 часа 30 минут (таблица 2).
Общая стоимость выполнения PCR-RFLP была выше, чем для PCR-SSP (таблица 3). Стоимость амплификации включает значения набора, содержащего ДНК-полимеразу Taq + MgCl2 + буфер, dNTP и праймеры. Для ПЦР-ПДРФ стоимость расщепления была связана с ценой набора, содержащего рестрикционный фермент и буфер, пропорционально используемому количеству.Стоимость электрофореза зависит от значений агарозы, 1 × TBE (основание TRIS + борная кислота + EDTA) и окрашивания ДНК геля.
Стоимость амплификации включает значения набора, содержащего ДНК-полимеразу Taq + MgCl2 + буфер, dNTP и праймеры. Для ПЦР-ПДРФ стоимость расщепления была связана с ценой набора, содержащего рестрикционный фермент и буфер, пропорционально используемому количеству.Стоимость электрофореза зависит от значений агарозы, 1 × TBE (основание TRIS + борная кислота + EDTA) и окрашивания ДНК геля.
Платформа Microarray HEA beadChipTM (Human Erythrocyte Antigen) (BioArray Solutions Ltd., Уоррен, Нью-Джерси, США) использует набор, содержащий все реагенты, необходимые для выполнения метода. Согласно предоставленным данным, комплект из 12 лезвий стоит 5760 долларов США. Каждое лезвие позволяет генотипировать 8 образцов, поэтому приблизительная стоимость образца составляла 60 долларов США, что добавляло стоимости экстракции ДНК (5 долларов США.46), общая стоимость составляет 65,46 долларов США. Среднее время выполнения метода составляет примерно 5 часов 30 минут, согласно рисунку 2.
Рисунок 3 показывает стоимость и время, необходимое для выполнения идентификации антигенов систем групп крови RHCE, Kell, Kidd и Duffy для каждой методологии ( фенотипирование, PCR-SSP, PCR-RFLP и Microarray).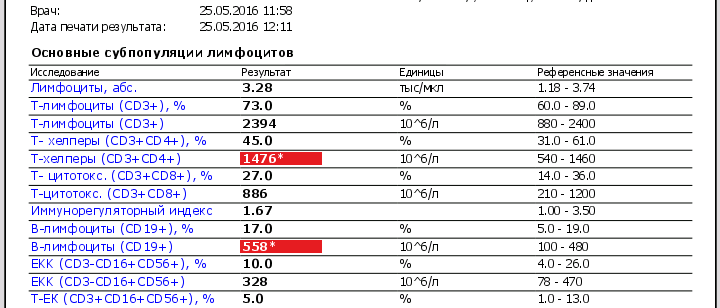
Образцы были проанализированы как минимум двумя методами. Образцы с 1 по 8 были фенотипированы гемагглютинацией в геле и генотипированы с помощью ПЦР-ПДРФ и ПЦР-SSP, а образцы с 9 по 16 были генотипированы с помощью ПЦР-SSP и микроматрицы (таблица 4).Результаты представлены в виде номенклатуры генотипов.18 Никаких расхождений между всеми проанализированными образцами обнаружено не было.
Обсуждение Молекулярное генотипирование антигенов групп крови является важным аспектом и успешно внедряется в трансфузионную медицину. Для этой цели были разработаны методы с низкой, средней и высокой пропускной способностью. В зависимости от требований центра, таких как скрининг на антигены с высокой или низкой распространенностью, когда антисыворотки недоступны, правильное типирование пациентов, которым переливали много крови, скрининг антиген-отрицательных донорских единиц для снижения скорости аллоиммунизации, подходящая методика может быть выбранным. 14
14
В этом исследовании мы сравнили гемагглютинацию методом гель-центрифугирования и методы генотипирования для получения фенотипа или профиля генотипа образца для RHCE * E, RHCE * e, KEL * 01, KEL * 02, JK * 01, JK * 02, FY * 01 и FY * 02 аллели.
При сравнении продолжительности каждого метода результаты показали, что иммунофенотипирование потребовало наименьшего времени для получения результатов. Хотя в PCR-SSP использовались две независимые реакции амплификации, по одной для каждого аллеля, что приводит к большим затратам и большему времени на подготовку к реакциям, она была воспроизведена за меньшее время, чем другие методы генотипирования.Несмотря на то, что ПЦР-ПДРФ позволяет амплификацию обоих аллелей с одной парой праймеров, то есть в одной реакции, ферментативное расщепление (в течение ночи) значительно увеличивает время реакции.
В обзоре общих затрат реакция PCR-SSP имела самую низкую стоимость по сравнению с другими методологиями. Безусловно, что привело к тому, что ПЦР-ПДРФ имел более высокую стоимость по сравнению с ПЦР-SSP, а также то, что наблюдалось при продолжительности метода, было главным образом этапом расщепления из-за высокой стоимости рестрикционных ферментов. Важно отметить, что для реакций ПЦР можно значительно снизить стоимость, обрабатывая более одного образца за раз, поскольку при обработке одного или нескольких образцов могут использоваться одни и те же контроли. Поэтому рекомендуется обрабатывать большее количество образцов за реакцию.
Важно отметить, что для реакций ПЦР можно значительно снизить стоимость, обрабатывая более одного образца за раз, поскольку при обработке одного или нескольких образцов могут использоваться одни и те же контроли. Поэтому рекомендуется обрабатывать большее количество образцов за реакцию.
Несмотря на высокую стоимость из-за использования передовых лабораторных ресурсов, метод микроматрицы позволяет проводить крупномасштабное генотипирование, сокращая количество изолированных процедур и, следовательно, уменьшая количество ошибок, позволяя идентифицировать более 30 различных антигенов, 23 фактора, которые необходимо учитывать при анализе экономической эффективности.
Несмотря на небольшое количество образцов, использованных для сравнения результатов различных методологий, все они оказались эффективными и надежными, поскольку полученные результаты были идентичны для всех образцов. Поскольку образцы, использованные в этом исследовании, взяты от доноров крови, у нас не было ни одного случая неубедительного фенотипирования, что является важным фактором в оценке чувствительности и специфичности этой методологии.
Хотя молекулярные методы считаются более чувствительными и специфичными, мы должны учитывать, что наличие определенного гена не гарантирует его экспрессию в мембране эритроцитов, то есть пациенты с нулевым фенотипом могут быть фенотипированы как положительные по определенному антигену.24 Фенотип, хотя и более быстрый, но также имеет некоторые важные ограничения, такие как отсутствие антисывороток к редким антигенам и высокая стоимость приобретения редких сывороток.9 Еще одной трудностью является фенотипирование пациентов, у которых также были антитела в сыворотке крови. как недавно переливаемые пациенты.10
Метод крупномасштабного генотипирования Microarray можно рассматривать как быстрый и высокопроизводительный метод генотипирования для поддержки отбора доноров крови и быстрого и эффективного ухода за пациентами, поскольку серологическое определение нескольких антигенов в больших группах доноров становится дорогостоящим, трудоемким и затрудненным из-за отсутствия антисыворотки. Однако этот метод лучше всего применять в крупных центрах гемотерапии, поскольку этот анализ требует значительного накопления образцов, что делает его менее привлекательным для решения отдельных случаев оказания неотложной трансфузионной помощи. Обычные методы ПЦР — хороший вариант для обычных банков крови, где количество пациентов и доноров меньше, поскольку они являются быстрыми и более экономичными методами, которые обладают хорошей чувствительностью и специфичностью для обнаружения антигенов основных групп крови.
Однако этот метод лучше всего применять в крупных центрах гемотерапии, поскольку этот анализ требует значительного накопления образцов, что делает его менее привлекательным для решения отдельных случаев оказания неотложной трансфузионной помощи. Обычные методы ПЦР — хороший вариант для обычных банков крови, где количество пациентов и доноров меньше, поскольку они являются быстрыми и более экономичными методами, которые обладают хорошей чувствительностью и специфичностью для обнаружения антигенов основных групп крови.
Анализируя преимущества и недостатки молекулярных и серологических методов, протестированных в этом исследовании, мы отмечаем, что оба они важны и дополняют друг друга, положительно влияя на определение фенотипа пациента.Возможность выполнения генотипирования в сочетании с гемагглютинацией изменяет диапазон возможностей в процедурах переливания, тем самым повышая безопасность перелитых пациентов.
Дальнейшие исследования могут дать оценку другим методикам, а также поиск альтернатив, которые снижают затраты при сохранении качества результатов.


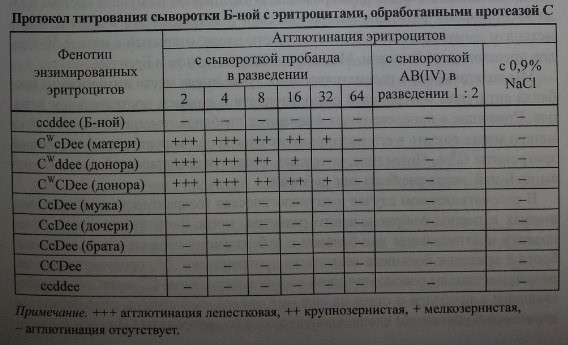
 )
)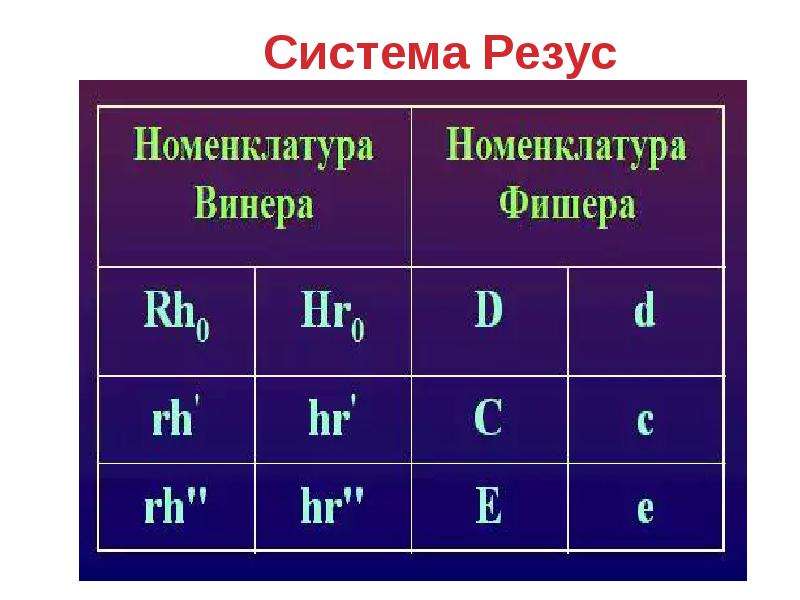
 Анализ на антирезусные антитела помогает выявлять эти процессы и вовремя назначать и корректировать лечение для предотвращения резус-конфликта.
Анализ на антирезусные антитела помогает выявлять эти процессы и вовремя назначать и корректировать лечение для предотвращения резус-конфликта.
 Curr Opin Hematol. 2005; 12: 135–40. [PubMed: 15725904]
Curr Opin Hematol. 2005; 12: 135–40. [PubMed: 15725904] Br J Haematol. 2000; 110: 409–11. [PubMed: 10971399]
Br J Haematol. 2000; 110: 409–11. [PubMed: 10971399]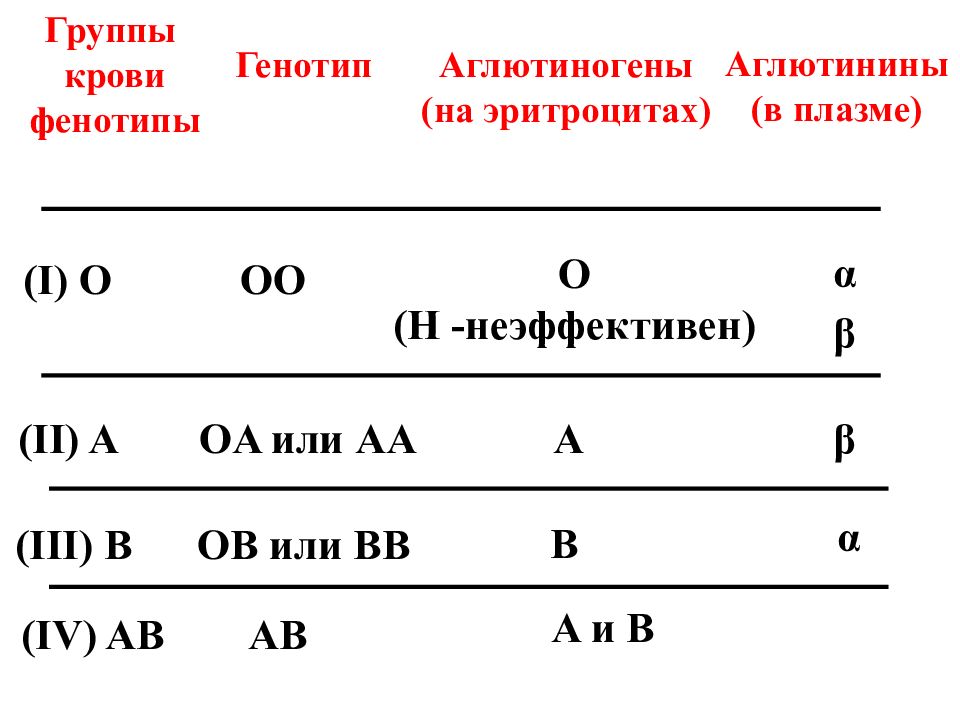 Vox Sang. 2001; 80: 117–20. [PubMed: 11348543]
Vox Sang. 2001; 80: 117–20. [PubMed: 11348543]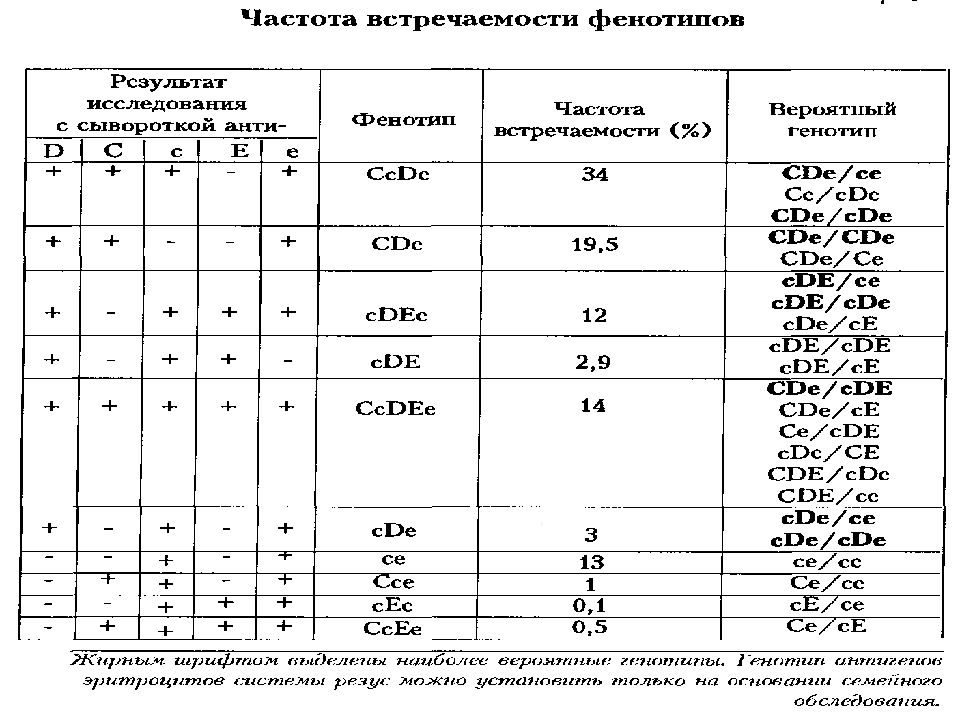 Am J Obstet Gynecol. 1984; 150: 888–9. [PubMed: 6507516]
Am J Obstet Gynecol. 1984; 150: 888–9. [PubMed: 6507516] , Редман С. Функциональные и структурные аспекты группы крови Келл
система. Transfus Med Rev.2000; 14 (2): 93–103. [PubMed: 10782495]
, Редман С. Функциональные и структурные аспекты группы крови Келл
система. Transfus Med Rev.2000; 14 (2): 93–103. [PubMed: 10782495] Curr Opin Hematol. 2005; 12: 135–40. [PubMed: 15725904]
Curr Opin Hematol. 2005; 12: 135–40. [PubMed: 15725904] Br J Haematol. 2000; 110: 409–11. [PubMed: 10971399]
Br J Haematol. 2000; 110: 409–11. [PubMed: 10971399] Vox Sang. 2001; 80: 117–20. [PubMed: 11348543]
Vox Sang. 2001; 80: 117–20. [PubMed: 11348543] Am J Obstet Gynecol. 1984; 150: 888–9. [PubMed: 6507516]
Am J Obstet Gynecol. 1984; 150: 888–9. [PubMed: 6507516] , Редман С. Функциональные и структурные аспекты группы крови Келл
система. Transfus Med Rev.2000; 14 (2): 93–103. [PubMed: 10782495]
, Редман С. Функциональные и структурные аспекты группы крови Келл
система. Transfus Med Rev.2000; 14 (2): 93–103. [PubMed: 10782495]