Классификация дисфагия: Дисфагия 3-4 степени – диагностика и лечение в Москве у доктора Мороз Ольги Владимировны
Дисфагия 3-4 степени – диагностика и лечение в Москве у доктора Мороз Ольги Владимировны
Глотание – крайне сложный физиологический процесс, который обеспечивает прохождение пищи по пищеводу. Нарушение этого процесса — дисфагия — приводит к «застреванию» пищи и может быть индикатором многих заболеваний. Примерно 10% пациентов обращаются к гастроэнтерологу с такой проблемой. И лишь у четверти от этого количества пациентов она обусловлена функциональным состоянием. В остальных случаях это может быть проявлением органической патологии — опухоли пищевода, либо неврологической симптоматикой — нарушением акта глотания. В каждом десятом случае, требуется хирургическое вмешательство для нормализации прохождения пищи по пищеводу.
При дисфагии пища может забрасываться в дыхательные пути, что будет вызывать кашель. Такое нарушение глотания характерно для нервно-мышечных заболеваний. При локализации патологии непосредственно в пищеводе, вначале возникает затруднение прохождения твердой пищи, затем жидкой. Дисфагия является часто встречаемой патологией, например, практически у 50% пациентов с инсультом обнаруживаются признаки затруднений при глотании.
Дисфагию по причине нарушения прохождения пищи можно разделить на:
- функциональную — при неврозах, повышенной возбудимости, некоторых психических заболеваниях;
- центрального генеза — как результат поражения глотательного центра в головном мозге при инсультах в этой области, при развитии отека и вклинения продолговатого мозга, при инфекционном поражении глотательного центра;
- органическую — воспалительные процессы и язвы слизистой оболочки пищевода, химические ожоги, дивертикул (выпячивание стенки) пищевода, опухолевое поражение пищевода и кардиального отдела желудка, сдавление пищевода опухолью извне.
Также существует подразделение на степени дисфагии по прохождению пищи различной консистенции:
- I степень — затруднение при глотании вызывают только некоторые виды твердой пищи,
- II степень — твердая пища не проходит, возможно употребление мягкой, полужидкой и жидкой пищи,
- III степень — возможно употребление только жидкой пищи,
- IV степень — глотание полностью невозможно.

Патогенез развития дисфагии во многом зависит от причины, которая её вызвала. При органической патологии основным фактором является механическая непроходимость пищевода при массивном опухолевом процессе или повреждения слизистой. При дисфагии центрального генеза происходит нарушение нервно-мышечной передачи, что приводит к нарушению координации при движении пищевого комка.
При дисфагии III-IV степени пациентам чаще всего требуется установка гастростомы. Это создание искусственного соустья между желудком и внешней средой. Такое соустье позволяет обеспечить необходимое питание пациента. Заболевания, которые могут привести к дисфагии III-IV степени можно разделить на две группы:
- Заболевания, при которых потребуется наложение постоянной гастростомы:
- неоперабельные опухоли пищевода и кардиального отдела желудка с распространением на пищевод,
- опухоли средостения, сдавливающие пищевод,
- рубцовые сужения пищевода не поддающиеся бужированию,
- боковой амиотрофический склероз,
- инсульт,
- миастения,
- опухоли головного мозга.
- Заболевания, при которых потребуется временное наложение гастростомы:
- ранения пищевода,
- химические ожоги пищевода на период восстановления,
- пищеводно-бронхиальные или пищеводно-трахеальные свищи,
- тяжелые травмы при невозможности самостоятельного питания,
- в качестве подготовки к операции при выраженном истощении.
Перкутанная рентгенологическая гастростомия – это современное хирургическое вмешательство, которое позволяет обеспечить пациенту достаточное и полноценное питание, путем создания искусственного соустья между передней брюшной стенкой и желудком под рентген-контролем. Это вмешательство является менее травматичным, чем традиционные методики наложения гастростомы, которые требуют выполнения больших разрезов и не всегда могут быть выполнены пациентам со слабостью дыхательной мускулатуры.
По данным обширного клинического исследования успешность наложения перкутанных радиологических гастростом близка к 100% (96,4%). Установка перкутанной радиологической гастростомы является безопасным и малотравматичным методом обеспечения пациента сбалансированным питанием.
причины, симптомы, диагностика и лечение
Дисфагия — это патологическое состояние, при котором нарушается акт глотания. Проявляется затруднением проглатывания твердой пищи, жидкостей, слюны, их попаданием в органы дыхания, усиленным образованием слюны, болевыми ощущениями за грудиной, осиплостью голоса, першением в горле. Диагностируется с помощью фарингоскопии, рентгенографии пищевода, эзофагогастроскопии, pH-метрии, эзофагеальной манометрии. Лечение предполагает назначение этиопатогенетической терапии заболевания, осложнившегося дисфагией. При возникновении расстройства на фоне тяжелых органических изменений глотки, пищевода, смежных органов осуществляются хирургические вмешательства.
Общие сведения
Дисфагия является вторичным патологическим процессом и развивается на фоне других заболеваний. Расстройства глотания выявляются во всех возрастных группах, однако с возрастом заболеваемость увеличивается. По результатам наблюдений, распространенность патологии составляет 11% в целом по популяции и достигает 13% у пациентов старше 65 лет.
В молодом возрасте дисфагия чаще осложняет течение травм, злокачественных неоплазий головы и шеи. У пожилых больных ведущими причинами нарушенного глотания являются расстройства мозгового кровообращения, нейродегенеративные болезни. Актуальность своевременной диагностики дисфагического синдрома обусловлена существенным ухудшением качества жизни больных и высоким риском смертности при возникновении осложнений.
Дисфагия
Причины дисфагии
Специалисты в сфере современной гастроэнтерологии отдельно рассматривают этиологические факторы, приводящие к развитию орофарингеальных («высоких») и пищеводных («нижних») расстройств глотания, хотя некоторые из них выявляются при обоих типах патологии. Прохождение пищевого комка через глотку и проксимальный отдел пищевода нарушается под влиянием таких причин, как:
Прохождение пищевого комка через глотку и проксимальный отдел пищевода нарушается под влиянием таких причин, как:
- Механическая обструкция. Нарушение орофарингеальной фазы глотания может быть вызвано воспалительными процессами (заглоточным абсцессом, тонзиллитом), гиперплазией щитовидной железы, увеличением лимфоузлов, гипофарингеальным дивертикулом, шейными остеофитами, фиброзом мышц, перстневидно-глоточной спайкой. Сужение верхних отделов пищеварительного тракта также наблюдается при злокачественных неоплазиях ротовой полости, глотки, гортани, последствиях их хирургического лечения и лучевой терапии.
- Нервно-мышечные расстройства. Ротоглоточная дисфагия развивается в острой фазе мозгового инсульта у 42-67% пациентов, ее выраженность напрямую коррелирует с тяжестью расстройств церебрального кровообращения. У половины больных с паркинсонизмом наблюдаются клинические симптомы нарушенного орофарингеального глотания, еще у 45% пациентов латентные признаки расстройства выявляются инструментально. Дисфагией осложняется рассеянный склероз, боковой амиотрофический склероз, псевдопаралитическая миастения.
Пищеводные нарушения глотания зачастую обусловлены эзофагеальной патологией, хроническими заболеваниями органов ЖКТ, средостения. Острые формы дисфагии возникают при аллергическом отеке Квинке, внезапной обструкции тела пищевода и гастроэзофагеального перехода инородными телами. Нормальному прохождению твердой и жидкой пищи по пищеводу в желудок могут мешать:
- Сужение пищевода. Просвет органа уменьшается при эозинофильном фарингите, злокачественных опухолях пищевода, раке желудка с поражением кардиального отдела, осложненном течении гастроэзофагеальной рефлюксной болезни. Рубцовый стеноз развивается после радиотерапии торакальных онкозаболеваний, химических ожогов едкими соединениями, хлористым калием, салицилатами, некоторыми другими препаратами. Признаки дисфагии отмечаются при сужении просвета органа менее 12 мм.

- Сдавление пищевода извне . Прохождению пищи препятствуют объемные образования, оказывающие давление на эзофагеальную стенку. Пищеводная дисфагия часто обнаруживается при опухолях (раке легкого, бронхов, тимоме), увеличении средостенных лимфоузлов, загрудинном зобе, инфекционных заболеваниях (туберкулезе, гистоплазмозе), параэзофагеальной грыже. Затруднения глотания выявляются при кардиопатологии — пороках митрального клапана, сосудистой компрессии.
- Нарушения сократительной активности пищевода. Эзофагеальные расстройства глотания осложняют ахалазию, диффузный спазм пищевода, штопорообразную деформацию органа. Патологические изменения моторики отмечаются у больных системной склеродермией, болезнью Шагаса, сахарным диабетом. Нарушения сокращений пищеводной мускулатуры, препятствующие процессу глотания, возникают при приеме нитратов, эстрогенов, метилксантинов, блокаторов кальциевых каналов.
Патогенез
Существует два ключевых механизма развития дисфагии — обструктивный и дизрегуляторный, которые при некоторых патологических состояниях могут сочетаться. При обструктивных расстройствах глотания прохождение пищи нарушается из-за существования механического препятствия — воспалительных, гранулематозных процессов, рубцовых изменений, объемных образований, выступающих в просвет пищеварительных органов или сжимающих их извне. В ряде случаев ситуация усугубляется болевым синдромом, особенно выраженным при воспалении.
Основу патогенеза дизрегуляторной дисфагии составляют расстройства иннервации вследствие поражения глотательного центра продолговатого мозга, энтеральной нервной системы, патологические изменения на уровне эзофагеального мускульного слоя. В результате сокращения мышц мягкого неба, глотки становятся дискоординированными, нарушается пищеводный перистальтический рефлекс, что приводит к изменению процесса естественного пассажа пищи.
Классификация
Существующая систематизация клинических форм дисфагии учитывает как анатомический уровень расстройств глотания, так и степень их выраженности.
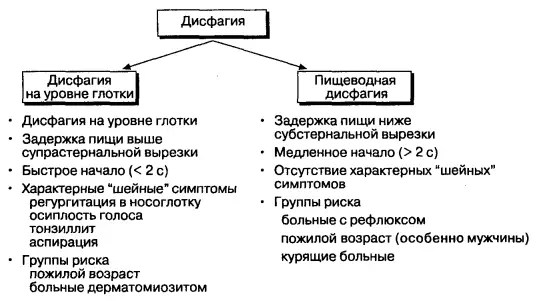
- По анатомическому уровню: орофарингеальная (ротоглоточная) и пищеводная дисфагия. В первом случае нарушается формирование пищевого комка, его перемещение в направлении горла, начальные глотательные движения. Во втором – затрудняется прохождение продуктов по пищеводу и их попадание в желудок.
- По выраженности: выделяют 4 степени дисфагии. При I степени пациент испытывает сложности с проглатыванием твердых продуктов, при II — проглатывается только жидкая пища. У больных с дисфагией III степени нарушено глотание не только твердой еды, но жидкостей, слюны. При IV степени становится невозможным проглатывание любой пищи.
Симптомы дисфагии
На начальной стадии заболевания больные обычно предъявляют жалобы на трудности при глотании твердой пищи, сопровождающиеся дискомфортом в области глотки и пищевода. Также могут появляться болезненные ощущения по ходу пищевода, усиленное слюноотделение, чувство распирания за грудиной. Характерные симптомы болезни — охриплость голоса, ощущение нехватки воздуха, сухой кашель, першение в горле. Прогрессирование дисфагии приводит к нарушениям проглатывания жидкой пищи, ее попаданию в дыхательные органы больного. Иногда заболевание сопровождается изжогой. При длительном течении отмечается ухудшение общего состояния пациента, значительная потеря массы тела вследствие нехватки пищи.
Осложнения
При дисфагии зачастую наблюдается эзофагит, который при хроническом течении повышает риск метаплазии эпителия эзофагеальной слизистой с развитием опухоли. Постоянный заброс частиц еды в дыхательные пути вызывает аспирационную пневмонию, отличающуюся тяжелым течением и резистентностью к проводимой терапии. Постоянный дефицит питательных веществ обусловливает резкое похудение пациента вплоть до кахексии, которая сопровождается дистрофическими изменениями внутренних органов. При сдавлении трахеи опухолями пищевода наблюдается острое нарушение дыхания (асфиксия), угрожающее жизни больного и требующее мер неотложной помощи.
При сдавлении трахеи опухолями пищевода наблюдается острое нарушение дыхания (асфиксия), угрожающее жизни больного и требующее мер неотложной помощи.
Диагностика
Выявление нарушений глотания обычно не представляет затруднений вследствие типичной клинической картины патологического состояния. Однако ключевой задачей диагностического поиска при дисфагии является диагностика заболеваний, которые могли стать причиной расстройства. Обследование пациента проводится комплексно и включает следующие методы:
- Осмотр глотки. В ходе фарингоскопии обнаруживаются причины ротоглоточной дисфагии: тонзиллиты, глосситы, новообразования, инородные тела. Метод дополняют проведением непрямой ларингоскопии, позволяющей диагностировать патологию надгортанника.
- Эзофагография. Рентгенография пищевода с пероральным приемом контрастного вещества выявляет характерные для дисфагии нарушения непроизвольной фазы глотания и изменения эзофагеальной моторики. Рентгенологически также можно определить наличие дивертикулов.
- Определение водородного показателя. Суточная рН-метрия является наиболее точным исследованием для диагностики рефлюкс-эзофагита с целью подтверждения органической природы дисфагии. Дополнительно может выполняться манометрия пищевода для выявления нарушений работы нижнего гастроэзофагеального сфинктера.
Изменения в клиническом анализе крови при дисфагии неспецифичны и соответствуют основному заболеванию. Может определяться анемия, умеренный лейкоцитоз, повышение СОЭ. В биохимическом анализе крови обнаруживается снижение уровня общего белка, диспротеинемия, возможно повышение содержания печеночных ферментов. Для оценки состояния пищеварительного тракта осуществляют УЗИ брюшной полости. С целью исключения патологии нервной системы проводят комплексное неврологическое обследование, по показаниям назначают МРТ головы, КТ головного мозга, ЭЭГ. Для исключения возможной пульмонологической и кардиологической патологии рекомендована рентгенография грудной клетки, эхокардиография, ЭКГ.
Для оценки состояния пищеварительного тракта осуществляют УЗИ брюшной полости. С целью исключения патологии нервной системы проводят комплексное неврологическое обследование, по показаниям назначают МРТ головы, КТ головного мозга, ЭЭГ. Для исключения возможной пульмонологической и кардиологической патологии рекомендована рентгенография грудной клетки, эхокардиография, ЭКГ.
Дифференциальная диагностика при синдроме дисфагии производится между заболеваниями, которые способны вызывать это патологическое состояние. Болезнь дифференцируют с одинофагией, истерическим «комком в горле» (globus pharyngeus), диспноэ, фагофобией. Кроме наблюдения у врача-гастроэнтеролога пациенту могут потребоваться консультации оториноларинголога, торакального хирурга, онколога и других специалистов.
Лечение дисфагии
Наибольшее влияние на выбор врачебной тактики оказывает этиология и течение расстройства. Основными терапевтическими задачами являются восстановление глотания, предупреждение возможных осложнений, в первую очередь — аспирации при орофарингеальной дисфагии нейромышечного генеза. Пациентам с острыми формами нарушения глотания, обычно возникающими при механической обструкции пищевода, показана неотложная помощь по удалению инородного тела.
Коррекция длительно существующих расстройств предполагает комплексное этиопатогенетическое лечение патологии, осложнившейся дисфагией. Из фармацевтических препаратов с учетом причин заболевания применяют:
- Средства для улучшения нейрорегуляции. Для восстановления глотания пациентам с паркинсонизмом назначаются агонисты и предшественники дофамина, центральные Н-холиноблокаторы. Проявления дисфагии при миастении уменьшаются на фоне приема антихолинэстеразных средств. При мозговых инсультах проводится интенсивная комплексная терапия нейрорепарантами, нейропротекторами, мембранными стабилизаторами.
- Блокаторы кальциевых каналов. Снижают концентрацию ионов кальция в мышечных волокнах, устраняя спастические состояния (диффузный эзофагеальный спазм, ахалазию) и улучшая прохождение пищи.
 При необходимости терапию дисфагии дополняют нитратами, оказывающими релаксирующий эффект, антихолинергическими средствами, ингибиторами фосфодиэстеразы, влияющими на нейромышечную регуляцию.
При необходимости терапию дисфагии дополняют нитратами, оказывающими релаксирующий эффект, антихолинергическими средствами, ингибиторами фосфодиэстеразы, влияющими на нейромышечную регуляцию. - Антисекреторные препараты. Рекомендованы при сочетании дисфагии с ГЭРБ, эозинофильным эзофагитом. Чаще всего применяют ингибиторы протонной помпы, которые снижают секрецию соляной кислоты и таким образом уменьшают раздражение слизистой оболочки пищевода желудочным секретом. При наличии эозинофильного эзофагита дополнительно используют аэрозольные формы местных стероидных препаратов.
При доказанном инфекционном генезе заболевания, сопровождающегося дисфагией, показана противобактериальная и противовирусная терапия. Большинству пациентов требуется коррекция рациона — замена твердых продуктов на мягкую пищу, ограничивающая диета при наличии гиперсекреторных расстройств. Во всех случаях неврологической патологии назначается реабилитация с использованием техник для улучшения орального глотания.
У ряда больных стойкое дисфагическое расстройство может быть устранено только хирургическим путем. При неоплазиях, сдавливающих пищевод, проводится резекция или удаление пораженных органов. По показаниям операция дополняется химио- и радиотерапией. При дисфункции верхнего пищеводного сфинктера, дивертикулах Ценкера эффективна крикофарингеальная миотомия.
Бужирование, баллонная дилатация, стентирование пищевода, эндоскопическое рассечение стриктур позволяют восстановить эзофагеальный просвет при его рубцовом сужении, сдавлении смежными органами. Для лечения терапевтически резистентной ахалазии производится эзофагокардиомиотомия. При дисфагии, связанной с необратимыми изменениями пищевода, выполняется эзофагопластика.
Прогноз и профилактика
Вероятность полного выздоровления зависит от причины, которая привела к развитию дисфагии. Прогноз считается относительно благоприятным, если симптоматика вызвана повышенной кислотностью желудочного сока и другими состояниями, хорошо поддающимися медикаментозной терапии. Профилактика дисфагии включает в себя своевременное лечение заболеваний пищеварительного тракта (язвенной болезни, ГЭРБ), отказ от употребления очень горячей, жареной пищи, алкоголя, прекращение курения, тщательный присмотр за детьми, исключающий проглатывание ребенком мелких предметов, игрушек.
Профилактика дисфагии включает в себя своевременное лечение заболеваний пищеварительного тракта (язвенной болезни, ГЭРБ), отказ от употребления очень горячей, жареной пищи, алкоголя, прекращение курения, тщательный присмотр за детьми, исключающий проглатывание ребенком мелких предметов, игрушек.
Дисфагия, симптомы, диагностика и лечение | Альфа
Дисфагия: симптомы, лечение
Дисфагия – это нарушение глотания. Больной не может нормально есть, пить. Комок пищи не проходит по пищеводу. Одним из характерных симптомов дисфагии является то, что жидкости и слюну проглатывать труднее, чем твердые куски.
Дисфагия пищевода не является самостоятельным заболеванием – это всегда вторичное состояние, вызванное другими патологиями. Затруднение глотания случается у пациентов всех возрастных групп. При отсутствии адекватного лечения качество жизни больного резко снижается, развиваются опасные осложнения вплоть до летального исхода.
Причины дисфагии
- Механическое сдавливание глотки или пищевода. Причиной дисфагии может стать тонзиллит, увеличение щитовидной железы, лимфатических узлов, развитие шейных остеофитов, перстневидно-глоточных спаек. Сужение также наблюдается при раковых опухолях ротовой полости, гортани, при фиброзе мышц и после хирургического вмешательства.
- Нервно-мышечное расстройство. Акт глотания нарушается практически у каждого второго пациента, перенесшего мозговой инсульт. Выраженность дисфагии зависит от распространенности процесса. Жалобы на затрудненное проглатывание пищи также наблюдаются при болезни Паркинсона, рассеянном склерозе, псевдопаралитической миастении, ахалазии кардии (хроническом спазме пищевода).
- Эзофагеальные патологии. Причиной сужения пищевода в острой форме может стать отек Квинке, попадание инородного тела в глотку, хроническое заболевание пищеварительной системы или средостения.
 Нарушением глотания сопровождается ахалазия, системная склеродермия, сахарный диабет. Возможно развитие дисфагии вследствие приема эстрогенов и нитратсодержащих веществ и препаратов.
Нарушением глотания сопровождается ахалазия, системная склеродермия, сахарный диабет. Возможно развитие дисфагии вследствие приема эстрогенов и нитратсодержащих веществ и препаратов.
Формы болезни
По анатомической локализации выделяют два вида дисфагии:
- Орофарингеальная (ротоглоточная). Нарушается проходимость глотки и горла – верхних отделов.
- Пищеводная. Пищевой комок не может пройти до желудка.
Классификация по степени выраженности симптомов:
- I степень – затруднено проглатывание твердых кусочков пищи.
- II степень – пациент может употреблять только жидкую еду.
- III степень – нарушено глотание пищи и слюны.
- IV степень – полная непроходимость пищевода.
Симптомы дисфагии
В начальной стадии пациенты жалуются на дискомфорт в горле и в области пищевода. На слабо выраженные симптомы дисфагии редко обращают внимание, что приводит к прогрессированию болезни.
Постепенно развивается чувство распирания в грудной клетке, усиливается слюноотделение. К жалобам на дисфагию добавляется сухой кашель, изменение голоса, першение в горле. При длительном нарушении пациент теряет вес, ослабевает, возможны проблемы с пищеварением.
Если своевременно не начать лечение основной болезни, дисфагия может спровоцировать перерождение эпителия слизистой с образованием опухоли. У многих пациентов развивается аспирационная пневмония – следствие попадания частиц пищи в дыхательные пути. При дисфагии, вызванной сдавливанием глотки опухолью, может развиваться острое нарушение дыхания, которое требует неотложной медицинской помощи.
Диагностика
Первичное обследование пациента проводит гастроэнтеролог, который может дополнительно рекомендовать консультацию отоларинголога, стоматолога, эндокринолога. Ключевой задачей диагностики является поиск причин нарушения.
Ключевой задачей диагностики является поиск причин нарушения.
Больному назначают комплексное обследование:
- Фарингоскопия. Осмотр глотки пациента позволяет обнаружить фарингит, тонзиллит, новообразования верхних отделов пищеварительной системы, застрявшее инородное тело.
- Рентген пищевода. Для диагностики дисфагии делают снимки с контрастом. Рентгенография помогает установить наличие дивертикулов, определить признаки изменения эзофагеальной моторики.
- Эзофагогастроскопия (ЭГДС). В ходе обследования врач осматривает слизистую пищевода и кардиальных отделов желудка. Картинка ЭГДС позволяет обнаружить эрозии, микротрещины.
- Клинический анализ крови. Изменения в результатах соответствуют основному заболеванию. Возможно повышение СОЭ, снижение уровня гемоглобина.
Лечение дисфагии
Терапию назначают с учетом причин патологии и степени выраженности симптома.
Лечение дисфагии острой формы, которая обычно возникает при механической обструкции, заключается в извлечении инородного тела или в снятии отека Квинке. Длительно существующий синдром расстройства глотания требует тщательного выбора препаратов.
Врач может назначить:
- Лекарства для улучшения нервной регуляции. Больным с паркинсонизмом назначают предшественники и агонисты дофамина, специфические препараты. При инсульте требуется комплексная терапия нейропротекторами и мембранными стабилизаторами. При миастении назначают антихолинэстеразные препараты.
- Блокаторы кальциевых каналов. Группа лекарств снижает концентрацию ионов в мышечных волокнах. В результаты уменьшается спастика мышц пищевода, улучшается его проходимость.
-
Антисекреторные препараты. Средства используют в случаях, когда дисфагия сопровождается эозинофильным эзофагитом. Назначение местных стероидных препаратов или ингибиторов протонной помпы уменьшает раздражение на слизистой, способствует ее заживлению.

- Антибактериальные или противовирусные средства. Показаны при подтвержденной инфекционной природе дисфагии.
Диагностика и лечение дисфагии пищевода в Нижнем Новгороде
Пройти диагностику и лечение дисфагии можно в клинике «Альфа-Центр Здоровья». У нас работают профильные специалисты, есть необходимое оборудование и современная лаборатория для комплексного обследования пациентов. Записаться на прием можно по телефону, указанному на сайте.
Дисфагия — Dysphagia — qaz.wiki
| Дисфагия | |
|---|---|
| Желудочно — кишечный тракт , с пищеводом отмечен красным цветом | |
| Специальность | Гастроэнтерология |
| Симптомы | Неспособность или затруднение глотания |
| Осложнения | Легочная аспирация , истощение , голодание |
| Причины | Рак пищевода , эзофагит , рак желудка , психические заболевания, алкоголизм , синдром возобновления питания , голодание , инфекции, гастрит , недоедание |
Дисфагия — затруднение глотания . Несмотря на то, классифицируются по « симптомам и признакам » в МКБ-10 , в некоторых случаях это классифицируется как условие в своем собственном праве.
Это может быть ощущение, указывающее на затруднения при прохождении твердой или жидкой пищи изо рта в желудок , отсутствие ощущения глотки или различные другие нарушения механизма глотания. Дисфагия отличается от других симптомов, включая одинофагию , которая определяется как болезненное глотание, и глобус , которое представляет собой ощущение комка в горле. У человека может быть дисфагия без одинофагии (дисфункция без боли), одинофагия без дисфагии (боль без дисфункции) или и то, и другое вместе. Психогенная дисфагия известна как phagophobia .
Психогенная дисфагия известна как phagophobia .
Признаки и симптомы
Некоторые пациенты плохо осведомлены о своей дисфагии, поэтому отсутствие симптома не исключает наличия основного заболевания. Когда дисфагия не диагностируется или не лечится, пациенты подвергаются высокому риску легочной аспирации и последующей аспирационной пневмонии из- за того, что пища или жидкость неправильно попадают в легкие. Некоторые люди обращаются с «тихим устремлением», не кашляя и не проявляя внешних признаков стремления. Недиагностированная дисфагия также может привести к обезвоживанию, недоеданию и почечной недостаточности .
Некоторые признаки и симптомы ротоглоточной дисфагии включают трудности с контролем еды во рту, неспособность контролировать пищу или слюну во рту, трудности с началом глотания, кашель, удушье, частую пневмонию , необъяснимую потерю веса, хриплый или влажный голос после глотания, носовую регургитацию и дисфагия (жалобы пациента на затруднение глотания). На вопрос, где застревает еда, пациенты часто указывают на шейный отдел ( шею ) как на место обструкции. Фактическое место обструкции всегда находится на уровне или ниже того уровня, на котором воспринимается уровень обструкции.
Наиболее частым симптомом дисфагии пищевода является неспособность проглотить твердую пищу, которую пациент описывает как «застревание» или «задержка» до того, как она попадет в желудок или срыгнет. Боль при глотании или одинофагия — отличительный симптом, который может указывать на карциному , хотя у него также есть множество других причин, не связанных с раком. Ахалазия — главное исключение из обычного паттерна дисфагии, поскольку глотание жидкости обычно вызывает больше трудностей, чем глотание твердой пищи. При ахалазии наблюдается идиопатическое разрушение парасимпатических ганглиев сплетения Ауэрбаха (кишечного тракта) всего пищевода, что приводит к функциональному сужению нижней части пищевода и перистальтической недостаточности по всей его длине.
Осложнения
Осложнения дисфагии могут включать аспирацию , пневмонию , обезвоживание и потерю веса.
Классификация и причина
Дисфагия подразделяется на следующие основные типы:
- Орофарингеальная дисфагия
- Пищеводная и обструктивная дисфагия
- Комплексы нервно-мышечных симптомов
- Функциональная дисфагия определяется у некоторых пациентов как не имеющая органической причины дисфагии, которая может быть обнаружена.
В следующей таблице перечислены возможные причины дисфагии:
| Место расположения | Причина |
|---|---|
| Оральная дисфагия | |
| Глоточная дисфагия |
|
| Пищеводная дисфагия |
|
Проблемы с глотанием или его неспособность могут быть вызваны или усугублены употреблением опиатов и / или опиоидных препаратов.
Диагностический подход
- Эзофагоскопия и ларингоскопия могут дать прямой обзор просвета.
- Исследование моторики пищевода полезно при ахалазии пищевода и диффузных спазмах пищевода.

- Эксфолиативная цитология может быть выполнена на лаваже пищевода, полученном при эзофагоскопии. Он может обнаруживать злокачественные клетки на ранней стадии.
- Ультрасонография и компьютерная томография не очень полезны для определения причины дисфагии; но может обнаруживать образования в средостении и аневризмах аорты.
- ПЛАТА (фиброоптическая эндоскопическая оценка глотания), иногда с сенсорной оценкой, обычно проводится медицинским логопедом или деглутологом. В этой процедуре пациент ест разную консистенцию, как указано выше.
- Глотательные звуки и вибрации потенциально могут быть использованы для скрининга дисфагии, но эти подходы находятся на ранних стадиях исследований.
Дифференциальная диагностика
Все причины дисфагии рассматриваются как дифференциальные диагнозы. Вот некоторые из распространенных:
Дисфагия пищевода почти всегда вызвана заболеванием пищевода или рядом с ним, но иногда поражение находится в глотке или желудке. При многих патологических состояниях, вызывающих дисфагию, просвет становится все более суженным и нерастяжимым. Первоначально трудности вызывают только волокнистые твердые вещества, но позже проблема может распространиться на все твердые вещества, а затем даже на жидкости. Пациенты с затрудненным глотанием могут получить пользу от загустевших жидкостей, если человек чувствует себя более комфортно с этими жидкостями, хотя до сих пор нет научных исследований, доказывающих, что эти загущенные жидкости полезны.
Дисфагия может проявляться в результате патологий вегетативной нервной системы, включая инсульт и БАС , или из-за быстрой ятрогенной коррекции электролитного дисбаланса.
Лечение
Есть много способов лечения дисфагии, таких как глотательная терапия, изменение диеты, кормление через зонд, некоторые лекарства и хирургическое вмешательство. Лечением дисфагии занимается группа специалистов, известная как многопрофильная команда. В состав мультидисциплинарной команды входят: логопед, специализирующийся на нарушениях глотания (терапевт по глотанию), терапевт, гастроэнтеролог, медперсонал, респираторный терапевт, диетолог, эрготерапевт, физиотерапевт, фармацевт и радиолог. Роль членов мультидисциплинарной группы будет зависеть от типа имеющегося расстройства глотания. Например, терапевт по глотанию будет непосредственно участвовать в лечении пациента с ротоглоточной дисфагией , а гастроэнтеролог будет непосредственно участвовать в лечении расстройства пищевода.
В состав мультидисциплинарной команды входят: логопед, специализирующийся на нарушениях глотания (терапевт по глотанию), терапевт, гастроэнтеролог, медперсонал, респираторный терапевт, диетолог, эрготерапевт, физиотерапевт, фармацевт и радиолог. Роль членов мультидисциплинарной группы будет зависеть от типа имеющегося расстройства глотания. Например, терапевт по глотанию будет непосредственно участвовать в лечении пациента с ротоглоточной дисфагией , а гастроэнтеролог будет непосредственно участвовать в лечении расстройства пищевода.
Стратегии лечения
Реализация стратегии лечения должна основываться на тщательной оценке многопрофильной командой. Стратегии лечения будут отличаться от пациента к пациенту и должны быть структурированы таким образом, чтобы отвечать конкретным потребностям каждого отдельного пациента. Стратегии лечения выбираются на основе ряда различных факторов, включая диагноз, прогноз, реакцию на компенсаторные стратегии, тяжесть дисфагии, когнитивный статус, респираторную функцию, поддержку попечителя, а также мотивацию и интерес пациента.
Пероральное кормление против неорального
Во время лечения дисфагии необходимо постоянно поддерживать адекватное питание и гидратацию. Общая цель терапии дисфагии — сохранить или вернуть пациента к пероральному питанию. Однако при этом необходимо обеспечить адекватное питание и гидратацию, а также безопасное глотание (отсутствие всасывания пищи в легкие). Если пероральное кормление приводит к увеличению продолжительности приема пищи и увеличению усилий во время глотания, в результате чего потребляется недостаточно пищи для поддержания веса, может потребоваться дополнительный метод питания без перорального кормления. Кроме того, если пациент всасывает пищу или жидкость в легкие, несмотря на использование компенсаторных стратегий, и, следовательно, небезопасно для перорального кормления, может потребоваться неоральное кормление. Неоральное кормление включает получение питания методом, обходящим ротоглоточный механизм глотания, включая назогастральный зонд, гастростому или еюностомию.
Лечебные процедуры
Компенсирующие лечебные процедуры предназначены для изменения потока пищи / жидкости и устранения симптомов, но не изменяют напрямую физиологию глотания.
- Постуральные техники
- Изменения в пищевой консистенции (диете)
- Изменение объема и скорости подачи еды
- Техника улучшения оральной сенсорной осведомленности
- Интраоральное протезирование
Лечебные лечебные процедуры — предназначены для изменения и / или улучшения физиологии глотания.
- Упражнения на диапазон движений полости рта и глотки
- Упражнения на сопротивление
- Упражнения для контроля болюса
- Приемы глотания
- Надгортанный глоток
- Супер-надгортанная ласточка
- Глотать с усилием
- Маневр Мендельсона
Пациентам может потребоваться комбинация лечебных процедур для поддержания безопасного глотания с адекватным питанием. Например, стратегии позы могут быть объединены с маневрами глотания, чтобы позволить пациенту глотать безопасным и эффективным образом.
Наиболее частыми вмешательствами, используемыми патологами речевого языка для пациентов с ротоглоточной дисфагией, являются изменение текстуры пищи, сгущение жидкости и изменение положения во время глотания. Эффективность изменения пищи и жидкости для предотвращения аспирационной пневмонии подвергается сомнению, и это может быть связано с плохим питанием, гидратацией и качеством жизни. Кроме того, существуют значительные различия в национальных подходах к описанию различной степени загустения жидкостей и текстур пищевых продуктов. Однако в 2015 году группа Международной инициативы по стандартизации диеты при дисфагии (IDDSI) разработала согласованную схему IDDSI, состоящую из континуума из 8 уровней (0-7), где напитки измеряются по уровням 0-4, а продукты — по уровням 3. — 7. Вероятно, что эта инициатива, получившая широкую поддержку среди практикующих, занимающихся дисфагией, улучшит общение с лицами, осуществляющими уход, и приведет к большей стандартизации модифицированных диет.
Эпидемиология
Нарушения глотания могут возникать во всех возрастных группах в результате врожденных аномалий, структурных повреждений и / или заболеваний. Проблемы с глотанием — обычная жалоба среди пожилых людей, а частота дисфагии выше у пожилых людей и у пациентов, перенесших инсульт . Дисфагия поражает около 3% населения.
Этимология
Слово «дисфагия» происходит от греческого dys, означающего «плохой» или «беспорядочный», и от корня phag, означающего «есть».
Смотрите также
Рекомендации
внешняя ссылка
Тонзиллит — Tonsillitis — qaz.wiki
| Тонзиллит | |
|---|---|
| Случай стрептококкового фарингита с типичным миндалинным экссудатом с положительным посевом у 16-летнего ребенка. | |
| Произношение | |
| Специальность | Инфекционное заболевание |
| Симптомы | Боль в горле , лихорадка , увеличение миндалин, проблемы с глотанием, большие лимфатические узлы на шее |
| Осложнения | Паратонзиллярный абсцесс |
| Продолжительность | ~ 1 неделя |
| Причины | Вирусная инфекция , бактериальная инфекция |
| Диагностический метод | На основании симптомов, мазка из зева , экспресс-теста на стрептококк. |
| Медикамент | Парацетамол ( парацетамол ), ибупрофен , пенициллин |
| Частота | 7,5% (за любые 3 месяца) |
Тонзиллит является воспаление из миндалин в верхней части горла. Тонзиллит — это тип фарингита, который обычно развивается быстро (быстро). Симптомы могут включать боль в горле , лихорадку , увеличение миндалин, проблемы с глотанием и большие лимфатические узлы на шее. Осложнения включают перитонзиллярный абсцесс .
Тонзиллит чаще всего вызывается вирусной инфекцией, и от 5% до 40% случаев вызваны бактериальной инфекцией . Когда он вызван бактерией стрептококка группы А , он называется стрептококковой ангиной . В редких случаях причиной могут быть такие бактерии, как Neisseria gonorrhoeae , Corynebacterium diphtheriae или Haemophilus influenzae . Обычно инфекция передается между людьми по воздуху. Система подсчета очков, такая как оценка Centor , может помочь разделить возможные причины. Подтверждением может служить мазок из зева или экспресс-тест на стрептококк .
Усилия по лечению включают улучшение симптомов и уменьшение осложнений. Парацетамол (ацетаминофен) и ибупрофен могут использоваться для облегчения боли. Если присутствует стрептококковая ангина, обычно рекомендуется принимать внутрь антибиотик пенициллин . Тем, у кого аллергия на пенициллин, могут использоваться цефалоспорины или макролиды . У детей с частыми эпизодами тонзиллита тонзиллэктомия незначительно снижает риск будущих эпизодов.
Около 7,5% людей болеют горлом в течение любого трехмесячного периода и 2% людей ежегодно посещают врача по поводу тонзиллита. Это наиболее часто встречается у детей школьного возраста и обычно возникает в более холодные осенние и зимние месяцы. Большинство людей выздоравливают с помощью лекарств или без них. У 40% людей симптомы исчезают в течение трех дней, а у 80% симптомы исчезают в течение одной недели, независимо от наличия стрептококка. Антибиотики уменьшают продолжительность симптомов примерно на 16 часов.
Признаки и симптомы
Иллюстрация сравнения нормальной анатомии миндалин и тонзиллитаБольные тонзиллитом обычно испытывают боль в горле , болезненное глотание , недомогание и лихорадку. Их миндалины — а часто и задняя часть глотки — кажутся красными и опухшими, а иногда выделяют белые выделения. У некоторых также наблюдается болезненное увеличение шейных лимфатических узлов .
Многие вирусные инфекции, вызывающие тонзиллит, также вызывают кашель, насморк , хриплый голос или образование волдырей во рту или горле. Инфекционный мононуклеоз может вызвать набухание миндалин с появлением красных пятен или белых выделений, которые могут распространиться на язык. Это может сопровождаться лихорадкой, болью в горле, отеком шейных лимфатических узлов, а также увеличением печени и селезенки. Бактериальные инфекции, вызывающие тонзиллит, также могут вызывать отчетливую «скарлатовидную» сыпь , рвоту и пятна или выделения из миндалин.
Тонзилолиты часто возникают у 10% населения из-за эпизодов тонзиллита.
Причины
Бактерии или вирусы могут вызвать тонзиллит.Вирусные инфекции вызывают от 40 до 60% случаев тонзиллита. Многие вирусы могут вызвать воспаление миндалин (и остальной части горла) , включая аденовирусы , риновирусы , коронавирус , вирус гриппа , вирус парагриппа , вирус Коксаки , вирус кори , вирус Эпштейна-Барр , цитомегаловирус , респираторно — синцитиальный вирус и вирус простого герпеса . Тонзиллит также может быть частью первоначальной реакции на ВИЧ- инфекцию. По оценкам, от 1 до 10% случаев вызваны вирусом Эпштейна-Барра.
Тонзиллит также может быть вызван инфекцией бактериями, преимущественно β-гемолитическими стрептококками группы А ( GABHS ), которые вызывают стрептококк в горле . Бактериальная инфекция миндалин обычно следует за первоначальной вирусной инфекцией. Когда тонзиллит рецидивирует после лечения антибиотиками стрептококка, это обычно происходит из-за тех же бактерий, что и в первый раз, что позволяет предположить, что лечение антибиотиками не было полностью эффективным. Менее распространенные бактериальные причины включают: Streptococcus pneumoniae , Mycoplasma pneumoniae , Chlamydia pneumoniae , Bordetella pertussis , Fusobacterium sp., Corynebacterium diphtheriae , Treponema pallidum и Neisseria gonorrhoeae .
Анаэробные бактерии причастны к развитию тонзиллита, и их возможная роль в остром воспалительном процессе подтверждается несколькими клиническими и научными наблюдениями.
Иногда тонзиллит вызван инфекцией из спирохеты и трепонем , которая называется стенокардией Винсента или Плот -Vincent ангины.
В миндалинах белые кровяные тельца иммунной системы разрушают вирусы или бактерии, производя воспалительные цитокины, такие как фосфолипаза А2 , которые также вызывают лихорадку. Инфекция также может присутствовать в горле и прилегающих областях, вызывая воспаление глотки .
Диагностика
Нет четкого различия между болью в горле, которая представляет собой тонзиллит, и болью в горле, вызванной воспалением как миндалин, так и близлежащих тканей. Острая боль в горле может быть диагностировано как тонзиллит , фарингит , или тонзиллофарингит (также называемый pharyngotonsillitis), в зависимости от клинических данных.
Мазок из горла.В первичной помощи установок, то критерии Centor используются для определения вероятности группы A инфекции бета-гемолитические стрептококки (GABHS) в остром тонзиллит и необходимость антибиотиков для лечения ангины. Однако у критериев Centor есть свои недостатки в том, чтобы поставить точный диагноз взрослым. Критерии Centor также неэффективны при диагностике тонзиллита у детей и в учреждениях вторичной медицинской помощи (больницах). Модифицированная версия критериев Centor, которая изменила исходные критерии Centor в 1998 году, часто используется для помощи в диагностике. В исходных критериях Centor было четыре основных критерия, но в модифицированных критериях Centor их было пять. Пять основных критериев модифицированной оценки Centor:
- Наличие миндалин экссудата
- Болезненные лимфатические узлы шеи
- История лихорадки
- Возраст от пяти до пятнадцати лет
- Отсутствие кашля
Вероятность заражения БГСА увеличивается с увеличением количества баллов. Вероятность заражения GABHS составляет от 2 до 23% для оценки 1 и от 25 до 85% для оценки 4. Диагноз тонзиллита GABHS может быть подтвержден посевом образцов, полученных путем взятия мазка из горла и посева их на кровяной агар. средний. Этот небольшой процент ложноотрицательных результатов является частью характеристик используемых тестов, но также возможен, если человек получал антибиотики до тестирования. Для идентификации требуется от 24 до 48 часов по культуре, но доступны быстрые скрининговые тесты (10–60 минут), чувствительность которых составляет 85–90%. У 40% людей без каких-либо симптомов посев из горла может быть положительным. Таким образом, посев из горла обычно не используется в клинической практике для выявления GABHS.
Бактериальный посев может потребоваться в случае отрицательного результата экспресс-теста на стрептококк. Повышение титра антител к стрептококку антистрептолизина O ( ASO ) после острой инфекции может предоставить ретроспективное свидетельство инфекции GABHS и считается окончательным доказательством инфекции GABHS, но не обязательно миндалин. Серология вируса Эпштейна-Барра может быть проверена для тех, у кого может быть инфекционный мононуклеоз, с типичным количеством лимфоцитов в результате полного анализа крови . Исследования крови требуются только для госпитализированных пациентов, которым требуется внутривенное введение антибиотиков. Повышенные значения секретируемой фосфолипазы А2 и измененный метаболизм жирных кислот, наблюдаемые у людей с тонзиллитом, могут иметь диагностическое значение.
Назоэндоскопия может использоваться при сильной боли в шее и неспособности глотать какие-либо жидкости, чтобы исключить замаскированный надгортанник и супраглотит. Рутинная назоэндоскопия детям не рекомендуется.
Уход
Для уменьшения дискомфорта от тонзиллита применяются следующие методы лечения:
- обезболивающие и жаропонижающие лекарства, такие как парацетамол (ацетаминофен) и ибупрофен
- полоскание теплой соленой водой, леденцы , мед или теплые жидкости
Противовирусного лечения тонзиллита, вызванного вирусами, не существует.
Антибиотики
Если тонзиллит вызван стрептококком группы А , тогда полезны антибиотики , в первую очередь пенициллин или амоксициллин . Цефалоспорины и макролиды считаются хорошей альтернативой пенициллину в условиях неотложной помощи. Макролид, такой как азитромицин или эритромицин , используется для людей с аллергией на пенициллин. Лица, не прошедшие терапию пенициллином, могут реагировать на лечение, эффективное против бактерий, продуцирующих бета-лактамазы, таких как клиндамицин или амоксициллин-клавуланат . Аэробные и анаэробные бактерии, продуцирующие бета-лактамазу, которые находятся в тканях миндалин, могут «защищать» стрептококки группы А от пенициллинов. Существенной разницы в эффективности различных групп антибиотиков при лечении тонзиллита нет. Внутривенные антибиотики могут применяться тем, кто госпитализирован с неспособностью глотать и поступил с осложнениями. Прием антибиотиков внутрь можно возобновить немедленно, если состояние пациента улучшилось и он может глотать перорально. Лечение антибиотиками обычно продолжается от семи до десяти дней.
Обезболивающее
Парацетамол и нестероидные противовоспалительные препараты (НПВП) можно использовать для лечения боли в горле у детей и взрослых. Не рекомендуется применять кодеин у детей младше 12 лет для лечения боли в горле или после тонзилэктомии. НПВП (например, ибупрофен ) и опиоиды (например, кодеин и трамадол ) одинаково эффективны для снятия боли, однако с этими обезболивающими следует соблюдать меры предосторожности. НПВП могут вызывать язвенную болезнь и повреждение почек. Опиоиды могут вызывать угнетение дыхания у уязвимых людей. Анестетик для полоскания рта также можно использовать для облегчения симптомов.
Кортикостероиды
Кортикостероиды уменьшают боль при тонзиллите и улучшают симптомы в течение 24-48 часов. Рекомендуются пероральные кортикостероиды, если человек не может глотать лекарства.
Операция
При частом рецидиве тонзиллита, часто произвольно определяемом как минимум пять эпизодов тонзиллита в год, или когда небные миндалины становятся настолько опухшими, что глотание становится затруднительным и болезненным, может быть выполнена тонзиллэктомия для хирургического удаления миндалин.
У детей была лишь небольшая польза от тонзиллэктомии при повторных случаях тонзиллита.
Прогноз
С момента появления пенициллина в 1940-х годах главной заботой при лечении стрептококкового тонзиллита была профилактика ревматической лихорадки и ее основных эффектов на нервную систему и сердце .
Осложнения могут редко включать обезвоживание и почечную недостаточность из-за затруднения глотания, закупорку дыхательных путей из-за воспаления и фарингит из-за распространения инфекции.
Абсцесс может развиться латеральнее миндалину во время инфекции, как правило , через несколько дней после начала ангины. Это называется перитонзиллярным абсцессом (или ангиной).
В редких случаях инфекция может распространяться за пределы миндалины, вызывая воспаление и инфекцию внутренней яремной вены, что приводит к распространению инфекционного тромбофлебита ( синдром Лемьера ).
При фарингите могут возникать такие заболевания, как постстрептококковый гломерулонефрит . Эти осложнения крайне редки в развитых странах, но остаются серьезной проблемой в более бедных странах.
Эпидемиология
Тонзиллит встречается во всем мире без расовых или этнических различий. Большинство детей болеют тонзиллитом, по крайней мере, в детстве, хотя редко возникает в возрасте до двух лет. Чаще всего это происходит в возрасте от четырех до пяти лет; бактериальные инфекции чаще всего возникают в более позднем возрасте.
Общество и культура
Тонзиллит описан в древнегреческом Корпусе Гиппократа .
Рецидивирующий тонзиллит может нарушить голосовую функцию и способность выступать среди людей, которые используют свой голос профессионально.
использованная литература
Цитируемые книги
- Дин-Джонс Л. (2013). «Детский пациент гиппократов: ранняя педиатрия?». В Grubbs JE, Parkin T (ред.). Оксфордский справочник детства и образования в классическом мире . Издательство Оксфордского университета. DOI : 10.1093 / oxfordhb / 9780199781546.013.005 . ISBN 9780199781546 .
- Ферри Ф.Ф. (2015). Клинический консультант Ферри 2016: 5 книг в 1 (первое изд.). Elsevier Health Sciences. ISBN 978-0323280471 .
- Джонс Р. (2005). Оксфордский учебник первичной медицинской помощи . Издательство Оксфордского университета. ISBN 9780198567820 .
- Ланг Ф (2009). Энциклопедия молекулярных механизмов болезней . Springer Science & Business Media. ISBN 9783540671367 .
- Нур С.Г., Мафи М.Р., Валвассори Г.Е., Валбассон Г.Е., Беккер М. (2005). Визуализация головы и шеи . Штутгарт: Тиме. п. 716]. ISBN 978-1-58890-009-8 .
- Sataloff RT, Hawkshaw MJ (2019). «Медицинская помощь при нарушениях голоса». В Eidsheim NS, Meisel K (ред.). Оксфордский справочник по изучению голоса . Нью-Йорк, Нью-Йорк: Издательство Оксфордского университета. С. 54–75. DOI : 10.1093 / oxfordhb / 9780199982295.013.11 . ISBN 978-0-19-998229-5 . OCLC 1076410526 .
- Саймон HB (2005). «Бактериальные инфекции верхних дыхательных путей». В Дейле, округ Колумбия, Федерман Д.Д. (ред.). ACP Medicine, издание 2006 г. (двухтомный набор) (второе изд.). WebMD Professional Publishing. ISBN 978-0-9748327-6-0 .
- Соммерс М, Фаннин Э (2015). Болезни и расстройства: руководство по сестринской терапии (5-е изд.). Компания FA Davis. ISBN 978-0803638556 .
- Штадельман-Коэн Т.К., Хиллман Р.Е. (2019). «Голосовая дисфункция и восстановление». В Welch GF, Howard DM, Nix J (ред.). Оксфордский справочник по пению . Издательство Оксфордского университета. С. 30–52. DOI : 10.1093 / oxfordhb / 9780199660773.013.018 . ISBN 978-0-19-966077-3 .
- Тума П. (2001). «Фарингит и тонзиллит». В Hoekelman RA, Adam HM, Nelson NM, Weitzman ML (ред.). Первичная педиатрическая помощь (4-е изд.). Сент-Луис: Мосби. ISBN 978-0-323-00831-0 .
- Ветмор РФ (2007). «Миндалины и аденоиды». В Kliegman RM, Behrman RE, Jenson HB, Stanton BF (ред.). Учебник по педиатрии Нельсона (18-е изд.). Филадельфия: Сондерс. ISBN 978-1-4160-2450-7 .
Паратонзиллярный абсцесс — Peritonsillar abscess
Гной за миндалинами из-за инфекции
| Паратонзиллярный абсцесс | |
|---|---|
| Другие имена | Квинси, ангина |
| Правосторонний перитонзиллярный абсцесс | |
| Специальность | Оториноларингология |
| Симптомы | Лихорадка , боль в горле, проблемы с открыванием рта, изменение голоса |
| Осложнения | Закупорка дыхательных путей, аспирационный пневмонит |
| Причины | Множественные типы бактерий |
| Факторы риска | Стрептококковый фарингит |
| Диагностический метод | По симптомам |
| Дифференциальная диагностика | Заглоточный абсцесс , инфекционный мононуклеоз , эпиглоттит , рак |
| Уход | Удаление гноя, антибиотиков , жидкости, обезболивающих , стероидов |
| Частота | ~ 3 на 10 000 в год (США) |
Перитонзиллярный абсцесс ( ПТА ), также известный как ангина , представляет собой скопление гноя из-за инфекции позади миндалины . Симптомы включают жар , боль в горле, проблемы с открытием рта и изменение голоса. Боль обычно усиливается с одной стороны. Осложнения могут включать закупорку дыхательных путей или аспирационный пневмонит .
Обычно они возникают из-за заражения несколькими типами бактерий . Часто это следует за стрептококковым фарингитом . Обычно они не возникают у тех, кто перенес тонзиллэктомию . Диагноз обычно ставится на основании симптомов. Медицинское обследование может быть выполнено, чтобы исключить осложнения.
Лечение заключается в удалении гноя, антибиотиках , достаточном количестве жидкости и обезболивающих . Также могут быть полезны стероиды . Госпитализация обычно не требуется. В Соединенных Штатах этим заболеванием страдают около 3 человек на 10 000 человек в год. Чаще всего страдают молодые люди.
Признаки и симптомы
Физические признаки перитонзиллярного абсцесса включают покраснение и припухлость в области миндалин на пораженной стороне, а также опухоль ягуло-желудочных лимфатических узлов . Язычка может быть смещен в сторону непораженной стороне.
В отличие от тонзиллита , который чаще встречается у детей, ЧТА имеет более равномерное возрастное распространение от детей к взрослым. Симптомы начинают проявляться за два-восемь дней до образования абсцесса . Прогрессирующая сильная ангина с одной стороны и боль при глотании ( одинофагия ) обычно являются самыми ранними симптомами. По мере развития абсцесса может появиться стойкая боль в перитонзиллярной области, лихорадка , общее недомогание , головная боль и искажение гласных, неофициально известные как «горячий картофельный голос». Боль в шее, связанная с болезненными, увеличенными лимфатическими узлами , болью в ушах и неприятным запахом изо рта также является обычным явлением. Хотя эти признаки могут присутствовать при самом тонзиллите, следует особенно рассмотреть возможность проведения ЧТА, если способность открывать рот ограничена ( тризм ).
Осложнения
Причины
ЧБТА обычно возникает как осложнение нелеченного или частично пролеченного эпизода острого тонзиллита. В этих случаях инфекция распространяется на перитонзиллярную область (перитонзиллит). Эта область состоит из рыхлой соединительной ткани и, следовательно, подвержена образованию абсцесса. PTA также может возникать de novo . Возбудителями могут быть как аэробные, так и анаэробные бактерии. Обычно участвующие аэробные патогены включают Streptococcus , Staphylococcus и Haemophilus . Наиболее распространенные анаэробные виды включают Fusobacterium necrophorum , Peptostreptococcus , Prevotella views и Bacteroides .
Диагностика
Перитонзиллярный абсцесс справа от человека на КТДиагноз обычно ставится на основании симптомов. Медицинское обследование может быть выполнено, чтобы исключить осложнения. Медицинская визуализация может включать компьютерную томографию , МРТ или ультразвуковое исследование , также полезное в диагностике.
Уход
Обычно достаточно медикаментозного лечения антибиотиками, восполнения объема жидкости и обезболивающих, хотя в случаях, когда возникает обструкция дыхательных путей или системный сепсис, может потребоваться хирургический дренаж. Также могут быть полезны стероиды . Госпитализация в больницу, как правило, не требуется.
Медикамент
Инфекция часто бывает устойчивой к пенициллину. Есть целый ряд вариантов , включая антибиотики амоксициллин / клавуланат , клиндамицин или метронидазол в сочетании с бензилпенициллина (пенициллин G) или пенициллина V . Также можно использовать пиперациллин / тазобактам .
Хирургия
Гной можно удалить несколькими способами, включая пункционную аспирацию , разрез и дренирование , а также тонзиллэктомию . Разрез и дренаж могут быть связаны с более низкой вероятностью рецидива, чем пункционная аспирация, но доказательства очень сомнительны. Аспирация иглой может быть менее болезненной, но, опять же, доказательства очень сомнительны.
Лечение также можно проводить, когда пациент находится под анестезией, но обычно это делается для детей или тревожных пациентов. Тонзиллэктомия может быть показана, если у пациента есть рецидивирующие перитонзиллярные абсцессы или тонзиллит в анамнезе. Для пациентов с первым перитонзиллярным абсцессом большинство ЛОР-хирургов предпочитают «подождать и понаблюдать», прежде чем рекомендовать тонзиллэктомию.
Эпидемиология
Это часто встречающаяся неотложная оториноларингологическая (ЛОР) ситуация.
Число новых случаев перитонзиллярного абсцесса в год в США оценивается примерно в 30 случаев на 100 000 человек. В исследовании, проведенном в Северной Ирландии , количество новых случаев составляло 10 случаев на 100 000 человек в год. В Дании количество новых случаев выше и достигает 41 случая на 100 000 человек в год. У детей младшего возраста, у которых развивается перитонзиллярный абсцесс, часто наблюдается ослабленный иммунитет, и у них инфекция может вызвать обструкцию дыхательных путей.
Этимология
Это состояние часто называют «квинси», «ангина» или «квинси», англизированные версии французского слова esquinancie, которое первоначально переводилось как «косоглазие», а затем «ангина».
Известные случаи
- Султан Хорезма Текиш
- Osceola
- Мишель де Монтень
- Папа Адриан IV
- Дэн Миноуг , капитан / тренер футбольной команды «Австралийские правила» Ричмонд, по слухам, умер за неделю до Гранд Финала ВФЛ 1920 года , но на самом деле он находился в своем родном городе Бендиго, выздоравливая от ангины.
- Считалось, что Джордж Вашингтон умер от осложнений, вызванных ангиной, но теперь считается, что он умер от эпиглоттита .
- Джеймс Грегори из группы The Ordinary Boys чуть не умер от ангины, потому что ее так долго не лечили, прежде чем было начато неотложное лечение.
- Эйитиро Ода , автор самой продаваемой манги One Piece , был госпитализирован из-за осложнений.
- Ян Макларен умер от осложнений, вызванных ангиной, во время лекционного тура по США.
Считалось, что древнеримская богиня Ангерона излечивает ангину (латинскую ангину ) у людей и овец.
Рекомендации
внешняя ссылка
Дисфагия | Компендиум
Дисфагия — затруднение проглатывания пищи, которое клинически характеризуется неспособностью проглотить пищевой комок или наличием неприятных ощущений при прохождении пищи.
Пищевод — сложно функционирующая анатомофункциональная структура, выстланная изнутри неороговевающим плоским эпителием. Подслизистый слой богат лимфатическими сплетениями, что приводит к быстрому метастазированию рака при его возникновении в пищеводе. Лимфатические сплетения расположены в рыхлой соединительной ткани, которая не может быть серьезным барьером при эзофагите, в результате чего воспаление сравнительно легко распространяется на средостение. Верхняя треть мышечной стенки содержит поперечно-полосатые мышечные волокна. Дистальные отделы пищевода построены с включением гладких мышц. Начальный акт глотания происходит произвольно. Моторика глотки, верхнего сфинктера и верхней трети пищевода регулируется V, VII, IX, X, XI и XII парами черепно-мозговых нервов. Дальнейшая перистальтика пищевода осуществляется за счет интрамуральных ганглиев, реагирующих на изменение объема и давления. Блуждающий нерв ответственен только за работу верхней трети пищевода, его поперечно-полосатой мышцы. Если нерв повреждается ниже этого сегмента, то перистальтика не нарушается.
Близ впадения пищевода в желудок гладкие мышцы пищевода утолщаются с образованием так называемого нижнего пищеводного сфинктера (кольцо Шацкого).
Вся эта сложно скоординированная система необходима для беспрепятственного прохождения пищи из полости рта в желудок и предотвращения рефлюкса.
Диагноз «заболевание пищевода» необходимо прежде всего основывать на тщательном сборе и анализе всех жалоб и симптомов. Физикальные данные всегда очень скупы. Удается определить выбухание дивертикулы пищевода ключичные ЛУ при метастазах.
Очень надежно и просто клинически диагностируют нарушения двигательной активности пищевода. Просят пациента сделать глоток воды или пищи, фиксируя время от момента глотка до шума плеска в желудке (поставить фонендоскоп в эпигастральной области). В норме это время в зависимости от возраста колеблется от 5 до 10 с, но никогда не превышает 12 с.
Причинами нарушения глотания и прохождения пищи по пищеводу могут быть:
- Боль в области глоточного кольца. Возникает при глотательных движениях. Такая боль не зависит от вида пищи. Чаще обусловлена местным воспалением (ангина, локальные травмы грубой пищей или инородным телом).
- «Поперхивания» (орофарингеальная дисфагия) — затруднения прохождения пищи (особенно и первоначально исключительно твердой) в глотке, нередко ее забрасывание в носоглотку, вытекание из носа. Сопровождается кашлем, аспирацией. Возникает при неврологических заболеваниях (бульбарный синдром) и поражениях мышц (дерматомиозит, миастения, полиомиелит, амилоидоз).
- Одинофагия — боль при прохождении пищи по пищеводу. Четко локализуется пациентом и может быть очень мучительной. Симптом сопровождает течение вирусных, грибковых, бактериальных, химических и других эзофагитов, ожогов слизистой оболочки, язв пищевода, травм. Одинофагия может быть как самостоятельным симптомом, так и сочетаться с дисфагией.
- Эзофагеальная дисфагия — затруднение прохождения плотной и/или жидкой пищи по пищеводу. Часто комбинируется с отрыжкой, рвотой, аспирацией. Выявляют при стриктурах, врожденных мембранах, опухолях, рубцах.
У истеричных субъектов часты жалобы на так называемый ком в горле (globus hystericus). При этом ощущение комка, инородного тела беспокоит вне всякой связи с приемом или характером пищи. Эмоции, конфликтные ситуации усугубляют субъективное ощущение. В реальности даже твердая пища проходит свободно. Общее состояние пациентов является решающим в трактовке жалоб.
Эзофагеальная дисфагия проявляется непостоянными или прогрессирующими нарушениями пассажа пищи, болью, регургитацией. Последняя может привести к пневмонии, ателектазам, что иногда доминирует в клинической картине. ДД путь при дисфагиях представлен на схеме 23.1.
Эзофагеальная дисфагия может быть при мега- эзофагусе. Выявляют при синдроме Рилея — Дея (а/p, типичен для евреев-ашкенази. Обусловлен патологией цереброспинальной и вегетативной нервной систем в результате снижения активности фактора роста нервов. Ожидаемая продолжительность жизни снижена), миотонической дистрофии Куршмана — Штайнерта (последняя нередко сочетается с дилатацией желудка).
Заболевания слизистой оболочки пищевода проявляются резко развившейся одинофагией. Наряду с отеком и гиперемией слизистой оболочки возможны изъязвления. Возникает после проглатывания инородных тел, употребления раздражающих жидкостей, вяленой костистой рыбы, жирной и горячей пищи, медленно стекающей по стенкам пищевода, особенно при наличии местных национально-этнических особенностей ее приема в положении лежа, что резко повышает экспозицию повреждения.
Такой же эффект вызывает применение тетрациклина, антихолинэргических средств, особенно без достаточного приема жидкости, перед сном. У пациентов с иммуносупрессией развиваются грибковые, герпетические и другие вирусные эзофагиты.
Нейромышечные нарушения протекают в виде ахалазии и эзофагоспазмов.
Ахалазия пищевода развивается при снижении его сократимости при сохраненном тонусе кардиального сфинктера. Может развиться в любом возрасте, но чаще в 20–40 лет. В аперистальтических отделах при гистологическом исследовании выявляют полное исчезновение интрамуральных ганглиев. Известна как идиопатическая ахалазия, так и вторичная, как осложнение болезни Чагаса (трипаносомоз) и при склеродермии.
Идиопатическая ахалазия (мегаэзофагус) начинается исподволь, полная клиническая картина развивается за месяцы–годы. Основной ее признак — дисфагия при приеме как твердой, так и жидкой пищи. Присоединяются ночной кашель (регургитация), боль за грудиной, умеренное уменьшение массы тела. (Если уменьшение массы тела существенное, особенно улиц пожилого возраста, ахалазия сформировалась быстро, необходимо безотлагательно исключить рак пищеводно-желудочного перехода). Ахалазия ведет к расширению пищевода. В вертикальном положении тела пища попадает в желудок за счет собственного веса, в положении лежа рентгенологически выявляется задержка пищи в пищеводе. Пищевод выглядит растянутым, не перистальтирует, контурирование стенок контрастным веществом и наличие в просвете газа создает феномен воздушного столба.
Болевые приступы при идиопатическом диффузном спазме пищевода могут возникать вне приема пищи, иногда в ночное время. Но провоцирующими факторами чаще являются твердая, очень холодная или горячая пища, стрессы, физические упражнения. Загрудинная боль напоминает стенокардию и вызывают большие сложности ДД. Причина не известна, ауэрбаховские ганглии при этом состоянии сохранены. Диагноз устанавливают рентгенокимографически. Изображение пищевода за счет псевдодивертикулов напоминает штопор или чурчхелу. Хороший терапевтический эффект оказывают нитроглицерин и антагонисты ионов кальция. В ряде случаев идиопатический диффузный спазм пищевода через несколько лет переходит в ахалазию.
Механические нарушения прохождения пищи по пищеводу развиваются прежде всего при его опухолях. Более того, каждая прогрессирующая дисфагия должна служить поводом для неотложного исключения рака пищевода. 95% всех случаев рака пищевода приходится на плоскоклеточный рак. Предрасполагающими факторами являются алкоголь, курение, синдром Пламмера — Винсона, ахалазия. Аденокарциному диагностируют редко. Для рака пищевода типичны избыточная саливация, жалобы на затруднение прохождения твердой пищи с четко ощущаемым уровнем препятствия, ощущение сдавления, стеснения за грудиной. Значительно позднее присоединяются синдром Горнера (в результате раздражения симпатического ствола), афония и осиплость голоса (поражение возвратного нерва), затруднение дыхания (сдавление трахеи). Наиболее информативным методом является эзофагоскопия. Рентгенологические признаки (ригидность стенки пищевода, дефект заполнения, язвенная ниша) выявляют позднее. Из доброкачественных опухолей пищевода чаще развивается лейомиома. Симптомы при этом новообразовании нарастают медленнее, общее состояние пациента не ухудшается, при эндоскопии видно выбухание слизистой оболочки без ее изъязвления. Рентгенологически регистрируют четко очерченное округлое утолщение стенки.
Ложное (неопухолевое, не поствоспалительное, нерубцовое) сужение пищевода за счет гипертрофии гладких мышц в нижней трети и вторичным расширением пищевода выше участка гипертрофии и/или лейомиоматоза его стенки заставляет думать об одонтомо (как вариант гамартом)-дисфагическом синдроме. Передается а/д? Пенетрантность и вариабельность не известны. Может сочетаться со стенозом аорты, цилиндрическими бронхоэктазами.
Ценкеровский дивертикул развивается только у лиц пожилого возраста и относительно просто диагностируется рентгенологически. Его пульсация служит ДД-отличием от тракционных дивертикулов. Причиной его развития служит дисфункция перстневидно-глоточной мышцы. Возможны повторные аспирации содержимого дивертикула, особенно в положении лежа, ночью, с развитием хронического поражения легких.
Кольцо Шацкого в виде циркулярного фиброзного сужения в нижней части пищевода шириной в несколько миллиметров и мембраны в виде эксцентрично расположенных тонких перепонок чаще в верхней трети пищевода обусловливает непостоянную дисфагию при употреблении твердой пищи. Наряду с врожденным происхождением обсуждается роль железодефицитных состояний (синдром Пламмера — Винсона, или синдром Паттерсона — Брауна — Келли). Сужение пищевода может быть у людей, матери которых в период беременности принимали блокаторы β-адренорецепторов в комплексном лечении при АГ, талидомид. Сужение пищевода в небольшой доле случаев обусловлено VATER-синдромом (58% больных умирают в детском возрасте). Синдром проявляется аномалиями позвонков и дисплазией ребер, стенозом пищевода, гидронефрозом, подковообразной почкой, полидактилией, синдактилией, аномалиями уха, низким ростом, аномалиями гениталий. Интеллект не страдает. Кариотип нормален. Возникает спорадически. Редкие семейные описания позволяют обсуждать а/p и а/д типы наследования.
Врожденная атрезия пищевода по понятным причинам известна только в практике неонатологов и в настоящем издании не обсуждаются.
Поствоспалительный (пептический) стеноз является типичным осложнением длительно существующего рефлюкс-эзофагита (рис. 23.2). Характеризуется изжогой, кислой отрыжкой, рецидивирующей болью ретростернальной и эпигастральной локализации. Почти всегда сочетается с грыжей пищеводного отверстия диафрагмы. Оптимальным методом диагностики рефлюкс-эзофагита является 24-часовая pH-метрия в пищеводе. Ее проведение (наряду с вышеуказанными жалобами и состояниями) показано также при бронхиальной астме, апноэ, загрудинной боли. Для pH-метрии соответствующий зонд фиксируется на 87% расстояния от пищевода до нижнего пищеводного сфинктера.
Методика расчета: (рост⋅0,252+5 см)⋅0,87.
В протоколе pH-метрии необходимо отмечать положение тела, прием пиши, жидкости, возникновение тошноты и т. д. При длительности рефлюксов более 10% всего периода pH-метрии можно диагностировать рефлюкс-эзофагит.
В нижних отделах пищевода за счет постоянного ожога соляной кислотой и агрессивного воздействия пепсина формируются язвы, цилиндрическая метаплазия эпителия (эпителий Баррета, барретовский эзофагит с возможной метаплазией в аденокарциному), формируются стриктуры с достаточно частым (до 10%) перерождением в рак.
Каждый случай язвы пищевода требует тщательного исключения портальной гипертензии.
Более редкими причинами стеноза пищевода являются ранения инородными телами, ожоги агрессивными жидкостями, длительное нахождение желудочного зонда, буллезный эпидермолиз.
Механическое затруднение прохождения пиши по пищеводу за счет объемных процессов средостения возникает редко. Это могут быть атипичное расположение дуги аорты или ее аневризма, опухоли и зоб, особенно при ретростернальном расположении.
У детей описана дисфагия при сдавлении пищевода аберрантной правой подключичной артерией, отходящей от левой стороны дуги аорты. Если этот вариант дисфагии проявляется значительно позже, то основное значение имеет атеросклероз аномального сосуда. Рентгенологически выявляют сдавление пищевода на уровне грудного позвонка ТIII. Для окончательной верификации диагноза необходимо проведение артериографии.
Ряд лекарственных препаратов, в том числе гормонов, способны изменять тонус кардиального сфинктера пищевода, обусловливая развитие рефлюкса или возникновение неприятных ощущений за грудиной (табл. 23.1).
Таблица 23.1
Влияние некоторых лекарственных препаратов и гормонов на тонус кардиального сфинктера пищевода
| Препарат | Тонус ↑ | Тонус ↓ |
| Гастрин | + | |
| Мотилин | + | |
| Секретин | + | |
| Холецистокинин | + | |
| Глюкагон | + | |
| Прогестерон (пероральные контрацептивы) | +++ | |
| Метахолин | +++ | |
| Норэпинефрин | + | |
| Эпинефрин | + | |
| Никотин (курильщики) | +++ | |
| Серотонин | + | |
| Нитраты и нитриты | +++ | |
| Допамин | + | |
| Блокаторы кальциевых каналов | + | |
| Простагландин Е1, Е2 | ++ | |
| Простагландин F2α | + |
Грыжа пищеводного отверстия диафрагмы может быть врожденной или приобретенной (вторичной после травмы). Скользящая грыжа диафрагмы — нахождение пищеводно-желудочного перехода и части
желудка над диафрагмой. При этом часть желудка, внедренного в пищеводное отверстие диафрагмы, покрыта брюшиной. Скользящую грыжу выявляют примерно в 20–40% случаев. Обычно ничем не проявляется, но может сопровождаться болью, а в крайних случаях — кровотечением.
При параэзофагеальной грыже пищеводно-желудочный переход оказывается в типичном месте, а часть желудка внедряется в пищевод. Этот вариант грыжи чаще приводит к ущемлению и кровотечению.
Дисфагия: основы практики, предыстория, анатомия
Palmer JB, DuChane AS. Phys Med Rehab Clin North Amer. Реабилитация нарушений глотания вследствие инсультов . 1991. 2: 529.
Пател Д.А., Кришнасвами С., Стегер Э. и др. Бремя дисфагии для экономики и выживания среди стационарных пациентов в США. Пищевод Дис . 1 января 2018 г. 31 (1): 1-7. [Медлайн].
Доддс WJ. Физиология глотания. Дисфагия . 1989. 3 (4): 171-8. [Медлайн].
Додрил П., Госа ММ. Детская дисфагия: физиология, оценка и лечение. Энн Нутр Метаб . 2015. 66 Дополнение 5: 24–31. [Медлайн]. [Полный текст].
Horton J, Atwood C, Gnagi S, Teufel R, Clemmens C. Временные тенденции детской дисфагии у госпитализированных пациентов. Дисфагия . 2018 20 февраля. [Medline].
Бакстер К.Дж., Бакстер Л.М., Ландри А.М., Вулкан М.Л., Бхатия А.М.Структурные нарушения дыхательных путей способствуют развитию дисфагии у детей с атрезией пищевода и трахеопищеводным свищом. J Педиатр Хирург . 2018 31 января. [Medline].
Christiaanse ME, Mabe B, Russell G, Simeone TL, Fortunato J, Rubin B. Нервно-мышечная электростимуляция не более эффективна, чем обычная помощь при лечении первичной дисфагии у детей. Педиатр Пульмонол . 2011 июн. 46 (6): 559-65. [Медлайн].
Шейкер Р., Керн М., Бардан Э, Тейлор А., Стюарт Э. Т., Хоффманн Р. Г. и др.Увеличение глотательного отверстия верхнего сфинктера пищевода у пожилых людей с помощью упражнений. Am J Physiol . 1997, июнь 272 (6, часть 1): G1518-22. [Медлайн].
Paik NJ, Kim SJ, Lee HJ, Jeon JY, Lim JY, Han TR. Движение подъязычной кости и надгортанника при глотании у пациентов с дисфагией различной этиологии. Дж Электромиогр Кинезиол . 2008 апреля 18 (2): 329-35. [Медлайн].
Veis SL, Logemann JA. Нарушения глотания у лиц с нарушением мозгового кровообращения. Arch Phys Med Rehabil . 1985 июн. 66 (6): 372-5. [Медлайн].
Logemann JA. Руководство по видеофлюорографическому исследованию глотания . 2-е изд. Остин, Техас: Pro-Ed; 1993.
Питтс Т., Болсер Д., Розенбек Дж., Троче М., Сапиенца С. Произвольное кашель и дисфункция глотания при болезни Паркинсона. Дисфагия . 2008 23 сентября (3): 297-301. [Медлайн].
Кавагути С., Такеучи Т., Иноуэ Й и др.Изучение скрытых нарушений моторики пищевода у пациентов с дисфагией. Пищеварение . 2017 г. 11 апреля. 95 (4): 269-74. [Медлайн].
Power ML, Hamdy S, Singh S. Деглютативное закрытие гортани у пациентов с аспирационным инсультом. J Neurol Neurosurg Psychiatry . 29 сен 2006.
Розенбек Дж. К., Роббинс Дж. А., Рокер Э. Б., Койл Дж. Л., Вуд Дж. Л.. Шкала проникновения-стремления. Дисфагия . 1996 Весна. 11 (2): 93-8.[Медлайн].
Kim H, Suh Y. Изменения дисфагии и статуса питания пациентов с черепно-мозговой травмой. J Clin Nurs . 2017 г. 21 декабря [Medline].
Монтейро Л., Соуза-Мачадо А., Пинхо П., Сампайо М., Нобрега А.С., Мело А. Нарушение глотания и легочная дисфункция при болезни Паркинсона: скрытые угрозы. J Neurol Sci . 2014 14 февраля [Medline].
Андренелли Э., Галли Флорида, Гесуита Р. и др.Нарушения глотания при боковом амиотрофическом склерозе и миотонической дистрофии 1 типа: поиск портрета пациента с дисфагией при нервно-мышечных заболеваниях. Нейрореабилитация . 2018. 42 (1): 93-102. [Медлайн].
Сантруп-Крюгер С., Кеммлинг А., Варнеке Т. и др. Влияние местоположения поражения на частоту, характер и осложнения дисфагии при остром инсульте. Часть 2: Остатки из ротоглотки, реакция глотания и кашля и пневмония. евро J Neurol .2017 27 апреля. [Medline].
Сантруп С., Кеммлинг А., Варнеке Т. и др. Влияние местоположения поражения на частоту, характер и осложнения дисфагии при остром инсульте. Часть 1: частота, тяжесть и аспирация дисфагии. евро J Neurol . 2015 май. 22 (5): 832-8. [Медлайн].
Ли Б., Ву П. Хронический кашель как признак сенсорной нейропатии гортани: диагностика и лечение. Энн Отол Ринол Ларингол . 2005 апр. 114 (4): 253-7.[Медлайн].
Clayton NA, Carnaby GD, Peters MJ, Ing AJ. Нарушение чувствительности гортани у пациентов с ХОБЛ: связь с функцией глотания. Int J Speech Lang Pathol . 2014 24 февраля [Medline].
Greven KM, White DR, Browne JD, Williams DW 3rd, McGuirt WF Sr, D’Agostino RB Jr. Дисфункция глотания является частым осложнением после химиолучевой терапии карциномы ротоглотки. Ам Дж. Клин Онкол . 2008 июн.31 (3): 209-12. [Медлайн].
Маккензи Ш., Го М., Чедвик Б., Томас К., Фанг Дж., Кувада С. и др. Эозинофильный эзофагит у пациентов с дисфагией — проспективный анализ. Алимент Фармакол Тер . 2008 г., 1. 28 (9): 1140-6. [Медлайн].
Bussell SA, Гонсалес-Фернандес М. Расовые различия в развитии дисфагии после инсульта: дополнительные данные из базы данных Medicare. Arch Phys Med Rehabil .2011 Май. 92 (5): 737-42. [Медлайн].
Gonzalez-Fernandez M, Kuhlemeier KV, Palmer JB. Расовые различия в развитии дисфагии после инсульта: анализ баз данных стационарных пациентов Калифорнии (MIRCal) и Нью-Йорка (SPARCS). Arch Phys Med Rehabil . 2008 июль 89 (7): 1358-65. [Медлайн].
Куи-ван Эс М., Эразмус CE, де Сварт Б.Дж.М. и др. Дисфагия и дизартрия у детей с нервно-мышечными заболеваниями, исследование распространенности. J Neuromuscul Dis . 2020 11 марта [Medline].
Манн Г., Хэнки Г.Дж., Кэмерон Д. Функция глотания после инсульта: прогноз и прогностические факторы через 6 месяцев. Инсульт . 1999 Апрель 30 (4): 744-8. [Медлайн].
Барер DH. Естественное течение и функциональные последствия дисфагии после полушарного инсульта. J Neurol Neurosurg Psychiatry . 1989 Февраль 52 (2): 236-41. [Медлайн]. [Полный текст].
Masiero S, Pierobon R, Previato C, Gomiero E.Пневмония у пациентов с инсультом и ротоглоточной дисфагией: последующее шестимесячное исследование. Neurol Sci . 29 июня 2008 г. (3): 139-45. [Медлайн].
Оддерсон И.Р., Китон Дж. К., Маккенна Б.С. Управление глотанием у пациентов с острым инсультом: качество рентабельно. Arch Phys Med Rehabil . 1995 Декабрь 76 (12): 1130-3. [Медлайн].
Eglseer D, Halfens RJG, Schols JMGA, Lohrmann C. Дисфагия у госпитализированных пожилых пациентов: сопутствующие факторы и нутриционные вмешательства. J Nutr Health Aging . 2018. 22 (1): 103-10. [Медлайн].
Finestone HM, Greene-Finestone LS, Wilson ES, Teasell RW. Недоедание у пациентов с инсультом, находящихся на реабилитационной службе и в период наблюдения: распространенность и предикторы. Arch Phys Med Rehabil . 1995 апр. 76 (4): 310-6. [Медлайн].
Gourin CG, Couch ME, Johnson JT. Влияние потери веса на краткосрочные результаты и затраты на лечение после операции по поводу рака головы и шеи. Энн Отол Ринол Ларингол . 2014 Февраль 123 (2): 101-10. [Медлайн].
Logemann JA. Оценка и лечение нарушений глотания . 2-е изд. Остин, Техас: Pro-Ed; 1998.
Палмер Дж. Б., Дреннан Дж. К., Баба М. Оценка и лечение нарушений глотания. Am Fam Врач . 2000, 15 апреля. 61 (8): 2453-62. [Медлайн].
Spieker MR. Оценка дисфагии. Am Fam Врач .2000, 15 июня. 61 (12): 3639-48. [Медлайн].
Kwek AB, Tan EK, Luman W. Дисфагия как побочный эффект инъекции ботулотоксина. Med J Malaysia . 2004 Октябрь 59 (4): 544-6. [Медлайн].
Lazarus C, Logemann JA. Нарушения глотания у больных с закрытой травмой головы. Arch Phys Med Rehabil . 1987 Февраль 68 (2): 79-84. [Медлайн].
DePippo KL, Holas MA, Reding MJ. Подтверждение результатов теста с проглатыванием 3 унций воды на аспирацию после инсульта. Arch Neurol . 1992 Декабрь 49 (12): 1259-61. [Медлайн].
Кумар В.В., Амин МР. Оценка средних и дистальных дивертикулов пищевода с помощью трансназальной эзофагоскопии. Энн Отол Ринол Ларингол . 2005 апр. 114 (4): 276-8. [Медлайн].
Splaingard ML, Hutchins B, Sulton LD, Chaudhuri G. Аспирация у реабилитируемых пациентов: видеофлюороскопия и клиническая оценка у постели больного. Arch Phys Med Rehabil . 1988 Август.69 (8): 637-40. [Медлайн].
Espitalier F, Fanous A, Aviv J, et al. Международный консенсус (ICON) по оценке ротоглоточной дисфагии. Eur Ann Otorhinolaryngol Head Neck Dis . 2018 фев. 135 (1S): S17-S21. [Медлайн].
Shem KL, Castillo K, Wong SL, Chang J, Kao MC, Kolakowsky-Hayner SA. Диагностическая точность прикроватной оценки глотания по сравнению с видеофлюороскопией для оценки дисфагии у лиц с тетраплегией. PM R .2012 апр. 4 (4): 283-9. [Медлайн].
Холт С., Мирон С.Д., Диаз М.С., Шилдс Р., Ингрэм Д., Беллон Э.М. Сцинтиграфическое измерение ротоглоточного транзита у человека. Dig Dis Sci . 1990 Октябрь 35 (10): 1198-204. [Медлайн].
Аддингтон В. Р., Стивенс Р. Е., Гиллиланд К., Родригес М. Оценка кашлевого рефлекса гортани и риска развития пневмонии после инсульта. Arch Phys Med Rehabil . 1999 Февраль 80 (2): 150-4. [Медлайн].
Эртекин С., Айдогду I, Юджеяр Н., Тарлачи С., Кийлиоглу Н., Пехливан М. и др. Электродиагностические методы нейрогенной дисфагии. Электроэнцефалогер Клин Нейрофизиол . 1998 августа 109 (4): 331-40. [Медлайн].
Noll SF, Bender CE, Marge CN. Реабилитация больных с нарушением глотания. Брэддом Р.Л., изд. Физическая медицина и реабилитация . У. Б. Сондерс: Филадельфия, Пенсильвания; 1996.
Paik NJ, Han TR.Критический обзор управления ротоглоточной дисфагией у взрослых. Crit Rev Phys Rehabil Med . 2002. 14: 247-72.
Национальная рабочая группа по диете при дисфагии. Национальная диета при дисфагии: стандартизация оптимального ухода . Чикаго, штат Иллинойс: Американская диетическая ассоциация; 2002.
Сьюэлл РК, Баумана Н.М. Врожденная перстно-глоточная ахалазия: лечение ботулотоксином перед миотомией. Arch Otolaryngol Head Neck Surg .2005 г., май. 131 (5): 451-3. [Медлайн].
Sonies BC, Almajid P, Kleta R, Bernardini I, Gahl WA. Дисфункция глотания у 101 пациента с нефропатическим цистинозом: преимущества долгосрочной терапии цистеамином. Медицина (Балтимор) . 2005 г., май. 84 (3): 137-46. [Медлайн].
Манн Л.Л., Вонг К. Разработка объективного метода оценки вязкости сформулированных пищевых продуктов и напитков для дисфагической диеты. J Am Diet Assoc .1996 июнь 96 (6): 585-8. [Медлайн].
Paik NJ, Han TR, Park JW, Lee EK, Park MS, Hwang IK. Категоризация диет при дисфагии с помощью теста на растяжение линии. Arch Phys Med Rehabil . 2004 Май. 85 (5): 857-61. [Медлайн].
Verschueren A, Monnier A, Attarian S, Lardillier D, Pouget J. Энтеральное и парентеральное питание на поздних стадиях БАС: обсервационное исследование. Боковой склер Amyotroph . 2009 Февраль 10 (1): 42-6. [Медлайн].
Choi JB, Shim SH, Yang JE, Kim HD, Lee DH, Park JS. Влияние упражнений на шейкер у выживших после инсульта с ротоглоточной дисфагией. Нейрореабилитация . 2017. 41 (4): 753-7. [Медлайн].
Fraser C, Power M, Hamdy S, Rothwell J, Hobday D, Hollander I, et al. Повышение пластичности моторной коры взрослого человека связано с улучшением моторной функции после травмы головного мозга. Нейрон . 2002 30 мая. 34 (5): 831-40. [Медлайн].
Фрид М.Л., Фрид Л., Чатберн Р.Л., Кристиан М. Электростимуляция при расстройствах глотания, вызванных инсультом. Respir Care . 2001 Май. 46 (5): 466-74. [Медлайн].
Leelamanit V, Limsakul C, Geater A. Синхронная электрическая стимуляция при лечении глоточной дисфагии. Ларингоскоп . 2002 декабрь 112 (12): 2204-10. [Медлайн].
Спросон Л., Паунолл С., Эндерби П., Фриман Дж. Комбинированная электрическая стимуляция и упражнения для реабилитации глотания после инсульта: пилотное рандомизированное контрольное исследование. Int J Lang Commun Disord . 2017 г. 30 декабря. [Medline].
Schultheiss C, Nusser-Müller-Busch R, Seidl RO. Полутвердый болюсный глотательный тест для клинической диагностики ротоглоточной дисфагии: проспективное рандомизированное исследование. евро Арка Оториноларингол . 2011 Декабрь 268 (12): 1837-44. [Медлайн]. [Полный текст].
Ho CH, Lin WC, Hsu YF, Lee IH, Hung YC. Годовой риск пневмонии и смертности у пациентов с постинсультной дисфагией: общенациональное популяционное исследование. J Stroke Cerebrovasc Dis . 2018 25 января. [Medline].
Кэмпбелл-Тейлор И., Надон Г.В., Склейтер А.Л., Фишер Р., Харрис-Кван Дж., Розен И. Кормление через ротопищеводный зонд: альтернатива назогастральным или гастростомическим зондам. Дисфагия . 1988. 2 (4): 220-1. [Медлайн].
Парк Р.Х., Эллисон М.К., Ланг Дж., Спенс Э., Моррис А.Дж., Данеш Б.Дж. и др. Рандомизированное сравнение чрескожной эндоскопической гастростомии и кормления через назогастральный зонд у пациентов с сохраняющейся неврологической дисфагией. BMJ . 1992 30 мая. 304 (6839): 1406-9. [Медлайн]. [Полный текст].
Gomes CA Jr, Lustosa SA, Matos D, Andriolo RB, Waisberg DR, Waisberg J. Чрескожная эндоскопическая гастростомия в сравнении с кормлением через назогастральный зонд для взрослых с нарушениями глотания. Кокрановская база данных Syst Rev . 2012 14 марта 3: CD008096. [Медлайн].
Хан TR, Paik NJ, Park JW, Kwon BS. Прогнозирование стойкой дисфагии через шесть месяцев после инсульта. Дисфагия . 2008 23 марта (1): 59-64. [Медлайн].
Хан TR, Paik NJ, Park JW. Количественная оценка функции глотания после инсульта: шкала функциональной дисфагии, основанная на видеофлюороскопических исследованиях. Arch Phys Med Rehabil . 2001 Май. 82 (5): 677-82. [Медлайн].
Дзевас Р., Варнеке Т., Оленберг С., Тейсманн И., Циммерманн Дж., Крамер С. и др. К базовой эндоскопической оценке глотания при остром инсульте — разработка и оценка простой шкалы дисфагии. Цереброваск Дис . 2008. 26 (1): 41-7. [Медлайн].
Дисфагия — Желудочно-кишечные расстройства — MSD Manual Professional Edition
Жевание, глотание, дегустация и общение требуют целостной, скоординированной нервно-мышечной функции во рту, лице и шее. В частности, двигательная функция полости рта заметно снижается с возрастом даже у здоровых людей. Снижение функции может иметь множество проявлений:
Снижение силы и координации жевательных мышц является обычным явлением, особенно среди пациентов с частичными или полными протезами, и может привести к тенденции проглатывать более крупные частицы пищи, что может увеличить риск удушья или аспирации.
Обвисание нижней части лица и губ, вызванное снижением тонуса околоротовых мышц и, у беззубых людей, снижением опоры костей, является эстетической проблемой и может привести к слюнотечению, проливанию пищи и жидкостей и затрудненному закрытию губ во время еды, сна, или отдыхает. Сиалорея (подтекание слюны) часто является первым симптомом.
Усиливаются затруднения глотания. Перемещение пищи изо рта в ротоглотку занимает больше времени, что увеличивает вероятность аспирации.
После возрастных изменений наиболее частыми причинами моторных расстройств полости рта являются нервно-мышечные расстройства (например, черепные невропатии, вызванные диабетом, инсультом, болезнью Паркинсона, боковым амиотрофическим склерозом, рассеянным склерозом). Ятрогенные причины также вносят свой вклад. Лекарства (например, холинолитики, диуретики), лучевая терапия головы и шеи и химиотерапия могут значительно ухудшить выработку слюны. Гипосаливация — основная причина задержки и нарушения глотания.
Дисфункция оральной моторики лучше всего лечится с помощью междисциплинарного подхода. Могут потребоваться согласованные направления к специалистам в области ортопедической стоматологии, реабилитационной медицины, патологии речи, отоларингологии и гастроэнтерологии.
Дисфагия у пожилых людей — Гастроэнтерология и гепатология
Дисфагия у пожилых людейМухаммад Аслам, доктор медицины, и Майкл Ф. Ваези, доктор медицины, доктор философии, магистр наук (Эпи)
Д-р Аслам — доцент-исследователь, а д-р Ваези — профессор медицины в отделении гастроэнтерологии, гепатологии и питания в Медицинском центре Университета Вандербильта в Нэшвилле, штат Теннесси.
Слово дисфагия, происходящее от греческих слов dys (трудность) и phagia (есть), относится к ощущению задержки или затруднения прохождения пищи изо рта в желудок. Анатомически дисфагию можно классифицировать как ротоглоточную или пищеводную. Орофарингеальная или переносящаяся дисфагия связана с началом глотания (т. Е. Движением пищевого комка от гортани к пищеводу). Дисфагия пищевода возникает в теле пищевода и связана с затруднением прохождения пищи в желудок.Дисфагия может быть результатом механической обструкции или нарушения двигательной функции в области прохождения пищи.
Пожилые люди подвержены повышенному риску развития дисфагии из-за болезней, влияющих на механизм глотания. Чтобы лучше обслуживать эту уязвимую группу пациентов, медицинские работники должны узнать о наличии дисфагии и иметь практические знания о ее патофизиологии. В этом обзоре рассматриваются несколько часто встречающихся вопросов об уходе за пожилыми людьми с дисфагией, включая обсуждение механизмов, имеющих решающее значение для нормального глотания, и того, как на них может повлиять процесс старения.
Насколько распространена дисфагия среди пожилых людей?
Истинная распространенность дисфагии выше среди пожилых людей, чем среди населения в целом. Хотя распространенность дисфагии среди населения Среднего Запада США составляет от 6% до 9%, 1 ее распространенность среди людей старше 50 лет, проживающих в общинах, оценивается в пределах от 15% до 22% .2-4 Распространенность дисфагии еще выше среди тех, кто проживает в домах престарелых и домах престарелых, где, как сообщается, от 40% до 60% жителей испытывают трудности с кормлением.4,5 Независимо от возраста дисфагия обычно связана с определенными заболеваниями, такими как нарушения мозгового кровообращения, боковой амиотрофический склероз, болезнь Паркинсона (БП), миастения и поздняя дискинезия, распространенность которых увеличивается с возрастом. Ожидается, что в ближайшем будущем распространенность дисфагии быстро возрастет с учетом демографических тенденций в Соединенных Штатах. Согласно данным, опубликованным Бюро переписи населения США, с января 2000 года по июль 2009 года общая численность населения США увеличилась на 9%, количество людей в возрасте 65 лет и старше увеличилось на 13%, а количество людей в возрасте 85 лет и старше. увеличился на 32%.В течение следующих 18 лет из-за старения населения бэби-бумеров ежедневно пожилыми людьми будут становиться еще 10 000 американцев. Ожидается, что к 2030 году каждый пятый житель США будет в возрасте 65 лет и старше6. В связи с быстрым ростом стареющего населения неудивительно, что дисфагия все чаще признается важной проблемой национального здравоохранения, которая связана с огромным количеством людей. Стоимость.
Что такое физиология нормального глотания?
Глотание представляет собой функцию, в которой задействовано более 30 нервов и мышц.7 Подготовка болюса и переход из полости рта в пищевод являются произвольными, в то время как дальнейшее прохождение через воздушно-пищеварительный тракт в желудок является рефлекторным. После начала глотания болюсу требуется менее 1 секунды для достижения пищевода2 и еще 10–15 секунд для завершения глотания. В среднем человек без особых усилий выполняет около 600 глотков в день. Центры глотания двусторонне представлены в центральной нервной системе, и степень представительства каждого полушария, по-видимому, имеет решающее значение для определения восстановления глотательной функции после дисфагического инсульта.8
Глотание условно описывается как 3 анатомические фазы: оральная, глоточная и пищеводная (рис. 1). Оральная фаза — это волевой компонент глотательной активности, который готовит и продвигает пищу в глотку и включает использование V черепных нервов (тройничный), VII (лицевой) и XII (подъязычный). Глоточная фаза глотания включает герметизацию дыхательных путей и проекцию болюса в пищевод. Этот механизм опосредуется рефлекторно и включает V черепные нервы (тройничный), X (блуждающий), XI (добавочный) и XII (подъязычный).Фаза пищевода дополнительно продвигает болюс в желудок за счет скоординированной перистальтики пищевода и расслабления нижнего сфинктера пищевода. Основные особенности нормального механизма глотания показаны на рисунке 1.
Как старение влияет на механизм глотания?
Нормальное старение связано с церебральной атрофией, ухудшением функции нервов и регионозависимым снижением мышечной массы 9, что может отрицательно повлиять на функцию глотания.10,11 Кроме того, влияние возраста на временную эволюцию изометрического давления и давления при глотании, кажется, со временем прогрессирует.12-15 Таким образом, многие бессимптомные пожилые люди — 84% в одном отчете — демонстрируют видеофлюороскопические изменения в глотании глотки по сравнению с тем, что есть. считается нормальным для здоровых молодых людей.16 Однако у здоровых пожилых людей влияние старения на глотание остается компенсированным, не достигая симптоматического уровня. Несмотря на рентгенологически подтвержденное удлинение фаз орального14 и глоточного12, координация моторных явлений, измеренных манометрически, практически не затрагивается, если вообще отсутствует, 14,17 и глотание глотки остается удивительно устойчивым у здоровых пожилых людей, о чем свидетельствует относительное сохранение болюсного клиренса.18 Следовательно, несмотря на физиологические изменения в механизме глотания из-за старения, дисфагию нельзя приписывать только нормальному старению, и ее наличие предполагает необходимость исследования для выявления потенциально излечимых причин.
Каковы общие причины дисфагии у пожилых людей?
Различные заболевания, связанные с дисфункцией ротоглотки (таблица 1) или пищевода (таблица 2), могут вызывать дисфагию у пожилых людей. Орофарингеальная дисфагия у пожилых людей чаще всего вызывается инсультом и встречается у одной трети всех пациентов с инсультом.19-21 Дисфагия пищевода может быть результатом ряда моторных или механических причин (Таблица 2 и Рисунок 2). У некоторых пациентов причину установить невозможно, и такие случаи классифицируются как функциональная дисфагия22
Несмотря на различную этиологию дисфагии, механически нарушение глотания вызвано либо нарушением моторики, либо вторжением изнутри или снаружи (механическая дисфагия) в ротоглоточно-пищеводный болюсный канал. Выявление различий между моторной и механической или ротоглоточной и пищеводной дисфагией важно не только с точки зрения этиологии, но и является ключевым моментом в лечении.
Каковы важные диагностические подсказки?
Оценка и лечение дисфагии — многогранная задача и часто требует междисциплинарного подхода. Важные начальные шаги включают подтверждение наличия дисфункции глотания; определение его анатомического уровня (ротоглоточный против пищеводного), его механизма (моторный против механического) и лежащей в основе конкретной этиологии; и установление целостности ротоглоточного глотания и степени риска или наличия скрытой или явной аспирации.Последующая оценка должна определить способности и нарушения пациента, а также степень, в которой эти нарушения могут быть улучшены.
Тщательный анамнез остается краеугольным камнем любой оценки дисфагии23, а тщательный анализ симптомов может отличить пищеводную дисфагию от ротоглоточной дисфагии24 и предсказать конкретную причину дисфагии с точностью примерно 80%, подтвержденной специфическим тестированием.25,26 Как пациент описывает его или ее затруднение и время, связанные с ним симптомы и другие характеристики (Таблица 3), которые могут конкретно обозначать анатомический уровень глотательной дисфункции.Хотя симптомы хронической изжоги, гематемезиса, рвоты из кофейной гущи и анемии у пациента с дисфагией указывают на наличие осложнений гастроэзофагеальной рефлюксной болезни (ГЭРБ), таких как эрозивный эзофагит, пептическая стриктура и аденокарцинома пищевода, ни наличие, ни отсутствие Признака изжоги имеет важное диагностическое значение. По крайней мере, у одной трети пациентов с аденокарциномой пищевода27 и примерно у одной четверти пациентов с пептической стриктурой28 до постановки диагноза не было изжоги.С другой стороны, более 40% пациентов с ахалазия имеют историю изжоги, хотя его причина остается controversial.29
Какие лекарства могут влиять на функцию глотания у пожилых людей?
Лекарства могут влиять на функцию глотания тремя основными путями.30 Ряд часто используемых лекарств посредством фармакологического воздействия на центральную нервную систему, нервно-мышечной передачи или миотоксических эффектов могут подавлять функцию гладких и поперечно-полосатых мышц, затрудняя глотание и транзит болюса. и снижение тонуса нижнего сфинктера пищевода.Оба механизма могут увеличивать частоту и тяжесть ГЭРБ и пептической стриктуры. Кроме того, ксеростомия, связанная с приемом лекарств, может влиять на способность пережевывать пищу, инициировать глотание, а также формировать и транспортировать болюс. Кроме того, существует повышенный риск инфекций ротовой полости, и пациенты могут испытывать трудности с сохранением зубных протезов.31
Дисфагия также может быть результатом побочного действия или осложнения приема лекарств. Хорошо известно, что химиотерапия, иммуносупрессия и длительная терапия антибиотиками облегчают условно-патогенные инфекции пищевода и образование стриктур.Сульфасодержащие препараты также связаны с системными аллергическими осложнениями, такими как синдром Стивенса-Джонсона32, и могут поражать пищевую трубку.
Медикаментозное повреждение пищевода, обычно вызываемое местным раздражением слизистой оболочки пищевода и называемое таблетированным эзофагитом33-37, может привести к затруднениям глотания. В Соединенных Штатах таблеточный эзофагит в основном вызывается тетрациклинами, препаратами хлорида калия, нестероидными противовоспалительными препаратами, алендронатом и хинидином.38,39 Наиболее частым местом эзофагита, связанного с приемом таблеток, является уровень дуги аорты, область, характеризующаяся сдавлением дуги, переходом скелетных мышц в гладкие и физиологическим снижением амплитуды перистальтической волны пищевода (40). Риск развития таблеточного эзофагита увеличивается, если лекарства принимаются в положении лежа на спине и перед сном, 34 поскольку частота глотания и способность слюны разжижать лекарства в пищеводе во время сна уменьшаются.41,42 Другие факторы включают прием лекарств без достаточного количества воды / жидкости, полипрагмазию, размер и форму таблетки, 43 нарушения моторики пищевода или компрессию, 44-46 или защемление неподвижными структурами средостения и спаек после предшествующей операции на грудной клетке.
Пожилые пациенты особенно подвержены риску развития лекарственной дисфагии и таблеточного эзофагита, потому что они потребляют больше лекарств и с большей вероятностью имеют анатомические нарушения и нарушения моторики, увеличение сердца с сопутствующим сдавлением средней части пищевода и снижение выработки слюны.50,51 Таким образом, подробный обзор лекарств и времени их приема является важным компонентом оценки дисфагии.
Насколько важен медицинский осмотр?
Комплексное физикальное обследование должно быть частью первоначальной оценки всех пациентов с дисфагией.52,53 Информация о речи и когнитивных способностях пациента, поведенческой дисфункции, силе и диапазоне движений мышц, участвующих в речи и глотании, напрямую влияет на решения о пригодность пациента к терапии глотания и выбранный вид терапии.54,55
Обследование полости рта, головы и шеи может выявить плохой зубной ряд, новообразования, лимфаденопатию, зоб, глоточный мешок, признаки тиреотоксикоза (тиреотоксической миопатии) 56 или признаки предшествующей операции, трахеостомии и лучевой терапии. Диффузные эрозии зубов могут указывать на ГЭРБ. Пальпируемый надключичный (Вирхов) лимфатический узел может указывать на дисфагию, вызванную злокачественным новообразованием брюшной полости (например, аденокарциномой пищеводно-желудочного перехода). Можно проверить подъем по гортани, слегка приложив указательный и средний пальцы к подъязычной и гортанной хрящам, соответственно, и попросив пациента сглотнуть.Уменьшение подъема гортани часто наблюдается при неврологической дисфагии. Физические особенности коллаген-сосудистых заболеваний, если они присутствуют, могут служить дополнительным доказательством дисфункции пищевода.
Неврологическое обследование является обязательным для оценки каждого случая дисфагии неизвестной причины и должно включать тестирование всех черепных нервов, особенно сенсорных (черепные нервы V, IX и X) и двигательных (черепные нервы V, VII, X, XI, и XII) компоненты, участвующие в глотании. Наличие тремора, зубчатого движения, ригидности и нарушений походки может указывать на БП, которая тесно связана с дисфагией.57,58 Сочетание моторных и сенсорных аномалий, особенно при более длительной продолжительности заболевания и значительных моторных аномалиях, может указывать на рассеянный склероз. 59 Слабость проксимальных мышц может быть следствием дерматомиозита или полимиозита. Миастения часто ассоциируется (до 70% случаев) со слабостью лица и глотки, а дисфагия наблюдается примерно у 30% больных миастенией60-62
Какова роль лабораторной оценки?
В большинстве случаев основная причина дисфагии легко очевидна после получения истории болезни пациента и проведения физического обследования.Лабораторные измерения могут быть полезны для подтверждения предварительного диагноза дисфагии или для выявления миастении, воспалительных миопатий или токсических миопатий (например, тиреотоксической или микседематозной миопатии). Серологическое обнаружение антител к рецепторам ацетилхолина (AChR) фактически является диагностикой миастении. Однако антитела к AChR отсутствуют примерно у половины больных миастенией без типичных глазных симптомов. В таких случаях можно использовать тест стимуляции тензилоном (эдрофониумом). В качестве альтернативы диагноз может быть поставлен с помощью повторяющейся нервной стимуляции или электромиографии одного волокна.63,64 Исследования мышечных ферментов, которые измеряют, например, креатининфосфокиназу в сыворотке или наличие антинуклеарных антител, могут быть полезны в диагностике воспалительных миопатий. Игольчатая электромиография полезна для дифференциации воспалительных миозитов от нейрогенных заболеваний, но не является абсолютно специфичной.65 Для окончательного диагноза миозита и дифференциации дерматомиозита, полимиозита и миозита с тельцами включения может потребоваться биопсия мышц.66 Функциональные тесты щитовидной железы помогают при диагностика микседемы и тиреотоксикоза.Тиреотоксикоз является обратимой причиной дисфагии и всегда должен учитываться при дифференциальной диагностике, особенно у пожилых пациентов, у которых обычно отсутствуют более классические признаки тиреотоксикоза.67
Какие тесты следует выполнить?
В настоящее время используются пять основных тестов для оценки и количественной оценки дисфункции глотания: рентгенография с барием, видеофлюороскопическое исследование глотания (VFSS; модифицированное глотание с барием), фибро-эндоскопическая оценка глотания (FEES), верхняя эндоскопия и манометрия пищевода.Эти инструменты предназначены для получения объективных измерений времени, давления 68-71, диапазона 72,73, 74-76 и силы 77,78 движений глотательного аппарата, потока болюса и зазора79-82; sensation83-85; и защита дыхательных путей наряду с риском или наличием аспирации.63
VFSS, часто называемый модифицированным глотанием бария, остается наиболее часто используемым начальным исследованием для оценки ротоглоточной дисфагии.54,86 Это исследование очень чувствительно и может служить руководством для большинства этих пациентов, поскольку оно предоставляет важную информацию обо всех 4 категориях. дисфункции ротоглоточного глотания: неспособность или чрезмерная задержка начала глотания, аспирация глотания, носоглоточная регургитация и остатки глотания в полости глотки после глотания.Впервые представленный в 1988 г., FEES превратился в быстрый, действенный, безопасный, недорогой и точный прикроватный метод для оценки дисфагии во всех возрастных группах и во всех условиях, включая дома престарелых и учреждения длительного ухода 87–89. На основании результатов волоконно-оптической эндоскопии у пациентов с острым инсультом были разработаны различные шкалы тяжести дисфагии, чтобы помочь предсказать исход и интеркуррентные осложнения.90 Несмотря на разногласия относительно их соответствующих сильных сторон и ограничений, 91-93 эти 2 метода, по-видимому, дополняют друг друга, а не заменяют каждый Другие.При появлении клинического подозрения на механическую орофарингеальную дисфагию в первую очередь следует использовать VFSS, поскольку она может предоставить анатомическую дорожную карту для последующих FEES.
В большинстве случаев дисфагии пищевода диагноз устанавливается на основании тщательного анамнеза и эндоскопии. Мнения экспертов разделились относительно того, следует ли проводить эндоскопию или исследование с барием в качестве первоначальной оценки у пациентов с подозрением на дисфагию пищевода (рис. 3). Эндоскопия практически всегда необходима при оценке дисфагии пищевода, позволяет отобрать образцы тканей и, во многих случаях, является терапевтической, избавляя от необходимости дальнейшего обследования.Учитывая это преимущество, большинство американских клиницистов используют эндоскопию в качестве первоначального диагностического исследования.94 В случаях, когда клинический сценарий предполагает проксимальное поражение пищевода (например, предшествующая операция на шее или лучевая терапия или наличие дивертикула Ценкера), сложная стриктура ( проглатывание каустика или облучение) или ахалазии, проглатывание бария может быть более чувствительным и безопасным исследованием перед попыткой эндоскопии.95 Чувствительность исследования с барием для выявления структурных и функциональных повреждений может быть дополнительно повышена с помощью маневра Вальсальвы или проглатывания твердый болюс, например зефир.96
Первичное проглатывание бария представляет собой «дорожную карту» для последующей эндоскопии в подгруппе пациентов с подозрением на сложное строгание. В других случаях целесообразно перейти непосредственно к эндоскопии.97 Эндоскопия остается первым исследованием выбора для оценки случаев одинофагии, поскольку она позволяет получить образцы ткани, необходимые для дифференциации неопластических поражений пищевода от инфекционного, вызванного таблетками или пептического эзофагита.98 У пожилого пациента с дисфагией и потерей веса эндоскопическая оценка становится первостепенной, потому что злокачественность является высоким показателем дифференциального диагноза.
Манометрия пищевода является золотым стандартом для оценки моторной дисфункции пищевода и полезна для постановки диагноза ахалазии и ее вариантов, диффузного спазма пищевода и неэффективного нарушения моторики пищевода, а также для выявления гипомоторности пищевода, связанной со склеродермией и другими заболеваниями коллагеновых сосудов. .99-101 Манометрия пищевода также показана пациентам с недиагностическим проглатыванием бария и / или верхней эндоскопией, и в 90% таких случаев сообщалось о нарушениях моторики пищевода.102
Как следует лечить орофарингеальную дисфагию у пожилых пациентов?
VFSS или FEES могут легко идентифицировать стриктуры глотки или перстно-глотки, новообразования ротоглотки, задние дивертикулы подглотки (Ценкера) и шейные перепонки. Эти механические аномалии могут потребовать хирургического вмешательства, дилатации, химиотерапии, лучевой терапии или комбинации этих методов. Расширение пищевода обычно безопасно и эффективно в 75% случаев доброкачественных стриктур или перепонок.103 Дилатация или перстно-глоточная миотомия (открытая или эндоскопическая с дивертикулэктомией связанного дивертикула Ценкера или без нее) может быть полезной у 98% пациентов с дисфункцией верхнего сфинктера пищевода. 104-106 Другие структурные аномалии включают перстно-глоточные стержни, шейные остеофиты или скелетные гиперостозы. боковые дивертикулы глотки также могут быть часто обнаружены при оценке глотания. Однако эти аномалии менее убедительно связаны с ротоглоточной дисфагией.
крикофарингеальные баре находятся в 5% до 19% пациентов, перенесших videofluoroscopy и спорно связаны с дисфагией. Они встречаются с одинаковой частотой у людей, не страдающих дисфагией, 107 и у подавляющего большинства пациентов с дисфагией они сопровождаются другими патологиями пищевода, которые могут спровоцировать дисфагию.108 Однако крикофарингеальные перемычки были связаны с дисфункцией верхнего сфинктера пищевода, 109,110 и в некоторых случаях , миотомия перстно-глотки может облегчить дисфагию.111 Таким образом, учитывая противоречивые отчеты, патофизиологическое значение крикофарингеальных перемычек и решение о лечении должны определяться конкретными клиническими сценариями. Шейки остеофиты также общие случайные находки замеченные в 6% до 30% пожилых пациентов с дисфагией, 112, но только 0,7% пациентов с цервикальной болезни диска отчет dysphagia.113 хирургии для шейки остеофитов является спорным, 114 связаны с осложнениями, 115 и должен быть зарезервировано для тяжелых случаев дисфагии, которые не прошли консервативное лечение.116 Боковые глоточные дивертикулов находятся в до 50% от бессимптомного patients.117 Несмотря на отдельных сообщения о успешном хирургическом лигировании, 118 ассоциации с дисфагией controversial.117
При тиреотоксикозе сообщалось о разрешении дисфункции глотки с возвратом к эутиреоидному состоянию.56 Аналогичным образом, иммуносупрессивная терапия воспалительных миопатий связана с улучшением функции глотания. представляет собой серьезную проблему для большинства пациентов.В этой группе тяжесть дисфункции глотания не связана с тяжестью основного заболевания, и специфическая медикаментозная терапия предсказуемо не помогла дисфункции глотания.
Пациенты с БП часто жалуются на затруднения глотания (от 18,5% до 100%). 121-123 Кроме того, более 50% пациентов, которые не сообщают о нарушениях глотания, имели нарушение глотания при объективной оценке, 124 и риск беззвучной аспирации повышен. вызывает серьезное беспокойство у этих пациентов.125,126 Патофизиология дисфагии в этой группе пациентов еще не ясна, но, по-видимому, включает недопаминергический путь, 124,127, что может объяснить его относительную невосприимчивость к антипаркинсонической лекарственной терапии.128
Диагноз миастения всегда требует специального лечения, поиска тимомы и всех мер предосторожности для предотвращения миастенического криза. Однако, как и при БП, улучшение глотательной дисфункции менее удовлетворительно, чем при других проявлениях болезни. В недавнем отчете указывается, что тест FEES-Tensilon может быть подходящим инструментом в диагностике и терапии миастении со слабостью глоточных мышц.129 Однако эти результаты требуют подтверждения с помощью крупных исследований.
В чем ценность реабилитации глотания у пожилых людей?
Большинству пожилых пациентов с нейрогенной дисфагией требуется глотательная терапия. Во время тренировки глотания часто пробуют 2 параллельных курса, в которых пациент: 1.) ешьте некоторые продукты орально, предотвращая аспирацию с помощью компенсационных приемов позы, сенсорных стимулов, произвольных маневров глотания и диетических изменений и 2.) упражнения для наращивания силы. и координация для восстановления полной функции глотания без компенсации.Эффективность различных компенсаторных техник для конкретного пациента можно оценить во время инструментальной оценки. Однако имеется мало данных о долгосрочной эффективности различных протоколов лечения с точки зрения оптимальной частоты и продолжительности лечения.
В настоящее время для компенсации глотания используются пять техник позы (опускание подбородка, подтягивание вверх, поворот головы, наклон головы и лежание) и несколько комбинаций позы, которые, как сообщается, эффективны в нескольких популяциях.130 Каждая поза имеет определенный эффект с точки зрения потока пищи и взаимоотношений ротоглоточных структур и может обеспечить оптимальную компенсацию у пациентов с определенными дефектами ротоглоточного глотания. Например, поза с опущенным подбородком хорошо подходит пациентам с заболеванием основания языка, а поза лежа полезна пациентам с двусторонним повреждением глотки или пониженным возвышением гортани. Химическая, термическая и тактильная стимуляция путем изменения вкуса, объема, температуры и газирования пищи (болюс) и даже дополнительного давления на язык ложкой при подаче пищи эффективно используются для модуляции поведения человека при глотании.131,132 Недавно было показано, что вкусовые стимулы, 133 тактильная тепловая стимуляция полости рта, 134 и электрическая стимуляция глотки135 модулируют двигательные пути глотания, корковое представление глотания и обратную неспособность глотать. Подобно постуральной технике, эффективность сенсорных стимулов можно оценить во время инструментальной оценки. Некоторые приемы глотания, такие как надгортанный, суперсупраглотический, глотание с усилием и маневр Мендельсона, использовались нормальными субъектами и пациентами с дисфагией для компенсации глоточного глотания и используются для реабилитации глотания.136-138 Все эти произвольные маневры приводят к специфическим изменениям глоточного глотания, но в нескольких исследованиях изучались оптимальные протоколы лечения различных типов пациентов с дисфагией с точки зрения частоты и продолжительности лечения. Для предотвращения аспирации жидкости у пациентов с ротоглоточной дисфагией обычно используются изменения в рационе, особенно жидкие сгущенные диеты.139 Однако результаты недавнего клинического исследования показывают, что сгущение жидкостей до различной вязкости может не обеспечить большей безопасности.140
Несколько упражнений на диапазон движений используются для ускорения глотания. Однако эффективность проявляется не сразу. Каждая программа упражнений ориентирована на определенный компонент ротоглоточного глотания, и ее эффективность занимает несколько недель (от 1 до 6). Например, упражнения по укреплению языка нацелены на сокращение времени прохождения через рот и глотку и, как сообщается, полезны для пациентов с дисфагией, перенесших инсульт141, и пациентов, которые лечились от рака головы и шеи.142 Аналогичным образом, упражнения с шейкер нацелены на улучшение движений в гипофаринге и раскрытия верхнего пищеводного сфинктера, и в небольшом, но мультиинституциональном рандомизированном исследовании сообщалось об их эффективности в предотвращении аспирации.143 Однако необходимы дальнейшие исследования для выявления подгрупп пациентов с дисфагией. кому наиболее полезны различные упражнения.144
Заключение
Таким образом, дисфагия у пожилых людей все чаще признается важной проблемой национального здравоохранения, требующей огромных затрат.Старение может отрицательно повлиять на все компоненты функции глотания. Пожилые люди подвержены повышенному риску развития дисфагии, поскольку заболевания, влияющие на механизм глотания, чаще встречаются в их группе населения. Оценка и лечение дисфагии обычно проводятся мультидисциплинарной командой и основываются на тщательном анамнезе, дифференциации ротоглоточной дисфагии от дисфагии пищевода и моторной дисфагии от механической дисфагии, выявлении основной причины, установлении степени риска или наличия скрытой или явной аспирации и определение способностей и нарушений пациента, а также степени их улучшения.Нет стандартных алгоритмических
подходов к ведению пожилых пациентов с дисфагией; скорее, цели и планы индивидуализируются в соответствии с конкретными клиническими сценариями. Большинство пациентов с ротоглоточной дисфагией получат пользу от программы реабилитации глотания, даже если основная патология не поддается лечению. Врачам следует узнать о дисфагии у своих пожилых пациентов и повысить осведомленность о диагнозах, изменяющих жизнь, и терапии, направленной на заболевание, с целью улучшения симптомов пациентов и качества жизни.
Авторы не сообщают о конфликте интересов.
Список литературы1. Талли Н.Дж., Уивер А.Л., Зинсмайстер А.Р., Мелтон Л.Дж. III. Возникновение и исчезновение желудочно-кишечных симптомов и функциональных желудочно-кишечных расстройств. Am J Epidemiol . 1992; 136 (2): 165-177.
2. Cook IJ, Kahrilas PJ. Технический обзор AGA по ведению ротоглоточной дисфагии. Гастроэнтерология . 1999; 116 (2): 455-478.
3.Линдгрен С., Янзон Л. Распространенность жалоб на глотание и клинические данные среди мужчин и женщин в возрасте 50-79 лет среди городского населения. Дисфагия . 1991; 6 (4): 187-192.
4. Барци С.Р., Салливан П.А., Роббинс Дж. Чем должно отличаться лечение дисфагии у пожилых людей? Установление оптимальных схем практики. Semin Speech Lang . 2000; 21 (4): 347-361.
5. Siebens H, Trupe E, Siebens A, et al. Корреляты и последствия пищевой зависимости у пожилых людей в специализированных учреждениях. Дж. Ам Гериатр Соц . 1986; 34 (3): 192-198.
6. Следующие четыре десятилетия, старшее население США: с 2010 по 2050 год. Бюро переписи населения США. http://www.census.gov/prod/2010pubs/p25-1138. pdf. По состоянию на 28 октября 2013 г.
7. Джонс Б., изд. Нормальное и аномальное глотание: визуализация в диагностике и терапии. 2-е изд. Нью-Йорк, штат Нью-Йорк: Спрингер-Верлаг; 2003.
8. Hamdy S, Aziz Q, Rothwell JC и др. Восстановление глотания после дисфагического инсульта связано с функциональной перестройкой неповрежденной моторной коры. Гастроэнтерология . 1998; 115 (5): 1104-1112.
9. Masoro EJ. Биология старения. Текущее состояние знаний. Arch Intern Med . 1987; 147 (1): 166-169.
10. Шейкер Р., Персонал Д. Расстройства пищевода у пожилых людей. Гастроэнтерол Clin North Am . 2001; 30 (2): 335-361, vii-viii.
11. Гумберт И.А., Роббинс Дж. Дисфагия у пожилых людей. Phys Med Rehabil Clin N Am . 2008; 19 (4): 853-866, ix-x.
12. Роббинс Дж., Гамильтон Дж. В., Лоф Г.Л., Кемпстер, Великобритания.Глотание через ротоглотку у здоровых взрослых людей разного возраста. Гастроэнтерология . 1992; 103 (3): 823-829.
13. Nicosia MA, Hind JA, Roecker EB, et al. Возрастное влияние на временную эволюцию изометрического давления и давления при глотании. J Gerontol A Biol Sci Med Sci . 2000; 55 (11): M634-M640.
14. Шоу Д., Кук И., Габб М. и др. Влияние нормального старения на функцию орально-глоточного и верхнего сфинктера пищевода во время глотания. Am J Physiol. 1995; 268: G389-G396.
15. Роббинс Дж., Левин Р., Вуд Дж., Рокер Э. Б., Лушей Э. Влияние возраста на формирование языкового давления как фактор риска дисфагии. J Gerontol A Biol Sci Med Sci . 1995; 50 (5): M257-M262.
16. Ekberg O, Feinberg MJ. Нарушение глотательной функции у пожилых пациентов без дисфагии: рентгенологические данные в 56 случаях. AJR Am J Roentgenol . 1991; 156 (6): 1181-1184.
17. Уилсон Дж. А., Прайд А., Макинтайр СС, Маран А. Г., Заголовок RC. Влияние возраста, пола и курения на нормальную моторику глотки и пищевода. Ам Дж. Гастроэнтерол . 1990; 85 (6): 686-691.
18. Cook I, Weltman M, Wallace K, et al. Влияние старения на орально-глоточный болюсный транзит и клиренс во время глотания: сцинтиграфическое исследование. Am J Physiol . 1994; 266: G972-G977.
19. Хорнер Дж., Мэсси Е.В., Риски Дж. Э., Латроп Д.Л., Чейз К.Н. Аспирация после инсульта: клинические корреляты и исход. Неврология . 1988; 38 (9): 1359-1362.
20. Э. Янг, Дюрант-Джонс Л. Разработка программы дисфагии в больнице неотложной помощи: оценка потребностей. Дисфагия . 1990; 5 (3): 159-165.
21. Гордон С., Хевер Р.Л., Уэйд Д.Т. Дисфагия при остром инсульте. Br Med J (Clin Res Ed) . 1987; 295 (6595): 411-414.
22. Дроссман Д., изд. Rome III: Th e Функциональные желудочно-кишечные расстройства . 3-е изд. Маклин, Вирджиния: Дегнон Ассошиэйтс, Инк; 2006.
23. Trate DM, Parkman HP, Fisher RS. Дисфагия. Оценка, диагностика и лечение. Prim Care . 1996; 23 (3): 417-432.
24.Ротштейн RD. Системный подход к пациенту с дисфагией. Госпиталь (1995) . 1997; 32 (3): 169-175.
25. Кастелл Д.О., Доннер М.В. Оценка дисфагии: тщательный сбор анамнеза имеет решающее значение. Дисфагия . 1987; 2 (2): 65-71.
26. Барлоун Т.Дж., Бергус Г.Р., Лу СС. Диагностическая визуализация при оценке дисфагии. Am Fam Врач . 1996; 53 (2): 535-546.
27. Лагергрен Дж., Бергстрём Р., Линдгрен А., Нирен О. Симптоматический гастроэзофагеальный рефлюкс как фактор риска аденокарциномы пищевода. N Engl J Med . 1999; 340 (11): 825-831.
28. Найяр А.К., Ройстон С., Бардхан К.Д. Кислотно-пептические стриктуры пищевода в эпоху антагонистов гистаминовых рецепторов h3 и ингибиторов протонной помпы. Dig Liver Dis . 2003; 35 (3): 143-150.
29. Spechler SJ, Соуза РФ, Розенберг SJ, Рубен Р.А., Гоял РК. Изжога у больных ахалазией. Кишечник . 1995; 37 (3): 305-308.
30. Американская ассоциация речи, языка и слуха. Руководство для речевых патологов, выполняющих видеофлюороскопические исследования глотания. ASLHA Дополнение . 2004; 24: 77-92.
31. Loesche WJ, Bromberg J, Terpenning MS, et al. Ксеростомия, ксерогенные препараты и отказ от пищевых продуктов в отдельных гериатрических группах. Дж. Ам Гериатр Соц . 1995; 43 (4): 401-407.
32. Stein MR, Thompson CK Jr, Sawicki JE, Martel AJ. Стриктура пищевода, осложняющая синдром Стивенса-Джонсона. Отчет о болезни. Ам Дж. Гастроэнтерол . 1974; 62 (5): 435-439.
33. Пембертон Дж. Обструкция пищевода и язвы, вызванные пероральной терапией калием. Br Сердце J . 1970; 32 (2): 267-268.
34. Кикендалл Дж. У., Фридман А. С., Оеволе М. А., Флейшер Д., Джонсон Л. Ф.. Травма пищевода, вызванная приемом таблеток. Отчеты о случаях заболевания и обзор медицинской литературы. Dig Dis Sci . 1983; 28 (2): 174-182.
35. Уолта Д. Ф., Гидденс Дж. Д., Джонсон Л. Ф., Келли Дж. Л., Во Д. Ф. Локализованный проксимальный эзофагит на фоне приема аскорбиновой кислоты и двигательного расстройства пищевода. Гастроэнтерология . 1976; 70 (5 п.1): 766-769.
36.Смит В. Связь приема аспирина с симптоматической грыжей пищеводного отверстия диафрагмы. South Med J. 1978; 71 (приложение 1): 45-47.
37. Иствуд Г. Л., Кастелл Д. О., Хиггс Р. Х. Экспериментальный эзофагит у кошек снижает давление нижнего сфинктера пищевода. Гастроэнтерология . 1975; 69 (1): 146-153.
38. Кикендалл Дж., Джонсон Л. Повреждение пищевода, вызванное таблетками. В: Кастелл Д.О., изд. Пищевод. 2-е изд. Бостон, Массачусетс: Литтл, Браун; 1995.
39. Колина Р. Э., Смит М., Кикендалл Дж. У., Вонг РК.Новая вероятная причина увеличения язв пищевода: алендронат. Ам Дж. Гастроэнтерол . 1997; 92 (4): 704-706.
40. Хамфрис Т.Дж., Кастелл Д.О. Профиль давления перистальтики пищевода у нормальных людей, измеренный прямыми внутрипищеводными датчиками. Am J Dig Dis . 1977; 22 (7): 641-645.
41. Эванс К.Т., Робертс Г.М. Куда деваются все планшеты? Ланцет . 1976; 2 (7997): 1237-1239.
42. Dent J, Dodds WJ, Friedman RH, et al. Механизм гастроэзофагеального рефлюкса у лежачих бессимптомных людей. Дж. Клин Инвест . 1980; 65 (2): 256-267.
43. Эй Х., Йоргенсен Ф., Соренсен К., Хассельбалх Х., Вамберг Т. Пищевой транзит шести обычно используемых таблеток и капсул. Br Med J (Clin Res Ed) . 1982; 285 (6356): 1717-1719.
44. McCall AJ. Письмо: Медленное изъязвление пищевода с аневризмой левого предсердия. BMJ . 1975; 3 (5977): 230-231.
45. Sumithran E, Lim KH, Chiam HL. Атрио-пищеводный свищ, осложняющий заболевание митрального клапана. BMJ . 1979; 2 (6204): 1552-1553.
46. Бохан Т.Д., Перро Дж., Фаулер Р.С. Эзофагит и обструкция пищевода от таблеток хинидина в сочетании с увеличением левого предсердия: отчет о клиническом случае. Aust Paediatr J . 1978; 14 (3): 191-192.
47. Уитни Б., Кроксон Р. Дисфагия, вызванная увеличением сердца. Клин Радиол . 1972; 23 (2): 147-152.
48. Boyce HW Jr. Дисфагия после операции на открытом сердце. Hosp Pract (Off Ed) . 1985; 20 (9): 40, 43, 47 пасс.
49. Теплик Ю.Г., Теплик С.К., Оминский С.Г., Хаскин М.Э. Эзофагит, вызванный пероральным приемом лекарств. Радиология . 1980; 134 (1): 23-25.
50. Stoschus B, Allescher HD. Дисфагия, вызванная лекарствами. Дисфагия . 1993; 8 (2): 154-159.
51. Мейсон Д., Чисхолм Д., ред. Слюнные железы в здоровье и болезнях. Филадельфия, Пенсильвания: У. Б. Сондерс; 1975.
52. Kahrilas PJ. Текущее исследование нарушений глотания. Байер Клин Гастроэнтерол .1994; 8 (4): 651-664.
53. Hendrix TR. Искусство и наука об анамнезе у пациента с затрудненным глотанием. Дисфагия . 1993; 8 (2): 69-73.
54. Logemann J, ed. Оценка и лечение нарушений глотания. Сан-Диего, Калифорния: Колледж-Хилл; 1983.
55. Байн Дж. Э., Фрэнк Е. М., МакДейд Х.Л. Дисфагия и деменция у пациентов с болезнью Паркинсона. Дисфагия . 1995; 10 (3): 160-164.
56. Брански Д., Леви Дж., Глобус М., Авиад I, Керен А., Човерс И.Дисфагия как первичное проявление гипертиреоза. Дж Клин Гастроэнтерол . 1984; 6 (5): 437-440.
57. Леопольд Н.А., Кагель М.С. Фаринго-пищеводная дисфагия при болезни Паркинсона. Дисфагия . 1997; 12 (1): 11-18, обсуждение 19-20.
58. Hartelius L, Svensson P. Симптомы речи и глотания, связанные с болезнью Паркинсона и рассеянным склерозом: обзор. Folia Phoniatr Logop . 1994; 46 (1): 9-17.
59. Пурджавад М., Дерахшандех Ф., Этемадифар М., Солеймани Б., Минагар А., Магзи А.Х.Орофарингеальная дисфагия при рассеянном склерозе. Мультисклер . 2010; 16 (3): 362-365.
60. Dumitru D, ed. Электродиагностическая медицина. Филадельфия, Пенсильвания: Хэнли и Белфус; 1995.
61. Оссерман К.Е., Генкинс Г. Исследования миастении гравис: обзор двадцатилетнего опыта у более чем 1200 пациентов. Гора Синай J Med . 1971; 38 (6): 497-537.
62. Хан О.А., Кэмпбелл WW. Миастения, проявляющаяся как дисфагия: клинические аспекты. Ам Дж. Гастроэнтерол .1994; 89 (7): 1083-1085.
63. Ньюсон-Дэвис Дж. Миастения и родственные синдромы. В: Уолтон Дж., Карпати Дж., Хилтон-Джонс Д., ред. Заболевания произвольной мышцы . Эдинбург: Черчилль Ливингстон; 1994.
64. Oh SJ, Kim DE, Kuruoglu R, Bradley RJ, Dwyer D. Диагностическая чувствительность лабораторных тестов при миастении. Мышечный нерв . 1992; 15 (6): 720-724.
65. Тиммс К.Э., Уэбб Дж. Дерматополимиозит и другие заболевания соединительной ткани: обзор 105 случаев. Дж Ревматол . 1985; 12 (6): 1140-1148.
66. Plotz PH, Dalakas M, Leff RL, Love LA, Miller FW, Cronin ME. Современные концепции идиопатических воспалительных миопатий: полимиозит, дерматомиозит и родственные заболевания. Энн Интерн Мед. . 1989; 111 (2): 143-157.
67. Sweatman MC, Chambers L. Нарушение моторики пищевода при тиреотоксической миопатии. Postgrad Med J . 1985; 61 (717): 619-620.
68. Cook IJ, Dodds WJ, Dantas RO, et al. Время проведения видеофлюороскопических, манометрических событий и транзита болюса во время оральной и глоточной фаз глотания. Дисфагия . 1989; 4 (1): 8-15.
69. Кендалл К.А., Маккензи С., Леонард Р.Дж., Гонсалвес М.И., Уокер А. Время событий при нормальном глотании: видеофлюороскопическое исследование. Дисфагия . 2000; 15 (2): 74-83.
70. Мартин-Харрис Б., Бродский М., Прайс С. и др. Временная координация глоточной и гортанной динамики с дыханием при глотании: глотание однократной жидкости. Журнал прикладной физики . 2003; 94 (5): 1735-1743.
71. Van Daele DJ, McCulloch TM, Palmer PM, Langmore SE.Сроки закрытия голосовой щели при глотании: комбинированный электромиографический и эндоскопический анализ. Энн Отол Ринол Ларингол . 2005; 114 (6): 478-487.
72. Castell JA, Castell DO, Schultz AR, Georgeson S. Влияние положения головы на динамику верхнего сфинктера пищевода и глотки. Дисфагия . 1993; 8 (1): 1-6.
73. Стил С.М., Хакаби М.Л. Влияние оролингвального давления на время наступления глоточного давления. Дисфагия .2007; 22 (1): 30-36.
74. Грин Дж. Р., Ван Ю. Т.. Модели движения поверхности языка во время речи и глотания. J Acoust Soc Am . 2003; 113 (5): 2820-2833.
75. Логеманн Дж.А., Паулоски Б.Р., Радемейкер А.В., Коланджело Л.А., Карилас П.Дж., Смит С.Х. Временные и биомеханические характеристики ротоглоточного глотания у мужчин более молодого и старшего возраста. J Speech Lang Hear Res . 2000; 43 (5): 1264-1274.
76. Логеманн Я.А., Паулоски Б.Р., Радемейкер А.В., Карилас П.Дж. Орофарингеальный глоток у молодых и пожилых женщин: видеофлюороскопический анализ. J Speech Lang Hear Res . 2002; 45 (3): 434-445.
77. Леонард Р., Белафски П.К., Рис С.Дж. Связь между рентгеноскопическими и манометрическими измерениями сужения глотки: коэффициент сужения глотки. Энн Отол Ринол Ларингол . 2006; 115 (12): 897-901.
78. Беркхед Л.М., Сапиенца С.М., Розенбек Дж.С. Силовые упражнения в реабилитации дисфагии: принципы, процедуры и направления будущих исследований. Дисфагия . 2007; 22 (3): 251-265.
79. Черенко Д., МакКоннел ФМ, Джексон РТ. Количественная оценка движущих сил глоточного болюса. Отоларингол Хирургия головы и шеи . 1989; 100 (1): 57-63.
80. Дэниэлс С.К., Шредер М.Ф., ДеДжордж П.К., Кори Д.М., Розенбек Дж.С. Влияние словесного сигнала на поток болюса при глотании. Am J Speech Lang Pathol . 2007; 16 (2): 140-147.
81. Джонссон Ф., Шоу Д., Габб М., Дент Дж., Кук И. Влияние силы тяжести и положения тела на нормальное глотание в ротоглотке. Am J Physiol . 1995; 269 (5 п.1): G653-G658.
82. Kahrilas PJ, Logemann JA, Lin S, Ergun GA. Клиренс глотки при глотании: комбинированное манометрическое и видеофлюороскопическое исследование. Гастроэнтерология . 1992; 103 (1): 128-136.
83. Авив Дж. Э., Мартин Дж. Х., Кин М. С., Дебелл М., Блитцер А. Количественная оценка надгортанного и глоточного ощущения с помощью воздушного импульса: новый метод. Энн Отол Ринол Ларингол . 1993; 102 (10): 777-780.
84. Leow LP, Huckabee ML, Sharma S, Tooley TP.Влияние вкуса на апноэ при глотании, время приготовления перорального приема, а также продолжительность и амплитуду сокращения субментальных мышц. Chem Senses . 2007; 32 (2): 119-128.
85. Pelletier CA, Dhanaraj GE. Влияние вкуса и вкусовых качеств на языковое давление при глотании. Дисфагия . 2006; 21 (2): 121-128.
86. Мартин-Харрис Б., Джонс Б. Видеоофлюорографическое исследование глотания. Phys Med Rehabil Clin N Am . 2008; 19 (4): 769-785, viii.
87.Варнеке Т., Тейсманн И., Оеленберг С. и др. Безопасность фибро-эндоскопической оценки глотания у пациентов с острым инсультом. Инсульт . 2009; 40 (2): 482-486.
88. Дзевас Р., Варнеке Т., Оленберг С. и др. К базовой эндоскопической оценке глотания при остром развитии инсульта и оценке простой балльной оценки дисфагии. Цереброваск Дис . 2008; 26 (1): 41-47.
89. Келли AM, Дриннан MJ, Лесли П. Оценка проникновения и аспирации: как сравнить видеофлюороскопию и фибро-эндоскопическую оценку глотания? Ларингоскоп .2007; 117 (10): 1723-1727.
90. Варнеке Т., Риттер М.А., Крогер Б. и др. Волоконно-оптическая шкала тяжести эндоскопической дисфагии позволяет прогнозировать исход острого инсульта. Цереброваск Дис . 2009; 28 (3): 283-289.
91. Langmore SE. Оценка ротоглоточной дисфагии: какой диагностический инструмент лучше? Curr Opin Otolaryngol Head Neck Surg . 2003; 11 (6): 485-489.
92. Логеманн Дж. А., Радемейкер А. В., Паулоски Б. Р., Омае Ю., Карилас П. Дж. Нормальная физиология глотания при видеофлюороскопии и видеоэндоскопии. Folia Phoniatr Logop . 1998; 50 (6): 311-319.
93. Aviv JE. Проспективное рандомизированное исследование результатов эндоскопии по сравнению с модифицированным глотанием бария у пациентов с дисфагией. Ларингоскоп . 2000; 110 (4): 563-574.
94. Либерман Д.А., Де Гармо П.Л., Флейшер Д.Е., Эйзен Г.М., Хельфанд М. Модели использования эндоскопии в США. Гастроэнтерология . 2000; 118 (3): 619-624.
95. Spechler SJ. Технический обзор AGA по лечению пациентов с дисфагией, вызванной доброкачественными нарушениями дистального отдела пищевода. Гастроэнтерология . 1999; 117 (1): 233-254.
96. Отт DJ, Келли Т.Ф., Чен М.Ю., Гельфанд Д.В., Ву WC. Использование болюса зефира для оценки колец слизистой оболочки нижнего отдела пищевода. Ам Дж. Гастроэнтерол . 1991; 86 (7): 817-820.
97. Varadarajulu S, Eloubeidi MA, Patel RS, et al. Выход и предикторы патологии пищевода, когда верхняя эндоскопия используется для начальной оценки дисфагии. Гастроинтест Endosc . 2005; 61 (7): 804-808.
98.Отт DJ. Радиографические методы и эффективность в оценке пищеводной дисфагии. Дисфагия . 1990; 5 (4): 192-203.
99. Kahrilas PJ, Clouse RE, Hogan WJ. Технический обзор Американской гастроэнтерологической ассоциации по клиническому использованию манометрии пищевода. Гастроэнтерология . 1994; 107 (6): 1865-1884.
100. Pandolfino JE, Kahrilas PJ; Американская гастроэнтерологическая ассоциация. Технический обзор AGA по клиническому использованию манометрии пищевода. Гастроэнтерология .2005; 128 (1): 209-224.
101. Spechler SJ, Castell DO. Классификация нарушений моторики пищевода. Кишечник . 2001; 49 (1): 145-151.
102. Гамбита П., Индриоло А., Гросу С., Пироне З, Коломбо П., Арчидиаконо Р. Роль манометрии пищевода в клинической практике. Пищевод Дис . 1999; 12 (1): 41-46.
103. Линдгрен С. Эндоскопическая дилатация и хирургическая миэктомия симптоматических шейных перепонок пищевода. Дисфагия . 1991; 6 (4): 235-238.
104. Шоу Д.В., Кук И.Дж., Джеймисон Г.Г., Габб М., Симула М.Э., Дент Дж. Влияние хирургического вмешательства на механику глотательного верхнего пищеводного сфинктера в дивертикуле Ценкера. Кишечник . 1996; 38 (6): 806-811.
105. Hatlebakk JG, Castell JA, Spiegel J, Paoletti V, Katz PO, Castell DO. Дилатационная терапия дисфагии у пациентов с дисфункцией верхнего сфинктера пищевода — манометрический и симптоматический ответ. Пищевод Дис . 1998; 11 (4): 254-259.
106. Мейсон Р.Дж., Бремнер К.Г., ДеМестер Т.Р. и др.Нарушения глотания глотки: выбор и исход после миотомии. Энн Сург . 1998; 228 (4): 598-608.
107. Curtis DJ, Cruess DF, Berg T. Крикофарингеальная мышца: обзор видеозаписи. AJR Am J Roentgenol . 1984; 142 (3): 497-500.
108. Джонс Б., Равич В.Дж., Доннер М.В., Крамер С.С., Хендрикс Т.Р. Фарингоэзофагеальные взаимоотношения: наблюдения и рабочие концепции. Гастроинтест Радиол . 1985; 10 (3): 225-233.
109. Сокол Е.М., Хейтманн П., Вольф Б.С., Коэн Б.Р.Одновременное кинорадиографическое и манометрическое исследование глотки, гипофаринкса и шейного отдела пищевода. Гастроэнтерология . 1966; 51 (6): 960-974.
110. Дантас Р.О., Кук И.Дж., Доддс В.Дж., Керн М.К., Ланг И.М., Брассер Дж. Биомеханика крикофарингеальных стержней. Гастроэнтерология . 1990; 99 (5): 1269-1274.
111. Круз Дж. П., Эдвардс Д. А., Смит Дж. Ф., Уилли Дж. Х. Патология крикофарингеальной дисфагии. Гистопатология . 1979; 3 (3): 223-232.
112.Saffouri MH, Ward PH. Хирургическая коррекция дисфагии по причине остеофитов шейки матки. Энн Отол Ринол Ларингол . 1974; 83 (1): 65-70.
113. Стюарт Д. Дисфагия, вызванная шейными остеофитами. Описание пяти пациентов и обзор литературы. Инт Ортоп . 1989; 13 (2): 95-99.
114. Кодама М., Савада Х., Удака Ф., Камеяма М., Кояма Т. Дисфагия, вызванная передним шейным остеофитом: клинический случай. Нейрорадиология . 1995; 37 (1): 58-59.
115. Валлийский LW, валлийский JJ, Chinnici JC. Дисфагия вследствие операции на шейном отделе позвоночника. Энн Отол Ринол Ларингол . 1987; 96 (1 п.1): 112-115.
116. Halama AR. Хирургическое лечение нарушений глотания ротоглотки. Acta Otorhinolaryngol Belg . 1994; 48 (2): 217-227.
117. Curtis DJ, Cruess DF, Crain M, Sivit C, Winters C. Jr, Dachman AH. Боковые выпадения глотки: сравнение пациентов с дисфагией и бессимптомным течением. Дисфагия .1988; 2 (3): 156-161.
118. Пейс-Бальзан А., Хабаши С.М., Нассар Вайоминг. Вид изнутри: рентгенологическое исследование в фокусе латерального дивертикула глотки. Дж Ларингол Отол . 1991; 105 (9): 793-795.
119. Wortmann RL. Воспалительные заболевания мышц и другие миопатии. В: Kelley WN, Harris ED, Ruddy S, Sledge CB, ред. Учебник ревматологии. 5 изд. Филадельфия, Пенсильвания: WB Saunders Co; 1997.
120. Dalakas MC. Полимиозит, дерматомиозит и миозит с тельцами включения. N Engl J Med . 1991; 325 (21): 1487-1498.
121. Baijens LW, Speyer R. Эффекты терапии дисфагии при болезни Паркинсона: систематический обзор. Дисфагия . 2009; 24 (1): 91-102.
122. Coates C, Bakheit AM. Дисфагия при болезни Паркинсона. евро Neurol . 1997; 38 (1): 49-52.
123. Johnston BT, Li Q, Castell JA, Castell DO. Глотание и функция пищевода при болезни Паркинсона. Ам Дж. Гастроэнтерол . 1995; 90 (10): 1741-1746.
124. Миллер Н., Ноубл Э., Джонс Д., Берн Д. Трудно глотать: дисфагия при болезни Паркинсона. Возраст . 2006; 35 (6): 614-618.
125. Nóbrega AC, Rodrigues B, Melo A. Тихая аспирация у пациентов с болезнью Паркинсона с суточной сиалореей. Clin Neurol Neurosurg . 2008; 110 (2): 117-119.
126. Тьяден К. Речь и глотание при болезни Паркинсона. Top Geriatr Rehabil . 2008; 24 (2): 115-126.
127. Али Г. Н., Уоллес К. Л., Шварц Р., ДеКарл Д. Д., Загами А. С., Кук И. Дж..Механизмы орально-глоточной дисфагии у пациентов с болезнью Паркинсона. Гастроэнтерология . 1996; 110 (2): 383-392.
128. Fuh JL, Lee RC, Wang SJ, et al. Затруднение глотания при болезни Паркинсона. Clin Neurol Neurosurg . 1997; 99 (2): 106-112.
129. Warnecke T., Teismann I., Zimmermann J, Oelenberg S, Ringelstein EB, Dziewas R. Фибероптическая эндоскопическая оценка глотания с одновременным применением Тенсилона в диагностике и терапии миастении. Дж Neurol . 2008; 255 (2): 224-230.
130. Logemann JA. Оценка и лечение нарушений глотания. 2-е изд. Остин, Техас: Издатели Pro-Ed; 1998.
131. Хэмди С., Джилани С., Прайс В., Паркер С., Холл Н., Пауэр М. Модуляция глотательного поведения человека с помощью термической и химической стимуляции в состоянии здоровья и после травмы головного мозга. Нейрогастроэнтерол Мотил . 2003; 15 (1): 69-77.
132. Lazzara G, Lazarus C, Logemann J. Влияние тепловой стимуляции на запуск глотательного рефлекса. Дисфагия . 1986; 1 (1): 73-77.
133. Mistry S, Rothwell JC, Thompson DG, Hamdy S. Модуляция моторных путей глотания коры головного мозга человека после приятных и отталкивающих вкусовых стимулов. Am J Physiol Gastrointest Liver Physiol . 2006; 291 (4): G666-G671.
134. Тейсманн И.К., Штайнстрэтер О., Варнеке Т. и др. Тактильная тепловая оральная стимуляция увеличивает корковое представление глотания. BMC Neurosci . 2009; 10 (1): 71.
135. Jayasekeran V, Singh S, Tyrrell P, et al.Дополнительная функциональная электрическая стимуляция глотки устраняет нарушение глотания после поражения головного мозга. Гастроэнтерология . 2010; 138 (5): 1737-1746, 1746.e2.
136. Kahrilas PJ, Logemann JA, Gibbons P. Прием пищи путем маневра; крайняя компенсация нарушения глотания. Дисфагия . 1992; 7 (3): 155-159.
137. Fujiu M, Logemann J, Pauloski B. Повышенное послеоперационное движение задней стенки глотки у пациентов с передним раком полости рта: предварительные результаты и возможные последствия для лечения. Am J Speech Lang Pathol . 1995; 4 (1): 24-30.
138. Fujiu M, Logemann J. Влияние маневра удержания языка на движение задней стенки глотки во время глотания. Am J Speech Lang Pathol . 1996; 5 (1): 23-30.
139. Groher ME, McKaig TN. Дисфагия и диетические уровни в учреждениях квалифицированного сестринского ухода. Дж. Ам Гериатр Соц . 1995; 43 (5): 528-532.
140. Логеманн Дж. А., Генслер Дж., Роббинс Дж. И др. Рандомизированное исследование трех вмешательств по аспирации жидких жидкостей у пациентов с деменцией или болезнью Паркинсона. J Speech Lang Hear Res . 2008; 51 (1): 173-183.
141. Роббинс Дж., Кейс С.А., Гангнон Р.Э. и др. Эффекты языковых упражнений у пациентов с инсультом и дисфагией. Arch Phys Med Rehabil . 2007; 88 (2): 150-158.
142. Lazarus C, Logemann JA, Pauloski BR, et al. Влияние лучевой терапии с химиотерапией или без нее на силу языка и глотание у пациентов с раком полости рта. Голова Шея . 2007; 29 (7): 632-637.
143. Логеманн JA, Rademaker A, Pauloski BR, et al.Рандомизированное исследование, сравнивающее упражнения Shaker с традиционной терапией: предварительное исследование. Дисфагия . 2009; 24 (4): 403-411.
144. Шейкер Р., Керн М., Бардан Э и др. Увеличение глотательного отверстия верхнего сфинктера пищевода у пожилых людей с помощью упражнений. Am J Physiol . 1997; 272 (6 пт 1): G1518-G1522.
Европейское общество расстройств глотания
Опрос ESSD, посвященный Всемирному дню глотания, 7–13 декабря 2020 г.
Европейское общество расстройств глотания, ESSD, участвует во Всемирном дне глотания, проводя короткий опрос для сбора данных о том, сколько пациентов проходят скрининг / оценку на предмет орофарингеальной дисфагии, какие инструменты скрининга / оценки используются, какие типы пациентов проходят скрининг как сообщается о ротоглоточной дисфагии.Помимо сбора полезной информации о скрининге и диагностике, ESSD способствует использованию кодов МКБ для дисфагии в медицинских отчетах, чтобы сделать состояние более заметным.
В этом, 2019 году, опрос будет проводиться с 7 по 13 декабря и будет доступен на 17 языках.
Исследование Всемирного дня глотания, проведенное ESSD, 2015 г.
Большое спасибо всем, кто принял участие в опросе Всемирного дня глотания ESSD, посвященном использованию кодов МКБ при дисфагии в медицинских отчетах.Графическое резюме результатов, результаты по странам и список участников с указанием клиники, города и страны доступны ниже.
В качестве третьего издания и в сжатые сроки это хороший ответ. 148 человек из 36 стран ответили на вопросы анкеты и обследовали 1944 пациентов на дисфагию. Из них у 1349 была дисфагия, у 1206 из них была диагностирована ротоглоточная дисфагия, но только 543 имели коды дисфагии по МКБ в медицинском заключении.
Международная классификация болезней (МКБ) Всемирной организации здравоохранения описана на их веб-сайте следующим образом:
«Международная классификация болезней (МКБ) — это стандартный диагностический инструмент для эпидемиологии, управления здравоохранением и клинических целей.Сюда входит анализ общего состояния здоровья групп населения. Он используется для мониторинга заболеваемости и распространенности заболеваний и других проблем со здоровьем, обеспечивая представление об общей ситуации со здоровьем в странах и населении.
ICD используется врачами, медсестрами, другими поставщиками медицинских услуг, исследователями, менеджерами и кодировщиками медицинской информации, работниками информационных технологий здравоохранения, политиками, страховщиками и организациями пациентов для классификации болезней и других проблем со здоровьем, зарегистрированных во многих типах медицинских и жизненно важных записей, включая свидетельства о смерти и медицинские карты.Помимо обеспечения возможности хранения и поиска диагностической информации для клинических, эпидемиологических и качественных целей, эти записи также служат основой для составления национальных статистических данных о смертности и заболеваемости государствами-членами ВОЗ. Наконец, ICD используется для принятия странами решений о возмещении расходов и распределении ресурсов ».
Использование кодов МКБ при дисфагии — простой способ привлечь внимание к своему заболеванию.
Всемирный день глотания
Цель Всемирного дня глотания состоит в том, чтобы провести всемирную информационную кампанию, направленную на специалистов здравоохранения, а также общественность, чтобы расширить знания о нормальных нарушениях глотания и глотания, их причинах, раннем обнаружении, осложнениях и лечении.
Европейское общество нарушений глотания, ESSD, разработало короткое обследование для сбора данных о том, сколько пациентов проходят скрининг / оценку на ротоглоточную дисфагию в течение недели (8-12 декабря) и сколько специалистов здравоохранения используют коды МКБ для диагностики дисфагии. в своих медицинских отчетах.
Всемирный день глотания был инициирован 12 декабря 2011 г. доц. Мохамед Фарахат (доктор медицины, доктор философии) из кафедры исследований нарушений голоса, глотания и коммуникации (RCVASD), Университет Короля Сауда, Эр-Рияд, Саудовская Аравия.
Союз европейских фониатров (UEP) присоединился к WSD в 2013 году, и это отмечалось мероприятиями в Саудовской Аравии, Кувейте, Дубае и Германии.
ESSD начал работу по проведению Дня дисфагии также в 2011 году с пилотного обследования по скринингу и оценке ротоглоточной дисфагии. Были проведены переговоры с ассоциациями, занимающимися дисфагией из Канады, Бразилии и Японии, с целью сделать это глобальное движение, признанное ВОЗ.
Сейчас мы работаем над объединением этих двух инициатив с общей целью под лозунгом «Всемирный день глотания».
Клиническая классификация нарушений силы и навыков при нейрогенной дисфагии.
Аннотация
Глотание — это сложная и точная последовательность движений, в основе которой лежит механизмы ствола мозга, но произвольно модулируемые корковыми процессами. Хотя глотая биомеханика довольно хорошо определена, мало что известно о лежащих в основе патофизиологических механизмы, которые приводят к биомеханическим нарушениям из-за периферических или центральных неврологических повреждать.Подходы поведенческой реабилитации при дисфагии сосредоточены в первую очередь на слабости, так как настоящая этиология. Это предположение во многом связано с ограничениями дифференциальной диагностики лежащая в основе патофизиология. Исследования в литературе, посвященной моторной речи и конечностям, показывают, что Повреждение периферических мышц приводит в первую очередь к слабости (уменьшению силы), в то время как центральные неврологические поражения могут быть связаны с нарушением навыков (снижение пространственно-временного точность движений), со слабостью или без нее.Необходима точная и конкретная диагностические методы при глотании, чтобы усовершенствованные и целенаправленные стратегии реабилитации могли предоставляться пациентам с дисфагией. Целью этой исследовательской программы было клиническое классифицировать пациентов с нейрогенной дисфагией вследствие инсульта или миопатии на подтипы на основе объективные меры силы и точности движений, связанных с глотанием.
Исследование 1 — это методологическое исследование, изучающее диапазон задействованной активности субментальных мышц. при глотании с минимальным, регулярным и максимальным усилием.Обучение на основе навыков и в протоколах оценки точности движений при глотании использовались цели, расположенные на субмаксимальные уровни мышечного сокращения, чтобы избежать любых возможных укрепляющих эффектов, которые могут происходят с максимальным усилием глотания. Регулярное усилие глотания уменьшило амплитуду активности субментальной поверхностной электромиографии (пЭМГ) по сравнению с максимальным усилием глотание. Однако неизвестно, могут ли люди добровольно и в какой степени уменьшить силу сокращения мышц до уровня ниже, чем при глотании с обычным усилием.Этот информация важна, чтобы не ставить цели ниже этих минимальных требований. Сорок три здоровых взрослых человека (22 женщины), представляющих четыре возрастные группы (20–39 лет, 40–59 лет, 60–79 лет и 80+ лет) участвовали в исследовании. Им было предложено проглотить слюну и 5 мл воды. болюсы с использованием максимального, обычного и минимального уровней усилия в случайном порядке. Максимальную амплитуду пика и продолжительность каждого глотка измеряли с помощью sEMG. Полученные результаты демонстрируют, что в среднем минимальная амплитуда пЭМГ, необходимая для генерации функциональных глотание составило 31% от максимальной активности глотательных мышц участника, что позволяет предположить что субмаксимальные целевые значения биологической обратной связи, используемые в протоколах, основанных на навыках, не должны быть ниже, чем этот порог.Кроме того, величина и продолжительность мышечной активности во время регулярных тренировок. глотание было больше похоже на глотание с минимальным усилием, чем на глотание с максимальным усилием, что подчеркивает возможную функциональную значимость субмаксимального глотания перед глотанием с максимальным усилием в тренировочных парадигмах.
В исследовании 2 здоровые люди из контрольной группы (n = 40) и пациенты с дисфагией вследствие инсульта (n = 55) и миопатия (n = 19) участвовала в новой клинической оценке, разработанной для различения нарушение силы и точности движений при глотании.Эти группы были выбраны потому что у них, вероятно, были определенные паттерны патофизиологии глотания, основанные на место поражения. Их оценивали по следующим четырем параметрам: сила глотания, открывание челюсти. сила, точность движения глотания и точность движения раскрытия челюсти. Пиковая амплитуда пЭМГ субментальной мышцы при глотании с усилием использовалась в качестве прокси. для силы глотания, в то время как изометрическая сила раскрытия челюсти измерялась с использованием динамометрия для получения сравнительной информации от произвольной задачи, не связанной с глотанием.Точность движений измерялась как 1) частота попаданий и 2) ошибка во времени и силе подпадания. активация мышц для размещения пика сигнала пЭМГ в экранной мишени во время глотание и не глотание, задачи по открытию челюсти. Результаты показали, что по сравнению со здоровыми Контрольная группа, пациенты с инсультом продемонстрировали снижение работоспособности по всей силе и движению прецизионные тесты (p <0,01), за исключением ошибки амплитуды глотания, в то время как пациенты с миопатией были ослаблены только при испытаниях на прочность (p <.01). Назначен иерархический кластерный анализ участников в один из четырех кластеров на основе результатов теста. Кластер 1 содержал в основном здоровые контрольные и представлены с лучшими показателями в тестах на силу и точность по сравнению с другими кластерами. Во второй кластер вошли пациенты с миопатиями и инсультами. и характеризовался пониженной эффективностью при выполнении силовых заданий, но относительно невредим. точность. Пациенты с инсультом были дополнительно отнесены к третьему кластеру (снижение работоспособности в тесты на прочность и точность челюсти) или четвертый кластер (дефицит силы и точности глотания тесты).Измерения точности движений позволили лучше классифицировать участников по группам, с вероятностями точности прогноза 73 - 89% по сравнению с мерами прочности. Полученные результаты из этого исследования показывают, что можно выделить несколько подтипов патофизиологии глотания. после инсульта. Возможно, что этим различным группам пациентов с дисфагией будет полезно от разных подходов к реабилитации. Новая клиническая оценка позволила дифференцировать между группами, от которых ожидалось, что они будут иметь различные модели силы и движения нарушения точности, предполагающие возможность использования в качестве дополнительного клинического теста для дифференциальной диагностики основной патофизиологии.Оценка точности движений при глотании может быть важный, но упускаемый из виду аспект реабилитации, который следует дополнительно изучить в контролируемых исследования.
В клинической практике измерения движения подъязычной кости при видеофлюороскопических исследованиях глотания (VFSS) иногда используются для оценки силы глотания, хотя взаимосвязь между биомеханическими показателями движения подъязычной кости и лежащих в основе патофизиология неясна. Исследование 3 было первой попыткой изучить эту взаимосвязь.Восемь пациенты с инсультом, которые участвовали в новой оценке силы и точности движений в Исследование 2 также участвовало в оценке проглатывания 5 мл жидкости и 5 мл пюре с использованием VFSS. Биомеханические измерения смещения подъязычной кости, продолжительность взрыва подъязычной кости, взрыва подъязычной кости скорость и продолжительность перехода между стадиями, полученные из VFSS, коррелировали с физиологическими показателями. измерения силы и точности движений с помощью динамометрии и sEMG. В целом, подъязычная траектория не была конкретно связана с мерами силы или точностью движения, предполагая, что существует множество сложных факторов, способствующих движению подъязычной кости, и может быть трудно вывести физиологию из визуализации движения подъязычной кости на VFSS.
Результаты этих исследований ставят под сомнение преобладающее предположение о том, что уменьшение силы поколение является преобладающей причиной дисфагии, особенно после центральных неврологических заболеваний. повреждение, такое как инсульт. Этот тезис определяет наличие нескольких подгрупп у пациентов с постинсультная дисфагия и дает характеристику паттернов нарушений в каждой подгруппе. Мы предполагаем, что снижение точности движения является одним из возможных основных механизмов. нарушения глотания, которое может сочетаться со слабостью.Первоначальная осуществимость клинического установлена оценка силы и точности движений, устанавливающая рамки для дальнейших исследований в области физиологической, а не чисто биомеханической оценки дисфагия. Повышение точности и специфичности диагностики патофизиологии глотания имеет фундаментальное значение для эффективного лечения дисфагии.
Серия случаев и предложенная классификация унд »Лауры Ф. Сантосо, Даниэля Ю. Кима и др.
Название
Сенсорная дисфагия: серия случаев и предлагаемая классификация недооцененного расстройства глотания
Служба UMMS
Отделение отоларингологии; Отделение неврологии; Школа медицины; Программа старших стипендиатов
Наставник факультета
Дэвид Пайдарфар
Дата публикации
2019-05-01
Дисциплины
Диагностика | Заболевания пищеварительной системы | Медицинское образование | Заболевания нервной системы | Оториноларингологические заболевания
Аннотация
СПРАВОЧНАЯ ИНФОРМАЦИЯ: Хотя сенсорная обратная связь является важным регулятором глотания, она не рассматривается всесторонне при стандартной оценке дисфагии.Затрудненное глотание, вторичное по отношению к потере чувствительности, может быть названо «сенсорной дисфагией» и может быть причиной случаев, когда диагностируется исключение, например функциональная или идиопатическая дисфагия.
МЕТОДЫ И РЕЗУЛЬТАТЫ: В трех случаях идиопатической дисфагии предполагалось наличие сенсорной дисфагии. У пациентов было (1) глотание с усилием, (2) ощущение шара и (3) аспирация. Эндоскопическое сенсорное картирование выявило потерю чувствительности гортани. Несмотря на нормальную моторную функцию гортани во время произвольных маневров, закрытие гортани было неполным во время глотания.Выявлены причины потери чувствительности: черепная нейропатия из-за мальформации Киари, иммуноопосредованная нейронопатия и повреждение нервов в результате предшествующей травматической интубации.
ВЫВОДЫ: потеря чувствительности может вызвать дисфагию без первичной двигательной дисфункции. Сенсорную дисфагию следует классифицировать как отдельную форму нарушения моторики глотания для улучшения диагностики. Повышение осведомленности и разработка соответствующих инструментов оценки может способствовать лечению дисфагии.
Ключевые слова
дисфагия, гибкая эндоскопическая оценка глотания с сенсорным тестированием, globus pharyngeus, внутренний верхний гортанный нерв, сенсорная дисфагия
DOI опубликованной версии
10.1002 / хед.25588
Журнал / Книга / Название конференции
Голова и шея
Ссылка на репозиторий
Сантосо LF, Ким Д.Й., Пайдарфар Д. (2019). Сенсорная дисфагия: серия случаев и предлагаемая классификация недооцененного расстройства глотания. Программа старших ученых. https://doi.org/10.1002/hed.25588. Получено с https: // escholarship.umassmed.edu/ssp/271
Дисфагия: текущая реальность и масштабы проблемы
ВОЗ. Международная классификация функционирования, инвалидности и здоровья [онлайн], (2014 г.).
ВОЗ. Международная классификация болезней [онлайн], (2010).
Экберг О. Дисфагия: диагностика и лечение. (Springer, Берлин, 2012 г.).
Фельдман, М., Фридман, Л. С. и Брандт, Л. Дж. Слейзенгер и болезни желудочно-кишечного тракта и печени Фордтрана: патофизиология, диагностика, лечение.(Saunders Elsevier, 2010).
Шейкер Р., Белафски П. К., Постма Г. Н. и Истерлинг К. Принципы глотания. Междисциплинарный текст по глотанию и его расстройствам. (Springer, 2013).
Клэйв, П., Терре, Р., де, К. М. и Серра, М. Приближение ротоглоточной дисфагии. Rev. Esp. Энферм. Копать землю. 96 , 119–131 (2004).
Артикул CAS PubMed Google Scholar
Barczi, S.Р., Салливан, П. А. и Роббинс, Дж. Чем должны отличаться методы лечения дисфагии у пожилых людей? Установление оптимальных схем практики. Семин. Speech Lang. 21 , 347–361 (2000).
Артикул CAS PubMed Google Scholar
Клэйв, П. и др. . в Hospital Healthcare Europe 2005/2006 (ред. Тейлор, С.) 5–8 (Campden Publishing Ltd., 2005).
Google Scholar
Boeckxstaens, G.Э., Занинотто, Дж. И Рихтер, Дж. Э. Ахаласия. Ланцет 383 , 83–93 (2014).
Артикул PubMed Google Scholar
Джин А. Контроль глотания стволовым мозгом: нейронная сеть и клеточные механизмы. Physiol. Ред. 81 , 929–969 (2001).
Артикул CAS PubMed Google Scholar
Мишу, Э.И Хэмди, С. Кортикальный вклад в контроль глотания. Curr. Opin. Отоларингол. Head Neck Surg. 17 , 166–171 (2009).
Артикул PubMed Google Scholar
Michou, E. et al . Характеристика кортикобульбарной нейрофизиологии глотки у пациентов с дисфагией и болезнью Паркинсона. Clin. Гастроэнтерол. Гепатол. 12 , 2037–2045 (2014).
Артикул PubMed Google Scholar
Clave, P. и др. . Влияние вязкости болюса на функцию глотания при нейрогенной дисфагии. Алимент. Pharmacol. Ther. 24 , 1385–1394 (2006).
Артикул CAS PubMed Google Scholar
Мацуо К. и Палмер Дж. Б. Координация жевания, глотания и дыхания. Jpn Dent. Sci. Ред. 45 , 31–40 (2009).
Артикул PubMed PubMed Central Google Scholar
Мацуо, К.И Палмер, Дж. Б. Анатомия и физиология кормления и глотания: нормальное и ненормальное. Phys. Med. Rehabil. Clin. N. Am. 19 , 691–707 (2008).
Артикул PubMed PubMed Central Google Scholar
Кохьяма, К., Миоче, Л. и Бурдиол, П. Влияние возраста и состояния зубов на жевательное поведение изучали с помощью записей ЭМГ во время потребления различных образцов пищи. Геродонтология 20 , 15–23 (2003).
Артикул CAS PubMed Google Scholar
Kahrilas, P.J., Logemann, J.A., Lin, S. & Ergun, G.A. Очистка глотки при глотании: комбинированное манометрическое и видеофлюороскопическое исследование. Гастроэнтерология 103 , 128–136 (1992).
Артикул CAS PubMed Google Scholar
Rofes, L. и др. .Патофизиология ротоглоточной дисфагии у ослабленных пожилых людей. Нейрогастроэнтерол. Мотил. 22 , 851–858 (2010).
Артикул CAS PubMed Google Scholar
Роббинс, Дж. и др. . Влияние языковых упражнений на глотание у пожилых людей. J. Am. Гериатр. Soc. 53 , 1483–1489 (2005).
Артикул PubMed Google Scholar
Рофес, Л. и др. . Диагностика и лечение ротоглоточной дисфагии и ее пищевых и респираторных осложнений у пожилых людей. Гастроэнтерол. Res. Практик. 2011 , 818979 (2011).
Артикул PubMed Google Scholar
Авив, Дж. Э. Влияние старения на чувствительность глоточной и надгортанной областей. Am. J. Med. 103 , 74С – 76С (1997).
Артикул CAS PubMed Google Scholar
Aviv, J.Е. и др. . Надгортанные и глоточные сенсорные аномалии у пациентов с инсультом и дисфагией. Ann. Отол. Ринол. Ларингол. 105 , 92–97 (1996).
Артикул CAS PubMed Google Scholar
Хэмди, С. и др. . Идентификация церебральных локусов, обрабатывающих глотание человека, с активацией h3 (15) O ПЭТ 1. J. Neurophysiol. 81 , 1917–1926 (1999).
Артикул CAS PubMed Google Scholar
Хэмди, С. и др. . Кортикальная топография глотательной мускулатуры человека в состоянии здоровья и болезни. Нат. Med. 2 , 1217–1224 (1996).
Артикул CAS PubMed Google Scholar
Michou, E. и др. . Нацеливание на неповрежденную моторную кору глотки улучшает глотание у здоровых людей и после дисфагического инсульта. Гастроэнтерология 142 , 29–38 (2012).
Артикул PubMed Google Scholar
Хэмди, С. и др. . Восстановление глотания после дисфагического инсульта связано с функциональной перестройкой неповрежденной моторной коры. Гастроэнтерология 115 , 1104–1112 (1998).
Артикул CAS PubMed Google Scholar
Му, Л.С. и др. . Патология альфа-синуклеина и дегенерация аксонов периферических двигательных нервов, иннервирующих мышцы глотки, при болезни Паркинсона. J. Neuropathol. Exp. Neurol. 72 , 119–129 (2013).
Артикул CAS PubMed PubMed Central Google Scholar
Рофес, Л., Арреола, В., Мартин, А. и Клэйв, П. Натуральные капсаициноиды улучшают реакцию глотания у пожилых пациентов с ротоглоточной дисфагией. Кишечник 62 , 1280–1287 (2013).
Артикул PubMed Google Scholar
Rofes, L. и др. . Влияние поверхностной сенсорной и моторной электростимуляции на хроническую постинсультную орофарингеальную дисфункцию. Нейрогастроэнтерол. Мотил. 25 , 888 – e701 (2013).
Артикул CAS PubMed Google Scholar
Рофес, Л., Арреола, В., Мукерджи, Р., Суонсон, Дж. И Клэйв, П. Влияние загустителя на основе ксантановой камеди на глотательную функцию пациентов с дисфагией. Алимент. Pharmacol. Ther. 39 , 1169–1179 (2014).
Артикул CAS PubMed Google Scholar
Рофес, Л., Арреола, В., Мартин, А. и Клэйв, П. Влияние перорального пиперина на реакцию глотания у пациентов с ротоглоточной дисфагией. J. Gastroenterol. 49 , 1517–1523 (2014).
Артикул PubMed Google Scholar
Джаясекеран, В. и др. . Дополнительная функциональная электрическая стимуляция глотки устраняет нарушение глотания после поражения головного мозга. Гастроэнтерология 138 , 1737–1746 (2010).
Артикул PubMed Google Scholar
Мэсси, Б.Т. Физиология полости рта, глотки и верхнего сфинктера пищевода. GI Motility online [онлайн], (2006).
Google Scholar
Кук И. Дж. и др. . Дивертикул глотки (зенкер) — это нарушение раскрытия верхнего сфинктера пищевода. Гастроэнтерология 103 , 1229–1235 (1992).
Артикул CAS PubMed Google Scholar
Кук И.J. Клинические нарушения верхнего сфинктера пищевода. GI Motility online [онлайн], (2006).
Google Scholar
Али, Г. Н. и др. . Механизмы орально-глоточной дисфагии у пациентов с болезнью Паркинсона. Гастроэнтерология 110 , 383–392 (1996).
Артикул CAS PubMed Google Scholar
Уильямс Р.Б., Уоллес, К. Л., Али, Г. Н. и Кук, И. Дж. Биомеханика неудачной релаксации глотательного верхнего пищеводного сфинктера при нейрогенной дисфагии. Am. J. Physiol. Гастроинтест. Liver Physiol. 283 , G16 – G26 (2002).
Артикул CAS PubMed Google Scholar
Мартин-Харрис, Б. Координация дыхания и глотания. GI Motility online [онлайн], (2006).
Google Scholar
Мартин-Харрис, Б. и др. . Динамика дыхания и глотания на протяжении всей жизни взрослого человека. Arch. Отоларингол. Head Neck Surg. 131 , 762–770 (2005).
Артикул PubMed Google Scholar
Мартин-Харрис, Б. Клинические последствия респираторно-глотательных взаимодействий. Curr. Opin. Отоларингол. Head Neck Surg. 16 , 194–199 (2008).
Артикул PubMed PubMed Central Google Scholar
Ниими, А. и др. . Нарушение кашлевого рефлекса у пациентов с рецидивирующей пневмонией. Грудь 58 , 152–153 (2003).
Артикул CAS PubMed PubMed Central Google Scholar
Алмиралл, Дж. и др. . Орофарингеальная дисфагия является фактором риска внебольничной пневмонии у пожилых людей. Eur. Респ. J. 41 , 923–928 (2013).
Артикул Google Scholar
Кук И.J. & Kahrilas, P. J. Технический обзор AGA по ведению ротоглоточной дисфагии. Гастроэнтерология 116 , 455–478 (1999).
Артикул CAS PubMed Google Scholar
Сифрим Д., Виларделл Н. и Клэйв П. в Функциональные расстройства и нарушения моторики ЖКТ . Vol. 33 гл. 1 (ред. Quigleyy, E. M. M., Hongo, M. & Fukudo, S.) 1–13 (Karger, 2014).
Google Scholar
Серра-Прат, М. и др. . Орофарингеальная дисфагия как фактор риска недоедания и инфекции нижних дыхательных путей у самостоятельно живущих пожилых людей: популяционное проспективное исследование. Возраст Старение 41 , 376–381 (2012).
Артикул PubMed Google Scholar
Экберг, О., Хамди, С., Войсард, В., Вуттге-Ханниг, А. и Ортега, П. Социальное и психологическое бремя дисфагии: его влияние на диагностику и лечение. Дисфагия 17 , 139–146 (2002).
Артикул PubMed Google Scholar
Роббинс, Дж., Лэнгмор, С., Хинд, Дж. А. и Эрлихман, М. Исследование дисфагии в 21 веке и за его пределами: материалы совещания экспертов по дисфагии, 21 августа 2001 г. Дж. Рехабил. Res. Dev. 39 , 543–548 (2002).
PubMed Google Scholar
Сура, Л., Мадхаван, А., Карнаби, Г. и Крэри, М. А. Дисфагия у пожилых людей: рекомендации по ведению и питанию. Clin. Интерв. Старение 7 , 287–297 (2012).
PubMed PubMed Central Google Scholar
Гумберт, И. А. и Роббинс, Дж. Дисфагия у пожилых людей. Phys. Med. Rehabil. Clin. N. Am. 19 , 853–866 (2008).
Артикул PubMed PubMed Central Google Scholar
Рой, Н., Стемпл, Дж., Меррилл, Р. М. и Томас, Л. Дисфагия у пожилых людей: предварительные данные о распространенности, факторах риска и социально-эмоциональных последствиях. Ann. Отол. Ринол. Ларингол. 116 , 858–865 (2007).
Артикул PubMed Google Scholar
Carrion, S. и др. . Орофарингеальная дисфагия является распространенным фактором риска недостаточности питания в группе пожилых пациентов, поступивших с острым заболеванием в больницу общего профиля. Clin. Nutr. 9 , S0261–5614 (2014).
Google Scholar
Серра-Прат, М. и др. . Распространенность ротоглоточной дисфагии и нарушение безопасности и эффективности глотания у самостоятельно живущих пожилых людей. J. Am. Гериатр. Soc. 59 , 186–187 (2011).
Артикул PubMed Google Scholar
Альтман, К.В., Ю., Г. П. и Шефер, С. Д. Последствия дисфагии у госпитализированного пациента: влияние на прогноз и ресурсы больницы. Arch. Отоларингол. Head Neck Surg. 136 , 784–789 (2010).
Артикул PubMed Google Scholar
Ледер, С. Б. и Суйтер, Д. М. Эпидемиологическое исследование старения и дисфагии у пациентов, госпитализированных для оказания неотложной помощи: 2000–2007 гг. Геронтология 55 , 714–718 (2009).
Артикул PubMed Google Scholar
Лин, Л. К., Ву, С. С., Чен, Х. С., Ван, Т. Г. и Чен, М. Ю. Распространенность нарушений глотания у пожилых людей в специализированных учреждениях на Тайване. J. Am. Гериатр. Soc. 50 , 1118–1123 (2002).
Артикул PubMed Google Scholar
Мартино, Р. и др. . Дисфагия после инсульта: частота, диагностика и легочные осложнения. Инсульт 36 , 2756–2763 (2005).
Артикул PubMed Google Scholar
Terre, R. & Mearin, F. Эволюция трахеальной аспирации при тяжелой черепно-мозговой дисфагии, связанной с орофарингеальной дисфагией: 1-летнее продолжительное исследование. Нейрогастроэнтерол. Мотил. 21 , 361–369 (2009).
Артикул CAS PubMed Google Scholar
Мишу, Э., Байдженс, Л., Рофес, Л., Санз, П. и Клэйв, П. Нарушения глотания через ротоглотку при болезни Паркинсона: еще раз. Внутр. J. Speech Lang. Патол. Audiol. 1 , 76–88 (2013).
Google Scholar
van den Engel-Hoek, L. et al. . Мышцы полости рта прогрессивно поражаются при мышечной дистрофии Дюшенна: последствия для лечения дисфагии. J. Neurol. 260 , 1295–1303 (2013).
Артикул PubMed Google Scholar
Lazarus, C. L. Влияние химиолучевой терапии на голос и глотание. Curr. Opin. Отоларингол. Head Neck Surg. 17 , 172–178 (2009).
Артикул PubMed PubMed Central Google Scholar
Гарсия-Перис, П. и др. . Долгосрочная распространенность ротоглоточной дисфагии у больных раком головы и шеи: влияние на качество жизни. Clin. Nutr. 26 , 710–717 (2007).
Артикул CAS PubMed Google Scholar
Роден Д. Ф. и Альтман К. В. Причины дисфагии среди разных возрастных групп систематический обзор литературы. Отоларингол. Clin. N. Am. 46 , 965–987 (2013).
Артикул Google Scholar
Cichero, J.А. и Альтман, К. В. Определение, распространенность и бремя ротоглоточной дисфагии: серьезная проблема среди пожилых людей во всем мире и ее влияние на прогноз и ресурсы больниц. Nestle Nutr. Inst. Мастерская Сер. 72 , 1–11 (2012).
Артикул PubMed Google Scholar
Маеда К. и Акаги Дж. Снижение давления языка связано с саркопенией и саркопенической дисфагией у пожилых людей. Дисфагия 30 , 80–87 (2015).
Артикул PubMed Google Scholar
Вакабаяши, Х. Трансдисциплинарный подход к саркопении. Саркопеническая дисфагия [яп.]. Clin. Кальций 24 , 1509–1517 (2014).
PubMed Google Scholar
Вакабаяси, Х. и Сакума, К. Реабилитационное питание при саркопении с инвалидностью: сочетание реабилитации и лечебного питания. J. Cachexia Sarcopenia Muscle 5 , 269–277 (2014).
Артикул PubMed PubMed Central Google Scholar
Марик П. Э. и Каплан Д. Аспирационная пневмония и дисфагия у пожилых людей. Сундук 124 , 328–336 (2003).
Артикул PubMed Google Scholar
Альмиралл, Дж., Кабре, М. и Клаве, П.Осложнения ротоглоточной дисфагии: аспирационная пневмония. Nestle Nutr. Inst. Мастерская Сер. 72 , 67–76 (2012).
Артикул PubMed Google Scholar
Ортега О. и др. . Здоровье полости рта у пожилых пациентов с ротоглоточной дисфагией. Возраст Старение 43 , 132–137 (2014).
Артикул PubMed Google Scholar
Бейн, В.Б., Ю., В. и Самме, Дж. П. Эпидемиологические тенденции в госпитализации пожилых пациентов Medicare по поводу пневмонии, 1991–1998. Am. J. Public Health 91 , 1121–1123 (2001).
Артикул CAS PubMed PubMed Central Google Scholar
Ортега О., Кабре М. и Клэйв П. Орофарингеальная дисфагия: этиология и последствия старения. J. Gastroenterol. Гепатол. Res. 3 , 1049–1054 (2014).
Google Scholar
Моряк У. Б. Глоточная и верхняя пищеводная дисфагия. JAMA 235 , 2643–2646 (1976).
Артикул Google Scholar
Paterson, W.G. Перистальтика пищевода. GI Motility online [онлайн], (2006).
Google Scholar
Лечеа, Б.Студия in vitro de la fisiología del esfínter esofágico inferior y de la motilidad del cuerpo esofágico humano y porcino. Диссертация, Автономный университет Барселоны (2013).
Lecea, B. et al. . Региональная функциональная специализация и ингибирующая нитрергическая и нонитрергическая коневротрансмиссия в пищеводе человека. Am. J. Physiol. Гастроинтест. Liver Physiol. 300 , G782 – G794 (2011).
Артикул CAS PubMed Google Scholar
Миллер, Л. и др. . Физиология верхнего сегмента, тела и нижнего сегмента пищевода. Ann. Акад. Sci. 1300 , 261–277 (2013).
Артикул PubMed PubMed Central Google Scholar
Фарре, Р., Аули, М., Лечеа, Б., Мартинес, Э. и Клэйв, П. Фармакологическая характеристика внутренних механизмов, контролирующих тонус и расслабление нижнего пищеводного сфинктера свиней. Дж.Pharmacol. Exp. Ther. 316 , 1238–1248 (2006).
Артикул CAS PubMed Google Scholar
Krysiak, P. S. & Preiksaitis, H. G. Тахикинины способствуют нервно-опосредованным сокращениям пищевода человека. Гастроэнтерология 120 , 39–48 (2001).
Артикул CAS PubMed Google Scholar
Лечеа, Б., Мартинес, Э., Аули, М., Опазо, А. и Клэйв, П. Селективная стимуляция внутренних возбуждающих и тормозных моторных путей в нижнем пищеводном сфинктере свиней. Нейрогастроэнтерол. Мотил. 21 , 1342 – e130 (2009 г.).
Артикул CAS PubMed Google Scholar
Lecea, B., Gallego, D., Farre, R. & Clave, P. Происхождение и модуляция сокращений кругового гладкомышечного слоя в пищеводе свиньи. Нейрогастроэнтерол. Мотил. 24 , 779–789 (2012).
Артикул CAS PubMed Google Scholar
Роман, С., Гьявали, К. П., Сяо, Ю., Пандольфино, Дж. Э. и Кахрилас, П. Дж. Чикагская классификация нарушений моторики: обновленная информация. Гастроинтест. Endosc. Clin. N. Am. 24 , 545–561 (2014).
Артикул PubMed PubMed Central Google Scholar
Гонсалес, А.А., Фарре, Р. и Клэйв, П. Различная реакция возбуждающих и тормозных энтеральных мотонейронов пищевода человека на стимуляцию электрическим полем и на никотин. Am. J. Physiol. Гастроинтест. Liver Physiol. 287 , G299 – G306 (2004).
Артикул CAS PubMed Google Scholar
Euchnerwamser, I., Sengupta, J. N., Gebhart, G. F. & Meller, S. T. Характеристика ответов T (2) -T (4) нейронов спинного мозга на растяжение пищевода у крыс. J. Neurophysiol. 69 , 868–883 (1993).
Артикул CAS Google Scholar
Сенгупта, Дж. Н., Каувар, Д. и Гоял, Р. К. Характеристики чувствительных к натяжению афферентных волокон блуждающего нерва в опоссуме. J. Neurophysiol. 61 , 1001–1010 (1989).
Артикул CAS PubMed Google Scholar
Сенгупта, Дж.Н., Саха, Дж. К. и Гоял, Р. К. Исследования функции стимул-реакция механочувствительных ноцицепторов пищевода в симпатических афферентах опоссума. J. Neurophysiol. 64 , 796–812 (1990).
Артикул CAS PubMed Google Scholar
Сенгупта, Дж. Н., Саха, Дж. К. и Гойал, Р. К. Дифференциальная чувствительность к брадикинину механорецепторов, чувствительных к растяжению пищевода, в вагусных и симпатических афферентах опоссума. J. Neurophysiol. 68 , 1053–1067 (1992).
Артикул CAS PubMed Google Scholar
Язаки, Э., Вудленд, П. и Сифрим, Д. Использование функционального тестирования пищевода: дисфагия. Гастроинтест. Endosc. Clin. N. Am. 24 , 643–654 (2014).
Артикул PubMed Google Scholar
Сяо, Ю. Л. и др. . Отсутствие корреляции между показателями ЧСС и симптомами во время манометрического протокола. Am. J. Gastroenterol. 109 , 521–526 (2014).
Артикул PubMed PubMed Central Google Scholar
Omari, T. I., Dejaeger, E., Tack, J., Van Beckevoort, D. и Rommel, N. Влияние объема и вязкости болюса на переменные манометрии автоматического импеданса глотки, полученные для пациентов с широкой дисфагией. Дисфагия 28 , 146–152 (2013).
Артикул PubMed Google Scholar
Омари Т. И. и др. . Дисфункция глотания у здоровых пожилых людей с использованием анализа глоточного давления-потока. Нейрогастроэнтерол. Мотил. 26 , 59–68 (2014).
Артикул CAS PubMed Google Scholar
Маркс, Р.Д. и Рихтер, Дж. Э. Пептические стриктуры пищевода. Am. J. Gastroenterol. 88 , 1160–1173 (1993).
CAS PubMed Google Scholar
Гуда, Н. М. и Вакил, Н. Ингибиторы протонной помпы и временные тенденции расширения пищевода. Am. J. Gastroenterol. 99 , 797–800 (2004).
Артикул CAS PubMed Google Scholar
Вакиль Н.Б., Тракслер, Б. и Левин, Д. Дисфагия у пациентов с эрозивным эзофагитом: распространенность, тяжесть и реакция на лечение ингибиторами протонной помпы. Clin. Гастроэнтерол. Гепатол. 2 , 665–668 (2004).
Артикул CAS PubMed Google Scholar
Энг Д., Блондо К., Сифрим Д. и Тэк Дж. Спектр нарушений двигательной функции при гастроэзофагеальной рефлюксной болезни и пищеводе Барретта. Пищеварение 79 , 158–168 (2009).
Артикул CAS PubMed Google Scholar
Мартинуччи, И. и др. . Исходные уровни импеданса пищевода у пациентов с патофизиологическими характеристиками функциональной изжоги. Нейрогастроэнтерол. Мотил. 26 , 546–555 (2014).
Артикул CAS PubMed Google Scholar
Mayberry, J.F. Эпидемиология и демография ахалазии. Гастроинтест. Endosc. Clin. N. Am. 11 , 235–248 (2001).
Артикул CAS PubMed Google Scholar
Парк В. и Ваези М. Ф. Этиология и патогенез ахалазии: современное понимание. Am. J. Gastroenterol. 100 , 1404–1414 (2005).
Артикул PubMed Google Scholar
Воутерс, М.М. и др. . Генетическая изменчивость локуса лимфотоксина-альфа (LTA) / фактора некроза опухоли-альфа (TNF-альфа) как фактор риска идиопатической ахалазии. Кишечник 63 , 1401–1409 (2014).
Артикул CAS PubMed Google Scholar
Kahrilas, P. J. & Boeckxstaens, G. Спектр ахалазии: уроки патофизиологии и манометрии высокого разрешения. Гастроэнтерология 145 , 954–965 (2013).
Артикул PubMed Google Scholar
Фриллинг, Т. и др. . Семейное возникновение ахалазии и диффузного спазма пищевода. Кишечник 29 , 1595–1602 (1988).
Артикул CAS PubMed PubMed Central Google Scholar
Пандольфино, Дж. Э. и др. . Ахалазия: новая клинически значимая классификация с помощью манометрии высокого разрешения. Гастроэнтерология 135 , 1526–1533 (2008).
Артикул PubMed PubMed Central Google Scholar
Пандольфино, Дж. Э., Фокс, М. Р., Бреденоорд, А. Дж. И Карилас, П. Дж. Манометрия с высоким разрешением в клинической практике: использование топографии давления для классификации нарушений моторики пищевода. Нейрогастроэнтерол. Мотил. 21 , 796–806 (2009).
Артикул CAS PubMed PubMed Central Google Scholar
Абушакра, М., Guillemin, F. & Lee, P. Желудочно-кишечные проявления системного склероза. Семин. Ревматоидный артрит. 24 , 29–39 (1994).
Артикул CAS Google Scholar
Маршалл, Дж. Б. и др. . Желудочно-кишечные проявления смешанного заболевания соединительной ткани. Гастроэнтерология 98 , 1232–1238 (1990).
Артикул CAS PubMed Google Scholar
Горовиц, М., Макнейл, Дж. Д., Мэддерн, Дж. Дж., Коллинз, П. Дж. И Ширман, Д. Дж. С. Аномалии опорожнения желудка и пищевода при полимиозите и дерматомиозите. Гастроэнтерология 90 , 434–439 (1986).
Артикул CAS PubMed Google Scholar
Джейкоб, Х., Берковиц, Д., Макдональд, Э., Бернштейн, Л. Х. и Беневентано, Т. Нарушение моторики пищевода при полимиозите — проспективное исследование. Arch. Междунар. Med. 143 , 2262–2264 (1983).
Артикул CAS PubMed Google Scholar
Терборг, Э. Дж. и др. . Клинические ассоциации антирибонуклеопротеидных антител у пациентов с системной красной волчанкой. Семин. Ревматоидный артрит. 20 , 164–173 (1990).
Артикул CAS Google Scholar
Холлоуэй, Р.Х. и др. . Взаимосвязь между моторикой пищевода и транзитом у пациентов с сахарным диабетом I типа. Am. J. Gastroenterol. 94 , 3150–3157 (1999).
Артикул CAS PubMed Google Scholar
Иствуд, Г. Л., Браверман, Л. Е., Уайт, Э. М. и Вандерсалм, Т. Дж. Устранение гипотензии нижнего сфинктера пищевода и аперистальтики пищевода после лечения гипотиреоза. J. Clin. Гастроэнтерол. 4 , 307–310 (1982).
Артикул CAS PubMed Google Scholar
Мешкинпур, Х., Афрасиаби, М. А. и Валента, Л. Дж. Двигательная функция пищевода при болезни Грейвса. Dig. Дис. Sci. 24 , 159–161 (1979).
Артикул CAS PubMed Google Scholar
Гранде, Л. и др. . Сокращения высокой амплитуды в средней трети пищевода: манометрический маркер хронического алкоголизма? Кишечник 38 , 655–662 (1996).
Артикул CAS PubMed PubMed Central Google Scholar
Кешаварзян А., Ибер, Ф. Л. и Фергюсон, Ю. Манометрия пищевода и опорожнение радионуклидов у хронических алкоголиков. Гастроэнтерология 92 , 651–657 (1987).
Артикул CAS PubMed Google Scholar
Поттер, Дж. У. и др. . Эозинофильный эзофагит у взрослых: новая проблема с уникальными особенностями пищевода. Гастроинтест. Endosc. 59 , 355–361 (2004).
Артикул PubMed Google Scholar
Керлин П., Джонс Д., Ремедиос М. и Кэмпбелл К.Распространенность эозинофильного эзофагита у взрослых с обструкцией пищевода пищевым болюсом. J. Clin. Гастроэнтерол. 41 , 356–361 (2007).
Артикул PubMed Google Scholar
Купер, Дж. С. и др. . Химиолучевая терапия местнораспространенного рака пищевода — долгосрочное наблюдение в проспективном рандомизированном исследовании (RTOG 85–01). JAMA 281 , 1623–1627 (1999).
Артикул CAS PubMed Google Scholar
Паттерсон, Э. Дж. и др. . Влияние бужа пищевода на частоту возникновения дисфагии после фундопликации по Ниссену — проспективное слепое рандомизированное клиническое исследование. Arch. Surg. 135 , 1055–1061 (2000).
Артикул CAS PubMed Google Scholar
Джонс, Б., Шейкер, Р. и Уолш, Л. Дисфагия. Интервью журнала Sciencewatch [онлайн], (2010).
Google Scholar
Фарре Р. и Сифрим Д. Регулирование базального тонуса, расслабление и сокращение нижнего сфинктера пищевода. Актуальность для открытия лекарств при расстройствах пищевода. Br. J. Pharmacol. 153 , 858–869 (2008).
Артикул CAS PubMed Google Scholar
Голландия, Г. и др. . Распространенность и профили симптомов ротоглоточной дисфагии в общинном жилище пожилого населения: анкетирование с самоотчетом. Дис. Пищевод 24 , 476–480 (2011).
Артикул CAS PubMed Google Scholar
Блум Б. Р. и др. . Распространенность субъективной дисфагии у жителей общины в возрасте старше 87 лет. BMJ 300 , 721–722 (1990).
Артикул CAS PubMed PubMed Central Google Scholar
Кавасима, К., Мотохаши, Ю. и Фудзисима, И. Распространенность дисфагии среди пожилых людей, проживающих в общинах, по оценке с использованием вопросника для скрининга дисфагии. Дисфагия 19 , 266–271 (2004).
Артикул PubMed Google Scholar
Ян, Э.Дж., Км, М. Х., Лим, Дж. Й. и Пайк, Н. Дж. Орофарингеальная дисфагия в когорте пожилых людей по месту жительства: корейское лонгитюдное исследование здоровья и старения. J. Korean Med. Sci. 28 , 1534–1539 (2013).
Артикул PubMed PubMed Central Google Scholar
Ли, А., Сито, Ю. Ю., Лиу, П. К., Фуа, С. Ю. и Чин, Дж. Дж. Нарушение глотания и зависимость от кормления у госпитализированных пожилых людей. Ann. Акад. Med. Сингапур. 28 , 371–376 (1999).
CAS PubMed Google Scholar
Кабре, М. и др. . Орофарнигеальная дисфагия является фактором риска повторной госпитализации по поводу пневмонии у очень пожилых людей: проспективное обсервационное исследование. J. Gerontol. Биол. Sci. Med. Sci. 69 , 330–337 (2014).
Артикул PubMed Google Scholar
Кабре, М. и др. . Распространенность и прогностические последствия дисфагии у пожилых пациентов с пенумонией. Возраст Старение 39 , 39–45 (2010).
Артикул PubMed Google Scholar
Ногейра, Д. и Рейс, Э. Расстройства глотания у жителей домов престарелых: как можно объяснить проблему? Clin. Интерв. Старение 8 , 221–227 (2013).
Артикул PubMed PubMed Central Google Scholar
Линь Л.К., Ву, С. С., Чен, Х. С., Ван, Т. Г. и Чен, М. Ю. Распространенность нарушения глотания у пожилых людей в специализированных учреждениях на Тайване. J. Am. Гериатр. Soc. 50 , 1118–1123 (2002).
Артикул PubMed Google Scholar
Калф, Дж. Г., де Сварт, Б. Дж., Блум, Б. Р., Муннеке, М. Распространенность ротоглоточной дисфагии при болезни Паркинсона: метаанализ. Parkinsonism Relat. Disord. 18 , 311–315 (2012).
Артикул CAS PubMed Google Scholar
Langmore, S.E., Olney, R.K., Lomen-Hoerth, C. & Miller, B.L. Дисфагия у пациентов с лобно-височной долей деменции. Arch. Neurol. 64 , 58–62 (2007).
Артикул PubMed Google Scholar
Хорнер, Дж., Альбертс, М.Дж., Доусон, Д. В. и Кук, Г. М. Глотание при болезни Альцгеймера. Alzheimer Dis. Доц. Disord. 8 , 177–189 (1994).
Артикул CAS PubMed Google Scholar
Икеда, М., Браун, Дж., Холланд, А. Дж., Фукухара, Р. и Ходжес, Дж. Р. Изменения аппетита, пищевых предпочтений и пищевых привычек при лобно-термпоральной деменции и болезни Альцгеймера. J. Neurol. Нейрохирургия. Психиатрия 73 , 371–376 (2002).
Артикул CAS PubMed PubMed Central Google Scholar
Сух, М. К., Ким, Х. и На, Д. Л. Дисфагия у пациентов с деменцией: болезнь Альцгеймера против сосудистой. Alzheimer Dis. Доц. Disord. 23 , 178–184 (2009).
Артикул PubMed Google Scholar
Де Пау, А., Дежегер, Э., Д’Хуг, Б. и Картон, Х., Дисфагия при рассеянном склерозе. Clin. Neurol. Нейрохирургия. 104 , 345–351 (2002).
Артикул CAS PubMed Google Scholar
Кальканьо П., Руопполо Г., Грассо М. Г., Де Винсентис М. и Паолуччи С. Дисфагия при рассеянном склерозе — распространенность и прогностические факторы. Acta Neurol. Сканд. 105 , 40–43 (2002).
Артикул CAS PubMed Google Scholar
Чен, А.


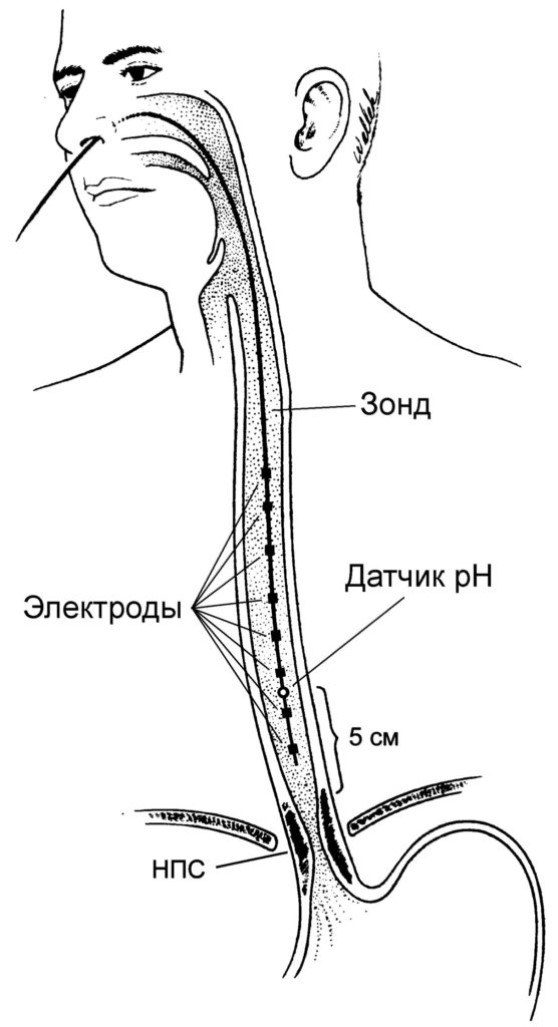
 При необходимости терапию дисфагии дополняют нитратами, оказывающими релаксирующий эффект, антихолинергическими средствами, ингибиторами фосфодиэстеразы, влияющими на нейромышечную регуляцию.
При необходимости терапию дисфагии дополняют нитратами, оказывающими релаксирующий эффект, антихолинергическими средствами, ингибиторами фосфодиэстеразы, влияющими на нейромышечную регуляцию. Нарушением глотания сопровождается ахалазия, системная склеродермия, сахарный диабет. Возможно развитие дисфагии вследствие приема эстрогенов и нитратсодержащих веществ и препаратов.
Нарушением глотания сопровождается ахалазия, системная склеродермия, сахарный диабет. Возможно развитие дисфагии вследствие приема эстрогенов и нитратсодержащих веществ и препаратов.