Кома ii степени характеризуется: Кома, или коматозное состояние — причины появления, симптомы заболевания, диагностика и способы лечения
Кома у ребенка. Что такое Кома у ребенка?
ВАЖНО
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Кома у ребенка — это нарушение сознания, сопровождающееся отсутствием психической деятельности, расстройствами всех видов чувствительности и двигательных функций. Основные причины патологии в педиатрии: перинатальные повреждения ЦНС, травмы головы, нейроинфекции и эндокринные расстройства. Для диагностики комы выполняется полное неврологическое обследование ребенка, стандартные анализы крови, методики нейровизуализации для установления этиологии. Интенсивная терапия включает адекватную оксигенацию, коррекцию водно-электролитного баланса и борьбу с отеком мозга, проведение этиопатогенетического лечения.
МКБ-10
R40.2 Кома неуточненная
- Причины
- Патогенез
- Классификация
- Симптомы комы у ребенка
- Осложнения
- Диагностика
- Лечение комы у ребенка
- Прогноз и профилактика
- Цены на лечение
Общие сведения
Кома (от греческого «koma» ‒ глубокий сон) является симптомокомплексом тяжелых повреждений нервной системы или метаболических нарушений, а не самостоятельным заболеванием. Состояние встречается у 5% детей, поступающих в отделение реанимации и интенсивной терапии (ОРИТ). В современной педиатрии проблема расстройств сознания очень актуальна, поскольку от слаженных действий врача в первые часы развития комы зависит прогноз для жизни ребенка и восстановления его неврологических функций.
Кома у ребенка
Причины
Нарушенное сознание отмечается при сотне различных патологических состояний.
- Внутричерепные процессы. Сюда относят любые церебральные повреждения, сопровождающиеся нарушениями сознания. У детей чаще встречаются воспалительные (менингиты, энцефалиты) и перинатальные поражения. Реже коматозное состояние наступает при опухолевых и сосудистых патологиях.
- Метаболические расстройства. Сахарный диабет — распространенная причина комы в школьном возрасте. Может вызываться как повышением, так и снижением уровня глюкозы в крови. Реже комы провоцируются нарушениями работы щитовидной железы (тиреотоксикоз, гипотиреоз), надпочечниковой недостаточностью.
- Соматические заболевания. Расстройства сознания бывают на терминальной стадии болезней почек и печени, когда происходит декомпенсация процесса, развивается недостаточность органов.

- Интоксикации. Для детей характерны экзогенные отравления бытовой химией, лекарственными препаратами, инсектицидами и сельскохозяйственными ядами. При этом у ребенка возникает тяжелая кома, которая усугубляется полиорганной недостаточностью.
Патогенез
Независимо от первичного этиологического фактора, развитие коматозного состояния идет по сходным механизмам и представлено несколькими типичными этапами. Церебральная недостаточность в основном вызвана расстройствами формирования и передачи нервных импульсов между участками головного мозга, что служит ответом на недостаточное снабжение органа кислородом и энергетическими соединениями. В нейронах нет запасов энергии, поэтому даже при кратковременных нарушениях сознание угнетается.
Постепенно нарастает гипоксия тканей, связанная с торможением дыхательного центра и отсутствием адекватной самостоятельной вентиляции легких. У ребенка происходят метаболические изменения, провоцирующие отек и набухание головного мозга и его оболочек. В это же время формируются расстройства регуляции вегетативных функций, которые усугубляют водно-электролитные нарушения и замыкают «порочный круг» патогенеза комы.
У ребенка происходят метаболические изменения, провоцирующие отек и набухание головного мозга и его оболочек. В это же время формируются расстройства регуляции вегетативных функций, которые усугубляют водно-электролитные нарушения и замыкают «порочный круг» патогенеза комы.
Классификация
По этиологическому фактору комы делят на цереброгенные, обусловленные поражением ЦНС, и нецереброгенные, которые возникают под действием метаболических, токсических или инфекционных факторов. По шкале Глазго патологическому состоянию соответствует оценка от 3 до 8 баллов. В практической медицине широко используется систематизация по тяжести, согласно которой выделяют 4 степени:
- Первая. Характеризуется реакцией ребенка на болевые раздражители, присутствием безусловных рефлексов, снижением кожной чувствительности, замедлением скорости реакции зрачков на свет.
- Вторая. Ребенок перестает реагировать на любые внешние раздражители, рефлексы частично сохранены.
 В этот период снижается тонус мышц, появляются патологические типы дыхания, сердечно-сосудистые расстройства.
В этот период снижается тонус мышц, появляются патологические типы дыхания, сердечно-сосудистые расстройства. - Третья. Сознание полностью отсутствует. У ребенка отмечается арефлексия. Тонус скелетной мускулатуры отсутствует. Зрачковый рефлекс не вызывается, из-за нарушений глоточного рефлекса возможен обратный заброс содержимого желудка.
- Четвертая. Запредельная кома, для которой характерны неподвижные зрачки, отсутствие самостоятельного дыхания и биоэлектрической активности мозга. Необратимое состояние, когда возможно только искусственное поддержание жизнедеятельности.
Симптомы комы у ребенка
Родители обнаруживают, что ребенок не реагирует на звуки и прикосновения, не открывает глаза, его руки и ноги безвольно лежат в неестественной позе. Кожные покровы могут иметь различный вид: бледные с синюшным оттенком, ярко-розовые, слишком сухие или покрытые липким потом. Иногда родители замечают стонущее или прерывистое дыхание, сопровождающееся хриплыми звуками. Лицо может быть загрязнено рвотными массами.
Лицо может быть загрязнено рвотными массами.
Специфические отличительные черты коматозного состояния зависят от особенностей повреждающего фактора. При ЧМТ зачастую видна кровь и открытая рана на голове, а произошедшие события можно установить по окружающей обстановке (падение на улице, ДТП, криминальное происшествие). При эпилептическом статусе у ребенка наблюдаются периодические судороги всего тела, выделение розовой пены изо рта, непроизвольные мочеиспускание и дефекация.
Для кетоацидотической комы типична сухость кожи и слизистых, запах ацетона из ротовой полости, редкое шумное дыхание. При гипогликемическом нарушении сознания коме предшествует период возбуждения, дрожь во всем теле, головокружение и предобморочное состояние. При наличии уремии от ребенка исходит резкий запах мочи, кожа сухая и покрыта расчесами, возможны редкие мышечные подергивания.
Осложнения
Показатель летальности при комах составляет 10-90% в зависимости от их причин и степени тяжести. Негативные последствия нарушения сознания делятся на 2 группы: непосредственно связанные с повреждением нейронов и обусловленные утратой нервной регуляции внутренних органов. Более опасна первая категория, которая включает остановку дыхания, критические расстройства гемодинамики, центральную гипертермию.
Негативные последствия нарушения сознания делятся на 2 группы: непосредственно связанные с повреждением нейронов и обусловленные утратой нервной регуляции внутренних органов. Более опасна первая категория, которая включает остановку дыхания, критические расстройства гемодинамики, центральную гипертермию.
Кома, если только она не вызвана травмой, свидетельствует о нарушениях работы организма и декомпенсации основного заболевания. У 88% пациентов в течение года после эпизода нарушенного сознания случается рецидив, который нередко приводит к летальному исходу. У 25% детей с ЧМТ выявляются отдаленные последствия, поэтому в ближайшие пару лет у них повторяется состояние комы.
Диагностика
Чтобы установить степень комы, достаточно осмотра, который проводится по стандартной схеме. Врач-реаниматолог обследует кожный покров, проверяет состояние дыхательной и сердечной деятельности, изучает функции ЧМН и безусловные рефлексы. У ребенка оценивают симптомы Брудзинского и Бабинского, двигательную реакцию и мышечный тонус.
- ЭКГ. Мониторинг сердечного ритма необходим для контроля за состоянием ребенка, обнаружения блокад, бради- или тахиаритмий, которые могли стать причиной потери сознания. При подозрении на кардиальную этиологию комы ЭКГ дополняют УЗИ сердца, коронарографией.
- Методы нейровизуализации. КТ или МРТ головного мозга производят для обнаружения очагов ишемии, новообразований, кровоизлияний в нервную ткань или мозговые желудочки. У младенцев информативно выполнение нейросонографии через незакрытый родничок. Для оценки церебральной электрической активности показана ЭЭГ.
- Исследование крови. В биохимическом анализе обращают внимание на уровень печеночных ферментов, показатели азотистых соединений, концентрацию основных электролитов. Обязательно исследуют кровь на концентрацию глюкозы. Для уточнения причины комы у ребенка могут потребоваться показатели коагулограммы.
Лечение комы у ребенка
На догоспитальном и госпитальном этапе обеспечивается недифференцированная терапия коматозных состояний, от своевременности и полноты которой зависит жизнь ребенка. Она направлена на стабилизацию витальных функций и поддержание адекватного уровня сознания до выяснения первопричины нарушений и их устранения. Лечение комы, проводимое в ОРИТ, включает следующие направления:
Она направлена на стабилизацию витальных функций и поддержание адекватного уровня сознания до выяснения первопричины нарушений и их устранения. Лечение комы, проводимое в ОРИТ, включает следующие направления:
- Восстановление кровообращения. При артериальной гипертензии давление снижают постепенно до показателей, которые на 10-15 мм рт. ст. превышают возрастную норму. Вводится магния сульфат, диабазол или аминофиллин. Артериальную гипотензию корректируют глюкокортикоидами. При нарушениях ритма применяют антиаритмические средства.
- Устранение отека мозга. Первая помощь при внутричерепной гипертензии и отеке нервных клеток — внутривенное введение ребенку дексаметазона. Далее рекомендована терапия диуретиками, вазоактивными препаратами и другими лекарствами с учетом вида мозгового отека.
- Нейропротекция. При любом уровне нарушений сознания показаны антиоксиданты, которые уменьшают степень повреждения нервной ткани и способствуют восстановлению уровня бодрствования.
 После улучшения состояния в схему лечения добавляют ноотропы.
После улучшения состояния в схему лечения добавляют ноотропы. - Симптоматическая терапия. При гипертермии назначают методы физического охлаждения и анальгетики-антипиретики. Судорожный синдром у ребенка купируется бензодиазепиновыми транквилизаторами или нейролептиками. Для прекращения рвоты вводятся антиэметики.
Одновременно с интенсивной терапией врачи осуществляется дифференциальную диагностику комы. После установления варианта коматозного состояния к лечению подключают профильных детских специалистов: эндокринолога, гастроэнтеролога, инфекциониста и т.д. Если врачи подозревают закрытую ЧМТ или объемное церебральное новообразование, ребенку необходима помощь нейрохирургов.
Прогноз и профилактика
Кома — крайне тяжелое состояние, которое без лечения заканчивается летальным исходом, поэтому прогноз определяется своевременностью и адекватностью терапии. При ранней коррекции патологии и устранении ее первопричины удается восстановить уровень бодрствованиям и неврологические функции. Длительное и глубокое нарушение сознания у ребенка считается прогностически неблагоприятным. Профилактика включает устранение этиологических факторов комы.
Длительное и глубокое нарушение сознания у ребенка считается прогностически неблагоприятным. Профилактика включает устранение этиологических факторов комы.
Вы можете поделиться своей историей болезни, что Вам помогло при лечении комы у ребенка.
Источники
- Детские болезни/ Н.П. Шабалов. — 2017.
- Симпозиум «Комы у детей»/ Н.В. Нагорная// Здоровье ребенка. — 2011.
- Коматозные состояния: дифференциальная диагностика и лечебная тактика на догоспитальном этапе/ Р.В. Хурса. — 2007.
- Диагностика и лечение коматозных состояний у детей/ Б.М. Блюхин// Неотложная терапия. — 2004.
- Настоящая статья подготовлена по материалам сайта: https://www.krasotaimedicina.ru/
ВАЖНО
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Черепно-мозговая травма
Черепно-мозговая травма — механическое повреждение черепа и (или) внутричерепных образований (головного мозга, мозговых оболочек, сосудов, черепных нервов). Составляет 25—30% всех травм, а среди летальных исходов при травмах ее удельный вес достигает 50—60%. Как причина смертности лиц молодого и среднего возраста Ч.-м. т. опережает сердечно-сосудистые и онкологические заболевания.
Черепно-мозговую травму по тяжести делят на 3 стадии: легкую, среднюю и тяжелую. К легкой Ч.-м. т. относят сотрясение мозга и ушибы мозга легкой степени; к средней тяжести — ушибы мозга средней степени; к тяжелой — ушибы мозга тяжелой степени, диффузное аксональное повреждение и сдавление мозга.
Основными клиническими формами черепно-мозговой травмы являются сотрясение мозга, ушибы мозга (легкой, средней и тяжелой степени), диффузное аксональное повреждение мозга и сдавление мозга.
Сотрясение головного мозга отмечается у 60—70% пострадавших. Легкая диффузная черепно-мозговая травма, характеризующаяся нарушением сознания. Хотя часто указывается на кратковременный характер этого нарушения, но четкой договоренности о его продолжительности нет. Обычно не наблюдается макро- и микроскопических повреждений мозгового вещества. На КТ и МРТ изменений нет. Также считается, что потеря сознания не является обязательной. Возможные изменения сознания: спутанность, амнезия (главный признак СГМ) или полная утрата сознания. После восстановления сознания возможны жалобы на головную боль, головокружение, тошноту, слабость, шум в ушах, приливы крови к лицу, потливость. Другие вегетативные симптомы и нарушение сна. Общее состояние больных быстро улучшается в течение 1-й, реже 2-й нед. после травмы.
Легкая диффузная черепно-мозговая травма, характеризующаяся нарушением сознания. Хотя часто указывается на кратковременный характер этого нарушения, но четкой договоренности о его продолжительности нет. Обычно не наблюдается макро- и микроскопических повреждений мозгового вещества. На КТ и МРТ изменений нет. Также считается, что потеря сознания не является обязательной. Возможные изменения сознания: спутанность, амнезия (главный признак СГМ) или полная утрата сознания. После восстановления сознания возможны жалобы на головную боль, головокружение, тошноту, слабость, шум в ушах, приливы крови к лицу, потливость. Другие вегетативные симптомы и нарушение сна. Общее состояние больных быстро улучшается в течение 1-й, реже 2-й нед. после травмы.
Ушиб (контузия) мозга. Различают ушибы головного мозга легкой, средней и тяжелой степени.
Ушиб головного мозга легкой степени отмечается у 10—15% больных с Ч.-м. т. Характеризуется нарушением сознания после травмы, длительность возможна до нескольких минут. После восстановления сознания типичны жалобы на головную боль, головокружение, тошноту и др. Неврологическая симптоматика обычно легкая (нистагм, признаки легкой пирамидной недостаточности в виде рефлекторных парезов в конечностях, менингеальные симптомы), чаще регрессирующая на 2—3 нед. после травмы. Лечение консервативное, проводится первоначально обязательно в стационарных условиях нейрохирургического отделения.
После восстановления сознания типичны жалобы на головную боль, головокружение, тошноту и др. Неврологическая симптоматика обычно легкая (нистагм, признаки легкой пирамидной недостаточности в виде рефлекторных парезов в конечностях, менингеальные симптомы), чаще регрессирующая на 2—3 нед. после травмы. Лечение консервативное, проводится первоначально обязательно в стационарных условиях нейрохирургического отделения.
Ушиб мозга средней степени отмечается у 8—10% пострадавших. Характеризуется выключением сознания после травмы продолжительностью от нескольких десятков минут до нескольких часов. Выражена амнезия (ретро-, кон-, антероградная). Головная боль нередко сильная. Может наблюдаться повторная рвота. Иногда отмечаются психические нарушения. Отчетливо проявляется очаговая симптоматика, характер которой обусловлен локализацией ушиба мозга; зрачковые и глазодвигательные нарушения, парезы конечностей, расстройства чувствительности, речи и др. Эти симптомы постепенно (в течение 3—5 нед. ) сглаживаются, но могут держаться и длительно. Лечение, в большинстве случаев, консервативное в нейрохирургическом отделении. В некоторых случаях, течение данного вида травмы осложняется появлением вторичных кровоизлияний и даже формированием внутримозговой гематомы, когда может потребоваться хирургическая помощь.
) сглаживаются, но могут держаться и длительно. Лечение, в большинстве случаев, консервативное в нейрохирургическом отделении. В некоторых случаях, течение данного вида травмы осложняется появлением вторичных кровоизлияний и даже формированием внутримозговой гематомы, когда может потребоваться хирургическая помощь.
Ушиб головного мозга тяжелой степени отмечается у 5—7% пострадавших. Характеризуется выключением сознания после травмы продолжительностью от суток до нескольких недель. Данный вид травмы особенно опасен тем, что проявляется нарушением стволовых функций головного мозга, наблюдаются тяжелые нарушения жизненно важных функций – дыхания и системной гемодинамики. Пациент госпитализируется в отделение реанимации. Лечением коллегиально занимается врач-нейрореаниматолог и врач-нейрохирург. Общемозговая и очаговая симптоматика регрессируют медленно. Характерны стойки остаточные явления в виде нарушений психики, двигательного дефицита.
В случае формирования внутримозговой гематомы, являющейся причиной сдавления головного мозга показано оперативное лечение – трепанация черепа, удаление гематомы.
Внутримозговая гематома правой височной доли.
Диффузное аксональное повреждение головного мозга характеризуется длительным (до 2—3 нед.) коматозным состоянием, выраженными стволовыми симптомами (парез взора вверх, разностояние глаз по вертикальной оси, двустороннее угнетение или выпадение световой реакции зрачков, нарушение или отсутствие окулоцефалического рефлекса и др.). Часто наблюдаются нарушения частоты и ритма дыхания, нестабильность гемодинамики. Характерной особенностью клинического течения диффузного аксонального повреждения является переход из длительной комы в стойкое или транзиторное вегетативное состояние, о наступлении которого свидетельствует появление ранее отсутствовавшего открывания глаз спонтанно либо в ответ на различные раздражения. При этом нет признаков слежения, фиксации взора или выполнения хотя бы элементарных инструкций (данное состояние называют апаллическим синдромом). Вегетативное состояние у таких больных длится от нескольких суток до нескольких месяцев и характеризуется функциональным и/или анатомическим разобщением больших полушарий и ствола мозга. По мере выхода из вегетативного состояния неврологические симптомы разобщения сменяются преимущественно симптомами выпадения. Среди них доминирует экстрапирамидный синдром с выраженной мышечной скованностью, дискоординацией, брадикинезией, олигофазией, гипомимией, мелкими гиперкинезами, атаксией. Одновременно четко проявляются нарушения психики: резко выраженная аспонтанность (безразличие к окружающему, неопрятность в постели, отсутствие любых побуждений к какой-либо деятельности), амнестическая спутанность, слабоумие и др. Вместе с тем наблюдаются грубые аффективные расстройства в виде гневливости, агрессивности.
По мере выхода из вегетативного состояния неврологические симптомы разобщения сменяются преимущественно симптомами выпадения. Среди них доминирует экстрапирамидный синдром с выраженной мышечной скованностью, дискоординацией, брадикинезией, олигофазией, гипомимией, мелкими гиперкинезами, атаксией. Одновременно четко проявляются нарушения психики: резко выраженная аспонтанность (безразличие к окружающему, неопрятность в постели, отсутствие любых побуждений к какой-либо деятельности), амнестическая спутанность, слабоумие и др. Вместе с тем наблюдаются грубые аффективные расстройства в виде гневливости, агрессивности.
КТ картина при диффузно-аксональном повреждении головного мозга (диффузный отек, множество мелких кровоизлияний).
Лечение данного вида травмы проводится консервативно с участием нейрореаниматолога, нейрохирурга, врача и инструктора ЛФК (проводится ранняя двигательная реабилитация с целью предупреждения формирования контрактур в суставах).
Сдавление (компрессия) головного мозга отмечается у 3—5% пострадавших. Характеризуется нарастанием через тот или иной промежуток времени после травмы либо непосредственно после нее общемозговых симптомов (появление или углубление нарушений сознания, усиление головной боли, повторная рвота, психомоторное возбуждение и т.д.), очаговых (появление или углубление гемипареза, фокальных эпилептических припадков и др.) и стволовых симптомов (появление или углубление брадикардии, повышение АД, ограничение взора вверх, тоничный спонтанный нистагм, двусторонние патологические знаки и др.).
Характеризуется нарастанием через тот или иной промежуток времени после травмы либо непосредственно после нее общемозговых симптомов (появление или углубление нарушений сознания, усиление головной боли, повторная рвота, психомоторное возбуждение и т.д.), очаговых (появление или углубление гемипареза, фокальных эпилептических припадков и др.) и стволовых симптомов (появление или углубление брадикардии, повышение АД, ограничение взора вверх, тоничный спонтанный нистагм, двусторонние патологические знаки и др.).
. Среди причин сдавления на первом месте стоят внутричерепные гематомы (эпидуральные, субдуральные, внутримозговые, внутрижелудочковые). Причиной сдавления мозга могут быть и вдавленные переломы костей черепа, очаги размозжения мозга, субдуральные гигромы, пневмоцефалия.
Эпидуральная гематома на компьютерной томограмме имеет вид двояковыпуклой, реже плосковыпуклой зоны повышенной плотности, примыкающей к своду черепа. Гематома имеет ограниченный характер и, как правило, локализуется в пределах одной-двух долей.
Эпидуральная гематома задней черепной ямки.
Лечение острых эпидуральных гематом.
Консервативное лечение:
— эпидуральная гематома объемом менее 30 см3, толщиной менее 15 мм, при смещении срединных структур менее 5 мм у пострадавших с уровнем сознания по ШКГ более 8 баллов и отсутствием очаговой неврологической симптоматики. Клинический контроль осуществляется в течение 72 часов с периодичностью каждые 3 часа.
Оперативное лечение
1. Экстренное оперативное вмешательство
острая эпидуральная гематома у пострадавшего в коме (менее 9 баллов по ШКГ) при наличии анизокории.
2. Срочное оперативное вмешательство
эпидуральная гематома более 30 см3 независимо от степени угнетения сознания по ШКГ. В отдельных случаях при незначительном превышении указанного объёма эпидуральной гематомы и полностью компенсированном состоянии пострадавшего с отсутствием симптоматики допустима консервативная тактика с динамическим КТ контролем ситуации.
Абсолютными показаниями к хирургическому лечению при повреждениях задней черепной ямки являются эпидуральные гематомы > 25 см3, повреждения мозжечка латеральной локализации > 20 см3, окклюзионная гидроцефалия, латеральная дислокация IV желудочка
Методы операций:
1.Декомпрессивная трепанация
2.Костно-пластическая трепанация
Для субдуральной гематомы на компьютерной томограмме чаще характерно наличие серповидной зоны измененной плотности плосковыпуклой, двояковыпуклой или неправильной формы.
Субдуральная гематома.
Лечение острых субдуральных гематом.
Оперативное лечение
1. При острой субдуральной гематоме толщиной >10 мм или смещении срединных структур > 5 мм независимо от неврологического статуса пострадавшего по ШКГ.
2. Пострадавшим в коме с субдуральной гематомой толщиной < 10 мм и смещением срединных структур < 5 мм, если наблюдается ухудшение неврологического статуса в динамике – нарастание глубины комы, появление стволовой симптоматики. У пострадавших с острой субдуральной гематомой, при наличии показаний к операции, хирургическое вмешательство должно быть выполнено в экстренном порядке. Удаление острой субдуральной гематомы осуществляется путем краниотомии в большинстве случаев с удалением костного лоскута и пластикой твердой мозговой
У пострадавших с острой субдуральной гематомой, при наличии показаний к операции, хирургическое вмешательство должно быть выполнено в экстренном порядке. Удаление острой субдуральной гематомы осуществляется путем краниотомии в большинстве случаев с удалением костного лоскута и пластикой твердой мозговой
Лечение вдавленных переломов костей черепа.
Оперативное лечение показано при наличии признаков повреждения твердой мозговой оболочки (ТМО), значительной внутричерепной гематомы, вдавления больше 1 см, вовлечения воздухоносных пазух, косметического дефекта.
Принципы оперативного лечения..
для снижения риска инфицирования рекомендуется раннее хирургическое вмешательство; устранение вдавления и хирургическая обработка раны являются основными элементами операции. При отсутствии инфицирования раны возможна первичная костная пластика.
Оскольчатый перелом костей черепа с наличием вдавления в полость черепа.
Прогноз при легкой Ч. -м. т. (сотрясение, ушиб мозга легкой степени) обычно благоприятный (при условии соблюдения рекомендованного пострадавшему режима и лечения).
-м. т. (сотрясение, ушиб мозга легкой степени) обычно благоприятный (при условии соблюдения рекомендованного пострадавшему режима и лечения).
При среднетяжелой травме (ушиб мозга средней степени) часто удается добиться полного восстановления трудовой и социальной активности пострадавших. У ряда больных развиваются лептоменингит и гидроцефалия, обусловливающие астенизацию, головные боли, вегетососудистую дисфункцию, нарушения статики, координации и другую неврологическую симптоматику.
При тяжелой травме (ушиб мозга тяжелой степени, диффузное аксональное повреждение, сдавление мозга) смертность достигает 30—50%. Среди выживших значительна инвалидизация, ведущими причинами которой являются психические расстройства, эпилептические припадки, грубые двигательные и речевые нарушения. При открытой Ч.-м. т. могут возникать воспалительные осложнения (менингит, энцефалит, вентрикулит, абсцессы мозга), а также ликворея.
Уровень сознания — клинические методы
Определение
Нормальное состояние сознания включает либо состояние бодрствования, осознания или бдительности, в котором большинство людей функционируют, когда они не спят, либо одну из признанных стадий нормального сна, из которой человек можно легко разбудить.
Аномальное состояние сознания труднее определить и охарактеризовать, о чем свидетельствует множество терминов, применяемых к измененным состояниям сознания различными наблюдателями. Среди таких терминов: помутнение сознания, спутанность сознания, делирий, летаргия, оглушение, ступор, деменция, гиперсомния, вегетативное состояние, акинетический мутизм, синдром запертости, кома, смерть мозга. Многие из этих терминов означают разные вещи для разных людей и могут оказаться неточными при передаче и записи информации о состоянии сознания пациента. Тем не менее, целесообразно дать как можно более точное определение некоторым терминам.
Помутнение сознания — очень легкая форма измененного психического статуса, при которой у больного наблюдается невнимательность и снижение бодрствования.
Спутанность сознания — это более глубокий дефицит, включающий дезориентацию, замешательство и трудности с выполнением команд.
Летаргия состоит из тяжелой сонливости, при которой пациент может быть разбужен умеренными раздражителями, а затем снова погрузиться в сон.
Оглушение — это состояние, похожее на летаргию, при котором у пациента снижен интерес к окружающему, замедлены реакции на стимуляцию и он склонен спать дольше, чем обычно, с сонливостью между состояниями сна.
Оцепенение означает, что только энергичные и повторяющиеся стимулы могут возбудить человека, и если его не беспокоить, пациент немедленно впадет в состояние невосприимчивости.
Кома — это состояние невозбуждаемой невосприимчивости.
Полезно иметь стандартную шкалу, по которой можно измерять уровни сознания. Это оказывается выгодным по нескольким причинам: улучшается информирование медицинского персонала о неврологическом состоянии пациента; рекомендации по диагностическому и терапевтическому вмешательству в определенных ситуациях могут быть привязаны к уровню сознания; а в некоторых ситуациях приблизительная оценка прогноза может быть сделана частично на основе оценки по шкале. Чтобы такая шкала была полезной, она должна быть простой для изучения, понимания и применения. Подсчет очков должен быть воспроизводим среди наблюдателей. Шкала комы Грейди (2) доказала свою эффективность в этом отношении. Он использовался более 10 лет в больнице Грейди Мемориал в Атланте, штат Джорджия, для измерения уровня сознания пациентов в нейрохирургическом отделении интенсивной терапии и в других местах. Пациент I степени лишь слегка спутан. Пациенту со степенью II требуется легкий болевой раздражитель (например, легкое постукивание острой булавкой по стенке грудной клетки) для соответствующего возбуждения, или он может проявлять воинственность или воинственность. Пациент III степени находится в коматозном состоянии, но адекватно реагирует на сильные болезненные раздражители, такие как давление на грудину или скручивание сосков. Пациенты IV степени неадекватно реагируют либо на декортикацию, либо на децеребрационную позу на такие глубоко болезненные стимулы, а пациенты степени V остаются вялыми при аналогичной стимуляции.
Подсчет очков должен быть воспроизводим среди наблюдателей. Шкала комы Грейди (2) доказала свою эффективность в этом отношении. Он использовался более 10 лет в больнице Грейди Мемориал в Атланте, штат Джорджия, для измерения уровня сознания пациентов в нейрохирургическом отделении интенсивной терапии и в других местах. Пациент I степени лишь слегка спутан. Пациенту со степенью II требуется легкий болевой раздражитель (например, легкое постукивание острой булавкой по стенке грудной клетки) для соответствующего возбуждения, или он может проявлять воинственность или воинственность. Пациент III степени находится в коматозном состоянии, но адекватно реагирует на сильные болезненные раздражители, такие как давление на грудину или скручивание сосков. Пациенты IV степени неадекватно реагируют либо на декортикацию, либо на децеребрационную позу на такие глубоко болезненные стимулы, а пациенты степени V остаются вялыми при аналогичной стимуляции.
Таблица 57.1
Шкала комы Грейди.
Было разработано множество других шкал комы. Большинство из них предназначены для конкретных подгрупп пациентов и предназначены не только для отражения уровня сознания, но и для включения дополнительных данных, чтобы можно было провести более надежные сравнения в исследовательских целях или сделать более надежные прогностические определения. Примером такой шкалы является шкала комы Глазго (). По этой шкале нормальное состояние оценивается в 15 баллов, а по мере ухудшения уровня сознания оценка становится меньше.
Таблица 57.2
Шкала комы Глазго.
Техника
Технику обследования пациента с измененным уровнем сознания можно разделить на три этапа. Во-первых, определить уровень самого сознания. Во-вторых, оценка пациента, тщательный поиск подсказок относительно причины спутанности сознания или комы. В-третьих, это наличие или отсутствие очаговости расстройства, как с точки зрения уровня дисфункции рострокаудальной нервной оси, так и специфического вовлечения структур коры или ствола мозга.
После того, как врач убедится в отсутствии неотложной угрозы жизни, такой как обструкция дыхательных путей или шок, обследование начинается с наблюдения за пациентом. Каково положение больного? Есть ли у пациента одна или несколько конечностей, расположенных необычным образом, что может свидетельствовать о параличе или спастичности? Глаза открыты или закрыты? Признает ли человек ваше присутствие или не обращает на него внимания? Если пациент в сознании, признает присутствие исследователя, хорошо ориентируется во времени и месте и не смущается при общих расспросах, то уровень сознания можно считать нормальным. Таким образом, человек может иметь нормальный уровень сознания, но при этом иметь субнормальные интеллектуальные способности, иметь очаговый неврологический дефицит, такой как афазия или гемипарез, или демонстрировать ненормальное содержание мыслей, как у больного шизофренией.
При произнесении имени больного нормальным тоном голоса или если при попытке простого разговора отмечается, что человек растерян, сонлив или безразличен, существует ненормальный уровень сознания. О людях, которые узнающе реагируют, когда их зовут по имени, и не впадают в сон, если их не беспокоить, можно сказать, что они находятся в коме I степени. Если изменение уровня сознания более серьезное, так что человек впадает в сон, когда его не беспокоят, и пробуждается только при легком постукивании булавкой по стенке грудной клетки, степень комы — II. В эту категорию также входят пациенты с органической дезориентацией, агрессивностью и отказом от сотрудничества (что можно увидеть в различных состояниях интоксикации) или молодые люди с умеренно тяжелой черепно-мозговой травмой.
О людях, которые узнающе реагируют, когда их зовут по имени, и не впадают в сон, если их не беспокоить, можно сказать, что они находятся в коме I степени. Если изменение уровня сознания более серьезное, так что человек впадает в сон, когда его не беспокоят, и пробуждается только при легком постукивании булавкой по стенке грудной клетки, степень комы — II. В эту категорию также входят пациенты с органической дезориентацией, агрессивностью и отказом от сотрудничества (что можно увидеть в различных состояниях интоксикации) или молодые люди с умеренно тяжелой черепно-мозговой травмой.
Если такие попытки, как произнесение имени пациента нормальным тоном голоса или легкое прокалывание кожи на грудной стенке булавкой, не дают ответа, исследователь должен выбрать более глубокий болевой раздражитель. Я предпочитаю щепотку или легкий поворот соска. Другие варианты включают давление на грудину, которое может быть применено кулаком, или сдавливание ногтевого ложа. Небольшие периареолярные кровоподтеки от повторяющегося скручивания сосков гораздо менее проблематичны для выздоравливающего пациента, чем хронически болезненные поднадкостничные или подногтевые кровоизлияния при последних вариантах. Ни в коем случае нельзя применять такой болевой раздражитель, как промывание ушей ледяной водой, пока не будет известно состояние внутричерепного давления. Затем отмечают реакцию пациента на глубокий болевой раздражитель. О пациенте, который вздрагивает и/или пытается соответствующим образом отразить глубокую боль, можно сказать, что он находится в коме III степени.
Ни в коем случае нельзя применять такой болевой раздражитель, как промывание ушей ледяной водой, пока не будет известно состояние внутричерепного давления. Затем отмечают реакцию пациента на глубокий болевой раздражитель. О пациенте, который вздрагивает и/или пытается соответствующим образом отразить глубокую боль, можно сказать, что он находится в коме III степени.
Однако глубокая болевая стимуляция может привести к аномальным постуральным рефлексам, как односторонним, так и двусторонним. Двумя наиболее распространенными являются декортикационная и децеребрационная поза. В обоих состояниях нижняя конечность демонстрирует разгибание в колене, внутреннюю ротацию и подошвенное сгибание в лодыжке. При декоративной позе верхняя конечность удерживается приведенной в плечевом суставе и согнутой в локтевом, лучезапястном и пястно-фаланговых суставах. В децеребрированном состоянии верхняя конечность приведена в плече, жестко выпрямлена и ротирована внутрь в локтевом суставе. В любом случае пациент, проявляющий такую позу в ответ на глубокую боль, оценивается как кома IV степени. Пациент, сохраняющий состояние вялой невосприимчивости, несмотря на глубокую болевую стимуляцию, находится в коме V степени.
Пациент, сохраняющий состояние вялой невосприимчивости, несмотря на глубокую болевую стимуляцию, находится в коме V степени.
После того, как уровень сознания определен, следует тщательно проверить намеки на причину изменения уровня сознания. В большинстве случаев анамнез (который можно получить от пациента или его сопровождающих или из доступных медицинских карт) более ценен, чем обследование. Однако история не всегда доступна, и во всех случаях требуется тщательное изучение. Жизненно важные признаки могут явно свидетельствовать об инфекции, гипертонии, шоке или повышенном внутричерепном давлении с брадикардией. Есть ли признаки травмы головы или другого места? Тщательно осмотрите кожу головы на наличие ссадин или ушибов, и если видна кровь, объясните причину, даже если для этого придется сбрить часть кожи головы. Имеются ли периорбитальные или ретроаурикулярные экхимозы или кровь за барабанной перепонкой, что свидетельствует о переломе основания черепа? Есть ли отек диска зрительного нерва или внутриглазное кровоизлияние? Конъюнктива иктерична, печень увеличена или у больного астериксис? Являются ли губы или ногтевые ложа обесцвеченными или бледными, что свидетельствует об анемии или легочной дисфункции? Ригидность шеи — предупреждение о менингите или субарахноидальном кровоизлиянии. Есть ли что-нибудь, что указывает на интоксикацию наркотиками или ядами, например, необычный запах изо рта или тела или суженные зрачки?
Есть ли что-нибудь, что указывает на интоксикацию наркотиками или ядами, например, необычный запах изо рта или тела или суженные зрачки?
Следующим шагом является попытка локализовать проблему, которая приводит к изменению сознания, во-первых, пытаясь локализовать дисфункцию на уровне рострокаудальной нервной оси, а во-вторых, путем поиска очаговых признаков, таких как специфический дефицит черепных нервов, аномальные рефлексы. или двигательная асимметрия.
Уровень сознания в определенной степени определяет уровень функциональных нарушений в пределах оси нерва. Пациент, который квалифицируется как степень I или II, имеет корковую или диэнцефальную дисфункцию. У пациента III степени имеется физиологическая дисфункция над средним мозгом. Кома IV степени указывает на дисфункцию выше уровня ножки мозга или моста, а при коме V степени может работать только продолговатый мозг. Наблюдение за паттерном дыхания может еще больше подтвердить впечатление исследователя о дисфункциональном уровне (). Дыхание Чейна-Стокса означает проблемы в промежуточном мозге или выше; центральная нейрогенная гипервентиляция (встречается редко) указывает на трудности в верхней части среднего мозга; апнейстическое дыхание предполагает функциональный дефицит моста; а атаксический паттерн дыхания предполагает дорсомедиальную дисфункцию мозгового вещества. Для документирования таких изменений необходимо наблюдение за частотой, характером и глубиной дыхания в течение как минимум нескольких минут. Как и дыхательные паттерны, размер и реактивность зрачков могут быть использованы для дальнейшего подтверждения уровня дисфункции внутри оси головного мозга (11). Маленькие реактивные зрачки предполагают диэнцефальную локализацию, часто на метаболической основе. Большие зрачки, которые автоматически расширяются и сужаются (гиппус), но не реагируют на прямой световой раздражитель, указывают на тектальное поражение. Фиксированные зрачки в среднем положении располагаются в среднем мозге. Двусторонние суженные зрачки указывают на проблемы с мостом.
Дыхание Чейна-Стокса означает проблемы в промежуточном мозге или выше; центральная нейрогенная гипервентиляция (встречается редко) указывает на трудности в верхней части среднего мозга; апнейстическое дыхание предполагает функциональный дефицит моста; а атаксический паттерн дыхания предполагает дорсомедиальную дисфункцию мозгового вещества. Для документирования таких изменений необходимо наблюдение за частотой, характером и глубиной дыхания в течение как минимум нескольких минут. Как и дыхательные паттерны, размер и реактивность зрачков могут быть использованы для дальнейшего подтверждения уровня дисфункции внутри оси головного мозга (11). Маленькие реактивные зрачки предполагают диэнцефальную локализацию, часто на метаболической основе. Большие зрачки, которые автоматически расширяются и сужаются (гиппус), но не реагируют на прямой световой раздражитель, указывают на тектальное поражение. Фиксированные зрачки в среднем положении располагаются в среднем мозге. Двусторонние суженные зрачки указывают на проблемы с мостом.
Таблица 57.3
Некоторые аномальные формы дыхания, обнаруживаемые у коматозных пациентов.
Таблица 57.4
Возможные формы зрачка у коматозных пациентов.
Исследование так называемых стволовых рефлексов имеет первостепенное значение при обследовании пациента в состоянии комы III, IV или V степени (). Все полагаются на целостность центров моста или дорсальной части среднего мозга. Как подчеркивалось ранее, калорический тест с холодной водой не следует проводить до тех пор, пока не будет известно состояние внутричерепного давления пациента. Орошение барабанной перепонки ледяной водой вызывает такую боль, что реакции Вальсальвы у пациента может быть достаточно, чтобы инициировать грыжу в и без того напряженной ситуации заметного повышения внутричерепного давления. Предлагаемые методы проверки этих рефлексов описаны в .
Таблица 57.5
Рефлексы ствола мозга.
Дальнейшее обследование может быть полезным для выявления таких признаков, как одностороннее расширение зрачка, фокальная недостаточность черепных нервов, асимметрия движений, свидетельствующая о гемипарезе, аномальные движения, свидетельствующие о судорожной активности, рефлекторная асимметрия или фокальная сенсорная аномалия, которые помогут в дальнейшем локализовать очаг поражения в центральной нервной системе. Конкретные методы такого обследования описаны в другом месте.
Конкретные методы такого обследования описаны в другом месте.
Основы науки
Точные связи нейронов, которые модулируют бдительность, бодрствование, нормальный сон и сонливость, точно не определены. Отдельная группа нейронов, ретикулярная формация, расположена в перивентрикулярных областях среднего мозга, моста и продолговатого мозга. Помимо модуляции различных взаимосвязанных путей в стволе мозга, эта группа нейронов связана с уровнями бдительности и бодрствования. Предполагается, что от этой ретикулярной формации исходит диффузная группа нейронных связей, проецирующихся вверх по среднему мозгу в таламические структуры, а затем в кору. Эта система называется восходящей ретикулярной активирующей системой (ВРАС). ARAS получает информацию от всех сенсорных систем, а эфферентные связи обширны. Считается, что эта система отвечает за модуляцию бдительности и сна. Таким образом, любое нарушение этой системы может привести к изменению уровня сознания (или к нарушениям цикла сна).
Механизмы, вызывающие дисфункцию дуги ARAS, различаются и сильно зависят от этиологии заболевания. В некоторых случаях может быть более одного фактора, способствующего ухудшению уровня сознания. Например, метаболические и токсические заболевания обычно вызывают ступор или кому, влияя на метаболизм нейронов или изменяя передачу нейронов. В таких ситуациях дисфункция обычно возникает упорядоченным рострокаудальным образом, начиная с корковой дисфункции и последовательно вовлекая промежуточный мозг, средний мозг, мост и продолговатый мозг (такая прогрессия характерна для индукции и поддержания общей анестезии). На раннем этапе, при поражении коры, могут возникать судороги или другие аномальные модели движений, которые модулируются корой (например, миоклонус).
Необычно, чтобы супратенториальное объемное образование приводило к значительному изменению уровня сознания, если только оно не было достаточно большим или не затрагивало оба полушария. Наоборот, прогрессирующий ступор или кома при таком поражении могут быть отнесены к отдельному физиологическому процессу на уровне ствола мозга или к вторичным воздействиям на ствол мозга смещений и грыж. Примером первого может быть ассоциация посттравматической супратенториальной субдуральной гематомы с растяжением аксонов и разрывом на уровне ствола мозга. Последнее лучше всего иллюстрируется кратким описанием транстенториальной грыжи и ее последствий. Когда супратенториальное объемное образование становится достаточно большим, чтобы сместить медиальную часть височной доли над тенториальным краем, у пациента может развиться ипсилатеральный частичный паралич третьего нерва, характеризующийся расширением зрачка и птозом, и, возможно, гомонимная гемианопсия из-за затылочной ишемии из-за компрессии. ипсилатеральной задней мозговой артерии по тенториальному краю. Поскольку ствол мозга скручивается и искривляется в пределах тенториального отверстия, в нем могут развиваться небольшие участки кровоизлияния или ишемии, что приводит к изменениям уровня сознания.
Примером первого может быть ассоциация посттравматической супратенториальной субдуральной гематомы с растяжением аксонов и разрывом на уровне ствола мозга. Последнее лучше всего иллюстрируется кратким описанием транстенториальной грыжи и ее последствий. Когда супратенториальное объемное образование становится достаточно большим, чтобы сместить медиальную часть височной доли над тенториальным краем, у пациента может развиться ипсилатеральный частичный паралич третьего нерва, характеризующийся расширением зрачка и птозом, и, возможно, гомонимная гемианопсия из-за затылочной ишемии из-за компрессии. ипсилатеральной задней мозговой артерии по тенториальному краю. Поскольку ствол мозга скручивается и искривляется в пределах тенториального отверстия, в нем могут развиваться небольшие участки кровоизлияния или ишемии, что приводит к изменениям уровня сознания.
Массовые поражения ствола головного мозга вызывают кому вследствие прямого воздействия на ретикулярную формацию. Повреждения мозжечка могут вызывать кому из-за вторичной компрессии ствола мозга.
Клиническое значение
При обследовании пациента с изменением уровня сознания клиницист должен в первую очередь помнить о наиболее частых причинах комы. Лидируют в списке различные метаболические и токсические нарушения головного мозга, такие как нарушения кислотно-щелочного равновесия, нарушения обмена кислорода или глюкозы, уремическая и печеночная энцефалопатия, передозировка лекарств и отравление. Эпилепсия и различные постсудорожные состояния могут проявляться измененным сознанием. Цереброваскулярные расстройства, такие как ишемический или эмболический инсульт, внутримозговое или субарахноидальное кровоизлияние, также являются частыми причинами ступора или комы. Причиной может быть инфекция (менингит, абсцесс головного мозга или энцефалит). Внутричерепные последствия черепно-мозговой травмы часто приводят к изменению сознания, как и опухоли головного мозга, как первичные, так и метастатические. Иногда могут действовать две или более этиологии; например, алкоголик в коме II степени с повышенным уровнем алкоголя в крови и субдуральной гематомой.
Следовательно, анамнез важен для диагностики причин измененных уровней сознания. Знание временного хода и последовательности развития симптомов или наличия сопутствующих болезненных состояний является наиболее полезным.
Применяя систематический подход к оценке пациента, находящегося в спутанном, оглушенном или коматозном состоянии, можно сделать много выводов относительно возможной этиологии. Сначала определяют уровень комы, затем ищут физические признаки, которые могут указывать на причины, а затем дополнительно локализуют уровень дисфункции в пределах нервной оси. Информация, собранная в ходе такой оценки, послужит для адаптации последующих диагностических и терапевтических шагов.
Ссылки
-
Fisher CM. Неврологическое обследование коматозного больного. Акта Нейрол Сканд. 1969; 45 (Приложение 36): 1–56. [PubMed: 5781179]
-
Дженнет Б., Бонд М. Оценка исхода после тяжелого повреждения головного мозга: практическая шкала. Ланцет.
 1975; 1: 480–84. [PubMed: 46957]
1975; 1: 480–84. [PubMed: 46957] -
Плам Ф., Познер Дж.Б. Диагностика ступора и комы, 3-е изд. Philadelphia: F.A. Davis, 1980.
Печеночная энцефалопатия: определение, клиническая классификация и принципы диагностики
Наркотики. 2019; 79 (Приложение 1): 5–9.
Опубликовано в Интернете 31 января 2019 г. doi: 10.1007/s40265-018-1018-z
Информация об авторе Информация об авторских правах и лицензии Отказ от ответственности
В общем, он Патическая энцефалопатия (ГЭ) определяется как дисфункция головного мозга, вызванная при печеночной недостаточности и/или порто-системном шунтировании крови. Эта статья относится к так называемому HE типа C: то есть HE у пациентов с циррозом печени. Он проявляется широким спектром неврологических или психических нарушений, начиная от субклинических изменений, обнаруживаемых только при нейропсихологической или нейрофизиологической оценке, до комы. Для оценки степени HE было разработано несколько шкал. Наиболее часто используются критерии Вест-Хейвена (WHC), которые различают четыре степени клинически выраженной ПЭ. Считается, что пациенты с циррозом печени без явных клинических симптомов ПЭ, но нейропсихологические или нейрофизиологические данные, указывающие на дисфункцию головного мозга, имеют минимальную печеночную энцефалопатию (МГЭ). Для упрощения некоторые эксперты предлагают различать скрытые HE (MHE плюс HE степени I по WHC) и явные HE (II–IV степени WHC). Диагностика как МГЭ, так и явной ПЭ затруднена тем фактом, что ни один из симптомов ПЭ или результаты различных диагностических мероприятий не являются специфическими. Таким образом, диагноз HE или MHE может быть поставлен только после исключения других возможных причин дисфункции головного мозга.
Для оценки степени HE было разработано несколько шкал. Наиболее часто используются критерии Вест-Хейвена (WHC), которые различают четыре степени клинически выраженной ПЭ. Считается, что пациенты с циррозом печени без явных клинических симптомов ПЭ, но нейропсихологические или нейрофизиологические данные, указывающие на дисфункцию головного мозга, имеют минимальную печеночную энцефалопатию (МГЭ). Для упрощения некоторые эксперты предлагают различать скрытые HE (MHE плюс HE степени I по WHC) и явные HE (II–IV степени WHC). Диагностика как МГЭ, так и явной ПЭ затруднена тем фактом, что ни один из симптомов ПЭ или результаты различных диагностических мероприятий не являются специфическими. Таким образом, диагноз HE или MHE может быть поставлен только после исключения других возможных причин дисфункции головного мозга.
Печеночная энцефалопатия (HE) представляет собой серьезное осложнение тяжелой острой или хронической печеночной недостаточности, характеризующееся преимущественно изменениями личности, сознания, когнитивных функций и двигательной функции. В зависимости от первопричины традиционно различают три типа ПЭ: тип А как эссенциальный компонент острой печеночной недостаточности, тип В как следствие порто-системных шунтов при отсутствии нарушений функции печени и тип С у больных с циррозом печени и порто- -системный шунт [1]. Текущая дискуссия касается вопроса о том, следует ли рассматривать HE у пациентов с острой хронической печеночной недостаточностью отдельно (как тип D), поскольку она клинически, патофизиологически и прогностически отличается от типов A–C [2]. Эта статья в первую очередь касается HE типа C.
В зависимости от первопричины традиционно различают три типа ПЭ: тип А как эссенциальный компонент острой печеночной недостаточности, тип В как следствие порто-системных шунтов при отсутствии нарушений функции печени и тип С у больных с циррозом печени и порто- -системный шунт [1]. Текущая дискуссия касается вопроса о том, следует ли рассматривать HE у пациентов с острой хронической печеночной недостаточностью отдельно (как тип D), поскольку она клинически, патофизиологически и прогностически отличается от типов A–C [2]. Эта статья в первую очередь касается HE типа C.
В большинстве случаев HE типа C возникает эпизодически в ответ на хорошо известные провоцирующие факторы (таблица). Однако у пациентов также может наблюдаться хроническое прогрессирующее или хроническое персистирующее течение заболевания, особенно при наличии обширного порто-системного шунтирования [3]. Эти пациенты могут оставаться в стадии HE I или II с вкраплениями эпизодов HE III–IV степени, несмотря на проводимую терапию. Читать и др. [4] описали отчетливые персистирующие нервно-психические синдромы у 21 пациента с хроническим заболеванием печени и обширным порто-системным шунтированием: у шести было «преобладающее психическое расстройство, напоминающее шизофрению или манию», у пяти — «параплегия», у пяти — «нарушение мозжечка и базальных ганглиев, у троих были «пароксизмальные расстройства сознания или мышечные спазмы», а у двоих — «локализованное или генерализованное корковое заболевание». Данные о распространенности хронического прогрессирующего или персистирующего HE немногочисленны. При поперечном анализе 214 пациентов с циррозом печени различной этиологии цирроз-ассоциированный паркинсонизм выявлен у 4,2% больных, печеночная миелопатия у 1,9% больных.% [5]. Следует отметить, что в отличие от эпизодической ПЭ эти хронические прогрессирующие варианты не реагируют на классическую аммиакоснижающую терапию, что указывает на иную патофизиологию. Однако после трансплантации печени наблюдается улучшение [1].
Читать и др. [4] описали отчетливые персистирующие нервно-психические синдромы у 21 пациента с хроническим заболеванием печени и обширным порто-системным шунтированием: у шести было «преобладающее психическое расстройство, напоминающее шизофрению или манию», у пяти — «параплегия», у пяти — «нарушение мозжечка и базальных ганглиев, у троих были «пароксизмальные расстройства сознания или мышечные спазмы», а у двоих — «локализованное или генерализованное корковое заболевание». Данные о распространенности хронического прогрессирующего или персистирующего HE немногочисленны. При поперечном анализе 214 пациентов с циррозом печени различной этиологии цирроз-ассоциированный паркинсонизм выявлен у 4,2% больных, печеночная миелопатия у 1,9% больных.% [5]. Следует отметить, что в отличие от эпизодической ПЭ эти хронические прогрессирующие варианты не реагируют на классическую аммиакоснижающую терапию, что указывает на иную патофизиологию. Однако после трансплантации печени наблюдается улучшение [1]. Таблица 1
Таблица 1
Открыть в отдельном окне
Каждый эпизод явной ПЭ связан с повышенным риском повторных эпизодов манифестной ПЭ и увеличения годовой смертности [1]. HE высокой степени также связана с повышенным риском смерти по сравнению с HE низкой степени [2].
Классификация
Критерии Вест-Хейвена (WHC) наиболее часто используются для классификации HE [1]. Эта система классификации различает четыре степени клинически манифестной HE (таблица). При I степени у больных отмечается дефицит внимания и некоторые малозаметные изменения личности, очевидные преимущественно для их близких. При II степени наиболее интригующей находкой является дезориентация во времени в сочетании, например, с неадекватным поведением и вялостью. При III степени больные находятся в ступоре, но реагируют на раздражители. Они также дезориентированы в отношении места и ситуации и могут проявлять странное поведение. При IV степени больные находятся в коме.
При II степени наиболее интригующей находкой является дезориентация во времени в сочетании, например, с неадекватным поведением и вялостью. При III степени больные находятся в ступоре, но реагируют на раздражители. Они также дезориентированы в отношении места и ситуации и могут проявлять странное поведение. При IV степени больные находятся в коме.
Таблица 2
Классификация HE в соответствии с WHC и конкурирующими критериями ISHEN, которые противопоставляют скрытую и явную печеночную энцефалопатию [1] с разрешения Wiley & Sons
HE печеночная энцефалопатия, ISHEN Международное общество печеночной энцефалопатии и метаболизма азота, MHE минимальная печеночная энцефалопатия, WHC критерии West Haven
Когда стало очевидно, что у пациентов без клинических признаков ПЭ могут наблюдаться изменения функции головного мозга по нейропсихологическим или нейрофизиологическим показателям, к этой системе был добавлен пятый класс: так называемая субклиническая или минимальная ПЭ (МГЭ).
Использование системы классификации WHC неоднократно подвергалось сомнению, особенно ее надежность при оценке HE I. Хотя это должно быть возможно при надлежащей клинической оценке, некоторые эксперты рекомендуют объединять MHE и HE степени I и классифицировать как «скрытую HE». », что контрастирует с «явной» HE с клиническими степенями 2–4 [6]. В таблице, перепечатанной с разрешения Американской ассоциации изучения заболеваний печени/Европейской ассоциации изучения печени [1], сравниваются эти системы классификации и приводятся рабочие критерии и комментарии по их использованию.
Помимо нарушений сознания и когнитивной дисфункции характерными признаками ПЭ являются двигательные симптомы. В частности, двигательные симптомы включают экстрапирамидные и мозжечковые признаки, такие как гипомимия, брадикинезия, ригидность, тремор, дизартрия, атаксия и хлопающий тремор (астериксис), который, вероятно, является наиболее часто упоминаемым двигательным симптомом HE. Следует отметить, что эти симптомы не привязаны строго к определенной степени HE. Астериксис, например, может присутствовать при отсутствии изменений познания или сознания. Таким образом, градация — если необходимо — должна производиться с точки зрения уровня сознания.
Астериксис, например, может присутствовать при отсутствии изменений познания или сознания. Таким образом, градация — если необходимо — должна производиться с точки зрения уровня сознания.
Когнитивная дисфункция часто предшествует дальнейшим симптомам HE и может быть обнаружена только с помощью психометрических тестов. Затрагиваемыми когнитивными областями являются внимание, зрительно-конструктивные способности и психомоторная скорость и точность [6].
Поскольку даже эти субклинические симптомы имеют важное значение в повседневной жизни пациента, как указано Монтаньезе и Баджаджем [7] в этом Приложении, продолжаются усилия по разработке диагностической процедуры для MHE, которая была бы чувствительной, специфичной и простой в применении. Разные группы предпочитают разные тесты, но существует консенсус в отношении того, что применяемые тесты должны оценивать как минимум две разные когнитивные области [1]. MHE диагностируется, если субъект достигает результатов хуже, чем -2 диапазона стандартных отклонений (SD) от норм с поправкой на возраст и, при необходимости, норм с поправкой на образование в двух разных тестах, если тесты не являются частью стандартизированной батареи. В противном случае применяются нормы для аккумуляторной батареи. Согласно литературным данным, тесты, используемые для диагностики MHE, включают тесты на соединение чисел (NCT) A и B, тест на числовой символ, тест на блок-схему, тест на синдром портосистемной энцефалопатии (PSE), обеспечивающий психометрическую оценку печеночной энцефалопатии (PHES). , тест ингибиторного контроля, тест Струпа, тест сканирования, тест непрерывного времени реакции, набор тестов когнитивных исследований наркотиков (CDR) или повторяющийся набор тестов для оценки нейропсихологического статуса (RBANS) [1, 8]. Только тест синдрома PSE [6] был разработан специально для диагностики минимальной ПЭ; ни один из них, включая тест синдрома PSE, не дает результатов, специфичных для HE. Чрезвычайно важно, чтобы нормы, полученные от местного населения, были доступны для измерения, применяемого при любом диагностическом подходе.
В противном случае применяются нормы для аккумуляторной батареи. Согласно литературным данным, тесты, используемые для диагностики MHE, включают тесты на соединение чисел (NCT) A и B, тест на числовой символ, тест на блок-схему, тест на синдром портосистемной энцефалопатии (PSE), обеспечивающий психометрическую оценку печеночной энцефалопатии (PHES). , тест ингибиторного контроля, тест Струпа, тест сканирования, тест непрерывного времени реакции, набор тестов когнитивных исследований наркотиков (CDR) или повторяющийся набор тестов для оценки нейропсихологического статуса (RBANS) [1, 8]. Только тест синдрома PSE [6] был разработан специально для диагностики минимальной ПЭ; ни один из них, включая тест синдрома PSE, не дает результатов, специфичных для HE. Чрезвычайно важно, чтобы нормы, полученные от местного населения, были доступны для измерения, применяемого при любом диагностическом подходе.
Поскольку нормы для PHES были ранее разработаны в различных странах, включая Германию, Испанию, Италию, Францию, Великобританию, Турцию, Данию и Китай, тест часто используется для диагностики MHE. Он состоит из пяти подтестов «бумага-карандаш»: NCT A и B, тест цифровых символов, тест последовательного расстановки точек и тест трассировки линий. Результаты по каждому из этих подтестов сравнивают с возрастными нормативными данными и переводят в баллы от + 1 до – 3 в зависимости от того, на сколько SD значение теста у пациента отличается от среднего значения в нормальной популяции. Поскольку время, необходимое для завершения задания, и количество ошибок в тесте на отслеживание линий рассматриваются отдельно, пациенты могут быть распределены между + 6 и − 18 баллами. Принимая во внимание результаты теста в нормальной популяции, а также у пациентов с клинически выраженной HE (OHE), граница между нормальными и аномальными результатами была установлена на уровне - 4 балла для немецкой версии [6]. Обратите внимание, что разные версии теста PHES используются разными группами, поэтому результаты теста следует сравнивать с осторожностью, если неясно, использовались ли идентичные версии батареи [9].
Он состоит из пяти подтестов «бумага-карандаш»: NCT A и B, тест цифровых символов, тест последовательного расстановки точек и тест трассировки линий. Результаты по каждому из этих подтестов сравнивают с возрастными нормативными данными и переводят в баллы от + 1 до – 3 в зависимости от того, на сколько SD значение теста у пациента отличается от среднего значения в нормальной популяции. Поскольку время, необходимое для завершения задания, и количество ошибок в тесте на отслеживание линий рассматриваются отдельно, пациенты могут быть распределены между + 6 и − 18 баллами. Принимая во внимание результаты теста в нормальной популяции, а также у пациентов с клинически выраженной HE (OHE), граница между нормальными и аномальными результатами была установлена на уровне - 4 балла для немецкой версии [6]. Обратите внимание, что разные версии теста PHES используются разными группами, поэтому результаты теста следует сравнивать с осторожностью, если неясно, использовались ли идентичные версии батареи [9]. ]. Еще более важно учитывать, что нормы, предусмотренные или используемые, например, в Италии или Испании, основаны только на пяти результатах испытаний: для теста на отслеживание линии необходимое время и количество ошибок объединяются и рассматриваются как единый фактор. , «время, взвешенное по ошибкам» [9]. Есть даже разница в подсчете этого «взвешенного» балла. Здесь рекомендуется пороговое значение ≤ − 4 с использованием соответствующих национальных норм.
]. Еще более важно учитывать, что нормы, предусмотренные или используемые, например, в Италии или Испании, основаны только на пяти результатах испытаний: для теста на отслеживание линии необходимое время и количество ошибок объединяются и рассматриваются как единый фактор. , «время, взвешенное по ошибкам» [9]. Есть даже разница в подсчете этого «взвешенного» балла. Здесь рекомендуется пороговое значение ≤ − 4 с использованием соответствующих национальных норм.
Несмотря на эти различия, тест PHES считается ценным инструментом для диагностики MHE во всем мире. Чувствительность теста для диагностики ПЭ составила 9 баллов.6%, а специфичность (в соответствии с определением) составила 100% при сравнении результатов тестов пациентов с клинически выраженным ОГЭ и здоровых лиц в валидационном исследовании [6]: 22% пациентов без клинических признаков ПЭ достигли аномальных результатов в батарее PHES и были классифицированы как имеющие MHE. Кампанья и др. [10] недавно обнаружили аномальные результаты PHES у 42,7% из 295 пациентов с циррозом печени, но без OHE [ n = 50 (17%) имели HE 1 степени, 76 (26%) имели MHE].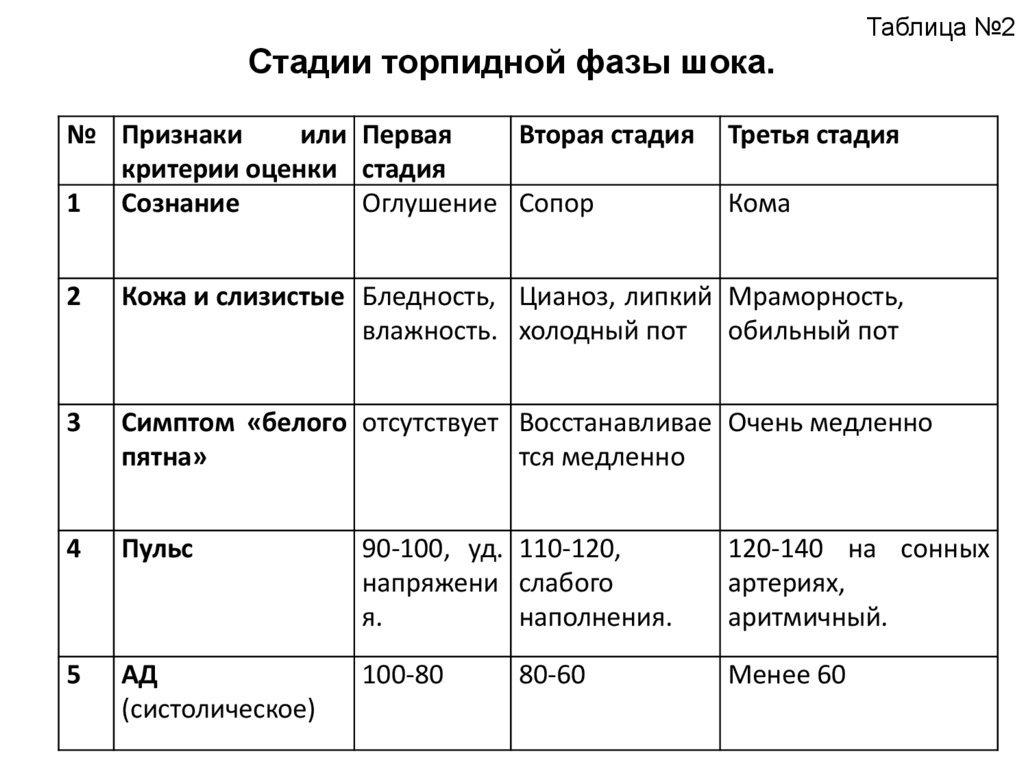
В настоящее время тест PHES широко считается золотым стандартом, который также следует использовать для оценки новых подходов к диагностике MHE или скрытой HE. Совсем недавно это было сделано для теста на имена животных (ANT) [10], в котором испытуемых просят назвать как можно больше животных в течение 1 минуты. После грубой поправки на влияние возраста и образования авторы определили пороговые значения для (упрощенной) оценки S-ANT, которые, по их мнению, могут быть использованы для оценки когнитивной функции пациентов. Оценка ≥ 15 указывает на вероятность около 80% отсутствия у субъекта когнитивной дисфункции, оценка < 10 указывает на наличие энцефалопатии с вероятностью около 80% [10].
Специализированные центры часто используют компьютерный анализ электроэнцефалограммы (ЭЭГ) и/или критическую частоту мельканий (КЧМ) в дополнение к психометрическим показателям для диагностики МГЭ [11, 12]. Однако широкому использованию ЭЭГ в качестве диагностического инструмента препятствует ограниченный доступ к этому методу. Для оценки КФС можно использовать портативный анализатор Гепатонорм ® , например, без специальных знаний, и поэтому этот метод представляется более применимым, чем ЭЭГ.
Для оценки КФС можно использовать портативный анализатор Гепатонорм ® , например, без специальных знаний, и поэтому этот метод представляется более применимым, чем ЭЭГ.
Комбинация различных нейропсихологических и нейрофизиологических диагностических подходов представляется рациональной, поскольку при сравнении различных доступных показателей нет полного совпадения результатов [11–15]. В последнее время для скрининга рекомендована комбинация наиболее часто используемых в настоящее время методов — PHES, ЭЭГ и КЧФ [12].
Диагностика HE, клинически явной или нет, по-прежнему требует клинических навыков. Ни клинические симптомы, наблюдаемые у пациентов с ПЭ, ни нейропсихологические или нейрофизиологические данные, характерные для ПЭ, не являются специфическими. Таким образом, диагноз ПЭ может быть поставлен только после исключения других возможных причин дисфункции головного мозга у каждого отдельного пациента. Наконец, ответ на лечение может быть лучшим показателем для подтверждения диагноза.
В дополнение к основному заболеванию печени или осложнениям цирроза печени необходимо также учитывать сопутствующие заболевания. Монтаньезе и др. [16] сообщили, что 95 из 177 пациентов с циррозом печени и MHE или OHE имели сопутствующие заболевания, которые могли добавить к их симптомам помимо HE. При эпизодах ПЭ наиболее важными дифференциальными диагнозами являются гипонатриемия, дефицит тиамина, сепсис и внутричерепное кровотечение [1, 17]. При диагностике МГЭ по возможности также следует учитывать индивидуальный уровень когнитивных способностей пациента. Пациенты с более высокими интеллектуальными способностями (или когнитивным резервом) могут достигать результатов теста в пределах (нижнего) нормального диапазона даже при нарастании метаболического дисбаланса [18]. В случае хронической прогрессирующей ПЭ с паркинсонизмом необходимо учитывать идиопатическую болезнь Паркинсона и множественную системную атрофию. В этих случаях полезными инструментами являются история болезни пациента, тщательный анализ клинических данных и томография головного мозга, включая магнитно-резонансную томографию (МРТ) и однофотонную эмиссионную томографию (ОФЭКТ), для оценки транспортера дофамина в стриарном теле и доступности дофаминовых рецепторов [5].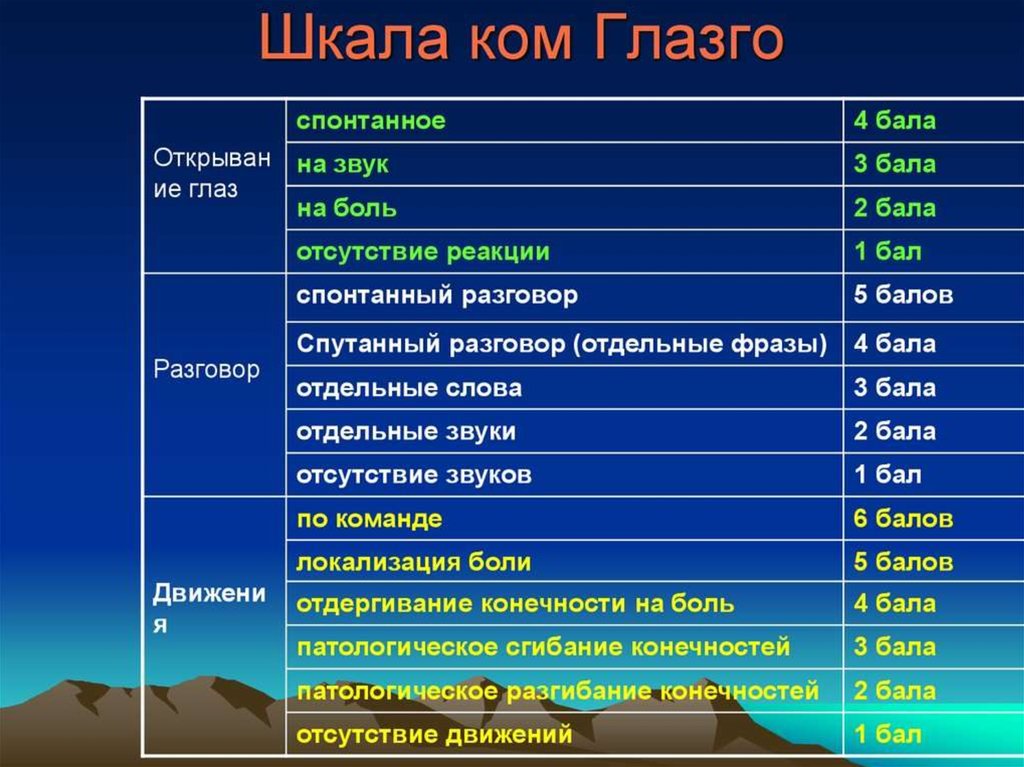 . Клинические данные, клиническое течение, МРТ и, в конечном итоге, анализ спинномозговой жидкости позволяют быстро провести дифференциальную диагностику печеночной миелопатии [19].].
. Клинические данные, клиническое течение, МРТ и, в конечном итоге, анализ спинномозговой жидкости позволяют быстро провести дифференциальную диагностику печеночной миелопатии [19].].
До сих пор визуализация головного мозга давала полезную информацию о патофизиологии HE [20]. Подробности также представлены в статье Butterworth [21] о патогенезе HE при циррозе в этом Приложении. Однако на сегодняшний день не существует научно доказанного метода визуализации, который мог бы однозначно диагностировать HE. Чен и др. [22] рекомендуют диффузионно-тензорную визуализацию головного мозга и карты средней диффузии (MD) и фракционной анизотропии (FA) в качестве потенциальных биомаркеров для MHE. Они наблюдали значительные различия в MD и FA в отдельных областях белого вещества головного мозга у пациентов с MHE по сравнению с пациентами с циррозом печени, но без HE. Более того, они идентифицировали две пространственно распределенные области белого вещества, которые вместе значительно предсказывали принадлежность к группе.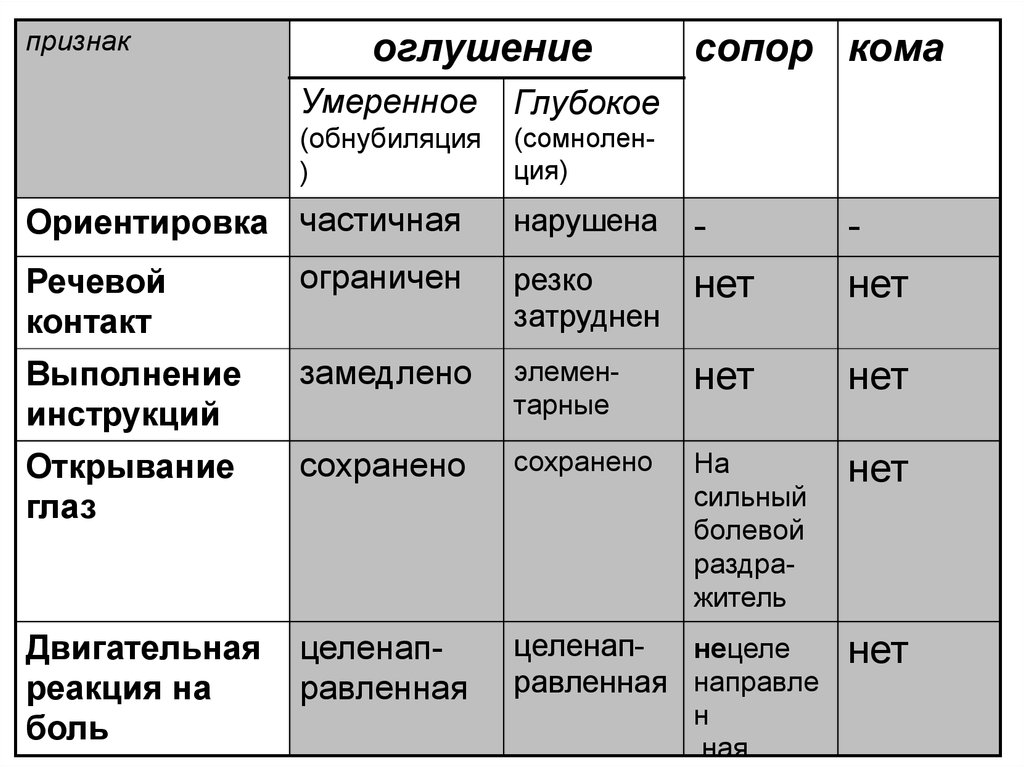 Используя карты MD и FA для пяти различных порогов, они показали, что использование порога на 0,75 SD ниже среднего FA приводит к точности классификации 9.2,3%. Хотя эти результаты интересны, карты FA или MD нельзя считать надежными биомаркерами HE. Чен и др. [22] исключили пациентов с «значительными» непеченочными заболеваниями, и мы еще не знаем, могут ли и как частые сопутствующие заболевания у пациентов с циррозом печени влиять на результаты МРТ. Таким образом, у нас до сих пор нет диагностического инструмента визуализации, который мог бы помочь в диагностике HE, кроме как путем исключения других возможных причин дисфункции головного мозга.
Используя карты MD и FA для пяти различных порогов, они показали, что использование порога на 0,75 SD ниже среднего FA приводит к точности классификации 9.2,3%. Хотя эти результаты интересны, карты FA или MD нельзя считать надежными биомаркерами HE. Чен и др. [22] исключили пациентов с «значительными» непеченочными заболеваниями, и мы еще не знаем, могут ли и как частые сопутствующие заболевания у пациентов с циррозом печени влиять на результаты МРТ. Таким образом, у нас до сих пор нет диагностического инструмента визуализации, который мог бы помочь в диагностике HE, кроме как путем исключения других возможных причин дисфункции головного мозга.
Было сделано несколько предложений по функциональному определению и классификации HE для клинических целей. Хотя предоставленные средства полезны, они не могут исправить тот факт, что HE представляет собой сложное расстройство, с которым нельзя справиться или которое нельзя понять путем чрезмерного упрощения. Независимо от используемого метода сохраняются определенные трудности в диагностике ПЭ; в каждом отдельном случае ПЭ необходимо дифференцировать от других возможных причин дисфункции головного мозга. Огромным шагом в продвижении понимания и диагностики ПЭ было бы признание общих правил диагностики нарушений головного мозга, таких как применение адекватных норм для оценки нейропсихологических или нейрофизиологических показателей или преднамеренная обработка различных диагностических данных, а также для диагностики ХЭ.
Огромным шагом в продвижении понимания и диагностики ПЭ было бы признание общих правил диагностики нарушений головного мозга, таких как применение адекватных норм для оценки нейропсихологических или нейрофизиологических показателей или преднамеренная обработка различных диагностических данных, а также для диагностики ХЭ.
Финансирование
Это дополнение к Препараты было полностью профинансировано Merz Pharmaceuticals GmbH, Франкфурт, Германия.
Конфликт интересов
KW получала гранты и личные вознаграждения от Boehringer Ingelheim и Abbvie, а также личные вознаграждения от Merz Pharmaceuticals GmbH, Novartis и BMS.
1. Vilstrup H, Amodio P, Bajaj J, Cordoba J, Ferenci P, Mullen KD, et al. Печеночная энцефалопатия при хроническом заболевании печени: практическое руководство 2014 г. Американской ассоциации по изучению заболеваний печени и Европейской ассоциации по изучению печени. Гепатология. 2014;60:715–735. doi: 10.1002/hep.27210. [PubMed] [CrossRef] [Академия Google]
2. Romero-Gómez M, Montagnese S, Jalan R. Печеночная энцефалопатия у больных с острой декомпенсацией цирроза печени и острой хронической печеночной недостаточностью. J Гепатол. 2015;62(2):437–447. doi: 10.1016/j.jhep.2014.09.005. [PubMed] [CrossRef] [Google Scholar]
Romero-Gómez M, Montagnese S, Jalan R. Печеночная энцефалопатия у больных с острой декомпенсацией цирроза печени и острой хронической печеночной недостаточностью. J Гепатол. 2015;62(2):437–447. doi: 10.1016/j.jhep.2014.09.005. [PubMed] [CrossRef] [Google Scholar]
3. Riggio O, Efrati C, Catalano C, Pediconi F, Mecarelli O, Accornero N, et al. Высокая распространенность спонтанных порто-системных шунтов при персистирующей печеночной энцефалопатии: исследование случай-контроль. Гепатология. 2005;42(5):1158–1165. doi: 10.1002/hep.20905. [PubMed] [CrossRef] [Google Scholar]
4. Read A, Sherlock S, Laidlaw J, Walker JG. Нервно-психические синдромы, связанные с хроническими заболеваниями печени и обширным портально-системным коллатеральным кровообращением. Кью Мед. 1967; 36 (114): 135–150. [Google Scholar]
5. Tryc AB, Goldbecker A, Berding G, Rümke S, Afshar K, Shahrezaei GH, et al. Связанный с циррозом паркинсонизм: распространенность, механизмы и ответ на лечение. J Гепатол. 2013;58(4):698–705. doi: 10.1016/j.jhep.2012.11.043. [PubMed] [CrossRef] [Академия Google]
2013;58(4):698–705. doi: 10.1016/j.jhep.2012.11.043. [PubMed] [CrossRef] [Академия Google]
6. Weissenborn K, Ennen JC, Schomerus H, Rückert N, Hecker H. Нейропсихологическая характеристика печеночной энцефалопатии. J Гепатол. 2001;34(5):768–773. doi: 10.1016/S0168-8278(01)00026-5. [PubMed] [CrossRef] [Google Scholar]
7. Montagnese S, Bajaj JS. Влияние печеночной энцефалопатии при циррозе на качество жизни. Наркотики. 2018 [PMC free article] [PubMed] [Google Scholar]
8. Weissenborn K. Диагностика минимальной печеночной энцефалопатии. J Clin Exp Гепатол. 2015; 5 (Приложение 1): S54–S59. doi: 10.1016/j.jceh.2014.06.005. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
9. Weissenborn K. PHES: одна этикетка, разные товары?! J Гепатол. 2008;49(3):308–312. doi: 10.1016/j.jhep.2008.06.023. [PubMed] [CrossRef] [Google Scholar]
10. Campagna F, Montagnese S, Ridola L, Senzolo M, Schiff S, De Rui M, et al. Тест на имена животных: простой инструмент для оценки печеночной энцефалопатии. Гепатология. 2017;66(1):198–208. doi: 10.1002/hep.29146. [PubMed] [CrossRef] [Академия Google]
Гепатология. 2017;66(1):198–208. doi: 10.1002/hep.29146. [PubMed] [CrossRef] [Академия Google]
11. Morgan MY, Amodio P, Cook NA, Jackson CD, Kircheis G, Lauridsen MM, et al. Квалификация и количественная оценка минимальной печеночной энцефалопатии. Метаб Мозг Дис. 2016;31(6):1217–1229. doi: 10.1007/s11011-015-9726-5. [PubMed] [CrossRef] [Google Scholar]
12. Montagnese S, Balistreri E, Schiff S, De Rui M, Angeli P, Zanus G, et al. Скрытая печеночная энцефалопатия: согласие и прогностическая достоверность различных индексов. Мир J Гастроэнтерол. 2014;20(42):15756–15762. doi: 10.3748/wjg.v20.i42.15756. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
13. Дхиман Р.К., Курми Р., Тумбуру К.К., Венкатамарао С.Х., Агарвал Р., Дуседжа А. и др. Диагностика и прогностическое значение минимальной печеночной энцефалопатии у больных циррозом печени. Dig Dis Sci. 2010;55(8):2381–2390. doi: 10.1007/s10620-010-1249-7. [PubMed] [CrossRef] [Google Scholar]
14. Romero-Gómez M, Córdoba J, Jover R, del Olmo JA, Ramírez M, Rey R, et al. Значение критической частоты мельканий у больных с минимальной печеночной энцефалопатией. Гепатология. 2007;45(4):879–885. doi: 10.1002/hep.21586. [PubMed] [CrossRef] [Google Scholar]
Romero-Gómez M, Córdoba J, Jover R, del Olmo JA, Ramírez M, Rey R, et al. Значение критической частоты мельканий у больных с минимальной печеночной энцефалопатией. Гепатология. 2007;45(4):879–885. doi: 10.1002/hep.21586. [PubMed] [CrossRef] [Google Scholar]
15. Goldbecker A, Weissenborn K, Hamidi Shahrezaei G, Afshar K, Rümke S, Barg-Hock H, et al. Сравнение наиболее предпочтительных методов диагностики печеночной энцефалопатии у кандидатов на трансплантацию печени. Кишка. 2013;62(10):1497–1504. doi: 10.1136/gutjnl-2012-303262. [PubMed] [CrossRef] [Google Scholar]
16. Монтаньезе С., Шифф С., Амодио П. Быстрая диагностика печеночной энцефалопатии: правда или вымысел? Гепатология. 2015;61(1):405–406. doi: 10.1002/hep.27127. [PubMed] [CrossRef] [Академия Google]
17. Вайссенборн К. Проблемы диагностики печеночной энцефалопатии. Нейрохим Рез. 2015;40(2):265–273. doi: 10.1007/s11064-014-1416-x. [PubMed] [CrossRef] [Google Scholar]
18. Montagnese S, De Rui M, Angeli P, Amodio P. Нейропсихиатрические показатели у пациентов с циррозом: кто «нормальный»? J Гепатол. 2017;66(4):825–835. doi: 10.1016/j.jhep.2016.11.021. [PubMed] [CrossRef] [Google Scholar]
Нейропсихиатрические показатели у пациентов с циррозом: кто «нормальный»? J Гепатол. 2017;66(4):825–835. doi: 10.1016/j.jhep.2016.11.021. [PubMed] [CrossRef] [Google Scholar]
19. Weissenborn K, Tietge UJ, Bokemeyer M, Mohammadi B, Bode U, Manns MP, et al. Трансплантация печени улучшает печеночную миелопатию: доказательства трех случаев. Гастроэнтерология. 2003;124(2):346–351. doi: 10.1053/gast.2003.50062. [PubMed] [CrossRef] [Академия Google]
20. Чжан XD, Чжан LJ. Мультимодальная МРТ при печеночной энцефалопатии: современное состояние. Метаб Мозг Дис. 2018;33(3):661–671. doi: 10.1007/s11011-018-0191-9. [PubMed] [CrossRef] [Google Scholar]
21. Butterworth RF. Печеночная энцефалопатия при циррозе: патология и патофизиология. Наркотики. 2018 [бесплатная статья PMC] [PubMed] [Google Scholar]
22. Chen HJ, Chen R, Yang M, Teng GJ, Herskovits EH. Выявление минимальной печеночной энцефалопатии у пациентов с циррозом печени на основе визуализации белого вещества и байесовского анализа данных.


 В этот период снижается тонус мышц, появляются патологические типы дыхания, сердечно-сосудистые расстройства.
В этот период снижается тонус мышц, появляются патологические типы дыхания, сердечно-сосудистые расстройства. После улучшения состояния в схему лечения добавляют ноотропы.
После улучшения состояния в схему лечения добавляют ноотропы. 1975; 1: 480–84. [PubMed: 46957]
1975; 1: 480–84. [PubMed: 46957]