Лечение консервативное миомы: Миома матки — консервативное лечение
Лечение миомы матки без операции (консервативное) — медикаментозное лечение лекарственными средствами в Москве
Цены Акции Врачи Вопрос-ответ Отзывы Клиники
Смотреть
видеопрезентацию
При наличии миомы матки не всегда требуется хирургическая операция. При определенных условиях можно справиться с миомой консервативными методами. При диагнозе миома матки лечение без операции будет включать в качестве основного компонента гормональную терапию.
В последнее время фармакология достигла определенных высот в создании гормональных препаратов и контрацептивов, которые могут применяться для лечения данной проблемы. Обратившись в ОН КЛИНИК, Вы получите шанс воспользоваться самыми современными и эффективными методиками лечения миомы, доступными в нашей стране, под чутким наблюдением опытных гинекологов.
Благодаря постоянному повышению профессионального уровня врачи ОН КЛИНИК всегда остаются в курсе новинок и последних тенденций в области консервативной терапии миомы матки.
Показания для консервативного лечения
Обычно лекарственное лечение миомы матки является комплексным. Оно может включать в себя сочетание нескольких гормональных препаратов, либо гормональный препарат и средства симптоматической терапии для уменьшения неприятных ощущений при миоме.
В последнее время появилась еще одна тенденция консервативного лечения – включение в комплекс иммуномодулирующих препаратов, позволяющих улучшить результаты терапии.
Использовать гормоны при миоме матки для ее консервативного лечения рекомендуется при размере узла миомы до 3 см. К этому виду лечения особенно часто обращаются при интерстициальном или субсерозном расположении узлов (то есть, если миома растет в толще стенки матки или ближе к ее наружной поверхности).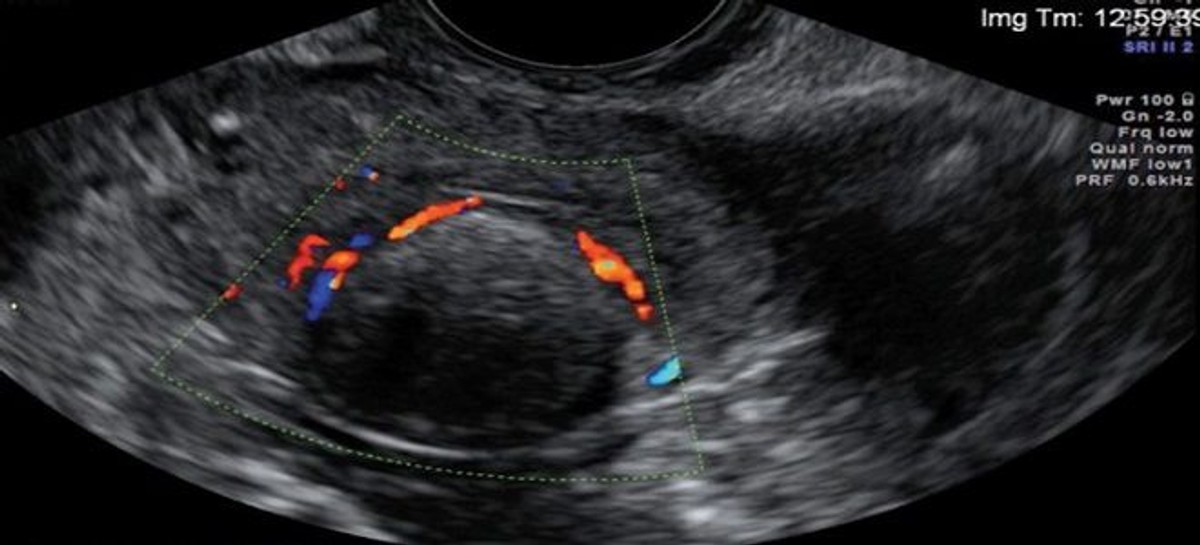
Какие препараты применяют для лекарственного лечения миомы матки
Наиболее часто используемые лекарства – это половые гормоны и факторы, влияющие на их выработку. Например, антигонадотропные препараты, антагонисты или агонисты гонадотропных рилизинг-гормонов, гестагены, антипрогестины и блокаторы рецепторов прогестерона, контрацептивы длительного действия и т.д.
Наиболее подходящую комбинацию для гормональной терапии выбирает врач на основании данных обследования, анамнеза и результатов предыдущего лечения. Кроме гормонов используют иммуномодуляторы, а также препараты, уменьшающие кровоточивость и улучшающие свертываемость крови, обезболивающие, препараты железа и т.д.
Алгоритмы метода консервативного лечения миомы матки
- Если размер узлов в пределах 2-3 см, то терапия проводится в 2 этапа.
 На первом используются агонисты гонадотропин рилизинг-гормона или антигонадотропины в течение полугода. Если удается достичь уменьшения узла менее 2 см, то переходят на второй этап – поддерживающую гормональную терапию. Если не удается – то врач принимает решение о продолжении гормонального лечения, либо об операции.
На первом используются агонисты гонадотропин рилизинг-гормона или антигонадотропины в течение полугода. Если удается достичь уменьшения узла менее 2 см, то переходят на второй этап – поддерживающую гормональную терапию. Если не удается – то врач принимает решение о продолжении гормонального лечения, либо об операции. - Если диаметр узла был изначально меньше 2 см и отсутствовали выраженные клинические проявления, то сразу начинают со второго этапа. Поддерживающая терапия включает комбинированные оральные контрацептивы, которые при миоме матки успешно используются уже не один год.
Преимущества медикаментозного лечения миомы матки
Положительные моменты успешной консервативной терапии очевидны. Основное преимущество – это шанс избежать оперативного вмешательства, а значит сразу двух стрессовых влияний на организм: воздействия наркоза и неизбежного травмирования тканей во время операции. Исключается также риск инфекции послеоперационной раны, болевой синдром и прочие возможные осложнения хирургического вмешательства.
Исключается также риск инфекции послеоперационной раны, болевой синдром и прочие возможные осложнения хирургического вмешательства.
Таким образом, гормональное лечение миомы матки – это шанс избежать операции.
Стоимость
Прием врача акушера-гинеколога первичный, амбулаторный
1 875 )
2 500 )
Прием врача акушера-гинеколога повторный, амбулаторный
2 500 )
Во избежание возможных недоразумений, советуем уточнять стоимость услуг на день обращения в регистратуре или в колл-центре по многоканальному номеру телефона +7 495 266-85-71
Акции
Показать все акции (3)Наши врачи
Выберите врача для записи на консультацию.
Показать
все клиники
Москва
Лысенко Наталия Владимировна
Главный врач, главный акушер-гинеколог, гинеколог-эндокринолог
Записаться на прием
Немировский Лев Лазаревич
Уролог-гинеколог, сексолог, семейный врач, Зав. отд. акушерства и гинекологии
отд. акушерства и гинекологии
Записаться на прием
Сеничкина Светлана Николаевна
Ведущий акушер-гинеколог ОН КЛИНИК, гинеколог-эндокринолог, врач высшей категории
Записаться на прием
Торосянц-Абрамян Анна Григорьевна
Ведущий акушер-гинеколог, эндокринолог, специалист по антивозрастной медицине, врач высшей категории
Записаться на прием
Цомаева Елена Александровна
Акушер-гинеколог, репродуктолог, КМН, Зав. отделением акушерства и гинекологии
Записаться на прием
Агаян Лилит Генриевна
Ведущий акушер-гинеколог, врач высшей категории, врач превентивной медицины
Записаться на прием
Белозерова Татьяна Александровна
Акушер-гинеколог, врач высшей категории, КМН, онкогинеколог, оперирующий гинеколог, интимный косметолог, эндокринолог
Записаться на прием
Герасимова Екатерина Владимировна
Акушер-гинеколог
Записаться на прием
Датиева Яна Валерьевна
Акушер-гинеколог, врач высшей категории
Записаться на прием
Ионова Елена Васильевна
Акушер-гинеколог, врач высшей категории, КМН
Записаться на прием
Насонова Нина Викторовна
Акушер-гинеколог, врач первой категории
Записаться на прием
Оленская Виктория Леонидовна
Акушер-гинеколог, гинеколог-эндокринолог, онкогинеколог, врач высшей категории
Записаться на прием
Печинина Лариса Саидбековна
Акушер-гинеколог, врач высшей категории
Записаться на прием
Сулейманова Зулейха Абакаровна
Акушер-гинеколог, врач высшей категории, КМН
Записаться на прием
Тихонова Елена Николаевна
Акушер-гинеколог, врач высшей категории
Записаться на прием
Токина Ирина ВикторовнаАкушер-гинеколог, врач высшей категории
Записаться на прием
Тоточиа Нато Энверовна
Акушер-гинеколог КМН, гинеколог-эндокринолог, специалист по озонотерапии, врач эстетической медицины
Записаться на прием
Формесин Инна Валериевна
Акушер-гинеколог
Записаться на прием
Показать всех врачей (14)Доверяйте Ваше здоровье профессионалам! ОН КЛИНИК
Часто задаваемые вопросы
Какова вероятность повторного появления миомы в матке после проведения гистерорезектоскопии и возможна ли беременность?
Лысенко Наталия Владимировна:
Не бойтесь оперативного лечения миомы. В большинстве случаев оно дает отличные результаты и редко приводит к повторному появлению заболевания. Мы применяем современные методики и оборудование, позволяющие быстро и безопасно устранить патологию, сохранив при этом матку. Больше половины наших пациенток после операции по удалению миоматозных узлов наблюдались по поводу беременности в нашем центре.
В большинстве случаев оно дает отличные результаты и редко приводит к повторному появлению заболевания. Мы применяем современные методики и оборудование, позволяющие быстро и безопасно устранить патологию, сохранив при этом матку. Больше половины наших пациенток после операции по удалению миоматозных узлов наблюдались по поводу беременности в нашем центре.
Отзывы
Оставить отзыв
Все отзывыОтзыв о враче: Насонова Нина Викторовна
Очень довольна консультацией, врач довольно во многом просветила меня касательно гормонов, веса и т.д. Прошла лечение, все устроило. Результат с врачом достигнут, я скоро стану мамой!
Отзыв о враче: Тоточиа Нато Энверовна
Мне понравился мой визит в клинику.
Отзыв о враче: Печинина Лариса Саидбековна
Очень понравилось качество работы и уровень профессионализма врача. Понравилось, как врач провела прием, деликатна в общении, ответила на все вопросы, аккуратно провела осмотр, составила план обследования и лечения. После приема появилась уверенность, что все будет хорошо! Большое спасибо доктору!
Отзыв о враче: Ионова Елена Васильевна
Мне очень понравилась доктор Елена Васильевна Ионова. Она опытный врач с большим стажем. На консультации она очень спокойна и ее спокойствие передалось и мне, несмотря на мои проблемы и волнения. Все у меня оказалось не так уж и страшно. Елена Васильевна, после получения результатов анализов, назначила мне лечение. Сейчас мне значительно легче. Большое спасибо, доктор!
Она опытный врач с большим стажем. На консультации она очень спокойна и ее спокойствие передалось и мне, несмотря на мои проблемы и волнения. Все у меня оказалось не так уж и страшно. Елена Васильевна, после получения результатов анализов, назначила мне лечение. Сейчас мне значительно легче. Большое спасибо, доктор!
Отзыв о враче: Герасимова Екатерина Владимировна
Профессиональный подход к приему пациентов, чуткое отношение к проблеме. Вежливое и тактичное общение. Врач оставила очень хорошее впечатление после приема. Сама клиника тоже понравилась, большая, есть все: УЗИ, кабинеты для сдачи анализов. Очень довольна обслуживанием!
Читать все отзывы
Лечение в Центре акушерства и гинекологии
Другие услуги
- Консультация гинеколога
- Гинекологическое обследование
- УЗИ органов малого таза
- Консервативная миомэктомия
- Эндоскопическая консервативная миомэктомия
Смотреть все услуги
Заболевания
- Миома матки
- Миома матки узловая
- Миома матки субмукозная
- Миома матки субсерозная
- Миома матки и беременность
Смотреть все заболевания
Открыть карту с клиниками
Новый метод консервативного лечения миомы матки | #03/17
Миома матки — одно из наиболее часто встречающихся доброкачественных новообразований в большинстве стран мира. Распространенность данного заболевания различается в различных исследованиях, что зависит от изучаемой популяции женщин и применяемых методов обследования [1]. У 30–35% пациенток миома выявляется в репродуктивном возрасте, и у трети из них сопровождается такими клиническими проявлениями, как аномальные маточные кровотечения, дисменорея, анемия, тазовые боли, диспареуния, бесплодие, осложненное течение беременности [2–4].
Распространенность данного заболевания различается в различных исследованиях, что зависит от изучаемой популяции женщин и применяемых методов обследования [1]. У 30–35% пациенток миома выявляется в репродуктивном возрасте, и у трети из них сопровождается такими клиническими проявлениями, как аномальные маточные кровотечения, дисменорея, анемия, тазовые боли, диспареуния, бесплодие, осложненное течение беременности [2–4].
Как правило, у подавляющего большинства пациенток сохраняется репродуктивная функция, за исключением субмукозной формы заболевания, но взаимосвязь между миомой матки и бесплодием увеличивается с возрастом. Принимая во внимание тенденцию к позднему планированию беременности и увеличение частоты встречаемости миомы матки среди женщин репродуктивного возраста, актуальность проблемы лечения данного заболевания значительно возрастает и принимает социальную значимость. Так, в России в 2012 г. почти каждый третий ребенок был рожден женщиной старше 35 лет. Вот почему следует придерживаться тактики преимущественно органосохраняющих операций при незначительных размерах миомы матки, особенно у женщин, не реализовавших свои репродуктивные планы [5].
Согласно данным ряда исследователей, миома матки заметно чаще других причин оказывается поводом для гистерэктомии. При этом во многих ситуациях к радикальному хирургическому лечению прибегают не только для удаления гигантских форм миомы, но и в случае множественной локализации узлов, даже если размеры каждого образования невелики, причем соотношение органоуносящих к органосохраняющим операциям как 95:5. Сторонники радикальных методов лечения считают, что после органосберегающих операций сохраняется риск рецидивов (15–45%) [6–9].
Однако органоуносящие операции не могут явиться методом выбора для женщин, не реализовавших репродуктивную функцию, что заставляет врачей искать другие методы лечения.
При выборе того или иного метода лечения пациентки с миомой матки учитываются следующие факторы: кровотечение, анемия с низким уровнем гемоглобина, железа и/или ферритина, проблемы с мочеиспусканием или дефекацией, тазовые боли, фертильность, возраст пациентки и ожидаемый период до наступления менопаузы. Выбор метода лечения зависит от возраста пациентки, размеров и локализации миоматозных узлов, динамики роста, их количества, желания сохранить фертильность [10–16].
Выбор метода лечения зависит от возраста пациентки, размеров и локализации миоматозных узлов, динамики роста, их количества, желания сохранить фертильность [10–16].
Варианты лечения пациенток с миомой матки включают терапевтическое, хирургическое и радиологическое вмешательство. Большую популярность в последнее десятилетие получили новые малоинвазивные технологии — эмболизация маточных артерий и фокальная ультразвуковая аблация миоматозных узлов. Эти высокотехнологичные хирургические вмешательства, безусловно, предпочтительнее, чем гистерэктомия, поскольку позволяют сохранить и орган, и его функцию, но их внедрение в широкую практику существенно ограничено ввиду высокой стоимости оборудования и недостатка квалифицированных кадров.
Консервативные методы лечения применяются, если пациентка хочет сохранить фертильность либо она находится в пременопаузальном периоде, а размеры миомы матки невелики, либо при наличии противопоказаний к оперативному вмешательству.
Медикаментозная консервативная терапия миомы матки должна быть направлена на замедление роста миоматозного узла, инволюцию миомы матки и устранение симптомов, например, менометроррагии и анемии [17].
В настоящее время увеличивается актуальность медикаментозного лечения миомы матки, а также предоперационной подготовки больных.
Основными преимуществами новых алгоритмов терапии миомы матки являются: увеличение интервала времени для подготовки пациентки к операции, более выраженное уменьшение размеров миомы, что позволяет провести органосохраняющую операцию менее травматично, возможность «выиграть» время у женщин с приближающейся менопаузой до наступления естественного менопаузального регресса миомы матки, снижение риска осложнений при оперативном вмешательстве. Однако в настоящее время все чаще ставится вопрос о возможном отказе от хирургического лечения в пользу консервативной терапии [18–20].
Для консервативной терапии миомы матки используются различные гормональные препараты. Так, прогестины в качестве самостоятельного лечения могут вызывать прорывные кровотечения и обладают неоднозначным ответом в плане стабилизации миоматозных узлов [21, 22]. Широко назначаемые для предоперационной подготовки агонисты гонадотропин-рилизинг гормонов (аГнРГ) приостанавливают рост, как правило, миоматозных узлов небольших размеров, создавая искусственную менопаузу. В то же время последующее выполнение органосохраняющей операции становится затруднительным из-за потери псевдокапсулы миоматозного узла, и из миомэктомии операция превращается в миометрэктомию, поскольку выделение миоматозного узла напоминает «очищение от кожуры засохшего апельсина». Необходимо учитывать побочные проявления аГнР, которые возможно назначать лишь короткими курсами (не более 6 месяцев): приливы, депрессии, снижение либидо, вагиниты, снижение минеральной плотности костной ткани, проявляющееся болями в костях. Данные проявления снижают качество жизни и как следствие комплаентность, что ограничивает назначение аГнРГ [23, 24].
В то же время последующее выполнение органосохраняющей операции становится затруднительным из-за потери псевдокапсулы миоматозного узла, и из миомэктомии операция превращается в миометрэктомию, поскольку выделение миоматозного узла напоминает «очищение от кожуры засохшего апельсина». Необходимо учитывать побочные проявления аГнР, которые возможно назначать лишь короткими курсами (не более 6 месяцев): приливы, депрессии, снижение либидо, вагиниты, снижение минеральной плотности костной ткани, проявляющееся болями в костях. Данные проявления снижают качество жизни и как следствие комплаентность, что ограничивает назначение аГнРГ [23, 24].
Большое значение в лечении миоматозных узлов небольших размеров (до 1–1,5 см) в сочетании с аденомиозом и гиперпластическими процессами эндометрия уделяется введению левоноргестрел-выделяющей системы Мирена, которая позволяет достичь контроля над меноррагиями. Однако введение данной системы нередко сопровождается нерегулярными кровотечениями, экспульсией и практически отсутствием влияния на крупные миоматозные узлы, невозможностью использования при деформации полости матки субмукозными узлами или узлами с выраженным центрипетальным ростом [25–27].
Полученные результаты гормональной терапии пациенток с миомой матки показали, что они пока не заняли достойного места в схемах лечения этого новообразования, в том числе в рамках дооперационной подготовки.
Миома матки — не только эстроген-, но и прогестеронзависимое заболевание, которое развивается, как правило, у женщин с овуляторным менструальным циклом [28–30]. Полученные знания о патогенетических механизмах роста миомы матки в последние годы привели к применению антипрогестагенов (АП) и селективных модуляторов прогестерона (СМРП). В 2012 г. Европейская комиссия одобрила препарат, относящийся к классу СМРП — улипристала ацетат в дозе 5 мг для применения в качестве предоперационной терапии миомы матки у пациенток старше 18 лет с умеренными или тяжелыми симптомами (2 курса по 3 месяца) [28–30]. Улипристала ацетат (Эсмия) — селективный модулятор прогестероновых рецепторов, обладает смешанными агонистическими/антагонистическими свойствами, оказывает антипролиферативный, антифиброзный эффекты, индуцирует апоптоз в клетках миоматозного узла, не влияя на здоровый миометрий [17, 31, 32]. Селективно блокируя влияние прогестерона в гипофизе, улипристала ацетат (УПА) уменьшает секрецию лютеинизирующего и частично фолликулостимулирующего гормонов, приводя к ановуляции, при этом концентрация эстрадиола характерна для середины фолликулярной фазы, что позволяет избежать симптомов гипоэстрогении [29]. Развивается гипофизарно-индуцируемая аменорея. Влияние на другие гормоны (тиреотропный, адренокортикотропный, пролактин) отсутствует. СМРП обладают фармакодинамическим эффектом относительно эндометрия, в том числе антипролиферативным эффектом, который может способствовать индукции аменореи. Улипристала ацетат оказывает прямое действие на эндометрий: вызывает аменорею или уменьшает интенсивность кровотечений уже к 6–10 дню применения, а также снижает выраженность болей, беспокоящих большинство пациенток с миомой.
Селективно блокируя влияние прогестерона в гипофизе, улипристала ацетат (УПА) уменьшает секрецию лютеинизирующего и частично фолликулостимулирующего гормонов, приводя к ановуляции, при этом концентрация эстрадиола характерна для середины фолликулярной фазы, что позволяет избежать симптомов гипоэстрогении [29]. Развивается гипофизарно-индуцируемая аменорея. Влияние на другие гормоны (тиреотропный, адренокортикотропный, пролактин) отсутствует. СМРП обладают фармакодинамическим эффектом относительно эндометрия, в том числе антипролиферативным эффектом, который может способствовать индукции аменореи. Улипристала ацетат оказывает прямое действие на эндометрий: вызывает аменорею или уменьшает интенсивность кровотечений уже к 6–10 дню применения, а также снижает выраженность болей, беспокоящих большинство пациенток с миомой.
Когда прием препарата прекращают, менструальный цикл обычно восстанавливается в течение 4 недель. Прямое действие на эндометрий приводит к специфичным для этого класса препаратов изменениям в слизистой оболочке, связанным с модулятором рецепторов прогестерона (Progesterone Receptor Modulator Associated Endometrial Changes, PAEC). Указанные изменения гистологически представлены неактивным и слабо пролиферирующим эпителием с асимметрией роста стромы и эпителия, выраженным кистозным расширением желез со смешанными эстрогенными (митотическими) и прогестагенными (секреторными) воздействиями на эпителий матки. Подобную картину ошибочно можно принять за гиперплазию эндометрия, однако процессы обратимы и исчезают после прекращения лечения; во время терапии в коррекции данного состояния нет необходимости [33–35].
Указанные изменения гистологически представлены неактивным и слабо пролиферирующим эпителием с асимметрией роста стромы и эпителия, выраженным кистозным расширением желез со смешанными эстрогенными (митотическими) и прогестагенными (секреторными) воздействиями на эпителий матки. Подобную картину ошибочно можно принять за гиперплазию эндометрия, однако процессы обратимы и исчезают после прекращения лечения; во время терапии в коррекции данного состояния нет необходимости [33–35].
Стоит отметить и отсутствие трудностей при выполнении миомэктомии и энуклеации миоматозных узлов. В отличие от аГнРГ, препараты с улипристала ацетатом не вызывают дефицита эстрогенов и не трансформируют псевдокапсулу миомы.
Немаловажным преимуществом СМПР можно считать отсутствие влияний на надпочечники, функции печени и систему гемостаза, что очень важно для пациенток с сопутствующими соматическими заболеваниями.
Многочисленные благоприятные влияния улипристала ацетата в качестве модулятора прогестероновых рецепторов были продемонстрированы в клинических исследованиях длительной цикловой терапии PEARL I, II, III [33–35].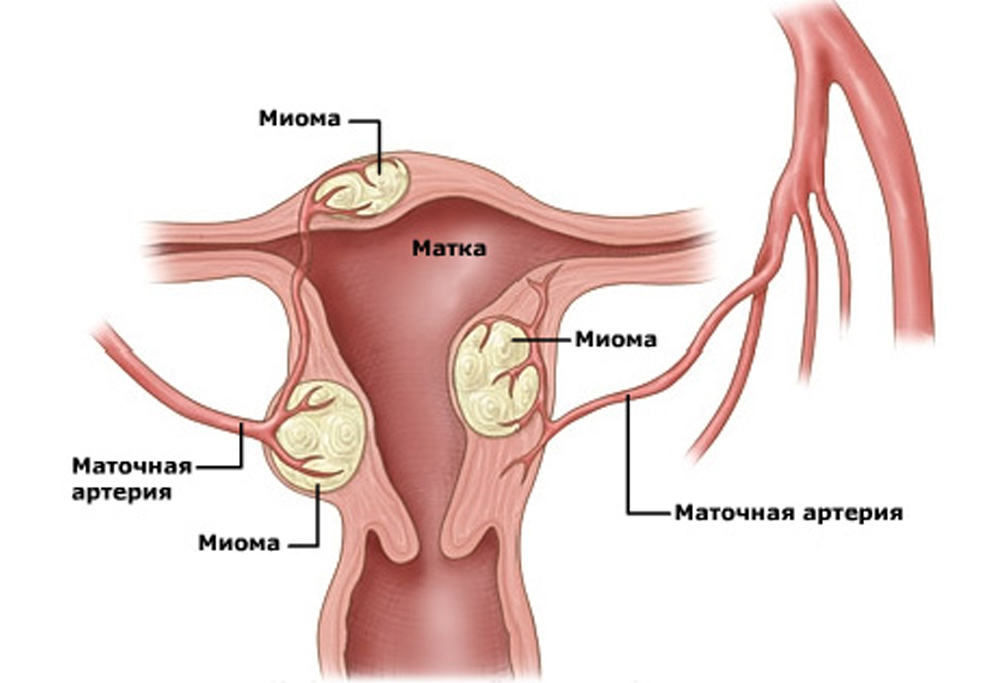 Авторами показано, что уже после первого курса лечения улипристала ацетатом аменорея наблюдалась через 4 дня от начала лечения (79%), а уменьшение узлов миомы в среднем составило 45%. Коррекция анемии достигается у 94% пациенток — уровень гемоглобина выше 120 г/л.
Авторами показано, что уже после первого курса лечения улипристала ацетатом аменорея наблюдалась через 4 дня от начала лечения (79%), а уменьшение узлов миомы в среднем составило 45%. Коррекция анемии достигается у 94% пациенток — уровень гемоглобина выше 120 г/л.
Повторные назначения 3-месячных курсов терапии улипристала ацетатом позволяют эффективно контролировать кровотечение и уменьшить размеры миомы у пациенток.
Гистологические исследования показали отсутствие гиперпластических процессов на фоне повторных курсов приема УПА, а также при применении норэтистерона ацетата или плацебо.
В настоящее время идет накопление российского опыта [1, 17, 18, 25]. по использованию УПА в качестве подготовки для хирургического лечения симптомной миомы матки.
Таким образом, улипристала ацетат — новая инновационная стратегия органосберегающей терапии миомы матки с возможностью проведения консервативного лечения при небольших размерах миоматозных узлов. Улипристала ацетат, обладающий высокоизбирательным действием на рецепторы тканей-мишеней, позволяет не только отсрочить оперативное вмешательство, но и, в некоторых случаях, вовсе его избежать. После лечения улипристала ацетатом эффект более выражен и сохраняется длительнее, чем после применения других фармакологических схем, предложенных для терапии миомы ранее [37].
После лечения улипристала ацетатом эффект более выражен и сохраняется длительнее, чем после применения других фармакологических схем, предложенных для терапии миомы ранее [37].
Литература
- Тихомиров А. Л. Новые возможности патогенетической терапии миомы матки // Гинекология. 2013. Т. 15, № 3. С. 36–38.
- Levy B. S. Management of uterine fibroids // Acta Obstet Gynecol Scand. 2008; 87 (8): 812–823.
- Practice Committee of American Society for Reproductive Medicine in collaboration with Society of Reproductive Sur geons // Myomas and reproductive function. Fertil Steril. 2008; 90: 5. Suppl: S125-S130.
- Somigliana E., Vercellini P., Daguati R., Pasin R., De Giorgi O., Crosignani P. G. Fibroids and female reproduction: a critical analysis of the evidence // Hum Reprod Update. 2007; 13: 465–476.
- Laughlin S. K., Schroeder J. C., Baird D. D. New directions in the epidemiology of uterine fibroids // Semin Reprod Med.
 2010; 28: 204–217.
2010; 28: 204–217. - Arici A., Sozen I. Transforming growth factor-beta3 is expressed at high levels in leiomyoma where it stimulates fibronectin expression and cell proliferation // Fertil Steril. 2000; 73: 1006–1011.
- Chavez N. F., Stewart E. A. Medical treatment of uterine fibroids // Clin Obstet Gynecol. 2001; 44: 372–384.
- Luo X., Ding L., Xu J., Chegini N. Gene expression profiling of leiomyoma and myometrial smooth muscle cells in response to transforming growth factor-beta // Endocrinology. 2005; 146: 1097–1018.
- Martin Chaves E. B., Brum I. S., Stoll J., Capp E., Corleta H. E. Insulin-like growth factor 1 receptor mRNA expression and autophosphorylation in human myometrium and leiomyoma // Gynecol Obstet Invest. 2004; 57: 210–213.
- Fields K. R., Neinstein L. S. Uterine myomas in adolescents: case reports and a review of the literature // J Pediatr Adolesc Gynecol.
 1996; 9: 195–198.
1996; 9: 195–198. - Cramer S. F., Patel A. The frequency of uterine leiomyomas // Am J Clin Pathol. 1990; 94: 435–438.
- Ross R. K., Pike M. C., Vessey M. P., Bull D., Yeates D., Casagrande J. T. Risk factors for uterine fibroids: reduced risk associated with oral contraceptives // Br Med J (Clin Res Ed). 1986; 293: 359–362.
- Lumbiganon P., Rugpao S., Phandhu-Fung S., Laopaiboon M., Vudhikamraksa N., Werawatakul Y. Protective effect of depotmedroxyprogesterone acetate on surgically treated uterine leiomyomas: a multicenter case-control study // Br J Obstet Gynaecol. 1996; 103: 909–914.
- Marshall L. M., Spiegelman D., Goldman M. B. et al. A prospective study of reproductive factors and oral contraceptive use in relation to the risk of uterine leiomyomata // Fertil Steril. 1998; 70: 432–439.
- Parazzini F., Negri E., La Vecchia C., Chatenoud L., Ricci E., Guarnerio P. Reproductive factors and risk of uterine fibroids // Epidemiology.
 1996; 7: 440–442.
1996; 7: 440–442. - Burbank F. Childbirth and myoma treatment by uterine artery occlusion: do they share a common biology? // J Am Assoc Gynecol Laparosc. 2004; 11: 138–152.
- Радзинский В. Е., Архипова М. П. Миома матки: проблемы и перспективы начала века // Медицинский совет. 2014. С. 2–4.
- Адамян Л. В., Козаченко А. В., Ревазова З. В. Новые подходы к медикаментозному лечению симптомной миомы матки // Пробл. репродукции. 2013. № 3. С. 21–23.
- Stewart E. A. Uterine fibroids and evidence-based medicine — not an oxymoron // N. Engl. J. Med. 2012. Vol. 366. P. 471–473.
- Zimmermann A., Bernuit D., Gerlinger C. et al. Prevalence, symptoms and management of uterine fibroids: an international internet-based survey of 21,746 women // BMC Women’s Health. 2012. Vol. 12. P. 6. DOI: 10.1186/14726874-12-6.
- Yin P. et al. Transcription factor KLF11 integrates progesterone receptor signaling and proliferation in uterine leiomyoma cells // Canser.
 Res. 2010. Feb 15. Vol. 70 (4). P. 1722–1730.
Res. 2010. Feb 15. Vol. 70 (4). P. 1722–1730. - Kim J. J., Sefton E. C. The role of progesterone signaling in the pathogenesis of uterine leiomyoma // Mol Cell Endocrinol. 2011, June 6 (Epub ahead of print).
- Lethaby A., Vollenhoven B., Sowter M. Pre-operative GnRH analogue therapy before hysterectomy or myomectomy for uterine fibroids // Cochrane Database Syst Rev. 2001; CD000547.
- Campo S., Garcea N. Laparoscopic myomectomy in premenopausal women with and without preoperative treatment using gonadotrophin-releasing hormone analogues // Hum Reprod. 1999; 14: 44–48.
- Тихомиров А. Л., Леденкова А. А. Доброкачественные гиперплазии матки и внутриматочная левоноргестрел-релизинг система // Гинекология. 2012. № 3. С. 62–64.
- Zapata L. B., Whiteman M. K., Tepper N. K., Jamieson D. J., Marchbanks P. A., Curtis K. M. Intrauterine device use among women with uterine fibroids: a systematic review // Contraception.
 2010; 82: 41–55.
2010; 82: 41–55. - Sayed G. H., Zakhera M. S., El-Nashar S. A., Shaaban M. M. A randomized clinical trial of a levonorgestrel-releasing intrauterine system and a low-dose combined oral contraceptive for fibroidrelated menorrhagia // Int J Gynaecol Obstet. 2011; 112: 126–130.
- Адамян Л. В., Зайратьянц О. В., Тихомиров А. Л. и др. Антипролиферативное и проапоптотическое действие селективного модулятора рецепторов прогестерона улипристала на лейомиомц матки in vivo // Пробл. репродукции. 2014. № 3. С. 25–28.
- Коренная В. В., Подзолкова Н. М. Улипристал ацетат в лечении миомы матки // Гинекология. 2013. № 15, № 6. С. 58–61.
- Ishikawa H., Ishi K., Serna V. A., Kakazu R. Progesterone is essential for maintenance and growth of uterine leiomyoma // Endocrinology. 2010. Vol. 151, № 6. P. 2433–2442.
- Тихомиров А. Л., Казенашев В. В. Улипристал ацетат — новые возможности в лечении лейомиомы матки // Акуш.
 и гин. 2013. № 9. С. 97–100.
и гин. 2013. № 9. С. 97–100. - Yoshida S., Ohara N., Xu Q. et al. Cell type specifications of progesterone receptor modulators in the regulation of uterine leiomyoma growth // Semin. Reprod. Med. 2010. Vol. 28. P. 260–273.
- Donnez J. With the advent of selective progesterone receptor modulators, what is the place of myoma surgery in current practice? // Fertility and Sterility. 2014.
- Donnez J., Tatarchuk T. F., Bouchard P., Puscasiu L., Zakharenko N. F., Ivanova T., Ugocsai G., Mara M., Jilla M. P., Bestel E., Terrill P., Osterloh I., Loumaye E. PEARL I Study Group. Ulipristal acetate versus placebo for fibroid treatment before surgery // N. Engl. J. Med. 2012. Feb 2. Vol. 366 (5). P. 409–420. DOI: 10.1056/NEJMoa1103182.
- Donnez J., Tomaszewski J., Vázquez F. et al. PEARL II Study Group. Ulipristal acetate versus leuprolide acetate for uterine fibroids // N. Engl. J. Med. 2012. Feb 2. Vol. 366 (5).
 P. 421–432. DOI: 10.1056/NEJMoa1103180. PMID 22296076.
P. 421–432. DOI: 10.1056/NEJMoa1103180. PMID 22296076. - Erekson E., Yip S., Martin D. et al. // Female Pelvic Med Reconstr Surg. 2012; 18 (5): 274–280.
- Радзинский В. Е., Тотчиев Г. Ф. Миома матки: курс на органосохранение. Информационный бюллетень. М., 2014. 25 с.
А. З. Хашукоева1, доктор медицинских наук, профессор
Т. Н. Сухова
Р. А. Рзаева
Г. Г. Мосешвили
ГБОУ ВПО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва
1 Контактная информация: [email protected]
Лечение миомы матки — статьи от специалистов клиники «Мать и дитя»
Выбор лечения у больных с лейомиомой матки зависит от:
— возраста,
— наличия и характера жалоб,
— данных объективного обследования,
— эндокринного статуса,
— сопутствующих заболеваний.
Динамическое наблюдение (или выжидательная тактика), которое осуществляется 1 раз в 6 месяцев, оправдано только у больных миомой матки, незаинтересованных в наступлении беременности, без клинических проявлений заболевания, небольших размерах узлов и при отсутствие роста опухоли.
Активная тактика подразумевает раннее начало лечебных мероприятий и заключается в применение различных методов лечения.
Современными тенденциями в лечение лейомиомы матки являются:
• более активная тактика ведения больных;
• рост органосохраняющих операций;
• более широкое применение медикаментозного лечения;
• внедрение малоинвазивных технологий.
Возможные методы лечения:
— хирургический,
— мадикаментозный
— комбинированный – медикаментозная терапия с последующей операцией
— новый малоинвазивный метод — эмболизация маточных артерий.
Традиционным лечением лейомиомы матки до сих пор считается хирургическое. В большинстве случаев – это радикальное удаление матки.
Однако в настоящее время все чаще производятся реконструктивно-пластические операции (или миомэктомия), особенно у женщин, которые хотят сохранить возможность иметь детей.
Миомэктомия – это удаление только миоматозных узлов, при этом матка сохраняется. Она рекомендует при отсутствие беременности в течение года или при привычном невынашивании беременности на фоне миомы матки. Причем миоматозные узлы удаляются, независимо от их размеров.
Миомэктомия может производиться:
— через разрез брюшной стенки (лапаротомия)
— через небольшие разрезы в передней брюшной стенке. При этом вводится лапароскоп (небольшая металлическая трубка, через которую хирург может видеть и удалять миоматозные узлы).
Серьёзным ограничением применения этого метода является величина и количество миоматозных узлов.
— с помощью гистерорезектоскопии: через трубку введенную через шейку матки под контролем зрения.
Такой доступ возможен при локализации миоматозных узлов в полости матки (как правило, при этом расположении миомы женщина страдает тяжелыми маточными кровотечениями). В результате этой операции значительно сокращается длительность и объем кровопотери при менструациях.
Новые малоинвазивные и неинвазивные методы лечения были предложены в качестве альтернативы хирургическим в течение последних лет. К ним относятся — эмболизация маточных артерий и фокусированная ультразвуковая аблация миоматозных узлов.
Эмболизация маточных артерий проводится пациентам, желающим сохранить репродуктивную функцию, а также тем женщинам, которые категорически отказываются от хирургического вмешательства или которым противопоказаны оперативное лечение и (или) эндотрахеальный наркоз в связи с сопутствующей патологией различных органов.
После тщательного гинекологического обследования (УЗИ, магнитно-резонансной томографии, диагностического выскабливания стенок полости матки, гормонального исследования) решается вопрос о целесообразности проведения данного вида лечения.
Эмболизация маточных артерий выполняется в условиях рентгенооперационной, чаще всего под перидуральной анестезией.
Основная цель вмешательства – «блокировка» сосуда или сосудов, питающих миоматозные узлы. Причем эмболизация проводится всех сосудов, независимо от количества миоматозных узлов.
После успешной эмболизации (непосредственно самой процедуры), которую удается осуществить примерно у 90-100% пациенток, происходит клиническое улучшение состояния (уменьшается кровопотеря во время менструации, боли – у 80-92%), через 3-6 месяцев – уменьшаются размеры матки и миоматозных узлов примерно на 45-60%.
У всех женщин после эмболизации маточных артерий развивается так называемый постэмболизационный синдром, выражающийся в повышении температуры, боли внизу живота, тошноте, но в большинстве случаев (до 75-81 %) при адекватном лечении симптомы исчезают в течение 5-7 дней.
Количество осложнений, по сравнению с хирургическим методом лечения, значительно меньше (составляют не более 1%) и в основном это инфекционные процессы.
Подавляющее число женщин, перенесших эмболизацию маточных артерий, удовлетворены проведенным лечением и отмечают значительное улучшение качества жизни.
Количество новых методов лечения постоянно увеличивается.
Одним из наиболее современных неинвазивных методов лечения является фокусированная ультразвуковая аблация миоматозных узлов под контролем магнитно-резонансной томографии. Метод предназначен для лечения больных лейомиомой матки, заинтересованных в сохранении матки, путем теплового воздействия на клетки за счет высвобождения энергии звуковой волны и изменения локального кровотока в опухолевой ткани.
Для предоперационной подготовки к эндоскопической операции используют так называемых агонисты Гн-РГ.
Сочетание органосохраняющих операций с предоперационной медикаментозной подготовкой к ним позволяет снизить травматизацию и осложнения во время хирургического вмешательства, риск рецидива заболевания и способствует сохранению и повышению фертильности.
Медикаментозное лечение направлено на торможение роста опухоли, уменьшение размеров матки, регресс клинических симптомов, сохранение репродуктивной функции, улучшение качества жизни.
Выбор препаратов зависит от возраста больной, переносимости лекарственных средств, наличия сопутствующей гинекологической патологии и заболеваний внутренних органов.
Механизм действия препаратов, применяемых для лечения миомы матки, в основном, заключается во временном и обратимом угнетении функции яичников.
Существует точка зрения о том, что миома матки является гормонозависимой опухолью и на фоне естественной менопаузы происходит уменьшение размеров узлов. Это послужило основанием для использования так называемых агонистов Гн-РГ. Эти препараты блокируют действие гормонов-стимуляторов выработки половых стероидов (ФСГ, ЛГ).
Агонисты ГнРГ (бусерелин, золадекс, диферелин) широко используются для лечения миомы матки в качестве предоперационной подготовки и в виде длительной терапии (по определенным показаниям).
На фоне лечения этими препаратами временно прекращаются менструации, что приводит к повышению гемоглобина, к увеличению плотности микрососудов, что важно для пациентов с кровотечениями.
Длительность курса лечения составляет 3 – 4 месяца, начинается введение препарата в первые 5 дней менструального цикла, 1 раз в 28-30 дней.
Монотерапия – длительность курса лечения составляет 6 месяцев 1 раз в 28-30 дней. Возможны долгосрочные курсы с перерывом на 3 месяца.
Антигонадотропные средства.
Механизм действия основан на создании «псевдоменопаузы». Длительность курса составляет 3 – 6 месяцев (возможно до 12 месяцев)
Даназол – перорально по 1 капсуле (100 или 200 мг) 4 или 2 раза в сутки (суточная доза 400 мг) в течение 3-6 мес, реже 12 мес.
Гестринон (неместран) – назначают перорально, стартовая доза по 2,5мг (в некоторых случаях 5мг) 2 раза в неделю. Продолжительность лечения составляет 3-6 месяцев.
Побочные эффекты андрогенного характера (у 40 – 72% больных) органичивают использование антигонадотропных средств.
Таким образом, не один из методов лечения не может быть единственным. Чаще всего врач комбинирует различные методы лечения, и тем самым достигается наилучший результат.
Чаще всего врач комбинирует различные методы лечения, и тем самым достигается наилучший результат.
При этом врач учитывает несколько факторов и в первую очередь желание женщины иметь детей. В последние годы в мире увеличилось число женщин, родивших здоровых детей, после использования современных методов лечения миомы матки.
Для получения наилучшей информации обратитесь к врачу гинекологу. Не все пациентки с миомами матки похожи друг на друга и поэтому очень важно, чтобы ваша индивидуальная ситуация адекватно была оценена специалистом.
Самойлова Т.Е., врач гинеколог-эндокринолог, доктор медицинских наук.
Консервативное и интервенционное лечение миомы
1. Ciavattini A, Di Giuseppe J, Stortoni P, et al. Миома матки: патогенез и взаимодействие с эндометрием и эндомиометриальным соединением. Акушерство Gynecol Int. 2013: 173–184. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2. Циммерманн А., Бернуит Д., Герлингер С. , Шеферс М., Гепперт К. Распространенность, симптомы и лечение миомы матки: международный интернет-опрос 21 746 женщин. Женское здоровье BMC. 2012;12 [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Шеферс М., Гепперт К. Распространенность, симптомы и лечение миомы матки: международный интернет-опрос 21 746 женщин. Женское здоровье BMC. 2012;12 [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Donnez J, Jadoul P. Каково влияние миомы на фертильность? Потребность в дебатах? Хум Репрод. 2002;17:1424–1430. [PubMed] [Google Scholar]
4. Metwally M, Cheong YC, Horne AW. Хирургическое лечение миомы при бесплодии. Cochrane Database Syst Rev. 2012 14 ноября; CD003857. [PubMed] [Google Scholar]
5. Ciavattini A, Clemente N, Delli Carpini G, Di Giuseppe J, Giannubilo SR, Tranquilli AL. Количество и размер миомы матки и акушерские исходы. J Matern Fetal Neonatal Med. 2014;5:1–5. [PubMed] [Академия Google]
6. Shavell V, Thakur M, Sawant A, et al. Неблагоприятные акушерские исходы, связанные с сонографически выявленными крупными миомами матки. Фертил Стерил. 2012;97:107–110. [PubMed] [Google Scholar]
7. Capmas P, Levaillant JM, Fernandez H. Хирургические методы и результаты лечения субмукозных миом. Curr Opin Obstet Gynecol. 2013; 25:332–338. [PubMed] [Google Scholar]
Curr Opin Obstet Gynecol. 2013; 25:332–338. [PubMed] [Google Scholar]
8. Donnez J, Tomaszewski J, Vázquez F, et al. Исследовательская группа PEARL II. Улипристала ацетат против лейпролида ацетата при миоме матки. N Engl J Med. 2012; 366: 421–432. [PubMed] [Академия Google]
9. Маньонда И.Т., Братби М., Хорст Дж.С., Бану Н., Горти М., Белли А.М. Эмболизация маточных артерий по сравнению с миомэктомией: влияние на качество жизни результатов исследования FUME (миомы матки: миомэктомия по сравнению с эмболизацией). Cardiovasc Intervent Radiol. 2012; 35: 530–536. [PubMed] [Google Scholar]
10. van der Kooij SM, Hehenkamp WJ, Birnie E, et al. Влияние предпочтения лечения и распределения лечения на качество жизни пациентов, связанное со здоровьем, в рандомизированном исследовании EMMY. Eur J Obstet Gynecol Reprod Biol. 2013;169: 69–74. [PubMed] [Google Scholar]
11. Sangkomkamhang US, Lumbiganon P, Laopaiboon M, Mol BW. Прогестогены или внутриматочные системы, высвобождающие прогестаген, при миоме матки. Cochrane Database Syst Rev. 2013 Feb 28; CD008994. [PubMed] [Google Scholar]
Cochrane Database Syst Rev. 2013 Feb 28; CD008994. [PubMed] [Google Scholar]
12. Tristan M, Orozco LJ, Steed A, Ramirez-Morera A, Stone P. Мифепристон для лечения миомы матки. Cochrane Database Syst Rev. 2012;8 CD007687. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Ke LQ, Yang K, Li J, Li CM. Даназол при миоме матки. Кокрановская система базы данных, ред. 2009 г.;3 CD007692. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Liu JP, Yang H, Xia Y, Cardini F. Травяные препараты для лечения миомы матки. Cochrane Database Syst Rev. 2013;4 CD005292. [PubMed] [Google Scholar]
15. Song H, Lu D, Navaratnam K, Shi G. Ингибиторы ароматазы при миоме матки. Кокрановская система базы данных, ред. 2013; 10 CD009505. [PubMed] [Google Scholar]
16. Духан Н., Мадаан С., Сен Дж. Роль ингибитора ароматазы летрозола в лечении лейомиомы матки у женщин в пременопаузе. Eur J Obstet Gynecol Reprod Biol. 2013;171:329–332. [PubMed] [Google Scholar]
17. Маврелос Д., Бен-Наги Дж., Дэвис А., Ли С., Салим Р., Юркович Д. Значение предоперационного лечения аналогами ГнРГ у женщин с подслизистой миомой: двойной слепое плацебо-контролируемое рандомизированное исследование. Хум Репрод. 2010;25:2264–2269. [PubMed] [Google Scholar]
Маврелос Д., Бен-Наги Дж., Дэвис А., Ли С., Салим Р., Юркович Д. Значение предоперационного лечения аналогами ГнРГ у женщин с подслизистой миомой: двойной слепое плацебо-контролируемое рандомизированное исследование. Хум Репрод. 2010;25:2264–2269. [PubMed] [Google Scholar]
18. Доннез Дж., Татарчук Т.Ф., Бушар П. и соавт. Исследовательская группа PEARL I: Сравнение улипристала ацетата и плацебо при лечении миомы перед операцией. N Engl J Med. 2012; 366: 409–420. [PubMed] [Академия Google]
19. Donnez J, Vázquez F, Tomaszewski J, et al. Длительное лечение миомы матки улипристала ацетатом. Фертил Стерил. 2014; 101:1565–1573. е1-18. [PubMed] [Google Scholar]
20. Jin C, Hu Y, Chen XC, et al. Лапароскопическая и открытая миомэктомия — метаанализ рандомизированных контролируемых исследований. Eur J Obstet Gynecol Reprod Biol. 2009; 145:14–21. [PubMed] [Google Scholar]
21. Sentilhes L, Vayssière C, Beucher G, et al. Роды у женщин, перенесших кесарево сечение в анамнезе: рекомендации по клинической практике Французского колледжа гинекологов и акушеров (CNGOF) Eur J Obstet Gynecol Reprod Biol. 2013;170:25–32. [PubMed] [Академия Google]
2013;170:25–32. [PubMed] [Академия Google]
22. Ким М.С., Ум Ю.К., Ким Дж.Й., Джи Б.К., Ким Ю.Б. Акушерские исходы после миомэктомии матки: лапароскопический и лапаротомный доступ. Акушерство Gynecol Sci. 2013; 56: 375–381. [Бесплатная статья PMC] [PubMed] [Google Scholar]
23. Bernardi TS, Radosa MP, Weisheit A, et al. Лапароскопическая миомэктомия: 6-летний одноцентровый когортный анализ показателей фертильности и акушерских исходов. Arch Gynecol Obstet. 2014; 290:87–91. [PubMed] [Google Scholar]
24. Mueller A, Boosz A, Koch M, et al. Инструмент Hohl для оптимизации тотальной лапароскопической гистерэктомии: результаты более 500 процедур в университетском учебном центре. Arch Gynecol Obstet. 2012; 285:123–127. [PubMed] [Академия Google]
25. Lethaby A, Mukhopadhyay A, Naik R. Тотальная и субтотальная гистерэктомия при доброкачественных гинекологических заболеваниях. Cochrane Database Syst Rev. 2012;4 CD004993. [PubMed] [Google Scholar]
26. Boosz A, Lermann J, Mehlhorn G, et al. Сравнение частоты повторных операций и осложнений после тотальной лапароскопической гистерэктомии (TLH) и супрацервикальной гистерэктомии с помощью лапароскопии (LASH) Eur J Obstet Gynecol Reprod Biol. 2011; 158: 269–273. [PubMed] [Google Scholar]
Сравнение частоты повторных операций и осложнений после тотальной лапароскопической гистерэктомии (TLH) и супрацервикальной гистерэктомии с помощью лапароскопии (LASH) Eur J Obstet Gynecol Reprod Biol. 2011; 158: 269–273. [PubMed] [Google Scholar]
27. Nieboer TE, Johnson N, Lethaby A, et al. Хирургический доступ к гистерэктомии при доброкачественных гинекологических заболеваниях. Кокрановская система базы данных, ред. 2009 г.CD003677. [PubMed] [Google Scholar]
28. Kröncke TJ, David M. Эмболизация маточных артерий (ОАЭ) zur Myombehandlung. РёФо. 2013; 185:461–463. [PubMed] [Google Scholar]
29. Gupta JK, Sinha A, Lumsden MA, et al. Эмболизация маточных артерий при симптоматической миоме матки. Кокрановская система базы данных, ред. 2012; 5 CD005073. [PubMed] [Google Scholar]
30. Тур С.С., Джабери А., Макдональд Д.Б. Частота осложнений и эффективность эмболизации маточных артерий при лечении симптоматических лейомиом: систематический обзор и метаанализ. АЖД 2012. 199: 1153–1163. [PubMed] [Google Scholar]
АЖД 2012. 199: 1153–1163. [PubMed] [Google Scholar]
31. van der Kooij SM, Shandra Bipat MD, et al. Эмболизация маточных артерий по сравнению с хирургическим вмешательством при лечении симптоматических миом: систематический обзор и метаанализ. Am J Obstet Gynecol. 2011;205 e1-18. [PubMed] [Google Scholar]
32. Froeling V, Meckelburg K, Schreiter NF, et al. Результаты эмболизации маточных артерий по сравнению с высокоинтенсивным сфокусированным ультразвуком под контролем МРТ для лечения миомы матки: долгосрочные результаты. Евр Дж Радиол. 2013; 82: 2265–2269. [PubMed] [Google Scholar]
33. Камп Дж. Э., Дэвид М., Шойриг-Мюнклер С., Хенгст С., Бек А. Клинические результаты магнитно-резонансной сфокусированной ультразвуковой хирургии (MRgFUS) при лечении симптоматической миомы матки. Рофо. 2013; 185:136–143. [PubMed] [Google Scholar]
34. Trumm CG, Stahl R, Clevert DA, et al. Фокусированное ультразвуковое лечение симптоматической миомы матки под контролем магнитно-резонансной томографии: влияние технического прогресса на объемы абляции у 115 пациентов. Инвестируйте Радиол. 2013;48:359–365. [PubMed] [Google Scholar]
Инвестируйте Радиол. 2013;48:359–365. [PubMed] [Google Scholar]
35. Stang A, Merrill RM, Kuss O. Гистерэктомия в Германии: общенациональный анализ на основе DRG. Dtsch Arztebl Int 2011. 2005–2006; 108: 508–514. [Бесплатная статья PMC] [PubMed] [Google Scholar]
36. Spies JB, Bruno J, Czeyda-Pommersheim F, Magee ST, Ascher SA, Jha RC. Отдаленные результаты эмболизации маточных артерий при лейомиомах. Акушерство Гинекол. 2005; 106: 933–939. [PubMed] [Google Scholar]
37. Goodwin SC, Spies JB, Worthington-Kirsch R, et al. Эмболизация маточных артерий для лечения лейомиомы: долгосрочные результаты из регистра FIBROID. Акушерство и гинекол. 2008; 111: 22–32. [PubMed] [Академия Google]
38. Stewart EA, Gostout B, Rabinovici J, et al. Устойчивое облегчение симптомов лейомиомы с помощью сфокусированной ультразвуковой хирургии. Акушерство и гинекол. 2007; 110: 279–287. [PubMed] [Google Scholar]
39. Saccardi C, Conte L, Fabris A, et al. Гистероскопическая энуклеация in toto подслизистой миомы 2 типа: долгосрочное наблюдение за женщинами, страдающими меноррагией. J Миним инвазивный гинекол. 2014;21:426–430. [PubMed] [Google Scholar]
J Миним инвазивный гинекол. 2014;21:426–430. [PubMed] [Google Scholar]
40. Ханафи М. Предикторы рецидива лейомиомы после миомэктомии. Акушерство Гинекол. 2005; 105: 877–881. [PubMed] [Академия Google]
е1. Robboy SJ, Bentley RC, Butnor K, Anderson MC. Патология и патофизиология гладкомышечных опухолей матки. Перспектива охраны окружающей среды. 2000; 108: 779–784. [PubMed] [Google Scholar]
e2. Рейн М.С., Пауэлл В.Л., Уолтерс Ф.К. и др. Цитогенетические аномалии при миоме матки связаны с размером миомы. Мол Хум Репрод. 1998; 4:83–86. [PubMed] [Google Scholar]
e3. Дэвид М., Крэтчелл Р. Миома матки: Корреляция фон Befundkenntnisstand und Beschwerden. Фрауэнарцт. 2013;54:119–123. [Google Scholar]
e4. Шокейр Т.А. Гистероскопическое лечение субмукозных миом для улучшения фертильности. Arch Gynecol Obstet. 2005; 273:50–54. [PubMed] [Google Scholar]
e5. Bernard G, Darai E, Poncelet C, Benifla JL, Madelenat P. Фертильность после гистероскопической миомэктомии: влияние интрамуральных миом. Eur J Obstet Gynecol Reprod Biol. 2000; 88: 85–90. [PubMed] [Google Scholar]
Eur J Obstet Gynecol Reprod Biol. 2000; 88: 85–90. [PubMed] [Google Scholar]
e6. Стюарт ЭА. Миома матки. Ланцет. 2001; 357: 293–298. [PubMed] [Академия Google]
е7. Парсанежад М.Е., Азмун М., Альборзи С. и др. Рандомизированное контролируемое клиническое исследование, сравнивающее влияние ингибитора ароматазы (летрозола) и агониста гонадотропин-рилизинг-гормона (трипторелина) на объем лейомиомы матки и гормональный статус. Фертил Стерил. 2010;93:192–198. [PubMed] [Google Scholar]
e8. Кампо С., Гарсеа Н. Лапароскопическая миомэктомия у женщин в пременопаузе с предоперационным лечением и без него с использованием аналогов гонадотропин-рилизинг-гормона. Человеческий отчет. 1999;14:44–48. [PubMed] [Google Scholar]
e9. Фельбербаум Р.Е., Гермер У., Людвиг М. и др. Лечение миомы матки препаратом медленного высвобождения антагониста гонадотропин-рилизинг-гормона Цетрореликс. Хум Репрод. 1998; 13:1660–1668. [PubMed] [Google Scholar]
e10. Кеттель Л.М., Мерфи А. А., Моралес А.Дж., Ривье Дж., Вейл В., Йен С.С. Быстрая регрессия лейомиомы матки в ответ на ежедневное введение антагониста гонадотропин-рилизинг-гормона. Фертил Стерил. 1993; 60: 642–646. [PubMed] [Академия Google]
А., Моралес А.Дж., Ривье Дж., Вейл В., Йен С.С. Быстрая регрессия лейомиомы матки в ответ на ежедневное введение антагониста гонадотропин-рилизинг-гормона. Фертил Стерил. 1993; 60: 642–646. [PubMed] [Академия Google]
е11. Фальконе Т., Паркер В.Х. Хирургическое лечение лейомиом для сохранения фертильности или матки. Акушерство Гинекол. 2013; 121:856–868. [PubMed] [Google Scholar]
e12. Ribeiro SC, Reich H, Rosenberg J, Guglielminetti E, Vidali A. Лапароскопическая миомэктомия и исход беременности у бесплодных пациентов. Фертил Стерил. 1999; 71: 571–574. [PubMed] [Google Scholar]
e13. Миллер Д.А., Гудвин Т.М., Герман Р.Б., Пол Р.Х. Интранатальный разрыв матки без рубца. Акушерство Гинекол. 1997;89:671–673. [PubMed] [Google Scholar]
e14. Стотланд Н.Е., Липшиц Л.С., Коги А.С. Стратегии родовспоможения для женщин с классическим кесаревым сечением в анамнезе: анализ решений. Am J Obstet Gynecol. 2002; 187:1203–1208. [PubMed] [Google Scholar]
e15. Фукуда М. , Танака Т., Камада М. и др. Сравнение перинатальных исходов после лапароскопической миомэктомии и абдоминальной миомэктомии. Гинеколь Обстет Инвест. 2013;76:203–208. [PubMed] [Google Scholar]
, Танака Т., Камада М. и др. Сравнение перинатальных исходов после лапароскопической миомэктомии и абдоминальной миомэктомии. Гинеколь Обстет Инвест. 2013;76:203–208. [PubMed] [Google Scholar]
e16. De Wilde R, Hucke J. Brauchen wir die Uterusarterien-Embolisation? Фрауэнарцт. 2006;47 [Google Академия]
е17. Крёнке Т.Дж., Дэвид М., Рике Дж. и др. Эмболизация маточных артерий для Myombehandlung. Фрауэнарцт. 2006; 47: 412–415. [Google Scholar]
e18. Мара М., Маскова Дж., Фуцикова З., Кузел Д., Белсан Т., Сосна О. Среднесрочные клинические и первые репродуктивные результаты рандомизированного контролируемого исследования, сравнивающего эмболизацию миомы матки и миомэктомию. Cardiovasc Intervent Radiol. 2008; 31:73–85. [Бесплатная статья PMC] [PubMed] [Google Scholar]
e19. Пинто И., Чимено П., Ромо А. и др. Миома матки: эмболизация маточных артерий по сравнению с абдоминальной гистерэктомией для лечения — проспективное, рандомизированное и контролируемое клиническое исследование.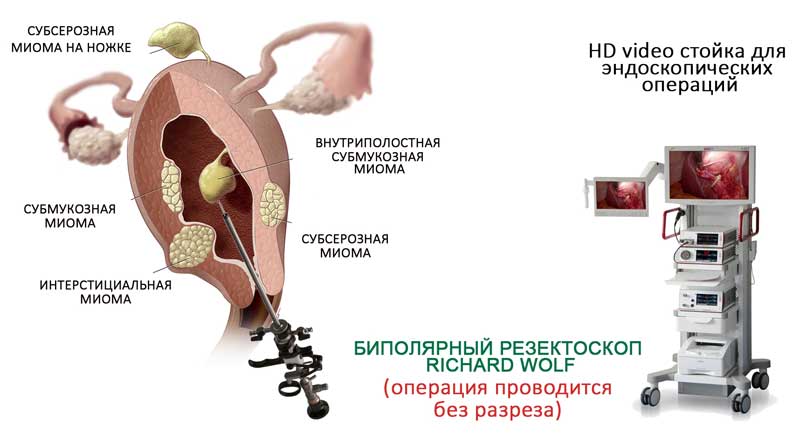 Радиология. 2003; 226:425–431. [PubMed] [Академия Google]
Радиология. 2003; 226:425–431. [PubMed] [Академия Google]
е20. Руусканен А., Хиппеляйнен М., Сипола П., Маннинен Х. Эмболизация маточных артерий по сравнению с гистерэктомией при лейомиомах: первичные и двухлетние результаты рандомизированного проспективного клинического исследования. Евро Радиол. 2010;20:2524–2532. [PubMed] [Google Scholar]
e21. Каумп Г.Р., Спайс Дж.Б. Влияние эмболизации маточных артерий на функцию яичников. J Vasc Interv Radiol. 2013; 24:459–467. [PubMed] [Google Scholar]
e22. Ли М.С., Ким М.Д., Юнг Д.К. и др. Кажущийся коэффициент диффузии лейомиомы матки как предиктор потенциального ответа на эмболизацию маточных артерий. J Vasc Interv Radiol. 2013; 24:1361–1365. [PubMed] [Академия Google]
е23. Рабиновичи Дж., Дэвид М., Фукуниси Х. и др. Исходы беременности после операции фокусированного ультразвука под магнитно-резонансным контролем (MRgFUS) для консервативного лечения миомы матки. Фертил Стерил. 2010;93:199–209. [PubMed] [Google Scholar]
Консервативное лечение тяжелых менструальных кровотечений и бесплодия, связанных с миомой матки: время для более глубокого понимания механизма и индивидуального подхода
1. Булун С.Е. Миома матки. Н. англ. Дж. Мед. 2013;369: 1344–1355. doi: 10.1056/NEJMra1209993. [PubMed] [CrossRef] [Google Scholar]
Булун С.Е. Миома матки. Н. англ. Дж. Мед. 2013;369: 1344–1355. doi: 10.1056/NEJMra1209993. [PubMed] [CrossRef] [Google Scholar]
2. Stewart E.A. Клиническая практика. Миома матки. Н. англ. Дж. Мед. 2015; 372:1646–1655. doi: 10.1056/NEJMcp1411029. [PubMed] [CrossRef] [Google Scholar]
3. Donnez J., Jadoul P. Каково влияние миомы на фертильность? Потребность в дебатах? Гум. Воспр. 2002;17:1424–1430. doi: 10.1093/humrep/17.6.1424. [PubMed] [CrossRef] [Google Scholar]
4. Donnez J., Dolmans M.M. Лечение миомы матки: от настоящего к будущему. Гум. Воспр. Обновлять. 2016;22:665–686. дои: 10.1093/humupd/dmw023. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
5. Donnez J. Миома матки и лечение прогестагеном: отсутствие доказательств его эффективности: обзор. Дж. Клин. Мед. 2020;9:3948. doi: 10.3390/jcm9123948. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
6. Baird D.D., Dunson D.B. Почему паритет защищает от миомы матки? Эпидемиология. 2003; 14: 247–250. doi: 10.1097/01.EDE.0000054360.61254.27. [PubMed] [CrossRef] [Google Scholar]
2003; 14: 247–250. doi: 10.1097/01.EDE.0000054360.61254.27. [PubMed] [CrossRef] [Google Scholar]
7. Wise L.A., Laughlin-Tommaso S.K. Эпидемиология миомы матки: от менархе до менопаузы. клин. Обст. Гинекол. 2016;59: 2–24. doi: 10.1097/GRF.0000000000000164. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
8. Стюарт Э. А., Бора Б. Дж. Миома матки и гипертония: шаги к пониманию связи. Дж. Клин. Эндокринол. Метаб. 2021;106:e1039–e1041. doi: 10.1210/clinem/dgaa829. [PubMed] [CrossRef] [Google Scholar]
9. Манро М.Г., Кричли Х.О., Фрейзер И.С., Рабочая группа по нарушениям менструального цикла FIGO. Классификация FIGO причин аномальных маточных кровотечений в репродуктивном возрасте. Плодородный. Стерильно. 2011;95:2204–2208. doi: 10.1016/j.fertnstert.2011.03.079. [PubMed] [CrossRef] [Google Scholar]
10. Базот М., Салем К., Фрей И., Дараи Э. Образы миомов: I’IRM est-elle utile en préopératoire? [Визуализация миомы: Полезна ли предоперационная МРТ?] Gynecol. Обст. Плодородный. 2002; 30: 711–716. doi: 10.1016/S1297-9589(02)00428-9. [PubMed] [CrossRef] [Google Scholar]
Обст. Плодородный. 2002; 30: 711–716. doi: 10.1016/S1297-9589(02)00428-9. [PubMed] [CrossRef] [Google Scholar]
11. Фрейтаг Д., Гюнтер В., Маасс Н., Алкатаут И. Миома матки и бесплодие. Диагностика. 2021;11:1455. дои: 10.3390/диагностика11081455. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
12. Donnez J., Dolmans M.M. Гормональная терапия бесплодия, связанного с интрамуральной миомой, от улипристала ацетата до антагониста ГнРГ: обзор. Воспр. Биомед. Онлайн. 2020; 41: 431–442. doi: 10.1016/j.rbmo.2020.05.017. [PubMed] [CrossRef] [Google Scholar]
13. Кричли Х.О., Бабаев Э., Булун С.Е., Кларк С., Гарсия-Грау И., Грегерсен П.К., Килкойн А., Ким Дж.Дж., Лаванда М., Марш Э.Е. Менструация: наука и общество. Являюсь. Дж. Обст. Гинекол. 2020; 223: 624–664. doi: 10.1016/j.ajog.2020.06.004. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
14. Уитакер Л., Кричли Х.О. Аномальные маточные кровотечения. Лучшая практика. Рез. клин. Обст. Гинеколь. 2016; 34:54–65. doi: 10.1016/j.bpobgyn.2015.11.012. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2016; 34:54–65. doi: 10.1016/j.bpobgyn.2015.11.012. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15. Ламсден М.А., Хамуди И., Гупта Дж., Хики М. Миомы: диагностика и лечение. БМЖ. 2015;351:h5887. doi: 10.1136/bmj.h5887. [PubMed] [CrossRef] [Google Scholar]
16. Кричли Х.О., Манро М.Г., Бродер М., Фрейзер И.С. Пятилетний международный обзор терминологии, определений и связанных с ними вопросов, связанных с аномальными маточными кровотечениями. Семин. Воспр. Мед. 2011;29: 377–382. doi: 10.1055/s-0031-1287661. [PubMed] [CrossRef] [Google Scholar]
17. Soliman A.M., Margolis M.K., Castelli-Haley J., Fuldeore M.J., Owens C.D., Coyne K.S. Влияние симптомов миомы матки на связанное со здоровьем качество жизни женщин в США: данные перекрестного исследования. Курс. Мед. Рез. мнение 2017; 33:1971–1978. doi: 10.1080/03007995.2017.1372107. [PubMed] [CrossRef] [Google Scholar]
18. Cardozo E.R., Clark A.D., Banks N.K., Henne M.B., Stegmann B.J., Segars J. H. Расчетная годовая стоимость лечения лейомиомы матки в США. Являюсь. Дж. Обст. Гинекол. 2012;206:e1–e211. doi: 10.1016/j.ajog.2011.12.002. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
H. Расчетная годовая стоимость лечения лейомиомы матки в США. Являюсь. Дж. Обст. Гинекол. 2012;206:e1–e211. doi: 10.1016/j.ajog.2011.12.002. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
19. Мунро М.Г. Классификация нарушений менструального кровотечения. Преподобный Эндокр. Метаб. Беспорядок. 2012;13:225–234. doi: 10.1007/s11154-012-9220-x. [PubMed] [CrossRef] [Google Scholar]
20. Donnez J., Vilos G., Gannon M.J., Maheux R., Emanuel M.H., Istre O., AZTEC Study Group Гозерелина ацетат (Золадекс) плюс абляция эндометрия при дисфункции матки кровотечение: 3-летняя последующая оценка. Плодородный. Стерильно. 2001; 75: 620–622. doi: 10.1016/S0015-0282(00)01767-2. [PubMed] [CrossRef] [Академия Google]
21. Гарри Р. Гистероскопия с контролируемым давлением во время менструации. Дж. Миним. Инвазивный гинекол. 2010;17:337–343. doi: 10.1016/j.jmig.2010.01.009. [PubMed] [CrossRef] [Google Scholar]
22. Buttram V.C., Jr., Reiter R.C. Лейомиомы матки: этиология, симптоматика и лечение. Плодородный. Стерильно. 1981; 36: 433–445. doi: 10.1016/s0015-0282(16)45789-4. [PubMed] [CrossRef] [Google Scholar]
Плодородный. Стерильно. 1981; 36: 433–445. doi: 10.1016/s0015-0282(16)45789-4. [PubMed] [CrossRef] [Google Scholar]
23. Stewart E.A., Nowak R.A. Кровотечение, связанное с лейомиомой: классическая гипотеза, обновленная для молекулярной эры. Гум. Воспр. Обновлять. 1996;2:295–306. doi: 10.1093/humupd/2.4.295. [PubMed] [CrossRef] [Google Scholar]
24. Кидо А., Тогаши К., Накаи А., Катаока М.Л., Кояма Т., Фуджи С. Оральные контрацептивы и перистальтика матки: оценка с помощью МРТ. Дж. Магн. Причина. Визуализация. 2005; 22: 265–270. doi: 10.1002/jmri.20384. [PubMed] [CrossRef] [Google Scholar]
25. Миура С., Хан К.Н., Китадзима М., Хираки К., Морияма С., Масузаки Х., Самедзима Т., Фудзисита А., Ишимару Т. Дифференциальная инфильтрация макрофагов и продукции простагландинов различными лейомиомами матки. Гум. Воспр. 2006;21:2545–2554. дои: 10.1093/хумреп/дел205. [PubMed] [CrossRef] [Google Scholar]
26. Sinclair D.C., Mastroyannis A., Taylor H.S. Лейомиома одновременно нарушает опосредованную BMP-2 децидуализацию эндометрия и экспрессию антикоагулянтов посредством секреции TGF-β3. Дж. Клин. Эндокринол. Метаб. 2011;96:412–421. doi: 10.1210/jc.2010-1450. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Дж. Клин. Эндокринол. Метаб. 2011;96:412–421. doi: 10.1210/jc.2010-1450. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
27. Taylor H.S. Миомы: когда их следует удалять, чтобы повысить эффективность экстракорпорального оплодотворения? Плодородный. Стерильно. 2018;109: 784–785. doi: 10.1016/j.fertnstert.2018.03.003. [PubMed] [CrossRef] [Google Scholar]
28. Коромпелис П., Пипери К., Адамопулос К., Далагиоргу Г., Корколопулу П., Сепса А., Антсаклис А., Папавассилиу А.Г. Экспрессия сосудистого эндотелиального фактора- А, желатиназы (ММП-2, ММП-9) и ТИМП-1 при лейомиомах матки. клин. хим. лаборатория Мед. 2015;53:1415–1424. doi: 10.1515/cclm-2014-0798. [PubMed] [CrossRef] [Google Scholar]
29. Vannuccini S., Clifton V.L., Fraser I.S., Taylor H.S., Critchley H., Giudice I.C., Petraglia F. Бесплодие и нарушения репродуктивной функции: влияние гормональных и воспалительных механизмов на беременность исход. Гум. Воспр. Обновлять. 2016;22:104–115. дои: 10.1093/humupd/dmv044. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
30. Pritts E.A., Parker W.H., Olive D.L. Миомы и бесплодие: обновленный систематический обзор доказательств. Плодородный. Стерильно. 2009;91:1215–1223. doi: 10.1016/j.fertnstert.2008.01.051. [PubMed] [CrossRef] [Google Scholar]
31. Nieuwenhuis L.L., Keizer A.L., Stoelinga B., Twisk J., Hehenkamp W., Brolmann H., Huirne J. Оценка васкуляризации миомы с помощью трехмерной ультразвуковой допплерографии предиктор роста миомы матки: проспективное когортное исследование. БЖОГ. 2018;125:577–584. дои: 10.1111/1471-0528.14608. [PubMed] [CrossRef] [Академия Google]
32. Schild R.L., Holthaus S., d’Alquen J., Fimmers R., Dorn C., van Der Ven H., Hansmann M. Количественная оценка субэндометриального кровотока с помощью трехмерного ультразвука является важным прогностическим фактором. фактор имплантации в программе экстракорпорального оплодотворения. Гум. Воспр. 2000; 15:89–94. doi: 10.1093/humrep/15.1.89. [PubMed] [CrossRef] [Google Scholar]
33. Kim A., Jung H., Choi W.J., Hong S.N., Kim H.Y. Выявление эндометриальной и субэндометриальной сосудистой сети в день переноса эмбрионов и прогнозирование беременности при свежих циклах экстракорпорального оплодотворения. Тайвань Дж. Обстет. Гинекол. 2014;53:360–365. doi: 10.1016/j.tjog.2013.05.007. [PubMed] [CrossRef] [Академия Google]
Kim A., Jung H., Choi W.J., Hong S.N., Kim H.Y. Выявление эндометриальной и субэндометриальной сосудистой сети в день переноса эмбрионов и прогнозирование беременности при свежих циклах экстракорпорального оплодотворения. Тайвань Дж. Обстет. Гинекол. 2014;53:360–365. doi: 10.1016/j.tjog.2013.05.007. [PubMed] [CrossRef] [Академия Google]
34. Йошино О., Хаяси Т., Осуга Ю., Орисака М., Асада Х., Окуда С., Хори М., Фуруя М., Онуки Х., Садошима Ю. Снижение частоты беременностей связано с аномалиями перистальтика матки, вызванная интрамуральной миомой. Гум. Воспр. 2010;25:2475–2479. doi: 10.1093/humrep/deq222. [PubMed] [CrossRef] [Google Scholar]
35. Йошино О., Ниши О., Осуга Ю., Асада Х., Окуда С., Орисака М., Хори М., Фудзивара Т., Хаяши Т. Миомэктомия уменьшает аномальную перистальтику матки и увеличивает частоту наступления беременности. Дж. Миним. Инвазивный гинекол. 2012;19: 63–67. doi: 10.1016/j.jmig.2011.09.010. [PubMed] [CrossRef] [Google Scholar]
36. Fanchin R. , Picone O., Ayoubi J.M., Marcadet-Fredet S., Kadoch J., Frydman R. Contractilité uterine et репродукция человека: перспективы Nouvelles [Маточная сократимость и репродукция: Новые перспективы] J. Gynecol. Обст. биол. Воспр. 2002; 31: 325–332. [PubMed] [Google Scholar]
, Picone O., Ayoubi J.M., Marcadet-Fredet S., Kadoch J., Frydman R. Contractilité uterine et репродукция человека: перспективы Nouvelles [Маточная сократимость и репродукция: Новые перспективы] J. Gynecol. Обст. биол. Воспр. 2002; 31: 325–332. [PubMed] [Google Scholar]
37. Ихена Д.Э., Булун С.Э. Обзор литературы о роли миомы матки в функции эндометрия. Воспр. науч. 2018;25:635–643. дои: 10.1177/1933719117725827. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
38. Rackow B.W., Taylor H.S. Подслизистые лейомиомы матки оказывают глобальное влияние на молекулярные детерминанты рецептивности эндометрия. Плодородный. Стерильно. 2010;93:2027–2034. doi: 10.1016/j.fertnstert.2008.03.029. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
39. Tinelli A., Favilli A., Lasmar R.B., Mazzon I., Gerli S., Xue X., Malvasi A. Важность сохранения псевдокапсулы во время гистероскопической миомэктомии. Евро. Дж. Обст. Гинекол. Воспр. биол. 2019;243:179–184. doi: 10. 1016/j.ejogrb.2019.09.008. [PubMed] [CrossRef] [Google Scholar]
1016/j.ejogrb.2019.09.008. [PubMed] [CrossRef] [Google Scholar]
40. Wang X., Chen L., Wang H., Li Q., Liu X., Qi H. Влияние интрамуральных миом, не искажающих полость, на эффективность экстракорпоральное оплодотворение-перенос эмбрионов: обновленный метаанализ. Биомед. Рез. Междунар. 2018;2018:8924703. doi: 10.1155/2018/8924703. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
41. Рихрай К., Тан Дж., Таскин О., Альберт А.Ю., Йонг П., Бедайви М.А. Влияние интрамуральных миом, не искажающих полость, на живых рождаемость в циклах экстракорпорального оплодотворения: систематический обзор и метаанализ. Дж. Женское здоровье. 2020;29: 210–219. doi: 10.1089/jwh.2019.7813. [PubMed] [CrossRef] [Google Scholar]
42. Yan L., Yu Q., Zhang Y.N., Guo Z., Li Z., Niu J., Ma J. Влияние интрамуральных миом 3 типа на экстракорпоральное оплодотворение -Исходы внутрицитоплазматической инъекции сперматозоидов: ретроспективное когортное исследование. Плодородный. Стерильно.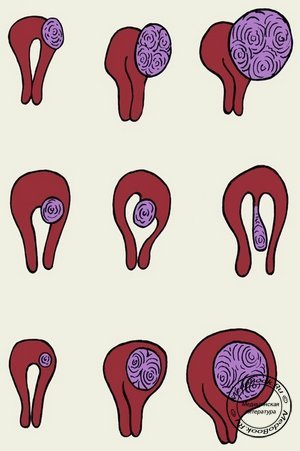 2018;109:817–822.e2. doi: 10.1016/j.fertnstert.2018.01.007. [PubMed] [CrossRef] [Google Scholar]
2018;109:817–822.e2. doi: 10.1016/j.fertnstert.2018.01.007. [PubMed] [CrossRef] [Google Scholar]
43. Metwally M., Raybould G., Cheong Y.C., Horne A.W. Хирургическое лечение миомы при бесплодии. Кокрановская система баз данных. Ред. 2020; 1:CD003857. doi: 10.1002/14651858.CD003857.pub4. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
44. Dolmans M.M., Isaacson K., Zhang M., Gordts S., Munro M., Steward E., Santulli P., Bourdon M., Donnez J. Интрамуральные миомы более 3–4 см подлежат хирургическому удалению. до экстракорпорального оплодотворения. Плодородный. Стерильно. 2021 в печати. [PubMed] [Google Scholar]
45. Donnez J. Интрамуральные миомы, связанные с бесплодием: следует ли удалять миомы??? Нелегко прийти к консенсусу. Плодородный. Стерильно. 2021 в печати. [PubMed] [Google Scholar]
46. Kim JJ, Sefton EC Роль передачи сигналов прогестерона в патогенезе лейомиомы матки. Мол. Клетка. Эндокринол. 2012; 358: 223–231. doi: 10.1016/j.mce.2011. 05.044. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
05.044. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
47. Lethaby A., Farquhar C., Cooke I. Антифибринолитики при обильных менструальных кровотечениях. Кокрановская система баз данных. Ред. 2000; 4:CD000249. doi: 10.1002/14651858.CD000249. [PubMed] [CrossRef] [Google Scholar]
48. Zapata L.B., Whiteman M.K., Tepper N.K., Jamieson D.J., Marchbanks P.A., Curtis K.M. Использование внутриматочной спирали женщинами с миомой матки: систематический обзор. Контрацепция. 2010;82:41–55. doi: 10.1016/j.contraception.2010.02.011. [PubMed] [CrossRef] [Академия Google]
49. Доннез Дж., Татарчук Т.Ф., Бушар П., Пушкашу Л., Захаренко Н.Ф., Иванова Т., Угоксай Г., Мара М., Джилла М.П., Бестел Э. Улипристала ацетат по сравнению с плацебо для лечения миомы перед операцией. Н. англ. Дж. Мед. 2012; 366: 409–420. doi: 10.1056/NEJMoa1103182. [PubMed] [CrossRef] [Google Scholar]
50. Donnez J., Tomaszewski J., Vázquez F., Bouchard P., Lemieszczuk B., Baró F., Nouri K. , Selvaggi L., Sodowski K., Бестел Э. Ацетат улипристала по сравнению с ацетатом лейпролида при миоме матки. Н. англ. Дж. Мед. 2012; 366: 421–432. doi: 10.1056/NEJMoa1103180. [PubMed] [CrossRef] [Академия Google]
, Selvaggi L., Sodowski K., Бестел Э. Ацетат улипристала по сравнению с ацетатом лейпролида при миоме матки. Н. англ. Дж. Мед. 2012; 366: 421–432. doi: 10.1056/NEJMoa1103180. [PubMed] [CrossRef] [Академия Google]
51. Donnez J., Vázquez F., Tomaszewski J., Nouri K., Bouchard P., Fauser B.C., Barlow D.H., Palacios S., Donnez O., Bestel E. Длительное лечение миомы матки улипристалом ацетат ☆ Fertil. Стерильно. 2014;101:e1–e18. doi: 10.1016/j.fertnstert.2014.02.008. [PubMed] [CrossRef] [Google Scholar]
52. Доннез Дж. Травма печени и улипристала ацетат: преувеличенная трагедия? Плодородный. Стерильно. 2018;110:593–595. doi: 10.1016/j.fertnstert.2018.06.044. [PubMed] [CrossRef] [Академия Google]
53. Donnez J., Arriagada P., Marciniak M., Larrey D. Параметры безопасности печени улипристала ацетата для лечения миомы матки: всесторонний обзор программы клинических исследований. Мнение эксперта. Препарат Саф. 2018;17:1225–1232. doi: 10.1080/14740338.2018.1550070. [PubMed] [CrossRef] [Google Scholar]
54. Donnez J., Schrurs B., Gillerot S., Sandow J., Clerckx F. Лечение миомы матки имплантатами агониста гонадотропин-рилизинг-гормона: оценка с помощью гистерографии. Плодородный. Стерильно. 1989;51:947–950. doi: 10.1016/S0015-0282(16)60723-9. [PubMed] [CrossRef] [Google Scholar]
Donnez J., Schrurs B., Gillerot S., Sandow J., Clerckx F. Лечение миомы матки имплантатами агониста гонадотропин-рилизинг-гормона: оценка с помощью гистерографии. Плодородный. Стерильно. 1989;51:947–950. doi: 10.1016/S0015-0282(16)60723-9. [PubMed] [CrossRef] [Google Scholar]
55. Lethaby A., Vollenhoven B., Sowter M. Эффективность предоперационных аналогов гонадотропин-высвобождающих гормонов у женщин с миомой матки, перенесших гистерэктомию или миомэктомию: систематический обзор. БЖОГ. 2002; 109:1097–1108. doi: 10.1111/j.1471-0528.2002.01225.x. [PubMed] [CrossRef] [Google Scholar]
56. Tan Y.H., Lethaby A. Предоперационные средства для истончения эндометрия перед разрушением эндометрия при тяжелых менструальных кровотечениях. Кокрановская система баз данных. Ред. 2013; 11:CD010241. doi: 10.1002/14651858.CD010241.pub2. [PubMed] [CrossRef] [Академия Google]
57. Osuga Y., Enya K., Kudou K., Tanimoto M., Hoshiai H. Пероральный антагонист гонадотропин-высвобождающего гормона релуголикс по сравнению с инъекциями лейпрорелина при лейомиоме матки: рандомизированное контролируемое исследование. Обст. Гинекол. 2019; 133:423–433. doi: 10.1097/AOG.0000000000003141. [PubMed] [CrossRef] [Google Scholar]
Обст. Гинекол. 2019; 133:423–433. doi: 10.1097/AOG.0000000000003141. [PubMed] [CrossRef] [Google Scholar]
58. Schlaff W.D., Ackerman R.T., Al-Hendy A., Archer D.F., Barnhart K.T., Bradley L.D., Carr B.R., Feinberg E.C., Hurtado S.M., Kim J., et al. . Элаголикс при обильных менструальных кровотечениях у женщин с миомой матки. Н. англ. Дж. Мед. 2020; 382: 328–340. дои: 10.1056/NEJMoa1904351. [PubMed] [CrossRef] [Google Scholar]
59. Al-Hendy A., Lukes A.S., Poindexter A.N., 3rd, Venturella R., Villarroel C., Critchley H.O.D., Li Y., McKain L., Arjona Ferreira J.C., Langenberg A.G.M., et al. Лечение симптомов миомы матки комбинированной терапией релуголиксом. Н. англ. Дж. Мед. 2021; 384: 630–642. doi: 10.1056/NEJMoa2008283. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
60. Stewart E., Taylor H., Taylor R., Donnez J., Bestel E., Gotteland J.P., Humberstone A., Garner E. Efficacy и безопасность линзаголикса (LGX) для лечения тяжелых менструальных кровотечений (HMB) из-за миомы матки: результаты двух рандомизированных клинических испытаний фазы 3. Плодородный. Стерильно. 2020; 114 ((Приложение E527)) doi: 10.1016/j.fertnstert.2020.090,016. [CrossRef] [Google Scholar]
Плодородный. Стерильно. 2020; 114 ((Приложение E527)) doi: 10.1016/j.fertnstert.2020.090,016. [CrossRef] [Google Scholar]
61. Di Spiezio Sardo A., Mazzon I., Bramante S., Bettocchi S., Bifulco G., Guida M., Nappi C. Гистероскопическая миомэктомия: всесторонний обзор хирургических методов. Гум. Воспр. Обновлять. 2008; 14:101–119. doi: 10.1093/humupd/dmm041. [PubMed] [CrossRef] [Google Scholar]
62. Bettocchi S., Ceci O., Nappi L., Di Venere R., Masciopinto V., Pansini V., Pinto L., Santoro A., Cormio G. Оперативная гистероскопия без анестезии: анализ 4863 случаев, выполненных механическими инструментами. Варенье. доц. Гинекол. Лапароск. 2004;11:59–61. doi: 10.1016/S1074-3804(05)60012-6. [PubMed] [CrossRef] [Google Scholar]
63. Di Spiezio Sardo A., Calagna G., Di Carlo C., Guida M., Perino A., Nappi C. Холодные петли, примененные к биполярному резектоскопу: безопасность «одноэтапная» миомэктомия для лечения подслизистых миом с интрамуральным развитием. Дж. Обст. Гинеколь. Рез. 2015; 41:1935–1941. doi: 10.1111/jog.12831. [PubMed] [CrossRef] [Google Scholar]
Гинеколь. Рез. 2015; 41:1935–1941. doi: 10.1111/jog.12831. [PubMed] [CrossRef] [Google Scholar]
64. Casadio P., Youssef A.M., Spagnolo E., Rizzo M.A., Talamo M.R., De Angelis D., Marra E., Ghi T., Savelli L., Farina A. ., и другие. Следует ли по-прежнему считать свободный край миометрия ограничивающим фактором для гистероскопической резекции субмукозных миом? Возможный ответ на старый вопрос. Плодородный. Стерильно. 2011;95:1764–1768.e1. doi: 10.1016/j.fertnstert.2011.01.033. [PubMed] [CrossRef] [Google Scholar]
65. Bhave Chittawar P., Franik S., Pouwer A.W., Farquhar C. Минимально инвазивные хирургические методы в сравнении с открытой миомэктомией при миоме матки. Кокрановская система баз данных. Ред. 2014; 10:CD004638. doi: 10.1002/14651858.CD004638.pub3. [PubMed] [CrossRef] [Google Scholar]
66. Segars J.H., Parrott E.C., Nagel J.D., Guo X.C., Gao X., Birnbaum L.S., Pinn V.W., Dixon D. Материалы третьего международного конгресса национальных институтов здоровья по достижения в исследованиях лейомиомы матки: всесторонний обзор, резюме конференции и будущие рекомендации. Гум. Воспр. Обновлять. 2014;20:309–333. doi: 10.1093/humupd/dmt058. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Гум. Воспр. Обновлять. 2014;20:309–333. doi: 10.1093/humupd/dmt058. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
67. Dubuisso J.B., Fauconnier A., Babaki-Fard K., Chapron C. Лапароскопическая миомэктомия: современный взгляд. Гум. Воспр. Обновлять. 2000; 6: 588–594. doi: 10.1093/humupd/6.6.588. [PubMed] [CrossRef] [Google Scholar]
68. Donnez O., Jadoul P., Squifflet J., Donnez J. Ятрогенная перитонеальная аденомиома после лапароскопической субтотальной гистерэктомии и морцелляции матки. Плодородный. Стерильно. 2006; 86: 1511–1512. doi: 10.1016/j.fertnstert.2006.06.009. [PubMed] [CrossRef] [Google Scholar]
69. Тон Р., Килик Г.С., Фелпс Дж.Ю. Медицинско-правовой обзор морцелляции власти перед лицом недавнего предупреждения FDA и судебного разбирательства. Дж. Миним. Инвазивный гинекол. 2015; 22: 564–572. doi: 10.1016/j.jmig.2015.01.017. [PubMed] [CrossRef] [Google Scholar]
70. Parker W.H., Kaunitz A.M., Pritts E.A., Olive D.L., Chalas E. , Clarke-Pearson DL, Berek J.S., Leiomyoma Morcellation Review Group Руководство Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США в отношении морцелляции лейомиом: благие намерения, но вредно ли это для женщин? Обст. Гинекол. 2016; 127:18–22. дои: 10.1097/АОГ.0000000000001157. [PubMed] [CrossRef] [Google Scholar]
, Clarke-Pearson DL, Berek J.S., Leiomyoma Morcellation Review Group Руководство Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США в отношении морцелляции лейомиом: благие намерения, но вредно ли это для женщин? Обст. Гинекол. 2016; 127:18–22. дои: 10.1097/АОГ.0000000000001157. [PubMed] [CrossRef] [Google Scholar]
71. Parker W.H., Pritts EA, Olive D.L. Каково будущее открытой внутрибрюшинной силовой морцелляции миомы? клин. Обст. Гинекол. 2016;59:73–84. doi: 10.1097/GRF.0000000000000166. [PubMed] [CrossRef] [Google Scholar]
72. Cholkeri-Singh A., Miller CE Морцелляция в пакете для образцов. Дж. Миним. Инвазивный гинекол. 2015;22:160. doi: 10.1016/j.jmig.2014.10.012. [PubMed] [CrossRef] [Академия Google]
73. Шахин Х., Каратас Ф., Кобан Г., Озен О., Эрдем О., Онан М.А., Айхан А. Гладкомышечная опухоль матки с неопределенным злокачественным потенциалом: фертильность и клинические результаты. Дж. Гинекол. Онкол. 2019;30:e54. doi: 10. 3802/jgo.2019.30.e54. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
3802/jgo.2019.30.e54. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
74. Zupi E., Centini G., Sabbioni L., Lazzeri L., Argay I.M., Petraglia F. Нехирургические альтернативы миоме матки. Лучшая практика. Рез. клин. Обст. Гинеколь. 2016; 34:122–131. doi: 10.1016/j.bpobgyn.2015.11.013. [PubMed] [CrossRef] [Академия Google]
75. Равина Дж.Х., Эрбрето Д., Чирару-Виньерон Н., Буре Дж.М., Удар Э., Аймар А., Мерланд Дж.Дж. Артериальная эмболизация при миоме матки. Ланцет. 1995; 346: 671–672. doi: 10.1016/S0140-6736(95)92282-2. [PubMed] [CrossRef] [Google Scholar]
76. Stewart E.A. Сравнение яблок с яблоками при миоме. Н. англ. Дж. Мед. 2020; 383: 489–490. doi: 10.1056/NEJMe2017266. [PubMed] [CrossRef] [Google Scholar]
77. Khaw S.C., Anderson R.A., Lui M.W. Систематический обзор исходов беременности после сохраняющего фертильность лечения миомы матки. Воспр. Биомед. Онлайн. 2020;40:429–444. doi: 10.1016/j.rbmo.2020.01.003. [PubMed] [CrossRef] [Google Scholar]
78. Маньонда И., Белли А.М., Ламсден М.А., Мосс Дж., Маккиннон В., Миддлтон Л.Дж., Чид В., Ву О., Сиркечи Ф., Дэниелс Дж.П., и другие. Эмболизация маточных артерий или миомэктомия при миоме матки. Н. англ. Дж. Мед. 2020; 383: 440–451. doi: 10.1056/NEJMoa1914735. [PubMed] [CrossRef] [Google Scholar]
Маньонда И., Белли А.М., Ламсден М.А., Мосс Дж., Маккиннон В., Миддлтон Л.Дж., Чид В., Ву О., Сиркечи Ф., Дэниелс Дж.П., и другие. Эмболизация маточных артерий или миомэктомия при миоме матки. Н. англ. Дж. Мед. 2020; 383: 440–451. doi: 10.1056/NEJMoa1914735. [PubMed] [CrossRef] [Google Scholar]
. Магнитно-резонансная высокоинтенсивная сфокусированная ультразвуковая терапия (MR-HIFU) симптоматической миомы матки с неограниченными протоколами лечения: систематический обзор и метаанализ. Евро. Дж. Радиол. 2019;120:108700. doi: 10.1016/j.ejrad.2019.108700. [PubMed] [CrossRef] [Google Scholar]
80. Флинн М., Джеймисон М., Датта С., Майерс Э. Использование ресурсов здравоохранения для лечения миомы матки в Соединенных Штатах. Являюсь. Дж. Обст. Гинекол. 2006; 195:955–964. doi: 10.1016/j.ajog.2006.02.020. [PubMed] [CrossRef] [Google Scholar]
81. Чоданкар Р., Кричли Х.О.Д. Биомаркеры аномальных маточных кровотечений. биол. Воспр. 2019;101:1155–1166. doi: 10.1093/biolre/ioy231. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Консервативное лечение миомы
William H. Parker, MD
Если вам необходимо лечение миомы, у вас есть несколько вариантов. Ваш выбор должен основываться на медицинских проблемах, которые вызывают миомы, вашем желании иметь детей, а также на ваших чувствах и мыслях об операции или других вариантах. Я думаю, что вам важно знать все доступные варианты.
Какие существуют варианты лечения миомы?
Если вам необходимо лечение миомы, у вас есть несколько вариантов. Ваш выбор должен основываться на медицинских проблемах, которые вызывают миомы, вашем желании иметь детей, а также на ваших чувствах и мыслях об операции или других вариантах. Я думаю, что вам важно знать все доступные варианты. Даже если некоторые виды лечения не применяются в настоящее время, ваше состояние или симптомы могут измениться. Если вы понимаете потенциал будущих симптомов и проблем, а также доступные альтернативные средства лечения, большая часть тайны миомы исчезнет.
Если вы понимаете потенциал будущих симптомов и проблем, а также доступные альтернативные средства лечения, большая часть тайны миомы исчезнет.
Можно ли наблюдать за моими миомами?
Хотя у большинства женщин миома возникает в течение жизни, лишь небольшому числу из них когда-либо потребуется лечение. Подавляющее большинство женщин с миомами не подозревают о них, пока их врач не прощупает их во время планового осмотра. Некоторые женщины имеют очень незначительные симптомы, которые совсем не беспокоят. Если это ваш случай, то никакого лечения не требуется. Я считаю тщательное наблюдение основным методом лечения.
Причина роста миомы изучена недостаточно, а скорость роста непредсказуема. Большинство миом никогда не растут; другие растут постепенно в течение многих лет; а некоторые, похоже, проходят скачки роста, а затем могут полностью перестать расти. Единственный способ узнать, что происходит, — это регулярно проходить гинекологический осмотр. Обычно я осматриваю женщин с миомами каждые три-шесть месяцев. Если миома растет в течение этого периода времени, рост будет обнаружен рано, и ряд вариантов, за исключением гистерэктомии, все еще должен быть доступен. Если кажется, что миома растет, я обычно провожу осмотр чаще, как правило, каждый месяц, пока рост не прекратится. Ультрасонография, простой тест, в котором используются звуковые волны для создания изображения, также может использоваться для определения размера миомы.
Обычно я осматриваю женщин с миомами каждые три-шесть месяцев. Если миома растет в течение этого периода времени, рост будет обнаружен рано, и ряд вариантов, за исключением гистерэктомии, все еще должен быть доступен. Если кажется, что миома растет, я обычно провожу осмотр чаще, как правило, каждый месяц, пока рост не прекратится. Ультрасонография, простой тест, в котором используются звуковые волны для создания изображения, также может использоваться для определения размера миомы.
С другой стороны, миомы могут иногда увеличиваться настолько, что вызывают постоянный дискомфорт, давление и даже боль. И, хотя это и не опасно, дискомфорт может привести к тому, что вы выберете операцию для лечения миомы. Еще одно замечание: очень большие миомы могут частично блокировать ток крови от ног обратно к сердцу. Это может привести к отеку ног и некоторому дискомфорту. Очень редко это также может привести к образованию тромбов в ногах, что может быть опасно. Если у вас очень большие миомы, важно, чтобы вы не сидели в течение длительного периода времени, чтобы у вас было меньше шансов на образование тромбов.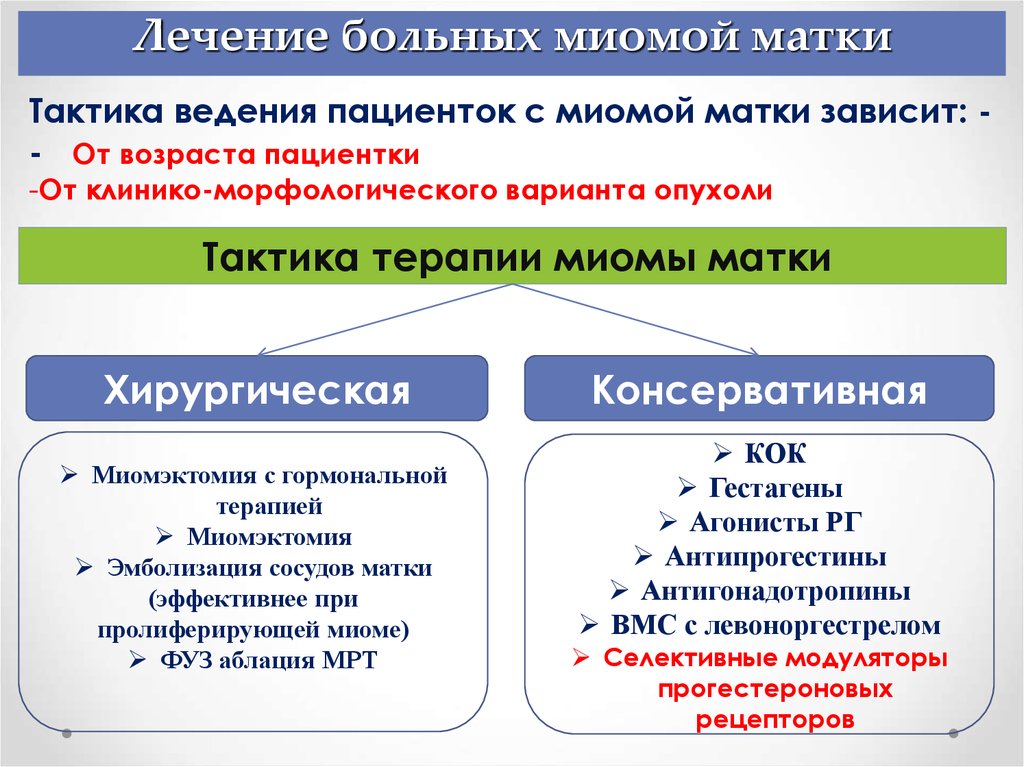
Что делать, если у вас большие миомы?
Врачей учили, что если у женщины миома размером с крупный грейпфрут (или матку на двенадцатой неделе беременности) или больше, у нее будет риск возникновения других проблем со здоровьем. Эта причина — возможность возникновения проблем в будущем — мне просто непонятна. Если у вас большая миома и вы чувствуете себя хорошо, я не вижу необходимости в операции. На самом деле вполне вероятно, что ваша крупная миома никогда не будет вызывать у вас каких-либо неприятных симптомов.
Врачи также считают, что большие миомы затрудняют проведение тщательного гинекологического осмотра, и опасаются, что неоптимальное гинекологическое обследование может привести к тому, что ранний диагноз рака яичников будет упущен. К сожалению, рак яичников чрезвычайно трудно диагностировать на ранних стадиях, с миомой или без нее, даже с помощью самого сложного и дорогостоящего тестирования (см. ).
Это разочаровывающая и трудная реальность для всех нас. Обычно к тому времени, когда гинеколог может почувствовать аномалию яичника при гинекологическом осмотре, болезнь уже распространилась. Гинекологи также часто не могут прощупать яичники каждой пациентки из-за размера яичников, положения яичников или веса пациентки. Было бы бессмысленно рекомендовать гистерэктомию каждой женщине, у которой гинеколог не смог прощупать яичники. И ни одно исследование никогда не показывало, что удаление матки, увеличенной из-за миомы, имеет какое-либо значение для раннего выявления рака яичников.
Обычно к тому времени, когда гинеколог может почувствовать аномалию яичника при гинекологическом осмотре, болезнь уже распространилась. Гинекологи также часто не могут прощупать яичники каждой пациентки из-за размера яичников, положения яичников или веса пациентки. Было бы бессмысленно рекомендовать гистерэктомию каждой женщине, у которой гинеколог не смог прощупать яичники. И ни одно исследование никогда не показывало, что удаление матки, увеличенной из-за миомы, имеет какое-либо значение для раннего выявления рака яичников.
Еще один аргумент в пользу агрессивной хирургии связан с убеждением, что риски и осложнения операции выше, если операция откладывается и матка увеличивается. Как показано в недавнем исследовании доктора Роберта Рейтера из Медицинского колледжа Университета Айовы, частота осложнений у женщин, перенесших гистерэктомию по поводу крупных миом, не отличается от таковой у женщин с небольшими миомами. Миомэктомия может быть безопасно выполнена у женщин с большими миомами.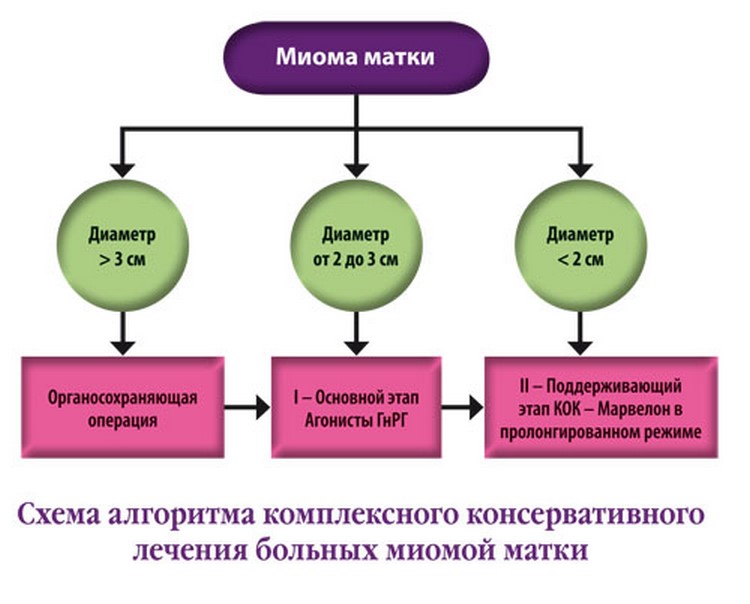
Д-р Стэнли Уэст, д-р Реджинальд Руис и я только что представили статью для публикации, в которой анализируются результаты лечения 91 женщины с миомой матки размером более четырех месяцев беременной матки, прооперированных доктором Уэстом между 01.03.98 и 02.03. 28/03 . Результаты очень выгодно отличаются от результатов других исследований женщин, перенесших гистерэктомию по поводу больших миом.
Таким образом, операция оправдана только в том случае, если у вас есть симптомы, которые действительно оправдывают риск, время, стресс и деньги, связанные с операцией. Многие пациентки с миомой матки не нуждаются в лечении.
Можно ли принимать лекарства от миомы?
К сожалению, в настоящее время не существует лекарств, способных предотвратить образование миомы или навсегда уменьшить ее размер при наличии. Лекарства часто используются, чтобы выиграть время или уменьшить симптомы. Некоторым женщинам достаточно уменьшения дискомфорта, чтобы на неопределенный срок отложить операцию. Другим лекарства дают более спокойный период времени для эмоциональной и физической подготовки к неизбежной операции. Лекарства также могут временно уменьшить размер миомы настолько, чтобы можно было провести менее инвазивную операцию с более быстрым выздоровлением. Для некоторых женщин, приближающихся к менопаузе, «выигранное время» может привести их прямо к менопаузе, когда естественная потеря эстрогена и прогестерона приводит к уменьшению размеров миомы.
Другим лекарства дают более спокойный период времени для эмоциональной и физической подготовки к неизбежной операции. Лекарства также могут временно уменьшить размер миомы настолько, чтобы можно было провести менее инвазивную операцию с более быстрым выздоровлением. Для некоторых женщин, приближающихся к менопаузе, «выигранное время» может привести их прямо к менопаузе, когда естественная потеря эстрогена и прогестерона приводит к уменьшению размеров миомы.
Люпрон и Синарел — два препарата, действие которых основано на временном отключении способности яичников вырабатывать эстроген и прогестерон, и менструальные циклы временно прекращаются. Поскольку эстроген и прогестерон необходимы для роста миомы, недостаток гормонов приводит к ее уменьшению. Поскольку эти лекарства разрушаются пищеварительными жидкостями в желудке, их следует давать не в виде таблеток. Люпрон вводят в виде инъекций, а Синарел вводят в виде назального спрея.
Этим препаратам требуется около двух недель, чтобы начать уменьшать миомы, а полный эффект наблюдается через три месяца. В это время размер большинства миом уменьшается примерно на 50 процентов от их объема. Эффект уменьшения сохраняется до тех пор, пока вы принимаете лекарство, но после третьего месяца лечения редко наблюдается дальнейшее уменьшение. Если прием лекарства прекращается, яичники снова начинают вырабатывать гормоны, и миомы возвращаются к своим первоначальным размерам в течение трех месяцев. Таким образом, лекарство не имеет постоянного эффекта и в основном используется для уменьшения симптомов и предоставления времени для коррекции анемии и планирования операции. Кроме того, длительное использование этих препаратов ограничено их побочными эффектами и риском развития остеопороза.
В это время размер большинства миом уменьшается примерно на 50 процентов от их объема. Эффект уменьшения сохраняется до тех пор, пока вы принимаете лекарство, но после третьего месяца лечения редко наблюдается дальнейшее уменьшение. Если прием лекарства прекращается, яичники снова начинают вырабатывать гормоны, и миомы возвращаются к своим первоначальным размерам в течение трех месяцев. Таким образом, лекарство не имеет постоянного эффекта и в основном используется для уменьшения симптомов и предоставления времени для коррекции анемии и планирования операции. Кроме того, длительное использование этих препаратов ограничено их побочными эффектами и риском развития остеопороза.
Два препарата, используемые для лечения миомы матки, сейчас проходят клинические испытания. Оба препарата действуют, блокируя стимулирующее рост действие прогестерона на миомы. Первый препарат — RU-486, также известный как таблетка для аборта. Это лекарство изучается в Рочестере, штат Нью-Йорк, и исследователи обнаружили примерно 50% уменьшение размера миомы после приема этого перорального лекарства. Поскольку препарат блокирует прогестерон, но не эстроген, эстроген из яичников может стимулировать клетки слизистой оболочки матки без какого-либо противодействия со стороны прогестерона. После года лечения примерно у 5% женщин наблюдался разрастание этих выстилающих клеток, хотя ни у кого не развился предрак или рак. Есть некоторые опасения, что дальнейшее использование этого лекарства может в конечном итоге привести к предраковым состояниям или раку, но, опять же, до сих пор этого не было обнаружено. Другие побочные эффекты включают приливы и головную боль.
Поскольку препарат блокирует прогестерон, но не эстроген, эстроген из яичников может стимулировать клетки слизистой оболочки матки без какого-либо противодействия со стороны прогестерона. После года лечения примерно у 5% женщин наблюдался разрастание этих выстилающих клеток, хотя ни у кого не развился предрак или рак. Есть некоторые опасения, что дальнейшее использование этого лекарства может в конечном итоге привести к предраковым состояниям или раку, но, опять же, до сих пор этого не было обнаружено. Другие побочные эффекты включают приливы и головную боль.
Я включаю реферат
Низкие дозы мифепристона при лейомиоме матки.
Авторы: Eisinger SH, Meldrum S, Fiscella K, le Roux HD, Guzick DS.
Акушерство Гинек. 2003 Feb;101(2):243-50
ЦЕЛЬ: Сравнить влияние 5 и 10 мг мифепристона на размер и симптомы лейомиомы матки, а также измерить побочные эффекты.
Методы. В открытом исследовании сорок женщин в пременопаузе с крупной симптоматической лейомиомой были рандомизированы для приема 5 или 10 мг мифепристона ежедневно в течение 6 месяцев. Объем матки измеряли каждые два месяца с помощью УЗИ. Были получены сывороточные концентрации уровней гемоглобина, фолликулостимулирующего гормона и ферментов печени, а также были оценены образцы эндометрия, симптомы и менструальные кровотечения.
Объем матки измеряли каждые два месяца с помощью УЗИ. Были получены сывороточные концентрации уровней гемоглобина, фолликулостимулирующего гормона и ферментов печени, а также были оценены образцы эндометрия, симптомы и менструальные кровотечения.
РЕЗУЛЬТАТЫ: Девятнадцать из 20 субъектов, принимавших 5 мг, и все 20 субъектов, принимавших 10 мг, завершили все 6 месяцев исследования. Средний объем матки уменьшился на 48% (P <0,001) в группе 5 мг и на 49% (P <0,001) в группе 10 мг, разница незначительна. Симптомы, связанные с лейомиомой, были сравнительно уменьшены в обеих группах. Аменорея имела место в 60-65% обеих групп. Уровни гемоглобина увеличились на 2,5 г/дл у субъектов с анемией. Частота приливов значительно увеличилась по сравнению с исходным уровнем в группе 10 мг, но не в группе 5 мг. Простая гиперплазия эндометрия имела место у 28% всех пациенток без различий между группами. Атипической гиперплазии не отмечено.
ЗАКЛЮЧЕНИЕ. Мифепристон в дозах 5 мг или 10 мг приводит к сопоставимой регрессии лейомиомы, улучшению симптомов и небольшому количеству побочных эффектов. Необходимы дальнейшие исследования для оценки долгосрочной безопасности и эффективности низких доз мифепристона.
Необходимы дальнейшие исследования для оценки долгосрочной безопасности и эффективности низких доз мифепристона.
Другим блокирующим прогестерон препаратом является азоприснил. Ранние результаты также показывают уменьшение размера миомы примерно на 50%.
Я включаю пока единственный опубликованный реферат (финансируемый TAP, компанией, производящей лекарство):
Азоприснил (J867): селективный модулятор рецепторов прогестерона для гинекологической терапии.
Авторы: DeManno D, Elger W, Garg R, Lee R, Schneider B, Hess-Stumpp H, Schubert G, Chwalisz K.
Стероиды. 2003 ноябрь; 68 (10-13): 1019-32.
TAP Pharmaceutical Products Inc., 675 N. Field Drive, 600452, Lake Forest, IL, USA
Азоприснил представляет собой новый селективный модулятор стероидных рецепторов, демонстрирующий уникальные фармакодинамические эффекты в моделях на животных и людях. Азоприснил, его основной метаболит J912 и структурно родственные соединения представляют собой новый класс лигандов рецептора прогестерона (PR), которые проявляют частичную агонистическую и антагонистическую активность in vivo. Азоприснил демонстрирует высокую степень селективности к рецепторам и тканям, с высоким сродством к PR, умеренным сродством к глюкокортикоидным рецепторам (GR), низким сродством к рецепторам андрогенов (AR) и отсутствием сродства к рецепторам эстрогена или минералокортикоидов. В эндометрии кроликов и азоприснил, и J912 вызывают эффекты частичного агониста и антагониста. Азоприснил вызывает образование слизи во влагалище морской свинки и оказывает выраженное антиутеротрофическое действие у здоровых морских свинок и морских свинок после овариэктомии. В отличие от антипрогестинов, азоприснил проявляет лишь незначительную активность в отношении стимуляции родов в середине беременности и совершенно неэффективен в отношении стимуляции преждевременных родов у морских свинок. Азоприснил проявляет лишь незначительную антиглюкокортикоидную активность в трансактивации в исследованиях in vitro и на животных моделях. У самцов крыс азоприснил проявлял слабые андрогенные и антиандрогенные свойства. В токсикологических исследованиях у самок яванских макаков лечение азоприснилом устраняло менструальный цикл и атрофию эндометрия.
Азоприснил демонстрирует высокую степень селективности к рецепторам и тканям, с высоким сродством к PR, умеренным сродством к глюкокортикоидным рецепторам (GR), низким сродством к рецепторам андрогенов (AR) и отсутствием сродства к рецепторам эстрогена или минералокортикоидов. В эндометрии кроликов и азоприснил, и J912 вызывают эффекты частичного агониста и антагониста. Азоприснил вызывает образование слизи во влагалище морской свинки и оказывает выраженное антиутеротрофическое действие у здоровых морских свинок и морских свинок после овариэктомии. В отличие от антипрогестинов, азоприснил проявляет лишь незначительную активность в отношении стимуляции родов в середине беременности и совершенно неэффективен в отношении стимуляции преждевременных родов у морских свинок. Азоприснил проявляет лишь незначительную антиглюкокортикоидную активность в трансактивации в исследованиях in vitro и на животных моделях. У самцов крыс азоприснил проявлял слабые андрогенные и антиандрогенные свойства. В токсикологических исследованиях у самок яванских макаков лечение азоприснилом устраняло менструальный цикл и атрофию эндометрия. Ранние клинические исследования азоприснила у здоровых добровольцев продемонстрировали дозозависимое подавление менструации независимо от влияния на овуляцию, без изменения базальной концентрации эстрогена и антиглюкокортикоидного действия. В отличие от прогестинов азоприснил не вызывает прорывных кровотечений. Благодаря благоприятным профилям безопасности и переносимости, азоприснил представляется многообещающим в качестве нового средства для лечения гинекологических заболеваний, таких как миома матки и эндометриоз.
Ранние клинические исследования азоприснила у здоровых добровольцев продемонстрировали дозозависимое подавление менструации независимо от влияния на овуляцию, без изменения базальной концентрации эстрогена и антиглюкокортикоидного действия. В отличие от прогестинов азоприснил не вызывает прорывных кровотечений. Благодаря благоприятным профилям безопасности и переносимости, азоприснил представляется многообещающим в качестве нового средства для лечения гинекологических заболеваний, таких как миома матки и эндометриоз.
Можно ли использовать Lupron для женщин, приближающихся к менопаузе?
Женщина с миомой, приближающаяся к менопаузе, может использовать Lupron или Synarel до наступления менопаузы. Тогда естественное поступление эстрогена прекратится, и миомы останутся маленькими без каких-либо лекарств. Однако, поскольку точный возраст естественной менопаузы непредсказуем, это может обернуться дорогостоящим предложением — 2000 долларов в год — и обычно не покрывается медицинской страховкой. Но для некоторых женщин этот план лечения может быть полезен.
Но для некоторых женщин этот план лечения может быть полезен.
Есть ли другие многообещающие лекарства на горизонте?
Пирфенидон — это новое, еще не доступное лекарство, которое блокирует рост существующих миом и может останавливать образование новых миом. Хотя точный механизм действия неизвестен, пирфенидон влияет на выработку коллагена, основного компонента миомы. Другие эффекты пирфенидона на факторы роста клеток также могут быть важны. В настоящее время проводятся исследования, чтобы оценить, как миомы реагируют на этот новый препарат, и оценить его побочные эффекты. В будущем женщины с небольшими миомами смогут принимать пирфенидон или подобное ему лекарство, чтобы предотвратить рост миомы и избежать любой другой потребности в лечении.
Можно ли использовать сфокусированный ультразвук для лечения миомы?
Ультразвук — это форма энергии, и при использовании с высокой интенсивностью и фокусировке на объекте энергия может быть использована для уничтожения этого объекта.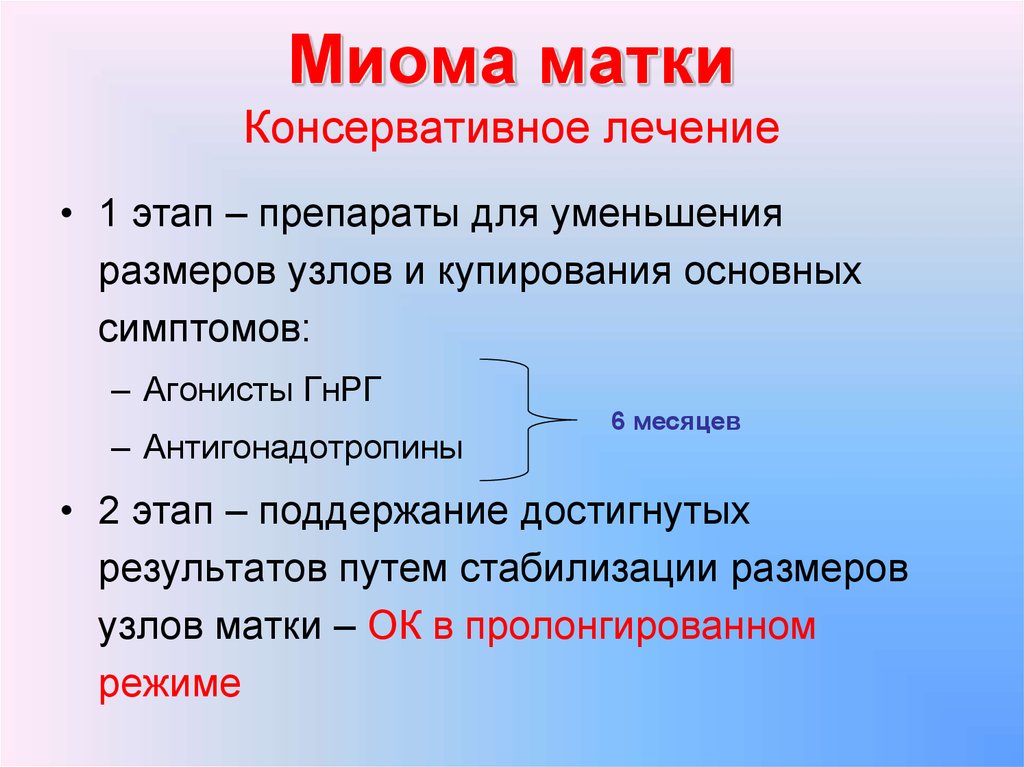

 На первом используются агонисты гонадотропин рилизинг-гормона или антигонадотропины в течение полугода. Если удается достичь уменьшения узла менее 2 см, то переходят на второй этап – поддерживающую гормональную терапию. Если не удается – то врач принимает решение о продолжении гормонального лечения, либо об операции.
На первом используются агонисты гонадотропин рилизинг-гормона или антигонадотропины в течение полугода. Если удается достичь уменьшения узла менее 2 см, то переходят на второй этап – поддерживающую гормональную терапию. Если не удается – то врач принимает решение о продолжении гормонального лечения, либо об операции.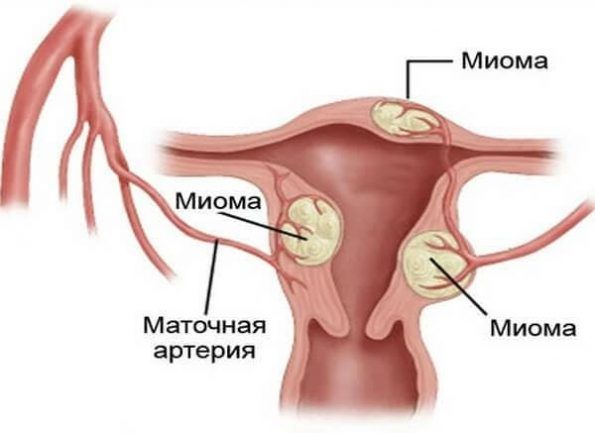 2010; 28: 204–217.
2010; 28: 204–217. 1996; 9: 195–198.
1996; 9: 195–198. 1996; 7: 440–442.
1996; 7: 440–442. Res. 2010. Feb 15. Vol. 70 (4). P. 1722–1730.
Res. 2010. Feb 15. Vol. 70 (4). P. 1722–1730. 2010; 82: 41–55.
2010; 82: 41–55. и гин. 2013. № 9. С. 97–100.
и гин. 2013. № 9. С. 97–100. P. 421–432. DOI: 10.1056/NEJMoa1103180. PMID 22296076.
P. 421–432. DOI: 10.1056/NEJMoa1103180. PMID 22296076.