Лейкоз лимфатический: Хронический лимфоцитарный лейкоз — причины, симптомы, диагностика, лечение и профилактика
Острый лимфобластный лейкоз (ОЛЛ) у детей и подростков
Что такое острый лимфобластный лейкоз?
Острый лимфобластный лейкоз (ОЛЛ) — это злокачественное заболевание крови и костного мозга. При лейкозе здоровые клетки крови замещаются опухолевыми клетками, что может стать причиной жара, повышенной утомляемости, синяков, проблем со свертыванием крови, инфекций и других нарушений. Обычно при остром лейкозе симптомы усиливаются в течение короткого периода. У детей болезнь может развиваться очень быстро и требует незамедлительного лечения.
Посмотри это видео
ОЛЛ нарушает процесс созревания белых клеток крови, называемых лимфоцитами. Эти клетки борются с инфекциями и обеспечивают защиту организма от заболеваний. В костном мозге пациентов с ОЛЛ содержится слишком много незрелых белых кровяных клеток (бластов). Такие клетки не способны полноценно функционировать. Они замещают собой нормальные белые и красные кровяные тельца, а также тромбоциты. В результате организму становится сложнее бороться с инфекциями, кожа становится бледной, возникают проблемы со свертыванием крови.
В результате организму становится сложнее бороться с инфекциями, кожа становится бледной, возникают проблемы со свертыванием крови.
виды лимфоцитов
Существует два вида лимфоцитов: В-лимфоциты и Т-лимфоциты. ОЛЛ может развиваться в любом из них, поэтому случаи ОЛЛ также подразделяют на B-клеточный ОЛЛ или T-клеточный ОЛЛ. Наиболее распространенным является В-клеточный ОЛЛ.
подвиды ОЛЛ
ОЛЛ имеет несколько подвидов. Во многих случаях врачи, определяя лечение, учитывают подвид ОЛЛ и сопряженную группу риска. Подробнее см. в разделе, посвященном лечению.
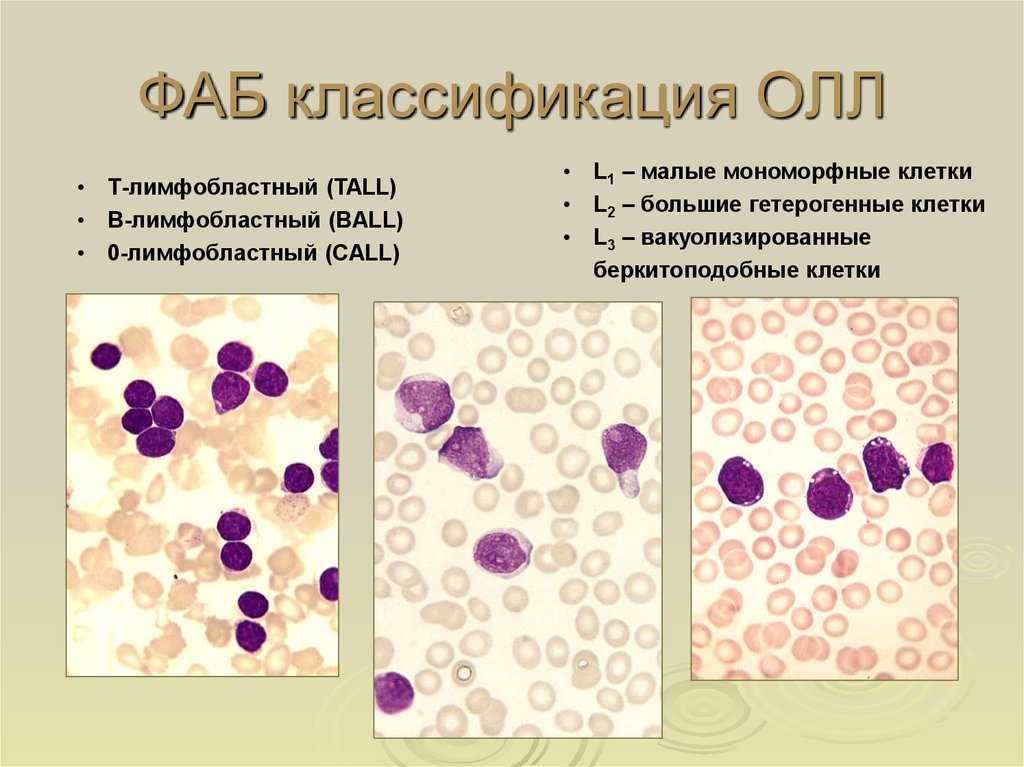
Подвиды ОЛЛ (Всемирная организация здравоохранения, 2016 г.)
В-клеточный лимфобластный лейкоз
В-клеточный лимфобластный лейкоз, без специфических характеристик
В-клеточный лимфобластный лейкоз с рецидивирующими генетическими нарушениями
В-клеточный лимфобластный лейкоз с транслокацией хромосом 9 и 22 (положительный по филадельфийской хромосоме ОЛЛ)
B-клеточный лимфобластный лейкоз с транслокацией KMT 2A
В-клеточный лимфобластный лейкоз с транслокацией хромосом 12 и 21 (ETV6-RUNX1)
В-клеточный лимфобластный лейкоз у детей с 46 нормальными хромосомами (гиподиплоидия)
В-клеточный лимфобластный лейкоз с транслокациями хромосом 5 и 14 (IL3-IGH)
В-клеточный лимфобластный лейкоз с транслокацией хромосом 1 и 19 (TCF3-PBX1).
В-клеточный лимфобластный лейкоз/лимфома (Ph-подобный)
В-клеточный лимфобластный лейкоз/лимфома с iAMP21
Т-клеточный лимфобластный лейкоз
Острый лимфобластный лейкоз из ранних предшественников Т-клеток
Лимфобластный лейкоз/лимфома из естественных клеток-киллеров (ЕК)
ОЛЛ нарушает процесс созревания разновидности белых клеток крови, называемой лимфоцитами. В костном мозге пациентов с ОЛЛ содержится слишком много незрелых белых клеток крови (бластов). Такие клетки не способны полноценно функционировать. Они замещают собой нормальные лейкоциты, эритроциты и тромбоциты.
ОЛЛ является наиболее распространенным онкологическим заболеванием у детей В США ОЛЛ ежегодно диагностируется у порядка 3000 человек моложе 20 лет. Чаще всего заболевание развивается у детей в возрасте от 2 до 5 лет, но также встречается и у детей старшего возраста и подростков. У мальчиков оно возникает несколько чаще, чем у девочек.
Признаки и симптомы острого лимфобластного лейкоза
Возможные признаки и симптомы ОЛЛ:
- Частые инфекции
- Жар
- Легкое появление синяков
- Кровотечения, которые трудно остановить
- Плоские, темно-красные пятна малого размера на коже (петехии), возникающие из-за подкожных кровотечений
- Боль в костях или суставах
- Уплотнения на шее, в подмышечных впадинах, животе или паху
- Боль или ощущение распирания под грудной клеткой
- Ощущение сильной усталости или слабости
- Бледность
- Потеря аппетита
- Одышка
Диагностика острого лимфобластного лейкоза
Для диагностики лейкоза требуется провести исследование костного мозга. Подозрение на лейкоз может возникнуть после медицинского осмотра, изучения истории болезни и оценки результатов анализа крови. У детей с лейкозом обычно повышено количество белых кровяных телец.
Подозрение на лейкоз может возникнуть после медицинского осмотра, изучения истории болезни и оценки результатов анализа крови. У детей с лейкозом обычно повышено количество белых кровяных телец.
Сначала врач проводит медицинский осмотр и изучает историю болезни пациента. В ходе медицинского осмотра врач проверяет общие показатели здоровья, в том числе наличие признаков заболевания — уплотнений или всего, что кажется необычным. Проводится тщательный осмотр глаз, ротовой полости, кожи и ушей. Может быть выполнено исследование состояния центральной нервной системы. При пальпации брюшной полости пациента врач проверяет, не увеличена ли в размере селезенка или печень.
Изучая историю болезни, врачи смотрят на наличие врожденных патологических состояний, которые могут способствовать развитию заболевания.
 Тем не менее, исследования показали, что только в 8–10% случаев болезнь у детей является наследственной. И сам факт наличия генетического заболевания не означает, что у человека обязательно разовьется опухоль.
Тем не менее, исследования показали, что только в 8–10% случаев болезнь у детей является наследственной. И сам факт наличия генетического заболевания не означает, что у человека обязательно разовьется опухоль.Возможные факторы риска:
- Воздействие рентгеновских лучей до рождения
- Перенесенная химиотерапия или лучевая терапия
Наличие определенных врожденных патологических состояний:
- Синдром Дауна
- Синдром Блума
- Некоторые формы анемии Фанкони
- Атаксия-телеангиэктазия
- Синдром Ли-Фраумени
- Синдром конституционального дефицита репарации неспаренных оснований ДНК (мутации в определенных генах, препятствующие восстановлению ДНК)
- Анемия Даймонда-Блэкфана
- Синдром Швахмана-Даймонда
- Наследственный PAX5-синдром
- Наследственный ETV6-синдром
- Наследственный Sh3B3-синдром
- Воздействие рентгеновских лучей до рождения
Общий клинический анализ крови
Врачи назначат анализ крови, называемый общим клиническим анализом крови.

Биохимический анализ крови
В образце крови измеряют количество определенных веществ, выделяемых в кровь органами и тканями организма. Необычное (выше или ниже нормы) количество вещества может являться признаком заболевания.
Подозрение на лейкоз может возникнуть после медицинского осмотра, изучения истории болезни и оценки результатов анализа крови.
-
Результаты исследований костного мозга, таких как пункция и биопсия костного мозга, используют для подтверждения онкологического диагноза и точного определения заболевания.
 Многим детям эту процедуру проводят во сне (под наркозом). Если пациент бодрствует во время процедуры, ему дают подходящее болеутоляющеесредство..
Многим детям эту процедуру проводят во сне (под наркозом). Если пациент бодрствует во время процедуры, ему дают подходящее болеутоляющеесредство..Костномозговая пункция: с помощью тонкой иглы врачи возьмут образец костного мозга из тазовой кости. Патологоанатом под микроскопом проверит образец костного мозга на наличие признаков опухоли.
На этом микроскопическом изображении показан нормальный, здоровый костный мозг.
На этом микроскопическом изображении показан костный мозг пациента с острым лимфобластным лейкозом.
Биопсия костного мозга: врачи извлекут небольшой фрагмент костной ткани для определения степени распространения опухоли в костном мозге. Обычно биопсия проводится непосредственно до или сразу после пункции.
Как выполняют пункцию/биопсию костного мозга?
- Пациент находится на кровати в положении лежа на боку или — реже — в положении сидя с согнутыми ногами, скрещенными в области голеностопных суставов.

- Врач выполнит пальпацию нижней части спины пациента, чтобы найти правильную точку для выполнения процедуры.
- Затем специалист, проводящий процедуру, надевает перчатки и дезинфицирует кожу на спине пациента с применением антибактериального мыла. После этого спину пациента накрывают специальными полотенцами так, чтобы оставить открытым лишь небольшой участок кожи.
- Если пациент во время пункции или биопсии находится в сознании, примерно за один час до выполнения процедуры на место взятия аспирата костного мозга или биопсии наносят обезболивающий крем. В место проведения процедуры может быть введено жидкое обезболивающее лекарственное средство.
- Медицинский работник вводит иглу в костный мозг через кожу. В случае выполнения и пункции, и биопсии, для каждой процедуры используется отдельная игла.
- Медицинский работник извлекает иглу, дезинфицирует место введения спиртом и накладывает повязку.
Для диагностики лейкоза требуется провести исследование костного мозга.

- Пациент находится на кровати в положении лежа на боку или — реже — в положении сидя с согнутыми ногами, скрещенными в области голеностопных суставов.
При обнаружении опухолевого процесса проводят дополнительные анализы для точного определения вида заболевания. Используют такие исследования:
Для диагностики отдельных видов лейкоза используется иммунофенотипирование: сравнения опухолевых клеток с нормальными клетками иммунной системы.
Такими лабораторными анализами являются иммуногистохимическое исследование и проточная цитометрия.
- Иммуногистохимия — это метод исследования с применением антител для выявления специфических белков в образце ткани. Комплексы белков и антител окрашиваются в коричневый или красный цвет, и их можно заметить под микроскопом.
- При выполнении проточной цитометрии клетки окрашивают светочувствительным красителем, помещают в жидкость и пропускают в потоке перед лазерным или другим световым лучом.
 В ходе исследования измеряют количество клеток, процент живых клеток и некоторые их характеристики, такие как размер, форма и наличие маркеров лейкоза на поверхности клеток.
В ходе исследования измеряют количество клеток, процент живых клеток и некоторые их характеристики, такие как размер, форма и наличие маркеров лейкоза на поверхности клеток.
Цитогенетический анализ включает в себя лабораторные анализы, в ходе которых патологоанатомы изучают определенные изменения в хромосомах.
Одним из применимых анализов является FISH-анализ (флуоресцентная гибридизация in situ). В ходе этого анализа изучаются гены или хромосомы в клетках и тканях. Фрагменты ДНК, содержащие флуоресцентный краситель, изготавливают в лаборатории и добавляют в клетки или ткани на предметном стекле. Когда эти фрагменты ДНК прикрепляются к определенным генам или областям хромосом на предметном стекле, они становятся различимы.
Врач порекомендует провести лабораторные анализы для выявления специфических генов, белков и других факторов, влияющих на развитиелейкоза.
 . Такое исследование важно, поскольку онкозаболевания вызваны ошибками (мутациями) в генах клетки. Выявление этих ошибок способствует диагностике конкретного подвида лейкоза. На основе этой информации врачи могут выбирать варианты лечения, соответствующие конкретному случаю. Детям, у которых лейкоз вызван мутациями с благоприятным прогнозом, назначают менее токсичное лечение. И наоборот, врачи могут назначать более интенсивное лечение, еслилейкозвызван наличием мутаций, имеющих менее благоприятный прогноз. Могут быть выявлены мутации, для которых имеются специальные направленныеметодылечения.
. Такое исследование важно, поскольку онкозаболевания вызваны ошибками (мутациями) в генах клетки. Выявление этих ошибок способствует диагностике конкретного подвида лейкоза. На основе этой информации врачи могут выбирать варианты лечения, соответствующие конкретному случаю. Детям, у которых лейкоз вызван мутациями с благоприятным прогнозом, назначают менее токсичное лечение. И наоборот, врачи могут назначать более интенсивное лечение, еслилейкозвызван наличием мутаций, имеющих менее благоприятный прогноз. Могут быть выявлены мутации, для которых имеются специальные направленныеметодылечения.
Исследования, определяющие степень распространения заболевания:
Люмбальную пункцию выполняют, чтобы взять образец спинномозговой жидкости из позвоночника и определить,распространилась ли опухольна центральную нервную систему.
 Эта процедура также называется «ЛП» или «поясничный прокол».
Эта процедура также называется «ЛП» или «поясничный прокол». Иглу размещают между двумя позвонками и вводят в жидкость в области спинного мозга. Берется образец жидкости. Далее проводят микроскопическое исследование этого образца на наличие признаков распространения лейкозных клеток на головной и спинной мозг. Организм постоянно вырабатывает спинномозговую жидкость, и поэтому небольшое количество, изъятое в ходе ЛП, быстро восстанавливается.
Рентгеновское излучение — это тип пучка энергии, который способен проходить сквозь тело и, попадая на пленку, создавать изображение областей внутри тела на экране компьютера или специальной пленке. Рентгенографию грудной клетки проводят для того, чтобы определить, есть ли новообразование внутри грудной клетки.

Лечение острого лимфобластного лейкоза
Основным методом лечения для детей с ОЛЛ является химиотерапия. Лечение также может включать в себя таргетную терапию, терапию с использованием гемопоэтических клеток (также называемую трансплантацией костного мозга или стволовых клеток), иммунотерапию и лучевую терапию.
Благодаря недавним достижениям в лечении ОЛЛ существует много различных вариантов лечения. Врачи все чаще могут адаптировать лечение для отдельных пациентов в зависимости от их группы риска.
Группа риска
Группа риска означает вероятность того, что опухоль пациента не будет поддаваться лечению (резистентная опухоль), либо заболевание вернется после первоначальной реакции на лечение (рецидив). Пациентам в группах низкого риска обычно проводят менее интенсивную терапию, которая тем не менее успешно справляетсяс опухолью.. Для пациентов в группах высокого риска обычно применяют более агрессивные методы лечения.
Группу риска определяют следующие факторы:
- Возраст ребенка. Дети в возрасте от 1 до 9 лет с В-клеточным ОЛЛ считаются группой низкого риска. Дети младше 1 года и старше 10 лет считаются группой высокого риска.
- Количество белых кровяных телец на момент постановки диагноза. Дети с числом более 50 000 на кубический миллиметр считаются группой высокого риска.
- Развитиеопухолевого процессав В-лимфоцитах или Т-лимфоцитах. Считается, что для Т-клеточного ОЛЛ характерен более высокий риск.
- Наличие определенных изменений в хромосомах или генах. Считается, что случаи ОЛЛ с наличием гибридного гена ETV6-RUNX1 относятся к группе низкого риска. Считается, что ОЛЛ с наличием филадельфийской хромосомы или транслокацией хромосом 1 и 19, либо включающей хромосому 11, является заболеванием высокого риска, однако при использовании передовых методов терапии прогноз улучшается.
- Количествохромосом. Случаи гипердиплоида (более 50 хромосом) относятся к факторам низкого риска, в то время как случаи гиподиплоида (менее 44 хромосом) относятся к факторам высокого риска.

- Скорость и степень уменьшенияколичества опухолевых (бластных) клетокпосле первоначального лечения. Считается, что случаи,когда количество бластных клеток резко падает в течение первых нескольких недель терапии,характеризуются низким уровнем риска. Во многих детских онкологических центрах используются высокочувствительные тесты для измерения минимальной остаточной болезни (МОБ).
минимальная остаточная болезнь (МОБ)
Минимальная остаточная болезнь (МОБ) — это термин используется, когда бластных клеток в костном мозге так мало, что их невозможно обнаружить с помощью микроскопа. Высокочувствительные тесты, такие как проточная цитометрия, полимеразная цепная реакция (ПЦР) и секвенирование следующего поколения, способны обнаружить 1 бластную клетку на 10 000–100 000 нормальных клеток костного мозга. МОБ-положительные пациенты (более 1 клетки на 10 000 после завершения первой фазы лечения ОЛЛ (индукция)) подвержены наивысшему риску рецидива.
- Наличие бластных клеток в спинномозговой жидкости при постановке диагноза.
 Если клетки распространились, случай относится к высокому риску.
Если клетки распространились, случай относится к высокому риску.
Фазы лечения
( / 5 )
Неделя 1
Диагностическое обследование, подготовка к лечению
Врачи собирают информацию для выбора методов лечения.
- Анализы крови
- Медицинский осмотр и изучение истории болезни
- Рентгенография грудной клетки
- Пункция и/или биопсия костного мозга
- Люмбальная пункция
Перед началом лечения
Пациенту проведут хирургическую операцию для установки подкожной порт-системы илидругого устройства венозного доступадля химиотерапии, введения жидкостей и взятия образцов крови.
Следующие 4-6 недель
Фаза индукции
Целью данной фазы является использование комбинации химиотерапевтических препаратов для уничтожения опухолевых клеток в крови и костном мозге и перевода заболевания в ремиссию. Это фаза интенсивного лечения, и для нее может потребоваться пребывание пациента в стационаре.
Для уничтожения опухолевых клеток в спинномозговой жидкости может быть назначена сохраняющая терапия центральной нервной системы (ЦНС).
Врачи будут наблюдать за реакцией лейкоза на индукционную терапию, чтобы определить, каким образом продолжить лечение.
- Случаи, когда количество бластных клеток резко падает, считаются низким уровнем риска.
- Во многих детских медицинских центрах используются высокочувствительные тесты для измерения минимальной остаточной болезни (МОБ). Положительная МОБ указывает на более высокий риск рецидива и необходимость применения более интенсивной терапии.
- Врачи примут решение о том, требуется ли проведение трансплантации гемопоэтических клеток.
Следующие 8-16 недель
Фаза консолидации/интенсификации
Целью этой более интенсивной фазы является использование другой комбинации препаратов для уничтожения любых оставшихся клеток, способных вызвать рецидив лейкоза. На это время может потребоваться пребывание пациента в стационаре.
Пациентам с ОЛЛ, положительным по филадельфийской хромосоме, на этой фазе могут назначать иматиниб.
Подробнее о лекарственных препаратах
Следующие 2-3 недели
Фаза стабилизации/продолжения
Еслипосле этих двух стадий лечения ремиссия сохраняется, можно начинать поддерживающую терапию. Ее целью является использование комбинации химиотерапевтических препаратов для уничтожения любых опухолевых клеток, которые могут остаться после первых фаз индукции и консолидации.
В это время еженедельная химиотерапия и анализы крови обычно чередуются с периодами высокодозной химиотерапии — реиндукцией.
Первые 9 месяцев лечения ОЛЛ обычно являются наиболее интенсивными. Часто пациенты могут вернуться в школу после первых 9 месяцев.
График последующего наблюдения
Год 1
Пациент будет посещать врача в рамках последующего наблюдения один раз в 4 месяца.
Во время проверок проводятся такие обследования:
- Осмотр и изучение истории болезни
- Анализы крови и другие лабораторные анализы
Год 2
Частота визитов для последующего наблюдения может быть снижена до одного раза в 6 месяцев.
Годы 3–5
Частота визитов для последующего наблюдения может быть снижена до одного раза в год.
Три фазы лечения
Лечение ОЛЛ включает в себя 3 фазы и длится от 2 до 3 лет. Основным методом лечения ОЛЛ является химиотерапия. В химиотерапии используются мощные лекарственные препараты для остановки роста опухолевых клеток, уничтожая их или препятствуя их делению. Детям чаще всего назначают комбинацию различных лекарственных препаратов. Эти препараты могут вводиться в кровоток (внутривенно), приниматься внутрь (перорально) или же вводиться непосредственно в спинномозговую жидкость (интратекально).
Выбор метода химиотерапии и лекарственных средств зависит от группы риска ребенка. Дети с лейкозом высокого риска обычно получают больше противоопухолевых препаратов и/или более высокие дозы, чем дети с ОЛЛ низкого риска.
1. Индукция
Целью индукционной терапии является уничтожение бластных клеток в крови и костном мозге и перевод заболевания в ремиссию. Эта фаза обычно длится 4–6 недель. В это же время для уничтожения бластных клеток, остающихся в спинномозговой жидкости, может быть назначена сохраняющая терапия центральной нервной системы (ЦНС) (также называемая профилактической терапией ЦНС). В этом случае препараты вводятся в заполненное жидкостью пространство между тонкими слоями ткани, покрывающими спинной мозг (интратекально).
Эта фаза обычно длится 4–6 недель. В это же время для уничтожения бластных клеток, остающихся в спинномозговой жидкости, может быть назначена сохраняющая терапия центральной нервной системы (ЦНС) (также называемая профилактической терапией ЦНС). В этом случае препараты вводятся в заполненное жидкостью пространство между тонкими слоями ткани, покрывающими спинной мозг (интратекально).
Для лечения используется комбинация химиотерапевтических препаратов. Эти препараты могут включать в себя винкристин, стероиды и пэгаспаргазу или аспарагиназу Erwinia, иногда с препаратом антрациклинового ряда, таким как доксорубицин или даунорубицин. В некоторых протоколах во время индукционной терапии применяют схему лечения, включающую циклофосфамид, цитарабин и 6-меркаптопурин.
2. Фаза консолидации/интенсификации
Целью терапии консолидации/интенсификации является уничтожение любых оставшихся клеток, способных к росту и вызывающих рецидив лейкоза. Эта фаза обычно длится 8-16 недель.
Пациенту назначают различные лекарственные средства, такие как циклофосфамид, цитарабин и или 6-меркаптопурин (6-МП). Также может назначаться метотрексат с терапией под защитой лейковорином или без нее.
3. Фаза стабилизации/продолжения
Целью поддерживающей терапии, последней и наиболее долгой фазы, является уничтожение любых опухолевых клеток, которые могли бы выжить после первых 2 фаз. Фаза стабилизации может продолжаться 2 или 3 года.
Эта фаза может включать в себя применение таких препаратов, как метотрексат, винкристин, стероиды, 6-меркаптопурин (6-МП). Пациентам с высоким риском могут назначаться антрациклиновые препараты, циклофосфамид и цитарабин.
Другие методы лечения
Трансплантация гемопоэтических клеток (также называемая трансплантацией костного мозга или стволовых клеток)
Трансплантация гемопоэтических клеток (также называемая трансплантацией костного мозга или стволовых клеток) может быть рекомендована детям с высоким риском рецидива или с резистентным к лечению ОЛЛ. Иногда врачи оценивают эффективность индукционной химиотерапии, чтобы решить, требуется ли трансплантация.
Иногда врачи оценивают эффективность индукционной химиотерапии, чтобы решить, требуется ли трансплантация.
Пациенты с ОЛЛ, у которых лейкоз является резистентным (не поддающимся лечению) или рецидивирующим, могут быть кандидатами на трансплантацию, если их состояние позволяет и найден подходящий донор.
Таргетная терапия
В таргетной терапии используются лекарственные препараты, которые уничтожают раковые клетки, не нанося вреда окружающим здоровым клеткам. Этот тип терапии может применяться только в том случае, когда рак имеет идентифицируемые маркеры, которые реагируют на доступные препараты таргетной терапии.
Иммунотерапия
Иммунотерапия — это метод лечения рака, при котором для борьбы с опухолью задействуется иммунная система. Иммунотерапия помогает иммунной системе находить опухолевые клетки, чтобы атаковать их, и/или повышает способность иммунной системы реагировать на опухоль.
Одна группа препаратов для таргетной терапии называется ингибиторами тирозинкиназы (ИТК).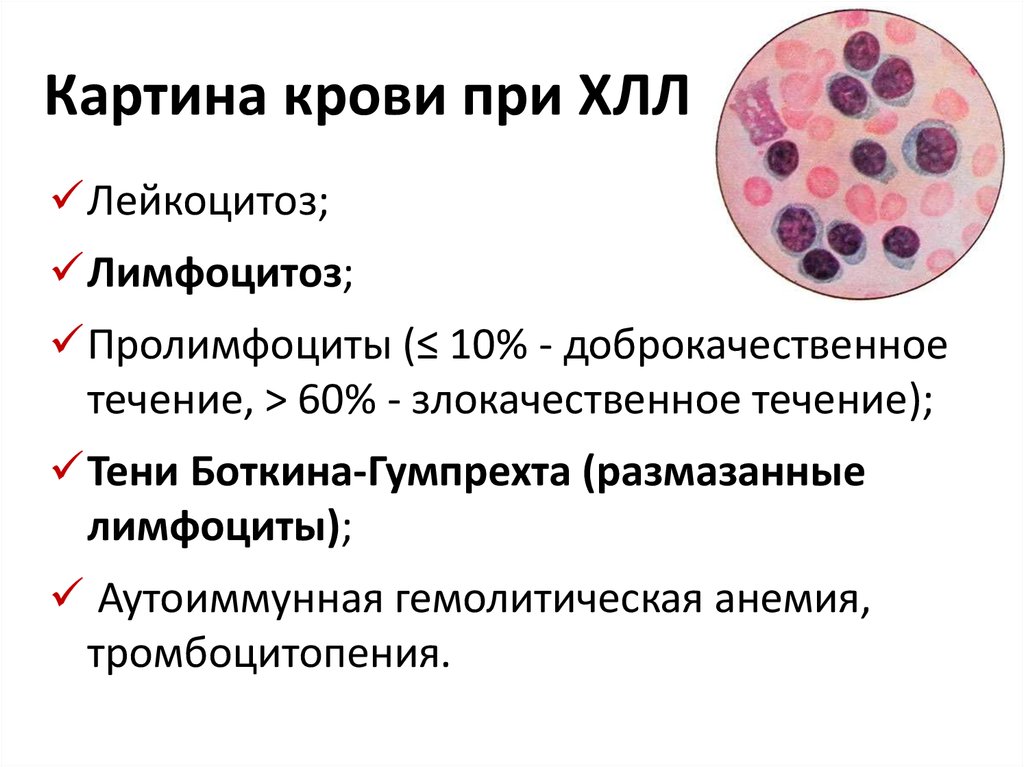 ИТК блокируют активность фермента тирозинкиназы, который иногда характеризуется чрезмерной активностью или высоким содержанием в некоторых опухолевых клетках. Препараты иматиниба мезилат и дазатиниб являются ИТК и применяются для лечения детей с ОЛЛ, положительным по филадельфийской хромосоме. Другие исследуемые ИТК включают руксолитиниб для лечения впервые диагностированного ОЛЛ высокого риска.
ИТК блокируют активность фермента тирозинкиназы, который иногда характеризуется чрезмерной активностью или высоким содержанием в некоторых опухолевых клетках. Препараты иматиниба мезилат и дазатиниб являются ИТК и применяются для лечения детей с ОЛЛ, положительным по филадельфийской хромосоме. Другие исследуемые ИТК включают руксолитиниб для лечения впервые диагностированного ОЛЛ высокого риска.
Еще один тип таргетной терапии называется терапией моноклональными антителами. В нем используются антитела, изготовленные в лаборатории, для идентификации на опухолевых или здоровых клетках веществ, способствующих росту клеток опухоли. Антитела прикрепляются к веществам, ускоряющим развитие опухоли, и убивают опухолевые клетки, блокируют их рост или препятствуют их распространению. Их можно использовать отдельно или для переноса лекарственных препаратов, токсинов или радиоактивных препаратов непосредственно в раковые клетки. Блинатумомаб и инотузумаб представляют собой два моноклональных антитела, которые сейчас изучаются для лечения резистентного к терапии (рефрактерного) ОЛЛ у детей.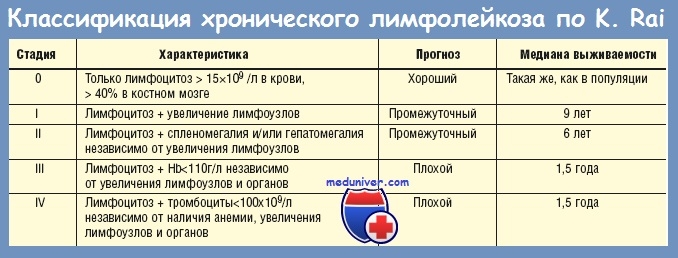 Кроме того, антитела могут синтезироваться в иммунных клетках, таких как Т-клетки, и заставлять иммунные клетки непосредственно атаковать бластные клетки. Такие Т-клетки называются Т-клетками с химерными антигенными рецепторами (ХАР).
Кроме того, антитела могут синтезироваться в иммунных клетках, таких как Т-клетки, и заставлять иммунные клетки непосредственно атаковать бластные клетки. Такие Т-клетки называются Т-клетками с химерными антигенными рецепторами (ХАР).
В настоящее время изучается добавление бортезомиба и вориностата, препаратов таргетной терапии, к стандартным методам лечения детей с ОЛЛ, поскольку у детей лечение в целом более сложное. Эти препараты могут использоваться в тех случаях, когда заболевание не дает хорошего ответа на лечение.
Прогноз (исход) при лечении острого лимфобластного лейкоза
Около 98% детей с ОЛЛ достигают ремиссии через несколько недель после начала лечения.
Более 90% детей с ОЛЛ могут выздороветь. Пациенты считаются выздоровевшими примерно через 5 лет ремиссии.
Коэффициент выживаемости для пациентов с ОЛЛ в группах низкого риска может составлять более 95%.
Если у пациента резистентная (не дающая ответа на лечение) или рецидивирующая форма ОЛЛ, врачи обсуждают дальнейшие варианты терапии.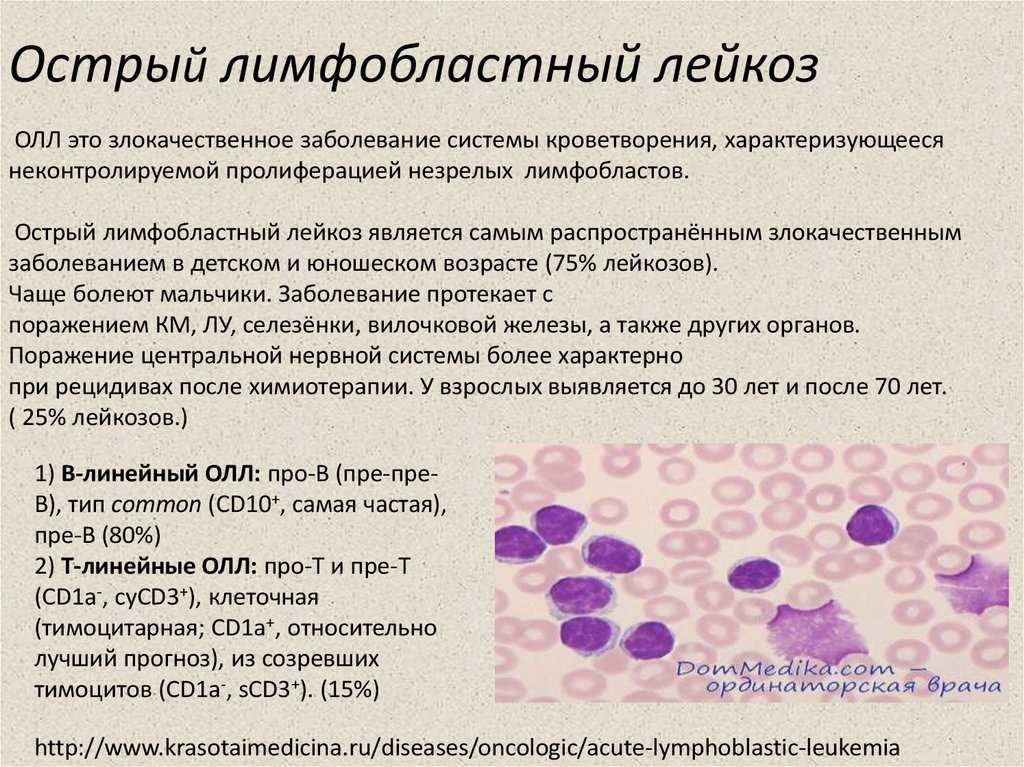
Отдаленные последствия лечения острого лимфобластного лейкоза
Отдаленное последствие — это проблема со здоровьем, возникающая спустя месяцы или годы после диагностирования заболевания или после окончания лечения. Отдаленные последствия могут быть вызваны как самой опухолью, так и ее лечением. Они могут включать в себя физические, психические и социальные проблемы, а также метастазирование.
К отдаленным последствиям относятся:
- Рецидив ОЛЛ
- Вторичные очаги болезни, например рак кожи, головного мозга, костей, молочных желез, мягких тканей и щитовидной железы. Предполагается, что после прекращения применения краниального облучения в качестве стандартного метода лечения ОЛЛ частота появления метастазов в последующие годы сократится.
- Нарушения функции сердца и легких
- Заболевания костей
- Эндокринные заболевания
- Заболевания желудочно-кишечного тракта
- Нарушения психической гибкости, логического мышления, планирования и организации
- Депрессия
- Нарушения сна
Цели современных исследований острого лимфобластного лейкоза
Текущие исследования проводятся в области разработки более эффективных методов лечения детских опухолей, не дающих ответа на первоначальную терапию, и в области разработки новых методов лечения, направленных на уничтожение раковых клеток без нанесения вреда окружающим здоровым клеткам. Исследователи также уделяют основное внимание разработке методов лечения, которые вызывают меньше отдаленных последствий у пациентов, перенесших онкозаболевания. Эту проблему помогут решить исследования в области отдаленных последствий среди растущего числа пациентов с долгосрочной выживаемостью.
Исследователи также уделяют основное внимание разработке методов лечения, которые вызывают меньше отдаленных последствий у пациентов, перенесших онкозаболевания. Эту проблему помогут решить исследования в области отдаленных последствий среди растущего числа пациентов с долгосрочной выживаемостью.
—
Дата изменения: июнь 2018 г.
Хронический лейкоз — виды, лечение
ОглавленияВам поставили диагноз: Хронический лейкоз?
Наверняка Вы задаётесь вопросом: что же теперь делать?
Подобный диагноз всегда делит жизнь на «до» и «после». Все эмоциональные ресурсы пациента и его родных брошены на переживания и страх. Но именно в этот момент необходимо изменить вектор «за что» на вектор «что можно сделать». Очень часто пациенты чувствуют себя безгранично одинокими вначале пути. Но вы должны понимать — вы не одни.
Мы поможем вам справиться с болезнью и будем идти с вами рука об руку через все этапы вашего лечения.
Предлагаем вашему вниманию краткий, но очень подробный обзор хронического лейкоза.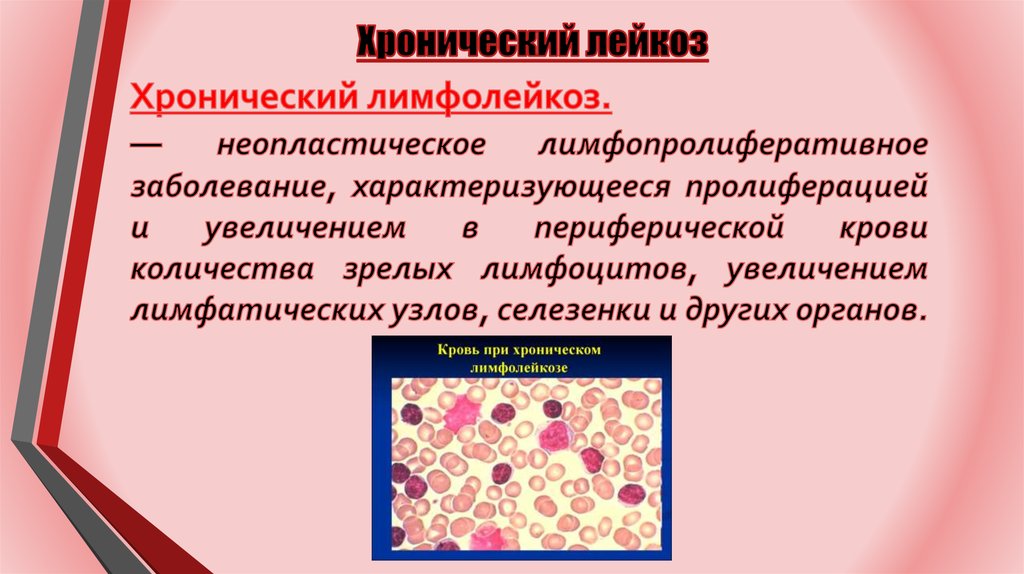
Его подготовили высоко квалифицированные специалисты Отдела лекарственного лечения злокачественных новообразований МРНЦ имени А.Ф. Цыба и Отдела лекарственного лечения опухолей МНИОИ имени П.А. Герцена – филиалов ФГБУ «НМИЦ радиологии» Минздрава России под редакцией заведующих отделами, д.м.н. ФАЛАЛЕЕВОЙ Н.А. и д.м.н. ФЕДЕНКО А.А.
Хронический лимфолейкоз (ХЛЛ)
— Опухолевое заболевание, морфологическим субстратом которого являются малого размера зрелые В-лимфоциты, обнаруживающиеся преимущественно в крови, костном мозге, лимфатических узлах, селезёнке и печени.
Для установления диагноза ХЛЛ, согласно современным критериям, необходимо наличие трех признаков: абсолютное число лимфоцитов крови не менее 5 х10 9 /л, более 30% лимфоцитов в костном мозге, иммунологическое подтверждение наличия опухолевых лимфоцитов со строго определенными характеристиками, без которого диагноз ХЛЛ не может считаться доказанным, поскольку дифференциальный диагноз с похожими заболеваниями проводится на основании именно иммунофенотипирования .
ХЛЛ — наиболее распространенный вид лейкоза в странах Европы и Северной Америки, где на его долю приходится до 30% всех лейкозов. Ежегодная заболеваемость ХЛЛ в этих странах составляет 3-3,5 случая на 100000 населения в год, при этом среди лиц старше 65 лет – до 20 случаев и старше 70 лет – до 50 на 100000.
Средний возраст заболевших — 65 лет, почти 70% заболевают между 50 и 70 годами, только около 10% — до 40 лет. Мужчины заболевают в 2 раза чаще женщин.
В большинстве случаев на ранних этапах ХЛЛ характеризуется медленным течением с постепенно нарастающим лейкоцитозом, который без лечения может достигать 500-1000 х109/л и более, лимфоцитозом, обычно коррелирующим с уровнем лейкоцитоза и составляющим 70-85-99%. Уровни гемоглобина, числа тромбоцитов на ранних этапах болезни обычно нормальные. При высоком лейкоцитозе и лимфоцитозе — уровни гемоглобина и числа тромбоцитов часто сниженные за счет вытеснения нормального кроветворения лейкозным клоном или присоединения нередких для ХЛЛ аутоиммунных осложнений – аутоиммунной гемолитической анемии и/или тромбоцитопении.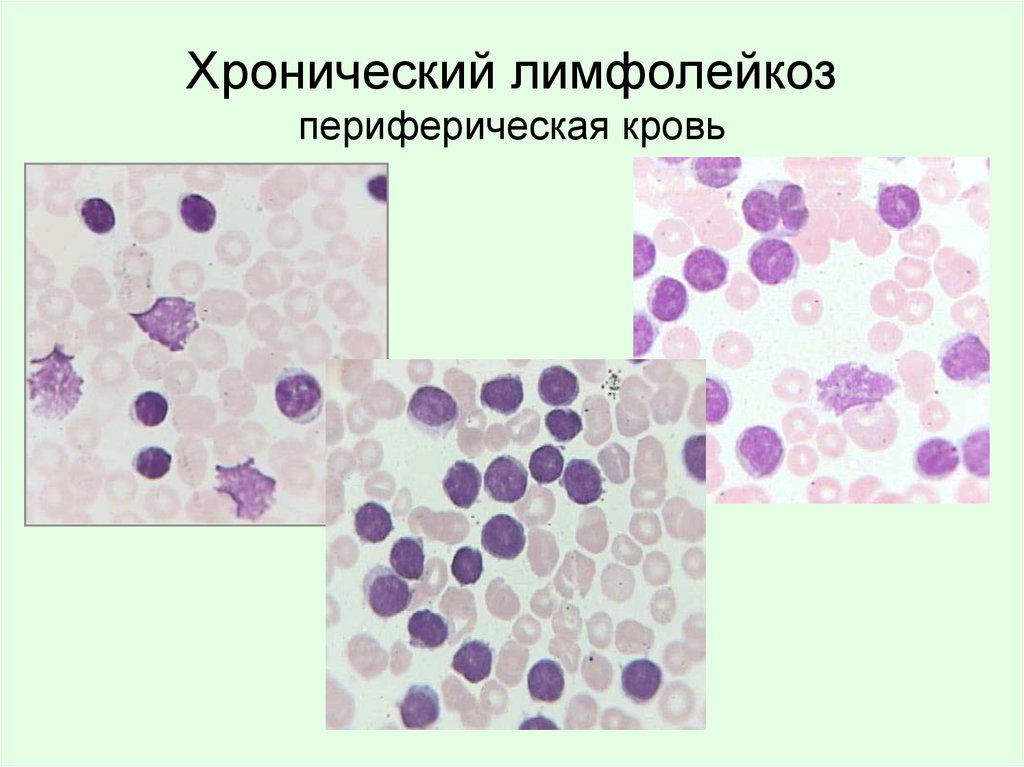
Темпы течения болезни и продолжительность жизни при ХЛЛ колеблются в широких пределах – от 2-3 до 20-30 лет. Медленное развитие в начале болезни – причина того, что у 70% пациентов с ХЛЛ диагностируется при анализе крови, сделанном в связи с другими заболеваниями. Примерно у 15-20% больных клинические и гематологические признаки заболевания остаются стабильными и минимально выраженными без лечения на протяжении многих лет и не влияют на продолжительность жизни.
При медленном прогрессировании ХЛЛ больной остается под наблюдением (выжидательная тактика), сигналом к началу лечения служат:
• Массивная инфильтрация костного мозга лимфоцитами (более 80% лимфоцитов в миелограмме), особенно если при этом имеется снижение уровня эритроцитов и тромбоцитов.
• Быстрое нарастание лимфоцитоза – удвоении абсолютного числа лимфоцитов в крови менее чем за 12 мес.
Химиотерапия хронического лейкоза:
В настоящее время препаратом выбора при ХЛЛ являются флударабин и флударабинсодержащие режимы.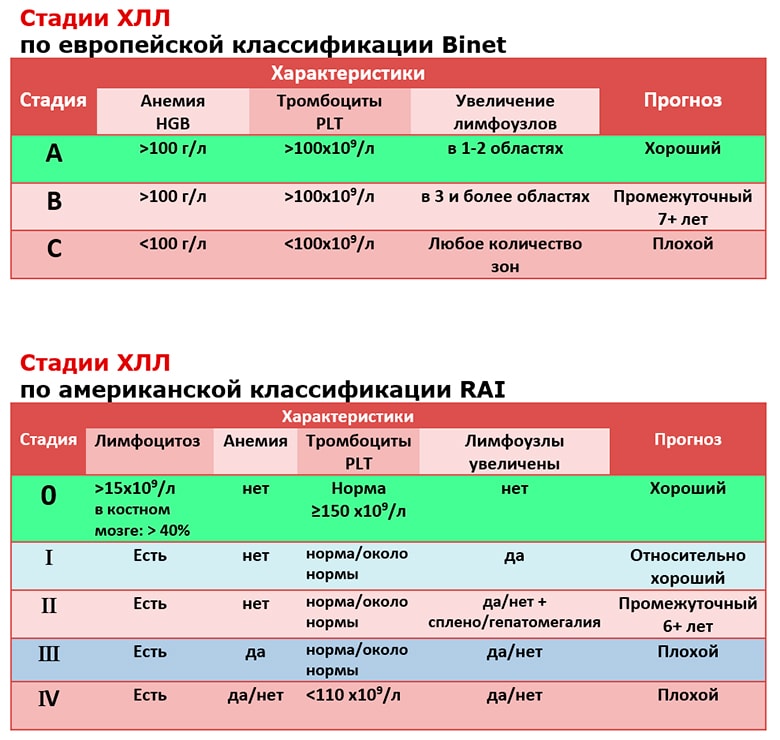 Схема FCR (флударабин, циклофосфамид, ритуксимаб) является стандартом терапии 1-й линии у молодых пациентов без тяжелой сопутствующей патологии. Хлорамбуцил (лейкеран), в настоящее время остаются стандартом стартовой терапии у пациентов преклонного возраста. Увеличение показателей выживаемости без прогрессирования может быть достигнуто путем добавления к хлорамбуцилу ритуксимаба.
Схема FCR (флударабин, циклофосфамид, ритуксимаб) является стандартом терапии 1-й линии у молодых пациентов без тяжелой сопутствующей патологии. Хлорамбуцил (лейкеран), в настоящее время остаются стандартом стартовой терапии у пациентов преклонного возраста. Увеличение показателей выживаемости без прогрессирования может быть достигнуто путем добавления к хлорамбуцилу ритуксимаба.
Препарат Бендамустин, вследствие своей низкой токсичности иногда является единственной возможностью терапии у пожилых пациентов, а также больных с сопутствующей патологией.
Таргетная (избирательная, точечная) терапия ХЛЛ: Важным шагом в разработке новых методов терапии при ХЛЛ стало добавление к флударабин-содержащим режимам моноклональных антител к антигену CD20 (ритуксимаб, обинотузумаб). В настоящее время лечение большинства пациентов проводится с использованием моноклональных анти-CD-20-антител.
Спектр таргетных препаратов при ХЛЛ расширяется с каждым годом. В настоящее время в России зарегистрирован препарат ибрутиниб (ингибитор тирозинкиназы Брутона) для лечения крайне неблагоприятной группы пациентов ХЛЛ с делецией хромосомы 17р или мутацией ТР53. Список таргетных препаратов постоянно обновляется.
Список таргетных препаратов постоянно обновляется.
Филиалы и отделения, где лечат хронический лейкоз
Что такое хронический лимфоцитарный лейкоз?
Рак начинается, когда клетки начинают бесконтрольно расти. Клетки почти в любой части тела могут стать раковыми и могут распространиться на другие части тела. Чтобы узнать больше о том, как возникает и распространяется рак, см. Что такое рак?
Хронический лимфолейкоз (ХЛЛ) является наиболее распространенным лейкозом у взрослых. Это тип рака, который начинается в клетках, которые становятся определенными лейкоцитами (называемыми лимфоцитами ) в костном мозге. Раковые (лейкозные) клетки зарождаются в костном мозге, но затем попадают в кровь.
При ХЛЛ лейкозные клетки часто растут медленно. Многие люди не имеют никаких симптомов в течение как минимум нескольких лет. Но со временем клетки растут и распространяются на другие части тела, включая лимфатические узлы, печень и селезенку.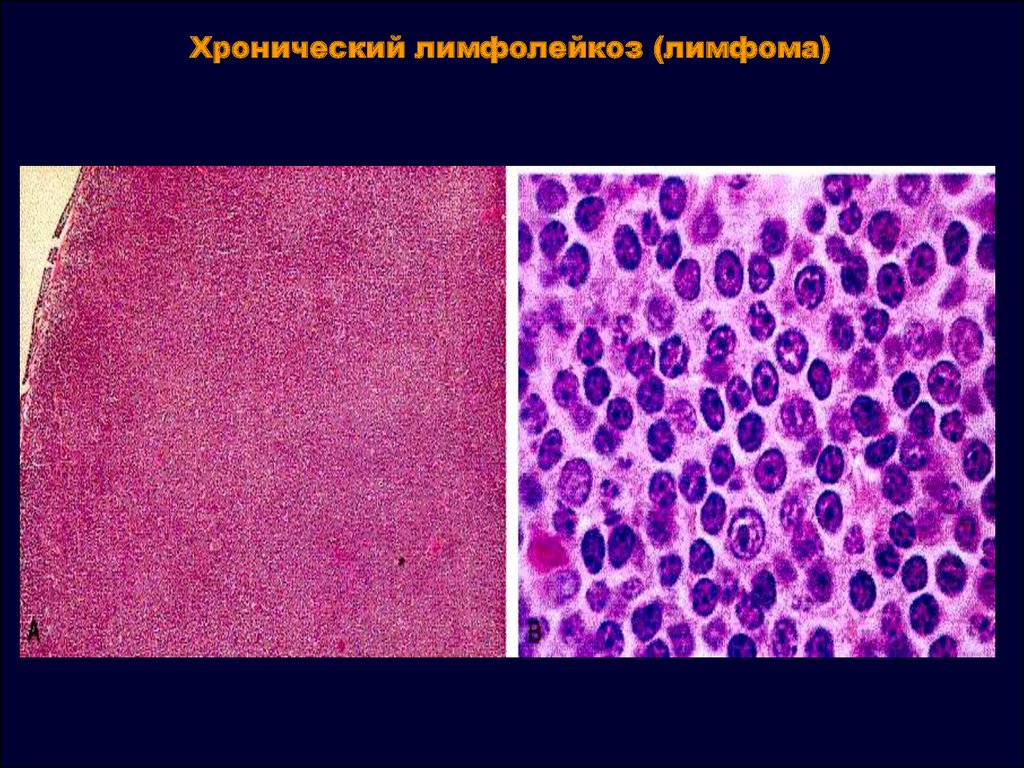
Что такое лейкемия?
Лейкемия — это рак, который начинается в кроветворных клетках костного мозга. Когда одна из этих клеток изменяется и становится лейкемической клеткой, она больше не созревает должным образом и выходит из-под контроля. Часто он делится, чтобы создавать новые клетки быстрее, чем обычно. Клетки лейкемии также не умирают, когда должны. Это позволяет им накапливаться в костном мозге, вытесняя нормальные клетки. В какой-то момент лейкозные клетки покидают костный мозг и попадают в кровоток. Это увеличивает количество лейкоцитов в крови. Попадая в кровь, лейкозные клетки могут распространяться на другие органы, где они могут препятствовать нормальному функционированию других клеток в организме.
Лейкемия отличается от других видов рака, которые начинаются в таких органах, как легкие, толстая кишка или грудь, а затем распространяются на костный мозг. Рак, который начинается в другом месте, а затем распространяется на костный мозг, не является лейкемией.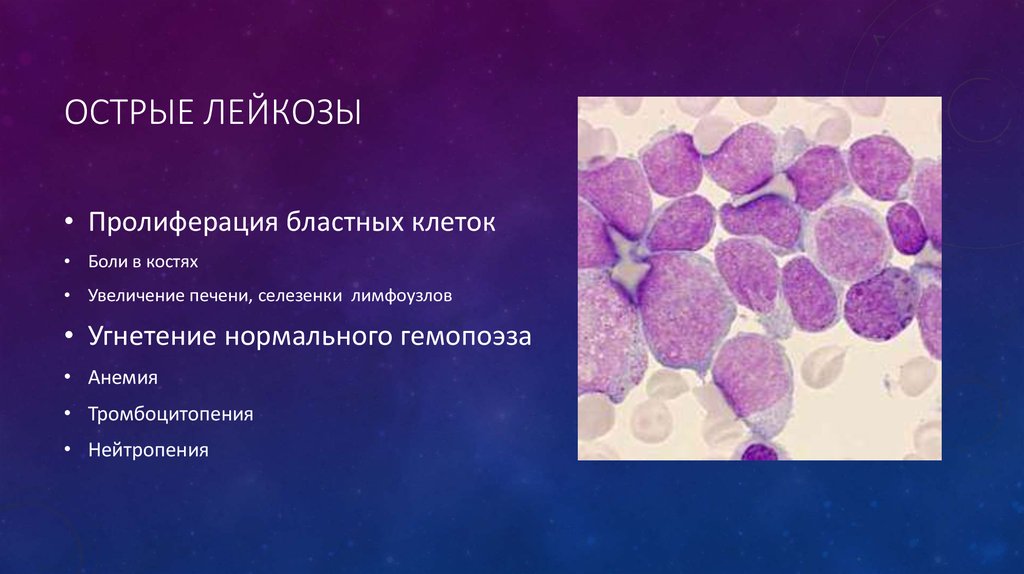
Знание точного типа лейкемии помогает врачам лучше прогнозировать перспективы каждого пациента и выбирать наилучшее лечение.
Что такое хронический лейкоз?
При хроническом лейкозе клетки могут частично созревать (и больше похожи на нормальные лейкоциты). но не полностью. Эти клетки могут выглядеть вполне нормально, но это не так. Как правило, они не борются с инфекцией так же хорошо, как нормальные лейкоциты. Клетки лейкемии выживают дольше, чем нормальные клетки, и накапливаются, вытесняя нормальные клетки в костном мозге. Может пройти много времени, прежде чем хронические лейкозы вызовут проблемы, и большинство людей могут жить с ними в течение многих лет. Но хронические лейкозы, как правило, труднее вылечить, чем острые лейкозы.
Что такое лимфоцитарная лейкемия?
Лейкемия миелоидная или лимфоцитарная в зависимости от того, в каких клетках костного мозга начинается рак.
Лимфоцитарный лейкоз (также известный как лимфоидный или лимфобластный лейкоз) начинается в клетках, которые становятся лимфоцитами. Лимфомы также являются раком, который начинается в этих клетках. Основное различие между лимфоцитарными лейкозами и лимфомами заключается в том, что при лейкозе раковые клетки находятся в основном в костном мозге и крови, тогда как при лимфоме они, как правило, находятся в лимфатических узлах.
и другие ткани.
Лимфомы также являются раком, который начинается в этих клетках. Основное различие между лимфоцитарными лейкозами и лимфомами заключается в том, что при лейкозе раковые клетки находятся в основном в костном мозге и крови, тогда как при лимфоме они, как правило, находятся в лимфатических узлах.
и другие ткани.
Различные типы ХЛЛ
Врачи согласны с тем, что существует 2 различных типа ХЛЛ:
- Один вид ХЛЛ растет очень медленно. Поэтому может пройти много времени, прежде чем пациенту понадобится лечение.
- Другой вид ХЛЛ развивается быстрее и является более серьезным заболеванием.
Лейкозные клетки этих двух типов выглядят одинаково, но лабораторные тесты могут выявить разницу между ними. Тесты ищут белки, называемые ZAP-70 и CD38. Если клетки CLL имеют низкое количество этих белков, лейкемия имеет тенденцию расти медленнее и иметь лучшие долгосрочные результаты.
Редкие формы лимфолейкоза
Распространенная форма ХЛЛ начинается с В-лимфоцитов. Но есть некоторые редкие типы лейкемии, которые имеют некоторые общие черты с ХЛЛ.
Но есть некоторые редкие типы лейкемии, которые имеют некоторые общие черты с ХЛЛ.
Пролимфоцитарный лейкоз (PLL): При этом типе лейкоза раковые клетки очень похожи на нормальные клетки, называемые пролимфоцитами. Это незрелые формы В-лимфоцитов (В-PLL) или Т-лимфоцитов (T-PLL). И B-PLL, и T-PLL имеют тенденцию расти и распространяться быстрее, чем обычный тип CLL. Большинство людей с ним поддаются той или иной форме лечения, но со временем они склонны к рецидивам (рак возвращается). PLL может развиться у кого-то, у кого уже есть CLL (в этом случае он имеет тенденцию быть более агрессивным), но также может возникнуть у людей, у которых никогда не было CLL.
Крупнозернистый лимфоцитарный (LGL) лейкоз: Это еще одна редкая форма хронического лейкоза. Раковые клетки большие и имеют признаки либо Т-лимфоцитов, либо другого типа лимфоцитов, называемых естественными клетками-киллерами (NK). Большинство лейкемий LGL медленно растут, но небольшое количество более агрессивны (они быстро растут и распространяются). Лекарства, подавляющие иммунную систему, могут помочь, но агрессивные типы очень трудно поддаются лечению.
Лекарства, подавляющие иммунную систему, могут помочь, но агрессивные типы очень трудно поддаются лечению.
Волосатоклеточный лейкоз (ВКЛ): Это редкий рак лимфоцитов, который имеет тенденцию к медленному прогрессированию. Раковые клетки представляют собой тип В-лимфоцитов, но они отличаются от тех, которые наблюдаются при ХЛЛ. Существуют также важные различия в симптомах и лечении. Этот тип лейкемии получил свое название из-за того, как клетки выглядят под микроскопом — на их поверхности есть тонкие выступы, из-за которых они выглядят «волосатыми». Лечение HCL может работать очень хорошо.
Что такое хронический лимфолейкоз (ХЛЛ)?
Обзор
Что такое хронический лимфолейкоз?
Хронический лимфолейкоз (ХЛЛ) — это тип рака крови. Это наиболее распространенная форма лейкемии у взрослых. Это происходит, когда здоровые лейкоциты (лимфоциты) в костном мозге мутируют или превращаются в раковые клетки, которые размножаются и вытесняют здоровые клетки крови и тромбоциты.
ХЛЛ обычно поражает людей в возрасте 65 лет и старше, но может поражать людей, начиная с 30 лет. Хронический лимфолейкоз может быть бессимптомным. Большинство людей узнают, что у них ХЛЛ, после сдачи анализов крови в рамках обычных медицинских осмотров.
В настоящее время поставщики медицинских услуг не имеют рутинных методов лечения хронического лимфоцитарного лейкоза. За последние 10 лет поставщики медицинских услуг разработали методы лечения, которые приводят к ремиссии ХЛЛ. (Ремиссия означает, что у вас нет симптомов и признаков ХЛЛ.) Эти методы лечения помогают людям с ХЛЛ жить дольше.
Типы хронического лимфоцитарного лейкоза
У вас может развиться ХЛЛ в В-клетках или Т-клетках, которые представляют собой лейкоциты (лимфоциты):
- В-лимфоциты (В-клетки) вырабатывают антитела. Антитела — это белки, нацеленные на вирусы, бактерии и раковые клетки, а также на другие чужеродные объекты.
- Т-лимфоциты (Т-клетки) контролируют реакцию иммунной системы вашего организма.
 Т-клетки напрямую атакуют и уничтожают аномальные клетки, включая раковые.
Т-клетки напрямую атакуют и уничтожают аномальные клетки, включая раковые.
Почти все люди с ХЛЛ страдают В-клеточным хроническим лимфолейкозом. Существует родственное состояние, которое влияет на Т-клетки, называемое Т-клеточным пролимфоцитарным лейкозом (PLL). У людей с Т-клеточным PLL симптомы развиваются быстрее, чем у людей с B-клеточным PLL.
Насколько распространено это состояние?
Хронический лимфолейкоз — один из наиболее распространенных видов лейкоза у взрослых. Он затрагивает около 5 из 100 000 человек в США. По оценкам Американского онкологического общества, около 18 700 человек будут диагностированы с ХЛЛ в 2023 году. Для сравнения, в 2023 году более чем у 238 000 человек будет диагностирован рак легких (один из самых распространенных видов рака в целом). .
Симптомы и причины
Каковы симптомы хронического лимфоцитарного лейкоза?
Хронический лимфолейкоз может протекать бессимптомно. Могут пройти месяцы или годы, прежде чем вы заметите симптомы ХЛЛ. Общие симптомы включают:
Общие симптомы включают:
- Усталость . CLL влияет на ваши эритроциты, вызывая анемию. Усталость является распространенным симптомом анемии.
- Лихорадка. Лихорадка является признаком инфекции. ХЛЛ влияет на здоровые лейкоциты, увеличивая риск инфекций.
- Увеличение лимфатических узлов на шее, в подмышечных впадинах, в паху или на животе.
- Ночные поты .
- Необъяснимая потеря веса .
- Боль или чувство распирания под ребрами. ХЛЛ может повлиять на вашу печень или селезенку. Раковые лейкоциты в печени и/или селезенке могут способствовать росту этих органов.
Что вызывает хронический лимфолейкоз?
Хронический лимфолейкоз возникает, когда определенные хромосомы и гены мутируют или изменяются в течение жизни. Медицинские исследователи не знают, что вызывает эти изменения, но они выявили некоторые факторы риска, в том числе:
- Семейный анамнез: Исследования показывают, что люди, имеющие близких родственников с ХЛЛ, таких как их биологические родители, братья, сестры или дети, в два-четыре раза более склонны к развитию ХЛЛ.

- Возраст: В среднем людям 71 год, когда им ставят диагноз.
- Пол: Мужчины и люди, отнесенные к мужскому полу при рождении (AMAB), заболевают ХЛЛ чаще, чем женщины и люди, отнесенные к женскому полу при рождении (AFAB).
- Воздействие Agent Orange: Исследования показывают связь между CLL и Agent Orange, химическим веществом, использовавшимся во время войны во Вьетнаме.
- Моноклональный В-клеточный лимфоцитоз: В этом состоянии у вас в крови повышенное количество идентичных В-клеток. Если у вас есть это заболевание, существует небольшой риск развития ХЛЛ.
Каковы осложнения хронического лимфоцитарного лейкоза?
Хронический лимфолейкоз поражает ваши эритроциты, лейкоциты и тромбоциты. Красные кровяные тельца переносят кислород по всему телу. Белые кровяные тельца защищают вас от инфекции. Тромбоциты помогают крови сворачиваться. Без здоровых клеток крови и тромбоцитов могут развиться следующие осложнения:
- Лимфома : Примерно у 2-10% людей с ХЛЛ развивается лимфома.

- Рак кожи , рак легких или рак толстой кишки : У вас может быть повышенный риск развития рака, поскольку ХЛЛ влияет на способность вашей иммунной системы защищать вас от злоумышленников, включая раковые клетки.
- Анемия : У вас может развиться анемия, потому что у вас недостаточно эритроцитов, переносящих кислород по всему телу.
- Тромбоцитопения : Хронический лимфолейкоз может повлиять на выработку тромбоцитов.
- Частые инфекции: У вас может быть повышенный риск бактериальных, грибковых или вирусных инфекций, поскольку у вас недостаточно здоровых лейкоцитов.
- Аутоиммунные заболевания: У некоторых людей с ХЛЛ может развиться аутоиммунная гемолитическая анемия.
Диагностика и тесты
Как диагностируется хронический лимфолейкоз?
Ваш лечащий врач спросит о ваших симптомах. Они проведут медицинский осмотр и могут заказать следующие тесты:
Они проведут медицинский осмотр и могут заказать следующие тесты:
- Общий анализ крови (ОАК) с дифференциальным : Общий анализ крови измеряет количество эритроцитов, лейкоцитов и тромбоцитов в твоей крови. Он также оценивает количество гемоглобина (белка, переносящего кислород) в эритроцитах.
- Мазок периферической крови : Патологоанатом исследует ваши клетки крови под микроскопом на наличие раковых клеток крови.
- Проточная цитометрия : Медицинские работники используют этот лабораторный тест, чтобы больше узнать о ваших клетках крови. При ХЛЛ они используют проточную цитометрию, чтобы определить, несут ли ваши лейкоциты клетки ХЛЛ.
- Генетические тесты : Патологи используют такие тесты, как флуоресцентная гибридизация in situ (FISH) и анализ тяжелых цепей иммуноглобулина (IGHV), чтобы исследовать ваши хромосомы и гены.
 Понимание того, как хромосомы и гены мутировали или изменились, помогает поставщикам определить, как лечить ХЛЛ.
Понимание того, как хромосомы и гены мутировали или изменились, помогает поставщикам определить, как лечить ХЛЛ.
Стадии хронического лимфоцитарного лейкоза
Медицинские работники используют системы определения стадии рака для разработки планов лечения и прогнозов (ожидаемый результат). Провайдеры позиционируют CLL с помощью двух аналогичных систем стадирования. Система стадирования Rai классифицирует ХЛЛ по вероятности ухудшения состояния и необходимости лечения. Система Бине стадирует ХЛЛ по степени распространения заболевания по всему телу.
Промежуточная система Rai
Категории промежуточной системы Rai:
- Низкий риск (ранее известный как Rai стадия 0): У вас лимфоцитоз и аномальные лейкоциты в крови и/или костном мозге.
- Промежуточный риск (ранее известный как Rai стадия I или стадия II): У вас лимфоцитоз, увеличение лимфатических узлов и увеличение селезенки и/или печени.
- Высокий риск (ранее известный как Rai Stage III): У вас анемия или тромбоцитопения.

Система стадирования Бине
Система стадирования Бине использует информацию о количестве клеток крови и тромбоцитов, а также о количестве участков тела с увеличенными лимфатическими узлами. Категории сценической системы Бине:
- Стадия A: У вас нет анемии (низкий уровень эритроцитов) или низкий уровень тромбоцитов, но у вас увеличены лимфатические узлы как минимум в двух областях тела. Например, у вас опухли лимфатические узлы на шее и в паху.
- Стадия B: У вас увеличены лимфатические узлы в трех областях тела, печени или селезенке, но у вас нет анемии, и уровень тромбоцитов в норме.
- Стадия C: У вас анемия, а также увеличение лимфатических узлов в трех или более областях тела.
Некоторые люди, больные раком, пугаются или нервничают из-за систем, которые, кажется, сводят их состояние к формуле цифр и букв. Ваши поставщики услуг понимают, почему вы можете себя так чувствовать. Если вы сбиты с толку или обеспокоены тем, что слышите, попросите своего врача объяснить, как система определения стадии рака работает в вашей ситуации.
Если вы сбиты с толку или обеспокоены тем, что слышите, попросите своего врача объяснить, как система определения стадии рака работает в вашей ситуации.
Управление и лечение
Как лечится хронический лимфолейкоз?
Лечение зависит от ваших симптомов и результатов анализов. Например, если у вас ХЛЛ на ранней стадии, ваш лечащий врач может выбрать выжидательную тактику (активное наблюдение).
Выжидая, медработники откладывают лечение, внимательно наблюдая за вашим общим состоянием здоровья, симптомами и результатами анализов.
Поставщики медицинских услуг также учитывают результаты генетических тестов. Например, определенные генетические изменения означают, что ваше состояние, скорее всего, ухудшится раньше, чем позже, или типичные методы лечения ХЛЛ будут не такими эффективными.
Общие методы лечения ХЛЛ включают таргетную терапию и химиотерапию. Медицинские работники могут использовать лучевую терапию для облегчения симптомов ХЛЛ. Каждый тип лечения может вызывать различные побочные эффекты. Ваш врач расскажет о конкретных преимуществах лечения, побочных эффектах и потенциальных долгосрочных осложнениях.
Ваш врач расскажет о конкретных преимуществах лечения, побочных эффектах и потенциальных долгосрочных осложнениях.
Таргетная терапия
Это лечение работает путем нацеливания или фокусирования на раковых клетках. При хроническом лимфоцитарном лейкозе лечение предотвращает рост раковых лейкоцитов. Некоторые целенаправленные методы лечения разрушают клетки, не повреждая здоровые клетки или тромбоциты. Конкретные методы лечения или лекарства могут включать:
- Ингибитор тирозинкиназы Брутона (BTK): Это лечение блокирует ферменты, которые заставляют В-клетки развиваться в избыточные лейкоциты. Примеры включают ибрутиниб (Imbruvica®), акалабрутиниб (Calquence®) и занубрутиниб (Brukinsa®).
- Ингибиторная терапия BCL2: Венетоклакс (Венклекста®) блокирует BCL2, белок, обнаруживаемый в лейкозных клетках, включая клетки CLL. Это лечение может разрушить лейкозные клетки или сделать их более чувствительными к другим противораковым препаратам.

- Терапия моноклональными антителами : Это лечение является разновидностью иммунотерапии. Моноклональные антитела — это созданные в лаборатории антитела, которые блокируют рост раковых клеток или уничтожают раковые клетки. Примеры препаратов для терапии моноклональными антителами включают ритуксимаб (Ритуксан®) и обинутузумаб (Газива®).
Химиотерапия
Ваш поставщик медицинских услуг может использовать химиотерапию в качестве начального лечения хронического лимфоцитарного лейкоза. Общие химиотерапевтические препараты для лечения ХЛЛ включают:
- Флударабин (Fludara®).
- Хлорамбуцил (лейкеран®).
- Циклофосфамид (Cytoxan®).
- Бендамустин (Треанда®).
Иммунотерапия
Этот метод лечения восстанавливает или укрепляет вашу иммунную систему, что позволяет эффективнее уничтожать раковые клетки или замедлять их рост.
Медицинские работники могут использовать иммунотерапевтический препарат леналидомид (Ревлимид®) для лечения хронического лимфоцитарного лейкоза, который не отвечает на химиотерапию, рецидивирующего ХЛЛ (рецидивирующий ХЛЛ) или прогрессирующего ХЛЛ.
Медицинские исследователи оценивают терапию химерными антигенными рецепторами (CAR-T) для людей с ХЛЛ, которые не ответили на стандартное лечение.
Профилактика
Можно ли предотвратить это состояние?
Нет известного способа предотвратить ХЛЛ.
Перспективы/прогноз
Как долго вы можете жить с хроническим лимфоцитарным лейкозом?
Хронический лимфолейкоз (ХЛЛ) обычно развивается очень медленно. Вы можете долго жить с ХЛЛ, прежде чем заметите симптомы. Когда вы это делаете, у медицинских работников есть очень эффективные методы лечения, которые переводят ХЛЛ в стадию ремиссии. Ремиссия от ХЛЛ обычно длится несколько лет, прежде чем состояние возвращается. Даже в этом случае ваш врач может порекомендовать различные методы лечения, которые возвращают ХЛЛ в состояние ремиссии. ХЛЛ никогда не исчезнет, но люди все еще могут прожить долгую и полноценную жизнь с этим заболеванием.
Какова общая выживаемость при хроническом лимфоцитарном лейкозе?
По оценкам Национального института рака, 87,9% людей с ХЛЛ живут через пять лет после постановки диагноза. Когда вы думаете о показателях выживаемости, важно помнить, что показатели выживаемости — это оценки, основанные на опыте больших групп людей с ХЛЛ. Многие вещи могут повлиять на выживаемость при ХЛЛ, от общего состояния здоровья и стадии состояния на момент постановки диагноза до того, как ваше состояние реагирует на лечение. Если у вас есть вопросы, спросите своего поставщика медицинских услуг, что вы можете ожидать в вашей ситуации.
Когда вы думаете о показателях выживаемости, важно помнить, что показатели выживаемости — это оценки, основанные на опыте больших групп людей с ХЛЛ. Многие вещи могут повлиять на выживаемость при ХЛЛ, от общего состояния здоровья и стадии состояния на момент постановки диагноза до того, как ваше состояние реагирует на лечение. Если у вас есть вопросы, спросите своего поставщика медицинских услуг, что вы можете ожидать в вашей ситуации.
Что происходит при терминальной стадии хронического лимфолейкоза?
Термин «терминальная стадия» означает, что лечение больше не помогает замедлить или остановить ХЛЛ. В этом случае у вас могут развиться опасные для жизни инфекции или неконтролируемое кровотечение, которые медицинские работники не в состоянии вылечить.
Жить с
Каково жить с хроническим лимфолейкозом?
Это зависит от вашей ситуации. У вас может быть ХЛЛ без каких-либо симптомов. Если у вас есть симптомы, есть методы лечения, чтобы уменьшить их и управлять вашим состоянием, но это никогда не исчезнет.
Вот несколько советов, как жить с ХЛЛ:
- Защитите себя от инфекции. Люди с ХЛЛ имеют повышенный риск заражения, некоторые из которых могут быть опасными для жизни. Спросите своего поставщика медицинских услуг, какие прививки целесообразны.
- Следите за своим здоровьем. У вас может быть повышен риск развития рака кожи, рака легких или рака толстой кишки. Спросите своего врача о скрининговых тестах на рак.
- Управляйте своим стрессом. Многие люди с ХЛЛ проходят циклы ремиссии и рецидива. Циклическое чередование ремиссии и рецидива может вызвать у вас беспокойство. Если это ваша ситуация, спросите своего врача о программах или услугах, которые помогут вам справиться со стрессом.
- Соблюдайте здоровую диету. Некоторые симптомы ХЛЛ могут влиять на ваш аппетит. Спросите своего врача о консультации с диетологом. Если у вас хороший аппетит, сосредоточьтесь на сбалансированной диете, состоящей из нежирного белка, злаков, фруктов и овощей и полезных жиров, чтобы улучшить общее состояние здоровья.

- Упражнение. Упражнения помогут вам справиться со стрессом и поднять настроение.
- Успокойся. CLL может быть утомительным. Старайтесь отдыхать, когда вам нужен перерыв.
- Знайте, чего ожидать. Знание — сила. Спросите своего врача о симптомах, которые могут свидетельствовать о том, что ваше состояние прогрессирует (ухудшается). Ваш врач может порекомендовать различные методы лечения, которые в большей степени помогают справиться с ХЛЛ.
Какие вопросы я должен задать своему лечащему врачу?
Вы можете спросить:
- Какой тип хронического лимфоцитарного лейкоза у меня?
- У меня нет симптомов. Когда мне следует начать лечение?
- Каковы мои варианты лечения?
- Всегда ли мне нужно лечение?
- Приведет ли лечение к ремиссии моего состояния?
Записка из клиники Кливленда
Хронический лимфолейкоз (ХЛЛ) — наиболее распространенная форма лейкоза у взрослых.

 Тем не менее, исследования показали, что только в 8–10% случаев болезнь у детей является наследственной. И сам факт наличия генетического заболевания не означает, что у человека обязательно разовьется опухоль.
Тем не менее, исследования показали, что только в 8–10% случаев болезнь у детей является наследственной. И сам факт наличия генетического заболевания не означает, что у человека обязательно разовьется опухоль.
 Многим детям эту процедуру проводят во сне (под наркозом). Если пациент бодрствует во время процедуры, ему дают подходящее болеутоляющеесредство..
Многим детям эту процедуру проводят во сне (под наркозом). Если пациент бодрствует во время процедуры, ему дают подходящее болеутоляющеесредство..
 В ходе исследования измеряют количество клеток, процент живых клеток и некоторые их характеристики, такие как размер, форма и наличие маркеров лейкоза на поверхности клеток.
В ходе исследования измеряют количество клеток, процент живых клеток и некоторые их характеристики, такие как размер, форма и наличие маркеров лейкоза на поверхности клеток. . Такое исследование важно, поскольку онкозаболевания вызваны ошибками (мутациями) в генах клетки. Выявление этих ошибок способствует диагностике конкретного подвида лейкоза. На основе этой информации врачи могут выбирать варианты лечения, соответствующие конкретному случаю. Детям, у которых лейкоз вызван мутациями с благоприятным прогнозом, назначают менее токсичное лечение. И наоборот, врачи могут назначать более интенсивное лечение, еслилейкозвызван наличием мутаций, имеющих менее благоприятный прогноз. Могут быть выявлены мутации, для которых имеются специальные направленныеметодылечения.
. Такое исследование важно, поскольку онкозаболевания вызваны ошибками (мутациями) в генах клетки. Выявление этих ошибок способствует диагностике конкретного подвида лейкоза. На основе этой информации врачи могут выбирать варианты лечения, соответствующие конкретному случаю. Детям, у которых лейкоз вызван мутациями с благоприятным прогнозом, назначают менее токсичное лечение. И наоборот, врачи могут назначать более интенсивное лечение, еслилейкозвызван наличием мутаций, имеющих менее благоприятный прогноз. Могут быть выявлены мутации, для которых имеются специальные направленныеметодылечения.  Эта процедура также называется «ЛП» или «поясничный прокол».
Эта процедура также называется «ЛП» или «поясничный прокол». 
.jpg) Если клетки распространились, случай относится к высокому риску.
Если клетки распространились, случай относится к высокому риску.