Лимфогранулематоз презентация: «Лимфогранулематоз ( болезнь Ходжкина ). Лимфогранулематоз или болезнь Ходжкина – это 1.лимфопролиферативное заболевание, 2.относящиеся к группе злокачественных.». Скачать бесплатно и без регистрации.
Лимфогранулематоз — презентация онлайн
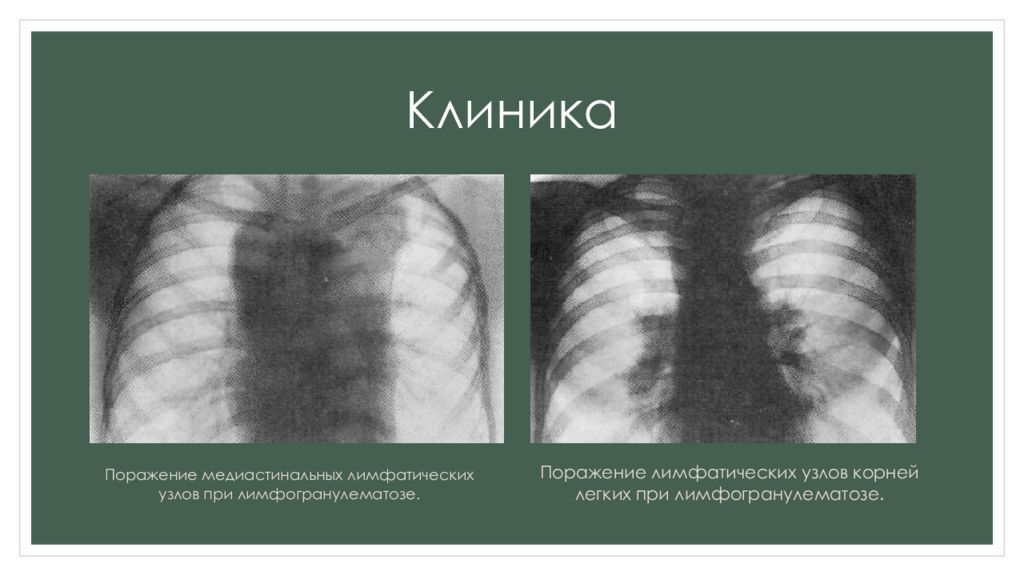
1. ЛИМФОГРАНУЛЕМАТОЗ
— первичное опухолевоезаболевание лимфатической
системы.
Характеризуется
злокачественной гиперплазией
лимфоидной ткани с
образованием в них
лимфогранулем.
Протекает в локализованной и
диссеминированной формах
2. ЗАБОЛЕВАЕМОСТЬ
• В мире: 0,5 — 3,1/ 100 тыс. нас.
• В России: 2,3
/100 тыс. нас.
•В Японии меньше
чем в Европе
• Негры болеют
реже, чем белые
• В любом возрасте
15-30 лет
старше
50 лет
► до 10 лет в основном
болеют мальчики
60-70%
мужчины
30-40%
женщины
3. ЭТИОЛОГИЯ
• неизвестнатеории
Доброкачественное
заболевание
Инфекционная
природа
Вирусная
природа
Опухолевая
природа
4. Патогенез (опухолевая теория)
Лимфоузелл/у
← лимфогенно
л/у
л/у
←
Лимфоидная
ткань
Нелимфоидные
органы
• Селезёнка в 25% случаев
гематогенно
5.
 Патогенез B- лимфоцит
Патогенез B- лимфоцитзародышевого
генетически измененный
В — лимфоцит
клетка Б-Ш
(Ходжкина)
– утратил способность к апоптозу
и синтезу Ig
Опухолевые своиства:
— анеуплодия
— клональность
Иммунная атака Т-лимфоцитов
(основная клеточная популяция пораженных л/у)
Истощение пула
Т-лимф
↓ клеточного
иммун. ответа
Прогрессирующий
рост опухоли
6. Патологическая анатомия
СУБСТРАТ ЛГМ:— лимфоциты
— гистиоциты
— нейтрофилы
— эозинофилы
— плазматические клетки
— фиброзная ткань
-гигантские клетки
Б-ш и Х
Полиморфноклеточная
гранулёма
7. Диагностические клетки
Березовского-Штернберга(Рид-Штернберга)
«глаза совы»
— рак молочной железы
— рак лёгких
— меланома
— миозит
— инф мононуклеоз
Вывод: Гистологическая структура Л/У
+ клетки Б-Ш
Ходжкина
– малая
диагностическая
ценность
Достоверность ЛГМ
8.
 Гистологическая классификация ЛГМ Гистол.
Гистологическая классификация ЛГМ Гистол.вариант
%
Патологическая анатомия
возр
лет
— пролиферация зрелых лимфоцитов,
-клетки Штернберга-Рида встречаются редко,
— трудности цитологической диагностики
+ СД15, СД30 маркеры
20-40
1.Лимфоидное
преобладание
(LP)
5%
2.Нодулярный
Склероз
(NS)
6580%
— правильные тяжи коллагена, делящие
опухолевую ткань на участки округлой формы
— опухолевая ткань состоит из лимфоцитов,
встречаются кл. Рид-Штернберга
15-40
3. Смешанно –
клеточный
(MS)
2035%
— клеточный состав полиморфен,
— Ш-Р встречаются часто,
— присутствуют очаги некроза, возможно
частичное поражение л/у
35-50
4. Миелоидное
истощение(LD)
а) диффузный
склероз
б)ретикулярн.
вариант
Редкая форма, для этого варианта
характерно почти полное отсутствие
лимфоцитов, что обусловлено резким
преобладанием ретикулярных клеток или
разрастанием грубых тяжей коллагена
Особенности
течения
-чаще у мужчин
-преобладают
локализ.
 формы,
формы,-м.б. поздние
рецидивы
стад
I-II А
чаще у женщин,
хар-но поражен.
л/у средостения и
надключичной
области
I-III А
или В
часто встречается
ретроперитонеаль
ное поражение,
сопровождается
В симптомами
II-IV А
или В
Субфибрилитет,
общая слабость,
поражение печени
и костного мозга
III-IV
B
9. Лимфогранулематоз
Э/лимфатическая системаинтоксикация
Легкие
(56% аут, 20% R)
Костная система
лихорадка
похудание
(56% аут, 20% R)
Костный мозг
(панцитопения)
печень
селезенка
ЖКТ
л/органы
почки
миндалины
л/у
кожа
10. Клиническая картина
I. Интоксикацияа) Лихорадка
↑ температуры
озноб
проливной пот
б) Потливость (проливной ночной пот смена белья)
в)Похудание
— терминальные стадии
— тяжелые обострения
11. Клиническая картина (поражение лимфатических органов)
1. Шейно-надключичная группа 60-75% (чаще справа):
Шейно-надключичная группа 60-75% (чаще справа):—
—
подвижные
плотноэластичные
не спаянные с кожей
безболезненные (редко болезненные, после приема алкоголя)
сливаются в конгломераты
2. Л/У средостения 15-20 %
—
(типично для нодулярного склероза)
кашель
одышка
боли за грудиной
3. Забрюшинные Л/У 1-2%
—
боли в области поясницы (ночью)
4. Мезентериальные л/у 5-10%
5. Селезенка 25%
(лимфоидное истощение)
12. Клиническая картина (экстралимфатическая локализация)
1. Легкие:R гр – 20%, аутопсия – 45-54%
— возможен инфильтративный рост из л/у
— самостоятельное появление очагов или диффузных инфильтратов
—
в пунктате клетки Березовского — Штернберга
сочетается с ув. л/у средостения и очагами в легочной ткани
3. Костная система: R гр – 14-20%, аутопсия – 41-56%
—
позвонки
грудина
кости таза
ребра
трубчатые кости — редко
4.
 Костный мозг: 12%
Костный мозг: 12%— может бессимптомно
— панцитопения
13. Клиническая картина (экстралимфатическая локализация)
5. Печень (поздно):—
Гепатомегалия
↑ ЩФ
↑ билирубина
↓ альбумина
↓ протромбина
↓ холестерина
6. ЖКТ: — первичное поражение редко
(желудок и тонкая кишка –подслизистый слой. Язвы не образуются)
— вторичное поражение (сдавление или прорастание из л/у)
7. ЦНС: — мозговые оболочки спинного мозга
8. Кожа: кожный зуд у 25-35 % → дерматит → психические расстройства
14. Клиническая картина (экстралимфатическая локализация)
Лимфогранулематозные очаги могут быть:— Почки
— Молочные железы
— Яичники
— Тимус
— Щитовидная железа
15. Причины смерти
1.Кахексия
2.
Сердечно-лёгочная недостаточность
3.
Печеночная недостаточность
4.
Печеночно-почечная недостаточность
5.
Амилоидоз
6.
Осложнения лечения (25%) — инфекции (вирусы, бакт.
 , грибы)
, грибы)— гипоплазия кроветворения
— кровотечения
— вторичные злокачественные
новообразования
16. Международная клиническая классификация (Ann Arbor1971 )
СтадияПризнаки
I
Вовлечение одной области лимфоузлов (I) или одного
нелимфоидного органа или области (IЕ)
II
Вовлечение двух или более областей лимфоузлов по одну
сторону диафрагмы (II) или одной или более областей
лимфоузлов с нелимфоидной областью (IIE)
III
Вовлечение областей лимфоузлов по обе стороны
диафрагмы (III), иногда с одновременным вовлечением
обоих (III SE)
IV
Диффузное или диссеминированное поражение одного или
более нелимфоидных органов с сочетанным поражением
лимфатических узлов или без него
Е – распространение из пораженного л/у
А – бессимптомные
В — интоксикация
17. Лабораторные показатели
• Патогномоничных признаков нет— 50% —
умеренный нейтрофильный лейкоцитоз
(не более 10 тыс)
— Лимфоцитопения (поздние стадии)
— 0,5-3% — высокая эозинофилия (до 80%)
— 10-15% — тромбоцитоз (600 – 1000 х 10
9)
— Панцитопения ( поздние стадии, после ХТ, миелограмма N)
— ↑ СОЭ
18.
 Биологические признаки активности • ↑ СОЭ – отражает активность процесса
Биологические признаки активности • ↑ СОЭ – отражает активность процесса• ↑ фибриногена 5,0 г/л и выше
• ↑ Альфа — 2 глобулинов свыше 10 г/л
• Гаптоглобин свыше ↑ 1,5 мг%
• Церулоплазмин ↑ 0,4 ЕД
19. Течение ЛГМ
• I и II стадии – течение благоприятное(10 летняя выживаемость – 80%)
• Ухудшают течение:
— инсоляция
— физиотерапевтические процедуры
(кварц, УВЧ, гальванизация, грязи и т.д.)
— беременность
20. Факторы неблагоприятного прогноза
1. B-симптомы: — ночной проливной пот— ↑ до 38 не менее 3х дней
— похудание на 10% и ↑ за полгода
2.
II-III стадии заболевания
3.
Возраст более 50 лет
4.
МТИ > 0,35 (расширение тени средостения за счёт л/у более чем
на 1/3 грудной клетки)
5.
Поражение 4 и более зон л/у
6.
↑ СОЭ более 50 мм/ч или
↑ СОЭ более 30 + B-симптомы
21. Лечение
ЛЕЧЕНИЕТрансплантация
костного мозга
Лучевая терапия
Химиотерапия
Комбинированная
терапия
22.
 Лечение. Современные рекомендации 1. IA / IIA – субтотальное облучение Л/У
Лечение. Современные рекомендации 1. IA / IIA – субтотальное облучение Л/У2. IB / IIB – комбинированная терапия
3. III A –полихимиотерапия
4. опухоль средостения большой массы –
комбинированная терапия
5. IIIB / IV — полихимиотерапия
23. Режимы химиотерапии
Режим1.Морр
Мустарген
Винкистин
Натулан
Преднизолон
Доксорубицин
Блеомицин
Винбластин
Дакарбазин
3.MOPP-ABVD
Чередуя каждый месяц
4.Гибрид MOPP-ABV
Мустарген
Винкистин
Натулан
Преднизолон
Доксорубицин
Блеомицин
Винбластин
5. ChIVPP
Хлорамбуцил
Винбластин
Натулан
Преднизолон
Рекомендуемы дозы (мг/м2)
6
1,4
100
40
25
10
6
375
Способ введения
в/в
в/в
внутрь
внутрь
в/в
в/в
в/в
в/в
Дни цикла
1и8
1и8
1 — 14
1 – 14
1 и 15
1 и 15
1 и 15
1 и 15
КАК МОРР И ABVD см.
 выше
выше6
1,4(максимум 2,0)
100
40
35
10
6
в/в
в/в
внутрь
внутрь
в/в
в/в
в/в
1
1
1-7
1-14
8
8
8
6
6
100
40
внутрь
в/в
внутрь
внутрь
1-14
1и8
1-14
1-14
24. Осложнения лечения
— Гипотиреоидизм 10-20%(после облучения коррекция заместительной терапией)
—
Стерильность у женщин (облучение таза)
Стерильность у мужчин (химиотерапия по схеме МОРР)
Пневмонии (лучевые)
Кардиотоксичность (химиотерапия – адриамицин + лучевая терапия)
Асептический некроз головки бедренной кости
(преднизолон в МОРР)
— Вторичные опухоли –острая нелимфобластная лейкемия (2-10% б-х через 3-10
лет после лечения МОРР+облучение)
— НХЛ (В-клеточного происхождения)
— Саркомы и эпителиальные опухоли
— Неврологические расстройства: — нейропатии (винкристин)
25. ЛИМФОПЕНИИ
• МИЛИАРНЫЙ ТУБЕРКУЛЕЗ• ОНКОЛОГИЧЕСКИЕ ЗАБОЛЕВАНИЯ (ТЕРМИНАЛЬНЫЕ
СТАДИИ)
• ОСТРЫЕ ИНФЕКЦИИ
• СКВ
• ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ
• ИММУНОДЕФИЦИТЫ
• ЛИМФОПЕНИЯ БРУТОНА
26.
 И.В.Давыдовский Если главная масса ошибок
И.В.Давыдовский Если главная масса ошибокпатологоанатомов по
биопсированному материалу
лимфатические узлы, то среди
заболеваний последних на
первом месте стоят ошибки
именно в отношении
лимфогранулематоза
Лимфогранулематоз (болезнь Ходжкина) — презентация онлайн
Лимфогранулематоз(болезнь Ходжкина )
Лимфогранулематоз или болезнь Ходжкина
– это
1. лимфопролиферативное заболевание,
2. относящиеся к группе злокачественных лимфом,
3. характеризующееся специфической морфологической
картиной с образованием клеток Березовского-ШтернбергаРида.
Иными словами ЛГМ –
1. злокачественная опухоль одного из звеньев иммунной
системы
2. С не выясненным до конца происхождением опухолевых
клеток и
3. вероятным макрофагольным происхождением опухолевых
клеток.
Эпидемиология ЛГМ
1. В России заболеваемость составляет от 1,7 до 2,5
случаев на 100000 населения.

2. Преобладают среди заболевших мужчины.
3. Среди первичных больных лимфогранулематозом
дети составляют в среднем 15%.
4. У детей и подростков наблюдается двугорбая кривая
заболеваемости: первый пик в 4—6 лет
второй в 12—14 лет
5. В зелом для населения характерны два типа пика
заболеваемости:
между 15 и 35 годами
и старше 50 лет.
Теории возникновения лимфогранулематоза:
Вирусная — лимфогранулематоз ассоциирован с вирусом
Эпштейна-Барра. По крайней мере, в 20% клеток
Березовского- Рида-Штейнберга находят генетический
материал этого вируса, обладающего иммунодепрессивными
свойствами.
Генетическая — Существует семейная форма
лимфогранулематоза, что может свидетельствовать о
генетической предрасположенности. Вероятность
возникновения заболевания возрастает при
иммунодефицитах (приобретенных и врождённых),
аутоиммунных заболеваниях.
Иммунологическая — В основе лежит предложение о
возможности переноса малых лимфоцитов матери в тело
Патологическая анатомия.

Субстратом лимфогранулематоза считается полиморфноклеточная гранулема,
образованная:
1.
Лимфоцитами
2.
Ретикулярными клетками
3.
Нейтрофилами
4.
Эозинофилами
5.
Плазматическими клетками
6.
фиброзной тканью.
Лимфогранулематозная ткань в начале образует отдельные мелкие узелки
внутри лимфатического узла, а затем, прогрессируя, вытесняет нормальную
ткань узла и стирает его рисунок.
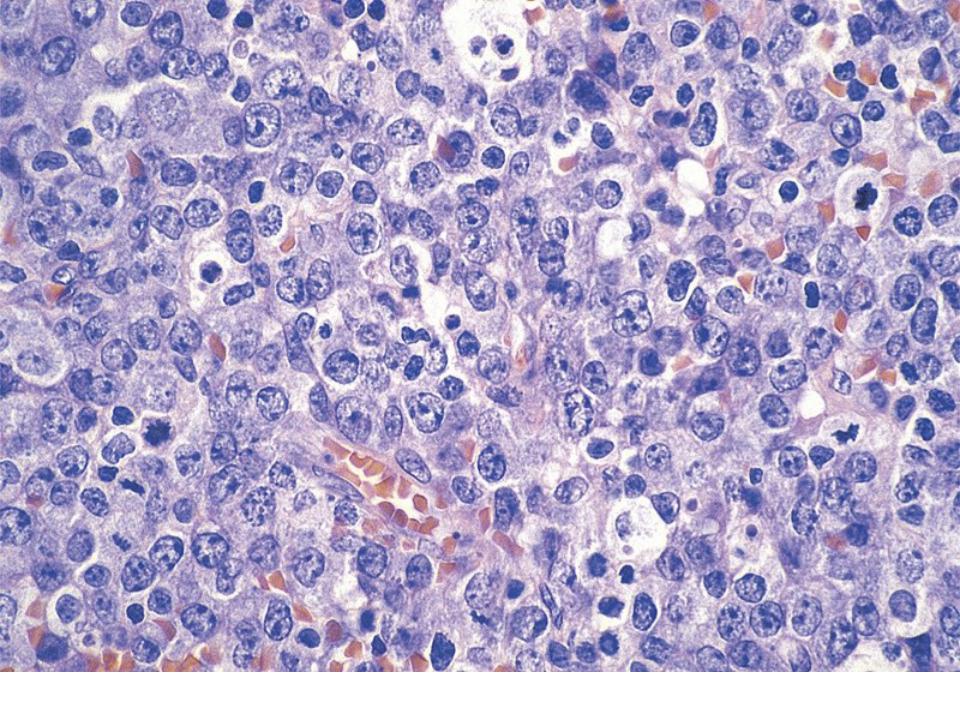
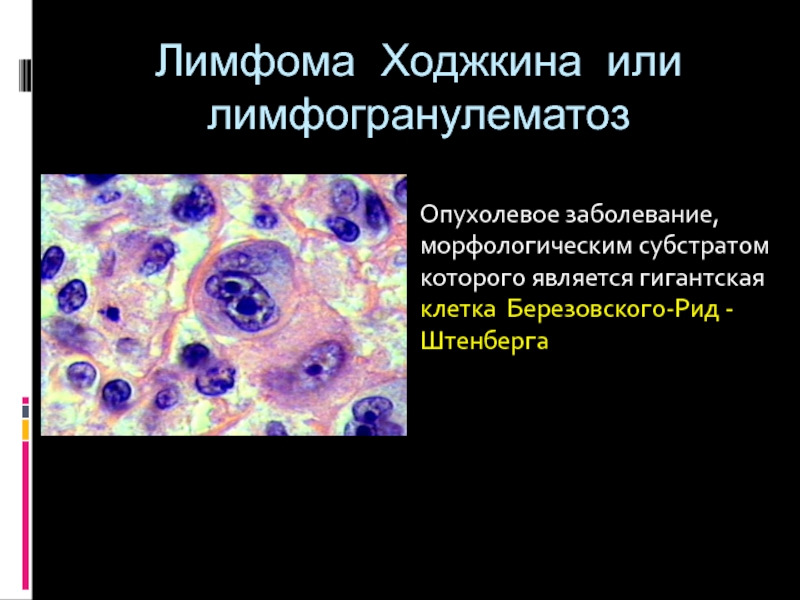
Гистологической особенностью лимфогранулемы являются гигантские клетки
Березовского-Штернберга.
Клетки Березовского-Штернберга
* крупные клетки диаметром 25 мкм и больше (до 80мкм),
* содержащие 2 и более овальных или круглых ядра.
Ядра часто располагаются рядом, создавая впечатление зеркального изображения.
* Хроматин ядер нежный, расположен равномерно,
ядрышко крупное, четкое, в большинстве случаев эозинофильное
Распространение ЛГМ в организме.
1. Лимфогенный путь распространения (теория смежного
распространения).

2. Гематогенный путь распространения. Метастазирование в
этом случае происходит в органы с развитой капиллярной
сетью: кости, печень, легкие.
3. Альтернативой этим теориям распространения может
служить теория D. W. Smithers, (1973 год). Автор полагает,
что клетки Березовского-Штернберга могут двигаться как
внутри, так и вне сосудов, давая начало новым дочерним
узлам в местах «восприимчивых» к клеткам.
Морфологические варианты ЛГМ.
I.
Лимфогистиоцитарный; лимфоцитарное преобладание.
Характеризуется выраженной пролиферацией, эозинофильные
гранулоциты и плазматические клетки встречаются редко, клетки
Березовского-Штернберга встречаются непостоянно, очаги некроза и
фиброза отсутствуют.
II.
Нодулярный склероз. Характеризуется развитием своеобразных
грубоволокнистых кольцевидных прослоек соединительной ткани,
разъединяющих всю ткань лимфоузла на отдельные узелки. Типпичны
клетки Березовского-Штернберга, встречаются очаги некроза,
нейтрофилы и гистиоциты.

III.
Смешанно-клеточный. Характеризуется пестрой картиной клеточного
состава, с большим количеством клеток Березовского-Штернберга.
Нередко в процесс вовлечена вся ткань лимфатического узла. Иногда
обнаруживается незначительное количество ретикулярных и
коллагеновых волокон.
IV.
Лимфоидное истощение. Отличается выраженным беспорядочным
развитием соединительной ткани и значительным уменьшением
клеточного состава ткани лимфатического узла. Характерно наличие
клеток Березовского-Штернберга и пролиферация гистиоцитов.
Стадия
Характеристика поражения
поражение одной лимфатической области или одного
IА
внелимфатического органа, отсутствие симптомов интоксикации
поражение одной лимфатической области или одного
IБ
внелимфатического органа, наличие симптомов
интоксикации
поражение двух или более лимфатических областей с одной
IIА стороны от диафрагмы — экстранодальное поражение одного
органа или ткани с поражением регионарных лимфоузлов
IIБ
IIIА
IIIБ
IVА
IVБ
поражение двух или более лимфатических областей с одной
стороны от диафрагмы — экстранодальное поражение одного
органа или ткани с поражением регионарных лимфоузлов,
наличие симптомов интоксикации
поражение лимфатических узлов по обе стороны диафрагмы
возможно локализованное поражение экстралимфатического органа
или ткани, отсутствие симптомов интоксикации
поражение лимфатических узлов по обе стороны диафрагмы
возможно локализованное поражение экстралимфатического органа
или ткани, наличие симптомов интоксикации
диффузное поражение экстралимфатических органов с возможным
поражением регионарных лимфоузлов, отсутствие симптомов
интоксикации
диффузное поражение экстралимфатических органов с возможным
поражением регионарных лимфоузлов, отсутствие симптомов
интоксикации
Ann Arbor, 1971
Симптомы интоксикации, позволяющие
выделять подстадии А и Б в классификации
ЛГМ:
1.
 необъяснимые подъемы температуры до 38°С по
необъяснимые подъемы температуры до 38°С повечерам с короткими афибрильными периодами
2. ночные поты
3. необъяснимая потеря веса тела более чем на 10% за
полгода
Гистологическое подтверждение поражения органов
и тканей обозначается следующими символами:
n(+) — внутрибрюшные и забрюшинные лимфатические узлы,
Н(+) — печень
S(+) — селезенка
L(+), М(+) — костный мозг
Р(+) — плевра
0(+) — кости
D(+) — кожа.
Оценка «биологической активности» процесса.
Используются 5 показателей:
1) СОЭ свыше 30 мм/час;
2) гаптоглобин свыше 1,5 г/л;
3) церулоплазмин свыше 185 ед./л;
4) альфа-2-глобулин свыше 10,0 г/л;
5) фибриноген свыше 4,0 г/л.
Увеличение двух и более показателей выше указанных
значений позволяет говорить об активности процесса.
Формы ЛГМ по локализации поражения:
изолированная, или локальная с поражением одной группы
лимфатических узлов;
генерализованная, при которой разрастание опухолевой
ткани обнаруживают не только в лимфатических узлах, но и в
селезенке, печени, легких, желудке, коже.

А так же выделяют следующие локализации ЛГМ:
1. периферическая форма (поражение поверхностных
лимфатических узлов)
2. медиастинальная
3. абдоминальная
4. легочно-плевральная
5. желудочно-кишечная
6. костная
7. кожная
8. нервная
Формы ЛГМ по скорости течения процесса:
Острая — болезнь проходит от начальной стадии до конечной
за несколько месяцев.
Хроническая – заболевание растягивается на много лет с
циклическими обострениями и ремиссиями.
Клиника лимфогранулематоза
складывается из трех основных
компонентов:
1. cимптомокомплекс интоксикации
2. симптоматика увеличения пораженных лимфатических
узлов
3. клиника распространения и прогрессирования
процесса, поражений экстралимфатических органов.
Симптомокомплекс интоксикации:
1. Повышенная утомляемость
2. Нарастающая слабость
3. Снижение работоспособности
4. Серо-землистый цвет кожи
5. Зуд кожи
6.
 Выпадение волос
Выпадение волос7. Проливной ночной пот, повышенная потливость
8. Периодическая лихорадка
9. Прогрессирующая потеря веса
10. Неспецифические изменения со стороны крови
(лейкоцитоз или лейкопения, моноцитоз, анемия,
повышение СОЭ и др.)
Симптоматика увеличения пораженных
лимфатических узлов
1. Лимфоузлы пальпируются в виде овоидных
отдельнолежащих образований, иногда достигающих
значительных размеров, не спаянных с кожей.
2. При росте и слиянии между собой конгломераты образуют
редко, чаще это группы лимфоузлов, лежащие близко друг
к другу и имеющие свою собственную капсулу.
3. Консистенция лимфоузлов, как правило, мягко
эластическая, в отличие от плотных метастатических
узлов.
4. Как правило, первичным очагом являются лимфоузлы шеи,
надключичные с одной или обеих сторон. Довольно часто
поражаются медиастинальные лимфоузлы. Весьма часто,
особенно в далеко зашедших стадиях наблюдается
поражение лимфоузлов ниже диафрагмы:
паховоподвздошные, парапортальные.
 Поражение
Поражениеабдоминальных лимфоузлов встречается редко.
Симптоматика увеличения пораженных
лимфатических узлов
Клиника поражений экстралимфатических
органов.
1. Поражается селезенка, что проявляется
симптомокомплексом спленомегалии и подтверждается
при УЗИ селезенки и /или сканировании.
2. Лимфогранулематоз внутренних органов встречается
реже, обычно в сочетании с поражением лимфоузлов и
только в единичном случаях бывает первичным.
Клинически проявляется симптомами,
свидетельствующими о наличии нарушения функции
органа.
3. Метастазы в кости характеризуются болевыми
ощущениями различной интенсивности, а при
поверхностном расположении очаговой припухлостью.
Метастазы в кости возникают редко, имеют вид небольших
округлых инфильтратов темно-красного цвета,с
пигментацией в окружности, а иногда с изъязвлением
Эхографическая картина печени при
лимфогранулематозе.
В проекции левой доли печени визуализируется пониженной
эхогенности образование с четкими контурами и неоднородной
внутренней эхоструктурой (отмечено маркерами).
 Косые
Косыевзаимоперпендикулярные сечения через проекцию образования.
Диагностика ЛГМ.
Диагноз лимфогранулематоза можно выставить только на
основании гистологического исследования после биопсии
лимфатического узла.
Морфологический диагноз лимфогранулематоза
считается несомненным, если он подтвержден тремя
морфологами.
Биопсию предпочтительно выполнять на шее,
надключичной области, подчелюстной зоне. Здесь
справедлив принцип -чем выше, тем лучше. Для этого
выбираются лимфатические узлы не более 3 см в
наибольшем измерении. Взятие для биопсии подмыщечных
или паховых узлов показано в случае, если надключичные и
шейные узлы интактны.
Обязательные методы исследования для
больных с подозрением на ЛГМ:
1.
Анамнез заболевания
2.
Осмотр больного с регистрацией всех зон поражения и размеров
опухолевых образований
3.
Общий анализ крови с подсчетом тромбоцитов
4.
Общий анализ мочи
5.

Биохимические исследования — общий белок крови, фракции белка,
трансаминаз, билирубин, креатинин, мочевина, фосфотазы,
фибриноген, сахар
6.
Рентгенография органов грудной клетки с томографией средостения и
определением соотношения наибольшего диаметра медиастинальных
масс к размеру грудной клетки (менее 0,33)
7.
Ультразвуковое исследование печени, селезенки, забрюшинных,
мезентериальных лимфатических узлов и/или компьютерная
томография
8.
Трепанбиопсия или стернальная пункция с подсчетом миелограммы
9.
Осмотр ЛОР-органов
10. Исследование органов ЖКТ, рентгенография, фиброгастроскопия.
Лимфогранулематоз 3б.ст.
Результаты рентгенологического исследования
Расширение правого контура сердца
Результаты рентгенологического исследования
Рентгенограммы грудной клетки при лимфогранулематозе:
расширения срединной тени, обусловленные поражением
лимфатических узлов переднего средостения
Результаты исследования компьютерной томографии
Увеличение лимфатических узлов в области бифуркации трахеи
Дополнительные методы исследования для
больных с подозрением на ЛГМ:
1.
 исследование костей (рентгенография, сцинтиграфия ТС)
исследование костей (рентгенография, сцинтиграфия ТС)2. исследование почек
3. сцинтиграфия печени, селезенки и забрюшинных
лимфоузлов
4. ирригорафия
5. прямая нижняя лимфография
6. эксплоративная лапоротомия или торокотомия с биопсией
лимфоузлов
Цели диагностической лапоротомии:
1. ревизию брюшной полости, лимфатических узлов,
расположенных по ходу аорты, мезентериальных сосудов,
подвздошных сосудов
2. удаления для гистологического исследования наиболее
подозрительных лимфатических узлов
3. ревизия и биопсия печени (процедура обязательная,
выполняется всегда при лапоротомии)
4. удаление селезенки с гистологическим исследованием
5. рентгеноконтрастная маркировка тканей для
последующего облучения или уточнения топики органов,
подлежащих облучению
Противопоказанием к диагностической лапоротомии
является быстрое прогрессирование процесса,
избыточный вес, возраст страше 60 лет.
Примеры формулировки диагноза:
1.
 Лимфогранулематоз, склеронодулярный вариант,
Лимфогранулематоз, склеронодулярный вариант,изолированная, периферическая, хроническая форма,
IIA стадия после комбинированного лечения в 1990
году, неактивная фаза, ремиссия.
2. Лимфогранулематоз, лимфогистиоцитарный
вариант, острая, генерализованная, абдоминаотная
форма, IIIБ стадия, активная фаза в процессе
комбинированного лечения.
Неблагоприятные факторы риска течения ЛГМ :
1. Повышение СОЭ выше 50 мм\час
2. Возраст старше 40 лет
3. Наличие массивных (диаметром более 5 см)
конгломератов лимфатических узлов, или расширение
тени средостения на рентгенограммах более чем на 1/3
диаметра грудной клетки в самом широком ее месте
4. Поражение более 3 зон лимфатических узлов
5. Смешанноклеточный или ретикулярный (лимфоидное
истощение) варианты лимфогранулематоза
Принципы оценки риска течения заболевания
• Группа больных с благоприятным прогнозом:
больные с IA и IIA без факторов риска.
•Группа больных с промежуточным прогнозом:
а) больные с I А и I Б стадиями и факторами риска 3,4,5*;
б) больные со IIА стадией и факторами риска 3–5*;
в) больные со IIБ стадией и факторами риска 4,5*;
г) больные с IIIА стадией без факторов риска.

• Группа больных с неблагоприятным прогнозом:
а) больные с I А и В и IIА стадиями и факторами риска 1,2*;
б) больные со IIБ стадией и факторами риска 1,2,3*;
в) больные с IIIА стадией и факторами риска 1–5*;
г) все больные с III Б и IV стадиями.
* Для включения больного в группу достаточно наличия одного из
указанных факторов риска.
Этапы лечения лимфогранулематоза
1. Индукция — этап введения больного в ремиссию, в
результате которого исчезают увеличенные
лимфатические узлы, исчезают симптомы интоксикации
2. Консолидация — этап проведения курсов лучевой и
химиотерапии для получения стойкой ремиссии
Основные методы лечения
лимфогранулематоза
лучевая терапия
химиотерапия
лучевая терапия + химиотерапия
Лучевая терапия в чистом виде используется
при лечении локальных поражений I-IIА стадий с
благоприятным прогнозом.
Применяется лучевая терапия на очаги в
суммарной дозе 40 грей и облучения смежных зон
в дозе до 36 грей.

Химиотерапия. Схемы I ряда (линии) для лечения
ЛГМ:
1. МОРР — эмбихин (мустарген) + онковин (винкристин) +
прокарбозин (натулан) + преднизолон
2. МVРР — аналогична МОРР, но вместо онковина используется
винбластин
3. СОРР — аналогична МОРР, но вместо мустаргена
используется циклофосфан
4. СУРР — аналогично МVРР с заменой мустаргена на
циклофосфан
5. АВVD — адриамицин (доксорубомицин) + блеомицин +
винбластин, ДТНК (дакарбазин)
6. ДВСV — даунорубицин (рубомицин) + блеомицин +
винкристин + цитостазан
Приблизительные дозы препаратов в различных схемах терапии
СХЕМА СОРР.
ЦИТОСТАТИКДЕНЬ
ДОЗА
Циклофосфамид
Винкристин
Прокарбазин
1, 8
1, 8
с 1 по 15-й
Преднизолон
с 1 по 15-й
500 мг/м2, в/в.
1,5 мг/м2, в/в.
100 мг/м2, в/в, внутрь, в
2-3 приема.
40 мг/м2, в/в, внутрь, в 3
приема.
СХЕМА ОРРА.
ЦИТОСТАТИК
ДЕНЬ
ДОЗА
Адриамицин
Винкристин (онковин)
Прокарбазин
1, 15
1, 8, 15
с 1 по 15-й
Преднизолон
с 1 по 15-й
40 мг/м2, в/в, 30 мин.

1,5 мг/м2, в/в, струйно.
100 мг/м2, в/в, внутрь,в 23 приема.
60 мг/м2, в/в, внутрь,в 3
приема.
Приблизительные дозы препаратов в различных схемах терапии
СХЕМА ABVD.
ЦИТОСТАТИКДЕНЬ
Адриамицин
(доксорубицин) 1-й и 14-й дни
Блеомицин
1-й и 14-й день
Винбластин
1-й и 14-й дни
ДТИК
(дакарбазин)
или
1, 2, 3, 4, 5 дни
1-й и14-й дни
Перерыв между курсами 2 недели.
ДОЗА
25 мг/м2 внутривенно
10 мг/м2 внутривенно
или внутримышечно
6 мг/м2 внутривенно
150 мг/м2 внутривенно
375мг/м2.
При проведении химиотерапии необходимо циклы
проводить до достижения полной ремиссии
(исчезновения лимфоузлов),
а затем еще минимум 2 курса
химиотерапии в качестве консолидирующей
терапии.
Обобщенные программы лечение ЛГМ в зависимости
от стадии заболевания
I-IIА
стадии с благоприятным прогнозом
2 цикла полихимиотерапии I ряда
+
облучение зон
поражения в дозе до 40 грей + 2 цикла полихимиотерапии I ряда.
I-II стадии с неблагоприятным прогнозом
зоны
3 курса полихимиотерапии I ряда (СОРР) + лучевая терапия на
поражения + 3 курса полихимиотерапии I ряда (СОРР)
III– стадия с благоприятным прогнозом
4 курса полихимиотерапии I ряда (СОРР) + лучевая терапия на
зоны поражения выше диафрагмы + 2 курса полихимиотерапии I ряда
(СОРР)
+ лучевая терапия на зоны поражения ниже диафрагмы + 4
курса полихимиотерапии I ряда (СОРР)
III– стадия с неблагоприятным прогнозом
6 курсов полихимиотерапии I ряда (СОРР) + лучевая
терапия на зоны
поражения выше диафрагмы + 2 курса
полихимиотерапии I ряда (СОРР)
+ лучевая терапия на зоны
поражения ниже диафрагмы + 6-8 курсов
полихимиотерапии I ряда
(СОРР)
IV стадии — лучевая терапия на манифестирующие очаги + 2 курса
консолидирующей химотерапии I ряда
При ЛГМ ремиссии удается достичь у 80-90% первичных
больных. Однако, в 10-40% у больных возникают рецидивы
заболевания.

Рецидивы в зависимости от времени возникновения:
1. ранние, т.е. возникшие в сроки до 2 лет
2. поздние, т.е., возникшие в сроки после 2 лет от момента
возникновения ремиссии.
Рецидивы разделяют по отношению к бывшим очагам
поражения:
1. Истинные рецидивы в зоне, подвергшейся облучению
или случаи возобновления роста в очагах,
регистрировавшихся до начала лечения
(полихимиотерапии)
2. Маргинальные — рецидивные очаги, возникшие по краю
поля облучения вне зон облучения
Лечение рецидивов ЛГМ.
У больных с поздними рецидивами как правило, используются
схемы эффективные при достижении первой ремиссии.
Трудность представляет лечение больных с ранними
рецидивами или больные, у которых не была достигнута
полная ремиссия при первичном лечении.
При наличии маргинального рецидива у больного I-II стадией
и благоприятных прогностических факторах возможно
дополнительное облучение в обычной зоне 40-45 грей.
 Во
Вовсех остальных случаях показана смена схем цик-лов
химиотерапии. Сначала это переход внутри схем I ряда
МVРР=АВVД=ДВVСу, а при неэффективности переход на
схемы II линии (ряда).
Химиотерапия. Схемы II ряда (линии) для лечения
рецидивов ЛГМ:
1. МОРР (АВV — «сэндвич») — схема МОРР чередуется со
схемой АВVД с исключением ДТНК
2. ССАВО — ССNU (ломустин) + адриабластин + винбластин +
блеомицин
3. ССVР — ССNU (ломустин) + винбластин + прокарбозин +
преднизолон
4. СЕР — ССNU (ломустин) + этопозид + преднемустин
5. МАВОР — мусторген + адриабластин + блеомицин +
винкристин + преднизолон
Прогноз.
Наибольшее значение в прогнозе имеет стадия
заболевания.
У пациентов с 4 стадией заболевания отмечается 75%
5 летняя выживаемость,
У пациентов с 1-2 стадией — 95%.
Тактика поведения врача поликлиники
1. Поиск увеличенных лимфатических узлов у каждого пациента.
2. В случае увеличения л/у – обязательное проведение пункции.

— обязательная госпитализация пациента
для выяснения причины увеличения л/у.
3. У пациентов с установленным диагнозом ЛГМ – регулярное
обследование и контроль показателей биологической активности
заболевания 1 раз в 4 месяца.
4. Наблюдение у гематолога-онколога в случае длительной
стабильной ремиссии 1 раз в 6 месяцев.
Реабилитация больных с ЛГМ осуществляется
в 4 этапа:
1 этап — активное лучевое и комбинированное
лечение
2 этап — противоопухолевое лечение и лечение
осложнений
3 этап — социальная, бытовая и профессиональная
реадаптация после достижения полной ремиссии
4 этап — полное восстановление социального и
профессионального статуса
45. Интерактивные вопросы
1. Субстратом болезни Ходжкина являетсяклетка
1. Березовского-Штенберга-Рида
2. Аддиса-Коковского
3. Клетка Ходжкина
46. Интерактивные вопросы
2. Какая стадия является начальной втечении ЛГМ
1.

2.
3.
4.
Лимфогистиоцитарная
Стадия нодулярного склероза
Стадия Смешанно-клеточная
Стадия Лимфоидного истощения
47. Интерактивные вопросы
3. Если у пациента изменены 3 группылимфоузлов с одной стороны
диафрагмы, и имеется ночная
потливость, то это какая стадия ЛГМ
1.
2.
3.
4.
II А
IБ
III Б
II Б
48. Случай из практики
• Пациентка 33 лет наблюдался в гематологическом центре.• После проведенного курса комбинированного лечения по
поводу лимфогранулематоза. Цикл был завершен 1,5 года
назад, когда был выставлен диагноз: лимфогранулематоз,
склеронодулярный вариант, изолированная периферическая
хроническая форма 1а ст , с поражением подмышечных
лимфатических узлов слева, после комбинированного лечения,
неактивная фаза , ремиссия.
• Больная обследована в связи с появлением увеличенных
лимфатических узлов подмышечной области слева.
• В анализе крови: СОЭ 54 мм\ч, гаптоглобин 2,3 г\л,
церулоплазмин 290 ед\л, альфа2- глобулин 24 г\л, фибриноген
7 г\л.

49. Литература
1. Абдулкадыров К.М. с соавт. Гематологические синдромы в общей клинической практике //«Элби», Санкт-Петербург.-1999.-С.83-94
2. Гематологические синдромы в клинической практике, под редакцией Вягорской Я.И., Киев
«Здорье» 1981 од
3. Воробьёв А.И. Руководство по гематологии.// «Ньюдиамед», Москва.-2003.-Т1.
4. Вуд М.Э., Банн П.А. Секреты гематологии и онкологии// «Бином»- Москва.-2001.-С.85-93.
5. Гусева С.А., Вознюк В.П. Болезни системы крови. Справочник. // «МЕДпресс-информ».-Москва.2004.-С.317-356.
6. Внутренние болезни под редакцией Рябва С.И., Алмазова В.А., Шляхто Е.В., Санкт-Петербург,
СпецЛит, 2000 год
7. Клиническая онкогематология, под редакцией Волковой М.А., Москва, «Медицина,» 2001 год
8. Шиффман Ф.Д. Патофизиология крови. // «Бином».-Москва.-2000.-С.71-123, 343-358
9. М.Вецлер, К.Блумфильд МИЕЛОИДНЫЕ ЛЕЙКОЗЫ. From Harrison’s Principles of Internal
Medicine. 14-th edition,2002.
10.
 Г.И. Абелев. Механизмы дифференцировки и опухолевый рост. Биохимия, 2000, 65, 127- 138
Г.И. Абелев. Механизмы дифференцировки и опухолевый рост. Биохимия, 2000, 65, 127- 13811. Болезни крови, «издательство энциклопедия», Москва, 2005 год
12. Диагностика и лечение ДВС крови, Лычев В.Г., москва, «медицина» 1993 год
13. Диагностика и контролируемая терапия нарушений гемостаза, Баркаган З.С., Момот А.П.,
«Ньюдиамед», москва 2001 год
14. Актуальный гемостаз , Воробьев П.А., «Ньюдиамед», москва 2004 год
Страница не найдена |
Страница не найдена |404. Страница не найдена
Архив за месяц
ПнВтСрЧтПтСбВс
21222324252627
28
12
12
1
3031
12
15161718192021
25262728293031
123
45678910
12
17181920212223
31
2728293031
1
1234
567891011
12
891011121314
11121314151617
28293031
1234
12
12345
6789101112
567891011
12131415161718
19202122232425
3456789
17181920212223
24252627282930
12345
13141516171819
20212223242526
2728293031
15161718192021
22232425262728
2930
Архивы
Мар
Апр
Май
Июн
Июл
Авг
Сен
Окт
Ноя
Дек
Метки
Настройки
для слабовидящих
Кафедра онкологии
|
Заведующий кафедрой Владислав Владимирович Семиглазов, доктор медицинских наук, доцент |
Контактная информация:
Тел. : 4399555 доб. 1323, 1309
: 4399555 доб. 1323, 1309
4399503
E-mail: [email protected]
Ответственные
- за учебную работу: доцент Виктор Владимирович Корхов 8-931-256-87-52
- за научную работу: профессор Василий Николаевич Клименко 8-921-793-50-83
- за лечебную работу: профессор Владислав Андреевич Тришкин 8-921-335-13-82
Кафедра расположена на базе НИИ онкологии им. Н.Н. Петрова
197758, ул.Ленинградская 68, пос. Песочный-2, Санкт-Петербург
История кафедры
Кафедра онкологии Санкт-Петербургского государственного медицинского университета им. акад. И.П.Павлова была основана 31 августа 1976 года и сформирована из воспитанников 1 ЛМИ. Решение об использовании научного потенциала Института онкологии для педагогического процесса принято на совместной встрече ректора 1 ЛМИ В.А. Миняева и директора НИИ онкологии Н.П. Напалкова.
Министр Здравоохранения СССР академик Б. В. Петровский, посетив кафедру 11 ноября 1978 года, с одобрением отметил перспективность расположения кафедры ВУЗа на базе профильного НИИ с единым руководством, обеспечивающим создание учебно-научно-лечебной структуры.
В. Петровский, посетив кафедру 11 ноября 1978 года, с одобрением отметил перспективность расположения кафедры ВУЗа на базе профильного НИИ с единым руководством, обеспечивающим создание учебно-научно-лечебной структуры.
Заведующим кафедрой был назначен руководитель отделения общей онкологии НИИ онкологии им. проф. Н.Н.Петрова В.И.Столяров. В 1997 г заведующим кафедрой избран профессор О.Н.Волков, а с 2005 г по настоящее время заведующим кафедрой является д.м.н. В.В.Семиглазов.
С момента организации кафедра онкологии базируется в НИИ онкологии им. Н.Н.Петрова. Институт онкологии состоит из 13 клинических подразделений (405 коек), экспериментальных лабораторий, радиологического комплекса и научно-поликлиннического отдела (около 400 ежедневных посещений больных). Научно-практическая направленность деятельности Института онкологии создает реальные возможности изучения клиники, диагностики и лечения основных локализаций злокачественных опухолей.
Цели и задачи кафедры, направления деятельности
Приоритетными направлениями деятельности кафедры остаются учебная, научная и лечебная работа.
В процессе преподавания онкологии на старших курсах детализируются организация онкологической помощи населению, тактика врача общей практики при подозрении на злокачественное новообразование, скрининговые исследования, современные проблемы диагностики, успехи в лечении, комбинированные и комплексные программы, паллиативная помощь, принципы диспансеризации онкологических больных, социально-трудовая реабилитация и медико-санитарная экспертиза. Акцент все же ставится на изучение ранней диагностики, от которой, в конечном счете, зависит успех лечения. К сожалению, ошибки в диагностике на уровне поликлинического звена встречаются достаточно часто, что связано с низким уровнем онкологической настороженности и недостаточным знанием ранних симптомов злокачественных опухолей. В связи с этим общение с пациентами и практическая работа предусмотрены на всех этапах занятий при диагностических и лечебных манипуляциях в поликлинике, приемном покое и в стационаре.
Сотрудники кафедры участвуют в научно-исследовательской работе Института онкологии и имеют возможность представлять результаты исследований на конференциях, симпозиумах, съездах и публиковать в открытой печати.
Лечебная работа ведется в клинических подразделениях НИИ онкологии им. Н.Н.Петрова и в медицинских учреждениях города. При участии сотрудников кафедры разрабатываются и внедряются высокотехнологические методы диагностики и лечения злокачественных новообразований:
- маммографическая визуализация и биопсия непальпируемых опухолей;
- идентификация сторожевых лимфатических узлов;
- видеоторакоскопический плевродез;
- регионарная гипертермическая химиоперфузия;
- радиочастотная деструкция метастазов.
Содержание дисциплины, учебные программы
Учебно-методическая работа проводится на VI курсе лечебного факультета, факультета спортивной медицины и факультета иностранных студентов в соответствии с требованиями ФГОСа, БРС, учебного плана и программы по онкологии для студентов высших учебных заведений. Основные положения этих документов учтены при составлении Рабочей программы кафедры.
Форма обучения – цикловая очная. Аудиторные занятия составляют 72 часа, самостоятельная работа 24 часа. Около 25% учебного времени уделяется амбулаторному компоненту занятий.
Теоретический курс состоит из 11 клинических занятий, которые ориентированы на принципы профилактики, ранней диагностики и комбинированного лечения социально значимых опухолей основных локализаций. Цикл завершается зачетом.
Темы клинических занятий
1. Организация онкологической службы в стране, амбулаторная онкология. Заболеваемость и смертность от злокачественных новообразований. Возрастно-половые показатели. Региональные особенности распространения злокачественных новообразований. Факторы, способствующие возникновению опухолей. Значение питания, курения, алкоголя, эндокринных нарушений, вирусов, радиоактивного и ультразвукового излучения, наследственности. Характеристика химических канцерогенов, экологические аспекты циркуляции канцерогенов во внешней среде. Социально-гигиенические и индивидуальные меры профилактики злокачественных опухолей.
Социально-гигиенические и индивидуальные меры профилактики злокачественных опухолей.
Динамика показателей излечения онкологических больных. Современные достижения в онкологии. Структура онкологической службы. Онкологический кабинет, диспансер, институт. Диагностические центры. Общая характеристика состояния онкологической помощи. Клинические группы. Диспансеризация. Учетная документация. Анализ причин запущенности. Понятие о расхождениях с ЗАГСом. Паллиативная помощь онкологическим больным. Хосписы.
2. Современные принципы профилактики и диагностики и лечения новообразований. Понятия о первичной и вторичной профилактике рака. Выявление рака в доклиническом периоде. Скрининг. Значение профилактических осмотров. Формирование групп повышенного риска. Оценка жалоб и анамнеза. Сигналы тревоги. Особенности объективного обследования при подозрении на злокачественную опухоль. Рентгенологические, эндоскопические, изотопные, ультразвуковые методы. Компьютерная, магнитно-резонансная и позитроно-эмиссионная томография. Изменения периферической крови, биохимические и иммунологические исследования. Опухолевые маркеры. Роль морфологического метода. Обязательный клинический минимум обследования в амбулаторных условиях.
Изменения периферической крови, биохимические и иммунологические исследования. Опухолевые маркеры. Роль морфологического метода. Обязательный клинический минимум обследования в амбулаторных условиях.
Методы лечения злокачественных опухолей. Роль лучевой терапии. Классификация методов лечения. Принципы хирургического лечения. Абластика и антибластика, анатомическая зональность и футлярность. Понятия об операбельности и резектабельности. Радикальные и паллиативные операции. Роль лучевой терапии. Методы лучевой терапии злокачественных опухолей. Радиочувствительные и радиорезистентные опухоли. Дозы и режимы облучения. Радикальная, паллиативная и симптоматическая лучевая терапия. Лучевые реакции и осложнения. Способы повышения радиочувствительности. Классификация противоопухолевых лекарственных препаратов. Механизм действия. Чувствительность злокачественных опухолей к химиотерапевтическим препаратам. Методы введения. Побочные действия. Противопоказания к химиотерапии. Адъювантная и неоадъювантная химиотерапия. Комбинированное и комплексное лечение. Непосредственные и отдаленные результаты.
Комбинированное и комплексное лечение. Непосредственные и отдаленные результаты.
3. Опухоли головы и шеи.
Рак нижней губы. Заболеваемость. Облигатный и факультативный предрак. Формы роста, гистологическое строение, пути метастазирования. Принципы диагностики и лечения. Результаты.
Рак языка и слизистой полости рта. Заболеваемость. Способствующие факторы. Формы роста, пути метастазирования. Стадии. Гистологическое строение. Особенности клинического течения. Принципы диагностики и лечения. Результаты.
Рак щитовидной железы. Заболеваемость. Способствующие факторы. Профилактика рака. Патологоанатомическая характеристика, пути метастазирования. Клиническая картина, методы диагностики, принципы лечения, результаты. Диспансеризация больных.
4. Рак легкого. Заболеваемость и смертность. Возрастно-половые особенности. Способствующие факторы. Профилактика. Патологоанатомическая характеристика. Формы роста. Понятие о центральном и периферическом раке.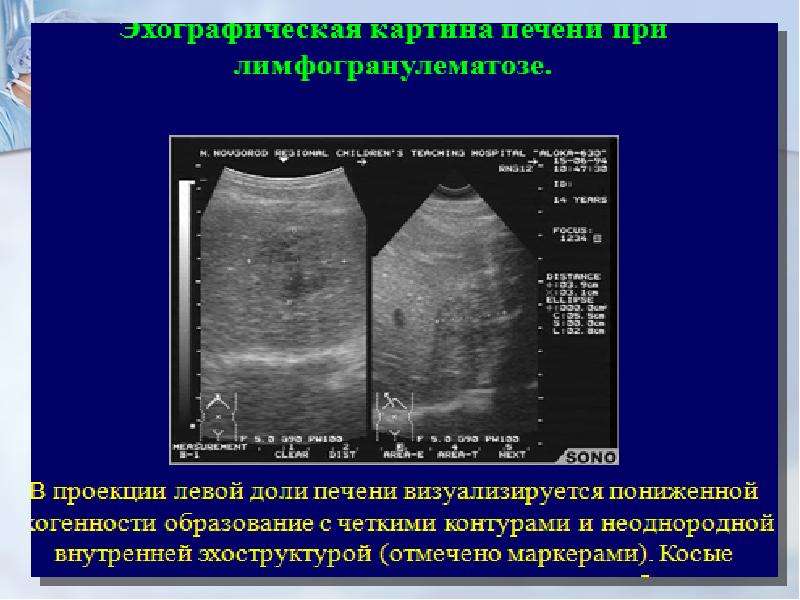 Гистологическое строение. Закономерности метастазирования. Стадии. Симптоматика рака легкого. Клинические варианты центрального и периферического рака. Оценка данных анамнеза и физикального обследования. Цитологическое исследование мокроты. Основные рентгенологические симптомы. Признаки ателектаза. Система дообследования при подозрении на рак легкого. Значение томографии и бронхоскопии. Трансторакальная пункция. Раннее выявление, значение флюорографии. Организация скрининга. Группы повышенного риска. Дифференциальная диагностика рака легкого. Общие принципы лечения. Выбор хирургического, лучевого или лекарственного лечения в зависимости от локализации, гистологического строения и степени распространения новообразования. Комбинированное и комплексное лечение. Непосредственные и отдаленные результаты.
Гистологическое строение. Закономерности метастазирования. Стадии. Симптоматика рака легкого. Клинические варианты центрального и периферического рака. Оценка данных анамнеза и физикального обследования. Цитологическое исследование мокроты. Основные рентгенологические симптомы. Признаки ателектаза. Система дообследования при подозрении на рак легкого. Значение томографии и бронхоскопии. Трансторакальная пункция. Раннее выявление, значение флюорографии. Организация скрининга. Группы повышенного риска. Дифференциальная диагностика рака легкого. Общие принципы лечения. Выбор хирургического, лучевого или лекарственного лечения в зависимости от локализации, гистологического строения и степени распространения новообразования. Комбинированное и комплексное лечение. Непосредственные и отдаленные результаты.
5. Рак молочной железы. Факторы риска, гормональные нарушения. Дисгормональные гиперплазии. Этиопатогенез. Классификация. Локализованные и диффузные формы. Клиническая картина.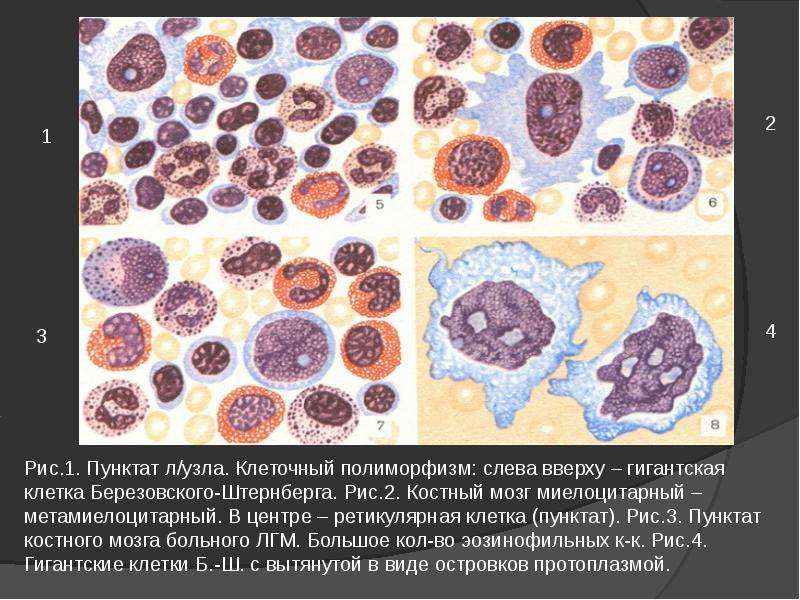 Лечение локализованных форм. Техника секторальной резекции молочной железы. Принципы негормональной и гормональной терапии диффузных форм. Диспансерное наблюдение. Профилактика рака молочной железы. Патологоанатомическая характеристика, особенности метастазирования. Деление на стадии. Этиопатогенетические формы. Клиника типичной (узловой) формы. Дифференциальный диагноз с фиброаденомой. Отечно-инфильтративная, маститоподобная, рожеподобная, панцирная формы, рак Педжета. Дифференциальный диагноз. Обследование больных. Пальпация молочных желез и лимфатических узлов. Маммография, эхография, пункция, секторальная резекция. Скрининг рака молочной железы. Методика самообследования. Профилактические осмотры, разрешающие возможности маммографии. Роль смотровых кабинетов. Принципы лечения рака молочной железы. Радикальные операции. Экономные и расширенные операции. Показания к комбинированному и комплексному лечению. Значения неоадъювантной и адъювантной лучевой и химиотерапии. Принципы лечения инфильтративных форм.
Лечение локализованных форм. Техника секторальной резекции молочной железы. Принципы негормональной и гормональной терапии диффузных форм. Диспансерное наблюдение. Профилактика рака молочной железы. Патологоанатомическая характеристика, особенности метастазирования. Деление на стадии. Этиопатогенетические формы. Клиника типичной (узловой) формы. Дифференциальный диагноз с фиброаденомой. Отечно-инфильтративная, маститоподобная, рожеподобная, панцирная формы, рак Педжета. Дифференциальный диагноз. Обследование больных. Пальпация молочных желез и лимфатических узлов. Маммография, эхография, пункция, секторальная резекция. Скрининг рака молочной железы. Методика самообследования. Профилактические осмотры, разрешающие возможности маммографии. Роль смотровых кабинетов. Принципы лечения рака молочной железы. Радикальные операции. Экономные и расширенные операции. Показания к комбинированному и комплексному лечению. Значения неоадъювантной и адъювантной лучевой и химиотерапии. Принципы лечения инфильтративных форм. Отдаленные результаты. Диспансеризация, реабилитация и экспертиза трудоспособности.
Отдаленные результаты. Диспансеризация, реабилитация и экспертиза трудоспособности.
6. Рак пищевода. Эпидемиология. Особенности распространения. Способствующие факторы. Меры профилактики. Локализация, формы роста, гистологическое строение, метастазирование, стадии. Клиническая картина, патогенез клинических симптомов. Рентгенологическое и эндоскопическое исследования. Дифференциальная диагностика. Лечение. Роль отечественных ученых в развитии хирургии рака пищевода. Радикальное и паллиативное хирургическое лечение. Лучевая терапия. Комбинированный метод. Симптоматическая терапия. Результаты лечения.
7. Рак толстой кишки. Рак ободочной кишки. Заболеваемость. Значение питания. Предраковые заболевания. Меры профилактики. Локализация, формы роста, гистологическое строение, закономерности метастазирования. Стадии. Клиническая картина. Симптомы рака правой и левой половины ободочной кишки. Клинические варианты. Диагностика. Значение рентгенологического и эндоскопического исследований. Раннее распознавание. Гемокульттест. Дифференциальный диагноз. Тактика лечения. Объем хирургического вмешательства в зависимости от локализации опухоли. Особенности лечения рака, осложненного кишечной непроходимостью. Паллиативные операции. Показания к лекарственному лечению Комбинированный метод. Результаты.
Раннее распознавание. Гемокульттест. Дифференциальный диагноз. Тактика лечения. Объем хирургического вмешательства в зависимости от локализации опухоли. Особенности лечения рака, осложненного кишечной непроходимостью. Паллиативные операции. Показания к лекарственному лечению Комбинированный метод. Результаты.
Рак прямой кишки. Заболеваемость. Способствующие факторы. Формы роста, гистологическое строение, закономерности метастазирования, деление на стадии. Клиническая картина в зависимости от локализации и формы роста опухоли. Диагностика. Клинический минимум обследования, пальцевое исследование, ректороманоскопия, ирригоскопия. Дифференциальный диагноз при кровотечении из прямой кишки (геморрой, полип, трещина, дизентерия). Лечение. Виды операции в зависимости от локализации и степени распространения опухолей. Радикальные и паллиативные вмешательства. Ведение больных с противоестественным задним проходом. Значение лучевой и химиотерапии. Комбинированный метод. Результаты лечения. Реабилитация.
Реабилитация.
8. Онкогинекология. Опухоли яичников. Классификация злокачественных опухолей. Группы риска. Особенности течения и закономерности метастазирования. Методы обследования. Дифференциальная диагностика. Хирургическое, лекарственное, лучевое и комплексное лечение. Выбор метода лечения в зависимости от стадии заболевания. Лечение запущенных форм.
Рак тела и шейки матки. Рак тела матки. Динамика заболеваемости. Классификация. Закономерности метастазирования. Симптоматология в зависимости от патогенетических вариантов. Методы диагностики. Диагностическое выскабливание, гистероскопия и –графия, ультразвуковое исследование. Дифференциальная диагностика. Хирургическое, гормональное и лучевое лечение. Комбинированный метод. Результаты. Врачебно-трудовая экспертиза и реабилитация. Рак и беременность.
Рак шейки матки. Эпителиальные дисплазии. Классификация. Клинические проявления. Методы лечения. Значение для профилактики рака. Динамика заболеваемости рака шейки матки. Стадии, пути метастазирования. Симптоматология. Меры ликвидации запущенных форм. Скрининг, его значение. Организация работы смотрового кабинета. Кольпоскопическое и цитологическое исследования. Показания к лучевому, хирургическому и комбинированному лечению. Результаты лечения. Диспансерное наблюдение. Врачебно-трудовая экспертиза и реабилитация.
Стадии, пути метастазирования. Симптоматология. Меры ликвидации запущенных форм. Скрининг, его значение. Организация работы смотрового кабинета. Кольпоскопическое и цитологическое исследования. Показания к лучевому, хирургическому и комбинированному лечению. Результаты лечения. Диспансерное наблюдение. Врачебно-трудовая экспертиза и реабилитация.
9. Рак кожи, меланома. Рак кожи. Заболеваемость. Способствующие факторы. Факультативный и облигатный предрак. Меры профилактики. Базалиома, плоскоклеточный рак. Особенности распространения. Стадии. Клинические варианты. Методика обследования. Принципы лечения (лучевое, хирургическое, лекарственное, криогенное). Непосредственные и отдаленные результаты.
Меланома. Эпидемиология. Факторы, способствующие озлокачествлению пигментных невусов. Меры профилактики. Особенности роста и метастазирования. Принципы стадирования. Клиническая характеристика. Методы обследования больных. Лечение. Результаты.
10. Саркомы мягких тканей и костей. Саркомы мягких тканей. Заболеваемость. Патологоанатомическая характеристика. Локализация, метастазирование. Клиническая картина. Методы диагностики. Рентгенологическое исследование, УЗИ, компьютерная томография, магнитный резонанс, морфологический метод. Дифференциальный диагноз. Лечение. Отдаленные результаты.
Саркомы мягких тканей. Заболеваемость. Патологоанатомическая характеристика. Локализация, метастазирование. Клиническая картина. Методы диагностики. Рентгенологическое исследование, УЗИ, компьютерная томография, магнитный резонанс, морфологический метод. Дифференциальный диагноз. Лечение. Отдаленные результаты.
Саркомы костей. Классификация. Заболеваемость. Патологоанатомическая характеристика. Остеогенная саркома, хондросаркома, саркома Юинга, метастатические изменения. Клиническая картина. Диагностика. Основные рентгенологические симптомы. Сцинтиграфия. Значение морфологического метода. Хирургическое, лучевое, комбинированное и комплексное лечение. Сохранные операции. Результаты лечения. Диспансеризация и реабилитация.
11. Лимфопролиферативные заболевания.
Лимфогранулематоз. Заболеваемость. Современные представления об этиологии и патогенезе. Гистологическая классификация лимфогранулематоза. Стадии. Клиника. Признаки интоксикации. Прогностическое значение. Методы диагностики и лечения.
Неходжкинские лимфомы. Классификация. Клиническая картина при поражении лимфатических узлов и внутренних органов, дифференциальный диагноз. Значение морфологического исследования. Техника биопсий. Объем обследования для оценки степени распространения процесса. Выбор метода лечения. Результаты, прогноз. Экспертиза трудоспособности, реабилитация.
12. Зачет.
Самостоятельная работа студентов
- в аудитории (изучение методических разработок, решение ситуационных задач и тестов, участие в элективном цикле)
- вне аудитории –а) теоретическая (изучение обязательной и дополнительной литературы, учебно-методических изданий, подготовка рефератов, презентаций, лекций и сообщений, использование компьютерных технологий, работа в СНО кафедры), б) практическая (участие в приеме больных, в обходах, клинических разборах и обсуждениях, в дежурствах, заполнении медицинской документации, в неинвазивных методах обследования)
- на базе кафедры в НИИ онкологии им.
 Н.Н.Петрова (отечественная школа онкологов и семинары с заведующими клинических отделений и экспериментальных лабораторий)
Н.Н.Петрова (отечественная школа онкологов и семинары с заведующими клинических отделений и экспериментальных лабораторий)
Работа СНО кафедры
СНО на кафедре онкологии организовано в 1976 г. Ежегодно в СНО занимается 6- 10 человек, преимущественно студенты старших курсов. Заседания СНО проводятся 1 раз в 1,5- 2 месяца на базе кафедры в НИИ онкологии им. Н.Н.Петрова.
Тематика работ студентов
- Система онкологической службы и противораковой борьбы
- Современные методы клинико-инструментальной диагностики опухолей;
- Комбинированное и комплексное лечение злокачественных новообразований;
- Реабилитация и качество жизни онкологических больных;
- Проблемы канцерогенеза.
На заседаниях СНО помимо обсуждения научных сообщений, проводится клинический разбор больных, демонстрация отдельных наблюдений. Студенты СНО кафедры являются постоянными участниками общеуниверситетских и международных научных конференций, посещают заседания научного общества онкологов С. -Петербурга и области и конференции отечественной школы онкологов.
-Петербурга и области и конференции отечественной школы онкологов.
Рекомендуемая литература
- Онкология : национальное руководство / Под ред. Чиссова В.И., Давыдова М.И. 2013. — 1072 с.: ил. (ЭБС Консультант врача, Консультант студента)
- Онкология. Национальное руководство. Краткое издание / Под ред. В. И. Чиссова, М. И. Давыдова. — М. : ГЭОТАР-Медиа, 2014. — 576 с. (ЭБС Консультант врача, Консультант студента)
- Амбулаторно-поликлиническая онкология: руководство. Ганцев Ш.Х., Старинский В.В., Рахматуллина И.Р. и др. 2012. — 448 с.: ил. (Серия «Библиотека врача-специалиста») (ЭБС Консультант врача, Консультант студента)
- Клиническая онкология. Избранные лекции : учебное пособие. — М. : ГЭОТАР-Медиа, 2014. — 496 с. : ил. (Консультант студента)
Дополнительная литература
- Справочник по онкологии : [руководство] / пер. с англ. В. Ю. Халатова; под ред. В.
 А. Горбуновой ; под ред. Д. Кэссиди [и др.]. — М. : ГЭОТАР-Медиа, 2010. — 510 с.
А. Горбуновой ; под ред. Д. Кэссиди [и др.]. — М. : ГЭОТАР-Медиа, 2010. — 510 с. - Детская онкология. Национальное руководство / [М. Д. Алиев, В. Н. Байкова, А. Ю. Барышников и др.] ; под ред. М. Д. Алиева [и др.] ; ФГБУ «РОНЦ им. Н. Н. Блохина» РАМН, НИИ детской онкологии и гематологии. — М. : Изд. группа РОНЦ ; М. : Практическая медицина, 2012. — 681 с. : ил.
- Лимфомы у детей : руководство / [А. Ю. Барышников и др.] ; под ред. Г. Л. Менткевича, С. А. Маяковой ; НИИ дет. онкологии и гематологии ФГБУ «РОНЦ им. Н. Н. Блохина» РАМН. — М. : Практическая медицина, 2014. — 238 с – 2 экз.
- Методы визуализации в онкологии. Стандарты описания опухолей : цветной атлас / Х. Хричак, Д. Хасбэнд, Д. М. Паничек. — М. : Практическая медицина, 2014. — 286 с. : ил.
- Лучевая терапия в онкологии : [руководство] / Э. К. Хансен, М. Роач III ; пер. с англ. под ред. А. В. Черниченко. — М. : ГЭОТАР-Медиа, 2014. — 986 с.
Журналы
1. Вопросы онкологии
Вопросы онкологии
Доступность электронных фондов учебно-методической документации
| №п/п | Ссылка на информационный ресурс | Наименованиеразработки в электронной форме | Доступность |
| 1 | http://www.clinicalkey.com/ | Clinicalkey | Доступ по IP адресам, по паролю |
| 2 | 1spbgmu.ru | Электронно-библиотечная система (ЭБС) «Консультант студента. Электронная библиотека Вуза» | Доступ по IP адресам, по паролю |
| 3 | www.scopus.com | Scopus — реферативная база данных. | Доступ по IP адресам, по паролю |
Электронные источники информации
www. geotar.ru
geotar.ru
http://www.rosoncoweb.ru
http://oncology.ru/
http://www.consilium-medicum.com/media/onkology/
http://www.esmo.ru/
http://www.niioncologii.ru/
http://www.ncbi.nlm.nih.gov/pubmed/
http://www.asco.org/
http://www.esmo.org/
Последипломная подготовка
Повышение квалификации в рамках непрерывного медицинского образования по специальности «Онкология», «Терапия», «Общая врачебная практика (семейная медицина)», «Хирургия» : «Аэрозольная внутрибрюшинная химиотерапия в лечении перитонеального канцероматоза» -36 часов.
Клиническая ординатура и аспирантура по специальности 14.01.12 – онкология.
Циклы профессиональной переподготовки не проводятся.
Научная деятельность
-
органосохраняющая и пластическая хирургия;
-
диагностика и лечение опухолей мягких тканей и костей;
-
диагностика и лечение неинвазивных и минимальных инвазивных форм рака молочной железы;
-
диагностика и лечение опухолей органов грудной полости (видеоторакоскопия, фотодинамическая и лазеротерапия).

Проблема комбинированного лечения и медицинской реабилитации больных саркомами мягких тканей остается одним из основных направлений научной работы кафедры. В последние годы в эту тематику включена разработка комбинированного лечения и органосохраняющих операций при опухолях костей. Сформулирована современная концепция лечения (операция + облучение) злокачественных опухолей мягких тканей и костей. Неоадъювантная лучевая терапия позволила избежать ампутации конечностей в 15% случаев и увеличить выживаемость больных, подвергшихся комбинированному методу в сравнении с хирургическим лечением (72.5% vs 56.8%). Частота осложнений была идентична, а характер однотипен в обеих группах больных. В настоящее время проводится изучение эффективности изолированной регионарной химиоперфузии с гипертермией при местно-распространенных опухолях конечностей. Наряду с рутинными видами костной пластики с использованием ауто- и гомотрансплантата, начала применяться методика эндопротезирования. Тем не менее, ампутации конечностей выполняются все еще достаточно часто. В связи с этим, особую актуальность приобретает медицинская реабилитация больных. Совместно с Институтом протезирования был разработан протез оригинальной конструкции специально для больных, перенесших гемипельвэктомию. Аналогов такого протеза в мире нет.
Тем не менее, ампутации конечностей выполняются все еще достаточно часто. В связи с этим, особую актуальность приобретает медицинская реабилитация больных. Совместно с Институтом протезирования был разработан протез оригинальной конструкции специально для больных, перенесших гемипельвэктомию. Аналогов такого протеза в мире нет.
Научные изыскания по проблеме рака молочной железы ведутся в двух направлениях. Первое — программа ранней (доклинической) диагностики и лечения непальпируемых форм и рака in situ. Разработан и внедрен алгоритм диагностических мероприятий при подозрении на опухоль молочной железы, предусматривающий выполнение стереотаксической биопсии под контролем лучевых методов диагностики. На основании проведенного исследования детализированы принципы органосохраняющих вмешательств, лучевой терапии и системного лечения больных раком in situ молочной железы.
Второе направление обеспечило обоснование комбинированного и комплексного лечения местно-распространенных и метастатических форм рака молочной железы T4N0-3M0-1. Наряду с хирургическим лечением и системной терапией цитостатиками и таргетными препаратами в этом исследовании проводилась радиочастотная абляция единичных отдаленных метастазов в печени и получены обнадеживающие результаты.
Наряду с хирургическим лечением и системной терапией цитостатиками и таргетными препаратами в этом исследовании проводилась радиочастотная абляция единичных отдаленных метастазов в печени и получены обнадеживающие результаты.
Оценка значимости видеоторакоскопии в диагностике, определении степени распространения и лечении новообразований лёгкого, средостения и плевры позволили сформулировать объективные показания к ее применению в онкологической практике. Метод видеоторакоскопии с комбинированным плевродезом оказался высокоэффективным в лечении опухолевых рецидивирующих экссудативных плевритов. В настоящее время проводится исследование по определению показаний и оценке результатов роботизированных торакоскопических операций.
Кроме того, кафедра участвует в программах по разработке новых медицинских технологий в области профилактики, диагностики, лечения злокачественных новообразований и реабилитации онкологических больных по линии совместной научной и инновационной деятельности с НИИ онкологии им. Н.Н.Петрова и с международными медицинскими организациями ESMO, ESSO, ECCO и ASCO.
Н.Н.Петрова и с международными медицинскими организациями ESMO, ESSO, ECCO и ASCO.
В НИР кафедры принимают участие студенты СНО, которые ежегодно привлекаются к научно-практическим конференциям университета, получают профессиональную ориентацию и по итогам работы возможность последипломного образования.
Дополнительная информация
Многолетний опыт подтвердил целесообразность расположения кафедры ВУЗа на базе специализированного НИИ, приводящего к созданию единой учебно-научно-лечебной структуры. Кроме того, в Институте онкологии сосредоточены почти все кафедры и курсы онкологии учебных заведений Санкт-Петербурга, что создает благоприятные условия для обмена опытом и совершенствования работы.
Научные контакты с высшими медицинскими учебными учреждениями города
- кафедра онкологии ФПО ПСПбГМУим.акад. И.П.Павлова
- кафедра онкологии СЗГМУ им. И.И.Мечникова
- кафедра онкологии СПбГПМУ
- кафедра онкологии СПбГУ
Материально-техническое оснащение
Кафедра онкологии расположена на базе авторитетного специализированного учреждения страны – НИИ онкологии им.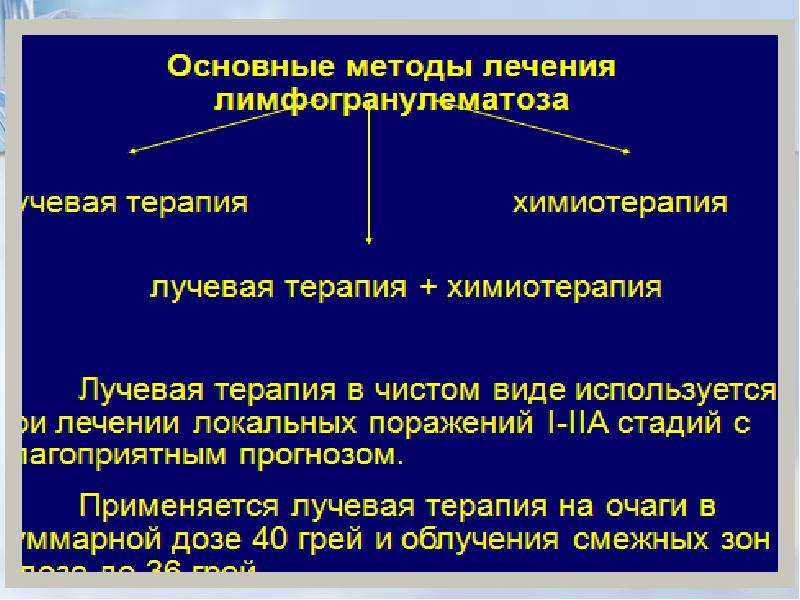 Н.Н.Петрова, имеющего современную диагностическую аппаратуру и проводящего высокотехнологическое комбинированное и комплексное лечение больных.
Н.Н.Петрова, имеющего современную диагностическую аппаратуру и проводящего высокотехнологическое комбинированное и комплексное лечение больных.
Учебные комнаты кафедры обеспечивают комфортное размещение студентов во время практических занятий, обставлены офисной мебелью, компьютеризированы и имеют возможности для мультимедийного иллюстративного обеспечения занятий.
Медицинские услуги
- диагностические:
инструментальные — современные лучевые, эндоскопические, эхографические, изотопные и морфологические исследования;
лабораторные – клинико-биохимические, эндокринологические и иммунологические исследования. - лечебные:хирургические вмешательства, лучевая терапия, лекарственное лечение, а также комбинированные и комплексные лечебные программы.
- консультативные: в НИИ онкологии им. Н.Н.Петрова, в диагностическом центре № 85.
Программа цикла 2018 — Возможности использования КТ-навигации в биопсии опухолей на примере системы SIRIO
Штат кафедры
В штатном расписании числятся заведующий кафедрой В. В.Семиглазов, профессора В.Н.Клименко, В.А.Тришкин, Г.И.Гафтон, доценты В.В.Корхов, Н.Г.Шашкова, М.В.Харитонов, С.М.Ергнян и ассистент Т.Т.Табагуа. Четверо сотрудников имеют ученую степень доктора наук и пятеро кандидата медицинских наук. Ученое звание профессор присуждено двум, а доцент – трем сотрудникам. Профессорско-преподавательский состав кафедры имеет сертификаты врача-специалиста и квалификационные врачебные категории. Все сотрудники являются членами научного общества онкологов Санкт-Петербурга.
В.Семиглазов, профессора В.Н.Клименко, В.А.Тришкин, Г.И.Гафтон, доценты В.В.Корхов, Н.Г.Шашкова, М.В.Харитонов, С.М.Ергнян и ассистент Т.Т.Табагуа. Четверо сотрудников имеют ученую степень доктора наук и пятеро кандидата медицинских наук. Ученое звание профессор присуждено двум, а доцент – трем сотрудникам. Профессорско-преподавательский состав кафедры имеет сертификаты врача-специалиста и квалификационные врачебные категории. Все сотрудники являются членами научного общества онкологов Санкт-Петербурга.
Вспомогательный персонал состоит из трех старших лаборантов с высшим образованием, один из которых имеют степень кандидата медицинских наук.
Средний возраст профессорско-преподавательского состава составляет 52 года, а учебно-вспомогательного персонала (старшие лаборанты, клинические ординаторы, аспиранты) не превышает 30 лет.
Владислав Владимирович Семиглазов, 1970 г.р., в 1993 г закончил СПбМИ им. акад. И.П.Павлова, работает на кафедре с 1993 г, с 2005 г заведующий кафедрой, доктор медицинских наук, доцент.
Автор 26 учебно-методических работ, курирует организацию и проведение учебного процесса в соответствии с требованиями ГОСа и БРС, обеспечивает интеграцию учебной программы со смежными кафедрами.
Является автором 230 научных работ, посвященных проблемам профилактики, ранней диагностики и комбинированного лечения основных локализаций злокачественных опухолей. Под его руководством защищено восемь кандидатских диссертаций.
Как врач, имеет высшую квалификационную категорию, владеет методами диагностики и лечения опухолей молочной железы, кожи, мягких тканей и костей.
Преподаваемая дисциплина: онкология.
Василий Николаевич Клименко, 1960 г.р., в 1989 г закончил 1ЛМИ им.акад. И.П.Павлова, работает на кафедре с 2006 г, доктор медицинских наук, профессор.
Автор 22 учебно-методических работ, курирует разделы учебно-методического комплекса по проблемам опухолей головы и шеи, грудной полости, принимает участие в интеграции учебной программы.
В 130 научных работах отражены проблемы диагностики и лечения опухолей головы и шеи, рака легкого, меланомы кожи и эндовидеохирургии в онкологии.
Врач высшей квалификационной категории, владеет методами диагностики и лечения опухолей головы и шеи и грудной полости. Имеет патенты на изобретения.
Преподаваемая дисциплина: онкология.
Владислав Андреевич Тришкин, 1941 г.р., в 1964 г закончил 1ЛМИ им.акад. И.П.Павлова, работает на кафедре с 1976 г, доктор медицинских наук, профессор.
Автор 23 учебно-методических работ. Обеспечивая интеграцию учебной программы, курирует разделы учебно-методического комплекса по проблемам опухолей опорно-двигательного аппарата.
Является автором 161 научной работы, посвященной диагностике и лечению опухолей опорно-двигательного аппарата, кожи, пищевода, желудка и молочной железы.
Врач высшей квалификационной категории, владеет методами диагностики и лечения опухолей основных локализаций. Имеет патенты на изобретения и удостоверения на рационализаторские предложения.
Имеет патенты на изобретения и удостоверения на рационализаторские предложения.
Преподаваемая дисциплина: онкология.
Георгий Иванович Гафтон, руководитель отделений общей онкологии и урологии НИИ онкологии им.Н.Н.Петрова, как совместитель профессор кафедры.
Преподаваемая дисциплина: онкология.
Виктор Владимирович Корхов, 1948 г.р., в 1972 г закончил 1ЛМИ им.акад. И.П.Павлова, работает на кафедре с 1982 г, кандидат медицинских наук, доцент.
Автор 22 учебно-методических работ, курирует разделы учебно-методического комплекса кафедры по проблемам опухолей желудочно-кишечного тракта, принимает участие в интеграции учебной программы.
Является автором 107 научных работ, посвященных диагностике и лечению рака желудка, ободочной и прямой кишок, совершенствованию комбинированного метода при раке этих локализаций и реабилитации онкологических больных.
Как врач имеет высшую квалификационную категорию, владеет методами диагностики и лечения опухолей желудочно-кишечного тракта.
Преподаваемая дисциплина: онкология.
Нина Георгиевна Шашкова, 1946 г.р., в 1970 г закончила 1ЛМИ им.акад.И.П.Павлова, работает на кафедре с 1979 г, кандидат медицинских наук, доцент.
Автор 22 учебно-методических работ. Принимая участие в интеграции учебной программы, курирует разделы учебно-методического комплекса по проблемам опухолей репродуктивной системы.
Является автором 72 научных работ, посвященных диагностике и лечению опухолей яичников, рака тела и шейки матки, совершенствованию комбинированного метода лечения при этих новообразованиях.
Врач высшей квалификационной категории, владеет методами диагностики и лечения опухолей репродуктивной системы.
Преподаваемая дисциплина: онкология.
Михаил Владимирович Харитонов, Главный врач онкологического диспансера Московского района СПб, как совместитель доцент кафедры.
Преподаваемая дисциплина: онкология.
Степан Мкртычевич Ергнян, 1976 г. р., в 1999 г закончил Ереванский ГМУ им. М.Гераци, работает на кафедре с 2006 г, кандидат медицинских наук, доцент кафедры.
р., в 1999 г закончил Ереванский ГМУ им. М.Гераци, работает на кафедре с 2006 г, кандидат медицинских наук, доцент кафедры.
Квалифицированный преподаватель, автор 16 учебно-методических работ, курирует разделы учебно-методического комплекса по проблеме опухолей кожи, участвует в методическом и иллюстративном обеспечении учебного процесса.
В 42 научных работах отражены современные методы диагностики и лечения опухолей головы и шеи, рака легкого, меланомы кожи и эндовидеохирургии.
Как врач, имеет первую квалификационную категорию, владеет методами диагностики и лечения опухолей кожи и грудной полости.
Преподаваемая дисциплина: онкология.
Табагуа Тенгиз Тенгизович, в 2007 окончил Тбилисский Государственный медицинский Университет по специальности лечебное дело, работает на кафедре с 2012 г, кандидат медицинских наук, ассистент кафедры.
Автор 3 методических пособий, курирует разделы учебно-методического комплекса по проблеме рака молочной железы, координирует лечебную практику студентов IV курса лечебного факультета. злокачественные клетки (клетки Ходжкина, клетки Березовского-Штернберга), так и неспецифические клетки (лимфоциты, плазмоциты, нейтрофильные и. эозинофильные гранулоциты, макрофаги, | фибробласты). Составляет около 1% всех \ онкологических заболеваний взрослых (10% } — гематоонкологических) и чаще встречается в возрасте 20-30 и после 50 лет. > КЛИНИКА ‚в течение нескольких месяцев появляются и усиливаются симптомы эндогенной интоксикации: общая слабость, повышенная утомляемость, потливость, потеря массы тела, кожный зуд, «беспричинное» повышение температуры тела. Уже \\ \& в дебюте заболевания отмечается № склонность к вирусным и грибковым инфекциям, что связано С ‘ угнетением Т-клеточного звена иммунитета. КЛИНИКА гу 20% больных лимфогранулематоз начинается С увеличения лимфатических узлов средостения. В начале это может протекать бессимптомно, однако по мере прогрессирования и увеличения ь т лимфоузлов возникают кашель, одышка, боль за грудиной, = симптомы — сдавления верхней < полой вены.
злокачественные клетки (клетки Ходжкина, клетки Березовского-Штернберга), так и неспецифические клетки (лимфоциты, плазмоциты, нейтрофильные и. эозинофильные гранулоциты, макрофаги, | фибробласты). Составляет около 1% всех \ онкологических заболеваний взрослых (10% } — гематоонкологических) и чаще встречается в возрасте 20-30 и после 50 лет. > КЛИНИКА ‚в течение нескольких месяцев появляются и усиливаются симптомы эндогенной интоксикации: общая слабость, повышенная утомляемость, потливость, потеря массы тела, кожный зуд, «беспричинное» повышение температуры тела. Уже \\ \& в дебюте заболевания отмечается № склонность к вирусным и грибковым инфекциям, что связано С ‘ угнетением Т-клеточного звена иммунитета. КЛИНИКА гу 20% больных лимфогранулематоз начинается С увеличения лимфатических узлов средостения. В начале это может протекать бессимптомно, однако по мере прогрессирования и увеличения ь т лимфоузлов возникают кашель, одышка, боль за грудиной, = симптомы — сдавления верхней < полой вены. В таких случаях \/ прогноз при отсутствии Й. | специфического лечения ЛА а неблагоприятный. У А ) Е КЛИНИКА ‚в периоде — развернутых клинических проявлений выявляется поражение всех лимфоидных органов, характерны оссальгия и стернальгия, увеличение печени и селезенки, костей. и —_ ДИАГНОСТИКА › Окончательная верификация °* Критерии неблагоприятного диагноза основывается на прогноза при болезни гистологическом исследовании Ходжкина биоптатов пораженных Пимфатических узлов, в КОТОрых —: позже чеоденияс риширеним ет боль И перен выявляют характерные изменения. грудной клетки о Поздние стадии с поражением костного мозга . Наличие выраженных симптомов общей интоксикации («В») ® В цел о М п ро ГН 03 п р и * Прогрессирование болезни на фоне проводимого лечения ЛИМ фо грану. лематозе * Рецидив болезни в течение первого года после окончания лечения * Морфологический вариант — лимфоцитное истощение благоприятный, поскольку при с возрытевышедо лет своевременном и адекватном `“”““»“” лечении удается вылечить от 60% 0 до 100% больных.
В таких случаях \/ прогноз при отсутствии Й. | специфического лечения ЛА а неблагоприятный. У А ) Е КЛИНИКА ‚в периоде — развернутых клинических проявлений выявляется поражение всех лимфоидных органов, характерны оссальгия и стернальгия, увеличение печени и селезенки, костей. и —_ ДИАГНОСТИКА › Окончательная верификация °* Критерии неблагоприятного диагноза основывается на прогноза при болезни гистологическом исследовании Ходжкина биоптатов пораженных Пимфатических узлов, в КОТОрых —: позже чеоденияс риширеним ет боль И перен выявляют характерные изменения. грудной клетки о Поздние стадии с поражением костного мозга . Наличие выраженных симптомов общей интоксикации («В») ® В цел о М п ро ГН 03 п р и * Прогрессирование болезни на фоне проводимого лечения ЛИМ фо грану. лематозе * Рецидив болезни в течение первого года после окончания лечения * Морфологический вариант — лимфоцитное истощение благоприятный, поскольку при с возрытевышедо лет своевременном и адекватном `“”““»“” лечении удается вылечить от 60% 0 до 100% больных.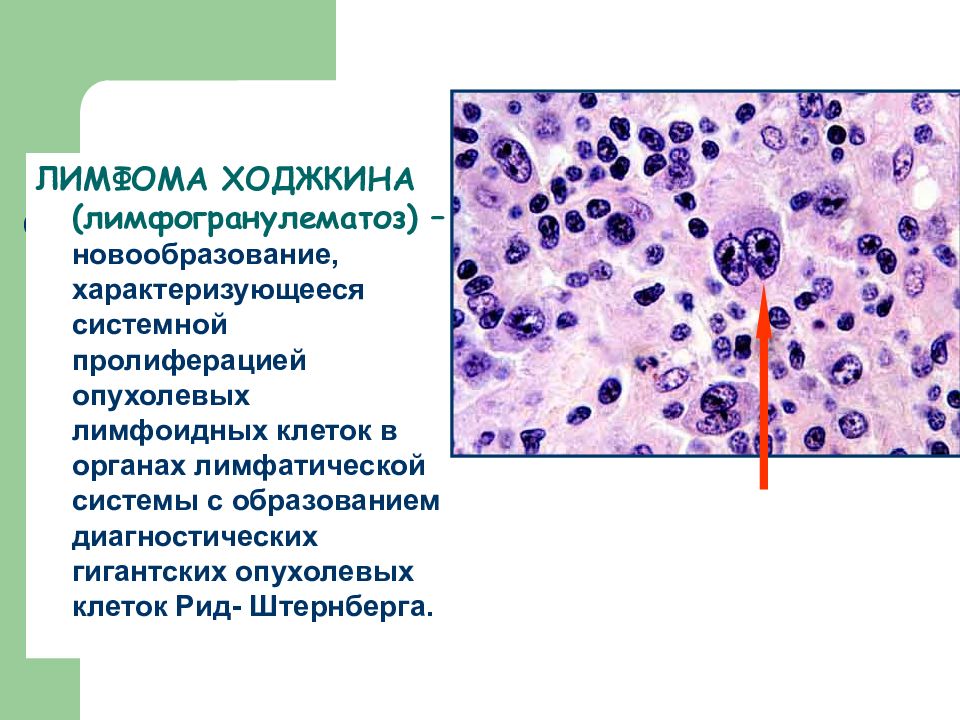 < Ь . В и —_ 1 стадии назначают цитостатическую терапию, а в отдельных случаях ограничиваются только лучевой терапией — локальным облучением очагов поражения в дозах 40-45 Гр (линейный ускоритель или гамматерапия). В этой стадии долгосрочная ремиссия отмечается в 90-100% случаев. Во 2-4 стадиях применяют комбинированную полихимиотерапию или комбинированное лечение. ЛЕЧЕНИЕ Высокоактивными первой полихимиотерапии схемы АВУБР и схемами ЛИНИИ ЯВЛЯЮТСЯ ВЕАСОРР которые повторяют каждые 4 недели, всего до 6-8 циклов. Клиническая стадия Размер наибольшего опухолевого очага$ Сумма бал- лов по 1РЕР Лечение ТА, ПА Малый Не рассмагри- вается АВУО х 4 или АВУГх 4 — РТВЗ* Ш, ГУ, любая с В симптомами Малый 0-3 АВУР с проведением 2 курсов после ПР (минимум 6, максимум 8) Ш, ТУ, любая с В симптомами Малый 4-7 Интенсивная химиотерания** Любая Большой 0-7 Интенсивная химиотерапия» * + ралиотерапия на зоны боль- ших опухолевых очагов < ЛЕЧЕНИЕ ремиссий при схеме АВ\/Р Схема АВУР 85%, 5-летнее выживание — Доксорубицин чи И безрецидивное течение (алриамицин) р Ре в 60-65% случаев.
< Ь . В и —_ 1 стадии назначают цитостатическую терапию, а в отдельных случаях ограничиваются только лучевой терапией — локальным облучением очагов поражения в дозах 40-45 Гр (линейный ускоритель или гамматерапия). В этой стадии долгосрочная ремиссия отмечается в 90-100% случаев. Во 2-4 стадиях применяют комбинированную полихимиотерапию или комбинированное лечение. ЛЕЧЕНИЕ Высокоактивными первой полихимиотерапии схемы АВУБР и схемами ЛИНИИ ЯВЛЯЮТСЯ ВЕАСОРР которые повторяют каждые 4 недели, всего до 6-8 циклов. Клиническая стадия Размер наибольшего опухолевого очага$ Сумма бал- лов по 1РЕР Лечение ТА, ПА Малый Не рассмагри- вается АВУО х 4 или АВУГх 4 — РТВЗ* Ш, ГУ, любая с В симптомами Малый 0-3 АВУР с проведением 2 курсов после ПР (минимум 6, максимум 8) Ш, ТУ, любая с В симптомами Малый 4-7 Интенсивная химиотерания** Любая Большой 0-7 Интенсивная химиотерапия» * + ралиотерапия на зоны боль- ших опухолевых очагов < ЛЕЧЕНИЕ ремиссий при схеме АВ\/Р Схема АВУР 85%, 5-летнее выживание — Доксорубицин чи И безрецидивное течение (алриамицин) р Ре в 60-65% случаев. Одним из обочных эффектов указанных Ей ни 8-й день ся развитие некроспермии (54- мери внутрь иде ев), поэтому перед началом Схема ВЕАСОРР лодым людям рекомендуют ТОО тм ву у на криоконсервирование. Дисорубишин резистентности К ии и — возникновении 100 гум? внутрь ецидивов применяют _ СТВОЛОВЫХ клеток, 1-4 дни после достижения 4
Одним из обочных эффектов указанных Ей ни 8-й день ся развитие некроспермии (54- мери внутрь иде ев), поэтому перед началом Схема ВЕАСОРР лодым людям рекомендуют ТОО тм ву у на криоконсервирование. Дисорубишин резистентности К ии и — возникновении 100 гум? внутрь ецидивов применяют _ СТВОЛОВЫХ клеток, 1-4 дни после достижения 4
Особенности проведения карбокситерапии в условиях санаториев и спа-отелей
Карбокситерапию называют по-разному: пневмопунктура, подкожные инъекции CO2, газовые уколы, газовые аппликации, газовые инъекции. Но суть всех вышеперечисленных названий данной процедуры сводится к одному – к подкожному введению природного или медицинского углекислого газа. Описываемый метод лечения с успехом применяется во многих санаториях мира, его эффективность и безопасность была доказана клиническими испытаниями при различных заболеваниях. В сегодняшней статье мы подробно расскажем о процедуре: методах ее проведения, показаниях и противопоказаниях к назначению, оказываемом на организм пациента действии.
Медицинский и природный газ: особенности применения
Карбокситерапия – лечебная процедура, суть которой заключается во введении в ткани пациента высокоочищенного медицинского углекислого газа или натурального газа из природных источников. Объем вводимого газа и места уколов определяет врач индивидуально для каждого пациента, в зависимости от диагноза и стадии болезни.
Углекислый газ вводят подкожно при помощи тонкой стерильной иглы. Газ подается под постоянным давлением из специального аппарата. Проводит такие процедуры опытный медицинский персонал только в условиях лечебных учреждений. В некоторых санаториях инъекции делают строго в акупунктурные точки. За один сеанс производят в среднем от 6 до 10 уколов.
Существует два вида углекислого газа для пневмопунктуры: природный и медицинский. Природный газ получают из месторождений углекислого газа. Например, всемирно известный источник Марии в Марианских Лазнях, где добывают натуральный углекислый газ. Введение подкожно природного углекислого газа является натуральным и экологическим методом лечения. Медицинский углекислый газ представляет собой стерильный углекислый газ, очищенный и безвредный для организма. Отличий в воздействии природного и медицинского газа на организм человека нет – их механизм действия сходный, и любой газ будет одинаково полезным и эффективным в лечении.
Медицинский углекислый газ представляет собой стерильный углекислый газ, очищенный и безвредный для организма. Отличий в воздействии природного и медицинского газа на организм человека нет – их механизм действия сходный, и любой газ будет одинаково полезным и эффективным в лечении.
Любой из используемых для процедур карбокситерапии газ безопасен для человека и не вызывает аллергических реакций. В теле человека углекислый газ участвует во многих биохимических процессах, является естественным, физиологическим веществом для клеток организма. Поэтому используемый в процедурах СО2 не оказывает токсичного воздействия и полностью выводится из организма примерно через 30 минут.
Углекислый газ улучшает на продолжительное время как местное кровообращение в точке укола, так и общее – мозга, сердца и сосудов. СО2 искусственно создает так называемое кислородное голодание. За счет такой стимуляции в тканях более чем в 3 раза повышается концентрация кислорода. Углекислый газ, вводиый в организм в ходе проведения процедуры, стимулирует дыхательный центр, энергетический обмен, функции фибробластов, нормализует кровоснабжение и оксигенацию тканей, ускоряет синтез коллагена и эластина; уменьшает локальные жировые отложения; оказывает бактерицидное, противовоспалительное, обезболивающее, спазмолитическое действие; способствует обновлению и очищению организма, повышению иммунитета, работоспособности и качества жизни .
Показания и противопоказания к проведению карбокситерапии
Процедура карбокситерапии полезна для организма, при этом сфера применения газовых инъекций довольно широка. Газовые уколы CO2 успешно используют в косметологии, ортопедии, дерматологии, ангиологии, флебологии, кардиологии, неврологии, пульмонологии, онкологии, офтальмологии, оториноларингологии, гинекологии, урологии, проктологии, пластической и общей хирургии, спортивной медицине. Перечислим заболевания, при которых назначается карбокситерапия?
- Заболевания опорно-двигательного аппарата и мышц: артрит, артроз, остеохондроз, остеопороз, мышечная атрофия, миозит, миастения, миалгия.
- Заболевания сердечно-сосудистой системы: период реабилитации после инсульта, ишемическая болезнь сердца, гипертония, стенокардия, атеросклероз, варикозное расширение вен, флебит, венозная недостаточность.
- Заболевания нервной системы: вегетососудистая дистония, невроз, неврит.
- Косметологические проблемы: целлюлит, первые признаки старения (дряблость кожи, морщинки), растяжки, рубцы и шрамы, частая отечность лица и тела, мешки и синяки под глазами, осложнения после неудачной липосакции и реабилитация после успешно проведенной липосакции, некоторые кожные заболевания.

- Заболевания мочеполовой системы у мужчин и женщин: простатит, нарушение потенции, аднексит, спаечная болезнь.
- Заболевания ЖКТ: гастрит, язвенная болезнь желудка.
- Нарушения обменных процессов: подагра, избыточный вес.
Однако, как и любое другое лечение, карбокситерапия проводится только по предписанию врача после проведения необходимых обследований и анализов, исключающих возможные противопоказания. Противопоказанием к проведению процедуры станет:
- эпилепсия
- тромбофлебит в стадии обострения
- нарушения сердечного ритма и острая сердечная недостаточность
- гипертиреоз
- тяжелые формы сахарного диабета
- ХОБЛ
- острые инфекционные заболевания
- состояния гипертермии
- психические заболевания
- состояние алкогольного или наркотического опьянения
- кожные инфекции, воспалительные и трофические изменения кожи в местах предполагаемых инъекций
- период обострения хронических заболеваний кожи
- беременность
Карбокситерапия в условиях курорта
Курс газовых уколов в санатории составляет лечащий врач, исходя из собранного анамнеза, проведенного осмотра, привезенных пациентом результатов обследований или обследований и анализов, проведенных непосредственно на курорте. Можно сказать однозначно, что потребуется ни один сеанс – как правило, назначается не менее 10 процедур для закрепления положительного лечебного эффекта на долгое время. Процедуру проводятся ежедневно или через день. Газовые инъекции относятся к физиотерапевтическим методам курортного лечения и применяются наравне с магнитотерапией, лазеротерапией и другими широко известными методиками.
Можно сказать однозначно, что потребуется ни один сеанс – как правило, назначается не менее 10 процедур для закрепления положительного лечебного эффекта на долгое время. Процедуру проводятся ежедневно или через день. Газовые инъекции относятся к физиотерапевтическим методам курортного лечения и применяются наравне с магнитотерапией, лазеротерапией и другими широко известными методиками.
Большинство санаториев, представленных на нашем сайте, предлагают своим пациентам процедуры пневмопунктуры. Однако особую популярность получили курорты Чехии: Карловы Вары, Мариинские Лазни, Франтишковы Лазни. Кроме того, эффективное лечение при помощи СО2 проводят в Венгрии на курорте Хевиз, в Словакии на курорте Пиештяны, в Рогашке Слатине в Словении.
Клиническая картина и стадия лимфомы Ходжкина
В настоящей главе авторы представляют краткий обзор диагностических методов, предложенных с течением времени для обнаружения распространения лимфомы Ходжкина (ЛХ), переходя от хирургических процедур через стандартные рентгенологические и функциональные методы визуализации к современному уровню техники для стадирования ЛХ. Основная часть обзора будет посвящена недавно опубликованным рекомендациям по стадированию лимфом (включая ЛХ), согласованным экспертами в ходе 12-го Международного конгресса по злокачественным лимфомам в Лугано.Будут представлены и прокомментированы рекомендации комиссии о том, как интегрировать позитронно-эмиссионную томографию с фтордезоксиглюкозой (ФДГ-ПЭТ) в арсенал процедур стадирования, с особым акцентом на полезность специальных процедур, таких как трепанобиопсия костного мозга, которые считается, что в эпоху ПЭТ больше не требуется. В то время как диагноз ЛХ в большинстве случаев не вызывает затруднений, иногда ЛХ является малозаметным заболеванием, которое трудно диагностировать из-за малочисленности симптомов, отсутствия физикальных данных или сопутствующих иммунологических нарушений: полный обзор частых и редких паттернов клинической картины ЛХ. также будет предложена презентация.Будущая перспектива использования ПЭТ-сканирования будет основываться на независимых от оператора количественных показаниях сканирования благодаря множеству сложных специализированных программ, которые в настоящее время доступны и способны количественно оценить каждый воксель, захваченный опухолью, для отображения метаболически активной опухоли.
Основная часть обзора будет посвящена недавно опубликованным рекомендациям по стадированию лимфом (включая ЛХ), согласованным экспертами в ходе 12-го Международного конгресса по злокачественным лимфомам в Лугано.Будут представлены и прокомментированы рекомендации комиссии о том, как интегрировать позитронно-эмиссионную томографию с фтордезоксиглюкозой (ФДГ-ПЭТ) в арсенал процедур стадирования, с особым акцентом на полезность специальных процедур, таких как трепанобиопсия костного мозга, которые считается, что в эпоху ПЭТ больше не требуется. В то время как диагноз ЛХ в большинстве случаев не вызывает затруднений, иногда ЛХ является малозаметным заболеванием, которое трудно диагностировать из-за малочисленности симптомов, отсутствия физикальных данных или сопутствующих иммунологических нарушений: полный обзор частых и редких паттернов клинической картины ЛХ. также будет предложена презентация.Будущая перспектива использования ПЭТ-сканирования будет основываться на независимых от оператора количественных показаниях сканирования благодаря множеству сложных специализированных программ, которые в настоящее время доступны и способны количественно оценить каждый воксель, захваченный опухолью, для отображения метаболически активной опухоли. объем. Кроме того, в настоящее время доступны новые индикаторы, способные отслеживать новые пути клеточного метаболизма помимо гликолиза, такие как аминокислоты, аналоги пуринов или специфические онкопротеины; будут представлены предварительные многообещающие результаты.Также будут представлены предварительные результаты других методов визуализации, таких как диффузионно-взвешенная магнитно-резонансная томография (ДВ-МРТ).
объем. Кроме того, в настоящее время доступны новые индикаторы, способные отслеживать новые пути клеточного метаболизма помимо гликолиза, такие как аминокислоты, аналоги пуринов или специфические онкопротеины; будут представлены предварительные многообещающие результаты.Также будут представлены предварительные результаты других методов визуализации, таких как диффузионно-взвешенная магнитно-резонансная томография (ДВ-МРТ).
Ключевые слова: лимфома Ходжкина; ДОМАШНИЙ ПИТОМЕЦ; Презентация; Постановка.
Редкое проявление лимфомы Ходжкина – гематология и онкология
Гематурия — редкое проявление лимфомы Ходжкина
Викас Дембла, доктор медицины 1
Брайан Н.Walker, DO 2
Stephanie L. Elkins, MD 1
Joe C. Files, MD 1
1 Отделение гематологии, Медицинский факультет, Медицинский центр Университета Миссисипи, Джексон, Миссисипи; 2 Онкологический центр, Джексон, Теннесси
Адресная корреспонденция: Викас Дембла, доктор медицинских наук, отделение гематологии-онкологии, Овертон Брукс, Медицинский центр Вирджинии, 510 E.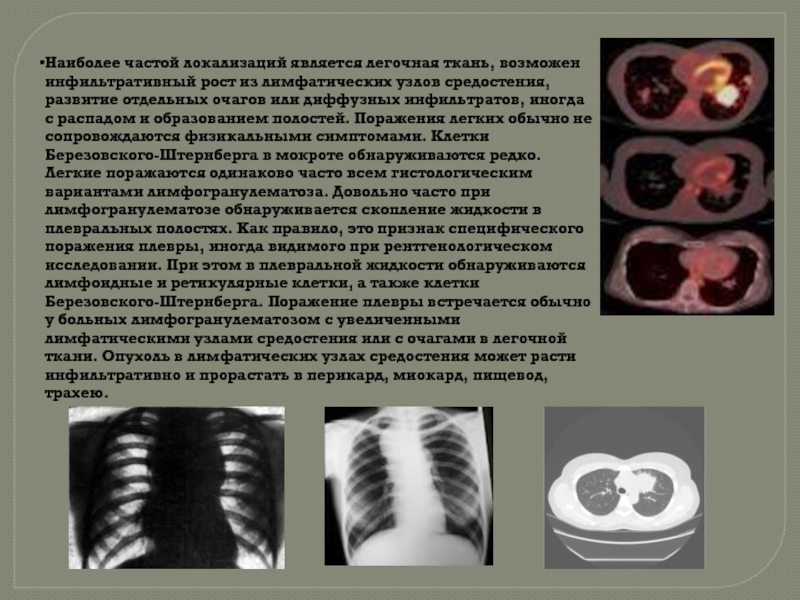 Stoner Avenue, Shreveport, LA 71101-4295; Телефон: 318-221-8411.
Stoner Avenue, Shreveport, LA 71101-4295; Телефон: 318-221-8411.
Введение
Лимфома Ходжкина (ЛХ) представляет собой редкое злокачественное новообразование лимфоидной системы, характеризующееся наличием клеток Рида-Штернберга, представляющих собой многоядерные гигантские клетки В-клеточного происхождения. Средний возраст при постановке диагноза составляет 30 лет, и есть второй, но меньший, пик в 50 лет и старше. Пациенты часто имеют бессимптомное новообразование или могут иметь сопутствующие симптомы группы В, такие как лихорадка, проливной ночной пот и необъяснимая потеря веса. Другие симптомы включают утомляемость, слабость, анорексию и зуд.
Мы представляем редкий случай ЛХ, где начальным проявлением была гематурия, а также включили краткий обзор литературы.
Представление дела
42-летний мужчина без серьезной медицинской истории обратился с гематурией в августе 2007 года. Он не курил и употреблял алкоголь в общественных местах. Обзор систем был положительным в отношении гематурии и отрицательным в отношении камней в почках, потери веса, ночной потливости, лихорадки, озноба, боли в животе или образования, боли в пояснице, мелены, кровохарканья и склонности к кровотечениям.На момент медицинского осмотра у пациента было ожирение, вес 336 фунтов, индекс массы тела 45; его артериальное давление было 130/72 мм рт.ст. Остальное обследование было ничем не примечательным, и не было пальпируемой лимфаденопатии в надключичной, шейной, подмышечной или паховой областях.
Обзор систем был положительным в отношении гематурии и отрицательным в отношении камней в почках, потери веса, ночной потливости, лихорадки, озноба, боли в животе или образования, боли в пояснице, мелены, кровохарканья и склонности к кровотечениям.На момент медицинского осмотра у пациента было ожирение, вес 336 фунтов, индекс массы тела 45; его артериальное давление было 130/72 мм рт.ст. Остальное обследование было ничем не примечательным, и не было пальпируемой лимфаденопатии в надключичной, шейной, подмышечной или паховой областях.
Лабораторный анализ ничем не примечательный, за исключением слегка повышенного уровня креатинина 1,6 мг/дл и кальция 11,0 мг/дл. Его базовый уровень креатинина за последний год был 1,5–1.6 мг/дл.
Пациенту была проведена цистоскопия, и было обнаружено узловатое образование мочевого пузыря. Консультация гематолога была получена после того, как биопсия мочевого пузыря выявила ЛХ с преобладанием лимфоцитов. Компьютерная томография (КТ) (рис. 1) выявила забрюшинные и двусторонние паховые лимфатические узлы размером 11 мм, которые также были обнаружены при позитивной эмиссионной томографии (ПЭТ). ПЭТ и КТ также выявили повышенное поглощение в селезенке и подозрение на мезентериальную лимфаденопатию (рис. 2).Биопсия тазового лимфатического узла показала клетки Рида-Штернберга, соответствующие ЛХ с преобладанием лимфоцитов. Слайды были отправлены в клинику Мейо для обзора, и клиницисты там согласились с диагнозом HL, который был отрицательным для CD15 и CD30 и положительным для CD45 и CD20. Биопсия костного мозга показала 60% клеточность без лимфоматозного поражения. Проточная цитометрия, стробированное сканирование сердца и тесты функции легких были нормальными. Больной IVA стадии ЛХ лечили доксорубицином, блеомицином, винбластином и дакарбазином (ABVD).Первоначально пациенту было назначено 3 курса химиотерапии с исчезновением массивной лимфаденопатии и очищением мочевого пузыря при повторной цистоскопии. За этим последовали еще 2 цикла химиотерапии после наилучшего ответа, всего 5 циклов и последующий полный ответ.
1) выявила забрюшинные и двусторонние паховые лимфатические узлы размером 11 мм, которые также были обнаружены при позитивной эмиссионной томографии (ПЭТ). ПЭТ и КТ также выявили повышенное поглощение в селезенке и подозрение на мезентериальную лимфаденопатию (рис. 2).Биопсия тазового лимфатического узла показала клетки Рида-Штернберга, соответствующие ЛХ с преобладанием лимфоцитов. Слайды были отправлены в клинику Мейо для обзора, и клиницисты там согласились с диагнозом HL, который был отрицательным для CD15 и CD30 и положительным для CD45 и CD20. Биопсия костного мозга показала 60% клеточность без лимфоматозного поражения. Проточная цитометрия, стробированное сканирование сердца и тесты функции легких были нормальными. Больной IVA стадии ЛХ лечили доксорубицином, блеомицином, винбластином и дакарбазином (ABVD).Первоначально пациенту было назначено 3 курса химиотерапии с исчезновением массивной лимфаденопатии и очищением мочевого пузыря при повторной цистоскопии. За этим последовали еще 2 цикла химиотерапии после наилучшего ответа, всего 5 циклов и последующий полный ответ.
В июне 2008 г. у пациента возник рецидив гематурии, повторная цистоскопия показала подозрительное поражение мочевого пузыря. Были выполнены биопсии мочевого пузыря и предстательной железы, подтвердившие рецидив ЛХ с преобладанием лимфоцитов как в мочевом пузыре, так и в предстательной железе.Были признаки, указывающие на трансформацию крупных В-клеток, положительные по CD20 и отрицательные по CD15 и CD30. Повторная визуализация показала лимфаденопатию в тазовых и двусторонних подвздошных цепочках. Пациенту была выполнена эксцизионная биопсия левого пахового лимфатического узла, который был доброкачественным.
Пациент прошел химиотерапию спасения с последующей трансплантацией аутологичных стволовых клеток.
Обсуждение
Поиск литературы показал, что поражение мочеполовой системы при лимфомах встречается очень редко.Несколько опубликованных клинических случаев показывают, что вторичное поражение мочевого пузыря относительно чаще встречается при неходжкинской лимфоме (НХЛ), чем при ЛХ. Хотя также сообщалось о первичной лимфоме мочевого пузыря, большая часть литературы ограничивается сообщениями о спорадических случаях.
Хотя также сообщалось о первичной лимфоме мочевого пузыря, большая часть литературы ограничивается сообщениями о спорадических случаях.
HL обычно считается распространенным лимфатическим заболеванием и обычно проявляется поражением наддиафрагмальных лимфатических узлов и только позже генерализованным и экстранодальным распространением лимфатических узлов.Это очень редкий случай с начальными участками поражения ЛХ в мочевом пузыре и предстательной железе.
В одном отчете Bocian et al., 1 , у 91-летнего пациента развился рецидив через 10 лет после известного диагноза ЛХ с поражением мочевого пузыря. Клетки Рида-Штернберга, обнаруженные при цитологическом исследовании мочи, помогли диагностировать рецидив. Авторы предположили, что рецидив возник в тазовых лимфатических узлах, находящихся вне поля облучения, с последующим прорастанием опухоли в структуры малого таза и прямой инвазией мочевого пузыря.Сосудистая инвазия не наблюдалась в биоптатах мочевого пузыря, а мазок периферической крови не выявил аномальных лимфоцитов или клеток Рида-Штернберга.
В 1981 г. Weimar и соавт. 2 провели ретроспективный анализ 1068 пациентов со злокачественными лимфомами за 10-летний период и сообщили об отсутствии поражения мочевого пузыря ни рентгенологически, ни во время операции, ни во время вскрытия. среди больных ХЛ. В целом сообщалось о 5,8% случаев поражения мочеполовой системы (только почек и мочеточников) при HL в какой-то момент течения заболевания.Зарегистрированная частота урогенитального поражения при НХЛ была выше — 7,3%. Они также пришли к выводу, что почти все пациенты с урогенитальным поражением находились на поздней стадии заболевания, что почки являются урогенитальным органом, наиболее часто поражаемым солидными лимфатическими опухолями, и что НХЛ приводит к более серьезным урологическим последствиям (обструкция, почечная инфильтрация).
В 2000 г. Сосна с соавт. 3 сообщила о четвертом рецидиве ЛХ, который проявлялся безболезненной гематурией.Их пациенту сделали трансплантацию стволовых клеток после третьего рецидива, и его лечили локальным облучением мочевого пузыря и 3 курсами химиотерапии мехлорэтамином, винкристином, прокарбазином и преднизоном (MOPP). Исход положительный, безрецидивный период более 3 лет.
Исход положительный, безрецидивный период более 3 лет.
Sufrin и соавторы 4 провели серию вскрытий 599 пациентов, умерших от злокачественной лимфомы, и сравнили первичное и вторичное поражение мочевого пузыря лимфомой.Они сообщили о следующих примечательных фактах: HL вызывает только 4% везикального поражения, а вторичное везикальное поражение имеет тенденцию возникать у пациентов моложе 50 лет по сравнению с первичным везикальным вовлечением, которое чаще встречается у пациентов старше 50 лет. Отмечено, что у мужчин вторичное поражение встречается чаще, чем у женщин, клинические симптомы встречаются редко, а прогноз, как правило, неблагоприятный.
Вовлечение простаты лимфомой встречается гораздо реже, чем считалось ранее. В 1983 году Sridhar и коллеги 5 оценили 12 случаев поражения предстательной железы лейкемией или лимфомой.ХЛ наблюдалась только в 1 случае. Они пришли к выводу, что нет никаких клинических признаков, указывающих на поражение предстательной железы при лейкемии или лимфоме, и что прогноз связан с первично-генерализованным заболеванием, а не с инфильтрацией предстательной железы.
В мочевом пузыре отсутствуют лимфатические сосуды, поэтому первичная лимфома мочевого пузыря встречается редко; у нашего пациента первоначальным рабочим диагнозом была карцинома мочевого пузыря. На сегодняшний день зарегистрировано менее 100 случаев первичной лимфомы мочевого пузыря.Эти опухоли невозможно отличить от других опухолей мочевого пузыря на основании их рентгенологических или эндоскопических признаков; только гистология позволяет поставить диагноз.
Этот случай также может представлять собой составную лимфому с признаками как ЛХ, так и НХЛ.
Заключение
Вторичное поражение мочевого пузыря при ЛХ встречается редко, но о нем сообщалось. Почки являются наиболее частым урогенитальным органом, вовлекаемым в лимфому. Многие пациенты, у которых отмечается поражение мочеполовой системы, уже находятся на поздней стадии заболевания.Экстранодальное поражение, как и в этом случае, может спутать рабочий диагноз и должно быть учтено в дифференциальной диагностике больного с гематурией. Большинство случаев поражения мочевого пузыря лимфомой — либо клинически, либо во время вскрытия — относится к разновидности НХЛ. Цистоскопия и цистография ценны в диагностике грубых поражений. Лечение вторичной лимфомы мочевого пузыря является симптоматическим, и для паллиативного лечения может быть назначено местное облучение. Лечение основного заболевания еще предстоит установить, но логически оно должно включать системную химиотерапию и/или лучевую терапию.
Большинство случаев поражения мочевого пузыря лимфомой — либо клинически, либо во время вскрытия — относится к разновидности НХЛ. Цистоскопия и цистография ценны в диагностике грубых поражений. Лечение вторичной лимфомы мочевого пузыря является симптоматическим, и для паллиативного лечения может быть назначено местное облучение. Лечение основного заболевания еще предстоит установить, но логически оно должно включать системную химиотерапию и/или лучевую терапию.
Ссылки
1. Bocian JJ, Flam MS, Mendoza Ca. Болезнь Ходжкина с поражением мочевого пузыря, диагностированная с помощью цитологического исследования мочи: клинический случай. Рак . 1982;50:2482-2485.
2. Weimar G, Culp DA, Loening S, Narayana A. Урогенитальное поражение злокачественными лимфомами. Дж Урол . 1981; 125:230-231.
3. Сосна Дж., Лоссос И.С., Либсон Э. Лимфома Ходжкина мочевого пузыря. Клин Радиол . 2000;55:405-406.
4. Sufrin G, Keogh B, Moore RH, Murphy GP. Вторичное поражение мочевого пузыря при злокачественной лимфоме. Дж Урол . 1977 год; 118:251-253.
Вторичное поражение мочевого пузыря при злокачественной лимфоме. Дж Урол . 1977 год; 118:251-253.
5. Шридхар К.Н., Вудхаус Ч.Р. Инфильтрация предстательной железы при лейкемии и лимфоме. Евро Урол . 1983; 9:153-156.
Редкое проявление лимфомы Ходжкина
Марта Кармона-Кампос, MD, 1 и Хосе Антонио Диас-Пероминго, MD 2
1 Отделение онкологии
2 Отделение внутренних болезней, Университетская клиническая больница, Сантьяго-де-Компостела, Испания
Адресная корреспонденция: Хосе Антонио Диас-Пероминго, MD, Медицинское отделение краткосрочного пребывания, Отделение внутренних болезней, Больница Clínico Universitario, 15706, Сантьяго-де-Компостела, Испания.Телефон: 0034981955167; Электронная почта: [email protected].
Dembla и коллеги 1 описывают интересный случай 42-летнего мужчины с гематурией как формой лимфомы Ходжкина (ЛХ). Его лечили химиотерапией без облучения. Новая гематурия, представляющая собой рецидив ЛХ, развилась почти через год. Диагностика и лечение подобных случаев остаются несколько неясными.
Его лечили химиотерапией без облучения. Новая гематурия, представляющая собой рецидив ЛХ, развилась почти через год. Диагностика и лечение подобных случаев остаются несколько неясными.
Лимфомы мочевого пузыря — очень редкие опухоли.Они составляют менее 1% всех злокачественных образований мочевого пузыря. Как правило, вторичное поражение наблюдается у пациентов с ранее диагностированной лимфомой (вторичная лимфома мочевого пузыря) и редко может проявляться как заболевание, локализованное в мочевом пузыре (первичная лимфома мочевого пузыря). Последняя не совсем «первичная» лимфома мочевого пузыря, так как она представляет собой место первых признаков диссеминированной лимфомы. 2
В мочевом пузыре большинство лимфом относятся к типу В-клеточной неходжкинской лимфомы (НХЛ), но есть некоторые различия в первой локализации опухоли.В случае первичных лимфом мочевого пузыря наиболее частым гистологическим типом является низкодифференцированная лимфоидная ткань, ассоциированная со слизистой оболочкой (MALT), а в случаях вторичной диссеминации в мочевой пузырь наиболее частым гистологическим типом является диффузная крупноклеточная В-клеточная лимфома.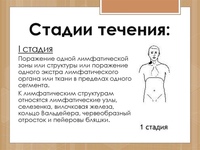 . 3
. 3
Поражение мочевого пузыря при ЛХ встречается крайне редко, и были опубликованы лишь отдельные сообщения как о первичном, так и о вторичном поражении мочевого пузыря у пациентов с ЛХ. 4,5 Это можно объяснить отсутствием лимфоидной ткани в мочевом пузыре.Предполагается, что непрерывность и гематогенная диссеминация объясняют развитие этих опухолей в мочевом пузыре. Случай вовлечения простаты несколько отличается. Лимфомы предстательной железы составляют менее 0,1% всех лимфом. Случайные рудиментарные лимфоидные узелки и некоторые случаи первичных лимфом, ограниченных предстательной железой, были описаны как НХЛ, преимущественно В-клеточного типа. ЛХ, поражающая предстательную железу, встречается еще реже. 6
Экстранодальные проявления ЛХ крайне редки и составляют менее 1% всех ЛХ у пациентов, не страдающих СПИДом.Перед постановкой этого диагноза рекомендуется использовать строгие морфологические и иммунофенотипические критерии. В случае лимфом мочевого пузыря хроническая антигенная стимуляция при повторных инфекциях мочевыводящих путей или воздействие вирусов, таких как ВИЧ или Эпштейн-Барр, считается важным фактором риска развития этих опухолей. 7
В случае лимфом мочевого пузыря хроническая антигенная стимуляция при повторных инфекциях мочевыводящих путей или воздействие вирусов, таких как ВИЧ или Эпштейн-Барр, считается важным фактором риска развития этих опухолей. 7
Наиболее частым симптомом лимфом мочевого пузыря является массивная гематурия, как у пациента, описанного Dembla et al. 1 Однако также сообщалось о дизурии, сопутствующей инфекции мочевыводящих путей или учащенном мочеиспускании. 8 Цистоскопия является ключевой процедурой в лечении макрогематурии и позволяет поставить диагноз у большинства пациентов с новообразованиями мочевого пузыря. После постановки диагноза ЛХ необходимо провести стадирование, включающее компьютерную томографию (КТ) и позитронно-эмиссионную томографию (ПЭТ), а также биопсию костного мозга. ПЭТ-сканирование особенно полезно для определения того, действительно ли лимфома мочевого пузыря является «первичной», и оно превосходит КТ для определения стадии и оценки распространенности заболевания как при ЛХ, так и при НХЛ. 9
9
Морфологическое исследование лимфатических узлов и образцов костного мозга должно искать клетки Рида-Штернберга, а также должны быть выполнены иммуногистохимические исследования. Положительный результат на CD30 и CD15 вместе с отрицательным результатом на CD45 и CD20, а также отсутствие экспрессии факторов транскрипции OCT-2 и BOB-1 позволяют предположить классический диагноз ЛХ (последнее полезно для исключения ЛХ с преобладанием лимфоцитов). ). Проточная цитометрия и молекулярная характеристика также очень полезны в диагностике, особенно для того, чтобы дифференцировать классические и неклассические формы ЛХ. 10,11
Лечение ЛХ зависит от гистологического типа, расширения поля лимфатических узлов и поражения костного мозга. Если расширение велико, следует избегать облучения, как в данном случае. Тем не менее и в этом случае недостаток облучения мог сыграть важную роль в рецидиве ЛХ. Терапевтические методы развились за последние несколько лет, и некоторые из них явно связаны с иммунофенотипической классификацией, например, использование ритуксимаба (Rituxan, Genentech) для CD20-положительных лимфом. 12 Вопрос о наилучшем терапевтическом подходе к ЛХ и НХЛ мочевого пузыря остается спорным. Варианты лечения включают химиотерапию, лучевую терапию и хирургическое вмешательство, но предпочтение отдается химиотерапии (в настоящее время циклофосфамидом, митоксантроном, винкристином, доксорубицином или блеомицином в различных комбинациях), поскольку она лечит обнаруживаемые и неопределяемые ранние системные заболевания. 13
12 Вопрос о наилучшем терапевтическом подходе к ЛХ и НХЛ мочевого пузыря остается спорным. Варианты лечения включают химиотерапию, лучевую терапию и хирургическое вмешательство, но предпочтение отдается химиотерапии (в настоящее время циклофосфамидом, митоксантроном, винкристином, доксорубицином или блеомицином в различных комбинациях), поскольку она лечит обнаруживаемые и неопределяемые ранние системные заболевания. 13
Поражение мочевого пузыря и предстательной железы при ЛХ, будь то первичное или вторичное, встречается очень редко. Необходима тщательная диагностика с особым вниманием к иммуногистохимическим исследованиям и распространению заболевания с помощью КТ и ПЭТ-сканирования.Терапевтический подход еще не определен. Этот диагноз следует иметь в виду у пациентов с новообразованиями мочевого пузыря, даже несмотря на то, что в настоящее время наиболее частым диагнозом является карцинома мочевого пузыря.
Ссылки
1. Дембла В., Уокер Б.Н., Элкинс С.Л., Файлс Дж.К. Гематурия — редкое проявление лимфомы Ходжкина. Clin Adv Hematol Oncol . 2011;9:788-790.
Дембла В., Уокер Б.Н., Элкинс С.Л., Файлс Дж.К. Гематурия — редкое проявление лимфомы Ходжкина. Clin Adv Hematol Oncol . 2011;9:788-790.
2. Айген А.Б., Филипс М. Первичная злокачественная лимфома мочевого пузыря. Урология .1986; 3:235-237.
3. Фримен С., Берг Дж.В., Катлер С.Дж. Возникновение и прогноз экстранодальных лимфом. Рак . 1972; 1: 252–260.
4. Сосна Дж., Лоссос И.С., Либсон Э. Лимфома Ходжкина мочевого пузыря. Клин Радиол . 2000;5:405-406.
5. de Leval L, Jardon-Jeghers C, Gennigens C, Boniver J. Лимфома Ходжкина, представляющая собой опухоль мочевого пузыря. Гематологические . 2006;91:6-7.
6. Шнидерян С.Д., Осункоя А.О. Лимфоидные новообразования мочевыводящих путей и мужских половых органов: клинико-патологическое исследование 40 случаев. Мод Патол . 2009;22:1057-1065.
7. Сантино А.М., Шумейкер Э.Дж., Гарсес Дж. Первичная злокачественная лимфома мочевого пузыря
. Дж Урол . 1970; 103:310-313.
Дж Урол . 1970; 103:310-313.
8. Herling M, Rassidakis GZ, Medeiros LJ, et al. Экспрессия латентного мембранного белка-1 вируса Эпштейна-Барр в клетках Ходжкина и Рида-Штернберга классической лимфомы Ходжкина: связь с клиническими проявлениями, уровнями интерлейкина 10 в сыворотке и клиническим исходом. Clin Cancer Res . 2003;9:2114-2120.
9. Диас-Пероминго Х.А., Тато-Родригес Х., Пескейра-Фонтан П.М., Молинос-Кастро С., Гайол-Фернандес М.С., Струзик Х.П. Неходжкинская лимфома в виде первичной опухоли мочевого пузыря: клинический случай. J Med Отчеты о случаях болезни . 2010;26;4:114.
10. Хиггинс Р.А., Бланкеншип Дж.Е., Кинни М.С. Применение иммуногистохимии в диагностике неходжкинских и ходжкинских лимфом. Медицинская лаборатория Arch Pathol . 2008; 132:441-461.
11. Фрага М., Фортеза Дж. Диагностика болезни Ходжкина: обновленная информация о гистопатологических и иммунофенотипических особенностях. Гистол Гистопатол . 2007; 22:923-935.
2007; 22:923-935.
12. Плоскер Г.Л., Фиггитт Д.П. Ритуксимаб: обзор его применения при неходжкинской лимфоме и хроническом лимфоцитарном лейкозе. Наркотики . 2003;63:803-843.
13. Ратор Б., Кадин М.Е. Терапия лимфомы Ходжкина: прошлое, настоящее и будущее. Экспертное заключение фармацевта . 2010;17:2891-2906.
Лимфома Ходжкина. Симптомы и лечение лимфомы Ходжкина
Синоним: Болезнь Ходжкина
Лимфома Ходжкина — злокачественная опухоль лимфатической системы, которая гистологически характеризуется наличием многоядерных гигантских клеток (клеток Рида-Штернберга) и связанных с ними аномальных и более мелких мононуклеарных клеток, происходящих из В-лимфоцитов в зародышевые центры лимфоидной ткани.
Классификация
Точная классификация типа и точное определение стадии заболевания определяют наиболее благоприятные варианты лечения и прогноз. Лимфома Ходжкина классифицируется на два отдельных объекта [1] :
- Классическая Лимфома Ходжкина (чаще всего):
- Узелковый склероз
- Смешанная клеточная площадь
- Смешанная клеточная площадь
- Lymphocyte — истощена
- ,
- Узвучный лимфоциты преобладающая лимфома Ходжкина (НЛХЛ).
Различий в прогнозе или лечении различных подтипов классической лимфомы Ходжкина нет. В Европе и Северной Америке нодулярная склерозная классическая лимфома Ходжкина составляет 70% всех классических лимфом Ходжкина. Классическая лимфома Ходжкина с истощением лимфоцитов чаще встречается у пациентов с ослабленным иммунитетом и чаще наблюдается в развивающихся странах, где она тесно связана с инфекцией, вызванной вирусом Эпштейна-Барр (EBV) [2] .
НЛХЛ отличается гистологически, клетки Рида-Штернберга отсутствуют, она имеет риск трансформации в неходжкинскую лимфому высокой степени злокачественности и лечится иначе, чем классическая лимфома Ходжкина. Остальная часть этой статьи посвящена классической лимфоме Ходжкина.
Эпидемиология
[2]- Ежегодная заболеваемость лимфомой Ходжкина в Великобритании составляет 2,7/100 000 с небольшим преобладанием мужчин.
- Пик заболеваемости приходится на молодых людей в возрасте 20–34 лет, а дальнейший пик наблюдается в возрасте старше 70 лет.
Факторы риска
- ВЭБ был обнаружен в клетках Рида-Штернберга примерно у 50% пациентов с лимфомой Ходжкина.
- Пациенты, у которых ранее развился мононуклеоз, имеют повышенный риск развития лимфомы Ходжкина.
- Другие факторы риска включают вирус иммунодефицита человека (ВИЧ), иммуносупрессию и курение сигарет.
Представление
- У большинства пациентов наблюдается увеличенный, но в остальном бессимптомный лимфатический узел, как правило, в нижней части шеи или надключичной области.
- Опухоли средостения встречаются часто и иногда выявляются при рутинной рентгенографии.
- Пациенты могут жаловаться на дискомфорт в груди с кашлем или одышкой.
- Системные симптомы проливной ночной потливости, необъяснимой лихорадки >38°C и потери веса >10% в течение шести месяцев называются В-симптомами и выявляются примерно у 25% пациентов [2] .
- Вызванная алкоголем боль в местах узлового поражения является специфической, но возникает менее чем у 10% пациентов.
- Результаты обследования включают лимфаденопатию, гепатомегалию, спленомегалию и синдром верхней полой вены; также могут быть признаки, вызванные паранеопластическими синдромами, например, дегенерация мозжечка, невропатия или синдром Гийена-Барре.
Дифференциальная диагностика
Исследования
- ОСК: для исключения лейкемии, мононуклеоза и других причин лимфаденопатии. Степень любой анемии, лейкоцитоз и лимфопения являются прогностическими показателями.
- Тесты для возможных дифференциальных диагнозов, например, тесты на инфекционный мононуклеоз.
- СОЭ: СОЭ более 70 означает неблагоприятный прогноз.
- Тесты функции печени и белков сыворотки: уровень любого повышения уровня лактатдегидрогеназы (ЛДГ) и снижения уровня альбумина имеет прогностическое значение.
- Тесты на ВИЧ необходимы пациентам с подозрением на лимфому Ходжкина.
- Образцы тонкоигольной аспирации обычно не следует использовать в качестве единственной ткани для диагностики.
- Биопсия лимфатического узла:
- Патологический диагноз должен быть сделан на основании достаточно большого образца или эксцизионной биопсии лимфатического узла, чтобы обеспечить образцы для свежезамороженных и фиксированных формалином образцов.
- Эксцизионная биопсия лимфатических узлов лучше, чем тонкоигольная или толстоигольная биопсия, поскольку она позволяет диагностировать лимфомы на основе морфологии лимфатического узла, что невозможно при пункционной биопсии.
- Рентгеновская рентгенограмма: оцените любую внутригрудную лимфаденопатию и расширение средостения.
- КТ органов грудной клетки и брюшной полости необходимы для определения стадии лимфомы Ходжкина.
- Лимфангиография: может быть полезна, если есть субдиафрагмальные проявления лимфомы Ходжкина с сомнительными результатами КТ брюшной полости или есть субдиафрагмальные проявления лимфомы Ходжкина с целью лечения только лучевой терапией.
- Сканирование галлия: может быть полезно, если КТ-сканирование дает неоднозначные результаты. Они выполняются, если вовлечены медиастинальные или внутригрудные узлы, а также в качестве исходного уровня у пациентов с объемным заболеванием для лучшего определения ответа во время и после терапии.
- Биопсия костного мозга показана для стадирования.
Стадирование и оценка риска
- ОСК, СОЭ и биохимический анализ крови, включая СРБ, щелочную фосфатазу, ЛДГ, ферменты печени, альбумин и ТТГ.
- Анализ крови перед лечением должен включать вирус гепатита В (ВГВ), вирус гепатита С (ВГС) и ВИЧ [2] .
- Пациентам следует провести КТ с контрастным усилением, охватывающую шею, грудную клетку, брюшную полость и таз. Настоятельно рекомендуется начальная позитронно-эмиссионная томография (ПЭТ)/КТ [2] .
- Общепринятой практикой было ограничение оценки костного мозга пациентами с запущенной стадией заболевания или симптомами группы В. В настоящее время общепризнано, что ПЭТ/КТ может точно определить поражение костного мозга, а оценка с помощью биопсии часто не требуется [2] .
- Постановка лапаротомии не рекомендуется.
Примечание редактора
Dr Sarah Jarvis, 11 февраля 2021 г.
В сентябре 2020 г. и январе 2021 г. Национальный институт здравоохранения и повышения квалификации (NICE) обновил свое руководство по распознаванию подозрений на рак и направлению к специалистам.Однако нет никаких изменений, которые касаются этой статьи [3] о лимфоме Ходжкина.
Стадирование
Пациентов с ранней стадией заболевания следует классифицировать по благоприятному или неблагоприятному прогнозу в зависимости от наличия или отсутствия медиастинальной лимфаденопатии, наличия симптомов, уровня СОЭ и количества пораженных лимфатических узлов [2] .
Система стадирования лимфомы Ходжкина по Анн-Арбору:
- Стадия I: поражение одного региона лимфатических узлов или лимфоидной структуры (например, селезенки, тимуса, кольца Вальдейера).
- Стадия II: две или более области лимфатических узлов на одной стороне диафрагмы.
- III стадия: лимфатические узлы с обеих сторон диафрагмы.
- Стадия III (1): с селезеночными, прикорневыми, чревными или портальными узлами.
- Стадия III (2): с парааортальными, подвздошными или брыжеечными лимфатическими узлами.
- Стадия IV: вовлечение экстранодального участка(ов) за пределами обозначенного E (см. ниже).
- Особенности модификации:
- A: нет симптомов.
- B: лихорадка, обильные ночные поты, потеря веса более 10% за шесть месяцев.
- X: объемное заболевание: расширение средостения более чем на треть или максимальный диаметр узлового образования более 10 см.
- E: вовлечение одного, смежного или проксимального экстранодального очага.
Заболевание подразделяется на ограниченное, промежуточное или прогрессирующее:
- Ограниченное заболевание: до IIB без факторов риска.
- Промежуточное заболевание: до IIB с поражением не менее трех областей лимфатических узлов или высокой СОЭ (СОЭ более 50 мм/ч без В-симптомов или более 30 мм/ч с В-симптомами; В-симптомы определяются как лихорадка, ночная потливость , потеря веса).
- Запущенная стадия:
- Стадия IIB с большим образованием в средостении (более одной трети горизонтального диаметра грудной клетки) или экстранодальным поражением.
- Любая стадия III или выше.
Ведение
[4]Перед началом лечения пациентов следует оценить на предмет риска острых и/или долгосрочных осложнений. Обязательны сердечные и легочные функциональные тесты, и следует рассмотреть возможность консультации со специалистом по оториноларингологии (особенно для пациентов с поражением области головы и шеи).Пациентке также может потребоваться консультация по вопросам репродуктивного здоровья, если она еще не создала семью, поскольку лечение может поставить под угрозу фертильность. Пациентам мужского пола по возможности следует предлагать криоконсервацию спермы до лечения. Для пациенток женского пола следует рассмотреть варианты перед лечением у специалиста по фертильности [2] .
Начальная терапия основывается на гистологии заболевания, анатомической стадии и наличии неблагоприятных прогностических признаков. Пациентов с ранней стадией заболевания обычно лечат комбинированными стратегиями лечения с курсами комбинированной химиотерапии с последующей лучевой терапией пораженного поля, в то время как пациенты с поздней стадией заболевания получают более длительный курс химиотерапии, часто без лучевой терапии.Новые препараты, включая брентуксимаб ведотин, в настоящее время включаются в передовую терапию, и эти новые комбинации становятся стандартом лечения.
Высокодозная химиотерапия (HDCT) с последующей аутологичной трансплантацией стволовых клеток (ASCT) является стандартом лечения для большинства пациентов с рецидивом после начальной терапии. Для пациентов, которым не удается провести HDCT с ASCT, следует рассмотреть возможность применения брентуксимаба ведотина, блокады PD-1, немиелоаблативной аллогенной трансплантации или участия в клинических испытаниях.
Как химиотерапия, так и лучевая терапия повышают риск развития вторичных солидных опухолей, например рака легких, молочной железы и желудка.
Прививки: поливалентная пневмококковая вакцина и вакцина против гриппа должны вводиться всем пациентам с лимфомой Ходжкина. Также рекомендуются конъюгированная вакцина против менингококка группы С и вакцина Haemophilus influenzae типа b, особенно для пациентов, получающих лечение, и пациентов с аспленией или дисфункцией селезенки [5] .
Химиотерапия
- Эффективен, но связан с повышенным риском лейкемии. Пик риска наблюдается примерно через пять лет после начала химиотерапии. Риск выше у пациентов, перенесших спленэктомию, и у пациентов с прогрессирующим заболеванием; на риск не влияет сопутствующая лучевая терапия.
- Химиотерапия обычно основана на определенных комбинациях [2] :
- ABVD: доксорубицин (ранее называвшийся Adriamycin®), блеомицин, винбластин и дакарбазин.
- BEACOPP: состоит из блеомицина, этопозида, доксорубицина (адриамицин®), циклофосфамида, винкристина (онковин®), прокарбазина и преднизолона.
- Если требуется терапия во время беременности, общий консенсус заключается в том, что ABVD является режимом выбора, если используется полихимиотерапия.
- Любому пациенту с тяжелой нейтропенией следует проводить антибиотикопрофилактику с химиотерапией.
- Рекомбинантный человеческий гранулоцитарный колониестимулирующий фактор (rhG-CSF) стимулирует выработку нейтрофилов и может сократить продолжительность вызванной химиотерапией нейтропении и, таким образом, снизить частоту ассоциированного сепсиса [5] .
Лучевая терапия
- Классическая картина – расширенное поле облучения в наддиафрагмальной мантии с вовлечением всех узловых областей над диафрагмой при локальном заболевании с профилактическим облучением брюшной полости в I и II стадиях заболевания.
- Более обширная лучевая терапия снижает риск рецидива, но увеличивает риск поздней смертности от других причин.
- Лучевую терапию обычно не следует пропускать у пациентов с объемным заболеванием на ранней стадии [2] .
Схемы лечения
Существуют некоторые различия между различными руководствами. Следующие режимы рекомендуются Европейским обществом медицинской онкологии (ESMO). Выбор лечения будет зависеть от стадии заболевания, гистологического подтипа и благоприятных прогностических факторов [2] :
- Ранняя стадия заболевания:
- Стандартом лечения больных с благоприятной и неблагоприятной ранней стадией является химиотерапия с использованием ABVD и лучевая терапия, с дополнительными циклами химиотерапии для больных с неблагоприятным прогнозом.
- Вариантом лечения неблагоприятной ранней стадии является BEACOPP, а затем ABVD плюс лучевая терапия.
- Заболевание на поздней стадии:
- Пациенты в возрасте от 16 до 60 лет с заболеванием на поздней стадии должны пройти либо от шести до восьми циклов ABVD, либо от шести циклов усиленного BEACOPP. Младшие и пожилые пациенты должны оцениваться на индивидуальной основе.
- Пациенты, пролеченные BEACOPP и достигшие в конце лечения ПЭТ-отрицательной ремиссии, не нуждаются в лучевой терапии консолидации остаточной ткани.
- Пациентам, пролеченным с помощью ABVD, следует рассмотреть вопрос о проведении лучевой терапии на участки первоначальной массы или остаточной ткани >1,5 см.
- Пациенты, которые остаются положительными по результатам ПЭТ после завершения терапии, нуждаются в биопсии или тщательном клиническом/радиологическом наблюдении для раннего прогрессирования.
Первичная резистентная и рецидивирующая классическая лимфома Ходжкина [6]
- Повторная биопсия рекомендуется для пациентов с подозрением на рецидив и должна быть рассмотрена у пациентов с остаточными поражениями после лечения.ПЭТ/КТ является предпочтительным методом повторного определения стадии после спасительной терапии (высокодозной химиотерапии).
- ASCT является стандартным методом лечения пациентов с первично резистентным заболеванием или с рецидивом заболевания, у которых достигнут адекватный ответ на химиотерапию спасения. ASCT не рекомендуется тем, у кого не удается добиться адекватного ответа.
- Выбор режима спасения первой линии у пациентов, которым показана АТСК, должен основываться на индивидуальных факторах пациента. Следует по возможности избегать схем, содержащих токсические агенты для стволовых клеток (например, кармустин и мелфалан), до тех пор, пока стволовые клетки не будут успешно собраны и криоконсервированы, если планируется ТГСК.
- У пациентов, которым не показана АСКТ, следует рассмотреть возможность комбинированной терапии (химиотерапия и лучевая терапия), особенно при:
- Ранней стадии рецидива.
- Пациенты, ранее не получавшие лучевую терапию или у которых возник рецидив за пределами первоначального поля лучевой терапии.
- У пациентов, которые вряд ли перенесут токсичность, связанную с более интенсивными схемами, следует рассмотреть возможность паллиативного лечения либо одним препаратом, либо многокомпонентным пероральным режимом с внутривенным введением винбластина или без него.
- Рекомендуется заблаговременно рассмотреть вопрос о привлечении служб паллиативной помощи, особенно у пациентов, которым не показана терапия высокими дозами.
- Для пациентов, которые не реагируют на высокодозную химиотерапию с ASCT, брентуксимаб ведотин, паллиативную химиотерапию, немиелоаблативную аллогенную трансплантацию или участие в клиническом исследовании, следует рассмотреть возможность [7, 8] .
- Аллогенная трансплантация с использованием режима кондиционирования с пониженной интенсивностью является методом выбора для более молодых пациентов с подходящим донором и химиочувствительным заболеванием после неудачи ASCT.
- Второй аутологичный трансплантат является разумным клиническим вариантом у отдельных пациентов с поздним рецидивом после ASCT.
- Использование лучевой терапии следует рассматривать в случаях локального рецидива или рецидива в местах, где в клинической картине преобладает локальное заболевание.
- Только лучевая терапия спасения может считаться разумным вариантом лечения у отдельных пациентов, которым не показана АСКТ, особенно у пожилых пациентов с рецидивом лимфомы Ходжкина с благоприятным прогнозом и ограниченной стадией заболевания при рецидиве.
Последующее наблюдение
[2]- Пациенты обычно находятся под периодическим амбулаторным клиническим осмотром в течение двух-пяти лет после терапии первой линии. Нет доказанной роли рутинной контрольной КТ или ПЭТ/КТ у пациентов, которые в остальном хорошо переносят терапию первой линии.
- Пациенты должны быть осведомлены о том, что они подвержены повышенному пожизненному риску вторичных новообразований, сердечно-сосудистых и легочных заболеваний и бесплодия.
- Для снижения риска вторичных новообразований и сердечно-сосудистого риска следует предлагать регулярные рекомендации по образу жизни, включая полный отказ от курения и управление сердечно-сосудистыми рисками, такими как артериальная гипертензия, сахарный диабет и гиперлипидемия.
- Пациенты, перенесшие лучевую терапию шеи и верхнего средостения, должны регулярно проверять функцию щитовидной железы. Гипотиреоз может возникнуть до 30 лет после лучевой терапии.
- Пациенты должны всю оставшуюся жизнь получать только облученные продукты крови.
Осложнения
- Лейкемия, особенно острый миелоидный лейкоз, может возникнуть у пациентов, получающих химиотерапию или комбинированную химиотерапию и лучевую терапию.
- Вторые солидные опухоли, особенно толстой кишки, легких, костей, молочной железы и щитовидной железы, могут возникать у пациентов, получавших лучевую терапию с химиотерапией или без нее [9] .Скрининг рака следует проводить регулярно.
- Риск рака молочной железы наиболее высок у женщин, получавших наддиафрагмальную лучевую терапию (СРТ) в подростковом и юношеском возрасте, хотя в большинстве исследований с СЛТ показано повышение риска до 30-40 лет, которое сохраняется в течение не менее 20-25 лет после лечения [10] .
- Также был обнаружен повышенный риск развития меланомы, неходжкинской лимфомы, саркомы мягких тканей, рака слюнных желез и рака поджелудочной железы.
- Другие осложнения облучения включают гипотиреоз и сердечно-сосудистые заболевания.
- Другие осложнения химиотерапии включают мужское бесплодие и женское бесплодие.
Прогноз
- Как локализованная, так и запущенная лимфома Ходжкина излечимы у большинства пациентов.
- При использовании современных стратегий лечения 80-90% пациентов достигают стойкой ремиссии и могут считаться вылеченными [11] .
- Неблагоприятные прогностические признаки включают [12] :
- Увеличение опухолевой массы и распространение болезни.
- Старение.
- Муж.
- Конституциональные симптомы (необъяснимая лихорадка выше 38°C, проливной ночной пот и потеря веса).
- Анемия, лейкоцитоз, лимфопения, моноцитоз.
- Низкий уровень сывороточного альбумина.
- Увеличение СОЭ.
- Повышенный уровень бета-2-микроглобулина.
- Биогуморальные факторы (ИЛ-10, ИЛ-6, sCD30, TNF, TARC).
- Циркулирующая ДНК клеточного и вирусного (ВЭБ) происхождения.
- Генетический фон.
- Несмотря на высокие показатели излечения, у длительно выживших больных повышена смертность [2] :
- В течение первых 5-10 лет наблюдения основной причиной повышенной смертности является само заболевание, особенно в лица с неблагоприятным прогнозом.
- Однако смертность остается значительно повышенной более чем через 20 лет после лечения. Основными причинами долговременной нерецидивной заболеваемости и смертности являются вторичные новообразования и сердечные заболевания, а также легочные заболевания и инфекции.
Рецидивирующая болезнь Ходжкина, проявляющаяся клинически изолированным синдромом кавернозного синуса
История вопроса . Болезнь Ходжкина с поражением центральной нервной системы встречается редко и обычно наблюдается у пациентов с неконтролируемым системным заболеванием или у тех, у кого были множественные эпизоды рецидивирующего заболевания.Общими симптомами внутричерепной болезни Ходжкина являются моторные и/или сенсорные нарушения, головная боль, отек диска зрительного нерва, кома и судороги. Отмечается редкость болезни Ходжкина с внутричерепным поражением, но еще реже встречаются пациенты с синдромом кавернозного синуса. Несмотря на свою редкость, наличие синдрома кавернозного синуса у пациента с известным анамнезом болезни Ходжкина требует полного использования современных диагностических методов в плане исследования. Представление дела .У 34-летней женщины, у которой ранее была лимфома Ходжкина и которая в настоящее время находится в ремиссии в течение последних 7 лет, появились признаки и симптомы, указывающие на синдром левого кавернозного синуса. В остальном системно она была здорова, других жалоб не было. Обширные исследования не выявили очевидной причины синдрома кавернозного синуса. КТ грудной клетки выявила субклиническую подмышечную лимфаденопатию, которая при эксцизионной биопсии подтвердила рецидив болезни Ходжкина. Единственным клиническим проявлением рецидива заболевания у пациентки был синдром кавернозного синуса без каких-либо других клинически очевидных системных признаков или симптомов, указывающих на рецидив.Это лечили стероидами, и было отмечено клиническое улучшение; она была направлена в онкологию для обширной химиотерапии. Выводы . Несмотря на недостаток литературы по этой теме, клиницист должен помнить, что синдром кавернозного синуса может быть единственным клиническим проявлением рецидивирующей болезни Ходжкина. Несмотря на то, что сообщалось, что лимфоматозное поражение головного мозга обычно происходит на поздних стадиях заболевания, этот случай свидетельствует о том, что синдром кавернозного синуса может предшествовать другим системным признакам и симптомам.Признание этой возможности обеспечит тщательный поиск болезни Ходжкина, раннюю и эффективную диагностику и лучший прогноз у пораженных пациентов.
1. Актуальная информация
Болезнь Ходжкина (БХ) с поражением центральной нервной системы (ЦНС) встречается редко и обычно наблюдается у пациентов с неконтролируемым системным заболеванием или у пациентов с множественными эпизодами рецидивирующего заболевания. [1] Не было идентифицированных факторов риска развития БХ с внутричерепным поражением.Будь то при первоначальном проявлении или при рецидиве, возникновение внутричерепной ГБ без явных признаков заболевания в другом месте очень редко. В то время как в литературе признается редкость БХ с симптомами со стороны ЦНС (особенно в отличие от неходжкинской болезни, которая часто проявляется в ЦНС), пациенты с синдромом кавернозного синуса (КСС) встречаются еще реже. Есть только 2 других задокументированных взрослых пациента с HD в стадии ремиссии, у которых был рецидив в кавернозном синусе [2], и ни одного взрослого случая первичной HD с изолированным CSS.Все наши знания по этой теме ограничены отдельными сообщениями о случаях у пациентов с характерными признаками. Клинически у нашего пациента была только ССГ без каких-либо других системных признаков или симптомов, указывающих на рецидив БХ.
2. Описание клинического случая
34-летняя женщина обратилась с жалобами на прогрессирующую левостороннюю головную боль в течение 8 дней, возникающую вокруг глаза и иррадиирующую назад. Она также сообщила о шестидневном ухудшении горизонтальной диплопии при бинокулярном зрении и недавней тошноте.Других конституциональных симптомов не было.
У нее десять пачек курения в год, в остальном у нее трезвые социальные привычки. В анамнезе ранее она лечилась от лимфомы Ходжкина (ЛХ), достигнув ремиссии в 2009 г. В мае 2007 г. ей был поставлен диагноз ЛХ стадии IIA, и она получила шесть циклов химиотерапии ABVD с последующей химиотерапией DHAP и лучевой терапией пораженного поля. терапия. В феврале 2009 года у нее случился рецидив ЛХ, который был вылечен шестью циклами химиотерапии ОПЕК.ПЭТ-сканирование после этого лечения не выявило дальнейшего активного заболевания. Ни в одной из этих презентаций неврологические нарушения отсутствовали. Затем она ежегодно посещала онкологическую бригаду, пока ее не выписали в 2014 году, и считалось, что она находится в состоянии ремиссии. С тех пор она оставалась бессимптомной.
При осмотре она выглядела как здоровая молодая женщина без каких-либо заметных аномалий, отмеченных при общем, дыхательном или сердечно-сосудистом обследовании. Следует отметить, что не было пальпируемых лимфатических узлов во всем мире.Нейроофтальмологическое исследование выявило нормальную остроту зрения и поля зрения, а глазное дно было нормальным, без признаков экзофтальма или хемоза. Неврологическое обследование при поступлении выявило паралич левого отводящего нерва и левостороннюю потерю чувствительности тройничного нерва в первом и втором отделах. В остальном неврологический осмотр изначально был нормальным; однако в течение нескольких дней после госпитализации ее симптомы прогрессировали и затронули также глазодвигательный нерв слева. Это сопровождалось усилением боли, что соответствовало поражению левого кавернозного синуса.
При обследовании: обширный анализ крови показал лишь незначительное повышение СОЭ 26 при поступлении. Общий анализ крови, функция почек и печени, функция щитовидной железы, бета-D-глюкан, скрининг на ВИЧ и сифилис, скрининг на гепатит и аутоиммунный скрининг были нормальными и отрицательными. Люмбальная пункция показала нормальный анализ спинномозговой жидкости, включая цитологию и проточную цитометрию. МРТ головного мозга подтвердила наличие аномального контраста и расширения левого кавернозного синуса и паракавернозной твердой мозговой оболочки, простирающихся до верхушки орбиты и кзади от места прикрепления тенториального хряща (рис. 1).Нейрохирургическая бригада не хотела проводить биопсию кавернозного синуса до того, как будет проведено дальнейшее системное обследование. КТ шеи, грудной клетки, брюшной полости и таза выявила субклиническую кластерную правую подмышечную лимфаденопатию (максимальный диаметр 15 мм) как единственную находку. На маммограмме был отмечен комплекс подмышечных лимфатических узлов, но в остальном все было нормально. Эксцизионная биопсия правых подмышечных лимфатических узлов выявила рассеянные клетки Рида-Штернберга с выраженными макронуклеолами, с положительными CD30 и CD15, отмеченными при иммуногистохимии атипичных клеток.
У больного диагностирована рецидивирующая лимфома Ходжкина (узелково-склерозирующая). Она получила внутривенные стероиды для лечения синдрома левого кавернозного синуса, который клинически разрешился в течение пяти дней, и была направлена в онкологию для дальнейшего лечения, которого она в настоящее время ожидает. Повторная МРТ головного мозга после клинического улучшения не проводилась.
3. Обсуждение и выводы
Синдром кавернозного синуса (CSS) определяется как офтальмоплегия, хемоз, экзофтальм, синдром Горнера или потеря чувствительности тройничного нерва вследствие патологических изменений в кавернозном синусе или вокруг него [1].В связи с тем, что несколько черепных нервов, включая глазодвигательный, блоковый, отводящий, а также глазную и верхнечелюстную части тройничного нерва, могут быть полностью или частично вовлечены в этот синдром, существует ряд клинических признаков, которые могут быть выявлены. Тем не менее, диагноз может быть поставлен клинически с достаточной уверенностью при наличии комбинации поражений этих черепных нервов. Причин много, в основном из-за инфекционного или неинфекционного воспаления, сосудистых, травматических и опухолевых процессов (табл. 1) [1].
| ||||||||||||||||||||||||||||||||||||||||||||||||||
Ретроспективные и проспективные когортные исследования предполагают, что поражение ЦНС происходит в 0.от 2% до 0,5% пациентов с системным ГБ [3]. В обзоре 2 больших серий, включавших 780 и 2185 пациентов, частота интракраниального вовлечения ГБ составила всего 0,4% и 0,5% соответственно [3,4]. Основными участками поражения головного мозга были паренхима (64%) и твердая мозговая оболочка (19%) [5]. Механизм метастазирования в головной мозг заключается либо в прямом прорастании опухоли через кости черепа, либо в системной гематогенной диссеминации, причем последний встречается наиболее часто [6].
Наиболее распространенными симптомами внутричерепной ГБ со стороны ЦНС являются двигательные и/или чувствительные нарушения, головная боль, отек диска зрительного нерва, кома и судороги [7].
Поражения ЦНС при БХ представляют собой диагностическую дилемму ввиду редкого поражения головного мозга болезнью Ходжкина. Несмотря на свою редкость, наличие признаков и симптомов CSS у пациента с известным анамнезом HD требует полного использования современных диагностических методов. Связь ВПС с лимфатическими узлами, костями и легкими указывает на то, что обследование при подозрении на ВПС должно включать как минимум тщательный сбор анамнеза и физикальное обследование, исследование крови и спинномозговой жидкости, визуализацию головного мозга, грудной клетки, брюшной полости и таза. и кости, или ПЭТ [4].Следует отметить, что существует определенная подгруппа пациентов, у которых развивается болезненная офтальмоплегия из-за неспецифического воспалительного процесса в области кавернозного синуса, и которые хорошо реагируют на лечение стероидами [8]. У этих пациентов есть заболевание, известное как синдром Толоса-Ханта. Хотя патогенетическая основа синдрома Толоса-Ханта остается неизвестной, с практической клинической точки зрения его можно рассматривать как отдельную сущность, которая может симулироваться различными другими расстройствами и является диагнозом исключения после тщательного поиска других причин [8]. .Если бы эта пациентка не прошла обширное обследование, как упоминалось выше, у нее мог бы быть ошибочно диагностирован синдром Толосы-Ханта.
Несмотря на недостаток литературы по этой теме, клиницист должен помнить, что синдром кавернозного синуса может быть единственным клиническим проявлением рецидивирующей болезни Ходжкина. Несмотря на то, что сообщалось, что лимфоматозное поражение головного мозга обычно происходит на поздних стадиях заболевания, этот случай свидетельствует о том, что CSS может предшествовать другим системным признакам и симптомам.Признание этой возможности обеспечит тщательный поиск БХ, раннюю и эффективную диагностику и лучший прогноз у пораженных пациентов.
Сокращения
| HD: болезнь | Ходжкина |
| ЦНС: | Центральная нервная система |
| УС: | кавернозного синуса Синдром |
| ABVD: | адриамицин / блеомицин / винбластин / Дакарбазин |
| DHAP: | Дексаметазон / высокие дозы aracytarabine / Platinol |
| ОПЕК: | винкристин / преднизолон / этопозид / хлорамбуцил |
| ПЭТ: | позитронно-эмиссионной томографии |
| ICHD: | Внутричерепная болезнь Ходжкина |
| СОЭ: | Скорость оседания эритроцитов |
| ВИЧ: | Вирус иммунодефицита человека. |
Доступность данных
Данные пациентов, использованные для подтверждения результатов этого исследования, можно получить у соответствующего автора по запросу.
Согласие
От пациента получено письменное информированное согласие на публикацию клинических данных и любых сопутствующих изображений.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Авторы хотели бы поблагодарить пациента за щедрое разрешение на использование данных в этом отчете.
Клиническая картина и стадирование лимфомы Ходжкина
https://doi.org/10.1053/j.seminhematol.2016.05.005Get rights and contentAbstract
В настоящей главе авторы представляют краткий обзор методов диагностики, предложенных на протяжении время для обнаружения распространения лимфомы Ходжкина (HL), переходя от хирургических процедур через стандартные радиологические и функциональные методы визуализации к современному уровню техники для стадирования HL. Основная часть обзора будет посвящена недавно опубликованным рекомендациям по стадированию лимфом (включая ЛХ), согласованным экспертами в ходе 12-го Международного конгресса по злокачественным лимфомам в Лугано.Будут представлены и прокомментированы рекомендации комиссии о том, как интегрировать позитронно-эмиссионную томографию с фтордезоксиглюкозой (ФДГ-ПЭТ) в арсенал процедур стадирования, с особым акцентом на полезность специальных процедур, таких как трепанобиопсия костного мозга, которые считается, что в эпоху ПЭТ больше не требуется. В то время как диагноз ЛХ в большинстве случаев не вызывает затруднений, иногда ЛХ является малозаметным заболеванием, которое трудно диагностировать из-за малочисленности симптомов, отсутствия физикальных данных или сопутствующих иммунологических нарушений: полный обзор частых и редких паттернов клинической картины ЛХ. также будет предложена презентация.Будущая перспектива использования ПЭТ-сканирования будет основываться на независимых от оператора количественных показаниях сканирования благодаря множеству сложных специализированных программ, которые в настоящее время доступны и способны количественно оценить каждый воксель, захваченный опухолью, для отображения метаболически активной опухоли. объем. Кроме того, в настоящее время доступны новые индикаторы, способные отслеживать новые пути клеточного метаболизма помимо гликолиза, такие как аминокислоты, аналоги пуринов или специфические онкопротеины; будут представлены предварительные многообещающие результаты.Также будут представлены предварительные результаты других методов визуализации, таких как диффузионно-взвешенная магнитно-резонансная томография (ДВ-МРТ).
Ключевые слова
Лимфома Ходжкина
Презентация
Постановка
ПЭТ
Рекомендуемые статьиСсылки на статьи (0)
Показать полный текст© 2016 Elsevier Inc. Все права защищены.
Рекомендуемые статьи
Со ссылкой на статьи
Неходжкинская лимфома с поражением позвоночника
История болезни 1 поражение одного или нескольких внелимфатических органов с поражением или без поражения лимфатических узлов).На момент постановки диагноза было обнаружено поражение узлов в надключичной и подмышечной областях и на шее; в брюшной полости была выраженная спленомегалия, а стернальная пункция выявила поражение костного мозга. Рестадирование после химиотерапии циклофосфамид-винкристин-преднизоном (ЦВП) и циклофосфамид-эпирубицин-винкристин-преднизон (ЦЭОП) в течение 10 мес показало отсутствие патологического узла при компьютерной томографии (КТ).
Через год после установления диагноза больная обратилась в отделение гематологии с внезапно возникшей болью в пояснице и радикулитом в правой ноге.Жалобы разрешились после лечения нестероидными противовоспалительными препаратами (НПВП). Три недели спустя у нее развился рецидив ишиаса с дизестезией и нарушением чувствительности правой ноги и прогрессирующим парезом правой ноги, однако системных признаков в то время не было. По клиническим признакам был поставлен диагноз острого ишиаса и начато лечение пероральным преднизолоном в дозе 20 мг ежедневно. Несмотря на лечение, поступила в экстренном порядке с острым парезом правой ноги.
При клиническом обследовании выявлен парез правой четырехглавой мышцы и передней большеберцовой мышцы. Это совместимо с участием уровней L4, L5 и S1. Тест на растяжение седалищного нерва был положительным при 30° (справа) и 50° (слева), пателлярный рефлекс справа отсутствовал, с индифферентным симптомом Бабинского и дефицитом чувствительности в правой голени и пятке. При перкуссии позвоночника выявлена болезненность от пятого поясничного позвонка до крестцовой области; антефлексия позвоночника была ограничена болью.Рентгенологическое исследование показало нормальный поясничный отдел позвоночника; на КТ межпозвонковых дисков поясничного отдела грыж не было видно, а сцинтиграфия костей всего тела 99m Tc была нормальной. Электромиография голеней выявила острую денервацию L4-L5-S1 справа и L5-S1 слева, совместимую с полирадикулопатией в сочетании с лежащей в основе полинейропатией, скорее всего, связанной с предшествующей химиотерапией. Люмбальная пункция показала злокачественные клетки с высокой степенью гистологии.На тот момент магнитно-резонансная томография (МРТ) позвоночника выявила диффузный арахноидит от уровня D11-D12 до пояснично-крестцового отдела. МРТ головного мозга в норме. Лечение высокими дозами кортикоидов и спинальная терапия (метотрексат, Ара-С) вызывали регресс числа злокачественных клеток, но не контролировали заболевание. Лучевая терапия позвоночника была прервана в связи с развившимся справа периферическим парезом лицевого нерва. Больной умер через четыре месяца после возникновения ишиаса.
История болезни 2
У 42-летнего мужчины в течение года была центробластная В-лимфома высокой степени злокачественности 3В стадии (поражение лимфатических узлов с обеих сторон диафрагмы и В-симптомы: зуд, ночная потливость, потеря) с объемным тазовым образованием. Его лечили индукционной химиотерапией адриабластин-циклофосфамид-виндезин-блеомицин-преднизолон (ACVBP) вместе с профилактикой лейкемического менингита (метотрексат) и консолидирующей терапией (ифосфамид-этопозид-Ara-C).Повторная оценка, проведенная за месяц до этого, выявила образование в области малого таза, не связанное с галлием, и узловатую селезенку. Биопсия этого тазового образования под контролем КТ показала только фиброзную ткань. Больному планировалась спленэктомия, когда у него внезапно развился ишиатический болевой синдром правой ноги.
При клиническом обследовании: положительный тест на растяжение седалищного нерва правой ноги (50°) без парезов и дефицита чувствительности. На обзорных рентгенограммах поясничного отдела позвоночника признаки дископатии на уровне L5-S1. 99m Tc Сцинтиграфия костей всего тела не выявила отклонений. Лечение НПВП и релаксационная терапия в течение одной недели не дали полного купирования жалоб, и было выполнено эпидуральное введение кортикостероидов. Через неделю у него развился прогрессирующий парез правой ноги с отсутствием ахиллова сухожильного рефлекса. Люмбальная пункция исключила лимфоматозный менингит. МРТ позвоночника показала локализованное образование в области таза с эпидуральной спинальной инфильтрацией на уровне L5-S1 и S1-S2 (рис. 1 и рис. 2).Начата лучевая терапия пораженного поля в сочетании с химиотерапией дексаметазон-Ара-С-цисплатином (ДГАП). Ишиас и парез быстро разрешились. После четырех курсов химиотерапии была проведена трансплантация периферических стволовых клеток, но через четыре месяца произошел рецидив лимфомы с вовлечением печени. На сегодняшний день у пациента нет ишиаса, но его общее состояние плохое, и его прогноз очень ограничен.
Рисунок 1Лимфоматозная инвазия позвоночника (второй случай).Сагиттальная Т1-взвешенная МРТ показывает слабый сигнал в телах позвонков S1 и S2 (стрелки).
Рисунок 2На аксиальном Т1-взвешенном изображении (второй случай) на уровне S1 показана опухоль, окружающая корешок S1 справа (большие стрелки). Обратите внимание на нормальный контралатеральный нервный корешок S1 (маленькая стрелка).
Обсуждение
Боль в пояснице и корешковые боли являются частыми жалобами, наиболее частой причиной которых является грыжа межпозвонкового диска. Другие причины включают чрезмерный рост кости, вклинившейся в позвоночный канал, спинальный стеноз, переломо-вывих позвоночника, инфекции и новообразования.1
Два пациента, описанные в этой статье, которые были госпитализированы с клиническими признаками поясничной грыжи диска, страдали злокачественной эпидуральной неходжкинской лимфомой.
Лимфомы представляют собой гетерогенную группу злокачественных новообразований из В- или Т-клеток, которые обычно возникают в лимфатических узлах, но могут возникать в любом органе тела.2 Экстранодальное заболевание является неблагоприятным прогностическим фактором, особенно поражением ЦНС ).3 От 5% до 10% пациентов с лимфомой узлового типа может развиться поражение ЦНС.Промежуточный или высокий гистологический тип неходжкинской лимфомы и наличие основного иммунодефицита являются наиболее значимыми факторами риска вторичного поражения ЦНС.4 Проявления ЦНС могут включать компрессию спинного мозга, лептоменингеальное распространение или внутримозговые объемные образования. Кроме того, следует учитывать другие механизмы невропатии, такие как эффекты химиотерапии.
Компрессия спинного мозга — редкое проявление неходжкинской лимфомы, возникающее в 0.от 1% до 3,3% пациентов. Это обычно вызвано экстрадуральным заболеванием либо из-за изолированного отложения в позвоночном канале, либо из-за распространения из соседнего узлового образования или вовлечения кости. Реже неходжкинская лимфома может возникать субдурально или внутри спинного мозга. Компрессия спинного мозга обычно проявляется болью в спине, онемением и покалыванием в ногах, корешковой болью с последующей слабостью конечностей, парезом и параличом, но также может протекать бессимптомно. 3
Пациент, описанный во втором случае, поступил с экстрадуральной компрессией спинного мозга, вызванной объемным забрюшинным заболеванием, связанным с ранее диагностированной неходжкинской лимфомой.Предлежание больного в первом случае встречается значительно реже в виде интрадурального поражения позвоночника, и что особенно интересно, представляет собой многокорневое предлежание. Как и у описанных пациентов, компрессия спинного мозга, вызванная неходжкинской лимфомой, может быть диагностирована с помощью КТ или МРТ, или того и другого. Изменения костей позвонков наблюдаются только у 30% пациентов с симптомами компрессии спинного мозга. Пациентам, которые продолжают страдать от ишиаса, несмотря на консервативное лечение, показаны дополнительные диагностические тесты для регистрации основной причины.Особенно у пациентов с лимфомой в анамнезе и неврологическими симптомами при отсутствии аномалий на обычных рентгенограммах строго показано выполнение МРТ позвоночника. Следовательно, контрольная визуализация позвоночника у пациентов в ремиссии в настоящее время не проводится, но показана в момент системного рецидива или при появлении новой неврологической симптоматики.6 МРТ является хорошим методом для просмотра спинного мозга и полезна для оценки механических нарушений пояснично-крестцового отдела позвоночника, а также для определения степени экстрадуральной инвазии опухоли в спинномозговой канал и сдавления или смещения спинного мозга. Однако этот метод обычно не доступен в Бельгии, что приводит к существованию длинных списков ожидания. По этой причине первому пациенту было проведено МРТ-обследование только через три недели после КТ.
В этом отчете показано, что, несмотря на наличие новых методов ранней диагностики, может быть трудно дифференцировать изначально «доброкачественный» острый ишиас от серьезных состояний в виде изолированного опухолевого поражения ЦНС при отсутствии распространенного заболевания.
Урок
Выполнение тотальной сцинтиграфии костей 99m Tc не всегда полезен как метод у пациентов с корешковой болью и подозрением на лимфому, поскольку эпидуральное поражение спинного мозга не может быть выявлено с помощью сканирования костей или КТ. Если клиническое подозрение на злокачественность остается высоким, следует рассмотреть вопрос о дальнейшем обследовании, если сканирование костей отрицательно.
Хотя поражение ЦНС наиболее часто описывается при неходжкинской лимфоме средней и высокой степени злокачественности, у пациентов с лимфомой низкой степени злокачественности в анамнезе может случайно развиться такое поражение.У пациентов с лимфомой в анамнезе и неврологическими симптомами необходимо выполнить МРТ позвоночника, и это метод выбора, поскольку он позволяет идентифицировать поражения спинного мозга, не видимые другими рентгенологическими методами.
Хотя эпидуральное поражение позвоночника является редким проявлением неходжкинской лимфомы, оно может быть единственным симптомом лимфомы и должно учитываться у каждого пациента с клиническими проявлениями острого ишиаса, не купируемыми традиционным лечением.
Границы | Неходжкинская лимфома, представляющая собой изолированный перитонеальный лимфоматоз: клинический случай и обзор литературы
Введение
Неходжкинская лимфома (НХЛ) включает более 90 различных генотипов гематологических злокачественных новообразований. Около 90% случаев НХЛ имеют В-клеточное происхождение, чаще всего наблюдаемое при диффузной крупноклеточной В-клеточной лимфоме (ДВККЛ) (1). ДВККЛ была описана в любой части тела, чаще всего при узловом (обычно шейном или абдоминальном) или экстранодальном поражении, а экстранодальное поражение встречается примерно в 40% случаев ДВККЛ (2, 3).Однако перитонеальный лимфоматоз (ПЛ), которому уделяется гораздо меньше внимания, чем перитонеальному карциноматозу, и который чаще неправильно диагностируется, обычно относящийся к диффузной В-клеточной лимфоме, относится к обсеменению париетальной брюшины и поверхности покрытых органов брюшной полости лимфомными клетками (4). ). Наиболее частыми клиническими симптомами перитонеального лимфоматоза являются боль в животе, вздутие живота и потеря веса (5). Мы описываем случай подростка, у которого по клинической картине, напоминающей туберкулезный перитонит и перитонеальный карциноматоз, впоследствии была диагностирована неходжкинская В-клеточная лимфома с изолированным поражением брюшины.
Описание клинического случая
Мальчик 16 лет поступил в нашу клинику с 10-дневным анамнезом вздутия живота и болей в эпигастрии, сопровождающихся анорексией, тошнотой, рвотой, одышкой, сердцебиением, а также субфебрильной температурой и ночным потливость. Он всегда был в добром здравии, без каких-либо серьезных заболеваний или злокачественных новообразований в семейном анамнезе.
При физикальном обследовании у пациента выявлены тахикардия, напряжение в животе, болезненность, рикошетная болезненность в верхнем квадранте и меняющаяся притупленность.Никаких пальпируемых образований и отеков конечностей не отмечалось. Ни лимфаденопатии, ни гепатоспленомегалии не выявлено.
Показатели периферической крови повышены: лейкоциты 10,71×10 9 /л (референсный диапазон: 3,50–9,50×10 9 /л), нейтрофилы 8,03×10 9 /л (референтный диапазон: 1,80–6,30 ×10 9 /л) и моноцитов 1,10×10 9 /л (референсный диапазон: 0,10–0,60×10 9 /л). Показатели лимфоцитов, гемоглобина и тромбоцитов были в норме. Анализ кала на скрытую кровь положительный.Лабораторные тесты выявили высокий уровень мочевой кислоты 1240,2 мкмоль/л (референсный диапазон: 208,0–506,0 мкмоль/л), значение аспартатаминотрансферазы 57 ЕД/л (референтный диапазон: 15–46 ЕД/л) и уровень углеводов в сыворотке крови. значение антигена 125 758 ЕД/мл (референтный диапазон, <35 ЕД/мл). Другие значения азота мочевины крови, креатинина, электролитов, вируса Эпштейна-Барра (ВЭБ), вируса иммунодефицита человека (ВИЧ), а также других онкомаркеров (раково-эмбриональный антиген, углеводный антиген 19-9 и альфа-фетопротеин) и маркеров гепатита были отрицательными.Ассистентские исследования, связанные с туберкулезом (туберкулиновая кожная проба, тест T-SPOT и антитела IgG к туберкулезу), были отрицательными. Дополнительно выполняли абдоминоцентез и исследование асцитической жидкости. Оранжево-желтая мутная жидкость с преобладанием мононуклеарных клеток свидетельствует об экссудате.
Компьютерная томография (КТ) шейно-грудного отдела и всей брюшной полости без вовлечения кишечника, опухолевых образований или увеличения лимфатических узлов выявила диффузное утолщение брюшины и сальника, грудной, брюшной и тазовый выпот (рис. 1), воспаление в нижней доле правое легкое, полосчатая тень ворот печени и гепатогастрального пространства, расширение внутрипеченочных желчных протоков, а также отек и утолщение стенки желчного пузыря.Во время пандемии коронавирусной болезни 2019 (COVID-19), поскольку состояние пациента прогрессивно ухудшалось, нам не удалось провести эндоскопию желудочно-кишечного тракта. Результат биопсии костного мозга отрицательный на злокачественность. Наконец, пациент прошел хирургическую лапароскопию, чтобы определить причину. Биопсия большого сальника показала диффузное утолщение брюшины и узелковую инфильтрацию сальника, что соответствовало агрессивному типу неходжкинской В-клеточной лимфомы. Иммуногистохимическое окрашивание впоследствии показало положительный результат на CD10, CD20, PAX-5 и c-myc с пролиферативной фракцией 90% (рис. 2), отрицательный результат на CD3, CD56, CD138 и Mum-1, что свидетельствовало в пользу диагноза диффузная крупноклеточная В-клеточная лимфома, В-клеточный тип зародышевого центра, IV стадия.
Рисунок 1 КТ до лечения. Аксиальные (A) , аксиальные (B) и коронарные (C) улучшенные КТ-изображения брюшной полости и таза в портальной фазе. Отмечены обширный асцит (звездочки), утолщение брюшины (красная стрелка) и заметное утолщение сальника (белые стрелки). Увеличенных лимфатических узлов не отмечено.
Рисунок 2 Гистопатология биоптата утолщения сальника. (A) Окрашивание гематоксилин-эозином показало диффузную инфильтрацию опухолевых лимфоидных клеток (400×).Опухолевые клетки были иммунореактивны в отношении (B) CD20, (C) CD10, (D) и экспрессировали высокий индекс Ki-67 (почти 90%) (400×).
Принимая во внимание возможность диагноза перитонеального карциноматоза, пациент сначала получил три курса гипертермической внутрибрюшинной химиотерапии, а затем пять циклов циклофосфамида, доксорубицина, винкристина и преднизолона (СНОР) с ритуксимабом. Во время первого курса химиотерапии у пациента появились признаки и симптомы синдрома лизиса опухоли, включая олигурию, гиперурикемию, гиперкалиемию, гиперфосфатемию и гипокальциемию.Последующее повторное КТ показало ремиссию его состояния (рис. 3). Позднее через 4 месяца после химиотерапии была завершена аутологичная трансплантация стволовых клеток периферической крови. К сожалению, через 4 месяца после трансплантации стволовых клеток крови у пациента развился рецидив, и ему был назначен режим цисплатина, дексаметазона и высоких доз цитарабина (DHAP) с ритуксимабом одновременно с интратекальной химиотерапией (метотрексат, цитарабин, дексаметазон). В конце концов, пациент страдал тяжелым угнетением костного мозга, отказался от всех видов лечения из-за финансовых трудностей и умер через 10 месяцев после первоначального диагноза.
Рисунок 3 КТ после лечения. Аксиальные (A) , аксиальные (B) и корональные (C) усиленные КТ-изображения брюшной полости и таза в портальной фазе после лечения продемонстрировали разрешение асцита, утолщение брюшины и сальника исчезли и превратились в нормальная форма.
Обсуждение
Перитонеальный лимфоматоз (ПЛ), который описан и объяснен в нескольких прошлых случаях и исследованиях (см. Таблицу 1), всегда обнаруживается у пациентов с ДВККЛ и лимфомой Беркитта и чаще встречается у мужчин.Существуют различия в возрастном распределении, но в основном они обнаруживаются у детей и пожилых людей (4, 5, 11–13). Самый молодой случай, о котором сообщалось до сих пор, был 3-летним младенцем (14). Насколько нам известно, это первое сообщение об изолированном перитонеальном лимфоматозе с ДВККЛ у подростка. Как и в нашем случае, большинство пациентов с ПЛ преимущественно жалуются на боль в животе, вздутие живота и потерю веса (5, 8, 11), хотя эти клинические проявления неспецифичны.
Таблица 1 Обзор литературы по перитонеальному лимфоматозу.
Обычно существует два пути перитонеальной инвазии злокачественной лимфомы (10). Во-первых, первичная выпотная лимфома (ПЭЛ), редкое В-клеточное злокачественное новообразование, связанное с инфекцией, ассоциированной с саркомой Капоши/вирусом герпеса человека 8 (KSHV/HHV-8) и коинфекцией ВЭБ или ВИЧ, чаще всего возникает у пациентов с ослабленным иммунитетом. Основной характеристикой ПЭЛ являются опухолевые выпоты в полостях тела без какой-либо обнаруживаемой опухоли (15–17). Во-вторых, поражение брюшины может возникать вторично по отношению к поражениям пищеварительного тракта или абдоминальных лимфатических узлов (18).Более того, поскольку сальник не содержит лимфоидной ткани, лимфома редко поражается. Хотя путь диссеминации не ясен, возможные пути — желудочно-ободочная связка, поперечная брыжейка толстой кишки и висцеральные поверхности брюшины (12, 19). В нашем случае мы обсуждаем молодого подростка с изолированной ЛП, главным образом учитывая, что его КТ и последующая визуализация не выявили никаких доказательств, указывающих на первичное поражение кишечника и лимфатических узлов. По классификации относится к ПЭЛ, но у больного отсутствовали признаки иммунодефицита и инфицирования ВЭБ или ВИЧ.Ограничением этого исследования является то, что наш пациент не проходил эндоскопию из-за ухудшения состояния во время пандемии COVID-19. Таким образом, мы не можем полностью исключить возможность инфильтрации первичной кишечной лимфомы брюшины и сальника.
Дифференциальный диагноз утолщения брюшины включает перитонеальный лимфоматоз, перитонеальный карциноматоз, туберкулезный перитонит, мезотелиому и метастатические опухоли, такие как карциномы яичников, молочной железы и желудочно-кишечного тракта (20, 21).PL имеет общие характеристики визуализации с карциноматозом брюшины и туберкулезом, содержащим асцит, утолщение брюшины и сальника (22). В более раннем исследовании сообщалось об отличительных КТ-признаках перитонеального лимфоматоза, включая асцит без локализации или перегородок и диффузно увеличенные лимфатические узлы (21). Кабрал и др. предположили, что отсутствие поражения желудочно-кишечного тракта не является признаком перитонеального лимфоматоза и что диффузное увеличение лимфатических узлов, гладкое утолщение мягких тканей брюшины или объемные гомогенные образования, а также визуализирующие признаки поражения экстранодальной лимфомы являются полезными признаками перитонеального лимфоматоза (19).Визуализирующие признаки лимфоматоза, а не карциноматоза, включают лимфаденопатию, большое образование брыжейки и спленомегалию (22). Позитронно-эмиссионную томографию или компьютерную томографию (ПЭТ-КТ) можно использовать для дифференциации того, вызван ли асцит злокачественными образованиями (23). Он показывает, что гиперметаболическая активность утолщения брюшины может способствовать отбору образцов, особенно при ДВККЛ и лимфоме Беркитта (24, 25). КТ/ПЭТ-КТ может быть первым выбором для выявления таких заболеваний.В нашем случае, поскольку нашему пациенту было решено пройти биопсию сальника, он не прошел ПЭТ-КТ, что ограничивало достоверность диагнозов относительно того, была ли болезнь изолирована от брюшины или была частью более генерализованной лимфомы. . Его компьютерная томография показала диффузное утолщение брюшины и сальника с асцитом большого объема, что отражало общие признаки перитонеального лимфоматоза и перитонеального карциноматоза. На снимке нашего пациента не было обнаружено увеличения лимфатических узлов или спленомегалии в пользу лимфоматоза.При этом желудочно-кишечный тракт и органы пищеварения были в норме, поэтому исключить ни одно из заболеваний мы не могли.
Поскольку результаты визуализации неспецифичны, было доказано, что только патология может поставить окончательный диагноз (26). Аатира и др. сообщили о случае перитонеального туберкулеза, который был подтвержден как лимфома Беркитта при биопсии сальника и костного мозга (11). В другом исследовании сообщалось о редком проявлении фолликулярной лимфомы, имитирующей перитонеальный карциноматоз, а биопсия увеличенного надключичного лимфатического узла соответствовала фолликулярной лимфоме (8).Кроме того, гистология считается хорошим критерием диагностики перитонеального лимфоматоза, потому что цитология не всегда доступна, а лимфома может выявить ярко выраженную мезотелиальную гиперплазию, что приводит к неточным результатам и удлиняет диагностический процесс (27, 28). Принимая во внимание анамнез, результаты визуализации и анализ асцита, первоначальные возможности нашего случая включали перитонеальный туберкулез и перитонеальный карциноматоз. Удивительно, но мы быстро взяли биопсию сальника, и в конце концов это было подтверждено как неходжкинская В-клеточная лимфома.
Перитонеальный лимфоматоз встречается редко и агрессивно. Основываясь на этом предыдущем опыте и обзорах литературы, схемы химиотерапии для перитонеальной лимфомы аналогичны схемам для ДВККЛ с использованием CHOP с ритуксимабом или без него в зависимости от стадии (5, 10). Сообщается, что 25% случаев перитонеального лимфоматоза имеют хороший ответ на химиотерапию и прогноз (11, 29). И наоборот, ДВККЛ ведет себя агрессивно и имеет плохой прогноз. При отсутствии лечения медиана выживаемости составляет менее 1 года (30).Поэтому необходимо распознать это редкое заболевание, чтобы как можно раньше поставить патологический диагноз и обеспечить своевременное начало правильного лечения.
В заключение, ЛП является редким проявлением экстранодального поражения лимфомы с известным неблагоприятным прогнозом. При отсутствии характерных клинических проявлений и специфической визуализации ПЛ часто неправильно диагностируется, а задержка диагноза снижает возможность оптимального лечения и шансы на выживание. В таких неоднозначных случаях ранняя гистологическая диагностика является основным инструментом быстрого и эффективного лечения.
Заявление о доступности данных
Первоначальные материалы, представленные в исследовании, включены в статью/дополнительный материал. Дальнейшие запросы можно направлять соответствующим авторам.
Заявление об этике
Этическая экспертиза и одобрение исследования с участием людей не требовались в соответствии с местным законодательством и институциональными требованиями. Письменное информированное согласие на участие в этом исследовании было предоставлено законным опекуном/ближайшим родственником участников.Письменное информированное согласие было получено от физического лица (лиц) и законного опекуна несовершеннолетнего (несовершеннолетних) / ближайших родственников на публикацию любых потенциально идентифицируемых изображений или данных, включенных в эту статью.
Вклад авторов
MZ провел сбор данных и написал первоначальный проект. ZW, ZY, BN, SY и HY внесли свой вклад в уход за пациентом и сделали критический пересмотр рукописи. XG внес свой вклад в описание патологии и изображения. HY и XG внесли свой вклад в окончательную версию рукописи.Все авторы внесли свой вклад в статью и одобрили представленную версию.
Финансирование
Эта работа была поддержана программой Kuanren Talents Program Второй дочерней больницы Медицинского университета Чунцина и Программой молодых медицинских высококлассных резервных талантов Чунцина (до HY).
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Примечания издателя
Все претензии, изложенные в этой статье, принадлежат исключительно авторам и не обязательно представляют претензии их дочерних организаций или издателя, редакторов и рецензентов. Любой продукт, который может быть оценен в этой статье, или претензии, которые могут быть сделаны его производителем, не гарантируются и не поддерживаются издателем.
Ссылки
2. Møller M, Pedersen N, Christensen B. Диффузная крупноклеточная B-клеточная лимфома: клинические последствия экстранодальной по сравнению с узловой презентацией – популяционное исследование 1575 случаев. Br J Haematol (2004) 124(2):151–9. doi: 10.1046/j.1365-2141.2003.04749.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
3. Mey U, Hitz F, Lohri A, Pederiva S, Taverna C, Tzankov A, et al. Диагностика и лечение диффузной крупноклеточной В-клеточной лимфомы. Swiss Med Wkly (2012) 142:w13511. doi: 10.4414/smw.2012.13511
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
4. Чуракова Е., Генадиева-Димитрова М., Мисевски Дж., Калошка-Иванова В., Андреевский В., Тодоровская Б. и др.Неходжкинская лимфома перитонеальной локализации. Case Rep Gastrointest Med (2014) 2014:723473. doi: 10.1155/2014/723473
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
5. Флорес Э., Айдин Н., Ву Д., Мисра С. Серия случаев диффузной крупноклеточной В-клеточной лимфомы и лимфомы Беркитта с перитонеальным лимфоматозом. Int J Surg Case Rep (2016) 28:262–5. doi: 10.1016/j.ijscr.2016.10.007
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
6.Вонг С., Санчес Т., Свищук Л., Хуанг Ф. Диффузный перитонеальный лимфоматоз: атипичное проявление лимфомы Беркитта. Педиатр Радиол (2009) 39(3):274–6. doi: 10.1007/s00247-008-1063-y
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
7. Oliveira C, Matos H, Serra P, Catarino R, Estevão A. Лимфома брюшной полости Беркитта у взрослых с изолированным поражением брюшины. J Radiol Case Rep (2014) 8(1):27–33. doi: 10.3941/jrcr.v8i1.1400
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
8.Каннингем Н., Френч-Констант С., Планш К., Гиллмор Р. Перитонеальный лимфоматоз: редкое проявление фолликулярной лимфомы, имитирующей перитонеальный карциноматоз. BMJ Case Rep (2015) 2015:bcr2014207136. doi: 10.1136/bcr-2014-207136
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
9. Fei N, Shah N. Спорадическая лимфома Беркитта у взрослых с быстрым развитием перитонеального лимфоматоза. Представитель Oncol Med (2017) 2017:4789706. дои: 10.1155/2017/4789706
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
10. Liu E, Wang J, Yang WJM. Перитонеальная лимфома с асцитом, имитирующим портальный гипертонический асцит: клинический случай. Медицина (Балтимор) (2019) 98(8):e14583. doi: 10.1097/md.0000000000014583
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
11. Равиндранат А., Шривастава А., Ситхараман Дж., Пандей Р., Сарма М., Поддар У. и др. Перитонеальный лимфоматоз, маскирующийся под пиоперитонеум у мальчика-подростка. Отчет по делу ACG (2019) 6(6):e00116. doi: 10.14309/crj.0000000000000116
CrossRef Full Text | Google Scholar
12. Шарифа М., Замзами Н., Рафеа Т. Диффузный перитонеальный лимфоматоз, имитирующий перитонеальный карциноматоз. Med J Malaysia (2011) 66(3):270–2.
Реферат PubMed | Google Scholar
13. Salemis N, Gourgiotis S, Tsiambas E, Karagkiouzis G, Nakos G, Karathanasis V. Диффузная крупноклеточная B-клеточная лимфома брыжейки: необычная презентация и обзор литературы. J Gastrointest Cancer (2009) 40:79–82. doi: 10.1007/s12029-009-9114-7
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
14. Лу Г., Цяо Л., Ли Д., Лю З., Чжао Ф., Ю. DJM. Сопутствующая лимфома и гемофилия B у педиатрического пациента: клинический случай. Медицина (Балтимор) (2019) 98(19):e15474. doi: 10.1097/md.0000000000015474
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
18. Glazer H, Lee J, Balfe D, Mauro M, Griffith R, Sagel SJR.Неходжкинская лимфома: компьютерная томографическая демонстрация необычного экстранодального поражения. Радиология (1983) 149(1):211–7. doi: 10.1148/radiology.149.1.6225145
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
19. Кабрал Ф., Краевски К., Ким К., Рамайя Н., Джаганнатан Дж. Перитонеальный лимфоматоз: данные КТ и ПЭТ/КТ и как отличить карциноматоз от саркоматоза. Визуализация рака (2013) 13:162–70. дои: 10.1102/1470-7330.2013.0018
Резюме PubMed | Полный текст перекрестной ссылки | Google Scholar
20. Choi W, Kim J, Choi S, Park J, Park Y, Lim J, et al. Перитонеальный лимфоматоз, спутанный с перитонеальным карциноматозом из-за предшествующей истории рака желудка: клинический случай. Clin Imaging (2016) 40(5):837–9. doi: 10.1016/j.clinimag.2016.03.006
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
22. О’Нил А., Шинагаре А., Розенталь М., Тирумани С., Джаганнатан Дж., Рамайя Н.Различия в КТ-признаках перитонеального карциноматоза, саркоматоза и лимфоматоза: ретроспективный анализ 122 случаев в третичном онкологическом учреждении. Clin Radiol (2014) 69(12):1219–27. doi: 10.1016/j.crad.2014.06.019
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
23. Song J, Li H, Li Y, Yu H, Li X, Yu S и др. Является ли ПЭТ-КТ эффективным инструментом для дифференциации асцита, вызванного злокачественными новообразованиями брюшной полости и туберкулезом брюшины? Clin Res Hepatol Gastroenterol (2014) 38(2):e41–3.doi: 10.1016/j.clinre.2013.08.009
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
24. Рой С., Парида Г., Трипати С., Сингхал А., Шамим С., Трипати М. Перитонеальное суперсканирование на F-FDG ПЭТ-КТ у пациента с лимфомой Беркитта. Indian J Nucl Med (2017) 32(2):155–6. doi: 10.4103/0972-3919.202250
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
25. Wang X, Chen Z, Tang G, Zhang X. Ребенок с лимфомой Беркитта с поражением плевры, брюшины, брыжейки, сальника и почек: диагностика с помощью ФДГ ПЭТ/КТ. Clin Nucl Med (2011) 36(7):612–5. doi: 10.1097/RLU.0b013e318217af84
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
26. Mito M, Fukunari H, Watanabe A, Hayashi T. Случай перитонеального лимфоматоза, диагностированный с помощью лапароскопической биопсии. Ган То Кагаку Риохо (2020) 47 (13): 1792–4.
Реферат PubMed | Google Scholar
27. Хазарика Н., Дхабхар Б., Сайкия Т. Высокое содержание СА 125 в сыворотке у женщины с асцитом и забрюшинным образованием – диагностическая дилемма. J Assoc Physicians India (2008) 56:47–8.
Реферат PubMed | Google Scholar
29. Караосманоглу Д., Карчаалтынкаба М., Огуз Б., Аката Д., Озмен М., Ахан О. КТ-обнаружения лимфомы с перитонеальным, сальниковым и брыжеечным поражением: перитонеальный лимфоматоз. Eur J Radiol (2009) 71(2):313–7. doi: 10.1016/j.ejrad.2008.04.012
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
30.

 Н.Н.Петрова (отечественная школа онкологов и семинары с заведующими клинических отделений и экспериментальных лабораторий)
Н.Н.Петрова (отечественная школа онкологов и семинары с заведующими клинических отделений и экспериментальных лабораторий) А. Горбуновой ; под ред. Д. Кэссиди [и др.]. — М. : ГЭОТАР-Медиа, 2010. — 510 с.
А. Горбуновой ; под ред. Д. Кэссиди [и др.]. — М. : ГЭОТАР-Медиа, 2010. — 510 с.
