Может ли быть аллергия на нервной почве: Аллергия:Причины аллергических реакций,Симптомы аллергии,Первые признаки аллергии
Крапивница от стресса. Аллергия от стресса
Даниил Давыдов
медицинский журналист
Профиль автораХронический стресс увеличивает риск развития многих заболеваний: от сердечно-сосудистых болезней до язвы желудка.
Но болезнь не разовьется, если на человека не будут действовать и другие факторы — например, вторжение вредных микробов, курение, переедание или наследственность. Поэтому неправильно говорить, что люди болеют аллергией и дерматитом из-за сильных переживаний или сверхнагрузок на работе.
Что такое стресс
Стресс — нормальная реакция организма на резкие перемены в окружающем мире, которые нельзя проигнорировать. Стресс помогает нам мобилизоваться и избежать опасности — например, увернуться от человека на электросамокате, которого мгновение назад мы даже не видели.
Что такое стресс — медицинская энциклопедия Medlineplus
Как мозг регулирует стресс — бюллетень Кливлендской клиники
Стрессовой реакцией управляет командный центр в головном мозге.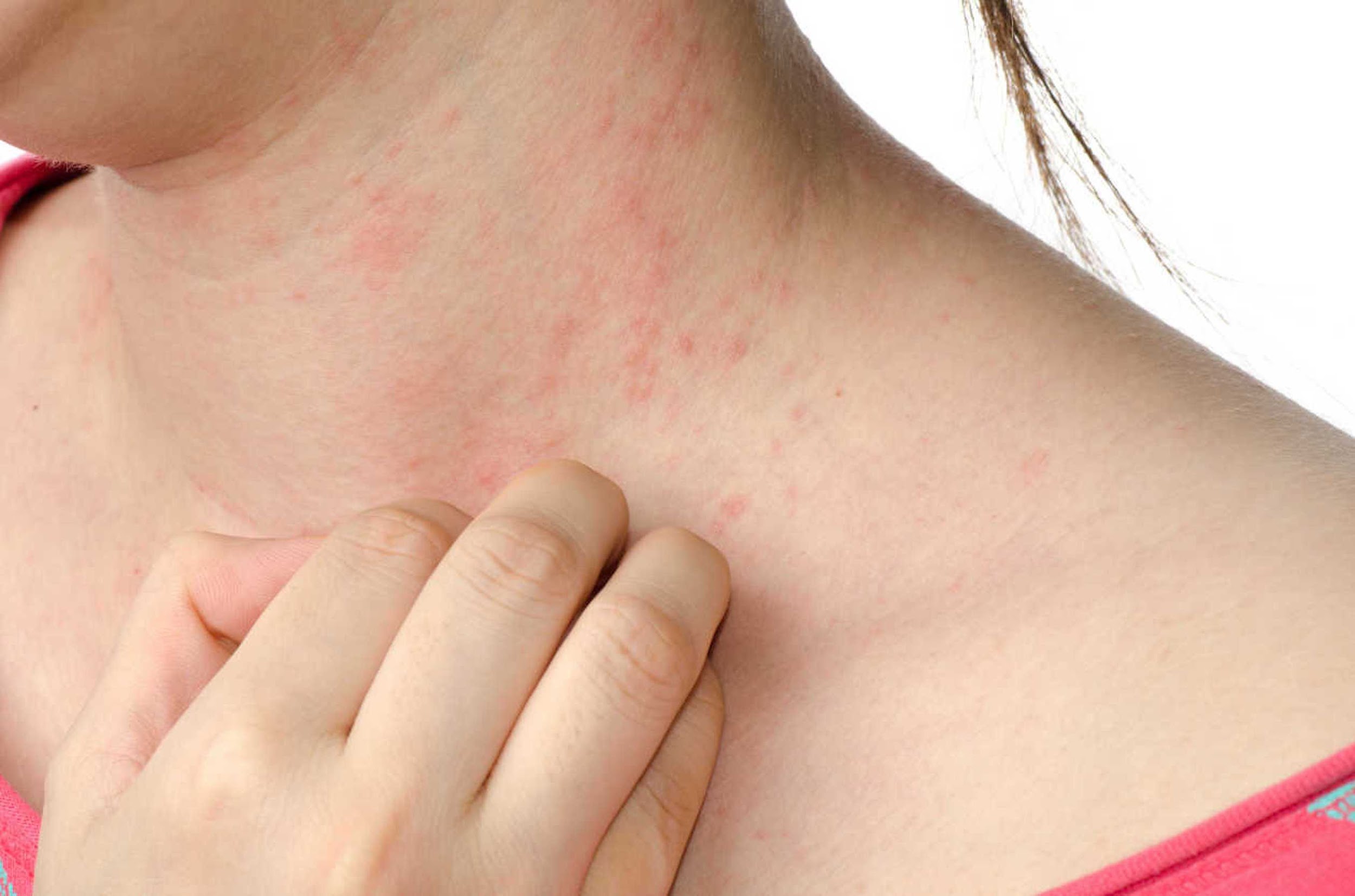
От спинного мозга почти к каждому кровеносному сосуду, потовой железе и мышце бегут нервные волокна, принадлежащие к симпатической или парасимпатической нервной системе.
Если вокруг нас внезапно случается что-то неожиданное, симпатическая нервная система отдает нашим внутренним органам приказ мобилизоваться. По ее команде зрачки расширяются, дыхание и сердцебиение ускоряются, а печень выпускает в кровь запасы глюкозы — топливо, которое срочно требуется мышцам для борьбы или бегства. При этом пищеварение подавляется, ведь организму сейчас не до усвоения пищи. В итоге мы приходим в состояние полной боевой готовности.
Как только опасность миновала, в дело вступает парасимпатическая система. Она отдает всему телу команду «Вольно»: сужает зрачки, замедляет дыхание и сердцебиение и разрешает пищеварительной системе продолжать работу в штатном режиме. Печень перестает выбрасывать в кровь глюкозу и сосредотачивается на выработке желчи, которая нужна для пищеварения.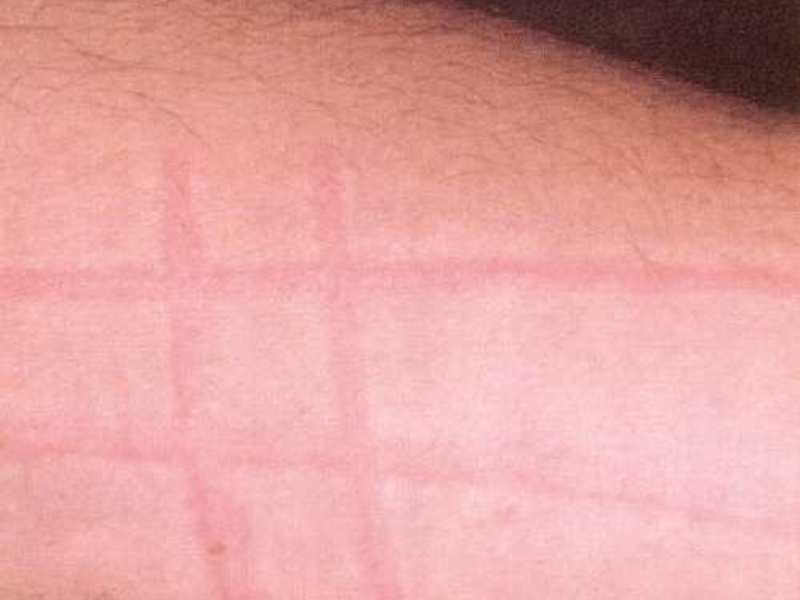
Нормальная стрессовая реакция спасала нас в древние времена, когда люди были охотниками и собирателями. В те времена стресс был кратковременным. Если удавалось успешно догнать добычу или избежать встречи со стаей гиен, люди сразу же успокаивались, ведь больше им ничего не грозило.
Когда человечество перебралось из пустынь и лесов в большие города, поводов для кратковременного стресса стало меньше. Зато появились новые источники стресса вроде нелюбимой работы или толп в метро, которые воздействуют на нас годами. В итоге стресс стал хроническим. В отличие от кратковременного стресса, который спасает человеку жизнь, хронический стресс для здоровья совсем не полезен.
УЧЕБНИК
Как победить выгорание
Курс для тех, кто много работает и устает. Цена открыта — назначаете ее сами
Цена открыта — назначаете ее сами
Как стресс увеличивает риск развития болезней
Поскольку стресс — комплексная реакция, задействующая весь организм, его воздействие увеличивает риск и психических, и физических болезней.
Психические заболевания. Когда стрессовые реакции длятся не несколько минут или часов, а месяцами и годами, симпатическая нервная система постоянно на взводе. В итоге здоровый человек тратит слишком много энергии на самые обычные бытовые задачи и понемногу теряет силы. Чем меньше у человека сил, тем выше риск, что он не справится с тяжелым жизненным испытанием вроде потери работы или развода — и заболеет, например, депрессией.
Если симпатическая нервная система постоянно активируется, увеличивается риск депрессии — журнал «Современная нейрофармакология»
Хронические заболевания. Еще опаснее стресс для людей, у которых есть предрасположенность или уже развилось какое-нибудь заболевание. Например, хронический стресс увеличивает частоту сердечных сокращений и артериальное давление. У человека с сердечно-сосудистой болезнью дополнительная нагрузка на сердце и сосуды может спровоцировать инфаркт.
Например, хронический стресс увеличивает частоту сердечных сокращений и артериальное давление. У человека с сердечно-сосудистой болезнью дополнительная нагрузка на сердце и сосуды может спровоцировать инфаркт.
Примерно по такому же принципу — перенапрягая уже поврежденные системы — стресс может спровоцировать начало болезни у людей с предрасположенностью к диабету второго типа, онкологическим заболеваниям и некоторым другим болезням.
Инфекционные заболевания. Хронический стресс напрямую воздействует на иммунную систему — повышает уровень супрессорных Т-лимфоцитов. Задача этих иммунных клеток — держать воспалительный процесс под контролем и не давать иммунной системе уничтожить заодно с микробами и сам организм. Но если супрессорные Т-клетки включаются без повода, они начинают подавлять нормальный иммунный ответ. Точно известно, что это повышает риск заразиться вирусной инфекцией.
Хронический стресс нарушает работу иммунной системы — журнал «Проблемы со стрессом и иммунитет в космосе»
Раны и травмы.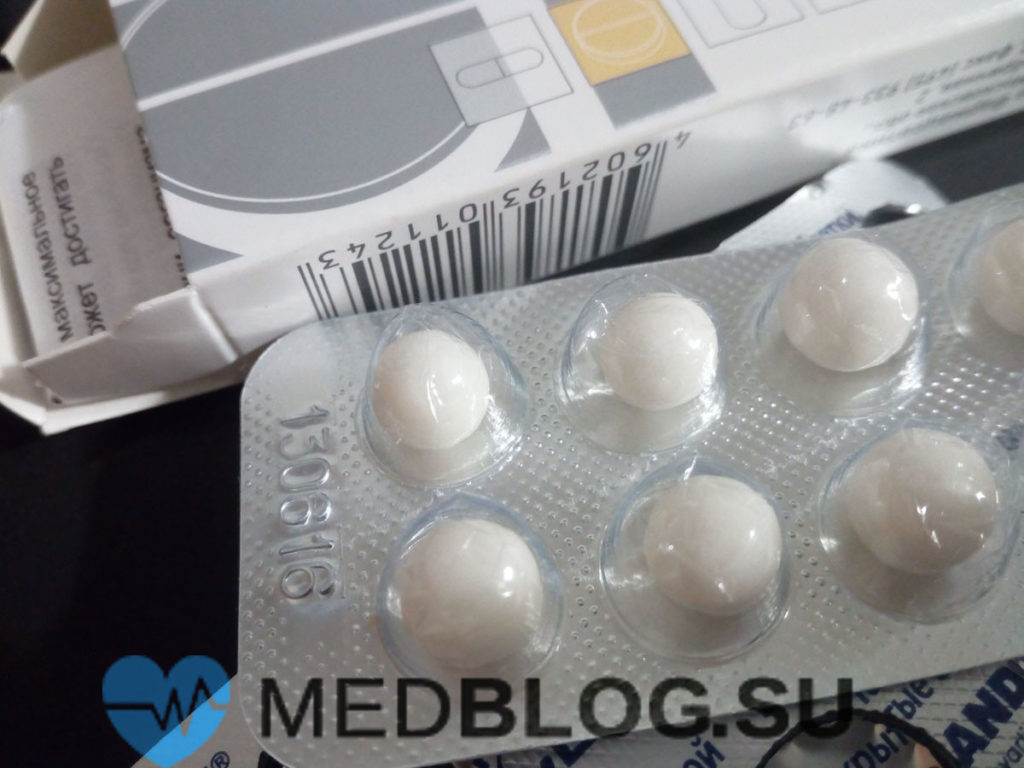 Заживление ран начинается с воспаления поврежденного участка тела. Это позволяет уничтожить микробов и поврежденные клетки. Затем клетки в поврежденной области начинают усиленно делиться, и рана зарастает. Подавляя воспаление, хронический стресс мешает ранам нормально заживать.
Заживление ран начинается с воспаления поврежденного участка тела. Это позволяет уничтожить микробов и поврежденные клетки. Затем клетки в поврежденной области начинают усиленно делиться, и рана зарастает. Подавляя воспаление, хронический стресс мешает ранам нормально заживать.
Психологический стресс мешает заживлению ран — журнал Клиники иммунологии и аллергии Северной Америки
Как правило, хронический стресс увеличивает риск развития болезней, потому что играет роль соломинки, которая ломает спину уже и так перегруженного верблюда. Но это вовсе не означает, что если бы люди с предрасположенностью к хроническим болезням не стояли в пробках, не общалась со склочными соседями или с вредным начальством и не нервничали по другим причинам, то они бы не заболели.
Роль последней соломинки может сыграть не только хронический стресс, но и другие факторы — например, вирусная инфекция. Науке известны случаи, когда люди с предрасположенностью к аутоиммунным болезням заболевали ими после того, как перенесли ротавирусную инфекцию или подхватили вирус герпеса.
Вирусы и аутоиммунные заболевания — журнал «Вирусы»
Есть ли связь у стресса, крапивницы и аллергии
Аллергия — ошибка иммунной системы, которая возникает, когда она принимает безобидный белок из пищи, пыльцы или пыли за опасного микроба и пытается его уничтожить. При большинстве аллергий иммунная система использует любимое супероружие — биологически активное вещество под названием гистамин.
Что такое аллергия — Национальная служба здравоохранения Великобритании
Генетическая предрасположенность увеличивает риск заболеть аллергией — журнал Nature
Гистамин провоцирует спазм кровеносных сосудов, из-за которого возникают отеки, и запускает воспаление. В итоге у человека текут сопли, краснеют глаза, а на коже появляется зудящая сыпь. Кожные проявления аллергии называются атопическим дерматитом, или крапивницей.
Сегодня большинство аллергологов полагают, что хронический стресс не может заставить изначально хорошо работающую иммунную систему начать совершать ошибки.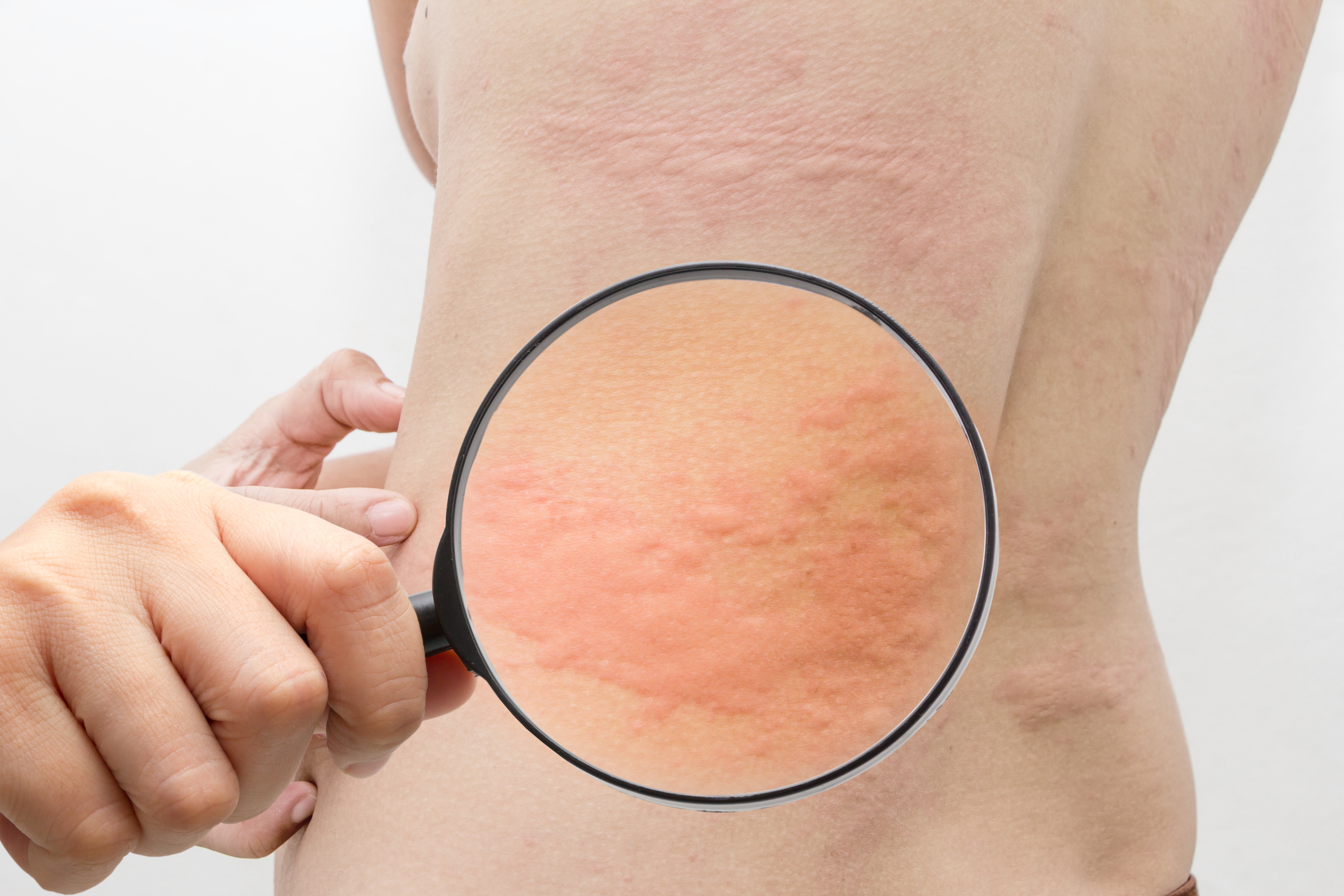 Хотя причины аллергий пока понятны не до конца, считается, что многие люди уже рождаются с генетической предрасположенностью к аллергиям. Стресс, даже хронический, не в силах перекроить геном.
Хотя причины аллергий пока понятны не до конца, считается, что многие люди уже рождаются с генетической предрасположенностью к аллергиям. Стресс, даже хронический, не в силах перекроить геном.
Стресс и аллергические заболевания — журнал Клиники иммунологии и аллергии Северной Америки
Зато стресс вполне способен спровоцировать внеочередной приступ у и без того склонного к аллергии человека. А еще он может сделать приступ аллергии более тяжелым.
Работает это так. Когда страдающий от крапивницы человек расстраивается, его симпатическая нервная система расширяет кровеносные сосуды. Это заставляет иммунные клетки выбрасывать больше гистамина — и в итоге сыпь зудит еще сильнее.
Как уменьшить уровень хронического стресса
У современного горожанина нет возможности полностью избежать воздействия факторов, вызывающих хронический стресс. Зато можно попытаться отрегулировать интенсивность воздействия источников хронического стресса на нашу жизнь.
Как победить хронический стресс — бюллетень Американской психологической ассоциацией, APA
Вот что советуют предпринять специалисты из Американской психологической ассоциации.
Ограничивайте вмешательство стрессоров. Попробуйте составить список всех проектов и обязательств, заставляющих вас нервничать или чувствовать себя подавленным. Оставьте в списке ежедневных задач только те пункты, без которых никак нельзя обойтись — например, экзамены или поездки на метро.
Если сильный стресс вызывают рабочие задачи, имеет смысл обсудить это с руководителем. Возможно, удастся распределить нагрузку. Может оказаться, что дело, вызывающее у вас сильный дискомфорт, без проблем мог бы выполнить кто-то из ваших коллег, а вы взамен могли бы взять некоторые его задачи.
Пожалуйтесь близкому человеку. Некоторые люди испытывают хронический стресс из-за того, что никому не рассказывают о том, что наступили трудные времена. Это не значит, что стоит превращаться в нытика. Но многим людям становится легче просто от того, что они рассказывают близким о своих проблемах.
Нет ничего плохого в том, чтобы иногда попросить друга или родственника о поддержке. Возможно, они тоже сталкивались с похожими проблемами и знают, как их решить. Например, посоветуют удобный способ упорядочить рабочие задачи или дадут контакт проверенного психолога или психотерапевта.
Возможно, они тоже сталкивались с похожими проблемами и знают, как их решить. Например, посоветуют удобный способ упорядочить рабочие задачи или дадут контакт проверенного психолога или психотерапевта.
Сократите количество кофе. Кофеин бодрит, но в слишком больших количествах он же может спровоцировать нервозность. Попробуйте ограничиться одной чашкой утреннего кофе. Если до этого вы часто пили этот напиток во время рабочего дня, может стать легче.
Добавьте в расписание ежедневные прогулки. Физическая активность увеличивает концентрацию эндорфинов — химических соединений, которые улучшают настроение и снижают уровень стресса. Не каждая работа позволяет посещать спортивный зал, но почти всегда можно выкроить время для получасовой прогулки вокруг дома или офиса, ну или хотя бы до метро.
Высыпайтесь. Здоровый 7—8-часовой сон уменьшает вредное воздействие стресса. Но загвоздка в том, что хронический стресс сам по себе нарушает сон, и получается замкнутый круг.
Помимо обычных советов поменьше есть на ночь, отказаться от светящихся гаджетов и спать в темноте, можно попробовать завести привычку записывать все беспокоящие мысли в блокнот. Это работает примерно так же, как и жалобы близкому человеку, то есть уменьшает напряжение. После того как вы все записали, шансы уснуть увеличиваются.
Если ничего не помогает — обратитесь за помощью. Некоторым людям проще справиться с хроническим стрессом, когда они работают с психологом или психотерапевтом. Правда, иногда найти подходящего именно вам специалиста получается не сразу, и услуги могут быть недешевыми: в разных городах прием обходится в 1500—5000 Р. Большинству людей становится легче после десятого приема.
Что в итоге
- Кратковременный стресс — нормальная физиологическая реакция, помогающая выживать в экстренных ситуациях.
- Хронический стресс вреден для здоровья, потому что ослабляет организм и увеличивает вероятность развития болезни у людей с предрасположенностью.

- Хронический стресс может спровоцировать и усилить симптомы многих заболеваний, но сам по себе аллергию или крапивницу не вызывает.
Может ли быть аллергия на нервной почве и как она развивается?
Содержание статьи
Механизм развития нервной аллергии. Причины возникновения ее симптоматики. Характерные признаки аллергии на нервной почве. Как избавиться от нервной аллергии и предотвратить ее появление.
До настоящего времени не известно наверняка, что именно вызывает аллергию. Ясно, что заболевание имеет наследственный характер, однако, может возникать и тогда, когда среди родственников аллергики отсутствуют. Второй возможной причиной исследователи называют плохую экологию и постоянный контакт с химическими веществами, некоторые соединения которых накапливаются в организме. Провоцировать же реакцию могут самые различные факторы. Потому многие, предрасположенные к непереносимости люди, задаются вопросом – может ли быть аллергия на нервной почве.
Причины
Аллергическая реакция в организме имеет иммунную причину. Симптоматика проявляется потому, что иммунитет пытается защитить организм. Таким образом, появление или исчезновение симптоматики полностью зависит от состояния иммунной системы. По этой причине, если в иммунной системе произошел сбой, то может возникнуть непереносимость компонента, который успешно использовался ранее. И, напротив, непереносимость может исчезнуть в том случае, если сбой был устранен.
Развивается аллергия на нервной почве или любая другая, по следующей схеме:
- В иммунной системе происходит сбой;
- В результате сбоя известный и «безобидный» компонент распознается иммунитетом как чужеродный и отторгается;
- Иммунитет начинает защищаться и вырабатывает аллергические антитела гистамины;
- Они действуют в организме и результатом этого становятся аллергические симптомы.
Серьезный эмоциональный стресс или психическая перегрузка способны снизить иммунитет и вызвать в нем сбой.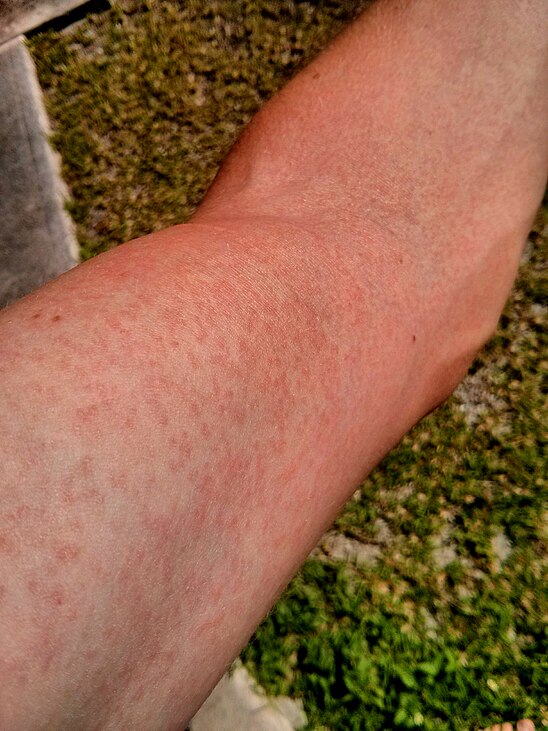 Это связано с тем, что защитные ресурсы организма ослабляются в результате того, что расходуются на защиту от стресса. В этом случае в иммунной системе может возникнуть тот сбой, который ведет к тому, что появляется аллергия на нервной почве.
Это связано с тем, что защитные ресурсы организма ослабляются в результате того, что расходуются на защиту от стресса. В этом случае в иммунной системе может возникнуть тот сбой, который ведет к тому, что появляется аллергия на нервной почве.
Может нервная аллергия быть обусловлена и иными физиологическими причинами. При длительном и сильном стрессе в организме пациента вырабатывает увеличенное количество медиаторов воспаления. Количество гистамина также повышается. В результате для запуска реакции может даже не потребоваться аллерген. То есть, любой компонент в стрессовом состоянии может стать причиной того, что возникнет нервная аллергия.
Симптоматика
Аллергия на нервной почве чаще возникает у женщин, чем у мужчин. Но именно у мужчин она зачастую проявляется сильнее. Нередко от такого заболевания страдают дети, ведь их психика менее устойчива и они больше подвержены стрессу. Проявляться нервная аллергия может следующими симптомами:
- Среди всех реакций чаще всего встречаются кожные.
 Высыпания чаще похожи на сыпь и поражают волосистую область головы. Зуд при этом сильнее, чем при истинной аллергии;
Высыпания чаще похожи на сыпь и поражают волосистую область головы. Зуд при этом сильнее, чем при истинной аллергии; - Экзема на небольших участках кожи. Может возникнуть на любом участке тела, с волосистой частью головы никак не связана;
- Крапивница возникает в основном у детей или подростков. Имеет вид крупных красных и зудящих пятен, на которых формируются волдыри;
- Ринит отличается усиленным отделением из носа слизи, а затем, его заложенностью. Встречается на нервной почве достаточно редко;
- Сухой кашель усиливается в моменты нервного напряжения (может даже носить характер приступов). Иногда носит хронический характер – кашель редкий и несильный, но присутствует на протяжении длительного времени. Реакция опасна тем, что может развиться бронхоспазм, ведущий к усложнению дыхания и удушью;
- Высыпания на слизистых оболочках рта. Его достаточно легко перепутать со стоматитом. Может сопровождаться налетами на слизистых, зудом, болью и жжением в полости рта.

Некоторые аллергики задаются вопросом, может ли быть аллергия на нервной (психологической) почве выражена иначе? Наиболее частым явлением считаются кожные реакции. Респираторные возникают куда реже. Еще реже возможны симптомы со стороны желудочно-кишечного тракта. Это могут быть тошнота, рвота, диарея.
Терапия
Интересные особенности имеет диагностика такой непереносимости. Основные симптомы проявляются только непосредственно в момент стресса. Для подтверждения подозрений пациента на наличие непереносимости проводятся аллергопробы. При этом, если пациент сдает их в спокойном настроении, то аллерген не удастся найти, т. к. результаты теста на аллергию будут отрицательными. Если же сдать пробы в период стресса, аллерген будет найден.
Аллергия от нервов, фото которой представлено в материале, лечится так же, как и любая другая. И первым правилом здесь будет устранить «аллерген», т. е. в данном случае необходимо в первую очередь избавиться от стресса. Необходимо избегать не только эмоциональных и психических, но и физических нагрузок.
Необходимо избегать не только эмоциональных и психических, но и физических нагрузок.
Лечение иммунной системы и повышение ее устойчивости – еще один важный фактор, который поможет снизить проявления непереносимости. Здоровый иммунитет редко дает сбои и вызывает аллергию.
–СНОСКА–
Врач может назначить также успокоительные препараты, которые помогут снизить уровень стресса. Снять физические симптомы непереносимости помогут противоаллергические препараты. Антигистаминные таблетки стоит принимать от покраснения и отека кожи, а также тогда когда симптомы респираторные. Для местного лечения кожных проявлений используйте противоаллергическую мазь.
Видео
Причины стрессовой сыпи на лице и теле, высыпания на коже при стрессе
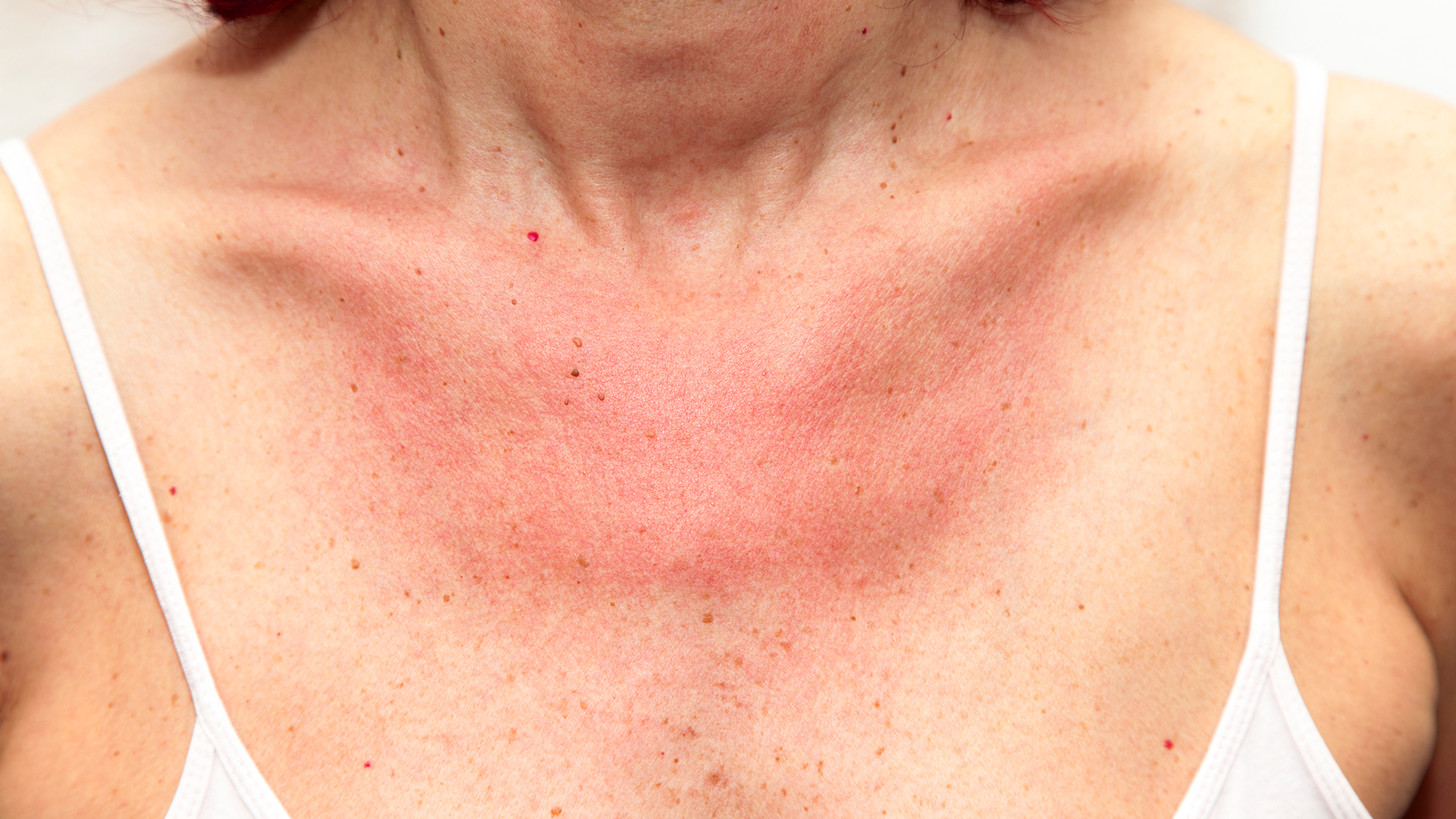
Хронический стресс влияет не только на наше настроение, но и на физическое состояние. На прием к врачу приходят пациенты с разными жалобами и одна из самых частых — появление сыпи на лице, шее и даже с переходом на грудь.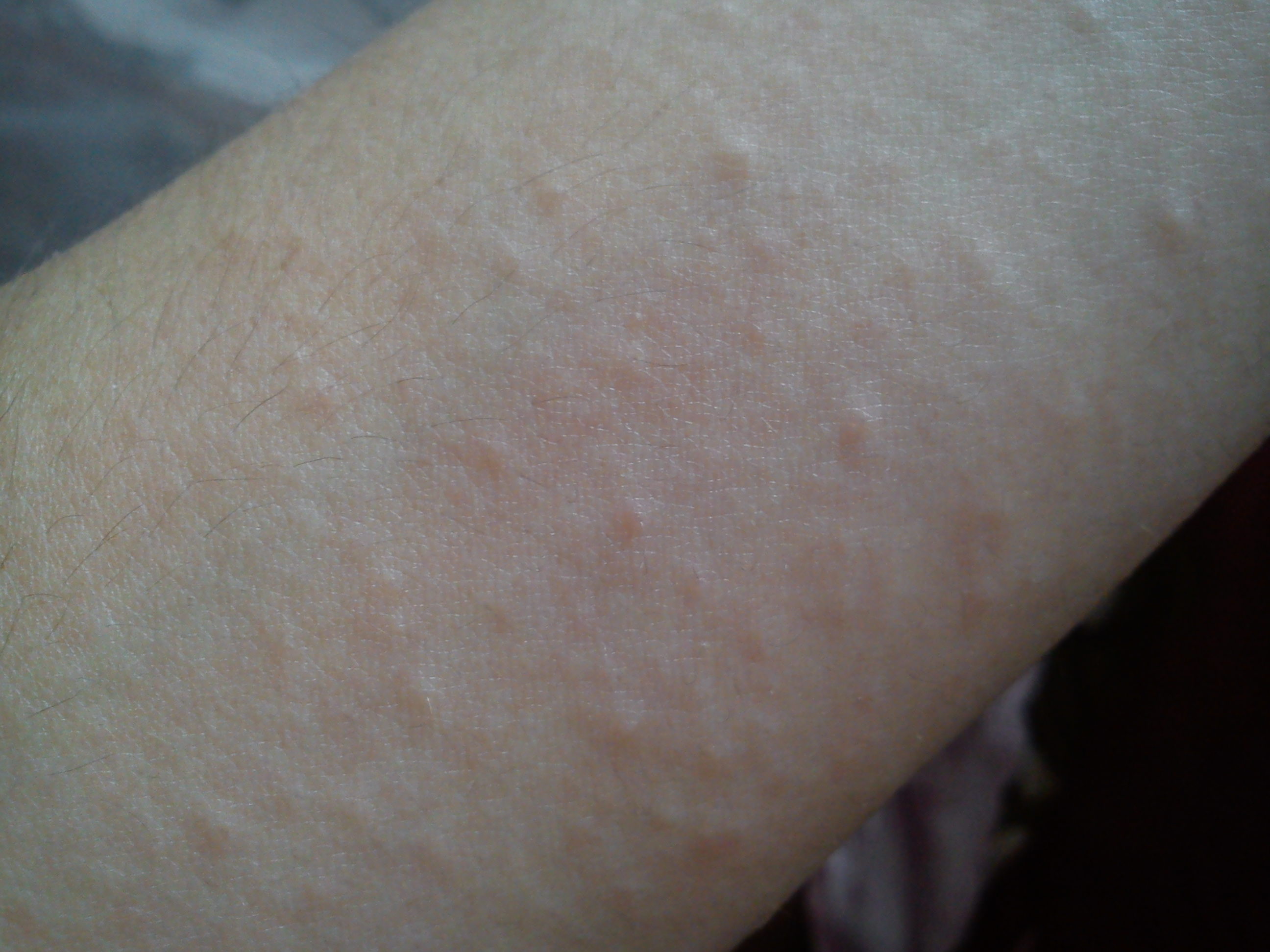 Сыпь проявляется как крапивница и ее оттенок зависит от тона кожи: от красного до фиолетового. Такую сыпь и называют стрессовой. Более того, при уже существующих кожных болезнях, стресс — это причина рецидива и ухудшения симптомов.
Сыпь проявляется как крапивница и ее оттенок зависит от тона кожи: от красного до фиолетового. Такую сыпь и называют стрессовой. Более того, при уже существующих кожных болезнях, стресс — это причина рецидива и ухудшения симптомов.
Стрессовая сыпь
В 2018 году было проведено исследование с участием студентов-медиков. Результаты показали, что обучение сопровождается высокими нагрузками и стрессом, что и стало причиной развития кожных болезней с характерными симптомами в виде сыпи.
У части студентов стрессовая сыпь проявлялась в виде крапивницы чаще на лице, груди и шее. Хотя выраженной закономерности уровня стресса и выраженности сыпи не было обнаружено. У студентов, подвергшихся стрессу, отмечались более частые обострения экземы, псориаза, розацеа и других кожных болезней. Известно, что характерным симптомом являются кожные высыпания.
Проявления стрессовой сыпи
Стрессовая сыпь может выглядеть по-разному, и все зависит от тона кожи: красные, темные или же фиолетовые пятна, зудящие и выступающие над поверхностью кожи. От чего зависит размер поражения неизвестно, но, в некоторых случаях, очаги сливаются между собой и локализуются не только на лице, но и переходят на шею и грудь.
От чего зависит размер поражения неизвестно, но, в некоторых случаях, очаги сливаются между собой и локализуются не только на лице, но и переходят на шею и грудь.
Сложнее определить причину и тип сыпи при хронических кожных болезнях, ведь симптоматика схожа. Нередко на фоне обострения основного заболевания кожи происходит резкое ухудшение состояния, что и говорит о присоединении стрессовой сыпи.
Почему появляется такая сыпь?
При стрессе в организме вырабатывается гормон – кортизол. При его большой концентрации и постоянной выработке, он негативным образом влияет на иммунную систему, что делает организм восприимчивым к болезням и аллергенам. Эти условия и обеспечивают обострение хронических болезней, в том числе и кожных.
Уже на фоне стрессовой сыпи кортизол ухудшает симптомы и провоцирует обострение хронических кожных заболеваний.
Другие виды высыпания на лице
Причины, по которым появляются высыпания на коже разнообразны. И, в первую очередь, врач исключает хронические дерматологические болезни, а уже потом рассматривает иные причины.
Первоначально врачи исключают следующие патологии:
Розацеа
В основном, сыпь локализуется в области лица. К числу характерных симптомов относят: покраснение, которое внешне похоже на солнечный ожог. Некоторые люди с розацеа страдают от жжения, зуда и покалывания.
Атопическая экзема
Хроническое заболевание кожи, которое характеризуется периодами обострений и ремиссии. Обычно симптомы сводятся к сухости, шелушению, покраснению и зуду.
Псориаз
Это хроническое заболевание кожи, при котором характерно образование покраснений, шелушений и белых чешуек.
Потница
Формируется при значительном потоотделении из-за чрезмерного раздражения кожи.
Контактный дерматит
Основная причина болезни – действие определенного аллергена, которым может быть: косметика, пища и др.
Опоясывающий герпес (лишай)
Это весьма серьезное инфекционное заболевание, которое характеризуется появлением сыпи на одной части тела по ходу определенного нерва. Заболевание имеет серьезное течение и яркую клиническую картину. На первое место выходит боль, выраженный зуд и, в последнюю очередь, пациента интересует сформировавшаяся сыпь.
Заболевание имеет серьезное течение и яркую клиническую картину. На первое место выходит боль, выраженный зуд и, в последнюю очередь, пациента интересует сформировавшаяся сыпь.
Какое лечение необходимо?
Лечение стрессовой сыпи чаще проходит в домашних условиях, однако консультация врача нужна обязательно. Только доктор сможет провести диагностику, исключить иные причины появления сыпи, которые требуют серьезного лечения.
В 2019 году было опубликовано исследование, в котором было доказано, что кокосовое масло обладает противовоспалительным и спазмолитическим действием и, следовательно, его можно рассматривать как средство лечения и профилактики кожных высыпаний.
Алоэ вера уменьшает зуд. Снять раздражение и улучшить состояние кожи поможет холодный компресс. Масло ромашки обладает антиоксидантным, противомикробным и противовоспалительным действием. Это масло по нескольку капель можно добавлять в уходовую косметику, которая используется ежедневно.
Для снятия зуда и отека рекомендованы безрецептурные антигистаминные препараты, а также лосьоны с каламином для облегчения симптомов сыпи.
Однако симптоматического лечения недостаточно, нужно позаботиться об устранении основной причины, то есть хронического стресса. В этом помогут медитативные практики, поддержка психолога и др. В сложных случаях может потребоваться прием лекарственных препаратов, но их рекомендует исключительно врач.
Когда необходима помощь врача
Стрессовая сыпь обычно проходит в течение нескольких дней. Однако при появлении симптомов консультация врача обязательна для исключения других причин появления кожной сыпи, в том числе, и инфекционной природы.
Поводом для посещения врача будет ухудшение состояния, то есть увеличение площади поражения, присоединение других симптомов, например, повышения температуры.
Затруднение дыхания, глотания, отек губы – повод немедленно вызвать скорую помощь. Это может свидетельствовать о развитии аллергической реакции, представляющей угрозу для здоровья и жизни человека.
Резюме
Хронический стресс – причина появления сыпи на лице, которая выглядит как крапивница.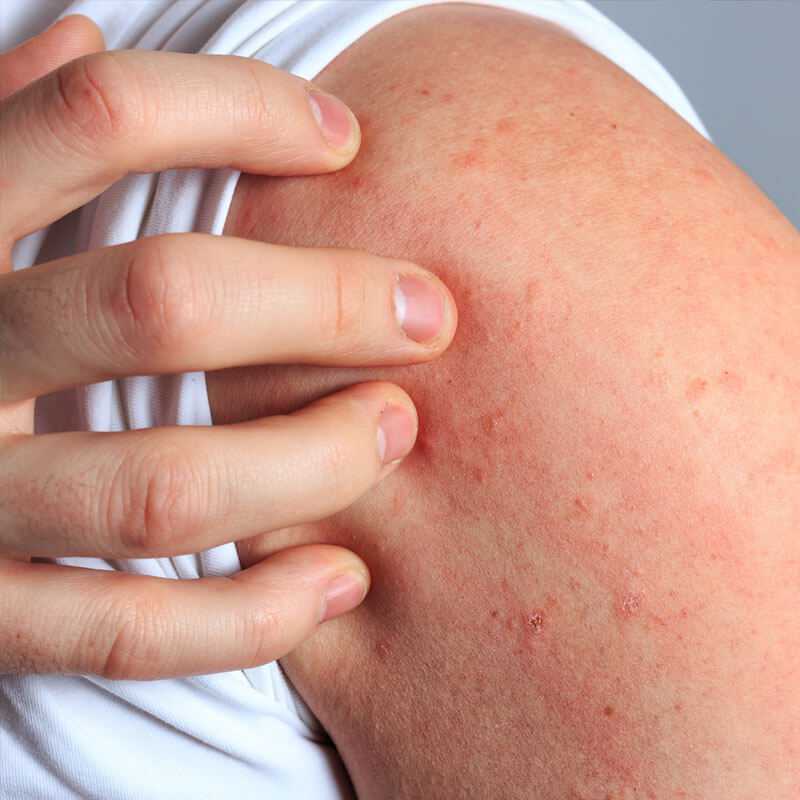 Если уже диагностировано хроническое заболевание кожи, то стресс — это причина обострения. Поэтому для точного определения причины появления сыпи, необходима консультация врача, который и назначит соответствующее лечение.
Если уже диагностировано хроническое заболевание кожи, то стресс — это причина обострения. Поэтому для точного определения причины появления сыпи, необходима консультация врача, который и назначит соответствующее лечение.
Несмотря на существующие методы лечения стрессовой сыпи, при частом появлении симптомов, нужно пройти полное обследование и выявить причину. Только на этих условиях может быть разработана тактика лечения, которая принесет результаты.
Будьте здоровы!
Список литературы:
1. Gada A. Ben Saif, Hala M. Alotaibi, Abdullatif A. Alzolibani. // Linking Psychological Stress to Skin Symptoms in Medical Students. // J Saudi Med.// Jan, 2018.39(1)
2. Sandip R. Varma, Tiyagarajan O. Shivaprakasam, Ilavarasu Arumugam. // In Vitro Anti-Inflammatory and Dermal Properties of Extra Virgin Coconut Oil. // Journal of Traditional and Complementary Medicine. // January, 2019. 9(1).
3. Sepide Miraj, Samira Alesaeidi. // Systematic review of the study of the therapeutic effects of chamomile Matricaria recuitta (chamomile). // Electronic doctor.// Sep, 2016. 8(9)
// Electronic doctor.// Sep, 2016. 8(9)
Аллергия на нервной почве: симптомы, лечение, фото
Аллергия на нервной почве называется также псевдоаллергией — это состояние, характеризующееся клиническим проявлением аллергии, но при этом отсутствует реакция антиген-антитело.
Аллергия от нервов возникает на фоне пониженного иммунитета и у людей при депрессивном складе характера. Более подвержены заболеванию женщины и дети раннего возраста, именно они часто испытывают стрессовое состояние и напряжение.
Факторы риска
Аллергия на нервной почве зависит от нескольких факторов:
1. Люди не способные противостоять стрессовым ситуациям на работе и в быту склоны к возникновению аллергии от нервов.
2. Нарушение в функционировании иммунной системы которая отвечает за постоянство внутренней среды и возможность противостоять негативным факторам присутствующим в жизни каждого человека.
3. Стрессы. Негативное влияние эмоционального напряжение на организм человека выражается в бессоннице, агрессии по отношении к окружающим, бессоннице, апатии.
4 . Депрессии. В результате длительных депрессивных состояний у человека страдает общее состояние, снижается иммунный ответ к инфекционным заболеваниям, понижается работоспособность. При длительной депрессии происходит нарушение во всех органах и системах организма и появляется склонность к нервной аллергии.
Длительное нервное перенапряжение приводит к нарушению внутренних биохимических реакций. Начинают выделяться медиаторы воспаления (гистамины).
Симптомы аллергии
Аллергический синдром проявляется различными симптомами, от кожных нарушений до сбоев в работе сердечно-сосудистой и дыхательной системы.
Обычно аллергия на нервной почве не отличается от истинной по проявлению.
- Зуд кожных покровов может возникнуть на фоне высыпаний, крапивницы, аллергической экземы или быть единственным симптомом.
- Высыпания, могут приобретать форму крупных красных пятен или вид мелкоточечной сыпи (на фото). Наиболее частая локализация: лицо, грудь, руки, волосистая часть головы, но не исключено появление аллергической реакции на любом участке кожи.

- При возникновении аллергии от нервов также моет возникнуть картина крапивницы. Тело покрывается волдырями в течении короткого времени, единственным отличаем от истинной реакции немедленного типа будет отсутствие контакта с аллергеном.
- Аллергия на нервной почве может проявиться симптомами ринита, возникает раздражение слизистой оболочки носа, насморк, чихание, слезотечение.
- Разновидностью аллергии от нервов является бронхиальная астма. Любой стресс может спровоцировать приступ удушья.
- Диспепсические расстройства, наиболее часто наблюдаются в детском возрасте, когда в состоянии эмоционального перенапряжения возникает понос, вздутие живота или сильные боли.
- Также аллергия, возникшая на нервной почве может проявиться приступообразным кашлем. Противокашлевые средства не приносят облегчения.
- Возможно аллергическое высыпание на слизистые оболочки рта, что может послужить постановке неверного диагноза — «стоматит» и назначению неверного лечения.

Независимо от местного проявления псевдоаллергия сопровождается снижением общего самочувствия:
- возникает быстрая утомляемость, выражающаяся в снижении трудоспособности;
- пациенты жалуются на нарушение сна: ночью не могут уснуть, весь день сохраняется сонливость;
- малейший раздражающий фактор может вызвать резкий приступ агрессии;
- наблюдаются частые мигрени, невралгии, мышечные боли;
- возникают периоды нарушения зрения, которые также внезапно и исчезают.
Все симптомы аллергии на нервной почве полностью исчезают при хорошем настроении и отсутствии стрессовых ситуаций. Это объясняет хорошее самочувствие во время отпуска и постоянные проблемы со здоровьем во время рабочих дней, «аллергия на работу» является нарушением здоровья на фоне нервного напряжения.
Возникновение аллергической реакции может быть в последствии контакта с каким-либо продуктом или веществом, на которое в спокойном состояние реакции не возникает. Это приводит к затруднению постановки диагноза. Одно и то же вещество может употребляться без последствий или вызывать специфическую реакцию.
Это приводит к затруднению постановки диагноза. Одно и то же вещество может употребляться без последствий или вызывать специфическую реакцию.
Диагностика
Обычно при такой реакции организма пациент обращается к аллергологу. Если пробы на иммуноглобулин оказались отрицательные, это не является поводом отказа человеку в лечении.
При подозрении на аллергию эмоциональной природы необходима консультация психолога или психиатра. Наиболее часто ложной аллергии подвержены люди с повышенной возбудимостью. Такие личности легко определяются опытным врачом по резкой смене настроения, эмоциональной речи сопровождающейся ярко выраженной мимикой. Мнительность не маловажный фактор в постановке диагноза.
Особенностью проведения кожных проб с веществом, на которое подозревается развитие аллергической реакции будет зависимость результатов от эмоционального состояния пациента. Например, пациент предполагает развитие аллергии на кофе, проба в спокойной обстановке будет отрицательная, а при психоэмоциональной нагрузке положительная.
При нервной природе заболевания определение иммуноглобулина Е не результативно и не выходит за рамки нормы. При этом уровень гистамина будет повышен.
После постановки диагноза назначается лечение.
Лечение аллергии
Аллергия, возникшая на нервной почве, разнится методами лечения от истинной в силу отсутствия контакта с аллергеном и отличающейся природой развития реакции.
При выраженных кожных проявлениях применяются антигистаминные препараты:
- Цетиризин;
- Супрастин;
- Тавегил;
- Лоратадин.
Учитывая, что провоцирующим фактором реакции будет нервные перенапряжения требуется проведение комплексного лечения, направленного на восстановление психоэмоционального благополучия.
- Работа с психологом или психотерапевтом.
- Иглорефлексотерапия.
- Физиотерапевтические процедуры, гармонизирующие состояние нервной системы: циркулярный душ, гидромассажная ванна, плавание в бассейне, ванны с седативной солью.

- Благотворно скажется занятие йогой или цигун.
- Массаж.
- Общее укрепление иммунитета.
Все перечисленные методы лечения обладают высокой эффективностью в лечении данного заболевания. Возможно применение всех средств не зависимо от возраста и общего состояния здоровья. Общеукрепляющие процедуры, направленные на восстановление эмоционального покоя, подходят детям, беременным женщинам, взрослым людям.
В качестве вспомогательной терапии используются средства народной медицины:
| Действующее вещество | Рецепт народной медицины |
|---|---|
| Уксусная вода | 1 столовая ложка уксуса смешивается с простой водой в равном количестве, в готовый раствор опустить натуральную ткань, отжать и протереть пораженные сыпью участки кожи. Процедуру проводить 2-3 раза в день до полного выздоровления. |
| Сок томата | Разводится с дистиллированной водой в соотношении 2:1 и используется для протирки, как и уксусная вода. |
| Ванна с использованием отвара трав | Кора дуба, череда и ромашка смешиваются в равных частях, 80 г полученной смеси залить 1л воды и оставить на 12 часов. Прокипятить полученную смесь, процедить и разбавить на 10 л воды. Принимать с раствором ванну. При большем количестве воды для ванны, готовится больше травяного отвара. Следует учитывать, что при аллергии на нервной почве и выраженном сомнении у пациента по поводу средства лечения, если к нему все-таки прибегнуть, это может усугубить состояние. |
Профилактика
Лучшим способом лечения во все времена считалось предупреждение болезни. При склонности к возникновению аллергии на нервной почве следует избегать стрессовых ситуаций и эмоциональных нарушений. Эффективными помощниками гармонизации состояния считается занятие спортом, прогулки на свежем воздухе, занятия любимым делом.
Эффективными помощниками гармонизации состояния считается занятие спортом, прогулки на свежем воздухе, занятия любимым делом.
Кожный зуд: причины, болезни кожи, аллергии, болезни внутренних органов и систем
Само слово «зуд» уже вызывает реакцию в теле. Руки потянулись почесать какую-то часть тела или вы просто заёрзали на стуле сейчас? Это естественный ответ на сигналы, которые посылает наш мозг. На коже по всему нашему телу расположены нервные окончания. Именно они через спинной мозг передают в наш мозг информацию о наличии раздражителя, на который необходимо отреагировать.
Например, обычной реакцией, когда на нас села муха погреться или комар, намеревающийся попить нашей крови, будет сразу же согнать насекомое и почесать или потереть участок кожи, где оно располагалось. Так работают наши нейронные связи. Но что касается зуда – ощущения, которое возникает в теле и заставляет чесаться – считается, что специфических рецепторов, воспринимающих его, не существует. Наша нервная система кодирует разные сочетания возбуждения рецепторов кожи как ощущение зуда. Поэтому стоит признать, что до конца это явление пока не изучено.
Наша нервная система кодирует разные сочетания возбуждения рецепторов кожи как ощущение зуда. Поэтому стоит признать, что до конца это явление пока не изучено.
Какой бывает зуд
Если возвратиться к примеру с насекомыми, то в случае, если комар все-таки успел попить нашей крови, то какое-то время место укуса на теле может хотеться расчесать. Этот тип зуда называют локализованным. Он вызван в основном укусами или ползанием насекомых по телу. Но также к этому типу относится анальный зуд (зуд в заднем проходе), зуд вульвы (зуд во влагалище) и зуд кожи головы, указывающий на различные заболевания. Зачастую имеет приступообразный характер.
Генерализованный зуд также может быть симптомом или следствием некоторых заболеваний и состояний. Зуд кожи может иметь разную степень интенсивности, и создавать серьезный дискомфорт человеку. Этот тип зуда может иметь постоянный характер. В таких случаях необходимо обратиться к врачу-дерматологу.
Стоит ли сразу записываться на прием к дерматологу?
Паниковать, конечно, не стоит. Но, несомненно, следует прислушаться к своему телу и обращаться к врачу в случаях, если кожный зуд:
- беспокоит больше 14 дней;
- вызывает дискомфорт и бессонницу;
- возникает по всему телу или локализуется на отдельных участках;
- дополняется иными симптомами, такими как: резкое снижение веса, потеря сил, перемена характера стула и мочи, и другие.
Этих условий будет достаточно, чтобы обратиться к дерматологу и получить своевременную консультацию, при необходимости направление на лабораторное обследование, и дальнейшее лечение по результатам диагностики.
Причины кожного зуда
Давайте же разберемся в причинах, которые могут вызывать кожный зуд, и рассмотрим их подробнее.
Заболевания внутренних органов и систем
1. Болезни печени и желчевыводящих путей
Нередко кожный зуд сопровождает такие заболевания печени и желчевыводящих путей, как холестаз – в 80-100 процентах случаев, при желчекаменной болезни, реже при синдроме Жильбера. Также от зуда страдают около 10-ти процентов больных циррозом печени в связи с накоплением в крови токсичных желчных кислот, 20-ти — хроническим гепатитом, до 3-х процентов – онкологией поджелудочной железы.
Также от зуда страдают около 10-ти процентов больных циррозом печени в связи с накоплением в крови токсичных желчных кислот, 20-ти — хроническим гепатитом, до 3-х процентов – онкологией поджелудочной железы.
Врач может назначить Программа 114 «Печеночные пробы», Бактериологический посев + антибиотикограмма желчи, Синдром Жильбера, негемолитическая гипербилирубинемия семейная/токсичность, Программа 164 «Проверься на гепатиты А, В и С», Биохимию Фибромакса и Фибротеста для оценки фиброза печени. При аутоиммунных поражениях – Антитела к митохондриям (АМА) — скрининг, Антитела к растворимому печеночному антигену (anti-SLA) — качествен., Антитела к микросомам печени и почек, ANTI-LKM — скрининг, Антитела к митохондриям (АМА-М2).
2. Заболевания почек
Больные с диагнозом «уремия» (почечная недостаточность), особенно на последней стадии развития болезни и получающих поддерживающий гемодиализ, испытывают кожный зуд в 77-ми процентах случаев. Назначая диализ, врач помогает максимально уменьшить его интенсивность вплоть до исчезновения.
3. Заболевания щитовидной железы
Во время прохождения курса лечения препаратами диффузного токсического зоба у пациентов может появляться кожный зуд.
4. Сахарный диабет
Причиной зуда в области половых органов является кандидоз, прогрессирующий на фоне повышенного уровня глюкозы в крови. Зуд кожи головы может проявляться при диабетической нейропатии.
5. Гематологические заболевания
Около 50-ти процентов обладателей диагноза «истинная полицитемия» беспокоит кожный зуд, который еще активней проявляется при взаимодействии с горячей водой. У 30-ти процентов больных лимфогранулематозом зуд начинается в районе нижних конечностей и по мере развития болезни распространяется по всей поверхности тела. Также может проявляться при железодефицитной анемии, мастоцитозе, парапротеинемие, лимфолейкозе. Нередко при гематологических заболеваниях зуд является первым сигналом недуга.
6.
 ВИЧ
ВИЧЛюди с ВИЧ нередко страдают от кожного зуда, но в 92-ух процентах случаев он спровоцирован сопутствующими инфекциями в связи с подавленным иммунитетом.
7. Аутоиммунные заболевания нервной системы
В случае рассеянного склероза кожный зуд может иметь характер внезапных приступов. После перенесенного церебрального кровоизлияния возникает с другой стороны от поврежденного участка мозга. Иногда за зуд принимают проявления парестезии – расстройства чувствительности, при котором могут возникать жжение, ощущения ползанья насекомых по коже и т.д. Парестезии сопровождают многие нервные заболевания.
Кожные заболевания
1. Псориаз
В случае быстрого развития заболевания зуд беспокоит больного на пораженных псориазом участках тела, сопровождаясь сильным шелушением кожи. Причинами возникновения могут быть стресс, разного рода эмоциональные потрясения, нарушения в работе эндокринной системы. Болезнь характеризуется красными очень сухими пятнами на коже, которые впоследствии сливаются в одно, образуя бляшки. При расчесывании пораженных участков образуются раны, которые долго не заживают.
При расчесывании пораженных участков образуются раны, которые долго не заживают.
2. Экзема
Зуд не всегда сопровождает течение болезни. Экземой в 20-30% случаев страдают люди, подвластные аллергическим реакциям на продукты или лекарства, но бывают и другие причины возникновения. Себорейную экзему вызывают дрожжеподобные грибы, и проявляется она на участках тела с высокой активностью сальных желез, сопровождаясь зудом.
Атопическая экзема, сопровождающаяся кожным зудом, чаще всего начинается в раннем возрасте и появляется вследствие аллергической реакции. Также может случиться рецидив и в более зрелом возрасте. У детей в основном проявляется покраснением на щеках, а у взрослых – на локтях, коленях и запястьях.
Контактная экзема отличается тем, что она более локальный – пятна на теле располагаются на месте контакта с аллергеном, где и возникает зуд.
Экзема имеет вид пятна, на месте которого появляются пузырьки, что впоследствии вскрываются и преобразуются в корочки.
Паразиты, бактерии, вирусы
1. Гельминтоз
Гельминтоз вызван паразитическими червями гельминтами. Заразиться можно, если не придерживаться правил гигиены – не мыть руки перед едой или овощи и фрукты перед употреблением, пить водопроводную воду и т.д. Больных гельминтозом может сильно беспокоить зуд заднего прохода.
2. Чесотка
Чесоточный клещ может принести с собой немало проблем. Характерными особенностями чесотки является сыпь и зуд по всему телу. При расчесывании могут возникнуть вторичные гнойнички вследствие инфицирования таким образом.
3. Демодекоз
Причиной зуда при этом заболевании являются клещи-железницы, поражающие волосяные фолликулы и сальные железы больного.
4. Педикулёз
Заболевание вызвано такими паразитами как головная, платяная и лобковая вши. На месте укусов паразитов на теле возникает зуд на коже. При расчесывании пораженных участков также могут возникать гнойнички в связи с инфицированием.
5. Пуликоз
Пуликоз вызван укусами человеческой блохи. На пораженном участке кожи возникает зудящая сыпь, а само место укуса паразитом опухает. Помимо дискомфорта, который доставляет зуд, человеческая блоха может также переносить многие возбудители опасных болезней.
6. Стрептодермия
Стрептококковое импетиго – одна из разновидностей поверхностной стрептодермии – вызвано стафилококками и стрептококками. Бактерии проникают в кожный покров при наличии даже незначительных повреждений эпидермиса. Вследствие заражения на поверхности тела появляется высыпание и кожный зуд.
7. Фолликулит
Зачастую фолликулит – воспаление волосяного фолликула – появляется по вине смешанной стрепто-стафилококковой инфекции или же по причине игнорирования правил личной гигиены, сильной потливости, трения кожи об одежду. В зоне пораженных фолликулов возникает зуд.
8. Герпес
Заражение вирусом проявляется высыпанием на коже и слизистой.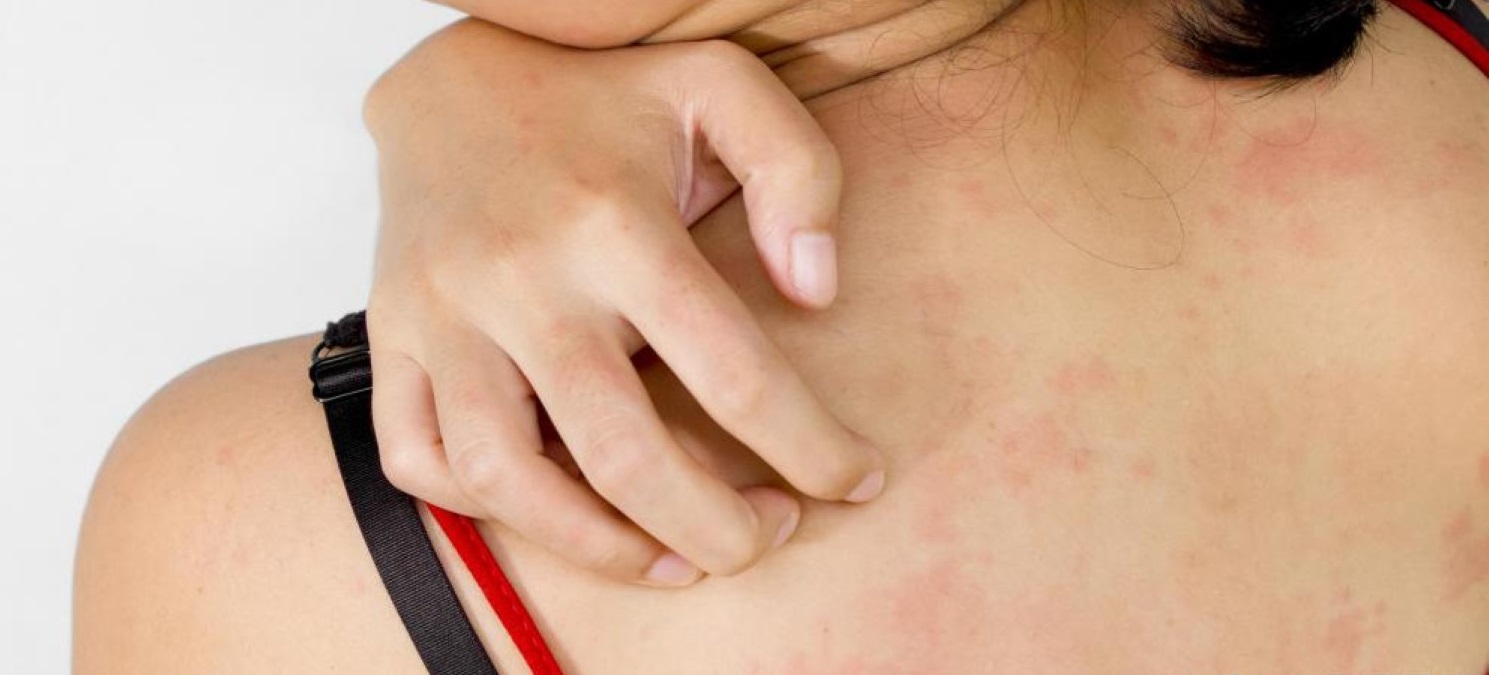 Имеет несколько типов, вызывающих разные заболевания, включая простой, генитальный герпес, ветряную оспу, опоясывающий лишай и другие. Большинство из вышеперечисленных недугов сопровождают кожный зуд, жжение и доставляют сильный дискомфорт больному. Также может иметь место при постгерпетической невралгии.
Имеет несколько типов, вызывающих разные заболевания, включая простой, генитальный герпес, ветряную оспу, опоясывающий лишай и другие. Большинство из вышеперечисленных недугов сопровождают кожный зуд, жжение и доставляют сильный дискомфорт больному. Также может иметь место при постгерпетической невралгии.
Врач может назначить Герпес простой, Herpes simplex, антитела к типам 1/2 IgG, Герпес простой, Herpes simplex, антитела к типам 1/2 IgM, Герпес простой, Herpes simplex, антитела к типу 2 IgG, Герпес, Human herpesvirus, антитела к типу 8 IgG, Герпес простой Herpes simplex, типы 1/2, ДНК методом REAL TIME ПЦР — кач., Герпес, Human herpesvirus, 6 тип, ДНК методом REAL TIME ПЦР — количеств., Герпес простой Herpes simplex, типы 1/2, ДНК методом REAL TIME ПЦР — кач.
Аллергия и крапивница
Одной из наиболее частых причин крапивницы является реакция при воздействии аллергена. В качестве аллергена могут быть как лекарственные вещества, пищевые продукты, аллергены насекомых, так и воздействие таких факторов, низкие и высокие температуры и др.
При предположении аллергии, как причины проявления крапивницы, врач может использовать исследования для выявления сенсибилизации к лекарственным препаратам; пищевым продуктам, например, таким, как специфические Ig E к ягодам, цитрусовым, яйцу, рыбе и др.
Сухость кожи
Из-за жесткой воды в сочетании с обычным мылом, недостаточной регидрации организма кожа становится сухая, шелушащаяся, в связи с чем может появиться зуд. В данном случае, чтобы избавиться от зуда, необходимо регулярно увлажнять кожу и пить больше жидкости.
Проблема сухой кожи также распространена и среди пожилых людей, когда сальные и потовые железы уже не так активно работают. В этом случае имеем дело с сенильным, или старческим, зудом.
Дефицит витаминов и минералов
Кожу необходимо питать не только водой и косметическими средствами, но и полезными витаминами и минералами. При авитаминозе кожа сохнет, из-за чего может возникнуть зуд. Компенсировав нехватку витаминов группы А, В, С, D, железа и цинка можно не только избавиться от проблемы шелушения и зуда, но и от угрей.
Компенсировав нехватку витаминов группы А, В, С, D, железа и цинка можно не только избавиться от проблемы шелушения и зуда, но и от угрей.
Психогенный зуд
В связи с такими состояниями как стресс, эмоциональные потрясения, переутомление, депрессия на нервной почве может возникнуть кожный зуд. Также к такой форме зуда можно отнести то, что после прочтения статьи захочется почесаться.
Беременность
По разным причинам многие беременные сталкиваются с проблемой кожного зуда чуть ли не с первых недель. В некоторых случаях это может быть связано с гормонами, в некоторых – с растяжением кожи или аллергенами.
Восстановление кожи
Заживление кожи после косметических процедур, ожогов действительно может сопровождаться зудом из-за усиленного кровообращения на участке тела.
Климактерический период
Период перестройки организма женщины во время климакса затрагивает гормоны, которые могут повлиять на появление кожного зуда, в основном в интимных зонах.
Выводы
Как видно, кожный зуд может вызывать масса причин: вирусы, паразиты, аллергии, сопутствующие болезни и т.д. Для того, чтобы выявить причину, потребуется консультация дерматолога.
Ну а для профилактики и для того, чтобы не столкнуться с данной проблемой, можно выделить несколько несложных правил:
- Хотя бы раз в год проходить полное обследование организма.
- Своевременно лечить кожные заболевания, инфекционные, грибковые, печени, почек и т.д.
- В случае аллергии избегать контакта с раздражителем.
- Соблюдать правила личной гигиены.
- Избегать стрессов, стараться высыпаться и радоваться каждому дню.
- Придерживаться здорового и сбалансированного питания и пить много воды.
- Регулярно увлажнять кожу.
Другие новости
11. 01.2022
01.2022
09.01.2022
04.01.2022
Почему мы страдаем от аллергии: новое объяснение
- Карл Зиммер
- BBC Future
Автор фото, SPL
Аллергические реакции на все — от пыльцы растений до арахиса — отравляют жизнь миллионов людей. Но почему же наш организм так болезненно реагирует на такие, казалось бы, безобидные раздражители? В этом попытался разобраться корреспондент BBC Future.
В моем случае это были шершни.
Как-то летним днем, когда мне было 12 лет, я оказался на заросшем высокой травой поле недалеко от дома одного из моих друзей и пнул ногой гнездо шершней размером с футбольный мяч. Эскадрилья разъяренных насекомых впилась в мою ногу. Их жала вонзались в меня, как раскаленные иглы. Я попытался смахнуть шершней с себя и бросился бежать, но спустя считанные минуты я ощутил, что с мной происходит что-то не то. Вокруг укусов образовалось целое созвездие розовых точек. Они начали распухать, сыпь поползла выше по ногам. У меня началась аллергическая реакция.
Эскадрилья разъяренных насекомых впилась в мою ногу. Их жала вонзались в меня, как раскаленные иглы. Я попытался смахнуть шершней с себя и бросился бежать, но спустя считанные минуты я ощутил, что с мной происходит что-то не то. Вокруг укусов образовалось целое созвездие розовых точек. Они начали распухать, сыпь поползла выше по ногам. У меня началась аллергическая реакция.
Мама друга дала мне какой-то антигистаминный препарат и погрузила меня в свой фургон. Пока мы ехали больницу графства, мне становилось все страшнее. Я очень смутно представлял себе, какие ужасы творятся, когда аллергия срывается с цепи. Я вообразил себе, как сыпь доползает до моего горла и запечатывает его.
Но я выжил и теперь могу рассказать эту историю. В больнице сыпь постепенно спала, но остался постоянный страх перед шершнями. Тест на аллергические реакции показал, что я восприимчив к насекомым. Причем не к медоносным пчелам или различным осам, а именно к конкретной разновидности шершней, которые меня жалили. Доктор из приемного покоя отделения скорой помощи предупредила, что в следующий раз, когда я наткнусь на их гнездо, мне может повезти меньше. Она дала мне инжектор EpiPen и сказала, что я должен тут же всадить иглу инжектора себе в бедро, если меня снова ужалит шершень. Содержащийся в инъекции противоаллергический препарат эпинефрин понизит давление крови, освободит дыхательные пути и, возможно, спасет мне жизнь.
Доктор из приемного покоя отделения скорой помощи предупредила, что в следующий раз, когда я наткнусь на их гнездо, мне может повезти меньше. Она дала мне инжектор EpiPen и сказала, что я должен тут же всадить иглу инжектора себе в бедро, если меня снова ужалит шершень. Содержащийся в инъекции противоаллергический препарат эпинефрин понизит давление крови, освободит дыхательные пути и, возможно, спасет мне жизнь.
В общем, мне повезло. С того дня прошло 35 лет, и за все это время я ни разу не натыкался на гнездо шершней.
Такая разная аллергия
У каждого человека, страдающего от аллергии, есть своя история ее возникновения. Это рассказ о том, как он обнаружил, что его иммунная система идет вразнос, когда некая произвольная, но вполне конкретная молекула попадает в организм. Таких историй – сотни миллионов. В одних только Соединенных Штатах насчитывается 18 млн человек, страдающих от сенной лихорадки. Пищевая аллергия наблюдается у миллионов американских детей. Различные виды аллергии все сильнее распространяются во многих других странах. Далеко не полный список аллергенов включает латекс, золото, пыльцу растений (пыльца амброзии, плевела и амаранта особенно опасны), пенициллин, яд насекомых, арахис, папайя, ожоги от щупалец медуз, духи, яйца, фекалии домашних пылевых клещей, орехи пекан, семгу, говядину и никель.
Различные виды аллергии все сильнее распространяются во многих других странах. Далеко не полный список аллергенов включает латекс, золото, пыльцу растений (пыльца амброзии, плевела и амаранта особенно опасны), пенициллин, яд насекомых, арахис, папайя, ожоги от щупалец медуз, духи, яйца, фекалии домашних пылевых клещей, орехи пекан, семгу, говядину и никель.
Автор фото, Thinkstock
Подпись к фото,Аллергия на насекомых может принимать самые страшные формы
Как только эти вещества вызывают аллергию, она может проявляться в целой гамме симптомов – от раздражающих до смертельных. Появляется сыпь, распухают губы. Сенная лихорадка сопровождается насморком и воспалением глаз. Аллергия на еду может проявляться в рвоте и поносе. У несчастного меньшинства различные виды аллергии могут почти мгновенно вызывать потенциально смертельную реакцию всего организма, известную как анафилактический шок.
Совокупное бремя всех этих напастей колоссально, тогда как набор средств лечения ограничен. EpiPen (известен и в России как ЭпиПен – Ред.) способен спасти жизнь, однако имеющиеся в распоряжении врачей средства длительного лечения предлагают неоднозначные результаты людям, измученным аллергией на плесень или ежегодное появление пыльцы растений. Антигистаминные препараты зачастую облегчают симптомы аллергии у страдальца, но эти лекарства вызывают сонливость.
EpiPen (известен и в России как ЭпиПен – Ред.) способен спасти жизнь, однако имеющиеся в распоряжении врачей средства длительного лечения предлагают неоднозначные результаты людям, измученным аллергией на плесень или ежегодное появление пыльцы растений. Антигистаминные препараты зачастую облегчают симптомы аллергии у страдальца, но эти лекарства вызывают сонливость.
В нашем распоряжении могло бы оказаться более эффективное средство лечения, если бы ученые сумели понять природу аллергии. Однако хитросплетение различных причин, вызывающих аллергические реакции, таково, что может свести с ума. Возбуждаются клетки, высвобождаются химические вещества, передаются сигналы. Ученым пока удалось лишь частично описать этот процесс. Но за всей этой биохимической паутиной скрывается еще более интригующая загадка: почему вообще у нас возникают аллергии?
Защита дает осечку
«Это именно та проблема, которую я люблю,- сказал мне недавно Руслан Меджитов.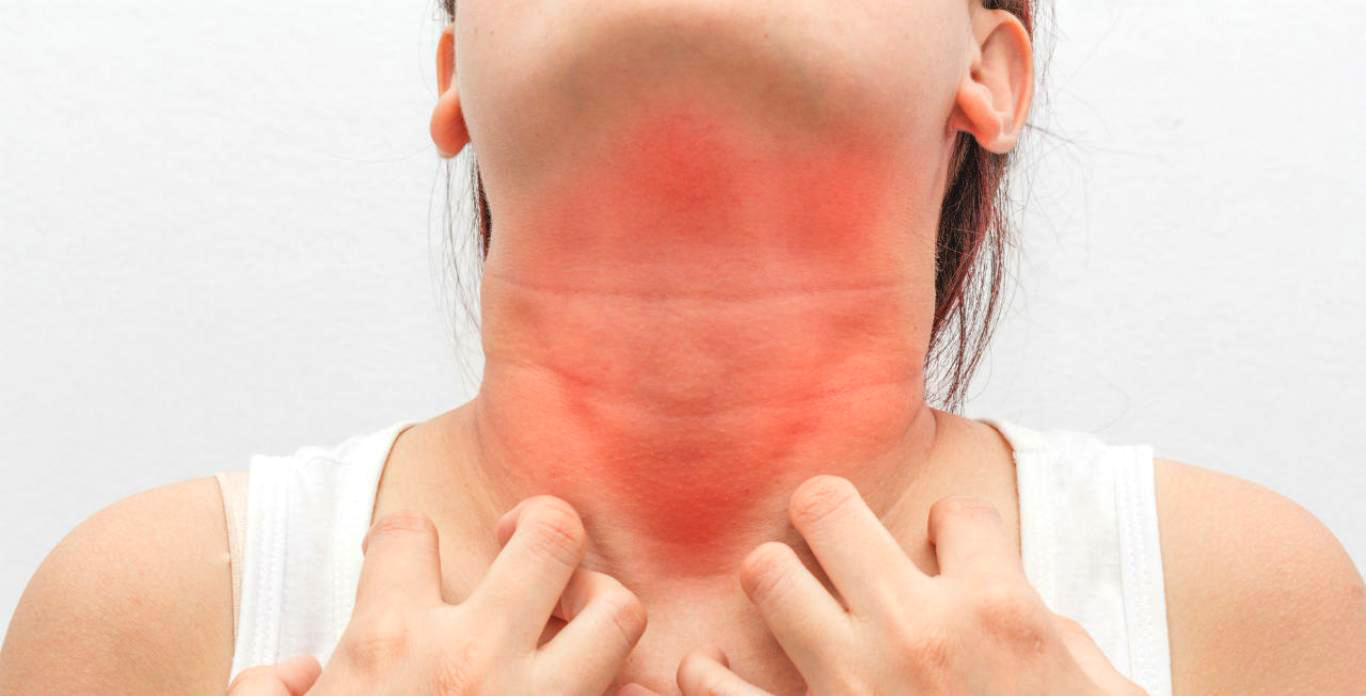 – Она очень велика, она фундаментальна и абсолютно неизучена».
– Она очень велика, она фундаментальна и абсолютно неизучена».
Меджитов и я неспешно прохаживались по его лаборатории, которая располагается на верхнем этаже Центра медицинских исследований и образования имени Уильяма Анлияна в Йельской школе медицины. Члены его команды, состоящей из постдокторантов и студентов выпускных курсов, едва протискиваются между достигающими размеров человека емкостями с кислородом и инкубаторами, наполненными иммунными клетками. «Здесь у нас беспорядок, но это продуктивный беспорядок», — говорит он, пожимая плечами. У Меджитова лицо боксера – массивное, круглое, с широким плоским носом. Однако речь его отличается изяществом выражений.
Автор фото, Thinkstock
Подпись к фото,У каждого свои симптомы аллергии
Действительно, беспорядок, царящий в лаборатории Меджитова, исключительно продуктивен. За последние 20 лет он совершил немало фундаментальных открытий в области иммунологии и получил целый ряд самых престижных премий. В прошлом он стал первым лауреатом только что учрежденной Премии имени Эльзе Кренер Фрезениус в размере 4 млн евро (из которых 3,5 млн идут на научные исследования, а полмиллиона – лично ученому). Хотя Мелжитов не получил Нобелевскую премию по медицине, многие из его коллег-ученых считают, что он более чем достоин этой награды. В 2011 году 26 ведущих иммунологов опубликовали в журнале Nature письмо с протестом против того, что Нобелевский комитет не выбрал его.
В прошлом он стал первым лауреатом только что учрежденной Премии имени Эльзе Кренер Фрезениус в размере 4 млн евро (из которых 3,5 млн идут на научные исследования, а полмиллиона – лично ученому). Хотя Мелжитов не получил Нобелевскую премию по медицине, многие из его коллег-ученых считают, что он более чем достоин этой награды. В 2011 году 26 ведущих иммунологов опубликовали в журнале Nature письмо с протестом против того, что Нобелевский комитет не выбрал его.
Сейчас внимание Меджитова сосредоточено на вопросе, ответ на который может совершить еще один переворот в иммунологии: почему мы подвержены аллергии? Твердого ответа нет ни у кого. Однако теория, которая сейчас считается ведущей, утверждает, что аллергии – это своего рода осечки при срабатывании защиты организма от червей-паразитов. В индустриальном мире, где такие инфекции стали редкостью, система непропорционально срабатывает на совершенно безобидные объекты, что заставляет нас страдать в процессе такой защитной реакции.
По мнению Меджитова, это неверно. Аллергии – это не просто биологические ошибки. На самом деле, они – действенный способ защиты против вредных химических веществ. Эти средства защиты служили нашим предкам десятки миллионов лет и продолжают служить нам поныне. Меджитов признает, что эта теория противоречива. Но вместе с тем он уверен, что история докажет его правоту. «Я думаю, что ситуация поменяется на 180 градусов по сравнению с тем этапом, когда сама идея вызывает ожесточенное сопротивление, — сказал он мне. – Настанет момент, когда все будут говорить: «Ну, да, это же очевидно. Конечно, все происходит именно так».
Иммунные реакции
Врачи древнего мира знали об аллергиях. Три тысячи лет назад китайские доктора описывали «растительную лихорадку», вызывавшую течь из носов осенью. Есть свидетельство, что египетский фараон Менес, основатель Первой династии, умер от укуса осы в 2641 году до Рождества Христова, хотя по другой версии его убил во время охоты гиппопотам. Спустя две с половиной тысячи лет римский философ Лукреций писал: «Что для одного еда, то для другого – яд».
Спустя две с половиной тысячи лет римский философ Лукреций писал: «Что для одного еда, то для другого – яд».
Автор фото, Thinkstock
Подпись к фото,Иногда аллергия с возрастом проходит
Но только чуть более века назад ученые поняли, что все эти многообразные симптомы – это разные головы одной и той же гидры. К тому времени исследователи уже установили, что причиной многих болезней служат бактерии и другие патогены, а мы отражаем нападения этих врагов с помощью нашей иммунной системы – армии клеток, способной выпускать смертельные химические вещества, точно поражающие антитела. Далее они выяснили, что иммунная система может причинять и вред.
В начале 1900-х гг. французские ученые Шарль Рише и Поль Портье изучали воздействие токсинов на организм. Они вводили малые дозы яда морской анемоны собакам, а спустя неделю, если собака выживала, вводили ей еще меньшую дозу. В течение нескольких минут у собаки наступал шок, и она погибала. Вместо того чтобы защищать животное от вреда, иммунная система делала его еще более восприимчивым к токсину.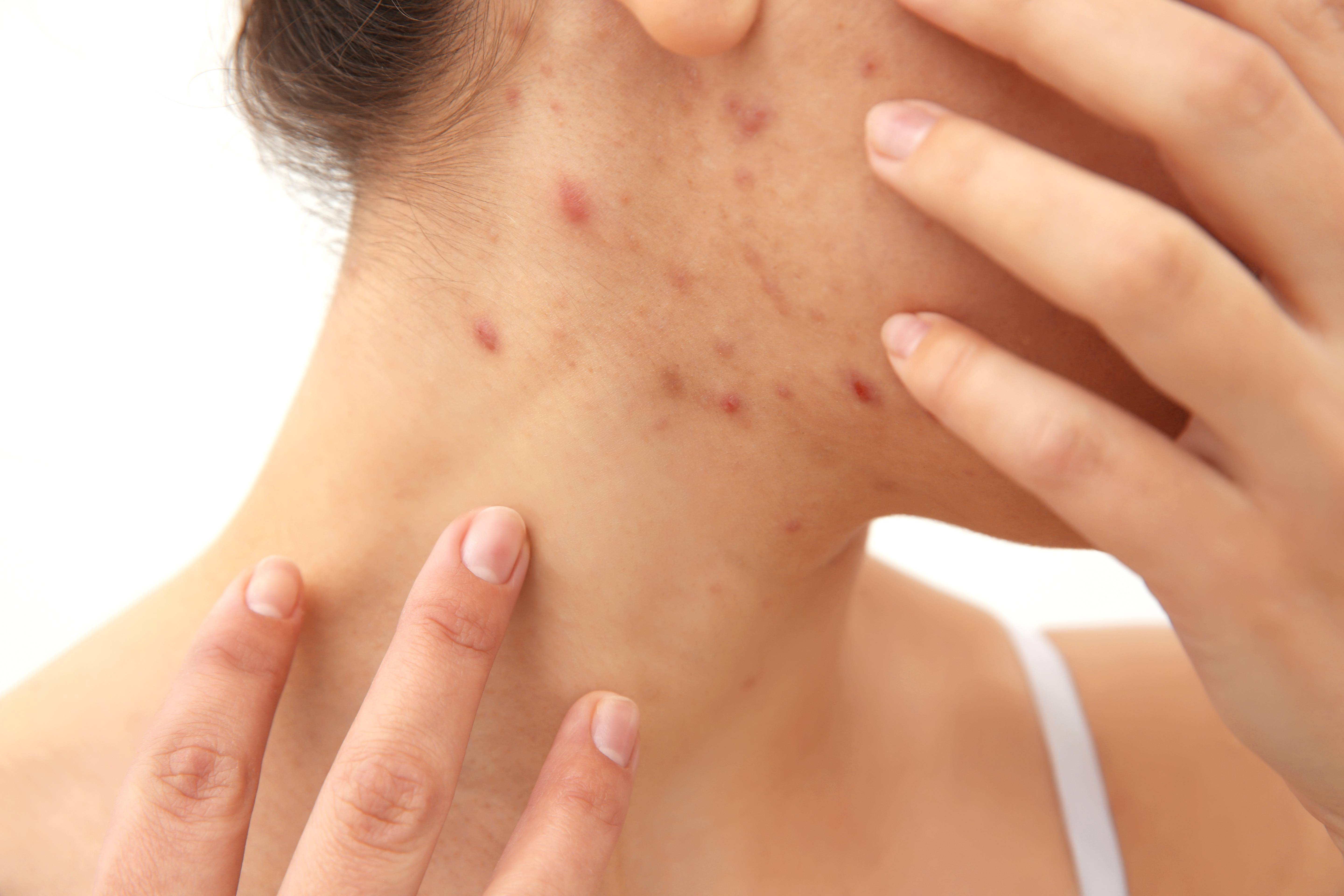 (За открытие этого явления, которому он дал название анафилаксия, Рише в 1913 году получил Нобелевскую премию – Ред.)
(За открытие этого явления, которому он дал название анафилаксия, Рише в 1913 году получил Нобелевскую премию – Ред.)
Другие ученые установили, что некоторые медицинские препараты вызывают сыпь и иные симптомы. Чувствительность увеличивается по мере воздействия в противоположность защите от инфекционных заболеваний, которую дают антитела. Австрийский врач-педиатр и диагност туберкулеза Клеменс фон Пирке задумался над тем, как вещества, проникающие в организм, способны менять характер его реакции. Чтобы описать этот процесс, он ввел в 1906 году термин «аллергия», составленный из греческих слов ἄλλος (другой) и ἔργον (работа, воздействие).
В последующие десятилетия ученые открыли, что молекулярные стадии таких реакций поразительно похожи. Процесс начинается тогда, когда аллерген попадает на одну из поверхностей тела – кожу, глаз, носоглотку, рот, дыхательные пути, кишечник. Эти поверхности изобилуют иммунными клетками, выполняющими функции пограничной стражи. Когда стражник сталкивается с аллергеном, он поглощает и уничтожает нарушителя, а затем украшает внешнюю поверхность фрагментами этого вещества. Затем клетка находит некую лимфатическую ткань. Там она передает фрагменты другой иммунной клетке, которая производит антитела, имеющие форму вилки, известные как иммуноглобулин E или IgE.
Когда стражник сталкивается с аллергеном, он поглощает и уничтожает нарушителя, а затем украшает внешнюю поверхность фрагментами этого вещества. Затем клетка находит некую лимфатическую ткань. Там она передает фрагменты другой иммунной клетке, которая производит антитела, имеющие форму вилки, известные как иммуноглобулин E или IgE.
Странная избирательность
Эти антитела активируют ответную реакцию, когда они снова встречают аллерген. Реакция начинается тогда, когда антитело активирует компонент иммунной системы, известный как мастоцит или тучная клетка, которая взрывается и выбрасывает целый рой химических веществ. Некоторые из этих химикатов цепляются к нервным окончаниям и вызывают зуд и кашель. Иногда появляется слизь. Мышцы гортани сжимаются, и становится трудно дышать.
Автор фото, Thinkstock
Подпись к фото,Люди по-разному спасаются от аллергии — кто-то пробует носить маску…
Эта картина, воссозданная в лабораториях на протяжении истекшего столетия, раскрывает часть тайны аллергии, обозначенную вопросом «как?». Без ответа остается вопрос «почему?» Это удивительно, потому что на данный вопрос есть вполне ясный ответ, который по большей части дает иммунная система. Наши предки постоянно подвергались атакам патогенов. Естественный отбор отдавал предпочтение тем мутациям, которые помогали им отражать эти атаки; и эти мутации накапливались, чтобы в итоге создать ту изощренную систему защиты, которой мы обладаем сегодня.
Без ответа остается вопрос «почему?» Это удивительно, потому что на данный вопрос есть вполне ясный ответ, который по большей части дает иммунная система. Наши предки постоянно подвергались атакам патогенов. Естественный отбор отдавал предпочтение тем мутациям, которые помогали им отражать эти атаки; и эти мутации накапливались, чтобы в итоге создать ту изощренную систему защиты, которой мы обладаем сегодня.
Труднее было понять, как естественный отбор мог привести к возникновению аллергий. Мощный иммунный ответ на безобидные вещи вряд ли мог способствовать выживанию наших предков. Кроме того, аллергии отличаются странной избирательностью. Лишь некоторые люди подвержены аллергии, и только некоторые вещества являются аллергенами. У некоторых людей аллергия начинает проявляться далеко не в юном возрасте, порой исчезает аллергия, от которой они страдали в детстве. А еще в течение десятилетий никто не мог понять, что такое иммуноглобулин IgE и каковы его свойства. Он не проявлял способности останавливать какие-либо вирусы или бактерии. Дело выглядело так, словно наш организм вырабатывает какой-то особый вид антител — просто для того, чтобы испортить нам жизнь.
Дело выглядело так, словно наш организм вырабатывает какой-то особый вид антител — просто для того, чтобы испортить нам жизнь.
Одна из первых подсказок появилась в 1964 году. Паразитолог Бриджит Огилви исследовала, как иммунная система противостоит паразитическим круглым червям — нематодам. Она обнаружила, что крысы, инфицированные этими паразитами, вырабатывают большие объемы вещества, которое позже получало название IgE. Дальнейшие исследования показали, что эти антитела дают иммунной системе сигнал начать сокрушительную контратаку против глистов.
Протеиновое звено
Черви-паразиты представляют серьезную угрозу не только для крыс, но и для людей. Глисты анкилостомы поражают, в частности, кишечник и высасывают кровь. Печеночные двуустки могут разрушить ткани печени и вызвать рак. Ленточные черви могут проникать в мозг и образовывать в нем кисты. Более 20% людей на Земле являются носителями глистных инвазий, большинство из них живет в странах с низкими доходами. До появления современных систем здравоохранения и контроля безопасности продуктов питания наши предки на протяжении всей своей жизни были вынуждены вести борьбу с глистами, а также клещами и другими паразитами.
До появления современных систем здравоохранения и контроля безопасности продуктов питания наши предки на протяжении всей своей жизни были вынуждены вести борьбу с глистами, а также клещами и другими паразитами.
Автор фото, Thinkstock
Подпись к фото,Аллергия на домашних животных довольно распространена
В 1980-е гг. несколько ученых настойчиво доказывали взаимосвязь между паразитами и аллергиями. Вероятно, у наших предков в процессе эволюции развилась способность распознавать белки (протеины) на поверхности червей и реагировать выработкой антител IgE. Антитела «воспламеняют» клетки иммунной системы на коже и в кишечнике, чтобы как можно скорее пресечь попытку паразита проникнуть в организм. «В нашем распоряжении есть примерно час времени, чтобы решительно отреагировать и понизить шансы паразитов на выживание», — говорит профессор Дэвид Данн, паразитолог и иммунолог и Кембриджского университета.
Согласно паразитарной теории, белки глистов имеют ту же форму, что и другие молекулы, с которыми мы постоянно сталкиваемся в жизни. Если мы встречаем такие молекулы, мы переходим к бессмысленной обороне. «Аллергия – это ничто иное как злополучный побочный эффект защиты от червей-паразитов», — говорит Данн.
Если мы встречаем такие молекулы, мы переходим к бессмысленной обороне. «Аллергия – это ничто иное как злополучный побочный эффект защиты от червей-паразитов», — говорит Данн.
Когда Меджитов только начинал изучать иммунологию, ему преподавали паразитарное учение о происхождении аллергии. Однако 10 лет назад у него начали возникать сомнения на этот счет. «Я видел, что это ничего не объясняет», — говорит он. Поэтому Меджитов задумался над своей собственной теорией на этот счет.
Размышления составляют немалую часть научной работы Меджитова. Это наследие, доставшееся ему от лет учебы в Советском Союзе в 1980-1990-е гг., когда в университетах страны было мало оборудования и еще меньше заинтересованности в подготовке хороших ученых. Студенческие годы Меджитова прошли в Ташкентском государственном университете в Узбекистане. Каждую осень профессора (по разнарядке коммунистических партийных органов – Ред.) отправляли студентов в поле на помощь колхозникам в уборке урожая хлопка. Работали ежедневно от рассвета до заката. «Это было ужасно, — говорит Меджитов. – Если ты не работал, тебя исключали из университета». Он вспоминает, как тайком брал с собой в поле учебники по биохимии, за что и подвергся взысканию.
Работали ежедневно от рассвета до заката. «Это было ужасно, — говорит Меджитов. – Если ты не работал, тебя исключали из университета». Он вспоминает, как тайком брал с собой в поле учебники по биохимии, за что и подвергся взысканию.
Автор фото, Thinkstock
Подпись к фото,Цветение растений, пыльца — мощнейшие аллергены
В аспирантуре было не лучше. Он приехал на учебу в Московский государственный университет сразу после краха советского режима. Университет оказался банкротом, у Меджитова не было оборудования, необходимого для проведения экспериментов. «Практически все свое время я читал и думал», — сказал мне Меджитов.
Главным образом он думал о том, как наш организм воспринимает внешний мир. Мы распознаем «паттерны» фотонов с помощью глаз, а «паттерны» вибраций воздуха – ушами. По мнению Меджитова, иммунная система – одна из систем распознания «паттернов»: она засекает молекулярные подписи вместо света и звуков.
В поисках научных статей по своей дисциплине Меджитов наткнулся на реферат эссе, написанного в 1989 году Чарльзом Дженуэем, иммунологом из Йельского университета, и озаглавленного «Приближение к асимптоте? Эволюция и революция в иммунологии». (Асимптота – в математике прямая линия, к которой бесконечно приближается кривая. – Ред.)
(Асимптота – в математике прямая линия, к которой бесконечно приближается кривая. – Ред.)
Меджитов был заинтригован и потратил свою стипендию за несколько месяцев, чтобы купить репринт этой работы. Его ожидания оказались полностью оправданными, поскольку эта работа открыла ему учение Дженуэя о «врожденном иммунитете», а этому учению было суждено изменить его жизнь.
Новый датчик
В то время Дженуэй утверждал, что антитела обладают одним существенным недостатком: иммунной системе требуется несколько дней, чтобы выработать эффективное антитело для противодействия новой инвазии. Он предположил, что у иммунной системы может быть еще одна линия обороны, которая обеспечивает более оперативную защиту. Возможно, она использует систему распознания «паттернов», позволяющую быстро засекать бактерии и вирусы и немедленно запускать ответную реакцию.
Меджитов рассуждал примерно так же, поэтому он немедленно написал Дженуэю. Дженуэй ответил, и между ними завязалась переписка, которая, в итоге, привела Меджитова в Нью-Хейвен, штат Коннектикут. В 1994 году он стал исследователем-постдокторантом в лаборатории Дженуэя. Чарльз Дженуэй умер в 2003 году.
Дженуэй ответил, и между ними завязалась переписка, которая, в итоге, привела Меджитова в Нью-Хейвен, штат Коннектикут. В 1994 году он стал исследователем-постдокторантом в лаборатории Дженуэя. Чарльз Дженуэй умер в 2003 году.
Автор фото, Thinkstock
Подпись к фото,Люди отказываются от многих продуктов, лишь бы не страдать от аллергии
Меджитов до сих пор диву дается, как это Дженуэй согласился с ним работать. «Я думаю, что единственная причина, почему он меня взял в свою лабораторию, заключается в том, что никто больше не хотел заниматься этой идеей», — вспоминает он.
Ощущая поддержку со стороны коллег Дженуэя, Дерека Сант’Анджело и других сотрудников лаборатории, Меджитов учился очень быстро. Вскоре он и Дженуэй обнаружили новый класс сенсоров на поверхности определенного вида иммунных клеток. Столкнувшись с вторжением в организм чужеродного тела, такой датчик прикрепляется к чужаку и включает систему химической тревоги, которая отправляет другие иммунные клетки на поиск патогенов, чтобы обнаружить их и уничтожить. Это быстрый и точный способ обнаружения и устранения чужеродных бактерий.
Это быстрый и точный способ обнаружения и устранения чужеродных бактерий.
Открытие Меджитовым и Дженуэем этих датчиков, ныне известных как толл-подобные рецепторы (TLR-4) у млекопитающих, выявило новое измерение, присущее нашей иммунной защите, и было признано фундаментальным принципом иммунологии.
Меджитов продолжал размышлять и после того, как они с Дженуэем открыли толл-подобные рецепторы. Если иммунная система обладает специальными сенсорами для бактерий и других инородных тел, возможно, у нее есть не открытые еще датчики для обнаружения других врагов. Именно тогда он задумался о паразитических червях, иммуноглобулинах E (IgE) и аллергиях. Но поначалу, когда он думал об этом, картина не складывалась.
Верно то, что когда иммунная система обнаруживает червей-паразитов, она вырабатывает IgE. Однако IgE не играет такой уж существенной роли в борьбе с инородными организмами. Так, например, ученые с помощью генной инженерии вывели мышей, не способных производить IgE, и обнаружили, что такие животные по-прежнему были способны защищаться от червей-паразитов.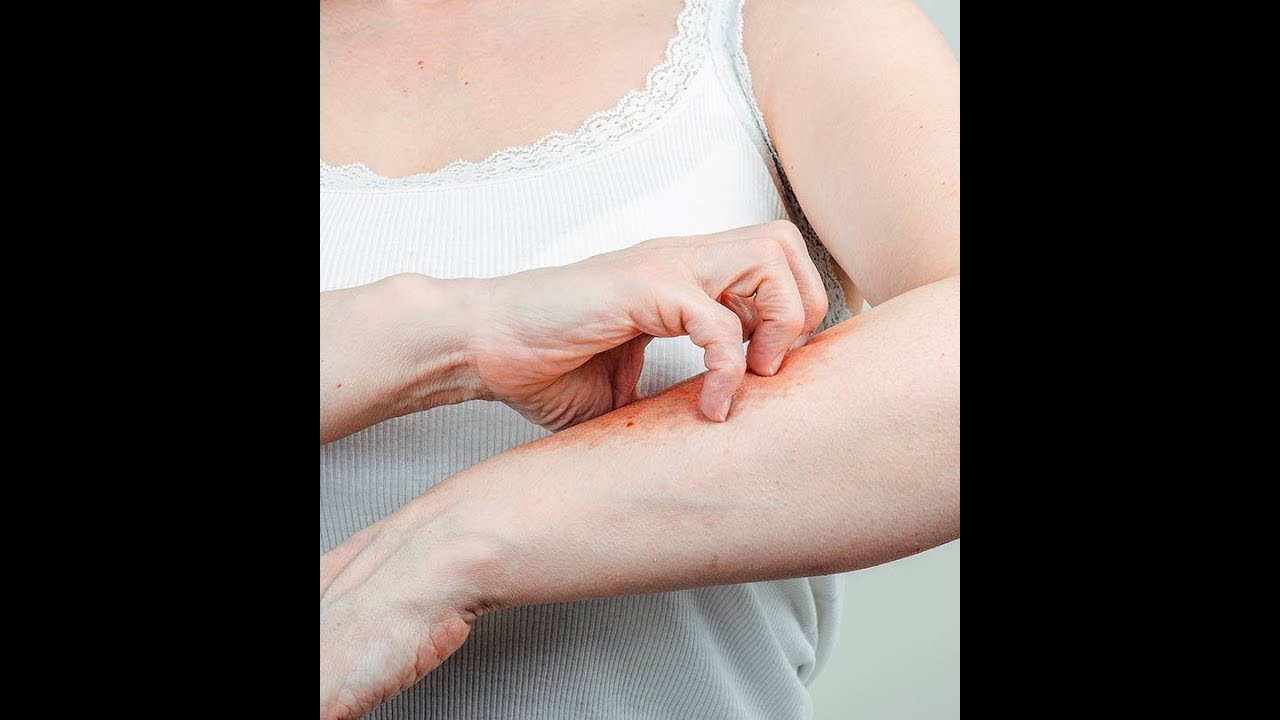 Меджитов скептически относился к идее, что аллергены имитируют белки-паразиты. У множества аллергенов, таких как никель или пенициллин, нет возможных аналогов в молекулярном строении паразита.
Меджитов скептически относился к идее, что аллергены имитируют белки-паразиты. У множества аллергенов, таких как никель или пенициллин, нет возможных аналогов в молекулярном строении паразита.
Чем больше Меджитов думал об аллергенах, тем менее важной представлялась ему их структура. Возможно, аллергены связаны друг с другом не формой, а тем, что они делают.
Борцы с токсинами
Мы знаем, что аллергены часто наносят физический ущерб. Они вскрывают клетки, раздражают мембраны, разрушают белки. Может быть, думал Меджитов, аллергены приносят такой серьезный вред, что нам нужна защита от них. «Если задуматься обо всех основных симптомах аллергических реакций – насморк, слезы, чихание, кашель, зуд, рвота, диарея, — у них у всех есть нечто общее, — говорит Меджитов. – Все они имеют отношение к изгнанию чего-либо». Внезапно тайна аллергии начала представляться по-иному. Аллергии не являются признаком возникновения неполадок в организме. Они представляют собой стратегию организма, направленную на избавление от аллергенов.
Они представляют собой стратегию организма, направленную на избавление от аллергенов.
Автор фото, Thinkstock
Подпись к фото,Определить точно, на что аллергия, как правило, трудно — не помогают и специальные тесты
Изучая такую возможность, Меджитов выяснил, что идея уже всплывала на поверхность время от времени, но затем вновь оказывалась погребена. Например, в 1991 году эволюционный биолог Марджи Профет высказывала предположение, что аллергии борются с токсинами. Иммунологи отвергли эту идею, видимо, на том основании, что Профет была для них чужаком. Меджитов счел эволюционную теорию токсинов, предложенную Профет, весьма полезной. «Она словно развязала нам руки», — сказал ученый.
В соавторстве с двумя своими учениками, Ноем Палмом и Рэйчел Розенстайн, Меджитов опубликовал статью с изложением своей теории в журнале Nature в 2012 году. Затем он стал проверять ее опытным путем. Сначала он проверил наличие связи между ущербом и аллергиями. Он и его коллеги делали мышам инъекции, содержащие PLA2, аллергический фермент фосфолипаза А2, который находится в пчелином яде и разрушает мембраны клеток.
Он и его коллеги делали мышам инъекции, содержащие PLA2, аллергический фермент фосфолипаза А2, который находится в пчелином яде и разрушает мембраны клеток.
Как и предсказывал Меджитов, иммунная система животных не реагировала собственно на PLA2 как таковой. Только тогда, когда фермент PLA2 вскрывал мембранные оболочки клеток, иммунная система вырабатывала антитела IgE.
Другое предсказание, содержавшееся в теории Меджитова, гласило, что эти антитела будут защищать мышей вместо того, чтобы стать для них причиной болезни. Чтобы проверить эту гипотезу, Меджитов и его коллеги вслед за первой инъекцией PLA2 ввели мышам вторую, более сильную дозу препарата. Если бы животные не подверглись ранее воздействию PLA2, температура тела у них должна была резко подскочить, что могло бы даже привести к гибели подопытных. Однако мыши, подвергшиеся воздействию, отреагировали на это аллергической реакцией, которая, по не ясным пока причинам, ослабила действие PLA2.
Клеточный щит
Меджитов не знал, что на другом краю США еще один ученый проводил эксперимент, результаты которого могли еще основательнее подкрепить его теорию. Стивен Галли, заведующий кафедрой патологии в Медицинской школе Стэнфордского университета, в течение многих лет изучал тучные клетки, загадочные иммунные клетки, способные убивать людей во время аллергических реакций. У него возникло подозрение, что на самом деле тучные клетки должны оказывать помощь организму. Так, в 2006 году Галли и его коллеги выяснили, что тучные клетки уничтожают токсины, содержащиеся в яде гадюки. Это открытие навело Галли на ту же мысль, к которой склонялся и Меджитов: а не могут ли аллергии выполнять защитную функцию.
Стивен Галли, заведующий кафедрой патологии в Медицинской школе Стэнфордского университета, в течение многих лет изучал тучные клетки, загадочные иммунные клетки, способные убивать людей во время аллергических реакций. У него возникло подозрение, что на самом деле тучные клетки должны оказывать помощь организму. Так, в 2006 году Галли и его коллеги выяснили, что тучные клетки уничтожают токсины, содержащиеся в яде гадюки. Это открытие навело Галли на ту же мысль, к которой склонялся и Меджитов: а не могут ли аллергии выполнять защитную функцию.
Автор фото, SPL
Подпись к фото,Те самые тучные клетки, основные агенты аллергических реакций
Что получить ответ на этот вопрос, Галли и его коллеги вводили мышам инъекции, содержащие от одной до двух доз яда, соответствующих одному укусу пчелы, вызывая тем самым аллергические реакции у животных. Затем они вводили подопытным потенциально смертельные дозы, чтобы понаблюдать, повысит ли ответная реакция шансы мышей на выживание. Так и произошло. Более того, когда Галли его команда ввели антитела IgE мышам, которые раньше не подвергались воздействию яда, эти животные также оказались защищенными от потенциально опасной дозы.
Так и произошло. Более того, когда Галли его команда ввели антитела IgE мышам, которые раньше не подвергались воздействию яда, эти животные также оказались защищенными от потенциально опасной дозы.
Меджитов был в восторге, когда обнаружил работу Галли в том же номере журнала Immunity («Иммунитет»), в котором была опубликована его собственная статья. «Приятно было узнать, что кто-то пришел к тем же результатам, используя совершенно другую модель. Это обнадеживало», — сказал мне Меджитов.
И все же после всех экспериментов многие вопросы оставались без ответов. Каким именно образом вред, наносимый организму пчелиным ядом, ведет к выделению IgE? И как IgE защищает мышей? Именно на эти вопросы ищет сейчас ответы команда Меджитова. Он продемонстрировал мне некоторые эксперименты, когда я снова побывал у него в марте. Мы с трудом протиснулись мимо новой морозильной камеры, перегораживающей коридор, чтобы проникнуть в комнату, где его сотрудница Джейми Каллен проводит большую часть своего времени.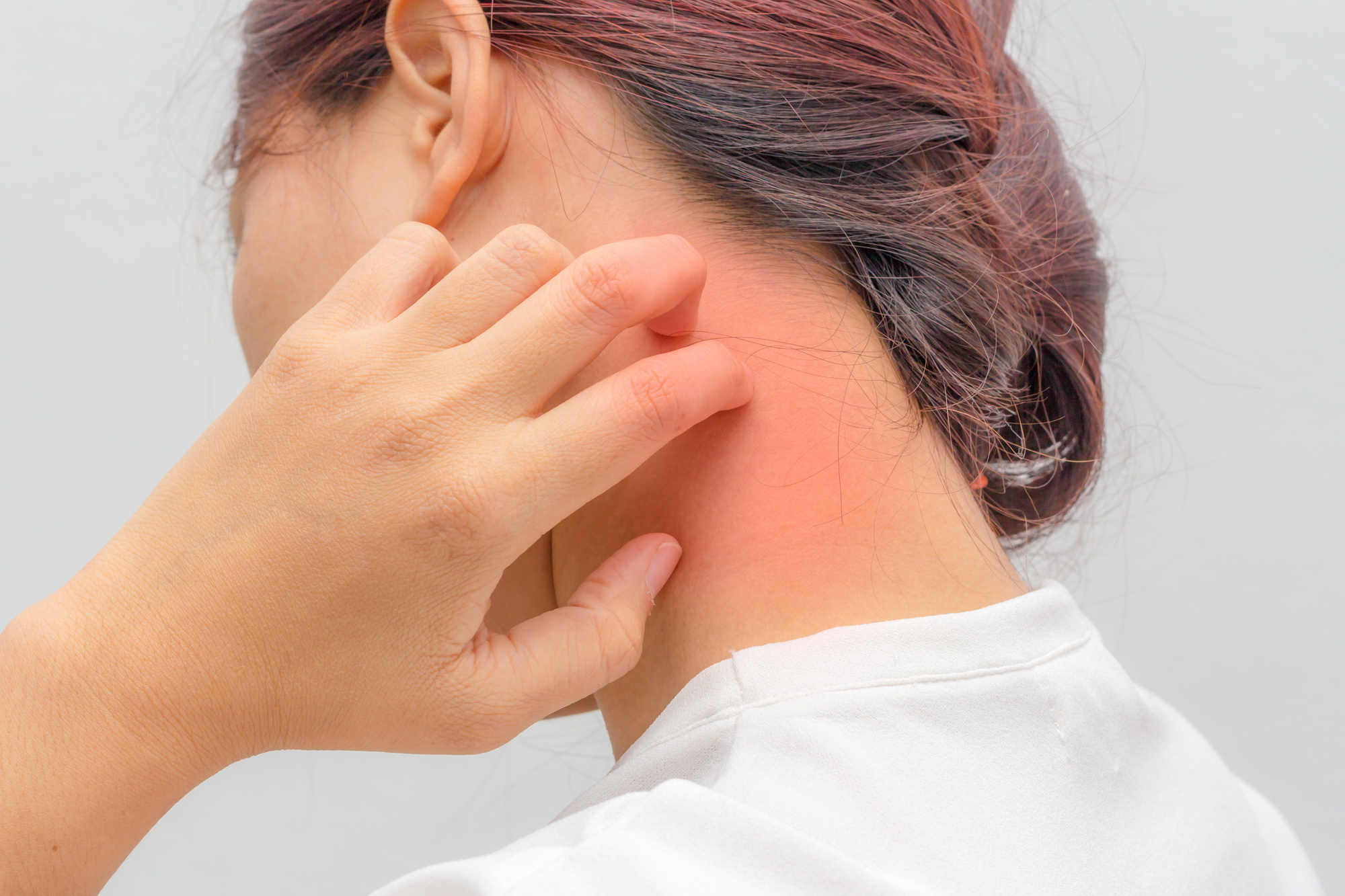 Она поместила под микроскоп емкость с розовым сиропом и пригласила меня взглянуть. Я увидел целое сонмище тел, имевших форму дыни.
Она поместила под микроскоп емкость с розовым сиропом и пригласила меня взглянуть. Я увидел целое сонмище тел, имевших форму дыни.
«Это именно те клетки, которые и создают все проблемы», — сказал Меджитов. Я смотрел на тучные клетки, основные агенты аллергических реакций. Каллен занимается изучением того, как антитела IgE вступают в столкновение с тучными клетками, побуждая их становиться восприимчивыми, а в некоторых случаях и сверхвосприимчивыми к аллергенам.
Сигнал тревоги для организма
Как предсказывает Меджитов, такие эксперименты покажут, что обнаружение аллергенов действует так же, как домашняя система охранной сигнализации: «Вы можете засечь грабителя не потому, что узнали его в лицо, а по разбитому окну», — объясняет он. Вред, причиненный аллергеном, возбуждает иммунную систему, которая собирает молекулы, находящиеся поблизости, и создает к ним антитела. Таким образом, преступник установлен и его можно будет скрутить, как только он попробует проникнуть в дом в следующий раз.
Аллергии становятся более понятными с точки зрения эволюции, если рассматривать их как своего рода домашнюю систему охранной сигнализации. Токсичные химические вещества, те же яды растений и животных, издавна угрожают здоровью человека. Аллергии обеспечивали защиту нашим предкам, вымывая эти вещества из организма. А тот дискомфорт, который наши предки испытывали, подвергаясь воздействию этих аллергенов, мог заставить их перебираться в более безопасные уголки среды их обитания.
В лаборатории Джейми Каллен стоит пластиковый ящик, в котором обитает пара мышей. В подвале здания хранятся дюжины других подобных ящиков. Некоторые из мышей – самые обыкновенные, другие – нет. Ученые из команды Меджитова с помощью методов генной инженерии лишили животных возможности производить IgE.
Меджитов и Каллен будут вести наблюдения за этими избавленными от аллергии мышами в течение следующей пары лет. Животные могут быть избавлены от страданий, связанных с сенной лихорадкой, вызванной пыльцой амброзии, которая неизбежно попадет в их ящики с потоками воздуха. Но, как предсказывает Меджитов, им придется хуже. Неспособные противостоять пыльце растений и другим аллергенам, они позволят токсичным молекулам беспрепятственно проникнуть в свой организм, где будет нанесен вред органам и тканям.
Но, как предсказывает Меджитов, им придется хуже. Неспособные противостоять пыльце растений и другим аллергенам, они позволят токсичным молекулам беспрепятственно проникнуть в свой организм, где будет нанесен вред органам и тканям.
«Этого еще никто никогда не делал, поэтому мы не знаем, какими окажутся последствия», — говорит Меджитов. Но если его теория верна, эксперимент продемонстрирует, что аллергии оснащают нас невидимым щитом.
Как повезет…
Даже если эксперимент пройдет так, как ожидается, Меджитов не уверен, что его гипотезы по поводу аллергий так же быстро заслужат признание, как идеи, относящиеся к толл-подобным рецепторам. Представление о вреде аллергий слишком прочно укоренилась в умах врачей. «Приходится считаться с инерцией мышления», — говорит он.
Однако понимание целей, которым служат аллергии, может привести к кардинальным изменениям в подходах к их лечению. «Один из выводов из наших взглядов состоит в том, что любая попытка полностью блокировать аллергическую защиту – это плохая идея», — говорит Меджитов. Вместо этого аллергологам следовало бы выяснить, почему у меньшинства людей защитные реакции приводят к сверхчувствительности. «Это так же, как с болью, — продолжает Меджитов. – Нормальная боль – это благо. Избыточная боль – беда».
Вместо этого аллергологам следовало бы выяснить, почему у меньшинства людей защитные реакции приводят к сверхчувствительности. «Это так же, как с болью, — продолжает Меджитов. – Нормальная боль – это благо. Избыточная боль – беда».
Пока же Меджитов был бы доволен, если бы удалось убедить людей не относиться к аллергиям, как к болезни, несмотря на все страдания, которые они причиняют. «Вы чихаете, чтобы защитить себя. А то, что вам не нравится чихать, это уж простое невезение, — говорит он, слегка пожимая плечами. – Эволюции нет дела до ваших чувств».
Аллергия на нервной почве: миф или реальность?
Аллергология как отдельная наука существует не так давно – всего несколько десятилетий. Будучи достаточно молодой, она еще не успела перенять мировой опыт, поэтому многие аллергологи-иммунологи настойчиво игнорируют тот факт, что первопричиной многих проблем являются именно заболевания нервной системы. Какого же мнения придерживаются западные специалисты и есть ли резон усматривать корень аллергических проблем в расстройствах психики?
Что такое псевдоаллергия?
Многие специалисты привыкли смотреть на проблему аллергии достаточно узко как на биохимическую реакцию, в то время как в ряде случаев нужен именно «стереоскопичный» подход. Достаточно часто врачи имеют дело лишь с психогенной или нейрогенно-аллергической реакцией, которая не имеет никакого отношения к пищевому, бытовому или другому аллергену. Только в прогрессивных клиниках аллергологии усматривают причину такой псевдоаллергии в эмоциональном факторе, состоянии вегетативной нервной системы.
Достаточно часто врачи имеют дело лишь с психогенной или нейрогенно-аллергической реакцией, которая не имеет никакого отношения к пищевому, бытовому или другому аллергену. Только в прогрессивных клиниках аллергологии усматривают причину такой псевдоаллергии в эмоциональном факторе, состоянии вегетативной нервной системы.
Термин «аллергия» появился всего сто лет назад, а до этого момента ее всегда связывали с психологическими проблемами – еще со времен Гиппократа и Авиценны. Ученые заметили, что высыпания и зуд появляются даже без контакта с аллергенами при сильных переживаниях, особенно у эмоционально возбудимых людей. В группу риска попадают те, кто склонен к утомляемости и раздражительности. Кроме того, симптомы псевдоаллергии дают о себе знать при колебаниях артериального давления, расстройствах сердечного ритма и других проблемах вегетативной нервной системы.
Основные способы борьбы с аллергией на нервной почве
Справиться с аллергией, имеющей психогенную природу, позволяет только комплексный подход. В этом случае практически бесполезны медикаментозное лечение или АСИТ-терапия, а им на смену приходят надежные и хорошо зарекомендовавшие себя альтернативные методы:
В этом случае практически бесполезны медикаментозное лечение или АСИТ-терапия, а им на смену приходят надежные и хорошо зарекомендовавшие себя альтернативные методы:
- акупунктура;
- точечный массаж;
- рефлекторно-мануальная терапия и т. д.
Комбинирование таких воздействий позволяет активизировать системы организма и получить стойкий результат. Терапия направлена не на снижение чувствительности к определенному аллергену, что в принципе не возможно в этом случае. Происходит базовое налаживание функционирования нейрогуморальной регуляции, вследствие чего организм избавляется от недуга.
Насколько эффективны психотерапевтические техники
Представители традиционной медицины убеждены, что лечить аллергию гипнозом, по меньшей мере, глупо, однако это может оказаться большим заблуждением. Специалисты из разных стран пришли к единому мнению, что методы гипноза и приемы нейролингвистического программирования на самом деле помогают избавиться от негативно-психологических установок на проявление аллергии. Поэтому они широко практикуются в западной медицине наряду с гомеопатией и другими альтернативными методиками.
Поэтому они широко практикуются в западной медицине наряду с гомеопатией и другими альтернативными методиками.
Механизмы, лежащие в основе нейрональных симптомов аллергия
J Allergy Clin Immunol. Авторская рукопись; Доступен в PMC 2019 APR 25.
Опубликовано в окончательной редактированной форме AS:
PMCID: PMC6483074
NIHMSID: NIHMS1021746
Bradley J. Undem
A NOME Отдел аллергии и клинической иммунологии Джонс Медицинская школа Хопкинса, Балтимор
Томас Тейлор-Кларк
b Кафедра молекулярной фармакологии и физиологии, Медицинский колледж Морсани, Университет Южной Флориды, Тампа.
a Отделение аллергии и клинической иммунологии, Джонс Медицинская школа Хопкинса, Балтимор
b Кафедра молекулярной фармакологии и физиологии, Медицинский колледж Морсани, Университет Южной Флориды, Тампа.
Автор, ответственный за переписку: Брэдли Дж. Ундем, доктор философии, отделение аллергии.
и клинической иммунологии, Медицинская школа Джона Хопкинса, 5501 Хопкинс
Bayview Circle, Baltimore, MD 21224. ude.imhj@mednub. См. другие статьи в PMC, в которых цитируется опубликованная статья.
Ундем, доктор философии, отделение аллергии.
и клинической иммунологии, Медицинская школа Джона Хопкинса, 5501 Хопкинс
Bayview Circle, Baltimore, MD 21224. ude.imhj@mednub. См. другие статьи в PMC, в которых цитируется опубликованная статья.Abstract
Лица с аллергией с симптомами, которые часто являются результатом
изменения в нервной системе. Нейрональные симптомы зависят от органа
при которой возникает аллергическая реакция, но она может включать покраснение глаз, зуд, чихание,
заложенность носа, ринорея, кашель, бронхоспазм, выделение слизи из дыхательных путей
секреция, дисфагия, нарушение перистальтики желудочно-кишечного тракта и зуд, отек кожи.
Эти симптомы возникают из-за того, что медиаторы, высвобождаемые во время аллергической реакции, могут
взаимодействуют с чувствительными нервами, изменяют обработку в центральной нервной системе,
и изменяют передачу симпатических, парасимпатических и энтеральных вегетативных
нервы.Кроме того, данные подтверждают идею о том, что у некоторых субъектов это
нейромодуляция по малопонятным причинам активируется таким образом, что
одинаковая степень нервного раздражения вызывает больший эффект, чем у здоровых
предметы. Существуют различия в механизмах и типах нервов, участвующих в
аллерген-индуцированная нейромодуляция в различных системах органов, но в целом
появились принципы. Продукты активированных тучных клеток, др.
воспалительные клетки, а резидентные клетки могут открыто стимулировать нервные окончания,
вызывают длительные изменения возбудимости нейронов, повышают синаптическую эффективность,
а также изменяют экспрессию генов в нервах, что приводит к фенотипически измененным
нейроны.Лучшее понимание этих процессов может привести к новым
терапевтические стратегии, направленные на ограничение страданий людей с
аллергии.
Существуют различия в механизмах и типах нервов, участвующих в
аллерген-индуцированная нейромодуляция в различных системах органов, но в целом
появились принципы. Продукты активированных тучных клеток, др.
воспалительные клетки, а резидентные клетки могут открыто стимулировать нервные окончания,
вызывают длительные изменения возбудимости нейронов, повышают синаптическую эффективность,
а также изменяют экспрессию генов в нервах, что приводит к фенотипически измененным
нейроны.Лучшее понимание этих процессов может привести к новым
терапевтические стратегии, направленные на ограничение страданий людей с
аллергии.
Ключевые слова: Аллергия, аллерген, тучные клетки, IgE, дегрануляция, нервные, афферентные, эфферентные, вегетативные, сенсорные, ноцицепторные, С-волокна, парасимпатические, симпатические, кишечные, миентеральные, одиночное ядро, ионный канал, деполяризация, потенциал действия, кашель, зуд, боль, рефлекс, подвижность, бронхоспазм, дисфункция, воспаление, кожа, легкие, дыхательные пути, кишечник, глаза, гиперсекреция, противовоспалительное, стероиды, блуждающий нерв, задние корешки, тройничный, узловатый, яремный, ганглии, взаимодействие тучных клеток и нервов, симптомы, транзиторные потенциальные каналы рецепторов, медиаторы тучных клеток, гистамин, простагландин, лейкотриен, цитокин, раздражитель, рецептор, иннервация, пластичность, критические периоды, фенотипический переключатель Балтимор, Мэриленд, Тампа, Флорида
Аллергия следствие гиперреакции иммунной системы, вызванной IgE. что в противном случае было бы относительно безобидным стимулом.Клинически аллергия проявляется
характеризуется симптомами, которые в основном являются вторичными по отношению к измененной нервной системе.
Набор нейрональных симптомов зависит от органа, в котором возникает реакция, но
может включать зуд и покраснение глаз; ринорея, заложенность носа и чихание; призывать
кашель, одышка, выделение слизи из дыхательных путей и эпизодический рефлекторный бронхоспазм; дисфагия,
измененная моторика желудочно-кишечного тракта и дискомфорт; и кожный зуд и воспаление
ответы. Эти события либо в сумме , либо частично вторичны по отношению к
изменение активности нейронов.Поэтому аллергию можно охарактеризовать как
иммунно-нейронное расстройство ().
что в противном случае было бы относительно безобидным стимулом.Клинически аллергия проявляется
характеризуется симптомами, которые в основном являются вторичными по отношению к измененной нервной системе.
Набор нейрональных симптомов зависит от органа, в котором возникает реакция, но
может включать зуд и покраснение глаз; ринорея, заложенность носа и чихание; призывать
кашель, одышка, выделение слизи из дыхательных путей и эпизодический рефлекторный бронхоспазм; дисфагия,
измененная моторика желудочно-кишечного тракта и дискомфорт; и кожный зуд и воспаление
ответы. Эти события либо в сумме , либо частично вторичны по отношению к
изменение активности нейронов.Поэтому аллергию можно охарактеризовать как
иммунно-нейронное расстройство ().
Нейромодуляция при аллергической реакции. Экспериментальные исследования in vivo и ex vivo подтверждают гипотезу
что аллергическая реакция может включать нейромодуляцию сенсорных
(афферентный) – ЦНС – вегетативная/кишечная нервная ось (см.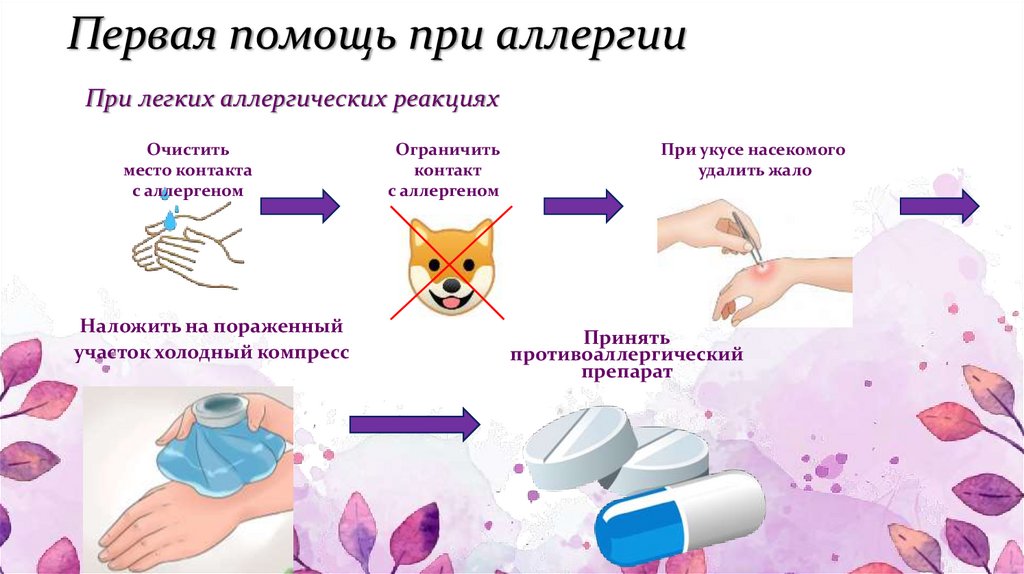 текст для
Детали). Нейромодуляция в конечном итоге приводит ко многим симптомам
аллергическое заболевание. DRG , Ганглий задних корешков.
текст для
Детали). Нейромодуляция в конечном итоге приводит ко многим симптомам
аллергическое заболевание. DRG , Ганглий задних корешков.
Иммунологи преобладают среди заинтересованных в изучении механизмов аллергии.За последние несколько десятилетий ученые добились огромного прогресса в распутывая сложную паутину, составляющую иммунологическую основу аллергии. Это включает в себя как афферентные (сенсибилизация), так и эфферентные (рекрутирование воспалительных клеток и активация) конечности ответа. Результаты этих расследований наполняют фармацевтические конвейеры с рациональными, умными и захватывающими терапевтическими стратегиями направлена на купирование воспаления, связанного с аллергической реакцией.
Однако можно утверждать, что иммунное воспаление, связанное с
Аллергические реакции в некоторых случаях могут быть тривиальными, если только они не трансдуцированы в нейрогенные реакции.
симптомы страдания (например, зуд, кашель, бронхоспазм, нарушение моторики, боль,
чихание, кожные заболевания). Тем не менее, несмотря на то, что противовоспалительный конвейер при аллергии
терапия изобилует активностью, антинейромодуляторный конвейер в значительной степени
пустой. Это может быть связано с недостаточным вниманием, уделяемым нейронам.
аспект этого иммунно-нейронного расстройства.
Тем не менее, несмотря на то, что противовоспалительный конвейер при аллергии
терапия изобилует активностью, антинейромодуляторный конвейер в значительной степени
пустой. Это может быть связано с недостаточным вниманием, уделяемым нейронам.
аспект этого иммунно-нейронного расстройства.
Здесь мы попытались сделать обзор литературы, которая дает представление о том, как
нервная система поражается аллергической реакцией. Ограничения по площади не позволяют
исчерпывающий обзор этой литературы, и поэтому вместо основных примеров выбраны
раскрыть некоторые из наиболее фундаментальных принципов нейромодуляции, вызванной аллергеном.Мы не рассматривали клиническую научную литературу, в которой исследовалась нейрональная
симптомы аллергии, мы также не касались вопроса о роли высших мозговых центров
(эмоции и стресс) на аллергическую реакцию. Мы также в значительной степени избегали связанных
важные аспекты взаимодействий тучных клеток и нервов, которые происходят независимо от
немедленная реакция гиперчувствительности, а также литература, относящаяся к
Механизмы, с помощью которых нервная система может модулировать иммунный ответ. Скорее у нас есть
здесь основное внимание уделялось основным механистическим исследованиям нейромодуляции, вызванной аллергией.
даст читателю представление о периферических неврологических субстратах аллергии.
Скорее у нас есть
здесь основное внимание уделялось основным механистическим исследованиям нейромодуляции, вызванной аллергией.
даст читателю представление о периферических неврологических субстратах аллергии.
ОБЩИЕ ПРИНЦИПЫ СЕНСОРНО-ВЕГЕТНОЙ ИННЕРВАЦИИ
Чувствительные (афферентные) нервы ощущают местное тканевое окружение. 1 Их периферические нервные окончания
«свободны» и не образуют синапсов с другими нервами. Вместо этого эти периферийные
синапсы сенсорных окончаний с местной тканевой средой. Периферический сенсорный
терминали экспрессируют различные рецепторы и ионные каналы, которые трансдуцируют окружающую среду.
сигналы в электрические сигналы (т. е. действие
потенциалы ).В висцеральной и соматосенсорной системах
стимулы включают прикосновение и другие механические воздействия, температуру, рН,
осмолярность и различные химические раздражители. Потенциалы действия проводят
вдоль аксона в центре, мимо тела клетки, которое находится в определенном периферическом
ганглий (дорсальные корешковые ганглии, блуждающие узловые ганглии, блуждающие яремные ганглии,
или ганглии тройничного нерва) и в центральную нервную систему (ЦНС), где сигнал
транспонируется в нейротрансмиттер выброс в
синапс нерва с центральными нейронами второго порядка.
Чувствительные нервы гетерогенны в отношении чувствительности к раздражителям (т.е. экспрессия рецептора), размер, миелинизация, скорость проведения и нейропептид и содержание нейротрансмиттеров. Однако в целом чувствительные нервы делятся на 2 основные категории: те, которые были специально адаптированы для обнаружения рутинных физиологических раздражители (например, осязание, слух, обоняние, умеренная температура, изменения артериального давления и т. осмолярность) и те, которые обнаруживают вредные или потенциально вредные стимулы, такие как физические повреждения, химические раздражители и сильные изменения рН.
Шеррингтон 2 был первым
специально описать эти последние типы нервов в своей знаменитой книге, Интегративное действие нервной системы . 2 Он отметил, что большое количество
чувствительные нервы в коже активировались только нефизиологической стимуляцией
вредный характер. Он назвал эти специализированные чувствительные нервы
«ноцицепторы» и предположил, что «…что при селективном
адаптации, они придают коже, так сказать, специфическое чувство собственного
травмы. 2 Как правило, ноцицепторы представляют собой немиелинизированные медленно проводящие нервы небольшого диаметра.
называются С-волокнами (А- и В-волокна миелинизированные , быстропроводящие нервы). Сейчас
известно, что чувствительные нервы внутренних органов также содержат С-волокна,
Определение ноцицепторов по Шеррингтону.
2 Как правило, ноцицепторы представляют собой немиелинизированные медленно проводящие нервы небольшого диаметра.
называются С-волокнами (А- и В-волокна миелинизированные , быстропроводящие нервы). Сейчас
известно, что чувствительные нервы внутренних органов также содержат С-волокна,
Определение ноцицепторов по Шеррингтону.
Сигналы (потенциалы действия), исходящие от этих первичных афферентных нервов
интегрированы в ЦНС, где конечным следствием может быть либо сознательное
восприятия (например, боль, спазмы, зуд, одышка или позывы к кашлю или чиханию) или
подсознательная активация преганглионарных вегетативных нейронов, тем самым инициируя симпатическая, парасимпатическая и кишечные рефлексы.В коже ноцицептор
активация приводит к зуду и боли. В дыхательных путях активация
Ноцицепторы вызывают чихание, кашель, одышку, рефлекторный бронхоспазм и
выделения. В кишечнике активация ноцицепторов может привести к секреции, диарее,
желудочный дискомфорт и висцеральные боли. 1,3-6 Другими словами активация этих нервов
приводит к сильным ощущениям и/или рефлексам, направленным на избегание раздражителя. Как мы
обсудим более подробно ниже, ноцицепторы являются наиболее подтипом афферентных нервов.
чувствителен к стимуляции вторичной острой аллергической реакцией.
1,3-6 Другими словами активация этих нервов
приводит к сильным ощущениям и/или рефлексам, направленным на избегание раздражителя. Как мы
обсудим более подробно ниже, ноцицепторы являются наиболее подтипом афферентных нервов.
чувствителен к стимуляции вторичной острой аллергической реакцией.
Вегетативная и кишечная нервная система зависит от синаптической связи
между пресинаптическими и постсинаптическими элементами, расположенными в симпатических,
парасимпатические и энтеральные ганглии. В большинстве органов эфферентная нервная регуляция
осуществляется пресинаптическими нейронами, исходящими из ЦНС. Преганглионарный нерв является
возбуждаются в ЦНС, а потенциалы действия проводятся по преганглионарным
аксонов, которые в конечном итоге образуют синапсы с нейронами вегетативных ганглиев. Должно
Имейте в виду, что эти ганглии представляют собой не простые ретрансляционные станции, а места, где
происходит фильтрация и интеграция входных данных ЦНС.Это может иметь значение при аллергии
потому что тучные клетки обычно связаны с симпатическими, парасимпатическими и
кишечные ганглии (как мы обсудим ниже). В кишечнике, в частности,
также является автономным эфферентным контролем, который не зависит от нервной системы ЦНС.
обработка. В этом случае чувствительный нерв, обнаруживающий раздражение в локальной
Окружающая среда может передавать эту информацию непосредственно в близлежащие эфферентные кишечные
нейронов через локальные афферентно-эфферентные синапсы. Это называется местный
«периферический рефлекс.Нейроны кишечного ганглия общаются через
внутриганглионарная передача. Периферические рефлексы могут встречаться и в других внутренних органах.
органов, таких как дыхательные пути и желчный пузырь, хотя и не в такой степени.
наблюдается в желудочно-кишечном тракте. 7,8
В кишечнике, в частности,
также является автономным эфферентным контролем, который не зависит от нервной системы ЦНС.
обработка. В этом случае чувствительный нерв, обнаруживающий раздражение в локальной
Окружающая среда может передавать эту информацию непосредственно в близлежащие эфферентные кишечные
нейронов через локальные афферентно-эфферентные синапсы. Это называется местный
«периферический рефлекс.Нейроны кишечного ганглия общаются через
внутриганглионарная передача. Периферические рефлексы могут встречаться и в других внутренних органах.
органов, таких как дыхательные пути и желчный пузырь, хотя и не в такой степени.
наблюдается в желудочно-кишечном тракте. 7,8
В некоторых органах нейропептидсодержащие афферентные С-волокна могут непосредственно
регулируют функцию органов независимо от ЦНС или эфферентных вегетативных или
энтеральные нейроны через локальные «аксонные рефлексы». 9 В этом случае потенциал действия, возникающий в
окончание периферического сенсорного нерва проводится центрально, пока не достигнет
бифуркацию, а затем антидромно проводит обратно к другим периферическим окончаниям
того же нерва, где он вызывает высвобождение сенсорных нейропептидов, таких как
вещество Р, нейрокинин А и пептид, родственный гену кальцитонина (CGRP). выпущенный
пептиды могут привести к отеку, расширению сосудов, сокращению гладкой мускулатуры и
релаксация, рекрутирование и активация иммунных клеток. Общее последствие
аксонные рефлексы часто называют «нейрогенными».
воспаление.» 9 Степень проявления нейрогенного воспаления зависит от вида и органа. За
Например, у людей доказательства нейрогенного воспаления сильнее выражены у людей.
кожи и слизистой оболочки носа, чем в нижних дыхательных путях. 10
выпущенный
пептиды могут привести к отеку, расширению сосудов, сокращению гладкой мускулатуры и
релаксация, рекрутирование и активация иммунных клеток. Общее последствие
аксонные рефлексы часто называют «нейрогенными».
воспаление.» 9 Степень проявления нейрогенного воспаления зависит от вида и органа. За
Например, у людей доказательства нейрогенного воспаления сильнее выражены у людей.
кожи и слизистой оболочки носа, чем в нижних дыхательных путях. 10
ОСНОВНЫЕ МЕХАНИЗМЫ АЛЛЕРГЕН-ИНДУЦИРОВАННОЙ НЕЙРОМОДУЛЯЦИИ
Аллергический ответ включает изменения на всех 3-х уровнях нервной дуги:
функция сенсорного нерва, интеграция ЦНС и вегетативная/энтеральная нейроэффекторная клетка
функция ().Эти изменения могут быть
подразделяются на острые изменения (явная активация нервов, которая длится только до тех пор, пока
раздражитель присутствует), более длительные изменения в нейровозбудимость которая может пережить раздражитель на часы или
дней, а еще более стойкие фенотипические изменения могут длиться неделями и
возможно, если принять во внимание идею «критического
периоды», годами.
Морфологические аспекты
Аллергическая реакция особенно хорошо влияет на изменение
функционируют в коже и внутренних тканях.Вероятно, это связано с закрытием
связь между нервными волокнами и тучными клетками (). 11,12 Тучные клетки были
анатомически связан с нервами практически во всех системах органов в лаборатории
животные и человеческие предметы. 11,13-17 Процент тучных клеток, делающих значимые
ассоциации с нервами зависят от расстояния, которое человек считает значимым.
В мочевом пузыре, например, утверждается, что более 75% тучного
клетки находятся достаточно близко к нервным волокнам для значимого двунаправленного
связь, 18 и
в желудочно-кишечном тракте человека считалось, что от 50% до 70% тучных клеток
находиться в тесном контакте с нейритами. 19 Имеются убедительные доказательства того, что тучные клетки действительно производят
синаптические контакты с нервами, но это верно только для небольшого подмножества
тучных клеток. 20,21 Интимный синаптический
контакты между нервом и тучными клетками могут быть индуцированы или усилены за счет специфической адгезии
молекулы, такие как молекула клеточной адгезии 1. 22 В экспериментальных системах тучных клеток-сенсорных
нервные контакты, связь между нервом и тучными клетками ингибировалась блокированием
гетерофильное связывание между тучными клетками и экспрессируемой клеточной адгезией
молекула 1 и нектин 3 локализованы в нерве. 23
20,21 Интимный синаптический
контакты между нервом и тучными клетками могут быть индуцированы или усилены за счет специфической адгезии
молекулы, такие как молекула клеточной адгезии 1. 22 В экспериментальных системах тучных клеток-сенсорных
нервные контакты, связь между нервом и тучными клетками ингибировалась блокированием
гетерофильное связывание между тучными клетками и экспрессируемой клеточной адгезией
молекула 1 и нектин 3 локализованы в нерве. 23
Тучные клетки находятся в непосредственной близости от нервов практически во всех
органы. A, Триптазоположительные клетки тучных клеток
( красный ) вблизи PGP9.5-положительных нервов ( зеленый )
в подслизистом сплетении кишечника человека. 11 B, Тучные клетки ( красный ) вблизи синапсин-положительных нейронов
( зеленый ) в желудочке сердца крысы. 12 C, Тучные клетки ( фиолетовый ) рядом с экспрессией MrgA3
«афферентные зудящие нервы» ( оранжевый ) в коже мыши
(личное наблюдение).
Тучные клетки чаще располагаются близко к нервам, не образуя истинных
контакты. Анатомическая связь между тучными клетками и нервами становится даже
более распространены в очагах воспаления 20,24,25 Были предложены механизмы для объяснения
склонность к ассоциациям тучных клеток и нервов, включая высвобождение
нейротрофические факторы и цитокины тучными клетками, которые способствуют удлинению нервов
вблизи тучных клеток. 26 При аллергическом воспалении инфильтративное
эозинофилы также часто связаны с нервами. 27 В дыхательных путях могут быть эозинофилы
притягивается к вегетативным холинергическим нейронам как следствие нейронального сосудистого
белок клеточной адгезии 1 и молекула межклеточной адгезии 1
выражение. 28 На
С другой стороны, тщательный морфометрический анализ показал, что аксоны тонких нервов и
терминали в различных тканях также обычно связаны не только с тучными
клетками и эозинофилами, но также и с другими клетками костного мозга, такими как
как плазматические клетки, и эти «ассоциации», по-видимому, не благоприятствуют
один тип клеток над другим. 13 Этот тип анализа позволяет сделать вывод, что
нервные ветви, тучные клетки и другие клетки, происходящие из костного мозга, часто
концентрируются в одном и том же участке ткани, что делает почти уверенным, что они будут, в
смысл, «колокализовать» случайно. Тучные клетки вместе с
вегетативные и чувствительные нервы часто находятся в непосредственной близости от
микроциркуляторном русле, в слизистой и подслизистой оболочках внутренних органов, вблизи гладкой
мышц и всей дермы.
13 Этот тип анализа позволяет сделать вывод, что
нервные ветви, тучные клетки и другие клетки, происходящие из костного мозга, часто
концентрируются в одном и том же участке ткани, что делает почти уверенным, что они будут, в
смысл, «колокализовать» случайно. Тучные клетки вместе с
вегетативные и чувствительные нервы часто находятся в непосредственной близости от
микроциркуляторном русле, в слизистой и подслизистой оболочках внутренних органов, вблизи гладкой
мышц и всей дермы.
Независимо от механизмов анатомические исследования, особенно при оценивая целые препараты ткани, часто выявляют впечатляющее отображение мачты клетки, расположенные вдоль афферентных, вегетативных и энтеральных ветвей нерва (12).Эти изображения не оставляют сомнений в том, что многие, если не большинство, нервных волокон в тканях находятся в сфере влияния медиаторов, высвобождаемых тучными клетками. Каким может быть это влияние, так это обсуждаются ниже.
Аллерген-индуцированная нейромодуляция афферентных (чувствительных) нервов
Разряд потенциала действия.

Заражение аллергеном часто связано с явной активацией афферентные нервные окончания, приводящие к разрядке потенциала действия (). 29,30 Обычно считается, что типы сенсорных нервы, наиболее восприимчивые к прямой активации через медиаторы аллергии, полимодальные С-волокна.Это связано с тем, что афферентные С-волокна экспрессируют рецепторы ко многим химическим медиаторам, присутствующим в аллергическом воспалении. ткань. Часто эти нервы можно точно классифицировать как ноцицепторы.
Воздействие аллергена открыто активирует афферентные С-волокна. Top , Гипотетический эффект аллергенной активации мачты
клетки на окончание афферентного нерва разряжают потенциал действия. Нижний , Примеры аллерген-индуцированной активации афферентных
ноцицепторы: осталось , аллерген (овальбумин) вызывает сильные
активация вагусных яремных С-волокон, иннервирующих легкое (потенциалы действия
регистрируется в блуждающем нервном узле) 30 ; право , аллерген (экстракт комаров)
индуцирует активацию соматосенсорных зудящих волокон в коже (действие
потенциалы, регистрируемые в задних рогах). 29
29
Окончание сенсорного нерва активируется при воздействии определенного раздражителя на специфические рецепторы или ионные каналы в мембране нерва, что приводит к деполяризация мембраны. Эта деполяризация называется «генератором потенциал». Если потенциал генератора имеет достаточную величину, то активирует потенциалзависимые натриевые каналы, что, в свою очередь, приводит к действию потенциальный разряд (, вверху). То частота потенциалов действия «все или ничего» пропорциональна амплитуде генераторного потенциала.
Афферентные С-волокна обычно экспрессируют члены временного рецептора
потенциальное (TRP) семейство ионных каналов. Два канала TRP, которые кажутся
важное значение в аллергических реакциях имеют транзиторный рецепторный потенциал ваниллоида 1
(TRPV1) и транзиторный рецепторный потенциал анкиринового повтора 1 (TRPA1). Когда
эти каналы открыты, они обеспечивают путь для притока катионов
(натрий и кальций), что приводит к генераторным потенциалам величин
достаточно для достижения порога разрядки потенциала действия. 31,32 TRPV1 стимулируется несколькими уместными механизмами
к аллергической реакции. Эти стимулы включают агонисты Gq-связанных
GPCR, такие как рецептор брадикинина 2 и рецептор гистамина h2;
закисление местной среды нервных окончаний; и определенные
липоксигеназные продукты семейства эйкозаноидов медиаторов воспаления. 33,34 TRPA1 есть
также активируется механизмами, имеющими отношение к аллергии. С-волокна в дыхательных путях
стимулируются через TRPA1 различными медиаторами окислительного стресса,
включая активные формы кислорода (например,
H 2 O 2 ) и продукты перекисного окисления липидов (например,
4-гидроксиноненаль и 4-оксононеналь) и нитрование (9-нитроолеат). 35 Метаболиты мачты
клеточный простагландин D 2 (PGD 2 ) также сильно
активируют С-волокна, вторичные по отношению к воротам TRPA1. 36
31,32 TRPV1 стимулируется несколькими уместными механизмами
к аллергической реакции. Эти стимулы включают агонисты Gq-связанных
GPCR, такие как рецептор брадикинина 2 и рецептор гистамина h2;
закисление местной среды нервных окончаний; и определенные
липоксигеназные продукты семейства эйкозаноидов медиаторов воспаления. 33,34 TRPA1 есть
также активируется механизмами, имеющими отношение к аллергии. С-волокна в дыхательных путях
стимулируются через TRPA1 различными медиаторами окислительного стресса,
включая активные формы кислорода (например,
H 2 O 2 ) и продукты перекисного окисления липидов (например,
4-гидроксиноненаль и 4-оксононеналь) и нитрование (9-нитроолеат). 35 Метаболиты мачты
клеточный простагландин D 2 (PGD 2 ) также сильно
активируют С-волокна, вторичные по отношению к воротам TRPA1. 36
В дополнение к каналам TRPV1 и TRPA1, которые могут интегрировать многие
различных раздражителей, афферентные С-волокна также экспрессируют рецепторы для специфических
медиаторы, связанные с аллергическим ответом, включая рецепторы АТФ
(P2X2 и P2X3), аденозиновые рецепторы (A1 и A2A), 5-HT рецепторы (5HT-3 и
5HT2), цистеиниллейкотриеновые рецепторы (CysLT1), триптаза и трипсин
(рецепторы, активируемые протеазами 2 и 1). 37-43
37-43
На основе основ фармакологии полимодального афферентного нерва волокна (обычно, но не исключительно С-волокна), она не должна удивительно, что активация тучных клеток приведет к их явной активации. Это наблюдается во многих органах, включая дыхательные пути, кожу, желудочно-кишечный тракт и мочевой пузырь. 24,29,30,43,44 Примеры разряда потенциала действия С-волокон в ответ на острый аллерген вызов иллюстрируется в . Один можно рационально предположить, что С-волокна также будут стимулироваться медиаторами прибывающих на поздней стадии аллергических реакций, когда клеточный начинается воспалительная реакция.
Изменения сенсорной возбудимости.
Чувствительные нервы могут возбуждаться независимо от стимулов, вызывающих
генераторные потенциалы. Открытие или закрытие различных ионных каналов (обычно
каналы утечки или потенциалзависимые каналы) могут вызывать электрофизиологические
эффекты, приводящие к повышенной возбудимости нерва по отношению к активирующему раздражителю. в
Говоря языком иммунологии, мы могли бы сказать, что нервные окончания
некоторые медиаторы воспаления. Медиаторы, ассоциированные с аллергией, такие как
гистамин, PGD 2 , цистеиниллейкотриен
D 4 , серотонин и брадикинин, банка
снижают активность некоторых калиевых каналов, что приводит к увеличению
резистентности афферентного нерва и последующее увеличение
электрическая возбудимость. 39,45,46 Цистеиниллейкотриен D 4 стимулирующий
рецепторы цистеиниллейкотриена 1 в нейронах С-волокон тройничного нерва
ганглии явно не активируют нерв, но повышают его возбудимость
такая частота разряда потенциала действия в ответ на другой
активирующий стимул значительно усиливается. 39
в
Говоря языком иммунологии, мы могли бы сказать, что нервные окончания
некоторые медиаторы воспаления. Медиаторы, ассоциированные с аллергией, такие как
гистамин, PGD 2 , цистеиниллейкотриен
D 4 , серотонин и брадикинин, банка
снижают активность некоторых калиевых каналов, что приводит к увеличению
резистентности афферентного нерва и последующее увеличение
электрическая возбудимость. 39,45,46 Цистеиниллейкотриен D 4 стимулирующий
рецепторы цистеиниллейкотриена 1 в нейронах С-волокон тройничного нерва
ганглии явно не активируют нерв, но повышают его возбудимость
такая частота разряда потенциала действия в ответ на другой
активирующий стимул значительно усиливается. 39
Заражение аллергеном и высвобождение медиатора тучных клеток в сенсибилизированном
trachea ex vivo явно не активирует ноцицептивную
Aδ воздействует на кашлевые нервы, но вместо этого снижает порог их активации до
механический раздражитель (). 47,48 В нижних дыхательных путях медиаторы аллергии, в т.ч.
гистамин, может повышать возбудимость некоторых С-волокон до точки
что механическое нарушение эвнейального дыхания приводит к их
активация. 49,50 Иммунологическая активация
Тучные клетки в кишечнике повышают возбудимость спинномозговых афферентных
нервов так, что одно и то же кратковременное механическое растяжение приводит к
гораздо более длительный разряд афферентных нервов (). 48 Точно так же активация тучных клеток приводит к выраженному увеличению
механическая чувствительность С-волокон блуждающего нерва в пищеводе. 51 Кинетика
повышение возбудимости афферентных нервов вследствие активации аллергеном
Тучные клетки могут быть довольно стойкими, сохраняясь в течение нескольких часов после острого
активация тучных клеток. Продукты активированных эозинофилов также могут
способствуют повышению возбудимости афферентных нервов в местах аллергических
воспаление. 52
47,48 В нижних дыхательных путях медиаторы аллергии, в т.ч.
гистамин, может повышать возбудимость некоторых С-волокон до точки
что механическое нарушение эвнейального дыхания приводит к их
активация. 49,50 Иммунологическая активация
Тучные клетки в кишечнике повышают возбудимость спинномозговых афферентных
нервов так, что одно и то же кратковременное механическое растяжение приводит к
гораздо более длительный разряд афферентных нервов (). 48 Точно так же активация тучных клеток приводит к выраженному увеличению
механическая чувствительность С-волокон блуждающего нерва в пищеводе. 51 Кинетика
повышение возбудимости афферентных нервов вследствие активации аллергеном
Тучные клетки могут быть довольно стойкими, сохраняясь в течение нескольких часов после острого
активация тучных клеток. Продукты активированных эозинофилов также могут
способствуют повышению возбудимости афферентных нервов в местах аллергических
воспаление. 52
Аллерген-индуцированное повышение возбудимости чувствительных нервов. А, Узловые окончания Aδ «кашляющих» волокон у морской свинки
трахея; повышенная чувствительность к механической стимуляции этого типа волокон
после введения аллергена (овальбумина). 47 B, Многокомпонентная запись афферентных нервов кишечника, демонстрирующая
заметно усиленный (пролонгированный) ответ на вздутие после аллергена (овальбумин)
вызов. 48
А, Узловые окончания Aδ «кашляющих» волокон у морской свинки
трахея; повышенная чувствительность к механической стимуляции этого типа волокон
после введения аллергена (овальбумина). 47 B, Многокомпонентная запись афферентных нервов кишечника, демонстрирующая
заметно усиленный (пролонгированный) ответ на вздутие после аллергена (овальбумин)
вызов. 48
Активация и/или увеличение окончания афферентного нерва
возбудимость встречается так часто в разрозненных тканях и экспериментальных
систем, что это можно рассматривать как принципиальный результат активации
тканевые тучные клетки. В общих чертах, явная активация С-волокна приводит к
ощущения и рефлексы, соответствующие органу, воспринимающему опасный раздражитель
и реагировать таким образом, чтобы попытаться уменьшить воздействие этого
стимул.Как обсуждалось выше, в зависимости от ткани активация
ноцицепторы могут в конечном итоге привести к позывам к кашлю или чиханию, рефлекторным
бронхоспазм, выделения, зуд, нейрогенные воспалительные реакции, которые
способствуют возникновению волдырей и воспалений, висцерального дискомфорта и изменений в
моторика желудочно-кишечного тракта и мочевого пузыря. Кроме того, если чувствительный нерв
вызывают гипервозбудимость медиаторы аллергии, а затем подпороговые раздражители
и даже безобидные рутинные раздражители могут вызвать эти ноцицептор-ассоциированные
рефлексы.
Кроме того, если чувствительный нерв
вызывают гипервозбудимость медиаторы аллергии, а затем подпороговые раздражители
и даже безобидные рутинные раздражители могут вызвать эти ноцицептор-ассоциированные
рефлексы.
Фенотипические изменения.
Термин «фенотипическое изменение» имеет расплывчатое определение, но в настоящее время контексте мы имеем в виду нейромодуляцию, которая происходит на уровне экспрессия генов.
У взрослых афферентные нервные окончания в крупных дыхательных путях
на расстоянии более 10 000 диаметров клетки от тела и ядра клетки. И все же это
Понятно, что местные аллергические реакции в дыхательных путях могут привести к изменению
экспрессия генов в отдаленных афферентных нейронах блуждающего нерва
тела. 53,54 Наиболее вероятно
объяснение этому состоит в том, что аллергическая реакция может привести к выработке
и высвобождение нейротрофических факторов в локальной среде нерва
терминалы. Имеются убедительные доказательства того, что повышенная продукция нейротрофинов
возникает при аллергической реакции во всех тканях. 55,56 Аллергические реакции могут привести непосредственно к выделению
нейротрофические факторы из тучных клеток, а также вторичные по отношению к стимуляции
других клеток ткани, таких как эпителий дыхательных путей.
55,56 Аллергические реакции могут привести непосредственно к выделению
нейротрофические факторы из тучных клеток, а также вторичные по отношению к стимуляции
других клеток ткани, таких как эпителий дыхательных путей.
Нейротрофические факторы, представленные фактором роста нервов (NGF), могут
связываться с высоким сродством к родственным рецепторам (например, тирозинкиназе
рецептор [TRK] A) на мембранах нервных окончаний. Это приводит к
интернализация комплекса NGF-TRKA, который затем транспортируется через
аксональные транспортные механизмы возвращаются на большие расстояния к телу клетки, где
это влияет на экспрессию генов. NGF относится к семейству нейротрофинов
нейротрофические факторы, которые также включают нейротрофический фактор головного мозга
и нейротрофины 3 и 4. 57 Помимо нейротрофинов, еще одно семейство
нейротрофические факторы, называемые глиальным нейротрофическим фактором
(GDNF) семейные лиганды (GFL) также могут иметь отношение к аллергическим
реакция. 54 GFL включают GDNF, нейтурин, артемин и персефин.
54 GFL включают GDNF, нейтурин, артемин и персефин.
Влияние нейротрофических факторов на фенотипические изменения афферентные нейроны, иннервирующие дыхательные пути, будут зависеть от репертуара рецепторы нейротрофического фактора, экспрессируемые нервами. Например, почти все афферентные нервы дыхательных путей экспрессируют GFRa1 и Ret, рецепторы для GDNF.Нейроны блуждающего нерва экспрессируют TRKB, TRK для роста головного мозга. фактор и нейротрофин 4, тогда как спинальные С-волокна и блуждающий яремный С-волокна обычно экспрессируют TRKA, рецептор NGF. 58,59
Вдыхание аллергена приводит к усилению экспрессии генов
участвует в производстве тахикининов ,
такие как вещество P и CGRP. 53 Интересно, что после заражения аллергеном большой диаметр
миелинизированные неноцицепторные нейроны А-волокна, которые в норме не экспрессируют эти
мощные нейропептиды начинают синтезировать и транспортировать пептиды к своим
центральные и периферийные терминалы.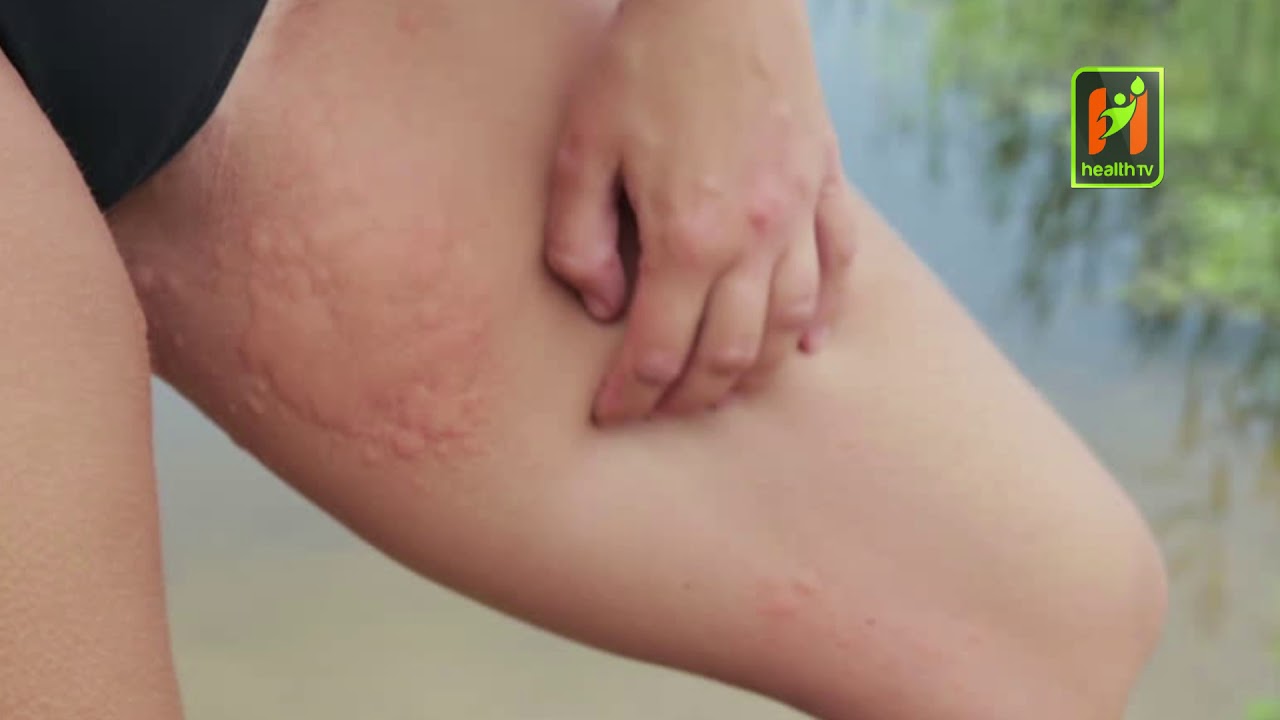 60,61 Прочее
словами, в нейропептиде происходит «фенотипический переключатель».
иннервация аллергическо воспаленной ткани. Этот эффект можно повторить
с экзогенными нейротрофинами. Этот тип фенотипического переключения также был
наблюдается в соматосенсорных нервах после болезненного воспаления. 62
60,61 Прочее
словами, в нейропептиде происходит «фенотипический переключатель».
иннервация аллергическо воспаленной ткани. Этот эффект можно повторить
с экзогенными нейротрофинами. Этот тип фенотипического переключения также был
наблюдается в соматосенсорных нервах после болезненного воспаления. 62
Существует также фенотипическое переключение, когда речь идет об экспрессии
Каналы TRP в сенсорных нервах дыхательных путей. Экспрессия TRPV1,
рецептор капсаицина, обсуждавшийся выше, ограничивается ноцицептивными С-волокнами в
здоровые ткани.Вдыхание аллергена крысами или морскими свинками приводит к
экспрессия TRPV1 в кашлевых нервах Aδ, а также в Aβ
низкопороговые механосенсоры (оба быстродействующие
адаптирующиеся и медленно адаптирующиеся подтипы рецепторов). 54,63 Подробнее
исследования в этой области необходимы для определения молекулярных механизмов
лежащие в основе фенотипических изменений, вызванных аллергеном, но ранние исследования подтверждают
потенциальное участие как нейротрофинов, так и GFL в
отклик. 54
54
Примеры сенсорной нейропластичности, вызванной аллергеном. Top , RT-PCR из отдельных нейронов ретроградно прослеживается
из трахеи. В примере показаны 12 нейронов морских свинок, получавших контрольное лечение.
и 16 нейронов из овальбумина (OVA) — обработанных морских свинок.
Гистограммы показывают процент узловых нейронов, специфичных для трахеи, в каждом
группы лечения, которые экспрессируют мРНК TRPV1. Воздействие аллергена (овальбумина) вызывает экспрессия de novo TRPV1 в узловой дозе Aδ
«кашлевые» волокна, иннервирующие трахею (от Lieu et al. 54 ). Низ ,
Заражение аллергеном индуцирует de novo чувствительность к капсаицину у
волокна легкого быстро адаптирующегося рецептора (RAR) , которые были
характеризуется их фазовой реакцией во время дыхания (RARph) . ΔFA , Разница в обжиге
Мероприятия. Используется с разрешения Zhang et al. 63 ** P < 0,01.
В целом, исследования сенсорной модуляции, вызванной аллергеном, поддерживают гипотеза о том, что в местах аллергической реакции интенсивное количественное нарастание залпов потенциала действия, возникающих в центральные окончания афферентных С-волокон в ЦНС (и в ганглии).Это происходит вторично по отношению к явной активации С-волокна. клеммы, а также обобщенный «затравочный» эффект повышается их электрическая возбудимость. Кроме того, также будет соответствующие качественные изменения в профиле активации А-волокон, и поскольку эти нервы начинают экспрессировать сенсорные нейропептиды, это может измениться. рефлекторные последствия их активации. Эти аллерген-сенсорные нервные взаимодействия могут быть острыми и кратковременными, но могут сохраняться и длительное время. после первичной аллергической реакции.
Аллерген-индуцированная модуляция нейронов ЦНС
Тучные клетки обнаружены в мозге всех видов, которые были
оценивается, 64 но
доказательства прямой активации этих клеток, вызванной аллергеном, отсутствуют.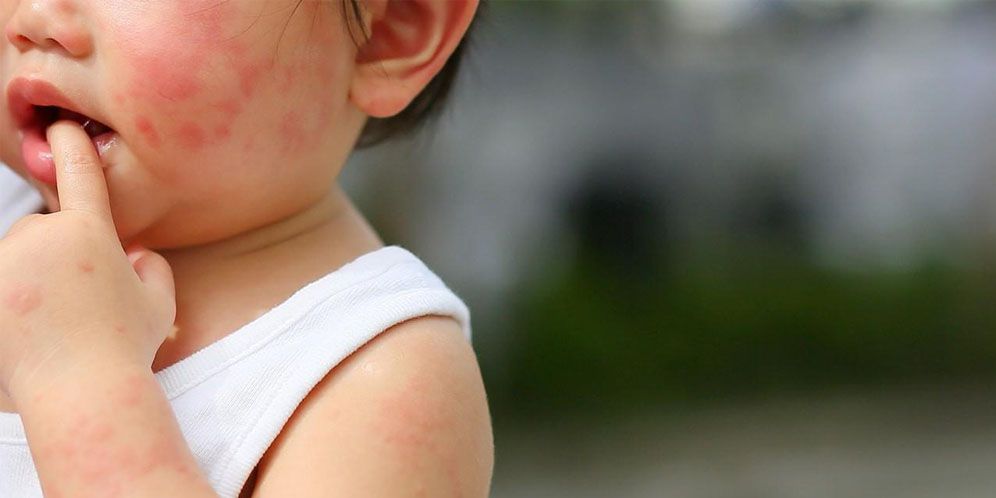 Это
кажется более вероятным, что аллергические реакции косвенно модулируют нейроны ЦНС.
путем создания ситуации, в которой существует интенсивное, а в некоторых случаях устойчивое
повышение активности ноцицепторов, возникающее вследствие явной активации,
и повышение возбудимости, как описано выше.Это приводит к увеличению
высвобождение нейротрансмиттера/нейропептида из центрального окончания афферентного
нервы в синапс нейронов ЦНС второго порядка, расположенных в дорсальной
рог спинного мозга для спинномозговых афферентных нервов и в стволе мозга в пределах
ядро одиночного тракта блуждающих афферентных нервов. 65 В случае фенотипических изменений
Нейроны ЦНС могут модулироваться пептидами, такими как CGRP и субстанция P, высвобождаемыми
от неноцицептивных нервов. В любом случае высвобождение пептидов и медиатора
от центральных окончаний афферентных нервов могут быть приведены в движение события
которые приводят к увеличению синаптической эффективности нейронов ЦНС, процесс
часто называют «центральной сенсибилизацией».
Это
кажется более вероятным, что аллергические реакции косвенно модулируют нейроны ЦНС.
путем создания ситуации, в которой существует интенсивное, а в некоторых случаях устойчивое
повышение активности ноцицепторов, возникающее вследствие явной активации,
и повышение возбудимости, как описано выше.Это приводит к увеличению
высвобождение нейротрансмиттера/нейропептида из центрального окончания афферентного
нервы в синапс нейронов ЦНС второго порядка, расположенных в дорсальной
рог спинного мозга для спинномозговых афферентных нервов и в стволе мозга в пределах
ядро одиночного тракта блуждающих афферентных нервов. 65 В случае фенотипических изменений
Нейроны ЦНС могут модулироваться пептидами, такими как CGRP и субстанция P, высвобождаемыми
от неноцицептивных нервов. В любом случае высвобождение пептидов и медиатора
от центральных окончаний афферентных нервов могут быть приведены в движение события
которые приводят к увеличению синаптической эффективности нейронов ЦНС, процесс
часто называют «центральной сенсибилизацией». ” 66
” 66
Когда нейроны ЦНС становятся сенсибилизированными, последствия данного
количество афферентного входа может быть усилено и даже качественно изменено.
Доказательства подтверждают концепцию, согласно которой центральная сенсибилизация может способствовать
феномен аллодинии (при котором обычно безболезненный раздражитель, такой как нежное
расчесывание волос и активация сенсорных Aβ-волокон,
приводит к неадекватной боли). 66 Аналогично, многие с аллергией на аэроаллергены испытывают
то, что можно было бы назвать «аллотуссивностью», при которой ощущение
постоянные позывы к кашлю присутствуют, даже когда в дыхательных путях ничего нет
кашлять, или постоянное желание чихнуть, когда ничего физического
находится в носовом проходе.У экспериментальных животных было зарегистрировано
что активация С-волокон блуждающего нерва дыхательных путей (что может
активация) приводит к ситуации, при которой стимуляция А-волокон трахеи
вызывает кашель с интенсивностью раздражителя, которая обычно намного меньше, чем
нормальный кашлевой порог. 67 Точно так же стимуляция С-волокон может посредством центральной сенсибилизирующей
взаимодействия, усиливают парасимпатический драйв к дыхательному
тракт. 68 В обоих случаях
это происходит за счет передатчиков, высвобождаемых из центральных окончаний С-волокон,
повышение эффективности нейронов, иннервируемых А-волокнами (конвергенция
А-волокна и С-волокна на нейроны второго порядка).Клинически значимый аспект
центральной сенсибилизации заключается в том, что она обеспечивает механизм, посредством которого аллергическая
реакция в одном месте может повлиять на физиологию в другом месте.
Например, стимуляция С-волокон в гортани может усилить парасимпатическую
привод к периферическим дыхательным путям. Активация С-волокон в пищеводе (например, во время
кислотный рефлюкс) может привести к позывам к кашлю за счет усиления синаптической активности
А-волокон в трахее. Попадание аллергена в нос может привести к центральному
сенсибилизация кашлевых нервов нижних дыхательных путей.
67 Точно так же стимуляция С-волокон может посредством центральной сенсибилизирующей
взаимодействия, усиливают парасимпатический драйв к дыхательному
тракт. 68 В обоих случаях
это происходит за счет передатчиков, высвобождаемых из центральных окончаний С-волокон,
повышение эффективности нейронов, иннервируемых А-волокнами (конвергенция
А-волокна и С-волокна на нейроны второго порядка).Клинически значимый аспект
центральной сенсибилизации заключается в том, что она обеспечивает механизм, посредством которого аллергическая
реакция в одном месте может повлиять на физиологию в другом месте.
Например, стимуляция С-волокон в гортани может усилить парасимпатическую
привод к периферическим дыхательным путям. Активация С-волокон в пищеводе (например, во время
кислотный рефлюкс) может привести к позывам к кашлю за счет усиления синаптической активности
А-волокон в трахее. Попадание аллергена в нос может привести к центральному
сенсибилизация кашлевых нервов нижних дыхательных путей. 69 Это повышает вероятность того, что кашель, связанный с
гастроэзофагеальный рефлюкс не является вторичным по отношению к микроаспирации веществ в
дыхательных путей и что кашель, связанный с назальной аллергией, не обязательно
вторично по отношению к «постназальному затеканию» и прямой активации кашля
нервов, так как это связано с центральной сенсибилизацией кашлевого пути
конвергенция ноцицепторов пищевода и носа.
69 Это повышает вероятность того, что кашель, связанный с
гастроэзофагеальный рефлюкс не является вторичным по отношению к микроаспирации веществ в
дыхательных путей и что кашель, связанный с назальной аллергией, не обязательно
вторично по отношению к «постназальному затеканию» и прямой активации кашля
нервов, так как это связано с центральной сенсибилизацией кашлевого пути
конвергенция ноцицепторов пищевода и носа.
Идея центральной сенсибилизации при аллергии поддерживается элегантным исследования с молодыми взрослыми макаками-резусами. 70 После сенсибилизации к клещу домашней пыли обезьяны неоднократное воздействие аэрозолем, содержащим клещей домашней пыли. Приблизительно через 5–6 месяцев электрическая возбудимость ствола мозга нейроны в ядре солитарного тракта были оценены и оказались сильно активизирован; их реакция на данный входной стимул была намного сильнее, чем у аналогичных нейронов у неаллергичных обезьян (14). 70
Вызванное аллергеном повышение электрической возбудимости нейронов ЦНС.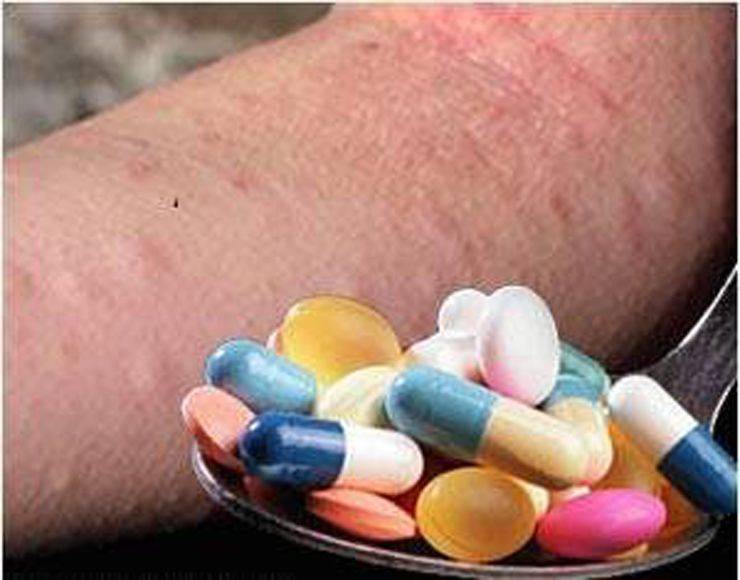 Верх , Стволовое расположение ядра солитарной
тракт. A, Микрофотография защемленного нейрона в головном мозге
срез от каудомедиального ядра солитарного тракта, где
чувствительные афференты блуждающего нерва заканчиваются. B, Цельноклеточный пластырь-зажим
регистрации импульсов деполяризующего тока, воздействующих на отдельные ядра
одиночные нейроны тракта от наивного или зараженного аллергеном (пылевой клещ) резуса
обезьяны. C, Повышенный разряд потенциала действия в ответ на
деполяризующий стимул в нейронах, выделенных от аллергичных обезьян. 70
Верх , Стволовое расположение ядра солитарной
тракт. A, Микрофотография защемленного нейрона в головном мозге
срез от каудомедиального ядра солитарного тракта, где
чувствительные афференты блуждающего нерва заканчиваются. B, Цельноклеточный пластырь-зажим
регистрации импульсов деполяризующего тока, воздействующих на отдельные ядра
одиночные нейроны тракта от наивного или зараженного аллергеном (пылевой клещ) резуса
обезьяны. C, Повышенный разряд потенциала действия в ответ на
деполяризующий стимул в нейронах, выделенных от аллергичных обезьян. 70
Трансмиттеры и молекулярные механизмы, лежащие в основе центральной
сенсибилизации многообразны и выходят за рамки данного обзора. Как долго
центральная сенсибилизация сохраняется за пределами воспалительной реакции, открыта для
дебаты. Тем не менее, представляется рациональным сделать вывод на основе имеющихся
доказательства того, что аллергическая реакция может привести к ноцицепторному вводу в
ЦНС (ствол мозга или задний рог), который повышает чувствительность синаптической передачи
в нем. Это может привести к резкому снижению ощущений и рефлексов.
неадекватно соответствует инсульту, присутствующему в периферических аллергических
воспаленные ткани.
Это может привести к резкому снижению ощущений и рефлексов.
неадекватно соответствует инсульту, присутствующему в периферических аллергических
воспаленные ткани.
Аллергическая модуляция эфферентных (вегетативных и кишечных) нервов
Активация и изменение синаптической эффективности.
Тучные клетки обычно располагаются близко к нейронам внутри
кишечные, симпатические и парасимпатические ганглии. 11,71,72 Нейроны
внутри этих ганглиев получают синаптические входы от преганглионарных вегетативных
нейроны с телами клеток в ЦНС. В частности, энтеральный ганглий может
также функционируют автономно посредством внутриганглионарной синаптической передачи.Когда тучные клетки, расположенные вблизи вегетативных ганглиев, стимулируются, это
приводит к существенному увеличению «синаптической эффективности». Это
сказать, что постганглионарный выход увеличивается относительно данного
преганглионарный вход. Эти ганглии являются первыми участками периферических
интеграция эфферентной информации, поступающей от ЦНС. Поэтому изменения
в синаптической эффективности в этих местах может оказывать мощное воздействие на ЦНС.
контроль за работой органов. Кроме того, изменение активности нейрона
внутри кишечных ганглиев также может изменить характеристики
автономное функционирование желудочно-кишечного тракта. 73
Поэтому изменения
в синаптической эффективности в этих местах может оказывать мощное воздействие на ЦНС.
контроль за работой органов. Кроме того, изменение активности нейрона
внутри кишечных ганглиев также может изменить характеристики
автономное функционирование желудочно-кишечного тракта. 73
Аллерген-индуцированное увеличение синаптической эффективности может наблюдаться
электрофизиологически в бронхиальных парасимпатических ганглиях, расположенных
преимущественно в трахее и крупных бронхах. Поступления от ЦНС часто приводят к
потенциалы возбуждения, которые являются подпороговыми для разряда потенциала действия
в постганглионарных нейронах. После активации аллергеном близлежащей мачты
клетки, усиливается синаптическая эффективность и фильтрующая способность
ганглий потерян (). 71,74-76 постганглионарные нейроны в этих ганглиях обеспечивают доминирующий контроль
напряжение гладких мышц не только в крупных дыхательных путях, но и на всем протяжении
вниз по дереву дыхательных путей к мелким бронхиолам. Поэтому изменения в
фильтрация, которая может происходить вторично по отношению к активации тучных клеток в более крупных
дыхательные пути могут иметь большое влияние на калибр дыхательных путей на всем протяжении бронхов.
дерево. У мышей эта тучная клетка-парасимпатический холинергический нерв
взаимодействие ответственно почти за все дыхательные пути, вызванные аллергеном.
сужение. 77,78
Поэтому изменения в
фильтрация, которая может происходить вторично по отношению к активации тучных клеток в более крупных
дыхательные пути могут иметь большое влияние на калибр дыхательных путей на всем протяжении бронхов.
дерево. У мышей эта тучная клетка-парасимпатический холинергический нерв
взаимодействие ответственно почти за все дыхательные пути, вызванные аллергеном.
сужение. 77,78
Аллерген-индуцированное повышение синаптической эффективности в вегетативных ганглиях. A, Малый парасимпатический бронхиальный ганглий морской свинки
бронх.Отдельный нейрон, заполненный пероксидазой хрена и нарисованный с помощью
показана техника камеры lucida. Парасимпатический нейрон
синаптическая эффективность в ответ на стимуляцию преганглионарных нервов (шок
артефакт) значительно увеличивается после воздействия аллергена (яичного альбумина). 76 фВПСП , Быстрые возбуждающие постсинаптические потенциалы. B, Динамика высвобождения гистамина и верхнешейного
синаптическая эффективность ганглиев (величина потенциала действия постганглионарных соединений)
во время провокации аллергеном (овальбумином). 75
75
В отличие от парасимпатических ганглиев симпатические ганглии большие и очень удобно для изучения синаптической передачи. В течение нескольких минут аллерген-индуцированная активация тучных клеток в верхнем шейном ганглии или чревном ганглии, наблюдается выраженное увеличение синаптической эффективности, часто приводит к удвоению постганглионарного выброса. 75,79 Потенцирование синаптической эффективности тучными клетками активация не является кратковременным событием. Как и при повышении возбудимости афферентных нервных окончаний, синаптическая потенциация, вызванная аллергеном, может сохраняются в течение многих часов после острой активации тучных клеток.Пример разницы в продолжительности увеличения синаптической эффективности по сравнению с Высвобождение гистамина в симпатическом ганглии показано на рис.
Особое значение имеет пищевая аллергия, иммунологическая активация
Тучные клетки в кишечнике обычно связаны с изменениями в
нейротрансмиссия в кишечных ганглиях, тем самым изменяя активность
секретомоторных нейронов подслизистой оболочки. 4,6 Тучные клетки
особенно богаты в подслизистом сплетении человека по сравнению с
миэнтеральное сплетение. 11 Медиаторы, высвобождаемые при IgE-зависимой активации тучных желез кишечника человека
клетки непосредственно возбуждают кишечные нейроны в подслизистой оболочке морских свинок и
человеческие предметы (). 80,81 Модель морской свинки с пищевой (молочной) аллергией элегантно
показывает, что аллергенная активация тучных клеток увеличивает и модулирует
синаптическая эффективность подслизистых нейронов в толстой и тонкой кишке
(). 81,82
4,6 Тучные клетки
особенно богаты в подслизистом сплетении человека по сравнению с
миэнтеральное сплетение. 11 Медиаторы, высвобождаемые при IgE-зависимой активации тучных желез кишечника человека
клетки непосредственно возбуждают кишечные нейроны в подслизистой оболочке морских свинок и
человеческие предметы (). 80,81 Модель морской свинки с пищевой (молочной) аллергией элегантно
показывает, что аллергенная активация тучных клеток увеличивает и модулирует
синаптическая эффективность подслизистых нейронов в толстой и тонкой кишке
(). 81,82
Аллерген-индуцированная стимуляция кишечных нейронов. А, Внутриклеточная запись нейрона подслизистого сплетения, выделенного из
морская свинка демонстрирует деполяризацию нейронов до порога потенциала действия после
вызов молочного аллергена. 81 B, Регистрация потенциала действия нейрона в подслизистом слое
сплетения кишечника человека. Потенциалы действия вызывались в ответ на
обработка супернатантом анти-IgE-активированного человеческого
тучные клетки кишечника. Используется с разрешения Schemann et al. 80
Используется с разрешения Schemann et al. 80
Медиаторы и ионные механизмы, лежащие в основе увеличения
вегетативная и энтеральная синаптическая активность многочисленна и зависит от того, какой
изучается специфический ганглий. Гистамин является особенно неразборчивым
медиатор, когда дело доходит до модуляции синаптической активности в ганглиях, с
потенциально задействованы все 4 гистаминовых рецептора.Тем не менее, ясно
что гистамин не единственный виновник. Многие медиаторы аллергии
было показано, что он изменяет вегетативную и энтеральную передачу, включая мастопатию.
клеточные медиаторы, такие как серотонин, PGD 2 , активирующие тромбоциты
фактора и триптазы. 6,17,73,79,83,84 . Индуцированное аллергеном усиление синаптической передачи может
происходят как через пресинаптические, так и постсинаптические механизмы действия. Там
является доказательством того, что активация тучных клеток приводит к увеличению количества нейротрансмиттеров.
(обычно ацетилхолин), высвобождаемый из пресинаптических окончаний в течение заданного времени. количество стимула. 85 данные также подтверждают гипотезу о том, что нейротрансмиттер в
синапс стимулирует более возбудимый постсинаптический нейрон из-за общего
повышение сопротивления нейронов и электрической возбудимости
государство. 4,76,85 Независимо от ионных механизмов относительно
последовательным открытием в исследованиях синаптической передачи является тот, в котором
Разряд потенциала действия для данного количества пресинаптического входа равен
постоянно усиливается. У восприимчивых субъектов это может быть повышено до
степень возникновения серьезных симптомов (например, тяжелый бронхоспазм, выделение слизи
секреция, желудочно-кишечные спазмы и боль, диарея и нарушение регуляции
подвижности).
количество стимула. 85 данные также подтверждают гипотезу о том, что нейротрансмиттер в
синапс стимулирует более возбудимый постсинаптический нейрон из-за общего
повышение сопротивления нейронов и электрической возбудимости
государство. 4,76,85 Независимо от ионных механизмов относительно
последовательным открытием в исследованиях синаптической передачи является тот, в котором
Разряд потенциала действия для данного количества пресинаптического входа равен
постоянно усиливается. У восприимчивых субъектов это может быть повышено до
степень возникновения серьезных симптомов (например, тяжелый бронхоспазм, выделение слизи
секреция, желудочно-кишечные спазмы и боль, диарея и нарушение регуляции
подвижности).
Заражение аллергеном также может привести к увеличению вегетативной нервной системы.
высвобождение нейротрансмиттера из постганглионарных периферических окончаний в
заданное количество стимула. Это наблюдается при постганглионарных
окончаний парасимпатических холинергических нервов, иннервирующих гладкую мускулатуру дыхательных путей
и объясняется эозинофильно-опосредованным снижением мускариновой
Функция рецептора М2 на нервных окончаниях. 86,87 Эти рецепторы М2 являются ингибирующими
«ауторецепторы» и служат для ограничения высвобождения
ацетилхолина по цепи отрицательной обратной связи.
86,87 Эти рецепторы М2 являются ингибирующими
«ауторецепторы» и служат для ограничения высвобождения
ацетилхолина по цепи отрицательной обратной связи.
Фенотипические изменения вегетативных нервов.
Как и в случае с первичными афферентными нервами,
аллерген-индуцированные фенотипические изменения вегетативных нейронов. Как обсуждалось
выше вегетативные нервы, иннервирующие дыхательные пути, в основном парасимпатические.
Парасимпатическая ветвь обеспечивает как сократительную (холинергическую) регуляцию
гладкой мускулатуры дыхательных путей и релаксант (нитрергический/вазоактивный кишечный
пептид) контроль. У морских свинок неоднократно вызывали аллерген
вдохе произошло фенотипическое переключение, так что вазоактивный
нейроны кишечного пептида/оксида азота начали превращаться в холинергические
синтез фенотипа. 88 В
Другими словами, баланс между сократительной и релаксантной иннервацией был
меняется в пользу первого. Вероятно, это объясняется
аллерген-индуцированная продукция нейротрофинов в дыхательных путях,
нейротрофин 3 является потенциальным виновником.
Концепция модуляции в критические периоды
До этого момента доклинические исследования в поддержку нашего обсуждения проводили у взрослых или молодых взрослых животных. Аллерген-индуцированный нейромодуляция часто довольно глубокая, но ожидается, что она продлится в течение сроки от минут до недель.Рискуя закончить этот обзор на чрезмерно спекулятивной ноте, стоит рассмотреть потенциальную роль «критического периоды» в нейромодуляции, вызванной аллергеном, потому что эти изменения могут сохраняться годами и даже всю жизнь.
Хорошо известно, что развитие сенсорных систем часто
требует активности, зависящей от использования, в раннем возрасте. 89 Во время постнатального сенсорного нерва
развития, существует определенное окно времени, в течение которого нервы
восприимчивы к этой зависящей от опыта пластичности.До или после определенного
окно времени, тот же самый опыт не влияет на развитие нейронов. Таким образом,
например, если молодое животное лишается зрения из-за закрытия век (или различных
другие методы), происходят изменения в нейронных цепях зрительной коры,
приводит к тяжелой и необратимой потере остроты зрения. 90 Это происходит, только если зрение
депривация происходит в критический период времени. Даже длительное зрение
депривация после критического периода не влияет на остроту зрения.То
точное время критического периода зависит от изучаемой системы. Поскольку эти
новаторские исследования, критические периоды были определены в аудио и
соматосенсорной системы и были отмечены практически у всех видов от человека Дрозофила . 89
90 Это происходит, только если зрение
депривация происходит в критический период времени. Даже длительное зрение
депривация после критического периода не влияет на остроту зрения.То
точное время критического периода зависит от изучаемой системы. Поскольку эти
новаторские исследования, критические периоды были определены в аудио и
соматосенсорной системы и были отмечены практически у всех видов от человека Дрозофила . 89
Недавние сообщения подтверждают концепцию о том, что
пластичность чувствительных нервов в критические периоды раннего возраста может привести к
стойкие изменения в соматосенсорных и вагусно-сенсорных нервных цепях.Руда и др.
al 91 воспаление одной задней ноги
лапу крысят с использованием полной модели адъюванта Фрейнда. Выставлены щенки
стереотипное поведение, свидетельствующее о боли в лапе. Что еще более важно, было
значительное увеличение плотности первичных афферентных нервов в
ипсилатеральный задний рог спинного мозга. Это изменение плотности
нейронные цепи в ЦНС сохранялись после воспаления и продолжались до
совершеннолетие. Поведенческие исследования показали, что взрослые крысы, которые испытали лапу
воспаление, так как новорожденные были значительно более гипералгетичны в ответ на
последующие воспалительные стимулы, чем контрольные крысы.Авторы пришли к выводу, что
«периферическое воспаление, возникающее в период новорожденности,
долгосрочные последствия для ноцицептивных нейронных цепей».
Это изменение плотности
нейронные цепи в ЦНС сохранялись после воспаления и продолжались до
совершеннолетие. Поведенческие исследования показали, что взрослые крысы, которые испытали лапу
воспаление, так как новорожденные были значительно более гипералгетичны в ответ на
последующие воспалительные стимулы, чем контрольные крысы.Авторы пришли к выводу, что
«периферическое воспаление, возникающее в период новорожденности,
долгосрочные последствия для ноцицептивных нейронных цепей».
Аналогичные выводы делаются в отношении висцеральной нервной
гиперчувствительность. Давно известно, что воспаление толстой кишки
лабораторных животных приводит к гиперчувствительности нейронов и чрезмерному и
аномальная рефлекторная физиология кишечника (в чем-то аналогичная дыхательным путям).
гиперреактивность бронхиальной астмы). Когда толстые кишки крыс были химически или
механическое раздражение через 8-21 день после рождения, воспалительная реакция была
вызывали афферентную нервную гипервозбудимость и состояние повышенной
висцеральная рефлексия.:rotate(0)/nplat-v2-assets/c6eayih2y9l5cduq3wtdj26v2g1b) Эти изменения повышенной возбудимости чувствительных нервов сохранялись.
помимо воспаления кишечника, длящегося не менее 3 месяцев (самое долгое время
анализируемая точка). Напротив, если толстая кишка крыс воспалилась после
на 21-й день после рождения (вне критического периода) гиперрефлексии не было.
настойчивый. 92 Аналогично, воздействие сигаретного дыма на животных во время послеродового критического состояния.
связан с постоянным повышением гиперреактивности дыхательных путей и
плотность чувствительных нервов. 93 Так
как в соматосенсорной модели боли, так и в висцерально-сенсорной модели боли.
гиперрефлексия, воспаление в критический период постнатального развития
вызывали аномалии в сенсорной нейросхеме, которые сохранялись, возможно, до
совершеннолетие.
Эти изменения повышенной возбудимости чувствительных нервов сохранялись.
помимо воспаления кишечника, длящегося не менее 3 месяцев (самое долгое время
анализируемая точка). Напротив, если толстая кишка крыс воспалилась после
на 21-й день после рождения (вне критического периода) гиперрефлексии не было.
настойчивый. 92 Аналогично, воздействие сигаретного дыма на животных во время послеродового критического состояния.
связан с постоянным повышением гиперреактивности дыхательных путей и
плотность чувствительных нервов. 93 Так
как в соматосенсорной модели боли, так и в висцерально-сенсорной модели боли.
гиперрефлексия, воспаление в критический период постнатального развития
вызывали аномалии в сенсорной нейросхеме, которые сохранялись, возможно, до
совершеннолетие.
Причина, по которой это может быть связано с аллергическим воспалением в раннем возрасте
заключается в том, что нейротрофины участвуют в нескольких моделях аллергических
воспалений (а также вирусных инфекций) и этот критический период сенсорной
пластичность нерва зависит от продукции нейротрофических
факторы. 94,95 Аллергическое (или инфекционное) воспаление в
поэтому критические периоды повышают вероятность того, что воспалительная реакция
может оставить после себя нервную систему, слегка измененную много лет спустя,
таким образом, легкое воспалительное поражение может привести к чрезмерно преувеличенным
ответы.
94,95 Аллергическое (или инфекционное) воспаление в
поэтому критические периоды повышают вероятность того, что воспалительная реакция
может оставить после себя нервную систему, слегка измененную много лет спустя,
таким образом, легкое воспалительное поражение может привести к чрезмерно преувеличенным
ответы.
ВЫВОДЫ
Среди совокупности симптомов, характеризующих аллергическую реакцию, многие, если не большинство, являются вторичными по отношению к изменениям в нервной системе. В зависимости от органа, в котором происходит реакция, эти симптомы, основанные на нейронах, включают слезотечение, раздражение глаз и расширение сосудов, ринорея, заложенность носа, чихание, постоянные позывы к кашлю, стеснение в груди, бронхоспазм, выделения из дыхательных путей, дисфагия, изменения моторики желудочно-кишечного тракта, зуд и волдыри и приливы реакции.В этом смысле аллергия является иммуно-нейронным расстройством.
Активация тучных клеток и последующая эозинофильная
Воспаление, вызванное T H 2, может привести к глубоким изменениям функции
афферентных нейронов, нейронов ЦНС и симпатических нейронов. парасимпатические и энтеральные ганглии. Эти изменения включают острое явное
активация нервов, длительное повышение их возбудимости и даже
длительно сохраняющиеся фенотипические изменения в нервной системе.
парасимпатические и энтеральные ганглии. Эти изменения включают острое явное
активация нервов, длительное повышение их возбудимости и даже
длительно сохраняющиеся фенотипические изменения в нервной системе.
Больше, чем тот факт, что люди с аллергией вырабатывают нейроактивные медиаторы в
участки аллергического воспаления, кажется, что сама нервная система
изменены при аллергических заболеваниях.То ли из-за событий, происходящих во время критических
периоды в развитии нейронов или просто из-за постоянной активации нервов,
нервная система становится гиперактивной у многих пациентов с аллергическими заболеваниями.
В клинических условиях это измененное состояние нейронов легко наблюдать, когда
концентрация нейроактивного медиатора, которая в норме не действует на здоровых
предметов приводит к ощущениям и рефлексам у людей с аллергией. Это легко
проявляется, например, у пациентов с аллергическим ринитом: концентрация
Стимулятор С-волокна (например, брадикинин или капсаицин), который не действует при применении на
слизистая носа здорового человека вызывает сильное чихание и рефлекторное
парасимпатические холинергические сокращения при воздействии на кого-то с аллергией
ринит. 96 Шустерман и др.
al 97 обнаружил, что назальный
Воздействие низких концентраций газообразного хлора приводит к более сильным реакциям у пациентов с
сезонный аллергический ринит, чем у здоровых лиц контрольной группы. Эти данные подтверждают
клинические наблюдения, на которые обычно жалуются пациенты с аллергическим ринитом.
преувеличенные носовые симптомы, вызванные различными сильными запахами и дымом, а также
изменения атмосферных условий. В анкете, представленной в рамках
протокол скрининга 350 пациентов с аллергическим ринитом, 60% указали курение как один из
триггеров назальных симптомов, 58% перечислили другие раздражители, а 47% перечислили
холодный воздух.Эти проценты были еще выше у добровольцев с многолетними по сравнению с
сезонный аллергический ринит. 98
96 Шустерман и др.
al 97 обнаружил, что назальный
Воздействие низких концентраций газообразного хлора приводит к более сильным реакциям у пациентов с
сезонный аллергический ринит, чем у здоровых лиц контрольной группы. Эти данные подтверждают
клинические наблюдения, на которые обычно жалуются пациенты с аллергическим ринитом.
преувеличенные носовые симптомы, вызванные различными сильными запахами и дымом, а также
изменения атмосферных условий. В анкете, представленной в рамках
протокол скрининга 350 пациентов с аллергическим ринитом, 60% указали курение как один из
триггеров назальных симптомов, 58% перечислили другие раздражители, а 47% перечислили
холодный воздух.Эти проценты были еще выше у добровольцев с многолетними по сравнению с
сезонный аллергический ринит. 98
В настоящее время наше понимание специфических медиаторов, ионных каналов и
сигнальные пути, участвующие в аллерген-индуцированной нейромодуляции, остаются на прежнем уровне. относительно рудиментарное состояние. Можно предположить, что наше понимание
эти основные механизмы продолжают развиваться, появляются новые терапевтические стратегии, нацеленные на
нервная система будет продолжать развиваться, работая синергетически с
противовоспалительные стратегии, будут служить для подавления страданий тех, у кого
иммунно-нейронное расстройство, которое мы называем аллергией.
относительно рудиментарное состояние. Можно предположить, что наше понимание
эти основные механизмы продолжают развиваться, появляются новые терапевтические стратегии, нацеленные на
нервная система будет продолжать развиваться, работая синергетически с
противовоспалительные стратегии, будут служить для подавления страданий тех, у кого
иммунно-нейронное расстройство, которое мы называем аллергией.
ГЛОССАРИЙ
ПОТЕНЦИАЛ ДЕЙСТВИЯ: Нервное волокно млекопитающего в состоянии покоя находится в состоянии
электроотрицательности из-за градиентов концентрации ионов и мембранных
проницаемость для определенных ионов. Потенциал действия включает резкие изменения
мембранный потенциал, который быстро распространяется по длине мембраны нервного волокна.
Нормальный отрицательный мембранный потенциал покоя изменяется внезапно (в течение нескольких
10 000 секунды) до положительного потенциала (деполяризация), а затем обратно до
отрицательный потенциал (реполяризация). События, вызывающие увеличение мембраны
потенциал от электроотрицательности к нулевому уровню запускает потенциалзависимую натриевую
каналы начинают открываться, вызывая дальнейшее увеличение мембранного потенциала и
большее открытие потенциалзависимых натриевых каналов до тех пор, пока не будут открыты все каналы.
Затем калиевые каналы начинают открываться, а натриевые каналы закрываться, что приводит к
прекращение потенциала действия.
События, вызывающие увеличение мембраны
потенциал от электроотрицательности к нулевому уровню запускает потенциалзависимую натриевую
каналы начинают открываться, вызывая дальнейшее увеличение мембранного потенциала и
большее открытие потенциалзависимых натриевых каналов до тех пор, пока не будут открыты все каналы.
Затем калиевые каналы начинают открываться, а натриевые каналы закрываться, что приводит к
прекращение потенциала действия.
ЦИСТИНИЛЛЕЙКОТРИЕНА D 4 (LTD 4 ): LTD 4 связывается с рецептором цистеиниллейкотриена (CysLT) 1 и CysLT2.CysLT1 способствует сокращению гладкой мускулатуры бронхов и регулирует различные аспекты иммунная система. Монтелукаст противодействует CysLT1.
СЕМЕЙСТВО ЭЙКОЗАНОИДОВ: Класс липидов, полученных из полиненасыщенные жирные кислоты (например, арахидоновая кислота), которые опосредуют воспаление.
ENTERIC: Нервная система, за исключением желудочно-кишечного тракта
тракт. Энтеральная система содержит около 100 миллионов нейронов, т.
сопоставимо с количеством нейронов в спинном мозге.Он содержит внешний
(мышечно-кишечное) сплетение и внутреннее (подслизистое) сплетение. Симпатический и парасимпатический
нервы соединяются с этими 2 сплетениями. Кишечные нервы выделяют различные
нейротрансмиттеры, в том числе ацетилхолин, норадреналин, серотонин, дофамин,
вещество Р и вазоактивный интестинальный полипептид.
Энтеральная система содержит около 100 миллионов нейронов, т.
сопоставимо с количеством нейронов в спинном мозге.Он содержит внешний
(мышечно-кишечное) сплетение и внутреннее (подслизистое) сплетение. Симпатический и парасимпатический
нервы соединяются с этими 2 сплетениями. Кишечные нервы выделяют различные
нейротрансмиттеры, в том числе ацетилхолин, норадреналин, серотонин, дофамин,
вещество Р и вазоактивный интестинальный полипептид.
МЕХАНОСЕНСОРЫ: Сенсорный рецептор, обнаруживающий механические сдавление или растяжение рецептора или прилегающих тканей. Дыхательная мышца механосенсоры передают афферентные импульсы к нейронам продолговатого мозга, а также сенсорная кора.
МИЕЛИНИРОВАННЫЕ: Нервные волокна с аксонами, окруженными миелином
оболочка. Шванновские клетки обволакивают аксоны и многократно вращаются вокруг аксона, создавая
слои мембраны, содержащие липидное вещество сфингомиелин. Сфингомиелин действует
в качестве электрического изолятора и способен уменьшать поток ионов через
мембрана примерно в 5000 раз. Неизолированные контакты между шванновскими клетками
называется узлом Ранвье. Потенциалы действия «прыгают» от узла к узлу
для увеличения скорости передачи нерва в миелинизированных волокнах.
Неизолированные контакты между шванновскими клетками
называется узлом Ранвье. Потенциалы действия «прыгают» от узла к узлу
для увеличения скорости передачи нерва в миелинизированных волокнах.
НЕЙРОТРАНСМИТТЕР: Химическое вещество, выделяемое нейронами, которое вызывает передачу сигнала в синапсах ЦНС. Большинство синапсов участвуют в сигнале ЦНС передачи осуществляются химическими синапсами. Нейромедиатор связывается с мембранным рецептором белков следующего нейрона для возбуждения, торможения или изменения чувствительности нейрон. Существует более 40 нейротрансмиттеров, в том числе ацетилхолин, норадреналин, гистамин, серотонин и гамма-аминомасляная кислота.
ПАРАСИМПАТИЧЕСКИЕ: Нервные волокна вегетативной нервной системы
которые выходят из ЦНС через черепные нервы III, VII, IX и X, а также спинномозговые
крестцовые нервы.Большинство парасимпатических нервов находится в блуждающих нервах (черепной нерв
ИКС). Парасимпатические нервы также содержат преганглионарные и постганглионарные нейроны. Большинство парасимпатических постганглионарных нейронов являются холинергическими.
Большинство парасимпатических постганглионарных нейронов являются холинергическими.
АКТИВНЫЕ ФОРМЫ КИСЛОРОДА (АФК): Обычно образующиеся вещества с низкой частотой при окислительном фосфорилировании в митохондриях, а также в ряде других клеточных реакций. АФК могут оказывать клеточное повреждение, реагируя с внутриклеточными компонентами, такими как ДНК и мембранные липиды.
СИМПАТИЧЕСКИЕ: Нервные волокна вегетативной нервной системы, которые
берут начало в спинном мозге между Th1 и L2. Сначала они переходят в паравертебральные
цепочки ганглиев и далее к тканям и органам. Каждый симпатический нерв состоит
преганглионарного нейрона и постганглионарного нейрона. Преганглионарные нервы могут
синапс в паравертебральном ганглии или периферическом симпатическом ганглии (например, чревный
ганглий). Преганглионарные нервы симпатической и парасимпатической систем
являются холинергическими (то есть секретируют ацетилхолин).Наиболее симпатические постганглионарные нейроны
являются адренергическими (то есть секретируют норадреналин).
ТАХИКИНИНЫ: Класс нейропептидов, который включает сенсорные афферентные нейромедиатор вещества P.
Сокращения, используемые| CGRP кальцитонин ген-родственный пептид | ||
| ЦНС Центральная нервная система | ||
| GDNF глиальных-производный фактор роста | ||
| GFL | глиальных нейротрофический фактор семейства лиганд | |
| ФРН | фактора роста нервов | |
| PGD 2 | простагландина D 2 | |
| TRK | рецепторной тирозинкиназы | |
| TRP | Переходный рецепторный потенциал | |
| TRPA1 | ||
| TRPA1 | Потенциал переходного рецептора Ankyrin 1 | |
| TRPV1 | TRPV1 | Потенциал переходного рецептора 1 |
Сноски
Раскрытие потенциального конфликта интересов: B. Ундем получил
гранты Национальных институтов здравоохранения и GlaxoSmithKline; на
научный консультативный совет Afferent Pharmaceuticals; и есть консультант
договоренности с GlaxoSmithKline. Т. Тейлор-Кларк заявляет, что у него нет
соответствующие конфликты интересов.
Ундем получил
гранты Национальных институтов здравоохранения и GlaxoSmithKline; на
научный консультативный совет Afferent Pharmaceuticals; и есть консультант
договоренности с GlaxoSmithKline. Т. Тейлор-Кларк заявляет, что у него нет
соответствующие конфликты интересов.
ССЫЛКИ
1. Линн Б. Соматосенсорные рецепторы и их ЦНС соединения. Анну Рев Физиол 1975; 37: 105–27. [PubMed] [Google Scholar]2. Шеррингтон С Интегративное действие нервной системы. Нью-Хейвен (Коннектикут): Йель университетская пресса; 1906 г.[Google Академия]3. Кольридж Дж. К., Кольридж Х. М. Иннервация афферентных С-волокон блуждающего нерва легких и дыхательных путей и их функциональное значение. Преподобный Физиол Биохим Фармакол 1984 год; 99:1–110. [PubMed] [Google Scholar]4. Вуд Джей Ди. Кишечная нейроиммунофизиология и патофизиология. Гастроэнтерология 2004; 127: 635–57. [PubMed] [Google Scholar]5. Блэкшоу Л.А., Брукс С.Дж., Гранди Д., Шеманн М. Сенсорная передача в желудочно-кишечном тракте. тракт. Нейрогастроэнтерол Мотил 2007; 19:1–19. [PubMed] [Google Scholar]6.Вуд Джей Ди. Симпозиум по питанию нежвачных животных: нейрогастроэнтерология
и пищевой аллергии. Джей Аним Наука
2012;90:1213–23. [PubMed] [Google Scholar]7. Майерс AC, Ундем Б.Дж. Электрофизиологические эффекты тахикининов и
капсаицин на бронхиальный парасимпатический ганглий морской свинки
нейроны. Дж Физиол
1993;470:
665–79. [Бесплатная статья PMC] [PubMed] [Google Scholar]8. Мэй ГМ. Тахикинины как медиаторы медленных ВПСП у морской свинки
ганглии желчного пузыря: вовлечение рецепторов нейрокинина-3.
Дж Физиол
1995;485(Пл
2): 513–24.[Бесплатная статья PMC] [PubMed] [Google Scholar]9. Балук П.
Нейрогенное воспаление кожи и дыхательных путей.
J Investig Dermatol Symp Proc
1997; 2:76–81. [PubMed] [Google Scholar] 10. Санико А.М., Ацута С., Прауд Д., Тогиас А. Дозозависимые эффекты назального введения капсаицина: в
vivo доказательства нейрогенного воспаления дыхательных путей человека.
J Аллергия Клин Иммунол
1997; 100: 632–41. [PubMed] [Google Scholar] 12. Silver RB, Reid AC, Mackins CJ, Askwith T, Schaefer U, Herzlinger D, et al.
[PubMed] [Google Scholar]6.Вуд Джей Ди. Симпозиум по питанию нежвачных животных: нейрогастроэнтерология
и пищевой аллергии. Джей Аним Наука
2012;90:1213–23. [PubMed] [Google Scholar]7. Майерс AC, Ундем Б.Дж. Электрофизиологические эффекты тахикининов и
капсаицин на бронхиальный парасимпатический ганглий морской свинки
нейроны. Дж Физиол
1993;470:
665–79. [Бесплатная статья PMC] [PubMed] [Google Scholar]8. Мэй ГМ. Тахикинины как медиаторы медленных ВПСП у морской свинки
ганглии желчного пузыря: вовлечение рецепторов нейрокинина-3.
Дж Физиол
1995;485(Пл
2): 513–24.[Бесплатная статья PMC] [PubMed] [Google Scholar]9. Балук П.
Нейрогенное воспаление кожи и дыхательных путей.
J Investig Dermatol Symp Proc
1997; 2:76–81. [PubMed] [Google Scholar] 10. Санико А.М., Ацута С., Прауд Д., Тогиас А. Дозозависимые эффекты назального введения капсаицина: в
vivo доказательства нейрогенного воспаления дыхательных путей человека.
J Аллергия Клин Иммунол
1997; 100: 632–41. [PubMed] [Google Scholar] 12. Silver RB, Reid AC, Mackins CJ, Askwith T, Schaefer U, Herzlinger D, et al. Тучные клетки: уникальный источник ренина.Proc Natl Acad Sci U S A
2004; 101:13607–12. [Бесплатная статья PMC] [PubMed] [Google Scholar]13. Аризоно Н., Мацуда С., Хаттори Т., Кодзима Ю., Маэда Т., Галли С.Дж. Анатомические вариации ассоциаций тучных клеток у
тонкий кишечник крысы, сердце, легкие и кожа. Сходство расстояний
между нервными отростками и тучными клетками, эозинофилами или плазматическими клетками в
собственная пластинка тощей кишки. Лаборатория Инвест
1990;62:
626–34. [PubMed] [Google Scholar] 14. Алвинг К., Сандстрем С., Матран Р., Панула П., Хокфельт Т., Лундберг Дж. М.Связь между тучными клетками, содержащими гистамин, и
чувствительные нервы в коже и дыхательных путях контрольные и обработанные капсаицином
свиньи. Сотовые Ткани Res
1991 год;
264: 529–38. [PubMed] [Google Scholar] 15. Форсайт П., Биненшток Дж. Функциональная единица тучных клеток и нервов: ключевой компонент
физиологические и патофизиологические реакции. Химия
Иммунол Аллергия
2012;98:
196–221. [PubMed] [Google Scholar] 16.
Тучные клетки: уникальный источник ренина.Proc Natl Acad Sci U S A
2004; 101:13607–12. [Бесплатная статья PMC] [PubMed] [Google Scholar]13. Аризоно Н., Мацуда С., Хаттори Т., Кодзима Ю., Маэда Т., Галли С.Дж. Анатомические вариации ассоциаций тучных клеток у
тонкий кишечник крысы, сердце, легкие и кожа. Сходство расстояний
между нервными отростками и тучными клетками, эозинофилами или плазматическими клетками в
собственная пластинка тощей кишки. Лаборатория Инвест
1990;62:
626–34. [PubMed] [Google Scholar] 14. Алвинг К., Сандстрем С., Матран Р., Панула П., Хокфельт Т., Лундберг Дж. М.Связь между тучными клетками, содержащими гистамин, и
чувствительные нервы в коже и дыхательных путях контрольные и обработанные капсаицином
свиньи. Сотовые Ткани Res
1991 год;
264: 529–38. [PubMed] [Google Scholar] 15. Форсайт П., Биненшток Дж. Функциональная единица тучных клеток и нервов: ключевой компонент
физиологические и патофизиологические реакции. Химия
Иммунол Аллергия
2012;98:
196–221. [PubMed] [Google Scholar] 16. Кит И.М., Джин Дж., Сабан Р. Взаимодействие нервно-тучных клеток в моче нормальной морской свинки
мочевой пузырь. Дж Комп Нейрол
1995; 363: 28–36.[PubMed] [Google Scholar] 17. Ван Нассау Л., Адриансен Д., Тиммерманс Дж. П. Двунаправленная связь между нейронами и мачтой
клеток желудочно-кишечного тракта. Автон
Неврологи
2007; 133:91–103. [PubMed] [Google Scholar] 18. Д’Андреа М.Р., Сабан М.Р., Джерард Н.П., Вершил Б.К., Сабан Р. Отсутствие экспрессии рецептора нейрокинина-1 влияет на ткань
количество тучных клеток, но не их пространственное соотношение с
нервы. Am J Physiol Regul Integr Comp
Физиол
2005; 288:
Р491–500. [PubMed] [Google Scholar] 19. Стед Р.Х., Диксон М.Ф., Брамвелл Н.Х., Ридделл Р.Х., Биненшток Дж.Тучные клетки тесно связаны с нервами человека.
слизистая желудочно-кишечного тракта. Гастроэнтерология
1989; 97: 575–85. [PubMed] [Google Scholar] 20. Stead RH, Tomioka M, Quinonez G, Simon GT, Felten SY, Bienenstock J. Тучные клетки слизистой оболочки кишечника в норме и
кишечник крыс, зараженных нематодами, находится в тесном контакте с пептидергическими
нервы.
Кит И.М., Джин Дж., Сабан Р. Взаимодействие нервно-тучных клеток в моче нормальной морской свинки
мочевой пузырь. Дж Комп Нейрол
1995; 363: 28–36.[PubMed] [Google Scholar] 17. Ван Нассау Л., Адриансен Д., Тиммерманс Дж. П. Двунаправленная связь между нейронами и мачтой
клеток желудочно-кишечного тракта. Автон
Неврологи
2007; 133:91–103. [PubMed] [Google Scholar] 18. Д’Андреа М.Р., Сабан М.Р., Джерард Н.П., Вершил Б.К., Сабан Р. Отсутствие экспрессии рецептора нейрокинина-1 влияет на ткань
количество тучных клеток, но не их пространственное соотношение с
нервы. Am J Physiol Regul Integr Comp
Физиол
2005; 288:
Р491–500. [PubMed] [Google Scholar] 19. Стед Р.Х., Диксон М.Ф., Брамвелл Н.Х., Ридделл Р.Х., Биненшток Дж.Тучные клетки тесно связаны с нервами человека.
слизистая желудочно-кишечного тракта. Гастроэнтерология
1989; 97: 575–85. [PubMed] [Google Scholar] 20. Stead RH, Tomioka M, Quinonez G, Simon GT, Felten SY, Bienenstock J. Тучные клетки слизистой оболочки кишечника в норме и
кишечник крыс, зараженных нематодами, находится в тесном контакте с пептидергическими
нервы. Proc Natl Acad Sci U S A
1987 год;
84:2975–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]21. Уильямс Р.М., Бертоуд Х.Р., Стед Р.Х. Афферентные нервные волокна блуждающего нерва контактируют с тучными клетками крысы.
слизистая тонкой кишки.Нейроиммуномодуляция
1997;4:
266–70. [PubMed] [Google Scholar] 22. Хагияма М., Фуруно Т., Хосокава Ю., Иино Т., Ито Т., Иноуэ Т. и др.
Усиленное взаимодействие нерва и тучных клеток за счет короткой изоформы нейронов
молекулы клеточной адгезии-1. Дж Иммунол
2011;186:5983–92. [PubMed] [Google Scholar] 23. Фуруно Т., Хагияма М., Секимура М., Окамото К., Судзуки Р., Ито А. и др.
Молекула клеточной адгезии 1 (CADM1) на тучных клетках способствует
взаимодействие с нейритами ганглия задних корешков путем гетерофильного связывания с
нектин-3. J Нейроиммунол
2012; 250:50–8.[PubMed] [Google Scholar] 24. Барбара Г., Ван Б., Стангеллини В., де Джорджио Р., Кремон С., Ди Нардо Г. и др.
Зависимое от тучных клеток возбуждение висцерально-ноцицептивной сенсорной
нейронов при синдроме раздраженного кишечника.
Proc Natl Acad Sci U S A
1987 год;
84:2975–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]21. Уильямс Р.М., Бертоуд Х.Р., Стед Р.Х. Афферентные нервные волокна блуждающего нерва контактируют с тучными клетками крысы.
слизистая тонкой кишки.Нейроиммуномодуляция
1997;4:
266–70. [PubMed] [Google Scholar] 22. Хагияма М., Фуруно Т., Хосокава Ю., Иино Т., Ито Т., Иноуэ Т. и др.
Усиленное взаимодействие нерва и тучных клеток за счет короткой изоформы нейронов
молекулы клеточной адгезии-1. Дж Иммунол
2011;186:5983–92. [PubMed] [Google Scholar] 23. Фуруно Т., Хагияма М., Секимура М., Окамото К., Судзуки Р., Ито А. и др.
Молекула клеточной адгезии 1 (CADM1) на тучных клетках способствует
взаимодействие с нейритами ганглия задних корешков путем гетерофильного связывания с
нектин-3. J Нейроиммунол
2012; 250:50–8.[PubMed] [Google Scholar] 24. Барбара Г., Ван Б., Стангеллини В., де Джорджио Р., Кремон С., Ди Нардо Г. и др.
Зависимое от тучных клеток возбуждение висцерально-ноцицептивной сенсорной
нейронов при синдроме раздраженного кишечника. Гастроэнтерология
2007; 132:26–37. [PubMed] [Google Scholar] 25. Мун Т.К., Сен-Лоран К.Д., Моррис К.Е., Марсет С., Йошимура Т., Секар Ю. и др.
Достижения в области биологии тучных клеток: новое понимание гетерогенности
и функция. Иммунол слизистых оболочек
2010;3:111–28. [PubMed] [Google Scholar] 26. Какурай М., Монтефорте Р., Суто Х., Цай М., Накаэ С., Галли С.Дж.Фактор некроза опухоли тучных клеток может способствовать
удлинение нервных волокон в коже при контактной гиперчувствительности в
мышей. Ам Джей Патол
2006; 169:1713–21. [Бесплатная статья PMC] [PubMed] [Google Scholar]27. Торнтон М.А., Акаше Н., Уолш М.Т., Молони М., Шихан П.О., Смит К.М. и соавт.
Рекрутирование эозинофилов в носовые нервы после заражения аллергеном
при аллергическом рините. Клин Иммунол
2013;147:50–7. [PubMed] [Google Scholar] 28. Савацки Д.А., Кингхэм П.Дж., Корт Э., Кумаравел Б., Фрайер А.Д., Джейкоби Д.Б. и др.
Адгезия эозинофилов к холинергическим нервам через ICAM-1 и VCAM-1
и связанная с этим дегрануляция эозинофилов.
Гастроэнтерология
2007; 132:26–37. [PubMed] [Google Scholar] 25. Мун Т.К., Сен-Лоран К.Д., Моррис К.Е., Марсет С., Йошимура Т., Секар Ю. и др.
Достижения в области биологии тучных клеток: новое понимание гетерогенности
и функция. Иммунол слизистых оболочек
2010;3:111–28. [PubMed] [Google Scholar] 26. Какурай М., Монтефорте Р., Суто Х., Цай М., Накаэ С., Галли С.Дж.Фактор некроза опухоли тучных клеток может способствовать
удлинение нервных волокон в коже при контактной гиперчувствительности в
мышей. Ам Джей Патол
2006; 169:1713–21. [Бесплатная статья PMC] [PubMed] [Google Scholar]27. Торнтон М.А., Акаше Н., Уолш М.Т., Молони М., Шихан П.О., Смит К.М. и соавт.
Рекрутирование эозинофилов в носовые нервы после заражения аллергеном
при аллергическом рините. Клин Иммунол
2013;147:50–7. [PubMed] [Google Scholar] 28. Савацки Д.А., Кингхэм П.Дж., Корт Э., Кумаравел Б., Фрайер А.Д., Джейкоби Д.Б. и др.
Адгезия эозинофилов к холинергическим нервам через ICAM-1 и VCAM-1
и связанная с этим дегрануляция эозинофилов. Ам Дж
Physiol Lung Cell Мол Физиол
2002; 282: L1279–88. [PubMed] [Google Scholar] 29. Omori Y, Andoh T, Shirakawa H, Ishida H, Hachiga T, Kuraishi Y. Связанные с зудом ответы нейронов заднего рога на
кожная аллергическая стимуляция у мышей.
Нейроотчет
2009; 20: 478–81. [PubMed] [Google Scholar] 30. Potenzieri C, Meeker S, Undem BJ. Активация бронхолегочных С-волокон мышей
серотонин и аллерген-овальбумин. Дж
Физиол
2012 г.; 590 (точка
21): 5449–59. [Бесплатная статья PMC] [PubMed] [Google Scholar]31.Катерина М.Дж., Шумахер М.А., Томинага М., Розен Т.А., Левин Д.Д., Юлиус Д. Рецептор капсаицина: активируемый нагреванием ионный канал в
болевой путь. Природа
1997 год;
389: 816–24. [PubMed] [Google Scholar] 32. Jordt SE, Bautista DM, Chuang HH, McKemy DD, Zygmunt PM, Hogestatt ED, et al.
Горчичное масло и каннабиноиды возбуждают чувствительные нервные волокна через
канал ГТО АНКТМ1. Природа
2004; 427: 260–5. [PubMed] [Google Scholar] 33. Shim WS, Tak MH, Lee MH, Kim M, Koo JY, Lee CH и другие.
Ам Дж
Physiol Lung Cell Мол Физиол
2002; 282: L1279–88. [PubMed] [Google Scholar] 29. Omori Y, Andoh T, Shirakawa H, Ishida H, Hachiga T, Kuraishi Y. Связанные с зудом ответы нейронов заднего рога на
кожная аллергическая стимуляция у мышей.
Нейроотчет
2009; 20: 478–81. [PubMed] [Google Scholar] 30. Potenzieri C, Meeker S, Undem BJ. Активация бронхолегочных С-волокон мышей
серотонин и аллерген-овальбумин. Дж
Физиол
2012 г.; 590 (точка
21): 5449–59. [Бесплатная статья PMC] [PubMed] [Google Scholar]31.Катерина М.Дж., Шумахер М.А., Томинага М., Розен Т.А., Левин Д.Д., Юлиус Д. Рецептор капсаицина: активируемый нагреванием ионный канал в
болевой путь. Природа
1997 год;
389: 816–24. [PubMed] [Google Scholar] 32. Jordt SE, Bautista DM, Chuang HH, McKemy DD, Zygmunt PM, Hogestatt ED, et al.
Горчичное масло и каннабиноиды возбуждают чувствительные нервные волокна через
канал ГТО АНКТМ1. Природа
2004; 427: 260–5. [PubMed] [Google Scholar] 33. Shim WS, Tak MH, Lee MH, Kim M, Koo JY, Lee CH и другие. TRPV1 опосредует вызванный гистамином зуд посредством активации
фосфолипаза А2 и 12-липоксигеназа.Дж
Неврологи
2007; 27: 2331–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]34. Suh YG, Oh U. Активация и активаторы TRPV1 и их
фармацевтическое значение. Карр Фарм Дес
2005; 11: 2687–98. [PubMed] [Google Scholar] 36. Тейлор-Кларк Т.Е., Ундем Б.Дж., Макглашан Д.В. младший, Гатта С., Карр М.Дж., МакАлександер М.А. Простагландин-индуцированная активация ноцицептивных нейронов
через прямое взаимодействие с переходным рецепторным потенциалом A1
(ТРПА1). Мол Фармакол
2008; 73: 274–81. [PubMed] [Google Scholar] 37. Динг-Пфеннигдорф Д., Авербек Б., Михаэлис М.Стимуляция PAR-2 возбуждает и сенсибилизирует крыс.
кожные С-ноцицепторы к теплу.
Нейроотчет
2004;15:2071–5. [PubMed] [Google Scholar] 38. Хонг Дж.Л., Хо С.И., Квонг К., Ли Л.И. Активация легочных С-волокон аденозином в
анестезированные крысы: роль аденозиновых рецепторов A1.
Дж Физиол
1998; 508 (Пл
1): 109–18. [Бесплатная статья PMC] [PubMed] [Google Scholar]39.
TRPV1 опосредует вызванный гистамином зуд посредством активации
фосфолипаза А2 и 12-липоксигеназа.Дж
Неврологи
2007; 27: 2331–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]34. Suh YG, Oh U. Активация и активаторы TRPV1 и их
фармацевтическое значение. Карр Фарм Дес
2005; 11: 2687–98. [PubMed] [Google Scholar] 36. Тейлор-Кларк Т.Е., Ундем Б.Дж., Макглашан Д.В. младший, Гатта С., Карр М.Дж., МакАлександер М.А. Простагландин-индуцированная активация ноцицептивных нейронов
через прямое взаимодействие с переходным рецепторным потенциалом A1
(ТРПА1). Мол Фармакол
2008; 73: 274–81. [PubMed] [Google Scholar] 37. Динг-Пфеннигдорф Д., Авербек Б., Михаэлис М.Стимуляция PAR-2 возбуждает и сенсибилизирует крыс.
кожные С-ноцицепторы к теплу.
Нейроотчет
2004;15:2071–5. [PubMed] [Google Scholar] 38. Хонг Дж.Л., Хо С.И., Квонг К., Ли Л.И. Активация легочных С-волокон аденозином в
анестезированные крысы: роль аденозиновых рецепторов A1.
Дж Физиол
1998; 508 (Пл
1): 109–18. [Бесплатная статья PMC] [PubMed] [Google Scholar]39. Тейлор-Кларк Т.Е., Нассенштейн С., Ундем Б.Дж. Лейкотриен D(4) повышает возбудимость
чувствительные к капсаицину носовые чувствительные нервы к электрическим и химическим
раздражители.Бр Дж Фармакол
2008; 154:1359–68. [Бесплатная статья PMC] [PubMed] [Google Scholar]40. Кремон С., Карини Г., Ван Б., Васина В., Коглиандро Р.Ф., Де Джорджио Р. и др.
Высвобождение серотонина в кишечнике, активация сенсорных нейронов и
боли в животе при синдроме раздраженного кишечника. Ам Дж
Гастроэнтерол
2011 г.;
106:1290–8. [PubMed] [Google Scholar]41. Пеллег А, Хёрт СМ. Механизм действия АТФ на легочный блуждающий нерв собак C
волокна нервных окончаний. Дж Физиол
1996;490(Пт
1): 265–75. [Бесплатная статья PMC] [PubMed] [Google Scholar]42.Киркап А.Дж., Цзян В., Баннетт Н.В., Гранди Д. Стимуляция активируемого протеиназой рецептора 2 возбуждает
тощекишечных афферентных нервов у анестезированных крыс. Дж
Физиол
2003 г.; 552 (Пл
2): 589–601. [Бесплатная статья PMC] [PubMed] [Google Scholar]43. Колдвелл Дж.
Тейлор-Кларк Т.Е., Нассенштейн С., Ундем Б.Дж. Лейкотриен D(4) повышает возбудимость
чувствительные к капсаицину носовые чувствительные нервы к электрическим и химическим
раздражители.Бр Дж Фармакол
2008; 154:1359–68. [Бесплатная статья PMC] [PubMed] [Google Scholar]40. Кремон С., Карини Г., Ван Б., Васина В., Коглиандро Р.Ф., Де Джорджио Р. и др.
Высвобождение серотонина в кишечнике, активация сенсорных нейронов и
боли в животе при синдроме раздраженного кишечника. Ам Дж
Гастроэнтерол
2011 г.;
106:1290–8. [PubMed] [Google Scholar]41. Пеллег А, Хёрт СМ. Механизм действия АТФ на легочный блуждающий нерв собак C
волокна нервных окончаний. Дж Физиол
1996;490(Пт
1): 265–75. [Бесплатная статья PMC] [PubMed] [Google Scholar]42.Киркап А.Дж., Цзян В., Баннетт Н.В., Гранди Д. Стимуляция активируемого протеиназой рецептора 2 возбуждает
тощекишечных афферентных нервов у анестезированных крыс. Дж
Физиол
2003 г.; 552 (Пл
2): 589–601. [Бесплатная статья PMC] [PubMed] [Google Scholar]43. Колдвелл Дж. Р., Филлис Б. Д., Сазерленд К., Ховарт Г. С., Блэкшоу Л. А. Повышенная реактивность толстой кишки крысы splanchnic
афференты к 5-HT после воспаления и восстановления. Дж
Физиол
2007; 579 (т.
1): 203–13. [Бесплатная статья PMC] [PubMed] [Google Scholar]44. Эглезос А., Леччи А., Сантичоли П., Джулиани С., Трамонтана М., Дель Бьянко Э. и др.Активация первичных афферентов, чувствительных к капсаицину, у крыс.
мочевого пузыря соединением 48/80: прямое действие на сенсорные
нервы?
Arch Int Pharmacodyn Ther
1992; 315: 96–109. [PubMed] [Google Scholar]45. Undem BJ, Hubbard W, Weinreich D. Иммунологически индуцированная нейромодуляция морской свинки
узловатых ганглиозных нейронов. J Auton Nerv Syst
1993;44:
35–44. [PubMed] [Google Scholar]46. Грин Р., Фаулер Дж., МакГлашан Д. младший, Вайнрайх Д. Тучные клетки легких человека, зараженные IgE, возбуждают блуждающий нерв
чувствительных нейронов in vitro.J Appl Physiol
1988;64:
2249–53. [PubMed] [Google Scholar]47. Риччио М.М., Майерс АС, Ундем Б.
Р., Филлис Б. Д., Сазерленд К., Ховарт Г. С., Блэкшоу Л. А. Повышенная реактивность толстой кишки крысы splanchnic
афференты к 5-HT после воспаления и восстановления. Дж
Физиол
2007; 579 (т.
1): 203–13. [Бесплатная статья PMC] [PubMed] [Google Scholar]44. Эглезос А., Леччи А., Сантичоли П., Джулиани С., Трамонтана М., Дель Бьянко Э. и др.Активация первичных афферентов, чувствительных к капсаицину, у крыс.
мочевого пузыря соединением 48/80: прямое действие на сенсорные
нервы?
Arch Int Pharmacodyn Ther
1992; 315: 96–109. [PubMed] [Google Scholar]45. Undem BJ, Hubbard W, Weinreich D. Иммунологически индуцированная нейромодуляция морской свинки
узловатых ганглиозных нейронов. J Auton Nerv Syst
1993;44:
35–44. [PubMed] [Google Scholar]46. Грин Р., Фаулер Дж., МакГлашан Д. младший, Вайнрайх Д. Тучные клетки легких человека, зараженные IgE, возбуждают блуждающий нерв
чувствительных нейронов in vitro.J Appl Physiol
1988;64:
2249–53. [PubMed] [Google Scholar]47. Риччио М.М., Майерс АС, Ундем Б. Дж. Иммуномодуляция афферентных нейронов морской свинки
изолированные дыхательные пути. Дж Физиол
1996;491(Пл
2): 499–509. [Бесплатная статья PMC] [PubMed] [Google Scholar]48. Jiang W, Kreis ME, Eastwood C, Kirkup AJ, Humphrey PP, Grundy D. 5-HT(3) и гистаминовые H(1) рецепторы опосредуют афферентные
чувствительность нервов к кишечной анафилаксии у крыс.
Гастроэнтерология
2000; 119:1267–75. [PubMed] [Google Scholar]49. Ли Л.И., Мортон Р.Ф. Гистамин усиливает реакцию вагусных легочных С-волокон на
капсаицин и вздутие легких.Дыхание
Физиол
1993; 93: 83–96. [PubMed] [Google Scholar]50. Чжан Г., Лин Р.Л., Виггерс М.Е., Ли Л.И. Сенсибилизирующие эффекты хронического воздействия и острого
ингаляции аэрозоля овальбумина на легочные С-волокна в
крысы. J Appl Physiol
2008; 105:128–38. [Бесплатная статья PMC] [PubMed] [Google Scholar]51. Ю С, Колларик М, Оуян А, Майерс А.С., Ундем Б.Дж. Опосредованное тучными клетками длительное увеличение
возбудимость С-волокон блуждающего нерва в пищеводе морской свинки.
Am J Physiol Gastrointest Liver Physiol
2007; 293:G850–6. [PubMed] [Google Scholar]52.Gu Q, Lim ME, Gleich GJ, Lee LY. Механизмы индуцирования главным основным белком эозинофилов
гипервозбудимость вагусных легочных химиочувствительных нейронов.
Am J Physiol Lung Cell Mol Physiol
2009; 296:L453–61. [Бесплатная статья PMC] [PubMed] [Google Scholar]53. Фишер А., МакГрегор Г.П., Сария А., Филиппин Б., Куммер В. Индукция экспрессии гена тахикинина и пептида в
морская свинка нодозирует первичные афферентные нейроны из-за аллергической реакции дыхательных путей
воспаление. Джей Клин Инвест
1996; 98:
2284–91. [Бесплатная статья PMC] [PubMed] [Google Scholar]54.Lieu TM, Myers AC, Meeker S, Undem BJ. Индукция TRPV1 в вагусных путях низкопороговая
механосенсорные нейроны при провокации аллергеном и нейротрофическом
факторы. Am J Physiol Lung Cell Mol Physiol
2012; 302:L941–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]55. Bonini S, Lambiase A, Levi-Schaffer F, Aloe L. Фактор роста нервов: важная молекула при аллергических реакциях.
Воспаление и ремоделирование тканей. Арка
Аллергия Иммунол
1999; 118:159–62. [PubMed] [Google Scholar]56. Нокхер В. А., Ренц Х. Нейротрофины и астма: новое понимание нейроиммунных
взаимодействие.J Аллергия Клин Иммунол
2006; 117: 67–71. [PubMed] [Google Scholar]57. Цвайфель Л.С., Курувилла Р., Гинти Д.Д. Функции и механизмы ретроградного нейротрофина
сигнализация. Нат Рев Нейроски
2005; 6: 615–25. [PubMed] [Google Scholar]58. Лиу Т., Колларик М., Майерс А.С., Ундем Б.Дж. Экспрессия рецепторов лигандов семейства нейротрофинов и GDNF
в подтипах блуждающего нерва, иннервирующего дыхательные пути взрослой морской свинки
тракт. Am J Physiol Lung Cell Mol Physiol
2011;300:
L790–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]59.Сурденикова Л., Ру Ф., Нассенштейн С., Татар М., Колларик М. Афференты, полученные из нервного гребня и плакод
иннервация пищевода мыши.
Нейрогастроэнтерол Мотил
2012; 24:e517–25. [PubMed] [Google Scholar] 60. Майерс А.С., Каекар Р., Ундем Б.Дж. Индуцированная аллергическим воспалением продукция нейропептидов в
быстро адаптирующиеся афферентные нервы дыхательных путей морской свинки.
Am J Physiol Lung Cell Mol Physiol
2002; 282: L775–81. [PubMed] [Google Scholar]61. Чуайчу Б., Хантер Д.Д., Майерс А.С., Колларик М., Ундем Б.Дж. Аллерген-индуцированный синтез вещества Р в
чувствительные нейроны, иннервирующие легкие.Дж Аллергия
Клин Иммунол
2005; 116: 325–31. [PubMed] [Google Scholar]62. Нойманн С., Дубелл Т.П., Лесли Т., Вульф С.Дж. Воспалительная болевая гиперчувствительность, опосредованная
фенотипическое переключение в миелинизированных первичных сенсорных нейронах.
Природа
1996; 384:360–4. [PubMed] [Google Scholar]63. Чжан Г., Лин Р.Л., Виггерс М., Сноу Д.М., Ли Л.И. Измененная экспрессия TRPV1 и чувствительность к капсаицину
в легочных миелинизированных афферентах после хронического воспаления дыхательных путей в
крыса. Дж Физиол
2008; 586 (т.
23): 5771–86. [Бесплатная статья PMC] [PubMed] [Google Scholar]64.Сильвер Р., Сильверман А.Дж., Виткович Л., Ледерхендлер II. Тучные клетки в головном мозге: доказательства и функционал
значение. Тренды Нейроси
1996; 19:25–31. [PubMed] [Google Scholar]65. Kreis ME, Muller M, Zittel TT, Glatzle J, Grundy D. Медиаторы активации нейронов в стволе головного мозга крысы
после кишечной анафилаксии. Неврологи
латынь
2000; 289:45–8. [PubMed] [Google Scholar]67. Маццоне С.Б., Мори Н., Каннинг Б.Дж. Синергические взаимодействия между афферентным нервом дыхательных путей
подтипы, регулирующие кашлевой рефлекс у морских свинок.Дж Физиол
2005;569(Пт
2): 559–73. [Бесплатная статья PMC] [PubMed] [Google Scholar]68. Маццоне С.Б., Каннинг Б.Дж. Синергические взаимодействия между афферентным нервом дыхательных путей
подтипы, опосредующие рефлекторный бронхоспазм у морских свинок.
Am J Physiol Regul Integr Comp Physiol
2002; 283: R86–98. [PubMed] [Google Scholar]69. Татар М., Плевкова Ю., Брозманова М., Пекова Р., Колларик М. Механизмы кашля при
риносинусит. Пульм Фармакол Тер
2009;22:121–6. [PubMed] [Google Scholar]70. Chen CY, Bonham AC, Schelegle ES, Gershwin LJ, Plopper CG, Joad JP.Продолжительное воздействие аллергена на астматических обезьян вызывает
нейропластичность ядра одиночного пути. Дж
Аллергия Клин Иммунол
2001; 108: 557–62. [PubMed] [Google Scholar]71. Undem BJ, Hubbard WC, Christian EP, Weinreich D. Тучные клетки в верхнем шейном ганглии морской свинки:
функциональная и гистологическая оценка. Джей Автон
Нерв Сист
1990; 30:75–87. [PubMed] [Google Scholar]72. Myers AC, Undem BJ, Weinreich D. Влияние антигена на свойства мембран цесарки.
нейронов бронхиального ганглия свиньи.J Appl
Физиол
1991;71:
970–6. [PubMed] [Google Scholar]73. Бишофф С.К., Гебхардт Т. Роль тучных клеток и эозинофилов в нейроиммунной
взаимодействия, регулирующие воспаление слизистой оболочки при воспалении кишечника
болезнь. Adv Exp Мед Биол
2006; 579: 177–208. [PubMed] [Google Scholar]74. Каекар Р., Ундем Б.Дж., Майерс АС. Роль активации циклооксигеназы и простагландинов в
антиген-индуцированные изменения возбудимости бронхиальных парасимпатических ганглиев
нейроны. Am J Physiol Lung Cell Mol Physiol
2003;284:
L581–7. [PubMed] [Google Scholar]75.Вайнрайх Д., Ундем Б.Дж. Иммунологическая регуляция синаптической передачи у
изолированные вегетативные ганглии морской свинки. Джей Клин
Вкладывать деньги
1987; 79: 1529–32. [Бесплатная статья PMC] [PubMed] [Google Scholar]76. Undem BJ, Myers AC, Weinreich D. Антиген-индуцированная модуляция вегетативной и сенсорной
нейроны в пробирке. Приложение Int Arch Allergy
Иммунол
1991 год;
94:319–24. [PubMed] [Google Scholar]78. Cyphert JM, Kovarova M, Allen IC, Hartney JM, Murphy DL, Wess J, et al.
Кооперация между тучными клетками и нейронами необходима для
антиген-опосредованная бронхоконстрикция.Дж
Иммунол
2009; 182:7430–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]79. Вайнрайх Д., Ундем Б.Дж., Леал-Кардосо Д.Х. Функциональные эффекты активации тучных клеток в
симпатические ганглии. Энн Н.Ю. Академия наук
1992; 664: 293–308. [PubMed] [Google Scholar]80. Шеманн М., Мишель К., Церегжин М., Зеллер Ф., Зайдл С., Бишофф С.К. Коктейль медиатора тучных клеток человека возбуждает нейроны в
кишечная нервная система человека и морской свинки.
Нейрогастроэнтерол Мотил
2005; 17: 281–9. [PubMed] [Google Scholar]81. Лю С., Ху Х.З., Гао Н., Гао С., Ван Г., Ван Х и др.Нейроиммунные взаимодействия в желудке морской свинки и
кишечник. Am J Physiol Gastrointest Печень
Физиол
2003; 284:G154–64. [PubMed] [Google Scholar]82. Фрилинг Т., Кук Х.Дж., Вуд Д.Д. Нейроиммунная связь в подслизистом сплетении
толстой кишки морской свинки после сенсибилизации к молочному антигену.
Am J Physiol
1994 год;
267:G1087–93. [PubMed] [Google Scholar]83. Бюнер С., Ли К., Бергер Т., Виньяли С., Барбара Г., Де Джорджио Р. и др.
Подслизистые, а не миэнтеральные нейроны активируются слизистой оболочкой.
супернатанты биопсии пациентов с синдромом раздраженного кишечника.Нейрогастроэнтерол Мотил
2012;24:
1134–e572. [PubMed] [Google Scholar]84. Breunig E, Michel K, Zeller F, Seidl S, Weyhern CW, Schemann M. Гистамин возбуждает нейроны в подслизистом сплетении человека
через активацию рецепторов h2, h3, h4 и h5. Дж
Физиол
2007; 583: 731–42. [Бесплатная статья PMC] [PubMed] [Google Scholar]85. Кристиан Э.П., Ундем Б.Дж., Вайнрайх Д. Эндогенный гистамин возбуждает нейроны морской свинки.
верхний шейный ганглий in vitro. Дж
Физиол
1989;409:
297–312. [Бесплатная статья PMC] [PubMed] [Google Scholar]86.Фрайер А.Д., Уиллс-Карп М. Дисфункция М2-мускариновых рецепторов в легких
парасимпатических нервов после введения антигена. Дж
Аппл Физиол
1991;71:2255–61. [PubMed] [Google Scholar]87. Костелло Р.В., Эванс К.М., Йост Б.Л., Бельмонте К.Е., Глейх Г.Дж., Якоби Д.Б. и др.
Антиген-индуцированная гиперреактивность к гистамину: роль блуждающего нерва
нервы и эозинофилы. Am J Physiol Lung Cell Mol
Физиол
1999; 276:L709–14. [PubMed] [Google Scholar]88. Пан Дж., Род Х.К., Ундем Б.Дж., Майерс АС. Нейромедиаторы в парасимпатических нейронах дыхательных путей
изменен нейротрофином-3 и повторным введением аллергена.Am J Respir Cell Мол Биол
2010;43:452–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]89. Берарди Н., Пиццоруссо Т., Маффеи Л. Критические периоды во время сенсорного
разработка. Курр Опин Нейробиол
2000; 10: 138–45. [PubMed] [Google Scholar]90. Визель Т.Н., Хьюбел Д.Х. Степень восстановления после воздействия визуальных
лишай у котят. J Нейрофизиол
1965; 28: 1060–72. [PubMed] [Google Scholar]91. Руда М.А., Линг К.Д., Хохманн А.Г., Пэн Ю.Б., Татибана Т. Измененные ноцицептивные нейронные цепи после новорожденных
периферическое воспаление.Наука
2000;289:
628–31. [PubMed] [Google Scholar]92. Аль-Чаер ЭД, Кавасаки М, Пасрича ПДж. Новая модель хронической висцеральной гиперчувствительности у
взрослых крыс, индуцированных раздражением толстой кишки в постнатальном периоде.
разработка. Гастроэнтерология
2000; 119:1276–85. [PubMed] [Google Scholar]93. Ву З.С., Хантер Д.Д., Киш В.Л., Бендерс К.М., Бэтчелор Т.П., Дей Р.Д. Пренатальное и раннее, но не позднее постнатальное воздействие
мышей в сторону от табачного дыма увеличивает гиперреактивность дыхательных путей позже
в жизни. Перспектива охраны окружающей среды
2009; 117:1434–40.[Бесплатная статья PMC] [PubMed] [Google Scholar]94. Хантер Д.Д., Каррелл-Джекс Л.А., Бэтчелор Т.П., Дей Р.Д. Роль фактора роста нервов в индуцированных озоном нейронах
реакции в раннем постнатальном развитии дыхательных путей. Являюсь
J Respir Cell Мол Биол
2011;45:359–65. [Бесплатная статья PMC] [PubMed] [Google Scholar]95. Макаллистер А.К., Кац Л.С., Ло Д.К. Нейротрофины и синаптическая пластичность.
Анну Рев Нейроски
1999; 22: 295–318. [PubMed] [Google Scholar]96. Сарин С., Ундем Б., Санико А., Тогиас А. Роль нервной системы в
ринит.J Аллергия Клин Иммунол
2006; 118: 999–1016. [PubMed] [Google Scholar]97. Шустерман Д.Дж., Мерфи М.А., Балмс М.Р. Субъекты с сезонным аллергическим ринитом и неринитным
субъекты по-разному реагируют на назальную провокацию хлором
газ. J Аллергия Клин Иммунол
1998; 101: 732–40. [PubMed] [Google Scholar]98. Ревицкий Д.А., Лейди Н.К., Бреннан-Димер Ф., Томпсон С., Тогиас А. Разработка и предварительная проверка
многоатрибутный индекс полезности симптомов ринита. Качество
Жизнь Рез
1998; 7: 693–702. [PubMed] [Google Scholar]
Дж. Иммуномодуляция афферентных нейронов морской свинки
изолированные дыхательные пути. Дж Физиол
1996;491(Пл
2): 499–509. [Бесплатная статья PMC] [PubMed] [Google Scholar]48. Jiang W, Kreis ME, Eastwood C, Kirkup AJ, Humphrey PP, Grundy D. 5-HT(3) и гистаминовые H(1) рецепторы опосредуют афферентные
чувствительность нервов к кишечной анафилаксии у крыс.
Гастроэнтерология
2000; 119:1267–75. [PubMed] [Google Scholar]49. Ли Л.И., Мортон Р.Ф. Гистамин усиливает реакцию вагусных легочных С-волокон на
капсаицин и вздутие легких.Дыхание
Физиол
1993; 93: 83–96. [PubMed] [Google Scholar]50. Чжан Г., Лин Р.Л., Виггерс М.Е., Ли Л.И. Сенсибилизирующие эффекты хронического воздействия и острого
ингаляции аэрозоля овальбумина на легочные С-волокна в
крысы. J Appl Physiol
2008; 105:128–38. [Бесплатная статья PMC] [PubMed] [Google Scholar]51. Ю С, Колларик М, Оуян А, Майерс А.С., Ундем Б.Дж. Опосредованное тучными клетками длительное увеличение
возбудимость С-волокон блуждающего нерва в пищеводе морской свинки.
Am J Physiol Gastrointest Liver Physiol
2007; 293:G850–6. [PubMed] [Google Scholar]52.Gu Q, Lim ME, Gleich GJ, Lee LY. Механизмы индуцирования главным основным белком эозинофилов
гипервозбудимость вагусных легочных химиочувствительных нейронов.
Am J Physiol Lung Cell Mol Physiol
2009; 296:L453–61. [Бесплатная статья PMC] [PubMed] [Google Scholar]53. Фишер А., МакГрегор Г.П., Сария А., Филиппин Б., Куммер В. Индукция экспрессии гена тахикинина и пептида в
морская свинка нодозирует первичные афферентные нейроны из-за аллергической реакции дыхательных путей
воспаление. Джей Клин Инвест
1996; 98:
2284–91. [Бесплатная статья PMC] [PubMed] [Google Scholar]54.Lieu TM, Myers AC, Meeker S, Undem BJ. Индукция TRPV1 в вагусных путях низкопороговая
механосенсорные нейроны при провокации аллергеном и нейротрофическом
факторы. Am J Physiol Lung Cell Mol Physiol
2012; 302:L941–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]55. Bonini S, Lambiase A, Levi-Schaffer F, Aloe L. Фактор роста нервов: важная молекула при аллергических реакциях.
Воспаление и ремоделирование тканей. Арка
Аллергия Иммунол
1999; 118:159–62. [PubMed] [Google Scholar]56. Нокхер В. А., Ренц Х. Нейротрофины и астма: новое понимание нейроиммунных
взаимодействие.J Аллергия Клин Иммунол
2006; 117: 67–71. [PubMed] [Google Scholar]57. Цвайфель Л.С., Курувилла Р., Гинти Д.Д. Функции и механизмы ретроградного нейротрофина
сигнализация. Нат Рев Нейроски
2005; 6: 615–25. [PubMed] [Google Scholar]58. Лиу Т., Колларик М., Майерс А.С., Ундем Б.Дж. Экспрессия рецепторов лигандов семейства нейротрофинов и GDNF
в подтипах блуждающего нерва, иннервирующего дыхательные пути взрослой морской свинки
тракт. Am J Physiol Lung Cell Mol Physiol
2011;300:
L790–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]59.Сурденикова Л., Ру Ф., Нассенштейн С., Татар М., Колларик М. Афференты, полученные из нервного гребня и плакод
иннервация пищевода мыши.
Нейрогастроэнтерол Мотил
2012; 24:e517–25. [PubMed] [Google Scholar] 60. Майерс А.С., Каекар Р., Ундем Б.Дж. Индуцированная аллергическим воспалением продукция нейропептидов в
быстро адаптирующиеся афферентные нервы дыхательных путей морской свинки.
Am J Physiol Lung Cell Mol Physiol
2002; 282: L775–81. [PubMed] [Google Scholar]61. Чуайчу Б., Хантер Д.Д., Майерс А.С., Колларик М., Ундем Б.Дж. Аллерген-индуцированный синтез вещества Р в
чувствительные нейроны, иннервирующие легкие.Дж Аллергия
Клин Иммунол
2005; 116: 325–31. [PubMed] [Google Scholar]62. Нойманн С., Дубелл Т.П., Лесли Т., Вульф С.Дж. Воспалительная болевая гиперчувствительность, опосредованная
фенотипическое переключение в миелинизированных первичных сенсорных нейронах.
Природа
1996; 384:360–4. [PubMed] [Google Scholar]63. Чжан Г., Лин Р.Л., Виггерс М., Сноу Д.М., Ли Л.И. Измененная экспрессия TRPV1 и чувствительность к капсаицину
в легочных миелинизированных афферентах после хронического воспаления дыхательных путей в
крыса. Дж Физиол
2008; 586 (т.
23): 5771–86. [Бесплатная статья PMC] [PubMed] [Google Scholar]64.Сильвер Р., Сильверман А.Дж., Виткович Л., Ледерхендлер II. Тучные клетки в головном мозге: доказательства и функционал
значение. Тренды Нейроси
1996; 19:25–31. [PubMed] [Google Scholar]65. Kreis ME, Muller M, Zittel TT, Glatzle J, Grundy D. Медиаторы активации нейронов в стволе головного мозга крысы
после кишечной анафилаксии. Неврологи
латынь
2000; 289:45–8. [PubMed] [Google Scholar]67. Маццоне С.Б., Мори Н., Каннинг Б.Дж. Синергические взаимодействия между афферентным нервом дыхательных путей
подтипы, регулирующие кашлевой рефлекс у морских свинок.Дж Физиол
2005;569(Пт
2): 559–73. [Бесплатная статья PMC] [PubMed] [Google Scholar]68. Маццоне С.Б., Каннинг Б.Дж. Синергические взаимодействия между афферентным нервом дыхательных путей
подтипы, опосредующие рефлекторный бронхоспазм у морских свинок.
Am J Physiol Regul Integr Comp Physiol
2002; 283: R86–98. [PubMed] [Google Scholar]69. Татар М., Плевкова Ю., Брозманова М., Пекова Р., Колларик М. Механизмы кашля при
риносинусит. Пульм Фармакол Тер
2009;22:121–6. [PubMed] [Google Scholar]70. Chen CY, Bonham AC, Schelegle ES, Gershwin LJ, Plopper CG, Joad JP.Продолжительное воздействие аллергена на астматических обезьян вызывает
нейропластичность ядра одиночного пути. Дж
Аллергия Клин Иммунол
2001; 108: 557–62. [PubMed] [Google Scholar]71. Undem BJ, Hubbard WC, Christian EP, Weinreich D. Тучные клетки в верхнем шейном ганглии морской свинки:
функциональная и гистологическая оценка. Джей Автон
Нерв Сист
1990; 30:75–87. [PubMed] [Google Scholar]72. Myers AC, Undem BJ, Weinreich D. Влияние антигена на свойства мембран цесарки.
нейронов бронхиального ганглия свиньи.J Appl
Физиол
1991;71:
970–6. [PubMed] [Google Scholar]73. Бишофф С.К., Гебхардт Т. Роль тучных клеток и эозинофилов в нейроиммунной
взаимодействия, регулирующие воспаление слизистой оболочки при воспалении кишечника
болезнь. Adv Exp Мед Биол
2006; 579: 177–208. [PubMed] [Google Scholar]74. Каекар Р., Ундем Б.Дж., Майерс АС. Роль активации циклооксигеназы и простагландинов в
антиген-индуцированные изменения возбудимости бронхиальных парасимпатических ганглиев
нейроны. Am J Physiol Lung Cell Mol Physiol
2003;284:
L581–7. [PubMed] [Google Scholar]75.Вайнрайх Д., Ундем Б.Дж. Иммунологическая регуляция синаптической передачи у
изолированные вегетативные ганглии морской свинки. Джей Клин
Вкладывать деньги
1987; 79: 1529–32. [Бесплатная статья PMC] [PubMed] [Google Scholar]76. Undem BJ, Myers AC, Weinreich D. Антиген-индуцированная модуляция вегетативной и сенсорной
нейроны в пробирке. Приложение Int Arch Allergy
Иммунол
1991 год;
94:319–24. [PubMed] [Google Scholar]78. Cyphert JM, Kovarova M, Allen IC, Hartney JM, Murphy DL, Wess J, et al.
Кооперация между тучными клетками и нейронами необходима для
антиген-опосредованная бронхоконстрикция.Дж
Иммунол
2009; 182:7430–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]79. Вайнрайх Д., Ундем Б.Дж., Леал-Кардосо Д.Х. Функциональные эффекты активации тучных клеток в
симпатические ганглии. Энн Н.Ю. Академия наук
1992; 664: 293–308. [PubMed] [Google Scholar]80. Шеманн М., Мишель К., Церегжин М., Зеллер Ф., Зайдл С., Бишофф С.К. Коктейль медиатора тучных клеток человека возбуждает нейроны в
кишечная нервная система человека и морской свинки.
Нейрогастроэнтерол Мотил
2005; 17: 281–9. [PubMed] [Google Scholar]81. Лю С., Ху Х.З., Гао Н., Гао С., Ван Г., Ван Х и др.Нейроиммунные взаимодействия в желудке морской свинки и
кишечник. Am J Physiol Gastrointest Печень
Физиол
2003; 284:G154–64. [PubMed] [Google Scholar]82. Фрилинг Т., Кук Х.Дж., Вуд Д.Д. Нейроиммунная связь в подслизистом сплетении
толстой кишки морской свинки после сенсибилизации к молочному антигену.
Am J Physiol
1994 год;
267:G1087–93. [PubMed] [Google Scholar]83. Бюнер С., Ли К., Бергер Т., Виньяли С., Барбара Г., Де Джорджио Р. и др.
Подслизистые, а не миэнтеральные нейроны активируются слизистой оболочкой.
супернатанты биопсии пациентов с синдромом раздраженного кишечника.Нейрогастроэнтерол Мотил
2012;24:
1134–e572. [PubMed] [Google Scholar]84. Breunig E, Michel K, Zeller F, Seidl S, Weyhern CW, Schemann M. Гистамин возбуждает нейроны в подслизистом сплетении человека
через активацию рецепторов h2, h3, h4 и h5. Дж
Физиол
2007; 583: 731–42. [Бесплатная статья PMC] [PubMed] [Google Scholar]85. Кристиан Э.П., Ундем Б.Дж., Вайнрайх Д. Эндогенный гистамин возбуждает нейроны морской свинки.
верхний шейный ганглий in vitro. Дж
Физиол
1989;409:
297–312. [Бесплатная статья PMC] [PubMed] [Google Scholar]86.Фрайер А.Д., Уиллс-Карп М. Дисфункция М2-мускариновых рецепторов в легких
парасимпатических нервов после введения антигена. Дж
Аппл Физиол
1991;71:2255–61. [PubMed] [Google Scholar]87. Костелло Р.В., Эванс К.М., Йост Б.Л., Бельмонте К.Е., Глейх Г.Дж., Якоби Д.Б. и др.
Антиген-индуцированная гиперреактивность к гистамину: роль блуждающего нерва
нервы и эозинофилы. Am J Physiol Lung Cell Mol
Физиол
1999; 276:L709–14. [PubMed] [Google Scholar]88. Пан Дж., Род Х.К., Ундем Б.Дж., Майерс АС. Нейромедиаторы в парасимпатических нейронах дыхательных путей
изменен нейротрофином-3 и повторным введением аллергена.Am J Respir Cell Мол Биол
2010;43:452–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]89. Берарди Н., Пиццоруссо Т., Маффеи Л. Критические периоды во время сенсорного
разработка. Курр Опин Нейробиол
2000; 10: 138–45. [PubMed] [Google Scholar]90. Визель Т.Н., Хьюбел Д.Х. Степень восстановления после воздействия визуальных
лишай у котят. J Нейрофизиол
1965; 28: 1060–72. [PubMed] [Google Scholar]91. Руда М.А., Линг К.Д., Хохманн А.Г., Пэн Ю.Б., Татибана Т. Измененные ноцицептивные нейронные цепи после новорожденных
периферическое воспаление.Наука
2000;289:
628–31. [PubMed] [Google Scholar]92. Аль-Чаер ЭД, Кавасаки М, Пасрича ПДж. Новая модель хронической висцеральной гиперчувствительности у
взрослых крыс, индуцированных раздражением толстой кишки в постнатальном периоде.
разработка. Гастроэнтерология
2000; 119:1276–85. [PubMed] [Google Scholar]93. Ву З.С., Хантер Д.Д., Киш В.Л., Бендерс К.М., Бэтчелор Т.П., Дей Р.Д. Пренатальное и раннее, но не позднее постнатальное воздействие
мышей в сторону от табачного дыма увеличивает гиперреактивность дыхательных путей позже
в жизни. Перспектива охраны окружающей среды
2009; 117:1434–40.[Бесплатная статья PMC] [PubMed] [Google Scholar]94. Хантер Д.Д., Каррелл-Джекс Л.А., Бэтчелор Т.П., Дей Р.Д. Роль фактора роста нервов в индуцированных озоном нейронах
реакции в раннем постнатальном развитии дыхательных путей. Являюсь
J Respir Cell Мол Биол
2011;45:359–65. [Бесплатная статья PMC] [PubMed] [Google Scholar]95. Макаллистер А.К., Кац Л.С., Ло Д.К. Нейротрофины и синаптическая пластичность.
Анну Рев Нейроски
1999; 22: 295–318. [PubMed] [Google Scholar]96. Сарин С., Ундем Б., Санико А., Тогиас А. Роль нервной системы в
ринит.J Аллергия Клин Иммунол
2006; 118: 999–1016. [PubMed] [Google Scholar]97. Шустерман Д.Дж., Мерфи М.А., Балмс М.Р. Субъекты с сезонным аллергическим ринитом и неринитным
субъекты по-разному реагируют на назальную провокацию хлором
газ. J Аллергия Клин Иммунол
1998; 101: 732–40. [PubMed] [Google Scholar]98. Ревицкий Д.А., Лейди Н.К., Бреннан-Димер Ф., Томпсон С., Тогиас А. Разработка и предварительная проверка
многоатрибутный индекс полезности симптомов ринита. Качество
Жизнь Рез
1998; 7: 693–702. [PubMed] [Google Scholar]механизмов, лежащих в основе нейронных симптомов аллергия
J Allergy Clin Immunol.Авторская рукопись; Доступен в PMC 2019 APR 25.
Опубликовано в окончательной редактированной форме AS:
PMCID: PMC6483074
NIHMSID: NIHMS1021746
Bradley J. Undem
A NOME Отдел аллергии и клинической иммунологии Джонс Медицинская школа Хопкинса, Балтимор
Томас Тейлор-Кларк
b Кафедра молекулярной фармакологии и физиологии, Медицинский колледж Морсани, Университет Южной Флориды, Тампа.
a Отделение аллергии и клинической иммунологии, Джонс Медицинская школа Хопкинса, Балтимор
b Кафедра молекулярной фармакологии и физиологии, Медицинский колледж Морсани, Университет Южной Флориды, Тампа.
Автор, ответственный за переписку: Брэдли Дж. Ундем, доктор философии, отделение аллергии. и клинической иммунологии, Медицинская школа Джона Хопкинса, 5501 Хопкинс Bayview Circle, Baltimore, MD 21224. ude.imhj@mednub. См. другие статьи в PMC, в которых цитируется опубликованная статья.Abstract
Лица с аллергией с симптомами, которые часто являются результатом изменения в нервной системе. Нейрональные симптомы зависят от органа при которой возникает аллергическая реакция, но она может включать покраснение глаз, зуд, чихание, заложенность носа, ринорея, кашель, бронхоспазм, выделение слизи из дыхательных путей секреция, дисфагия, нарушение перистальтики желудочно-кишечного тракта и зуд, отек кожи. Эти симптомы возникают из-за того, что медиаторы, высвобождаемые во время аллергической реакции, могут взаимодействуют с чувствительными нервами, изменяют обработку в центральной нервной системе, и изменяют передачу симпатических, парасимпатических и энтеральных вегетативных нервы.Кроме того, данные подтверждают идею о том, что у некоторых субъектов это нейромодуляция по малопонятным причинам активируется таким образом, что одинаковая степень нервного раздражения вызывает больший эффект, чем у здоровых предметы. Существуют различия в механизмах и типах нервов, участвующих в аллерген-индуцированная нейромодуляция в различных системах органов, но в целом появились принципы. Продукты активированных тучных клеток, др. воспалительные клетки, а резидентные клетки могут открыто стимулировать нервные окончания, вызывают длительные изменения возбудимости нейронов, повышают синаптическую эффективность, а также изменяют экспрессию генов в нервах, что приводит к фенотипически измененным нейроны.Лучшее понимание этих процессов может привести к новым терапевтические стратегии, направленные на ограничение страданий людей с аллергии.
Ключевые слова: Аллергия, аллерген, тучные клетки, IgE, дегрануляция, нервные, афферентные, эфферентные, вегетативные, сенсорные, ноцицепторные, С-волокна, парасимпатические, симпатические, кишечные, миентеральные, одиночное ядро, ионный канал, деполяризация, потенциал действия, кашель, зуд, боль, рефлекс, подвижность, бронхоспазм, дисфункция, воспаление, кожа, легкие, дыхательные пути, кишечник, глаза, гиперсекреция, противовоспалительное, стероиды, блуждающий нерв, задние корешки, тройничный, узловатый, яремный, ганглии, взаимодействие тучных клеток и нервов, симптомы, транзиторные потенциальные каналы рецепторов, медиаторы тучных клеток, гистамин, простагландин, лейкотриен, цитокин, раздражитель, рецептор, иннервация, пластичность, критические периоды, фенотипический переключатель Балтимор, Мэриленд, Тампа, Флорида
Аллергия следствие гиперреакции иммунной системы, вызванной IgE. что в противном случае было бы относительно безобидным стимулом.Клинически аллергия проявляется характеризуется симптомами, которые в основном являются вторичными по отношению к измененной нервной системе. Набор нейрональных симптомов зависит от органа, в котором возникает реакция, но может включать зуд и покраснение глаз; ринорея, заложенность носа и чихание; призывать кашель, одышка, выделение слизи из дыхательных путей и эпизодический рефлекторный бронхоспазм; дисфагия, измененная моторика желудочно-кишечного тракта и дискомфорт; и кожный зуд и воспаление ответы. Эти события либо в сумме , либо частично вторичны по отношению к изменение активности нейронов.Поэтому аллергию можно охарактеризовать как иммунно-нейронное расстройство ().
Нейромодуляция при аллергической реакции. Экспериментальные исследования in vivo и ex vivo подтверждают гипотезу что аллергическая реакция может включать нейромодуляцию сенсорных (афферентный) – ЦНС – вегетативная/кишечная нервная ось (см. текст для Детали). Нейромодуляция в конечном итоге приводит ко многим симптомам аллергическое заболевание. DRG , Ганглий задних корешков.
Иммунологи преобладают среди заинтересованных в изучении механизмов аллергии.За последние несколько десятилетий ученые добились огромного прогресса в распутывая сложную паутину, составляющую иммунологическую основу аллергии. Это включает в себя как афферентные (сенсибилизация), так и эфферентные (рекрутирование воспалительных клеток и активация) конечности ответа. Результаты этих расследований наполняют фармацевтические конвейеры с рациональными, умными и захватывающими терапевтическими стратегиями направлена на купирование воспаления, связанного с аллергической реакцией.
Однако можно утверждать, что иммунное воспаление, связанное с Аллергические реакции в некоторых случаях могут быть тривиальными, если только они не трансдуцированы в нейрогенные реакции. симптомы страдания (например, зуд, кашель, бронхоспазм, нарушение моторики, боль, чихание, кожные заболевания).Тем не менее, несмотря на то, что противовоспалительный конвейер при аллергии терапия изобилует активностью, антинейромодуляторный конвейер в значительной степени пустой. Это может быть связано с недостаточным вниманием, уделяемым нейронам. аспект этого иммунно-нейронного расстройства.
Здесь мы попытались сделать обзор литературы, которая дает представление о том, как нервная система поражается аллергической реакцией. Ограничения по площади не позволяют исчерпывающий обзор этой литературы, и поэтому вместо основных примеров выбраны раскрыть некоторые из наиболее фундаментальных принципов нейромодуляции, вызванной аллергеном.Мы не рассматривали клиническую научную литературу, в которой исследовалась нейрональная симптомы аллергии, мы также не касались вопроса о роли высших мозговых центров (эмоции и стресс) на аллергическую реакцию. Мы также в значительной степени избегали связанных важные аспекты взаимодействий тучных клеток и нервов, которые происходят независимо от немедленная реакция гиперчувствительности, а также литература, относящаяся к Механизмы, с помощью которых нервная система может модулировать иммунный ответ. Скорее у нас есть здесь основное внимание уделялось основным механистическим исследованиям нейромодуляции, вызванной аллергией. даст читателю представление о периферических неврологических субстратах аллергии.
ОБЩИЕ ПРИНЦИПЫ СЕНСОРНО-ВЕГЕТНОЙ ИННЕРВАЦИИ
Чувствительные (афферентные) нервы ощущают местное тканевое окружение. 1 Их периферические нервные окончания «свободны» и не образуют синапсов с другими нервами. Вместо этого эти периферийные синапсы сенсорных окончаний с местной тканевой средой. Периферический сенсорный терминали экспрессируют различные рецепторы и ионные каналы, которые трансдуцируют окружающую среду. сигналы в электрические сигналы (т. е. действие потенциалы ).В висцеральной и соматосенсорной системах стимулы включают прикосновение и другие механические воздействия, температуру, рН, осмолярность и различные химические раздражители. Потенциалы действия проводят вдоль аксона в центре, мимо тела клетки, которое находится в определенном периферическом ганглий (дорсальные корешковые ганглии, блуждающие узловые ганглии, блуждающие яремные ганглии, или ганглии тройничного нерва) и в центральную нервную систему (ЦНС), где сигнал транспонируется в нейротрансмиттер выброс в синапс нерва с центральными нейронами второго порядка.
Чувствительные нервы гетерогенны в отношении чувствительности к раздражителям (т.е. экспрессия рецептора), размер, миелинизация, скорость проведения и нейропептид и содержание нейротрансмиттеров. Однако в целом чувствительные нервы делятся на 2 основные категории: те, которые были специально адаптированы для обнаружения рутинных физиологических раздражители (например, осязание, слух, обоняние, умеренная температура, изменения артериального давления и т. осмолярность) и те, которые обнаруживают вредные или потенциально вредные стимулы, такие как физические повреждения, химические раздражители и сильные изменения рН.
Шеррингтон 2 был первым специально описать эти последние типы нервов в своей знаменитой книге, Интегративное действие нервной системы . 2 Он отметил, что большое количество чувствительные нервы в коже активировались только нефизиологической стимуляцией вредный характер. Он назвал эти специализированные чувствительные нервы «ноцицепторы» и предположил, что «…что при селективном адаптации, они придают коже, так сказать, специфическое чувство собственного травмы. 2 Как правило, ноцицепторы представляют собой немиелинизированные медленно проводящие нервы небольшого диаметра. называются С-волокнами (А- и В-волокна миелинизированные , быстропроводящие нервы). Сейчас известно, что чувствительные нервы внутренних органов также содержат С-волокна, Определение ноцицепторов по Шеррингтону.
Сигналы (потенциалы действия), исходящие от этих первичных афферентных нервов интегрированы в ЦНС, где конечным следствием может быть либо сознательное восприятия (например, боль, спазмы, зуд, одышка или позывы к кашлю или чиханию) или подсознательная активация преганглионарных вегетативных нейронов, тем самым инициируя симпатическая, парасимпатическая и кишечные рефлексы.В коже ноцицептор активация приводит к зуду и боли. В дыхательных путях активация Ноцицепторы вызывают чихание, кашель, одышку, рефлекторный бронхоспазм и выделения. В кишечнике активация ноцицепторов может привести к секреции, диарее, желудочный дискомфорт и висцеральные боли. 1,3-6 Другими словами активация этих нервов приводит к сильным ощущениям и/или рефлексам, направленным на избегание раздражителя. Как мы обсудим более подробно ниже, ноцицепторы являются наиболее подтипом афферентных нервов. чувствителен к стимуляции вторичной острой аллергической реакцией.
Вегетативная и кишечная нервная система зависит от синаптической связи между пресинаптическими и постсинаптическими элементами, расположенными в симпатических, парасимпатические и энтеральные ганглии. В большинстве органов эфферентная нервная регуляция осуществляется пресинаптическими нейронами, исходящими из ЦНС. Преганглионарный нерв является возбуждаются в ЦНС, а потенциалы действия проводятся по преганглионарным аксонов, которые в конечном итоге образуют синапсы с нейронами вегетативных ганглиев. Должно Имейте в виду, что эти ганглии представляют собой не простые ретрансляционные станции, а места, где происходит фильтрация и интеграция входных данных ЦНС.Это может иметь значение при аллергии потому что тучные клетки обычно связаны с симпатическими, парасимпатическими и кишечные ганглии (как мы обсудим ниже). В кишечнике, в частности, также является автономным эфферентным контролем, который не зависит от нервной системы ЦНС. обработка. В этом случае чувствительный нерв, обнаруживающий раздражение в локальной Окружающая среда может передавать эту информацию непосредственно в близлежащие эфферентные кишечные нейронов через локальные афферентно-эфферентные синапсы. Это называется местный «периферический рефлекс.Нейроны кишечного ганглия общаются через внутриганглионарная передача. Периферические рефлексы могут встречаться и в других внутренних органах. органов, таких как дыхательные пути и желчный пузырь, хотя и не в такой степени. наблюдается в желудочно-кишечном тракте. 7,8
В некоторых органах нейропептидсодержащие афферентные С-волокна могут непосредственно регулируют функцию органов независимо от ЦНС или эфферентных вегетативных или энтеральные нейроны через локальные «аксонные рефлексы». 9 В этом случае потенциал действия, возникающий в окончание периферического сенсорного нерва проводится центрально, пока не достигнет бифуркацию, а затем антидромно проводит обратно к другим периферическим окончаниям того же нерва, где он вызывает высвобождение сенсорных нейропептидов, таких как вещество Р, нейрокинин А и пептид, родственный гену кальцитонина (CGRP).выпущенный пептиды могут привести к отеку, расширению сосудов, сокращению гладкой мускулатуры и релаксация, рекрутирование и активация иммунных клеток. Общее последствие аксонные рефлексы часто называют «нейрогенными». воспаление.» 9 Степень проявления нейрогенного воспаления зависит от вида и органа. За Например, у людей доказательства нейрогенного воспаления сильнее выражены у людей. кожи и слизистой оболочки носа, чем в нижних дыхательных путях. 10
ОСНОВНЫЕ МЕХАНИЗМЫ АЛЛЕРГЕН-ИНДУЦИРОВАННОЙ НЕЙРОМОДУЛЯЦИИ
Аллергический ответ включает изменения на всех 3-х уровнях нервной дуги: функция сенсорного нерва, интеграция ЦНС и вегетативная/энтеральная нейроэффекторная клетка функция ().Эти изменения могут быть подразделяются на острые изменения (явная активация нервов, которая длится только до тех пор, пока раздражитель присутствует), более длительные изменения в нейровозбудимость которая может пережить раздражитель на часы или дней, а еще более стойкие фенотипические изменения могут длиться неделями и возможно, если принять во внимание идею «критического периоды», годами.
Морфологические аспекты
Аллергическая реакция особенно хорошо влияет на изменение функционируют в коже и внутренних тканях.Вероятно, это связано с закрытием связь между нервными волокнами и тучными клетками (). 11,12 Тучные клетки были анатомически связан с нервами практически во всех системах органов в лаборатории животные и человеческие предметы. 11,13-17 Процент тучных клеток, делающих значимые ассоциации с нервами зависят от расстояния, которое человек считает значимым. В мочевом пузыре, например, утверждается, что более 75% тучного клетки находятся достаточно близко к нервным волокнам для значимого двунаправленного связь, 18 и в желудочно-кишечном тракте человека считалось, что от 50% до 70% тучных клеток находиться в тесном контакте с нейритами. 19 Имеются убедительные доказательства того, что тучные клетки действительно производят синаптические контакты с нервами, но это верно только для небольшого подмножества тучных клеток. 20,21 Интимный синаптический контакты между нервом и тучными клетками могут быть индуцированы или усилены за счет специфической адгезии молекулы, такие как молекула клеточной адгезии 1. 22 В экспериментальных системах тучных клеток-сенсорных нервные контакты, связь между нервом и тучными клетками ингибировалась блокированием гетерофильное связывание между тучными клетками и экспрессируемой клеточной адгезией молекула 1 и нектин 3 локализованы в нерве. 23
Тучные клетки находятся в непосредственной близости от нервов практически во всех органы. A, Триптазоположительные клетки тучных клеток ( красный ) вблизи PGP9.5-положительных нервов ( зеленый ) в подслизистом сплетении кишечника человека. 11 B, Тучные клетки ( красный ) вблизи синапсин-положительных нейронов ( зеленый ) в желудочке сердца крысы. 12 C, Тучные клетки ( фиолетовый ) рядом с экспрессией MrgA3 «афферентные зудящие нервы» ( оранжевый ) в коже мыши (личное наблюдение).
Тучные клетки чаще располагаются близко к нервам, не образуя истинных контакты. Анатомическая связь между тучными клетками и нервами становится даже более распространены в очагах воспаления 20,24,25 Были предложены механизмы для объяснения склонность к ассоциациям тучных клеток и нервов, включая высвобождение нейротрофические факторы и цитокины тучными клетками, которые способствуют удлинению нервов вблизи тучных клеток. 26 При аллергическом воспалении инфильтративное эозинофилы также часто связаны с нервами. 27 В дыхательных путях могут быть эозинофилы притягивается к вегетативным холинергическим нейронам как следствие нейронального сосудистого белок клеточной адгезии 1 и молекула межклеточной адгезии 1 выражение. 28 На С другой стороны, тщательный морфометрический анализ показал, что аксоны тонких нервов и терминали в различных тканях также обычно связаны не только с тучными клетками и эозинофилами, но также и с другими клетками костного мозга, такими как как плазматические клетки, и эти «ассоциации», по-видимому, не благоприятствуют один тип клеток над другим. 13 Этот тип анализа позволяет сделать вывод, что нервные ветви, тучные клетки и другие клетки, происходящие из костного мозга, часто концентрируются в одном и том же участке ткани, что делает почти уверенным, что они будут, в смысл, «колокализовать» случайно. Тучные клетки вместе с вегетативные и чувствительные нервы часто находятся в непосредственной близости от микроциркуляторном русле, в слизистой и подслизистой оболочках внутренних органов, вблизи гладкой мышц и всей дермы.
Независимо от механизмов анатомические исследования, особенно при оценивая целые препараты ткани, часто выявляют впечатляющее отображение мачты клетки, расположенные вдоль афферентных, вегетативных и энтеральных ветвей нерва (12).Эти изображения не оставляют сомнений в том, что многие, если не большинство, нервных волокон в тканях находятся в сфере влияния медиаторов, высвобождаемых тучными клетками. Каким может быть это влияние, так это обсуждаются ниже.
Аллерген-индуцированная нейромодуляция афферентных (чувствительных) нервов
Разряд потенциала действия.
Заражение аллергеном часто связано с явной активацией афферентные нервные окончания, приводящие к разрядке потенциала действия (). 29,30 Обычно считается, что типы сенсорных нервы, наиболее восприимчивые к прямой активации через медиаторы аллергии, полимодальные С-волокна.Это связано с тем, что афферентные С-волокна экспрессируют рецепторы ко многим химическим медиаторам, присутствующим в аллергическом воспалении. ткань. Часто эти нервы можно точно классифицировать как ноцицепторы.
Воздействие аллергена открыто активирует афферентные С-волокна. Top , Гипотетический эффект аллергенной активации мачты клетки на окончание афферентного нерва разряжают потенциал действия. Нижний , Примеры аллерген-индуцированной активации афферентных ноцицепторы: осталось , аллерген (овальбумин) вызывает сильные активация вагусных яремных С-волокон, иннервирующих легкое (потенциалы действия регистрируется в блуждающем нервном узле) 30 ; право , аллерген (экстракт комаров) индуцирует активацию соматосенсорных зудящих волокон в коже (действие потенциалы, регистрируемые в задних рогах). 29
Окончание сенсорного нерва активируется при воздействии определенного раздражителя на специфические рецепторы или ионные каналы в мембране нерва, что приводит к деполяризация мембраны. Эта деполяризация называется «генератором потенциал». Если потенциал генератора имеет достаточную величину, то активирует потенциалзависимые натриевые каналы, что, в свою очередь, приводит к действию потенциальный разряд (, вверху). То частота потенциалов действия «все или ничего» пропорциональна амплитуде генераторного потенциала.
Афферентные С-волокна обычно экспрессируют члены временного рецептора потенциальное (TRP) семейство ионных каналов. Два канала TRP, которые кажутся важное значение в аллергических реакциях имеют транзиторный рецепторный потенциал ваниллоида 1 (TRPV1) и транзиторный рецепторный потенциал анкиринового повтора 1 (TRPA1). Когда эти каналы открыты, они обеспечивают путь для притока катионов (натрий и кальций), что приводит к генераторным потенциалам величин достаточно для достижения порога разрядки потенциала действия. 31,32 TRPV1 стимулируется несколькими уместными механизмами к аллергической реакции. Эти стимулы включают агонисты Gq-связанных GPCR, такие как рецептор брадикинина 2 и рецептор гистамина h2; закисление местной среды нервных окончаний; и определенные липоксигеназные продукты семейства эйкозаноидов медиаторов воспаления. 33,34 TRPA1 есть также активируется механизмами, имеющими отношение к аллергии. С-волокна в дыхательных путях стимулируются через TRPA1 различными медиаторами окислительного стресса, включая активные формы кислорода (например, H 2 O 2 ) и продукты перекисного окисления липидов (например, 4-гидроксиноненаль и 4-оксононеналь) и нитрование (9-нитроолеат). 35 Метаболиты мачты клеточный простагландин D 2 (PGD 2 ) также сильно активируют С-волокна, вторичные по отношению к воротам TRPA1. 36
В дополнение к каналам TRPV1 и TRPA1, которые могут интегрировать многие различных раздражителей, афферентные С-волокна также экспрессируют рецепторы для специфических медиаторы, связанные с аллергическим ответом, включая рецепторы АТФ (P2X2 и P2X3), аденозиновые рецепторы (A1 и A2A), 5-HT рецепторы (5HT-3 и 5HT2), цистеиниллейкотриеновые рецепторы (CysLT1), триптаза и трипсин (рецепторы, активируемые протеазами 2 и 1). 37-43
На основе основ фармакологии полимодального афферентного нерва волокна (обычно, но не исключительно С-волокна), она не должна удивительно, что активация тучных клеток приведет к их явной активации. Это наблюдается во многих органах, включая дыхательные пути, кожу, желудочно-кишечный тракт и мочевой пузырь. 24,29,30,43,44 Примеры разряда потенциала действия С-волокон в ответ на острый аллерген вызов иллюстрируется в . Один можно рационально предположить, что С-волокна также будут стимулироваться медиаторами прибывающих на поздней стадии аллергических реакций, когда клеточный начинается воспалительная реакция.
Изменения сенсорной возбудимости.
Чувствительные нервы могут возбуждаться независимо от стимулов, вызывающих генераторные потенциалы. Открытие или закрытие различных ионных каналов (обычно каналы утечки или потенциалзависимые каналы) могут вызывать электрофизиологические эффекты, приводящие к повышенной возбудимости нерва по отношению к активирующему раздражителю. в Говоря языком иммунологии, мы могли бы сказать, что нервные окончания некоторые медиаторы воспаления. Медиаторы, ассоциированные с аллергией, такие как гистамин, PGD 2 , цистеиниллейкотриен D 4 , серотонин и брадикинин, банка снижают активность некоторых калиевых каналов, что приводит к увеличению резистентности афферентного нерва и последующее увеличение электрическая возбудимость. 39,45,46 Цистеиниллейкотриен D 4 стимулирующий рецепторы цистеиниллейкотриена 1 в нейронах С-волокон тройничного нерва ганглии явно не активируют нерв, но повышают его возбудимость такая частота разряда потенциала действия в ответ на другой активирующий стимул значительно усиливается. 39
Заражение аллергеном и высвобождение медиатора тучных клеток в сенсибилизированном trachea ex vivo явно не активирует ноцицептивную Aδ воздействует на кашлевые нервы, но вместо этого снижает порог их активации до механический раздражитель (). 47,48 В нижних дыхательных путях медиаторы аллергии, в т.ч. гистамин, может повышать возбудимость некоторых С-волокон до точки что механическое нарушение эвнейального дыхания приводит к их активация. 49,50 Иммунологическая активация Тучные клетки в кишечнике повышают возбудимость спинномозговых афферентных нервов так, что одно и то же кратковременное механическое растяжение приводит к гораздо более длительный разряд афферентных нервов (). 48 Точно так же активация тучных клеток приводит к выраженному увеличению механическая чувствительность С-волокон блуждающего нерва в пищеводе. 51 Кинетика повышение возбудимости афферентных нервов вследствие активации аллергеном Тучные клетки могут быть довольно стойкими, сохраняясь в течение нескольких часов после острого активация тучных клеток. Продукты активированных эозинофилов также могут способствуют повышению возбудимости афферентных нервов в местах аллергических воспаление. 52
Аллерген-индуцированное повышение возбудимости чувствительных нервов. А, Узловые окончания Aδ «кашляющих» волокон у морской свинки трахея; повышенная чувствительность к механической стимуляции этого типа волокон после введения аллергена (овальбумина). 47 B, Многокомпонентная запись афферентных нервов кишечника, демонстрирующая заметно усиленный (пролонгированный) ответ на вздутие после аллергена (овальбумин) вызов. 48
Активация и/или увеличение окончания афферентного нерва возбудимость встречается так часто в разрозненных тканях и экспериментальных систем, что это можно рассматривать как принципиальный результат активации тканевые тучные клетки. В общих чертах, явная активация С-волокна приводит к ощущения и рефлексы, соответствующие органу, воспринимающему опасный раздражитель и реагировать таким образом, чтобы попытаться уменьшить воздействие этого стимул.Как обсуждалось выше, в зависимости от ткани активация ноцицепторы могут в конечном итоге привести к позывам к кашлю или чиханию, рефлекторным бронхоспазм, выделения, зуд, нейрогенные воспалительные реакции, которые способствуют возникновению волдырей и воспалений, висцерального дискомфорта и изменений в моторика желудочно-кишечного тракта и мочевого пузыря. Кроме того, если чувствительный нерв вызывают гипервозбудимость медиаторы аллергии, а затем подпороговые раздражители и даже безобидные рутинные раздражители могут вызвать эти ноцицептор-ассоциированные рефлексы.
Фенотипические изменения.
Термин «фенотипическое изменение» имеет расплывчатое определение, но в настоящее время контексте мы имеем в виду нейромодуляцию, которая происходит на уровне экспрессия генов.
У взрослых афферентные нервные окончания в крупных дыхательных путях на расстоянии более 10 000 диаметров клетки от тела и ядра клетки. И все же это Понятно, что местные аллергические реакции в дыхательных путях могут привести к изменению экспрессия генов в отдаленных афферентных нейронах блуждающего нерва тела. 53,54 Наиболее вероятно объяснение этому состоит в том, что аллергическая реакция может привести к выработке и высвобождение нейротрофических факторов в локальной среде нерва терминалы. Имеются убедительные доказательства того, что повышенная продукция нейротрофинов возникает при аллергической реакции во всех тканях. 55,56 Аллергические реакции могут привести непосредственно к выделению нейротрофические факторы из тучных клеток, а также вторичные по отношению к стимуляции других клеток ткани, таких как эпителий дыхательных путей.
Нейротрофические факторы, представленные фактором роста нервов (NGF), могут связываться с высоким сродством к родственным рецепторам (например, тирозинкиназе рецептор [TRK] A) на мембранах нервных окончаний. Это приводит к интернализация комплекса NGF-TRKA, который затем транспортируется через аксональные транспортные механизмы возвращаются на большие расстояния к телу клетки, где это влияет на экспрессию генов. NGF относится к семейству нейротрофинов нейротрофические факторы, которые также включают нейротрофический фактор головного мозга и нейротрофины 3 и 4. 57 Помимо нейротрофинов, еще одно семейство нейротрофические факторы, называемые глиальным нейротрофическим фактором (GDNF) семейные лиганды (GFL) также могут иметь отношение к аллергическим реакция. 54 GFL включают GDNF, нейтурин, артемин и персефин.
Влияние нейротрофических факторов на фенотипические изменения афферентные нейроны, иннервирующие дыхательные пути, будут зависеть от репертуара рецепторы нейротрофического фактора, экспрессируемые нервами. Например, почти все афферентные нервы дыхательных путей экспрессируют GFRa1 и Ret, рецепторы для GDNF.Нейроны блуждающего нерва экспрессируют TRKB, TRK для роста головного мозга. фактор и нейротрофин 4, тогда как спинальные С-волокна и блуждающий яремный С-волокна обычно экспрессируют TRKA, рецептор NGF. 58,59
Вдыхание аллергена приводит к усилению экспрессии генов участвует в производстве тахикининов , такие как вещество P и CGRP. 53 Интересно, что после заражения аллергеном большой диаметр миелинизированные неноцицепторные нейроны А-волокна, которые в норме не экспрессируют эти мощные нейропептиды начинают синтезировать и транспортировать пептиды к своим центральные и периферийные терминалы. 60,61 Прочее словами, в нейропептиде происходит «фенотипический переключатель». иннервация аллергическо воспаленной ткани. Этот эффект можно повторить с экзогенными нейротрофинами. Этот тип фенотипического переключения также был наблюдается в соматосенсорных нервах после болезненного воспаления. 62
Существует также фенотипическое переключение, когда речь идет об экспрессии Каналы TRP в сенсорных нервах дыхательных путей. Экспрессия TRPV1, рецептор капсаицина, обсуждавшийся выше, ограничивается ноцицептивными С-волокнами в здоровые ткани.Вдыхание аллергена крысами или морскими свинками приводит к экспрессия TRPV1 в кашлевых нервах Aδ, а также в Aβ низкопороговые механосенсоры (оба быстродействующие адаптирующиеся и медленно адаптирующиеся подтипы рецепторов). 54,63 Подробнее исследования в этой области необходимы для определения молекулярных механизмов лежащие в основе фенотипических изменений, вызванных аллергеном, но ранние исследования подтверждают потенциальное участие как нейротрофинов, так и GFL в отклик. 54
Примеры сенсорной нейропластичности, вызванной аллергеном. Top , RT-PCR из отдельных нейронов ретроградно прослеживается из трахеи. В примере показаны 12 нейронов морских свинок, получавших контрольное лечение. и 16 нейронов из овальбумина (OVA) — обработанных морских свинок. Гистограммы показывают процент узловых нейронов, специфичных для трахеи, в каждом группы лечения, которые экспрессируют мРНК TRPV1. Воздействие аллергена (овальбумина) вызывает экспрессия de novo TRPV1 в узловой дозе Aδ «кашлевые» волокна, иннервирующие трахею (от Lieu et al. 54 ). Низ , Заражение аллергеном индуцирует de novo чувствительность к капсаицину у волокна легкого быстро адаптирующегося рецептора (RAR) , которые были характеризуется их фазовой реакцией во время дыхания (RARph) . ΔFA , Разница в обжиге Мероприятия. Используется с разрешения Zhang et al. 63 ** P < 0,01.
В целом, исследования сенсорной модуляции, вызванной аллергеном, поддерживают гипотеза о том, что в местах аллергической реакции интенсивное количественное нарастание залпов потенциала действия, возникающих в центральные окончания афферентных С-волокон в ЦНС (и в ганглии).Это происходит вторично по отношению к явной активации С-волокна. клеммы, а также обобщенный «затравочный» эффект повышается их электрическая возбудимость. Кроме того, также будет соответствующие качественные изменения в профиле активации А-волокон, и поскольку эти нервы начинают экспрессировать сенсорные нейропептиды, это может измениться. рефлекторные последствия их активации. Эти аллерген-сенсорные нервные взаимодействия могут быть острыми и кратковременными, но могут сохраняться и длительное время. после первичной аллергической реакции.
Аллерген-индуцированная модуляция нейронов ЦНС
Тучные клетки обнаружены в мозге всех видов, которые были оценивается, 64 но доказательства прямой активации этих клеток, вызванной аллергеном, отсутствуют. Это кажется более вероятным, что аллергические реакции косвенно модулируют нейроны ЦНС. путем создания ситуации, в которой существует интенсивное, а в некоторых случаях устойчивое повышение активности ноцицепторов, возникающее вследствие явной активации, и повышение возбудимости, как описано выше.Это приводит к увеличению высвобождение нейротрансмиттера/нейропептида из центрального окончания афферентного нервы в синапс нейронов ЦНС второго порядка, расположенных в дорсальной рог спинного мозга для спинномозговых афферентных нервов и в стволе мозга в пределах ядро одиночного тракта блуждающих афферентных нервов. 65 В случае фенотипических изменений Нейроны ЦНС могут модулироваться пептидами, такими как CGRP и субстанция P, высвобождаемыми от неноцицептивных нервов. В любом случае высвобождение пептидов и медиатора от центральных окончаний афферентных нервов могут быть приведены в движение события которые приводят к увеличению синаптической эффективности нейронов ЦНС, процесс часто называют «центральной сенсибилизацией».” 66
Когда нейроны ЦНС становятся сенсибилизированными, последствия данного количество афферентного входа может быть усилено и даже качественно изменено. Доказательства подтверждают концепцию, согласно которой центральная сенсибилизация может способствовать феномен аллодинии (при котором обычно безболезненный раздражитель, такой как нежное расчесывание волос и активация сенсорных Aβ-волокон, приводит к неадекватной боли). 66 Аналогично, многие с аллергией на аэроаллергены испытывают то, что можно было бы назвать «аллотуссивностью», при которой ощущение постоянные позывы к кашлю присутствуют, даже когда в дыхательных путях ничего нет кашлять, или постоянное желание чихнуть, когда ничего физического находится в носовом проходе.У экспериментальных животных было зарегистрировано что активация С-волокон блуждающего нерва дыхательных путей (что может активация) приводит к ситуации, при которой стимуляция А-волокон трахеи вызывает кашель с интенсивностью раздражителя, которая обычно намного меньше, чем нормальный кашлевой порог. 67 Точно так же стимуляция С-волокон может посредством центральной сенсибилизирующей взаимодействия, усиливают парасимпатический драйв к дыхательному тракт. 68 В обоих случаях это происходит за счет передатчиков, высвобождаемых из центральных окончаний С-волокон, повышение эффективности нейронов, иннервируемых А-волокнами (конвергенция А-волокна и С-волокна на нейроны второго порядка).Клинически значимый аспект центральной сенсибилизации заключается в том, что она обеспечивает механизм, посредством которого аллергическая реакция в одном месте может повлиять на физиологию в другом месте. Например, стимуляция С-волокон в гортани может усилить парасимпатическую привод к периферическим дыхательным путям. Активация С-волокон в пищеводе (например, во время кислотный рефлюкс) может привести к позывам к кашлю за счет усиления синаптической активности А-волокон в трахее. Попадание аллергена в нос может привести к центральному сенсибилизация кашлевых нервов нижних дыхательных путей. 69 Это повышает вероятность того, что кашель, связанный с гастроэзофагеальный рефлюкс не является вторичным по отношению к микроаспирации веществ в дыхательных путей и что кашель, связанный с назальной аллергией, не обязательно вторично по отношению к «постназальному затеканию» и прямой активации кашля нервов, так как это связано с центральной сенсибилизацией кашлевого пути конвергенция ноцицепторов пищевода и носа.
Идея центральной сенсибилизации при аллергии поддерживается элегантным исследования с молодыми взрослыми макаками-резусами. 70 После сенсибилизации к клещу домашней пыли обезьяны неоднократное воздействие аэрозолем, содержащим клещей домашней пыли. Приблизительно через 5–6 месяцев электрическая возбудимость ствола мозга нейроны в ядре солитарного тракта были оценены и оказались сильно активизирован; их реакция на данный входной стимул была намного сильнее, чем у аналогичных нейронов у неаллергичных обезьян (14). 70
Вызванное аллергеном повышение электрической возбудимости нейронов ЦНС. Верх , Стволовое расположение ядра солитарной тракт. A, Микрофотография защемленного нейрона в головном мозге срез от каудомедиального ядра солитарного тракта, где чувствительные афференты блуждающего нерва заканчиваются. B, Цельноклеточный пластырь-зажим регистрации импульсов деполяризующего тока, воздействующих на отдельные ядра одиночные нейроны тракта от наивного или зараженного аллергеном (пылевой клещ) резуса обезьяны. C, Повышенный разряд потенциала действия в ответ на деполяризующий стимул в нейронах, выделенных от аллергичных обезьян. 70
Трансмиттеры и молекулярные механизмы, лежащие в основе центральной сенсибилизации многообразны и выходят за рамки данного обзора. Как долго центральная сенсибилизация сохраняется за пределами воспалительной реакции, открыта для дебаты. Тем не менее, представляется рациональным сделать вывод на основе имеющихся доказательства того, что аллергическая реакция может привести к ноцицепторному вводу в ЦНС (ствол мозга или задний рог), который повышает чувствительность синаптической передачи в нем. Это может привести к резкому снижению ощущений и рефлексов. неадекватно соответствует инсульту, присутствующему в периферических аллергических воспаленные ткани.
Аллергическая модуляция эфферентных (вегетативных и кишечных) нервов
Активация и изменение синаптической эффективности.
Тучные клетки обычно располагаются близко к нейронам внутри кишечные, симпатические и парасимпатические ганглии. 11,71,72 Нейроны внутри этих ганглиев получают синаптические входы от преганглионарных вегетативных нейроны с телами клеток в ЦНС. В частности, энтеральный ганглий может также функционируют автономно посредством внутриганглионарной синаптической передачи.Когда тучные клетки, расположенные вблизи вегетативных ганглиев, стимулируются, это приводит к существенному увеличению «синаптической эффективности». Это сказать, что постганглионарный выход увеличивается относительно данного преганглионарный вход. Эти ганглии являются первыми участками периферических интеграция эфферентной информации, поступающей от ЦНС. Поэтому изменения в синаптической эффективности в этих местах может оказывать мощное воздействие на ЦНС. контроль за работой органов. Кроме того, изменение активности нейрона внутри кишечных ганглиев также может изменить характеристики автономное функционирование желудочно-кишечного тракта. 73
Аллерген-индуцированное увеличение синаптической эффективности может наблюдаться электрофизиологически в бронхиальных парасимпатических ганглиях, расположенных преимущественно в трахее и крупных бронхах. Поступления от ЦНС часто приводят к потенциалы возбуждения, которые являются подпороговыми для разряда потенциала действия в постганглионарных нейронах. После активации аллергеном близлежащей мачты клетки, усиливается синаптическая эффективность и фильтрующая способность ганглий потерян (). 71,74-76 постганглионарные нейроны в этих ганглиях обеспечивают доминирующий контроль напряжение гладких мышц не только в крупных дыхательных путях, но и на всем протяжении вниз по дереву дыхательных путей к мелким бронхиолам.Поэтому изменения в фильтрация, которая может происходить вторично по отношению к активации тучных клеток в более крупных дыхательные пути могут иметь большое влияние на калибр дыхательных путей на всем протяжении бронхов. дерево. У мышей эта тучная клетка-парасимпатический холинергический нерв взаимодействие ответственно почти за все дыхательные пути, вызванные аллергеном. сужение. 77,78
Аллерген-индуцированное повышение синаптической эффективности в вегетативных ганглиях. A, Малый парасимпатический бронхиальный ганглий морской свинки бронх.Отдельный нейрон, заполненный пероксидазой хрена и нарисованный с помощью показана техника камеры lucida. Парасимпатический нейрон синаптическая эффективность в ответ на стимуляцию преганглионарных нервов (шок артефакт) значительно увеличивается после воздействия аллергена (яичного альбумина). 76 фВПСП , Быстрые возбуждающие постсинаптические потенциалы. B, Динамика высвобождения гистамина и верхнешейного синаптическая эффективность ганглиев (величина потенциала действия постганглионарных соединений) во время провокации аллергеном (овальбумином). 75
В отличие от парасимпатических ганглиев симпатические ганглии большие и очень удобно для изучения синаптической передачи. В течение нескольких минут аллерген-индуцированная активация тучных клеток в верхнем шейном ганглии или чревном ганглии, наблюдается выраженное увеличение синаптической эффективности, часто приводит к удвоению постганглионарного выброса. 75,79 Потенцирование синаптической эффективности тучными клетками активация не является кратковременным событием. Как и при повышении возбудимости афферентных нервных окончаний, синаптическая потенциация, вызванная аллергеном, может сохраняются в течение многих часов после острой активации тучных клеток.Пример разницы в продолжительности увеличения синаптической эффективности по сравнению с Высвобождение гистамина в симпатическом ганглии показано на рис.
Особое значение имеет пищевая аллергия, иммунологическая активация Тучные клетки в кишечнике обычно связаны с изменениями в нейротрансмиссия в кишечных ганглиях, тем самым изменяя активность секретомоторных нейронов подслизистой оболочки. 4,6 Тучные клетки особенно богаты в подслизистом сплетении человека по сравнению с миэнтеральное сплетение. 11 Медиаторы, высвобождаемые при IgE-зависимой активации тучных желез кишечника человека клетки непосредственно возбуждают кишечные нейроны в подслизистой оболочке морских свинок и человеческие предметы (). 80,81 Модель морской свинки с пищевой (молочной) аллергией элегантно показывает, что аллергенная активация тучных клеток увеличивает и модулирует синаптическая эффективность подслизистых нейронов в толстой и тонкой кишке (). 81,82
Аллерген-индуцированная стимуляция кишечных нейронов. А, Внутриклеточная запись нейрона подслизистого сплетения, выделенного из морская свинка демонстрирует деполяризацию нейронов до порога потенциала действия после вызов молочного аллергена. 81 B, Регистрация потенциала действия нейрона в подслизистом слое сплетения кишечника человека. Потенциалы действия вызывались в ответ на обработка супернатантом анти-IgE-активированного человеческого тучные клетки кишечника. Используется с разрешения Schemann et al. 80
Медиаторы и ионные механизмы, лежащие в основе увеличения вегетативная и энтеральная синаптическая активность многочисленна и зависит от того, какой изучается специфический ганглий. Гистамин является особенно неразборчивым медиатор, когда дело доходит до модуляции синаптической активности в ганглиях, с потенциально задействованы все 4 гистаминовых рецептора.Тем не менее, ясно что гистамин не единственный виновник. Многие медиаторы аллергии было показано, что он изменяет вегетативную и энтеральную передачу, включая мастопатию. клеточные медиаторы, такие как серотонин, PGD 2 , активирующие тромбоциты фактора и триптазы. 6,17,73,79,83,84 . Индуцированное аллергеном усиление синаптической передачи может происходят как через пресинаптические, так и постсинаптические механизмы действия. Там является доказательством того, что активация тучных клеток приводит к увеличению количества нейротрансмиттеров. (обычно ацетилхолин), высвобождаемый из пресинаптических окончаний в течение заданного времени. количество стимула. 85 данные также подтверждают гипотезу о том, что нейротрансмиттер в синапс стимулирует более возбудимый постсинаптический нейрон из-за общего повышение сопротивления нейронов и электрической возбудимости государство. 4,76,85 Независимо от ионных механизмов относительно последовательным открытием в исследованиях синаптической передачи является тот, в котором Разряд потенциала действия для данного количества пресинаптического входа равен постоянно усиливается. У восприимчивых субъектов это может быть повышено до степень возникновения серьезных симптомов (например, тяжелый бронхоспазм, выделение слизи секреция, желудочно-кишечные спазмы и боль, диарея и нарушение регуляции подвижности).
Заражение аллергеном также может привести к увеличению вегетативной нервной системы. высвобождение нейротрансмиттера из постганглионарных периферических окончаний в заданное количество стимула. Это наблюдается при постганглионарных окончаний парасимпатических холинергических нервов, иннервирующих гладкую мускулатуру дыхательных путей и объясняется эозинофильно-опосредованным снижением мускариновой Функция рецептора М2 на нервных окончаниях. 86,87 Эти рецепторы М2 являются ингибирующими «ауторецепторы» и служат для ограничения высвобождения ацетилхолина по цепи отрицательной обратной связи.
Фенотипические изменения вегетативных нервов.
Как и в случае с первичными афферентными нервами, аллерген-индуцированные фенотипические изменения вегетативных нейронов. Как обсуждалось выше вегетативные нервы, иннервирующие дыхательные пути, в основном парасимпатические. Парасимпатическая ветвь обеспечивает как сократительную (холинергическую) регуляцию гладкой мускулатуры дыхательных путей и релаксант (нитрергический/вазоактивный кишечный пептид) контроль. У морских свинок неоднократно вызывали аллерген вдохе произошло фенотипическое переключение, так что вазоактивный нейроны кишечного пептида/оксида азота начали превращаться в холинергические синтез фенотипа. 88 В Другими словами, баланс между сократительной и релаксантной иннервацией был меняется в пользу первого. Вероятно, это объясняется аллерген-индуцированная продукция нейротрофинов в дыхательных путях, нейротрофин 3 является потенциальным виновником.
Концепция модуляции в критические периоды
До этого момента доклинические исследования в поддержку нашего обсуждения проводили у взрослых или молодых взрослых животных. Аллерген-индуцированный нейромодуляция часто довольно глубокая, но ожидается, что она продлится в течение сроки от минут до недель.Рискуя закончить этот обзор на чрезмерно спекулятивной ноте, стоит рассмотреть потенциальную роль «критического периоды» в нейромодуляции, вызванной аллергеном, потому что эти изменения могут сохраняться годами и даже всю жизнь.
Хорошо известно, что развитие сенсорных систем часто требует активности, зависящей от использования, в раннем возрасте. 89 Во время постнатального сенсорного нерва развития, существует определенное окно времени, в течение которого нервы восприимчивы к этой зависящей от опыта пластичности.До или после определенного окно времени, тот же самый опыт не влияет на развитие нейронов. Таким образом, например, если молодое животное лишается зрения из-за закрытия век (или различных другие методы), происходят изменения в нейронных цепях зрительной коры, приводит к тяжелой и необратимой потере остроты зрения. 90 Это происходит, только если зрение депривация происходит в критический период времени. Даже длительное зрение депривация после критического периода не влияет на остроту зрения.То точное время критического периода зависит от изучаемой системы. Поскольку эти новаторские исследования, критические периоды были определены в аудио и соматосенсорной системы и были отмечены практически у всех видов от человека Дрозофила . 89
Недавние сообщения подтверждают концепцию о том, что пластичность чувствительных нервов в критические периоды раннего возраста может привести к стойкие изменения в соматосенсорных и вагусно-сенсорных нервных цепях.Руда и др. al 91 воспаление одной задней ноги лапу крысят с использованием полной модели адъюванта Фрейнда. Выставлены щенки стереотипное поведение, свидетельствующее о боли в лапе. Что еще более важно, было значительное увеличение плотности первичных афферентных нервов в ипсилатеральный задний рог спинного мозга. Это изменение плотности нейронные цепи в ЦНС сохранялись после воспаления и продолжались до совершеннолетие. Поведенческие исследования показали, что взрослые крысы, которые испытали лапу воспаление, так как новорожденные были значительно более гипералгетичны в ответ на последующие воспалительные стимулы, чем контрольные крысы.Авторы пришли к выводу, что «периферическое воспаление, возникающее в период новорожденности, долгосрочные последствия для ноцицептивных нейронных цепей».
Аналогичные выводы делаются в отношении висцеральной нервной гиперчувствительность. Давно известно, что воспаление толстой кишки лабораторных животных приводит к гиперчувствительности нейронов и чрезмерному и аномальная рефлекторная физиология кишечника (в чем-то аналогичная дыхательным путям). гиперреактивность бронхиальной астмы). Когда толстые кишки крыс были химически или механическое раздражение через 8-21 день после рождения, воспалительная реакция была вызывали афферентную нервную гипервозбудимость и состояние повышенной висцеральная рефлексия.Эти изменения повышенной возбудимости чувствительных нервов сохранялись. помимо воспаления кишечника, длящегося не менее 3 месяцев (самое долгое время анализируемая точка). Напротив, если толстая кишка крыс воспалилась после на 21-й день после рождения (вне критического периода) гиперрефлексии не было. настойчивый. 92 Аналогично, воздействие сигаретного дыма на животных во время послеродового критического состояния. связан с постоянным повышением гиперреактивности дыхательных путей и плотность чувствительных нервов. 93 Так как в соматосенсорной модели боли, так и в висцерально-сенсорной модели боли. гиперрефлексия, воспаление в критический период постнатального развития вызывали аномалии в сенсорной нейросхеме, которые сохранялись, возможно, до совершеннолетие.
Причина, по которой это может быть связано с аллергическим воспалением в раннем возрасте заключается в том, что нейротрофины участвуют в нескольких моделях аллергических воспалений (а также вирусных инфекций) и этот критический период сенсорной пластичность нерва зависит от продукции нейротрофических факторы. 94,95 Аллергическое (или инфекционное) воспаление в поэтому критические периоды повышают вероятность того, что воспалительная реакция может оставить после себя нервную систему, слегка измененную много лет спустя, таким образом, легкое воспалительное поражение может привести к чрезмерно преувеличенным ответы.
ВЫВОДЫ
Среди совокупности симптомов, характеризующих аллергическую реакцию, многие, если не большинство, являются вторичными по отношению к изменениям в нервной системе. В зависимости от органа, в котором происходит реакция, эти симптомы, основанные на нейронах, включают слезотечение, раздражение глаз и расширение сосудов, ринорея, заложенность носа, чихание, постоянные позывы к кашлю, стеснение в груди, бронхоспазм, выделения из дыхательных путей, дисфагия, изменения моторики желудочно-кишечного тракта, зуд и волдыри и приливы реакции.В этом смысле аллергия является иммуно-нейронным расстройством.
Активация тучных клеток и последующая эозинофильная Воспаление, вызванное T H 2, может привести к глубоким изменениям функции афферентных нейронов, нейронов ЦНС и симпатических нейронов. парасимпатические и энтеральные ганглии. Эти изменения включают острое явное активация нервов, длительное повышение их возбудимости и даже длительно сохраняющиеся фенотипические изменения в нервной системе.
Больше, чем тот факт, что люди с аллергией вырабатывают нейроактивные медиаторы в участки аллергического воспаления, кажется, что сама нервная система изменены при аллергических заболеваниях.То ли из-за событий, происходящих во время критических периоды в развитии нейронов или просто из-за постоянной активации нервов, нервная система становится гиперактивной у многих пациентов с аллергическими заболеваниями. В клинических условиях это измененное состояние нейронов легко наблюдать, когда концентрация нейроактивного медиатора, которая в норме не действует на здоровых предметов приводит к ощущениям и рефлексам у людей с аллергией. Это легко проявляется, например, у пациентов с аллергическим ринитом: концентрация Стимулятор С-волокна (например, брадикинин или капсаицин), который не действует при применении на слизистая носа здорового человека вызывает сильное чихание и рефлекторное парасимпатические холинергические сокращения при воздействии на кого-то с аллергией ринит. 96 Шустерман и др. al 97 обнаружил, что назальный Воздействие низких концентраций газообразного хлора приводит к более сильным реакциям у пациентов с сезонный аллергический ринит, чем у здоровых лиц контрольной группы. Эти данные подтверждают клинические наблюдения, на которые обычно жалуются пациенты с аллергическим ринитом. преувеличенные носовые симптомы, вызванные различными сильными запахами и дымом, а также изменения атмосферных условий. В анкете, представленной в рамках протокол скрининга 350 пациентов с аллергическим ринитом, 60% указали курение как один из триггеров назальных симптомов, 58% перечислили другие раздражители, а 47% перечислили холодный воздух.Эти проценты были еще выше у добровольцев с многолетними по сравнению с сезонный аллергический ринит. 98
В настоящее время наше понимание специфических медиаторов, ионных каналов и сигнальные пути, участвующие в аллерген-индуцированной нейромодуляции, остаются на прежнем уровне. относительно рудиментарное состояние. Можно предположить, что наше понимание эти основные механизмы продолжают развиваться, появляются новые терапевтические стратегии, нацеленные на нервная система будет продолжать развиваться, работая синергетически с противовоспалительные стратегии, будут служить для подавления страданий тех, у кого иммунно-нейронное расстройство, которое мы называем аллергией.
ГЛОССАРИЙ
ПОТЕНЦИАЛ ДЕЙСТВИЯ: Нервное волокно млекопитающего в состоянии покоя находится в состоянии электроотрицательности из-за градиентов концентрации ионов и мембранных проницаемость для определенных ионов. Потенциал действия включает резкие изменения мембранный потенциал, который быстро распространяется по длине мембраны нервного волокна. Нормальный отрицательный мембранный потенциал покоя изменяется внезапно (в течение нескольких 10 000 секунды) до положительного потенциала (деполяризация), а затем обратно до отрицательный потенциал (реполяризация).События, вызывающие увеличение мембраны потенциал от электроотрицательности к нулевому уровню запускает потенциалзависимую натриевую каналы начинают открываться, вызывая дальнейшее увеличение мембранного потенциала и большее открытие потенциалзависимых натриевых каналов до тех пор, пока не будут открыты все каналы. Затем калиевые каналы начинают открываться, а натриевые каналы закрываться, что приводит к прекращение потенциала действия.
ЦИСТИНИЛЛЕЙКОТРИЕНА D 4 (LTD 4 ): LTD 4 связывается с рецептором цистеиниллейкотриена (CysLT) 1 и CysLT2.CysLT1 способствует сокращению гладкой мускулатуры бронхов и регулирует различные аспекты иммунная система. Монтелукаст противодействует CysLT1.
СЕМЕЙСТВО ЭЙКОЗАНОИДОВ: Класс липидов, полученных из полиненасыщенные жирные кислоты (например, арахидоновая кислота), которые опосредуют воспаление.
ENTERIC: Нервная система, за исключением желудочно-кишечного тракта тракт. Энтеральная система содержит около 100 миллионов нейронов, т. сопоставимо с количеством нейронов в спинном мозге.Он содержит внешний (мышечно-кишечное) сплетение и внутреннее (подслизистое) сплетение. Симпатический и парасимпатический нервы соединяются с этими 2 сплетениями. Кишечные нервы выделяют различные нейротрансмиттеры, в том числе ацетилхолин, норадреналин, серотонин, дофамин, вещество Р и вазоактивный интестинальный полипептид.
МЕХАНОСЕНСОРЫ: Сенсорный рецептор, обнаруживающий механические сдавление или растяжение рецептора или прилегающих тканей. Дыхательная мышца механосенсоры передают афферентные импульсы к нейронам продолговатого мозга, а также сенсорная кора.
МИЕЛИНИРОВАННЫЕ: Нервные волокна с аксонами, окруженными миелином оболочка. Шванновские клетки обволакивают аксоны и многократно вращаются вокруг аксона, создавая слои мембраны, содержащие липидное вещество сфингомиелин. Сфингомиелин действует в качестве электрического изолятора и способен уменьшать поток ионов через мембрана примерно в 5000 раз. Неизолированные контакты между шванновскими клетками называется узлом Ранвье. Потенциалы действия «прыгают» от узла к узлу для увеличения скорости передачи нерва в миелинизированных волокнах.
НЕЙРОТРАНСМИТТЕР: Химическое вещество, выделяемое нейронами, которое вызывает передачу сигнала в синапсах ЦНС. Большинство синапсов участвуют в сигнале ЦНС передачи осуществляются химическими синапсами. Нейромедиатор связывается с мембранным рецептором белков следующего нейрона для возбуждения, торможения или изменения чувствительности нейрон. Существует более 40 нейротрансмиттеров, в том числе ацетилхолин, норадреналин, гистамин, серотонин и гамма-аминомасляная кислота.
ПАРАСИМПАТИЧЕСКИЕ: Нервные волокна вегетативной нервной системы которые выходят из ЦНС через черепные нервы III, VII, IX и X, а также спинномозговые крестцовые нервы.Большинство парасимпатических нервов находится в блуждающих нервах (черепной нерв ИКС). Парасимпатические нервы также содержат преганглионарные и постганглионарные нейроны. Большинство парасимпатических постганглионарных нейронов являются холинергическими.
АКТИВНЫЕ ФОРМЫ КИСЛОРОДА (АФК): Обычно образующиеся вещества с низкой частотой при окислительном фосфорилировании в митохондриях, а также в ряде других клеточных реакций. АФК могут оказывать клеточное повреждение, реагируя с внутриклеточными компонентами, такими как ДНК и мембранные липиды.
СИМПАТИЧЕСКИЕ: Нервные волокна вегетативной нервной системы, которые берут начало в спинном мозге между Th1 и L2. Сначала они переходят в паравертебральные цепочки ганглиев и далее к тканям и органам. Каждый симпатический нерв состоит преганглионарного нейрона и постганглионарного нейрона. Преганглионарные нервы могут синапс в паравертебральном ганглии или периферическом симпатическом ганглии (например, чревный ганглий). Преганглионарные нервы симпатической и парасимпатической систем являются холинергическими (то есть секретируют ацетилхолин).Наиболее симпатические постганглионарные нейроны являются адренергическими (то есть секретируют норадреналин).
ТАХИКИНИНЫ: Класс нейропептидов, который включает сенсорные афферентные нейромедиатор вещества P.
Сокращения, используемые| CGRP кальцитонин ген-родственный пептид | ||
| ЦНС Центральная нервная система | ||
| GDNF глиальных-производный фактор роста | ||
| GFL | глиальных нейротрофический фактор семейства лиганд | |
| ФРН | фактора роста нервов | |
| PGD 2 | простагландина D 2 | |
| TRK | рецепторной тирозинкиназы | |
| TRP | Переходный рецепторный потенциал | |
| TRPA1 | ||
| TRPA1 | Потенциал переходного рецептора Ankyrin 1 | |
| TRPV1 | TRPV1 | Потенциал переходного рецептора 1 |
Сноски
Раскрытие потенциального конфликта интересов: B.Ундем получил гранты Национальных институтов здравоохранения и GlaxoSmithKline; на научный консультативный совет Afferent Pharmaceuticals; и есть консультант договоренности с GlaxoSmithKline. Т. Тейлор-Кларк заявляет, что у него нет соответствующие конфликты интересов.
ССЫЛКИ
1. Линн Б. Соматосенсорные рецепторы и их ЦНС соединения. Анну Рев Физиол 1975; 37: 105–27. [PubMed] [Google Scholar]2. Шеррингтон С Интегративное действие нервной системы. Нью-Хейвен (Коннектикут): Йель университетская пресса; 1906 г.[Google Академия]3. Кольридж Дж. К., Кольридж Х. М. Иннервация афферентных С-волокон блуждающего нерва легких и дыхательных путей и их функциональное значение. Преподобный Физиол Биохим Фармакол 1984 год; 99:1–110. [PubMed] [Google Scholar]4. Вуд Джей Ди. Кишечная нейроиммунофизиология и патофизиология. Гастроэнтерология 2004; 127: 635–57. [PubMed] [Google Scholar]5. Блэкшоу Л.А., Брукс С.Дж., Гранди Д., Шеманн М. Сенсорная передача в желудочно-кишечном тракте. тракт. Нейрогастроэнтерол Мотил 2007; 19:1–19. [PubMed] [Google Scholar]6.Вуд Джей Ди. Симпозиум по питанию нежвачных животных: нейрогастроэнтерология и пищевой аллергии. Джей Аним Наука 2012;90:1213–23. [PubMed] [Google Scholar]7. Майерс AC, Ундем Б.Дж. Электрофизиологические эффекты тахикининов и капсаицин на бронхиальный парасимпатический ганглий морской свинки нейроны. Дж Физиол 1993;470: 665–79. [Бесплатная статья PMC] [PubMed] [Google Scholar]8. Мэй ГМ. Тахикинины как медиаторы медленных ВПСП у морской свинки ганглии желчного пузыря: вовлечение рецепторов нейрокинина-3. Дж Физиол 1995;485(Пл 2): 513–24.[Бесплатная статья PMC] [PubMed] [Google Scholar]9. Балук П. Нейрогенное воспаление кожи и дыхательных путей. J Investig Dermatol Symp Proc 1997; 2:76–81. [PubMed] [Google Scholar] 10. Санико А.М., Ацута С., Прауд Д., Тогиас А. Дозозависимые эффекты назального введения капсаицина: в vivo доказательства нейрогенного воспаления дыхательных путей человека. J Аллергия Клин Иммунол 1997; 100: 632–41. [PubMed] [Google Scholar] 12. Silver RB, Reid AC, Mackins CJ, Askwith T, Schaefer U, Herzlinger D, et al. Тучные клетки: уникальный источник ренина.Proc Natl Acad Sci U S A 2004; 101:13607–12. [Бесплатная статья PMC] [PubMed] [Google Scholar]13. Аризоно Н., Мацуда С., Хаттори Т., Кодзима Ю., Маэда Т., Галли С.Дж. Анатомические вариации ассоциаций тучных клеток у тонкий кишечник крысы, сердце, легкие и кожа. Сходство расстояний между нервными отростками и тучными клетками, эозинофилами или плазматическими клетками в собственная пластинка тощей кишки. Лаборатория Инвест 1990;62: 626–34. [PubMed] [Google Scholar] 14. Алвинг К., Сандстрем С., Матран Р., Панула П., Хокфельт Т., Лундберг Дж. М.Связь между тучными клетками, содержащими гистамин, и чувствительные нервы в коже и дыхательных путях контрольные и обработанные капсаицином свиньи. Сотовые Ткани Res 1991 год; 264: 529–38. [PubMed] [Google Scholar] 15. Форсайт П., Биненшток Дж. Функциональная единица тучных клеток и нервов: ключевой компонент физиологические и патофизиологические реакции. Химия Иммунол Аллергия 2012;98: 196–221. [PubMed] [Google Scholar] 16. Кит И.М., Джин Дж., Сабан Р. Взаимодействие нервно-тучных клеток в моче нормальной морской свинки мочевой пузырь. Дж Комп Нейрол 1995; 363: 28–36.[PubMed] [Google Scholar] 17. Ван Нассау Л., Адриансен Д., Тиммерманс Дж. П. Двунаправленная связь между нейронами и мачтой клеток желудочно-кишечного тракта. Автон Неврологи 2007; 133:91–103. [PubMed] [Google Scholar] 18. Д’Андреа М.Р., Сабан М.Р., Джерард Н.П., Вершил Б.К., Сабан Р. Отсутствие экспрессии рецептора нейрокинина-1 влияет на ткань количество тучных клеток, но не их пространственное соотношение с нервы. Am J Physiol Regul Integr Comp Физиол 2005; 288: Р491–500. [PubMed] [Google Scholar] 19. Стед Р.Х., Диксон М.Ф., Брамвелл Н.Х., Ридделл Р.Х., Биненшток Дж.Тучные клетки тесно связаны с нервами человека. слизистая желудочно-кишечного тракта. Гастроэнтерология 1989; 97: 575–85. [PubMed] [Google Scholar] 20. Stead RH, Tomioka M, Quinonez G, Simon GT, Felten SY, Bienenstock J. Тучные клетки слизистой оболочки кишечника в норме и кишечник крыс, зараженных нематодами, находится в тесном контакте с пептидергическими нервы. Proc Natl Acad Sci U S A 1987 год; 84:2975–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]21. Уильямс Р.М., Бертоуд Х.Р., Стед Р.Х. Афферентные нервные волокна блуждающего нерва контактируют с тучными клетками крысы. слизистая тонкой кишки.Нейроиммуномодуляция 1997;4: 266–70. [PubMed] [Google Scholar] 22. Хагияма М., Фуруно Т., Хосокава Ю., Иино Т., Ито Т., Иноуэ Т. и др. Усиленное взаимодействие нерва и тучных клеток за счет короткой изоформы нейронов молекулы клеточной адгезии-1. Дж Иммунол 2011;186:5983–92. [PubMed] [Google Scholar] 23. Фуруно Т., Хагияма М., Секимура М., Окамото К., Судзуки Р., Ито А. и др. Молекула клеточной адгезии 1 (CADM1) на тучных клетках способствует взаимодействие с нейритами ганглия задних корешков путем гетерофильного связывания с нектин-3. J Нейроиммунол 2012; 250:50–8.[PubMed] [Google Scholar] 24. Барбара Г., Ван Б., Стангеллини В., де Джорджио Р., Кремон С., Ди Нардо Г. и др. Зависимое от тучных клеток возбуждение висцерально-ноцицептивной сенсорной нейронов при синдроме раздраженного кишечника. Гастроэнтерология 2007; 132:26–37. [PubMed] [Google Scholar] 25. Мун Т.К., Сен-Лоран К.Д., Моррис К.Е., Марсет С., Йошимура Т., Секар Ю. и др. Достижения в области биологии тучных клеток: новое понимание гетерогенности и функция. Иммунол слизистых оболочек 2010;3:111–28. [PubMed] [Google Scholar] 26. Какурай М., Монтефорте Р., Суто Х., Цай М., Накаэ С., Галли С.Дж.Фактор некроза опухоли тучных клеток может способствовать удлинение нервных волокон в коже при контактной гиперчувствительности в мышей. Ам Джей Патол 2006; 169:1713–21. [Бесплатная статья PMC] [PubMed] [Google Scholar]27. Торнтон М.А., Акаше Н., Уолш М.Т., Молони М., Шихан П.О., Смит К.М. и соавт. Рекрутирование эозинофилов в носовые нервы после заражения аллергеном при аллергическом рините. Клин Иммунол 2013;147:50–7. [PubMed] [Google Scholar] 28. Савацки Д.А., Кингхэм П.Дж., Корт Э., Кумаравел Б., Фрайер А.Д., Джейкоби Д.Б. и др. Адгезия эозинофилов к холинергическим нервам через ICAM-1 и VCAM-1 и связанная с этим дегрануляция эозинофилов.Ам Дж Physiol Lung Cell Мол Физиол 2002; 282: L1279–88. [PubMed] [Google Scholar] 29. Omori Y, Andoh T, Shirakawa H, Ishida H, Hachiga T, Kuraishi Y. Связанные с зудом ответы нейронов заднего рога на кожная аллергическая стимуляция у мышей. Нейроотчет 2009; 20: 478–81. [PubMed] [Google Scholar] 30. Potenzieri C, Meeker S, Undem BJ. Активация бронхолегочных С-волокон мышей серотонин и аллерген-овальбумин. Дж Физиол 2012 г.; 590 (точка 21): 5449–59. [Бесплатная статья PMC] [PubMed] [Google Scholar]31.Катерина М.Дж., Шумахер М.А., Томинага М., Розен Т.А., Левин Д.Д., Юлиус Д. Рецептор капсаицина: активируемый нагреванием ионный канал в болевой путь. Природа 1997 год; 389: 816–24. [PubMed] [Google Scholar] 32. Jordt SE, Bautista DM, Chuang HH, McKemy DD, Zygmunt PM, Hogestatt ED, et al. Горчичное масло и каннабиноиды возбуждают чувствительные нервные волокна через канал ГТО АНКТМ1. Природа 2004; 427: 260–5. [PubMed] [Google Scholar] 33. Shim WS, Tak MH, Lee MH, Kim M, Koo JY, Lee CH и другие. TRPV1 опосредует вызванный гистамином зуд посредством активации фосфолипаза А2 и 12-липоксигеназа.Дж Неврологи 2007; 27: 2331–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]34. Suh YG, Oh U. Активация и активаторы TRPV1 и их фармацевтическое значение. Карр Фарм Дес 2005; 11: 2687–98. [PubMed] [Google Scholar] 36. Тейлор-Кларк Т.Е., Ундем Б.Дж., Макглашан Д.В. младший, Гатта С., Карр М.Дж., МакАлександер М.А. Простагландин-индуцированная активация ноцицептивных нейронов через прямое взаимодействие с переходным рецепторным потенциалом A1 (ТРПА1). Мол Фармакол 2008; 73: 274–81. [PubMed] [Google Scholar] 37. Динг-Пфеннигдорф Д., Авербек Б., Михаэлис М.Стимуляция PAR-2 возбуждает и сенсибилизирует крыс. кожные С-ноцицепторы к теплу. Нейроотчет 2004;15:2071–5. [PubMed] [Google Scholar] 38. Хонг Дж.Л., Хо С.И., Квонг К., Ли Л.И. Активация легочных С-волокон аденозином в анестезированные крысы: роль аденозиновых рецепторов A1. Дж Физиол 1998; 508 (Пл 1): 109–18. [Бесплатная статья PMC] [PubMed] [Google Scholar]39. Тейлор-Кларк Т.Е., Нассенштейн С., Ундем Б.Дж. Лейкотриен D(4) повышает возбудимость чувствительные к капсаицину носовые чувствительные нервы к электрическим и химическим раздражители.Бр Дж Фармакол 2008; 154:1359–68. [Бесплатная статья PMC] [PubMed] [Google Scholar]40. Кремон С., Карини Г., Ван Б., Васина В., Коглиандро Р.Ф., Де Джорджио Р. и др. Высвобождение серотонина в кишечнике, активация сенсорных нейронов и боли в животе при синдроме раздраженного кишечника. Ам Дж Гастроэнтерол 2011 г.; 106:1290–8. [PubMed] [Google Scholar]41. Пеллег А, Хёрт СМ. Механизм действия АТФ на легочный блуждающий нерв собак C волокна нервных окончаний. Дж Физиол 1996;490(Пт 1): 265–75. [Бесплатная статья PMC] [PubMed] [Google Scholar]42.Киркап А.Дж., Цзян В., Баннетт Н.В., Гранди Д. Стимуляция активируемого протеиназой рецептора 2 возбуждает тощекишечных афферентных нервов у анестезированных крыс. Дж Физиол 2003 г.; 552 (Пл 2): 589–601. [Бесплатная статья PMC] [PubMed] [Google Scholar]43. Колдвелл Дж. Р., Филлис Б. Д., Сазерленд К., Ховарт Г. С., Блэкшоу Л. А. Повышенная реактивность толстой кишки крысы splanchnic афференты к 5-HT после воспаления и восстановления. Дж Физиол 2007; 579 (т. 1): 203–13. [Бесплатная статья PMC] [PubMed] [Google Scholar]44. Эглезос А., Леччи А., Сантичоли П., Джулиани С., Трамонтана М., Дель Бьянко Э. и др.Активация первичных афферентов, чувствительных к капсаицину, у крыс. мочевого пузыря соединением 48/80: прямое действие на сенсорные нервы? Arch Int Pharmacodyn Ther 1992; 315: 96–109. [PubMed] [Google Scholar]45. Undem BJ, Hubbard W, Weinreich D. Иммунологически индуцированная нейромодуляция морской свинки узловатых ганглиозных нейронов. J Auton Nerv Syst 1993;44: 35–44. [PubMed] [Google Scholar]46. Грин Р., Фаулер Дж., МакГлашан Д. младший, Вайнрайх Д. Тучные клетки легких человека, зараженные IgE, возбуждают блуждающий нерв чувствительных нейронов in vitro.J Appl Physiol 1988;64: 2249–53. [PubMed] [Google Scholar]47. Риччио М.М., Майерс АС, Ундем Б.Дж. Иммуномодуляция афферентных нейронов морской свинки изолированные дыхательные пути. Дж Физиол 1996;491(Пл 2): 499–509. [Бесплатная статья PMC] [PubMed] [Google Scholar]48. Jiang W, Kreis ME, Eastwood C, Kirkup AJ, Humphrey PP, Grundy D. 5-HT(3) и гистаминовые H(1) рецепторы опосредуют афферентные чувствительность нервов к кишечной анафилаксии у крыс. Гастроэнтерология 2000; 119:1267–75. [PubMed] [Google Scholar]49. Ли Л.И., Мортон Р.Ф. Гистамин усиливает реакцию вагусных легочных С-волокон на капсаицин и вздутие легких.Дыхание Физиол 1993; 93: 83–96. [PubMed] [Google Scholar]50. Чжан Г., Лин Р.Л., Виггерс М.Е., Ли Л.И. Сенсибилизирующие эффекты хронического воздействия и острого ингаляции аэрозоля овальбумина на легочные С-волокна в крысы. J Appl Physiol 2008; 105:128–38. [Бесплатная статья PMC] [PubMed] [Google Scholar]51. Ю С, Колларик М, Оуян А, Майерс А.С., Ундем Б.Дж. Опосредованное тучными клетками длительное увеличение возбудимость С-волокон блуждающего нерва в пищеводе морской свинки. Am J Physiol Gastrointest Liver Physiol 2007; 293:G850–6. [PubMed] [Google Scholar]52.Gu Q, Lim ME, Gleich GJ, Lee LY. Механизмы индуцирования главным основным белком эозинофилов гипервозбудимость вагусных легочных химиочувствительных нейронов. Am J Physiol Lung Cell Mol Physiol 2009; 296:L453–61. [Бесплатная статья PMC] [PubMed] [Google Scholar]53. Фишер А., МакГрегор Г.П., Сария А., Филиппин Б., Куммер В. Индукция экспрессии гена тахикинина и пептида в морская свинка нодозирует первичные афферентные нейроны из-за аллергической реакции дыхательных путей воспаление. Джей Клин Инвест 1996; 98: 2284–91. [Бесплатная статья PMC] [PubMed] [Google Scholar]54.Lieu TM, Myers AC, Meeker S, Undem BJ. Индукция TRPV1 в вагусных путях низкопороговая механосенсорные нейроны при провокации аллергеном и нейротрофическом факторы. Am J Physiol Lung Cell Mol Physiol 2012; 302:L941–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]55. Bonini S, Lambiase A, Levi-Schaffer F, Aloe L. Фактор роста нервов: важная молекула при аллергических реакциях. Воспаление и ремоделирование тканей. Арка Аллергия Иммунол 1999; 118:159–62. [PubMed] [Google Scholar]56. Нокхер В. А., Ренц Х. Нейротрофины и астма: новое понимание нейроиммунных взаимодействие.J Аллергия Клин Иммунол 2006; 117: 67–71. [PubMed] [Google Scholar]57. Цвайфель Л.С., Курувилла Р., Гинти Д.Д. Функции и механизмы ретроградного нейротрофина сигнализация. Нат Рев Нейроски 2005; 6: 615–25. [PubMed] [Google Scholar]58. Лиу Т., Колларик М., Майерс А.С., Ундем Б.Дж. Экспрессия рецепторов лигандов семейства нейротрофинов и GDNF в подтипах блуждающего нерва, иннервирующего дыхательные пути взрослой морской свинки тракт. Am J Physiol Lung Cell Mol Physiol 2011;300: L790–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]59.Сурденикова Л., Ру Ф., Нассенштейн С., Татар М., Колларик М. Афференты, полученные из нервного гребня и плакод иннервация пищевода мыши. Нейрогастроэнтерол Мотил 2012; 24:e517–25. [PubMed] [Google Scholar] 60. Майерс А.С., Каекар Р., Ундем Б.Дж. Индуцированная аллергическим воспалением продукция нейропептидов в быстро адаптирующиеся афферентные нервы дыхательных путей морской свинки. Am J Physiol Lung Cell Mol Physiol 2002; 282: L775–81. [PubMed] [Google Scholar]61. Чуайчу Б., Хантер Д.Д., Майерс А.С., Колларик М., Ундем Б.Дж. Аллерген-индуцированный синтез вещества Р в чувствительные нейроны, иннервирующие легкие.Дж Аллергия Клин Иммунол 2005; 116: 325–31. [PubMed] [Google Scholar]62. Нойманн С., Дубелл Т.П., Лесли Т., Вульф С.Дж. Воспалительная болевая гиперчувствительность, опосредованная фенотипическое переключение в миелинизированных первичных сенсорных нейронах. Природа 1996; 384:360–4. [PubMed] [Google Scholar]63. Чжан Г., Лин Р.Л., Виггерс М., Сноу Д.М., Ли Л.И. Измененная экспрессия TRPV1 и чувствительность к капсаицину в легочных миелинизированных афферентах после хронического воспаления дыхательных путей в крыса. Дж Физиол 2008; 586 (т. 23): 5771–86. [Бесплатная статья PMC] [PubMed] [Google Scholar]64.Сильвер Р., Сильверман А.Дж., Виткович Л., Ледерхендлер II. Тучные клетки в головном мозге: доказательства и функционал значение. Тренды Нейроси 1996; 19:25–31. [PubMed] [Google Scholar]65. Kreis ME, Muller M, Zittel TT, Glatzle J, Grundy D. Медиаторы активации нейронов в стволе головного мозга крысы после кишечной анафилаксии. Неврологи латынь 2000; 289:45–8. [PubMed] [Google Scholar]67. Маццоне С.Б., Мори Н., Каннинг Б.Дж. Синергические взаимодействия между афферентным нервом дыхательных путей подтипы, регулирующие кашлевой рефлекс у морских свинок.Дж Физиол 2005;569(Пт 2): 559–73. [Бесплатная статья PMC] [PubMed] [Google Scholar]68. Маццоне С.Б., Каннинг Б.Дж. Синергические взаимодействия между афферентным нервом дыхательных путей подтипы, опосредующие рефлекторный бронхоспазм у морских свинок. Am J Physiol Regul Integr Comp Physiol 2002; 283: R86–98. [PubMed] [Google Scholar]69. Татар М., Плевкова Ю., Брозманова М., Пекова Р., Колларик М. Механизмы кашля при риносинусит. Пульм Фармакол Тер 2009;22:121–6. [PubMed] [Google Scholar]70. Chen CY, Bonham AC, Schelegle ES, Gershwin LJ, Plopper CG, Joad JP.Продолжительное воздействие аллергена на астматических обезьян вызывает нейропластичность ядра одиночного пути. Дж Аллергия Клин Иммунол 2001; 108: 557–62. [PubMed] [Google Scholar]71. Undem BJ, Hubbard WC, Christian EP, Weinreich D. Тучные клетки в верхнем шейном ганглии морской свинки: функциональная и гистологическая оценка. Джей Автон Нерв Сист 1990; 30:75–87. [PubMed] [Google Scholar]72. Myers AC, Undem BJ, Weinreich D. Влияние антигена на свойства мембран цесарки. нейронов бронхиального ганглия свиньи.J Appl Физиол 1991;71: 970–6. [PubMed] [Google Scholar]73. Бишофф С.К., Гебхардт Т. Роль тучных клеток и эозинофилов в нейроиммунной взаимодействия, регулирующие воспаление слизистой оболочки при воспалении кишечника болезнь. Adv Exp Мед Биол 2006; 579: 177–208. [PubMed] [Google Scholar]74. Каекар Р., Ундем Б.Дж., Майерс АС. Роль активации циклооксигеназы и простагландинов в антиген-индуцированные изменения возбудимости бронхиальных парасимпатических ганглиев нейроны. Am J Physiol Lung Cell Mol Physiol 2003;284: L581–7. [PubMed] [Google Scholar]75.Вайнрайх Д., Ундем Б.Дж. Иммунологическая регуляция синаптической передачи у изолированные вегетативные ганглии морской свинки. Джей Клин Вкладывать деньги 1987; 79: 1529–32. [Бесплатная статья PMC] [PubMed] [Google Scholar]76. Undem BJ, Myers AC, Weinreich D. Антиген-индуцированная модуляция вегетативной и сенсорной нейроны в пробирке. Приложение Int Arch Allergy Иммунол 1991 год; 94:319–24. [PubMed] [Google Scholar]78. Cyphert JM, Kovarova M, Allen IC, Hartney JM, Murphy DL, Wess J, et al. Кооперация между тучными клетками и нейронами необходима для антиген-опосредованная бронхоконстрикция.Дж Иммунол 2009; 182:7430–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]79. Вайнрайх Д., Ундем Б.Дж., Леал-Кардосо Д.Х. Функциональные эффекты активации тучных клеток в симпатические ганглии. Энн Н.Ю. Академия наук 1992; 664: 293–308. [PubMed] [Google Scholar]80. Шеманн М., Мишель К., Церегжин М., Зеллер Ф., Зайдл С., Бишофф С.К. Коктейль медиатора тучных клеток человека возбуждает нейроны в кишечная нервная система человека и морской свинки. Нейрогастроэнтерол Мотил 2005; 17: 281–9. [PubMed] [Google Scholar]81. Лю С., Ху Х.З., Гао Н., Гао С., Ван Г., Ван Х и др.Нейроиммунные взаимодействия в желудке морской свинки и кишечник. Am J Physiol Gastrointest Печень Физиол 2003; 284:G154–64. [PubMed] [Google Scholar]82. Фрилинг Т., Кук Х.Дж., Вуд Д.Д. Нейроиммунная связь в подслизистом сплетении толстой кишки морской свинки после сенсибилизации к молочному антигену. Am J Physiol 1994 год; 267:G1087–93. [PubMed] [Google Scholar]83. Бюнер С., Ли К., Бергер Т., Виньяли С., Барбара Г., Де Джорджио Р. и др. Подслизистые, а не миэнтеральные нейроны активируются слизистой оболочкой. супернатанты биопсии пациентов с синдромом раздраженного кишечника.Нейрогастроэнтерол Мотил 2012;24: 1134–e572. [PubMed] [Google Scholar]84. Breunig E, Michel K, Zeller F, Seidl S, Weyhern CW, Schemann M. Гистамин возбуждает нейроны в подслизистом сплетении человека через активацию рецепторов h2, h3, h4 и h5. Дж Физиол 2007; 583: 731–42. [Бесплатная статья PMC] [PubMed] [Google Scholar]85. Кристиан Э.П., Ундем Б.Дж., Вайнрайх Д. Эндогенный гистамин возбуждает нейроны морской свинки. верхний шейный ганглий in vitro. Дж Физиол 1989;409: 297–312. [Бесплатная статья PMC] [PubMed] [Google Scholar]86.Фрайер А.Д., Уиллс-Карп М. Дисфункция М2-мускариновых рецепторов в легких парасимпатических нервов после введения антигена. Дж Аппл Физиол 1991;71:2255–61. [PubMed] [Google Scholar]87. Костелло Р.В., Эванс К.М., Йост Б.Л., Бельмонте К.Е., Глейх Г.Дж., Якоби Д.Б. и др. Антиген-индуцированная гиперреактивность к гистамину: роль блуждающего нерва нервы и эозинофилы. Am J Physiol Lung Cell Mol Физиол 1999; 276:L709–14. [PubMed] [Google Scholar]88. Пан Дж., Род Х.К., Ундем Б.Дж., Майерс АС. Нейромедиаторы в парасимпатических нейронах дыхательных путей изменен нейротрофином-3 и повторным введением аллергена.Am J Respir Cell Мол Биол 2010;43:452–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]89. Берарди Н., Пиццоруссо Т., Маффеи Л. Критические периоды во время сенсорного разработка. Курр Опин Нейробиол 2000; 10: 138–45. [PubMed] [Google Scholar]90. Визель Т.Н., Хьюбел Д.Х. Степень восстановления после воздействия визуальных лишай у котят. J Нейрофизиол 1965; 28: 1060–72. [PubMed] [Google Scholar]91. Руда М.А., Линг К.Д., Хохманн А.Г., Пэн Ю.Б., Татибана Т. Измененные ноцицептивные нейронные цепи после новорожденных периферическое воспаление.Наука 2000;289: 628–31. [PubMed] [Google Scholar]92. Аль-Чаер ЭД, Кавасаки М, Пасрича ПДж. Новая модель хронической висцеральной гиперчувствительности у взрослых крыс, индуцированных раздражением толстой кишки в постнатальном периоде. разработка. Гастроэнтерология 2000; 119:1276–85. [PubMed] [Google Scholar]93. Ву З.С., Хантер Д.Д., Киш В.Л., Бендерс К.М., Бэтчелор Т.П., Дей Р.Д. Пренатальное и раннее, но не позднее постнатальное воздействие мышей в сторону от табачного дыма увеличивает гиперреактивность дыхательных путей позже в жизни. Перспектива охраны окружающей среды 2009; 117:1434–40.[Бесплатная статья PMC] [PubMed] [Google Scholar]94. Хантер Д.Д., Каррелл-Джекс Л.А., Бэтчелор Т.П., Дей Р.Д. Роль фактора роста нервов в индуцированных озоном нейронах реакции в раннем постнатальном развитии дыхательных путей. Являюсь J Respir Cell Мол Биол 2011;45:359–65. [Бесплатная статья PMC] [PubMed] [Google Scholar]95. Макаллистер А.К., Кац Л.С., Ло Д.К. Нейротрофины и синаптическая пластичность. Анну Рев Нейроски 1999; 22: 295–318. [PubMed] [Google Scholar]96. Сарин С., Ундем Б., Санико А., Тогиас А. Роль нервной системы в ринит.J Аллергия Клин Иммунол 2006; 118: 999–1016. [PubMed] [Google Scholar]97. Шустерман Д.Дж., Мерфи М.А., Балмс М.Р. Субъекты с сезонным аллергическим ринитом и неринитным субъекты по-разному реагируют на назальную провокацию хлором газ. J Аллергия Клин Иммунол 1998; 101: 732–40. [PubMed] [Google Scholar]98. Ревицкий Д.А., Лейди Н.К., Бреннан-Димер Ф., Томпсон С., Тогиас А. Разработка и предварительная проверка многоатрибутный индекс полезности симптомов ринита. Качество Жизнь Рез 1998; 7: 693–702. [PubMed] [Google Scholar]механизмов, лежащих в основе нейронных симптомов аллергия
J Allergy Clin Immunol.Авторская рукопись; Доступен в PMC 2019 APR 25.
Опубликовано в окончательной редактированной форме AS:
PMCID: PMC6483074
NIHMSID: NIHMS1021746
Bradley J. Undem
A NOME Отдел аллергии и клинической иммунологии Джонс Медицинская школа Хопкинса, Балтимор
Томас Тейлор-Кларк
b Кафедра молекулярной фармакологии и физиологии, Медицинский колледж Морсани, Университет Южной Флориды, Тампа.
a Отделение аллергии и клинической иммунологии, Джонс Медицинская школа Хопкинса, Балтимор
b Кафедра молекулярной фармакологии и физиологии, Медицинский колледж Морсани, Университет Южной Флориды, Тампа.
Автор, ответственный за переписку: Брэдли Дж. Ундем, доктор философии, отделение аллергии. и клинической иммунологии, Медицинская школа Джона Хопкинса, 5501 Хопкинс Bayview Circle, Baltimore, MD 21224. ude.imhj@mednub. См. другие статьи в PMC, в которых цитируется опубликованная статья.Abstract
Лица с аллергией с симптомами, которые часто являются результатом изменения в нервной системе. Нейрональные симптомы зависят от органа при которой возникает аллергическая реакция, но она может включать покраснение глаз, зуд, чихание, заложенность носа, ринорея, кашель, бронхоспазм, выделение слизи из дыхательных путей секреция, дисфагия, нарушение перистальтики желудочно-кишечного тракта и зуд, отек кожи. Эти симптомы возникают из-за того, что медиаторы, высвобождаемые во время аллергической реакции, могут взаимодействуют с чувствительными нервами, изменяют обработку в центральной нервной системе, и изменяют передачу симпатических, парасимпатических и энтеральных вегетативных нервы.Кроме того, данные подтверждают идею о том, что у некоторых субъектов это нейромодуляция по малопонятным причинам активируется таким образом, что одинаковая степень нервного раздражения вызывает больший эффект, чем у здоровых предметы. Существуют различия в механизмах и типах нервов, участвующих в аллерген-индуцированная нейромодуляция в различных системах органов, но в целом появились принципы. Продукты активированных тучных клеток, др. воспалительные клетки, а резидентные клетки могут открыто стимулировать нервные окончания, вызывают длительные изменения возбудимости нейронов, повышают синаптическую эффективность, а также изменяют экспрессию генов в нервах, что приводит к фенотипически измененным нейроны.Лучшее понимание этих процессов может привести к новым терапевтические стратегии, направленные на ограничение страданий людей с аллергии.
Ключевые слова: Аллергия, аллерген, тучные клетки, IgE, дегрануляция, нервные, афферентные, эфферентные, вегетативные, сенсорные, ноцицепторные, С-волокна, парасимпатические, симпатические, кишечные, миентеральные, одиночное ядро, ионный канал, деполяризация, потенциал действия, кашель, зуд, боль, рефлекс, подвижность, бронхоспазм, дисфункция, воспаление, кожа, легкие, дыхательные пути, кишечник, глаза, гиперсекреция, противовоспалительное, стероиды, блуждающий нерв, задние корешки, тройничный, узловатый, яремный, ганглии, взаимодействие тучных клеток и нервов, симптомы, транзиторные потенциальные каналы рецепторов, медиаторы тучных клеток, гистамин, простагландин, лейкотриен, цитокин, раздражитель, рецептор, иннервация, пластичность, критические периоды, фенотипический переключатель Балтимор, Мэриленд, Тампа, Флорида
Аллергия следствие гиперреакции иммунной системы, вызванной IgE. что в противном случае было бы относительно безобидным стимулом.Клинически аллергия проявляется характеризуется симптомами, которые в основном являются вторичными по отношению к измененной нервной системе. Набор нейрональных симптомов зависит от органа, в котором возникает реакция, но может включать зуд и покраснение глаз; ринорея, заложенность носа и чихание; призывать кашель, одышка, выделение слизи из дыхательных путей и эпизодический рефлекторный бронхоспазм; дисфагия, измененная моторика желудочно-кишечного тракта и дискомфорт; и кожный зуд и воспаление ответы. Эти события либо в сумме , либо частично вторичны по отношению к изменение активности нейронов.Поэтому аллергию можно охарактеризовать как иммунно-нейронное расстройство ().
Нейромодуляция при аллергической реакции. Экспериментальные исследования in vivo и ex vivo подтверждают гипотезу что аллергическая реакция может включать нейромодуляцию сенсорных (афферентный) – ЦНС – вегетативная/кишечная нервная ось (см. текст для Детали). Нейромодуляция в конечном итоге приводит ко многим симптомам аллергическое заболевание. DRG , Ганглий задних корешков.
Иммунологи преобладают среди заинтересованных в изучении механизмов аллергии.За последние несколько десятилетий ученые добились огромного прогресса в распутывая сложную паутину, составляющую иммунологическую основу аллергии. Это включает в себя как афферентные (сенсибилизация), так и эфферентные (рекрутирование воспалительных клеток и активация) конечности ответа. Результаты этих расследований наполняют фармацевтические конвейеры с рациональными, умными и захватывающими терапевтическими стратегиями направлена на купирование воспаления, связанного с аллергической реакцией.
Однако можно утверждать, что иммунное воспаление, связанное с Аллергические реакции в некоторых случаях могут быть тривиальными, если только они не трансдуцированы в нейрогенные реакции. симптомы страдания (например, зуд, кашель, бронхоспазм, нарушение моторики, боль, чихание, кожные заболевания).Тем не менее, несмотря на то, что противовоспалительный конвейер при аллергии терапия изобилует активностью, антинейромодуляторный конвейер в значительной степени пустой. Это может быть связано с недостаточным вниманием, уделяемым нейронам. аспект этого иммунно-нейронного расстройства.
Здесь мы попытались сделать обзор литературы, которая дает представление о том, как нервная система поражается аллергической реакцией. Ограничения по площади не позволяют исчерпывающий обзор этой литературы, и поэтому вместо основных примеров выбраны раскрыть некоторые из наиболее фундаментальных принципов нейромодуляции, вызванной аллергеном.Мы не рассматривали клиническую научную литературу, в которой исследовалась нейрональная симптомы аллергии, мы также не касались вопроса о роли высших мозговых центров (эмоции и стресс) на аллергическую реакцию. Мы также в значительной степени избегали связанных важные аспекты взаимодействий тучных клеток и нервов, которые происходят независимо от немедленная реакция гиперчувствительности, а также литература, относящаяся к Механизмы, с помощью которых нервная система может модулировать иммунный ответ. Скорее у нас есть здесь основное внимание уделялось основным механистическим исследованиям нейромодуляции, вызванной аллергией. даст читателю представление о периферических неврологических субстратах аллергии.
ОБЩИЕ ПРИНЦИПЫ СЕНСОРНО-ВЕГЕТНОЙ ИННЕРВАЦИИ
Чувствительные (афферентные) нервы ощущают местное тканевое окружение. 1 Их периферические нервные окончания «свободны» и не образуют синапсов с другими нервами. Вместо этого эти периферийные синапсы сенсорных окончаний с местной тканевой средой. Периферический сенсорный терминали экспрессируют различные рецепторы и ионные каналы, которые трансдуцируют окружающую среду. сигналы в электрические сигналы (т. е. действие потенциалы ).В висцеральной и соматосенсорной системах стимулы включают прикосновение и другие механические воздействия, температуру, рН, осмолярность и различные химические раздражители. Потенциалы действия проводят вдоль аксона в центре, мимо тела клетки, которое находится в определенном периферическом ганглий (дорсальные корешковые ганглии, блуждающие узловые ганглии, блуждающие яремные ганглии, или ганглии тройничного нерва) и в центральную нервную систему (ЦНС), где сигнал транспонируется в нейротрансмиттер выброс в синапс нерва с центральными нейронами второго порядка.
Чувствительные нервы гетерогенны в отношении чувствительности к раздражителям (т.е. экспрессия рецептора), размер, миелинизация, скорость проведения и нейропептид и содержание нейротрансмиттеров. Однако в целом чувствительные нервы делятся на 2 основные категории: те, которые были специально адаптированы для обнаружения рутинных физиологических раздражители (например, осязание, слух, обоняние, умеренная температура, изменения артериального давления и т. осмолярность) и те, которые обнаруживают вредные или потенциально вредные стимулы, такие как физические повреждения, химические раздражители и сильные изменения рН.
Шеррингтон 2 был первым специально описать эти последние типы нервов в своей знаменитой книге, Интегративное действие нервной системы . 2 Он отметил, что большое количество чувствительные нервы в коже активировались только нефизиологической стимуляцией вредный характер. Он назвал эти специализированные чувствительные нервы «ноцицепторы» и предположил, что «…что при селективном адаптации, они придают коже, так сказать, специфическое чувство собственного травмы. 2 Как правило, ноцицепторы представляют собой немиелинизированные медленно проводящие нервы небольшого диаметра. называются С-волокнами (А- и В-волокна миелинизированные , быстропроводящие нервы). Сейчас известно, что чувствительные нервы внутренних органов также содержат С-волокна, Определение ноцицепторов по Шеррингтону.
Сигналы (потенциалы действия), исходящие от этих первичных афферентных нервов интегрированы в ЦНС, где конечным следствием может быть либо сознательное восприятия (например, боль, спазмы, зуд, одышка или позывы к кашлю или чиханию) или подсознательная активация преганглионарных вегетативных нейронов, тем самым инициируя симпатическая, парасимпатическая и кишечные рефлексы.В коже ноцицептор активация приводит к зуду и боли. В дыхательных путях активация Ноцицепторы вызывают чихание, кашель, одышку, рефлекторный бронхоспазм и выделения. В кишечнике активация ноцицепторов может привести к секреции, диарее, желудочный дискомфорт и висцеральные боли. 1,3-6 Другими словами активация этих нервов приводит к сильным ощущениям и/или рефлексам, направленным на избегание раздражителя. Как мы обсудим более подробно ниже, ноцицепторы являются наиболее подтипом афферентных нервов. чувствителен к стимуляции вторичной острой аллергической реакцией.
Вегетативная и кишечная нервная система зависит от синаптической связи между пресинаптическими и постсинаптическими элементами, расположенными в симпатических, парасимпатические и энтеральные ганглии. В большинстве органов эфферентная нервная регуляция осуществляется пресинаптическими нейронами, исходящими из ЦНС. Преганглионарный нерв является возбуждаются в ЦНС, а потенциалы действия проводятся по преганглионарным аксонов, которые в конечном итоге образуют синапсы с нейронами вегетативных ганглиев. Должно Имейте в виду, что эти ганглии представляют собой не простые ретрансляционные станции, а места, где происходит фильтрация и интеграция входных данных ЦНС.Это может иметь значение при аллергии потому что тучные клетки обычно связаны с симпатическими, парасимпатическими и кишечные ганглии (как мы обсудим ниже). В кишечнике, в частности, также является автономным эфферентным контролем, который не зависит от нервной системы ЦНС. обработка. В этом случае чувствительный нерв, обнаруживающий раздражение в локальной Окружающая среда может передавать эту информацию непосредственно в близлежащие эфферентные кишечные нейронов через локальные афферентно-эфферентные синапсы. Это называется местный «периферический рефлекс.Нейроны кишечного ганглия общаются через внутриганглионарная передача. Периферические рефлексы могут встречаться и в других внутренних органах. органов, таких как дыхательные пути и желчный пузырь, хотя и не в такой степени. наблюдается в желудочно-кишечном тракте. 7,8
В некоторых органах нейропептидсодержащие афферентные С-волокна могут непосредственно регулируют функцию органов независимо от ЦНС или эфферентных вегетативных или энтеральные нейроны через локальные «аксонные рефлексы». 9 В этом случае потенциал действия, возникающий в окончание периферического сенсорного нерва проводится центрально, пока не достигнет бифуркацию, а затем антидромно проводит обратно к другим периферическим окончаниям того же нерва, где он вызывает высвобождение сенсорных нейропептидов, таких как вещество Р, нейрокинин А и пептид, родственный гену кальцитонина (CGRP).выпущенный пептиды могут привести к отеку, расширению сосудов, сокращению гладкой мускулатуры и релаксация, рекрутирование и активация иммунных клеток. Общее последствие аксонные рефлексы часто называют «нейрогенными». воспаление.» 9 Степень проявления нейрогенного воспаления зависит от вида и органа. За Например, у людей доказательства нейрогенного воспаления сильнее выражены у людей. кожи и слизистой оболочки носа, чем в нижних дыхательных путях. 10
ОСНОВНЫЕ МЕХАНИЗМЫ АЛЛЕРГЕН-ИНДУЦИРОВАННОЙ НЕЙРОМОДУЛЯЦИИ
Аллергический ответ включает изменения на всех 3-х уровнях нервной дуги: функция сенсорного нерва, интеграция ЦНС и вегетативная/энтеральная нейроэффекторная клетка функция ().Эти изменения могут быть подразделяются на острые изменения (явная активация нервов, которая длится только до тех пор, пока раздражитель присутствует), более длительные изменения в нейровозбудимость которая может пережить раздражитель на часы или дней, а еще более стойкие фенотипические изменения могут длиться неделями и возможно, если принять во внимание идею «критического периоды», годами.
Морфологические аспекты
Аллергическая реакция особенно хорошо влияет на изменение функционируют в коже и внутренних тканях.Вероятно, это связано с закрытием связь между нервными волокнами и тучными клетками (). 11,12 Тучные клетки были анатомически связан с нервами практически во всех системах органов в лаборатории животные и человеческие предметы. 11,13-17 Процент тучных клеток, делающих значимые ассоциации с нервами зависят от расстояния, которое человек считает значимым. В мочевом пузыре, например, утверждается, что более 75% тучного клетки находятся достаточно близко к нервным волокнам для значимого двунаправленного связь, 18 и в желудочно-кишечном тракте человека считалось, что от 50% до 70% тучных клеток находиться в тесном контакте с нейритами. 19 Имеются убедительные доказательства того, что тучные клетки действительно производят синаптические контакты с нервами, но это верно только для небольшого подмножества тучных клеток. 20,21 Интимный синаптический контакты между нервом и тучными клетками могут быть индуцированы или усилены за счет специфической адгезии молекулы, такие как молекула клеточной адгезии 1. 22 В экспериментальных системах тучных клеток-сенсорных нервные контакты, связь между нервом и тучными клетками ингибировалась блокированием гетерофильное связывание между тучными клетками и экспрессируемой клеточной адгезией молекула 1 и нектин 3 локализованы в нерве. 23
Тучные клетки находятся в непосредственной близости от нервов практически во всех органы. A, Триптазоположительные клетки тучных клеток ( красный ) вблизи PGP9.5-положительных нервов ( зеленый ) в подслизистом сплетении кишечника человека. 11 B, Тучные клетки ( красный ) вблизи синапсин-положительных нейронов ( зеленый ) в желудочке сердца крысы. 12 C, Тучные клетки ( фиолетовый ) рядом с экспрессией MrgA3 «афферентные зудящие нервы» ( оранжевый ) в коже мыши (личное наблюдение).
Тучные клетки чаще располагаются близко к нервам, не образуя истинных контакты. Анатомическая связь между тучными клетками и нервами становится даже более распространены в очагах воспаления 20,24,25 Были предложены механизмы для объяснения склонность к ассоциациям тучных клеток и нервов, включая высвобождение нейротрофические факторы и цитокины тучными клетками, которые способствуют удлинению нервов вблизи тучных клеток. 26 При аллергическом воспалении инфильтративное эозинофилы также часто связаны с нервами. 27 В дыхательных путях могут быть эозинофилы притягивается к вегетативным холинергическим нейронам как следствие нейронального сосудистого белок клеточной адгезии 1 и молекула межклеточной адгезии 1 выражение. 28 На С другой стороны, тщательный морфометрический анализ показал, что аксоны тонких нервов и терминали в различных тканях также обычно связаны не только с тучными клетками и эозинофилами, но также и с другими клетками костного мозга, такими как как плазматические клетки, и эти «ассоциации», по-видимому, не благоприятствуют один тип клеток над другим. 13 Этот тип анализа позволяет сделать вывод, что нервные ветви, тучные клетки и другие клетки, происходящие из костного мозга, часто концентрируются в одном и том же участке ткани, что делает почти уверенным, что они будут, в смысл, «колокализовать» случайно. Тучные клетки вместе с вегетативные и чувствительные нервы часто находятся в непосредственной близости от микроциркуляторном русле, в слизистой и подслизистой оболочках внутренних органов, вблизи гладкой мышц и всей дермы.
Независимо от механизмов анатомические исследования, особенно при оценивая целые препараты ткани, часто выявляют впечатляющее отображение мачты клетки, расположенные вдоль афферентных, вегетативных и энтеральных ветвей нерва (12).Эти изображения не оставляют сомнений в том, что многие, если не большинство, нервных волокон в тканях находятся в сфере влияния медиаторов, высвобождаемых тучными клетками. Каким может быть это влияние, так это обсуждаются ниже.
Аллерген-индуцированная нейромодуляция афферентных (чувствительных) нервов
Разряд потенциала действия.
Заражение аллергеном часто связано с явной активацией афферентные нервные окончания, приводящие к разрядке потенциала действия (). 29,30 Обычно считается, что типы сенсорных нервы, наиболее восприимчивые к прямой активации через медиаторы аллергии, полимодальные С-волокна.Это связано с тем, что афферентные С-волокна экспрессируют рецепторы ко многим химическим медиаторам, присутствующим в аллергическом воспалении. ткань. Часто эти нервы можно точно классифицировать как ноцицепторы.
Воздействие аллергена открыто активирует афферентные С-волокна. Top , Гипотетический эффект аллергенной активации мачты клетки на окончание афферентного нерва разряжают потенциал действия. Нижний , Примеры аллерген-индуцированной активации афферентных ноцицепторы: осталось , аллерген (овальбумин) вызывает сильные активация вагусных яремных С-волокон, иннервирующих легкое (потенциалы действия регистрируется в блуждающем нервном узле) 30 ; право , аллерген (экстракт комаров) индуцирует активацию соматосенсорных зудящих волокон в коже (действие потенциалы, регистрируемые в задних рогах). 29
Окончание сенсорного нерва активируется при воздействии определенного раздражителя на специфические рецепторы или ионные каналы в мембране нерва, что приводит к деполяризация мембраны. Эта деполяризация называется «генератором потенциал». Если потенциал генератора имеет достаточную величину, то активирует потенциалзависимые натриевые каналы, что, в свою очередь, приводит к действию потенциальный разряд (, вверху). То частота потенциалов действия «все или ничего» пропорциональна амплитуде генераторного потенциала.
Афферентные С-волокна обычно экспрессируют члены временного рецептора потенциальное (TRP) семейство ионных каналов. Два канала TRP, которые кажутся важное значение в аллергических реакциях имеют транзиторный рецепторный потенциал ваниллоида 1 (TRPV1) и транзиторный рецепторный потенциал анкиринового повтора 1 (TRPA1). Когда эти каналы открыты, они обеспечивают путь для притока катионов (натрий и кальций), что приводит к генераторным потенциалам величин достаточно для достижения порога разрядки потенциала действия. 31,32 TRPV1 стимулируется несколькими уместными механизмами к аллергической реакции. Эти стимулы включают агонисты Gq-связанных GPCR, такие как рецептор брадикинина 2 и рецептор гистамина h2; закисление местной среды нервных окончаний; и определенные липоксигеназные продукты семейства эйкозаноидов медиаторов воспаления. 33,34 TRPA1 есть также активируется механизмами, имеющими отношение к аллергии. С-волокна в дыхательных путях стимулируются через TRPA1 различными медиаторами окислительного стресса, включая активные формы кислорода (например, H 2 O 2 ) и продукты перекисного окисления липидов (например, 4-гидроксиноненаль и 4-оксононеналь) и нитрование (9-нитроолеат). 35 Метаболиты мачты клеточный простагландин D 2 (PGD 2 ) также сильно активируют С-волокна, вторичные по отношению к воротам TRPA1. 36
В дополнение к каналам TRPV1 и TRPA1, которые могут интегрировать многие различных раздражителей, афферентные С-волокна также экспрессируют рецепторы для специфических медиаторы, связанные с аллергическим ответом, включая рецепторы АТФ (P2X2 и P2X3), аденозиновые рецепторы (A1 и A2A), 5-HT рецепторы (5HT-3 и 5HT2), цистеиниллейкотриеновые рецепторы (CysLT1), триптаза и трипсин (рецепторы, активируемые протеазами 2 и 1). 37-43
На основе основ фармакологии полимодального афферентного нерва волокна (обычно, но не исключительно С-волокна), она не должна удивительно, что активация тучных клеток приведет к их явной активации. Это наблюдается во многих органах, включая дыхательные пути, кожу, желудочно-кишечный тракт и мочевой пузырь. 24,29,30,43,44 Примеры разряда потенциала действия С-волокон в ответ на острый аллерген вызов иллюстрируется в . Один можно рационально предположить, что С-волокна также будут стимулироваться медиаторами прибывающих на поздней стадии аллергических реакций, когда клеточный начинается воспалительная реакция.
Изменения сенсорной возбудимости.
Чувствительные нервы могут возбуждаться независимо от стимулов, вызывающих генераторные потенциалы. Открытие или закрытие различных ионных каналов (обычно каналы утечки или потенциалзависимые каналы) могут вызывать электрофизиологические эффекты, приводящие к повышенной возбудимости нерва по отношению к активирующему раздражителю. в Говоря языком иммунологии, мы могли бы сказать, что нервные окончания некоторые медиаторы воспаления. Медиаторы, ассоциированные с аллергией, такие как гистамин, PGD 2 , цистеиниллейкотриен D 4 , серотонин и брадикинин, банка снижают активность некоторых калиевых каналов, что приводит к увеличению резистентности афферентного нерва и последующее увеличение электрическая возбудимость. 39,45,46 Цистеиниллейкотриен D 4 стимулирующий рецепторы цистеиниллейкотриена 1 в нейронах С-волокон тройничного нерва ганглии явно не активируют нерв, но повышают его возбудимость такая частота разряда потенциала действия в ответ на другой активирующий стимул значительно усиливается. 39
Заражение аллергеном и высвобождение медиатора тучных клеток в сенсибилизированном trachea ex vivo явно не активирует ноцицептивную Aδ воздействует на кашлевые нервы, но вместо этого снижает порог их активации до механический раздражитель (). 47,48 В нижних дыхательных путях медиаторы аллергии, в т.ч. гистамин, может повышать возбудимость некоторых С-волокон до точки что механическое нарушение эвнейального дыхания приводит к их активация. 49,50 Иммунологическая активация Тучные клетки в кишечнике повышают возбудимость спинномозговых афферентных нервов так, что одно и то же кратковременное механическое растяжение приводит к гораздо более длительный разряд афферентных нервов (). 48 Точно так же активация тучных клеток приводит к выраженному увеличению механическая чувствительность С-волокон блуждающего нерва в пищеводе. 51 Кинетика повышение возбудимости афферентных нервов вследствие активации аллергеном Тучные клетки могут быть довольно стойкими, сохраняясь в течение нескольких часов после острого активация тучных клеток. Продукты активированных эозинофилов также могут способствуют повышению возбудимости афферентных нервов в местах аллергических воспаление. 52
Аллерген-индуцированное повышение возбудимости чувствительных нервов. А, Узловые окончания Aδ «кашляющих» волокон у морской свинки трахея; повышенная чувствительность к механической стимуляции этого типа волокон после введения аллергена (овальбумина). 47 B, Многокомпонентная запись афферентных нервов кишечника, демонстрирующая заметно усиленный (пролонгированный) ответ на вздутие после аллергена (овальбумин) вызов. 48
Активация и/или увеличение окончания афферентного нерва возбудимость встречается так часто в разрозненных тканях и экспериментальных систем, что это можно рассматривать как принципиальный результат активации тканевые тучные клетки. В общих чертах, явная активация С-волокна приводит к ощущения и рефлексы, соответствующие органу, воспринимающему опасный раздражитель и реагировать таким образом, чтобы попытаться уменьшить воздействие этого стимул.Как обсуждалось выше, в зависимости от ткани активация ноцицепторы могут в конечном итоге привести к позывам к кашлю или чиханию, рефлекторным бронхоспазм, выделения, зуд, нейрогенные воспалительные реакции, которые способствуют возникновению волдырей и воспалений, висцерального дискомфорта и изменений в моторика желудочно-кишечного тракта и мочевого пузыря. Кроме того, если чувствительный нерв вызывают гипервозбудимость медиаторы аллергии, а затем подпороговые раздражители и даже безобидные рутинные раздражители могут вызвать эти ноцицептор-ассоциированные рефлексы.
Фенотипические изменения.
Термин «фенотипическое изменение» имеет расплывчатое определение, но в настоящее время контексте мы имеем в виду нейромодуляцию, которая происходит на уровне экспрессия генов.
У взрослых афферентные нервные окончания в крупных дыхательных путях на расстоянии более 10 000 диаметров клетки от тела и ядра клетки. И все же это Понятно, что местные аллергические реакции в дыхательных путях могут привести к изменению экспрессия генов в отдаленных афферентных нейронах блуждающего нерва тела. 53,54 Наиболее вероятно объяснение этому состоит в том, что аллергическая реакция может привести к выработке и высвобождение нейротрофических факторов в локальной среде нерва терминалы. Имеются убедительные доказательства того, что повышенная продукция нейротрофинов возникает при аллергической реакции во всех тканях. 55,56 Аллергические реакции могут привести непосредственно к выделению нейротрофические факторы из тучных клеток, а также вторичные по отношению к стимуляции других клеток ткани, таких как эпителий дыхательных путей.
Нейротрофические факторы, представленные фактором роста нервов (NGF), могут связываться с высоким сродством к родственным рецепторам (например, тирозинкиназе рецептор [TRK] A) на мембранах нервных окончаний. Это приводит к интернализация комплекса NGF-TRKA, который затем транспортируется через аксональные транспортные механизмы возвращаются на большие расстояния к телу клетки, где это влияет на экспрессию генов. NGF относится к семейству нейротрофинов нейротрофические факторы, которые также включают нейротрофический фактор головного мозга и нейротрофины 3 и 4. 57 Помимо нейротрофинов, еще одно семейство нейротрофические факторы, называемые глиальным нейротрофическим фактором (GDNF) семейные лиганды (GFL) также могут иметь отношение к аллергическим реакция. 54 GFL включают GDNF, нейтурин, артемин и персефин.
Влияние нейротрофических факторов на фенотипические изменения афферентные нейроны, иннервирующие дыхательные пути, будут зависеть от репертуара рецепторы нейротрофического фактора, экспрессируемые нервами. Например, почти все афферентные нервы дыхательных путей экспрессируют GFRa1 и Ret, рецепторы для GDNF.Нейроны блуждающего нерва экспрессируют TRKB, TRK для роста головного мозга. фактор и нейротрофин 4, тогда как спинальные С-волокна и блуждающий яремный С-волокна обычно экспрессируют TRKA, рецептор NGF. 58,59
Вдыхание аллергена приводит к усилению экспрессии генов участвует в производстве тахикининов , такие как вещество P и CGRP. 53 Интересно, что после заражения аллергеном большой диаметр миелинизированные неноцицепторные нейроны А-волокна, которые в норме не экспрессируют эти мощные нейропептиды начинают синтезировать и транспортировать пептиды к своим центральные и периферийные терминалы. 60,61 Прочее словами, в нейропептиде происходит «фенотипический переключатель». иннервация аллергическо воспаленной ткани. Этот эффект можно повторить с экзогенными нейротрофинами. Этот тип фенотипического переключения также был наблюдается в соматосенсорных нервах после болезненного воспаления. 62
Существует также фенотипическое переключение, когда речь идет об экспрессии Каналы TRP в сенсорных нервах дыхательных путей. Экспрессия TRPV1, рецептор капсаицина, обсуждавшийся выше, ограничивается ноцицептивными С-волокнами в здоровые ткани.Вдыхание аллергена крысами или морскими свинками приводит к экспрессия TRPV1 в кашлевых нервах Aδ, а также в Aβ низкопороговые механосенсоры (оба быстродействующие адаптирующиеся и медленно адаптирующиеся подтипы рецепторов). 54,63 Подробнее исследования в этой области необходимы для определения молекулярных механизмов лежащие в основе фенотипических изменений, вызванных аллергеном, но ранние исследования подтверждают потенциальное участие как нейротрофинов, так и GFL в отклик. 54
Примеры сенсорной нейропластичности, вызванной аллергеном. Top , RT-PCR из отдельных нейронов ретроградно прослеживается из трахеи. В примере показаны 12 нейронов морских свинок, получавших контрольное лечение. и 16 нейронов из овальбумина (OVA) — обработанных морских свинок. Гистограммы показывают процент узловых нейронов, специфичных для трахеи, в каждом группы лечения, которые экспрессируют мРНК TRPV1. Воздействие аллергена (овальбумина) вызывает экспрессия de novo TRPV1 в узловой дозе Aδ «кашлевые» волокна, иннервирующие трахею (от Lieu et al. 54 ). Низ , Заражение аллергеном индуцирует de novo чувствительность к капсаицину у волокна легкого быстро адаптирующегося рецептора (RAR) , которые были характеризуется их фазовой реакцией во время дыхания (RARph) . ΔFA , Разница в обжиге Мероприятия. Используется с разрешения Zhang et al. 63 ** P < 0,01.
В целом, исследования сенсорной модуляции, вызванной аллергеном, поддерживают гипотеза о том, что в местах аллергической реакции интенсивное количественное нарастание залпов потенциала действия, возникающих в центральные окончания афферентных С-волокон в ЦНС (и в ганглии).Это происходит вторично по отношению к явной активации С-волокна. клеммы, а также обобщенный «затравочный» эффект повышается их электрическая возбудимость. Кроме того, также будет соответствующие качественные изменения в профиле активации А-волокон, и поскольку эти нервы начинают экспрессировать сенсорные нейропептиды, это может измениться. рефлекторные последствия их активации. Эти аллерген-сенсорные нервные взаимодействия могут быть острыми и кратковременными, но могут сохраняться и длительное время. после первичной аллергической реакции.
Аллерген-индуцированная модуляция нейронов ЦНС
Тучные клетки обнаружены в мозге всех видов, которые были оценивается, 64 но доказательства прямой активации этих клеток, вызванной аллергеном, отсутствуют. Это кажется более вероятным, что аллергические реакции косвенно модулируют нейроны ЦНС. путем создания ситуации, в которой существует интенсивное, а в некоторых случаях устойчивое повышение активности ноцицепторов, возникающее вследствие явной активации, и повышение возбудимости, как описано выше.Это приводит к увеличению высвобождение нейротрансмиттера/нейропептида из центрального окончания афферентного нервы в синапс нейронов ЦНС второго порядка, расположенных в дорсальной рог спинного мозга для спинномозговых афферентных нервов и в стволе мозга в пределах ядро одиночного тракта блуждающих афферентных нервов. 65 В случае фенотипических изменений Нейроны ЦНС могут модулироваться пептидами, такими как CGRP и субстанция P, высвобождаемыми от неноцицептивных нервов. В любом случае высвобождение пептидов и медиатора от центральных окончаний афферентных нервов могут быть приведены в движение события которые приводят к увеличению синаптической эффективности нейронов ЦНС, процесс часто называют «центральной сенсибилизацией».” 66
Когда нейроны ЦНС становятся сенсибилизированными, последствия данного количество афферентного входа может быть усилено и даже качественно изменено. Доказательства подтверждают концепцию, согласно которой центральная сенсибилизация может способствовать феномен аллодинии (при котором обычно безболезненный раздражитель, такой как нежное расчесывание волос и активация сенсорных Aβ-волокон, приводит к неадекватной боли). 66 Аналогично, многие с аллергией на аэроаллергены испытывают то, что можно было бы назвать «аллотуссивностью», при которой ощущение постоянные позывы к кашлю присутствуют, даже когда в дыхательных путях ничего нет кашлять, или постоянное желание чихнуть, когда ничего физического находится в носовом проходе.У экспериментальных животных было зарегистрировано что активация С-волокон блуждающего нерва дыхательных путей (что может активация) приводит к ситуации, при которой стимуляция А-волокон трахеи вызывает кашель с интенсивностью раздражителя, которая обычно намного меньше, чем нормальный кашлевой порог. 67 Точно так же стимуляция С-волокон может посредством центральной сенсибилизирующей взаимодействия, усиливают парасимпатический драйв к дыхательному тракт. 68 В обоих случаях это происходит за счет передатчиков, высвобождаемых из центральных окончаний С-волокон, повышение эффективности нейронов, иннервируемых А-волокнами (конвергенция А-волокна и С-волокна на нейроны второго порядка).Клинически значимый аспект центральной сенсибилизации заключается в том, что она обеспечивает механизм, посредством которого аллергическая реакция в одном месте может повлиять на физиологию в другом месте. Например, стимуляция С-волокон в гортани может усилить парасимпатическую привод к периферическим дыхательным путям. Активация С-волокон в пищеводе (например, во время кислотный рефлюкс) может привести к позывам к кашлю за счет усиления синаптической активности А-волокон в трахее. Попадание аллергена в нос может привести к центральному сенсибилизация кашлевых нервов нижних дыхательных путей. 69 Это повышает вероятность того, что кашель, связанный с гастроэзофагеальный рефлюкс не является вторичным по отношению к микроаспирации веществ в дыхательных путей и что кашель, связанный с назальной аллергией, не обязательно вторично по отношению к «постназальному затеканию» и прямой активации кашля нервов, так как это связано с центральной сенсибилизацией кашлевого пути конвергенция ноцицепторов пищевода и носа.
Идея центральной сенсибилизации при аллергии поддерживается элегантным исследования с молодыми взрослыми макаками-резусами. 70 После сенсибилизации к клещу домашней пыли обезьяны неоднократное воздействие аэрозолем, содержащим клещей домашней пыли. Приблизительно через 5–6 месяцев электрическая возбудимость ствола мозга нейроны в ядре солитарного тракта были оценены и оказались сильно активизирован; их реакция на данный входной стимул была намного сильнее, чем у аналогичных нейронов у неаллергичных обезьян (14). 70
Вызванное аллергеном повышение электрической возбудимости нейронов ЦНС. Верх , Стволовое расположение ядра солитарной тракт. A, Микрофотография защемленного нейрона в головном мозге срез от каудомедиального ядра солитарного тракта, где чувствительные афференты блуждающего нерва заканчиваются. B, Цельноклеточный пластырь-зажим регистрации импульсов деполяризующего тока, воздействующих на отдельные ядра одиночные нейроны тракта от наивного или зараженного аллергеном (пылевой клещ) резуса обезьяны. C, Повышенный разряд потенциала действия в ответ на деполяризующий стимул в нейронах, выделенных от аллергичных обезьян. 70
Трансмиттеры и молекулярные механизмы, лежащие в основе центральной сенсибилизации многообразны и выходят за рамки данного обзора. Как долго центральная сенсибилизация сохраняется за пределами воспалительной реакции, открыта для дебаты. Тем не менее, представляется рациональным сделать вывод на основе имеющихся доказательства того, что аллергическая реакция может привести к ноцицепторному вводу в ЦНС (ствол мозга или задний рог), который повышает чувствительность синаптической передачи в нем. Это может привести к резкому снижению ощущений и рефлексов. неадекватно соответствует инсульту, присутствующему в периферических аллергических воспаленные ткани.
Аллергическая модуляция эфферентных (вегетативных и кишечных) нервов
Активация и изменение синаптической эффективности.
Тучные клетки обычно располагаются близко к нейронам внутри кишечные, симпатические и парасимпатические ганглии. 11,71,72 Нейроны внутри этих ганглиев получают синаптические входы от преганглионарных вегетативных нейроны с телами клеток в ЦНС. В частности, энтеральный ганглий может также функционируют автономно посредством внутриганглионарной синаптической передачи.Когда тучные клетки, расположенные вблизи вегетативных ганглиев, стимулируются, это приводит к существенному увеличению «синаптической эффективности». Это сказать, что постганглионарный выход увеличивается относительно данного преганглионарный вход. Эти ганглии являются первыми участками периферических интеграция эфферентной информации, поступающей от ЦНС. Поэтому изменения в синаптической эффективности в этих местах может оказывать мощное воздействие на ЦНС. контроль за работой органов. Кроме того, изменение активности нейрона внутри кишечных ганглиев также может изменить характеристики автономное функционирование желудочно-кишечного тракта. 73
Аллерген-индуцированное увеличение синаптической эффективности может наблюдаться электрофизиологически в бронхиальных парасимпатических ганглиях, расположенных преимущественно в трахее и крупных бронхах. Поступления от ЦНС часто приводят к потенциалы возбуждения, которые являются подпороговыми для разряда потенциала действия в постганглионарных нейронах. После активации аллергеном близлежащей мачты клетки, усиливается синаптическая эффективность и фильтрующая способность ганглий потерян (). 71,74-76 постганглионарные нейроны в этих ганглиях обеспечивают доминирующий контроль напряжение гладких мышц не только в крупных дыхательных путях, но и на всем протяжении вниз по дереву дыхательных путей к мелким бронхиолам.Поэтому изменения в фильтрация, которая может происходить вторично по отношению к активации тучных клеток в более крупных дыхательные пути могут иметь большое влияние на калибр дыхательных путей на всем протяжении бронхов. дерево. У мышей эта тучная клетка-парасимпатический холинергический нерв взаимодействие ответственно почти за все дыхательные пути, вызванные аллергеном. сужение. 77,78
Аллерген-индуцированное повышение синаптической эффективности в вегетативных ганглиях. A, Малый парасимпатический бронхиальный ганглий морской свинки бронх.Отдельный нейрон, заполненный пероксидазой хрена и нарисованный с помощью показана техника камеры lucida. Парасимпатический нейрон синаптическая эффективность в ответ на стимуляцию преганглионарных нервов (шок артефакт) значительно увеличивается после воздействия аллергена (яичного альбумина). 76 фВПСП , Быстрые возбуждающие постсинаптические потенциалы. B, Динамика высвобождения гистамина и верхнешейного синаптическая эффективность ганглиев (величина потенциала действия постганглионарных соединений) во время провокации аллергеном (овальбумином). 75
В отличие от парасимпатических ганглиев симпатические ганглии большие и очень удобно для изучения синаптической передачи. В течение нескольких минут аллерген-индуцированная активация тучных клеток в верхнем шейном ганглии или чревном ганглии, наблюдается выраженное увеличение синаптической эффективности, часто приводит к удвоению постганглионарного выброса. 75,79 Потенцирование синаптической эффективности тучными клетками активация не является кратковременным событием. Как и при повышении возбудимости афферентных нервных окончаний, синаптическая потенциация, вызванная аллергеном, может сохраняются в течение многих часов после острой активации тучных клеток.Пример разницы в продолжительности увеличения синаптической эффективности по сравнению с Высвобождение гистамина в симпатическом ганглии показано на рис.
Особое значение имеет пищевая аллергия, иммунологическая активация Тучные клетки в кишечнике обычно связаны с изменениями в нейротрансмиссия в кишечных ганглиях, тем самым изменяя активность секретомоторных нейронов подслизистой оболочки. 4,6 Тучные клетки особенно богаты в подслизистом сплетении человека по сравнению с миэнтеральное сплетение. 11 Медиаторы, высвобождаемые при IgE-зависимой активации тучных желез кишечника человека клетки непосредственно возбуждают кишечные нейроны в подслизистой оболочке морских свинок и человеческие предметы (). 80,81 Модель морской свинки с пищевой (молочной) аллергией элегантно показывает, что аллергенная активация тучных клеток увеличивает и модулирует синаптическая эффективность подслизистых нейронов в толстой и тонкой кишке (). 81,82
Аллерген-индуцированная стимуляция кишечных нейронов. А, Внутриклеточная запись нейрона подслизистого сплетения, выделенного из морская свинка демонстрирует деполяризацию нейронов до порога потенциала действия после вызов молочного аллергена. 81 B, Регистрация потенциала действия нейрона в подслизистом слое сплетения кишечника человека. Потенциалы действия вызывались в ответ на обработка супернатантом анти-IgE-активированного человеческого тучные клетки кишечника. Используется с разрешения Schemann et al. 80
Медиаторы и ионные механизмы, лежащие в основе увеличения вегетативная и энтеральная синаптическая активность многочисленна и зависит от того, какой изучается специфический ганглий. Гистамин является особенно неразборчивым медиатор, когда дело доходит до модуляции синаптической активности в ганглиях, с потенциально задействованы все 4 гистаминовых рецептора.Тем не менее, ясно что гистамин не единственный виновник. Многие медиаторы аллергии было показано, что он изменяет вегетативную и энтеральную передачу, включая мастопатию. клеточные медиаторы, такие как серотонин, PGD 2 , активирующие тромбоциты фактора и триптазы. 6,17,73,79,83,84 . Индуцированное аллергеном усиление синаптической передачи может происходят как через пресинаптические, так и постсинаптические механизмы действия. Там является доказательством того, что активация тучных клеток приводит к увеличению количества нейротрансмиттеров. (обычно ацетилхолин), высвобождаемый из пресинаптических окончаний в течение заданного времени. количество стимула. 85 данные также подтверждают гипотезу о том, что нейротрансмиттер в синапс стимулирует более возбудимый постсинаптический нейрон из-за общего повышение сопротивления нейронов и электрической возбудимости государство. 4,76,85 Независимо от ионных механизмов относительно последовательным открытием в исследованиях синаптической передачи является тот, в котором Разряд потенциала действия для данного количества пресинаптического входа равен постоянно усиливается. У восприимчивых субъектов это может быть повышено до степень возникновения серьезных симптомов (например, тяжелый бронхоспазм, выделение слизи секреция, желудочно-кишечные спазмы и боль, диарея и нарушение регуляции подвижности).
Заражение аллергеном также может привести к увеличению вегетативной нервной системы. высвобождение нейротрансмиттера из постганглионарных периферических окончаний в заданное количество стимула. Это наблюдается при постганглионарных окончаний парасимпатических холинергических нервов, иннервирующих гладкую мускулатуру дыхательных путей и объясняется эозинофильно-опосредованным снижением мускариновой Функция рецептора М2 на нервных окончаниях. 86,87 Эти рецепторы М2 являются ингибирующими «ауторецепторы» и служат для ограничения высвобождения ацетилхолина по цепи отрицательной обратной связи.
Фенотипические изменения вегетативных нервов.
Как и в случае с первичными афферентными нервами, аллерген-индуцированные фенотипические изменения вегетативных нейронов. Как обсуждалось выше вегетативные нервы, иннервирующие дыхательные пути, в основном парасимпатические. Парасимпатическая ветвь обеспечивает как сократительную (холинергическую) регуляцию гладкой мускулатуры дыхательных путей и релаксант (нитрергический/вазоактивный кишечный пептид) контроль. У морских свинок неоднократно вызывали аллерген вдохе произошло фенотипическое переключение, так что вазоактивный нейроны кишечного пептида/оксида азота начали превращаться в холинергические синтез фенотипа. 88 В Другими словами, баланс между сократительной и релаксантной иннервацией был меняется в пользу первого. Вероятно, это объясняется аллерген-индуцированная продукция нейротрофинов в дыхательных путях, нейротрофин 3 является потенциальным виновником.
Концепция модуляции в критические периоды
До этого момента доклинические исследования в поддержку нашего обсуждения проводили у взрослых или молодых взрослых животных. Аллерген-индуцированный нейромодуляция часто довольно глубокая, но ожидается, что она продлится в течение сроки от минут до недель.Рискуя закончить этот обзор на чрезмерно спекулятивной ноте, стоит рассмотреть потенциальную роль «критического периоды» в нейромодуляции, вызванной аллергеном, потому что эти изменения могут сохраняться годами и даже всю жизнь.
Хорошо известно, что развитие сенсорных систем часто требует активности, зависящей от использования, в раннем возрасте. 89 Во время постнатального сенсорного нерва развития, существует определенное окно времени, в течение которого нервы восприимчивы к этой зависящей от опыта пластичности.До или после определенного окно времени, тот же самый опыт не влияет на развитие нейронов. Таким образом, например, если молодое животное лишается зрения из-за закрытия век (или различных другие методы), происходят изменения в нейронных цепях зрительной коры, приводит к тяжелой и необратимой потере остроты зрения. 90 Это происходит, только если зрение депривация происходит в критический период времени. Даже длительное зрение депривация после критического периода не влияет на остроту зрения.То точное время критического периода зависит от изучаемой системы. Поскольку эти новаторские исследования, критические периоды были определены в аудио и соматосенсорной системы и были отмечены практически у всех видов от человека Дрозофила . 89
Недавние сообщения подтверждают концепцию о том, что пластичность чувствительных нервов в критические периоды раннего возраста может привести к стойкие изменения в соматосенсорных и вагусно-сенсорных нервных цепях.Руда и др. al 91 воспаление одной задней ноги лапу крысят с использованием полной модели адъюванта Фрейнда. Выставлены щенки стереотипное поведение, свидетельствующее о боли в лапе. Что еще более важно, было значительное увеличение плотности первичных афферентных нервов в ипсилатеральный задний рог спинного мозга. Это изменение плотности нейронные цепи в ЦНС сохранялись после воспаления и продолжались до совершеннолетие. Поведенческие исследования показали, что взрослые крысы, которые испытали лапу воспаление, так как новорожденные были значительно более гипералгетичны в ответ на последующие воспалительные стимулы, чем контрольные крысы.Авторы пришли к выводу, что «периферическое воспаление, возникающее в период новорожденности, долгосрочные последствия для ноцицептивных нейронных цепей».
Аналогичные выводы делаются в отношении висцеральной нервной гиперчувствительность. Давно известно, что воспаление толстой кишки лабораторных животных приводит к гиперчувствительности нейронов и чрезмерному и аномальная рефлекторная физиология кишечника (в чем-то аналогичная дыхательным путям). гиперреактивность бронхиальной астмы). Когда толстые кишки крыс были химически или механическое раздражение через 8-21 день после рождения, воспалительная реакция была вызывали афферентную нервную гипервозбудимость и состояние повышенной висцеральная рефлексия.Эти изменения повышенной возбудимости чувствительных нервов сохранялись. помимо воспаления кишечника, длящегося не менее 3 месяцев (самое долгое время анализируемая точка). Напротив, если толстая кишка крыс воспалилась после на 21-й день после рождения (вне критического периода) гиперрефлексии не было. настойчивый. 92 Аналогично, воздействие сигаретного дыма на животных во время послеродового критического состояния. связан с постоянным повышением гиперреактивности дыхательных путей и плотность чувствительных нервов. 93 Так как в соматосенсорной модели боли, так и в висцерально-сенсорной модели боли. гиперрефлексия, воспаление в критический период постнатального развития вызывали аномалии в сенсорной нейросхеме, которые сохранялись, возможно, до совершеннолетие.
Причина, по которой это может быть связано с аллергическим воспалением в раннем возрасте заключается в том, что нейротрофины участвуют в нескольких моделях аллергических воспалений (а также вирусных инфекций) и этот критический период сенсорной пластичность нерва зависит от продукции нейротрофических факторы. 94,95 Аллергическое (или инфекционное) воспаление в поэтому критические периоды повышают вероятность того, что воспалительная реакция может оставить после себя нервную систему, слегка измененную много лет спустя, таким образом, легкое воспалительное поражение может привести к чрезмерно преувеличенным ответы.
ВЫВОДЫ
Среди совокупности симптомов, характеризующих аллергическую реакцию, многие, если не большинство, являются вторичными по отношению к изменениям в нервной системе. В зависимости от органа, в котором происходит реакция, эти симптомы, основанные на нейронах, включают слезотечение, раздражение глаз и расширение сосудов, ринорея, заложенность носа, чихание, постоянные позывы к кашлю, стеснение в груди, бронхоспазм, выделения из дыхательных путей, дисфагия, изменения моторики желудочно-кишечного тракта, зуд и волдыри и приливы реакции.В этом смысле аллергия является иммуно-нейронным расстройством.
Активация тучных клеток и последующая эозинофильная Воспаление, вызванное T H 2, может привести к глубоким изменениям функции афферентных нейронов, нейронов ЦНС и симпатических нейронов. парасимпатические и энтеральные ганглии. Эти изменения включают острое явное активация нервов, длительное повышение их возбудимости и даже длительно сохраняющиеся фенотипические изменения в нервной системе.
Больше, чем тот факт, что люди с аллергией вырабатывают нейроактивные медиаторы в участки аллергического воспаления, кажется, что сама нервная система изменены при аллергических заболеваниях.То ли из-за событий, происходящих во время критических периоды в развитии нейронов или просто из-за постоянной активации нервов, нервная система становится гиперактивной у многих пациентов с аллергическими заболеваниями. В клинических условиях это измененное состояние нейронов легко наблюдать, когда концентрация нейроактивного медиатора, которая в норме не действует на здоровых предметов приводит к ощущениям и рефлексам у людей с аллергией. Это легко проявляется, например, у пациентов с аллергическим ринитом: концентрация Стимулятор С-волокна (например, брадикинин или капсаицин), который не действует при применении на слизистая носа здорового человека вызывает сильное чихание и рефлекторное парасимпатические холинергические сокращения при воздействии на кого-то с аллергией ринит. 96 Шустерман и др. al 97 обнаружил, что назальный Воздействие низких концентраций газообразного хлора приводит к более сильным реакциям у пациентов с сезонный аллергический ринит, чем у здоровых лиц контрольной группы. Эти данные подтверждают клинические наблюдения, на которые обычно жалуются пациенты с аллергическим ринитом. преувеличенные носовые симптомы, вызванные различными сильными запахами и дымом, а также изменения атмосферных условий. В анкете, представленной в рамках протокол скрининга 350 пациентов с аллергическим ринитом, 60% указали курение как один из триггеров назальных симптомов, 58% перечислили другие раздражители, а 47% перечислили холодный воздух.Эти проценты были еще выше у добровольцев с многолетними по сравнению с сезонный аллергический ринит. 98
В настоящее время наше понимание специфических медиаторов, ионных каналов и сигнальные пути, участвующие в аллерген-индуцированной нейромодуляции, остаются на прежнем уровне. относительно рудиментарное состояние. Можно предположить, что наше понимание эти основные механизмы продолжают развиваться, появляются новые терапевтические стратегии, нацеленные на нервная система будет продолжать развиваться, работая синергетически с противовоспалительные стратегии, будут служить для подавления страданий тех, у кого иммунно-нейронное расстройство, которое мы называем аллергией.
ГЛОССАРИЙ
ПОТЕНЦИАЛ ДЕЙСТВИЯ: Нервное волокно млекопитающего в состоянии покоя находится в состоянии электроотрицательности из-за градиентов концентрации ионов и мембранных проницаемость для определенных ионов. Потенциал действия включает резкие изменения мембранный потенциал, который быстро распространяется по длине мембраны нервного волокна. Нормальный отрицательный мембранный потенциал покоя изменяется внезапно (в течение нескольких 10 000 секунды) до положительного потенциала (деполяризация), а затем обратно до отрицательный потенциал (реполяризация).События, вызывающие увеличение мембраны потенциал от электроотрицательности к нулевому уровню запускает потенциалзависимую натриевую каналы начинают открываться, вызывая дальнейшее увеличение мембранного потенциала и большее открытие потенциалзависимых натриевых каналов до тех пор, пока не будут открыты все каналы. Затем калиевые каналы начинают открываться, а натриевые каналы закрываться, что приводит к прекращение потенциала действия.
ЦИСТИНИЛЛЕЙКОТРИЕНА D 4 (LTD 4 ): LTD 4 связывается с рецептором цистеиниллейкотриена (CysLT) 1 и CysLT2.CysLT1 способствует сокращению гладкой мускулатуры бронхов и регулирует различные аспекты иммунная система. Монтелукаст противодействует CysLT1.
СЕМЕЙСТВО ЭЙКОЗАНОИДОВ: Класс липидов, полученных из полиненасыщенные жирные кислоты (например, арахидоновая кислота), которые опосредуют воспаление.
ENTERIC: Нервная система, за исключением желудочно-кишечного тракта тракт. Энтеральная система содержит около 100 миллионов нейронов, т. сопоставимо с количеством нейронов в спинном мозге.Он содержит внешний (мышечно-кишечное) сплетение и внутреннее (подслизистое) сплетение. Симпатический и парасимпатический нервы соединяются с этими 2 сплетениями. Кишечные нервы выделяют различные нейротрансмиттеры, в том числе ацетилхолин, норадреналин, серотонин, дофамин, вещество Р и вазоактивный интестинальный полипептид.
МЕХАНОСЕНСОРЫ: Сенсорный рецептор, обнаруживающий механические сдавление или растяжение рецептора или прилегающих тканей. Дыхательная мышца механосенсоры передают афферентные импульсы к нейронам продолговатого мозга, а также сенсорная кора.
МИЕЛИНИРОВАННЫЕ: Нервные волокна с аксонами, окруженными миелином оболочка. Шванновские клетки обволакивают аксоны и многократно вращаются вокруг аксона, создавая слои мембраны, содержащие липидное вещество сфингомиелин. Сфингомиелин действует в качестве электрического изолятора и способен уменьшать поток ионов через мембрана примерно в 5000 раз. Неизолированные контакты между шванновскими клетками называется узлом Ранвье. Потенциалы действия «прыгают» от узла к узлу для увеличения скорости передачи нерва в миелинизированных волокнах.
НЕЙРОТРАНСМИТТЕР: Химическое вещество, выделяемое нейронами, которое вызывает передачу сигнала в синапсах ЦНС. Большинство синапсов участвуют в сигнале ЦНС передачи осуществляются химическими синапсами. Нейромедиатор связывается с мембранным рецептором белков следующего нейрона для возбуждения, торможения или изменения чувствительности нейрон. Существует более 40 нейротрансмиттеров, в том числе ацетилхолин, норадреналин, гистамин, серотонин и гамма-аминомасляная кислота.
ПАРАСИМПАТИЧЕСКИЕ: Нервные волокна вегетативной нервной системы которые выходят из ЦНС через черепные нервы III, VII, IX и X, а также спинномозговые крестцовые нервы.Большинство парасимпатических нервов находится в блуждающих нервах (черепной нерв ИКС). Парасимпатические нервы также содержат преганглионарные и постганглионарные нейроны. Большинство парасимпатических постганглионарных нейронов являются холинергическими.
АКТИВНЫЕ ФОРМЫ КИСЛОРОДА (АФК): Обычно образующиеся вещества с низкой частотой при окислительном фосфорилировании в митохондриях, а также в ряде других клеточных реакций. АФК могут оказывать клеточное повреждение, реагируя с внутриклеточными компонентами, такими как ДНК и мембранные липиды.
СИМПАТИЧЕСКИЕ: Нервные волокна вегетативной нервной системы, которые берут начало в спинном мозге между Th1 и L2. Сначала они переходят в паравертебральные цепочки ганглиев и далее к тканям и органам. Каждый симпатический нерв состоит преганглионарного нейрона и постганглионарного нейрона. Преганглионарные нервы могут синапс в паравертебральном ганглии или периферическом симпатическом ганглии (например, чревный ганглий). Преганглионарные нервы симпатической и парасимпатической систем являются холинергическими (то есть секретируют ацетилхолин).Наиболее симпатические постганглионарные нейроны являются адренергическими (то есть секретируют норадреналин).
ТАХИКИНИНЫ: Класс нейропептидов, который включает сенсорные афферентные нейромедиатор вещества P.
Сокращения, используемые| CGRP кальцитонин ген-родственный пептид | ||
| ЦНС Центральная нервная система | ||
| GDNF глиальных-производный фактор роста | ||
| GFL | глиальных нейротрофический фактор семейства лиганд | |
| ФРН | фактора роста нервов | |
| PGD 2 | простагландина D 2 | |
| TRK | рецепторной тирозинкиназы | |
| TRP | Переходный рецепторный потенциал | |
| TRPA1 | ||
| TRPA1 | Потенциал переходного рецептора Ankyrin 1 | |
| TRPV1 | TRPV1 | Потенциал переходного рецептора 1 |
Сноски
Раскрытие потенциального конфликта интересов: B.Ундем получил гранты Национальных институтов здравоохранения и GlaxoSmithKline; на научный консультативный совет Afferent Pharmaceuticals; и есть консультант договоренности с GlaxoSmithKline. Т. Тейлор-Кларк заявляет, что у него нет соответствующие конфликты интересов.
ССЫЛКИ
1. Линн Б. Соматосенсорные рецепторы и их ЦНС соединения. Анну Рев Физиол 1975; 37: 105–27. [PubMed] [Google Scholar]2. Шеррингтон С Интегративное действие нервной системы. Нью-Хейвен (Коннектикут): Йель университетская пресса; 1906 г.[Google Академия]3. Кольридж Дж. К., Кольридж Х. М. Иннервация афферентных С-волокон блуждающего нерва легких и дыхательных путей и их функциональное значение. Преподобный Физиол Биохим Фармакол 1984 год; 99:1–110. [PubMed] [Google Scholar]4. Вуд Джей Ди. Кишечная нейроиммунофизиология и патофизиология. Гастроэнтерология 2004; 127: 635–57. [PubMed] [Google Scholar]5. Блэкшоу Л.А., Брукс С.Дж., Гранди Д., Шеманн М. Сенсорная передача в желудочно-кишечном тракте. тракт. Нейрогастроэнтерол Мотил 2007; 19:1–19. [PubMed] [Google Scholar]6.Вуд Джей Ди. Симпозиум по питанию нежвачных животных: нейрогастроэнтерология и пищевой аллергии. Джей Аним Наука 2012;90:1213–23. [PubMed] [Google Scholar]7. Майерс AC, Ундем Б.Дж. Электрофизиологические эффекты тахикининов и капсаицин на бронхиальный парасимпатический ганглий морской свинки нейроны. Дж Физиол 1993;470: 665–79. [Бесплатная статья PMC] [PubMed] [Google Scholar]8. Мэй ГМ. Тахикинины как медиаторы медленных ВПСП у морской свинки ганглии желчного пузыря: вовлечение рецепторов нейрокинина-3. Дж Физиол 1995;485(Пл 2): 513–24.[Бесплатная статья PMC] [PubMed] [Google Scholar]9. Балук П. Нейрогенное воспаление кожи и дыхательных путей. J Investig Dermatol Symp Proc 1997; 2:76–81. [PubMed] [Google Scholar] 10. Санико А.М., Ацута С., Прауд Д., Тогиас А. Дозозависимые эффекты назального введения капсаицина: в vivo доказательства нейрогенного воспаления дыхательных путей человека. J Аллергия Клин Иммунол 1997; 100: 632–41. [PubMed] [Google Scholar] 12. Silver RB, Reid AC, Mackins CJ, Askwith T, Schaefer U, Herzlinger D, et al. Тучные клетки: уникальный источник ренина.Proc Natl Acad Sci U S A 2004; 101:13607–12. [Бесплатная статья PMC] [PubMed] [Google Scholar]13. Аризоно Н., Мацуда С., Хаттори Т., Кодзима Ю., Маэда Т., Галли С.Дж. Анатомические вариации ассоциаций тучных клеток у тонкий кишечник крысы, сердце, легкие и кожа. Сходство расстояний между нервными отростками и тучными клетками, эозинофилами или плазматическими клетками в собственная пластинка тощей кишки. Лаборатория Инвест 1990;62: 626–34. [PubMed] [Google Scholar] 14. Алвинг К., Сандстрем С., Матран Р., Панула П., Хокфельт Т., Лундберг Дж. М.Связь между тучными клетками, содержащими гистамин, и чувствительные нервы в коже и дыхательных путях контрольные и обработанные капсаицином свиньи. Сотовые Ткани Res 1991 год; 264: 529–38. [PubMed] [Google Scholar] 15. Форсайт П., Биненшток Дж. Функциональная единица тучных клеток и нервов: ключевой компонент физиологические и патофизиологические реакции. Химия Иммунол Аллергия 2012;98: 196–221. [PubMed] [Google Scholar] 16. Кит И.М., Джин Дж., Сабан Р. Взаимодействие нервно-тучных клеток в моче нормальной морской свинки мочевой пузырь. Дж Комп Нейрол 1995; 363: 28–36.[PubMed] [Google Scholar] 17. Ван Нассау Л., Адриансен Д., Тиммерманс Дж. П. Двунаправленная связь между нейронами и мачтой клеток желудочно-кишечного тракта. Автон Неврологи 2007; 133:91–103. [PubMed] [Google Scholar] 18. Д’Андреа М.Р., Сабан М.Р., Джерард Н.П., Вершил Б.К., Сабан Р. Отсутствие экспрессии рецептора нейрокинина-1 влияет на ткань количество тучных клеток, но не их пространственное соотношение с нервы. Am J Physiol Regul Integr Comp Физиол 2005; 288: Р491–500. [PubMed] [Google Scholar] 19. Стед Р.Х., Диксон М.Ф., Брамвелл Н.Х., Ридделл Р.Х., Биненшток Дж.Тучные клетки тесно связаны с нервами человека. слизистая желудочно-кишечного тракта. Гастроэнтерология 1989; 97: 575–85. [PubMed] [Google Scholar] 20. Stead RH, Tomioka M, Quinonez G, Simon GT, Felten SY, Bienenstock J. Тучные клетки слизистой оболочки кишечника в норме и кишечник крыс, зараженных нематодами, находится в тесном контакте с пептидергическими нервы. Proc Natl Acad Sci U S A 1987 год; 84:2975–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]21. Уильямс Р.М., Бертоуд Х.Р., Стед Р.Х. Афферентные нервные волокна блуждающего нерва контактируют с тучными клетками крысы. слизистая тонкой кишки.Нейроиммуномодуляция 1997;4: 266–70. [PubMed] [Google Scholar] 22. Хагияма М., Фуруно Т., Хосокава Ю., Иино Т., Ито Т., Иноуэ Т. и др. Усиленное взаимодействие нерва и тучных клеток за счет короткой изоформы нейронов молекулы клеточной адгезии-1. Дж Иммунол 2011;186:5983–92. [PubMed] [Google Scholar] 23. Фуруно Т., Хагияма М., Секимура М., Окамото К., Судзуки Р., Ито А. и др. Молекула клеточной адгезии 1 (CADM1) на тучных клетках способствует взаимодействие с нейритами ганглия задних корешков путем гетерофильного связывания с нектин-3. J Нейроиммунол 2012; 250:50–8.[PubMed] [Google Scholar] 24. Барбара Г., Ван Б., Стангеллини В., де Джорджио Р., Кремон С., Ди Нардо Г. и др. Зависимое от тучных клеток возбуждение висцерально-ноцицептивной сенсорной нейронов при синдроме раздраженного кишечника. Гастроэнтерология 2007; 132:26–37. [PubMed] [Google Scholar] 25. Мун Т.К., Сен-Лоран К.Д., Моррис К.Е., Марсет С., Йошимура Т., Секар Ю. и др. Достижения в области биологии тучных клеток: новое понимание гетерогенности и функция. Иммунол слизистых оболочек 2010;3:111–28. [PubMed] [Google Scholar] 26. Какурай М., Монтефорте Р., Суто Х., Цай М., Накаэ С., Галли С.Дж.Фактор некроза опухоли тучных клеток может способствовать удлинение нервных волокон в коже при контактной гиперчувствительности в мышей. Ам Джей Патол 2006; 169:1713–21. [Бесплатная статья PMC] [PubMed] [Google Scholar]27. Торнтон М.А., Акаше Н., Уолш М.Т., Молони М., Шихан П.О., Смит К.М. и соавт. Рекрутирование эозинофилов в носовые нервы после заражения аллергеном при аллергическом рините. Клин Иммунол 2013;147:50–7. [PubMed] [Google Scholar] 28. Савацки Д.А., Кингхэм П.Дж., Корт Э., Кумаравел Б., Фрайер А.Д., Джейкоби Д.Б. и др. Адгезия эозинофилов к холинергическим нервам через ICAM-1 и VCAM-1 и связанная с этим дегрануляция эозинофилов.Ам Дж Physiol Lung Cell Мол Физиол 2002; 282: L1279–88. [PubMed] [Google Scholar] 29. Omori Y, Andoh T, Shirakawa H, Ishida H, Hachiga T, Kuraishi Y. Связанные с зудом ответы нейронов заднего рога на кожная аллергическая стимуляция у мышей. Нейроотчет 2009; 20: 478–81. [PubMed] [Google Scholar] 30. Potenzieri C, Meeker S, Undem BJ. Активация бронхолегочных С-волокон мышей серотонин и аллерген-овальбумин. Дж Физиол 2012 г.; 590 (точка 21): 5449–59. [Бесплатная статья PMC] [PubMed] [Google Scholar]31.Катерина М.Дж., Шумахер М.А., Томинага М., Розен Т.А., Левин Д.Д., Юлиус Д. Рецептор капсаицина: активируемый нагреванием ионный канал в болевой путь. Природа 1997 год; 389: 816–24. [PubMed] [Google Scholar] 32. Jordt SE, Bautista DM, Chuang HH, McKemy DD, Zygmunt PM, Hogestatt ED, et al. Горчичное масло и каннабиноиды возбуждают чувствительные нервные волокна через канал ГТО АНКТМ1. Природа 2004; 427: 260–5. [PubMed] [Google Scholar] 33. Shim WS, Tak MH, Lee MH, Kim M, Koo JY, Lee CH и другие. TRPV1 опосредует вызванный гистамином зуд посредством активации фосфолипаза А2 и 12-липоксигеназа.Дж Неврологи 2007; 27: 2331–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]34. Suh YG, Oh U. Активация и активаторы TRPV1 и их фармацевтическое значение. Карр Фарм Дес 2005; 11: 2687–98. [PubMed] [Google Scholar] 36. Тейлор-Кларк Т.Е., Ундем Б.Дж., Макглашан Д.В. младший, Гатта С., Карр М.Дж., МакАлександер М.А. Простагландин-индуцированная активация ноцицептивных нейронов через прямое взаимодействие с переходным рецепторным потенциалом A1 (ТРПА1). Мол Фармакол 2008; 73: 274–81. [PubMed] [Google Scholar] 37. Динг-Пфеннигдорф Д., Авербек Б., Михаэлис М.Стимуляция PAR-2 возбуждает и сенсибилизирует крыс. кожные С-ноцицепторы к теплу. Нейроотчет 2004;15:2071–5. [PubMed] [Google Scholar] 38. Хонг Дж.Л., Хо С.И., Квонг К., Ли Л.И. Активация легочных С-волокон аденозином в анестезированные крысы: роль аденозиновых рецепторов A1. Дж Физиол 1998; 508 (Пл 1): 109–18. [Бесплатная статья PMC] [PubMed] [Google Scholar]39. Тейлор-Кларк Т.Е., Нассенштейн С., Ундем Б.Дж. Лейкотриен D(4) повышает возбудимость чувствительные к капсаицину носовые чувствительные нервы к электрическим и химическим раздражители.Бр Дж Фармакол 2008; 154:1359–68. [Бесплатная статья PMC] [PubMed] [Google Scholar]40. Кремон С., Карини Г., Ван Б., Васина В., Коглиандро Р.Ф., Де Джорджио Р. и др. Высвобождение серотонина в кишечнике, активация сенсорных нейронов и боли в животе при синдроме раздраженного кишечника. Ам Дж Гастроэнтерол 2011 г.; 106:1290–8. [PubMed] [Google Scholar]41. Пеллег А, Хёрт СМ. Механизм действия АТФ на легочный блуждающий нерв собак C волокна нервных окончаний. Дж Физиол 1996;490(Пт 1): 265–75. [Бесплатная статья PMC] [PubMed] [Google Scholar]42.Киркап А.Дж., Цзян В., Баннетт Н.В., Гранди Д. Стимуляция активируемого протеиназой рецептора 2 возбуждает тощекишечных афферентных нервов у анестезированных крыс. Дж Физиол 2003 г.; 552 (Пл 2): 589–601. [Бесплатная статья PMC] [PubMed] [Google Scholar]43. Колдвелл Дж. Р., Филлис Б. Д., Сазерленд К., Ховарт Г. С., Блэкшоу Л. А. Повышенная реактивность толстой кишки крысы splanchnic афференты к 5-HT после воспаления и восстановления. Дж Физиол 2007; 579 (т. 1): 203–13. [Бесплатная статья PMC] [PubMed] [Google Scholar]44. Эглезос А., Леччи А., Сантичоли П., Джулиани С., Трамонтана М., Дель Бьянко Э. и др.Активация первичных афферентов, чувствительных к капсаицину, у крыс. мочевого пузыря соединением 48/80: прямое действие на сенсорные нервы? Arch Int Pharmacodyn Ther 1992; 315: 96–109. [PubMed] [Google Scholar]45. Undem BJ, Hubbard W, Weinreich D. Иммунологически индуцированная нейромодуляция морской свинки узловатых ганглиозных нейронов. J Auton Nerv Syst 1993;44: 35–44. [PubMed] [Google Scholar]46. Грин Р., Фаулер Дж., МакГлашан Д. младший, Вайнрайх Д. Тучные клетки легких человека, зараженные IgE, возбуждают блуждающий нерв чувствительных нейронов in vitro.J Appl Physiol 1988;64: 2249–53. [PubMed] [Google Scholar]47. Риччио М.М., Майерс АС, Ундем Б.Дж. Иммуномодуляция афферентных нейронов морской свинки изолированные дыхательные пути. Дж Физиол 1996;491(Пл 2): 499–509. [Бесплатная статья PMC] [PubMed] [Google Scholar]48. Jiang W, Kreis ME, Eastwood C, Kirkup AJ, Humphrey PP, Grundy D. 5-HT(3) и гистаминовые H(1) рецепторы опосредуют афферентные чувствительность нервов к кишечной анафилаксии у крыс. Гастроэнтерология 2000; 119:1267–75. [PubMed] [Google Scholar]49. Ли Л.И., Мортон Р.Ф. Гистамин усиливает реакцию вагусных легочных С-волокон на капсаицин и вздутие легких.Дыхание Физиол 1993; 93: 83–96. [PubMed] [Google Scholar]50. Чжан Г., Лин Р.Л., Виггерс М.Е., Ли Л.И. Сенсибилизирующие эффекты хронического воздействия и острого ингаляции аэрозоля овальбумина на легочные С-волокна в крысы. J Appl Physiol 2008; 105:128–38. [Бесплатная статья PMC] [PubMed] [Google Scholar]51. Ю С, Колларик М, Оуян А, Майерс А.С., Ундем Б.Дж. Опосредованное тучными клетками длительное увеличение возбудимость С-волокон блуждающего нерва в пищеводе морской свинки. Am J Physiol Gastrointest Liver Physiol 2007; 293:G850–6. [PubMed] [Google Scholar]52.Gu Q, Lim ME, Gleich GJ, Lee LY. Механизмы индуцирования главным основным белком эозинофилов гипервозбудимость вагусных легочных химиочувствительных нейронов. Am J Physiol Lung Cell Mol Physiol 2009; 296:L453–61. [Бесплатная статья PMC] [PubMed] [Google Scholar]53. Фишер А., МакГрегор Г.П., Сария А., Филиппин Б., Куммер В. Индукция экспрессии гена тахикинина и пептида в морская свинка нодозирует первичные афферентные нейроны из-за аллергической реакции дыхательных путей воспаление. Джей Клин Инвест 1996; 98: 2284–91. [Бесплатная статья PMC] [PubMed] [Google Scholar]54.Lieu TM, Myers AC, Meeker S, Undem BJ. Индукция TRPV1 в вагусных путях низкопороговая механосенсорные нейроны при провокации аллергеном и нейротрофическом факторы. Am J Physiol Lung Cell Mol Physiol 2012; 302:L941–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]55. Bonini S, Lambiase A, Levi-Schaffer F, Aloe L. Фактор роста нервов: важная молекула при аллергических реакциях. Воспаление и ремоделирование тканей. Арка Аллергия Иммунол 1999; 118:159–62. [PubMed] [Google Scholar]56. Нокхер В. А., Ренц Х. Нейротрофины и астма: новое понимание нейроиммунных взаимодействие.J Аллергия Клин Иммунол 2006; 117: 67–71. [PubMed] [Google Scholar]57. Цвайфель Л.С., Курувилла Р., Гинти Д.Д. Функции и механизмы ретроградного нейротрофина сигнализация. Нат Рев Нейроски 2005; 6: 615–25. [PubMed] [Google Scholar]58. Лиу Т., Колларик М., Майерс А.С., Ундем Б.Дж. Экспрессия рецепторов лигандов семейства нейротрофинов и GDNF в подтипах блуждающего нерва, иннервирующего дыхательные пути взрослой морской свинки тракт. Am J Physiol Lung Cell Mol Physiol 2011;300: L790–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]59.Сурденикова Л., Ру Ф., Нассенштейн С., Татар М., Колларик М. Афференты, полученные из нервного гребня и плакод иннервация пищевода мыши. Нейрогастроэнтерол Мотил 2012; 24:e517–25. [PubMed] [Google Scholar] 60. Майерс А.С., Каекар Р., Ундем Б.Дж. Индуцированная аллергическим воспалением продукция нейропептидов в быстро адаптирующиеся афферентные нервы дыхательных путей морской свинки. Am J Physiol Lung Cell Mol Physiol 2002; 282: L775–81. [PubMed] [Google Scholar]61. Чуайчу Б., Хантер Д.Д., Майерс А.С., Колларик М., Ундем Б.Дж. Аллерген-индуцированный синтез вещества Р в чувствительные нейроны, иннервирующие легкие.Дж Аллергия Клин Иммунол 2005; 116: 325–31. [PubMed] [Google Scholar]62. Нойманн С., Дубелл Т.П., Лесли Т., Вульф С.Дж. Воспалительная болевая гиперчувствительность, опосредованная фенотипическое переключение в миелинизированных первичных сенсорных нейронах. Природа 1996; 384:360–4. [PubMed] [Google Scholar]63. Чжан Г., Лин Р.Л., Виггерс М., Сноу Д.М., Ли Л.И. Измененная экспрессия TRPV1 и чувствительность к капсаицину в легочных миелинизированных афферентах после хронического воспаления дыхательных путей в крыса. Дж Физиол 2008; 586 (т. 23): 5771–86. [Бесплатная статья PMC] [PubMed] [Google Scholar]64.Сильвер Р., Сильверман А.Дж., Виткович Л., Ледерхендлер II. Тучные клетки в головном мозге: доказательства и функционал значение. Тренды Нейроси 1996; 19:25–31. [PubMed] [Google Scholar]65. Kreis ME, Muller M, Zittel TT, Glatzle J, Grundy D. Медиаторы активации нейронов в стволе головного мозга крысы после кишечной анафилаксии. Неврологи латынь 2000; 289:45–8. [PubMed] [Google Scholar]67. Маццоне С.Б., Мори Н., Каннинг Б.Дж. Синергические взаимодействия между афферентным нервом дыхательных путей подтипы, регулирующие кашлевой рефлекс у морских свинок.Дж Физиол 2005;569(Пт 2): 559–73. [Бесплатная статья PMC] [PubMed] [Google Scholar]68. Маццоне С.Б., Каннинг Б.Дж. Синергические взаимодействия между афферентным нервом дыхательных путей подтипы, опосредующие рефлекторный бронхоспазм у морских свинок. Am J Physiol Regul Integr Comp Physiol 2002; 283: R86–98. [PubMed] [Google Scholar]69. Татар М., Плевкова Ю., Брозманова М., Пекова Р., Колларик М. Механизмы кашля при риносинусит. Пульм Фармакол Тер 2009;22:121–6. [PubMed] [Google Scholar]70. Chen CY, Bonham AC, Schelegle ES, Gershwin LJ, Plopper CG, Joad JP.Продолжительное воздействие аллергена на астматических обезьян вызывает нейропластичность ядра одиночного пути. Дж Аллергия Клин Иммунол 2001; 108: 557–62. [PubMed] [Google Scholar]71. Undem BJ, Hubbard WC, Christian EP, Weinreich D. Тучные клетки в верхнем шейном ганглии морской свинки: функциональная и гистологическая оценка. Джей Автон Нерв Сист 1990; 30:75–87. [PubMed] [Google Scholar]72. Myers AC, Undem BJ, Weinreich D. Влияние антигена на свойства мембран цесарки. нейронов бронхиального ганглия свиньи.J Appl Физиол 1991;71: 970–6. [PubMed] [Google Scholar]73. Бишофф С.К., Гебхардт Т. Роль тучных клеток и эозинофилов в нейроиммунной взаимодействия, регулирующие воспаление слизистой оболочки при воспалении кишечника болезнь. Adv Exp Мед Биол 2006; 579: 177–208. [PubMed] [Google Scholar]74. Каекар Р., Ундем Б.Дж., Майерс АС. Роль активации циклооксигеназы и простагландинов в антиген-индуцированные изменения возбудимости бронхиальных парасимпатических ганглиев нейроны. Am J Physiol Lung Cell Mol Physiol 2003;284: L581–7. [PubMed] [Google Scholar]75.Вайнрайх Д., Ундем Б.Дж. Иммунологическая регуляция синаптической передачи у изолированные вегетативные ганглии морской свинки. Джей Клин Вкладывать деньги 1987; 79: 1529–32. [Бесплатная статья PMC] [PubMed] [Google Scholar]76. Undem BJ, Myers AC, Weinreich D. Антиген-индуцированная модуляция вегетативной и сенсорной нейроны в пробирке. Приложение Int Arch Allergy Иммунол 1991 год; 94:319–24. [PubMed] [Google Scholar]78. Cyphert JM, Kovarova M, Allen IC, Hartney JM, Murphy DL, Wess J, et al. Кооперация между тучными клетками и нейронами необходима для антиген-опосредованная бронхоконстрикция.Дж Иммунол 2009; 182:7430–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]79. Вайнрайх Д., Ундем Б.Дж., Леал-Кардосо Д.Х. Функциональные эффекты активации тучных клеток в симпатические ганглии. Энн Н.Ю. Академия наук 1992; 664: 293–308. [PubMed] [Google Scholar]80. Шеманн М., Мишель К., Церегжин М., Зеллер Ф., Зайдл С., Бишофф С.К. Коктейль медиатора тучных клеток человека возбуждает нейроны в кишечная нервная система человека и морской свинки. Нейрогастроэнтерол Мотил 2005; 17: 281–9. [PubMed] [Google Scholar]81. Лю С., Ху Х.З., Гао Н., Гао С., Ван Г., Ван Х и др.Нейроиммунные взаимодействия в желудке морской свинки и кишечник. Am J Physiol Gastrointest Печень Физиол 2003; 284:G154–64. [PubMed] [Google Scholar]82. Фрилинг Т., Кук Х.Дж., Вуд Д.Д. Нейроиммунная связь в подслизистом сплетении толстой кишки морской свинки после сенсибилизации к молочному антигену. Am J Physiol 1994 год; 267:G1087–93. [PubMed] [Google Scholar]83. Бюнер С., Ли К., Бергер Т., Виньяли С., Барбара Г., Де Джорджио Р. и др. Подслизистые, а не миэнтеральные нейроны активируются слизистой оболочкой. супернатанты биопсии пациентов с синдромом раздраженного кишечника.Нейрогастроэнтерол Мотил 2012;24: 1134–e572. [PubMed] [Google Scholar]84. Breunig E, Michel K, Zeller F, Seidl S, Weyhern CW, Schemann M. Гистамин возбуждает нейроны в подслизистом сплетении человека через активацию рецепторов h2, h3, h4 и h5. Дж Физиол 2007; 583: 731–42. [Бесплатная статья PMC] [PubMed] [Google Scholar]85. Кристиан Э.П., Ундем Б.Дж., Вайнрайх Д. Эндогенный гистамин возбуждает нейроны морской свинки. верхний шейный ганглий in vitro. Дж Физиол 1989;409: 297–312. [Бесплатная статья PMC] [PubMed] [Google Scholar]86.Фрайер А.Д., Уиллс-Карп М. Дисфункция М2-мускариновых рецепторов в легких парасимпатических нервов после введения антигена. Дж Аппл Физиол 1991;71:2255–61. [PubMed] [Google Scholar]87. Костелло Р.В., Эванс К.М., Йост Б.Л., Бельмонте К.Е., Глейх Г.Дж., Якоби Д.Б. и др. Антиген-индуцированная гиперреактивность к гистамину: роль блуждающего нерва нервы и эозинофилы. Am J Physiol Lung Cell Mol Физиол 1999; 276:L709–14. [PubMed] [Google Scholar]88. Пан Дж., Род Х.К., Ундем Б.Дж., Майерс АС. Нейромедиаторы в парасимпатических нейронах дыхательных путей изменен нейротрофином-3 и повторным введением аллергена.Am J Respir Cell Мол Биол 2010;43:452–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]89. Берарди Н., Пиццоруссо Т., Маффеи Л. Критические периоды во время сенсорного разработка. Курр Опин Нейробиол 2000; 10: 138–45. [PubMed] [Google Scholar]90. Визель Т.Н., Хьюбел Д.Х. Степень восстановления после воздействия визуальных лишай у котят. J Нейрофизиол 1965; 28: 1060–72. [PubMed] [Google Scholar]91. Руда М.А., Линг К.Д., Хохманн А.Г., Пэн Ю.Б., Татибана Т. Измененные ноцицептивные нейронные цепи после новорожденных периферическое воспаление.Наука 2000;289: 628–31. [PubMed] [Google Scholar]92. Аль-Чаер ЭД, Кавасаки М, Пасрича ПДж. Новая модель хронической висцеральной гиперчувствительности у взрослых крыс, индуцированных раздражением толстой кишки в постнатальном периоде. разработка. Гастроэнтерология 2000; 119:1276–85. [PubMed] [Google Scholar]93. Ву З.С., Хантер Д.Д., Киш В.Л., Бендерс К.М., Бэтчелор Т.П., Дей Р.Д. Пренатальное и раннее, но не позднее постнатальное воздействие мышей в сторону от табачного дыма увеличивает гиперреактивность дыхательных путей позже в жизни. Перспектива охраны окружающей среды 2009; 117:1434–40.[Бесплатная статья PMC] [PubMed] [Google Scholar]94. Хантер Д.Д., Каррелл-Джекс Л.А., Бэтчелор Т.П., Дей Р.Д. Роль фактора роста нервов в индуцированных озоном нейронах реакции в раннем постнатальном развитии дыхательных путей. Являюсь J Respir Cell Мол Биол 2011;45:359–65. [Бесплатная статья PMC] [PubMed] [Google Scholar]95. Макаллистер А.К., Кац Л.С., Ло Д.К. Нейротрофины и синаптическая пластичность. Анну Рев Нейроски 1999; 22: 295–318. [PubMed] [Google Scholar]96. Сарин С., Ундем Б., Санико А., Тогиас А. Роль нервной системы в ринит.J Аллергия Клин Иммунол 2006; 118: 999–1016. [PubMed] [Google Scholar]97. Шустерман Д.Дж., Мерфи М.А., Балмс М.Р. Субъекты с сезонным аллергическим ринитом и неринитным субъекты по-разному реагируют на назальную провокацию хлором газ. J Аллергия Клин Иммунол 1998; 101: 732–40. [PubMed] [Google Scholar]98. Ревицкий Д.А., Лейди Н.К., Бреннан-Димер Ф., Томпсон С., Тогиас А. Разработка и предварительная проверка многоатрибутный индекс полезности симптомов ринита. Качество Жизнь Рез 1998; 7: 693–702. [PubMed] [Google Scholar]механизмов, лежащих в основе нейронных симптомов аллергия
J Allergy Clin Immunol.Авторская рукопись; Доступен в PMC 2019 APR 25.
Опубликовано в окончательной редактированной форме AS:
PMCID: PMC6483074
NIHMSID: NIHMS1021746
Bradley J. Undem
A NOME Отдел аллергии и клинической иммунологии Джонс Медицинская школа Хопкинса, Балтимор
Томас Тейлор-Кларк
b Кафедра молекулярной фармакологии и физиологии, Медицинский колледж Морсани, Университет Южной Флориды, Тампа.
a Отделение аллергии и клинической иммунологии, Джонс Медицинская школа Хопкинса, Балтимор
b Кафедра молекулярной фармакологии и физиологии, Медицинский колледж Морсани, Университет Южной Флориды, Тампа.
Автор, ответственный за переписку: Брэдли Дж. Ундем, доктор философии, отделение аллергии. и клинической иммунологии, Медицинская школа Джона Хопкинса, 5501 Хопкинс Bayview Circle, Baltimore, MD 21224. ude.imhj@mednub. См. другие статьи в PMC, в которых цитируется опубликованная статья.Abstract
Лица с аллергией с симптомами, которые часто являются результатом изменения в нервной системе. Нейрональные симптомы зависят от органа при которой возникает аллергическая реакция, но она может включать покраснение глаз, зуд, чихание, заложенность носа, ринорея, кашель, бронхоспазм, выделение слизи из дыхательных путей секреция, дисфагия, нарушение перистальтики желудочно-кишечного тракта и зуд, отек кожи. Эти симптомы возникают из-за того, что медиаторы, высвобождаемые во время аллергической реакции, могут взаимодействуют с чувствительными нервами, изменяют обработку в центральной нервной системе, и изменяют передачу симпатических, парасимпатических и энтеральных вегетативных нервы.Кроме того, данные подтверждают идею о том, что у некоторых субъектов это нейромодуляция по малопонятным причинам активируется таким образом, что одинаковая степень нервного раздражения вызывает больший эффект, чем у здоровых предметы. Существуют различия в механизмах и типах нервов, участвующих в аллерген-индуцированная нейромодуляция в различных системах органов, но в целом появились принципы. Продукты активированных тучных клеток, др. воспалительные клетки, а резидентные клетки могут открыто стимулировать нервные окончания, вызывают длительные изменения возбудимости нейронов, повышают синаптическую эффективность, а также изменяют экспрессию генов в нервах, что приводит к фенотипически измененным нейроны.Лучшее понимание этих процессов может привести к новым терапевтические стратегии, направленные на ограничение страданий людей с аллергии.
Ключевые слова: Аллергия, аллерген, тучные клетки, IgE, дегрануляция, нервные, афферентные, эфферентные, вегетативные, сенсорные, ноцицепторные, С-волокна, парасимпатические, симпатические, кишечные, миентеральные, одиночное ядро, ионный канал, деполяризация, потенциал действия, кашель, зуд, боль, рефлекс, подвижность, бронхоспазм, дисфункция, воспаление, кожа, легкие, дыхательные пути, кишечник, глаза, гиперсекреция, противовоспалительное, стероиды, блуждающий нерв, задние корешки, тройничный, узловатый, яремный, ганглии, взаимодействие тучных клеток и нервов, симптомы, транзиторные потенциальные каналы рецепторов, медиаторы тучных клеток, гистамин, простагландин, лейкотриен, цитокин, раздражитель, рецептор, иннервация, пластичность, критические периоды, фенотипический переключатель Балтимор, Мэриленд, Тампа, Флорида
Аллергия следствие гиперреакции иммунной системы, вызванной IgE. что в противном случае было бы относительно безобидным стимулом.Клинически аллергия проявляется характеризуется симптомами, которые в основном являются вторичными по отношению к измененной нервной системе. Набор нейрональных симптомов зависит от органа, в котором возникает реакция, но может включать зуд и покраснение глаз; ринорея, заложенность носа и чихание; призывать кашель, одышка, выделение слизи из дыхательных путей и эпизодический рефлекторный бронхоспазм; дисфагия, измененная моторика желудочно-кишечного тракта и дискомфорт; и кожный зуд и воспаление ответы. Эти события либо в сумме , либо частично вторичны по отношению к изменение активности нейронов.Поэтому аллергию можно охарактеризовать как иммунно-нейронное расстройство ().
Нейромодуляция при аллергической реакции. Экспериментальные исследования in vivo и ex vivo подтверждают гипотезу что аллергическая реакция может включать нейромодуляцию сенсорных (афферентный) – ЦНС – вегетативная/кишечная нервная ось (см. текст для Детали). Нейромодуляция в конечном итоге приводит ко многим симптомам аллергическое заболевание. DRG , Ганглий задних корешков.
Иммунологи преобладают среди заинтересованных в изучении механизмов аллергии.За последние несколько десятилетий ученые добились огромного прогресса в распутывая сложную паутину, составляющую иммунологическую основу аллергии. Это включает в себя как афферентные (сенсибилизация), так и эфферентные (рекрутирование воспалительных клеток и активация) конечности ответа. Результаты этих расследований наполняют фармацевтические конвейеры с рациональными, умными и захватывающими терапевтическими стратегиями направлена на купирование воспаления, связанного с аллергической реакцией.
Однако можно утверждать, что иммунное воспаление, связанное с Аллергические реакции в некоторых случаях могут быть тривиальными, если только они не трансдуцированы в нейрогенные реакции. симптомы страдания (например, зуд, кашель, бронхоспазм, нарушение моторики, боль, чихание, кожные заболевания).Тем не менее, несмотря на то, что противовоспалительный конвейер при аллергии терапия изобилует активностью, антинейромодуляторный конвейер в значительной степени пустой. Это может быть связано с недостаточным вниманием, уделяемым нейронам. аспект этого иммунно-нейронного расстройства.
Здесь мы попытались сделать обзор литературы, которая дает представление о том, как нервная система поражается аллергической реакцией. Ограничения по площади не позволяют исчерпывающий обзор этой литературы, и поэтому вместо основных примеров выбраны раскрыть некоторые из наиболее фундаментальных принципов нейромодуляции, вызванной аллергеном.Мы не рассматривали клиническую научную литературу, в которой исследовалась нейрональная симптомы аллергии, мы также не касались вопроса о роли высших мозговых центров (эмоции и стресс) на аллергическую реакцию. Мы также в значительной степени избегали связанных важные аспекты взаимодействий тучных клеток и нервов, которые происходят независимо от немедленная реакция гиперчувствительности, а также литература, относящаяся к Механизмы, с помощью которых нервная система может модулировать иммунный ответ. Скорее у нас есть здесь основное внимание уделялось основным механистическим исследованиям нейромодуляции, вызванной аллергией. даст читателю представление о периферических неврологических субстратах аллергии.
ОБЩИЕ ПРИНЦИПЫ СЕНСОРНО-ВЕГЕТНОЙ ИННЕРВАЦИИ
Чувствительные (афферентные) нервы ощущают местное тканевое окружение. 1 Их периферические нервные окончания «свободны» и не образуют синапсов с другими нервами. Вместо этого эти периферийные синапсы сенсорных окончаний с местной тканевой средой. Периферический сенсорный терминали экспрессируют различные рецепторы и ионные каналы, которые трансдуцируют окружающую среду. сигналы в электрические сигналы (т. е. действие потенциалы ).В висцеральной и соматосенсорной системах стимулы включают прикосновение и другие механические воздействия, температуру, рН, осмолярность и различные химические раздражители. Потенциалы действия проводят вдоль аксона в центре, мимо тела клетки, которое находится в определенном периферическом ганглий (дорсальные корешковые ганглии, блуждающие узловые ганглии, блуждающие яремные ганглии, или ганглии тройничного нерва) и в центральную нервную систему (ЦНС), где сигнал транспонируется в нейротрансмиттер выброс в синапс нерва с центральными нейронами второго порядка.
Чувствительные нервы гетерогенны в отношении чувствительности к раздражителям (т.е. экспрессия рецептора), размер, миелинизация, скорость проведения и нейропептид и содержание нейротрансмиттеров. Однако в целом чувствительные нервы делятся на 2 основные категории: те, которые были специально адаптированы для обнаружения рутинных физиологических раздражители (например, осязание, слух, обоняние, умеренная температура, изменения артериального давления и т. осмолярность) и те, которые обнаруживают вредные или потенциально вредные стимулы, такие как физические повреждения, химические раздражители и сильные изменения рН.
Шеррингтон 2 был первым специально описать эти последние типы нервов в своей знаменитой книге, Интегративное действие нервной системы . 2 Он отметил, что большое количество чувствительные нервы в коже активировались только нефизиологической стимуляцией вредный характер. Он назвал эти специализированные чувствительные нервы «ноцицепторы» и предположил, что «…что при селективном адаптации, они придают коже, так сказать, специфическое чувство собственного травмы. 2 Как правило, ноцицепторы представляют собой немиелинизированные медленно проводящие нервы небольшого диаметра. называются С-волокнами (А- и В-волокна миелинизированные , быстропроводящие нервы). Сейчас известно, что чувствительные нервы внутренних органов также содержат С-волокна, Определение ноцицепторов по Шеррингтону.
Сигналы (потенциалы действия), исходящие от этих первичных афферентных нервов интегрированы в ЦНС, где конечным следствием может быть либо сознательное восприятия (например, боль, спазмы, зуд, одышка или позывы к кашлю или чиханию) или подсознательная активация преганглионарных вегетативных нейронов, тем самым инициируя симпатическая, парасимпатическая и кишечные рефлексы.В коже ноцицептор активация приводит к зуду и боли. В дыхательных путях активация Ноцицепторы вызывают чихание, кашель, одышку, рефлекторный бронхоспазм и выделения. В кишечнике активация ноцицепторов может привести к секреции, диарее, желудочный дискомфорт и висцеральные боли. 1,3-6 Другими словами активация этих нервов приводит к сильным ощущениям и/или рефлексам, направленным на избегание раздражителя. Как мы обсудим более подробно ниже, ноцицепторы являются наиболее подтипом афферентных нервов. чувствителен к стимуляции вторичной острой аллергической реакцией.
Вегетативная и кишечная нервная система зависит от синаптической связи между пресинаптическими и постсинаптическими элементами, расположенными в симпатических, парасимпатические и энтеральные ганглии. В большинстве органов эфферентная нервная регуляция осуществляется пресинаптическими нейронами, исходящими из ЦНС. Преганглионарный нерв является возбуждаются в ЦНС, а потенциалы действия проводятся по преганглионарным аксонов, которые в конечном итоге образуют синапсы с нейронами вегетативных ганглиев. Должно Имейте в виду, что эти ганглии представляют собой не простые ретрансляционные станции, а места, где происходит фильтрация и интеграция входных данных ЦНС.Это может иметь значение при аллергии потому что тучные клетки обычно связаны с симпатическими, парасимпатическими и кишечные ганглии (как мы обсудим ниже). В кишечнике, в частности, также является автономным эфферентным контролем, который не зависит от нервной системы ЦНС. обработка. В этом случае чувствительный нерв, обнаруживающий раздражение в локальной Окружающая среда может передавать эту информацию непосредственно в близлежащие эфферентные кишечные нейронов через локальные афферентно-эфферентные синапсы. Это называется местный «периферический рефлекс.Нейроны кишечного ганглия общаются через внутриганглионарная передача. Периферические рефлексы могут встречаться и в других внутренних органах. органов, таких как дыхательные пути и желчный пузырь, хотя и не в такой степени. наблюдается в желудочно-кишечном тракте. 7,8
В некоторых органах нейропептидсодержащие афферентные С-волокна могут непосредственно регулируют функцию органов независимо от ЦНС или эфферентных вегетативных или энтеральные нейроны через локальные «аксонные рефлексы». 9 В этом случае потенциал действия, возникающий в окончание периферического сенсорного нерва проводится центрально, пока не достигнет бифуркацию, а затем антидромно проводит обратно к другим периферическим окончаниям того же нерва, где он вызывает высвобождение сенсорных нейропептидов, таких как вещество Р, нейрокинин А и пептид, родственный гену кальцитонина (CGRP).выпущенный пептиды могут привести к отеку, расширению сосудов, сокращению гладкой мускулатуры и релаксация, рекрутирование и активация иммунных клеток. Общее последствие аксонные рефлексы часто называют «нейрогенными». воспаление.» 9 Степень проявления нейрогенного воспаления зависит от вида и органа. За Например, у людей доказательства нейрогенного воспаления сильнее выражены у людей. кожи и слизистой оболочки носа, чем в нижних дыхательных путях. 10
ОСНОВНЫЕ МЕХАНИЗМЫ АЛЛЕРГЕН-ИНДУЦИРОВАННОЙ НЕЙРОМОДУЛЯЦИИ
Аллергический ответ включает изменения на всех 3-х уровнях нервной дуги: функция сенсорного нерва, интеграция ЦНС и вегетативная/энтеральная нейроэффекторная клетка функция ().Эти изменения могут быть подразделяются на острые изменения (явная активация нервов, которая длится только до тех пор, пока раздражитель присутствует), более длительные изменения в нейровозбудимость которая может пережить раздражитель на часы или дней, а еще более стойкие фенотипические изменения могут длиться неделями и возможно, если принять во внимание идею «критического периоды», годами.
Морфологические аспекты
Аллергическая реакция особенно хорошо влияет на изменение функционируют в коже и внутренних тканях.Вероятно, это связано с закрытием связь между нервными волокнами и тучными клетками (). 11,12 Тучные клетки были анатомически связан с нервами практически во всех системах органов в лаборатории животные и человеческие предметы. 11,13-17 Процент тучных клеток, делающих значимые ассоциации с нервами зависят от расстояния, которое человек считает значимым. В мочевом пузыре, например, утверждается, что более 75% тучного клетки находятся достаточно близко к нервным волокнам для значимого двунаправленного связь, 18 и в желудочно-кишечном тракте человека считалось, что от 50% до 70% тучных клеток находиться в тесном контакте с нейритами. 19 Имеются убедительные доказательства того, что тучные клетки действительно производят синаптические контакты с нервами, но это верно только для небольшого подмножества тучных клеток. 20,21 Интимный синаптический контакты между нервом и тучными клетками могут быть индуцированы или усилены за счет специфической адгезии молекулы, такие как молекула клеточной адгезии 1. 22 В экспериментальных системах тучных клеток-сенсорных нервные контакты, связь между нервом и тучными клетками ингибировалась блокированием гетерофильное связывание между тучными клетками и экспрессируемой клеточной адгезией молекула 1 и нектин 3 локализованы в нерве. 23
Тучные клетки находятся в непосредственной близости от нервов практически во всех органы. A, Триптазоположительные клетки тучных клеток ( красный ) вблизи PGP9.5-положительных нервов ( зеленый ) в подслизистом сплетении кишечника человека. 11 B, Тучные клетки ( красный ) вблизи синапсин-положительных нейронов ( зеленый ) в желудочке сердца крысы. 12 C, Тучные клетки ( фиолетовый ) рядом с экспрессией MrgA3 «афферентные зудящие нервы» ( оранжевый ) в коже мыши (личное наблюдение).
Тучные клетки чаще располагаются близко к нервам, не образуя истинных контакты. Анатомическая связь между тучными клетками и нервами становится даже более распространены в очагах воспаления 20,24,25 Были предложены механизмы для объяснения склонность к ассоциациям тучных клеток и нервов, включая высвобождение нейротрофические факторы и цитокины тучными клетками, которые способствуют удлинению нервов вблизи тучных клеток. 26 При аллергическом воспалении инфильтративное эозинофилы также часто связаны с нервами. 27 В дыхательных путях могут быть эозинофилы притягивается к вегетативным холинергическим нейронам как следствие нейронального сосудистого белок клеточной адгезии 1 и молекула межклеточной адгезии 1 выражение. 28 На С другой стороны, тщательный морфометрический анализ показал, что аксоны тонких нервов и терминали в различных тканях также обычно связаны не только с тучными клетками и эозинофилами, но также и с другими клетками костного мозга, такими как как плазматические клетки, и эти «ассоциации», по-видимому, не благоприятствуют один тип клеток над другим. 13 Этот тип анализа позволяет сделать вывод, что нервные ветви, тучные клетки и другие клетки, происходящие из костного мозга, часто концентрируются в одном и том же участке ткани, что делает почти уверенным, что они будут, в смысл, «колокализовать» случайно. Тучные клетки вместе с вегетативные и чувствительные нервы часто находятся в непосредственной близости от микроциркуляторном русле, в слизистой и подслизистой оболочках внутренних органов, вблизи гладкой мышц и всей дермы.
Независимо от механизмов анатомические исследования, особенно при оценивая целые препараты ткани, часто выявляют впечатляющее отображение мачты клетки, расположенные вдоль афферентных, вегетативных и энтеральных ветвей нерва (12).Эти изображения не оставляют сомнений в том, что многие, если не большинство, нервных волокон в тканях находятся в сфере влияния медиаторов, высвобождаемых тучными клетками. Каким может быть это влияние, так это обсуждаются ниже.
Аллерген-индуцированная нейромодуляция афферентных (чувствительных) нервов
Разряд потенциала действия.
Заражение аллергеном часто связано с явной активацией афферентные нервные окончания, приводящие к разрядке потенциала действия (). 29,30 Обычно считается, что типы сенсорных нервы, наиболее восприимчивые к прямой активации через медиаторы аллергии, полимодальные С-волокна.Это связано с тем, что афферентные С-волокна экспрессируют рецепторы ко многим химическим медиаторам, присутствующим в аллергическом воспалении. ткань. Часто эти нервы можно точно классифицировать как ноцицепторы.
Воздействие аллергена открыто активирует афферентные С-волокна. Top , Гипотетический эффект аллергенной активации мачты клетки на окончание афферентного нерва разряжают потенциал действия. Нижний , Примеры аллерген-индуцированной активации афферентных ноцицепторы: осталось , аллерген (овальбумин) вызывает сильные активация вагусных яремных С-волокон, иннервирующих легкое (потенциалы действия регистрируется в блуждающем нервном узле) 30 ; право , аллерген (экстракт комаров) индуцирует активацию соматосенсорных зудящих волокон в коже (действие потенциалы, регистрируемые в задних рогах). 29
Окончание сенсорного нерва активируется при воздействии определенного раздражителя на специфические рецепторы или ионные каналы в мембране нерва, что приводит к деполяризация мембраны. Эта деполяризация называется «генератором потенциал». Если потенциал генератора имеет достаточную величину, то активирует потенциалзависимые натриевые каналы, что, в свою очередь, приводит к действию потенциальный разряд (, вверху). То частота потенциалов действия «все или ничего» пропорциональна амплитуде генераторного потенциала.
Афферентные С-волокна обычно экспрессируют члены временного рецептора потенциальное (TRP) семейство ионных каналов. Два канала TRP, которые кажутся важное значение в аллергических реакциях имеют транзиторный рецепторный потенциал ваниллоида 1 (TRPV1) и транзиторный рецепторный потенциал анкиринового повтора 1 (TRPA1). Когда эти каналы открыты, они обеспечивают путь для притока катионов (натрий и кальций), что приводит к генераторным потенциалам величин достаточно для достижения порога разрядки потенциала действия. 31,32 TRPV1 стимулируется несколькими уместными механизмами к аллергической реакции. Эти стимулы включают агонисты Gq-связанных GPCR, такие как рецептор брадикинина 2 и рецептор гистамина h2; закисление местной среды нервных окончаний; и определенные липоксигеназные продукты семейства эйкозаноидов медиаторов воспаления. 33,34 TRPA1 есть также активируется механизмами, имеющими отношение к аллергии. С-волокна в дыхательных путях стимулируются через TRPA1 различными медиаторами окислительного стресса, включая активные формы кислорода (например, H 2 O 2 ) и продукты перекисного окисления липидов (например, 4-гидроксиноненаль и 4-оксононеналь) и нитрование (9-нитроолеат). 35 Метаболиты мачты клеточный простагландин D 2 (PGD 2 ) также сильно активируют С-волокна, вторичные по отношению к воротам TRPA1. 36
В дополнение к каналам TRPV1 и TRPA1, которые могут интегрировать многие различных раздражителей, афферентные С-волокна также экспрессируют рецепторы для специфических медиаторы, связанные с аллергическим ответом, включая рецепторы АТФ (P2X2 и P2X3), аденозиновые рецепторы (A1 и A2A), 5-HT рецепторы (5HT-3 и 5HT2), цистеиниллейкотриеновые рецепторы (CysLT1), триптаза и трипсин (рецепторы, активируемые протеазами 2 и 1). 37-43
На основе основ фармакологии полимодального афферентного нерва волокна (обычно, но не исключительно С-волокна), она не должна удивительно, что активация тучных клеток приведет к их явной активации. Это наблюдается во многих органах, включая дыхательные пути, кожу, желудочно-кишечный тракт и мочевой пузырь. 24,29,30,43,44 Примеры разряда потенциала действия С-волокон в ответ на острый аллерген вызов иллюстрируется в . Один можно рационально предположить, что С-волокна также будут стимулироваться медиаторами прибывающих на поздней стадии аллергических реакций, когда клеточный начинается воспалительная реакция.
Изменения сенсорной возбудимости.
Чувствительные нервы могут возбуждаться независимо от стимулов, вызывающих генераторные потенциалы. Открытие или закрытие различных ионных каналов (обычно каналы утечки или потенциалзависимые каналы) могут вызывать электрофизиологические эффекты, приводящие к повышенной возбудимости нерва по отношению к активирующему раздражителю. в Говоря языком иммунологии, мы могли бы сказать, что нервные окончания некоторые медиаторы воспаления. Медиаторы, ассоциированные с аллергией, такие как гистамин, PGD 2 , цистеиниллейкотриен D 4 , серотонин и брадикинин, банка снижают активность некоторых калиевых каналов, что приводит к увеличению резистентности афферентного нерва и последующее увеличение электрическая возбудимость. 39,45,46 Цистеиниллейкотриен D 4 стимулирующий рецепторы цистеиниллейкотриена 1 в нейронах С-волокон тройничного нерва ганглии явно не активируют нерв, но повышают его возбудимость такая частота разряда потенциала действия в ответ на другой активирующий стимул значительно усиливается. 39
Заражение аллергеном и высвобождение медиатора тучных клеток в сенсибилизированном trachea ex vivo явно не активирует ноцицептивную Aδ воздействует на кашлевые нервы, но вместо этого снижает порог их активации до механический раздражитель (). 47,48 В нижних дыхательных путях медиаторы аллергии, в т.ч. гистамин, может повышать возбудимость некоторых С-волокон до точки что механическое нарушение эвнейального дыхания приводит к их активация. 49,50 Иммунологическая активация Тучные клетки в кишечнике повышают возбудимость спинномозговых афферентных нервов так, что одно и то же кратковременное механическое растяжение приводит к гораздо более длительный разряд афферентных нервов (). 48 Точно так же активация тучных клеток приводит к выраженному увеличению механическая чувствительность С-волокон блуждающего нерва в пищеводе. 51 Кинетика повышение возбудимости афферентных нервов вследствие активации аллергеном Тучные клетки могут быть довольно стойкими, сохраняясь в течение нескольких часов после острого активация тучных клеток. Продукты активированных эозинофилов также могут способствуют повышению возбудимости афферентных нервов в местах аллергических воспаление. 52
Аллерген-индуцированное повышение возбудимости чувствительных нервов. А, Узловые окончания Aδ «кашляющих» волокон у морской свинки трахея; повышенная чувствительность к механической стимуляции этого типа волокон после введения аллергена (овальбумина). 47 B, Многокомпонентная запись афферентных нервов кишечника, демонстрирующая заметно усиленный (пролонгированный) ответ на вздутие после аллергена (овальбумин) вызов. 48
Активация и/или увеличение окончания афферентного нерва возбудимость встречается так часто в разрозненных тканях и экспериментальных систем, что это можно рассматривать как принципиальный результат активации тканевые тучные клетки. В общих чертах, явная активация С-волокна приводит к ощущения и рефлексы, соответствующие органу, воспринимающему опасный раздражитель и реагировать таким образом, чтобы попытаться уменьшить воздействие этого стимул.Как обсуждалось выше, в зависимости от ткани активация ноцицепторы могут в конечном итоге привести к позывам к кашлю или чиханию, рефлекторным бронхоспазм, выделения, зуд, нейрогенные воспалительные реакции, которые способствуют возникновению волдырей и воспалений, висцерального дискомфорта и изменений в моторика желудочно-кишечного тракта и мочевого пузыря. Кроме того, если чувствительный нерв вызывают гипервозбудимость медиаторы аллергии, а затем подпороговые раздражители и даже безобидные рутинные раздражители могут вызвать эти ноцицептор-ассоциированные рефлексы.
Фенотипические изменения.
Термин «фенотипическое изменение» имеет расплывчатое определение, но в настоящее время контексте мы имеем в виду нейромодуляцию, которая происходит на уровне экспрессия генов.
У взрослых афферентные нервные окончания в крупных дыхательных путях на расстоянии более 10 000 диаметров клетки от тела и ядра клетки. И все же это Понятно, что местные аллергические реакции в дыхательных путях могут привести к изменению экспрессия генов в отдаленных афферентных нейронах блуждающего нерва тела. 53,54 Наиболее вероятно объяснение этому состоит в том, что аллергическая реакция может привести к выработке и высвобождение нейротрофических факторов в локальной среде нерва терминалы. Имеются убедительные доказательства того, что повышенная продукция нейротрофинов возникает при аллергической реакции во всех тканях. 55,56 Аллергические реакции могут привести непосредственно к выделению нейротрофические факторы из тучных клеток, а также вторичные по отношению к стимуляции других клеток ткани, таких как эпителий дыхательных путей.
Нейротрофические факторы, представленные фактором роста нервов (NGF), могут связываться с высоким сродством к родственным рецепторам (например, тирозинкиназе рецептор [TRK] A) на мембранах нервных окончаний. Это приводит к интернализация комплекса NGF-TRKA, который затем транспортируется через аксональные транспортные механизмы возвращаются на большие расстояния к телу клетки, где это влияет на экспрессию генов. NGF относится к семейству нейротрофинов нейротрофические факторы, которые также включают нейротрофический фактор головного мозга и нейротрофины 3 и 4. 57 Помимо нейротрофинов, еще одно семейство нейротрофические факторы, называемые глиальным нейротрофическим фактором (GDNF) семейные лиганды (GFL) также могут иметь отношение к аллергическим реакция. 54 GFL включают GDNF, нейтурин, артемин и персефин.
Влияние нейротрофических факторов на фенотипические изменения афферентные нейроны, иннервирующие дыхательные пути, будут зависеть от репертуара рецепторы нейротрофического фактора, экспрессируемые нервами. Например, почти все афферентные нервы дыхательных путей экспрессируют GFRa1 и Ret, рецепторы для GDNF.Нейроны блуждающего нерва экспрессируют TRKB, TRK для роста головного мозга. фактор и нейротрофин 4, тогда как спинальные С-волокна и блуждающий яремный С-волокна обычно экспрессируют TRKA, рецептор NGF. 58,59
Вдыхание аллергена приводит к усилению экспрессии генов участвует в производстве тахикининов , такие как вещество P и CGRP. 53 Интересно, что после заражения аллергеном большой диаметр миелинизированные неноцицепторные нейроны А-волокна, которые в норме не экспрессируют эти мощные нейропептиды начинают синтезировать и транспортировать пептиды к своим центральные и периферийные терминалы. 60,61 Прочее словами, в нейропептиде происходит «фенотипический переключатель». иннервация аллергическо воспаленной ткани. Этот эффект можно повторить с экзогенными нейротрофинами. Этот тип фенотипического переключения также был наблюдается в соматосенсорных нервах после болезненного воспаления. 62
Существует также фенотипическое переключение, когда речь идет об экспрессии Каналы TRP в сенсорных нервах дыхательных путей. Экспрессия TRPV1, рецептор капсаицина, обсуждавшийся выше, ограничивается ноцицептивными С-волокнами в здоровые ткани.Вдыхание аллергена крысами или морскими свинками приводит к экспрессия TRPV1 в кашлевых нервах Aδ, а также в Aβ низкопороговые механосенсоры (оба быстродействующие адаптирующиеся и медленно адаптирующиеся подтипы рецепторов). 54,63 Подробнее исследования в этой области необходимы для определения молекулярных механизмов лежащие в основе фенотипических изменений, вызванных аллергеном, но ранние исследования подтверждают потенциальное участие как нейротрофинов, так и GFL в отклик. 54
Примеры сенсорной нейропластичности, вызванной аллергеном. Top , RT-PCR из отдельных нейронов ретроградно прослеживается из трахеи. В примере показаны 12 нейронов морских свинок, получавших контрольное лечение. и 16 нейронов из овальбумина (OVA) — обработанных морских свинок. Гистограммы показывают процент узловых нейронов, специфичных для трахеи, в каждом группы лечения, которые экспрессируют мРНК TRPV1. Воздействие аллергена (овальбумина) вызывает экспрессия de novo TRPV1 в узловой дозе Aδ «кашлевые» волокна, иннервирующие трахею (от Lieu et al. 54 ). Низ , Заражение аллергеном индуцирует de novo чувствительность к капсаицину у волокна легкого быстро адаптирующегося рецептора (RAR) , которые были характеризуется их фазовой реакцией во время дыхания (RARph) . ΔFA , Разница в обжиге Мероприятия. Используется с разрешения Zhang et al. 63 ** P < 0,01.
В целом, исследования сенсорной модуляции, вызванной аллергеном, поддерживают гипотеза о том, что в местах аллергической реакции интенсивное количественное нарастание залпов потенциала действия, возникающих в центральные окончания афферентных С-волокон в ЦНС (и в ганглии).Это происходит вторично по отношению к явной активации С-волокна. клеммы, а также обобщенный «затравочный» эффект повышается их электрическая возбудимость. Кроме того, также будет соответствующие качественные изменения в профиле активации А-волокон, и поскольку эти нервы начинают экспрессировать сенсорные нейропептиды, это может измениться. рефлекторные последствия их активации. Эти аллерген-сенсорные нервные взаимодействия могут быть острыми и кратковременными, но могут сохраняться и длительное время. после первичной аллергической реакции.
Аллерген-индуцированная модуляция нейронов ЦНС
Тучные клетки обнаружены в мозге всех видов, которые были оценивается, 64 но доказательства прямой активации этих клеток, вызванной аллергеном, отсутствуют. Это кажется более вероятным, что аллергические реакции косвенно модулируют нейроны ЦНС. путем создания ситуации, в которой существует интенсивное, а в некоторых случаях устойчивое повышение активности ноцицепторов, возникающее вследствие явной активации, и повышение возбудимости, как описано выше.Это приводит к увеличению высвобождение нейротрансмиттера/нейропептида из центрального окончания афферентного нервы в синапс нейронов ЦНС второго порядка, расположенных в дорсальной рог спинного мозга для спинномозговых афферентных нервов и в стволе мозга в пределах ядро одиночного тракта блуждающих афферентных нервов. 65 В случае фенотипических изменений Нейроны ЦНС могут модулироваться пептидами, такими как CGRP и субстанция P, высвобождаемыми от неноцицептивных нервов. В любом случае высвобождение пептидов и медиатора от центральных окончаний афферентных нервов могут быть приведены в движение события которые приводят к увеличению синаптической эффективности нейронов ЦНС, процесс часто называют «центральной сенсибилизацией».” 66
Когда нейроны ЦНС становятся сенсибилизированными, последствия данного количество афферентного входа может быть усилено и даже качественно изменено. Доказательства подтверждают концепцию, согласно которой центральная сенсибилизация может способствовать феномен аллодинии (при котором обычно безболезненный раздражитель, такой как нежное расчесывание волос и активация сенсорных Aβ-волокон, приводит к неадекватной боли). 66 Аналогично, многие с аллергией на аэроаллергены испытывают то, что можно было бы назвать «аллотуссивностью», при которой ощущение постоянные позывы к кашлю присутствуют, даже когда в дыхательных путях ничего нет кашлять, или постоянное желание чихнуть, когда ничего физического находится в носовом проходе.У экспериментальных животных было зарегистрировано что активация С-волокон блуждающего нерва дыхательных путей (что может активация) приводит к ситуации, при которой стимуляция А-волокон трахеи вызывает кашель с интенсивностью раздражителя, которая обычно намного меньше, чем нормальный кашлевой порог. 67 Точно так же стимуляция С-волокон может посредством центральной сенсибилизирующей взаимодействия, усиливают парасимпатический драйв к дыхательному тракт. 68 В обоих случаях это происходит за счет передатчиков, высвобождаемых из центральных окончаний С-волокон, повышение эффективности нейронов, иннервируемых А-волокнами (конвергенция А-волокна и С-волокна на нейроны второго порядка).Клинически значимый аспект центральной сенсибилизации заключается в том, что она обеспечивает механизм, посредством которого аллергическая реакция в одном месте может повлиять на физиологию в другом месте. Например, стимуляция С-волокон в гортани может усилить парасимпатическую привод к периферическим дыхательным путям. Активация С-волокон в пищеводе (например, во время кислотный рефлюкс) может привести к позывам к кашлю за счет усиления синаптической активности А-волокон в трахее. Попадание аллергена в нос может привести к центральному сенсибилизация кашлевых нервов нижних дыхательных путей. 69 Это повышает вероятность того, что кашель, связанный с гастроэзофагеальный рефлюкс не является вторичным по отношению к микроаспирации веществ в дыхательных путей и что кашель, связанный с назальной аллергией, не обязательно вторично по отношению к «постназальному затеканию» и прямой активации кашля нервов, так как это связано с центральной сенсибилизацией кашлевого пути конвергенция ноцицепторов пищевода и носа.
Идея центральной сенсибилизации при аллергии поддерживается элегантным исследования с молодыми взрослыми макаками-резусами. 70 После сенсибилизации к клещу домашней пыли обезьяны неоднократное воздействие аэрозолем, содержащим клещей домашней пыли. Приблизительно через 5–6 месяцев электрическая возбудимость ствола мозга нейроны в ядре солитарного тракта были оценены и оказались сильно активизирован; их реакция на данный входной стимул была намного сильнее, чем у аналогичных нейронов у неаллергичных обезьян (14). 70
Вызванное аллергеном повышение электрической возбудимости нейронов ЦНС. Верх , Стволовое расположение ядра солитарной тракт. A, Микрофотография защемленного нейрона в головном мозге срез от каудомедиального ядра солитарного тракта, где чувствительные афференты блуждающего нерва заканчиваются. B, Цельноклеточный пластырь-зажим регистрации импульсов деполяризующего тока, воздействующих на отдельные ядра одиночные нейроны тракта от наивного или зараженного аллергеном (пылевой клещ) резуса обезьяны. C, Повышенный разряд потенциала действия в ответ на деполяризующий стимул в нейронах, выделенных от аллергичных обезьян. 70
Трансмиттеры и молекулярные механизмы, лежащие в основе центральной сенсибилизации многообразны и выходят за рамки данного обзора. Как долго центральная сенсибилизация сохраняется за пределами воспалительной реакции, открыта для дебаты. Тем не менее, представляется рациональным сделать вывод на основе имеющихся доказательства того, что аллергическая реакция может привести к ноцицепторному вводу в ЦНС (ствол мозга или задний рог), который повышает чувствительность синаптической передачи в нем. Это может привести к резкому снижению ощущений и рефлексов. неадекватно соответствует инсульту, присутствующему в периферических аллергических воспаленные ткани.
Аллергическая модуляция эфферентных (вегетативных и кишечных) нервов
Активация и изменение синаптической эффективности.
Тучные клетки обычно располагаются близко к нейронам внутри кишечные, симпатические и парасимпатические ганглии. 11,71,72 Нейроны внутри этих ганглиев получают синаптические входы от преганглионарных вегетативных нейроны с телами клеток в ЦНС. В частности, энтеральный ганглий может также функционируют автономно посредством внутриганглионарной синаптической передачи.Когда тучные клетки, расположенные вблизи вегетативных ганглиев, стимулируются, это приводит к существенному увеличению «синаптической эффективности». Это сказать, что постганглионарный выход увеличивается относительно данного преганглионарный вход. Эти ганглии являются первыми участками периферических интеграция эфферентной информации, поступающей от ЦНС. Поэтому изменения в синаптической эффективности в этих местах может оказывать мощное воздействие на ЦНС. контроль за работой органов. Кроме того, изменение активности нейрона внутри кишечных ганглиев также может изменить характеристики автономное функционирование желудочно-кишечного тракта. 73
Аллерген-индуцированное увеличение синаптической эффективности может наблюдаться электрофизиологически в бронхиальных парасимпатических ганглиях, расположенных преимущественно в трахее и крупных бронхах. Поступления от ЦНС часто приводят к потенциалы возбуждения, которые являются подпороговыми для разряда потенциала действия в постганглионарных нейронах. После активации аллергеном близлежащей мачты клетки, усиливается синаптическая эффективность и фильтрующая способность ганглий потерян (). 71,74-76 постганглионарные нейроны в этих ганглиях обеспечивают доминирующий контроль напряжение гладких мышц не только в крупных дыхательных путях, но и на всем протяжении вниз по дереву дыхательных путей к мелким бронхиолам.Поэтому изменения в фильтрация, которая может происходить вторично по отношению к активации тучных клеток в более крупных дыхательные пути могут иметь большое влияние на калибр дыхательных путей на всем протяжении бронхов. дерево. У мышей эта тучная клетка-парасимпатический холинергический нерв взаимодействие ответственно почти за все дыхательные пути, вызванные аллергеном. сужение. 77,78
Аллерген-индуцированное повышение синаптической эффективности в вегетативных ганглиях. A, Малый парасимпатический бронхиальный ганглий морской свинки бронх.Отдельный нейрон, заполненный пероксидазой хрена и нарисованный с помощью показана техника камеры lucida. Парасимпатический нейрон синаптическая эффективность в ответ на стимуляцию преганглионарных нервов (шок артефакт) значительно увеличивается после воздействия аллергена (яичного альбумина). 76 фВПСП , Быстрые возбуждающие постсинаптические потенциалы. B, Динамика высвобождения гистамина и верхнешейного синаптическая эффективность ганглиев (величина потенциала действия постганглионарных соединений) во время провокации аллергеном (овальбумином). 75
В отличие от парасимпатических ганглиев симпатические ганглии большие и очень удобно для изучения синаптической передачи. В течение нескольких минут аллерген-индуцированная активация тучных клеток в верхнем шейном ганглии или чревном ганглии, наблюдается выраженное увеличение синаптической эффективности, часто приводит к удвоению постганглионарного выброса. 75,79 Потенцирование синаптической эффективности тучными клетками активация не является кратковременным событием. Как и при повышении возбудимости афферентных нервных окончаний, синаптическая потенциация, вызванная аллергеном, может сохраняются в течение многих часов после острой активации тучных клеток.Пример разницы в продолжительности увеличения синаптической эффективности по сравнению с Высвобождение гистамина в симпатическом ганглии показано на рис.
Особое значение имеет пищевая аллергия, иммунологическая активация Тучные клетки в кишечнике обычно связаны с изменениями в нейротрансмиссия в кишечных ганглиях, тем самым изменяя активность секретомоторных нейронов подслизистой оболочки. 4,6 Тучные клетки особенно богаты в подслизистом сплетении человека по сравнению с миэнтеральное сплетение. 11 Медиаторы, высвобождаемые при IgE-зависимой активации тучных желез кишечника человека клетки непосредственно возбуждают кишечные нейроны в подслизистой оболочке морских свинок и человеческие предметы (). 80,81 Модель морской свинки с пищевой (молочной) аллергией элегантно показывает, что аллергенная активация тучных клеток увеличивает и модулирует синаптическая эффективность подслизистых нейронов в толстой и тонкой кишке (). 81,82
Аллерген-индуцированная стимуляция кишечных нейронов. А, Внутриклеточная запись нейрона подслизистого сплетения, выделенного из морская свинка демонстрирует деполяризацию нейронов до порога потенциала действия после вызов молочного аллергена. 81 B, Регистрация потенциала действия нейрона в подслизистом слое сплетения кишечника человека. Потенциалы действия вызывались в ответ на обработка супернатантом анти-IgE-активированного человеческого тучные клетки кишечника. Используется с разрешения Schemann et al. 80
Медиаторы и ионные механизмы, лежащие в основе увеличения вегетативная и энтеральная синаптическая активность многочисленна и зависит от того, какой изучается специфический ганглий. Гистамин является особенно неразборчивым медиатор, когда дело доходит до модуляции синаптической активности в ганглиях, с потенциально задействованы все 4 гистаминовых рецептора.Тем не менее, ясно что гистамин не единственный виновник. Многие медиаторы аллергии было показано, что он изменяет вегетативную и энтеральную передачу, включая мастопатию. клеточные медиаторы, такие как серотонин, PGD 2 , активирующие тромбоциты фактора и триптазы. 6,17,73,79,83,84 . Индуцированное аллергеном усиление синаптической передачи может происходят как через пресинаптические, так и постсинаптические механизмы действия. Там является доказательством того, что активация тучных клеток приводит к увеличению количества нейротрансмиттеров. (обычно ацетилхолин), высвобождаемый из пресинаптических окончаний в течение заданного времени. количество стимула. 85 данные также подтверждают гипотезу о том, что нейротрансмиттер в синапс стимулирует более возбудимый постсинаптический нейрон из-за общего повышение сопротивления нейронов и электрической возбудимости государство. 4,76,85 Независимо от ионных механизмов относительно последовательным открытием в исследованиях синаптической передачи является тот, в котором Разряд потенциала действия для данного количества пресинаптического входа равен постоянно усиливается. У восприимчивых субъектов это может быть повышено до степень возникновения серьезных симптомов (например, тяжелый бронхоспазм, выделение слизи секреция, желудочно-кишечные спазмы и боль, диарея и нарушение регуляции подвижности).
Заражение аллергеном также может привести к увеличению вегетативной нервной системы. высвобождение нейротрансмиттера из постганглионарных периферических окончаний в заданное количество стимула. Это наблюдается при постганглионарных окончаний парасимпатических холинергических нервов, иннервирующих гладкую мускулатуру дыхательных путей и объясняется эозинофильно-опосредованным снижением мускариновой Функция рецептора М2 на нервных окончаниях. 86,87 Эти рецепторы М2 являются ингибирующими «ауторецепторы» и служат для ограничения высвобождения ацетилхолина по цепи отрицательной обратной связи.
Фенотипические изменения вегетативных нервов.
Как и в случае с первичными афферентными нервами, аллерген-индуцированные фенотипические изменения вегетативных нейронов. Как обсуждалось выше вегетативные нервы, иннервирующие дыхательные пути, в основном парасимпатические. Парасимпатическая ветвь обеспечивает как сократительную (холинергическую) регуляцию гладкой мускулатуры дыхательных путей и релаксант (нитрергический/вазоактивный кишечный пептид) контроль. У морских свинок неоднократно вызывали аллерген вдохе произошло фенотипическое переключение, так что вазоактивный нейроны кишечного пептида/оксида азота начали превращаться в холинергические синтез фенотипа. 88 В Другими словами, баланс между сократительной и релаксантной иннервацией был меняется в пользу первого. Вероятно, это объясняется аллерген-индуцированная продукция нейротрофинов в дыхательных путях, нейротрофин 3 является потенциальным виновником.
Концепция модуляции в критические периоды
До этого момента доклинические исследования в поддержку нашего обсуждения проводили у взрослых или молодых взрослых животных. Аллерген-индуцированный нейромодуляция часто довольно глубокая, но ожидается, что она продлится в течение сроки от минут до недель.Рискуя закончить этот обзор на чрезмерно спекулятивной ноте, стоит рассмотреть потенциальную роль «критического периоды» в нейромодуляции, вызванной аллергеном, потому что эти изменения могут сохраняться годами и даже всю жизнь.
Хорошо известно, что развитие сенсорных систем часто требует активности, зависящей от использования, в раннем возрасте. 89 Во время постнатального сенсорного нерва развития, существует определенное окно времени, в течение которого нервы восприимчивы к этой зависящей от опыта пластичности.До или после определенного окно времени, тот же самый опыт не влияет на развитие нейронов. Таким образом, например, если молодое животное лишается зрения из-за закрытия век (или различных другие методы), происходят изменения в нейронных цепях зрительной коры, приводит к тяжелой и необратимой потере остроты зрения. 90 Это происходит, только если зрение депривация происходит в критический период времени. Даже длительное зрение депривация после критического периода не влияет на остроту зрения.То точное время критического периода зависит от изучаемой системы. Поскольку эти новаторские исследования, критические периоды были определены в аудио и соматосенсорной системы и были отмечены практически у всех видов от человека Дрозофила . 89
Недавние сообщения подтверждают концепцию о том, что пластичность чувствительных нервов в критические периоды раннего возраста может привести к стойкие изменения в соматосенсорных и вагусно-сенсорных нервных цепях.Руда и др. al 91 воспаление одной задней ноги лапу крысят с использованием полной модели адъюванта Фрейнда. Выставлены щенки стереотипное поведение, свидетельствующее о боли в лапе. Что еще более важно, было значительное увеличение плотности первичных афферентных нервов в ипсилатеральный задний рог спинного мозга. Это изменение плотности нейронные цепи в ЦНС сохранялись после воспаления и продолжались до совершеннолетие. Поведенческие исследования показали, что взрослые крысы, которые испытали лапу воспаление, так как новорожденные были значительно более гипералгетичны в ответ на последующие воспалительные стимулы, чем контрольные крысы.Авторы пришли к выводу, что «периферическое воспаление, возникающее в период новорожденности, долгосрочные последствия для ноцицептивных нейронных цепей».
Аналогичные выводы делаются в отношении висцеральной нервной гиперчувствительность. Давно известно, что воспаление толстой кишки лабораторных животных приводит к гиперчувствительности нейронов и чрезмерному и аномальная рефлекторная физиология кишечника (в чем-то аналогичная дыхательным путям). гиперреактивность бронхиальной астмы). Когда толстые кишки крыс были химически или механическое раздражение через 8-21 день после рождения, воспалительная реакция была вызывали афферентную нервную гипервозбудимость и состояние повышенной висцеральная рефлексия.Эти изменения повышенной возбудимости чувствительных нервов сохранялись. помимо воспаления кишечника, длящегося не менее 3 месяцев (самое долгое время анализируемая точка). Напротив, если толстая кишка крыс воспалилась после на 21-й день после рождения (вне критического периода) гиперрефлексии не было. настойчивый. 92 Аналогично, воздействие сигаретного дыма на животных во время послеродового критического состояния. связан с постоянным повышением гиперреактивности дыхательных путей и плотность чувствительных нервов. 93 Так как в соматосенсорной модели боли, так и в висцерально-сенсорной модели боли. гиперрефлексия, воспаление в критический период постнатального развития вызывали аномалии в сенсорной нейросхеме, которые сохранялись, возможно, до совершеннолетие.
Причина, по которой это может быть связано с аллергическим воспалением в раннем возрасте заключается в том, что нейротрофины участвуют в нескольких моделях аллергических воспалений (а также вирусных инфекций) и этот критический период сенсорной пластичность нерва зависит от продукции нейротрофических факторы. 94,95 Аллергическое (или инфекционное) воспаление в поэтому критические периоды повышают вероятность того, что воспалительная реакция может оставить после себя нервную систему, слегка измененную много лет спустя, таким образом, легкое воспалительное поражение может привести к чрезмерно преувеличенным ответы.
ВЫВОДЫ
Среди совокупности симптомов, характеризующих аллергическую реакцию, многие, если не большинство, являются вторичными по отношению к изменениям в нервной системе. В зависимости от органа, в котором происходит реакция, эти симптомы, основанные на нейронах, включают слезотечение, раздражение глаз и расширение сосудов, ринорея, заложенность носа, чихание, постоянные позывы к кашлю, стеснение в груди, бронхоспазм, выделения из дыхательных путей, дисфагия, изменения моторики желудочно-кишечного тракта, зуд и волдыри и приливы реакции.В этом смысле аллергия является иммуно-нейронным расстройством.
Активация тучных клеток и последующая эозинофильная Воспаление, вызванное T H 2, может привести к глубоким изменениям функции афферентных нейронов, нейронов ЦНС и симпатических нейронов. парасимпатические и энтеральные ганглии. Эти изменения включают острое явное активация нервов, длительное повышение их возбудимости и даже длительно сохраняющиеся фенотипические изменения в нервной системе.
Больше, чем тот факт, что люди с аллергией вырабатывают нейроактивные медиаторы в участки аллергического воспаления, кажется, что сама нервная система изменены при аллергических заболеваниях.То ли из-за событий, происходящих во время критических периоды в развитии нейронов или просто из-за постоянной активации нервов, нервная система становится гиперактивной у многих пациентов с аллергическими заболеваниями. В клинических условиях это измененное состояние нейронов легко наблюдать, когда концентрация нейроактивного медиатора, которая в норме не действует на здоровых предметов приводит к ощущениям и рефлексам у людей с аллергией. Это легко проявляется, например, у пациентов с аллергическим ринитом: концентрация Стимулятор С-волокна (например, брадикинин или капсаицин), который не действует при применении на слизистая носа здорового человека вызывает сильное чихание и рефлекторное парасимпатические холинергические сокращения при воздействии на кого-то с аллергией ринит. 96 Шустерман и др. al 97 обнаружил, что назальный Воздействие низких концентраций газообразного хлора приводит к более сильным реакциям у пациентов с сезонный аллергический ринит, чем у здоровых лиц контрольной группы. Эти данные подтверждают клинические наблюдения, на которые обычно жалуются пациенты с аллергическим ринитом. преувеличенные носовые симптомы, вызванные различными сильными запахами и дымом, а также изменения атмосферных условий. В анкете, представленной в рамках протокол скрининга 350 пациентов с аллергическим ринитом, 60% указали курение как один из триггеров назальных симптомов, 58% перечислили другие раздражители, а 47% перечислили холодный воздух.Эти проценты были еще выше у добровольцев с многолетними по сравнению с сезонный аллергический ринит. 98
В настоящее время наше понимание специфических медиаторов, ионных каналов и сигнальные пути, участвующие в аллерген-индуцированной нейромодуляции, остаются на прежнем уровне. относительно рудиментарное состояние. Можно предположить, что наше понимание эти основные механизмы продолжают развиваться, появляются новые терапевтические стратегии, нацеленные на нервная система будет продолжать развиваться, работая синергетически с противовоспалительные стратегии, будут служить для подавления страданий тех, у кого иммунно-нейронное расстройство, которое мы называем аллергией.
ГЛОССАРИЙ
ПОТЕНЦИАЛ ДЕЙСТВИЯ: Нервное волокно млекопитающего в состоянии покоя находится в состоянии электроотрицательности из-за градиентов концентрации ионов и мембранных проницаемость для определенных ионов. Потенциал действия включает резкие изменения мембранный потенциал, который быстро распространяется по длине мембраны нервного волокна. Нормальный отрицательный мембранный потенциал покоя изменяется внезапно (в течение нескольких 10 000 секунды) до положительного потенциала (деполяризация), а затем обратно до отрицательный потенциал (реполяризация).События, вызывающие увеличение мембраны потенциал от электроотрицательности к нулевому уровню запускает потенциалзависимую натриевую каналы начинают открываться, вызывая дальнейшее увеличение мембранного потенциала и большее открытие потенциалзависимых натриевых каналов до тех пор, пока не будут открыты все каналы. Затем калиевые каналы начинают открываться, а натриевые каналы закрываться, что приводит к прекращение потенциала действия.
ЦИСТИНИЛЛЕЙКОТРИЕНА D 4 (LTD 4 ): LTD 4 связывается с рецептором цистеиниллейкотриена (CysLT) 1 и CysLT2.CysLT1 способствует сокращению гладкой мускулатуры бронхов и регулирует различные аспекты иммунная система. Монтелукаст противодействует CysLT1.
СЕМЕЙСТВО ЭЙКОЗАНОИДОВ: Класс липидов, полученных из полиненасыщенные жирные кислоты (например, арахидоновая кислота), которые опосредуют воспаление.
ENTERIC: Нервная система, за исключением желудочно-кишечного тракта тракт. Энтеральная система содержит около 100 миллионов нейронов, т. сопоставимо с количеством нейронов в спинном мозге.Он содержит внешний (мышечно-кишечное) сплетение и внутреннее (подслизистое) сплетение. Симпатический и парасимпатический нервы соединяются с этими 2 сплетениями. Кишечные нервы выделяют различные нейротрансмиттеры, в том числе ацетилхолин, норадреналин, серотонин, дофамин, вещество Р и вазоактивный интестинальный полипептид.
МЕХАНОСЕНСОРЫ: Сенсорный рецептор, обнаруживающий механические сдавление или растяжение рецептора или прилегающих тканей. Дыхательная мышца механосенсоры передают афферентные импульсы к нейронам продолговатого мозга, а также сенсорная кора.
МИЕЛИНИРОВАННЫЕ: Нервные волокна с аксонами, окруженными миелином оболочка. Шванновские клетки обволакивают аксоны и многократно вращаются вокруг аксона, создавая слои мембраны, содержащие липидное вещество сфингомиелин. Сфингомиелин действует в качестве электрического изолятора и способен уменьшать поток ионов через мембрана примерно в 5000 раз. Неизолированные контакты между шванновскими клетками называется узлом Ранвье. Потенциалы действия «прыгают» от узла к узлу для увеличения скорости передачи нерва в миелинизированных волокнах.
НЕЙРОТРАНСМИТТЕР: Химическое вещество, выделяемое нейронами, которое вызывает передачу сигнала в синапсах ЦНС. Большинство синапсов участвуют в сигнале ЦНС передачи осуществляются химическими синапсами. Нейромедиатор связывается с мембранным рецептором белков следующего нейрона для возбуждения, торможения или изменения чувствительности нейрон. Существует более 40 нейротрансмиттеров, в том числе ацетилхолин, норадреналин, гистамин, серотонин и гамма-аминомасляная кислота.
ПАРАСИМПАТИЧЕСКИЕ: Нервные волокна вегетативной нервной системы которые выходят из ЦНС через черепные нервы III, VII, IX и X, а также спинномозговые крестцовые нервы.Большинство парасимпатических нервов находится в блуждающих нервах (черепной нерв ИКС). Парасимпатические нервы также содержат преганглионарные и постганглионарные нейроны. Большинство парасимпатических постганглионарных нейронов являются холинергическими.
АКТИВНЫЕ ФОРМЫ КИСЛОРОДА (АФК): Обычно образующиеся вещества с низкой частотой при окислительном фосфорилировании в митохондриях, а также в ряде других клеточных реакций. АФК могут оказывать клеточное повреждение, реагируя с внутриклеточными компонентами, такими как ДНК и мембранные липиды.
СИМПАТИЧЕСКИЕ: Нервные волокна вегетативной нервной системы, которые берут начало в спинном мозге между Th1 и L2. Сначала они переходят в паравертебральные цепочки ганглиев и далее к тканям и органам. Каждый симпатический нерв состоит преганглионарного нейрона и постганглионарного нейрона. Преганглионарные нервы могут синапс в паравертебральном ганглии или периферическом симпатическом ганглии (например, чревный ганглий). Преганглионарные нервы симпатической и парасимпатической систем являются холинергическими (то есть секретируют ацетилхолин).Наиболее симпатические постганглионарные нейроны являются адренергическими (то есть секретируют норадреналин).
ТАХИКИНИНЫ: Класс нейропептидов, который включает сенсорные афферентные нейромедиатор вещества P.
Сокращения, используемые| CGRP кальцитонин ген-родственный пептид | ||
| ЦНС Центральная нервная система | ||
| GDNF глиальных-производный фактор роста | ||
| GFL | глиальных нейротрофический фактор семейства лиганд | |
| ФРН | фактора роста нервов | |
| PGD 2 | простагландина D 2 | |
| TRK | рецепторной тирозинкиназы | |
| TRP | Переходный рецепторный потенциал | |
| TRPA1 | ||
| TRPA1 | Потенциал переходного рецептора Ankyrin 1 | |
| TRPV1 | TRPV1 | Потенциал переходного рецептора 1 |
Сноски
Раскрытие потенциального конфликта интересов: B.Ундем получил гранты Национальных институтов здравоохранения и GlaxoSmithKline; на научный консультативный совет Afferent Pharmaceuticals; и есть консультант договоренности с GlaxoSmithKline. Т. Тейлор-Кларк заявляет, что у него нет соответствующие конфликты интересов.
ССЫЛКИ
1. Линн Б. Соматосенсорные рецепторы и их ЦНС соединения. Анну Рев Физиол 1975; 37: 105–27. [PubMed] [Google Scholar]2. Шеррингтон С Интегративное действие нервной системы. Нью-Хейвен (Коннектикут): Йель университетская пресса; 1906 г.[Google Академия]3. Кольридж Дж. К., Кольридж Х. М. Иннервация афферентных С-волокон блуждающего нерва легких и дыхательных путей и их функциональное значение. Преподобный Физиол Биохим Фармакол 1984 год; 99:1–110. [PubMed] [Google Scholar]4. Вуд Джей Ди. Кишечная нейроиммунофизиология и патофизиология. Гастроэнтерология 2004; 127: 635–57. [PubMed] [Google Scholar]5. Блэкшоу Л.А., Брукс С.Дж., Гранди Д., Шеманн М. Сенсорная передача в желудочно-кишечном тракте. тракт. Нейрогастроэнтерол Мотил 2007; 19:1–19. [PubMed] [Google Scholar]6.Вуд Джей Ди. Симпозиум по питанию нежвачных животных: нейрогастроэнтерология и пищевой аллергии. Джей Аним Наука 2012;90:1213–23. [PubMed] [Google Scholar]7. Майерс AC, Ундем Б.Дж. Электрофизиологические эффекты тахикининов и капсаицин на бронхиальный парасимпатический ганглий морской свинки нейроны. Дж Физиол 1993;470: 665–79. [Бесплатная статья PMC] [PubMed] [Google Scholar]8. Мэй ГМ. Тахикинины как медиаторы медленных ВПСП у морской свинки ганглии желчного пузыря: вовлечение рецепторов нейрокинина-3. Дж Физиол 1995;485(Пл 2): 513–24.[Бесплатная статья PMC] [PubMed] [Google Scholar]9. Балук П. Нейрогенное воспаление кожи и дыхательных путей. J Investig Dermatol Symp Proc 1997; 2:76–81. [PubMed] [Google Scholar] 10. Санико А.М., Ацута С., Прауд Д., Тогиас А. Дозозависимые эффекты назального введения капсаицина: в vivo доказательства нейрогенного воспаления дыхательных путей человека. J Аллергия Клин Иммунол 1997; 100: 632–41. [PubMed] [Google Scholar] 12. Silver RB, Reid AC, Mackins CJ, Askwith T, Schaefer U, Herzlinger D, et al. Тучные клетки: уникальный источник ренина.Proc Natl Acad Sci U S A 2004; 101:13607–12. [Бесплатная статья PMC] [PubMed] [Google Scholar]13. Аризоно Н., Мацуда С., Хаттори Т., Кодзима Ю., Маэда Т., Галли С.Дж. Анатомические вариации ассоциаций тучных клеток у тонкий кишечник крысы, сердце, легкие и кожа. Сходство расстояний между нервными отростками и тучными клетками, эозинофилами или плазматическими клетками в собственная пластинка тощей кишки. Лаборатория Инвест 1990;62: 626–34. [PubMed] [Google Scholar] 14. Алвинг К., Сандстрем С., Матран Р., Панула П., Хокфельт Т., Лундберг Дж. М.Связь между тучными клетками, содержащими гистамин, и чувствительные нервы в коже и дыхательных путях контрольные и обработанные капсаицином свиньи. Сотовые Ткани Res 1991 год; 264: 529–38. [PubMed] [Google Scholar] 15. Форсайт П., Биненшток Дж. Функциональная единица тучных клеток и нервов: ключевой компонент физиологические и патофизиологические реакции. Химия Иммунол Аллергия 2012;98: 196–221. [PubMed] [Google Scholar] 16. Кит И.М., Джин Дж., Сабан Р. Взаимодействие нервно-тучных клеток в моче нормальной морской свинки мочевой пузырь. Дж Комп Нейрол 1995; 363: 28–36.[PubMed] [Google Scholar] 17. Ван Нассау Л., Адриансен Д., Тиммерманс Дж. П. Двунаправленная связь между нейронами и мачтой клеток желудочно-кишечного тракта. Автон Неврологи 2007; 133:91–103. [PubMed] [Google Scholar] 18. Д’Андреа М.Р., Сабан М.Р., Джерард Н.П., Вершил Б.К., Сабан Р. Отсутствие экспрессии рецептора нейрокинина-1 влияет на ткань количество тучных клеток, но не их пространственное соотношение с нервы. Am J Physiol Regul Integr Comp Физиол 2005; 288: Р491–500. [PubMed] [Google Scholar] 19. Стед Р.Х., Диксон М.Ф., Брамвелл Н.Х., Ридделл Р.Х., Биненшток Дж.Тучные клетки тесно связаны с нервами человека. слизистая желудочно-кишечного тракта. Гастроэнтерология 1989; 97: 575–85. [PubMed] [Google Scholar] 20. Stead RH, Tomioka M, Quinonez G, Simon GT, Felten SY, Bienenstock J. Тучные клетки слизистой оболочки кишечника в норме и кишечник крыс, зараженных нематодами, находится в тесном контакте с пептидергическими нервы. Proc Natl Acad Sci U S A 1987 год; 84:2975–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]21. Уильямс Р.М., Бертоуд Х.Р., Стед Р.Х. Афферентные нервные волокна блуждающего нерва контактируют с тучными клетками крысы. слизистая тонкой кишки.Нейроиммуномодуляция 1997;4: 266–70. [PubMed] [Google Scholar] 22. Хагияма М., Фуруно Т., Хосокава Ю., Иино Т., Ито Т., Иноуэ Т. и др. Усиленное взаимодействие нерва и тучных клеток за счет короткой изоформы нейронов молекулы клеточной адгезии-1. Дж Иммунол 2011;186:5983–92. [PubMed] [Google Scholar] 23. Фуруно Т., Хагияма М., Секимура М., Окамото К., Судзуки Р., Ито А. и др. Молекула клеточной адгезии 1 (CADM1) на тучных клетках способствует взаимодействие с нейритами ганглия задних корешков путем гетерофильного связывания с нектин-3. J Нейроиммунол 2012; 250:50–8.[PubMed] [Google Scholar] 24. Барбара Г., Ван Б., Стангеллини В., де Джорджио Р., Кремон С., Ди Нардо Г. и др. Зависимое от тучных клеток возбуждение висцерально-ноцицептивной сенсорной нейронов при синдроме раздраженного кишечника. Гастроэнтерология 2007; 132:26–37. [PubMed] [Google Scholar] 25. Мун Т.К., Сен-Лоран К.Д., Моррис К.Е., Марсет С., Йошимура Т., Секар Ю. и др. Достижения в области биологии тучных клеток: новое понимание гетерогенности и функция. Иммунол слизистых оболочек 2010;3:111–28. [PubMed] [Google Scholar] 26. Какурай М., Монтефорте Р., Суто Х., Цай М., Накаэ С., Галли С.Дж.Фактор некроза опухоли тучных клеток может способствовать удлинение нервных волокон в коже при контактной гиперчувствительности в мышей. Ам Джей Патол 2006; 169:1713–21. [Бесплатная статья PMC] [PubMed] [Google Scholar]27. Торнтон М.А., Акаше Н., Уолш М.Т., Молони М., Шихан П.О., Смит К.М. и соавт. Рекрутирование эозинофилов в носовые нервы после заражения аллергеном при аллергическом рините. Клин Иммунол 2013;147:50–7. [PubMed] [Google Scholar] 28. Савацки Д.А., Кингхэм П.Дж., Корт Э., Кумаравел Б., Фрайер А.Д., Джейкоби Д.Б. и др. Адгезия эозинофилов к холинергическим нервам через ICAM-1 и VCAM-1 и связанная с этим дегрануляция эозинофилов.Ам Дж Physiol Lung Cell Мол Физиол 2002; 282: L1279–88. [PubMed] [Google Scholar] 29. Omori Y, Andoh T, Shirakawa H, Ishida H, Hachiga T, Kuraishi Y. Связанные с зудом ответы нейронов заднего рога на кожная аллергическая стимуляция у мышей. Нейроотчет 2009; 20: 478–81. [PubMed] [Google Scholar] 30. Potenzieri C, Meeker S, Undem BJ. Активация бронхолегочных С-волокон мышей серотонин и аллерген-овальбумин. Дж Физиол 2012 г.; 590 (точка 21): 5449–59. [Бесплатная статья PMC] [PubMed] [Google Scholar]31.Катерина М.Дж., Шумахер М.А., Томинага М., Розен Т.А., Левин Д.Д., Юлиус Д. Рецептор капсаицина: активируемый нагреванием ионный канал в болевой путь. Природа 1997 год; 389: 816–24. [PubMed] [Google Scholar] 32. Jordt SE, Bautista DM, Chuang HH, McKemy DD, Zygmunt PM, Hogestatt ED, et al. Горчичное масло и каннабиноиды возбуждают чувствительные нервные волокна через канал ГТО АНКТМ1. Природа 2004; 427: 260–5. [PubMed] [Google Scholar] 33. Shim WS, Tak MH, Lee MH, Kim M, Koo JY, Lee CH и другие. TRPV1 опосредует вызванный гистамином зуд посредством активации фосфолипаза А2 и 12-липоксигеназа.Дж Неврологи 2007; 27: 2331–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]34. Suh YG, Oh U. Активация и активаторы TRPV1 и их фармацевтическое значение. Карр Фарм Дес 2005; 11: 2687–98. [PubMed] [Google Scholar] 36. Тейлор-Кларк Т.Е., Ундем Б.Дж., Макглашан Д.В. младший, Гатта С., Карр М.Дж., МакАлександер М.А. Простагландин-индуцированная активация ноцицептивных нейронов через прямое взаимодействие с переходным рецепторным потенциалом A1 (ТРПА1). Мол Фармакол 2008; 73: 274–81. [PubMed] [Google Scholar] 37. Динг-Пфеннигдорф Д., Авербек Б., Михаэлис М.Стимуляция PAR-2 возбуждает и сенсибилизирует крыс. кожные С-ноцицепторы к теплу. Нейроотчет 2004;15:2071–5. [PubMed] [Google Scholar] 38. Хонг Дж.Л., Хо С.И., Квонг К., Ли Л.И. Активация легочных С-волокон аденозином в анестезированные крысы: роль аденозиновых рецепторов A1. Дж Физиол 1998; 508 (Пл 1): 109–18. [Бесплатная статья PMC] [PubMed] [Google Scholar]39. Тейлор-Кларк Т.Е., Нассенштейн С., Ундем Б.Дж. Лейкотриен D(4) повышает возбудимость чувствительные к капсаицину носовые чувствительные нервы к электрическим и химическим раздражители.Бр Дж Фармакол 2008; 154:1359–68. [Бесплатная статья PMC] [PubMed] [Google Scholar]40. Кремон С., Карини Г., Ван Б., Васина В., Коглиандро Р.Ф., Де Джорджио Р. и др. Высвобождение серотонина в кишечнике, активация сенсорных нейронов и боли в животе при синдроме раздраженного кишечника. Ам Дж Гастроэнтерол 2011 г.; 106:1290–8. [PubMed] [Google Scholar]41. Пеллег А, Хёрт СМ. Механизм действия АТФ на легочный блуждающий нерв собак C волокна нервных окончаний. Дж Физиол 1996;490(Пт 1): 265–75. [Бесплатная статья PMC] [PubMed] [Google Scholar]42.Киркап А.Дж., Цзян В., Баннетт Н.В., Гранди Д. Стимуляция активируемого протеиназой рецептора 2 возбуждает тощекишечных афферентных нервов у анестезированных крыс. Дж Физиол 2003 г.; 552 (Пл 2): 589–601. [Бесплатная статья PMC] [PubMed] [Google Scholar]43. Колдвелл Дж. Р., Филлис Б. Д., Сазерленд К., Ховарт Г. С., Блэкшоу Л. А. Повышенная реактивность толстой кишки крысы splanchnic афференты к 5-HT после воспаления и восстановления. Дж Физиол 2007; 579 (т. 1): 203–13. [Бесплатная статья PMC] [PubMed] [Google Scholar]44. Эглезос А., Леччи А., Сантичоли П., Джулиани С., Трамонтана М., Дель Бьянко Э. и др.Активация первичных афферентов, чувствительных к капсаицину, у крыс. мочевого пузыря соединением 48/80: прямое действие на сенсорные нервы? Arch Int Pharmacodyn Ther 1992; 315: 96–109. [PubMed] [Google Scholar]45. Undem BJ, Hubbard W, Weinreich D. Иммунологически индуцированная нейромодуляция морской свинки узловатых ганглиозных нейронов. J Auton Nerv Syst 1993;44: 35–44. [PubMed] [Google Scholar]46. Грин Р., Фаулер Дж., МакГлашан Д. младший, Вайнрайх Д. Тучные клетки легких человека, зараженные IgE, возбуждают блуждающий нерв чувствительных нейронов in vitro.J Appl Physiol 1988;64: 2249–53. [PubMed] [Google Scholar]47. Риччио М.М., Майерс АС, Ундем Б.Дж. Иммуномодуляция афферентных нейронов морской свинки изолированные дыхательные пути. Дж Физиол 1996;491(Пл 2): 499–509. [Бесплатная статья PMC] [PubMed] [Google Scholar]48. Jiang W, Kreis ME, Eastwood C, Kirkup AJ, Humphrey PP, Grundy D. 5-HT(3) и гистаминовые H(1) рецепторы опосредуют афферентные чувствительность нервов к кишечной анафилаксии у крыс. Гастроэнтерология 2000; 119:1267–75. [PubMed] [Google Scholar]49. Ли Л.И., Мортон Р.Ф. Гистамин усиливает реакцию вагусных легочных С-волокон на капсаицин и вздутие легких.Дыхание Физиол 1993; 93: 83–96. [PubMed] [Google Scholar]50. Чжан Г., Лин Р.Л., Виггерс М.Е., Ли Л.И. Сенсибилизирующие эффекты хронического воздействия и острого ингаляции аэрозоля овальбумина на легочные С-волокна в крысы. J Appl Physiol 2008; 105:128–38. [Бесплатная статья PMC] [PubMed] [Google Scholar]51. Ю С, Колларик М, Оуян А, Майерс А.С., Ундем Б.Дж. Опосредованное тучными клетками длительное увеличение возбудимость С-волокон блуждающего нерва в пищеводе морской свинки. Am J Physiol Gastrointest Liver Physiol 2007; 293:G850–6. [PubMed] [Google Scholar]52.Gu Q, Lim ME, Gleich GJ, Lee LY. Механизмы индуцирования главным основным белком эозинофилов гипервозбудимость вагусных легочных химиочувствительных нейронов. Am J Physiol Lung Cell Mol Physiol 2009; 296:L453–61. [Бесплатная статья PMC] [PubMed] [Google Scholar]53. Фишер А., МакГрегор Г.П., Сария А., Филиппин Б., Куммер В. Индукция экспрессии гена тахикинина и пептида в морская свинка нодозирует первичные афферентные нейроны из-за аллергической реакции дыхательных путей воспаление. Джей Клин Инвест 1996; 98: 2284–91. [Бесплатная статья PMC] [PubMed] [Google Scholar]54.Lieu TM, Myers AC, Meeker S, Undem BJ. Индукция TRPV1 в вагусных путях низкопороговая механосенсорные нейроны при провокации аллергеном и нейротрофическом факторы. Am J Physiol Lung Cell Mol Physiol 2012; 302:L941–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]55. Bonini S, Lambiase A, Levi-Schaffer F, Aloe L. Фактор роста нервов: важная молекула при аллергических реакциях. Воспаление и ремоделирование тканей. Арка Аллергия Иммунол 1999; 118:159–62. [PubMed] [Google Scholar]56. Нокхер В. А., Ренц Х. Нейротрофины и астма: новое понимание нейроиммунных взаимодействие.J Аллергия Клин Иммунол 2006; 117: 67–71. [PubMed] [Google Scholar]57. Цвайфель Л.С., Курувилла Р., Гинти Д.Д. Функции и механизмы ретроградного нейротрофина сигнализация. Нат Рев Нейроски 2005; 6: 615–25. [PubMed] [Google Scholar]58. Лиу Т., Колларик М., Майерс А.С., Ундем Б.Дж. Экспрессия рецепторов лигандов семейства нейротрофинов и GDNF в подтипах блуждающего нерва, иннервирующего дыхательные пути взрослой морской свинки тракт. Am J Physiol Lung Cell Mol Physiol 2011;300: L790–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]59.Сурденикова Л., Ру Ф., Нассенштейн С., Татар М., Колларик М. Афференты, полученные из нервного гребня и плакод иннервация пищевода мыши. Нейрогастроэнтерол Мотил 2012; 24:e517–25. [PubMed] [Google Scholar] 60. Майерс А.С., Каекар Р., Ундем Б.Дж. Индуцированная аллергическим воспалением продукция нейропептидов в быстро адаптирующиеся афферентные нервы дыхательных путей морской свинки. Am J Physiol Lung Cell Mol Physiol 2002; 282: L775–81. [PubMed] [Google Scholar]61. Чуайчу Б., Хантер Д.Д., Майерс А.С., Колларик М., Ундем Б.Дж. Аллерген-индуцированный синтез вещества Р в чувствительные нейроны, иннервирующие легкие.Дж Аллергия Клин Иммунол 2005; 116: 325–31. [PubMed] [Google Scholar]62. Нойманн С., Дубелл Т.П., Лесли Т., Вульф С.Дж. Воспалительная болевая гиперчувствительность, опосредованная фенотипическое переключение в миелинизированных первичных сенсорных нейронах. Природа 1996; 384:360–4. [PubMed] [Google Scholar]63. Чжан Г., Лин Р.Л., Виггерс М., Сноу Д.М., Ли Л.И. Измененная экспрессия TRPV1 и чувствительность к капсаицину в легочных миелинизированных афферентах после хронического воспаления дыхательных путей в крыса. Дж Физиол 2008; 586 (т. 23): 5771–86. [Бесплатная статья PMC] [PubMed] [Google Scholar]64.Сильвер Р., Сильверман А.Дж., Виткович Л., Ледерхендлер II. Тучные клетки в головном мозге: доказательства и функционал значение. Тренды Нейроси 1996; 19:25–31. [PubMed] [Google Scholar]65. Kreis ME, Muller M, Zittel TT, Glatzle J, Grundy D. Медиаторы активации нейронов в стволе головного мозга крысы после кишечной анафилаксии. Неврологи латынь 2000; 289:45–8. [PubMed] [Google Scholar]67. Маццоне С.Б., Мори Н., Каннинг Б.Дж. Синергические взаимодействия между афферентным нервом дыхательных путей подтипы, регулирующие кашлевой рефлекс у морских свинок.Дж Физиол 2005;569(Пт 2): 559–73. [Бесплатная статья PMC] [PubMed] [Google Scholar]68. Маццоне С.Б., Каннинг Б.Дж. Синергические взаимодействия между афферентным нервом дыхательных путей подтипы, опосредующие рефлекторный бронхоспазм у морских свинок. Am J Physiol Regul Integr Comp Physiol 2002; 283: R86–98. [PubMed] [Google Scholar]69. Татар М., Плевкова Ю., Брозманова М., Пекова Р., Колларик М. Механизмы кашля при риносинусит. Пульм Фармакол Тер 2009;22:121–6. [PubMed] [Google Scholar]70. Chen CY, Bonham AC, Schelegle ES, Gershwin LJ, Plopper CG, Joad JP.Продолжительное воздействие аллергена на астматических обезьян вызывает нейропластичность ядра одиночного пути. Дж Аллергия Клин Иммунол 2001; 108: 557–62. [PubMed] [Google Scholar]71. Undem BJ, Hubbard WC, Christian EP, Weinreich D. Тучные клетки в верхнем шейном ганглии морской свинки: функциональная и гистологическая оценка. Джей Автон Нерв Сист 1990; 30:75–87. [PubMed] [Google Scholar]72. Myers AC, Undem BJ, Weinreich D. Влияние антигена на свойства мембран цесарки. нейронов бронхиального ганглия свиньи.J Appl Физиол 1991;71: 970–6. [PubMed] [Google Scholar]73. Бишофф С.К., Гебхардт Т. Роль тучных клеток и эозинофилов в нейроиммунной взаимодействия, регулирующие воспаление слизистой оболочки при воспалении кишечника болезнь. Adv Exp Мед Биол 2006; 579: 177–208. [PubMed] [Google Scholar]74. Каекар Р., Ундем Б.Дж., Майерс АС. Роль активации циклооксигеназы и простагландинов в антиген-индуцированные изменения возбудимости бронхиальных парасимпатических ганглиев нейроны. Am J Physiol Lung Cell Mol Physiol 2003;284: L581–7. [PubMed] [Google Scholar]75.Вайнрайх Д., Ундем Б.Дж. Иммунологическая регуляция синаптической передачи у изолированные вегетативные ганглии морской свинки. Джей Клин Вкладывать деньги 1987; 79: 1529–32. [Бесплатная статья PMC] [PubMed] [Google Scholar]76. Undem BJ, Myers AC, Weinreich D. Антиген-индуцированная модуляция вегетативной и сенсорной нейроны в пробирке. Приложение Int Arch Allergy Иммунол 1991 год; 94:319–24. [PubMed] [Google Scholar]78. Cyphert JM, Kovarova M, Allen IC, Hartney JM, Murphy DL, Wess J, et al. Кооперация между тучными клетками и нейронами необходима для антиген-опосредованная бронхоконстрикция.Дж Иммунол 2009; 182:7430–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]79. Вайнрайх Д., Ундем Б.Дж., Леал-Кардосо Д.Х. Функциональные эффекты активации тучных клеток в симпатические ганглии. Энн Н.Ю. Академия наук 1992; 664: 293–308. [PubMed] [Google Scholar]80. Шеманн М., Мишель К., Церегжин М., Зеллер Ф., Зайдл С., Бишофф С.К. Коктейль медиатора тучных клеток человека возбуждает нейроны в кишечная нервная система человека и морской свинки. Нейрогастроэнтерол Мотил 2005; 17: 281–9. [PubMed] [Google Scholar]81. Лю С., Ху Х.З., Гао Н., Гао С., Ван Г., Ван Х и др.Нейроиммунные взаимодействия в желудке морской свинки и кишечник. Am J Physiol Gastrointest Печень Физиол 2003; 284:G154–64. [PubMed] [Google Scholar]82. Фрилинг Т., Кук Х.Дж., Вуд Д.Д. Нейроиммунная связь в подслизистом сплетении толстой кишки морской свинки после сенсибилизации к молочному антигену. Am J Physiol 1994 год; 267:G1087–93. [PubMed] [Google Scholar]83. Бюнер С., Ли К., Бергер Т., Виньяли С., Барбара Г., Де Джорджио Р. и др. Подслизистые, а не миэнтеральные нейроны активируются слизистой оболочкой. супернатанты биопсии пациентов с синдромом раздраженного кишечника.Нейрогастроэнтерол Мотил 2012;24: 1134–e572. [PubMed] [Google Scholar]84. Breunig E, Michel K, Zeller F, Seidl S, Weyhern CW, Schemann M. Гистамин возбуждает нейроны в подслизистом сплетении человека через активацию рецепторов h2, h3, h4 и h5. Дж Физиол 2007; 583: 731–42. [Бесплатная статья PMC] [PubMed] [Google Scholar]85. Кристиан Э.П., Ундем Б.Дж., Вайнрайх Д. Эндогенный гистамин возбуждает нейроны морской свинки. верхний шейный ганглий in vitro. Дж Физиол 1989;409: 297–312. [Бесплатная статья PMC] [PubMed] [Google Scholar]86.Фрайер А.Д., Уиллс-Карп М. Дисфункция М2-мускариновых рецепторов в легких парасимпатических нервов после введения антигена. Дж Аппл Физиол 1991;71:2255–61. [PubMed] [Google Scholar]87. Костелло Р.В., Эванс К.М., Йост Б.Л., Бельмонте К.Е., Глейх Г.Дж., Якоби Д.Б. и др. Антиген-индуцированная гиперреактивность к гистамину: роль блуждающего нерва нервы и эозинофилы. Am J Physiol Lung Cell Mol Физиол 1999; 276:L709–14. [PubMed] [Google Scholar]88. Пан Дж., Род Х.К., Ундем Б.Дж., Майерс АС. Нейромедиаторы в парасимпатических нейронах дыхательных путей изменен нейротрофином-3 и повторным введением аллергена.Am J Respir Cell Мол Биол 2010;43:452–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]89. Берарди Н., Пиццоруссо Т., Маффеи Л. Критические периоды во время сенсорного разработка. Курр Опин Нейробиол 2000; 10: 138–45. [PubMed] [Google Scholar]90. Визель Т.Н., Хьюбел Д.Х. Степень восстановления после воздействия визуальных лишай у котят. J Нейрофизиол 1965; 28: 1060–72. [PubMed] [Google Scholar]91. Руда М.А., Линг К.Д., Хохманн А.Г., Пэн Ю.Б., Татибана Т. Измененные ноцицептивные нейронные цепи после новорожденных периферическое воспаление.Наука 2000;289: 628–31. [PubMed] [Google Scholar]92. Аль-Чаер ЭД, Кавасаки М, Пасрича ПДж. Новая модель хронической висцеральной гиперчувствительности у взрослых крыс, индуцированных раздражением толстой кишки в постнатальном периоде. разработка. Гастроэнтерология 2000; 119:1276–85. [PubMed] [Google Scholar]93. Ву З.С., Хантер Д.Д., Киш В.Л., Бендерс К.М., Бэтчелор Т.П., Дей Р.Д. Пренатальное и раннее, но не позднее постнатальное воздействие мышей в сторону от табачного дыма увеличивает гиперреактивность дыхательных путей позже в жизни. Перспектива охраны окружающей среды 2009; 117:1434–40.[Бесплатная статья PMC] [PubMed] [Google Scholar]94. Хантер Д.Д., Каррелл-Джекс Л.А., Бэтчелор Т.П., Дей Р.Д. Роль фактора роста нервов в индуцированных озоном нейронах реакции в раннем постнатальном развитии дыхательных путей. Являюсь J Respir Cell Мол Биол 2011;45:359–65. [Бесплатная статья PMC] [PubMed] [Google Scholar]95. Макаллистер А.К., Кац Л.С., Ло Д.К. Нейротрофины и синаптическая пластичность. Анну Рев Нейроски 1999; 22: 295–318. [PubMed] [Google Scholar]96. Сарин С., Ундем Б., Санико А., Тогиас А. Роль нервной системы в ринит.J Аллергия Клин Иммунол 2006; 118: 999–1016. [PubMed] [Google Scholar]97. Шустерман Д.Дж., Мерфи М.А., Балмс М.Р. Субъекты с сезонным аллергическим ринитом и неринитным субъекты по-разному реагируют на назальную провокацию хлором газ. J Аллергия Клин Иммунол 1998; 101: 732–40. [PubMed] [Google Scholar]98. Ревицкий Д.А., Лейди Н.К., Бреннан-Димер Ф., Томпсон С., Тогиас А. Разработка и предварительная проверка многоатрибутный индекс полезности симптомов ринита. Качество Жизнь Рез 1998; 7: 693–702. [PubMed] [Google Scholar]Механизмы, лежащие в основе нейрональных симптомов аллергии
У людей с аллергией проявляются симптомы, которые часто являются результатом изменений в нервной системе.Нейрональные симптомы зависят от органа, в котором возникает аллергическая реакция, но могут включать покраснение глаз, зуд, чихание, заложенность носа, ринорею, кашель, бронхоконстрикцию, секрецию слизи в дыхательных путях, дисфагию, нарушение перистальтики желудочно-кишечного тракта и зуд, отек кожи. Эти симптомы возникают из-за того, что медиаторы, высвобождаемые во время аллергической реакции, могут взаимодействовать с чувствительными нервами, изменять процессинг в центральной нервной системе и изменять передачу в симпатических, парасимпатических и кишечных вегетативных нервах.Кроме того, данные подтверждают идею о том, что у некоторых субъектов эта нейромодуляция по малопонятным причинам усиливается, так что одинаковая степень нервного стимула вызывает больший эффект, чем у здоровых субъектов. Существуют различия в механизмах и типах нервов, участвующих в аллерген-индуцированной нейромодуляции среди различных систем органов, но появились общие принципы. Продукты активированных тучных клеток, других воспалительных клеток и резидентных клеток могут явно стимулировать нервные окончания, вызывать длительные изменения возбудимости нейронов, повышать синаптическую эффективность, а также изменять экспрессию генов в нервах, что приводит к фенотипически измененным нейронам.Лучшее понимание этих процессов может привести к новым терапевтическим стратегиям, направленным на ограничение страданий людей с аллергией.
Ключевые слова: аллергия; С-волокно; IgE; потенциал действия; афферентный; дыхательные пути; аллерген; противовоспалительное средство; автономный; бронхоспазм; кашель; критические периоды; цитокин; дегрануляция; деполяризация; задний корень; дисфункция; эфферентный; кишечнорастворимый; глаз; ганглии; кишечник; гистамин; гиперсекреция; воспаление; иннервация; ионный канал; раздражитель; зуд; яремный; лейкотриен; легкие; тучная клетка; медиаторы тучных клеток; взаимодействия тучных клеток и нервов; подвижность; миентеральный; нерв; ноцицептор; узловатая; ядро пути одиночное; боль; парасимпатический; фенотипический переключатель; пластичность; простагландин; рецептор; рефлекс; сенсорный; кожа; стероиды; сочувствующий; симптомы; каналы временного рецепторного потенциала; тройничный; блуждающий.
Аллергическое воспаление приводит к нейропатической боли посредством активации глиальных клеток
Abstract
Аллергические и атопические расстройства участились за последние несколько десятилетий и были связаны с психоневрологическими состояниями, такими как расстройства аутистического спектра и астматическая амиотрофия. Миелит, проявляющийся невропатической болью, может возникать у пациентов с атопическим расстройством; однако взаимосвязь между аллергическим воспалением и нейропатической болью, а также лежащий в их основе механизм еще предстоит установить.Мы изучали, влияет ли аллергическое воспаление на спинальную ноцицептивную систему. Мы обнаружили, что у мышей с астмой, атопическим дерматитом или атопическим диатезом в спинном мозге были широко распространены и значительно более активны микроглия и астроглия, чем у мышей без атопии, и проявлялась тактильная аллодиния. Микроматричный анализ выделенной микроглии выявил дисрегуляцию фенотипа, демонстрирующую повышенную регуляцию маркеров макрофагов M1 и пониженную регуляцию маркеров M2 у мышей с атопией. Среди генов белков клеточной поверхности рецептор эндотелина типа B ( EDNRB ) был наиболее активен.Иммуногистохимический анализ показал, что экспрессия EDNRB была увеличена в микроглии и астроглии, тогда как эндотелин-1, лиганд EDNRB, был увеличен в сыворотке, легких и эпидермисе мышей с атопией. Экспрессия EDNRA в спинном мозге не обнаружена. Экспрессия гомолога В вирусного онкогена остеосаркомы мышей FBJ была значительно выше в нейронах задних рогов мышей с астмой, чем у мышей без атопии. Антагонист EDNRB BQ788 устранял глиальную и нервную активацию и аллодинию. Мы обнаружили повышенный уровень эндотелина-1 в сыворотке у пациентов с атопией с миелитом и невропатической болью, а также активацию спинальной микроглии и астроглии с активацией EDNRB в случае вскрытия.Эти результаты свидетельствуют о том, что аллергическое воспаление индуцирует диффузную активацию глии, влияя на ноцицептивную систему через путь EDNRB.
ЗАЯВЛЕНИЕ О ЗНАЧИМОСТИ Распространенность аллергических заболеваний заметно увеличилась за последние несколько десятилетий. Аллергические расстройства связаны с нервно-психическими состояниями; однако связь между аллергическим воспалением и осложнениями со стороны ЦНС неизвестна. Специфический миелит, проявляющийся персистирующей нейропатической болью, был зарегистрирован у пациентов с аллергическими заболеваниями.Мы изучали, как атопия оказывает существенное влияние на ноцицептивную систему. Мы обнаружили, что мыши с аллергическими расстройствами имели тяжелую аллодинию с активированной астроглией и микроглией, а также продемонстрировали выраженную активацию рецептора эндотелина-1 (ET-1) типа B (EDNRB) в спинном мозге. Селективный антагонист EDNRB предотвращал аллодинию и активацию глии. Наши результаты предполагают новый механизм, посредством которого атопия вызывает активацию глии и невропатическую боль через путь ET-1/EDNRB.
Введение
Распространенность аллергических и атопических расстройств во всем мире заметно возросла за последние несколько десятилетий (Pawankar et al., 2012). Аллергические расстройства связаны с психоневрологическими состояниями, такими как синдром дефицита внимания и гиперактивности, расстройство аутистического спектра и астматическая амиотрофия (синдром Хопкинса) (Hopkins, 1974; Roth et al., 1991; Liedholm et al., 1994; MH Chen). и др., 2014). Однако неизвестно, как аллергическое воспаление вызывает нервно-психическую дисфункцию. Мы и другие сообщали о появлении особой формы миелита, проявляющейся персистирующей нейропатической болью, особенно аллодинией, в качестве основного симптома у пациентов с атопическими расстройствами, такими как атопический дерматит, аллергический ринит и атопическая астма, в Японии и Корее (Kira и другие., 1997, 1998, 2008; Мураи и др., 2004 г.; Очи и др., 2004 г.; Юн и др., 2009 г.; Айнидинг и др., 2012; Канамори и др., 2013). У этих пациентов с миелитом и атопией было обнаружено специфическое увеличение содержания хемокина 11 мотива CC и интерлейкина-9 в спинномозговой жидкости (Tanaka et al., 2008). Общенациональные исследования неоднократно выявляли широкое распространение этой формы миелита в Японии (Osoegawa et al., 2003a; Isobe et al., 2009), а также аналогичные случаи регистрировались во всем мире, в том числе в западных странах (Zoli et al., 2005; Константинеску и др., 2006 г.; Грегуар и др., 2006; Айзекс и др., 2011). Нейропатологические исследования биоптатов спинного мозга у пациентов с атопией и хроническим персистирующим миелитом выявили активное воспаление с потерей миелина и аксонов, сопровождающееся эозинофильной инфильтрацией различной степени (Kikuchi et al., 2001; Osoegawa et al., 2003b). Таким образом, был введен термин «атопический миелит» вместе с диагностическими критериями (Isobe et al., 2012). Атопический миелит развивается у части больных атопией, обладающих генами предрасположенности, такими как HLA-DRB1 * 02:01 (Sato et al., 2012). Однако связь между аллергическим воспалением и аллодинией, а также механизм, лежащий в основе аллодинии при этом состоянии, еще предстоит выяснить.
Целью данного исследования было определить, как атопия оказывает существенное влияние на ноцицептивную систему. Сначала мы изучили влияние атопии на микроглию и астроглию спинного мозга у мышей с моделью атопии, потому что оба типа глии играют решающую роль в индукции и поддержании стойкой невропатической боли при повреждении периферических нервов (PNI) на животных моделях (Tsuda et al., 2003; Г. Чен и др., 2014). Мы обнаружили, что у мышей с моделью атопии была тяжелая аллодиния с глиальным воспалением в спинном мозге. Развитие аллодинии было успешно предотвращено введением селективного антагониста рецептора эндотелина-1 (ET-1) типа B (EDNRB) с ослаблением активации глии. Затем мы распространили наше исследование на людей и обнаружили повышение уровня ET-1 в сыворотке и активацию спинальной микроглии и астроглии с активацией EDNRB у пациентов с атопией и миелитом неизвестной этиологии, преимущественно с нейропатической болью.Эти результаты указывают на ранее неизвестный механизм, посредством которого атопия вызывает активацию глии и невропатическую боль через путь ET-1/EDNRB, который может быть потенциальной терапевтической мишенью при нейропатической боли, связанной с атопией.
Результаты
Глиальное воспаление возникает в спинном мозге мышей с моделью атопии. назальная аспирация раствора OVA (группа O+A) (Nials and Uddin, 2008).У этих мышей наблюдалась выраженная инфильтрация воспалительных клеток, в том числе многочисленные эозинофилы, положительные по катионному белку эозинофилов, в перибронхиальной и периваскулярной областях, а также гиперпродукция слизи и гиперплазия бокаловидных клеток. У мышей группы PBS и группы Alum не было эозинофильной инфильтрации, несмотря на ингаляцию OVA (рис. 1
A , B ). У мышей с атопическим дерматитом, индуцированным прямым нанесением OVA на кожу с лентой (Spergel et al., 1998), наблюдалась заметная инфильтрация эозинофилов, положительных по катионному белку, с гипертрофированным эпидермисом, но не у мышей, которым вводили PBS вместо OVA. Инжир.1 C , D ). Рисунок 1.Протоколы для создания моделей атопии и аллергического воспаления в тканях легких и кожи мышей с моделью атопии. A , Протокол индукции бронхиальной астмы у мышей. Верхняя линия показывает схематический рисунок для группы, получавшей О+А. Вторая и третья строки обозначают группу квасцов и группу PBS соответственно. B , Гистохимический анализ тканей легких в группах O+A и PBS. В группе О+А очевидна мощная инфильтрация воспалительных клеток в бронхах (первый ряд).Среди инфильтрированных воспалительных клеток имеется большое количество эозинофилов, положительных по катионному белку (ECP) (красный цвет) (второй ряд). Периодическое окрашивание кислотой по Шиффу (PAS) также демонстрирует гиперпродукцию слизи и гиперплазию бокаловидных клеток в группе O+A (третий ряд). Масштабная линейка, 50 мкм. C , Схема индукции атопического дерматита. Верхний ряд, контроль PBS. Нижний ряд: модель атопического дерматита. D , Гистология кожи мышей с мазком PBS и OVA.Соскоб с кожи мышей с OVA показывает утолщение эпидермиса и дермы (первый ряд) и многочисленные ЕСР-положительные (красные) эозинофилы, проникающие в дерму (второй ряд). Масштабные линейки: H&E, 100 мкм; ЭКП, 50 мкм.
У мышей только с астмой, атопическим дерматитом и атопическим диатезом активация микроглии спинного мозга была выше, чем у мышей без атопии. В поясничном отделе спинного мозга мышей с бронхиальной астмой (группа О+А) было увеличено количество микроглии (PBS vs O+A, p = 0,0005; Alum vs O+A, p = 0.0026) и разветвление было снижено (PBS против O+A, p = 0,0102; Квасцы против O+A, p = 0,0242) по сравнению с таковыми в группах PBS и Alum (рис. 2). Не было обнаружено различий между группами PBS и Alum. Такая активация микроглии была более выражена в шейном отделе, чем в поясничном, у мышей с астмой, тогда как у мышей с атопическим дерматитом она была более заметна в грудном отделе, чем в поясничном (рис. 3 A–D ), что свидетельствует о что активация микроглии была более выражена на уровне спинного мозга, где иннервируются аллергические ткани дыхательных путей и кожи (Atoji et al., 2005). Однако аналогичная глиальная активация наблюдалась и в спинном мозге мышей с атопическим диатезом без явных аллергических проявлений (рис. 3 E , F ). В аксиальной плоскости активация микроглии наблюдалась преимущественно в задних рогах и столбцах (рис. 3 G , H ). Используя мышей Ccr2 rfp/+ Cx3cr1 gfp/+ (Yamasaki et al., 2014), мы подтвердили отсутствие инфильтрации макрофагов периферической крови в спинной мозг мышей с астмой (рис.4).
Рисунок 2.Активация микроглии у мышей с моделью бронхиальной астмы. A–C , Иммуногистохимия поясничного отдела спинного мозга на микроглию (зеленый), окрашенный антиионизированным антителом Ca 2+ , связывающим адаптерную молекулу 1 (Iba1), с последующим окрашиванием FluoroMyelin (красный) из PBS- ( A ), квасцы ( B ) и предварительно обработанные O+A мыши ( C ). Масштабная линейка, 100 мкм. Масштабная линейка: вставка, 20 мкм. D , Плотность клеток микроглии. E , Округлость клеток микроглии. * p < 0,05 (пост-тест Тьюки после однофакторного дисперсионного анализа). ** p < 0 0,01 (пост-тест Тьюки после однофакторного дисперсионного анализа). *** p < 0,001 (пост-тест Тьюки после однофакторного дисперсионного анализа).
Рисунок 3.Активация микроглии в отдельных участках спинного мозга мышей с бронхиальной астмой или атопическим дерматитом на коже спины на уровне грудного отдела спинного мозга (между обеими лопатками). A , C , Иммуногистохимия шейного и поясничного отделов спинного мозга на микроглию (зеленый цвет), окрашенная антителом против Iba1 с последующим окрашиванием FluoroMyelin (красный) у мышей с астмой ( A 90) атопический дерматит ( С ).Масштабные линейки, 100 мкм. B , D , Сравнение плотности микроглии шейного и поясничного отделов спинного мозга у мышей с моделью астмы ( B ) и с моделью атопического дерматита у мышей (
8 ) E , Иммуногистохимия поясничного отдела спинного мозга на микроглию (зеленый), окрашенную анти-Iba1-антителом, с последующим окрашиванием FluoroMyelin (красный) у мышей, получавших PBS, Alum и O+A, без индукции бронхиальной астма.Масштабная линейка, 100 мкм. F , Количественная оценка плотности клеток микроглии у мышей, получавших PBS, Alum и O+A, без индукции бронхиальной астмы. Наблюдается значительное увеличение плотности микроглии в группе O+A по сравнению с группами, получавшими PBS и Alum. G , H , Плотность микроглии в зависимости от расположения спинного мозга у мышей с моделью астмы, предварительно обработанных PBS и предварительно обработанных O+A ( G ), и мышей с моделью атопического дерматита ( G ) и модели атопического дерматита ( G ) Н ).Увеличение микроглии более заметно в задней (р) области, чем в передней (а) области у мышей с астмой (группа О+А). Те же тенденции, что и у мышей с моделью астмы ( G ), также наблюдаются у мышей с моделью атопического дерматита ( H ), которые не достигают статистической значимости из-за небольшого размера выборки. * p < 0,05 (пост-тест Тьюки после однофакторного дисперсионного анализа). ** p < 0,01 (пост-тест Тьюки после однофакторного дисперсионного анализа).*** p < 0,001 (пост-тест Тьюки после однофакторного дисперсионного анализа). Рисунок 4.Иммуногистохимия инфильтрации макрофагами из периферической крови. Ccr2 rfp/+ Cx3cr1 gfp/+ мышей, у которых макрофаги периферической крови маркируются красным флуоресцентным белком (RFP), тогда как микроглия маркируется GFP (Yamasaki et al., 2014). Этих мышей использовали для выяснения вклада иммунных клеток периферической крови. Нет RFP-позитивных клеток ни у мышей с астмой, предварительно обработанных PBS, ни у мышей с астмой, предварительно обработанных OVA и квасцами (O+A).Масштабная линейка, 100 мкм.
Астроглии также были активированы, и их количество увеличилось в группе O+A по сравнению с группами PBS и Alum, как определено иммуноокрашиванием GFAP и S100β (PBS vs O+A, p = 0,0008; Alum vs O+A, p = 0,0055) (рис. 5). Это наблюдалось по всему спинному мозгу независимо от очагов аллергического воспаления (рис. 6 A–D ), включая как передние, так и задние отделы (рис. 6 E , F ). Кроме того, эндотелиальные клетки были активированы с повышенной экспрессией молекулы межклеточной адгезии-1 с экстравазацией сывороточного альбумина, что свидетельствует о нарушении гематоэнцефалического барьера (ГЭБ) (рис.7).
Рисунок 5.Активация астроглии у мышей с моделью бронхиальной астмы. A , Иммуноокрашивание поясничного отдела спинного мозга антителами против GFAP и антителами против S100β от мышей, предварительно обработанных PBS, Alum и O+A. B , Плотность астроглиальных клеток. ** p < 0,01 (пост-тест Тьюки после однофакторного дисперсионного анализа). *** p < 0,001 (пост-тест Тьюки после однофакторного дисперсионного анализа). Масштабная линейка, 100 мкм.
Рис. 6.Активация астроглии в отдельных участках спинного мозга мышей с бронхиальной астмой или атопическим дерматитом на коже спины на уровне грудного отдела спинного мозга (между обеими лопатками). A , C , иммуногистохимия шейного и поясничного спинного мозга для астроглии, окрашенных антителом против S100β у мышей с астмой ( A ) или атопический дерматит ( C ). Масштабные линейки, 100 мкм. B , C , Сравнение плотности астроглии было выполнено между уровнями шейного и поясничного отделов спинного мозга у мышей с моделью астмы ( B ) и с моделью атопического дерматита у мышей ( D
7 9). E , F , Плотность астроглии в зависимости от расположения спинного мозга у мышей с моделью астмы, предварительно обработанных PBS и предварительно обработанных O+A ( E ) и модели атопического дерматита ( E ) и модели атопического дерматита ( E ) Ф ). В отличие от микроглии, плотность астроглии одинакова между передней и задней областями в обеих моделях. а, передняя область; р, задняя область; PBS, контрольные мыши; О+А, мыши с бронхиальной астмой. * p < 0,05 (пост-тест Тьюки после однофакторного дисперсионного анализа).** p < 0,01 (пост-тест Тьюки после однофакторного дисперсионного анализа). *** p < 0,001 (пост-тест Тьюки после однофакторного дисперсионного анализа). Рисунок 7.Иммуногистохимия целостности ГЭБ. A , Поясничные срезы спинного мозга мыши с моделью бронхиальной астмы, окрашенные антителом против молекулы межклеточной адгезии-1 (ICAM-1). Масштабная линейка, 100 мкм. B , Поясничные срезы спинного мозга мыши с моделью бронхиальной астмы, дважды окрашенные антимышиным альбумином и анти-GFAP-антителами.Масштабная линейка, 50 мкм. У мышей с астмой, предварительно получавших О+А, эндотелиальные клетки спинного мозга становятся ICAM-1-позитивными (белые стрелки), а альбумин просачивается из сосудов в паренхиму спинного мозга (белые стрелки).
У мышей с моделью атопии наблюдается тяжелая тактильная аллодиния
Затем мы проверили тактильную аллодинию, нанеся калиброванные нити фон Фрея на среднюю часть подошвы задней лапы (Chaplan et al., 1994). Группа O+A показала значительно более высокую скорость реакции, чем группы PBS и Alum (двусторонний ANOVA; p = 0.0134) (рис. 8 A ). Апостериорный тест Bonferroni также показал значительно более высокую скорость реакции в группе O + A для каждой силы стимуляции, чем в группах PBS и Alum ( p <0,001), что свидетельствует о развитии тактильной аллодинии у мышей с астмой. Тактильная аллодиния также наблюдалась в меньшей степени у мышей только с атопическим диатезом без аспирации OVA, о чем свидетельствует значительно усиленный ответ при стимуляции 0,04, 0,07 и 0,40 г филаментов ( p < 0.01) (Рис. 8 B ). В спинном роге мышей с моделью бронхиальной астмы экспрессия гомолога В вирусного онкогена остеосаркомы мышей FBJ (FOSB), маркера активации сенсорных нейронов (Cruz et al., 2013), была значительно повышена по сравнению с другими контрольными животными (рис. 8 C , D ).
Рисунок 8.Тактильная аллодиния с активацией нейронов задних рогов у мышей с моделью атопии. Тактильная аллодиния по результатам филаментной пробы фон Фрея. A , Тактильная аллодиния у мышей с моделью бронхиальной астмы.Скорость реакции мышей, предварительно обработанных PBS, Alum и O + A, с разной силой стимуляции филаментов фон Фрея. Столбцы, заполненные разными узорами, представляют собой различные предварительные процедуры перед ингаляцией OVA. n = 5 для каждой группы. B , Тактильная аллодиния также проявляется у мышей с атопическим диатезом без вдыхания OVA (группа O+A). n = 4 для каждой группы. C , Сенсорные нейроны задних рогов были активированы с увеличением количества FOSB-позитивных клеток только в модели бронхиальной астмы. D , Количественный анализ FOSB-позитивных клеток в задних рогах мышей с моделью бронхиальной астмы. ** p < 0 0,01 (пост-тест Тьюки после однофакторного дисперсионного анализа). *** p < 0,001 (пост-тест Тьюки после однофакторного дисперсионного анализа).
Микроглия мышей с атопией демонстрирует нерегулируемые профили экспрессии генов
Чтобы определить гены, связанные с активацией глии, мы провели анализ РНК-матрицы клеток микроглии, выделенных из спинного мозга мышей с атопическим диатезом и без него.Среди 39 430 проверенных генов 807 генов были нарушены. Эти результаты анализа массива генов были загружены в общий репозиторий экспрессии генов (номер доступа GSE68202) на домашней странице Национального центра биотехнологической информации (http://www.ncbi.nlm.nih.gov/geo/query/acc.cgi? акк=GSE68202). Анализ массива РНК микроглии выявил активацию нескольких путей, включая убиквитин-опосредованный протеолиз ( p = 0,00076), клеточный цикл ( p = 0,015), сигнальный путь ErbB ( p = 0.015) и эндоцитоз ( p = 0,018). Были очевидные различия между уровнями экспрессии каждого подмножества генов в микроглии мышей с атопическим диатезом и без него (Fig. 9 A ). Среди них гены, связанные с цитокинами и опухолями, показали наиболее значительную дисрегуляцию. Эти данные указывают на провоспалительные и пролиферативные характеристики микроглии при атопическом диатезе. Затем мы проанализировали гены, о которых известно, что они нарушены в классически активированных макрофагах (фенотип М1) и альтернативно активированных макрофагах (фенотип М2) (Jablonski et al., 2015). Среди генов, связанных с M1, CD38 , который был недавно обнаружен в качестве нового маркера для макрофагов M1, был значительно активизирован у мышей с моделью атопического диатеза (оценка Z = 2,86, кратное увеличение: 186,8). С другой стороны, FMS-подобная тирозинкиназа 1 ( Flt1 ), уровень которой, как известно, повышается в макрофагах, связанных с M2, была значительно снижена ( Z оценка = -2,368, кратность увеличения: 0,015) (рис. 9 B ). ). Эти результаты ясно указывают на тенденцию микроглии к отклонению от провоспалительного (М1-подобного) фенотипа у мышей с моделью атопического диатеза.
Рисунок 9.Изменения в паттернах экспрессии генов микроглии у мышей с моделью атопии. Результаты анализа РНК микроглии, выделенной из спинного мозга мышей с атопическим диатезом и без него. A Кластерный анализ массива экспрессии генов, которые классифицируются по шести общим путям: цитокины, комплемент, алармин, активные формы кислорода, антигены главного комплекса гистосовместимости и ген, связанный с опухолью. B , Кластерный анализ массива экспрессии генов в соответствии с генами, связанными с фенотипом активации макрофагов.М1 и М2 соответствуют классическому (провоспалительному) и альтернативному (иммунорегуляторному) фенотипам соответственно. Цветовая маркировка в каждом столбце представляет Z баллов для каждого гена.
Активация эндотелина-1 и его рецептора у мышей с моделью атопии
Затем мы сосредоточились на кластерах генов, которые кодируют рецепторы клеточной поверхности, и обнаружили, что экспрессия генов Ednrb резко повышалась ( Z оценка = 2,38, кратное увеличение: 78,13 ) (Таблица 2). Иммуногистохимический анализ показал, что экспрессия EDNRB была повышена в микроглии и более заметно в астроглии мышей с астмой по сравнению с мышами без астмы (рис.10 А , В ). Вестерн-блот анализ с использованием всего спинного мозга также продемонстрировал повышенные уровни EDNRB у мышей с моделью астмы (фиг. 10 C , D ). Иммуногистохимическое окрашивание ET-1 в тканях легких выявило выраженную активацию ET-1 в клетках альвеолярного эпителия и инфильтрированных воспалительных клетках у мышей с астмой, но не у мышей без астмы (рис. 10 E ). Экспрессия ET-1 также была усилена в тканях кожи при атопическом дерматите (фиг. 10 F ).Соответственно, у мышей с астмой сывороточные уровни ET-1, лиганда EDNRB, были значительно повышены по сравнению с мышами без астмы ( p = 0,0238) (рис. 10 G ), несмотря на очень короткий период полувыведения. ЭТ-1 (7 мин) (Рубин и Левин, 1994). Напротив, другой основной рецептор для ET-1, рецептор эндотелина типа А (EDNRA), не был обнаружен в спинном мозге мышей с моделью бронхиальной астмы, включая микроглию и астроглию (фиг. 10 H , I ). Нейроны спинного мозга не экспрессировали ни EDNRA, ни EDNRB (рис.10 J ). Хотя считается, что регуляторный фактор интерферона-8 (IRF8) (Masuda et al., 2012) и сателлитные клетки (Xu et al., 2013) участвуют в аллодинии, связанной с PNI, мы не наблюдали положительного окрашивания IRF8 в микроглии. Рис. 11 A ), или активация сателлитных клеток в DRG (Фиг. 11 B ) мышей с астмой. Хотя фенотип микроглии отклонялся от M1, не было ни демиелинизации, ни дегенерации аксонов (рис. 11 C , D ).
Таблица 2.Пять из наиболее активных генов, кодирующих рецепторы в микроглии
Рисунок 10.Активация ET-1 и EDNRB у мышей с моделью атопии. A , Двойное иммунное окрашивание антителами анти-Iba1 и анти-EDNRB образцов поясничного отдела спинного мозга от мышей, предварительно обработанных PBS и предварительно обработанных O+A. B , Двойное иммунное окрашивание антителами против GFAP и против EDNRB поясничного отдела спинного мозга от мышей, предварительно обработанных PBS и предварительно обработанных O+A. A , стрелки указывают на коэкспрессию EDNRB и Iba1 на микроглии. B , Стрелки указывают на коэкспрессию EDNRB и GFAP. Экспрессия EDNRB более выражена в астроглии, чем в микроглии в группе O+A. Масштабные линейки, 100 мкм. C , Иммуноблоттинг EDNRB с использованием спинного мозга мышей, предварительно обработанных PBS и предварительно обработанных O+A. D , Относительная плотность иммуноблотов EDNRB с использованием спинного мозга мышей, предварительно обработанных PBS и предварительно обработанных O+A. E , Иммуноокрашивание ET-1 в легких мышей с моделью бронхиальной астмы, предварительно обработанных PBS и предварительно обработанных O+A.Иммуноокрашивание ET-1 (коричневый) заметно усиливается в группе O+A. Масштабная линейка, 50 мкм. F , Иммуноокрашивание ET-1 в коже мышей с моделью атопического дерматита, обработанных PBS и OVA. Иммуноокрашивание ET-1 (коричневое) усиливается в эпидермисе мышей с мазком OVA по сравнению с мышами с мазком PBS. Масштабная линейка, 50 мкм. G , Уровень ET-1 в сыворотке повышен в группе O+A по сравнению с группой PBS. H , Двойное иммунное окрашивание с антителами против Iba1 и против EDNRA образцов поясничного отдела спинного мозга от мышей, предварительно обработанных PBS и предварительно обработанных O+A. I , Двойное иммунное окрашивание с антителами против GFAP и против EDNRB образцов поясничного отдела спинного мозга от мышей, предварительно обработанных PBS и предварительно обработанных O+A. J , Двойное иммунное окрашивание с антителами против ядер нейронов (NeuN) и антителами против EDNRA или EDNRB образцов поясничного отдела спинного мозга от мышей, предварительно обработанных О+А. Масштабные линейки: H–J , 100 мкм. * p < 0,05 (пост-тест Тьюки после однофакторного дисперсионного анализа).
Рисунок 11.Иммуногистохимия поясничного отдела спинного мозга у мышей с моделью атопии и DRG у мышей с моделью различных невропатических болей. A , Иммуногистохимия IRF8 поясничного отдела спинного мозга у мышей, предварительно обработанных PBS, предварительно обработанных квасцами и предварительно обработанных O + A. В группе O+A, несмотря на увеличение и активацию микроглии (красный цвет), экспрессия IRF8 не увеличивается. Красный представляет Iba1. Зеленый представляет IRF8. B , Иммуноокрашивание на GFAP DRG на поясничном уровне (L5).В модели PNI сателлитные глиальные клетки активированы и положительны в отношении GFAP (красные стрелки), тогда как у мышей с астмой, предварительно обработанных О+А, активация сателлитной глии не очевидна. Масштабные линейки: A , B , 50 мкм. C , Иммуногистохимия основного белка миелина (MBP). Д , Иммунохимия СМИ31/32. Нет ни явной демиелинизации, ни дегенерации аксонов. Масштабные линейки: C , D , 100 мкм.
Активация глии и аллодиния, связанные с атопией, предотвращаются с помощью антагониста EDNRB
Затем мы изучили влияние селективного антагониста EDNRB, BQ-788 (Lo et al., 2005), на активацию глии и аллодинию у мышей с атопией (Lo et al., 2005). Рис. 12 A ). BQ-788 не влиял на гиперпродукцию слизи, гиперплазию бокаловидных клеток и инфильтрацию эозинофилов в легких (фиг. 12 B ). Удивительно, но BQ-788 не только устранял активацию сенсорных нейронов микроглии, астроглии и задних рогов, но также эффективно устранял аллодинию у мышей с астмой, тогда как уровни IgE в сыворотке оставались неизменными, а активация эндотелиальных клеток увеличивалась экспрессией молекулы межклеточной адгезии-1. и экстравазация сывороточного альбумина не изменилась (рис.12 C–H , 13). Эти результаты свидетельствуют о том, что развитие аллодинии у мышей с моделью атопии в основном связано с путем ET-1/EDNRB, ведущим к активации спинальной астроглии и микроглии.
Рисунок 12.Профилактика активации глии и аллодинии у мышей с астмой. A , Схематическое изображение протоколов профилактической терапии для лечения активации глии и аллодинии у мышей с моделью бронхиальной астмы. Перед индукцией атопического диатеза BQ788 (1 мкг/кг/день) инъецировали внутрибрюшинно с 7-го по 19-й день после умерщвления мышей. B , Периодическое окрашивание легких кислотой по Шиффу показывает гиперпродукцию слизи и гиперплазию бокаловидных клеток у мышей, предварительно получавших О+А, с профилактическим лечением или без него, что указывает на успешную индукцию бронхиальной астмы. Масштабная линейка, 20 мкм. C , Тактильная аллодиния, определенная тестом нитей фон Фрея у мышей, предварительно обработанных PBS, предварительно обработанных O+A и предварительно обработанных O+A и BQ788 (O+A+BQ). Наблюдается заметное улучшение аллодинии при лечении BQ788 у мышей с астмой. D , Уровни IgE в сыворотке у мышей, предварительно обработанных PBS, предварительно обработанных O+A, предварительно обработанных O+A+BQ. E , Иммуноокрашивание с использованием антител против Iba1, антител против S100β и антител против FOSB образцов поясничного отдела спинного мозга мышей, предварительно обработанных PBS, O+A и O+A+BQ. Масштабная линейка, 100 мкм. F , Плотность клеток микроглии. G , Плотность астроглиальных клеток. H , FOSB-положительная плотность нейронов.* p < 0,05 (пост-тест Тьюки после однофакторного дисперсионного анализа). ** p < 0,01 (пост-тест Тьюки после однофакторного дисперсионного анализа). *** p < 0,001 (пост-тест Тьюки после однофакторного дисперсионного анализа).
Рисунок 13.Иммуногистохимия активации эндотелиальных клеток и утечки альбумина в поясничном отделе спинного мозга у мышей с моделью атопии, получавших селективный ингибитор EDNRB. A , Поясничные срезы спинного мозга мыши с моделью бронхиальной астмы, получавшие селективный антагонист EDNRB, BQ788, окрашенные антителом против ICAM-1.Масштабная линейка, 100 мкм. B , Поясничные срезы спинного мозга мыши с моделью бронхиальной астмы, обработанные BQ788, дважды окрашенные антителами против мышиного альбумина и против GFAP. Масштабная линейка, 20 мкм. У мышей с астмой, предварительно обработанных O + A, эндотелиальные клетки в спинном мозге все еще остаются ICAM-1-позитивными (белые стрелки), а альбумин просачивается из сосудов в паренхиму спинного мозга (белые стрелки), несмотря на лечение BQ788.
У пациентов с атопией с миелитом, преимущественно проявляющимся невропатической болью, наблюдается активация пути ET-1/EDNRB, 2012), сообщается о развитии миелита, проявляющегося персистирующей нейропатической болью. Поэтому мы провели невропатологическое исследование образцов спинного мозга из вскрытого случая атопического миелита. Мы обнаружили диффузную активацию микроглии и астроглии в задних рогах спинного мозга (рис. 14
A ), которая сопровождалась потерей как миелина, так и аксонов, о чем ранее сообщалось в биоптатах тканей спинного мозга (Kikuchi et al. , 2001; Osoegawa et al., 2003b). При этом лишь небольшое количество CD8 + Т-клеток и CD68 + макрофагов, но не CD4 + Т-клеток, инфильтрировали паренхиму спинного мозга (рис.14 B ), что, вероятно, отражает длительную кортикостероидную терапию пациента. Экспрессия EDNRB была заметно усилена, главным образом, на астроглиальной поверхности (фиг. 14 C , D ), что совместимо с данными, полученными на нашей модели мышей с атопией. Рисунок 14.Активация глии и повышение уровня ET-1 в сыворотке крови при атопическом миелите. AD , Активация глии в аутопсийных образцах спинного мозга пациента с атопией с миелитом и невропатической болью, который соответствовал установленным диагностическим критериям атопического миелита с высокой специфичностью и чувствительностью (оба > 90%) (Isobe et al., 2012). A , Иммуногистохимический анализ глиального воспаления в шейном отделе спинного мозга у аутопсийного пациента с атопическим миелитом и невропатической болью. Контрольные образцы были получены от больного, умершего от септического шока без каких-либо неврологических признаков и атопии. Наблюдается сильное увеличение астроглии и микроглии в шейном отделе спинного мозга у пациентов с атопией с миелитом и невропатической болью. Масштабные линейки, 200 мкм. Шкала баров: вставка, 50 мкм. B , Иммуноокрашивание CD8 и CD68 в тканях спинного мозга.Несколько CD8 + Т-клеток и CD68 + макрофагов проникли в паренхиму спинного мозга. Масштабные линейки, 100 мкм. C , Иммуноокрашивание EDNRB в тканях спинного мозга. EDNRB экспрессируется в астроглии спинного мозга в контрольной ткани, тогда как его экспрессия заметно повышается в астроглии в ткани пациента с атопическим миелитом и невропатической болью. Шкала баров, 20 мкм. D , Двойное иммунофлуоресцентное окрашивание образцов шейного отдела спинного мозга пациента с атопическим миелитом и нейропатической болью.Почти все EDNRB-позитивные клетки сливаются с GFAP-позитивной астроглией, хотя некоторые GFAP-негативные клетки (белые звездочки) также очевидны. Шкала баров: верхний ряд, 50 мкм; нижний ряд, 10 мкм. E , Уровни ET-1 в сыворотке крови человека, включая контрольную группу здоровых людей без атопических расстройств и пациентов с атопическим миелитом. Значительное повышение уровня ET-1 в сыворотке крови наблюдается у пациентов с атопическим миелитом по сравнению со здоровыми людьми без атопических заболеваний ( p = 0.0052). ** p < 0,01 (критерий Манна-Уитни U ). HC, здоровый контроль; АМ, атопический миелит.
Наконец, мы измерили уровни ET-1 в сыворотке у пациентов с атопией с миелитом, проявляющимся невропатической болью (Isobe et al., 2012), и у здоровых людей без атопии (таблица 3). По сравнению со здоровым контролем без атопии и невропатической боли уровни ET-1 в сыворотке были значительно повышены у пациентов с атопией с миелитом и невропатической болью, хотя пациенты с атопией с миелитом и невропатической болью чаще принимали противоаллергические препараты, что могло снизить уровни ET-1 в сыворотке. (Инжир.14 Е ; Таблица 3) (Zietkowski et al., 2010). Эти наблюдения предполагают аналогичный механизм, включающий путь ET-1/EDNRB, который частично действует у пациентов с атопией с миелитом, проявляющимся невропатической болью.
Таблица 3.Демографические особенности субъектов a
Обсуждение
Это исследование показывает, что атопические расстройства, такие как атопический дерматит и астма, и даже атопический диатез сами по себе могут индуцировать обширную активацию спинного мозга и микроглия.Активация спинальной микроглии наблюдалась преимущественно в задних рогах и столбах, и эта активированная микроглия демонстрировала нерегулируемый провоспалительный фенотип. Хотя эндотелиальные клетки были активированы и ГЭБ был нарушен у мышей с астмой, активация микроглии, но не инвазия макрофагов периферической крови, также подтверждается результатами, полученными на мышах Ccr2 rfp/+ Cx3cr1 gfp/+ . Интересно, что активация глии при атопии сопровождалась появлением тактильной аллодинии.Поскольку изначально мы не обнаружили различий ни в активации глии, ни в аллодинии между группами PBS и квасцами, в некоторых наших экспериментах в качестве контроля использовали группу PBS, но не группу квасцов. Хотя для таких данных требуется тщательная интерпретация, активация микроглии и астроглии, совпадающая с развитием аллодинии, была поразительно последовательной у мышей с моделью астмы, даже по сравнению с группами квасцов. Однако ни IRF8 (Tsuda et al., 2003), ни сателлитная глия DRG (M.H. Chen et al., 2014) не вносили вклад, что позволяет предположить, что отдельный каскад от аллодинии, связанной с PNI, действует при аллодинии, связанной с атопией.
Недавно сообщалось, что фокальная активация астроглии без активации микроглии в задних рогах, иннервирующих кожу с локализованным атопическим дерматитом, усиливала ощущение хронического зуда у мышей (Shiratori-Hayashi et al., 2015). Это отличается от нашей модели системной атопии, демонстрирующей активацию как микроглии, так и астроглии, хотя оба результата в совокупности подтверждают возможную связь между атопией и активацией спинальной глии. Учитывая, что даже в нашей модели активация микроглии была более выражена на уровне спинного мозга, где иннервируются аллергические ткани дыхательных путей и кожи, входы сенсорных нейронов также могут частично способствовать активации микроглии.Наблюдение, что активация астроцитов не связана с очагами аллергического воспаления, предполагает меньший вклад в это явление местных факторов, связанных с аллергией. Важно отметить, что атопический диатез сам по себе может индуцировать не только активацию глии, но и аллодинию, вероятно, посредством определенных системных факторов. Таким образом, предполагается, что атопия может постоянно оказывать широкий стимулирующий эффект не только на спинальную астроглию, но и на микроглию, приводя к активации ноцицептивной системы.
В нашей модели аллергического воспаления путь ET-1/EDNRB, по-видимому, имеет решающее значение как для активации глии, так и для аллодинии. ET-1 продуцируется различными клетками, такими как эндотелиальные клетки, гладкомышечные клетки сосудов, лейкоциты, тучные клетки, макрофаги и даже нейроны (Smith et al., 2014). И EDNRA, и EDNRB участвуют в нейропатической и воспалительной боли, хотя взаимодействие между системой эндотелина и ноцицептивной системой очень сложное (Smith et al., 2014).EDNRA экспрессируется на периферических нервных окончаниях ноцицепторов, нервных аксонах и телах ноцицепторных клеток (Pomonis et al., 2001). EDNRB обнаруживается на эндотелиальных клетках, макрофагах, кератиноцитах и гладкомышечных клетках (Smith et al., 2014). Периферическое введение ET-1 усиливает ноцицептивное поведение у людей и грызунов через рецепторы EDNRA на сенсорных нейронах, тогда как введение ET-1 непосредственно в ЦНС часто оказывает антиноцицептивное действие, где ET-1 активирует нисходящий ингибирующий путь к спинному мозгу, возможно, через высвобождение эндогенных опиоидов (Smith et al., 2014). Сообщалось, что в модели хронического артрита селективный блокатор EDNRB усиливает ноцицепцию (Piovezan et al., 2004), тогда как в модели невралгии тройничного нерва, вызванной повреждением тройничного нерва, механическая аллодиния уменьшалась за счет блокады EDNRB (Chichorro et al., 2006). ). В нашем исследовании механическая гипералгезия устранялась селективной блокадой EDNRB, которая также устраняла активацию глии и нейронов. Поскольку экспрессия EDNRA или EDNRB в нейронах у наших мышей с атопией практически не обнаруживалась, маловероятно, что антагонист EDNRB в первую очередь действовал на нейроны.Вместо этого эти данные свидетельствуют о важности микроглии и астроглии в возникновении невропатической боли, связанной с аллергическим воспалением.
Накапливающиеся данные свидетельствуют о том, что ET-1 ослабляет целостность ГЭБ (Matsuo et al., 2001; Didier et al., 2003; Leung et al., 2009), ET-1, продуцируемый воспаленными аллергическими тканями, может повышать проницаемость ГЭБ и активировать EDNRB-укрывающий микроглию и астроглию из-за скомпрометированного ГЭБ при атопических воспалительных состояниях. В нашем исследовании селективная блокада EDNRB с помощью BQ788 не могла блокировать ни активацию эндотелиальных клеток, ни утечку альбумина, что можно объяснить тем фактом, что ET-1-индуцированная активация эндотелия и повреждение ГЭБ опосредуются EDNRA, а не EDNRB (Matsuo et al., 2001). Также возможно, что провоспалительные цитокины периферической крови, высвобождаемые из атопических воспалительных тканей, могут частично способствовать нарушению целостности ГЭБ (Chesné et al., 2014; Waisman et al., 2015). Таким образом, возможно, что BQ788 непосредственно ингибирует активацию глиальных клеток, проникающих через ослабленный ГЭБ у мышей с нашей моделью атопии.
Мы показали, что ET-1 продуцируется в тканях легких и кожи у мышей с атопическим дерматитом, что согласуется с повышенной экспрессией ET-1 в эпидермисе пациентов с атопическим дерматитом (Aktar et al., 2015) и бронхиального эпителия больных астмой (Pégorier et al., 2007). Мы также обнаружили, что ET-1 в сыворотке был значительно повышен у пациентов, которые соответствовали установленным диагностическим критериям атопического миелита, но большинство из них получали противоаллергические препараты, которые потенциально могут снижать уровни ET-1 (Zietkowski et al., 2010). Это согласуется с недавним сообщением о повышении уровня ET-1 в периферической крови у пациентов с атопическим дерматитом при обострении (Цыбиков и др., 2015), поскольку атопический миелит развивается и рецидивирует во время или сразу после обострения атопического заболевания (Kira et al., 1997, 1998; Осоегава и др., 2003а; Мураи и др., 2004 г.; Изобе и др., 2009). Учитывая, что период полураспада ET-1 составляет 7 минут (Rubin and Levin, 1994), значительное увеличение ET-1 у пациентов с атопическим миелитом может свидетельствовать о персистирующей продукции ET-1 во время обострения атопического миелита. Интересно, что первый случай вскрытия с атопическим миелитом продемонстрировал активацию как микроглии, так и астроглии с заметной активацией EDNRB в спинном мозге, особенно в задних рогах, что согласуется с патологическими данными у мышей с нашей моделью атопии.Это говорит о том, что сходный механизм, индуцирующий глиальную активацию и невропатическую боль посредством пути ET-1/EDNRB, может быть, по крайней мере частично, действующим у людей.
ET-1 является сильным раздражителем у людей, и, как сообщается, его количество увеличивается в коже пациентов с узловатой почесухой (Kido-Nakahara et al., 2014). Кроме того, у пациентов с атопическим дерматитом порог восприятия электрического тока ниже, чем у здоровых людей (Kobayashi et al., 2003). Возможно, ET-1 играет важную роль в усилении не только зуда, но и болевых ощущений, способствуя повышению чувствительности к сенсорным стимулам у пациентов с атопией.Плазмаферез может эффективно облегчить неврологические симптомы, включая невропатическую боль и обострение атопических заболеваний, таких как атопический дерматит и атопическая астма, у пациентов с атопическим миелитом (Osoegawa et al., 2003a; Murai et al., 2004; Isobe et al., 2009). ). Это подтверждает представление о том, что гуморальный фактор(ы), включая ET-1, может ухудшить течение атопического миелита вместе с атопическими расстройствами.
В биоптатах спинного мозга пациентов с атопическим миелитом было показано активное воспаление с инфильтрацией периферических иммунных клеток, включая Т-клетки, В-клетки, макрофаги и эозинофилы различной степени (Kikuchi et al., 2001; Осоегава и др., 2003b). CD4 + Т-клетки инфильтрируют периваскулярно, тогда как CD8 + Т-клетки инвазируют в паренхиму при атопическом миелите (Kikuchi et al., 2001; Osoegawa et al., 2003b). Напротив, мы не наблюдали какой-либо инфильтрации периферических иммунных клеток в спинной мозг у мышей с моделью атопии, хотя активация глии обычно наблюдалась как у мышей с моделью атопии, так и у пациентов с атопическим миелитом у людей. Одной из предполагаемых причин может быть разница в продолжительности заболевания; средний возраст начала атопического миелита составляет 30 лет, что на десятилетия отстает от начала атопических заболеваний в организме (Osoegawa et al., 2003а; Изобе и др., 2009). Таким образом, длительное и многократное воздействие ET-1 вместе с постоянно подавленным ГЭБ может вызывать инфильтрацию воспалительных клеток у пациентов-людей. В качестве альтернативы, аутоантитела или аутоиммунные клетки, нацеленные на ткани ЦНС, могут потребоваться для инфильтрации периферических иммунных клеток, поскольку плазмаферез эффективен при атопическом миелите (Murai et al., 2004), а экспериментальный аутоиммунный энцефаломиелит усугубляется ET-1 (Guo et al. , 2014). В настоящее время ведутся поиски аутоиммунитета у пациентов с атопическим миелитом.Требуются дальнейшие невропатологические исследования с использованием большего количества образцов от аналогичных пациентов с атопией и миелитом. Выяснение нижестоящего каскада от опосредованной ET-1/EDNRB глиальной активации к преувеличенной активации ноцицепторов в нашей модели атопии также необходимо в будущих исследованиях.
В заключение, наше исследование раскрывает новый механизм, посредством которого аллергическое воспаление вызывает чрезмерную активацию ноцицептивной системы посредством широко распространенной активации микроглии и астроглии в спинном мозге.Наблюдение за тем, что обычное аллергическое воспаление может вызывать широко распространенную активацию микроглии и астроглии, может дать некоторые ключи к разгадке механизмов нейропсихиатрической коморбидности с атопией, а также невропатической боли неясно определенной причины, в которой, как предполагается, активированная микроглия и астроглия играют решающую роль. (Цуда и др., 2003; Лоуренс и Фатеми, 2005; Морган и др., 2010). Наши результаты показывают, что путь ET-1/EDNRB может быть новой терапевтической мишенью при проявлениях ЦНС, связанных с атопией.
Решение проблемы аллергии может заключаться не только в лекарствах
Хотя в это может быть трудно поверить сейчас, когда зима в Чикаго бушует как одна из самых холодных за последние годы, весна не за горами. В то время как передышка от холода будет благословением, те, кто страдает от сезонной аллергии, столкнутся с еще одним нападением со стороны Матери-природы в виде аллергенов.
Вместо того, чтобы обращаться к лекарствам от аллергии и ингаляторам, некоторые из которых вызывают долгосрочные побочные эффекты, такие как слабоумие, депрессия и высокое кровяное давление, можно найти утешение в преимуществах хиропрактики.Причина аллергических реакций заключается в том, что наш организм неправильно диагностирует чужеродные вещества, такие как пыльца, перхоть домашних животных, пыль и т. д. Где-то по пути через нашу нервную систему посылается сигнал о высвобождении в организм антител, которые доказывают больше вреда, чем пользы. Хотя каждый организм реагирует по-своему, наиболее распространенные симптомы аллергических реакций варьируются от воспаления кожи, носовых пазух, дыхательных путей и пищеварительной системы.
Эти сигналы подаются, в частности, парасимпатическими нервами нервной системы.В исследовании, опубликованном Отделением пульмонологии и реаниматологии Орегонского университета здравоохранения и науки, делается вывод о том, что:
«Парасимпатические нервы снабжают все основные системы органов, связанные с аллергией и воспалением, включая мышцы, железы и воспалительные клетки. Таким образом, они способны индуцировать и модулировать дисфункцию гладкой мускулатуры или усиленное сокращение, а также повышенную секрецию слизи. Важно отметить, что влияние парасимпатических нервов распространяется на воспалительные клетки, все из которых экспрессируют мускариновые рецепторы.Таким образом, парасимпатические нервы могут модулировать воспаление».
При подвывихе позвоночника нервные сигналы прерываются и неправильно доставляются по всему телу. Эти ложные реакции коррелируют как с симпатическими, так и с парасимпатическими нервами. В другом исследовании, проведенном Колледжем Шермана, «предполагается, что шейные корректировки могут приводить к парасимпатическим реакциям, тогда как торакальные корректировки приводят к симпатическим реакциям. Кроме того, оказывается, что эти ответы могут демонстрировать взаимосвязь вегетативных ответов в связи с конкретным скорректированным сегментом (сегментами).
Здоровая взаимосвязь между этими вегетативными реакциями жизненно важна для реакции нашего организма на аллергены. Чтобы нервная система правильно реагировала и подавала сигналы различным частям нашего тела, позвоночник должен быть в правильном положении, чтобы нервы оставались свободными. В клинике хиропрактики Кнехта в районе Лейквью в Чикаго мы делаем именно это.


 Высыпания чаще похожи на сыпь и поражают волосистую область головы. Зуд при этом сильнее, чем при истинной аллергии;
Высыпания чаще похожи на сыпь и поражают волосистую область головы. Зуд при этом сильнее, чем при истинной аллергии;

