Подслизистое образование в желудке: Подслизистые новообразования желудочно-кишечного тракта в эндоскопической практике
Подслизистые новообразования желудка: клиника, диагностика, лечение (обзор литературы и собственные клинические наблюдения)
Paediatric surgery.Ukraine.2020.1(66):81-91; doi 10.15574/PS.2020.66.81
Хоменко В. С.1, Строцкий К. П.1, Сироткин А. В.1, Перепелица В. П.1, Хоменко Л. В.2
1КНП «Областная клиническая больница имени О.Ф. Гербачевского» Житомирского областного совета, Украина
2КП «Больница №1» Житомирского городского совета, Украина
Для цитирования: Хоменко ВС, Строцкий КП, Сироткин АВ, Перепелица ВП, Хоменко ЛВ. (2020). Подслизистые новообразования желудка: клиника, диагностика, лечение (обзор литературы и собственные клинические наблюдения). Хирургия детского возраста. 1(66): 81-91; doi 10.15574/PS.2020.66. 81
81
Статья поступила в редакц
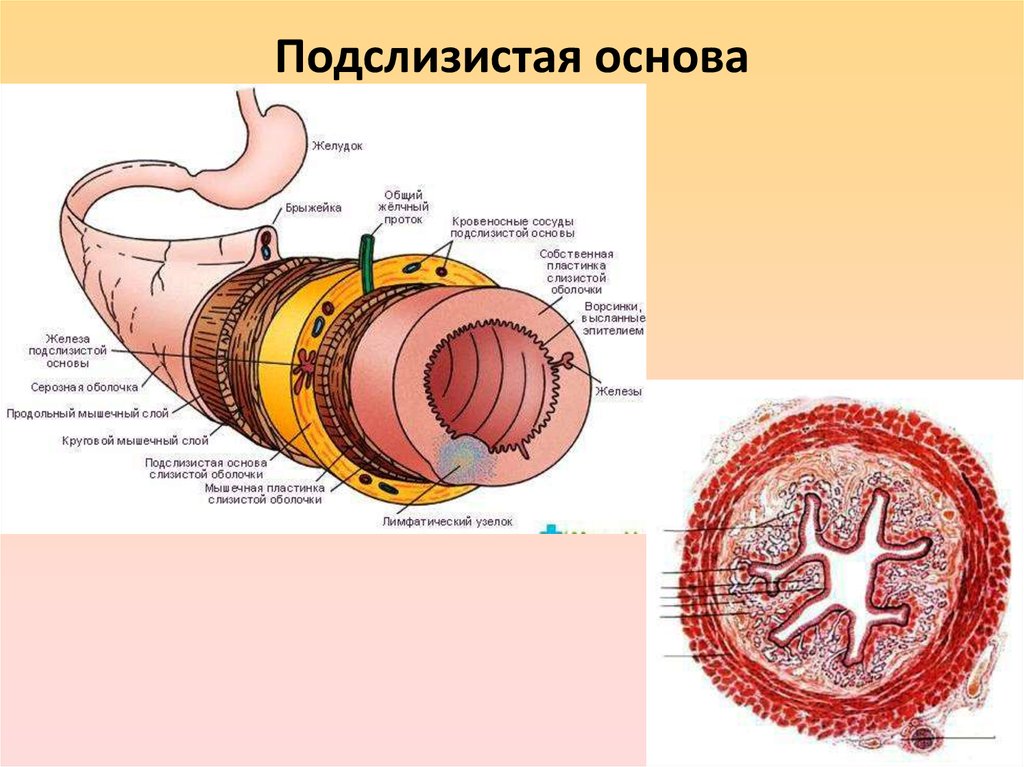
Подслизистые опухоли желудка представляют собой гетерогенную группу заболеваний, различающихся по этиологии, клинической семиотике и терапевтической тактике. На долю подслизистых опухолей приходится около 0,1–1% от всех опухолей желудочно-кишечного тракта. В педиатрической практике заболеваемость составляет 0,02 на 1 млн, или примерно 0,4% всех больных с гастроинтестинальными стромальными опухолями младше 20 лет. В 70% случаев новообразования диагностируются у девочек. В большинстве случаев подслизистые опухоли бессимптомные и представляют собой случайную находку при проведении эндоскопии. Лишь около 3% пациентов, госпитализированных в стационар, у которых в дальнейшем диагностируют подслизистые опухоли, имеют определенные симптомы, ассоциированные с имеющейся опухолью.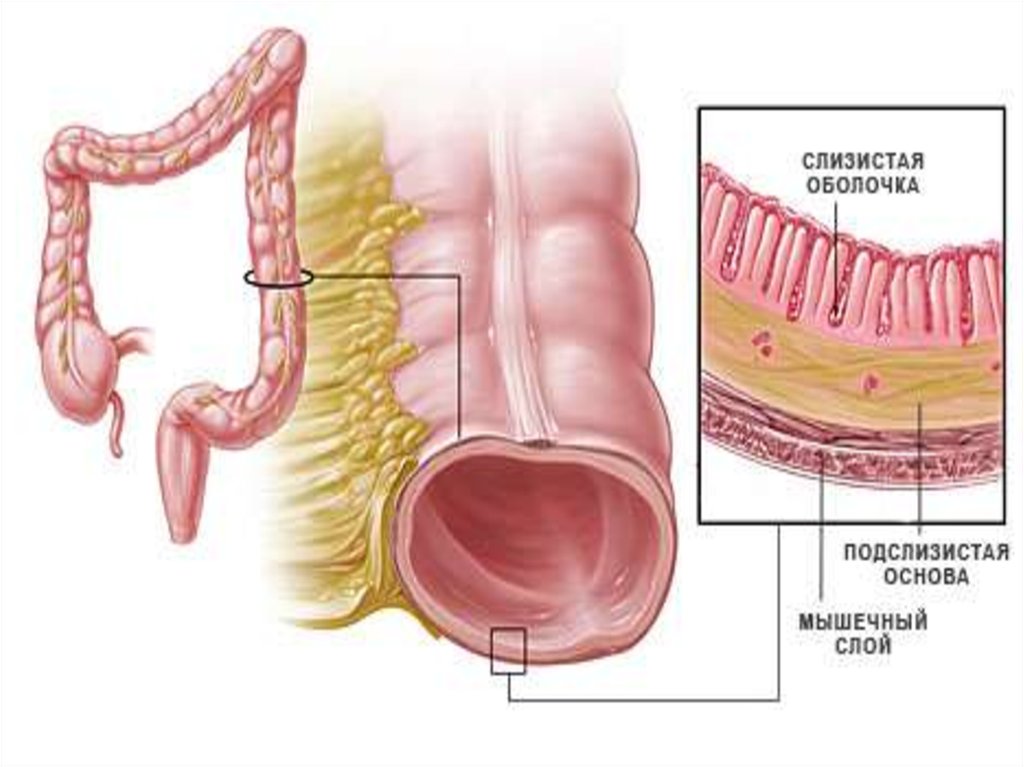
Для иллюстрации приведены случаи из собственной практики.
Исследование было выполнено в соответствии с принципами Хельсинкской Декларации. Протокол исследования был одобрен Локальным этическим комитетом всех участвующих учреждений. На проведение исследований было получено информированное согласие пациентов.
Авторы заявляют об отсутствии конфликта интересов.
Ключевые слова: подслизистые опухоли, гастроинтестинальные стромальные опухоли, предоперационная гистологическая диагностика,лапароскопическая резекция.
ЛИТЕРАТУРА
1. Галкин В, Майстренко Н. (2003). Диагностика и хирургическое лечение неэпителиальных опухолей желудочно-кишечного тракта. Хирургия. Журнал имени НИ. Пирогова. 1: 22-2.
2. Прокопчик НИ, Гривачевский АС, Жигулич СП, Андреева ОВ. (2013). Нейрофиброма желудка. Журнал Гродненского государственного медицинского университета. 2(42): 107-108.
3. Скоpопад В. (2016). Шваннома желудка. Онкология. Журнал имени ПА Герцена. 1: 63-65.
4. Старков Ю с соавт. (2010). Подслизистые новообразования желудочно-кишечного тракта в эндоскопической практике. Хирургия. Журнал имени НИ Пирогова. 2: 52-59.
5. Albayrak F. (2010). Inflammatory myofibroblastic tumor of the stomach in an adult woman: a rare intermittent cause of gastric outlet obstruction. Tumori. 96(3): 492-495. https://doi.org/10.1177/030089161009600320; PMid:20845815
6. Cheng B et al. (2018). Primary gastric inflammatory myofibroblastic Tumor A case report. Medicine. 97: 50. https://doi.org/10.1097/MD.0000000000013423; PMid:30557996 PMCid:PMC6320093
Medicine. 97: 50. https://doi.org/10.1097/MD.0000000000013423; PMid:30557996 PMCid:PMC6320093
7. European Sarcoma Network Working Group. (2014). Gastrointestinal stromal tumours: ESMO Clinical practice guidelines for diagnosis, treatment and follow-up.
8. Joensuu H, Hohenberger P, Corless C. (2013). Gastrointestinal stromal tumour. Lancet. 382: 973-983. https://doi.org/10.1016/S0140-6736(13)60106-3
9. Hirota S et al. (1998). Gain-of-function mutations of c-kit in human gastrointestinal stromal tumors. Science. 279: 577-580. https://doi.org/10.1126/science.279.5350.577; PMid:9438854
10. Jin W. (2016). Current guidelines in the management of upper gastrointestinal subepithelial tumors. Clin Endosc. 49: 235-240. https://doi.org/10.5946/ce.2015.096; PMid:26898512 PMCid:PMC4895944
11. Katakwar A. (2014). Primary gastric inflammatory myofibroblastic tumor in an adult – case report with brief review. Indian J Surg Oncol. 5(1): 66–70. https://doi.org/10.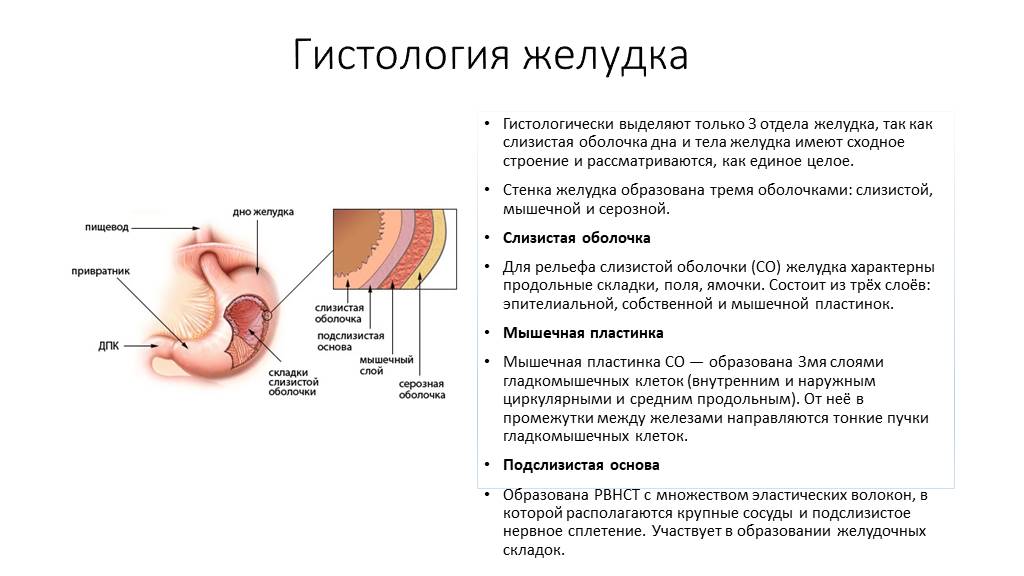 1007/s13193-014-0296-5; PMid:24669167 PMCid:PMC3964230
1007/s13193-014-0296-5; PMid:24669167 PMCid:PMC3964230
12. Kim GH. (2015). Сlinical and endoscopic features of metastatic tumors in the stomach. Gut and Liver. 9(5): 615-622. https://doi.org/10.5009/gnl14032
13. Mądro A. (2014). Neurofibroma of the stomach without Recklinghausen’s disease: a case report. Prz Gastroenterol. 9(5): 310-312. https://doi.org/10.5114/pg.2014.46168; PMid:25396008 PMCid:PMC4223121
14. Masoni L et al. (2014). Laparoscopic resection of large gastric GISTs: feasibility and long-term results. Surgical Endoscopy. 28: 2905-2910. https://doi.org/10.1007/s00464-014-3552-4; PMid:24879133
15. Miettinen M, Lasota J. (2003). Gastrointestinal stromal tumors (GISTs): definition, occurrence, pathology, differential diagnosis and molecular genetics. Pol J Pathol. 54: 3-24.
16. Nishida T et al. (2013). Submucosal tumors: Comprehensive guide for the diagnosis and therapy of gastrointestinal submucosal tumors. Digestive Endoscopy. 25: 479-489.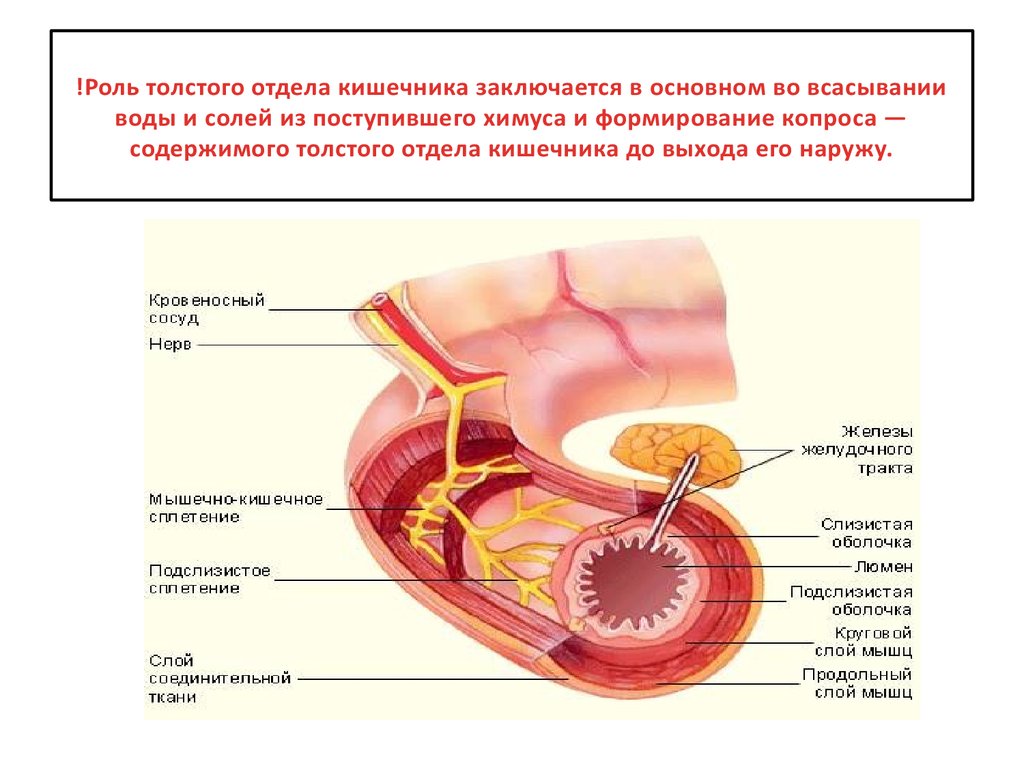 https://doi.org/10.1111/den.12149; PMid:23902569
https://doi.org/10.1111/den.12149; PMid:23902569
17. Quiroz HJ. (2018). Pediatric gastrointestinal stromal tumors – a review of diagnostic modalities. Transl Gastroenterol Hepatol. 3: 54. https://doi.org/10.21037/tgh.2018.07.08; PMid:30225388 PMCid:PMC6131159
18. Ries L et al. (2002). SEER cancer statistics review, 1973–1999.
19. Rosch T et al. (2002). Accuracy of endoscopic ultrasonography in upper gastrointestinal submucosal lesions: a prospective multicenter study. Scand J Gastroenterol. 37: 856-862. https://doi.org/10.1080/713786521; PMid:12190103
20. Sato T et al. (2005). Strategy of treatment of submucosal gastric tumours. Eur J Med Res. 10: 292-295.
21. Weigt J, Malfertheiner P. (2015). Metastatic disease in the stomach. Gastrointest Tumors. 2: 61-64. https://doi.org/10.1159/000431304; PMid:26674003 PMCid:PMC4668793
Доброкачественные опухоли желудка — Клиника 29
Доброкачественные опухоли желудка – группа новообразований эпителиального и неэпителиального гистогенеза, исходящих из разных слоев желудочной стенки, характеризующихся медленным развитием и относительно благоприятным прогнозом.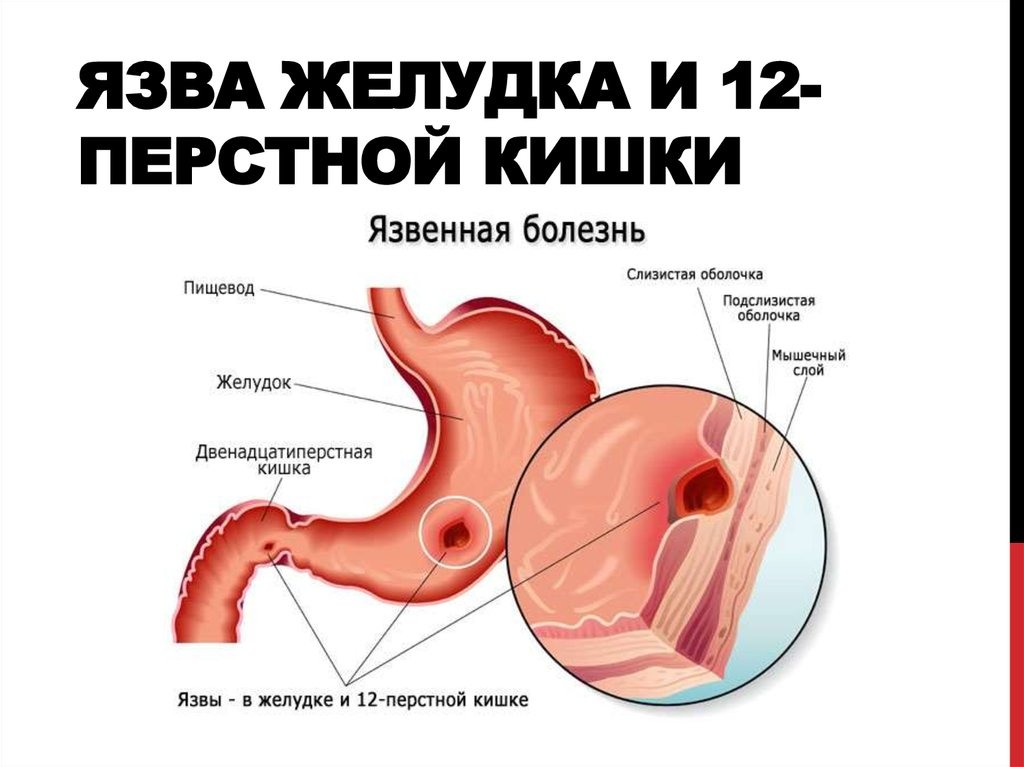 Опухоли могут проявляться болями в эпигастрии, симптомами желудочного кровотечения, тошнотой, рвотой. Основными методами диагностики доброкачественных опухолей являются рентгенография желудка и фиброгастроскопия, гистологическое исследование опухолевой ткани. Лечение доброкачественных опухолей желудка заключается в их удалении эндоскопическим методом или хирургическим путем.
Опухоли могут проявляться болями в эпигастрии, симптомами желудочного кровотечения, тошнотой, рвотой. Основными методами диагностики доброкачественных опухолей являются рентгенография желудка и фиброгастроскопия, гистологическое исследование опухолевой ткани. Лечение доброкачественных опухолей желудка заключается в их удалении эндоскопическим методом или хирургическим путем.
В зависимости от происхождения доброкачественные опухоли желудка разделяются на эпителиальные и неэпителиальные.
Среди эпителиальных опухолей встречаются единичные или множественные аденоматозные и гиперпластические полипы, диффузный полипоз. Полипы представляют собой опухолевидные эпителиальные выросты в просвете желудка с ножкой или широким основанием, шаровидной и овальной формы, с гладкой или грануляционной поверхностью, плотной или мягкой консистенцией. Полипы желудка чаще всего возникают у лиц мужского пола в возрасте 40-60 лет, обычно располагаются в пилороантральном отделе. Ткани полипа представлены разросшимся покровным эпителием желудка, железистыми элементами и соединительной тканью, богатой сосудами.
Аденоматозные полипы желудка — истинные доброкачественные опухоли из железистого эпителия состоят из папиллярных и/или тубулярных структур с выраженной клеточной дисплазией и метаплазией. Аденомы опасны в плане малигнизации и часто приводят к развитию рака желудка. До 75% доброкачественных эпителиальных опухолей желудка составляют гиперпластические (опухолеподобные) полипы, возникающие вследствие очаговой гиперплазии покровного эпителия, имеющие относительно низкий риск озлокачествления (около 3%). При диффузном полипозе желудка выявляются и гиперпластические, и аденоматозные полипы.
Редко встречающиеся неэпителиальные доброкачественные опухоли желудка формируются внутри желудочной стенки — в ее подслизистом, мышечном или подсерозном слое из различных элементов (мышечной, жировой, соединительной тканей, нервов и сосудов). К ним относятся миомы, невриномы, фибромы, липомы, лимфангиомы, гемангиомы, эндотелиомы и их смешанные варианты. Также в желудке могут наблюдаться дермоиды, остеомы, хондромы, гамартомы и гетеротопии из тканей поджелудочной железы, дуоденальных желез.
Лейомиомы – наиболее часто встречающиеся доброкачественные неэпителиальные опухоли желудка могут оставаться в мышечном слое, расти в направлении серозной оболочки или прорастать сквозь слизистую желудка, приводя к изъязвлению и желудочному кровотечению. Доброкачественные неэпителиальные опухоли желудка предрасположены к малигнизации.
Причины развития доброкачественных опухолей желудка окончательно не выяснены. Развитие полипов может быть связано с нарушением регенерации слизистой оболочки желудка, дискоординацией процессов пролиферации и дифференцировки ее клеток при хроническом гастрите. Аденомы желудка возникают на фоне атрофического гастрита в результате перестройки желез и покровного эпителия, появления кишечной метаплазии. Гиперпластические полипы развиваются при нарушении обновления и увеличения продолжительности жизни клеток, из-за избыточной регенерации покровно-ямочного эпителия.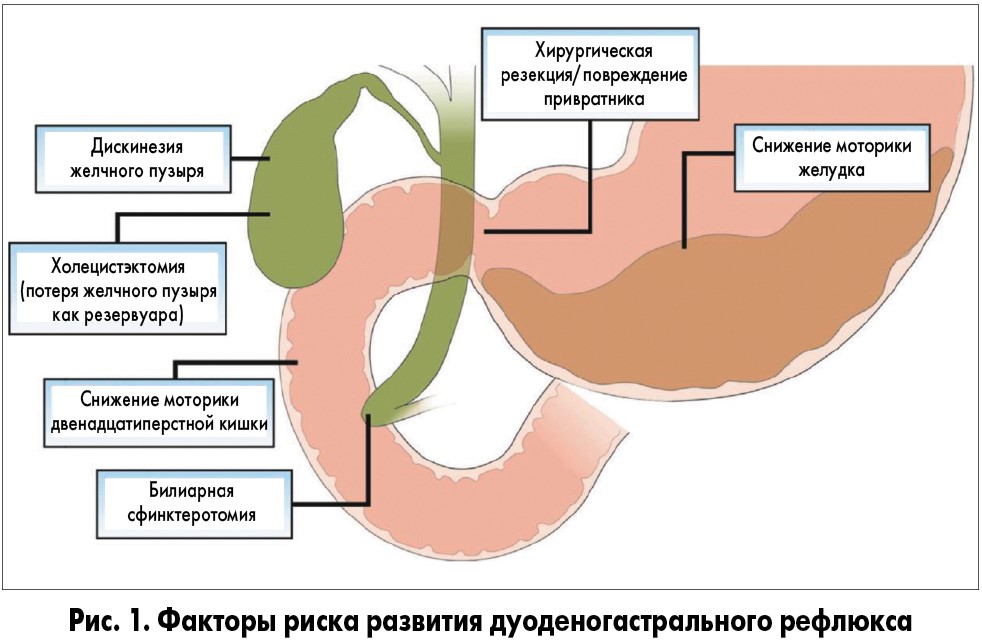
Источником неэпителиальных доброкачественных опухолей желудка может быть гетеротопированная эмбриональная ткань, сохранившаяся в слизистой оболочке при нарушении внутриутробного развития.
Симптомы доброкачественных опухолей желудка
В половине случаев полипы желудка протекают без клинических проявлений. Симптомы полипов желудка в основном определяются фоновым заболеванием (хроническим гастритом) и осложнениями (изъязвлением верхушки полипа, кровотечением, пролапсом полипа в двенадцатиперстную кишку и непроходимостью привратника).Боли при полипах желудка обусловлены воспалительным процессом в окружающей его слизистой оболочке, локализуются в эпигастральной области и имеют тупой, ноющий характер. Сначала они возникают после приема пищи, затем становятся постоянными. Могут наблюдаться жалобы на горечь во рту, тошноту и отрыжку.
 При развитии непроходимости привратника — появляется рвота, при ущемлении полипа – начинаются схваткообразные боли в подложечной области и по всему животу. Изъязвление полипа приводит к умеренному желудочному кровотечению; при этом может выявляться кровь в рвотной массе, дегтеобразный стул, недомогание, бледность кожных покровов, анемия. Малигнизация полипов, как правило, происходит незаметно, поэтому подозрение должны вызвать отсутствие аппетита, похудание, нарастание общей слабости, диспепсические расстройства.
При развитии непроходимости привратника — появляется рвота, при ущемлении полипа – начинаются схваткообразные боли в подложечной области и по всему животу. Изъязвление полипа приводит к умеренному желудочному кровотечению; при этом может выявляться кровь в рвотной массе, дегтеобразный стул, недомогание, бледность кожных покровов, анемия. Малигнизация полипов, как правило, происходит незаметно, поэтому подозрение должны вызвать отсутствие аппетита, похудание, нарастание общей слабости, диспепсические расстройства.Клинические признаки неэпителиальных доброкачественных опухолей желудка зависят от их локализации, характера и скорости роста, наличия изъязвления поверхности. Чаще всего неэпителиальные опухоли желудка сопровождаются кратковременными и постоянными болями, возникающими натощак, после приема пищи, при изменении положения тела. При невриномах болевой синдром сильный, жгучего характера. Изъязвление опухоли (особенно, гемангиомы) может вызывать скрытые или обильные желудочные кровотечения с угрозой для жизни больного.
При большом размере опухоли могут пальпироваться через переднюю брюшную стенку. Доброкачественные неэпителиальные опухоли желудка могут осложняться перитонитом при некрозе новообразований; острой или хронической непроходимостью привратника в случае ущемления в нем опухоли и ее злокачественным перерождением.
Диагностика доброкачественных опухолей желудка
Диагностировать опухоли желудка позволяют данные анамнеза, рентгенологического и эндоскопического исследований.На наличие полипов при рентгенографии желудка может указывать дефект наполнения, повторяющий очертания опухоли: четкие, ровные контуры, круглую или овальную форму, его смещаемость при наличии ножки или неподвижность – при полипе с широким основанием.
В случае полипоза желудка выявляют большое число разных по величине дефектов наполнения. Перистальтика стенок желудка при этом сохраняется. Признаки отсутствия перистальтики, увеличение размера, изменение формы, появление нечеткости контуров дефекта наполнения при динамическом наблюдении могут говорить о малигнизации полипа.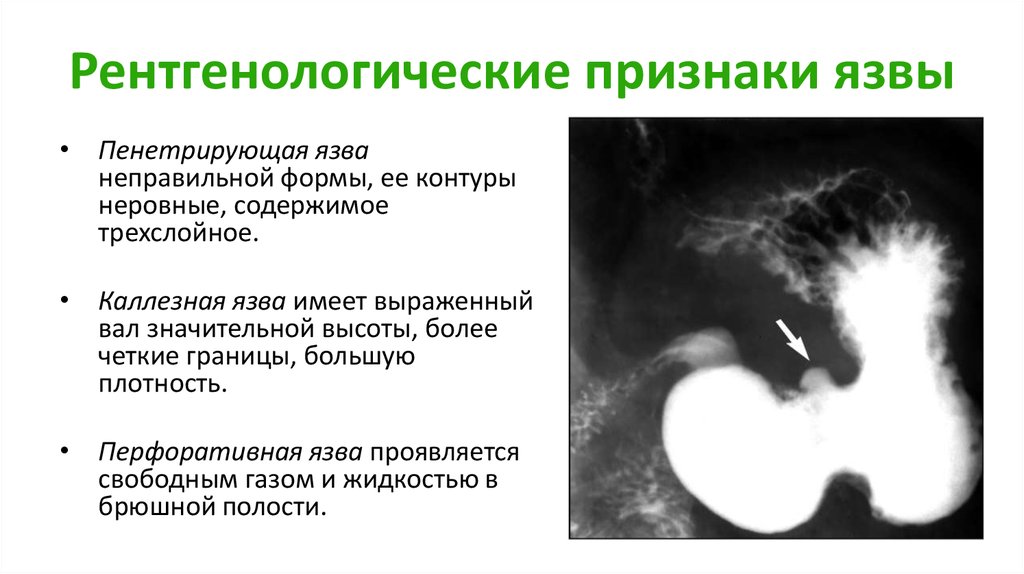
Диагноз уточняется при фиброгастродуоденоскопии (ФГДС), которая позволяет провести визуальный осмотр состояния слизистой оболочки желудка, распознавание и дифференциацию полипов от других заболеваний. Визуальная дифференциация доброкачественного полипа от малигнизированного затруднена. Обычно об озлокачествлении могут свидетельствовать наличие полипа размером более 2 см, с бугристой дольчатой поверхностью, неправильными изъеденными контурами. Для точного определения характера полипа во время ФГДС выполняется биопсия подозрительных участков с морфологическим исследованием биоптатов.
Диагноз неэпителиальной доброкачественной опухоли желудка в большинстве случаев можно установить только после операции и морфологического исследования данного новообразования. Наличие клинических проявлений (например, кровотечения) указывает на возможность опухолевого процесса. ФГДС более информативна при эндогастральном росте неэпителиальных опухолей желудка. При интрамурально или экзогастрально расположенных опухолях при эндоскопическом исследовании определяется сдавление желудка извне.
Рентгенография желудка при неэпителиальных доброкачественных опухолях помогает обнаружить округлые или неправильные контуры дефекта наполнения с сохранением перистальтики и складок на подслизистом слое; экзогастральный рост новообразования с оттягиванием стенки желудка; изъязвление с образованием ниши на верхушке опухоли и др. Для обнаружения экзогастральных опухолей желудка могут быть использованы УЗИ и КТ брюшной полости.
Лечение доброкачественных опухолей желудка
Лечение доброкачественных опухолей желудка — только хирургическое; метод оперативного вмешательства зависит от вида, характера опухоли и ее локализации.В отсутствии надежных критериев малигнизации доброкачественных опухолей желудка, необходимо проводить удаление всех выявленных новообразований.
Основными методами удаления доброкачественных опухолей желудка в настоящее время являются малоинвазивная эндоскопическая электроэксцизия (или электрокоагуляция), энуклеация, резекция желудка, редко – гастрэктомия.
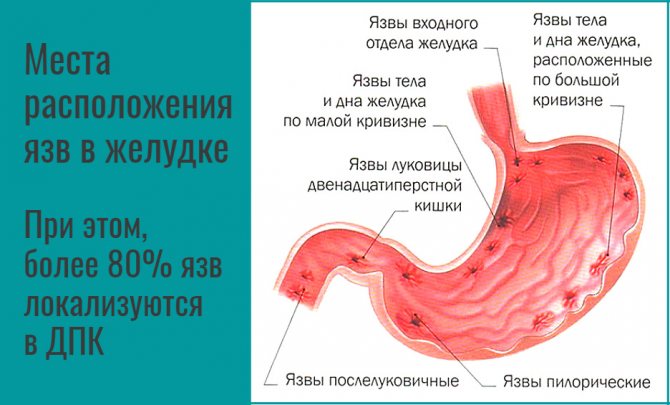
Эндоскопическая полипэктомия проводится при небольших одиночных полипах, локализующихся в различных отделах желудка: при размере менее 0,5 см — прижиганием с помощью точечного коагулятора, при размере от 0,5 до 3 см — методом электроэксцизии.
При крупных одиночных полипах желудка на широком основании выполняют хирургическую полипэктомию (иссечение в пределах слизистой оболочки или со всеми слоями стенки желудка) с предварительной гастротомией и ревизией желудка.
При множественных полипах или подозрении на малигнизацию выполняют ограниченную или субтотальную резекцию желудка. После полипэктомии и резекции существует риск неполного удаления, рецидива и малигнизации опухоли, возможно развитие послеоперационных осложнений и функциональных расстройств. Гастрэктомия может быть показана при диффузном полипозе желудка.
Во время удаления неэпителиальных опухолей желудка проводится срочное гистологическое исследование опухолевых тканей. Небольшие доброкачественные новообразования, растущие в направлении просвета желудка, удаляют эндоскопически; инкапсулированные опухоли вылущивают методом энуклеации. Большие, труднодоступные эндо- и экзогастральные доброкачественные опухоли желудка удаляют методом клиновидной или парциальной резекции, при подозрении на малигнизацию — резекцию производят с соблюдением онкологических принципов.
Большие, труднодоступные эндо- и экзогастральные доброкачественные опухоли желудка удаляют методом клиновидной или парциальной резекции, при подозрении на малигнизацию — резекцию производят с соблюдением онкологических принципов.
После удаления доброкачественных опухолей желудка показано динамическое диспансерное наблюдение гастроэнтеролога с обязательным эндоскопическим и рентгенологическим контролем.
Консультация по платным услугам
Показать телефоны
Неожиданная причина поражения подслизистой оболочки желудка
Эйнштейн (Сан-Паулу). 2017 январь-март; 15(1): 112–113.
doi: 10.1590/S1679-45082017AI3772
Информация об авторе Примечания к статье Информация об авторских правах и лицензии Отказ от ответственности
52-летний бессимптомный пациент прошел повторную эндоскопию по поводу пищевода Барретта. Его осмотр показал 1,5-сантиметровую выпуклость в антральном отделе желудка (). Пациент был направлен на эндоскопическое УЗИ, которое расценило поражение как стромальную опухоль желудочно-кишечного тракта (), но не типичную опухоль, после чего была предложена компьютерная томография (КТ) брюшной полости. На КТ выявлено гетерогенное поражение антрального отдела желудка и левого латерального сегмента печени (). Исследовательская лапаротомия показала, что поражение представляет собой куриную кость (). Послеоперационный период протекал без осложнений, за исключением гнойной инфекции в области хирургического вмешательства.
На КТ выявлено гетерогенное поражение антрального отдела желудка и левого латерального сегмента печени (). Исследовательская лапаротомия показала, что поражение представляет собой куриную кость (). Послеоперационный период протекал без осложнений, за исключением гнойной инфекции в области хирургического вмешательства.
Открыть в отдельном окне
(A) Эндоскопия, показывающая выпуклость в антральном отделе желудка рядом с привратником. (B) Эндоскопическое ультразвуковое исследование показало, что поражение совместимо со стромальной опухолью желудочно-кишечного тракта, но была рекомендована компьютерная томография брюшной полости
Открыть в отдельном окне
(A) Компьютерная томография брюшной полости показывает поражение желудка и печени. (B) Проглоченное инородное тело: куриная кость
Подслизистые поражения желудка обычно имеют мезенхимальное происхождение и включают желудочно-кишечные стромальные, лейомиомы, лейомиосаркомы, нейроэндокринные новообразования и шванномы. 1 Эндоскопическое ультразвуковое исследование в настоящее время считается стандартным подходом к оценке интрамуральных поражений желудка. 2 Желудочно-кишечная стромальная опухоль может возникать в любой части желудочно-кишечного тракта. При гастроинтестинальной стромальной опухоли (60% всех желудочно-кишечных стромальных опухолей) обычно рекомендуется хирургическая резекция. Небольшие опухоли (<2 см) без признаков злокачественности (изъязвление, кровотечение, неровные края, некроз и кистозные изменения) можно лечить под активным наблюдением. Однако существует вероятность малигнизации любой стромальной опухоли желудочно-кишечного тракта, независимо от ее размера. 1,3-5
1 Эндоскопическое ультразвуковое исследование в настоящее время считается стандартным подходом к оценке интрамуральных поражений желудка. 2 Желудочно-кишечная стромальная опухоль может возникать в любой части желудочно-кишечного тракта. При гастроинтестинальной стромальной опухоли (60% всех желудочно-кишечных стромальных опухолей) обычно рекомендуется хирургическая резекция. Небольшие опухоли (<2 см) без признаков злокачественности (изъязвление, кровотечение, неровные края, некроз и кистозные изменения) можно лечить под активным наблюдением. Однако существует вероятность малигнизации любой стромальной опухоли желудочно-кишечного тракта, независимо от ее размера. 1,3-5
Перфорация желудочно-кишечного тракта, вызванная попаданием внутрь инородных тел, напротив, встречается редко. Большинство этих инородных тел проходят через пищеварительный тракт, и менее 1% из них вызывают перфорацию. 6 По неизвестным причинам некоторые из них перфорируют стенку желудка и оседают в левой доле печени. 7 Удаление можно осуществить с помощью эндоскопии, лапароскопии или лапаротомии. Важно отметить, что проглатывание инородных тел часто происходит у людей, пользующихся зубными протезами, как это произошло с нашим пациентом. Протезы мешают оральной чувствительности. И они могут не только проглотить себя, но и облегчить акт проглатывания какого-либо другого инородного тела. 7,8
7 Удаление можно осуществить с помощью эндоскопии, лапароскопии или лапаротомии. Важно отметить, что проглатывание инородных тел часто происходит у людей, пользующихся зубными протезами, как это произошло с нашим пациентом. Протезы мешают оральной чувствительности. И они могут не только проглотить себя, но и облегчить акт проглатывания какого-либо другого инородного тела. 7,8
1. Vernuccio F, Taibbi A, Picone D, La Grutta L, Midiri M, Lagalla R, et al. Визуализация стромальных опухолей желудочно-кишечного тракта: от диагностики до оценки терапевтического ответа. Противораковый Рез. 2016;36(6):2639–2648. Обзор. [PubMed] [Google Scholar]
2. Папаниколау И.С., Триантафиллоу К., Курику А., Рёш Т. Эндоскопическое ультразвуковое исследование подслизистых поражений желудка. World J Gastrointest Endosc. 2011;3(5):86–94. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Ку Д.Х., Рю М.Х., Ким К.М., Ян Х.К., Саваки А., Хирота С. и соавт. Азиатские согласованные рекомендации по диагностике и лечению гастроинтестинальной стромальной опухоли. Лечение рака. 2016;48(4):1155–1166. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Лечение рака. 2016;48(4):1155–1166. [Бесплатная статья PMC] [PubMed] [Google Scholar]
4. Mehren M von, Randall RL, Benjamin RS, Boles S, Bui MM, EU Conrad, 3rd, et al. Саркома мягких тканей, Версия 2.2016, Клинические рекомендации NCCN по онкологии. J Natl Compr Canc Netw. 2016;14(6):758–786. [PubMed] [Академия Google]
5. Рабочая группа SMO/European Sarcoma Network Стромальные опухоли желудочно-кишечного тракта: Клинические практические рекомендации ESMO по диагностике, лечению и последующему наблюдению. Энн Онкол. 2014;25(Приложение 3):iii21–iii26. Опечатка в: Энн Онкол. 2015;26 Приложение 5:v174-7. [PubMed] [Google Scholar]
6. Kuzmich S, Burke CJ, Harvey CJ, Kuzmich T, Andrews J, Reading N, et al. Перфорация желудочно-кишечного тракта малозаметными проглоченными инородными телами: рентгенологическая диагностика. Бр Дж Радиол. 2015;88(1050) Обзор. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Maglinte DD, Taylor SD, Ng AC. Перфорация желудочно-кишечного тракта куриными костями. Радиология. 1979;130(3):597–599. [PubMed] [Google Scholar]
Радиология. 1979;130(3):597–599. [PubMed] [Google Scholar]
8. Величков Н.Г., Григоров Г.И., Лосано Дж.Е., Кёсев К.Т. Заглатывание инородных тел желудочно-кишечного тракта: ретроспективный анализ 542 случаев. Мир J Surg. 1996;20(8):1001–1005. [PubMed] [Google Scholar]
История болезни и обзор литературы
На этой странице
РезюмеВведениеПрезентация делаОбсуждениеЗаключениеСсылкиАвторское правоСтатьи по теме
Мы сообщаем о случае 40-летней женщины с диспепсическими симптомами в течение шести месяцев. Эндоскопия верхних отделов ЖКТ выявила подслизистый узел в антральном отделе желудка. Используя «метод для вскрытия гигантской биопсии», мы смогли получить адекватную ткань для анализа. Гистопатология выявила карциноид желудка III типа. Пациенту была проведена лапароскопическая дистальная субтотальная гастрэктомия с реконструкцией по Ру и частичной оментэктомией. Хотя при первоначальном обращении не было никаких признаков метастазирования, восемнадцать месяцев спустя у пациентки были обнаружены множественные метастатические поражения печени. Повреждения пациента лечили внутриартериальный (печеночная артерия) Иттрий-90 .
Повреждения пациента лечили внутриартериальный (печеночная артерия) Иттрий-90 .
1. Введение
Опухоли подслизистой оболочки желудка являются частой случайной находкой при рутинной эндоскопии верхних отделов желудочно-кишечного тракта. Хотя доступны различные методы диагностики этих опухолей, окончательный диагноз требует анализа тканей. Получение ткани для опухолей подслизистой оболочки желудка может быть сложной задачей. Мы сообщаем о случае 40-летней женщины с диспепсическими явлениями. Эндоскопия верхних отделов ЖКТ выявила подслизистый узел в антральном отделе желудка. Гистопатология была совместима с карциноидом желудка типа III. Хотя при первоначальном обращении не было никаких признаков метастазирования, восемнадцать месяцев спустя у пациентки были обнаружены множественные метастатические поражения печени. Наш случай подчеркивает злокачественный потенциал подслизистого узла желудка, который в противном случае может представлять собой случайную находку при эндоскопии верхних отделов желудочно-кишечного тракта.
2. Клиническое наблюдение
Женщина 40-ка лет в течение 6 месяцев жалуется на диспепсические явления. Она отрицала наличие тошноты, рвоты или изменений в работе кишечника. В анамнезе не было кровавой рвоты, мелены или потери веса. Физикальное обследование выявило тучную женщину с нормальными жизненными показателями. Осмотр головы и шеи показал легкую бледность, но не было отмечено желтухи, тиреомегалии или увеличения лимфатических узлов. Живот мягкий, безболезненный, гепатоспленомегалии нет.
Обследование показало Hb 11 г/дл, количество лейкоцитов 11000/л и количество тромбоцитов 2,26 × 10 3 /л. Азот мочевины крови, креатинин и электролиты в норме.
Пациент прошел эзофагогастродуоденоскопию и у него был обнаружен хронический активный гастрит, связанный с Helicobacter pylori . Одновременно в антральном отделе желудка было отмечено подслизистое образование размером около 2,0 см (рис. 1).
Используя технику «раскрытой» биопсии большого размера, мы смогли получить обширные биопсии этой массы, и результаты выявили хорошо дифференцированную нейроэндокринную опухоль (НЭО), соответствующую карциноиду желудка (рис. 2 и 3). Подтипирование подтвердило карциноид желудка III типа.
2 и 3). Подтипирование подтвердило карциноид желудка III типа.
Впоследствии было проведено эндоскопическое ультразвуковое исследование (ЭУЗИ), которое подтвердило наличие подслизистого образования немного меньшего размера, чем первоначально предполагалось, возникающего из третьего слоя, и отсутствия лимфаденопатии. Биомаркеры карциноида, такие как серотонин, хромогранин А и 5-HIAA, также были отрицательными. Компьютерная томография брюшной полости выявила утолщение антрального отдела желудка вследствие карциноида и отсутствие метастазов вне желудка, метастазов в печень или надпочечники.
Пациенту была проведена лапароскопическая дистальная субтотальная гастрэктомия с реконструкцией по Ру и частичной оментэктомией. Результаты биопсии подтвердили хорошо дифференцированную нейроэндокринную опухоль (НЭО), соответствующую карциноиду желудка типа III, ограниченную подслизистой оболочкой, без вовлечения собственной мышечной оболочки (рис. 4). Двадцать два лимфатических узла (17 по большой кривизне и 5 по малой кривизне) не имели метастазов, сальник также был доброкачественным.
После операции пациент чувствовал себя хорошо, но жаловался на некоторую тошноту. Была выполнена серия верхних отделов желудочно-кишечного тракта, которая исключила утечку из места анастомоза (рис. 5). Больной хорошо перенес диету и был выписан из стационара.
Восемнадцать месяцев спустя пациент поступил в больницу с прогрессирующим ухудшением генерализованной боли в животе в течение одного месяца. Она жаловалась на периодическую тошноту, но отрицала какие-либо изменения аппетита или веса. Физикальное обследование было ничем не примечательным. Компьютерная томография брюшной полости показала множественные, небольшие, нечетко очерченные и слабо затухающие поражения в левой доле печени и образование размером 1,7 см в брыжейке тонкой кишки (рис. 6).
Магнитно-резонансная томография выявила несколько поражений печени, самое большое из которых размером 2,1 1,4 см в левой доле печени. Также были увеличены множественные лимфатические узлы в брыжейке тонкой кишки и воротах печени (рис. 7).
7).
Выполнена пункционная биопсия поражений печени под контролем компьютерной томографии, и результаты подтвердили метастатические поражения, вторичные по отношению к карциноиду желудка (рис. 8). Больному вводили внутриартериально (печеночная артерия) иттрий-90.
Пациентка наблюдалась у нас более двух лет, и до сих пор ее поражения были стабильными.
3. Обсуждение
Подслизистые опухоли желудка (SMT) являются частой случайной находкой при рутинной эндоскопии верхних отделов желудочно-кишечного тракта. Точная распространенность этих поражений неизвестна, хотя в одном ретроспективном исследовании сообщалось о частоте 0,36% [1].
Различия варьируются от доброкачественных поражений, таких как фиброма, липома, лейомиома, варикоз и гетеротопия поджелудочной железы, до злокачественных или потенциально злокачественных поражений, таких как лимфома, стромальные опухоли желудочно-кишечного тракта (GIST), карциноид, нейрофиброма, шваннома и так далее. Внепросветная компрессия, вторичная по отношению к висцеральным структурам, также может проявляться в виде подслизистого узла при эндоскопии.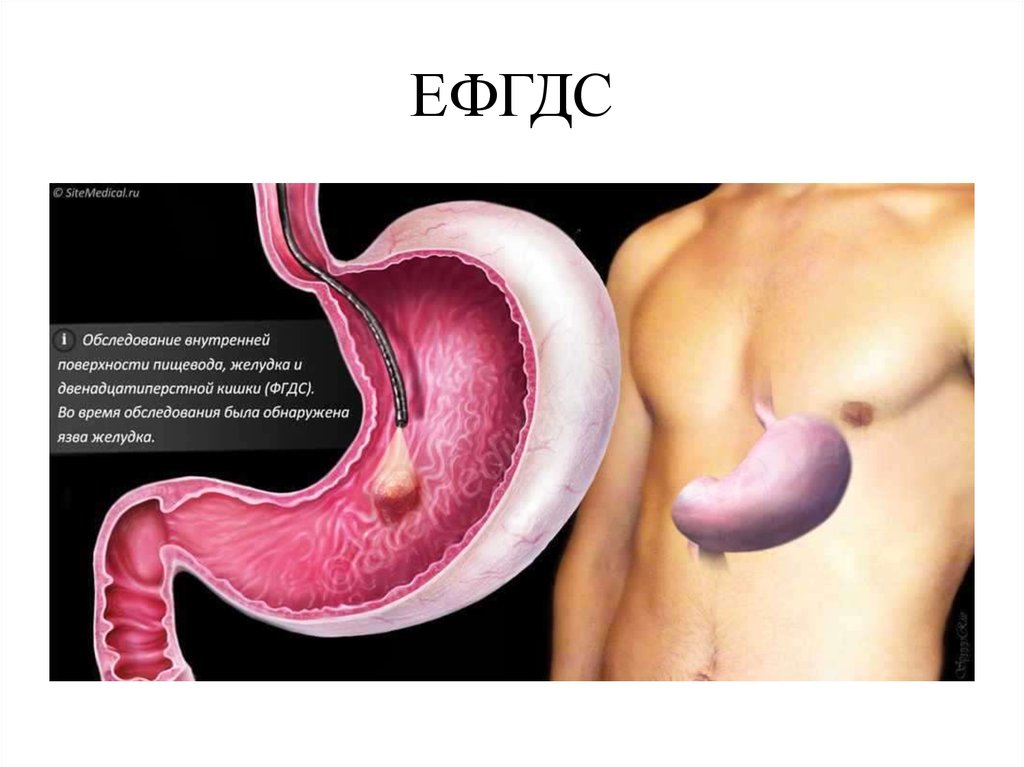 Наиболее частым источником внепросветной компрессии являются селезенка и селезеночные сосуды [2]. Хотя дифференциал очень широк, окончательный диагноз зависит от гистопатологии ткани.
Наиболее частым источником внепросветной компрессии являются селезенка и селезеночные сосуды [2]. Хотя дифференциал очень широк, окончательный диагноз зависит от гистопатологии ткани.
При ЭУЗИ были установлены определенные критерии риска злокачественного новообразования в подслизистом узле. К ним относятся размер > 3 см, неоднородная эхо-картина, неровные края и наличие лимфатических узлов [3]. ЭУЗИ имеет чувствительность 64% и специфичность 80% в диагностике злокачественных ГМО при наличии хотя бы двух из этих критериев [4]. Такие поражения, как липома, гетеротопическая поджелудочная железа и дупликационная киста, имеют характерный вид при ЭУЗИ [3]. Однако для подтверждения гипоэхогенных поражений, таких как лейомиома, ГИСО, карциноид и шванномы, требуется тканевая диагностика. ЭУЗИ может отличить настоящую SMT от внепросветной компрессии, вызванной висцеральными органами. ЭУЗИ стенки желудка обычно показывает пять слоев. EUS также может помочь нам определить точный уровень происхождения SMT. Поражения, возникающие из третьего и четвертого эхо-слоев, с высокой вероятностью являются злокачественными и требуют тканевой диагностики.
Поражения, возникающие из третьего и четвертого эхо-слоев, с высокой вероятностью являются злокачественными и требуют тканевой диагностики.
Визуализация поперечного сечения, такая как КТ и МРТ, может использоваться для оценки степени метастазирования злокачественных опухолей, таких как ГИСО [5]. Однако визуализация поперечного сечения, в отличие от ЭУЗИ, не дает преимущества идентификации точного слоя происхождения подслизистого узла.
Карциноиды желудка — редкие поражения, составляющие менее 1% всех новообразований желудка. Они возникают из энтерохромаффиноподобных клеток, выстилающих слизистую оболочку желудка. Карциноиды можно разделить на три категории. Карциноиды типа I и типа II составляют 80% этих поражений и связаны с атрофическим гастритом и синдромом Золлингера-Эллисона соответственно. Лечение включает эндоскопическую резекцию с последующим эндоскопическим наблюдением. Карциноид III типа составляет 15–20% этих опухолей и имеет самый высокий уровень метастазов (> 50%). Большинство этих опухолей являются метастатическими на момент выявления. Лечение этого подтипа требует хирургической резекции. При эндоскопии карциноиды выглядят как полиплоидные массы с нормальной слизистой оболочкой [6]. Обычно они возникают из второго или третьего слоя на EUS. Адекватная выборка и последующее подтипирование не только помогают нам в постановке окончательного диагноза, но и помогают нам выбрать правильный метод лечения для этих пациентов.
Большинство этих опухолей являются метастатическими на момент выявления. Лечение этого подтипа требует хирургической резекции. При эндоскопии карциноиды выглядят как полиплоидные массы с нормальной слизистой оболочкой [6]. Обычно они возникают из второго или третьего слоя на EUS. Адекватная выборка и последующее подтипирование не только помогают нам в постановке окончательного диагноза, но и помогают нам выбрать правильный метод лечения для этих пациентов.
Стромальные опухоли желудочно-кишечного тракта (ГИСО) являются наиболее распространенными мезенхимальными опухолями желудочно-кишечного тракта. Ежегодная заболеваемость оценивается как минимум в 10-20 случаев на миллион [7]. Большинство GIST являются положительными при окрашивании C-KIT и CD 34 и, как полагают, возникают из интерстициальных клеток Кахаля. Опухоли вегетативных нервов желудочно-кишечного тракта (GANT) также относятся к категории GISTS из-за их иммуногистохимического сходства. 65% ГИСО возникают в желудке и проявляются в виде узелков под слизистой оболочкой при эндоскопии верхних отделов желудочно-кишечного тракта. От 10% до 30% ГИСО являются злокачественными. Однако последние данные свидетельствуют о том, что все GIST имеют злокачественный потенциал [8]. При ЭУЗИ ГИСО обычно возникают из четвертого слоя, а размер, неровные границы, дольчатость и эхогенные очаги указывают на злокачественность [9].]. Эндоскопические дифференциальные диагнозы включают лимфому желудка и воспалительный фиброзный полип [10]. Таким образом, тканевая диагностика подслизистого узла должна не только дифференцировать ГИСО от не-ГИСО, но и оценивать злокачественный потенциал этой опухоли.
От 10% до 30% ГИСО являются злокачественными. Однако последние данные свидетельствуют о том, что все GIST имеют злокачественный потенциал [8]. При ЭУЗИ ГИСО обычно возникают из четвертого слоя, а размер, неровные границы, дольчатость и эхогенные очаги указывают на злокачественность [9].]. Эндоскопические дифференциальные диагнозы включают лимфому желудка и воспалительный фиброзный полип [10]. Таким образом, тканевая диагностика подслизистого узла должна не только дифференцировать ГИСО от не-ГИСО, но и оценивать злокачественный потенциал этой опухоли.
Получение тканей для СМТ желудка может быть сложной задачей. Результат стандартной эндоскопии обычно невелик [1]. Для получения ткани можно использовать тонкоигольную аспирационную аспирацию (FNA) под контролем ЭУЗИ, но результат часто недостаточен для постановки окончательного диагноза, особенно для мезенхимальных опухолей и когда необходимо дифференцировать доброкачественные и злокачественные стромальные опухоли [11]. Выход ткани EUS-FNA колеблется от 50% до 93% [11, 12].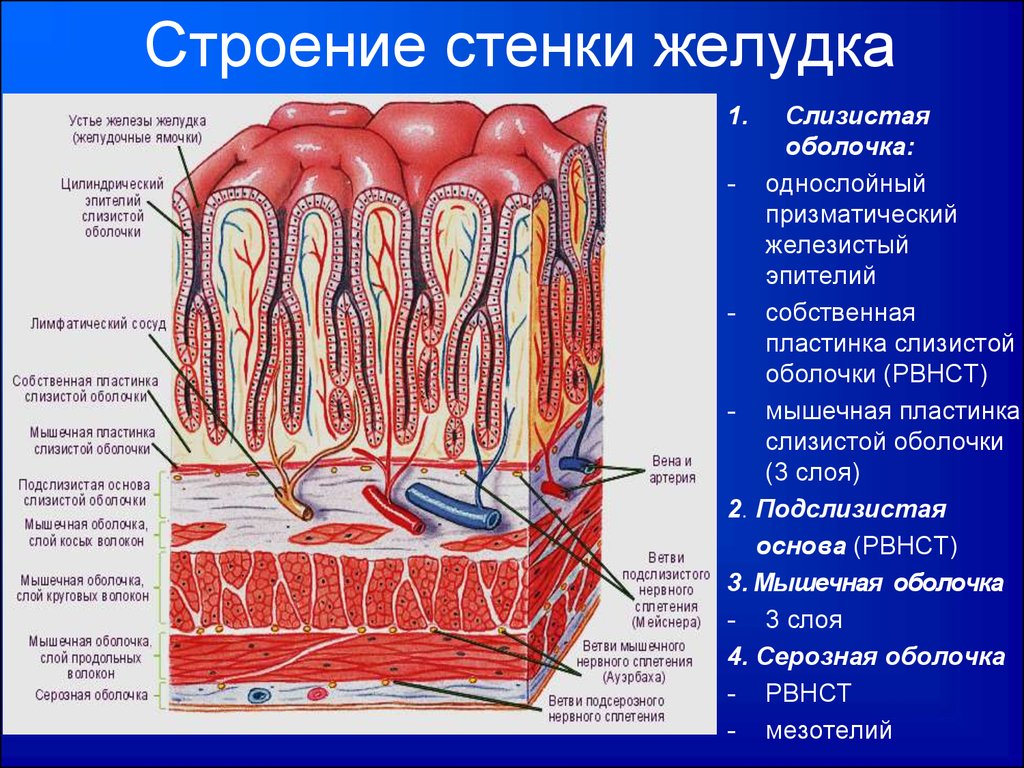 В проспективном исследовании Turhan et al. чувствительность, специфичность, положительные и отрицательные прогностические значения и точность EUS-FNA для диагностики подслизистых мезенхимальных опухолей верхних отделов желудочно-кишечного тракта составили 82,9%, 73,3%, 87,9%, 64,7% и 80% соответственно. Соответствующие значения для немезенхимальных поражений составили 100%, 85,7%, 80%, 100% и 90,9% [13].
В проспективном исследовании Turhan et al. чувствительность, специфичность, положительные и отрицательные прогностические значения и точность EUS-FNA для диагностики подслизистых мезенхимальных опухолей верхних отделов желудочно-кишечного тракта составили 82,9%, 73,3%, 87,9%, 64,7% и 80% соответственно. Соответствующие значения для немезенхимальных поражений составили 100%, 85,7%, 80%, 100% и 90,9% [13].
Хотя цитологического исследования обычно достаточно для постановки диагноза ГИСО, дифференциация доброкачественных и злокачественных стромальных опухолей требует гистопатологического и иммунохимического анализа. Патологическая оценка GIST требует иммуногистохимического окрашивания на c-KIT (CD 117). 95% GIST являются положительными для C-KIT. Иммуногистохимическое окрашивание также можно использовать для дифференциации ГИСО от эндоскопических дифференциалов, таких как лимфома и воспалительный полип. Тем не менее, есть некоторые GIST, отрицательные для C-KIT. В этих опухолях можно использовать экспрессию гена DOG 1. DOG 1 обладает большей чувствительностью по сравнению с C-KIT [14, 15]. Индекс маркировки Ki-67 также использовался для дифференциации доброкачественных ГИСО от злокачественных. В исследовании, проведенном Ando et al. и Liu et al., точность Ki-67 в прогнозировании агрессивности GIST составила более 90% [16, 17].
DOG 1 обладает большей чувствительностью по сравнению с C-KIT [14, 15]. Индекс маркировки Ki-67 также использовался для дифференциации доброкачественных ГИСО от злокачественных. В исследовании, проведенном Ando et al. и Liu et al., точность Ki-67 в прогнозировании агрессивности GIST составила более 90% [16, 17].
Различные факторы, такие как размер поражения, локализация (из поражений в нижней трети желудка трудно взять образцы), количество проходов иглы, присутствие цитопатолога на месте и цитологическая или гистопатологическая оценка, могут повлиять на результат EUS-FNA. Побочные эффекты EUS-FNA включают кровотечения и инфекции. ЭУЗИ допплерография перед ЭУЗИ-ТНА может предотвратить разрыв варикозного расширения вен, который в противном случае можно было бы ошибочно принять за подслизистый узел [18].
Биопсия иглы под контролем ЭУЗИ (TCB) использовалась для получения образцов центральной ткани. Процедурные трудности, такие как жесткость иглы и поражения дистального отдела желудка, могут стать проблемой для эндоскописта. Было обнаружено, что комбинация как EUS-FNA, так и EUS TCB превосходит любой метод по отдельности [19].]. Сочетание этих двух методов показало повышение точности диагностики до 95% без непосредственного обращения к цитопатологу [19].
Было обнаружено, что комбинация как EUS-FNA, так и EUS TCB превосходит любой метод по отдельности [19].]. Сочетание этих двух методов показало повышение точности диагностики до 95% без непосредственного обращения к цитопатологу [19].
Биопсийные щипцы Jumbo можно использовать для получения ткани из более глубоких слоев стенки желудка. В ретроспективном исследовании Buscaglia et al. из 129 пациентов с субэпителиальными поражениями верхних и нижних отделов желудочно-кишечного тракта, которым была выполнена эндоУЗИ с биопсией с использованием джамбо-пинцетов, у 58,9% пациентов был установлен окончательный диагноз [20]. Результаты в третьем слое (EUS) были наиболее определенными. Однако 34,9% пациентов испытывали значительное кровотечение и нуждались в той или иной форме эндоскопического гемостаза [20]. В другом исследовании, проведенном Komanduri et al., из 66 пациентов, перенесших джамбо-биопсию «методом снятия крыши» для получения ткани, у 92% была получена адекватная ткань без значительных осложнений [21, 22]. Биопсийные щипцы Jumbo вместе с «цитологией сенсорного препарата» на месте показали дальнейшее повышение точности [22]. Таким образом, использование щипцов для биопсии Jumbo для получения ткани представляется безопасным и эффективным вариантом диагностики SMT желудка.
Биопсийные щипцы Jumbo вместе с «цитологией сенсорного препарата» на месте показали дальнейшее повышение точности [22]. Таким образом, использование щипцов для биопсии Jumbo для получения ткани представляется безопасным и эффективным вариантом диагностики SMT желудка.
4. Заключение
Тканевая диагностика СМТ желудка может быть сложной задачей. Использование джамбо-биопсии «техника снятия крыши» кажется привлекательным вариантом для диагностики этих опухолей. «Цитология сенсорного препарата на месте» показала дальнейшее повышение точности.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Ссылки
J. L. Hedenbro, M. Ekelund, and P. Wetterberg, «Эндоскопическая диагностика подслизистых поражений желудка — результаты обычной эндоскопии», Хирургическая эндоскопия , том. 5, нет. 1, стр. 20–23, 1991.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Y.
 Motoo, T. Okai, H. Ohta et al., «Эндоскопическая ультрасонография в диагностике внепросветных компрессий, имитирующих подслизистые опухоли желудка», Endoscopy , vol. 26, нет. 2, стр. 239–242, 1994.
Motoo, T. Okai, H. Ohta et al., «Эндоскопическая ультрасонография в диагностике внепросветных компрессий, имитирующих подслизистые опухоли желудка», Endoscopy , vol. 26, нет. 2, стр. 239–242, 1994.Посмотреть по адресу:
Google Scholar
Б. Ланди и Л. Палаццо, «Роль эндосонографии в подслизистых опухолях», Передовая практика и исследования , vol. 23, нет. 5, стр. 679–701, 2009.
Посмотреть по адресу:
Сайт издателя | Google Scholar
T. Rösch, B. Kapfer, U. Will et al., «Точность эндоскопического ультразвукового исследования подслизистых поражений верхних отделов желудочно-кишечного тракта: проспективное многоцентровое исследование», Scandinavian Journal of Gastroenterology , vol. 37, нет. 7, pp. 856–862, 2002.
Просмотр по адресу:
Google Scholar
S.
 Hasegawa, R. C. Semelka, T. C. Noone et al., «Стромальные саркомы желудка: корреляция МРТ и гистопатологических данных в девяти пациентов» Радиология , том. 208, нет. 3, pp. 591–595, 1998.
Hasegawa, R. C. Semelka, T. C. Noone et al., «Стромальные саркомы желудка: корреляция МРТ и гистопатологических данных в девяти пациентов» Радиология , том. 208, нет. 3, pp. 591–595, 1998.Просмотр по адресу:
Google Scholar
С. Накамура, М. Иида, Т. Яо и М. Фудзисима, «Эндоскопические признаки карциноидов желудка», Желудочно-кишечный тракт Эндоскопия , том. 37, нет. 5, pp. 535–538, 1991.
Посмотреть по адресу:
Google Scholar
М. С. Саунд, Г. Д. Деметри и С. В. Эшли, «Гастроинтестинальные стромальные опухоли (GIST)», Текущее мнение enterology in Gastroology , том. 20, нет. 2, стр. 89–94, 2004 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Трупиано Дж. К., Стюарт Р.
 Э., Мисик К., Аппельман Х. Д. и Голдблюм Дж. Р. Стромальные опухоли желудка: клинико-патологическое исследование 77 случаев с корреляцией признаков с неагрессивным и агрессивным клиническим поведением, Американский журнал Хирургическая патология , том. 26, нет. 6, стр. 705–714, 2002.
Э., Мисик К., Аппельман Х. Д. и Голдблюм Дж. Р. Стромальные опухоли желудка: клинико-патологическое исследование 77 случаев с корреляцией признаков с неагрессивным и агрессивным клиническим поведением, Американский журнал Хирургическая патология , том. 26, нет. 6, стр. 705–714, 2002.Посмотреть по адресу:
Сайт издателя | Академия Google
А. Чак, М. И. Канто, Т. Рош и др., «Эндосонографическая дифференциация доброкачественных и злокачественных опухолей стромальных клеток», Gastrointestinal Endoscopy , vol. 45, нет. 6, стр. 468–473, 1997.
Посмотреть по адресу:
Сайт издателя | Google Scholar
K. Zinkiewicz, W. Zgodziñski, A. Dbrowski, J. Szumio, G. Æwik и G. Wallner, «Рецидивирующий воспалительный фиброзный полип кардии: отчет о клиническом случае», World Journal of Gastroenterology , том.
 10, нет. 5, pp. 767–768, 2004.
10, нет. 5, pp. 767–768, 2004.Просмотр по адресу:
Google Scholar
M. A. Mekky, K. Yamao, A. Sawaki et al., «Диагностическая полезность FNA под контролем ЭУЗИ у пациентов с подслизистой оболочкой желудка» опухоли», Gastrointestinal Endoscopy , vol. 71, нет. 6, стр. 913–919, 2010.
Посмотреть по адресу:
Сайт издателя | Google Scholar
M. Matsui, H. Goto, Y. Niwa, T. Arisawa, Y. Hirooka и T. Hayakawa, «Предварительные результаты гистологического исследования тонкоигольной аспирационной биопсии в подслизистых опухолях верхних отделов желудочно-кишечного тракта», Эндоскопия , том. 30, нет. 9, pp. 750–755, 1998.
Посмотреть по адресу:
Google Scholar
Турхан Н., Айдог Г., Озин Ю., Цичек Б.
 , Курт М., Огуз Д. Эндоскопические тонкоигольная аспирация под контролем УЗИ для диагностики подслизистых поражений верхних отделов желудочно-кишечного тракта: проспективное исследование 50 случаев», Diagnostic Cytopathology , vol. 39, нет. 11, стр. 808–817, 2011.
, Курт М., Огуз Д. Эндоскопические тонкоигольная аспирация под контролем УЗИ для диагностики подслизистых поражений верхних отделов желудочно-кишечного тракта: проспективное исследование 50 случаев», Diagnostic Cytopathology , vol. 39, нет. 11, стр. 808–817, 2011.Посмотреть по адресу:
Сайт издателя | Академия Google
DG Hwang, X. Qian и JL Hornick, «Антитело DOG1 является высокочувствительным и специфичным маркером гастроинтестинальных стромальных опухолей в блоках цитологических клеток», American Journal of Clinical Pathology , vol. 135, нет. 3, стр. 448–453, 2011.
Посмотреть по адресу:
Сайт издателя | Google Scholar
C. Wang, M. S. Jin, YB Zou et al., «Диагностическое значение экспрессии DOG-1 и PKC- θ и мутаций c-Kit/PDGFRA в гастроинтестинальных стромальных опухолях», Скандинавский журнал гастроэнтерологии , том.
 48, нет. 9, стр. 1055–1065, 2013.
48, нет. 9, стр. 1055–1065, 2013.Просмотр по адресу:
Google Scholar
Н. Андо, Х. Гото, Ю. Нива и др., «Диагностика стромальных опухолей ЖКТ с помощью ЭУЗИ аспирация иглы с иммуногистохимическим анализом», Gastrointestinal Endoscopy , vol. 55, нет. 1, стр. 37–43, 2002 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
L. C. Liu, WT Xu, X. Wu, P. Zhao, YL Lv и L. Chen, «Сверхэкспрессия белков карбоангидразы II и Ki-67 в прогнозе желудочно-кишечных стромальных опухолей», Всемирный журнал гастроэнтерологии , том. 19, нет. 16, стр. 2473–2480, 2013.
Посмотреть по адресу:
Сайт издателя | Google Scholar
H. Sakamoto, M. Kitano и M. Kudo, «Диагностика субэпителиальных опухолей верхних отделов желудочно-кишечного тракта с помощью эндоскопической ультрасонографии», World Journal of Radiology , vol.
 2, нет. 8, pp. 289–297, 2010.
2, нет. 8, pp. 289–297, 2010.Просмотр по адресу:
Google Scholar
I. Storch, M. Jorda, R. Thurer et al., «Преимущество EUS Trucut-биопсии в сочетании с тонкоигольной аспирацией без немедленного цитопатологического исследования на месте» Эндоскопия желудочно-кишечного тракта , vol. 64, нет. 4, стр. 505–511, 2006 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
JM Buscaglia, S. Nagula, V. Jayaraman et al., «Диагностическая эффективность и безопасность щипцов для биопсии большого размера у пациентов с субэпителиальными поражениями верхних и нижних отделов желудочно-кишечного тракта», Gastrointestinal Endoscopy , vol. 75, нет. 6, стр. 1147–1152, 2012.
Посмотреть по адресу:
Сайт издателя | Академия Google
S.


 Motoo, T. Okai, H. Ohta et al., «Эндоскопическая ультрасонография в диагностике внепросветных компрессий, имитирующих подслизистые опухоли желудка», Endoscopy , vol. 26, нет. 2, стр. 239–242, 1994.
Motoo, T. Okai, H. Ohta et al., «Эндоскопическая ультрасонография в диагностике внепросветных компрессий, имитирующих подслизистые опухоли желудка», Endoscopy , vol. 26, нет. 2, стр. 239–242, 1994. Hasegawa, R. C. Semelka, T. C. Noone et al., «Стромальные саркомы желудка: корреляция МРТ и гистопатологических данных в девяти пациентов» Радиология , том. 208, нет. 3, pp. 591–595, 1998.
Hasegawa, R. C. Semelka, T. C. Noone et al., «Стромальные саркомы желудка: корреляция МРТ и гистопатологических данных в девяти пациентов» Радиология , том. 208, нет. 3, pp. 591–595, 1998. Э., Мисик К., Аппельман Х. Д. и Голдблюм Дж. Р. Стромальные опухоли желудка: клинико-патологическое исследование 77 случаев с корреляцией признаков с неагрессивным и агрессивным клиническим поведением, Американский журнал Хирургическая патология , том. 26, нет. 6, стр. 705–714, 2002.
Э., Мисик К., Аппельман Х. Д. и Голдблюм Дж. Р. Стромальные опухоли желудка: клинико-патологическое исследование 77 случаев с корреляцией признаков с неагрессивным и агрессивным клиническим поведением, Американский журнал Хирургическая патология , том. 26, нет. 6, стр. 705–714, 2002. 10, нет. 5, pp. 767–768, 2004.
10, нет. 5, pp. 767–768, 2004. , Курт М., Огуз Д. Эндоскопические тонкоигольная аспирация под контролем УЗИ для диагностики подслизистых поражений верхних отделов желудочно-кишечного тракта: проспективное исследование 50 случаев», Diagnostic Cytopathology , vol. 39, нет. 11, стр. 808–817, 2011.
, Курт М., Огуз Д. Эндоскопические тонкоигольная аспирация под контролем УЗИ для диагностики подслизистых поражений верхних отделов желудочно-кишечного тракта: проспективное исследование 50 случаев», Diagnostic Cytopathology , vol. 39, нет. 11, стр. 808–817, 2011. 48, нет. 9, стр. 1055–1065, 2013.
48, нет. 9, стр. 1055–1065, 2013.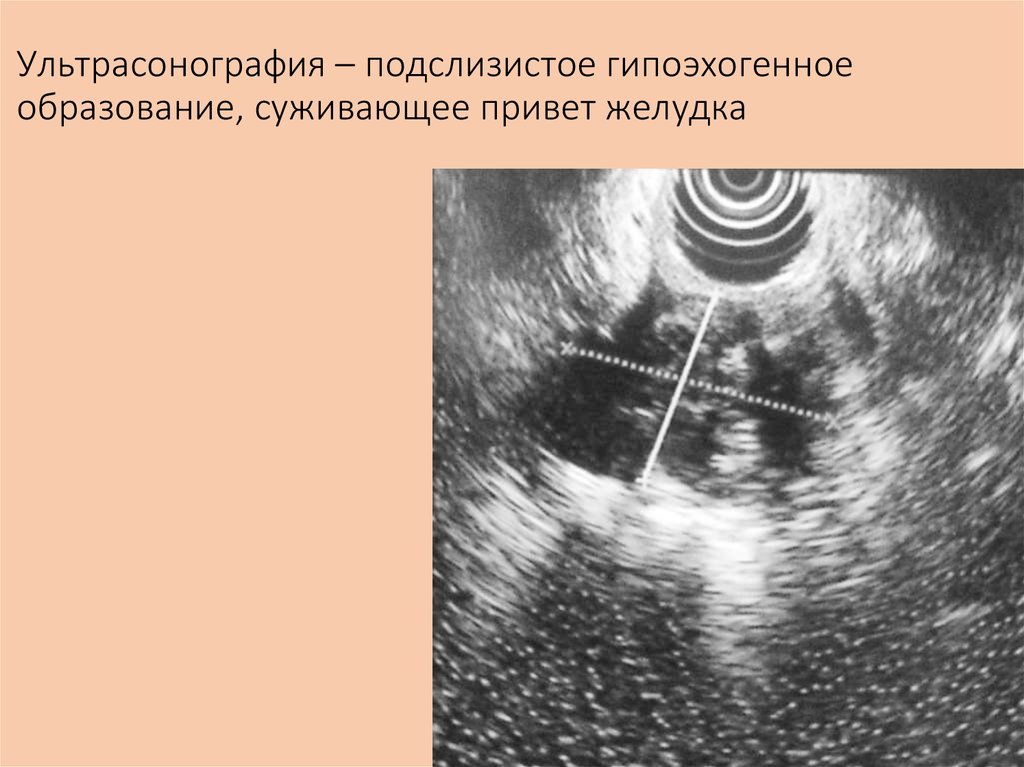 2, нет. 8, pp. 289–297, 2010.
2, нет. 8, pp. 289–297, 2010.