Пограничный невус фото: Пограничный пигментный невус. Что такое Пограничный пигментный невус?
Пограничный пигментный невус. Что такое Пограничный пигментный невус?
ВАЖНО
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
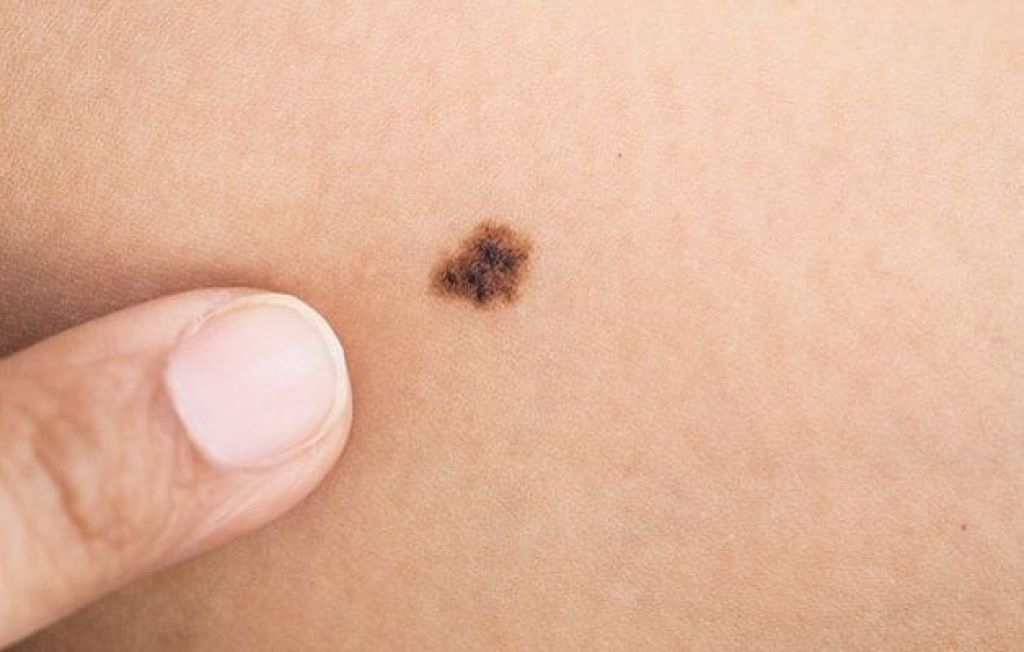
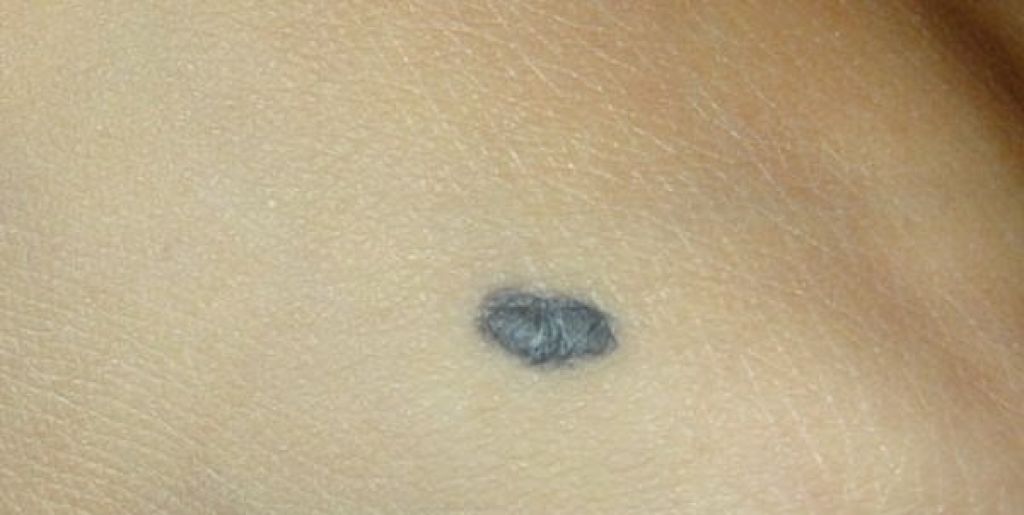
Пограничный пигментный невус — пигментированный узелок размером до 1 см, окраска которого может варьировать от светло-коричневого и серого цвета до черного. Пограничный невус может иметь любую локализацию. Чаще бывает единичным. Диагностика проводится путем дерматологического осмотра, дерматоскопии, сиаскопии. В целях профилактики меланомы рекомендовано удаление невуса лазером, радиоволновым аппаратом, жидким азотом, электрокоагуляцией или путем хирургического иссечения. При необходимости производится гистологическое исследование удаленного материала.
- Симптомы пограничного пигментного невуса
- Диагностика пограничного пигментного невуса
- Лечение пограничного пигментного невуса
- Цены на лечение
Общие сведения
Пограничный пигментный невус чаще всего бывает врожденным новообразованием. Реже он появляется в детском возрасте, пубертатном периоде или позже. Наряду с невусом Ота, голубым невусом, меланозом Дюбрейля и гиганским пигментным невусом пограничный пигментный невус может претерпевать злокачественное перерождение. Поэтому дерматология относит его к меланомоопасным невусам.
Реже он появляется в детском возрасте, пубертатном периоде или позже. Наряду с невусом Ота, голубым невусом, меланозом Дюбрейля и гиганским пигментным невусом пограничный пигментный невус может претерпевать злокачественное перерождение. Поэтому дерматология относит его к меланомоопасным невусам.
Пограничный пигментный невус
Симптомы пограничного пигментного невуса
Пограничный пигментный невус представляет собой уплощенный узелок серого, черного, светло- или темно-коричневого цвета. Его размеры бывают от нескольких миллиметров до 4-5 см, но чаще не превышают 1 см. Поверхность невуса гладкая и сухая, может быть немного неровной. Отличительной особенностью является отсутствие роста волос (даже пушковых) на поверхности невуса. Пограничный невус не имеет излюбленной локализации и может располагаться на любом участке тела, в том числе на ладонях и подошвах, где другие виды невусов практически не встречаются. Обычно пограничный невус является одиночным образованием, но встречаются случаи и множественного невуса.
Разновидностью пограничного невуса является кокардный невус, характеризующийся постепенным усилением пигментации по периферии образования, за счет чего с течением времени невус приобретает вид концентрических колец, отличающихся различной насыщенностью окраски. Изменение цвета пограничного пигментного невуса, его резкое увеличение, появление трещин, эрозий или бугристостей на его поверхности, возникновение покраснения вокруг невуса или расплывчатость его границ могут свидетельствовать о злокачественной трансформации и требуют безотлагательной консультации дерматолога.
Диагностика пограничного пигментного невуса
Пограничный пигментный невус диагностируется в ходе дерматологического осмотра и дерматоскопии. Дополнительным методом является сиаскопия. При подозрении на малигнизацию невуса требуется консультация дерматоонколога.
Биопсия кожи из области пограничного пигментного невуса обычно не проводится, поскольку такое травмирование может дать толчок к его злокачественному перерождению. Гистологическое исследование осуществляется после удаления невуса хирургическим или радиоволновым методом.
Гистологическое исследование осуществляется после удаления невуса хирургическим или радиоволновым методом.
Пограничный пигментный невус дифференцируют от других пигментных образований: веснушек, пигментных пятен, невуса Сеттона, меланоза Дюбрейля, голубого невуса.
Лечение пограничного пигментного невуса
Пациентам с пограничным пигментным невусом рекомендовано наблюдение дерматолога. Как доброкачественное новообразование кожи он не нуждается в срочном удалении. Но следует помнить, что пограничный пигментный невус относится к меланомоопасным и лучшим способом предупреждения меланомы является удаление невуса. Показанием для хирургического лечения невуса является его постоянная травматизация, особенно при расположении на подошвах или ладонях.
Удаление пограничного пигментного невуса может проводиться хирургическим скальпелем, лазером или радиоволновым аппаратом. Электрокоагуляция и криодеструкция невуса не желательна, так как по мнению некоторых специалистов эти методы удаления вызывают сильную травматизацию тканей, что может привести к развитию меланомы на месте удаленного пигментного невуса.
Удаление родинок лазером не оставляет после себя косметического дефекта. Однако оно может применяться только в тех случаях, когда гистологическое исследование удаленного материала не требуется. Удаление невусов радиохирургическим ножом чаще проводится при их размерах до 5 мм. Оба метода при небольших размерах образования не требуют наложения швов. При выявлении признаков злокачественной трансформации невуса проводится его срочное хирургическое иссечение с последующим гистологическим исследованием удаленного материала.
Вы можете поделиться своей историей болезни, что Вам помогло при лечении пограничного пигментного невуса.
Источники
- Настоящая статья подготовлена по материалам сайта: https://www.krasotaimedicina.ru/
ВАЖНО
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
причины, симптомы, диагностика и лечение
Пограничный пигментный невус — это врождённое новообразование. В редких случаях оно появляется после рождения человека, в любом возрасте. Вместе с такими видами невуса, как голубой невус, меланоз Дюбрейля, невус Ота, гигантский пигментный, невус претерпевает злокачественное перерождение в 1,8% до 10% случаев. Поэтому специалисты классифицируют его как меланомоопасный вид.
Содержание статьи:
- Симптомы пограничного пигментного невуса
- Пограничный пигментный невус и его диагностирование
- Лечение пограничного пигментного невуса
Симптомы пограничного пигментного невуса
Пограничный пигментный невус — это уплощенный черный, серый, темно- или светло-коричневый узелок диаметром от нескольких миллиметров и до 4-5 см, но, как правило, чаще всего он не превышает 1 см. Поверхность невуса может быть гладкой, сухой и немного неровной. Пограничный пигментный невус отличается от остальных видов тем, что на его поверхности отсутствуют волосы (даже пушковые).
Поверхность невуса может быть гладкой, сухой и немного неровной. Пограничный пигментный невус отличается от остальных видов тем, что на его поверхности отсутствуют волосы (даже пушковые).
Пограничный невус может встретиться на разных участках тела, а также на подошвах и ладонях. Как правило, пограничный невус — это одиночное образование, но также встречаются и очаги множественных невусов.
Кокардный невус — это разновидность пограничного невуса, особенностью которого является постепенное усиление пигментации, за счет чего через некоторое время невус приобретает очертание колец и имеет различную степень окраски.
О злокачественной трансформации пограничного пигментного невуса свидетельствует изменение цвета, резкое увеличение в размерах, появление на его поверхности эрозии, трещин и бугорков, покраснение вокруг образования или его расплывчатые границы. В случае выявления таких изменений требуется срочная консультация дерматолога.
Пигментный пограничный невус также следует отличать от кавернозных гемангиом, консистенция которых является более мягкой, и от «старческой» (себорейной) кератомы, для которой характерна «шершавая» сальная и менее ровная поверхность. В дифференциальной диагностике между ранней меланомой и пограничным пигментным невусом уделяют усиленное внимание анамнезу. Большинство пациентов, у которых выявили меланому, указывают на то, что опухоль развивалась в течение длительного времени на месте существовавшего пигментного невуса, который не причинял каких-либо неудобств. Невус растёт медленно соответственно весу тела человека. Во время пубертатного периода пациенты отмечают, что невус растет быстрее вследствие повышение уровня обменных и пигментных процессов, а также гормональной перестройки организма. Механическая травма часто выступает одним из главных факторов, который сопутствует озлокачествлению невусов, которые ранее не приносили дискомфорта.
Пограничный пигментный невус и его диагностирование
Пограничный пигментный невус у пациента диагностируется во время дерматоскопии и дерматологического осмотра.
Из пограничного пигментного невуса биопсию обычно не проводят, так как его травмирование может подтолкнуть к перерождению в злокачественное образование. Гистологические исследования проводят после того, как невус удаляется радиоволновым или хирургическим методом.
Пограничный пигментный невус отличают от таких пигментных образований, как веснушки, пигментные пятна, невусы Сеттона, меланозы Дюбрея и голубые невусы.
Лечение пограничного пигментного невуса
Тем пациентам, у которых выявили пограничный пигментный невус, следует регулярно наблюдаться у врача-дерматолога. Если новообразование доброкачественное, то такой невус не удаляют. Но следует не забывать, что пограничный пигментный невус также относят к меланомоопасным, поэтому самый лучший способ предотвращения меланомы — это удаление невуса.
Удаляют пограничный пигментный невус с помощью хирургического скальпеля, а также радиоволновым или лазерным аппаратом. Электрокоагуляция и криодеструкция невуса нежелательны, поскольку по мнению специалистов такие методы удаления могут вызвать сильное травмирование тканей, которое может вызвать развитие меланомы.
Как правило, косметический дефект после удаления родинок лазером не остается. Однако лазерное лечение могут применять только тогда, когда удаленное образование не требует гистологического исследования. Удаление невусов с помощью радиохирургического ножа чаще всего проводится, когда размер образования не превышает 5 мм. Такие методы удаления при небольших размерах образований не требуют наложения швов.
Если у невуса выявляют признаки злокачественной трансформации, его следует незамедлительно удалить хирургическим путем и провести гистологический анализ удаленного материала.
Глубокий пенетрирующий невус и пограничный глубокий пенетрирующий невус: обзор литературы
Введение
Термин «глубокий пенетрирующий невус» (ГПН) впервые был введен Seab et al. в 1989 г., автор, описывающий серию случаев, которые изначально были неправильно диагностированы. как злокачественная меланома (1). Из-за своего клинического и, в частности, гистопатологического проявления, ДПН может быть сложно дифференцировать от клеточных голубых невусов, невусов шпица и злокачественной меланомы (2). Клинически проявляясь в виде одиночных пигментированных папул или узелков, ДПН чаще встречается у молодых людей с преимущественным появлением в области головы и шеи (3, 4). Гистологически он характеризуется как четко очерченные клиновидные поражения, достигающие ретикулярной дермы/подкожной клетчатки, демонстрирующие эпителиоидные/веретеноклеточные меланоцитарные гнезда с низкой степенью цитологической атипии и возможными фигурами митоза (1, 2, 5, 6). Несмотря на заметный гистопатологический вид, ДПН имеют хороший прогноз, демонстрируя доброкачественное течение (1, 2, 5, 6). Однако было описано распространение в регионарные лимфатические узлы (7), и в литературе можно найти даже случаи метастазирования ДПН с атипичными признаками, классифицированными как «пограничные» (В-ДПН) (7–10). Представляя диагностическую проблему даже для специалистов в области дерматопатологии и патологии (7), правильный диагноз имеет первостепенное значение для эффективного клинического лечения и исхода. Рекомендации по терапевтическому лечению и последующему наблюдению непоследовательны и не основаны на достаточных клинических данных. Недостаточное и чрезмерное лечение, включая длительное наблюдение, часто встречается у пациентов с этими опухолями (2, 6, 8, 9)., 11, 12). Мы стремились предоставить обзор литературы по ДПН и Б-ДПН с оценкой клинического ведения, включая лечение и последующую оценку.
Однако было описано распространение в регионарные лимфатические узлы (7), и в литературе можно найти даже случаи метастазирования ДПН с атипичными признаками, классифицированными как «пограничные» (В-ДПН) (7–10). Представляя диагностическую проблему даже для специалистов в области дерматопатологии и патологии (7), правильный диагноз имеет первостепенное значение для эффективного клинического лечения и исхода. Рекомендации по терапевтическому лечению и последующему наблюдению непоследовательны и не основаны на достаточных клинических данных. Недостаточное и чрезмерное лечение, включая длительное наблюдение, часто встречается у пациентов с этими опухолями (2, 6, 8, 9)., 11, 12). Мы стремились предоставить обзор литературы по ДПН и Б-ДПН с оценкой клинического ведения, включая лечение и последующую оценку.
Материалы и методы
Мы провели обзор наборов данных Medline, Scopus и Embase для клинических исследований, опубликованных с 1989 г. по 30 июля 2019 г., по ДПН и Б-ДПН.
Слова «глубоко проникающий невус» и «глубокий невус» использовались для обозначения исследований пациентов с этим заболеванием, содержащих данные клинических и лабораторных исследований, которым они подвергались. Комбинации терминов MeSH (Medical Subject Heading) и логических операторов, использованных в нашем поиске в Medline, перечислены ниже: глубокий проникающий невус ИЛИ глубокий проникающий невус ИЛИ темно-синий невус ИЛИ темно-синий невус ИЛИ глубокий невус ИЛИ глубокий невус. Поиск в Scopus выполнялся с использованием следующих комбинаций терминов MeSH и логических операторов: [(невус) ИЛИ (невус) ИЛИ (невус) ИЛИ (невус)] И [(глубокий) ИЛИ (синий) ИЛИ (проникающий)]. Комбинации терминов MeSH и логических операторов, используемые в нашем поиске на Embase, включали следующее: [невус/невус И ((синий) ИЛИ (глубокий)]. Мы рассматривали только статьи, опубликованные на английском или немецком языке, для дальнейшего рассмотрения и исключали дубликаты. Чтобы восполнить ожидаемое общее отсутствие хорошо спланированных исследований в больших популяциях пациентов с ДПН и Б-ДПН, мы включили проспективные исследования любого дизайна, ретроспективный когортный анализ, а также отчеты о клинических случаях. устойчивые эффекты клинического ведения и прогностические исходы, мы включили только те исследования, которые содержали данные последующего наблюдения. Статьи были проверены на основе названия и аннотации, чтобы определить соответствие критериям для нашего обзора. Были проанализированы и извлечены целые статьи для оценки приемлемости. Кроме того, мы вручную провели поиск библиографии включенных статей.
устойчивые эффекты клинического ведения и прогностические исходы, мы включили только те исследования, которые содержали данные последующего наблюдения. Статьи были проверены на основе названия и аннотации, чтобы определить соответствие критериям для нашего обзора. Были проанализированы и извлечены целые статьи для оценки приемлемости. Кроме того, мы вручную провели поиск библиографии включенных статей.
Результаты
Первоначальный поиск выявил в общей сложности 3513 исследований, а в процессе обзора еще три статьи были найдены путем ручного поиска в списках литературы. После устранения повторяющихся статей осталось 3369 статей. Статьи были сужены по названию, аннотации и полнотекстовому обзору. Всего 15 статей соответствовали критериям включения (рис. 1). Все 15 статей, которые соответствовали критериям включения, перечислены в таблицах 1A, B. Исследования были разделены на статьи, посвященные клиническому ведению ДПН, и статьи, посвященные Б-ДПН. Включенные исследования состоят из 10 когортных исследований и пяти клинических случаев, включающих в общей сложности 355 пациентов с ДПН и 48 пациентов с Б-ДПН.
Рисунок 1 . Схема выбора исследования.
Таблица 1A . Клинические данные пациентов, включенных в группу ДПН.
Таблица 1B . Клинические данные пациентов, включенных в группу Б-ДПН.
Клинические характеристики
Для группы глубоко проникающих невусов возрастной диапазон в исследованиях, за исключением описания случая, варьировал от 3 месяцев до 64 лет со средним возрастом 30 лет, аналогично группе B-DPN, где возрастной диапазон составлял 4 года. –62 года, при этом средний возраст во всех исследованиях был моложе 30 лет. Распределение по полу было сходным для обеих групп с немного большим количеством женщин, 203 (57,1%) в DPN и 25 (54,1%) в B-DPN, чем мужчин, 152 (42,8%) в DPN и 22 (45,8%). ) в B-DPN. Расположение невуса было разделено на шесть категорий: голова и шея, туловище, верхняя конечность, нижняя конечность (включая ягодицы), другое и неизвестное.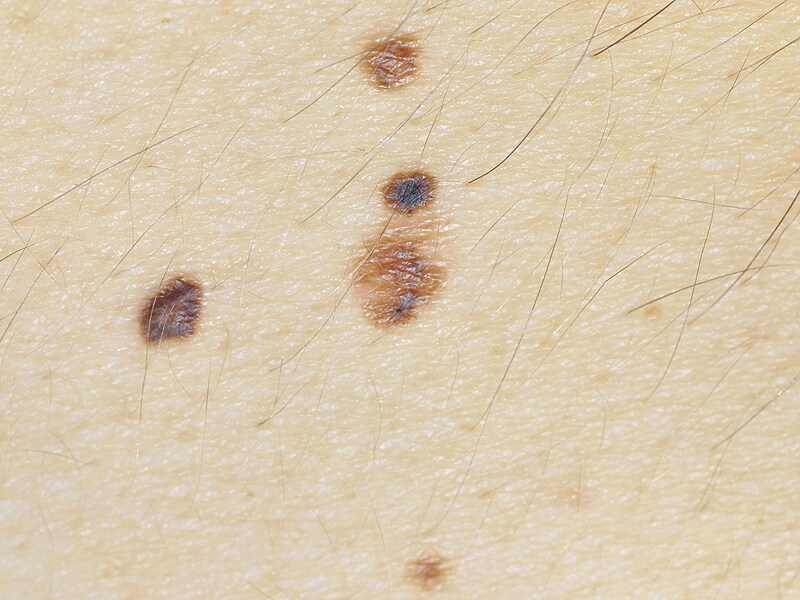 Большинство невусов в группе ДПН располагалось в области головы и шеи, 117 (32,9%), а на верхней и нижней конечности — 111 (31,2%). Из 111 невусов на конечностях диагностировано больше невусов на верхней конечности, чем на нижней, 61 против 44 соответственно. Среди необычных мест расположения невусов была конъюнктива в 34 случаях ДПН (19) и слизистая оболочка щек и мягкое небо в одном случае (17). В группе B-DPN наиболее частая локализация была аналогична группе DPN, голова и шея с 16 случаями, затем туловище и верхняя конечность, каждая с 14 случаями, а в остальных четырех случаях локализация была нижней конечностью.
Большинство невусов в группе ДПН располагалось в области головы и шеи, 117 (32,9%), а на верхней и нижней конечности — 111 (31,2%). Из 111 невусов на конечностях диагностировано больше невусов на верхней конечности, чем на нижней, 61 против 44 соответственно. Среди необычных мест расположения невусов была конъюнктива в 34 случаях ДПН (19) и слизистая оболочка щек и мягкое небо в одном случае (17). В группе B-DPN наиболее частая локализация была аналогична группе DPN, голова и шея с 16 случаями, затем туловище и верхняя конечность, каждая с 14 случаями, а в остальных четырех случаях локализация была нижней конечностью.
Ведение
Информация о тактике лечения в группе ДПН была доступна не для всех включенных исследований. Простое иссечение без каких-либо дополнительных хирургических процедур было основным методом лечения большинства пациентов. В нескольких случаях было выполнено повторное иссечение, в случаях, когда невус не был полностью удален в первый раз, а у некоторых пациентов было выполнено широкое иссечение без дополнительных уточнений по этому поводу. В группе B-DPN лечение варьировалось от иссечений/широких иссечений до биопсии сигнальных лимфатических узлов (SLNB) и системного лечения. В исследование Magro et al., проведенное в 2010 г., были включены 32 пациента с пограничными меланоцитарными опухолями, из которых у семи пациентов был диагностирован В-ДПН (9).). У четырех из этих пациентов были положительные результаты биопсии сигнальных лимфатических узлов (БСЛУ). У одного из этих пациентов был первоначально диагностирован ДПН, и поражение рецидивировало через 1,5 года, демонстрируя гистологические характеристики глубоко инвазивной меланомы. Повторная оценка первоначальной биопсии диагностировала поражение как B-DPN, что, по мнению авторов, имело бы показание для широкого иссечения и БСЛУ. У пациента развились последующие полиорганные метастазы, и он умер. Остальным пациентам с положительным SLB была проведена полная лимфаденэктомия без дальнейших признаков заболевания и проведена адъювантная терапия интерфероном. У пациентов не было выявлено каких-либо дальнейших рецидивов или метастазов в течение 4-летнего наблюдения.
В группе B-DPN лечение варьировалось от иссечений/широких иссечений до биопсии сигнальных лимфатических узлов (SLNB) и системного лечения. В исследование Magro et al., проведенное в 2010 г., были включены 32 пациента с пограничными меланоцитарными опухолями, из которых у семи пациентов был диагностирован В-ДПН (9).). У четырех из этих пациентов были положительные результаты биопсии сигнальных лимфатических узлов (БСЛУ). У одного из этих пациентов был первоначально диагностирован ДПН, и поражение рецидивировало через 1,5 года, демонстрируя гистологические характеристики глубоко инвазивной меланомы. Повторная оценка первоначальной биопсии диагностировала поражение как B-DPN, что, по мнению авторов, имело бы показание для широкого иссечения и БСЛУ. У пациента развились последующие полиорганные метастазы, и он умер. Остальным пациентам с положительным SLB была проведена полная лимфаденэктомия без дальнейших признаков заболевания и проведена адъювантная терапия интерфероном. У пациентов не было выявлено каких-либо дальнейших рецидивов или метастазов в течение 4-летнего наблюдения. Второе исследование Magro et al. (8) включили 40 пациентов с ДПН-подобной пограничной опухолью. В 35 случаях было выполнено повторное иссечение, и в 23 из них процедура представляла собой широкое повторное иссечение, остаточная пограничная опухоль присутствовала в 11 образцах. Из 23 пациентов с широким повторным иссечением 19прошла БСЛУ, из которых 7 были положительными. Авторы сообщили, что в большинстве этих положительных случаев СЛУ опухолевые отложения были субкапсулярными и небольшими, в то время как у одного пациента, у которого возник рецидив через 1 год после лечения, были обширные паренхиматозные отложения. Полная лимфаденэктомия была выполнена у четырех пациентов с положительным SLNB без дальнейших признаков заболевания, а два пациента получили адъювантную терапию интерфероном альфа. В двух из 40 случаев первоначальным диагнозом был диспластический невус и клеточный голубой невус, пациентам проводилось небольшое консервативное повторное иссечение или не проводилось повторное иссечение соответственно.
Второе исследование Magro et al. (8) включили 40 пациентов с ДПН-подобной пограничной опухолью. В 35 случаях было выполнено повторное иссечение, и в 23 из них процедура представляла собой широкое повторное иссечение, остаточная пограничная опухоль присутствовала в 11 образцах. Из 23 пациентов с широким повторным иссечением 19прошла БСЛУ, из которых 7 были положительными. Авторы сообщили, что в большинстве этих положительных случаев СЛУ опухолевые отложения были субкапсулярными и небольшими, в то время как у одного пациента, у которого возник рецидив через 1 год после лечения, были обширные паренхиматозные отложения. Полная лимфаденэктомия была выполнена у четырех пациентов с положительным SLNB без дальнейших признаков заболевания, а два пациента получили адъювантную терапию интерфероном альфа. В двух из 40 случаев первоначальным диагнозом был диспластический невус и клеточный голубой невус, пациентам проводилось небольшое консервативное повторное иссечение или не проводилось повторное иссечение соответственно. У обоих пациентов развились плексиформные меланомы вблизи предыдущего очага с метастазами, от которых оба пациента умерли. В эту группу был включен один отчет о случае 4-летнего мальчика с поражением на шее с диагнозом ДПН, у которого через 4 месяца после лечения развился видимый и пальпируемый лимфатический узел. В СЛУ были обнаружены пигментированные атипичные клетки, и мальчику была выполнена комплексная модифицированная радикальная диссекция шейки II типа с удалением 39лимфоузлы все отрицательные. Постановка не выявила дополнительных признаков метастазирования. Повторная оценка первичной биопсии привела к повторному диагнозу поражения как злокачественной меланомы.
У обоих пациентов развились плексиформные меланомы вблизи предыдущего очага с метастазами, от которых оба пациента умерли. В эту группу был включен один отчет о случае 4-летнего мальчика с поражением на шее с диагнозом ДПН, у которого через 4 месяца после лечения развился видимый и пальпируемый лимфатический узел. В СЛУ были обнаружены пигментированные атипичные клетки, и мальчику была выполнена комплексная модифицированная радикальная диссекция шейки II типа с удалением 39лимфоузлы все отрицательные. Постановка не выявила дополнительных признаков метастазирования. Повторная оценка первичной биопсии привела к повторному диагнозу поражения как злокачественной меланомы.
Последующее наблюдение
Срок наблюдения пациентов в группе ДПН варьировал от 4 месяцев до 23 лет. В пяти исследованиях некоторые пациенты наблюдались более 10 лет. Из 12 исследований местные рецидивы были зарегистрированы только у двух пациентов из двух разных исследований, и ни одного случая метастазирования не наблюдалось.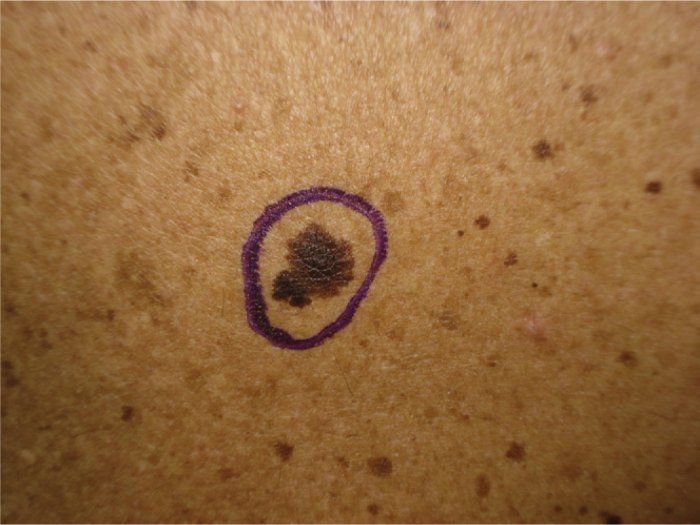 Срок наблюдения в группе Б-ДПН варьировал от 5 месяцев до 5 лет. В общей сложности наблюдалось четыре рецидива и три случая смерти, причем во всех трех случаях изначально был поставлен неправильный диагноз, что привело к недостаточному лечению пациентов.
Срок наблюдения в группе Б-ДПН варьировал от 5 месяцев до 5 лет. В общей сложности наблюдалось четыре рецидива и три случая смерти, причем во всех трех случаях изначально был поставлен неправильный диагноз, что привело к недостаточному лечению пациентов.
Обсуждение
Гистологический диагноз атипичных меланоцитарных опухолей может быть очень сложным даже для опытных дерматопатологов и патологов (7), а дифференциация между доброкачественными и злокачественными образованиями имеет терапевтические и прогностические последствия. Несмотря на то, что ДПН широко описывается как доброкачественное меланоцитарное поражение (1, 6, 11, 13, 18, 19), его злокачественный потенциал интенсивно обсуждается (5, 7) и сообщалось о случаях поражения регионарных лимфатических узлов ( 2, 5, 12). Тем не менее, 2009 г.Международная исследовательская группа по патологии меланомы согласилась с тем, что отдаленное заболевание за пределами регионарных узлов встречается редко и что при отсутствии митотической активности, ядерного плеоморфизма и экспансивного роста <2% поражений распространяются на лимфатические узлы (5). Во время «XXIX симпозиума Международного общества дерматопатологов в Граце» в 2008 г. эксперты-дерматопатологи и патологоанатомы рассмотрели 57 случаев MELTUMP (меланоцитарные опухоли с неопределенным злокачественным потенциалом), которые включали атипичные опухоли шпица (AST) и атипичные эпителиоидные/веретенообразные голубые невусы, последние категория, включая ДПН (7). Пациенты были разделены на три группы с благоприятным (отсутствие метастазов в течение 5 лет наблюдения), неблагоприятным (смерть, связанная с опухолью и/или метастазирование в лимфатические узлы и/или внутренние органы) и пограничным (узловые отложения опухолевых клеток ≤ 0,2). мм) поведение, и авторы отметили, что неблагоприятная группа чаще представляла три гистопатологических признака, а именно наличие митоза, митоза у основания и воспалительную реакцию. Кроме того, авторы отметили сложность достижения консенсуса в отношении доброкачественного или злокачественного диагноза поражений. О случаях метастатической ДПН сообщали и другие группы, в которых отмечалось, что эти поражения имели «пограничные» или «атипичные» признаки (8–10), что указывает на неопределенный злокачественный потенциал этих поражений, когда диагностика и терапевтическое лечение затруднены.
Во время «XXIX симпозиума Международного общества дерматопатологов в Граце» в 2008 г. эксперты-дерматопатологи и патологоанатомы рассмотрели 57 случаев MELTUMP (меланоцитарные опухоли с неопределенным злокачественным потенциалом), которые включали атипичные опухоли шпица (AST) и атипичные эпителиоидные/веретенообразные голубые невусы, последние категория, включая ДПН (7). Пациенты были разделены на три группы с благоприятным (отсутствие метастазов в течение 5 лет наблюдения), неблагоприятным (смерть, связанная с опухолью и/или метастазирование в лимфатические узлы и/или внутренние органы) и пограничным (узловые отложения опухолевых клеток ≤ 0,2). мм) поведение, и авторы отметили, что неблагоприятная группа чаще представляла три гистопатологических признака, а именно наличие митоза, митоза у основания и воспалительную реакцию. Кроме того, авторы отметили сложность достижения консенсуса в отношении доброкачественного или злокачественного диагноза поражений. О случаях метастатической ДПН сообщали и другие группы, в которых отмечалось, что эти поражения имели «пограничные» или «атипичные» признаки (8–10), что указывает на неопределенный злокачественный потенциал этих поражений, когда диагностика и терапевтическое лечение затруднены.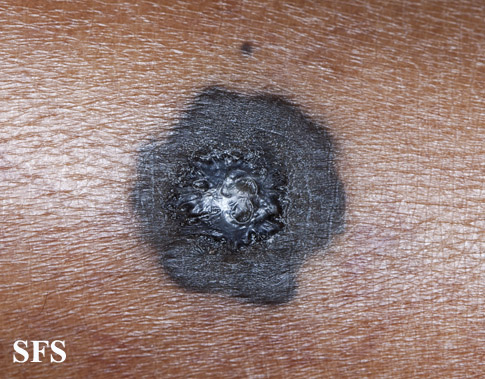 В настоящем обзоре мы разделили включенные исследования на две группы: ДПН и Б-ДПН. В общей сложности 355 пациентов были включены в группу ДПН, и в течение периода наблюдения от 4 месяцев до 23 лет было зарегистрировано только два местных рецидива и ни одного метастаза. Во вторую группу, Б-ДПН, было включено 48 пациентов, из них 24 пациента перенесли СЛУ и пять блокировали лимфоузлы после положительного результата СЛУ, а некоторые пациенты даже получали после этого адъювантную терапию интерфероном альфа. В этой группе «высокого риска» частота рецидивов была низкой, у четырех пациентов развились локальные рецидивы и у трех широко распространенные метастатические заболевания. Тот факт, что ни у одного из пациентов в группе ДПН не развилось метастатическое заболевание, и что, несмотря на то, что из 12 пациентов из группы В-ДПН были положительные БСЛУ, только у трех, двое из которых изначально были неправильно диагностированы, развилось широкое метастатическое заболевание, подчеркивает доброкачественное течение этого меланоцитарного поражения.
В настоящем обзоре мы разделили включенные исследования на две группы: ДПН и Б-ДПН. В общей сложности 355 пациентов были включены в группу ДПН, и в течение периода наблюдения от 4 месяцев до 23 лет было зарегистрировано только два местных рецидива и ни одного метастаза. Во вторую группу, Б-ДПН, было включено 48 пациентов, из них 24 пациента перенесли СЛУ и пять блокировали лимфоузлы после положительного результата СЛУ, а некоторые пациенты даже получали после этого адъювантную терапию интерфероном альфа. В этой группе «высокого риска» частота рецидивов была низкой, у четырех пациентов развились локальные рецидивы и у трех широко распространенные метастатические заболевания. Тот факт, что ни у одного из пациентов в группе ДПН не развилось метастатическое заболевание, и что, несмотря на то, что из 12 пациентов из группы В-ДПН были положительные БСЛУ, только у трех, двое из которых изначально были неправильно диагностированы, развилось широкое метастатическое заболевание, подчеркивает доброкачественное течение этого меланоцитарного поражения. . Однако на основании двух исследований Magro et al. (8, 9) его следует дополнительно оценить и исследовать, если более широкий начальный хирургический подход не окажется полезным для пациентов с пограничной/атипичной ДПН.
. Однако на основании двух исследований Magro et al. (8, 9) его следует дополнительно оценить и исследовать, если более широкий начальный хирургический подход не окажется полезным для пациентов с пограничной/атипичной ДПН.
Несмотря на то, что возраст при постановке диагноза ДПН и В-ДПН варьирует от 3 месяцев до 64 лет, в нашем обзоре поражения обычно диагностировались у молодых людей в возрасте до 30 лет (1, 6, 8, 9). Ранее в литературе сообщалось о врожденной ДПН (6), но в большинстве случаев ДПН является приобретенным поражением (3). В одном случае, включенном в наш обзор, авторы сообщают о развитии ДПН во врожденном невусе правой подколенной ямки у 3-месячного мальчика (14). Первоначальное иссечение поражения показало положительные глубокие края, из-за чего пациент подвергся повторному иссечению, после чего в течение 15 месяцев последующего наблюдения не было никаких признаков рецидива или метастазов. Самый молодой обнаруженный случай B-DPN был у 4-летнего мальчика, у которого первоначально был диагностирован DPN, но повторно диагностирована как меланома после того, как 4 месяца спустя были обнаружены метастазы в лимфатических узлах. У мальчика не было никаких дальнейших метастатических заболеваний, однако ему была проведена модифицированная радикальная диссекция шеи III типа с иссечением 39лимфатические узлы, все гистологически отрицательные. Дифференциальный диагноз между ДПН и злокачественной меланомой у детей может быть затруднен, поскольку ДПН может демонстрировать цитологическую атипию и наличие митотической активности, вызывая подозрение на злокачественность (2). Авторы упомянули, что рассматривали диагноз пигментированной эпителиоидной меланоцитомы, но поскольку не все гистологические критерии были соблюдены, диагноз был изменен на меланому (20). Было бы интересно повторно оценить поражение и определить, применяются ли критерии, упомянутые в более поздних исследованиях (7–9) поражение лучше классифицировать как пограничную/атипичную ДПН.
У мальчика не было никаких дальнейших метастатических заболеваний, однако ему была проведена модифицированная радикальная диссекция шеи III типа с иссечением 39лимфатические узлы, все гистологически отрицательные. Дифференциальный диагноз между ДПН и злокачественной меланомой у детей может быть затруднен, поскольку ДПН может демонстрировать цитологическую атипию и наличие митотической активности, вызывая подозрение на злокачественность (2). Авторы упомянули, что рассматривали диагноз пигментированной эпителиоидной меланоцитомы, но поскольку не все гистологические критерии были соблюдены, диагноз был изменен на меланому (20). Было бы интересно повторно оценить поражение и определить, применяются ли критерии, упомянутые в более поздних исследованиях (7–9) поражение лучше классифицировать как пограничную/атипичную ДПН.
В недавней публикации, посвященной генетике меланоцитарных поражений с гистологическими аспектами ДПН, были сделаны наблюдения, отличающие эту нозологию от других меланоцитарных опухолей (21). Помимо мутаций, активирующих путь киназы MAP (например, MAP2K1 или BRAF ), также наблюдаемых в других невусах, стало очевидным, что ДПН имеют частые одновременные мутации CTNNB1 . Это приводит к постоянной активации сигнального пути бета-катенина. Это также наблюдалось гистологически. В обычных невусах меланоциты становятся меньше («зрелыми») и демонстрируют более низкую экспрессию CTNNB1 и CCND1 по данным иммуногистохимии в более глубоких слоях дермы. При ДПН клетки не мельчают («созревают») и сохраняют экспрессию CTNNB1 и CCND1 в нижних слоях дермы. Авторы также определили, что злокачественная ДПН (меланомы, возникающие при ДПН) демонстрируют дополнительные генетические изменения (в сторону активации MAP-киназы и CTNNB1 мутаций). Эти выводы имеют ряд важных следствий. Иммуногистохимия CTNNB1 может быть полезна для выявления поражений ДПН (19, 22). Кроме того, профиль мутаций может помочь в дифференциации голубых невусов (с мутациями GNAQ или GNA11 (23)) от ДПН, что может быть затруднено исключительно на основании гистологических критериев.
Помимо мутаций, активирующих путь киназы MAP (например, MAP2K1 или BRAF ), также наблюдаемых в других невусах, стало очевидным, что ДПН имеют частые одновременные мутации CTNNB1 . Это приводит к постоянной активации сигнального пути бета-катенина. Это также наблюдалось гистологически. В обычных невусах меланоциты становятся меньше («зрелыми») и демонстрируют более низкую экспрессию CTNNB1 и CCND1 по данным иммуногистохимии в более глубоких слоях дермы. При ДПН клетки не мельчают («созревают») и сохраняют экспрессию CTNNB1 и CCND1 в нижних слоях дермы. Авторы также определили, что злокачественная ДПН (меланомы, возникающие при ДПН) демонстрируют дополнительные генетические изменения (в сторону активации MAP-киназы и CTNNB1 мутаций). Эти выводы имеют ряд важных следствий. Иммуногистохимия CTNNB1 может быть полезна для выявления поражений ДПН (19, 22). Кроме того, профиль мутаций может помочь в дифференциации голубых невусов (с мутациями GNAQ или GNA11 (23)) от ДПН, что может быть затруднено исключительно на основании гистологических критериев. Наконец, наличие дополнительных генетических событий, таких как промотор TERT , CDKN2A, TP53 или других мутаций, свидетельствует о злокачественной опухоли и плохом прогнозе.
Наконец, наличие дополнительных генетических событий, таких как промотор TERT , CDKN2A, TP53 или других мутаций, свидетельствует о злокачественной опухоли и плохом прогнозе.
Недавно описанные генетические данные могут оказать значительную помощь в правильно диагностированных ДПН и В-ДПН. Эти генетические находки были включены в последнюю систему классификации меланоцитарных опухолей ВОЗ, в которой ДПН и В-ДПН помещались между обычными невусами и меланомами в промежуточных группах/меланоцитомах, где ДПН обозначали как дисплазию низкой степени, а В-ДПН — как дисплазию высокой степени. 24). Подробные последующие исследования, в которых применяются генетические критерии, представленные Yeh et al. в настоящее время отсутствуют. Особое значение, конечно, имело бы более крупное проспективное исследование. Эти данные потенциально могут дополнительно уточнить модель, предложенную Yeh et al. и позволяют более точно оценить поведение опухоли на генетической основе в случаях, когда их трудно классифицировать только на основе гистопатологической оценки.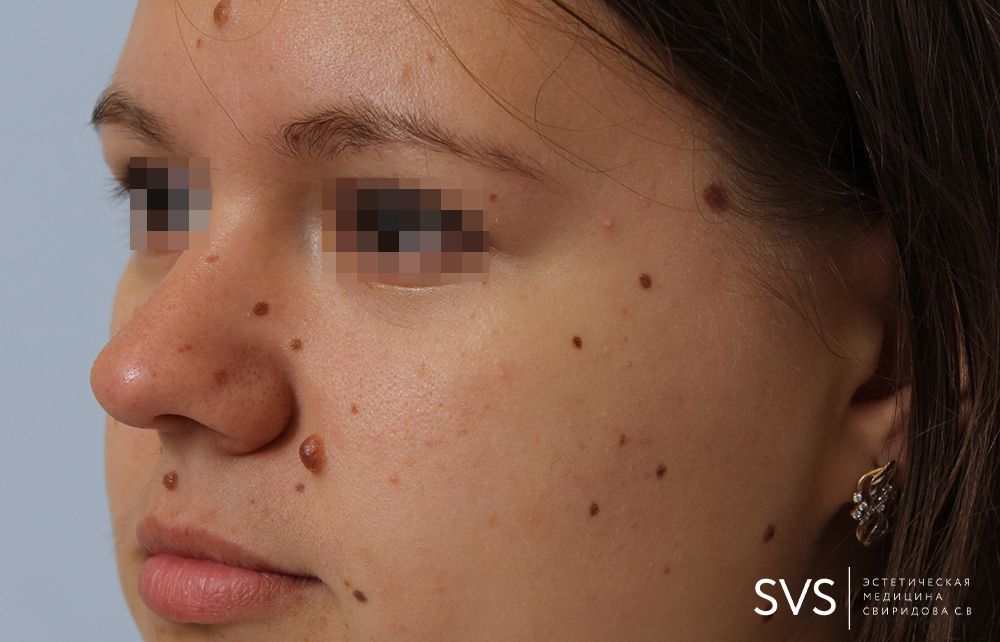
Сила нашего обзора подчеркивает существенный недостаток проспективных когортных исследований, сочетающих клиническую и гистопатологическую корреляцию с генетической оценкой для определения эффективных стратегий клинического лечения ДПН и В-ДПН. В то же время малое количество включенных исследований является ограничением для надлежащего статистического анализа при лечении ДПН и пограничной/атипичной ДПН.
Вклад авторов
IC и TS внесли свой вклад в разработку концепции исследования. IC, TS, AT и LU внесли свой вклад в разработку дизайна исследования. Сбор и анализ данных осуществляли IC и KG. IC, AT, KG, LU и TS подготовили и рассмотрели рукопись.
Финансирование
Подтверждение поддержки Фондом публикаций открытого доступа SLUB/TU Dresden.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Настоящая работа является частью магистерской диссертации в рамках магистерской программы клинических исследований Центра клинических исследований и управленческого образования, Отдел медицинских наук, Дрезденский международный университет, Дрезден, Германия.
Ссылки
1. Seab JA Jr, Graham JH, Helwig EB. Глубоко проникающий невус. Am J Surg Pathol. (1989) 13:39–44. doi: 10.1097/00000478-1980-00005
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
2. Robson A, Morley-Quante M, Hempel H, McKee PH, Calonje E. Глубоко проникающий невус: клинико-патологическое исследование 31 случая с дальнейшим определением гистологических особенностей, позволяющих отличить его от других пигментированных доброкачественных меланоцитарных поражений и меланомы. Гистопатология. (2003) 43:529–37. doi: 10.1111/j.1365-2559.2003.01730.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
3. Страццула Л., Сенна М.М., Ясуда М., Белазарян Л. Глубоко проникающий невус. J Am Acad Дерматол. (2014) 71:1234–40. doi: 10.1016/j.jaad.2014.07.026
Страццула Л., Сенна М.М., Ясуда М., Белазарян Л. Глубоко проникающий невус. J Am Acad Дерматол. (2014) 71:1234–40. doi: 10.1016/j.jaad.2014.07.026
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
4. Luzar B, Calonje E. Глубоко проникающий невус: обзор. Arch Pathol Lab Med. (2011) 135:321–6. дои: 10.1043/2009-0493-RA.1
CrossRef Полный текст | Google Scholar
5. Barnhill RL, Cerroni L, Cook M, Elder DE, Kerl H, Leboit PE, et al. Состояние дел, номенклатура, точки консенсуса и разногласия в отношении доброкачественных меланоцитарных поражений: итоги международного семинара. Адвокат Анат Патол. (2010) 17:73–90. doi: 10.1097/PAP.0b013e3181cfe758
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
6. Cooper PH. Глубоко проникающий (плексиформный веретеноклеточный) невус: частый участник комбинированных невусов. Дж. Кутан Патол. (1992) 19:172–80. doi: 10.1111/j.1600-0560.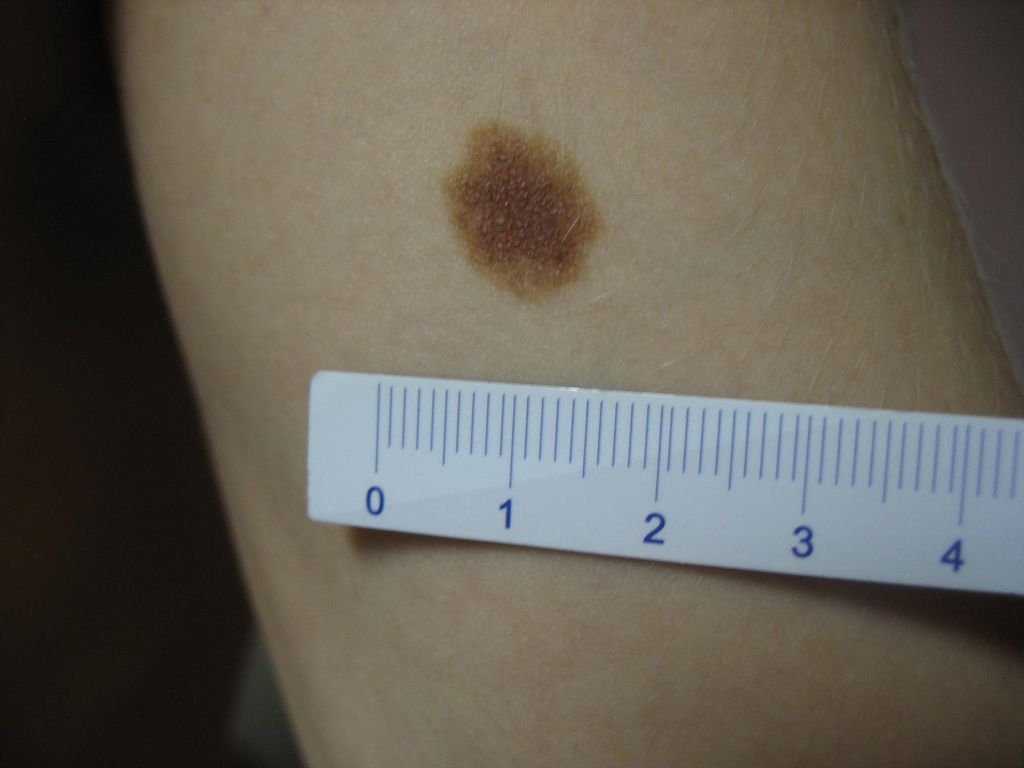 1992.tb01655.x
1992.tb01655.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
7. Cerroni L, Barnhill R, Elder D, Gottlieb G, Heenan P, Kutzner H, et al. Меланоцитарные опухоли неопределенного злокачественного потенциала: результаты учебного курса, проведенного на XXIX симпозиуме международного общества дерматопатологов в Граце, октябрь 2008 г. Am J Surg Pathol. (2010) 34:314–26. дои: 10.1097/PAS.0b013e3181cf7fa0
Резюме PubMed | Полный текст перекрестной ссылки | Google Scholar
8. Magro CM, Abraham RM, Guo R, Li S, Wang X, Proper S, et al. Глубоко проникающие невусоподобные пограничные опухоли: уникальное подмножество неоднозначных меланоцитарных опухолей со злокачественным потенциалом и нормальной цитогенетикой. Eur J Дерматол. (2014) 24:594–602. doi: 10.1684/ejd.2014.2393
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
9. Magro CM, Crowson AN, Mihm MC Jr, Gupta K, Walker MJ, Solomon G. Кожная пограничная меланоцитарная опухоль: категориальный подход. J Am Acad Дерматол. (2010) 62:469–79. doi: 10.1016/j.jaad.2009.06.042
J Am Acad Дерматол. (2010) 62:469–79. doi: 10.1016/j.jaad.2009.06.042
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
10. Abraham RM, Ming ME, Elder DE, Xu X. Атипичное меланоцитарное поражение без геномных аномалий показывает локорегиональные метастазы. Дж. Кутан Патол. (2012) 39:21–4. doi: 10.1111/j.1600-0560.2011.01849.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
11. Барнхилл Р.Л., Михм М.С. мл., Магро С.М. Плексиформный веретенообразный невус: характерный вариант плексиформного меланоцитарного невуса. Гистопатология. (1991) 18:243–7. doi: 10.1111/j.1365-2559.1991.tb00832.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
12. Хай В.А., Аланен К.В., Голиц Л.Е. Является ли меланоцитарный невус с очаговыми атипичными эпителиоидными компонентами (клональный невус) поверхностным вариантом глубоко проникающего невуса? J Am Acad Дерматол. (2006) 55:460–6. doi: 10.1016/j.jaad.2006.04.054
doi: 10.1016/j.jaad.2006.04.054
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
13. Мехреган Д.А., Мехреган А.Х. Глубоко проникающий невус. Арка Дерматол. (1993) 129:328–31. doi: 10.1001/archderm.129.3.328
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
14. Murphy MJ, Jen M, Chang MW, Grant-Kels JM, Makkar H. Молекулярная диагностика доброкачественного пролиферативного узла, развивающегося во врожденном меланоцитарном невусе у 3-месячного младенца. J Am Acad Дерматол. (2008) 59:518–23. doi: 10.1016/j.jaad.2008.05.011
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
15. Абрахам Р.М., Каракусис Г., Ас Г., Зиобер А.Ф., Черрони Л., Михм М.К. мл. и др. Лимфатическая инвазия предсказывает агрессивное поведение меланоцитарных опухолей с неопределенным злокачественным потенциалом (MELTUMP). Am Дж. Сург Патол. (2013) 37:669–75. doi: 10.1097/PAS.0b013e318288ff47
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
16. Veronese F, Celasco M, Meli F, Zavattaro E, Ramponi A, Merlo E, et al. Глубоко проникающий невус подошвенной поверхности: отчет о случае с дерматоскопическими признаками. J Dtsch Dermatol Ges. (2016) 14:517–8. doi: 10.1111/ddg.12718
Veronese F, Celasco M, Meli F, Zavattaro E, Ramponi A, Merlo E, et al. Глубоко проникающий невус подошвенной поверхности: отчет о случае с дерматоскопическими признаками. J Dtsch Dermatol Ges. (2016) 14:517–8. doi: 10.1111/ddg.12718
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
17. Чо Э.С., Чо Х.М., Нам В., Ким Х.С. Множественные глубоко проникающие невусы в ротовой полости, распространяющиеся на жевательные мышцы и буккальное жировое тело. J Оральный челюстно-лицевой хирург. (2017) 75:2579–92. doi: 10.1016/j.joms.2017.05.026
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
18. Lee JJ, Vilain RE, Granter SR, Hu NR, Bresler SC, Xu S, et al. 5-Гидроксиметилцитозин является ядерным биомаркером для оценки биологического потенциала гистологически неоднозначных сильно пигментированных меланоцитарных новообразований. Дж. Кутан Патол. (2017) 44: 249–55. doi: 10.1111/cup.12880
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
19.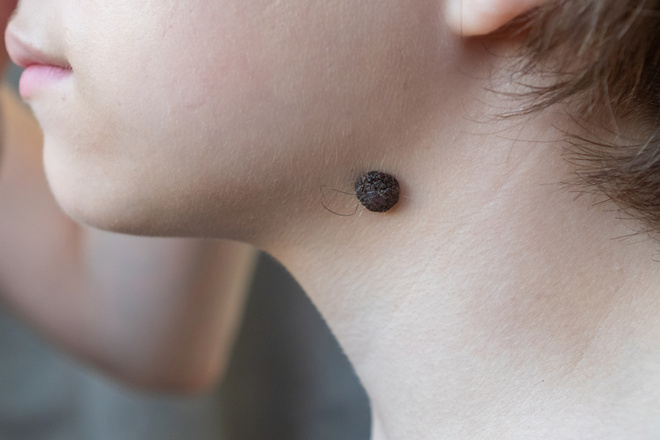 Шекоранья Д., Вергот К., Хаулина Г., Пизем Дж. Комбинированные глубокие невусы конъюнктивы — относительно распространенные поражения, характеризующиеся мутацией BRAFV600E и активацией пути бета-катенина: клинико-патологический анализ 34 поражений. Br J Офтальмол . (2019). doi: 10.1136/bjophthalmol-2019-314807. [Epub перед печатью].
Шекоранья Д., Вергот К., Хаулина Г., Пизем Дж. Комбинированные глубокие невусы конъюнктивы — относительно распространенные поражения, характеризующиеся мутацией BRAFV600E и активацией пути бета-катенина: клинико-патологический анализ 34 поражений. Br J Офтальмол . (2019). doi: 10.1136/bjophthalmol-2019-314807. [Epub перед печатью].
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
20. Ridha H, Ahmed S, Theaker JM, Horlock N. Злокачественная меланома и глубоко проникающие родинки – трудности диагностики у детей. J Plast Reconstr Aestet Surg. (2007) 60:1252–5. doi: 10.1016/j.bjps.2006.05.002
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
21. Yeh I, Lang UE, Durieux E, Tee MK, Jorapur A, Shain AH, et al. Комбинированная активация пути MAP-киназы и передачи сигналов β-катенина вызывает глубоко проникающие невусы. Нац.коммун. (2017) 8:644. doi: 10.1038/s41467-017-00758-3
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
22. Де ла Фушардье А., Кайо С., Жакмюс Дж., Дюрье Э., Улье А., Хаддад В. и др. Ядерная экспрессия β-катенина отличает глубоко проникающие невусы от других кожных меланоцитарных опухолей. Архив Вирхова. (2019) 474: 539–550. doi: 10.1007/s00428-019-02533-9
Де ла Фушардье А., Кайо С., Жакмюс Дж., Дюрье Э., Улье А., Хаддад В. и др. Ядерная экспрессия β-катенина отличает глубоко проникающие невусы от других кожных меланоцитарных опухолей. Архив Вирхова. (2019) 474: 539–550. doi: 10.1007/s00428-019-02533-9
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
23. Griewank KG, Muller H, Jackett LA, Emberger M, Moller I, van de Nes JA, et al. Мутации SF3B1 и BAP1 при меланоме, подобной голубому невусу. Мод Патол. (2017) doi: 10.1038/modpathol.2017.23
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
24. Старейшина Д.Е., Масси Д., Скольер Р.А., Виллемзе Р. (ред.). Классификация ВОЗ опухолей кожи . 4-е изд. Лион: МАИР (2018).
Google Scholar
Atypical/Borderline and Malignant Spitz Tumors
Most patients have good prognosis, with only minority of cases progressing to systemic disease or death
Microscopic
• Severely atypical /пограничная опухоль шпица
Как правило, крупные и глубокие клеточные составные меланоцитарные опухоли
Может казаться симметричным и хорошо очерченным при малом увеличении
Клетки демонстрируют тяжелую цитологическую атипию с ядерной гиперхромазией, увеличенными ядрышками, нерегулярным хроматином и обильной амфофильной или плотной эозинофильной цитоплазмой
невусы
• Шпицоидная меланома
Также большие и глубокие опухоли
Явная атипия и плеоморфизм
Соединительный компонент часто показывает неравномерное размещение, слияние и заметное рассеяние вверх
Обычно присутствуют множественные митотические фигуры
Часто атипично и/или глубоко
Клиническая фотография атипичной опухоли Spitz3 опухоль на ягодице у больного 16 лет.
 Несмотря на клинически банальный вид, гистологически была выявлена тяжелая цитологическая атипия и множественные дермальные митотические фигуры.
Несмотря на клинически банальный вид, гистологически была выявлена тяжелая цитологическая атипия и множественные дермальные митотические фигуры. Тяжело атипичная опухоль шпица
Эта крайне атипичная составная опухоль шпица демонстрирует преимущественно внутрикожную популяцию атипичных веретеновидных клеток с увеличением ядер, гиперхромазией и фокально выступающими ядрышками.
Шпицоидная меланома
Это пример шпицоидной меланомы у молодого взрослого человека. Клетки дермы заметно увеличены, атипичны, имеют плеоморфный вид. Кроме того, в этом поле имеется несколько митотических фигур.
HMB-45 Иммуногистохимия шпицоидной меланомы
Эта шпицоидная меланома демонстрирует сильное окрашивание HMB-45 в дерме. Хотя это и не всегда положительно, сильная кожная экспрессия HMB-45 при атипичной меланоцитарной пролиферации должна вызывать подозрение на меланому.
TERMINOLOGY
Abbreviations
• Atypical Spitz tumor (AST)
Synonyms
• Atypical spitzoid melanocytic proliferation
• Spitz tumor of borderline/uncertain malignant potential
• Spitzoid melanoma
Definitions
• Atypical/borderline Spitz tumor: Severely atypical melanocytic proliferation with features intermediate between Spitz nevus and spitzoid melanoma
• Malignant Spitz tumor: Malignant melanocytic proliferation with spitzoid features
ЭТИОЛОГИЯ/ПАТОГЕНЕЗ
Неизвестно
• Обычно возникают у молодых пациентов без каких-либо известных факторов риска развития меланомы
• Sun exposure may be risk factor in some cases
Possible Genetic Role
• Suggested by chromosome 11p amplification in minority of Spitz nevi
• Complex chromosomal alterations typically seen in melanoma
CLINICAL ISSUES
Эпидемиология
• Заболеваемость
Очень редкие опухоли
• Возраст
В основном молодые пациенты; диапазон: 2-30 лет
Злокачественные опухоли чаще встречаются в постпберти
Презентация
• Dermal Papule или Nodle
.
 Клинические края 5 мм для атипичных/пограничных опухолей
Клинические края 5 мм для атипичных/пограничных опухолей– Шпицоидные меланомы следует лечить с теми же краями, что и инвазивные меланомы той же глубины Бреслоу
Биопсия сигнального лимфатического узла остается спорной
– В настоящее время следует рассматривать как прогностическую, а не терапевтическую процедуру
– Спорная, но, вероятно, ее не следует использовать рутинно (особенно при атипичных/пограничных опухолях) до тех пор, пока не будет подтверждено более обширными клиническими исследованиями
Прогноз
• Трудно предсказать
Большинство пациентов имеют относительно хороший прогноз, и только в меньшинстве случаев развивается метастазирование и смерть
Even patients with lymph node involvement often have relatively good prognosis, as most tumors do not disseminate further
MICROSCOPIC
Histologic Features
• Severely atypical/borderline Spitz tumor
Typically, большая и глубокая клеточная составная опухоль
Читать дальше могут только участники с золотым статусом.
