После переноса эмбрионов выделения на 6 день после: Этапы переноса эмбриона
Выделения после переноса эмбрионов: коричневые, кровянистые, розовые
Методы ЭКО и ИКСИ предусматривают оплодотворение в лабораторных условиях. После культивирования зародышей в течение 2-5 дней происходит завершающий этап – перенос эмбрионов. Выделения, замеченные женщиной после окончания процедуры, могут свидетельствовать как о нормальном ходе беременности, так и о патологических процессах в организме будущей мамы.
Содержание статьи
Перенос эмбрионов иногда сопровождают слабые тянущие боли и ощущения дискомфорта внизу живота. Это связанно с небольшим повреждением стенок влагалища катетером для трансплантации зародышей. Выделения первых дней после процедуры не имеют отличительных особенностей. В женском организме постоянно вырабатывается влагалищная слизь. Она необходима для поддержания микрофлоры и кислотности, а также для предотвращения пересыхания органа. Нет повода для беспокойства, если выделения не имеют насыщенного цвета, резкого запаха, не вызывают зуд и не превышают в объеме одной чайной ложки в сутки.
Розовые выделения при переносе эмбрионов
Перенос эмбрионов и имплантация не происходят в один день. Между этими процессами обычно проходит 10-12 суток. Если зародыш приживается в материнском лоне, то характеристика слизи немного меняется. В этом случае выделения становятся бежевыми или светло-розовыми. Это происходит из-за того, что эмбрион активно внедряется в стенку матки, нарушая целостность небольших кровеносных сосудов. Именно эта кровь и окрашивает слизь в розовый оттенок. Стоит заметить, что такие симптомы наблюдаются лишь у 20% беременных. Поэтому отсутствие подобного проявления не означает замирания плода.
Влияние гормональных препаратов
Для того чтобы перенос эмбрионов осуществить сильным и здоровым биоматериалом, необходимо, чтобы в яичнике за один менструальный цикл созрело несколько здоровых яйцеклеток. Этого можно добиться методом стимулирования яичников гормональными препаратами. После перемещения эмбрионов репродуктивной системе также нужна поддерживающая терапия.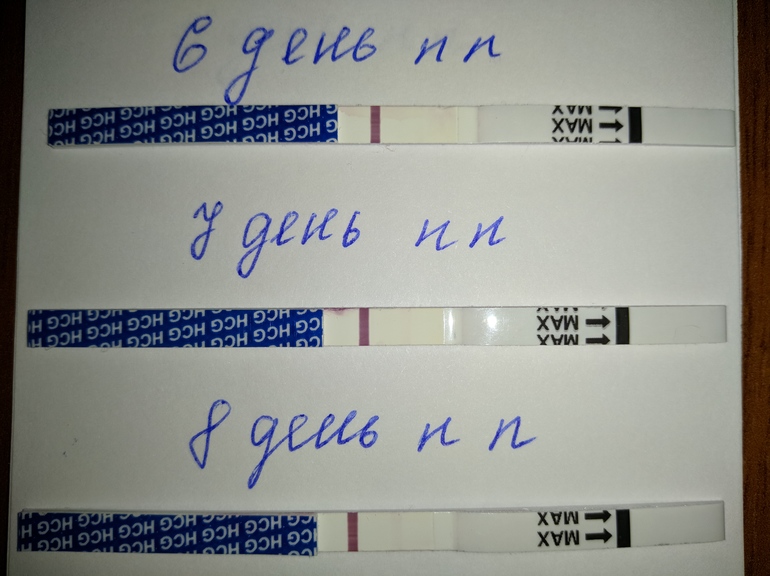 Она осуществляется посредством гелей и мазей с прогестероном. Ингредиенты этих препаратов смешиваются с влагалищной смазкой, делая выделения гуще и окрашивая их в желтоватый оттенок. После прекращения гормонотерапии цвет и консистенция слизи вновь становятся естественными.
Она осуществляется посредством гелей и мазей с прогестероном. Ингредиенты этих препаратов смешиваются с влагалищной смазкой, делая выделения гуще и окрашивая их в желтоватый оттенок. После прекращения гормонотерапии цвет и консистенция слизи вновь становятся естественными.
Белые творожистые выделения
Искусственное оплодотворение, завершающим этапом которого является перенос эмбрионов в матку, всегда сопровождается гормонотерапией. Она изменяет флору влагалища и создает условия для усиленного роста и размножения дрожжеподобного грибка Candida albicans – возбудителя молочницы. Это заболевание не может повлиять на закрепление плода, однако не стоит относиться к нему легкомысленно. Обильные выделения создают дискомфорт, а во время родов они попадают на кожу малыша и становятся причиной кандидоза ротовой полости и половых органов младенца. Лечить молочницу самостоятельно строго запрещено. Терапия должна быть составлена таким образом, чтобы не навредить ребенку. Поэтому рассчитать дозировку лекарства может только доктор.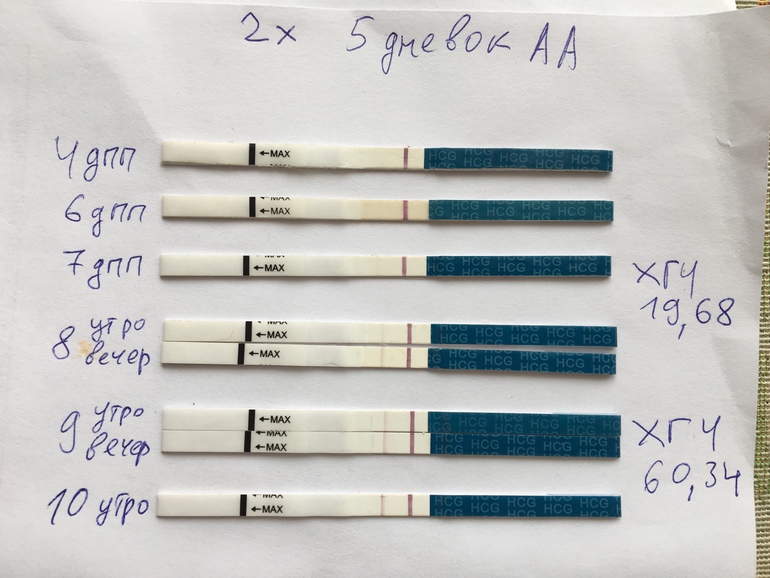
Мутные зеленые выделения
Выделения такого цвета свидетельствуют об инфекционном заражении или появлении бактериального вагиноза. Это заболевание чрезвычайно опасно для беременных, поэтому, если вы заметили обильные зеленоватые выделения с резким неприятным запахом, напоминающим рыбный, следует срочно обратиться к врачу и не допустить развития тяжелой стадии болезни. Гинеколог может назначить мази антисептического действия, антибиотики, общеукрепляющие средства. К профилактическим мерам относится отказ от синтетического нижнего белья и ежедневных прокладок, включение в рацион кисломолочных продуктов, своевременное лечение дисбактериоза.
Коричневые выделения после переноса эмбрионов
Эти выделения являются самыми опасными симптомами. После их обнаружения следует срочно обратиться к врачу, чтобы пройти все диагностические мероприятия и постараться сохранить ребенка. Кровянистые выделения после переноса эмбрионов могут означать замирание плода, отслойку эмбрионов, внематочную беременность.
Любые необычные симптомы, которые наблюдаются после того, как прошел перенос эмбрионов, требуют пристального внимания. Чтобы сохранить беременность после искусственного оплодотворения нужно прислушиваться к сигналам своего организма и вовремя корректировать лекарственные средства, питание или образ жизни.
Записаться
Перенос эмбрионов
Услуга оказывается в 8 клиниках – стоимость от 5 400 до 28 000 руб
Гинеколог 1176 врачей на сайте
Альбатрос +
Записаться
Доктор рядом в Очаково-Матвеевском на Веерной
Записаться
Аида на ул. Малая Никитская
Малая Никитская
Записаться
Буду Говорить на Фрунзенской
Записаться
Диагностический центр Медэксперт
Записаться
- Читайте также:
14226 16 мая 2016
Женское здоровье
Жизнь после удаления миомы
26503 16 мая 2016
Женское здоровье
На какой день цикла назначается миомэктомия
30160 16 мая 2016
Женское здоровье
Возможен ли спорт после миомэктомии?
3945 15 мая 2016
Женское здоровье
Дисфункция яичников: как забеременеть?
10895 13 мая 2016Женское здоровье
Удаление миомы матки во время кесарева сечения
10842 12 мая 2016
Женское здоровье
Миомэктомия: особенности послеоперационного периода
5926 12 мая 2016
Женское здоровье
Перенос эмбрионов: измеряем базальную температуру
24098 12 мая 2016
Женское здоровье
Боли в яичнике после имплантации эмбрионов
Женское здоровье
Боли в груди на последнем этапе ЭКО
23463 10 мая 2016
Женское здоровье
Удаление миомы матки: особенности выбора наркоза
29905 10 мая 2016
Женское здоровье
Месячные после миомэктомии
19184 10 мая 2016
Женское здоровье
Миомэктомия: болевые ощущения после операции
9565 09 мая 2016
Женское здоровье
Последствия миомэктомии: рубец на матке
4336 04 мая 2016
Женское здоровье
Влияние миомэктомии на результаты ЭКО
11637 04 мая 2016
Женское здоровье
Беременность и роды после удаления миомы матки
ЭКО в клинике ИНМЕД на Рахманинова 3К в Пензе
Данный метод основан на технологии оплодотворения яйцеклеток вне организма человека и перенос эмбриона(ов) в полость матки матери.
Впервые в мире метод ЭКО был применен в Великобритании в 1977 г., в результате чего в 1978 г. родился первый человек, «зачатый в пробирке». Это событие можно считать абсолютной революцией в мире медицины.
Первый ребёнок (девочка), зачатый посредством ЭКО в Советском Союзе, был рождён в феврале 1986 г. Процедура была выполнена в г. Москве, в Центре охраны здоровья матери и ребёнка (в настоящее время ФГБУ «Научный центр акушерства, гинекологии и перинаталогии имени академика В.И. Кулакова» Министерства здравоохранения Российской Федерации).
Метод экстракорпорального оплодотворения тесно связан с научно-техническим прогрессом. Для достижения конечного результата — рождения ребенка — необходим большой диапазон знаний, так как метод ЭКО объединяет такие области медицины, как эндокринология, гинекология, урология, хирургия, эмбриология, генетика, иммунология и ультразвуковая диагностика. Помимо этого, для проведения таких тщательных и тонких манипуляций необходима совершенная техническая и лабораторная база.
Благодаря эффективности метода ЭКО ежегодно во всем мире огромное количество семейных пар становятся родителями.
Основными направлениями деятельности клиники «ИНМЕД» являются гинекология и репродуктология. В нашей клинике в Пензе ЭКО проводится с 2008 г.
Обследование перед ЭКО
Перед началом программы ЭКО супружеской паре необходимо пройти обследование согласно приказу Министерства здравоохранения Российской Федерации от 30.08.2012 г. № 107н «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению».
При наличии показаний стандартный план обследования может быть скорректирован лечащим врачом.
Этапы программы ЭКО
Первый этап: Стимуляция суперовуляции
Стимуляция суперовуляции начинается со 2 — 3-го дня менструального цикла и продолжается в среднем 10 — 12 дней. Для стимуляции суперовуляции используются препараты, которые непосредственно стимулируют рост фолликулов и созревание яйцеклеток, а также рост эндометрия – внутреннего слоя матки, куда в последующем будет имплантироваться эмбрион.
При стимуляции суперовуляции регулярно контролируется рост фолликулов с помощью трансвагинального УЗИ, периодичность которого определяет лечащий врач. Возможна корректировка дозы назначенных препаратов.
Этап стимуляции заканчивается введением овуляторной дозы ХГЧ с целью финального дозревания яйцеклеток.
Второй этап: Пункция фолликулов
После введения овуляторной дозы ХГЧ, пациентке через 36-48 часов назначается пункция фолликулов.
Пункция фолликулов (забор яйцеклеток) является малой хирургической операцией, которая проводится под коротковременным наркозом и под ультразвуковым контролем.
Третий этап: Получение сперматозоидов
Сперматозоиды либо извлекаются из эякулята, собранного в день пункции, либо берутся непосредственно из яичка или из придатка яичка. Если супруг в день пункции фолликулов не может присутствовать в клинике, сперматозоиды можно извлечь заранее и заморозить для оплодотворения в день пункции.
Четвертый этап: Оплодотворение яйцеклеток и культивирование (выращивание) эмбрионов
После получения яйцеклеток и сперматозоидов происходит их оплодотворение. После оплодотворения проводится культивирование эмбрионов в инкубаторе. Культивирование эмбрионов продолжается 3 — 5 дней.
Пятый этап: Перенос эмбрионов
После этапа культивирования под ультразвуковым контролем производится перенос эмбрионов. Перенос эмбрионов в полость матки быстрая и безболезненная процедура, выполняемая без общего обезболивания при помощи тонкого катетера, который вводится в матку. Посредством катетера эмбрионы попадают в полость матки, где в течение нескольких дней они должны имплантироваться, а в течение трех последующих недель развиться в один или несколько плодов.
На данном этапе непосредственно процедура ЭКО заканчивается.
Дополнительные манипуляции в программе ЭКО
Вспомогательный эмбриологический хетчинг
Ооцит и эмбрион на ранних стадиях развития окружены особой защитной оболочкой (зона пеллюцида). В норме на 5-7 сутки развития эмбрион разрывает эту оболочку и покидает ее. Однако не все эмбрионы способны самостоятельно разорвать зону пеллюцида и, соответственно, не могут прикрепиться к стенке матки. Это связывают с изменениями свойств оболочки вследствие различных причин. Для решения этой проблемы специалистами в области ЭКО были разработаны методы вспомогательного хетчинга.
В норме на 5-7 сутки развития эмбрион разрывает эту оболочку и покидает ее. Однако не все эмбрионы способны самостоятельно разорвать зону пеллюцида и, соответственно, не могут прикрепиться к стенке матки. Это связывают с изменениями свойств оболочки вследствие различных причин. Для решения этой проблемы специалистами в области ЭКО были разработаны методы вспомогательного хетчинга.
Вспомогательный хетчинг — процедура, при которой эмбриолог с помощью специальных инструментов делает небольшое отверстие в зоне пеллюцида, благодаря чему увеличивается потенциал имплантации эмбриона.
Вспомогательный эмбриологический хетчинг показан:
женщинам с тремя или более неудачными попытками переноса эмбрионов хорошего качества;
женщинам старше 38 лет;
женщинам с высоким уровнем ФСГ;
женщинам, чьи эмбрионы имеют аномально утолщенную зону пеллюцида.

Информация об оказании медицинской помощи в рамках территориальной программы ОМС
Часто задаваемые вопросы по лечению методом ЭКО
1. Как вести себя после переноса эмбрионов?
В течение двух следующих недель рекомендуется щадящий режим нагрузок, умеренный ритм жизненной активности, при котором желательно:
максимально ограничить половую жизнь;
не допускать запоров, расстройства желудка;
вместо горячей воды, бани или сауны принимать теплый душ;
отказаться от чрезмерно активного образа жизни (занятий шейпингом, аэробикой, бегом, плаванием, другими активными видами спорта), а также от выполнения тяжелой физической работы, поднятия тяжестей;
максимально ограничить возможность инфекционных заболеваний и простуды;
ограничить психоэмоциональные нагрузки.

Не забывайте также, что для нормального течения беременности необходимо регулярное полноценное питание. Рекомендуется больше бывать на свежем воздухе, вести максимально здоровый образ жизни. Спать можно в любом удобном для Вас положении: на боку, спине или животе.
После переноса эмбрионов у Вас могут появиться незначительные мажущие кровянистые выделения – не стоит этого бояться. Многие пациентки имеют подобные выделения даже после получения положительного теста на беременность.
В это время и в дальнейшем не принимайте никаких лекарств и препаратов, назначенных самостоятельно или другими врачами без согласования с лечащим врачом клиники! Строго соблюдайте данные Вам назначения и рекомендации! При возникновении любых вопросов не стесняйтесь обратиться к своему лечащему врачу.
2. Когда можно проводить тест на беременность (ХГЧ) ?
Ровно через две недели после переноса эмбрионов следует сдать кровь на ХГЧ и сообщить о его результате лечащему врачу. Делать тест ранее 14-го дня не имеет смысла, скорее всего, он окажется отрицательным, так как содержание гормона беременности в моче в это время чрезвычайно минимальное. При этом помните, что даже через две недели возможен ложноотрицательный результат, ни в коем случае не отменяйте препараты самостоятельно – их резкая отмена приведет к прерыванию беременности в раннем сроке. Обязательно согласуйте все дальнейшие назначения и рекомендации с Вашим лечащим врачом в этот же день.
Делать тест ранее 14-го дня не имеет смысла, скорее всего, он окажется отрицательным, так как содержание гормона беременности в моче в это время чрезвычайно минимальное. При этом помните, что даже через две недели возможен ложноотрицательный результат, ни в коем случае не отменяйте препараты самостоятельно – их резкая отмена приведет к прерыванию беременности в раннем сроке. Обязательно согласуйте все дальнейшие назначения и рекомендации с Вашим лечащим врачом в этот же день.
3. Какие действия необходимо предпринимать в случае неудачной попытки?
Как известно, беременность наступает далеко не в ста процентах попыток, как самостоятельного, так и искусственного оплодотворения. Возникает вопрос: что делать при неудачной попытке, сколько раз можно предпринимать попытки ЭКО?
Этот вопрос решается индивидуально. Сама процедура ЭКО при стандартном контроле и соответствующем опыте врача безопасна и может повторяться много раз. У некоторых пар беременность наступает после 3 — 4 попытки. Разумный предел количества попыток есть, он определяется врачом в зависимости от конкретной ситуации. При повторных попытках оптимально использование криоэмбрионов, полученных в стимулированной попытке.
Разумный предел количества попыток есть, он определяется врачом в зависимости от конкретной ситуации. При повторных попытках оптимально использование криоэмбрионов, полученных в стимулированной попытке.
При отсутствии беременности в результате ДАЖЕ одного курса лечения методом ЭКО в клинике врач стремится найти причины безуспешной попытки и возможности их устранения и только после этого доктор совместно с супружеской парой вновь разрабатывают план пути, конечным результатом которого является именно долгожданный ребенок. Но чудодейственных методов подготовки пациентки к следующему циклу ЭКО не существует. После 3-4 неудачных попыток ЭКО рекомендуют провести ПГД (предимплантационную диагностики) — это специальное молекулярно-биологическое тестирование хромосомного набора яйцеклеток или клеток эмбриона, проводимое до переноса эмбриона в полость матки.
4. Процент наступления беременности методом лечения ЭКО.
ЭКО не следует рассматривать как разовый цикл лечения. Пациенты должны планировать (по крайней мере, мысленно!) пройти через 3 — 4 цикла ЭКО, чтобы обеспечить себе достаточно высокие шансы на наступление беременности. После 4 циклов ЭКО вероятность наступления беременности (кумулятивный или накопительный процент) составляет около 70 — 80%. Это означает, что даже если в каждом конкретном цикле вероятность забеременеть составляет не более 40%, после 4 циклов эта вероятность увеличивается до 80%.
Пациенты должны планировать (по крайней мере, мысленно!) пройти через 3 — 4 цикла ЭКО, чтобы обеспечить себе достаточно высокие шансы на наступление беременности. После 4 циклов ЭКО вероятность наступления беременности (кумулятивный или накопительный процент) составляет около 70 — 80%. Это означает, что даже если в каждом конкретном цикле вероятность забеременеть составляет не более 40%, после 4 циклов эта вероятность увеличивается до 80%.
5. Сколько времени должно пройти после неудачи до следующей попытки?
Перерыв между попытками ЭКО напрямую зависит от причин неудачной попытки. Данный вопрос оговаривается непосредственно с лечащим врачом. Обычно начало программы возможно спустя 1 — 3 менструальных цикла.
6. Почему большинство женщин, забеременевших после ЭКО, рожают при помощи кесарева сечения?
В большинстве стран ЭКО не является показанием для кесарева сечения. Роды при беременности после ЭКО ничем не отличаются от обычных. В тех случаях, когда причина бесплодия — болезнь женщины, роды проводятся с учётом конкретного заболевания и таких заболеваний среди «ЭКОшниц» вполне достаточно, чтобы появился миф о том, что всем надо делать кесарево сечение. К способу оплодотворения это уже не имеет никакого отношения. Но, учитывая, что многие супружеские пары данную беременность ждали несколько лет (5 — 20 лет) и она досталась им с таким неимоверными усилиями (и это может быть последняя беременность), то чтобы минимизировать риски осложнений родов (гипоксия плода, слабость родовых сил), предпочтительнее в этой ситуации сделать плановое кесарево сечение на сроке 39 — 40 недель беременности в утренние часы с бригадой высококвалифицированных специалистов (врач-акушер-гинеколог, врач-неонатолог, взрослый и детский врач-анестезиолог-реаниматолог), чтобы при малейших осложнениях у роженицы или ребенка экстренно оказать ему своевременную помощь. Родоразрешение лучше проводить в перинатальном центре (3 уровень оказания медицинской помощи).
В тех случаях, когда причина бесплодия — болезнь женщины, роды проводятся с учётом конкретного заболевания и таких заболеваний среди «ЭКОшниц» вполне достаточно, чтобы появился миф о том, что всем надо делать кесарево сечение. К способу оплодотворения это уже не имеет никакого отношения. Но, учитывая, что многие супружеские пары данную беременность ждали несколько лет (5 — 20 лет) и она досталась им с таким неимоверными усилиями (и это может быть последняя беременность), то чтобы минимизировать риски осложнений родов (гипоксия плода, слабость родовых сил), предпочтительнее в этой ситуации сделать плановое кесарево сечение на сроке 39 — 40 недель беременности в утренние часы с бригадой высококвалифицированных специалистов (врач-акушер-гинеколог, врач-неонатолог, взрослый и детский врач-анестезиолог-реаниматолог), чтобы при малейших осложнениях у роженицы или ребенка экстренно оказать ему своевременную помощь. Родоразрешение лучше проводить в перинатальном центре (3 уровень оказания медицинской помощи).
Исследование бактериального загрязнения во время переноса эмбрионов и его влияния на исход ЭКО/беременности
J Assist Reprod Genet. 2007 сен; 24(9): 395–399.
Опубликовано онлайн 2007 г. 17 июля. DOI: 10.1007/S10815-007-9146-5
, 1 , 1 , 1 , 2 , 2 , 1, 10008, 2 , 1, 10007, 2 , 1, 2 , 2 , 1, 2 , 1 и 1
Информация об авторе Примечания к статье Информация об авторских правах и лицензиях Отказ от ответственности
Цель
Это исследование было разработано для изучения влияния бактериального загрязнения на результаты экстракорпорального оплодотворения.
Метод
В проспективном клиническом исследовании для этого исследования были отобраны 152 пациента в возрасте 23–38 лет, средний возраст 33,3 ± 4,6 года, проходящие ЭКО. Во время переноса эмбрионов брали отдельные образцы для микробиологического исследования из следующих участков: дно влагалища, шейка матки, среда для культивирования эмбрионов до и после переноса эмбрионов, кончик катетера и внешний слой. Все образцы культивировали отдельно для выявления любых присутствующих бактерий или дрожжей.
Во время переноса эмбрионов брали отдельные образцы для микробиологического исследования из следующих участков: дно влагалища, шейка матки, среда для культивирования эмбрионов до и после переноса эмбрионов, кончик катетера и внешний слой. Все образцы культивировали отдельно для выявления любых присутствующих бактерий или дрожжей.
Результаты
Частота наступления беременности у пациенток с положительным результатом теста на Entrobacteriaceae (22,2% против 51%) и видов Staphylococcus (17,6% против 44%) была значительно ниже, чем в группе с отрицательным посевом ( p < 0,001). Другие изолированные микроорганизмы, по-видимому, не влияют на частоту наступления беременности.
Заключение
Это исследование показывает, что наличие микробного загрязнения влагалища и шейки матки во время переноса эмбрионов связано со значительным снижением частоты наступления беременности.
Ключевые слова: Бактериальная популяция, Катетер для переноса эмбрионов, Имплантация, Экстракорпоральное оплодотворение, Вагинально-цервикальное заражение
Несмотря на значительный прогресс в области вспомогательной репродукции, уровень имплантации замененных эмбрионов остается низким. Это в значительной степени связано с такими переменными, как возраст пациентки, рецептивность эндометрия, качество эмбриона [1, 2] и метод переноса эмбриона как таковой [3-5]. Поскольку лечение экстракорпорального оплодотворения (ЭКО) включает размещение эмбрионов в полость матки с помощью катетера, проходящего через шейку матки, возможность бактериального заражения во время процедуры переноса эмбрионов явно существует, но недостаточно изучена. На самом деле, появляется все больше доказательств того, что бактериальное заражение полости матки после трансцервикального переноса эмбрионов может негативно повлиять на частоту имплантации и исход беременности. Такая контаминация может происходить при замене эмбрионов через кончик катетера для переноса эмбрионов различными вагинально-цервикальными микроорганизмами [6–9].]. Антимикробные препараты в питательной среде, вероятно, слабо ингибируют потенциально большое количество бактерий, которые могут контаминировать катетер для переноса эмбрионов, когда он проходит через шейку матки.
Это в значительной степени связано с такими переменными, как возраст пациентки, рецептивность эндометрия, качество эмбриона [1, 2] и метод переноса эмбриона как таковой [3-5]. Поскольку лечение экстракорпорального оплодотворения (ЭКО) включает размещение эмбрионов в полость матки с помощью катетера, проходящего через шейку матки, возможность бактериального заражения во время процедуры переноса эмбрионов явно существует, но недостаточно изучена. На самом деле, появляется все больше доказательств того, что бактериальное заражение полости матки после трансцервикального переноса эмбрионов может негативно повлиять на частоту имплантации и исход беременности. Такая контаминация может происходить при замене эмбрионов через кончик катетера для переноса эмбрионов различными вагинально-цервикальными микроорганизмами [6–9].]. Антимикробные препараты в питательной среде, вероятно, слабо ингибируют потенциально большое количество бактерий, которые могут контаминировать катетер для переноса эмбрионов, когда он проходит через шейку матки. Следует отметить, что генитальные инфекции, особенно вызванные микроорганизмами, передающимися половым путем, являются одной из ведущих причин бесплодия [10, 11]. Фактически, обнаружение вида Chlamydia в эндоцервиксе женщин, проходящих лечение ЭКО, было связано с уменьшением имплантации и снижением частоты продолжающихся беременностей [12, 13].
Следует отметить, что генитальные инфекции, особенно вызванные микроорганизмами, передающимися половым путем, являются одной из ведущих причин бесплодия [10, 11]. Фактически, обнаружение вида Chlamydia в эндоцервиксе женщин, проходящих лечение ЭКО, было связано с уменьшением имплантации и снижением частоты продолжающихся беременностей [12, 13].
Кроме того, исследования показали, что у субъектов с отрицательным результатом теста на бактериальное загрязнение частота наступления беременности примерно на 50% выше, чем у субъектов с положительным результатом теста на бактериальное загрязнение, вызванное наконечником катетера для переноса эмбрионов. Также сообщалось о повышенном риске потери беременности до шестой недели гестации у женщин с бактериальным вагинозом (БВ), проходящих лечение экстракорпоральным оплодотворением [14, 15]. Снижение числа живорождений после ЭКО у женщин с контаминацией кончика катетера, а также у женщин с БВ может быть вызвано снижением показателей оплодотворяемости, повышенным невынашиванием беременности или тем и другим. Кроме того, исследования показали, что патогенные бактерии, культивируемые на кончике катетера, отрицательно влияют на показатели живорождения [6–9].]. И наоборот, выделение лактобацилл, продуцирующих перекись водорода (H 2 O 2 ), из кончика катетера, по-видимому, связано с увеличением числа живорождений [9]. Понимание того, оказывают ли генитальные бактерии негативное влияние на зачатие, может привести к принятию эффективного вмешательства, которое может улучшить исходы беременности и родов.
Кроме того, исследования показали, что патогенные бактерии, культивируемые на кончике катетера, отрицательно влияют на показатели живорождения [6–9].]. И наоборот, выделение лактобацилл, продуцирующих перекись водорода (H 2 O 2 ), из кончика катетера, по-видимому, связано с увеличением числа живорождений [9]. Понимание того, оказывают ли генитальные бактерии негативное влияние на зачатие, может привести к принятию эффективного вмешательства, которое может улучшить исходы беременности и родов.
Это исследование было разработано для оценки влияния отдельных бактерий, выделенных из влагалища, шейки матки и кончика катетера для переноса эмбрионов, на исход лечения ЭКО.
Отбор пациентов
В проспективное клиническое исследование были включены 152 пациента в возрасте 23–38 лет, средний возраст 33,3 ± 4,6 года, проходящие ЭКО. Клиническими показаниями для лечения ЭКО были аномалии спермы, трубный фактор или идиопатическое бесплодие. Чтобы ограничить дополнительные факторы (например, качество эмбриона и восприимчивость эндометрия), которые могут повлиять на результаты, мы отобрали только пациенток в возрасте ≤38 лет с морфологически нормальной маткой и по крайней мере двумя эмбрионами хорошего качества, доступными для переноса эмбрионов. Перенос эмбрионов проводил тот же врач. Все женщины были отрицательными на Chlamydia trachomatis , и ни у одного из них не было клинических признаков вагинита или цервицита. Посевы спермы проводились за 2 месяца до лечения ЭКО. Мужчинам с положительным микробным ростом было назначено лечение антибиотиками; таким образом, у всех мужчин были отрицательные результаты посева спермы во время ЭКО. Все пациенты были проинформированы о характере исследования и дали письменное информированное согласие. Исследование было одобрено нашим местным комитетом по этике исследований.
Перенос эмбрионов проводил тот же врач. Все женщины были отрицательными на Chlamydia trachomatis , и ни у одного из них не было клинических признаков вагинита или цервицита. Посевы спермы проводились за 2 месяца до лечения ЭКО. Мужчинам с положительным микробным ростом было назначено лечение антибиотиками; таким образом, у всех мужчин были отрицательные результаты посева спермы во время ЭКО. Все пациенты были проинформированы о характере исследования и дали письменное информированное согласие. Исследование было одобрено нашим местным комитетом по этике исследований.
Все женщины-участницы прошли микробиологическое исследование на вагинально-цервикальные и уретральные патогенные микроорганизмы за два месяца до лечения ЭКО. Больным с положительным результатом на какой-либо патогенный микроорганизм проводилась специфическая терапия, после чего проводился посттерапевтический контроль. Всем пациенткам был проведен стандартный протокол подавления индукции стимуляции яичников. Извлечение ооцитов осуществляли через 36 часов после введения ХГЧ, а перенос эмбрионов осуществляли через 48 часов после осеменения.
Извлечение ооцитов осуществляли через 36 часов после введения ХГЧ, а перенос эмбрионов осуществляли через 48 часов после осеменения.
Сбор культур и выделение бактерий
Непосредственно перед переносом эмбрионов было взято шесть отдельных образцов для микробного исследования: мазок из дна влагалища и шейки матки был взят после промывания и введения зеркала; образец среды для культивирования эмбрионов, используемый для переноса эмбрионов, был собран до загрузки эмбрионов, а также образец той же среды после промывки катетера для переноса эмбрионов после переноса эмбрионов; образец с кончика внутреннего катетера для переноса эмбрионов, а также один с кончика внешнего листа. Затем все образцы культивировали для выделения любых присутствующих бактерий. Образцы считались положительными, когда в каждом образце обнаруживалось 50 образующих колоний единиц. В частности, аэробные и анаэробные микроорганизмы, физиологически присутствующие в половых путях, и патогенные микроорганизмы, такие как урогенитальная микоплазма, 9В этом исследовании рассматривались 0041 Neisseria gonorrhoeae и Gardnerella vaginalis . Пациенты были классифицированы на основе присутствия каждого отдельного микроорганизма в исследованных образцах. Пациентов считали положительными на один микроорганизм, когда положительный результат посева вагинальных и/или цервикальных образцов был подтвержден на кончике внутреннего катетера, наружном листе и среде, используемой для промывания катетера после переноса. Полученные данные были статистически коррелированы с частотой наступления беременности как у пациентов с положительным, так и с отрицательным результатом тестирования.
Пациенты были классифицированы на основе присутствия каждого отдельного микроорганизма в исследованных образцах. Пациентов считали положительными на один микроорганизм, когда положительный результат посева вагинальных и/или цервикальных образцов был подтвержден на кончике внутреннего катетера, наружном листе и среде, используемой для промывания катетера после переноса. Полученные данные были статистически коррелированы с частотой наступления беременности как у пациентов с положительным, так и с отрицательным результатом тестирования.
Для статистического анализа х 2 и t тесты были использованы, где это уместно. Различия считались статистически значимыми при p ≤ 0,05.
Данные о характеристиках пациентов, протоколе стимуляции, эмбриологии, а также количестве и качестве перенесенных эмбрионов существенно не различались между группами с положительным и отрицательным посевом (таблица ). Общая частота наступления беременности у 152 обследованных женщин составила 32,2 %. Из 152 исследованных пациентов 133 (87,5%) дали положительный результат на один или несколько микроорганизмов, а остальные 19у пациентов (12,5%) тесты на бактериальное обсеменение полностью отрицательны. Хотя частота наступления беременности была одинаковой в обеих группах, частота имплантации значительно различалась ( p ≤ 0,001) между пациентами, положительными на одну или несколько бактерий, и полностью отрицательными (12,4 против 14%). Более высокие показатели выкидышей, хотя и не статистически значимые, также были обнаружены у положительных пациенток по сравнению с отрицательными на наличие каких-либо бактерий (таблица). Микроорганизмы, идентифицированные в группе положительной культуры, были следующими: Lactobacillus видов у 19 пациентов (12,5%), Streptococcus видов у 43 пациентов (28,2%), Enterobacteriaceae у 99 пациентов (65,1%), Staphylococcus видов у 68 пациентов (45%) и другие микроорганизмы, такие как S. agalactiae , G.
Из 152 исследованных пациентов 133 (87,5%) дали положительный результат на один или несколько микроорганизмов, а остальные 19у пациентов (12,5%) тесты на бактериальное обсеменение полностью отрицательны. Хотя частота наступления беременности была одинаковой в обеих группах, частота имплантации значительно различалась ( p ≤ 0,001) между пациентами, положительными на одну или несколько бактерий, и полностью отрицательными (12,4 против 14%). Более высокие показатели выкидышей, хотя и не статистически значимые, также были обнаружены у положительных пациенток по сравнению с отрицательными на наличие каких-либо бактерий (таблица). Микроорганизмы, идентифицированные в группе положительной культуры, были следующими: Lactobacillus видов у 19 пациентов (12,5%), Streptococcus видов у 43 пациентов (28,2%), Enterobacteriaceae у 99 пациентов (65,1%), Staphylococcus видов у 68 пациентов (45%) и другие микроорганизмы, такие как S. agalactiae , G.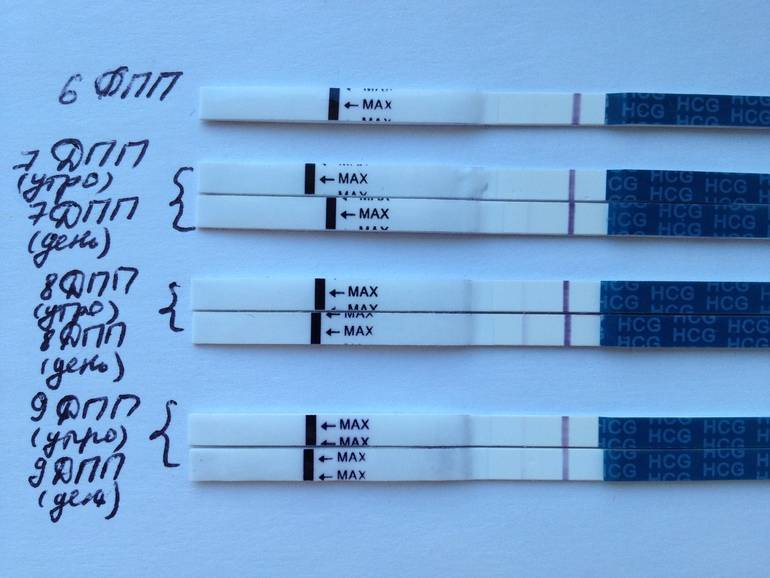 vaginalis , Ureaplasma urealyticun и дрожжи у 28 пациентов (18,3%). Среди наблюдаемых видов Entrobacteriaceae Escherichia coli был наиболее часто обнаруживаемым видом, за которым следуют 9 видов.0041 Клебсиелла и в меньшей степени Протей . Значительное число пациентов дали положительный результат на более чем один микроорганизм. Культуры всех образцов из культуральной среды для переноса эмбрионов до переноса эмбрионов были отрицательными в отношении любого микробного загрязнения. Как показано в таблице , пациенты (№ = 152) были распределены на основе одного типа выделенных бактерий. Сравнивая группы положительных и отрицательных культур для каждого изолированного микроорганизма с точки зрения клинической частоты наступления беременности, мы обнаружили, что частота наступления беременности у пациентов с положительным результатом теста на Entrobacteriaceae (22,2 против 51%) и видов Staphylococcus (17,6 против 44%) были значительно ниже, чем в группе с отрицательной культурой ( p ≤ 0,001).
vaginalis , Ureaplasma urealyticun и дрожжи у 28 пациентов (18,3%). Среди наблюдаемых видов Entrobacteriaceae Escherichia coli был наиболее часто обнаруживаемым видом, за которым следуют 9 видов.0041 Клебсиелла и в меньшей степени Протей . Значительное число пациентов дали положительный результат на более чем один микроорганизм. Культуры всех образцов из культуральной среды для переноса эмбрионов до переноса эмбрионов были отрицательными в отношении любого микробного загрязнения. Как показано в таблице , пациенты (№ = 152) были распределены на основе одного типа выделенных бактерий. Сравнивая группы положительных и отрицательных культур для каждого изолированного микроорганизма с точки зрения клинической частоты наступления беременности, мы обнаружили, что частота наступления беременности у пациентов с положительным результатом теста на Entrobacteriaceae (22,2 против 51%) и видов Staphylococcus (17,6 против 44%) были значительно ниже, чем в группе с отрицательной культурой ( p ≤ 0,001). Другие выделенные микроорганизмы, по-видимому, не влияли на частоту наступления беременности (рис. ).
Другие выделенные микроорганизмы, по-видимому, не влияли на частоту наступления беременности (рис. ).
Таблица 1
Глобальные данные групп культуры пациентов
| No. of patients | 133 | 19 | |
| Mean age ± SD | 34.7 ± 3.9 | 33.2 ± 5.6 | ns |
| Male factor (%) | 40 | 43.2 | ns |
| Tubal factor (%) | 44.7 | 41.3 | ns |
| Unexplained (%) | 3. 8 8 | 2.9 | ns |
| Other factors (%) | 11.5 | 12.6 | ns |
| No. of embryo transfer | 133 | 19 | |
| Mean number of embryos per patients ± SD | 2.9 ± 0.3 | 3 ± 0.0 | ns |
| Clinical pregnancies (%) | 41 (30.8) | 6 (31.6) | ns |
| Multiple pregnancies (%) | 7 (17) | 2 (16. 7) 7) | ns |
| Miscarriage rate (%) | 5 (12.2) | 0 (0) | ns |
| Implantation rate (%) a | 12.4 | 14.0 | ≤0.001 |
Открыть в отдельном окне
нс Незначительно
a Частота имплантации достоверно выше в пользу отрицательной группы
0003
| Изолированные микробные организмы | Количество положительных пациентов | Количество отрицательных пациентов | P | ||
|---|---|---|---|---|---|
(Not Berstant Berstant (Att.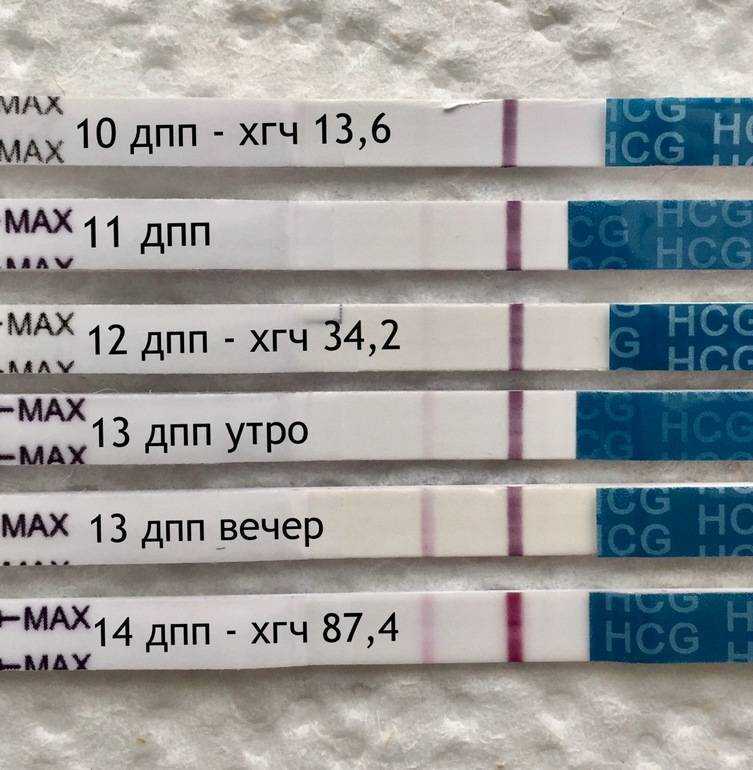 %) %) | (Not Berstant (%) (Not Berstant (%)) 9010 2 7) 9010 2 7). pregnant (%)|||||
| Lactobacillus | 3 (15.8) | 16 (84.2) | 46 (34.6) | 87 (65.4) | ns |
| Entrobacteriaceae | 22 (22,2) | 77 (77,8) | 27 (51) | 26 (49) | ≤0,001 |
| Staphylococcus 1 | 12 (17,6) | 56 (82,4) | 37 (44) | 47 (56) | ≤0,001 |
900. 4 Streptoccus 4 Streptoccus | 18 (41,8) | 25 (58,1) | 31 (28,4) | 78 (71,6) | нс |
| Прочие | 0144 12 (42.8) | 16 (57.2) | 37 (29.8) | 87 (70.2) | ns |
Open in a separate window
ns Not significant
a Other микроорганизмы включают: S agalactiae , G. vaginalis , микоплазмы и дрожжи
Открыто в отдельном окне
Корреляция между отдельными изолированными микроорганизмами и частотой наступления беременности лечения были опубликованы, данные о том, что бактериальная инфекция вредна для результатов экстракорпорального оплодотворения, неуклонно растут.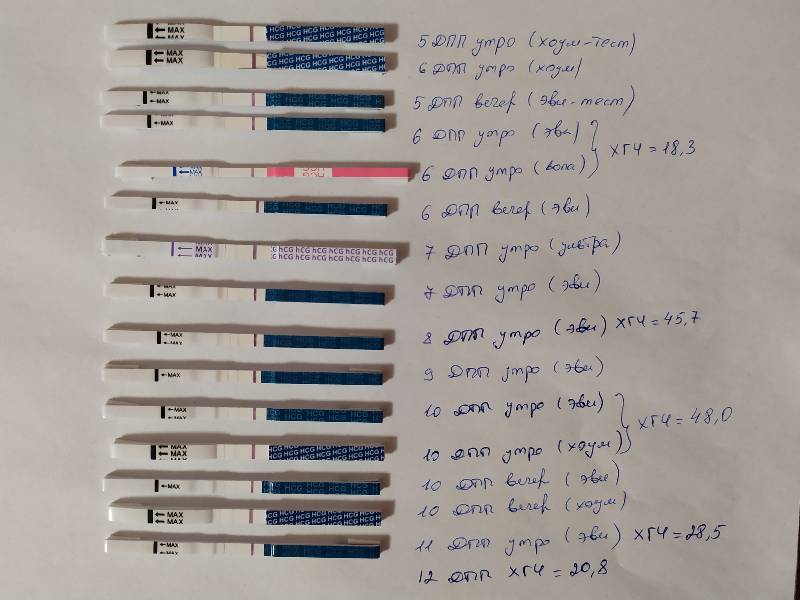 Сообщалось о снижении частоты живорождения у тех пациентов, у которых патогенные бактерии были выделены из катетера для переноса эмбрионов [6–9].].
Сообщалось о снижении частоты живорождения у тех пациентов, у которых патогенные бактерии были выделены из катетера для переноса эмбрионов [6–9].].
В нашем исследовании мы оценили возможные последствия бактериального загрязнения кончика катетера при переносе эмбрионов на исход лечения ЭКО. Микроорганизмы оценивали с помощью бактериологического анализа цервикального и вагинального мазка и кончика катетера до и после переноса эмбрионов. Хотя частота наступления беременности существенно не отличалась между положительными и отрицательными группами, при рассмотрении корреляции отдельных выделенных микроорганизмов наблюдались значительные различия в показателях наступления беременности. Снижение частоты наступления беременности наблюдалось у пациенток с положительным результатом на Entrobacteriaceae и видов Staphylococcus по сравнению с теми, у кого был отрицательный результат на те же микроорганизмы, в то время как другие изолированные микроорганизмы, по-видимому, не влияли на частоту наступления беременности.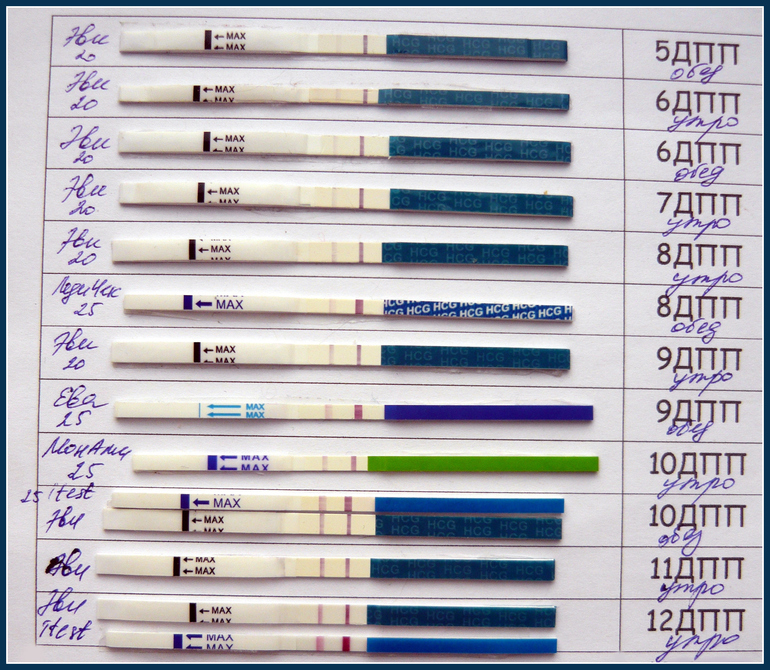 Поскольку характеристики пациентов, протокол стимуляции, эмбриология, а также количество и качество перенесенных эмбрионов существенно не различались между группами с положительным и отрицательным культивированием, мы можем предположить, что присутствие таких микроорганизмов на шейке матки при переносе эмбрионов может быть связано с снижение скорости имплантации эмбриона.
Поскольку характеристики пациентов, протокол стимуляции, эмбриология, а также количество и качество перенесенных эмбрионов существенно не различались между группами с положительным и отрицательным культивированием, мы можем предположить, что присутствие таких микроорганизмов на шейке матки при переносе эмбрионов может быть связано с снижение скорости имплантации эмбриона.
Более низкая частота наступления беременности среди пациенток с положительным посевом может быть объяснена как минимум тремя механизмами: (1) процедура переноса эмбрионов может инокулировать эндоцервикальные микроорганизмы в полость матки, тем самым изменяя биохимические [16, 17] или ультраструктурные [17, 18] характеристика эндометрия; (2) высокая концентрация микроорганизмов на шейке матки может быть связана с субклиническим хроническим эндометритом [19], который в последующем вызывает плохую рецептивность матки; (3) возможное прямое заражение эмбрионов во время трансцервикального переноса может препятствовать их имплантации. В предыдущем исследовании снижение частоты наступления беременности на 50 % произошло, когда бактерии были извлечены из кончика катетера для переноса эмбрионов [6–8, 20]. Интересен тот факт, что доминирующими изученными микроорганизмами были D. streptococcus , E. coli , S. viridians , Entrococcus , S. epidermidis и H 2 O 2 -продуцирующие лактобактерии.
В предыдущем исследовании снижение частоты наступления беременности на 50 % произошло, когда бактерии были извлечены из кончика катетера для переноса эмбрионов [6–8, 20]. Интересен тот факт, что доминирующими изученными микроорганизмами были D. streptococcus , E. coli , S. viridians , Entrococcus , S. epidermidis и H 2 O 2 -продуцирующие лактобактерии.
В нашем исследовании мы обнаружили, что наличие эндоцервикальных видов Entrobacteriaceae и стафилококков у женщин, проходящих ЭКО, явно связано как со снижением частоты наступления беременности, так и с увеличением частоты абортов. Это может подтверждать растущее количество данных о том, что присутствие некоторых патогенных микроорганизмов, обнаруживаемых при переносе эмбрионов, оказывает негативное влияние на клиническую частоту наступления беременности. Кроме того, важно помнить, что успех после экстракорпорального оплодотворения зависит от множества факторов. Наши результаты согласуются с предыдущими отчетами [6-9], которые предполагают, что наличие бактериальной контаминации при переносе эмбрионов может быть одним из факторов, влияющих на исход ЭКО.
Наши результаты согласуются с предыдущими отчетами [6-9], которые предполагают, что наличие бактериальной контаминации при переносе эмбрионов может быть одним из факторов, влияющих на исход ЭКО.
Однако лучшее понимание влияния цервиковагинальной флоры и контаминации катетера на исход ЭКО может позволить целенаправленно проводить конкретные вмешательства для снижения провоспалительного ответа цитокинов и установления нормальной бактериальной флоры влагалища. Что касается этого вопроса, представляется особенно важным, что клетки эндометрия экспрессируют Toll-подобный рецептор 4, молекулу, участвующую в грамотрицательном эндотоксине, и что E. coli , связываясь с этими клетками, продуцирует простагландины F и E 2 , тем самым модулируя воспалительную реакцию и эндокринные функции [21].
Недавно сообщалось, что цефтриаксон и метронидазол, вводимые при извлечении ооцитов в циклах ЭКО-переноса эмбрионов, могут снижать количество бактерий на катетере для переноса и, следовательно, улучшать частоту наступления беременности [7], в то время как введение доксициклина, по-видимому, не влияет ни на вагинальные бактериальной флоры или показателей живорождения [9]. Действительно, необходимы дальнейшие исследования, чтобы определить, какие конкретные антибиотики действительно могут уменьшить количество вирулентных бактерий и, что более важно, сохранить вагинальные защитные бактерии. Наконец, доказательства воспаления после переноса эмбрионов должны быть задокументированы в большей выборке пациентов для дальнейшего изучения гипотезы о том, что воспаление может быть механизмом, посредством которого бактерии могут негативно влиять на беременность.
Действительно, необходимы дальнейшие исследования, чтобы определить, какие конкретные антибиотики действительно могут уменьшить количество вирулентных бактерий и, что более важно, сохранить вагинальные защитные бактерии. Наконец, доказательства воспаления после переноса эмбрионов должны быть задокументированы в большей выборке пациентов для дальнейшего изучения гипотезы о том, что воспаление может быть механизмом, посредством которого бактерии могут негативно влиять на беременность.
Наличие вагинально-цервикального микробного обсеменения, выявленное при переносе эмбрионов, отрицательно влияет на исход лечения экстракорпоральным оплодотворением
1. Roseboom TJ, Vermeiden JPW, Schoute E, Lens JW, Schats R. Вероятность беременности после переноса эмбрионов зависит от возраста пациентки, причины бесплодия, количества перенесенных эмбрионов и среднего балла по морфологии, что было выявлено с помощью множественного логистического регрессионного анализа. Хум Репрод. 1995; 10:3035–3041. [PubMed] [Академия Google]
[PubMed] [Академия Google]
2. Munne S, Alikani M, Tomkin G, Grifo J, Cohen J. Морфология эмбриона, скорость развития и возраст матери коррелируют с хромосомными аномалиями. Фертил Стерил. 1995; 64: 382–391. [PubMed] [Google Scholar]
3. Karande VC, Morris R, Chapman C, Rinehart J, Gleicher N. Влияние «врача-фактора» на показатели беременности в крупной программе вспомогательных репродуктивных технологий: слишком много поваров портят бульон? Фертил Стерил. 1999;71:1001–1009. дои: 10.1016/S0015-0282(99)00139-9. [PubMed] [CrossRef] [Google Scholar]
4. Hearns-Stokes RM, Miller BT, Scott L, Creuss D, Chakraborty PK, Segars JH. Частота наступления беременности после переноса эмбрионов зависит от поставщика услуг по переносу эмбрионов. Фертил Стерил. 2000;74:80–86. doi: 10.1016/S0015-0282(00)00582-3. [PubMed] [CrossRef] [Google Scholar]
5. Анджелини А., Бруско Г.Ф., Барнокки Н., Эль-Данасури И., Паккиаротти А., Селман Х. Влияние врача, выполняющего перенос эмбрионов, на частоту наступления беременности в программе вспомогательных репродуктивных технологий. J Assist Reprod Genet. 2006;23:329–332. doi: 10.1007/s10815-006-9032-6. [PubMed] [CrossRef] [Google Scholar]
J Assist Reprod Genet. 2006;23:329–332. doi: 10.1007/s10815-006-9032-6. [PubMed] [CrossRef] [Google Scholar]
6. Egbase PE, Al-Sharhan M, Al-Othman S, Al-Mutawa M, Udo EE, Grudzinskas JG. Частота микробного роста на кончике катетера для переноса эмбрионов после переноса эмбрионов в зависимости от клинической частоты наступления беременности после экстракорпорального оплодотворения и переноса эмбрионов. Хум Репрод. 1996; 11: 1687–1689. [PubMed] [Google Scholar]
7. Egbase PE, Udo EE, Al-Sharhan M, et al. Профилактическая антибиотикотерапия и эндоцервикальная микробная инокуляция эндометрия при переносе эмбрионов (письмо) Ланцет. 1999;354:651–652. doi: 10.1016/S0140-6736(99)02415-0. [PubMed] [CrossRef] [Google Scholar]
8. Fanchin R, Harmas A, Benaoudia F, Lundkvist U, Olivennes F, Frydman R. Микробная флора шейки матки, оцениваемая во время переноса эмбрионов, неблагоприятно влияет на исход экстракорпорального оплодотворения. . Фертил Стерил. 1998; 70: 866–870. doi: 10.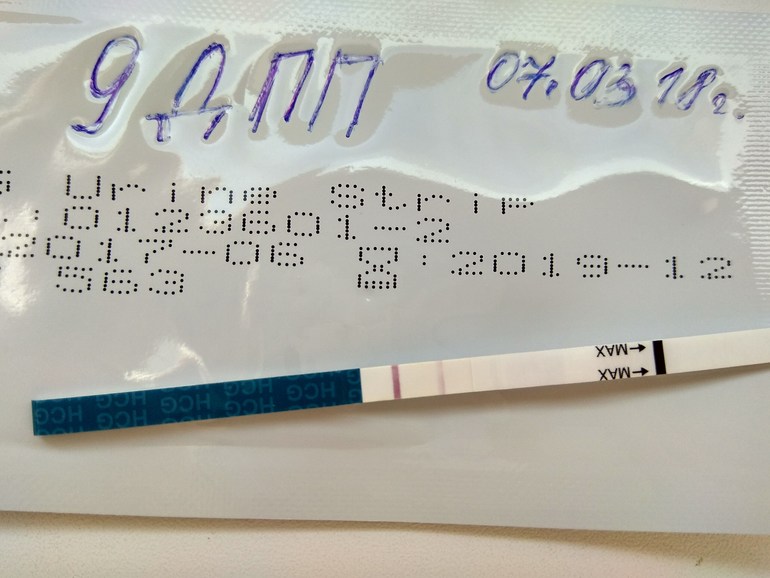 1016/S0015-0282(98)00277-5. [PubMed] [CrossRef] [Google Scholar]
1016/S0015-0282(98)00277-5. [PubMed] [CrossRef] [Google Scholar]
9. Moore DE, Soules MR, Klein NA, Fujimoto VY, Agnew KJ, Eschenobach DA. Бактерии на кончике катетера для переноса влияют на уровень живорождения после экстракорпорального оплодотворения. Фертил Стерил. 2000;74:1118–1124. doi: 10.1016/S0015-0282(00)01624-1. [PubMed] [CrossRef] [Академия Google]
10. Вестром Л. Влияние острых воспалительных заболеваний органов малого таза на фертильность. Am J Obstet Gynecol. 1975; 121: 707–713. [PubMed] [Google Scholar]
11. Faro S. Chlamydia trachomatis : инфекция женского таза. Am J Obstet Gynecol. 1991; 164: 1767–1770. [PubMed] [Google Scholar]
12. Виткин С.С., Султан К.М., Нил Г.С., Джеремиас Дж., Грифо Дж.А., Розенвакс З. Неожиданная инфекция Chlamydia trachomatis и результаты экстракорпорального оплодотворения. Am J Obstet Gynecol. 1994;171:1208–1214. [PubMed] [Google Scholar]
13. Witkin SS, Kligman II, Grifo JA, Rosenwaks Z. Chlamydia trachomatis , обнаруженная с помощью полимеразной цепной реакции в шейке матки женщин с отрицательным посевом, коррелирует с неблагоприятным исходом экстракорпорального оплодотворения. J заразить дис. 1995; 17: 1657–1659. [PubMed] [Google Scholar]
Chlamydia trachomatis , обнаруженная с помощью полимеразной цепной реакции в шейке матки женщин с отрицательным посевом, коррелирует с неблагоприятным исходом экстракорпорального оплодотворения. J заразить дис. 1995; 17: 1657–1659. [PubMed] [Google Scholar]
14. Ральф С.Г., Резерфорд А.Дж., Уилсон Д.Д. Влияние бактериального вагиноза на зачатие и невынашивание беременности в первом триместре: когортное исследование. БМЖ. 1999;319: 220–223. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. Ливерседж Н.Х., Тернер А., Хорнер П.Дж., Кей С.Д., Дженкинс Дж.М., Халл М.Г. Влияние бактериального вагиноза на экстракорпоральное оплодотворение и имплантацию эмбрионов при лечении с помощью вспомогательных репродуктивных технологий. Хум Репрод. 1999; 14:2411–2415. doi: 10.1093/humrep/14.9.2411. [PubMed] [CrossRef] [Google Scholar]
16. Татбибзаде С., Бабакня А. Сигналы и молекулярный путь, участвующие в имплантации: симбиотическое взаимодействие между бластоцистой и эндометрием, включающее адгезию и тканевую инвазию. Хум Репрод. 1995;10:1579–1602. [PubMed] [Google Scholar]
Хум Репрод. 1995;10:1579–1602. [PubMed] [Google Scholar]
17. Полсон Р.Дж., Зауэр М.В., Лобо Р.А. Факторы, влияющие на имплантацию эмбриона после экстракорпорального оплодотворения человека: гипотеза. Am J Obstet Gynecol. 1990;163:2020–2023. [PubMed] [Google Scholar]
18. Навот Д., Андерсон Т.Л., Дросек К., Скотт Р.Т., Крайнер Д., Розенвакс З. Гормональная манипуляция созревания эндометрия. J Clin Endocrinol Metab. 1989; 68: 801–807. doi: 10.1210/jcem-68-4-801. [PubMed] [CrossRef] [Академия Google]
19. Чернобыльский Б. Эндометрит и бесплодие. Фертил Стерил. 1978; 30: 119–130. [PubMed] [Google Scholar]
20. Hillier SL, Krohn MA, Rabe LK, Klebanoff SJ, Eschenbach DA. Нормальная вагинальная флора, лактобациллы, продуцирующие h3O2, и бактериальный вагиноз у беременных. Клин Инфекция Дис. 1993; 16 (Приложение 4): S273–S281. [PubMed] [Google Scholar]
21. Herath S, Fischer DP, Werling D, Williams EJ, Lilly ST, Dobson H, et al. Экспрессия и функция Toll-подобного рецептора 4 в клетках эндометрия матки.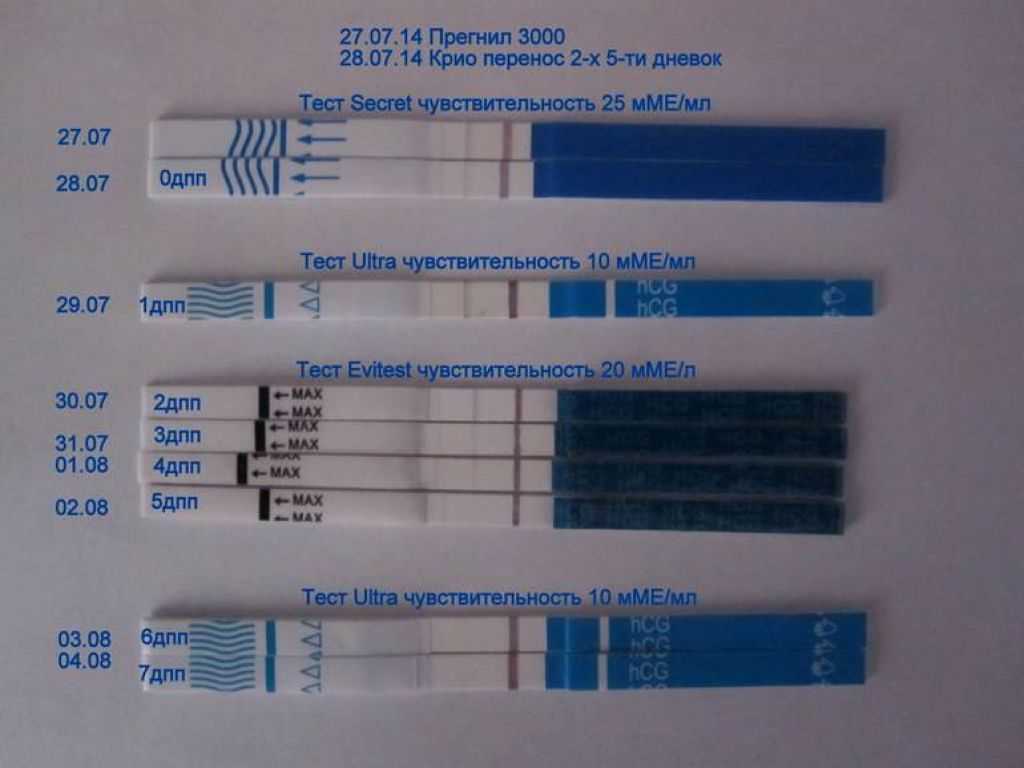 Эндокринология. 2006; 147: 562–570. doi: 10.1210/en.2005-1113. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Эндокринология. 2006; 147: 562–570. doi: 10.1210/en.2005-1113. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Влияние прошлой инфекции COVID-19 на частоту наступления беременности в циклах переноса замороженных эмбрионов
Резюме
Цель
Изучить влияние инфекции SARS-CoV-2 на частоту наступления беременности в циклах переноса замороженных эмбрионов (FET).
Методы
Ретроспективное когортное исследование, включающее женщин в возрасте до 42 лет с документально подтвержденной инфекцией SARS-CoV-2 в течение 1 года до лечения, проходящих циклы FET в первой половине 2021 г., с переносом эмбрионов, созданных до инфекционное заболевание. Контролем были женщины без диагноза SARS-CoV-2, не вакцинированные, совпадающие по возрасту, количеству и дню переноса эмбрионов. Были сопоставлены демографические и циклические характеристики и результаты.
Результаты
Были включены 41 выздоровевшая женщина и 41 контрольная женщина.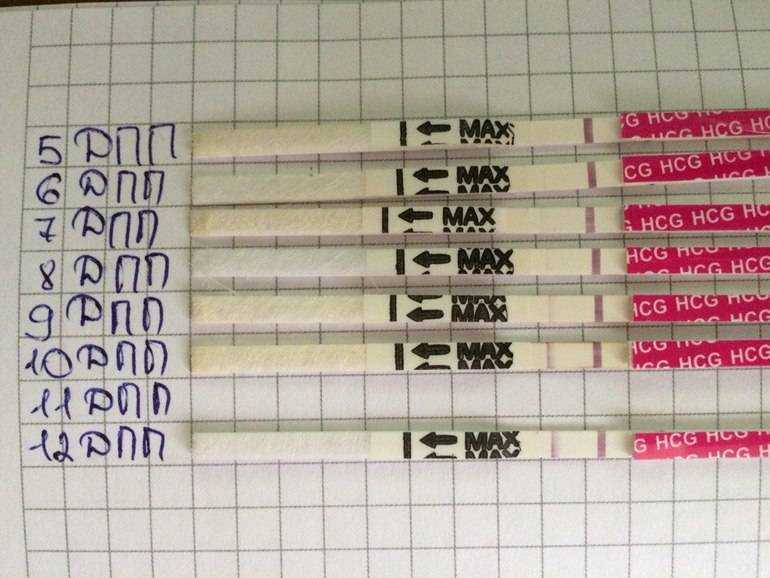 Частота наступления беременности составила 29% и 49% соответственно ( p = 0,070). Стратификация по времени от заражения SARS-CoV-2 до передачи в ≤ 60 и > 60 дней выявила разницу в частоте наступления беременности, при этом у женщин в группе COVID частота наступления беременности была ниже, если они были инфицированы в непосредственной близости от переноса (21% против 55% ; p = 0,006). В модели логистической регрессии инфекция была значимой переменной (9).0501 p = 0,05, ОШ 0,325, 95% ДИ 0,106–0,998). Логистическая регрессия, примененная к подгруппе женщин, инфицированных непосредственно перед переводом, еще больше усилила одномерные результаты, при этом COVID-19 остался значимым параметром ( p = 0,005, ОШ 0,072, 95% ДИ 0,012–0,450).
Частота наступления беременности составила 29% и 49% соответственно ( p = 0,070). Стратификация по времени от заражения SARS-CoV-2 до передачи в ≤ 60 и > 60 дней выявила разницу в частоте наступления беременности, при этом у женщин в группе COVID частота наступления беременности была ниже, если они были инфицированы в непосредственной близости от переноса (21% против 55% ; p = 0,006). В модели логистической регрессии инфекция была значимой переменной (9).0501 p = 0,05, ОШ 0,325, 95% ДИ 0,106–0,998). Логистическая регрессия, примененная к подгруппе женщин, инфицированных непосредственно перед переводом, еще больше усилила одномерные результаты, при этом COVID-19 остался значимым параметром ( p = 0,005, ОШ 0,072, 95% ДИ 0,012–0,450).
Выводы
В циклах FET у пациентов с перенесенной инфекцией SARS-CoV-2, у которых ооциты были извлечены до заражения, наблюдалось снижение частоты наступления беременности, особенно у пациентов, выздоровевших менее чем за 60 дней до переноса эмбрионов. В ожидании дальнейших исследований, в случаях циклов FET с ограниченным количеством эмбрионов, отсрочка переноса эмбрионов не менее чем на 60 дней после выздоровления от COVID-19.можно рассмотреть, когда это возможно.
В ожидании дальнейших исследований, в случаях циклов FET с ограниченным количеством эмбрионов, отсрочка переноса эмбрионов не менее чем на 60 дней после выздоровления от COVID-19.можно рассмотреть, когда это возможно.
Введение
Тяжелый острый респираторный синдром коронавирус-2 (SARS-CoV-2), причина коронавирусной болезни 19 (COVID-19), проникает в клетки-хозяева через клеточный рецептор, ангиотензинпревращающий фермент 2 (ACE2), и клеточная протеаза, трансмембранная протеаза серин-2 (TMPRSS2) [1]. Это привело к опасениям, что органы с высокой экспрессией ACE2 или TMPRSS2 уязвимы к неблагоприятным последствиям в результате инфекции [2]. Большинство исследований, посвященных влиянию COVID-19пандемия на фертильность человека сосредоточилась на мужском компоненте, учитывая обилие рецепторов ACE2 и TMPRSS2 в ткани яичка [3,4,5,6,7,8].
Несмотря на наличие ACE2 и TMPRSS2 в женских репродуктивных органах, влияние инфекции COVID-19 на женскую фертильность изучено ограниченно. Существование оси ACE2 и маркеров ACE2 было подтверждено на всех стадиях созревания фолликулов в яичнике человека и в гранулезных клетках, а также в фолликулярной жидкости [9].,10,11,12], потенциально позволяя SARS-CoV-2 вмешиваться в фолликулогенез и развитие эмбриона.
Существование оси ACE2 и маркеров ACE2 было подтверждено на всех стадиях созревания фолликулов в яичнике человека и в гранулезных клетках, а также в фолликулярной жидкости [9].,10,11,12], потенциально позволяя SARS-CoV-2 вмешиваться в фолликулогенез и развитие эмбриона.
Имплантация — еще один важный этап, на который потенциально может повлиять инфекция SARS-CoV-2. ACE2 и TMPRSS2 экспрессируются в эндометрии [13, 14], что потенциально способствует вирусной инвазии клеток. В отличие от бактериальных инфекций, влияние вирусных инфекций на частоту имплантации и беременность неясно. Некоторые данные свидетельствуют о том, что ранняя эмбриональная и трофобластическая инфекция, даже вызванная обычными вирусами с низким патогенным потенциалом, может привести к нарушению имплантации или плацентации. Это объясняется индукцией антитрофобластного клеточного иммунного ответа с последующим апоптозом, снижением инвазии трофобласта и ремоделированием децидуальной оболочки и маточных артериальных сосудов, а также остановкой раннего эмбрионального развития [15]. Другим механизмом, который может повлиять на имплантацию, являются транзиторные изменения уровня половых гормонов у женщин, недавно перенесших инфекцию SARS-CoV-2, что проявляется изменением менструального цикла [16].
Другим механизмом, который может повлиять на имплантацию, являются транзиторные изменения уровня половых гормонов у женщин, недавно перенесших инфекцию SARS-CoV-2, что проявляется изменением менструального цикла [16].
Целью нашего исследования было выяснить влияние инфекции SARS-CoV-2 на частоту наступления беременности в циклах переноса замороженных эмбрионов (FET) с упором на этап имплантации.
Материалы и методы
Это ретроспективное когортное исследование, включающее всех женщин, инфицированных SARS-CoV-2, в возрасте 20–42 лет, которые прошли циклы FET в период с 1 января по 31 июня 2021 г. в крупном отделении ЭКО. в Израиле (группа COVID). Статус COVID-19 был основан на результатах теста полимеразной цепной реакции. Перенесенные эмбрионы были результатом извлечения ооцитов, проведенного до заражения SARS-CoV-2. Для включения в исследование максимальное время от заражения SARS-CoV-2 до передачи было определено как 1 год. Был включен только первый цикл FET после выздоровления, чтобы избежать включения повторных переводов на одного пациента. Исследование было одобрено Институциональным наблюдательным советом.
Исследование было одобрено Институциональным наблюдательным советом.
Исследуемая группа была сопоставима по возрасту, количеству перенесенных эмбрионов и дате переноса с невакцинированными пациентами без истории прошлой инфекции, которые прошли лечение ЭКО с помощью FET в тот же период (контрольная группа). Протоколы подготовки эндометрия были индивидуально подобраны лечащей командой и включали естественные циклы и циклы заместительной гормональной терапии в соответствии с обычной процедурой учреждения. Пересадку эмбрионов осуществляли высококвалифицированные врачи старшего звена. Демографические характеристики (включая возраст при переносе и извлечении, возраст партнера, статус курения, количество предыдущих беременностей и родов, количество процедур ЭКО и причину бесплодия), а также характеристики цикла (протокол лечения, уровень эмбриона и ширина эндометрия) и исходный регистрировали поисковые характеристики (количество ооцитов и количество эмбрионов хорошего качества). Первичным исходом была клиническая частота наступления беременности, определяемая по внутриутробному гестационному мешку и сердечной деятельности плода при трансвагинальном ультразвуковом исследовании. Оценка эмбрионов была основана на параметрах Стамбульского консенсусного семинара [17].
Оценка эмбрионов была основана на параметрах Стамбульского консенсусного семинара [17].
Анализ данных
Критерий Шапиро-Уилка использовался для проверки нормальности распределения. Непрерывные переменные суммировались со средним значением и 95% доверительным интервалом (ДИ) и сравнивались между группами с использованием теста Манна-Уитни. Категориальные переменные суммировались с использованием подсчетов и процентов. Для сравнения различий между группами использовали точный критерий Фишера или хи-квадрат. Модель логистической регрессии была применена для выявления факторов, связанных с клинической частотой наступления беременности в замороженных циклах. Для выбора оптимальной модели было применено обратное исключение, а возраст и группа COVID были принудительно включены в модель. Вменение отсутствующих данных не применялось. Двусторонний p ≤ 0,05 считалось значимым. Все анализы проводились на пакете R версии 3.6.3 и SPSS-27 (IBM, США).
Результаты
Были включены сорок одна женщина с инфекцией SARS-CoV-2 в прошлом и 41 контрольная группа (таблица 1). Среднее время от заражения до переноса эмбрионов составило 59 ± 68,31 дня. Средний возраст при взятии яйцеклетки (30,72 против 30,69; p = 0,929) и при переносе (31,56 против 31,58; p = 0,966) был одинаковым между группами, как и все другие демографические характеристики. Количество предыдущих извлечений и переводов было одинаковым между группами. Используемый преобладающий протокол передачи отличался между группами с более высокими показателями протокола естественного цикла (NC) в группе COVID (61% против 33%; 9).0501 p = 0,013), тогда как в контрольной группе чаще применялся протокол заместительной гормональной терапии (ЗГТ). Все другие характеристики цикла, включая ширину эндометрия, количество перенесенных эмбрионов, день переноса эмбрионов и степень эмбриона, были одинаковыми между группами. Точно так же не было различий между группами по количеству извлеченных ооцитов и количеству витрифицированных эмбрионов цикла, из которого произошли перенесенные эмбрионы, и количеству пациенток, у которых был свежий перенос при этом извлечении.
Среднее время от заражения до переноса эмбрионов составило 59 ± 68,31 дня. Средний возраст при взятии яйцеклетки (30,72 против 30,69; p = 0,929) и при переносе (31,56 против 31,58; p = 0,966) был одинаковым между группами, как и все другие демографические характеристики. Количество предыдущих извлечений и переводов было одинаковым между группами. Используемый преобладающий протокол передачи отличался между группами с более высокими показателями протокола естественного цикла (NC) в группе COVID (61% против 33%; 9).0501 p = 0,013), тогда как в контрольной группе чаще применялся протокол заместительной гормональной терапии (ЗГТ). Все другие характеристики цикла, включая ширину эндометрия, количество перенесенных эмбрионов, день переноса эмбрионов и степень эмбриона, были одинаковыми между группами. Точно так же не было различий между группами по количеству извлеченных ооцитов и количеству витрифицированных эмбрионов цикла, из которого произошли перенесенные эмбрионы, и количеству пациенток, у которых был свежий перенос при этом извлечении. Хотя частота клинической беременности была ниже в группе с COVID, эта разница не достигала статистической значимости (29).% против 49%; p = 0,070). Поскольку у большинства пациентов был перенос одного эмбриона, частота имплантации была относительно сходна с частотой наступления беременности и не отличалась между группами (27% против 43%, p = 0,093). На момент сбора данных одна беременность в каждой группе закончилась замершей беременностью, а остальные были зарегистрированы как продолжающаяся беременность.
Хотя частота клинической беременности была ниже в группе с COVID, эта разница не достигала статистической значимости (29).% против 49%; p = 0,070). Поскольку у большинства пациентов был перенос одного эмбриона, частота имплантации была относительно сходна с частотой наступления беременности и не отличалась между группами (27% против 43%, p = 0,093). На момент сбора данных одна беременность в каждой группе закончилась замершей беременностью, а остальные были зарегистрированы как продолжающаяся беременность.
Полноразмерная таблица
Стратификация группы COVID по времени от заражения SARS-CoV-2 до переноса эмбриона на ≤ 60 дней и > 60 дней (таблица 2) выявила значительную разницу в частоте наступления беременности: женщины в группе COVID имели более низкие показатели беременности, если были инфицированы в близость (≤ 60 дней) к переводу по сравнению со здоровыми женщинами (20,7% против 55,2%; p = 0,006).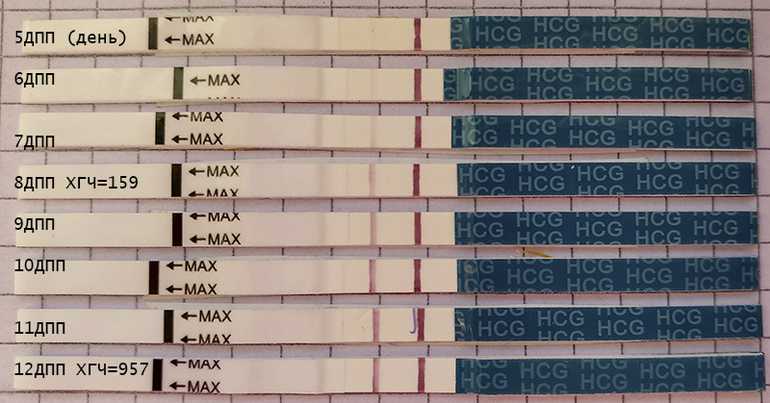 Не было никаких различий в демографических характеристиках и характеристиках цикла между группами, за исключением протокола подготовки эндометрия, при этом NC был более распространенным в группе COVID (69).% против 37%; p = 0,016) (дополнительная таблица 1). В подгруппе пациентов с переносом эмбрионов > 60 дней после заражения не наблюдалось различий в демографических характеристиках и характеристиках цикла, а также в частоте наступления беременности, хотя размер выборки был небольшим.
Не было никаких различий в демографических характеристиках и характеристиках цикла между группами, за исключением протокола подготовки эндометрия, при этом NC был более распространенным в группе COVID (69).% против 37%; p = 0,016) (дополнительная таблица 1). В подгруппе пациентов с переносом эмбрионов > 60 дней после заражения не наблюдалось различий в демографических характеристиках и характеристиках цикла, а также в частоте наступления беременности, хотя размер выборки был небольшим.
 , 95% ДИ 2,22–83,33), вместе с возрастом в OPU. Группа пациентов с инфекцией SARS-CoV-2 > 60 дней до перевода была слишком мала для отдельной модели анализа. Чтобы подтвердить результаты, мы дополнительно применили ту же модель для пациентов, перенесших перенос эмбрионов, с отсечкой 30 дней от инфекции SARS-CoV-2 (дополнительная таблица 2). Перенесенная инфекция SARS-CoV-2 в течение 30 дней или менее после переноса эмбрионов значительно снижала вероятность клинической беременности (9).0501 p = 0,003, ОШ 21,461, 95% ДИ 2,78–165,46). В группе пациентов с переносом эмбриона более чем через 30 дней после заражения SARS-CoV-2 инфекция не оказала существенного влияния на вероятность клинической беременности. Поскольку размер выборки в обеих группах (≤ 30, > 30) был небольшим, доверительный интервал был широким, что влияло на стабильность модели.
, 95% ДИ 2,22–83,33), вместе с возрастом в OPU. Группа пациентов с инфекцией SARS-CoV-2 > 60 дней до перевода была слишком мала для отдельной модели анализа. Чтобы подтвердить результаты, мы дополнительно применили ту же модель для пациентов, перенесших перенос эмбрионов, с отсечкой 30 дней от инфекции SARS-CoV-2 (дополнительная таблица 2). Перенесенная инфекция SARS-CoV-2 в течение 30 дней или менее после переноса эмбрионов значительно снижала вероятность клинической беременности (9).0501 p = 0,003, ОШ 21,461, 95% ДИ 2,78–165,46). В группе пациентов с переносом эмбриона более чем через 30 дней после заражения SARS-CoV-2 инфекция не оказала существенного влияния на вероятность клинической беременности. Поскольку размер выборки в обеих группах (≤ 30, > 30) был небольшим, доверительный интервал был широким, что влияло на стабильность модели. При одномерном анализе наблюдалась разница в типе протокола между группами, получавшими COVID, и контрольной группой. В моделях не было обнаружено, что это значимая переменная. Чтобы еще больше исключить возможный эффект смешения, мы проанализировали подгруппу из 44 пациентов, по 22 в каждой группе, которые также соответствовали протоколу в дополнение к возрасту, количеству эмбрионов и дню переноса. Однофакторный анализ не выявил различий в частоте наступления беременности в группе COVID (36,4%) по сравнению с контрольной группой (54,5%) (9).0501 p = 0,225), как и для исходной группы, но опять же при стратификации по времени от заражения SARS-CoV-2 показатели беременности были значительно выше для подгруппы с переносом < 30 дней от заражения ( p = 0,012) но не для подгруппы > 30 дней ( p = 0,699). Модель регрессии, примененная для этой подгруппы пациентов со стратификацией по времени от заражения, соответствовала модели, примененной для всей группы, идентифицируя COVID как значимую переменную (9).0501 p = 0,026, ОШ = 23, 95% ДИ 1,44–326,23), хотя размер выборки был небольшим, что делало модель менее стабильной (дополнительная таблица 3).
Чтобы еще больше исключить возможный эффект смешения, мы проанализировали подгруппу из 44 пациентов, по 22 в каждой группе, которые также соответствовали протоколу в дополнение к возрасту, количеству эмбрионов и дню переноса. Однофакторный анализ не выявил различий в частоте наступления беременности в группе COVID (36,4%) по сравнению с контрольной группой (54,5%) (9).0501 p = 0,225), как и для исходной группы, но опять же при стратификации по времени от заражения SARS-CoV-2 показатели беременности были значительно выше для подгруппы с переносом < 30 дней от заражения ( p = 0,012) но не для подгруппы > 30 дней ( p = 0,699). Модель регрессии, примененная для этой подгруппы пациентов со стратификацией по времени от заражения, соответствовала модели, примененной для всей группы, идентифицируя COVID как значимую переменную (9).0501 p = 0,026, ОШ = 23, 95% ДИ 1,44–326,23), хотя размер выборки был небольшим, что делало модель менее стабильной (дополнительная таблица 3).
Обсуждение
Целью нашего исследования было изучить влияние на имплантацию путем анализа частоты клинических и продолжающихся беременностей в циклах FET у женщин, инфицированных SARS-CoV-2 в прошлом, с эмбрионами, полученными в результате лечения до COVID. В этом ретроспективном когортном исследовании перенесенная инфекция SARS-CoV-2 до переноса замороженных эмбрионов снизила частоту наступления беременности, особенно у женщин с недавней инфекцией. Это исследование является первым, в котором сообщается о продолжающихся беременностях в циклах FET у женщин, инфицированных SARS-CoV-2 в прошлом.
В недавно опубликованном исследовании изучалось влияние иммунитета к COVID-19 на результаты цикла FET, включая как выздоровевших, так и вакцинированных пациентов. Группу выздоровевших составили 44 пациентки, у которых не было различий в частоте наступления клинической беременности по сравнению с вакцинированной и контрольной группой [18]. Исследование включало несколько циклов FET у одних и тех же пациентов и не делало различий между эмбрионами, которые были созданы до и после инфекции, что, возможно, ограничивало силу его выводов. Кроме того, не было стратификации по времени от COVID-19.инфекционное заболевание; таким образом, непосредственные последствия инфекции для показателей беременности не могли быть должным образом оценены.
Кроме того, не было стратификации по времени от COVID-19.инфекционное заболевание; таким образом, непосредственные последствия инфекции для показателей беременности не могли быть должным образом оценены.
SARS-CoV2 проникает в клетки через клеточный рецептор ACE2 и клеточную протеазу TMPRSS2, экспрессирующуюся на всех стадиях созревания фолликулов в яичнике человека, в гранулезных клетках и в эндометрии [9,10,11,12]. Чтобы нейтрализовать любое потенциальное вирусное воздействие на фолликулогенез и развитие эмбриона, а также изолировать стадию имплантации в процессе ЭКО, мы сосредоточились на циклах FET с извлечением до заражения SARS-CoV-2. Мы обнаружили значительное снижение частоты наступления беременности, особенно когда перенос осуществлялся в непосредственной близости от инфекции SARS-CoV-2. Эти результаты могут быть связаны с несколькими потенциальными причинами. Во-первых, менструальные изменения после COVID-19сообщалось, возможно, из-за временных изменений уровня половых гормонов [16]. Это может объяснить краткосрочное влияние на частоту имплантации и беременности, которое в основном связано с острой инфекцией. Во-вторых, как и другие острые вирусные инфекции, SARS-CoV-2 может нарушать имплантацию или плацентацию посредством ранней эмбриональной и трофобластической инфекции [15]. Этот механизм можно сравнить с воспалительным орхитом, вызванным SARS-CoV-2, который может привести к временному снижению функции яичек [6, 19].]. Доказательства трофобластической инфекции получены в исследованиях, сообщающих об увеличении внутриутробной гибели плода у пациенток, заразившихся COVID-19 во время беременности, что позволяет предположить, что отличительной чертой плацентарной инфекции SARS-CoV-2 является трофобластическое повреждение [20, 21].
Это может объяснить краткосрочное влияние на частоту имплантации и беременности, которое в основном связано с острой инфекцией. Во-вторых, как и другие острые вирусные инфекции, SARS-CoV-2 может нарушать имплантацию или плацентацию посредством ранней эмбриональной и трофобластической инфекции [15]. Этот механизм можно сравнить с воспалительным орхитом, вызванным SARS-CoV-2, который может привести к временному снижению функции яичек [6, 19].]. Доказательства трофобластической инфекции получены в исследованиях, сообщающих об увеличении внутриутробной гибели плода у пациенток, заразившихся COVID-19 во время беременности, что позволяет предположить, что отличительной чертой плацентарной инфекции SARS-CoV-2 является трофобластическое повреждение [20, 21].
Основным ограничением нашего исследования является его ретроспективный характер с присущими систематическими ошибками при сборе данных, которые не генерировались единообразным образом в соответствии с протоколом исследования. Еще одним предостережением является ограниченный размер выборки из-за строгих критериев включения, включающих только пациентов с извлечением до заражения COVID и только первого цикла FET. Наконец, распределение протокола цикла (естественный против ЗГТ) различалось между группами, даже несмотря на то, что возраст и диагноз бесплодия, который может быть связан с выбором метода подготовки эндометрия, были одинаковыми между группами. Однако тип протокола не был значимым фактором в многомерной регрессионной модели частоты наступления беременности в циклах FET, даже при применении ее к подгруппе пациенток, соответствующих протоколу, в дополнение к другим критериям соответствия. Кроме того, согласно литературным данным, частота наступления беременности одинакова для разных протоколов [22].
Наконец, распределение протокола цикла (естественный против ЗГТ) различалось между группами, даже несмотря на то, что возраст и диагноз бесплодия, который может быть связан с выбором метода подготовки эндометрия, были одинаковыми между группами. Однако тип протокола не был значимым фактором в многомерной регрессионной модели частоты наступления беременности в циклах FET, даже при применении ее к подгруппе пациенток, соответствующих протоколу, в дополнение к другим критериям соответствия. Кроме того, согласно литературным данным, частота наступления беременности одинакова для разных протоколов [22].
В заключение, в циклах FET, проведенных у женщин с инфекцией SARS-CoV-2 в прошлом, у которых ооциты были извлечены до заражения, наблюдалось снижение частоты наступления беременности, особенно у пациенток, выздоровевших менее чем за 60 дней до переноса эмбрионов. Для подтверждения этих выводов необходимы дальнейшие исследования с более крупными группами. В ожидании дополнительной информации в случаях циклов FET с ограниченным количеством эмбрионов (преклонный возраст, донорство эмбрионов, сохранение фертильности, эмбрионы после извлечения спермы) отсрочка переноса эмбрионов на 30–60 дней после выздоровления от COVID-19. можно рассмотреть, если это возможно.
можно рассмотреть, если это возможно.
Ссылки
Лукассен С., Чуа Р.Л., Трефцер Т., Кан Н.С., Шнайдер М.А., Мули Т., Винтер Х., Мейстер М., Вейт С., Бутс А.В., Хенниг Б.П., Кройтер М., Конрад С., Эйлс Р. ТОРС Рецептор -CoV-2 ACE2 и TMPRSS2 в основном экспрессируются в транзиторных секреторных клетках бронхов. EMBO J. 2020;39(10):e105114.
Zou X, Chen K, Zou J, Han P, Hao J, Han Z. Анализ данных одноклеточной РНК-секвенции по экспрессии рецептора ACE2 показывает потенциальный риск уязвимости различных органов человека к 2019 году.-nCoV инфекция. Фронт Мед [Интернет]. 2020 [цитировано 16 октября 2021 г.]; 14: 185–92. https://doi.org/10.1007/s11684-020-0754-0.
Го Л., Чжао С., Ли В., Ван Ю., Ли Л., Цзян С. и др. Отсутствие SARS-CoV-2 в сперме когорты пациентов с COVID-19. Андрология. 2021; 9: 42–7 (Blackwell Publishing Ltd).
Артикул КАС Google Scholar
«>Gacci M, Coppi M, Baldi E, Sebastianelli A, Zaccaro C, Morselli S et al. Повреждение спермы и появление вируса SARS-CoV-2 в сперме после выздоровления от COVID-19. Hum Reprod [Интернет]. Оксфордский академический; 2021 [цитировано 16 октября 2021 г.]; 36: 1520–9. Доступно по адресу: https://academic.oup.com/humrep/article/36/6/1520/6125160.
Тур-Каспа I, Тур-Каспа Т, Хильдебранд Г., Коэн Д. COVID-19 может влиять на мужскую фертильность, но не передается половым путем: систематический обзор. F&S Rev Elsevier. 2021; 2: 140–9.
Артикул Google Scholar
Анифандис Г., Мессини К.И., Дапонте А., Мессини И.Е. COVID-19 и фертильность: виртуальная реальность.
 Reprod Biomed Online [Интернет]. 2020; 41: 157–9. https://doi.org/10.1016/j.rbmo.2020.05.001 (Elsevier Ltd).
Reprod Biomed Online [Интернет]. 2020; 41: 157–9. https://doi.org/10.1016/j.rbmo.2020.05.001 (Elsevier Ltd).Артикул КАС Google Scholar
Li R, Yin T, Fang F, Li Q, Chen J, Wang Y et al. Потенциальные риски заражения SARS-CoV-2 для репродуктивного здоровья [Интернет]. Репрод Биомед. В сети. 2020 [цитировано 8 сентября 2021 г.]. п. 89–95. https://doi.org/10.1016/j.rbmo.2020.04.018.
Рейс FM, Буиссу Д.Р., Перейра В.М., Камаргос А.Ф., Дос Рейс А.М., Сантос Р.А. Ангиотензин-(1-7), его рецептор Mas и ангиотензинпревращающий фермент 2 типа экспрессируются в яичниках человека. Фертил Стерил. 2011; 95: 176–81 (Эльзевир).
Артикул КАС Google Scholar
Анифандис Г., Мессини К.И., Симопулу М., Сверонис Г., Гарас А., Дапонте А. и другие. SARS-CoV-2 против человеческих гамет, эмбрионов и криоконсервации.
 Сист Биол Репрод Мед [Интернет]. 2021; 67: 260–9.
Сист Биол Репрод Мед [Интернет]. 2021; 67: 260–9.Jing Y, Run-Qian L, Hao-Ran W, Hao-Ran C, Ya-Bin L, Yang G и др. Потенциальное влияние COVID-19/ACE2 на женскую репродуктивную систему. Мол Хум Репрод [Интернет]. 2020; 26: 367–73.
Choi Y, Jeon H, Brännström M, Akin JW, Curry TE, Jo M. Овуляторная активация ангиотензинпревращающего фермента 2, рецептора SARS-CoV-2, в доминантных фолликулах яичника человека. Фертил Стерил [Интернет]. Фертиль Стерил; 2021 [цитировано 1 декабря 2021 г.]; 116.
Vaz-Silva J, Carneiro MM, Ferreira MC, Pinheiro SVB, Silva DA, Silva-Filho AL et al. Вазоактивный пептид ангиотензин-(1—7), его рецептор Mas и ангиотензинпревращающий фермент 2 типа экспрессируются в эндометрии человека: 101177/1933719108327593 [Интернет]. Публикации SAGE Sage CA: Лос-Анджелес, Калифорния; 2009 [цитировано 16 октября 2021 г.]; 16: 247–56. Доступно по адресу: https://doi.
 org/10.1177/1933719108327593.
org/10.1177/1933719108327593.Хенарехос-Кастильо И., Себастьян-Леон П., Девеса-Пейро А., Пеллисер А., Диас-Химено П. Оценка риска инфицирования SARS-CoV-2 в эндометрии: экспрессия генов, связанных с вирусной инфекцией, в течение менструального цикла. Фертил Стерил [Интернет]. 2020; 114: 223–32. https://doi.org/10.1016/j.fertnstert.2020.06.026.
Артикул КАС Google Scholar
Arechavaleta-Velasco F, Koi H, Strauss JF, Parry S. Вирусная инфекция трофобласта: время серьезно взглянуть на его роль в аномальной имплантации и плацентации? J Reprod Immunol [Интернет]. 2002; 55: 113–21.
Li K, Chen G, Hou H, Liao Q, Chen J, Bai H et al. Анализ половых гормонов и менструации у женщин детородного возраста с COVID-19. Reprod Biomed Online [Интернет]. 2021 [цитировано 16 декабря 2021 г.]; 42: 260–7. https://doi.org/10.1016/j.rbmo.2020.090,020.

Балабан Б., Брисон Д., Кальдерон Г., Кэтт Дж., Конаган Дж., Коуэн Л. и др. Стамбульский консенсусный семинар по оценке эмбрионов: материалы совещания экспертов. Hum Reprod [Интернет]. Хум Репрод; 2011 [цитировано 16 октября 2021 г.]. п. 1270–83. Доступно по ссылке: https://pubmed.ncbi.nlm.nih.gov/21502182/.
Айзер А., Ноуч-Хирш М., Дратвиман-Сторобинский О., Нахум Р., Махтингер Р., Юнг Ю. и др. Влияние иммунитета к COVID-19 на исход циклов переноса замороженных-размороженных эмбрионов. Фертил Стерил [Интернет]. 2022 г.; Доступно по адресу: https://linkinghub.elsevier.com/retrieve/pii/S001502822200022X.
Chen L, Huang X, Yi Z, Deng Q, Jiang N, Feng C et al. Результаты ультразвуковой визуализации острой инфекции яичек у пациентов с коронавирусной болезнью 2019: одноцентровое исследование в Ухане, Китай. J Ultrasound Med [Интернет]. 2021; 40: 1787–94. Доступно по адресу: http://www.
 ncbi.nlm.nih.gov/pubmed/33174632.
ncbi.nlm.nih.gov/pubmed/33174632.Гарридо-Понтноу М., Наварро А., Камачо Х., Криспи Ф., Альгвасиль-Гильен М., Морено-Баро А. и др. Диффузное повреждение трофобласта является отличительной чертой гибели плода, связанной с SARS-CoV-2. Мод Патол [Интернет]. 2021; 34: 1704–9.
Ганор Паз Ю., Шайлох С., Брош-Ниссимов Т., Групель Д., Сорек Н., Кустин Т., Штерн А., Маклаковский М., Полак М., Шарвит М., Нееман О., Бен Валид Т., Товбин Дж., Барзилай Э. Связь между инфекцией SARS-CoV-2 и поздней потерей беременности. Int J Gynaecol Obstet. 2022;157(1):208–9.
Groenewoud ER, Cohlen BJ, Al-Oraiby A, Brinkhuis EA, Broekmans FJM, De Bruin JP et al. Рандомизированное контролируемое исследование не меньшей эффективности модифицированного естественного цикла по сравнению с искусственным для переноса криоразмороженных эмбрионов. Хум Репрод. Хум Репрод; 2016 [цитировано 12 апреля 2022 г.]; 31: 1483–9.
 2. Доступно по ссылке: https://pubmed.ncbi.nlm.nih.gov/27179265/.
2. Доступно по ссылке: https://pubmed.ncbi.nlm.nih.gov/27179265/.
Ли Д., Джин М., Бао П., Чжао В., Чжан С. Клинические характеристики и результаты исследований спермы у мужчин с коронавирусной болезнью 2019 г.. Сеть JAMA открыта. 2020;3:e208292.
Скачать ссылки
Благодарности
Мы благодарим Rawan Haj Yahia и Chen Katz за помощь в сборе данных и Zmira Silman за статистический анализ.
Информация об авторе
Авторы и организации
Отделение ЭКО, Отделение акушерства и гинекологии, Медицинский центр Шамир, 70300, Церифин, Израиль Йерушалми, Ариэль Хурвиц и Алон Кедем
Медицинский факультет Саклера, Тель-Авивский университет, Тель-Авив, Израиль
Михал Янгстер, Сарит Авраам, Итай Гат, Гил Йерушалми, Миша Баум, Этти Маман, Ариэль Хурвиц и Алон Кедем
Отделение ЭКО, отделение акушерства и гинекологии, Медицинский центр Шиба, Рамат-Ган, Израиль
Миха Баум и Этти Маман
7 Отделение внутривенных вливаний Медицинский центр Герцлия, Герцлия, Израиль
Михал Янгстер, Миша Баум, Этти Маман и Алон Кедем
Авторы
- Michal Youngster
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Сарит Авраам
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Оделия Яаков
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Академия
- Моран Ландау Рабби
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Itai Gat
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Gil Yerushalmi
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Micha Baum
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Ettie Maman
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Ariel Hourvitz
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Алон Кедем
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Автор, ответственный за переписку
Михал Янгстер.



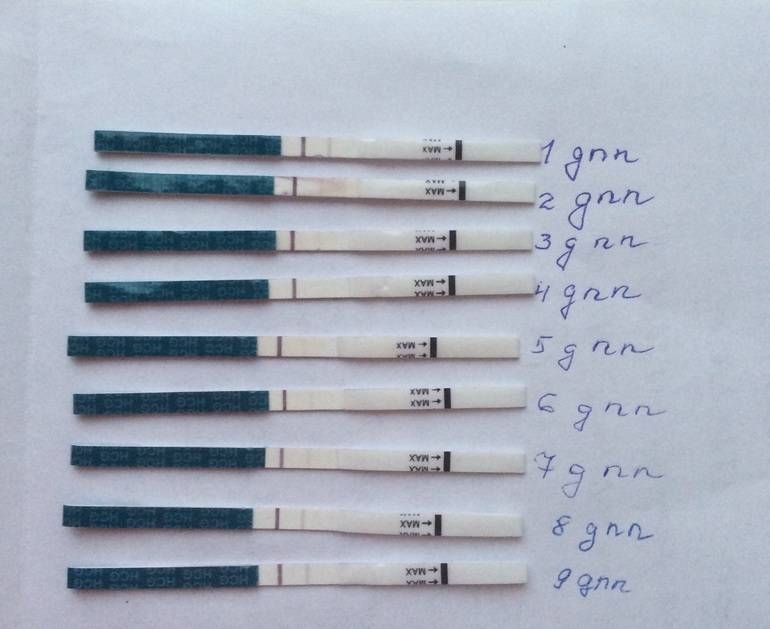 Reprod Biomed Online [Интернет]. 2020; 41: 157–9. https://doi.org/10.1016/j.rbmo.2020.05.001 (Elsevier Ltd).
Reprod Biomed Online [Интернет]. 2020; 41: 157–9. https://doi.org/10.1016/j.rbmo.2020.05.001 (Elsevier Ltd). Сист Биол Репрод Мед [Интернет]. 2021; 67: 260–9.
Сист Биол Репрод Мед [Интернет]. 2021; 67: 260–9. org/10.1177/1933719108327593.
org/10.1177/1933719108327593.
 ncbi.nlm.nih.gov/pubmed/33174632.
ncbi.nlm.nih.gov/pubmed/33174632. 2. Доступно по ссылке: https://pubmed.ncbi.nlm.nih.gov/27179265/.
2. Доступно по ссылке: https://pubmed.ncbi.nlm.nih.gov/27179265/.