Последствия после удаления яичников после 50 лет последствия: Как жить после удаления обоих яичников в Москве
Удаление яичников
- Разное
- Удаление яичников
Удаление яичников – эту операцию ещё называют удалением придатков матки или аднексэктомией, резекция яичников. Проводится как лапароскопическим доступом (через 2-3 отверстия в животе с помощью эндоскопов), так и прямым доступом через разрез передней брюшной стенки.
Показания к удалению: – Опухолевидные образования яичников, кисты и кистомы.
- при простых кистах яичников резекция яичника чаще является достаточным объёмом операции
- при кистомах (предраковое состояние) резекция яичника является диагностическим этапом, когда после проведения гистологического исследования определяется необходимость удаления всех придатков или выполнения другого объёма операции
– Рак яичников. При этом удаление яичников дополняется удалением матки, резекцией сальника, – чаще всего как первый этап комплексного лечения. Вторым этапом проводится полихимиотерапия – Различные формы внематочной беременности, когда ворсины детского места могут проростать маточную трубу и капсулу яичника – При воспалительных и гнойных заболеваниях придатков, когда яичник становится частью воспалительной опухоли – При планировании экстракорпорального оплодотворения проводится резекция яичника с целью консервирования ткани яичника, содержащую фолликулы с яйцеклетками.
 Меняется характер менструального цикла, менструации могут приходить 1 раз в 2 месяца. Это связано с тем, что первый и левый яичники работают по очереди. Особенности проведения операции Афасьевым М.С.: – Очень важно правильно определить показания и объём оперативного вмешательства – Целью является не только полностью вылечить от болезни. Первостепенной задачей является сохранить качество жизни моих пациенток. Особенно это важно для женщин детородного возраста – Клиника в которой я веду приём имеет все возможности, позволяющие мне проводить любой объём необходимых диагностик для постановки диагноза и определения объёма операции – Использование малоинвазивной лапароскопической техники на немецком оборудовании фирмы Storz позволяет мне сократить длительность восстановления после операции – Для определения границ распространения опухоли яичников я использую метод флюорисцентной диагностики. Перед операцией пациенткам ввожу фотосенсибилизатор, который накапливается во всех опухолевых тканях.
Меняется характер менструального цикла, менструации могут приходить 1 раз в 2 месяца. Это связано с тем, что первый и левый яичники работают по очереди. Особенности проведения операции Афасьевым М.С.: – Очень важно правильно определить показания и объём оперативного вмешательства – Целью является не только полностью вылечить от болезни. Первостепенной задачей является сохранить качество жизни моих пациенток. Особенно это важно для женщин детородного возраста – Клиника в которой я веду приём имеет все возможности, позволяющие мне проводить любой объём необходимых диагностик для постановки диагноза и определения объёма операции – Использование малоинвазивной лапароскопической техники на немецком оборудовании фирмы Storz позволяет мне сократить длительность восстановления после операции – Для определения границ распространения опухоли яичников я использую метод флюорисцентной диагностики. Перед операцией пациенткам ввожу фотосенсибилизатор, который накапливается во всех опухолевых тканях.
Запись на прием по телефону 8 (800) 555-77-26
Проконсультируйтесь у доктора Афанасьева по тел. 8 (987) 980-25-34 .
Комментируйте! Задавайте вопросы!
Вернуться на предыдущую страницу
Состояние молочных желез у женщин после лапароскопической гистерэктомии
До настоящего времени во всем мире гистерэктомия остается наиболее частой операцией на органах малого таза у женщин. При этом основным показанием к операции является миома матки с клиническими проявлениями. В последние годы прослеживается четкая тенденция роста числа гистерэктомий у женщин репродуктивного возраста [1]. Учитывая высокую частоту сочетания патологических изменений молочных желез с миомой матки, достигающую согласно данным литературы 90% [2, 3], особый интерес представляет исследование состояния молочных желез до и после хирургического лечения миомы матки.
При этом основным показанием к операции является миома матки с клиническими проявлениями. В последние годы прослеживается четкая тенденция роста числа гистерэктомий у женщин репродуктивного возраста [1]. Учитывая высокую частоту сочетания патологических изменений молочных желез с миомой матки, достигающую согласно данным литературы 90% [2, 3], особый интерес представляет исследование состояния молочных желез до и после хирургического лечения миомы матки.
Как известно, доброкачественные заболевания молочных желез у женщин рассматриваются, с одной стороны, как возможный фон для развития рака, с другой, как группа заболеваний, существенно снижающая качество жизни. В ряде работ доказано, что наиболее часто миома матки сочетается с пролиферативными формами фиброзно-кистозной мастопатии, при которых повышен относительный риск развития рака молочной железы [4—6]. Следует признать, что в литературе имеются лишь единичные работы о состоянии молочных желез у больных, оперированных по поводу миомы матки. Это послужило поводом для проведения научно-практического исследования.
Это послужило поводом для проведения научно-практического исследования.
Целью настоящего исследования явилась оценка динамики состояния молочных желез у больных миомой матки до и после лапароскопической гистерэктомии (ЛГ) в зависимости от возраста пациентки и выполненного объема операции.
Материал и методы
В исследование включены 103 пациентки в возрасте 39—50 лет, подвергшихся ЛГ по поводу миомы матки с клиническими появлениями. Все больные были разделены на 2 группы: 1-ю группу составили пациентки (n=41), оперированные в объеме надвлагалищной ампутации матки без придатков в репродуктивном возрасте (36—44 лет). Во 2-ю группу вошли 62 женщины, перенесшие гистерэктомию в объеме надвлагалищной ампутации матки или экстирпации матки в пременопаузе (45—47 лет). Из этих женщин у 24 (38,71%) в ходе ЛГ была произведена двусторонняя аднексэктомия по поводу доброкачественных новообразований яичников, соответственно у 38 (61,29%) придатки матки с обеих сторон были сохранены.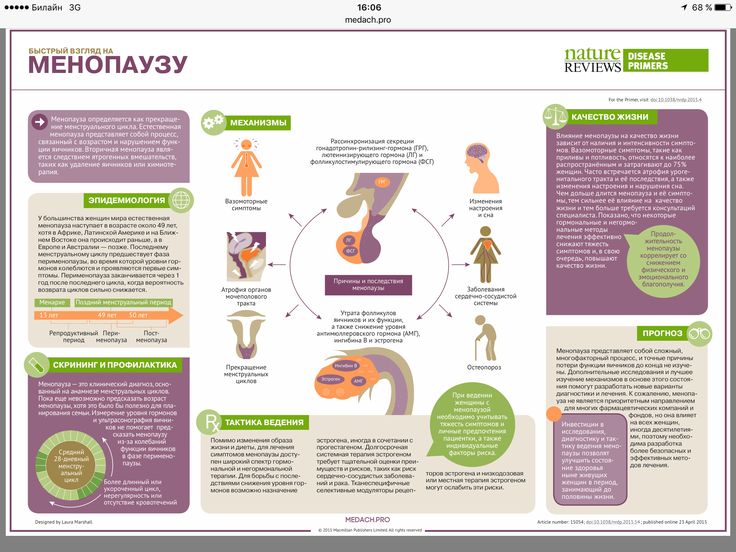
Согласно представленным данным, среди показаний к ЛГ у больных 1-й группы превалировали миома матки больших размеров с нарушением функции тазовых органов. Средний размер удаляемых маток соответствовал таковому при 14—15 нед беременности. У больных 2-й группы наиболее частым показанием к операции явились различные нарушения менструального цикла, приводящие к анемии. Средний размер удаляемых маток в этой группе соответствовал таковому при 9—10 нед беременности. Показания к удалению шейки матки были представлены дисплазией, лейкоплакией, эктопией в сочетании с рубцовой деформацией.
Всем пациенткам с нарушением менструального цикла с целью уточнения состояния эндометрия на первом этапе проводилась гистероскопия с раздельным диагностическим выскабливанием стенок матки. Остальным больным была выполнена аспирационная биопсия из полости матки.
Оперативная лапароскопия выполнялась с использованием стандартного комплекта эндоскопического оборудования фирмы “Karl Storz” (Германия). Лапароскопические операции проводили под эндотрахеальным наркозом с наложением пневмоперитонеума с приданием пациентке положения Тренделенбурга.
Лапароскопические операции проводили под эндотрахеальным наркозом с наложением пневмоперитонеума с приданием пациентке положения Тренделенбурга.
Период наблюдения в обеих группах составил 3 года.
С целью оценки динамики состояния молочных желез всем больным до и после хирургического лечения проводили пальпаторное обследование молочных желез, ультразвуковое сканирование молочных желез и маммографию. По показаниям (при выявлении узловых форм мастопатии, в том числе солитарных кист и для уточнения диагноза) выполняли пункционную или аспирационную биопсию молочных желез под ультразвуковым контролем с цитологическим исследованием биоптата.
Результаты
Изменения молочных желез до выполнения ЛГ у больных 1-й группы были представлены диффузной фиброзно-кистозной мастопатией (ДФКМ), отмеченной в 28 (68,3%) наблюдениях. Из них ДФКМ с преобладанием железистого компонента диагностирована у 7 (25,0%) пациенток, кистозного компонента — у 8 (28,6%), фиброзного — у 4 (14,3%). Соответственно у 9 (32,1%) больных была выявлена смешанная форма ДФКМ. Следует отметить, что ранее диагноз фиброзно-кистозной мастопатии (ФКМ) был установлен лишь у 10 (35,7%) из 28 обследованных женщин. При этом жалобы на масталгию различной интенсивности предъявляли 17 (60,7%) больных. Из них около 50% женщин не придавали жалобам особого значения и к врачу не обращались. Кроме того, в анамнезе у 4 (9,8%) пациенток имелась секторальная резекция молочной железы по поводу фиброаденомы.
Из них ДФКМ с преобладанием железистого компонента диагностирована у 7 (25,0%) пациенток, кистозного компонента — у 8 (28,6%), фиброзного — у 4 (14,3%). Соответственно у 9 (32,1%) больных была выявлена смешанная форма ДФКМ. Следует отметить, что ранее диагноз фиброзно-кистозной мастопатии (ФКМ) был установлен лишь у 10 (35,7%) из 28 обследованных женщин. При этом жалобы на масталгию различной интенсивности предъявляли 17 (60,7%) больных. Из них около 50% женщин не придавали жалобам особого значения и к врачу не обращались. Кроме того, в анамнезе у 4 (9,8%) пациенток имелась секторальная резекция молочной железы по поводу фиброаденомы.
Структура заболеваний молочных желез у пациенток 1-й группы до проведения ЛГ представлена на рис. 1, а.Рисунок 1. Структура заболеваний молочных желез у пациенток 1-й группы (а) и 2-й группы (б) до про- ведения ЛГ. ДФКМ — диффузная фиброзно-кистозная мастопатия; ДУФКМ — диффузно-узловая фиброзно-кистозная мастопатия.
Среди пациенток 2-й группы различные заболевания молочных желез на момент поступления для проведения ЛГ выявлены у 46 (74,2%) из 62. Структура заболеваний молочных желез у пациенток 2-й группы до операции на момент поступления и в анамнезе представлена на рис. 1, б.
Структура заболеваний молочных желез у пациенток 2-й группы до операции на момент поступления и в анамнезе представлена на рис. 1, б.
Патологические изменения в молочных железах на момент госпитализации для хирургического лечения были представлены ДФКМ у 42 (67,7%) пациенток 2-й группы. При этом преобладание железистого компонента выявлено у 13 (30,9%) из 42 женщин, кистозного — у 10 (23,8%), фиброзного — у 3 (7,1%). Смешанная форма ДФКМ отмечена у 16 (38,1%) из 42 больных. Диффузно-узловая форма ФКМ выявлена у 4 (6,5%) больных, подвергшихся ЛГ в пременопаузе. У 15 (24,2%) женщин в анамнезе отмечены хирургические вмешательства на молочных железах по поводу фиброаденомы и солитарных кист молочных желез.
Через 3 года после ЛГ маммологическое обследование позволило обнаружить различные заболевания молочных желез у 40 (97,6%) больных 1-й группы. Среди патологических изменений молочных желез, как и до операции, преобладала ДФКМ, выявленная у 33 (82,5%) из 40 пациенток. Вместе с тем у 3 (7,5%) больных, подвергшихся ЛГ в репродуктивном возрасте, после операции была диагностирована узловая форма ФКМ, а у 4 (10,0%) — смешанная диффузно-узловая форма ФКМ.
Вместе с тем у 3 (7,5%) больных, подвергшихся ЛГ в репродуктивном возрасте, после операции была диагностирована узловая форма ФКМ, а у 4 (10,0%) — смешанная диффузно-узловая форма ФКМ.
Во 2-й группе у больных, подвергшихся гистерэктомии без придатков, в отдаленном периоде различные заболевания молочных желез констатированы у 35 (92,1%) из 38. Из них ДФКМ отмечена у 24 (68,6%) пациенток, диффузно-узловая форма ФКМ — у 5 (14,3%), узловая форма ФКМ — у 4 (11,4%). Кроме того, у 2 (5,7%) больных отмечен рецидив солитарных кист молочных желез. При этом достоверных различий в состоянии молочных желез после надвлагалищной ампутации матки или экстирпации матки не получено.
Среди 24 пациенток, у которых в ходе гистерэктомии были удалены придатки матки, в молочных железах отмечено доминирование фиброзно-жировой инволюции, умеренно выраженные проявления ДФКМ сохранялись лишь у одной (4,2%) больной.
Динамика состояния молочных желез у обследованных больных до и после проведения ЛГ представлена на рис. 2.Рисунок 2. Динамика состояния молочных желез у обследованных больных до и после проведения ЛГ. При этом группа 2А отражает сведения о больных в пременопаузе, которым ЛГ проводилась с сохранением придатков матки. Соответственно группа 2Б представляет данные о пациентках, которым ЛГ осуществлялась с удалением придатков матки.
2.Рисунок 2. Динамика состояния молочных желез у обследованных больных до и после проведения ЛГ. При этом группа 2А отражает сведения о больных в пременопаузе, которым ЛГ проводилась с сохранением придатков матки. Соответственно группа 2Б представляет данные о пациентках, которым ЛГ осуществлялась с удалением придатков матки.
Обсуждение
Ввиду того что с функциональной точки зрения молочные железы и половые органы едины в составе репродуктивной системы, необходимость оценки состояния молочных желез у пациенток с дисгормональными гинекологическими заболеваниями совершенно очевидна. При изучении частоты сочетания заболеваний молочных желез и половых органов было установлено, что наиболее часто различная патология молочных желез выявляется у больных миомой матки, и составляет по различным данным 69—90% [2, 3, 6, 7]. До настоящего времени основным методом лечения миомы матки остается хирургический, а наиболее часто выполняемой операцией — гистерэктомия. Состояние молочных желез как органов-мишеней после проведения гистерэктомии вызывает несомненный интерес, особенно у пациенток, оперированных в репродуктивном возрасте.
Состояние молочных желез как органов-мишеней после проведения гистерэктомии вызывает несомненный интерес, особенно у пациенток, оперированных в репродуктивном возрасте.
В настоящем исследовании частота нераковых заболеваний молочных желез (НЗМЖ) у больных с миомой матки до хирургического лечения составила 71,8%. Согласно данным литературы, наибольший риск возникновения НЗМЖ отмечается в возрасте 45 лет [6]. По нашим данным, до хирургического лечения дисгормональные патологические изменения в молочных железах на момент поступления у больных репродуктивного возраста и в пременопаузе встречались практически одинаково часто: в 68,3 и 74,2% случаев соответственно. Однако у пациенток 2-й группы хирургические вмешательства в анамнезе по поводу фиброаденом и солитарных кист молочных желез встречались в 2,5 раза чаще. Кроме того, у пациенток, подвергшихся гистерэктомии в репродуктивном возрасте, до хирургического лечения отсутствовали диффузно-узловые формы ФКМ.
До настоящего времени при проведении гистерэктомии остается нерешенным вопрос об объеме операции, т.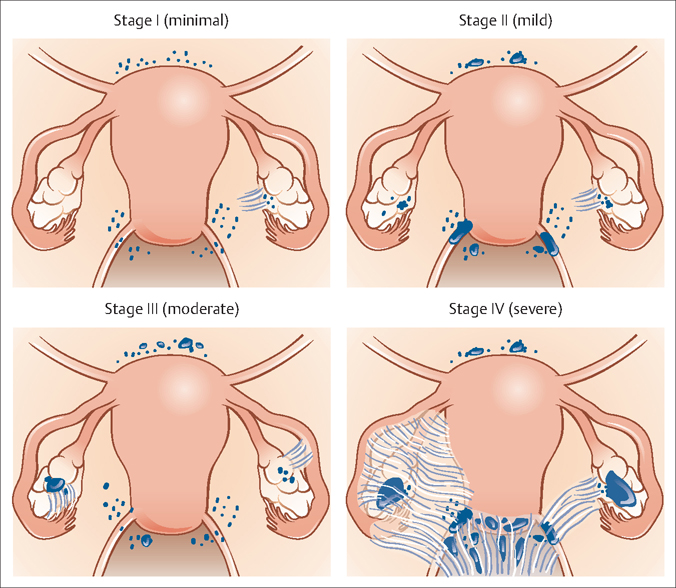 е. удалять или сохранять придатки матки. Эта проблема обсуждается в связи с возможностью возникновения в оставленных придатках матки и в молочных железах (как органах-мишенях) различных доброкачественных и злокачественных изменений. В ряде работ было доказано, что двусторонняя овариэктомия у больных миомой матки с пролиферативными формами ФКМ приводит к регрессу пролиферативных изменений в ткани молочных желез [4, 8]. Полученные в настоящем исследовании результаты согласуются с данными литературы о том, что хирургическое лечение с удалением придатков матки оказывает положительное влияние на патологические изменения в молочных железах и снижает риск возникновения их заболеваний. Так, среди 24 пациенток в пременопаузе, у которых в ходе гистерэктомии были удалены придатки матки, умеренно выраженные проявления ДФКМ сохранялись лишь у одной (4,2%). В то же время за трехлетний период наблюдения после гистерэктомии с сохранением придатков матки результаты исследования позволили констатировать рост числа заболеваний молочных желез в репродуктивном возрасте на 29,3%, в пременопаузе — на 17,9%.
е. удалять или сохранять придатки матки. Эта проблема обсуждается в связи с возможностью возникновения в оставленных придатках матки и в молочных железах (как органах-мишенях) различных доброкачественных и злокачественных изменений. В ряде работ было доказано, что двусторонняя овариэктомия у больных миомой матки с пролиферативными формами ФКМ приводит к регрессу пролиферативных изменений в ткани молочных желез [4, 8]. Полученные в настоящем исследовании результаты согласуются с данными литературы о том, что хирургическое лечение с удалением придатков матки оказывает положительное влияние на патологические изменения в молочных железах и снижает риск возникновения их заболеваний. Так, среди 24 пациенток в пременопаузе, у которых в ходе гистерэктомии были удалены придатки матки, умеренно выраженные проявления ДФКМ сохранялись лишь у одной (4,2%). В то же время за трехлетний период наблюдения после гистерэктомии с сохранением придатков матки результаты исследования позволили констатировать рост числа заболеваний молочных желез в репродуктивном возрасте на 29,3%, в пременопаузе — на 17,9%. Кроме того, для этих пациенток было характерно прогрессирование имевшихся до операции диффузных форм заболевания в более тяжелые локализованные формы. Полученные данные согласуются с результатами исследования М.И. Пиддубного и соавт. о состоянии органов-мишеней у больных, оперированных по поводу миомы матки [8]. Однако общепринятая в настоящее время тактика выбора объема операции у пациенток репродуктивного возраста в отсутствие образований в яичниках предполагает сохранение придатков матки. Как известно, при гистерэктомии с удалением обоих яичников у больных вследствие резкого сдвига гормонального баланса и вторичного вовлечения в патологический процесс гипоталамических структур развивается постовариоэктомический синдром. По данным Е.М. Вихляевой, клиническая картина заболевания после острого выключения функции яичников характеризуется наибольшей тяжестью на протяжении первых 2 лет после операции и выражается в многообразных проявлениях вегетативно-сосудистых нарушений. По мнению автора, целесообразно сохранение неизмененных яичников у всех женщин, подвергающихся хирургическому лечению вплоть до периода перименопаузы [1].
Кроме того, для этих пациенток было характерно прогрессирование имевшихся до операции диффузных форм заболевания в более тяжелые локализованные формы. Полученные данные согласуются с результатами исследования М.И. Пиддубного и соавт. о состоянии органов-мишеней у больных, оперированных по поводу миомы матки [8]. Однако общепринятая в настоящее время тактика выбора объема операции у пациенток репродуктивного возраста в отсутствие образований в яичниках предполагает сохранение придатков матки. Как известно, при гистерэктомии с удалением обоих яичников у больных вследствие резкого сдвига гормонального баланса и вторичного вовлечения в патологический процесс гипоталамических структур развивается постовариоэктомический синдром. По данным Е.М. Вихляевой, клиническая картина заболевания после острого выключения функции яичников характеризуется наибольшей тяжестью на протяжении первых 2 лет после операции и выражается в многообразных проявлениях вегетативно-сосудистых нарушений. По мнению автора, целесообразно сохранение неизмененных яичников у всех женщин, подвергающихся хирургическому лечению вплоть до периода перименопаузы [1]. Следует отметить, что мы разделяем это мнение: удаление придатков матки в настоящем исследовании проводилось только при наличии доброкачественных образований в яичниках.
Следует отметить, что мы разделяем это мнение: удаление придатков матки в настоящем исследовании проводилось только при наличии доброкачественных образований в яичниках.
Таким образом, пациентки с миомой матки, которым предполагается проведение гистерэктомии с сохранением придатков матки, входят в группу повышенного риска развития и прогрессирования дисплазий молочных желез в послеоперационном периоде. Это обусловливает необходимость рассматривать общность патогенетических механизмов развития миомы матки и дисгормональных заболеваний молочных желез и осуществлять комплексный подход при выборе метода лечения у этих пациенток. Помимо удаления матки как патологического субстрата у больных данной категории необходимо проведение целевой терапии.
Долгосрочные эффекты двусторонней овариэктомии на старение мозга: оставшиеся без ответа вопросы когортного исследования овариэктомии и старения клиники Мэйо
Особо примечательные статьи были отмечены как представляющие интерес (•) как представляющие значительный интерес (••) для читателей.
1. Паркер В.Х., Бродер М.С., Лю З., Шоуп Д., Фаркуар С., Берек Дж.С. Сохранение яичников во время гистерэктомии по поводу доброкачественного заболевания. Обст. Гинекол. 2005; 106: 219–226. [PubMed] [Google Scholar]Первоначальный обзор научных данных о рисках и преимуществах профилактической двусторонней овариэктомии.
2. Кешаварз Х., Хиллис С.Д., Кике Б.А., Марчбэнкс П.А. Наблюдение за гистерэктомией — США, 1994–1999 гг. ММВР. Наблюдение. Сумма. 2002; 51:1–8. [Google Scholar]
3. Рокка В.А., Гроссардт Б.Р., де Андраде М., Малкасян Г.Д., Мелтон Л.Дж., 3-е. Выживаемость после овариэктомии у женщин в пременопаузе: популяционное когортное исследование. Ланцет Онкол. 2006; 7: 821–828. [PubMed] [Google Scholar] Данные о смертности из когортного исследования овариэктомии и старения клиники Майо.
4. Shoupe D, Parker WH, Broder MS, Liu Z, Farquhar C, Berek JS. Плановая овариэктомия при доброкачественных гинекологических заболеваниях. Менопауза. 2007; 14: 580–585. [PubMed] [Академия Google]
[PubMed] [Академия Google]
5. Паркер В.Х., Бродер М.С., Лю З., Шоуп Д., Фаркуар С., Берек Дж.С. Сохранение яичников во время гистерэктомии по поводу доброкачественного заболевания. клин. Обст. Гинекол. 2007; 50: 354–361. [PubMed] [Google Scholar]
6. ACOG. Практический бюллетень ACOG № 89. Избирательная и снижающая риск сальпингоовариэктомия. Обст. Гинекол. 2008; 111: 231–241. [PubMed] [Google Scholar] Текущие практические рекомендации по двусторонней овариэктомии в США
7. Shuster LT, Gostout BS, Grossardt BR, Rocca WA. Профилактическая овариэктомия у женщин в пременопаузе и долговременное здоровье. Менопауза Инт. 2008; 14:111–116. [Бесплатная статья PMC] [PubMed] [Google Scholar] Резюме результатов когортного исследования оофорэктомии и старения клиники Майо.
8. Мелтон Л.Дж., 3-й, Бергстрах Э.Дж., Малкасиан Г.Д., О’Фаллон В.М. Тенденции двусторонней овариэктомии в округе Олмстед, Миннесота, 1950–1987 гг. Эпидемиология. 1991; 2: 149–152. [PubMed] [Google Scholar]
9. Rivera CM, Grossardt BR, Rhodes DJ, et al. Повышенная сердечно-сосудистая смертность после ранней двусторонней овариэктомии. Менопауза. 2008 г. в печати. [Google Scholar]
Rivera CM, Grossardt BR, Rhodes DJ, et al. Повышенная сердечно-сосудистая смертность после ранней двусторонней овариэктомии. Менопауза. 2008 г. в печати. [Google Scholar]
10. Rocca WA, Bower JH, Maraganore DM, et al. Повышенный риск когнитивных нарушений или деменции у женщин, перенесших овариэктомию до наступления менопаузы. Неврология. 2007;69: 1074–1083. [PubMed] [Google Scholar]Когнитивные нарушения и деменция, полученные в когортном исследовании овариэктомии и старения клиники Майо.
11. Rocca WA, Bower JH, Maraganore DM, et al. Повышенный риск развития паркинсонизма у женщин, перенесших овариэктомию до наступления менопаузы. Неврология. 2008; 70: 200–209. [PubMed] [Google Scholar]Паркинсонизм и болезнь Паркинсона, полученные в когортном исследовании овариэктомии и старения клиники Майо.
12. Rocca WA, Grossardt BR, Maraganore DM. Долгосрочные эффекты овариэктомии на когнитивное и двигательное старение зависят от возраста. Нейродегенер. Дис. 2008; 5: 257–260. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Rocca WA, Grossardt BR, Geda YE, et al. Долгосрочный риск симптомов депрессии и тревоги после ранней двусторонней овариэктомии. Менопауза. 2008 г. в печати. [PubMed] [Google Scholar] Результаты исследования симптомов депрессии и тревоги по результатам когортного исследования овариэктомии и старения клиники Майо.
14. Хьюз С.Л., мл., Уолл Л.Л., Крисман В.Т. Уровни репродуктивных гормонов у онкогинекологических больных, перенесших хирургическую кастрацию после спонтанной менопаузы. Гинекол. Онкол. 1991; 40:42–45. [PubMed] [Академия Google]
15. Лафлин Г.А., Барретт-Коннор Э., Криц-Сильверштейн Д., фон Мюлен Д.Г. Гистерэктомия, овариэктомия и уровни эндогенных половых гормонов у пожилых женщин: исследование Ранчо Бернардо. Дж. Клин. Эндокринол. Метаб. 2000; 85: 645–651. [PubMed] [Google Scholar]
16. Симпсон Э.Р., Дэвис С.Р. Миниобзор: ароматаза и регуляция биосинтеза эстрогенов – некоторые новые перспективы. Эндокринология. 2001; 142:4589–4594. [PubMed] [Google Scholar]
Эндокринология. 2001; 142:4589–4594. [PubMed] [Google Scholar]
17. Simpson ER. Ароматизация андрогенов у женщин: современные концепции и результаты. Плодородный. Стерильно. 2002; 77:S6–S10. [PubMed] [Академия Google]
18. Иивонен С., Кордер Э., Лехтовирта М. и соавт. Полиморфизмы гена CYP19 повышают риск развития болезни Альцгеймера. Неврология. 2004;62:1170–1176. [PubMed] [Google Scholar]
19. Armstrong K, Schwartz JS, Randall T, Rubin SC, Weber B. Заместительная гормональная терапия и ожидаемая продолжительность жизни после профилактической овариэктомии у женщин с мутациями BRCA1/2: анализ решений. Дж. Клин. Онкол. 2004; 22:1045–1054. [PubMed] [Google Scholar]
20. Burger HG, Hale GE, Dennerstein L, Robertson DM. Цикл и гормональные изменения в перименопаузе: ключевая роль функции яичников. Менопауза. 2008; 15: 603–612. [PubMed] [Академия Google]
21. Приор JC. Старение яичников и перименопаузальный переход: парадокс эндогенной гиперстимуляции яичников. Эндокринный. 2005; 26: 297–300. [PubMed] [Google Scholar]
Эндокринный. 2005; 26: 297–300. [PubMed] [Google Scholar]
22. Моррисон Дж. Х., Бринтон Р. Д., Шмидт П. Дж., Гор А. С. Эстроген, менопауза и старение мозга: как фундаментальная неврология может дать информацию о гормональной терапии у женщин. Дж. Нейроски. 2006; 26:10332–10348. [Бесплатная статья PMC] [PubMed] [Google Scholar] Всесторонний обзор основных нейробиологических механизмов, связанных с менопаузой.
23. Гиббс Р.Г. Длительное лечение эстрогеном и прогестероном улучшает усвоение задачи пространственной памяти старыми крысами после овариэктомии. Нейробиол. Старение. 2000; 21:107–116. [PubMed] [Google Scholar]
24. Webber KM, Casadesus G, Marlatt MW, et al. Эстроген кланяется новому хозяину: роль гонадотропинов в патогенезе болезни Альцгеймера. Анна. Н. Я. акад. науч. 2005; 1052: 201–209. [PubMed] [Google Scholar]
25. Сингх М. Нейропротекция, индуцированная прогестероном. Эндокринный. 2006;29: 271–274. [PubMed] [Google Scholar]
26. Singh M, Sumien N, Kyser C, Simpkins JW. Эстрогены и прогестерон как нейропротекторы: чему нас учат модели на животных. Фронт. Бионауч. 2008; 13:1083–1089. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Эстрогены и прогестерон как нейропротекторы: чему нас учат модели на животных. Фронт. Бионауч. 2008; 13:1083–1089. [Бесплатная статья PMC] [PubMed] [Google Scholar]
27. Snieder H, MacGregor AJ, Spector TD. Гены контролируют прекращение репродуктивной жизни женщины: двойное исследование гистерэктомии и возраста наступления менопаузы. Дж. Клин. Эндокринол. Метаб. 1998; 83: 1875–1880. [PubMed] [Google Scholar]
28. Weel AE, Uitterlinden AG, Westendorp IC, et al. Полиморфизм эстрогеновых рецепторов предсказывает наступление естественной и хирургической менопаузы. Дж. Клин. Эндокринол. Метаб. 1999;84:3146–3150. [PubMed] [Google Scholar]
29. Cramer DW, Petterson KS, Barbieri RL, Huhtaniemi IT. Репродуктивные гормоны, рак и состояния, связанные с распространенным генетическим вариантом лютеинизирующего гормона. Гум. Воспр. 2000;15:2103–2107. [PubMed] [Google Scholar]
30. Di W, Guo SW. Поиск генетических вариантов, предрасполагающих женщин к эндометриозу. Курс. мнение Обст. Гинекол. 2007; 19: 395–401. [PubMed] [Google Scholar]
мнение Обст. Гинекол. 2007; 19: 395–401. [PubMed] [Google Scholar]
31. Montgomery GW, Nyholt DR, Zhao ZZ, et al. Поиск генов, способствующих риску эндометриоза. Гум. Воспр. Обновлять. 2008; 14: 447–457. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Шкло М., Ньето Ф.Дж. Эпидемиология: помимо основ. 2-е изд. Садбери, Массачусетс: издательство Jones and Bartlett Publishers; 2007. [Google Scholar]
33. Porrello E, Monti MC, Sinforiani E, et al. Альфа-рецептор эстрогена и полиморфизмы APOEepsilon4 взаимодействуют, увеличивая риск спорадического атопического дерматита у итальянских женщин. Евро. Дж. Нейрол. 2006; 13: 639–644. [PubMed] [Google Scholar]
34. Rocca WA, Grossardt BR, de Andrade M, Bower JH, Maraganore DM. Варианты генов в пути синтеза эстрогена и ответной реакции и риск болезни Паркинсона: исследование случай-контроль у женщин. Неврология. 2006;66:А64. [Академия Google]
35. Лукхаус К., Санд П.Г. Варианты гена рецептора эстрогена 1 (ESR1) при болезни Альцгеймера.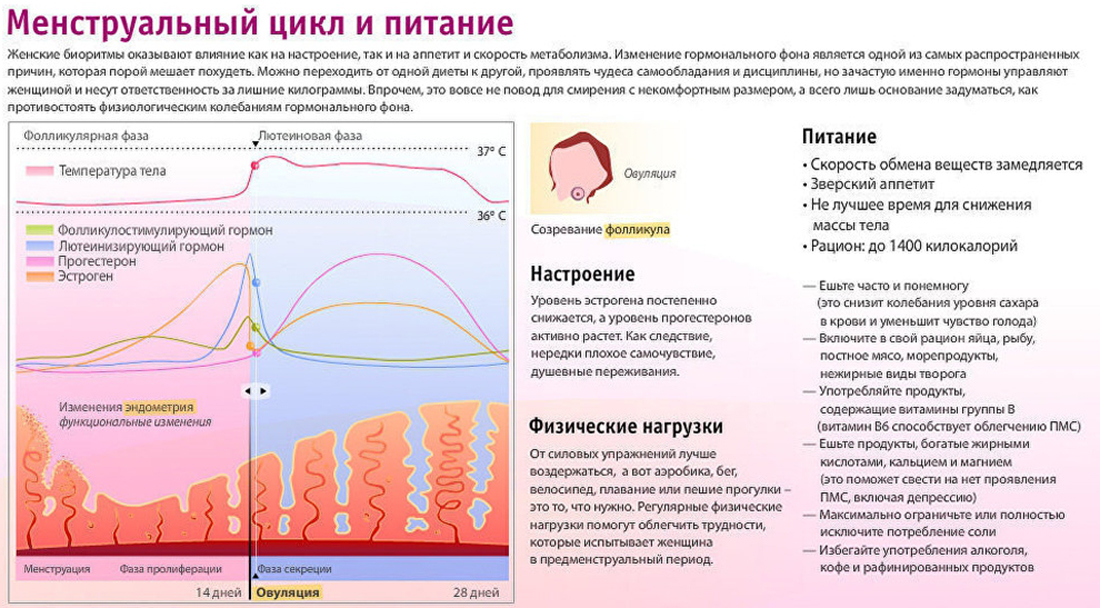 Результаты метаанализа. Старение клин. Эксп. Рез. 2007; 19: 165–168. [PubMed] [Google Scholar]
Результаты метаанализа. Старение клин. Эксп. Рез. 2007; 19: 165–168. [PubMed] [Google Scholar]
36. Maraganore DM, de Andrade M, Lesnick TG, et al. Полногеномное ассоциативное исследование болезни Паркинсона с высоким разрешением. Являюсь. Дж. Хам. Жене. 2005; 77: 685–693. [Статья PMC бесплатно] [PubMed] [Google Scholar]
37. Hogervorst E, Bandelow S. Следует ли хирургическим женщинам в период менопаузы лечить эстрогенами для снижения риска деменции? Неврология. 2007;69: 1070–1071. [PubMed] [Google Scholar]
38. Yaffe K, Sawaya G, Lieberburg I, Grady D. Терапия эстрогенами у женщин в постменопаузе: влияние на когнитивные функции и деменцию. ДЖАМА. 1998; 279: 688–695. [PubMed] [Google Scholar]
39. Hogervorst E, Williams J, Budge M, Riedel W, Jolles J. Природа эффекта заместительной гормональной терапии женских половых желез на когнитивные функции у женщин в постменопаузе: метаанализ . Неврология. 2000; 101:485–512. [PubMed] [Академия Google]
40. Леблан Э.С., Яновский Дж., Чан Б.К., Нельсон Х.Д. Заместительная гормональная терапия и познание: систематический обзор и метаанализ. ДЖАМА. 2001; 285:1489–1499. [PubMed] [Google Scholar]
Леблан Э.С., Яновский Дж., Чан Б.К., Нельсон Х.Д. Заместительная гормональная терапия и познание: систематический обзор и метаанализ. ДЖАМА. 2001; 285:1489–1499. [PubMed] [Google Scholar]
41. Grodstein F, Clarkson TB, Manson JE. Понимание расходящихся данных о постменопаузальной гормональной терапии. Н. англ. Дж. Мед. 2003; 348: 645–650. [PubMed] [Google Scholar]
42. Харман С.М., Нафтолин Ф., Бринтон Э.А., Джудельсон Д.Р. Закончен ли спор об эстрогене? Деконструкция исследования Инициативы женского здоровья: критическая оценка доказательств. Анна. Н. Я. акад. науч. 2005;1052:43–56. [PubMed] [Академия Google]
43. Shumaker SA, Legault C, Rapp SR, et al. Эстроген плюс прогестин и частота слабоумия и легких когнитивных нарушений у женщин в постменопаузе: исследование памяти Инициативы женского здоровья: рандомизированное контролируемое исследование. ДЖАМА. 2003; 289: 2651–2662. [PubMed] [Google Scholar]
44. Rapp SR, Espeland MA, Shumaker SA, et al. Влияние эстрогена плюс прогестин на глобальную когнитивную функцию у женщин в постменопаузе: исследование памяти Инициативы женского здоровья: рандомизированное контролируемое исследование. ДЖАМА. 2003;289: 2663–2672. [PubMed] [Google Scholar]
ДЖАМА. 2003;289: 2663–2672. [PubMed] [Google Scholar]
45. Espeland MA, Rapp SR, Shumaker SA, et al. Конъюгированные лошадиные эстрогены и глобальная когнитивная функция у женщин в постменопаузе: исследование памяти Инициативы женского здоровья. ДЖАМА. 2004; 291:2959–2968. [PubMed] [Google Scholar]
46. Shumaker SA, Legault C, Kuller L, et al. Конъюгированные лошадиные эстрогены и частота вероятной деменции и легких когнитивных нарушений у женщин в постменопаузе: исследование памяти инициативы Women’s Health Initiative. ДЖАМА. 2004;291: 2947–2958. [PubMed] [Google Scholar]
47. Manson JE, Bassuk SS, Harman SM, et al. Постменопаузальная гормональная терапия: новые вопросы и повод для новых клинических испытаний. Менопауза. 2006; 13: 139–147. [PubMed] [Google Scholar]
48. Зигфрид Т. Неврология: все дело во времени. Природа. 2007; 445: 359–361. [PubMed] [Google Scholar]
49. Henderson VW, Benke KS, Green RC, Cupples LA, Farrer LA. Постменопаузальная гормональная терапия и риск болезни Альцгеймера: взаимодействие с возрастом. Дж. Нейрол. Нейрохирург. Психиатрия. 2005; 76: 103–105. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Дж. Нейрол. Нейрохирург. Психиатрия. 2005; 76: 103–105. [Бесплатная статья PMC] [PubMed] [Google Scholar]
50. Барретт-Коннор Э. Гормоны и болезни сердца у женщин: гипотеза времени. Являюсь. Дж. Эпидемиол. 2007; 166: 506–510. [PubMed] [Google Scholar]
51. Wierman ME, Basson R, Davis SR, et al. Андрогенная терапия у женщин: руководство по клинической практике эндокринного общества. Дж. Клин. Эндокринол. Метаб. 2006;91:3697–3710. [PubMed] [Google Scholar]
52. Yaffe K, Barnes D, Lindquist K, et al. Уровни эндогенных половых гормонов и риск снижения когнитивных функций в старшей двухрасовой когорте. Нейробиол. Старение. 2007; 28: 171–178. [PubMed] [Академия Google]
53. Xu H, Gouras GK, Greenfield JP, et al. Эстроген снижает выработку нейронами бета-амилоидных пептидов болезни Альцгеймера. Нац. Мед. 1998; 4: 447–451. [PubMed] [Google Scholar]
54. Huang J, Guan H, Booze RM, Eckman CB, Hersh LB. Эстроген регулирует активность неприлизина в мозге крыс. Неврологи. лат. 2004; 367:85–87. [PubMed] [Google Scholar]
Неврологи. лат. 2004; 367:85–87. [PubMed] [Google Scholar]
55. Casadesus G, Milliken EL, Webber KM, et al. Повышение уровня лютеинизирующего гормона связано со снижением когнитивных функций. Мол. Клетка. Эндокринол. 2007;269: 107–111. [PubMed] [Google Scholar]
56. Rodrigues MA, Verdile G, Foster JK, et al. Гонадотропины и познание у пожилых женщин. Дж. Альцгеймер Дис. 2008; 13: 267–274. [PubMed] [Google Scholar]
57. Casadesus G, Webber KM, Atwood CS, et al. Лютеинизирующий гормон модулирует когнитивные функции и отложение бета-амилоида у трансгенных мышей с болезнью Альцгеймера. Биохим. Биофиз. Акта. 2006; 1762: 447–452. [PubMed] [Google Scholar]
58. Farrer LA, Cupples LA, Haines JL, et al. Влияние возраста, пола и этнической принадлежности на связь между генотипом аполипопротеина Е и болезнью Альцгеймера. Метаанализ. APOE и Консорциум метаанализа болезни Альцгеймера. ДЖАМА. 1997;278:1349–1356. [PubMed] [Google Scholar]
59. Йорм А.Ф., Мазер К. А., Баттерворт П., Ансти К.Дж., Кристенсен Х., Истил С. Генотип APOE и когнитивное функционирование в большой выборке населения, стратифицированной по возрасту. Нейропсихология. 2007; 21:1–8. [PubMed] [Google Scholar]
А., Баттерворт П., Ансти К.Дж., Кристенсен Х., Истил С. Генотип APOE и когнитивное функционирование в большой выборке населения, стратифицированной по возрасту. Нейропсихология. 2007; 21:1–8. [PubMed] [Google Scholar]
60. Cheng X, McAsey ME, Li M, et al. Замена эстрадиола увеличивает белок, связанный с рецептором липопротеинов низкой плотности (LRP) в мозге мыши. Неврологи. лат. 2007; 417:50–54. [PubMed] [Академия Google]
61. Struble RG, Cady C, Nathan BP, McAsey M. Аполипопротеин E может быть критическим фактором нейропротекции гормональной терапии. Фронт. Бионауч. 2008; 13: 5387–5405. [PubMed] [Google Scholar]
62. Stone DJ, Розовский I, Морган TE, Андерсон CP, Финч CE. Увеличение синаптического прорастания в ответ на эстроген через механизм, зависящий от аполипопротеина Е: значение для болезни Альцгеймера. Дж. Нейроски. 1998;18:3180–3185. [Бесплатная статья PMC] [PubMed] [Google Scholar]
63. Horsburgh K, Macrae IM, Carswell H. Эстроген оказывает нейропротекторное действие через аполипопротеин Е-зависимый механизм в мышиной модели глобальной ишемии. Дж. Цереб. Кровоток Метаб. 2002;22:1189–1195. [PubMed] [Google Scholar]
Дж. Цереб. Кровоток Метаб. 2002;22:1189–1195. [PubMed] [Google Scholar]
64. Натан Б.П., Барсукова А.Г., Шен Ф., МакЭси М., Струбл Р.Г. Эстроген способствует удлинению нейритов посредством аполипопротеина Е в культивируемых нейронах коры головного мозга взрослых мышей. Эндокринология. 2004; 145:3065–3073. [PubMed] [Google Scholar]
65. Mattila KM, Axelman K, Rinne JO, et al. Взаимодействие между рецептором эстрогена 1 и аллелем epsilon4 аполипопротеина Е увеличивает риск семейной болезни Альцгеймера у женщин. Неврологи. лат. 2000; 282:45–48. [PubMed] [Академия Google]
66. Yaffe K, Haan M, Byers A, Tangen C, Kuller L. Использование эстрогенов, APOE и снижение когнитивных функций: свидетельство взаимодействия генов и окружающей среды. Неврология. 2000; 54:1949–1954. [PubMed] [Google Scholar]
67. Burkhardt MS, Foster JK, Laws SM, et al. Заместительная терапия эстрогенами может улучшить работу памяти в отсутствие АРОЕ эпсилон4. Дж. Альцгеймер Дис. 2004; 6: 221–228. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
68. Rippon GA, Tang MX, Lee JH, Lantigua R, Medrano M, Mayeux R. Семейная болезнь Альцгеймера у латиноамериканцев: взаимодействие между APOE, инсультом и заменой эстрогена. Неврология. 2006; 66: 35–40. [Бесплатная статья PMC] [PubMed] [Google Scholar]
69. Канехиса М., Гото С., Хаттори М. и др. От геномики к химической геномике: новые разработки KEGG. Нуклеиновые Кислоты Res. 2006; 34:D354–D357. [Бесплатная статья PMC] [PubMed] [Google Scholar]
70. Hanson MA, Gluckman PD. Эволюционные истоки здоровья и болезней: новые идеи. Базовый клин. Фармакол. Токсикол. 2008; 102:90–93. [PubMed] [Google Scholar]
71. Гранжан П. Позднее понимание раннего происхождения болезней. Базовый клин. Фармакол. Токсикол. 2008; 102:94–99. [Бесплатная статья PMC] [PubMed] [Google Scholar]
72. День Ю.С. Текущие отчеты о населении. Вашингтон, округ Колумбия: Типография правительства США; 1993. Прогнозы населения США по возрасту, полу, расе и латиноамериканскому происхождению: с 1993 по 2050 год. стр. 25–1104.
стр. 25–1104.
73. Wimo A, Jonsson L, Winblad B. Оценка распространенности деменции во всем мире и прямых затрат на нее в 2003 г. Dement. Гериатр. Познан. Беспорядок. 2006; 21: 175–181. [PubMed] [Google Scholar]
74. Brookmeyer R, Johnson E, Ziegler-Graham K, Arrighi HM. Прогнозирование глобального бремени болезни Альцгеймера. Демент Альцгеймера. 2007; 3: 186–19.1. [PubMed] [Google Scholar]
75. Rocca WA. Деменция, болезнь Паркинсона и инсульт в Европе: комментарий. Неврология. 2000;54:S38–S40. [PubMed] [Google Scholar]
76. Fratiglioni L, Rocca WA. Эпидемиология деменции. В: Боллер Ф., Каппа С., редакторы. Справочник по нейропсихологии. Амстердам: Эльзевир; 2001. С. 193–215. [Google Scholar]
5 вещей, которые нужно знать об овариэктомии
Каждый год более 2 миллионов американских женщин официально переживают период больших перемен, сопровождающийся характерными для менопаузы приливами, ночной потливостью, перепадами настроения и многим другим. Но для небольшой группы женщин эти и другие пытки не являются просто следствием природы: около 600 000 женщин переживают так называемую хирургическую менопаузу, потому что им удалили яичники.
Но для небольшой группы женщин эти и другие пытки не являются просто следствием природы: около 600 000 женщин переживают так называемую хирургическую менопаузу, потому что им удалили яичники.
Некоторым это делается, чтобы свести к минимуму риск рака яичников. У других с яичниками уже что-то не так, например, кисты, боль или даже экстренная ситуация, связанная с перекручиванием (не гуглите, обещаем). Но независимо от того, почему вы делаете операцию, одно можно сказать наверняка: менопауза наступает немедленно со всеми ее прибамбасами, потому что яичники являются гормональным центром репродуктивной системы. Без них вы больше не будете вырабатывать много эстрогена, что приведет к тем же симптомам, что и при более естественной менопаузе — приливы, сухость и дискомфорт во влагалище, проблемы со сном, изменения настроения, изменения кожи, увеличение веса и многое другое, — говорит Мэтью. Т. Сидхофф, доктор медицинских наук, хирург-гинеколог в Cedars-Sinai в Лос-Анджелесе.
Преимущества удаления яичников, называемого овариэктомией, могут быть огромными. Чрезвычайные ситуации можно предотвратить; боль можно свести к минимуму. Согласно обзору профилактической хирургии, среди женщин, являющихся носителями мутаций генов BRCA1 и BRCA2, удаление яичников может снизить риск развития рака молочной железы и яичников примерно на 80%.
Но это не значит, что операция по удалению яичников — простое решение. Вот несколько вещей, о которых следует помнить.
Операция может быть менее сложной, чем вы думаете. Наименее инвазивный способ удаления яичников — лапароскопический, при котором маленькая камера вводится через небольшой разрез в пупке, чтобы направлять удаление, говорит Сидхофф. «Снижается риск осложнений, таких как тромб или инфекция, и вы проведете меньше времени в больнице», — объясняет он. Лапароскопическая процедура также дает «лучший косметический эффект», говорит он, в то время как открытая операция оставляет шрам, очень похожий на шрам после кесарева сечения. Восстановление после открытой операции может занять немного больше времени, но может быть необходимо для некоторых женщин.
Восстановление после открытой операции может занять немного больше времени, но может быть необходимо для некоторых женщин.
Да, преимущества, такие как более низкий риск рака яичников и рака молочной железы, значительны, но это не означает, что удаление яичников не сопряжено с риском. Фактически, это было связано с серьезно более высоким риском сердечных заболеваний, остеопороза, деменции и смерти по любой причине, вероятно, из-за резкого падения уровня эстрогена. Исследования показывают, что женщины в пременопаузе, у которых яичники были удалены в возрасте 35 лет или моложе, имеют почти в два раза более высокий риск развития когнитивных нарушений или деменции, в семь раз более высокий риск сердечных заболеваний и в восемь раз более высокий риск сердечного приступа, объясняет Филип Саррел. , доктор медицинских наук, почетный профессор акушерства, гинекологии, репродуктивных наук и психиатрии в Йельском университете и президент Фонда улучшения здоровья после гистерэктомии.
Эксперты считают, что повторное введение некоторых недостающих эстрогенов может иметь решающее значение. Однако через 10 месяцев после процедуры только 25% женщин без яичников вообще принимают эстроген, говорит Саррел. Как и многие женщины, вступившие в нехирургическую менопаузу, женщины, которым удалили яичники, также боялись принимать заместительную гормональную терапию (или, точнее, гормональную терапию) из-за противоречивых данных исследования Инициативы женского здоровья, опубликованного в начале 2000-х годов. Мы не будем повторять здесь все детали, но достаточно сказать, что результаты были в значительной степени завышены, и, следовательно, многие женщины избегали гормонов. Тем не менее, многие женщины могут получить пользу от гормональной терапии, с яичниками или без них, до и после менопаузы, говорит Сидхофф, но он особенно рекомендует женщинам, которым удалили яичники в возрасте 30 или 40 лет, принимать ее до тех пор, пока они не станут, по крайней мере, ближе. до естественного возраста менопаузы, обычно 50 или 51 год.
до естественного возраста менопаузы, обычно 50 или 51 год.
В идеале вы должны начать принимать гормональную терапию сразу после удаления яичников (или даже прямо перед ней), говорит Саррел, чтобы избежать острого синдрома отмены гормонов. Время имеет значение, говорит он, потому что чем старше вы начинаете гормональную терапию, тем более рискованной она может быть, как показывают результаты WHI, и тем больший ущерб вашему здоровью уже нанесен. Например, начало гормональной терапии через 6 лет после овариэктомии привело к большему ухудшению здоровья костей, чем начало ее через 3 года после операции, что, в свою очередь, было связано с более слабыми костями, чем начало ее в течение 2 месяцев.
Вы можете сохранить свои яичники, даже если у вас нет матки. Если вам необходимо удалить матку из-за таких проблем, как миома или эндометриоз, ваши яичники определенно могут остаться на месте. На самом деле, учитывая риски потери эстрогена, вы, вероятно, захотите, чтобы они остались. Да, говорит Сидхофф, гистерэктомия — это естественное время, чтобы поднять вопрос об удалении яичников, и в прошлые годы обе операции часто проводились одновременно у женщин в пременопаузе. «Сейчас большинство женщин предпочитают сохранять свои здоровые яичники ради гормонов», — говорит он.
Да, говорит Сидхофф, гистерэктомия — это естественное время, чтобы поднять вопрос об удалении яичников, и в прошлые годы обе операции часто проводились одновременно у женщин в пременопаузе. «Сейчас большинство женщин предпочитают сохранять свои здоровые яичники ради гормонов», — говорит он.
Однако, если вам сделали гистерэктомию, после этого вам необходимо контролировать уровень гормонов, говорит Саррел. Он опубликовал исследование, которое показало, что через 6 месяцев после операции 25% женских яичников перестали функционировать из-за отсутствия кровотока. Через три года после операции так было у 40% женщин. По его словам, остальные 60% были в полном порядке. «Вы можете предположить, что яичники будут продолжать функционировать, но мы должны убедиться, что они производят регулярное количество эстрогена», — говорит он. По его словам, верным признаком того, что это не так, было бы начало симптомов, связанных с менопаузой, таких как приливы, проблемы со сном и чувство депрессии. «Все, что вам нужно сделать, это заменить эстроген, и это конец симптомов».
«Все, что вам нужно сделать, это заменить эстроген, и это конец симптомов».
Если вашей основной целью является профилактика рака, вам необходимо удалить оба яичника. Но если вас беспокоит один-единственный яичник, например, киста, это совершенно безопасно, и даже рекомендуется оставить здоровый яичник. «Одного яичника достаточно, чтобы избежать изменений в потенциале фертильности и гормональной функции», — говорит Сидхофф, а это означает, что у вас будут продолжаться менструации, вы избежите рисков для здоровья, связанных с ранней менопаузой, и, возможно, даже сможете забеременеть.
Если вам удаляют яичники, попрощайтесь с маточными трубами. Это потому, что на самом деле нет веских причин держать их, так как яйцеклетки все равно не будут перемещаться по трубам из яичников.
