Послеоперационный период миома матки: Лапаротомия, миомэктомия (одиночный узел менее 7 см) — 1 категория сложности
Лапаротомия, миомэктомия (одиночный узел менее 7 см) — 1 категория сложности
Лапаротомия, миомэктомия (одиночный узел менее 7 см) — 1 категория сложности
Лапароскопия миомэктомия.
Миома матки (фиброма, лейомиома) – доброкачественные опухоли матки, которые встречаются довольно часто у женщин детородного возраста, в период перименопаузы. В большинстве случаев миомы имеют небольшой размер и не причиняют никакого беспокойства, но иногда миомы могут увеличиться до больших размеров, вызывая клинические симптомы.
Симптомы К симптомам миомы матки относятся: боль в низу живота, кровотечение, различные нарушения мочеиспускания, нарушения менструального цикла.При больших размерах миомы могут появляться признаки анемии( слабость, утомляемость, головокружение) В НМЦ Парацельс проводится оперативное лечение любых видов миом, путем лапароскопического и лапаротомического, резектоскопического удаления миоматозных узлов с сохранением матки, а также удаление матки различным доступом.
Миомэктомия является хирургической операцией, выполняемой на теле матки для удаления доброкачественной опухоли (миомы) из ее мышечной стенки. Проведение операции подразумевает изъятие фиброматозых узлов, при этом тело матки сохраняется, а соответственно детородная функция не нарушается. Миомэктомия, как правило, проводится у молодых пациенток.
Лапароскопическая миомэктомия проводится в случае, когда миома расположена на внешней стороне стебля матки (ножки) или субсерозные узлы прикреплены близко к наружной части.
Операция, проводимая при помощи лапароскопа, относится к органосохраняющим хирургическим вмешательствам, что означает сохранение репродуктивной функции женщины.
Лапароскопия — современный метод хирургии, при котором операции на внутренних половых органах проводят через небольшие (обычно 0,5—1,5 см) отверстия на передней брюшной стенке.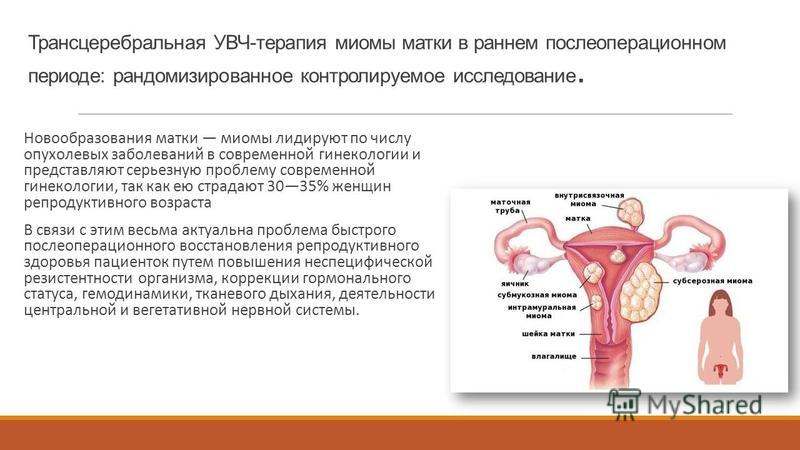
Операция на органах малого таза осуществляется из нескольких небольших разрезов, куда вводятся специальные инструменты. Предварительно брюшная полость наполняется стерильным газом, который позволяет отодвинуть внутренние органы друг от друга. Обзор осуществляется с помощью видеокамеры, которая также вводится в брюшную полость.
С помощью введенных инструментов хирург проводит удаление миоматозного узла, ложе узла или его ножка ушиваются, восстанавливается стенка матки.
Миоматозный узел(узлы) удаляются из брюшной полости после размельчения специальным инструментом- морцеллятором.Все удаленные ткани обязательно отправляются на гистологическое исследование.
После осмотра и очищения(санации) брюшной полости, контроля отсутствия кровотечения, инструменты удаляются. Выводится газ и брюшной полости. В Нашем МЦ Парацельс во время лапароскопических операций используется оборудование фирмы Karl Storz (производитель №1 в мире лапароскопии), электрокоагуляция проводится биполярным электродом, что исключает электротравму пациентки во время операции, минимизирую термическую травму внутренних половых органов. На сегодняшний день существует ряд специальных гелей, который хирург вводит в брюшную полость для профилактики спайкообразования
Выводится газ и брюшной полости. В Нашем МЦ Парацельс во время лапароскопических операций используется оборудование фирмы Karl Storz (производитель №1 в мире лапароскопии), электрокоагуляция проводится биполярным электродом, что исключает электротравму пациентки во время операции, минимизирую термическую травму внутренних половых органов. На сегодняшний день существует ряд специальных гелей, который хирург вводит в брюшную полость для профилактики спайкообразования
Основные преимущества лапароскопического метода удаления миомы матки:
-выполнение нескольких небольших разрезов, что значительно сокращает срок реабилитации и восстановления организма пациента, а так же исключает образование шрамов;
-минимальный болевой синдром в послеоперационном периоде;
-низкая вероятность бактериального и инфекционного заражения операционной области, так как в ходе процедуры брюшная полость не вскрывается;
Показания:1. Субсерозно и субсерозно-интерстициальная миома матки. Обследование на оперативное вмешательство и сроки действия результатов обследования:Весь объем предоперационного обследования Вы можете пройти в Нашем МЦ Парацель за один день!
Субсерозно и субсерозно-интерстициальная миома матки. Обследование на оперативное вмешательство и сроки действия результатов обследования:Весь объем предоперационного обследования Вы можете пройти в Нашем МЦ Парацель за один день!
- кольпоскопия-12мес
- УЗИ органов малого таза
- УЗИ вен нижних конечностей – 3месУЗИ брюшной полости, почек и мочевого пузыря, забрюшинного пространства
- Мазок на флору, бактериологический посев из цервикального канала -10дн
- онкоцитология с шейки матки – 6мес
- Общий анализ мочи-10 дн, Анализ кала на скрытую кровь-10дн.Общий анализ крови и ретикулоциты -10 дн,
- Электрокардиограмма с расшифровкой -14дн,
- Кровь на ВИЧ, Гепатит В, Гепатит С, Сифилис 3мес.
- Биохимический анализ крови: общий, прямой, непрямой Билир., Общий Белок, альбумин, мочевина, глюкоза, креатинин, мочевая кислота, АСТ,АЛТ, ЩФ, натрий и калий крови,холестерин, рН крови -10дн
- Коагулограмма — 10дн
- Группа Крови и резус фактор
- Флюрография — 6мес.

- Маммография -24мес (после 36 лет), УЗИ молочных желез (до 36 лет) -12мес
- Консультация Терапевта, анестезиолога и других специалистов,по показаниям.По показаниям могут быть добавлены другие обследования.Обезболивание: Данные операции проводятся под эндотрахеальным наркозом. При этом методе обезболивания пациентка полностью расслаблена, во время проведения операции спит.Болевые ощущения после пробуждения минимизируются путем введения специальных препаратов. Противопоказания:
Плановое вмешательство не проводят при клинически значимых нарушениях свертываемости крови, острых инфекциях, декомпенсированных соматических заболеваниях (гипертонии, нестабильной стенокардии, тяжело протекающем сахарном диабете, выраженной анемии). После проведения оперативного лечения в Нашем МЦ Парацельс с 1х послеоперационных суток пациентки начинают физиолечение, что благоприятно сказывается на послеоперационном течении, профилактирует образование спаек и улучшает процессы заживления рубца на матке.
Восстановление месячного цикла после удаления миомы матки
Вид операции и оперативного доступа определяют течение периода после удаления миомы и восстановления женского организма при миоме матки.
При миоме матки могут быть использованы следующие операции:
Органосохраняющие:
- Абдоминальным доступом;
- Лапароскопическим;
- Гистероскопическим;
Радикальная — гистерэктомия:
- Ампутация — с сохранением шейки матки;
- Экстирпация.
При органосохраняющем типе операции производится удаление только миоматозных узлов с сохранением матки. Радикальная операция предполагает удаление матки с придатками или без них по показаниям.
Послеоперационным периодом называется время от момента проведения оперативного вмешательства до восстановления работоспособности пациентки.
В послеоперационном периоде выделяют 3 этапа со своими особенностями и осложнениями:
- Ранний;
- Поздний;
- Отдаленный.

Ранний послеоперационный период
Под ранним послеоперационным периодом подразумевается время от момента операции до выписки женщины из стационара.
Среди основных задач на первом этапе восстановления выделяют:
- Предупреждение развития послеоперационных осложнений;
- Своевременная диагностика и лечение возникших осложнений.
Транспортировка женщины в реанимационное отделение после хирургического вмешательства осуществляется при полном восстановлении самостоятельного дыхания.
В палате интенсивной терапии на 30 минут на область живота кладется пузырь со льдом, что проводится в качестве профилактики раннего кровотечения.
Посленаркозные осложнения
Посленаркозный период длится до полного пробуждения пациентки под контролем медперсонала, что связано с риском развития осложнений после наркоза:
- западение языка;
- рвота;
- нарушенная терморегуляция;
- нарушенный сердечный ритм.

Нарушение сердечного ритма и дыхания, западение языка связаны с расслаблением мышц.
Опасность западения языка заключается в возможном перекрытии им просвета дыхательных путей. При рвоте также может возникнуть асфиксия в результате регургитации и аспирации рвотными массами.
Основной метод профилактики данных осложнений — постоянный контроль за пациенткой и поворот головы набок.
Нарушенная терморегуляция может проявляться в виде гипо- или гипертермии, что требует согревания или охлаждения женщины.
Основной жалобой пациентки после удаления миомы матки является боль разной интенсивности в области послеоперационной раны. Для избегания осложнений, связанных с болью, применяются медикаментозные и нефармакологические методы, направленные на:
- уменьшение интенсивности болезненных ощущений;
- снижение продолжительности боли.
С целью профилактики ранних послеоперационных осложнений женщине рекомендовано:
- ношение компрессионных чулок или эластичных бинтов;
- ранняя физическая активность, что заключается в ранней активизации женщины.
 В зависимости от вида операции вставать можно через несколько часов после нее или на следующие сутки;
В зависимости от вида операции вставать можно через несколько часов после нее или на следующие сутки; - соблюдение диеты. В первые сутки разрешены бульоны или перетертая пища. После самостоятельного опорожнения кишечника возможен переход на обычную еду.
В раннем послеоперационном периоде женщине назначаются следующие препараты:
2. антибактериальные препараты с целью профилактики гнойно-септических осложнений;
3. антикоагулянты с целью профилактики образования тромбов;
4. инфузионная терапия с целью восполнения объема циркулирующей жидкости, или ОЦК, в результате кровопотери.
Ранние послеоперационные осложнения
Среди ранних послеоперационных осложнений после удаления миомы матки выделяют:
изменение послеоперационного рубца в виде:
- воспаления, которое сопровождается гиперемией, отечностью и болезненностью;
- гнойного отделяемого из раны;
- расхождения швов;
изменения мочеиспускания в виде:
- болезненных ощущений;
- резей;
- травматического уретрита из-за повреждения слизистой оболочки мочеиспускательного канала;
кровотечение:
- наружное;
- внутреннее, обусловленное недостаточным гемостазом.

- ТЭЛА, или тромбоэмболия легочной артерии, возникающая из-за закупорки ветвей легочной артерии тромбами;
- тромбофлебит;
- перитонит, который возникает из-за воспаления брюшины;
- гематомы в области послеоперационного шва;
- пневмония гипостатического типа;
- непроходимость кишечника паралитического типа;
- сердечно-сосудистая недостаточность.
В норме мажущие кровяные выделения после операции продолжаются до 10 — 14 дней, что связано с процессами регенерации тканей.
Выписка из стационара зависит от типа оперативного доступа:
- лапароскопия — от 3 до 5 дней;
- лапаротомия — от 8 до 10 дней.
Поздний послеоперационный период
Под поздним периодом после удаления миомы подразумевается период от момента выписки из стационара в течение двух месяцев.
Поздние послеоперационные осложнения
Среди поздних постоперационных осложнений выделяют:
- грыжи;
- кишечную непроходимость спаечного типа.
Реабилитационный период
В поздний период после удаления миомы необходимо соблюдение рекомендаций врача для минимизации риска развития осложнений и более быстрого восстановления организма женщины.
В течение 2 месяцев после проведения оперативного вмешательства женщине рекомендовано:
- ношение послеоперационного бандажа, который обеспечивает поддержку внутренних органов;
- запрещено выполнение тяжелой физической нагрузки, поднятие тяжестей;
- при отсутствии осложнений возможно вести половую жизнь;
- нельзя подвергаться тепловому воздействию в виде ванн, бань, саун;
- при наличии выделений из половых путей необходимо использовать прокладки вместо тампонов;
- рекомендовано поддерживать режим питания с преобладанием клетчатки, что позволит избежать запоров.

Если женщине проведена органосохраняющая операция, необходима обязательная контрацепция в течение 1 года.
При необходимости дополнительно врач подбирает гормональную терапию.
Больничный лист выдается женщине на время восстановительного периода, который зависит от вида операции:
- лапароскопия — от 14 до 18 дней;
- экстирпация матки — 30 — 45 дней;
- надвлагалищная ампутация матки — 25 — 28 дней.
Отдаленный послеоперационный период
Отдаленным послеоперационным периодом называется время до окончательного исхода заболевания в виде:
- выздоровления;
- инвалидности;
- смерти.
Среди отсроченных осложнений выделяют:
- спаечный процесс;
- рецидив миомы матки при органосохраняющей операции;
- климактерический синдром;
- остеопороз;
- опущение влагалища.

Спаечный процесс
Спаечный процесс является следствием оперативного вмешательства на органах брюшной полости. Спайки представляют собой тяжи из соединительной ткани, которые могут образовываться между брюшиной, внутренними органами.
Одним из основных средств профилактики спаек в раннем послеоперационном периоде является ранняя двигательная активность.
Климактерический синдром
Климактерический синдром представляет собой развитие менопаузы у женщины детородного возраста в результате гистерэктомии. При этом операция может проходить с удалением или оставлением придатков.
Данное осложнение переносится тяжело вследствие резкой гормональной перестройки женского организма. Симптомы аналогичны климактерическим и проявляются в виде:
Симптомы аналогичны климактерическим и проявляются в виде:
- приливов;
- повышенной потливости;
- лабильности нервной системы;
- снижение либидо.
В зависимости от возраста женщины назначается заместительная гормональная терапия, которая может включать в себя прием:
- натуральных эстрогеновых препаратов;
- эстроген-гестагенных препаратов в физиологическом цикле;
- при удалении матки проводится монотерапия эстрогенами.
ЗГТ назначается через 1 — 2 месяца после операции на срок от 2 — 3 месяцев до 10 и более лет женщинам до 60-летнего возраста при отсутствии противопоказаний.
Остеопороз развивается в результате снижения выработки эстрогенов. При этом наблюдается снижение концентрации кальция в организме, что приводит к истончению костной ткани и повышению риска переломов.
Опущение влагалища
Опущение влагалища после удаления матки связано с:
- травматизацией поддерживающего аппарата матки;
- опущением в малый таз внутренних органов, что ведет к цистоцеле, или опущению мочевого пузыря, и ректоцеле, или опущению прямой кишки.

В ряде случаев проводится пластика влагалища.
Послеоперационный период после гистероскопической миомэктомии
Гистероскопическая миомэктомия проводится при субмукозной типе миоматозного узла.
Выполняется оперативное вмешательство на 5 — 7 день менструального цикла. После операции женщина может покинуть стационар в день ее проведения.
Гистероскопическое вмешательство относится к органосохраняющей операции и имеет короткий реабилитационный период, который занимает 14 дней.
Планирование беременности возможно спустя 6 — 12 месяцев после операции.
Послеоперационный период требует соблюдения рекомендаций врача в течение 1 месяца. В это время запрещено:
- поднятие тяжестей и активная физическая нагрузка;
- тепловые процедуры в виде ванн, бани, сауны;
- воздействие ультрафиолета;
- переохлаждения;
- спринцевания;
- половые акты.

Дополнительно назначается гормональная терапия.
Осложнения гистероскопической миомэктомии
Среди возможных осложнений гистероскопической миомэктомии выделяют:
- газовую эмболию маточных сосудов;
- перфорацию стенок матки;
- гематометру;
- инфекционные осложнения;
- воспалительные реакции;
- бесплодие.
послеоперационный период и реабилитация – медицинский центр Омега-Киев
Миома матки – доброкачественная опухоль, которая развивается в мышечном слое матки. Болезнь довольно распространенная, встречается в 30% от общего числа гинекологических заболеваний. Особенным фактором риска развития миомы матки является климактерический период. Также, влиять на развитие миомы матки может генетическая предрасположенность и воспалительный процесс в половых органах.
Также, влиять на развитие миомы матки может генетическая предрасположенность и воспалительный процесс в половых органах.
Причины образования миомы:
- Малоподвижный образ жизни;
- Ожирение;
- Сахарный диабет;
- Нарушение обмена веществ;
- Последствия перенесенных абортов.
Хирургическое лечение миомы матки
В зависимости от показаний, стадии и формы болезни, миома матки может лечится медикаментозным и хирургическим методами. Для пациенток детородного возраста используется преимущественно медикаментозное лечение. Хирургическое лечение назначается при быстром росте опухоли, сдавлении мочевого пузыря, ее расположение в области шейки матки.
Типы операций при миоме матки:
- Лапароскопия . Операция, которая проводится через небольшие разрезы в брюшной полости. Максимальная точность достигается путем контроля через аппарат ультразвукового исследования;
- Гистероскопия . Удаление опухолей в матке специальными инструментами интравагинальным способом;
- Полостная операция.
 Процедура проводится путем разреза в нижней части живота;
Процедура проводится путем разреза в нижней части живота; - Гистерэктомия. Процедура полного иссечения органа. Имеет специальные показания к применению.
Восстановление после операции
Состояние пациента, после оперативного вмешательства, может отличаться и является сугубо индивидуальным в каждом клиническом случае.
Реабилитация после операции при миоме матки включает:
- Соблюдение диеты. Необходимо придерживаться специального рациона питания, которое приведет в норму стул – в период восстановления нельзя допускать поносы и запоры;
- Активный образ жизни. Рекомендовано записаться в секцию плавания, посещать аэробику, пилатес. Ежедневно проводить прогулки на свежем воздухе, по утрам выполнять зарядку. В случае со спортом, главное не переусердствовать. Не стоит проводить силовые тренировки, выполнять прыжки и сложные акробатические упражнения;
- Гормональная терапия. Курс проводится строго по назначению лечащего врача, для предостережения раннего климакса;
- Половая жизнь.
 Для полноценной реабилитации не позволяется вести активную половую жизнь в первые 2-3 месяца после операции;
Для полноценной реабилитации не позволяется вести активную половую жизнь в первые 2-3 месяца после операции; - Отдых. Нужно обязательно высыпаться, отдыхать, избегать переутомления. Полноценный сон, отсутствие негативных эмоций и стрессов – способствуют ускоренному восстановлению.
Также, в первые несколько месяцев после операции запрещено посещать сауны, бани, солярий. Полезно отправится в санаторий и пройти восстановительный курс с радоновыми ваннами.
Лапароскопическое удаление миомы в Москве
Миома представляет собой доброкачественное новообразование, которое формируется из мышечной ткани. Чаще всего ее диагностируют у женщин репродуктивного возраста. Размер может быть разным – от крошечной опухоли размером с горошину до образования гигантских размеров.
Чаще всего эту проблему устраняют оперативным путем. В French Clinic проводится щадящее и эффективное лапароскопическое удаление миомы, а также лапаротомия под чутким руководством опытных специалистов, с применением оборудования современного образца.
Причины возникновения, симптомы патологии
Точные причины возникновения миоматозных узлов до сих пор не выяснены. Но есть предположения, что склонность к патологии передается по наследству. Также образования могут появиться из-за гормональных сбоев, при диабете, после прерывания беременности, в результате инфекций, при болезнях мочеполовой системы.
Симптомы:
- Нарушения в менструальном цикле. Выделения могут быть слишком обильными, со сгустками крови. Иногда отмечаются произвольные маточные кровотечения, которые могут стать причиной малокровия у женщины.
- Боли в пояснице и внизу живота.
- Боли во время полового акта.
- Возникновение запоров.
- Невынашивание беременности, бесплодие.
- Увеличение размера живота.
- Учащенное мочеиспускание.
Но если узлы маленького размера, заболевание протекает практически бессимптомно. Поэтому так важно проходить регулярные профилактические осмотры у гинеколога. Если же вы отмечаете у себя хотя бы один из вышеперечисленных симптомов, то визит к специалисту должен быть незамедлительным.
Если же вы отмечаете у себя хотя бы один из вышеперечисленных симптомов, то визит к специалисту должен быть незамедлительным.
Методы лечения
Стратегия терапии разрабатывается с учетом размера и количества узлов, возраста пациентки, состояния ее здоровья. В некоторых случаях патологию просто наблюдают. Если узлы небольшие, то врач может посоветовать медикаментозную терапию. Прием гормональных лекарств может приостановить рост и даже уменьшить размеры образования.
Если же узлы большие и доставляют пациентке явный дискомфорт, то лапароскопическая миомэктомия или лапаротомия являются наиболее эффективными методами борьбы с проблемой.
Подготовка к операции
Перед оперативным вмешательством необходимо сдать анализы крови, мочи, пройти УЗИ органов малого таза, сдать гинекологический мазок, ЭКГ, флюорографию, заключение терапевта об общем состоянии организма. За несколько дней до операции необходимо придерживаться легкой диеты. Накануне следует сделать очищающие клизмы.
Удаление миомы лапароскопией
Миомэктомия предполагает устранение только миоматозных узлов. Операция проводится щадящим методом, что позволяет женщине сохранить детородный орган. После операции менструальный цикл восстанавливается, сохраняется возможность в будущем иметь детей.
Удаление миомы лапароскопическим доступом проводится, если новообразование небольших или умеренных размеров, нет выраженного спаечного процесса в брюшной полости и тяжелых общих заболеваний, являющихся противопоказанием для данной методики. Через маленькие проколы (0,5 — 1 см) в брюшной полости вводятся эндоскопические инструменты, видеокамеры, посредством которых удаляют узлы. На раны накладывают швы. Период восстановления после лапароскопической миомэктомии – 3-5 дней.
Удаление миомы больших размеров
Лапаротомия – это полостная операция, которая может иметь как продольный, так и поперечный характер операционного доступа. Этот метод используется, если необходимо удаление миомы больших размеров, а также при наличии у пациентки противопоказаний к проведению лапароскопии. Период восстановления после лапаротомии более продолжительный – 3-4 недели.
Период восстановления после лапаротомии более продолжительный – 3-4 недели.
В послеоперационный период женщине рекомендуется носить специальный бандаж, не поднимать тяжести, не допускать запоров, ограничить физические упражнения (первый месяц).
Запишитесь на прием к гинекологу
Наши специалисты проведут операцию наиболее подходящим в каждом конкретном случае способом на высоком профессиональном уровне. Обратитесь в French Clinic за консультацией опытного специалиста.
Оставьте свой номер телефона.
Вам перезвонит администратор клиники.
Популярные вопросы
1. Может ли образование переродиться в рак матки?
Вероятность трансформации этой доброкачественной опухоли в злокачественную очень мала – всего 0,3-0,7% случаев.
2. Возможно ли родить после миомэктомии?
Беременность вполне возможна. Но стоит повременить и не перегружать ослабленную операцией матку беременностью в первые месяцы после оперативного вмешательства.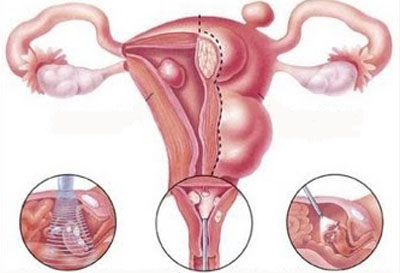
3. Действительно ли миома может исчезнуть при беременности?
Это опасное сочетание. Если плод делит матку с миомой, то сохраняется вероятность выкидыша, может наступить кислородного голодание, истончение плаценты. Колебание гормонального фона при беременности может привести как к росту образования, так и к регрессии. Но второй случай встречается намного реже, чем первый. Поэтому лучше всего позаботиться об устранении доброкачественной опухоли еще на стадии планирования беременности.
4. Стоит ли отложить операцию по удалению до наступления климакса?
Патологию необходимо оперировать лишь в том случае, если она располагается под слизистой матки, при быстром росте узлов, либо если она “симптомная”, то есть способствует обильным менструациям, запорам, частым позывам на мочеиспускание (за счет сдавления прямой кишки, мочевого пузыря). В других случаях миоматозные узлы необходимо наблюдать до наступления климакса, поскольку в менопаузе на фоне нехватки половых гормонов узлы не растут, регрессируют и даже могут уменьшаться в размерах.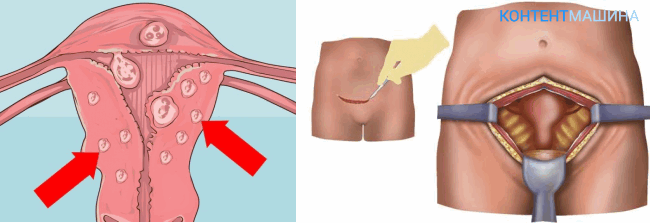
Сложный случай атипичного расположения миомы матки -Наши новости
НАШИ БУДНИ: Сложный случай атипичного расположения миомы маткиВ ГКБ № 15 им. О.М. Филатова недавно проанализирован один интересный клинический случай. У пациентки Б., 46 лет, проходившей лечение в 12-м гинекологическом отделении (база – Университетская клиника МГМСУ) и поступившей на плановое оперативное удаление миомы матки. Интерес представляет шеечная локализация узла (миоматозный узел до 9 см в диаметре).
В плановом порядке профессором, д.м.н. С.И. Киселевым произведена малоинвазивная органосохраняющая операция в объёме лапароскопии и миомэктомии.
Сложность данной операции заключается в атипичном расположении миомы матки, которое встречается всего в 5-8 % случаев.
Хирургическое лечение больных с атипичным расположением миомы относится к категории травматичных, технически сложных операций и имеет высокий риск интра- и послеоперационных осложнений.
Благодаря высокому профессионализму оперирующих хирургов послеоперационный период у данной больной протекал без осложнений, пациентка была выписана на пятые сутки в удовлетворительном состоянии.
НАША СПРАВКА:
Миома матки (также фибромиома, лейомиома)— это доброкачественная опухоль, возникающая в мышечном слое матки — миометрии. Является одним из самых распространенных недугов у женщин в момент позднего репродуктивного периода и перед климаксом, достигая частоты 12-25% от всех гинекологических заболеваний. Существует мнение, что истинная распространенность миомы значительно больше и достигает более 70% как в России, так и за рубежом.
Узел миомы представляет собой клубок хаотично переплетающихся гладкомышечных волокон округлой формы. Большинство узлов имеют диаметр от нескольких миллиметров до нескольких сантиметров, но иногда они могут достигать очень больших размеров и веса в несколько килограммов.
Причины появления миомы до конца не изучены.
Для лечения миомы матки на протяжении многих десятилетий применяется хирургическое удаление узлов (вылущивание) и удаление матки.
Классификация
По количеству узлов:
- одиночная миома;
- множественная миома.

По расположению узлов в матке:
- Подслизистые узлы (субмукозная миома) — расположены ближе к полости матки. Встречаются относительно редко, иногда имеют тонкую ножку и могут опускаться из матки в шейку матки или во влагалище; в этом случае говорят о «рождающемся» узле миомы.
- Межмышечные узлы (интерстициальную, интрамуральную) — узлы находятся в стенке матки в мышечном слое.
- Подбрюшинные узлы (субсерозная миома) — расположены на наружной стороне матки, ближе к брюшной полости. Могут иметь основание меньшего диаметра, чем сам узел; в этом случае употребляют термин «узел на ножке».
- Межсвязочные узлы (интралигаментарная миома).
- Шеечная миома.
Наиболее распространенной является интерстициальная миома матки. По данным разных авторов её частота колеблется от 50 до 61% и более. Частота субсерозной миомы — от 26 до 35%, субмукозной — не более 13%.
В 50% случаев это заболевание протекает бессимптомно. Оно более характерно для небольшой одиночной или множественной миомы с межмышечным и подбрюшинным расположением.
Симптомы
Наиболее типичными симптомами являются сильные менструальные кровотечения (меноррагии), чувство давления и боли внизу живота. Меноррагии более характерны для подслизистых миом. При росте миомы менструации постепенно становятся более обильными и продолжительными, нередко приводя к развитию малокровия (анемии). Чувство тяжести или давления внизу живота более характерно для межмышечной и подбрюшинной миомы, особенно при больших размерах узлов. Боли, как правило, возникают во время менструаций и носят схваткообразный характер, но могут быть постоянными. Боли также могут иметь внезапный режущий характер, что отмечается при очень редком осложнении — перекруте ножки подбрюшинного узла. К более редким симптомам миомы матки относят бесплодие и нарушение функции соседних органов: мочевого пузыря и прямой кишки.
Диагностика
Для диагностики миомы матки наиболее информативным методом считается ультразвуковое исследование, при котором миома обнаруживается в виде округлых очагов пониженной эхогенности (имеющих менее плотную структуру, чем миометрий). В некоторых случаях для дифференциальной диагностики миомы матки и опухоли яичника используют магнитно-резонансную томографию.
В некоторых случаях для дифференциальной диагностики миомы матки и опухоли яичника используют магнитно-резонансную томографию.
Особенности проведения полостной операции по удалению матки и реабилитационный период после нее
Полостное удаление матки подразумевает кожный разрез на передней брюшной стенке, через который осуществляется хирургическое вмешательство. Этот способ применяется при сложных патологиях или некоторых особенностях женского организма.
Полостное удаление матки рекомендуют при следующих заболеваниях:
- миоме матки – образовании доброкачественных опухолей больших размеров;
- эндометриозе – внутри матки образовываются ткани, которые выстилают ее изнутри и распространяются на окружающие органы;
- опущение матки – при ослаблении мышц матка опускается во влагалище, создавая массу неприятных ощущений;
- болезненные ощущения в тазовой области – возникают при наличии патологий, например, миомы, спаек, инфекций, травмы;
- рак матки, шейки матки, маточных труб или яичников;
- аномальные маточные кровотечения – появляются при гормональном дисбалансе, наличии инфекций, миом, полипов, злокачественных опухолей, а также после менопаузы.

Миома матки как одна из главных причин полостного удаления матки
Одной из самых распространенных женских патологий являются доброкачественные опухоли – фибромиомы, или просто миомы. Примерно у половины женщин в возрасте от 30 до 47 лет имеются миомы разного размера и сложности. Миома представляет собой образование соединительных клеточных структур на маточных стенках. В зависимости от места образования миомы делятся на:
- субсерозные – появляются под серозным слоем матки с наружной стороны и растут в брюшную область;
- интерстициальные – формируются в глубине мышечного слоя матки;
- субмукозные – образовываются под слизистым слоем внутри матки.
Причиной образования миомы наиболее часто является гормональный дисбаланс. Если на ранних сроках выявить миому и привести гормональный фон в порядок, то существует большая вероятность, что миома рассосется сама.
Лечение миомы бывает консервативное и хирургическое. Если в первом случае достаточно приема гормональных препаратов, то во втором понадобится полостная операция по удалению миомы матки. Показаниями к хирургическому вмешательству является следующее:
Показаниями к хирургическому вмешательству является следующее:
- большие размеры образования;
- субмукозный характер узлов;
- образование опухолей в яичниках;
- быстрое увеличение размеров опухоли;
- болезненные ощущения в нижней части живота, в левом или правом боку;
- у женщины не получается забеременеть на протяжении длительного времени или из-за фибромы случился выкидыш;
- есть вероятность, что доброкачественная опухоль переродится в злокачественную;
- обильные менструации или кровотечения, которые появляются вне зависимости от менструального цикла.
Полное восстановление после полостного удаления миомы матки происходит в среднем через 2-6 месяцев, в зависимости от сложности патологии и индивидуальных особенностей организма пациентки.
Если миома небольших размеров, то матка остается целой и восстанавливается детородная функция. На запущенных этапах заболевания, когда фиброма достигла больших размеров, может понадобиться удаление матки.
Подготовка к полостному удалению матки или миомы
Перед полостной операцией по удалению матки или миомы пациентка проходит полное обследование у лечащего врача. Ей будет предоставлен ряд рекомендаций, которые нужно выполнять на протяжении последних 2 дней перед операцией. Так, подготовка к полостной операции по удалению матки предполагает следующие рекомендации:
- нельзя кушать и пить что-либо после полуночи в день операции, этот запрет распространяется даже на жевательную резинку;
- если были прописаны медикаменты, нужно продолжить их прием, но запивать только одним глотком воды;
- нельзя курить после полуночи в день операции;
- нельзя наносить косметику на лицо, красить ногти; если у пациентки искусственные ногти, то их нужно снять на время операции, так как именно по ногтям можно судить о снабжении организма кислородом;
- не стоит надевать драгоценности, контактные линзы;
- обязательно взять список назначенных лекарственных препаратов и их дозировок;
- при наличии предоставить страховой полис.

В день операции медсестра измеряет основные показатели жизнедеятельности (температуру, пульс, кровяное давление). Нужно быть готовым ответить на ряд вопросов, касающихся самочувствия. Также может понадобиться сдать кровь и мочу на анализ.
Чтобы предотвратить обезвоживание организма, пациентке ставят капельницу. Она будет стоять и на протяжении нескольких дней после операции, пока женщина не сможет пить самостоятельно. Чтобы уменьшить риск инфицирования, во время операции будут введены антибиотики. Если пациентка заметно нервничает, ей сделают успокаивающий укол.
После того, как пациентка уснула под анестезией, в ее мочевой пузырь вводится катетер, а в желудок — назогастральная трубка. Через первый будет выводиться моча, а через трубку – выделения из желудка.
Длительность операции будет зависеть от сложности заболевания, общего состояния здоровья пациентки и опыта хирурга. Обычно она занимает около 30-40 минут. В результате удаления матки на брюшной стенке будет шов длиной около 20 см, которому нужно уделить особое внимание в период реабилитации.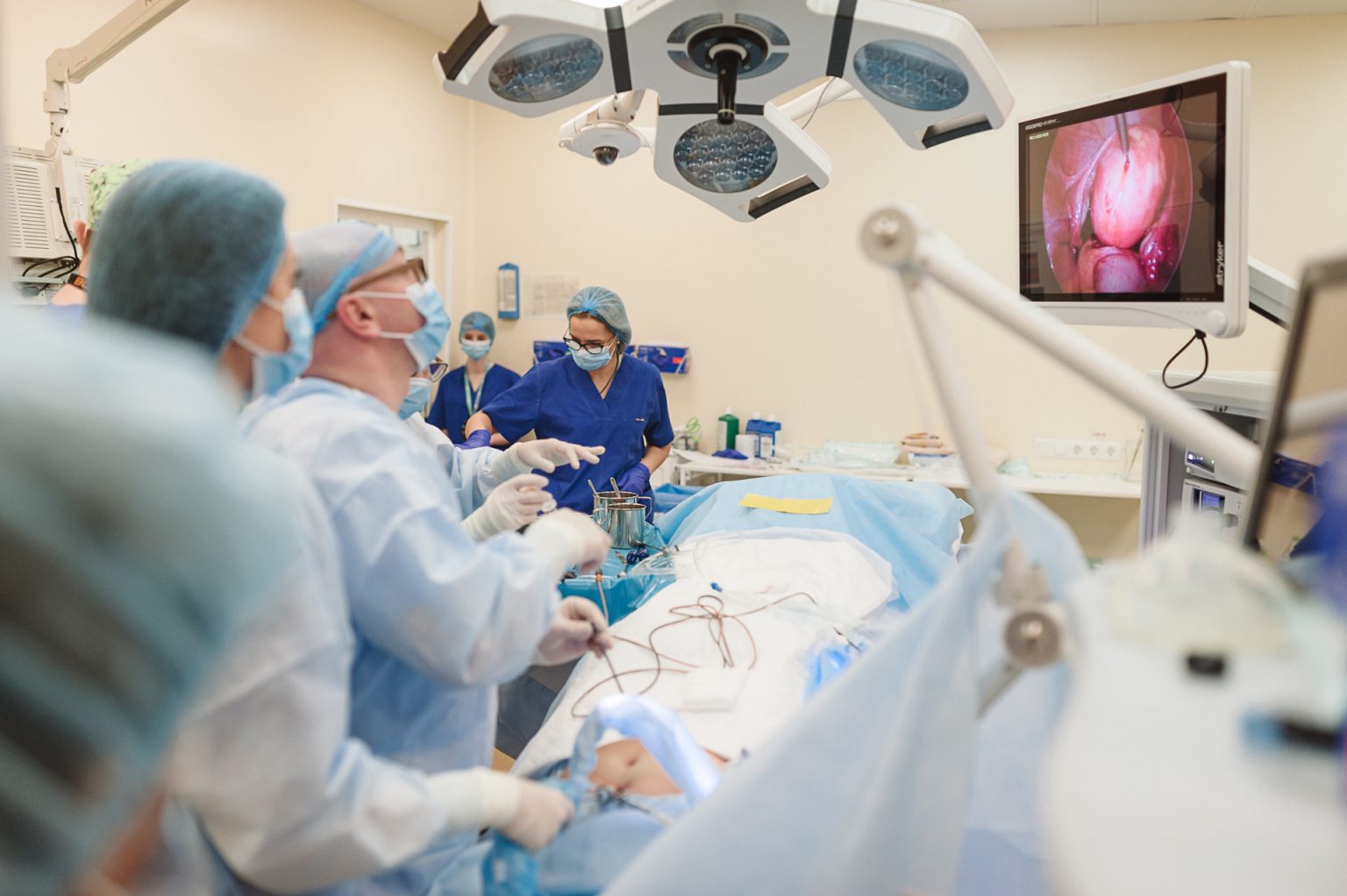
Восстановление после полостной операции по удалению матки
Операция по удалению матки несложная и обычно проходит без осложнений, но каждый организм по-разному реагирует на хирургическое вторжение. Женщина может испытывать неприятные ощущения как сразу после операции, так и на протяжении всего периода восстановления.
Примерно первые 1-2 недели после операции «спутниками» женщины будут слабость, сонливость или бессонница, проблемы с концентрацией внимания, плохой аппетит, разбитость, болезненные ощущения в горле (из-за трубки, которая обеспечивала дыхание во время удаления матки или миомы). Если через некоторое время эти симптомы не проходят, то нужно посетить врача.
После полостной операции по удалению матки или миомы некоторое время нужно придерживаться щадящего режима – это примерно 2-6 месяцев. Если послеоперационный период проходит со сложностями, врач может его продлить еще на несколько месяцев.
Сразу после операции в медицинском учреждении женщина находится под постоянным наблюдением доктора, медсестра периодически измеряет показатели жизнедеятельности организма, поэтому на начальном этапе восстановления осложнения практически не наблюдаются. Плохое самочувствие появляется уже после выписки, когда женщина сама контролирует процесс восстановления.
Плохое самочувствие появляется уже после выписки, когда женщина сама контролирует процесс восстановления.
Чтобы избежать возможных осложнений, нужно выполнять следующие рекомендации:
- После операции пациентка может испытывать болезненные ощущения, но с каждым днем они становятся слабее. Как правило, хирург назначает обезболивающие препараты – их нужно принимать, четко следуя инструкции, и ни в коем случае не увеличивать дозировку без разрешения доктора. Если боли не слишком ощутимы, то можно пропустить прием обезболивающего.
- При приме антибиотиков и обезболивающих средств лучше не садиться за руль, так как многим пациенткам сложно реагировать на экстремальную дорожную обстановку.
- Не стоит опасаться ходьбы по лестнице – она только пойдет на пользу, так как позволяет поддерживать в тонусе тазовые и бедренные мышцы.
- Прогулки на свежем воздухе – обязательная часть реабилитационного периода. Они не должны быть слишком длительными, но ежедневными.

- Нельзя поднимать тяжести более 5-7 кг примерно полтора месяца. Если у женщины есть маленькие дети, то их можно сажать на колени, а вот поднимать противопоказано.
- Нужно чередовать время работы и отдыха.
- Избегать стрессовых ситуаций; если работа нервная – лучше продлить больничный.
- Избегать запоров, метеоризма и других проблем с кишечником, соответственно, нужно правильно питаться и соблюдать питьевой режим.
- Если самочувствие хорошее, можно выполнять несложные физические упражнения. Они положительно скажутся на выздоровлении. После 6 недель можно приступать к интенсивным нагрузкам.
- Что касается интимной жизни, то при хорошем самочувствии противопоказаний никаких нет, если хирург не рекомендовал некоторое время воздержаться от секса.
- Если боль резко усилилась, постоянно нарастает или сопровождается повышением температуры выше +38°С, стоит немедленно посетить врача. Также признаками для визита к доктору или вызова его на дом является рвота или диарея, сильные покраснения вокруг шва, из шва сочится кровь, мутная жидкость или из раны идет неприятный запах.

- Особое внимание нужно уделить шву, так как он имеет значительные размеры и требует тщательного ухода. Первое время вокруг шва возможны покраснения – это нормально. Первые две недели нельзя самостоятельно удалять стерильный пластырь, но если он сам отпадет – ничего страшного. Натяжение в области шва – это тоже нормально. Нельзя подставлять шов под воздействие прямых солнечных лучей. Без рекомендации доктора нельзя использовать кремы, мази. Если на шве и вокруг него образуется корочка, то засохшие части можно аккуратно смывать. Примерно через полгода-год шов полностью заживет и станет менее заметным. Пока шов полностью не зажил, не стоит посещать бассейны, сауны и бани.
Осталось дней: 13
Уважаемые пациенты! Клиника «Центр ЭКО» приглашает вас на бесплатный прием репродуктолога с проведением УЗИ и составлением плана лечения.
Начните свой путь к счастью — прямо сейчас!
Другие статьи
Уважаемые пациенты! Забота о вашем здоровье и безопасности – наш долг. «Центр ЭКО» предпринимает все необходимые меры для вашей защиты, в соответствии с рекомендациями Министерства Здравоохранения и Роспотребнадзора по предотвращению распространения вирусной инфекции.
«Центр ЭКО» предпринимает все необходимые меры для вашей защиты, в соответствии с рекомендациями Министерства Здравоохранения и Роспотребнадзора по предотвращению распространения вирусной инфекции.
Протокол ЭКО в естественном цикле (ЕЦ) — наиболее щадящая процедура из всех программ экстракорпорального оплодотворения.
Гормональная терапия в послеоперационном периоде у больных с эндометриозом и миомой матки
ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России, Москва;
ИППОВ 1-го Московского государственного медицинского университета им. И.М. Мечникова, Россия
Цель исследования. Изучить эффективность применения агониста гонадотропин-рилизинг-гормона трипторелина 3,75 мг в послеопрационном периоде по данным отечественной и зарубежной литературы.
Материал и методы. По ключевым словам «трипторелин», «эндометриоз», «миома матки», «послеоперационный период» нами проведен поиск литературных источников в отечественных и зарубежных БД: elibrary, Medline/PubMed, Embase, CINAHL. Отобрано 26 источников.
Отобрано 26 источников.
Результаты исследования. Женщины с миомой матки и эндометриозом имеют высокую частоту рецидива заболевания в послеоперационном периоде. С целью реабилитации подобных больных и профилактики рецидива заболевания используются различные виды гормональной терапии, где одно из лидирующих мест занимают агонисты гонадотропин-рилизинг-гормона, и, в частности, трипторелин 3,75 мг. Однако в настоящее время недостаточное количество исследований посвящено данной проблеме. Единой тактики реабилитации пациенток с миомой матки и эндометриозом не существует.
Заключение. Агонисты гонадотропин-рилизинг-гормона и, в частности, трипторелин 3,75 мг имеет высокую эффективность и может быть рекомендован к применению. Однако вопрос подбора индивидуального лечения и тактики реабилитации требует дальнейшего изучения.
Эндометриоз и миома матки являются одними из самых часто встречающихся нозологий в гинекологической практике. Так, распространенность эндометриоза в общей популяции в среднем составляет 10%, или 30–50% женщин репродуктивного возраста, имеющих характерные симптомы и жалобы [1]. В свою очередь, частота миомы матки составляет около 25–35% у женщин репродуктивного возраста, возрастая до 52% у женщин в перименопаузальном возрасте [2, 3]. Кроме того, у значительной части женщин одновременно обнаруживаются и миома матки, и эндометриоз. Согласно данным некоторых авторов, подобная сочетанная патология во время оперативного лечения по поводу миомы матки встречается в 12–86% случаев [4–6]. К общим патогенетическим механизмам развития миомы матки и эндометриоза относят резистентность к прогестерону, пролиферацию, проангиогенез, а также активацию провоспалительных факторов.
В свою очередь, частота миомы матки составляет около 25–35% у женщин репродуктивного возраста, возрастая до 52% у женщин в перименопаузальном возрасте [2, 3]. Кроме того, у значительной части женщин одновременно обнаруживаются и миома матки, и эндометриоз. Согласно данным некоторых авторов, подобная сочетанная патология во время оперативного лечения по поводу миомы матки встречается в 12–86% случаев [4–6]. К общим патогенетическим механизмам развития миомы матки и эндометриоза относят резистентность к прогестерону, пролиферацию, проангиогенез, а также активацию провоспалительных факторов.
К основным способам лечения указанных патологий относят хирургический метод и гормонотерапию. Гормонотерапия является патогенетически обоснованным методом лечения и включает следующие группы препаратов: комбинированные оральные контрацептивы, агонисты гонадотропин-рилизинг-гормона (аГнРГ), прогестагены, а также антигестагены и селективные модуляторы прогестероновых рецепторов.
Но несмотря на разнообразие показаний для гормонотерапии при эндометриозе, основным методом лечения остается хирургический [7]. Однако следует отметить, что после проведенного вмешательства вероятность развития рецидива эндометриоза составляет 21% через 1–2 года, 47% – через 5 лет, и до 55% через 5–7 лет [8]. Вероятность рецидива миомы матки после проведенного вмешательства достигает 84,4% в последующие 8 лет, а необходимость повторного хирургического лечения возрастает до 30% в течение следующих 7 лет [9, 10] (таблица).
Однако следует отметить, что после проведенного вмешательства вероятность развития рецидива эндометриоза составляет 21% через 1–2 года, 47% – через 5 лет, и до 55% через 5–7 лет [8]. Вероятность рецидива миомы матки после проведенного вмешательства достигает 84,4% в последующие 8 лет, а необходимость повторного хирургического лечения возрастает до 30% в течение следующих 7 лет [9, 10] (таблица).
Послеоперационная реабилитация указанного контингента пациентов является одним из важнейших этапов лечения и должна быть направлена на восстановление гемостазиологических показателей, профилактику гнойно-септических осложнений, а также предотвращение рецидива заболевания. В комплекс реабилитационных послеоперационных мероприятий целесообразно включать гормональную, иммуномодулирующую, пр…
Хилькевич Е.Г., Языкова О.И.
Миома матки: диагностика и лечение
1. Wallach EE,
Vlahos NF.
Миома матки: обзор развития, клинические особенности и лечение. Акушерский гинекол .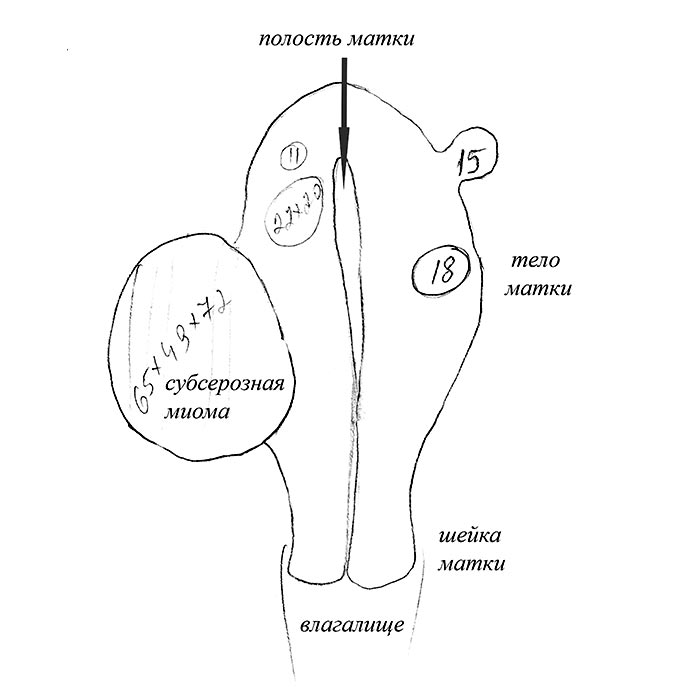 2004; 104 (2): 393–406 ….
2004; 104 (2): 393–406 ….
2. Циммерманн А., Бернуит Д, Герлингер С, и другие. Распространенность, симптомы и лечение миомы матки: международный интернет-опрос 21 746 женщин. BMC Womens Health . 2012; 12 (1): 6.
3. Уайтман М.К., Хиллис С.Д., Джеймисон DJ, и другие. Стационарное наблюдение за гистерэктомией в США, 2000–2004 гг. Am J Obstet Gynecol . 2008; 198 (1): 34.e1–34.e7.
4. Вилос Г.А., Аллер С, Лаберже П.Ю., и другие. Ведение лейомиомы матки. Банка J Obstet Gynaecol . 2015; 37 (2): 157–181.
5. Bulun SE. Миома матки. N Engl J Med .2013. 369 (14): 1344–1355.
6. Исикава H,
Иши К.,
Серна В.А.,
и другие.
Прогестерон необходим для поддержания и роста лейомиомы матки. Эндокринология .
2010. 151 (6): 2433–2442.
151 (6): 2433–2442.
7. Росс РК, Щука MC, Весси М.П., и другие. Факторы риска миомы матки: снижение риска, связанного с оральными контрацептивами [опубликованная поправка опубликована в Br Med J (Clin Res Ed). 1986, 293 (6553): 1027]. Br Med J (Clin Res Ed) . 1986. 293 (6543): 359–362.
8. Райан Г.Л., Сироп СН, Ван Вурхис Б.Дж. Роль, эпидемиология и естественное течение доброкачественных образований матки. Clin Obstet Gynecol . 2005. 48 (2): 312–324.
9. Чиаффарино Ф, Параццини Ф, Ла Веккья C, и другие. Использование оральных контрацептивов и миома матки: результаты исследования случай-контроль. Br J Obstet Gynaecol .1999. 106 (8): 857–860.
10. Стюарт Э.А.,
Николсон В.К.,
Брэдли Л,
и другие.
Бремя миомы матки для афроамериканок: результаты национального исследования. J Womens Health (Larchmt) .
2013. 22 (10): 807–816.
J Womens Health (Larchmt) .
2013. 22 (10): 807–816.
11. Манро М.Г., Сторц К, Abbott JA, и другие. Практические рекомендации по лечению гистероскопических расширяющихся сред. J Минимально инвазивный гинекол .2013. 20 (2): 137–148.
12. Осушитель СМ, Катерино WH. Распространенность, заболеваемость и текущее лечение лейомиомы матки. Int J Gynaecol Obstet . 2015. 131 (2): 117–122.
13. Букулмез О, Дуди К.Дж. Клинические особенности миом. Акушерская гинекологическая клиника North Am . 2006. 33 (1): 69–84.
14. Карранса-Мамане B, Хэвлок Дж., Хеммингс Р, и другие. Ведение миомы матки у женщин с бесплодием без объяснения причин. Банка J Obstet Gynaecol . 2015; 37 (3): 277–288.
15. Метвалли М,
Cheong YC,
Хорн А.В.
Хирургическое лечение миомы по поводу субфертильности. Кокрановская база данных Syst Rev .
2012; (11): CD003857.
Кокрановская база данных Syst Rev .
2012; (11): CD003857.
16. Приттс Э.А., Паркер WH, Оливковый DL. Миома и бесплодие: обновленный систематический обзор доказательств. Fertil Steril . 2009. 91 (4): 1215–1223.
17. De Vivo A, Манкузо А, Джакоббе А, и другие.Миома матки при беременности: продольное сонографическое исследование. Ультразвуковой акушерский гинеколь . 2011. 37 (3): 361–365.
18. Хаммуд АО, Асаад Р., Берман Дж., и другие. Изменение объема миомы матки при беременности: действительно ли миомы растут? J Минимально инвазивный гинекол . 2006. 13 (5): 386–390.
19. Стаут MJ,
Одибо АО,
Graseck AS,
и другие.
Лейомиомы при плановом ультразвуковом обследовании во втором триместре и неблагоприятные акушерские исходы. Акушерский гинекол .
2010. 116 (5): 1056–1063.
116 (5): 1056–1063.
20. Клацкого ПК, Тран Н.Д., Caughey AB, и другие. Миома и репродуктивные исходы: систематический обзор литературы от зачатия до родов. Am J Obstet Gynecol . 2008. 198 (4): 357–366.
21. Рыцарь J, Фальконе Т. Извлечение ткани путем морцелляции: клиническая дилемма. J Минимально инвазивный гинекол . 2014. 21 (3): 319–320.
22.Бюллетень практики ACOG. Альтернативы гистерэктомии в лечении лейомиом. Акушерский гинекол . 2008; 112 (2 п.1): 387–400.
23. Практический комитет Американского общества репродуктивной медицины; Общество репродуктивных хирургов. Миомы и репродуктивная функция. Fertil Steril . 2008; 90 (5 доп.): S125 – S130.
24. Сингх С.С.,
Белланд Л.
Современное лечение миомы матки: акцент на новых медицинских методах лечения [опубликованные исправления опубликованы в Curr Med Res Opin. 2016; 32 (4): 797]. Curr Med Res Opin .
2015; 31 (1): 1–12.
2016; 32 (4): 797]. Curr Med Res Opin .
2015; 31 (1): 1–12.
25. Dueholm M, Лундорф Э, Хансен Э.С., и другие. Точность магнитно-резонансной томографии и трансвагинального ультразвукового исследования в диагностике, картировании и измерении миомы матки. Am J Obstet Gynecol . 2002. 186 (3): 409–415.
26. Чичинелли Э., Романо Ф, Анастасио П.С., и другие. Трансабдоминальная соногистерография, трансвагинальная сонография и гистероскопия при оценке подслизистых миом. Акушерский гинекол . 1995. 85 (1): 42–47.
27. Томассин-Наггара I, Dechoux S, Bonneau C, и другие. Как отличить доброкачественные опухоли миометрия от злокачественных с помощью МРТ. евро Радиол . 2013. 23 (8): 2306–2314.
28. Bonneau C,
Томассин-Наггара I,
Dechoux S,
и другие. Значение УЗИ и магнитно-резонансной томографии для характеристики мезенхимальных опухолей матки. Acta Obstet Gynecol Scand .
2014; 93 (3): 261–268.
Значение УЗИ и магнитно-резонансной томографии для характеристики мезенхимальных опухолей матки. Acta Obstet Gynecol Scand .
2014; 93 (3): 261–268.
29. Варелас Ф.К., Папаниколау А.Н., Ваваци-Христаки Н, и другие. Влияние анастразола на симптоматическую лейомиому матки. Акушерский гинекол . 2007. 110 (3): 643–649.
30. Райт Дж. Д., Tergas AI, Берк В.М., и другие. Патология матки у женщин, перенесших малоинвазивную гистерэктомию с использованием морцелляции. JAMA .2014. 312 (12): 1253–1255.
31. Fleischer AC, Джеймс А.Э. младший, Миллис Дж. Б., и другие. Дифференциальная диагностика новообразований малого таза с помощью сонографии по шкале серого AJR Am J Roentgenol . 1978. 131 (3): 469–476.
32. Летаби А,
Волленховен Б,
Соутер М.
Эффективность предоперационных аналогов, высвобождающих гонадотропиновый гормон, у женщин с миомой матки, перенесших гистерэктомию или миомэктомию. BJOG .2002. 109 (10): 1097–1108.
BJOG .2002. 109 (10): 1097–1108.
33. Sayed GH, Захера М.С., Эль-Нашар С.А., и другие. Рандомизированное клиническое испытание внутриматочной системы, высвобождающей левоноргестрел, и комбинированного перорального контрацептива с низкой дозой для лечения меноррагии, связанной с миомой. Int J Gynaecol Obstet . 2011; 112 (2): 126–130.
34. Летаби А, Дакитт К., Фаркуар К. Нестероидные противовоспалительные препараты при обильных менструальных кровотечениях. Кокрановская база данных Syst Rev .2013; (1): CD000400.
35. Тристан М, Ороско LJ, Конь А, и другие. Мифепристон при миоме матки. Кокрановская база данных Syst Rev . 2012; (8): CD007687.
36. Donnez J,
Татарчук Т.Ф.,
Бушар П.,
и другие.
Улипристала ацетат в сравнении с плацебо при лечении миомы до операции.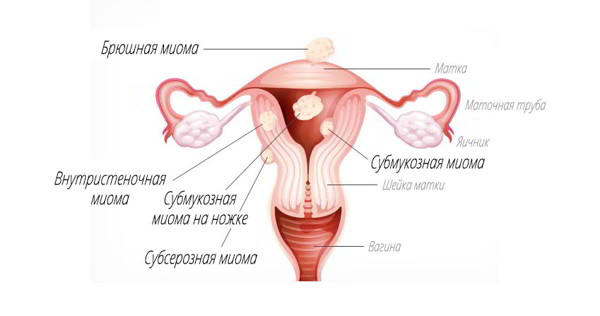 N Engl J Med .
2012. 366 (5): 409–420.
N Engl J Med .
2012. 366 (5): 409–420.
37. Летаби А, Фаркуар C, Кук И.Антифибринолитики при обильных менструальных кровотечениях. Кокрановская база данных Syst Rev . 2000; (4): CD000249.
38. Lukes AS, Мур К.А., Муза К.Н., и другие. Лечение транексамовой кислотой при обильных менструальных кровотечениях. Акушерский гинекол . 2010. 116 (4): 865–875.
39. Аартс Ю.В., Nieboer TE, Джонсон Н, и другие. Хирургический доступ к гистерэктомии при доброкачественном гинекологическом заболевании. Кокрановская база данных Syst Rev . 2015; (8): CD003677.
40. Стюарт Э.А., Гостоут Б, Рабинович Дж., и другие. Устойчивое облегчение симптомов лейомиомы с помощью фокусированной ультразвуковой хирургии. Акушерский гинекол . 2007. 110 (2 ч. 1): 279–287.
41. Бхаве Читтавар П.,
Франик С,
и другие.
Минимально инвазивные хирургические методы в сравнении с открытой миомэктомией при миоме матки. Кокрановская база данных Syst Rev .2014; (10): CD004638.
Бхаве Читтавар П.,
Франик С,
и другие.
Минимально инвазивные хирургические методы в сравнении с открытой миомэктомией при миоме матки. Кокрановская база данных Syst Rev .2014; (10): CD004638.
42. Гупта JK, Синха А, Ламсден М.А., и другие. Эмболизация маточной артерии при симптоматической миоме матки. Кокрановская база данных Syst Rev . 2014; (12): CD005073.
43. Sesti F, Cosi V, Calonzi F, и другие. Рандомизированное сравнение тотальных лапароскопических, лапароскопических вагинальных и вагинальных гистерэктомий по поводу миоматозной матки. Arch Gynecol Obstet .2014. 290 (3): 485–491.
44. Hwang JL,
Сеу КМ,
Цай Ю.Л.,
и другие.
Сравнительное исследование вагинальных, вагинальных и абдоминальных гистерэктомий с лапароскопическим ассистированием по поводу миомы матки диаметром более 6 см или матки массой не менее 450 г. Acta Obstet Gynecol Scand .
2002. 81 (12): 1132–1138.
Acta Obstet Gynecol Scand .
2002. 81 (12): 1132–1138.
45. Сапата ЛБ, Вайтмен МК, Теппер Н.К., и другие. Использование внутриматочной спирали у женщин с миомой матки. Контрацепция . 2010. 82 (1): 41–55.
46. Venkatachalam S, Баграти JS, Мудли Дж. Лечение миомы матки медроксипрогестерона ацетатом (Депо Провера). J Obstet Gynaecol . 2004. 24 (7): 798–800.
47. Verspyck E, Марпо L, Лукас К. Леупрорелин депо 3,75 мг по сравнению с линестренолом в предоперационном лечении симптоматической миомы матки. евро J Obstet Gynecol Reprod Biol .2000. 89 (1): 7–13.
48. Ичиго С, Такаги Х, Мацунами К, и другие. Благоприятное влияние диеногеста на объем миомы матки. Arch Gynecol Obstet . 2011. 284 (3): 667–670.
49. ИП ПП,
Лам К.В.,
Чунг CL,
и другие. Некроз, связанный с транексамовой кислотой, и внутриочаговый тромбоз лейомиомы матки. Am J Surg Pathol .
2007. 31 (8): 1215–1224.
Некроз, связанный с транексамовой кислотой, и внутриочаговый тромбоз лейомиомы матки. Am J Surg Pathol .
2007. 31 (8): 1215–1224.
50.Peitsidis P, Кукуломати А. Транексамовая кислота для лечения миомы матки. Клинические случаи в мире J. . 2014. 2 (12): 893–898.
51. Милсом I, Андерссон К., Андерш Б, и другие. Сравнение флурбипрофена, транексамовой кислоты и внутриматочного контрацептива, высвобождающего левоноргестрел, в лечении идиопатической меноррагии. Am J Obstet Gynecol . 1991. 164 (3): 879–883.
52.Карбонелл Эстев Дж. Л., Акоста Р, Эредиа Б, и другие. Мифепристон для лечения лейомиомы матки. Акушерский гинекол . 2008. 112 (5): 1029–1036.
53. Hilário SG,
Боззини Н,
Борсари Р,
и другие.
Действие ингибитора ароматазы при лечении лейомиомы матки у пациентов в перименопаузе. Fertil Steril .
2009. 91 (1): 240–243.
Fertil Steril .
2009. 91 (1): 240–243.
54. Гуратов Б, Пармаксиз Ц, Килич Г, и другие.Лечение симптоматической лейомиомы матки летрозолом. Репродукция Биомед онлайн . 2008. 17 (4): 569–574.
55. Песня H, Лу Д, Наваратнам К, и другие. Ингибиторы ароматазы при миоме матки. Кокрановская база данных Syst Rev . 2013; (10): CD009505.
56. Садан О, Гинат С, Софер Д, и другие. Роль тамоксифена в лечении симптоматической лейомиомы матки — пилотное исследование. евро J Obstet Gynecol Reprod Biol . 2001. 96 (2): 183–186.
57. Дэн Л., Ву Т, Чен XY, и другие. Селективные модуляторы рецепторов эстрогена (SERM) для лейомиомы матки. Кокрановская база данных Syst Rev . 2012; (10): CD005287.
58. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Обновлено: лапароскопическое снижение мощности матки при гистерэктомии и миомэктомии: сообщение FDA по безопасности. http://www.fda.gov/MedicalDevices/Safety/AlertsandNotices/ucm424443.htm. По состоянию на 20 января 2016 г.
Обновлено: лапароскопическое снижение мощности матки при гистерэктомии и миомэктомии: сообщение FDA по безопасности. http://www.fda.gov/MedicalDevices/Safety/AlertsandNotices/ucm424443.htm. По состоянию на 20 января 2016 г.
59. Американский колледж акушеров и гинекологов. Смертельное поражение и скрытые злокачественные новообразования в гинекологической хирургии. http://www.acog.org/Resources-And-Publications/Task-Force-and-Work-Group-Reports/Power-Morcellation-and-Occult-Malignancy-in-Gynecologic-Surgery. По состоянию на 20 января 2016 г.
60. Bogani G, Клиби WA, Aletti GD. Влияние морцелляции на выживаемость пациентов с неожиданной лейомиосаркомой матки. Гинекол Онкол . 2015; 137 (1): 167–172.
61. Карлсон К.Дж., Миллер Б.А., Фаулер Ф.Дж. младший Исследование здоровья женщин в штате Мэн: I. Результаты гистерэктомии. Акушерский гинекол . 1994. 83 (4): 556–565.
62. Camanni M,
Бонино Л,
Дельпиано Э. М.,
и другие.
Гистероскопическое лечение больших симптоматических подслизистых миом матки. J Минимально инвазивный гинекол .
2010. 17 (1): 59–65.
М.,
и другие.
Гистероскопическое лечение больших симптоматических подслизистых миом матки. J Минимально инвазивный гинекол .
2010. 17 (1): 59–65.
63.Гудвин СК, Шпионы JB. Эмболизация миомы матки. N Engl J Med . 2009. 361 (7): 690–697.
64. Херст А, Даттон С, Ву О, и другие. Многоцентровое ретроспективное когортное исследование, сравнивающее эффективность, безопасность и рентабельность гистерэктомии и эмболизации маточной артерии для лечения симптоматической миомы матки. Оценка медицинских технологий . 2008. 12 (5): 1–248.
65. Таран Ф.А.,
Темпаны CM,
Риган Л,
и другие.;
MRgFUS Group.
Фокусированное ультразвуковое исследование под магнитным резонансом (MRgFUS) в сравнении с абдоминальной гистерэктомией при лечении лейомиомы матки. Ультразвуковой акушерский гинеколь . 2009. 34 (5): 572–578.
2009. 34 (5): 572–578.
66. Куинн С.Д., Веделаго Дж., Gedroyc W, и другие. Безопасность и повторное пятилетнее вмешательство после сфокусированного ультразвукового исследования под магнитным резонансом (MRgFUS) при миоме матки. евро J Obstet Gynecol Reprod Biol .2014; 182: 247–251.
67. Rabinovici J, Дэвид М, Фукуниси Х, и другие.; Исследовательская группа MRgFUS. Исход беременности после операции с фокусированным ультразвуком под магнитным резонансом (MRgFUS) для консервативного лечения миомы матки. Fertil Steril . 2010. 93 (1): 199–209.
68. Эванс П., Брунселл С. Опухоли миомы матки: диагностика и лечение. Ам Фам Врач . 2007. 75 (10): 1503–1508.
Миома матки | ACOG
Анемия : Аномально низкий уровень эритроцитов в кровотоке. Большинство случаев вызвано дефицитом железа (недостатком железа).
Гистерэктомия : Операция по удалению матки.
Гистеросальпингография : Специальная рентгеновская процедура, при которой небольшое количество жидкости вводится в матку и фаллопиевы трубы, чтобы обнаружить аномальные изменения или увидеть, не заблокированы ли трубы.
Гистероскопия : Процедура, при которой телескоп с подсветкой вводится в матку через шейку матки для осмотра внутренней части матки или выполнения операции.
Внутриматочная спираль (ВМС) : Небольшое устройство, которое вставляется и оставляется внутри матки для предотвращения беременности.
Лапароскопия : Хирургическая процедура, при которой тонкий телескоп с подсветкой, называемый лапароскопом, вводится через небольшой разрез (разрез) в брюшной полости.Лапароскоп используется для просмотра органов малого таза. С ним можно использовать другие инструменты для проведения хирургических операций.
Менструация : ежемесячное выделение крови и тканей из матки, которое происходит, когда женщина не беременна.
Менопауза : Время, когда менструальный цикл женщины прекращается навсегда. Менопауза подтверждается через 1 год без менструации.
Тазовое обследование : Физикальное обследование тазовых органов женщины.
Прогестин : Синтетическая форма прогестерона, аналогичная гормону, вырабатываемому организмом естественным путем.
Резектоскоп : Тонкий телескоп с петлей из электрического провода или шариковым наконечником, используемый для удаления или разрушения тканей.
Соногистерография : Процедура, при которой стерильная жидкость вводится в матку через шейку матки при одновременном получении ультразвуковых изображений внутренней части матки.
Ультрасонография : тест, в котором звуковые волны используются для исследования внутренних частей тела.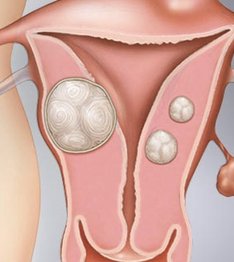 Во время беременности можно использовать ультразвуковое исследование для проверки плода.
Во время беременности можно использовать ультразвуковое исследование для проверки плода.
Матка : Мышечный орган женского таза. Во время беременности этот орган удерживает и питает плод.
осложнений миомы матки и их лечение, хирургическое лечение миомы, лапароскопия и гистероскопия в сравнении с гистерэктомией, кровотечением, спаечными процессами и осложнениями
В критическом анализе хирургического лечения миомы сравниваются все доступные методы миомэктомии.Различные статистические анализы показывают преимущества лапароскопического и гистероскопического доступа. Осложнения могут возникнуть из-за расположения миомы. Они варьируются от периодических кровотечений до непрерывных кровотечений в течение нескольких недель, от единичных приступов боли до сильной боли, от дизурии и запора до хронических спазмов мочевого пузыря и кишечника. Очень редко возникает перитонит. Бесплодие может быть результатом постоянного метро и меноррагии. Сложность лапароскопической и гистероскопической миомэктомии заключается в достижении удовлетворительного гемостаза с помощью соответствующих швов.Гистероскопическая миомэктомия требует наличия оперативного гистероскопа и опытного хирурга-гинеколога.
Сложность лапароскопической и гистероскопической миомэктомии заключается в достижении удовлетворительного гемостаза с помощью соответствующих швов.Гистероскопическая миомэктомия требует наличия оперативного гистероскопа и опытного хирурга-гинеколога.
1. Введение
У 25–30% женщин диагностируются миомы. Хотя патогенез полностью не изучен, мы знаем, что миомы гормонозависимы и происходят из отдельных клеток миомы, а не в результате метастатического процесса. Миомы — самые распространенные доброкачественные солидные опухоли женских половых путей. Хотя они часто протекают бессимптомно, они могут вызывать меноррагию, метроррагию, бесплодие, боль, кровотечение из-за сдавления и повторные аборты.В то время как открытая абдоминальная миомэктомия приводит к ограниченной заболеваемости, как и при гистерэктомии, лапароскопическая миомэктомия дала пациенту значительные преимущества в медицинском, социальном и экономическом плане, с меньшим количеством послеоперационных болей и более коротким временем восстановления. Semm и Mettler опубликовали свою первую статью о лапароскопической миомэктомии в 1980 г. [1]. Сегодня с помощью этой методики можно удалить все миомы. Обычная лапароскопическая хирургия дополняется роботизированной поддержкой и абдоминальным входом, часто модифицируемым до NOS (хирургия естественного отверстия) и NOTES (транслюминальная эндоскопическая хирургия естественного отверстия), также называемая однопортовым входом.
2. Материал и методы
Хирургическое вмешательство
2.1. Традиционная и лапароскопическая миомэктомия
В зависимости от протяженности миомы зрительный троакар помещают в пределах пупка или на 10 см выше по средней линии или в точке Палмера. Под зрением в нижней части живота размещаются 2–3 дополнительных порта. Техника резекции миомы варьируется в зависимости от положения и размера миомы.
(1) Миома на ножке
Ножка миомы коагулируется с помощью биполярных щипцов и разрезается лапароскопическими ножницами или резецируется после наложения петель или степлеров.Швы нужны не всегда.
(2) Субсерозные и интрамуральные миомы
После инъекции в стенку миомы (экстракапсулярной) раствора производного вазопрессина после гемостаза делается вертикальный или горизонтальный разрез с помощью биполярных / монополярных щипцов, ультразвука или термофузии в точке выпуклости матки, на месте миомы и вдали от придатков. Разрез расширяют до достижения псевдокапсулы; Затем рассечение миомы выполняется строго в плоскости капсулы двумя парами захватывающих щипцов.Непрерывный гемостаз выполняется биполярным пинцетом (ультразрез). После энуклеации миомы матку сшивают вдоль серозно-мышечной плоскости (край к краю) с использованием одного или двух слоев отдельных швов из полидиоксаноловой нити (PDS) с экстра- или интракорпоральными узлами. Ножки шва должны находиться внутри раны. Непрерывное всасывание и орошение выполняются для минимизации образования адгезии.
Затем миомы извлекаются надлобковым путем путем морцелляции с помощью электрического морцеллятора с последующей лапароскопической проверкой и тщательной очисткой брюшины и гемостазом.
(3) Миомы шейки матки
Эти миомы легко доступны и энуклеированы трансвагинально; однако иногда необходимо комбинированное вагинальное лапароскопическое иссечение.
(4) Фокальный аденомиоз
В случаях дисменореи, вызванной хорошо различимыми аденомиотическими поражениями, рекомендуется тщательная энуклеация или резекция этих областей. Гистероскопическая ультразвуковая помощь может помочь в резекции.
(5) Подслизистые миомы
Подслизистые миомы, расположенные в полости матки, классифицируются в соответствии с инфильтрацией миометрия на 3 категории.Гистероскопическая резекция этих миомы проста и выполняется с помощью резектоскопической петли нарезкой биполярным или монополярным током.
(6) Гистероскопия
Хотя первое исследование полости матки относится к Боззини, современная жидкостная, офисная и операционная гистероскопия (резектоскопия) CO 2 была разработана Хансом Линдеманном в Гамбурге в 1972 году и улучшила ее. модифицировано Bettocchi et al., Loffer et al., Cooper et al., Gallinat и Campo et al.[2–8]. В последнее время снова была применена вагиноскопия, чтобы направить диагностический гистероскоп из влагалища в шейку матки без какой-либо тракции шейного тазобедренного сустава. С физиологическим раствором в качестве среды для растяжения и при точном контроле давления и потока визуализация полости матки и ее патологии видны, включая синехии, перегородку, эндометрий, цервикальный канал, полость матки с устьем матки, полипы и миомы. Самая современная система предлагает непрерывное отсасывание резецированного материала.Классификация ESHRE 1993 г. упрощает описание локализации миомы [5, 9].
2.2. Энуклеация миомы с одним портом
Энуклеацию миомы можно легко выполнить с помощью всех видов однопортовых вводов (SILS: лапароскопическая операция с одним разрезом, LESS: лапароэндоскопическая операция с одним узлом), хирургия естественного отверстия (БДУ) и естественного отверстия транслюминальная эндоскопическая хирургия (ПРИМЕЧАНИЯ). Однако проблема заключается в измельчении материала и экстракции.Ответ можно найти в гомогенизации в порошок.
2.3. Роботизированная миомэктомия
После завершения процесса обучения робот da Vinci предлагает более точную технику для каждой операции, включая миомэктомию. Роботизированное наложение швов проще и быстрее. На мой взгляд, когда-нибудь все хирургические операции будут проводиться с помощью роботов.
После 30 лет опыта выполнения и обучения лапароскопической миомэктомии профессор Меттлер имел возможность выполнить ряд роботизированных миомэктомий с помощью робота da Vinci.Процедура проста, может быть выполнена с меньшей кровопотерей, чем при лапароскопии, и наложение швов может быть выполнено более точно. Однако трехмерное зрение и шарнирные инструменты также могут служить той же цели. Роботизированная хирургия — это увлекательно, но должна произойти финансовая революция, чтобы ее приняли во всем мире не только в хирургии рака, но и в таких процедурах, как миомэктомия.
2.4. Лапаротомная миомэктомия
Лапаротомная миомэктомия может быть выполнена, если миома более 20 см в диаметре, расположена в очень критической точке или подозревается на саркому.При наличии более 10 миомы может потребоваться лапаротомия. Решение принимает хирург.
2,5. Гистерэктомия
(1) Классическая интрафасциальная супрацервикальная гистерэктомия (CISH)
В случаях аденомиоза или диффузного миоматоза матки без патологии шейки матки, CISH или LASH должны быть методом выбора для гистерэктомии [10]. В CISH зона трансформации шейки матки вырезается в дополнение к субтотальной резекции матки.
(2) Лапароскопическая субтотальная гистерэктомия (LASH)
LASH оказалась безопасной, быстрой и очень атравматичной методикой гистерэктомии.Преимущество процедуры LASH заключается в том, что ее можно проводить у нерожавших пациенток, пациентов, у которых ранее не было родов через естественные родовые пути, и пациентов, которые ранее перенесли абдоминальные операции. В этих случаях матка морцеллируется, но кольпотомия не выполняется.
(3) Тотальная лапароскопическая гистерэктомия (TLH)
Показания для TLH включают доброкачественные гинекологические изменения, такие как миома, эндометриоз и дисфункциональное маточное кровотечение у пациентов, которым вагинальные операции противопоказаны или не могут быть выполнены.TLH может выполняться при возможных злокачественных показаниях, таких как ранний рак эндометрия, ранний локализованный небольшой рак шейки матки (трахелэктомия), а также на ранних стадиях рака яичников с лимфаденэктомией. Лапароскопическая часть состоит из препарирования матки, шейки матки и полного рассечения культи влагалища.
(4) Вагинальная гистерэктомия
Когда Лангенбек впервые выполнил вагинальную гистерэктомию в 1813 году, возникла гинекологическая дисциплина.С тех пор вагинальный доступ стал привилегией хирурга-гинеколога. В 1939 году, по словам французского хирурга Дуайена, никто не мог бы называть себя гинекологом, если бы он не сделал вагинальную гистерэктомию [11].
Вагинальная гистерэктомия до сих пор остается центральной темой гинекологических дискуссий. Гинеколог рассматривает другие пути доступа для исследования малого таза только в том случае, если вагинальный доступ не может дать четкий диагноз и возможность лечения. Сегодня, однако, похоже, что только очень опытные вагинальные хирурги все еще оперируют миомы вагинальным путем, используя вагинальное морцеллирование с помощью ножа.
(5) Абдоминальная гистерэктомия
Абдоминальная гистерэктомия сегодня является безопасной техникой. Больше нет страха перед инфекцией, тромбозом или другими заболеваниями. За последние 40 лет ХХ века произошло резкое увеличение количества гистерэктомий. Даже в Германии методом выбора при кровотечениях, миомах и других патологиях всегда были лапаротомия и гистерэктомия. Большие диффузные миомы и множественные миомы иногда требуют абдоминальной гистерэктомии.
2.6. Предотвращение адгезии
При большом количестве адгезий, профилактические агенты, представленные за последние 10 лет, гиалобарьеры Adept (4% раствор икодекстрина) и SprayShield (распыляемая жидкость на основе полиэтиленгликоля, которая полимеризуется в течение нескольких секунд до гидроабсорбируемого геля) представляются наиболее многообещающими. вещества. Также настоятельно рекомендуется Hya-Corp endogel, антиадгезионный гель на основе гиалуронидазы.
2.7. Кровоизлияние
Кровотечение может происходить в подслизистых фибромах, но редко в интрамуральных фибромах.Единственная терапия — миомэктомия, дальнейшие обсуждения не требуются.
3. Результаты
3.1. Сравнение удаления одиночной и множественной миомы
С января 2002 г. по сентябрь 2007 г. 335 женщин, средний возраст 35,2 года, подверглись однократной или множественной внутрикапсулярной лапароскопической миомэктомии в нескольких гинекологических центрах. Из этих пациентов 62 ранее перенесли кесарево сечение (18,7%). Все пациенты подписали информированное согласие перед включением в это исследование, одобренное местным институциональным комитетом по этике исследований.
Отобранные пациенты запросили миомэктомию по поводу следующих сопутствующих симптомов: тазовая боль, меноррагия и рост миоматических узелков, подтвержденных ультразвуком. Некоторые обратились за миомэктомией в связи с будущей беременностью. Критериями исключения из исследования были: предшествующая операция на матке (за исключением кесарева сечения), дооперационное лечение аналогами гонадолиберина, наличие злокачественных гинекологических заболеваний в анамнезе и первичная субфертильность.
Критерии исключения для предоперационного лечения аналогами ГнРГ были связаны с сообщенным повышенным риском рецидива, возможной задержкой диагностики лейомиосаркомы, риском массивного кровоизлияния в результате дегенерации, большей трудностью поиска плоскости дробления и большей степенью гиалинизации. явления [12, 13].Все миомы были отобраны с помощью стандартизированного трансвагинального ультразвукового картирования миомы; у всех пациентов были субсерозные и / или интрамуральные миомы, и данные трансвагинального ультразвукового исследования регистрировались для послеоперационной оценки.
В предварительной настройке исследования врачи выбрали всех женщин с 3–6 миомами в качестве пациентов для выполнения множественной миомэктомии. В условиях исследования размер миомы до лапароскопии составлял от 4 до 9 см. Этот предел был выбран хирургами, чтобы избежать длительного времени операции и бессмысленной травмы матки при меньших размерах миомы.
Чтобы обеспечить однородность интракапсулярной лапароскопической миомэктомии, авторы исключили миомы на ножке, шейки матки и интралигаментарные миомы, поскольку они являются экстрамиометрием.
Пациенты были сначала разделены на две нерандомизированные группы: 195 женщин с одной миомой в группе I и 140 женщин с двумя или более миомами (менее четырех) во II группе.
Женщинам была выполнена стандартная методика, описанная Mais et al. в 1996 г., который проводился теми же хорошо подготовленными ординаторами в специализированных гинекологических центрах [14].Этот стандартизированный метод включал гистеротомию, разрез псевдокапсулы, удаление миомы путем растяжения и наложения швов на матку.
Перед рассечением миометрия, покрывающего миому, в слои ткани вводили 10 мл раствора вазопрессина или разбавленного адреналина (1/100), чтобы облегчить ишемию ткани и лучше очертить плоскость деления и псевдокапсулу.
Лапароскопическая внутрикапсулярная миомэктомия была выполнена с использованием следующей интракапсулярной техники: миометрий разрезали вертикально монополярным скальпелем после определения плоскости между псевдокапсулой и миомой.
Целью гистеротомии, учитывая длину и глубину разрезов матки, было обнажение псевдокапсулы миомы. Таким образом, глубина разреза матки была адаптирована для локализации миомы в матке и отображения окружающей структуры. Длина разреза в среднем зависела от диаметра миомы. Как правило, длина в каждой группе ограничивалась длиной нижней стороны миомы, а глубина разреза матки ограничивалась глубиной псевдокапсулы.
Для отделения соединительных мостиков псевдокапсулы от окружающего миометрия и для энуклеации внутрикапсулярной миомы авторы использовали монополярную иглу для вязания крючком или биполярные зажимные ножницы (Gyrus PlasmaKinetic AMS) и сверла для миомы или щипцы Коллинза (рис. 1).
Во всех процедурах миомы удаляли с помощью электрических морцелляторов (Karl Storz Endoscopy и Gynecare, Johnson & Johnson), а миометрий зашивали интра- и экстракорпоральными одинарными или двойными швами с рассасывающейся мононитью полиглекапрона 0.
Хирурги аппроксимировали четкие края дефекта матки (связанный с интракапсулярным методом) интрофлексирующими одиночными U-образными швами с шагом 1 см. Если дефект миометрия был глубоким или большим, его ремонтировали путем наложения швов с множественными интрофлексирующими одиночными швами с последующей серозной пластикой множественными интрофлексирующими одиночными швами. Миометрий, хоть и сложно, но иногда требовал двухслойного наложения швов. Затем накладывали швы с шагом 1 см, используя экстракорпоральное или интракорпоральное завязывание узлов, в зависимости от кровотечения: экстракорпоральный для более крупного кровотечения и интракорпоральный для меньшего.
Стандартное трансвагинальное ультразвуковое исследование выявило проблемы перед выпиской. Все процедуры были основаны на следующих хирургических параметрах: инфильтрация в миометрий (количество пациентов в группе), общее время операции (в минутах), интраоперационная кровопотеря (в мл), послеоперационное кровотечение (мл в дренаже), потребность в обезболивающих (количество пациентов в группе), послеоперационная лихорадка (количество пациентов с лихорадкой> 38 ° C через 24 часа и в первые 2 дня госпитализации), послеоперационный прием антибиотиков (количество пациентов кто запросил терапию), длительность госпитализации (на 24 или 48 часов) и послеоперационная клинически значимая внутримиометриальная гематома> 3 см, как обнаружено с помощью стандартного трансвагинального ультразвукового исследования перед выпиской [15].
Симптомами пациентов, перенесших лапароскопическую миомэктомию в I группе, были тазовая боль у 134 пациентов (68,7%), меноррагия у 91 пациента (46,6%) и рост миоматических узелков, подтвержденный ультразвуком (УЗИ), у 119 (61,02). %). Во II группе такие же симптомы отмечали 59 (42,1%), 77 (55%) и 73 пациента (52,1%) соответственно.
Сравнение исходных характеристик участников не выявило статистически значимых различий () (Таблица 1).
| ||||||||||||||||||||||||||||||
Среднее общее время лапароскопической операции составляло минуты в группе I и было значительно больше во второй группе минут (в анализ Стьюдента).Не было обнаружено статистических различий () в величине средней интраоперационной кровопотери (мл в группе I по сравнению с группой II), количестве катетеров, установленных внутри таза для послеоперационного дренирования (78 женщин в группе I по сравнению с 51 женщиной в группе II), потребность в обезболивающих (81 женщина в группе I против 56 во II группе), послеоперационная лихорадка в первый день госпитализации (22 пациента в группе I против 13 во II группе) или послеоперационный прием антибиотиков (16 женщин в группе I против 9 во II группе) ). При анализе критерия Стьюдента не было обнаружено статистических различий () для продолжительности госпитализации в отношении количества женщин, выписанных через 24 часа (140 женщин в группе I по сравнению с 99 в группе II) и через 48 часов (55 пациентов в группе группа I против 41 во II группе) или при обнаружении послеоперационной внутримиометриальной гематомы (> 3 см) с помощью УЗИ во время госпитализации пациентов (13 женщин в группе I против 8 во II группе).
В этом исследовании лапароконверсия не проводилась. Обычно все пациенты покидают операционную с обезболивающей смесью кеторолака или трамадола в насосе; однако, если пациенты требуют большего количества анальгетиков, медсестры обычно вводят «по требованию» 30 мг кеторолака внутривенно. или 100 мг трамадола внутривенно. у аллергиков (таблица 2).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Данные представлены как среднее ± стандартное отклонение или медианный диапазон. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Не было значительных различий в краткосрочных осложнениях, таких как острая анемия (с Hb <9 г / дл, гематокритом (Hct) <30 или эритроцитами (RC) <3,500,000 миллионов / мм 3 ) , послеоперационное чрезмерное брюшное кровотечение (более 50 мл крови в катетере внутри таза для послеоперационного дренирования) и инфекции мочевыводящих путей (обнаруженные при положительном посеве мочи после удаления Фолея) между двумя группами (Таблица 3).
| ||||||||||||||||||||||||||||||||||||||||||||||||||
Все женщины забеременели спонтанно, без вспомогательных методов оплодотворения или фармакологических методов лечения субфертильности и ни один из оставшихся пациентов не решил получить дополнительную вспомогательную репродуктивную технологию (ВРТ).
3.2. Частота спонтанных беременностей после лапароскопической миомэктомии в Киле
В серии из 1032 лапароскопических миомэктомий было всего 6 осложнений (отделение акушерства и гинекологии Кильского университета, Германия). Из 130 пациенток, желающих забеременеть, 78 (60%) забеременели. Среди 78 беременностей было 6 абортов, 60 самопроизвольных родов и 18 операций кесарева сечения. Сообщалось о восьми парах близнецов и одной тройне [16].
3.3. Последние сведения о лапароскопической миомэктомии и гистероскопическом лечении
При лапароскопической миомэктомии подвергались лечению следующие типы миомы: субсерозная миома на ножке 24%, интрамуральная 76% и диффузный миоматоз 0% (рис. 2).Средний диаметр миом, удаленных лапароскопически, составлял см (диапазон 1–10 см), 57% из которых имели диаметр> 4 см. Дренаж для наблюдения за возможным внутрибрюшным кровотечением был установлен в 168 случаях лапароскопической миомэктомии и удален через 24 часа. Ни одному пациенту не потребовалось переливание крови.
Среднее время операции при лапароскопической миомэктомии составляло 90 минут (диапазон 25–215 минут). Средняя продолжительность госпитализации при лапароскопической миомэктомии составляла несколько дней (от 2 до 6 дней). В Германии во время проведения исследования страховые компании оплачивали больницу в соответствии с количеством дней, в течение которых пациент был госпитализирован, а не в соответствии с проведенной процедурой.Это привело к более длительному пребыванию в больнице. Сейчас эта практика меняется.
4. Исходы пациентов
4.1. Непосредственные / поздние осложнения
У двух пациентов образовалась гематома в брюшной стенке. У одного пациента эпигастральная артерия была немедленно зашита; у второго пациента через четыре часа в левой брюшной стенке была обнаружена растущая гематома. Поздних осложнений, таких как кровотечение, инфекции мочевыводящих путей или поражения кишечника, не наблюдалось.
4.2. Множественные миомы и необходимость в последующей операции
Спустя шесть-восемь недель повторная лапароскопия с миомэктомией была предложена семи из 178 пациентов, перенесших лапароскопическую миомэктомию. В каждом случае индивидуальный хирург решил оперировать за два сеанса. Конверсий на лапаротомию не произошло. В нашем отделении пациенты с более крупными миомами проходят мини-лапаротомию / фиброидэктомию напрямую. Как видно на Рисунке 4, у большинства пациентов была только одна миома, субсерозная или интрамуральная на ножке (Рисунок 4).
4.3. Облегчение симптомов
На сегодняшний день из 178 пациентов только двое перенесли дальнейшие операции по поводу жалоб, связанных с нарушениями кровотечения и необходимостью гистерэктомии.
5. Результат фертильности
У первородящих женщин было наибольшее количество миом, а наименьшее — у женщин с параграфом> 3 (рис. 3). Когда критерии отбора строго соблюдались и не было другого сопутствующего бесплодия, лапароскопическая миомэктомия увеличивала частоту имплантации [17, 18].
За период от 10 месяцев до 4 лет после лапароскопической миомэктомии частота наступления беременности составила 55%. Частота кесарева сечения составила 30%.
Лапароскопическая миомэктомия обеспечивает безопасные роды через естественные родовые пути [19–21]. Другими возможными методами являются эмболизация маточных артерий или лапароскопическая перевязка маточных артерий [22].
Пациенты, перенесшие лапароскопическую или лапаротомическую миомэктомию и забеременевшие, должны сообщить своим гинекологам о необходимости кесарева сечения.
6. Восстановление нормальной жизни после операции
Пациенты, перенесшие лапароскопическую миомэктомию, вернулись к работе в течение 4–6 дней после первой операции.
7. Обсуждение
7.1. Преимущества лапароскопической миомэктомии перед открытой миомэктомией
При поиске литературы с помощью Medline было найдено 1400 ссылок. Выбранные статьи были проверены для дальнейшего использования. Критериями отбора литературы были количество случаев (исключено, если менее 20), методы анализа (статистические или нестатистические), оперативная процедура (были выбраны только общепринятые процедуры) и учреждение, в котором проводилось исследование (специализированное учреждения лапароскопической хирургии) [23].Из 30 статей только шесть соответствовали критериям отбора.
Chapron et al., В метаанализе опубликованных данных рандомизированных клинических исследований 2002 г., изучили риски, с которыми сталкиваются пациенты после лапароскопической миомэктомии (1809 пациентов прошли лапароскопию и 1802 пациента — лапаротомию) [24]. Они обнаружили, что общий риск осложнений был значительно ниже у пациентов, оперированных лапароскопией [24].
Holzer et al. аккредитованы в первом двойном слепом исследовании контроля боли после лапароскопической миомэктомии [25].После операции у всех пациентов были одинаковые повязки, и поэтому ни один из пациентов не знал, кто перенес какой тип операции (19 — лапароскопия, 21 — лапаротомия). Следователей также держали в неведении. Анализ, проведенный по завершении исследования, показал, что лапароскопическая хирургия имеет явные преимущества перед лапаротомией в отношении контроля боли [25].
Rossetti et al. В своем обзоре, опубликованном в апреле 2001 г., изучали частоту рецидивов миомы после лапароскопической или лапаротомной миомэктомии (162 пациента, 82 для каждого типа операции) [26].Наблюдение за пациентом продолжалось до 40 месяцев. По истечении этого времени у 11 пациентов в группе лапароскопии и у 9 пациентов в группе лапаротомии случился рецидив. Анализ не показал статистической значимости [26].
Чтобы оценить наши собственные лапароскопические миомэктомии, давайте представим нашу недавно оцененную серию из 178 миомэктомий в Киле [16].
Следующие пять критериев были оценены в анкете, разосланной всем пациентам через 10–24 месяцев после хирургического лечения: (1) немедленные или поздние осложнения, (2) необходимость в следующей, повторной или последующей повторной операции, (3) облегчение. симптомов, (4) исход фертильности и (5) возобновление нормальной жизни.
7.1.1. Признаки и симптомы миомы
Из 178 пациентов 24% имели массу таза с симптомами давления, 17% метроррагию, 14% тазовую боль и 40% бесплодие.
7.1.2. Непосредственные / поздние осложнения
У двух пациентов образовалась гематома в брюшной стенке. У одного пациента надчревная артерия была немедленно разорвана и зашита; у второго пациента через четыре часа в левой брюшной стенке была обнаружена растущая гематома. Поздних осложнений, таких как кровотечение, инфекции мочевыводящих путей или поражения кишечника, не наблюдалось.Частота миом, связанных с паритетом: 97 = 55% были нерожавшими, 11 = 6% пара 3, и> 3,68 = 39% пара 1 и 2.
7.2. Осложнения и заключение
Осложнения могут возникнуть из-за расположения миомы. Эти осложнения варьируются от периодических кровотечений до непрерывного кровотечения в течение нескольких недель, от единичных болевых эпизодов до тяжелой меноррагии и хронической боли в животе с периодическими спазмами, от дизурии и запоров до хронических спазмов мочевого пузыря и кишечника и даже до перитонита.Бесплодие может быть результатом постоянного метро и меноррагии, что приводит к хронической инфекции и спазмам матки вплоть до отсутствия имплантации. Возможные осложнения, возникающие в результате лечения этих заболеваний, включают кровотечения, инфекции, спайки и вторичную боль в результате усилий по лечению.
Миома матки очень часто встречается у женщин репродуктивного возраста, и их диагностика не всегда требует хирургического вмешательства. С появлением аналогов гонадолиберина лечение стало возможным.Это лечение способно вызвать значительное уменьшение объема миомы (до 50%) за счет снижения уровня циркулирующего эстрогена. Максимальное снижение достигается при двенадцатинедельной терапии. Однако после прекращения терапии миома может снова увеличиться в размерах до первоначального диаметра в течение трех месяцев. Миомы могут быть причиной метроррагии, тазовой боли, анемии, бесплодия и абортов. Когда возникают эти симптомы, основным лечением могут быть анальгетики при тазовой боли, железо при анемии или даже ЭКО при бесплодии.Однако, если это лечение не дает результатов, всегда показано хирургическое вмешательство [27–29].
Когда операция показана при миоме, лапароскопическая операция является первым выбором. В зависимости от альтернатив, доступных хирургической бригаде, эндоскопическое лечение может быть традиционным лапароскопическим, роботизированным, резектоскопическим с использованием одного или нескольких портов с БДУ или ЗАМЕТКАМИ или гистероскопическим, в зависимости от местоположения.
Предоперационная оценка важна для определения стратегии операции в зависимости от размера, количества и расположения миом.Точный предоперационный диагноз показывает, возможна ли лапароскопическая миомэктомия или следует выполнять лапаротомию при больших или многочисленных миомах. Каждый подход имеет свои показания.
Результаты нашего исследования и многих международных серий демонстрируют возможность лапароскопической и гистероскопической миомэктомии как метода, ведущего к ремиссии симптомов и низкому уровню осложнений. Сложность операции заключается в достижении удовлетворительного гемостаза и правильном наложении швов.Гистероскопическая миомэктомия требует наличия оперативного гистероскопа и хорошо обученного гинекологического хирурга, чтобы им пользоваться [30]. Можно бороться с сильными кровотечениями и предотвратить образование спаек.
Благодарности
Авторы благодарят Доун Рютер за редактирование статьи и Николь Гукельсбергер за ее постоянную поддержку.
(PDF) Важность послеоперационного ухода и инструкций по выписке у пациентов, перенесших эмболизацию миомы матки
Под лучом
Важность послеоперационного ухода и инструкций по выписке
для пациентов, перенесших эмболизацию миомы матки
Liza DeJes , РН
а
, Ана М.Echenique, MD
a, *
, Allison Absich, BS, RN
b
a
Отделение интервенционной радиологии, Больница и клиники Университета Майами / Центр рака Сильвестра, Майами, Флорида
b
Сосудистые и сосудистые заболевания. Институт позвоночника, Майами, Флорида
Фиброиды матки — очень распространенные доброкачественные образования
, которые развиваются в мышечной стенке матки. Другие
наименований фиброидов включают лейомиомы, лейомиомы, фибромиомы,
фибром, миофибром и миомы.Они состоят из
гладких мышц и соединительной ткани, развивающейся и укрепляющей стенку матки
. Они могут иметь очень широкий диапазон размеров, от маленьких до
увеличенных миом и могут возникать в различных областях и слоях матки
(рис. 1). Самая распространенная опухоль, обнаруживаемая в репродуктивной системе женщин
, фибриды матки, встречается у 20-25% всех
женщин и, по оценкам, встречается у 49% менструирующих
женщин старше 50 лет.Фиброид матки может возникать в любое время
между менархе и менопаузой, но чаще всего встречается у женщин
в возрасте от 35 до 49 лет (Siskin, 2015, пункт 3e4). Африканцы по сравнению с европеоидами в три раза более склонны к фиброобразованию матки. На их долю приходится треть всех гистерэктомий, выполняемых
в США и примерно 100000 процедур ежегодно
(Sofoudis, 2015).
Эмболизация фиброидов матки (UFE) была внедрена в
США в качестве варианта лечения фиброидов в 1997 году.UFE
снижает боль, выраженность симптомов (давление и деформацию брюшной стенки
) и в большинстве случаев.
Хотя гистерэктомия долгое время считалась окончательным методом лечения
симптоматических фиброидов и остается наиболее распространенным вмешательством
мес для фиброидов, растет интерес к менее
инвазивным методам лечения и методам лечения, которые позволяют избежать удаления матки
. включая медицинское лечение, абдоминальную или лапаро-
объемную миомэктомию, абляцию эндометрия, сфокусированное ультразвуковое исследование,
и UFE.Эмболизация матки стала одним из наиболее важных методов сохранения матки (Bulman, Ascher, &
Spies, 2012).
ОАЭ выполняется с использованием трансфеморального доступа (Рисунки 2
и 3). После размещения кончика катетера с концевым отверстием 4F / 5F или коаксиально продвинутого микрокатетера в горизонтальном сегменте
маточной артерии, далеко за пределами ангиографически
визуализированы шейно-влагалищные ветви, эмболизация свободными частицами
Реализуется с использованием 500–900
м
м трисакрилового желатина
микросфер (Embosphere
®
; Biosphere Medical, Париж, Франция)
или частиц поливинилового спирта у 20 пациентов (BeadBlock
®
;
Biocompatibles, Фарнхэм, Великобритания или Contour-SE
®
; BostonScienti ‑ fc,
Natick, MA).Эмболизация микросферами трисакрил-желатина проводится в соответствии с протоколом ограниченной эмболизации с окклюзией
перифибридного сплетения, но с сохранением вялого оттока в маточных артериях до
степени в качестве конечной точки ангиографии.
Для сферических частиц поливинилового спирта (BeadBlock
®
и Con-
tour-SE
®
), более радикальная ангиографическая конечная точка, то есть около
стаз в горизонтальном сегменте матки. артерия, выбрана.
Выбор эмболического агента оставлен на усмотрение интервенциониста
(Schering-Muenkler et al., 2011).
Медсестринский уход и послеоперационные инструкции
Наиболее частым непосредственным осложнением ЭМА является боль, так как
являются результатом фиброидной ишемии и ишемии миометрия. По этим причинам
пациент, перенесший ОАЭ, должен быть готов к
тазовой боли, а также к симптомам постэмболизационного синдрома
(ПЭС).Эта информация должна быть включена в обсуждение процедуры до
. ПЭС — частый побочный эффект эмболизации твердого органа
. Клиническими проявлениями PES обычно являются боль, лихорадка
и тошнота (тошнота), иногда описываемая как болезнь, подобная гриппу
. Помимо боли и других симптомов постэмболизации
, связанных с ЭМА в первые часы после процедуры,
других симптомов, таких как вздутие живота, запор, лихорадка,
вагинальное кровотечение, боль, тошнота и / или рвота, анорексия и т. —
tigue может произойти в последующие дни.Поскольку у большинства пациентов
будут наблюдаться симптомы после процедуры в течение 4-5 дней, во многих случаях, когда выполняется ЭМА, пациенты поступают в больницу
на ночь или через 1-2 дня после процедуры из-за боли в животе или контроля рвоты
. Используются многие различные лекарства, включая фента-
нил, ибупрофен, прометазин, ацетаминофен, кодеин, мепери-
дин, кеторолак, цефазолин, гидроксизин, оксикодон, морфин,
дроперидол и ондацетрон.Использование морфина сульфата и / или гидроморфона, вводимого через контролируемую пациентом анальгетическую помпу (Billhim & Pisco-Martins, 2010), является еще одним эффективным способом облегчения боли. Медсестринское обследование
должно включать в себя места проколов в паховой области на предмет кровотечения или образования гем-
томы и выявление нижних конечностей при любых проблемах с кровообращением или сенсорными нарушениями
. Пациентке
следует сообщить, что выделения из влагалища в следующие несколько периодов
могут быть более тяжелыми, чем обычно, и эти выделения могут быть сероватыми или
* Автор-корреспондент: Ана М.Эченике, больница Университета Майами и
клиник / Центр рака Сильвестра, Майами, Флорида 33136.
Адрес электронной почты: [email protected] (A.M. Echenique).
Списки содержания доступны в ScienceDirect
Journal of Radiology Nursing
Домашняя страница журнала: www.radiologynursing.org
http://dx.doi.org/10.1016/j.jradnu.2016.10.0 03
1546-0843 / $ 36.00/Copyright © 2016 Ассоциация медсестер по радиологии и визуализации.
Journal of Radiology Nursing 35 (2016) 323e325
Миомэктомия матки — обзор
ПРЕДОПЕРАЦИОННЫЕ СООБРАЖЕНИЯ
По сравнению с открытой миомэктомией и лапароскопической миомэктомией, гистероскопическая миомэктомия связана с меньшим количеством успешных осложнений. 7 Тем не менее, полное информированное согласие обязательно. Пациенты должны понимать низкий риск осложнений, включая перегрузку жидкостью, двухэтапную процедуру, кровотечение и перфорацию матки. Необходимо получить согласие и документацию на лапароскопию, лапаротомию и гистерэктомию, даже если абсолютный риск осложнений и перехода на более обширные процедуры невысок.
Большинство операционных гистероскопов имеют толщину от 7 до 10 F. Наиболее частыми осложнениями оперативной гистероскопии являются перфорация матки или разрывы шейки матки.Для расширения шейки матки используются расширители Пратта или Хегара. Часто самым сложным этапом проведения оперативной гистероскопии является расширение шейки матки. Хотя частота перфорации низкая, от 0,8% до 1,2% в более чем 24000 проанализированных гистероскопических процедурах, 8, 9 , если перфорация происходит, запланированная процедура не может быть завершена и должна быть перенесена.
Настоятельно рекомендуется предоперационное размещение палаток из ламинарии или введение мизопростола перорально или вагинально.Оба метода эффективно облегчают раскрытие шейки матки, снижают риск разрыва шейки матки, уменьшают риск использования чрезмерной силы для расширения шейки матки и, следовательно, снижают риск перфорации матки. Заметно улучшается легкость раскрытия шейки матки.
Мизопростол перорально или вагинально (200-400 мкг), вводимый за 8-12 часов до операции, смягчает и создает опухоль шейки матки, снижает силу, необходимую для раскрытия шейки матки, уменьшает шейные осложнения и сокращает время операции по сравнению с контрольной группой плацебо. женщины как в пременопаузе, так и в период менопаузы. 10, 11 Хотя мизопростол имеет несколько неприятных побочных эффектов, таких как боль в нижней части живота, диарея и легкое вагинальное кровотечение, его применению препятствуют лишь некоторые побочные эффекты, если таковые имеются. Спазмы матки возникают при использовании мизопростола. Иногда при применении мизопростола некоторые внутриполостные миомы пролапсируют в шейку матки или влагалище, что облегчает операцию.
Все пациенты, перенесшие оперативную гистероскопию, получают пользу от мизопростола, но рассмотрите возможность предоперационного назначения мизопростола пациентам с наибольшим риском стеноза шейки матки и перфорации матки: менопаузальным или нерожавшим женщинам, тем, кто принимает терапию ГнРГ, и тем, кто ранее прошел биопсию конуса, LEEP процедура, или кесарево сечение.Этим последним пациентам назначают 200-400 мкг мизопростола перорально за 2 дня до и за 8-12 часов до оперативной гистероскопии, при этом значительно улучшается способность расширять шейку матки.
Точно так же палатки из ламинарии, вставленные за 12–24 часа до операции, также способствуют расширению шейки матки, но это требует дополнительного посещения врача и не может использоваться женщинами с аллергией на моллюсков. Палатки из ламинарии не могут быть вставлены, особенно женщинам с точечным зевом шейки матки. При снятии палатки из ламинарии проверьте ее длину, чтобы убедиться, что ни одна часть не отсоединилась.
Рандомизированное исследование по сравнению палаток с мизопростолом и ламинарией показало, что оба препарата одинаково эффективны для прайминга шейки матки перед оперативной гистероскопией. 12 Преимущество мизопростола, однако, заключается в том, что его можно принимать перорально или вагинально в уединении дома пациента и не требует дополнительного посещения офиса.
Эмболизация миомы матки (UFE)
Эмболизация миомы матки (UFE) — это малоинвазивная процедура, используемая для лечения фибромиомы матки, которая может вызвать обильное менструальное кровотечение, боль и давление на мочевой пузырь или кишечник.Он использует форму рентгена в реальном времени, называемую рентгеноскопией, для управления доставкой эмболических агентов к матке и миоме. Эти агенты блокируют артерии, которые снабжают кровью миомы, и вызывают их сокращение. Исследования показали, что почти 90 процентов женщин, перенесших НФЭ, испытывают значительное или полное исчезновение симптомов, связанных с миомой.
Ваш врач, скорее всего, сначала оценит ваше состояние с помощью диагностической визуализации. Сообщите своему врачу, если есть вероятность, что вы беременны, и обсудите любые недавние заболевания, состояния здоровья, аллергии и лекарства, которые вы принимаете, включая травяные добавки и аспирин.Вам могут посоветовать прекратить прием аспирина, нестероидных противовоспалительных препаратов (НПВП) или антикоагулянтов за несколько дней до процедуры. Вам также могут запретить есть и пить после полуночи перед процедурой. Планируйте остаться в больнице на ночь. Оставьте украшения дома и носите свободную удобную одежду. Вам будет предложено надеть платье.
Что такое эмболизация миомы матки (UFE)?
Эмболизация миомы матки (UFE) — это малоинвазивное лечение миомы матки.Процедуру также иногда называют эмболизацией маточной артерии (ЭАЭ), но этот термин менее специфичен и, как будет описано ниже, ЭАЭ используется для состояний, отличных от миомы.
Фиброидные опухоли, также известные как миомы, — это доброкачественные опухоли, возникающие из мышечной стенки матки. Они крайне редко становятся злокачественными. Чаще они вызывают обильное менструальное кровотечение, боль в области таза и давление на мочевой пузырь или кишечник.
Во время процедуры UFE врачи используют рентгеновскую камеру, называемую флюороскопом, для направления доставки мелких частиц к матке и миоме.Мелкие частицы вводятся через тонкую гибкую трубку, называемую катетером. Они блокируют артерии, обеспечивающие кровоток, в результате чего миома сокращается. Почти 90 процентов женщин с миомой испытывают облегчение своих симптомов.
Поскольку влияние эмболизации миомы матки на фертильность до конца не изучено, UFE обычно предлагается женщинам, которые больше не хотят забеременеть или которые хотят или нуждаются в гистерэктомии, то есть операции по удалению матки.
вверх страницы
Каковы наиболее распространенные способы использования процедуры в ОАЭ?
Эмболизация маточной артерии десятилетиями использовалась для остановки тяжелого тазового кровотечения, вызванного:
- травма
- злокачественные гинекологические опухоли
- кровоизлияние после родов
Эмболизация миомы матки — это специализированная форма ЭМА для лечения симптоматической миомы.
вверх страницы
Как мне подготовиться?
Визуализация матки с помощью магнитно-резонансной томографии (МРТ) или ультразвука выполняется перед процедурой, чтобы определить, являются ли фиброидные опухоли причиной ваших симптомов, и полностью оценить размер, количество и расположение миомы.
Иногда ваш гинеколог может захотеть непосредственно осмотреть матку, выполнив лапароскопию. Если у вас сильное кровотечение между менструациями, может быть выполнена биопсия эндометрия (внутренней оболочки матки), чтобы исключить рак. См. Страницу «Аномальное вагинальное кровотечение» для получения дополнительной информации.
Сообщите своему врачу обо всех принимаемых вами лекарствах, включая травяные добавки. Перечислите любые аллергии, особенно на местный анестетик, общую анестезию или контрастные вещества.Ваш врач может посоветовать вам прекратить прием аспирина, нестероидных противовоспалительных препаратов (НПВП) или антикоагулянтов перед процедурой.
Сообщите своему врачу о недавних заболеваниях или других заболеваниях.
Женщинам следует всегда сообщать своему врачу и рентгенологу, если есть вероятность, что они беременны. Многие визуализационные тесты не проводятся во время беременности, чтобы не подвергать плод воздействию радиации. Если рентгеновский снимок необходим, будут приняты меры, чтобы свести к минимуму радиационное воздействие на ребенка. Дополнительную информацию о беременности и рентгеновских лучах см. На странице «Безопасность».
Скорее всего, вас попросят ничего не есть и не пить после полуночи перед процедурой. Ваш врач скажет вам, какие лекарства вы можете принимать утром.
Вам следует запланировать ночевку в больнице после процедуры.
Вам дадут халат, который вы наденете во время процедуры.
вверх страницы
Как выглядит оборудование?
В этой процедуре используются рентгеновское оборудование, катетер и различные лекарства и синтетические материалы, называемые эмболическими агентами.
Оборудование, обычно используемое для этого обследования, состоит из рентгенографического стола, одной или двух рентгеновских трубок и телевизионного монитора, который находится в смотровой. Рентгеноскопия, которая преобразует рентгеновские лучи в видеоизображения, используется для наблюдения и управления ходом процедуры. Видео создается рентгеновским аппаратом и детектором, подвешенным над столом, на котором лежит пациент.
Катетер — это длинная тонкая пластиковая трубка, которая значительно меньше «грифеля карандаша» или примерно 1/8 дюйма в диаметре.
Для эмболизации миомы матки используется несколько различных типов эмболических агентов. Они действуют аналогично, но различаются по составу:
- поливиниловый спирт, пластик, напоминающий крупный песок
- Gelfoam ™, желатиновый губчатый материал
- микросферы полиакриламидные с желатиновым покрытием
Все они оказались безопасными и эффективными при эмболизации миомы матки.
Другое оборудование, которое может использоваться во время процедуры, включает в себя внутривенную линию (IV), ультразвуковой аппарат и устройства, которые контролируют ваше сердцебиение и артериальное давление.
вверх страницы
Как работает процедура?
Процедура включает введение катетера через пах, маневрирование им через маточную артерию и введение эмболического агента в артерии, которые снабжают кровью матку и миомы. Когда миома умирает и начинает сокращаться, матка полностью восстанавливается.
вверх страницы
Как проходит процедура?
UFE — это минимально инвазивная процедура с визуальным контролем, при которой используется рентгеновская камера высокого разрешения, чтобы направить обученного специалиста, чаще всего интервенционного радиолога, для введения катетера в маточные артерии для доставки частиц.Процедура обычно выполняется в катетерической лаборатории или иногда в операционной.
Вы окажетесь на столе процедуры.
Вы можете быть подключены к мониторам, которые отслеживают вашу частоту сердечных сокращений, артериальное давление, уровень кислорода и пульс.
Медсестра или технолог вставит внутривенную (IV) трубку в вену на руке или руке, чтобы ввести успокаивающее средство. В этой процедуре может использоваться умеренная седация. Не требует дыхательной трубки. Однако некоторым пациентам может потребоваться общая анестезия.
Область вашего тела, в которую будет вводиться катетер, будет стерилизована и покрыта хирургической простыней.
Ваш врач обезболит пораженную область с помощью местного анестетика. Это может ненадолго обжечься или пощекотать кожу, прежде чем область онемеет.
На этом участке кожи делается очень маленький разрез.
Под контролем рентгеновского излучения катетер вводится в бедренную артерию, расположенную в области паха. Контрастный материал представляет собой дорожную карту для катетера, когда он вводится в маточные артерии.Эмболический агент попадает как в правую, так и в левую маточные артерии путем изменения положения того же катетера, который был первоначально введен. На всю процедуру требуется всего один небольшой кожный прокол. Дополнительную информацию см. На странице «Эмболизация катетера».
По окончании процедуры катетер удаляют и прикладывают давление, чтобы остановить кровотечение. Иногда ваш врач может использовать закрывающее устройство, чтобы закрыть небольшое отверстие в артерии. Это позволит вам перемещаться быстрее.На коже не видно швов. Крошечное отверстие в коже закрывается повязкой.
Ваша капельница удалена перед тем, как вы отправитесь домой.
Скорее всего, вы останетесь в больнице на ночь, чтобы получить обезболивающие и под наблюдением.
Обычно эта процедура занимает 90 минут.
вверх страницы
Кто интерпретирует результаты и как их получить?
Интервенционный радиолог обсудит с вами результаты и скоординирует последующее наблюдение с вашим лечащим врачом или гинекологом.
вверх страницы
Что я испытаю во время и после процедуры?
Устройства для контроля частоты пульса и артериального давления будут прикреплены к вашему телу.
Вы почувствуете легкое ущемление, когда игла вводится в вашу вену для внутривенного введения и когда вводится местный анестетик. Чаще всего ощущения возникают в месте разреза кожи. Это обезболивается с помощью местного анестетика. Вы можете почувствовать давление, когда катетер введен в вену или артерию.Однако серьезного дискомфорта вы не ощутите.
Если процедура проводится под действием седативных средств, внутривенное (в / в) седативное средство позволит вам расслабиться, почувствовать сонливость и комфорт во время процедуры. Вы можете бодрствовать, а можете и не бодрствовать, в зависимости от того, насколько глубоко вы находитесь под действием седативного препарата.
Вы можете почувствовать легкое давление при введении катетера, но это не вызывает серьезного дискомфорта.
Когда контрастное вещество проходит через ваше тело, вы можете почувствовать тепло. Это быстро пройдет.
Пока вы находитесь в больнице, вашу боль можно будет контролировать с помощью наркотика.
Проведя ночь в больнице, вы сможете вернуться домой на следующий день после процедуры.
Вы можете испытывать тазовые судороги в течение нескольких дней после UFE, а также, возможно, легкую тошноту и субфебрильную температуру. Спазмы наиболее сильны в течение первых 24 часов после процедуры и быстро пройдут в течение следующих нескольких дней. В больнице дискомфорт обычно хорошо контролируется обезболивающими, вводимыми через капельницу.
По возвращении домой вам выдадут рецепты на обезболивающие и другие лекарства, которые можно принимать внутрь.Вы сможете вернуться к своей обычной деятельности в течение одной-двух недель после UFE.
После этого менструальные кровотечения обычно становятся намного меньше во время первого цикла и постепенно повышаются до нового уровня, который обычно значительно улучшается по сравнению с тем, что было до процедуры. Иногда вы можете пропустить один-два цикла или даже изредка вообще прекратить менструацию. Для облегчения симптомов, связанных с объемным объемом, обычно требуется две-три недели, и в течение нескольких месяцев миома продолжает уменьшаться и смягчаться.К шести месяцам процесс обычно завершается, и степень улучшения симптомов стабилизируется.
вверх страницы
Каковы преимущества по сравнению с рисками?
Преимущества
- Эмболизация миомы матки, проводимая под местной анестезией, гораздо менее инвазивна, чем открытая или лапароскопическая операция по удалению отдельных миом матки (миомэктомия) или всей матки (гистерэктомия).
- Никакого хирургического разреза не требуется — только небольшой разрез на коже, который не требует наложения швов.
- Пациенты обычно могут вернуться к своей обычной деятельности намного раньше, чем если бы они перенесли операцию по лечению миомы.
- По сравнению с хирургическим вмешательством, общая анестезия не требуется, время восстановления намного короче, практически без кровопотери.
- Последующие исследования показали, что почти у 90 процентов женщин, у которых миома была вылечена эмболизацией миомы матки, наблюдается либо значительное, либо полное исчезновение симптомов, связанных с миомой.Это верно как для женщин с сильным кровотечением, так и для тех, у кого есть симптомы, связанные с объемным мочеиспусканием, включая частое мочеиспускание, боль в области таза или давление. В среднем миома сокращается до половины своего первоначального объема, что составляет примерно 20-процентное уменьшение их диаметра. Что еще более важно, они размягчаются после эмболизации и больше не оказывают давления на соседние органы малого таза.
- Последующие исследования, проведенные в течение нескольких лет, показали, что после эмболизации миомы матки редко восстанавливаются или развиваются новые миомы.Это связано с тем, что во время процедуры лечат все миомы, присутствующие в матке, даже узелки на ранней стадии, которые могут быть слишком маленькими, чтобы их можно было увидеть при визуализации. Эмболизация миомы матки — более постоянное решение, чем вариант гормональной терапии, потому что, когда гормональное лечение прекращается, опухоли миомы обычно отрастают. Повторный рост также был проблемой при лазерном лечении миомы матки.
Риски
- Любая процедура, при которой катетер помещается в кровеносный сосуд, сопряжена с определенным риском.Эти риски включают повреждение кровеносного сосуда, синяк или кровотечение в месте прокола, а также инфекцию. Врач примет меры предосторожности, чтобы снизить эти риски.
- При проведении опытным интервенционным радиологом вероятность возникновения любого из этих событий во время эмболизации миомы матки составляет менее одного процента.
- Любая процедура, при которой проникают кожные покровы, сопряжена с риском инфицирования. Вероятность заражения, требующего лечения антибиотиками, составляет менее одного случая на 1000.
- Всегда есть шанс, что агент эмболии может застрять в неправильном месте и лишить нормальные ткани снабжения кислородом.
- У случайной пациентки может возникнуть аллергическая реакция на рентгеноконтрастное вещество, используемое во время эмболизации миомы матки. Эти эпизоды варьируются от легкого зуда до тяжелых реакций, которые могут повлиять на дыхание женщины или артериальное давление. Женщины, перенесшие НФЭ, во время процедуры тщательно наблюдаются врачом и медсестрой, поэтому любая аллергическая реакция может быть немедленно обнаружена и устранена.
- Примерно у двух-трех процентов женщин после эмболизации миомы матки проходят небольшие фрагменты миомы. Это происходит, когда миома, расположенная внутри полости матки, отслаивается после эмболизации. Женщинам с этой проблемой может потребоваться процедура, называемая D&C (дилатация и выскабливание), чтобы убедиться, что весь материал удален, чтобы предотвратить кровотечение или развитие инфекции.
- У большинства женщин, перенесших эмболизацию миомы матки, нормальный менструальный цикл возобновляется после процедуры.Однако примерно у одного до пяти процентов женщин менопауза наступает после эмболизации миомы матки. Это чаще встречается у женщин старше 45 лет.
- Хотя цель эмболизации миомы матки — вылечить симптомы, связанные с миомой, без хирургического вмешательства, некоторым женщинам в конечном итоге может потребоваться гистерэктомия из-за инфекции или стойких симптомов. Вероятность необходимости гистерэктомии после эмболизации миомы матки зависит от того, сколько времени проходит до менопаузы.Чем моложе пациент, тем больше вероятность развития новых миомы или рецидивов симптомов.
- Женщины подвергаются облучению рентгеновскими лучами во время эмболизации миомы матки, но уровни воздействия обычно намного ниже тех, при которых неблагоприятные последствия для пациентки или будущего деторождения могут стать проблемой.
- На вопрос, влияет ли эмболизация миомы матки на фертильность, пока нет ответа, хотя у женщин, перенесших эту процедуру, было зарегистрировано несколько случаев здоровой беременности.Врачи могут порекомендовать женщине, которая хочет иметь больше детей, рассмотреть возможность хирургического удаления отдельных опухолей, а не эмболизацию миомы матки. Если это невозможно, то лучшим вариантом может быть UFE. В качестве альтернативы UFE см. Страницу «Фокусированное ультразвуковое исследование под контролем МРТ для миомы матки».
- Невозможно предсказать, ослаблена ли стенка матки каким-либо образом из-за НФЭ, что может вызвать проблемы во время родов. Поэтому в настоящее время рекомендуется использовать противозачаточные средства в течение шести месяцев после процедуры и сделать кесарево сечение во время родов, чтобы избежать риска разрыва стенки матки из-за интенсивных мышечных сокращений, которые происходят во время родов.
вверх страницы
Каковы ограничения эмболизации миомы матки (UFE)?
Эмболизация миомы матки не должна выполняться женщинам, у которых нет симптомов фиброидной опухоли, когда существует вероятность рака, или когда есть воспаление или инфекция в тазу. Эмболизация миомы матки не подходит для беременных женщин. Женщине с серьезной аллергией на контрастные вещества, содержащие йод, требуется предварительная обработка перед UFE или, возможно, следует рассмотреть другой вариант лечения.
вверх страницы
Какой тест, процедура или лечение лучше всего мне подходят?
вверх страницы
Эта страница была просмотрена 29 января 2020 г.
Абдоминальная миомэктомия | Медицинская школа Эмори
Что такое абдоминальная миомэктомия?
Миомэктомия — это операция по удалению миомы из матки. Миома — это доброкачественные ткани, которые растут внутри матки. Примерно у 3 из 4 женщин в какой-то момент жизни возникает миома.Абдоминальная миомэктомия — это серьезная операция, выполняемая через разрез в нижней части живота.
Почему мне делают эту операцию?
Если ваш врач обнаружит миомы в вашей матке, вам может потребоваться миомэктомия для их удаления. Миома может вызывать такие симптомы, как обильные или продолжительные месячные, боль в спине, тазовая боль или давление, запор, а также частое или затрудненное мочеиспускание. Операция по удалению миомы может быть эффективным вариантом лечения для облегчения этих симптомов. Еще одна возможная причина для удаления миомы — это попытка забеременеть, поскольку миома может вызвать проблемы с бесплодием.
Что происходит во время этой операции?
Перед началом операции вам сделают анестезию для сна. В нижней части живота будет сделан разрез длиной около 4 дюймов. Разрез будет вдоль лобковых волос или линии бикини. Из этого разреза хирург удалит миому внутри матки.
Какие риски?
Эта процедура имеет небольшой риск:
- Кровотечение во время операции, при которой может потребоваться переливание крови
- Инфекция операционного поля
- Повреждение окружающих органов (мочевого пузыря, кишечника и мочеточников)
- Возможна дальнейшая операция
Что мне делать, чтобы подготовиться к процедуре?
- Не ешьте и не пейте после полуночи накануне операции.
- Вы будете находиться под наркозом во время процедуры, поэтому вам понадобится кто-то, кто отвезет вас на прием и обратно.
- Обязательно приходите за два часа до предполагаемого времени начала операции.
- Задайте своему провайдеру любые вопросы, которые могут у вас возникнуть перед процедурой, особенно инструкции по прекращению или продолжению приема любых существующих лекарств.
- Следуйте инструкциям нашего офиса, чтобы записаться на прием до и после операции.
Чего ожидать во время восстановления?
После операции вам обычно нужно оставаться в больнице примерно на 2 ночи. Вы должны ожидать, что полное выздоровление после операции займет около 6 недель.
Кровотечение и выделения из влагалища в течение 1-2 недель после операции — это нормально. Выделения и кровотечение должны постепенно уменьшаться.
В течение 6 недель после операции вам необходимо избегать физических упражнений, подъема тяжелых предметов и сексуальной активности.



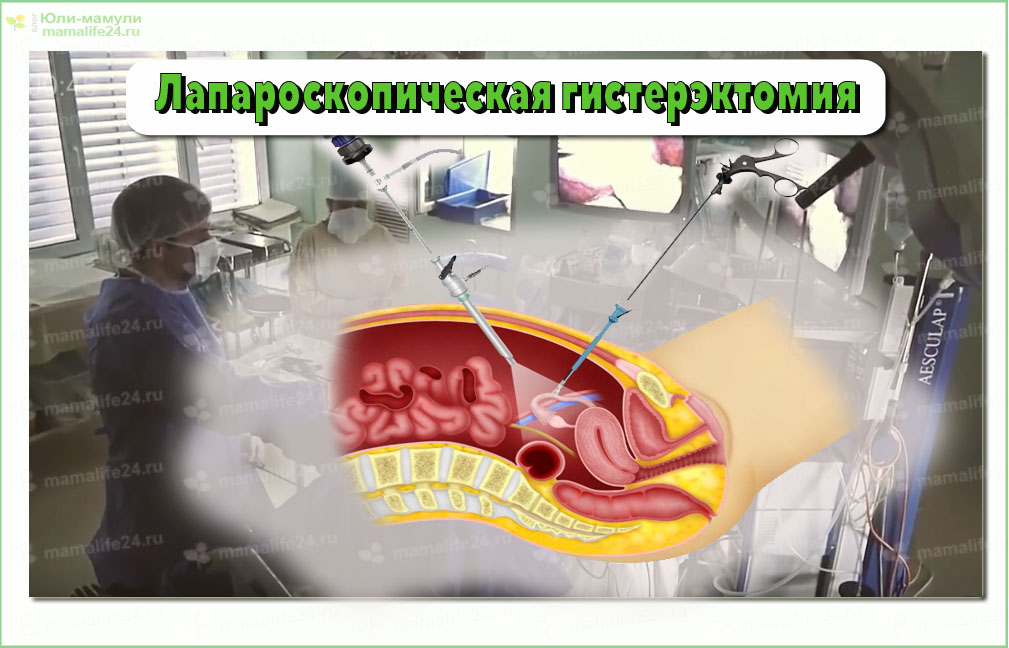
 В зависимости от вида операции вставать можно через несколько часов после нее или на следующие сутки;
В зависимости от вида операции вставать можно через несколько часов после нее или на следующие сутки;
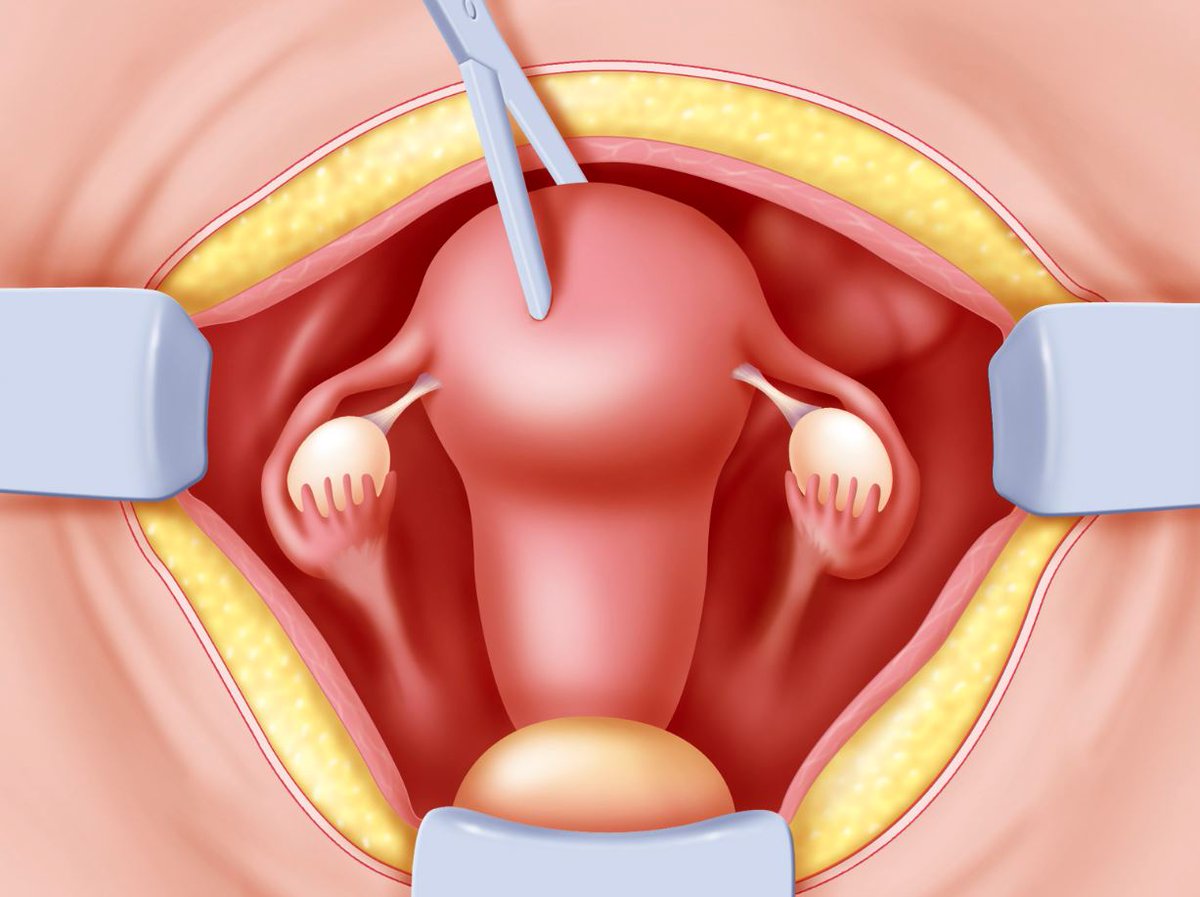
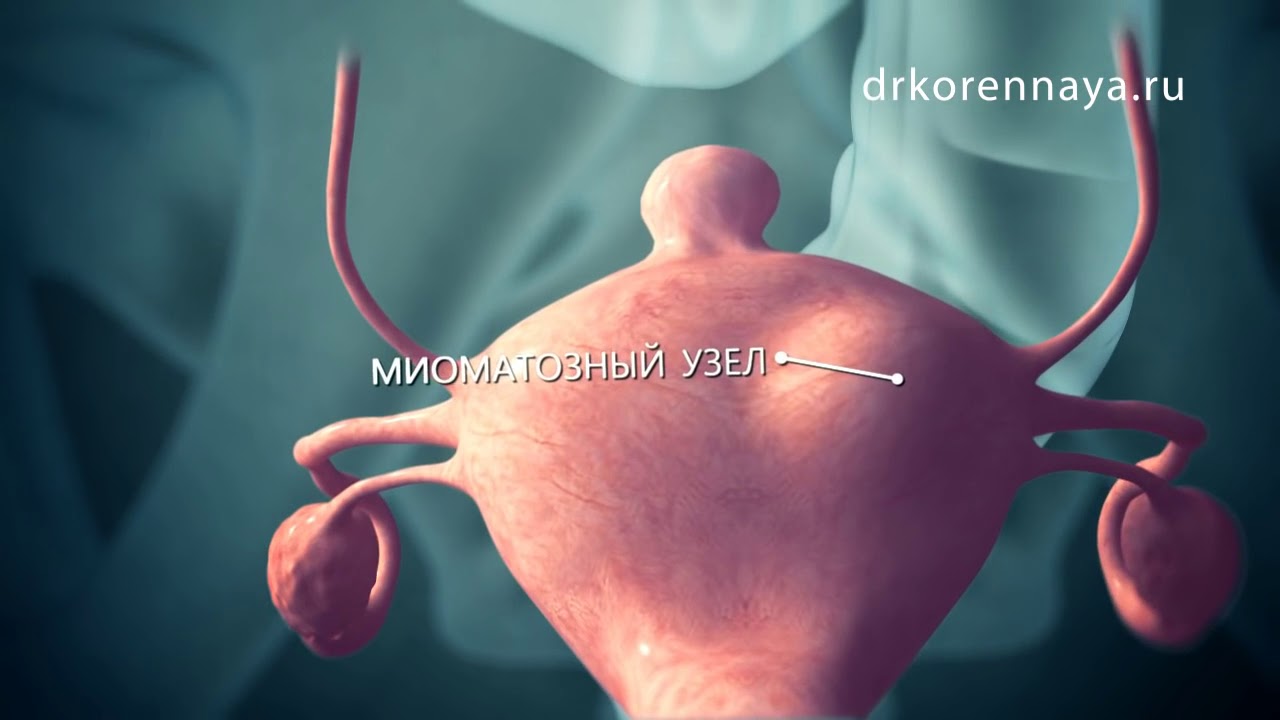


 Процедура проводится путем разреза в нижней части живота;
Процедура проводится путем разреза в нижней части живота; Для полноценной реабилитации не позволяется вести активную половую жизнь в первые 2-3 месяца после операции;
Для полноценной реабилитации не позволяется вести активную половую жизнь в первые 2-3 месяца после операции;




