Проявление микроангиопатии: Микроангиопатия — признаки, причины, симптомы, лечение и профилактика
Микроангиопатия понятие формы течение лечение
- Опубликовано: 22.09.2022
Микроангиопатия представляет собой заболевание сосудистой системы, характеризующееся поражением капилляров и развитием патологических изменений в их структуре. Это проявление некоторых самостоятельных патологий внутренних органов, приводящее к некрозу ткани, тромбозу и гиалинозу.
Термин «микроангиопатия» в переводе с латинского языка означает «патология мелких сосудов», возникающая на фоне хронических инфекционных заболеваний, эндокринопатии, онкопатологии, системных заболеваний соединительной ткани, недостаточности кровоснабжения головного мозга, дисфункции почек или сетчатки глаза. Такие тяжелые состояния, как почечная недостаточность, пурпура и гемолиз, проявляются микроангиопатией.
Микроангиопатия головного мозга обусловлена недостаточным поступлением кислорода и глюкозы к основным клеточным структурам, что проявляется дисфункцией и поражением капилляров мозга. При этом стенки базальной мембраны и интимы капилляров утолщаются. Нарушение мозговой микроциркуляции со временем приводит к повреждению белого вещества и заканчивается развитием инсульта или энцефалопатии.
При этом стенки базальной мембраны и интимы капилляров утолщаются. Нарушение мозговой микроциркуляции со временем приводит к повреждению белого вещества и заканчивается развитием инсульта или энцефалопатии.
слева – нормальное кровоснабжение мозга, справа – кислородное голодание
Диабетическая микроангиопатия развивается вследствие повышения уровня глюкозы в крови и приводит к повреждаются капилляров, артериол и венул. Гипоксия и сосудистый спазм способствуют развитию воспаления и появлению отеков. Диабетическая микроангиопатия заканчивается нефропатией, дисфункцией почек, протеинурией. При поражении сосудов, питающих сетчатку глаз, происходит ее отслойка и развивается ретинопатия.
Этиология
Основная причина микроангиопатии – нарушение метаболизма, при котором возникает гипоксия тканей, дисфункция сосудистого эндотелия, спазм сосудов, склеивание тромбоцитов, активация ренин-ангиотензивной системы.
Заболевания, при которых развивается микроангиопатия:
- Острая инфекция – краснуха, корь,
- Травматические повреждения,
- Злокачественные новообразования,
- Эндокринопатия — сахарный диабет,
- Печеночно-почечная патология,
- Интоксикации,
- Синдром приобретенного иммунодефицита,
- Генетически обусловленная дистония,
- Гематологические болезни.

К факторам, способствующим развитию патологии, относятся: табакокурение и алкоголизм, общее истощение организма, гипертония, пожилой возраст, производственные вредности.
Микроангиопатия мозга является следствием тромбоза, некроза, пролиферации эндотелия, гиалиноза, фибриноида, аневризмы капилляров, расширения венул и прочих патологических процессов, происходящих в организме человека при том или ином заболевании.
Симптоматика
При микроангиопатии нарушается целостность стенок капилляров, и развивается дисфункция свертывающей системы крови.
В зависимости от локализации патологического процесса микроангиопатия проявляется следующими клиническими признаками:
- Нарушением зрения,
- Болезненностью, онемением, дискомфортом в ногах,
- Синдромом «перемежающейся» хромоты,
- Кровотечением из носа или ЖКТ,
- Гематурией,
- Кровью в мокроте,
- Подкожными кровоизлияниями,
- Шелушением и сухостью кожи ног.
Микроангиопатия головного мозга проявляется постоянной головной болью, перепадами артериального давления, головокружением, общей слабостью, чрезмерной утомляемостью, нарушением координации движений, ухудшением памяти, снижением мнестических функций, судорожными припадками.
Тромботическая микроангиопатия имеет спорадический характер. Заболевание начинается с кишечной продромы, протекающей по типу диарейного или постдиарейного синдрома. Тромботическая микроангиопатия является причиной острой почечной недостаточности у детей, для которой характерны сезонные колебания в летние месяцы. У большинства больных женщин тромбоцитопеническая пурпура проявляется типичными симптомами патологии с частыми обострениями. Проявления тромботической микроангиопатии наблюдаются у беременных женщин, у лиц, страдающих гипертонической болезнью, онкопатологией, системными заболеваниями.
Формы
Микроангиопатия головного мозга (церебральная)
Церебральная микроангиопатия проявляется симптомами энцефалопатии, ишемии и лакунарного инфаркта, приводящим к диффузному или очаговому повреждению вещества мозга. Симптоматика микроангиопатии головного мозга появляется не сразу. У больных нарушается память, возникает беспричинная слабость, быстрая утомляемость, головокружение и головная боль, плохо купируемая приемом анестетиков. В результате дисциркуляторных процессов в головном мозге повреждаются стенки капилляров, запускаются процессы окислительного фосфорилирования.
В результате дисциркуляторных процессов в головном мозге повреждаются стенки капилляров, запускаются процессы окислительного фосфорилирования.
на изображении: пример микроангиопатии амилоидной этиологии ( при нарушении белкового обмена), напрямую связанной с сосудистой деменцией/болезнью Альцгеймера
Затем нарушается сон: ночью больной не спит, а в дневное время становится сонливым, вялым и рассеянным. Со временем к общим симптомам присоединяются очаговые: шаткость походки, нарушение координации движений, патологические рефлексы. Зрительные функции ухудшаются, появляются аневризмы в глазах, из носа часто течет кровь, возникает боль в ногах при ходьбе и дискомфорт в покое, кожа стоп шелушится и сохнет.
Диабетическая микроангиопатия
Диабетическая микроангиопатия развивается в результате стойкого повышения уровня глюкозы в крови. Мелкие сосуды, кровоснабжающие внутренние органы, повреждаются.
Основные клинические формы диабетической микроангиопатии:
- Нефропатия характеризуется поражением почечных структур и сосудов, питающих их.
 В тяжелых случаях диабетическая нефропатия может привести к развитию декомпенсированной почечной недостаточности, требующей проведения гемодиализа или трансплантации. Продукты обмена веществ при сахарном диабете накапливаются в крови и отравляют организм. Пораженные почки не справляются с их фильтрацией. На начальной стадии патологии у больных периодически повышается артериальное давление, ухудшается общее самочувствие, развивается нефротический синдром, появляются отеки. На терминальной стадии нефропатии кровяное давление достигает высоких цифр, развивается диспепсия, уремия, хроническая почечная недостаточность. В результате самоотравления организма поражаются внутренние органы и системы.
В тяжелых случаях диабетическая нефропатия может привести к развитию декомпенсированной почечной недостаточности, требующей проведения гемодиализа или трансплантации. Продукты обмена веществ при сахарном диабете накапливаются в крови и отравляют организм. Пораженные почки не справляются с их фильтрацией. На начальной стадии патологии у больных периодически повышается артериальное давление, ухудшается общее самочувствие, развивается нефротический синдром, появляются отеки. На терминальной стадии нефропатии кровяное давление достигает высоких цифр, развивается диспепсия, уремия, хроническая почечная недостаточность. В результате самоотравления организма поражаются внутренние органы и системы. - диабетическая микроангиопатия – следствие повреждения сосудов из-за избытка глюкозы, больше всего страдают глаза и нижние конечности Ретинопатия — поражение сетчатки глаза, приводящее в тяжелых случаях к слепоте. У больных постепенно падает острота зрения плоть до полной потери. С диагностической целью им проводят офтальмоскопию, биомикроскопию, визометрию, ангиографию сосудов сетчатки.
 Чтобы избавиться от патологии, необходимо скорректировать уровень сахара в крови и устранить метаболические нарушения.
Чтобы избавиться от патологии, необходимо скорректировать уровень сахара в крови и устранить метаболические нарушения. - Полинейропатия – осложнение диабета, поражающее нервную систему и проявляющееся определенным симптомокомплексом. У больных утрачивается работоспособность, повышаются все виды чувствительности, в том числе и болевая, нижние конечности немеют и болят, походка становится неустойчивой и шаткой, возникает эректильная дисфункция, энурез, ухудшается состояние волос и кожи. В тяжелых случаях нарушаются глотательный рефлекс и речь, возникают судороги, головокружение, потеря сознания. Если уровень сахара в крови нормализуется, признаки заболевания исчезнут.
Микроангиопатия нижних конечностей
Микроангиопатия нижних конечностей проявляется поражением капилляров. При этом ток крови в капиллярах и артериях замедляется, питание тканей нарушается, отдельные участки стоп поражаются. При снижении иммунной защиты заболевание начинает прогрессировать.
«Диабетическая стопа» – клиническая форма развития микроангиопатии ног при сахарном диабете. Пропускная способность капилляров снижается, развивается гипоксия и дистрофия тканей стоп, а со временем полная атрофия. Поражаются обычно пальцы стоп, стопы, голени и вся конечность до самого бедра.
Пропускная способность капилляров снижается, развивается гипоксия и дистрофия тканей стоп, а со временем полная атрофия. Поражаются обычно пальцы стоп, стопы, голени и вся конечность до самого бедра.
Заболевание в течение длительного периода протекает скрыто и не доставляет больному беспокойства. Пациенты жалуются на боль и повышенную утомляемость в ногах. Болевой синдром умеренно выражен и носит ноющий, ломящий или колющий характер. Со временем боль становится постоянной и интенсивной. Больные чувствуют скованность и повышенную утомляемость в ногах, возникающую в покое. Периодически появляется онемение и жжение ног, болезненность разной степени интенсивности, чувство «ползания мурашек». Объем мышц стоп и голени увеличивается, пальцы ног становятся синюшными, ногти ломкими и исчерченными, голени бледнеют, процессы ороговения кожи активизируются. На коже голеней и стоп появляются незаживающие язвы. Возможно развитие гангрены.
Микроангиопатия печени
Микроангиопатия печени характеризуется изменением стенок сосудов, нарушением свертываемости крови, замедлением скорости кровотока. Эти факторы способствуют активации тромбоцитов, повышению вязкости крови, вазодилатации, тромбообразованию.
Эти факторы способствуют активации тромбоцитов, повышению вязкости крови, вазодилатации, тромбообразованию.
Диагностика
- Магнитно-резонансная томография позволяет обнаружить признаки гипоплазии артерий и церебральной атрофии, визуализировать очаги инфарктов, точечные кровоизлияния, единичные супратенториальные очаги глиоза. пример снимка МРТ при ангиопатии мозга, стрелками выделен очаг глиоза
- Ультразвуковая допплерография выявляет патологические изменения в сосудах, сужение их просвета, закупорку.
- Общий анализ крови.
- УЗИ глазного дна.
- Биохимическое исследование крови.
- Электрокардиография.
- Рентгенологическое исследование больной конечности в прямой и боковой проекции.
- Бактериологическое исследование гнойных выделений и определение чувствительности выделенного микроба к антибиотикам.
- Компьютерная томография.
Видео по теме:
» src=»https://www.youtube.com/embed/h4kWZkkxlrU» frameborder=»0″ allowfullscreen=»allowfullscreen»>Лечение
Лечение микроангиопатии головного мозга комплексное, включающее соблюдение диеты и назначение больным основных групп препаратов:
- Антигипоксанты устраняют признаки гипоксии в ткани мозга – «Эмоксипин».
- Статины и фибраты корректируют уровень липидов в крови – «Флувастатин», «Ловастатин», «Фенофибрат».
- Ноотропные средства улучшают трофику мозга – «Пантогам», «Ноотропил», «Фенибут».
- Гипотензивные средства назначают больным с артериальной гипертензией – «Капотен», «Тенорик».
- Препараты, улучшающие микроциркуляцию – «Пентоксифиллин», «Ксантинол».
- Ангиопротекторы улучшают состояние сосудистой стенки и снижают ее патологическую проницаемость – «Дицинон», «Компламин».
- Антиоксиданты – витамин Е, группы В, селен, липоевая кислота.
- Дезагреганты и антиагреганты – «Тромбо АСС», «Кардиомагнил», «Трентал», «Курантил».

- Коферменты нормализуют все виды обмена при сахарном диабете – «Кокарбоксилаза», «Флавинат», «Пиридоксальфосфат».
Физиотерапия обычно дополняет медикаментозное лечение и улучшает микроциркуляцию крови в тканях. Больным проводят грязелечение, электростимуляцию, плазмофорез, электролечение, теплолечение, бальнеотерапию, микроволновую резонансную терапию, массаж, иглорефлексотерапию.
Для лечения диабетической микроангиопатии необходимо нормализовать уровень глюкозы крови.
В настоящее время фармацевтическая промышленность выпускает огромное количество гипогликемических препаратов, которые подбирает эндокринолог индивидуально каждому пациенту. При необходимости им назначают инсулин. Параллельно с лечением основной патологии проводят симптоматическую и патогенетическую терапию, направленную на предотвращение развития осложнений микроангиопатии. Для восстановления проходимости сосудов прибегают к хирургическому вмешательству: криохирургии или коагуляции лазером. В запущенных случая требуется ампутация конечности или ее элементов, а в дальнейшем — протезирование ампутированной части ноги.
В запущенных случая требуется ампутация конечности или ее элементов, а в дальнейшем — протезирование ампутированной части ноги.
Понедельник — пятница:
с 8.00 до 20.00
Суббота:
с 8.00 до 14.00
прием ведут дежурные врачи
Воскресенье — ВЫХОДНОЙ
ул. 1-я Баррикадная, 48
8 (863) 268-74-97
ул. Плеханова, 14
8 (863) 222-34-19
- Крымская Геморрагическая лихорадка 01.06.2022
- Европейская неделя иммунизации с 24 апреля по 30 апреля 2022г. Вакцинируйся! Будь на шаг впереди инфекции! 25.04.2022
- Общероссийское голосование за выбор общественных территорий, планируемых к благоустройству в 2023 году. 22.04.2022
- Памятка для граждан о действиях в случае бессимптомного или легкого течения новой коронавирусной инфекции и острой респираторной вирусной инфекции 01.
 02.2022
02.2022 - ЩИТ от COVID: вся правда о вакцинации 11.01.2022
- Выражаем искренние соболезнования родным и близким 23.11.2021
Церебральная микроангиопатия, ассоциированная с артериальной гипертензией и метаболическими нарушениями uMEDp
Основным этиопатогенетическим фактором поражения церебральных сосудов мелкого калибра, ассоциированным с артериальной гипертензией и метаболическими нарушениями, является эндотелиальная дисфункция – наиболее ранний признак атеросклероза и риска развития таких осложнений цереброваскулярной болезни, как когнитивные нарушения. Своевременная комплексная терапия – решающий фактор обратного развития эндотелиальной дисфункции и надежная профилактика сосудистых когнитивных нарушений. Препарат дипиридамол, обладающий плейотропными эффектами, может рассматриваться как одно из патогенетически обоснованных средств в комплексной медикаментозной терапии эндотелиальной дисфункции.
Таблица 1. Спектр клинических проявлений церебральной микроангиопатии
Спектр клинических проявлений церебральной микроангиопатии
Таблица 2. Плейотропные эффекты дипиридамола
Введение
Артериальной гипертензией (АГ) страдает более 60% людей в возрасте 55 лет и старше и более 80% людей в возрасте старше 85 лет [1]. Мозг является одним из органов-мишеней, наиболее рано поражаемых при АГ: в первую очередь страдают сосуды мелкого калибра, в результате чего наблюдаются повреждение белого вещества, расширение периваскулярных пространств и лакунарные инфаркты.
Поражение церебральных сосудов мелкого калибра (церебральная микроангиопатия или дисциркуляторная энцефалопатия) – основной фактор развития когнитивных нарушений и сосудистой деменции. Ввиду распространенности и медицинской значимости проблемы тонкие механизмы патогенеза церебральной микроангиопатии, а также связь между ангиопатией и когнитивными нарушениями находятся в фокусе современных научных исследований. Более сложные взаимосвязи возникают при кумулятивном поражении церебральных сосудов АГ и коморбидными патологическими состояниями, в первую очередь сахарным диабетом и метаболическим синдромом.
Основным этиопатогенетическим фактором поражения церебральных сосудов мелкого калибра, ассоциированным с АГ и метаболическими нарушениями, является эндотелиальная дисфункция – наиболее ранний признак атеросклероза и риска развития таких осложнений цереброваскулярной болезни, как инсульт и когнитивные нарушения [3].
Не вызывает сомнений, что эндотелий – важный гомеостатический орган, контролирующий регуляцию сосудистого тонуса. В норме он поддерживает структуру и тонус сосуда, регулируя баланс между вазодилатацией и вазоконстрикцией, ингибицией и активацией роста эндотелия, антитромбогенезом и протромбогенезом, антивоспалительными и провоспалительными реакциями, а также антиоксидантными и прооксидантными эффектами.
На ранних стадиях повреждения эндотелия возникают только обратимые изменения эндотелиальной функции, которые принято обозначать термином «эндотелиальная дисфункция». Фундаментальный признак дисфункции – нарушение биодоступности NO и соответственно ослабление сосудорасширяющей реакции на эндотелиальные раздражители. При уменьшении биодоступности NO эндотелий пытается компенсировать дефицит различными физиологическими путями.
Окислительный стресс, при котором происходит накопление в крови большого количества активных форм кислорода (свободнорадикальных соединений), значительно стимулирует прогрессирование эндотелиальной дисфункции [5]. В случае выраженного окислительного стресса даже при нормальном синтезе NO происходит его быстрая инактивация. Связь эндотелиальной дисфункции и сердечно-сосудистых факторов риска, как правило, двусторонняя. Например, у женщин в постменопаузальном периоде эндотелиальная дисфункция может быть, с одной стороны, предрасполагающим фактором для развития АГ [6] и сахарного диабета [7], а с другой – пусковым патогенетическим механизмом для их появления.
Следует отметить роль эндотелиальной дисфункции в прогрессировании атеросклеротического повреждения органов-мишеней, в первую очередь сердца, почек, артерий, питающих мозг. В настоящее время нет специфических исследований, оценивающих связь функции периферического эндотелия и эндотелия церебральных сосудов. Однако имеющиеся данные свидетельствуют об увеличении циркулирующих маркеров повреждения эндотелия: молекул адгезии сосудистого эндотелия первого типа, тромбомодулинов, тканевых факторов свертывания крови и ингибитора пути тканевого фактора – у пациентов с церебральной микроангиопатией.
Однако имеющиеся данные свидетельствуют об увеличении циркулирующих маркеров повреждения эндотелия: молекул адгезии сосудистого эндотелия первого типа, тромбомодулинов, тканевых факторов свертывания крови и ингибитора пути тканевого фактора – у пациентов с церебральной микроангиопатией.
Эндотелиальная дисфункция и артериальная гипертензия
Большинство экспертов рассматривают нарушение свойств эндотелия как основной механизм становления АГ. Механизм развития эндотелиальной дисфункции при гипертонической болезни окончательно не выяснен. Однако значение имеет снижение активности NO-синтазы, вследствие чего уменьшается выработка NO или повышается его инактивация свободными радикалами – продуктами перекисного окисления липидов. Основное последствие нарушения эндотелий-зависимой вазодилатации – усиление периферического сопротивления. Артериальная ригидность способствует увеличению импульсного давления, что является гемодинамическим стрессором для мозга, который имеет низкую резистентность к пульсовому ударному потоку. Ударное давление в первую очередь наносит ущерб сосудам головного мозга мелкого калибра. Нарушение функционирования пенетрирующих артерий и артериол приводит к расстройству механизмов ауторегуляции мозгового кровообращения и нарушению целостности гематоэнцефалического барьера [8]. Повышение проницаемости гематоэнцефалического барьера сопровождается экстравазацией компонентов плазмы непосредственно в артериальную стенку (что способствует ее утолщению и дезинтеграции), прилегающие области мозга с развитием периваскулярного отека (что может быть одним из механизмов поражения белого вещества), а также процессами асептического воспаления. Эти изменения – важный этап, предшествующий повреждению ткани мозга, включая инсульт лакунарного подтипа. Ввиду более неблагоприятных условий кровоснабжения подкорковое и перивентрикулярное белое вещество полушарий головного мозга может страдать в большей степени, чем серое вещество мозга, что обусловливает клиническую картину хронической ишемии мозга. В результате повреждения мелких сосудов головного мозга нарушается перфузия в лобных-подкорковых областях мозга.
Ударное давление в первую очередь наносит ущерб сосудам головного мозга мелкого калибра. Нарушение функционирования пенетрирующих артерий и артериол приводит к расстройству механизмов ауторегуляции мозгового кровообращения и нарушению целостности гематоэнцефалического барьера [8]. Повышение проницаемости гематоэнцефалического барьера сопровождается экстравазацией компонентов плазмы непосредственно в артериальную стенку (что способствует ее утолщению и дезинтеграции), прилегающие области мозга с развитием периваскулярного отека (что может быть одним из механизмов поражения белого вещества), а также процессами асептического воспаления. Эти изменения – важный этап, предшествующий повреждению ткани мозга, включая инсульт лакунарного подтипа. Ввиду более неблагоприятных условий кровоснабжения подкорковое и перивентрикулярное белое вещество полушарий головного мозга может страдать в большей степени, чем серое вещество мозга, что обусловливает клиническую картину хронической ишемии мозга. В результате повреждения мелких сосудов головного мозга нарушается перфузия в лобных-подкорковых областях мозга.
Эндотелиальная дисфункция и сахарный диабет
У больных сахарным диабетом, как правило, наблюдается нарушение эндотелий-зависимой вазодилатации. Отчасти это связано с высокой коморбидностью диабета с другими факторами воздействия на эндотелий, включая АГ, ожирение и дислипидемию, вкусовые предпочтения (употребление высококалорийных продуктов с последующим образованием свободнорадикальных соединений, способных
В последнее время появляется все больше публикаций о взаимодействии инсулина и eNOS. Показано, что в норме инсулин способен индуцировать дозозависимое увеличение кровотока за счет снижения сосудистого сопротивления в скелетной мышце и вазодилатации микрососудистого русла [12]. Сосудорасширяющее действие инсулина опосредуется повышенным синтезом NO благодаря активации инсулиновых рецепторов фосфоинозитид-3-киназного пути и повышению экспрессии eNOS [13]. Таким образом, инсулин через прямое взаимодействие с системой эндотелиальной eNOS/NO или другими внутриклеточными системами участвует в регуляции сосудистого тонуса и реактивности. Инсулинорезистентность нарушает вышеописанную регуляцию сосудистого тонуса. Кроме того, гипергликемия приводит к образованию продуктов ускоренного гликирования, которые формируются в результате неферментативных реакций белков с глюкозой и ее производными. Продукты ускоренного гликирования инициируют экспрессию генов коллагена и других белков капиллярной мембраны, обладающих проатерогенными свойствами.
Показано, что в норме инсулин способен индуцировать дозозависимое увеличение кровотока за счет снижения сосудистого сопротивления в скелетной мышце и вазодилатации микрососудистого русла [12]. Сосудорасширяющее действие инсулина опосредуется повышенным синтезом NO благодаря активации инсулиновых рецепторов фосфоинозитид-3-киназного пути и повышению экспрессии eNOS [13]. Таким образом, инсулин через прямое взаимодействие с системой эндотелиальной eNOS/NO или другими внутриклеточными системами участвует в регуляции сосудистого тонуса и реактивности. Инсулинорезистентность нарушает вышеописанную регуляцию сосудистого тонуса. Кроме того, гипергликемия приводит к образованию продуктов ускоренного гликирования, которые формируются в результате неферментативных реакций белков с глюкозой и ее производными. Продукты ускоренного гликирования инициируют экспрессию генов коллагена и других белков капиллярной мембраны, обладающих проатерогенными свойствами.
Важная роль в развитии сосудистых осложнений диабета принадлежит неферментативному аутоокислительному гликозилированию и окислительному стрессу, вызванному нарушением углеводного обмена. Снижение биодоступности NO и редукция антиоксидантной защиты – основные механизмы эндотелиальной дисфункции независимо от причины повреждения эндотелия. Собственно метаболические нарушения и сахарный диабет, коморбидный с АГ, независимо или совместно нарушают эндотелиальную функцию по общим механизмам, провоцируя развитие атеросклероза и тромбоэмболических осложнений.
Снижение биодоступности NO и редукция антиоксидантной защиты – основные механизмы эндотелиальной дисфункции независимо от причины повреждения эндотелия. Собственно метаболические нарушения и сахарный диабет, коморбидный с АГ, независимо или совместно нарушают эндотелиальную функцию по общим механизмам, провоцируя развитие атеросклероза и тромбоэмболических осложнений.
Эндотелиальная дисфункция и тромбогенез
У всех пациентов с эндотелиальной дисфункцией, включая самые ранние формы, имеются однонаправленные изменения гемореологии и гемостаза, выражающиеся прежде всего в повышении агрегационной активности тромбоцитов. Тромбоциты играют решающую роль в тромбозе, воспалении и атерогенезе. Артериальные тромбы состоят преимущественно из тромбоцитов, образующихся в условиях повышенного кровотока в местах атеросклеротического поражения сосудов. Хроническая атеросклеротическая болезнь часто клинически не проявляется, но при осложнении тромбозом может привести к острому коронарному синдрому, инсульту, транзиторной ишемической атаке.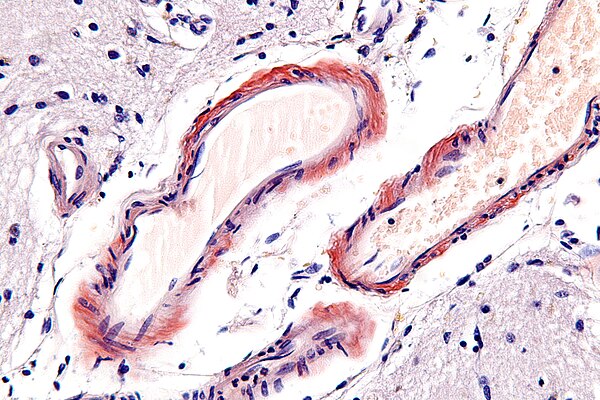 Тромбоциты – ключевой фактор клинических событий при атеротромбозе.
Тромбоциты – ключевой фактор клинических событий при атеротромбозе.
Важный фактор, способствующий развитию атеротромбоза, – окислительный стресс. Известно, что поврежденный эндотелий сосудистой стенки продуцирует активные формы кислорода и способствует активации лейкоцитов и тромбоцитов. Развивающаяся агрегация тромбоцитов за счет образования тромбоцит-тромбоцитарных взаимодействий связана с увеличением потребления кислорода. Образующиеся активированные тромбоцитарно-нейтрофильные комплексы высвобождают NO, который взаимодействует с супероксид-анион-радикалом, модулируя таким образом воспалительный процесс в сосудистой стенке. Активированные тромбоциты вступают в контакт с субэндотелиальным слоем, образуют отростки с формированием тромбоцитарных конгломератов (агрегация) и приклеиваются (адгезия) на этих участках, образуя белый тромб.
Длительно сохраняющаяся повышенная активность тромбоцитов – одна из причин тромботических осложнений многих заболеваний. Антиагрегантные препараты ингибируют агрегацию тромбоцитов и эритроцитов, уменьшают их способность к склеиванию и прилипанию к эндотелию кровеносных сосудов. Антиагреганты способны не только предупреждать агрегацию, но и вызывать дезагрегацию уже агрегированных кровяных пластинок.
Антиагрегантные препараты ингибируют агрегацию тромбоцитов и эритроцитов, уменьшают их способность к склеиванию и прилипанию к эндотелию кровеносных сосудов. Антиагреганты способны не только предупреждать агрегацию, но и вызывать дезагрегацию уже агрегированных кровяных пластинок.
Клиническая манифестация церебральной микроангиопатии, ассоциированной с артериальной гипертензией и метаболическими нарушениями
Выявление снижения когнитивных способностей на ранних стадиях у пациентов с АГ предоставляет уникальную возможность для проведения профилактической терапии до развития деменции. Церебральная микроангиопатия длительное время протекает асимптомно и обычно игнорируется. Поэтому важно ориентироваться не только на нарушения когнитивной функции, но и на неспецифические церебральные симптомы. Развернутая клиническая картина включает три кластера симптомов (табл. 1).
Наиболее ранний клинический маркер недостаточности церебральной перфузии – расстройства тревожно-депрессивного спектра, проявляющиеся множеством неспецифических жалоб преимущественно астенического круга, за фасадом которых скрываются мягкие когнитивные нарушения. Обычно это нарушение регуляторных когнитивных функций и внимания при полном сохранении бытовой независимости и профессиональных навыков. В таких случаях пациенты редко жалуются на грусть, печальное настроение, тоскливое ожидание будущего. Напротив, их в большей степени беспокоят неспецифические соматические симптомы (астения, быстрая утомляемость, боли, плохой сон, снижение аппетита и др.). Тревога часто сопровождает депрессию позднего возраста. Маской психических симптомов депрессии также могут быть раздражительность, ворчливость, которые часто расцениваются окружающими как особенность пожилого возраста. Сочетание нарушения концентрации внимания с легкими или умеренными симптомами тревожно-депрессивного спектра и едва заметными изменениями походки в виде замедления, укорочения шага, неустойчивости (жалоба на головокружение) может свидетельствовать о клиническом дебюте сосудистой энцефалопатии.
Обычно это нарушение регуляторных когнитивных функций и внимания при полном сохранении бытовой независимости и профессиональных навыков. В таких случаях пациенты редко жалуются на грусть, печальное настроение, тоскливое ожидание будущего. Напротив, их в большей степени беспокоят неспецифические соматические симптомы (астения, быстрая утомляемость, боли, плохой сон, снижение аппетита и др.). Тревога часто сопровождает депрессию позднего возраста. Маской психических симптомов депрессии также могут быть раздражительность, ворчливость, которые часто расцениваются окружающими как особенность пожилого возраста. Сочетание нарушения концентрации внимания с легкими или умеренными симптомами тревожно-депрессивного спектра и едва заметными изменениями походки в виде замедления, укорочения шага, неустойчивости (жалоба на головокружение) может свидетельствовать о клиническом дебюте сосудистой энцефалопатии.
При прогрессировании заболевания усугубляется когнитивный дефицит. Врачу не следует пренебрегать активной жалобой пациента на забывчивость. Необходимо проанализировать, как забывчивость отражается на ежедневном функционировании пациента. Кроме того, важно получить объективное свидетельство родственников о чрезмерной забывчивости пациента в последнее время: например, пациент не может запомнить новые имена, имеет затруднения при счетных операциях.
Необходимо проанализировать, как забывчивость отражается на ежедневном функционировании пациента. Кроме того, важно получить объективное свидетельство родственников о чрезмерной забывчивости пациента в последнее время: например, пациент не может запомнить новые имена, имеет затруднения при счетных операциях.
Умеренные когнитивные нарушения характеризуются постоянной забывчивостью, утомляемостью при выполнении обычной умственной работы. Описанные нарушения вызывают у пациента сложности, но не лишают его независимости. Такой пациент не может правильно организовать свою деятельность, быстро устает, часто допускает ошибки из-за невнимательности. Во время беседы врач может заметить, что пациент затрудняется самостоятельно полно изложить анамнез, не понимает его рекомендаций. Если такой пациент оказывается на приеме с сопровождающим, например с родственником, то при попытке ответить на вопрос врача он поворачивается к сопровождающему лицу, ища поддержки или подсказки. Данный феномен получил название «симптом поворачивающейся головы».
Множество неспецифических жалоб у пожилого пациента также должно настораживать клинициста, особенно если пациент не может объяснить их суть. Когнитивные нарушения сосудистой природы обязательно сопровождаются нарушениями со стороны неврологического статуса, в частности почти всегда нарушается походка. Это может легко заметить даже врач, не имеющий навыков неврологического осмотра. Походка у пациента становится осторожной, замедленной, он испытывает трудности при начале ходьбы, поворотах, иногда шаркает, вероятны падения. Пациент может активно жаловаться на неустойчивость.
Синдромальная диагностика включает установление факта снижения когнитивных способностей по сравнению с индивидуальной нормой и оценку тяжести когнитивных нарушений. Значительную помощь в синдромальной диагностике могут оказать нейропсихологические тесты. Простой в использовании тест Mini-Cog применяется для скрининговой оценки когнитивной сферы. Наиболее чувствительна и специфична к умеренным когнитивным нарушениям Монреальская шкала оценки когнитивных функций, включающая исследование различных когнитивных сфер: концентрации внимания, исполнительных функций, памяти, языка, зрительно-конструктивных навыков, абстрактного мышления, счета и ориентации.
На втором этапе диагностического поиска определяются наиболее вероятные причины когнитивных расстройств, то есть осуществляется нозологическая диагностика. При подозрении на когнитивный дефицит в анамнезе у пациента следует попытаться выявить и взвесить факторы риска сосудистых когнитивных нарушений: артериальную гипертензию неустановленной давности, избыточную массу тела в прошлом, кардиальную патологию, нарушение гликемического контроля и др. Соматическое обследование абсолютно необходимо для диагностики ведущего сосудистого фактора риска либо равноценного комплекса таких факторов, например метаболического синдрома. При наличии у пациента двух из пяти диагностических критериев метаболического синдрома (повышенного артериального давления и абдоминального ожирения) [14] проводится инициальное лабораторное исследование, включающее стандартную биохимическую панель для оценки обмена глюкозы, липидов и почечной функции. Для верификации сосудистой природы когнитивных нарушений большое значение имеют результаты нейровизуализации. В соответствии с современными требованиями диагноз сосудистых когнитивных расстройств неправомерен при отсутствии нейровизуализационного подтверждения. Магнитно-резонансная томография помогает выявить различные варианты морфологических изменений, связанных с патологией мелких мозговых артерий, главные из которых диффузное поражение белого вещества (лейкоэнцефалопатия), лакунарные инфаркты, микрокровоизлияния, вторичная церебральная атрофия. Оценка структурных изменений, ассоциированных с микроангиопатией, значительно улучшилась за последнее десятилетие благодаря достижениям в области нейровизуализации.
В соответствии с современными требованиями диагноз сосудистых когнитивных расстройств неправомерен при отсутствии нейровизуализационного подтверждения. Магнитно-резонансная томография помогает выявить различные варианты морфологических изменений, связанных с патологией мелких мозговых артерий, главные из которых диффузное поражение белого вещества (лейкоэнцефалопатия), лакунарные инфаркты, микрокровоизлияния, вторичная церебральная атрофия. Оценка структурных изменений, ассоциированных с микроангиопатией, значительно улучшилась за последнее десятилетие благодаря достижениям в области нейровизуализации.
Дальнейшее прогрессирование заболевания у некоторых больных может привести к развитию деменции с ограничением повседневной активности, формированием зависимости от посторонней помощи. Прогрессирование двигательных нарушений (ходьбы и равновесия) может приводить к падениям, которые в значительной степени ограничивают мобильность пациента. Бремя сосудистой деменции для пациента, его окружения и общества в целом – важный фактор, побуждающий врача к ранней диагностике и лечению церебральной микроангиопатии.
Лечение
На ранних этапах церебральной микроангиопатии лечение проводится с учетом факторов риска и целью предотвратить или значительно замедлить прогрессирование заболевания, в том числе развитие острых состояний. Основные стратегии включают:
- нормализацию артериального давления, углеводного и липидного обмена при их нарушении;
- борьбу с курением, ожирением и гиподинамией;
- ограничение употребления алкоголя, соли, животных жиров.
Для реализации этих мероприятий в первую очередь следует мотивировать пациента к увеличению физической активности, соблюдению диеты, богатой антиоксидантами. Лица, предпочитающие так называемую средиземноморскую диету, реже имеют когнитивные нарушения.
В качестве гипотензивных средств наиболее обоснованным считается применение ингибиторов ангиотензинпревращающего фермента и антагонистов ангиотензиновых рецепторов, поскольку эти препараты повышают реактивность мелких церебральных сосудов, а также обладают антиоксидантной и антивоспалительной активностью [15]. Кроме того, этот класс гипотензивных средств имеет некоторые преимущества для пациентов, страдающих сахарным диабетом. Риск инсульта и сердечно-сосудистых событий значительно уменьшается при уровне систолического артериального давления менее 140 мм рт. ст., а диастолического – менее 90 мм рт. ст. Некоторые эксперты рекомендуют более мягкие целевые цифры артериального давления, например для лиц старше 60 лет – 150/90 мм рт. ст. Однако у пациентов с сахарным диабетом или заболеванием почек следует стремиться к уровню артериального давления ниже 130/80 мм рт. ст.
Кроме того, этот класс гипотензивных средств имеет некоторые преимущества для пациентов, страдающих сахарным диабетом. Риск инсульта и сердечно-сосудистых событий значительно уменьшается при уровне систолического артериального давления менее 140 мм рт. ст., а диастолического – менее 90 мм рт. ст. Некоторые эксперты рекомендуют более мягкие целевые цифры артериального давления, например для лиц старше 60 лет – 150/90 мм рт. ст. Однако у пациентов с сахарным диабетом или заболеванием почек следует стремиться к уровню артериального давления ниже 130/80 мм рт. ст.
Метформин обычно используется в инициирующий период лечения для контроля гипергликемии у пациентов с метаболическим синдромом. Некоторые исследования демонстрируют, что метформин помогает обратить вспять патофизиологические изменения у таких пациентов.
При нарушении липидного обмена следует рассмотреть назначение статинов. Существуют убедительные доказательства того, что снижение уровня холестерина липопротеинов низкой плотности увеличивает показатель эндотелий-зависимой вазодилатации [16]. Это связано с тем, что помимо снижения уровня холестерина в крови статины обладают холестерин-независимыми плейотропными эффектами. Обсуждается влияние статинов на уменьшение риска инсульта. Кроме того, статины не дают откладываться бета-амилоиду в сосудистой стенке, что замедляет течение микроангиопатии. Если не удается достигнуть желаемого результата, используя диету в сочетании с приемом статинов, можно добавить препараты нестатинового ряда, снижающие уровень липидов, например из группы фенофибратов или содержащие омега-3-полиненасыщенную жирную кислоту.
Это связано с тем, что помимо снижения уровня холестерина в крови статины обладают холестерин-независимыми плейотропными эффектами. Обсуждается влияние статинов на уменьшение риска инсульта. Кроме того, статины не дают откладываться бета-амилоиду в сосудистой стенке, что замедляет течение микроангиопатии. Если не удается достигнуть желаемого результата, используя диету в сочетании с приемом статинов, можно добавить препараты нестатинового ряда, снижающие уровень липидов, например из группы фенофибратов или содержащие омега-3-полиненасыщенную жирную кислоту.
Главное клиническое показание к антиагрегантной терапии – профилактика артериального тромбоза. В ходе многочисленных исследований изучалась роль антиагрегантных средств в первичной и вторичной профилактике цереброваскулярных осложнений. Польза антиагрегантной терапии при вторичной профилактике не вызывает сомнений. Напротив, при первичной профилактике данные о рутинном применении ацетилсалициловой кислоты или любого другого антиагрегантного средства неоднозначны, что предполагает назначение антиагрегантной терапии на индивидуальной основе, если тромботический риск перевешивает риск серьезных осложнений кровотечения.
Дополнительное показание для назначения антиагрегантной терапии – сочетание АГ с сахарным диабетом или метаболическим синдромом. У этой категории больных, имеющих начальные клинические проявления церебральной микроангиопатии, целесообразно использовать антиагреганты с максимальными преимуществами по совокупному показателю «эффективность – безопасность» и при условии строгого контроля состояния гемостаза. Один из наиболее безопасных препаратов – дипиридамол, антиагрегантное действие которого не сопровождается подавлением активности циклооксигеназы и уменьшением синтеза простациклина, как при приеме ацетилсалициловой кислоты, благодаря чему не нарушается протекция слизистых оболочек. Важный аспект безопасности дипиридамола – возможность управляемого антитромботического эффекта путем подбора оптимальной дозы. Антитромботический эффект дипиридамола реализуется через два дополняющих друг друга механизма: антиагрегантное действие, которое препятствует формированию тромба, и действие, связанное с активацией плазмина, которое редуцирует образовавшийся тромб.
Более чем 30-летний период клинического использования дипиридамола подтверждает его эффективность в профилактике инсульта, причем и в режиме монотерапии, и в комбинации с ацетилсалициловой кислотой. Но при ведении пациентов с церебральной микроангиопатией крайне важны дополнительные эффекты дипиридамола (табл. 2), в первую очередь его влияние на эндотелиальную дисфункцию. Известно, что дипиридамол усиливает NO-опосредованный вазодилататорный эффект [17] и подавляет образование эндотелиальных клеток, выделяющих активные формы кислорода, что улучшает окислительно-восстановительный баланс эндотелия. Таким образом, дипиридамол регулирует одновременно NO-опосредованную вазодилатацию и выделение супероксида из эндотелия [18]. В результате этого комбинированного (антиагрегантного и вазодилататорного) эффекта дипиридамол приводит к улучшению микроциркуляции и перфузии ткани.
Как потенциальный окислительный агент, передающий электроны от гидрофильных и гидрофобных молекул, дипиридамол устраняет продукты свободнорадикального окисления, вследствие чего повышается васкулярная протекция. Как показали многие экспериментальные исследования, нейтрализация свободных радикалов предупреждает развитие патологической вазореактивности и нарушение проницаемости гематоэнцефалического барьера [19, 20], что важно для профилактики церебральной микроангиопатии. Установлено, что дипиридамол в низких дозах эффективно предотвращал ангиопатию и нефропатию на экспериментальных моделях сахарного диабета за счет снижения вазоренального окислительного стресса [21].
Как показали многие экспериментальные исследования, нейтрализация свободных радикалов предупреждает развитие патологической вазореактивности и нарушение проницаемости гематоэнцефалического барьера [19, 20], что важно для профилактики церебральной микроангиопатии. Установлено, что дипиридамол в низких дозах эффективно предотвращал ангиопатию и нефропатию на экспериментальных моделях сахарного диабета за счет снижения вазоренального окислительного стресса [21].
Наконец, противовоспалительный эффект дипиридамола направлен на ключевое звено патогенеза атеросклероза. Важнейшая особенность дипиридамола – его способность увеличивать образование эндотелиального фактора роста и стимулировать развитие капиллярной сети за счет действия аденозина на аденозиновые рецепторы в капиллярах. Этот эффект стимуляции ангиогенеза важен для пациентов с ишемической болезнью сердца, у которых в результате повышается толерантность к физической нагрузке, и для больных с левожелудочковой дисфункцией, у которых увеличивается фракция выброса.
Обзор плейотропных эффектов дипиридамола свидетельствует о перспективности его применения для лечения церебральной микроангиопатии и первичной профилактики сосудистых нарушений. Первичная профилактика может проводиться дипиридамолом в режиме монотерапии – по 25 или 75 мг три раза в сутки.
Заключение
Профилактика и лечение церебральных осложнений АГ и метаболических нарушений требуют изменения стиля жизни, пищевых привычек и комплексного медикаментозного вмешательства, воздействующего на все патогенетические звенья, с целью улучшения или обратного развития эндотелиальной дисфункции.
Тромботическая микроангиопатия как первое проявление острой инфекции, вызванной вирусом иммунодефицита человека: клинический случай и обзор литературы | Журнал медицинских историй болезни
- История болезни
- Открытый доступ
- Опубликовано:
- М. Сармьенто 1 ,
- М. Э. Балселлс 2 и
- П. Рамирес 1
Журнал медицинских историй болезни том 10 , Номер статьи: 152 (2016) Процитировать эту статью
1438 доступов
6 Цитаты
Сведения о показателях
Abstract
История вопроса
Мы представляем случай пациента с острой инфекцией, вызванной вирусом иммунодефицита человека, и тромботической микроангиопатией в качестве первого клинического проявления, о котором, насколько нам известно, ранее не сообщалось.
Презентация корпуса
35-летний боливийский мужчина поступил с носовым кровотечением и тромбоцитопенией. Мы обнаружили микроангиопатическую анемию, лимфопению, повышенную лактатдегидрогеназу, прогрессирующую острую почечную недостаточность, отрицательный прямой антиглобулиновый тест и нормальную активность ADAMTS13. Тест ELISA на вирус иммунодефицита человека был отрицательным, вирусная нагрузка вируса иммунодефицита человека составила 10 000 000 копий РНК/мл. Антиретровирусная терапия и три сеанса лечебного плазмафереза позволили контролировать тромботическую микроангиопатию.
Заключение
Часто встречаются гематологические проявления инфекции вирусом иммунодефицита человека. Однако дебют острой инфекции вирусом иммунодефицита человека с тромботической микроангиопатией — редкое явление. Требуется высокий индекс подозрения и раннее лечение.
Отчеты экспертной оценки
История вопроса
В большинстве случаев ранняя инфекция вируса иммунодефицита человека (ВИЧ) протекает бессимптомно [1]. У пациентов с симптомами могут наблюдаться различные клинические проявления, включая гематологические изменения. Анемия и лейкопения могут быть обнаружены у 70 % пациентов в какой-то момент в течение этой вирусной инфекции, в то время как тромбоцитопения обычно бывает легкой и возникает в начале инфекции из-за снижения продукции и увеличения скорости разрушения тромбоцитов [2, 3]. ]. Другие нарушения свертывания крови, такие как тромбоз, связанный с антифосфолипидным синдромом, и дефицит протеина С и протеина S, также могут возникать, но нечасто. Тромботическая тромбоцитопеническая пурпура (ТТП) и тромботическая микроангиопатия (ТМА) иногда описывались у пациентов с ВИЧ на поздних стадиях инфекции. Однако дебют острой ВИЧ-инфекции с ТТП или ТМА бывает редко [4]. Мы представляем случай пациента с острой ВИЧ-инфекцией с тяжелой ТМА и полным ответом на терапевтический плазмаферез (ТПО) и антиретровирусную терапию (АРТ).
У пациентов с симптомами могут наблюдаться различные клинические проявления, включая гематологические изменения. Анемия и лейкопения могут быть обнаружены у 70 % пациентов в какой-то момент в течение этой вирусной инфекции, в то время как тромбоцитопения обычно бывает легкой и возникает в начале инфекции из-за снижения продукции и увеличения скорости разрушения тромбоцитов [2, 3]. ]. Другие нарушения свертывания крови, такие как тромбоз, связанный с антифосфолипидным синдромом, и дефицит протеина С и протеина S, также могут возникать, но нечасто. Тромботическая тромбоцитопеническая пурпура (ТТП) и тромботическая микроангиопатия (ТМА) иногда описывались у пациентов с ВИЧ на поздних стадиях инфекции. Однако дебют острой ВИЧ-инфекции с ТТП или ТМА бывает редко [4]. Мы представляем случай пациента с острой ВИЧ-инфекцией с тяжелой ТМА и полным ответом на терапевтический плазмаферез (ТПО) и антиретровирусную терапию (АРТ).
Описание случая
35-летний ранее здоровый боливийский мужчина обратился с постоянным носовым кровотечением, лихорадкой, усталостью и болью в горле. В прошлом месяце у него была незащищенная сексуальная активность. Физикальное обследование при поступлении не выявило серьезных изменений, за исключением осмотра уха, носа и горла, которое показало интенсивное кровотечение из слизистой оболочки без каких-либо видимых повреждений и только частичный ответ на тампонирование носа. Лабораторные тесты показали лимфопению, анемию, тяжелую тромбоцитопению, острую почечную недостаточность, уровень лактатдегидрогеназы (ЛДГ) в два раза выше нормы и гипербилирубинемию, которая постепенно ухудшалась в течение первой недели госпитализации (таблица 1). Было проведено специфическое гематологическое исследование, в котором были обнаружены шистоциты наряду с отрицательным прямым антиглобулиновым тестом (рис. 1). Было заподозрено ТТП, и ТПО была немедленно начата на четвертый день госпитализации; он достиг нормального количества тромбоцитов и функции почек после трех ежедневных процедур ТПО. Его уровень дезинтегрина и металлопротеиназы с мотивом тромбоспондина типа 1, членом 13 (ADAMTS13) был нормальным на 8-й день (118 %; нормальное значение от 20 до 100 %).
В прошлом месяце у него была незащищенная сексуальная активность. Физикальное обследование при поступлении не выявило серьезных изменений, за исключением осмотра уха, носа и горла, которое показало интенсивное кровотечение из слизистой оболочки без каких-либо видимых повреждений и только частичный ответ на тампонирование носа. Лабораторные тесты показали лимфопению, анемию, тяжелую тромбоцитопению, острую почечную недостаточность, уровень лактатдегидрогеназы (ЛДГ) в два раза выше нормы и гипербилирубинемию, которая постепенно ухудшалась в течение первой недели госпитализации (таблица 1). Было проведено специфическое гематологическое исследование, в котором были обнаружены шистоциты наряду с отрицательным прямым антиглобулиновым тестом (рис. 1). Было заподозрено ТТП, и ТПО была немедленно начата на четвертый день госпитализации; он достиг нормального количества тромбоцитов и функции почек после трех ежедневных процедур ТПО. Его уровень дезинтегрина и металлопротеиназы с мотивом тромбоспондина типа 1, членом 13 (ADAMTS13) был нормальным на 8-й день (118 %; нормальное значение от 20 до 100 %). Исследования на инфекционные заболевания показали отрицательный результат теста ELISA на ВИЧ, но вирусная нагрузка ВИЧ в плазме >10 миллионов копий РНК на мл и немного низкое количество клеток CD4 (39).8 клеток/мкл). Мы не обнаружили никаких оппортунистических инфекций или других вирусных инфекций. Была диагностирована острая ВИЧ-инфекция и начата АРТ тенофовиром, эмтрицитабином и ралтегравиром. После 13-дневного пребывания в больнице он был выписан в хорошем состоянии без каких-либо дополнительных признаков ТМА. Последующее 6-месячное наблюдение показало, что у него была хорошая переносимость антиретровирусного лечения, и у него были нормальные показатели крови и функция почек (рис. 2).
Исследования на инфекционные заболевания показали отрицательный результат теста ELISA на ВИЧ, но вирусная нагрузка ВИЧ в плазме >10 миллионов копий РНК на мл и немного низкое количество клеток CD4 (39).8 клеток/мкл). Мы не обнаружили никаких оппортунистических инфекций или других вирусных инфекций. Была диагностирована острая ВИЧ-инфекция и начата АРТ тенофовиром, эмтрицитабином и ралтегравиром. После 13-дневного пребывания в больнице он был выписан в хорошем состоянии без каких-либо дополнительных признаков ТМА. Последующее 6-месячное наблюдение показало, что у него была хорошая переносимость антиретровирусного лечения, и у него были нормальные показатели крови и функция почек (рис. 2).
Полная таблица
Рис. 1Мазок периферической крови при микроангиопатической анемии (оптическая микроскопия ×100). Очевидны скудные тромбоциты и обильные шистоциты, акантоциты и разрушение эритроцитов
Изображение в полный размер
Рис. 2
2 Хронологическая схема клинических и лабораторных характеристик наблюдения. Cr креатинин, Hb гемоглобин, LDH лактатдегидрогеназа, PLT тромбоциты, TPE терапевтический плазмаферез
Увеличить
Обсуждение
Данный случай демонстрирует широкий разброс клинических проявлений у пациентов с ранней ВИЧ-инфекцией. Наиболее частыми гематологическими находками при этом состоянии являются изменения клеток периферической крови, хотя также могут возникать нарушения свертывания крови. Кроме того, сообщалось о сосуществовании иммунологически опосредованной тромбоцитопении с ТТП при хронической ВИЧ-инфекции [5].
Тромботические проявления, такие как тяжелые тромбозы, ТТП и ТМА, обычно возникают на поздних стадиях хронической ВИЧ-инфекции или у пациентов с плохой приверженностью к АРТ [6]. Классическая форма ТТП вызывается приобретенным или наследственным нарушением/дефицитом ADAMTS13, который не расщепляет ультракрупные мультимеры фактора фон Виллебранда (v-WF) и вызывает классическую тромботическую микроангиопатическую анемию и полиорганную недостаточность [7]. . С другой стороны, ТМА, связанная с лекарствами, новообразованиями или инфекциями, имеет те же признаки, что и классическая ТТП, но другие механизмы приводят к тромбозу без ингибирования ADAMTS13. При ВИЧ-инфекции были описаны множественные изменения, которые могут индуцировать либо иммунную ТТП, запускаемую дисфункциональным ADAMTS13, либо ТМА, вызванную различными состояниями, такими как изменения белков комплемента, повреждение эндотелия, вторичное по отношению к цитокинам, индуцированным вирусом, или повреждение эндотелиальных клеток, непосредственно опосредованное вирусом. частицы [8]. Из-за этих множественных патологических путей лечение пациентов с ТТП или ТМА, связанными с ВИЧ, должно быть направлено на быстрый контроль вирусной нагрузки, уменьшение вызванной вирусом иммуносупрессии и замену дефектных белков ADAMTS13 и коагуляционных белков на ТПО.
. С другой стороны, ТМА, связанная с лекарствами, новообразованиями или инфекциями, имеет те же признаки, что и классическая ТТП, но другие механизмы приводят к тромбозу без ингибирования ADAMTS13. При ВИЧ-инфекции были описаны множественные изменения, которые могут индуцировать либо иммунную ТТП, запускаемую дисфункциональным ADAMTS13, либо ТМА, вызванную различными состояниями, такими как изменения белков комплемента, повреждение эндотелия, вторичное по отношению к цитокинам, индуцированным вирусом, или повреждение эндотелиальных клеток, непосредственно опосредованное вирусом. частицы [8]. Из-за этих множественных патологических путей лечение пациентов с ТТП или ТМА, связанными с ВИЧ, должно быть направлено на быстрый контроль вирусной нагрузки, уменьшение вызванной вирусом иммуносупрессии и замену дефектных белков ADAMTS13 и коагуляционных белков на ТПО.
Миллер и др. . показали, что у 12 % пациентов с диагнозом ТТП была сопутствующая ВИЧ-инфекция, причем чаще они находились на поздних стадиях заболевания с выраженной иммуносупрессией. В этой ситуации имелась очевидная терапевтическая польза от добавления ВРТ в дополнение к ТПО [9]. Однако в самой большой когорте пациентов, регистре Оклахомской тромботической тромбоцитопенической пурпуры — гемолитико-уремического синдрома (ТТП-ГУС), только 1,84 % из 326 пациентов с ТТП имели ВИЧ-инфекцию, и авторы пришли к выводу, что ВИЧ-инфекция, как и другие воспалительные состояния, может вызвать острые эпизоды ТТП у восприимчивых пациентов. Более того, онкологические и инфекционные заболевания, вызванные ВИЧ, могут имитировать клинические признаки ТТП и должны быть включены в дифференциальный диагноз [10].
В этой ситуации имелась очевидная терапевтическая польза от добавления ВРТ в дополнение к ТПО [9]. Однако в самой большой когорте пациентов, регистре Оклахомской тромботической тромбоцитопенической пурпуры — гемолитико-уремического синдрома (ТТП-ГУС), только 1,84 % из 326 пациентов с ТТП имели ВИЧ-инфекцию, и авторы пришли к выводу, что ВИЧ-инфекция, как и другие воспалительные состояния, может вызвать острые эпизоды ТТП у восприимчивых пациентов. Более того, онкологические и инфекционные заболевания, вызванные ВИЧ, могут имитировать клинические признаки ТТП и должны быть включены в дифференциальный диагноз [10].
Случай нашего пациента в некоторых аспектах примечателен. Первое и, возможно, самое интересное, это то, что его острая ВИЧ-инфекция дебютировала с тяжелой ТМА, о которой, насколько нам известно, ранее не сообщалось. Отрицательные антитела к ВИЧ с очень высокой вирусной нагрузкой ВИЧ определяют острую ВИЧ-инфекцию и обычно связаны с чрезвычайно высокой виремией. Наш пациент подчеркнул, что рискованное сексуальное поведение произошло недавно (<1 месяца), и что кровотечение и конституциональные симптомы появились почти сразу после предполагаемого контакта с ВИЧ.
В этом случае ТМА быстро контролировалась с помощью ТПО и быстрого начала АРТ. Хотя ТПО могла сыграть некоторую роль в выздоровлении нашего пациента, информация в поддержку использования ТМА отсутствует. В данном конкретном случае использование ТПО было крайним действием, учитывая тяжесть симптомов пациента. В клинической гематологической практике общепризнано, что ТПО преимущественно полезен в случаях, когда ТТП сосуществует с иммунным ингибитором ADAMTS13, а не в неиммунных формах ТМА. Тем не менее, есть несколько недавних сообщений, показывающих, что ТПО и другие иммунологические методы лечения, такие как ритуксимаб и экулизумаб, могут быть полезны в случаях, не обязательно связанных с аутоиммунитетом. Этот эффект может быть связан с репозицией других регуляторных белков свертывания крови, или модуляция этого эффекта может быть связана с репозицией других регуляторных белков свертывания или модуляцией В-лимфоцитов [11].
Выводы
Мы представили необычное проявление острой ВИЧ-инфекции, связанной с ТМА, которая успешно ответила на ТПО и быстрое начало АРТ. У пациентов с ТТП или ТМА тестирование на ВИЧ должно быть обязательным. Кроме того, у пациентов с установленной ВИЧ-инфекцией врачи должны знать о вероятности развития тромботических осложнений, включая ТТП и ТМА.
У пациентов с ТТП или ТМА тестирование на ВИЧ должно быть обязательным. Кроме того, у пациентов с установленной ВИЧ-инфекцией врачи должны знать о вероятности развития тромботических осложнений, включая ТТП и ТМА.
Ссылки
Розенберг Н.Е., Пилчер К.Д., Буш М.П., Коэн М.С. Как мы можем лучше выявлять ранние ВИЧ-инфекции? Curr Opin ВИЧ СПИД. 2015;10(1):61–8.
Артикул КАС пабмед ПабМед Центральный Google Scholar
Хикс CB. Консорциум по острой ВИЧ-инфекции Duke-Unc. AIDS Res Hum Retroviruses. 2013;29(1):121.
Артикул пабмед ПабМед Центральный Google Scholar
Цукер-Франклин Д., Цао Ю.З. Мегакариоциты людей, инфицированных вирусом иммунодефицита человека, экспрессируют вирусную РНК. Proc Natl Acad Sci U S A. 1989;86(14):5595.

Артикул КАС пабмед ПабМед Центральный Google Scholar
Беккер С., Фуско Г., Фуско Дж., Балу Р., Ганджи С., Бреннан С. и др. ВИЧ-ассоциированная тромботическая микроангиопатия в эпоху высокоактивной антиретровирусной терапии: обсервационное исследование. Клин Инфекция Дис. 2004; 39 Приложение 5:S267.
Артикул пабмед Google Scholar
Routy JP, Beaulieu R, Monte M, Saint-Louis J, Sauvageau G, Toma E. Иммунологическая тромбоцитопения с последующей тромботической тромбоцитопенической пурпурой у двух пациентов с ВИЧ1. Am J Гематол. 1991;38(4):327–8.
Артикул КАС пабмед Google Scholar
Рахмания Н., Вонг Э., Дэвис Дж., Рэй П. Геморрагический инсульт у девочки-подростка с ВИЧ-ассоциированной тромботической тромбоцитопенической пурпурой.
 Клиника СПИДа Res. 2014;5(6):311.
Клиника СПИДа Res. 2014;5(6):311.Google Scholar
Furlan M, Robles R, Galbusera M, Remuzzi G, Kyrle PA, et al. Протеаза, расщепляющая фактор фон Виллебранда, при тромботической тромбоцитопенической пурпуре и гемолитико-уремическом синдроме. N Engl J Med. 1998; 339: 1578–84.
Артикул КАС пабмед Google Scholar
Бречер М.Е., Хей С.Н., Пак Ю.А. Это ВИЧ-ТТП или ВИЧ-ассоциированная тромботическая микроангиопатия? Джей Клин Афер. 2008; 23:186–90.
Артикул пабмед Google Scholar
Миллер Р.Ф., Скалли М., Коэн Х., Рёдлинг С., Старке Р. и др. Тромботическая тромбоцитопеническая пурпура у ВИЧ-инфицированных. Int J STD AIDS. 2005; 16: 538–42.
Артикул КАС пабмед Google Scholar
«>Муругапандян С., Биджин Б., Мансур И., Дахешпур С., Пиллаи Б.Г., Таджудин Б. и др. Улучшение гемцитабин-индуцированной тромботической микроангиопатии с помощью ритуксимаба у пациентки с раком яичников: механистические соображения. Case Rep Нефроловый циферблат. 2015;5(2):160–7.
Артикул пабмед ПабМед Центральный Google Scholar
Бенджамин М., Террелл Д.Р., Веселый С.К., Воскул Г.В., Дезубе Б.Дж., Кремер Ховинга Д.А. и др. Частота и значимость ВИЧ-инфекции среди больных с диагнозом тромботическая тромбоцитопеническая пурпура. Клин Инфекция Дис. 2009;48(8):1129–37.
Артикул пабмед Google Scholar
Ссылки на скачивание
Благодарности
Авторы заявляют, что у них нет благодарностей в этой рукописи.
Вклад авторов
MS, MEB и PR внесли равный вклад в лечение пациента и в написание рукописи. Все авторы прочитали и одобрили окончательный вариант рукописи.
Все авторы прочитали и одобрили окончательный вариант рукописи.
Конкурирующие интересы
Авторы заявляют, что у них нет конкурирующих интересов.
Согласие
От пациента было получено письменное информированное согласие на публикацию данного клинического случая и прилагаемых изображений. Копия письменного согласия доступна для ознакомления главному редактору этого журнала.
Информация об авторе
Авторы и организации
Кафедра гематологии и онкологии, Медицинский факультет, Папский католический университет Чили, Сантьяго, Столичный регион, Чили
M. Sarmiento & P. Ramirez
Departamento de Enfermedades Infecciosas, Facultad de Medicina, Pontificia Universidad Católica de Chile, Сантьяго, столичный регион, Чили
M. E Балселлы
Авторы
- М. Сармьенто
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- M.
 E. Balcells
E. BalcellsПосмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- P. Ramirez
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Автор, ответственный за переписку
М. Сармиенто.
Права и разрешения
Открытый доступ Эта статья распространяется в соответствии с условиями международной лицензии Creative Commons Attribution 4.0 (http://creativecommons.org/licenses/by/4.0/), которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии вы должным образом указываете автора (авторов) и источник, предоставляете ссылку на лицензию Creative Commons и указываете, были ли внесены изменения. Отказ от права Creative Commons на общественное достояние (http://creativecommons.org/publicdomain/zero/1. 0/) применяется к данным, представленным в этой статье, если не указано иное.
0/) применяется к данным, представленным в этой статье, если не указано иное.
Перепечатки и разрешения
Об этой статье
Тромботическая микроангиопатия (ТМА) | Почечный центр UNC
Содержание
- Что такое тромботическая микроангиопатия (ТМА)?
- Как ТМА влияет на мои почки?
- Как это выглядит (под микроскопом)?
- Как я это получил?
- Что такое TTP и HUS?
- Кто может получить ДТП и ЖКУ?
- Каковы симптомы?
- Как диагностируется?
- Чем лечить?
- Каковы шансы, что мне станет лучше?
- Подкаст: Тромботическая микроангиопатия (ТМА) – с доктором Манишем Саха
Что такое тромботическая микроангиопатия (ТМА)?
Тромботическая микроангиопатия (часто известная как ТМА) — редкое, но серьезное заболевание.
Это модель повреждения, которая может возникнуть в мельчайших кровеносных сосудах во многих жизненно важных органах вашего тела — чаще всего в почках и головном мозге.
«Микроангиопатия» буквально переводится как «проблема мелких кровеносных сосудов».
«Тромботический» означает, что вовлечены тромбы.
Как ТМА влияет на мои почки?
В нормальной почке (как и в остальной части тела) есть мелкие кровеносные сосуды, называемые капиллярами . Они выстланы скользким покрытием из клеток, известных как эндотелиальные клетки (см. рис. 1).
При повреждении эндотелиальных клеток капилляров кровоток через почку замедляется (рис. 2).
Жидкая часть крови, называемая плазмой , способствует выведению отходов из организма через мочу в почки. В крови также присутствуют твердые частицы, в том числе эритроциты и тромбоциты. Эритроциты переносят кислород из легких в остальные части тела, включая клетки почек. Тромбоциты закупоривают любую поврежденную часть кровеносного сосуда, чтобы предотвратить его утечку.
Дефекты слизистой оболочки стенки кровеносного сосуда могут привести к появлению шероховатостей, похожих на выбоины на дороге, — они могут замедлить движение транспорта и причинить большой ущерб. Эритроциты могут деформироваться, а затем лопнуть. Тромбоциты могут активироваться и вызывать образование тромбов. Обломки всех этих событий могут закупорить целые кровеносные сосуды. В конце концов, части вашей почки могут отмирать из-за недостатка кровотока, и в вашем организме может закончиться дефицит эритроцитов и тромбоцитов.
Эритроциты могут деформироваться, а затем лопнуть. Тромбоциты могут активироваться и вызывать образование тромбов. Обломки всех этих событий могут закупорить целые кровеносные сосуды. В конце концов, части вашей почки могут отмирать из-за недостатка кровотока, и в вашем организме может закончиться дефицит эритроцитов и тромбоцитов.
Как это выглядит (под микроскопом)?
ТМА вызывает изменения в почках, которые можно увидеть под микроскопом. На рисунках ниже показаны кровеносные сосуды в основном фильтре почки (называемом клубочком). Здоровый кровеносный сосуд выглядит как круг с открытым (белым) центром. Сосуды, пораженные ТМА, будут заполнены розоватым материалом, представляющим собой сгусток. Со временем части почки могут отмирать из-за недостатка кровотока.
ТМА также меняет внешний вид капли вашей крови под микроскопом. Нормальная кровь имеет полностью круглые эритроциты и множество крошечных тромбоцитов. Когда вы страдаете от ТМА, в вашей крови будут деформированные эритроциты (называемые шистоцитов ) и тромбоцитов нет.
Как я это получил?
Есть несколько сложных и часто довольно серьезных заболеваний, которые могут привести к ТМА – они перечислены в таблице ниже. В этой статье будут обсуждаться первые два из них: Тромботическая тромбоцитопеническая пурпура и Гемолитический уремический синдром . Учитывая их сложные названия, лучше всего называть их аббревиатурами TTP и HUS.
| Болезни, вызывающие ТМА | Аббревиатура |
|---|---|
| Тромботическая тромбоцитопеническая пурпура | ТТП |
| Гемолитический уремический синдром | ГУС |
| Атипичная ТТП/ГУС | Атипичный TTP/HUS |
| Злокачественная гипертензия | — |
| Диссеминированная внутрисосудистая коагуляция | ДИК |
| Синдром гемолиза, повышенный уровень печени Ферменты и низкий уровень тромбоцитов | ПОМОЩЬ |
| Склеродермия Почечный криз | СРЦ |
Что такое TTP и HUS?
TTP обычно возникает, когда тромбоциты слишком легко слипаются (рис. 3). Тромбоциты используют клей в плазме под названием von Willebrand Factor (vWF) , чтобы скреплять себя в форме сгустка. Клей может быть более или менее липким в зависимости от размера его молекул — поэтому, если молекулы клея станут слишком длинными, тромбоциты будут образовывать сгустки, даже если они не должны этого делать. Обычно тело удерживает клей vWF точно на нужной длине с помощью фермента под названием 9.0296 АДАМЦ13 . ТТП развивается, когда нехватка этого фермента приводит к нежелательному свертыванию крови в мелких кровеносных сосудах почек. Нехватка может быть вызвана одной из следующих причин:
3). Тромбоциты используют клей в плазме под названием von Willebrand Factor (vWF) , чтобы скреплять себя в форме сгустка. Клей может быть более или менее липким в зависимости от размера его молекул — поэтому, если молекулы клея станут слишком длинными, тромбоциты будут образовывать сгустки, даже если они не должны этого делать. Обычно тело удерживает клей vWF точно на нужной длине с помощью фермента под названием 9.0296 АДАМЦ13 . ТТП развивается, когда нехватка этого фермента приводит к нежелательному свертыванию крови в мелких кровеносных сосудах почек. Нехватка может быть вызвана одной из следующих причин:
- генетическая проблема, не позволяющая вырабатывать достаточное количество фермента клиппирования
- чрезмерно активная иммунная система, которая атакует и уничтожает ваши запасы клиппирующего фермента
Таким образом, ваше тело становится неспособным удерживать клей vWF достаточно коротким, чтобы предотвратить аномальный сгусток и повреждение мелких кровеносных сосудов вашего тела.
Напротив, ГУС чаще всего возникает, когда ваш организм подвергается воздействию определенного типа токсина (Рисунок 4). Токсин обычно происходит от бактериальной инфекции кишечника. Как правило, эта инфекция должна быть достаточно серьезной, чтобы вызвать кровавый понос. Токсин попадает в кровоток, а затем повреждает эндотелиальные клетки в почках. Это вызывает свертывание тромбоцитов и разрыв эритроцитов, как описано выше. По неизвестным причинам ГУС обычно возникает у детей, а не у взрослых.
Рисунок 4. Краткая информация о том, как обычно развивается ГУС. Существует также много менее типичных моделей ТТП и ГУС. Врачи еще точно не определили, почему они возникают, но обычно они случаются только с людьми, у которых уже есть другое хроническое заболевание. Примеры состояний, которые могут привести к этому атипичному ТТП и ГУС, включают беременность, трансплантацию органов и такие заболевания, как ВИЧ, волчанка и рак.
Кто может получать ВТП и ГУС?
TTP и HUS встречаются довольно редко. В городе с населением 1 миллион человек будет в среднем всего около 11 случаев в данном году. Женщины и чернокожие несколько чаще заболевают. По неизвестным причинам ГУС гораздо чаще встречается у детей, а ТТП — у взрослых.
Каковы симптомы?
ТТП, ГУС и другие разновидности ТМА имеют ряд общих симптомов. Они перечислены ниже:
| Симптом | Причина появления симптома |
|---|---|
| Усталость, головокружение, одышка | Низкое количество эритроцитов |
| Синяки, кровотечения из десен/носа, небольшие порезы сильно кровоточат | Низкое количество тромбоцитов |
| Спутанность сознания, сонливость, судороги | Повреждение клеток крови в головном мозге |
| Уменьшение количества мочи, Отек ног, Высокое кровяное давление | Повреждение кровеносных сосудов в почках |
| Лихорадка (чаще при ТТП) |
Как это диагностируется?
Диагноз ТТП и ГУС следует рассматривать всякий раз, когда человек поступает в больницу с несколькими из упомянутых выше симптомов. Ваш врач проведет тщательный медицинский осмотр, а затем проверит некоторые анализы крови. Следующие результаты тестов вызывают серьезную озабоченность в отношении ТТП или ГУС:
Ваш врач проведет тщательный медицинский осмотр, а затем проверит некоторые анализы крови. Следующие результаты тестов вызывают серьезную озабоченность в отношении ТТП или ГУС:
- Чрезвычайно низкое количество тромбоцитов при нормальных факторах свертывания крови
- Легкий или умеренный низкий уровень эритроцитов
- Аномальное функционирование почек (измерено с помощью лабораторного теста под названием креатинин )
Ваш врач может исследовать кровь под микроскопом, чтобы определить наличие поврежденных эритроцитов (известных как шистоцитов ). Положительный результат теста у ребенка, у которого недавно была кровавая диарея, приведет к диагнозу ГУС. Положительный результат тестирования у взрослого делает ТТП наиболее вероятным диагнозом.
Что такое лечение?
Рисунок 5: Схема плазмафереза TTP и HUS имеют разные методы лечения. Для предотвращения летального исхода и серьезного повреждения органов TTP требует немедленного лечения с помощью плазмафереза (PLEX) — см. схему на Рисунке 5. Процесс происходит следующим образом:
схему на Рисунке 5. Процесс происходит следующим образом:
- Большой внутривенный катетер, называемый катетером PLEX, вводится в одну из ваших вен (обычно на шее или в паху).
- Затем ваша кровь переносится из этого катетера по трубке в аппарат для плазмообмена.
- Плазменная (жидкая) часть вашей крови удаляется, а затем заменяется плазмой донора крови.
- Обработанная кровь возвращается в катетер, а затем обратно в ваше тело.
Этот процесс позволяет заменить аномальный клей (vWF), вызывающий TTP, на нормальный vWF. Лечение обычно длится несколько часов каждое и продолжается каждые 1-2 дня в течение примерно 2 недель. Для тех, у кого повторяются эпизоды ТТП, тестируется лекарство под названием ритуксимаб, чтобы выяснить, может ли его использование предотвратить рецидивы заболевания.
Напротив, ГУС обычно улучшается сам по себе. Пациентам потребуется госпитализация для жидкости и наблюдения, пока болезнь ухудшается. Если функция почек снижается слишком сильно, может потребоваться ручная очистка крови с помощью диализа.


 В тяжелых случаях диабетическая нефропатия может привести к развитию декомпенсированной почечной недостаточности, требующей проведения гемодиализа или трансплантации. Продукты обмена веществ при сахарном диабете накапливаются в крови и отравляют организм. Пораженные почки не справляются с их фильтрацией. На начальной стадии патологии у больных периодически повышается артериальное давление, ухудшается общее самочувствие, развивается нефротический синдром, появляются отеки. На терминальной стадии нефропатии кровяное давление достигает высоких цифр, развивается диспепсия, уремия, хроническая почечная недостаточность. В результате самоотравления организма поражаются внутренние органы и системы.
В тяжелых случаях диабетическая нефропатия может привести к развитию декомпенсированной почечной недостаточности, требующей проведения гемодиализа или трансплантации. Продукты обмена веществ при сахарном диабете накапливаются в крови и отравляют организм. Пораженные почки не справляются с их фильтрацией. На начальной стадии патологии у больных периодически повышается артериальное давление, ухудшается общее самочувствие, развивается нефротический синдром, появляются отеки. На терминальной стадии нефропатии кровяное давление достигает высоких цифр, развивается диспепсия, уремия, хроническая почечная недостаточность. В результате самоотравления организма поражаются внутренние органы и системы. Чтобы избавиться от патологии, необходимо скорректировать уровень сахара в крови и устранить метаболические нарушения.
Чтобы избавиться от патологии, необходимо скорректировать уровень сахара в крови и устранить метаболические нарушения.
 02.2022
02.2022
 Клиника СПИДа Res. 2014;5(6):311.
Клиника СПИДа Res. 2014;5(6):311. E. Balcells
E. Balcells