Рак синхронный: Синхронный рак молочной железы | Patient-mt.ru
Билатеральный синхронный рак молочной железы: отдаленные результаты лечения
В структуре онкологической заболеваемости женщин на долю рака молочной железы (РМЖ) приходится 20,7% [1]. По мере увеличения числа больных РМЖ повышается частота первичного поражения обеих молочных желез.
В последнее время интерес к изучению билатерального РМЖ заметно возрос. Это связано с накоплением клинических наблюдений и экспериментальных данных об особенностях возникновения и течения различных форм первично-множественного РМЖ. В настоящее время продолжается дискуссия о ранней диагностике второго РМЖ в связи с внедрением в онкологическую практику органосохраняющих операций и профилактических мастэктомий. Не определены факторы, влияющие на прогноз заболевания, знание которых необходимо для объективного выбора адекватного метода лечения.
Частота встречаемости билатерального поражения молочных желез, по данным литературы, составляет от 0,1 до 20%. Следует отметить, что метахронные опухоли выявляются чаще, чем синхронные и составляют от 0,9 до 4,5% [2].
Одним из актуальных аспектов проблемы первичной множественности опухолей остается определение принципиальных позиций в выборе лечебной тактики. Это в первую очередь связано с увеличением контингента подобных больных. Еще несколько десятилетий назад выявление второй злокачественной опухоли, как правило, являлось противопоказанием к планированию радикального лечения. Определение тактики лечения синхронно выявленных опухолей — задача гораздо более сложная, и требует более дифференцированного подхода к каждой конкретной больной.
К факторам, влияющим на выбор лечения при билатеральном синхронном РМЖ, можно отнести следующие: локализация, стадия и гистогенез каждой опухоли; прогноз каждой из выявленных опухолей; возраст и соматическое состояние больной, а также нарушения, связанные с наличием опухолей; характер предшествующего лечения; состояние менструальной функции. Очень спорным остается вопрос о необходимости выполнения биопсии контралатеральной молочной железы и контралатеральной мастэктомии.
Вопрос о возможности выполнения органосохраняющих операций при билатеральном РМЖ остается дискутабельным. Поискам ответа на него посвящено множество исследований последних лет. Большинство авторов считают возможным выполнение этих операций при соблюдении определенных показаний. Так, T. Arimura и соавт. [3] показаниями к выполнению органосохраняющих операций считают опухоль менее 3 см, отсутствие мультицентрического роста и значительной инвазии протоков. Авторами были выполнены органосохраняющие операции при синхронном РМЖ у 44% больных с одной стороны и у 38% — с обеих сторон. Показатели выживаемости в этих группах и в группе больных с мастэктомиями практически не различались. Во всех этих исследованиях не было получено различий общей и безрецидивной выживаемости, частоте рецидивов. Авторы считают выполнение органосохраняющих операций при билатеральном раке альтернативой мастэктомиям при наличии соответствующих показаний к ним, как и при одностороннем РМЖ. L. Wilson и соавт. [4] считают, что частота местных рецидивов после органосохраняющих операций с послеоперационной лучевой терапией в группе больных с двусторонним РМЖ выше, в связи с чем этим больным показано выполнение мастэктомии.
В исследовании S. Mose и соавт. [5] изучены отдаленные результаты лечения 498 больных РМЖ, из которых у 36 имелась двусторонняя опухоль. В группе с двусторонним раком 10-летняя выживаемость составила 56%, в группе с односторонним раком — 54%. Частота рецидивов составила 38,8 и 24,4% соответственно (р>0,05). Авторы приходят к выводу, что наличие двустороннего рака не влияет существенно на выживаемость, хотя развитие метастазов и местных рецидивов в этой группе больных встречается несколько чаще. По данным Р.А. Керимова [6], 5-летняя общая выживаемость больных при синхронном раке I—IIA стадии с каждой стороны составила 90,0±5,6%, безрецидивная — 82,2±4,8%, при IIВ стадии — 75,6±8,7 и 67,4±9,5% соответственно, при IIIА—В стадии — 50,4±3,2 и 40,2±3,6%; при I—IIA стадии с одной стороны и IIB с другой — 79,1±5,3 и 69,5±5,5%; при I—IIA и IIIA—B — 73,2±8,8 и 65,3±9,2%; при IIB и IIIA—B — 51,3±4,7 и 40,4±4,9%. Ранние стадии опухолей с одной стороны при наличии местно-распространенного процесса с другой очень незначительно влияют на выживаемость.
При первично-нерезектабельных формах рака с одной или обеих сторон комплексное лечение дает достоверно лучшие результаты, чем все прочие виды терапии. Неоадъювантная терапия при местно-распространенном процессе с одной или обеих сторон достоверно увеличивает и общую, и безрецидивную выживаемость, в то же время неоадъювантное лечение при первичных стадиях не приводит к достоверному улучшению выживаемости [4, 7, 8].
Материал и методы
В МНИОИ им. П.А. Герцена проведен анализ результатов обследования и лечения 59 больных с билатеральным синхронным РМЖ.
Средний возраст пациенток составил 55,7±1,7 года.
Одинаковая стадия заболевания в двух молочных железах была выявлена у 20 (34%) из 59 больных, в том числе I стадия — у 5 (8,5%), IIА — у 6 (10,2%), IIB — у 2 (3,4%), IIIА — у 4 (6,8%), IIIB — у 3 (5,1%). У остальных 39 (66,0%) стадия была разной. Сочетание начальных (I и IIA) стадий рака в обеих молочных железах выявлено у 16 (27,1%) больных. У остальных 43 (72,9%) имел место местно-распространенный рак IIB, IIIА, IIIB стадий в одной железе, который сочетался с опухолевым процессом такой же распространенности в другой — у 21 (35,5%) больной или начальных I и IIА стадий — у 22 (37,2%). Таким образом, в наших наблюдениях чаще диагностировали билатеральный синхронный РМЖ разных стадий, причем у значительной части больных (у 43 из 59) в другой железе преобладал рак распространенных стадий.
Метастазы в регионарных лимфатических узлах были выявлены у 45 (76,3%) больных. Метастазы в регионарных лимфатических узлах были выявлены с одной стороны у 23 (39,0%) больных, с двух сторон — у 22 (37,3%) больных. При двустороннем регионарном метастазировании уровень поражения был одинаковым у 13 (22,0%), разным — у 9 (15,2%) больных.
Наиболее часто с обеих сторон имел место инфильтративный протоковый рак (49,1%) .
При билатеральном синхронном РМЖ раздельно проводили лечение каждой пораженной молочной железы в соответствии со стадией опухолевого процесса и общего состояния больной. В 95% (56 больных) проведено хирургическое лечение каждой пораженной молочной железы. У 3 (5%) пациенток проведено паллиативное химиогормональное лечение в связи с наличием тяжелых интеркуррентных сопутствующих заболеваний. У 2 из 56 больных выполнено хирургическое лечение только с одной стороны.
Подавляющему большинству больных — 30 (53,6%) выполнена радикальная мастэктомия (Холстед, Пэйти, Пирогов, Мадден) с двух сторон (рис. 1).
1).
Радикальные резекции с двух сторон — у 7 (12,5%), мастэктомия с одной стороны и органосохраняющие и реконструктивно-пластические операции с другой — у 10 (18%), органосохраняющие и реконструктивно-пластические операции с двух сторон — у 7 (12,5%) больных (рис. 2).
Неоадъювантная химиотерапия проведена 10 (16,9%) больным, лучевая терапия — 11 (18,6%), химиолучевое лечение — 6 (10,1%) больным. Адъювантная химиотерапия проведена 8 (13,5%) больным, лучевая терапия — 11 (18,6%), химиолучевое лечение — 29 (49,1%) больным. Гормональную терапию получили 33 (56%) пациентки.
Результаты
Анализ отдаленных результатов лечения при билатеральном синхронном РМЖ показал, что местные рецидивы выявлены у 4 (6,8%) больных, в среднем через 54,5±24,2 мес. При этом ни у одной пациентки не было выявлено двусторонних рецидивов. Отдаленные метастазы возникли у 17 (28,8%) больных, в среднем через 34,6±5,9 мес.
В целом 3- и 5-летняя выживаемость составила 83,1±4,9 и 72,8±5,8%, безрецидивная выживаемость на тех же сроках — 74,6%±5,7 и 66,1±6,1% соответственно.
В зависимости от стадии заболевания 5-летняя выживаемость больных при I и IIА стадии с каждой стороны составила 85,7±10,0%, безрецидивная — 85,7±9,3 и 85,7±9,3%; при IIВ, IIIА—В стадии — 28,6±17,1 и 14,3±13,2% соответственно; при I, IIА стадии с одной стороны и IIIА—В с другой — 66,7±12,2 и 60,0±12,6% соответственно и при IIВ и IIIА—В стадиях — 50,0±17,7 и 28,5±17,0% соответственно. Из приведенных данных видно, что общая и безрецидивная выживаемость достоверно ( р<0,05) снижаются с увеличением стадии опухолевого процесса с каждой стороны (табл. 1). Наличие ранней стадии с одной стороны и местно-распространенного процесса с другой очень незначительно влияют на выживаемость. Выживаемость преимущественно определяется местно-распространенным процессом.
Общая 5-летняя выживаемость в 1-й группе после хирургического лечения составила 80,0±17,8%, безрецидивная — 60,0±22,0%, после комбинированного лечения — 88,0±11,5 и 88,0±11,5% соответственно, после комплексного лечения — 100 и 91,0±8,6% соответственно.
Во 2-й группе больных 5-летняя выживаемость после консервативного и хирургического лечения составила 0%, безрецидивная — 0%, после комбинированного лечения — 50,0±25,0 и 50,0±25,0%, после комплексного лечения — 63,0±9,3 и 55,5±9,6% соответственно (табл. 2).
Из приведенных данных видно, что внутри групп различия в выживаемости из-за малой численности больных недостоверны (р>0,05). Мы также не получили достоверных различий общей и безрецидивной выживаемости в группах с комбинированным и комплексным лечением, она практически одинаковая, хотя есть тенденция к увеличению выживаемости у больных, получивших комплексную терапию.
Прогноз заболевания у больных при билатеральном раке достоверно хуже, чем при одностороннем РМЖ. При одностороннем раке 5-летняя общая выживаемость составила 90,2±1,0%, при двустороннем синхронном — 72,8±5,8%, при метахронном — 73,0±5,5%, и безрецидивная — 84,7±1,3, 66,1±6,1 и 65,0±5,5% соответственно (р<0,05) (табл. 3, 4).
Заключение
При билатеральном синхронном раке прогноз жизни больных коррелирует с наибольшей стадией опухолевого процесса. 5-летняя общая выживаемость больных с I и IIА стадиями с каждой стороны составила 85,7±10,%, безрецидивная — 85,7±9,3%, при IIВ, IIIА стадиях с каждой стороны — 28,6±17,1 и 14,3±13,2% соответственно (р<0,05). Прогноз заболевания у пациентов с билатеральным раком достоверно хуже, чем у больных с односторонним РМЖ. 5-летняя общая выживаемость при одностороннем раке составила 90,2±1,0%, при билатеральном синхронном — 72,8±5,8%, безрецидивная — 84,7±1,3 и 66,1±6,1% (р<0,05).
Лечение при билатеральном синхронном РМЖ проводится на основании учета стадии с каждой стороны. При первично-резектабельных формах рака с двух сторон возможно проведение хирургического или комбинированного лечения. При первично-нерезектабельных формах рака с одной или обеих сторон показано проведение комплексного лечения.
Синхронный рак молочных желез: клиника, диагностика, лечение, прогноз
И. Ю. Филюшкина, В. М. Иванов, Ю. В. Буйденок.
Ю. Филюшкина, В. М. Иванов, Ю. В. Буйденок.
ГУ РОНЦ им. Н. Н. Блохина РАМН
Рак молочной железы – в настоящее время одно из самых распространенных злокачественных опухолей у женщин. В структуре онкологической заболеваемости в России рак молочной железы занимает первое место и частота его неуклонно растет. Число заболевших в 2004 году составило 49,2 тыс., а умерших — 23 тыс. Заболеваемость раком молочной железы в Москве и Санкт-Петербурге в 2004году составила 51,4 и 48,3 на 100000 населения, соответственно (М. И. Давыдов, Е.М.Аксель) [2].
Первично-множественные злокачественные опухоли — одновременное или поочередное возникновение злокачественных опухолей. Они развиваются самостоятельно и независимо друг от друга в пределах одного или нескольких органов. Синхронный рак молочных желез — один из вариантов первично-множественного рака, и по мнению ряда авторов, является проявлением мультицентричности заболевания в парном органе. Наиболее важным признаком синхронного рака молочных желез является одновременность возникновения опухолей в обеих молочных железах, однако ряд авторов допускает возможность интервала между первой и второй опухолью в пределах 6-12 месяцев.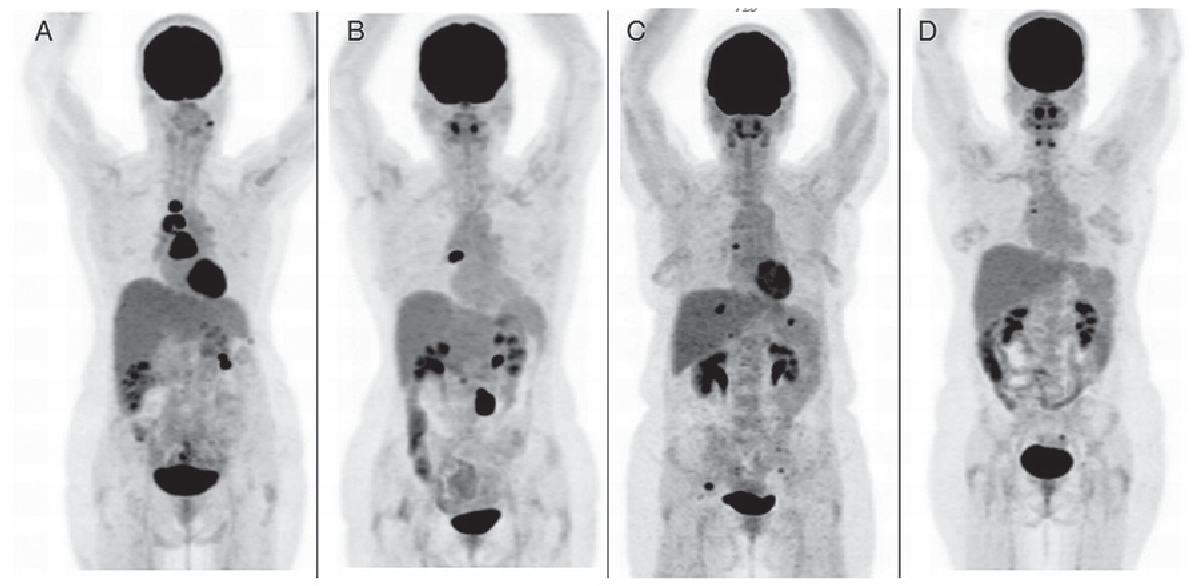 Синхронные опухоли молочных желез выявляются достоверно реже (22,7%), чем метахронные опухоли (69,6%) [6].
Синхронные опухоли молочных желез выявляются достоверно реже (22,7%), чем метахронные опухоли (69,6%) [6].
На долю рака молочной железы среди всех первично-множественных опухолей приходится от 8% до 21,9%. По данным ОНЦ РАМН, первично-множественный мультицентрический рак молочной железы составил 5,7%, синхронный рак – 0,9%, метахронный рак – 1,0%, метастатический рак молочной железы – 0,98%.
При первично- множественных синхронных злокачественных новообразованиях вторая опухоль при обследовании не диагностируется у 25,3% женщин [7]. Совершенствование методов своевременной диагностики, выявление особенностей или закономерностей возникновения и клинического течения синхронного рака молочных желез, усовершенствование методов комплексного лечения способствуют улучшению результатов лечения, и, как следствие, увеличению продолжительности жизни больных. Основным методом диагностики рака на сегодняшний день остается маммография. T. J. Murphy и соавт. на основании изучения маммограмм 35 больных синхронным раком молочных желез пришли к выводу, что маммографические проявления синхронного рака не отличаются от таковых при одностороннем раке. Двухсторонние синхронные опухоли очень часто имеют одинаковые внешние проявления и расположены в молочных железах в виде «зеркального отображения» [14]. Маммографию необходимо проводить с обеих сторон, даже при поражении одной железы.
Двухсторонние синхронные опухоли очень часто имеют одинаковые внешние проявления и расположены в молочных железах в виде «зеркального отображения» [14]. Маммографию необходимо проводить с обеих сторон, даже при поражении одной железы.
Несмотря на высокую чувствительность маммографии (92,5%), в некоторых случаях она бывает малоинформативной. Магнитно-резонансная маммография (МР-маммография) желез является дополнительным эффективным методом комплексной диагностики патологии молочных желез и реализуется при неэффективности других методов визуализации (чувствительность 99,2%, специфичность 97,9%, точность 98,9%).
МР- маммографию целесообразно использовать при:
- отчетливо определяемых (на маммограммах) изменениях не вполне ясной клинически значимости;
- неотчетливо определяемых (на маммограммах) изменениях, в частности, при подозрении на наличие опухоли у молодых женщин, имеющих плотную структуру ткани;
- уточнение причин локальной симптоматики в молочной железе;
- выявлении участков микрокальцинатов;
- дифференциальной диагностике узловых форм рака и ФКБ при категорическом отказе пациентки от пункционной биопсии;
- поиске скрытых форм рака молочной железы у пациенток с множественными метастазами из неустановленного первичного очага;
- уточнении местной распространенности процесса;
- при дифференциальной диагностике злокачественной опухоли и жирового некроза.

В последнее время в литературе все чаще появляются сообщения о достаточно высокой значимости сцинтимаммографии в диагностике синхронного рака молочных желез. Имеются сообщения об использовании 99mTc-MIBI в диагностике двухсторонних опухолей молочных желез. E.Derebek и соавт. сообщают о том, что ранняя и отсроченная сцинтиграфия предоставляет важную дополнительную информацию при синхронном поражении молочных желез, даже в случаях, когда маммография и динамическая МРТ не эффективны [10].
Генетические факторы играют важную роль в возможной предрасположенности к возникновению синхронного рака молочных желез. Положительный семейный анамнез рака молочной железы в 2 раза чаще имеет место у больных синхронным раком молочных желез по сравнению с общей популяцией. Anderson D.E. установил, что синхронные раки, возникающие у женщин до менопаузы, являются строго наследственными и почти у 30% дочерей данной группы велика вероятность возникновения рака молочной железы в возрасте до 40 лет [8]. Данные литературы, касающиеся этой проблемы, немногочисленны, и анализируют небольшое число наблюдений. Kinoshita T. И соавт. пришли к выводу, что генетические изменения и механизм канцерогенеза при одностороннем и двухстороннем раке молочных желез различны [13]. A. E. Ozer и соавт., исследовав прогностическую значимость мутаций гена р53 при синхронном раке молочных желез, пришли к выводу, что выраженная степень мутаций р53, особенно в сочетании с экспрессией Ki-67 (маркером опухолевой клеточной пролиферации), является неблагоприятным фактором прогноза при синхронном раке и может служить предсказателем развития метахронного рака в контрлатеральной молочной железе [15]. Е.М. Бит-Савва выявила, что синхронный рак молочных желез в 50% случаях ассоциирован с мутациями в генах BRCA1, BRCA2, а при сочетании этого признака наследственного заболевания с раком яичников у кровных родственников больной, герминальные мутации в генах репарации ДНК выявляются в 100% случаев [1].
Данные литературы, касающиеся этой проблемы, немногочисленны, и анализируют небольшое число наблюдений. Kinoshita T. И соавт. пришли к выводу, что генетические изменения и механизм канцерогенеза при одностороннем и двухстороннем раке молочных желез различны [13]. A. E. Ozer и соавт., исследовав прогностическую значимость мутаций гена р53 при синхронном раке молочных желез, пришли к выводу, что выраженная степень мутаций р53, особенно в сочетании с экспрессией Ki-67 (маркером опухолевой клеточной пролиферации), является неблагоприятным фактором прогноза при синхронном раке и может служить предсказателем развития метахронного рака в контрлатеральной молочной железе [15]. Е.М. Бит-Савва выявила, что синхронный рак молочных желез в 50% случаях ассоциирован с мутациями в генах BRCA1, BRCA2, а при сочетании этого признака наследственного заболевания с раком яичников у кровных родственников больной, герминальные мутации в генах репарации ДНК выявляются в 100% случаев [1].
Общая и безрецидивная выживаемость больных синхронным раком молочных желез зависит от прогностических факторов. По данным Р. А. Керимова, средний возраст больных синхронным раком молочных желез составляет 49,98 ± 2,9 года [3]. По J.Kelmendi de Ustrann и соавт., роль других прогностических факторов (возраст; менархе; овариально- менструальная функция, время лактации, время рождения первого ребенка, соотношение между числом инвазивных и неинвазивных опухолей) одинакова при синхронном и одностороннем поражении молочных желез [12].
Р. А. Керимов, анализируя клинические проявления при двухстороннем раке молочных желез, показал, что у 39,5% больных синхронным раком стадийность поражения была одинаковой с обеих сторон, у 60,5% — разная. Более чем в половине случаев (59,3%) отмечены локализованные формы рака. Симметричное расположение опухолей выявлено в 22,9% случаях. Опухоли локализовались в наружных и верхних квадрантах молочных желез у 86% больных. Метастазы в регионарных лимфатических узлах были обнаружены с обеих сторон у 50% больных, с одной – у 27,9%. При синхронном поражении наиболее часто с обеих сторон отмечался инфильтративный рак: протоковый у 46,4% больных, дольковый – у 26,2% больных. У 11,9% больных установлено сочетание инфильтративного протокового или долькового рака с одной стороны и редких форм – с другой. У 73,8% больных опухоли с обеих сторон были одинакового гистологического строения, у 26,2% — различного. Исследование окружающей ткани молочной железы при синхронном раке выявило различной степени выраженности фиброзно-кистозную болезнь: в 67,3% случаев – пролиферативная форма, проявляющаяся развитием внутрипротоковых и внутридольковых пролифератов, внутрипротоковых папиллом, участков атипии эпителия. У 17,3% больных выявлены очаги неинвазивного рака [3].
При синхронном поражении наиболее часто с обеих сторон отмечался инфильтративный рак: протоковый у 46,4% больных, дольковый – у 26,2% больных. У 11,9% больных установлено сочетание инфильтративного протокового или долькового рака с одной стороны и редких форм – с другой. У 73,8% больных опухоли с обеих сторон были одинакового гистологического строения, у 26,2% — различного. Исследование окружающей ткани молочной железы при синхронном раке выявило различной степени выраженности фиброзно-кистозную болезнь: в 67,3% случаев – пролиферативная форма, проявляющаяся развитием внутрипротоковых и внутридольковых пролифератов, внутрипротоковых папиллом, участков атипии эпителия. У 17,3% больных выявлены очаги неинвазивного рака [3].
Существенное влияние на прогноз оказывает рецепторный статус опухоли. Высокий уровень рецепторов эстрогенов свидетельствует о более благоприятном прогнозе у молодых женщин, а рецепторов прогестерона – у пожилых больных.
Распределение больных синхронным раком молочных желез по стадиям с каждой стороны следующая: T1-2N0M0 и T1-2N0M0 – у 18,6% больных; T1-2N1M0 и T1-2N1M0 – у 9,3%; T3-4N0-2M0 и T3-4N0-2M0 – у 24,4%; T1-2N0M0 и T1-2N1M0 – у 18,6%; T1-2N0M0 и T3-4N0-2M0 – у 9,3%; T1-2N1M0 и T3-4N0-2M0 – у 19,8%. Локализованные формы рака отмечены более чем в половине случаев – у 59,3% пациентов[3].
Локализованные формы рака отмечены более чем в половине случаев – у 59,3% пациентов[3].
По данным Hong Wen-shan показатели 5- и 8-летней выживаемости у больных с отсутствием поражения метастазами лимфатических узлов, односторонним поражением лимфатических узлов и двухсторонним поражением лимфатических узлов – 75,6 и 65,5%; 43,8 и 32,9%; 28,9 и 0% соответственно [11].
По Р. А. Керимову 5-летняя общая выживаемость больных с I-IIа с каждой стороны составила 90,0 ± 5,6%, безрецидивная – 82,2 ± 4,8%, при IIб стадии – соответственно 75,6 ± 8,7% и 67,4 ± 9,5%, при lllа-б стадии – 50,4 ± 3,2 и 40,2 ± 3,6%; при l-llа стадии с одной стороны и llб с другой – соответственно 79,1 ± 5,3% и 69,5 ± 5,5%, при l-llа и lllа-б – 73,2 ± 8,8% и 65,3 ± 9,2%, при llб и lllа-б – 51,3 ± 4,7% и 40,4 ± 4,9%. Ранние стадии опухолей с одной стороны при наличии местно-распространенного процесса с другой очень незначительно влияют на выживаемость [3].
Лечение синхронного рака молочных желез весьма разнообразно и зависит от прогностических факторов. Длительное время основным методом лечения оставался хирургический – двухсторонняя радикальная мастэктомия. Однако, с усовершенствованием методов химио- и лучевой терапии, стало возможным проведение органосохраняющих операций [5].
Длительное время основным методом лечения оставался хирургический – двухсторонняя радикальная мастэктомия. Однако, с усовершенствованием методов химио- и лучевой терапии, стало возможным проведение органосохраняющих операций [5].
При первично-неоперабельных формах рака с одной или обеих сторон комплексное лечение дает достоверно лучшие результаты, чем все прочие виды терапии. Проведение неоадъювантной терапии при местно- распространенном процессе с одной или с обеих сторон достоверно увеличивает и общую, и безрецидивную выживаемость, в то же время проведение неоадъювантного лечения при первично- операбельных стадиях не приводит к достоверному улучшению выживаемости [4].
До сих пор вопрос о возможности выполнения органосохраняющих операций при синхронном раке молочных желез является противоречивым. Поиском ответа на этот вопрос посвящено множество исследований последних лет. Большинство авторов считают возможным выполнение этих операций при соблюдении определенных показаний. Так, T.Arimura и соавт. показаниями к выполнению органосохраняющих операций считают опухоль менее 3-х см, отсутствие мультицентрического роста, отсутствие значительной инвазии протоков. Авторами были выполнены органосохраняющие операции при синхронном раке молочных желез у 44% больных с одной стороны и у 38% больных с обеих сторон. Показатели выживаемости в этих группах и в группе больных с мастэктомиями практически не различались [9]. Сходные данные были получены и многими другими авторами. Во всех этих исследованиях не было получено различий в общей и безрецидивной выживаемости, частоте рецидивов. Однако, остаются еще отдельные публикации, в которых авторы являются строгими приверженцами выполнения операций большего объема при синхронном раке молочных желез.
Так, T.Arimura и соавт. показаниями к выполнению органосохраняющих операций считают опухоль менее 3-х см, отсутствие мультицентрического роста, отсутствие значительной инвазии протоков. Авторами были выполнены органосохраняющие операции при синхронном раке молочных желез у 44% больных с одной стороны и у 38% больных с обеих сторон. Показатели выживаемости в этих группах и в группе больных с мастэктомиями практически не различались [9]. Сходные данные были получены и многими другими авторами. Во всех этих исследованиях не было получено различий в общей и безрецидивной выживаемости, частоте рецидивов. Однако, остаются еще отдельные публикации, в которых авторы являются строгими приверженцами выполнения операций большего объема при синхронном раке молочных желез.
Резюмируя проведенный выше анализ литературных данных о синхронном раке молочных желез, можно заключить, что эта проблема остается сложной и далеко не полностью изученной. Существует множество спорных вопросов, касаемых эпидемиологии, диагностики и лечения синхронного рака молочных желез.
Литература
- Бит- Сава Е. М. Клинические и генетические аспекты наследственного рака молочной железы. Автореферат кандидатской диссертации, Санкт- Петербург, 2005г.
- Давыдов М. И., Аксель Е. М. Вестник РОНЦ им. Н. Н. Блохина РАМН. 2006, том 17, №3, приложение 1, стр. 47, 82, 108, 113.
- Керимов Р. А. Двусторонний рак молочных желез: особенности течения и результаты терапии. Маммология, 2005, №1, стр. 36 — 41.
- Летягин В. П., Высоцкая И. В. Лечение двустороненного синхронного рака молочных желез стадий Т0-2 N0-1 M0. Вестник РОНЦ – 2004г- №4, стр. 23-27.
- Летягин В. П. Первичные опухоли молочной железы. Практическое руководство по лечению. М — 2004г, стр. 205-233.
- Сельчук В. Ю. Первично- множественные опухоли (клиника, лечение и закономерности развития). Дисс. док. мед. наук. М — 1994г, стр. 173- 184.
- Сельчук В. Ю. Первично- множественные синхронные злокачественные новообразования репродуктивной системы у женщин.
 Российский онкологический журнал — 2001г — №3, стр. 18 – 21.
Российский онкологический журнал — 2001г — №3, стр. 18 – 21. - Anderson D.E. Genetic study of breast cancer: identification of high risk group. Cancer, 1974, 34, р. 1090-1097.
- Arimura T., Fukuda M., Ohtuka T. et al. Evaluation of possibility of breast conserving for patients with synchronous bilateral breast cancer // Journ. of Japan Society of cancer therapy. – 1994. – Vol. 29, № 2. – P. 513.
- Derebek E., Вalci P., Alanyali H. et al. Detection of bilateral multifokal breast cancer using Tc-99m sestamibi imaging: the role of delayed imaging. Clinical nuclear medicine, 1999, v. 24, № 8, p. 590-593.
- Hong Wen- shan, Yang Ming- tian, Wang Si- yu, Li Bao- jiang, Tang Jun, Lian Zhen- giang // Zhongliu fangzhi zazhi = China Prev. and Treat. – 2005. – 12, № 4. – C. 297-300. – Кит.; рез. англ.
- Kelmendi de Ustaran J., Meiss Roberto P. Cancer bilateral sincronico de mama (aspectos epidemiologicos). Bol. Acad. Nac.
 Med. Buenos Aires, 1986, v. 64, № 2, p. 492- 502.
Med. Buenos Aires, 1986, v. 64, № 2, p. 492- 502. - Kinoshita S., Ueda M., Enomoto K. et al. Comparison of p 53 gene abnormalities in bilateral and unilateral breast cancer. Cancer, 1995, v. 76, № 12, p.2504 – 2509.
- Murphy T.J., Conant E.F., Hanau C.A. et al. Bilateral breast carcinoma: mammographic and histologic correlation// Radiology. – 1995.- Vol. 195 №3. – P. 617 – 621.
- Ozer E., Canda T., Kuyucuoolu F. et al. p53 mulations in bilateral breast carcinoma. Correlation with Ki-67 expression and the mean nuclear volume. Cancer letters, 1998, v. 122, № 1-2, p. 101-106.
ПЕРВИЧНО-МНОЖЕСТВЕННЫЕ СИНХРОННЫЕ ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ СИГМОВИДНОЙ КИШКИ И МОЛОЧНОЙ ЖЕЛЕЗЫ В СОЧЕТАНИИ С МЕНИНГИОМОЙ СПИННОГО МОЗГА | Агапов
1. Copur M. S., Manapuram S. Multiple Primary Tumors Over a Lifetime. Oncology (Williston Park, NY). – 2019; 33.7.
2. Каприн А.Д., Старинский В.В. Состояние онкологической помощи населению России в 2016 году / МНИОМ им. П.А. Герцена – филиал ФГБУ «НМИРЦ» Минздрава России, Москва, 2017 год. 236 с.
П.А. Герцена – филиал ФГБУ «НМИРЦ» Минздрава России, Москва, 2017 год. 236 с.
3. April Fritz Constance Percy Andrew Jack Kanagaratnam Shanmugaratnam Leslie Sobin D Max Parkin Sharon Whelan. International classification of diseases for oncology (ICD-O) – 3rd edition, 1st revision. WHO, 2013. 252 p.
4. Miller KD, Nogueira L, Mariotto AB, Rowland JH, Yabroff KR, Alfano CM, Jemal A, Kramer JL, Siegel RL. Cancer treatment and survivorship statistics, 2019. CA Cancer J Clin. 2019 June 11. https://doi.org/10.3322/caac.21565
5. Wood ME, Vogel V, Ng A, Foxhall L, Goodwin P, Travis LB. Second malignant neoplasms: assessment and strategies for risk reduction. J Clin Oncol. 2012 Oct 20;30(30):3734-45. https://doi.org/ 10.1200/JCO.2012.41.8681
6. Vogt A, Schmid S, Heinimann K, Frick H, Herrmann C, Cerny T, Omlin A. Multiple primary tumours: challenges and approaches, a review. ESMO Open. 2017 May 2;2(2):e000172. https://doi.org/ 10.1136/esmoopen-2017-000172
7. Coyte A, Morrison DS, McLoone P. Second primary cancer risk—the impact of applying different definitions of multiple primaries: results from a retrospective population-based cancer registry study. BMC Cancer. 2014;14:272. https://doi.org/10.1186/1471-2407-14-272
Second primary cancer risk—the impact of applying different definitions of multiple primaries: results from a retrospective population-based cancer registry study. BMC Cancer. 2014;14:272. https://doi.org/10.1186/1471-2407-14-272
8. Amer MH. Multiple neoplasms, single primaries, and patient survival. Cancer Manag Res. 2014;6:119-34. https://doi.org/10.2147/CMAR.S57378
9. Scott LC, Kuo TM, Il’yasova D, Mobley LR. Geospatial analysis of multiple cancers in individuals in the US, 2004-2014. Ann Cancer Epidemiol. 2021 Mar;5:2. https://doi.org/10.21037/ace-19-40
10. Zheng G, Sundquist K, Sundquist J, Chen T, Försti A, Hemminki A, Hemminki K. Second Primary Cancers After Gastric Cancer, and Gastric Cancer as Second Primary Cancer. Clin Epidemiol. 2021 Jul 2;13:515-525. https://doi.org/10.2147/CLEP.S304332
11. Fraumeni JF, Curtis RE, Edwards BK, Tucker MA. Introduction. In: Curtis RE, Freedman DM, Ron E. New malignancies among cancer survivors: SEER Cancer Registries, 1973-2000. NIH Publ. 05-5302. Bethesda, MD: National Cancer Institute; 2006.
NIH Publ. 05-5302. Bethesda, MD: National Cancer Institute; 2006.
12. Waespe N, Belle FN, Redmond S, Schindera C, Spycher BD, Rössler J, Ansari M, Kuehni CE; Swiss Paediatric Oncology Group (SPOG). Cancer predisposition syndromes as a risk factor for early second primary neoplasms after childhood cancer — A national cohort study. Eur J Cancer. 2021 Mar;145:71-80. https://doi.org/ 10.1016/j.ejca.2020.11.042
13. Begg CB, Zhang ZF, Sun M, Herr HW, Schantz SP. Methodology for evaluating the incidence of second primary cancers with application to smoking-related cancers from the Surveillance, Epidemiology, and End Results (SEER) program. Am J Epidemiol. 1995;142:653-65. https://doi.org/10.1093/oxfordjournals.aje.a117689
14. Sung H, Hyun N, Leach CR, Yabroff KR, Jemal A. Association of First Primary Cancer With Risk of Subsequent Primary Cancer Among Survivors of AdultOnset Cancers in the United States. JAMA. 2020 Dec 22;324(24):2521-2535. https://doi.org/ 10.1001/jama.2020. 23130
23130
15. Forjaz de Lacerda G, Howlader N, Mariotto AB. Differences in Cancer Survival with Relative versus Cause-Specific Approaches: An Update Using More Accurate Life Tables. Cancer Epidemiol Biomarkers Prev. 2019 Sep;28(9):1544-1551. https://doi.org/ 10.1158/1055-9965.EPI-19-0125
16. Montiel Ishino FA, Odame EA, Villalobos K, Liu X, Salmeron B, Mamudu H, Williams F. A National Study of Colorectal Cancer Survivorship Disparities: A Latent Class Analysis Using SEER (Surveillance, Epidemiology, and End Results) Registries. Front Public Health. 2021 Feb 25;9:628022. https://doi.org/10.3389/fpubh.2021.628022
17. Ishimori T, Patel PV, Wahl RL. Detection of unexpected additional primary malignancies with PET/CT. J Nucl Med. 2005 May;46(5):752-7.
18. Miyazaki T, Sohda M, Higuchi T, et al. Effectiveness of FDG-PET in screening of synchronous cancer of other organs in patients with esophageal cancer. Anticancer Res. 2014;34
19. McNeill KA. Epidemiology of Brain Tumors. Neurol Clin. 2016 Nov;34(4):981-998. https://doi.org/10.1016/j.ncl.2016.06.014
Neurol Clin. 2016 Nov;34(4):981-998. https://doi.org/10.1016/j.ncl.2016.06.014
20. Baldi I, Engelhardt J, Bonnet C, Bauchet L, Berteaud E, Grüber A, Loiseau H. Epidemiology of meningiomas. Neurochirurgie. 2018 Mar;64(1):5-14. https:// doi.org/10.1016/j.neuchi.2014.05.006
21. Ketter R, Rahnenführer J, Henn W, Kim YJ, Feiden W, Steudel WI, Zang KD, Urbschat S. Correspondence of tumor localization with tumor recurrence and cytogenetic progression in meningiomas. Neurosurgery. 2008 Jan; 62(1):61-9; discussion 69-70. https://doi.org/10.1227/01.NEU.0000311062.72626.D6
22. Choy W, Kim W, Nagasawa D, Stramotas S, Yew A, Gopen Q, Parsa AT, Yang I. The molecular genetics and tumor pathogenesis of meningiomas and the future directions of meningioma treatments. Neurosurg Focus. 2011 May;30(5):E6. https://doi.org/10.3171/2011.2.FOCUS1116
23. Clark VE, Erson-Omay EZ, Serin A, Yin J, Cotney J, Ozduman K, Avşar T, Li J, Murray PB, Henegariu O, Yilmaz S, Günel JM, Carrión-Grant G, Yilmaz B, Grady C, Tanrikulu B, Bakircioğlu M, Kaymakçalan H, Caglayan AO, Sencar L, Ceyhun E, Atik AF, Bayri Y, Bai H, Kolb LE, Hebert RM, Omay SB, Mishra-Gorur K, Choi M, Overton JD, Holland EC, Mane S, State MW, Bilgüvar K, Baehring JM, Gutin PH, Piepmeier JM, Vortmeyer A, Brennan CW, Pamir MN, Kiliç T, Lifton RP, Noonan JP, Yasuno K, Günel M. Genomic analysis of non-NF2 meningiomas reveals mutations in TRAF7, KLF4, AKT1, and SMO. Science. 2013 Mar 1;339(6123):1077-80. https://doi.org/ 10.1126/science.1233009
Genomic analysis of non-NF2 meningiomas reveals mutations in TRAF7, KLF4, AKT1, and SMO. Science. 2013 Mar 1;339(6123):1077-80. https://doi.org/ 10.1126/science.1233009
24. Kerr K, Qualmann K, Esquenazi Y, Hagan J, Kim DH. Familial Syndromes Involving Meningiomas Provide Mechanistic Insight Into Sporadic Disease. Neurosurgery. 2018 Dec 1;83(6):1107-1118. https://doi.org/ 10.1093/neuros/nyy121
25. Custer BS, Koepsell TD, Mueller BA. The association between breast carcinoma and meningioma in women. Cancer. 2002 Mar 15;94(6):1626-35. https://doi.org/ 10.1002/cncr.10410
Случай успешного хирургического лечения синхронно-метахронного рака поджелудочной железы у пациента с тремя локализациями злокачественной полинеоплазии
Первично-множественными злокачественными новообразованиями принято считать опухоли 2-х и более локализаций, развившиеся в одном организме. В настоящее время первично-множественные злокачественные опухоли (ПМЗО) не являются редкими. В 2013 г. заболеваемость ПМЗО составляла 22,9 на 100 тыс. населения, их доля среди всех впервые выявленных злокачественных опухолей – 6,1%. Частота развития ПМЗО постоянно возрастает: в 2000 г. – 1,9%, в 2010 г. – 2,8%. Считается, что это связано с увеличением продолжительности жизни больных (за счет достижений хирургии, развития комбинированных методов лечения, внедрения новейших диагностических технологий), а также с влиянием неблагоприятных факторов окружающей среды [1, 4]. Сочетание 2-х ПМЗО отмечается в 75–80% случаев, 3-х – в 10–15%, 4-х – в 5%, 5-ти и более – в 2–3% [5].
населения, их доля среди всех впервые выявленных злокачественных опухолей – 6,1%. Частота развития ПМЗО постоянно возрастает: в 2000 г. – 1,9%, в 2010 г. – 2,8%. Считается, что это связано с увеличением продолжительности жизни больных (за счет достижений хирургии, развития комбинированных методов лечения, внедрения новейших диагностических технологий), а также с влиянием неблагоприятных факторов окружающей среды [1, 4]. Сочетание 2-х ПМЗО отмечается в 75–80% случаев, 3-х – в 10–15%, 4-х – в 5%, 5-ти и более – в 2–3% [5].
Вероятность выявления вторых и последующих опухолей у пролеченных пациентов примерно в 1,3–5 раз выше, чем у лиц, у которых ранее не было новообразований. По времени возникновения опухоли делятся на синхронные (выявленные одновременно или в срок до 6 мес.) и метахронные. В случае 3–х и более локализаций ПМЗО эти варианты могут сочетаться. Несомненно, что наличие множественного неопластического поражения приводит к синергетическому негативному влиянию каждой из опухолей на организм пациента и снижению его шансов перенести лечение и нередко ставит клиницистов перед необходимостью решения трудных диагностических и лечебных вопросов [2, 3].
С нашей точки зрения, представляет интерес следующее клиническое наблюдение ПМЗО 3-х локализаций у одного больного.
Больной Н., 69 лет, наблюдается в РНИОИ с 2008 г., когда у него был впервые выявлен рак предстательной железы. Уже на тот момент заболевание было запущенным, имело место метастатическое поражение легких и забрюшинных лимфатических узлов. Лечение первичной опухоли высокоинтенсивным сфокусированным ультразвуком (HIFU) в сочетании с трансуретральной резекцией простаты было проведено в Германии. Гистологически определена умеренно дифференцированная аденокарцинома простаты (G2). Показатель Глисона составил 6 (3+3). В течение 4 лет проводилось лечение бикалутамидом и гозерелином, отмечалась стабилизация процесса. В июне 2012 г. появились боли в пояснице и крестце. При компьютерной томографии обнаружены множественные метастатические очаги в левой подвздошной кости, левой половине L5, L1, Th5, 7, 12 позвонков. С июля 2012 г. проведено 3 курса химиотерапии доцетакселом и гормонотерапии преднизолоном, затем в сентябре – курс полихимиотерапии с включением доксорубицина и винорелбина без эффекта. Стабилизация состояния достигнута после начала гормональной терапии абиратероном в дозе 1000 мг/сут (всего 20 курсов).
Стабилизация состояния достигнута после начала гормональной терапии абиратероном в дозе 1000 мг/сут (всего 20 курсов).
В апреле 2014 г. у пациента выявлена опухоль кожи подошвенной поверхности левой стопы. 14.04.2014 г. выполнено широкое иссечение опухоли кожи левой стопы с пластикой свободным кожным лоскутом. Получено гистологическое заключение: меланома, узловая форма, преимущественно из веретеноподобных клеток, с умеренным содержанием меланина, инвазией V уровня по Кларку, толщиной более 12 мм по Бреслоу. Опухоль распространяется в эпидермис и жировую клетчатку; удалена в пределах здоровых тканей. В эпидермисе и перифокальной зоне – меланоцитарная дисплазия меланоцитарного типа (рис. 1). Послеоперационный диагноз: меланома кожи стопы T4bN0M0, стадия 2С. После операции проведено 2 курса иммунотерапии интерфероном-α2a.
В августе 2014 г. на фоне продолжающейся гормонотерапии абиратероном и стабильно выявляющихся очаговых образований в обоих легких было решено выполнить их верификацию. Видеоторакоскопия справа выполнена 15.08.2014 г., проведена атипичная резекция верхней доли правого легкого. Получено морфологическое подтверждение метастатической природы очагов в легких, источником которых явилась первичная злокачественная опухоль предстательной железы: при гистологическом исследовании выявлена аденокарцинома железистого строения, вероятнее, метастаз аденокарциномы простаты, при иммуногистохимическом исследовании препарата – метастаз аденокарциномы простаты (рис. 2 А, Б).
Видеоторакоскопия справа выполнена 15.08.2014 г., проведена атипичная резекция верхней доли правого легкого. Получено морфологическое подтверждение метастатической природы очагов в легких, источником которых явилась первичная злокачественная опухоль предстательной железы: при гистологическом исследовании выявлена аденокарцинома железистого строения, вероятнее, метастаз аденокарциномы простаты, при иммуногистохимическом исследовании препарата – метастаз аденокарциномы простаты (рис. 2 А, Б).
В сентябре 2014 г. пациент отметил появление болей в верхних отделах живота. В течение 1 мес. интенсивность болей постепенно нарастала, начал худеть, потеря веса составила 4–5 кг. Появилась слабость, периодически беспокоили запоры. При магнитно-резонансной томографии 26.10.2014 г. выявлена опухоль в области хвоста поджелудочной железы размерами 4,2х3,2х3,9 см, циркулярно охватывающая селезеночные сосуды, инфильтрирующая окружающую клетчатку.
Поступил в отделение абдоминальной онкологии № 1 РНИОИ 5. 11.2014 г. для хирургического лечения. Больной взят в операционную 10.11.2014 г. Под эндотрахеальным наркозом выполнена верхняя срединная лапаротомия. При ревизии определяется плотная бугристая опухоль тела и хвоста поджелудочной железы до 6 см в диаметре, прорастающая в брыжейку поперечной ободочной кишки. Видимых изменений в периферических лимфатических узлах нет. Отдаленные метастазы не определяются. Решено выполнить радикальную операцию: корпорокаудальную резекцию поджелудочной железы, резекцию брыжейки поперечно-ободочной кишки, спленэктомию. Мобилизованы селезенка вместе с хвостом и телом поджелудочной железы, фрагментом брыжейки поперечно-ободочной кишки. Пересечены и перевязаны короткие желудочные сосуды. Селезеночная вена и артерия перевязаны раздельно, пересечены на уровне перешейка поджелудочной железы. На расстоянии 1 см от края опухоли на уровне перешейка пересечена поджелудочная железа, тело и хвост ее вместе с опухолью, селезенкой, участком брыжейки поперечной ободочной кишки удалены.
11.2014 г. для хирургического лечения. Больной взят в операционную 10.11.2014 г. Под эндотрахеальным наркозом выполнена верхняя срединная лапаротомия. При ревизии определяется плотная бугристая опухоль тела и хвоста поджелудочной железы до 6 см в диаметре, прорастающая в брыжейку поперечной ободочной кишки. Видимых изменений в периферических лимфатических узлах нет. Отдаленные метастазы не определяются. Решено выполнить радикальную операцию: корпорокаудальную резекцию поджелудочной железы, резекцию брыжейки поперечно-ободочной кишки, спленэктомию. Мобилизованы селезенка вместе с хвостом и телом поджелудочной железы, фрагментом брыжейки поперечно-ободочной кишки. Пересечены и перевязаны короткие желудочные сосуды. Селезеночная вена и артерия перевязаны раздельно, пересечены на уровне перешейка поджелудочной железы. На расстоянии 1 см от края опухоли на уровне перешейка пересечена поджелудочная железа, тело и хвост ее вместе с опухолью, селезенкой, участком брыжейки поперечной ободочной кишки удалены. Культя поджелудочной железы ушита отдельными узловыми швами. Панкреатический проток прошит и перевязан отдельно. Гемостаз. Брюшная полость осушена, дренирована 3 трубками, установленными в ложе удаленной селезенки, левом боковом канале, области культи поджелудочной железы, выведенными через отдельные проколы в правом и левом подреберье. Рана ушита послойно наглухо (оператор – проф. О.И. Кит). При гистологическом исследовании получено заключение: G2 аденокарцинома c инвазией парапанкреатической клетчатки, в лимфатических узлах без метастазов (рис. 3).
Культя поджелудочной железы ушита отдельными узловыми швами. Панкреатический проток прошит и перевязан отдельно. Гемостаз. Брюшная полость осушена, дренирована 3 трубками, установленными в ложе удаленной селезенки, левом боковом канале, области культи поджелудочной железы, выведенными через отдельные проколы в правом и левом подреберье. Рана ушита послойно наглухо (оператор – проф. О.И. Кит). При гистологическом исследовании получено заключение: G2 аденокарцинома c инвазией парапанкреатической клетчатки, в лимфатических узлах без метастазов (рис. 3).
Послеоперационный период протекал без осложнений. На 3–и сут после операции отмечена активная перистальтика, на 5-е сут – самостоятельный стул. Разрешено пить через 4 сут после операции, через 7 сут – принимать полужидкую пищу с включением смесей для энтерального питания. Дренажи из брюшной полости удалены на 6–8-е сут. Послеоперационная рана зажила первичным натяжением. Больной выписан на 18-е сут после операции в удовлетворительном состоянии. Консультирован химиотерапевтом 22.11.2014 г., адъювантная химиотерапия по поводу рака поджелудочной железы не показана, рекомендовано продление гормонотерапии рака предстательной железы. Клинический диагноз при выписке больного был сформулирован следующим образом: первично-множественный синхронно-метахронный рак: рак предстательной железы T3N1M1 (множественные метастазы в легкие, забрюшинные л/узлы, стадия IV, состояние после лечения HIFU и трансуретральной резекции в 2008 г., метастазирование в кости в 2012 г., состояние после химиотерапии и гормонотерапии; меланома кожи левой стопы T4bN0M0, стадия IIС, состояние после иссечения опухоли кожи левой стопы с пластикой свободным кожным лоскутом в апреле 2014 г., иммунотерапии; рак тела поджелудочной железы T3N0M0, стадия II.
Консультирован химиотерапевтом 22.11.2014 г., адъювантная химиотерапия по поводу рака поджелудочной железы не показана, рекомендовано продление гормонотерапии рака предстательной железы. Клинический диагноз при выписке больного был сформулирован следующим образом: первично-множественный синхронно-метахронный рак: рак предстательной железы T3N1M1 (множественные метастазы в легкие, забрюшинные л/узлы, стадия IV, состояние после лечения HIFU и трансуретральной резекции в 2008 г., метастазирование в кости в 2012 г., состояние после химиотерапии и гормонотерапии; меланома кожи левой стопы T4bN0M0, стадия IIС, состояние после иссечения опухоли кожи левой стопы с пластикой свободным кожным лоскутом в апреле 2014 г., иммунотерапии; рак тела поджелудочной железы T3N0M0, стадия II.
При контрольном обследовании через 3 мес. после выписки из стационара, включавшем в себя рентгенографию органов грудной клетки, УЗИ брюшной полости и таза, данных о прогрессировании процесса в легких и генерализации опухоли в брюшной полости не выявлено. Продолжает лечение абиратероном.
Продолжает лечение абиратероном.
Представленное наблюдение обосновывает необходимость придерживаться активной тактики лечения больных ПМЗО даже при наличии отдаленных метастазов. При этом хирургические вмешательства должны быть максимально радикальными для той опухоли, по поводу которой они выполняются. Интересно, что данная активная хирургическая тактика применена для лечения метахронно (и синхронно по отношению друг к другу) возникших второй и третьей злокачественных неоплазий различного гистологического строения и гистогенеза.
Первично-множественные опухоли — КГБУЗ Горбольница №12, г. Барнаул: статьи
Первично множественные опухоли – неоплазии, возникающие одновременно или через определенный промежуток времени и не являющиеся метастазами друг друга. Могут быть доброкачественными или злокачественными, мультицентрически располагаться в одном органе, возникать в парных органах, локализоваться в пределах одной системы или нескольких систем. Возникают в результате соматических мутаций или наследственных генетических аномалий. Диагностируются на основании клинических симптомов, лабораторных и инструментальных исследований. Тактика лечения определяется типом, распространенностью, локализацией и степенью злокачественности новообразований.
Возникают в результате соматических мутаций или наследственных генетических аномалий. Диагностируются на основании клинических симптомов, лабораторных и инструментальных исследований. Тактика лечения определяется типом, распространенностью, локализацией и степенью злокачественности новообразований.
Общие сведения
Первично множественные опухоли – две или более неоплазии различного генеза, одновременно либо последовательно развившиеся в одном или нескольких органах. В большинстве случаев диагностируются два новообразования. Три узла обнаруживаются у 5-8% пациентов. Случаи четырех и более неоплазий являются крайне редкими и рассматриваются как казуистические. В последние десятилетия отмечается резкое увеличение количества первично множественных опухолей, однако истинная частота их развития пока является предметом исследований.
Согласно статистическим данным, первично множественные опухоли выявляются у 13% пациентов с онкологическими заболеваниями, однако некоторые специалисты указывают, что эта цифра может быть заниженной из-за возможных диагностических ошибок (при определении независимого процесса, как метастаза первичного новообразования) и гибели некоторых больных до появления симптомов второй неоплазии. Лечение первично множественных опухолей осуществляют онкологи, гастроэнтерологи, эндокринологи, маммологи, гинекологи и специалисты в других сферах медицины (в зависимости от локализации новообразований).
Лечение первично множественных опухолей осуществляют онкологи, гастроэнтерологи, эндокринологи, маммологи, гинекологи и специалисты в других сферах медицины (в зависимости от локализации новообразований).
Первое упоминание о множественных неоплазиях встречается в трудах Авиценны, который более тысячи лет назад описал двухсторонний рак молочных желез. В XIX веке описания первично множественных опухолей стали все чаще встречаться в специализированной литературе. Наиболее существенный вклад в определение понятия и изучение данной патологии внес немецкий хирург Бильрот. В частности, он первым дал определение подобным патологическим состояниям, отнеся к первично множественным опухолям новообразования различной структуры, локализующиеся в разных органах и дающие собственные метастазы.
В первой половине XX века формулировка Бильтота была пересмотрена. В настоящее время первично множественными опухолями считаются неоплазии, которые могут располагаться в одном или в разных органах. Основным условием отнесения заболеваний к этой категории является одновременное или последовательное появление в организме нескольких независимых друг от друга очагов трансформации клеток. Второе и последующие новообразования не должны возникать в результате контактного распространения, лимфогенного или гематогенного метастазирования.
Второе и последующие новообразования не должны возникать в результате контактного распространения, лимфогенного или гематогенного метастазирования.
Причины
Непосредственной причиной развития солитарных и первично множественных опухолей являются генетические мутации, обусловленные несколькими факторами. С учетом особенностей этиопатогенеза различают три основных типа неоплазий: возникшие в результате спонтанных соматических мутаций, образовавшиеся вследствие индуцированных соматических мутаций, являющиеся результатом передающихся по наследству генетических мутаций. Следует учитывать, что подобное разделение является достаточно условным. На практике, скорее, можно выделить преобладающую причину развития, которая сочетается с другими, менее значимыми факторами.
При первично множественных опухолях перечисленные мутации могут сочетаться. Возможны любые комбинации, например, первое новообразование развивается спонтанно, второе – в результате индукции; первое является наследственным, второе – индуцированным; оба рака имеют одну и ту же природу (наследственность, воздействие экзогенных факторов) и т.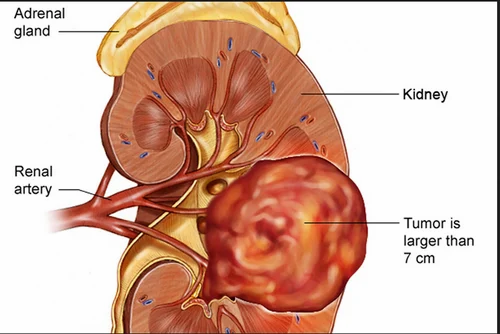 д. При этом у больных первично множественными опухолями отмечается преобладание индуцированных и наследственных мутаций.
д. При этом у больных первично множественными опухолями отмечается преобладание индуцированных и наследственных мутаций.
В числе наиболее значимых факторов, индуцирующих развитие первично множественных опухолей, рассматривают курение, проживание в неблагоприятных экологических зонах, профессиональные вредности (контакт с химическими мутагенами на некоторых производствах, превышение установленных нагрузок у радиологов), многократные рентгенологические обследования, лучевую терапию и химиотерапию предшествующих онкологических заболеваний. Вероятность возникновения первично множественных опухолей также повышается при нарушениях питания, иммунодефицитных состояниях, гормональных расстройствах и некоторых эндемических заболеваниях.
В список наследственных синдромов, сопровождающихся облигатным развитием или повышенной вероятностью возникновения онкологических поражений, включают более 100 заболеваний. Первично множественные опухоли развиваются или могут развиться при трети таких заболеваний. Наиболее известными синдромами являются МЭН-1, МЭН-2 и МЭН-3, при которых выявляются множественные эндокринные неоплазии. Кроме того, первично множественные опухоли могут диагностироваться при синдроме Линча, синдроме Гарднера, болезни Гиппеля-Линдау, синдроме Пейтца-Егерса и других.
Наиболее известными синдромами являются МЭН-1, МЭН-2 и МЭН-3, при которых выявляются множественные эндокринные неоплазии. Кроме того, первично множественные опухоли могут диагностироваться при синдроме Линча, синдроме Гарднера, болезни Гиппеля-Линдау, синдроме Пейтца-Егерса и других.
Классификация
Существует несколько классификаций, созданных на разных этапах изучения данной патологии. Современные специалисты обычно используют классификацию Бебякина, разработанную в 1974 году. Согласно этой классификации выделяют следующие типы первично множественных опухолей:
- С учетом сочетаний: все неоплазии имеют доброкачественный характер; выявляются доброкачественные и злокачественные новообразования; все опухоли протекают злокачественно.
- С учетом последовательности обнаружения: синхронные первично множественные опухоли (обнаруженные одновременно или практически одновременно), метахронные (диагностированные с интервалом 6 и более месяцев), метахронно-синхронные и синхронно-метахронные.

- С учетом функциональных взаимосвязей: гормональнозависимые, функциональнозависимые, несистематизированные.
- С учетом происхождения из определенной ткани: первично множественные опухоли одинакового происхождения и разного происхождения.
- С учетом гистологических особенностей: одинаковой гистологической структуры, разной гистологической структуры.
- С учетом локализации: расположенные в одном органе или парных органах; поражающие несколько органов одной системы; локализующихся в органах различных систем.
Диагностика
Основой успешной диагностики первично множественных неоплазий является комплексный подход, разработанный с учетом особенностей возникновения и течения этой группы заболеваний. Одной из наиболее распространенных проблем при обнаружении первично множественных опухолей является отсутствие четкой клинической картины, характерной для каждого новообразования. Проявления неоплазий могут накладываться друг на друга, симптомы одного из поражений могут быть слабо выраженными, маскироваться под неопухолевое заболевание или имитировать признаки отдаленных метастазов.
Хотя бы частично решить эту проблему позволяют продуманные планы первичного и последующих обследований, составленные с учетом возможности развития первично множественных опухолей. Так, при локализации солитарного новообразования в зоне молочной железы специалисты уделяют пристальное внимание состоянию второй молочной железы и внутренних женских половых органов, при расположении неоплазии в области желудка – состоянию толстого кишечника, кожи, яичников, матки и молочных желез и т. д. План обследования в каждом конкретном случае составляется индивидуально. Решающую роль при постановке диагноза обычно играют радиологические методики (рентгенография, КТ), УЗИ, МРТ и гистологические исследования.
Вероятность развития первично множественных опухолей у онкологических больных в 6 раз выше, чем в среднем по популяции. С учетом этого обстоятельства, все пациенты с такими заболеваниями после лечения должны находиться под диспансерным наблюдением и проходить регулярные обследования. Такая мера позволяет выявлять рецидивы первичной неоплазии и диагностировать метахронные первично множественные опухоли. Риск развития второго онкологического поражения увеличивается в возрасте 55-70 лет, что должно учитываться при планировании обследования пациентов.
Риск развития второго онкологического поражения увеличивается в возрасте 55-70 лет, что должно учитываться при планировании обследования пациентов.
Лечение первично множественных опухолей
Лечение синхронных неоплазий осуществляется одновременно. В зависимости от локализации новообразований и состояния больного хирургическое вмешательство может проводиться единовременно либо быть поэтапным. При планировании очередности операций при первично множественных опухолях учитывают степень распространенности каждого онкологического процесса. В ряде случаев по поводу одного новообразования может быть проведено радикальное лечение, по поводу другого – симптоматическое или паллиативное.
При выборе консервативных методик ориентируются на чувствительность каждой опухоли к радиотерапии и различным химиопрепаратам. Тактика лечения метахронных первично множественных опухолей соответствует тактике лечения солитарных новообразований аналогичных стадий и локализаций. Прогноз определяется видом, расположением, стадией и степенью злокачественности первично множественных опухолей. Отдаленные результаты лечения метахронных неоплазий примерно совпадают с результатами терапии одиночных образований. При синхронных процессах прогноз ухудшается.
Отдаленные результаты лечения метахронных неоплазий примерно совпадают с результатами терапии одиночных образований. При синхронных процессах прогноз ухудшается.
Опухоль представляет собой новообразование, клетки которого утратили способность к контролируемому росту. Данная группа заболеваний является очень обширной, поэтому ее выделяют в отдельный раздел медицины — онкологию. Онкология занимается изучением механизмов развития, диагностикой, лечением, профилактикой не только злокачественных, но и доброкачественных новообразований.
Опухоли представлены в очень большом многообразии и могут развиваться в любом органе или ткани. Для каждого вида новообразования выделяют ряд признаков, по которым проводится классификация и устанавливается диагноз.
Атипизм опухолей
Любая опухоль состоит из стромы и паренхимы. Строма представляет собой внеклеточный матрикс, сосуды и нервные окончания. Паренхима — это непосредственно опухолевые клетки. По своей структуре они, как правило, отличаются от нормальных клеток — это и есть атипизм. Отличие может заключаться не только в строении самих клеток, но и в их функционировании, метаболизме и др. Поэтому выделяют несколько видов атипизма:
Отличие может заключаться не только в строении самих клеток, но и в их функционировании, метаболизме и др. Поэтому выделяют несколько видов атипизма:
- Морфологический атипизм. Может быть клеточным и тканевым. В первом случае клетки опухоли теряют способность к созреванию и дифференцировке, в результате чего они приобретают большое ядро, неправильную форму и другие признаки, которые отличают их от нормальных клеток. При тканевом атипизме изменяется соотношение различных элементов ткани, например, соотношение толщины эпидермиса и дермы.
- Биохимический атипизм. Характеризуется изменением метаболизма опухоли. Именно эта особенность играет важную роль в бесконтрольном росте новообразованной ткани. У опухолевых клеток изменяются практически все виды обмена веществ, но наиболее существенным является изменение обмена углеводов, который увеличивается в несколько десятков раз. Среди других особенностей можно отметить преобладание синтеза белка над его распадом, усиленное поглощение аминокислот и воды, накопление ионов калия и потеря ионов кальция.

- Иммунологический атипизм. Для опухолей характерно изменение антигенной структуры. По этой причине иммунная система не может эффективно «атаковать» измененные клетки, в результате чего последние могут бесконтрольно размножаться и расти.
- Функциональный атипизм. Является следствием описанных выше изменений. Изменение строения и метаболизма клеток опухоли неминуемо приводит к изменению их функций. Это может быть повышенная секреция гормонов, потеря способности к фагоцитозу, выработка веществ, которые в норме не образуются и др.
Некоторые виды атипизма позволили разработать специфические противоопухолевые препараты. В частности, некоторые цитостатики, которые используются во время химиотерапии, блокируют потребление глутамина и глюкозы. Эти вещества используются определенными опухолями в большом количестве и необходимы для роста и деления патологических клеток. Иммунологический атипизм лег в основу иммунотерапии раковых заболеваний. При помощи специальных препаратов удается устранить «защитные механизмы» опухоли, которые делают ее «невидимой» для иммунной системы.
Особенности роста опухолей
Второй важный признак, который характерен для всех новообразований — это бесконтрольный и автономный рост. То есть опухоль может расти столько, сколько существует организм. При этом регулирующие механизмы, которые распространяются на нормальные клетки, не работают. Выделяют следующие разновидности роста:
- Экспансивный рост. Характерен для доброкачественных опухолей. Первичный очаг имеет четкие границы за счет капсулы. При увеличении опухоли в размерах, отмечается оттеснение и сдавливание окружающих тканей.
- Инфильтрирующий рост. Характеризуется врастанием опухоли в окружающие ткани, поэтому его еще называют инвазивным ростом. При этом границы первичного очага стерты, за счет чего возникают сложности с определением точных размеров. Опухоль захватывает не только здоровые ткани органа, но и лимфатические протоки и кровеносные сосуды, что является предпосылкой к метастазированию. Такой вид роста отмечается при злокачественных новообразованиях.

- Экзофитный и эндофитный рост. Отмечается в полых органах. В первом случае опухоль растет в просвет органа, а во втором — в его стенку.
- Уницетрический рост — новообразование развивается из единичного очага, расположенного в одном органе.
- Мультицентрический рост — новообразование исходит из нескольких очагов, расположенных в одном органе.
Для каждого вида опухоли характерны определенные особенности роста. Доброкачественные новообразования в большинстве случаев растут медленно, могут длительное время не увеличиваться в размерах и даже регрессировать. При злокачественных новообразованиях, наоборот, часто отмечается быстрый рост с инфильтрацией и разрушением здоровой ткани.
Разновидности опухолей
Классификация опухолей проводится по различным параметрам. Одним из важнейших является степень дифференцировки. На основании этого признака выделяют доброкачественные и злокачественные новообразования. Доброкачественные опухоли состоят из дифференцированных клеток. Их клетки максимально схожи с клетками нормальных тканей. По этой причине такие заболевания не представляют серьезной угрозы для здоровья в большинстве случаев. Для доброкачественных опухолей характерны следующие признаки:
Их клетки максимально схожи с клетками нормальных тканей. По этой причине такие заболевания не представляют серьезной угрозы для здоровья в большинстве случаев. Для доброкачественных опухолей характерны следующие признаки:
- Медленный рост.
- Отсутствие метастазов.
- Отсутствие инфильтрации окружающих тканей.
- Отсутствие склонности к рецидивам.
Доброкачественные опухоли очень хорошо поддаются лечению, которое проводится хирургическими методами. Примерами таких новообразований являются миома, липома, аденома, папиллома, атерома.
Злокачественные опухоли состоят из слабодифференцированных клеток, которые утратили свою функцию и приобрели способность к бесконтрольному делению. Они обладают негативным влиянием на организм, прорастают в окружающие ткани, быстро распространяются по организму и приводят к выраженному нарушению работы внутренних органов.
Ключевым отличием злокачественных опухолей от доброкачественных является склонность к метастазированию. Метастаз представляет собой вторичный опухолевый очаг, который возникает в отдаленном органе или ткани в результате перемещения раковых клеток из первичного очага. Для каждого вида рака характерны определенные локализации метастазов. Наиболее часто поражаются печень, легкие, кости, головной мозг. Распространение опухолевых клеток может происходить следующими способами:
Метастаз представляет собой вторичный опухолевый очаг, который возникает в отдаленном органе или ткани в результате перемещения раковых клеток из первичного очага. Для каждого вида рака характерны определенные локализации метастазов. Наиболее часто поражаются печень, легкие, кости, головной мозг. Распространение опухолевых клеток может происходить следующими способами:
- Через кровь (гематогенное метастазирование).
- Через лимфатические протоки (лимфогенное метастазирование).
- По нервным волокнам (периневральное метастазирование).
- При контакте с другими органами и тканями (контактное метастазирование).
В некоторых случаях может отмечаться комбинация из нескольких вариантов.
Среди других особенностей злокачественных опухолей, отмечается склонность к рецидивам, сложности в лечении и существенное влияние на функции организма за счет нарушения обмена веществ. В частности, раковые клетки активно поглощают глюкозу, витамины и другие питательные вещества, нарушают естественные биохимические реакции и выделяют токсины, которые губительны для здоровых клеток.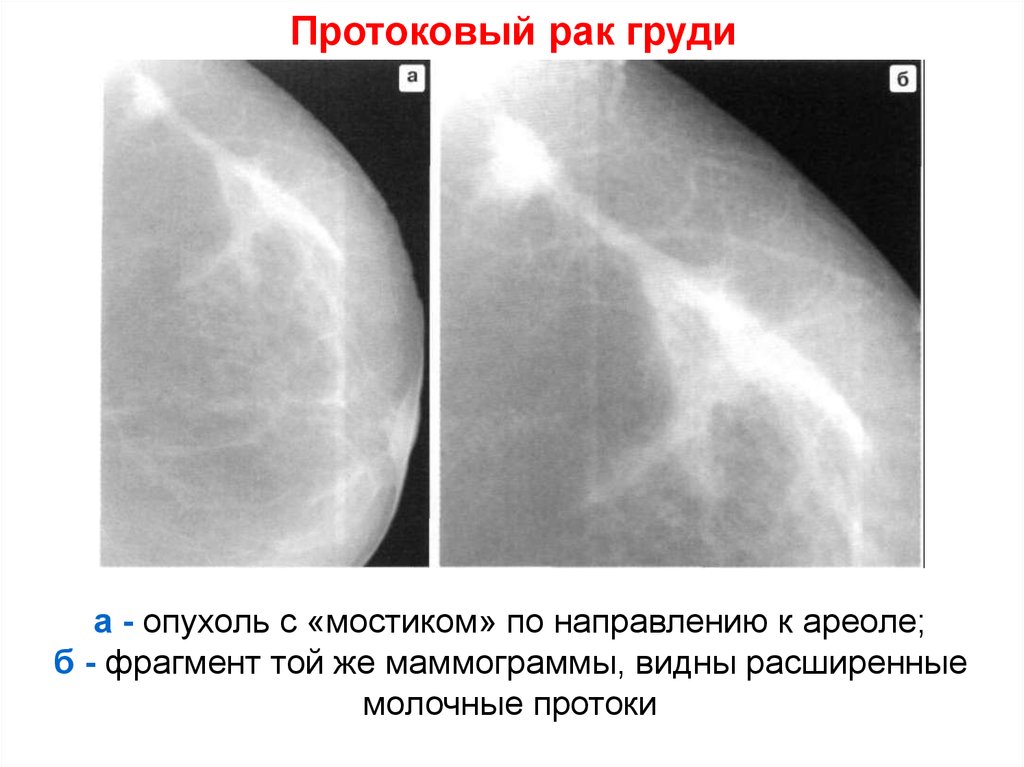 В результате развиваются такие общие симптомы рака, как кахексия (истощение), гипоксия, анемия, интоксикационный синдром.
В результате развиваются такие общие симптомы рака, как кахексия (истощение), гипоксия, анемия, интоксикационный синдром.
Почему возникают опухоли
До сих пор ученые не смогли установить точные причины и механизмы образования опухолей, однако благодаря современным молекулярным методам диагностики, известны важные детали процесса онкогенеза. Нарушение процесса деления и дифференцировки клеток развивается в результате изменений в молекулах ДНК. Такой сбой могут провоцировать различные факторы, которые называются канцерогенами. Их разделяют на три основные группы:
- Химические канцерогены. Представлены вредными веществами, которые образуются при сгорании табака, используются на производстве, присутствуют в пище, выделяются во внешнюю среду. В эту группу входит очень большое количество веществ, число которых приближается к 2000. Из этого списка выделяются несколько десятков химических канцерогенов, которые оказывают наиболее существенное влияние на организм и с большой долей вероятности приводят к развитию опухолей.

- Физические канцерогены. К ним относится радиоактивное, рентгеновское и ультрафиолетовое излучение в дозах, которые превышают допустимые значения. Физические канцерогены, так же как и химические, не влияют напрямую на образование опухолевых клеток. Они провоцируют различные изменения, в том числе и нарушение структуры ДНК, которые и становятся причиной развития различных новообразований.
- Биологические канцерогены. Данная группа представлена специфическими вирусами, которые способствуют онкогенезу. В эту группу входят некоторые типы вируса папилломы человека, ретровирусы, аденовирусы, вирусы гепатита В и С и др. Биологические канцерогены, в отличие от двух предыдущих групп, напрямую влияют на генетический аппарат клетки и изменяют его.
Понимание механизмов развития опухолей и открытие различных канцерогенов позволили врачам разработать средства профилактики. В частности, чтобы снизить риск развития доброкачественных и злокачественных новообразований необходимо отказаться от курения, следить за рационом, избегать работы во вредных условиях труда, укреплять иммунитет и др.
Классификация опухолей
Наиболее простой и понятной является классификация доброкачественных новообразований. В этом случае необходимо знать лишь ткань, из которой развилась опухоль. С учетом этой особенности будет сформирован диагноз. Если доброкачественное новообразование развилось из хрящевой ткани, то диагноз будет «хондрома», из железистой ткани — аденома и др.
Деление злокачественных опухолей куда более сложное. Новообразования из эпителиальной ткани называются раком или карциномой (фолликулярный рак, аденокарцинома). Если опухоль развилась из соединительной ткани, то ее относят к саркомам (хондросаркома, миосаркома), из нервной ткани — глиома и т.д.
Следующий показатель, который учитывается при постановке диагноза — это степень дифференцировки клеток. Она оценивается по шкале Grade и включает в себя следующие варианты:
- GX — определить дифференцировку клеток не удается.
- G1 — клетки высоко дифференцированы.
- G2 — клетки умеренно дифференцированы.

- G3 — клетки низко дифференцированы.
- G4 — клетки недифференцированы.
С увеличением балла увеличивается и агрессивность опухоли, а также степень ее злокачественности.
В зависимости от характеристик первичного очага, наличия метастазов в регионарных лимфоузлах и отдаленных органах, злокачественные опухоли классифицируются по международной системе TNM. Буква Т описывает размер и особенности роста первичной опухоли, N обозначает наличие или отсутствие метастазов в близлежащих лимфоузлах, а буква М — метастазы в отдаленных органах. Для каждой буквы присваивается определенный индекс, в результате диагноз может выглядеть следующим образом — Т3N1М0 или Т1N0М0 и т.д.
На основе классификации TNM, злокачественные опухоли разделяются по стадиям. Локализованный первичный очаг, который не выходит за пределы органа и имеет небольшие размеры, соответствует первой стадии. Если опухоль прорастает в прилегающие органы или имеет отдаленные метастазы, то выставляется четвертая стадия.
Методы диагностики
Для современной онкологии продолжает оставаться актуальной проблема своевременного выявления опухолей, в первую очередь — злокачественных. На начальных стадиях новообразования никак не проявляют себя. Первые признаки отмечаются по мере роста опухоли и нарушения функций тех или иных органов. В таких случаях пациенты жалуются на боль, дискомфорт, слабость и другие неспецифические симптомы, которые зависят от точной локализации новообразования.
Если опухоль расположена поверхностно, например, в тканях молочной железы, то она может прощупываться. Эта особенность немного облегчает диагностику, но для того, чтобы понять истинную природу опухоли, необходимо пройти комплексное обследование. Оно включает в себя различные методы визуализации, которые помогают обнаружить первичный очаг: КТ, МРТ, УЗИ, эндоскопию, рентген.
На следующем этапе перед врачом стоит задача определить вид новообразования, степень дифференцировки клеток и другие важные особенности. Ответить на эти вопросы может биопсия — золотой стандарт диагностики опухолей. Как правило, без биопсии в онкологии невозможно поставить точный диагноз и подобрать лечение.
Ответить на эти вопросы может биопсия — золотой стандарт диагностики опухолей. Как правило, без биопсии в онкологии невозможно поставить точный диагноз и подобрать лечение.
Дополнительно для оценки общего состояния пациента или для определения чувствительности к тому или иному лекарственному препарату назначаются лабораторные и молекулярно-генетические методы исследований. Точная программа диагностики всегда подбирается индивидуально.
Лечение опухолей
Вторая актуальная проблема онкологии — эффективное лечение новообразований. Если доброкачественную опухоль можно удалить хирургическим путем относительно просто, то при злокачественном процессе сделать это удается не всегда. Из-за отсутствия выраженных симптомов, прорастания опухоли в соседние органы и жизненно важные сосуды и склонности к метастазированию, многие пациенты остаются неоперабельными. В таких ситуациях применяется консервативное лечение, в которое входят такие методы, как химиотерапия, лучевая терапия, таргетная терапия, иммунотерапия и др. Однако в этом случае шансы пациента на полное выздоровление снижаются. Если опухоль распространилась за пределы органа, то консервативная терапия в большинстве случаев поможет отсрочить рецидив и увеличить продолжительность жизни пациента.
Однако в этом случае шансы пациента на полное выздоровление снижаются. Если опухоль распространилась за пределы органа, то консервативная терапия в большинстве случаев поможет отсрочить рецидив и увеличить продолжительность жизни пациента.
Максимально эффективное лечение возможно при обнаружении опухоли на самой ранней стадии, после удаления первичного очага хирургическим путем, после чего при некоторых заболеваниях возможно применение методов консервативного лечения.
В настоящее время все силы врачей и ученых брошены на решение двух актуальных проблем. С одной стороны, разрабатываются методы раннего выявления рака, а с другой — новые и эффективные способы лечения.
Метастатический рак печени – вторичная опухоль печени, возникшая в результате распространения злокачественных клеток из первичного очага, расположенного в другом органе. Сопровождается неспецифическими симптомами онкологического заболевания (гипертермией, потерей веса и аппетита), увеличением печени и ее болезненностью при пальпации. На поздних стадиях печень становится бугристой, возникают асцит, прогрессирующая желтуха и печеночная энцефалопатия. Диагноз выставляют с учетом анамнеза, клинической симптоматики, результатов лабораторных и инструментальных исследований. Лечение – химиотерапия, эмболизация, радиочастотная абляция, хирургическое вмешательство.
На поздних стадиях печень становится бугристой, возникают асцит, прогрессирующая желтуха и печеночная энцефалопатия. Диагноз выставляют с учетом анамнеза, клинической симптоматики, результатов лабораторных и инструментальных исследований. Лечение – химиотерапия, эмболизация, радиочастотная абляция, хирургическое вмешательство.
МКБ-10
Общие сведения
Метастатический рак печени – самое распространенное метастатическое поражение при онкологических заболеваниях. Наблюдается примерно у 1/3 больных злокачественными опухолями различной локализации. Выявляется у каждого второго пациента, страдающего раком желудка, раком толстого кишечника, раком легких и раком молочной железы. На начальных стадиях протекает бессимптомно, что затрудняет своевременную диагностику, особенно при одновременном скрытом течении первичной опухоли.
До недавнего времени метастатический рак печени считался неоперабельным вне зависимости от вида, размера, локализации и количества вторичных очагов, однако в наши дни эта точка зрения постепенно подвергается пересмотру. Лечение осуществляют специалисты в области онкологии, гастроэнтерологии и абдоминальной хирургии.
Лечение осуществляют специалисты в области онкологии, гастроэнтерологии и абдоминальной хирургии.
Причины метастазов в печень
Метастатический рак печени особенно часто возникает при висцеральных новообразованиях, поскольку кровь от органов брюшной полости поступает в печень через систему воротной вены. Является распространенным осложнением рака желудка, рака поджелудочной железы, рака желчного пузыря и рака прямой кишки. Вместе с тем, злокачественные клетки могут попадать в печень и из органов, не дренируемых системой воротной вены. Метастатический рак печени часто возникает при раке легких, меланоме и раке молочной железы, нередко диагностируются при раке яичников, раке простаты и опухолях почки.
К числу злокачественных новообразований, редко метастазирующих в печень, относятся рак мочевого пузыря, рак глотки, рак полости рта и рак кожи. В ряде случаев метастатический рак печени бывает трудно отличить от первичной опухоли органа. Заподозрить вторичное поражение в подобных случаях можно по раннему появлению асцита, обусловленного обсеменением брюшной полости злокачественными клетками. Больные с вторичным новообразованием в печени нередко погибают от ракового перитонита, не успевая дожить до значительного увеличения органа.
Больные с вторичным новообразованием в печени нередко погибают от ракового перитонита, не успевая дожить до значительного увеличения органа.
Патанатомия
При метастатическом раке печени преобладают узловые формы. Очаги могут быть как одиночными, так и множественными, локализуются в центре печени или на ее поверхности. Диаметр метастазов колеблется от нескольких миллиметров до нескольких сантиметров. При множественных очагах метастатического рака печени может выявляться так называемая «каштановая» печень – орган, покрытый многочисленными новообразованиями, напоминающими лесные орехи. Иногда вторичные опухоли развиваются преимущественно в центре органа, не выявляются при пальпации и становятся видны только на разрезе.
Гистологическая структура метастатического рака печени обычно соответствует структуре первичного очага. Большинство метастазов представляют собой белесоватые узлы округлой либо неправильной формы. При первичном раке яичников в печени обычно выявляются множественные светлые очаги мягкой консистенции с четкими контурами. При светлоклеточном раке почки консистенция узлов метастатического рака печени практически не отличается от консистенции нормальной ткани органа. Узлы светло-коричневые, контуры четкие. При первичных эндокринных новообразованиях цвет метастазов – от беловатого или желтоватого до темно-коричневого. Консистенция – немного плотнее ткани печени. Как и в других случаях, метастазы имеют четкие контуры.
При светлоклеточном раке почки консистенция узлов метастатического рака печени практически не отличается от консистенции нормальной ткани органа. Узлы светло-коричневые, контуры четкие. При первичных эндокринных новообразованиях цвет метастазов – от беловатого или желтоватого до темно-коричневого. Консистенция – немного плотнее ткани печени. Как и в других случаях, метастазы имеют четкие контуры.
Реже выявляется несоответствие патологоанатомических характеристик первичной опухоли и метастатического рака печени, обусловленное различиями в степени дифференцировки злокачественных клеток. Иногда гистологическая дифференцировка первичного и метастатического очага представляет собой сложную задачу из-за сходства структуры первичного процесса в печени и опухолей внепеченочной локализации. Подобная проблема может возникать, например, при различении метастазов аденокарциномы пищеварительного тракта и холангиоцеллюлярного рака печени, имеющих похожее строение.
Симптомы метастазов в печень
На ранних стадиях метастатический рак печени протекает бессимптомно. У пациентов могут выявляться общие признаки онкологического заболевания: слабость, повышенная утомляемость, повышение температуры тела, снижение аппетита и потеря веса. При пальпации определяется некоторое увеличение печени. Печень плотная, иногда болезненная. В отдельных случаях при аускультации выявляются шумы. Возможно увеличение селезенки.
У пациентов могут выявляться общие признаки онкологического заболевания: слабость, повышенная утомляемость, повышение температуры тела, снижение аппетита и потеря веса. При пальпации определяется некоторое увеличение печени. Печень плотная, иногда болезненная. В отдельных случаях при аускультации выявляются шумы. Возможно увеличение селезенки.
Желтуха обычно отсутствует или слабо выражена за исключением метастатического рака печени, расположенного поблизости от желчных путей. Выявляется увеличение уровня лактатдегидрогеназы и щелочной фосфатазы. Нередко возникает ранний асцит, обусловленный одновременным обсеменением брюшины. На поздних стадиях метастатического рака печени наблюдаются выраженное увеличение органа, нарастающая желтуха и печеночная энцефалопатия. Многие больные не успевают дожить до этих симптомов. Причиной гибели становится раковый перитонит, обусловленный множественными метастазами в брюшной полости.
Диагностика
Диагноз устанавливается на основании анамнеза (наличие онкологического заболевания), жалоб, данных объективного осмотра, результатов инструментальных и лабораторных исследований. Пациентов с подозрением на метастатический рак печени направляют на УЗИ и КТ. В большинстве случаев данные методики достаточно результативны, однако при мелких метастазах и изменениях печени, вызванных доброкачественными опухолями и хроническими заболеваниями неопухолевой природы, возможны диагностические затруднения.
Пациентов с подозрением на метастатический рак печени направляют на УЗИ и КТ. В большинстве случаев данные методики достаточно результативны, однако при мелких метастазах и изменениях печени, вызванных доброкачественными опухолями и хроническими заболеваниями неопухолевой природы, возможны диагностические затруднения.
Для оценки печеночных функций назначают биохимический анализ крови. В сомнительных случаях метастатический рак печени подтверждают на основании результатов биопсии печени. Для повышения точности диагностики биопсия может выполняться под контролем УЗИ или в процессе лапароскопии.
Кроме того, больного метастатическим раком печени направляют на УЗИ органов брюшной полости, рентгенографию грудной клетки, КТ головного мозга и другие исследования для выявления вторичных новообразований в других органах. Если метастазы в печень обнаружены при первичном обращении, а основное онкологическое заболевание протекает бессимптомно, назначают расширенное обследование.
КТ ОБП С+. Множественные гиподенсные/гиповаскулярные вторичные очаги в печени с тонким гиперваскулярным ободком по периферии у пациента с первичной опухолью толстой кишки.
Множественные гиподенсные/гиповаскулярные вторичные очаги в печени с тонким гиперваскулярным ободком по периферии у пациента с первичной опухолью толстой кишки.
Лечение метастатического рака печени
Хирургические методы
Долгое время метастатический рак печени рассматривался как свидетельство близкого летального исхода. Из-за особенностей строения и васкуляризации органа проведение хирургических вмешательств было сопряжено с высоким операционным риском, поэтому резекции печени в первой половине ХХ века проводились очень редко. Совершенствование хирургических методик и появление новых способов лечения позволило изменить подход к терапии метастатического рака печени, хотя проблема увеличения продолжительности жизни при данной патологии по-прежнему остается крайне актуальной.
Наилучшие отдаленные результаты оперативного лечения наблюдаются у пациентов с раком толстой кишки. К сожалению, всего около 10% метастатического рака печени являются операбельными на момент постановки диагноза. В остальных случаях операции не показаны из-за слишком крупной опухоли, близости новообразования к крупным сосудам, большого количества очагов в печени, наличия метастазов внепеченочной локализации или тяжелого состояния больного.
В остальных случаях операции не показаны из-за слишком крупной опухоли, близости новообразования к крупным сосудам, большого количества очагов в печени, наличия метастазов внепеченочной локализации или тяжелого состояния больного.
В последние годы список показаний к хирургическому вмешательству при метастатическом раке печени расширился. Иногда онкологи рекомендуют резекцию при наличии метастазов не только в печени, но и в легких. Операцию выполняют в два этапа: вначале убирают очаг в печени, затем – в легком. Статистические данные об изменении продолжительности жизни при подобных вмешательствах пока отсутствуют.
Противоопухолевая терапия
При неоперабельном метастатическом раке печени показана химиотерапия. Пациентам назначают 5-фторурацил (иногда – в сочетании с кальция фолинатом), оксалиплатин. Средняя продолжительность жизни после медикаментозного лечения колеблется от 15 до 22 месяцев.
В некоторых случаях химиотерапия позволяет уменьшить рост опухоли и провести хирургическое вмешательство при метастатическом раке печени, который до начала лечения рассматривался, как неоперабельный. Резекция становится возможной примерно у 15% пациентов. Средняя продолжительность жизни – такая же, как при изначально операбельных опухолях. Во всех случаях после удаления метастатического рака печени в отдаленные сроки возможно появление новых вторичных очагов в различных органах. При операбельных печеночных метастазах проводят повторную резекцию. При метастатическом поражении других органов назначают химиотерапию.
Резекция становится возможной примерно у 15% пациентов. Средняя продолжительность жизни – такая же, как при изначально операбельных опухолях. Во всех случаях после удаления метастатического рака печени в отдаленные сроки возможно появление новых вторичных очагов в различных органах. При операбельных печеночных метастазах проводят повторную резекцию. При метастатическом поражении других органов назначают химиотерапию.
Малоинвазивные методы
Наряду с классическими оперативными вмешательствами и химиотерапией, при метастатическом раке печени применяют эмболизацию печеночной артерии и воротной вены, радиоабляцию, криодеструкцию и введение этилового спирта в область новообразования. В результате эмболизации питание опухоли нарушается, в тканях возникают некротические изменения. Одновременное введение химиопрепаратов через катетер позволяет создать очень высокую концентрацию лекарственных веществ в ткани новообразования, что еще больше увеличивает эффективность методики. Химиоэмболизация может применяться в качестве самостоятельного метода лечения метастатического рака печени или использоваться на этапе подготовки больного к резекции органа.
Целью радиочастотной абляции, криодеструкции и введения этилового спирта также является разрушение ткани опухоли. Специалисты отмечают перспективность этих методик, но не сообщают статистические данные об изменении выживаемости после их применения, поэтому оценить отдаленные результаты пока затруднительно.
Прогноз
Резекция одиночного метастаза размером до 5 см позволяет увеличить среднюю пятилетнюю выживаемость больных раком прямой кишки до 30-40%. При множественном поражении прогноз после оперативного лечения метастатического рака печени менее благоприятный, однако, при удалении всех очагов удается достичь средней трехлетней выживаемости 30%. Смертность в послеоперационном периоде составляет 3-6%. При первичных злокачественных опухолях других локализаций за исключением рака прямой кишки (раке легких, раке молочной железы и т. д.) прогноз после резекций печеночных метастазов менее оптимистичный.
Смертность больных с метастатическим раком печени при использовании малоинвазивных методов составляет около 0,8%. В запущенных случаях, когда проведение оперативного лечения, химиотерапии, эмболизации, радиоабляции или криодеструкции невозможно из-за тяжелого состояния пациента, назначают симптоматические средства, позволяющие смягчить проявления заболевания. Продолжительность жизни при метастатическом раке печени в подобных случаях обычно не превышает нескольких недель или месяцев.
В запущенных случаях, когда проведение оперативного лечения, химиотерапии, эмболизации, радиоабляции или криодеструкции невозможно из-за тяжелого состояния пациента, назначают симптоматические средства, позволяющие смягчить проявления заболевания. Продолжительность жизни при метастатическом раке печени в подобных случаях обычно не превышает нескольких недель или месяцев.
Многие пациенты совершенно однозначно интерпретируют термины «рак», «онкология», «злокачественное новообразование». Однако нужно понимать, что это не одна болезнь, а скорее целый класс заболеваний, имеющих между собой как сходства, так и значительные отличия.
Рак — это злокачественная опухоль, при которой происходит бесконтрольное размножение клеток, сопровождающееся инвазией в подлежащие ткани и метастазированием в отдаленные органы с током лимфы и/или крови. В народе раком называют любую злокачественную опухоль, но ученые сюда относят только карциномы — опухоли, произрастающие из эпителиальных тканей. Злокачественные новообразования из других тканей называют саркомами, злокачественные новообразования лимфатической системы называют лимфомами, а кроветворной — лейкозами.
Злокачественные новообразования из других тканей называют саркомами, злокачественные новообразования лимфатической системы называют лимфомами, а кроветворной — лейкозами.
Зачастую онкология воспринимается пациентами, как смертный приговор. Однако в реальности далеко не все злокачественные опухоли приводят к гибели человека. Более половины всех пациентов благополучно излечиваются и люди забывают о перенесенном заболевании навсегда.
Несмотря на значительные успехи в лечении онкологии, все же данная патология характеризуется достаточно высоким уровнем летальности и, безусловно, для успешного лечения требует к себе самого пристального внимания со стороны высококвалифицированных докторов.
Механизм возникновения рака
В основе онкологического заболевания лежит нарушение процессов регуляции тканевого роста.
Клетки нашего организма постоянно обновляются. В процессе их деления всегда существует вероятность возникновения ошибок в генах (мутации). Это происходит и в норме, но их частота значительно возрастает при воздействии на организм таких неблагоприятных факторов, как канцерогенные вещества, ионизирующее излучение и др.
Для предупреждения и исправления мутаций существуют различные механизмы. Если они не срабатывают, клетка с поврежденной ДНК развивается и многократно делится, не подчиняясь контролирующим системам организма. В итоге формируется образование, которое принято называть термином «злокачественная опухоль».
Злокачественные опухоли характеризуются тремя ключевыми отличиями от доброкачественных:
- Неконтролируемый бесконечный рост.
- Прорастание (инвазия) в соседние ткани и органы с нарушением их функционирования.
- Способность к метастазированию — процессу миграции раковых клеток с током крови или лимфы в другие части тела
Именно данные характеристики определяют агрессивность процесса и его злокачественность.
Опухоль может состоять из плотной ткани и тогда говорят о солидном образовании. Однако она может иметь и жидкую консистенцию, как при лейкозах и лимфомах.
Трудности в лечении рака
Онкологическое заболевание может возникнуть у любого живого организма в любом возрасте. Однако данный риск увеличивается с возрастом. Считается, что более 64% случаев заболевания выявляются у людей старше 65 лет. Тем не менее, в настоящее время онкологи говорят об омоложении таких пациентов. Все чаще болезнь диагностируется в возрасте до 40 лет.
Однако данный риск увеличивается с возрастом. Считается, что более 64% случаев заболевания выявляются у людей старше 65 лет. Тем не менее, в настоящее время онкологи говорят об омоложении таких пациентов. Все чаще болезнь диагностируется в возрасте до 40 лет.
Существуют две основные проблемы в лечении данной патологии:
- Распространенность опухолевого процесса, что ограничивает возможности радикального хирургического лечения.
- Гетерогенность клеточного состава опухоли. Можно подобрать препараты, которые убьют 99% опухолевых клеток, но если хотя бы несколько из них уцелеют, то они снова будут делиться, и разовьется рецидив
заболевания.
Причины появления рака
Причины онкологических заболеваний очень разнообразны, но все они приводят
к тому, что в клетках организма возникает мутация, которая приводит к их
бесконтрольному размножению. Спровоцировать образование и размножение
таких клеток могут следующие факторы:
Неправильное питание
Оно является одной из главных причин возникновения рака. И здесь есть несколько аспектов. Во-первых, во многих продуктах, которые люди употребляют ежедневно, содержится определенное количество пищевых канцерогенов. К таким продуктам относят копчености, маринады и другие консервированные и жареные блюда, овощи и фрукты, выращенные с применением химических удобрений и пестицидов и др. Во-вторых, имеет значение сбалансированность питания. Например, есть данные, что избыток мяса в рационе приводит к увеличению риска развития колоректального рака, в то же время большое количество растительных волокон и клетчатки снижает эти риски. Несбалансированное питание может привести к развитию ожирения, которое является фактором риска таких злокачественных новообразований как рак поджелудочной железы.
И здесь есть несколько аспектов. Во-первых, во многих продуктах, которые люди употребляют ежедневно, содержится определенное количество пищевых канцерогенов. К таким продуктам относят копчености, маринады и другие консервированные и жареные блюда, овощи и фрукты, выращенные с применением химических удобрений и пестицидов и др. Во-вторых, имеет значение сбалансированность питания. Например, есть данные, что избыток мяса в рационе приводит к увеличению риска развития колоректального рака, в то же время большое количество растительных волокон и клетчатки снижает эти риски. Несбалансированное питание может привести к развитию ожирения, которое является фактором риска таких злокачественных новообразований как рак поджелудочной железы.
Старение
В подавляющем большинстве случаев злокачественные опухоли возникают у людей старше 50 лет. Это связывают с накоплением действия факторов риска и ослаблением механизмов защиты и уничтожения мутировавших клеток.
Наследственность
Когда говорят о наследственных причинах онкологии, имеют ввиду два аспекта — генетическую предрасположенность и наследственные формы злокачественных новообразований. В целом вероятность заболеть той или иной формой рака в течение жизни составляет 5-10%. Однако при наличии в семье случаев злокачественных новообразований, эта вероятность увеличивается более, чем в два раза. Это называется генетической предрасположенностью. Помимо этого, есть наследственные формы рака, при которых имеются мутации в определенных генах. В качестве примера можно привести мутации в генах BRCA, при наличии которых вероятность развития рака молочной железы или яичников составляет около 80%.
В целом вероятность заболеть той или иной формой рака в течение жизни составляет 5-10%. Однако при наличии в семье случаев злокачественных новообразований, эта вероятность увеличивается более, чем в два раза. Это называется генетической предрасположенностью. Помимо этого, есть наследственные формы рака, при которых имеются мутации в определенных генах. В качестве примера можно привести мутации в генах BRCA, при наличии которых вероятность развития рака молочной железы или яичников составляет около 80%.
Вирусы
Вирус папилломы человека высокого онкогенного риска вызывает рак шейки матки. Вирусы гепатитов В и С увеличивают вероятность возникновения рака печени. Инфицирование вирусом Эпштейна-Барр может привести к развитию лимфомы, а Т-лимфотропный вирус может вызвать развитие лейкоза.
Вредные привычки и химическая зависимость
Курение, злоупотребление алкоголем и наркомания также являются серьезными причинами развития рака. Например, каждый пятый случай развития злокачественного новообразования связывают именно с курением. Причем речь идет не только о раке легких. Табачный дым увеличивает риск развития рака ЛОР-органов и органов пищеварительной системы, то же касается и алкоголя. Наркомания приводит к серьезным нарушениям обмена веществ и работы всех систем организма, в том числе и иммунной. На этом фоне развиваются неоплазии, характерные для иммунодефицитов — лимфомы, лейкозы, саркомы.
Причем речь идет не только о раке легких. Табачный дым увеличивает риск развития рака ЛОР-органов и органов пищеварительной системы, то же касается и алкоголя. Наркомания приводит к серьезным нарушениям обмена веществ и работы всех систем организма, в том числе и иммунной. На этом фоне развиваются неоплазии, характерные для иммунодефицитов — лимфомы, лейкозы, саркомы.
Ионизирующее излучение
Когда говорят об ионизирующем излучении как о причине развития онкологии на постсоветском пространстве, большинство людей имеет ввиду катастрофу на ЧАЭС. И с этим сложно спорить, поскольку после взрыва отмечалось увеличение случаев развития злокачественных неоплазий, в том числе лейкозов, лимфом и рака щитовидной железы. Однако, помимо этого, нельзя забывать об опасности воздействия солнечного излучения, которое может неблагоприятно воздействовать на кожу и органы зрения. Также увеличивает риск развития вторичных раковых опухолей прохождение лучевой терапии.
Предраковые заболевания
Некоторые виды рака развиваются на фоне имеющейся патологии. Например, колоректальный рак в большинстве случае происходит из аденоматозных кишечных полипов, рак эндометрия может происходить на фоне миом или эндометриоза, раку кожи могут предшествовать пигментный кератоз, лейкоплакия или кожный рог, раку легкого — некоторые профессиональные заболевания легких, раку шейки матки — воспалительные и диспластические процессы. Поэтому важно регулярно проходить скрининговое обследование для своевременного выявления предраковых заболеваний и их лечения.
Например, колоректальный рак в большинстве случае происходит из аденоматозных кишечных полипов, рак эндометрия может происходить на фоне миом или эндометриоза, раку кожи могут предшествовать пигментный кератоз, лейкоплакия или кожный рог, раку легкого — некоторые профессиональные заболевания легких, раку шейки матки — воспалительные и диспластические процессы. Поэтому важно регулярно проходить скрининговое обследование для своевременного выявления предраковых заболеваний и их лечения.
Неблагоприятная экологическая обстановка и воздействие промышленных и химических канцерогенов
Наиболее агрессивные канцерогены — это асбест, сажа, выхлопные газы автомобилей, некоторые виды продуктов переработки нефти.
Симультанные операции при синхронных метастазах колоректального рака в печени: анализ выживаемости и факторов негативного прогноза | Солодкий
1. Каприн А.Д., Старинский В.В., Петрова Г.В.. Злокачественные новообразования в России в 2017 году (заболеваемость и смертность). Москва: МНИОИ им. П.А. Герцена филиал ФГБУ «НМИЦ радиологии» Минздрава России. 2018. 250 с. ISBN 978-5-85502-243-8.
Москва: МНИОИ им. П.А. Герцена филиал ФГБУ «НМИЦ радиологии» Минздрава России. 2018. 250 с. ISBN 978-5-85502-243-8.
2. Kopetz S., Chang G.J., Overman M.J., Eng C., Sargent D.J., Larson D.W., Grothey A., Vauthey J.-N., Nagorney D.M., McWilliams R.R. Improved survival in metastatic colorectal cancer is associated with adoption of hepatic resection and improved chemotherapy. J Clin Oncol. 2009; 27:3677-83. DOI: 10.1200/JCO.2008.20.5278.
3. House M.G., Ito H., Gönen M., Fong Y., Allen P.J., DeMatteo R.P., Brennan M.F., Blumgart L.H., Jarnagin W.R., D’Angelica M.I. Survival after hepatic resection for metastatic colorectal cancer: trends in outcomes for 1,600 patients during two decades at a single institution. J Am Coll Surg. 2010; 210:744-52. DOI: 10.1016/j.jamcollsurg.2009.12.040.
4. Wei A.C., Greig P.D., Grant D., Taylor B., Langer B., Gallinger S. Survival after hepatic resection for colorectal metastases: a 10-year experience. Ann Surg Oncol. 2006; 13:668-676. DOI: 10. 1245/ASO.2006.05.039.
1245/ASO.2006.05.039.
5. Leal J.N., Bressan A.K., Vachharajani N., Gonen M., Kingham T.P., D’Angelica M.I., Allen P.J., DeMatteo R.P., Doyle M.B.M., Bathe O.F., Greig P.D., Wei A., Chapman W.C., Dixon E., Jarnagin W.R. Time-tosurgery and survival outcomes in resectable colorectal livermetastases: a multi-institutional evaluation. J Am Coll Surg. 2016. 222:766-79. DOI: 10.1016/j.jamcollsurg.2016.01.046.
6. Slupski M., Jasinski M., Pierscinski S., Wicinski M. Long-term results of simultaneous and delayed liver resections of synchronous colorectal cancer liver metastases. ANZ Journal of Surgery. 2020; 90 (6):1119-1124. DOI: 10.1111/ans.15740.
7. Valdimarsson V.T., Syk I., Lindell G., Sandstrom P., Isaksson B., Rizell M., Noren A., Ardnor B., Sturesson C. Outcomes of Simultaneous Resections and Classical Strategy for Synchronous Colorectal Liver Metastases in Sweden: A Nationwide Study with Special Reference to Major Liver Resections. World J Surg. 2020; 44:2409-2417. DOI: 10. 1007/s00268-020-05475-5.
1007/s00268-020-05475-5.
8. Abelson J.S., Michelassi F., Sun T., Mao J., Milsom J., Samstein B., Sedrakyan A., Yeo H.L. Simultaneous Resection for Synchronous Colorectal Liver Metastasis: the New Standard of Care? Journal of Gastrointestinal Surgery. 2016; 21:975-982. DOI: 10.1007/s11605-017-3422-1.
9. Fukami Y., Kaneoka Y., Maeda A., Takayama Y., Onoe S., Isogai M. Simultaneous resection for colorectal cancer and synchronous liver metastases. Surg Today. 2016; 46:176-182. DOI: 10.1007/s00595-015-1188-1.
10. Ахаладзе ГГ, Гребенкин ЕН, Чхиквадзе ВД, Станоевич УС, Гончаров СВ, Рагимов ВА, Колесников РВ, Абрамов АА. Симультанные лапароскопические резекции печени: опыт одного центра. Альманах клинической медицины. 2018; 46 (6):592–597. DOI: 10.18786/2072-0505-2018-46-6-592-597.
11. Luna-Perez P., Rodriguez-Coria D.F., Arroyo B., Gonzalez-Macouzet J. The natural history of liver metastases from colorectal cancer. Arch. Med. Res. 1998; 29:319–24.
12. Stangl R., Altendorf-Hofmann A. , Charnley R.M., Scheele J. Factors influencing the natural history of colorectal liver metastases. Lancet. 1994; 343:1405–10. DOI: 10.1016/s0140-6736(94)92529-1.
, Charnley R.M., Scheele J. Factors influencing the natural history of colorectal liver metastases. Lancet. 1994; 343:1405–10. DOI: 10.1016/s0140-6736(94)92529-1.
13. Ali S.M., Pawlik T.M., Rodriguez-Bigas M.A., Monson J.R.T., Chang G.J., Larson D.W. Timing of Surgical Resection for Curative Colorectal Cancer with Liver Metastasis. Ann Surg Oncol. 2018; 25:32-37. DOI: 10.1245/s10434-016-5745-7.
14. Silberhumer G.R, Paty P.B., Temple L.K., Araujo R.L.C., Dentond B., Gonen M., Nash G.M., Allen P.J., DeMatteo R.P., Guillem J., Weiser M.R., D’Angelica M.I., Jarnagin W.R., Wong W.D., Fong Y. Simultaneous resection for rectal cancer with synchronous liver metastasis is a safe procedure. Am. J. Surg. 2015; 209:935–42. DOI: 10.1016/j.amjsurg.2014.09.024.
15. Abbott D.E., Cantor S.B., Hu C.-Y., Aloia T.A., You Y.N., Nguyen S., Chang G.J. Optimizing clinical and economic outcomes of surgical therapy for patients with colorectal cancer and synchronous liver metastases. J. Am. Coll. Surg. 2012; 215:262–70. DOI: 10.1016/j.jamcollsurg.2012.03.021.
Surg. 2012; 215:262–70. DOI: 10.1016/j.jamcollsurg.2012.03.021.
16. Weber J.C., Bachellier P., Oussoultzoglou E., Jaeck D. Simultaneous resection of colorectal primary tumour and synchronous liver metastases. Br. J. Surg. 2003; 90:956–62. DOI: 10.1002/bjs.4132.
17. Chen J., Li Q., Wang C., Zhu H., Shi Y., Zhao G. Simultaneous vs. staged resection for synchronous colorectal liver metastases: a metaanalysis. Int. J. Colorectal Dis. 2011; 26:191–9. DOI: 10.1007/s00384-010-1018-2.
18. Allen P.J., Kemeny N., Jarnagin W., DeMatteo R., Blumgart L., Fong Y. Importance of response to neoadjuvant chemotherapy in patients undergoing resection of synchronous colorectal liver metastases. J Gastrointest Surg. 2003; 7:109-115. DOI: 10.1016/S1091-255X(02)00121-X.
19. Gallagher D.J., Zheng J., Capanu M., Haviland D., Paty P., Dematteo R.P., D’Angelica M., Fong Y., Jarnagin W.R., Allen P.J., Kemeny N. Response to neoadjuvant chemotherapy does not predict overall survival for patients with synchronous colorectal metastases. Ann Surg Oncol. 2009; 15:384-391. DOI: 10.1245/s10434-009-0348-1.
Ann Surg Oncol. 2009; 15:384-391. DOI: 10.1245/s10434-009-0348-1.
20. Mayo S.C., Pulitano C., Marques H., Lamelas J., Wolfgang C.L., Wassila de Saussure, Choti M.A., Gindrat I., Aldrighetti L., Barrosso E., Mentha G., Pawlik T.M. Surgical management of patients with synchronous colorectal liver metastasis: a multicenter international analysis. J Am Coll Surg. 2013; 216:707–716. DOI: 10.1016/j.jamcollsurg.2012.12.029.
21. Slesser A.A., Simillis C., Goldin R., Brown G., Mudan S., Tekkis P.P. A meta-analysis comparing simultaneous versus delayed resections in patients with synchronous colorectal liver metastases. Surg Oncol. 2013; 22:36–47. DOI: 10.1016/j.suronc.2012.11.002.
22. Snyder R.A., Hao S., Irish W., Zervos E.E., Tuttle-Newhall J.E., Parikh A.A. Thirty-Day Morbidity after Simultaneous Resection of Colorectal Cancer and Colorectal Liver Metastasis: American College of Surgeons NSQIP Analysis. Journal of the American College of Surgeons. 2020; 230 (4):617-627. DOI: 10. 1016/j.jamcollsurg.2019.12.018.
1016/j.jamcollsurg.2019.12.018.
Синхронный колоректальный рак: клинические, патологические и молекулярные последствия
1. Welch JP. Множественные колоректальные опухоли. Оценка естественной истории и терапевтических возможностей. Am J Surg. 1981; 142: 274–280. [PubMed] [Google Scholar]
2. Кайбара Н., Кога С., Джиннай Д. Синхронные и метахронные злокачественные новообразования толстой и прямой кишки в Японии с особой ссылкой на сосуществующий ранний рак. Рак. 1984; 54: 1870–1874. [PubMed] [Google Scholar]
3. Cunliffe WJ, Hasleton PS, Tweedle DE, Schofield PF. Заболеваемость синхронной и метахронной колоректальной карциномой. Бр Дж Сур. 1984;71:941–943. [PubMed] [Google Scholar]
4. Langevin JM, Nivatvongs S. Истинная заболеваемость синхронным раком толстой кишки. Перспективное исследование. Am J Surg. 1984; 147: 330–333. [PubMed] [Google Scholar]
5. Гринштейн А.Дж., Слейтер Г., Хейманн Т.М., Сахар Д.Б., Ауфсес А.Х. Сравнение множественного синхронного колоректального рака при язвенном колите, семейном полипозе толстой кишки и раке de novo. Энн Сург. 1986; 203: 123–128. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Энн Сург. 1986; 203: 123–128. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Finan PJ, Ritchie JK, Hawley PR. Синхронные и «ранние» метахронные карциномы толстой и прямой кишки. Бр Дж Сур. 1987;74:945–947. [PubMed] [Google Scholar]
7. Wagner HE, Barbier PA, Luder PJ, Niederhäuser U. Прогноз при синхронных колоректальных карциномах. Z Гастроэнтерол. 1988; 26: 117–120. [PubMed] [Google Scholar]
8. Evers BM, Mullins RJ, Matthews TH, Broghamer WL, Polk HC. Множественные аденокарциномы толстой и прямой кишки. Анализ инцидентов и современных тенденций. Расстройство прямой кишки. 1988; 31: 518–522. [PubMed] [Google Scholar]
9. Adloff M, Arnaud JP, Bergamaschi R, Schloegel M. Синхронная карцинома толстой и прямой кишки: прогностические и терапевтические последствия. Am J Surg. 1989;157:299–302. [PubMed] [Google Scholar]
10. Fegiz G, Ramacciato G, Indinnimeo M, Gozzo P, Valabrega S, De Angelis R, Barillari P. Синхронный рак толстой кишки: серия из 47 случаев. Ital J Surg Sci. 1989; 19: 23–28. [PubMed] [Google Scholar]
Ital J Surg Sci. 1989; 19: 23–28. [PubMed] [Google Scholar]
11. Greig JD, Miller DF. Синхронный и ранний метахронный рак толстой и прямой кишки. Акта Чир Сканд. 1989; 155: 287–289. [PubMed] [Google Scholar]
12. Eu KW, Seow-Choen F, Goh HS. Синхронный колоректальный рак в восточной популяции. Int J Colorectal Dis. 1993;8:193–196. [PubMed] [Google Scholar]
13. Kimura T, Iwagaki H, Fuchimoto S, Hizuta A, Orita K. Синхронные колоректальные карциномы. Гепатогастроэнтерология. 1994; 41: 409–412. [PubMed] [Google Scholar]
14. Hayakumo T, Cho E, Nakajima M, Kato G, Kawai K, Azuma T. Точечные мутации в гене c-K-ras 2 при множественных колоректальных карциномах. J Гастроэнтерол Гепатол. 1995; 10:70–75. [PubMed] [Google Scholar]
15. Fante R, Roncucci L, Di GregorioC MG, Losi L, Benatti P, Pedroni M, Percesepe A, De Pietri S, Ponz de Leon M. Частота и клинические особенности множественных опухолей толстой кишки в общей популяции и у пациентов с наследственной колоректальной карциномой. Рак. 1996;77:2013–2021. [PubMed] [Google Scholar]
Рак. 1996;77:2013–2021. [PubMed] [Google Scholar]
16. Passman MA, Pommier RF, Vetto JT. Синхронный первичный рак толстой кишки имеет тот же прогноз, что и одиночный рак толстой кишки. Расстройство прямой кишки. 1996; 39: 329–334. [PubMed] [Google Scholar]
17. Koness RJ, King TC, Schechter S, McLean SF, Lodowsky C, Wanebo HJ. Синхронные карциномы толстой кишки: молекулярно-генетические доказательства мультицентричности. Энн Сург Онкол. 1996; 3: 136–143. [PubMed] [Google Scholar]
18. Takeuchi H, Toda T, Nagasaki S, Kawano T, Minamisono Y, Maehara Y, Sugimachi K. Синхронные множественные колоректальные аденокарциномы. Дж. Хирург Онкол. 1997;64:304–307. [PubMed] [Google Scholar]
19. Bekdash B, Harris S, Broughton CI, Caffarey SM, Marks CG. Исход после множественных колоректальных опухолей. Бр Дж Сур. 1997; 84: 1442–1444. [PubMed] [Google Scholar]
20. Pedroni M, Tamassia MG, Percesepe A, Roncucci L, Benatti P, Lanza G, Gafà R, Di Gregorio C, Fante R, Losi L, et al. Микросателлитная нестабильность при множественных колоректальных опухолях. Инт Джей Рак. 1999;81:1–5. [PubMed] [Google Scholar]
Микросателлитная нестабильность при множественных колоректальных опухолях. Инт Джей Рак. 1999;81:1–5. [PubMed] [Google Scholar]
21. Box JC, Rodriguez-Bigas MA, Weber TK, Petrelli NJ. Клинические проявления множественных колоректальных карцином при наследственном неполипозном колоректальном раке. Расстройство прямой кишки. 1999;42:717–721. [PubMed] [Google Scholar]
22. Brueckl WM, Limmert T, Brabletz T, Guenther K, Jung A, Hermann K, Wiest GH, Kirchner T, Hohenberger W, Hahn EG, et al. Дефицит репарации несоответствия при спорадическом синхронном колоректальном раке. Противораковый Рез. 2000;20:4727–4732. [PubMed] [Google Scholar]
23. Eguchi K, Yao T, Konomoto T, Hayashi K, Fujishima M, Tsuneyoshi M. Несоответствие мутаций p53 синхронных колоректальных карцином. Мод Патол. 2000; 13: 131–139. [PubMed] [Академия Google]
24. Чен Х.С., Шин-Чен С.М. Синхронная и «ранняя» метахронная колоректальная аденокарцинома: анализ прогноза и современных тенденций. Расстройство прямой кишки. 2000;43:1093–1099. [PubMed] [Google Scholar]
2000;43:1093–1099. [PubMed] [Google Scholar]
25. Abe Y, Masuda H, Okubo R. Микросателлитная нестабильность каждой опухоли при спорадическом синхронном множественном колоректальном раке. Oncol Rep. 2001; 8: 299–304. [PubMed] [Google Scholar]
26. Chirila DN, Popp RA, Balacescu O, Turdeanu NA, Constantea NA, Pop TR, Vesa SC, Cuce C. Варианты гена GST при синхронном колоректальном раке и синхронная ассоциация колоректального рака с другими раки. Хирургия (Букур) 2013; 108: 365–371. [PubMed] [Академия Google]
27. Норри М.В., Хокинс Н.Дж., Тодд А.В., Мигер А.П., О’Коннор Т.В., Уорд Р.Л. Роль метилирования hMLh2 в развитии синхронных спорадических колоректальных карцином. Расстройство прямой кишки. 2002; 45: 674–680. [PubMed] [Google Scholar]
28. Oya M, Takahashi S, Okuyama T, Yamaguchi M, Ueda Y. Синхронная колоректальная карцинома: клинико-патологические особенности и прогноз. Jpn J Clin Oncol. 2003; 33:38–43. [PubMed] [Google Scholar]
29. Уэно М. , Муто Т., Оя М., Ота Х., Азекура К., Ямагучи Т. Множественный первичный рак: опыт в больнице Института рака с особым упором на колоректальный рак. Int J Clin Oncol. 2003; 8: 162–167. [PubMed] [Академия Google]
, Муто Т., Оя М., Ота Х., Азекура К., Ямагучи Т. Множественный первичный рак: опыт в больнице Института рака с особым упором на колоректальный рак. Int J Clin Oncol. 2003; 8: 162–167. [PubMed] [Академия Google]
30. Dykes SL, Qui H, Rothenberger DA, García-Aguilar J. Доказательства предпочтительного молекулярного пути у пациентов с синхронным колоректальным раком. Рак. 2003; 98: 48–54. [PubMed] [Google Scholar]
31. Wang HZ, Huang XF, Wang Y, Ji JF, Gu J. Клинические особенности, диагностика, лечение и прогноз множественной первичной колоректальной карциномы. Мир J Гастроэнтерол. 2004; 10: 2136–2139. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Николоудис Н., Салиангас К., Эконому А., Андреадис Э., Симиноу С., Манна И., Георгакис К., Хриссидис Т. Синхронный колоректальный рак. Тех. Колопрокт. 2004;8 Приложение 1:s177–s179. [PubMed] [Google Scholar]
33. Пападопулос В., Михалопулос А., Басданис Г., Папаполихрониадис К., Парамитиотис Д., Фотиадис П. , Беровалис П., Харлафтис Н. Синхронная и метахронная колоректальная карцинома. Тех. Колопрокт. 2004;8 Приложение 1:с97–с100. [PubMed] [Google Scholar]
, Беровалис П., Харлафтис Н. Синхронная и метахронная колоректальная карцинома. Тех. Колопрокт. 2004;8 Приложение 1:с97–с100. [PubMed] [Google Scholar]
34. Икеда Ю., Саку М., Каванака Х., Муранака Т., Такешита М., Ватанабе Дж., Йошида К., Сугимати К. Распространение синхронного и метахронного множественного колоректального рака. Гепатогастроэнтерология. 2004; 51: 443–446. [PubMed] [Академия Google]
35. Piñol V, Andreu M, Castells A, Payá A, Bessa X, Jover R. Синхронные колоректальные новообразования у пациентов с колоректальным раком: предрасполагающие индивидуальные и семейные факторы. Расстройство прямой кишки. 2004;47:1192–1200. [PubMed] [Google Scholar]
36. Velayos FS, Lee SH, Qiu H, Dykes S, Yiu R, Terdiman JP, Garcia-Aguilar J. Механизм микросателлитной нестабильности различен при синхронном и метахронном колоректальном раке. J Gastrointest Surg. 2005; 9: 329–335. [PubMed] [Академия Google]
37. Fukatsu H, Kato J, Nasu JI, Kawamoto H, Okada H, Yamamoto H, Sakaguchi K, Shiratori Y. Клинические характеристики синхронного колоректального рака различаются в зависимости от локализации опухоли. Копать печень Dis. 2007; 39:40–46. [PubMed] [Google Scholar]
Клинические характеристики синхронного колоректального рака различаются в зависимости от локализации опухоли. Копать печень Dis. 2007; 39:40–46. [PubMed] [Google Scholar]
38. Latournerie M, Jooste V, Cottet V, Lepage C, Faivre J, Bouvier AM. Эпидемиология и прогноз синхронного колоректального рака. Бр Дж Сур. 2008;95:1528–1533. [PubMed] [Google Scholar]
39. Цирис Н., Докмециоглу Дж., Яннулис К., Кесисоглу И., Сапалидис К., Котидис Э., Гамброс О. Синхронные и метахронные аденокарциномы толстой кишки. Гиппократия. 2008; 12: 150–152. [Бесплатная статья PMC] [PubMed] [Google Scholar]
40. Yalcinkaya U, Ozturk E, Ozgur T, Yerci O, Yilmazlar T. Экспрессия P53 при синхронном колоректальном раке. Saudi Med J. 2008; 29: 826–831. [PubMed] [Google Scholar]
41. Aslanian HR, Burgart LJ, Harrington JJ, Mahoney DW, Zinsmeister AR, Thibodeau SN, Ahlquist DA. Измененная экспрессия восстановления несоответствия ДНК при синхронном и метахронном колоректальном раке. Клин Гастроэнтерол Гепатол. 2008; 6: 1385–1388. [PubMed] [Google Scholar]
2008; 6: 1385–1388. [PubMed] [Google Scholar]
42. Konishi K, Shen L, Jelinek J, Watanabe Y, Ahmed S, Kaneko K, Kogo M, Takano T, Imawari M, Hamilton SR, et al. Конкордантное метилирование ДНК при синхронных колоректальных карциномах. Рак Предыдущий Res (Фила) 2009;2:814–822. [Бесплатная статья PMC] [PubMed] [Google Scholar]
43. Ношо К., Куре С., Ирахара Н., Сима К., Баба И., Шпигельман Д., Мейерхардт Дж. А., Джованнуччи Э. Л., Фукс К. С., Огино С. Проспективное когортное исследование показывает уникальные эпигенетические, генетические и прогностические особенности синхронного колоректального рака. Гастроэнтерология. 2009;137:1609–20.e1-3. [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Gonzalo V, Lozano JJ, Muñoz J, Balaguer F, Pellisé M, Rodríguez de Miguel C, Andreu M, Jover R, Llor X, Giráldez MD и др. . Аберрантное метилирование промотора гена, связанное со спорадическим множественным колоректальным раком. ПЛОС Один. 2010;5:e8777. [Бесплатная статья PMC] [PubMed] [Google Scholar]
45.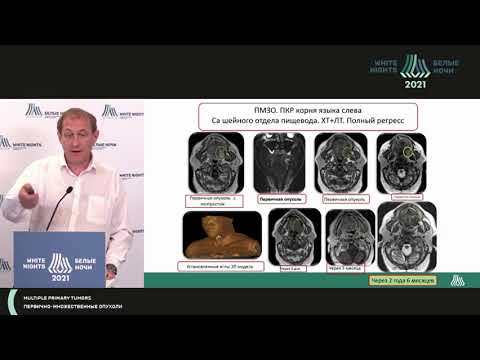 Киран Р.П., Хури В., Черч Дж.М., Лавери И.С., Фацио В.В., Ремзи Ф.Х. Колоректальный рак, осложняющий воспалительное заболевание кишечника: сходства и различия между болезнью Крона и язвенным колитом, основанные на трехдесятилетнем опыте. Энн Сург. 2010; 252:330–335. [PubMed] [Google Scholar]
Киран Р.П., Хури В., Черч Дж.М., Лавери И.С., Фацио В.В., Ремзи Ф.Х. Колоректальный рак, осложняющий воспалительное заболевание кишечника: сходства и различия между болезнью Крона и язвенным колитом, основанные на трехдесятилетнем опыте. Энн Сург. 2010; 252:330–335. [PubMed] [Google Scholar]
46. Lam AK, Carmichael R, Gertraud Buettner P, Gopalan V, Ho YH, Siu S. Клиникопатологическое значение синхронной карциномы при колоректальном раке. Am J Surg. 2011; 202:39–44. [PubMed] [Академия Google]
47. Mulder SA, Kranse R, Damhuis RA, de Wilt JH, Ouwendijk RJ, Kuipers EJ, van Leerdam ME. Распространенность и прогноз синхронного колоректального рака: голландское популяционное исследование. Эпидемиол рака. 2011; 35: 442–447. [PubMed] [Google Scholar]
48. Дервингер К., Густавссон Б. Исследование аспектов пола и прогноза при синхронном колоректальном раке. Clin Med Insights Oncol. 2011;5:259–264. [Бесплатная статья PMC] [PubMed] [Google Scholar]
49. Mohammadi M, Kristensen MH, Nielsen HJ, Bonde JH, Holck S. Характеристики сидячей зубчатой аденомы/полипа/поражения и ее пограничного варианта в контексте синхронного колоректального рака карцинома. Джей Клин Патол. 2012;65:924–927. [PubMed] [Google Scholar]
Характеристики сидячей зубчатой аденомы/полипа/поражения и ее пограничного варианта в контексте синхронного колоректального рака карцинома. Джей Клин Патол. 2012;65:924–927. [PubMed] [Google Scholar]
50. Bae JM, Cho NY, Kim TY, Kang GH. Клинико-патологические и молекулярные характеристики синхронного колоректального рака: неоднородность клинического исхода в зависимости от статуса микросателлитной нестабильности отдельных опухолей. Расстройство прямой кишки. 2012;55:181–190. [PubMed] [Google Scholar]
51. Liu X, Goldblum JR, Zhao Z, Landau M, Heald B, Pai R, Lin J. Отличительные клинико-гистологические особенности колоректальной аденокарциномы, связанной с воспалительным заболеванием кишечника: по сравнению со спорадической микросателлитной стабильная и связанная с синдромом Линча колоректальная аденокарцинома. Ам Дж. Сург Патол. 2012;36:1228–1233. [PubMed] [Академия Google]
52. Ху Х, Чанг Д.Т., Никифорова М.Н., Куан С.Ф., Пай Р.К. Клинико-патологические особенности синхронной колоректальной карциномы: отдельная подгруппа, возникающая из множественных сидячих зазубренных аденом и связанная с высоким уровнем микросателлитной нестабильности и благоприятным прогнозом. Ам Дж. Сург Патол. 2013; 37:1660–1670. [PubMed] [Google Scholar]
Ам Дж. Сург Патол. 2013; 37:1660–1670. [PubMed] [Google Scholar]
53. Şavlovschi C, Comandaşu M, Şerban D. Особенности диагностики и лечения синхронного колоректального рака (SCC) Chirurgia (Bucur) 2013; 108: 43–45. [PubMed] [Академия Google]
54. Ueda E, Watanabe T, Umetani N, Ishigami H, Sasaki S, Nagawa H. Микросателлитная нестабильность рака и сопутствующих аденом у пациентов с синхронным множественным колоректальным раком. J Exp Clin Cancer Res. 2002; 21: 149–154. [PubMed] [Google Scholar]
55. Lam AK, Gopalan V, Carmichael R, Buettner PG, Leung M, Smith R, Lu CT, Ho YH, Siu S. Метахронные карциномы толстой кишки и их клинико-патологическое значение. Int J Colorectal Dis. 2012; 27:1303–1310. [PubMed] [Академия Google]
56. Кинг-Инь Лам А., Онг К., Хо Ю.Х. Колоректальная муцинозная аденокарцинома: клинико-патологические особенности и значение экспрессии p16 и p53. Расстройство прямой кишки. 2006; 49: 1275–1283. [PubMed] [Google Scholar]
57. Пакнешан С. , Саладжеге А., Смит Р.А., Лам А.К. Клинико-патологическое значение мутаций BRAF при раке человека. Патология. 2013;45:346–356. [PubMed] [Google Scholar]
, Саладжеге А., Смит Р.А., Лам А.К. Клинико-патологическое значение мутаций BRAF при раке человека. Патология. 2013;45:346–356. [PubMed] [Google Scholar]
58. Pritchard CC, Grady WM. Молекулярная биология колоректального рака переходит в клиническую практику. Кишка. 2011;60:116–129. [Бесплатная статья PMC] [PubMed] [Google Scholar]
59. Огино С., Гоэль А. Молекулярная классификация и корреляты при колоректальном раке. J Мол Диагн. 2008; 10:13–27. [Бесплатная статья PMC] [PubMed] [Google Scholar]
60. Weekes J, Lam AK, Sebesan S, Ho YH. Терапия иринотеканом и молекулярные мишени при колоректальном раке: системный обзор. Мир J Гастроэнтерол. 2009;15:3597–3602. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Lam AK, Ong K, Ho YH. Экспрессия hTERT при колоректальной аденокарциноме: корреляция с экспрессией p21, p53 и клинико-патологическими особенностями. Int J Colorectal Dis. 2008; 23: 587–59.4. [PubMed] [Google Scholar]
62. Di Pietro G, Magno LA, Rios-Santos F.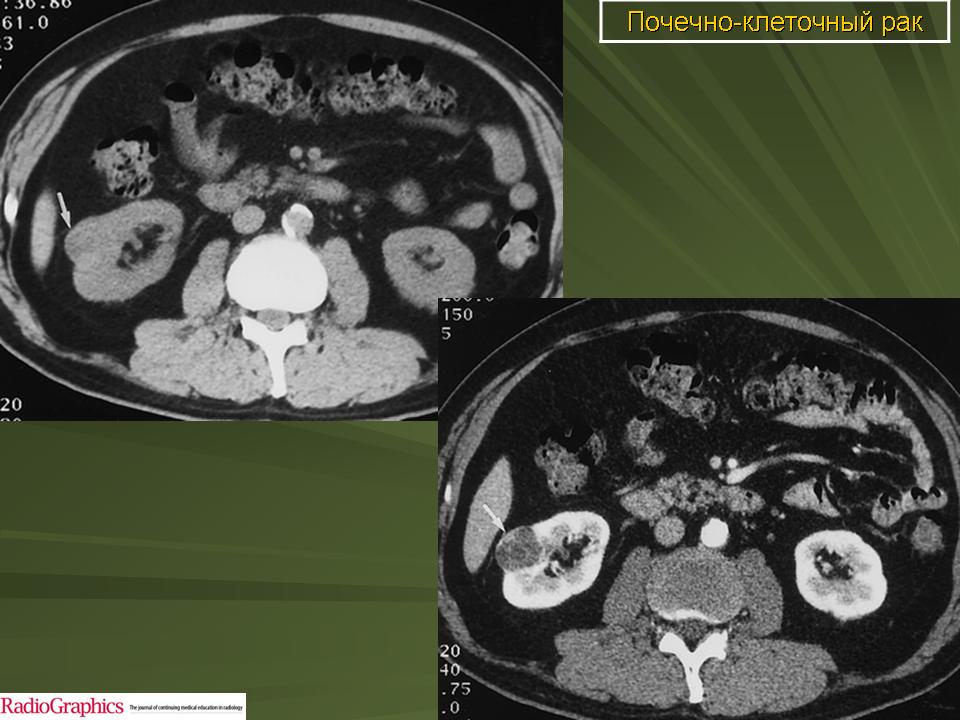 Глутатион-S-трансферазы: обзор исследований рака. Мнение эксперта Препарат Метаб Токсикол. 2010;6:153–170. [PubMed] [Google Scholar]
Глутатион-S-трансферазы: обзор исследований рака. Мнение эксперта Препарат Метаб Токсикол. 2010;6:153–170. [PubMed] [Google Scholar]
63. Park SH, Lee JH, Lee SS, Kim JC, Yu CS, Kim HC, Ye BD, Kim MJ, Kim AY, Ha HK. КТ-колонография для выявления и характеристики синхронных поражений проксимального отдела толстой кишки у больных стенозирующим колоректальным раком. Кишка. 2012;61:1716–1722. [PubMed] [Академия Google]
Синхронные и метахронные аденокарциномы толстой кишки
Гиппократия. июль-сентябрь 2008 г.; 12(3): 150–152.
N Tziris, J Dokmetzioglou, K Giannoulis, I Kesisoglou, K Sapalidis, E Kotidis и O Gambros
Информация об авторе Авторские права и информация о лицензии или более первичные аденокарциномы составляют от 3 до 5 % случаев колоректального рака. Целью данного исследования является обзор нашего опыта ведения пациентов с синхронными и метахронными поражениями и получение выводов об их оптимальной диагностике, лечении и последующем наблюдении.
Пациенты и методы: В период с 1987 по 2004 год было пролечено 12 пациентов (семь мужчин и пять женщин, средний возраст 67,5 лет, диапазон 47-83 лет) с синхронными (три пациента) и метахронными (девять пациентов) поражениями, включая 4,3% всех больных, оперированных по поводу колоректального рака. Лаг диагностики метахронных поражений колебался от 1,5 до 14 лет. У всех трех пациентов с синхронным раком было два поражения.
Результаты: Этапная колоноскопия и КТ брюшной полости были проведены 10 пациентам, а оставшимся двум пациентам была проведена только КТ брюшной полости в связи с их критическим состоянием при поступлении. Хирургическое вмешательство имело лечебную цель у 10 пациентов и паллиативную у двух. Среднее послеоперационное пребывание в стационаре составило 21 день (10–49 дней).дней). Послеоперационная летальность была нулевой. Выживаемость пациентов после лечебных процедур составила 80% на первом году, 60% на третьем и 50% на пятом году. После паллиативной хирургии выживаемость в первый год составила 50%, а в третий — ноль.
После паллиативной хирургии выживаемость в первый год составила 50%, а в третий — ноль.
Выводы: Пациенты с колоректальным раком должны регулярно наблюдаться после операции. Последующее наблюдение направлено на раннюю диагностику и лечение метахронных поражений, которые могут появиться через много лет после постановки диагноза первичного поражения. Предоперационная колоноскопия является бесценным диагностическим (биопсия) и стадирующим (исключение синхронных поражений, локализация первичного) методом, диктующим хирургическую тактику. Кроме того, он способствует профилактике рака, позволяя обнаруживать и удалять небольшие полипы до их трансформации.
Ключевые слова: колоректальный рак, синхронные карциномы, метахронные карциномы
Множественные первичные карциномы чаще встречаются в прямой и толстой кишке. Промежуток времени между первой и второй злокачественной трансформацией вариабелен. Две или более первичные карциномы могут сосуществовать на момент постановки диагноза (синхронно) или развиваться последовательно (метахронно), иногда спустя годы после резекции первой первичной карциномы.
Согласно Cunliffe et al 1 , синхронных аденокарцином может быть две или более, выявляемых либо до/интраоперационно, либо в 6-месячный период после операции. Они должны быть четко отделены друг от друга на расстоянии не менее 4 см и не должны состоять из подслизистого распространения или сателлитного поражения друг друга. В любом другом случае они рассматриваются как региональное распространение или метастатические поражения. Напротив, метахронные карциномы можно определить как карциномы, диагностированные через 6 месяцев после операции по поводу первичного поражения и расположенные в другой части толстой кишки, чтобы не возникало рецидива.
Хорошо известно, что наследственные синдромы колоректального рака, такие как семейный аденоматозный полипоз (САП) и воспалительное заболевание кишечника (язвенный колит — НЯК), предрасполагают к развитию множественных колоректальных карцином. Эти пациенты, а также пациенты с карциномой in situ были исключены из исследования. У всех обследованных больных. Факторы, способствующие развитию синхронных и метахронных поражений, исследованы у всех обследованных больных.
У всех обследованных больных. Факторы, способствующие развитию синхронных и метахронных поражений, исследованы у всех обследованных больных.
Двести восемьдесят больных, прооперированных по поводу колоректального рака за период 1987-2004 были изучены ретроспективно. У 268 пациентов (95,7%) был одиночный и у 12 (4,3%) множественный первичный рак (). Пациентов с синхронным или метахронным поражением составили семь мужчин (58,3%) и пять женщин (41,7%). Их средний возраст составлял 67,5 лет (от 47 до 83 лет). Опухоли были синхронными у трех пациентов (25%, двое мужчин и одна женщина) и метахронными у девяти (75%, пять мужчин и четыре женщины). Метахронные аденокарциномы были выявлены в сроки от 18 месяцев до 14 лет после иссечения первичного очага. Опухоли чаще локализовались в прямой кишке, затем в сигмовидной кишке (2).
Таблица 1.
Распределение опухолей по полу больных
Открыть в отдельном окне
Таблица 2.
Распределение опухолей по различным отделам толстой кишки
23 Открыть в отдельном окне window
У двух пациентов с синхронными карциномами диагноз был заподозрен при ирригоскопии и подтвержден колоноскопией и биопсией..png) У третьего пациента диагноз был поставлен интраоперационно, так как он был оперирован в экстренном порядке по поводу кишечной непроходимости и перфорации. Всем больным с метахронным поражением выполнялась клизма с барием. Обследование было диагностическим у всех пациентов; но у 8 из них диагноз был подтвержден при колоноскопии и биопсии. Колоноскопия помогла обнаружить и удалить аденоматозные полипы у трех пациентов (пациент с синхронным раком и двое с метахронным раком). Эти полипы были доброкачественными при гистологическом исследовании. КТ органов брюшной полости выполняли всем пациентам для стадирования.
У третьего пациента диагноз был поставлен интраоперационно, так как он был оперирован в экстренном порядке по поводу кишечной непроходимости и перфорации. Всем больным с метахронным поражением выполнялась клизма с барием. Обследование было диагностическим у всех пациентов; но у 8 из них диагноз был подтвержден при колоноскопии и биопсии. Колоноскопия помогла обнаружить и удалить аденоматозные полипы у трех пациентов (пациент с синхронным раком и двое с метахронным раком). Эти полипы были доброкачественными при гистологическом исследовании. КТ органов брюшной полости выполняли всем пациентам для стадирования.
Все пациенты оперированы. У трех пациентов с синхронными опухолями было два первичных очага, которые были удалены с помощью обширной колэктомии. Девяти пациентам с метахронным поражением выполнены последовательные операции по удалению опухоли. Операции были радикальными и признаны излечительными у 10 больных. Двум пациентам выполнена паллиативная резекция по поводу метастазов в печень (больной с метахронной карциномой) и локально-распространенного заболевания (больной с синхронными карциномами). У двух пациентов, перенесших лечебную операцию, были синхронные карциномы. При гистологическом исследовании очаги поражения по классификации Астлера-Коллера показали поражения стадии В2, в то время как остальные восемь пациентов относились к группе метахронной карциномы. В двух не удалось найти гистологические результаты первичных раков, потому что они были оперированы в другой больнице, а до постановки диагноза метахронного поражения прошло более 10 лет. Стадия опухоли (метахронных поражений) – В2 по классификации Астлера-Коллера. У остальных пациентов опухоли были стадий А, В1, В2 и С2 (классификация Астлера-Коллера, ).
У двух пациентов, перенесших лечебную операцию, были синхронные карциномы. При гистологическом исследовании очаги поражения по классификации Астлера-Коллера показали поражения стадии В2, в то время как остальные восемь пациентов относились к группе метахронной карциномы. В двух не удалось найти гистологические результаты первичных раков, потому что они были оперированы в другой больнице, а до постановки диагноза метахронного поражения прошло более 10 лет. Стадия опухоли (метахронных поражений) – В2 по классификации Астлера-Коллера. У остальных пациентов опухоли были стадий А, В1, В2 и С2 (классификация Астлера-Коллера, ).
Таблица 3.
Типы хирургических операций, выполненных
Open в отдельном окне
Таблица 4.
В этой серии наблюдений наблюдается более высокая частота множественных аденокарцином у пациентов мужского пола (41,7%). Только 10 пациентов имели адекватное послеоперационное наблюдение (от 6 мес до 15 лет). Два пациента с лечебно-целесообразными резекциями были потеряны для последующего наблюдения. Послеоперационная летальность была нулевой. Выживаемость после радикального удаления составила 80% через 1 год, 60% через 3 года и 50% через 5 лет. Пятьдесят процентов пациентов, перенесших паллиативные процедуры, выжили в течение 1 года, и ни один — в течение трех.
Два пациента с лечебно-целесообразными резекциями были потеряны для последующего наблюдения. Послеоперационная летальность была нулевой. Выживаемость после радикального удаления составила 80% через 1 год, 60% через 3 года и 50% через 5 лет. Пятьдесят процентов пациентов, перенесших паллиативные процедуры, выжили в течение 1 года, и ни один — в течение трех.
Множественные первичные аденокарциномы толстой кишки были впервые описаны Czerny в 1880 1 . Зарегистрированные показатели заболеваемости варьируются от 2 до 8% 2 – 5 . Фактический процент, вероятно, выше, учитывая тот факт, что не все опухоли обнаруживаются (диагностические трудности), а также потому, что некоторые пациенты подвергаются только паллиативным операциям. Частота множественных первичных аденокарцином в нашем исследовании составила 4,3%.
Предоперационная диагностика множественных синхронных колоректальных карцином остается сложной. Результаты по-прежнему неудовлетворительны, а второе местоположение часто упускается из виду, хотя имеющиеся методы значительно улучшились. Идентификация опухоли, которая оправдывает клинические симптомы, обычно приостанавливает дальнейшее исследование. Таким образом, необходима настойчивость в диагностическом подходе 4 , 6 , 7 .
Идентификация опухоли, которая оправдывает клинические симптомы, обычно приостанавливает дальнейшее исследование. Таким образом, необходима настойчивость в диагностическом подходе 4 , 6 , 7 .
Kaibara et al 4 сообщили о 60% частоте дооперационной диагностики с помощью двойного контрастного исследования с барием (DCBE) и/или колоноскопии, тогда как Takeuchi et al 8 сообщили, что использование обоих методов привело к общей дооперационной точности 77,8% . В нашей серии из трех пациентов с синхронной колоректальной карциномой двое были диагностированы до операции. У остального пациента синхронная опухоль была обнаружена интраоперационно (экстренная операция по поводу кишечной непроходимости).
Предрасположенность к множественным первичным колоректальным карциномам у пациентов с длительно текущим язвенным колитом (18%) и семейным аденоматозным полипозом (21%) 9 хорошо известна. Меньший риск оценивается для пациентов с семейным анамнезом колоректального рака 10 . Из нашего исследования были исключены три пациента с множественным колоректальным раком и САП. У одного из наших пациентов в семейном анамнезе был наследственный неполипозный колоректальный рак (HNPCC или синдром Линча), аутосомно-доминантное заболевание, характеризующееся развитием синхронного или метахронного колоректального рака, обычно в молодом возрасте. Связанный генетический дефект лежит в генах репарации несоответствия, ответственных за исправление несоответствия оснований ДНК. Сосуществование аденоматозных полипов также считается фактором риска развития метахронных поражений 8 , 11 – 13 . В нашем исследовании у трех из 12 пациентов с множественным первичным колоректальным раком были сосуществующие аденоматозные полипы.
Меньший риск оценивается для пациентов с семейным анамнезом колоректального рака 10 . Из нашего исследования были исключены три пациента с множественным колоректальным раком и САП. У одного из наших пациентов в семейном анамнезе был наследственный неполипозный колоректальный рак (HNPCC или синдром Линча), аутосомно-доминантное заболевание, характеризующееся развитием синхронного или метахронного колоректального рака, обычно в молодом возрасте. Связанный генетический дефект лежит в генах репарации несоответствия, ответственных за исправление несоответствия оснований ДНК. Сосуществование аденоматозных полипов также считается фактором риска развития метахронных поражений 8 , 11 – 13 . В нашем исследовании у трех из 12 пациентов с множественным первичным колоректальным раком были сосуществующие аденоматозные полипы.
Несколько линий доказательств указывают на то, что множественные карциномы толстой кишки чаще встречаются у восьмидесятилетних, тогда как первые первичные опухоли возникают у пациентов в возрасте от 60 до 70 лет 1 , 9 . В нашей серии одиночные карциномы были диагностированы у пожилых пациентов (в среднем 60,3 года), тогда как пациенты с множественными карциномами были моложе (в среднем 55,6 лет). Таким образом, детальное и точное предоперационное стадирование и интраоперационное обследование для выявления синхронных колоректальных карцином также необходимы у более молодых пациентов 14 .
В нашей серии одиночные карциномы были диагностированы у пожилых пациентов (в среднем 60,3 года), тогда как пациенты с множественными карциномами были моложе (в среднем 55,6 лет). Таким образом, детальное и точное предоперационное стадирование и интраоперационное обследование для выявления синхронных колоректальных карцином также необходимы у более молодых пациентов 14 .
Как видно из нашей серии, множественные первичные колоректальные карциномы, как и единичные, чаще локализуются в прямой и сигмовидной кишке 1 , 4 , 15 .
Тип первоначального хирургического вмешательства при множественных колоректальных карциномах остается спорным. Некоторые авторы предлагают радикальные операции, такие как тотальная колэктомия с илеоректальным анастомозом 16 , 17 , чтобы удалить сосуществующие синхронные опухоли и полипы, которые были неправильно диагностированы, чтобы предотвратить развитие метахронных опухолей в будущем. С другой стороны, другие 1 , 18 – 20 рекомендуют более консервативный подход для пожилых пациентов и радикальные процедуры для пациентов моложе 60 лет с регионарно ограниченным неметастатическим заболеванием, особенно для тех, кто с сопутствующими аденоматозными полипами. Мы согласны со вторым мнением, потому что пациенты с колоректальными карциномами обычно пожилые и характеризуются повышенной сопутствующей патологией, что делает их плохими кандидатами на серьезную операцию. Регулярное послеоперационное наблюдение за пациентами с колоректальным раком снизит риск метахронной карциномы. В соответствии с нашей серией несколько исследований не показали существенной разницы в выживаемости между множественным и одиночным колоректальным раком 4 , 6 .
С другой стороны, другие 1 , 18 – 20 рекомендуют более консервативный подход для пожилых пациентов и радикальные процедуры для пациентов моложе 60 лет с регионарно ограниченным неметастатическим заболеванием, особенно для тех, кто с сопутствующими аденоматозными полипами. Мы согласны со вторым мнением, потому что пациенты с колоректальными карциномами обычно пожилые и характеризуются повышенной сопутствующей патологией, что делает их плохими кандидатами на серьезную операцию. Регулярное послеоперационное наблюдение за пациентами с колоректальным раком снизит риск метахронной карциномы. В соответствии с нашей серией несколько исследований не показали существенной разницы в выживаемости между множественным и одиночным колоректальным раком 4 , 6 .
Ни одна операция по поводу колоректального рака не должна проводиться без тщательной оценки характеристик заболевания у каждого конкретного пациента, чтобы определить эффективную оперативную стратегию. Образец должен включать регионарные лимфатические узлы для лечения местного распространения и достаточную длину кишечника для предотвращения рецидива или последующего злокачественного изменения.
Образец должен включать регионарные лимфатические узлы для лечения местного распространения и достаточную длину кишечника для предотвращения рецидива или последующего злокачественного изменения.
1. Cunliffe WJ, Hasieton PS, Tweedie DE, Schofield PF. Заболеваемость синхронной и метахронной колоректальной карциномой. Бр Дж Сур. 1984;71:941–943. [PubMed] [Google Scholar]
2. Мертель Г.Г., Барген Дж.А., Докерти М.Б. Множественные карциномы толстой кишки: обзор литературы и изучение 261 случая. Гастроэнтерология. 1958; 34: 85–98. [PubMed] [Google Scholar]
3. Polk HC, Jr, Spratt JS, Jr, Butcher HR., Jr Частота множественных первичных злокачественных новообразований, связанных с колоректальной карциномой. Am J Surg. 1965; 109: 71–75. [PubMed] [Google Scholar]
4. Кайбара Н., Кога С., Джиннал Д. Синхронные и метахронные злокачественные новообразования толстой и прямой кишки в Японии с особой ссылкой на сосуществующий ранний рак. Рак. 1984;54:1870–1874. [PubMed] [Google Scholar]
5. Пападопулос В., Михалопулос А., Басданис Г. и соавт. Синхронный и метахронный колоректальный рак. Тех. Колопрокт. 2004; 8 (Прил. 1): с97–с100. [PubMed] [Google Scholar]
Пападопулос В., Михалопулос А., Басданис Г. и соавт. Синхронный и метахронный колоректальный рак. Тех. Колопрокт. 2004; 8 (Прил. 1): с97–с100. [PubMed] [Google Scholar]
6. Агрез М.В., Готовый Р., Ильструп Д., Беарт Р.В. Метахронные колоректальные злокачественные новообразования. Dis Colon Rec. 1982; 25: 569–574. [PubMed] [Google Scholar]
7. Кифер П.Дж., Торсон А.Г., Кристенсен М.А. Метахронный колоректальный рак. Интервал времени до проявления метахронного рака. Dis Colon Rect. 1986;29:378–382. [PubMed] [Google Scholar]
8. Takeuchi H, Toda T, Nagasaki S, et al. Синхронные множественные колоректальные аденомы. Дж. Хирург Онкол. 1997; 64: 304–307. [PubMed] [Google Scholar]
9. Greenstein AJ, Heimann TM, Sachar DB, Slater G, Aufsen AH ., Jr Сравнение множественного синхронного колоректального рака с язвенным колитом, знакомым полипозом толстой кишки и раком de novo. Энн Сург. 1986; 203: 123–128. [Бесплатная статья PMC] [PubMed] [Google Scholar]
10. Пиноль В., Андреу М., Кастельс А., Пайя А., Бесса Х., Джовер Р. Синхронные колоректальные новообразования у пациентов с колоректальным раком: предрасполагающие индивидуальные и семейные факторы. Расстройство прямой кишки. 2004;47:1192–1200. [PubMed] [Google Scholar]
Пиноль В., Андреу М., Кастельс А., Пайя А., Бесса Х., Джовер Р. Синхронные колоректальные новообразования у пациентов с колоректальным раком: предрасполагающие индивидуальные и семейные факторы. Расстройство прямой кишки. 2004;47:1192–1200. [PubMed] [Google Scholar]
11. Bussey HJR, Wallace MH, Morson BC. Метахронный рак толстой кишки и полипы кишечника. Proc R Soc Med. 1967; 60: 208–210. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Heald RJ, Bussey HJ. Клинический опыт в больнице Св. Марка с множественным синхронным раком толстой и прямой кишки. Расстройство прямой кишки. 1975; 18: 6–10. [PubMed] [Google Scholar]
13. Rickert RR, Auerbach D, Garfinkel L, et al. Аденоматозное поражение толстой кишки и патологоанатомическое исследование. Рак. 1979;43:1845–1857. [Google Scholar]
14. Чен Х.С., Шин-Чен С.М. Синхронная и «ранняя» метахронная колоректальная аденокарцинома: анализ прогноза и современных тенденций. Расстройство прямой кишки. 2000;43:1093–1099. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
15. Ikeda Y, Saku M, Kawanaka H, et al. Распространение синхронного и метахронного множественного колоректального рака. Гепатогастроэнтерология. 2004; 51: 443–446. [PubMed] [Google Scholar]
16. Lillehei RC, Wangesteen OH. Функция кишечника после колэктомии по поводу рака, полипов и дивертикулитов. ДЖАМА. 1955;159:163–170. [PubMed] [Google Scholar]
17. Розенталь И., Бароновский И.Д. Прогностическое и терапевтическое значение полипов при метахронной карциноме толстой кишки. ДЖАМА. 1960; 172: 37–41. [PubMed] [Google Scholar]
18. Райт Х.К., Томас В.Х., Кливленд Дж.К. Низкая частота рецидивов карциномы толстой кишки в подвздошно-ободочных анастомозах. Хирургический гинекологический акушер. 1969; 129: 960–962. [PubMed] [Google Scholar]
19. Адерсон Б.Б. Синхронный рак толстой кишки как случай более радикальной резекции при раке толстой кишки. J Natl Med Assoc. 1978;70:583–585. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Tsantilas D, Ntinas A, Petras P, et al. Метахронные колоректальные аденокарциномы. Тех. Колопрокт. 2004; 8 (Приложение 1): с202–с204. [PubMed] [Google Scholar]
Tsantilas D, Ntinas A, Petras P, et al. Метахронные колоректальные аденокарциномы. Тех. Колопрокт. 2004; 8 (Приложение 1): с202–с204. [PubMed] [Google Scholar]
Синхронные и метахронные метастазы в печень у пациентов с колоректальным раком — к клинически значимому определению | World Journal of Surgical Oncology
Синхронные и метахронные метастазы в печень у пациентов с колоректальным раком — к клинически значимому определению
Скачать PDF
Скачать PDF
- Исследования
- Открытый доступ
- Опубликовано:
- Дженни Энгстранд
ORCID: orcid.
 org/0000-0003-1123-7022 1 ,
org/0000-0003-1123-7022 1 , - Сесилия Стрёмберг 2 ,
- Хенрик Нильссон 1 ,
- Джейкоб Фридман 1 и
- …
- Эдуард Йонас 2,3
6
6 Всемирный журнал хирургической онкологии том 17 , Номер статьи: 228 (2019) Процитировать эту статью
7136 доступов
17 цитирований
3 Альтметрика
Сведения о показателях
Abstract
Background
Приблизительно у 25% пациентов с колоректальным раком (КРР) метастазы в печень классифицируются как синхронные или метахронные.
 Нет единого мнения об определении момента времени для синхронного/метахронного, и его прогностические последствия остаются неясными. Цель исследования состояла в том, чтобы оценить прогностическую ценность дифференциального обнаружения в различные определяющие моменты времени в популяционной когорте пациентов и провести обзор литературы по этой теме.
Нет единого мнения об определении момента времени для синхронного/метахронного, и его прогностические последствия остаются неясными. Цель исследования состояла в том, чтобы оценить прогностическую ценность дифференциального обнаружения в различные определяющие моменты времени в популяционной когорте пациентов и провести обзор литературы по этой теме.Методы
Все пациенты с диагнозом КРР в графствах Стокгольм и Готланд, Швеция, в течение 2008 г. были включены в исследование и наблюдались в течение 5 лет или до смерти для выявления пациентов с диагнозом метастазы в печень. Пациентов с метастазами в печень наблюдали с момента постановки диагноза метастазов в печень в течение не менее 5 лет или до смерти. К когорте применяли различные временные точки, определяющие синхронное/метахронное обнаружение, как сообщалось в литературе и при поиске литературы в базах данных (PubMed, Embase, Cochrane library), а общую выживаемость рассчитывали с использованием кривых Каплана-Мейера и сравнивали с лог-ранговый тест.
 Также оценивалось влияние синхронно или метахронно обнаруженных метастазов в печени на безрецидивную и общую выживаемость, как сообщалось в статьях, полученных в результате поиска литературы.
Также оценивалось влияние синхронно или метахронно обнаруженных метастазов в печени на безрецидивную и общую выживаемость, как сообщалось в статьях, полученных в результате поиска литературы.Результаты
Метастазы в печень были диагностированы у 272/1026 пациентов с КРР (26,5%). Не было продемонстрировано статистически значимой разницы в общей выживаемости при синхронном и метахронном обнаружении в любой из определяющих моментов времени (диагноз КРР/операция и 3, 6 и 12 месяцев после диагностики/операции) для оперированных или неоперированных пациентов. При поиске литературы критериям включения соответствовала 41 публикация. Не было выявлено четкой закономерности в отношении прогностического значения синхронного или метахронного обнаружения.
Заключение
Синхронное и метахронное обнаружение метастазов CRC в печени не имеет прогностической ценности. Использование диагноза/операции первичной опухоли в качестве стандартизированной точки отсечки для определения синхронного/метахронного обнаружения является семантически правильным.
 При синхронном обнаружении он определяет клинически значимую группу пациентов, к которой будут применяться индивидуальные протоколы мультимодального лечения.
При синхронном обнаружении он определяет клинически значимую группу пациентов, к которой будут применяться индивидуальные протоколы мультимодального лечения.История вопроса
В США, а также в Европе колоректальный рак (КРР) является третьим наиболее распространенным видом рака и ведущей причиной смерти от рака [1]. Приблизительно у 25% пациентов с диагнозом КРР во время болезни будут диагностированы метастазы в печень [2,3,4]. В качестве прогностических факторов оценивается большое количество клинико-патологических особенностей метастазов CRC в печени (CRCLM), включая характеристики пациента, предоперационные факторы, характеристики первичной опухоли и метастазов в печень и операционные факторы [5, 6]. Синхронное или метахронное обнаружение или появление CRCLM как прогностического фактора в основном исследовалось и сообщалось в серии хирургических случаев [7, 8]. Однако нет единого мнения относительно определения синхронного и метахронного, используемого в контексте CRCLM.
 Использовался момент времени диагностики первичной опухоли, альтернативно время операции первичной опухоли и изменение временных интервалов, связанных с этими моментами времени [3]. Попытка решить эту проблему была предпринята Adam et al. в 2015 г., где синхронность определялась как метастазы в печени, выявленные до или во время диагностики первичной опухоли [9].]. С современными тенденциями и разработками в лечении CRC и CRCLM обнаружение метастазов в печени во время диагностики первичной опухоли имеет важное терапевтическое значение, как с точки зрения хирургической стратегии, так и с точки зрения планирования онкологического лечения [10,11,12,13]. ]. В ранее опубликованной популяционной когорте пациентов с КРР время обнаружения метастазов в печени (синхронных или метахронных) не оказывало существенного влияния на выживаемость при многомерном анализе [4]. В этом исследовании ранее использовавшиеся определения синхронного и метахронного обнаружения CRCLM применяются к той же когорте пациентов для оценки прогностической ценности обнаружения в различные определяющие моменты времени в популяционной когорте.
Использовался момент времени диагностики первичной опухоли, альтернативно время операции первичной опухоли и изменение временных интервалов, связанных с этими моментами времени [3]. Попытка решить эту проблему была предпринята Adam et al. в 2015 г., где синхронность определялась как метастазы в печени, выявленные до или во время диагностики первичной опухоли [9].]. С современными тенденциями и разработками в лечении CRC и CRCLM обнаружение метастазов в печени во время диагностики первичной опухоли имеет важное терапевтическое значение, как с точки зрения хирургической стратегии, так и с точки зрения планирования онкологического лечения [10,11,12,13]. ]. В ранее опубликованной популяционной когорте пациентов с КРР время обнаружения метастазов в печени (синхронных или метахронных) не оказывало существенного влияния на выживаемость при многомерном анализе [4]. В этом исследовании ранее использовавшиеся определения синхронного и метахронного обнаружения CRCLM применяются к той же когорте пациентов для оценки прогностической ценности обнаружения в различные определяющие моменты времени в популяционной когорте. Чтобы выявить ранее использовавшиеся определения для синхронного и метахронного обнаружения CRCLM, был проведен литературный поиск статей, в которых была указана временная точка для синхронного и метахронного обнаружения.
Чтобы выявить ранее использовавшиеся определения для синхронного и метахронного обнаружения CRCLM, был проведен литературный поиск статей, в которых была указана временная точка для синхронного и метахронного обнаружения.Методы
Для оценки потенциального прогностического влияния обнаружения метастазов в печени в различные моменты времени, используемые для определения синхронного или метахронного обнаружения CRCLM, была использована популяционная когорта пациентов. Все пациенты, у которых был диагностирован КРР в шведских округах Стокгольм и Готланд в период с 1 января 2008 г. по 31 декабря 2008 г. (общая численность населения на 1 ноября 2008 г. = 2 034 886), были включены в Шведский регистр колоректального рака (SCRCR) и включены в исследование. . SCRCR — это проверенная база данных, охватывающая более 99% случаев рака толстой кишки, диагностированных в Швеции в период с 2007 по 2011 год [14]. Данные о метастатическом заболевании не зарегистрированы в SCRCR, и для выявления пациентов, у которых были обнаружены метастазы в печени, электронные истории болезни всех включенных в исследование пациентов были проанализированы в течение не менее 5 лет после установления диагноза первичной опухоли, или до времени смерти.
 Авторы рассмотрели все результаты визуализации и уведомления об интраоперационном обнаружении метастазов и задокументировали возникновение любого метастатического заболевания. В частности, были задокументированы моменты времени для диагностики первичной опухоли, операции по поводу первичной опухоли, диагностики метастазов в печени и времени смерти умерших пациентов. Подробное описание сбора данных, а также демографических и клинико-патологических особенностей всех включенных пациентов было опубликовано в другом месте [4]. В этой статье использовалось несколько иное определение синхронного и метахронного метастазов с некоторыми метастазами в печень, обнаруженными после выделения лечения, но во время неоадъювантной химиотерапии, которые были классифицированы как синхронные. Общая выживаемость (ОВ) пациентов с синхронно и метахронно обнаруженными метастазами в печени сравнивалась для разных моментов времени, определяющих синхронное и метахронное обнаружение, идентифицированных из литературного поиска, как описано ниже.
Авторы рассмотрели все результаты визуализации и уведомления об интраоперационном обнаружении метастазов и задокументировали возникновение любого метастатического заболевания. В частности, были задокументированы моменты времени для диагностики первичной опухоли, операции по поводу первичной опухоли, диагностики метастазов в печени и времени смерти умерших пациентов. Подробное описание сбора данных, а также демографических и клинико-патологических особенностей всех включенных пациентов было опубликовано в другом месте [4]. В этой статье использовалось несколько иное определение синхронного и метахронного метастазов с некоторыми метастазами в печень, обнаруженными после выделения лечения, но во время неоадъювантной химиотерапии, которые были классифицированы как синхронные. Общая выживаемость (ОВ) пациентов с синхронно и метахронно обнаруженными метастазами в печени сравнивалась для разных моментов времени, определяющих синхронное и метахронное обнаружение, идентифицированных из литературного поиска, как описано ниже. Расчет проводился для группы больных с метастазами в печень в целом, а также отдельно для больных, перенесших лечебно-профилактические вмешательства на печени (резекция и/или локальная аблация), и получавших паллиативное лечение. ОВ оценивалась с момента постановки диагноза метастазов в печень до смерти, последнего наблюдения или цензуры 21 января 2019 г..
Расчет проводился для группы больных с метастазами в печень в целом, а также отдельно для больных, перенесших лечебно-профилактические вмешательства на печени (резекция и/или локальная аблация), и получавших паллиативное лечение. ОВ оценивалась с момента постановки диагноза метастазов в печень до смерти, последнего наблюдения или цензуры 21 января 2019 г..Чтобы определить ранее использовавшиеся определения моментов времени для синхронного и метахронного обнаружения, был проведен литературный поиск публикаций за период с 2005 по 2018 год, в которых описывались определения синхронного и метахронного обнаружения. Сообщаемое прогностическое значение различия в статьях, в которых сообщалось об ОС и/или безрецидивной выживаемости (DFS), также было задокументировано. Был проведен поиск в базах данных библиотек PubMed, Embase и Cochrane, а статьи были проанализированы в соответствии с руководящими принципами заявления PRISMA [15]. Были использованы следующие поисковые заголовки: (КРР ИЛИ колоректальный рак) И (печень ИЛИ печень) И (метастазы ИЛИ метастазы ИЛИ метастатические) И (синхронный ИЛИ метахронный) И выживаемость.
 Статьи, написанные не на английском языке, дубликаты, тезисы конференций, тематические отчеты, обзорные статьи и статьи, написанные до 2005 года, были исключены. Остальные статьи подверглись более тщательному отбору. Для включения исследования должны были (а) указать определение синхронного и метахронного обнаружения CRCLM и (b) оценить синхронное или метахронное обнаружение в качестве прогностического фактора (как OS и/или DSF). Если одна и та же популяция использовалась в двух разных исследованиях, включалось более позднее исследование. Публикации, не отвечающие критериям включения, считались нерелевантными. Для выявления возможных пропущенных статей был проведен контрольный скрининг. Исследование было одобрено Региональным советом по этике в Стокгольме.
Статьи, написанные не на английском языке, дубликаты, тезисы конференций, тематические отчеты, обзорные статьи и статьи, написанные до 2005 года, были исключены. Остальные статьи подверглись более тщательному отбору. Для включения исследования должны были (а) указать определение синхронного и метахронного обнаружения CRCLM и (b) оценить синхронное или метахронное обнаружение в качестве прогностического фактора (как OS и/или DSF). Если одна и та же популяция использовалась в двух разных исследованиях, включалось более позднее исследование. Публикации, не отвечающие критериям включения, считались нерелевантными. Для выявления возможных пропущенных статей был проведен контрольный скрининг. Исследование было одобрено Региональным советом по этике в Стокгольме.Статистический анализ
Непрерывные данные с ненормальным распределением представлены как медианы (минимум, максимум), а категориальные данные — как частоты (в процентах). Кривые выживаемости рассчитывали с использованием оценок Каплана-Мейера, а функции выживаемости сравнивали с использованием критерия логарифмического ранга.
 Порог статистической значимости был установлен на уровне 90 433 a 90 380 < 0,05. Sigmaplot 13 (Systat Software, Сан-Хосе, Калифорния, США) использовали для статистического анализа.
Порог статистической значимости был установлен на уровне 90 433 a 90 380 < 0,05. Sigmaplot 13 (Systat Software, Сан-Хосе, Калифорния, США) использовали для статистического анализа.Результаты
Данные о выживаемости популяционной когорты
За период исследования КРР был диагностирован у 1026 пациентов. Медиана возраста составила 71 год (31 год, 97 лет), 485 (47,3%) женщин и 651 (65,1%) первичная опухоль левостороннего происхождения. При 5-летнем наблюдении у 272 (26,5%) пациентов (57,7% мужчин и 42,3% женщин) были диагностированы метастазы в печени, из них 65 (24%) подверглись резекции печени, Таблица 1. Кумулятивная частота обнаружения метастазов в печень в зависимости от времени постановки диагноза первичной опухоли представлены на рис. Диагноз первичной опухоли (у неоперированных больных) или время операции первичной опухоли (у оперированных больных) и через 3, 6 и 12 месяцев после диагностики/операции первичной опухоли показаны в таблице 2.
Таблица 1 Характеристика пациентов и опухолей у 272 больных с метастазами в печеньПолная таблица
Рис. паллиативная)/операция по поводу первичной опухоли (резецированная)
паллиативная)/операция по поводу первичной опухоли (резецированная)Полный размер изображения
Таблица 2 Количество пациентов с метастазами в печени, классифицированными как синхронные и метахронные, в зависимости от различных определяющих моментов времени.Полноразмерная таблица
Кривые общей выживаемости пациентов с синхронно и метахронно выявленными метастазами для оперированных и неоперированных пациентов показаны для различных синхронных и метахронных определяющих моментов времени (рис. 2). Статистически значимой разницы в выживаемости ни в один из моментов времени ни у оперированных, ни у неоперированных больных не наблюдалось.
Рис. 2a – d Кривые общей выживаемости при синхронных и метахронных обнаруженных метастазах. Оперированные и неоперированные пациенты показаны для различных синхронных/метахронных точек отсечки на a , выявление первичной опухоли (неоперированная, паллиативная)/операция по поводу первичной опухоли (резецированная) и b , 3 мес, c , 6 мес и d , 12 мес после выявления/резекции первичной опухоли
Изображение в натуральную величину
Обзор существующей литературы по теме
Блок-схема, представляющая результаты поиска в электронной базе данных, представлена на рис.
Рис. 3 3. После исключения было сохранено 39 статей, 2 статьи были добавлено из эталонного скрининга. В большинстве исследований сообщается о пациентах, оперированных только по поводу CRCLM (9).0433 n = 34), 6 включали как оперированных, так и неоперированных пациентов, а 1 исследование включало только пациентов, получавших паллиативное лечение (табл. 3). Прогностические результаты по временным точкам представлены в табл. 4. Количество субъектов, включенных в исследования, значительно различалось (минимум 40, максимум 1784), а доля пациентов с синхронным выявлением метастазов в печени варьировала от 31,3 до 79,7%. . Наиболее часто используемый момент времени для определения синхронности был при диагностике/операции первичной опухоли (18 из 41 публикации). Наблюдалась тенденция к лучшей выживаемости метахронных обнаруженных метастазов с более ранним отсечением: 50% исследований показали статистически значимые различия при использовании 0- или 3-месячного определения по сравнению с 33% при 6-месячном определении и 0 % для 12-месячного определения; в большинстве исследований сделан вывод о незначительной прогностической ценности синхронного и метахронного обнаружения.
3. После исключения было сохранено 39 статей, 2 статьи были добавлено из эталонного скрининга. В большинстве исследований сообщается о пациентах, оперированных только по поводу CRCLM (9).0433 n = 34), 6 включали как оперированных, так и неоперированных пациентов, а 1 исследование включало только пациентов, получавших паллиативное лечение (табл. 3). Прогностические результаты по временным точкам представлены в табл. 4. Количество субъектов, включенных в исследования, значительно различалось (минимум 40, максимум 1784), а доля пациентов с синхронным выявлением метастазов в печени варьировала от 31,3 до 79,7%. . Наиболее часто используемый момент времени для определения синхронности был при диагностике/операции первичной опухоли (18 из 41 публикации). Наблюдалась тенденция к лучшей выживаемости метахронных обнаруженных метастазов с более ранним отсечением: 50% исследований показали статистически значимые различия при использовании 0- или 3-месячного определения по сравнению с 33% при 6-месячном определении и 0 % для 12-месячного определения; в большинстве исследований сделан вывод о незначительной прогностической ценности синхронного и метахронного обнаружения.
Блок-схема, представляющая результаты поиска в электронной базе данных
Полноразмерное изображение
Таблица 3 Исследования, сравнивающие прогностическую ценность синхронного и метахронного обнаружения CRCLM, опубликованные в 2005–2018 гг.Полная таблица
Таблица 4 Сводка моментов времени для определения синхронного и метахронного и прогностического значения, измеренного с помощью OS и DFS в публикациях 2005–2018 гг.Полная таблица
Обсуждение
В настоящем исследовании ставится вопрос о прогностическом влиянии времени обнаружения метастазов в печени при КРР, а также о значимости временных точек, отличных от времени диагностики первичной опухоли у неоперированных пациентов и времени хирургического лечения первичной опухоли у оперированных пациентов, как определение синхронного обнаружения. В четко определенной когорте из четко определенного географического региона Швеции не наблюдалось существенных различий в выживаемости, измеренной от времени обнаружения метастазов в печени до смерти между двумя группами, независимо от используемых временных точек.

У пациентов с КРКЛМ пропорции опухолей, выявляемых синхронно и метахронно, и прогностическое значение этого различия сообщалось в многочисленных исследованиях [3, 9]. Отчеты, посвященные этой проблеме, значительно различаются в отношении моментов времени, используемых в качестве отсечки для определения синхронного и метахронного обнаружения. Кроме того, существуют большие различия в количестве субъектов и соотношении синхронного и метахронного обнаружения во включенных когортах. Хотя наблюдалась тенденция у пациентов с метахронным выявлением, у которых была лучшая ОВ с ранними временными точками в качестве отсечки (50% исследований, демонстрирующих статистически значимые различия с использованием определения 0 или 3 месяцев) по сравнению с более поздними временными точками (50% для 6-месячного и 0% для 12-месячного определения), нет убедительных доказательств того, что различие имеет какое-либо прогностическое значение. В исследовании Furukawa et al. прогностическое значение синхронного и метахронного обнаружения изучали в когорте пациентов с нерезектабельными метастазами в печень.
 При отсечении, определяемом как время оценки первичной опухоли, различий в ОВ пациентов обнаружено не было [33]. Адам и др. приняли консенсусный подход к тому же вопросу и пришли к выводу, что метахронные опухоли считаются имеющими лучшую биологию и лучшую выживаемость, и этот вывод был проиллюстрирован кривыми выживаемости из LiverMetSurvey [9].].
При отсечении, определяемом как время оценки первичной опухоли, различий в ОВ пациентов обнаружено не было [33]. Адам и др. приняли консенсусный подход к тому же вопросу и пришли к выводу, что метахронные опухоли считаются имеющими лучшую биологию и лучшую выживаемость, и этот вывод был проиллюстрирован кривыми выживаемости из LiverMetSurvey [9].].С учетом современных тенденций и разработок в области лечения CRC и CRCLM установление наличия метастазов в печени во время диагностики первичной опухоли имеет важное терапевтическое значение [6, 55]. Во-первых, хирургическое вмешательство по поводу CRCLM необходимо согласовывать с операцией по поводу первичной опухоли. Необходимо рассмотреть различные хирургические варианты, например первый доступ к печени или одновременную резекцию первичной опухоли и метастазов в печень [10, 56, 57, 58]. Во-вторых, это может также влиять на использование и сроки онкологического лечения, при этом неоадъювантная химиотерапия все чаще предпочтительнее у пациентов с метастазами в печени, обнаруженными до операции по поводу первичной опухоли [11,12,13].

Терминология, часто используемая в литературе, например, развитие синхронных метастазов по сравнению с метахронными, подразумевает две разные клинические единицы, создавая необоснованное впечатление, что метастатические события происходят в соответствующие периоды. Подробно описан механизм метастазов КРР в печень, при этом опухолевые клетки попадают в печень либо через воротную вену, либо через печеночную артерию, причем общей точкой входа является синусоидальное пространство [59]. Остается неясным, прекращается ли риск новых метастазов в печень при удалении первичной опухоли. Паттерны рецидивов в печени, наблюдаемые в когорте пациентов, перенесших трансплантацию CRCLM, позволяют предположить, что ранее не диагностированные метастазы в легкие или лимфатические узлы могут быть источником метастазов в трансплантированную печень [60, 61]. Развитие метастазов в трансплантированной печени при отсутствии каких-либо других метастазов позволяет предположить, что жизнеспособные опухолевые клетки могут сохраняться в кровотоке после удаления первичной опухоли и резекции всей печени с метастазами в печень.
 Однако более правдоподобно, что дооперационно присутствующие, но невыявленные поражения печени составляют подавляющее большинство метастазов в печень, обнаруженных после операции по поводу первичной опухоли. Таким образом, эти поражения потенциально обнаруживаются при первоначальном обследовании печени.
Однако более правдоподобно, что дооперационно присутствующие, но невыявленные поражения печени составляют подавляющее большинство метастазов в печень, обнаруженных после операции по поводу первичной опухоли. Таким образом, эти поражения потенциально обнаруживаются при первоначальном обследовании печени.В свете вышеизложенного мы предлагаем стандартизированное определение для синхронного и метахронного обнаружения CRCLM, которое будет рациональным, семантически правильным и будет иметь четкое клиническое применение, а именно время операции по поводу первичной опухоли у оперированных пациенты и время диагностики первичной опухоли, включая метастатическое исследование, для пациентов, лечившихся консервативно по поводу первичной опухоли, в качестве отсечки. Обоснование наличия порога синхронности во время, а не перед операцией по поводу первичной опухоли заключается в том, что, хотя установление наличия метастазов во время предоперационного обследования первичной опухоли является оптимальным с точки зрения планирования лечения, интраоперационная оперативное выявление еще в некоторой степени дает возможность изменить план лечения, если это необходимо.
 К счастью, интраоперационное обнаружение дооперационно не диагностированных метастазов в печень становится все более редким событием благодаря высококачественной визуализации с использованием передовых технологий и современных протоколов во время обследования [62]. Предлагаемое определение также сосредоточит внимание на эффективности визуализации печени во время обнаружения первичной опухоли, причем доля метастазов, обнаруженных до операции по поводу первичной опухоли, напрямую связана с качеством и тщательностью стратегии визуализации. Это может служить надежным параметром предоперационного контроля качества визуализации. Рандомизированное исследование показало, что МРТ со специфичным для печени контрастом лучше подходит для выявления CRCLM по сравнению с КТ с контрастным усилением и МРТ с внеклеточным контрастом [63]. Экономические исследования в области здравоохранения показывают, что первый подход МРТ с точки зрения затрат сравним с поэтапным подходом с КТ с контрастным усилением в первую очередь [64, 65].
К счастью, интраоперационное обнаружение дооперационно не диагностированных метастазов в печень становится все более редким событием благодаря высококачественной визуализации с использованием передовых технологий и современных протоколов во время обследования [62]. Предлагаемое определение также сосредоточит внимание на эффективности визуализации печени во время обнаружения первичной опухоли, причем доля метастазов, обнаруженных до операции по поводу первичной опухоли, напрямую связана с качеством и тщательностью стратегии визуализации. Это может служить надежным параметром предоперационного контроля качества визуализации. Рандомизированное исследование показало, что МРТ со специфичным для печени контрастом лучше подходит для выявления CRCLM по сравнению с КТ с контрастным усилением и МРТ с внеклеточным контрастом [63]. Экономические исследования в области здравоохранения показывают, что первый подход МРТ с точки зрения затрат сравним с поэтапным подходом с КТ с контрастным усилением в первую очередь [64, 65].
Однако существует ряд ограничений, которые необходимо учитывать при интерпретации и обобщении результатов. SCRCR включает только шведское население, относительно однородную группу с точки зрения этнического разнообразия, и результаты не могут быть обобщены. В предыдущей публикации об общей когорте пациентов с КРР, из которых пациенты с КРКЛ были включены в это исследование, был проведен регрессионный анализ Кокса, включая возраст, пол, опухолевые факторы (стадия опухоли, узловая стадия, правосторонняя или левосторонняя), число и размер метастазов в печень, время обнаружения (синхронное или метахронное), резекцию печени и наличие метастазов в легкие. При многомерном анализе возраст, первичное происхождение опухоли (средняя кишка или задняя кишка), размер самого крупного метастаза в печень и резекция печени достоверно предсказывали выживаемость, в то время как синхронная или метахронная (ОР 0,9)1, 95% ДИ 0,64–1,30) существенно не влияли на выживаемость [4]. В этой статье пациенты, которые были прооперированы, и пациенты, не прооперированные по поводу CRCLM, оценивались отдельно.
 В идеале дополнительное лечение, такое как неоадъювантная, адъювантная и паллиативная химиотерапия, должно контролироваться многопараметрическим анализом, но довольно небольшая когорта CRCLM исключает дальнейший анализ подгрупп.
В идеале дополнительное лечение, такое как неоадъювантная, адъювантная и паллиативная химиотерапия, должно контролироваться многопараметрическим анализом, но довольно небольшая когорта CRCLM исключает дальнейший анализ подгрупп.Несмотря на то, что для извлечения опубликованных данных, необходимых для исследования (определения и влияние синхронного и метахронного обнаружения на прогноз в различные моменты времени), были соблюдены руководящие принципы заявления PRISMA, формальный систематический обзор не проводился. Крайне желательны систематический обзор и метаанализ для оценки прогностической ценности синхронного и метахронного обнаружения с использованием предложенного определения, поскольку это может прояснить влияние на прогноз.
Заключение
Это исследование, насколько нам известно, является первым, в котором рассматривается вопрос в хорошо проверенной популяционной когорте, и оно не демонстрирует какой-либо прогностической ценности в различии синхронного и метахронного обнаружения CRCLM для любого из ранее сообщили об определении пороговых значений ни для оперированных пациентов, ни для пациентов, получавших паллиативное лечение.
 Мы предлагаем использовать диагноз/операцию первичной опухоли в качестве стандартной точки отсечки для определения синхронного/метахронного обнаружения как клинически значимого определения.
Мы предлагаем использовать диагноз/операцию первичной опухоли в качестве стандартной точки отсечки для определения синхронного/метахронного обнаружения как клинически значимого определения.Доступность данных и материалов
Наборы данных, созданные и/или проанализированные в ходе текущего исследования, не являются общедоступными, поскольку это не было изначально указано в этической заявке и последующем утверждении.
Сокращения
- CRC:
Колоректальный рак
- CRCLM:
Метастазы колоректального рака в печень
- ДФС:
Безрецидивная выживаемость
- ОС:
Общая выживаемость
- SCRCR:
Шведский регистр колоректального рака
Ссылки
- «>
Ferlay J, Steliarova-Foucher E, Lortet-Tieulent J, Rosso S, Coebergh JW, Comber H, et al. Модели заболеваемости и смертности от рака в Европе: оценки для 40 стран в 2012 г. Eur J Cancer. 2013;49(6): 1374–403.
КАС пабмед Статья Google ученый
Сйовалл А., Ярв В., Блумквист Л., Сингномклао Т., Седермарк Б., Глимелиус Б. и др. Потенциал улучшения результатов у пациентов с метастазами рака толстой кишки в печень: популяционное исследование. Eur J Surg Oncol. 2004;30(8):834–41.
КАС пабмед Статья Google ученый
Хакл К., Нойманн П., Геркен М., Лосс М., Клинкхаммер-Шальке М., Шлитт Х.Дж. Лечение колоректальных метастазов в печени в Германии: десятилетний популяционный анализ 5772 случаев первичной колоректальной аденокарциномы. БМК Рак. 2014;14:810.
ПабМед ПабМед Центральный Статья Google ученый
«>de Jong MC, Pulitano C, Ribero D, Strub J, Mentha G, Schulick RD, et al. Частота и характер рецидивов после радикальной операции по поводу метастазов колоректального рака в печень: международный межведомственный анализ 1669 г.пациенты. Энн Сург. 2009;250(3):440–8.
ПабМед Google ученый
Павлик Т.М., Шулик Р.Д., Чоти М.А. Расширение критериев резектабельности метастазов колоректального рака в печень. Онколог. 2008;13(1):51–64.
ПабМед Статья Google ученый
Settmacher U, Dittmar Y, Knosel T, Schone U, Heise M, Jandt K, et al.
 Предикторы долгосрочной выживаемости у пациентов с метастазами колоректального рака в печень: одноцентровое исследование и обзор литературы. Int J Color Dis. 2011;26(8):967–81.
Предикторы долгосрочной выживаемости у пациентов с метастазами колоректального рака в печень: одноцентровое исследование и обзор литературы. Int J Color Dis. 2011;26(8):967–81.Артикул Google ученый
Спелед Л., Андерссон Б., Нильссон Дж., Андерссон Р. Прогностические модели исхода после резекции печени по поводу метастазов колоректального рака: систематический обзор. Eur J Surg Oncol. 2012;38(1):16–24.
КАС пабмед Статья Google ученый
Адам Р., де Грамон А., Фигерас Дж., Кокудо Н., Кунстлингер Ф., Лойер Э. и др. Лечение синхронных метастазов колоректального рака в печень: междисциплинарный международный консенсус. Лечение рака, ред. 2015; 41(9)): 729–41.
ПабМед Статья Google ученый
Редди С.К., Барбас А.С., Клэри Б.
 М. Синхронные метастазы колоректального рака в печень: пора ли пересмотреть традиционные парадигмы лечения? Энн Сург Онкол. 2009;16(9):2395–410.
М. Синхронные метастазы колоректального рака в печень: пора ли пересмотреть традиционные парадигмы лечения? Энн Сург Онкол. 2009;16(9):2395–410.ПабМед Статья Google ученый
Шварц Р.Е., Берлин Д.Д., Ленц Х.Дж., Нордлингер Б., Руббиа-Брандт Л., Чоти М.А. Системная цитотоксическая и биологическая терапия метастазов колоректального рака в печень: заключение экспертов. Е.П.Б. (Оксфорд). 2013;15(2):106–15.
Артикул Google ученый
Джонс Р.П., Малик Х.З., Фенвик С.В., Постон Г.Дж. Периоперационная химиотерапия операбельных метастазов колоректального рака в печень: где сейчас? Eur J Surg Oncol. 2013;39(8):807–11.
КАС пабмед Статья Google ученый
Brouquet A, Nordlinger B. Неоадъювантная терапия метастазов колоректального рака в печень: уроки, извлеченные из клинических испытаний.
 Дж. Хирург Онкол. 2010;102(8):932–6.
Дж. Хирург Онкол. 2010;102(8):932–6.ПабМед Статья Google ученый
Кодеда К., Натанаэльссон Л., Юнг Б., Олссон Х., Джестин П., Шовалл А. и др. Популяционные данные из Шведского регистра рака толстой кишки. Бр Дж Сур. 2013;100(8):1100–7.
КАС пабмед Статья Google ученый
McInnes MDF, Moher D, Thombs BD, McGrath TA, Bossuyt PM, Clifford T, et al. Предпочтительные элементы отчетности для систематического обзора и метаанализа исследований точности диагностических тестов: заявление PRISMA-DTA. ДЖАМА. 2018;319(4): 388–96.
ПабМед Статья Google ученый
Mutsaerts EL, van Ruth S, Zoetmulder FA, Rutgers EJ, Hart AA, van Coevorden F. Прогностические факторы и оценка хирургического лечения метастазов в печень колоректального происхождения: 10-летний опыт одного института.
 J Gastrointest Surg. 2005;9(2):178–86.
J Gastrointest Surg. 2005;9(2):178–86.ПабМед Статья Google ученый
Leporrier J, Maurel J, Chiche L, Bara S, Segol P, Launoy G. Популяционное исследование заболеваемости, лечения и прогноза метастазов колоректального рака в печень. Бр Дж Сур. 2006;93(4):465–74.
КАС пабмед Статья Google ученый
Минагава М., Ямамото Дж., Мива С., Сакамото Ю., Кокудо Н., Косугэ Т. и др. Критерии выбора одномоментной резекции у больных с синхронным метастазированием в печень. Арка Сур. 2006;141(10):1006–12.
ПабМед Статья Google ученый
Таниай Н., Йошида Х., Мамада Ю., Мацумото С., Мизугути Ю., Сузуки Х. и др. Исходы хирургического лечения синхронных метастазов колоректального рака в печень. Медицинская школа J Nippon. 2006;73(2):82–88.

Артикул Google ученый
Симидзу Ю., Ясуи К., Сано Т., Хираи Т., Канемицу Ю., Комори К. и др. Стратегия лечения синхронных метастазов колоректального рака: целесообразна ли резекция печени после интервала наблюдения? Арка Лангенбека Surg. 2007;392(5):535–8.
Артикул Google ученый
Tsai MS, Su YH, Ho MC, Liang JT, Chen TP, Lai HS и др. Клинико-патологические особенности и прогноз при операбельном синхронном и метахронном метастазировании колоректального рака в печень. Энн Сург Онкол. 2007;14(2):786–94.
ПабМед Статья Google ученый
Wang X, Hershman DL, Abrams JA, Feingold D, Grann VR, Jacobson JS, et al. Предикторы выживаемости после резекции печени у больных с метастазами колоректального рака в печень. Бр Дж Рак. 2007;97 (12): 1606–12.

КАС пабмед ПабМед Центральный Статья Google ученый
Бокхорн М., Фриллинг А., Фрухауф Н.Р., Нейхаус Дж., Молменти Э., Трарбах Т. и др. Выживаемость пациентов с синхронными и метахронными метастазами колоректального рака в печень — есть ли разница? J Gastrointest Surg. 2008;12(8):1399–405.
ПабМед Статья Google ученый
Hamady ZZR, Malik HZ, Alwan N, Wyatt JI, Prasad RK, Toogood GT и др. Осведомленность хирурга о синхронных метастазах в печени при резекции колоректального рака может повлиять на исход. Eur J Surg Oncol. 2008;34(2):180–4.
КАС пабмед Статья Google ученый
Вигано Л., Ферреро А., Ло Тесорьер Р., Капуссотти Л. Хирургия печени при колоректальных метастазах: результаты после 10 лет наблюдения. Долгосрочные выжившие, поздние рецидивы и прогностическая роль заболеваемости.
 Энн Сург Онкол. 2008;15(9): 2458–64.
Энн Сург Онкол. 2008;15(9): 2458–64.ПабМед Статья Google ученый
Конопке Р., Керстинг С., Дистлер М., Дитрих Дж., Гастмайер Дж., Хеллер А. и др. Прогностические факторы и оценка клинической оценки для прогнозирования выживаемости после резекции метастазов колоректального рака в печень. Печень инт. 2009;29(1):89–102.
ПабМед Статья Google ученый
Ng WWC, Cheung YS, Wong J, Lee KF, Lai PBS. Предварительный анализ сочетанной резекции печени с новой химиотерапией при синхронном и метахронном колоректальном метастазировании в печень. Азиатский журнал хирургии. 2009 г.;32(4):189–97.
ПабМед Статья Google ученый
Xu J, Wei Y, Zhong Y, Fan J, Zhou J, Qin L, et al. Гепатэктомия при метастазах колоректального рака в печень.
 Int J Color Dis. 2009;24(4):419–25.
Int J Color Dis. 2009;24(4):419–25.Артикул Google ученый
Tonelli F, Leo F, Nobili S, Mini E, Batignani G. Прогностические факторы при первичной и повторной хирургии метастазов колоректального рака в печень. Джей Чемотер. 2010;22(5):358–63.
КАС пабмед Статья Google ученый
van der Pool AEM, Lalmahomed ZS, Ozbay Y, de Wilt JHW, Eggermont AMM, Jzermans JNM и др. «Поэтапная» резекция печени при синхронных и метахронных колоректальных метастазах в печень: различия в клинико-патологических особенностях и исходах. Цвет Дис. 2010;12(10):e229–e35.
Артикул Google ученый
Бруке А., Оверман М.Дж., Копец С., Мару Д.М., Лойер Э.М., Андреу А. и др. Оправдана ли резекция метастазов колоректального рака в печени после схемы химиотерапии второй линии? Рак.
 2011;117(19): 4484–92.
2011;117(19): 4484–92.ПабМед Статья Google ученый
Свон П.Дж., Уэлш Ф.К., Чандракумаран К., Рис М. Долгосрочная выживаемость после отсроченного поступления и резекции колоректальных метастазов в печень. Бр Дж Сур. 2011;98(9):1309–17.
КАС пабмед Статья Google ученый
Фурукава К., Шиба Х., Харуки К., Фудзивара Ю., Иида Т., Мицуяма Ю. и др. Прогностическая шкала Глазго полезна при колоректальном раке как с синхронными, так и с метахронными нерезектабельными метастазами в печень. Онкол Летт. 2012;4(2):324–8.
КАС пабмед ПабМед Центральный Статья Google ученый
Вигано Л., Руссолилло Н., Ферреро А., Ланджелла С., Сперти Э., Капуссотти Л. Эволюция долгосрочных результатов резекции печени при колоректальных метастазах: анализ фактических показателей 5-летней выживаемости за два десятилетия.
 Энн Сург Онкол. 2012;19(6):2035–44.
Энн Сург Онкол. 2012;19(6):2035–44.ПабМед Статья Google ученый
Dexiang Z, Li R, Ye W, Haifu W, Yunshi Z, Qinghai Y и др. Исход пациентов с колоректальным метастазированием в печень: анализ 1613 последовательных случаев. Энн Сург Онкол. 2012;19(9):2860–8.
ПабМед Статья Google ученый
Gur I, Diggs BS, Wagner JA, Vaccaro GM, Lopez CD, Sheppard BC, et al. Безопасность и исходы после резекции метастазов колоректального рака в печень в эпоху современной периоперационной химиотерапии. J Gastrointest Surg. 2013;17(12):2133–42.
ПабМед Статья Google ученый
Нанджи С., Клири С., Райан П., Гуинди М., Селвараджа С., Григ П. и др. Передняя резекция печени при метастатическом колоректальном раке приводит к благоприятному долгосрочному выживанию.
 Энн Сург Онкол. 2013;20(1):295–304.
Энн Сург Онкол. 2013;20(1):295–304.ПабМед Статья Google ученый
Рибейро Х.С., Стеванато-Фильо П.Р., Коста В.Л. мл., Диниз А.Л., Герман П., Коимбра Ф.Дж. Прогностические факторы выживания у пациентов с метастазами колоректального рака в печень: опыт одного бразильского онкологического центра. Арк Гастроэнтерол. 2012;49(4): 266–72.
ПабМед Статья Google ученый
John SK, Robinson SM, Rehman S, Harrison B, Vallance A, French JJ, et al. Прогностические факторы и выживаемость после резекции колоректального метастаза в печени в эпоху предоперационной химиотерапии: 11-летнее одноцентровое исследование. Копать сург. 2013;30(4-6):293–301.
КАС пабмед Статья Google ученый
Кумар Р., Прайс Т.Дж., Бик С., Джейн К., Патель Г.
 , Падбери Р. и др. Выживаемость при колоректальном раке: анализ пациентов с метастатическим заболеванием, синхронным и метахронным с первичной опухолью. Клин Колоректальный рак. 2014;13(2):87–93.
, Падбери Р. и др. Выживаемость при колоректальном раке: анализ пациентов с метастатическим заболеванием, синхронным и метахронным с первичной опухолью. Клин Колоректальный рак. 2014;13(2):87–93.ПабМед Статья Google ученый
Куо И.М., Хуанг С.Ф., Чан Дж.М., Йе С.И., Чан К.М., Чен Дж.С. и др. Клинические особенности и прогноз при гепатэктомии по поводу колоректального рака с центральным метастазированием в печень. World J Surg Oncol. 2015;13:92.
ПабМед ПабМед Центральный Статья Google ученый
Али М.А., Ди Сандро С., Лаутерио А., Конконе Г., Мангони И., Ферла Ф. и др. Повторная гепатэктомия при рецидивирующих колоректальных метастазах в печень: стоит ли это того? J Gastrointest Surg. 2015;19(12):2192–8.
ПабМед Статья Google ученый
«>Лемке Дж., Каммерер Г., Гансер Дж., Шееле Дж., Сюй П., Сандер С. и др. Выживаемость и прогностические факторы метастазов колоректального рака в печень после хирургического и консервативного лечения. Клин Колоректальный рак. 2016;15(4):e183–e92.
ПабМед Статья Google ученый
Миллер С.Л., Тейлор М.С., Кадан М., Дешпанде В., Уортингтон С., Смолли Р. и др. Прогностическое значение размера хирургического края после неоадъювантной FOLFOX и/или FOLFIRI для метастазов колоректального рака в печень. J Gastrointest Surg. 2017;21(11):1831–40.
ПабМед Статья Google ученый
«>Бартолини И., Рингресси М.Н., Мелли Ф., Рисалити М., Бругия М., Мини Е. и др. Анализ прогностических факторов резецированных синхронных и метахронных метастазов колоректального рака в печень. Гастроэнтерол Рез Практ. 2018;2018.
Маргонис Г.А., Бюттнер С., Андреатос Н., Ким И., Вагнер Д., Сасаки К. и др. Связь мутаций BRAF с выживаемостью и рецидивами у хирургически леченных пациентов с метастатическим колоректальным раком печени. JAMA Surg. 2018;153(7):e180996.
ПабМед ПабМед Центральный Статья Google ученый
Marques MC, CR HS, Costa WL Jr, VHF d J, de Macedo MP, Diniz AL и др.
 Является ли первичная односторонность прогностическим фактором у пациентов с резецированным раком толстой кишки с метастазами в печень (CLM)? Дж. Хирург Онкол. 2018;117(5):858–63.
Является ли первичная односторонность прогностическим фактором у пациентов с резецированным раком толстой кишки с метастазами в печень (CLM)? Дж. Хирург Онкол. 2018;117(5):858–63.КАС пабмед Статья Google ученый
Мемео Р., де Блази В., Адам Р., Гёре Д., Пиарди Т., Лермит Э. и др. Пограничный статус по-прежнему является важным прогностическим фактором при гепатэктомии по поводу метастазов колоректального рака в печень: анализ сопоставления показателей предрасположенности. Мир J Surg. 2018;42(3):892–901.
ПабМед Статья Google ученый
Quireze Junior C, Brasil AMS, Morais LK, Campion ERL, Taveira EJF, Rassi MC. Метахронные колоректальные метастазы в печень имеют лучший прогноз – правда ли это? Арк Гастроэнтерол. 2018;55(3):258–63.
ПабМед Статья Google ученый
«>Страндберг Холка П., Эрикссон С., Эберхард Дж., Бергенфельдт М., Линделл Г., Стурссон С. Значение плохого состояния здоровья после резекции метастазов колоректального рака в печень. World J Surg Oncol. 2018;16(1):3.
ПабМед ПабМед Центральный Статья Google ученый
Чжао Й, Дэн Й, Пэн Дж, Суй Кью, Лин Дж, Цю М и др. Предсказывает ли предоперационный прогностический нутриционный индекс выживаемость пациентов с метастазами колоректального рака в печень, перенесших лечебную резекцию? Дж Рак. 2018;9(12):2167–74.
ПабМед ПабМед Центральный Статья КАС Google ученый
«>Lam VW, Laurence JM, Pang T, Johnston E, Hollands MJ, Pleass HC и др. Систематический обзор подхода «сначала печень» у пациентов с колоректальным раком и синхронными метастазами колоректального рака в печень. Е.П.Б. 2014;16(2):101–8.
ПабМед Статья Google ученый
Siriwardena AK, Mason JM, Mullamitha S, Hancock HC, Jegatheeswaran S. Лечение колоректального рака с синхронными метастазами в печень. Nat Rev Clin Oncol. 2014;11(8):446–59.
КАС пабмед Статья Google ученый
Слессер А.
 А., Симиллис С., Голдин Р., Браун Г., Мудан С., Теккис П.П. Метаанализ, сравнивающий одновременные и отсроченные резекции у пациентов с синхронными метастазами колоректального рака в печень. Сур Онкол. 2013;22(1):36–47.
А., Симиллис С., Голдин Р., Браун Г., Мудан С., Теккис П.П. Метаанализ, сравнивающий одновременные и отсроченные резекции у пациентов с синхронными метастазами колоректального рака в печень. Сур Онкол. 2013;22(1):36–47.КАС пабмед Статья Google ученый
Van den Eynden GG, Majeed AW, Illemann M, Vermeulen PB, Bird NC, Hoyer-Hansen G, et al. Многогранная роль микроокружения при метастазировании в печень: биология и клинические последствия. Рак рез. 2013;73(7):2031–43.
ПабМед Статья КАС Google ученый
Hagness M, Foss A, Egge TS, Dueland S. Модели рецидивов после трансплантации печени для нерезектабельных метастазов в печень от колоректального рака. Энн Сург Онкол. 2014; 21(4):1323–9..
ПабМед Статья Google ученый
Hagness M, Foss A, Line PD, Scholz T, Jorgensen PF, Fosby B, et al.
 Трансплантация печени при неоперабельных метастазах колоректального рака в печень. Энн Сург. 2013;257(5):800–6.
Трансплантация печени при неоперабельных метастазах колоректального рака в печень. Энн Сург. 2013;257(5):800–6.ПабМед Статья Google ученый
Карталис Н., Брисмар Т.Б., Михокса Л., Исакссон Б., Альбиин Н. Дополнительные преимущества ультразвукового исследования с контрастным усилением у пациентов с колоректальным раком, проходящих предоперационную оценку с обширной МРТ печени с гадобенатом и димеглюмином. Евро Радиол. 2011;21(10):2067–73.
ПабМед Статья Google ученый
Zech CJ, Korpraphong P, Huppertz A, Denecke T, Kim MJ, Tanomkiat W, et al. Рандомизированное многоцентровое исследование МРТ с усилением гадоксетовой кислотой по сравнению с традиционной МРТ или КТ при стадировании метастазов колоректального рака в печень. Бр Дж Сур. 2014;101(6):613–21.
КАС пабмед ПабМед Центральный Статья Google ученый
«>Zech CJ, Grazioli L, Jonas E, Ekman M, Niebecker R, Gschwend S, et al. Медицинско-экономическая оценка трех стратегий визуализации у пациентов с подозрением на метастазы колоректального рака в печень: МРТ с усилением Gd-EOB-DTPA по сравнению с МРТ с усилением внеклеточным контрастным веществом и трехфазной МДКТ в Германии, Италии и Швеции. Евро Радиол. 2009 г.;19 Приложение 3:S753-S763.
Артикул Google ученый
Отделение хирургии, отделение клинических наук, Каролинский институт, больница Дандерюд, 182 88, Стокгольм, Швеция
Дженни Энгстранд, Хенрик Нильссон и Джейкоб Фридман
Отделение хирургии, Департамент клинических наук, интервенций и технологий (CLINTEC), Каролинский институт, Каролинская университетская больница, Стокгольм, Швеция
Сесилия Стрёмберг 7 9 0304 Йонас
Отделение хирургической гастроэнтерологии, отделение хирургии, больница Гроот Шур, факультет медицинских наук Кейптаунского университета, Кейптаун, Южная Африка
Eduard Jonas
- Jennie Engstrand
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Cecilia Strömberg
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Henrik Nilsson
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Академия
- Джейкоб Фридман
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Eduard Jonas
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Ferlay, J. et al. Оценка глобальной заболеваемости раком и смертности от рака в 2018 г.: источники и методы GLOBOCAN. Int J. Cancer 144 , 1941–1953 (2019).
КАС пабмед Статья Google ученый
Burrell, R. A. et al. Причины и последствия генетической гетерогенности в эволюции рака. Природа 501 , 338–345 (2013).
КАС пабмед Статья Google ученый
Bedard, P.L. et al. Неоднородность опухоли в клинике. Природа 501 , 355–364 (2013).
КАС пабмед ПабМед Центральный Статья Google ученый
«>Wood, L.D. et al. Геномные ландшафты рака молочной железы и колоректального рака человека. Наука 318 , 1108–1113 (2007).
КАС пабмед Статья Google ученый
Boland, C.R. & Goel, A. Микросателлитная нестабильность при колоректальном раке. Гастроэнтерология 138 , 2073–2087 e3 (2010).
КАС пабмед Статья Google ученый
Пелтомаки, П. Роль дефектов восстановления несоответствия ДНК в патогенезе рака человека. Дж. Клин. Онкол. 21 , 1174–1179 (2003).
КАС пабмед Статья Google ученый
«>Ленгауэр К., Кинцлер К. В. и Фогельштейн Б. Генетическая нестабильность при колоректальном раке. Природа 386 , 623–627 (1997).
КАС пабмед Статья Google ученый
Буллман, С. и др. Анализ персистенции фузобактерий и ответа на антибиотики при колоректальном раке. Наука 358 , 1443 (2017).
КАС пабмед ПабМед Центральный Статья Google ученый
Lievre, A. et al. Статус мутации KRAS является предиктором ответа на терапию цетуксимабом при колоректальном раке. Рак Res. 66 , 3992–3995 (2006).

КАС пабмед Статья Google ученый
Урсем К., Атрея К. Э. и Ван Лун К. Новые возможности лечения колоректального рака с мутацией BRAF. Гастроинтест. Рак 8 , 13–23 (2018).
ПабМед ПабМед Центральный Google ученый
Smeets, D. et al. Нагрузка числом копий предсказывает исход у пациентов с метастатическим колоректальным раком, получающих комбинированную терапию бевацизумабом. Нац. коммун. 9 , 4112 (2018).
ПабМед ПабМед Центральный Статья КАС Google ученый
Benvenuti, S. et al. Онкогенная активация сигнального пути RAS/RAF ухудшает реакцию метастатического колоректального рака на терапию антителами против рецептора эпидермального фактора роста. Cancer Res 67 , 2643–2648 (2007).

КАС пабмед Статья Google ученый
Amado, R.G. et al. KRAS дикого типа необходим для эффективности панитумумаба у пациентов с метастатическим колоректальным раком. Дж. Клин. Онкол. 26 , 1626–1634 (2008).
КАС пабмед Статья Google ученый
Калян А. и др. Обновления по иммунотерапии колоректального рака. Ж. Гастроинтест. Онкол. 9 , 160–169 (2018).
ПабМед ПабМед Центральный Статья Google ученый
Ле, Д. Т. и др. Блокада PD-1 в опухолях с дефицитом репарации несоответствия. Н. англ. Дж. Мед. 372 , 2509–2520 (2015).
КАС пабмед ПабМед Центральный Статья Google ученый
«>Xiao, Y. & Freeman, G. J. Микросателлитная нестабильная подгруппа колоректального рака является особенно хорошим кандидатом для иммунотерапии с блокадой контрольных точек. Рак Дисков. 5 , 16–18 (2015).
КАС пабмед ПабМед Центральный Статья Google ученый
Ле, Д. Т. и др. Дефицит репарации несоответствия предсказывает реакцию солидных опухолей на блокаду PD-1. Наука 357 , 409–413 (2017).
КАС пабмед ПабМед Центральный Статья Google ученый
«>Boeckx, N. et al. Односторонность первичной опухоли влияет на прогноз и исход лечения метастатического колоректального рака: результаты двух рандомизированных исследований панитумумаба первой линии. Энн. Онкол. 28 , 1862–1868 (2017).
КАС пабмед ПабМед Центральный Статья Google ученый
Вирта, Э. В. и др. Иммуноскоры при раке толстой кишки с несоответствием репарации и репарации. Дж. Патол. клин. Рез. 3 , 203–213 (2017).
КАС пабмед ПабМед Центральный Статья Google ученый
«>Guinney, J. et al. Консенсусные молекулярные подтипы колоректального рака. Нац. Мед. 21 , 1350–1356 (2015).
КАС пабмед ПабМед Центральный Статья Google ученый
Isella, C. et al. Селективный анализ внутренних признаков транскрипции раковых клеток определяет новые клинически значимые подтипы колоректального рака. Нац. коммун. 8 , 15107 (2017).
КАС пабмед ПабМед Центральный Статья Google ученый
Lam, A.
 K. et al. Клинико-патологическое значение синхронной карциномы при колоректальном раке. утра. Дж. Сур. 202 , 39–44 (2011).
K. et al. Клинико-патологическое значение синхронной карциномы при колоректальном раке. утра. Дж. Сур. 202 , 39–44 (2011).ПабМед Статья Google ученый
Latournerie, M. et al. Эпидемиология и прогноз синхронного колоректального рака. Бр. Дж. Сур. 95 , 1528–1533 (2008).
КАС пабмед Статья Google ученый
Hanninen, U.A. et al. Анализы экзома и иммунных клеток показывают большие различия в синхронном первичном колоректальном раке. Бр. Дж. Рак 120 , 922–930 (2019).
ПабМед ПабМед Центральный Статья Google ученый
Середа, М. и др. Пациенты с генетически гетерогенным синхронным колоректальным раком несут редкие повреждающие зародышевые мутации в генах, связанных с иммунитетом.
 Нац. коммун. 7 , 12072 (2016).
Нац. коммун. 7 , 12072 (2016).КАС пабмед ПабМед Центральный Статья Google ученый
Ди, Дж. и др. Полное экзомное секвенирование выявляет межопухолевую гетерогенность и различное генетическое происхождение спорадического синхронного колоректального рака. Междунар. Дж. Рак 142 , 927–939 (2018).
КАС пабмед Статья Google ученый
Wang, X. F. et al. Молекулярный ландшафт синхронного колоректального рака демонстрирует генетическую гетерогенность. Канцерогенез 39 , 708–718 (2018).
КАС пабмед ПабМед Центральный Статья Google ученый
Mulder, S.A. et al. Распространенность и прогноз синхронного колоректального рака: голландское популяционное исследование.
 Рак Эпидемиол. 35 , 442–447 (2011).
Рак Эпидемиол. 35 , 442–447 (2011).ПабМед Статья Google ученый
Мацуока К. и Канаи Т. Микробиота кишечника и воспалительные заболевания кишечника. Семин. Иммунопатол. 37 , 47–55 (2015).
КАС пабмед Статья Google ученый
Pages, F. et al. Международная валидация консенсуса Immunoscore для классификации рака толстой кишки: прогностическое исследование и исследование точности. Ланцет 391 , 2128–2139 (2018).
ПабМед Статья Google ученый
Franke, A.J. et al. Иммунотерапия колоректального рака: обзор современных и новых терапевтических подходов. J. Natl Cancer Inst. 111 , 1131–1141 (2019).
КАС пабмед ПабМед Центральный Статья Google ученый
«>Karapetis, C.S. et al. Мутации K-ras и преимущества цетуксимаба при распространенном колоректальном раке. Н. англ. Дж. Мед. 359 , 1757–1765 (2008 г.).
КАС пабмед Статья Google ученый
Misale, S. et al. Возникновение мутаций KRAS и приобретенная устойчивость к анти-EGFR терапии при колоректальном раке. Природа 486 , 532–536 (2012).
КАС пабмед ПабМед Центральный Статья Google ученый
Ли, Х. и Дурбин, Р. Быстрое и точное выравнивание коротких считываний с преобразованием Берроуза-Уилера.
 Биоинформатика 25 , 1754–1760 (2009).
Биоинформатика 25 , 1754–1760 (2009).КАС пабмед ПабМед Центральный Статья Google ученый
Добин, А. и др. STAR: сверхбыстрый универсальный выравниватель RNA-seq. Биоинформатика 29 , 15–21 (2013).
КАС Статья пабмед Google ученый
Cibulskis, K. et al. Чувствительное обнаружение соматических точечных мутаций в неочищенных и гетерогенных образцах рака. Нац. Биотехнолог. 31 , 213–219 (2013).
КАС пабмед ПабМед Центральный Статья Google ученый
Saunders, C. T. et al. Стрелка: точный соматический вызов малых вариантов из секвенированных пар опухолевых и нормальных образцов. Биоинформатика 28 , 1811–1817 (2012).
КАС пабмед Статья Google ученый
«>Рауш, Т. и др. DELLY: обнаружение структурных вариантов с помощью интегрированного анализа парных концов и раздельного чтения. Биоинформатика 28 , i333–i339 (2012).
КАС пабмед ПабМед Центральный Статья Google ученый
Shen, R. & Seshan, V. E. FACETS: инструмент анализа аллель-специфического числа копий и клональной гетерогенности для высокопроизводительного секвенирования ДНК. Рез. нуклеиновых кислот. 44 , e131 (2016).
ПабМед ПабМед Центральный Статья КАС Google ученый
«>McLaren, W. et al. Предиктор эффекта варианта ансамбля. Геном Биол. 17 , 122 (2016).
ПабМед ПабМед Центральный Статья КАС Google ученый
Тамбореро, Д. и др. Интерпретатор генома рака аннотирует биологическую и клиническую значимость опухолевых изменений. Геном Мед. 10 , 25 (2018).
ПабМед ПабМед Центральный Статья КАС Google ученый
Ван, К., Ли, М. и Хаконарсон, Х. ANNOVAR: функциональная аннотация генетических вариантов на основе данных высокопроизводительного секвенирования.
 Рез. нуклеиновых кислот. 38 , e164 (2010 г.).
Рез. нуклеиновых кислот. 38 , e164 (2010 г.).ПабМед ПабМед Центральный Статья КАС Google ученый
Wang, H. et al. Изменения числа копий соматического гена при колоректальном раке: новые поиски драйверов рака и биомаркеров. Онкоген 35 , 2011–2019 (2016).
КАС пабмед Статья Google ученый
Chen, H. & Boutros, PC VennDiagram: пакет для создания диаграмм Венна и Эйлера с широкими возможностями настройки в R. BMC Bioinforma. 12 , 35 (2011).
Артикул Google ученый
Rosenthal, R. et al. DeconstructSigs: очерчивание мутационных процессов в отдельных опухолях позволяет различать недостатки репарации ДНК и закономерности эволюции карциномы. Геном Биол. 17 , 31 (2016).

ПабМед ПабМед Центральный Статья КАС Google ученый
Костич А.Д. и др. PathSeq: программное обеспечение для идентификации или обнаружения микробов путем глубокого секвенирования тканей человека. Нац. Биотехнолог. 29 , 393–396 (2011).
КАС пабмед ПабМед Центральный Статья Google ученый
Bray, N.L. et al. Почти оптимальная вероятностная количественная оценка секвенирования РНК. Нац. Биотехнолог. 34 , 525–527 (2016).
КАС Статья пабмед Google ученый
Лав, М. И., Хубер, В. и Андерс, С. Модерированная оценка изменения кратности и дисперсии для данных секвенирования РНК с помощью DESeq2. Геном Биол. 15 , 550 (2014).
ПабМед ПабМед Центральный Статья КАС Google ученый
«>Финотелло, Ф. и др. Молекулярные и фармакологические модуляторы иммунного контекста опухоли, выявленные путем деконволюции данных секвенирования РНК. Геном Мед. 11 , 34 (2019).
ПабМед ПабМед Центральный Статья КАС Google ученый
Elizabeth J. Ryan
Present address: Health Research Institute, Department of Biological Sciences, University of Limerick, Limerick, Ireland
Genomic Oncology Исследовательская группа, кафедра физиологии и медицинской физики, Королевский колледж хирургов в Ирландии, Дублин, Ирландия
Валентина Томас и Саймон Дж. Ферни
Центр системной медицины, Королевский колледж хирургов Ирландии, Дублин, Ирландия
Валентина Томас и Саймон Дж. Ферни
Центр колоректальных заболеваний, Университетская больница Св. Винсента, Дублин, Ирландия
Маура Б. Коттер, Мириам Тосетто, Йи Линг Хоу, Роберт Джерати, Десмонд С. Винтер, Элизабет Дж. Райан и Киран Шихан
Медицинский факультет Дублинского университетского колледжа, Дублин, Ирландия
Маура Б.
 Коттер, Мириам Тосетто, Йи Линг Хоу, Роберт Герати, Десмонд С. Винтер, Элизабет Дж. Райан и Киран Шихан
Коттер, Мириам Тосетто, Йи Линг Хоу, Роберт Герати, Десмонд С. Винтер, Элизабет Дж. Райан и Киран Шихан- Валентина Томас
Вы также можете искать публикации этого автора
23 автор в PubMed Google Scholar
- Maura B. Cotter
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Miriam Tosetto
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Yi Ling Khaw
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Robert Geraghty
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Десмонд С. Винтер
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Элизабет Дж.
 Райан
РайанПросмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Kieran Sheahan
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Simon J. Furney
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
Мультифокальные органоиды выявляют клональные ассоциации между синхронными опухолями кишечника с распространенными гетерогенными реакциями на лекарства.
- Нахён Чжон
- Сун-Чан Ким
- Джа-Лок Ку
npj Геномная медицина (2022)
Молекулярная характеристика колоректальных карцином, связанных с язвенным колитом
- Даниэла Хирш
- Джулия Хардт
- Тимо Гайзер
Современная патология (2021)
- 90
Venous invasion Present 17 14 0.366 Absent 25 34 *Median (interquartile range) .

Открыть в новой вкладке
Таблица 2.
Сравнение патологических данных между индексными поражениями и сопутствующими поражениями при синхронных карциномах
No. of lesions P Index lesion Concurrent lesion No. of lesions 42 48 Size* 50 (40–65) 21 (15–40) <0.001 Differentiation Well 23 39 0.008 Moderate 16 5 Poor 0 2 Mucinous 3 2 Location Right colon 14 15 0.  292
292 Rectum 13 9 Wall penetration pT1 1 21 <0.001 pT2 3 11 pT3 24 15 pT4 14 1 Morphology Elevated 3 23 <0.001 Ulcerated 39 25 Lymphatic invasion Присутствует 33 22 0,003 92Отсутствует2582 9 26 Venous invasion Present 17 14 0.  366
366 Absent 25 34 Число поражений P Индекс 58 поражений 3 No. of lesions 42 48 Size* 50 (40–65) 21 (15–40) <0.001 Differentiation Well 23 39 0.008 Moderate 16 5 Poor 0 2 Mucinous 3 2 Location Right colon 14 15 0.  292
292 Прямая кишка 13 9 Проникновение в стену 22582 pT1 1 21 <0.001 pT2 3 11 pT3 24 15 pT4 14 1 Morphology Elevated 3 23 <0.001 Ulcerated 39 25 Lymphatic invasion Present 33 22 0.003 Absent 9 26 Венозная инвазия 2583 0,366 Отсутствует 25 34 3 * (межквартильный диапазон).

Открыть в новой вкладке
Таблица 3.
Сравнение клинических характеристик и патоморфологических данных между индексными поражениями синхронных карцином и одиночных карцином2582 P
- Уролог врач для женщин: От чего лечит женщин уролог?
- Исаков роман анатольевич невролог биография: Медицинский центр «Эдельвейс» — 4 врача, 16 отзывов | Санкт-Петербург
Engstrand J, Nilsson H, Stromberg C, Jonas E, Freedman J. Метастазы колоректального рака в печень — популяционное исследование заболеваемости, лечения и выживаемости. БМК Рак. 2018;18(1):78.
ПабМед ПабМед Центральный Статья Google ученый
Кавамура Дж., Ядзава Т., Сумида К., Кида Й., Огава Р., Тани М. и др. Клиническая эффективность резекции печени после уменьшения объема системной химиотерапии при исходно нерезектабельных метастазах в печень. World J Surg Oncol. 2016;14(1). https://doi.org/10.1186/s12957-016-0807-7.
Angelsen JH, Horn A, Sorbye H, Eide GE, Løes IM, Viste A. Популяционное исследование частоты резекций и выживаемости пациентов с метастазами колоректального рака в печень в Норвегии. Бр Дж Сур. 2017;104(5):580–9.
ПабМед Статья Google ученый
Suthananthan AE, Bhandari M, Platell C. Влияние первичного очага на метастатическое распространение и выживаемость при колоректальном раке IV стадии. ANZ J Surg. 2018;88(5):445–9.
ПабМед Статья Google ученый
Вереман Г., Робайс Дж., Верлей Л., Лерой Р., Рольфо С., Ван Катсем Э. и др. Объединенный анализ хирургического лечения метастазов колоректального рака в печень. Crit Rev Oncol Hematol. 2015;94(1):122–35.
КАС пабмед Статья Google ученый
Zech CJ, Justo N, Lang A, Ba-Ssalamah A, Kim MJ, Rinde H и др. Оценка стоимости магнитно-резонансной томографии с усилением гадоксетовой кислоты при диагностике метастазов колоректального рака в печень: результаты исследования VALUE. Евро Радиол. 2016;26(11):4121–30.
ПабМед ПабМед Центральный Статья Google ученый
Ссылки на скачивание
Благодарности
Неприменимо.
Финансирование
Ни один из авторов не получил каких-либо грантов или пожертвований для завершения этого исследования. Финансирование открытого доступа предоставлено Каролинским институтом.
Финансирование открытого доступа предоставлено Каролинским институтом.
Информация об авторе
Авторы и организации
Авторы
Contributions
Авторы в равной степени внесли свой вклад в рассмотрение клинических записей. Анализ данных был выполнен JE, HN и EJ. EJ, JE, CS и JF провели поиск литературы. Все авторы прочитали и одобрили окончательный вариант рукописи.
Анализ данных был выполнен JE, HN и EJ. EJ, JE, CS и JF провели поиск литературы. Все авторы прочитали и одобрили окончательный вариант рукописи.
Автор, ответственный за переписку
Переписка с Дженни Энгстранд.
Декларация этики
Одобрение этики и согласие на участие
Исследование было одобрено Региональным советом по этике в Стокгольме.
Согласие на публикацию
Неприменимо.
Конкурирующие интересы
Авторы заявляют об отсутствии конкурирующих интересов.
Дополнительная информация
Примечание издателя
Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Права и разрешения
Открытый доступ Эта статья распространяется в соответствии с условиями международной лицензии Creative Commons Attribution 4.0 (http://creativecommons.org/licenses/by/4.0/), которая разрешает неограниченное использование, распространение, и воспроизведение на любом носителе, при условии, что вы укажете автора(ов) оригинала и источник, предоставите ссылку на лицензию Creative Commons и укажете, были ли внесены изменения. Отказ от права Creative Commons на общественное достояние (http://creativecommons.org/publicdomain/zero/1.0/) применяется к данным, представленным в этой статье, если не указано иное.
Отказ от права Creative Commons на общественное достояние (http://creativecommons.org/publicdomain/zero/1.0/) применяется к данным, представленным в этой статье, если не указано иное.
Перепечатки и разрешения
Об этой статье
Синхронный колоректальный рак: обзор клинических особенностей, диагностики, лечения и прогноза — FullText — Пищеварительная хирургия 2011, Vol. 28, No. 5-6
Предпосылки/цели: С развитием технологий ранней диагностики можно клинически выявить больше синхронных колоректальных раков (SCRCs). Хотя SCRC признаны важным клиническим заболеванием, их клинические особенности, диагностика, лечение и прогноз еще окончательно не установлены. Чтобы получить всестороннее представление об этом заболевании и создать эффективный профиль, по которому можно распознать лиц с высоким риском развития SCRC, мы провели обзор соответствующей литературы. Методы: В базе данных PubMed был проведен поиск публикаций о «синхронной колоректальной карциноме/раке/аденокарциноме» и «множественной колоректальной карциноме». Были рассмотрены все публикации до января 2011 г., после чего для включения в этот обзор были отобраны только статьи на английском языке. Результаты: Было обнаружено, что заболеваемость SCRC выше у пожилых пациентов и пациентов мужского пола. Прогноз у пациентов с ПКР был эквивалентен таковому у пациентов с солитарным КРР. Отсутствие диагностики синхронных поражений до и во время операции было связано с повторным вмешательством. Заключение: SCRC обладают отличительными чертами по сравнению с одиночными CRC. В то время как все пациенты с колоректальным раком должны быть тщательно обследованы, чтобы исключить наличие сопутствующих аденом толстой кишки, поскольку пропущенные поражения могут привести к дополнительной операции и плохому прогнозу, особое внимание следует уделять группе высокого риска — пожилым пациентам мужского пола.
Были рассмотрены все публикации до января 2011 г., после чего для включения в этот обзор были отобраны только статьи на английском языке. Результаты: Было обнаружено, что заболеваемость SCRC выше у пожилых пациентов и пациентов мужского пола. Прогноз у пациентов с ПКР был эквивалентен таковому у пациентов с солитарным КРР. Отсутствие диагностики синхронных поражений до и во время операции было связано с повторным вмешательством. Заключение: SCRC обладают отличительными чертами по сравнению с одиночными CRC. В то время как все пациенты с колоректальным раком должны быть тщательно обследованы, чтобы исключить наличие сопутствующих аденом толстой кишки, поскольку пропущенные поражения могут привести к дополнительной операции и плохому прогнозу, особое внимание следует уделять группе высокого риска — пожилым пациентам мужского пола.
Введение и методы
Колоректальный рак (КРР) является одним из наиболее распространенных видов рака желудочно-кишечного тракта в современном мире. Исторически КРР относительно редко встречался у азиатов, но недавнее социально-экономическое развитие и адаптация к западному образу жизни в Азиатско-Тихоокеанском регионе сопровождались значительным увеличением заболеваемости КРР. Кроме того, синхронный колоректальный рак (SCRCs) [1] также вырос во всем мире, бросая вызов современным стратегиям лечения и неблагоприятно влияя на общий прогноз CRC.
Исторически КРР относительно редко встречался у азиатов, но недавнее социально-экономическое развитие и адаптация к западному образу жизни в Азиатско-Тихоокеанском регионе сопровождались значительным увеличением заболеваемости КРР. Кроме того, синхронный колоректальный рак (SCRCs) [1] также вырос во всем мире, бросая вызов современным стратегиям лечения и неблагоприятно влияя на общий прогноз CRC.
Критерии Уоррена и Гейтса были установлены для клинической диагностики SCRC [2] на основе патологических данных при биопсии CRC. Эти критерии широко используются и включают следующие ключевые элементы: (1) каждая опухоль должна представлять определенную картину злокачественности; (2) каждая опухоль должна быть отличной; (3) должна быть исключена вероятность того, что один является метастазом другого, и (4) синхронные поражения должны быть диагностированы одновременно или в течение 6 месяцев после первоначального диагноза [3]. В SCRC наиболее распространенный рак (определяемый по стадии опухоли TNM) обычно обозначается как индексный рак; менее запущенные формы рака (с более низкой стадией TNM) затем рассматриваются как сопутствующие поражения индексного рака. В случаях SCRC с двумя или более поражениями на идентичной патологической стадии самое большое поражение обозначается как индексный рак [4].
В случаях SCRC с двумя или более поражениями на идентичной патологической стадии самое большое поражение обозначается как индексный рак [4].
Несмотря на растущую заболеваемость SCRC, очень мало известно о его факторах риска и прогнозе. Всесторонний обзор профиля SCRC, включая характеристики пациентов, характеристики поражений, методы лечения и исходы, не только поможет клиницистам более легко выявлять пациентов с высоким риском и разрабатывать более эффективные стратегии лечения, но и поможет исследователям направить усилия по выяснению лежащих в основе молекулярные механизмы патогенеза ПКРК. С этой целью мы просмотрели все журнальные статьи в PubMed по ключевым словам «синхронная колоректальная карцинома/рак/аденокарцинома» и «множественные колоректальные карциномы», опубликованные до января 2011 года. Всего была выявлена 71 статья. Этот список был ограничен только статьями на английском языке, в результате чего было исключено 11 статей. После поиска и просмотра оставшихся статей еще 15 были исключены, поскольку при ближайшем рассмотрении их содержание не имело отношения к данному обзору. Стратегия отбора показана на рисунке 1. Наконец, в этот обзор было включено 45 статей, 10 из которых сведены в таблицу 19.0003
Стратегия отбора показана на рисунке 1. Наконец, в этот обзор было включено 45 статей, 10 из которых сведены в таблицу 19.0003
Таблица 1
Список основных исследований ПКРК
Рис. 1
Блок-схема выбора статей.
SCRC Эпидемиология
Распространенность
Согласно сообщениям, распространенность SCRC колеблется от 2,3 до 12,4% [5,6]. Оценки распространенности относительно широки из-за того, что в литературе нет последовательного определения синхронных событий, которым можно было бы руководствоваться при исследованиях. В некоторых исследованиях «синхронный» определяется как вторая карцинома, диагностированная менее чем через 6 месяцев после постановки диагноза основной опухоли [3,7,8,9].,10], в то время как другие определяли его как карциному, возникающую через 1 год и более после первоначального диагноза [4,11,12,13]. Кроме того, популяции SCRC значительно различались по размеру, клиническим и демографическим характеристикам между исследованиями, и периоды исследований также были очень разными.
В более ранних исследованиях понятия «синхронный» и «метахронный» еще не были полностью разграничены, и в результате их часто смешивали в анализе, что приводило к переоценке синхронной заболеваемости. Со временем достижения в технологиях визуализации и диагностических процедурах привели к более частому и более раннему обнаружению поражений; например, колоноскопия более эффективна, чем ирригоскопия, для выявления SCRC [10], и ее широкое применение совпало с расширением диагностики. Тем не менее, самые последние оценки заболеваемости по-прежнему считаются неточными, поскольку не все опухоли обнаруживаются клинически, а количество соответствующих популяционных исследований все еще относительно невелико.
Возраст
Предыдущие исследования не пришли к единому мнению о взаимосвязи между возрастом и частотой SCRC. Некоторые авторы указали, что пациенты с SCRC были старше, чем пациенты с CRC [6,14,15], в то время как другие обнаружили, что SCRC чаще присутствовал у более молодых пациентов [3,16]. Однако еще три недавних исследования пришли к выводу, что не было существенной разницы в возрасте лиц с CRC и с SCRC [4,12,17]. Возможно, что в более ранних исследованиях опора на базовые статистические подходы ограничивала их возможности в определении связи возраста с ПКРК. Когда Фукацу и др. [17] расслоили 249Пациенты SCRC в своем исследовании по локализации опухоли обнаружили, что пациенты с синхронным поражением правой или обеих сторон ободочной кишки были значительно старше, чем пациенты с поражением левой толстой кишки (правая/оба против левой: 71,9 ± 9,1/69,4). ± 9,5 против 64,4 ± 11,0 лет, p < 0,0167). Аналогичным образом, когда Latournerie et al. [10] исследовали сложные ассоциации факторов риска с SCRC с использованием передовых статистических подходов, включая многомерную логистическую регрессию, они обнаружили, что у пациентов в возрасте 75 лет и старше вероятность развития SCRC выше, чем у более молодых пациентов (отношение шансов: 1,31).
Однако еще три недавних исследования пришли к выводу, что не было существенной разницы в возрасте лиц с CRC и с SCRC [4,12,17]. Возможно, что в более ранних исследованиях опора на базовые статистические подходы ограничивала их возможности в определении связи возраста с ПКРК. Когда Фукацу и др. [17] расслоили 249Пациенты SCRC в своем исследовании по локализации опухоли обнаружили, что пациенты с синхронным поражением правой или обеих сторон ободочной кишки были значительно старше, чем пациенты с поражением левой толстой кишки (правая/оба против левой: 71,9 ± 9,1/69,4). ± 9,5 против 64,4 ± 11,0 лет, p < 0,0167). Аналогичным образом, когда Latournerie et al. [10] исследовали сложные ассоциации факторов риска с SCRC с использованием передовых статистических подходов, включая многомерную логистическую регрессию, они обнаружили, что у пациентов в возрасте 75 лет и старше вероятность развития SCRC выше, чем у более молодых пациентов (отношение шансов: 1,31).
Пол
Как показано в таблице 2, несколько исследований показали, что мужчины подвержены более высокому риску ПКРК [4,7,8,9,10,11,12,17,18]. В качестве крупнейшего исследования за последние годы Latournerie et al. [10] определили, что соотношение мужчин и женщин в SCRCs было 1,85, тогда как в CRC оно было 1,22 (p <0,001). Оя и др. [4] также сообщили об аналогичном преобладании мужчин в случаях SCRC, но наблюдали еще более высокое соотношение в своей исследуемой популяции (p = 0,018). Фукацу и др. [17] также определили, что поражения у пациентов мужского пола в основном возникают в левой части толстой кишки или двусторонне; однако поражения, возникшие исключительно в правой части толстой кишки, не были связаны с предрасположенностью мужчин или женщин. Их анализ показал, что мужской пол был значительным фактором риска только для тех, у кого обе опухоли располагались в левой части толстой кишки [17]. До сих пор не было ясного объяснения этому явлению.
В качестве крупнейшего исследования за последние годы Latournerie et al. [10] определили, что соотношение мужчин и женщин в SCRCs было 1,85, тогда как в CRC оно было 1,22 (p <0,001). Оя и др. [4] также сообщили об аналогичном преобладании мужчин в случаях SCRC, но наблюдали еще более высокое соотношение в своей исследуемой популяции (p = 0,018). Фукацу и др. [17] также определили, что поражения у пациентов мужского пола в основном возникают в левой части толстой кишки или двусторонне; однако поражения, возникшие исключительно в правой части толстой кишки, не были связаны с предрасположенностью мужчин или женщин. Их анализ показал, что мужской пол был значительным фактором риска только для тех, у кого обе опухоли располагались в левой части толстой кишки [17]. До сих пор не было ясного объяснения этому явлению.
Таблица 2
Распределение пациентов с SCRC и CRC по полу в крупных исследованиях
Патологические характеристики
Количество и расположение поражений
Большинство SCRC состоят из 2 поражений, но у некоторых пациентов их 3 или даже 4. В исключительный случай, Kaibara et al. [11] сообщили о пациенте с 7 одновременными видами рака толстой кишки. При сравнении локализации SCRC и отдельных карцином в большинстве исследований было обнаружено, что SCRC чаще локализуются в правой толстой кишке [12,15,19].]. Однако Оя и соавт. [4] и Finan et al. [20] сообщили о преобладании в левой части толстой кишки. Расположение индекса и одновременного поражения важны, поскольку они могут повлиять на стратегию лечения; например, если поражения расположены далеко друг от друга, может потребоваться более обширная резекция. Пассман и др. [15] обнаружили, что у большинства пациентов (63,8%; 102/160) поражения локализовались в разных сегментах толстой кишки. В исследовании Kaibara et al. [11], однако, получили противоположные результаты: 62,5% (405/648) пациентов имели поражения в одном и том же сегменте и только 2,3% (15/648) поражений располагались в совершенно разных сегментах. Латурнери и др. [10] также обнаружили, что у большего числа пациентов были поражения в одном и том же сегменте толстой кишки, но процент не был таким отличительным от пациентов с другим расположением сегмента (54 против 46% соответственно).
В исключительный случай, Kaibara et al. [11] сообщили о пациенте с 7 одновременными видами рака толстой кишки. При сравнении локализации SCRC и отдельных карцином в большинстве исследований было обнаружено, что SCRC чаще локализуются в правой толстой кишке [12,15,19].]. Однако Оя и соавт. [4] и Finan et al. [20] сообщили о преобладании в левой части толстой кишки. Расположение индекса и одновременного поражения важны, поскольку они могут повлиять на стратегию лечения; например, если поражения расположены далеко друг от друга, может потребоваться более обширная резекция. Пассман и др. [15] обнаружили, что у большинства пациентов (63,8%; 102/160) поражения локализовались в разных сегментах толстой кишки. В исследовании Kaibara et al. [11], однако, получили противоположные результаты: 62,5% (405/648) пациентов имели поражения в одном и том же сегменте и только 2,3% (15/648) поражений располагались в совершенно разных сегментах. Латурнери и др. [10] также обнаружили, что у большего числа пациентов были поражения в одном и том же сегменте толстой кишки, но процент не был таким отличительным от пациентов с другим расположением сегмента (54 против 46% соответственно).
Характеристики синхронных поражений
Сравнение SCRC и CRC
Oya et al. [4] изучили 876 хирургически резецированных первичных колоректальных карцином, и их исследование было единственным, специально сравнивавшим SCRCs с CRC. Они обнаружили, что синхронные карциномы были значительно меньше по размеру (p < 0,001), чаще локализовались в левой части толстой кишки (p = 0,001), реже проникали в стенку (p < 0,001) и чаще встречались на поздних стадиях поражения (p = 0,003). ), чем CRC.
Сравнение индексных поражений и сопутствующих поражений в SCRC
Указательное поражение клинически определяется как патологически наиболее распространенное поражение. В четырех исследованиях конкретно сообщалось о характеристиках, отличающих индексное поражение от сопутствующих поражений [4,12,20]. Неудивительно, что первичные поражения обычно были больше по размеру, чаще были умеренно дифференцированными, более глубоко проникали и чаще имели изъязвленную морфологию, чем сопутствующие поражения. Кроме того, в одном исследовании сообщалось, что лимфатическая инвазия также чаще встречалась при основных поражениях, чем при сопутствующих поражениях [4].
Кроме того, в одном исследовании сообщалось, что лимфатическая инвазия также чаще встречалась при основных поражениях, чем при сопутствующих поражениях [4].
Сравнение индексных поражений SCRC и CRC
Oya et al. [4] провели сравнение индекса поражения ПКРК и КРР, чтобы определить, существуют ли различия в ключевых особенностях опухолевой патологии, которые могли бы служить диагностическими или прогностическими маркерами. Хотя авторы не обнаружили различий в размере, дифференциации, локализации, патологической стадии, морфологии или лимфатической инвазии, они обнаружили, что отдаленные метастазы и венозная инвазия чаще встречались в индексных поражениях синхронных случаев.
Частота сопутствующих аденом
В большинстве исследований сообщалось, что частота сопутствующих аденом была значительно выше у пациентов с SCRC, чем у пациентов с солитарным раком [3,12,13,21]. Латурнери и др. [10] сообщили, что 34,1% пациентов с SCRC имели аденомы по сравнению с 19,1% пациентов с одиночным раком. Они также показали, что пациенты с SCRC, у которых обе опухоли находились в правой части толстой кишки, вероятно, имели сопутствующие аденомы в правой части. Точно так же, если обе опухоли были в левой толстой кишке, аденомы имели тенденцию возникать в левой толстой кишке. Эверс и др. [3] также обнаружили, что в SCRC 52% имели остатки аденомы; этот результат был аналогичен выводам Latournerie et al. [10] при патологоанатомическом исследовании, которое выявило аденоматозные остатки в 24,3% SCRC, но только в 12,7% случаев одиночного рака. Эти данные в совокупности подтверждают гипотезу о последовательности аденомы-карциномы при ПКРК. Таким образом, пациенты с полипами аденомы или ранней карциномы в анамнезе должны быть тщательно обследованы на SCRC при обнаружении новых поражений толстой кишки, как предложено Cunliffe et al. [6].
Они также показали, что пациенты с SCRC, у которых обе опухоли находились в правой части толстой кишки, вероятно, имели сопутствующие аденомы в правой части. Точно так же, если обе опухоли были в левой толстой кишке, аденомы имели тенденцию возникать в левой толстой кишке. Эверс и др. [3] также обнаружили, что в SCRC 52% имели остатки аденомы; этот результат был аналогичен выводам Latournerie et al. [10] при патологоанатомическом исследовании, которое выявило аденоматозные остатки в 24,3% SCRC, но только в 12,7% случаев одиночного рака. Эти данные в совокупности подтверждают гипотезу о последовательности аденомы-карциномы при ПКРК. Таким образом, пациенты с полипами аденомы или ранней карциномы в анамнезе должны быть тщательно обследованы на SCRC при обнаружении новых поражений толстой кишки, как предложено Cunliffe et al. [6].
Потенциальные факторы риска
В нескольких исследованиях изучались потенциальные факторы риска развития ПКРК. Кимура и др. [16], в частности, исследовали связь между семейным анамнезом рака и частотой синхронных поражений, но не обнаружили значимой корреляции между ними. Борда и др. [22] исследовали потенциальный вклад индекса массы тела (ИМТ) и определили, что ИМТ <21 может выступать защитным фактором против синхронных поражений. Однако эта корреляция была потеряна в более детальном статистическом анализе, когда полы были стратифицированы, и предполагалось, что общий более низкий ИМТ у женщин из их исследуемой популяции мог повлиять на первоначальный вывод. Потребление табака и алкоголя оценивалось в нескольких исследованиях CRC и считается фактором риска развития CRC. Когда Борда и др. [22] исследовали обе привычки в отношении SCRC, они обнаружили, что эти привычки были статистически связаны с мужским полом, но не с синхронными поражениями. Маэкава и др. [23], однако, сообщили, что если накопленное количество алкоголя (средненедельное количество алкоголя, умноженное на годы употребления алкоголя) превышало 9,800, риск ПКРК был примерно в 6,8 раза выше, чем у непьющих; на эту связь не влиял тип потребляемых алкогольных напитков. Биологические механизмы связанного с алкоголем канцерогенеза в значительной степени не определены, но прием алкоголя может сделать всю слизистую оболочку толстой кишки нестабильной, делая ее в целом более восприимчивой к злокачественным изменениям [23].
Борда и др. [22] исследовали потенциальный вклад индекса массы тела (ИМТ) и определили, что ИМТ <21 может выступать защитным фактором против синхронных поражений. Однако эта корреляция была потеряна в более детальном статистическом анализе, когда полы были стратифицированы, и предполагалось, что общий более низкий ИМТ у женщин из их исследуемой популяции мог повлиять на первоначальный вывод. Потребление табака и алкоголя оценивалось в нескольких исследованиях CRC и считается фактором риска развития CRC. Когда Борда и др. [22] исследовали обе привычки в отношении SCRC, они обнаружили, что эти привычки были статистически связаны с мужским полом, но не с синхронными поражениями. Маэкава и др. [23], однако, сообщили, что если накопленное количество алкоголя (средненедельное количество алкоголя, умноженное на годы употребления алкоголя) превышало 9,800, риск ПКРК был примерно в 6,8 раза выше, чем у непьющих; на эту связь не влиял тип потребляемых алкогольных напитков. Биологические механизмы связанного с алкоголем канцерогенеза в значительной степени не определены, но прием алкоголя может сделать всю слизистую оболочку толстой кишки нестабильной, делая ее в целом более восприимчивой к злокачественным изменениям [23].
Генетический анализ
Молекулярное объяснение SCRC не определено. Однако генетические события, лежащие в основе CRC, были тщательно изучены, и CRC можно разделить на три различных фенотипа. Хромосомная нестабильность означает опухоли с частыми кариотипическими аномалиями и хромосомными приобретениями и потерями. Микросателлитная нестабильность (MSI) обозначает опухоли с измененной длиной коротких последовательностей нуклеотидных повторов. Наконец, фенотип метилирования CpG-островков (CIMP) обозначает опухоли, в которых инактивация транскрипции произошла за счет эпигенетического механизма метилирования цитозина в промоторах генов-супрессоров опухолей. Было показано, что каждая из этих генетических особенностей играет важную роль в патологических и биологических характеристиках CRC [24].
Одним из наиболее важных генов-супрессоров опухолей является p53. Этот ген считается наиболее распространенным генетическим изменением в новообразованиях человека. Эгучи и др. [25] обнаружили, что в SCRC мутации p53 при левосторонней и ректальной карциномах отличались от таковых при правосторонней карциноме (p = 0,04), подтверждая идею о том, что SCRC могут иметь мультицентрическое происхождение [26]. Кроме того, Yalcinkaya et al. [27] показали, что экспрессия p53 в SCRC тесно связана с агрессивностью и плохим прогнозом; в частности, аденокарциномы с плохой дифференцировкой и более глубокой инвазией имели более высокую экспрессию р53.
Кроме того, Yalcinkaya et al. [27] показали, что экспрессия p53 в SCRC тесно связана с агрессивностью и плохим прогнозом; в частности, аденокарциномы с плохой дифференцировкой и более глубокой инвазией имели более высокую экспрессию р53.
Гонсало и др. [28] обнаружили, что статус метилирования промотора гена был связан с SCRC, особенно в генах MGMT1, MGMT2 и RASSF1A. Ношо и др. [29] также показали, что SCRCs чаще содержали мутации в сигнальном гене клеточного цикла BRAF (p = 0,0041), в основном были CIMP (≥6/8 метилированных промоторов с использованием 8-маркерной панели CIMP, p = 0,013) и имели высокие уровни метилирования на длинных перемежающихся последовательностях ретротранспозона ядерного элемента-1 (p = 0,0072) и на CpG-островках (p <0,0001).
Педрони и др. [30] сообщили о 32% MSI в SCRC, аналогично 32% заболеваемости MSI, о которой сообщалось в исследовании Dykes et al. [31]. Ношо и др. [29] также обнаружили, что фенотип MSI-high, определяемый как наличие нестабильности в ≥30% маркеров, чаще встречается при SCRC (p = 0,037). Эти данные свидетельствуют о том, что фенотип MSI чаще встречается при поражениях SCRC, чем при одиночных поражениях. Однако Брюкл и соавт. [32] сообщили, что только 10% пациентов с SCRC были охарактеризованы как MSI. Таким образом, фенотип MSI может фактически описывать еще не распознанный подтип патологии SCRC или пациентов.
Эти данные свидетельствуют о том, что фенотип MSI чаще встречается при поражениях SCRC, чем при одиночных поражениях. Однако Брюкл и соавт. [32] сообщили, что только 10% пациентов с SCRC были охарактеризованы как MSI. Таким образом, фенотип MSI может фактически описывать еще не распознанный подтип патологии SCRC или пациентов.
Диагностика
Предоперационная или интраоперационная диагностика SCRC очень важна. Отсутствие диагностики приводит к ошибкам в лечении и неблагоприятному прогнозу. Важно тщательно пальпировать всю толстую кишку до окончания операции по поводу CRC, чтобы можно было избежать ошибочного диагноза ПКРК. Однако, к сожалению, такая интраоперационная пальпация относительно нечувствительна и связана с более чем 50% неудач в обнаружении поражений ПКРК [33], особенно когда опухоль находится на более ранней гистологической стадии [34]. По этой причине перед операцией необходимо полное клиническое и рентгенологическое обследование. В начале 19В 70-х годах обследование больных с толстокишечными симптомами в основном основывалось на ирригоскопии и ригидной ректороманоскопии. Однако за последние несколько лет произошли важные изменения в диагностических процедурах CRC. Рекомендуется широкое использование предоперационной колоноскопии для тщательной оценки статуса колоректального рака и содействия выявлению ПКРК. Кайбара и др. [11] сообщили о 60,1% частоте предоперационной диагностики ПКР с помощью двойного контрастирования с барием или колоноскопии, тогда как Takeuchi et al. [8] сообщили, что использование обоих методов привело к общей предоперационной точности 77,8%. Однако ни один из этих показателей диагностики не был оптимальным, и неприемлемое количество SCRC остается недиагностированным.
Однако за последние несколько лет произошли важные изменения в диагностических процедурах CRC. Рекомендуется широкое использование предоперационной колоноскопии для тщательной оценки статуса колоректального рака и содействия выявлению ПКРК. Кайбара и др. [11] сообщили о 60,1% частоте предоперационной диагностики ПКР с помощью двойного контрастирования с барием или колоноскопии, тогда как Takeuchi et al. [8] сообщили, что использование обоих методов привело к общей предоперационной точности 77,8%. Однако ни один из этих показателей диагностики не был оптимальным, и неприемлемое количество SCRC остается недиагностированным.
Клизма с барием может не поставить диагноз, поскольку визуализация опухоли может быть затруднена кровотечением или неадекватной подготовкой кишечника и задержкой кала. Наличие кольцевидной карциномы также может мешать препаративной очистке и прохождению бария через поражение, эффективно маскируя проксимальные поражения. При колоноскопии качество обзора в большинстве случаев лучше, но хорошая подготовка толстой кишки по-прежнему важна. Однако скиррозный рак может препятствовать прохождению эндоскопа через просвет и препятствовать обнаружению дополнительных поражений.
Однако скиррозный рак может препятствовать прохождению эндоскопа через просвет и препятствовать обнаружению дополнительных поражений.
До сих пор ведутся споры о том, какое обследование лучше для полного выявления SCRC. В настоящее время виртуальная колоноскопия стала жизнеспособным альтернативным методом оценки всего толстого кишечника. КТ-колонография особенно ценна у пациентов со стенозом или удлинением толстой кишки, что приводит к неполной колоноскопии. Он не только полезен при оценке проксимального отдела кишечника, но также может предоставить хирургам точную информацию о стадии и локализации опухоли [35,36]. Сообщалось, что другие технические достижения, такие как магнитно-резонансная колонография [37] и комбинация КТ-колонографии с ПЭТ [38], являются полезными инструментами для предоперационной оценки ПКР. Интраоперационная эндоскопия является еще одним доступным методом полного обследования толстой и прямой кишки в случаях, когда предоперационная колоноскопия невозможна, например, в экстренных ситуациях. Хотя этот подход дает достаточные результаты, он занимает много времени и затрудняет закрытие брюшной полости, поскольку кишка наполняется воздухом [39].].
Хотя этот подход дает достаточные результаты, он занимает много времени и затрудняет закрытие брюшной полости, поскольку кишка наполняется воздухом [39].].
Вариант лечения и прогноз
Хирургическая резекция является основным методом лечения SCRC. Пассман и др. [15] рекомендовали пациентам с поражением соседних сегментов выполнять более обширную резекцию, включающую в некоторых случаях удаление проксимальных отделов кишечника и местных лимфатических узлов. До сих пор ведутся споры о том, как лучше всего лечить синхронные поражения в отдельных сегментах. Некоторые авторы предлагают выполнять тотальную или субтотальную колэктомию [9].,14,40,41], потому что, если во время операции пропустить синхронные поражения, пациенту, возможно, вскоре придется перенести повторную операцию, и поражения, вероятно, перейдут в патологическую стадию и будут связаны с более плохим прогнозом. 4]. Некоторые авторы предложили использовать обширные процедуры, такие как проктоколэктомия с J-образным илеоанальным анастомозом, тотальная абдоминальная колэктомия с илеоректальным анастомозом и проктосигмоидэктомия с колоанальным анастомозом [33].
Некоторыми была предложена более консервативная тактика, состоящая из множественных сегментарных резекций, направленных на сохранение нормальной толстой кишки [19]. Причины такого подхода заключаются в том, что субтотальная колэктомия может увеличить частоту стула, а синхронные анастомозы толстой кишки, по-видимому, не связаны с повышенным риском осложнений [42]. На основании имеющихся данных представляется, что, когда общее состояние пациента подходит для проведения операции или когда пациент подвергается повышенному риску анастомотических осложнений, например, в случаях недоедания, иммуносупрессии или сепсиса, субтотальная колэктомия представляется оправданной. выбор [34,40,42]. В некоторых сообщениях авторы лечили рак прямой кишки T1 с помощью SCRC с помощью трансанальной эндоскопической микрохирургии перед выполнением радикальной операции по поводу второго поражения [43]. В другом сообщении лапароскопическая тотальная абдоминальная колэктомия с одним разрезом с илеоректальным анастомозом и интраоперационным СО 2 колоноскопия была успешно выполнена пациенту с ПКРК слепой и сигмовидной кишки [44].
Ожидаемые показатели 5-летней выживаемости пациентов с SCRC все еще остаются спорными. В то время как одно исследование показало более высокую выживаемость у пациентов с SCRC [45], другие продемонстрировали, что пациенты с первичными опухолями единственной толстой кишки имеют больше шансов выжить [4,41]. В первом проспективном исследовании, проведенном с целью устранения источников значительной систематической ошибки, которая неизбежно присутствовала в ретроспективных исследованиях случай-контроль, Nosho et al. [29] показали, что случаи SCRC были значительно связаны с плохим прогнозом. Считается, что неблагоприятный прогноз ПКР обусловлен, главным образом, относительно частым отдаленным метастазированием, возникающим в синхронных случаях [4]. Однако еще больше исследований показали, что нет никакой разницы в выживаемости между ПКР и КРР, когда патологические стадии опухолей были идентичными, а резекции были излечивающими [7, 10, 12, 15, 16, 19, 21].
Заключение
С развитием технологий ранней диагностики было диагностировано больше ПКРК. По сравнению с одиночным CRC, SCRC обладают отличительными чертами. Они должны быть полностью исследованы в предоперационном клиническом обследовании, чтобы избежать возможности того, что дополнительные поражения останутся незамеченными и не будут удалены. Пожилые пациенты мужского пола с одновременными аденомами в толстой кишке подвергаются особенно высокому риску ПКРК, и им следует уделять пристальное внимание. Объем хирургической резекции зависит от локализации и количества поражений. Резецируемая область должна включать в себя достаточную длину кишечника и регионарные лимфатические узлы, чтобы зафиксировать любое местное распространение, тем самым защищая от рецидива или последующего злокачественного изменения. Конечно, необходимо полностью выяснить механизмы формирования мультицентричности, чтобы получить представление о генезисе и развитии SCRC, что в конечном итоге принесет пользу молекулярной терапии и улучшит выживаемость пациентов.
По сравнению с одиночным CRC, SCRC обладают отличительными чертами. Они должны быть полностью исследованы в предоперационном клиническом обследовании, чтобы избежать возможности того, что дополнительные поражения останутся незамеченными и не будут удалены. Пожилые пациенты мужского пола с одновременными аденомами в толстой кишке подвергаются особенно высокому риску ПКРК, и им следует уделять пристальное внимание. Объем хирургической резекции зависит от локализации и количества поражений. Резецируемая область должна включать в себя достаточную длину кишечника и регионарные лимфатические узлы, чтобы зафиксировать любое местное распространение, тем самым защищая от рецидива или последующего злокачественного изменения. Конечно, необходимо полностью выяснить механизмы формирования мультицентричности, чтобы получить представление о генезисе и развитии SCRC, что в конечном итоге принесет пользу молекулярной терапии и улучшит выживаемость пациентов.
Авторское право: Все права защищены. Никакая часть данной публикации не может быть переведена на другие языки, воспроизведена или использована в любой форме и любыми средствами, электронными или механическими, включая фотокопирование, запись, микрокопирование или любую систему хранения и поиска информации, без письменного разрешения издателя. .
Никакая часть данной публикации не может быть переведена на другие языки, воспроизведена или использована в любой форме и любыми средствами, электронными или механическими, включая фотокопирование, запись, микрокопирование или любую систему хранения и поиска информации, без письменного разрешения издателя. .
Дозировка препарата: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор препарата и дозировка, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации. Тем не менее, в связи с продолжающимися исследованиями, изменениями в правительственных постановлениях и постоянным потоком информации, касающейся лекарственной терапии и реакций на лекарства, читателю настоятельно рекомендуется проверять вкладыш в упаковке для каждого лекарства на предмет любых изменений в показаниях и дозировке, а также для дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендуемый агент является новым и/или редко используемым лекарственным средством.
Отказ от ответственности: заявления, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и участникам, а не издателям и редакторам. Появление рекламы и/или ссылок на продукты в публикации не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор(ы) отказываются от ответственности за любой ущерб, нанесенный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в содержании или рекламе.
Персонализированное картирование развития опухоли у пациентов с синхронным колоректальным раком
Реферат
Синхронный колоректальный рак (сиКРР) — это две или более первичные опухоли, выявленные одновременно у пациента. Предыдущие исследования сообщают о высокой межопухолевой гетерогенности syCRC, предполагая независимое происхождение и различную реакцию на лечение, что делает их лечение особенно сложным, при этом в настоящее время нет конкретных руководств. Здесь мы провели углубленный биоинформатический анализ геномных и транскриптомных данных одиннадцати syCRC и одного метахронного CRC, собранных у трех пациентов. Мы обнаружили смешанный микросателлитный статус между пациентами и внутри них. Перекрытие мутаций между синхронными опухолями было неизменно низким (<0,5%), а гетерогенность драйверных событий в syCRC была высокой у всех пациентов. Микробиологический анализ показал наличие видов Fusobacterium nucleatum у пациентов с опухолями MSI, в то время как количественная оценка иммунной инфильтрации опухоли показала различные иммунные ответы между syCRC. Наши результаты свидетельствуют о высокой гетерогенности syCRC у пациентов, но обнаруживают клинически действенные биомаркеры, которые помогают прогнозировать ответ на доступные в настоящее время таргетные методы лечения. Наше исследование подчеркивает важность персонализированного секвенирования генома и транскриптома всех синхронных поражений, чтобы помочь принять решение о терапии и улучшить ведение пациентов с сиКРР.
Здесь мы провели углубленный биоинформатический анализ геномных и транскриптомных данных одиннадцати syCRC и одного метахронного CRC, собранных у трех пациентов. Мы обнаружили смешанный микросателлитный статус между пациентами и внутри них. Перекрытие мутаций между синхронными опухолями было неизменно низким (<0,5%), а гетерогенность драйверных событий в syCRC была высокой у всех пациентов. Микробиологический анализ показал наличие видов Fusobacterium nucleatum у пациентов с опухолями MSI, в то время как количественная оценка иммунной инфильтрации опухоли показала различные иммунные ответы между syCRC. Наши результаты свидетельствуют о высокой гетерогенности syCRC у пациентов, но обнаруживают клинически действенные биомаркеры, которые помогают прогнозировать ответ на доступные в настоящее время таргетные методы лечения. Наше исследование подчеркивает важность персонализированного секвенирования генома и транскриптома всех синхронных поражений, чтобы помочь принять решение о терапии и улучшить ведение пациентов с сиКРР.
Введение
Колоректальный рак (КРР) является третьим наиболее часто диагностируемым злокачественным новообразованием и четвертой ведущей причиной смерти от рака во всем мире 1 . Основной проблемой при лечении этого заболевания является его высокая внутри- и межопухолевая гетерогенность, которая развивается за счет множественных генетических и эпигенетических путей нестабильности генома, каждый из которых вносит свои особенности в геном опухоли 2,3,4 . CRC различаются по своим связанным с раком драйверным мутациям, которые можно найти в ряде генов, таких как КРАС и BRAF 5 . Около 15% CRC приобретают аномалии в генах репарации несоответствия ДНК (MMR), которые приводят к микросателлитной нестабильности (MSI) 6,7 . MSI, как правило, взаимоисключающий с хромосомной нестабильностью (CIN), которая составляет большинство поражений 8,9 . CRC также различаются по составу микробиома: некоторые из них обогащены Fusobacterium nucleatum и уменьшаются в размерах после лечения антибиотиками 10 . Знание о статусе указанных признаков рака дает биомаркеры, которые предсказывают его реакцию на таргетную терапию, например, Статус дикого типа KRAS для анти-EGFR терапии, Статус мутанта BRAF для комбинированной Ингибирующей терапии BRAF и MEK , статус MSI для иммунотерапии, высокий CIN для комбинированной терапии VEGF-A и Fusobacterium -нагрузка для антимикробное вмешательство 10,11,12,13,14,15,16,17,18,19,20,21 . Однако, как и в случае подмножества KRAS опухолей дикого типа, которые не реагируют на анти-EGFR терапию 22 , не все случаи ведут себя аналогично, указывая на необходимость множественных биомаркеров для улучшения лечения. Недавние исследования показывают, что различные молекулярные характеристики, прогноз и результаты лечения КРР также различаются в зависимости от локализации опухоли 22 и иммунный контекст опухоли 23,24 . Дальнейшие усилия по продвижению целевого вмешательства были сосредоточены на субтипировании CRC на основе профилей экспрессии генов и привели к двум основным классификаторам: консенсусным молекулярным подтипам и внутренним подтипам CRC, оба из которых обладают значительным потенциалом для дальнейшего диагностического значения 25,26 .
Знание о статусе указанных признаков рака дает биомаркеры, которые предсказывают его реакцию на таргетную терапию, например, Статус дикого типа KRAS для анти-EGFR терапии, Статус мутанта BRAF для комбинированной Ингибирующей терапии BRAF и MEK , статус MSI для иммунотерапии, высокий CIN для комбинированной терапии VEGF-A и Fusobacterium -нагрузка для антимикробное вмешательство 10,11,12,13,14,15,16,17,18,19,20,21 . Однако, как и в случае подмножества KRAS опухолей дикого типа, которые не реагируют на анти-EGFR терапию 22 , не все случаи ведут себя аналогично, указывая на необходимость множественных биомаркеров для улучшения лечения. Недавние исследования показывают, что различные молекулярные характеристики, прогноз и результаты лечения КРР также различаются в зависимости от локализации опухоли 22 и иммунный контекст опухоли 23,24 . Дальнейшие усилия по продвижению целевого вмешательства были сосредоточены на субтипировании CRC на основе профилей экспрессии генов и привели к двум основным классификаторам: консенсусным молекулярным подтипам и внутренним подтипам CRC, оба из которых обладают значительным потенциалом для дальнейшего диагностического значения 25,26 .
Примерно у 4% пациентов с КРР развиваются множественные первичные колоректальные опухоли, диагностированные одновременно или в течение 6 месяцев друг от друга, известные как синхронные КРР (сиКРР) 27,28 . Известные предрасполагающие генетические состояния являются причиной только около 10% syCRC 27 , что позволяет предположить участие других генетических и экологических факторов риска. Предыдущие исследования syCRC показали высокую гетерогенность вариантов между синхронными опухолями, с различными мутациями, происходящими в известных генах CRC, и различиями между содержанием сигнатуры опухоли, количеством иммунных клеток и статусом MSI 29,30,31,32 . Хотя прогноз пациентов с сиКРР, по-видимому, существенно не отличается от прогноза пациентов с солитарным КРР 30,33 , понимание механизмов, связанных с этим явлением, все еще ограничено, и в настоящее время нет конкретных руководств по ведению и лечению синхронных случаев.
Здесь мы провели углубленную характеристику 12 опухолей у 3 пациентов с syCRC (таблица 1) путем анализа данных гистопатологического секвенирования всего генома (WGS) и секвенирования РНК. Мы оценили степень генетического перекрытия между синхронными опухолями и изучили ассоциации между клинико-патологической информацией и молекулярными, микробными и иммунными особенностями генома каждой опухоли.
Мы оценили степень генетического перекрытия между синхронными опухолями и изучили ассоциации между клинико-патологической информацией и молекулярными, микробными и иммунными особенностями генома каждой опухоли.
Полноразмерная таблица
Результаты
Описание образца
Всего было собрано двенадцать образцов опухолей (11 первичных и 1 метахронный) у трех пациентов со спорадическим (т. и пациент C) и проанализированы в этом исследовании. Клинико-патологические данные пациентов представлены в таблице 1. Пациенты не сообщили о семейном анамнезе CRC, и большинство опухолей были расположены на правой стороне толстой кишки, но простирались от слепой кишки до сигмовидной кишки.
Пациент А
Пациент А был 36-летним мужчиной с язвенным колитом в анамнезе, включая многочисленные обострения в течение предшествующих 2 лет, и лечился препаратом Пентаза (месалазин/5АСК). Фоновый неактивный хронический колит и дисплазия низкой степени были выявлены почти в каждом отделе при гистологическом исследовании, что свидетельствует о полевом эффекте по всей толстой кишке. Таким образом, опухоли возникали в очаге воспаления, а не в нормальной слизистой оболочке. Были собраны две первичные опухоли в восходящей ободочной кишке (опухоли А1 и А2). WGS выявил более высокую мутационную нагрузку в опухоли A1 по сравнению с A2 для всех типов мутаций (дополнительная таблица 1). Большинство мутаций, обнаруженных у пациента А, были уникальными для А1 или А2 (рис. 1а и дополнительные рис. 1а, б). Отличительный Драйверные мутации TP53 обнаружены в обеих опухолях. Дополнительные мутации в SMAD4 и MYC произошли в A1, при этом ни одна из перекрывающихся мутаций не была идентифицирована как известный драйвер (рис. 1b). Это говорит о том, что syCRC у пациента A генетически различны и, вероятно, возникли независимо. Мы провели анализ мутационных сигнатур (https://cancer.
Фоновый неактивный хронический колит и дисплазия низкой степени были выявлены почти в каждом отделе при гистологическом исследовании, что свидетельствует о полевом эффекте по всей толстой кишке. Таким образом, опухоли возникали в очаге воспаления, а не в нормальной слизистой оболочке. Были собраны две первичные опухоли в восходящей ободочной кишке (опухоли А1 и А2). WGS выявил более высокую мутационную нагрузку в опухоли A1 по сравнению с A2 для всех типов мутаций (дополнительная таблица 1). Большинство мутаций, обнаруженных у пациента А, были уникальными для А1 или А2 (рис. 1а и дополнительные рис. 1а, б). Отличительный Драйверные мутации TP53 обнаружены в обеих опухолях. Дополнительные мутации в SMAD4 и MYC произошли в A1, при этом ни одна из перекрывающихся мутаций не была идентифицирована как известный драйвер (рис. 1b). Это говорит о том, что syCRC у пациента A генетически различны и, вероятно, возникли независимо. Мы провели анализ мутационных сигнатур (https://cancer. sanger.ac.uk/cosmic/signatures_v2), чтобы исследовать мутационные процессы, которые произошли во время развития опухоли. Этот анализ выявил аналогичные профили сигнатур в A1 и A2 со значительной долей возрастной сигнатуры 1 (рис. 1c и дополнительная рис. 1c). Сигнатуры, связанной с дефицитом MMR, обнаружено не было. Анализ изменения числа копий (CNA) выявил высокий CIN в обеих опухолях, а опухоль A1 показала гипердиплоидию (рис. 1d и дополнительная рис. 1d). EGFR амплифицировался в обоих поражениях, а амплификация других известных онкогенов CRC, таких как KRAS и TOP1 , была исключительной для A1 или A2. Точно так же было обнаружено, что TP53 делетирован в A2, но амплифицирован в A1, что еще больше подчеркивает гетерогенность этих опухолей (рис. 1e).
sanger.ac.uk/cosmic/signatures_v2), чтобы исследовать мутационные процессы, которые произошли во время развития опухоли. Этот анализ выявил аналогичные профили сигнатур в A1 и A2 со значительной долей возрастной сигнатуры 1 (рис. 1c и дополнительная рис. 1c). Сигнатуры, связанной с дефицитом MMR, обнаружено не было. Анализ изменения числа копий (CNA) выявил высокий CIN в обеих опухолях, а опухоль A1 показала гипердиплоидию (рис. 1d и дополнительная рис. 1d). EGFR амплифицировался в обоих поражениях, а амплификация других известных онкогенов CRC, таких как KRAS и TOP1 , была исключительной для A1 или A2. Точно так же было обнаружено, что TP53 делетирован в A2, но амплифицирован в A1, что еще больше подчеркивает гетерогенность этих опухолей (рис. 1e).
a Диаграмма Венна для SNV показывает 0,49% перекрытия между опухолями. b Частоты вариантов аллелей (VAF) предполагаемых драйверных мутаций показывают гетерогенные драйверы в A1 и A2. c Анализ сигнатур мутаций. d Геномный ландшафт CNA показывает CIN как в A1 (плоидность 3,58), так и в A2 (плоидность 2,2). e Логарифмическое соотношение предполагаемых CNA-драйверов подчеркивает гетерогенность онкогенных событий между A1 и A2. f Микробный анализ данных ДНК показывает обилие микробов на уровне типов. г Количественная оценка иммунной инфильтрации опухоли для восьми популяций иммунных клеток в A1 и A2.
c Анализ сигнатур мутаций. d Геномный ландшафт CNA показывает CIN как в A1 (плоидность 3,58), так и в A2 (плоидность 2,2). e Логарифмическое соотношение предполагаемых CNA-драйверов подчеркивает гетерогенность онкогенных событий между A1 и A2. f Микробный анализ данных ДНК показывает обилие микробов на уровне типов. г Количественная оценка иммунной инфильтрации опухоли для восьми популяций иммунных клеток в A1 и A2.
Полноразмерное изображение
Анализ ДНК микробных организмов кишечника у пациента А выявил высокую численность Bacteroidetes и Firmicutes spp . (рис. 1е). Транскриптомное подтипирование предсказало обе опухоли как CMS4 и CRIS-B (дополнительная таблица 1). A1 показал меньшее количество нейтрофилов, но большее количество B-клеток и CD8 + T-клеток, тогда как CD4 + T-клеток были обнаружены только в A2, который показал более высокое соотношение нейтрофилов к лимфоцитам и более высокое соотношение CD4/CD8, оба связаны с плохими клиническими исходами (рис. 1g).
1g).
Пациент B
Пациентка B, 79-летняя женщина, поступила с пятью первичными синхронными опухолями от слепой до сигмовидной кишки (опухоли B1–B5; таблица 1). В опухолях B1–B4 были обнаружены более высокие однонуклеотидные варианты (SNV) и InDel по сравнению с B5, которые, в свою очередь, показали наибольшее количество структурных вариантов (SV; дополнительная таблица 1). Большинство мутаций, обнаруженных у пациента B, были уникальными для каждой первичной опухоли (рис. 2а и дополнительные рис. 2а, б). Однако те же Драйверная мутация BRAF V600E была идентифицирована во всех опухолях MSI B1–B4. В опухоли B2 также наблюдалась делеция генов MSh4 и MSH6 , тогда как в опухолях B1 и B4 была обнаружена вставка MSH6 , при этом опухоль B1 приобрела дополнительные мутации в PIK3CA h2047R и FBXW7 R485C, а опухоли R485C в FBXW7 G587fs, PMS1 F544fs и TP53 L257P. Мутации PIK3CA и h2047R FBXW7 G587fs также были обнаружены в B3. B5 (опухоль MSS) разделяет одну мутацию APC E1554fs с B1, но не мутирует с остальными первичными мутациями, представляя отдельные: FBXW7 R399 * и KRAS G12D (рис. 2b, c). Гетерогенность драйвера SNV в пяти опухолях была подтверждена анализом вызывающих мутации данных секвенирования РНК.
B5 (опухоль MSS) разделяет одну мутацию APC E1554fs с B1, но не мутирует с остальными первичными мутациями, представляя отдельные: FBXW7 R399 * и KRAS G12D (рис. 2b, c). Гетерогенность драйвера SNV в пяти опухолях была подтверждена анализом вызывающих мутации данных секвенирования РНК.
a Диаграммы Венна SNV для всех поражений B1–B5 (слева) и для поражений MSI B1–B4 (справа) показывают низкое перекрытие между опухолями. b Предполагаемое филогенетическое дерево, основанное на драйверных мутациях. c VAF предполагаемых драйверных мутаций. d Анализ сигнатур мутаций. e Количество транскриптов MLh2 , обнаруженных с помощью анализа секвенирования РНК. f Геномный ландшафт CNA показывает низкий CIN для образцов MSI B1 (плоидность: 2), B2 (плоидность: 1,95), B3 (плоидность: 2) и B4 (плоидность: 1,98) и более высокий CIN для образца MSS B5 (плоидность : 2. 13). г Среднее логарифмическое отношение предполагаемых драйверных CNA подчеркивает гетерогенность онкогенных событий между всеми поражениями. 904:61 h Микробный анализ данных ДНК показывает обилие микробов на уровне типов. i Количественная оценка иммунной инфильтрации опухоли выявила различные профили для восьми популяций иммунных клеток в B1–B5.
13). г Среднее логарифмическое отношение предполагаемых драйверных CNA подчеркивает гетерогенность онкогенных событий между всеми поражениями. 904:61 h Микробный анализ данных ДНК показывает обилие микробов на уровне типов. i Количественная оценка иммунной инфильтрации опухоли выявила различные профили для восьми популяций иммунных клеток в B1–B5.
Полноразмерное изображение
Анализ сигнатур мутаций показал опухоли B1–B4 с высокой долей сигнатур, связанных с дефицитом MMR, и отсутствием этих сигнатур в B5 (рис. 2d и дополнительная рис. 2c). Это было подтверждено белковой иммуногистохимией (ИГХ), которая показала потерю MLh2 в опухолях B1–B4 и снижение экспрессии транскрипта MLh2 (рис. 2д), вероятно, за счет гиперметилирования промотора MLh2 . Анализ CNA выявил низкий CIN в опухолях MSI (B1–B4) и высокий CIN в опухоли MSS B5 (рис. 2f и дополнительная рис. 2d). B5 был единственным образцом, который показал амплификацию EGFR , KRAS был амплифицирован в B3 и B5, тогда как гены-супрессоры опухолей, такие как DCC и SMAD4 , были делетированы в B4 и B5 (рис. 2g).
2g).
Анализ ДНК микробных организмов кишечника, связанных с каждой опухолью у пациента B, выявил преобладание Bacteroidetes и Firmicutes spp. , а также наличие F. nucleatum во всех поражениях (рис. 2h). Интересно, что опухоли B1 и B5 были классифицированы как CMS2 и CRIS-E. Они согласуются с высоким CIN и мутантным состоянием KRAS B5, но не B1. Как и ожидалось, B2, B3 и B4 были присвоены MSI-подобным и BRAF 9.0380 -мутированный CRIS-A. B4 также был идентифицирован как CMS3 (дополнительная таблица 1). Опухоль MSS B5 показала иммунную инфильтрацию ~ 15%, в то время как инфильтрация в опухолях MSI варьировала от ~ 11% в B1 до ~ 25% в B2. Вместе с самой низкой инфильтрацией, B1 показал более низкое количество нейтрофилов, более высокую долю CD8+ T-клеток и отсутствие CD4+ T-клеток. Самое высокое отношение нейтрофилов к лимфоцитам наблюдалось в B5, за которым следовали B4, B2, B3 и B1 (рис. 2i).
Пациент C
Пациент C, 70-летний мужчина, первоначально поступил с четырьмя первичными синхронными опухолями (C1–C4) и метахронной опухолью (C5) более чем через 6 месяцев. WGS выявил одинаковое количество SNV, InDels и SV во всех образцах опухоли у пациента C (дополнительная таблица 1). Большинство мутаций произошло исключительно в каждом поражении (рис. 3а и дополнительные рис. 3а, б). Тот самый 9Мутация 0433 BRAF V600E произошла во всех опухолях, что указывает на вероятное раннее событие в развитии опухоли (дополнительная рис. 3c). Опухоли C1 и C5 дополнительно приобрели вставку в гене MSH6 , при этом опухоль C1 приобрела мутации в PIK3CA h2047R, TP53 Q144* и TP53 R282W, а опухоль C5 приобрела мутацию в 8 R038XW7. Напротив, в опухолях С2 и С4 была делеция гена MSH6 , при этом опухоль С2 приобрела дополнительные мутации в APC R876* и опухоль C4, получившие мутации в APC E1554fs, PIK3CA Q546R и TP53 K382fs. C3 испытал делецию в MSh4 и приобрел мутацию в POLH R253C (рис. 3b, c и дополнительная рис. 3d). Гетерогенность драйвера SNV была подтверждена анализом данных секвенирования РНК.
WGS выявил одинаковое количество SNV, InDels и SV во всех образцах опухоли у пациента C (дополнительная таблица 1). Большинство мутаций произошло исключительно в каждом поражении (рис. 3а и дополнительные рис. 3а, б). Тот самый 9Мутация 0433 BRAF V600E произошла во всех опухолях, что указывает на вероятное раннее событие в развитии опухоли (дополнительная рис. 3c). Опухоли C1 и C5 дополнительно приобрели вставку в гене MSH6 , при этом опухоль C1 приобрела мутации в PIK3CA h2047R, TP53 Q144* и TP53 R282W, а опухоль C5 приобрела мутацию в 8 R038XW7. Напротив, в опухолях С2 и С4 была делеция гена MSH6 , при этом опухоль С2 приобрела дополнительные мутации в APC R876* и опухоль C4, получившие мутации в APC E1554fs, PIK3CA Q546R и TP53 K382fs. C3 испытал делецию в MSh4 и приобрел мутацию в POLH R253C (рис. 3b, c и дополнительная рис. 3d). Гетерогенность драйвера SNV была подтверждена анализом данных секвенирования РНК. Анализ сигнатур мутаций выявил высокую долю сигнатур, связанных с дефицитом MMR, во всех опухолях (рис. 3d и дополнительная рис. 3e). Это подтверждается потерей 9Экспрессия 0433 MLh2 , обнаруженная с помощью ИГХ, и снижение экспрессии транскрипта MLh2 (рис. 3e) во всех опухолях. Анализ CNA показал низкий CIN во всех опухолях у пациента C (рис. 3f и дополнительная рис. 3f). Мы идентифицировали амплифицированные онкогены, такие как KRAS в C1 и MYC в C3-C5, и делетированные гены-супрессоры опухолей, такие как DCC в C5 (рис. 3g).
Анализ сигнатур мутаций выявил высокую долю сигнатур, связанных с дефицитом MMR, во всех опухолях (рис. 3d и дополнительная рис. 3e). Это подтверждается потерей 9Экспрессия 0433 MLh2 , обнаруженная с помощью ИГХ, и снижение экспрессии транскрипта MLh2 (рис. 3e) во всех опухолях. Анализ CNA показал низкий CIN во всех опухолях у пациента C (рис. 3f и дополнительная рис. 3f). Мы идентифицировали амплифицированные онкогены, такие как KRAS в C1 и MYC в C3-C5, и делетированные гены-супрессоры опухолей, такие как DCC в C5 (рис. 3g).
a Диаграмма Венна SNV показывает низкое перекрытие между опухолями. b Предполагаемое филогенетическое дерево, основанное на драйверных мутациях. c VAF предполагаемых драйверных мутаций. d Анализ сигнатур мутаций. e Количество транскриптов MLh2, обнаруженных с помощью анализа секвенирования РНК. f Геномный ландшафт CNA показывает низкий CIN для всех образцов C1 (плоидность: 2,03), C2 (плоидность: 2,06), C3 (плоидность: 2,13), C4 (плоидность: 2,02) и C5 (плоидность: 2,13). г Среднее логарифмическое отношение предполагаемых драйверных CNA подчеркивает гетерогенность онкогенных событий между всеми поражениями. 904:61 h Микробный анализ данных ДНК показывает обилие микробов на уровне типов. i Количественная оценка иммунной инфильтрации опухоли выявила различные фракции для восьми популяций иммунных клеток во всех образцах.
f Геномный ландшафт CNA показывает низкий CIN для всех образцов C1 (плоидность: 2,03), C2 (плоидность: 2,06), C3 (плоидность: 2,13), C4 (плоидность: 2,02) и C5 (плоидность: 2,13). г Среднее логарифмическое отношение предполагаемых драйверных CNA подчеркивает гетерогенность онкогенных событий между всеми поражениями. 904:61 h Микробный анализ данных ДНК показывает обилие микробов на уровне типов. i Количественная оценка иммунной инфильтрации опухоли выявила различные фракции для восьми популяций иммунных клеток во всех образцах.
Изображение с полным размером
Анализ ДНК микробных организмов кишечника, ассоциированных с каждой опухолью, выявил преобладание Bacteroidetes и Firmicutes spp. . по всем поражениям. ДНК-доказательства F. nucleatum были обнаружены во всех опухолях C1–C5 (рис. 3h). C1 был классифицирован как CMS4 и CRIS-D. CRIS-D также был отнесен к C3, где амплификация 9Наблюдали 0433 IGF2 . C2 был классифицирован как CMS2 и CRIS-E в соответствии с амплификации хромосомы 13. C4 и C5 были отнесены к CRIS-C в соответствии с увеличением хромосом 8 (которая содержит протоонкоген MYC ) и, для C5, увеличение хромосом 7 (которая содержит ген EGFR ) и 13 (дополнительная таблица 1). Наименьшая иммунная инфильтрация (9,7%) наблюдалась в С5, в то время как она возрастала до ~15% в С1 и С2, 26% в С3 и 31% в С4. C3 и C4 показали большую долю классически активированных макрофагов M1 и отсутствие промоторов опухоли M2 макрофагов. C3 показал большее количество В-клеток, низкое количество Т-клеток и отсутствие нейтрофилов. Более низкие отношения CD4/CD8 наблюдались в C4 и C5 (рис. 3i).
C4 и C5 были отнесены к CRIS-C в соответствии с увеличением хромосом 8 (которая содержит протоонкоген MYC ) и, для C5, увеличение хромосом 7 (которая содержит ген EGFR ) и 13 (дополнительная таблица 1). Наименьшая иммунная инфильтрация (9,7%) наблюдалась в С5, в то время как она возрастала до ~15% в С1 и С2, 26% в С3 и 31% в С4. C3 и C4 показали большую долю классически активированных макрофагов M1 и отсутствие промоторов опухоли M2 макрофагов. C3 показал большее количество В-клеток, низкое количество Т-клеток и отсутствие нейтрофилов. Более низкие отношения CD4/CD8 наблюдались в C4 и C5 (рис. 3i).
Обсуждение
По мере совершенствования технологий ранней диагностики выявляется все большее число syCRC. syCRC имеют отличительные черты от одиночных CRC, и в настоящее время нет конкретных рекомендаций по их лечению 27,28 . Как правило, опухоль с самой высокой стадией TNM используется в качестве ориентира для прогноза и клинического лечения, при этом позитивность лимфатических узлов является наиболее важным параметром. Полногеномный анализ syCRC в этом исследовании подчеркивает, что каждый пациент представляет собой совершенно отдельный сценарий. В целом, наши результаты показывают высокую степень генетической гетерогенности между syCRC. Синхронные поражения у пациента содержат в основном разные мутации в одних и тех же известных генах CRC, хотя и перекрываются некоторые известные драйверные мутации, такие как BRAF V600E, произошло. Действительно, наличие одной и той же мутации BRAF V600E во всех опухолях у пациента С является интересным открытием, в частности, поскольку мутация также встречается в метахронной опухоли С5. Мутация BRAF в условиях MSI тесно связана со спорадическим CRC. У пациента C эта общая мутация может либо свидетельствовать об общем происхождении опухоли, либо является ярким примером конвергентной эволюции в развитии опухоли, вероятно, возникающей через зазубренный путь BRAF из предшественников сидячих зазубренных полипов. Однако в целом наши результаты показывают, что syCRC имеют тенденцию возникать независимо, часто получая доступ к одним и тем же мутационным процессам 29,30,32 .
Полногеномный анализ syCRC в этом исследовании подчеркивает, что каждый пациент представляет собой совершенно отдельный сценарий. В целом, наши результаты показывают высокую степень генетической гетерогенности между syCRC. Синхронные поражения у пациента содержат в основном разные мутации в одних и тех же известных генах CRC, хотя и перекрываются некоторые известные драйверные мутации, такие как BRAF V600E, произошло. Действительно, наличие одной и той же мутации BRAF V600E во всех опухолях у пациента С является интересным открытием, в частности, поскольку мутация также встречается в метахронной опухоли С5. Мутация BRAF в условиях MSI тесно связана со спорадическим CRC. У пациента C эта общая мутация может либо свидетельствовать об общем происхождении опухоли, либо является ярким примером конвергентной эволюции в развитии опухоли, вероятно, возникающей через зазубренный путь BRAF из предшественников сидячих зазубренных полипов. Однако в целом наши результаты показывают, что syCRC имеют тенденцию возникать независимо, часто получая доступ к одним и тем же мутационным процессам 29,30,32 . Что касается временного развития опухолей, для пожилых пациентов B (79 лет) и C (70 лет) нет записей о предшествующей эндоскопии или биопсии до госпитализации. Следовательно, опухоли у этих пациентов могли образоваться в разные моменты времени на протяжении многих лет. Пациент А имел длительный анамнез язвенного колита и был включен в программу рутинного эндоскопического обследования для наблюдения за дисплазией. Обнаружение дисплазии у пациентов с язвенным колитом является известным предиктором риска последующего развития КРР, и опухоли, вероятно, развивались синхронно.
Что касается временного развития опухолей, для пожилых пациентов B (79 лет) и C (70 лет) нет записей о предшествующей эндоскопии или биопсии до госпитализации. Следовательно, опухоли у этих пациентов могли образоваться в разные моменты времени на протяжении многих лет. Пациент А имел длительный анамнез язвенного колита и был включен в программу рутинного эндоскопического обследования для наблюдения за дисплазией. Обнаружение дисплазии у пациентов с язвенным колитом является известным предиктором риска последующего развития КРР, и опухоли, вероятно, развивались синхронно.
Анализ ДНК микробных организмов кишечника показал, что распределение Fusobacteria согласуется с предыдущими наблюдениями, в которых сообщалось о повышенной численности F. nucleatum в BRAF мутантных, гипермутантных, MSI опухолях 10 . Анализ микробиома, связанного с каждой опухолью у пациента А, выявил снижение разнообразия микробиоты кишечника, что может отражать дисбактериоз, связанный с язвенным колитом в анамнезе пациента 34 , хотя в данном случае на эти результаты могло повлиять введение препарата кишечника с антибиотиком. Предыдущее исследование показало различия в подсчете иммунных клеток между синхронными парами опухолей 29 . Количественная оценка иммунного статуса была утверждена в качестве прогностического маркера риска рецидива рака толстой кишки, при этом качество и плотность иммунного инфильтрата зависят от факторов, включая ранее существовавшее микроокружение опухоли, генетику опухоли и микробиом кишечника 35 . Наши результаты показывают различия в микробном и иммунном составе между синхронными опухолями, что еще больше подчеркивает сложность, присущую этим опухолям. Кроме того, недавние результаты показали, что пациентам с Fusobacterium -позитивными опухолями может помочь назначение антибиотиков 10 , хотя исследования эффективности лечения, нацеленного на микробы, все еще находятся на ранних стадиях.
Предыдущее исследование показало различия в подсчете иммунных клеток между синхронными парами опухолей 29 . Количественная оценка иммунного статуса была утверждена в качестве прогностического маркера риска рецидива рака толстой кишки, при этом качество и плотность иммунного инфильтрата зависят от факторов, включая ранее существовавшее микроокружение опухоли, генетику опухоли и микробиом кишечника 35 . Наши результаты показывают различия в микробном и иммунном составе между синхронными опухолями, что еще больше подчеркивает сложность, присущую этим опухолям. Кроме того, недавние результаты показали, что пациентам с Fusobacterium -позитивными опухолями может помочь назначение антибиотиков 10 , хотя исследования эффективности лечения, нацеленного на микробы, все еще находятся на ранних стадиях.
Молекулярное субтипирование КРР на основе транскриптома выявило клинические и прогностические ассоциации подтипов КРР 25 . Мы показываем гетерогенность в молекулярной классификации подтипов синхронных опухолей у двух из трех пациентов. Анализ транскриптома отнес обе опухоли пациента А к одному и тому же молекулярному подтипу (CMS4/CRIS-B). Соответствующие общие черты между CMS4 и CRIS-B включают высокую CIN, активацию TGF-β и эпителиально-мезенхимальный переход (EMT) и связаны с плохо и дедифференцированными опухолями со стромально-мезенхимальным фенотипом. Этот иммунный фенотип TGF-β/EMT согласуется с язвенным колитом в анамнезе пациента. Кроме того, общий молекулярный подтип A1 и A2 не является неожиданным, поскольку гистопатологический обзор всей толстой кишки показал фоновую дисплазию низкой степени. Однако опухоли у пациентов B и C относились к разным подтипам, что подчеркивает гетерогенность этих пациентов. Из девяти опухолей MSI, включенных в это исследование, только одна, C5, была отнесена к группе CMS1, предложенной как «иммунная к MSI» группа 25 . Опухоль C5 была метахронной первичной (возникла более чем через 6 месяцев) и единственной низкодифференцированной опухолью MSI (солидный рост 60%; таблица 1), что потенциально способствовало межопухолевой транскриптомной гетерогенности у этого пациента.
Анализ транскриптома отнес обе опухоли пациента А к одному и тому же молекулярному подтипу (CMS4/CRIS-B). Соответствующие общие черты между CMS4 и CRIS-B включают высокую CIN, активацию TGF-β и эпителиально-мезенхимальный переход (EMT) и связаны с плохо и дедифференцированными опухолями со стромально-мезенхимальным фенотипом. Этот иммунный фенотип TGF-β/EMT согласуется с язвенным колитом в анамнезе пациента. Кроме того, общий молекулярный подтип A1 и A2 не является неожиданным, поскольку гистопатологический обзор всей толстой кишки показал фоновую дисплазию низкой степени. Однако опухоли у пациентов B и C относились к разным подтипам, что подчеркивает гетерогенность этих пациентов. Из девяти опухолей MSI, включенных в это исследование, только одна, C5, была отнесена к группе CMS1, предложенной как «иммунная к MSI» группа 25 . Опухоль C5 была метахронной первичной (возникла более чем через 6 месяцев) и единственной низкодифференцированной опухолью MSI (солидный рост 60%; таблица 1), что потенциально способствовало межопухолевой транскриптомной гетерогенности у этого пациента. Еще три опухоли MSI (B2, B3 и B4) были классифицированы как CRIS-A: предложенная подгруппа включала опухоли MSI 26 . Это подчеркивает сложность применения очень определенных систем классификации к отдельным опухолям с различными драйверными мутациями и геномными изменениями. Поскольку иммунотерапия в настоящее время рекомендуется только для опухолей MMR с дефицитом MSI-H 36 , требуется более глубокое исследование того, как паттерны транскрипции в опухолях syCRC MSI соответствуют ответу на иммунотерапию.
Еще три опухоли MSI (B2, B3 и B4) были классифицированы как CRIS-A: предложенная подгруппа включала опухоли MSI 26 . Это подчеркивает сложность применения очень определенных систем классификации к отдельным опухолям с различными драйверными мутациями и геномными изменениями. Поскольку иммунотерапия в настоящее время рекомендуется только для опухолей MMR с дефицитом MSI-H 36 , требуется более глубокое исследование того, как паттерны транскрипции в опухолях syCRC MSI соответствуют ответу на иммунотерапию.
В целом, мы обнаружили различия в общих биомаркерах, таких как BRAF и KRAS , для таргетной терапии 21 , а также в других характеристиках, которые могут повлиять или предсказать ответ на лечение 20 . В опухолях пациента А (обе MSS) статус дикого типа KRAS и увеличение числа копий EGFR делают их кандидатами на лечение анти-EGFR терапией цетуксимабом 9.0159 37,38 если они повторятся. Классификации CMS4 и CRIS-B для этих опухолей предсказывают худшую безрецидивную и общую выживаемость для этого пациента. У пациента B образцы MSI B1–B4 демонстрируют потенциал ответа на иммунотерапию, в то время как этот вариант, скорее всего, не повлияет на рак MSS B5, в котором, хотя мы видим усиление EGFR , мы также находим Мутация KRAS , которая, таким образом, исключает терапию против EGFR в качестве варианта лечения 39 . CRIS-A связан с отсутствием ответа на терапию анти-EGFR, что согласуется с нормальным состоянием копии EGFR в B2, B3 и B4. Антиметаболическая терапия была предложена для подгрупп CRIS-A 26 . У пациента С все пять опухолей демонстрируют потенциальную пользу от аналогичных методов лечения, а именно ингибирования BRAF и, особенно в случае С3 и С4, иммунотерапии. Конкретная роль ингибирования BRAF в MSI CRC, однако, еще предстоит определить 21 . CRIS-C связан с опухолями, чувствительными к цетуксимабу, что позволяет предположить, что эта терапия является жизнеспособным вариантом для C4 и C5, в то время как CRIS-E предсказывает плохой ответ на лечение анти-EGFR в C2.
У пациента B образцы MSI B1–B4 демонстрируют потенциал ответа на иммунотерапию, в то время как этот вариант, скорее всего, не повлияет на рак MSS B5, в котором, хотя мы видим усиление EGFR , мы также находим Мутация KRAS , которая, таким образом, исключает терапию против EGFR в качестве варианта лечения 39 . CRIS-A связан с отсутствием ответа на терапию анти-EGFR, что согласуется с нормальным состоянием копии EGFR в B2, B3 и B4. Антиметаболическая терапия была предложена для подгрупп CRIS-A 26 . У пациента С все пять опухолей демонстрируют потенциальную пользу от аналогичных методов лечения, а именно ингибирования BRAF и, особенно в случае С3 и С4, иммунотерапии. Конкретная роль ингибирования BRAF в MSI CRC, однако, еще предстоит определить 21 . CRIS-C связан с опухолями, чувствительными к цетуксимабу, что позволяет предположить, что эта терапия является жизнеспособным вариантом для C4 и C5, в то время как CRIS-E предсказывает плохой ответ на лечение анти-EGFR в C2.
В заключение, насколько нам известно, мы провели первое исследование WGS syCRC. Это позволило нам получить гораздо более широкое аналитическое разрешение за пределами экзома с точки зрения выявления общих/частных мутаций в каждой опухоли, а также возможность определить микробный состав в опухоли и соответствующих нормальных образцах. Кроме того, мы смогли провести анализ структурных вариаций и показать гетерогенность СВ в опухолях пациентов. Кроме того, мы провели согласованный анализ РНК-секвенций нескольких syCRC. Это облегчило как консенсусное молекулярное подтипирование CRC, так и анализ иммунного состава.
Предыдущие исследования во всех, кроме нескольких случаев пациентов, проводили анализы экзома парных синхронных опухолей у пациентов. В двух наших исследованиях пациентов мы проанализировали пять опухолей от каждого пациента, чтобы построить гораздо более полное представление об общей геномной и транскриптомной гетерогенности в нескольких syCRC. Хотя наши результаты, возможно, не повлияли на стандарт лечения этих пациентов, по сравнению с предыдущими исследованиями мы выявили неоднородность в текущих и новых биомаркерах CRC, которые, возможно, придется учитывать при принятии клинических решений для пациентов в будущем.
Таким образом, наше исследование подчеркивает гетерогенность геномных, транскриптомных, микробных и иммунных биомаркеров CRC у пациентов с syCRC, что может иметь серьезные последствия для терапевтического лечения и требует тщательного и тщательного изучения.
Методы
Клинические образцы
Двенадцать образцов опухоли были собраны у трех пациентов со спорадическим КРР, ранее не получавших лечения (пациент A, пациент B и пациент C) в Университетской больнице Св. Винсента (SVUH) в Дублине. Свежая опухоль и нормальная ткань были получены из образцов хирургической резекции, при этом блоки нормальной ткани были взяты на некотором расстоянии от инвазивных опухолей. Klean Prep (в состав которого входит макрогол) применяли в качестве стандартной предоперационной подготовки кишечника в двух из трех случаев (пациенты А и В). Пациенту С не проводилась подготовка кишечника, так как он был прооперирован в экстренном порядке из-за кишечной непроходимости. Одному пациенту (пациенту А, ципрофлоксацину и метронидазолу) вместе с предоперационным гидрокортизоном был назначен препарат кишечника с антибиотиком. В каждом случае опухоли подвергали стандартному протоколу скрининга SVUH для тестирования MSI. На основании протокола скрининга врач решает, запрашивать ли тест на зародышевую линию или нет. В каждом случае было определено, что тестирование зародышевой линии не является необходимым на основании результатов иммуногистохимического MSI и BRAF (ПЦР в реальном времени) в сочетании с историей болезни. Соседние здоровые ткани, подвергнутые патологическому контролю качества, дополнительно брали у каждого пациента, чтобы обеспечить эталон нормального генома пациента. Письменное информированное согласие пациента было получено Центром колоректальных заболеваний в SVUH, и исследование было одобрено Комитетом по этике исследований SVUH. Опухоли классифицировали в соответствии с последней системой TNM Американского объединенного комитета по раку (AJCC) (8-е издание AJCC: колоректальный рак). Все образцы хранились при температуре -80 °С. Клинико-патологические данные были доступны для всех пациентов и представлены в таблице 1.
В каждом случае опухоли подвергали стандартному протоколу скрининга SVUH для тестирования MSI. На основании протокола скрининга врач решает, запрашивать ли тест на зародышевую линию или нет. В каждом случае было определено, что тестирование зародышевой линии не является необходимым на основании результатов иммуногистохимического MSI и BRAF (ПЦР в реальном времени) в сочетании с историей болезни. Соседние здоровые ткани, подвергнутые патологическому контролю качества, дополнительно брали у каждого пациента, чтобы обеспечить эталон нормального генома пациента. Письменное информированное согласие пациента было получено Центром колоректальных заболеваний в SVUH, и исследование было одобрено Комитетом по этике исследований SVUH. Опухоли классифицировали в соответствии с последней системой TNM Американского объединенного комитета по раку (AJCC) (8-е издание AJCC: колоректальный рак). Все образцы хранились при температуре -80 °С. Клинико-патологические данные были доступны для всех пациентов и представлены в таблице 1.
MSI оценивали с использованием IHC для белков MMR, MLh2 (BD Bioscience, клон G168-728), PMS2 (BD Biosciences, клон A16-4), MSh3 (Calbiochem, клон FE11) и MSH0 (BD Biosciences, клон A16-4). (BD Biosciences, клон 44). ИГХ проводили на автоматическом иммуностейнере Leica BOND.
Экстракция ДНК и РНК
Экстракция ДНК и РНК из образцов замороженных тканей проводилась в SVUH Dublin.
ДНК
Около 30 мг (2 мм 3 ) замороженной ткани помещали во флакон с завинчивающейся крышкой, предварительно загруженный керамическими шариками диаметром 1,4 мм (Cambio), и образцы гомогенизировали с использованием гомогенизатора тканей Precellys 24 (Bertin Instruments) в течение 20 с при 5500 об/мин. Затем образцы инкубировали при 55 °С на водяной бане в течение 2 часов, встряхивая образцы каждые 20 минут. Выделение ДНК проводили с помощью E.Z.N.A . ® Tissue DNA Kit (Omega Bio-Tek) в соответствии с протоколом производителя. Чистоту оценивали с помощью NanoDrop, отмечая A 260/280 > 1,8. Образцы помещали в 1% агарозный гель для проверки на деградацию и загрязнение РНК. Флуориметрический количественный анализ проводили с помощью набора для анализа Qubit dsDNA HS (Invitrogen).
Чистоту оценивали с помощью NanoDrop, отмечая A 260/280 > 1,8. Образцы помещали в 1% агарозный гель для проверки на деградацию и загрязнение РНК. Флуориметрический количественный анализ проводили с помощью набора для анализа Qubit dsDNA HS (Invitrogen).
РНК
Около 30 мг (2 мм 3 ) замороженной ткани помещали в предварительно заполненные охлажденные пробирки с шариками (Precellys ® Ceramic kit 2,8 мм, усиленные) с 1 мл лизирующего буфера. Образцы гомогенизировали при 4 °C с использованием Precellys 24 при 5500 об/мин, 10 с ×2. Выделение РНК из образцов быстрозамороженной ткани проводили с помощью Э.З.Н.А. . ® Total RNA Kit I (Omega Bio-Tek). Чистоту РНК оценивали с использованием NanoDrop, отмечая A 260/280 > 2. Затем образцы анализировали на Bioanalyzer 2100 (Agilent), и для секвенирования использовали только образцы с числом целостности РНК > 7.
Полногеномное секвенирование
Для каждого пациента для WGS были отобраны все синхронные опухоли и соответствующий образец нормальной ткани. Чтения секвенирования парных концов (151 bp) были созданы с использованием технологии секвенирования Illumina HiSeq X, что дает покрытие ~ × 60 на образец. Последовательности были сопоставлены с эталонным геномом человека (GRCh47/hg19) с использованием BWA 40 . Дубликаты ПЦР были помечены с использованием инструментов Picard (http://broadinstitute.github.io/picard), а перестройка InDel и повторная калибровка базового качества были проведены с помощью набора инструментов для анализа генома (GATK) v3 (http://www.broadinstitute.org/gatk). ).
Чтения секвенирования парных концов (151 bp) были созданы с использованием технологии секвенирования Illumina HiSeq X, что дает покрытие ~ × 60 на образец. Последовательности были сопоставлены с эталонным геномом человека (GRCh47/hg19) с использованием BWA 40 . Дубликаты ПЦР были помечены с использованием инструментов Picard (http://broadinstitute.github.io/picard), а перестройка InDel и повторная калибровка базового качества были проведены с помощью набора инструментов для анализа генома (GATK) v3 (http://www.broadinstitute.org/gatk). ).
РНК-секвенирование
РНК была выделена из всех опухолей у каждого пациента и подвергнута анализу РНК-секвенирования. Секвенированные чтения были сопоставлены с эталонным геномом человека (GRCh47) с использованием STAR 41 . Вызов SNP был проведен в соответствии с рекомендациями Broad Institute Best Practices (https://gatkforums.broadinstitute.org/gatk/discussion/389).2/the-gatk-best-practices-for-varian-call-on-rnaseq-в-полной-детали).
Обнаружение мутаций
Соматические мутации были идентифицированы путем сравнения каждого образца опухоли с прилегающей здоровой колоректальной тканью в качестве совпадающей нормы.
Замены
SNV идентифицированы с помощью алгоритмов вызова мутаций MuTect v1 42 и Strelka v1 43 . Мы использовали BEDTools 44 для пересечения их выходных данных и сохранили только мутации, обнаруженные обоими вызывающими объектами. Затем они были сопоставлены со списком распространенных вариантов dbSNP (https://www.ncbi.nlm.nih.gov/SNP/), чтобы исключить потенциальные вариации зародышевой линии. Чтобы гарантировать, что никакие вариации, связанные с раком, не будут удалены, мутации, зарегистрированные в базе данных COSMIC (https://cancer.sanger.ac.uk/cosmic), ранее были исключены из списка dbSNP.
Мы рассчитали частоту вариантного аллеля (VAF) каждого SNV и дополнительно подтвердили мутации, оставив только те, которые соответствовали следующим параметрам: нормальный альтернативный аллель ≤ 1, минимальная комбинированная глубина = 20, минимальная альтернативная глубина = 2 и минимальная VAF = 0,05.
InDels
InDels были идентифицированы со Стрелкой v1 43 и отфильтрованы от потенциально зародышевых вариантов таким же образом, как и замены (см. выше).
Варианты конструкции
SV (делеции, тандемные дупликации, инверсии, транслокации) были идентифицированы с помощью DELLY v0.7.9 45 .
Изменения номера копии
CNA были идентифицированы с помощью пакета R FACETS v0.5.14 46 и визуализированы с номером копии пакета R v1.24.0 47 .
Генная аннотация и анализ драйверов
Генная локализация и функциональное влияние SNV, InDels и SV были аннотированы с использованием Ensembl Variant Effect Predictor (VEP) v97 48 . Известные драйверные гены вместе с генами MMR и HR были исследованы на наличие причинных мутаций во всех образцах. Это было сделано с помощью интерпретатора генома рака 49 https://www.cancergenomeinterpreter.org/home и VEP 48 . VAF каждого идентифицированного водителя был рассчитан, чтобы установить его распространенность. CNA были аннотированы с использованием функции annotate_variation, реализованной в ANNOVAR v2018Apr16 50 , и поиск драйверов осуществлялся на основе известных CNA соматических генов, связанных с CRC 51 . Релевантность каждого предполагаемого CNA драйвера оценивалась через его медианный логарифмический коэффициент, который был получен в результате анализа FACETS.
VAF каждого идентифицированного водителя был рассчитан, чтобы установить его распространенность. CNA были аннотированы с использованием функции annotate_variation, реализованной в ANNOVAR v2018Apr16 50 , и поиск драйверов осуществлялся на основе известных CNA соматических генов, связанных с CRC 51 . Релевантность каждого предполагаемого CNA драйвера оценивалась через его медианный логарифмический коэффициент, который был получен в результате анализа FACETS.
Перекрытие мутаций с диаграммами Венна
Перекрытие SNV, InDels и SV между опухолями у пациента было рассчитано и визуализировано с помощью диаграмм Венна с использованием R-пакета VennDiagram v1.6.20 52 .
Анализ сигнатур мутаций
Анализ сигнатур мутаций был проведен для получения информации о воздействии и биологической истории рака. Сигнатуры мутаций были идентифицированы из SNV с помощью пакета R deconstructSigs v1.8 9.0159 53 на основе панракового каталога 30 сигнатур, указанных в базе данных COSMIC (https://cancer. sanger.ac.uk/cosmic/signatures).
sanger.ac.uk/cosmic/signatures).
Анализ микробиома кишечника
Микробиота кишечника, связанная с опухолью и нормальной тканью, была идентифицирована по данным ДНК с использованием PathSeq v2.0 54 , доступно в GATK v4 (http://www.broadinstitute.org/software/pathseq/) .
Данные секвенирования РНК: количественная оценка экспрессии генов, нормализация и преобразование ID генов
Количество генов в образцах опухолей было получено на основе данных секвенирования РНК с использованием Kallisto 55 . Нормализация количества РНК была выполнена с помощью DESeq2 v1.24 56 с использованием rlog и формулы «~patient_id». Идентификаторы генов Ensembl были сопоставлены с идентификаторами Entrez и Symbol с использованием biomaRt v2.40 57 .
Молекулярное субтипирование и иммунная инфильтрация опухоли
Молекулярное субтипирование опухолей на основе профилей экспрессии генов было выполнено с использованием двух систем классификации, реализованных в R: классификатор CMS v1 25 и классификатор CRIS v1 26 .
Иммунный контекст опухоли был проанализирован для каждого образца с использованием вычислительного конвейера quanTIseq 58 , который использует данные секвенирования РНК для количественного определения фракций десяти типов иммунных клеток (В-клеток, классически активированных макрофагов M1, альтернативно активированных макрофагов M2, нейтрофилов, естественные киллеры, CD4 + Т-клетки, CD8 + Т-клетки, регуляторные Т-клетки, моноциты и дендритные клетки) в гетерогенных тканях.
Сводка отчета
Дополнительная информация о дизайне исследования доступна в Сводке отчета об исследовании природы, связанной с этой статьей.
Доступность данных
Данные соматических последовательностей, полученные и проанализированные в ходе текущего исследования, были депонированы в Европейском архиве геномов и феномов (EGA), который находится в EBI и CRG под регистрационным номером исследования EGAS00001004413. Данные доступны по запросу после публикации из базы данных EGA, связавшись с комитетом по доступу к данным (Genomic Oncology Research Group DAC: EGAC00001001585), назначенным для этого проекта. Данные ограничены по соображениям конфиденциальности пациентов.
Данные ограничены по соображениям конфиденциальности пациентов.
Доступность кода
Данные и результаты, полученные в этом исследовании, были получены без использования специального кода.
Ссылки
Ильяс М. и др. Генетические пути колоректального и других видов рака. Евро. Дж. Рак 35 , 1986–2002 (1999).
КАС пабмед Статья Google ученый
Ленгауэр К., Кинцлер К. В. и Фогельштейн Б. Генетическая нестабильность при раке человека. Природа 396 , 643–649 (1998).
КАС пабмед Статья Google ученый
Corcoran, R. B. et al. Комбинированное ингибирование BRAF и MEK дабрафенибом и траметинибом при колоректальном раке с мутацией BRAF V600. Дж. Клин. Онкол. 33 , 4023–4031 (2015).
КАС пабмед ПабМед Центральный Статья Google ученый
Копец, С. и др. Энкорафениб, биниметиниб и цетуксимаб при колоректальном раке с мутацией BRAF V600E. Н. англ. Дж. Мед. 381 , 1632–1643 (2019).
КАС пабмед Статья Google ученый
Млечник Б. и др. Интегративный анализ колоректального рака показывает, что иммуноскоры являются более сильным предиктором выживаемости пациентов, чем микросателлитная нестабильность. Иммунитет 44 , 698–711 (2016).
КАС пабмед Статья Google ученый
Мериджи, Ф. и др. Анти-Egfr-терапия при колоректальном раке: как правильно выбрать пациента. Курс. Цели по борьбе с наркотиками 10 , 1033–1040 (2009 г.).
КАС пабмед Статья Google ученый
Куинлан, А. Р. и Холл, И. М. BEDTools: гибкий набор утилит для сравнения геномных признаков. Биоинформатика 26 , 841–842 (2010).
КАС пабмед ПабМед Центральный Статья Google ученый
Нильсен Г. и др. Число копий: эффективные алгоритмы для одно- и многодорожечной сегментации числа копий. BMC Genomics 13 , 591 (2012).
КАС пабмед ПабМед Центральный Статья Google ученый
Durinck, S. et al. Картографические идентификаторы для интеграции наборов геномных данных с пакетом biomaRt R/Bioconductor. Нац. протокол 4 , 1184–1191 (2009).
КАС пабмед ПабМед Центральный Статья Google ученый
Загрузить ссылки
Благодарности
KS и SJF признательны за любезную поддержку Фонда здравоохранения Ирландии и Фонда борьбы с раком Сент-Винсента. SJF признателен за поддержку со стороны Европейской комиссии (FP7-PEOPLE-2013-IEF – 6270270) и программы StAR Королевского колледжа хирургов в Ирландии. Мы хотели бы поблагодарить Ирландский центр высокопроизводительных вычислений (https://www. ichec.ie/) за использование инфраструктуры высокопроизводительных вычислений.
ichec.ie/) за использование инфраструктуры высокопроизводительных вычислений.
Author information
Author notes
Authors and Affiliations
Авторы
Взносы
SJF и KS задумали, направили и обеспечили финансирование исследования. KS, DCW и EJR контролировали набор пациентов, а также сбор, обработку и хранение образцов. SJF курировал и проводил биоинформатический и геномный анализы. В.Т. провела биоинформатический и геномный анализы. К.С. руководил гистопатологическим анализом. MBC и YLK провели гистопатологический анализ. МТ провела обработку образцов, экстракцию нуклеиновых кислот и контроль качества. RG провела подготовку и хранение образцов. VT, MBC, DCW, EJR, KS и SJF интерпретировали результаты и составили рукопись. Все авторы одобрили рукопись.
Все авторы одобрили рукопись.
Авторы переписки
Переписка с Киран Шихан или Саймон Дж. Ферни.
Заявление об этике
Конкурирующие интересы
Авторы не заявляют об отсутствии конкурирующих интересов.
Дополнительная информация
Примечание издателя Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Дополнительная информация
Дополнительная информация
Сводка отчетов
Права и разрешения
Открытый доступ Эта статья находится под лицензией Creative Commons Attribution 4.0 International License, которая разрешает использование, совместное использование, адаптацию, распространение и воспроизведение на любом носителе или в любом формате в течение длительного времени. по мере того, как вы укажете первоначальных авторов и источник, предоставьте ссылку на лицензию Creative Commons и укажите, были ли внесены изменения. Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons для статьи, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/.
Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons для статьи, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/.
Перепечатка и разрешения
Об этой статье
Дополнительная литература
Синхронный колоректальный рак: клинико-патологические особенности и прогноз | Японский журнал клинической онкологии
Резюме
Цель: Настоящее исследование было предпринято для выяснения клинических и патологических особенностей синхронных колоректальных карцином, для сравнения прогноза между случаями синхронных карцином и случаев с одиночными карциномами, а также для изучения прогностических факторов синхронные карциномы.
Пациенты и методы: Среди 876 хирургически резецированных первичных колоректальных карцином было выявлено 42 случая (4,8%) с синхронными карциномами. Клинические характеристики, рутинные патологические данные по классификации TNM и послеоперационная выживаемость сравнивались между синхронными случаями и единичными случаями. Прогностические факторы синхронных случаев были изучены с использованием модели пропорциональных рисков.
Результаты: Индекс поражений синхронных случаев не отличался от одиночных поражений по возрасту, размеру, дифференциации, локализации, значению pT, значению pN, патологической стадии, морфологии или лимфатической инвазии. Однако соотношение мужчин и женщин было выше, а отдаленные метастазы чаще встречались в синхронных случаях, чем в единичных. Хотя послеоперационная выживаемость синхронных случаев была короче, чем у одиночных случаев, они были одинаковыми в многомерной модели пропорциональных рисков, включая патологическую стадию и излечимость в качестве сопутствующих факторов. Только патологическая стадия и излечимость основного поражения были значимыми кофакторами послеоперационной выживаемости синхронных случаев.
Только патологическая стадия и излечимость основного поражения были значимыми кофакторами послеоперационной выживаемости синхронных случаев.
Заключение: Синхронные карциномы и одиночные карциномы были сходны по клиническим характеристикам и обычным патологическим проявлениям. Прогноз синхронных случаев и одиночных случаев не отличался, если патологические стадии были идентичными, а резекции были излечивающими.
Ключевые слова: синхронный колоректальный рак – патология – прогноз
Поступила в редакцию 25.06.2002 г.; принято 18 октября 2002 г.
ВВЕДЕНИЕ
Хорошо известно, что пациенты с первичными колоректальными карциномами могут иметь более одного злокачественного образования в толстой и прямой кишках во время первоначального проявления (синхронная карцинома). Зарегистрированная частота синхронной колоректальной карциномы колеблется от 2,3 до 12,4% (1,2). Предоперационная или интраоперационная диагностика наличия синхронных колоректальных карцином очень важна, потому что, если их не заметить, они представляют собой ранние метахронные карциномы с поздними стадиями и обычно требуют повторной операции. Если синхронные карциномы обнаруживаются во время операции, иногда необходимо изменить хирургическую процедуру.
Если синхронные карциномы обнаруживаются во время операции, иногда необходимо изменить хирургическую процедуру.
Хотя синхронная колоректальная карцинома признана значимой клинической единицей, ее клинические и патологические особенности, а также ее прогноз до сих пор остаются спорными (3–5). Цели настоящего исследования заключались в том, чтобы уточнить клинические и патологические особенности синхронных карцином, сравнить прогноз между синхронными карциномами и одиночными карциномами, а также изучить прогностические факторы синхронных карцином.
МЕТОДЫ
С июня 1984 г. по 19 декабря99 879 случаев инвазивной колоректальной аденокарциномы были хирургически резецированы в хирургическом отделении больницы Косигая Медицинской школы Университета Доккио. После исключения двух случаев язвенного колита и одного случая семейного аденоматозного полипоза для исследования было отобрано 876 случаев. Пациенты, оперированные по поводу внутрислизистой карциномы, не были включены. Из них 834 случая были одиночными карциномами и 42 случая (4,8%) были синхронными карциномами, при которых в каждом случае были выявлены две или более инвазивные карциномы. Случаи с одной инвазивной карциномой и одной или несколькими внутрислизистыми карциномами были включены в единичные случаи. Мы использовали следующие критерии множественной колоректальной карциномы: каждая опухоль должна была иметь определенную гистологическую картину инвазивного злокачественного новообразования, быть отчетливо отделенной неповрежденной стенкой кишечника и явно не иметь метастатического происхождения от другой колоректальной опухоли (6,7). Карциномы, выявленные в течение 1 года после предшествующей операции, расценивали как синхронные карциномы. Таким образом, в синхронный случай был включен один случай, когда сопутствующая карцинома была выявлена через 3 мес после резекции индексного очага.
Из них 834 случая были одиночными карциномами и 42 случая (4,8%) были синхронными карциномами, при которых в каждом случае были выявлены две или более инвазивные карциномы. Случаи с одной инвазивной карциномой и одной или несколькими внутрислизистыми карциномами были включены в единичные случаи. Мы использовали следующие критерии множественной колоректальной карциномы: каждая опухоль должна была иметь определенную гистологическую картину инвазивного злокачественного новообразования, быть отчетливо отделенной неповрежденной стенкой кишечника и явно не иметь метастатического происхождения от другой колоректальной опухоли (6,7). Карциномы, выявленные в течение 1 года после предшествующей операции, расценивали как синхронные карциномы. Таким образом, в синхронный случай был включен один случай, когда сопутствующая карцинома была выявлена через 3 мес после резекции индексного очага.
Опухоли были разделены на три группы: (i) правая ободочная кишка, которая включала червеобразный отросток, слепую кишку, восходящую ободочную кишку, печеночный изгиб ободочной кишки и поперечную ободочную кишку; (ii) левая ободочная кишка, которая включала селезеночный изгиб ободочной кишки, нисходящую ободочную кишку и сигмовидную кишку; и (iii) прямая кишка, которая находилась ниже уровня крестцового промонтия. Морфология каждого поражения была макроскопически классифицирована как возвышающаяся или изъязвленная. Другой патологический диагноз был основан на классификации TNM (8), за исключением дифференцировки, которая диагностировалась по преобладающему типу. В синхронных случаях поражения, которые были наиболее патологически развиты, обозначались как индексные поражения. Когда два или более поражения находились на одинаковой патологической стадии, наибольшее поражение рассматривалось как индексное поражение.
Морфология каждого поражения была макроскопически классифицирована как возвышающаяся или изъязвленная. Другой патологический диагноз был основан на классификации TNM (8), за исключением дифференцировки, которая диагностировалась по преобладающему типу. В синхронных случаях поражения, которые были наиболее патологически развиты, обозначались как индексные поражения. Когда два или более поражения находились на одинаковой патологической стадии, наибольшее поражение рассматривалось как индексное поражение.
Категориальные данные и числовые данные сравнивали между группами с использованием критерия хи-квадрат и критерия Манна-Уитни U соответственно. Послеоперационную выживаемость анализировали с использованием как кривых выживаемости Каплана-Мейера с логарифмическим критерием, так и модели пропорционального риска. В анализ прогноза включались только пациенты, наблюдавшиеся в течение не менее 6 мес или до смерти; медиана наблюдения за выжившими составила 54,1 месяца.
РЕЗУЛЬТАТЫ
Характеристики синхронных поражений
Всего было выявлено 90 синхронных поражений в 42 случаях синхронных карцином. Количество синхронных карцином в каждом случае синхронной карциномы составляло две в 37 случаях, три в четырех случаях и четыре в одном случае. Синхронные карциномы присутствовали рядом (в пределах одного сегмента или смежного сегмента) в 29 случаях, тогда как они присутствовали в двух сегментах отдельно друг от друга в 11 случаях. В одном случае с четырьмя поражениями синхронные карциномы были обнаружены как рядом, так и в отдельных сегментах. Комбинации пенетрации стенки индекса и сопутствующих поражений были pT1 и pT1 в одном случае, pT2 или pT3 или pT4 и pT1 в 17 случаях и pT2 или pT3 или pT4 и pT2 или pT3 или pT4 в 24 случаях.
Количество синхронных карцином в каждом случае синхронной карциномы составляло две в 37 случаях, три в четырех случаях и четыре в одном случае. Синхронные карциномы присутствовали рядом (в пределах одного сегмента или смежного сегмента) в 29 случаях, тогда как они присутствовали в двух сегментах отдельно друг от друга в 11 случаях. В одном случае с четырьмя поражениями синхронные карциномы были обнаружены как рядом, так и в отдельных сегментах. Комбинации пенетрации стенки индекса и сопутствующих поражений были pT1 и pT1 в одном случае, pT2 или pT3 или pT4 и pT1 в 17 случаях и pT2 или pT3 или pT4 и pT2 или pT3 или pT4 в 24 случаях.
Сравнение между синхронными карциномами и одиночными карциномами
Синхронные карциномы были значительно меньше по размеру, чем одиночные карциномы. Синхронные карциномы чаще обнаруживались в левой части толстой кишки, чем единичные карциномы. Проникновение стенок синхронных карцином было меньше, чем у одиночных карцином. Возвышенные поражения чаще встречались при синхронных карциномах, чем при одиночных карциномах (таблица 1).
Возвышенные поражения чаще встречались при синхронных карциномах, чем при одиночных карциномах (таблица 1).
Сравнение индексных поражений и одновременных поражений в синхронных случаях
Поражения Index были больше по размеру, чаще умеренно дифференцированы, более глубоко проникали и чаще были изъязвлены по морфологии, чем одновременные поражения (таблица 2). Лимфатическая инвазия была более частой при основных поражениях, чем при сопутствующих поражениях.
Сравнение индексных поражений синхронных случаев и одиночных карцином
Синхронные карциномы чаще обнаруживались у мужчин, чем у женщин (таблица 3). Возраст на момент операции не различался между пациентами с синхронными карциномами и пациентами с одиночными карциномами. Ни размер, ни дифференциация, ни расположение, ни значение pT, ни значение pN, ни патологическая стадия, ни морфология, ни лимфатическая инвазия существенно не различались между индексными поражениями синхронных случаев и одиночными карциномами. Однако отдаленные метастазы значительно чаще встречались при индексных поражениях синхронных случаев, чем при одиночных карциномах. Венозная инвазия была незначительно более частой при индексных поражениях синхронных случаев, чем при одиночных карциномах (таблица 3).
Однако отдаленные метастазы значительно чаще встречались при индексных поражениях синхронных случаев, чем при одиночных карциномах. Венозная инвазия была незначительно более частой при индексных поражениях синхронных случаев, чем при одиночных карциномах (таблица 3).
Сравнение прогноза между синхронными случаями и одиночными случаями
Послеоперационная выживаемость была значительно короче в синхронных случаях, чем в одиночных случаях при однофакторном анализе (рис. 1А). Однако, когда были проанализированы только радикально резецированные (R0) случаи, разница была незначительной (рис. 1В). В многофакторной модели пропорциональных рисков, в которой патологическая стадия и излечимость были включены в число возможных прогностических кофакторов, послеоперационная выживаемость не отличалась между синхронными и единичными случаями (табл. 4).
Прогностические факторы синхронных случаев
При однофакторном анализе послеоперационная выживаемость пациентов с синхронными карциномами была короче у пациентов с индексными поражениями с более глубоким проникновением в стенку (более высокое значение pT), более обширными метастазами в лимфатические узлы (более высокое значение pN), отдаленными метастазирование и, следовательно, более поздняя патологическая стадия. Нелечебная (R1 или R2) резекция также была связана с относительно короткой послеоперационной выживаемостью (таблица 5). Ни количество синхронных поражений, ни расстояние между синхронными поражениями, ни глубина проникновения стенок синхронного поражения существенно не повлияли на послеоперационную выживаемость.
Нелечебная (R1 или R2) резекция также была связана с относительно короткой послеоперационной выживаемостью (таблица 5). Ни количество синхронных поражений, ни расстояние между синхронными поражениями, ни глубина проникновения стенок синхронного поражения существенно не повлияли на послеоперационную выживаемость.
Метахронная колоректальная карцинома и злокачественные новообразования других органов
В послеоперационном периоде метахронная колоректальная карцинома, выявленная через 1 год и более после операции по поводу индексного поражения, встречалась в 10 случаях. Однако частота метахронной карциномы существенно не различалась между синхронными и единичными случаями (таблица 6). Злокачественные новообразования в других органах были ассоциированы до или после операции в 33 случаях (3,8%). Частота злокачественных новообразований других органов также не отличалась между синхронными и единичными случаями.
ОБСУЖДЕНИЕ
Заболеваемость синхронной колоректальной карциномой в нашей серии составила 4,8%, что было аналогично другим отчетам из западных стран (4,9–11).
Мы не анализировали поражения, обработанные эндоскопической резекцией, которая была достаточным лечением как внутрислизистых карцином, так и аденом. Кроме того, было показано, что патологические критерии внутрислизистой карциномы, особенно ее отличие от аденом с атипией высокой степени, различаются у западных и японских патологов (12). Поэтому из исследования были исключены случаи только внутрислизистых карцином, а случаи с одной инвазивной карциномой и одной или несколькими внутрислизистыми карциномами рассматривались как единичные случаи.
При сравнении синхронных и единичных случаев возраст пациентов был сопоставим. Однако синхронные карциномы чаще обнаруживались у мужчин, чем у женщин; соотношение мужчин и женщин в синхронных случаях составляло 3,67: 1, тогда как при одиночной карциноме — 1,44: 1. Хотя соотношение мужчин и женщин в синхронных случаях существенно не отличалось от соотношения одиночных случаев в других отчетах, оно было немного больше в китайских сериях Chen и Sheen-Chen (5). Соотношение 2,19:1 в более крупном кумулятивном ряду Kaibara et al. (13) также было значительно больше, чем соотношение мужчин и женщин во всех случаях Многоучрежденческого регистра рака толстой кишки в Японии (1,44:1) (14).
Соотношение 2,19:1 в более крупном кумулятивном ряду Kaibara et al. (13) также было значительно больше, чем соотношение мужчин и женщин во всех случаях Многоучрежденческого регистра рака толстой кишки в Японии (1,44:1) (14).
В настоящем исследовании синхронные карциномы были обнаружены преимущественно в левой части толстой кишки. В большинстве других исследований синхронные карциномы чаще локализовались в правой части толстой кишки (4, 5, 10). Однако Финан и соавт. (9) сообщили о преобладании в левой части толстой кишки. Преобладание левой половины толстой кишки в настоящем исследовании, вероятно, связано с тем, что одновременные поражения часто обнаруживались в сигмовидной кишке, в случаях, когда указательное поражение находилось в прямой кишке.
Синхронные карциномы были менее развиты патологически, чем одиночные карциномы, в сравнении, включая все поражения синхронных случаев в настоящем исследовании. Эти результаты воспроизводили отчет Passman et al. (4) и были связаны с тем, что 21 из 48 одновременных поражений в синхронных случаях были поражениями pT1. Поскольку патологически наиболее распространенное поражение было определено как индексное поражение, одновременные поражения синхронных случаев были менее распространенными, чем индексные поражения. Другие авторы также сообщают о менее поздних патологических стадиях при сопутствующих поражениях, чем при индексных поражениях (5,9).).
Поскольку патологически наиболее распространенное поражение было определено как индексное поражение, одновременные поражения синхронных случаев были менее распространенными, чем индексные поражения. Другие авторы также сообщают о менее поздних патологических стадиях при сопутствующих поражениях, чем при индексных поражениях (5,9).).
Семейный анамнез рака может быть важным фактором в изучении синхронной карциномы. Взаимосвязь между семейным анамнезом рака и частотой синхронного поражения была исследована только Kimura et al., которые не обнаружили значимой корреляции между ними (3). Нам не удалось проанализировать взаимосвязь, так как данных семейного анамнеза в больничных картах у многих пациентов было недостаточно для этой цели.
Индекс поражений синхронных карцином был подобен единичным карциномам по размеру, дифференциации, расположению и проникновению в стенку. Поэтому прогнозирование наличия синхронных карцином по клиническим характеристикам или патологическим данным считается невозможным. Было показано, что генетический анализ, такой как обнаружение микросателлитной нестабильности (MSI), полезен для прогнозирования метахронной карциномы (15). Кроме того, сообщалось, что некоторые синхронные карциномы связаны с MSI, а некоторые пациенты могут быть больными наследственным неполипозным колоректальным раком (16–18). Таким образом, MSI индексных поражений может быть полезен для прогнозирования синхронных поражений. С другой стороны, исследование гистологически нормальной слизистой оболочки может выявить «дефект поля», который, вероятно, связан с развитием карциномы всей толстой кишки (19).,20).
Было показано, что генетический анализ, такой как обнаружение микросателлитной нестабильности (MSI), полезен для прогнозирования метахронной карциномы (15). Кроме того, сообщалось, что некоторые синхронные карциномы связаны с MSI, а некоторые пациенты могут быть больными наследственным неполипозным колоректальным раком (16–18). Таким образом, MSI индексных поражений может быть полезен для прогнозирования синхронных поражений. С другой стороны, исследование гистологически нормальной слизистой оболочки может выявить «дефект поля», который, вероятно, связан с развитием карциномы всей толстой кишки (19).,20).
Отдаленные метастазы чаще встречались в синхронных случаях, чем в единичных. Это может быть частично связано с относительно частой венозной инвазией, обнаруживаемой в основных поражениях синхронных случаев в настоящей серии. Кроме того, пациент с множественными распространенными карциномами может иметь синергетически высокий риск отдаленных метастазов. Действительно, у восьми (33,3%) из 24 пациентов с двумя или более распространенными карциномами (поражения pT2, pT3 или pT4) во время операции были отдаленные метастазы.
Что касается послеоперационной выживаемости, Kimura et al. сообщили о худшем прогнозе в синхронных случаях, чем в одиночных случаях, хотя разница была незначительной (3). Другие недавние исследования не обнаружили существенной разницы в выживаемости между синхронными случаями и единичными случаями (4,5). В настоящем исследовании послеоперационная выживаемость была значительно короче в синхронных случаях, чем в одиночных случаях. Считается, что это различие связано в основном с относительно частыми отдаленными метастазами в синхронных случаях. Таким образом, при корректировке патологической стадии индексного поражения и излечимости резекции в многофакторном анализе послеоперационная выживаемость в синхронных случаях была не хуже, чем в единичных, и в основном зависела от патологической стадии и излечимости индексных поражений.
В случаях с синхронными карциномами иногда необходима обширная резекция кишечника, такая как тотальная или субтотальная колэктомия (10,11,21). Если синхронные поражения упускаются из виду во время операции по поводу основного поражения, пациенту вскоре может потребоваться повторная операция по поводу ранней метахронной карциномы. Такие поражения неизбежно прогрессируют до патологических стадий и имеют плохой прогноз. Предоперационная тотальная колоноскопия, если это возможно (22, 23), осторожная интраоперационная пальпация всей толстой кишки и тщательный осмотр резецированного образца должны быть выполнены у всех пациентов с колоректальными карциномами, чтобы обнаружить синхронные карциномы,
Такие поражения неизбежно прогрессируют до патологических стадий и имеют плохой прогноз. Предоперационная тотальная колоноскопия, если это возможно (22, 23), осторожная интраоперационная пальпация всей толстой кишки и тщательный осмотр резецированного образца должны быть выполнены у всех пациентов с колоректальными карциномами, чтобы обнаружить синхронные карциномы,
В заключение, текущее исследование показало, что синхронная карцинома возникает у 4,8% пациентов с колоректальной карциномой. Хотя синхронные случаи чаще были связаны с отдаленными метастазами, чем единичные случаи, прогноз синхронных случаев был подобен прогнозу одиночных случаев, если патологические стадии были идентичными, а резекции были излечивающими.
+
Для перепечаток и всей корреспонденции: Масатоси Оя, нынешний адрес Отделение хирургии, больница Института рака, 1–37–1 Ками-Икебукуро, Тосима-Ку, Токио 170-8455, Япония. Электронная почта: [email protected]. jp
jp
Открыть в новой вкладкеСкачать слайд
Рисунок 1. Сравнение послеоперационной выживаемости между синхронными и одиночными случаями. (А) Все случаи; (B) радикально резецированные случаи.
Table 1.
Comparison of pathological findings between synchronous and single carcinomas
| No. of lesions | P | ||||||||||
| Synchronous | Single | ||||||||||
| No. of lesions | 90 | 834 | |||||||||
| Size* | 40 (20–50) | 45 (32–60) | <0.001 | ||||||||
| Differentiation | |||||||||||
| Well | 62 | 507 | 0.653 | ||||||||
| Moderate | 21 | 268 | |||||||||
| Poor | 2 | 17 | |||||||||
| Mucinous | 5 | 34 | |||||||||
| Others | 0 | 8 | |||||||||
| Location | |||||||||||
| 29 | 189 | 0,001 | |||||||||
| Левая толстая кишка | 39 | 272 | 272 | 272 | 272 | 272 | 2590 | ||||
| Rectum | 22 | 373 | |||||||||
| Wall penetration | |||||||||||
| pT1 | 22 | 56 | <0. 001 001 | ||||||||
| pT2 | 14 | 108 | |||||||||
| pT3 | 39 | 428 | |||||||||
| pT4 | 15 | 242 | |||||||||
| Morphology | |||||||||||
| Elevated | 26 | 126 | 0.003 | ||||||||
| Ulcerated | 64 | 703 | |||||||||
| Others | 0 | 5 Лимфатическая инвазия2583 | 586 | 0.095 | |||||||
| Absent | 35 | 248 | |||||||||
| Venous invasion | |||||||||||
| Present | 31 | 218 | 0.118 | ||||||||
| Absent | 59 | 616 | |||||||||
| 92 Количество из 83 поражений2487 P | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Synchronous | Single | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
No. of lesions of lesions | 90 | 834 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Size* | 40 (20–50) | 45 (32 –60) | <0,001 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Дифференциация | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| скважина | 7590 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| скважины | 7590 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .2582 Moderate | 21 | 268 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poor | 2 | 17 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mucinous | 5 | 34 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Others | 0 | 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Местоположение | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Правая толстая кишка | 29 | 189 | 8833839899 | 189 | 8833333333383 | 883 | 189 | 883 | 839899189 | 883 | 189 | 88339899 | .2590 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Left colon | 39 | 272 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rectum | 22 | 373 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wall penetration | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| pT1 | 22 | 56 | <0. 001 001 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| pT2 | 14 | 108 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| pT3 | 39 | 428 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| pT4 | 15 | 242 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Morphology | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elevated | 26 | 126 | 0.003 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ulcerated | 64 | 703 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Другие | 0 | 5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Лимфатическая инвазия3 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Present | 55 | 586 | 0.095 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Absent | 35 | 248 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Venous invasion | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Present | 31 | 218 | 0,118 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Отсутствует | 59 | 616 | 92 5822872 * Медиана (межквартильный размах). Открыть в новой вкладке Table 1. Comparison of pathological findings between synchronous and single carcinomas
* Медиана (межквартильный размах). Открыть в новой вкладке Table 2. Comparison of pathological findings between index lesions and concurrent lesions in synchronous carcinomas
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
0
999990
999990
8832582
 of lesions
of lesions 282092
288 292 1
 001
001  2583
2583 187
187  2581
2581| Число пациентов | 3 P90 | |||||||||
| Synchronous | Single | |||||||||
No. of patients of patients | 42 | 834 | ||||||||
| Age* | 65.3 (58.1–71.8) | 63.2 (54.8–71.3) | 0.251 | |||||||
| Gender (male:female) | 33:9 | 492:342 | 0.018 | |||||||
| Size* | 50 (40–65) | 45 (32–60) | 0.141 | |||||||
| Differentiation | ||||||||||
| Well | 23 | 507 | 0.494 | |||||||
| Moderate | 16 | 268 | ||||||||
| Poor | 0 | 17 | ||||||||
| Mucinous | 3 | 34 | ||||||||
| ДРУГОЙ | 0 | 8 9 9 | 0 | 8 9 9 99833 | 0 | 8 | ||||
| Location | ||||||||||
| Right colon | 14 | 189 | 0. 152 152 | |||||||
| Left colon | 15 | 272 | ||||||||
| Rectum | 13 | 373 | ||||||||
| Проникновение стен | ||||||||||
| PT1 | ||||||||||
| PT1 | ||||||||||
| PT1 | ||||||||||
| PT1 | 56 | 0.194 | ||||||||
| pT2 | 3 | 108 | ||||||||
| pT3 | 24 | 428 | ||||||||
| pT4 | 14 | 242 | ||||||||
| Lymph Узел Metastasis | ||||||||||
| PN0 | 14 | 321 | 0.187 | 999900.187 | 0.187 | 3999030.187 9258 | 90.2583 | 13 | 244 | |
| pN2 | 10 | 125 | ||||||||
| pNx | 5 | 144 | ||||||||
| Distant metastasis | ||||||||||
| Present | 14 | 140 | 0. 011 011 | |||||||
| Absent | 28 | 694 | ||||||||
| Stage | ||||||||||
| 1 | 2 | 75 | 0.173 | |||||||
| 2 | 14 | 232 | ||||||||
| 3 | 10 | 247 | ||||||||
| 4 | 14 | 154 | ||||||||
| НЕДЕЙНА2583 | ||||||||||
| Elevated | 3 | 126 | 0.314 | |||||||
| Ulcerated | 39 | 703 | ||||||||
| Others | 0 | 5 | ||||||||
| Лимфатическая инвазия | ||||||||||
| Настоящее время | 33 | 5863 0,2582 0,25820 | ||||||||
| Absent | 9 | 248 | ||||||||
| Venous invasion | ||||||||||
| Present | 17 | 218 | 0. 062 062 | |||||||
| Absent | 25 | 616 | ||||||||
* Медиана (межквартильный размах).
Открыть в новой вкладке
Таблица 3.
Comparison of clinical characteristics and pathological findings between index lesions of synchronous carcinomas and single carcinomas
| No. of patients | P | ||||||||
| Synchronous | Single | ||||||||
| Число больных | 42 | 834 | |||||||
| Возраст* | 65,3 (58,1–71,8) | 63.2 (54.8–71.3) | 0.251 | ||||||
| Gender (male:female) | 33:9 | 492:342 | 0.018 | ||||||
| Size* | 50 (40–65) | 45 (32–60) | 0. 141 141 | ||||||
| Differentiation | |||||||||
| Well | 23 | 507 | 0.494 | ||||||
| Moderate | 16 | 268 | |||||||
| Poor | 0 | 17 | |||||||
| Mucinous | 3 | 34 | |||||||
| Others | 0 | 8 | |||||||
| Location | |||||||||
| Правая толстая кишка | 14 | 189 | 0,152 | ||||||
| .2582 15 | 272 | ||||||||
| Rectum | 13 | 373 | |||||||
| Wall penetration | |||||||||
| pT1 | 1 | 56 | 0.194 | ||||||
| pT2 | 3 | 108 | |||||||
| pT3 | 24 | 428 | |||||||
| pT4 | 14 | 242 | |||||||
| Lymph node metastasis | |||||||||
| pN0 | 14 | 321 | 0. 187 187 | ||||||
| pN1 | 13 | 244 | |||||||
| pN2 | 10 | 125 | |||||||
| pNx | 5 | 144 | |||||||
| Distant metastasis | |||||||||
| Present | 14 | 140 | 0.011 | ||||||
| Absent | 28 | 694 | |||||||
| Stage | |||||||||
| 1 | 2 | 75 | 0,173 | ||||||
| 2 | 14 | 232 | 232 | 232 | 232 | 0 | |||
| 3 | 10 | 247 | |||||||
| 4 | 14 | 154 | |||||||
| Undetermined | 2 | 126 | |||||||
| Morphology | |||||||||
| Elevated | 3 | 126 | 0. 314 314 | ||||||
| Ulcerated | 39 | 703 | |||||||
| Others | 0 | 5 | |||||||
| Lymphatic invasion | |||||||||
| Present | 33 | 586 | 0.327 | ||||||
| Absent | 9 | 248 Венозная инвазия2582 218 | 0.062 | ||||||
| Absent | 25 | 616 | |||||||
| No. of patients | P | |||||||||||||
| Synchronous | Single | |||||||||||||
| Число больных | 42 | 834 | ||||||||||||
| Возраст* | 8,8,52582 63.2 (54.8–71.3) | 0.251 | ||||||||||||
| Gender (male:female) | 33:9 | 492:342 | 0. 018 018 | |||||||||||
| Size* | 50 (40–65) | 45 (32–60) | 0.141 | |||||||||||
| Differentiation | ||||||||||||||
| Well | 23 | 507 | 0.494 | |||||||||||
| Moderate | 16 | 268 | ||||||||||||
| Poor | 0 | 17 | ||||||||||||
| Mucinous | 3 | 34 | ||||||||||||
| Others | 0 | 8 | ||||||||||||
| Location | ||||||||||||||
| Правая кишка | 14 | 189 | 0,152 | |||||||||||
| Левая 8 2583 | 272 | |||||||||||||
| Rectum | 13 | 373 | ||||||||||||
| Wall penetration | ||||||||||||||
| pT1 | 1 | 56 | 0. 194 194 | |||||||||||
| pT2 | 3 | 108 | ||||||||||||
| PT3 | 24 | 428 | ||||||||||||
| 2583 | 242 | |||||||||||||
| Lymph node metastasis | ||||||||||||||
| pN0 | 14 | 321 | 0.187 | |||||||||||
| pN1 | 13 | 244 | ||||||||||||
| pN2 | 10 | 125 | ||||||||||||
| PNX | 5 | 144 | ||||||||||||
| .2583 | ||||||||||||||
| Present | 14 | 140 | 0. 011 011 | |||||||||||
| Absent | 28 | 694 | ||||||||||||
| Stage | ||||||||||||||
| 1 | 2 | 75 | 0.173 | |||||||||||
| 2 | 14 | 232 | ||||||||||||
| 3 | 10 | 247 | ||||||||||||
| 4 | 14 | 154 | ||||||||||||
| Undetermined | 2 | 126 | ||||||||||||
| Morphology | ||||||||||||||
| Elevated | 3 | 126 | 0,314 | |||||||||||
| Изъязвленный | 39 | 703 | 92 5812582 Others | 0 | 5 | |||||||||
| Lymphatic invasion | ||||||||||||||
| Present | 33 | 586 | 0. 327 327 | |||||||||||
| Absent | 9 | 248 | ||||||||||||
| Венозное вторжение | ||||||||||||||
| Присутствует | 17 | 218 | 0689 | 218 | 0.06 29292 | 218 | 0.06 292 | 218 | 06.1589 | 218 | 06 888 | 218 | 0682 | 218 |
| Отсутствует | 25 | 616 | ||||||||||||
* Медиана (межквартильный размах).
Открыть в новой вкладке
Таблица 4.
Прогнозное значение синхронной карциномы в сравнении с отдельной карциномой в многомерной модели пропорциональной опасности
 2582 P
2582 P | Hazard ratio | 95% Confidence interval | P | ||
| Lower | Upper | |||
| Synchronous:single | 1.157 | 0,747 | 1,791 | 0,513 |
| Патологическая стадия | 1,792 | 1,461 | 8 91582 <0.001 | |
| Curability (R0:R1 or R2) | 0. 284 284 | 0.198 | 0.408 | <0.001 |
Открыть в новой вкладке
Таблица 4.
Прогностическое значение синхронной карциномы по сравнению с одиночной карциномой в многомерной модели пропорционального риска2583
| Hazard ratio | 95% Confidence interval | P | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lower | Upper | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Synchronous:single | 1,157 | 0,747 | 1,791 | 0,513 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Патологическая стадия | 1,792 | 94582 2,198 | <0,001 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Обоснованность (R0: R1 или R2) | 0,284 | 0,198 | 0,408 | 1 | 0,408 | 1 | 2 0,4081 | 208. Открыть в новой вкладке Открыть в новой вкладкеТаблица 5. Прогностическое значение клинических характеристик и патологических находок при синхронной карциноме
Открыть в новой вкладке Table 6. Metachronous carcinomas and malignancies of other organs
Открыть в новой вкладке Таблица 6. Метахронные карциномы и злокачественные новообразования других органов
| Открыть в новой вкладке|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


 Российский онкологический журнал — 2001г — №3, стр. 18 – 21.
Российский онкологический журнал — 2001г — №3, стр. 18 – 21. Med. Buenos Aires, 1986, v. 64, № 2, p. 492- 502.
Med. Buenos Aires, 1986, v. 64, № 2, p. 492- 502.




 org/0000-0003-1123-7022 1 ,
org/0000-0003-1123-7022 1 , Нет единого мнения об определении момента времени для синхронного/метахронного, и его прогностические последствия остаются неясными. Цель исследования состояла в том, чтобы оценить прогностическую ценность дифференциального обнаружения в различные определяющие моменты времени в популяционной когорте пациентов и провести обзор литературы по этой теме.
Нет единого мнения об определении момента времени для синхронного/метахронного, и его прогностические последствия остаются неясными. Цель исследования состояла в том, чтобы оценить прогностическую ценность дифференциального обнаружения в различные определяющие моменты времени в популяционной когорте пациентов и провести обзор литературы по этой теме. Также оценивалось влияние синхронно или метахронно обнаруженных метастазов в печени на безрецидивную и общую выживаемость, как сообщалось в статьях, полученных в результате поиска литературы.
Также оценивалось влияние синхронно или метахронно обнаруженных метастазов в печени на безрецидивную и общую выживаемость, как сообщалось в статьях, полученных в результате поиска литературы. При синхронном обнаружении он определяет клинически значимую группу пациентов, к которой будут применяться индивидуальные протоколы мультимодального лечения.
При синхронном обнаружении он определяет клинически значимую группу пациентов, к которой будут применяться индивидуальные протоколы мультимодального лечения. Использовался момент времени диагностики первичной опухоли, альтернативно время операции первичной опухоли и изменение временных интервалов, связанных с этими моментами времени [3]. Попытка решить эту проблему была предпринята Adam et al. в 2015 г., где синхронность определялась как метастазы в печени, выявленные до или во время диагностики первичной опухоли [9].]. С современными тенденциями и разработками в лечении CRC и CRCLM обнаружение метастазов в печени во время диагностики первичной опухоли имеет важное терапевтическое значение, как с точки зрения хирургической стратегии, так и с точки зрения планирования онкологического лечения [10,11,12,13]. ]. В ранее опубликованной популяционной когорте пациентов с КРР время обнаружения метастазов в печени (синхронных или метахронных) не оказывало существенного влияния на выживаемость при многомерном анализе [4]. В этом исследовании ранее использовавшиеся определения синхронного и метахронного обнаружения CRCLM применяются к той же когорте пациентов для оценки прогностической ценности обнаружения в различные определяющие моменты времени в популяционной когорте.
Использовался момент времени диагностики первичной опухоли, альтернативно время операции первичной опухоли и изменение временных интервалов, связанных с этими моментами времени [3]. Попытка решить эту проблему была предпринята Adam et al. в 2015 г., где синхронность определялась как метастазы в печени, выявленные до или во время диагностики первичной опухоли [9].]. С современными тенденциями и разработками в лечении CRC и CRCLM обнаружение метастазов в печени во время диагностики первичной опухоли имеет важное терапевтическое значение, как с точки зрения хирургической стратегии, так и с точки зрения планирования онкологического лечения [10,11,12,13]. ]. В ранее опубликованной популяционной когорте пациентов с КРР время обнаружения метастазов в печени (синхронных или метахронных) не оказывало существенного влияния на выживаемость при многомерном анализе [4]. В этом исследовании ранее использовавшиеся определения синхронного и метахронного обнаружения CRCLM применяются к той же когорте пациентов для оценки прогностической ценности обнаружения в различные определяющие моменты времени в популяционной когорте.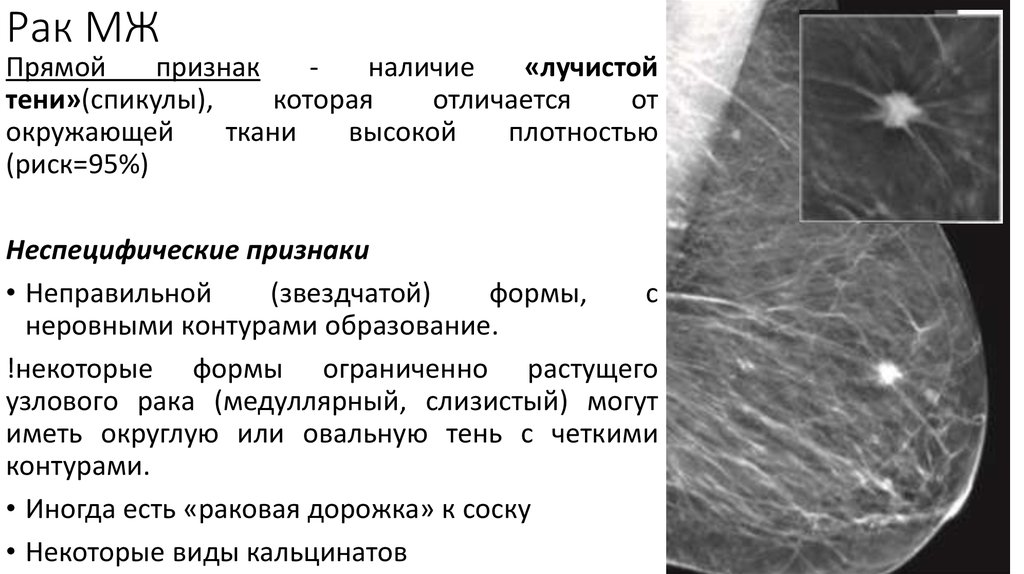 Чтобы выявить ранее использовавшиеся определения для синхронного и метахронного обнаружения CRCLM, был проведен литературный поиск статей, в которых была указана временная точка для синхронного и метахронного обнаружения.
Чтобы выявить ранее использовавшиеся определения для синхронного и метахронного обнаружения CRCLM, был проведен литературный поиск статей, в которых была указана временная точка для синхронного и метахронного обнаружения.