Вегетативный пароксизм: Пароксизм | Симптомы | Диагностика | Лечение
Вегетативные пароксизмы (кризы) — Неврология — LiveJournal
В структуре соматической и неврологической патологии вегетативные расстройства достигают 25 — 80 %. К числу наиболее частых форм относятся вегетативные пароксизмы (ВП), которые обычно диагностируются у лиц в возрасте 20 — 40 лет. ВП определяется как приступообразное проявление эмоциональных, вегетативных, когнитивных и поведенческих расстройств в относительно короткий промежуток времени (Заболевания вегетативной нервной системы: Руководство для врачей / Под ред. А. М. Вейна. – М.: Медицина, 1991. — 624 с.).
Основную роль в патогенезе ВП играет нарушение вегетативной регуляции и развитие вегетативного дисбаланса. В соответствии с наиболее распространенной концепцией H. Selbach отношения между симпатической и парасимпатической нервными системами соответствуют принципу «качающегося равновесия»: повышение тонуса одной системы влечет за собой возрастание тонуса другой. Такая форма вегетативного обеспечения позволяет поддерживать гомеостаз и создавать условия для повышенной лабильности физиологических функций. Клинико-экспериментальные исследования обнаружили эту лабильность практически во всех системах — вариации ритма сердца, артериального давления (АД), температуры тела и других показателей. Выход этих колебаний за пределы гомеостатического диапазона повышает уязвимость системы вегетативной регуляции для повреждающих факторов. В таких условиях экзогенные либо эндогенные стимулы могут приводить к предельному напряжению регуляторных систем, а затем к их поломке или (по А.М. Вейну) «дезинтеграции» с клинической манифестацией, в том числе в варианте ВП.
Клинико-экспериментальные исследования обнаружили эту лабильность практически во всех системах — вариации ритма сердца, артериального давления (АД), температуры тела и других показателей. Выход этих колебаний за пределы гомеостатического диапазона повышает уязвимость системы вегетативной регуляции для повреждающих факторов. В таких условиях экзогенные либо эндогенные стимулы могут приводить к предельному напряжению регуляторных систем, а затем к их поломке или (по А.М. Вейну) «дезинтеграции» с клинической манифестацией, в том числе в варианте ВП.
Ключевым звеном «дезинтеграции» регуляторных систем является дисбаланс вегетативной регуляции. Он может возникнуть, например, при вовлечении каких-либо надсегментарных структур вегетативной нервной системы (ВНС) в «застойную циркуляцию» возбуждения. Хронические заболевания внутренних органов и нервной системы, очаги инфекции, осложненный остеохондроз позвоночника могут вызывать существенное возрастание афферентного потока и формирование ансамблей вегетативных нейронов с повышенной возбудимостью. Закрытые травмы мозга, нейроинфекции и нейроинтоксикации, хронические нарушения мозгового кровообращения и ликвородинамики могут приводить к изменению химизма мозга и биоэлектрической активности нейронов по типу «посттетанической потенциации», что влечет образование очагов застойной циркуляции возбуждения в лимбико-ретикулярных структурах.
Закрытые травмы мозга, нейроинфекции и нейроинтоксикации, хронические нарушения мозгового кровообращения и ликвородинамики могут приводить к изменению химизма мозга и биоэлектрической активности нейронов по типу «посттетанической потенциации», что влечет образование очагов застойной циркуляции возбуждения в лимбико-ретикулярных структурах.
Другим механизмом «дезинтеграции» может стать изменение чувствительности нейронов гипоталамуса и ретикулярной формации среднего мозга к медиаторам (норадреналину, серотонину, нейропептидам). Такая динамика выявляется после эмоционального стресса, при хроническом болевом воздействии, гипокинезии. Действие различных предрасполагающих факторов наследственно-конституциональной природы, родовых травм, гормональных дисфункций может проявляться в нарушении синтеза, высвобождения и инактивации медиаторов, «поломке» механизмов ауто- и гетерорегуляции синапсов. В результате действия этих факторов в структурах мозга создается мозаичная картина чувствительности и реактивности нейронов, развивается вегетативный дисбаланс, нарушается адекватное вегетативное обеспечение жизнедеятельности. Установлено, что на психоэмоциональный и физический стресс, под воздействием импульсации, поступающей из лимбической системы, в гипоталамусе выделяются норадреналин и другие нейротрансмиттеры. Это сопровождается активацией симпатоадреналовой системы и изменением функционирования внутренних органов (сердца, легких, желудочно-кишечного тракта).
Установлено, что на психоэмоциональный и физический стресс, под воздействием импульсации, поступающей из лимбической системы, в гипоталамусе выделяются норадреналин и другие нейротрансмиттеры. Это сопровождается активацией симпатоадреналовой системы и изменением функционирования внутренних органов (сердца, легких, желудочно-кишечного тракта).
Выше описанные патологические факторы создают в лимбической системе, гипоталамусе, ретикулярной формации предраспоженность к высокой чувствительности и реактивности нейронов на действие нейротрансмиттеров. Поэтому, даже подпороговые стрессовые стимулы могут вызвать у таких людей чрезмерную активацию вегетативных нейронов гипоталамуса и эмоциогенных структур лимбической системы, что может манифестироваться ВП. Кроме того, у таких лиц выявлено снижение в крови концентрации серотонина, который является функциональным антагонистом норадреналина и препятствует развитию этих реакций, и -эндорфинов, которые обладают стресс-протективным действием. В результате постоянно поддерживается очаг возбуждения и застойная циркуляция импульсов в этих структурах мозга и любой стрессовый стимул, даже незначительной силы, вызывает их активацию и развитие ВП симпатической, парасимпатической или смешанной природы (в зависимости от того, какие именно ядра гипоталамуса и среднего мозга вовлекаются в возбуждение).
читайте также статью: Вегетативная дистония – от синдрома к болезни (на laesus-de-liro.livejournal.com) [читать]
У больных с ВП, манифестировавшими кризами преимущественно симпато-адреналового характера, клиническая картина болезни характеризуется тахикардией, повышением артериального давления и температуры тела, ознобом, неприятными ощущениями в области сердца. У большинства больных в конце приступа возникает полиурия. Вагоинсулярные пароксизмы клинически протекают с ощущением удушья, головокружения, тошноты, которая иногда сопровождается рвотой, брадикардией, усилением перистальтики кишечника, чувством жара, гипергидрозом. При смешанных ВП отмечаются отдельные признаки обоих типов (то есть головокружение, тошнота, повышение артериального давления, сердцебиение и т.д.).
При хроническом стрессе, вследствие иррадиации возбуждения, могут вовлекаться новые нервные центры и истощаться содержание нейромедиаторов, что влечет изменение клинической картины и вида ВП. Пролонгированный вегетативный дисбаланс может не только усугублять течение имеющихся висцеральных дисфункций, но и способствовать формированию новых соматоневрологических синдромов.
Пролонгированный вегетативный дисбаланс может не только усугублять течение имеющихся висцеральных дисфункций, но и способствовать формированию новых соматоневрологических синдромов.
Исходя из патогенеза, клинической картины (и данных нейрофункциональной диагностики), основные принципы терапии вегетативных пароксизмов должны включать: [1] коррекцию психоэмоционального состояния больного, в том числе с использованием стресс-протекторов; [2] устранение очагов патологической афферентной импульсации; [3] лечение и профилактику хронических заболеваний внутренних органов; [4] лечение неврологических проявлений остеохондроза позвоночника; [5] устранение очагов застойного возбуждения и циркуляции импульсов в лимбической системе; [6] восстановление нарушенного вегетативного баланса; [7] дифференцированный подход в назначении лекарственных средств в зависимости от типа и тяжести ВП; [8] устранение избыточного напряжения в функционировании внутренних органов; [9] создание благоприятных метаболических условий для мозга в процессе терапии; [10] комплексность терапии.
Обратите внимание! Материал изложен по материалам стати «Вегетативные пароксизмы: вопросы патогенеза, диагностики и лечения» Одинак М.М., Михайленко А.А., Шустов Е.Б., Иванов Ю.С., Семин Г.Ф., Котельников С.А., Коваленко А.П. // Воен.-мед. журн. – 1996. – №11. – С. 37-45. В настоящий момент в неврологии для лечени ВП применяют и другие препараты, кроме тех, которые указаны ниже. Но основные принципы и применяемые группы препаратов не претерпели какого-либо существенного изменения.
Для купирования любых ВП может быть рекомендовано введение 2 мл 0,5 % раствора диазепама (сибазона, седуксен, реланиум), клозапина (50 — 300 мг/сут) внутривенно в 20 мл 5 % раствора глюкозы или внутримышечно (клозапин выпускается в виде раствора для инъекций 2,5% по 2 мл в ампулах). При преобладании симпатических проявлений может быть использовано введение обзидана (1 мл 0,1 % раствора), пирроксана (1 — 2 мл 1 % раствора внутримышечно), при преобладании парасимпатических – подкожное введение 0,5 — 1 мл 0,1 % раствора атропина.
Эффективным средством профилактики ВП являются стресс-протекторы. С этой целью могут широко использоваться транквилизаторы дневного действия, например, тофизопам (торговое название: грандаксин) и фенибут. Грандаксин обладает транквилизирующей активностью, не вызывая сонливости (дневной транквилизатор). Он снижает психоэмоциональное напряжение, тревогу, обладает вегетостабилизирующим действием. Препарат назначается по 50 — 100 мг 3 раза в день. Фенибут оказывает ноотропное и противотревожное (анксиолитическое) действие. Применяется по 0,25 г 3 раза в день.
Для коррекции психоэмоционального состояния больного применяются препараты разных групп — бензодиазепиновые транквилизаторы, антидепрессанты, некоторые нейролептики (например, тералиджен) и антиконвульсанты. Они также оказывают благоприятное воздействие на очаги повышенной возбудимости и «застойную» циркуляцию нервных импульсов. Бензодиазепиновые транквилизаторы потенциируют действие ГАМК. Они уменьшают возбудимость лимбической системы, таламуса, гипоталамуса. Препараты ограничивают иррадиацию импульсов из очага «застойного» возбуждения и уменьшают их «застойную» циркуляцию. Среди них особенно эффективным препаратом является феназепам, который по силе транквилизирующего и анксиолитического действия превосходит другие транквилизаторы. Назначается по 0,5 — 1 мг 1 — 2 раза в день, обычно утром и днем, в комбинации с антидепрессантами, которые назначают на ночь. Используются также другие препараты этой группы — сибазон (диазепам), тазепам, мезапам, клоназепам. [!!!] Бензодиазепиновые транквилизаторы более эффективны при симпатических ВП. Следует иметь в виду, что очень часто больные избирательно реагируют на то или иное лекарственное средство, поэтому как препараты, так и их дозы должны подбираться строго индивидульно для каждого больного.
Препараты ограничивают иррадиацию импульсов из очага «застойного» возбуждения и уменьшают их «застойную» циркуляцию. Среди них особенно эффективным препаратом является феназепам, который по силе транквилизирующего и анксиолитического действия превосходит другие транквилизаторы. Назначается по 0,5 — 1 мг 1 — 2 раза в день, обычно утром и днем, в комбинации с антидепрессантами, которые назначают на ночь. Используются также другие препараты этой группы — сибазон (диазепам), тазепам, мезапам, клоназепам. [!!!] Бензодиазепиновые транквилизаторы более эффективны при симпатических ВП. Следует иметь в виду, что очень часто больные избирательно реагируют на то или иное лекарственное средство, поэтому как препараты, так и их дозы должны подбираться строго индивидульно для каждого больного.
Также для лечения ВП используется альпразолам (кассадан, ксанакс). Препарат является триазоловым производным бензодиазепинов с предположительно ГАМК-эргическим механизмом действия и занимает промежуточное положение между транквилизаторами и антидепрессантами. Он оказывает сильное противотревотревожное и также тимоаналептическое,а также умеренное седативное действие, предотвращает развитие спонтанных и ситуационных ВП и обладает вегетостабилизирующим эффектом. У большинства больных действие препарата проявляется в течение 1 недели. Назначается с 0,25 — 0,5 мг/сут 1 — 3 раза в день с постепенным повышением дозировки до 4 — 6 мг/сут.
Он оказывает сильное противотревотревожное и также тимоаналептическое,а также умеренное седативное действие, предотвращает развитие спонтанных и ситуационных ВП и обладает вегетостабилизирующим эффектом. У большинства больных действие препарата проявляется в течение 1 недели. Назначается с 0,25 — 0,5 мг/сут 1 — 3 раза в день с постепенным повышением дозировки до 4 — 6 мг/сут.
Антидепрессанты в той или иной степени блокируют обратный захват норадреналина (НА) и серотонина и оказывают анксиолитическое, тимоаналептическое и седативное действие. Для лечения ВП широко используются амитриптилин, мапротилин (лудиомил), миансерин (леривон), флувоксамин. Амитриптилин в большей степени (в 3 раза) блокирует обратный захват НА по сравнению с серотонином. [!!!] Из-за наличия холинолитической активности он является препаратом выбора при ВП парасимпатического характера. При его применении могут возникать побочные эффекты в виде тахикардии, сухости слизистых, задержки мочи, запоров. Эффект наступает через 3 — 4 недели от начала терапии. Применяют в дозах 12,5 — 25 мг в сутки. Миансерин блокирует пресинаптические 1- и 2-адренорецепторы, три типа серотониновых рецепторов и h2-гистаминовые. Особенностью его клинического действия является относительная быстрота наступления эффекта. Уже в первую неделю происходит купирование тревоги, психоэмоционального возбуждения и расстройств сна. Назначается по 30 мг/сут на ночь. Особенностью мапротилина является большая эффективность в отношение психосоматических заболеваний. Он назначается, когда имеются сопутствующие заболевания внутренних органов, в дозе 12,5 — 25 мг/сут. Флувоксамин — является сильным ингибитором обратного захвата серотонина, но не оказывает холинолитического, антигистаминного и адренолитического действия и, следовательно, не вызывает гипотензивных и кардиотоксических побочных эффектов. У препарата особенно выражен вегетостабилизирующий эффект. Применяется по 50 — 100 мг/сут однократно вечером. [!!!] Некоторые антидепрессанты (амитриптилин, флувоксамин) могут давать усиление симптоматики в начале лечения, поэтому они обычно используются в комбинации с бензодиазепиновыми транквилизаторами, в частности, с феназепамом.
Применяют в дозах 12,5 — 25 мг в сутки. Миансерин блокирует пресинаптические 1- и 2-адренорецепторы, три типа серотониновых рецепторов и h2-гистаминовые. Особенностью его клинического действия является относительная быстрота наступления эффекта. Уже в первую неделю происходит купирование тревоги, психоэмоционального возбуждения и расстройств сна. Назначается по 30 мг/сут на ночь. Особенностью мапротилина является большая эффективность в отношение психосоматических заболеваний. Он назначается, когда имеются сопутствующие заболевания внутренних органов, в дозе 12,5 — 25 мг/сут. Флувоксамин — является сильным ингибитором обратного захвата серотонина, но не оказывает холинолитического, антигистаминного и адренолитического действия и, следовательно, не вызывает гипотензивных и кардиотоксических побочных эффектов. У препарата особенно выражен вегетостабилизирующий эффект. Применяется по 50 — 100 мг/сут однократно вечером. [!!!] Некоторые антидепрессанты (амитриптилин, флувоксамин) могут давать усиление симптоматики в начале лечения, поэтому они обычно используются в комбинации с бензодиазепиновыми транквилизаторами, в частности, с феназепамом.
Среди антиконвульсантов эффективным препаратом в лечении ВП оказался карбамазепин (финлепсин). Он обладает серотонинэргическим механизмом действия (повышает чувствительность тормозных серотонинэргических рецепторов, усиливает высвобождение серотонина). Препарат снижает возбудимость нейронов в очаге возбуждения, ограничивает иррадиацию возбуждения из доминантного очага, снимает посттетаническую потенциацию. Обладает нормотимическим (нормализуют настроение) и вегетостабилизирующим действием. Карбамазепин применяется по 0,1 г (= 1/2 таб) 1 — 2 раза в день.
В случае неэффективности препаратов других групп, для лечения ВП при их тяжелом течении могут использоваться некоторые нейролептики, к которым относятся тиоридазин (меллерил, сонапакс), перициазин (неулептил), азалептин (лепонекс, клозапин). Они эффективно влияют на синаптическую передачу и тормозят высвобождение возбуждающих медиаторов (дофамина, НА, АХ, гистамина), оказывают дополнительное постсинаптическое М- и Н- холинолитическое действие. Они практически лишены такого побочного действия, как развитие экстрапирамидных нарушений. В отличие от других нейролептиков, они не вызывают вялости, заторможенности и эмоциональной индифферентности; обладают успокаивающим влиянием, снимают тревогу, страх, напряженность, навязчивость. Характерной особенностью азалептина является угнетение реакции активации РФ (ретикулярной формации). Он обладает сомато-, нейро- и вегетотропной активностью и среди нейролептиков является препаратом выбора. Неулептил особенно эффективен при сочетании ВП с расстройствами поведения. [!!!] Нейролептики в большей степени эффективны при смешанных и парасимпатических ВП и, в основном, используются для купирования тяжелых приступов ВП, когда другие средства неэффективны. В случаях курсового лечения назначаются минимальные терапевтические небольшие дозы.
Они практически лишены такого побочного действия, как развитие экстрапирамидных нарушений. В отличие от других нейролептиков, они не вызывают вялости, заторможенности и эмоциональной индифферентности; обладают успокаивающим влиянием, снимают тревогу, страх, напряженность, навязчивость. Характерной особенностью азалептина является угнетение реакции активации РФ (ретикулярной формации). Он обладает сомато-, нейро- и вегетотропной активностью и среди нейролептиков является препаратом выбора. Неулептил особенно эффективен при сочетании ВП с расстройствами поведения. [!!!] Нейролептики в большей степени эффективны при смешанных и парасимпатических ВП и, в основном, используются для купирования тяжелых приступов ВП, когда другие средства неэффективны. В случаях курсового лечения назначаются минимальные терапевтические небольшие дозы.
Для коррекции психоэмоционального состояния необходимо также использовать [!!!] ПСИХОТЕРАПИЮ, в том числе направленную на изменение личностных отношений к психотравмирующим факторам.
Восстановление нарушенного вегетативного баланса. Клинико-нейрофизиологическая диагностика ВП помогает установить избыточность или недостаточность функционировния эрго- и трофотропных (симпатических и парасимпатических) центров. Влияние на эрготропную систему оказывают пирроксан и этимизол. Пирроксан — обладает центральным и периферическим — адреноблокирующим действием. Проникает через гемато-энцефалический барьер в диэнцефальной зоне и подавляет эффекты, связанные с чрезмерным возбуждением заднего гипоталамуса (локализация центров симпатической нервной системы). Он снижает общий симпатический тонус, обладает легким седативным и антитревожным действием, нормализует терморегуляцию и обмен катехоламинов. Назначается при ВП симпатоадреналового характера в начальной стадии заболевания (до 5 лет). Этимизол — повышает активность гипоталамо-гипофизарно-надпочечниковой системы. При этом происходит увеличение концентрации кортизола в крови и увеличение симпатической активности (в т.ч. у больных с артериальной гипотензией повышается артериальное давление). Препарат также тормозит спонтанную сократительную активность гладкомышечных клеток кишечника. Он улучшает самочувствие и эмоциональное состояние больных, повышает работоспособность, уменьшает также выраженность синдрома постуральной тахикардии, вплоть до полного исчезновения. Поэтому препарат используется при парасимпатических ВП и в случаях, когда активность симпатической нервной системы недостаточная. Обычно эти средства (и пирроксан, и этимизол) используются в комбинации с бензодиазепиновыми транквилизаторами или антидепрессантами.
Препарат также тормозит спонтанную сократительную активность гладкомышечных клеток кишечника. Он улучшает самочувствие и эмоциональное состояние больных, повышает работоспособность, уменьшает также выраженность синдрома постуральной тахикардии, вплоть до полного исчезновения. Поэтому препарат используется при парасимпатических ВП и в случаях, когда активность симпатической нервной системы недостаточная. Обычно эти средства (и пирроксан, и этимизол) используются в комбинации с бензодиазепиновыми транквилизаторами или антидепрессантами.
Устранение функционального висцерального напряжения. Последнее особенно часто выявляется в сердечно-сосудистой системе и проявляется в виде тахикардии в покое и при переходе из горизонтального положения в вертикальное (синдром постуральной тахикардии), а также в увеличении индекса напряжения миокарда, уменьшении вариативности ритма сердца, сопровождается прессорной реакцией на ортостаз. Для коррекции этих расстройств назначают — адреноблокаторы — пропранолол (анаприлин, индерал, тразикор). Во избежание побочных эффектов со стороны кардио-респираторной системы предпочтение следует отдавать препаратам, имеющим внутреннюю симпатомиметическую активность — пиндолол (вискен). Напряженное функционирование органов желудочно-кишечного тракта может проявляться в виде усиления перистальтики (частый жидкий стул) и повышения секреции желудком соляной кислоты (изжога). В этих случаях назначают препараты белладонны, спазмолитин, галидор, баралгин (триган, максиган). Следует помнить, что назначение этих препаратов является симптоматической мерой и они должны использоваться в качестве дополнения к основным терапевтическим средствам.
Во избежание побочных эффектов со стороны кардио-респираторной системы предпочтение следует отдавать препаратам, имеющим внутреннюю симпатомиметическую активность — пиндолол (вискен). Напряженное функционирование органов желудочно-кишечного тракта может проявляться в виде усиления перистальтики (частый жидкий стул) и повышения секреции желудком соляной кислоты (изжога). В этих случаях назначают препараты белладонны, спазмолитин, галидор, баралгин (триган, максиган). Следует помнить, что назначение этих препаратов является симптоматической мерой и они должны использоваться в качестве дополнения к основным терапевтическим средствам.
Метаболическая коррекция. У больных с органическими заболеваниями нервной системы, в структуре которых имеются ВП (последствия закрытых травм мозга, хроническая недостаточность мозгового кровообращения) необходимо назначать средства, создающие благоприятные метаболические условия для мозга. К ним относятся различные витаминные комплексы, аминокислоты (глютаминовая кислота) и ноотропы с легким седативным компонентом – пиридитол (энцефабол), деанол. Пиридитол активирует метаболические процессы в ЦНС, способствует проникновению глюкозы через ГЭБ, снижает избыточное образование молочной кислоты, повышает устойчивость тканей мозга к гипоксии. Обладает седативным действием, усиливает эффекты бензодиазепинов. Деанол улучшает метаболические процессы в мозге, на ЦНС оказывает мягкое стимулирующее действие, также является ингибитором свободных радикалов.
Пиридитол активирует метаболические процессы в ЦНС, способствует проникновению глюкозы через ГЭБ, снижает избыточное образование молочной кислоты, повышает устойчивость тканей мозга к гипоксии. Обладает седативным действием, усиливает эффекты бензодиазепинов. Деанол улучшает метаболические процессы в мозге, на ЦНС оказывает мягкое стимулирующее действие, также является ингибитором свободных радикалов.
После того, когда основная симптоматика регрессирует (через 2 — 4 недели) для уменьшения явлений астенизации, апатии следует назначать адаптогены. Применяются экстракт элеутерококка, корень женьшеня, настойка лимонника по 20 — 30 капель 3 раза в день. В связи с их активирующим действием препараты не следует назначать после 18 часов. Адаптогены не следует назначать на начальных этапах лечения, так как они способны усиливать вегетативные расстройства.
© Laesus De Liro
Вегетативные пароксизмы (кризы)
Для купирования любых ВП может быть рекомендовано введение 2 мл 0,5 % раствора диазепама (сибазона, седуксен, реланиум), клозапина (50 – 300 мг/сут) внутривенно в 20 мл 5 % раствора глюкозы или внутримышечно (клозапин выпускается в виде раствора для инъекций 2,5% по 2 мл в ампулах). При преобладании симпатических проявлений может быть использовано введение обзидана (1 мл 0,1 % раствора), пирроксана (1 – 2 мл 1 % раствора внутримышечно), при преобладании парасимпатических – подкожное введение 0,5 – 1 мл 0,1 % раствора атропина.
При преобладании симпатических проявлений может быть использовано введение обзидана (1 мл 0,1 % раствора), пирроксана (1 – 2 мл 1 % раствора внутримышечно), при преобладании парасимпатических – подкожное введение 0,5 – 1 мл 0,1 % раствора атропина.
Эффективным средством профилактики ВП являются стресс-протекторы. С этой целью могут широко использоваться транквилизаторы дневного действия, например, тофизопам (торговое название: грандаксин) и фенибут. Грандаксин обладает транквилизирующей активностью, не вызывая сонливости (дневной транквилизатор). Он снижает психоэмоциональное напряжение, тревогу, обладает вегетостабилизирующим действием. Препарат назначается по 50 – 100 мг 3 раза в день. Фенибут оказывает ноотропное и противотревожное (анксиолитическое) действие. Применяется по 0,25 г 3 раза в день.
Для коррекции психоэмоционального состояния больного применяются препараты разных групп – бензодиазепиновые транквилизаторы, антидепрессанты, некоторые нейролептики (например, тералиджен) и антиконвульсанты. Они также оказывают благоприятное воздействие на очаги повышенной возбудимости и “застойную” циркуляцию нервных импульсов. Бензодиазепиновые транквилизаторы потенциируют действие ГАМК. Они уменьшают возбудимость лимбической системы, таламуса, гипоталамуса. Препараты ограничивают иррадиацию импульсов из очага “застойного” возбуждения и уменьшают их “застойную” циркуляцию. Среди них особенно эффективным препаратом является феназепам, который по силе транквилизирующего и анксиолитического действия превосходит другие транквилизаторы. Назначается по 0,5 – 1 мг 1 – 2 раза в день, обычно утром и днем, в комбинации с антидепрессантами, которые назначают на ночь. Используются также другие препараты этой группы – сибазон (диазепам), тазепам, мезапам, клоназепам. Бензодиазепиновые транквилизаторы более эффективны при симпатических ВП. Следует иметь в виду, что очень часто больные избирательно реагируют на то или иное лекарственное средство, поэтому как препараты, так и их дозы должны подбираться строго индивидульно для каждого больного.
Они также оказывают благоприятное воздействие на очаги повышенной возбудимости и “застойную” циркуляцию нервных импульсов. Бензодиазепиновые транквилизаторы потенциируют действие ГАМК. Они уменьшают возбудимость лимбической системы, таламуса, гипоталамуса. Препараты ограничивают иррадиацию импульсов из очага “застойного” возбуждения и уменьшают их “застойную” циркуляцию. Среди них особенно эффективным препаратом является феназепам, который по силе транквилизирующего и анксиолитического действия превосходит другие транквилизаторы. Назначается по 0,5 – 1 мг 1 – 2 раза в день, обычно утром и днем, в комбинации с антидепрессантами, которые назначают на ночь. Используются также другие препараты этой группы – сибазон (диазепам), тазепам, мезапам, клоназепам. Бензодиазепиновые транквилизаторы более эффективны при симпатических ВП. Следует иметь в виду, что очень часто больные избирательно реагируют на то или иное лекарственное средство, поэтому как препараты, так и их дозы должны подбираться строго индивидульно для каждого больного.
Также для лечения ВП используется альпразолам (кассадан, ксанакс). Препарат является триазоловым производным бензодиазепинов с предположительно ГАМК-эргическим механизмом действия и занимает промежуточное положение между транквилизаторами и антидепрессантами. Он оказывает сильное противотревотревожное и также тимоаналептическое,а также умеренное седативное действие, предотвращает развитие спонтанных и ситуационных ВП и обладает вегетостабилизирующим эффектом. У большинства больных действие препарата проявляется в течение 1 недели. Назначается с 0,25 – 0,5 мг/сут 1 – 3 раза в день с постепенным повышением дозировки до 4 – 6 мг/сут.
Антидепрессанты в той или иной степени блокируют обратный захват норадреналина (НА) и серотонина и оказывают анксиолитическое, тимоаналептическое и седативное действие. Для лечения ВП широко используются амитриптилин, мапротилин (лудиомил), миансерин (леривон), флувоксамин. Амитриптилин в большей степени (в 3 раза) блокирует обратный захват НА по сравнению с серотонином. Из-за наличия холинолитической активности он является препаратом выбора при ВП парасимпатического характера. При его применении могут возникать побочные эффекты в виде тахикардии, сухости слизистых, задержки мочи, запоров. Эффект наступает через 3 – 4 недели от начала терапии. Применяют в дозах 12,5 – 25 мг в сутки. Миансерин блокирует пресинаптические 1- и 2-адренорецепторы, три типа серотониновых рецепторов и h2-гистаминовые. Особенностью его клинического действия является относительная быстрота наступления эффекта. Уже в первую неделю происходит купирование тревоги, психоэмоционального возбуждения и расстройств сна. Назначается по 30 мг/сут на ночь. Особенностью мапротилина является большая эффективность в отношение психосоматических заболеваний. Он назначается, когда имеются сопутствующие заболевания внутренних органов, в дозе 12,5 – 25 мг/сут. Флувоксамин – является сильным ингибитором обратного захвата серотонина, но не оказывает холинолитического, антигистаминного и адренолитического действия и, следовательно, не вызывает гипотензивных и кардиотоксических побочных эффектов.
Из-за наличия холинолитической активности он является препаратом выбора при ВП парасимпатического характера. При его применении могут возникать побочные эффекты в виде тахикардии, сухости слизистых, задержки мочи, запоров. Эффект наступает через 3 – 4 недели от начала терапии. Применяют в дозах 12,5 – 25 мг в сутки. Миансерин блокирует пресинаптические 1- и 2-адренорецепторы, три типа серотониновых рецепторов и h2-гистаминовые. Особенностью его клинического действия является относительная быстрота наступления эффекта. Уже в первую неделю происходит купирование тревоги, психоэмоционального возбуждения и расстройств сна. Назначается по 30 мг/сут на ночь. Особенностью мапротилина является большая эффективность в отношение психосоматических заболеваний. Он назначается, когда имеются сопутствующие заболевания внутренних органов, в дозе 12,5 – 25 мг/сут. Флувоксамин – является сильным ингибитором обратного захвата серотонина, но не оказывает холинолитического, антигистаминного и адренолитического действия и, следовательно, не вызывает гипотензивных и кардиотоксических побочных эффектов. У препарата особенно выражен вегетостабилизирующий эффект. Применяется по 50 – 100 мг/сут однократно вечером. Некоторые антидепрессанты (амитриптилин, флувоксамин) могут давать усиление симптоматики в начале лечения, поэтому они обычно используются в комбинации с бензодиазепиновыми транквилизаторами, в частности, с феназепамом.
У препарата особенно выражен вегетостабилизирующий эффект. Применяется по 50 – 100 мг/сут однократно вечером. Некоторые антидепрессанты (амитриптилин, флувоксамин) могут давать усиление симптоматики в начале лечения, поэтому они обычно используются в комбинации с бензодиазепиновыми транквилизаторами, в частности, с феназепамом.
Среди антиконвульсантов эффективным препаратом в лечении ВП оказался карбамазепин (финлепсин). Он обладает серотонинэргическим механизмом действия (повышает чувствительность тормозных серотонинэргических рецепторов, усиливает высвобождение серотонина). Препарат снижает возбудимость нейронов в очаге возбуждения, ограничивает иррадиацию возбуждения из доминантного очага, снимает посттетаническую потенциацию. Обладает нормотимическим (нормализуют настроение) и вегетостабилизирующим действием. Карбамазепин применяется по 0,1 г (= 1/2 таб) 1 – 2 раза в день.
В случае неэффективности препаратов других групп, для лечения ВП при их тяжелом течении могут использоваться некоторые нейролептики, к которым относятся тиоридазин (меллерил, сонапакс), перициазин (неулептил), азалептин (лепонекс, клозапин). Они эффективно влияют на синаптическую передачу и тормозят высвобождение возбуждающих медиаторов (дофамина, НА, АХ, гистамина), оказывают дополнительное постсинаптическое М- и Н- холинолитическое действие. Они практически лишены такого побочного действия, как развитие экстрапирамидных нарушений. В отличие от других нейролептиков, они не вызывают вялости, заторможенности и эмоциональной индифферентности; обладают успокаивающим влиянием, снимают тревогу, страх, напряженность, навязчивость. Характерной особенностью азалептина является угнетение реакции активации РФ (ретикулярной формации). Он обладает сомато-, нейро- и вегетотропной активностью и среди нейролептиков является препаратом выбора. Неулептил особенно эффективен при сочетании ВП с расстройствами поведения. Нейролептики в большей степени эффективны при смешанных и парасимпатических ВП и, в основном, используются для купирования тяжелых приступов ВП, когда другие средства неэффективны. В случаях курсового лечения назначаются минимальные терапевтические небольшие дозы.
Они эффективно влияют на синаптическую передачу и тормозят высвобождение возбуждающих медиаторов (дофамина, НА, АХ, гистамина), оказывают дополнительное постсинаптическое М- и Н- холинолитическое действие. Они практически лишены такого побочного действия, как развитие экстрапирамидных нарушений. В отличие от других нейролептиков, они не вызывают вялости, заторможенности и эмоциональной индифферентности; обладают успокаивающим влиянием, снимают тревогу, страх, напряженность, навязчивость. Характерной особенностью азалептина является угнетение реакции активации РФ (ретикулярной формации). Он обладает сомато-, нейро- и вегетотропной активностью и среди нейролептиков является препаратом выбора. Неулептил особенно эффективен при сочетании ВП с расстройствами поведения. Нейролептики в большей степени эффективны при смешанных и парасимпатических ВП и, в основном, используются для купирования тяжелых приступов ВП, когда другие средства неэффективны. В случаях курсового лечения назначаются минимальные терапевтические небольшие дозы.
Восстановление нарушенного вегетативного баланса. Клинико-нейрофизиологическая диагностика ВП помогает установить избыточность или недостаточность функционировния эрго- и трофотропных (симпатических и парасимпатических) центров. Влияние на эрготропную систему оказывают пирроксан и этимизол. Пирроксан – обладает центральным и периферическим – адреноблокирующим действием. Проникает через гемато-энцефалический барьер в диэнцефальной зоне и подавляет эффекты, связанные с чрезмерным возбуждением заднего гипоталамуса (локализация центров симпатической нервной системы). Он снижает общий симпатический тонус, обладает легким седативным и антитревожным действием, нормализует терморегуляцию и обмен катехоламинов. Назначается при ВП симпатоадреналового характера в начальной стадии заболевания (до 5 лет). Этимизол – повышает активность гипоталамо-гипофизарно-надпочечниковой системы. При этом происходит увеличение концентрации кортизола в крови и увеличение симпатической активности (в т.ч. у больных с артериальной гипотензией повышается артериальное давление). Препарат также тормозит спонтанную сократительную активность гладкомышечных клеток кишечника. Он улучшает самочувствие и эмоциональное состояние больных, повышает работоспособность, уменьшает также выраженность синдрома постуральной тахикардии, вплоть до полного исчезновения. Поэтому препарат используется при парасимпатических ВП и в случаях, когда активность симпатической нервной системы недостаточная. Обычно эти средства (и пирроксан, и этимизол) используются в комбинации с бензодиазепиновыми транквилизаторами или антидепрессантами.
Препарат также тормозит спонтанную сократительную активность гладкомышечных клеток кишечника. Он улучшает самочувствие и эмоциональное состояние больных, повышает работоспособность, уменьшает также выраженность синдрома постуральной тахикардии, вплоть до полного исчезновения. Поэтому препарат используется при парасимпатических ВП и в случаях, когда активность симпатической нервной системы недостаточная. Обычно эти средства (и пирроксан, и этимизол) используются в комбинации с бензодиазепиновыми транквилизаторами или антидепрессантами.
Устранение функционального висцерального напряжения. Последнее особенно часто выявляется в сердечно-сосудистой системе и проявляется в виде тахикардии в покое и при переходе из горизонтального положения в вертикальное (синдром постуральной тахикардии), а также в увеличении индекса напряжения миокарда, уменьшении вариативности ритма сердца, сопровождается прессорной реакцией на ортостаз. Для коррекции этих расстройств назначают – адреноблокаторы – пропранолол (анаприлин, индерал, тразикор). Во избежание побочных эффектов со стороны кардио-респираторной системы предпочтение следует отдавать препаратам, имеющим внутреннюю симпатомиметическую активность – пиндолол (вискен). Напряженное функционирование органов желудочно-кишечного тракта может проявляться в виде усиления перистальтики (частый жидкий стул) и повышения секреции желудком соляной кислоты (изжога). В этих случаях назначают препараты белладонны, спазмолитин, галидор, баралгин (триган, максиган). Следует помнить, что назначение этих препаратов является симптоматической мерой и они должны использоваться в качестве дополнения к основным терапевтическим средствам.
Во избежание побочных эффектов со стороны кардио-респираторной системы предпочтение следует отдавать препаратам, имеющим внутреннюю симпатомиметическую активность – пиндолол (вискен). Напряженное функционирование органов желудочно-кишечного тракта может проявляться в виде усиления перистальтики (частый жидкий стул) и повышения секреции желудком соляной кислоты (изжога). В этих случаях назначают препараты белладонны, спазмолитин, галидор, баралгин (триган, максиган). Следует помнить, что назначение этих препаратов является симптоматической мерой и они должны использоваться в качестве дополнения к основным терапевтическим средствам.
Метаболическая коррекция.
У больных с органическими заболеваниями нервной системы, в структуре которых имеются ВП (последствия закрытых травм мозга, хроническая недостаточность мозгового кровообращения) необходимо назначать средства, создающие благоприятные метаболические условия для мозга. К ним относятся различные витаминные комплексы, аминокислоты (глютаминовая кислота) и ноотропы с легким седативным компонентом – пиридитол (энцефабол), деанол. Пиридитол активирует метаболические процессы в ЦНС, способствует проникновению глюкозы через ГЭБ, снижает избыточное образование молочной кислоты, повышает устойчивость тканей мозга к гипоксии. Обладает седативным действием, усиливает эффекты бензодиазепинов. Деанол улучшает метаболические процессы в мозге, на ЦНС оказывает мягкое стимулирующее действие, также является ингибитором свободных радикалов.
Пиридитол активирует метаболические процессы в ЦНС, способствует проникновению глюкозы через ГЭБ, снижает избыточное образование молочной кислоты, повышает устойчивость тканей мозга к гипоксии. Обладает седативным действием, усиливает эффекты бензодиазепинов. Деанол улучшает метаболические процессы в мозге, на ЦНС оказывает мягкое стимулирующее действие, также является ингибитором свободных радикалов.
После того, когда основная симптоматика регрессирует (через 2 – 4 недели) для уменьшения явлений астенизации, апатии следует назначать адаптогены. Применяются экстракт элеутерококка, корень женьшеня, настойка лимонника по 20 – 30 капель 3 раза в день. В связи с их активирующим действием препараты не следует назначать после 18 часов. Адаптогены не следует назначать на начальных этапах лечения, так как они способны усиливать вегетативные расстройства.
ПАНИЧЕСКАЯ АТАКА – МАСКА ПСИХОГЕННЫХ ПРИПАДКОВ? СРАВНИТЕЛЬНЫЙ АНАЛИЗ ФЕНОМЕНОЛОГИИ ПСИХОГЕННЫХ ПРИСТУПОВ И ПАНСИЧЕСКИХ АТАК
Александр Вейн, Галина Дюкова, Ольга Воробьева
Отсутствие четких клинических критериев диагностики психогенных припадков и обилие в их структуре вегетативной симптоматики ставит вопрос о том, как их дифференцировать. состояния от панических атак (ПА). Клиническая симптоматика пароксизма сравнивалась в группе из 32 больных с ПА и в группе из 15 больных с психогенными припадками. Выявлено, что симптомы, отнесенные к паническим по критериям DSM-III R, в равной степени наблюдаются в обеих группах. Эти состояния дифференцируются только симптомом «страх смерти», наблюдаемым у 20% больных с психогенными припадками и у 90% больных с ПА, так и по количеству конверсионных симптомов (5,9 у больных с психогенными припадками и 2,2 у больных с ПА). Предполагается, что при обоих типах пароксизмов симптомы, связанные с паникой, не являются специфическими, и эти симптомы отражают только аффективный дистресс. Последнее специфически выражается в виде симптома «страха смерти» при панических атаках и в виде конверсионных симптомов при психогенных припадках.
состояния от панических атак (ПА). Клиническая симптоматика пароксизма сравнивалась в группе из 32 больных с ПА и в группе из 15 больных с психогенными припадками. Выявлено, что симптомы, отнесенные к паническим по критериям DSM-III R, в равной степени наблюдаются в обеих группах. Эти состояния дифференцируются только симптомом «страх смерти», наблюдаемым у 20% больных с психогенными припадками и у 90% больных с ПА, так и по количеству конверсионных симптомов (5,9 у больных с психогенными припадками и 2,2 у больных с ПА). Предполагается, что при обоих типах пароксизмов симптомы, связанные с паникой, не являются специфическими, и эти симптомы отражают только аффективный дистресс. Последнее специфически выражается в виде симптома «страха смерти» при панических атаках и в виде конверсионных симптомов при психогенных припадках.
КЛЮЧЕВЫЕ СЛОВА: Конверсионные симптомы, паническая атака, психогенные припадки.
ВВЕДЕНИЕ
Пароксизмальные истерические состояния (психогенные припадки) составляют относительно аморфную категорию. Нет ни четких положительных критериев диагностики таких пароксизмов, ни ясности в терминологии этих состояний. Обычно используются следующие термины: истерические припадки, псевдоприпадки, псевдоэпилептические припадки, психогенные припадки. Согласно DSM-III R, третье издание, психогенные припадки не выделяются в отдельную сущность, но конверсионные симптомы включаются в определения: «конверсионные расстройства» и «соматизационные расстройства» (1). В то же время психогенные припадки составляют 20% симптомов, наблюдаемых у больных истерией (2).
Нет ни четких положительных критериев диагностики таких пароксизмов, ни ясности в терминологии этих состояний. Обычно используются следующие термины: истерические припадки, псевдоприпадки, псевдоэпилептические припадки, психогенные припадки. Согласно DSM-III R, третье издание, психогенные припадки не выделяются в отдельную сущность, но конверсионные симптомы включаются в определения: «конверсионные расстройства» и «соматизационные расстройства» (1). В то же время психогенные припадки составляют 20% симптомов, наблюдаемых у больных истерией (2).
Традиционно основными критериями диагностики психогенных припадков являются двигательные явления (спазмы, судороги) и потеря сознания. Поэтому психогенные припадки обычно дифференцируют от неврологических заболеваний, таких как эпилепсия, обмороки, пароксизмальный хореоатетоз, вздрагивание, миоклональные припадки и др. Stefanis et al. (3) указали на тенденцию к редукции классических драматических форм истерии в 1976 г. Было также замечено, что они могут замещаться малыми формами конверсии, главным образом за счет вегетативных конверсионных симптомов. Менее драматичные припадки без выраженных двигательных явлений и потери сознания наблюдал и Фентон (4). Весьма вероятно, что психогенные припадки, сопровождающиеся множественными вегетативными нарушениями (сердечно-легочной, желудочно-кишечной и другими симптомами) без явных двигательных явлений, могут «симулировать» паническую атаку (ПА).
Менее драматичные припадки без выраженных двигательных явлений и потери сознания наблюдал и Фентон (4). Весьма вероятно, что психогенные припадки, сопровождающиеся множественными вегетативными нарушениями (сердечно-легочной, желудочно-кишечной и другими симптомами) без явных двигательных явлений, могут «симулировать» паническую атаку (ПА).
Вопрос о сходстве и различии психогенных припадков и ПА мало освещен в литературе, хотя «истерический выплеск» в структуре ПА (5), «ПА с агрессией» (6) и очаговые неврологические явления при ПА (7) уже были описаны. Также были предприняты попытки выделить пароксизмы с неврологическими конверсионными симптомами при ПА (8). Более того, Шихан и соавт. (9) применили критерии панических расстройств DSM-III R к больным истерией и пришли к выводу, что у 70% больных, страдающих пароксизмальными состояниями, эти состояния можно классифицировать как «панические атаки».
Поэтому основной целью настоящего исследования было проведение сравнительного анализа клинических проявлений психогенных припадков и ПА с целью изучения представленности конверсионных симптомов в структуре панических атак и представленности «панических» симптомов в структуре психогенных припадков. припадки.
припадки.
МАТЕРИАЛЫ И МЕТОДЫ
Обследованы и пролечены 47 больных с тревожными и/или истерическими пароксизмами в Клинике Российского центра вегетативных расстройств Московской медицинской академии за период 1988-1991. ПА страдали 32 (6 мужчин и 26 женщин) больных, средний возраст которых составил 33,2±1,1 года (диапазон 23-44 года). Также было 15 пациентов (1 мужчина и 14 женщин) с психогенными припадками, возраст которых варьировал от 16 до 47 лет (в среднем 30,9±2,4 года).
Диагностика и отбор пациентов для этого исследования проводились исследователями Центра, имевшими предыдущий опыт диагностики и лечения тревожных и конверсионных расстройств. Идентификация пароксизма как «панической атаки» проводилась на основании критериев DSM-III R (1). Пароксизм расценивали как психогенный припадок, когда он состоял из незначительных периодов неврологических конверсионных нарушений (мутизм, судороги, судороги, псевдопарезы, потеря сознания и др.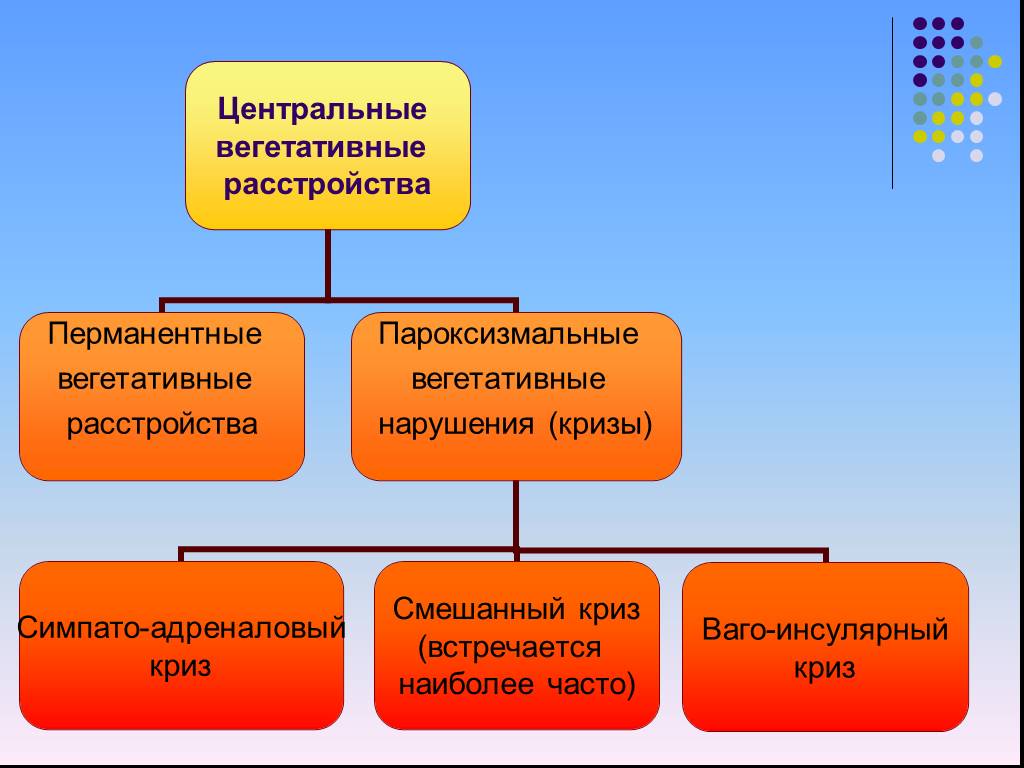 ) в сочетании с вегетативной симптоматикой. В это исследование были включены только больные, у которых пароксизмальные состояния были оценены одинаково (без единого расхождения в диагностике) тремя опытными исследователями. Из анализа исключались больные, вызвавшие сомнение хотя бы у одного из экспертов в отношении типа пароксизма. Ни один из больных не страдал органическими неврологическими заболеваниями (исключены как причина пароксизмальных состояний).
) в сочетании с вегетативной симптоматикой. В это исследование были включены только больные, у которых пароксизмальные состояния были оценены одинаково (без единого расхождения в диагностике) тремя опытными исследователями. Из анализа исключались больные, вызвавшие сомнение хотя бы у одного из экспертов в отношении типа пароксизма. Ни один из больных не страдал органическими неврологическими заболеваниями (исключены как причина пароксизмальных состояний).
Каждому из больных предлагалось отметить симптомы, характерные для его пароксизма, из приведенного списка (табл. 1) и ранжировать каждый из симптомов по степени их выраженности от 0 до 4 баллов (0 = нет, 1 = легкая, 2 = умеренная, 3 = тяжелая, 4 = очень тяжелая). В список вошли симптомы ПА по классификации DSM-III R (группа А) и неврологические конверсионные симптомы (группа В).
Все результаты проанализированы методами вариационной статистики с использованием доверительных интервалов распределения Стьюдента.
РЕЗУЛЬТАТЫ
В таблице II приведены «ассоциированные с паникой» симптомы и конверсионные симптомы в двух группах пациентов в этом исследовании. 10 из 14 «панических симптомов» встречались более чем у 70% больных с психогенными припадками. Такие симптомы, как «одышка», «сердцебиение», «головокружение», «головокружение» или «неустойчивое ощущение себя» превышали 90%. Среди «панических» симптомов наиболее редкими были «страх сойти с ума или сделать что-то неконтролируемое во время приступа» (7%) или «страх смерти» (20%). Однако 73% больных с психогенными припадками отмечали «чувство внутреннего напряжения». Среди конверсионных симптомов наиболее часто встречались «нарушения зрения и слуха» (9).3%), «псевдопарез» (80%), «потеря речи и голоса» (73%). «Судороги» наблюдались в 60% случаев, «потеря сознания» в 53% случаев, «элементы истерической дуги» в 33% случаев.
10 из 14 «панических симптомов» встречались более чем у 70% больных с психогенными припадками. Такие симптомы, как «одышка», «сердцебиение», «головокружение», «головокружение» или «неустойчивое ощущение себя» превышали 90%. Среди «панических» симптомов наиболее редкими были «страх сойти с ума или сделать что-то неконтролируемое во время приступа» (7%) или «страх смерти» (20%). Однако 73% больных с психогенными припадками отмечали «чувство внутреннего напряжения». Среди конверсионных симптомов наиболее часто встречались «нарушения зрения и слуха» (9).3%), «псевдопарез» (80%), «потеря речи и голоса» (73%). «Судороги» наблюдались в 60% случаев, «потеря сознания» в 53% случаев, «элементы истерической дуги» в 33% случаев.
Среди пациентов с ПА 10 из 14 «панических симптомов» встречались более чем у 70%. Наиболее редкими симптомами были «чувство нереальности» (34%) и «страх сойти с ума или сделать что-то неконтролируемое во время приступа» (31%). Был только один пациент с ПА, у которого не было ни «страха смерти», ни «чувства внутреннего напряжения». Более чем в 70% случаев не было выявлено ни одного конверсионного симптома. Однако более чем в 50 % случаев больные отмечали «псевдопарез» (56 %) и «ком в горле» (50 %), более чем в трети случаев — «нарушения зрения и слуха» (37,5 %) и «судороги» (31%). Ни один пациент из этой группы не сообщил о «потере сознания». У 8 больных (25%) во время приступов было 4 и более конверсионных симптома.
Более чем в 70% случаев не было выявлено ни одного конверсионного симптома. Однако более чем в 50 % случаев больные отмечали «псевдопарез» (56 %) и «ком в горле» (50 %), более чем в трети случаев — «нарушения зрения и слуха» (37,5 %) и «судороги» (31%). Ни один пациент из этой группы не сообщил о «потере сознания». У 8 больных (25%) во время приступов было 4 и более конверсионных симптома.
Сравнительный анализ «панически-ассоциированных» симптомов и конверсионных симптомов в группе больных с психогенными припадками и с ПА показал большую статистически достоверную разницу таких симптомов, как «страх смерти» (х 2 =26,6, р<0,001), «потеря сознания» (х 2 =23,7, р<0,001), «нарушение походки» (х 2 =21,1, р<0,001). Остальные отличия касались только конверсионных симптомов: «потеря речи». и голоса» (х 2 =17,4, р<0,001), «нарушения зрения и слуха» (х 2 =14,3, р<0,001). У больных с психогенными припадками преобладали все перечисленные симптомы, кроме «страха смерти». Выявлено, что симптомы, отнесенные к паническим по критериям DSM-III R, в равной степени наблюдаются в обеих группах. Эти состояния дифференцируются только по симптому «страх смерти», наблюдающемуся у 20% больных с психогенными припадками и у 90% больных с ПА, и по количеству конверсионных симптомов (5,9 у больных с психогенными припадками и 2,2 у больных с психогенными припадками). с ПА).
Выявлено, что симптомы, отнесенные к паническим по критериям DSM-III R, в равной степени наблюдаются в обеих группах. Эти состояния дифференцируются только по симптому «страх смерти», наблюдающемуся у 20% больных с психогенными припадками и у 90% больных с ПА, и по количеству конверсионных симптомов (5,9 у больных с психогенными припадками и 2,2 у больных с психогенными припадками). с ПА).
Таблица III содержит субъективную оценку выраженности рассматриваемых симптомов у больных с психогенными припадками и ПА.
Наивысшая оценка касалась сердцебиения и страха смерти в обеих группах. Достоверная разница была только в отношении «чувства нереальности», которое было сильно выражено у больных ПА.
ОБСУЖДЕНИЕ
В нашем исследовании было показано, что симптомы, классифицируемые как панические по критериям DSM-III R, в равной степени наблюдаются в группе из 32 больных с ПА и в группе из 15 больных с психогенными припадками. Эти состояния дифференцируются только симптомом «страх смерти», наблюдаемым у 20% больных с психогенными припадками и у 90% больных ПА, так и по количеству конверсионных симптомов (5,9 у больных с психогенными припадками и 2,2. у больных с ПА).
Эти состояния дифференцируются только симптомом «страх смерти», наблюдаемым у 20% больных с психогенными припадками и у 90% больных ПА, так и по количеству конверсионных симптомов (5,9 у больных с психогенными припадками и 2,2. у больных с ПА).
Это исследование также доказывает сложность дифференциации психогенных припадков и ПА. Как правило, врач сам пароксизм не наблюдает, особенно у амбулаторных больных. Сообщая о пароксизме, больные обычно подчеркивают вегетативные симптомы, тогда как абортивные пароксизмы чаще ограничиваются 3-4 вегетативными симптомами. С другой стороны, в критериях DSM-IIIR для ПА не оговаривается, сколько дополнительных симптомов и какие симптомы могут быть в пароксизме.
Сравнение симптомов ПА и психогенных приступов, клинически идентифицированных сходным образом, показало значительное совпадение большинства рассматриваемых симптомов. В настоящее время отсутствуют критерии, которые можно было бы считать достоверными при дифференциации пароксизмальных состояний. Десаи и др. (10) предложили бессознательное состояние в качестве дифференциально-диагностического симптома для дифференциации психогенных припадков и ПА. Однако в нашем исследовании «потери сознания» встречаются только у 50% больных с психогенными припадками. Поэтому он не может быть достаточным критерием для диагностики психогенных припадков. Это исследование показало, что наличие «страха смерти» в приступе и количество конверсионных симптомов позволяют дифференцировать эти состояния.
Десаи и др. (10) предложили бессознательное состояние в качестве дифференциально-диагностического симптома для дифференциации психогенных припадков и ПА. Однако в нашем исследовании «потери сознания» встречаются только у 50% больных с психогенными припадками. Поэтому он не может быть достаточным критерием для диагностики психогенных припадков. Это исследование показало, что наличие «страха смерти» в приступе и количество конверсионных симптомов позволяют дифференцировать эти состояния.
Пациенты с типичным ПА сообщали о наличии 3,15±0,26 конверсионных симптомов в приступе, тогда как отдельные симптомы, например, «псевдопарез», «ком в горле» встречались у половины больных. Аронсон и др. (11) проанализировали симптомы, не включенные в описательные критерии DSM-III R для ПА, а также указали на «ком в горле» и «затрудненное глотание» у 54,4% пациентов с ПА. Койл и др. (2) наблюдали наличие у больных ПА 2-3 очаговых неврологических симптомов: сенсорных — «онемение» и «покалывание в гемисенсорной распространенности»; моторные — «неуклюжесть» или «чувство тяжести в одной или двух конечностях»; зрительные – «двусторонняя нечеткость или полная слепота». Авторы исключали органическое происхождение очаговой неврологической симптоматики и считали ее соматическим производным гипервентиляции. Многие исследователи наблюдали гипервентиляционные расстройства у подавляющего большинства больных ПА, основываясь на симптомах (12) и данных биохимических исследований (13). В то же время они уделяли значительно меньше внимания неврологическим конверсионным симптомам. Это исследование показало, что 4 и более конверсионных симптома можно наблюдать у 25% пациентов с ПА.
Авторы исключали органическое происхождение очаговой неврологической симптоматики и считали ее соматическим производным гипервентиляции. Многие исследователи наблюдали гипервентиляционные расстройства у подавляющего большинства больных ПА, основываясь на симптомах (12) и данных биохимических исследований (13). В то же время они уделяли значительно меньше внимания неврологическим конверсионным симптомам. Это исследование показало, что 4 и более конверсионных симптома можно наблюдать у 25% пациентов с ПА.
Гипервентиляция является основным механизмом формирования симптомов при конверсионных расстройствах. Учитывая, что такие симптомы гипервентиляции, как «одышка», «парестезии» и др., в равной степени наблюдаются в обеих группах больных в данном исследовании, можно предположить одинаковую выраженность гипервентиляционных расстройств в этих группах. Однако, принимая во внимание, что конверсионные симптомы более широко представлены в структуре пароксизма у больных с психогенными припадками, чем у больных с ПА, можно предположить наличие иных механизмов, участвующих в формировании конверсионных симптомов у больных с психогенными припадками. Эта проблема требует дальнейшего изучения.
Эта проблема требует дальнейшего изучения.
Так называемые «панические ассоциированные» симптомы наблюдались с одинаковой частотой как в группе больных с ПА, так и с психогенными припадками в нашем исследовании. Мы предполагаем, что «связанные с паникой» симптомы, вероятно, не являются специфическими, а отражают состояние аффективного дистресса (общее возбуждение), общее для обоих состояний. В известной мере это подтверждается высокой и сходной представленностью «чувства внутреннего напряжения» у больных с психогенными припадками и с ПА. Мы предполагаем, что этот симптом является эквивалентом аффективного дистресса, который не дифференцируется пациентами. На основании полученных нами результатов мы заключаем, что при одном типе реакции аффективный дистресс, вероятно, специфически выражается в панике или «страхе смерти» (во время ПА), при другом типе реакции он выражается в конверсионной симптоматике (при психогенных припадках).
БЛАГОДАРНОСТЬ
Авторы выражают признательность доктору наук Шепелевой И. П. за предоставление клинического материала.
П. за предоставление клинического материала.
ЛИТЕРАТУРА
1. Американская психиатрическая ассоциация: Диагностическое и статистическое руководство по психическим расстройствам, третье издание, пересмотренное. Вашингтон, округ Колумбия: Американская психиатрическая ассоциация, 1987
2. Люндберг Л., Истерия. Клиническое, прогностическое и генетическое исследование. Acta Psychiatr Scand 1957; 32 (Suppl 112): 1–162
3. Стефанис С., Маркидис М., Христодулон Г. Наблюдения за эволюцией истерической симптоматики. Бр. Дж. Психиатрия, 1976; 128:269-275
4. Фентон Г. Эпилепсия и истерия. Бр. Дж. Психиатрия, 1986; 149:28-37
5. Frohlich E, Tazari R, Dustan H. Гипердинамическое бета-адренергическое состояние кровообращения. Arch Intern Med 1969; 123:1-7
6. Edlund M, Swann A, Clothier J. Пациенты с паническими атаками и результаты ЭЭГ брюшной полости. Am J Психиатрия 1987; 144:508-509
7. Койл П., Стерман А. Очаговые неврологические симптомы при панических атаках. Am J Психиатрия 1976; 143:648-649
Койл П., Стерман А. Очаговые неврологические симптомы при панических атаках. Am J Психиатрия 1976; 143:648-649
8. Дюкова Г.М., Алиева Х.К., Хаспекова Н.Б. Пароксизмальные состояния при неврозах. Журнал неврологии и психиатрии. Москва 1986; 89:12-18 (на русском языке)
9. Шихан Д., Шихан К. Классификация тревожных и истерических состояний. Часть II: к более невристической классификации. J Clin Psychopharmacol 1982; 1:235-244
10. Десаи Б., Портер Р., Пири Дж. Психогенный приступ. Неврология 1976;29:602-614
11. Аронсон Т., Лог С. Феноменология панических атак: описательное исследование пациентов с паническим расстройством. Самоотчет. J Clin Psychiatry 1988;449:8-13
12. Гелдер М.Г. Панические атаки: новые подходы к старой проблеме. Бр. Дж. Психиатрия, 1986; 149:346-352
13. Хибберт Г. Гипервентиляция как причина панических атак. BMJ 1984;288:263-264
Систематический анализ патофизиологии сосудистых пароксизмов в перименопаузе: методы коррекции питания | Громова
1. Parazzini F. Ресвератрол, триптофан, глицин и витамин Е: нутрицевтический подход к нарушению сна и раздражительности в пери- и постменопаузе. Минерва Джинеколь. 2015;67(1):1–5. PMID: 25660429.
Parazzini F. Ресвератрол, триптофан, глицин и витамин Е: нутрицевтический подход к нарушению сна и раздражительности в пери- и постменопаузе. Минерва Джинеколь. 2015;67(1):1–5. PMID: 25660429.
2. Громова О. А., Торшин И. Ю., Лиманова О. А., Никонов А. А. Патофизиология вегето-сосудистых пароксизмов (приливов) в период менопаузы у женщин и механизмы действия β-аланина. Новая клинико-фармакологическая концепция. Патофизиология вегетативно-сосудистых пароксизмов (приливы) в период менопаузы у женщин и механизмы воздействия β-аланина. Новая клинико-фармакологическая концепция. Гинекология. 2010;12(2):29–36. (на рус.).
3. Торшин И. Ю., Громова О. А., Лиманова О. А. «Быстрое действие» клималанина (β-аланина) на приливы: сравнительное исследование взаимодействий β-аланина, таурина и глицина с глициновыми рецепторами. «Быстрый эффект» клималанина (β-аланина) при приливах: сравнительное исследование взаимодействий β-аланина, таурина и глицина с глициновыми рецепторами. Гинекология.
4. Шанафельт Т. Д., Бартон Д. Л., Аджей А. А., Лопринци С. Л. Патофизиология и лечение приливов. Мэйо Клин Proc. 2002;77(11):1207–18. https://doi.org/10.4065/77.11.1207. PMID: 12440557.
5. Maclennan A.H., Broadbent J.L., Lester S., Moore V. Пероральный прием эстрогена и комбинированная эстроген/прогестагенная терапия в сравнении с плацебо при приливах. Кокрановская система базы данных, ред. 2004; 2004(4):CD002978. https://doi.org/10.1002/14651858.CD002978.pub2. PMID: 15495039.
6. Рабин Д. С., Чиппарроне Н., Линн Э. С., Моэн М. Почему женщины в менопаузе не хотят принимать заместительную гормональную терапию. Менопауза. 1999;6(1):61–7. PMID: 10100182.
7. Rossouw J.E., Anderson G.L., Prentice R.L. et al. Риски и преимущества комбинации эстрогена и прогестина у здоровых женщин в постменопаузе: основные результаты рандомизированного контролируемого исследования Инициативы по охране здоровья женщин. ДЖАМА. 2002;288(3):321–33. https://doi.
8. Лейси Дж. В., Минк П. Дж., Любин Дж. Х. и соавт. Менопаузальная заместительная гормональная терапия и риск рака яичников. ДЖАМА. 2002;288(3):334–41. https://doi.org/10.1001/jama.288.3.334. PMID: 12117398.
9. Coughlin S.S., Giustozzi A., Smith S.J., Lee N.C. Метаанализ заместительной терапии эстрогенами и риск развития эпителиального рака яичников. Дж. Клин Эпидемиол. 2000;53(4):367–75. https://doi.org/10.1016/s0895-4356(99)00179-1. PMID: 10785567.
10. Tanis B.C., van den Bosch M.A., Kemmeren J.M. et al. Оральные контрацептивы и риск инфаркта миокарда. N Engl J Med. 2001; 345 (25): 1787–9.3. https://doi.org/10.1056/NEJMoa003216. PMID: 11752354.
11. Громова О. А., Торшин И. Ю., Лиманова О. А. и соавт. Сравнительное изучение доказательных данных об эффективности и безопасности пероральной и трансдермальной заместительной терапии эстрогенами у женщин разного возраста. Сравнительное исследование доказательной базы эффективности и безопасности применения пероральной и трансдермальной формы заместительной гормональной терапии эстрогенами у женщин в различные возрастные периоды.
12. Пинкертон Дж. В., Джеймс А. Х. Лечение симптомов менопаузы у женщин с высоким риском тромбоза. Клин Обстет Гинекол. 2018;61(2):260–8. https://doi.org/10.1097/GRF.0000000000000358. PMID: 29419532.
13. Nachtigall L.E., Baber R.J., Barentsen R. et al. Дополнительная и гормональная терапия для облегчения вазомоторных симптомов: консервативный клинический подход. J Obstet Gynaecol Can. 2006;28(4):279–89. https://doi.org/10.1016/S1701-2163(16)32136-3. PMID: 16776904.
14. Shen W., Stearns V. Стратегии лечения приливов. Эксперт Опин Фармаколог. 2009;10(7):1133–44. https://doi.org/10.1517/14656560902868217. PMID: 19405789.
15. Мелис Г.Б., Гамбаччиани М., Каньяччи А. и соавт. Влияние антагониста дофамина вералиприда на приливы и секрецию лютеинизирующего гормона у женщин в постменопаузе. Акушерство Гинекол. 1988;72(5):688–92. PMID: 3140150.
16. Barton D.L., Loprinzi C.L., Quella S.K. et al. Проспективная оценка витамина Е при приливах у выживших после рака молочной железы. Дж. Клин Онкол. 1998;16(2):495–500. https://doi.org/10.1200/JCO.1998.16.2.495. PMID: 9469333.
Дж. Клин Онкол. 1998;16(2):495–500. https://doi.org/10.1200/JCO.1998.16.2.495. PMID: 9469333.
17. Bourre J.M. Пищевые омега-3 жирные кислоты для женщин. Биомед Фармаколог. 2007;61(2–3):105–12. https://doi.org/10.1016/j.biopha.2006.09.015. PMID: 17254747.
18. Громова О.А., Торшин И.Ю., Тетруашвили Н.К. Молекулярные механизмы фармакологического действия препаратов на основе экстрактов цимицифуги кистевидной. Молекулярные механизмы осуществления фармакологических эффектов препаратов на основе экстрактов Cimicifuga racemosa. Гинекология. 2018;20(1):39–46. (на рус.).
19. Торшин И. Ю., Громова О. А., Лиманова О. А. Систематический анализ состава и молекулярных механизмов стандартизированных экстрактов Vitex Agnus-castus. Системный анализ состава и механизмов молекулярного воздействия стандартизированных экстрактов Vitex Agnus-castus. Трудный пациент. 2015;13(1–2):19–28. (на рус.).
20. Торшин И. Ю., Рудаков К. В. Комбинаторный анализ свойств разрешимости задач распознавания и полноты алгоритмических моделей. Часть 1: метод факторизации. Распознавание образов и анализ изображений. 2017;27(1):16–28. https://doi.org/10.1134/S1054661817010151.
Часть 1: метод факторизации. Распознавание образов и анализ изображений. 2017;27(1):16–28. https://doi.org/10.1134/S1054661817010151.
21. Торшин И. Ю., Рудаков К. В. Комбинаторный анализ свойств разрешимости задач распознавания и полноты алгоритмических моделей. Часть 2: метрический подход в рамках теории классификации значений признаков. Распознавание образов и анализ изображений. 2017;27(2):184–99. https://doi.org/10.1134/S1054661817020110.
22. Торшин И. Ю. Оптимальные словари итоговой информации на основе критерия разрешимости и их приложения в биоинформатике. Распознавание образов и анализ изображений. 2013;23(2):319–27. https://doi.org/10.1134/S1054661813020156.
23. Торшин И. Ю., Рудаков К. В. К теоретическим основам метрического анализа слабо формализованных задач распознавания и классификации. Распознавание образов и анализ изображений. 2015;25(4):577–87. https://doi.org/10.1134/S1054661815040252.
24. Торшин И. Ю., Рудаков К. В. О метрических пространствах, возникающих при формализации задач распознавания и классификации. Часть 2: свойства плотности. Распознавание образов и анализ изображений. 2016;26(3):483–49.6. https://doi.org/10.1134/S1054661816030202.
Часть 2: свойства плотности. Распознавание образов и анализ изображений. 2016;26(3):483–49.6. https://doi.org/10.1134/S1054661816030202.
25. Лекарство от менопаузы. Эд. В. П. Сметник. [Медицина климактерия. Стручок красный. В. П. Сметник]. Москва: Литера, 2006. 847 с.
26. Арендт М., Розенберг Р., Фолдагер Л. и соавт. Симптомы отмены не являются предвестником рецидива среди субъектов, лечившихся от зависимости от каннабиса. Я Джей Наркоман. 2007;16(6):461–7. https://doi.org/10.1080/10550490701640985. PMID: 18058411.
27. Karaoulanis S.E., Daponte A., Rizouli K.A. et al. Роль цитокинов и приливов в перименопаузальной депрессии. Энн Джен Психиатрия. 2012;11:9. https://doi.org/10.1186/1744-859X-11-9. PMID: 224
.28. Каспер Р.Ф., Йен С.С. Нейроэндокринология менопаузальных приливов: гипотеза механизма приливов. Клин Эндокринол (Оксфорд). 1985;22(3):293–312. https://doi.org/10.1111/j.1365-2265.1985.tb03243.x. PMID: 3884189.
29. Хайри Х.А., Шуид А. Н., Ибрагим Н. и соавт. Эффекты и механизмы действия фитоэстрогенов на вазомоторные симптомы во время менопаузального перехода: терморегуляторный механизм. Curr Цели наркотиков. 2019;20(2):192–200. https://doi.org/10.2174/1389450118666170816123740. PMID: 28814228.
Н., Ибрагим Н. и соавт. Эффекты и механизмы действия фитоэстрогенов на вазомоторные симптомы во время менопаузального перехода: терморегуляторный механизм. Curr Цели наркотиков. 2019;20(2):192–200. https://doi.org/10.2174/1389450118666170816123740. PMID: 28814228.
30. Чен Л. Р., Ко Н. Ю., Чен К. Х. Изофлавоновые добавки для женщин в период менопаузы: систематический обзор. Питательные вещества. 2019;11(11):2649. https://doi.org/10.3390/nu11112649. PMID: 31689947.
31. Сингхал С. Р., Шуллай В. К. Сравнительное исследование габапентина и изофлавона при вазомоторных симптомах менопаузы. J Здоровье среднего возраста. 2016;7(3):132–9. https://doi.org/10.4103/0976-7800.191017. PMID: 27721641.
32. Lambert M.N.T., Thorup A.C., Hansen E.S.S., Jeppesen P.B. Комбинированные изофлавоны красного клевера и пробиотики эффективно уменьшают вазомоторные симптомы менопаузы. ПЛОС Один. 2017;12(6):e0176590. https://doi.org/10.1371/journal.pone.0176590. PMID: 28591133.
33. Lee J.H., Dean M., Austin J.R. et al. Ирилон из красного клевера (Trifolium pratense) усиливает передачу сигналов прогестерона. J Nat Prod. 201828; 81 (9): 1962–7. https://doi.org/10.1021/acs.jnatprod.8b00131. PMID: 30199256.
Lee J.H., Dean M., Austin J.R. et al. Ирилон из красного клевера (Trifolium pratense) усиливает передачу сигналов прогестерона. J Nat Prod. 201828; 81 (9): 1962–7. https://doi.org/10.1021/acs.jnatprod.8b00131. PMID: 30199256.
34. Кун Дж. Т., Питтлер М. Х., Эрнст Э. Изофлавоны Trifolium pratense в лечении менопаузальных приливов: систематический обзор и метаанализ. Фитомедицина. 2007; 14 (2–3): 153–9. https://doi.org/10.1016/j.phymed.2006.12.009.
35. Myers S. P., Vigar V. Эффекты стандартизированного экстракта Trifolium pratense (Promensil) в дозе 80 мг при лечении менопаузальных приливов: систематический обзор и метаанализ. Фитомедицина. 2017; 24:141–147. https://doi.org/10.1016/j.phymed.2016.12.003.
36. Palacios S., Lilue M., Mejia A., Menendez C. Омега-3 против изофлавонов в контроле вазомоторных симптомов у женщин в постменопаузе. Гинекол Эндокринол. 2017;33(12):951–7. https://doi.org/10.1080/09513590.2017.1332588.
37. Вахид Дастджерди М., Эслами Б. , Алсадат Шарифи М. и др. Влияние изофлавона сои на приливы, толщину эндометрия и клинические, а также сонографические признаки груди. Иран J Общественное здравоохранение. 2018;47(3):382–9. PMID: 29845026.
, Алсадат Шарифи М. и др. Влияние изофлавона сои на приливы, толщину эндометрия и клинические, а также сонографические признаки груди. Иран J Общественное здравоохранение. 2018;47(3):382–9. PMID: 29845026.
38. Перна С., Перони Г., Микконо А. и соавт. Многомерные эффекты изофлавонов сои в пище или добавках у женщин в период менопаузы: систематический обзор и библиометрический анализ. Нац Прод коммун. 2016;11(11):1733–40. PMID: 30475519.
39. Кузнецова И. В. Негормональные методы лечения нарушений менструального цикла. [Возможности негормональной коррекции нарушений менструального цикла]. Медицинский совет. 2019;(13):16–27. (на рус.). https://doi.org/10.21518/2079-701X-2019-13-16-27.
40. Громова О. А., Ребров В. Г. Витамины, макро- и микроэлементы: образовательные программы РНЦ Института микроэлементов ЮНЕСКО. [Витамины, макро- и микроэлементы. Обучающие программы РНЦ института микроэлементов ЮНЕСКО. Москва: ГЭОТАР-Медиа, 2008. 954 в. (на рус.). ISBN: 978-5-9704-0814-8.
41. Фридман Р. Р., Крелл В. Снижение терморегуляторной нулевой зоны у женщин в постменопаузе с приливами. Am J Obstet Gynecol. 1999;181(1):66–70. https://doi.org/10.1016/s0002-9378(99)70437-0.
42. Андрикула М., Прелевич Г. Повторный взгляд на приливы менопаузы. Климактерический. 2009;12(1):3–15. https://doi.org/10.1080/13697130802556296.
43. Bansal R., Aggarwal N. Менопаузальные приливы: краткий обзор. J Здоровье среднего возраста. 2019;10(1):6–13. https://doi.org/10.4103/jmh.JMH_7_19.
44. Берендсен Х. Х. Роль серотонина в приливах. Зрелые. 2000;36(3):155–64. https://doi.org/10.1016/s0378-5122(00)00151-1.
45. Монтассер М.Е., Зив-Гал А., Браун Дж.П. и соавт. Потенциально функциональный вариант гена переносчика серотонина связан с пременопаузальными и перименопаузальными приливами. Менопауза. 2015;22(1):108–13. https://doi.org/10.1097/GME.0000000000000291.
46. Кэрролл Д. Г. Негормональная терапия приливов при менопаузе. Ам семейный врач. 2006;73(3):457–64. PMID: 16477892.
2006;73(3):457–64. PMID: 16477892.
47. McGarry K., Geary M., Gopinath V. Помимо эстрогена: варианты лечения приливов. Клин Тер. 2018;40(10):1778–86. https://doi.org/10.1016/j.clithera.2018.08.010.
48. Тулис К. А., Целлос Т., Кувелас Д., Гулис Д. Г. Габапентин для лечения приливов у женщин с естественной или вызванной тамоксифеном менопаузой: систематический обзор и метаанализ. Клин Тер. 2009;31(2):221–35. https://doi.org/10.1016/j.clithera.2009.02.006.
49. Флорес-Рамос М., Морено Дж., Хайнце Г. и соавт. Уровни гонадных гормонов и концентрации триптофана и серотонина в тромбоцитах у женщин в перименопаузе с депрессивными симптомами или без них. Гинекол Эндокринол. 2014;30(3):232–5. https://doi.org/10.3109/09513590.2013.875994.
50. Блюмель Дж. Э., Паласиос С., Легоррета Д. и др. Является ли фибромиалгия частью климактерического синдрома? Зрелые. 2012;73(2):87–93. https://doi.org/10.1016/j.maturitas.2012.06.001.
51. Чатта Р., Нагаратна Р., Падмалатха В. , Нагендра Х. Р. Влияние йоги на когнитивные функции при климактерическом синдроме: рандомизированное контрольное исследование. БЖОГ. 2008;115(8):991–1000. https://doi.org/10.1111/j.1471-0528.2008.01749.x.
, Нагендра Х. Р. Влияние йоги на когнитивные функции при климактерическом синдроме: рандомизированное контрольное исследование. БЖОГ. 2008;115(8):991–1000. https://doi.org/10.1111/j.1471-0528.2008.01749.x.
52. Микель Дж., Рамирес-Боска А., Рамирес-Боска Дж.В., Альпери Дж.Д. Менопауза: обзор роли кислородного стресса и благоприятного воздействия пищевых антиоксидантов. Арх Геронтол Гериатр. 2006;42(3):289–306. https://doi.org/10.1016/j.archger.2005.08.005.
53. Sanchez ibanez J.M. Лечение приливов менопаузы витамином Е. Rev Esp Obstet Ginecol. 1951; 8 (58): 247–51. PMID: 145.
54. Атаеи-Альмангадим К., Фаршбаф-Халили А., Остадрахими А.Р. и соавт. Влияние пероральных капсул куркумина и витамина Е на приливы и тревогу у женщин в постменопаузе: тройное слепое рандомизированное контролируемое исследование. Дополнение Ther Med. 2020;48:102267. https://doi.org/10.1016/j.ctim.2019.102267.
55. Бани С., Хасанпур С., Фарзад Рик Л. и др. Влияние фолиевой кислоты на менопаузальные приливы: рандомизированное клиническое исследование.
