Воспалительная миопатия: Воспалительная миопатия — причины, симптомы, диагностика и лечение

Воспалительная миопатия — воспалительный процесс, возникающий преимущественно в скелетных мышцах и приводящий к их дегенеративным изменениям. Воспалительная миопатия характеризуется мышечной слабостью, болями в мышцах, резким снижением объема активных движений, развитием контрактур, уплотнением и отечностью мышц. Из методов диагностики воспалительной миопатии наиболее информативно определение уровня КФК и миоглобина, электромиография и биопсия мышц. Лечение воспалительной миопатии осуществляется высокими дозами глюкокортикостероидов с последующей поддерживающей терапией. Однако достаточно часто встречаются резистентные к кортикостероидам формы заболевания.
Общие сведения
Воспалительные миопатии представляют собой целую группу заболеваний, в которую входят как системные поражение мышечной ткани, так и локальные воспалительные процессы в отдельных мышцах. Воспалительная миопатия системного характера представлена дерматомиозитом, полимиозитом, эозинофильным миозитом, миозитом с включениями, ревматической полимиалгией и миопатиями при системных заболеваниях. Примером локальной воспалительной миопатии может быть миозит глазных мышц, псевдотромбофлебит мышц голени и др. Кроме того, воспалительная миопатия может наблюдаться при некоторых инфекционных заболеваниях.
Возраст пациентов, наиболее подверженных заболеваемости, различается в зависимости от вида воспалительной миопатии. Так, полимиозит обычно возникает у лиц старше 30 лет. Дерматомиозит наблюдается как у взрослых, так и в детском возрасте. А миозит с включениями чаще встречается после 40 лет и является наиболее распространенной формой воспалительной миопатии в пожилом возрасте.
Воспалительная миопатия
Причины возникновения воспалительной миопатии
В некоторых случаях воспалительная миопатия напрямую связана с инфекционным процессом. Агентами, вызывающими инфекционно-воспалительно поражение мышц, могут быть вирусы (краснуха, грипп, ВИЧ-инфекция, энтеровирусы и пр.), бактерии (чаще стрептококковые инфекции), паразитарные инвазии (цистицеркоз, токсоплазмоз, трихинеллез). При этом заболевание классифицируется как инфекционная воспалительная миопатия.
В тех случаях, когда прямая связь миопатии с инфекцией не прослеживается, говорят об идиопатической миопатии. К ней относятся: миозит с включениями, полимиозит, дерматомиозит, миопатии при системных заболеваниях (системной красной волчанке, склеродермии, синдроме Шегрена, системных васкулитах, ревматоидном артрите). Наиболее распространенным как в неврологии, так и в ревматологии является мнение, что идиопатическая воспалительная миопатия имеет аутоиммунный механизм развития. Однако до сих пор не выделен антиген, который запускает лежащую в ее основе аутоиммунную реакцию. В отдельных случаях воспалительная миопатия имеет семейный характер, свидетельствующий о ее генетическом происхождении.
Симптомы воспалительной миопатии
Воспалительная миопатия клинически проявляется болями в мышцах, прогрессирующей мышечной слабостью и тугоподвижностью в пораженных отделах конечностей. Болевой синдром (миалгия) возникает не только в период двигательной активности, но и при прощупывании мышц, а иногда и в состоянии полного покоя. Мышечная слабость, как правило, начинает проявляться затруднением при удерживании предметов в руках. По мере ее прогрессирования для пациента становится невозможным поднять руку или ногу, сесть, встать. Воспалительная миопатия распространенного характера часто приводит к значительному сокращению объема активных движений, которые может выполнять больной, а иногда и к полной обездвиженности.
Воспалительная миопатия протекает с отеком и уплотнением пораженных мышц. В результате воспаления в них происходят атрофические изменения, развивается миофиброз — замещение мышечных волокон на соединительнотканные, возможен кальциноз. Образующиеся мышечные контрактуры приводят к тугоподвижности суставов. Зачастую воспалительная миопатия имеет длительное ремиттирующее течение. В некоторых случаях, чаще у детей, наблюдается полное выздоровление после перенесенного острого приступа воспалительной миопатии.
Наиболее тяжело воспалительная миопатия протекает при вовлечении в воспалительный процесс мышц гортани и дыхательной мускулатуры, что ведет к развитию миопатического пареза гортани и дыхательной недостаточности. Слабость дыхательных мышц приводит к снижению легочной вентиляции и возникновению застойной пневмонии. Слабость мышц глотки является причиной дисфагии (расстройств глотания), при которой возможно попадание пищи в дыхательные пути и возникновение аспирационной пневмонии. Если воспалительная миопатия распространяется на глазодвигательные мышцы, то возникает косоглазие и опущение верхнего века. Поражение мимических мышц приводит к маскообразному выражению лица. Системная воспалительная миопатия, например, дерматомиозит и полимиозит, может сопровождаться поражением сердечной мышцы с клиникой миокардита, кардиомиопатии и сердечной недостаточности.
Полимиозит проявляется типичным для воспалительной миопатии мышечным синдромом, который захватывает мышцы проксимальных отделов конечностей, в первую очередь плечевого и тазового пояса. В большинстве случаев наблюдается также поражение внутренних органов: ЖКТ (диарея, запор, кишечная непроходимость, язва желудка с перфорацией или желудочно-кишечным кровотечением), сердца и сосудов (артериальная гипотония, аритмия, кардиомиопатия и др), легких (очаговая или долевая пневмония). В 15% случаев эта воспалительная миопатия сопровождается суставным синдромом в виде артритов суставов кисти, реже — других суставов конечностей.
Дерматомиозит имеет сходную с полимиозитом клиническую картину. Отличительной чертой является наличие кожных проявлений: эритематозных пятен, участков гипо- и гиперпигментации, очагов гиперкератоза. Возможно поражение слизистых оболочек с развитием стоматита, гингивита, конъюнктивита.
Миозит с включениями характеризуется ранним поражением мускулатуры дистальных отделов рук: сгибателей пальцев и мышц предплечья. В ногах воспалительная миопатия распространяется как на дистальные, так и на проксимальные мышечные группы. Типично поражение разгибателей стопы и четырехглавой мышцы.
Диагностика воспалительной миопатии
К диагностике воспалительной миопатии помимо неврологов могут привлекаться ревматологи, кардиологи, пульмонологи, дерматологи, иммунологи и др. специалисты. К сожалению, на сегодняшний день воспалительная миопатия не имеет четких диагностических критериев. Определенное значение имеет обнаружение в биохимическом анализе крови повышения уровня креатинфосфокиназы (КФК), а также лактатдегидрогеназы и альдолазы, что свидетельствует о повреждении мышечной ткани. Зачастую воспалительная миопатия сопровождается повышением миоглобина. Однако уровень этих показателей не коррелирует с тяжестью клинических проявлений. По этой причине единственным достоверным критерием прогрессирования миопатии могут быть лишь результате исследования мышечной силы (эргометрии) в динамике. Следует также отметить, что повышение КФК и миоглобина наблюдается далеко не при всех видах воспалительной миопатии. Например, при миозите с включениями уровень КФК и миоглобина часто находится в пределах нормы.
Важное диагностическое значение имеют данные электромиографии. При дерматомиозите и полимиозите наблюдается снижение продолжительности и амплитуды потенциалов двигательных единиц, повышенная электровозбудимость. При миозите с включениями наряду с типичными для миопатии низкоамплитудными и кратковременными потенциалами отмечаются высокоамплитудные и длительные потенциалы, характеризующие нейрогенное поражение.
Уточнить характер поражения мышц и определить его распространенность позволяет биопсия мышц. Морфологическое исследование биоптата выявляет наличие воспалительных инфильтратов, атрофические изменения и некроз мышечных волокон, их замещение соединительной тканью.
Диагностика сопутствующих поражений внутренних органов осуществляется при помощи рентгенографии легких, ЭКГ, Эхо-КГ, гастроскопии, УЗИ органов брюшной полости.
Лечение воспалительной миопатии
Альтернативными препаратами в лечении воспалительной миопатии являются цитостатики (азатиоприн, метотрексат, циклоспорин, циклофосфамид). Они применяются вместо кортикостероидов при наличии стероидной резистентности или в комбинации с ними для уменьшения дозы глюкокортикостероидов во избежание их побочных эффектов.
Поскольку системная воспалительная миопатия обычно имеет аутоиммунный характер, то в ее лечении зачастую применяется плазмаферез, позволяющий снизить количество ЦИК в крови.
Лечение ПМ/ДМ
Основные цели фармакотерапии ПМ/ДМ
· достижение полного клинического ответа (отсутствия клинико-лабораторной активности в течение, не менее чем 6 месяцев на фоне терапии) или ремиссии (отсутствия клинико-лабораторной активности в течение, не менее чем 6 месяцев на фоне отмены терапии) (уровень доказательности В),
· снижение риска комарбидных инфекций ГК) (
· выявление и своевременное лечение пациентов с наибольшим риском ИПЛ
Общие рекомендации по лечению
· Лечение пациентов ПМ/ДМ должно проводиться врачами-ревматологами.
· В случае наличия ИПЛ с ФА при АСС – с привлечением пульмонологов и основываться на тесном взаимодействии врача и пациента
· Следует рекомендовать пациентам избегать факторов, которые могут спровоцировать обострение болезни: отказаться от пребывания на солнце, от курения, от контактов и инфекционными больными, избегать физических и психо-эмоциональных перегрузок.
· Следует рекомендовать пациентам исключить факторы, повышающие риск развития побочных эффектов терапии ГК: не употреблять в пищу сладкие продукты, включая мед и сладкие фрукты, повышающие риск развития стероидного сахарного диабета, также, исключение острой пищи, применение гастропротекторов с целью предотвращения язвенных осложнений (уровень доказательности С)
· У пациентов ПМ/ДМ следует избегать внутримышечных инъекций, проведение которых, затрагивая мышечную ткань, может способствовать как формированию постинъекционных кальцинатов, так быть причиной ложноположительных результатов уровня креатинфосфокиназы (КФК).
Ведущая роль в лечении ПМ/ДМ отводится ГК. Основные принципы лечения ГК:
· Раннее начало терапии (в течение первых 3-х месяцев от начала симптомов) ассоциируется с благоприятным прогнозом.
· Ежедневный прием ГК.
· Суточную дозу ГК в начале лечения следует делить на 3 приема (оценивая ее переносимость), однако в течение первой половины дня; затем перевести пациента на прием полной дозы ГК в утренние часы.
· Оценка эффективности терапии проводиться через 2-4 недели от начала терапии ГК. Положительный эффект терапии расценивается при начавшемся снижении уровня КФК, АСТ, АЛТ, уменьшении интенсивности кожных проявлений, нарастании мышечной силы.
Отсутствие положительной динамики в течение 4 недель требует повторного проведения дифференциального диагноза с фенотипически схожими нозологиями, включающими в клинической картине миопатический синдромам, в т.ч., пересмотра морфологического материала.
· Длительность инициальной дозы ГК составляет, в среднем, 2,5-3 месяца.
· Снижение дозы ГК начинается при нормализации уровня КФК в сыворотке крови, исчезновении спонтанной активности при и-ЭМГ, нарастании мышечной силы, объема движений и проводиться под строгим клинико-лабораторным контролем. Доза ГК постепенно снижается по ¼ дозы от исходной в месяц, в среднем, по ½ — ¼ таблетки в 5-7-10 дней до достижения поддерживающего уровня. Темп снижения зависит от исходной дозы ГК и степени активности болезни. Чем ниже доза ГК, тем медленнее ее снижение.
· Поддерживающая доза ГК индивидуальна: 5-10, реже 15 мг/сутки и зависит от клинико-иммунологического подтипа болезни, возраста больного. При ЮДМ известны случаи клинико-лабораторной ремиссии на фоне длительной отмены терапии. Полная отмена ГК у взрослых пациентов, как правило, ведет к обострению болезни, даже если они несколько лет находились в состоянии полного клинического ответа.
Пульс-терапия ГК у взрослых пациентов не является основополагающей при ПМ/ДМ и не служит поводом для применения меньших (не адекватных) доз ГК назначаемых внутрь, как в острый период болезни, так и при ее обострении.
Потенциальные показания к подключению иммуносупрессивной терапии
· Принадлежность больных к клинико-иммунологическим подтипам ПМ/ДМ, особенностью которых является заведомо «плохой ответ» на терапию ГК: АСС c ФА, у пациентов антител к SRP
· Язвенно-некротический васкулит
· Обострение заболевания при снижении дозы ГК
· Стероидрезистентность у больных, ране получавших неадекватно малые дозы ГК
· Неэффективность ГК в течение 3-х месяцев
· Тяжелые побочные эффекты ГК, лимитирующие назначение адекватной дозы ГК (неконтролируемые сахарный диабет или артериальная гипертензия, острая язва желудка, множественные остеопоретические переломы)
Рекомендации по лечению ПМ/ДМ соответственно наиболее тяжелым синдромам ИПЛ с синдромом ФА при АСС
· Наиболее тяжелым и плохо контролируемым монотерапией ГК при ПМ/ДМ синдромом является АСС. Плохой прогноз определяется вовлечением в патологический процесс легочной ткани — ИПЛ с развитием ФА.
· Объем терапии и выбор препарата (в сочетании с ГК) определяется тяжестью ИПЛ (по данным КТ и ФЛТ: форсированной ЖЕЛ, DLCO и с учетом анамнеза (ранее применяемые иммуносупрессивные препараты).
· Основное место в лечении ИПЛ занимает ЦФ, назначаемый внутривенно в дозе 500 мг/м2 -750 мг/м2 мг в месяц в сочетании с ГК (уровень доказательности А)
· Длительность ЦФ должна быть не менее 6 месяцев (уровень доказательности С)
· Контроль эффективности ЦФ осуществляется по динамической оценке (1 раз в 6 месяцев) форсированной ЖЕЛ, показателей DLCO
· При агрессивном течении СФА при выраженном снижении ЖЕЛ и DLCO, а также, в случае неэффективности ранее применяемой терапии ЦФ, целесообразно применение РТМ.
· Применение ММФ рассматривается в качестве терапии «второго» ряда при ИПЛ в случае невозможности применения ЦФ или РТМ
Дисфагия
· Дисфагия является фактором риска аспирационной пневмонии, течение и терапия которой осложняется иммуноскомпроментированностью пациентов, связанной с терапией высокими дозами ГК и цитостатиков.
· Рекомендовано проведение пульс-терапии ГК (метипред 1000мг) N 3 в сочетании с пероральным приемом ГК в адекватной дозе.
· Тяжелая дисфагия является потенциальным показанием ВВИГ.
Наличие дисфагии у больных ПМ/ДМ служит поводом для проведения более активного онкопоиска (уровень доказательности Д).
Язвенно-некротический васкулит
Наличие язвенно-некротического васкулита является показанием для проведения пульс-терапии циклофосфамидом в дозе 600-800-1000 мг в месяц в сочетании метилпреднизолоном 500-1000мг.
Кожный синдром при ДМ в сочетании с проксимальной мышечной слабостью отражает активность болезни и, как правило, контролируется ГК в адекватных дозах в острый период болезни.
При резистентном кожном синдроме, сохраняющемся на фоне восстановления мышечной силы, рекомендуется применение антималярийных препаратов (гидроксихлорохин по 200–400 мг/сут), ММФ, топических стероидов.
Наличие резистентного кожного синдрома и/или язвенно-некротического васкулита у больных ПМ/ДМ служит поводом для проведения более активного онкопоиска (уровень доказательности С).
Лихорадка или субфебрилитет встречаются редко, главным образом при АСС с острым началам болезни.
· Контролируется ГК и не требует дополнительной терапии
При появлении субфебрилитета (или лихорадки) у пациентов на фоне лечения ГК в период клинико-лабораторной положительной динамики – исключение присоединения сопутствующей инфекции. Необходимо учитывать атипизм течения инфекционных осложнений на фоне иммуносупрессивной терапии.
Поражение суставов
· Наличие артрита при ПМ/ДМ может присутствовать в начале болезни. Артриты входят в состав симптомокомплекса АСС, хорошо контролируются ГК и не требуют дополнительного лечения.
· Сгибательные контрактуры, как правило, локтевых, реже коленных суставов, развиваются в острый период ПМ/ДМ и обусловлены воспалительным поражением мышечной ткани, а не непосредственным поражением суставов. Дополнительного медикаментозного лечения не требуется (уровень доказательности С).
Кальциноз мягких тканей
· Кальциноз мягких тканей наиболее часто присутствует (и более агрессивен) при ЮДМ
· Появление множественных кальцинатов, как правило, сопутствует острому течению ПМ/ДМ. Кальцинаты сохраняются на фоне снижения активности болезни, даже при достижении клинико-лабораторной ремиссии и наиболее выражении при ЮДМ.
· При ЮДМ, с целью снижения риска развития кальциноза и его распространенности применяется пульс-терапия ГК в дозе 1-2 мг/кг/сут.
· Хирургическое лечение малоэффективно, поскольку повышает риск присоединения вторичной инфекции и может спровоцировать появление новых кальцинатов.
· В качестве медикаментозной терапии применяютт бисфосфонаты (ксидифон, фосамакс, фосаванс и др.), однако полного контроля над процессом гетеротопического кальцийобразования не достигается.
· Для лечения кальциноза применяется, также динатриевая соль этилендиаминотетрауксусной кислоты (Na2ЭДТА), образующей комплексные соединения с различными катионами, в т.ч.с ионами Са2+ и способствует выделению их с мочой.
· Имеются данные об эффективном предотвращении прогрессирования кальциноза при применении ВВИГ в течение 2 дней каждый месяц в сочетании с метилпреднизолоном (уровень доказательности С).
Традиционные иммуносупрессивные препараты, применяемые в лечении ПМ/ДМ
· Метотрексат по 7,5–25 мг/нед внутрь или внутривенно (при недостаточной эффективности или плохой переносимости перорального приема препарата, особенно в высоких дозах).
· Азатиоприн по 2–3 мг/кг/сут (100–200 мг/сут)
· Циклоспорин А по 2,5–5.,0 мг/кг/cутки назначают пациентам с резистентными к ГК формами заболевания, в т.ч. при хроническом течении болезни, связанной с неадекватно малой инициальной дозой ГК (уровень доказательности С).
· ММФ. Имеются данные об эффективности ММФ при ИПЛ и резистентном кожном синдроме. Прием начинают с дозы 1000 мг/сут (в 2 приема), постепенно титруя дозу до 2000 мг/сут под контролем показателей общего и биохимического анализов крови (уровень доказательности С).
Общие принципы лечения иммуносупрессивными препаратами:
— титрование дозы: назначение с небольшой дозы и постепенное ее повышение под контролем переносимости.
— контроль переносимости: оценка уровня гемоглобина, числа лейкоцитов, тромбоцитов, азота мочевины, креатинина, активности АСТ, АЛТ. При уменьшении числа лейкоцитов менее 2,5х109/л и/или тромбоцитов – менее 100 х 109/л и повышении концентрации АСТ, АЛТ более чем в 3 раза от верхней границы нормы, лечение необходимо прекратить до устранения симптомов токсичности.
— при присоединении интеркурренотой инфекции, в т.ч. герпетической – временная отмена иммуносупрессивных препаратов до исчезновения ее признаков.
Применение ВВИГ 2 г/кг 1 раз в месяц в течение 3 месяцев является эффективным методом лечения ПМ/ДМ (особенно ЮДМ), резистентного к стандартной терапии. Потенциальным показанием для ВВИГ является тяжелая дисфагия. (уровень доказательности В)
Плазмаферез следует использовать главным образом у больных с тяжёлым, резистентным к другим метода лечения ПМ/ДМ в сочетании с ГК и цитотоксическими препаратами.
Новые направления терапии ПМ/ДМ. Биологические препараты
В настоящее время активно изучается роль и место биологической терапии в терапии ПМ/ДМ.
— Применение в терапии ПМ/ДМ ингибиторов фактора некроза опухоли α TNF-a (инфликсимаба) не принесло желаемых результатов: поскольку он не способен контролировать активность болезни, в том числе ИПЛ, а также, увеличивают риск оппортунистических инфекций [10, 44].
— Имеются данные об успешном применении этанерцепта в качестве стероидсберегающей терапии. (Уровень доказательности Д)
— Применение блокаторов ко-стимуляции Т-лимфоцитов (абатацепта) в сочетании с тиосульфат натрия при ЮДМ с язвенно-некротичнским васкулитом и прогрессирующим кальцинозом оказало положительный эффект в виде нарастания мышечной силы, восстановления целостности кожный покровов, снижения прогрессирования кальциноза, что позволило снизить поддерживающую дозу ГК. (Уровень доказательности Д)
— Особое место среди биологических препаратов, на сегодняшний день, применяемых при ПМ/ДМ, занимает использование анти В-клеточной терапии. Накоплен положительный опыт по применению РТМ у пациентов с тяжелым мышечным поражением и при АСС с СФА, резистентных к ГК и применяемой ранее традиционной цитостатической терапии (уровень доказательности Д)
Практически все авторы описывают высокую эффективность РТМ при ПМ/ДМ. Так, на фоне терапии РТМ (в сочетании с ГК) наблюдается положительная клинико-лабораторная динамика (уменьшение выраженности кожного синдрома, нарастание мышечной силы).
— В случае применения РТМ при АСС с СФА, позитивный эффект наблюдался более, чем у 70% больных в виде увеличения показателей функции внешнего дыхания: увеличения показателей ЖЕЛ и DLCO, а также уменьшения инфильтратов по КТ грудной клетки.
— Максимальный эффект развивался через 12 недель после первой инфузии и коррелировал со снижением CD 20 + В клеток.
Ведение пациентов ПМ/ДМ с хроническим течением болезни, связанным с неадекватно малой инициальной дозой ГК
· Сложность ведения таких пациентов обусловлена развитием поствоспалительной фиброзной и жировой инволюции мышечной ткани (при назначении не адекватной инициальной дозы ГК). В этом случае отсутствует (или минимален) воспалительный компонент (миозит), являющийся субстратом для проведения противовоспалительной терапии ГК.
· Клинически — сохраняется проксимальная мышечная слабость, однако показатели активности болезни (уровень КФК, данные и-ЭМГ, биоптата мышечной ткани) не свидетельствуют в пользу текущего воспалительного процесса.
· Присутствие фиброзной и жировой инволюции мышечной ткани подтверждается при МРТ исследовании проксимальных отделов конечностей.
· Повышение дозы ГК целесообразно при наличии, хотя бы минимальных, признаков воспаления мышечной ткани.
· Хроническое течение болезни, связанное с неадекватно малой инициальной дозой ГК является потенциальным показанием для подключения иммуносупрессивной терапии (Циклоспорин А, ММФ, метотрексат, азатиоприн) .
Реабилитационные мероприятия и обучение пациентов.
Проводятся в зависимости от стадии заболевания
· В острую фазу противопоказаны ЛФК и физические нагрузки, проводимые пациентами «через силу»; допускаются только пассивные упражнения
· В стадию выздоровления — изометрические, а затем изотонические упражнения
· В хронической стадии — анаэробные упражнения
Профилактика ГК- остеопороза
Препараты кальция в сочетание с витамином Д3, бисфосфанаты.
Профилактика язвенных осложнений
Гастропротекторы (миозпростол, ранитидин, омепразол).
Профилактика стероидного диабета
Строгое исключение потребления продуктов, содержащих глюкозу, в т.ч., сладких фруктов, соков и йогуртов.
Предосторожности: Исключение контакта с инфекционными больными – во избежание присоединения вторичной инфекции.
Избегание физических перегрузок (в острый период ЛФК противопоказана, только пассивные движения).
Воспалительные миопатии представляют собой группу заболеваний, которые вызваны с хроническим мышечным воспалением, слабостью мышц и, в отдельных случаях, мышечными спазмами и болью. Миопатия — общее медицинское понятие, используемое для описания дистрофии мышц. Все миопатии приводят к мышечной слабости.
Четыре основных типа хронических или длительных воспалительных миопатий:
- полимиозит
- дерматомиозит
- миозит
- некротизирующая аутоиммунная миопатия
Причины
Причины миозита или общего мышечного воспаления:
- аутоиммунные нарушения, при которых нарушается иммунная система мышц;
- аллергическая реакция;
- вирус или другие инфекционные организмы, такие, например как бактерии.
Хотя причины множества воспалительных миопатий неизвестны, к основным относятся аутоиммунные нарушения.
Кто находится под угрозой?
Воспалительные миопатии встречаются достаточно редко. Данные заболевания могут поражать как взрослых, так и детей. Дерматомиозит является наиболее распространенной хронической формой у детей. Полимиозит и дерматомиозит чаще встречаются у женщин, в то время как миозит развивается главным образом у мужчин.
Признаки и симптомы
К общим симптомам хронической воспалительной миопатии относится медленная, но прогрессирующая мышечная дистрофия. Воспаление повреждает мышечные волокна, что вызывает слабость и может воздействовать на артерии и кровеносные сосуды, проходящие через мышцы. К другим симптомам относятся усталость после ходьбы, частые случаи нарушения равновесия или падения, а также трудности при глотании или дыхании. У некоторых людей может возникать боли в мышцах.
Полимиозит воздействует на скелетные мышцы (тип мышц, отвечающих за движения тела) по обе стороны тела. Заболевание редко встречается у людей моложе 20 лет. Обычно полимиозит развивается между 30 и 60 годами.
Признаки и симптомы полимиозита значительно различаются у отдельного больного, что может затруднить его диагностику. Прогрессирующая мышечная дистрофия, неконтролиуемая врачом, может привести к затруднению глотания, трудности при разговоре, принятия положения стоя или сидя, подъема по лестнице, перемещения предметов и т.д. У некоторых людей, страдающих полимиозитом, могут также развиваться артрит, одышка, сердечные аритмии (нерегулярные сердечные сокращения) или застойная сердечная недостаточность (когда сердце не справляется с перекачкой достаточное количество крови).
Дерматомиозит характеризуется кожной сыпью, которая предшествует или сопровождает прогрессирующую мышечную дистрофию. Сыпь, как правило, пятнистая, с фиолетовыми или красными пятнами, и появляется на веках и области локтей, колен и пальцев ног. Красные высыпания могут также возникать на лице, шее, плечах, верхней части туловища, спине и других местах. В подверженных сыпи областях может развиваться отек. Сыпь часто становится более отчетливой при воздействии солнца.
Взрослые люди, страдающие дерматомиозитом, могут терять вес или испытывать лихорадку со средней температурой 39-40°, воспаление легких, а также быть чувствительными к свету. Дерматомиозит у взрослых людей, в отличие от полимиозита, может сопровождаться отеком молочной железы, легких, женских половых органов или кишечника. У детей и взрослых с дерматомиозитом могут развиться отложения кальция, которые выражаются в виде твердых образований под кожей или мышцами (так называемый кальциноз). Кальциноз чаще всего встречается через один-три года после начала заболевания, но может возникать и много лет спустя. Эти отложения чаще встречаются при детском дерматомиозите, чем при дерматомиозите, который развивается у взрослых больных.
В отдельных случаях при полимиозите и дерматомиозите мышцы дистальных отделов тела, которые расположены вдали от центра тела, например, мышцы предплечий или вокруг лодыжек и запястий), могут подвергаться дистрофии при прогрессировании заболевания. Полимиозит и дерматомиозит могут быть вызваны коллагеновыми или аутоиммунными заболеваниями, такими как волчанка. Полимиозит также может быть связан с инфекционными заболеваниями, такими как ВИЧ.
Миозит с включениями (МСВ) является наиболее распространенной формой воспалительной миопатии у людей в возрасте 50 лет и старше и характеризуется медленной, прогрессирующей мышечной дистрофией. МСВ поражает как проксимальные, так и дистальные мышцы, как правило мышцы в бедрах и предплечьях, и часто наблюдается на обеих сторонам тела, хотя мышечная слабость может воздействовать только на одну сторону тела. Миозит с включениями также характеризуется дегенерацией мышц с многобелковыми агрегатами (прионами) в мышце, которые могут содержать токсины, наблюдаемые при болезни Альцгеймера и других нейродегенеративных заболеваниях.
Падения как правило являются первыми заметными симптомами. Заболевание часто начинается со слабости в запястьях и пальцах, что создает проблемы с захватом (например, застегиванием пуговицы) предметов. Больные могут испытывать слабость в мышцах запястья и пальца и атрофию (слабость или потеря мышечной массы) в мышцах предплечья и четырехглавой мышце бедра. Трудности при глотании возникают примерно в половине случаев МСВ при дистрофии мышц горла.
Симптомы заболевания обычно начинаются после 50 лет, хотя болезнь может развиваться и ранее. В отличие от полимиозита и дерматомиозита, миозит со включениями чаще встречается у мужчин, чем у женщин.
Некротизирующая аутоиммунная миопатия является редкой и относительно недавно признанной самостоятельной подгруппой воспалительных миопатий. Она может происходить в любом возрасте, но как правило затрагивает взрослое население. Его симптомы сходны с полимиозитом и дерматомиозитом, слабость как в верхней, так и в нижней части тела, трудности со вставанием со стула, подъем по лестнице или подъем предметов. Однако начало данных симптомов может быть более гнетущим и внезапным, достигая своего пика в течение нескольких дней или недель. К другим симптомам относятся усталость, потеря веса и боль в мышцах.
Некротизирующая аутоиммунная миопатия происходит как отдельно, так и совместно с вирусными инфекциями, вызванные заболеваниями соединительной ткани, например, такими как склеродермия, или, реже, приемом лекарственных средств, снижающих уровень холестерина (статины). Мышечная слабость и боль могут прогрессировать даже после того, как люди перестают принимать препараты.
Детские формы воспалительных миопатий имеют некоторое сходство со взрослым дерматомиозитом и полимиозитом. Они обычно касаются детей в возрасте от 2 до 15 лет. Симптомы включают проксимальную мышечную слабость и воспаление, отек (аномальную задержку жидкостей в тканях организма, вызывающую отек и припухлость), мышечную боль, утомление, кожную сыпь, боли в животе, лихорадку и контрактуры. Контрактуры суставов вызваны укорочением мышц или сухожилий вокруг суставов, воспалением в сухожилиях мышц и препятствуют свободному сокращению суставов.
У детей, страдающих воспалительными миопатиями, могут возникать проблемы при глотании и дыхании. Работа сердца также может нарушаться. У порядка от 20 до 40 процентов детей с ювенильным дерматомиозитом развивается кальциноз, который может вызвать существенную мышечную слабость и боль, суставную контрактуру, язвы кожи и пониженную мышечную массу.
Диагностика
Диагностика основана на изучении истории болезни, результатах физического обследования, которые включают тесты на мышечную силу и исследование образцов крови, которые показывают повышение уровня различных мышечных ферментов и аутоантител.
Диагностические инструменты включают в себя:
- электромиография для фиксации электрической активности, создаваемой мышцами во время сокращения и покоя
- УЗИ для отыскивания мышечного воспаления
- магнитно-резонансная томография, чтобы выявить аномальную мышечную анатомию.
Биопсийный образец мышечной ткани позволяет исследовать на предмет признаков хронического воспаления, потери мышечного волокна, деформаций сосудов или других изменений, характерных для диагностики определенного типа воспалительной миопатии. Биопсия кожи может показать видоизменения в коже, связанные с дерматомиозитом.
Лечение
Инъекции гена адренокортикотропного гормона могут быть еще одним вариантом лечения для людей, которые не реагируют на лечение либо не могут переносить другие медикаменты. Биологические методы лечения, такие как ингибиторы ритуксимаба или фактора некроза опухоли, такие как инфликсимаб или этанерцепт, могут быть использованы в тяжелых случаях, когда другие варианты лечения не помогли. Тем не менее, в настоящее время известно мало исследований, которые продемонстрировали, насколько хорошо эти средства лечат полимиозит и дерматомиозит.
Как правило физическая терапия рекомендуется для предотвращения атрофии мышц, а также для поддержания мышечной силы и диапазона движения. Следует избегать постельного режима в течение длительного периода времени, поскольку у людей может развиться атрофия мышц, снижение мышечной функции и суставные контрактуры. Диета с низким содержанием натрия может помочь уменьшить отеки и сердечно-сосудистые осложнения.
Большинству людей страдающих дерматомиозитом может быть полезным использование местной мази, содержащей кортикостероиды, такролимус или пимекролимус для лечения расстройства кожи. Таким людям рекомендуется использование защитного солнцезащитного крема и одежды, особенно тем больным, которые чувствительны к свету. В редких случаях может потребоваться хирургическое вмешательство для удаления отложений кальция, вызывающих неврологическую боль и рецидивирующие инфекции.
Не существует стандартного, основанного на научных доказательствах, курса лечения для миозита со включениями. Болезнь, как правило, не реагирует на прием кортикостероидов и иммунодепрессантов. Некоторые данные свидетельствуют о том, что иммунодепрессанты или внутривенный иммуноглобулин могут иметь небольшое, но кратковременное, благоприятное действие в небольшом числе случаев. Физическая терапия может оказывать полезное действие для поддержания мобильности. Остальная терапия является симптоматической и поддерживающей.
Прогноз
В большинстве случаев симптомы дерматомиозита контролируются при терапии. У людей с сердечно-сосудистыми заболеваниями болезнь как правило протекает в более тяжелой форме и более устойчива к терапии. Примерно одна треть людей, страдающих дерматомиозитом, восстанавливается после болезни, у одной трети заболевание носит рецидивирующий характер, а у другой третьей части людей происходит хроническое течение болезни.
Прогноз на полимиозит различен. Большинство людей довольно хорошо реагируют на терапию, но у некоторых людей болезнь развивается в тяжелой форме. Поскольку полимиозит может вызывать проблемы при глотании, больные могут испытывать недоедание. Они также подвергаются повышенному риску случаев падения, что может привести к переломам бедер и других костей, инвалидности или смерти. В редких случаях у людей с тяжелой и прогрессирующей формой мышечной дистрофии могут развиться дыхательная недостаточность или пневмония.
Хотя некротизирующая аутоиммунная миопатия хуже поддается лечению, чем полимиозит и дерматомиозит, она в целом хорошо реагирует на долгосрочные комбинации иммунодепрессантов.
МСВ, как правило, устойчива ко всем методам лечения, а имеющиеся в настоящее время методы лечения плохо замедляют ее прогрессирование.
ЛАБОРАТОРНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ ДЕТЕЙ ПЕРВЫХ 3 ЛЕТ ЖИЗНИ В НЕВРОЛОГИЧЕСКОЙ КЛИНИКЕЕЩЕ: НА ГЛАВНУЮ СТРАНИЦУ
Воспалительные заболевания мышц – группа заболеваний, основным проявлением которых является мышечная слабость, связанная с воспалением поперечно–полосатой мускулатуры [1]. К ним относятся: идиопатические воспалительные миопатии (ИВМ), миопатии, связанные с инфекцией, и миопатии, связанные с воздействием лекарственных препаратов и токсинов. Наиболее яркими представителями ИВМ являются системные аутоиммунные ревматические заболевания неизвестной этиологии: полимиозит (ПМ) и дерматомиозит (ДМ). Наряду с ПМ и ДМ в группу ИВМ входят: ювенильный ДМ, миозит, ассоциирующийся с СЗСТ (перекрестный синдром), миозит, ассоциирующийся с опухолями, миозит с внутриклеточными включениями и несколько более редких заболеваний (оссифицирующий миозит, локализованный или очаговый миозит, гигантоклеточный миозит, эозинофильный миозит) (по Wortman R.L. 1994) [1].
История вопроса. Первые описания дерматомиозита и полимиозита принадлежат немецким клиницистам в период между 1886 и 1891 г. Термин «полимиозит» предложен E. Wagner в 1886 году, а в 1891 г. – H. Unverricht обратил внимание на сочетание кожного и мышечного поражения и использовал термин «дерматомиозит». Около 2/3 описаний XIX века соответствуют полимиозиту, оставшиеся – дерматомиозиту. В 1916 году описана ассоциация со злокачественными опухолями, однако причинная взаимосвязь предположена только в 1935 году. В 1967 Chou впервые описал миозит с включениями, хотя сам термин «миозит с включениями» введен Yunis и Samaha в 1971 году, когда в гистопатологических срезах мышечной ткани были обнаружены характерные ядерные цитоплазматические включения [2].
Частота ПМ/ДМ в популяции колеблется от 2 до 10 на 1 млн населения в год. ДМ, реже ПМ, ассоциирующиеся с опухолями, составляют примерно 20% от всех случаев воспалительных миопатий. Опухоли могут развиваться до появления признаков ИВМ, одновременно с ними или после их появления. Частота злокачественных новообразований при ПМ/ДМ в 12 раз выше, чем в популяции. На фоне злокачественных новообразований чаще развивается ДМ, чем ПМ [1,3].
Этиология. На роль генетической предрасположенности указывает возможность развития ПМ/ДМ у монозиготных близнецов и кровных родственников пациентов. Носительство некоторых HLA (HLA–В8/DR3, HLA B14 и HLA B40) более тесно связано не с самим заболеванием, а с определенными иммунологическими нарушениями, в первую очередь гиперпродукцией миозит–специфических аутоантител (табл. 1) [1].
Патогенез. В основе патогенеза ПМ/ДМ лежат клеточные и гуморальные иммунные реакции. Следует отметить, что в патогенезе ПМ и ДМ существуют принципиальные иммунопатологические различия.
При ДМ развивается гуморальный иммунный ответ, приводящий к активации системы комплемента и формированию активированного С3, что ведет к формированию C3b неоантигена и мембранолитического атакующего комплекса, который откладывается в эндотелиальных клетках и вокруг них, в стенке эндомизиальных капилляров. Отложение мембранолитического атакующего комплекса ведет к деструкции и уменьшению числа капилляров с ишемией и микроинфарктами миоцитов, наиболее выраженного на периферии пучка. В результате развивается картина малого числа увеличенных в диаметре капилляров и перифасцикулярная атрофия [3].
При ДМ также наблюдается миграция В–клеток, CD4+ Т–лимфоцитов и макрофагов, образующих внутримышечный инфильтрат. Миграции способствуют васкулярные молекулы клеточной адгезии 1 (VCAM1) и межклеточные молекулы адгезии 1 (ICAM1), экспрессия которых на эндотелиальных клетках повышена за счет воздействия высвобожденных цитокинов, с последующим поражением внутримышечных микрососудов и развитием внутримышечной васкулопатии. Цитокины, высвобожденные активированными Т– и В–клетками, усиливают процесс трансмиграции воспалительных клеток в мышцу [3].
При ПМ и миозите с включениями увеличивается клон аутоинвазивных СD8+ Т–клеток. CD8+ Т–лимфоциты синтезируют цитотоксические субстанции (перфорин, гранзим) и через перфориновый путь оказывают миотоксическое действие на миофибриллы, экспрессирующие молекулы HLA–I класса [1–4]. В дебюте патогенетического процесса ПМ и миозита с включениями наблюдается повышение экспрессии молекул HLA–I на мышечных волокнах, даже в отсутствие аутоинвазивных СD8+ Т–клеток [3].
Наиболее часто болезнь дебютирует недомоганием, общей слабостью, миалгиями, преходящим симметричным поражением суставов, поражением кожи. Началу болезни может предшествовать инсоляция. Затем, в течение нескольких недель (месяцев), постепенно нарастает слабость проксимальных групп мышц. У детей и лиц молодого возраста может наблюдаться более острое начало, часто сочетающееся с выраженными конституциональными проявлениями (лихорадка, похудание и др.). У больных с амиопатическим ДМ в течение длительного времени может наблюдаться типичное для ДМ поражение кожи при отсутствии мышечной слабости [1].
Ведущим клиническим признаком заболевания [5,6] является поражение мышц, выражающееся симметричной слабостью проксимальных групп мышц верхних и нижних конечностей и мышц шеи, ведущей к затруднению при подъеме с низкого стула, посадке в транспорт, при умывании и причесывании; больной не может оторвать голову от подушки. Наблюдаются: изменение походки и эпизоды неожиданных падений. Может развиваться отек мышц. Характерно поражение мышц глотки, гортани и верхней трети пищевода (дисфония, дисфагия). Амиотрофии развиваются только у больных, длительно страдающих ПМ/ДМ.
Поражение дистальной мускулатуры не характерно и наблюдается, главным образом, при миозите с «включениями».
Поражение кожи при ДМ часто предшествует развитию мышечной слабости. Характерным признаком является эритематозная («гелиотропная») сыпь, локализующаяся на верхних веках, скулах, в зоне «декольте» и «шали» (рис. 1), над локтевыми, коленными, пястнофаланговыми и проксимальными межфаланговыми суставами – эритема/папулы Готтрона (рис. 2), эритема волосистой части головы (рис. 3). Также наблюдаются шелушение и трещины на коже ладоней («рука механика»), околоногтевая эритема, фотодерматит, кожный зуд. Могут наблюдаться такие формы сосудистой патологии, как инфаркты околоногтевого ложа, петехии и сетчатое ливедо [6,7].
Артриты/артралгии наблюдаются достаточно редко и быстро купируются при назначении глюкокортикоидов (ГК). Развитие хронического деформирующего артрита с подвывихами суставов кистей наблюдается редко и не сопровождается эрозивными изменениями (синдром Жаку) (рис. 4) [1].
Кальциноз мягких тканей наиболее часто наблюдается при ЮДМ, при перекрестных синдромах миозита (например, с системной склеродермией) или на поздних стадиях ПМ/ДМ. Кальцинаты располагаются подкожно, в соединительной ткани, вокруг мышечных волокон и, наиболее часто, в зонах травматизации или после внутримышечных инъекций, например, на ягодицах [1].
Наиболее часто встречающимся органным поражением является поражение дыхательной системы (80%) [8,9]. При ПМ/ДМ наблюдаются различные варианты поражения дыхательной системы.
У подавляющего большинства пациентов наблюдается вовлечение в патологический процесс как межреберных мышц, так и диафрагмы. Высокое стояние куполов диафрагмы и вялость ее дыхательной экскурсии приводит к экспираторной одышке, изменению функции внешнего дыхания по рестриктивному типу. Кроме того, нарушение глотания, связанное с поражением глоточных мышц, может приводить к аспирации пищи и слюны с последующим развитием аспирационной пневмонии.
Наиболее частой формой легочного поражения является пневмония, которая встречается при ПМ/ДМ в 29–54% случаев. Ведущую роль в ее развитии играет аспирация пищи. Риск развития пневмоний и трудности при их лечении возрастают в связи выраженным иммунодефицитом пациентов с ПМ/ДМ, обусловленным длительным приемом высоких доз ГК и иммуносупрессивной терапии. Кроме того, гиповентиляционный синдром усугубляет риск развития пневмонии [8].
Наиболее тяжелым поражением легочной ткани является фиброзирующий альвеолит, который в зарубежной литературе принято называть интерстициальным заболеванием легких (ИЗЛ). Фиброзирующий альвеолит при ПМ/ДМ имеет широкий спектр клинико–лабораторных проявлений и сходен с идиопатическим фиброзирующим альвеолитом. Targoff I.N. c соавт.1992, выделяют три формы синдрома фиброзирующего альвеолита: 1 – По типу быстро прогрессирующего синдрома фиброзирующего альвеолита (синдром Хаммана–Ричи): острый непродуктивный кашель, одышка в покое, лихорадка. На рентгенограммах – множественные мелкоочаговые затемнения и сетчатая деформация легочного рисунка. Симптомы поражения мускулатуры могут быть на втором плане. Прогноз в данном случае, неблагоприятный. 2 – Более медленное развитие болезни, в дебюте: одышка при физической нагрузке и/или непродуктивный кашель. Клинические проявления могут предшествовать мышечному поражению, возникать одновременно с ним или развиваться на фоне имеющегося тяжелого миозита. У ряда больных 1 и 2 групп может присутствовать тахипноэ, крепитация в нижних отделах легких, реже развитие легочного сердца. 3 – Субклиническое поражение: яркая клиническая легочная симптоматика отсутствует. Интерстициальные изменения в легочной ткани выявляются только при помощи специальных методов исследования (КТ, рентгенография) [8].
Так, клиника фиброзирующего альвеолита может опережать развитие мышечного синдрома или проявляться одновременно с ним. Однако наиболее часто клинические признаки синдрома фиброзирующего альвеолита развиваются на фоне клинической картины ПМ/ДМ, как правило, на ранних этапах болезни.
Поражение сердца в большинстве случаев протекает без явных клинических признаков повреждения. Ведущее место в структуре кардиологической патологии при ИВМ занимает поражение миокарда, наиболее часто проявляющееся нарушением ритма (суправентрикулярная или желудочковая экстрасистолия) и проводимости (наиболее часто – блокада левой ножки пучка Гиса), а также снижением его сократительной способности. Наиболее частым проявлением нарушения сократительной функции сердца является снижение локальной сократимости в области задней стенки левого желудочка и межжелудочковой перегородки. Крайне редко развиваются миокардит или застойная сердечная недостаточность на фоне миокардиофиброза [10].
Поражение ЖКТ: нарушение глотания обусловлено поражением мышц глотки, гипотония пищевода (верхняя треть) [1]. Поражение почек наблюдается крайне редко, как правило, при overlap–синдромах, в основном с ССД. Возможна протеинурия. Описаны единичные случаи развития рабдомиолиза (миоглобинурия – острая почечная недостаточность) [1,4].
Феномен Рейно чаще наблюдается при ДМ, антисинтетазном синдроме и у больных с перекрестным синдромом ПМ/ДМ и со смешанным заболеванием соединительной ткани [1,4,11].
Клинико–иммунологические ассоциации (табл. 1). Согласно современным представлениям, развитие ИВМ связано с синтезом целого «семейства» аутоантител, направленных к цитоплазматическим белкам и рибонуклеиновым кислотам. Эти антитела присутствуют в сыворотках у почти 90% больных, рассматриваются как миозитспецифические антитела и подразделяются на подгруппы [4,8]. Выявление аутоантител каждой подгруппы ассоциировано с определенным симптомокомплексом. Наиболее тяжелым является «антисинтетазный» синдром, который маркируют антитела к аминоацилсинтетазам тРНК (Jo–1и др.) [11].
Лабораторные данные включают повышение уровня сывороточной креатинфосфокиназы (КФК), лактатдегидрогеназы (ЛДГ), аспарагиновой (АСТ), аланиновой (АЛТ) трансаминаз. При мышечном повреждении может наблюдаться снижение уровня сывороточного креатинина [11–13].
АНФ определяется у 50–80%, чаще у больных с перекрестными синдромами миозита с другими СЗСТ и в более высоких титрах [14]. Определение антител к аминоацилсинтетазам транспортной РНК, в первую очередь Jo–1: диагностический критерий ПМ/ДМ и лабораторный маркер «антисинтазного» синдрома [15–18].
Электромиографическое исследование игольчатыми электродами (и–ЭМГ) проводится с целью подтверждения первично–мышечного поражения, определения степени активности воспалительного процесса и некроза мышечных волокон. При ПМ/ДМ наблюдается снижение амплитуды и средней длительности потенциалов двигательных единиц (ПДЕ), полифазия, псевдополифазия и спонтанная активность (СА) мышечных волокон (потенциалы фибрилляций и положительные острые волны). Поведение и–ЭМГ необходимо и в динамике, для оценки эффективности проводимой терапии [19–20].
Согласно классическим диагностическим критериям, в мышечном биоптате выявляются: некроз и атрофия мышечных волокон, выраженная лимфогистиоцитарная инфильтрация, умеренная регенерация мышечных волокон, потеря поперечнополосатой исчерченности [12,24].
Капилляроскопическая картина представлена деструкцией и дезорганизацией капилляров, уменьшением их числа, увеличением размера; неоангиогенезом, а также формированием так называемых «кустовидных» капилляров (рис. 5).
Рентгенологическое исследование легких или рентгеновская компьютерная томография с высоким разрешением способствует выявлению патологических изменений легочной ткани, от базального пневмосклероза до острого фиброзирующего альвеолита [8].
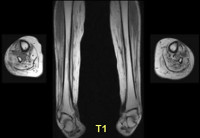
В последние годы многие исследователи опираются на результаты магнитно–резонансной томографии (МРТ) [22]. МРТ позволяет провести раннюю диагностику заболевания благодаря выявлению отека мышечной ткани даже до клинических проявлений поражения мышц, особенно в случае дерматомиозита, когда поражение кожных покровов уже очевидно. Отек мышечной ткани является индикатором активности болезни.
За годы изучения ИВМ неоднократно повторялись попытки разработки оптимальных диагностических критериев ИВМ: Bohan and Peter 1975; Dalakas 1991; Griggs 1995; Tanimoto 1995; Targoff 1997; Mastaglia 2002; Van der Meulen 2003; Dalakas, Hohlfeld 2003 [5–13]. Наиболее широко в настоящее время используются критерии Bohan and Peter 1975 и Tanimoto 1995 (табл. 2) [12,13,23–28].
Вызывают интерес диагностические критерии, предложенные Dalakas в 1991 году, которые основаны на специфических иммуногистопатологических особенностях мышечного инфильтрата и позволяют дифференцировать ДМ и ПМ от других миопатических синдромов (см. дифференциальная диагностика). Так, по мнению Dalakas, мышечный биоптат при достоверном ПМ имеет инвазию CD8+ лимфоцитами ненекротизированных мышечных волокон, экспрессирующих HLA–I класса гистосовместимости. При этом отсутствуют вакуоли, характерные для миозита с «включениями». Достоверный диагноз ДМ по Dalakas характеризуется наличием перифасциальной атрофии и воспалительных инфильтратов в мышцах в сочетании с характерными кожными изменениями [21].
Дифференциальная диагностика [19–20,29] ИВМ представляет сложную проблему и проводится с широким спектром заболеваний, сопровождающихся также мышечной слабостью, увеличением КФК и первично–мышечными электромиографическими изменениями.
Истинную проксимальную мышечную слабость следует отличать от общей слабости, утомляемости или миалгии, вызываемыми различными причинами.
Учитывая актуальность и сложность проблемы дифференциальной диагностики воспалительных миопатий, еще в 1975 году Bohan and Peter были выделены критерии исключения [12], объединяющие различные нозологическое формы, где одним из клинических проявлений может являться мышечная слабость. В первую очередь, это неврологические заболевания, миастения гравис и миодистрофии, а также саркоидоз, инфекционные болезни (трихенеллез, цистеркоз, токсоплазмоз), токсин– и лекарственно–индуцированные миопатии, рабдомиолиз, метаболические миопатии (например, болезнь Мак Ардла) и эндокринопатии (табл. 3).
В 2000 г. создана международная мультидисциплинарная группа исследователей по оценке миозита и клинических исследований (International Myositis Assessment and Clinical Studies Group – IMACS) под руководством профессора P. Plotz. Разработаны стандартизированные методы обследования больных ИВМ (табл. 4) [30–32].
Предложены следующие дефиниции:
Активность рассматривается как частично или полностью обратимые явления, связанные непосредственно с воспалительным процессом в мышцах. Повреждение – критерий исхода болезни, отражающий поствоспалительные необратимые изменения в мышцах и других органах (рубцевание, фиброз, амиотрофии, замещение жировой тканью) и в результате проводимой терапии (стероидная катаракта, сахарный диабет, инфекционные осложнения и др.) [30–34]. Полный клинический ответ на терапию определяется как отсутствие признаков активности болезни на фоне продолжения проводимого лечения, а полная клиническая ремиссия – как отсутствие признаков активности миозита на фоне отсутствия любой терапии в течение 6 месяцев [32].
Основу лечения ИВМ составляют ГК [36]. Раннее начало терапии (в течение первых 3–х месяцев от начала симптомов) ассоциируется с благоприятным прогнозом [37,38]. В зависимости от тяжести заболевания начальная доза колеблется от 1 до 2 мг/кг/сут. Улучшение состояния (нарастание мышечной силы) больных ПМ/ДМ развивается медленнее, чем при других ревматических заболеваниях. При отсутствии положительной динамики в течение 4 недель следует увеличить дозу ГК. После достижения эффекта или значительного улучшения (нарастание мышечной силы и КФК) дозу ГК постепенно снижают до поддерживающей. Снижение дозы ГК должно проводиться под строгим клинико–лабораторным контролем [39].
Пульс–терапия ГК редко эффективна, применяется, главным образом, при ЮДМ, когда она может предотвратить быстрое прогрессирование миопатии и развитие кальциноза. При ПМ/ДМ у взрослых пульс–терапию ГК применяют в случае быстрого прогрессирования дисфагии (риск аспирационной пневмонии) и развития системных проявлений (миокардит, альвеолит).
При наличии факторов риска неблагоприятного прогноза (позднее назначение ГК–терапии, тяжелая мышечная слабость, наличие дисфагии) [37,38], при невозможности назначения адекватной дозы ГК из–за побочных эффектов или при недостаточной эффективности ГК применяются препараты «второго» ряда: метотрексат, азатиоприн [37], циклофосфамид: («препарат выбора» при интерстициальном легочном фиброзе), циклоспорин А.
Имеются данные о положительном эффекте циклоспорина А в отношении прогрессирования интерстициального легочного фиброза [40,41]. Накоплен некоторый опыт лечения такролимусом, который сходен по иммуномодулирующим эффектам с циклоспорином А [39,42,43].
Одним из наиболее обнадеживающих направлений фармакотерапии ИВМ многие годы считается использование внутривенного иммуноглобулина. Еще в 1993 г. М.С. Dalakas [44] доказан его положительный клинико–лабораторный эффект. Однако кратковременность эффекта после прекращения его применения требует проведения повторных инфузий. Потенциальным показанием для внутривенного иммуноглобулина является тяжелая дисфагия [42].
Относительно новым цитостатическим препаратом для лечения аутоиммунных заболеваний является микофенолата мофетил – иммунодепрессант антиметаболического типа, обладающий хорошей переносимостью согласно литературным данным [42,43].
В последние годы для лечения ИВМ все чаще применяются ингибиторы фактора некроза опухоли? (ФНО–a), в частности инфликсимаб [42,45–48]. Появились данные об успешном применении при аутоиммунных заболеваниях препаратов, блокирующих пролиферацию В–клеток, одним из которых является ритуксимаб. Имеются отдельные сообщения об его эффективности при ДМ [42,49,50].
При резистентном кожном синдроме, сохраняющемся на фоне восстановления мышечной силы, рекомендуется применение антималярийных препаратов, топических стероидов, такролимуса, микофенолат мофетила [39,42,43].
Реабилитационные мероприятия проводятся в зависимости от стадии заболевания. В острую фазу показаны пассивные упражнения, в стадию выздоровления – изометрические, а затем изотонические упражнения и, наконец, в хронической стадии – анаэробные упражнения [1].
Прогноз. Внедрение в клиническую практику ГК существенно увеличило выживаемость больных ПМ/ДМ, которая составляет 90% через 5 лет после постановки диагноза, за исключением больных онкомиозитом. Факторами, ассоциирующимися с неблагоприятным прогнозом при ПМ/ДМ, являются пожилой возраст, поздно поставленный диагноз, неадекватная терапия ГК в начале болезни, тяжелое течение миозита, антисинтетазный синдром [1,8].







Литература
1. Насонов Е.Л. Воспалительные заболевания мышц. Рациональная фармакотерапия ревматических заболеваний. 195–202. Москва. Литера. 2003.
2. Wortmann R.L. “Diseases of Skeletal Muscle” 1 с 45–57.
3. Dalakas M. Mechanisms of disease:signaling pathways and immunobyology of inflammatory myopathies. Nature clinical practice rheumatology. 2006, vol l2, 4, 219–227.
4. Насонов Е.Л., Штутман В.З, Саложин К.В, Гусева Н.Г., Насонова В.А, Плотц П. Клинико – иммунологическая гетерогенность идиопатических воспалительных миопатий. Клиническая Медицина 1995; 2 3–8.
5. Miller M. Clinical manifestations and diagnosis of adult dermatomyositis and po;ymyositis. UpToDate 2004; 12.2
6. Stahl, NI, Klippel, JH, Decker, JL. A cutaneous lesion associated with myositis. Ann Intern Med 1979; 91:577
7. Kovacs, SO, Kovacs, SC. Dermatomyositis. J Am Acad Dermatol 1998; 39:899.
8. Бондаренко И.В., Мухин Н.А., Насонов Е.Л. Поражение легких при полимиозите и дерматомиозите. Интерстициальные заболевания легких. Руководство для врачей. Под редакцией Ильковича М.М., Кокосова А.Н. 274–287. Санкт–Петерург. Нордмедиздат 2005.
9. Lakhanpal, S, Lie, JT, Conn, DL, Martin, WJ II. Pulmonary disease in polymyositis/dermatomyositis: A clinicopathologic analysis of 65 autopsied cases. Ann Rheum Dis 1987; 46:23.
10. Хитров А.Н. Поражение сердца при дерматомиозите и полимиозите. Автореферат диссертации на соискание ученой степени кандидата медицинских наук. Москва 1999.
11. Love, LA, Leff, RL, Fraser, DD, et al. A new approach to the classification of idiopathic inflammatory myopathy: Myositisspecific autoantibodies define useful homogeneous patient groups. Medicine 1991; 70:360.
12. Bohan, A, Peter, JB. Polymyositis and dermatomyositis (second of two parts). N Engl J Med 1975; 292:403.
13. Bohan, A, Peter, JB, Bowman, RL, Pearson, CM. Computer–assisted analysis of 153 patients with polymyositis and dermatomyositis. Medicine (Baltimore) 1977; 56:255.
14. Reichlin, M, Arnett, FC. Multiplicity of antibodies in myositis sera. Arthritis Rheum 1984; 27:1150.
15. Love, LA, Leff, RL, Fraser, DD, et al. A new approach to the classification of idiopathic inflammatory myopathy: Myositisspecific autoantibodies define useful homogeneous patient groups. Medicine 1991; 70:360.
16. Plotz, PH, Rider, LG, Targoff, IN, et al. Myositis: Immunologic contributions to understanding cause, pathogenesis, and therapy. Ann Intern Med 1995; 122:715.
17. Brouwer, R, Hengstman, GJ, Vree Egberts, W, et al. Autoantibody profiles in the sera of European patients with myositis. Ann. Rheum Dis 2001; 60:116.
18. Mozaffar T, Pestronk, A. Myopathy with anti–Jo–1 antibodies: pathology in perimysium and neighbouring muscle fibres. J Neurol Neurosurg Psychiatry 2000; 68:472.
19. Гехт Б.М., Ильина Н.А. «Нервно–мышечные болезни». «Медицина» 1982.
20. Антелава О.А., Касаткина Л.Ф., Гуркина Г.Т., Хитров А.Н., Пикуля Н.В., Штутман В.З., Насонов Е.Л.. Дифференциальная диагностика мышечной слабости. Русский медицинский журнал N 14, 2004, 854–862.
21. Dalakas M.C. Polymyositis, dermatomyositis and inclusion–body myositis. Engl.J. Med. 1991, 325, 1487–1498.
22. Miller FW, Rider LG, Chung YL, et al, for the International Myositis Outcome Assessment Collaborative Study Group, Proposed preliminary core set measures for disease outcome assessment in adult and juvenile idiopathic inflammatory myopathies, Rheumatology (Oxford), 2001, 40,11,1262–1273.).
23. Griggs RC, Askanas, V, DiMauro, S, et al. Inclusion body myositis and myopathies. Ann Neurol 1995, 38:705.
24. Tanimoto K., Nakano K., Kano S. et al. Classification criteria for polymyositis and dermatomyositis. J. Rheumatol 1995; 22: 668–574.
25. Targoff I.N., Miller F.W., Medsger T.A. et al. Classification criteria for the idiopathic inflammatory myopathies. Curr Opin Rheumatol. 1997;9, 527–535.
26. Mastaglia FL, Phillips BA. Idiopathic inflammatory myopathies: epidemiology, classification, and diagnostic criteria.Rheum Dis Clin North Am 2002;28, 823–832.
27. Dalakas M.C., Hohlfeld R. Pofymyositis and dermatomyositis. Lancet 2003, 362, 971–982.
28. Nirmalananthan N, Holton JL. Hanna MG. Is it really myositis? Consideration of the differential diagnosis. Curr Opin Rheumatol 2004; 16: 684–691.
29. Ильина Н.И. «Миопатические синдромы» Клиническая медицина , 1983, N9, с 30–35.
30. Isenberg D.A., Allen E., Farewell V., et al. International consensus outcome measures for patients with idiopathic inflammatory myopathies. Development and initial validation of myositis activity and damage indices in patients with adult onset disease. Rheumatology (Oxford), 2004, 43, 1, 49–54.
31. Miller F.W., Rider L.G., Feldman. Development of validated disease activity and damage indices for the juvenile idiopathic inflammatory myopathies: I. Arthr. Rheum., 1997, 40, 11, 1976–1983.
32. Oddis C.V., Outcomes and disease activity measures for assessing treatments in the idiopathic inflammatory myopathies. Curr. Rheumatol. Rep. 2005, 7, 87–93.
33. Lovell D.J., Lindsley C.B., Rennebohm R.M., et al. Development of validated disease activity and damage indices for the juvenile idiopathic inflammatory myopathies. II. The Childhood Myositis Assessment Scale (CMAS): a quantitative tool for the evaluation of muscle function. The Juvenile Dermatomyositis Disease Activity Collaborative Study Group. Arthritis Rheum. 1999 42, 10, 2213–2219.
34. Park J. H., Olsen N. J, King L. et al. Use of imaging and P–31 magnetic resonance spectroscopy to detect and quantify muscle dysfunction in the myopathic variants of dermatomyositis. Arth.Rheum., 1995, 38, 68–77.
35. Lovell D.J., Lindsley C.B., Rennebohm R.M., et al. Development of validated disease activity and damage indices for the juvenile idiopathic inflammatory myopathies. II. The Childhood Myositis Assessment Scale (CMAS): a quantitative tool for the evaluation of muscle function. The Juvenile Dermatomyositis Disease Activity Collaborative Study Group. Arthritis Rheum. 1999 42, 10, 2213–2219.
36. Drake LA, Dinehart SM, Farmer ER, et al. Guidelines of care for dermatomyositis. J Am Acad Dermatol 1996; 34:824.
37. Fafalak RG, Peterson MGE, Kagen LJ. Strength in polymyositis and dermatomyositis: Best outcome in patients treated early. J Rheumatol. 1994; 21:643.
38. Joffe MM, Love LA, Leff RL et al. Drug therapy of the idiopathic inflammatory myopathies: Predictors of response to prednisone, azathioprine, and methotrexate and a comparison of their efficacy. Am J Med 1993; 94:379.
39. Насонов Е.Л., Штутман В.З. Фармакотерапия идиопатических воспалительных миопатий. Клиническая фармакология, 1995, 4 (2). 57–63.
40. Grau JM, Herrero, C, Casademont J, et al. Cyclosporin A as a first choice therapy for dermatomyositis. J Rheumatol 1994; 21:381.
41. Qushmaq KA, Chalmers A, Esdaile JM. Cyclosporin A in the treatment of refractory adult polymyositis/dermatomyositis: population based experience in 6 patients and literature review. J Rheumatol 2000; 27:2855.
42. Антелава О.А., Соловьев С.К,. Хитров А.Н, Насонов Е.Л. Новые аспекты фармакотерапии идиопатических воспалительных миопатий. (Обзор литературы). Русский медицинский журнал 2006, 14, 8 (260), 627–629.
43. Антелава О.А., Насонов Е.Л. Место микофенолат мофетила при идиопатических воспалительных миопатиях. Научно–практическая ревматология 2006,3,38–41.
44. Dalakas, MC, Illa I, Dambrosia, JM, et al. A controlled trial of high–dose intravenous immune globulin infusions as treatment for dermatomyositis. N Engl J Med 1993; 329:1993
45. Efthimiou P., Schwartzman S, Kagen L. Possible role for TNF–Inhibitors in the treatment of resistant dermatomyositis and polymiositis. Ann.Rheum. Dis. 2006, 13.
46. Hengstelman G.J., van den Hoogen F.H., Barrera P. et аl. Successful treatment of dermatomyositis and polymyositis with anti–tumor–necrosis–factor–alpha: preliminary observations. Eur.Neurol., 2003, 50(1),10–15.
47. Saaden C.K. Etanercept is effective in the treatment of polymyositis/dermatomyositis wich refractory to conventional therapy including steroid and other disease modifying agents. Arthr.Rheum., 2000, 43,193.
48. Hengstelman G., van den Hoogen F., van Engelen B., et al. Anti–TNF–blockade with infliximab (Remicaid) in polymyositis and dermatomyositis. Arthr.Rheum., 2000,43, 3193.
49. Levin T.D. Rituximab in the treatment of dermatomyositis. Arthr. Rheum. 2005, 52, 2, 601–607.
50. Levin T.D. A pilot study of rituximab therapy for refractory dermatomyositis. Arthr. Rheum. 2002,46, (suppl 9), 488.
.
что это такое, самый распространенный тип
Некоторые люди начинают замечать у себя мышечную слабость, которая сохраняется даже после отдыха, отмечают дряблость мускулатуры и даже искривление позвоночника.
Этими симптомами нередко проявляется миопатия – что это такое, можно ли справиться с заболеванием, как протекает процесс и каких признаков следует опасаться пациенту?
Лучший способ уточнить особенности болезни – обратиться к доктору, ведь болезнь протекает по-разному у всех пациентов. Но ознакомиться с общими признаками заболевания можно до посещения специалиста.
Общие сведения о болезни
Чаще у пациентов обнаруживают воспалительную миопатию. Общее определение для всех типов болезни – поражение нервно-мышечной ткани, дистрофическое изменение клеток, неуклонный прогресс, сопровождающийся разрушением волокон. С точки зрения механики, миопатический синдром развивается следующим образом:
- сначала изменяется работа митохондрий – прекращается корректное окисление продуктов обмена после получения энергии;
- затем изменяется структура миофибрилл, которые отвечают за корректное сокращение мышечных волокон;
- после этого нарушается генерация ферментов и белков, участвующих в обмене веществ мускулатуры;
- завершает дегенеративный процесс сбой в работе вегетативной нервной системы, которая отвечает за функционирование большинства других органов и приспособительных реакций

Все это приводит к тому, что мышцы перестают правильно функционировать, начинают разрушаться. На смену им при воспалительной миопатии приходит жировая прослойка. Теряется сократительная и двигательная способность волокон. Даже умеренные физические нагрузки не идут на пользу поврежденным тканям.
Важно! Нарушения связаны с молекулярными процессами, поэтому физкультурой болезнь вылечить не получится.
Напротив, чрезмерные физические нагрузки при воспалительной миопатии ускоряют процесс разрушения волокон, так как мышцы задействуются неравномерно.
Виды синдрома
Обнаружить миопатический синдром можно уже в раннем детстве, так как большая часть заболеваний этого вида относится к наследственным формам. Но есть ситуации, в которых обнаруживаются вторичные формы миопатии, в том числе воспалительная патология:
- Наследственные. Вызывают миопатию этого вида болезни Дюшенна, Эрба, патологии нервного стержня и некоторые другие наследственные повреждения генов.
- Воспалительные. Бывают инфекционные формы миопатии, вызванные стрептококками или различными вирусами и паразитами, в том числе токсоплазмозом. Вторая группа – идиопатические, к ним относят патологии неясного происхождения, например, дерматомиозиты или синдром Шегрена.
- Метаболические. Такая болезнь развивается из-за сбоя в выработке липидов. Иногда вместо липидов страдает обмен пуринов или гликогена. Встречается в основном одна форма миопатии – митохондриальная.
- Паранеопластические. Патологии связаны со злокачественными опухолями.
- Токсические. За формирование миопатического синдрома ответственны отравления химическими веществами, в том числе сильнодействующими лекарственными препаратами или наркотиками. Болезнь возникает из-за постоянных инъекций, которые вызывают нагноение, формирование язв и уплотнение.

Существует и другой способ классификации видов миопатии – по места расположения. Патология поражает разные отделы скелета, в том числе глаза. Но чаще встречается болезнь, развивающаяся в руках и ногах в области кистей и стоп, а также тазобедренная форма болезни.
Причины воспалительной формы
Воспалительные миопатии встречаются намного чаще, что связано в основном с особенностями их происхождения. Воспаления и инфекции, действующие на человека, вызывают различные осложнения в 99% случаев, если интоксикация очень сильная. Точно узнать, почему появляется воспалительная миопатия, не удается до сих пор, но врачи делают несколько предположений. В связи с ними выделяют некоторые формы миопатии:
- провокаторы – инфекции, в том числе ВИЧ, грипп и даже краснуха;
- стрептококки и паразиты, некоторые виды грибков;
- воспалительные миопатии, вызванные аутоиммунными процессами (повреждение структуры мышц иммунными клетками, которые работают неправильно).

Нередко под идиопатическими формами мышечной миопатии находят такие болезни, как системная красная волчанка, ревматоидный артрит и воскулит.
Признаки и симптомы патологий
Симптомы воспалительных миопатий делятся на несколько групп. Часть из них может быть неотрывно связана с основными болезнями, из-за которых развивается непрогрессирующая или прогрессирующая миопатия. Основной признак болезни – это устойчивая мышечная дистрофия.
При повреждении мышечных волокон развивается сильная слабость, в результате сдавливаются прилегающие сосуды и артерии. Также пациенты отмечают постоянную слабость, нарушения равновесия. Но страдают не только ноги, воспалительная миопатия затрагивает дыхательные и глотательные мышцы. Иногда отмечается болезненность, но не так часто, как основные симптомы. Следует отметить симптомы, коррелирующие с заболеваниями:
- При полимиозите поражаются мышцы, отвечающие за подвижность скелета с обеих сторон тела. В основном развитие болезни начинается после 30 лет и редко наблюдается после 60. При этой форме воспалительная миопатия может сопровождаться разными симптомами, не одинаковыми для пациентов. Нередко патология протекает с нарушением глотательных функций, пациенту сложно разговаривать, принимать сидячее положение, и врачи не могут контролировать этот процесс. У некоторых людей наблюдаются сопутствующие болезни как симптомы миопатии: артрит, аритмия, одышка или сердечная недостаточность.

- Дерматомиозит сопровождается сыпью на коже, которая идет вместе с мышечной дистрофией. Сыпь проявляется синими или красными пятнами с фиолетовым оттенком. Чаще всего поражается кожа век, колен и локтей, а также пальцы ног. Если пациент подвергается воздействию солнца, сыпь становится более яркой. У некоторых пациентов при этой форме воспалительной миопатии отмечается повышение температуры и лихорадка, в тяжелых случаях развивается воспаление легких.
У большинства наблюдается сильная чувствительность к свету. У части пациентов наблюдается отечность молочных желез и внутренних органов, при воспалительной миопатии страдает кишечник и половые железы. У части пациентов наблюдаются отложения кальция под кожей или в области мышц, эти участки становятся плотными.

Есть и общие признаки, объединяющие полимиозит и дерматомиозит. Первый – это дистрофия отдаленных мышечных волокон, расположенных в запястьях или лодыжках.
Миозит МСВ, то есть с включениями, — это самая распространенная воспалительная миопатия у людей в возрасте от 50 лет. Мышечная дистрофия в этом случае прогрессирует очень медленно. Поражаются длинные мышцы, расположенные в области бедер, затем процесс охватывает другие части тела.
Важно! МСВ может протекать с преобладанием в одной стороне, но чаще поражает обе стороны туловища.
Для всех форм миозита характерны падения – это первый симптом воспалительной миопатии, который становится очевиден всем. Также пациенты отмечают слабость в пальцах и запястьях, им с трудом даются такие процессы, как застегивание пуговиц.

Многие близкие, если их родственники старше 50 лет начинают испытывать трудности с простыми механическими операциями, списывают все на развитие Альцгеймера или Паркинсона. МСВ чаще обнаруживается у мужчин, тогда как дерматомиозит или полимиозит одинаково часто встречается у обоих полов.
Некротизирующая аутоиммунная форма болезни
Аутоиммунная воспалительная миопатия обнаруживается очень редко, врачи лишь лет назад выделили эту форму патологии в отдельную группу. Она может возникнуть как в детском, так и во взрослом возрасте. Слабость возникает в верхней или нижней части тела.
Нередко наблюдаются проблемы с вставанием со стула. Эта форма относится к выраженным прогрессирующим видами заболевания. Симптомы нарастают в течение нескольких недель. Кроме слабости, отмечается потеря мышечной массы, боль и сильная усталость.
Протекать аутоиммунные воспалительные миопатии могут вместе с вирусами и другими заболеваниями. Очень часто обнаруживается склеродермия, реже – причины, вызванные приемом статинов. Отмечено, что симптомы сохраняются даже после прекращения приема препаратов.

Детские формы похожи на взрослые, чаще обнаруживаются в возрасте от 2 до 15 лет. Кроме основных симптомов, отмечают кожную сыпь и боль в животе, а также лихорадку и контрактуру суставов. Последний признак сопровождается стягиванием сухожилий вокруг хрящей. Нередко возникают дыхательные и глотательные проблемы.
Диагностика патологического состояния
Для диагностики миопатии привлекаются такие врачи, как неврологи, ревматологи. Дополнительно требуется консультация дерматологов, кардиологов и прочих специалистов. Четких диагностических критериев для определения одной из форм болезни в современной медицине не существует. Но есть условные показатели:
- биохимический анализ крови – высокий уровень КФК (креатинфосфокиназы), альдолазы, лактодегидрогеназы – эти вещества отвечают за целостность мышечных тканей, чем выше уровень, тем больше повреждения;
- анализ крови – высокий показатель миоглобина;

- исследование мышечной силы – используют динамический способ;
- электромиография – определение продолжительности и амплитуды мышечных волокон, электровозбудимости;
- мышечная биопсия – характер и место поражения определяется анализом полученных волокон, гистологическое поражение легко выявляет медиаторы воспаления, некроз;
- УЗИ, рентген и электрокардиограмма – необходимы для определения сопутствующих поражений органов при непрогрессирующей или прогрессирующей миопатии.

Специалисты отмечают, что биохимический анализ крови не может быть основным критерием для определения болезни. Так, при воспалительной миопатии, которая вызвана миозитом, эти показатели находятся в пределах нормы.
Лечение патологии
Лечение миопатии – сложный, продолжительный процесс, требующий применения сильнодействующих препаратов. Наиболее распространенный способ терапии патологии легкой степени – применение глюкокортикостероидов, в частности, — преднизолона. Ежедневная дозировка находится в пределах 100 мг.
Важно! Снижение дозировки начинают постепенно, если повышается мышечная сила, затем поддерживают прием препарата 15 мг/сутки.
В тяжелых случаях лечить воспалительную миопатию нужно пульс-терапией, что предполагает прием ударных доз метилпреднизолона. Осложняется лечение миопатии тем, что принимать глюкокортикостероиды в течение длительного времени невозможно из-за побочных эффектов.
Запрещено проводить терапию, если у пациента есть болезни:
- язва;
- гипертония;
- катаракта или глаукома;
- остеопороз.

Если в течение 3 месяцев после начала терапии нет улучшений, то пациенту с воспалительной миопатией нельзя продолжать лечение из-за устойчивости к стероидам.
Важно! Существует альтернатива для терапии болезни – цитостатики. Назначают такие вещества, как метотрексат, циклофосфамид, азатиоприн.
Эффект этих препаратов не такой выраженный, но они подходят для лечения, если возможно применение уменьшенных доз стероидов. Если диагностирована системная патология, назначают плазмоферез для сокращения антител в плазме крови.
Прогноз при воспалительной миопатии положительный, если терапия начата вовремя. Симптомы болезни поддаются коррекции, но могут возникнуть трудности при заболеваниях сердца. Примерно треть пациентов восстанавливается почти полностью, у 30% сохраняются рецидивы, а у оставшегося количества человек болезнь приобретает хронический характер. При этом некротизирующие формы патологии сложно поддаются лечению.
Антелава О.А., Хитров А.Н., Насонов Е.Л.
Воспалительные заболевания мышц – группа заболеваний, основным проявлением которых является мышечная слабость, связанная с воспалением поперечно–полосатой мускулатуры [1]. К ним относятся: идиопатические воспалительные миопатии (ИВМ), миопатии, связанные с инфекцией, и миопатии, связанные с воздействием лекарственных препаратов и токсинов. Наиболее яркими представителями ИВМ являются системные аутоиммунные ревматические заболевания неизвестной этиологии: полимиозит (ПМ) и дерматомиозит (ДМ). Наряду с ПМ и ДМ в группу ИВМ входят: ювенильный ДМ, миозит, ассоциирующийся с СЗСТ (перекрестный синдром), миозит, ассоциирующийся с опухолями, миозит с внутриклеточными включениями и несколько более редких заболеваний (оссифицирующий миозит, локализованный или очаговый миозит, гигантоклеточный миозит, эозинофильный миозит) (по Wortman R.L. 1994) [1].
История вопроса. Первые описания дерматомиозита и полимиозита принадлежат немецким клиницистам в период между 1886 и 1891 г. Термин «полимиозит» предложен E. Wagner в 1886 году, а в 1891 г. – H. Unverricht обратил внимание на сочетание кожного и мышечного поражения и использовал термин «дерматомиозит». Около 2/3 описаний XIX века соответствуют полимиозиту, оставшиеся – дерматомиозиту. В 1916 году описана ассоциация со злокачественными опухолями, однако причинная взаимосвязь предположена только в 1935 году. В 1967 Chou впервые описал миозит с включениями, хотя сам термин «миозит с включениями» введен Yunis и Samaha в 1971 году, когда в гистопатологических срезах мышечной ткани были обнаружены характерные ядерные цитоплазматические включения [2].
Частота ПМ/ДМ в популяции колеблется от 2 до 10 на 1 млн населения в год. ДМ, реже ПМ, ассоциирующиеся с опухолями, составляют примерно 20% от всех случаев воспалительных миопатий. Опухоли могут развиваться до появления признаков ИВМ, одновременно с ними или после их появления. Частота злокачественных новообразований при ПМ/ДМ в 12 раз выше, чем в популяции. На фоне злокачественных новообразований чаще развивается ДМ, чем ПМ [1,3].
Этиология.
На роль генетической предрасположенности указывает возможность развития ПМ/ДМ у монозиготных близнецов и кровных родственников пациентов. Носительство некоторых HLA (HLA–В8/DR3, HLA B14 и HLA B40) более тесно связано не с самим заболеванием, а с определенными иммунологическими нарушениями, в первую очередь гиперпродукцией миозит–специфических аутоантител (табл. 1) [1].
Патогенез.
В основе патогенеза ПМ/ДМ лежат клеточные и гуморальные иммунные реакции. Следует отметить, что в патогенезе ПМ и ДМ существуют принципиальные иммунопатологические различия.
При ДМ развивается гуморальный иммунный ответ, приводящий к активации системы комплемента и формированию активированного С3, что ведет к формированию C3b неоантигена и мембранолитического атакующего комплекса, который откладывается в эндотелиальных клетках и вокруг них, в стенке эндомизиальных капилляров. Отложение мембранолитического атакующего комплекса ведет к деструкции и уменьшению числа капилляров с ишемией и микроинфарктами миоцитов, наиболее выраженного на периферии пучка. В результате развивается картина малого числа увеличенных в диаметре капилляров и перифасцикулярная атрофия [3].
При ДМ также наблюдается миграция В–клеток, CD4+ Т–лимфоцитов и макрофагов, образующих внутримышечный инфильтрат. Миграции способствуют васкулярные молекулы клеточной адгезии 1 (VCAM1) и межклеточные молекулы адгезии 1 (ICAM1), экспрессия которых на эндотелиальных клетках повышена за счет воздействия высвобожденных цитокинов, с последующим поражением внутримышечных микрососудов и развитием внутримышечной васкулопатии. Цитокины, высвобожденные активированными Т– и В–клетками, усиливают процесс трансмиграции воспалительных клеток в мышцу [3].
При ПМ и миозите с включениями увеличивается клон аутоинвазивных СD8+ Т–клеток. CD8+ Т–лимфоциты синтезируют цитотоксические субстанции (перфорин, гранзим) и через перфориновый путь оказывают миотоксическое действие на миофибриллы, экспрессирующие молекулы HLA–I класса [1–4]. В дебюте патогенетического процесса ПМ и миозита с включениями наблюдается повышение экспрессии молекул HLA–I на мышечных волокнах, даже в отсутствие аутоинвазивных СD8+ Т–клеток [3].
Наиболее часто болезнь дебютирует недомоганием, общей слабостью, миалгиями, преходящим симметричным поражением суставов, поражением кожи. Началу болезни может предшествовать инсоляция. Затем, в течение нескольких недель (месяцев), постепенно нарастает слабость проксимальных групп мышц. У детей и лиц молодого возраста может наблюдаться более острое начало, часто сочетающееся с выраженными конституциональными проявлениями (лихорадка, похудание и др.). У больных с амиопатическим ДМ в течение длительного времени может наблюдаться типичное для ДМ поражение кожи при отсутствии мышечной слабости [1].
Ведущим клиническим признаком заболевания [5,6] является поражение мышц, выражающееся симметричной слабостью проксимальных групп мышц верхних и нижних конечностей и мышц шеи, ведущей к затруднению при подъеме с низкого стула, посадке в транспорт, при умывании и причесывании; больной не может оторвать голову от подушки. Наблюдаются: изменение походки и эпизоды неожиданных падений. Может развиваться отек мышц. Характерно поражение мышц глотки, гортани и верхней трети пищевода (дисфония, дисфагия). Амиотрофии развиваются только у больных, длительно страдающих ПМ/ДМ.
Поражение дистальной мускулатуры не характерно и наблюдается, главным образом, при миозите с «включениями».
Поражение кожи при ДМ часто предшествует развитию мышечной слабости. Характерным признаком является эритематозная («гелиотропная») сыпь, локализующаяся на верхних веках, скулах, в зоне «декольте» и «шали» (рис. 1), над локтевыми, коленными, пястнофаланговыми и проксимальными межфаланговыми суставами – эритема/папулы Готтрона (рис. 2), эритема волосистой части головы (рис. 3). Также наблюдаются шелушение и трещины на коже ладоней («рука механика»), околоногтевая эритема, фотодерматит, кожный зуд. Могут наблюдаться такие формы сосудистой патологии, как инфаркты околоногтевого ложа, петехии и сетчатое ливедо [6,7].
Артриты/артралгии наблюдаются достаточно редко и быстро купируются при назначении глюкокортикоидов (ГК). Развитие хронического деформирующего артрита с подвывихами суставов кистей наблюдается редко и не сопровождается эрозивными изменениями (синдром Жаку) (рис. 4) [1].
Кальциноз мягких тканей наиболее часто наблюдается при ЮДМ, при перекрестных синдромах миозита (например, с системной склеродермией) или на поздних стадиях ПМ/ДМ. Кальцинаты располагаются подкожно, в соединительной ткани, вокруг мышечных волокон и, наиболее часто, в зонах травматизации или после внутримышечных инъекций, например, на ягодицах [1].
Наиболее часто встречающимся органным поражением является поражение дыхательной системы (80%) [8,9]. При ПМ/ДМ наблюдаются различные варианты поражения дыхательной системы.
У подавляющего большинства пациентов наблюдается вовлечение в патологический процесс как межреберных мышц, так и диафрагмы. Высокое стояние куполов диафрагмы и вялость ее дыхательной экскурсии приводит к экспираторной одышке, изменению функции внешнего дыхания по рестриктивному типу. Кроме того, нарушение глотания, связанное с поражением глоточных мышц, может приводить к аспирации пищи и слюны с последующим развитием аспирационной пневмонии.
Наиболее частой формой легочного поражения является пневмония, которая встречается при ПМ/ДМ в 29–54% случаев. Ведущую роль в ее развитии играет аспирация пищи. Риск развития пневмоний и трудности при их лечении возрастают в связи выраженным иммунодефицитом пациентов с ПМ/ДМ, обусловленным длительным приемом высоких доз ГК и иммуносупрессивной терапии. Кроме того, гиповентиляционный синдром усугубляет риск развития пневмонии [8].
Наиболее тяжелым поражением легочной ткани является фиброзирующий альвеолит, который в зарубежной литературе принято называть интерстициальным заболеванием легких (ИЗЛ). Фиброзирующий альвеолит при ПМ/ДМ имеет широкий спектр клинико–лабораторных проявлений и сходен с идиопатическим фиброзирующим альвеолитом. Targoff I.N. c соавт.1992, выделяют три формы синдрома фиброзирующего альвеолита: 1 – По типу быстро прогрессирующего синдрома фиброзирующего альвеолита (синдром Хаммана–Ричи): острый непродуктивный кашель, одышка в покое, лихорадка. На рентгенограммах – множественные мелкоочаговые затемнения и сетчатая деформация легочного рисунка. Симптомы поражения мускулатуры могут быть на втором плане. Прогноз в данном случае, неблагоприятный. 2 – Более медленное развитие болезни, в дебюте: одышка при физической нагрузке и/или непродуктивный кашель. Клинические проявления могут предшествовать мышечному поражению, возникать одновременно с ним или развиваться на фоне имеющегося тяжелого миозита. У ряда больных 1 и 2 групп может присутствовать тахипноэ, крепитация в нижних отделах легких, реже развитие легочного сердца. 3 – Субклиническое поражение: яркая клиническая легочная симптоматика отсутствует. Интерстициальные изменения в легочной ткани выявляются только при помощи специальных методов исследования (КТ, рентгенография) [8].
Так, клиника фиброзирующего альвеолита может опережать развитие мышечного синдрома или проявляться одновременно с ним. Однако наиболее часто клинические признаки синдрома фиброзирующего альвеолита развиваются на фоне клинической картины ПМ/ДМ, как правило, на ранних этапах болезни.
Поражение сердца в большинстве случаев протекает без явных клинических признаков повреждения. Ведущее место в структуре кардиологической патологии при ИВМ занимает поражение миокарда, наиболее часто проявляющееся нарушением ритма (суправентрикулярная или желудочковая экстрасистолия) и проводимости (наиболее часто – блокада левой ножки пучка Гиса), а также снижением его сократительной способности. Наиболее частым проявлением нарушения сократительной функции сердца является снижение локальной сократимости в области задней стенки левого желудочка и межжелудочковой перегородки. Крайне редко развиваются миокардит или застойная сердечная недостаточность на фоне миокардиофиброза [10].
Поражение ЖКТ: нарушение глотания обусловлено поражением мышц глотки, гипотония пищевода (верхняя треть) [1]. Поражение почек наблюдается крайне редко, как правило, при overlap–синдромах, в основном с ССД. Возможна протеинурия. Описаны единичные случаи развития рабдомиолиза (миоглобинурия – острая почечная недостаточность) [1,4].
Феномен Рейно чаще наблюдается при ДМ, антисинтетазном синдроме и у больных с перекрестным синдромом ПМ/ДМ и со смешанным заболеванием соединительной ткани [1,4,11].
Клинико–иммунологические ассоциации (табл. 1). Согласно современным представлениям, развитие ИВМ связано с синтезом целого «семейства» аутоантител, направленных к цитоплазматическим белкам и рибонуклеиновым кислотам. Эти антитела присутствуют в сыворотках у почти 90% больных, рассматриваются как миозитспецифические антитела и подразделяются на подгруппы [4,8]. Выявление аутоантител каждой подгруппы ассоциировано с определенным симптомокомплексом. Наиболее тяжелым является «антисинтетазный» синдром, который маркируют антитела к аминоацилсинтетазам тРНК (Jo–1и др.) [11].
Лабораторные данные включают повышение уровня сывороточной креатинфосфокиназы (КФК), лактатдегидрогеназы (ЛДГ), аспарагиновой (АСТ), аланиновой (АЛТ) трансаминаз. При мышечном повреждении может наблюдаться снижение уровня сывороточного креатинина [11–13].
АНФ определяется у 50–80%, чаще у больных с перекрестными синдромами миозита с другими СЗСТ и в более высоких титрах [14]. Определение антител к аминоацилсинтетазам транспортной РНК, в первую очередь Jo–1: диагностический критерий ПМ/ДМ и лабораторный маркер «антисинтазного» синдрома [15–18].
Электромиографическое исследование игольчатыми электродами (и–ЭМГ) проводится с целью подтверждения первично–мышечного поражения, определения степени активности воспалительного процесса и некроза мышечных волокон. При ПМ/ДМ наблюдается снижение амплитуды и средней длительности потенциалов двигательных единиц (ПДЕ), полифазия, псевдополифазия и спонтанная активность (СА) мышечных волокон (потенциалы фибрилляций и положительные острые волны). Поведение и–ЭМГ необходимо и в динамике, для оценки эффективности проводимой терапии [19–20].
Согласно классическим диагностическим критериям, в мышечном биоптате выявляются: некроз и атрофия мышечных волокон, выраженная лимфогистиоцитарная инфильтрация, умеренная регенерация мышечных волокон, потеря поперечнополосатой исчерченности [12,24].
Капилляроскопическая картина представлена деструкцией и дезорганизацией капилляров, уменьшением их числа, увеличением размера; неоангиогенезом, а также формированием так называемых «кустовидных» капилляров (рис. 5).
Рентгенологическое исследование легких или рентгеновская компьютерная томография с высоким разрешением способствует выявлению патологических изменений легочной ткани, от базального пневмосклероза до острого фиброзирующего альвеолита [8].
В последние годы многие исследователи опираются на результаты магнитно–резонансной томографии (МРТ) [22]. МРТ позволяет провести раннюю диагностику заболевания благодаря выявлению отека мышечной ткани даже до клинических проявлений поражения мышц, особенно в случае дерматомиозита, когда поражение кожных покровов уже очевидно. Отек мышечной ткани является индикатором активности болезни.
За годы изучения ИВМ неоднократно повторялись попытки разработки оптимальных диагностических критериев ИВМ: Bohan and Peter 1975; Dalakas 1991; Griggs 1995; Tanimoto 1995; Targoff 1997; Mastaglia 2002; Van der Meulen 2003; Dalakas, Hohlfeld 2003 [5–13]. Наиболее широко в настоящее время используются критерии Bohan and Peter 1975 и Tanimoto 1995 (табл. 2) [12,13,23–28].
Вызывают интерес диагностические критерии, предложенные Dalakas в 1991 году, которые основаны на специфических иммуногистопатологических особенностях мышечного инфильтрата и позволяют дифференцировать ДМ и ПМ от других миопатических синдромов (см. дифференциальная диагностика). Так, по мнению Dalakas, мышечный биоптат при достоверном ПМ имеет инвазию CD8+ лимфоцитами ненекротизированных мышечных волокон, экспрессирующих HLA–I класса гистосовместимости. При этом отсутствуют вакуоли, характерные для миозита с «включениями». Достоверный диагноз ДМ по Dalakas характеризуется наличием перифасциальной атрофии и воспалительных инфильтратов в мышцах в сочетании с характерными кожными изменениями [21].
Дифференциальная диагностика [19–20,29] ИВМ представляет сложную проблему и проводится с широким спектром заболеваний, сопровождающихся также мышечной слабостью, увеличением КФК и первично–мышечными электромиографическими изменениями.
Истинную проксимальную мышечную слабость следует отличать от общей слабости, утомляемости или миалгии, вызываемыми различными причинами.
Учитывая актуальность и сложность проблемы дифференциальной диагностики воспалительных миопатий, еще в 1975 году Bohan and Peter были выделены критерии исключения [12], объединяющие различные нозологическое формы, где одним из клинических проявлений может являться мышечная слабость. В первую очередь, это неврологические заболевания, миастения гравис и миодистрофии, а также саркоидоз, инфекционные болезни (трихенеллез, цистеркоз, токсоплазмоз), токсин– и лекарственно–индуцированные миопатии, рабдомиолиз, метаболические миопатии (например, болезнь Мак Ардла) и эндокринопатии (табл. 3).
В 2000 г. создана международная мультидисциплинарная группа исследователей по оценке миозита и клинических исследований (International Myositis Assessment and Clinical Studies Group – IMACS) под руководством профессора P. Plotz. Разработаны стандартизированные методы обследования больных ИВМ (табл. 4) [30–32].
Предложены следующие дефиниции:
Активность рассматривается как частично или полностью обратимые явления, связанные непосредственно с воспалительным процессом в мышцах. Повреждение – критерий исхода болезни, отражающий поствоспалительные необратимые изменения в мышцах и других органах (рубцевание, фиброз, амиотрофии, замещение жировой тканью) и в результате проводимой терапии (стероидная катаракта, сахарный диабет, инфекционные осложнения и др.) [30–34]. Полный клинический ответ на терапию определяется как отсутствие признаков активности болезни на фоне продолжения проводимого лечения, а полная клиническая ремиссия – как отсутствие признаков активности миозита на фоне отсутствия любой терапии в течение 6 месяцев [32].
Основу лечения ИВМ составляют ГК [36]. Раннее начало терапии (в течение первых 3–х месяцев от начала симптомов) ассоциируется с благоприятным прогнозом [37,38]. В зависимости от тяжести заболевания начальная доза колеблется от 1 до 2 мг/кг/сут. Улучшение состояния (нарастание мышечной силы) больных ПМ/ДМ развивается медленнее, чем при других ревматических заболеваниях. При отсутствии положительной динамики в течение 4 недель следует увеличить дозу ГК. После достижения эффекта или значительного улучшения (нарастание мышечной силы и КФК) дозу ГК постепенно снижают до поддерживающей. Снижение дозы ГК должно проводиться под строгим клинико–лабораторным контролем [39].
Пульс–терапия ГК редко эффективна, применяется, главным образом, при ЮДМ, когда она может предотвратить быстрое прогрессирование миопатии и развитие кальциноза. При ПМ/ДМ у взрослых пульс–терапию ГК применяют в случае быстрого прогрессирования дисфагии (риск аспирационной пневмонии) и развития системных проявлений (миокардит, альвеолит).
При наличии факторов риска неблагоприятного прогноза (позднее назначение ГК–терапии, тяжелая мышечная слабость, наличие дисфагии) [37,38], при невозможности назначения адекватной дозы ГК из–за побочных эффектов или при недостаточной эффективности ГК применяются препараты «второго» ряда: метотрексат, азатиоприн [37], циклофосфамид: («препарат выбора» при интерстициальном легочном фиброзе), циклоспорин А.
Имеются данные о положительном эффекте циклоспорина А в отношении прогрессирования интерстициального легочного фиброза [40,41]. Накоплен некоторый опыт лечения такролимусом, который сходен по иммуномодулирующим эффектам с циклоспорином А [39,42,43].
Одним из наиболее обнадеживающих направлений фармакотерапии ИВМ многие годы считается использование внутривенного иммуноглобулина. Еще в 1993 г. М.С. Dalakas [44] доказан его положительный клинико–лабораторный эффект. Однако кратковременность эффекта после прекращения его применения требует проведения повторных инфузий. Потенциальным показанием для внутривенного иммуноглобулина является тяжелая дисфагия [42].
Относительно новым цитостатическим препаратом для лечения аутоиммунных заболеваний является микофенолата мофетил – иммунодепрессант антиметаболического типа, обладающий хорошей переносимостью согласно литературным данным [42,43].
В последние годы для лечения ИВМ все чаще применяются ингибиторы фактора некроза опухоли? (ФНО–a), в частности инфликсимаб [42,45–48]. Появились данные об успешном применении при аутоиммунных заболеваниях препаратов, блокирующих пролиферацию В–клеток, одним из которых является ритуксимаб. Имеются отдельные сообщения об его эффективности при ДМ [42,49,50].
При резистен
причины, симптомы, диагностика и лечение
Миопатии — группа заболеваний, основу которых составляют различные нарушения в метаболизме и строении мышечной ткани, приводящие к снижению силы пораженных мышц и ограничению двигательной активности. Типичными чертами миопатии являются: прогрессирующая мышечная слабость, развитие мышечных атрофий, снижение сухожильных рефлексов и тонуса мышц. Установить диагноз миопатии помогают электрофизиологические исследования, биохимические анализы крови и мочи, результаты молекулярно-генетического и гистохимического анализа образцов, полученных путем биопсии мышц. Лечение предполагает комплексное назначение метаболических препаратов курсами 3 раза в год.
Общие сведения
Миопатии относятся к группе нервно-мышечных заболеваний. Характеризуются дистрофическим поражением мышечной ткани (преимущественно скелетной мускулатуры) с выборочной атрофией отдельных волокон (миофибрилл) при полной функциональной сохранности анимальной нервной системы. Отличаются хроническим неуклонно прогрессирующим течением. Как правило, манифестация клинических проявлений миопатии приходится на детский и юношеский возраст. Большую часть случаев заболевания представляет генетическая патология — это так называемые первичные миопатии. Реже встречаются миопатии приобретенного генеза — вторичные или симптоматические.
Миопатии
Причины миопатий
В основе первичных миопатий лежат генетически детерминированные нарушения в функционировании митохондрий и ионных каналов миофибрилл, в синтезе мышечных белков или ферментов, регулирующих обмен веществ мышечной ткани. Наследование дефектного гена может происходить рецессивно, доминантно и сцеплено с Х-хромосомой. При этом внешние факторы зачастую выступают в роли триггеров, запускающих развитие болезни. Подобными «пусковыми» факторами могут являться разнообразные инфекции (хронический тонзиллит, частые ОРВИ, бактериальная пневмония, сальмонеллез, пиелонефрит и пр.), алиментарная дистрофия, тяжелые травмы (перелом костей таза, политравма, ЧМТ и др.), физическое перенапряжение, интоксикации.
Приобретенные миопатии могут развиваться на фоне эндокринных расстройств (гиперпаратиреоза, болезни Иценко-Кушинга, гиперальдостеронизма), хронических интоксикаций (токсикомании, наркомании, алкоголизма, профессиональных вредностей), мальабсорбции и авитаминозов, тяжелых хронических заболеваний (ХПН, хронической печеночной недостаточности, сердечной недостаточности, ХОБЛ), опухолевых процессов.
Патогенез
Наличие генетически детерминированных или приобретенных дефектов метаболитов, участвующих в обмене веществ и построении мышечных волокон, приводит к возникновению и прогрессированию дегенеративных изменений последних. Развивается атрофия миофибрилл, происходит их замещение жировой и соединительной тканью. Мышцы утрачивают способность к сокращению, что обуславливает мышечную слабость и ограничение возможности выполнять активные движения.
Последние исследования выявили у больных различными формами миопатий нарушения функционирования как центральных (на диэнцефальном уровне), так и периферических отделов вегетативной нервной системы, играющих не последнюю роль в патогенезе заболевания. Именно этим можно объяснить типичное для миопатий преимущественное поражение проксимальных отделов конечностей, имеющих более богатую вегетативную иннервацию.
Классификация
Специалистами в области неврологии разработано несколько классификаций миопатий. Наибольшую популярность среди клиницистов получил этиопатогенетический принцип разделения, согласно которому выделяют наследственные, воспалительные, метаболические, мембранные, паранеопластические и токсические миопатии. Среди наследственных миопатий наиболее распространены 3 вида: ювенильная/юношеская форма Эрба, псевдогипертрофическая форма Дюшена и плече-лопаточно-лицевая форма. Реже встречаются скапулоперонеальная, окулофарингеальная, дистальная и др. формы. Отдельной группой идут врожденные миопатии: болезнь центрального стержня, немалиновая и миотубулярная миопатия, диспропорция типов миофибрилл.
Воспалительные миопатии классифицируются как инфекционные — возникающие вследствие инфекционно-воспалительного поражения мышечной ткани при различных инфекционных процессах: бактериальных (стрептококковая инфекция), вирусных (энтеровирусы, грипп, краснуха, ВИЧ), паразитарных (трихинеллез, токсоплазмоз) и идиопатические — дерматомиозит, миозит с включениями, полимиозит, миопатии при коллагенозах.
Метаболические миопатии подразделяются на связанные с нарушением липидного обмена в мышцах (недостаточность ацетил-КоА-дегидрогеназы, дефицит карнитина), обмена гликогена (болезнь Андерсена, болезнь Помпе, гликогеноз III типа, болезнь Мак-Ардля, дефицит киназы фосфорилазы b, дефицит фосфоглицеромутазы), метаболизма пуринов (дефицит фермента МАДА) и митохондриальные миопатии (дефицит редуктазы, АТФ, цитохрома b, b1).
Симптомы миопатий
Большинство миопатий имеют постепенное начало с появления небольшой мышечной слабости в конечностях, более быстро возникающей усталости от ходьбы и другой физической нагрузки. В течение нескольких лет происходит нарастание слабости, появляются и прогрессируют мышечные атрофии, возникают деформации конечностей. Из-за значительной мышечной слабости пациенты с трудом поднимаются с пола и ходят по лестнице, не могут прыгать и бегать. Для того, чтобы встать со стула, им приходится использовать специальные приемы. Характерен вид больного: крыловидно отстоящие лопатки, опущенные плечи, выпяченный вперед живот и усиленный поясничный лордоз. Наблюдается «утиная» походка — пациент передвигается, раскачиваясь в стороны.
Патологические изменения при миопатиях происходят симметрично в мышцах конечностей и туловища. Как правило, мышечные атрофии наблюдаются в проксимальных отделах рук и ног. В связи с этим мышцы дистальных отделов конечностей могут выглядеть гипертрофированными. Такая миопатическая псевдогипертрофия наиболее заметна в мышцах голеней. Наряду с нарастанием мышечной слабости наблюдается постепенное угасание сухожильных рефлексов и прогрессирующее снижение мышечного тонуса, т. е. развивается и усугубляется периферический вялый паралич. Со временем результатом резкого ограничения активных движений становятся контрактуры суставов.
Миопатии могут сопровождаться поражением мимических мышц, что проявляется невозможностью вытянуть губы трубочкой, свистеть, нахмурить лоб или улыбнуться. Поражение круговой мышцы рта приводит к появлению дизартрии, связанной с затруднением произношения гласных звуков.
Клиника некоторых миопатий включает поражение дыхательной мускулатуры, приводящее к возникновению застойной пневмонии и развитию дыхательной недостаточности. Возможны патологические изменения сердечной мышцы с возникновением кардиомиопатии и сердечной недостаточности, мышц глотки и гортани с развитием дисфагии и миопатического пареза гортани.
Особенности отдельных форм миопатии
Ювенильная миопатия Эрба наследуется аутосомно-рецессивно. Патологические процессы начинают проявляться в возрасте 20-30 лет. В первую очередь они охватывают мышцы тазового пояса и бедер, затем быстро распространяются на другие мышечные группы. Вовлечение лицевой мускулатуры не характерно. Начало миопатии в более молодом возрасте приводит к ранней обездвиженности пациентов. При развитии заболевания в старшем возрасте его течение менее тяжелое: пациенты длительно сохраняют способность передвигаться.
Псевдогипертрофическая миопатия Дюшена наследуется рецессивно сцеплено с полом. Болеют исключительно мальчики. Как правило, манифестирует в течение первых 3-х лет жизни, реже — в период от 5 до 10 лет. Типично начало с атрофических изменений мышц тазового пояса и проксимальных отделов ног, сопровождающихся псевдогипертрофией икроножных мышц. Рано возникают контрактуры и искривление позвоночника (кифоз, сколиоз, гиперлордоз). Может наблюдаться олигофрения. Заболевание протекает с поражением дыхательных мышц и сердца (кардиомиопатия отмечается у 90% больных миопатией Дюшена), что является причиной раннего летального исхода.
Плече-лопаточно-лицевая миопатия Ландузи – Дежерина имеет аутосомно-доминантное наследование. Манифестирует в 10-20 лет с поражения мимических мышц. Постепенно слабость и атрофии охватывают мышцы надплечий, плеч и груди. Мышцы тазового пояса обычно не страдают. Характерно медленное течение с длительной сохранностью работоспособности, без сокращения продолжительности жизни.
Скапулоперонеальная миопатия — аутосомно-доминантное заболевание. Его особенностью является развитие атрофий в мышцах дистальных отделов ног и проксимальных отделов рук, а также наличие легких сенсорных нарушений дистальных отделов как нижних, так и верхних конечностей.
Окулофарингеальная миопатия характеризуется сочетанием поражения глазодвигательных мышц со слабостью мышц языка и глотки. Обычно манифестирует двусторонним птозом, затем присоединяются расстройства глотания. Особенностью этой миопатии является ее позднее начало — на 4-6-ом десятилетии жизни.
Дистальная поздняя миопатия наследуется аутосомно-доминантно. Отличается развитием слабости и атрофий в дистальных отделах конечностей: вначале в стопах и кистях, а затем в голенях и предплечьях. Характерно медленное течение.
Особенности клинических проявлений различных форм врожденных, наследственных и метаболических миопатий описаны в самостоятельных обзорах.
Диагностика
Установить диагноз миопатии неврологу помогают электрофизиологические методы обследования: электронейрография (ЭНГ) и электромиография (ЭМГ). Они позволяют исключить поражение периферического двигательного нейрона и, таким образом, дифференцировать миопатию от инфекционной миелопатии, нарушений спинномозгового кровообращения, миелита и опухолей спинного мозга. Данные ЭМГ говорят о характерных для миопатий изменениях мышечных потенциалов — уменьшении их амплитуды и сокращении длительности. О прогрессирующем процессе свидетельствует наличие большого количества коротких пиков.
Биохимический анализ крови при миопатии показывает повышение содержания альдолазы, КФК, АЛТ, АСТ, ЛДГ и др. ферментов. В биохимическом анализе мочи показательным является увеличение концентрации креатинина. В установлении формы миопатии первостепенное значение имеет биопсия мышц. Морфологическое исследование образцов мышечной ткани выявляет наличие беспорядочно разбросанных атрофированных миофибрилл среди практически сохранных и гипертрофированных мышечных волокон, а также замещение участков мышечной ткани на соединительную или жировую. Постановка окончательного диагноза возможна только после сопоставления результатов гистохимических, иммунобиохимических и молекулярно-генетических исследований.
С целью диагностики поражений сердечной мышцы пациенту с миопатией могут быть назначены консультация кардиолога, ЭКГ, УЗИ сердца; при подозрении на возникновение пневмонии — консультация пульмонолога и рентгенография легких.
Лечение миопатий
В настоящее время патогенетическое лечение миопатий находится в состоянии научных экспериментов в области генной инженерии. В клинической практике применяется симптоматическая терапия, состоящая в основном в улучшении метаболизма мышечной ткани. С этой целью применяют витамины Е, В1, В6, В12, АТФ, неостигмин, аминокислоты (глютаминовую кислоту, гидролизат из мозга свиньи), антихолинэстеразные препараты (амбеноний, галантамин), анаболические стероиды (нандролона деканоат, метандиенон), препараты калия и кальция, тиаминпирофосфат. Комбинации из нескольких препаратов назначают курсом 1-1,5 мес. 3 раза в год.
Медикаментозное лечение миопатий дополняют физиотерапией (электрофорез с неостигмином, ионофорез с кальцием, ультразвук), легким массажем и ЛФК. Проведение ЛФК может осуществляться в бассейне. Комплекс упражнений должен быть подобран таким образом, чтобы избежать перегрузки ослабленной мускулатуры. В некоторых случаях пациенты нуждаются в консультации ортопеда и подборе средств ортопедической коррекции (корсетов, обуви).
Основу лечения приобретенных форм миопатий составляет терапия основного заболевания: коррекция эндокринных нарушений, устранение токсического воздействия и дезинтоксикация организма, ликвидация инфекционного процесса, перевод хронического заболевания в стадию устойчивой ремиссии и т. д.
Прогноз и профилактика
Наиболее неблагоприятны в прогностическом плане наследственные миопатии, проявляющиеся в раннем детском возрасте. В остальном прогноз зависит от формы миопатии, вовлеченности в процесс сердечной и дыхательных мышц. Прогноз вторичных миопатий более благоприятный при условии успешного лечения основного заболевания.
Профилактикой первичных миопатий служит тщательный сбор семейного анамнеза и обязательное консультирование у генетика пар, планирующих беременность. Профилактикой вторичных миопатий является исключение токсических воздействий на организм, своевременное лечение инфекционных и эндокринных заболеваний, коррекция метаболических нарушений.
90000 Diseases and Conditions Inflammatory Myopathies 90001 Other ACR Sites 90002 90003 Simple Tasks 90004 90003 The Foundation 90004 90003 The Lupus Initiative 90004 90009 Get Involved 90002 90003 Donate 90004 90003 Volunteer 90004 90003 Speaking Opportunities 90004 90003 Awards 90004 90003 Mentoring 90004 90003 COIN 90004 90009 Find a Rheumatologist Cart Join Login Toggle navigation Toggle search 90002 90003 Login 90004 90009 90002 90029 I Am A 90002 90031 Rheumatologist 90002 90033 Education 90004 90035 Practice & Quality 90002 90037 Administrative Support 90004 90039 Clinical Support 90004 90009 90004 90043 RISE Registry 90002 90045 RISE for Practices 90004 90047 RISE for Research 90002 90049 Requesting RISE Data 90004 90009 90004 90053 RISE FAQs 90004 90009 90004 90057 Research 90002 90059 Clinical Trials 90004 90061 Clinician Researchers 90002 90063 Six Minute Walk Test (SMWT) 90004 90065 Arthritis Impact Measurement Scales (AIMS) 90004 90067 Evidence Based Practice (EBP) 90004 90069 Fibromyalgia Impact Questionnaire (FIQ) 90004 90071 Multidimensional Assessment of Fatigue (MAF) 90004 90073 Outcomes Instrumentation Introduction (OII) 90004 90075 Timed Up & Go (TUG) 90004 90009 90004 90079 Young Investigators 90002 90081 Resources for Doctoral Students / Post-Doctoral Fellows 90004 90009 90004 90085 Evidence-Based Practice for Academic Researchers 90004 90087 Responsible Data Management in Research 90004 90009 90004 90091 Career Planning 90004 90093 Treatments 90004 90095 Patient and Caregiver Resources 90004 90097 Rheumatology Board Certification 90002 90099 Exploring Certification 90004 90101 Certification FAQs 90004 90103 Rheumatology Certification Timeline 90004 90009 90004 90009 90004 90109 Health Professional 90002 90035 Practice & Quality 90004 90057 Research 90004 90115 Medication Guides 90004 90095 Patient and Caregiver Resources 90004 90119 Health Professional Education 90004 90009 90004 90123 Fellow-in-Training 90002 90125 Fellow-in-Training Resources 90004 90127 Adult In-Training Examination 90004 90129 Awards & Grants 90004 90131 Career Roadmap 90004 90133 Professional Communities 90004 90135 Virtual Rheumatology Program 90002 90137 Learning Collaborative 90004 90139 Adult Practicum 90004 90141 Pediatric Practicum 90004 90009 90004 90009 90004 90147 Student / Resident 90002 90149 Diseases & Conditions 90004 90093 Treatments 90004 90153 Explore Rheumatology 90002 90155 Choose Rheumatology 90002 90157 Rheumatologist Testimonials 90004 90009 90004 90161 Careers 90004 90009 90004 90033 Education 90004 90009 90004 90169 Patient / Caregiver 90002 90171 Health Care Team 90002 90173 What is a Rheumatologist? 90004 90175 Advanced Practice Provider 90004 90177 Certified Medical Assistant 90004 90179 Clinical Nurse Specialist 90004 90181 Health Educator 90004 90183 Licensed Practical Nurse 90004 90185 Licensed Psychologist 90004 90187 Occupational Therapist 90004 90189 Pharmacist 90004 90191 Physical Therapist 90004 90193 Primary Care Physician 90004 90195 Registered Dietician 90004 90197 Registered Nurse 90004 90199 Role of a Patient 90004 90201 Social Worker 90004 90009 90004 90095 Patient and Caregiver Resources 90004 90207 Patient Education Videos 90004 90093 Treatments 90002 90211 Abatacept (Orencia) 90004 90213 Allopurinol (Zyloprim, Aloprim) 90004 90215 Anakinra (Kineret) 90004 90217 Apremilast (Otezla) 90004 90219 Azathioprine (Imuran) 90004 90221 Belimumab (Benlysta) 90004 90223 Bisphosphonate Therapy 90004 90225 Canakinumab (Ilaris) 90004 90227 Clinical Research Trials 90004 90229 Colchicine (Colcrys, Mitigare) 90004 90231 Cyclophosphamide (Cytoxan) 90004 90233 Cyclosporine (Neoral, Sandimmune, Gengraf) 90004 90235 Denosumab (Prolia) 90004 90237 Febuxostat (Uloric) 90004 90239 Hyaluronic Acid 90004 90241 Hydroxychloroquine (Plaquenil) 90004 90243 Intravenous Immunoglobulin (IVIG) 90004 90245 Intravenous (IV) Methylprednisolone (Solu-medrol) 90004 90247 Ixekizumab (Taltz) 90004 90249 Joint Injection / Aspiration 90004 90251 Joint Replacement Surgery 90004 90253 Leflunomide (Arava) 90004 90255 Lesinurad (Zurampic) 90004 90257 Methotrexate (Rheumatrex, Trexall) 90004 90259 Minocycline (Minocin) 90004 90261 Mycophenolate Mofetil & Mycophenolate Sodium 90004 90263 NSAIDs 90004 90265 Pegloticase (Krystexxa) 90004 90267 Prednisone (Deltasone) 90004 90269 Rilonacept (Arcalyst) 90004 90271 Rituximab (Rituxan & MabThera) 90004 90273 Sarilumab (Kevzara) 90004 90275 Secukinumab (Cosentyx) 90004 90277 Sulfasalazine (Azulfidine) 90004 90279 Teriparatide (Forteo) 90004 90281 TNF Inhibitors 90004 90283 Tocilizumab (Actemra) 90004 90285 Tofacitinib Citrate (Xeljanz) 90004 90287 Ustekinumab (Stelara) 90004 90009 90004 90291 Tratamientos 90004 90149 Diseases & Conditions 90002 90295 Amplified Musculoskeletal Pain Syndrome (AMPS) 90004 90297 Antinuclear Antibodies (ANA) 90004 90299 Antiphospholipid Syndrome 90004 90301 Calcium Pyrophosphate Deposition (CPPD) 90004 90303 Carpal Tunnel Syndrome 90004 90305 Chronic Recurrent Multifocal Osteomyelitis (CRMO) 90004 90307 Cryopyrin-Associated Autoinflammatory Syndrome (CAPS) (Pediatric) 90004 90309 Familial Mediterranean Fever 90004 90311 Fibromyalgia 90004 90313 Giant Cell Arteritis 90004 90315 Glucocorticoid-induced Osteoperosis 90004 90317 Gout 90004 90319 Granulomatosis with Polyangitis (Wegner’s) 90004 90321 HCV & Rheumatic Diseases 90004 90323 Henoch Schönlein Purpura (HSP) 90004 90325 HIV & Rheumatic Diseases 90004 90327 Hyperimmunoglobulin D Syndrome (Juvenile) 90004 90329 Hypermobility (Juvenile) 90004 90331 IgG4-Related Disease (IgG4-RD) 90004 90333 Inflammatory Myopathies 90004 90335 Juvenile Arthritis 90004 90337 Juvenile Dermatomyositis 90004 90339 Kawasaki Disease (KD) 90004 90341 Localized Scleroderma (Juvenile) 90004 90343 Lupus 90004 90345 Lyme Disease 90004 90347 Metabolic Myopathies 90004 90349 Osteoarthritis 90004 90351 Osteonecrosis 90004 90353 Osteonecrosis of the Jaw (ONJ) 90004 90355 Osteoporosis 90004 90357 Paget’s Disease of Bone 90004 90359 Periodic Fever, Aphthous Stomatitis, Pharyngitis, Adenitis Syndrome (Juvenile) 90004 90361 Polymyalgia Rheumatica 90004 90363 Psoriatic Arthritis 90004 90365 Raynaud’s Phenomenon 90004 90367 Reactive Arthritis 90004 90369 Rheumatoid Arthritis 90004 90371 Scleroderma 90004 90373 Sjogren’s Syndrome 90004 90375 Spinal Stenosis 90004 90377 Spondyloarthritis 90004 90379 Systemic Lupus Erythematosus (Juvenile) 90004 90381 Takayasu’s Arteritis 90004 90383 Tendinitis & Bursitis 90004 90385 Tumor Necrosis Factor Receptor Associated Periodic Syndrome (Juvenile) 90004 90387 Vasculitis 90004 90009 90004 90391 Enfermedades y Condiciones 90004 90009 90004 90395 Rheumatology Educator 90002 90397 General Education Resources 90004 90399 Fellowship Training Program Resources 90002 90401 Rheumatology Training Programs 90004 90009 90004 90405 Education Awards & Scholarships 90004 90407 Adult Rheumatology In Training Exam 90004 90409 Division Director Resources 90004 90411 Clinician Educator Resources 90004 90009 90004 90009 90004 90417 Membership 90002 90419 Membership Benefits 90004 90421 Membership Types 90002 90423 International 90004 90009 90004 90427 Join 90004 90429 Renew Membership 90004 90431 FAQs 90004 90009 90004 90435 Advocacy 90002 90437 Legislative Action Center 90004 90439 Advocacy News 90004 90441 Federal Advocacy 90002 90443 Key Issues 90004 90445 Policy Positions 90004 90447 Letters to Policy Makers 90004 90009 90004 90451 State Advocacy 90002 90453 State Societies 90004 90447 Letters to Policy Makers 90004 90457 State Advocacy Key Issues 90004 90009 90004 90461 Advocates for Arthritis 90004 90463 Key Contact Program 90004 90465 Advocacy Tools and Resources 90004 90467 RheumPAC 90002 90469 RheumPAC Contributors 90004 90431 FAQs 90004 90009 90004 90009 90004 90035 Practice & Quality 90002 90037 Administrative Support 90002 90481 MACRA 90002 90483 MACRA FAQs 90004 90485 MACRA Glossary 90004 90487 MACRA Resources 90004 90009 90004 90491 Position Statements 90004 90493 Insurance Advocacy 90002 90495 Current Issues 90004 90497 Tools & Resources 90004 90009 90004 90501 Practice Resources 90002 90503 Practice Publications 90004 90505 Audit Programs 90004 90009 90004 90509 Coding 90002 90511 ICD-10 90004 90513 E / M 90004 90515 CPT 90004 90517 E / M FAQs 90004 90519 Infusion FAQs 90004 90521 Incident-to FAQs 90004 90523 Injection FAQs 90004 90009 90004 90527 Encounter Forms 90002 90529 Patient Encounters 90004 90531 ABN Forms 90004 90533 Consultations & Referrals 90004 90009 90004 90537 Medicare 90002 90539 Medicare Fee Schedule 90004 90541 Medicare Participation 90004 90009 90004 90545 Legal and Regulatory Compliance 90004 90009 90004 90039 Clinical Support 90002 90551 Clinical Practice Guidelines 90002 90553 Call for Letters of Interest 90004 90555 Call for Topics 90004 90557 Axial Spondyloarthritis 90004 90559 Glucocorticoid-Induced Osteoporosis 90004 90317 Gout 90004 90563 Juvenile Idiopathic Arthritis 90004 90345 Lyme Disease 90004 90349 Osteoarthritis 90004 90569 Perioperative 90004 90571 PMR 90004 90363 Psoriatic Arthritis 90004 90575 Reproductive Health in Rheumatic Diseases 90004 90369 Rheumatoid Arthritis 90004 90387 Vasculitis 90004 90009 90004 90583 Quality Measurement 90002 90585 ACR En 90004 90009 90004 90009 90004 90009 90004 90009.90000 Inflammatory Myopathies 90001 90002 The inflammatory myopathies are a group of diseases, with no known cause, that involve chronic muscle inflammation accompanied by muscle weakness. The three main types of chronic, or persistent, inflammatory myopathy are polymyositis, dermatomyositis, and inclusion body myositis (IBM). These rare disorders may affect both adults and children, although dermatomyositis is more common in children. Polymyositis and dermatomyositis are more common in women than in men.General symptoms of chronic inflammatory myopathy include slow but progressive muscle weakness that starts in the proximal muscles-those muscles closest to the trunk of the body. Other symptoms include fatigue after walking or standing, tripping or falling, and difficulty swallowing or breathing. Some patients may have slight muscle pain or muscles that are tender to the touch. Polymyositis affects skeletal muscles (involved with making movement) on both sides of the body. Dermatomyositis is characterized by a skin rash that precedes or accompanies progressive muscle weakness.IBM is characterized by progressive muscle weakness and wasting. Juvenile myositis has some similarities to adult dermatomyositis and polymyositis. 90003 90004 Treatment 90005 90002 The chronic inflammatory myopathies can not be cured in most adults but many of the symptoms can be treated. Options include medication, physical therapy, exercise, heat therapy (including microwave and ultrasound), orthotics and assistive devices, and rest.Polymyositis and dermatomyositis are first treated with high doses of prednisone or another corticosteroid drug. This is most often given as an oral medication but can be delivered intravenously. Immunosuppressant drugs, such as azathioprine and methotrexate, may reduce inflammation in people who do not respond well to prednisone. IBM has no standard course of treatment. The disease is generally unresponsive to corticosteroids and immunosuppressive drugs. 90003 90004 Prognosis 90005 90002 Most cases of dermatomyositis respond to therapy.The prognosis for polymyositis varies. Most individuals respond fairly well to therapy, but some people have a more severe disease that does not respond adequately to therapies and are left with significant disability. IBM is generally resistant to all therapies and its rate of progression appears to be unaffected by currently available treatments. 90003 90004 Research 90005 90002 The National Institutes of Health (NIH), through the collaborative efforts of its National Institute of Neurological Disorders and Stroke (NINDS), National Institute of Arthritis and Musculoskeletal and Skin Diseases (NIAMS), and National Institute of Environmental Health Sciences (NIEHS) , conducts and supports a wide range of research on neuromuscular disorders, including the inflammatory myopathies.The NINDS and NIAMS are funding DNA analyses using microarrays to characterize patterns of muscle gene expression among adult and juvenile individuals with distinct subtypes of inflammatory myopathies. Findings will be used to refine disease classification and provide clues to the pathology of these disorders. Other NIH-funded research is studying prior viral infection as a precursor to inflammatory myopathy. Other research hopes to determine whether the drug infliximab, which blocks a protein that is associated with harmful inflammation, is safe and effective in treating dermatomyositis and polymyositis.90003 View research on this topic. View studies being conducted about this condition. View NINDS publications on this topic.90004 Organizations 90005 90002 90019 American Autoimmune Related Diseases Association 90020 90021 National organization that works to alleviate suffering and the socioeconomic impact of autoimmunity. Dedicated to the eradication of autoimmune diseases through fostering and facilitating collaboration in the areas of education, research, and patient services.90003 90002 22100 Gratiot Avenue 90021 Eastpointe, MI 48021-2227 90021 [email protected] 90021 http://www.aarda.org 90021 Tel: Eastpointe 90021 Fax: 586-776-3903 90021 90003 90002 90019 Myositis Association 90020 90021 Works to improve the lives of those affected by inflammatory myopathies. Seeks out persons with inflammatory myopathies, provides a support network, acts as a resource for patients and the medical community, advocates for patients, and promotes research into the causes and treatment of the disorders.90003 90002 1737 King Street 90021 Suite 600 90021 Alexandria, VA 22314 90021 [email protected] 90021 http://www.myositis.org 90021 Tel: Alexandria 90021 Fax: 202-466-8940 90021 90003 90002 90019 Arthritis Foundation 90020 90021 Volunteer-driven organization that works to improve lives through leadership in the prevention, control, and cure of arthritis and related diseases.Offers free brochures on various types of arthritis, treatment options, and management of daily activities when affected. 90003 90002 P.O. Box 7669 90021 Atlanta, GA 30357 90021 [email protected] 90021 http://www.arthritis.org 90021 Tel: Atlanta 90021 Fax: 404-872-0457 90021 90003 90002 90019 Muscular Dystrophy Association 90020 90021 Voluntary health agency that fosters neuromuscular disease research and provides patient care funded almost entirely by individual private contributors.MDA addresses the muscular dystrophies, spinal muscular atrophy, ALS, Charcot-Marie-Tooth disease, myasthenia gravis, Friedreich’s ataxia, metabolic diseases of muscle, and inflammatory diseases of muscle, for a total of more than 40 neuromuscular diseases. 90003 90002 National Office — 222 S. Riverside Plaza 90021 Suite 1500 90021 Chicago, IL 60606 90021 [email protected] 90021 http://www.mda.org 90021 Tel: Chicago 90021 Fax: 520-529-5300 90021 90003 90072 Content Provided By 90073 90002 90075 90003 90002 NINDS Disorders is an index of neurological conditions provided by the National Institute of Neurological Disorders and Stroke.This valuable tool offers detailed descriptions, facts on treatment and prognosis, and patient organization contact information for over 500 identified neurological disorders. 90003 90002 Neurological Disorders and Stroke »90003 .90000 Rheum2Learn Inflammatory Myopathies 90001 Other ACR Sites 90002 90003 Simple Tasks 90004 90003 The Foundation 90004 90003 The Lupus Initiative 90004 90009 Get Involved 90002 90003 Donate 90004 90003 Volunteer 90004 90003 Speaking Opportunities 90004 90003 Awards 90004 90003 Mentoring 90004 90003 COIN 90004 90009 Find a Rheumatologist Cart Join Login Toggle navigation Toggle search 90002 90003 Login 90004 90009 90002 90029 I Am A 90002 90031 Rheumatologist 90002 90033 Education 90004 90035 Practice & Quality 90002 90037 Administrative Support 90004 90039 Clinical Support 90004 90009 90004 90043 RISE Registry 90002 90045 RISE for Practices 90004 90047 RISE for Research 90002 90049 Requesting RISE Data 90004 90009 90004 90053 RISE FAQs 90004 90009 90004 90057 Research 90002 90059 Clinical Trials 90004 90061 Clinician Researchers 90002 90063 Six Minute Walk Test (SMWT) 90004 90065 Arthritis Impact Measurement Scales (AIMS) 90004 90067 Evidence Based Practice (EBP) 90004 90069 Fibromyalgia Impact Questionnaire (FIQ) 90004 90071 Multidimensional Assessment of Fatigue (MAF) 90004 90073 Outcomes Instrumentation Introduction (OII) 90004 90075 Timed Up & Go (TUG) 90004 90009 90004 90079 Young Investigators 90002 90081 Resources for Doctoral Students / Post-Doctoral Fellows 90004 90009 90004 90085 Evidence-Based Practice for Academic Researchers 90004 90087 Responsible Data Management in Research 90004 90009 90004 90091 Career Planning 90004 90093 Treatments 90004 90095 Patient and Caregiver Resources 90004 90097 Rheumatology Board Certification 90002 90099 Exploring Certification 90004 90101 Certification FAQs 90004 90103 Rheumatology Certification Timeline 90004 90009 90004 90009 90004 90109 Health Professional 90002 90035 Practice & Quality 90004 90057 Research 90004 90115 Medication Guides 90004 90095 Patient and Caregiver Resources 90004 90119 Health Professional Education 90004 90009 90004 90123 Fellow-in-Training 90002 90125 Fellow-in-Training Resources 90004 90127 Adult In-Training Examination 90004 90129 Awards & Grants 90004 90131 Career Roadmap 90004 90133 Professional Communities 90004 90135 Virtual Rheumatology Program 90002 90137 Learning Collaborative 90004 90139 Adult Practicum 90004 90141 Pediatric Practicum 90004 90009 90004 90009 90004 90147 Student / Resident 90002 90149 Diseases & Conditions 90004 90093 Treatments 90004 90153 Explore Rheumatology 90002 90155 Choose Rheumatology 90002 90157 Rheumatologist Testimonials 90004 90009 90004 90161 Careers 90004 90009 90004 90033 Education 90004 90009 90004 90169 Patient / Caregiver 90002 90171 Health Care Team 90002 90173 What is a Rheumatologist? 90004 90175 Advanced Practice Provider 90004 90177 Certified Medical Assistant 90004 90179 Clinical Nurse Specialist 90004 90181 Health Educator 90004 90183 Licensed Practical Nurse 90004 90185 Licensed Psychologist 90004 90187 Occupational Therapist 90004 90189 Pharmacist 90004 90191 Physical Therapist 90004 90193 Primary Care Physician 90004 90195 Registered Dietician 90004 90197 Registered Nurse 90004 90199 Role of a Patient 90004 90201 Social Worker 90004 90009 90004 90095 Patient and Caregiver Resources 90004 90207 Patient Education Videos 90004 90093 Treatments 90002 90211 Abatacept (Orencia) 90004 90213 Allopurinol (Zyloprim, Aloprim) 90004 90215 Anakinra (Kineret) 90004 90217 Apremilast (Otezla) 90004 90219 Azathioprine (Imuran) 90004 90221 Belimumab (Benlysta) 90004 90223 Bisphosphonate Therapy 90004 90225 Canakinumab (Ilaris) 90004 90227 Clinical Research Trials 90004 90229 Colchicine (Colcrys, Mitigare) 90004 90231 Cyclophosphamide (Cytoxan) 90004 90233 Cyclosporine (Neoral, Sandimmune, Gengraf) 90004 90235 Denosumab (Prolia) 90004 90237 Febuxostat (Uloric) 90004 90239 Hyaluronic Acid 90004 90241 Hydroxychloroquine (Plaquenil) 90004 90243 Intravenous Immunoglobulin (IVIG) 90004 90245 Intravenous (IV) Methylprednisolone (Solu-medrol) 90004 90247 Ixekizumab (Taltz) 90004 90249 Joint Injection / Aspiration 90004 90251 Joint Replacement Surgery 90004 90253 Leflunomide (Arava) 90004 90255 Lesinurad (Zurampic) 90004 90257 Methotrexate (Rheumatrex, Trexall) 90004 90259 Minocycline (Minocin) 90004 90261 Mycophenolate Mofetil & Mycophenolate Sodium 90004 90263 NSAIDs 90004 90265 Pegloticase (Krystexxa) 90004 90267 Prednisone (Deltasone) 90004 90269 Rilonacept (Arcalyst) 90004 90271 Rituximab (Rituxan & MabThera) 90004 90273 Sarilumab (Kevzara) 90004 90275 Secukinumab (Cosentyx) 90004 90277 Sulfasalazine (Azulfidine) 90004 90279 Teriparatide (Forteo) 90004 90281 TNF Inhibitors 90004 90283 Tocilizumab (Actemra) 90004 90285 Tofacitinib Citrate (Xeljanz) 90004 90287 Ustekinumab (Stelara) 90004 90009 90004 90291 Tratamientos 90004 90149 Diseases & Conditions 90002 90295 Amplified Musculoskeletal Pain Syndrome (AMPS) 90004 90297 Antinuclear Antibodies (ANA) 90004 90299 Antiphospholipid Syndrome 90004 90301 Calcium Pyrophosphate Deposition (CPPD) 90004 90303 Carpal Tunnel Syndrome 90004 90305 Chronic Recurrent Multifocal Osteomyelitis (CRMO) 90004 90307 Cryopyrin-Associated Autoinflammatory Syndrome (CAPS) (Pediatric) 90004 90309 Familial Mediterranean Fever 90004 90311 Fibromyalgia 90004 90313 Giant Cell Arteritis 90004 90315 Glucocorticoid-induced Osteoperosis 90004 90317 Gout 90004 90319 Granulomatosis with Polyangitis (Wegner’s) 90004 90321 HCV & Rheumatic Diseases 90004 90323 Henoch Schönlein Purpura (HSP) 90004 90325 HIV & Rheumatic Diseases 90004 90327 Hyperimmunoglobulin D Syndrome (Juvenile) 90004 90329 Hypermobility (Juvenile) 90004 90331 IgG4-Related Disease (IgG4-RD) 90004 90333 Inflammatory Myopathies 90004 90335 Juvenile Arthritis 90004 90337 Juvenile Dermatomyositis 90004 90339 Kawasaki Disease (KD) 90004 90341 Localized Scleroderma (Juvenile) 90004 90343 Lupus 90004 90345 Lyme Disease 90004 90347 Metabolic Myopathies 90004 90349 Osteoarthritis 90004 90351 Osteonecrosis 90004 90353 Osteonecrosis of the Jaw (ONJ) 90004 90355 Osteoporosis 90004 90357 Paget’s Disease of Bone 90004 90359 Periodic Fever, Aphthous Stomatitis, Pharyngitis, Adenitis Syndrome (Juvenile) 90004 90361 Polymyalgia Rheumatica 90004 90363 Psoriatic Arthritis 90004 90365 Raynaud’s Phenomenon 90004 90367 Reactive Arthritis 90004 90369 Rheumatoid Arthritis 90004 90371 Scleroderma 90004 90373 Sjogren’s Syndrome 90004 90375 Spinal Stenosis 90004 90377 Spondyloarthritis 90004 90379 Systemic Lupus Erythematosus (Juvenile) 90004 90381 Takayasu’s Arteritis 90004 90383 Tendinitis & Bursitis 90004 90385 Tumor Necrosis Factor Receptor Associated Periodic Syndrome (Juvenile) 90004 90387 Vasculitis 90004 90009 90004 90391 Enfermedades y Condiciones 90004 90009 90004 90395 Rheumatology Educator 90002 90397 General Education Resources 90004 90399 Fellowship Training Program Resources 90002 90401 Rheumatology Training Programs 90004 90009 90004 90405 Education Awards & Scholarships 90004 90407 Adult Rheumatology In Training Exam 90004 90409 Division Director Resources 90004 90411 Clinician Educator Resources 90004 90009 90004 90009 90004 90417 Membership 90002 90419 Membership Benefits 90004 90421 Membership Types 90002 90423 International 90004 90009 90004 90427 Join 90004 90429 Renew Membership 90004 90431 FAQs 90004 90009 90004 90435 Advocacy 90002 90437 Legislative Action Center 90004 90439 Advocacy News 90004 90441 Federal Advocacy 90002 90443 Key Issues 90004 90445 Policy Positions 90004 90447 Letters to Policy Makers 90004 90009 90004 90451 State Advocacy 90002 90453 State Societies 90004 90447 Letters to Policy Makers 90004 90457 State Advocacy Key Issues 90004 90009 90004 90461 Advocates for Arthritis 90004 90463 Key Contact Program 90004 90465 Advocacy Tools and Resources 90004 90467 RheumPAC 90002 90469 RheumPAC Contributors 90004 90431 FAQs 90004 90009 90004 90009 90004 90035 Practice & Quality 90002 90037 Administrative Support 90002 90481 MACRA 90002 90483 MACRA FAQs 90004 90485 MACRA Glossary 90004 90487 MACRA Resources 90004 90009 90004 90491 Position Statements 90004 90493 Insurance Advocacy 90002 90495 Current Issues 90004 90497 Tools & Resources 90004 90009 90004 90501 Practice Resources 90002 90503 Practice Publications 90004 90505 Audit Programs 90004 90009 90004 90509 Coding 90002 90511 ICD-10 90004 90513 E / M 90004 90515 CPT 90004 90517 E / M FAQs 90004 90519 Infusion FAQs 90004 90521 Incident-to FAQs 90004 90523 Injection FAQs 90004 90009 90004 90527 Encounter Forms 90002 90529 Patient Encounters 90004 90531 ABN Forms 90004 90533 Consultations & Referrals 90004 90009 90004 90537 Medicare 90002 90539 Medicare Fee Schedule 90004 90541 90004 90009 90004 90009 90004 90009 90004 90009.90000 Inflammatory Myopathy 90001 90002 90003 IIM: PATHOLOGIC CLASSIFICATION 90004 90005 90006 68 90007 90008 90002 Myofasciopathy 90005 90011 Feature: Connective tissue pathology 90011 90002 Perimysial Pathology 90005 (IMPP) 90011 Features 90011 Perimysial damage & Histiocytes 90011 Aldolase high 90011 Dermatomyopathy with IMPP 90011 Amyopathic (MDA5 Ab) 90011 Fasciitis 90011 t-RNA synthetase antibodies: Jo-1 90011 IMPP + Necrosis 90011 HMGCR (200/100) antibody 90011 90002 Endomysial Pathology 90005 90011 Features: C 90028 5b9 90029 deposits; Glycoprotein Δ 90011 Brachio-Cervical Inflammatory (BCIM) 90011 Chondroitin sulfate C deficient 90011 Decorin antibody (BJ) myopathy 90011 90002 Endomysial + Perimysial Pathology 90005 90011 Feature: Connective tissue proliferation 90011 SRP antibody 90011 Focal myositis 90039 90008 90002 Myovasculopathy 90005 90011 Feature: Damage to large or small vessels 90011 Dermatomyositis with Vascular Pathology 90011 (DM-VP; Childhood Dermatomyositis) 90011 Regional Ischemic (RIIM; Paraneoplastic) 90011 DM + NXP-2 antibodies 90011 DM + TIF1γ antibodies 90011 Pipestem capillaries 90039 90008 90002 Histiocytic Myopathy 90005 90011 Histiocytic cells: Foci or Predominant 90011 Granulomatous 90011 Mitochondrial antibody 90011 Sarcoid 90011 Hemophagocytic lymphohistiocytosis 90011 IM + Abundant Macrophages (IMAM) 90011 IRIS 90011 LHIM 90011 Macrophagic myofasciitis 90039 90008 90002 Primary Myopathy 90005 90011 90002 IM-VAMP syndromes 90005 90011 Features: Foci of T-cells but not B-cells 90011 90002 V 90005 acuoles, 90002 A 90005 ggregates or 90002 M 90005 ito 90002 P 90005 ath 90011 No response to immunomodulation 90011 Inclusion body myositis 90011 IM + Mitochondrial Pathology 90011 LHIM 90011 Also see: Muscle fiber necrosis 90039 90008 90002 Multiple Tissue Pathology 90005 90011 Focal myositis 90011 Graft-vs-host disease 90011 90039.- Ревматолог трофимов евгений александрович – Трофимов Евгений Александрович
- 4D узи беременности отзывы – 4D УЗИ во время беременности
