Зачем после операции вводят в искусственную кому: Искусственный сон. Зачем человека погружают в медикаментозную кому? | Здоровье
Искусственный сон. Зачем человека погружают в медикаментозную кому? | Здоровье
Анна Шатохина
6987
shutterstock.com
Про погружение человека в искусственную кому можно услышать в том числе из новостей. Зачем это делают и что получает от этого пациент?
«Если объяснять простым и понятным языком, то искусственная (медикаментозная) кома — состояние при котором анестезиолог-реаниматолог с помощью лекарственных препаратов „выключает“ на время работу жизненно важных органов человека для проведения медицинских манипуляций», — говорит Вадим Груздев, заведующий отделением анестезиологии и реанимации многопрофильного онкоцентра. В первую очередь, как отмечает специалист, речь идет про функцию восприятия внешних раздражителей, за которую отвечает головной мозг.
Для чего погружают?
«Основная задача при введении в искусственную (медикаментозную) кому — это, грубо говоря, отключить мозг, но обеспечить органы и ткани кислородом, чтобы организм не пострадал от гипоксии, которая особенно опасна для головного мозга. Нервные клетки не восстанавливаются, и это чистая правда, поэтому цель процедуры — сохранить головной мозг пациента неповрежденным и дать возможность человеку проснуться полноценной личностью, сохранив все приобретенные знания и умения, после операции, тяжелой пневмонии или другой патологии», — говорит врач.
Нервные клетки не восстанавливаются, и это чистая правда, поэтому цель процедуры — сохранить головной мозг пациента неповрежденным и дать возможность человеку проснуться полноценной личностью, сохранив все приобретенные знания и умения, после операции, тяжелой пневмонии или другой патологии», — говорит врач.
Погружение в медикаментозную кому — это большое искусство, отмечает специалист. «Врач должен правильно выбрать препарат и дозу, а также способ введения препарата. Ошибка на каком-то из этапов может обернуться необратимыми последствиями для пациента. Не менее важно правильно определить момент, когда больного надо ввести в кому и когда вывести из нее», — подчеркивает Вадим Груздев.
Медикаментозная кома — это сложная процедура, поэтому анестезиолог-реаниматолог должен определить, необходимо ли введение пациента в кому.
«При погружении в искусственную кому организм человека не может самостоятельно функционировать. Все процессы жизнедеятельности за него обеспечивают аппараты. Если после того, как человек пришел в сознание, он все еще не может самостоятельно дышать, то его снова возвращают в кому и ждут момента, когда организм окрепнет и начнет работать самостоятельно», — говорит Вадим Груздев.
Если после того, как человек пришел в сознание, он все еще не может самостоятельно дышать, то его снова возвращают в кому и ждут момента, когда организм окрепнет и начнет работать самостоятельно», — говорит Вадим Груздев.
Почему может потребоваться такая процедура?
Вадим Груздев отмечает, что для введения человека в искусственную кому требуется определенная причина. У медиков есть целый перечень ситуаций, когда без этой меры не обойтись.
Итак, основные причины, по которым пациента вводят в медикаментозную кому:
- Самая часто встречающаяся причина в период пандемии коронавируса — массивное воспаление легких (пневмония). Пока современные лекарства (антибиотики, противовирусные препараты) не справятся с воспалением легочной ткани, адекватная доставка кислорода к головному мозгу невозможна. Поэтому пациента в это время подключают к аппарату искусственной вентиляции легких. Но, если человек находится в сознании, для него такая процедура мучительна, потому что она связана с установкой в дыхательные пути трубки и принудительным вдуванием в легкие дыхательной смеси.
 Чтобы больной не страдал, его вводят в искусственную кому. Также в состоянии сна мозг и мышцы человека потребляют гораздо меньше кислорода, чем при бодрствовании, поэтому медикаментозная кома дает возможность обеспечить организм больного «полноценным питанием» даже при значительном повреждении легких. Когда состояние пациента стабилизируется, его возвращают к нормальной жизни.
Чтобы больной не страдал, его вводят в искусственную кому. Также в состоянии сна мозг и мышцы человека потребляют гораздо меньше кислорода, чем при бодрствовании, поэтому медикаментозная кома дает возможность обеспечить организм больного «полноценным питанием» даже при значительном повреждении легких. Когда состояние пациента стабилизируется, его возвращают к нормальной жизни. - Операция, во время которой человек может потерять много крови. Несмотря на то что пациенту тут же переливается донорская кровь, ее возможность доставлять кислород в ткани восстанавливается не сразу. Для того чтобы организм «спал» и не потреблял много кислорода, пациента вводят в медикаментозную кому.
- Инсульт или травма головного мозга. Любой повреждённый орган отекает. Для мозга это особенно критично, потому что ему, грубо говоря, некуда деваться из черепной коробки. В результате происходит сдавливание сосудов, наступает кислородное голодание, клетки отмирают.

По этому списку понятно, что искусственная кома — эффективный инструмент для лечения тяжелых состояний в руках умелого анестезиолога-реаниматолога.
Длительность процедуры определяется индивидуально: в каких-то случаях, например, при операциях, это несколько часов, в каких-то, например, при травмах, пневмониях и т. п., — несколько недель и больше. После подобной процедуры пациенту потребуется реабилитация, которую предложит наблюдающий его специалист.
комаздоровье
Следующий материал
Также вам может быть интересно
- Как улучшить качество сна?
- Болезни Рапунцель и Диогена.
 Каким необычным синдромам подвержены люди?
Каким необычным синдромам подвержены люди? - Чёрный волосатый язык. Что это за синдром?
- Обожженные солнцем. Чем лечить ожоги после загара?
Искусственная кома или состояние медикаментозного сна
Кома – это состояние, при котором снижается активность головного мозга. Встречается она как проявление заболевания или тяжелой травмы. Человек в коме не реагирует на внешние раздражители: он не чувствует боли, у него замедляется дыхание и сердечная деятельность, снижается температура тела, мышцы полностью расслабляются.
В таком состоянии больной требует очень серьезного наблюдения и контроля. Врачам приходится поддерживать у него достаточную вентиляцию легких и кровообращение. Это промежуточное состояние между жизнью и смертью. Человек в коме крайне уязвим. Любая ошибка при поддержании жизненных функций может закончиться фатально.
Для оценки степени комы используют шкалу Глазго.
Диагноз комы вызывает негативные ассоциации. Кома после аварии или в исходе какого-то тяжелого заболевания обычно имеет плохой прогноз. Её применение с лечебной целью воспринимается врачами с тревогой. Человека искусственно погружают в глубокий сон с помощью лекарственных препаратов, поэтому такую кому называют искусственной, медикаментозной или индуцированной.
Где используется
Человека в медикаментозный сон вводят:
- для уменьшения отека мозга;
- после тяжелой травмы;
- чтобы уменьшить повреждения во время длительного судорожного припадка;
- для того, чтобы дать больному время на восстановление на фоне тяжелых травм или заболеваний;
- для восстановления нервных клеток после реанимации, сильного отравления или инсульта.

Чаще индуцированную кому наблюдают после оперативных вмешательств. Для того, чтобы отключить восприимчивость к боли, человека вводят в состояние глубокого медикаментозного сна. Подавление сознания при наркозе является скорее побочным эффектом. В большинстве случаев во время оперативного вмешательства требуется только отключение боли и обездвиживание пациента. Иногда этого можно добиться спинномозговой анестезией при полном сохранении сознания.
Кома после операции продолжается ровно столько, сколько действует наркоз.
Как вводят в медикаментозный сон?
Больного вводят в кому, используя различные лекарственные средства. Он будет лежать без движения, без минимального напряжения мышц, без сознания, он не будет реагировать на раздражители. Без движения на теле пациента могут образовываться пролежни, поэтому каждые два часа его будут поворачивать на кровати.
Дыхание на фоне действия препаратов обычно слишком слабое. Пациенту проводят искусственную вентиляцию легких. Мышцы больного расслаблены, а сознание отсутствует. Это позволяет проводить вспомогательное дыхание без какого-либо сопротивления.
Мышцы больного расслаблены, а сознание отсутствует. Это позволяет проводить вспомогательное дыхание без какого-либо сопротивления.
Существуют несколько групп препаратов, которые используют для введения в индуцированную кому:
- Пропофол. Пропофол – это средство для общей анестезии. Его применяют для наркоза. Клиническими исследованиями было установлено, что этот препарат обладает выраженным защитным действием при повреждении мозга. Особенностью пропофола является то, что он действует очень непродолжительное время. Обычно такие средства вводят в виде внутривенной инфузии. Медицинский персонал следит за эффективностью наркоза и постоянно регулирует глубину комы. Инфузию пропофола замедляют или ускоряют. Короткая продолжительность такого наркоза позволяет уменьшить побочные эффекты и время, которое требуется для выхода из индуцированной комы. Степень угнетения сознания при этом остается хорошо управляемой. Однако, поддерживать точную концентрацию действующего вещества в течение длительного времени очень сложно.

- Бензодиазепины. Бензодиазепины – это транквилизаторы, которые используют для лечения тревоги, в качестве снотворных или противосудорожных препаратов. Продолжительность медикаментозной комы под действием бензодиазепинов обычно не превышает 72 часов.
- Барбитураты. Барбитураты чаще всего используют для индуцированной комы. Также, как и пропофол, эти препараты уменьшают отек. Барбитураты считают классическими средствами для медикаментозной комы. Они остаются актуальны уже несколько десятилетий.
- Опиаты. Опиаты относятся к наркотическим анальгетикам. Индуцированная кома под действием этих препаратов часто развивается как побочный эффект на фоне обезболивающего действия.
Традиционно для индуцированной комы применяют именно барбитураты. Их используют у людей с тяжелыми заболеваниями, при инсульте, после затянувшейся реанимации или при нейрохирургических вмешательствах. Эффективность барбитуратов контролируют с помощью электроэнцефалограммы. Это исследование регистрирует электрическую активность, которая связана с мыслительной деятельностью. При достижении достаточного снижения активности мозга эффект препаратов считают достигнутым. Несмотря на огромный опыт использования барбитуратов, всегда существует вероятность побочного действия. Чаще всего происходит угнетение работы сердца. Подобные осложнения могут быть опасны для жизни. Поэтому индуцированную кому применяют только после оценки предполагаемой пользы и риска.
Это исследование регистрирует электрическую активность, которая связана с мыслительной деятельностью. При достижении достаточного снижения активности мозга эффект препаратов считают достигнутым. Несмотря на огромный опыт использования барбитуратов, всегда существует вероятность побочного действия. Чаще всего происходит угнетение работы сердца. Подобные осложнения могут быть опасны для жизни. Поэтому индуцированную кому применяют только после оценки предполагаемой пользы и риска.
В чем польза
Индуцированную кому применяют с целью длительного общего обезболивания или для защиты головного мозга.
Обезболивание
Искусственная кома в качестве длительного обезболивания не слишком отличается от временного наркоза. Иногда человек получает настолько тяжелую травму, что сохранить его сознание на фоне большой дозы обезболивающих невозможно. Контроль над всеми функциями организма пострадавшего берет на себя медицинский персонал и специальные устройства. Мышечную деятельность и дыхание пациента подавляют, для чего вводят в искусственную кому. Больной не испытывает стресс, и организм эффективнее восстанавливается.
Больной не испытывает стресс, и организм эффективнее восстанавливается.
Защита мозга
Индуцированную кому применяют для уменьшения активности мозга. Чем она ниже, тем меньше потребность в кислороде. Это важно в тех ситуациях, когда нарушено нормальное снабжение кислородом жизненно важных центров. Дефицит кислорода может развиваться по разным причинам.
Дефицит кислорода в крови
Искусственную кому применяют у новорожденных, подвергшихся длительному кислородному голоданию. Иногда в результате родовой деятельности кровоток в пуповине прекращается, а дыхание еще отсутствует. Такое состояние называют асфиксией. Это своеобразный вариант удушения. Головной мозг новорожденного будет страдать от недостатка кислорода. Ребенка погружают в медикаментозный сон, чтобы позволить нервным клеткам восстановить обмен веществ. Речь идет о том варианте, когда не нарушено кровообращение, но кровь содержит мало кислорода.
Нарушение кровообращения в головном мозге
Бывают ситуации, когда кровь содержит кислород, но не может поступить в кровеносные сосуды. Это случается при так называемом ишемическом инсульте. Сосуды головного мозга при инсульте оказываются перекрыты тромбами или другими субстанциями, которые называют эмболами.
Это случается при так называемом ишемическом инсульте. Сосуды головного мозга при инсульте оказываются перекрыты тромбами или другими субстанциями, которые называют эмболами.
Снижение объема кровотока
Кровоснабжение нервных клеток нарушается при снижении общего объема кровотока. Проблема бывает в самом сердце, например, при инфаркте миокарда. Тогда сердце не справляется со своей насосной функцией, и кровообращение будет недостаточным.
Может уменьшаться собственно объем циркулирующей крови. Это случается при массивном кровотечении в результате какой-нибудь травмы или оперативного вмешательства.
Отек мозга
Снабжение мозга кислородом нарушается также при отеке. К отеку могут приводить множество различных состояний: при инфекциях, инсульте, опухолях, кровотечении, травмах, полученных в автокатастрофах, авариях на производстве или при занятиях экстремальными видами спорта.
При любой причине отека мозга происходит примерно одно и то же. Вещество мозга увеличивается в объеме и вклинивается в естественные отверстия черепа.
Когда у человека отекают и выпячиваются из черепа зрительные нервы, это приводит только к нарушению зрения. Но если произойдет отек всего вещества мозга и вклинение его в затылочное отверстие, то человек обычно умирает. Та часть мозга, которая прилегает к затылочному отверстию, содержит жизненно важные центры. Эта область управляет кровообращением, дыханием и прочими жизненными функциями. Вклинение этой части мозга смертельно опасно.
Для профилактики вклинения применяют разные методы уменьшения отека. Иногда прибегают к трепанации черепа, удаляют часть костей и тем самым предоставляют больше места для расширения и снижения давления. Иногда агрессивно используют различные осмотические или мочегонные препараты.
Искусственная кома уменьшает отек не совсем очевидным образом. Применяемые для индуцированной комы средства резко снижают мозговую активность. Мозг является таким же органом, как и все другие. Ему нужна энергия и питательные вещества. Когда человек решает задачи или думает, его нервные клетки потребляют много энергии.
Соответственно увеличивается и приток крови. Кровеносные сосуды переполняются неё, и это может заметно увеличить отек. Если снизить мыслительную деятельность, потребность в кислороде и питательных веществах также уменьшается. Соответственно, снижается потребность в дополнительном притоке крови. Поэтому при появлении угрожающего отека мозга больного вводят в искусственную кому, подавляют сознание и любую другую активность.
Чем меньше крови притекает к головному мозгу, тем меньше выраженность отека. Именно этот механизм и помогает предупредить осложнения.
Продолжительность
Индуцированная кома может продолжаться от нескольких часов, до нескольких недель. Риск осложнений зависит от продолжительности угнетения сознания. Чем дольше медикаментозный сон, тем выше риск осложнений. Возможно развитие сердечной недостаточности, различных инфекций, пролежней или длительное пребывание пациента в вегетативном состоянии. После комы длительное время могут сохраняться симптомы, связанные с поражением сердечно-сосудистой и нервной систем.
Период восстановления зачастую занимает недели, месяцы или продолжается неопределенно долго. Пациент может пролежать в коме ровно столько, сколько будет продолжаться уход. Ограничивать этот период могут только жизнеугрожающие осложнения.
При выходе из комы всегда есть риск остаточных явлений. Чаще всего больные жалуются на яркие кошмарные сновидения и даже галлюцинации. Врачи связывают это с тем, что во время индуцированной комы некоторая часть внешних раздражителей поступает в нервные центры.
Поскольку больной оказывается в состоянии на грани жизни и смерти, врачи предпочитают удерживать его ближе к безопасной области медикаментозного сна. Так человек сохраняет способность получать некоторую часть внешних раздражителей. Подобных внешних стимулов будет очень немного. При недостатке информации мозг причудливым образом обрабатывает и интерпретирует все, что было ему доступно. Так появляются кошмары и видения.
Часто родные и близкие людей, находящихся в медикаментозной коме, участвуют в уходе. Принято считать, что с больными в подобной ситуации можно и нужно разговаривать. Некоторые пациенты утверждают, что многое слышали во время пребывания в больнице в состоянии индуцированной комы. Очевидно, что информация, которую человек в медикаментозном сне услышит от близких людей, будет в меньшей степени пугающей и тревожащей. Подобная поддержка помогает больным спокойнее переживать период выхода из комы.
Принято считать, что с больными в подобной ситуации можно и нужно разговаривать. Некоторые пациенты утверждают, что многое слышали во время пребывания в больнице в состоянии индуцированной комы. Очевидно, что информация, которую человек в медикаментозном сне услышит от близких людей, будет в меньшей степени пугающей и тревожащей. Подобная поддержка помогает больным спокойнее переживать период выхода из комы.
Как выходят такого состояния
Выход из комы занимает определенное время. В большинстве случаев пациент не способен просто открыть глаза и встать с постели. Если больному длительно проводили искусственную вентиляцию легких, и ему приходилось лежать без движения, то все мышцы, включая и дыхательные, окажутся в ослабленном состоянии. На этом этапе больной может пострадать из-за нарушения дыхания, даже находясь в сознании.
Из комы выводят в течении определенного подготовительного периода. Больного отключают от аппарата искусственной вентиляции легких и тренируют его собственное дыхание. Такие периоды самостоятельного дыхания будут постепенно увеличивать и в какой-то момент полностью откажутся от искусственной вентиляции легких. Человеку, в зависимости от продолжительности комы, придется учиться самостоятельно питаться, восстанавливать способность к движению и навыки самообслуживания. Период реабилитации занимает много времени.
Такие периоды самостоятельного дыхания будут постепенно увеличивать и в какой-то момент полностью откажутся от искусственной вентиляции легких. Человеку, в зависимости от продолжительности комы, придется учиться самостоятельно питаться, восстанавливать способность к движению и навыки самообслуживания. Период реабилитации занимает много времени.
Перспективы в применении медикаментозной комы
Для успешного введения больного в состояние искусственной комы требуются лекарственные препараты и средства контроля за состоянием организма. Очевидно, что со временем фармацевтическая наука разработает и предоставит новые средства для медикаментозного сна, обладающие меньшими побочными эффектами. Также развиваются средства для мониторинга состояния больного.
Индуцированная кома спасает жизнь. Поэтому в тех случаях, когда предполагаемая польза для здоровья перевешивает риск, пациента подвергнут этой процедуре.
Общая анестезия, сон и кома
1. Оповещение о событии Sentinel: предотвращение и устранение последствий осведомленности об анестезии. Окбрук-Террас, Иллинойс: Совместная комиссия; 2004. (http://www.jointcommission.org/sentinel_event_alert_issue_32_preventing_and_managing_the_impact_of_anesthesia_awareness.) [Google Scholar]
Оповещение о событии Sentinel: предотвращение и устранение последствий осведомленности об анестезии. Окбрук-Террас, Иллинойс: Совместная комиссия; 2004. (http://www.jointcommission.org/sentinel_event_alert_issue_32_preventing_and_managing_the_impact_of_anesthesia_awareness.) [Google Scholar]
2. Evers A, Crowder M. Клеточные и молекулярные механизмы анестезии. В: Бараш П.Г., Каллен Б.Ф., Столтинг Р.К., Кахалан М., Сток М.С., редакторы. Клиническая анестезия. 6. Нью-Йорк: Липпинкотт Уильямс и Уилкинс; 2006. С. 9.5–114. [Google Scholar]
3. Гиббс Ф.А., Гиббс Л.Е., Леннокс В.Г. Влияние на электроэнцефалограмму некоторых лекарств, влияющих на нервную деятельность. Arch Intern Med. 1937; 60: 154–66. [Google Scholar]
4. Кирси Д.К., Бикфорд Р.Г., Фолконер А., мл. Электроэнцефалографические картины, создаваемые тиопенталом натрия во время хирургических операций; описание и классификация. Бр Джей Анаст. 1951; 23: 141–52. [PubMed] [Google Scholar]
5. Уотсон С., Багдоян Х. , Лидик Р. Нейрохимический взгляд на состояния сознания. В: Hudetz AG, Pearce RA, редакторы. Подавление разума: анестезирующая модуляция памяти и сознания. Нью-Йорк: Springer/Humana Press; 2010. С. 33–80. [Академия Google]
, Лидик Р. Нейрохимический взгляд на состояния сознания. В: Hudetz AG, Pearce RA, редакторы. Подавление разума: анестезирующая модуляция памяти и сознания. Нью-Йорк: Springer/Humana Press; 2010. С. 33–80. [Академия Google]
6. Кеннеди Д., Норман К. Чего мы не знаем? Наука. 2005;309:75. [PubMed] [Google Scholar]
7. Крайгер М., Рот Т., Демент В. Принципы и практика медицины сна. 5. Нью-Йорк: Эльзевир Сондерс; 2010. [Google Scholar]
8. Маккарли Р.В. Нейробиология быстрого и медленного сна. Сон Мед. 2007; 8: 302–30. [PubMed] [Google Scholar]
9. Познер Дж., Сапер С., Шифф Н., Плам Ф. Плам и диагноз Познера ступора и комы. Нью-Йорк: Издательство Оксфордского университета; 2007. [Google Академия]
10. Молодой ГБ. ЭЭГ в коме. Дж. Клин Нейрофизиол. 2000; 17: 473–85. [PubMed] [Google Scholar]
11. Gawande A, Denno DW, Truog RD, Waisel DM. Врачи и казнь — основные моменты обсуждения смертельной инъекции. N Engl J Med. 2008; 358: 448–51. [PubMed] [Google Scholar]
12. Davis MH, Coleman MR, Absalom AR, et al. Диссоциация восприятия и понимания речи на сниженном уровне сознания. Proc Natl Acad Sci U S A. 2007; 104:16032–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Davis MH, Coleman MR, Absalom AR, et al. Диссоциация восприятия и понимания речи на сниженном уровне сознания. Proc Natl Acad Sci U S A. 2007; 104:16032–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Bevan JC, Veall GR, Macnab AJ, Ries CR, Marsland C. Премедикация мидазоламом задерживает выздоровление после пропофола без изменения непроизвольных движений. Анест Анальг. 1997; 85: 50–4. [PubMed] [Google Scholar]
14. McCarthy MM, Brown EN, Kopell N. Возможные сетевые механизмы, опосредующие изменения электроэнцефалографического бета-ритма во время парадоксального возбуждения, вызванного пропофолом. Дж. Нейроски. 2008; 28:13488–504. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. Clark DL, Rosner BS. Нейрофизиологические эффекты общих анестетиков. I. Электроэнцефалограмма и сенсорные вызванные реакции у человека. Анестезиология. 1973;38:564–82. [PubMed] [Google Scholar]
16. Rampil IJ. Праймер для обработки сигналов ЭЭГ в анестезии. Анестезиология. 1998; 89: 980–1002. [PubMed] [Google Scholar]
1998; 89: 980–1002. [PubMed] [Google Scholar]
17. Coté CJ, Goudsouzian NG, Liu LM, Dedrick DF, Rosow CE. Дозозависимая реакция внутривенного тиопентала для индукции общей анестезии у детей без премедикации. Анестезиология. 1981; 55: 703–5. [PubMed] [Google Scholar]
18. Gray AT, Krejci ST, Larson MD. Препараты, блокирующие нервно-мышечную передачу, не изменяют зрачковый световой рефлекс у людей, находящихся под наркозом. Арх Нейрол. 1997;54:579–84. [PubMed] [Google Scholar]
19. Прис-Робертс К. Анестезия: практичная или непрактичная конструкция? Бр Джей Анаст. 1987; 59: 1341–5. [PubMed] [Google Scholar]
20. Паланка Б.Дж., Машур Г.А., Авидан М.С. Обработанная электроэнцефалограмма при мониторинге глубины анестезии. Курр Опин Анаэстезиол. 2009; 22: 553–9. [PubMed] [Google Scholar]
21. Подкомитет стандартов качества Американской академии неврологии. Параметры практики: определение смерти мозга у взрослых. Неврология. 1995;45:1012–4. [PubMed] [Google Scholar]
22. Фещенко В.А., Веселис Р.А., Рейнсель Р.А. Альфа-ритм, индуцированный пропофолом. Нейропсихобиология. 2004; 50: 257–66. [PubMed] [Google Scholar]
Фещенко В.А., Веселис Р.А., Рейнсель Р.А. Альфа-ритм, индуцированный пропофолом. Нейропсихобиология. 2004; 50: 257–66. [PubMed] [Google Scholar]
23. Тинкер Дж. Х., Шарбро Ф. В., Михенфельдер Дж. Д. Передний сдвиг доминирующего ритма ЭЭГ во время анестезии у яванских обезьян: корреляция с эффективностью анестетика. Анестезиология. 1977; 46: 252–9. [PubMed] [Google Scholar]
24. Дойл П.В., Матта Б.Ф. Подавление всплесков или изоэлектрическая энцефалограмма для защиты головного мозга: данные исследований подавления метаболизма. Бр Джей Анаст. 1999;83:580–4. [PubMed] [Google Scholar]
25. Берджи Г.К. Рефрактерный эпилептический статус: является ли подавление вспышек ЭЭГ подходящей целью лечения при медикаментозной коме? Что такое Святой Грааль? Эпилепсия Curr. 2006; 6: 119–20. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. Claassen J, Hirsch LJ, Emerson RG, Mayer SA. Лечение рефрактерного эпилептического статуса пентобарбиталом, пропофолом или мидазоламом: систематический обзор. Эпилепсия. 2002;43:146–53. [PubMed] [Академия Google]
Эпилепсия. 2002;43:146–53. [PubMed] [Академия Google]
27. Giacino JT, Ashwal S, Childs N, et al. Состояние минимального сознания: определение и критерии диагностики. Неврология. 2002; 58: 349–53. [PubMed] [Google Scholar]
28. Олдрете Дж. А. Пересмотрена оценка восстановления после анестезии. Джей Клин Анест. 1995; 7: 89–91. [PubMed] [Google Scholar]
29. Alkire MT, Hudetz AG, Tononi G. Сознание и анестезия. Наука. 2008; 322: 876–80. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Ангел А. Лекция Г. Л. Брауна. Приключения в наркозе. Опыт физиол. 1991;76:1–38. [PubMed] [Google Scholar]
31. Alkire MT, Haier RJ, Barker SJ, Shah NK, Wu JC, Kao YJ. Мозговой метаболизм при анестезии пропофолом у человека изучали с помощью позитронно-эмиссионной томографии. Анестезиология. 1995; 82: 393–403. [PubMed] [Google Scholar]
32. Fiset P, Paus T, Daloze T, et al. Мозговые механизмы индуцированной пропофолом потери сознания у людей: исследование позитронно-эмиссионной томографии. Дж. Нейроски. 1999;19:5506–13. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Дж. Нейроски. 1999;19:5506–13. [Бесплатная статья PMC] [PubMed] [Google Scholar]
33. Purdon PL, Pierce ET, Bonmassar G, et al. Одновременная электроэнцефалография и функциональная магнитно-резонансная томография общей анестезии. Энн Н.Ю. Академия наук. 2009;1157:61–70. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Velly LJ, Rey MF, Bruder NJ, et al. Дифференциальная динамика действия на корковые и подкорковые структуры анестетиков при вводном наркозе. Анестезиология. 2007; 107: 202–12. [Erratum, Anesthesiology 2008; 108:175.] [PubMed] [Google Scholar]
35. Ferrarelli F, Massimini M, Sarasso S, et al. Нарушение кортикальной эффективной связи во время потери сознания, вызванной мидазоламом. Proc Natl Acad Sci U S A. 2010;107:2681–6. [Бесплатная статья PMC] [PubMed] [Google Scholar]
36. Рудольф У., Антковяк Б. Молекулярные и нейрональные субстраты для общей анестезии. Нат Рев Нейроски. 2004; 5: 709–20. [PubMed] [Google Scholar]
37. Hemmings HC, Jr, Akabas MH, Gold-stein PA, Trudell JR, Orser BA, Harrison NL. Новые молекулярные механизмы действия общего анестетика. Trends Pharmacol Sci. 2005; 26: 503–10. [PubMed] [Академия Google]
Новые молекулярные механизмы действия общего анестетика. Trends Pharmacol Sci. 2005; 26: 503–10. [PubMed] [Академия Google]
38. Бай Д., Пеннефатер П.С., Макдональд Дж.Ф., Орсер Б.А. Общий анестетик пропофол замедляет дезактивацию и десенсибилизацию рецепторов ГАМК(А). Дж. Нейроски. 1999;19:10635–46. [PMC бесплатная статья] [PubMed] [Google Scholar]
39. Шеперд Г. Синаптическая организация мозга. 4. Нью-Йорк: издательство Оксфордского университета; 1998. [Google Scholar]
40. Propofol. Бедфорд, Огайо: Лаборатории Бедфорда; 2008 г. (вкладыш). (http://dailymed.nlm.nih.gov/dailymed/drugInfo.cfm?id=6337) [Google Scholar]
41. Девор М., Залкинд В. Обратимая анальгезия, атония и потеря сознания при двусторонней внутримозговой микроинъекции пентобарбитала. Боль. 2001; 94: 101–12. [PubMed] [Google Scholar]
42. Парвизи Дж., Дамасио А.Р. Нейроанатомические корреляты комы ствола мозга. Мозг. 2003; 126:1524–36. [PubMed] [Google Scholar]
43. Feldman JL, Del Negro CA. В поисках вдохновения: новые взгляды на дыхательный ритм. Нат Рев Нейроски. 2006; 7: 232–42. [Бесплатная статья PMC] [PubMed] [Google Scholar]
В поисках вдохновения: новые взгляды на дыхательный ритм. Нат Рев Нейроски. 2006; 7: 232–42. [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Kungys G, Kim J, Jinks SL, Atherley RJ, Antognini JF. Пропофол вызывает неподвижность за счет действия на вентральные рога спинного мозга по ГАМКергическому механизму. Анест Анальг. 2009; 108:1531–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
45. Мостовой (медиальный) и медуллярный (латеральный) ретикулоспинальные пути. Лаборатория 12: системы трактов I. Школа ветеринарной медицины Пенсильванского университета; 2006. (http://cal.vet.upenn.edu/projects/neurology/lab12/lab12_rspt.htm.) [Google Scholar]
46. Dutton RP, Eckhardt WF, III, Sunder N. Тотальная спинномозговая анестезия после межлестничной блокады плечевого сплетения. Анестезиология. 1994; 80: 939–41. [PubMed] [Google Scholar]
47. Durrani Z, Winnie AP. Токсичность ствола головного мозга с обратимым синдромом запертости после внутрилестничной блокады плечевого сплетения. Анест Анальг. 1991; 72: 249–52. [PubMed] [Google Scholar]
Анест Анальг. 1991; 72: 249–52. [PubMed] [Google Scholar]
48. Penn RD, Savoy SM, Corcos D, et al. Баклофен интратекально при выраженной спастичности позвоночника. N Engl J Med. 1989 г.;320:1517–21. [PubMed] [Google Scholar]
49. Mourisse J, Gerrits W, Lerou J, van Egmond J, Zwarts MJ, Booij L. Электромиографическая оценка мигательных и роговичных рефлексов во время введения мидазолама: полезные методы для оценки глубины анестезии ? Acta Anaesthesiol Scand. 2003; 47: 593–600. [PubMed] [Google Scholar]
50. Nelson LE, Guo TZ, Lu J, Saper CB, Franks NP, Maze M. Седативный компонент анестезии опосредован рецепторами ГАМК (A) в эндогенном пути сна. Нат Нейроски. 2002; 5:979–84. [PubMed] [Google Scholar]
51. Saper CB, Scammell TE, Lu J. Гипоталамическая регуляция сна и циркадных ритмов. Природа. 2005; 437:1257–63. [PubMed] [Google Scholar]
52. Morairty S, Rainnie D, McCarley R, Greene R. Растормаживание аденозином активных во сне нейронов вентролатеральной преоптической области: новый механизм стимуляции сна. Неврология. 2004; 123:451–7. [PubMed] [Google Scholar]
Неврология. 2004; 123:451–7. [PubMed] [Google Scholar]
53. Correa-Sales C, Rabin BC, Maze M. Гипнотический ответ на дексмедетомидин, агонист альфа-2, опосредован в голубом пятне у крыс. Анестезиология. 1992;76:948–52. [PubMed] [Google Scholar]
54. Jorm CM, Stamford JA. Действие снотворного анестетика дексмедетомидина на высвобождение норадреналина и возбуждение клеток в срезах голубого пятна крысы. Бр Джей Анаст. 1993; 71: 447–9. [PubMed] [Google Scholar]
55. Huupponen E, Maksimow A, Lapinlampi P, et al. Активность веретена электроэнцефалограммы во время седации дексмедетомидином и физиологического сна. Acta Anaesthesiol Scand. 2008; 52: 289–94. [PubMed] [Google Scholar]
56. Lydic R, Baghdoyan HA. Сон, анестезиология и нейробиология контроля состояния возбуждения. Анестезиология. 2005; 103:1268–95. [PubMed] [Google Scholar]
57. Осман Н.И., Багдоян Х.А., Лидик Р. Морфин ингибирует высвобождение ацетилхолина в префронтальной коре крыс при системной доставке или микродиализе в базальные отделы переднего мозга. Анестезиология. 2005; 103: 779–87. [PubMed] [Google Scholar]
Анестезиология. 2005; 103: 779–87. [PubMed] [Google Scholar]
58. Генрихер М.М., Морган М.М. Супраспинальные механизмы опиоидной анальгезии. В: Stein C, редактор. Опиоиды в борьбе с болью: основные и клинические аспекты. Кембридж, Соединенное Королевство: Издательство Кембриджского университета; 1999. С. 46–69.. [Google Scholar]
59. Cesselin FBJ, Bourgoin S, et al. Спинальные механизмы обезболивания. В: Stein C, редактор. Опиоиды в борьбе с болью: основные и клинические аспекты. Кембридж, Соединенное Королевство: Издательство Кембриджского университета; 1999. С. 70–95. [Google Scholar]
60. Stein C, Machelska H, Binder W, Schafer M. Периферическая опиоидная анальгезия. Курр Опин Фармакол. 2001; 1: 62–5. [PubMed] [Google Scholar]
61. Hug CC., Jr Существует ли опиоидная «анестезия»? Анестезиология. 1990;73:1–4. [PubMed] [Академия Google]
62. Хильгенберг Дж.К. Интраоперационная осведомленность во время высокодозной фентанил-кислородной анестезии. Анестезиология. 1981; 54: 341–3. [PubMed] [Google Scholar]
Анестезиология. 1981; 54: 341–3. [PubMed] [Google Scholar]
63. Meuret P, Backman SB, Bonhomme V, Plourde G, Fiset P. Физостигмин обращает индуцированное пропофолом бессознательное состояние и ослабление слуховой устойчивой реакции и биспектрального индекса у людей-добровольцев. Анестезиология. 2000;93:708–17. [PubMed] [Google Scholar]
64. Lepousé C, Lautner CA, Liu L, Gomis P, Leon A. Возникновение делирия у взрослых в отделении послеанестезии. Бр Джей Анаст. 2006;96: 747–53. [PubMed] [Google Scholar]
65. Funk W, Hollnberger H, Geroldinger J. Физостигмин и делирий при появлении анестезии у детей дошкольного возраста: рандомизированное слепое исследование. Евр Дж Анаэстезиол. 2008; 25:37–42. [PubMed] [Google Scholar]
66. Чейз М.Х. Подтверждение консенсуса о том, что глицинергическое постсинаптическое торможение ответственно за атонию быстрого сна. Спать. 2008; 31:1487–91. [Бесплатная статья PMC] [PubMed] [Google Scholar]
67. Lavigne GJ, Sessle BJ, Choiniere M, Soja PJ, редакторы. Сон и боль. Сиэтл: IASP Press; 2007. [Google Академия]
Сон и боль. Сиэтл: IASP Press; 2007. [Google Академия]
68. Стериаде М., Тимофеев И. Нейрональная пластичность в таламокортикальных сетях во время сна и бодрствования. Нейрон. 2003; 37: 563–76. [PubMed] [Google Scholar]
69. Schiff ND. Центральный таламический вклад в регуляцию возбуждения и неврологические расстройства сознания. Энн Н.Ю. Академия наук. 2008;1129:105–18. [PubMed] [Google Scholar]
70. Шифф Н.Д., Плам Ф. Роль систем возбуждения и «ворот» в неврологии нарушения сознания. Дж. Клин Нейрофизиол. 2000; 17: 438–52. [PubMed] [Академия Google]
71. Schiff ND, Giacino JT, Kalmar K, et al. Поведенческие улучшения при стимуляции таламуса после тяжелой черепно-мозговой травмы. Природа. 2007; 448: 600–3. [PubMed] [Google Scholar]
72. Alkire MT, McReynolds JR, Hahn EL, Trivedi AN. Таламическая микроинъекция никотина восстанавливает индуцированную севофлураном потерю установочного рефлекса у крыс. Анестезиология. 2007; 107: 264–72. [PubMed] [Google Scholar]
73. Schiff ND, Posner JB. Еще одно «Пробуждение» Энн Нейрол. 2007; 62: 5–7. [PubMed] [Академия Google]
Schiff ND, Posner JB. Еще одно «Пробуждение» Энн Нейрол. 2007; 62: 5–7. [PubMed] [Академия Google]
74. Брефель-Курбон С., Пайоукс П., Ори Ф. и соавт. Клинические и визуализационные данные об эффекте золпидема при гипоксической энцефалопатии. Энн Нейрол. 2007;62:102–5. [PubMed] [Google Scholar]
75. Chen L, Savio Chan C, Yung WH. Электрофизиологические и поведенческие эффекты золпидема у крыс globus pallidus. Опыт Нейрол. 2004; 186: 212–20. [PubMed] [Google Scholar]
76. Фултон С.А., Маллен К.Д. Завершение верхних эндоскопических процедур, несмотря на парадоксальную реакцию на мидазолам: роль флумазенила? Am J Гастроэнтерол. 2000;95:809–11. [PubMed] [Google Scholar]
77. Тунг А., Тадимети Л., Каруана-Монтальдо Б. и соавт. Связь седации с преднамеренной самоэкстубацией. Джей Клин Анест. 2001; 13:24–9. [PubMed] [Google Scholar]
78. Mhuirchheartaigh RN, Rosenorn-Langg D, Wise R, Jbabdi S, Rogers R, Tracey I. Изменения корковой и подкорковой связи при снижении уровня сознания у людей: исследование функциональной магнитно-резонансной томографии. с помощью пропофола. Дж. Нейроски. 2010;30:9095–102. [Бесплатная статья PMC] [PubMed] [Google Scholar]
с помощью пропофола. Дж. Нейроски. 2010;30:9095–102. [Бесплатная статья PMC] [PubMed] [Google Scholar]
79. Steriade M, Nuñez A, Amzica F. Новые медленные (< 1 Гц) колебания неокортикальных нейронов in vivo: деполяризующие и гиперполяризующие компоненты. Дж. Нейроски. 1993; 13:3252–65. [PMC free article] [PubMed] [Google Scholar]
80. Steriade M, Contreras D, Curro Dossi R, Nuñez A. Медленные (< 1 Гц) колебания в ретикулярных таламических и таламокортикальных нейронах: сценарий генерации ритма сна у взаимодействующие таламические и неокортикальные сети. Дж. Нейроски. 1993; 13:3284–99. [Бесплатная статья PMC] [PubMed] [Google Scholar]
81. Чинг С., Сименсер А., Пурдон П., Браун Э.Н., Копелл Н.К. Таламокортикальная модель пропофол-индуцированного альфа-ритма, связанного с потерей сознания. Proc Natl Acad Sci U S A. 2010 (в печати) [бесплатная статья PMC] [PubMed] [Google Scholar]
82. Steriade M, Amzica F, Contreras D. Кортикальные и таламические клеточные корреляты подавления электроэнцефалографических всплесков. Электроэнцефалогр Клин Нейрофизиол. 1994; 90:1–16. [PubMed] [Google Scholar]
Электроэнцефалогр Клин Нейрофизиол. 1994; 90:1–16. [PubMed] [Google Scholar]
83. Кениг М.А., Каплан П.В., Такор Н.В. Клинический нейрофизиологический мониторинг и повреждение головного мозга при остановке сердца. Нейрол клин. 2006;24:89–106. [PubMed] [Google Scholar]
84. Stecker MM, Cheung AT, Pochettino A, et al. Глубокая гипотермическая остановка кровообращения: I. Влияние охлаждения на электроэнцефалограмму и вызванные потенциалы. Энн Торак Серг. 2001; 71:14–21. [PubMed] [Google Scholar]
85. Яматоги Ю., Охтахара С. Ранняя детская эпилептическая энцефалопатия с вспышками подавления, синдром Отахара: обзор, относящийся к нашим 16 случаям. Мозг Дев. 2002; 24:13–23. [PubMed] [Google Scholar]
86. Maksimow A, Särkelä M, Långsjö JW, et al. Увеличение высокочастотной активности ЭЭГ объясняет плохую работу монитора спектральной энтропии ЭЭГ во время анестезии S-кетамином. Клин Нейрофизиол. 2006; 117:1660–8. [PubMed] [Академия Google]
87. Tsuda N, Hayashi K, Hagihira S, Sawa T.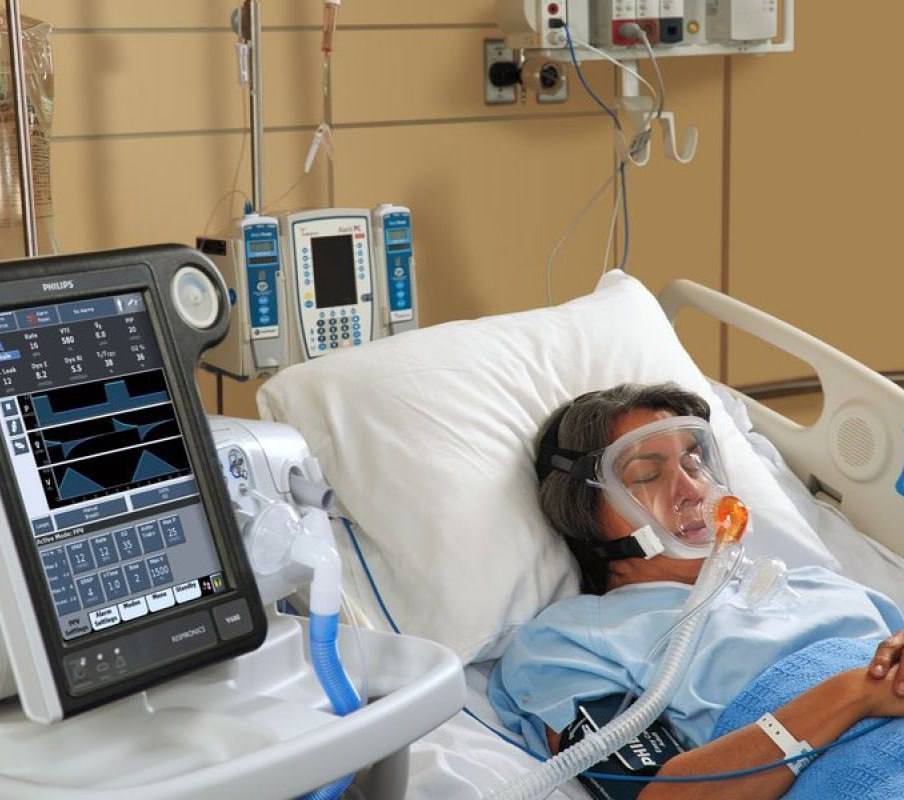 Кетамин, антагонист NMDA, увеличивает частоту колебаний альфа-пиков на электроэнцефалографическом спектре мощности. Acta Anaesthesiol Scand. 2007; 51: 472–81. [PubMed] [Google Scholar]
Кетамин, антагонист NMDA, увеличивает частоту колебаний альфа-пиков на электроэнцефалографическом спектре мощности. Acta Anaesthesiol Scand. 2007; 51: 472–81. [PubMed] [Google Scholar]
88. Blumenfeld H, Taylor J. Почему припадки вызывают потерю сознания? Нейробиолог. 2003; 9: 301–10. [PubMed] [Google Scholar]
89. Симанс Дж. Потеря ингибирования с помощью кетамина. Nat Chem Biol. 2008;4:91–3. [PubMed] [Академия Google]
90. Олни Дж.В., Новичок Дж.В., Фарбер Н.Б. Модель гипофункции рецептора NMDA при шизофрении. J Psychiatr Res. 1999; 33: 523–33. [PubMed] [Google Scholar]
91. Reboso Morales JA, Ketamine González Miranda F. Rev Esp Anestesiol Reanim. 1999;46:111–22. (На испанском языке) [PubMed] [Google Scholar]
92. Oye I, Paulsen O, Maurset A. Влияние кетамина на сенсорное восприятие: доказательства роли рецепторов N-метил-D-аспартата. J Pharmacol Exp Ther. 1992; 260:1209–13. [PubMed] [Академия Google]
93. Грешник Б., Граф Б.М. Кетамин. Handb Exp Pharmacol. 2008; 182:313–33. [PubMed] [Google Scholar]
Handb Exp Pharmacol. 2008; 182:313–33. [PubMed] [Google Scholar]
94. Lydic R, Baghdoyan HA. Кетамин и МК-801 снижают высвобождение ацетилхолина в ретикулярной формации моста, замедляют дыхание и нарушают сон. Спать. 2002; 25: 617–22. [PubMed] [Google Scholar]
95. Джачино Дж. Т., Калмар К., Уайт Дж. Шкала восстановления после комы Джона Кеннеди – пересмотренная: характеристики измерения и диагностическая полезность. Arch Phys Med Rehabil. 2004;85:2020–9. [PubMed] [Академия Google]
96. Monk TG, Weldon BC, Garvan CW, et al. Предикторы когнитивной дисфункции после обширных экстракардиальных операций. Анестезиология. 2008; 108:18–30. [PubMed] [Google Scholar]
97. Kelz MB, Sun Y, Chen J, et al. Существенная роль орексинов в выходе из общей анестезии. Proc Natl Acad Sci U S A. 2008;105:1309–14. [Бесплатная статья PMC] [PubMed] [Google Scholar]
98. Franks NP. Общая анестезия: от молекулярных мишеней к нейронным путям сна и пробуждения. Нат Рев Нейроски. 2008;9: 370–86. [PubMed] [Google Scholar]
2008;9: 370–86. [PubMed] [Google Scholar]
99. Ren J, Ding X, Funk GD, Greer JJ. Ампакин CX717 защищает крыс от угнетения дыхания, вызванного фентанилом, и летального апноэ. Анестезиология. 2009; 110:1364–70. [PubMed] [Google Scholar]
100. Watson SL, Watson CJ, Baghdoyan HA, Lydic R. Тепловая ноцицепция снижается гипокретином-1 и агонистом рецептора аденозина A1, микроинъекцией в ретикулярную формацию моста крысы Sprague Dawley. Джей Пейн. 2010; 11: 535–44. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Нокаут, усыпление, наркоз и успокоительное: разные виды анестезии | Office for Science and Society
Если вы читали статью, которую я написал о том, почему пациентам разрешено пить прозрачные жидкости, но не есть перед операцией, вы знаете, что недавно мне сделали операцию по восстановлению передней крестообразной связки и мениска в левом колене. Мне дали указание прекратить есть в полночь накануне операции, чтобы к утру мой желудок был пуст. Это было сделано для того, чтобы снизить риск того, что я срыгну пищу из желудка в трахею и задохнусь, как только меня «усыпят». Однако, как оказалось, поскольку мне не делали операцию под общим наркозом, риск аспирации был незначительным. Что у меня было, если не общий наркоз? Позволь мне объяснить.
Однако, как оказалось, поскольку мне не делали операцию под общим наркозом, риск аспирации был незначительным. Что у меня было, если не общий наркоз? Позволь мне объяснить.
Существует четыре основных категории анестезии: общая, регионарная, седация и местная.
Общая анестезия — это, скорее всего, то, о чем вы думаете, когда представляете себе хирургическую анестезию. Технически это медикаментозная кома, когда лекарства вводятся через капельницу или маску. Во время общей анестезии обычно требуется какая-либо дыхательная трубка, поскольку часто не происходит спонтанного дыхания. Поскольку ваши дыхательные рефлексы, такие как кашель, подавляются, вы подвергаетесь повышенному риску аспирации. Пробуждение от этого типа анестезии занимает около часа после того, как лекарства перестанут поступать в кровь.
Регионарная анестезия обычно используется при кесаревом сечении и ортопедических операциях. Он включает в себя введение местного анестетика в нервы, которые обеспечивают чувствительность части тела, но оставляют вас в полном сознании.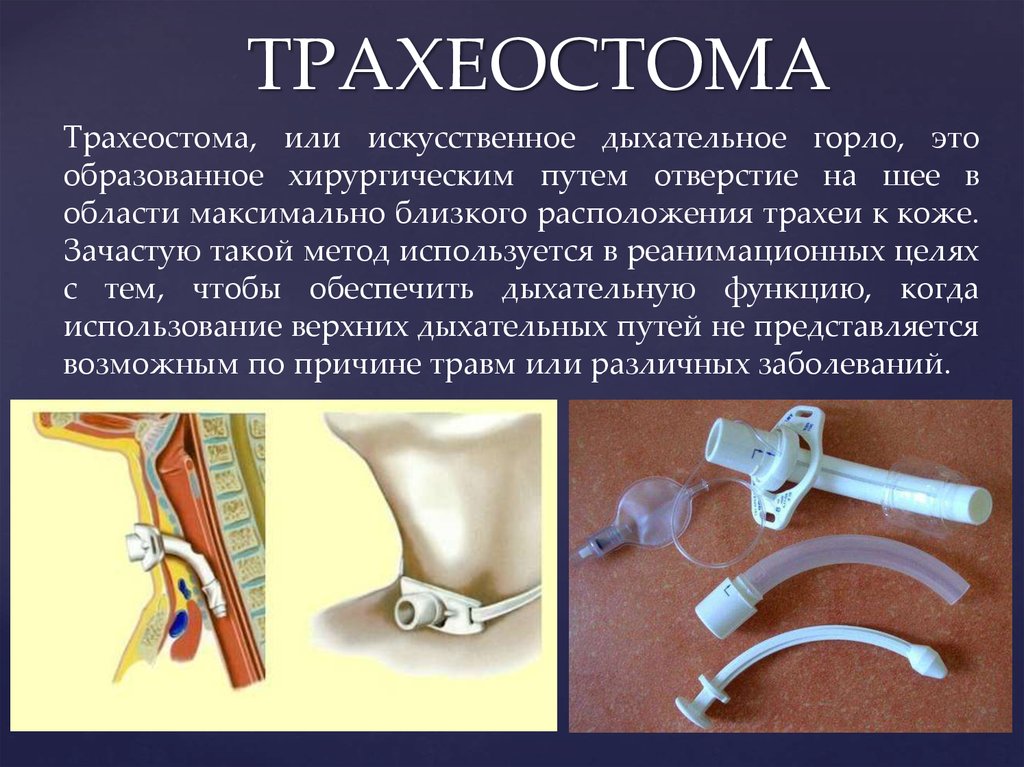
Седация, часто называемая «сумеречной седацией», включает введение лекарств, которые вызывают у пациента сонливость, расслабление и потерю концентрации. Хотя вы не теряете сознание, как при общей анестезии, вы можете естественным образом заснуть из-за сонливости. Седация не подавляет ваше дыхание или рефлексы и, таким образом, не несет риска аспирации, как это делает общая анестезия. Он довольно быстро изнашивается и, таким образом, позволяет сократить время восстановления.
Местная анестезия проводится у стоматолога. Он включает введение небольшого количества препарата, такого как лидокаин, в определенную область, обычно с помощью инъекции. Помимо зубных пломб, его можно использовать для простых процедур, таких как зашивание разреза.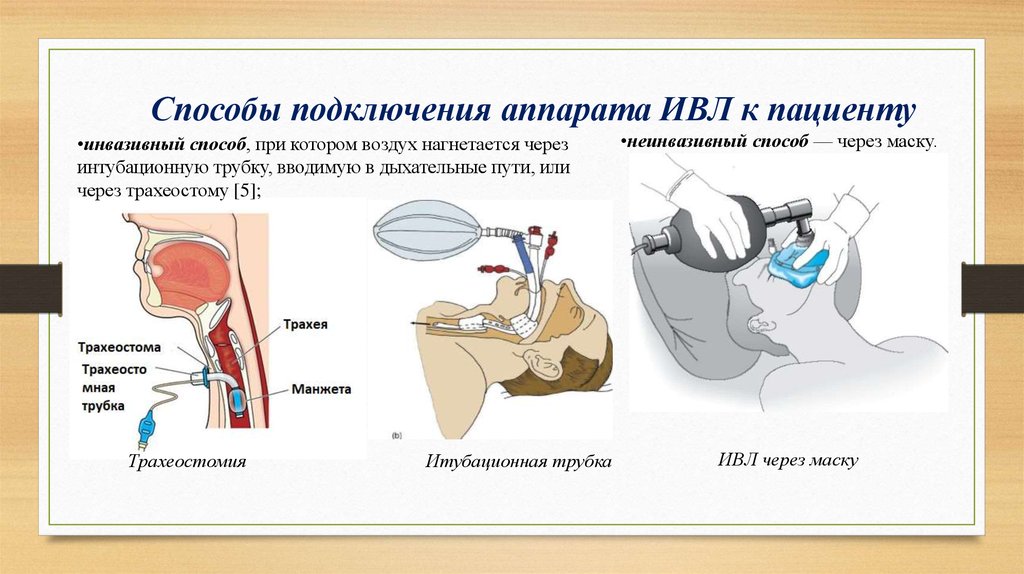

 Чтобы больной не страдал, его вводят в искусственную кому. Также в состоянии сна мозг и мышцы человека потребляют гораздо меньше кислорода, чем при бодрствовании, поэтому медикаментозная кома дает возможность обеспечить организм больного «полноценным питанием» даже при значительном повреждении легких. Когда состояние пациента стабилизируется, его возвращают к нормальной жизни.
Чтобы больной не страдал, его вводят в искусственную кому. Также в состоянии сна мозг и мышцы человека потребляют гораздо меньше кислорода, чем при бодрствовании, поэтому медикаментозная кома дает возможность обеспечить организм больного «полноценным питанием» даже при значительном повреждении легких. Когда состояние пациента стабилизируется, его возвращают к нормальной жизни.
 Каким необычным синдромам подвержены люди?
Каким необычным синдромам подвержены люди?
 Соответственно увеличивается и приток крови. Кровеносные сосуды переполняются неё, и это может заметно увеличить отек. Если снизить мыслительную деятельность, потребность в кислороде и питательных веществах также уменьшается. Соответственно, снижается потребность в дополнительном притоке крови. Поэтому при появлении угрожающего отека мозга больного вводят в искусственную кому, подавляют сознание и любую другую активность.
Соответственно увеличивается и приток крови. Кровеносные сосуды переполняются неё, и это может заметно увеличить отек. Если снизить мыслительную деятельность, потребность в кислороде и питательных веществах также уменьшается. Соответственно, снижается потребность в дополнительном притоке крови. Поэтому при появлении угрожающего отека мозга больного вводят в искусственную кому, подавляют сознание и любую другую активность.