Атрезия желчных путей что это – Атрезия желчных ходов — причины, симптомы, диагностика и лечение
Атрезия желчных ходов — причины, симптомы, диагностика и лечение
Атрезия желчных ходов – аномалия развития желчевыводящих путей, выражающаяся в нарушении проходимости внутрипеченочных или/и внепеченочных желчных протоков. Атрезия желчных ходов проявляется упорной желтухой, обесцвечиванием испражнений, интенсивной темной окраской мочи, увеличением печени и селезенки, развитием портальной гипертензии, асцитом. Атрезия желчных ходов распознается с помощью УЗИ, холангиографии, сцинтиграфии, лапароскопии, биохимических проб, пункционной биопсии печени. При атрезии желчных ходов показано оперативное лечение (гепатико-, холедохоеюностомия, портоэнтеростомия).
Общие сведения
Атрезия желчных ходов (билиарная атрезия) – тяжелый врожденный порок развития, характеризующийся частичной или полной облитерацией просвета желчных ходов. Атрезия желчных ходов встречается в педиатрии и детской хирургии примерно в 1 случае на 20000-30000 родов, составляя около 8% всех пороков внутренних органов у детей. Атрезия желчных ходов представляет собой крайне опасное состояние, требующее раннего выявления и безотлагательного оперативного лечения. Без оказания своевременной хирургической помощи дети с атрезией желчных ходов погибают в течение первых месяцев жизни от пищеводного кровотечения, печеночной недостаточности или инфекционных осложнений.
Атрезия желчных ходов
Причины атрезии желчных ходов
Причины и патогенез атрезия желчных ходов до конца не ясны. В большинстве случаев при атрезии желчные протоки сформированы, однако их проходимость нарушена вследствие облитерации или прогрессирующей деструкции. Чаще всего причиной обстуктивной холангиопатии становятся внутриутробные инфекции (герпес, краснуха, цитомегалия и др.) или неонатальный гепатит. Воспалительный процесс вызывает повреждение гепатоцитов, эндотелия желчных ходов с последующим внутриклеточным холестазом и фиброзом желчных ходов. Реже атрезия желчных ходов связана с ишемией протоков. В этих случаях атрезия желчных ходов не обязательно будет носить врожденный характер, а может развиваться в перинатальном периоде вследствие прогрессирующего воспалительного процесса.
Истинная атрезия желчных ходов выявляется реже и связана с нарушением первичной закладки желчных путей в эмбриональном периоде. При этом в случае нарушения закладки печеночного дивертикула или канализации дистальных отделов желчевыводящей системы развивается атрезия внутрипеченочных желчных ходов, а при нарушении формирования проксимальных отделов желчевыводящей системы — атрезия внепеченочных желчных протоков. Желчный пузырь может являться единственным звеном наружных желчевыводящих путей или отсутствовать полностью.
Примерно у 20% детей атрезия желчных ходов сочетается с другими аномалиями развития: врожденными пороками сердца, незавершенным поворотом кишечника, аспленией или полиспленией.
Классификация атрезии желчных ходов
К аномалиям развития желчевыводящих путей относятся следующие клинико-морфологические формы: гипоплазия, атрезия, нарушение ветвления и слияния, кистозные изменения желчных ходов, аномалии холедоха (киста, стеноз, перфорация).
По локализации различают внепеченочную, внутрипеченочную и тотальную (смешанную) атрезию желчных ходов. С учетом места обструкции желчных протоков выделяют корригируемую атрезию желчных ходов (непроходимость общего желчного или общего печеночного протока) и некорригируемую атрезию желчных ходов (полное замещение протоков в воротах печени фиброзной тканью). Локализация и уровень обструкции желчных протоков являются определяющими факторами, влияющими на выбор техники хирургического вмешательства.
Симптомы атрезии желчных ходов
Дети с атрезией желчных ходов обычно рождаются доношенными с нормальными антропометрическими показателями. На 3-4-е сутки жизни у них развивается желтуха, однако в отличие от транзиторной гипербилирубинемии новорожденных, желтуха при атрезии желчных ходов сохраняется длительно и постепенно нарастает, придавая кожным покровам ребенка шафрановый или зеленоватый оттенок. Обычно атрезия желчных ходов не распознается в первые дни жизни ребенка, и новорожденный выписывается из роддома с диагнозом «затянувшаяся физиологическая желтуха».
Характерными признаками атрезии желчных ходов, присутствующими с первых дней жизни ребенка, служат ахоличный (обесцвеченный) стул и моча интенсивного темного («пивного») цвета. Сохранение обесцвеченного кала в течение 10 дней указывает на атрезию желчных ходов.
К исходу первого месяца жизни нарастает снижение аппетита, дефицит массы, адинамия, кожный зуд, задержка физического развития. В это же время отмечается увеличение печени, а затем – селезенки. Гепатомегалия является следствием холестатического гепатита, на фоне которого быстро развивается билиарный цирроз печени, асцит, а к 4-5 месяцам — печеночная недостаточность. Нарушение кровоснабжения печени способствует формированию портальной гипертензии и, как следствие, — варикозному расширению вен пищевода, спленомегалии, появлению подкожной венозной сети на передней брюшной стенке. У детей с атрезией желчных ходов отмечается геморрагический синдром: мелкоточечные или обширные кровоизлияния на коже, кровотечения из пуповинного остатка, пищеводные или желудочно-кишечные кровотечения.
При отсутствии своевременного хирургического лечения дети с атрезией желчных ходов обычно не доживают до 1 года, погибая от печеночной недостаточности, кровотечений, присоединившейся пневмонии, сердечно-сосудистой недостаточности, интеркурентных инфекций. При неполной атрезии желчных ходов некоторые дети могут дожить до 10 лет.
Диагностика атрезии желчных ходов
Крайне важно, чтобы атрезия желчных ходов была выявлена неонатологом или педиатром как можно раньше. Персистирующая желтуха и ахоличный стул должны навести детских специалистов на мысль о наличии у ребенка атрезии желчных ходов и заставить предпринять необходимые меры к уточнению диагноза.
Уже с первых дней жизни в крови новорожденного нарастают уровни биохимических маркеров печени, прежде всего, билирубина (вначале за счет увеличения прямой фракции, позже – за счет преобладания непрямого билирубина), щелочной фосфатазы, гамма-глютамил-трансферазы. Постепенно развивается анемия и тромбоцитопения, снижается ПТИ. При атрезии желчных ходов в кале ребенка отсутствует стеркобилин.
УЗИ печени, селезенки и желчных путей позволяет оценить размеры органов и структуру паренхимы, состояние желчного пузыря, вне- и внутрипеченочных желчных протоков, воротной вены. Обычно при атрезии желчных ходов желчный пузырь не определяется или визуализируется в виде тяжа, также не выявляется общий желчный проток. Информативными методами для уточнения диагноза служат чрескожная чреспеченочная холангиография, МР-холангиография, статическая сцинтиграфия печени, динамическая сцинтиграфия гепатобилиарной системы.
Окончательное подтверждение атрезии желчных ходов может быть достигнуто при выполнении диагностической лапароскопии, интраоперационной холангиографии, биопсии печени. Морфологическое исследование биоптата способствует уточнению характера поражения гепатоцитов и состояния внутрипеченочных желчных протоков.
Атрезию желчных ходов у детей следует дифференцировать с желтухой новорожденных, врожденным гигантоклеточным гепатитом, механической закупоркой желчных путей слизистыми или желчными пробками.
Лечение атрезии желчных ходов
Важным условием успешности лечения атрезии желчных ходов является проведение хирургического вмешательства в возрасте до 2-3-х месяцев, поскольку в более старшем возрасте операция, как правило, безуспешна из-за необратимых изменений.
В случае непроходимости общего желчного или печеночного протоков и наличия супрастенического расширения производится наложение холедохоэнтероанастомоза (холедохоеюностомия) или гепатикоеюноанастомоза (гепатикоеюностомия) с петлей тощей кишки. Полная атрезия внепеченочных желчных ходов диктует необходимость выполнения портоэнтеростомии по Касаи – наложения анастомоза между воротами печени и тонкой кишкой. Наиболее частыми послеоперационными осложнениями служат послеоперационный холангит, абсцессы печени.
При выраженной портальной гипертензии и рецидивирующих гастроинтестинальных кровотечениях может быть проведено портокавальное шунтирование. В случае прогрессирующей печеночной недостаточности и гиперспленизма решается вопрос о трансплантации печени.
Прогноз атрезии желчных ходов
В целом прогноз атрезии желчных ходов очень серьезный, поскольку цирротические изменения печени носят прогрессирующий характер. Без хирургической помощи дети обречены на гибель в течение 12-18 месяцев.
Очень важно выявить клинические проявления атрезии желчных ходов (упорную желтуху, ахоличный кал) в неонатальном периоде и провести раннее хирургическое лечение. В большинстве случаев наложение холедоходигестивных анастомозов или печеночных анастомозов способно продлить жизнь ребенка на несколько лет и отсрочить необходимость трансплантации печени.
www.krasotaimedicina.ru
Атрезия желчевыводящих путей – причины, симптомы и лечение |
Атрезия желчевыводящих путей у детей, или слияние желчных протоков, является врожденной аномалией, относящихся к редким заболеваниям. Необработанная билиарная атрезия желчевыводящих путей у новорожденных может привести к циррозу печени и даже смерти. Согласно исследованиям Всемирной организации здоровья, около 90% детей с атрезией желчных протоков умирают, не достигнув 3 лет. Каковы причины и симптомы атрезии желчных путей, как лечить врожденную патологию, будет рассмотрено в этой статье.

Желтуха – основной признак атрезии
Суть проблемы
Билиарная атрезия желчных протоков является врожденным анатомическим дефектом у детей, суть которого, это воспаление желчных протоков, то есть желчная непроходимость, когда жидкость, выделяемая печенью для переваривания жиров, не доходит до тонкого кишечника. Воспаление приводит к фиброзу желчных протоков и дополнительно к их обструкции. Следствием этого процесса является прекращение оттока желчи из печени в кишечник – холестаз.
Желчь в избытке накапливается в печени и желчных протоках, что со временем приводит к увеличению давления в желчных путях и повреждении. Клеток печени. Частота врожденной билиарной атрезии желчевыводящих путей оценивается медицинскими экспертами примерно 1 случай на 20000 новорожденных, причём девочки страдают врожденной аномалией в два раза чаще, чем мальчики.
Атрезия желчных путей – причины
Причины слияния желчных протоков неизвестны. Предполагается, что заболевание имеет аутоиммунную основу, то есть клетки иммунной системы атакуют правильно сформированные желчные протоки, и приводят к их воспалению.
Классификация атрезий желчных протоков
Врожденная аномалия желчевыводящих путей имеет определенную клинико-морфологическую форму, определяемую по месту локализации:
- Первый тип – внепеченочная атрезия желчных путей.
- Второй тип – внутрипеченочная атрезия.
- Третий тип – тотальная или смешанная атрезия желчных протоков.
Локализация места и вида обструкции желчевыводящих путей является определяющим фактором при выборе методики оперативного вмешательства.
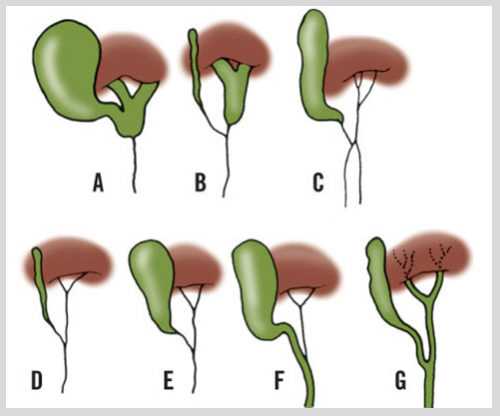
Виды атрезии желчевыводящих путей
Билиарная атрезия – симптомы
Симптомы атрезии желчевыводящих протоков появляются в первые дни, или недели жизни ребенка, обычно между 2-й и 6-й неделями. Основной симптом – это длительная желтуха, то есть желтое обесцвечивание кожи и слизистой оболочки глаз. Как правило, желтуха может встречаться у многих новорожденных и обычно исчезает в течение первых двух недель жизни. Если этого не происходит, то с большой долей вероятности можно предполагать атрезию желчных протоков у ребенка.
Кроме того, заболевание сопровождается и прочими симптоматическими признаками, например:
- серый или светло-желтый глинистый стул у ребенка;
- моча цвета темного пива;
- слегка увеличенная печень, визуально определяемая в правом верхнем брюшном квадрате;
- длительное кровотечение из пупка.
Также в 10-20% случаев, у детей с билиарной атрезией, определяются прочие врожденные аномалии, например, дефекты сердца, двойная селезенка или поликистозная болезнь почек.
Атрезия желчных путей – диагностика состояния
В случае подозрения на билиарную атрезию выполняется абдоминальное ультразвуковое исследование, благодаря которому врач может оценить функцию печени, желчных протоков и желчного пузыря. Кроме того, рекомендуется сцинтиграфия желчных протоков и анализ крови. При соединении желчных протоков повышаются билирубин, ГГТП, холестерин, щелочная фосфатаза и слегка трансаминазы.
Эти тесты подтверждают диагноз и исключают другие возможные причины, такие как вирусные и бактериальные инфекции печени или врожденные метаболические заболевания. Если исследование не дает определенного результата, то может потребоваться проведение биопсии печени, которая включает в себя взятие фрагмента органа специальной иглой для обследования под микроскопом.
Атрезия желчевыводящих протоков
Атрезия желчевыводящих путей – лечение
Единственный способ восстановления оттока желчи из печени в кишечник – это операция, которая должна выполняться как можно скорее. Хирургическое вмешательство желательно произвести не позже чем до двух месяцев жизни ребенка. Чем позже выполняется процедура, тем меньше ее эффективность. Операция называется портосистемный анастомоз или лечение Касаи, от имени врача, который ввел его. Хирургическая манипуляция предусматривает полное удаление фиброзных внепеченочных желчных протоков. После операции используются антибактериальная терапия и анальгетики.
Около половины детей, особенно тех, кто был прооперирован до двух месяцев жизни, успешно избежали осложнений в виде печеночной недостаточности, и прочих отягощающих патологий. Тем не менее, даже после успешной операции, имеет место быть прогрессирующее повреждение печени. В этом случае, необходимо трансплантация органа жизнедеятельности в течение первых двух лет жизни ребенка.
Берегите своих детей и будьте всегда здоровы!
Атрезия желчевыводящих путей: причины, симптомы, лечение
Атрезия желчевыводящих путей – это врожденный дефект, характеризующийся отсутствием билиарных путей или их частичной непроходимостью. Один из вариантов заболевания – гипоплазия – недоразвитие желчевыводящих протоков.
Оперативное вмешательство (операция Касаи) – единственный способ лечения атрезии желчевыводящих путей, однако несмотря на успешность операции, риск смерти составляет более 50%. Патология приводит к желудочно-кишечному кровотечению, печеночной недостаточности, циррозу, бактериальному или вирусному заражению. В результате этих осложнений дети умирают в первые два года жизни.
Распространенность аномалии: у новорожденных атрезия встречается в 1 из 20 тысяч родов. Это – более 8% среди всех внутриутробных дефектов развития внутренних органов. У 20% детей атрезия желчных протоков комбинируется с другими внутриутробными дефектами: пороками сердца, кишечника, отсутствием селезенки или полиспленией (когда много селезенок).

Причины
Атрезия частично сформированных желчевыводящих путей у новорожденных формируется из-за таких причин:
- Внутриутробные инфекции: краснуха, герпес или цитомегаловирус.
- Неонатальный гепатит (воспаление печени). Воспалительные заболевания приводят к разрушению клеток печени и повреждению тканей желчных путей. Из-за этого в желчном пузыре застаивается желчь и выводящие пути обрастают соединительной тканью. В просвете протока появляются рубцы. Они, увеличиваясь в размере, перекрывают путь.
- Ишемия (недостаточное кровоснабжение) билиарных протоков. Часто ишемия тканей носит приобретенный характер и обнаруживается в первую неделю жизни в результате воспалительных заболеваний.
Первичная атрезия желчных путей, то есть полное отсутствие билиарного тракта у младенца, образуется из-за нарушения внутриутробного развития. Так, каждый орган в организме имеет свою закладку, на основе которой он растет и формируется. При истинной атрезии строение этой закладки нарушается или она не появляется вовсе.

Классификация
Существует несколько классификаций атрезии желчных протоков:
- Анатомическое строение:
- гипоплазия – недоразвитие органа;
- атрезия – полное отсутствие желчевыводящих путей или частичная их закупорка;
- нарушение разветвления или слияние отдельных трактов.
- наличие кист в протоках;
- врожденный стеноз (перекрытие просвета тракта).
- Расположение атрезии:
- внутри печени;
- вне печени;
- смешанная (вне печени и внутри нее).
- По степени разрастания соединительной тканью:
- Первая степень: в процесс вовлекается менее половины протоков;
- Вторая степень: вовлеклось более 50% протоков без формирования патологических образований;
- Третья степень: вовлечено больше половины трактов с формированием узелков.
Симптомы
Клиническая картина билиарного заращения проявляется на фоне доношенности ребенка на 2-3 или 4 день после рождения. В это время появляются первые признаки желтухи: кожа и слизистые оболочки приобретают желтушный оттенок.
Важно: часто желтуху на фоне атрезии путают с физиологической желтухой новорожденных (нормальным преходящим состоянием, которое исчезает самостоятельно к 7-8 дню жизни). С предварительным диагнозом «затянувшаяся физиологическая желтуха» маму с ребенком выписывают.
К этому времени присоединяется второй характерный симптом – ахоличный стул. Темный цвет калу придает именно желчь, которая не выходит из пузыря из-за непроходимости или отсутствия протоков, поэтому стул обесцвечивается. Параллельно нарастает желтуха, увеличивается печень и интенсивно окрашивается моча в цвет темного пива. Внешне увеличивается живот, а на его поверхности расширяются подкожные вены из-за повышения внутрибрюшного давления.
В течение первого месяца состояние ребенка может быть относительно стабильным: малыш сосет, питается и набирает массу тела. Однако в период внешнего благополучия развивается дефицит витамина К. Возникает геморрагический синдром: на теле появляются точечные кровоизлияния.
Ко второму месяцу жизни увеличивается селезенка. Нарастает давление в портальной системе печени: появляется асцит – в брюшной полости из-за повышения проницаемости сосудов накапливается жидкость. Общее состояние ребенка ухудшается: пропадает аппетит, нарушается сон, появляется рвота и беспокойство. На фоне дефицита витамина К появляется рвота с примесями крови.
Если к 5-6 месяцу заболевание не выявили и не применили хирургическое лечение, формируется билиарный цирроз печени. Начинает чесаться кожа, ребенок становится апатичным, безучастным, сонливым. Он быстро утомляется. Развивается печеночная недостаточность. Усиливается портальная гипертензия, расширяются сосуды пищевода, из-за чего возрастает риск пищеводного кровотечения.
Если к первому году жизни заболевание не поддалось лечению, ребенок в результате осложнений умирает. Редко дети с атрезией желчевыводящих путей доживают до 10 лет.

Диагностика
Патология имеет ключевые диагностические критерии:
- Жалобы. С первых дней жизни малыша родители могут наблюдать пожелтение кожи и слизистых оболочек, ахоличный стул и темную мочу.
- Динамика заболевания: желтушность кожи развивается на 3-4 день после рождения, которая постепенно нарастает, вплоть до зеленоватого оттенка кожи. Ахоличность кала при атрезии наблюдается в течение как минимум 10 первых дней жизни. Как правило, именно этот симптом указывает на наличие заболевания.
- Объективный осмотр: врач пальпирует живот и обнаруживает увеличение печени и селезенки. Кожа желтовата, кал ахоличен.
- Лабораторная диагностика. В общем анализе крови наблюдается увеличение количества лейкоцитов, повышение скорости сворачивания эритроцитов, анемия и низкий уровень тромбоцитов. Биохимическое исследование крови показывает повышение прямого билирубина и щелочной фосфатазы. Анализ кала фиксирует отсутствие желчных пигментов. Иммуноферментный анализ в 75% случаев указывает на наличие цитомалегаловирусной инфекции.
- Инструментальные методы. На ультразвуковом исследовании не наблюдаются желчные протоки. Аналогично на магнитно-резонансной и компьютерной томографии. Холецистохолангиография выявляет степень непроходимости билиарных трактов. Дополнительно для дифференциальной диагностики назначают нейросонографию, электрокардиограмму и эхокардиограмму.
- Консультация смежных специалистов. Они нужны для детализации клинической картины и уточнения состояния ребенка. Назначается консультация детского хирурга, гепатолога, невролога и кардиолога.
Если показатели сомнительны, показана диагностическая лапароскопия – операция, цель которой состоит в том, чтобы осмотреть органы брюшной полости и выявить патологический очаг.
После того, как жизненные показатели здоровья ребенка подошли под эти критерии и после консультации детского хирурга, выставляется диагноз «атрезия желчевыводящих протоков» и малыша госпитализируют в стационар для лечения.

Лечение
Атрезия лечится только в условиях стационара. Показаний для домашнего лечения нет. Способ лечения – хирургическое вмешательство, также назначается поддерживающая медикаментозная терапия.
Хирургическое
При частичной непроходимости или заращении выполняется холедохоэнтероанастомоз. Цель операции – искусственно создать желчевыводящее соустье между общим печеночно-желчным протоком и тонкой кишкой. При истинной атрезии, когда протока нет вообще, создается канал между печенью и тонким кишечником, по которому проходит желчь. Оперативное лечение есть смысл проводит до двух месяцев жизни малыша, позже наступают необратимые изменения. Операция противопоказана при высоком риске кардиологического шока.
Консервативное
Принципы поддерживающей медикаментозной терапии:
- Гемостатические препараты (Этамзилат натрия). Они останавливают кровотечение. Назначаются после операции как симптоматическая терапия кровоизлияний.
- Антибиотики и противогрибковые средства (Цефуроксим, Амикацин, Флуконазол). Назначаются для профилактики бактериального осложнения и в качестве подготовки к операции, чтобы предотвратить инфицирование.
- Обезболивание (Анальгин, Аспирин, Индометацин). Их принимают после операции, чтобы снять послеоперационный болевой синдром.
- Инфузионная терапия (Физиологический раствор, Раствор альбумина 10%, Глюкоза 5%). Она восстанавливает объем циркулирующей крови, нормализирует водно-солевой и кислотно-щелочной баланс.
- Питание (Витаминные комплексы, аминокислотные комплексы). Восстанавливает недостаток питательных веществ.
- Желчегонные препараты (Урсодезоксихолиевая кислота). Стимулирует пассаж желчи в кишечник.
Также назначается симптоматическая терапия, например, противовирусные средства, если обнаружили вирус, или неврологические препараты, если в клинической картине наблюдаются неврологические нарушения.
Лечение считается эффективным в таких случаях:
- устранились признаки желтухи;
- послеоперационная рана натянулась, нет инфицирования и симптомов нагноения;
- лабораторные анализы нормализируются;
- желчь поступает в тонкий кишечник и кал приобретает желтый цвет.
Профилактика
Заболевание носит врожденных характер, поэтому специфической профилактики нет.
Прогноз
При патологии прогноз неблагоприятный: цирроз печени развивается быстро, достигая пика к 1-1,5 года жизни. Если к этому времени не вылечить болезнь, ребенок умирает к концу второго года жизни. При успешной операции жизнь продлевается на несколько лет, а трансплантация печени способна отстрочить смерть на 3-5 лет.
Если операция прошла без осложнений, ребенка выписывают из стационара. Родителям даются рекомендации по питанию и уходу. В дальнейшем малыш наблюдается детским хирургом, гастроэнтерологом и гепатологом.

Заключение
Атрезия желчевыводящих путей – это врожденный дефект, при котором желчевыводящие пути отсутствуют, недоразвиты или в них есть непроходимость. Причина – нарушение внутриутробного развития вследствие инфекций или нарушения формирование закладки. Симптомы: на 3-4 день появляется желтуха, кал обесцвечивается. Увеличивается печень и селезенка, на теле появляются точечные кровоизлияния. Без лечения к шестому месяцу жизни развивается билиарный цирроз печени. Заболевание диагностируется при помощи жалоб, лабораторных и инструментальных методов исследования. Основное лечение – хирургическое, которое поддерживается медикаментозно. Прогноз неблагоприятный: ко второму году жизни ребенок умирает. Операция отсрочивает смерть на 2-3 года.
Загрузка…zpdoc.ru
Билиарная атрезия. Показания к трансплантации печени.
Содержание статьи:
Билиарная атрезия – это прогрессирующее фибро-облитерирующее заболевание внутрипеченочных и внепеченочных желчных протоков у новорожденных детей. Билиарная атрезия повсеместно, её заболеваемость составляет 1 случай на 10 000 – 18 000 новорожденных.
У большинства детей с атрезией желчевыводящих протоков, в конечном счёте, развивается цирроз печени, и им требуется трансплантация печени.
В данной статье будут рассмотрены показания к трансплантации печени при билиарной атрезии, а также подготовка к трансплантации печени детей с билиарной атрезией.
Билиарная атрезия. Причины возникновения.
Причины и патогенез атрезия желчных ходов до конца не ясны. В большинстве случаев при атрезии желчные протоки сформированы, однако их проходимость нарушена вследствие облитерации или прогрессирующей деструкции. Чаще всего причиной обстуктивной холангиопатии становятся внутриутробные инфекции (герпес, краснуха, цитомегалия и др.) или неонатальный гепатит. Воспалительный процесс вызывает повреждение гепатоцитов, эндотелия желчных ходов с последующим внутриклеточным холестазом и фиброзом желчных ходов. Реже атрезия желчных ходов связана с ишемией протоков. В этих случаях атрезия желчных ходов не обязательно будет носить врожденный характер, а может развиваться в перинатальном периоде вследствие прогрессирующего воспалительного процесса.
Примерно у 20% детей атрезия желчных ходов сочетается с другими аномалиями развития: врожденными пороками сердца, незавершенным поворотом кишечника, аспленией или полиспленией.
Показания к трансплантации печени при билиарной атрезии.
- Неудачная портоэнтеростомия по Касаи;
- Отсутствие желчеотведения;
- Позднее развитие цирроза, несмотря на хороший отток желчи;
- Поздняя диагностика билиарной атрезии;
- Невозможность адекватной нутритивной поддержки;
- Невыполнение требований, требующих агрессивной поддержки питания;
- Метаболическая болезнь кости, приводящая к переломам;
- Рецидивирующий холангит, несмотря на соответствующую антибактериальную терапию;
- Мультирезистентные бактериальные штаммы;
- Жизнеугрожающий сепсис;
- Периодические госпитализации, ухудшающие качество жизни;
- Осложнения синдрома портальной гипертензии;
- Кровотечения из варикозно расширенных вен пищевода;
- Напряженный асцит и эпизоды спонтанных бактериальных перитонитов;
- Злокачественная тромбоцитопения;
- Выраженный зуд;
- Легочные сосудистые расстройства;
- Гепатопульмональный синдром;
- Порто-пульмональная гипертензия;
- Гепаторенальный синдром;
- Злокачественные новообразования печени;
- Гепаитоциллюлярная карцинома;
- Холангиокарцинома.
Неудачная портоэнтеростомия по Касаи.
Понятие порогового возраста, после которого портоэнтеростомия по Касаи (ПЭС) неэффективно, остаётся дискутабельным. Считается, что пациенты с “поздно выполненной ПЭС”, это те пациенты, которым ПЭС выполнили в сроки более 90 дней с момента рождения.
Мировые исследования показали, что у таких пациентов двухлетняя выживаемость составляет до 42%, 23-45% через 4-5 лет, 15-40% после 10 лет.
Ни фиброз, выявленный морфологически, ни узловатый вид печени во время ПЭС достоверно не предсказывают результат после операции.
Однако ПЭС у младенцев с циррозом и асцитом может ускорить печеночную декомпенсацию. В нескольких исследованиях было показано, что пациенты с предшествующей ПЭС подвергаются повышенному риску перфорации кишечника и билиарных осложнений после трансплантации печени.
Во многих трансплантационных центрах в мире считается целесообразным выполнить трансплантацию печени, нежели портоэнтеростомию по Касаи.
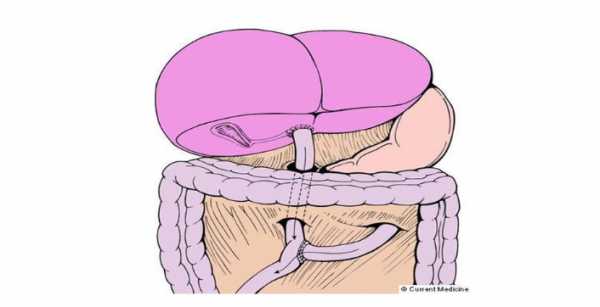
Билиарная атрезия. Портоэнтеростомия по Касаи не рекомендуется к выполнению у детей с билиарной атрезией во многих трансплантационных центрах.
Нутритивные нарушения.
У детей с нарушенным желчеоттоком (в том числе после ПЭС) будет постепенно развиваться значительная мальабсорбция, белково-энергетическая недостаточность, и, как следствие, задержка развития.
Дети с нормализацией желчеоттока после ПЭС, также будут страдать от этих последствий, хоть и несколько позже. Помимо всего прочего, у таких пациентов наблюдаются биохимическая и клиническая недостаточность жирорастворимых витаминов, железа и цинка являются общими и требуют агрессивной коррекции и регулярного мониторинга.
Метаболические нарушения в костях скелета, приводящие к рецидивирующим переломам, также могут развиваться по мере прогрессирования заболевания печени, даже без дефицита витамина D или кальция.
Также, агрессивная нутритивная поддержка (включая назогастральные кормления или парентеральное питание) является показанием к трансплантации печени.
Бактериальный холангит.
От 40% до 80% пациентов после ПЭС испытывают по крайней мере 1 эпизод бактериального холангита до достижения 2-летнего возраста, а у 25% пациентов случаются частые рецидивирующие холангиты. Послеоперационный холангит ассоциируется с снижением 1- , 3- и 5-летней выживаемости по сравнению с детьми без холангита (92%, 76% и 76% против 80%, 51% и 23% соответственно).
Кроме того, рецидивирующий холангит дает 3-кратное повышение риска нарушения желчеоттока после ПЭС, которое приводит к билиарному циррозу.
Также показаниями к трансплантации печени являются те случаи, когда у ребенка развивается рецидивирующий холангит, несмотря на агрессивную антибактериальную терапию, высеваются полирезистентные бактериальные штаммы, развивается сепсиса. Также снижение качества жизни из-за частых госпитализаций по поводу холангитов относят к показаниям к трансплантации печени.
Портальная гипертензия.
Не смотря на то, что у 60% младенцев с билиарной атрезией восстанавливается желчеотток после ПЭС, печеночный фиброз постепенно прогрессирует. Из-за этого у большинства детей развивается портальная гипертензия.
Проявления портальной гипертензии:
- Спленомегалия;
- Асцит;
- Варикозное расширение вен желудка с риском желудочно-кишечных кровотечений;
- Панцитопения.
Проявления портальной гипертензии связаны со значительной заболеваемостью и смертностью. Пациенты с портальной гипертензией требуют регулярного наблюдения.
Зуд.
По данным мировой литературы, чаще сообщается о детях с синдромом Аладжиля и прогрессирующем семейном внутрипеченочном холестазом, что у них чаще бывает зуд. Однако холестаз-индуцированный зуд может возникать и при билиарной атрезии. У некоторых пациентов зуд достаточно значительно выражен, и сильно ухудшает качество жизни как ребенка, так и его родителей.
В этих случаях необходимо подтвердить, что диагноз билиарной атрезии правильно установлен, а также, что были исключены другие медицинские причины зуда (например, атопия, педикулез или крапивница). Трансплантация печени показана для пациентов с трудноизлечимым зудом, который нарушает сон, или нормальную деятельность, не смотря на адекватную терапию.
Гепатопульмональный синдром и портопульмональная гипертензия.
Гепатопульмональный синдром (ГПС) и портопульмональная гипертензия (ППГ) могут возникать вследствие билиарной атрезии и являются показаниями к трансплантации печени из-за высокой смертности без проведения трансплантации печени. ГПС характеризуется артериальной гипоксемией, вызванной расширением внутрилегочных сосудов у пациентов с синдромом портальной гипертензии или врожденными портосистемными шунтами.
Гипоксия, повышенная утомляемость и вялость являются основными клиническими проявлениями. ГПС Развивается у 3-20% детей с циррозом печени.
Диагноз ГПС устанавливается на основании сцинтиграфии (определяются лёгочные шунты, сформировавшиеся на фоне портальной гипертензии), а также на основании ЭХО-кардиографии.
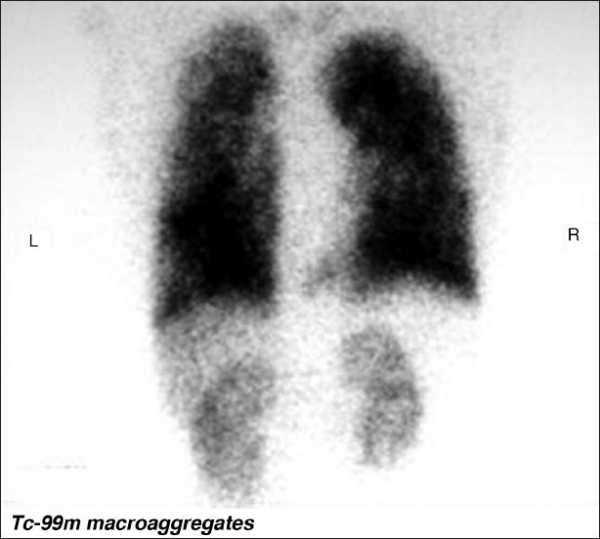
Билиарная атрезия. Сцинтиграфия лёгких при гепатопульмональном синдроме.
Эффективной терапии, помимо трансплантации печени, для ГПС и ППГ не существует. В некоторых случаях применяют инсуффляцию увлажнённого кислорода, что может увеличить парциальное давление кислорода в периферической крови. Тяжелая гипоксемия (PaO2 <45-50 мм рт. ст.) создаёт дополнительные сложности у детей с циррозом печени после трансплантации печени (сложности с экстубацией в раннем послеоперационном периоде).
Во многих трансплантационных центрах при ГПС и ППС измеряют среднее давление лёгочной артерии (mPAP), и если оно выше >50 мм.рт.ст., это является противопоказанием к трансплантации печени из-за высокой интраоперационной и послеоперационной смертности.
Таким образом, ГПС и ППС являются показаниями к трансплантации печени при билиарной атрезии, но тяжесть и темпы прогрессирования этих расстройств диктуют необходимость срочной оценки показаний к трансплантации.
Гепаторенальный синдром.
Гепаторенальный синдром (ГРС) является редким осложнением на терминальных стадиях болезней печени, при котором развивается острая почечная недостаточность. Особенность этого синдрома заключается в том, что он развивается несмотря на интактные почки, ввиду уменьшения почечного кровотока. Это тяжелое осложнения купируется после трансплантации печени и функция почек восстанавливается. Поэтому ГРС является показанием к трансплантации печени у детей с билиарной атрезией.
Злокачественные опухоли печени.
Озлокачествление является признанным осложнением хронических заболеваний печени. В редких случаях (менее 1%) у детей первых месяцев жизни на фоне билиарной атрезии может развиваться гепатоцеллюлярная карцинома. Холангиокарцинома встречается ещё реже.
При повышенный уровня альфа-фетопротеина или выявления подозрительных очагов при УЗИ печени, необходимо дополнительная визуализация в виде компьютерной томографии с внутривенным болюсным контрастированием для подтверждения диагноза и оценки метастазирования.
Полное хирургическое удаление опухоли – единственный радикальный вариант лечения, хотя, по литературным данным, химиотерапия может быть более эффективной у детей, чем у взрослых. Миланские критерии могут быть неприменимы для детей, и успешные результаты трансплантации печени были достигнуты даже у детей, которые не соответствовали более “мягким” критериям Калифорнийского университета Сан-Франциско (одиночная опухоль <6,5 см или максимум 3 опухоли, причём каждая в диаметре не более 4,5 см, и общим размером опухолевых узлов <8 см) или критерий «до 7» (отсутствие сосудистой инвазии, количество узлов плюс максимальный размер самого крупного узла ≤7 см). Поэтому решение проводит трансплантацию печени должно быть индивидуализировано для каждого ребенка.
Трансплантацию следует рассматривать в тех случаях, когда отсутствуют доказательства внепеченочного распространения опухоли или сосудистой инвазии, независимо от размера опухоли или количества опухолевых узлов.
Билиарная атрезия. Подготовка детей к трансплантации печени.
Оптимальная подготовка к трансплантации печени требует наличия в клинике многопрофильной команды с опытом работы с билиарной атрезией и осложнениями хронических заболеваний печени. команда специалистов состоит из следующих специалистов: педиатр, хирург, реаниматолог, диетолог, социальный работник,детский психолог, фармаколог, медсестры.
Ряд важных вопросов должен быть рассмотрен для каждого кандидата на трансплантацию печени с билиарной атрезией.
Особенности нутритивной поддержки детей с билиарной атрезией.
Одним из ключевых предикторов успешной трансплантации печени у пациентов с билиарной атрезией является адекватная нутритивная поддержка. Оценка нутритивного статуса ребёнка должна быть частью стандартного протокола подготовки к трансплантации печени с момента установления диагноза билиарной атрезии. Регулярная оценка нутритивного статуса диктует агрессивность, с которой осуществляется поддержка питания детей (см. таблицу № 1).
Увеличение массы тела ребенка может дать ложное представление о адекватном развитии ребёнка, поскольку гепатоспленомегалия, асцит и отеки могут давать ложное представление о качественном составе веса.
Таблица 1. Нутритивная поддержка детей с билиарной атрезией.
| Питательные вещества. | Показания. | Назначения и дозировки. | Побочные эффекты/Токсичность/Особенности. |
|---|---|---|---|
| See Feranchak, Suchy, Sokol (2014). | |||
| Макронутриенты. | |||
| Энергия. | Данные антропометрии, толщина трицепса и толщина подколенной складки, измерения веса и роста в динамике, косвенная калориметрия, мальабсорбция жиров. | Целевая калорийность: 125% – 140% от расчётного суточного каллоража в расчете на вес на рост. Высококалорийное детское питание. Концентрат детской смеси с добавлением глюкозных полимеров (энергетическая ценность должна быть примерно 100,5-113 кДж / 30 мл). При необходимости назначаются дополнительные ночные или непрерывные ежедневные назогастральные капельные кормления, парентеральное питание. | Большие затраты на питание, аспирационная пневмония. |
| Незаменимые жирные кислоты. | Дефицит жирных кислот | Назначение липидных эмульсий или специального питания, в том числе парентерального. | |
| Белки. | Задержка мышечного развитие, сывороточный альбумин менее 35 г/л. | Потребление белков 2-4 г / кг / день у младенцев. Потребление белка 2 г / кг / день при печеночной энцефалопатии. | |
| Жирорастворимые витамины. | |||
| Витамин A. | Дефицит витамина А: ретинол: ретинолсвязывающий белковый молярный коэффициент <0,8 или сывороточный ретинол <20 мкг / дл; цитологическое исследование конъюнктивы; ксероз, пятна Бито. | 5000-25,0000 ед/день препарата витамина А перорально смешиваемой с водой, в/м инъекции витамина А. | Гепатотоксичность, костные поражения. |
| Витамин D. | Дефицит витамина D: 25-OH-D <14 нг / мл (недостаточность <30 нг / мл), рахит, остеомаляция. | Витамин D3, до 500-1000 МЕ / кг / день или 25-OHD, 3-5 мкг / кг / день или 1,25-Oh3-D, 0,05-0,2 мкг / кг / день. | Гиперкальциемия, нефрокальциноз. |
| Витамин E. | Дефицит витамина Е: витамин Е: общее соотношение липидов <0,6 мг / г (возраст <1 года) и <0,8 мг / г (возраст> 1 года). | α-токоферол (ацетат), 25-200 МЕ/кг/день, токоферол – 15-25 МЕ/кг/день. | Коагулопатия, вызванная дефицитом витамина К, диарея. |
| Витамин K. | Дефицит витамина K: длительное протромбиновое время, увеличение МНО. | назначение препаратов витамина К (Менадион) 4 мг/сут. | |
| Водо-растворимые витамины | Необходимо предотвратить дефицит водорастворимых витаминов. | Токсичность жирорастворимых витаминов. | |
| Минералы и микроэлементы | |||
| Кальций. | Дефицит кальция из-за стеатореи, несмотря на скорректированный статус витамина D | 25-100 мг /кг /день до 800-1200 мг/сут. | Гиперкальциемия, гиперкальциурия. |
| Фосфор. | Низкий сывороточный фосфор, несмотря на коррекцию концентрации витамина D и кальция | 25-50 мг/кг/ день до 500 мг/сут. | Желудочно-кишечная непереносимость. |
| Магний. | Дефицит магния: сывороточный Mg <1,8 мг / дл | Оксид магния, 1-2 мЭкв/кг/день перорально или 50% раствор MgSO 40,3-0,5 мЭкв/кг в течение 3 часов (максимум, 3-6 мг-экв). | Угнетение дыхания, кома. |
| Цинк. | Дефицит цинка: цинк плазмы крови <60 мкг / дл. | Раствор цинкаSO4 (10 мг цинка/мл) 1 мг/кг/день перорально в течение 2-3 месяцев. | Снижение кишечной абсорбция меди и железа. |
| Селен. | Дефицит селена: селен плазмы крови <40 мкг / дл | 1-2 мкг / кг / день орального селенита натрия или 1-2 мкг/кг / день селена в парентеральном питательном растворе. | Кожные изменения (кожные высыпания, изменения ногтей, выпадение волос), диспепсия, диарея, анорексия |
| Железо. | Дефицит железа: ↓ сывороточного железа, ↑ железосвязывающей способности сыворотки, индекс насыщения железом <16% | Препараты железа 5-6 мг/кг/день. | Окрашивание зубов, геморрагический гастроэнтерит . Передозировка: метаболический ацидоз, кома, печеночная недостаточность. |
Особенности нутритивной поддержки детей с билиарной атрезией.
При наличии холестаза и цирроза цель потребления энергии должна составлять 125 до 140% от рекомендуемых энергетических потребностей, основанных на идеальной массе тела. Дополнительные калории могут потребоваться для обеспечения роста ребёнка, если присутствует значительный дефицит по массы тела, как указано в таблице 1.
Однако, как показывает практика, сложно обеспечить достаточный прирост массы тела ребёнка при наличии тяжелого холестаза. Таким образом, предпочтительными являются детские смеси, содержащие значительное количество специальные масла, абсорбция которых в меньшей степени зависит от желчных кислот, и в то же время содержат адекватное количество незаменимых жирных кислоты (триглицеридов с длинной цепью). Потребление белка должно сохраняться в достаточном объёме (не менее 2-4 г / кг / день) и не должно быть ограничено из-за наличия цирроза печени.
Зондовое и парентеральное питание.
Хотя пероральное кормление ребёнка остаётся предпочтительным, у детей с выраженным дефицитом массы тела и с невозможностью адекватного перорального кормления имеются показания для зондового или парентерального питания
Для зондового кормления рекомендуется использовать мягкие назогастральные трубки, которые снижают риск аспирации и травматизации варикозных вен пищевода.
Также в некоторых случаях требуется назначения парентерального внутривенного непрерывного питания через постоянный центральный венозный катетер (в дополнении к пероральному или назогастральному кормлению.
Мальабсорбция витаминов и микроэлементов.
Кишечная абсорбция витаминов и микроэлементов сильно нарушена у пациентов с билиарной атрезией ввиду того, что желчь не попадает в просвет кишечника. Необходимо регулярно проводить оценку дефицита витаминов и микроэлементов с адекватной коррекцией и оценкой побочных эффектов (см. таблицу 1).
Медикаментозное лечение при подготовке к трансплантации печени.
Медикаментозная поддержка пациентов с билиарной атрезией крайне важна. Ниже будет представлена посиндромная лекарственная терапия различных состояний, которые могут развиваться при билиарной атрезии.
Таблица 2. Медикаментозное лечение пациентов с билиарной атрезией.
| Препарат | Показания | Дозировка | Побочные эффекты |
|---|---|---|---|
| See Feranchak, Suchy, and Sokol (2014). | |||
| Урсодезоксихолевая кислота. | Холестаз, зуд, гиперхолестеринемия. | 15-20 мг/кг/день. | Диарея, усиление зуда. |
| Смолы, связывающие желчные кислоты (холестирамин, колестипол, козезевелам). | Ксантома, зуд, гиперхолестеринемия. | 250-500 мг/кг/день (холестирамин, колестипол). | Запоры, гиперхлоремический ацидоз, связывание лекарственных средств, стеаторея, кишечная непроходимость. |
| Налтрексон. | Зуд. | 1-2 мг/кг/день. | Тошнота, головная боль, реакция отмены опиоидов, возможная гепатотоксичность. |
| Фенобарбитал. | Зуд, гиперхолестеринемия | 3-10 мг/кг/день. | Сонливость, нарушение поведения, нарушение метаболизма витамина D. |
| Рифампицин. | Зуд. | 10 мг/кг/день. | Гепатотоксичность, гемолитическая анемия, почечная недостаточность |
| Антигистаминные препараты. | Зуд. | Димедрол 5 мг/кг/день или гидроксизин 2 мг/кг/день. | Сонливость. |
| Облучение ультрафиолетовыми лучами | Зуд. | Ожоги кожи. | |
| Триметоприм/сульфаметоксазол | Профилактика холангитов. | 2-5 мг/кг/день. TMP | Реакция гиперчувствительности, выделение неконъюгированного билирубина из альбумина, угнетение костного мозга, гепатотоксичность. |
| Фуросемид | Асцит, отёки | От 1 мг/кг/ на внутривенное введение. | Гипонатриемия, гипокалиемия, дегидратация, реакция гиперчувствительности, нарушения слуха, угнетение костного мозга |
| Спиринолактон | Асцит | 2-6 мг/кг/день. | Гипернатриемия, гиперкалиемия, дегидратация гинекомастия, реакция гиперчувствительности |
| Октреотид | Кровотечения из варикозных вен | 1-5 наног/кг/час. | Гипотония, угнетение костного мозга |
| Альбумин | Асцит | 1 г/кг при инфузия 20%-25% раствора альбумина. | Перегрузка жидкостью. |
Билиарная атрезия. Особенности лечения синдрома портальной гипертензии.
Проявления синдрома портальной гипертензии часто требуют медикаментозной или иного медицинского вмешательства. Наиболее частыми жизнеугрожающими проявлениями являются:
- Спленомегалия -> гиперспленизм;
- Асцит;
- Варикозное расширение вен желудка с риском желудочно-кишечных кровотечений.
Кровотечения из варикозно расширенных вен пищевода.
До 90% детей с билиарной атрезией имеют варикозно расширенные вены пищевода при эндоскопическом обследовании, а у ~ 30% случается по крайней мере 1 эпизод кровотечения из варикозно расширенных вен.
Последний консенсус по симпозиуму Baveno VI гласит, что скрининговая эзофагогастродуоденоскопия не рекомендуется всем детям с циррозом. Существует множество аргументов против проведения эндоскопии у пациентов с билиарной атрезией, у которых никогда не было кровотечений из варикозных вен. Во-первых, ~50% детей с билиарной атрезией будут нуждаться в трансплантации печени в первые 2 года жизни, таким образом, после трансплантации проблема с варикозным расширением вен пищевода будет решена. Во вторых, даже при выполненной эндоскопии и последующей эндоскопической коррекции (лигировании вен пищевода) есть высокий риск рецидивов и повторных кровотечений. В-третьих, регулярная ЭГДС влечет за собой риск травматизации варикозно расширенных вен пищевода.
Лечение острого варикозного кровотечения включает в себя трансфузию плазмы и эритроцитарной массы, аналогов соматостатина (например, октреотида), эндоскопическую остановку кровотечения, а также, баллонную тампонады или , реже, портосистемное шунтирование. Коагулопатию с дефицитом витамина K следует лечить с помощью препаратов менадиона. Кроме того, следует назначать антибактериальную терапию ввиду высокого риска потенциально фатальных инфекционных осложнений у пациентов с циррозом и, одновременно, желудочно-кишечным кровотечением.
Октреотид, вызывает вазоконстрикцию с уменьшением портального давления, позволяет контролировать варикозное кровотечение и гемодинамическую стабилизацию. Это позволяет выиграть время и подготовить пациента к эндоскопическому гемостазу или баллонной тампонаде. Октреотид применяется в течение 2-5 дней после состоявшегося варикозного кровотечения.
Баллонная тампонада вен пищевода или портосистемное шунтирование применяется в случае тяжёлого рефрактерного варикозного кровотечения. Баллонная тампонада (с использованием зонда Блекмора) обеспечивает хороший гемостаз путем прямого сжатия варикозных вен пищевода и очень успешно останавливает кровотечение. Однако рецидив кровотечения в течение 24 часов после сдувания баллона происходит у ~ 50% пациентов при отсутствии консервативного лечения, включающего гемостатическую терапию (плазма крови, этамзилат, транексамовая кислота, препараты витамина К).
Трансъюгулярный внутрипеченочный портосистемный шунт (TIPS) или, реже, хирургические портосистемные шунты (портокавальные или дистальные спленоренальные шунты) могут потребоваться для лечения рефрактерного варикозного кровотечения у пациентов с билиарной атрезией.

Порто-системный шунт (TIPS)
Тромбоцитопения.
У пациентов с билиарной атрезией наиболее распространенным проявлением гиперспленизма является тромбоцитопения. Нейтропения обычно не имеет последствий. Трансфузии тромбоцитов следует резервировать для тяжелого варикозного кровотечения или клинически значимого кровотечения из других источников при значительном тромбоцитопении (<20-60 × 10^9 / л).
При рецидивирующих кровотечениях, связанных с портальной гипертензией, и сопутствующей тромбоцитопенией, селективная эмболизация селезёночной артерии у пациентов с компенсированным циррозом.
Асцит.
Асцит встречается примерно у одной трети пациентов с синдромом портальной гипертензии. Диуретическая терапия и исключение избыточного потребления натрия (соли) являются основой лечения детей (см. таблицу 2).
При ненапряжённом асците назначают спиринолактон – калийсберегающий диуретик. У пациентов с умеренным или тяжелым асцитом следует использовать спиронолактон и фуросемид наряду с предотвращением употребления продуктов с высоким содержанием натрия.
При асцитах, возникающих на фоне низкого содержания альбумина в плазме крови, наряду с диуретической терапией назначаются инфузии альбумина.
При напряжённых асцитах, которые вызывают дыхательную недостаточность, дополнительно требуется лапароцентез или дренирование брюшной полости. Рекомендуемый объём удаления асцита составляет <200 мл / кг массы тела или <680 мл / час. Если объём сливаемой жидкости больше, требуется назначить дополнительную инфузию альбумина для исключения перераспределительного шока.
Гипонатриемия.
Гипонатриемия (сывороточный натрий <130 мг-экв/л) не редкость у пациентов с билиарной атрезией на фоне асцита. Портальная гипертензия приводит к системной вазодилатации, которая снижает объем артериальной крови. Это вызывает высвобождение аргинин-вазопрессина и антидиуретического гормона, что выводит натрий из кровяного русла. Коррекцию натрия проводят физиологическим раствором или гипертоническим раствором натрия хлорида. Целевые значения натрия – 135-145 мг-экв/л.
Спонтанный бактериальный перитонит.
Спонтанный бактериальный перитонит является серьезным осложнением синдрома портальной гипертензии. Часто он возникает как асцит-перитонит. Источниками инфекции являются стрептококк, а также грамотрицательные бактерии. В таких случаях назначают системные антибиотики.
Лечение бактериального холангита.
Холангит – одно из наиболее распространенных осложнений билиарной атрезии. Холангит стоит подозревать у любого пациента,с повышением температуры тела, рвотой, болью в правом подреберье, осветленным стулом, нарастанием желтухи, ростом аминотрансфераз и ферментов холестаза. У 30% пациентов с вышеперечисленными симптомами будет положительный посев крови (бактериемия). Поэтому, всем пациентом с подозрением на холангит назначают антибактериальную терапию с чувствительностью к грамотрицательным и анаэробным бактериям.
Также отмечено, нет показаний к профилактическому назначению антибиотиков пациентам, перенесших операцию Касаи, у которых не было атак холангита.
Билиарная атрезия. Сроки проведения трансплантации печени.
Не смотря на то, что билиарная атрезия является наиболее распространенным показанием для трансплантации печени, существует недостаточно данных для оптимального выбора времени для трансплантации. Анализ данных UNOS за 2001-2004 гг. Показал, что пациенты с оценкой PELD> 17 имели хорошую выживаемость после трансплантации печени. Однако тяжесть пациентов в соотвтетсвии с критериями PELD не всегда объективна и данные PELD могут не точно отражать истинный риск смертности, поскольку у пациентов, помимо критериев PELD бывают такие осложнения, как портальная гипертензия, варикозные кровотечения, асцитом и т.д. Таким образом, сама билиарная атрезия является показанием к трансплантации печени.
Важным аспектом является “сухой вес ребенка”. Понятие “сухой вес” обозначает вес пациента без учёта асцитической жидкости. У детей с малым мышечным весом большой риск слабости дыхательной мускулатуры после проведенных интубации и введения в наркоз во время трансплантации печени. Поэтому, рекомендуемый “сухой вес” пациента должен превышать 6 кг, чтобы рассматривает его на трансплантацию печени.
Также немаловажным фактором, оценивающим оптимальное время для трансплантации печени, является наличие подходящего органа для трансплантации. Так, в случае нехватки посмертных органов, может использоваться прижизненное донорство фрагментов печени для трансплантации детям.
Крайне важно, чтобы семья имела четкое представление о состоянии своего ребенка и осознавали необходимость в трансплантации. Родители часто страдают от чувства неадекватности, вины, стресса, гнева и страха. Установление доверительных отношений между семьей, ребенком и врачами поможет облегчить переживания и принять рациональное решение. Признание и устранение негативных эмоций также может положительно повлиять как на укрепление семьи в трудный период и направить энергию на борьбу с болезнью.
Выводы и заключение.
До тех пор, пока мы не сможем понять истинную патофизиологию билиарной атрезии и, следовательно, разработать адекватное лечебное пособие для её предотвращения, трансплантация печени останется основным методом лечения этого редкого заболевания.
Детям с билиарной атрезией необходима трансплантация печени ввиду развития жизнеугрожающих осложнений.
Нынешняя схема распределения органов не позволяет обеспечить потребность в трансплантации у детей первых лет жизни. Детская смертность в листах ожидания также подчеркивает критическую потребность в новых подходах к расширению пула доноров. Именно поэтому очень важно прижизненная донация фрагментов печени для трансплантации детям.
В Российской Федерации потребность в трансплантации печени детям практически полностью решена за счёт родственного донорства.
Авторский коллектив: Shikha S. Sundaram, Cara L. Mack, Amy G. Feldman, Ronald J. Sokol.
Оригинальная статья была опубликована в журнале «Liver Transplantation» и доступна по ссылке: http://onlinelibrary.wiley.com/doi/10.1002/lt.24640/full
Перевод: Сёмаш Константин Олесьевич.
doctorsemash.com
| Антибактериальные средства: b-лактамные антибиотики и другие антибактериальные средства (антибиотики подбираются в зависимости от результата чувствительности микроба) | |||||
| 1 | Цефуроксим или | в/м, в/в | для хирургической профилактики детям от 1мес до 18лет цефуроксим рекомендовано вводить внутривенно за 30минут до процедуры 50 mg/kg (max. 1.5 g), в последующем в/м либо в/в по 30 mg/kg (max. 750 mg) каждые 8часов для процедур высокого риска инфекции | 7-10 дней | В |
| 2 | цефтазидим или | в/м, в/в | Дозировка для детей составляет: до двух месяцев – 30 мг на кг веса внутривенно, разделенные на два раза; от двух месяцев до 12 лет – 30-50 мг на кг веса внутривенно, разделенные на три раза. | 7-10 дней | В |
| 3 | амикацин | в/м, в/в | Внутримышечно или внутривенно Амикацин вводят каждые 8 часов из расчета 5 мг/кг или каждые 12 часов по 7,5 мг/кг. При неосложненных бактериальных инфекциях, поразивших мочевые пути, показано применение Амикацина каждые 12 часов по 250 мг. Новорожденным недоношенным детям препарат начинают вводить в дозировке 10 мг/кг, после чего переходят на дозу 7,5 мг/кг, которую вводят каждые 18-24 часа.При внутримышечном введении терапия длится 7-10 дней, при внутривенном – 3-7 дней. | 7-10 дней | А |
| 4. | гентамицин | в/м, в/в | В/м, в/в, местно, субконъюнктивально. Доза устанавливается индивидуально. При парентеральном введении обычная суточная доза при заболеваниях средней тяжести для взрослых с нормальной функцией почек одинакова при в/в и в/м введении — 3 мг/кг/сут, кратность введения — 2–3 раза в сутки; при тяжелых инфекциях — до 5 мг/кг (максимальная суточная доза) в 3–4 приема. Средняя продолжительность лечения — 7–10 дней. В/в инъекции проводят в течение 2–3 дней, затем переходят на в/м введение. При инфекциях мочевыводящих путей суточная доза для взрослых и детей старше 14 лет составляет 0,8–1,2 мг/кг. Детям раннего возраста назначают только по жизненным показаниям при тяжелых инфекциях. Максимальная суточная доза для детей всех возрастов — 5 мг/кг. | 7 дней | В |
| 5. | метронидазол | в/в, per os | Неонатальный период 5–10 mg/kg в 2приёма. Дети от 1мес до 1года 5–10 mg/kg в 2 приёма. Дети от 1 года до 18лет 10 mg/kg (max. 600 mg) в 2 приёма. | 7-10 дней | В |
| Противогрибковые ЛС (для профилактики дисбактериоза) | |||||
| 6. | флуконазол | в/в | При в/в введении флюконазола детям при кандидозном поражении кожи и слизистой из расчета 1 – 3 мг/кг При инвазивных микозах доза повышается до 6 – 12 мг/кг. | 7-10 дней | В |
| Симптоматическая терапия | |||||
| 7. | альбумин 10%. | в/в | В/в капельно при операционном шоке, гипоальбуминемии, гипопротеинемии. У детей альбумин назначается из расчета не более 3 мл/кг массы тела в сутки. (по показаниям) | по показаниям | В |
| 8. | альбумин 20%. | в/в | Разовая доза для детей составляет 0.5-1 г/кг. Препарат можно применять у недоношенных грудных детей (по показаниям) | по показаниям | В |
| 9. | фуросемид | в/м, в/в | Средняя суточная доза для внутривенного или внутримышечного введения у детей до 15 лет — 0,5-1,5 мг/кг. | по показаниям | В |
| Гормоальные препараты | |||||
| 10. | Дексаметазон | в\в, в\м | Суточная доза составляет 0,2-0,4 мг\кг | 7-10 дней | |
| Препараты парэнтерального питания | |||||
| 11 | Комплекс аминокислот для парентерального питания | в\в | 1,5-2,5 г аминокислот на 1 кг веса массы в сутки, или 15-25 мл раствора Аминовен инфанта 10% на 1 кг массы тела в сутки. | По показаниям | |
| 12. | Комплекс аминокислот | в\в | Новорожденные (до 28 дней): 2-3 г (до 4 г) липидов/кг массы тела/сут, что соответствует 20-30 мл (до 40 мл)/кг массы тела/сут. Дети с 29 дней до 5 лет включительно: 1-3 г липидов/кг массы тела/сут, что соответствует 10-30 мл/кг массы тела/сут. | По показаниям | |
| 13. | Глюкоза 5% | в\в | Детям для парентерального питания наряду с жирами иаминокислотами в первый день вводят 6 г/кг/сут, в последующем – до 15 г/кг/сут. При расчете дозы следует принимать во внимание допустимый объем вводимой жидкости: для детей с массой тела 2-10 кг – 100-165 мл/кг/сут, детям с массой тела 10-40 кг – 45-100 мл/кг/сут. | По показаниям | |
| 14 | Глюкоза 10% | в\в | Детям для парентерального питания наряду с жирами иаминокислотами в первый день вводят 6 г/кг/сут, в последующем – до 15 г/кг/сут. При расчете дозы следует принимать во внимание допустимый объем вводимой жидкости: для детей с массой тела 2-10 кг – 100-165 мл/кг/сут, детям с массой тела 10-40 кг – 45-100 мл/кг/сут. | По показаниям | |
| 15. | Глюкоза 15% | в\в | Детям для парентерального питания наряду с жирами иаминокислотами в первый день вводят 6 г/кг/сут, в последующем – до 15 г/кг/сут. При расчете дозы следует принимать во внимание допустимый объем вводимой жидкости: для детей с массой тела 2-10 кг – 100-165 мл/кг/сут, детям с массой тела 10-40 кг – 45-100 мл/кг/сут. | По показаниям | |
| Противовирусные препараты | |||||
| 16. | Неоцитотек | в\в | не менее 2 мл/кг каждые 2 дня | По показаниям | |
| Гемостатики | |||||
| 17. | Этамзилат | в\в | Однократная доза 12,5 мг/кг массы тела (0,1 мл = 12,5 мг). Введение препарата проводят каждые б часов в течение 4 суток до совокупной дозы 200 мг/кг. | По показаниям | |
| Желчегонные препараты | |||||
| 18 | Урсодезоксихолевая кислота | внутрь | Суточная доза препарата составляет 10 мг/кг/сут., принимают однократно вечером. | 10-14 дней | |
diseases.medelement.com
Атрезия желчевыводящих путей: диагностика и лечение патологии
Атрезия желчевыводящих путей – сложное патологическое состояние, характеризующееся частичным или полным заращением желчных ходов. Это довольно редкий врожденный порок развития. Билиарная атрезия у детей составляет 8% от всех возникающих патологий органов.
Что такое атрезия
Это состояние, встречающееся у новорожденных: один случай на 30 тыс. родов, причем у девочек недуг появляется несколько чаще, нежели у мальчиков. Единственная действенная помощь таким детям – хирургическое вмешательство. Процедура предполагает создание искусственного протока или полную пересадку печени. Все же после операции риск смертельного исхода составляет более 50%.
Болезнь очень опасна, поэтому важно выявить патологию как можно раньше и оказать ребенку помощь своевременно, в противном случае дети погибают в первые месяцы жизни. Развивается печеночная недостаточность, интоксикация на фоне инфицирования.
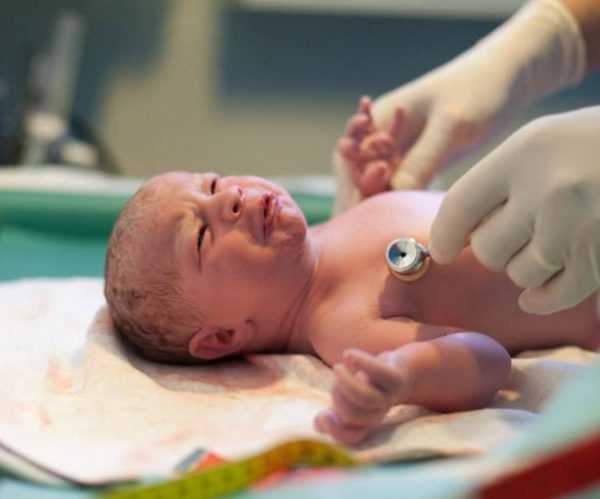
В период внутриутробного развития у плода прогрессирует воспаление, процесс имеет длительное вялотекущее течение. В результате возникает атрезия желчных путей, проток частично сужается или зарастает полностью. Нарушается функция каналов, воспалению подвергаются внутренние и наружные желчные и печеночные протоки.
Заболевание редко протекает как самостоятельное, сопутствующие патологии: деформация костей черепа и позвоночника, патологии органов выделительной системы, а также сосудистой и сердечной.
Причины патологии
Факторы развития патологии полностью не изучены. Большая часть заболевших младенцев имеет полностью сформировавшиеся протоки. Но патологически разрастающаяся соединительная ткань нарушает их проходимость вплоть до полного зарастания жёлчных путей. Желчь не выводится из-за сужения просвета, или прогрессирующий инфекционный процесс разрушает стенки сосудов изнутри.
Деструкция происходит по причине заражения плода от беременной такими инфекциями, как краснуха, герпес, цитомегаловирусная инфекция, ОРВИ или внутриутробный гепатит. Процесс приводит к повреждению гепатоцитов и эндотелия желчных протоков. Впоследствии возникает застой желчи и фиброз протоков.
Иногда непроходимость связана с ишемией и развивается в период новорожденности как следствие воспалительного заболевания. В таком случае болезнь не считается врожденной.
Развитие основных органов и систем плода при беременности происходит в первые два месяца. Возникает атрезия на стадии эмбриогенеза. Так называемая истинная атрезия желчевыводящих путей появляется вследствие нарушения внутриутробной закладки органов и характеризуется полным отсутствием всех протоков, а иногда и самого желчного пузыря.

Проявления заболевания
Непроходимость протоков дает о себе знать появлением желтухи сразу после рождения ребенка. Если у малыша нет других отклонений, а все показатели в норме, ошибочно желтуху диагностируют как физиологическую, упуская время для лечения. При атрезии этот признак прогрессирует, нарастает, возникает печеночная недостаточность. Моча у новорожденного приобретает цвет пива, а стул становится почти белым. Если на протяжении 10 дней цвет кала не изменяется, это говорит о непроходимости желчных протоков. Симптомы могут нарастать на протяжении 1,5 месяцев. Со временем желтушность появляется на глазных яблоках, заметно увеличивается и уплотняется печень и селезенка. Возникают другие признаки:
- исчезает аппетит;
- ребенок теряет в весе;
- отстает физическое развитие младенца;
- малыш становится вялым, слабым;
- уменьшается двигательная активность.
Желтуха кожных покровов сопровождается сильным зудом, ребенок становится беспокойным. На теле появляются желтоватые прыщики – доброкачественные жировые отложения. К шести месяцам у ребенка может развиться цирроз тканей печени. От повышенного давления страдает вена, которая обеспечивает кровоток кишечника.

Из-за отмеченных нарушений в брюшине собирается жидкость. Появляются кровоизлияния не только на слизистой пищевода, но и на коже. Состояние усугубляется кровавой рвотой, признаками рахита, нервно-мышечными расстройствами. Если вовремя не приняты меры, продолжительность жизни таких деток исчисляется периодом от 10 до 18 месяцев.
Диагностика
В первые дни жизни младенца сложно отличить физиологическую желтуху новорожденных от патологии желчных протоков, поэтому лучший срок для постановки диагноза – после первой недели жизни и до полутора месяцев.
Особенно следует обратить внимание на то, что желтушность не убывает со временем, а нарастает.
Атрезия желчных протоков имеет несколько форм: это гипоплазия и атрезия, расстройство ветвления и слияния, перфорация, стеноз и кисты холедоха, желчных ходов. В зависимости от локализации патологии различают атрезию внепеченочных протоков, нарушения внутри печени и заболевание смешанного типа.
По месту сужения протоков (печеночного, желчного) различают корригируемую и некорригируемую непроходимость главных каналов. Если все протоки внутри покрыты волокнистой тканью, патология считается некорригируемой. Сложность непроходимости каналов, область атрезии, ее характеристики напрямую влияют на выбор техники проведения оперативного вмешательства.

Лечение
Болезнь лечится только оперативным путем. Хирургическое вмешательство выполняют детям до двухмесячного возраста. Важно при малейшем подозрении на атрезию обратиться к доктору и пройти обследование.
Поздно проведенная операция повышает риск гибели ребенка, процент выживших детей резко сокращается, так как появляется угроза цирроза печени.
Операция заключается в создании адекватного оттока для желчи. Чаще всего используется реконструктивная методика Касаи – по имени японского хирурга. Выполняется наложение анастомоза, соединяющего ворота печени и тонкую кишку. Операция обеспечивает положительный эффект на длительный период. Однако возможны послеоперационные осложнения в виде холангита или абсцесса печени из-за инфицирования тканей.
Если операция проведена своевременно, наблюдается положительная динамика, исход благоприятен у 30% детей. Когда от лечения нет эффекта, заращением охвачены внутрипеченочные протоки или невозможна реконструктивная операция, возникает необходимость полной пересадки печени.
prozhelch.ru
Атрезия билиарная
Атрезия билиарная (синоним — атрезия желчевыводящих путей) — это редко встречаемая аномалия развития, которая представляет собой отсутствие или непроходимость желчевыводящих путей.
Желчевыводящая система представляет собой целую сеть желчных протоков, где малые протоки впадают в большие. Из общежелчного протока желчь попадает непосредственно в двенадцатиперстную кишку.
Но иногда во время эмбриогенеза нарушается формирование желчевыводящих путей. Такие протоки либо вообще остаются несформированными, либо непроходимыми. В таком случае желчь вырабатывается, но не выводится в кишечник, а накапливается в системе желчных протоков.
Причины
Причины болезни до конца не известны. Медики предполагают, что причинами аномалии могут быть инфекции, перенесенные ребенком внутриутробно, а также генетические изменения.
Виды аномалии
В зависимости от локализации участка непроходимости желчевыводящих путей выделяют такие типы заболевания:
- Атрезия внутрипеченочных желчных путей;
- Атрезия внепеченочных желчных путей;
- Смешанная атрезия.
Симптомы заболевания
Рождаются дети обычно с нормальным весом. Но в дальнейшем они не набирают необходимую массу тела, отстают в физическом развитии.
Основным симптомом билиарной атрезии является желтуха. Этот симптом возникает на третий-четвертый день жизни ребенка. Поэтому важно дифференцировать это состояние с физиологической желтухой. Для атрезии билиарной характерно то, что желтуха с каждым днем становится все более выраженной, кожа приобретает зеленоватый оттенок.
При этом кал бесцветен, а моча приобретает темный, насыщенный оттенок. По мере прогрессирования болезни наблюдаются увеличения печени, селезенки, развитие асцита.
Чем опасно заболевание?
Опасность заболевания, прежде всего, заключается в развитии цирроза печени и затем органной недостаточности. Отсутствие хирургического лечения приводит к смертельному исходу.
Диагностика
Симптомы атрезии желчевыводящих путей не специфичны. Чтобы дифференцировать аномалию развития с другими вероятными заболеваниями проводят такие методы исследования:
- Биохимический анализ крови — определяется высокий уровень прямого билирубина
- УЗИ печени
- Холангиопанкреатография
- Лапароскопия с биопсией печени
Лечение
Лечение билиарной атрезии возможно только хирургическим путем. Наиболее эффективного результата можно добиться в случае, если операция проводится в период полутора-двух месяцев жизни ребенка. Предпочтение отдают операции Kasai, во время которой формируется анастомоз (соединение) между желчным протоком и тонкой кишкой. Благодаря этому удается устранить препятствие, в результате желчь попадает из желчных путей, как полагается, в кишечник.
Однако операция не устраняет воспаление в желчных протоках. Поэтому в дальнейшем пациентам рекомендуют провести операцию по пересадке печени.
Профилактика послеоперационных осложнений
После хирургического вмешательства важно не допустить холангита — воспаления желчных путей. Для этого используют антибактериальные препараты.
gastra.ru
