Подслизистое образование желудка – Подслизистое образование в желудке: причины, лечение
Подслизистое образование в желудке: причины, лечение
В желудке иногда возникают доброкачественные опухоли. Одним из распространенных видов такой онкологии считается подслизистое образование желудка. Это может быть заболевание антрального отдела либо подслизистой. Диагностируется с помощью эндоскопии. Чаще не несет никаких серьезных последствий, но иногда образуется злокачественное образование (фибросаркома, лейомиосаркома).
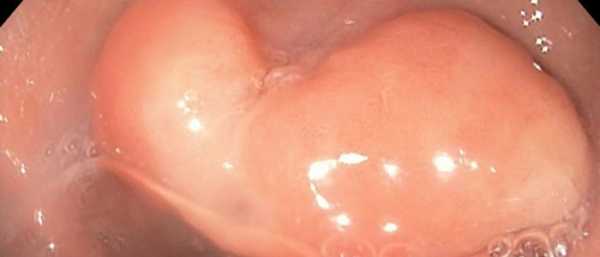
Подслизистая опухоль
Новообразование возникает в мышечной, жировой, нервной или соединительной ткани.
Патологическое формирование растет внутри стенки, в антральном или подслизистом отделении. Различают доброкачественные (липома, лейомиома, гемангиома, фиброма, нейроэндокринная) и злокачественные (лейомиосаркома, фибросаркома). Липомы и фибромы образуются в слизистом слое, лейомиомы — в мышечных и нервных тканях, а в сосудах — гемангиомы. Так как заболевания чаще не опасны для жизни, то они на работу соседних органов не влияют.
Рост протекает медленно и незаметно для больного. Тела опухолей могут быть различных размеров (доброкачественные 3—4 см), иметь разные контуры и находится в хаотическом порядке на разных слоях желудка. Подслизистые образования зачастую имеют гомогенные характер и четкие контуры. Опухоли с неровными краями, с гиперэхогенными включениями чаще характеризуются как злокачественные.
Вернуться к оглавлениюПричины появления
 Гастрит может являться причиной образования карциномы.
Гастрит может являться причиной образования карциномы.До конца неизвестны точные факторы возникновения. Но врачи называют несколько вариантов, почему появляется карцинома. Причины общие для всех видов опухолей:
- гастрит, язва желудка;
- бактерия хеликобактер пилори;
- генетическая предрасположенность;
- неправильное питание;
- химическое воздействие на организм;
- вредные привычки (курение и алкоголь).
Симптомы заболевания
Чаще возникает у людей старше 40 лет. Развитие онкологии незаметно для больного. Его обнаруживают случайно во время проведения эндоскопии. Но если карцинома достигла больших размеров, то пациента беспокоят тошнота, рвота, ноющая боль и запоры. Лейомиомы вызывают внутреннее кровотечение, потому люди с такой патологией ощущают постоянную слабость. Злокачественные образования провоцируют метастазирование. Из-за них происходит кровотечение в желудке, снижение полости его стенок и быстрая потеря веса. Иногда такие образования изменяют кислотность желудка.
Вернуться к оглавлениюМетоды диагностики
Эндоскопия является основным способом диагностики заболевания.Основными способами исследования является рентгенография и эндоскопия. Второй вариант диагностирования более точный. Врач может определить месторасположение, ее контур и размер. Для подтверждения диагноза применяется:
- рентгенография с двойным контрастирования позволяет определить наличие опухоли и ее расположение;
- биопсию для более точного определения и подтверждения злокачественности;
- УЗИ или МСКТ, чтобы выявить наличие метастазов;
- анализы крови, которые нужны для определения общего состояния пациента.
Лечение заболевания
Подслизистые образования устраняются медикаментозным способом. Только если карцинома злокачественная, требуется срочное хирургическое вмешательство. Но проводится удаление и доброкачественных образований, чтобы не возникало негативных последствий. Удаляется либо только полип, либо и близлежащие к нему ткани. Перед операцией проводится гистологическое исследование. После назначается терапия препаратами: прописываются антибиотики, останавливающие размножение хеликобактерий и ингибиторы протонной помпы.
Шансы на выздоровления большие, но случаются рецидивы. Чтобы это предотвратить, больному нужно проводить своевременное обследование. Пациенты после операции всю жизнь находятся под наблюдением врачей. Для профилактики рекомендуется правильное питание, отказ от вредных привычек и регулярные консультации у гастроэнтеролога. Такая же проверка необходима людям с наследственной склонностью к заболеванию. Без своевременного обследования и лечения опухоли трансформируются в рак желудка.
etozheludok.ru
Лейомиома желудка: лечение, прогноз, профилактика
Лейомиома желудка относится к доброкачественным новообразованиям. Возникает болезнь в результате разрастания гладких мышц. Это вид опухоли располагается не только в желудке, но и в матке или кишечнике. Чаще всего она небольших размеров и по этой причине может долгое время никак себя не проявлять. Первые серьезные симптомы начинают беспокоить при больших размерах опухоли. Отсутствие правильного лечения приводит к преобразованию лейомиомы в злокачественное состояние.
Эпидемиология
Диагноз лейомиома желудка, согласно последним статистическим данным, редко встречается в онкологии. Среди миомных поражений около 2% приходятся на лейомиосаркому. Обычно ей подвержены люди после 50 лет. Локализоваться в виде одиночных узлов она может в любом отделе желудка, но чаще это касается антрального отдела. По мере роста лейомиома распространяется в просвет желудка или располагается в подслизистом слое.
Вернуться к оглавлениюПричины
Найти точную причину, почему возникает лейомиосаркома, врачам до сих пор не удалось. Большое количество негативных факторов приводят к развитию данного заболевания:
- неправильное или неполноценное питание, злоупотребление жирной и острой пищей приводит к разрушению стенок желудка, что провоцирует активное разрастание гладких мышц ;
- отсутствие в рационе витаминов и минералов;
- воздействие на организм радиации и ульрафиолета, например, любым видам опухолей больше подвержены люди, которые часто летают на самолетах и проходят пропускной контроль через рентгеновские арки;
- районы с плохой экологией провоцируют не только загрязнение легких, но и всего организма;
- слабая иммунная система;
- нарушение гормонального фона вызывает рост опухолей из-за значительного разрастания клеток;
- влияние определенных бактерий и вирусных заболеваний, например, бактерия Helicobacter pylori может стать причиной не только лейомиомы, но и антрального гастрита;
- воспаление слизистой оболочки желудка;
- нервное напряжение и стресс;
- наследственная предрасположенность к заболеваниям желудка.
Симптоматика
Диагностировать начальную стадию лейомиомы желудка сложно, так как при небольших размерах она не беспокоит. Основные симптомы проявляются, когда опухоль начинает увеличиваться в размерах и кровоточить. Чаще лейомиосаркома диагностируется при таких симптомах:
- головокружение и слабость, которые характеры для внутреннего кровотечения;
- резкое снижение массы тела, что связано с разрушением слизистой желудка и ее неспособностью впитывать питательные вещества;
- снижение уровня гемоглобина в крови и, наоборот, повышение количества лейкоцитов может свидетельствовать о кровотечении внутренних органов;
- сильная боль в области желудка после приема пищи;
- темный цвет кала — признак кишечного или желудочного кровотечения;
- постоянная усталость;
- бледность кожных покровов из-за кровопотери и анемии;
- возникает частая изжога по причине выбрасывания желудочного сока в пищевод, так как желудок уменьшается в размерах из-за опухоли.
Диагностика
Для постановки точного диагноза и обнаружения лейомиомы используется комплексная диагностика, которая включает в себя такие методы:
- сбор анамнеза о пациенте, то есть условия проживания, место работы, состояние здоровья в последнее время;
- при физическом осмотре проводится пальпация в области желудка и выявление болезненных ощущений;
- необходимо сдать анализ крови, мочи, и кала на обнаружение в нем крови;
- фиброгастроэндоскопия позволит оценить состояние пищеварительного тракта;
- ультразвуковая диагностика (УЗИ) дает возможность определить размеры опухоли и ее локализацию;
- дополнительно назначается бактериальный анализ на наличие бактерий, вызывающих язвенные состояния;
- с помощью компьютерной томографии можно узнать о происхождении этого вида саркомы, так как проводится полное сканирование органа.
Методы лечения лейомиомы желудка
При назначении метода лечения важную роль играют размеры опухоли и общее состояние пациента. Если подслизистое образование до 3 см, в этом случае проводится гастроэндоскопия. Локальное удаление опухоли позволит сохранить здоровые желудочные ткани. Хирургическая полостная операция применяется только при больших размерах образования. В послеоперационный период назначаются противовоспалительные медикаменты и антибиотики. Также назначаются лекарства, которые снижают уровень соляной кислоты. Подслизистая в этом случает восстанавливается намного быстрее.
Вернуться к оглавлениюНетрадиционное лечение
 Обязательно необходимо отказаться от острого, жирного, копченого.
Обязательно необходимо отказаться от острого, жирного, копченого.В послеоперационный период пациент должен соблюдать строгую диету и соблюдать рекомендации лечащего врача. Обязательный отказ от острого, жирного, копченого, тяжелых для желудка продуктов; кофе и алкогольных напитков. В рацион должны входить различные виды каш, нежирное мясо, овощные пюре, молочные продукты и рыба.
Эффективно восстановить организм после операции помогут народные средства. Прием противоопухолевых сборов позволит существенно улучшить общее состояние и благоприятно влияет на подслизистые: сбор травы подорожника, чистотела, ромашки, зверобоя, калгана, календулы, татарника, корня аира. Кроме названных трав, могут использоваться настойки барвинка, аира, омелы, татарника.
Вернуться к оглавлениюПоследствия и осложнения
Тяжелые последствия и осложнения возникают при несвоевременном обращении к врачу. В этом случает опухоль перерастает в злокачественную, которая провоцирует развитие метастазов в другие органы.
Вернуться к оглавлениюМогут возникать другие осложнения: кровоизлияния, возникновение перитонита, существенное уменьшение поверхности желудка, распространение образования в двенадцатиперстную кишку.
Прогноз и профилактика
После операции необходимо избавиться от вредных привычек.После выполнения назначений врача или после хирургического вмешательства, лейомиома желудка обычно имеет благоприятный прогноз на выздоровление. Это зависит и от ранней диагностики и правильного метода удаления опухоли.
Определенных методов профилактики данного вида заболевания нет. Так как часто лейомиома развивается бессимптомно, оптимальным вариантом профилактики будет регулярное посещение специалистов. К методам профилактики желудочной онкологии относятся здоровый образ жизни, правильное питание и отказ от вредных привычек.
tvoyzheludok.ru
Эндоскопические признаки доброкачественных опухолей желудка
Полип — доброкачественная опухоль из эпителиальной ткани, растущая в просвет органа. Термин «полип» возник для определения образований на слизистой носовых ходов. Первое описание макроскопического состояния полипа желудка сделал Оматус Люсинатус в 1557 г. На основании клинического обследования диагноз полипа желудка впервые поставил Образцов — при исследовании промывных вод желудка. В 1912 г. Хосреф, оперируя эту больную, нашёл у неё полип. Впервые при гастроскопии полип обнаружил Шиндлер в 1923 г. В настоящее время к полипам желудка относят регенераторные, воспалительные и опухолевые изменения слизистой оболочки.
Частота заболевания. Полипы желудка диагностируются:
- 0,5% всех секций,
- 0,6% больных при рентгеноскопии желудка,
- 2,0-2,2% больных, направленных на гастроскопию.
Локализация. Антральный отдел — 58,5% всех полипов желудка, тело желудка — 23,2%, кардия — 2,5%. На уровне пищевода и двенадцатиперстной кишки от 0,01 до 0,18% случаев.
Полипы могут быть одиночными и множественными. Если несколько полипов формируются в пределах одного сегмента органа — множественные полипы, если в двух и более сегментах органа — полипоз. Около 50% полипов желудка протекают бессимптомно.
Причины образования полипов.
- Воспалительная теория (Славянский и его ученики). Полип есть результат продолжающегося воспаления ЖКТ. При воспалении развивается экссудация и пролиферация. Когда пролиферация железистого эпителия преобладает над покровным — возникает полип. Следующий этап развития полипа — рак ( в настоящее время данных за это нет).
- Теория эмбриональной эктопии (Давыдовский, 1934 г.). Формирование полипа — результат эмбриональной эктопии. Как пример — полипы у детей и эмбрионов.
- Дисрегенераторная теория (Лозовский, 1947 г.). Воспаление играет роль в образовании полипов, но само по себе оно не определяет необходимость формирования полипов. Слизистая оболочка ЖКТ обладает очень высокой потенцией к росту, что компенсирует повреждение тканей при воспалении, но если травматизация происходит часто — нарушается регенерация (координация между процессом пролиферации и процессом стабилизации) и формируется полип.
Классификация полипов
Анатомическая классификация полипов.
- По форме ножки:
- полипы на ножке — имеют чётко выраженную ножку и головку, для них характерен магистральный тип кровоснабжения;
- полипы на широком основании — не имеют ножки, их основание чётко отграниченное, в отличие от подслизистых и полиповидных опухолей. Характерен рассыпной тип кровоснабжения.
- По форме полипа:
- шаровидные,
- цилиндрические,
- грибовидные,
- конические,
- плоские.
- Конические и плоские полипы обычно ножку не имеют, кровоснабжение по рассыпному типу.
Морфологическая классификация полипов (ВОЗ).
- Аденомы.
- папиллярные;
- тубулярные.
- Воспалительные полипы (эозинофильные гранулёмы).
- Полипы Пейтц-Егерса.
Аденомы. Представляют собой разрастания железистого эпителия и стромы. У папиллярных аденом железистый эпителий в виде отдельных тяжей, у тубулярных аденом — в виде ветвящихся структур, пронизывающих весьполип. Обычно имеют ровную поверхность, мягкую консистенцию, цвет зависит от изменений в слизистой оболочке, покрывающей полип (чаще воспалительного характера): может быть красноватого, ярко-красного цвета, пятнистой окраски — эрозии с налётом фибрина.
При захвате полипы смещаются вместе со слизистой, из которой они исходят, при этом образуется складка в виде псевдоножки. При подтягивании и смещении полипа он свою форму не меняет. Кровотечение при биопсии неактивное. Аденомы могут быть гиперпластическими, когда есть атипия (например, кишечный эпителий). Аденоматозные полипы относят к предраковым заболеваниям.
Воспалительные (гиперпластические) полипы. Составляют 70-90% всех полипов желудка. Развиваются в результате гиперплазии фиброзных и лимфоидных структур из подслизистого слоя или из собственной пластинки слизистой оболочки. Определяется лимфоидная, гистиоцитарная и плазмоцитарная инфильтрация с примесью эозинофилов. Чаще располагаются на слизистой антрального отдела или нижней трети тела желудка. Часто сопутствуют язве двенадцатиперстной кишки (луковицы), при которой нарушается функция привратника, что приводит к рефлюксу жёлчи, а жёлчь вызывает воспалительные изменения слизистой желудка и формирование эрозий. Выглядят в виде округло-цилиндрических возвышений на слизистой оболочке на широком основании с уплощённой верхушкой, в области уплощения или эрозия, или беловато-серая рубцовая ткань. Консистенция плотная.
Полипы Пейтц-Егерса. Множественные полипы, внешне мало чем отличающиеся от аденом, но имеют плотную консистенцию. Имеют богато разветвлённую гладкомышечную строму, которая пронизывает весь полип. Слизистая полипа имеет обычную железистую структуру. Располагаются чаще на границе антрального отдела с телом желудка.
Подслизистые (неэпителиальные) опухоли желудка
Часть опухолевидных образований может быть не полипами, а подслизистыми опухолями и другими образованиями. Растут они из неэпителиальной (нервной, мышечной, жировой, соединительной) ткани, нередко бывают смешанными и могут быть доброкачественными и злокачественными. Макроскопическая диагностика подслизистых опухолей затруднена в связи с идентичностью эндоскопических признаков эпителиальных, неэпителиальных и воспалительных новообразований. Частота установления правильного диагноза на основании визуальных данных составляет 48-55%.
Эндоскопическая картина подслизистых опухолей определяется характером их роста, расположением в стенке органа, размером, наличием осложнений, техникой эндоскопического обследования, количеством введенного воздуха и степенью растяжения стенок желудка: чем больше нагнетается воздуха и сильнее растягиваются стенки, тем рельефнее и чётче опухоль. Рост опухолей может быть экзо-, эндофитным и интрамуральным.
В типичных случаях подслизистые опухоли представляют собой новообразования округлой формы (от уплощённой до полусферической в зависимости от глубины расположения) с очерченными границами. Могут быть разных размеров — от небольших (1-2 см) до значительных (10-20 см). Последние занимают бьльшую часть органа, и тщательная ревизия их невозможна.
Поверхность подслизистых опухолей зависит от характера покрывающей её слизистой оболочки. Она может быть ровной и складчатой. При инструментальной «пальпации» слизистая над опухолями больших размеров обычно подвижна, а при наличии воспалительных изменений спаяна с тканью опухоли и неподвижна. Слизистая небольших подслизистых опухолей малоподвижна.
Слизистая оболочка над опухолями обычно не изменена, но могут отмечаться воспалительные (отёк, гиперемия) и деструктивные (кровоизлияния, эрозии, изъязвления) изменения. Нередко обнаруживают втяжения слизистой, обусловленные её сращением с тканью опухоли. Основание подслизистых опухолей плохо дифференцируется в связи с наличием складок слизистой оболочки. При нагнетании воздуха складки расправляются и основание опухоли контурируется лучше. При инструментальной «пальпации» можно определить консистенцию и подвижность опухоли.
На основании визуальных данных очень трудно определить морфологическую структуру (липома, миома) и доброкачественность опухоли. Макроскопически доброкачественные опухоли (с неизменённой слизистой оболочкой, выраженным основанием) могут оказаться злокачественными и, наоборот, злокачественные по виду опухоли — доброкачественными. Имеются, однако, признаки, благодаря которым при эндоскопическом исследовании можно с определённой долей вероятности утверждать о доброкачественности опухоли:
- Симптом шатра: слизистая оболочка над опухолью может быть приподнята при помощи биопсийных щипцов как шатёр.
- Признак Шиндлера: конвергенция складок слизистой оболочки к опухоли в виде дорожек.
- Симптом подушки: поверхность опухоли может быть вдавлена при нажатии на неё биопсийными щипцами (например, при липоме).
Фиброма. Исходит из подслизистого слоя желудка. Очень плотной консистенции. При пальпации выскальзывает из-под пальпатора (нет сращения со слизистой). Положительный симптом шатра. Биопсия не даёт представления о характере подслизистой опухоли.
Липома. Исходит из подслизистого или субсерозного слоёв. Трудности при дифференциальной диагностике возникают в основном при липомах, расположенных в подслизистом слое. При пальпации мягкая, при контакте с инструментом не ускользает. Если опухоль придавливается пальпатором, в ней образуется вдавление. При биопсии — неизменённая слизистая.
Лейомиома. Чаще конической формы. Окраска слизистой над ней нередко интенсивно-красная (просвечивает опухоль). Консистенция мягкая. По её поверхности иногда удаётся проследить радиарную исчерченность в виде узких полос красноватого цвета — сосуды (опухоль хорошо кровоснабжается). Нередко опухоль прорастает слизистую оболочку — тогда при биопсии удаётся установить её морфологическую структуру. Кровотечение при биопсии активное.
Ксантома. Опухоль состоит из липофагов. Опухоль желтоватой окраски. Форма различная, чаще неправильно-округлая или овальная. Над поверхностью слизистой оболочки выступает незначительно. Размеры от точечных до 0,6-1,0 см. При биопсии активно кровоточит.
Биоптат всегда подтверждает морфологическую структуру. Ксантомы на слизистой двенадцатиперстной кишки требуют особого внимания, т.к. их можно спутать с карциноидом, который озлокачествляется значительно чаще.
Эктопированная поджелудочная железа. Всегда располагается в антральном отделе на задней стенке или большой кривизне, ближе к привратнику. Внешним видом напоминает воспалительный полип, в отличие от которого в зоне уплощённой вершины нет эрозий или фиброзно изменённых тканей. Отличительным признаком является отверстие в центре верхушки, соответствующее рудиментарному протоку. При захвате биопсийными щипцами вершины опухоли она свободно смещается в виде хоботка, отпущенная она вновь втягивается в вершину опухоли, не сохраняя форму хоботка.
Карциноид. Это опухоль, занимающая промежуточное место между доброкачественными и злокачественными опухолями. Исходит из ткани базальной мембраны слизи стой оболочки. Прокрашивается серебром — аргентофильная опухоль ЖKT. Имеет округлую или коническую форму, основание широкое, отграниченное от окружающих тканей. Окраска обычно пятнистая за счёт чередования белесовато-красноватых тонов. Имеет наклонность к раннему эрозированию и метастазированию. Истинный характер точно устанавливается на основании биопсии.
Лимфофолликулярная гиперплазия. Гиперплазия в лимфоидном аппарате слизистой оболочки или подслизистого слоя. Образования округлой формы на широком основании. Размеры могут быть от точечных до 0,3-0,4 см. Консистенция плотная. Слизистая в пределах гранулём инфильтрирована. При биопсии лимфоидная и гистиоцитарная инфильтрация с примесью желез кишечного типа. Цвет серовато-белесоватый или серовато-желтоватый.
Метастазы меланомы в слизистую желудка. Имеют округло-цилиндрическую форму, напоминают воспалительный полип, в отличие от которого в области уплощённой вершины слизистая синевато-дымчатого или коричневого оттенка. При биопсии кровоточивость обычная или снижена. Отмечается фрагментация. Консистенция плотная. Истинный характер устанавливается на основании биопсии.
[1], [2], [3], [4], [5], [6], [7], [8], [9], [10], [11], [12], [13], [14], [15], [16]
ilive.com.ua
Подслизистое образование желудка — Онкология
анонимно (Женщина, 39 лет лет)
Подслизистое образованиеЗдравствуйте! При профосмотре методом ФГДС поставлен диагноз лейкоплакия н/3 пищевода, поверхностный гастрит. Сдала биопсию пищевода,заключение биопсии- материал представлен 6 фрагментами серой ткани, гистологически- фрагменты гиперплазированного многослойного плоского эпителия (лейкоплакия). Решила…
анонимно (Женщина, 39 лет лет)
Подслизистое образование желудкаЗдравствуйте, прошу консультации по следующему вопросу: 5 лет назад при фгдс был обнаружен полип желудка, последующая гистология подтвердила железистый полип. Показано динамическое наблюдение. ФГДС прохожу раз в год, последние три…
анонимно (Женщина, 32 года лет)
Подслизистое образование 1см в желудкеДобрый день уважаемые доктора. Очень надеемся на вашу консультацию, так как находимся в легкой панике и сильном расстройстве. Жена (32 года, 179 см, 73 кг, без вредных привычек) вчера сходила…
Илья ……. (Мужчина, 29 лет лет)
Подслизистое образование антрального отдела желудкаЗдравствуйте доктор!!!Мне месяц назад была сделана операция по удалению пупочной грыжи,недавно начались боли в облости живота,пошел к хирургу который оперировал,осмотрев меня сказал что в облости грыжи нет ничего(все нормально,образуеться рубец).Инаправил…
Илья ……. (Мужчина, 29 лет лет)
Подслизистое образование антрального отдела желудкаЗдравствуйте доктор!!!Мне месяц назад была сделана операция по удалению пупочной грыжи,недавно начались боли в облости живота,пошел к хирургу который оперировал,осмотрев меня сказал что в облости грыжи нет ничего(все нормально,образуеться рубец).Инаправил…
анонимно
Подслизистое образование желудкаДобрый день,Елена Сергеевна! Мне 59 лет. В октябре 2012 года на ЭГДС было обнаружено полиповидное образование привратника желудка 0,4см в диаметре, высотой 0,3см. В июне 2013г.,при повторной ЭГДС, в антральном…
анонимно
Подслизистое образование желудкаЗдравствуйте,Павел Михайлович! Мне 59 лет. В ноябре 2012 г. у меня на гастроскопии был обнаружен полип желудка размером 5 мм. и смешанный гастрит. Дополнительных обследований назначено не было. Сегодня, т.е….
health.mail.ru
Опухоль в желудке лечение. Подслизистая опухоль желудка
Под недугом, поражающим слои желудка, понимается доброкачественная или злокачественная опухоль желудка, которые по-разному влияют на здоровье как детей, так и взрослых. В последнее время динамика развития опухолей снизилась. Для недуга характерны такие основные признаки, как общая слабость, резкое похудение, чувство дискомфорта при переваривании пищи, непроходимость привратника, состояние депрессии. В медицине существует множество диагностических способов (биопсия, эндоскопия), которые помогут вовремя выявить новообразование.
Что подразумевают под образованием опухолей в желудке?
По своей природе опухоли быстро развиваются, имея определенные факторы развития и степень разрастания. Реже встречаются доброкачественные образования (миомы, фибромы и т. д.), представленные в виде полипов. В остальных случаях развиваются злокачественные новообразования, такие как рак. Заболевание чаще диагностируется у мужчин, женщины страдают в 1,5 раза реже. При этом среди пациентов больше встречают людей возрастом от 50 лет, среди малышей возможны редкие случаи.
По статистике уровень развития опухолей в последние 10 лет снизился . В качестве факторов развития такого явления врачи называют своевременное выявление и лечение опухолей. Придерживаются мнения, что это связано с очисткой организма от Хеликобактер пилори. Бактерия с легкостью вызывает язвенное заболевание, которое со временем перерастает в опухоли желудка.
Классификация доброкачественных и злокачественных опухолей и их размеры
В зависимости от степени дифференцировки опухоли делят на два типа. К первому типу относят доброкачественные опухоли желудка, имеющие два подвида — эпителиальный и не эпителиальный. К эпителиальному типу относятся полипы и тубулярная аденома желудка, которые имеют разную форму и размеры. При наличии большого количества полипов говорят о развитии полипоза. Для недуга характерно появление таких проявлений, как и при гастрите. Больные страдают от резких болевых ощущений, которые распространяются на всю область живота. Доброкачественные опухоли желудка данного типа вылечивают только с помощью операции, поскольку только так организм очищается от ненужных наростов.
Ко второму подвиду относится миома, липома желудка, фиброма, гемангиома, хористома, которые реже всего диагностируются у пациентов. Чаще встречается миома. При исследовании миомы акцентируют внимание на анамнезе и клинических данных. Течение болезни, появление симптомов зависят от того, какой участок поразил недуг. Болевые ощущения в эпигастральной зоне усиливаются, если пациент меняет положение тела. Благодаря рентгену определяют степень развития недуга, его форму.
В классификации, кроме доброкачественных опухолей, выделяют злокачественное образование, которое делится на два типа. К эпителиальному типу относят раковые опухоли, занимающие первое место среди онкологических недугов. По статистике, онкологическая симптоматика чаще проявляется у мужчин, чем у женщин. Проявления напрямую зависят от того, какая стадия и форма развития недуга, какова причина развития. Выделяют такие подвиды недуга: экзофитные разрастания, уплощенные и язвенные. Экзофитная и язвенная формы недуга, распространяясь на соседние органы, ведут к срастанию опухолей между собой. Например, скирр, меланома, бластома распространяются по слизистой оболочке быстрыми темпами, захватывая крупный желудочный участок.
Еще одним типом являются злокачественные не эпителиальные проявления, среди которых чаще выделяется саркома. Болезнь распространяется в 1,5 раза реже у женщин, чем у мужчин. При этом появляются различные виды сарком, которые отличаются болевыми ощущениями, переходящими в левое подреберье. Опухоль становится очень большой, что затрудняет лечебный процесс.
Причины и симптомы заболевания
Одной из причин болезни является бактерия Хеликобактер пилори.
Проблема факторов развития опухолей желудка не изучена до конца. Однако выделяют предрасполагающие факторы, к которым относят:
- хронические гастриты, при которых воспаляется слизистая оболочка;
- попадание в организм Хеликобактер пилори, увеличивающей выделение желудочного сока и снижающий защитные свойства организма;
- генетическая предрасположенность, при которой родители передали гены ребенку;
- наличие вредных привычек, таких как курение и злоупотребление спиртными напитками;
- несбалансированный рацион, в котором отсутствуют овощи и фрукты, имеется большое количество жирных, соленых и острых продуктов;
- неблагоприятные условия окружающей среды, заключающиеся в загрязненной экологии;
- резкое или постепенное снижение иммунитета из-за ряда факторов.
У каждого типа патологии симптомы проявляются по-разному. Большая часть доброкачественных опухолей протекает бессимптомно, а выявляют их при обследовании других недугов. Если полипы имеют крупный размер, пациент ощущает ноющие боли после принятия пищи, появляется тошнота и рвота, в которой заметны кровяные прожилки. К проявлениям относят отрыжку, изжогу, слабость, головокружения, запоры, сменяющиеся на поносы.
Симптомы злокачественного недуга возникают на фоне общего здоровья или развиваются вместе с другой патологией, например, хроническим гастритом. На первых этапах у пациента снижается аппетит, после приема пищи начинается боль и чувство перенасыщения. Человек быстрыми темпами теряет вес, у него извращается вкус, в результате чего появляется большая непереносимость некоторых продуктов. Для дальнейших этапов характерно ра
gcchili.ru
ЭНДОСОНОГРАФИЧЕСКАЯ ДИАГНОСТИКА НЕЭПИТЕЛИАЛЬНЫХ ОБРАЗОВАНИЙ ЖЕЛУДКА
ЭНДОСОНОГРАФИЧЕСКАЯ ДИАГНОСТИКА НЕЭПИТЕЛИАЛЬНЫХ ОБРАЗОВАНИЙ ЖЕЛУДКА
Кащенко В. А., Сишкова Е. А., Солоницын Е. Г., Распереза Д. В., Лобач С. М.
Клиническая больница №122 им. Л.Г. Соколова
г. Санкт-Петербург
Неэпителиальные образования – разнородная группа опухолей желудка, исходящих из различных структур стенки. Наиболее часто в желудка выявляют гастроинтестинальные стромальные опухоли (ГИСО) и лейомиомы. Однако, так же могут встречаться липомы, абберантные поджелудочные опухоли, карциноиды, опухоли Абрикосова, кисты, вариксы, метастазы при злокачественных образованиях других органов. Дифференциальная диагностика неэпителиальных образований осложняется трудностями при определении слоя, из которого исходит образование, его распространенности, а так же получением морфологического материала.
На эндоскопическом отделении нашего стационара за – 2011 год было проведено 44 эндосонографических исследований пациентам с подслизистыми образованиями желудка. У троих из них выполнена тонкоигольная аспирационная биопсия. Пациенты были направлены на исследование со следующими диагнозами: подслизистое образование желудка (без уточнения) – 7 чел. (16%), лейомиома – 26 (59%), ГИСО 3(7%), липома 4 (9%), абберантная поджелудочная железа – 3 (7%), карциноид 1 – (2%).
Эндосонография проводилась эхоэндосокпом Olympus GF-UE160 (аппарат с радиальным датчиком). При исследовании обращалось внимание на эхографические свойства образования, слой, из которого исходит образование, внутреннюю структуру, признаки инвазии, увеличение лимфатических узлов. В результате были получены следующие результаты: лейомиома была диагностирована в 25 случаях (57%), ГИСО – 10 (23%), липома 1 (2%), аббератная поджелудочная железа 4 (9%), карциноид 1 – (2%). В 3-х случаях не удалось четко дифференцировать образование. При этом в одном случае это было огромное (около 7 см) образование, которое выходило за зону сканирования. Нельзя было исключить образование поджелудочной железы с инвазией в стенку желудка. В двух случаях нельзя было четко дифференцировать ГИСО и лейомиому.
При сравнении с другими методами исследования чувствительность эндосонографии к таким параметрам, как слой, из которого исходит образование, инвазия за пределы стенки, наличие увеличенных локальных лимфатических узлов значительно превосходила МРТ и КТ.
Наибольшие технические сложности возникали при сканировании образований в антральном отделе желудка. Из этого отдела сложно полноценно удалить воздух и заполнить его жидкостью без риска для пациента, особенно, если образование располагалось близко к малой кривизне. Еще одним сложным для визуализации местом является свод желудка. Однако, зачастую кардиальный отдел и свод удается осмотреть через дистальный отдел пищевода. Исходя из размера образования, тяжелее всего удавалось визуализировать, а в последующем провести дифференциальную диагностику небольших образований (до 1 см), и наоборот очень больших – более 6 см. При этом размер, определяемый эндоскопически в ряде случаев значительно отличался от истинного размера образования.
Пункция образований оказалась эффективна в одном из 3-х случаев, когда была диагностирована лейомиома. В двух случаях был получен клеточный материал, который не позволял провести дифференциальную диагностику между ГИСО и лейомиомой.
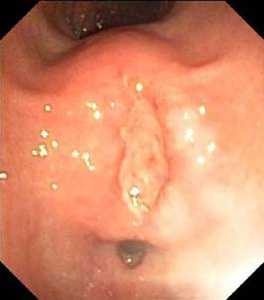
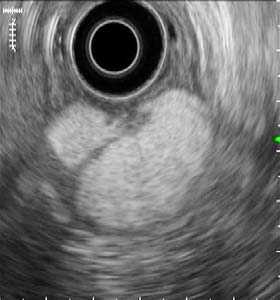
Рис.1. Изъязвленное подслизистое образование, по эндоскопическим признакам более всего напоминающее злокачественную ГИСО (а). По эндосонографически признакам – липома, без инвазии за пределы стенки желудка. Диагноз подтвержден интраоперационно.
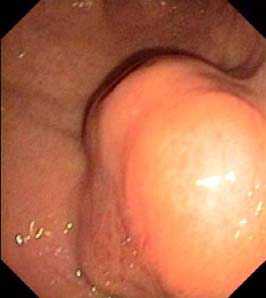
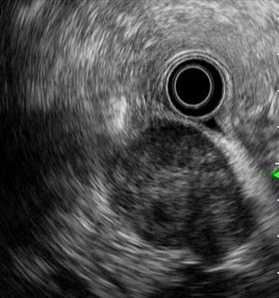
Рис. 2. Подслизистое образование (а) с эндосонографическими признаками инвазии за пределы стенки (б)
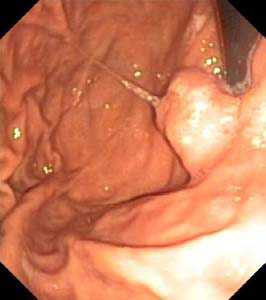
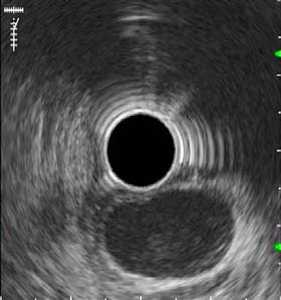
Рис. 3. Подслизистое образвоание, с бугристой эрозированной поверхностью, по эндоскопическим признакам напоминающее ГИСО (а). По эндосонографическим признака лейомиома, расположенная во 2-м слое. Удалена эндоскопически, диагноз подтвержден
Выводы:
Эндосонография – эффективный метод дифференциальной диагностики неэпителиальных образований желудка. Тонкоигольная аспирационная биопсия под эндосонографическим контролем позволяет получить лишь цитологический материал, что не всегда эффективно для дифференциальной диагностики неэпителиальных образований, а так же не позволяет определить индекс злокачественности ГИСО.
rusendo.ru
Подслизистые новообразования желудочно-кишечного тракта в эндоскопической практике — Хирургия. Журнал им. Н.И. Пирогова — 2010-02
Подслизистые новообразования желудочно-кишечного тракта — собирательное понятие, включающее изменения, общим признаком которых является локализация патологического очага подслизистой стенки полого органа. Они составляют до 5% всех новообразований данной локализации и могут быть бессимптомными, являясь случайной находкой при эндоскопическом исследовании (0,4% наблюдений) [50]. По сообщениям некоторых авторов, при патологоанатомических исследованиях умерших в возрасте старше 50 лет подслизистые опухоли пищевода впервые выявляются в 5%, подслизистые опухоли желудка — в 50% случаев [59]. Прижизненно подслизистые новообразования верхних отделов желудочно-кишечного тракта обнаруживаются с различной частотой. Наиболее часто они встречаются в желудке, составляя 60% всех подслизистых новообразований верхних отделов желудочно-кишечного тракта, на долю пищевода приходится 30%, на долю двенадцатиперстной кишки — 10% [47]. В толстой кишке подслизистые опухоли встречаются редко и в общей сложности составляют около 3% всех доброкачественных опухолей толстой кишки [2]. При этом для каждого органа характерно преобладание определенного вида опухоли (табл. 1).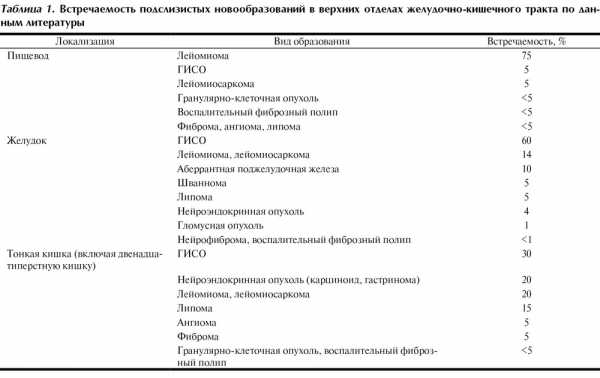
Длительное время подслизистые новообразования трактовались хирургами и эндоскопистами как доброкачественные и в большинстве подлежащие динамическому наблюдению. Исключение составляли новообразования больших размеров, которые имели клинические проявления и вынуждали хирургов к оперативному вмешательству. Подслизистые новообразования наиболее часто выявляются при эндоскопическом или при рентгенологическом исследовании желудочно-кишечного тракта. При рентгенологическом исследовании данные образования выглядят как пристеночно расположенные дефекты наполнения округлой или овоидной формы. Однако данное исследование не позволяет провести дифференциальную диагностику между образованием стенки полого органа и экстраорганно расположенным патологическим очагом. Наиболее эффективным методом диагностики подслизистых опухолей до последнего времени оставалось эндоскопическое исследование, при котором визуализируются округлой или овоидной формы образования, деформирующие просвет органа и покрытые в большинстве наблюдений неизмененной слизистой. По косвенным эндоскопическим признакам можно предположить, что данное образование исходит из стенки полого органа, однако четкие критерии, позволяющие провести дифференциальную диагностику между подслизистым образованием и экстраорганной компрессией, отсутствуют. По данным литературы, чувствительность и специфичность рутинного эндоскопического исследования в дифференциальной диагностике между подслизистыми образованиями и экстраорганной компрессией составляют 87 и 29% соответственно [51]. Также визуальное эндоскопическое исследование не дает ответа на вопрос о структуре образования и не позволяет определить, из какого именно слоя стенки полого органа оно происходит. С учетом локализации биопсия по стандартной методике при эндоскопическом исследовании также не дает возможности установить гистологическую природу этих новообразований [8]. Другие неинвазивные лучевые методы диагностики (КТ, УЗИ, МРТ) еще менее чувствительны [40], так как в большинстве наблюдений небольшие подслизистые образования этими методами не выявляются. Возможности диагностики и дифференциальной диагностики неэпителиальных опухолей и неопухолевых образований стенки желудочно-кишечного тракта значительно расширяет эндоскопическая ультрасонография. Этот метод позволяет не только достоверно различать образования стенки и экстраорганные структуры, но и определять слой, из которого происходит новообразование, а оценивая его эхогенную характеристику, четко дифференцировать неэпителиальные опухоли и неопухолевые образования желудочно-кишечного тракта. При морфологическом исследовании становится ясно, что подслизистые образования включают кисты, дистопию ткани поджелудочной железы и целую группу неэпителиальных опухолей мышечного, неврогенного и сосудистого происхождения [48].
В последние годы интерес к неэпителиальным опухолям желудочно-кишечного тракта значительно возрос, активно изучаются визуальные и лучевые характеристики этих новообразований, их гистологическое строение, проводятся исследования результатов хирургического и химиотерапевтического лечения пациентов с различными подслизистыми новообразованиями желудочно-кишечного тракта. Своей задачей в данном обзоре мы видим необходимость дать информацию для эндоскопистов и врачей других специальностей о том, каковы могут быть возможные варианты безобидных с виду подслизистых новообразований, так как только своевременная дифференциальная диагностика служит основой решения тактических вопросов.
Гастроинтестинальные стромальные опухоли являются наиболее распространенными среди неэпителиальных опухолей желудочно-кишечного тракта и составляют до 1% всех злокачественных опухолей этой локализации [7, 12, 18, 38, 51, 53]. Эти новообразования ранее расценивались как лейомиомы, лейомиобластомы и лейомиосаркомы, однако иммуногистохимические исследования показали их особую природу [27].
Еще в 1960 г. J. Martin и соавт. [33] опубликовали сообщение о 6 наблюдениях «интрамуральных мышечных опухолей» желудка и предположили мышечное происхождение этих «странных» опухолей [27]. Двумя годами позже A. Stout [55] ввел термин «лейомиобластома» для описания группы «причудливых» миогенных опухолей желудка. В течение двух десятков лет авторы использовали различные названия для удобства описания веретеноклеточных и эпителиоидных опухолей, встречающихся во всех отделах желудочно-кишечного тракта. Первыми термин «гастроинтестинальная стромальная опухоль» (ГИСО) ввели M. Mazur и H. Clark в 1983 г. как компромиссный для описания опухолей с не вполне понятной дифференцировкой [35]. Для этих опухолей характерной была двойственность их фенотипа: гладкомышечный и нейрогенный.
Большой шаг в выяснении морфогенеза ГИСО был сделан в работах S. Hirota [27], который выявил С-kit-позитивные клетки в мышечной оболочке желудочно-кишечного тракта у мышей. Эти клетки располагаются в области интрамуральных сплетений и по локализации совпадают с интерстициальными клетками Кахля, обладающими пейсмекерной активностью. Эти клетки, как и клетки ГИСО, имеют положительную реакцию на С-kit (CD117) в 90% наблюдений. CD117 является трансмембранным белком, внешний фрагмент которого функционирует как рецептор к фактору роста стволовых клеток, а внутренний — как протеинкиназа, регулирующая фосфорилирование сигнальных внутриклеточных молекул, влияющих на деление клетки. Таким образом, мутация протоонкогена С-kit приводит к постоянной стимуляции рецептора CD117 и активации сложного комплекса внутриклеточных сигналов, результатом которых является стимуляция митотической активности и пролиферации клеток [36]. Из молекулярно-генетических нарушений наиболее частой является мутация в экзоне 11 гена С-kit, выявляемая в 60-70% наблюдений. Эти опухоли чувствительны к лекарственной терапии иматинибом. Второй по частоте является мутация в экзоне 9 (5-15%), при данном варианте чаще наблюдается первичная лекарственная резистентность. Редки мутации в экзонах 13 и 17. В некоторых случаях ГИСО не выявляются мутации С-kit, однако имеются мутации других генов. Значимы также мутации, связанные с рецептором тромбоцитарного фактора роста альфа (PDGFRa), в этих случаях диагноз опухоли устанавливается по совокупности других признаков или требует молекулярно-генетического анализа [26]. Положительная реакция клеток ГИСО на СD34 выявляется в 46-100% наблюдений и зависит от локализации опухоли: наиболее редко эта реакция выявляется при локализации опухоли в тонкой кишке [23]. В настоящее время доказано, что гастроинтестинальные стромальные опухоли — это наиболее частая разновидность мезенхимальных опухолей желудочно-кишечного тракта и большинство опухолей, ранее расценивавшихся как лейомиома, лейомиобластома и лейомиосаркома, трактуются клиницистами и патоморфологами как ГИСО [12].
Наиболее часто встречаются веретеноклеточный (62%), эпителиоидный (17%) и смешанный (21%) гистологические варианты строения ГИСО [1]. Несмотря на различные варианты гистологического строения, все ГИСО считаются потенциально злокачественными [1, 12, 26]. Даже после радикального удаления опухоли (макро- и микроскопически в пределах здоровых тканей) частота рецидивов достигает 30-50%, проявляясь либо метастазами в печень, либо местным рецидивом (метастазы по брюшине). Особенно неблагоприятен прогноз при опухолях тонкой кишки, когда средний уровень выживаемости составляет около 20 мес [41]. Основными путями генерализации гастроинтестинальной стромальной опухоли является метастазирование в печень и распространение по брюшине. Лимфогенное метастазирование для опухоли не характерно [12, 23]. В настоящее время для определения степени злокачественности ГИСО пользуются критериями, предложенными C. Fletcher и соавт. [18] и M. Miettinen и соавт. [38], по которым высокий риск определяется размером опухоли более 5 см, количеством митозов более 5 в 50 полях зрения при увеличении 400 и инвазией опухолью слизистой. Иммуногистохимическим маркером степени злокачественности опухоли является также индекс экспрессии Ki-67, который достоверно возрастает выше 10% в опухолях высокого риска [68].
Многие авторы отмечают различия в строении и развитии ГИСО в разных отделах желудочно-кишечного тракта.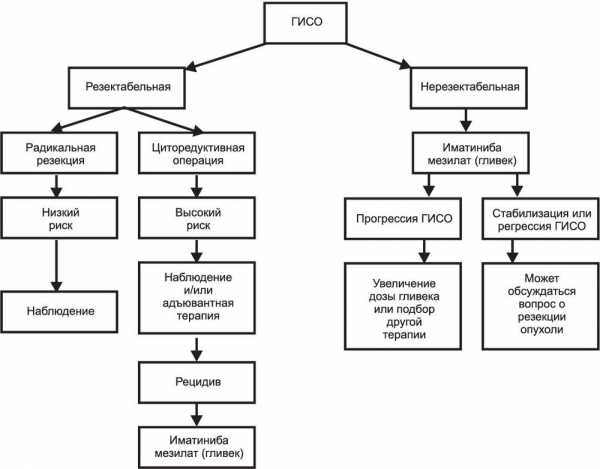 Рисунок 1. Cхема алгоритма лечения гастроинтестинальных стромальных опухолей. Наиболее часто гастроинтестинальные стромальные опухоли встречаются в желудке — до 60-70%. Несмотря на то что, по мнению некоторых авторов, опухоли этой локализации в большинстве наблюдений по гистологическому строению и митотической активности относятся к низкому и среднему риску малигнизации, нередки наблюдения, в которых гистологически благоприятные опухоли рано метастазируют в печень, в то время как опухоли с высоким риском малигнизации остаются клинически более благоприятными [23]. Опухоли тонкой кишки, включая и двенадцатиперстную, встречаются в 20-30% наблюдений и характеризуются более агрессивным течением, более половины из них злокачественные [22]. Гистологически неблагоприятными факторами при опухолях тонкой кишки являются количество митозов и прорастание слизистой. ГИСО с локализацией в пищеводе встречаются крайне редко, составляя 1-2% ГИСО других локализаций, в большинстве же наблюдений в пищеводе выявляются истинные миогенные опухоли. По гистологическому строению ГИСО пищевода сходны с опухолями желудка, однако для пищеводной локализации характерно более агрессивное течение заболевания — злокачественными оказываются более половины опухолей [37]. Независимо от локализации большинство гастроинтестинальных стромальных опухолей чувствительны к ингибиторам тирозинкиназы, например к иматиниба мезилату (гливек). Применение этого препарата при ГИСО позволяет стабилизировать течение опухолевого процесса. Однако лечение этим препаратом имеет строгие показания, включающие в основном первично диссеминированные и рецидивные опухоли [5, 10]. Основным же методом лечения локальных форм ГИСО остается хирургический. В настоящее время предложен и используется алгоритм для лечения первично выявленных гастроинтестинальных стромальных опухолей, представленный на схеме [12].
Рисунок 1. Cхема алгоритма лечения гастроинтестинальных стромальных опухолей. Наиболее часто гастроинтестинальные стромальные опухоли встречаются в желудке — до 60-70%. Несмотря на то что, по мнению некоторых авторов, опухоли этой локализации в большинстве наблюдений по гистологическому строению и митотической активности относятся к низкому и среднему риску малигнизации, нередки наблюдения, в которых гистологически благоприятные опухоли рано метастазируют в печень, в то время как опухоли с высоким риском малигнизации остаются клинически более благоприятными [23]. Опухоли тонкой кишки, включая и двенадцатиперстную, встречаются в 20-30% наблюдений и характеризуются более агрессивным течением, более половины из них злокачественные [22]. Гистологически неблагоприятными факторами при опухолях тонкой кишки являются количество митозов и прорастание слизистой. ГИСО с локализацией в пищеводе встречаются крайне редко, составляя 1-2% ГИСО других локализаций, в большинстве же наблюдений в пищеводе выявляются истинные миогенные опухоли. По гистологическому строению ГИСО пищевода сходны с опухолями желудка, однако для пищеводной локализации характерно более агрессивное течение заболевания — злокачественными оказываются более половины опухолей [37]. Независимо от локализации большинство гастроинтестинальных стромальных опухолей чувствительны к ингибиторам тирозинкиназы, например к иматиниба мезилату (гливек). Применение этого препарата при ГИСО позволяет стабилизировать течение опухолевого процесса. Однако лечение этим препаратом имеет строгие показания, включающие в основном первично диссеминированные и рецидивные опухоли [5, 10]. Основным же методом лечения локальных форм ГИСО остается хирургический. В настоящее время предложен и используется алгоритм для лечения первично выявленных гастроинтестинальных стромальных опухолей, представленный на схеме [12].
В рекомендациях конференции по тактике лечения ГИСО (март 2004 г.) указывается, что лапароскопическая и лапароскопически ассистированная резекция может использоваться только при небольших (менее 2 см) опухолях, при более крупных образованиях показана лапаротомия с широкой резекцией полого органа, несущего опухоль, и при инвазии — резекция окружающих органов [10]. В то же время многими авторами доказывается эффективность и онкологическая безопасность удаления крупных опухолей лапароскопическим способом [41]. Однако число наблюдений для оценки результатов лапароскопических операций в настоящее время явно недостаточно. В последние годы в связи с развитием внутрипросветной — эндолюминальной хирургии стали возможными эндоскопические вмешательства в виде подслизистой диссекции при небольших ГИСО c низким риском злокачественности и без инвазии в мышечный слой стенки полого органа [28], хотя большинство авторов относятся сдержанно к такому способу лечения.
При эндоскопическом исследовании опухоли могут выявляться в виде образований округлой или овоидной формы; небольшие образования покрыты неизмененной слизистой, однако нередко можно выявить ее изъязвление над опухолью, что служит прогностически неблагоприятным фактором относительно злокачественности образования и может стать источником желудочно-кишечных кровотечений с развитием анемии, в 50% наблюдений это является поводом для обращения пациентов к врачу и причиной выявления ГИСО [21]. При эндосонографическом исследовании ГИСО визуализируется как гипоэхогенное образование, которое в зависимости от степени злокачественности может иметь как гомогенную, так и гетерогенную структуру и исходить из мышечной пластинки слизистой или мышечного слоя стенки органа [25].
В дифференциально-диагностическом ряду с гастроинтестинальными опухолями находятся мезенхимальные опухоли и другие новообразования, локализующиеся в стенке пищеварительной трубки и покрытые неизмененной слизистой. Наиболее часто гастроинтестинальную опухоль приходится дифференцировать с истинными гладкомышечными опухолями, липомой, шванномой, нейроэндокринной опухолью, эктопированной поджелудочной железой. Такие образования, как воспалительная миофибробластическая опухоль, воспалительный фиброзный полип, гранулярно-клеточные опухоли, нейрофиброма, сосудистые опухоли и метастазы в стенке желудочно-кишечного тракта, встречаются крайне редко и имеют небольшое практическое значение в дифференциальной диагностике.
Истинные мышечные опухоли лейомиома и лейомиосаркома также встречаются в желудочно-кишечном тракте, однако гораздо реже ГИСО. Опухоль может локализоваться в любом отделе пищеварительной трубки, однако наиболее часто — в пищеводе, где составляет до 75% доброкачественных опухолей, в желудке лейомиома в настоящее время встречается в 0,1% всех опухолей этого органа. По гистологическому строению опухоли сходны с ГИСО, но в отличие от нее истинные мышечные опухоли чаще обнаруживаются у молодых пациентов, при иммуногистохимическом исследовании дают отрицательную реакцию на CD117 и CD34 и положительную на десмин и мышечный актин [37]. Образования имеют округлую или овоидную форму, покрыты неизмененной слизистой, при эндосонографии гипоэхогенные, с ровным, четким контуром, гомогенной структуры, исходящие из II (мышечной пластинки слизистой) или IV (мышечного) эхо-слоя [25]. Лейомиома — доброкачественная опухоль, нередко не имеет клинических симптомов, однако при изъязвлении покрывающей слизистой может быть источником кровотечения, приводя к анемии и обусловливая соответствующую клиническую картину [58]. Лейомиосаркома — злокачественная гладкомышечная опухоль, часто приводящая к изъязвлению слизистой и кровотечению. Опухоль радио- и химиoрезистентна, поэтому подлежит обязательному хирургическому лечению [23].
Шваннома — доброкачественная нейрогенная опухоль, встречается в желудке, в толстой кишке, реже в пищеводе. При иммуногистохимическом исследовании дает положительную реакцию на S-100, иногда может быть положительной по CD34, но всегда отрицательна по CD117 [49]. По эндоскопической и эндосонографической картине сходна с лейомиомой и гастроинтестинальной стромальной опухолью, дифференциальная диагностика возможна только на основании гистологического и иммуногистохимического исследований [25]. Опухоль доброкачественная и при отсутствии клинических проявлений не требует хирургического лечения.
Липома — доброкачественная опухоль из жировой ткани, составляет от 1 до 3% всех доброкачественных неэпителиальных опухолей желудка [6]. Наиболее часто встречается в толстой кишке, но может локализоваться в любом отделе пищеварительной трубки. Опухоль обычно исходит из подслизистого слоя, гистологически имеет типичное строение (жировая ткань). При больших размерах может вызывать непроходимость и кровотечение [53]. При клинических проявлениях и тенденции к росту необходимо удаление опухоли. В последнее время в литературе появляются сообщения об успешном удалении даже больших опухолей эндоскопически без каких-либо осложнений. Авторы отмечают отсутствие рецидива опухоли в сроки наблюдения до 8 лет [63].
Нейроэндокринные опухоли желудочно-кишечного тракта развиваются в органах, производных от передней кишки эмбриона (пищевод, желудок и двенадцатиперстная кишка), и составляют до 5-8% всех нейроэндокринных опухолей. При локализации в верхних отделах желудочно-кишечного тракта обычно гормонально не активны и выявляются случайно при эндоскопическом исследовании или при оперативных вмешательствах по поводу других заболеваний [19]. Гистологически опухоль представлена в виде гнездных скоплений мелких клеток с круглыми ядрами или в виде тяжей опухолевых клеток, соединенных трабекулами. Образование обычно локализуется во II (мышечной пластинке слизистой) или III (подслизистом) эхо-слое, покрыто неизмененной слизистой, однако иногда покрывающая слизистая может изъязвляться, что также является причиной кровотечений [39]. Нейроэндокринные опухоли обладают определенным злокачественным потенциалом, и чем больше размер опухоли, тем выше риск метастазирования, поэтому при образованиях размером более 2 см рекомендуется их удаление [34].
Воспалительная миофибробластическая опухоль (воспалительная псевдоопухоль или воспалительная фибросаркома) — общее название редких мезенхимальных опухолей, состоящих из веретеновидных клеток (миофибробластов), лимфоцитов и плазматических клеток. Хотя эти опухоли развиваются как реакция на инфекционный процесс, некоторые из них способны к пролиферативному росту и очень редко озлокачествляются [15, 23]. Чаще встречаются в детском возрасте, иммуногистохимически дают положительную реакцию на десмин и актин, в то же время CD117 и CD34 отрицательны [15].
Воспалительный фиброзный полип — подслизистое образование, наиболее часто встречающееся в желудке и терминальном отделе подвздошной кишки. При эндосонографии выявляется гипоэхогенное образование однородной эхо-структуры, локализующееся во II или III эхо-слое, мышечный слой полого органа при этих образованиях интактен. В отличие от лейомиомы или нейроэндокринной опухоли этой локализации воспалительный фиброзный полип имеет нечеткий наружный контур [25]. Опухоль состоит из веретеновидных клеток, мелких сосудов и воспалительных клеток (обычно преобладают эозинофилы, но встречаются и плазматические клетки, и лимфоциты). Большинство этих опухолей дает положительную реакцию на CD34, однако стромальный компонент опухоли отрицателен по CD117 [19, 23].
Гранулярно-клеточные опухоли — редкие образования желудочно-кишечного тракта. Гистологически они представлены в виде опухоли преимущественного солидного строения, с веретеновидными или овальными клетками, особенностью которых является наличие в цитоплазме эозинофильных гранул. Опухоль, вероятно, смешанного происхождения, так как иммуногистохимически имеет признаки как нейроэктодермального, так и миогенного ростка. Опухоль обычно позитивна по S-100 и дает отрицательную реакцию на десмин, CD117 и CD34 [40]. Проявляется в виде единичных подслизистых узлов или полипов, при эхографии визуализируется как однородное гипоэхогенное образование, с ровным контуром, исходящее из подслизистого или мышечного слоя стенки желудка [25]. Опухоль доброкачественная, редко достигает больших размеров, не метастазирует, не рецидивирует и обычно не требует хирургического лечения [46].
Нейрофиброма — нейрогенная опухоль, обычно исходящая из ауэрбаховского сплетения и локализующаяся в желудке, тонкой и ободочной кишке, чаще всего в подвздошной кишке. Обычно является признаком нейрофиброматоза типа I (болезнь Реклингхаузена) и часто сопровождается типичными проявлениями на коже (мелкие опухоли на ножке и пятна цвета кофе с молоком). Нейрофиброма может локализоваться в любом отделе желудка, при эндоскопии визуализируется как округлый очаг плотноэластической консистенции, при эндосонографии — как гипоэхогенное образование, локализующееся в IV слое, без гистологического исследования неотличимо от других образований, исходящих из мышечной стенки желудка. Опухоль доброкачественная, однако может малигнизироваться и склонна к рецидивам после удаления [31].
Гемангиома — зрелая доброкачественная опухоль из сосудов. Капиллярная гемангиома — это истинное новообразование с пролиферацией эндотелиальных клеток и формированием атипичных капилляров. Макроскопически представлена красным или синюшным узлом с гладкой или бугристой поверхностью, на разрезе имеет ячеистое строение. Микроскопически опухоль состоит из ветвящихся сосудов капиллярного типа с узким просветом, который не всегда заполнен кровью. Кавернозная гемангиома — новообразование, состоящее из причудливых полостей типа синусоидов различной величины, сообщающихся между собой. Макроскопически имеет вид четко отграниченного от окружающих тканей багрово-синюшного узла, на разрезе напоминающего губку. Микроскопически состоит из тонкостенных каверн, выстланных одним слоем эндотелиальных клеток и заполненных кровью. Венозная гемангиома микроскопически представлена преимущественно сосудами венозного типа [4]. Гемангиомы нередко являются причиной кровотечений и требуют удаления хирургическим или эндоскопическим способом, однако при множественном поражении удаление опухолей затруднено. Альтернативным методом лечения при небольших размерах новообразования может являться аргоно-плазменная или электрокоагуляция [16].
Другие сосудистые опухоли: гломусная опухоль (гломус-ангиома) состоит из щелевидных сосудов, выстланных эндотелием и окруженных муфтами из эпителиоидных (гломусных) клеток; лимфангиома развивается из лимфатических сосудов, разрастающихся в разных направлениях и образующих узел или диффузное утолщение стенки органа. На разрезе опухоль состоит из полостей разной величины, заполненных лимфой. Эти опухоли имеют доброкачественное течение и при наличии клинической симптоматики могут быть удалены эндоскопически [53].
Эктопированная поджелудочная железа обычно выявляется случайно при эндоскопии, оперативных вмешательствах или на аутопсии. По данным литературы, она встречается у 1 из 500 больных, оперированных по поводу заболеваний верхних отделов желудочно-кишечного тракта. На аутопсии эктопированная поджелудочная железа выявляется в 6-14% случаев [25]. Новообразование имеет строение, характерное для поджелудочной железы, нередко на слизистой, покрывающей образование, можно визуализировать устье выводного протока. В большинстве наблюдений клиническая симптоматика отсутствует, однако возможно развитие осложнений в виде воспаления, кистозной трансформации, изъязвления, кровотечения, обтурации просвета кишки и малигнизации, что оправдывает ее удаление [48].
Дупликационные кисты — врожденное заболевание, связанное с удвоением любого отдела желудочно-кишечного тракта, встречается крайне редко (примерно 1 на 4500 родившихся) [11]. Клинические проявления чаще бывают у детей. Кисты представляют собой шаровидные жидкостные образования, связанные с мышечным слоем стенки полого органа, имеют эпителиальную выстилку и локализуются в любом отделе от языка до прямой кишки. Обычно это единичные образования, которые могут иметь и не иметь связи с просветом желудочно-кишечного тракта. Клинически они чаще бессимптомны, однако иногда пациенты предъявляют жалобы на дискомфорт в животе, диспепсию, анемию и похудание, иногда может развиваться перитонит вследствие перфорации стенки кисты [42]. При эндоскопии обычно выявляется деформация стенки желудка, и только эндосонография позволяет установить правильный диагноз [56, 57]. С учетом сообщения в литературе о развитии злокачественных опухолей в дупликационных кистах динамическое наблюдение за такими пациентами нецелесообразно, поэтому наиболее адекватным лечением признается хирургическое удаление кисты [30], однако возможность малигнизации дупликационных кист достоверно не доказана. Эндоскопическое и транскутанное пункционное лечение дупликационных кист возможно, но может сопровождаться развитием таких осложнений, как кровотечение и формирование свища [17].
Обобщая изложенное выше, можно сделать заключение, что современные тенденции в лечении подслизистых новообразований желудочно-кишечного тракта сводятся к следующему алгоритму: при небольших доброкачественных бессимптомных опухолях, таких как лейомиома, шваннома, липома, гранулярно-клеточная опухоль и сосудистые опухоли, проводится динамическое наблюдение, условно доброкачественные и симптоматические доброкачественные опухоли подлежат удалению преимущественно из малоинвазивного эндолюминального доступа [16, 48, 53, 63]. При злокачественных опухолях, к которым относят и солитарные ГИСО, большинство авторов склоняются к необходимости резекции органа из лапаротомного, лапароскопического или лапароскопического трансгастрального доступа [10, 12, 23, 32, 41].
Такой дифференцированный подход к лечебной тактике при подслизистых образованиях предъявляет высокие требования к дооперационной диагностике. Эндосонография открывает новые возможности точной диагностики подслизистых образований. Первым рубежом диагностики является разграничение образований стенки и экстраорганных опухолей, деформирующих просвет полого органа [62]. Наибольшие трудности встречаются при дупликационных кистах, которые часто, особенно при расположении на задней стенке желудка, трактуются диагностами как кистозные опухоли поджелудочной железы [56]. Помимо доказательства связи образования со стенкой органа перед эндосонографией ставится задача установить предположительный диагноз, характер образования и его локализацию относительно слоев стенки полого органа, на основании чего можно косвенно судить о характере поражения (табл. 2) [25].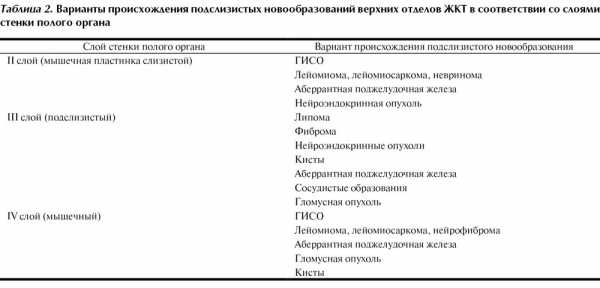
Совокупность этих данных играет немаловажную роль в определении лечебной тактики и метода удаления опухоли в каждом конкретном наблюдении. Основными характеристиками опухоли, определяемыми при эндосонографии, являются размер образования, эхогенность, внутреннее строение, четкость контура и слой, из которого она исходит [43, 61].
Эхогенность патологического очага — немаловажная характеристика, так как позволяет однозначно дифференцировать из всей группы образований кисты и липомы. Если при эндосонографии визуализируется анэхогенное четко очерченное образование, можно с большой вероятностью предполагать диагноз дупликационной кисты [56, 57]. Однако нередко отмечается негомогенное содержимое кисты, что свидетельствует о неоднородности ее содержимого и может вызывать неоднозначную трактовку характера подслизистого образования [56]. Напротив, липома визуализируется как гиперэхогенное однородное образование, исходящее из подслизистого слоя [39, 63]. Наибольшие трудности возникают при трактовке гипоэхогенных подслизистых опухолей, так как практически все подслизистые образования, за исключением кист и липом, являются гипоэхогенными. Большинство авторов сходятся во мнении, что на основании одной только ультразвуковой картины невозможно достоверно судить о гистологическом варианте той или иной мезенхимальной опухоли [9]. Значимыми критериями в этом случае являются структура, размер и контур образования, на основании анализа которых можно составить представление о степени злокачественности опухоли [54]. L. Palazzo и соавт., E. Shen и соавт. предложены ультразвуковые признаки, говорящие о возможном злокачественном характере опухоли [45, 52, 54]: размер опухоли более 3-4 см, неровный контур образования, наличие внутренних фокусов повышенной эхогенности или кист, стремительный рост при динамическом наблюдении.
M. Miettinen и соавт. [38] на большом клиническом материале показали, что мелкие, до 2 см, ГИСО не имели метастазов, что позволяет отнести небольшой размер опухоли к прогностически благоприятным факторам. Для удобства оценки риска злокачественности опухоли L. Palazzo и соавт. [45] выделили 3 основных критерия: неровность контура опухоли, наличие в ней анэхогенных зон и увеличение регионарных лимфоузлов (последний критерий не актуален для ГИСО). Авторы отмечают, что чувствительность и специфичность каждого из этих признаков составляет 91 и 88% соответственно, достигая 100% при наличии двух признаков из трех.
В большинстве наблюдений для окончательного определения гистологического характера опухоли необходимо получение ткани опухоли для проведения гистологического и иммуногистохимического исследований. Возможности щипцовой биопсии при подслизистых образованиях значительно ограничены, а выполнение резекции части опухоли для ее гистологического исследования чревато такими осложнениями, как кровотечение из опухоли и диссеминация процесса. Транскутанная биопсия сложна при образованиях небольшого размера и может привести к диссеминации процесса, поэтому ее следует использовать только при крупных, нерезектабельных опухолях для подбора химиотерапии [14]. Тонкоигольная пункция и аспирационная биопсия под контролем эндосонографии открыли новые возможности для морфологического и иммуногистохимического анализа подслизистых новообразований. По мнению P. Chatzipantelis и соавт. [13] и M. Gu и соавт. [24], с внедрением этого метода ГИСО стали диагностировать значительно чаще. Метод позволяет получить материал для гистологического и иммуногистохимического исследований в 60-80% наблюдений [20, 60]. Многие исследователи предпочитают проведение микроскопического исследования непосредственно в операционной для первичной оценки результативности биопсии и при недостаточном количестве материала прибегают к повторной пункции и аспирационной биопсии, что позволяет достигать 100% эффективности манипуляции [8]. По данным P. Chatzipantelis и соавт. [13], гистологическая верификация диагноза при анализе мазка в операционной достигала 82,4%, в 17,6% наблюдений потребовалось проведение иммуногистохимического исследования фиксированного материала. По данным разных авторов, диагностическая точность аспирационной биопсии под контролем эндоскопического УЗИ составляет от 91 до 100% [7, 8, 30].
Учитывая сложности дооперационной диагностики и сохранение даже малого процента вероятности ошибки, в том числе при исследовании биоптата, мы считаем, что любые подслизистые образования подлежат хирургическому лечению. Эндосонография при подслизистых образованиях позволяет, во-первых, дифференцировать подслизистые образования с опухолями окружающих органов. Во-вторых, метод незаменим при выборе лечебной тактики. При выявлении крупных, выходящих за пределы органа опухолей, которые по данным эндосонографии имеют признаки злокачественности, необходимо решать вопрос о выполнении лапаротомии для широкой резекции органа. При опухолях меньшего размера с пограничными признаками злокачественности, что наиболее часто встречается в повседневной практике, эндосонография является решающим методом, определяющим способ удаления новообразования. Способ удаления следует выбирать исходя из локализации опухоли по отношению к слоям стенки желудка. Если опухоль исходит из мышечного (IV) эхо-слоя, ее удаление эндоскопическим способом с высокой вероятностью может привести к перфорации органа, кроме того, наиболее частой неэпителиальной опухолью, исходящей из мышечного слоя, является ГИСО. В таких ситуациях оптимальной и онкологически оправданной следует считать полнослойную резекцию органа, несущего опухоль, что на сегодняшний день возможно выполнить адекватно и безопасно из лапароскопического доступа. Образование небольших размеров, исходящее из мышечной пластинки слизистой (особенно в пищеводе), с отсутствием признаков злокачественности может быть удалено эндоскопически — эндолюминально методами подслизистой диссекции. Аналогичный способ удаления можно предложить для образований, локализующихся в III слое, где вероятность злокачественных опухолей минимальна. Таким образом, эндосонография является важнейшим методом в диагностике неэпителиальных опухолей желудочно-кишечного тракта, позволяющим проводить их дифференциальную диагностику, и играет немалую роль в определении тактики и способа лечения пациентов с подслизистыми образованиями.
Подводя итог изложенному, хотелось бы еще раз подчеркнуть, что подслизистые новообразования являются широкой группой заболеваний, которая требует серьезного обследования, дифференциальной диагностики и лечения с использованием современных эндоскопических методов. В связи с выделением потенциально злокачественных гастроинтестинальных стромальных опухолей, которые считаются самыми распространенными неэпителиальными опухолями желудочно-кишечного тракта, и трудностью проведения дифференциальной диагностики их с другими неэпителиальными опухолями подход к ведению и лечению таких пациентов на сегодняшний день изменился. При выявлении во время эндоскопического исследования подслизистых новообразований необходимо дифференцировать их от сдавления органа извне с помощью других уточняющих методов исследования, таких как УЗИ, КТ, МРТ. Однако самым точным методом диагностики, позволяющим определить органную принадлежность опухоли и слой стенки полого органа, из которого она исходит, является эндосонография, данные которой определяют выбор метода лечения подслизистых новообразований желудочно-кишечного тракта.
Мы считаем, что выявленные подслизистые образования необходимо удалять с последующими гистологическим и иммуногистохимическим исследованиями. Исключения составляют диссеминированные формы ГИСО, при которых необходимо проведение комплексного лечения в специализированных стационарах. Вместе с тем при наличии мелких бессимптомных образований, не имеющих признаков злокачественности, особенно исходящих из мышечной оболочки пищевода, возможно динамическое наблюдение. При этом мы руководствуемся тем, что ГИСО для пищевода наименее характерны, а радикальное удаление опухоли, исходящей из мышечного слоя, требует резекции стенки органа, т.е. торакоскопии или торакотомии. Таким образом, имеется несоответствие риска оперативного вмешательства и риска прогрессирования заболевания. При выборе хирургического доступа необходимо руководствоваться размером опухоли, ее распространенностью за пределы органа и наличием признаков злокачественности. Пограничные опухоли или вызывающие те или иные жалобы у пациентов подлежат удалению по возможности из малоинвазивного доступа. Способ удаления следует выбирать, принимая во внимание слой стенки органа, из которой исходит опухоль. При локализации опухоли в мышечной пластинке слизистой или в подслизистом слое предпочтение следует отдавать эндоскопическим методам лечения. Если опухоль исходит из мышечного слоя, необходимо выполнять лапароскопическую резекцию. При наличии признаков злокачественности, выявляемых при эндосонографии, следует производить операцию лапаротомным способом, используя широкую резекцию с лимфаденэктомией.
В заключение хотелось бы сказать, что благодаря появлению такого метода эндоскопического исследования, как эндосонография, подход к диагностике и лечению пациентов с подслизистыми образованиями желудочно-кишечного тракта претерпел значительные изменения. Точность в постановке верного диагноза увеличилась в разы, что обусловливает улучшение исходов лечения данной группы пациентов.
www.mediasphera.ru
