Рак синхронный – Первично-множественный рак: синхронный и метахронный
Синхронный рак
Описание клинического случая.
Каприн Андрей Дмитриевич, зам. директора по научной работе, руководитель отделения урологии, профессор;
Нестеров Павел Владимирович, врач уролог, кандидат медицинских наук;
Фадеев Андрей Васильевич, врач уролог, кандидат медицинских наук;
Российский Научный Центр Рентгенорадиологии Росмедтехнологий.
Абстракт.
По данным статистики, развитие первичномножественного синхронного злокачественного заболевания мочеполовой системы, а именно рака мочевого пузыря и рака предстательной железы, в возрасте до 30 лет встречается крайне редко. При анализе литературы нами были встречены лишь единичные сообщения о такого рода заболеваниях в данной возрастной группе. Мы приводим клинический случай больного в возрасте 28 лет с диагнозом: «Первично-множественный синхронный рак. Рак предстательной железы Т2NoMo. Рак мочевого пузыря Т2NoMo». В клинике Рентгенорадиологии Росмедтехнологий выполнено комбинированное лечение данного пациента, которое состояло из дооперационной адъювантной химиотерапии и радикальной цистпростатвезикулэктомии с формированием илеокондуита по методике Briker. В течение 4 лет наблюдения рецидива болезни отмечено не было. Больной социально адаптирован, работает по профессии.
Введение.
По данным статистики, доля первичномножественного синхронного злокачественного заболевания: рака мочевого пузыря и рака предстательной железы составляет 14,2% (Nicolas B.,Kaili Mao 2005, n=141) и 7,3% (по данным ФГУ РНЦРР Росмедтехнологий 2008г.) от всех первично-множественных злокачественных заболеваний. При анализе литературы нами были встречены лишь единичные сообщения о данного рода заболевании в возрастной группе до 30 лет [1]. Во всем мире отмечается рост заболеваемости первично-множественным раком, наиболее выраженный в экономически развитых странах [2]. На фоне роста заболеваемости синхронным раком у 60% пациентов с впервые установленным диагнозом уже имеются распространенные формы опухолевого процесса [3]. У 45-50% больных распространенность опухолевого процесса служит причиной отказа от выполнения радикальных оперативных вмешательств. В тех случаях, когда радикальное хирургическое лечение выполнимо, ситуация диктует необходимость выполнения органоуносящей, травматичной операции [4]. Накопленный клинический опыт свидетельствует, что цистпростатвезикулэктомия с двусторонней подвздошно-обтураторная лимфаденэктомией приводит к выздоровлению более 60% оперированных таким образом больных [5].
Мы приводим клинический случай 28-летнего больного с диагнозом первично-множественного синхронного рака.
Описание случая.
Пациент 28 лет поступил в хирургическую клинику ФГУ РНЦРР Росмедтехнологий 19-03-05г. с жалобами на примесь крови в моче в течение года. Похудел за 6 месяцев на 9 кг. Анамнез курильщика: 15 лет (с 13 летнего возраста) выкуривает до 1 пачки в день. Алкоголь не употребляет. При поступлении: вес 53 кг, при росте 172 см. Общее состояние средней степени тяжести, периферические лимфоузлы не пальпируются. АД 130/80 мм.рт.ст. Пульс 94 уд. в мин. Живот мягкий безболезненный. Почки, печень, селезенка не пальпируются. Наружные половые органы развиты правильно. Органы мошонки без патологии. Per rectum: сфинктер прямой кишки тоничен, предстательная железа не увеличена, туго-элластической консистенции, границы ее четкие, железа безболезненная, слизистая прямой кишки над железой подвижна. В общем анализе крови гемоглобин 78 гл, эритроциты 3.2х10¹²/л, лейкоциты 6.2х109/л, цветовой показатель 0.64, тромбоциты 226х109/л, СОЭ 7мм/ч, гематокрит 0.25. В биохимическом анализе крови общий белок 61.9г/л, мочевина 7.8ммоль/л, креатинин 103.0мкмоль/л. Онкомаркеры ПСА -3.7 нгмл. ЭКГ и рентгенологическое исследование органов грудной клетки без особенностей. При ультразвуковом исследовании орагнов брюшной полости – без патологии. При ультразвуковом исследовании почек и мочевого пузыря выявлено два образования занимающих практически всю полость мочевого пузыря, размерами 68х56х84мм и 60х38мм, не сливающихся с изображением предстательной железы.(Рисунок 1,2).
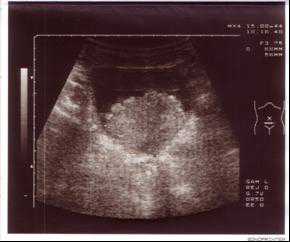
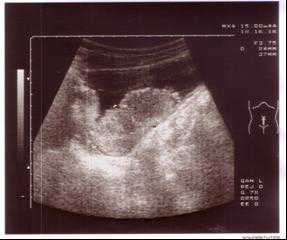
Рисунок 1,2. УЗИ мочевого пузыря во фронтальной(рис1) и саггитальных плоскостях(рис2). Образование мочевого пузыря занимает практически всю полость мочевого пузыря.
Выполнено трансректальное ультразвуковое исследование – данных за патологию простаты и семенных пузырьков выявлено не было.
По рузультатам магнитно-резонансной томографии органов малого таза получены следующие данные – образование в просвете мочевого пузыря, заполняющее собой 23 объема, исходящее из задней стенки,с прорастанием всех слоев стенки мочевого пузыря.(Рисунок 3).
Рисунок 3. МРТ малого таза. Отсутствует четкая дифференцировка слоев мочевого пузыря.
Выполнена цистоскопия с биопсией образования мочевого пузыря и мультифокальной биопсией простатического отдела уретры. При осмотре: устья мочеточников не определяются, все поле зрения занимает опухоль, ворсинчатой структуры, кровоточащая при контакте. При биопсии уротелиальный рак высокой степени злокачественнности. При биопсии уретры данных за распространение опухоли не получено (Рисунок 4).
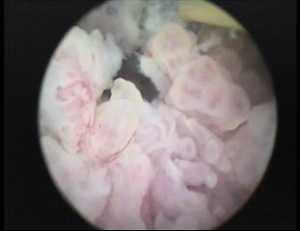
Рисунок 4. Цистоскопия. Нежно-ворсинчатое образование занимающее все поле зрения.
Данных за метастатическое поражение регионарных лимфатических узлов и наличие отдаленных метастазов в ходе предоперационного обследования получено не было. При исследовании функции верхних мочевых путей патологии выявлено не было. Пациенту был установлен следующий клинический диагноз: «Рак мочевого пузыря Т3NoMo. Гематурия. Постгемморагическая анемия 2ст.»
25. 03. 2005 проведен консилиум в составе: директор ФГУ РНЦРР академик РАМН, д.м.н., профессор В.П. Харченко, зам. директора по научной работе, руководитель отделения урологии, д.м.н., профессор А.Д. Каприн, заведующий отделением реанимации и анестезиологии, к.м.н. С.В. Воскресенский, к.м.н. Н.Ю. Добровольская. Консилиум принял решение о выполнении комбинированного лечения. Больному в предоперационном периоде проведено 2 курса неоадъювантной полихимиотерапии по схеме гемзар 1200 мг +карбоплатин 500 мг; на фоне проведения гемостатической терапии. Результат: купирование макрогематурии, уменьшение объема опухоли на 30%.
18. 05. 2005. больному выполнен 2 этап комбинированного лечения: хирургическое лечение в объеме радикальная цистпростатвезикулэктомия с формированием илеокондуита по методике Briker, двусторонняя подвздошнообтураторная лимфаденэктомия. При срочном гистологическом исследовании препарата выявлена аденокарцинома предстательной железы, удаленная в пределах здоровых тканей. В мочевом пузыре уротелиальный рак высокой степени злокачественности.
Объем хирургического лечения изменен не был. Длительность операции составила 6 ч. 10 мин., кровопотеря во время операции – 800 мл. Ближайший послеоперационный период протекал без осложнений. В отделении реанимации и интенсивной терапии пациент находился в течение 4 суток. Бандеры из верхних мочевых путей удалены на 14 сутки.
Учитывая радикальность проведенного хирургического лечения дополнительное химио-лучевое лечение пациенту не было показано. С пациентом была проведена беседа, даны рекомендации об образе жизни, гигиены наружного отверстия илеокондуита.
Пациент на 16 сутки послеоперационного периода был выписан из клиники под наблюдение онколога по месту жительства.
В настоящее время: по результатам проведенного комплексного обследования в феврале 2009 г. данных за рецидив и прогрессирование основного заболевания не получено. Вес 84 кг. Гемоглобин 146 гл. ПСА 0 нгмл.
Пациент социально-адаптирован.
Рисунок 5. Больной через 3 года после комбинированного лечения. Социально адаптирован. Работает по специальности.
Заключение.
По нашему мнению, возникновению первичномножественного синхронного онкологического заболевания в столь молодом возрасте способствовал длительный анамнез курильщика. А длительное необращение пациента за медицинской помощью, несмотря на появление примеси крови в моче, не оставило нам шансов на проведение органосохраняющего лечения.
Информированное согласие пациента. Получено и предоставлено редакции.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы.
1. Аксель Е.М. Заболеваемость злокачественными новообразованиями мочевых и мужских половых органов в России в 2003г.// Онкоурология 2005г.№ 1. С 6-9.
2. Алексеев Б.Я., Русаков И.Г., Франк Г.А. и др. Первично-множественный рак мочевого пузыря и предстательной железы у больных, перенесших радикальную цистэктомию.//Онкоурология.2005г. №2. С. 40-45.
3. Изгейм В.П, Лыков А.В., Нямцу А.М. Результаты оперативного лечения мышечноинвазивного рака мочевого пузыря. Опубликовано на сайте www.netoncology.ru
4. Латыпов В.Р. Пути улучшения результатов хирургического лечения заболеваний мочевого пузыря. Автореферат диссертации на соискание ученой степени доктора медицинских наук. Томск 2007.
5. Рихард Э. Хаутманн, Роберт Де Петрикони, Ханс-Вернер Готтфрид, Клаус Кляйншмидт, Роланд Маттес, Томас Пайс. Мочевой пузырь из подвздошной кишки: осложнения и функциональные результаты у 363 пациентов за 11 лет наблюдения. Международный Медицинский Журнал. №2.2000.
Источник: www.medmir.com
medprosvita.com.ua
как вылечить, причины, симптомы, профилактика, консультация врача, последствия
Метахронный рак – это одна из трех форм двустороннего рака органов или желез, которые в организме расположены попарно, левой и правой стороны одной системы, либо же опухоли, имеющие одинаковую гистологическую структуру. Новообразование сначала появляется в одном органе, а через некоторое время во втором (если они парные). Вторичные узлы болезни имеют значительно меньший размер по сравнению с первыми. Наиболее часто этот процесс наблюдается в молочных железах, желудочно-кишечном тракте и легких. Также встречаются случаи лимфопролиферативных заболеваний.
Содержание статьи
Что такое метахронный рак и откуда он берется
Множественный метахронный рак имеет от двух до шести первичных узлов опухоли. При этом первичное новообразование может формироваться в одном органе, второй – в другом, а третий – снова в первом. И таких комбинаций множество. Так, под метахронным раком молочной железы понимается процесс, когда поражены обе молочные железы, или же вторая железа поражается максимум через год после диагностирования рака первой.
В медицине известны случаи, когда пациенты имели 6 различных злокачественных процессов с неодинаковой продолжительностью ремиссии. Существует предположение, что такие ситуации развиваются при раннем обнаружении первичного очага и применении преимущественно щадящих или паллиативных методов лечения, то есть без удаления самой опухоли.
Также учеными проводились исследования, которые показали, что наличие определенных показателей активности ферментов дают возможность определения группы риска.
Новообразования появляются с большим интервалом. Если болезнь будет выявлена на раннем этапе развития и среди методов лечения будет выбран радикальный – прогноз выживаемости считается относительно благоприятным.
По статистике, зачастую вторая опухоль появляется в течение 5-10 лет после первой. Большое значение имеет длительность интервала между возникновением новообразований. Ученые считают, если спустя 5 лет наблюдения и удовлетворительного самочувствия пациента появляется новый очаг, стоит говорить о первично множественном метахронном раке.
Точных причин развития болезни не выявлено. Медиками проводятся исследования о возможности влияния лучевого облучения и химиотерапии. Также существуют доводы о негативном воздействии дооперационной терапии, тогда как послеоперационная химиотерапия и облучение не оказывают такого эффекта.
Есть достоверные сведения о вреде курения, как провоцирующего фактора развития онкологического процесса. В целях профилактики онкологи рекомендуют отказаться от пагубной привычки.

Диагностика и лечение метахронного рака
Для диагностики используются разные методы в зависимости от расположения первой опухоли и предположительной дислокации второй. Среди самых распространенных следующие:
- анализ крови на онкомаркеры;
- ультразвуковое исследование;
- компьютерная и магнитно-резонансная томографии;
- рентгенография.
Каждый онкобольной даже при успешном излечении злокачественного процесса обязан регулярно проходить профилактические осмотры.
Для излечения больного используются комбинированный метод и радикальный хирургический с удалением большого участка тканей.
Обычно метод лечения выбирается в соответствии со сроком обнаружения вторичного очага. Если это происходит на ранних стадиях – преобладает комбинированная терапия, на поздних – хирургическое вмешательство, лучевое облучение и устранение симптоматики.
Профилактика, консультация онколога по вопросу лечения метахронного рака
Считается, что развитие метахронных опухолей не влияет на общую выживаемость кардинально, тогда как появление синхронной онкологии значительно понижает этот показатель.
Особо важную роль в лечении онкологи приписывают динамическому наблюдению за больными после успешного устранения первого очага патологического процесса. При этом учитываются наиболее вероятные места локализации второго узла.
medbooking.com
Синхронный рак молочных желез: клиника, диагностика, лечение, прогноз
И. Ю. Филюшкина, В. М. Иванов, Ю. В. Буйденок.
ГУ РОНЦ им. Н. Н. Блохина РАМН
Рак молочной железы – в настоящее время одно из самых распространенных злокачественных опухолей у женщин. В структуре онкологической заболеваемости в России рак молочной железы занимает первое место и частота его неуклонно растет. Число заболевших в 2004 году составило 49,2 тыс., а умерших — 23 тыс. Заболеваемость раком молочной железы в Москве и Санкт-Петербурге в 2004году составила 51,4 и 48,3 на 100000 населения, соответственно (М. И. Давыдов, Е.М.Аксель) [2].
Первично-множественные злокачественные опухоли — одновременное или поочередное возникновение злокачественных опухолей. Они развиваются самостоятельно и независимо друг от друга в пределах одного или нескольких органов. Синхронный рак молочных желез — один из вариантов первично-множественного рака, и по мнению ряда авторов, является проявлением мультицентричности заболевания в парном органе. Наиболее важным признаком синхронного рака молочных желез является одновременность возникновения опухолей в обеих молочных железах, однако ряд авторов допускает возможность интервала между первой и второй опухолью в пределах 6-12 месяцев. Синхронные опухоли молочных желез выявляются достоверно реже (22,7%), чем метахронные опухоли (69,6%) [6].
На долю рака молочной железы среди всех первично-множественных опухолей приходится от 8% до 21,9%. По данным ОНЦ РАМН, первично-множественный мультицентрический рак молочной железы составил 5,7%, синхронный рак – 0,9%, метахронный рак – 1,0%, метастатический рак молочной железы – 0,98%.
При первично- множественных синхронных злокачественных новообразованиях вторая опухоль при обследовании не диагностируется у 25,3% женщин [7]. Совершенствование методов своевременной диагностики, выявление особенностей или закономерностей возникновения и клинического течения синхронного рака молочных желез, усовершенствование методов комплексного лечения способствуют улучшению результатов лечения, и, как следствие, увеличению продолжительности жизни больных. Основным методом диагностики рака на сегодняшний день остается маммография. T. J. Murphy и соавт. на основании изучения маммограмм 35 больных синхронным раком молочных желез пришли к выводу, что маммографические проявления синхронного рака не отличаются от таковых при одностороннем раке. Двухсторонние синхронные опухоли очень часто имеют одинаковые внешние проявления и расположены в молочных железах в виде «зеркального отображения» [14]. Маммографию необходимо проводить с обеих сторон, даже при поражении одной железы.
Несмотря на высокую чувствительность маммографии (92,5%), в некоторых случаях она бывает малоинформативной. Магнитно-резонансная маммография (МР-маммография) желез является дополнительным эффективным методом комплексной диагностики патологии молочных желез и реализуется при неэффективности других методов визуализации (чувствительность 99,2%, специфичность 97,9%, точность 98,9%).
МР- маммографию целесообразно использовать при:
- отчетливо определяемых (на маммограммах) изменениях не вполне ясной клинически значимости;
- неотчетливо определяемых (на маммограммах) изменениях, в частности, при подозрении на наличие опухоли у молодых женщин, имеющих плотную структуру ткани;
- уточнение причин локальной симптоматики в молочной железе;
- выявлении участков микрокальцинатов;
- дифференциальной диагностике узловых форм рака и ФКБ при категорическом отказе пациентки от пункционной биопсии;
- поиске скрытых форм рака молочной железы у пациенток с множественными метастазами из неустановленного первичного очага;
- уточнении местной распространенности процесса;
- при дифференциальной диагностике злокачественной опухоли и жирового некроза.
В последнее время в литературе все чаще появляются сообщения о достаточно высокой значимости сцинтимаммографии в диагностике синхронного рака молочных желез. Имеются сообщения об использовании 99mTc-MIBI в диагностике двухсторонних опухолей молочных желез. E.Derebek и соавт. сообщают о том, что ранняя и отсроченная сцинтиграфия предоставляет важную дополнительную информацию при синхронном поражении молочных желез, даже в случаях, когда маммография и динамическая МРТ не эффективны [10]
.Генетические факторы играют важную роль в возможной предрасположенности к возникновению синхронного рака молочных желез. Положительный семейный анамнез рака молочной железы в 2 раза чаще имеет место у больных синхронным раком молочных желез по сравнению с общей популяцией. Anderson D.E. установил, что синхронные раки, возникающие у женщин до менопаузы, являются строго наследственными и почти у 30% дочерей данной группы велика вероятность возникновения рака молочной железы в возрасте до 40 лет [8]. Данные литературы, касающиеся этой проблемы, немногочисленны, и анализируют небольшое число наблюдений. Kinoshita T. И соавт. пришли к выводу, что генетические изменения и механизм канцерогенеза при одностороннем и двухстороннем раке молочных желез различны [13]. A. E. Ozer и соавт., исследовав прогностическую значимость мутаций гена р53 при синхронном раке молочных желез, пришли к выводу, что выраженная степень мутаций р53, особенно в сочетании с экспрессией Ki-67 (маркером опухолевой клеточной пролиферации), является неблагоприятным фактором прогноза при синхронном раке и может служить предсказателем развития метахронного рака в контрлатеральной молочной железе
Общая и безрецидивная выживаемость больных синхронным раком молочных желез зависит от прогностических факторов. По данным Р. А. Керимова, средний возраст больных синхронным раком молочных желез составляет 49,98 ± 2,9 года [3]. По J.Kelmendi de Ustrann и соавт., роль других прогностических факторов (возраст; менархе; овариально- менструальная функция, время лактации, время рождения первого ребенка, соотношение между числом инвазивных и неинвазивных опухолей) одинакова при синхронном и одностороннем поражении молочных желез [12].
Р. А. Керимов, анализируя клинические проявления при двухстороннем раке молочных желез, показал, что у 39,5% больных синхронным раком стадийность поражения была одинаковой с обеих сторон, у 60,5% — разная. Более чем в половине случаев (59,3%) отмечены локализованные формы рака. Симметричное расположение опухолей выявлено в 22,9% случаях. Опухоли локализовались в наружных и верхних квадрантах молочных желез у 86% больных. Метастазы в регионарных лимфатических узлах были обнаружены с обеих сторон у 50% больных, с одной – у 27,9%. При синхронном поражении наиболее часто с обеих сторон отмечался инфильтративный рак: протоковый у 46,4% больных, дольковый – у 26,2% больных. У 11,9% больных установлено сочетание инфильтративного протокового или долькового рака с одной стороны и редких форм – с другой. У 73,8% больных опухоли с обеих сторон были одинакового гистологического строения, у 26,2% — различного. Исследование окружающей ткани молочной железы при синхронном раке выявило различной степени выраженности фиброзно-кистозную болезнь: в 67,3% случаев – пролиферативная форма, проявляющаяся развитием внутрипротоковых и внутридольковых пролифератов, внутрипротоковых папиллом, участков атипии эпителия. У 17,3% больных выявлены очаги неинвазивного рака [3].
Существенное влияние на прогноз оказывает рецепторный статус опухоли. Высокий уровень рецепторов эстрогенов свидетельствует о более благоприятном прогнозе у молодых женщин, а рецепторов прогестерона – у пожилых больных.
Распределение больных синхронным раком молочных желез по стадиям с каждой стороны следующая: T1-2N0M0 и T1-2N0M0 – у 18,6% больных; T1-2N1M0 и T1-2N1M0 – у 9,3%; T3-4N0-2M0 и T3-4N0-2M0 – у 24,4%; T1-2N0M0 и T1-2N1M0 – у 18,6%; T1-2N0M0 и T3-4N0-2M0 – у 9,3%; T1-2N1M0 и T3-4N0-2M0 – у 19,8%. Локализованные формы рака отмечены более чем в половине случаев – у 59,3% пациентов[3].
По данным Hong Wen-shan показатели 5- и 8-летней выживаемости у больных с отсутствием поражения метастазами лимфатических узлов, односторонним поражением лимфатических узлов и двухсторонним поражением лимфатических узлов – 75,6 и 65,5%; 43,8 и 32,9%; 28,9 и 0% соответственно [11].
По Р. А. Керимову 5-летняя общая выживаемость больных с I-IIа с каждой стороны составила 90,0 ± 5,6%, безрецидивная – 82,2 ± 4,8%, при IIб стадии – соответственно 75,6 ± 8,7% и 67,4 ± 9,5%, при lllа-б стадии – 50,4 ± 3,2 и 40,2 ± 3,6%; при l-llа стадии с одной стороны и llб с другой – соответственно 79,1 ± 5,3% и 69,5 ± 5,5%, при l-llа и lllа-б – 73,2 ± 8,8% и 65,3 ± 9,2%, при llб и lllа-б – 51,3 ± 4,7% и 40,4 ± 4,9%. Ранние стадии опухолей с одной стороны при наличии местно-распространенного процесса с другой очень незначительно влияют на выживаемость [3].
Лечение синхронного рака молочных желез весьма разнообразно и зависит от прогностических факторов. Длительное время основным методом лечения оставался хирургический – двухсторонняя радикальная мастэктомия. Однако, с усовершенствованием методов химио- и лучевой терапии, стало возможным проведение органосохраняющих операций [5].
При первично-неоперабельных формах рака с одной или обеих сторон комплексное лечение дает достоверно лучшие результаты, чем все прочие виды терапии. Проведение неоадъювантной терапии при местно- распространенном процессе с одной или с обеих сторон достоверно увеличивает и общую, и безрецидивную выживаемость, в то же время проведение неоадъювантного лечения при первично- операбельных стадиях не приводит к достоверному улучшению выживаемости [4].
До сих пор вопрос о возможности выполнения органосохраняющих операций при синхронном раке молочных желез является противоречивым. Поиском ответа на этот вопрос посвящено множество исследований последних лет. Большинство авторов считают возможным выполнение этих операций при соблюдении определенных показаний. Так, T.Arimura и соавт. показаниями к выполнению органосохраняющих операций считают опухоль менее 3-х см, отсутствие мультицентрического роста, отсутствие значительной инвазии протоков. Авторами были выполнены органосохраняющие операции при синхронном раке молочных желез у 44% больных с одной стороны и у 38% больных с обеих сторон. Показатели выживаемости в этих группах и в группе больных с мастэктомиями практически не различались [9]. Сходные данные были получены и многими другими авторами. Во всех этих исследованиях не было получено различий в общей и безрецидивной выживаемости, частоте рецидивов. Однако, остаются еще отдельные публикации, в которых авторы являются строгими приверженцами выполнения операций большего объема при синхронном раке молочных желез.
Резюмируя проведенный выше анализ литературных данных о синхронном раке молочных желез, можно заключить, что эта проблема остается сложной и далеко не полностью изученной. Существует множество спорных вопросов, касаемых эпидемиологии, диагностики и лечения синхронного рака молочных желез.
Литература
- Бит- Сава Е. М. Клинические и генетические аспекты наследственного рака молочной железы. Автореферат кандидатской диссертации, Санкт- Петербург, 2005г.
- Давыдов М. И., Аксель Е. М. Вестник РОНЦ им. Н. Н. Блохина РАМН. 2006, том 17, №3, приложение 1, стр. 47, 82, 108, 113.
- Керимов Р. А. Двусторонний рак молочных желез: особенности течения и результаты терапии. Маммология, 2005, №1, стр. 36 — 41.
- Летягин В. П., Высоцкая И. В. Лечение двустороненного синхронного рака молочных желез стадий Т0-2 N0-1 M0. Вестник РОНЦ – 2004г- №4, стр. 23-27.
- Летягин В. П. Первичные опухоли молочной железы. Практическое руководство по лечению. М — 2004г, стр. 205-233.
- Сельчук В. Ю. Первично- множественные опухоли (клиника, лечение и закономерности развития). Дисс. док. мед. наук. М — 1994г, стр. 173- 184.
- Сельчук В. Ю. Первично- множественные синхронные злокачественные новообразования репродуктивной системы у женщин. Российский онкологический журнал — 2001г — №3, стр. 18 – 21.
- Anderson D.E. Genetic study of breast cancer: identification of high risk group. Cancer, 1974, 34, р. 1090-1097.
- Arimura T., Fukuda M., Ohtuka T. et al. Evaluation of possibility of breast conserving for patients with synchronous bilateral breast cancer // Journ. of Japan Society of cancer therapy. – 1994. – Vol. 29, № 2. – P. 513.
- Derebek E., Вalci P., Alanyali H. et al. Detection of bilateral multifokal breast cancer using Tc-99m sestamibi imaging: the role of delayed imaging. Clinical nuclear medicine, 1999, v. 24, № 8, p. 590-593.
- Hong Wen- shan, Yang Ming- tian, Wang Si- yu, Li Bao- jiang, Tang Jun, Lian Zhen- giang // Zhongliu fangzhi zazhi = China Prev. and Treat. – 2005. – 12, № 4. – C. 297-300. – Кит.; рез. англ.
- Kelmendi de Ustaran J., Meiss Roberto P. Cancer bilateral sincronico de mama (aspectos epidemiologicos). Bol. Acad. Nac. Med. Buenos Aires, 1986, v. 64, № 2, p. 492- 502.
- Kinoshita S., Ueda M., Enomoto K. et al. Comparison of p 53 gene abnormalities in bilateral and unilateral breast cancer. Cancer, 1995, v. 76, № 12, p.2504 – 2509.
- Murphy T.J., Conant E.F., Hanau C.A. et al. Bilateral breast carcinoma: mammographic and histologic correlation// Radiology. – 1995.- Vol. 195 №3. – P. 617 – 621.
- Ozer E., Canda T., Kuyucuoolu F. et al. p53 mulations in bilateral breast carcinoma. Correlation with Ki-67 expression and the mean nuclear volume. Cancer letters, 1998, v. 122, № 1-2, p. 101-106.
netoncology.ru
Хирургическое лечение первично-множественного рака легких
За последнее время отмечается рост случаев первично-множественного рака легких, который принято разделять на первично-множественный рак одного легкого и двусторонний первично-множественш’й рак. Первично-множественный рак обоих лёгких перестал быть казуистикой. Частота его составляет в среднем 1,3%. Каждый может выявляться последовательно (метахронный) и одновременно (синхронный). По сводным данным литературы, среди 816 наблюдений первично-множественного рака органов дыхания метахронные опухоли имелись у 71,1%, синхронные — у 27,9%. Последняя группа множественных опухолей легких встречается редко и отмечена у 0,16—0,35% больных, оперированных по поводу рака легкого.Полинеоплазия одного легкого — это почти всегда операционная находка, поскольку окончательный диагноз устанавливается после гистологического исследования. Еще сложнее диагностика одностороннего метахронного рака, его дифференциальная диагностика от рецидива, продолженного роста и метастаза.
Большое значение для постановки диагноза имеют критерии первичной множественности опухолей органов дыхания. В настоящее время определена совокупность критериев, которые делятся на абсолютные (морфологические) и относительные (клинико-рентгенологические).
Наиболее достоверным признаком первичности множественных опухолей является их разная гистологическая структура. Клинические, рентгенологические и эндоскопические критерии играют вспомогательную роль и должны учитываться при их сочетании.
Под нашим наблюдением находилось 10 пациентов мужского пола в возрасте от 47 до 70 лет с такой патологией. У 6 больных диагностирован синхронный, у 4 — метахронный рак. В 7 случаях отмечалось одностороннее поражение легкого, в 3 — двустороннее.
При синхронном раке I стадия заболевания отмечена у 1, II — у 2, III стадия — у 3 больных. При метахронном раке первичная опухоль имела начальную стадию (I — 2, II — 2). При двустороннем раке вторичный процесс возник в противоположном легком у 2 больных через 6 месяцев и через 1 год, и на оперированной стороне (2 пациента) через 5 и 6 лет. В 2 случаях обнаружена III стадия заболевания и в 2 — I и II.
Клиническая картина при первично-множественных опухолях легких мало чем отличается от таковой при солитарном раке. Лишь у одного больного она манифестировалась клиникой присоединившейся острой абсцедирующей пневмонии.
Больной П., 58 лет, история болезни № 3252. Заболел в конце октября 1988 г., когда поднялась температура до 38°С, появился кашель со зловонной мокротой, одышка, слабость.
27.10.88 поступил в терапевтическое отделение одной из больниц, где при рентгенологическом обследовании (рис.20) выявлена абсцедирующая пневмония верхней доли правого легкого, а также две шаровидные тени в нижней доле того же легкого.
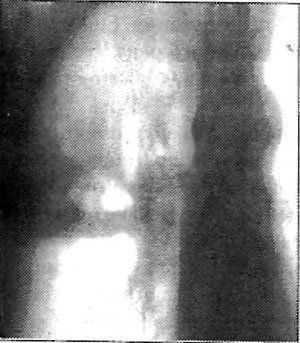
Рис. 20. Больной П.,58 лет, история болезни № 3252. Правосторонняя абсцедирующая пневмония в сочетании с первично-множественным опухолевым процессом
Больному была проведена противовоспалительная, дезинтоксикационная, десенсибилизирующая, общеукрепляющая и иммуннотерапия. Состояние больного улучшилось, полость распада в верхней доле исчезла (рис.21).

Рис. 21. Тот же больной. Состояние после противовоспалительной терапии
21.12.88 с диагнозом метастатический процесс в правом легком больной поступил в городской онкологический диспансер. В поисках первичного очага произведено обследование (бронхоскопия, ректороманоскопия, фиброколоноскопия, рентгеноскопия пищевода, желудка, двенадцатиперстной кишки, сканирование почек, щитовидной железы, печени, экскреторная урография).
23.12.88 —трансторакальная пункция одного из образований. Результат: рак из умеренно-дифференцированных клеток.
16.01.89 с диагнозом первично-множественный синхронный рак правого легкого T2N1M0, гипертоническая болезнь ПА стадии больной был оперирован. Выполнена пневмонэктомия с удалением бифуркационных и трахеобронхиальных лимфоузлов.
Гистологическое исследование: узел под плеврой имеет строение низкодифференцированного плоскоклеточного рака; узел, связанный со стенкой бронха — лимфоцитоподобный рак. В 1 лимфоузле из 2 исследованных — метастаз низкодифференцированного плоскоклеточного рака. Послеоперационный период протекал без осложнений. Проведено 2 курса полихимиотерапии по схеме ЦВАМП.
02.03.89 выписан из стационара под наблюдение онколога по месту жительства. Скончался через 8 месяцев от диссеминации процесса.
В доступной литературе не описаны случаи сочетания первично-множественного синхронного рака одного легкого с абсцедирующей пневмонией.
При постановке диагноза первично-множественного рака легких, использовались следующие критерии: отсутствие в анамнезе и при обследовании указаний на какой-либо злокачественный процесс, наличие не более двух тенеобразований в легочной ткани.
Для исключения субъективизма к первично-множественным поражениям причислялись наблюдения с разным гистологическим строением. Дифференциальная диагностика первично-множественного синхронного рака легкого и метастазов в легочную ткань рака другой локализации является довольно сложной.
Тем не менее, всем больным диагноз был поставлен до операции. Это важно, поскольку большинство случаев множественных новообразований легких трактуется как метастатическое поражение. Такая трактовка ведет к отказу от радикального лечения, результаты которого сравнимы с данными при солитарном первичном раке легкого.
Характерно, что большая по размеру опухоль при синхронном процессе имела строение плоскоклеточного рака, а при метахронном этот морфологический вариант был первичным. Вторая локализация — аденокарцинома (5), мелкоклеточный (3), крупноклеточный рак (2).
Больной А., 53 лет, история болезни № 275. При очередном флюорографическом осмотре в обоих легких выявлены две округлые тени (рис.22). Поступил с диагнозом метастазы в легкие без выявленного первичного очага. Жалоб при поступлении не предъявлял.
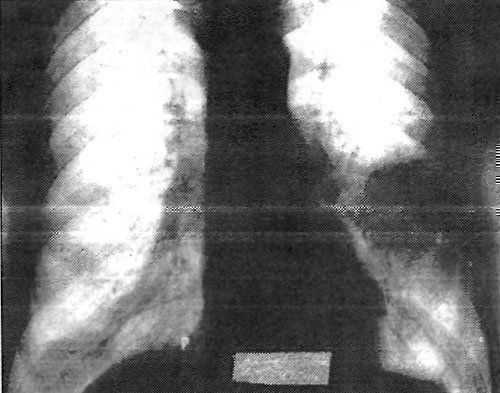
Рис. 22. Больной A., 58 г., история болезни № 275. Первично множественный синхронный рак обоих легких
Проведенное обследование не дало указаний на диссеминированный онкологический процесс. С диагнозом первично-множественный синхронный рак обоих легких больной был дважды оперирован. 13.03.90 г. выполнена нижняя лобэктомия справа. Опухоль имела строение бронхоальвеолярной аденокарциномы(рис.23). 02.04.90 г. — верхняя лобэктомия слева.
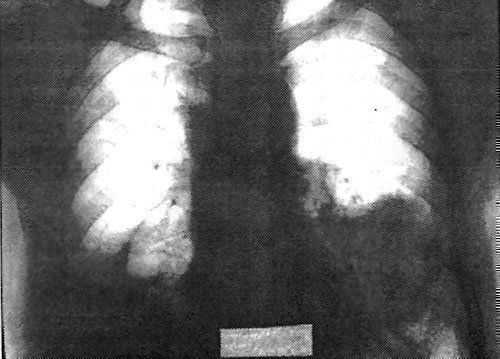
Рис. 23. Тот же больной. Состояние после нижней лобэктомии справа
Гистологически: плоскоклеточный рак без ороговения. Послеоперационный период без осложнений(рис.24). Проведена лучевая терапия на зону регионарного метастазирования, два курса полихимиотерапии по схеме ЦАВ. Осмотрен через 3 года. Данных на рецидив заболевания нет.
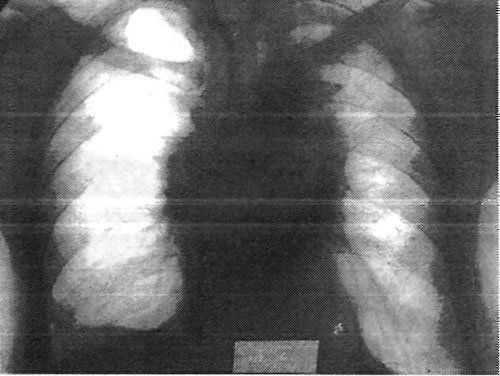
Рис. 24. Тот же больной. Рентгенологическая картина легких через год после окончания лучевой терапии. Двусторонний лучевой пневмосклероз
При первично-множественном синхронном раке одного легкого произведены следующие операции: расширенная пневмонэктомия (3), плевропневмонэктомия (1), пневмонэктомия с резекцией бифуркации трахеи (1). При первично-множественном синхронном раке обоих легких у 1 больного выполнены нижняя лобэктомия справа, а через 3 недели верхняя лобэктомия слева. Следует признать целесообразность последовательных операций с интервалом 3—4 недели.
За этот период наступает адаптация организма больного и повторное вмешательство переносится легче. В результате уменьшается риск возникновения послеоперационных осложнений. Кроме того, не исключается вероятность обнаружения при плановом гистологическом исследовании метастаза внелегочного рака. В таком случае операция на втором легком не всегда целесообразна. При метахронном раке одного легкого у 2 больных выполнено удаление остатка легкого по типу пневмонэктомии. Приводим следующее наблюдение.
Больной Ш., 39 лет, история болезни № 1232, 25.05.89 благополучно перенес нижнюю лобэктомию справа по поводу плоскоклеточного рака T2N1M0 (рис.25), курс послеоперационной лучевой терадаи.
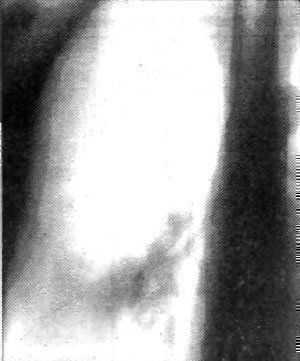
Рис. 25. Больной Ш., 39 лет, история болезни №1232. Рак нижней доли правого легкого
В августе 1994 г. при очередном ренгенологическом обследовании обнаружено образование в верхней доле (рис.26). 02.11.94 — правосторонняя плевропневмонэктомия.
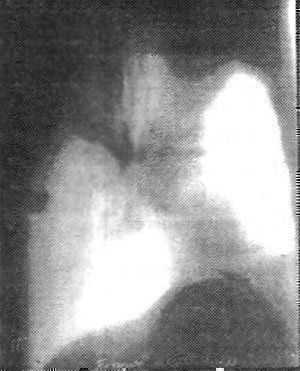
Рис. 26. Тот же больной. Периферический рак оставшегося легкого
Послеоперационный период протекал без осложнений. Гистологическое заключение: аденокарцинома средней степени дифференцировки, в одном лимфоузле из трех исследованных — метастаз раковой опухоли. Выписан в удовлетворительном состоянии с диагнозом первично-множественный метахронный рак правого легкого T3N1M0G2.
При двустороннем поражении выполнены лобэктомия и (с учетом I стадии процесса) удаление верхушечных сегментов верхней доли слева с лимфаденэктомией. Всего было 13 оперативных вмешательств (табл. 14).
Таблица 14. Характер оперативного вмешательства при первично-множественном раке органов дыхания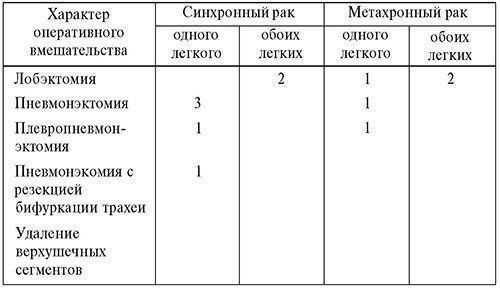
Послеоперационный период осложнился у 1 больного дыхательной недостаточностью, явления которой купировались на пятый день. Летальных исходов не было. Отдаленные результаты прослежены у всех. Умер 1 больной через 8 месяцев от диссеминации процесса. Двое живут более 5 лет, трое — более 3, один — более года.
Таким образом, наличие множественных тенеобразований в легочной ткани не всегда соответствует диагнозу — метастатическое поражение легких раком другой локализации. Больные с такой патологией требуют тщательного обследования для исключения первично-множественного процесса, при котором возможно радикальное лечение, результаты его сравнимы с таковыми при солитарном раке.
В.Ю. Горшков
medbe.ru
клиника, диагностика, лечение, прогноз – тема научной статьи по медицине и здравоохранению читайте бесплатно текст научно-исследовательской работы в электронной библиотеке КиберЛенинка
Лекция
СИНХРОННЫЙ РАК МОЛОЧНЫХ ЖЕЛЕЗ: КЛИНИКА, ДИАГНОСТИКА, ЛЕЧЕНИЕ, ПРОГНОЗ
И.Ю. Филюшкина, В.М. Иванов, Ю.В. Буйденок
ГУ РОНЦ им. Н.Н. Блохина РАМН, Москва
Рак молочной железы (РМЖ) является в настоящее время одной из самых распространенных злокачественных опухолей у женщин. В структуре онкологической заболеваемости в России РМЖ занимает 1-е место и частота его неуклонно растет. Число заболевших в 2004 г. составило 49,2 тыс., а умерших — 23 тыс. Заболеваемость РМЖ в Москве и Санкт-Петербурге в 2004 г. составила 51,4 и 48,3 на 100 000 населения соответственно [1].
Первично-множественные злокачественные опухоли — это новообразования, возникающие одновременно или поочередно. Они развиваются самостоятельно и независимо друг от друга в пределах одного или нескольких органов. Синхронный РМЖ — один из вариантов первично-множественного рака; по мнению ряда авторов, он представляет собой проявление мультицентричности заболевания в парном органе. Наиболее важным признаком синхронного РМЖ является одновременность возникновения опухолей в обеих молочных железах, однако ряд авторов допускают возможность интервала между первой и второй опухолью в пределах 6—12 мес. Синхронные опухоли молочных желез выявляются достоверно реже (22,7%), чем метахронные опухоли (69,6%) [2].
На долю РМЖ среди всех первично-множественных опухолей приходится от 8 до 21,9%. По данным ГУ РОНЦ им. Н.Н. Блохина РАМН, первично-множественный мультицентрический РМЖ составил 5,7%, синхронный — 0,9%, мета-хронный — 1,0%, метастатический — 0,98%.
При первично-множественных синхронных злокачественных новообразованиях вторая опухоль при обследовании не диагностируется у 25,3% женщин [3]. Совершенствование методов своевременной диагностики, выявление особенностей или закономерностей возникновения и клинического течения синхронного РМЖ, совершенствование методов комплексного лечения способствуют улучшению результатов лечения и, как следствие, увеличению продолжительности жизни больных. Основным методом диагностики РМЖ на сегодняшний день остается маммография. T. Murphy и соавт. [4] на основании изучения маммограмм 35 больных синхронным РМЖ пришли к выводу, что маммографические проявления синхронного рака не отличаются от таковых при одностороннем раке. Двусторонние синхронные опухоли очень часто имеют одинаковые внешние проявления и расположены
в молочных железах в виде «зеркального отображения». Маммографию необходимо проводить с обеих сторон, даже при поражении одной железы.
Несмотря на высокую чувствительность маммографии (92,5%), в некоторых случаях она бывает малоинформативной. Магнитно-резонансная маммография (МРМ) желез является дополнительным эффективным методом комплексной диагностики патологии молочных желез и выполняется при неэффективности других методов визуализации (чувствительность 99,2%, специфичность 97,9%, точность 98,9%).
МРМ целесообразно использовать:
— при отчетливо определяемых (на маммо-граммах) изменениях не вполне ясной клинически значимости;
— при неотчетливо определяемых (на мам-мограммах) изменениях, в частности, при подозрении на наличие опухоли у молодых женщин, имеющих плотную структуру ткани;
— для уточнения причин локальной симптоматики в молочной железе;
— для выявления участков микрокальцинатов;
— в дифференциальной диагностике узловых форм рака и фиброзно-кистозной болезни при категорическом отказе пациентки от пункци-онной биопсии;
— для поиска скрытых форм РМЖ у пациенток с множественными метастазами из неустановленного первичного очага;
— для уточнения местной распространенности процесса;
— при дифференциальной диагностике злокачественной опухоли и жирового некроза.
В последнее время в литературе все чаще появляются сообщения о достаточно высокой значимости сцинтимаммографии в диагностике синхронного РМЖ. Имеются сообщения об использовании 99mTc-MIBI в диагностике двусторонних опухолей молочных желез. E. Derebek и соавт. [5] сообщают, что ранняя и отсроченная сцинтигра-фия предоставляют важную дополнительную информацию при синхронном поражении молочных желез даже в случаях, когда маммография и динамическая МРТ неэффективны.
Генетические факторы играют важную роль в возможной предрасположенности к возникновению синхронного РМЖ. Положительный семейный анамнез РМЖ в 2 раза чаще имеет место
Е Н
у больных синхронным РМЖ по сравнению с общей популяцией. D. Anderson [6] установил, что синхронные раки, возникающие у женщин до менопаузы, являются строго наследственными и почти у 30% дочерей данной группы велика вероятность возникновения РМЖ в возрасте до 40 лет. Данные литературы, касающиеся этой проблемы, немногочисленны и ограничены небольшим числом наблюдений. T. Kinoshita и соавт. [7] пришли к выводу, что генетические изменения и механизм канцерогенеза при одно- и двустороннем РМЖ различны. E. Ozer и соавт. [8], исследовав прогностическую значимость мутаций гена р53 при синхронном РМЖ, пришли к выводу, что выраженная степень мутаций Tр53, особенно в сочетании с экспрессией Ki-67 (маркером опухолевой клеточной пролиферации), является неблагоприятным фактором прогноза при синхронном раке и может служить предсказателем развития метахронного рака в контралатеральной молочной железе. Е.М. Бит-Сава [9] выявила, что синхронный РМЖ в 50% случаях ассоциирован с мутациями в генах BRCA1, BRCA2, а при сочетании этого признака наследственного заболевания с раком яичников у кровных родственников больной герминальные мутации в генах репарации ДНК выявляются в 100% случаев.
Общая и безрецидивная выживаемость больных синхронным РМЖ зависит от прогностических факторов. По данным Р.А. Керимова [10], средний возраст больных синхронным РМЖ составляет 49,98±2,9 года. Роль других прогностических факторов (возраст менархе, овариально-менструальная функция, время лактации, время рождения первого ребенка, соотношение между числом инвазивных и неинвазивных опухолей) одинакова при синхронном и одностороннем поражении молочных желез [11].
Р.А. Керимов [10], анализируя клинические проявления при двустороннем РМЖ, показал, что у 39,5% больных синхронным раком стадийность поражения была одинаковой с обеих сторон, у 60,5% — разной. В 59,3% случаев отмечены локализованные формы рака. Симметричное расположение опухолей выявлено в 22,9% случаев. Опухоли локализовались в наружных и верхних квадрантах молочных желез у 86% больных. Метастазы в регионарных лимфоузлах были обнаружены с обеих сторон у 50% больных, с одной — у 27,9%. При синхронном поражении наиболее часто с обеих сторон отмечался инфильтративный рак: протоковый — у 46,4% больных, дольковый — у 26,2%. У 11,9% больных установлено сочетание инфильтративного протокового или долькового рака с одной стороны и редких форм — с другой. У 73,8% больных опухоли с обеих сторон были одинакового гистологического строения,
у 26,2% — разного. Исследование окружающей ткани молочной железы при синхронном раке выявило различной степени выраженности фиброзно-кистозную болезнь, в 67,3% случаев представленную пролиферативной формой, проявляющейся развитием внутрипротоковых и внутри-дольковых пролифератов, внутрипротоковых папиллом, участков атипии эпителия. У 17,3% больных выявлены очаги неинвазивного рака.
Существенное влияние на прогноз оказывает рецепторный статус опухоли. Высокий уровень рецепторов эстрогенов свидетельствует о более благоприятном прогнозе у молодых женщин, а рецепторов прогестерона — у пожилых больных.
Распределение больных синхронным РМЖ по стадиям с каждой стороны выглядит следующим образом [10]: T1—2N0M0 и T1—2N0M0 — 18,6%; T1—2N1M0 и T1—2N1M0 — 9,3%; T3—4N0—2M0 и T3—4N0—2M0 — 24,4%; T1—2N0M0 и T1— 2N1M0 — 18,6%; T1—2N0M0 и T3—4N0—2M0 — 9,3%; T1—2N1M0 и T3—4N0—2M0 — 19,8%.
По данным Wen-shan Hong и соавт. [12], 5- и 8-летняя выживаемость больных с отсутствием поражения метастазами лимфоузлов, их односторонним и двусторонним поражением составляет 75,6 и 65,5%; 43,8 и 32,9%; 28,9 и 0% соответственно.
По данным Р.А. Керимова [10], 5-летняя общая выживаемость больных с I—Па стадией с каждой стороны составила 90,0±5,6%, безрецидив-ная — 82,2±4,8%, при Пб стадии — 75,6±8,7 и 67,4±9,5% соответственно, при Ша—б стадии — 50,4±3,2 и 40,2±3,6%; при I—На стадии с одной стороны и Пб с другой — 79, 1 ±5,3 и 69,5±5,5%; при I—Па и Ша—б — 73,2±8,8 и 65,3±9,2%; при Пб и Ша—б — 51,3±4,7 и 40,4±4,9%. Ранние стадии опухолей с одной стороны при наличии местно-распространенного процесса с другой очень незначительно влияют на выживаемость.
Методы лечения синхронного РМЖ весьма разнообразны, и их выбор зависит от прогностических факторов. Длительное время основным методом лечения оставался хирургический — двусторонняя радикальная мастэктомия. Однако с усовершенствованием методов химио- и лучевой терапии стало возможным проведение органосохраняющих операций [13].
При первично-неоперабельных формах рака с одной или обеих сторон комплексное лечение дает достоверно лучшие результаты, чем все прочие виды терапии. Неоадъювантная терапия при местно- распространенном процессе с одной или обеих сторон достоверно увеличивает и общую, и безрецидивную выживаемость, в то же время не-оадъювантное лечение при первично-операбельных стадиях не приводит к достоверному улучшению выживаемости [14].
Лекция
Лекция
Н
Р
О
За последнее десятилетие с появлением новых групп препаратов произошел переворот в гормонотерапии рака молочной железы. «Золотым стандартом» гормонотерапии более 30 лет оставался тамоксифен. Однако уровень рецидивов и профиль побочных эффектов зачастую лимитируют его практическую ценность.
Результаты исследований, посвященных применению ингибиторов ароматазы третьего поколения в адъювантном режиме, показали достоверно более высокую эффективность и лучшую переносимость по сравнению с тамоксифеном. В исследовании АТАС было установлено, что 5-летний курс инициальной адъювантной терапии Арими-дексом значительно эффективнее 5-летнего курса лечения тамоксифеном и позволяет снизить риск рецидива заболевания в группе пациентов с гормоноположительным РМЖ на 26 % (^=0,0002).
Согласно клиническим исследованиям и рекомендациям по терапии операбельного гормоноположительного РМЖ (EUSOMA 2002, St Gallen 2005) больным репродуктивного возраста должно быть предложено 2-летнее лечение ЛГРГ-a (Золадекс) ± тамоксифен в течение 5 лет как альтернатива химиотерапии. Данная схема лечения рекомендуется всем больным молодого возраста, у которых не достигнуты аменорея или кастрационный уровень эст-радиола и ФСГ после проведения химиотерапии.
Поиск новых антиэстрогенов, не обладающих активностью агонистов подобно тамоксифе-ну, привел к открытию нового класса препаратов — «чистых» антиэстрогенов. Первым препаратом, который зарегистрирован для клинического использования, стал Фазлодекс (фулвестрант) в дозе 250 мг ежемесячно. Фазлодекс — первый антиэстроген нового типа, регулятор уровня рецепторов эстрогенов (ЭР), лишенный агонистиче-
ской активности. Связывание Фазлодекса с рецепторами ведет к быстрому разрушению и потере рецепторами белков, тем самым вызывая деградацию и разрушение стероидных рецепторов к эстрогену. В клинических исследованиях была показана высокая эффективность Фазлодекса при использовании во всех линиях гормонотерапии диссеминированного РМЖ.
До сих пор вопрос о возможности выполнения органосохраняющих операций при синхронном РМЖ вызывает дискуссии. Поискам ответа на него посвящено множество исследований последних лет. Большинство авторов считают возможным выполнение этих операций при соблюдении определенных показаний. Так, Т. Агтига и соавт. [15] показаниями к выполнению органосохраняющих операций считают опухоль менее 3 см, отсутствие мультицентрического роста, отсутствие значительной инвазии протоков. Авторами были выполнены органосохраняющие операции при синхронном РМЖ у 44% больных с одной стороны и у 38% больных с обеих сторон. Показатели выживаемости в этих группах и в группе больных с мастэкто-миями практически не различались. Сходные данные были получены и многими другими авторами. Во всех этих исследованиях не было получено различий в общей и безрецидивной выживаемости, частоте рецидивов. Однако до сих пор появляются отдельные публикации, авторы которых являются строгими приверженцами выполнения операций большего объема при синхронном РМЖ.
Резюмируя проведенный выше анализ литературных данных о синхронном РМЖ, можно заключить, что эта проблема остается сложной и далеко не полностью изученной. Существует множество спорных вопросов, касающихся эпидемиологии, диагностики и лечения синхронного РМЖ.
ЛИТЕРАТУРА
1. Давыдов М.И., Аксель Е.М. Вестн РОНЦ им. Н. Н. Блохина РАМН 2006;17(3 Прил 1):47, 82, 108, 113.
2. Сельчук В.Ю. Первично-множественные опухоли (клиника, лечение
и закономерности развития). Авто-реф. дис. … докт. мед. наук. М.; 1994.
3. Сельчук В. Ю. Первично-множественные синхронные злокачественные новообразования репродуктивной системы у женщин. Рос онкол журн 2001;(3):18—21.
4. Murphy T.J., Conant E.F., Hanau CA. et al. Bilateral breast carcinoma: mammographie and histologic correlation. Radiology 1995;195(3):617— 21.
5. Derebek E., Balci P., Alanyali H. et al. Detection of bilateral multifokal breast cancer using Tc-99m sestamibi imaging: the role of delayed imaging. Clin Nucl Med 1999;24(8):590— 3.
6. Anderson D.E. Genetic study of breast cancer: identification of high risk group. Cancer 1974;34:1090— 7.
7. Kinoshita T., Ueda M., Enomoto K. et al. Comparison of p53 gene abnormalities in bilateral and unilateral breast cancer. Cancer 1995;76(12):2504— 9.
8. Ozer E., Canda T., Kuyucuolu F. p53 mutations in bilateral breast carcinoma. Correlation with Ki-67 expression and the mean nuclear volume. Cancer Lett 1998;122(1-2):101— 6.
9. Бит-Сава Е.М. Клинические и генетические аспекты наследственного рака молочной железы. Автореф. дис. … канд. мед. наук. С.-Пб.; 2005.
10. Керимов Р.А. Двусторонний рак молочных желез: особенности течения и результаты терапии. Маммология 2005;(1):36—41.
11. Kelmendi de Ustaran J.,
Meiss Roberto P. Cancer bilateral sin-cronico de mama (aspectos epidemio-logicos). Bol Acad Nac Med Buenos Aires 1986;64(2):492— 502.
12. Hong Wen-shan, Yang Ming-tian, Wang Si-yu et al. Zhongliu fangzhi zazhi 2005;12(4):297— 300.
13. Летягин В.П. Первичные опухоли молочной железы. Практическое руководство по лечению. М.; 2004. с. 205—33.
14. Летягин В.П., Высоцкая И.В. Лечение двустороненного синхронного рака молочных желез стадий Т0— 2N0—1M0. Вестн РОНЦ 2004;(4): 23—7.
15. Arimura T., Fukuda M., Ohtuka T. et al. Evaluation of possibility of breast conserving for patients with synchronous bilateral breast cancer. J Jpn Soc Cancer Ther 1994;29(2):513.
cyberleninka.ru
Диагностика и лечение синхронного рака молочных железы
Рак молочной железы – в настоящее время одно из самых распространенных злокачественных опухолей у женщин. В структуре онкологической заболеваемости в России рак молочной железы занимает первое место и частота его неуклонно растет. Число заболевших в 2004 году составило 49,2 тыс. а умерших — 23 тыс. Заболеваемость раком молочной железы в Москве и Санкт-Петербурге в 2004году составила 51,4 и 48,3 на 100000 населения, соответственно (М. И. Давыдов, Е.М.Аксель) [2] .
Первично-множественные злокачественные опухоли — одновременное или поочередное возникновение злокачественных опухолей. Они развиваются самостоятельно и независимо друг от друга в пределах одного или нескольких органов. Синхронный рак молочных желез — один из вариантов первично-множественного рака, и по мнению ряда авторов, является проявлением мультицентричности заболевания в парном органе. Наиболее важным признаком синхронного рака молочных желез является одновременность возникновения опухолей в обеих молочных железах, однако ряд авторов допускает возможность интервала между первой и второй опухолью в пределах 6-12 месяцев. Синхронные опухоли молочных желез выявляются достоверно реже (22,7%), чем метахронные опухоли (69,6%) [6] .
На долю рака молочной железы среди всех первично-множественных опухолей приходится от 8% до 21,9%. По данным ОНЦ РАМН, первично-множественный мультицентрический рак молочной железы составил 5,7%, синхронный рак – 0,9%, метахронный рак – 1,0%, метастатический рак молочной железы – 0,98%.
При первично- множественных синхронных злокачественных новообразованиях вторая опухоль при обследовании не диагностируется у 25,3% женщин [7]. Совершенствование методов своевременной диагностики, выявление особенностей или закономерностей возникновения и клинического течения синхронного рака молочных желез, усовершенствование методов комплексного лечения способствуют улучшению результатов лечения, и, как следствие, увеличению продолжительности жизни больных. Основным методом диагностики рака на сегодняшний день остается маммография. T. J. Murphy и соавт. на основании изучения маммограмм 35 больных синхронным раком молочных желез пришли к выводу, что маммографические проявления синхронного рака не отличаются от таковых при одностороннем раке. Двухсторонние синхронные опухоли очень часто имеют одинаковые внешние проявления и расположены в молочных железах в виде «зеркального отображения» [14]. Маммографию необходимо проводить с обеих сторон, даже при поражении одной железы.
Несмотря на высокую чувствительность маммографии (92,5%), в некоторых случаях она бывает малоинформативной. Магнитно-резонансная маммография (МР-маммография) желез является дополнительным эффективным методом комплексной диагностики патологии молочных желез и реализуется при неэффективности других методов визуализации (чувствительность 99,2%, специфичность 97,9%, точность 98,9%).
МР- маммографию целесообразно использовать при:
- отчетливо определяемых (на маммограммах) изменениях не вполне ясной клинически значимости;
- неотчетливо определяемых (на маммограммах) изменениях, в частности, при подозрении на наличие опухоли у молодых женщин, имеющих плотную структуру ткани;
- уточнение причин локальной симптоматики в молочной железе;
- выявлении участков микрокальцинатов;
- дифференциальной диагностике узловых форм рака и ФКБ при категорическом отказе пациентки от пункционной биопсии;
- поиске скрытых форм рака молочной железы у пациенток с множественными метастазами из неустановленного первичного очага;
- уточнении местной распространенности процесса;
- при дифференциальной диагностике злокачественной опухоли и жирового некроза.
В последнее время в литературе все чаще появляются сообщения о достаточно высокой значимости сцинтимаммографии в диагностике синхронного рака молочных желез. Имеются сообщения об использовании 99mTc-MIBI в диагностике двухсторонних опухолей молочных желез. E.Derebek и соавт. сообщают о том, что ранняя и отсроченная сцинтиграфия предоставляет важную дополнительную информацию при синхронном поражении молочных желез, даже в случаях, когда маммография и динамическая МРТ не эффективны [10] .
Генетические факторы играют важную роль в возможной предрасположенности к возникновению синхронного рака молочных желез. Положительный семейный анамнез рака молочной железы в 2 раза чаще имеет место у больных синхронным раком молочных желез по сравнению с общей популяцией. Anderson D.E. установил, что синхронные раки, возникающие у женщин до менопаузы, являются строго наследственными и почти у 30% дочерей данной группы велика вероятность возникновения рака молочной железы в возрасте до 40 лет [8]. Данные литературы, касающиеся этой проблемы, немногочисленны, и анализируют небольшое число наблюдений. Kinoshita T. И соавт. пришли к выводу, что генетические изменения и механизм канцерогенеза при одностороннем и двухстороннем раке молочных желез различны [13]. A. E. Ozer и соавт. исследовав прогностическую значимость мутаций гена р53 при синхронном раке молочных желез, пришли к выводу, что выраженная степень мутаций р53, особенно в сочетании с экспрессией Ki-67 (маркером опухолевой клеточной пролиферации), является неблагоприятным фактором прогноза при синхронном раке и может служить предсказателем развития метахронного рака в контрлатеральной молочной железе [15]. Е.М. Бит-Савва выявила, что синхронный рак молочных желез в 50% случаях ассоциирован с мутациями в генах BRCA1, BRCA2, а при сочетании этого признака наследственного заболевания с раком яичников у кровных родственников больной, герминальные мутации в генах репарации ДНК выявляются в 100% случаев [1] .
Общая и безрецидивная выживаемость больных синхронным раком молочных желез зависит от прогностических факторов. По данным Р. А. Керимова, средний возраст больных синхронным раком молочных желез составляет 49,98 ± 2,9 года [3] . По J.Kelmendi de Ustrann и соавт. роль других прогностических факторов (возраст; менархе; овариально- менструальная функция, время лактации, время рождения первого ребенка, соотношение между числом инвазивных и неинвазивных опухолей) одинакова при синхронном и одностороннем поражении молочных желез [12] .
Р. А. Керимов, анализируя клинические проявления при двухстороннем раке молочных желез, показал, что у 39,5% больных синхронным раком стадийность поражения была одинаковой с обеих сторон, у 60,5% — разная. Более чем в половине случаев (59,3%) отмечены локализованные формы рака. Симметричное расположение опухолей выявлено в 22,9% случаях. Опухоли локализовались в наружных и верхних квадрантах молочных желез у 86% больных. Метастазы в регионарных лимфатических узлах были обнаружены с обеих сторон у 50% больных, с одной – у 27,9%. При синхронном поражении наиболее часто с обеих сторон отмечался инфильтративный рак: протоковый у 46,4% больных, дольковый – у 26,2% больных. У 11,9% больных установлено сочетание инфильтративного протокового или долькового рака с одной стороны и редких форм – с другой. У 73,8% больных опухоли с обеих сторон были одинакового гистологического строения, у 26,2% — различного. Исследование окружающей ткани молочной железы при синхронном раке выявило различной степени выраженности фиброзно-кистозную болезнь: в 67,3% случаев – пролиферативная форма, проявляющаяся развитием внутрипротоковых и внутридольковых пролифератов, внутрипротоковых папиллом, участков атипии эпителия. У 17,3% больных выявлены очаги неинвазивного рака [3] .
Существенное влияние на прогноз оказывает рецепторный статус опухоли. Высокий уровень рецепторов эстрогенов свидетельствует о более благоприятном прогнозе у молодых женщин, а рецепторов прогестерона – у пожилых больных.
Распределение больных синхронным раком молочных желез по стадиям с каждой стороны следующая: T 1-2 N 0 M 0 и T 1-2 N 0 M 0 – у 18,6% больных; T 1-2 N 1 M 0 и T 1-2 N 1 M 0 – у 9,3%; T 3-4 N 0-2 M 0 и T 3-4 N 0-2 M 0 – у 24,4%; T 1-2 N 0 M 0 и T 1-2 N 1 M 0 – у 18,6%; T 1-2 N 0 M 0 и T 3-4 N 0-2 M 0 – у 9,3%; T 1-2 N 1 M 0 и T 3-4 N 0-2 M 0 – у 19,8%. Локализованные формы рака отмечены более чем в половине случаев – у 59,3% пациентов [3] .
По данным Hong Wen-shan показатели 5- и 8-летней выживаемости у больных с отсутствием поражения метастазами лимфатических узлов, односторонним поражением лимфатических узлов и двухсторонним поражением лимфатических узлов – 75,6 и 65,5%; 43,8 и 32,9%; 28,9 и 0% соответственно [11] .
По Р. А. Керимову 5-летняя общая выживаемость больных с I-IIа с каждой стороны составила 90,0 ± 5,6%, безрецидивная – 82,2 ± 4,8%, при IIб стадии – соответственно 75,6 ± 8,7% и 67,4 ± 9,5%, при lllа-б стадии – 50,4 ± 3,2 и 40,2 ± 3,6%; при l-llа стадии с одной стороны и llб с другой – соответственно 79,1 ± 5,3% и 69,5 ± 5,5%, при l-llа и lllа-б – 73,2 ± 8,8% и 65,3 ± 9,2%, при llб и lllа-б – 51,3 ± 4,7% и 40,4 ± 4,9%. Ранние стадии опухолей с одной стороны при наличии местно-распространенного процесса с другой очень незначительно влияют на выживаемость [3] .
Лечение синхронного рака молочных желез весьма разнообразно и зависит от прогностических факторов. Длительное время основным методом лечения оставался хирургический – двухсторонняя радикальная мастэктомия. Однако, с усовершенствованием методов химио- и лучевой терапии, стало возможным проведение органосохраняющих операций [5] .
При первично-неоперабельных формах рака с одной или обеих сторон комплексное лечение дает достоверно лучшие результаты, чем все прочие виды терапии. Проведение неоадъювантной терапии при местно- распространенном процессе с одной или с обеих сторон достоверно увеличивает и общую, и безрецидивную выживаемость, в то же время проведение неоадъювантного лечения при первично- операбельных стадиях не приводит к достоверному улучшению выживаемости [4] .
До сих пор вопрос о возможности выполнения органосохраняющих операций при синхронном раке молочных желез является противоречивым. Поиском ответа на этот вопрос посвящено множество исследований последних лет. Большинство авторов считают возможным выполнение этих операций при соблюдении определенных показаний. Так, T.Arimura и соавт. показаниями к выполнению органосохраняющих операций считают опухоль менее 3-х см, отсутствие мультицентрического роста, отсутствие значительной инвазии протоков. Авторами были выполнены органосохраняющие операции при синхронном раке молочных желез у 44% больных с одной стороны и у 38% больных с обеих сторон. Показатели выживаемости в этих группах и в группе больных с мастэктомиями практически не различались [9]. Сходные данные были получены и многими другими авторами. Во всех этих исследованиях не было получено различий в общей и безрецидивной выживаемости, частоте рецидивов. Однако, остаются еще отдельные публикации, в которых авторы являются строгими приверженцами выполнения операций большего объема при синхронном раке молочных желез.
Резюмируя проведенный выше анализ литературных данных о синхронном раке молочных желез, можно заключить, что эта проблема остается сложной и далеко не полностью изученной. Существует множество спорных вопросов, касаемых эпидемиологии, диагностики и лечения синхронного рака молочных желез.
Читайте также:
therapycancer.ru
Билатеральный синхронный рак молочной железы: отдаленные результаты лечения — Онкология. Журнал им. П.А. Герцена — 2014-01
В структуре онкологической заболеваемости женщин на долю рака молочной железы (РМЖ) приходится 20,7% [1]. По мере увеличения числа больных РМЖ повышается частота первичного поражения обеих молочных желез.
В последнее время интерес к изучению билатерального РМЖ заметно возрос. Это связано с накоплением клинических наблюдений и экспериментальных данных об особенностях возникновения и течения различных форм первично-множественного РМЖ. В настоящее время продолжается дискуссия о ранней диагностике второго РМЖ в связи с внедрением в онкологическую практику органосохраняющих операций и профилактических мастэктомий. Не определены факторы, влияющие на прогноз заболевания, знание которых необходимо для объективного выбора адекватного метода лечения.
Частота встречаемости билатерального поражения молочных желез, по данным литературы, составляет от 0,1 до 20%. Следует отметить, что метахронные опухоли выявляются чаще, чем синхронные и составляют от 0,9 до 4,5% [2].
Одним из актуальных аспектов проблемы первичной множественности опухолей остается определение принципиальных позиций в выборе лечебной тактики. Это в первую очередь связано с увеличением контингента подобных больных. Еще несколько десятилетий назад выявление второй злокачественной опухоли, как правило, являлось противопоказанием к планированию радикального лечения. Определение тактики лечения синхронно выявленных опухолей — задача гораздо более сложная, и требует более дифференцированного подхода к каждой конкретной больной.
К факторам, влияющим на выбор лечения при билатеральном синхронном РМЖ, можно отнести следующие: локализация, стадия и гистогенез каждой опухоли; прогноз каждой из выявленных опухолей; возраст и соматическое состояние больной, а также нарушения, связанные с наличием опухолей; характер предшествующего лечения; состояние менструальной функции. Очень спорным остается вопрос о необходимости выполнения биопсии контралатеральной молочной железы и контралатеральной мастэктомии.
Вопрос о возможности выполнения органосохраняющих операций при билатеральном РМЖ остается дискутабельным. Поискам ответа на него посвящено множество исследований последних лет. Большинство авторов считают возможным выполнение этих операций при соблюдении определенных показаний. Так, T. Arimura и соавт. [3] показаниями к выполнению органосохраняющих операций считают опухоль менее 3 см, отсутствие мультицентрического роста и значительной инвазии протоков. Авторами были выполнены органосохраняющие операции при синхронном РМЖ у 44% больных с одной стороны и у 38% — с обеих сторон. Показатели выживаемости в этих группах и в группе больных с мастэктомиями практически не различались. Во всех этих исследованиях не было получено различий общей и безрецидивной выживаемости, частоте рецидивов. Авторы считают выполнение органосохраняющих операций при билатеральном раке альтернативой мастэктомиям при наличии соответствующих показаний к ним, как и при одностороннем РМЖ. L. Wilson и соавт. [4] считают, что частота местных рецидивов после органосохраняющих операций с послеоперационной лучевой терапией в группе больных с двусторонним РМЖ выше, в связи с чем этим больным показано выполнение мастэктомии.
В исследовании S. Mose и соавт. [5] изучены отдаленные результаты лечения 498 больных РМЖ, из которых у 36 имелась двусторонняя опухоль. В группе с двусторонним раком 10-летняя выживаемость составила 56%, в группе с односторонним раком — 54%. Частота рецидивов составила 38,8 и 24,4% соответственно (р>0,05). Авторы приходят к выводу, что наличие двустороннего рака не влияет существенно на выживаемость, хотя развитие метастазов и местных рецидивов в этой группе больных встречается несколько чаще. По данным Р.А. Керимова [6], 5-летняя общая выживаемость больных при синхронном раке I—IIA стадии с каждой стороны составила 90,0±5,6%, безрецидивная — 82,2±4,8%, при IIВ стадии — 75,6±8,7 и 67,4±9,5% соответственно, при IIIА—В стадии — 50,4±3,2 и 40,2±3,6%; при I—IIA стадии с одной стороны и IIB с другой — 79,1±5,3 и 69,5±5,5%; при I—IIA и IIIA—B — 73,2±8,8 и 65,3±9,2%; при IIB и IIIA—B — 51,3±4,7 и 40,4±4,9%. Ранние стадии опухолей с одной стороны при наличии местно-распространенного процесса с другой очень незначительно влияют на выживаемость. R. Bellantone и соавт. [7], H. Brenner и соавт. [8] показали, что выживаемость у этих больных намного ниже. По данным В.П. Демидова и соавт. [9], суммарно при всех стадиях заболевания при билатеральном синхронном раке 3-летняя выживаемость составила 82,7%, 5-летняя — 65,2%, 7 лет прожили 36,4% больных. При рассмотрении выживаемости больных по стадиям заболевания авторы отметили низкую 5-летнюю выживаемость при IIА и IIIА стадиях (60 и 50% соответственно) и очень низкую при IIIА (0%) и IIIB (20%) стадиях. При билатеральном метахронном раке 5-летняя выживаемость при лечении первой опухоли составила 87,9%, а после лечения второй опухоли — 43,8%. В целом прогноз при двустороннем метахронном РМЖ, по данным авторов, значительно хуже, чем при синхронном билатеральном раке.
При первично-нерезектабельных формах рака с одной или обеих сторон комплексное лечение дает достоверно лучшие результаты, чем все прочие виды терапии. Неоадъювантная терапия при местно-распространенном процессе с одной или обеих сторон достоверно увеличивает и общую, и безрецидивную выживаемость, в то же время неоадъювантное лечение при первичных стадиях не приводит к достоверному улучшению выживаемости [4, 7, 8].
Материал и методы
В МНИОИ им. П.А. Герцена проведен анализ результатов обследования и лечения 59 больных с билатеральным синхронным РМЖ.
Средний возраст пациенток составил 55,7±1,7 года.
Одинаковая стадия заболевания в двух молочных железах была выявлена у 20 (34%) из 59 больных, в том числе I стадия — у 5 (8,5%), IIА — у 6 (10,2%), IIB — у 2 (3,4%), IIIА — у 4 (6,8%), IIIB — у 3 (5,1%). У остальных 39 (66,0%) стадия была разной. Сочетание начальных (I и IIA) стадий рака в обеих молочных железах выявлено у 16 (27,1%) больных. У остальных 43 (72,9%) имел место местно-распространенный рак IIB, IIIА, IIIB стадий в одной железе, который сочетался с опухолевым процессом такой же распространенности в другой — у 21 (35,5%) больной или начальных I и IIА стадий — у 22 (37,2%). Таким образом, в наших наблюдениях чаще диагностировали билатеральный синхронный РМЖ разных стадий, причем у значительной части больных (у 43 из 59) в другой железе преобладал рак распространенных стадий.
Метастазы в регионарных лимфатических узлах были выявлены у 45 (76,3%) больных. Метастазы в регионарных лимфатических узлах были выявлены с одной стороны у 23 (39,0%) больных, с двух сторон — у 22 (37,3%) больных. При двустороннем регионарном метастазировании уровень поражения был одинаковым у 13 (22,0%), разным — у 9 (15,2%) больных.
Наиболее часто с обеих сторон имел место инфильтративный протоковый рак (49,1%) .
При билатеральном синхронном РМЖ раздельно проводили лечение каждой пораженной молочной железы в соответствии со стадией опухолевого процесса и общего состояния больной. В 95% (56 больных) проведено хирургическое лечение каждой пораженной молочной железы. У 3 (5%) пациенток проведено паллиативное химиогормональное лечение в связи с наличием тяжелых интеркуррентных сопутствующих заболеваний. У 2 из 56 больных выполнено хирургическое лечение только с одной стороны.
Подавляющему большинству больных — 30 (53,6%) выполнена радикальная мастэктомия (Холстед, Пэйти, Пирогов, Мадден) с двух сторон (рис. 1).
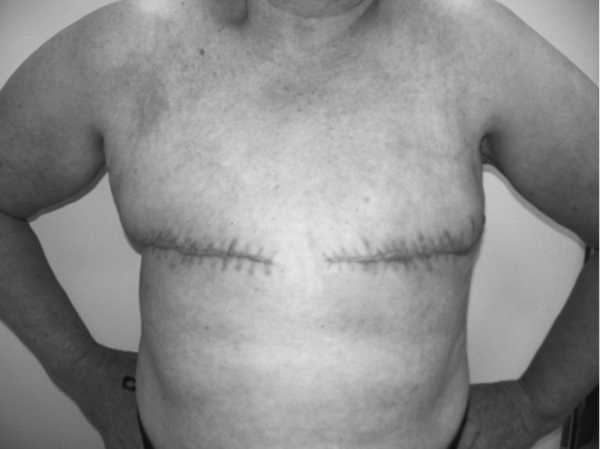
Радикальные резекции с двух сторон — у 7 (12,5%), мастэктомия с одной стороны и органосохраняющие и реконструктивно-пластические операции с другой — у 10 (18%), органосохраняющие и реконструктивно-пластические операции с двух сторон — у 7 (12,5%) больных (рис. 2).
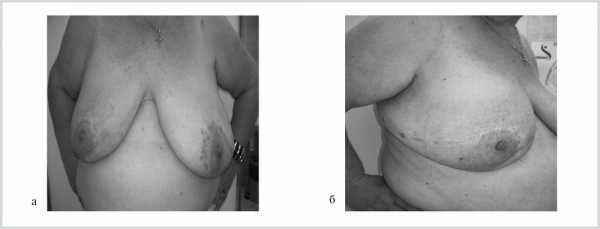
Неоадъювантная химиотерапия проведена 10 (16,9%) больным, лучевая терапия — 11 (18,6%), химиолучевое лечение — 6 (10,1%) больным. Адъювантная химиотерапия проведена 8 (13,5%) больным, лучевая терапия — 11 (18,6%), химиолучевое лечение — 29 (49,1%) больным. Гормональную терапию получили 33 (56%) пациентки.
Анализ отдаленных результатов лечения при билатеральном синхронном РМЖ показал, что местные рецидивы выявлены у 4 (6,8%) больных, в среднем через 54,5±24,2 мес. При этом ни у одной пациентки не было выявлено двусторонних рецидивов. Отдаленные метастазы возникли у 17 (28,8%) больных, в среднем через 34,6±5,9 мес.
В целом 3- и 5-летняя выживаемость составила 83,1±4,9 и 72,8±5,8%, безрецидивная выживаемость на тех же сроках — 74,6%±5,7 и 66,1±6,1% соответственно.
В зависимости от стадии заболевания 5-летняя выживаемость больных при I и IIА стадии с каждой стороны составила 85,7±10,0%, безрецидивная — 85,7±9,3 и 85,7±9,3%; при IIВ, IIIА—В стадии — 28,6±17,1 и 14,3±13,2% соответственно; при I, IIА стадии с одной стороны и IIIА—В с другой — 66,7±12,2 и 60,0±12,6% соответственно и при IIВ и IIIА—В стадиях — 50,0±17,7 и 28,5±17,0% соответственно. Из приведенных данных видно, что общая и безрецидивная выживаемость достоверно (р<0,05) снижаются с увеличением стадии опухолевого процесса с каждой стороны (табл. 1). Наличие ранней стадии с одной стороны и местно-распространенного процесса с другой очень незначительно влияют на выживаемость. Выживаемость преимущественно определяется местно-распространенным процессом.
Общая 5-летняя выживаемость в 1-й группе после хирургического лечения составила 80,0±17,8%, безрецидивная — 60,0±22,0%, после комбинированного лечения — 88,0±11,5 и 88,0±11,5% соответственно, после комплексного лечения — 100 и 91,0±8,6% соответственно.
Во 2-й группе больных 5-летняя выживаемость после консервативного и хирургического лечения составила 0%, безрецидивная — 0%, после комбинированного лечения — 50,0±25,0 и 50,0±25,0%, после комплексного лечения — 63,0±9,3 и 55,5±9,6% соответственно (табл. 2).
Из приведенных данных видно, что внутри групп различия в выживаемости из-за малой численности больных недостоверны (р>0,05). Мы также не получили достоверных различий общей и безрецидивной выживаемости в группах с комбинированным и комплексным лечением, она практически одинаковая, хотя есть тенденция к увеличению выживаемости у больных, получивших комплексную терапию.
Прогноз заболевания у больных при билатеральном раке достоверно хуже, чем при одностороннем РМЖ. При одностороннем раке 5-летняя общая выживаемость составила 90,2±1,0%, при двустороннем синхронном — 72,8±5,8%, при метахронном — 73,0±5,5%, и безрецидивная — 84,7±1,3, 66,1±6,1 и 65,0±5,5% соответственно (р<0,05) (табл. 3, 4).
При билатеральном синхронном раке прогноз жизни больных коррелирует с наибольшей стадией опухолевого процесса. 5-летняя общая выживаемость больных с I и IIА стадиями с каждой стороны составила 85,7±10,%, безрецидивная — 85,7±9,3%, при IIВ, IIIА стадиях с каждой стороны — 28,6±17,1 и 14,3±13,2% соответственно (р<0,05). Прогноз заболевания у пациентов с билатеральным раком достоверно хуже, чем у больных с односторонним РМЖ. 5-летняя общая выживаемость при одностороннем раке составила 90,2±1,0%, при билатеральном синхронном — 72,8±5,8%, безрецидивная — 84,7±1,3 и 66,1±6,1% (р<0,05).
Лечение при билатеральном синхронном РМЖ проводится на основании учета стадии с каждой стороны. При первично-резектабельных формах рака с двух сторон возможно проведение хирургического или комбинированного лечения. При первично-нерезектабельных формах рака с одной или обеих сторон показано проведение комплексного лечения.
www.mediasphera.ru
