Закрытая митральная комиссуротомия – ЗАКРЫТАЯ и ОТКРЫТАЯ МИТРАЛЬНАЯ КОМИССУРОТОМИЯ
ЗАКРЫТАЯ и ОТКРЫТАЯ МИТРАЛЬНАЯ КОМИССУРОТОМИЯ
Хирургия клапанов сердца ¦ Закрытая и открытая митральная комиссуротомия
Закрытая митральная комиссуротомия заключается в хирургическом разделении сращений створок левого атриовентрикулярного отверстия в случае его стеноза. Выполняется данная операция на закрытом сердце без применения искусственного (экстракорпорального) кровообращения из лево- или правостороннего торакотомического доступа.
После того как посредством чреспищеводной эхокардиографии исключено присутвствие тромба в ушке левого предсердия, на него накладывают кисетный шов, проникают в полость сердца и производят пальцевую ревизию, оценивая таким образом состояние митрального клапана, выясняя степень его стеноза (сужения) и подвижности створок.
Рыхлые сращения допускается разъединять пальцевым способом, плотные спайки — только при помощи специальных инструментов (дилататоров, комиссуротомов), которыми расширяют суженное митральное отверстие до диаметра в 3,5-4 сантиметра. С целью снижения риска эмболии артериальных сосудов головного мозга в момент выполнения этой манипуляции рекомендуют надавливать на сонные артерии. Невозможность проведения адекватной закрытой комиссуротомии считается поводом к переходу на экстракорпоральное кровообращение и выполнению открытого хирургического вмешательства.
Кстати, с 1950-х годов — с момента внедрения в практику метода искусственного кровообращения закрытую митральную комиссуротомию стало вытеснять протезирование. Её использование теперь считается оправданным лишь тогда, когда отсутствует возможность по тем либо иным причинам осуществлять искусственное кровообращение. Также закрытую митральную комиссуротомию в некоторых случаях производят у беременных с тяжёлым митральным стенозом.
К открытой митральной комиссуротомии обращаются тогда, когда имеет место невыраженное поражение клапанного аппарата пациента в отсутствие массивного кальцинирования. При этом операция предполагает выполнение срединной стернотомии и переход на экстракорпоральное кровообращение с так называемым бикавальным канюлированием. В левое предсердие хирург входит с задней его поверхности в районе межжелудочковой борозды. После того, как обнажён митральный клапан, приступают собственно к комиссуротоми, в первую очередь выявив область слияния створок, а потом разрезав этот участок в направлении от его свободного конца к фиброзному кольцу. Затем аккуратно разделяют сухожильные хорды и продолжают вести разрез продольно до папиллярных мышц.
При этом можно локально удалить небольшие отложения кальция, стараясь при этом никоим образом не повредить клапанный аппарат. В завершении разрез левого предсердия ушивают и прекращают искусственное кровообращение. В отличие от закрытой комиссуротомии, открытая методика позволяет более надёжно осуществить удаление тромбов из предсердия и рассечь имеющиеся спайки. Открытая митральная комиссуротомия даёт отличные отдалённые результаты, но сопряжена с риском развития рестеноза либо недостаточности клапана. Только незначительной части (не более 7%) всех пациентов в последующем требуется протезирование митрального клапана. При закрытой комиссуротомии высока вероятность формирования митральной недостаточности и эмболии, особенно в случае тромбоза предсердия и наличия кальциноза клапана.
(495) 506-61-01 — где лучше оперировать клапаны сердца
ЗАПРОС в КЛИНИКУ
www.rusmedserv.com
ХИРУРГИЯ МИТРАЛЬНОГО КЛАПАНА – МИТРАЛЬНАЯ КОМИССУРОТОМИЯ
ХИРУРГИЯ МИТРАЛЬНОГО КЛАПАНА – МИТРАЛЬНАЯ КОМИССУРОТОМИЯ
Митральный клапан (двустворчатый клапан) сердца — клапан между левым предсердием и левым желудочком сердца. Представлен двумя соединительнотканными пластинками, которые предотвращают, во время систолы левого желудочка, регургитацию (обратный ток) крови в левое предсердие.
Различные патологические процессы, как приобретенные, так и врожденные, могут вызывать нарушение работы клапанов.
Митральная комиссуротомия – это метод хирургического лечения врожденной или приобретенной патологии митрального клапана.
МИТРАЛЬНАЯ КОМИССУРОТОМИЯ — хирургическая операция, целью которой является рассечение спаек лепестков митрального клапана сердца (комиссур).
Проводится митральная комиссуротомия для лечения митрального стеноза — патологического сужения митрального клапана сердца (между левыми предсердием и желудочком). Операция проводится всем больным митральным стенозом, за исключением первой стадии заболевания, когда собственные компенсаторные механизмы организма позволяют ему легко справляться с возникшими нарушениями.
Митральная комиссуротомия бывает двух типов:
Закрытая
Открытая
ЗАКРЫТАЯ МИТРАЛЬНАЯ КОМИССУРОТОМИЯ
Закрытая митральная комиссуротомия
Выполняется данная операция на закрытом сердце без применения искусственного (экстракорпорального) кровообращения из лево- или правостороннего торакотомического доступа.
После того как посредством чреспищеводной эхокардиографии исключено присутвствие тромба в ушке левого предсердия, на него накладывают кисетный шов, проникают в полость сердца и производят пальцевую ревизию, оценивая таким образом состояние митрального клапана, выясняя степень его стеноза (сужения) и подвижности створок.
Рыхлые сращения допускается разъединять пальцевым способом, плотные спайки — только при помощи специальных инструментов (дилататоров, комиссуротомов), которыми расширяют суженное митральное отверстие до диаметра в 3,5-4 сантиметра.
С целью снижения риска эмболии артериальных сосудов головного мозга в момент выполнения этой манипуляции рекомендуют надавливать на сонные артерии.
Невозможность проведения адекватной закрытой комиссуротомии считается поводом к переходу на экстракорпоральное кровообращение и выполнению открытого хирургического вмешательства.
C 1950-х годов — с момента внедрения в практику метода искусственного кровообращения закрытую митральную комиссуротомию стало вытеснять протезирование.
Закрытую комиссуротомию использовать теперь считается оправданным лишь тогда, когда отсутствует возможность по тем либо иным причинам осуществлять искусственное кровообращение. Закрытую митральную комиссуротомию в некоторых случаях производят у беременных с тяжёлым митральным стенозом.
При закрытой комиссуротомии высока вероятность формирования митральной недостаточности и эмболии, особенно в случае тромбоза предсердия и наличия кальциноза клапана.
ОТКРЫТАЯ МИТРАЛЬНАЯ КОМИССУРОТОМИЯ
Открытая митральная комиссуротомия – операция, которая предполагает выполнение срединной стернотомии и переход на экстракорпоральное кровообращение с так называемым бикавальным канюлированием.
К открытой митральной комиссуротомии обращаются тогда, когда имеет место невыраженное поражение клапанного аппарата пациента в отсутствие массивного кальцинирования.
В левое предсердие хирург входит с задней его поверхности в районе межжелудочковой борозды. После того, как обнажён митральный клапан, приступают собственно к комиссуротоми, в первую очередь выявив область слияния створок, а потом разрезав этот участок в направлении от его свободного конца к фиброзному кольцу. Затем аккуратно разделяют сухожильные хорды и продолжают вести разрез продольно до папиллярных мышц.
При этом можно локально удалить небольшие отложения кальция, стараясь при этом никоим образом не повредить клапанный аппарат.
В завершении разрез левого предсердия ушивают и прекращают искусственное кровообращение.
В отличие от закрытой комиссуротомии, открытая методика позволяет более надёжно осуществить удаление тромбов из предсердия и рассечь имеющиеся спайки.
Открытая митральная комиссуротомия даёт отличные отдалённые результаты, но сопряжена с риском развития рестеноза либо недостаточности клапана. Только незначительной части (не более 7%) всех пациентов в последующем требуется протезирование митрального клапана.
coronarography.ru
МИТРАЛЬНЫЙ КЛАПАН – МИТРАЛЬНАЯ КОМИССУРОТОМИЯ
Митральный клапан (двустворчатый клапан) сердца — клапан между левым предсердием и левым желудочком сердца. Представлен двумя соединительнотканными пластинками, которые предотвращают, во время систолы левого желудочка, регургитацию (обратный ток) крови в левое предсердие.
Митральная комиссуротомия — хирургическая операция, целью которой является рассечение спаек лепестков митрального клапана сердца (комиссур).
Проводится митральная комиссуротомия для лечения митрального стеноза — патологического сужения митрального клапана сердца (между левыми предсердием и желудочком). Операция проводится всем больным митральным стенозом, за исключением первой стадии заболевания, когда собственные компенсаторные механизмы организма позволяют ему легко справляться с возникшими нарушениями.
Митральная комиссуротомия бывает двух типов:
Закрытая
Открытая
ЗАКРЫТАЯ МИТРАЛЬНАЯ КОМИССУРОТОМИЯ
Закрытая митральная комиссуротомия — это хирургическое разделение сращений створок левого атриовентрикулярного отверстия в случае его стеноза.
Выполняется данная операция на закрытом сердце без применения искусственного (экстракорпорального) кровообращения из лево- или правостороннего торакотомического доступа.
После того как посредством чреспищеводной эхокардиографии исключено присутвствие тромба в ушке левого предсердия, на него накладывают кисетный шов, проникают в полость сердца и производят пальцевую ревизию, оценивая таким образом состояние митрального клапана, выясняя степень его стеноза (сужения) и подвижности створок.
Рыхлые сращения допускается разъединять пальцевым способом, плотные спайки — только при помощи специальных инструментов (дилататоров, комиссуротомов), которыми расширяют суженное митральное отверстие до диаметра в 3,5-4 сантиметра.
С целью снижения риска эмболии артериальных сосудов головного мозга в момент выполнения этой манипуляции рекомендуют надавливать на сонные артерии.
Невозможность проведения адекватной закрытой комиссуротомии считается поводом к переходу на экстракорпоральное кровообращение и выполнению открытого хирургического вмешательства.
C 1950-х годов — с момента внедрения в практику метода искусственного кровообращения закрытую митральную комиссуротомию стало вытеснять протезирование.
Закрытую комиссуротомию использовать теперь считается оправданным лишь тогда, когда отсутствует возможность по тем либо иным причинам осуществлять искусственное кровообращение. Закрытую митральную комиссуротомию в некоторых случаях производят у беременных с тяжёлым митральным стенозом.
При закрытой комиссуротомии высока вероятность формирования митральной недостаточности и эмболии, особенно в случае тромбоза предсердия и наличия кальциноза клапана.
ОТКРЫТАЯ МИТРАЛЬНАЯ КОМИССУРОТОМИЯ
Открытая митральная комиссуротомия – операция, которая предполагает выполнение срединной стернотомии и переход на экстракорпоральное кровообращение с так называемым бикавальным канюлированием.
К открытой митральной комиссуротомии обращаются тогда, когда имеет место невыраженное поражение клапанного аппарата пациента в отсутствие массивного кальцинирования.
В левое предсердие хирург входит с задней его поверхности в районе межжелудочковой борозды. После того, как обнажён митральный клапан, приступают собственно к комиссуротоми, в первую очередь выявив область слияния створок, а потом разрезав этот участок в направлении от его свободного конца к фиброзному кольцу. Затем аккуратно разделяют сухожильные хорды и продолжают вести разрез продольно до папиллярных мышц.
При этом можно локально удалить небольшие отложения кальция, стараясь при этом никоим образом не повредить клапанный аппарат.
В завершении разрез левого предсердия ушивают и прекращают искусственное кровообращение.
В отличие от закрытой комиссуротомии, открытая методика позволяет более надёжно осуществить удаление тромбов из предсердия и рассечь имеющиеся спайки.
Открытая митральная комиссуротомия даёт отличные отдалённые результаты, но сопряжена с риском развития рестеноза либо недостаточности клапана. Только незначительной части (не более 7%) всех пациентов в последующем требуется протезирование митрального клапана.
В кардиологических клиниках Израиля пациенты получают качественную медицинскую помощь со стороны высококвалифицированных кардиохирургов, которые подбирают индивидуальный подход к каждому пациенту.
Операция по протезированию клапанов сердца стала обычной для кардиохирургических клиник Израиля, благодаря современным операционным и высокой подготовке хирургов. Протезирование клапанов выполняется не только взрослым, но и детям.
ichilov.net
митр. стеноз. комиссуротомия
Закрытая и открытая митральная комиссуротомия
Закрытая митральная комиссуротомия заключается в хирургическом разделении сращений створок левого атриовентрикулярного отверстия в случае его стеноза. Выполняется данная операция на закрытом сердце без применения искусственного (экстракорпорального) кровообращения из лево- или правостороннего торакотомического доступа.
После того как посредством чреспищеводной эхокардиографии исключено присутвствие тромба в ушке левого предсердия, на него накладывают кисетный шов, проникают в полость сердца и производят пальцевую ревизию, оценивая таким образом состояние митрального клапана, выясняя степень его стеноза (сужения) и подвижности створок.
Рыхлые сращения допускается разъединять пальцевым способом, плотные спайки — только при помощи специальных инструментов (дилататоров, комиссуротомов), которыми расширяют суженное митральное отверстие до диаметра в 3,5-4 сантиметра. С целью снижения риска эмболии артериальных сосудов головного мозга в момент выполнения этой манипуляции рекомендуют надавливать на сонные артерии. Невозможность проведения адекватной закрытой комиссуротомии считается поводом к переходу на экстракорпоральное кровообращение и выполнению открытого хирургического вмешательства.
Кстати, с 1950-х годов — с момента внедрения в практику метода искусственного кровообращения закрытую митральную комиссуротомию стало вытеснять протезирование. Её использование теперь считается оправданным лишь тогда, когда отсутствует возможность по тем либо иным причинам осуществлять искусственное кровообращение. Также закрытую митральную комиссуротомию в некоторых случаях производят у беременных с тяжёлым митральным стенозом.
К открытой митральной комиссуротомии обращаются тогда, когда имеет место невыраженное поражение клапанного аппарата пациента в отсутствие массивного кальцинирования. При этом операция предполагает выполнение срединной стернотомии и переход на экстракорпоральное кровообращение с так называемым бикавальным канюлированием. В левое предсердие хирург входит с задней его поверхности в районе межжелудочковой борозды. После того, как обнажён митральный клапан, приступают собственно к комиссуротоми, в первую очередь выявив область слияния створок, а потом разрезав этот участок в направлении от его свободного конца к фиброзному кольцу. Затем аккуратно разделяют сухожильные хорды и продолжают вести разрез продольно до папиллярных мышц.
При этом можно локально удалить небольшие отложения кальция, стараясь при этом никоим образом не повредить клапанный аппарат. В завершении разрез левого предсердия ушивают и прекращают искусственное кровообращение. В отличие от закрытой комиссуротомии, открытая методика позволяет более надёжно осуществить удаление тромбов из предсердия и рассечь имеющиеся спайки. Открытая митральная комиссуротомия даёт отличные отдалённые результаты, но сопряжена с риском развития рестеноза либо недостаточности клапана. Только незначительной части (не более 7%) всех пациентов в последующем требуется протезирование митрального клапана. При закрытой комиссуротомии высока вероятность формирования митральной недостаточности и эмболии, особенно в случае тромбоза предсердия и наличия кальциноза клапана.
Митральная комиссуротомия – это метод хирургического лечения врожденной или приобретенной патологии митрального клапана. Этот клапан расположен между левым предсердием и левым желудочком сердца, имеет две створки. В ряде случаев может возникнуть стеноз митрального клапана. Это состояние, при котором происходит сужение просвета этого отверстия и возникает препятствие току крови. Благодаря этой операции производится рассечение комиссур (спаек), которые мешают нормальной работе клапана. Доступов для выполнения операции существует 2: прямой и не прямой. В первом случае операция производится при открытой грудной клетке, непосредственно через сердце. Во втором случае через бедренные сосуды вводится специальный катетер, который подводится к двухстворчатому клапану и производится иссечение спаек.
наверх
Показание к проведению операции:
Митральный стеноз 2-4 стадии
наверх
Противопоказание к проведению операции:
Острые инфекционные заболевания
Пониженное количество тромбоцитов в крови
Пониженное артериальное давление
наверх
Осложнение после операции:
Миокардит и эндокардит (воспаление мышечной оболочки сердца или внутренней)
Гиповолемический шок (резкое снижение давление из-за кровопотери)
Митральный стеноз
17-04-2011, 17:11
Митральный стеноз — сужение левого атриовентрикулярного отверстия — самый распространенный из приобретенных пороков сердца. Практически всегда он является следствием ревматизма, хотя ревматизм мог быть и не диагностирован в прошлом. Чистый или преобладающий митральный стеноз отмечается приблизительно у 40% больных ревматическими пороками сердца, 2/3 из них женщины. В редких случаях митральный стеноз бывает связан с миксомой левого предсердия. При аортальной недостаточности изредка возникают признаки относительного митрального стеноза.
Если площадь митрального отверстия уменьшается более чем в 2 раза, то для поддержания сердечного выброса давление в левом предсердии увеличивается, предсердие гипертрофируется и дилатируется. В дальнейшем возникает венозный застой в легких и рефлекторно повышается давление в системе легочной артерии, что постепенно приводит к перегрузке и увеличению правых отделов сердца. Перераспределение крови ухудшает условия внешнего дыхания, предрасполагает к возникновению отека легких и легочной инфекции. Растяжение предсердия может сопровождаться образованием пристеночных тромбов и эмболией сосудов мозга, почек и других органов, а также почти закономерным в поздних стадиях развитием мерцательной аритмии. Гипертензия малого круга, вначале лабильная и обратимая, в дальнейшем, по мере появления морфологических изменений в сосудистой стенке, стабилизируется и становится необратимой. После периода компенсации, который иногда охватывает несколько десятилетий, развивается правожелудочковая недостаточность.
Клиническая картина митрального стеноза
Примерно 2/3 больных указывают на ревматические атаки в прошлом. Если порок невелик и нет чрезмерных нагрузок, то самочувствие многие годы может оставаться удовлетворительным. В типичных случаях ранней жалобой является одышка при подъеме в гору. В более тяжелых случаях одышку провоцируют любая нагрузка, возбуждение, лихорадка и другие факторы, учащающие ритм. Приступы сердечной астмы могут возникать и в положении лежа, ночью. Возможны сердцебиение, кашель, кровохарканье, боли и тяжесть в груди. Уменьшение сердечного выброса может привести к головокружению и обмороку. Внешний вид больного обычно не изменяется, и лишь при тяжелом митральном стенозе заметны периферический цианоз, цианотический румянец, пульсация предсердечной и эпигастральной области вследствие увеличения правого желудочка. Пульс и АД остаются нормальными или отмечается склонность к тахикардии и гипотензии. Позже развивается мерцание предсердий (пароксизмальное или стойкое). Для ранней диагностики решающее значение имеют аускультативная картина, эхокардиографические данные, изменение конфигурации сердца.
Выявляемые при аускультации изменения обычно предшествуют всей другой симптоматике. В типичных случаях над верхушкой выслушивается громкий (хлопающий) I тон и отрывистый тон (щелчок) открытия митрального клапана в начале диастолы. Наиболее характерен низкочастотный диастолический шум, начинающийся после тона открытия митрального клапана, с протодиастолическим и пресистолическим усилением. В некоторых случаях слышны лишь протодиастолический и пресистолический шумы, иногда — только пресистолический. Пресистолическое усиление не выражено при мерцании предсердий и иногда в период, предшествующий мерцанию. Шум может сопровождаться местным пальпируемым дрожанием грудной стенки. Сочетание пресистолического шума и тона открытия митрального клапана патогномоничны для ревматического митрального стеноза. У части больных выслушивается и систолический шум, который может быть обусловлен или митральной недостаточностью, или, особенно при значительном увеличении правого желудочка, относительной трикуспидальной недостаточностью.
Вся звуковая симптоматика, как и дрожание, лучше выявляются в положении больного на левом боку, при несколько учащенном ритме, например после небольшой нагрузки, при задержке дыхания на полном выдохе. Выраженность звуковой симптоматики зависит от многих факторов и не всегда отражает тяжесть порока. Над легочной артерией выявляют акцент и иногда расщепление II тона, что связано с гипертонией малого круга. В поздних стадиях там же может выслушиваться самостоятельный мягкий протодиастолический шум, обусловленный относительной недостаточностью клапана легочной артерии. Фонокардиография подтверждает аускультативные данные. На фонокардиограмме, снятой с верхушки, могут быть измерены интервалы между началом II тона и началом тона открытия митрального клапана, а также между началом зубца Q ЭКГ и началом I тона. По мере повышения давления в левом предсердии первый интервал уменьшается, второй увеличивается.
ЭхоКГ легко подтверждает наличие митрального стеноза и дает возможность судить о его выраженности. Она позволяет уточнить структуру клапана (фиброз, обызвествление) и особенности движения створок: во время диастолы они смещаются конкордантно, а не дискордантно, как в норме. На эхоКГ можно определить размеры полостей сердца и иногда выявить пристеночные тромбы.
Изменение конфигурации сердца обнаруживают при рентгенологическом исследовании в прямой и косых проекциях с контрастированием пищевода. При небольшом митральном стенозе силуэт сердца может быть не изменен. По мере прогрессирования порока выявляется увеличение левого предсердия, что приводит к выпрямлению левого контура сердца (сглаживанию талии) и затем к его выбуханию. В правой косой проекции видно оттеснение пищевода назад по дуге малого радиуса. Тень легочной артерии расширяется. При далеко зашедшей болезни выявляется увеличение и правых отделов сердца, крупных легочных сосудов и верхней полой вены. При просвечивании иногда заметны кальцинаты в движущихся створках митрального клапана.
На ЭКГ могут быть заметны признаки перегрузки левого предсердия (широкий двугорбый зубец Р, особенно в I и II отведениях) и правого желудочка (увеличение зубца R, снижение сегмента ST, отрицательные зубцы Т в правых грудных отведениях), иногда с развитием неполной или полной блокады правой ножки пучка Гиса. Значительная деформация и расширение зубца Р позволяют прогнозировать скорое наступление мерцания предсердий.
Диагностика митрального стеноза
В подавляющем большинстве случаев диагноз может быть поставлен амбулаторно — на основании анамнестических и аускультативных данных, результатов эхокардиографического и рентгенологического исследований. Все эти данные могут быть получены в поликлинике. Дополнительное обследование в стационаре, тем более в специализированном, необходимо лишь части больным, если трудно исключить сложный порок, текущий ревматизм и для решения специальных вопросов, связанных с подготовкой к операции.
Классификация
Анатомические формы стеноза митрального клапана:
«Рыбий рот» — стеноз воронкообразной формы.
Стеноз в виде «пиджачной петли».
Стеноз с двойным сужением.
По величине отверстия сужение митрального клапана бывает таких типов:
Минимальный стеноз.
Резкий стеноз – общая площадь митрального отверстия меньше 0.5 см квадр.
Выраженный стеноз – площадь отверстия составляет от 0.5 до 1 см квадр.
Умеренный стеноз – площадь митрального отверстия — от 1 до 1.5 см квадр.
Более 1.5 см. квадр.
Стадии митрального стеноза:
Первая стадия называется полной компенсацией. Данная стадия не сопровождается выраженной симптоматикой, но некоторые признаки заболевания при объективном исследовании можно выявить.
Вторая стадия характеризуется выраженными симптомами митрального стеноза, которые возникают при физической нагрузке. Также, на этой стадии могут появиться признаки легочной гипертензии.
Третья стадия митрального стеноза сопровождается застоем в большом и малом кругах кровообращения, значительным повышением ЦВД (центрального венозного давления), увеличением сердца и печени.
Четвертая стадия – это выраженная недостаточность кровообращения. У больных отмечается серьезный застой в малом круге кровообращения, уплотнение и увеличение печени, периферические отеки, асцит. Консервативная терапия может улучшить состояние пациента.
Пятая стадия митрального стеноза называется терминальной дистрофической стадией недостаточности кровообращения. Она характеризуется необратимыми изменениями внутренних органов. У пациентов с такой стадией стеноза митрального клапана наблюдаются отеки, асцит, цирроз печени, одышка в покое и кардиомегалия. Консервативное лечение не приводит к улучшению.
Клиническая картина стеноза митрального клапана
При легкой степени митрального стеноза в течение длительного периода времени выраженных клинических проявлений может и не наблюдаться. Однако, ухудшение самочувствия может быть внезапным.
Наиболее характерными и частыми симптомами митрального стеноза являются перебои в работе сердца, учащенное сердцебиение и одышка. Проявление этих жалоб говорит о наличии тканевой циркулярной гипоксии, которая сопровождает данный порок.
Сердцебиение и одышка вначале возникают при значительных физических нагрузках, затем – при минимальных усилиях и, наконец, — в полном покое (при критической степени митрального стеноза). Очень часто у пациентов наблюдается кашель – это проявление застойного бронхита хронической формы. Кровохарканье может отмечаться при выраженном застое в легких.
Как правило, больные жалуются на общую слабость, боли в области сердца, повышенную утомляемость и осиплость голоса (увеличенное левое предсердие сдавливает левый возвратной нерв).
Еще к симптомам митрального стеноза относятся: гиперемия щек, акроцианоз, бледность кожных покровов и носогубного треугольника, цианоз губ, набухание и пульсация вен шеи, сердечный горб (деформация грудной клетки) и тахикардия.
Также, есть и другие симптомы митрального стеноза, которые выявить может только врач-специалист: застой в легких, легочная гипертензия, шумы в сердце, тромбообразование и аритмия (нарушение ритма сердца).
К врачу-кардиологу необходимо обращаться в случае наблюдения следующих симптомов:
Боль или чувство дискомфорта в груди.
Частые респираторные болезни, такие как бронхит.
Отеки на ногах.
Одышка при физических нагрузках или в лежачем положении.
Ощущение сердцебиения.
Повышенная утомляемость.
Выраженный кашель, который сопровождается кровохарканьем.
Осложнения болезни
При отсутствии адекватного лечения митральный стеноз приводит к следующим осложнениям:
Сердечная недостаточность (патологическое состояние организма, при котором мышца сердца настолько слаба, что перекачивает кровь в организме слабо и неадекватно). Это осложнение возникает при тяжелой степени митрального стеноза.
Фибрилляция предсердий. Расширение левого предсердия (при стенозе митрального клапана) ведет к аритмии. При этом состоянии сокращения левого предсердия происходят в хаотичном порядке.
Расширение сердца. Сужение митрального клапана сопровождается переполнением кровью левого предсердия, а затем, и правых камер сердца.
Тромбообразование. Отсутствие должного лечения митрального стеноза ведет к образованию тромбов в полости предсердия. Тромбы, с помощью тока крови, могут оказаться в разных частях тела, провоцируя серьезные проблемы.
Застой крови в легких. Отек легких, при котором происходит скопление плазмы в альвеолах, сопровождается одышкой и кашлем с кровохарканьем.
Лечение митрального стеноза
Лечение митрального стенозаЛечение сужения митрального клапана может быть и консервативным, и оперативным. Консервативное лечение митрального стеноза не может излечить порок, но дает возможность вылечить некоторые осложнения данной патологии (сердечную недостаточность, отек легких, аритмию и проч.).
Что касается хирургического вмешательства, то оно при стенозе митрального клапана бывает нужным не всегда. Если сужение минимальное и выраженных симптомов митрального стеноза не наблюдается, то доктор-кардиолог назначает больному постоянный контроль состояния сердца.
Из медикаментозных препаратов применяют: антикоагулянты (для разжижения крови), диуретики (для вывода избытка жидкости из организма), противоаритмические препараты (при наличии аритмии) и антибиотики.
Критическая степень митрального стеноза, как правило, требует хирургического лечения. В таких случаях могут применяться, как малоинвазивные вмешательства (баллонная вальвулопластика), так и традиционные (открытое хирургическое вмешательство). Главными преимуществами малоинвазивных методов являются низкий уровень травматичности и более легкая переносимость.
В комплексе средств медицинской реабилитации кардиохирурги-ческих больных все большее место занимает лечебная физкультура (Е.И.Янкелевич, 1973, X98Q; Л.В.Петрунина, 1980).
Применение реабилитационных мероприятий в кардиохирургичес-ких клиниках и санаториях выдвигает проблему разработки специальных тренирующих программ ЛФК с целью поддержания на должном уровне функционального состояния больных, восстановления их физической работоспособности.
Роль, повышенных нагрузок как способ быстрейшей реабилитации больных после протезирования клапанов сердца не изучена. В клиниках придерживались мнения, что не следует применять интенсивные нагрузки этим больным* Однако практика ведения больных с применением интенсивных нагрузок давала положительные результаты, хотя научные обоснования для применения, интенсивных нагрузок до настоящего времени отсутствует. Вопрос о соответствии применяемой нагрузки функциональному состоянию и возможностям организма можно решать только с учетом переносимости физических нагрузок. При этом все больше внимания привлекают к себе нагрузочные тесты (Н*М.Верич, 1979; Л.В.Петрунина, 1980*, s.Fisch с соавт., 1976; D.G.Gilmour с соавт., 1976).
Актуальным является изучение различных форм ЛФК и определение их энергетических затрат как наиболее объективного критерия, величины физической нагрузки (М.Ф.Гриненко с соавт., 1977).
Цель и задачи исследования. Целью работы являлось изучение влияния обычных и интенсифицированных физических нагрузок на функциональное состояние и физическую работоспособность, разработка методов ЛФК повышенной интенсивности для более эффективной реабилитации больных после протезирования клапанов сердца.112 ВЫВОДЫ
1. В период предоперационной подготовки больных наиболее целесообразно применение лечебной гимнастики со специальными дыхательными упражнениями, требующими энергетических затрат, не превышающих 26,5 ккал.
2. В результате применения в раннем послеоперационном периоде основной программы ЯФК достигнуто улучшение показателей функционального состояния больных. Физическая работоспособность больных с протезами клапанов сердца через 30 дней после операции возросла на 28,6$ по сравнению с предоперационными показателями. В эти же сроки отмечено снижение затрат кислорода на I кгм работы на 18,4$, что свидетельствует о повышении экономичности обменных процессов.
3. Разработаны программы послеоперационной физической реабилитации, включающие пять режимов лечебной гимнастики и других форм ЛФК с постепенным возрастанием нагрузки от 13,5 ккал в первые 2-3 дня после операции до 485,2 ккал в день к исходу первого месяца.
4. Применение повышенной программы нагрузки, на уровне субмаксимальной мощности способствовало повышению физической работоспособности на 103,8$ по сравнению с предоперационными данными. .Потребление кислорода на I кгм раооты снизилось на 38,5$.
5. Для оценки функционального состояния и во избежание передозировки при повышенных нагрузках в раннем периоде реабилитации больных с протезами клапанов сердца применялась регистрация ЧСС, АД и ЭКГ, что способствовало предотвращению осложнений. Доказана необходимость использования субмаксимальных нагрузочных велоэргометрических тестов с определением потребления кислорода для количественной оценки эффективности различных форм и методов ЛФК в процессе физической реабилитации.
6. Б позднем послеоперационном периоде особое значение приобретает постепенная физическая реабилитация после протезирования клапанов сердца в стационарных и санаторных условиях. Физическая работоспособность составила 22,2$ показателей у здоровых лиц в группе, прошедшей основную программу, и 35,3$ — в группе, прошедшей повышенную программу ЛФК.
7. Выявленная положительная динамика функционального состояния в результате применения интенсифицированных программ ЛФК в ранней послеоперационной реабилитации позволяет рекомендовать их для широкого использования у больных с протезами клапанов сердца.
8. Разработанные и рекомендованные в практику ЛФК программы физической реабилитации, применяемые в комплексном лечении больных с протезами клапанов сердца, способствуют повышению результатов лечения, нормализации функционального состояния сердечно-сосудистой и дыхательной систем, улучшению работоспособности и повышению экономического эффекта благодаря сокращению сроков пребывания больных в стационаре.
1. Обеспечение задач ранней послеоперационной физической реабилитации требует обучения больных основным элементам ЛГ в период, предоперационной подготовки.
2. Для улучшения дыхательной функции легких целесообразно начинать ЛГ за 1,5-2 недели до операции.
3. В период предоперационной подготовки больных 1У и Ш функциональных классов hyha рекомендуется проводить процедуры ЛГ только в положении лежа.
4. В процессе обучения больных большое внимание уделяется правильному вдоху и удлиненному выдоху, откашливанию , а также основным типам и способам дыхания.
5. В комплекс лечения, больных после протезирования клапанов сердца должна быть включена физическая реабилитация.
6. Физическую, реабилитацию следует начинать со вторых су-ТОЕ послеоперационного периода и ежедневно проводить с возрастающей интенсивностью, на стационарном и санаторном этапах лечения.
7. После протезирования клапанов сердца первые 2-3 дня ЛГ применяется 2-3 раза, при осложнениях легких — 4-5 раз в день с интенсивным откашливанием.
8. Больным в крайне тяжелом состоянии, которые не могут самостоятельно выполнять упражнения ( при искусственной вентиляции, периодической экстубации), рекомендуется проводить общий и вибрационный массаж грудной клетки, а также менять позы для создания дренажного эффекта и облегчения определения секрета. При этом обеспечивается перкуссия спины.
9. Для профилактики и лечения легочных осложнений в раннем послеоперационном периоде необходимо использовать локальное межреберное дыхание.
10• При осложнениях со стороны легких перкуссия спины и вибрационный массаж применяются в дренажных положениях: лежа на спине, на боку, при повороте корпуса на 90° или 45° (супинации) с приподнятой верхней или нижней частью тела под углом 15-20°.
11. В зависимости от дыхательной функции легких на регионарном участке грудной клетки рекомендуются разные способы локального дыхания: верхнегрудное (одностороннее, двухстороннее),нижнегрудное (правостороннее, левостороннее), среднегрудное и задне-грудное, а также перкуссия спины и вибрационный массаж грудной клетки.
12. При отсутствии признаков осложнений в раннюю физическую реабилитацию следует включать групповой метод для эмоционального и психологического эффекта.
13. Целесообразно через 7 дней после протезирования клапанов сердца постепенно увеличивать нагрузки, включая в занятиях ЛФК дополнительные мероприятия (дозированную ходьбу, ходьбу по лестнице) и через 10 дней — велоэргометрию.
14. Кроме специальных дыхательных упражнений в процедурах ЛФК рекомендуются включать общеукрепляющие упражнения с возрастающей нагрузкой в зависимости от исходного положения, длительности,числа повторений и сложности самих упражнений.
15. Больным после протезирования клапанов сердца для эмо-циального эффекта в занятиях ЛФК рекомендуются упражнения со снарядами (гимнастические палки, мячи разного объема, гантели весом от 0,5 до I кг, стулья, гимнастическая стенка) и надувные мячики.
16. Во всех режимах ЛГ упражнения должны сочетаться с дыханием, отдыхом и мышечным расслаблением.
17. После интенсивной мышечной работы в течение 2-3 мин назначаются короткие паузы отдыха от 0,5 до 1,0 мин , которые помогают избежать выраженной усталости и достичь хорошей толерантности предложенной нагрузки.
18. Все дыхательные упражнения в процедурах ЛФК выполняются в медленном, остальные упражнения — в среднем и — реже — в быстром темпах.
19. При выполнении махов рекомендуется ограничиваться средним темпом во избежание резких движений.
20. Вольная с протезами клапанов сердца для стационарного и санаторного этапов лечения рекомендуются две программы физической реабилитации: основная и повышенная.
21. В основную программу включаются пять двигательных режимов ЛГ, дозированная ходьба, ходьба на лестнице, а в повышенную-добавляются интенсивные нагрузки на велоэргометре.
22. Целесообразно применение пяти двигательных режимов ЛГ с постепенно возрастающей нагрузкой больным с протезированными клапанами сердца на ранеем стационарном и ближайшем санаторном этапах послеоперационного лечения.
23. В программу дозированной ходьбы целесообразно включать самостоятельный и контрольный методы.
24. Больным после протезирования клапанов сердца в течение 4-5 дней рекомендуется самостоятельная ходьба в пределах палаты и — ограниченная — в коридоре.
25. В начале ходьба проводится в медленном, а при повторных занятиях — в среднем темпе с учетом времени ходьбы и восстановления исходных данных ( ЧСС, АД, частоты дыхания).
26. Контрольную ходьбу на 100 м рекомендуется начинать на 7-й день после операции при отсутствии признаков осложнений.
27. Программа дозированной ходьбы начинается от 100 м и увеличивается до 3,0-3,5 км в день к концу месяца.
28. Больным после протезирования клапанов сердца рекомендуются различные темпы ходьбы: медленный (60-70), средний (60-90) и быстрый (110-120 шагов) в минуту.
29. Больным с нарушением ритма сердца рекомендуется проводить ходьбу в замедленном темпе с паузами отдыха.
30. Контроль за ходьбой целесообразно вести самим больным с отметкой в листке, даты, расстояния, темпа, пульса ( в покое и после нагрузки) и признаков неадекватности во время ходьбы и после нее.
31. Повышенной программой физической реабилитации рекомендуются разные варианты упражнений на лестнице: I) спуск и подъем по лестнице с паузами отдыха; 2) спуск в среднем и подъем в медленном темпах; 3) спуск и подъем в среднем темпе. Бо всех случаях упражнения выполняются с произвольными дыханием.
studfiles.net
МИТРАЛЬНАЯ КОМИССУРОТОМИЯ в ГЕРМАНИИ
MedTravel Лечение за рубежом » Кардиология в Германии » Митральная комиссуротомия в Германии
МИТРАЛЬНАЯ КОМИССУРОТОМИЯ в ГЕРМАНИИ
Закрытая и открытая митральная комиссуротомия
Митральная комиссуротомия — это хирургическая операция, целью которой является рассечение спаек лепестков митрального клапана сердца (комиссур).
ЗАКРЫТАЯ МИТРАЛЬНАЯ КОМИССУРОТОМИЯ
Закрытая митральная комиссуротомия заключается в хирургическом разделении сращений створок левого атриовентрикулярного отверстия в случае его стеноза. Выполняется данная операция на закрытом сердце без применения искусственного (экстракорпорального) кровообращения из лево- или правостороннего торакотомического доступа.
После того как посредством чреспищеводной эхокардиографии исключено присутствие тромба в ушке левого предсердия, на него накладывают кисетный шов, проникают в полость сердца и производят пальцевую ревизию, оценивая таким образом состояние митрального клапана, выясняя степень его стеноза (сужения) и подвижности створок.
Рыхлые сращения допускается разъединять пальцевым способом, плотные спайки — только при помощи специальных инструментов (дилататоров, комиссуротомов), которыми расширяют суженное митральное отверстие до диаметра в 3,5-4 сантиметра. С целью снижения риска эмболии артериальных сосудов головного мозга в момент выполнения этой манипуляции рекомендуют надавливать на сонные артерии. Невозможность проведения адекватной закрытой комиссуротомии считается поводом к переходу на экстракорпоральное кровообращение и выполнению открытого хирургического вмешательства.
С 1950-х годов — с момента внедрения в практику метода искусственного кровообращения закрытую митральную комиссуротомию стало вытеснять протезирование. Её использование теперь считается оправданным лишь тогда, когда отсутствует возможность по тем либо иным причинам осуществлять искусственное кровообращение. Также закрытую митральную комиссуротомию в некоторых случаях производят у беременных с тяжёлым митральным стенозом.
При закрытой комиссуротомии высока вероятность формирования митральной недостаточности и эмболии, особенно в случае тромбоза предсердия и наличия кальциноза клапана.
ОТКРЫТАЯ МИТРАЛЬНАЯ КОМИССУРОТОМИЯ
К открытой митральной комиссуротомии обращаются тогда, когда имеет место невыраженное поражение клапанного аппарата пациента в отсутствие массивного кальцинирования.
Открытая митральная комиссуротомия – это операция, предполагающая выполнение срединной стернотомии и переход на экстракорпоральное кровообращение с бикавальным канюлированием.
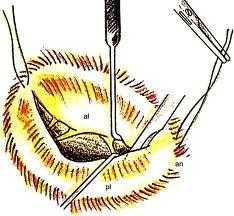
В левое предсердие хирург входит с задней его поверхности в районе межжелудочковой борозды. После того, как обнажён митральный клапан, приступают собственно к комиссуротомии, в первую очередь, выявив область слияния створок, а потом разрезав этот участок в направлении от его свободного конца к фиброзному кольцу. Затем аккуратно разделяют сухожильные хорды и продолжают вести разрез продольно до папиллярных мышц. При этом можно локально удалить небольшие отложения кальция, стараясь при этом никоим образом не повредить клапанный аппарат. В завершении разрез левого предсердия ушивают и прекращают искусственное кровообращение.
В отличие от закрытой комиссуротомии, открытая методика позволяет более надёжно осуществить удаление тромбов из предсердия и рассечь имеющиеся спайки.
Открытая митральная комиссуротомия даёт отличные отдалённые результаты, но сопряжена с риском развития рестеноза либо недостаточности клапана. Только незначительной части (не более 7%) всех пациентов в последующем требуется протезирование митрального клапана.
(495) 50-253-50 — бесплатная консультация по клиникам и специалистам
ОФОРМИТЬ ЗАЯВКУ на ЛЕЧЕНИЕ
medtravel.ru
89. Хирургическое лечение ишемической болезни сердца (закрытые и открытые, комиссуротомия и протезирование клапанов, пластические операции на клапанах, искусственные клапаны).
При неэффективности консервативного медикаментозного лечения показано хирургическое лечение, включающее в себя закрытые (баллонная дилатация, стентирование коронарных артерии) и открытие (маммарно-коронарный анастомоз — М-КА, аортокоронарное шунтирование — АКШ) методы.
Ангиопластика венечных артерий. Показанием служит поражение коронарной артерии в ее проксимальных отделах при условии отсутствия выраженного кальциноза и поражения дистального русла этой артерии. Необходимым условием выполнения ангиопластики является наличие готовой операционной бригады для выполнения экстренной операции аортокоронарного шунтирования в случае появления осложнений при выполнении процедуры.
Техника операции. Используется система двух катетеров: катетер-проводник (более широкого диаметра) и дилатационный катетер (более узкий). После выполнения коронарографии обычным методом катетер заменяют катетером-проводником, через который проводят дилатационный катетер в стенозированную артерию. Максимальный диаметр наполненного баллончика — 3-3.7 мм, в спавшемся состоянии — 1,2-1,3 мм. При достижении баллончиком стенозированного сегмента он (баллончик) заполняется 30% раствором контрастного вещества. В таком состоянии баллончик находится в течение 5-60 секунд. При необходимости процедуру повторяют несколько раз. Успешным считается вмешательство, при котором степень стеноза уменьшается более чем на 20%. Суммарный положительный результат баллонной дилатации достигается примерно у 65% больных.
Основными осложнениями ангиопластики являются: острый инфаркт миокарда (5,3%), окклюзия коронарной артерии (4,6%). спазм коронарной артерии (4,5%). Клинический эффект ангиопластики заключается в исчезновении или значительном урежении приступов стенокардии примерно у 80% больных. Эффективность процедуры через 3 года составляет 67%. В последнее время баллонную дилатацию коронарных артерий стаяв дополнять стентированием (каркасированием) суженого участка с помощью механических изделий с эффектом памяти (стентов), что позволило улучшить отдаленные результаты.
Аортокоронарное шунтирование. В настоящее время основой для определения показаний к хирургическому лечению являются следующие факторы: выраженность стенокардии и устойчивость ее к медикаментозному лечению: степень и локализация, а также количество пораженных сосудов; сократительная функция миокарда. Только на основании этих факторов ставятся показания к АКШ. которое может быть дополнено при необходимости маммарно-коронарным анастомозом.
Техника АКШ. Операция осуществляется в несколько этапов: 1) доступ к сердцу, обычно срединная стернотомия; 2) забор аутотрансплантатов, выполняемый другой бригадой хирургов одновременно с производством стернотомии; 3) канюляция восходящей части аорты и полых вен и подключение ИК; 4) пережатие восходящей аорты с кардиоплегией; 5) наложение дистальных анастомозов с коронарными артериями; 6) снятие зажима с восходящей аорты; 7) профилактика воздушной эмболии: 8) восстановление сердечной деятельности; 9) наложение проксимальных анастомозов; 10) отключение ИК; 11) деканюляция; 12) ушивание торакотомной раны с дренированием полости перикарда (рис. 10).
В качестве трансплантата используют: реверсированный (повернутый на 180°) участок большой скрытой вены голени, а в последнее время — нижняя надчревная, лучевая, левая желудочная, обе желудочносальниковые и внутренняя грудная артерии. Маммарно — коронарный анастомоз (рис. 11). Впервые выполнен В.И.Колесовым в 1964 году. Преимущества метода: — может выполняться без использования АИК: — большее соответствие диаметров внутренней грудной и коронарной артерий; — анастомоз накладывается между однородными тканями; — выше линейная скорость кровотока, что тео-Рис. 10. Схема АКШ
ретически должно снизить частоту тромбозов; — накладывается только один анастомоз, что сокращает время операции и уменьшает вероятность технической ошибки; — внутренняя грудная артерия редко поражается атеросклерозом; в ней не развивается субинти-мапьная гиперплазия, как в аутовенозных шунтах.
Ограничениями к применению М-КА следует считать следующее: 1) диаметр правой внутренней грудной артерии значительно меньше, чем правой коронарной артерии, а диаметр левой внутренней грудной артерии меньше, чем передней межжелудочковойветви левой коронарной артерии; 2) имеются только две внутренние грудные артерии, что ограничивает возможность реваскуляризации нескольких артерий; 3) выделение внутренней грудной артерии является более сложным, чем забор аутовены; 4) наложение анастомоза технически более сложно из-за меньшего диаметра и тонкой стенки внутренней грудной артерии.
Закрытая и открытая митральная комиссуротомия
Митральная комиссуротомия— это хирургическая операция, целью которой является рассечение спаек лепестков митрального клапана сердца (комиссур).
ЗАКРЫТАЯ МИТРАЛЬНАЯ КОМИССУРОТОМИЯ
Закрытая митральная комиссуротомия заключается в хирургическом разделении сращений створок левого атриовентрикулярного отверстия в случае его стеноза. Выполняется данная операция на закрытом сердце без применения искусственного (экстракорпорального) кровообращения из лево- или правостороннего торакотомического доступа.
После того как посредством чреспищеводной эхокардиографии исключено присутствие тромба в ушке левого предсердия, на него накладывают кисетный шов, проникают в полость сердца и производят пальцевую ревизию, оценивая таким образом состояние митрального клапана, выясняя степень его стеноза (сужения) и подвижности створок.
Рыхлые сращения допускается разъединять пальцевым способом, плотные спайки — только при помощи специальных инструментов (дилататоров, комиссуротомов), которыми расширяют суженное митральное отверстие до диаметра в 3,5-4 сантиметра. С целью снижения риска эмболии артериальных сосудов головного мозга в момент выполнения этой манипуляции рекомендуют надавливать на сонные артерии. Невозможность проведения адекватной закрытой комиссуротомии считается поводом к переходу на экстракорпоральное кровообращение и выполнению открытого хирургического вмешательства.
С 1950-х годов — с момента внедрения в практику метода искусственного кровообращения закрытую митральную комиссуротомию стало вытеснять протезирование. Её использование теперь считается оправданным лишь тогда, когда отсутствует возможность по тем либо иным причинам осуществлять искусственное кровообращение. Также закрытую митральную комиссуротомию в некоторых случаях производят у беременных с тяжёлым митральным стенозом.
При закрытой комиссуротомии высока вероятность формирования митральной недостаточности и эмболии, особенно в случае тромбоза предсердия и наличия кальциноза клапана.
ОТКРЫТАЯ МИТРАЛЬНАЯ КОМИССУРОТОМИЯ
К открытой митральной комиссуротомии обращаются тогда, когда имеет место невыраженное поражение клапанного аппарата пациента в отсутствие массивного кальцинирования.
Открытая митральная комиссуротомия – это операция, предполагающая выполнение срединной стернотомии и переход на экстракорпоральное кровообращение с бикавальным канюлированием.
В левое предсердие хирург входит с задней его поверхности в районе межжелудочковой борозды. После того, как обнажён митральный клапан, приступают собственно к комиссуротомии, в первую очередь, выявив область слияния створок, а потом разрезав этот участок в направлении от его свободного конца к фиброзному кольцу. Затем аккуратно разделяют сухожильные хорды и продолжают вести разрез продольно до папиллярных мышц. При этом можно локально удалить небольшие отложения кальция, стараясь при этом никоим образом не повредить клапанный аппарат. В завершении разрез левого предсердия ушивают и прекращают искусственное кровообращение.
В отличие от закрытой комиссуротомии, открытая методика позволяет более надёжно осуществить удаление тромбов из предсердия и рассечь имеющиеся спайки.
Открытая митральная комиссуротомия даёт отличные отдалённые результаты, но сопряжена с риском развития рестеноза либо недостаточности клапана. Только незначительной части (не более 7%) всех пациентов в последующем требуется протезирование митрального клапана.
Протезирование клапанов сердца — хирургическая операция замены протезом одного или нескольких клапанов сердца, функция которых необратимо нарушена.
Необходимость замены пораженного клапана протезом возникает у больных с приобретенными или врожденными изменениями структуры и функции клапанного аппарата сердца, не подлежащими пластической коррекции (см. Пороки сердца приобретенные, Сердце). Наиболее часто выполняют протезирование митрального и (или) аортального клапанов. Благодаря современным возможностям сердечной хирургии операция протезирования клапанов сердца стала обычной для специализированных кардиохирургических центров. При этом ведущее значение в достижении хороших отдаленных результатов у больных, являющихся носителями клапанных протезов, приобретает квалифицированный контроль и лечение этих пациентов у врача поликлиники по месту жительства.
При относительной сохранности клапанного аппарата (отсутствии грубых фиброзных изменений и кальцификации створок) хирурги стремятся выполнить клапаносохраняющую операцию. Протезирование клапанов сердца проводят с использованием механических (искусственных) или биологических (тканевых) протезов.
Механические клапаны сердца имеют запирательный элемент вентильного или лепесткового типа, изготовленный из искусственного материала (силикон, соединения графита) помещенный в металлический каркас. Широкое клиническое применение имеют шаровые клапаны, отличающиеся высокой надежностью. У ряда больных использование шаровых клапанов невозможно из-за относительно больших размеров каркаса протеза. В этих ситуациях предпочтительны низкопрофильные дисковые или створчатые протезы, имеющие небольшие габариты и массу, меньшую инерционность запирательного элемента и обеспечивающие близкий к центральному поток крови. Общим недостатком механических протезов клапанов сердца является необходимость для пациента пожизненного приема антикоагулянтов и ежемесячного контроля за показателями свертывающей системы крови из-за опасности тромбоэмболических осложнений.
У больных с высоким риском тромбоэмболических осложнений (тромбоз левого предсердия, тромбоэмболии в анамнезе, значительные размеры полостей сердца и мерцательная аритмия, склонность к ускоренному тромбообразованию), при противопоказаниях к проведению антикоагулянтной терапии (язвенная болезнь желудка и двенадцатиперстной кишки, гипертоническая болезнь IIБ стадии,мочекаменная болезнь, метроррагии), а также у лиц пожилого возраста предпочтительнее использовать биологические протезы клапанов сердца. Эти протезы имеют естественный трехстворчатый запирательный элемент биологической природы (ксенаортальный клапан, ксеноклапан из перикарда, аллоклапан из твердой мозговой оболочки, консервированные в растворе глутаральдегида), фиксированный на полимерном или металлическом опорном каркасе. Для биологических протезов клапанов сердца характерны близкие к естественным гемодинамические свойства, небольшие размеры и вес, отсутствие гемолиза. Однако в отдаленные периоды отмечается биодегенерация клапанов в виде кальциноза и разрыва створок. Основным преимуществом биологических протезов перед механическими клапанами является отсутствие или небольшой риск тромбоза и тромбоэмболий.
Операции по протезированию клапанов сердца выполняют на остановленном сердце в условиях искусственного кровообращения и холодовой кардиоплегии.
При определении лечебной тактики (хирургической или терапевтической) у пациента с пороком сердца необходимо оценить выраженность клапанной дисфункции и состояние сократительной функции миокарда, что в большинстве случаев можно сделать на основании результатов неинвазивных методов исследованияния — электрокардиографии, фонокардиографии, рентгенографии, эхокардиографии.
Показанием к протезированию служат грубые изменения клапанного аппарата сердца с выраженным кальцинозом и фиброзом створок, приводящие к нарушению кровообращения. При бактериальном септическом эндокардите показаниями к П. к. с. являются прогрессирующая сердечная недостаточность, неэффективность антибактериальной терапии, эмболические осложнения, эхокардиографические признаки наличия вегетаций и разрушения клапанов.
Противопоказания к операции связаны общим тяжелым состоянием пациента и в значительной степени зависят от поражений легких, печени и почек, развившихся в результате застойной сердечной недостаточности и сопутствующей патологии этих органов. Искусственное кровообращение при сердечной недостаточности нередко приводит к развитию необратимой дыхательной и печеночно-почечной недостаточности. Поэтому своевременность направления больных с клапанными пороками в кардиохирургический стационар приобретает первостепенное значение в достижении хороших ближайших и отдаленных результатов протезирования. Протезирование клапанов сердца противопоказано также при наличии в организме очага инфекции любой локализации (гайморит, тонзиллит, холецистит, пиелонефрит, эндометрит, кариес зубов и т.д.) из-за опасности развития инфекционных эндокардитов после операции. Поэтому при отборе больных для хирургического лечения порока сердца необходимо провести всестороннее обследование с целью выявления очагов инфекции и санацию полости рта, лечение всех хронических заболеваний. Госпитализация в кардиохирургический стационар должна проводиться не ранее чем через месяц после экстракции зуба и через три месяца к любой полостной операции. В первые 6 мес. после П. к. с. все пациенты нуждаются в ограничении физической нагрузки и соблюдении водно-солевого режима с уменьшением употребления поваренной соли и жидкости и достаточным содержанием солей калия и магния в пище. В этот период показано применение небольших дозсердечных гликозидов, калийсберегающих препаратов (см. Мочегонные средства), анаболических средств. Более тщательный контроль за водно-солевым режимом, дополнительное назначение вазодилататоров, гепатопротекторов следует рекомендовать пациентам с недостаточностью кровообращения IIБ стадии.
Пациенты с ревматическими пороками и различной степенью активности ревматизма должны получать противовоспалительную терапию с учетом степени активности ревматического процесса (по данным клинического течения и гистологического исследования удаленного на операции клапана). Длительность противоревматической терапии определяется при динамическом наблюдении за больными и условиях терапевтического отделения. Пациентам, имеющим хронические очаги стрептококковой инфекции в носоглотке, при отсутствии дисбактериоза и аллергии на пенициллин показано назначение бициллина круглогодично. Наиболее грозным осложнением П. к. с. является тромбоэмболия, возникновению которой способствуетмерцательная аритмия, неадекватная антикоагулянтная терапия или ее внезапная отмена, обострение ревматического процесса (см. Ревматизм), поздний септический эндокардит, дисфункция протеза клапана.
Профилактика тромбоэмболии требует жизненной антикоагулянтной терапии у больных с искусственными клапанами сердца. При неосложненном течении операции начиная со вторых суток послеоперационного периода пациентам назначают гепарин 4—6 раз в сутки. Разовую дозу препарата подбирают индивидуально под контролем тромбоэластограммы с целью достижения умеренной гипокоагуляции, препятствующей тромбообразованию. С 5-х суток после операции назначают непрямые антикоагулянты на фоне постепенного снижения дозы гепарина, который отменяют при достижении необходимого уровня протромбинового индекса. В дальнейшем пациент получает непрямые антикоагулянты постоянно, с еженедельным контролем уровня протромбинового индекса. Однако следует помнить, что суточная доза препарата может варьироваться в зависимости от содержания в пище витамина К, что требует более тщательного контроля за протромбиновым индексом весной (тенденция к гипокоагуляции) и в конце лета и осенью (тенденция гиперкоагуляции). Необходимо также учитывать усиление эффекта непрямых антикоагулянтов при применении нестероидных противовоспалительных препаратов, трентала и компламина. С другой стороны, следует помнить об ослаблении их действия при одновременном назначении глюкокортикоидных гормонов, мочегонных, противозачаточных средств, эссенциале. Дополнительное назначение одного из перечисленных препаратов требует более частого контроля за протромбиновым индексом с последующей коррекцией дозы непрямых антикоагулянтов. При появлении симптомов гипокоагуляции (гематурии, кровоточивости десен или слизистой оболочки носа) необходимо уменьшить дозу препарата без резкой отмены и исследовать протромбиновый индекс в динамике. Неконтролируемая гипокоагуляция, признаки внутриполостного кровотечения, мелена являются показанием для срочной госпитализации в стационар по месту жительства. Необходимо также помнить, что внезапное снижение толерантности к непрямым антикоагулянтам с появлением геморрагического синдрома может быть клиническим проявлением развивающегося гепатита.
Пластические операции на клапанах
Пластические операции на клапанах в зависимости от вида порока могут заключаться в рассечении сросшихся створок (комиссуротомия) и восстановлении функции клапана путем изменения размеров створок, подшивания искусственных хорд, опорного кольца (вальвулопластика).
При назначении пластических операций для коррекции клапанных пороков учитывают технические возможности для восстановления клапана, степень выраженности порока, его анатомические особенности (наличие и степень кальциноза и др.).
Чаще всего назначают пластические операции при митральном стенозе – митральная комиссуротомия, реже – при пороках аортального клапана. При функциональной недостаточности трикуспидального клапана в сочетании с поражением других клапанов выполняют вальвулопластику трехстворчатого клапана.
Иску́сственный кла́пан се́рдца — это устройство для имплантации в сердце пациента с патологией сердечных клапанов.
При заболевании или дисфункции по причине патологии развития одного из четырёх клапанов сердца решением по восстановлению его работоспособности может быть замена естественного клапана на его протез. Как правило, это требует операции на открытом сердце.
Среди искусственных клапанов сердца выделяются механические и биологические конструкции.
studfiles.net
Хирургическое лечение митрального порока после закрытой комиссуротомии Текст научной статьи по специальности «Медицина и здравоохранение»
ВОПРОСЫ ПРАКТИЧЕСКОГО ЗДРАВООХРАНЕНИЯ
© САКОВИЧ В.А., ШАМРИН Ю.Н., ПУСТОВОЙТОВ А.В., ДРОБОТ Д.Б., ИВАНИЦКАЯ Ю.В., ТЕПЛОВ П.В., ИВАНИЦКИЙ Э.А., БУЯНКОВ Д.И., ХАЛИУЛИНА А.Р.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ МИТРАЛЬНОГО ПОРОКА ПОСЛЕ ЗАКРЫТОЙ КОМИССУРОТОМИИ
В. А. Сакович, Ю.Н. Шамрин, А.В. Пустовойтов, Д.Б. Дробот,
Ю.В. Иваницкая, П.В. Теплов, Э.А. Иваницкий, Д.И. Буянков,
А. Р. Халиулина
Красноярская краевая клиническая больница, гл. врач. — Заслуж. врач Р.Ф. — Б.П. Маштаков; краевой центр интенсивной кардиологии и сердечнососудистой хирургии, руковод. — д.м.н. А.В. Протопопов.
Резюме. В исследование включено 63 пациента с рестенозом митрального клапана после закрытой митральной комиссуротомии. Срок от закрытой митральной комиссуротомии до появления первой клиники рестеноза митрального клапана от 1 года до 31 (13,28) года. Срок от закрытой митральной комиссуротомии до повторной операции от 2 до 34 (в среднем 15,79) лет. Во всех случаях выполнялось протезирование митрального клапана ввиду грубых фиброзных изменений клапана, кальциноза, спаяние хорд, папиллярных мышц и желудочковой поверхности створок, укорочение хорд, разрывы створок. Нередко выполнялись сочетанные операции (пластика трикуспидального клапана, радиочастотная абляция, протезирование аортального клапана, аортокоронарное шунтирование). Общая летальность составила 12,69%, основной причиной, которой явилась прогрессирующая сердечно-сосудистая и полиорганная недостаточность.
Ключевые слова: митральный порок, комиссуротомия, протезирование митрального клапана.
Закрытая митральная комиссуротомия (ЗМКТ), выполненная в начале 20-х гг. Souttar и Cutler положила начало хирургическому лечению митрального стеноза. В течение 20 века (а в некоторых клиниках и по настоящее время) ЗМКТ является операцией выбора при ревматическом митральном стенозе. Отличительной чертой ЗМКТ является высокая гемодинамическая эффективность, низкая летальность, минимальные требования к оснащению операционной и низкие экономические затраты [6]. Изучение отдаленных результатов этой операции показало, что рецидивирование порока, приводящее к повторному нарастанию клиники митрального стеноза и/или недостаточности, в 30% случаев требует выполнение повторной операции в сроки от 5 до 10 лет [7,10]. Время от проведенной комиссуротомии до формирования рестеноза различно и определятся рядом факторов: активностью ревматического процесса, адекватностью выполненной комиссуротомии, морфологическими особенностями клапана, степенью регургитации [7]. В зависимости от оснащенности клиники, опыта хирурга, состояния пациента, хирургическое лечении митрального порока после ЗМКТ, может быть выполнено как по закрытой методике (закрытая рекомиссуротомия), так и с искусственным кровообращением (реконструкция или протезирование клапана). Целью настоящего исследования является анализ хирургического лечения митрального порока после закрытой комиссуротомии и обосновать протезирование клапана как операцию выбора.
Материалы и методы
В кардиохирургическом отделении краевой клинической с 2000 по 2008 г.г. больницы оперировано 63 пациента с митральными пороками после ЗМКТ. Из них было 15 (23,80%) мужчин, 48 (76,20%) — женщин. Возраст пациентов составил от 22 до 70, в среднем 54,7 лет. Все пациенты были первично оперированы с 1973 по 2004 гг. В краевом центре ИК и ССХ г. Красноярска последняя ЗМКТ была выполнена в 2000 г. Пациенты, поступившие с
рестенозом МК, которым была выполнена ЗМКТ после 2000г., оперировались в других клиниках. Дважды ЗМКТ выполнялась у 3 (4,76%) пациентов. После ЗМКТ все пациенты отмечали улучшение состояния, а нарастание симптомов митрального порока с усилением явлений недостаточности кровообращения проявлялись от одного до 31 года после операции, в среднем 13,28±0,8 лет (табл.1).
Таблица 1
Сроки от выполнения закрытой комиссуротомии до рецидивирования
митрального порока
Таким образом, в 68,3% случаев эффект от выполненной комиссуротомии сохранялся на протяжении 10-30 лет после ЗМКТ. Рецидив митрального порока возник от одного года до 5 лет после операции в 25,4% случаев, а нарастание симптомов порока в сроки до 9 лет после первичной операции в -6,4%. Распределение по функциональным классам (ФК) КУИЛ было следующим: ко II Ф.К. относился один (3,17%) пациент, к III — 51 (80,95%), и к IV — 11 (17,46%). Недостаточность кровообращения по Стражеско-Василенко 2А стадии имела место у 46 (73.01%) пациентов, у 17 (26,99%) -2Б. Хроническая форма фибрилляции предсердий при поступлении, отмечалась у 53 (84,12%) пациентов, желудочковая экстрасистолия — у 3, пароксизмы желудочковой тахикардии — у 1 (1,58%). При поступлении нарушений ритма сердца выявлено не было у 6 (9,52%) пациентов.
Таблица 2
Показатели эхокардиографии при поступлении у пациентов с митральным пороком после закрытой комиссуротомии
Таким образом, размер ЛП колебался от 2,6 до 8, в среднем 5,24±0,15см, а увеличение его — в 96,8% случаев (табл. 2). Увеличение размеров левого желудочка отмечалось в 54% случаев, конечно-диастолический размер его составил от 4 до 6,7 см, в среднем 5,31±0,8 см. Фракция выброса левого
желудочка колебалась от 42 до 74, в среднем 60,47% и она была снижена, она была снижена в 34,9%. Давление в легочной артерии (СДЛА) колебалось от 25 до 85, и составило в среднем 41,03±1,63 мм. рт. ст. Легочная гипертензия отмечалась в 85,7% случаев. Причем в 71,4% СДЛА составило 30-60 мм.рт.ст., а в 4,8% случаев превышало 60 мм.рт.ст. Диаметр левого атрио-вентрикулярного отверстия составил от 0,4 до 2,2 см 2, в среднем 1,26±0,5 см . Имели пациенты умеренную степень стеноза митрального клапана (МК) (диаметр левого атрио-вентрикулярного отверстия 2,2-1,0 см) в 73% случаев, установлен резкий стеноз (0,5-1,0 см) — в 23,8%, и он был критический (менее 0,5 см) — в 1,6%.
Таблица 3
Показатели эхокардиографии у пациентов с рестенозом митрального клана при поступлении
Различной степени выраженности кальциноз МК встречался в 54% случаев. Недостаточнось МК от 2 до 4 степени наблюдался в 61,9% случаев, митральная недостаточность 1 степени — в 11,1%, а рестеноз в чистом виде -в 27%. Недостаточность трикуспидального клапана (ТК) от 2 до 4 степени отмечалась в 46%. Недостаточность митрального клапана оценивали по глубине струи регургитации в ЛП (1ст. — над створками МК; 2ст. — до середины ЛП; 3ст. — за середину ЛП; 4ст. — до крыши ЛП). По тем же параметрам оценивали и недостаточность ТК. Кальциноз МК оценивали по следующей классификации: 1 ст. — створчатый кальциноз; 2 ст. — кальциноз створок, хорд, паппилярных мышц; 3 ст. — кальциноз с переходом на близлежащие структуры (митрально-аортальный контакт, межжелудочковую перегородку) [4]. Тромбоз ушка ЛП был у 4 (6,34%) пациентов. Таким образом, показанием к повторной операции служили клинические проявления митрального порока, кардиомегалия, недостаточность кровообращения.
Доступом при операции была срединная стернотомия. Предпочтение отдавалось частичному кардиолизу с выделением правых отделов сердца,
аорты и полых вен, что позволяло не выделяя из сращений желудочки сердца и левое предсердие, выполнить адекватный доступ к МК. Тотальный кардиолиз выполнялся только при проведения аорто-коронарного шунтирования (АКШ). Доступ к МК осуществлялся через правое предсердие межпредсердную перегородку по С. БиЬоБІ;, что позволяло проводить ревизию не только МК, но и ТК. Тромбэктомия из ЛП выполнялась у 4 (6,34%) пациентов.
Таблица 4
Результаты интраоперационной оценки МК
Интраоперационно (табл. 4) кальциноз МК наблюдался реже, чем по данным ЭхоКГ (53,96% и 31,74% соответственно). Наиболее частым морфологическим изменением МК был фиброз створок (92,06%) Спаяние хорд, папиллярных мышц и желудочковой поверхности створок отмечалось в 47,61% случаев, укорочение хорд было в 63,49%, а разрыв створок наблюдался в 4,76%. Необходимо отметить, что практически у всех пациентов наблюдалось комбинированное поражение МК. Клапан иссекался полностью, либо с сохранением задней створки. Фиксация протеза выполнялось «П»-образными швами с прокладками. Количество швов было от 11 до 16, в среднем составило 14. Двухстворчатый протез «МедИнж» был имплантирован у 53 (84,14%) пациентам, двухстворчатый протез
«СагЬоше&СБ» — 8 (12,68%), по одному случаю (1,59%) использованы протезы «Оп-Х» (1,59%) и «Биолаб».
При ревизии правого атриовентрикулярного отверстия недостаточность ТК обусловленная дилатацией фиброзного кольца отмечалась у 29 (46,03%) пациентов (размеры отверстия более 45 мм, неудовлетворительная водногидравлическая проба при неизмененных створках клапана), которым выполнялась его пластика. Выполнялась пластика ТК по Бойду у 24 (82,75%) пациентов, по Де Вега — у 4 (13,79%) и опорным кольцом — у одного (3.44%). Наблюдался стеноз правого атриовентрикулярного отверстия — у двух (3,17%), что потребовало проведение комиссуротомии ТК.
Хирургическая радиочастотная процедура проведена по методике «MAZE III» у 8 (12,69%) пациентов. Её выполняли по следующей схеме: после начала искусственного кровообращения (ИК), высокочастотным током мощностью 30 Вт «формировали линию», вдоль L. Terminalis, далее перпендикулярно последней до предсердно-желудочковой борозды. После вскрытия правого предсердия продолжали процедуру вокруг коронарного синуса, по синусу полых вен и вокруг устьев полых вен. После вскрытия ЛП проводилась циркулярно абляция площадки устьев легочных вен, далее по линии от нижней левой легочной вены до фиброзного кольца МК.
У трех пациентов был протезирован и аортальный клапан, у двух -АКШ.
Аорта пережималась от 42 до 216, в среднем 64,15 мин. Время ИК продолжалось от 56 до 360, в среднем 117,60 мин. У трех (4,76%) пациентов была налажена внутриаортальная баллонная контрпульсация, в связи со слабостью сердечной деятельности.
В раннем послеоперационном периоде ИВЛ продолжалась от 6 до 72 (в среднем 12,7) часов. Требовалась инотропная поддержка у 25 (39,68%) пациентов, которая осуществлялась адреналином, мезатоном и дофамином. Наиболее часто в качестве инотропной поддержки использовался адреналин
— в 30,15% случаев. Комбинация двух препаратов применялась у 8 (32%) пациентов, трех одновременно — у одного (4%). У трех пациентов совместно с адреналином проводилась инфузия нитратов.
Результаты и обсуждение Из 63 оперированных летальный исход наблюдался у 8 (12,69%) пациентов. В одном случае смерть наступила на операционном столе. Причиной явился разрыв ЛЖ и травма огибающей ветви левой коронарной артерии, во время ушивания разрыва ЛЖ. В остальных случаях смерть наступила после операции от 1 до 27 суток. Во всех случаях причиной смерти явилась прогрессирующая сердечно-сосудистая недостаточность, полиорганная недостаточность. Смерть от тампонады сердца наступила у
одного (1,58%) и от интраоперационного острого инфаркта миокарда — у одного (1,58%).
Причинами летальных исходов являлось исходное тяжелое состояние пациентов до операции: у всех 8 отмечалась декомпенсированная сердечная недостаточность. СДЛА у этих пациентов составило 50-б0 мм. рт. ст.
Оперативное лечение среди погибших пациентов состоялось в том же году, у двух (25%), когда появились первые жалобы и клиника митрального порока, через год после появления клиники — у двух (25%), через 2 года — у З (З7,5%) и через 10 лет — у одного (12,5%). Необходимо отметить, что уровень летальности возрастал при увеличении объема операции. Так при одной клапанной коррекции из З4 пациентов умерло двое (5,88%). При двух клапанной коррекция (протезирование митрального и пластика трикуспидального клапана) из 27 пациентов умерло 4 (14,81%). При трех клапанной (митрально-аортальное протезирование, пластика
трикуспидального клапана) из двоих пациентов умер один (50%). При сочетании с АКШ из двух пациентов умер один (50%).
После проведения радиочастотной хирургической процедуры по методике «MAZE III» свободны лишь от ФП были трое (З7,5%) пациентов. У двоих (З,17%) пациентов зафиксирована транзиторная атриовентрикулярная блокада З ст., которая сохранялась в течение 2-З суток и требовала проведения временной электрокардиостимуляции. Среди выживших пациентов по данным ЭхоКГ после операции гемодинамически незначимые парапротезные фистулы были отмечены у З (4,7б%) пациентов, недостаточность ТК более 1 степени (ввиду неадекватной пластики или невыполнение последней) была у 14,З% пациентов. В 19% случаев СДЛА было выше З0 torr, не превышая 45 torr. Размеры левого предсердия были от З,б до б,0, в среднем 4,81см. Средний градиент на протезе составил от З,5 до 9 (в среднем 5,51 мм рт.ст.). Патогистологическое исследование удаленных клапанов показало, что изменения МК были следующими: склероз,
дезорганизация соединительной ткани, миксоидная дегенерация, гиалиноз, кальциноз.
Рестеноз МК после ЗМКТ остается актуальной проблемой хирургии сердца, особенно учитывая распространенность ЗМКТ в течение 20 века [7]. Причинами рестеноза МК являются: неадекватная ЗМКТ; неспецифический рубцовый процесс; обострение ревматизма [9]. Причем, если одни авторы основной причиной рестеноза называют ревматизм и соответственно рубцовый процесс на клапане [1,2], то другие авторы первопричиной митрального рестеноза называют неадекватную ЗМКТ [1б]. H. Harley единственной причиной рестеноза называет неполную ЗМКТ [12]. Такое мнение подтверждается и тем, что результативность открытой митральной комиссуротомии выше закрытой, т.к. вмешательство на клапане выполняется в полном объеме. [11]. По нашему мнению неадекватная ЗМКТ приведет к формированию рестеноза в ранние сроки (не более З лет) после первичной операции. Появление же признаков митрального порока в более поздние сроки от ЗМКТ обусловлены активностью ревматизма и рубцовым процессом на МК, что подтверждают и другие авторы [1]. Патогенез рестеноза МК не отличается от патогенеза первичного порока. Однако длительный ревматический процесс, более выраженные морфологические изменения клапана и подклапанных структур, чаще встречаемые осложненные формы порока, поражение других клапанов, выраженный миокардиосклероз и проведение повторной операции выделяют пациентов с митральными пороками после ЗМКТ в особую группу, требующую пристального внимания. Определяя показания к операции у пациентов с рестенозом, мы придерживаемся мнения Л. А. Бокерия с соавт [1], что кроме морфологических изменений на клапане необходимо учитывать эффективность ЗМКТ, состояние пациента в последнее время при адекватном лечении ревматизма, удовлетворенность или неудовлетворенность пациента существующим функциональным статусом, а также факторы осложняющие течение митрального рестеноза (тромбоз предсердия, состояние отека легких,
тромбоэмболии, легочная гипертензия). В хирургическом лечении митрального рестеноза возможно применение как закрытых вмешательств (закрытая митральная рекомиссуротомия и транслюминальная баллонная вальвулопластика), так и операции в условиях ИК, преимущества последних достаточно полно освещены в литературе и останавливаться на этом нет необходимости [1,8,9]. Таким образом, операция по поводу митрального рестеноза проводится в условиях ИК. Проведение частичного кардиолиза, для подключения аппарата ИК и доступа к коррегируемым структурам предпочтительно по мнению многих авторов [1,2,8,9] т.к. позволяют экономить время, снижается риск кровотечения, уменьшается кровопотеря по дренажам. В наших наблюдениях частичный кардиолиз использовался в 95,2% случаев. В 2 случаях тотальный кардиолиз выполнялся в связи с необходимостью АКШ и в 1 случае выделение сердца потребовалось для остановки кровотечения в связи с разрывом задней стенки ЛЖ. Использование черездвухпредсердного доступа при коррекции митрального порока после ЗМКТ позволяет провести коррекции как митрального так и трикуспидального клапанов, а при недостаточной визуализации подклапанных структур линии разреза объединяется [1,8]. В наших серии наблюдений у 100% пациентов выполнено протезирование клапана. Показанием к протезированию МК являлись длительное течение ревматического процесса, выраженные фиброзные изменения створок клапана, патология хордо-папиллярного аппарата (укорочение, удлинение, отрыв хорд, спаяние хорд и папиллярных мышц), наличие кальциноза клапана и разрыв створок. Отказ от пластической реконструкции МК обусловлен тем, что изменения МК требовали бы многокомпонентной его реконструкции, причем на фоне грубого фиброза створок и длительно текущего ревматического процесса. Все вышеуказанное не позволяло обеспечить хороший и удовлетворительный как непосредственный, так и отдаленный результат коррекции. Так коллектив авторов из НЦ ССХ им. А.Н.Бакулева РАМН [1] представили данные о 312 операциях по поводу
митрального рестеноза и в 97,8% случаев выполнили протезирование МК. А в 2005г., также авторы из НЦ ССХ им. А.Н. Бакулева РАМН [8] представили серию из 78 пациентов оперированных по поводу рестеноза и во всех случаях, предпочтенье было отдано протезированию. Причиной отказа от пластической реконструкции клапана явились грубые фиброзные изменения МК, длительность течения патологического процесса после первой операции. Так E. Schwartz и J. Bottger, (198б) [15] противопоказаниями для
пластической реконструкции называют: возраст оперированный больных выше 49 лет (P<0,05), «чистую» регургитацию на МК (P<0,001), IV Ф.К. NYHA (P<0,02), предшествующую ЗМКТ (P<0,001), давление в правом предсердии больше, либо равное 4 мм рт.ст. (P<0,01). Для улучшения результатов протезирования митрального клапана важную роль играет сохранение аннуло-паппилярной непрерывности, что требует сохранения подклапанных структур. При невозможности же сохранения последних, целесообразно протезирование хорд нитями PTFE [1,8,9,15]. Эффективность хирургической радиочастотной процедуры «MAZE» в нашей группе пациентов составила З7,5%, что ниже общей результативности (первичные и повторные вмешательства на МК + «MAZE») по данным других авторов [1З,14]. По данным Kim K.B. (200б) [1З] результативность процедуры «MAZE», (на момент выписки), у пациентов с одновременной коррекций ревматического митрального порока составила 88,2%. Rеnzulli et. al. (200б) [14], сообщили о 78,8% эффективности операции «MAZE», у пациентов с одновременной коррекций митрального порока, предикторами же возврата ФП, после хирургической радиочастотной аблации они называют: размер ЛП больше 5,81 см; IV Ф.К. NYHA; недостаточность ТК от 2 степени, это соответствует и мнению других авторов. Низкая эффективность РЧА объясняется по видимому 2 факторами: Отсутствие трансмуральности воздействия радиочастотного тока ввиду спаечного процесса и невыполнения тотального кардиолиза; длительностью ревматического процесса у этой категории пациентов, приводящему к стойкому морфологическому
ремоделированию миокарда предсердий. В нашей серии наблюдений летальность составила 12,69%, что соответствует данным других авторов [3,5,9]. Как и по данным других авторов, уровень летальности зависел от тяжести состояния пациентов и объема коррекции. Кроме того, летальность возрастала при необходимости выполнения тотального кардиолиза. Основной причиной смерти является острая сердечная недостаточность на фоне полиорганной недостаточности. [1,8,9,12].
Таким образом, пациенты с рестенозом митрального клапана относятся к тяжелой категории, что обусловлено исходной тяжестью состояния, длительно текущим ревматическим процессом, необходимостью выполнения повторной операции. Операцией выбора при хирургическом лечении митрального порока после ЗМКТ является протезирование МК, ввиду выраженных изменений створок клапана и хордально-папиллярного аппарата, что не может обеспечить хорошего непосредственного и отдаленного результата пластической реконструкции. По показаниям необходимо выполнение РЧА. Летальность составила 12,69%. Основными причинами летальных осложнений является тяжелое исходное состояние пациентов, необходимость сочетанных операций на сердце — таких как двухтрех клапанная коррекция, АКШ.
SURGICAL TREATMENT OF MITRAL VALVULAR DISEASE AFTER
CLOSED COMMISSUROTOMY V.A. Sakovich, YU. N. Shamrin, A.V. Pustovojtov, D.B. Drobot, YU.V.
Ivanitskaya, P.V. Teplov, E.A. Ivanitskij, D.I. Buyankov, A.R. Haliulina Krasnoyarsk state medical university named in honour of V.F. Vojno-Yasenetskij
63 patients with mitral restenosis after closed commissurotomy were included in the study. The period from closed commissurotomy to revelation of first clinics of mitral restenosis was from 1 to 31 years (13,28). The period from closed commissurotomy to repeated operation from 2 to 34 years (15,79). In all cases mitral valve replacement was done because of rude fibrosis changes, calcinosis, cohesion of hords, papillary muscles and ventricular surface of cusp, hord
contraction and cusp rupture. Not rarely combination of operations was done (plastics of tricuspid valve, radio-frequency ablation, coronary artery bypass grafting). General mortality was 12,69 %, the main cause — progressing cardiovascular collapse and multiple organ failure.
Key words: mitral valvular disease, commissurotomy, mitral valve replacement.
Литература
1. Бокерия Л.А., Скопин И.И., Мироненко В.А. Хирургия митрального порока после закрытой митральной комиссуротомии, изд. НЦССХ им. А.Н. Бакулева РАМН. — Москва, 200З. — 52З с.
2. Дроботин С.С., Чигинев В.А., Земскова Е.Н., Медведев А.П. Результаты лечения рецидивирующего митрального стеноза в условиях искусственного кровообращения // Груд. и серд.-сосудистая хирургия. — 199З. — №2. — С. З5-З8.
3. Караматов А.Ш. Повторные операции на митральном клапана после закрытых митральных комиссуротомий: автореф. дис. … д-ра мед. наук. -М., 1992. — 2б с.
4. Клиническое руководство по ультразвуковой диагностике. — Том 5. // Под редакцией В.В. Митьков, В.А. Сандриков. — М.: ВИДАР, 1998. — Зб0 с.
5. Колесникова Н.И. Хирургическое лечение митрального стеноза на открытом сердце в условиях искусственного кровообращения: автореф. дис. … д-ра мед. наук. — М., 1966. — 27 с.
6. Мешалкин Е.Н., Келин Е.П., Короткова Р.П. и др. Митральный стеноз, диагностика, хирургическое лечение // Груд. хирургия. — 1975. — №3. — С.9-
15.
7. Сердечно-сосудистая хирургия // Под ред. В.И. Бураковский, Л.А. Бокерия. — М.: Медицина, 1996. — 741 с.
8. Скопин И.И., Мироненок В.А., Алиев Ш.М., Чрагян В.А. Современные аспекты хирургического лечения митрального рестеноза // Хирургия журнал им. Н.И. Пирогова. — 2005. — № 12. — С. 4-7.
9. Таричко Ю.В., Черкасов И.Ю. Современный подход к хирургии рестеноза митрального отверстия // Вест. Рос. ун-та Дружбы народов. Серия «Медицина». — 2000. — № 1. — С. 7-14.
10.Behrendt D.M., Austen W.G. Current status of prosthetics for heart valve replacement // Progr. cardiovasc. disease. — 1973. — Vol. 15, № 4. — P. 82-86.
11.Cohn L.H. Mitral valve surgery: reconstruction versus replacement // Z. Cardiology. — 1985. — Vol. 74, №6. — P. 1-5.
12.Gao S.Z. An evaluation of long-term results of closed commissurutomy of mitral stenosis // Chung Hua Wai Ko Tsa Chih. — 1989. — Vol. 27, №1. — P. 2-4,
60.
13.Kim K.B., Cho K.R., Kim K.C. et al. Long term results of the Cox-MAZE 111 prosedure for chronic atrial fibrillation associated with rheumatic mitral valve disease; 10-year experience //J. Interactiv. CardioVasc. And Thorac. Surg. — 2006.
— Vol. 2. — P.210.
14.Renzulli A., Virgilio A., Onorati F. et al. Successful radiofrequency ablation determines atrio-ventricular remodeling and improves systo-diastolic function at tissue Doppler-imaging // J. Interactiv. CardioVasc. And Thorac. Surg. — 2006. -Vol. 2. — P.210.
15.Schwartz E., Bottger J. Indicationfor surgery in mitral stenosis // Herz. — 1986.
— Bd 11, № 2. — S. 24 — 25.
16.Tala P., Mericallo E. // Ann. Chir. Gynec. Fenn. — 1968. — Vol. 57. — P.267-271.
cyberleninka.ru
