Амилаза что это такое: Анализы в KDL. Амилаза панкреатическая
Амилаза общая в сыворотке — Сдать анализ в Ростове-на-Дону
Острый панкреатит – это воспаление поджелудочной железы, часто возникающее на фоне переедания, употребления алкоголя и сопутствующих заболеваний желчного пузыря и желчевыводящих протоков. При отсутствии своевременной диагностики и неотложных лечебных мероприятий, панкреатит может иметь серьезные последствия. Одним из важных ранних диагностических критериев заболевания является амилаза общая в сыворотке крови, отражающая активность воспалительного процесса.
Что такое амилаза?
Амилаза – это пищевой фермент, расщепляющий углеводы до крахмала и гликогена, которые усваиваются в пищеварительном тракте. Различают амилазу S-типа и Р-типа. Первая вырабатывается слюнными железами, вторая – поджелудочной. При наличии воспалительного процесса поджелудочной железы амилаза не попадает в кишечник, а всасывается в кровь еще в тканях самого органа. Это приводит к выраженным системным проявлениям заболевания.
-
у беременных;
-
при приеме каптоприла,кортикостероидов,фуросемида,ибупрофена,наркотических анальгетиков.
Повышенный холестерин может занижать активность амилазы.
Альтернативой лабораторной диагностики острого панкреатита является определение уровня амилазы в моче, но для фильтрации фермента через систему почечных канальцев требуется определенное время, тогда как амилаза общая в сыворотке повышена уже на ранних стадиях заболевания.Также рекомендуется сдать амилазу панкреатическую,липазу. Необходимо отметить, что те случаи, когда амилаза общая в сыворотке понижена или находится в пределах нормы, требуются повторения исследования через определенное время.
Подготовка к сдаче крови на амилазу
Для получения достоверных результатов исследования к нему необходимо правильно подготовиться, соблюдая простые правила:-
не употреблять пищу на протяжении 12 часов до исследования.
 В случаях острого панкреатита в первые дни заболевания показано голодание;
В случаях острого панкреатита в первые дни заболевания показано голодание;
-
не курить за полчаса до сдачи крови. Никотин может повлиять на результат исследования;
-
за 30 минут до процедуры исключить физическое и эмоциональное напряжение.
Где сдать анализ в Ростове-на-Дону?
Такой лабораторный анализ как амилаза общая в сыворотке крови в Ростове-на-Дону можно сдать в медицинском центре «Да Винчи». Здесь работает высокопрофессиональный персонал, правильно выполняющий забор крови и подготовку биоматериала. А современное диагностическое оборудование позволяет получать точные результаты исследования в кратчайшие сроки.
Наименование услуги
ЦенаАмилаза общая в сыворотке
230 pуб.
Отзывы об услуге
Амилаза общая в сыворотке: исследования в лаборатории KDLmed
Амилаза – один из ферментов пищеварительного сока, который выделяется слюнными железами и поджелудочной железой.
Синонимы русские
Диастаза, сывороточная амилаза, альфа-амилаза, амилаза сыворотки.
Синонимы английские
Amy, alpha-amylase, AML, diastase, 1,4-?-D-glucanohydralase, serum amylase, blood amylase.
Метод исследования
Кинетический колориметрический метод.
Единицы измерения
Ед/л (единица на литр).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Не принимать пищу в течение 12 часов до исследования.
- Исключить физическое и эмоциональное перенапряжение и не курить 30 минут до сдачи крови.

Общая информация об исследовании
Амилаза – один из нескольких ферментов, которые вырабатываются в поджелудочной железе и входят в состав панкреатического сока. Липаза расщепляет жиры, протеаза – белки, а амилаза расщепляет углеводы. Из поджелудочной железы панкреатический сок, содержащий амилазу, через панкреатический проток попадает в двенадцатиперстную кишку, где помогает переварить пищу.
В норме только небольшое количество амилазы циркулирует в кровяном русле (из-за обновления клеток поджелудочной железы и слюнных желез) и попадает в мочу. Если происходит повреждение поджелудочной железы, как при панкреатите, или если панкреатический проток блокируется камнем либо опухолью, амилаза начинает в больших количествах попадать в кровоток, а затем в мочу.
Небольшие количества амилазы образуются в яичниках, кишечнике, бронхах и скелетной мускулатуре.
Для чего используется исследование?
- Чтобы диагностировать острый или хронический панкреатит и другие заболевания, вовлекающие в патологический процесс поджелудочную железу (вместе с тестом на липазу).

- Для контроля за лечением рака, затрагивающего поджелудочную железу.
- Чтобы убедиться, что панкреатический проток не скомпрометирован после удаления камней из желчного пузыря.
Когда назначается исследование?
- Когда у пациента есть признаки патологии поджелудочной железы:
- интенсивная боль в животе и спине («опоясывающая боль»),
- повышение температуры,
- потеря аппетита,
- рвота.
- При наблюдении за состоянием пациента с заболеванием поджелудочной железы и контроле за эффективностью его лечения.
Что означают результаты?
Референсные значения: 28 — 100 Ед/л.
Причины повышения активности общей амилазы в сыворотке
- Острый панкреатит. При этом заболевании активность амилазы может превосходить допустимую в 6-10 раз. Повышение обычно происходит через 2-12 часов после повреждения поджелудочной железы и сохраняется в течение 3-5 дней. Вероятность того, что острая боль вызвана острым панкреатитом, достаточно высока, если активность амилазы превышает 1000 Ед/л.
 Тем не менее у некоторых больных с острым панкреатитом данный показатель иногда повышается незначительно или даже остается в норме. Вообще, активность амилазы не отражает тяжести поражения поджелудочной железы. К примеру, при массивном панкреатите может происходить гибель большинства клеток, вырабатывающих амилазу, поэтому ее активность не изменяется.
Тем не менее у некоторых больных с острым панкреатитом данный показатель иногда повышается незначительно или даже остается в норме. Вообще, активность амилазы не отражает тяжести поражения поджелудочной железы. К примеру, при массивном панкреатите может происходить гибель большинства клеток, вырабатывающих амилазу, поэтому ее активность не изменяется. - Хронический панкреатит. При хроническом панкреатите активность амилазы вначале умеренно повышена, однако затем может уменьшаться и приходить в норму по мере усугубления поражения поджелудочной железы. Основная причина хронического панкреатита – алкоголизм.
- Травма поджелудочной железы.
- Рак поджелудочной железы.
- Закупорка (камнем, рубцом) панкреатического протока.
- Острый аппендицит, перитонит.
- Перфорация (прободение) язвы желудка.
- Декомпенсация сахарного диабета – диабетический кетоацидоз.
- Нарушение оттока в слюнных железах или слюнных протоках, например при паротите (свинке).

- Операции на органах брюшной полости.
- Острый холецистит – воспаление желчного пузыря.
- Кишечная непроходимость.
- Прерванная трубная беременность.
- Разрыв аневризмы аорты.
- Макроамилаземия – редкое доброкачественное состояние, когда амилаза соединяется с крупными белками в сыворотке и поэтому не может пройти через почечные клубочки, накапливаясь в сыворотке крови.
Причины понижения активности общей амилазы в сыворотке
- Снижение функции поджелудочной железы.
- Тяжелый гепатит.
- Муковисцидоз (кистозный фиброз) поджелудочной железы – тяжелое наследственное заболевание, связанное с поражением желез внешней секреции (легких, желудочно-кишечного тракта).
- Удаление поджелудочной железы.
Что может влиять на результат?
- Активность амилазы в сыворотке повышается:
- у беременных,
- при приеме каптоприла, кортикостероидов, оральных контрацептивов, фуросемида, ибупрофена, наркотических анальгетиков.

- Повышенный холестерин может занижать активность амилазы.
Важные замечания
- При остром панкреатите повышение амилазы обычно сопровождается увеличением активности липазы.
- Активность амилазы у детей в первые два месяца жизни низкая, она повышается до взрослого уровня к концу первого года.
Также рекомендуется
Кто назначает исследование?
Врач общей практики, терапевт, гастроэнтеролог, хирург.
Амилаза (Amylase) в крови, биохимический анализ
Амилаза (Amylase) в крови, биохимический анализ
- Подробности
- Просмотров: 5608
Амилаза
(Amylase) в крови, биохимический анализ крови животных
ОБЩИЕ СВЕДЕНИЯ
Материал для исследования: Кровь.
Объяснение методики проведения исследования. Физиологические принципы исследования
Физиологические принципы исследования
Амилаза — фермент, гидролизующий крахмал и гликоген, синтезируется в поджелудочной железе (ПЖ) и в тканях многих других органов, например в двенадцатиперстной кишке, почках, легких и селезенке; из плазмы выводится почками.
Повышение концентрации фермента Амилазы в крови у собак часто возникает при панкреатите.
После экспериментально вызванного воспаления ПЖ максимальное повышение уровня амилазы наблюдается в течение 12—48 часов, после чего уровень фермента восстанавливается до нормы примерно за 8—14 дней. Однако повышение амилазы может возникать и при других поражениях ткани, синтезирующей этот фермент, и при снижении скорости клубочковой фильтрации (СКФ) в почках. При панкреатите у кошек не всегда развивается повышение концентрации амилазы, даже, напротив, может отмечаться снижение уровня фермента.
В референсных лабораториях и в некоторых лабораториях при ветеринарных клиниках для определения уровня амилазы чаще всего используют спектрофотометрический метод. В некоторых лабораториях анализ проводят с использованием сухих реагентов. Определение уровня амилазы выполняют с помощью амилолитического (оценивают растворение крахмала в реакционной смеси), сахарогенного (оценивают образование глюкозы и мальтозы) и хромогенного способов. Активность мальтозы в сыворотке крови, полученной от здоровых собак, необратимо влияет на сахарогенный метод анализа, поэтому этот метод не рекомендуется использовать в ветеринарной практике.
В некоторых лабораториях анализ проводят с использованием сухих реагентов. Определение уровня амилазы выполняют с помощью амилолитического (оценивают растворение крахмала в реакционной смеси), сахарогенного (оценивают образование глюкозы и мальтозы) и хромогенного способов. Активность мальтозы в сыворотке крови, полученной от здоровых собак, необратимо влияет на сахарогенный метод анализа, поэтому этот метод не рекомендуется использовать в ветеринарной практике.
Показания
- Заболевание, сопровождающееся нарушениями, которые могут указывать на панкреатит (рвота, анорексия, абдоминальная боль, желтуха).
- Присутствие в брюшной полости несептического воспалительного экссудата.
Противопоказания — неизвестны.
Возможные осложнения — неизвестны.
Информация для владельца
- Для получения более точных результатов перед исследованием собаку необходимо выдержать на голодной диете.
- Владельцам животных следует объяснить, что оценка уровня амилазы является неспецифическим тестом и что изменение концентрации этого фермента может быть связано с панкреатитом, а может быть следствием заболевания других органов, например почек или кишечника.

Оцениваемые системы органов
- Желудочно-кишечный тракт.
- Гепатобилиарная.
- Почки и мочевыделительная система.
РАБОТА С ОБРАЗЦОМ
Взятие образца
- Необходимо взять 1-2 мл венозной крови.
- Проба абдоминальной жидкости.
Обработка полученных образцов
- Кровь лучше всего брать в пробирку с красной крышкой или в пробирку с компонентами для отделения сыворотки крови.
- Допустимо использование пробирки с зеленой крышкой (с гепаринатом лития), но не желательно.
Условия хранения
Образец хранят в охлажденном виде (в холодильнике) или в замороженном состоянии.
Стабильность образца
- 1 неделю: при комнатной температуре.
- Не менее 1 месяца: при 2—8 °С (в холодильнике).
- Несколько лет: при -20 °С (в замороженном состоянии).

ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ ТЕСТА
Диапазон нормальных значений
- Собаки: 371-1503 МЕ/л.
- Кошки: 571-1660 МЕ/л.
- Референсные значения могут отличаться, что зависит от методики исследования и лаборатории, в которой проводится данный тест.
Возможные патологические изменения
Значения, превышающие показатели нормы.
Угрожающие жизни патологические изменения — не известны.
Факторы, влияющие на результаты теста
Препараты, которые могут повлиять на результаты исследования или на его интерпретацию
Препараты, которые могут повлиять на методологию теста — не известны.
Препараты, которые могут повлиять на физиологические процессы в организме
Препараты, которые могут усилить панкреатит:
- глюкокортикоиды;
- антибиотики, например метронидазол, сульфонамиды и тетрациклин;
- диуретики, включая фуросемид и тиазиды;
- другие препараты, например аспарагиназа и азатиоприн.

Нарушения, которые могут повлиять на результаты теста
Отсутствуют.
Ошибки при взятии пробы и проведении теста, которые могут повлиять на его результаты
Не известны.
Особые факторы, влияющие на проведение и интерпретацию результатов данного теста
Вид животного
Повышенный уровень амилазы у собак может указывать на присутствие панкреатита; однако, у кошек такие изменения являются ненадежным показателем.
Порода — не влияет.
Возраст — не влияет.
Пол — не влияет.
Беременность — не влияет.
Недостатки теста
- У данного теста низкая чувствительность и специфичность при диагностике панкреатита.
- Амилаза образуется в тканях почек или кишечника, поэтому поражение этих органов может усилить активность этого фермента.
- Уровень активности амилазы не коррелирует с выраженностью панкреатита; у некоторых животных с тяжелой формой острого панкреатита был выявлен нормальный уровень амилазы.

Чувствительность и специфичность теста, прогностичность положительного и отрицательного результатов исследования — не применимо к данному виду теста.
Причины появления патологических изменений
Высокие значения
- Снижение СКФ.
- Выраженная дегидратация.
- Заболевания почек.
- Обструкция мочевыводящих путей.
- Панкреатит.
- Заболевания кишечника.
- Заболевания печени.
Низкие значения — не информативны.
Клиническое применение
- Если у животного выявляется высокий уровень амилазы, необходимо провести ряд дополнительных исследований, для того чтобы исключить заболевание печени, кишечника или ухудшение скорости клубочковой фильтрации.
- Наиболее вероятно, что уровень амилазы, в 3 раза превышающий норму, является следствием заболевания поджелудочной железы (ПЖ), а не какого-то другого органа.

- На сегодняшний день такие новейшие тесты, как оценка иммунореактивности липазы ПЖ у собак, являются более чувствительными и специфичными методами исследования при диагностике заболеваний ПЖ по сравнению с определением уровня амилазы.
- Повышение уровня амилазы в пробе абдоминальной жидкости в 2 раза по сравнению с нормой указывает на панкреатит, хотя это может быть и следствием разрыва кишечника.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Дополнительные исследования
- Определение уровня липазы, оценка иммунореактивности липазы ПЖ или трипсиноподобной иммунореактивности для подтверждения заболевания ПЖ.
- Определение уровня азота мочевины крови, креатинина, анализ мочи для оценки функции почек.
- Определение активности ферментов печени.
- УЗИ поджелудочной железы.
Синонимы — отсутствуют.
Сделать биохимический анализ и определить концентрацию Амилаза (Amylase) в крови можно в независимой лаборатории ветеринарной клиники Котофей, г.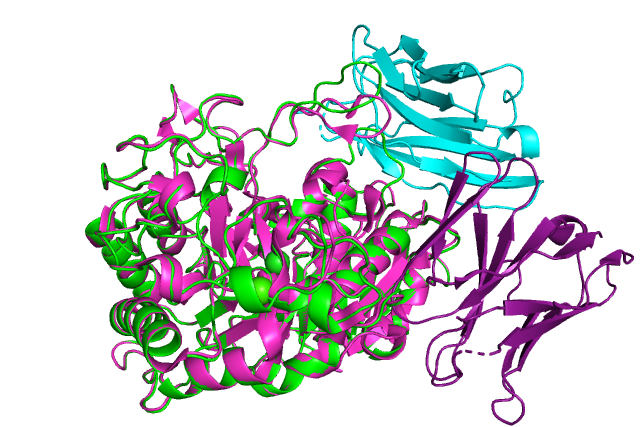 Днепр.
Днепр.
Информация взята из открытых источников и учебников популярных издательств.
Анализ на альфа-амилазу панкреатическую сдать в Москве
Метод определения Энзиматический колориметрический.
Исследуемый материал Сыворотка крови
Доступен выезд на дом
Онлайн-регистрацияСинонимы: Анализ крови на панкреатическую амилазу; α-амилаза панкреатическая; P-амилаза; P-тип амилазы.
Pancreatic α-amylase; Pancreatic AML; P-type amylase; P-type alpha-amylase; Amylase isoenzymes; Amylase isoforms.
Краткая характеристика определяемого вещества Альфа-Амилаза панкреатическая
Панкреатическая альфа-амилаза синтезируется ацинарными клетками поджелудочной железы и в составе панкреатического сока через общий панкреатический проток попадает в двенадцатиперстную кишку. Панкреатическая альфа-амилаза относится к кальций-зависимым металлопротеинам и обеспечивает расщепление сложных углеводов, поступающих с пищей гидролизирует альфа-1,4-гликозидные связи в полисахаридах и приводит к образованию олигосахаридов различной длины.
Бóльшая часть панкреатической амилазы расщепляется в нижней части кишечного тракта трипсином, небольшое количество попадает в кровь.
При каких состояниях может повышаться уровень Альфа-амилазы панкреатической
Тест на альфа-амилазу панкреатическую используют для диагностики и мониторинга лечения острого панкреатита и для дифференциации панкреатита от других острых абдоминальных расстройств.
Активность панкреатической альфа-амилазы в крови низкая, но она возрастает при острых панкреатитах, а также при хирургических и травматических повреждениях поджелудочной железы.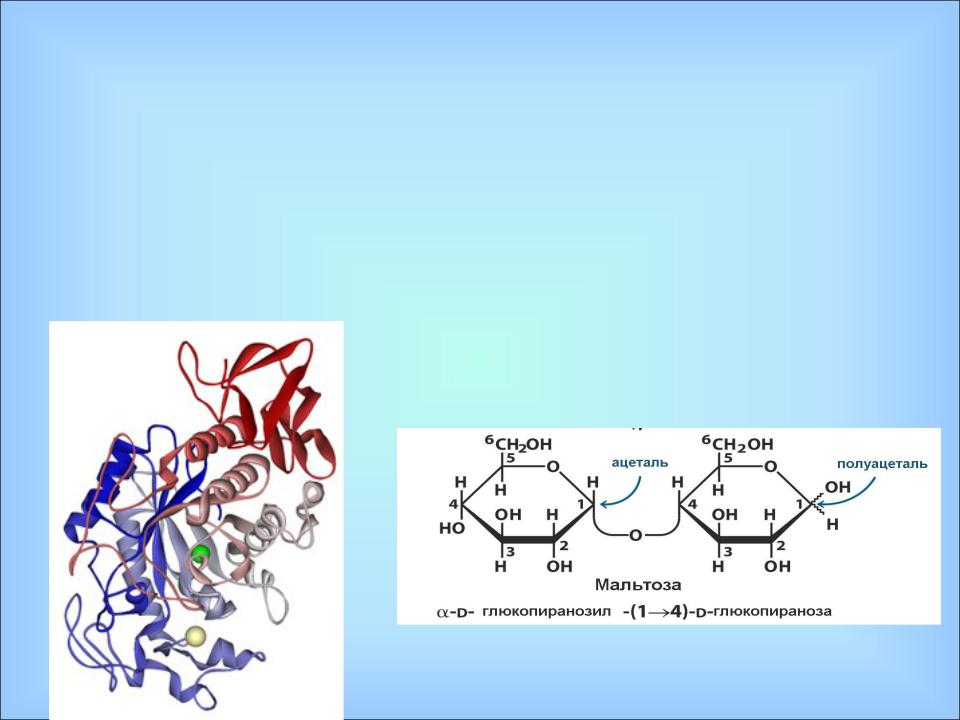
Заболевания желчных путей, такие как холецистит, вызывают повышение активности панкреатической альфа-амилазы в сыворотке в результате первичного или вторичного поражения поджелудочной железы.
По клинической чувствительности и специфичности диагностическая ценность исследования панкреатической альфа-амилазы сопоставима с диагностическим значением исследования липазы (см. тест № 23) – наиболее специфического для поджелудочной железы фермента. Если используется критерий трехкратного превышения нормальных значений, чувствительность панкреатической альфа-амилазы на 38% выше чувствительности общей альфа-амилазы (см. тест № 11) в диагностике острых панкреатитов.С какой целью определяют Альфа-амилазу панкреатическую в сыворотке крови
Определение активности панкреатической амилазы используют в диагностике и мониторинге острых панкреатитов и обострений хронических панкреатитов.
Что может повлиять на результат исследования крови на Альфа-амилазу панкреатическую
Повышенный уровень альфа-амилазы панкреатической обнаруживается у пациентов, злоупотребляющих алкоголем, при диабетическом кетоацидозе, а также у беременных женщин.
Прием некоторых лекарств (например, оральных контрацептивов, антибиотиков, кортикостероидов, тиазидных диуретиков и др.) может искажать результаты исследования крови на панкреатическую альфа-амилазу.
Ферменты
Ферменты – специфические белки, выполняющие в организме роль биологических катализаторов. Ферменты содержатся во всех клетках организма, где их концентрация значительно выше, чем в плазме крови.
Нормальные уровни активности ферментов в сыворотке крови отражают соотношение между биосинтезом и высвобождением ферментов, а также их клиренсом из кровотока.
Исследование уровня ферментов в клинической практике применяется для решения следующих задач:
- установление диагноза;
- проведение дифференциальной диагностики;
- оценка динамики течения болезни;
- определение эффективности лечения и степени выздоровления.
В Клинико-диагностической лаборатории выполняется определение сывороточной активности следующих ферментов:
Амилаза
Амилаза – фермент, осуществляющий расщепление полисахаридов. Наиболее богаты этим ферментом поджелудочная и слюнные железы. Определение активности амилазы имеет важное значение в диагностике заболеваний поджелудочной железы.
Наиболее богаты этим ферментом поджелудочная и слюнные железы. Определение активности амилазы имеет важное значение в диагностике заболеваний поджелудочной железы.
Повышение активности амилазы в сыворотке крови в 2 и более раз должно расцениваться как симптом поражения поджелудочной железы. Большей информативностью о функции поджелудочной железы обладает определение активности амилазы в моче.
Амилаза панкреатическая
Панкреатическая амилаза – это биологически активное вещество, участвующее в процессе метаболизма углеводов. В организме человека большая ее часть вырабатывается поджелудочной железой.
В случае заболевания поджелудочной железы или блокировки протока между нею и двенадцатиперстной кишкой амилаза панкреатическая начинает выделяться в кровь, свидетельствуя об имеющемся существенном неблагополучии в состоянии этого важного пищеварительного органа.
Липаза
Липаза — водорастворимый фермент, который катализирует гидролиз нерастворимых эстеров-липидных субстратов, помогая переваривать, растворять и фракционировать жиры.
Липаза вместе с желчью расщепляет жиры и жирные кислоты, а также жирорастворимые витамины A, D, E, K, обращая их в энергию теплопродукции.
АСТ — аспартатаминотрансфераза
АСТ – аспартатаминотрансфераза – фермент, широко распространенный в тканях человека (сердце, печень, скелетная мускулатура, почки, легкие и т.д.).
Активность АСТ в крови повышается при ряде заболеваний, особенно при поражении органов и тканей, богатых этим ферментом.
Наиболее резкие изменения в активности АСТ наблюдают при поражении сердечной мышцы. АСТ также повышается при остром гепатите и других тяжелых поражениях клеток печени.
АЛТ — аланинаминотрансфераза
АЛТ – аланинаминотрансфераза – фермент, содержащийся в скелетных мышцах, печени, сердце. В миокарде его значительно меньше, чем АСТ. Самых больших концентраций АЛТ достигает в печени.
В клинической практике широко применяется одновременное определение в крови активности АСТ и АЛТ; оно несет гораздо больше информации о локализации и глубине поражения, активности патологического процесса; позволяет прогнозировать исход заболевания.
ЩФ — Щелочная фосфатаза
ЩФ – щелочная фосфатаза – широко распространена в тканях человека, особенно в слизистой оболочке кишечника, остеобластах, стенках желчных протоков печени. Увеличение активности ЩФ сопровождает рахит любой этиологии, костные изменения, связанные с гиперпаратиреозом.
Быстро растет активность фермента при остеогенной саркоме, метастазах рака в кости, миеломной болезни, лимфогранулематозе с поражением костей.
Значительное увеличение активности ЩФ наблюдается при холестазе. Повышение ее наблюдается у 90% больных первичным раком печени и при метастазах в печень. Резко возрастает ее активность при отравлениях алкоголем на фоне хронического алкоголизма. Она может повышаться при лекарственных назначениях, проявляющих гепатотоксический эффект.
ГГТ — гамма-глутамилтранспептидаза
ГГТ – гамма-глутамилтранспептидаза – обнаружена в печени, поджелудочной железе, почках.
В других тканях – в небольших количествах. Изменение ее активности в сыворотке имеет большое диагностическое значение при заболеваниях печени и гепатобилиарного тракта. Этот фермент более чувствителен к нарушениям в клетках печени, чем АЛТ, АСТ, ЩФ и т.д.
Этот фермент более чувствителен к нарушениям в клетках печени, чем АЛТ, АСТ, ЩФ и т.д.
ЛДГ — общая лактатдегидрогеназа.
ЛДГ – общая лактатдегидрогеназа – наибольшая активность обнаружена в почках, миокарде, скелетной мускулатуре и печени. В физиологических условиях повышенная активность ЛДГ наблюдается у беременных, у лиц после интенсивной физической нагрузки.
Из патологических состояний повышение активности ЛДГ вызывают инфаркт миокарда, застойные явления в печени, инфаркт легкого, миопатии, карциномы печени или метастазы рака в печень, мегалобластная и гемолитическая анемия, острые и обострение хронических заболеваний почек.
Медицинские анализы — Альфа-Амилаза
Альфа-амилазы – это гидролитические ферменты, разлагающие крахмал до мальтозы. В организме человека альфа-амилазы имеют различное происхождение: панреатическая амилаза производится поджелудочной железой и выходит в кишечный тракт, слюнная амилаза синтезируется в слюнных железах и секретируется в слюну. Присутствующая в крови амилаза выходит через почки и экскретируется в мочу. В основном, измерение альфа-амилазы в сыворотке и в моче используется для диагностики нарушений работы поджелудочной железы и для обнаружения развития осложнений. При острых панкреатитах активность амилазы повышается в течении нескольких часов после начала болей в животе, примерно через 12 часов достигает пика и возвращается к нормальным значениям по прошествии 5и дней. Специфичность альфа-амилазы для болезней поджелудочной железы не очень высока, поскольку повышенные уровни также наблюдаются при различных болезнях, не связанных с поджелудочной железой, например, паротите и почечной недостаточности. Поэтому для подтверждения острого панкреатита необходимо дополнительно проводить измерение активности липазы.
Присутствующая в крови амилаза выходит через почки и экскретируется в мочу. В основном, измерение альфа-амилазы в сыворотке и в моче используется для диагностики нарушений работы поджелудочной железы и для обнаружения развития осложнений. При острых панкреатитах активность амилазы повышается в течении нескольких часов после начала болей в животе, примерно через 12 часов достигает пика и возвращается к нормальным значениям по прошествии 5и дней. Специфичность альфа-амилазы для болезней поджелудочной железы не очень высока, поскольку повышенные уровни также наблюдаются при различных болезнях, не связанных с поджелудочной железой, например, паротите и почечной недостаточности. Поэтому для подтверждения острого панкреатита необходимо дополнительно проводить измерение активности липазы.
Референтные значение
| Возраст | Активность альфа-амилазы Ед/мл |
| Новорожденные от 2 до 4 дней | 5 – 65 |
| Взрослые | 27 – 131 |
| Взрослые в возрасте от 60 до 90 лет | 24 — 151 |
Факторы, вызывающие искажение результата: гемолиз пробы крови.
Факторы, увеличивающие активность
- Прием алкоголя.
- Вещества, вызывающие сокращение сфинктера Одди (например, бетанехол, дифеноксилат, наркотические анальгетики), секретин.
Некоторые препараты могут вызывать повышение активности амилазы в сыворотке и, возможно, панкреатит:
Аспарагиназа, Азатиоприн, Каптоприл, Циметидин, Клофибрат, Кортикостероиды, Ципрогептадин, Диданозин, Эстроген, Этакриновая кислота, Фуросемид, Ибупрофен, Индометацин, Мефенаминовая кислота, Метилдофа, Нитрофурантоин, Пероральные контрацептивы, Пентамидин, Фенилбутазон, Сульфонамиды, Сулиндак, Тетрациклины, Тиазидные диуретики, Вальпроевая кислота, Зальцитабин, Загрязнение образца или реакционной смеси слюной.
Факторы, уменьшающие активность
Анаболические стероиды, Липемия, Оксалаты, Цитрат, Фторид, ЭДТА.
Увеличение активности
- Панкреатит (при остром панкреатите активность повышается более чем в 5 раз)
- Паротит
- Обтурационная и странгуляционная непроходимость или инфаркт кишки
- Эктопическая беременность
- Заболевания желчных путей всех типов
- Диабетический кетоацидоз
- Киста или псевдокиста поджелудочной железы, как осложнения острого панкреатита (при панкреатической псевдокисте активность амилазы не возвращается к норме после острого приступа более длительный срок)
- Перитонит
- Макроамилаземия
- Некоторые опухоли легких и яичников
- Почечная недостаточность
- Эндоскопическая ретроградная холангиопанкреатография
- Абдоминальная травма
- Повреждение черепа
- Вирусные инфекции
- Состояние после операции, алкоголь
Уменьшение активности
- Недостаточность поджелудочной железы
- Выраженный муковисцидоз
- Тяжелое поражение печени
- Хирургическое удаление поджелудочной железы
Панкреатическая амилаза в крови — сдать анализ, цена в СПб | Медицинский центр
α-амилаза ― биоактивное вещество из группы ферментов, необходимое для переработки углеводов. Продуцируется саливационными железами и поджелудочной. Незначительные концентрации есть в составе поперечно-полосатых мышц, оболочек кишечника, яичников. Амилаза обнаруживается во многих биологических жидкостях (поте, секрете слизистых, амниотической жидкости), но больше всего ее содержится в слюне и панкреатическом соке. Небольшая часть проникает в кровь. Для диагностики различных заболеваний определяют уровень общей и панкреатической амилазы. Результаты особенно важны для выявления патологий поджелудочной железы, но анализы на амилазу могут применяться при заболеваниях других внутренних органов.
Продуцируется саливационными железами и поджелудочной. Незначительные концентрации есть в составе поперечно-полосатых мышц, оболочек кишечника, яичников. Амилаза обнаруживается во многих биологических жидкостях (поте, секрете слизистых, амниотической жидкости), но больше всего ее содержится в слюне и панкреатическом соке. Небольшая часть проникает в кровь. Для диагностики различных заболеваний определяют уровень общей и панкреатической амилазы. Результаты особенно важны для выявления патологий поджелудочной железы, но анализы на амилазу могут применяться при заболеваниях других внутренних органов.
Об анализе
Существует 2 типа альфа-амилазы. Р-тип, или амилаза панкреатическая, секретируется клетками только этого органа. В составе панкреатического сока она попадает в 12-перстную кишку, где расщепляет те углеводы, которые не были переработаны в верхних отделах ЖКТ. S-тип продуцируется слюнными железами и участвует в начальных этапах пищеварения. Посредством слюнной амилазы происходит расщепление крахмала и других углеводов непосредственно в ротовой полости. Данный тип может всасываться в системный кровоток.
Данный тип может всасываться в системный кровоток.
60% общей амилазы крови представлено S-типом и только 40% Р-типом. Такое соотношение используют для оценки состояния панкреаса. Амилаза панкреатическая показывает целостность клеток органа и качество оттока поджелудочного сока. Например, если затруднена проходимость протоков (опухолью или конкрементом) наблюдается застой сока, из-за чего ферменты всасываются в кровеносное русло. Нормальное соотношение слюнной и панкреатической амилазы смещается в пользу последней, что является специфическим маркером органических изменений последней. Активность S-формы остается прежней.
Как подготовиться
Последний прием пищи должен состояться за 12 часов до забора биоматериала (венозной крови). Нежелательно подвергать себя повышенным психоэмоциональным и физическим нагрузкам. За полчаса до анализа нельзя курить. Завышать показатели амилазы могут медикаменты следующих групп:
- оральные контрацептивы;
- глюкокортикоиды;
- наркотические анальгетики.

Если человек употребляет перечисленные средства, а также Каптоприл, Ибупрофен, Фуросемид, об этом нужно сообщить врачу.
Когда нужно пройти тест
Анализ крови на амилазу панкреатическую проводят для подтверждения диагноза «Панкреатит», т.е. исследование применяется в диагностике острой и хронический формы, а также для выявления рецидива. Однако уровень амилазного фермента играет лишь второстепенную роль. Для выявления панкреатита более ценным является показатель активности липазы.
Второе показание – контроль состояния пациента после проведения операций на поджелудочной и после вмешательств на органах ЖКТ.
Чаще всего анализ назначает гастроэнтеролог, терапевт или хирург.
В некоторых случаях исследование проводят в комплексной диагностике патологий дыхательной системы, придатков матки и слюнных желез.
Нормы
Активность панкреатической амилазы измеряют в Ед/л. Референсные значения отличаются по возрасту. Нормы для женщин и мужчин выглядят следующим образом:
- дети до года ― до 8 Ед/л;
- до 10 лет ― до 31 Ед/л;
- до 18 лет ― до 39 Ед/л;
- взрослые ― от 13 до 53 Ед/л.

Результаты исследования на панкреатическую амилазу крови нужно сравнивать с показателем альфа-амилазы общей. Так, если общий показатель высокий, а Р-тип снижен, искать проблему нужно в других внутренних органах, но не в поджелудочной железе. Если общая альфа-амилаза повышается одновременно с P-типом, а S-тип остается в норме, необходимо углубленно обследовать панкреас.
Почему показатель высокий
Выраженное повышение амилазы панкреатической в крови часто наблюдается в острой стадии панкреатита (обнаруживается более 90% от активности общей амилазы). У части пациентов выраженного увеличения уровня фермента не происходит, так как при деструктивных процессах погибают продуцирующие клетки.
По уровню амилазы нельзя судить о характере и степени органических изменений в структуре панкреаса. При хроническом панкреатите наблюдается скачок уровня Р-амилазы, после чего показатели нормализуются.
Высокая активность фермента отмечается у лиц, страдающих от диабета, во время кетоацидоза и на стадии декомпенсации, при травмах поджелудочной или опухолевых заболеваниях железы. Кроме перечисленных нарушений, повышение уровня амилазы может быть спровоцировано:
Кроме перечисленных нарушений, повышение уровня амилазы может быть спровоцировано:
- перитонитом;
- воспалительным процессом аппендикса;
- язвенным дефектом стенки органа брюшной полости;
- воспалением желчного пузыря;
- непроходимостью кишечника;
- разрывом аневризмы аорты.
Высокий уровень фермента или макроамилаземия наблюдается при взаимодействии фермента с некоторыми альбуминами крови. Из-за образования крупных комплексов избыток вещества не может выводиться почками и накапливается в организме.
Сниженный уровень
Уровень активности Р-амилазы у лиц до 18 лет может соответствовать 0, что считается вариантом нормы. Для взрослых предельно низким значением считается 13 Ед/л. Чрезмерно низкие показатели наблюдаются у пациентов с муковисцидозом (наследственное заболевание, сопровождающееся нарушением активности всех желез внешней секреции, в том числе пищеварительных). Панкреатическая амилаза понижена после удаления железы, также низкие показатели могут говорить о недостаточности органа.
В клинике «МедПросвет» можно проверить уровень панкреатической амилазы в крови, а также при необходимости проконсультироваться с врачом. Точные результаты лабораторных анализов помогают установить объективный диагноз.
Сдать анализы крови можно без предварительной записи ежедневно:
- пн.-сб.: 08:30—13:00 (первый забор), 13:00—17:00 (второй забор)
- вс.: 09:30—14:00.
Для получения результатов анализов по электронной почте необходимо оставить письменное согласие на отправку у администраторов медицинского центра.
Амилаза — StatPearls — NCBI Bookshelf
Введение
Амилаза представляет собой пищеварительный фермент, преимущественно секретируемый поджелудочной железой и слюнными железами и обнаруживаемый в других тканях в очень малых количествах[1]. Амилаза была впервые описана в начале 1800-х годов и считается одним из первых ферментов в истории, подвергшихся научному исследованию. Первоначально он назывался диастаст , но позже в начале 20 века был переименован в амилазу[2].
Основная функция амилаз заключается в гидролизе гликозидных связей в молекулах крахмала, превращении сложных углеводов в простые сахара.Существует три основных класса ферментов амилазы; Альфа-, бета- и гамма-амилазы действуют на разные части углеводной молекулы. Альфа-амилазу можно найти у людей, животных, растений и микробов. Бета-амилаза содержится в микробах и растениях. Гамма-амилаза обнаружена у животных и растений. Эта статья будет посвящена альфа-амилазе и ее применению [3].
В 1908 году исследование Вольгемута выявило наличие амилазы в моче, что впоследствии привело к использованию амилазы в качестве диагностического лабораторного теста.Анализ на амилазу обычно назначают вместе с липазой, особенно при подозрении на острый панкреатит [2].
Этиология и эпидемиология
Хотя повышенный уровень амилазы или гиперамилаземия в первую очередь наблюдается при заболеваниях слюнных желез и поджелудочной железы, они также могут наблюдаться при различных заболеваниях, включая желудочно-кишечные заболевания, злокачественные новообразования и гинекологические заболевания (см. таблицу ниже). Снижение уровня амилазы наблюдается при преэклампсии, муковисцидозе и заболеваниях печени [4, 5, 6, 1, 7, 8, 9, 10, 11].
таблицу ниже). Снижение уровня амилазы наблюдается при преэклампсии, муковисцидозе и заболеваниях печени [4, 5, 6, 1, 7, 8, 9, 10, 11].
Повышенный уровень амилазы можно наблюдать при различных состояниях, включая заболевания поджелудочной железы, заболевания слюнных желез, снижение метаболического клиренса, заболевания кишечника и макроамилаземию (обсуждается ниже). Хроническое повышение уровня амилазы также может наблюдаться при редком состоянии, называемом доброкачественной гиперэнзимемией поджелудочной железы или синдромом Гулло. Пациенты обычно здоровы, у них нет заболеваний поджелудочной железы. Этиология состояния неизвестна [3][12]. У 26 (12,5%) из 208 пациентов с острой болью в животе, не связанной с поджелудочной железой, при поступлении был повышен уровень амилазы в сыворотке крови[13].Аномально повышенный уровень амилазы наблюдается у 35% пациентов с заболеваниями печени [14]. 16–25% случаев диабетического кетоацидоза проявляются повышенным уровнем амилазы [15][11]. В группе из 74 пациентов с операбельным раком легкого у 13 была выявлена гиперамилаземия [16].
Патофизиология
Основной функцией амилазы является катализация гидролиза крахмала в сахара. Было обнаружено несколько изоформ амилазы, но наиболее распространенными из них являются амилаза поджелудочной железы (P-амилаза) и амилаза слюны (S-амилаза). тракт.S-амилаза в основном вырабатывается в слюнных железах, но также может вырабатываться в яичниках, фаллопиевых трубах, желудочно-кишечном тракте, легких, поперечно-полосатых мышцах и злокачественных новообразованиях [17, 18]. Амилаза сыворотки жестко регулируется в организме. Существует баланс между скоростью производства и скоростью очистки. Повышенный уровень амилазы может быть связан с увеличением панкреатической или экстрапанкреатической продукции со сниженной скоростью клиренса [19].
Амилаза имеет молекулярную массу примерно от 50 до 55 кДа, оптимальный физиологический рН 6.от 7 до 7,0, и для оптимальной активности фермента требуются ионы кальция и хлорида. Небольшой размер позволяет легко фильтроваться через клубочки[3]. Амилаза выводится через почки и ретикулоэндотелиальную систему [1].
Амилаза выводится через почки и ретикулоэндотелиальную систему [1].
Диагностические тесты
В течение многих лет амилаза в основном использовалась для диагностики острого панкреатита. Амилазу можно измерить с помощью анализа крови или мочи. Анализ мочи может быть выполнен путем сбора чистой мочи или 24-часового сбора мочи. Нормальный диапазон сывороточной амилазы отличается от лаборатории к лаборатории [3].Клинически важно дифференцировать панкреатическую амилазу от других изоформ амилазы. Повышенный уровень амилазы при нормальной липазе может свидетельствовать о проблемах вне поджелудочной железы [20].
Влияющие факторы
Лекарства, включая аспирин, морфин, антиретровирусные препараты и эстрогенсодержащие препараты, могут влиять на уровень амилазы в сыворотке крови. Макроамилаземия, как упоминалось выше, является еще одной хорошо известной причиной повышения уровня амилазы в сыворотке крови. В этом состоянии фермент образует комплекс с белками, такими как иммуноглобулины и полисахариды [21]. Из-за большого размера макромолекулярного комплекса снижается почечный клиренс, что приводит к постоянному повышению уровня амилазы [22, 7]. Макроамилаземия может возникать у здоровых людей или при заболеваниях, включая аутоиммунные заболевания, диабет и рак, например рак щитовидной железы [23, 24].
Из-за большого размера макромолекулярного комплекса снижается почечный клиренс, что приводит к постоянному повышению уровня амилазы [22, 7]. Макроамилаземия может возникать у здоровых людей или при заболеваниях, включая аутоиммунные заболевания, диабет и рак, например рак щитовидной железы [23, 24].
Амилаза в моче обычно является нормальной макроамилаземией и может помочь исключить это состояние. Это состояние встречается у 1% здоровых людей и у 2,5% людей с гиперамилаземией. Макроамилаземию следует подозревать у бессимптомных пациентов с повышенным уровнем амилазы в сыворотке.Для этого состояния не требуется лечения[21]. Прошлые исследования показали, что о макроамилаземии в основном сообщалось у пациентов с нарушениями гуморального иммунитета, такими как глютеновая болезнь, ВИЧ-инфекция, язвенный колит, ревматоидный артрит и множественная миелома [25].
Результаты, отчетность, критические выводы
В настоящее время не существует установленного на международном уровне эталонного диапазона уровней амилазы. Референтный диапазон может достигать 20–300 ЕД/л. Однако повышенный уровень амилазы, более чем в три раза превышающий верхний предел нормы, убедительно подтверждает диагноз острого панкреатита.Меньше этого часто связано с другими состояниями[26]. Аномально низкий уровень амилазы встречается нечасто, но может наблюдаться при муковисцидозе, хроническом панкреатите, сахарном диабете, ожирении и курении [8][27]. Клиницисты должны знать о таких причинах, чтобы помочь интерпретировать низкую активность амилазы у пациентов [8].
Референтный диапазон может достигать 20–300 ЕД/л. Однако повышенный уровень амилазы, более чем в три раза превышающий верхний предел нормы, убедительно подтверждает диагноз острого панкреатита.Меньше этого часто связано с другими состояниями[26]. Аномально низкий уровень амилазы встречается нечасто, но может наблюдаться при муковисцидозе, хроническом панкреатите, сахарном диабете, ожирении и курении [8][27]. Клиницисты должны знать о таких причинах, чтобы помочь интерпретировать низкую активность амилазы у пациентов [8].
Клиническое значение
Амилаза в основном используется для диагностики заболеваний поджелудочной железы. Амилаза является обычно измеряемым ферментом из-за наличия недорогих, легко автоматизируемых методов [18].Хотя амилаза является чувствительным индикатором острого панкреатита, она неспецифична, так как может быть повышена при некоторых состояниях, не связанных с поджелудочной железой. Панкреатит может быть определен по двум из трех следующих критериев: боль в животе, уровни сывороточной амилазы и/или липазы более чем в три раза превышают верхний предел нормы, а визуализация брюшной полости подтверждает характерные признаки панкреатита [28]. Таким образом, его клиническое значение было поставлено под сомнение. В случаях повышенного уровня амилазы при незначительной поддержке панкреатита следует рассмотреть альтернативные причины гиперамилаземии [20].Амилаза бесполезна для прогнозирования тяжести острого приступа поджелудочной железы или мониторинга состояния [29].
Таким образом, его клиническое значение было поставлено под сомнение. В случаях повышенного уровня амилазы при незначительной поддержке панкреатита следует рассмотреть альтернативные причины гиперамилаземии [20].Амилаза бесполезна для прогнозирования тяжести острого приступа поджелудочной железы или мониторинга состояния [29].
Ингибиторы амилазы, такие как акарбоза, использовались при лечении диабета 2 типа, и было показано, что они снижают уровень гемоглобина A1C и пик постпрандиальной глюкозы [30]. Также было показано, что акарбоза улучшает ремиссию демпинг-синдрома у бариатрических пациентов [31]. Также было показано, что препарат снижает риск сердечно-сосудистых заболеваний, замедляя утолщение сонных артерий [32].Повышенный уровень амилазы можно наблюдать при самых разных состояниях. Для клиницистов важно иметь четкий поэтапный подход при обнаружении гиперамилаземии. Это поможет избежать ненужной госпитализации и отложенного или неадекватного лечения[22][7].
Улучшение результатов работы медицинских бригад
Медицинские работники должны эффективно общаться, когда результаты лабораторных исследований указывают на непанкреатическую причину. Также важно знать различные условия, которые могут повлиять на уровень амилазы [18].Липаза обычно предпочтительнее амилазы из-за более высокой специфичности. Липаза обычно остается повышенной до двух недель, тогда как концентрация амилазы остается повышенной до пяти дней. Следовательно, амилаза не так полезна в клиническом отношении, как липаза, если существует задержка между появлением симптомов и временем обращения пациента за медицинской помощью [26, 29]. Американский колледж гастроэнтерологии 2013 года отмечает, что совместный заказ липазы и амилазы не является ни экономически эффективным, ни выгодным для лечения. В нем также говорится, что назначение только амилазы ненадежно и не повышает диагностическую эффективность по сравнению с липазой [33].Если есть доступ к тесту на липазу, добавление амилазы увеличивает стоимость для пациента и не имеет большого значения для подтверждения диагноза панкреатита [34, 26].
Также важно знать различные условия, которые могут повлиять на уровень амилазы [18].Липаза обычно предпочтительнее амилазы из-за более высокой специфичности. Липаза обычно остается повышенной до двух недель, тогда как концентрация амилазы остается повышенной до пяти дней. Следовательно, амилаза не так полезна в клиническом отношении, как липаза, если существует задержка между появлением симптомов и временем обращения пациента за медицинской помощью [26, 29]. Американский колледж гастроэнтерологии 2013 года отмечает, что совместный заказ липазы и амилазы не является ни экономически эффективным, ни выгодным для лечения. В нем также говорится, что назначение только амилазы ненадежно и не повышает диагностическую эффективность по сравнению с липазой [33].Если есть доступ к тесту на липазу, добавление амилазы увеличивает стоимость для пациента и не имеет большого значения для подтверждения диагноза панкреатита [34, 26].
Рисунок
Состояния, связанные с высоким уровнем амилазы в сыворотке. Предоставлено Ololade Akinfemiwa
Предоставлено Ololade Akinfemiwa
Ссылки
- 1.
- Pieper-Bigelow C, Strocchi A, Levitt MD. Откуда берется сывороточная амилаза и куда она уходит? Гастроэнтерол Клин Норт Ам. 1990 декабрь; 19 (4): 793-810. [PubMed: 1702756]
- 2.
- Zakowski JJ, Bruns DE. Биохимия изоферментов альфа-амилазы человека. Crit Rev Clin Lab Sci. 1985;21(4):283-322. [PubMed: 2578342]
- 3.
- Аззопарди Э., Ллойд С., Тейшейра С.Р., Конлан Р.С., Уитакер И.С. Клиническое применение амилазы: новые перспективы. Операция. 2016 июль; 160 (1): 26-37. [PubMed: 27117578]
- 4.
- Corlette MB, Dratch M, Sorger K. Повышение уровня амилазы, связанное с новообразованием яичников. Гастроэнтерология. 1978 г., май; 74 (5, часть 1): 907-9. [PubMed: 640346]
- 5.
- Хаякава Т., Камея А., Мидзуно Р., Нода А., Кондо Т., Хирабаяши Н. Гиперамилаземия с папиллярно-серозной цистаденокарциномой яичника. Рак. 1984 15 октября; 54 (8): 1662-5. [PubMed: 6206939]
- 6.

- Катаяма С., Икеучи М., Канадзава Ю., Аканума Ю., Косака К., Такеучи Т., Накаяма Т. Амилазопродуцирующий рак легких: клинический случай и обзор литературы. Рак. 1981 01 декабря; 48 (11): 2499-502. [PubMed: 6170423]
- 7.
- Сривастава Р., Фрейзер С., Джентльмен Д., Джеймисон Л.А., Мерфи М.Дж.Гиперамилаземия: не обычные подозрения. БМЖ. 2005 г., 15 октября; 331 (7521): 890-1. [Статья бесплатно PMC: PMC1255801] [PubMed: 16223823]
- 8.
- Terui K, Hishiki T, Saito T, Mitsunaga T, Nakata M, Yoshida H. Отношение амилазы в моче к креатинину в моче (uAm/uCr) – a менее инвазивный параметр для лечения гиперамилаземии. БМС Педиатр. 2013 13 декабря; 13:205. [Бесплатная статья PMC: PMC3878803] [PubMed: 24330759]
- 9.
- Nitsche CJ, Jamieson N, Lerch MM, Mayerle JV. Медикаментозный панкреатит.Best Pract Res Clin Gastroenterol. 2010 апр; 24(2):143-55. [PubMed: 20227028]
- 10.
- Andersen V, Sonne J, Andersen M. Спонтанные отчеты о медикаментозном панкреатите в Дании с 1968 по 1999 год.
 Eur J Clin Pharmacol. 2001 сен; 57 (6-7): 517-21. [PubMed: 11699619]
Eur J Clin Pharmacol. 2001 сен; 57 (6-7): 517-21. [PubMed: 11699619] - 11.
- Мунирадж Т., Данг С., Питчумони С.С. ПАНКРЕАТИТ ИЛИ НЕТ? — Повышенный уровень липазы и амилазы у пациентов в ОИТ. J Крит Уход. 2015 г.; 30 (6): 1370-5. [PubMed: 26411523]
- 12.
- Rosell-Camps A, Martinez-Cepas P, Riera-Llodra JM, Ventura-Espejo L, Riutord-Arrom N.Доброкачественная панкреатическая гиперферментемия, также известная как синдром Гулло. Лаборатория мед. 2020 08 июля; 51 (4): 423-425. [PubMed: 31860089]
- 13.
- Chase CW, Barker DE, Russell WL, Burns RP. Амилаза и липаза сыворотки в оценке острой боли в животе. Am Surg. 1996 декабрь; 62 (12): 1028-33. [PubMed: 8955242]
- 14.
- Pezzilli R, Andreone P, Morselli-Labate AM, Sama C, Billi P, Cursaro C, Barakat B, Gramenzi A, Fiocchi M, Miglio F, Bernardi M. Концентрация ферментов поджелудочной железы в сыворотке при хронических вирусных заболеваниях печени.Dig Dis Sci. 1999 г., февраль; 44(2):350-5.
 [PubMed: 10063922]
[PubMed: 10063922] - 15.
- Ризви А.А. Сывороточная амилаза и липаза при диабетическом кетоацидозе. Уход за диабетом. 2003 ноябрь; 26 (11): 3193-4. [PubMed: 14578269]
- 16.
- Lenler-Petersen P, Grove A, Brock A, Jelnes R. Альфа-амилаза при операбельном раке легкого. Eur Respir J. 1994 May;7(5):941-5. [PubMed: 8050552]
- 17.
- Линдберг Т., Скуде Г. Амилаза в грудном молоке. Педиатрия. 1982 г., август; 70 (2): 235-8. [PubMed: 6179037]
- 18.
- Logie JJ, Cox M, Sharkey J, Williams A. Междисциплинарный подход к необычной причине гиперамилаземии. BMJ Case Rep. 2015 Jul 06; 2015 [бесплатная статья PMC: PMC4493173] [PubMed: 26150631]
- 19.
- Peyrot des Gachons C, Breslin PA. Слюнная амилаза: пищеварительный и метаболический синдром. Представитель Curr Diab, 16 октября 2016 г. (10): 102. [Статья PMC бесплатно: PMC6825871] [PubMed: 27640169]
- 20.
- Оцуки М. [Полезность определения изофермента амилазы для диагностики заболеваний поджелудочной железы].
 Нихон Ринсё. 1995 г., май; 53(5):1184-91. [PubMed: 7541479]
Нихон Ринсё. 1995 г., май; 53(5):1184-91. [PubMed: 7541479] - 21.
- Клонофф, округ Колумбия. Макроамилаземия и другие ферментативные расстройства иммуноглобулинового комплекса. Уэст Дж. Мед. 1980 ноябрь; 133(5):392-407. [Бесплатная статья PMC: PMC1272350] [PubMed: 6162278]
- 22.
- Wiederkehr JC, Wiederkehr BA, Wiederkehr HA, Carvalho CA. Неспецифическая гиперамилаземия: клинический случай. JOP. 2013 10 января; 14 (1): 74-6. [PubMed: 23306339]
- 23.
- Кутоло М., Солли А., Бароне А., Пиччиотто А., Мангравити С., Сериоло Б., Аккардо С.Макроамилаземия: возможная причина необъяснимой гиперамилаземии при ревматоидном артрите. Br J Ревматол. 1995 март; 34(3):290-2. [PubMed: 7537158]
- 24.
- Ishizuka T, Yasuda K, Kajita K, Sakata S, Kimura M, Ito Y, Miura K. Макроамилаземия, связанная с раком щитовидной железы, повышением уровня тироксинсвязывающего глобулина (ТСГ) в сыворотке крови, хроническим панкреатитом и полипоз желудочно-кишечного тракта.
 Гастроэнтерол Jpn. 1986 авг; 21 (4): 385-90. [PubMed: 2429888]
Гастроэнтерол Jpn. 1986 авг; 21 (4): 385-90. [PubMed: 2429888] - 25.
- Чо С.И., Ли А., Ли Х.Дж., Сух Дж.Т.Перекрывающееся присутствие макроамилаземии и гиперамилаземии при остром панкреатите. Корейская J Lab Med. 2011 Апрель; 31 (2): 98-100. [Бесплатная статья PMC: PMC3116008] [PubMed: 21474984]
- 26.
- Rompianesi G, Hann A, Komolafe O, Pereira SP, Davidson BR, Gurusamy KS. Амилаза и липаза сыворотки и трипсиноген и амилаза мочи для диагностики острого панкреатита. Cochrane Database Syst Rev. 2017 Apr 21;4:CD012010. [Бесплатная статья PMC: PMC6478262] [PubMed: 28431198]
- 27.
- Oh HC, Kwon CI, El Hajj II, Easler JJ, Watkins J, Fogel EL, McHenry L, Sherman S, Zimmerman MK, Lehman GA.Низкие значения панкреатической амилазы и липазы в сыворотке являются простыми и полезными предикторами для диагностики хронического панкреатита. Кишечник Печень. 2017 15 ноября; 11 (6): 878-883. [Бесплатная статья PMC: PMC5669605] [PubMed: 212]
- 28.

- Мунирадж Т., Гаджендран М., Тирувенгадам С., Рагурам К., Рао С., Деварадж П. Острый панкреатит. Дис пн. 2012 март; 58(3):98-144. [PubMed: 22370054]
- 29.
- Basnayake C, Ratnam D. Анализы крови на острый панкреатит. Aust Prescr. 2015 авг; 38 (4): 128-30. [Бесплатная статья PMC: PMC4653980] [PubMed: 26648641]
- 30.
- Макиннес Н., Смит А., Отто Р., Вандерми Дж., Пунтаки З., Шерифали Д., Баласубраманян К., Холл С., Герштейн Х.К. Пилотирование стратегии ремиссии при диабете 2 типа: результаты рандомизированного контролируемого исследования. J Clin Endocrinol Metab. 2017 01 мая; 102 (5): 1596-1605. [PubMed: 28324049]
- 31.
- Cadegiani FA, Silva OS. Акарбоза способствует ремиссии как раннего, так и позднего демпинг-синдрома у постбариатрических пациентов. Диабет метаболический синдром ожирение. 2016;9:443-446. [Бесплатная статья PMC: PMC5153290] [PubMed: 27994477]
- 32.
- Ямагиши С., Мацуи Т., Уэда С., Фуками К., Окуда С.
 Клиническая польза акарбозы, ингибитора альфа-глюкозидазы при кардиометаболических расстройствах. Curr Drug Metab. 2009 Февраль; 10 (2): 159-63. [PubMed: 19275550]
Клиническая польза акарбозы, ингибитора альфа-глюкозидазы при кардиометаболических расстройствах. Curr Drug Metab. 2009 Февраль; 10 (2): 159-63. [PubMed: 19275550] - 33.
- Barbieri JS, Riggio JM, Jaffe R. Тестирование амилазы на боль в животе и подозрение на острый панкреатит. Дж Хосп Мед. 2016 май; 11(5):366-8. [PubMed: 27160507]
- 34.
- Beauregard JM, Lyon JA, Slovis C. Использование литературы для оценки диагностических тестов: амилаза или липаза для диагностики острого панкреатита? J Med Libr Assoc.2007 г., апрель; 95 (2): 121-6. [Статья бесплатно PMC: PMC1852619] [PubMed: 17443244]
Амилаза — StatPearls — NCBI Bookshelf
Введение
Амилаза представляет собой пищеварительный фермент, преимущественно секретируемый поджелудочной железой и слюнными железами и обнаруживаемый в других тканях в очень малых количествах[1 ]. Амилаза была впервые описана в начале 1800-х годов и считается одним из первых ферментов в истории, подвергшихся научному исследованию. Первоначально он назывался диастаст , но позже в начале 20 века был переименован в амилазу[2].
Первоначально он назывался диастаст , но позже в начале 20 века был переименован в амилазу[2].
Основная функция амилаз заключается в гидролизе гликозидных связей в молекулах крахмала, превращении сложных углеводов в простые сахара. Существует три основных класса ферментов амилазы; Альфа-, бета- и гамма-амилазы действуют на разные части углеводной молекулы. Альфа-амилазу можно найти у людей, животных, растений и микробов. Бета-амилаза содержится в микробах и растениях. Гамма-амилаза обнаружена у животных и растений. Эта статья будет посвящена альфа-амилазе и ее применению [3].
В 1908 году исследование Вольгемута выявило наличие амилазы в моче, что впоследствии привело к использованию амилазы в качестве диагностического лабораторного теста. Анализ на амилазу обычно назначают вместе с липазой, особенно при подозрении на острый панкреатит [2].
Этиология и эпидемиология
Хотя повышенный уровень амилазы или гиперамилаземия в первую очередь наблюдается при заболеваниях слюнных желез и поджелудочной железы, они также могут наблюдаться при различных заболеваниях, включая желудочно-кишечные заболевания, злокачественные новообразования и гинекологические заболевания (см. таблицу ниже).Снижение уровня амилазы наблюдается при преэклампсии, муковисцидозе и заболеваниях печени [4, 5, 6, 1, 7, 8, 9, 10, 11].
таблицу ниже).Снижение уровня амилазы наблюдается при преэклампсии, муковисцидозе и заболеваниях печени [4, 5, 6, 1, 7, 8, 9, 10, 11].
Повышенный уровень амилазы можно наблюдать при различных состояниях, включая заболевания поджелудочной железы, заболевания слюнных желез, снижение метаболического клиренса, заболевания кишечника и макроамилаземию (обсуждается ниже). Хроническое повышение уровня амилазы также может наблюдаться при редком состоянии, называемом доброкачественной гиперэнзимемией поджелудочной железы или синдромом Гулло. Пациенты обычно здоровы, у них нет заболеваний поджелудочной железы.Этиология состояния неизвестна [3][12]. У 26 (12,5%) из 208 пациентов с острой болью в животе, не связанной с поджелудочной железой, при поступлении был повышен уровень амилазы в сыворотке крови[13]. Аномально повышенный уровень амилазы наблюдается у 35% пациентов с заболеваниями печени [14]. 16–25% случаев диабетического кетоацидоза проявляются повышенным уровнем амилазы [15][11]. В группе из 74 пациентов с операбельным раком легкого у 13 была выявлена гиперамилаземия [16].
Патофизиология
Основной функцией амилазы является катализация гидролиза крахмала в сахара.Было обнаружено несколько изоформ амилазы, но наиболее распространенными из них являются амилаза поджелудочной железы (P-амилаза) и амилаза слюны (S-амилаза). тракт. S-амилаза в основном вырабатывается в слюнных железах, но также может вырабатываться в яичниках, фаллопиевых трубах, желудочно-кишечном тракте, легких, поперечно-полосатых мышцах и злокачественных новообразованиях [17, 18]. Амилаза сыворотки жестко регулируется в организме.Существует баланс между скоростью производства и скоростью очистки. Повышенный уровень амилазы может быть связан с увеличением панкреатической или экстрапанкреатической продукции со сниженной скоростью клиренса [19].
Амилаза имеет молекулярную массу от 50 до 55 кДа, оптимальный физиологический рН от 6,7 до 7,0, и для оптимальной ферментативной активности требуются ионы кальция и хлорида. Небольшой размер позволяет легко фильтроваться через клубочки[3]. Амилаза выводится через почки и ретикулоэндотелиальную систему [1].
Амилаза выводится через почки и ретикулоэндотелиальную систему [1].
Диагностические тесты
В течение многих лет амилаза в основном использовалась для диагностики острого панкреатита. Амилазу можно измерить с помощью анализа крови или мочи. Анализ мочи может быть выполнен путем сбора чистой мочи или 24-часового сбора мочи. Нормальный диапазон сывороточной амилазы отличается от лаборатории к лаборатории [3]. Клинически важно дифференцировать панкреатическую амилазу от других изоформ амилазы. Повышенный уровень амилазы при нормальной липазе может свидетельствовать о проблемах вне поджелудочной железы [20].
Влияющие факторы
Лекарства, включая аспирин, морфин, антиретровирусные препараты и эстрогенсодержащие препараты, могут влиять на уровень амилазы в сыворотке крови. Макроамилаземия, как упоминалось выше, является еще одной хорошо известной причиной повышения уровня амилазы в сыворотке крови. В этом состоянии фермент образует комплекс с белками, такими как иммуноглобулины и полисахариды [21].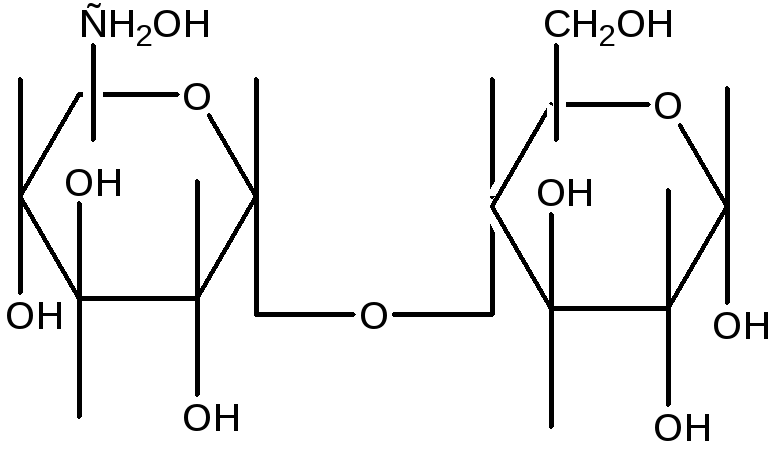 Из-за большого размера макромолекулярного комплекса снижается почечный клиренс, что приводит к постоянному повышению уровня амилазы [22, 7].Макроамилаземия может возникать у здоровых людей или при заболеваниях, включая аутоиммунные заболевания, диабет и рак, например рак щитовидной железы [23, 24].
Из-за большого размера макромолекулярного комплекса снижается почечный клиренс, что приводит к постоянному повышению уровня амилазы [22, 7].Макроамилаземия может возникать у здоровых людей или при заболеваниях, включая аутоиммунные заболевания, диабет и рак, например рак щитовидной железы [23, 24].
Амилаза в моче обычно является нормальной макроамилаземией и может помочь исключить это состояние. Это состояние встречается у 1% здоровых людей и у 2,5% людей с гиперамилаземией. Макроамилаземию следует подозревать у бессимптомных пациентов с повышенным уровнем амилазы в сыворотке. Для этого состояния не требуется лечения[21].Прошлые исследования показали, что о макроамилаземии в основном сообщалось у пациентов с нарушениями гуморального иммунитета, такими как глютеновая болезнь, ВИЧ-инфекция, язвенный колит, ревматоидный артрит и множественная миелома [25].
Результаты, отчетность, критические выводы
В настоящее время не существует установленного на международном уровне эталонного диапазона уровней амилазы. Референтный диапазон может достигать 20–300 ЕД/л. Однако повышенный уровень амилазы, более чем в три раза превышающий верхний предел нормы, убедительно подтверждает диагноз острого панкреатита.Меньше этого часто связано с другими состояниями[26]. Аномально низкий уровень амилазы встречается нечасто, но может наблюдаться при муковисцидозе, хроническом панкреатите, сахарном диабете, ожирении и курении [8][27]. Клиницисты должны знать о таких причинах, чтобы помочь интерпретировать низкую активность амилазы у пациентов [8].
Референтный диапазон может достигать 20–300 ЕД/л. Однако повышенный уровень амилазы, более чем в три раза превышающий верхний предел нормы, убедительно подтверждает диагноз острого панкреатита.Меньше этого часто связано с другими состояниями[26]. Аномально низкий уровень амилазы встречается нечасто, но может наблюдаться при муковисцидозе, хроническом панкреатите, сахарном диабете, ожирении и курении [8][27]. Клиницисты должны знать о таких причинах, чтобы помочь интерпретировать низкую активность амилазы у пациентов [8].
Клиническое значение
Амилаза в основном используется для диагностики заболеваний поджелудочной железы. Амилаза является обычно измеряемым ферментом из-за наличия недорогих, легко автоматизируемых методов [18].Хотя амилаза является чувствительным индикатором острого панкреатита, она неспецифична, так как может быть повышена при некоторых состояниях, не связанных с поджелудочной железой. Панкреатит может быть определен по двум из трех следующих критериев: боль в животе, уровни сывороточной амилазы и/или липазы более чем в три раза превышают верхний предел нормы, а визуализация брюшной полости подтверждает характерные признаки панкреатита [28].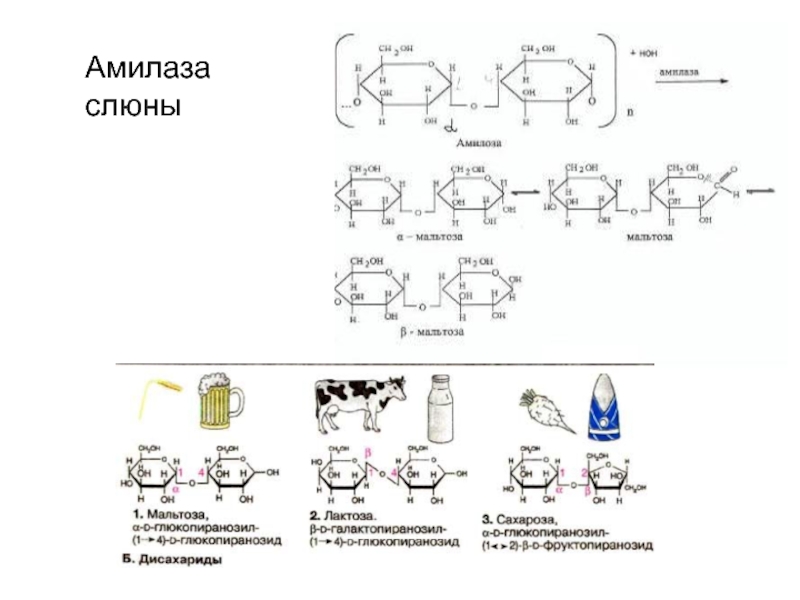 Таким образом, его клиническое значение было поставлено под сомнение. В случаях повышенного уровня амилазы при незначительной поддержке панкреатита следует рассмотреть альтернативные причины гиперамилаземии [20].Амилаза бесполезна для прогнозирования тяжести острого приступа поджелудочной железы или мониторинга состояния [29].
Таким образом, его клиническое значение было поставлено под сомнение. В случаях повышенного уровня амилазы при незначительной поддержке панкреатита следует рассмотреть альтернативные причины гиперамилаземии [20].Амилаза бесполезна для прогнозирования тяжести острого приступа поджелудочной железы или мониторинга состояния [29].
Ингибиторы амилазы, такие как акарбоза, использовались при лечении диабета 2 типа, и было показано, что они снижают уровень гемоглобина A1C и пик постпрандиальной глюкозы [30]. Также было показано, что акарбоза улучшает ремиссию демпинг-синдрома у бариатрических пациентов [31]. Также было показано, что препарат снижает риск сердечно-сосудистых заболеваний, замедляя утолщение сонных артерий [32].Повышенный уровень амилазы можно наблюдать при самых разных состояниях. Для клиницистов важно иметь четкий поэтапный подход при обнаружении гиперамилаземии. Это поможет избежать ненужной госпитализации и отложенного или неадекватного лечения[22][7].
Улучшение результатов работы медицинских бригад
Медицинские работники должны эффективно общаться, когда результаты лабораторных исследований указывают на непанкреатическую причину. Также важно знать различные условия, которые могут повлиять на уровень амилазы [18].Липаза обычно предпочтительнее амилазы из-за более высокой специфичности. Липаза обычно остается повышенной до двух недель, тогда как концентрация амилазы остается повышенной до пяти дней. Следовательно, амилаза не так полезна в клиническом отношении, как липаза, если существует задержка между появлением симптомов и временем обращения пациента за медицинской помощью [26, 29]. Американский колледж гастроэнтерологии 2013 года отмечает, что совместный заказ липазы и амилазы не является ни экономически эффективным, ни выгодным для лечения. В нем также говорится, что назначение только амилазы ненадежно и не повышает диагностическую эффективность по сравнению с липазой [33].Если есть доступ к тесту на липазу, добавление амилазы увеличивает стоимость для пациента и не имеет большого значения для подтверждения диагноза панкреатита [34, 26].
Также важно знать различные условия, которые могут повлиять на уровень амилазы [18].Липаза обычно предпочтительнее амилазы из-за более высокой специфичности. Липаза обычно остается повышенной до двух недель, тогда как концентрация амилазы остается повышенной до пяти дней. Следовательно, амилаза не так полезна в клиническом отношении, как липаза, если существует задержка между появлением симптомов и временем обращения пациента за медицинской помощью [26, 29]. Американский колледж гастроэнтерологии 2013 года отмечает, что совместный заказ липазы и амилазы не является ни экономически эффективным, ни выгодным для лечения. В нем также говорится, что назначение только амилазы ненадежно и не повышает диагностическую эффективность по сравнению с липазой [33].Если есть доступ к тесту на липазу, добавление амилазы увеличивает стоимость для пациента и не имеет большого значения для подтверждения диагноза панкреатита [34, 26].
Рисунок
Состояния, связанные с высоким уровнем амилазы в сыворотке. Предоставлено Ololade Akinfemiwa
Предоставлено Ololade Akinfemiwa
Ссылки
- 1.
- Pieper-Bigelow C, Strocchi A, Levitt MD. Откуда берется сывороточная амилаза и куда она уходит? Гастроэнтерол Клин Норт Ам. 1990 декабрь; 19 (4): 793-810. [PubMed: 1702756]
- 2.
- Zakowski JJ, Bruns DE. Биохимия изоферментов альфа-амилазы человека. Crit Rev Clin Lab Sci. 1985;21(4):283-322. [PubMed: 2578342]
- 3.
- Аззопарди Э., Ллойд С., Тейшейра С.Р., Конлан Р.С., Уитакер И.С. Клиническое применение амилазы: новые перспективы. Операция. 2016 июль; 160 (1): 26-37. [PubMed: 27117578]
- 4.
- Corlette MB, Dratch M, Sorger K. Повышение уровня амилазы, связанное с новообразованием яичников. Гастроэнтерология. 1978 г., май; 74 (5, часть 1): 907-9. [PubMed: 640346]
- 5.
- Хаякава Т., Камея А., Мидзуно Р., Нода А., Кондо Т., Хирабаяши Н. Гиперамилаземия с папиллярно-серозной цистаденокарциномой яичника. Рак. 1984 15 октября; 54 (8): 1662-5. [PubMed: 6206939]
- 6.

- Катаяма С., Икеучи М., Канадзава Ю., Аканума Ю., Косака К., Такеучи Т., Накаяма Т. Амилазопродуцирующий рак легких: клинический случай и обзор литературы. Рак. 1981 01 декабря; 48 (11): 2499-502. [PubMed: 6170423]
- 7.
- Сривастава Р., Фрейзер С., Джентльмен Д., Джеймисон Л.А., Мерфи М.Дж.Гиперамилаземия: не обычные подозрения. БМЖ. 2005 г., 15 октября; 331 (7521): 890-1. [Статья бесплатно PMC: PMC1255801] [PubMed: 16223823]
- 8.
- Terui K, Hishiki T, Saito T, Mitsunaga T, Nakata M, Yoshida H. Отношение амилазы в моче к креатинину в моче (uAm/uCr) – a менее инвазивный параметр для лечения гиперамилаземии. БМС Педиатр. 2013 13 декабря; 13:205. [Бесплатная статья PMC: PMC3878803] [PubMed: 24330759]
- 9.
- Nitsche CJ, Jamieson N, Lerch MM, Mayerle JV. Медикаментозный панкреатит.Best Pract Res Clin Gastroenterol. 2010 апр; 24(2):143-55. [PubMed: 20227028]
- 10.
- Andersen V, Sonne J, Andersen M. Спонтанные отчеты о медикаментозном панкреатите в Дании с 1968 по 1999 год.
 Eur J Clin Pharmacol. 2001 сен; 57 (6-7): 517-21. [PubMed: 11699619]
Eur J Clin Pharmacol. 2001 сен; 57 (6-7): 517-21. [PubMed: 11699619] - 11.
- Мунирадж Т., Данг С., Питчумони С.С. ПАНКРЕАТИТ ИЛИ НЕТ? — Повышенный уровень липазы и амилазы у пациентов в ОИТ. J Крит Уход. 2015 г.; 30 (6): 1370-5. [PubMed: 26411523]
- 12.
- Rosell-Camps A, Martinez-Cepas P, Riera-Llodra JM, Ventura-Espejo L, Riutord-Arrom N.Доброкачественная панкреатическая гиперферментемия, также известная как синдром Гулло. Лаборатория мед. 2020 08 июля; 51 (4): 423-425. [PubMed: 31860089]
- 13.
- Chase CW, Barker DE, Russell WL, Burns RP. Амилаза и липаза сыворотки в оценке острой боли в животе. Am Surg. 1996 декабрь; 62 (12): 1028-33. [PubMed: 8955242]
- 14.
- Pezzilli R, Andreone P, Morselli-Labate AM, Sama C, Billi P, Cursaro C, Barakat B, Gramenzi A, Fiocchi M, Miglio F, Bernardi M. Концентрация ферментов поджелудочной железы в сыворотке при хронических вирусных заболеваниях печени.Dig Dis Sci. 1999 г., февраль; 44(2):350-5.
 [PubMed: 10063922]
[PubMed: 10063922] - 15.
- Ризви А.А. Сывороточная амилаза и липаза при диабетическом кетоацидозе. Уход за диабетом. 2003 ноябрь; 26 (11): 3193-4. [PubMed: 14578269]
- 16.
- Lenler-Petersen P, Grove A, Brock A, Jelnes R. Альфа-амилаза при операбельном раке легкого. Eur Respir J. 1994 May;7(5):941-5. [PubMed: 8050552]
- 17.
- Линдберг Т., Скуде Г. Амилаза в грудном молоке. Педиатрия. 1982 г., август; 70 (2): 235-8. [PubMed: 6179037]
- 18.
- Logie JJ, Cox M, Sharkey J, Williams A. Междисциплинарный подход к необычной причине гиперамилаземии. BMJ Case Rep. 2015 Jul 06; 2015 [бесплатная статья PMC: PMC4493173] [PubMed: 26150631]
- 19.
- Peyrot des Gachons C, Breslin PA. Слюнная амилаза: пищеварительный и метаболический синдром. Представитель Curr Diab, 16 октября 2016 г. (10): 102. [Статья PMC бесплатно: PMC6825871] [PubMed: 27640169]
- 20.
- Оцуки М. [Полезность определения изофермента амилазы для диагностики заболеваний поджелудочной железы].
 Нихон Ринсё. 1995 г., май; 53(5):1184-91. [PubMed: 7541479]
Нихон Ринсё. 1995 г., май; 53(5):1184-91. [PubMed: 7541479] - 21.
- Клонофф, округ Колумбия. Макроамилаземия и другие ферментативные расстройства иммуноглобулинового комплекса. Уэст Дж. Мед. 1980 ноябрь; 133(5):392-407. [Бесплатная статья PMC: PMC1272350] [PubMed: 6162278]
- 22.
- Wiederkehr JC, Wiederkehr BA, Wiederkehr HA, Carvalho CA. Неспецифическая гиперамилаземия: клинический случай. JOP. 2013 10 января; 14 (1): 74-6. [PubMed: 23306339]
- 23.
- Кутоло М., Солли А., Бароне А., Пиччиотто А., Мангравити С., Сериоло Б., Аккардо С.Макроамилаземия: возможная причина необъяснимой гиперамилаземии при ревматоидном артрите. Br J Ревматол. 1995 март; 34(3):290-2. [PubMed: 7537158]
- 24.
- Ishizuka T, Yasuda K, Kajita K, Sakata S, Kimura M, Ito Y, Miura K. Макроамилаземия, связанная с раком щитовидной железы, повышением уровня тироксинсвязывающего глобулина (ТСГ) в сыворотке крови, хроническим панкреатитом и полипоз желудочно-кишечного тракта.
 Гастроэнтерол Jpn. 1986 авг; 21 (4): 385-90. [PubMed: 2429888]
Гастроэнтерол Jpn. 1986 авг; 21 (4): 385-90. [PubMed: 2429888] - 25.
- Чо С.И., Ли А., Ли Х.Дж., Сух Дж.Т.Перекрывающееся присутствие макроамилаземии и гиперамилаземии при остром панкреатите. Корейская J Lab Med. 2011 Апрель; 31 (2): 98-100. [Бесплатная статья PMC: PMC3116008] [PubMed: 21474984]
- 26.
- Rompianesi G, Hann A, Komolafe O, Pereira SP, Davidson BR, Gurusamy KS. Амилаза и липаза сыворотки и трипсиноген и амилаза мочи для диагностики острого панкреатита. Cochrane Database Syst Rev. 2017 Apr 21;4:CD012010. [Бесплатная статья PMC: PMC6478262] [PubMed: 28431198]
- 27.
- Oh HC, Kwon CI, El Hajj II, Easler JJ, Watkins J, Fogel EL, McHenry L, Sherman S, Zimmerman MK, Lehman GA.Низкие значения панкреатической амилазы и липазы в сыворотке являются простыми и полезными предикторами для диагностики хронического панкреатита. Кишечник Печень. 2017 15 ноября; 11 (6): 878-883. [Бесплатная статья PMC: PMC5669605] [PubMed: 212]
- 28.

- Мунирадж Т., Гаджендран М., Тирувенгадам С., Рагурам К., Рао С., Деварадж П. Острый панкреатит. Дис пн. 2012 март; 58(3):98-144. [PubMed: 22370054]
- 29.
- Basnayake C, Ratnam D. Анализы крови на острый панкреатит. Aust Prescr. 2015 авг; 38 (4): 128-30. [Бесплатная статья PMC: PMC4653980] [PubMed: 26648641]
- 30.
- Макиннес Н., Смит А., Отто Р., Вандерми Дж., Пунтаки З., Шерифали Д., Баласубраманян К., Холл С., Герштейн Х.К. Пилотирование стратегии ремиссии при диабете 2 типа: результаты рандомизированного контролируемого исследования. J Clin Endocrinol Metab. 2017 01 мая; 102 (5): 1596-1605. [PubMed: 28324049]
- 31.
- Cadegiani FA, Silva OS. Акарбоза способствует ремиссии как раннего, так и позднего демпинг-синдрома у постбариатрических пациентов. Диабет метаболический синдром ожирение. 2016;9:443-446. [Бесплатная статья PMC: PMC5153290] [PubMed: 27994477]
- 32.
- Ямагиши С., Мацуи Т., Уэда С., Фуками К., Окуда С.
 Клиническая польза акарбозы, ингибитора альфа-глюкозидазы при кардиометаболических расстройствах. Curr Drug Metab. 2009 Февраль; 10 (2): 159-63. [PubMed: 19275550]
Клиническая польза акарбозы, ингибитора альфа-глюкозидазы при кардиометаболических расстройствах. Curr Drug Metab. 2009 Февраль; 10 (2): 159-63. [PubMed: 19275550] - 33.
- Barbieri JS, Riggio JM, Jaffe R. Тестирование амилазы на боль в животе и подозрение на острый панкреатит. Дж Хосп Мед. 2016 май; 11(5):366-8. [PubMed: 27160507]
- 34.
- Beauregard JM, Lyon JA, Slovis C. Использование литературы для оценки диагностических тестов: амилаза или липаза для диагностики острого панкреатита? J Med Libr Assoc.2007 г., апрель; 95 (2): 121-6. [Статья бесплатно PMC: PMC1852619] [PubMed: 17443244]
Амилаза — StatPearls — NCBI Bookshelf
Введение
Амилаза представляет собой пищеварительный фермент, преимущественно секретируемый поджелудочной железой и слюнными железами и обнаруживаемый в других тканях в очень малых количествах[1 ]. Амилаза была впервые описана в начале 1800-х годов и считается одним из первых ферментов в истории, подвергшихся научному исследованию. Первоначально он назывался диастаст , но позже в начале 20 века был переименован в амилазу[2].
Первоначально он назывался диастаст , но позже в начале 20 века был переименован в амилазу[2].
Основная функция амилаз заключается в гидролизе гликозидных связей в молекулах крахмала, превращении сложных углеводов в простые сахара. Существует три основных класса ферментов амилазы; Альфа-, бета- и гамма-амилазы действуют на разные части углеводной молекулы. Альфа-амилазу можно найти у людей, животных, растений и микробов. Бета-амилаза содержится в микробах и растениях. Гамма-амилаза обнаружена у животных и растений. Эта статья будет посвящена альфа-амилазе и ее применению [3].
В 1908 году исследование Вольгемута выявило наличие амилазы в моче, что впоследствии привело к использованию амилазы в качестве диагностического лабораторного теста. Анализ на амилазу обычно назначают вместе с липазой, особенно при подозрении на острый панкреатит [2].
Этиология и эпидемиология
Хотя повышенный уровень амилазы или гиперамилаземия в первую очередь наблюдается при заболеваниях слюнных желез и поджелудочной железы, они также могут наблюдаться при различных заболеваниях, включая желудочно-кишечные заболевания, злокачественные новообразования и гинекологические заболевания (см. таблицу ниже).Снижение уровня амилазы наблюдается при преэклампсии, муковисцидозе и заболеваниях печени [4, 5, 6, 1, 7, 8, 9, 10, 11].
таблицу ниже).Снижение уровня амилазы наблюдается при преэклампсии, муковисцидозе и заболеваниях печени [4, 5, 6, 1, 7, 8, 9, 10, 11].
Повышенный уровень амилазы можно наблюдать при различных состояниях, включая заболевания поджелудочной железы, заболевания слюнных желез, снижение метаболического клиренса, заболевания кишечника и макроамилаземию (обсуждается ниже). Хроническое повышение уровня амилазы также может наблюдаться при редком состоянии, называемом доброкачественной гиперэнзимемией поджелудочной железы или синдромом Гулло. Пациенты обычно здоровы, у них нет заболеваний поджелудочной железы.Этиология состояния неизвестна [3][12]. У 26 (12,5%) из 208 пациентов с острой болью в животе, не связанной с поджелудочной железой, при поступлении был повышен уровень амилазы в сыворотке крови[13]. Аномально повышенный уровень амилазы наблюдается у 35% пациентов с заболеваниями печени [14]. 16–25% случаев диабетического кетоацидоза проявляются повышенным уровнем амилазы [15][11]. В группе из 74 пациентов с операбельным раком легкого у 13 была выявлена гиперамилаземия [16].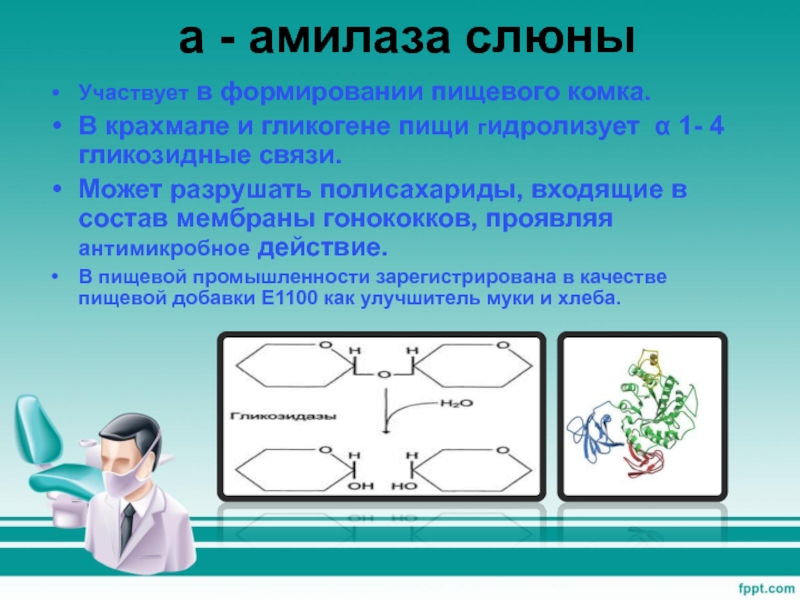
Патофизиология
Основной функцией амилазы является катализация гидролиза крахмала в сахара.Было обнаружено несколько изоформ амилазы, но наиболее распространенными из них являются амилаза поджелудочной железы (P-амилаза) и амилаза слюны (S-амилаза). тракт. S-амилаза в основном вырабатывается в слюнных железах, но также может вырабатываться в яичниках, фаллопиевых трубах, желудочно-кишечном тракте, легких, поперечно-полосатых мышцах и злокачественных новообразованиях [17, 18]. Амилаза сыворотки жестко регулируется в организме.Существует баланс между скоростью производства и скоростью очистки. Повышенный уровень амилазы может быть связан с увеличением панкреатической или экстрапанкреатической продукции со сниженной скоростью клиренса [19].
Амилаза имеет молекулярную массу от 50 до 55 кДа, оптимальный физиологический рН от 6,7 до 7,0, и для оптимальной ферментативной активности требуются ионы кальция и хлорида. Небольшой размер позволяет легко фильтроваться через клубочки[3]. Амилаза выводится через почки и ретикулоэндотелиальную систему [1].
Амилаза выводится через почки и ретикулоэндотелиальную систему [1].
Диагностические тесты
В течение многих лет амилаза в основном использовалась для диагностики острого панкреатита. Амилазу можно измерить с помощью анализа крови или мочи. Анализ мочи может быть выполнен путем сбора чистой мочи или 24-часового сбора мочи. Нормальный диапазон сывороточной амилазы отличается от лаборатории к лаборатории [3]. Клинически важно дифференцировать панкреатическую амилазу от других изоформ амилазы. Повышенный уровень амилазы при нормальной липазе может свидетельствовать о проблемах вне поджелудочной железы [20].
Влияющие факторы
Лекарства, включая аспирин, морфин, антиретровирусные препараты и эстрогенсодержащие препараты, могут влиять на уровень амилазы в сыворотке крови. Макроамилаземия, как упоминалось выше, является еще одной хорошо известной причиной повышения уровня амилазы в сыворотке крови. В этом состоянии фермент образует комплекс с белками, такими как иммуноглобулины и полисахариды [21]. Из-за большого размера макромолекулярного комплекса снижается почечный клиренс, что приводит к постоянному повышению уровня амилазы [22, 7].Макроамилаземия может возникать у здоровых людей или при заболеваниях, включая аутоиммунные заболевания, диабет и рак, например рак щитовидной железы [23, 24].
Из-за большого размера макромолекулярного комплекса снижается почечный клиренс, что приводит к постоянному повышению уровня амилазы [22, 7].Макроамилаземия может возникать у здоровых людей или при заболеваниях, включая аутоиммунные заболевания, диабет и рак, например рак щитовидной железы [23, 24].
Амилаза в моче обычно является нормальной макроамилаземией и может помочь исключить это состояние. Это состояние встречается у 1% здоровых людей и у 2,5% людей с гиперамилаземией. Макроамилаземию следует подозревать у бессимптомных пациентов с повышенным уровнем амилазы в сыворотке. Для этого состояния не требуется лечения[21].Прошлые исследования показали, что о макроамилаземии в основном сообщалось у пациентов с нарушениями гуморального иммунитета, такими как глютеновая болезнь, ВИЧ-инфекция, язвенный колит, ревматоидный артрит и множественная миелома [25].
Результаты, отчетность, критические выводы
В настоящее время не существует установленного на международном уровне эталонного диапазона уровней амилазы. Референтный диапазон может достигать 20–300 ЕД/л. Однако повышенный уровень амилазы, более чем в три раза превышающий верхний предел нормы, убедительно подтверждает диагноз острого панкреатита.Меньше этого часто связано с другими состояниями[26]. Аномально низкий уровень амилазы встречается нечасто, но может наблюдаться при муковисцидозе, хроническом панкреатите, сахарном диабете, ожирении и курении [8][27]. Клиницисты должны знать о таких причинах, чтобы помочь интерпретировать низкую активность амилазы у пациентов [8].
Референтный диапазон может достигать 20–300 ЕД/л. Однако повышенный уровень амилазы, более чем в три раза превышающий верхний предел нормы, убедительно подтверждает диагноз острого панкреатита.Меньше этого часто связано с другими состояниями[26]. Аномально низкий уровень амилазы встречается нечасто, но может наблюдаться при муковисцидозе, хроническом панкреатите, сахарном диабете, ожирении и курении [8][27]. Клиницисты должны знать о таких причинах, чтобы помочь интерпретировать низкую активность амилазы у пациентов [8].
Клиническое значение
Амилаза в основном используется для диагностики заболеваний поджелудочной железы. Амилаза является обычно измеряемым ферментом из-за наличия недорогих, легко автоматизируемых методов [18].Хотя амилаза является чувствительным индикатором острого панкреатита, она неспецифична, так как может быть повышена при некоторых состояниях, не связанных с поджелудочной железой. Панкреатит может быть определен по двум из трех следующих критериев: боль в животе, уровни сывороточной амилазы и/или липазы более чем в три раза превышают верхний предел нормы, а визуализация брюшной полости подтверждает характерные признаки панкреатита [28]. Таким образом, его клиническое значение было поставлено под сомнение. В случаях повышенного уровня амилазы при незначительной поддержке панкреатита следует рассмотреть альтернативные причины гиперамилаземии [20].Амилаза бесполезна для прогнозирования тяжести острого приступа поджелудочной железы или мониторинга состояния [29].
Таким образом, его клиническое значение было поставлено под сомнение. В случаях повышенного уровня амилазы при незначительной поддержке панкреатита следует рассмотреть альтернативные причины гиперамилаземии [20].Амилаза бесполезна для прогнозирования тяжести острого приступа поджелудочной железы или мониторинга состояния [29].
Ингибиторы амилазы, такие как акарбоза, использовались при лечении диабета 2 типа, и было показано, что они снижают уровень гемоглобина A1C и пик постпрандиальной глюкозы [30]. Также было показано, что акарбоза улучшает ремиссию демпинг-синдрома у бариатрических пациентов [31]. Также было показано, что препарат снижает риск сердечно-сосудистых заболеваний, замедляя утолщение сонных артерий [32].Повышенный уровень амилазы можно наблюдать при самых разных состояниях. Для клиницистов важно иметь четкий поэтапный подход при обнаружении гиперамилаземии. Это поможет избежать ненужной госпитализации и отложенного или неадекватного лечения[22][7].
Улучшение результатов работы медицинских бригад
Медицинские работники должны эффективно общаться, когда результаты лабораторных исследований указывают на непанкреатическую причину. Также важно знать различные условия, которые могут повлиять на уровень амилазы [18].Липаза обычно предпочтительнее амилазы из-за более высокой специфичности. Липаза обычно остается повышенной до двух недель, тогда как концентрация амилазы остается повышенной до пяти дней. Следовательно, амилаза не так полезна в клиническом отношении, как липаза, если существует задержка между появлением симптомов и временем обращения пациента за медицинской помощью [26, 29]. Американский колледж гастроэнтерологии 2013 года отмечает, что совместный заказ липазы и амилазы не является ни экономически эффективным, ни выгодным для лечения. В нем также говорится, что назначение только амилазы ненадежно и не повышает диагностическую эффективность по сравнению с липазой [33].Если есть доступ к тесту на липазу, добавление амилазы увеличивает стоимость для пациента и не имеет большого значения для подтверждения диагноза панкреатита [34, 26].
Также важно знать различные условия, которые могут повлиять на уровень амилазы [18].Липаза обычно предпочтительнее амилазы из-за более высокой специфичности. Липаза обычно остается повышенной до двух недель, тогда как концентрация амилазы остается повышенной до пяти дней. Следовательно, амилаза не так полезна в клиническом отношении, как липаза, если существует задержка между появлением симптомов и временем обращения пациента за медицинской помощью [26, 29]. Американский колледж гастроэнтерологии 2013 года отмечает, что совместный заказ липазы и амилазы не является ни экономически эффективным, ни выгодным для лечения. В нем также говорится, что назначение только амилазы ненадежно и не повышает диагностическую эффективность по сравнению с липазой [33].Если есть доступ к тесту на липазу, добавление амилазы увеличивает стоимость для пациента и не имеет большого значения для подтверждения диагноза панкреатита [34, 26].
Рисунок
Состояния, связанные с высоким уровнем амилазы в сыворотке.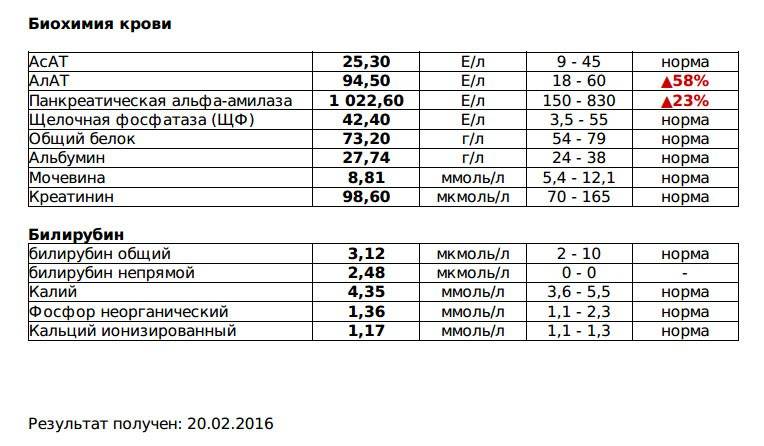 Предоставлено Ololade Akinfemiwa
Предоставлено Ololade Akinfemiwa
Ссылки
- 1.
- Pieper-Bigelow C, Strocchi A, Levitt MD. Откуда берется сывороточная амилаза и куда она уходит? Гастроэнтерол Клин Норт Ам. 1990 декабрь; 19 (4): 793-810. [PubMed: 1702756]
- 2.
- Zakowski JJ, Bruns DE. Биохимия изоферментов альфа-амилазы человека. Crit Rev Clin Lab Sci. 1985;21(4):283-322. [PubMed: 2578342]
- 3.
- Аззопарди Э., Ллойд С., Тейшейра С.Р., Конлан Р.С., Уитакер И.С. Клиническое применение амилазы: новые перспективы. Операция. 2016 июль; 160 (1): 26-37. [PubMed: 27117578]
- 4.
- Corlette MB, Dratch M, Sorger K. Повышение уровня амилазы, связанное с новообразованием яичников. Гастроэнтерология. 1978 г., май; 74 (5, часть 1): 907-9. [PubMed: 640346]
- 5.
- Хаякава Т., Камея А., Мидзуно Р., Нода А., Кондо Т., Хирабаяши Н. Гиперамилаземия с папиллярно-серозной цистаденокарциномой яичника. Рак. 1984 15 октября; 54 (8): 1662-5. [PubMed: 6206939]
- 6.

- Катаяма С., Икеучи М., Канадзава Ю., Аканума Ю., Косака К., Такеучи Т., Накаяма Т. Амилазопродуцирующий рак легких: клинический случай и обзор литературы. Рак. 1981 01 декабря; 48 (11): 2499-502. [PubMed: 6170423]
- 7.
- Сривастава Р., Фрейзер С., Джентльмен Д., Джеймисон Л.А., Мерфи М.Дж.Гиперамилаземия: не обычные подозрения. БМЖ. 2005 г., 15 октября; 331 (7521): 890-1. [Статья бесплатно PMC: PMC1255801] [PubMed: 16223823]
- 8.
- Terui K, Hishiki T, Saito T, Mitsunaga T, Nakata M, Yoshida H. Отношение амилазы в моче к креатинину в моче (uAm/uCr) – a менее инвазивный параметр для лечения гиперамилаземии. БМС Педиатр. 2013 13 декабря; 13:205. [Бесплатная статья PMC: PMC3878803] [PubMed: 24330759]
- 9.
- Nitsche CJ, Jamieson N, Lerch MM, Mayerle JV. Медикаментозный панкреатит.Best Pract Res Clin Gastroenterol. 2010 апр; 24(2):143-55. [PubMed: 20227028]
- 10.
- Andersen V, Sonne J, Andersen M. Спонтанные отчеты о медикаментозном панкреатите в Дании с 1968 по 1999 год.
 Eur J Clin Pharmacol. 2001 сен; 57 (6-7): 517-21. [PubMed: 11699619]
Eur J Clin Pharmacol. 2001 сен; 57 (6-7): 517-21. [PubMed: 11699619] - 11.
- Мунирадж Т., Данг С., Питчумони С.С. ПАНКРЕАТИТ ИЛИ НЕТ? — Повышенный уровень липазы и амилазы у пациентов в ОИТ. J Крит Уход. 2015 г.; 30 (6): 1370-5. [PubMed: 26411523]
- 12.
- Rosell-Camps A, Martinez-Cepas P, Riera-Llodra JM, Ventura-Espejo L, Riutord-Arrom N.Доброкачественная панкреатическая гиперферментемия, также известная как синдром Гулло. Лаборатория мед. 2020 08 июля; 51 (4): 423-425. [PubMed: 31860089]
- 13.
- Chase CW, Barker DE, Russell WL, Burns RP. Амилаза и липаза сыворотки в оценке острой боли в животе. Am Surg. 1996 декабрь; 62 (12): 1028-33. [PubMed: 8955242]
- 14.
- Pezzilli R, Andreone P, Morselli-Labate AM, Sama C, Billi P, Cursaro C, Barakat B, Gramenzi A, Fiocchi M, Miglio F, Bernardi M. Концентрация ферментов поджелудочной железы в сыворотке при хронических вирусных заболеваниях печени.Dig Dis Sci. 1999 г., февраль; 44(2):350-5.
 [PubMed: 10063922]
[PubMed: 10063922] - 15.
- Ризви А.А. Сывороточная амилаза и липаза при диабетическом кетоацидозе. Уход за диабетом. 2003 ноябрь; 26 (11): 3193-4. [PubMed: 14578269]
- 16.
- Lenler-Petersen P, Grove A, Brock A, Jelnes R. Альфа-амилаза при операбельном раке легкого. Eur Respir J. 1994 May;7(5):941-5. [PubMed: 8050552]
- 17.
- Линдберг Т., Скуде Г. Амилаза в грудном молоке. Педиатрия. 1982 г., август; 70 (2): 235-8. [PubMed: 6179037]
- 18.
- Logie JJ, Cox M, Sharkey J, Williams A. Междисциплинарный подход к необычной причине гиперамилаземии. BMJ Case Rep. 2015 Jul 06; 2015 [бесплатная статья PMC: PMC4493173] [PubMed: 26150631]
- 19.
- Peyrot des Gachons C, Breslin PA. Слюнная амилаза: пищеварительный и метаболический синдром. Представитель Curr Diab, 16 октября 2016 г. (10): 102. [Статья PMC бесплатно: PMC6825871] [PubMed: 27640169]
- 20.
- Оцуки М. [Полезность определения изофермента амилазы для диагностики заболеваний поджелудочной железы].
 Нихон Ринсё. 1995 г., май; 53(5):1184-91. [PubMed: 7541479]
Нихон Ринсё. 1995 г., май; 53(5):1184-91. [PubMed: 7541479] - 21.
- Клонофф, округ Колумбия. Макроамилаземия и другие ферментативные расстройства иммуноглобулинового комплекса. Уэст Дж. Мед. 1980 ноябрь; 133(5):392-407. [Бесплатная статья PMC: PMC1272350] [PubMed: 6162278]
- 22.
- Wiederkehr JC, Wiederkehr BA, Wiederkehr HA, Carvalho CA. Неспецифическая гиперамилаземия: клинический случай. JOP. 2013 10 января; 14 (1): 74-6. [PubMed: 23306339]
- 23.
- Кутоло М., Солли А., Бароне А., Пиччиотто А., Мангравити С., Сериоло Б., Аккардо С.Макроамилаземия: возможная причина необъяснимой гиперамилаземии при ревматоидном артрите. Br J Ревматол. 1995 март; 34(3):290-2. [PubMed: 7537158]
- 24.
- Ishizuka T, Yasuda K, Kajita K, Sakata S, Kimura M, Ito Y, Miura K. Макроамилаземия, связанная с раком щитовидной железы, повышением уровня тироксинсвязывающего глобулина (ТСГ) в сыворотке крови, хроническим панкреатитом и полипоз желудочно-кишечного тракта.
 Гастроэнтерол Jpn. 1986 авг; 21 (4): 385-90. [PubMed: 2429888]
Гастроэнтерол Jpn. 1986 авг; 21 (4): 385-90. [PubMed: 2429888] - 25.
- Чо С.И., Ли А., Ли Х.Дж., Сух Дж.Т.Перекрывающееся присутствие макроамилаземии и гиперамилаземии при остром панкреатите. Корейская J Lab Med. 2011 Апрель; 31 (2): 98-100. [Бесплатная статья PMC: PMC3116008] [PubMed: 21474984]
- 26.
- Rompianesi G, Hann A, Komolafe O, Pereira SP, Davidson BR, Gurusamy KS. Амилаза и липаза сыворотки и трипсиноген и амилаза мочи для диагностики острого панкреатита. Cochrane Database Syst Rev. 2017 Apr 21;4:CD012010. [Бесплатная статья PMC: PMC6478262] [PubMed: 28431198]
- 27.
- Oh HC, Kwon CI, El Hajj II, Easler JJ, Watkins J, Fogel EL, McHenry L, Sherman S, Zimmerman MK, Lehman GA.Низкие значения панкреатической амилазы и липазы в сыворотке являются простыми и полезными предикторами для диагностики хронического панкреатита. Кишечник Печень. 2017 15 ноября; 11 (6): 878-883. [Бесплатная статья PMC: PMC5669605] [PubMed: 212]
- 28.

- Мунирадж Т., Гаджендран М., Тирувенгадам С., Рагурам К., Рао С., Деварадж П. Острый панкреатит. Дис пн. 2012 март; 58(3):98-144. [PubMed: 22370054]
- 29.
- Basnayake C, Ratnam D. Анализы крови на острый панкреатит. Aust Prescr. 2015 авг; 38 (4): 128-30. [Бесплатная статья PMC: PMC4653980] [PubMed: 26648641]
- 30.
- Макиннес Н., Смит А., Отто Р., Вандерми Дж., Пунтаки З., Шерифали Д., Баласубраманян К., Холл С., Герштейн Х.К. Пилотирование стратегии ремиссии при диабете 2 типа: результаты рандомизированного контролируемого исследования. J Clin Endocrinol Metab. 2017 01 мая; 102 (5): 1596-1605. [PubMed: 28324049]
- 31.
- Cadegiani FA, Silva OS. Акарбоза способствует ремиссии как раннего, так и позднего демпинг-синдрома у постбариатрических пациентов. Диабет метаболический синдром ожирение. 2016;9:443-446. [Бесплатная статья PMC: PMC5153290] [PubMed: 27994477]
- 32.
- Ямагиши С., Мацуи Т., Уэда С., Фуками К., Окуда С.
 Клиническая польза акарбозы, ингибитора альфа-глюкозидазы при кардиометаболических расстройствах. Curr Drug Metab. 2009 Февраль; 10 (2): 159-63. [PubMed: 19275550]
Клиническая польза акарбозы, ингибитора альфа-глюкозидазы при кардиометаболических расстройствах. Curr Drug Metab. 2009 Февраль; 10 (2): 159-63. [PubMed: 19275550] - 33.
- Barbieri JS, Riggio JM, Jaffe R. Тестирование амилазы на боль в животе и подозрение на острый панкреатит. Дж Хосп Мед. 2016 май; 11(5):366-8. [PubMed: 27160507]
- 34.
- Beauregard JM, Lyon JA, Slovis C. Использование литературы для оценки диагностических тестов: амилаза или липаза для диагностики острого панкреатита? J Med Libr Assoc.2007 г., апрель; 95 (2): 121-6. [Бесплатная статья PMC: PMC1852619] [PubMed: 17443244]
Лабораторный анализ амилазы на панкреатит: цель, процедура, подготовка, результаты
Если ваш врач подозревает, что что-то не так с вашей поджелудочной железой — органом в животе, который помогает вы перевариваете пищу — они могут сделать тест на амилазу. Амилаза — это белок, вырабатываемый вашей поджелудочной железой и железами во рту и вокруг рта и горла. Он помогает расщеплять углеводы и крахмалы на сахар.
Он помогает расщеплять углеводы и крахмалы на сахар.
Наличие некоторого количества амилазы в крови является нормальным явлением.Но слишком много его может означать, что один из протоков (трубок) в вашей поджелудочной железе заблокирован или поврежден. Симптомы этого могут включать:
- Боль в животе — обычно вокруг пупка — которая не проходит
- Лихорадка
- Потеря аппетита
- Тошнота
Зачем мне нужен этот тест?
Почти во всех случаях ваш врач назначит тест на амилазу одновременно с тестом на липазу. Липаза — это химическое вещество, которое вырабатывает поджелудочная железа, чтобы помочь организму переваривать жиры.Вместе эти тесты могут сказать вашему врачу, есть ли у вас заболевание поджелудочной железы, такое как панкреатит, что означает, что ваша поджелудочная железа воспалена.
Они также могут заказать тест на амилазу, если подозревают, что у вас заболевание слюнных желез или если имеется закупорка протока, по которому пищеварительные ферменты поступают в тонкую кишку. Эта закупорка может быть вызвана раком поджелудочной железы, камнями в желчном пузыре или сужением протока или сфинктера, который отделяет проток поджелудочной железы от кишечника.
Эта закупорка может быть вызвана раком поджелудочной железы, камнями в желчном пузыре или сужением протока или сфинктера, который отделяет проток поджелудочной железы от кишечника.
Тест на амилазу также используется для проверки людей с муковисцидозом (МВ).Это заболевание, вызывающее легочные инфекции. Это также может затруднить усвоение организмом питательных веществ из пищи. Если у вас муковисцидоз, высокий уровень амилазы может означать, что у вас толстые слизистые пробки, которые блокируют продвижение пищеварительных ферментов из поджелудочной железы в тонкую кишку.
Подготовка к тесту
Вам не нужно делать ничего особенного, чтобы подготовиться к тесту на амилазу. Но сообщите своему врачу, если вы принимаете лекарства, травы или витамины. Некоторые лекарства, такие как аспирин, противозачаточные таблетки, опиаты и диуретики, могут повлиять на результаты.Алкоголь тоже может.
Результаты
Обычно их получение занимает день или два.
Если уровень амилазы в крови низкий, это может означать, что поджелудочная железа не вырабатывает достаточно белка. Возможные причины этого включают:
Возможные причины этого включают:
Высокие уровни могут сигнализировать о многом, например:
Ваш врач назначит дополнительные анализы, если сочтет это необходимым.
Каковы функции пищеварительных ферментов амилазы, протеазы и липазы | Здоровое питание
Автор: Joanne Marie Обновлено 12 декабря 2018 г.
Ваша пищеварительная система расщепляет питательные вещества, которые вы потребляете с пищей, превращая их в небольшие молекулы, которые ваши клетки, ткани и органы используют в качестве топлива и для сотен метаболических функций.Для завершения этого сложного процесса требуются часы, в результате которых образуются простые сахара, жирные кислоты, глицерин и аминокислоты. После того, как вы разбиваете пищу на мелкие кусочки, пережевывая ее, специальные ферменты, вырабатываемые в разных частях вашего пищеварительного тракта, воздействуют на нее, чтобы завершить процесс.
Амилаза
Амилаза — это пищеварительный фермент, который действует на крахмал в пище, расщепляя его на более мелкие молекулы углеводов. Фермент производится в двух местах. Во-первых, слюнные железы во рту вырабатывают слюнную амилазу, которая начинает пищеварительный процесс, расщепляя крахмал, когда вы пережевываете пищу, превращая его в мальтозу, меньший углевод.Когда крахмалистые продукты, такие как рис или картофель, начинают расщепляться во рту, вы можете почувствовать слегка сладковатый привкус, поскольку высвобождается мальтоза. Клетки поджелудочной железы вырабатывают другой тип амилазы, называемой панкреатической амилазой, которая проходит через проток и достигает тонкой кишки. Панкреатическая амилаза завершает переваривание углеводов, производя глюкозу, маленькую молекулу, которая всасывается в кровь и разносится по всему телу.
Фермент производится в двух местах. Во-первых, слюнные железы во рту вырабатывают слюнную амилазу, которая начинает пищеварительный процесс, расщепляя крахмал, когда вы пережевываете пищу, превращая его в мальтозу, меньший углевод.Когда крахмалистые продукты, такие как рис или картофель, начинают расщепляться во рту, вы можете почувствовать слегка сладковатый привкус, поскольку высвобождается мальтоза. Клетки поджелудочной железы вырабатывают другой тип амилазы, называемой панкреатической амилазой, которая проходит через проток и достигает тонкой кишки. Панкреатическая амилаза завершает переваривание углеводов, производя глюкозу, маленькую молекулу, которая всасывается в кровь и разносится по всему телу.
Протеаза
Любой фермент, расщепляющий белок на строительные блоки, аминокислоты, называется протеазой, это общий термин.Ваш пищеварительный тракт вырабатывает ряд этих ферментов, но три основные протеазы — это пепсин, трипсин и химотрипсин.
Специальные клетки желудка вырабатывают неактивный фермент пепсиноген, который превращается в пепсин при контакте с кислой средой желудка. Пепсин разрывает определенные химические связи в белках, образуя более мелкие молекулы, называемые пептидами, и начинает переваривание белков.
Пепсин разрывает определенные химические связи в белках, образуя более мелкие молекулы, называемые пептидами, и начинает переваривание белков.
Ваша поджелудочная железа вырабатывает трипсин и химотрипсин, ферменты, которые выбрасываются в тонкую кишку через панкреатический проток.Когда частично переваренная пища перемещается из желудка в кишечник, трипсин и химотрипсин завершают переваривание белков, производя простые аминокислоты, которые всасываются в кровоток.
Липаза
Липаза — это фермент, расщепляющий пищевые жиры на более мелкие молекулы, называемые жирными кислотами и глицерином. Небольшое количество липазы, называемой желудочной липазой, вырабатывается клетками желудка. Этот фермент специально переваривает масляный жир в вашей пище.
Основным источником липазы в пищеварительном тракте является поджелудочная железа, которая вырабатывает панкреатическую липазу, действующую в тонком кишечнике.Во-первых, желчь, вырабатываемая в печени и попадающая в кишечник, превращает пищевой жир в маленькие жировые шарики.
Липаза поджелудочной железы, также называемая стеапсином, воздействует на эти жировые шарики, превращая их в жирные кислоты и глицерин, которые представляют собой небольшие энергоемкие молекулы, используемые всеми вашими клетками. Жирные кислоты и глицерин попадают в кровь и лимфатические сосуды, достигая всех частей тела.
Другие ферменты
Хотя амилаза, протеаза и липаза являются тремя основными ферментами, которые организм использует для переваривания пищи, многие другие специализированные ферменты также помогают в этом процессе.Клетки, выстилающие ваш кишечник, вырабатывают ферменты, называемые мальтазой, сахаразой и лактазой, каждая из которых способна превращать определенный тип сахара в глюкозу.
Точно так же особые клетки желудка выделяют два других фермента — ренин и желатиназу. Ренин воздействует на белки молока, превращая их в более мелкие молекулы, называемые пептидами, которые затем полностью перевариваются пепсином. Желатиназа переваривает желатин и коллаген, два больших белка в мясе, в соединения среднего размера, переваривание которых затем завершается пепсином, трипсином и химотрипсином с образованием аминокислот.
Желатиназа переваривает желатин и коллаген, два больших белка в мясе, в соединения среднего размера, переваривание которых затем завершается пепсином, трипсином и химотрипсином с образованием аминокислот.
Амилаза | Ингредиенты для выпечки | BAKERpedia
Происхождение
Амилаза широко распространена в природе. Он есть как у растений, так и у животных. Зерновые и злаки, а также мука из них, естественно, содержат различные типы амилазы. В злаках он содержится в эндосперме, отрубях и зародышах.
Коммерческое производство
Амилаза обычно производится промышленной ферментацией. Используются источники бактерий, такие как Bacillus subtilis или B. stearothermophilus .Или грибковые источники, такие как Aspergillus oryzae или A. niger .
Функция
Амилазы выполняют следующие функции в хлебобулочных изделиях:
- Обеспечивают ферментируемые и восстанавливающие сахара.
- Ускорение брожения дрожжей и усиленное газообразование для оптимального расширения теста во время расстойки и выпечки
- Усиливает вкус и цвет корочки, усиливая реакции Майяра и карамелизацию.

- Уменьшение вязкости теста/теста во время клейстеризации крахмала в духовке.
- Увеличьте высоту подъема/пружины печи и увеличьте объем продукта.
- Действуют как смягчители мякиша, препятствуя черствению.
- Измените свойства теста, уменьшив его липкость.
Применение
Характеристики амилаз, используемых в выпечке, включают: 2,3,4
| Тип | Номер ЕС | Химическая связь расщеплена/Реакция катализируется | Продукт | Применение |
| α-амилаза (разжижающий фермент) | 3.2.1.1. | Случайный эндогидролиз α(1→4)-D-глюкозидных связей между единицами глюкозы в амилозе и амилопектине. Не может пересечь точку разветвления (связь α-1,6) | Декстрины 10–20 единиц глюкозы Мальтоза | Производство крахмальных сиропов Проращивание зерновых Средства против черствения Альфа-амилаза оказывает наибольшее влияние на свойства теста и качество хлеба |
| β-амилаза | 3. 2.1.2 2.1.2 | Экзогидролиз α(1→4)-D-глюкозидных связей Последовательно удаляет мальтозу с нередуцирующих концов крахмала. Не может пересечь точку ветвления (связь α-1,6) | Мальтоза | Проращивание злаков Обеспечивает питание дрожжей для оптимального объема и цвета продукта |
| Амилоглюкозидаза или глюкоамилаза (осахаривающий фермент) | 3.2.1.3 | Экзогидролиз α(1→4)- и α(1→6)-D-глюкозидов | Глюкоза | Сокращает время расстойки теста с низким содержанием сахара и замороженного теста Производство крахмальных сиропов с высоким ДЭ Обеспечивает субстрат для глюкозооксидазы, чтобы она функционировала как усилитель теста |
| Мальтогенная амилаза | 3.2.1.33 | Гидролиз α(1→4)-D-глюкозидных связей | Малые декстрины из амилопектина снаружи | Средство против черствения |
| Пуллуланаза (фермент деветвления) | 3. 2.1.41 2.1.41 | Гидролиз α-1,6-глюкозидных связей | Крахмальные ветки | Производство крахмальных сиропов |
Активность альфа-амилазы
α-амилаза действует только на поврежденный и желатинизированный крахмал. Превращение крахмала в декстрины и мальтозу посредством катализа α-амилазой происходит следующим образом: 5
Крахмал + H 2 O → Декстрины + Мальтоза
Оптимальные условия для активности α-амилазы:
- рН: 5.5–6,0
- Диапазон температур: 104–140°F (40–60°C)
- Время контакта между ферментом и субстратом: не менее 60 минут обработки теста
- Доступность воды: предпочтительно aw 0,9 или выше
- Количество поврежденного и клейстеризованного крахмального субстрата
- Дозировка фермента по отношению к субстрату: Альфа-амилазу обычно добавляют в рецептуру хлеба в количестве 0,002–0,006% (от 20 до 60 частей на миллион) в расчете на массу муки.

Ферментативная активность α-амилазы может быть определена аналитически.Одна единица (1U) определяется как количество фермента, необходимое для высвобождения 1 мкмоль восстанавливающих групп, т. е. мальтозы/мин, из растворимого крахмала при 25°C и pH 7,0.
α-Амилазу также можно количественно определить косвенно с помощью тестов числа падения, RVA или амилографа. 5
Сравнительная функциональность амилаз из различных источников:
| Источник | Чистота | Термостойкость/термическая стабильность | Побочная деятельность | Примечания |
| Зерновые | Низкий | Средний | Высокий | Может использоваться в тесте числа падения (FN) |
| Грибки | Средний | Низкий | Средний | Нельзя использовать в тесте FN |
| Бактериальный | Высокий | Высокий | Низкий | Чрезвычайно термостабильный Проблемы с передозировкой |
Регламент FDA
Этот ингредиент считается GRAS (общепризнанным безопасным) в США Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов. Его можно использовать в пищевых продуктах без каких-либо ограничений, кроме существующих правил надлежащей производственной практики. 6
Его можно использовать в пищевых продуктах без каких-либо ограничений, кроме существующих правил надлежащей производственной практики. 6
Ссылки
- Mathewson, PR Enzymes, 2-е издание, серия справочников Eagan Press, AACC International, Inc., 1998, стр. 1–105.
- Ван Оорт, М. «Ферменты в хлебопекарном производстве». Ферменты в пищевых технологиях, 2-е издание, Blackwell Publishing Ltd, 2010 г., стр. 103–143.
- Розелл, С.М., и Дура, А. «Ферменты в пекарнях». Ферменты в производстве продуктов питания и напитков, CRC Press, Taylor & Francis Group, LLC, 2016, стр.171–195.
- Прасада Рао, У.Дж.С., и Хемалатха, М.С. «Ферменты». Наука и технология хлебобулочных изделий, 2-е издание, John Wiley & Sons, Ltd, 2014 г., стр. 276–291.
- Бисвангер, Х. «Ферментные анализы». Практическая энзимология, 2-е издание, Wiley-VCH Verlag & Co. KGaA, 2011, стр. 170–174.
- Смит, Дж. «Ферменты». Справочник по пищевым добавкам, 2-е издание, Blackwell Publishing Ltd.
 , 2011 г., стр. 366–454.
, 2011 г., стр. 366–454.
Пищеварительные ферменты: амилаза, протеаза и липаза
Концепцию пищеварительных ферментов довольно легко понять, но при углублении в детали полезно сделать шаг назад и понять, что на самом деле выполняет множество доступных ферментов. тело.В то время как для взаимодействия с пищей, которую мы едим, необходимо много отдельных ферментов, есть три амилазы, протеазы и липазы, которые связаны с основными макроэлементами в нашем рационе; углеводов, белков и жиров соответственно.
Поджелудочная железа является основным органом, отвечающим за выработку и высвобождение амилазы, протеазы и липазы. Когда пищевой болюс проходит через пищеварительный тракт, он стимулирует высвобождение этих важных ферментов, обеспечивающих эффективное расщепление углеводов, белков и жиров на более мелкие частицы, которые могут быть поглощены позже в процессе пищеварения и в конечном итоге использованы во всем теле.Помимо поджелудочной железы, амилаза также высвобождается в слюне во рту и известна как слюнная амилаза.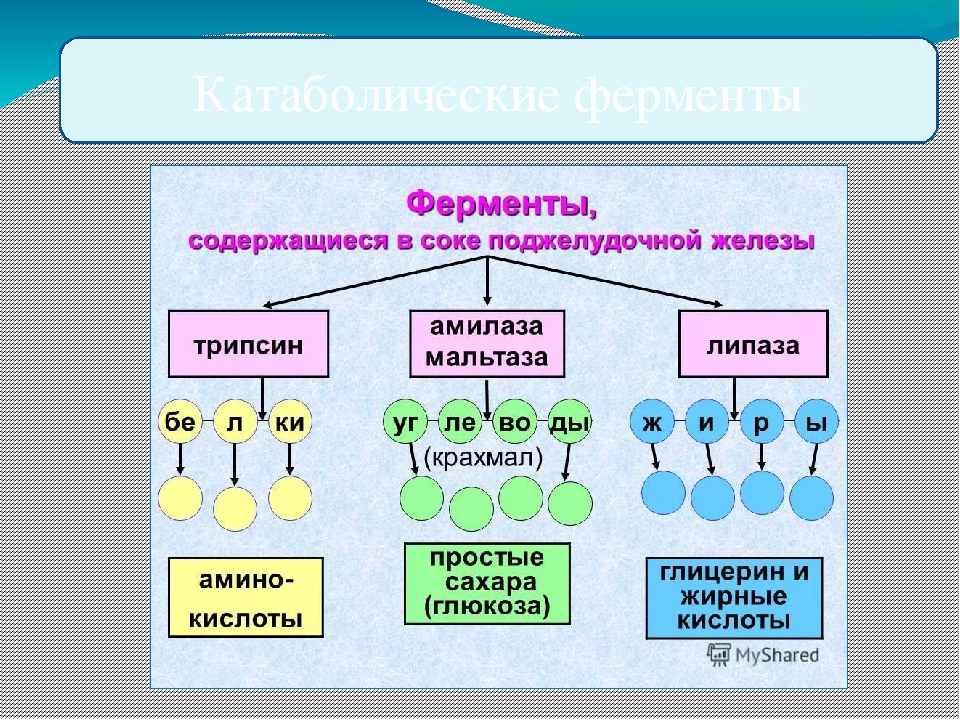
Хотя процесс пищеварения зависит от гораздо большего, чем просто амилаза, протеаза и липаза, для полного и эффективного переваривания съеденной пищи, они являются ключевым компонентом и отличной отправной точкой при изучении того, как пищеварительные ферменты способствуют здоровью желудочно-кишечного тракта.*
Амализа
Амилаза отвечает за разрыв связей в крахмалах, полисахаридах и сложных углеводах с образованием простых сахаров, которые легче усваиваются. 1 Амилаза слюны является первой стадией химического переваривания пищи. Это одна из основных причин, по которой людям так важно уделять время еде и тщательно пережевывать пищу. 2 Этот начальный этап процесса пищеварения необходим для правильного расщепления съеденной пищи и окончательного высвобождения питательных веществ внутри, которые будут поглощены позже в процессе пищеварения. По мере того как крахмалы, полисахариды и сложные углеводы проходят через пищеварительный тракт, они далее расщепляются дополнительной амилазой, высвобождаемой из поджелудочной железы в проксимальный отдел тонкой кишки.
Протеаза
Еще одним важным ферментом для эффективного переваривания съеденной пищи является протеаза. Он отвечает за первичный распад белков и полипептидов животных и растений, а также дипептидов пролина из глютена и казеина. Протеазы высвобождаются поджелудочной железой в проксимальный отдел тонкой кишки, где они смешиваются с белками, уже денатурированными желудочным секретом, и расщепляют их на аминокислоты, строительные блоки белка, которые в конечном итоге будут абсорбироваться и использоваться во всем организме.
Липаза
В то время как амилаза и протеаза прекрасно расщепляют углеводы и белки, организму нужен другой фермент для расщепления жиров, масел и триглицеридов. Здесь работает липаза. Липаза необходима для полного переваривания жиров до их более мелких компонентов жирных кислот.
Какое значение имеют пищеварительные ферменты?
Иногда пища может не полностью перевариваться, когда она проходит через пищеварительный тракт. В основе этого обстоятельства может лежать ряд причин.Это может привести к неэффективному высвобождению питательных веществ из пищи. Хотя это может быть трудно почувствовать в повседневной жизни, есть несколько вещей, которые могут указывать на необходимость немного более целенаправленной поддержки пищеварительных ферментов. Когда кто-то периодически испытывает газы, вздутие живота и/или расстройство желудка, эффективным решением может быть дополнительный прием пищеварительных ферментов.* 3 , 4 с бактериями в дистальных отделах тонкой и толстой кишки.Бактерии, присутствующие в этой области, будут ферментировать плохо переваренные макроэлементы, в результате чего побочными продуктами будут газы, выделяемые в пищеварительном тракте. Это чрезмерное накопление газов — это то, что многие люди замечают и сначала сообщают своему лечащему врачу.
В основе этого обстоятельства может лежать ряд причин.Это может привести к неэффективному высвобождению питательных веществ из пищи. Хотя это может быть трудно почувствовать в повседневной жизни, есть несколько вещей, которые могут указывать на необходимость немного более целенаправленной поддержки пищеварительных ферментов. Когда кто-то периодически испытывает газы, вздутие живота и/или расстройство желудка, эффективным решением может быть дополнительный прием пищеварительных ферментов.* 3 , 4 с бактериями в дистальных отделах тонкой и толстой кишки.Бактерии, присутствующие в этой области, будут ферментировать плохо переваренные макроэлементы, в результате чего побочными продуктами будут газы, выделяемые в пищеварительном тракте. Это чрезмерное накопление газов — это то, что многие люди замечают и сначала сообщают своему лечащему врачу.
Пищеварительные ферменты, включая амилазу, протеазу и липазу, представляют собой основополагающий аспект здоровья желудочно-кишечного тракта.

 В случаях острого панкреатита в первые дни заболевания показано голодание;
В случаях острого панкреатита в первые дни заболевания показано голодание;



 Тем не менее у некоторых больных с острым панкреатитом данный показатель иногда повышается незначительно или даже остается в норме. Вообще, активность амилазы не отражает тяжести поражения поджелудочной железы. К примеру, при массивном панкреатите может происходить гибель большинства клеток, вырабатывающих амилазу, поэтому ее активность не изменяется.
Тем не менее у некоторых больных с острым панкреатитом данный показатель иногда повышается незначительно или даже остается в норме. Вообще, активность амилазы не отражает тяжести поражения поджелудочной железы. К примеру, при массивном панкреатите может происходить гибель большинства клеток, вырабатывающих амилазу, поэтому ее активность не изменяется.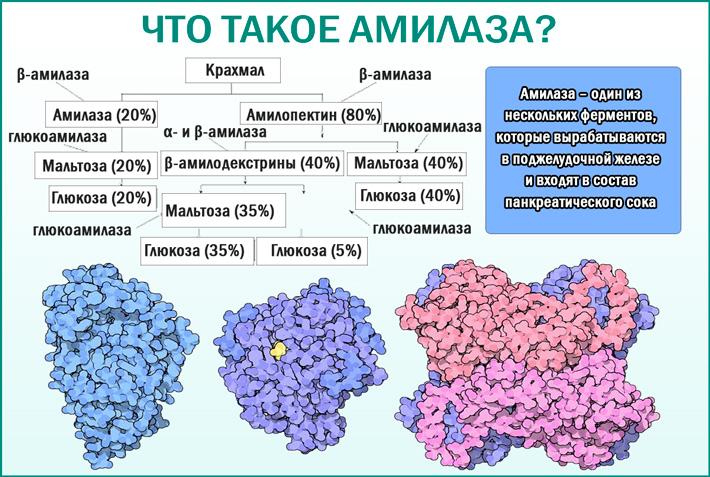


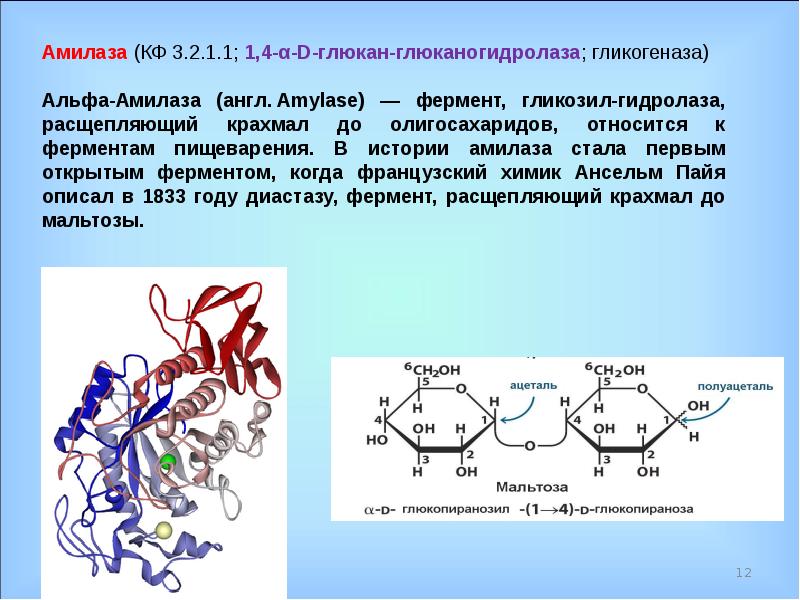



 Eur J Clin Pharmacol. 2001 сен; 57 (6-7): 517-21. [PubMed: 11699619]
Eur J Clin Pharmacol. 2001 сен; 57 (6-7): 517-21. [PubMed: 11699619]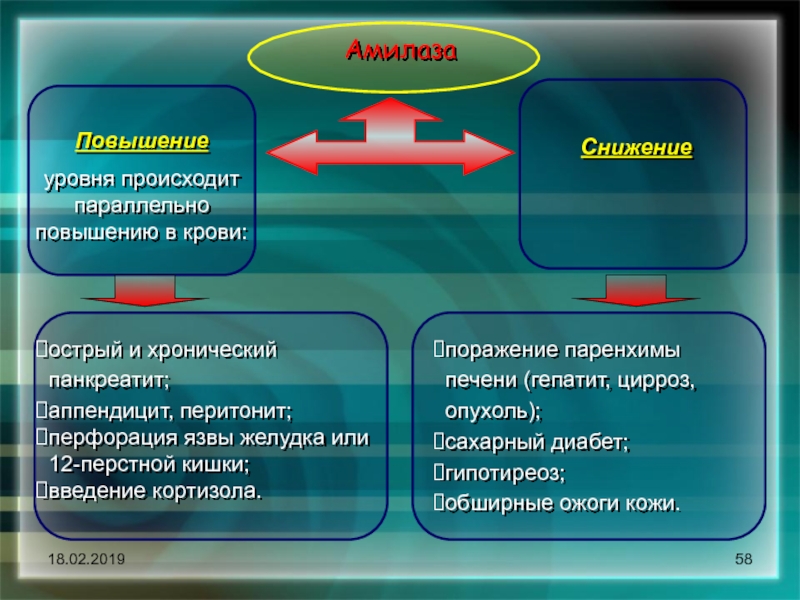 [PubMed: 10063922]
[PubMed: 10063922]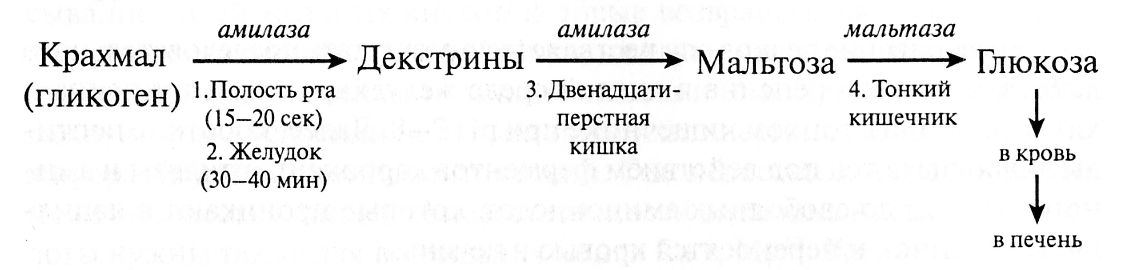 Нихон Ринсё. 1995 г., май; 53(5):1184-91. [PubMed: 7541479]
Нихон Ринсё. 1995 г., май; 53(5):1184-91. [PubMed: 7541479]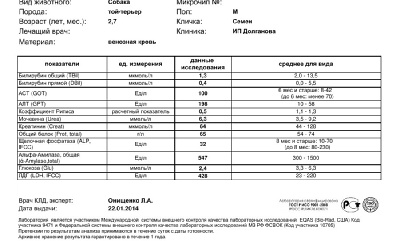 Гастроэнтерол Jpn. 1986 авг; 21 (4): 385-90. [PubMed: 2429888]
Гастроэнтерол Jpn. 1986 авг; 21 (4): 385-90. [PubMed: 2429888]
 Клиническая польза акарбозы, ингибитора альфа-глюкозидазы при кардиометаболических расстройствах. Curr Drug Metab. 2009 Февраль; 10 (2): 159-63. [PubMed: 19275550]
Клиническая польза акарбозы, ингибитора альфа-глюкозидазы при кардиометаболических расстройствах. Curr Drug Metab. 2009 Февраль; 10 (2): 159-63. [PubMed: 19275550]
 Eur J Clin Pharmacol. 2001 сен; 57 (6-7): 517-21. [PubMed: 11699619]
Eur J Clin Pharmacol. 2001 сен; 57 (6-7): 517-21. [PubMed: 11699619]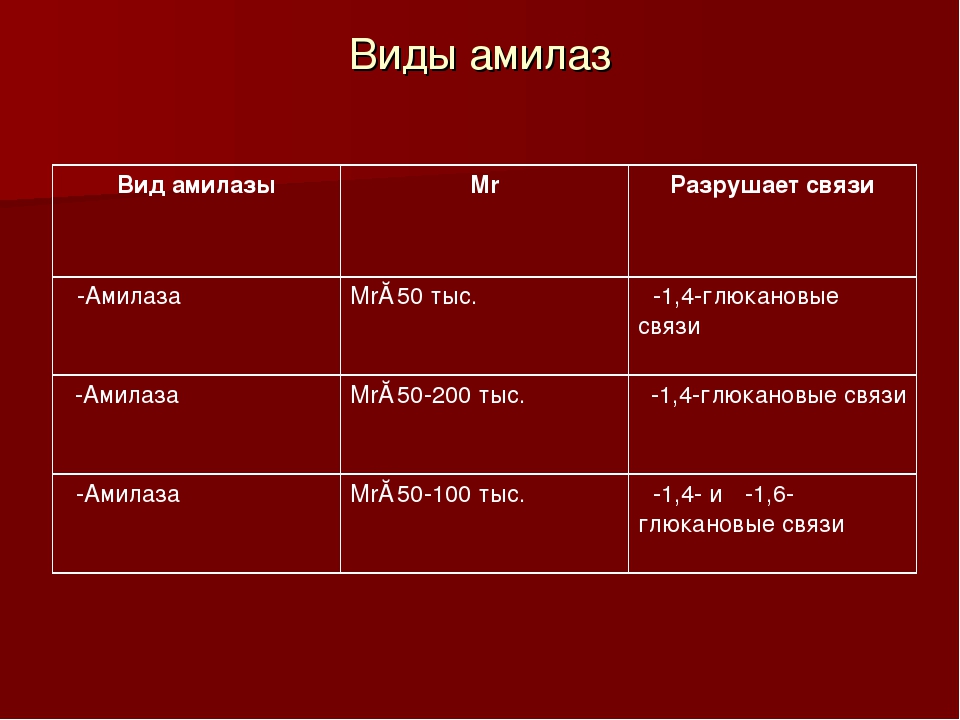 [PubMed: 10063922]
[PubMed: 10063922] Нихон Ринсё. 1995 г., май; 53(5):1184-91. [PubMed: 7541479]
Нихон Ринсё. 1995 г., май; 53(5):1184-91. [PubMed: 7541479] Гастроэнтерол Jpn. 1986 авг; 21 (4): 385-90. [PubMed: 2429888]
Гастроэнтерол Jpn. 1986 авг; 21 (4): 385-90. [PubMed: 2429888]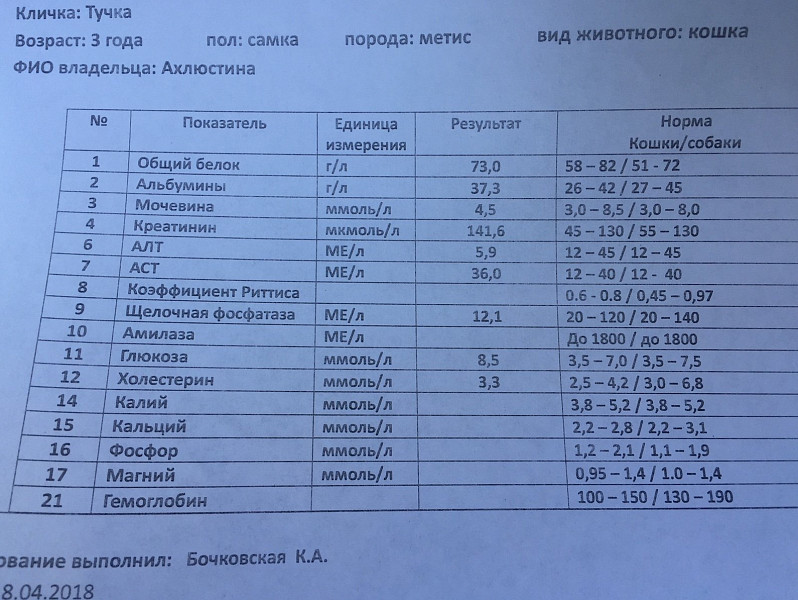
 Клиническая польза акарбозы, ингибитора альфа-глюкозидазы при кардиометаболических расстройствах. Curr Drug Metab. 2009 Февраль; 10 (2): 159-63. [PubMed: 19275550]
Клиническая польза акарбозы, ингибитора альфа-глюкозидазы при кардиометаболических расстройствах. Curr Drug Metab. 2009 Февраль; 10 (2): 159-63. [PubMed: 19275550]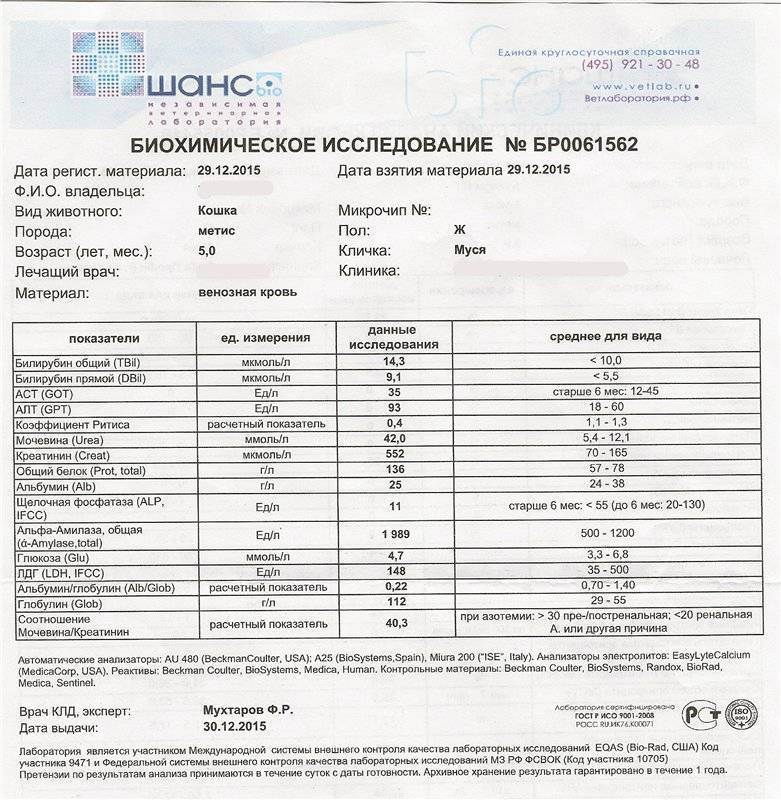
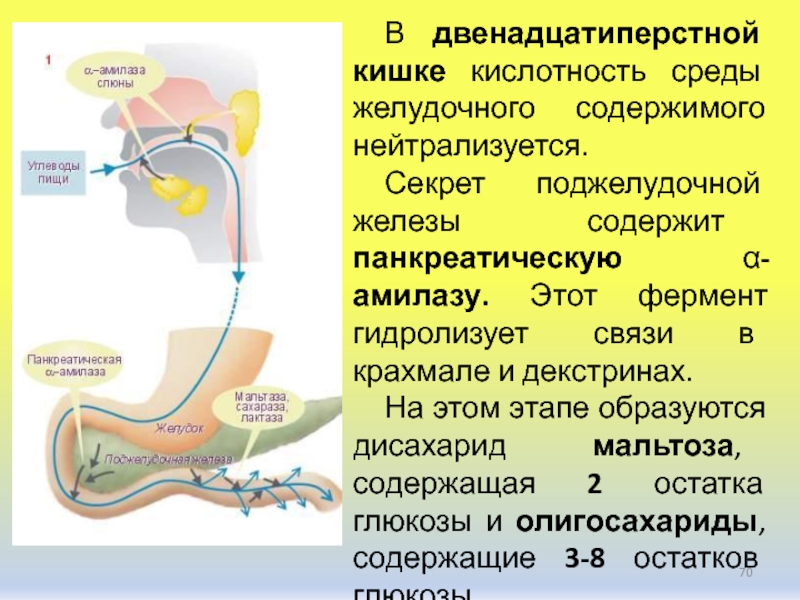 Eur J Clin Pharmacol. 2001 сен; 57 (6-7): 517-21. [PubMed: 11699619]
Eur J Clin Pharmacol. 2001 сен; 57 (6-7): 517-21. [PubMed: 11699619] [PubMed: 10063922]
[PubMed: 10063922]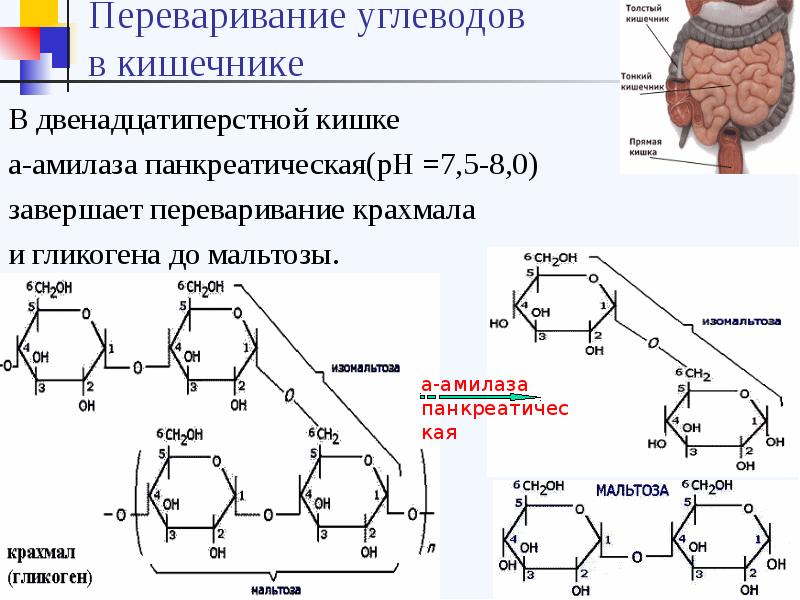 Нихон Ринсё. 1995 г., май; 53(5):1184-91. [PubMed: 7541479]
Нихон Ринсё. 1995 г., май; 53(5):1184-91. [PubMed: 7541479] Гастроэнтерол Jpn. 1986 авг; 21 (4): 385-90. [PubMed: 2429888]
Гастроэнтерол Jpn. 1986 авг; 21 (4): 385-90. [PubMed: 2429888]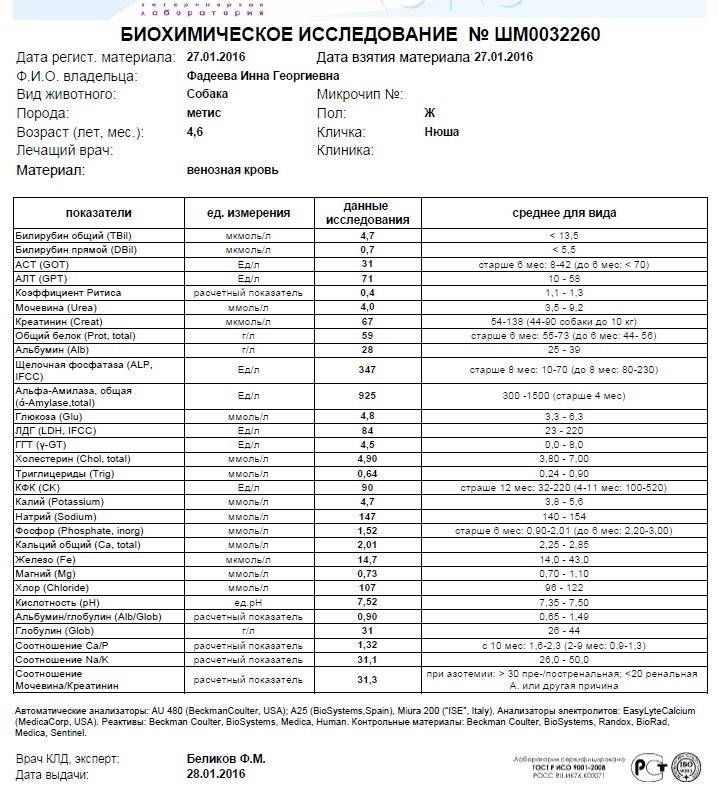
 Клиническая польза акарбозы, ингибитора альфа-глюкозидазы при кардиометаболических расстройствах. Curr Drug Metab. 2009 Февраль; 10 (2): 159-63. [PubMed: 19275550]
Клиническая польза акарбозы, ингибитора альфа-глюкозидазы при кардиометаболических расстройствах. Curr Drug Metab. 2009 Февраль; 10 (2): 159-63. [PubMed: 19275550]

 , 2011 г., стр. 366–454.
, 2011 г., стр. 366–454.