Базисная терапия при ревматоидном артрите: Базисная терапия ревматоидного артрита
Базисная терапия ревматоидного артрита
Базисная терапия системных заболеваний соединительной тканиГлавным средством в лечении аутоимунных заболеваний являются, так называемые базисные препараты. Их название произошло от того, что они воздействуют на основание болезни, ее «базис». Эти препараты вызывают ремиссию и предотвращают или замедляют разрушение суставов, но не являются противовоспалительными препаратами. В настоящее время в качестве базисной терапии используют чаще всего: цитостатики, антималярийные препараты, сульфаниламиды, пеницилламин.
1. Цитостатики.
Цитостатические препараты: метотрексат, арава, азатиоприн (имуран), циклофосфан (эндоксан), циклоспорин (сандимун, экворал), проспидин и др.
Не стоит пугаться от названия «цитостатики», зная спектр их побочных эффектов: дозы этих препаратов при лечении артритов примерно в 5-20 раз меньше используемых при лечении опухолей! Использование цитостатиков помогает, как минимум, 70-80% больных, побочные явления возможны у 15-20% пациентов и редко бывают тяжелыми. Подбор доз под контролем ревматолога сводит возможность побочных эффектов к минимуму
Подбор доз под контролем ревматолога сводит возможность побочных эффектов к минимуму
В течение всего периода терапии цитостатиками необходимо, с помощью лабораторных методов исследования, контролировать показатели общего анализа крови,биохимических анализов и мочи у пациента. Если же пациент легко переносит цитостатическую терапию, можно ждать улучшения самочувствия уже через 2-4 недели после начала лечения.
Метотрексат (методжект) Считается «золотым стандартом» лечения ревматоидного и псориатического артрита, всвязи с его высокой эффективностью, хорошей переносмостью и удобством приема Для базисного лечения ревматоидного артрита метотрексат принимают только 1 раз в неделю. В первый раз выбирают конкретный день недели и с этих пор на протяжении всего курса лечения, метотрексат принимают только в этот день . Доза подбирается постепенно, в зависимости от активности процесса и переносимости препарата Терапевтический эффект обычно проявляется через 2-6 недель от начала приема и достигает максимума обычно за полгода, год. В день приема метотрексата желательно обойтись без употребления НПВП.
В день приема метотрексата желательно обойтись без употребления НПВП.
Арава (элафра, лефлайд, лефлюнамид) рекомендуется больным, у которых артрит протекает очень активно, и тем, кто плохо переносит метотрексат. Терапевтический эффект обычно проявляется через 4-6 недель от начала приема аравы и может нарастать в течение 4-6 месяцев.
Ремикейд (инфликсимаб) — быстродействующий и довольно эффективный базисный препарат. Его применяют в тех случаях, когда другие базисные препараты не дают должного эффекта.
Ремикейд действует быстрее многих других базисных препаратов.
Однако применять ремикейд надо с очень большой осторожностью. До начала лечения ремикейдом необходимо выявить и пролечить все имеющиеся у пациента инфекции. Если этого не сделать, применение ремикейда может спровоцировать сильнейшее обострение недолеченных инфекционных процессов вплоть до развития сепсиса.
Также, во время лечения ремикейдом рекомендуется применять антиаллергические препараты, чтобы предотвратить возможные аллергические реакции. Стоимость препарата высокая. Лечение проводится только в стационарных условиях
Стоимость препарата высокая. Лечение проводится только в стационарных условиях
Биологические препараты это одна из новейших групп препаратов для лечения артритов. Они инактивируют специальный белок (фактор некроза опухоли (ФНО)), который играет важную роль в воспалительной процессе. Эти препараты действуют быстро и эффективно уменьшают воспаление. К ним относится ингибитор ФНО этанерцепт (энбрел), анакинра (кинерет), хумира (адалимубаб), актемра (тоцилизумаб), ритуксимаб (ритуксан, мабтера), оренция (абатацепт).
Все эти препараты были разработаны в течение последнего десятилетия, а на мировом фармацевтическом рынке начали появляться не более пяти лет назад. В связи с этим они ещё весьма дороги. Ещё одним их недостатком является то, что они могут вводиться только в инъекционной форме (подкожно или внутривенно), причем в стационарных условиях, так как процедура проводится от получаса до нескольких часов под контролем специалиста. Поэтому данные препараты пока еще не получили широкого применения.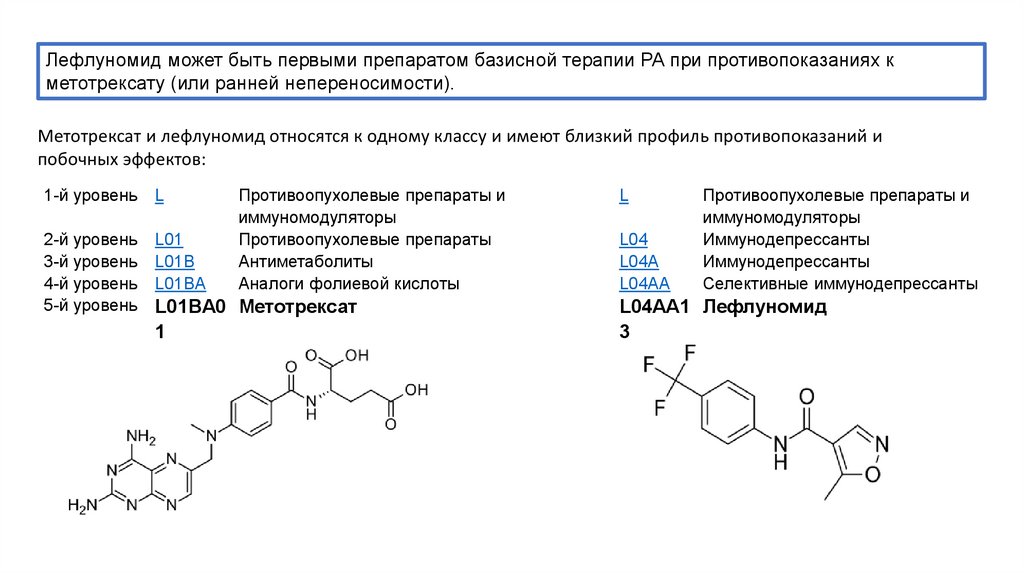 Обычно их применяют в комбинации с метотрексатом или с другим базовым препаратом.
Обычно их применяют в комбинации с метотрексатом или с другим базовым препаратом.
Также необходимо знать, что биологические препараты обычно не комбинируют друг с другом из-за высокой вероятности развития побочных эффектов!
Тофацитиниб – первый пероральный ингибитор янус-киназ в лечении ревматоидного артрита. Высокоэффективный и достаточно безопасный препарат. Однако высокая стоимость препарата не дает возможности говорить о его доступности для широкого круга больных.
Другие цитостатические препараты, такие как азатиоприн (имуран), циклофосфан (эндоксан) и циклоспорин (имуспорин, консупрен, сандимун, экворал) применяются только при неэффективности остальных базисных препаратов.
2. Антималярийные препараты
Антималярийные препараты делагил и плаквенил (иммард)
При очень длительном применении делагил и плаквенил способны влиять на активность ревматоидного процесса. К сожалению, со временем выяснилось, что эти препараты действуют медленно: лечебный эффект развивается спустя полгода — год непрерывного приема лекарства. Эффект незначитеьный по сравнению с другими базисными препаратами. Назначаются обычно при небольшой активности аутоимунного процесса при артритах, а также в при системной красной волчанке, васкулитах. Достоинством является хорошая переносимость и малое количество побочных эффектов.
Эффект незначитеьный по сравнению с другими базисными препаратами. Назначаются обычно при небольшой активности аутоимунного процесса при артритах, а также в при системной красной волчанке, васкулитах. Достоинством является хорошая переносимость и малое количество побочных эффектов.
3. Сульфаниламиды.
Сульфасалазин (салазопирин EN-Табс) — антимикробные препараты, успешно применяемые в базисном лечении недифференцированных артритов , анкилозирующего спондиллита, ревматоидного артрита.
По силе лечебного действия сульфаниламиды совсем немного уступают цитостатикам, вполне сопоставимы по эффективности с метотрексатом и пеницилламином, и явно превосходят по силе действия делагил и плаквенил. Главным преимуществом сульфаниламидов является их хорошая переносимость — при длительном приеме побочные эффекты развиваются только у 10-20% больных. Однако, для достижения лечебного эффекта данной группой препаратов, необходим весьма длительный промежуток времени – около 3-х месяцев, а «пик формы» достигается спустя 6-12 месяцев от начала лечения.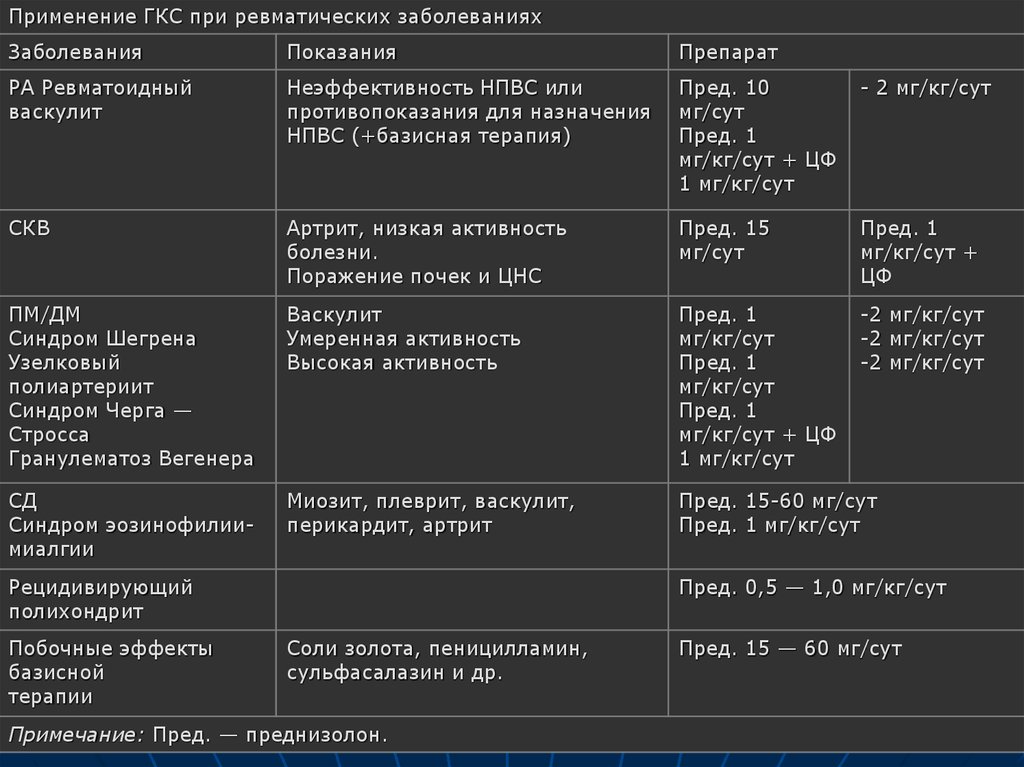
4. Пеницилламин.
Пеницилламин (купренил ) при артритах обычно назначается в тех случаях, когда терапия цитостатиками не приносит больному облегчения. При системной скеродермии явяется препаратом выбора. Применение купренила при ССД основано в первую очередь на связывании препаратом альдегидных групп коллагена, что приводит к нарушению его биосинтеза и поперечного связывания отдельных молекул
Клинический эффект Купренила при ССД проявляется в первую очередь положительной динамикой кожных поражений — уменьшением плотного отека, индурации и пигментации кожи. Снижается выраженность синдрома Рейно, уменьшаются или исчезают артралгии и миалгии. Отмечается также положительная динамика висцеральных проявлений заболевания .
Однако, следует учитывать, что пеницилламин является довольно токсичным препаратом, который значительно чаще вызывает осложнения — при его применении побочные реакции возникают в 30-40% случаев.
Лечение ревматоидного артрита базисными противовоспалительными препаратами | #07/12
Лечение ревматоидного артрита (РА), заболевания с неизвестной этиологией, сложным многокомпонентным патогенезом, чрезвычайной вариабельностью вариантов дебюта и течения, всегда представляло определенные трудности для практикующего врача.
Очевидно, что успех лечения во многом зависит от ранней диагностики и, соответственно, раннего начала патогенетической терапии. Последние классификационные критерии РА облегчают эту задачу, так как, используя их, врач в большинстве случаев может установить диагноз РА в течение первых 3–4 месяцев [1].
Лечение РА ориентировано на подавление активности и прогрессирования заболевания. Для лечения воспалительного процесса используются два вида терапии: 1) симптоматическая терапия нестероидными (НПВП) или глюкокортикоидными (ГК) противовоспалительными препаратами и 2) терапия базисными противовоспалительными препаратами (БПВП). Симптоматические средства способны уменьшить выраженность воспаления в синовиальной оболочке, уменьшить боль и скованность, однако эти препараты не влияют на течение РА.
Лечение синтетическими базисными противовоспалительными препаратами (БПВП) начинают сразу после установления диагноза РА (уровень доказательности 1а, уровень соглашения 9,9 ± 0,4) [2]. При раннем начале лечения (первые 3–6 месяцев) у большинства пациентов возможно добиться ремиссии или течения РА с низкой активностью [3–6], что по современным представлениям и является основной целью лечения РА [7]. Задержка с назначением БПВП приводит к уменьшению эффекта лечения. При анализе 14 рандомизированных клинических исследований (РКИ) была оценена частота развития эффекта у 1440 больных (1178 получали различные БПВП и 262 — плацебо) при различной длительности РА учитывались демографические факторы (пол, возраст), функциональный класс (ФК) по Steinbrocker, клинико-лабораторные параметры активности болезни (боль, число болезненных суставов (ЧБС), число воспаленных суставов (ЧВС), СОЭ, опросник состояния здоровья HAQ (Health Assessment Questionnaire) и др.) [8]. При любой длительности РА различия в частоте развития эффекта между активным лечением и плацебо были примерно одинаковы — около 30%. По мере увеличения длительности РА эффективность БПВП снижалась с 52% «ответчиков» (< 1 года) до 35% «ответчиков» (> 10 лет) (табл.
При раннем начале лечения (первые 3–6 месяцев) у большинства пациентов возможно добиться ремиссии или течения РА с низкой активностью [3–6], что по современным представлениям и является основной целью лечения РА [7]. Задержка с назначением БПВП приводит к уменьшению эффекта лечения. При анализе 14 рандомизированных клинических исследований (РКИ) была оценена частота развития эффекта у 1440 больных (1178 получали различные БПВП и 262 — плацебо) при различной длительности РА учитывались демографические факторы (пол, возраст), функциональный класс (ФК) по Steinbrocker, клинико-лабораторные параметры активности болезни (боль, число болезненных суставов (ЧБС), число воспаленных суставов (ЧВС), СОЭ, опросник состояния здоровья HAQ (Health Assessment Questionnaire) и др.) [8]. При любой длительности РА различия в частоте развития эффекта между активным лечением и плацебо были примерно одинаковы — около 30%. По мере увеличения длительности РА эффективность БПВП снижалась с 52% «ответчиков» (< 1 года) до 35% «ответчиков» (> 10 лет) (табл.
Помимо раннего начала лечения РА БПВП, необходим и жесткий контроль за выраженностью достигнутого эффекта, со своевременной коррекцией терапии. При таком подходе, как это было показано в ряде исследований [9–13], результат лечения лучше, чем при рутинном подходе. Это послужило основанием для формирования концепции современного лечения РА. В последние годы большинство стран Европы, включая и Российскую Федерацию, поддержали инициативу «Лечение РА до достижения цели» (в оригинале — инициатива «Treat to target» — Т2Т) [7].
Общие принципы инициативы Т2Т:
А) Лечение ревматоидного артрита следует проводить на основании совместного решения пациента и ревматолога.
Б) Основная цель при лечении больного ревматоидным артритом — обеспечить максимально продолжительное сохранение высокого качества жизни, связанного с состоянием здоровья, путем контроля клинических проявлений, предотвращения структурного поражения суставов, нормализации функционирования и социальных возможностей пациента.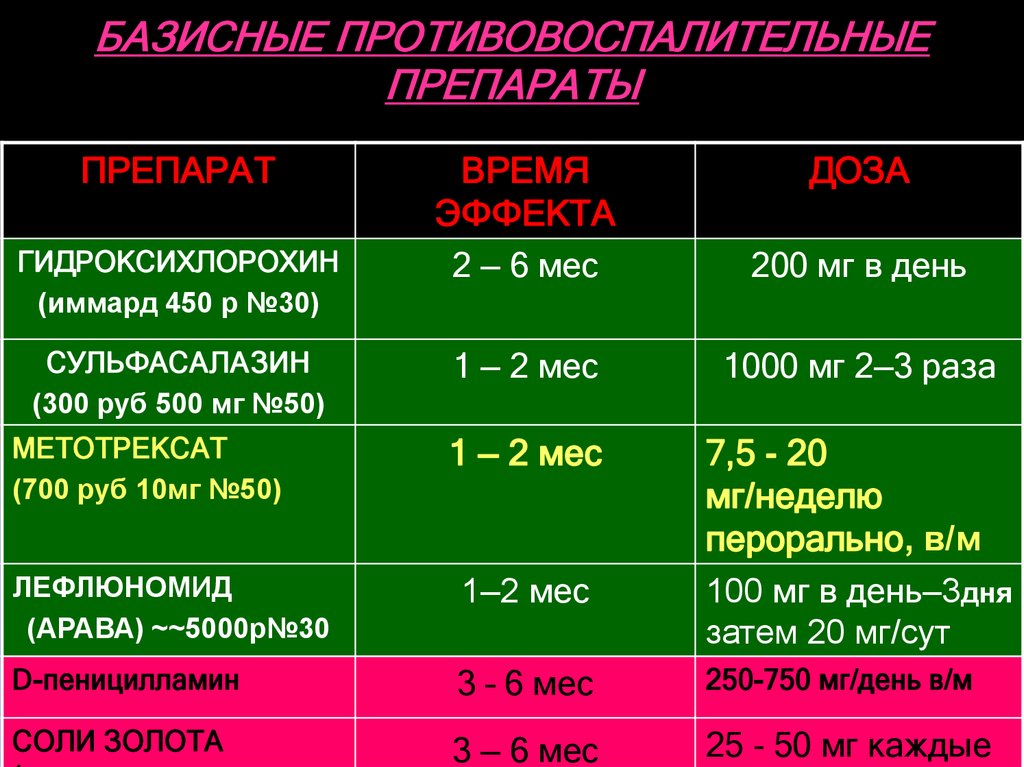
В) Устранение воспаления — наиболее важный способ достижения этих целей.
Г) Для оптимизации исходов при ревматоидном артрите лечение следует проводить до достижения определенной цели, контролируя активность заболевания и соответствующим образом корригируя терапию.
Первый пункт этих рекомендаций ставит перед врачом задачу обязательного обучения больного для того, чтобы он осознанно участвовал в лечении. Пациенту необходимо разъяснить, что такое хроническое заболевание, какова цель лечения, необходимость длительного многомесячного непрерывного лечения для предотвращения тяжелых исходов и осложнений РА (выраженной деструкции, утраты функции, амилоидоза и пр.).
Основные рекомендации инициативы Т2Т определяют главную цель лечения — достижение клинической ремиссии или, как альтернатива, низкой активности РА, что должно поддерживаться в течение всего периода болезни. Для достижения этой цели больные с умеренной/высокой активностью болезни должны осматриваться ежемесячно, при стабильно низкой активности — реже, раз в 3–6 месяцев, с регистрацией количественных параметров активности и использованием валидированных индексов.
В соответствии с рекомендациями Европейской антиревматической лиги (EULAR) лечение РА начинают с монотерапии БПВП, а не с комбинации препаратов, и первым БПВП, назначаемым сразу после установки диагноза РА, должен быть Метотрексат (MTX) [2], по рекомендациям ACR (Американская коллегия ревматологов, American College of Rheumatology) первыми БПВП могут быть MTX и лефлуномид (LEF) [14]. Метаанализ 2008 года [15] показал равнозначную эффективность без значительных различий в переносимости и длительности применения между БПВП (MTX, LEF и Сульфасалазин (SSZ)), которые являются препаратами, наиболее часто применяемыми при РА.
Метотрексат является высокоэффективным препаратом [16, 17], причем его эффект является дозозависимым [18]. Минимальная терапевтическая доза MTX составляет 10 мг/неделю, но при умеренной/высокой активности РА она должна быть увеличена в течение первых месяцев лечения до 15 мг/нед, а далее доза корригируется в зависимости от успеха лечения. Применяется как в таблетированной, так и в парентеральной форме.
И терапевтические эффекты, и токсичность MTX определяются фолатзависимыми механизмами. Подавление активности дигидрофолатредуктазы, ведущее к снижению синтеза ДНК, наблюдается главным образом при назначении очень высоких доз MTX онкологическим больным и составляет основу антипролиферативного действия препарата. При использовании низких доз MTX в ревматологии ингибиция дигидрофолатредуктазы, вероятно, имеет меньшее значение, а клиническая эффективность связана с действием его глутамированных производных.
Препарат обладает быстрым началом действия (в течение 2–3 месяцев) и дозозависимым эффектом [20]. В таблетированной форме препарата назначается 1 раз в неделю по 2,5 мг через 12 часов, вначале в пробных дозах 5 мг и 7,5 мг/нед, далее доза увеличивается до терапевтической. При применении парентеральных форм лечение также начинают с пробной дозы (5–7,5 мг/нед), далее доза может варьировать от 10 до 30 мг/неделю в зависимости от эффективности и переносимости. В контролируемом многомесячном исследовании было выявлено преимущество формы для подкожного введения перед таблетированной: более высокая эффективность при использовании одинаковых доз [21].
Лефлуномид (Арава) является дериватом изоксазола, создан специально для лечения РА, хотя в последние годы он начал использоваться и для лечения псориатической артропатии. Лефлуномид является «пролекарством», в желудочно-кишечном тракте и плазме быстро превращается в активный метаболит — малононитриламид (А77 1726), имеющий, в отличие от лефлуномида, открытое боковое ароматическое кольцо. Именно действием активного метаболита А77 1726 опосредован эффект лефлуномида.
По данным многочисленных экспериментальных исследований основным механизмом действия лефлуномида на активированные клетки является угнетение de novo синтеза пиримидиновых нуклеотидов в поздней G1-фазе клеточного цикла [22]. Предполагают, что лефлуномид действует избирательно на активированные Т-клетки, в то время как преобладающее большинство лимфоцитов находятся в фазе G0 до тех пор, пока не появится потребность в иммунном ответе [23]. Под воздействием метаболита А77 1726 не уменьшается количество клеток и внутриклеточная концентрация белков в угнетенных клетках после 72 часов воздействия метаболита А77 1726 в концентрации 100 мкмоль/л остается такой же, как в клетках в состоянии покоя. Лефлуномид не влияет на фагоцитоз человека. Все вышеперечисленные свойства позволяют рассматривать лефлуномид в большей степени как иммуномодулятор, нежели как иммунодепрессант.
Лефлуномид не влияет на фагоцитоз человека. Все вышеперечисленные свойства позволяют рассматривать лефлуномид в большей степени как иммуномодулятор, нежели как иммунодепрессант.
Угнетение Т-клеточного аутоиммунного ответа сопровождается снижением синтеза провоспалительных цитокинов (интерферона-гамма, фактора некроза опухоли-альфа (ФНО-альфа), интерлейкина 6 (IL-6), интерлейкина-бета (IL-бета), простагландина Е2), оксида азота и матриксных металлопротеиназ (ММР-1, ММР-3, ММР-12) в крови и в культуре синовиальной ткани больных РА. Недавно получены данные о противовоспалительном эффекте лефлуномида в отношении культуры моноцитов и макрофагов синовиальной оболочки больных РА: показано уменьшение синтеза провоспалительных цитокинов культурами клеток [24].
Из-за длительной элиминации А77 1726 лечение лефлуномидом рекомендуется начинать с насыщающей дозы 100 мг в течение 3 дней для достижения устойчивой равновесной концентрации препарата в плазме крови. Без насыщающей дозы лекарства для достижения равновесной концентрации А77 1726 потребуется около 2 месяцев.
Хотя в целом эффективность LEF и MTX равнозначна [15], но клиническая эффективность LEF имеет ряд особенностей.
Следует отметить очень быстрое развитие эффекта при применении LEF. Эффект LEF проявляется через 4 недели от начала приема, что продемонстрировано в зарубежных исследованиях (рис. 1) [31] и подтверждено нашим собственным опытом [25–28]. Уже через 1 месяц после начала лечения (табл. 2) отмечается отчетливое уменьшение выраженности суставного синдрома и заметное снижение концентрации С-реактивного белка (СРБ) — практически в 2 раза [28]. Известно, что СРБ является лабораторным тестом, гораздо более тесно коррелирующим с активностью РА, чем СОЭ. При продолжении лечения эффект препарата быстро нарастает в течение первых 4–5 месяцев и продолжает увеличиваться при продолжении лечения до 12 месяцев.
Известно, что СРБ является лабораторным тестом, гораздо более тесно коррелирующим с активностью РА, чем СОЭ. При продолжении лечения эффект препарата быстро нарастает в течение первых 4–5 месяцев и продолжает увеличиваться при продолжении лечения до 12 месяцев.
Оценивая динамику индекса активности болезни (Disease activity score, DAS) в различной его модификации — DAS 4, DAS 28 (рис. 2), можно увидеть, что Арава через 6, 12, 18, 24 и 36 месяцев достоверно снижала активность заболевания, причем выраженность уменьшения DAS соответствовала хорошему эффекту терапии (критерии EULAR). Из рис. 2 видно, что уже через 3–4 месяца средний уровень активности соответствовал низкой.
Такое быстрое подавление активности РА при приеме LEF обусловило и еще одну особенность препарата. При сравнении влияния лефлуномида на деструктивный процесс в суставах с базисным действием Метотрексата и Сульфасалазина было показано, что эффект LEF сопоставим с действием Метотрексата, но превышает действие Сульфасалазина [29–31]. По нашим многолетним исследованиям влияния базисных препаратов на темпы деструкции при РА (рис. 3) было показано [32], что только под влиянием LEF выраженное уменьшение числа новых эрозий отмечается уже в первые 6 месяцев лечения. Под влиянием всех других базисных средств, включая Метотрексат, в первое полугодие терапии темп прогрессирования деструктивного артрита значительно не меняется и только к 12 месяцам успешной терапии можно зарегистрировать подавление прогрессирования деструкции в суставах кистей и стоп, а наиболее отчетливое подавление деструкции при приеме различных БПВП можно зарегистрировать только через 18 месяцев успешной терапии. Судя по быстрому снижению концентрации СРБ под влиянием лефлуномида, можно утверждать, что Арава быстрее других базисных средств подавляет ревматоидное воспаление в синовиальной оболочке, что и приводит к ранней остановке прогрессирования деструкции. Впервые нами продемонстрировано заживление костной эрозии у больного с тяжелым РА (исходное число эрозий более 100), на фоне ремиссии отмечено заживление эрозии в крючковидной кости левого запястья через 18 месяцев приема LEF (рис.
По нашим многолетним исследованиям влияния базисных препаратов на темпы деструкции при РА (рис. 3) было показано [32], что только под влиянием LEF выраженное уменьшение числа новых эрозий отмечается уже в первые 6 месяцев лечения. Под влиянием всех других базисных средств, включая Метотрексат, в первое полугодие терапии темп прогрессирования деструктивного артрита значительно не меняется и только к 12 месяцам успешной терапии можно зарегистрировать подавление прогрессирования деструкции в суставах кистей и стоп, а наиболее отчетливое подавление деструкции при приеме различных БПВП можно зарегистрировать только через 18 месяцев успешной терапии. Судя по быстрому снижению концентрации СРБ под влиянием лефлуномида, можно утверждать, что Арава быстрее других базисных средств подавляет ревматоидное воспаление в синовиальной оболочке, что и приводит к ранней остановке прогрессирования деструкции. Впервые нами продемонстрировано заживление костной эрозии у больного с тяжелым РА (исходное число эрозий более 100), на фоне ремиссии отмечено заживление эрозии в крючковидной кости левого запястья через 18 месяцев приема LEF (рис. 4) [33].
4) [33].
Лефлуномид возможно применять в длительные сроки (в исследованиях до 5 лет) без развития вторичной неэффективности (рис. 5), что очень важно с учетом хронического характера течения РА [34, 35].
Основной отдаленной целью терапии при РА является сохранение функциональной способности больного, предупреждение развития инвалидности. Поэтому особый интерес представляет влияние терапии лефлуномидом на функциональное состояние больных, оцениваемое по стандартным тестам (HAQ, SF-36): уже через 6 месяцев только у 10% больных средний балл индекса HAQ-DI составлял 1,6–2,1; а средний балл 0,5 (то есть практически полное отсутствие функциональной недостаточности) отмечалось у 54% больных [36]. При оценке качества жизни больных РА по тесту SF-36 уже через 6 месяцев достигнуто достоверное улучшение по 5 из 8 доменов (данные Института ревматологии РАМН). Сравнение влияния на качество жизни лефлуномида и Метотрексата за 1–2 года терапии было продемонстрировано преимущество лефлуномида с достоверным улучшением по 3 из 8 доменов (телесная боль, жизнеспособность и ролевое эмоциональное функционирование) (рис. 6) [37]. Как видно из рисунка, при приеме LEF в ряде доменов качество жизни пациентов приблизилось к популяционной норме.
6) [37]. Как видно из рисунка, при приеме LEF в ряде доменов качество жизни пациентов приблизилось к популяционной норме.
Еще одним аспектом использования лефлуномида при РА является комбинация препарата с другими БПВП. При недостаточности эффекта базисного средства такой подход обеспечивает оптимизацию терапии. В опубликованном в 2005 году исследовании были оценены возможности Аравы при комбинированном базисном лечении. Арава была назначена 968 больным РА, из которых у 672 развился клинический эффект. Остальные больные при недостаточности эффекта по критериям DAS28 были разделены на две группы: 1-я группа больных получала лефлуномид в комбинации с Сульфасалазином, 2-я группа — Сульфасалазин и плацебо. Через 24 недели зарегистрировано достоверно более выраженное снижение активности при комбинации базисных средств по сравнению с монотерапией Сульфасалазином [38]. В другом исследовании продемонстрирован достоверно более выраженный эффект комбинации лефлуномида (10–20 мг/сут) и Метотрексата (10–20 мг/нед) по сравнению с монотерапией Метотрексатом (рис. 7) [39]. Возможно использование LEF и в комбинации с генно-инженерными биологическими препаратами: адалимумабом, тоцилизумабом и абатацептом. Менее желательно комбинировать LEF с инфликсимабом, хотя имеются сообщений об удачном использовании и этой комбинации [40].
7) [39]. Возможно использование LEF и в комбинации с генно-инженерными биологическими препаратами: адалимумабом, тоцилизумабом и абатацептом. Менее желательно комбинировать LEF с инфликсимабом, хотя имеются сообщений об удачном использовании и этой комбинации [40].
Отмечается хорошая переносимость лефлуномида в сроки лечения до 2–3 лет, как по данным отечественных, так и зарубежных авторов [31, 41]. Среди наших 50 больных лефлуномид был отменен из-за диареи в 1 случае и из-за кожного зуда у 6 больных, причем отмена препарата вследствие непереносимости потребовалась только у лиц старше 50 лет [28]. У половины больных, получавших LEF, в первые месяцы лечения отмечается повышенное выпадение волос, не потребовавшее отмены лечения. Примерно у 10% больных при назначении LEF может появиться артериальная гипертензия (или измениться течение существовавшей артериальной гипертензии), что требует мониторирования артериального давления и коррекции антигипертензивной терапии. Повышение печеночных ферментов отмечается реже, чем при приеме MTX, однако необходим регулярный мониторинг за уровнем аспартатаминотрансферазы и аланинаминотрансферазы (рис. 8). Развитие инфекционных заболеваний требует перерыва в лечении Аравой до купирования инфекции, далее можно продолжать лечение в обычной суточной дозе. Частота развития реакций непереносимости в контролируемых исследованиях лефлуномида показала, что переносимость лефлуномида не уступает переносимости Метотрексата [30, 35, 42].
8). Развитие инфекционных заболеваний требует перерыва в лечении Аравой до купирования инфекции, далее можно продолжать лечение в обычной суточной дозе. Частота развития реакций непереносимости в контролируемых исследованиях лефлуномида показала, что переносимость лефлуномида не уступает переносимости Метотрексата [30, 35, 42].
Таким образом, лефлуномид является активным базисным противовоспалительным препаратом более чем у 90% больных РА. Препарат отличается быстрым развитием эффекта как в отношении параметров активности РА, так и в отношении прогрессирования деструкции, что приводит к стойкому улучшению функции опорно-двигательного аппарата и улучшения качества жизни больных. Побочные реакции на фоне лефлуномида развиваются редко и в большинстве случаев не ведут к его отмене.
Литература
- Aletaha D., Neogi T., Silman A. J. et al. 2010 rheumatoid arthritis classification criteria: an American College of Rheumatology/European League Against Rheumatism collaborative initiative // Ann.
 Rheum. Dis. 2010, 69: 1580–1588.
Rheum. Dis. 2010, 69: 1580–1588. - Smolen J. S., Landeve R., Breedveld F. C. et al. EULAR recommendation for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs // Ann. Rheum. Dis. 2010, 69: 964–975.
- Emery P., Breedveld F. C., Hall S. et al. Comparison of methotrexate monotherapy with a combination of methotrexate and etanercept in active, early, moderate to severe rheumatoid arthritis (COMET): a randomized, double-blind, parallel treatment trial // Lancet. 2008, 372: 375–382.
- Nandi P., Kingsley G. H., Scott D. L. Disease-modifying antirheumatic drugs other than methotrexate in rheumatoid arthritis and seronegative arthritis // Curr. Opin. Rheumatol. 2008, 20: 251–256.
- Plosker G. L., Croom K. F. Sulphasalazine: a review of its use in the management of rheumatoid arthritis // Drugs. 2005, 65: 1825–1849.
- Dougados M., Emery P.
 , Lemmel E. M. et al. Efficacy and safety of leflunomide and predisposing factors for treatment response in patients with active rheumatoid arthritis: RELIF 6-month data // J. Rheum. 2003, 30: 2672–2579.
, Lemmel E. M. et al. Efficacy and safety of leflunomide and predisposing factors for treatment response in patients with active rheumatoid arthritis: RELIF 6-month data // J. Rheum. 2003, 30: 2672–2579. - Smolen J. S., Aletha D., Bijsma J. W. J. et al. Treating rheumatoid arthritis to target: recommendations of an international task force // Ann. Rheum. Dis. 2010, 69: 631–637.
- Lard L. R., Visser H., Speyer I. et al. Early versus delayed treatment un patients with recent-onset rheumatoid arthritis: comparison of two cohorts who received different treatment strategies // Amer. J. Med. 2001, V. 111: 446–451.
- Grigor C., Capell H., Stirling A. et al. Effect of treatment strategy of tight control of rheumatoid arthritis (the TIСORA study): a single-blind randomised controlled trial // Lancet. 2004, 364: 263–269.
- Korpela M., Laansonen L., Hannonen P. et al. Retardation of joint damage in patients with early rheumatoid arthritis by initial aggressive treatment with disease-modifying antirheumatic drugs: five-year experience from FIN-RACo study // Arthr.
 Rheum. 2004, 50: 2072–2081.
Rheum. 2004, 50: 2072–2081. - Goekoop-Ruiterman Y. P., de Vries-Bouwstra J. K., Allaart C. F. et al. Comparison of treatment strategies in early rheumatoid arthritis: a randomized trial // Ann. Intern. Med. 2007, 146: 406–415.
- Verstappen S. M. M., Jacobs J. W., van der Veen M. J. et al. Intensive treatment with methotrexate in early rheumatoid arthritis: aiming for remission. Computer Assisted Management in Early Rheumatoid Arthritis (CAMERA, an open-label strategy trial) // Ann. Rheum. Dis. 2007, 66: 1443–1449.
- Bakker M. F., Jacobs W. C., Welsing P. M. J. et al. Early clinical response to treatment predict 5-year outcome in RA patients: follow-up results from the CAMERA st4 // Ann. Rheum. Dis. 2011, 70: 1099–1103.
- Saag K. G., Teng G. G., Patkar N. M. et al. American College of Rheumatology 2008 Recommendations for the Use of Nonbiologic and Biologic Disease-Modifying Antirheumatic Drugs in Rheumatoid Arthritis // Arthr.
 Care and Res. 2008, 59: 762–784.
Care and Res. 2008, 59: 762–784. - Donanue K. E., Gartlenhar G., Jonas D. E. et al. Systematic review: comparative effectiveness and harms of disease-modifying medications for rheumatoid arthritis // Ann. Int. Med. 2008, 148: 124–134.
- Weinblatt M. E. Efficacy of methotrexate in rheumatoid arthritis // Br. J. Rheum. 1995, 34 (Suppl. 2): 43–48.
- Visser K., van der Heijde D. Optimal dosage and route of administration of methotrexate in rheumatoid arthritis: a systematic review of the literature // Ann. Rheum. Dis. 2009, 68: 1094–1099.
- Pincus T., Yazici Y., Sokka T. et al. Methotrexate as the anchor drug. for the treatment of early rheumatoid arthritis // Clin. Exp. Rheum. 2003, 21 (Supl. 31): S178–185.
- Chan E. S. L., Cronstein B. N. Molecular action of methotrexate in inflammatory diseases // Arthr. Res. 2002, 4: 266–273.
- Aletaha D., Smolen J. S. Effectiveness profiles and dose dependent retention of traditional disease modifying antirheumatic drugs for rheumatoid arthritis.
 An observational study // J. Rheum. 2022, 29: 1631–1638.
An observational study // J. Rheum. 2022, 29: 1631–1638. - Braun J., Kastner P., Flaxenberg P. et al. Comparison of the clinical efficacy and safety of subcutaneous versus oral administration of methotrexate in patients with active rheumatoid arthritis // Arthr. Rheum. 2008, 58: 73–81.
- Silva H. T., Morris Jr. E. Leflunomide and malononitroamides // Exp. Opin. Invest Drugs. 1997, 6, 51–64.
- Ruckemann K., Fairbanks L., Carrey E. et al. Leflunomide inhibits pyrimidine de novo synthesis in mitogen-stimulated T-lymphocytes from healthy humans // J Biol. Chem. 1998; 273: 21682–21691.
- Cuoto M., Sulli A., Ghiorzo P. et al. Anti-inflammatory effects of leflunomide on cultured synovial macrophages from patients with rheumatoid arthritis // Ann Rheum Dis. 2003; 62: 297–302.
- Cohen S., Weaver A., Schiff M., Strand V. Two-year treatment of active RA with leflunomide compared with placebo or methotrexate // Arthritis rheum.
 1999; 159: 2542–2550.
1999; 159: 2542–2550. - Strand V., Cohen S., Shiff M. et al. Treatment of active rheumatoid arthritis with leflunomide compared with placebo and methotrexate // Arch Inter Med. 1999; 2542–2550.
- Emery P., Breedveld F. C., Lemmel E. M. et al. A comparation of the efficacy and safety of leflunomide and methotrexate for the treatment of rheumatoid arthritis // Rheumatology (Oxford). 2000; 39: 655–665.
- Чичасова Н. В., Бродецкая К. А., Иголкина Е. В. и др. 18-месячное применение лефлуномида — клиническая эффективность, переносимость и влияние на прогрессирование эрозивного артрита у больных РА // Научно-практическая ревматология. 2004, № 2. Тезисы «Школы молодых ревматологов. № 11, с. 124.
- Smolen J. S., Kalden J. R., Scott D. L., Rozman B., Kvien T. K., Larsen A. et al. Sulphasalasine in active rheumatoid arthritis: a double-blind, randomized, multicenter trial. European Leflunomide Study Group // Lancet.
 1999; 353: 259–266.
1999; 353: 259–266. - Emery P., Breedveld F. C., Lemmel E. M. et al. A comparation of the efficacy and safety of leflunomide and methotrexate for the treatment of rheumatoid arthritis // Rheumatology (Oxford). 2000; 39: 655–665.
- Osiri M., Shea B., Robinson V. et al. Leflunomide for the treatment of RA: A systematic review and metaanalysis // J. Rheumatology. 2003: 30: 6.
- Чичасова Н. В., Чижова К. А., Иголкина Е. В. и др. Новый базисный препарат для лечения ревматоидного артрита — Арава (лефлуномид): опыт многомесячного применения // РМЖ. 2004, т. 12, 2 (202), с. 124–128.
- Chichasova N., Brodetskaya K., Igolkina E. et al. Leflunomide for the treatment of rheumatoid arthritis during 18 months: the clinical efficacy, safety and influence on radiological progression // Annals of Rheumatic Diseases. 2004, vol. 673, Suppl. 1, p. 530 (AB0062).
- Scott D. L., Smolen J. S., Kalden J.
 R. et al. Treatment of active rheumatoid arthritis with leflunomide: two year follow up of a double-blind, placebo-controlled trial versus sulfasalasine // Ann Rheum Dis. 2001; 60: 913–923.
R. et al. Treatment of active rheumatoid arthritis with leflunomide: two year follow up of a double-blind, placebo-controlled trial versus sulfasalasine // Ann Rheum Dis. 2001; 60: 913–923. - Kalden J. R., Schattenkirchner M., Sorensen H., Emery P., Deighton C., Rozman B., Bredveld F. The efficacy and safety of leflunomide in patients with active rheumatoid arthritis: a five-year follow-up // Arthritis Rheum. 2003; 48: 1513–1520.
- Strand V., Cohen S., Shiff M. et al. Treatment of active rheumatoid arthritis with leflunomide compared with placebo and methotrexate // Arch Inter Med. 1999; 159: 2542–2550.
- Strand V., Scott D. L., Emery P. et al. Physical function and health related quality of life analysis of 2-year data from randomized, controlled studies of leflunomude, sulfasalazine, or methotrexate in patients with active rheumatoid arthritis // J. Rheum. 2005, 32: 590–601.
- Dougados M., Emery P.
 , Lemmel E. M. et al. When a DMARD fails, shoud patients switch to sulfasalazine or add sulfasalazine to continuing leflunomide? // Ann. Rheum. Dis. 2005, 64: 44–51.
, Lemmel E. M. et al. When a DMARD fails, shoud patients switch to sulfasalazine or add sulfasalazine to continuing leflunomide? // Ann. Rheum. Dis. 2005, 64: 44–51. - Kremer J. M., Genovese M. C., Cannon G. W. et al. Combination leflunomide and methotrexate (MTX) therapy for patients with active rheumatoid arthritis failing MTX monotherapy: open-label extension of a randomized, double-blind, placebo controlled trial // J. Rheum. 2004, v. 31: 1521–1531.
- Hansen K. E., Cush J., Singhal A. et al. Safety and efficacy of leflunomide in combination with infliximab in rheumatoid arthritis // Arthr. Rheum. 2004, v. 51: 228–232.
- Чичасова Н. В., Насонов Е. Л. Лефлуномид в лечении ревматических заболеваний. М.: МегаПро, 2010, 110 с.
- Smolen J. S., Kalden J. R., Scott D. L., Rozman B., Kvien T. K., Larsen A. et al. Efficacy and safety of leflunomide compared with placebo and sulphasalasine in active rheumatoid arthritis: a double-blind, randomized, multicenter trial.
 European Leflunomide Study Group // Lancet. 1999; 353: 259–266.
European Leflunomide Study Group // Lancet. 1999; 353: 259–266.
Н. В. Чичасова, доктор медицинских наук, профессор
ГБОУ ВПО Первый МГМУ им. И. М. Сеченова Минздравсоцразвития России, Москва
Контактная информация об авторе для переписки: [email protected]
Тест на С-реактивный белок — Клиника Майо
Обзор
С-реактивный белок (СРБ) — это белок, вырабатываемый печенью. Уровень CRP повышается при воспалении в организме. Простой анализ крови может проверить уровень С-реактивного белка.
Высокочувствительный тест на С-реактивный белок (вч-СРБ) более чувствителен, чем стандартный тест на С-реактивный белок. Это означает, что высокочувствительный тест может обнаружить меньшее увеличение С-реактивного белка, чем стандартный тест.
Тест hs-CRP может помочь выявить риск развития ишемической болезни сердца. При коронарной болезни артерии сердца сужаются. Сужение артерий может привести к сердечному приступу.
При коронарной болезни артерии сердца сужаются. Сужение артерий может привести к сердечному приступу.
Для чего это делается
Ваш лечащий врач может назначить анализ на С-реактивный белок по адресу:
- Проверить на инфекцию.
- Помощь в диагностике хронического воспалительного заболевания, такого как ревматоидный артрит или волчанка.
- Узнайте свой риск сердечных заболеваний.
- Узнайте свой риск второго сердечного приступа.
Заметка о тестах на СРБ при сердечных заболеваниях
Высокий уровень hs-CRP в крови связан с повышенным риском сердечных приступов. Кроме того, люди, перенесшие сердечный приступ, с большей вероятностью перенесут повторный сердечный приступ, если у них высокий уровень hs-CRP . Но их риск снижается, когда их уровень hs-CRP находится в типичном диапазоне.
Тест hs-CRP подходит не всем. Тест не показывает причину воспаления. Так что можно получить высокие hs-CRP , не влияя на сердце.
Тест hs-CRP может быть наиболее полезен для людей, у которых вероятность сердечного приступа в течение следующих 10 лет составляет от 10% до 20%. Это известно как промежуточный риск. Медицинский работник может определить ваш риск с помощью тестов, которые учитывают ваш образ жизни, семейный анамнез и общее состояние здоровья.
Дополнительная информация
- Болезнь Стилла у взрослых
- Гигантоклеточный артериит
- Ювенильный идиопатический артрит
- Ревматическая полимиалгия
- Артериит Такаясу
Записаться на прием в клинику Майо
Из клиники Майо на ваш почтовый ящик
Зарегистрируйтесь бесплатно и будьте в курсе научных достижений, советов по здоровью и актуальных тем, связанных со здоровьем, таких как COVID-19, а также экспертных знаний по управлению здоровьем.
Чтобы предоставить вам наиболее актуальную и полезную информацию, а также понять, какие информация полезна, мы можем объединить вашу электронную почту и информацию об использовании веб-сайта с другая информация о вас, которой мы располагаем. Если вы пациент клиники Майо, это может включать защищенную информацию о здоровье. Если мы объединим эту информацию с вашей защищенной медицинской информации, мы будем рассматривать всю эту информацию как информацию и будет использовать или раскрывать эту информацию только так, как указано в нашем уведомлении о практики конфиденциальности. Вы можете отказаться от получения сообщений по электронной почте в любое время, нажав на ссылка для отписки в письме.
Как вы готовитесь
Тяжелые упражнения, такие как интенсивные силовые тренировки или длительный бег, могут вызвать внезапный скачок уровня С-реактивного белка. Ваш поставщик медицинских услуг может попросить вас избегать таких действий перед тестом.
Ваш поставщик медицинских услуг может попросить вас избегать таких действий перед тестом.
Некоторые лекарства могут влиять на уровень CRP . Расскажите своему поставщику медицинских услуг о лекарствах, которые вы принимаете, в том числе о тех, которые вы купили без рецепта.
Если ваш образец крови будет использоваться для других анализов, вам может потребоваться воздержаться от еды и питья в течение периода времени до анализа. Например, если у вас есть hs-CRP для проверки сердечно-сосудистых заболеваний, у вас может быть тест на холестерин, который требует поста, в то же время.
Ваш лечащий врач расскажет вам, как подготовиться к тесту.
Что вы можете ожидать
Чтобы взять образец вашей крови, медицинский работник вводит иглу в вену на вашей руке, обычно на сгибе локтя. Образец крови отправляется в лабораторию для анализа. Вы можете сразу же вернуться к своей обычной деятельности.
Результаты
Получение результатов может занять несколько дней. Ваш поставщик медицинских услуг может объяснить, что означают результаты теста.
С-реактивный белок измеряется в миллиграммах на литр (мг/л). Результаты, равные или превышающие 8 мг/л или 10 мг/л , считаются высокими. Значения диапазона варьируются в зависимости от лаборатории, проводящей тест.
Высокий результат теста является признаком воспаления. Это может быть связано с серьезной инфекцией, травмой или хроническим заболеванием. Ваш поставщик медицинских услуг может порекомендовать другие тесты для определения причины.
Результаты теста hs-CRP обычно представлены следующим образом:
- Более низкий риск сердечных заболеваний: Менее 2,0 мг/л
- Более высокий риск сердечных заболеваний: Равен или выше 2,0 мг/л
Уровни CRP человека меняются со временем. Оценка риска ишемической болезни сердца должна основываться на среднем значении двух тестов hs-CRP . Лучше всего, если они будут сняты с интервалом в две недели. Значения выше 2,0 мг/л может означать повышенный риск сердечных приступов или риск повторного сердечного приступа.
Оценка риска ишемической болезни сердца должна основываться на среднем значении двух тестов hs-CRP . Лучше всего, если они будут сняты с интервалом в две недели. Значения выше 2,0 мг/л может означать повышенный риск сердечных приступов или риск повторного сердечного приступа.
Уровень Hs-CRP является лишь одним из факторов риска ишемической болезни сердца. Наличие высокого уровня hs-CRP не всегда означает более высокий риск развития сердечных заболеваний. Результаты других тестов могут помочь определить риск.
Поговорите со своим лечащим врачом о факторах риска сердечно-сосудистых заболеваний и способах их предотвращения. Изменения образа жизни или лекарства могут помочь снизить риск сердечного приступа.
Персонал клиники Мэйо
Похожие
Лечение ревматоидного артрита | Arthritis Foundation
Лечение ревматоидного артрита
Узнайте, какие медицинские препараты доступны для лечения ревматоидного артрита и что вы можете сделать, чтобы справиться со своим заболеванием.
Мэри Энн Данкин | 12 июня 2022 г.
Чтобы взять под контроль ревматоидный артрит (РА) и воспаление, которое его подпитывает, необходимы лекарства, физическая активность и здоровый образ жизни. Вам следует тесно сотрудничать со своим врачом и другими медицинскими работниками, чтобы составить план лечения, который будет вам подходить.
Целью лечения ревматоидного артрита является
- Уменьшение боли и скованности
- Замедление или остановка прогрессирования заболевания
- Предотвращение повреждения суставов
- Улучшите физическую функцию, чтобы вы могли выполнять обычную повседневную деятельность
- Снятие усталости и слабости
Лекарства являются неотъемлемой частью лечения большинства людей с РА. Ваш план лечения, скорее всего, будет включать некоторые из следующих действий:
- НПВП. Нестероидные противовоспалительные препараты (НПВП) в низких дозах могут быть эффективными для облегчения боли.
 В более высоких дозах, отпускаемых по рецепту, они также могут помочь контролировать воспаление.
В более высоких дозах, отпускаемых по рецепту, они также могут помочь контролировать воспаление. - БПВП. Обычные синтетические противоревматические препараты, модифицирующие заболевание (БПВП), в первую очередь метотрексат, могут быть первым лекарством, которое вам назначают для замедления активности заболевания при РА. Другие DMARD, используемые при лечении РА, включают лефлуномид, гидроксихлорохин и сульфасалазин. Иногда два или более DMARD используются вместе.
- Биопрепараты. Биопрепараты представляют собой генетически модифицированные белки, воздействующие на определенные части иммунной системы, которые вызывают воспаление. Обычно они используются, если ваше заболевание не поддается лечению обычными БПВП. Различные биологические препараты действуют в организме по-разному, поэтому, если один не работает, другой может. Все они вводятся в виде инъекций или инфузий.
- Ингибиторы янус-киназы (JAK). Новейший класс препаратов для лечения ревматоидного артрита, ингибиторов JAK блокирует ферменты янус-киназы 1 (JAK1), JAK2, JAK3 и тирозинкиназы 2, которые играют роль в передаче клеточных сигналов, что приводит к наблюдаемым воспалительным и иммунным реакциям.
 в РА и других условиях. В настоящее время для лечения РА используются три ингибитора JAK: тофацитиниб ( Xeljanz ), барацитиниб ( Olumiant ) и упадацитиниб ( Rinvoq ). Их принимают внутрь.
в РА и других условиях. В настоящее время для лечения РА используются три ингибитора JAK: тофацитиниб ( Xeljanz ), барацитиниб ( Olumiant ) и упадацитиниб ( Rinvoq ). Их принимают внутрь. - Анальгетики. Обезболивающее ацетаминофен может облегчить боль, если вы не можете принимать НПВП. Это не уменьшит воспаление.
- Кортикостероиды. Подобно кортизону, вырабатываемому организмом естественным путем, кортикостероидные препараты являются мощными противовоспалительными средствами. Ваш врач может назначить пероральные кортикостероиды для уменьшения воспаления, которое может привести к повреждению суставов и органов, обычно в то время, когда вы ждете, пока подействуют более медленно действующие лекарства, модифицирующие заболевание.
Каждое лекарство сопряжено с риском и возможными побочными эффектами. Важно спросить своего врача о рисках, связанных с приемом лекарств, и о том, что делать, если вы испытываете побочные эффекты.
Регулярная физическая активность является важной частью вашего общего плана лечения. Это может помочь сохранить диапазон движений в суставах и укрепить мышцы, которые их поддерживают.
Многим людям с ревматоидным артритом полезно работать с опытным физиотерапевтом (ПТ). PT может составить для вас программу силы и подвижности и показать вам, как двигаться так, чтобы это помогало и не наносило дальнейшего ущерба. Физиотерапевт также может научить вас методам обезболивания и прописать шины и скобы для поддержки поврежденных суставов.
В дополнение к упражнениям, назначенным физиотерапевтом, вы можете выполнять множество упражнений самостоятельно, чтобы сохранить или улучшить подвижность суставов, нарастить мышечную массу, укрепить сердечно-сосудистую систему и улучшить общее состояние здоровья и самочувствия. Правильный для вас вид деятельности зависит не только от того, какие суставы поражены и тяжести вашего заболевания, но и от ваших интересов. Лучшие упражнения — это те, которые вам нравятся, и вы можете делать их регулярно. Популярные и безопасные варианты для людей с РА включают ходьбу, плавание, водные упражнения, аэробику с низким уровнем воздействия и езду на велосипеде.
Лучшие упражнения — это те, которые вам нравятся, и вы можете делать их регулярно. Популярные и безопасные варианты для людей с РА включают ходьбу, плавание, водные упражнения, аэробику с низким уровнем воздействия и езду на велосипеде.
Вы должны поговорить со своим врачом, прежде чем начинать какой-либо новый план упражнений.
Жизнь с ревматоидным артритомНаряду с физиотерапией и лекарствами, вы можете самостоятельно заниматься многими вещами, чтобы следить за своим здоровьем и чувствовать себя лучше в целом.
Будьте активны
- Принимайте активное участие в принятии решений о лечении и научитесь хорошо управлять собой.
- Соберите команду медиков, которой вы доверяете.
- Следите за симптомами, лекарствами, побочными эффектами и уровнем боли.
- Проходите регулярные осмотры и делайте прививки.
- Задавайте вопросы и делитесь опасениями со своей медицинской командой.

Бросьте курить
Если вы курите, бросьте. Курение усиливает воспаление и может привести к более тяжелому РА. Исследования показывают, что это может также повлиять на вашу реакцию на лечение, что затрудняет контроль над ревматоидным артритом. Кроме того, это может увеличить риск других проблем со здоровьем, связанных с артритом.
Использование устройств самопомощи
Если у вас ограниченная подвижность, устройства самопомощи могут облегчить ваши повседневные задачи. Эрготерапевт может посоветовать вам вспомогательные средства и вспомогательные устройства.
Стремление к эмоциональному благополучию
Чувство грусти, беспокойства или беспокойства — все это обычные реакции на наличие хронического заболевания. Воспаление в основе РА также может способствовать депрессии, которая чаще встречается у пациентов с РА, чем среди населения в целом. Но вы можете научиться справляться с артритом, улучшать настроение и избавляться от беспокойства.
Общайтесь со своим партнером
Ограниченное движение, особенно в тазобедренном суставе, может мешать сексуальной активности. Может помочь дополнительное планирование и общение. Обсуждение своих потребностей с партнером поможет вам преодолеть практически любые трудности.
Обеспечение рабочего места
Большинство людей с ревматоидным артритом могут продолжать продуктивный и активный график работы. Независимо от того, работаете ли вы дома или вне дома, следующие советы могут вам помочь.
- Не поднимайте, не наклоняйтесь и не оставайтесь в сжатом или согнутом положении.
- Поднимите монитор компьютера на уровень глаз, чтобы у вас была правильная осанка.
- Часто меняйте положение и передвигайтесь не реже одного раза в час.
- Используйте подушку, когда сидите, чтобы поддерживать спину.
- Поддерживайте темп и делайте короткие перерывы в течение дня.
Если работа и домашние дела сложны или причиняют боль, поработайте с эрготерапевтом, который может дать индивидуальный совет и предоставить вспомогательные средства.
Хорошо питайтесь
Диета не может вылечить ревматоидный артрит, и не существует специальной диеты для облегчения симптомов. Тем не менее, план питания, богатый овощами, фруктами, рыбой и полезными жирами, такими как оливковое масло, поможет поддерживать здоровый образ жизни в целом и может помочь предотвратить обострение воспаления.
Облегчение боли и усталости
Наряду с физическими упражнениями и лекарствами попробуйте эти методы для облегчения боли, усталости и беспокойства.
- Темп активности. Облегчите свой график и обратитесь за помощью, когда вам это нужно. Делайте перерывы в течение дня, чтобы экономить энергию и защищать суставы.
- Горячие и холодные процедуры. Тепло улучшает кровоток, уменьшая скованность суставов. Холод помогает уменьшить отек, сужая кровеносные сосуды. Один или оба могут помочь облегчить боль.
- Техники релаксации.
 Расслабьте мышцы и замедлите мысли. Попробуйте глубокое дыхание, управляемые образы и визуализацию.
Расслабьте мышцы и замедлите мысли. Попробуйте глубокое дыхание, управляемые образы и визуализацию. - Массаж. Массаж может помочь уменьшить боль, улучшить функцию суставов и снять стресс и тревогу.
- Местное лечение. Обезболивающие кремы можно втирать в кожу над болезненным суставом. Они могут содержать НПВП, салицилаты или противораздражающие средства, такие как капсаицин или ментол.
- Акупунктура. Акупунктура – это практика введения тонких игл в специальные точки тела. Некоторые исследования показали, что это может помочь облегчить боль.
В какой-то момент вам, возможно, придется подумать об операции на суставах, чтобы восстановить суставы и улучшить их функцию. Замена тазобедренного и коленного суставов является наиболее распространенной операцией у людей с ревматоидным артритом и весьма эффективной. Но некоторые другие суставы, в том числе суставы рук, также могут быть заменены для улучшения подвижности и облегчения боли.

 Rheum. Dis. 2010, 69: 1580–1588.
Rheum. Dis. 2010, 69: 1580–1588.