Бластный лейкоз острый: Острый лимфобластный лейкоз: симптомы, диагностика, лечение
Острый лимфобластный лейкоз (ОЛЛ) у детей и подростков
Что такое острый лимфобластный лейкоз?
Острый лимфобластный лейкоз (ОЛЛ) — это злокачественное заболевание крови и костного мозга. При лейкозе здоровые клетки крови замещаются опухолевыми клетками, что может стать причиной жара, повышенной утомляемости, синяков, проблем со свертыванием крови, инфекций и других нарушений. Обычно при остром лейкозе симптомы усиливаются в течение короткого периода. У детей болезнь может развиваться очень быстро и требует незамедлительного лечения.
Посмотри это видео
ОЛЛ нарушает процесс созревания белых клеток крови, называемых лимфоцитами. Эти клетки борются с инфекциями и обеспечивают защиту организма от заболеваний. В костном мозге пациентов с ОЛЛ содержится слишком много незрелых белых кровяных клеток (бластов). Такие клетки не способны полноценно функционировать. Они замещают собой нормальные белые и красные кровяные тельца, а также тромбоциты. В результате организму становится сложнее бороться с инфекциями, кожа становится бледной, возникают проблемы со свертыванием крови.
В результате организму становится сложнее бороться с инфекциями, кожа становится бледной, возникают проблемы со свертыванием крови.
виды лимфоцитов
Существует два вида лимфоцитов: В-лимфоциты и Т-лимфоциты. ОЛЛ может развиваться в любом из них, поэтому случаи ОЛЛ также подразделяют на B-клеточный ОЛЛ или T-клеточный ОЛЛ. Наиболее распространенным является В-клеточный ОЛЛ.
подвиды ОЛЛ
ОЛЛ имеет несколько подвидов. Во многих случаях врачи, определяя лечение, учитывают подвид ОЛЛ и сопряженную группу риска. Подробнее см. в разделе, посвященном лечению.
Подвиды ОЛЛ (Всемирная организация здравоохранения, 2016 г.)
В-клеточный лимфобластный лейкоз
В-клеточный лимфобластный лейкоз, без специфических характеристик
В-клеточный лимфобластный лейкоз с рецидивирующими генетическими нарушениями
В-клеточный лимфобластный лейкоз с транслокацией хромосом 9 и 22 (положительный по филадельфийской хромосоме ОЛЛ)
B-клеточный лимфобластный лейкоз с транслокацией KMT 2A
В-клеточный лимфобластный лейкоз с транслокацией хромосом 12 и 21 (ETV6-RUNX1)
В-клеточный лимфобластный лейкоз у детей с 46 нормальными хромосомами (гиподиплоидия)
В-клеточный лимфобластный лейкоз с транслокациями хромосом 5 и 14 (IL3-IGH)
В-клеточный лимфобластный лейкоз с транслокацией хромосом 1 и 19 (TCF3-PBX1).

В-клеточный лимфобластный лейкоз/лимфома (Ph-подобный)
В-клеточный лимфобластный лейкоз/лимфома с iAMP21
Т-клеточный лимфобластный лейкоз
Острый лимфобластный лейкоз из ранних предшественников Т-клеток
Лимфобластный лейкоз/лимфома из естественных клеток-киллеров (ЕК)
ОЛЛ нарушает процесс созревания разновидности белых клеток крови, называемой лимфоцитами. В костном мозге пациентов с ОЛЛ содержится слишком много незрелых белых клеток крови (бластов). Такие клетки не способны полноценно функционировать. Они замещают собой нормальные лейкоциты, эритроциты и тромбоциты.
ОЛЛ является наиболее распространенным онкологическим заболеванием у детей В США ОЛЛ ежегодно диагностируется у порядка 3000 человек моложе 20 лет. Чаще всего заболевание развивается у детей в возрасте от 2 до 5 лет, но также встречается и у детей старшего возраста и подростков. У мальчиков оно возникает несколько чаще, чем у девочек.
Признаки и симптомы острого лимфобластного лейкоза
Возможные признаки и симптомы ОЛЛ:
- Частые инфекции
- Жар
- Легкое появление синяков
- Кровотечения, которые трудно остановить
- Плоские, темно-красные пятна малого размера на коже (петехии), возникающие из-за подкожных кровотечений
- Боль в костях или суставах
- Уплотнения на шее, в подмышечных впадинах, животе или паху
- Боль или ощущение распирания под грудной клеткой
- Ощущение сильной усталости или слабости
- Бледность
- Потеря аппетита
- Одышка
Диагностика острого лимфобластного лейкоза
Для диагностики лейкоза требуется провести исследование костного мозга.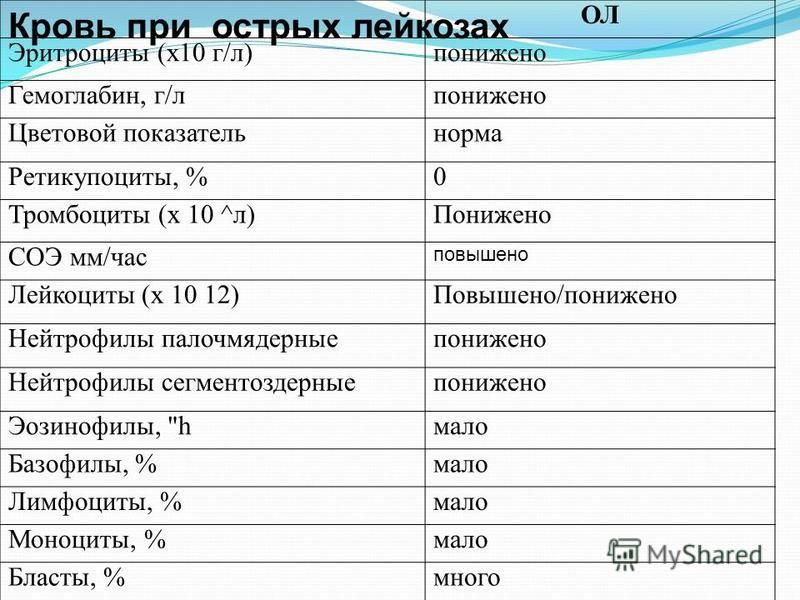 Подозрение на лейкоз может возникнуть после медицинского осмотра, изучения истории болезни и оценки результатов анализа крови. У детей с лейкозом обычно повышено количество белых кровяных телец.
Подозрение на лейкоз может возникнуть после медицинского осмотра, изучения истории болезни и оценки результатов анализа крови. У детей с лейкозом обычно повышено количество белых кровяных телец.
Сначала врач проводит медицинский осмотр и изучает историю болезни пациента. В ходе медицинского осмотра врач проверяет общие показатели здоровья, в том числе наличие признаков заболевания — уплотнений или всего, что кажется необычным. Проводится тщательный осмотр глаз, ротовой полости, кожи и ушей. Может быть выполнено исследование состояния центральной нервной системы. При пальпации брюшной полости пациента врач проверяет, не увеличена ли в размере селезенка или печень.
Изучая историю болезни, врачи смотрят на наличие врожденных патологических состояний, которые могут способствовать развитию заболевания.
 Тем не менее, исследования показали, что только в 8–10% случаев болезнь у детей является наследственной. И сам факт наличия генетического заболевания не означает, что у человека обязательно разовьется опухоль.
Тем не менее, исследования показали, что только в 8–10% случаев болезнь у детей является наследственной. И сам факт наличия генетического заболевания не означает, что у человека обязательно разовьется опухоль.Возможные факторы риска:
- Воздействие рентгеновских лучей до рождения
- Перенесенная химиотерапия или лучевая терапия
Наличие определенных врожденных патологических состояний:
- Синдром Дауна
- Синдром Блума
- Некоторые формы анемии Фанкони
- Атаксия-телеангиэктазия
- Синдром Ли-Фраумени
- Синдром конституционального дефицита репарации неспаренных оснований ДНК (мутации в определенных генах, препятствующие восстановлению ДНК)
- Анемия Даймонда-Блэкфана
- Синдром Швахмана-Даймонда
- Наследственный PAX5-синдром
- Наследственный ETV6-синдром
- Наследственный Sh3B3-синдром
- Воздействие рентгеновских лучей до рождения
Общий клинический анализ крови
Врачи назначат анализ крови, называемый общим клиническим анализом крови.

Биохимический анализ крови
В образце крови измеряют количество определенных веществ, выделяемых в кровь органами и тканями организма. Необычное (выше или ниже нормы) количество вещества может являться признаком заболевания.
Подозрение на лейкоз может возникнуть после медицинского осмотра, изучения истории болезни и оценки результатов анализа крови.
-
Результаты исследований костного мозга, таких как пункция и биопсия костного мозга, используют для подтверждения онкологического диагноза и точного определения заболевания.
 Многим детям эту процедуру проводят во сне (под наркозом). Если пациент бодрствует во время процедуры, ему дают подходящее болеутоляющеесредство..
Многим детям эту процедуру проводят во сне (под наркозом). Если пациент бодрствует во время процедуры, ему дают подходящее болеутоляющеесредство..Костномозговая пункция: с помощью тонкой иглы врачи возьмут образец костного мозга из тазовой кости. Патологоанатом под микроскопом проверит образец костного мозга на наличие признаков опухоли.
На этом микроскопическом изображении показан нормальный, здоровый костный мозг.
На этом микроскопическом изображении показан костный мозг пациента с острым лимфобластным лейкозом.
Биопсия костного мозга: врачи извлекут небольшой фрагмент костной ткани для определения степени распространения опухоли в костном мозге. Обычно биопсия проводится непосредственно до или сразу после пункции.
Как выполняют пункцию/биопсию костного мозга?
- Пациент находится на кровати в положении лежа на боку или — реже — в положении сидя с согнутыми ногами, скрещенными в области голеностопных суставов.

- Врач выполнит пальпацию нижней части спины пациента, чтобы найти правильную точку для выполнения процедуры.
- Затем специалист, проводящий процедуру, надевает перчатки и дезинфицирует кожу на спине пациента с применением антибактериального мыла. После этого спину пациента накрывают специальными полотенцами так, чтобы оставить открытым лишь небольшой участок кожи.
- Если пациент во время пункции или биопсии находится в сознании, примерно за один час до выполнения процедуры на место взятия аспирата костного мозга или биопсии наносят обезболивающий крем. В место проведения процедуры может быть введено жидкое обезболивающее лекарственное средство.
- Медицинский работник вводит иглу в костный мозг через кожу. В случае выполнения и пункции, и биопсии, для каждой процедуры используется отдельная игла.
- Медицинский работник извлекает иглу, дезинфицирует место введения спиртом и накладывает повязку.
Для диагностики лейкоза требуется провести исследование костного мозга.

- Пациент находится на кровати в положении лежа на боку или — реже — в положении сидя с согнутыми ногами, скрещенными в области голеностопных суставов.
При обнаружении опухолевого процесса проводят дополнительные анализы для точного определения вида заболевания. Используют такие исследования:
Для диагностики отдельных видов лейкоза используется иммунофенотипирование: сравнения опухолевых клеток с нормальными клетками иммунной системы.
Такими лабораторными анализами являются иммуногистохимическое исследование и проточная цитометрия.
- Иммуногистохимия — это метод исследования с применением антител для выявления специфических белков в образце ткани. Комплексы белков и антител окрашиваются в коричневый или красный цвет, и их можно заметить под микроскопом.
- При выполнении проточной цитометрии клетки окрашивают светочувствительным красителем, помещают в жидкость и пропускают в потоке перед лазерным или другим световым лучом.
 В ходе исследования измеряют количество клеток, процент живых клеток и некоторые их характеристики, такие как размер, форма и наличие маркеров лейкоза на поверхности клеток.
В ходе исследования измеряют количество клеток, процент живых клеток и некоторые их характеристики, такие как размер, форма и наличие маркеров лейкоза на поверхности клеток.
Цитогенетический анализ включает в себя лабораторные анализы, в ходе которых патологоанатомы изучают определенные изменения в хромосомах.
Одним из применимых анализов является FISH-анализ (флуоресцентная гибридизация in situ). В ходе этого анализа изучаются гены или хромосомы в клетках и тканях. Фрагменты ДНК, содержащие флуоресцентный краситель, изготавливают в лаборатории и добавляют в клетки или ткани на предметном стекле. Когда эти фрагменты ДНК прикрепляются к определенным генам или областям хромосом на предметном стекле, они становятся различимы.
Врач порекомендует провести лабораторные анализы для выявления специфических генов, белков и других факторов, влияющих на развитиелейкоза.
 . Такое исследование важно, поскольку онкозаболевания вызваны ошибками (мутациями) в генах клетки. Выявление этих ошибок способствует диагностике конкретного подвида лейкоза. На основе этой информации врачи могут выбирать варианты лечения, соответствующие конкретному случаю. Детям, у которых лейкоз вызван мутациями с благоприятным прогнозом, назначают менее токсичное лечение. И наоборот, врачи могут назначать более интенсивное лечение, еслилейкозвызван наличием мутаций, имеющих менее благоприятный прогноз. Могут быть выявлены мутации, для которых имеются специальные направленныеметодылечения.
. Такое исследование важно, поскольку онкозаболевания вызваны ошибками (мутациями) в генах клетки. Выявление этих ошибок способствует диагностике конкретного подвида лейкоза. На основе этой информации врачи могут выбирать варианты лечения, соответствующие конкретному случаю. Детям, у которых лейкоз вызван мутациями с благоприятным прогнозом, назначают менее токсичное лечение. И наоборот, врачи могут назначать более интенсивное лечение, еслилейкозвызван наличием мутаций, имеющих менее благоприятный прогноз. Могут быть выявлены мутации, для которых имеются специальные направленныеметодылечения.
Исследования, определяющие степень распространения заболевания:
Люмбальную пункцию выполняют, чтобы взять образец спинномозговой жидкости из позвоночника и определить,распространилась ли опухольна центральную нервную систему.
 Эта процедура также называется «ЛП» или «поясничный прокол».
Эта процедура также называется «ЛП» или «поясничный прокол». Иглу размещают между двумя позвонками и вводят в жидкость в области спинного мозга. Берется образец жидкости. Далее проводят микроскопическое исследование этого образца на наличие признаков распространения лейкозных клеток на головной и спинной мозг. Организм постоянно вырабатывает спинномозговую жидкость, и поэтому небольшое количество, изъятое в ходе ЛП, быстро восстанавливается.
Рентгеновское излучение — это тип пучка энергии, который способен проходить сквозь тело и, попадая на пленку, создавать изображение областей внутри тела на экране компьютера или специальной пленке. Рентгенографию грудной клетки проводят для того, чтобы определить, есть ли новообразование внутри грудной клетки.

Лечение острого лимфобластного лейкоза
Основным методом лечения для детей с ОЛЛ является химиотерапия. Лечение также может включать в себя таргетную терапию, терапию с использованием гемопоэтических клеток (также называемую трансплантацией костного мозга или стволовых клеток), иммунотерапию и лучевую терапию.
Благодаря недавним достижениям в лечении ОЛЛ существует много различных вариантов лечения. Врачи все чаще могут адаптировать лечение для отдельных пациентов в зависимости от их группы риска.
Группа риска
Группа риска означает вероятность того, что опухоль пациента не будет поддаваться лечению (резистентная опухоль), либо заболевание вернется после первоначальной реакции на лечение (рецидив). Пациентам в группах низкого риска обычно проводят менее интенсивную терапию, которая тем не менее успешно справляетсяс опухолью.. Для пациентов в группах высокого риска обычно применяют более агрессивные методы лечения.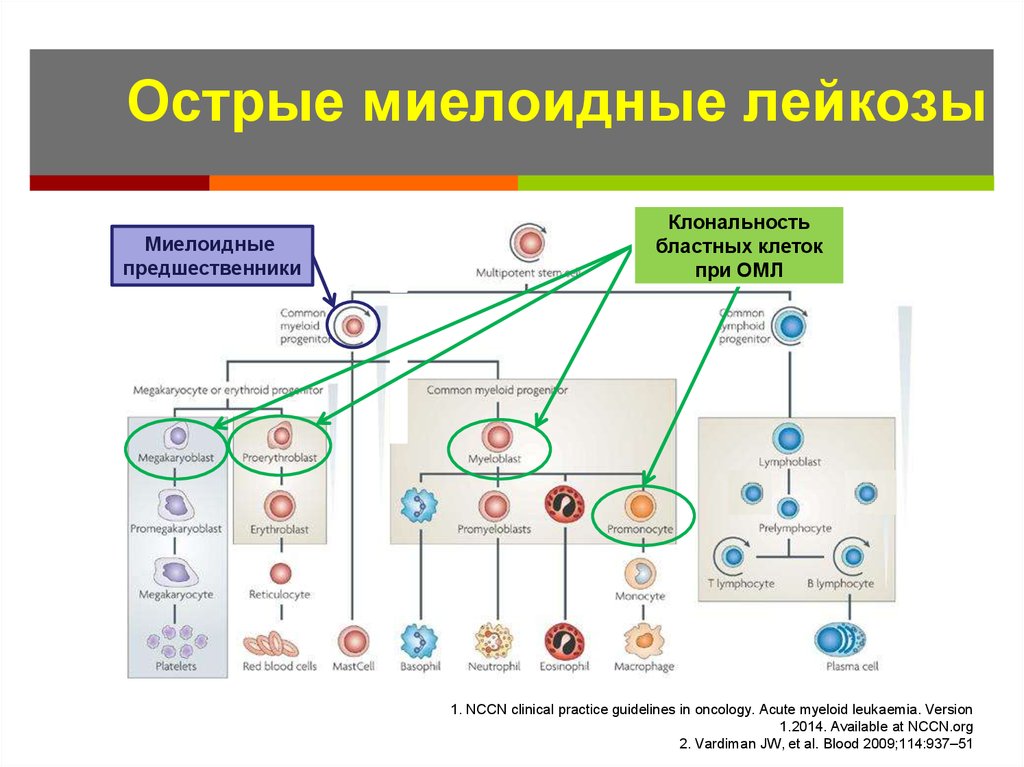
Группу риска определяют следующие факторы:
- Возраст ребенка. Дети в возрасте от 1 до 9 лет с В-клеточным ОЛЛ считаются группой низкого риска. Дети младше 1 года и старше 10 лет считаются группой высокого риска.
- Количество белых кровяных телец на момент постановки диагноза. Дети с числом более 50 000 на кубический миллиметр считаются группой высокого риска.
- Развитиеопухолевого процессав В-лимфоцитах или Т-лимфоцитах. Считается, что для Т-клеточного ОЛЛ характерен более высокий риск.
- Наличие определенных изменений в хромосомах или генах. Считается, что случаи ОЛЛ с наличием гибридного гена ETV6-RUNX1 относятся к группе низкого риска. Считается, что ОЛЛ с наличием филадельфийской хромосомы или транслокацией хромосом 1 и 19, либо включающей хромосому 11, является заболеванием высокого риска, однако при использовании передовых методов терапии прогноз улучшается.
- Количествохромосом. Случаи гипердиплоида (более 50 хромосом) относятся к факторам низкого риска, в то время как случаи гиподиплоида (менее 44 хромосом) относятся к факторам высокого риска.

- Скорость и степень уменьшенияколичества опухолевых (бластных) клетокпосле первоначального лечения. Считается, что случаи,когда количество бластных клеток резко падает в течение первых нескольких недель терапии,характеризуются низким уровнем риска. Во многих детских онкологических центрах используются высокочувствительные тесты для измерения минимальной остаточной болезни (МОБ).
минимальная остаточная болезнь (МОБ)
Минимальная остаточная болезнь (МОБ) — это термин используется, когда бластных клеток в костном мозге так мало, что их невозможно обнаружить с помощью микроскопа. Высокочувствительные тесты, такие как проточная цитометрия, полимеразная цепная реакция (ПЦР) и секвенирование следующего поколения, способны обнаружить 1 бластную клетку на 10 000–100 000 нормальных клеток костного мозга. МОБ-положительные пациенты (более 1 клетки на 10 000 после завершения первой фазы лечения ОЛЛ (индукция)) подвержены наивысшему риску рецидива.
- Наличие бластных клеток в спинномозговой жидкости при постановке диагноза.
 Если клетки распространились, случай относится к высокому риску.
Если клетки распространились, случай относится к высокому риску.
Фазы лечения
( / 5 )
Неделя 1
Диагностическое обследование, подготовка к лечению
Врачи собирают информацию для выбора методов лечения.
- Анализы крови
- Медицинский осмотр и изучение истории болезни
- Рентгенография грудной клетки
- Пункция и/или биопсия костного мозга
- Люмбальная пункция
Перед началом лечения
Пациенту проведут хирургическую операцию для установки подкожной порт-системы илидругого устройства венозного доступадля химиотерапии, введения жидкостей и взятия образцов крови.
Следующие 4-6 недель
Фаза индукции
Целью данной фазы является использование комбинации химиотерапевтических препаратов для уничтожения опухолевых клеток в крови и костном мозге и перевода заболевания в ремиссию. Это фаза интенсивного лечения, и для нее может потребоваться пребывание пациента в стационаре.
Для уничтожения опухолевых клеток в спинномозговой жидкости может быть назначена сохраняющая терапия центральной нервной системы (ЦНС).
Врачи будут наблюдать за реакцией лейкоза на индукционную терапию, чтобы определить, каким образом продолжить лечение.
- Случаи, когда количество бластных клеток резко падает, считаются низким уровнем риска.
- Во многих детских медицинских центрах используются высокочувствительные тесты для измерения минимальной остаточной болезни (МОБ). Положительная МОБ указывает на более высокий риск рецидива и необходимость применения более интенсивной терапии.
- Врачи примут решение о том, требуется ли проведение трансплантации гемопоэтических клеток.
Следующие 8-16 недель
Фаза консолидации/интенсификации
Целью этой более интенсивной фазы является использование другой комбинации препаратов для уничтожения любых оставшихся клеток, способных вызвать рецидив лейкоза. На это время может потребоваться пребывание пациента в стационаре.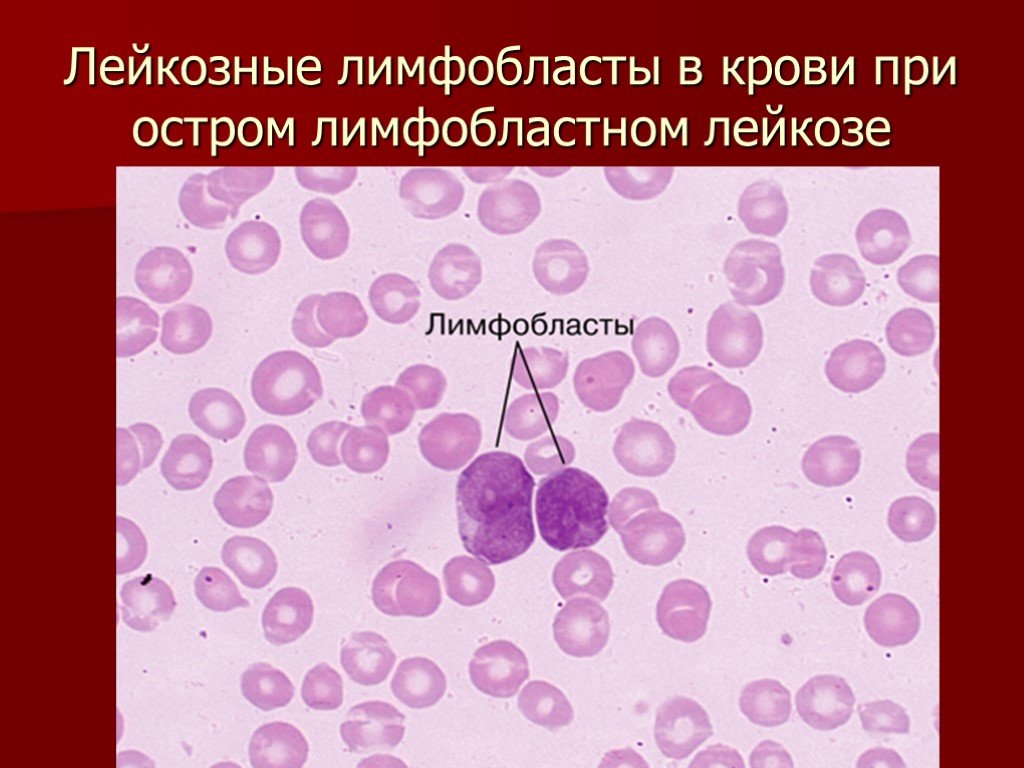
Пациентам с ОЛЛ, положительным по филадельфийской хромосоме, на этой фазе могут назначать иматиниб.
Подробнее о лекарственных препаратах
Следующие 2-3 недели
Фаза стабилизации/продолжения
Еслипосле этих двух стадий лечения ремиссия сохраняется, можно начинать поддерживающую терапию. Ее целью является использование комбинации химиотерапевтических препаратов для уничтожения любых опухолевых клеток, которые могут остаться после первых фаз индукции и консолидации.
В это время еженедельная химиотерапия и анализы крови обычно чередуются с периодами высокодозной химиотерапии — реиндукцией.
Первые 9 месяцев лечения ОЛЛ обычно являются наиболее интенсивными. Часто пациенты могут вернуться в школу после первых 9 месяцев.
График последующего наблюдения
Год 1
Пациент будет посещать врача в рамках последующего наблюдения один раз в 4 месяца.
Во время проверок проводятся такие обследования:
- Осмотр и изучение истории болезни
- Анализы крови и другие лабораторные анализы
Год 2
Частота визитов для последующего наблюдения может быть снижена до одного раза в 6 месяцев.
Годы 3–5
Частота визитов для последующего наблюдения может быть снижена до одного раза в год.
Три фазы лечения
Лечение ОЛЛ включает в себя 3 фазы и длится от 2 до 3 лет. Основным методом лечения ОЛЛ является химиотерапия. В химиотерапии используются мощные лекарственные препараты для остановки роста опухолевых клеток, уничтожая их или препятствуя их делению. Детям чаще всего назначают комбинацию различных лекарственных препаратов. Эти препараты могут вводиться в кровоток (внутривенно), приниматься внутрь (перорально) или же вводиться непосредственно в спинномозговую жидкость (интратекально).
Выбор метода химиотерапии и лекарственных средств зависит от группы риска ребенка. Дети с лейкозом высокого риска обычно получают больше противоопухолевых препаратов и/или более высокие дозы, чем дети с ОЛЛ низкого риска.
1. Индукция
Целью индукционной терапии является уничтожение бластных клеток в крови и костном мозге и перевод заболевания в ремиссию. Эта фаза обычно длится 4–6 недель. В это же время для уничтожения бластных клеток, остающихся в спинномозговой жидкости, может быть назначена сохраняющая терапия центральной нервной системы (ЦНС) (также называемая профилактической терапией ЦНС). В этом случае препараты вводятся в заполненное жидкостью пространство между тонкими слоями ткани, покрывающими спинной мозг (интратекально).
Эта фаза обычно длится 4–6 недель. В это же время для уничтожения бластных клеток, остающихся в спинномозговой жидкости, может быть назначена сохраняющая терапия центральной нервной системы (ЦНС) (также называемая профилактической терапией ЦНС). В этом случае препараты вводятся в заполненное жидкостью пространство между тонкими слоями ткани, покрывающими спинной мозг (интратекально).
Для лечения используется комбинация химиотерапевтических препаратов. Эти препараты могут включать в себя винкристин, стероиды и пэгаспаргазу или аспарагиназу Erwinia, иногда с препаратом антрациклинового ряда, таким как доксорубицин или даунорубицин. В некоторых протоколах во время индукционной терапии применяют схему лечения, включающую циклофосфамид, цитарабин и 6-меркаптопурин.
2. Фаза консолидации/интенсификации
Целью терапии консолидации/интенсификации является уничтожение любых оставшихся клеток, способных к росту и вызывающих рецидив лейкоза. Эта фаза обычно длится 8-16 недель.
Пациенту назначают различные лекарственные средства, такие как циклофосфамид, цитарабин и или 6-меркаптопурин (6-МП). Также может назначаться метотрексат с терапией под защитой лейковорином или без нее.
3. Фаза стабилизации/продолжения
Целью поддерживающей терапии, последней и наиболее долгой фазы, является уничтожение любых опухолевых клеток, которые могли бы выжить после первых 2 фаз. Фаза стабилизации может продолжаться 2 или 3 года.
Эта фаза может включать в себя применение таких препаратов, как метотрексат, винкристин, стероиды, 6-меркаптопурин (6-МП). Пациентам с высоким риском могут назначаться антрациклиновые препараты, циклофосфамид и цитарабин.
Другие методы лечения
Трансплантация гемопоэтических клеток (также называемая трансплантацией костного мозга или стволовых клеток)
Трансплантация гемопоэтических клеток (также называемая трансплантацией костного мозга или стволовых клеток) может быть рекомендована детям с высоким риском рецидива или с резистентным к лечению ОЛЛ. Иногда врачи оценивают эффективность индукционной химиотерапии, чтобы решить, требуется ли трансплантация.
Иногда врачи оценивают эффективность индукционной химиотерапии, чтобы решить, требуется ли трансплантация.
Пациенты с ОЛЛ, у которых лейкоз является резистентным (не поддающимся лечению) или рецидивирующим, могут быть кандидатами на трансплантацию, если их состояние позволяет и найден подходящий донор.
Таргетная терапия
В таргетной терапии используются лекарственные препараты, которые уничтожают раковые клетки, не нанося вреда окружающим здоровым клеткам. Этот тип терапии может применяться только в том случае, когда рак имеет идентифицируемые маркеры, которые реагируют на доступные препараты таргетной терапии.
Иммунотерапия
Иммунотерапия — это метод лечения рака, при котором для борьбы с опухолью задействуется иммунная система. Иммунотерапия помогает иммунной системе находить опухолевые клетки, чтобы атаковать их, и/или повышает способность иммунной системы реагировать на опухоль.
Одна группа препаратов для таргетной терапии называется ингибиторами тирозинкиназы (ИТК). ИТК блокируют активность фермента тирозинкиназы, который иногда характеризуется чрезмерной активностью или высоким содержанием в некоторых опухолевых клетках. Препараты иматиниба мезилат и дазатиниб являются ИТК и применяются для лечения детей с ОЛЛ, положительным по филадельфийской хромосоме. Другие исследуемые ИТК включают руксолитиниб для лечения впервые диагностированного ОЛЛ высокого риска.
ИТК блокируют активность фермента тирозинкиназы, который иногда характеризуется чрезмерной активностью или высоким содержанием в некоторых опухолевых клетках. Препараты иматиниба мезилат и дазатиниб являются ИТК и применяются для лечения детей с ОЛЛ, положительным по филадельфийской хромосоме. Другие исследуемые ИТК включают руксолитиниб для лечения впервые диагностированного ОЛЛ высокого риска.
Еще один тип таргетной терапии называется терапией моноклональными антителами. В нем используются антитела, изготовленные в лаборатории, для идентификации на опухолевых или здоровых клетках веществ, способствующих росту клеток опухоли. Антитела прикрепляются к веществам, ускоряющим развитие опухоли, и убивают опухолевые клетки, блокируют их рост или препятствуют их распространению. Их можно использовать отдельно или для переноса лекарственных препаратов, токсинов или радиоактивных препаратов непосредственно в раковые клетки. Блинатумомаб и инотузумаб представляют собой два моноклональных антитела, которые сейчас изучаются для лечения резистентного к терапии (рефрактерного) ОЛЛ у детей. Кроме того, антитела могут синтезироваться в иммунных клетках, таких как Т-клетки, и заставлять иммунные клетки непосредственно атаковать бластные клетки. Такие Т-клетки называются Т-клетками с химерными антигенными рецепторами (ХАР).
Кроме того, антитела могут синтезироваться в иммунных клетках, таких как Т-клетки, и заставлять иммунные клетки непосредственно атаковать бластные клетки. Такие Т-клетки называются Т-клетками с химерными антигенными рецепторами (ХАР).
В настоящее время изучается добавление бортезомиба и вориностата, препаратов таргетной терапии, к стандартным методам лечения детей с ОЛЛ, поскольку у детей лечение в целом более сложное. Эти препараты могут использоваться в тех случаях, когда заболевание не дает хорошего ответа на лечение.
Прогноз (исход) при лечении острого лимфобластного лейкоза
Около 98% детей с ОЛЛ достигают ремиссии через несколько недель после начала лечения.
Более 90% детей с ОЛЛ могут выздороветь. Пациенты считаются выздоровевшими примерно через 5 лет ремиссии.
Коэффициент выживаемости для пациентов с ОЛЛ в группах низкого риска может составлять более 95%.
Если у пациента резистентная (не дающая ответа на лечение) или рецидивирующая форма ОЛЛ, врачи обсуждают дальнейшие варианты терапии.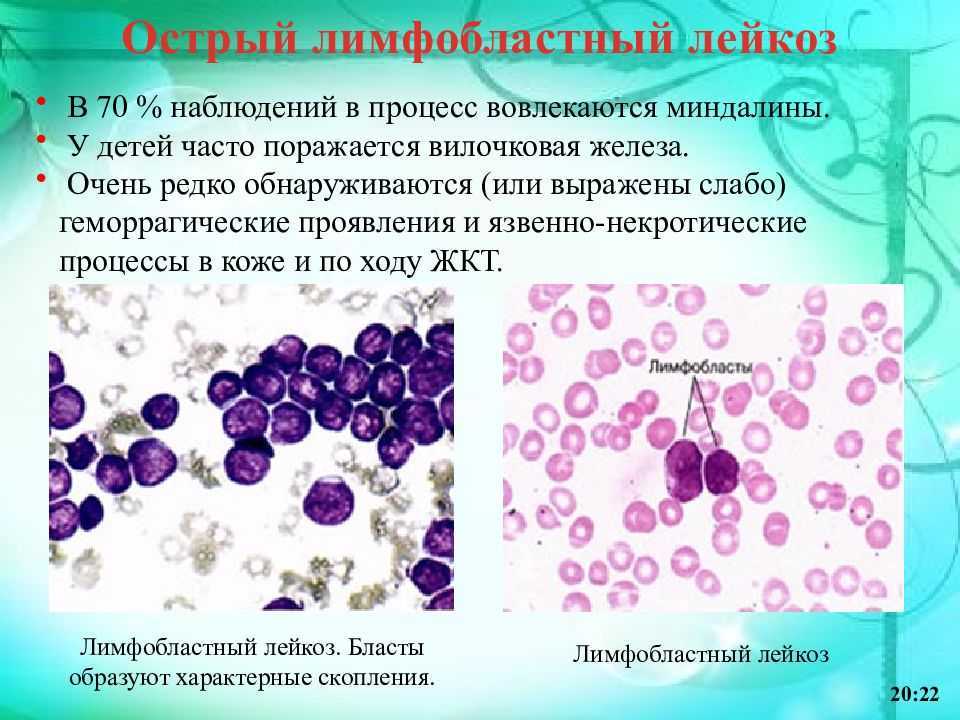
Отдаленные последствия лечения острого лимфобластного лейкоза
Отдаленное последствие — это проблема со здоровьем, возникающая спустя месяцы или годы после диагностирования заболевания или после окончания лечения. Отдаленные последствия могут быть вызваны как самой опухолью, так и ее лечением. Они могут включать в себя физические, психические и социальные проблемы, а также метастазирование.
К отдаленным последствиям относятся:
- Рецидив ОЛЛ
- Вторичные очаги болезни, например рак кожи, головного мозга, костей, молочных желез, мягких тканей и щитовидной железы. Предполагается, что после прекращения применения краниального облучения в качестве стандартного метода лечения ОЛЛ частота появления метастазов в последующие годы сократится.
- Нарушения функции сердца и легких
- Заболевания костей
- Эндокринные заболевания
- Заболевания желудочно-кишечного тракта
- Нарушения психической гибкости, логического мышления, планирования и организации
- Депрессия
- Нарушения сна
Цели современных исследований острого лимфобластного лейкоза
Текущие исследования проводятся в области разработки более эффективных методов лечения детских опухолей, не дающих ответа на первоначальную терапию, и в области разработки новых методов лечения, направленных на уничтожение раковых клеток без нанесения вреда окружающим здоровым клеткам.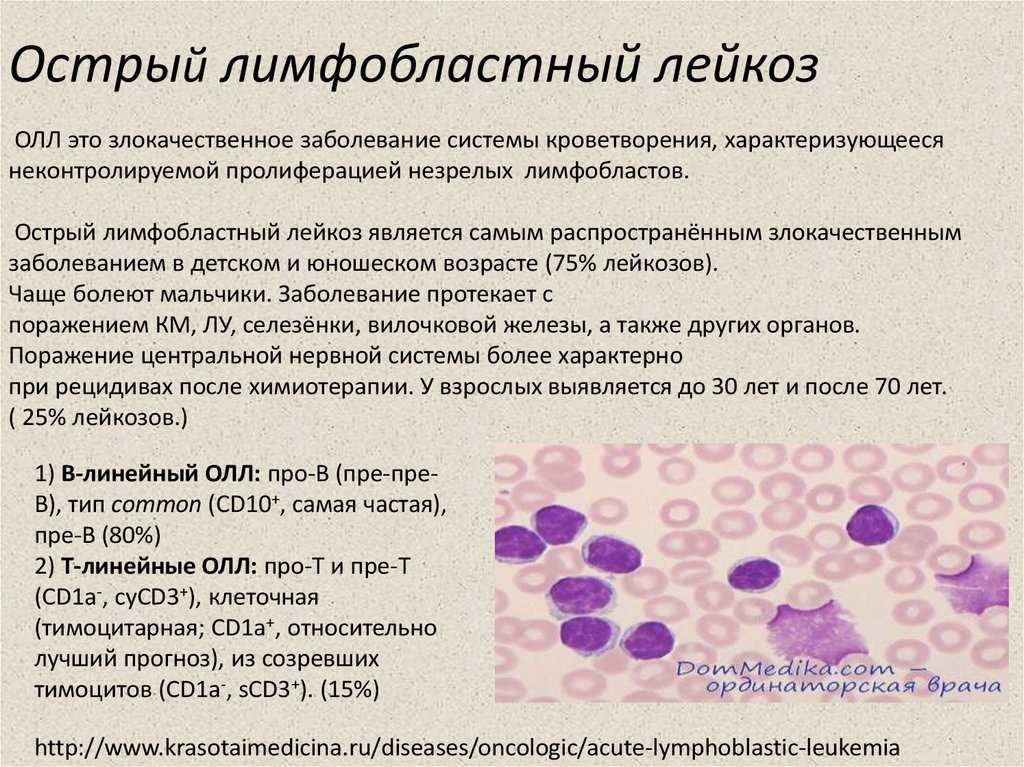 Исследователи также уделяют основное внимание разработке методов лечения, которые вызывают меньше отдаленных последствий у пациентов, перенесших онкозаболевания. Эту проблему помогут решить исследования в области отдаленных последствий среди растущего числа пациентов с долгосрочной выживаемостью.
Исследователи также уделяют основное внимание разработке методов лечения, которые вызывают меньше отдаленных последствий у пациентов, перенесших онкозаболевания. Эту проблему помогут решить исследования в области отдаленных последствий среди растущего числа пациентов с долгосрочной выживаемостью.
—
Дата изменения: июнь 2018 г.
Острый лимфобластный лейкоз (ОЛЛ) у детей и подростков
Что такое острый лимфобластный лейкоз?
Острый лимфобластный лейкоз (ОЛЛ) — это злокачественное заболевание крови и костного мозга. При лейкозе здоровые клетки крови замещаются опухолевыми клетками, что может стать причиной жара, повышенной утомляемости, синяков, проблем со свертыванием крови, инфекций и других нарушений. Обычно при остром лейкозе симптомы усиливаются в течение короткого периода. У детей болезнь может развиваться очень быстро и требует незамедлительного лечения.
Посмотри это видео
ОЛЛ нарушает процесс созревания белых клеток крови, называемых лимфоцитами. Эти клетки борются с инфекциями и обеспечивают защиту организма от заболеваний. В костном мозге пациентов с ОЛЛ содержится слишком много незрелых белых кровяных клеток (бластов). Такие клетки не способны полноценно функционировать. Они замещают собой нормальные белые и красные кровяные тельца, а также тромбоциты. В результате организму становится сложнее бороться с инфекциями, кожа становится бледной, возникают проблемы со свертыванием крови.
Эти клетки борются с инфекциями и обеспечивают защиту организма от заболеваний. В костном мозге пациентов с ОЛЛ содержится слишком много незрелых белых кровяных клеток (бластов). Такие клетки не способны полноценно функционировать. Они замещают собой нормальные белые и красные кровяные тельца, а также тромбоциты. В результате организму становится сложнее бороться с инфекциями, кожа становится бледной, возникают проблемы со свертыванием крови.
виды лимфоцитов
Существует два вида лимфоцитов: В-лимфоциты и Т-лимфоциты. ОЛЛ может развиваться в любом из них, поэтому случаи ОЛЛ также подразделяют на B-клеточный ОЛЛ или T-клеточный ОЛЛ. Наиболее распространенным является В-клеточный ОЛЛ.
подвиды ОЛЛ
ОЛЛ имеет несколько подвидов. Во многих случаях врачи, определяя лечение, учитывают подвид ОЛЛ и сопряженную группу риска. Подробнее см. в разделе, посвященном лечению.
Подвиды ОЛЛ (Всемирная организация здравоохранения, 2016 г.)
В-клеточный лимфобластный лейкоз
В-клеточный лимфобластный лейкоз, без специфических характеристик
В-клеточный лимфобластный лейкоз с рецидивирующими генетическими нарушениями
В-клеточный лимфобластный лейкоз с транслокацией хромосом 9 и 22 (положительный по филадельфийской хромосоме ОЛЛ)
B-клеточный лимфобластный лейкоз с транслокацией KMT 2A
В-клеточный лимфобластный лейкоз с транслокацией хромосом 12 и 21 (ETV6-RUNX1)
В-клеточный лимфобластный лейкоз у детей с более чем 50 хромосомами
В-клеточный лимфобластный лейкоз у детей с 46 нормальными хромосомами (гиподиплоидия)
В-клеточный лимфобластный лейкоз с транслокациями хромосом 5 и 14 (IL3-IGH)
В-клеточный лимфобластный лейкоз с транслокацией хромосом 1 и 19 (TCF3-PBX1).
В-клеточный лимфобластный лейкоз/лимфома (Ph-подобный)
В-клеточный лимфобластный лейкоз/лимфома с iAMP21
Т-клеточный лимфобластный лейкоз
Острый лимфобластный лейкоз из ранних предшественников Т-клеток
Лимфобластный лейкоз/лимфома из естественных клеток-киллеров (ЕК)
ОЛЛ нарушает процесс созревания разновидности белых клеток крови, называемой лимфоцитами. В костном мозге пациентов с ОЛЛ содержится слишком много незрелых белых клеток крови (бластов). Такие клетки не способны полноценно функционировать. Они замещают собой нормальные лейкоциты, эритроциты и тромбоциты.
ОЛЛ является наиболее распространенным онкологическим заболеванием у детей В США ОЛЛ ежегодно диагностируется у порядка 3000 человек моложе 20 лет. Чаще всего заболевание развивается у детей в возрасте от 2 до 5 лет, но также встречается и у детей старшего возраста и подростков. У мальчиков оно возникает несколько чаще, чем у девочек.
Признаки и симптомы острого лимфобластного лейкоза
Возможные признаки и симптомы ОЛЛ:
- Частые инфекции
- Жар
- Легкое появление синяков
- Кровотечения, которые трудно остановить
- Плоские, темно-красные пятна малого размера на коже (петехии), возникающие из-за подкожных кровотечений
- Боль в костях или суставах
- Уплотнения на шее, в подмышечных впадинах, животе или паху
- Боль или ощущение распирания под грудной клеткой
- Ощущение сильной усталости или слабости
- Бледность
- Потеря аппетита
- Одышка
Диагностика острого лимфобластного лейкоза
Для диагностики лейкоза требуется провести исследование костного мозга. Подозрение на лейкоз может возникнуть после медицинского осмотра, изучения истории болезни и оценки результатов анализа крови. У детей с лейкозом обычно повышено количество белых кровяных телец.
Подозрение на лейкоз может возникнуть после медицинского осмотра, изучения истории болезни и оценки результатов анализа крови. У детей с лейкозом обычно повышено количество белых кровяных телец.
Сначала врач проводит медицинский осмотр и изучает историю болезни пациента. В ходе медицинского осмотра врач проверяет общие показатели здоровья, в том числе наличие признаков заболевания — уплотнений или всего, что кажется необычным. Проводится тщательный осмотр глаз, ротовой полости, кожи и ушей. Может быть выполнено исследование состояния центральной нервной системы. При пальпации брюшной полости пациента врач проверяет, не увеличена ли в размере селезенка или печень.
Изучая историю болезни, врачи смотрят на наличие врожденных патологических состояний, которые могут способствовать развитию заболевания.
 Тем не менее, исследования показали, что только в 8–10% случаев болезнь у детей является наследственной. И сам факт наличия генетического заболевания не означает, что у человека обязательно разовьется опухоль.
Тем не менее, исследования показали, что только в 8–10% случаев болезнь у детей является наследственной. И сам факт наличия генетического заболевания не означает, что у человека обязательно разовьется опухоль.Возможные факторы риска:
- Воздействие рентгеновских лучей до рождения
- Перенесенная химиотерапия или лучевая терапия
Наличие определенных врожденных патологических состояний:
- Синдром Дауна
- Синдром Блума
- Некоторые формы анемии Фанкони
- Атаксия-телеангиэктазия
- Синдром Ли-Фраумени
- Синдром конституционального дефицита репарации неспаренных оснований ДНК (мутации в определенных генах, препятствующие восстановлению ДНК)
- Анемия Даймонда-Блэкфана
- Синдром Швахмана-Даймонда
- Наследственный PAX5-синдром
- Наследственный ETV6-синдром
- Наследственный Sh3B3-синдром
- Воздействие рентгеновских лучей до рождения
Общий клинический анализ крови
Врачи назначат анализ крови, называемый общим клиническим анализом крови.
 При этом берут образец крови и определяют количество эритроцитов и тромбоцитов, количество и вид лейкоцитов, количество гемоглобина в эритроцитах и пропорцию эритроцитов в образце крови. При лейкозе в крови может содержаться слишком много белых кровяных телец, многие из которых будут бластами — ранними предшественниками клеток крови. У здоровых детей они обычно обнаруживаются только в костном мозге.
При этом берут образец крови и определяют количество эритроцитов и тромбоцитов, количество и вид лейкоцитов, количество гемоглобина в эритроцитах и пропорцию эритроцитов в образце крови. При лейкозе в крови может содержаться слишком много белых кровяных телец, многие из которых будут бластами — ранними предшественниками клеток крови. У здоровых детей они обычно обнаруживаются только в костном мозге.Биохимический анализ крови
В образце крови измеряют количество определенных веществ, выделяемых в кровь органами и тканями организма. Необычное (выше или ниже нормы) количество вещества может являться признаком заболевания.
Подозрение на лейкоз может возникнуть после медицинского осмотра, изучения истории болезни и оценки результатов анализа крови.
Результаты исследований костного мозга, таких как пункция и биопсия костного мозга, используют для подтверждения онкологического диагноза и точного определения заболевания.
 Многим детям эту процедуру проводят во сне (под наркозом). Если пациент бодрствует во время процедуры, ему дают подходящее болеутоляющеесредство..
Многим детям эту процедуру проводят во сне (под наркозом). Если пациент бодрствует во время процедуры, ему дают подходящее болеутоляющеесредство..Костномозговая пункция: с помощью тонкой иглы врачи возьмут образец костного мозга из тазовой кости. Патологоанатом под микроскопом проверит образец костного мозга на наличие признаков опухоли.
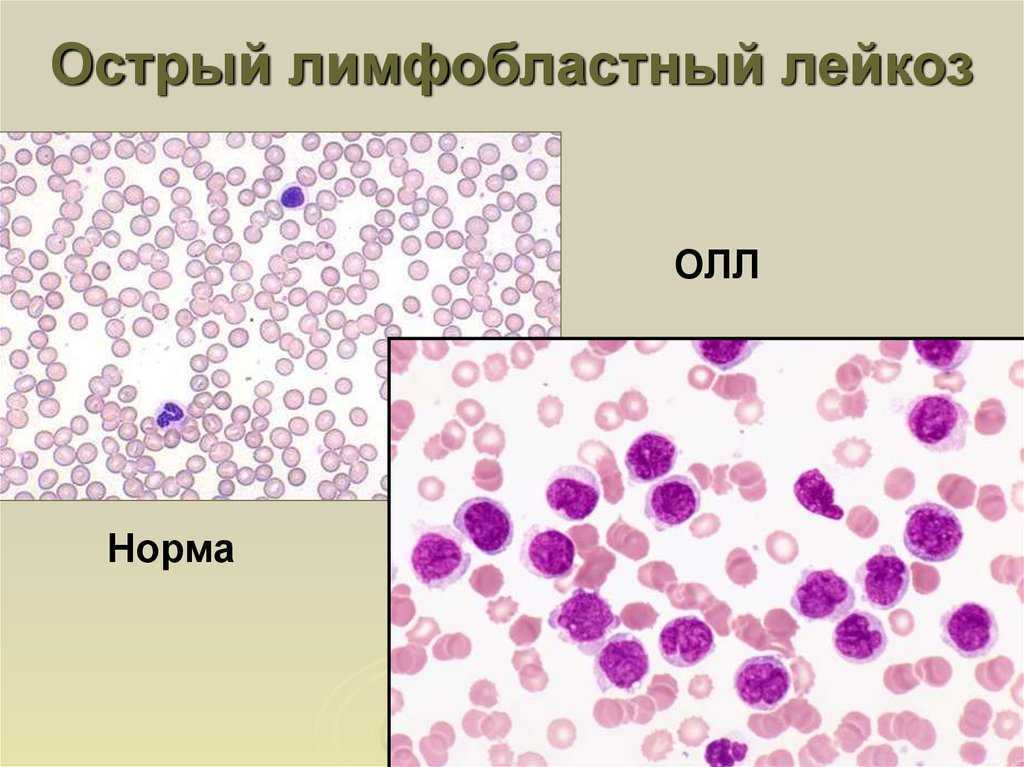
На этом микроскопическом изображении показан нормальный, здоровый костный мозг.
На этом микроскопическом изображении показан костный мозг пациента с острым лимфобластным лейкозом.
Биопсия костного мозга: врачи извлекут небольшой фрагмент костной ткани для определения степени распространения опухоли в костном мозге. Обычно биопсия проводится непосредственно до или сразу после пункции.
Как выполняют пункцию/биопсию костного мозга?
- Пациент находится на кровати в положении лежа на боку или — реже — в положении сидя с согнутыми ногами, скрещенными в области голеностопных суставов.

- Врач выполнит пальпацию нижней части спины пациента, чтобы найти правильную точку для выполнения процедуры.
- Затем специалист, проводящий процедуру, надевает перчатки и дезинфицирует кожу на спине пациента с применением антибактериального мыла. После этого спину пациента накрывают специальными полотенцами так, чтобы оставить открытым лишь небольшой участок кожи.
- Если пациент во время пункции или биопсии находится в сознании, примерно за один час до выполнения процедуры на место взятия аспирата костного мозга или биопсии наносят обезболивающий крем. В место проведения процедуры может быть введено жидкое обезболивающее лекарственное средство.
- Медицинский работник вводит иглу в костный мозг через кожу. В случае выполнения и пункции, и биопсии, для каждой процедуры используется отдельная игла.
- Медицинский работник извлекает иглу, дезинфицирует место введения спиртом и накладывает повязку.
Для диагностики лейкоза требуется провести исследование костного мозга.

- Пациент находится на кровати в положении лежа на боку или — реже — в положении сидя с согнутыми ногами, скрещенными в области голеностопных суставов.
При обнаружении опухолевого процесса проводят дополнительные анализы для точного определения вида заболевания. Используют такие исследования:
Для диагностики отдельных видов лейкоза используется иммунофенотипирование: сравнения опухолевых клеток с нормальными клетками иммунной системы.
Такими лабораторными анализами являются иммуногистохимическое исследование и проточная цитометрия.
- Иммуногистохимия — это метод исследования с применением антител для выявления специфических белков в образце ткани. Комплексы белков и антител окрашиваются в коричневый или красный цвет, и их можно заметить под микроскопом.
- При выполнении проточной цитометрии клетки окрашивают светочувствительным красителем, помещают в жидкость и пропускают в потоке перед лазерным или другим световым лучом.
 В ходе исследования измеряют количество клеток, процент живых клеток и некоторые их характеристики, такие как размер, форма и наличие маркеров лейкоза на поверхности клеток.
В ходе исследования измеряют количество клеток, процент живых клеток и некоторые их характеристики, такие как размер, форма и наличие маркеров лейкоза на поверхности клеток.
Цитогенетический анализ включает в себя лабораторные анализы, в ходе которых патологоанатомы изучают определенные изменения в хромосомах.
Одним из применимых анализов является FISH-анализ (флуоресцентная гибридизация in situ). В ходе этого анализа изучаются гены или хромосомы в клетках и тканях. Фрагменты ДНК, содержащие флуоресцентный краситель, изготавливают в лаборатории и добавляют в клетки или ткани на предметном стекле. Когда эти фрагменты ДНК прикрепляются к определенным генам или областям хромосом на предметном стекле, они становятся различимы.
Врач порекомендует провести лабораторные анализы для выявления специфических генов, белков и других факторов, влияющих на развитиелейкоза.
 . Такое исследование важно, поскольку онкозаболевания вызваны ошибками (мутациями) в генах клетки. Выявление этих ошибок способствует диагностике конкретного подвида лейкоза. На основе этой информации врачи могут выбирать варианты лечения, соответствующие конкретному случаю. Детям, у которых лейкоз вызван мутациями с благоприятным прогнозом, назначают менее токсичное лечение. И наоборот, врачи могут назначать более интенсивное лечение, еслилейкозвызван наличием мутаций, имеющих менее благоприятный прогноз. Могут быть выявлены мутации, для которых имеются специальные направленныеметодылечения.
. Такое исследование важно, поскольку онкозаболевания вызваны ошибками (мутациями) в генах клетки. Выявление этих ошибок способствует диагностике конкретного подвида лейкоза. На основе этой информации врачи могут выбирать варианты лечения, соответствующие конкретному случаю. Детям, у которых лейкоз вызван мутациями с благоприятным прогнозом, назначают менее токсичное лечение. И наоборот, врачи могут назначать более интенсивное лечение, еслилейкозвызван наличием мутаций, имеющих менее благоприятный прогноз. Могут быть выявлены мутации, для которых имеются специальные направленныеметодылечения.
Исследования, определяющие степень распространения заболевания:
Люмбальную пункцию выполняют, чтобы взять образец спинномозговой жидкости из позвоночника и определить,распространилась ли опухольна центральную нервную систему.
 Эта процедура также называется «ЛП» или «поясничный прокол».
Эта процедура также называется «ЛП» или «поясничный прокол». Иглу размещают между двумя позвонками и вводят в жидкость в области спинного мозга. Берется образец жидкости. Далее проводят микроскопическое исследование этого образца на наличие признаков распространения лейкозных клеток на головной и спинной мозг. Организм постоянно вырабатывает спинномозговую жидкость, и поэтому небольшое количество, изъятое в ходе ЛП, быстро восстанавливается.
Рентгеновское излучение — это тип пучка энергии, который способен проходить сквозь тело и, попадая на пленку, создавать изображение областей внутри тела на экране компьютера или специальной пленке. Рентгенографию грудной клетки проводят для того, чтобы определить, есть ли новообразование внутри грудной клетки.

Лечение острого лимфобластного лейкоза
Основным методом лечения для детей с ОЛЛ является химиотерапия. Лечение также может включать в себя таргетную терапию, терапию с использованием гемопоэтических клеток (также называемую трансплантацией костного мозга или стволовых клеток), иммунотерапию и лучевую терапию.
Благодаря недавним достижениям в лечении ОЛЛ существует много различных вариантов лечения. Врачи все чаще могут адаптировать лечение для отдельных пациентов в зависимости от их группы риска.
Группа риска
Группа риска означает вероятность того, что опухоль пациента не будет поддаваться лечению (резистентная опухоль), либо заболевание вернется после первоначальной реакции на лечение (рецидив). Пациентам в группах низкого риска обычно проводят менее интенсивную терапию, которая тем не менее успешно справляетсяс опухолью.. Для пациентов в группах высокого риска обычно применяют более агрессивные методы лечения.
Группу риска определяют следующие факторы:
- Возраст ребенка. Дети в возрасте от 1 до 9 лет с В-клеточным ОЛЛ считаются группой низкого риска. Дети младше 1 года и старше 10 лет считаются группой высокого риска.
- Количество белых кровяных телец на момент постановки диагноза. Дети с числом более 50 000 на кубический миллиметр считаются группой высокого риска.
- Развитиеопухолевого процессав В-лимфоцитах или Т-лимфоцитах. Считается, что для Т-клеточного ОЛЛ характерен более высокий риск.
- Наличие определенных изменений в хромосомах или генах. Считается, что случаи ОЛЛ с наличием гибридного гена ETV6-RUNX1 относятся к группе низкого риска. Считается, что ОЛЛ с наличием филадельфийской хромосомы или транслокацией хромосом 1 и 19, либо включающей хромосому 11, является заболеванием высокого риска, однако при использовании передовых методов терапии прогноз улучшается.
- Количествохромосом. Случаи гипердиплоида (более 50 хромосом) относятся к факторам низкого риска, в то время как случаи гиподиплоида (менее 44 хромосом) относятся к факторам высокого риска.

- Скорость и степень уменьшенияколичества опухолевых (бластных) клетокпосле первоначального лечения. Считается, что случаи,когда количество бластных клеток резко падает в течение первых нескольких недель терапии,характеризуются низким уровнем риска. Во многих детских онкологических центрах используются высокочувствительные тесты для измерения минимальной остаточной болезни (МОБ).
минимальная остаточная болезнь (МОБ)
Минимальная остаточная болезнь (МОБ) — это термин используется, когда бластных клеток в костном мозге так мало, что их невозможно обнаружить с помощью микроскопа. Высокочувствительные тесты, такие как проточная цитометрия, полимеразная цепная реакция (ПЦР) и секвенирование следующего поколения, способны обнаружить 1 бластную клетку на 10 000–100 000 нормальных клеток костного мозга. МОБ-положительные пациенты (более 1 клетки на 10 000 после завершения первой фазы лечения ОЛЛ (индукция)) подвержены наивысшему риску рецидива.
- Наличие бластных клеток в спинномозговой жидкости при постановке диагноза.
 Если клетки распространились, случай относится к высокому риску.
Если клетки распространились, случай относится к высокому риску.
Фазы лечения
( / 5 )
Неделя 1
Диагностическое обследование, подготовка к лечению
Врачи собирают информацию для выбора методов лечения.
- Анализы крови
- Медицинский осмотр и изучение истории болезни
- Рентгенография грудной клетки
- Пункция и/или биопсия костного мозга
- Люмбальная пункция
Перед началом лечения
Пациенту проведут хирургическую операцию для установки подкожной порт-системы илидругого устройства венозного доступадля химиотерапии, введения жидкостей и взятия образцов крови.
Следующие 4-6 недель
Фаза индукции
Целью данной фазы является использование комбинации химиотерапевтических препаратов для уничтожения опухолевых клеток в крови и костном мозге и перевода заболевания в ремиссию. Это фаза интенсивного лечения, и для нее может потребоваться пребывание пациента в стационаре.
Для уничтожения опухолевых клеток в спинномозговой жидкости может быть назначена сохраняющая терапия центральной нервной системы (ЦНС).
Врачи будут наблюдать за реакцией лейкоза на индукционную терапию, чтобы определить, каким образом продолжить лечение.
- Случаи, когда количество бластных клеток резко падает, считаются низким уровнем риска.
- Во многих детских медицинских центрах используются высокочувствительные тесты для измерения минимальной остаточной болезни (МОБ). Положительная МОБ указывает на более высокий риск рецидива и необходимость применения более интенсивной терапии.
- Врачи примут решение о том, требуется ли проведение трансплантации гемопоэтических клеток.
Следующие 8-16 недель
Фаза консолидации/интенсификации
Целью этой более интенсивной фазы является использование другой комбинации препаратов для уничтожения любых оставшихся клеток, способных вызвать рецидив лейкоза. На это время может потребоваться пребывание пациента в стационаре.
Пациентам с ОЛЛ, положительным по филадельфийской хромосоме, на этой фазе могут назначать иматиниб.
Подробнее о лекарственных препаратах
Следующие 2-3 недели
Фаза стабилизации/продолжения
Еслипосле этих двух стадий лечения ремиссия сохраняется, можно начинать поддерживающую терапию. Ее целью является использование комбинации химиотерапевтических препаратов для уничтожения любых опухолевых клеток, которые могут остаться после первых фаз индукции и консолидации.
В это время еженедельная химиотерапия и анализы крови обычно чередуются с периодами высокодозной химиотерапии — реиндукцией.
Первые 9 месяцев лечения ОЛЛ обычно являются наиболее интенсивными. Часто пациенты могут вернуться в школу после первых 9 месяцев.
График последующего наблюдения
Год 1
Пациент будет посещать врача в рамках последующего наблюдения один раз в 4 месяца.
Во время проверок проводятся такие обследования:
- Осмотр и изучение истории болезни
- Анализы крови и другие лабораторные анализы
Год 2
Частота визитов для последующего наблюдения может быть снижена до одного раза в 6 месяцев.
Годы 3–5
Частота визитов для последующего наблюдения может быть снижена до одного раза в год.
Три фазы лечения
Лечение ОЛЛ включает в себя 3 фазы и длится от 2 до 3 лет. Основным методом лечения ОЛЛ является химиотерапия. В химиотерапии используются мощные лекарственные препараты для остановки роста опухолевых клеток, уничтожая их или препятствуя их делению. Детям чаще всего назначают комбинацию различных лекарственных препаратов. Эти препараты могут вводиться в кровоток (внутривенно), приниматься внутрь (перорально) или же вводиться непосредственно в спинномозговую жидкость (интратекально).
Выбор метода химиотерапии и лекарственных средств зависит от группы риска ребенка. Дети с лейкозом высокого риска обычно получают больше противоопухолевых препаратов и/или более высокие дозы, чем дети с ОЛЛ низкого риска.
1. Индукция
Целью индукционной терапии является уничтожение бластных клеток в крови и костном мозге и перевод заболевания в ремиссию. Эта фаза обычно длится 4–6 недель. В это же время для уничтожения бластных клеток, остающихся в спинномозговой жидкости, может быть назначена сохраняющая терапия центральной нервной системы (ЦНС) (также называемая профилактической терапией ЦНС). В этом случае препараты вводятся в заполненное жидкостью пространство между тонкими слоями ткани, покрывающими спинной мозг (интратекально).
Эта фаза обычно длится 4–6 недель. В это же время для уничтожения бластных клеток, остающихся в спинномозговой жидкости, может быть назначена сохраняющая терапия центральной нервной системы (ЦНС) (также называемая профилактической терапией ЦНС). В этом случае препараты вводятся в заполненное жидкостью пространство между тонкими слоями ткани, покрывающими спинной мозг (интратекально).
Для лечения используется комбинация химиотерапевтических препаратов. Эти препараты могут включать в себя винкристин, стероиды и пэгаспаргазу или аспарагиназу Erwinia, иногда с препаратом антрациклинового ряда, таким как доксорубицин или даунорубицин. В некоторых протоколах во время индукционной терапии применяют схему лечения, включающую циклофосфамид, цитарабин и 6-меркаптопурин.
2. Фаза консолидации/интенсификации
Целью терапии консолидации/интенсификации является уничтожение любых оставшихся клеток, способных к росту и вызывающих рецидив лейкоза. Эта фаза обычно длится 8-16 недель.
Пациенту назначают различные лекарственные средства, такие как циклофосфамид, цитарабин и или 6-меркаптопурин (6-МП). Также может назначаться метотрексат с терапией под защитой лейковорином или без нее.
3. Фаза стабилизации/продолжения
Целью поддерживающей терапии, последней и наиболее долгой фазы, является уничтожение любых опухолевых клеток, которые могли бы выжить после первых 2 фаз. Фаза стабилизации может продолжаться 2 или 3 года.
Эта фаза может включать в себя применение таких препаратов, как метотрексат, винкристин, стероиды, 6-меркаптопурин (6-МП). Пациентам с высоким риском могут назначаться антрациклиновые препараты, циклофосфамид и цитарабин.
Другие методы лечения
Трансплантация гемопоэтических клеток (также называемая трансплантацией костного мозга или стволовых клеток)
Трансплантация гемопоэтических клеток (также называемая трансплантацией костного мозга или стволовых клеток) может быть рекомендована детям с высоким риском рецидива или с резистентным к лечению ОЛЛ. Иногда врачи оценивают эффективность индукционной химиотерапии, чтобы решить, требуется ли трансплантация.
Иногда врачи оценивают эффективность индукционной химиотерапии, чтобы решить, требуется ли трансплантация.
Пациенты с ОЛЛ, у которых лейкоз является резистентным (не поддающимся лечению) или рецидивирующим, могут быть кандидатами на трансплантацию, если их состояние позволяет и найден подходящий донор.
Таргетная терапия
В таргетной терапии используются лекарственные препараты, которые уничтожают раковые клетки, не нанося вреда окружающим здоровым клеткам. Этот тип терапии может применяться только в том случае, когда рак имеет идентифицируемые маркеры, которые реагируют на доступные препараты таргетной терапии.
Иммунотерапия
Иммунотерапия — это метод лечения рака, при котором для борьбы с опухолью задействуется иммунная система. Иммунотерапия помогает иммунной системе находить опухолевые клетки, чтобы атаковать их, и/или повышает способность иммунной системы реагировать на опухоль.
Одна группа препаратов для таргетной терапии называется ингибиторами тирозинкиназы (ИТК). ИТК блокируют активность фермента тирозинкиназы, который иногда характеризуется чрезмерной активностью или высоким содержанием в некоторых опухолевых клетках. Препараты иматиниба мезилат и дазатиниб являются ИТК и применяются для лечения детей с ОЛЛ, положительным по филадельфийской хромосоме. Другие исследуемые ИТК включают руксолитиниб для лечения впервые диагностированного ОЛЛ высокого риска.
ИТК блокируют активность фермента тирозинкиназы, который иногда характеризуется чрезмерной активностью или высоким содержанием в некоторых опухолевых клетках. Препараты иматиниба мезилат и дазатиниб являются ИТК и применяются для лечения детей с ОЛЛ, положительным по филадельфийской хромосоме. Другие исследуемые ИТК включают руксолитиниб для лечения впервые диагностированного ОЛЛ высокого риска.
Еще один тип таргетной терапии называется терапией моноклональными антителами. В нем используются антитела, изготовленные в лаборатории, для идентификации на опухолевых или здоровых клетках веществ, способствующих росту клеток опухоли. Антитела прикрепляются к веществам, ускоряющим развитие опухоли, и убивают опухолевые клетки, блокируют их рост или препятствуют их распространению. Их можно использовать отдельно или для переноса лекарственных препаратов, токсинов или радиоактивных препаратов непосредственно в раковые клетки. Блинатумомаб и инотузумаб представляют собой два моноклональных антитела, которые сейчас изучаются для лечения резистентного к терапии (рефрактерного) ОЛЛ у детей. Кроме того, антитела могут синтезироваться в иммунных клетках, таких как Т-клетки, и заставлять иммунные клетки непосредственно атаковать бластные клетки. Такие Т-клетки называются Т-клетками с химерными антигенными рецепторами (ХАР).
Кроме того, антитела могут синтезироваться в иммунных клетках, таких как Т-клетки, и заставлять иммунные клетки непосредственно атаковать бластные клетки. Такие Т-клетки называются Т-клетками с химерными антигенными рецепторами (ХАР).
В настоящее время изучается добавление бортезомиба и вориностата, препаратов таргетной терапии, к стандартным методам лечения детей с ОЛЛ, поскольку у детей лечение в целом более сложное. Эти препараты могут использоваться в тех случаях, когда заболевание не дает хорошего ответа на лечение.
Прогноз (исход) при лечении острого лимфобластного лейкоза
Около 98% детей с ОЛЛ достигают ремиссии через несколько недель после начала лечения.
Более 90% детей с ОЛЛ могут выздороветь. Пациенты считаются выздоровевшими примерно через 5 лет ремиссии.
Коэффициент выживаемости для пациентов с ОЛЛ в группах низкого риска может составлять более 95%.
Если у пациента резистентная (не дающая ответа на лечение) или рецидивирующая форма ОЛЛ, врачи обсуждают дальнейшие варианты терапии.
Отдаленные последствия лечения острого лимфобластного лейкоза
Отдаленное последствие — это проблема со здоровьем, возникающая спустя месяцы или годы после диагностирования заболевания или после окончания лечения. Отдаленные последствия могут быть вызваны как самой опухолью, так и ее лечением. Они могут включать в себя физические, психические и социальные проблемы, а также метастазирование.
К отдаленным последствиям относятся:
- Рецидив ОЛЛ
- Вторичные очаги болезни, например рак кожи, головного мозга, костей, молочных желез, мягких тканей и щитовидной железы. Предполагается, что после прекращения применения краниального облучения в качестве стандартного метода лечения ОЛЛ частота появления метастазов в последующие годы сократится.
- Нарушения функции сердца и легких
- Заболевания костей
- Эндокринные заболевания
- Заболевания желудочно-кишечного тракта
- Нарушения психической гибкости, логического мышления, планирования и организации
- Депрессия
- Нарушения сна
Цели современных исследований острого лимфобластного лейкоза
Текущие исследования проводятся в области разработки более эффективных методов лечения детских опухолей, не дающих ответа на первоначальную терапию, и в области разработки новых методов лечения, направленных на уничтожение раковых клеток без нанесения вреда окружающим здоровым клеткам. Исследователи также уделяют основное внимание разработке методов лечения, которые вызывают меньше отдаленных последствий у пациентов, перенесших онкозаболевания. Эту проблему помогут решить исследования в области отдаленных последствий среди растущего числа пациентов с долгосрочной выживаемостью.
Исследователи также уделяют основное внимание разработке методов лечения, которые вызывают меньше отдаленных последствий у пациентов, перенесших онкозаболевания. Эту проблему помогут решить исследования в области отдаленных последствий среди растущего числа пациентов с долгосрочной выживаемостью.
—
Дата изменения: июнь 2018 г.
Острый миелоидный лейкоз (ОМЛ) | Международный фонд апластической анемии и МДС
- Болезни
- Острый миелоидный лейкоз (ОМЛ)
Что такое острый миелоидный лейкоз или ОМЛ?
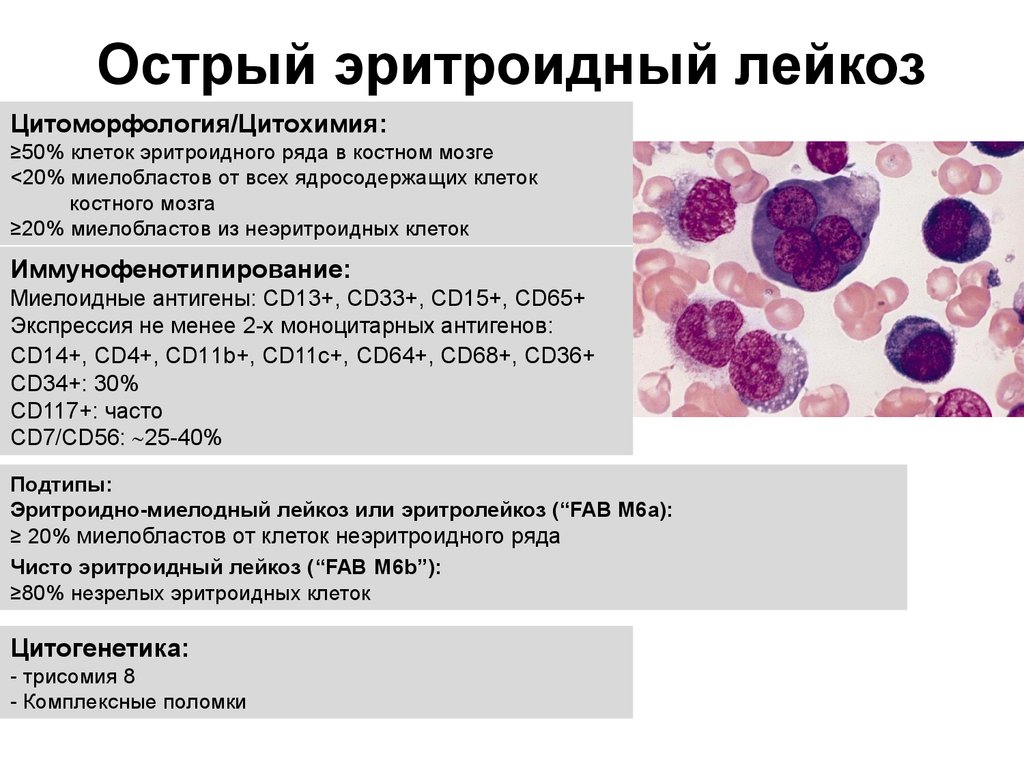
Some cases of MDS become AML. But most do not. Also called AML, acute myeloblastic leukemia, acute myelocytic leukemia. »> Острый миелоидный лейкоз (ОМЛ) — это рак крови. Это происходит, когда молодые аномальные лейкоциты называются 9.0015 бласты (клетки лейкемии), начинают заполнять костный мозг , препятствуя нормальному кроветворению. Врачи ставят диагноз ОМЛ, когда 20 из каждых 100 лейкоцитов в костном мозге представляют собой бластных клеток . ОМЛ является наиболее распространенным острым лейкозом, поражающим взрослых, ежегодно диагностируется около 20 000 новых случаев.
Когда у людей есть ОД, бласты быстро копируют себя. Это замедляет выработку эритроцитов и тромбоцитов, вызывая усталость с 9 часов.0023 анемия и риск кровотечения из-за низкого количества тромбоцитов . Существует также повышенный риск инфекции, поскольку лейкоциты, борющиеся с инфекцией, не созревают и не могут бороться с инфекцией.
Это замедляет выработку эритроцитов и тромбоцитов, вызывая усталость с 9 часов.0023 анемия и риск кровотечения из-за низкого количества тромбоцитов . Существует также повышенный риск инфекции, поскольку лейкоциты, борющиеся с инфекцией, не созревают и не могут бороться с инфекцией.
ОМЛ также известен как острый миелогенный лейкоз , острый миелобластный лейкоз и острый нелимфоцитарный лейкоз.
Связь с The most common of these rare diseases are aplastic anemia, myelodysplastic syndromes (MDS) and paroxysmal nocturnal hemoglobinuria (PNH). Bone marrow failure can be acquired (begin any time in life) or can be hereditary (less common, passed down from parent to child).»> недостаточностью костного мозга заболеваний:
Со временем около трети всех случаев МДС трансформируется в ОМЛ. Риск развития ОМЛ во многом зависит от того, какой у вас подтип МДС на момент постановки диагноза.
- У пациента с МДС низкого риска вероятность развития ОМЛ составляет до 2 из 10.
- У пациента с МДС более высокого риска вероятность развития ОМЛ составляет более 4 из 10.
У меньшего числа людей с Most scientists believe that aplastic anemia happens when the immune system attacks the bone marrow stem cells. Aplastic anemia can be acquired (begin any time in life) or can be hereditary (less common, passed down from parent to child). »> апластической анемией и ПНГ развивается ОМЛ.
Что вызывает ОД?
ОМЛ может возникнуть в любом возрасте, но чаще всего у пожилых людей. Для большинства людей с ОМЛ нет легко идентифицируемой причины. Однако есть несколько известных факторов риска, которые могут увеличить шансы заболеть ОМЛ. Среди них:
- Многократное воздействие химического вещества «> бензола , а также других подобных ему химических веществ, называемых фторуглеродами, которые содержатся в сигаретном дыме, нефтепродуктах и в некоторых промышленных условиях
- Некоторые необычные генетические состояния, такие как синдром Дауна, анемия Фанкони , врожденный дискератоз , синдром MonoMAC, синдром Блума, синдром Швахмана и синдром Даймонда-Блэкфана
- Наличие других видов рака крови или заболеваний, таких как истинная полицитемия, первичный миелофиброз, эссенциальная тромбоцитемия и Myelo refers to the bone marrow. Dysplastic means abnormal growth or development. People with MDS have low blood cell count for at least 1 blood cell type. Also, the bone marrow and blood contain blood cells with an abnormal shape, size, or look. Symptoms vary greatly from person to person. The differences depend on which blood cells are affected.»> миелодиспластические синдромы (МДС)
- Ранее »> химиотерапия или лучевая терапия других видов рака
Каковы симптомы ОМЛ?
Признаки и симптомы ОМЛ в основном являются результатом низкого количества клеток крови. В начале заболевания симптомы могут имитировать другие распространенные заболевания, такие как грипп. Это может включать лихорадку, усталость, потерю аппетита и одышку. По мере того как ОМЛ ухудшается и все больше лейкозных клеток заполняют костный мозг , симптомы могут включать:
- Бледный цвет лица из-за анемии , вызванной низким количеством эритроцитов
- Длительное кровотечение и легкие кровоподтеки, вызванные очень низким Platelets help the blood to clot and stop bleeding. Also called a thrombocyte.»> количеством тромбоцитов , называемым тромбоцитопенией , которая также может включать появление на коже красных пятен размером с булавочную головку, называемых петехиями
- Частые инфекции, вызванные недостаточным количеством лейкоцитов, называемых нейтрофилами
- Опухание десен
- Потеря веса
- Дискомфорт в костях или суставах
- Увеличение селезенки
- Увеличение печени
Более серьезные симптомы могут включать:
- Кровоизлияние в мозг или легкие
- Серьезные инфекции, вызванные недостаточным количеством лейкоцитов, называемых нейтрофилами
- Миелоидная саркома, масса клеток ОМЛ, образующих опухоль в определенных местах, таких как головной или спинной мозг, что может привести к неврологическим проблемам
Как диагностировать ОМЛ?
Точный диагноз важен для выбора лечения. Врачи используют ряд тестов для подтверждения диагноза ОМЛ и определения подтипа ОМЛ у пациента. К ним относятся:
Врачи используют ряд тестов для подтверждения диагноза ОМЛ и определения подтипа ОМЛ у пациента. К ним относятся:
- Медицинский осмотр и сбор анамнеза
- Анализы крови, которые включают:
- Полный анализ крови с дифференциалом, который рассматривает общее количество и тип клеток крови в крови
- Мазок крови, позволяющий врачу исследовать кровь под микроскопом
- Аспирация костного мозга и биопсия используются для того, чтобы увидеть, как костный мозг выглядит под микроскопом и сколько в нем бластных клеток.
- Цитогенетическое тестирование и молекулярно-генетическое тестирование, которое исследует аномалии в ДНК клеток лейкемии.

Как вы лечите ОМЛ?
Большинство пациентов с ОМЛ нуждаются в лечении вскоре после постановки диагноза, поскольку болезнь часто прогрессирует быстро. Первоначальная цель состоит в том, чтобы ввести пациента в ремиссию. Долгосрочной целью является излечение болезни, хотя это не всегда возможно.
Врачи используют несколько видов терапии для взрослых с ОМЛ:
- »> Химиотерапия или другие медикаментозные методы лечения являются первой линией лечения. Люди с ОМЛ обычно сразу начинают химиотерапию. Некоторые из наиболее часто используемых препаратов включают цитарабин (также называемый цитозинарабинозидом или ara-C.) и антрациклин (например, даунорубицин или идарубицин).
- Трансплантация стволовых клеток может использоваться после химиотерапии в качестве второй фазы лечения и может дать возможность излечения.
- Клинические испытания могут включать терапию новыми препаратами и новыми комбинациями препаратов для увеличения шансов на первую ремиссию или новые подходы к трансплантации стволовых клеток.
Другие факторы, которые могут повлиять на лечение, включают:
- Если человек старше 70 лет или имеет другие серьезные проблемы со здоровьем (например, больное сердце, легкие или почки): некоторые люди в этой категории могут быть не в состоянии переносить токсичные вещества. химиотерапевтические препараты.
 Наркотики, такие как децитабин или Azacitidine is approved by the U.S. Food and Drug Administration (FDA) for treating all myelodysplastic syndromes (MDS) subtypes.
»> азацитидин или гидроксимочевина могут лучше переноситься пожилыми пациентами.
Наркотики, такие как децитабин или Azacitidine is approved by the U.S. Food and Drug Administration (FDA) for treating all myelodysplastic syndromes (MDS) subtypes.
»> азацитидин или гидроксимочевина могут лучше переноситься пожилыми пациентами. - Если ребенок проходит лечение от ОМЛ: терапия может немного отличаться от таковой для среднего взрослого человека.
- Если рак вернулся (рецидив) или все еще присутствует после того, как пациент закончил стандартную терапию ( рефрактерная лейкемия): может быть другой подход к лечению, чем в первый раз.
тестов на острый миелоидный лейкоз (ОМЛ)
Определенные признаки и симптомы могут свидетельствовать о том, что у человека может быть острый миелоидный лейкоз (ОМЛ), но для подтверждения диагноза необходимы тесты.
Медицинский анамнез и медицинский осмотр
Врач захочет получить подробный анамнез , уделив особое внимание вашим симптомам и тому, как долго они у вас были. Они также могут спросить о других проблемах со здоровьем, а также о возможных факторах риска развития лейкемии.
Во время физического осмотра врач, скорее всего, обратит пристальное внимание на ваши глаза, рот, кожу, лимфатические узлы, печень, селезенку и нервную систему, а также выявит области кровотечения или кровоподтеков или возможные признаки инфекции. .
Если есть основания полагать, что проблемы могут быть вызваны низким уровнем клеток крови (анемия, инфекции, кровотечения или кровоподтеки и т. д.), врач, скорее всего, назначит анализы крови для проверки количества клеток крови. Вас также могут направить к гематологу, врачу, специализирующемуся на заболеваниях крови (включая лейкемию).
Типы образцов, используемых для тестирования на ОМЛ
Если врач считает, что у вас может быть лейкемия, необходимо проверить образцы клеток крови и костного мозга, чтобы убедиться в этом. Другие образцы тканей и клеток также могут быть взяты, чтобы помочь в лечении.
Другие образцы тканей и клеток также могут быть взяты, чтобы помочь в лечении.
Образцы крови
Анализы крови, как правило, являются первым тестом, проводимым для выявления лейкемии. Кровь берут из вены на руке.
Образцы костного мозга
Лейкемия начинается в костном мозге, поэтому проверка костного мозга на наличие лейкозных клеток является ключевой частью тестирования на нее. Образцы костного мозга получают из 2 тестов, которые обычно проводятся одновременно:
- Аспирация костного мозга
- Биопсия костного мозга
Образцы обычно берут из задней части тазовой (бедренной) кости, но иногда вместо нее используют другие кости. Если нужно сделать только аспирацию, ее можно взять из грудины (грудной кости).
Для аспирации костного мозга вы лежите на столе (либо на боку, либо на животе). Врач очистит кожу над бедром, а затем обезболит область и поверхность кости, введя местный анестетик. Это может вызвать кратковременное покалывание или жжение. Затем в кость вводят тонкую полую иглу и с помощью шприца отсасывают небольшое количество жидкого костного мозга. Даже при анестезии у большинства пациентов сохраняется непродолжительная боль при удалении костного мозга.
Затем в кость вводят тонкую полую иглу и с помощью шприца отсасывают небольшое количество жидкого костного мозга. Даже при анестезии у большинства пациентов сохраняется непродолжительная боль при удалении костного мозга.
A Биопсия костного мозга обычно проводится сразу после аспирации. Небольшой кусочек кости и костного мозга удаляют с помощью иглы немного большего размера, которую вводят в кость. Это также может вызвать кратковременную боль. После того, как биопсия будет сделана, на место будет оказано давление, чтобы предотвратить кровотечение.
Эти тесты костного мозга используются для диагностики лейкемии, но их также можно повторить позже, чтобы определить, поддается ли лейкемия лечению.
Спинномозговая жидкость
Спинномозговая жидкость (ЦСЖ) окружает головной и спинной мозг. Иногда ОМЛ может распространяться на область вокруг головного и спинного мозга. Чтобы проверить это распространение, врачи могут взять образец спинномозговой жидкости для тестирования (процедура, называемая люмбальной пункцией или спинномозговой пункцией ). Люмбальная пункция не часто используется для проверки на ОМЛ, если только у человека нет симптомов, которые могут быть вызваны лейкозными клетками, распространившимися в головной и спинной мозг.
Люмбальная пункция не часто используется для проверки на ОМЛ, если только у человека нет симптомов, которые могут быть вызваны лейкозными клетками, распространившимися в головной и спинной мозг.
Для этого теста вы можете лечь на бок или сесть. Сначала врач обезболивает участок кожи в нижней части спины над позвоночником. Затем между костями позвоночника вводят маленькую полую иглу в область вокруг спинного мозга, чтобы удалить часть жидкости.
Люмбальная пункция также иногда используется для доставки химиотерапевтических препаратов в спинномозговую жидкость, чтобы помочь предотвратить или вылечить распространение лейкемии на спинной и головной мозг.
Лабораторные тесты, используемые для диагностики и классификации ОМЛ
Один или несколько из следующих лабораторных тестов могут быть проведены на образцах для диагностики ОМЛ и/или для определения конкретного подтипа ОМЛ.
Общий анализ крови и мазок периферической крови
Общий анализ крови (CBC) — это тест, который измеряет количество различных клеток в крови, таких как эритроциты, лейкоциты и тромбоциты. Общий анализ крови часто проводится вместе с дифференциалом (или diff), который рассматривает количество различных типов лейкоцитов. Для мазка периферической крови образец крови исследуют под микроскопом. Изменения количества и внешний вид различных типов клеток крови часто помогают диагностировать лейкемию.
Общий анализ крови часто проводится вместе с дифференциалом (или diff), который рассматривает количество различных типов лейкоцитов. Для мазка периферической крови образец крови исследуют под микроскопом. Изменения количества и внешний вид различных типов клеток крови часто помогают диагностировать лейкемию.
У большинства пациентов с ОМЛ в крови слишком много незрелых лейкоцитов и недостаточно эритроцитов или тромбоцитов. Многие из лейкоцитов могут быть миелобластами (часто называемыми просто бластами), которые являются очень ранними формами кроветворных клеток, которые обычно не обнаруживаются в крови. Эти клетки не работают как нормальные, зрелые лейкоциты. Эти результаты могут свидетельствовать о лейкемии, но заболевание обычно не диагностируется без исследования образца клеток костного мозга.
Биохимический анализ крови и тесты на коагуляцию
Эти тесты измеряют количество определенных химических веществ в крови и способность крови к свертыванию. Эти тесты не используются для диагностики лейкемии, но они могут помочь выявить проблемы с печенью или почками, аномальные уровни определенных минералов в крови или проблемы со свертываемостью крови.
Обычные исследования клеток под микроскопом
Образцы крови, костного мозга или ЦСЖ изучаются под микроскопом патологоанатомом (врачом, специализирующимся на лабораторных исследованиях) и могут быть рассмотрены гематологом/онкологом пациента (врачом, рак и болезни крови).
Врачи будут смотреть на размер, форму и другие характеристики лейкоцитов в образцах, чтобы классифицировать их по определенным типам.
Ключевым элементом является то, выглядят ли клетки зрелыми (как нормальные клетки крови) или незрелыми (отсутствуют признаки нормальных клеток крови). Наиболее незрелые клетки называются миелобластами (или бластами).
Процентное содержание бластов в костном мозге или крови имеет особое значение. Для диагностики ОМЛ обычно требуется наличие не менее 20% бластов в костном мозге или крови. (В нормальном костном мозге количество бластов составляет 5% или меньше, в то время как кровь обычно не содержит бластов). в конкретном типе ПОД, даже если процент взрыва не достигает 20%.
Иногда простого подсчета и изучения клеток недостаточно для постановки точного диагноза. Другие лабораторные тесты могут использоваться для подтверждения диагноза ОМЛ.
Цитохимия
Для цитохимических исследований клетки подвергают воздействию химических красителей (красителей), которые реагируют только с некоторыми типами лейкозных клеток. Эти пятна вызывают изменения цвета, которые можно увидеть под микроскопом, что может помочь врачу определить, какие типы клеток присутствуют. Например, одно окрашивание может помочь отличить клетки ОМЛ от клеток острого лимфоцитарного лейкоза (ОЛЛ). Окрашивание приводит к тому, что гранулы большинства клеток ОМЛ выглядят под микроскопом в виде черных пятен, но не вызывает изменения цвета ВСЕХ клеток.
Проточная цитометрия и иммуногистохимия
Как для проточной цитометрии, так и для иммуноцитохимии образцы клеток обрабатывают антителами, представляющими собой белки, которые связываются только с некоторыми другими белками клеток. Для иммуноцитохимии клетки затем рассматривают под микроскопом, чтобы увидеть, прилипли ли к ним антитела (что означает, что они содержат эти белки), а для проточной цитометрии используется специальный аппарат.
Для иммуноцитохимии клетки затем рассматривают под микроскопом, чтобы увидеть, прилипли ли к ним антитела (что означает, что они содержат эти белки), а для проточной цитометрии используется специальный аппарат.
Эти тесты используются для иммунофенотипирования – классификации лейкозных клеток по веществам (антигенам) на их поверхности. Клетки лейкемии могут иметь разные антигены в зависимости от того, в каком типе клеток они зарождаются и насколько они зрелы, и эта информация может быть полезна для классификации ОМЛ.
Хромосомные тесты
Эти тесты исследуют хромосомы (длинные нити ДНК) внутри клеток. Нормальные клетки человека содержат 23 пары хромосом, каждая из которых имеет определенный размер и окрашивается определенным образом. Клетки ОМЛ иногда имеют хромосомные изменения, которые можно увидеть под микроскопом или обнаружить с помощью других тестов. Распознавание этих изменений может помочь идентифицировать определенные типы ОМЛ и может иметь важное значение для определения прогноза пациента.
Цитогенетика: В этом тесте клетки исследуют под микроскопом, чтобы определить, есть ли в хромосомах какие-либо аномалии. Недостатком этого теста является то, что он обычно занимает от 2 до 3 недель, потому что клетки должны расти в лабораторных чашках в течение нескольких недель, прежде чем можно будет увидеть их хромосомы.
Результаты цитогенетического тестирования записываются в сокращенной форме, описывающей хромосомные изменения:
- Транслокация означает, что части двух хромосом поменялись местами друг с другом. Например, если хромосомы 8 и 21 поменялись местами, это будет записано как t(8;21).
- Инверсия , записанная как inv(16), например, означает, что часть хромосомы 16 теперь находится в обратном порядке, но все еще прикреплена к хромосоме.
- Делеция , записанная как del(7) или -7, например, указывает на то, что часть хромосомы 7 потеряна.
- Добавление или дупликация , такая как +8, например, означает, что вся или часть хромосомы 8 была продублирована, и в клетке обнаружено слишком много ее копий.

Не все хромосомные изменения можно увидеть под микроскопом. Другие лабораторные тесты часто могут обнаружить эти изменения.
Флуоресцентная гибридизация in situ (FISH): В этом тесте более тщательно исследуется клеточная ДНК с использованием специальных флуоресцентных красителей, которые прикрепляются только к определенным генам или частям определенных хромосом. FISH может обнаружить хромосомные изменения (например, транслокации), которые видны под микроскопом в стандартных цитогенетических тестах, а также некоторые изменения, которые слишком малы, чтобы их можно было увидеть при обычном цитогенетическом тестировании.
FISH можно использовать для поиска изменений в определенных генах или частях хромосом. Его можно использовать с обычными образцами крови или костного мозга без предварительного выращивания их в лаборатории. Это означает, что результаты часто доступны быстрее, чем при обычном цитогенетическом тестировании.
Полимеразная цепная реакция (ПЦР): Это очень чувствительный тест, который также может обнаружить некоторые генные и хромосомные изменения, которые слишком малы, чтобы их можно было увидеть под микроскопом. Это полезно для обнаружения генных изменений, которые есть только в нескольких клетках, что делает его подходящим для обнаружения небольшого количества клеток лейкемии в образце (например, после лечения).
Это полезно для обнаружения генных изменений, которые есть только в нескольких клетках, что делает его подходящим для обнаружения небольшого количества клеток лейкемии в образце (например, после лечения).
Другие молекулярные и генетические тесты
Другие, более новые типы лабораторных тестов также могут проводиться на образцах для поиска специфического гена или других изменений в лейкозных клетках.
Визуализирующие тесты на ОМЛ
Визуализирующие тесты используют рентгеновские лучи, звуковые волны, магнитные поля или радиоактивные частицы для создания изображений внутренней части тела. Лейкемия обычно не образует опухоли, поэтому визуализирующие исследования не всегда помогают в постановке диагноза. Когда визуализирующие тесты проводятся у людей с ОМЛ, чаще всего ищут инфекции или другие проблемы, а не саму лейкемию. В некоторых случаях могут быть проведены тесты на визуализацию, чтобы помочь определить степень заболевания, если предполагается, что оно могло распространиться за пределы костного мозга и крови.
Рентген
Рутинное рентгенологическое исследование органов грудной клетки может быть выполнено при подозрении на легочную инфекцию.
Компьютерная томография (КТ)
КТ использует рентгеновские лучи для получения подробных изображений поперечного сечения вашего тела. Этот тест может помочь определить, увеличены ли какие-либо лимфатические узлы или органы в вашем теле. Обычно это не требуется для диагностики ОМЛ, но это может быть сделано, если ваш врач подозревает, что лейкемия растет в органе, таком как селезенка.
Биопсия иглы под контролем КТ: В некоторых случаях КТ можно использовать для введения иглы для биопсии в предполагаемую аномалию, например абсцесс. Для этой процедуры вы лежите на столе для компьютерной томографии, а врач проводит иглой для биопсии через кожу к новообразованию. КТ повторяют до тех пор, пока игла не окажется внутри образования. Затем образец извлекают и отправляют в лабораторию для изучения под микроскопом.
ПЭТ/КТ: Некоторые аппараты сочетают КТ-сканирование с ПЭТ-сканированием (ПЭТ/КТ-сканирование). Для ПЭТ-сканирования в кровь вводят глюкозу (форма сахара), содержащую радиоактивный атом. Поскольку раковые клетки в организме быстро растут, они поглощают большое количество радиоактивного сахара. Затем специальная камера может создать изображение областей радиоактивности в организме. С помощью ПЭТ/КТ врач может сравнить области с более высокой радиоактивностью на ПЭТ-сканировании с более подробным изображением этой области на КТ.
Магнитно-резонансная томография (МРТ)
Как и компьютерная томография, МРТ дает подробные изображения мягких тканей тела. Но при МРТ вместо рентгеновских лучей используются радиоволны и сильные магниты.
МРТ-сканирование очень полезно для изучения головного и спинного мозга, но оно обычно не требуется людям с ОМЛ.
Ультразвук
Ультразвук использует звуковые волны и их эхо для получения изображений внутренних органов или масс.

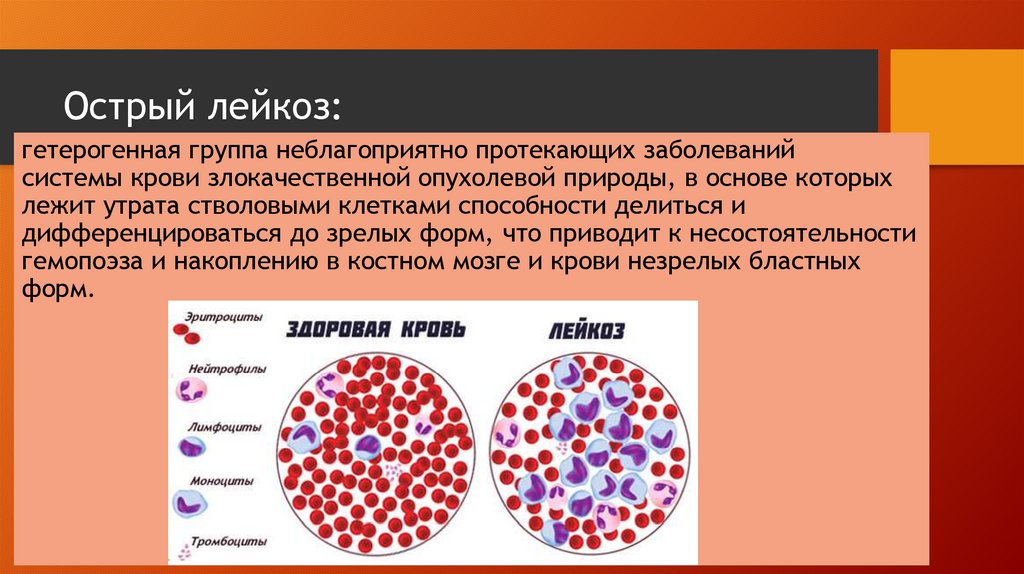 Тем не менее, исследования показали, что только в 8–10% случаев болезнь у детей является наследственной. И сам факт наличия генетического заболевания не означает, что у человека обязательно разовьется опухоль.
Тем не менее, исследования показали, что только в 8–10% случаев болезнь у детей является наследственной. И сам факт наличия генетического заболевания не означает, что у человека обязательно разовьется опухоль.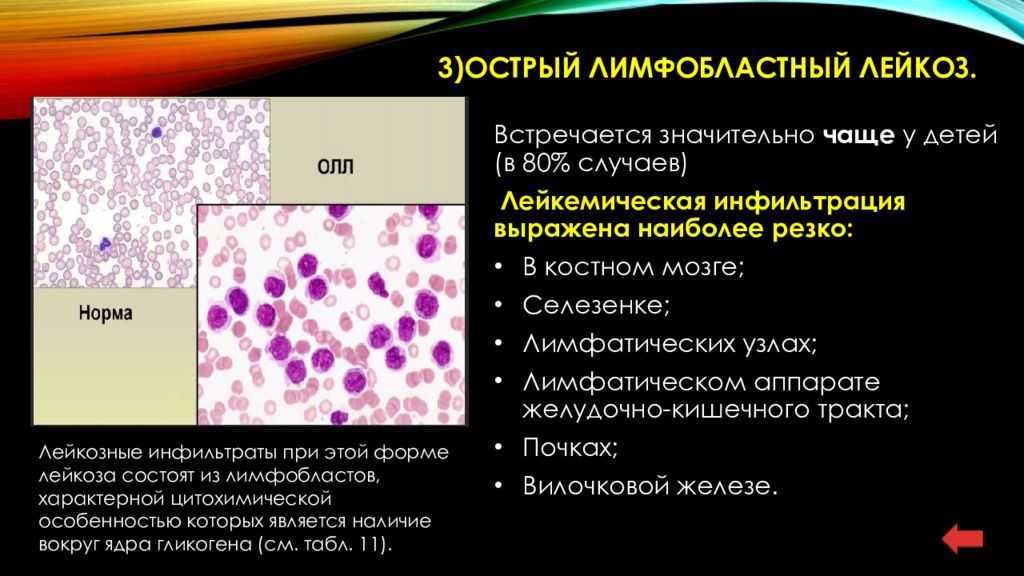
 Многим детям эту процедуру проводят во сне (под наркозом). Если пациент бодрствует во время процедуры, ему дают подходящее болеутоляющеесредство..
Многим детям эту процедуру проводят во сне (под наркозом). Если пациент бодрствует во время процедуры, ему дают подходящее болеутоляющеесредство..

 В ходе исследования измеряют количество клеток, процент живых клеток и некоторые их характеристики, такие как размер, форма и наличие маркеров лейкоза на поверхности клеток.
В ходе исследования измеряют количество клеток, процент живых клеток и некоторые их характеристики, такие как размер, форма и наличие маркеров лейкоза на поверхности клеток. . Такое исследование важно, поскольку онкозаболевания вызваны ошибками (мутациями) в генах клетки. Выявление этих ошибок способствует диагностике конкретного подвида лейкоза. На основе этой информации врачи могут выбирать варианты лечения, соответствующие конкретному случаю. Детям, у которых лейкоз вызван мутациями с благоприятным прогнозом, назначают менее токсичное лечение. И наоборот, врачи могут назначать более интенсивное лечение, еслилейкозвызван наличием мутаций, имеющих менее благоприятный прогноз. Могут быть выявлены мутации, для которых имеются специальные направленныеметодылечения.
. Такое исследование важно, поскольку онкозаболевания вызваны ошибками (мутациями) в генах клетки. Выявление этих ошибок способствует диагностике конкретного подвида лейкоза. На основе этой информации врачи могут выбирать варианты лечения, соответствующие конкретному случаю. Детям, у которых лейкоз вызван мутациями с благоприятным прогнозом, назначают менее токсичное лечение. И наоборот, врачи могут назначать более интенсивное лечение, еслилейкозвызван наличием мутаций, имеющих менее благоприятный прогноз. Могут быть выявлены мутации, для которых имеются специальные направленныеметодылечения.  Эта процедура также называется «ЛП» или «поясничный прокол».
Эта процедура также называется «ЛП» или «поясничный прокол». 
 Если клетки распространились, случай относится к высокому риску.
Если клетки распространились, случай относится к высокому риску.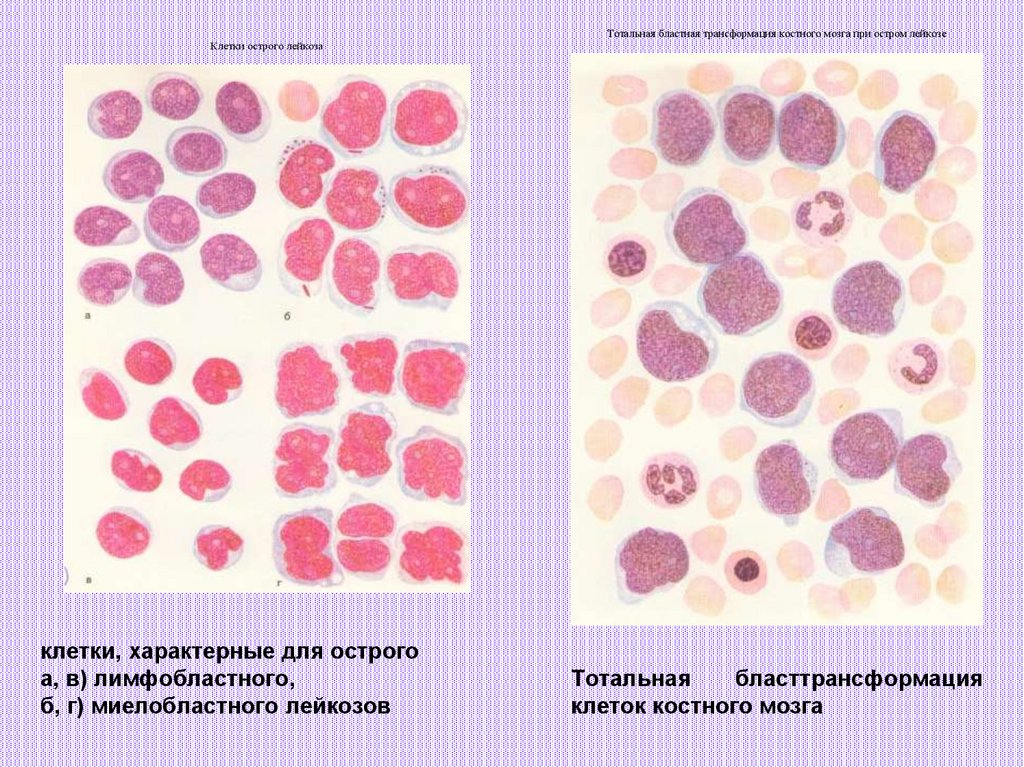 Тем не менее, исследования показали, что только в 8–10% случаев болезнь у детей является наследственной. И сам факт наличия генетического заболевания не означает, что у человека обязательно разовьется опухоль.
Тем не менее, исследования показали, что только в 8–10% случаев болезнь у детей является наследственной. И сам факт наличия генетического заболевания не означает, что у человека обязательно разовьется опухоль.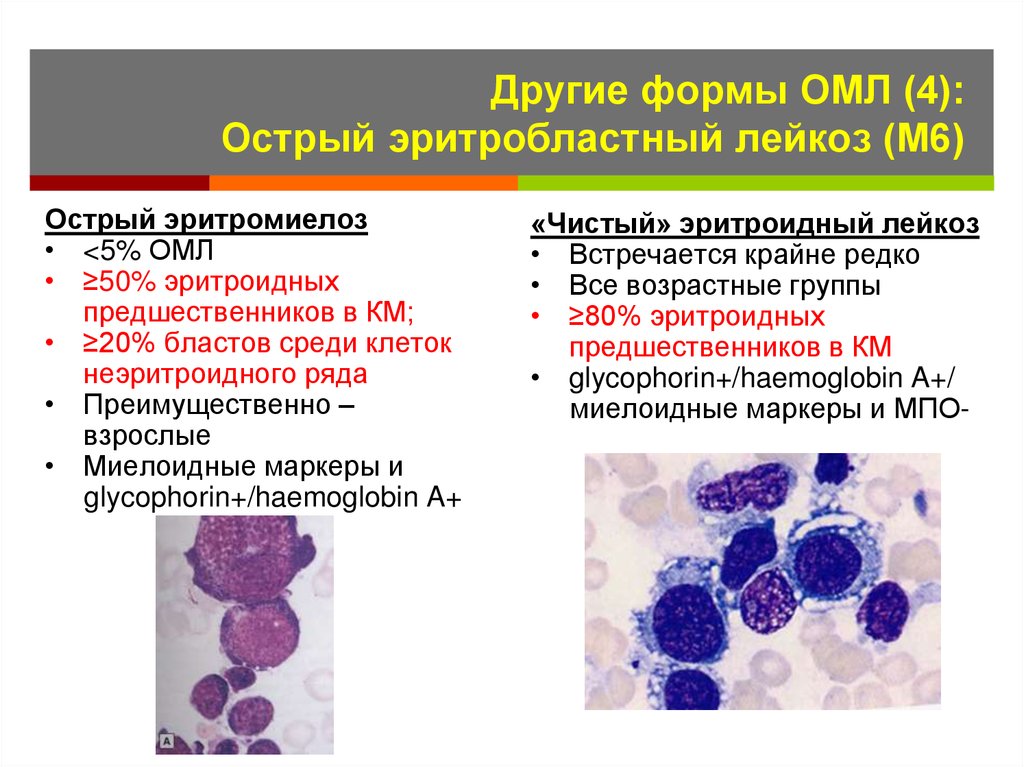 При этом берут образец крови и определяют количество эритроцитов и тромбоцитов, количество и вид лейкоцитов, количество гемоглобина в эритроцитах и пропорцию эритроцитов в образце крови. При лейкозе в крови может содержаться слишком много белых кровяных телец, многие из которых будут бластами — ранними предшественниками клеток крови. У здоровых детей они обычно обнаруживаются только в костном мозге.
При этом берут образец крови и определяют количество эритроцитов и тромбоцитов, количество и вид лейкоцитов, количество гемоглобина в эритроцитах и пропорцию эритроцитов в образце крови. При лейкозе в крови может содержаться слишком много белых кровяных телец, многие из которых будут бластами — ранними предшественниками клеток крови. У здоровых детей они обычно обнаруживаются только в костном мозге.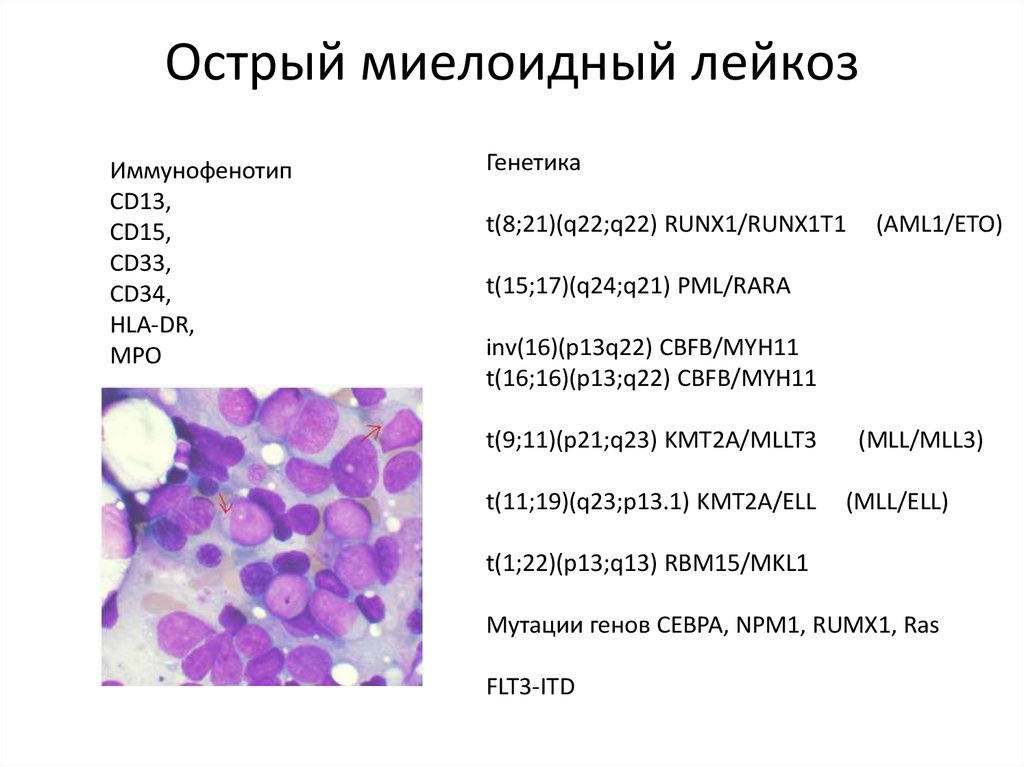 Многим детям эту процедуру проводят во сне (под наркозом). Если пациент бодрствует во время процедуры, ему дают подходящее болеутоляющеесредство..
Многим детям эту процедуру проводят во сне (под наркозом). Если пациент бодрствует во время процедуры, ему дают подходящее болеутоляющеесредство..