Что такое гиперурикемия и гиперурикозурия: Гиперурикозурия (Hyperuricosuria, HUU) — сеть ветеринарных лабораторий «Шанс Био»
Гиперурикемия и проблема хронической болезни почек
АГ — артериальная гипертония
ГУ — гиперурикемия
ДИ — доверительный интервал
ДЭ — дисфункция эндотелия
ЗЭВЗ — зависимая от эндотелия вазодилатация
МАУ — микроальбуминурия
МК — мочевая кислота
Мфб — миофибробласт
ОР — относительный риск
ОШ — отношение шансов
СД — сахарный диабет
СКФ — скорость клубочковой фильтрации
ССО — сердечно-сосудистые осложнения
ХБП — хроническая болезнь почек
ЭндМТ — эндотелиально-мезенхимальная трансдифференциация
ЭпитМТ — эпителиально-мезенхимальная трансдифференциация
MCP-1 — белок-хемоаттрактант моноцитов 1-го типа
TGF-β1 — трансформирующий β-фактор роста 1-го типа
α-SMA — гладкомышечный α-актин
Спектр заболеваний, лежащих в основе развития хронической болезни почек (ХБП) и приводящих к хронической почечной недостаточности, широк.
 М. Тареев, Внутренние болезни, 1951 г.). Эти идеи получили дальнейшее развитие в многочисленных клинических и экспериментальных исследованиях, выполненных в России [5—8] и в мире. Стало очевидно, что первично развившаяся ГУ/гиперурикозурия может вызывать разные формы поражения почек (нефролитиаз, острая мочекислая блокада, тубулоинтерстициальный нефрит). В то же время нарушения обмена МК, возникающие вторично при ХБП и оказывающие повреждающее действие на почки (механизмы которого частично расшифрованы), могут быть одним из неиммунных факторов, способствующих прогрессированию ХБП любой природы. Распространенность ГУ в популяции, по данным разных авторов, варьирует от 5—8% (в Европе) до 25 % в отдельных регионах Китая и Японии [9]. Среди лиц, страдающих ХБП, этот показатель существенно возрастает (с 24% среди пациентов с ХБП II—III стадии до 80% среди больных после трансплантации почки) [10, 11]. Самостоятельная роль МК в развитии ХБП и связанных с ней осложнений подтверждена результатами эпидемиологических исследований, выявивших ассоциацию ГУ с сердечно-сосудистыми заболеваниями, артериальной гипертонией (АГ), сахарным диабетом (СД), ожирением [12].
М. Тареев, Внутренние болезни, 1951 г.). Эти идеи получили дальнейшее развитие в многочисленных клинических и экспериментальных исследованиях, выполненных в России [5—8] и в мире. Стало очевидно, что первично развившаяся ГУ/гиперурикозурия может вызывать разные формы поражения почек (нефролитиаз, острая мочекислая блокада, тубулоинтерстициальный нефрит). В то же время нарушения обмена МК, возникающие вторично при ХБП и оказывающие повреждающее действие на почки (механизмы которого частично расшифрованы), могут быть одним из неиммунных факторов, способствующих прогрессированию ХБП любой природы. Распространенность ГУ в популяции, по данным разных авторов, варьирует от 5—8% (в Европе) до 25 % в отдельных регионах Китая и Японии [9]. Среди лиц, страдающих ХБП, этот показатель существенно возрастает (с 24% среди пациентов с ХБП II—III стадии до 80% среди больных после трансплантации почки) [10, 11]. Самостоятельная роль МК в развитии ХБП и связанных с ней осложнений подтверждена результатами эпидемиологических исследований, выявивших ассоциацию ГУ с сердечно-сосудистыми заболеваниями, артериальной гипертонией (АГ), сахарным диабетом (СД), ожирением [12].
Результаты 2 когортных исследований, суммарно включающих 13 388 человек, прослеженных в течение 9 лет, были проанализированы D. Weiner и соавт. Выявлено, что повышение уровня МК в сыворотке крови на каждый 1 мг/дл ассоциировалось с увеличением риска развития ХБП: отношение шансов (ОШ) 1,07 при 95% доверительном интервале (ДИ) от 1,01 до 1,14 и ОШ 1,11 при 95% ДИ от 1,02 до 1,21 для скорости клубочковой фильтрации (СКФ) и уровня креатинина в сыворотке крови соответственно [13].
В другом исследовании, включившем 22 000 здоровых лиц, проведен анализ развития ХБП в зависимости от наличия умеренной и тяжелой степени ГУ — 7—8,9 мг/дл (416—529 ммоль/л) и более 9 мг/дл (более 535 ммоль/л). При многофакторном анализе риск развития ХБП был высок как у лиц с умеренно повышенным уровнем МК в крови, так и с тяжелой степенью ГУ (ОШ 1,26 при 95% ДИ от 1,02 до 1,55 и ОШ 1,63 при 95% ДИ от 1,18 до 2,27 соответственно) [14].
При многофакторном анализе рисков (возраст, пол, масса тела, уровни МК, глюкозы, общего холестерина и триглицеридов в крови, среднее артериальное давление и коэффициент альбумин/креатинин в моче) у 900 здоровых волонтеров выявлена значимая связь между уровнем МК и риском снижения СКФ через 59 мес наблюдения (скорригированный относительный риск — ОР 1,28 при 95% ДИ от 1,12 до 1,48 для каждого 1 мг/дл повышения уровня МК в крови) [15].
При изучении ГУ как фактора риска развития диабетической нефропатии у пациентов с СД 2-го типа (средняя длительность наблюдения 18,1 года) выявлено, что исходный уровень МК в крови являлся предиктором развития персистирующей протеинурии (ОР 2,37 для каждых 100 ммоль/л, или1,7 мг/дл, повышения уровня МК в крови; р=0,04) [16].
В недавно представленном систематическом обзоре с метаанализом когортных исследований, проведенных в период с 1948 по 2011 г., доказана роль ГУ как независимого фактора риска развития de novo нефропатии в трансплантированной почке (ОР 1,65 при 95%ДИ от 1,02 до 2,65) и потери трансплантата (ОР 2,01 при 95% ДИ от 1,39 до 2,94), причем влияние ГУ зависело от дозы.
Если приведенные выше факты позволяют сделать вывод о том, что ГУ является одним из значимых факторов риска развития ХБП, то в отношении влияния МК на прогрессирование поражения почек и смертность пациентов с ХБП результаты эпидемиологических исследований неоднозначны [18—20]. Однако на основании многих из них с высокой долей достоверности можно считать, что ГУ является одним из факторов риска смерти пациентов с ХБП [21—23], в первую очередь как и в общей популяции, от сердечно-сосудистых осложнений (ССО) [24].
В проведенном в 2012 г. метаанализе когортных исследований (за период с 1966 по 2010 г., в том числе 11, посвященных риску возникновения, и 10 — риску прогрессирования поражения почек) выявлены взаимосвязи ГУ с формированием и/или прогрессированием поражения почек.
Анализ взаимосвязи прогрессирования ХБП и ГУ затруднен большим количеством сопутствующих факторов, способствующих прогрессированию почечной недостаточности у больных ХБП. Роль МК как фактора прогрессирования не бесспорна. Многие исследователи отводят ей только дополнительное значение к основным факторам, влияющим на течение ХБП и сердечно-сосудистую смерть, — АГ, инсулинорезистентность, избыточная масса тела, гиперлипидемия [18, 19].
Одной из причин, затрудняющих достоверную оценку влияния уровня МК в крови на прогрессирование ХБП, была низкая частота морфологического подтверждения уратного повреждения почек из-за отсутствия четких показаний к биопсии почки у больных с уратным дисметаболизмом в стандартной практике.
В результате существенно снизился энтузиазм по поводу назначения аллопуринола и применения других методов коррекции уровня МК при бессимптомной ГУ, например в США. В то же время в Японии медикаментозное снижение урикемии включено в стандарты лечения пациентов с АГ и сопутствующей ГУ даже без клинических проявлений (суставной подагры, нефролитиаза, хронического уратного тубулоинтерстициального нефрита) [29]. Между тем изучение морфологических изменений в почке, связанных с уратным дисметаболизмом, может иметь большое значение для углубленной оценки ассоциированного поражения почек и оптимизации методов лечения.
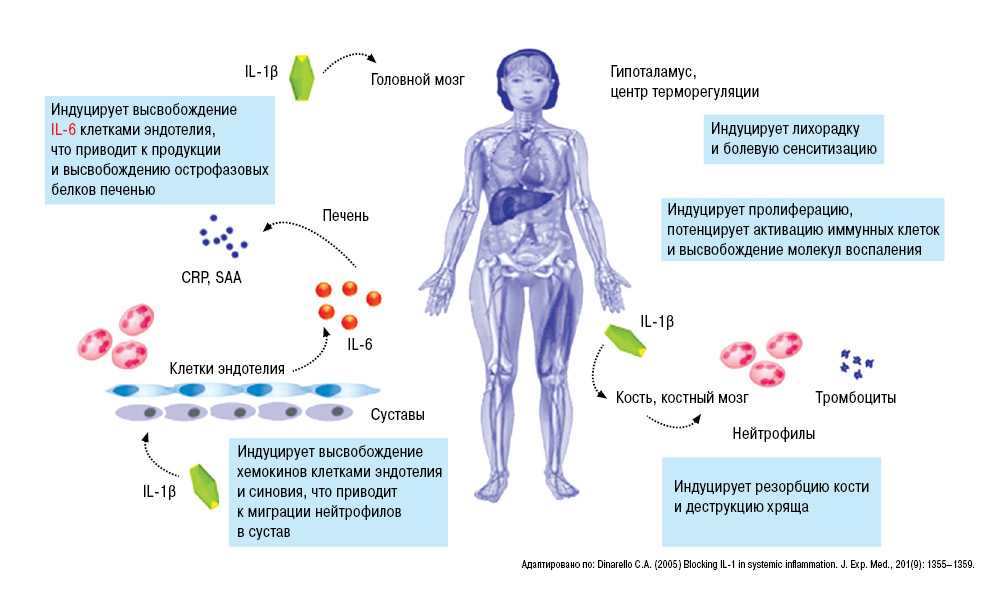
Несмотря на то что все большее количество исследований, публикуемых в последние годы и выполненных в соответствии с принципами доказательной медицины, обосновывают связь ГУ с ХБП, остаются неясными конкретные механизмы реализации повреждающего действия МК в органах и тканях. Накоплено достаточное количество свидетельств того, что МК является фактором воспаления: кристаллы моноурата натрия вызывают каскад воспалительных реакций в суставах при подагре [30] и воспаление в других тканях, в первую очередь в тубулоинтерстиции почек [31, 32].
Эти результаты были подтверждены Yang Zhou и соавт. [32] при исследовании ткани почки крыс с интраперитонеальным введением МК: миграция и инфильтрация тубулоинтерстициальной ткани активированными Т-клетками и макрофагами сопровождались выделением ими RANTES (Regulated on activation, normal T-cells expressed and secreted) — хемоаттрактанта для моноцитов и Т-клеток фенотипа CD4/CD45R0, белка-хемоаттрактанта моноцитов 1-го типа (MCP-1), трансформирующего β-фактора роста 1-го типа (TGF-β Авторы установили, что экспрессия этих провоспалительных и профиброгенных цитокинов в ответ на воздействие МК происходит, главным образом, через активацию внутриклеточной сигнальной системы NF-κB.
Авторы установили, что экспрессия этих провоспалительных и профиброгенных цитокинов в ответ на воздействие МК происходит, главным образом, через активацию внутриклеточной сигнальной системы NF-κB.
Результаты последних исследований свидетельствуют о влиянии ГУ на степень экспрессии TGF-β1 в тубулоинтерстиции почки и значении индуцированного им тубулоинтерстициального фиброза в прогрессировании поражения почек в целом. Так, в исследовании S. Кim и соавт. [35] на модели СД 2-го типа у крыс показано, что длительное воздействие ГУ способствует экспрессии TGF-β1 с усилением фиброзных изменений в тубулоинтерстиции почек. Применение аллопуринола способствовало замедлению прогрессирования поражения почек, что выражалось в отсутствии нарастания альбуминурии и снижении активации TGF-β1 в канальцевых клетках и сопровождалось увеличением экспрессии тубулоцитами Е-катгерина, уменьшением продукции ими виментина и гладкомышечного α-актина (α-SMA), свидетельствуя о замедлении трансдифференциации этих клеток в миофибробласты (Мфб) — главные «продуценты» фиброза в ткани почек. Данное исследование впервые позволило на примере нефропатии, обусловленной СД 2-го типа, оценить влияние терапии, снижающей уровень МК, на профиброгенные процессы в ткани почек [35].
Данное исследование впервые позволило на примере нефропатии, обусловленной СД 2-го типа, оценить влияние терапии, снижающей уровень МК, на профиброгенные процессы в ткани почек [35].
Способность МК прямо вызывать эпителиально-мезенхимальную трансдифференциацию (ЭпитМТ) клеток почечных канальцев подтверждена в эксперименте у крыс с ГУ. Под влиянием МК менялся фенотип тубулярных эпителиоцитов: снижалась экспрессия эпителиального маркера Е-катгерина, а синтез α-SMA — мезенхимального маркера повышался к 4-й неделе эксперимента еще до развития существенного тубулоинтерстициального фиброза, свидетельствуя о трансформации эпителиоцитов в активированные Мфб. По действием аллопуринола сокращались вызванные МК накопления Мфб в ткани почки, замедляя формирование тубулоинтерстициального фиброза уже к 6-й неделе эксперимента. В культуре эпителиальных канальцевых клеток у крыс показано, что непосредственно под влиянием МК увеличивается деградация и снижается экспрессия Е-катгерина, приводя к разрушению межклеточных контактов и нарушению полярности эпителиальных клеток. По мнению авторов, это является пусковым механизмом ЭпитМТ [33].
По мнению авторов, это является пусковым механизмом ЭпитМТ [33].
В ткани почек человека 90% профильтрованной МК реабсорбируется с участием транспортных систем, локализованных в апикальных мембранах проксимальных канальцев, среди которых одной из наиболее изученных является транспортная система URAT-1. Последние исследования свидетельствуют о повышенной активации этой системы под воздействием МК [36].
Гиперурикозурия, сопровождающая ГУ, способствует увеличению концентрации МК в цитоплазме клеток проксимальных канальцев с усилением ее повреждающего действия через активацию транспортной системы URAT-1. Так, активация транспортной системы URAT-1 усиливает, а блокада пробенецидом тормозит экспрессию RANTES, MCP-1, TGF-β1 в ответ на воздействие МК. Однако блокада URAT-1 не вызывает полное прекращение поступление МК в клетку. По-видимому, имеются и другие транспортные системы, обеспечивающие поступление МК в клетку. В то же время не вызывает сомнений, что состояние транспортных систем, их активация или блокада, в том числе обусловленные генетическими факторами [37], играют важную роль в процессах воспаления и повреждения канальцевых структур почек при ГУ.
В более ранних работах, посвященных механизмам повреждающего действия на тканевые структуры почки МК, изучена индуцированная ей ДЭ [38—40]. ГУ способствует как генерализованной, так и локально-почечной ДЭ. Предполагают, что ДЭ, индуцированная ГУ и сопряженная с ней эндотелиально-мезенхимальная трансдифференциация (ЭндМТ), лежат в основе развития кардиоренального синдрома у больных ХБП [38, 41, 42]. Экспериментальные данные, результаты проспективных и плацебо-контролируемых исследований показали, что МК обладает способностью инициировать и поддерживать ДЭ опосредованно через NO-синтазу [39, 43], а также стимулировать пролиферацию гладких мышечных клеток как в системном сосудистом русле, так и в почечных сосудах [39].
M. Kanbay и соавт. [44] установили, что при применении аллопуринола в дозе 300 мг/сут в течение 4 мес у пациентов с ГУ и АГ происходит достоверное уменьшение проявлений ДЭ, оцененной с помощью теста с зависимой от эндотелия вазодилатации (ЗЭВЗ). Это улучшение оказалось достоверным по сравнению контрольной группой, получавшей стандартную антигипертензивную терапию (р=0,003)./60-1.jpg) Результаты многофакторного линейного регрессионного анализа указывали на достоверную независимую взаимосвязь между ГУ и ЗЭВЗ как до, так и после лечения (β=-0,55; p=0,03 и β=-0,40; p=0,024) [44].
Результаты многофакторного линейного регрессионного анализа указывали на достоверную независимую взаимосвязь между ГУ и ЗЭВЗ как до, так и после лечения (β=-0,55; p=0,03 и β=-0,40; p=0,024) [44].
В эксперименте также показано, что МК прямо стимулирует ренин-ангиотензин-альдостероновую систему [39], а через активацию ангиотензина II может участвовать в генезе почечной АГ, усугублять ДЭ и ЭндМТ и процессы образования фиброза тубулоинтерстиция при ХБП [41].
В настоящее время для оценки ДЭ и в целом поражения почек широко применяется определения микроальбуминурии (МАУ) [45—47]. МАУ достоверно чаще выявлялась у пациентов с ГУ и коррелировала с признаками ДЭ [27].
У пациентов с АГ, ассоциированной с ГУ, выявлена высокая и достоверная корреляция между урикемией и выраженностью альбуминурии (r=0,898; p<0,001), урикемией и концентрацией в плазме крови эндотелина-1 — показателя генерализованной ДЭ (r=0,864; p<0,001) [27].
На основании результатов многофакторного анализа и множественного линейного регрессионного анализа выявлено, что МАУ достоверно ассоциировалась с высоким уровнем МК (более 7 мг/дл у мужчин и более 6 мг/дл у женщин; p<0,01), при этом ГУ была независимым фактором риска повышения МАУ (коэфф. 4,8; p=0,033) [48].
4,8; p=0,033) [48].
В связи с этим возможно применение МАУ в диагностике поражения почек, индуцированном ГУ, и в оценке адекватности нефропротективной терапии [27, 46, 48].
При обследовании 113 пациентов с ХБП (исходная СКФ 40,6±11,3 мл/мин на 1,73 м2, средний уровень МК в крови 7,9±2,1мг/дл) показано, что коррекция ГУ аллопуринолом может замедлить прогрессирование ХБП. Через 24 мес наблюдения снижение СКФ было значительно менее выражено в группе пациентов, получавших аллопуринол в дозе 100 мг/сут, по сравнению с контрольной группой, в которой лечение ГУ не проводилось (р=0,018) [49].
В метаанализе, выполненном в 2011 г. и включающем 735 пациентов, получены убедительные данные, свидетельствующие о влиянии лечения, снижающего уровень МК в крови, на прогрессирование поражения почек. Снижение урикемии на фоне лечения аллопуринолом у пациентов с ХБП способствует повышению СКФ и снижению уровня креатинина в крови (р<0,05) [50].
Среди механизмов благоприятного воздействия аллопуринола на прогрессирование ХБП, помимо снижения уровня МК и торможения процессов фиброзирования в тубулоинтерстиции почки, рассматривают также способность препарата воздействовать на ДЭ [28, 51]. Блокируя ксантиноксидазу, аллопуринол предотвращает индукцию окислительного стресса, обрывая дальнейший каскад воспалительных и профиброгенных реакций [52]. Уменьшение проявлений ДЭ у пациентов, получающих аллопуринол, сопровождается снижением риска развития ССО [53, 54]. Благоприятное влияние на функцию эндотелия оказывает также другой препарат, снижающий уровень МК крови, но не являющийся ингибитором ксантиноксидазы — бензомарон [55].
Блокируя ксантиноксидазу, аллопуринол предотвращает индукцию окислительного стресса, обрывая дальнейший каскад воспалительных и профиброгенных реакций [52]. Уменьшение проявлений ДЭ у пациентов, получающих аллопуринол, сопровождается снижением риска развития ССО [53, 54]. Благоприятное влияние на функцию эндотелия оказывает также другой препарат, снижающий уровень МК крови, но не являющийся ингибитором ксантиноксидазы — бензомарон [55].
Вызывает интерес изучение других лекарственных средств, влияющих на уровень МК в крови. Так, многофакторный анализ в исследовании RENAAL, посвященном оценке эффективности лечения СД 2-го типа антагонистом ангиотензина II лозартаном, показал, что нефропротективный эффект лозартана складывается как из антигипертензивного, антипротеинурического действия, так и из способности препарата снижать уровень МК в крови [56]. Эти данные подтверждают значение МК как потенциально модифицируемого фактора прогрессирования ХБП.
Полученные результаты дают основания полагать, что дальнейшие исследования в этом направлении должны быть направлены на обоснование назначения препаратов, снижающих уровень МК в крови, больным ХБП с ГУ в качестве нефропротективной терапии.
Эти перспективы поддерживаются появлением новых препаратов, нарушающих синтез МК, такого как фебукостат, фармакокинетика которого отличается от таковой аллопуринола, с преимущественным выведением через печень, с большей степенью безопасности и широким «терапевтическим коридором». Благодаря этим свойствам фебукостат способен стать средством выбора у пациентов на развернутых стадиях ХБП [57].
Таким образом, становится очевидной необходимость индивидуализированного подхода к первичной и вторичной профилактике ХБП с учетом факторов прогрессирования у каждого конкретного пациента. В этом отношении изучение ГУ как дополнительного фактора риска развития и прогрессирования ХБП является перспективным и актуальным [58]. Появление новых препаратов, снижающих уровень МК, обладающих большей степенью безопасности и широким терапевтическим действием [57], а также использование ранее изученных препаратов урикозурического действия (в частности, ряда блокаторов рецепторов ангиотензина II) [56], позволяет более активно корректировать ГУ с целью замедления прогрессирования ХБП и профилактики ССО.
Нарушения обмена пуринов в практике врача-уролога
Обмен пуринов представляет собой сложный биохимический процесс, в котором принимают участие многие ферментные системы. Большая часть мочевой кислоты в организме образуется в процессе метаболизма нуклеиновых кислот, однако описаны и другие пути ее синтеза. Во всех вариантах важнейшим промежуточным звеном является инозиновая кислота, которая в дальнейшем подвергается гидролизу. Образующийся гипоксантин под влиянием фермента ксантиноксидазы преобразуется в ксантин и мочевую кислоту. С точки зрения биохимии нарушения пуринового обмена представляют собой различные варианты дисбаланса между ферментными системами, отвечающими за синтез и транспортировку мочевой кислоты и ее предшественников.
Содержание пуринов в организме складывается из их поступления с продуктами питания и эндогенного синтеза. Считается, что в организме взрослого здорового человека содержится около 1000 мг
мочевой кислоты. При подагре этот
показатель может возрастать в несколько раз. Содержание мочевой
кислоты в организме не является
жестким и основным клиническим
показателем состояния пуринового
обмена. Диапазон нормальных
значений мочевой кислоты крови колеблется в широких пределах, и у
мужчин он находится в пределах
200-360 мкмоль/л, у женщин – 160340 мкмоль/сут. У здоровых людей за
сутки выводится и вновь синтезируется примерно 750 мг, или 2/3 от общего объема мочевой кислоты. Из
этого количества около 80%, или 600
мг экскретируется почками, оставшиеся 20% выводятся через желудочно-кишечный тракт. По расчетам
П.М. Клименко и соавт. (2010), клиренс мочевой кислоты в норме составляет 5,4-9,0 мл/мин [1].
При подагре этот
показатель может возрастать в несколько раз. Содержание мочевой
кислоты в организме не является
жестким и основным клиническим
показателем состояния пуринового
обмена. Диапазон нормальных
значений мочевой кислоты крови колеблется в широких пределах, и у
мужчин он находится в пределах
200-360 мкмоль/л, у женщин – 160340 мкмоль/сут. У здоровых людей за
сутки выводится и вновь синтезируется примерно 750 мг, или 2/3 от общего объема мочевой кислоты. Из
этого количества около 80%, или 600
мг экскретируется почками, оставшиеся 20% выводятся через желудочно-кишечный тракт. По расчетам
П.М. Клименко и соавт. (2010), клиренс мочевой кислоты в норме составляет 5,4-9,0 мл/мин [1].
Обмен уратов в почках представляет собой сложный и многоступенчатый процесс. В клубочках
происходит фильтрация уратов
плазмы. Попавшие в ультрафильтрат
ураты практически полностью реабсорбируются в проксимальном канальце, а затем секретируются.
Некоторая часть секретированных
уратов заново реабсорбируется. Процесс активной секреции уратов
очень чувствителен к различным химическим агентам. Считается, что
почечную секрецию уратов повышают оротовая кислота, лозартан,
эстрогены, продукты распада тетрациклина. Почечную экскрецию уратов понижают этамбутол, тиазиды и
тиазидоподобные диуретики, в
меньшей степени фуросемид и ацетазоламид [2]. Склонность тиазидов
и индапамида уменьшать почечную
экскрецию уратов и повышать их сывороточную концентрацию делает эти препараты противопоказаными
при подагре и гиперурикемии.
Процесс активной секреции уратов
очень чувствителен к различным химическим агентам. Считается, что
почечную секрецию уратов повышают оротовая кислота, лозартан,
эстрогены, продукты распада тетрациклина. Почечную экскрецию уратов понижают этамбутол, тиазиды и
тиазидоподобные диуретики, в
меньшей степени фуросемид и ацетазоламид [2]. Склонность тиазидов
и индапамида уменьшать почечную
экскрецию уратов и повышать их сывороточную концентрацию делает эти препараты противопоказаными
при подагре и гиперурикемии.
При нарушениях пуринового обмена происходит гиперпродукция мочевой кислоты, что проявляется повышением ее концентрации в крови (гиперурикемия) и моче (гиперурикурия).
КЛИНИЧЕСКИЕ ВАРИАНТЫ НАРУШЕНИЯ ОБМЕНА ПУРИНОВ
Сами по себе нарушения обмена
пуринов не являются нозологическими
единицами, подобно тому, как не являются заболеваниями различные
врожденные и приобретенные ферментопатии без клинических проявлений. Однако заболевания, связанные
нарушениями пуринового обмена, в
реальной урологической практике
встречаются сравнительно часто, что
делает этот аспект актуальным. Большинство врачей-урологов хорошо знакомы с особенностями уратного
нефролитиаза, и в то же время в большинстве случаев совершенно не имеют
даже представления о существовании
других, подчас более тяжелых заболеваний, обусловленных нарушениями
пуринового обмена. Между тем все они
встречаются с разной частотой в урологических стационарах, а также при
консультативной работе.
Большинство врачей-урологов хорошо знакомы с особенностями уратного
нефролитиаза, и в то же время в большинстве случаев совершенно не имеют
даже представления о существовании
других, подчас более тяжелых заболеваний, обусловленных нарушениями
пуринового обмена. Между тем все они
встречаются с разной частотой в урологических стационарах, а также при
консультативной работе.
Наиболее клинически значимым следствием нарушений пуринового обмена является повышение уровня мочевой кислоты в крови – гиперурикемия, которая и является основным патогенетическим фактором различных патологических состояний. В зависимости от этиологии гиперурикемия подразделяется на первичную и вторичную по отношению к какому-либо заболеванию.
Клиническим следствием первичной гиперурикемии является подагра в широком понимании этого
термина. Сюда входит и классический
острый микрокристаллический артрит, а также другие варианты поражения опорно-двигательной системы, и
различные варианты подагрической нефропатии, одним из которых является уратный нефролитиаз, и тофусы различной локализации, и
осложнения всех этих состояний.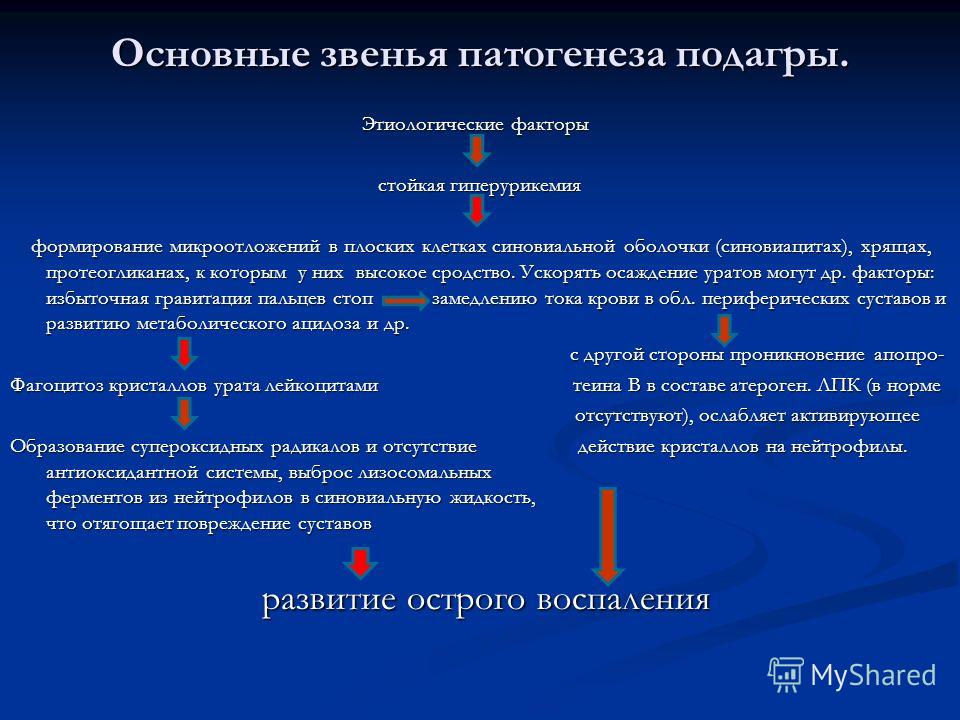
Вполне очевидно, что для врачауролога больший интерес представляют заболевания органов мочеполовой системы, обусловленные гиперурикемией. В нефрологической и общетерапевтической практике для определения поражения почек вследствие гиперурикемии несколько десятилетий назад было введено понятие «подагрическая почка», которое в современной медицине трансформировалось в «подагрическую нефропатию». Учитывая экспериментально доказанное повреждающее действие гиперурикурии на почечные структуры, также предлагался термин «уратная нефропатия». Эти понятия являются обобщающими и объединяют несколько достаточно сильно различающихся по своему патогенезу процессов: острую мочекислую нефропатию, уратный нефролитиаз и хронический тубулоинтерстициальный нефрит. Некоторые авторы также отмечают возможность иммунокомплексного гломерулонефрита вследствие нарушения обмена пуринов [3].
В урологической практике наиболее часто встречаются пациенты с
уратным нефролитиазом. До 80%
таких пациентов хотя бы один раз в
жизни имели эпизод артрита, причем
совершенно необязательно классической локализации – I плюснефалангового сустава. В последнее время все
чаше встречаются атипичные варианты артрита, например, гонит. Кроме
того, широкое и бесконтрольное применение нестероидных противовоспалительных средств зачастую смазывает клиническую картину, увеличивая удельный вес артритов с
меньшей активностью воспалительного процесса. Можно отметить, что
сочетание артрита и уратного нефролитиаза является не обязательным, а,
скорее, характерным.
До 80%
таких пациентов хотя бы один раз в
жизни имели эпизод артрита, причем
совершенно необязательно классической локализации – I плюснефалангового сустава. В последнее время все
чаше встречаются атипичные варианты артрита, например, гонит. Кроме
того, широкое и бесконтрольное применение нестероидных противовоспалительных средств зачастую смазывает клиническую картину, увеличивая удельный вес артритов с
меньшей активностью воспалительного процесса. Можно отметить, что
сочетание артрита и уратного нефролитиаза является не обязательным, а,
скорее, характерным.
Клиническая картина конкремента почки, мочеточника хорошо
известна всем урологам, поэтому еще
раз ее подробно описывать смысла
нет. Однако необходимо отметить, что при наиболее тяжелом, «злокачественном» течении наряду с образованием уратных камней в просвете
мочевых путей, возможно и отложение кристаллов мочевой кислоты в
почечном интерстиции, что носит название нефрокальциноз. В отличие от
нефролитиаза, нефрокальциноз при
подагре всегда двухсторонний. Нефрокальциноз не имеет каких-либо
специфических симптомов. Клинические проявления сводятся к прогрессированию почечной недостаточности за счет прогрессирования нефросклероза. Нефрокальциноз в большинстве случаев выявляется при
ультразвуковом сканировании.
Нефрокальциноз не имеет каких-либо
специфических симптомов. Клинические проявления сводятся к прогрессированию почечной недостаточности за счет прогрессирования нефросклероза. Нефрокальциноз в большинстве случаев выявляется при
ультразвуковом сканировании.
Тубулоинтерстициальный нефрит является характерным и частым вариантом подагрической нефропатии. Однако в виду меньшей яркости клинической картины, он известен, главным образом, специалистамнефрологам и ревматологам.
На начальных стадиях тубулоинтерстициального нефрита патологический процесс затрагивает, в
основном, канальцы и почечный интерстиций, поэтому ведущим симптомом является нарушение концентрационной функции почек – полиурия с низкой плотностью мочи (гипостенурия). Протеинурия не превышает 1 г/сут или вовсе отсутствует –
она связана с нарушением реабсорбции белка канальцами. Для подагрического интерстициального нефрита
характерна стойкая уратурия, а также
стойкая или эпизодическая микрогематурия, особенно после перенесенной респираторной вирусной инфекции. При иммуногистохимическом исследовании почечных биоптатов у части пациентов с клинической картиной подагрического тубулоинтерстициального нефрита было
отмечено свечение С3-фракции комплемента и IgG, что характерно для
иммунокомплексных гломерулонефритов. Это позволило выделить хронический гломерулонефрит как
отдельный вариант подагрической
нефропатии [3].
При иммуногистохимическом исследовании почечных биоптатов у части пациентов с клинической картиной подагрического тубулоинтерстициального нефрита было
отмечено свечение С3-фракции комплемента и IgG, что характерно для
иммунокомплексных гломерулонефритов. Это позволило выделить хронический гломерулонефрит как
отдельный вариант подагрической
нефропатии [3].
При прогрессировании подагрического тубулоинтерстициального нефрита характерно развитие артериальной гипертензии и нефросклероза.
Острая мочекислая нефропатия
(острая подагрическая почка) в
своей основе имеет обструкцию почечных канальцев кристаллами
мочевой кислоты, что приводит к
острой почечной недостаточности.
Заболевание начинается с олигурии.
Часть пациентов одновременно
предъявляет жалобы на болевой
синдром по типу почечной колики,
макрогематурию, что может объясняться миграцией крупных кристаллов уратов по мочеточнику.
Патогномоничной является высокая
уратурия, не характерная для острой
почечной недостаточности другой
этиологии. Предположение об острой мочекислой нефропатии основывается на сочетании трех
клинических признаков – высокоактивного артрита с характерной локализацией, резкого уменьшения
диуреза и кирпично-бурого цвета
мочи. Диагноз тем более вероятен,
если имеются указания в анамнезе на
гипогидратацию любого генеза – от
посещения бани до неадекватной инфузионной терапии и передозировки
мочегонных, а также на употребление значительного количества мясных продуктов и/или алкоголя. При
естественном течении заболевания
олигурия практически всегда прогрессирует до анурии с развернутой
клинической картиной острой почечной недостаточности.
Предположение об острой мочекислой нефропатии основывается на сочетании трех
клинических признаков – высокоактивного артрита с характерной локализацией, резкого уменьшения
диуреза и кирпично-бурого цвета
мочи. Диагноз тем более вероятен,
если имеются указания в анамнезе на
гипогидратацию любого генеза – от
посещения бани до неадекватной инфузионной терапии и передозировки
мочегонных, а также на употребление значительного количества мясных продуктов и/или алкоголя. При
естественном течении заболевания
олигурия практически всегда прогрессирует до анурии с развернутой
клинической картиной острой почечной недостаточности.
Проблема острой мочекислой
нефропатии тесно связана с вторичным гиперурикемиям. Причины повышения уровня мочевой кислоты в
сыворотке крови довольно многочисленны и разнообразны. Среди
них: хроническая почечная недостаточность, независимо от этиологии,
ожирение, особенно высоких степеней, плохо компенсированный сахарный диабет 2 типа, дислипидемия, акромегалия, гипотиреоз, гипопаратиреоз, токсикоз беременности, миелопролиферативные заболевания, хроническая интоксикация
свинцом, хронический алкоголизм,
тяжелые формы псориаза, химиои
лучевая терапия. В большинстве случаев выраженность гиперурикемии
при этих заболевания небольшая,
реже – умеренная. Таким образом
нарушения пуринового обмена довольно редко значимо отражаются
на клинической картине заболевания. Однако их наличие влияет на
развитие осложнений, а также повышает относительный риск кардиоваскулярной и общей смертности.
В большинстве случаев выраженность гиперурикемии
при этих заболевания небольшая,
реже – умеренная. Таким образом
нарушения пуринового обмена довольно редко значимо отражаются
на клинической картине заболевания. Однако их наличие влияет на
развитие осложнений, а также повышает относительный риск кардиоваскулярной и общей смертности.
Самым ярким и клинически значимым вариантом вторичной гиперурикемии является «синдром лизиса опухоли» («синдром распада опухоли»), развивающийся при химиотерапии и радиотерапии лимфопролиферативных заболеваний, реже опухолей другой локализации. Ключевым компонентом этого синдрома, наряду с гиперфосфатемией и гиперкалиемией, является гиперпродукция мочевой кислоты, приводящая к развитию острой мочекислой нефропатии, причем нередко на неизмененных почках [4].
МЕДИКАМЕНТОЗНАЯ ТЕРАПИЯ ЗАБОЛЕВАНИЙ, ОБУСЛОВЛЕННЫХ НАРУШЕНИЯМИ ПУРИНОВОГО ОБМЕНА
Терапия нарушений обмена пуринов складывается из нескольких
составляющих. Обязательно назначается диета с ограничением продуктов, богатых пуринами. Специфическими препаратами являются аллопуринол и цитрат.
Обязательно назначается диета с ограничением продуктов, богатых пуринами. Специфическими препаратами являются аллопуринол и цитрат.
Аллопуринол показан при подагрическом тубулоинтерстициальном нефрите, острой мочекислой нефропатии, уратном нефролитиазе в сочетании с гиперурикемией, а также при химиотерапии злокачественных новообразований для профилактики развития вторичной гиперурикемии и острой почечной недостаточности. Минимально эффективная дозировка – 200 мг/сут, среднетерапевтическая – 300-400 мг/сут. При химиотерапии злокачественных новообразований требуются высокие, близкие к максимальным дозировки аллопуринола – 600-900 мг/сут [2].
Цитратная терапия является
неотъемлемой составляющей медикаментозного лечения подагрической нефропатии. Действие солей
лимонной кислоты на процесс кристаллобразования в моче многогранно. Растворимость мочевой
кислоты значительно меняется в зависимости от реакции среды. В кислой среде ураты имеют очень плохую
растворимость и легко переходят в
твердую фазу – кристаллизуются. При нейтральной или щелочной реакции растворимость этих солей
увеличивается. Основным эффектом
цитратов является способность
уменьшать кислотность мочи, что
предотвращает кристаллизацию уратов и создает условия для растворения уже сформированных кристаллов. На этом основана литолитическая терапия. Однако при щелочной реакции среды уменьшается
растворимость фосфатов. Наслоение
пленки фосфата на уратный камень
делает практически бесперспективным процесс дальнейшего литолиза.
Это диктует необходимость тщательного контроля за реакцией мочи на
протяжении всего курса лечения. В
современных условиях на смену эмпирическому применению растительного сырья, богатого лимонной
кислотой и ее солями, пришли лекарственные средства, включающие
в себя химически чистый цитрат и
набор тест-полосок для мониторирования реакции мочи.
При нейтральной или щелочной реакции растворимость этих солей
увеличивается. Основным эффектом
цитратов является способность
уменьшать кислотность мочи, что
предотвращает кристаллизацию уратов и создает условия для растворения уже сформированных кристаллов. На этом основана литолитическая терапия. Однако при щелочной реакции среды уменьшается
растворимость фосфатов. Наслоение
пленки фосфата на уратный камень
делает практически бесперспективным процесс дальнейшего литолиза.
Это диктует необходимость тщательного контроля за реакцией мочи на
протяжении всего курса лечения. В
современных условиях на смену эмпирическому применению растительного сырья, богатого лимонной
кислотой и ее солями, пришли лекарственные средства, включающие
в себя химически чистый цитрат и
набор тест-полосок для мониторирования реакции мочи.
Помимо ощелачивания цитратом, для перевода мочевой кислоты
в растворимую кето-форму необходимы ионы калия и натрия. Именно
их количество определяет «ионную
силу раствора». Соотношение же
этих ионов между собой также немаловажно, т.к. показано, что избыток
ионов натрия провоцирует образование кальциевой «корки» на камне.
Соотношение же
этих ионов между собой также немаловажно, т.к. показано, что избыток
ионов натрия провоцирует образование кальциевой «корки» на камне.
Исследования 80-90-х годов продемонстрировали эффективность литолиза уратных камней с применением цитратов в режиме монотерапии порядка 75-80% [5, 6]. В настоящее время в результате совершенствования методики эффективность литолиза удалось поднять до 85-90%, в зависимости от особенностей химического состава конкрементов [1, 7, 8].
В последние годы появились
работы, свидетельствующие о целесообразности включения препаратов
цитрата в многокомпонентные схемы терапии. В частности, при уратных камнях мочеточника, особенно
его дистальной трети, комбинированная терапия, включающая цитрат
и тамсулозин, привела к самостоятельному отхождению 84,8% конкрементов, что достоверно отличается
от групп пациентов, получавших монотерапию этими препаратами
(68,8% и 58,8% соответственно), а
также от пациентов, получавших
плацебо (26,1%) [9].
Имеются убедительные доказательства эффективности комбинации аллопуринола и цитрата при подагрическом интерстициальном нефрите. Двенадцатинедельный курс комбинированной терапии, включающей Калия-натрия-гидрогенцитрат 3 гр/сут и аллопуринол 100-200 мг/сут, привел к росту скорости клубочковой фильтрации в среднем на 15 мл/мин по сравнению с контрольной группой монотерапии аллопуринолом. Также существенно повысился и клиренс мочевой кислоты и отмечалось большее ее снижение в крови. Отметим при этом низкую дозировку аллопуринола. Можно сделать предположение о возможном потенцировании эффектов аллопуринола и Калия-натриягидроген-цитрат. Дополнительным позитивным следствием должно быть снижение частоты побочных действий аллопуринола, что является существенным лимитирующим фактором при медикаментозном лечении подагрической нефропатии. Особенно значимым стало повышение клиренса креатинина при начальных стадиях хронической почечной недостаточности. [10]
Более яркий эффект цитрата в
отношении функции почек отмечен
при лечении хронического интерстициального нефрита, обусловленного гиперурикемией, у пациентов,
страдающих ожирением [11].
Механизм действия цитрата не ограничивается защелачиванием мочи. Цитрат является одним из физиологических ингибиторов кристаллообразования. Так как моча в норме представляет собой пересыщенный солевой раствор, присутствие в ней ингибиторов кристаллообразования служит необходимым условием адекватного функционирования всей системы мочевыделения. Гипоцитратурия является самой распространенной метаболической аномалией у больных с камнеобразованием. Кроме этого, хелатные свойства цитратной молекулы по отношению к ионам кальция делают цитрат-ион незаменимым в профилактике рецидивов кальцийсодержащих камней. Цитрат + тиазидный диуретик – стандартное сочетание для метафилактики кальций-оксалатного нефролитиаза. Более того, такая терапия способствует увеличению плотности костной ткани. Этим может объясняться эффективность цитратов не только при уратном, но и при кальций-оксалатном нефролитиазе [12-14].
В связи с широким использованием ДЛТ и чрескожной нефролитотомии цитратная терапия стала
активно применяться как до, так и
после процедуры в течение 3х-4хнедель. Прием цитрата перед ДЛТ
позволяет разрыхлить поверхность
и структуру камня, что повышает
успешность дробления камня при
меньшей травматизации почки. А
длительный прием после процедуры
способствует ускоренному клиренсу фрагментов камня и препятствует рецидивированию литогенеза.
Прием цитрата перед ДЛТ
позволяет разрыхлить поверхность
и структуру камня, что повышает
успешность дробления камня при
меньшей травматизации почки. А
длительный прием после процедуры
способствует ускоренному клиренсу фрагментов камня и препятствует рецидивированию литогенеза.
Наряду в вышеописанными механизмами действия, соли лимонной
кислоты дополнительно обладают
антисептическим, цитопротективным и метаболическим эффектами,
которые также могут находить применение в клинической практике.
В частности, Strassner C. и Friesen A.
сообщают об исчезновении кандидурии у 16 пациентов из 18 на фоне терапии цитратами, что, вероятно,
связано с изменением реакции мочи [15]. Заключение о цитопротективном эффекте цитрата сделано на основании успешных попыток Brühl P.
et al. предотвращать с его помощью
химическую травму слизистой мочевого пузыря при терапии препаратами из группы оксазафосфоринов –
циклофосфамидом и ифосфамидом
[16] (в современной онкологической
и нефрологической практике с этой
целью применяется препарат из
группы муколитиков месна, практически не влияющий на КЩС).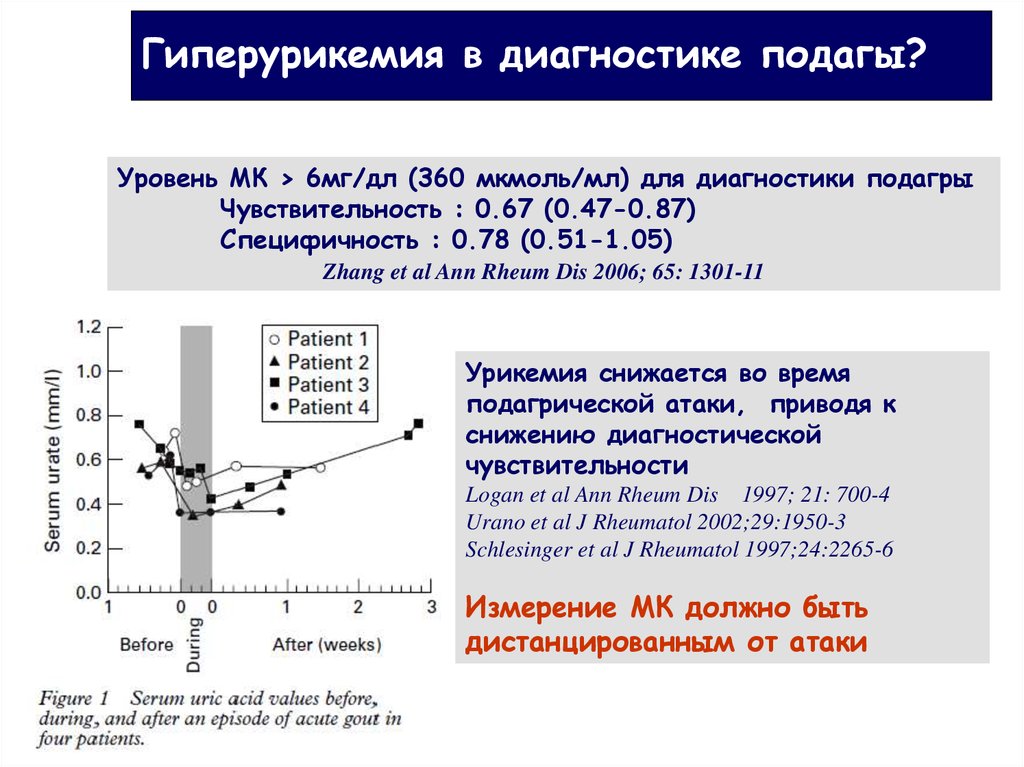 Также
имеются сообщения об использовании цитрата для коррекции ацидоза вследствие уретеросигмостомии [17].
Также
имеются сообщения об использовании цитрата для коррекции ацидоза вследствие уретеросигмостомии [17].
Основная сложность при цитратной терапии уратного нефролитиаза заключается в подборе адекватной дозировки препарата. Н.К.Дзеранов, на протяжении многих лет изучавший и разрабатывавший этот аспект, рекомендует начинать с назначения диеты и оценки реакции мочи в течение 5 дней в строго определенное время суток. На основании полученных средних значений рН мочи определяется начальная доза препарата и, главное, ее распределение в течение суток. Через 5 дней лечения снова определяются средние показатели реакции мочи в строго аналогичное время суток и, при необходимости, проводится коррекция дозировки препарата [18]. «Интерактивное», то есть в реальном времени, изменение дозировки цитрата неэффективно и даже небезопасно, так как приводит к скачкам рН, что может вызвать кристаллизацию фосфата.
Так как цитрат в норме присутствует в организме, лекарственные
средства на его основе практически
лишены токсичности. Тем не менее,
существуют клинические ситуации,
когда применение этих препаратов
требует осмотрительности. Применение цитратных смесей нежелательно при острой мочекислой
нефропатии и вообще при острой
почечной недостаточности любой
этиологии. Лимитирующим фактором выступает не цитратион как таковой, а калий, выведение которого в этой клинической ситуации затруднено. При острой мочекислой нефропатии целесообразно введение 4%
раствора гидрокарбоната натрия, физиологического раствора и т.д. в сочетании с петлевыми диуретиками.
Необходимо поддерживать диурез на
уровне не менее 100-150 мл/час, рН
мочи не ниже 6,5 [3, 4].
Тем не менее,
существуют клинические ситуации,
когда применение этих препаратов
требует осмотрительности. Применение цитратных смесей нежелательно при острой мочекислой
нефропатии и вообще при острой
почечной недостаточности любой
этиологии. Лимитирующим фактором выступает не цитратион как таковой, а калий, выведение которого в этой клинической ситуации затруднено. При острой мочекислой нефропатии целесообразно введение 4%
раствора гидрокарбоната натрия, физиологического раствора и т.д. в сочетании с петлевыми диуретиками.
Необходимо поддерживать диурез на
уровне не менее 100-150 мл/час, рН
мочи не ниже 6,5 [3, 4].
При тяжелой недостаточности
кровообращения лимитирующим
фактором является повышенное поступление в организм натрия. Иногда в этой ситуации предпочтительнее оказывается ацетазоламид.
Этот препарат из группы диуретиков сильно, а главное, неконтролируемо защелачивает мочу, что делает
его неконкурентоспособным по
сравнению с цитратом при медикаментозной терапии уратного нефролитиаза. Однако ацетазоламид –
практически единственная возможность повысить рН мочи, не прибегая к введению солей, что в условиях
тяжелой сердечной недостаточности
крайне нежелательно.
Однако ацетазоламид –
практически единственная возможность повысить рН мочи, не прибегая к введению солей, что в условиях
тяжелой сердечной недостаточности
крайне нежелательно.
Таким образом, медикаментозное лечение пациентов с нарушениями обмена пуринов представляет собой сложную и многогранную проблему, требующую междисциплинарного подхода.
Резюме:
В статье рассмотрены основные клинические варианты нарушений пуринового обмена, встречающиеся в урологической практике. Кратко отражена патофизиология нарушений метаболизма пуринов. Рассмотрены все клинические
варианты подагрической нефропатии, в том числе особенности патогенеза и клинические проявления. В статье подробно рассмотрены основные подходы к медикаментозной терапии этих состояний с акцентом на специфическую
терапию цитратом. Проанализирована доступная литература по данному вопросу. Продемонстрированы возможности применения цитрата как в режиме монотерапии, так и в комбинации с другими лекарственными средствами. Определены показания и противопоказания к применению этих препаратов.
Определены показания и противопоказания к применению этих препаратов.
ЛИТЕРАТУРА
1.Клименко П.М., Чабанов В.А., Акиншевич И.Ю. Возможности консервативного лечения больных уратным нефролитиазом. // Новости медицины и фармации. 2010. №3. С.5-7.
2. Федеральное руководство по использованию лекарсвенных средств (формулярная система). Выпуск Х. 2009 год. Под редакцией Чучалина А.Г., Белоусова Ю.Б., Яснецова В.В. Москва. ЗАО РИЦ «Человек и лекарство».
3. Нефрология. Руководство для врачей. Под редакцией И.Е. Тареевой. Москва. Медицина. 2000. 688с.
4. Нефрология. Национальное руководство. Под редакцией Н.А. Мухина. Москва. ГЭОТАР–Медиа. 2009. 716с.
5. Chugtai M.N., Khan F.A., Kaleem M., Ahmed M. Management of uric acid stone. // J Pak Med Assoc. 1992 Jul;42(7):153-5.
6. Petritsch P.H. Uric acid calculi: results of conservative treatment.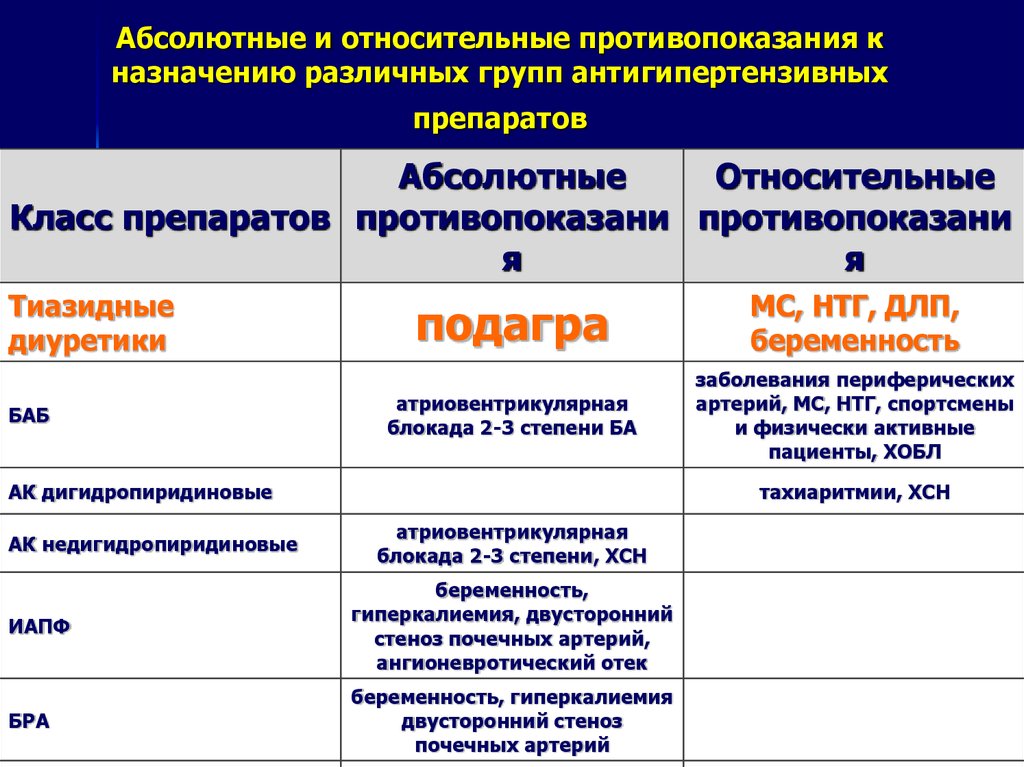 // Urology. 1977 Dec;10(6):536-8.
// Urology. 1977 Dec;10(6):536-8.
7. Елисеев М.С., Денисов И.С., Барскова В.Г. Применение цитрата Уралит–У у больных подагрой и нефролитиазом. // Совpeменная ревматология. 2012. № 3. С.13-15.
8. Пасечников С.П., Митченко М.В. Современные аспекты цитратной терапии при мочекаменной болезни. Опыт применения препарата Уралит-У. // Здоровье мужчины. 2007. №3. С.109-113.
9. El-Gamal O., El-Bendary M., Ragab M., Rasheed M. Role of combined use of potassium citrate and tamsulosin in the management of uric acid distal ureteral calculi // Urological Research June 2012, Volume 40, Issue 3, pp 219-224.
10. Saito J., Matsuzawa Y., Ito H., Omura M., Ito Y., Yoshimura K., Yajima Y., Kino T., Nishikawa T. рЈe alkalizer citrate reduces serum uric Acid levels and improves renal // Endocr Res 2010;35(4):145-154.
11. Saito J., Matsuzawa Y., Ito H., Omura M., Kino T., Nishikawa T.
Alkalizer Administration Improves Renal Function in
Hyperuricemia Associated with Obesity. // Japanese Clinical
Medicine 2013:4.
// Japanese Clinical
Medicine 2013:4.
12. Butz M. Oxalate stone prophylaxis by alkalinizing therapy. // Urologe A. 1982 May;21(3):142-6.
13. Ito H. Combined administration of calcium and citrate reduces urinary oxalate excretion. // Hinyokika Kiyo. 1991 Oct;37(10):1107-10.
14. Berg C., Larsson L., Tiselius H.G. Effects of different doses of alkaline citrate on urine composition and crystallization of calcium oxalate. // Urological Research February 1990, Volume 18, Issue 1, pp 13-16.
15. Strassner C., Friesen A. Therapy of candiduria by alkalinization of urine. Oral treatment with potassium-sodium-hydrogen citrate. // http://www.ncbi.nlm.nih.gov/pubmed/7498850
16. Bruhl P., Hoefer-Janker H., Scheef W., Vahlensieck W. Prophylactic
alkalization of the urine during cytostatic tumor treatment
with the oxazaphosphorine derivatives, cyclophosphamide and
ifosfamide. // Onkologie. 1979 Jun;2(3):120-4.
// Onkologie. 1979 Jun;2(3):120-4.
17. Sasagama I., Nakada T., Ishgooka M., Kubota Y., Sawamura T. Efect of standardized mixture of potassium and sodium citrate and citric acide (Uralit-U) on the correction of postoperative acidosis in patients who underwent uireterosigmostomy. // Nephron 1994;66:477-478.
18. Дзеранов Н.К., Рапопорт Л.М. Литолитическая терапия. Практические рекомендации. Москва. ООО «Информполиграф». 2011. 16с.
| Прикрепленный файл | Размер |
|---|---|
| Скачать статью | 346.13 кб |
‹ Молекулярно-генетические нарушения как критерии в дифференциальной диагностике редких опухолей почки Вверх Ноктурия: современные гендерные аспекты эпидемиологии, патогенеза и диагностики ›
Гиперурикемия: симптомы, лечение и др.
Распространена ли гиперурикемия?
Гиперурикемия возникает, когда в крови слишком много мочевой кислоты. Высокий уровень мочевой кислоты может привести к ряду заболеваний, включая болезненный тип артрита, называемый подагрой. Повышенный уровень мочевой кислоты также связан с такими состояниями здоровья, как болезни сердца, диабет и заболевания почек.
Высокий уровень мочевой кислоты может привести к ряду заболеваний, включая болезненный тип артрита, называемый подагрой. Повышенный уровень мочевой кислоты также связан с такими состояниями здоровья, как болезни сердца, диабет и заболевания почек.
Показатели гиперурикемии резко возросли с 1960 года. Самое последнее значительное исследование гиперурикемии и подагры показало, что 43,3 миллиона американцев страдают этим заболеванием.
Мочевая кислота образуется при распаде пуринов в организме. Пурины — это химические вещества, содержащиеся в определенных продуктах. Обычно это:
- красное мясо
- субпродукты
- морепродукты
- бобы
В норме ваше тело избавляется от мочевой кислоты при мочеиспускании. Гиперурикемия возникает, когда ваш организм либо вырабатывает слишком много мочевой кислоты, либо не может выделять ее в достаточном количестве. Обычно это происходит потому, что ваши почки не выводят его достаточно быстро.
Избыточный уровень мочевой кислоты в крови может привести к образованию кристаллов. Хотя они могут образовываться в любом месте тела, они, как правило, образуются в суставах и вокруг них, а также в почках. Защитные лейкоциты вашего тела могут атаковать кристаллы, вызывая воспаление и боль.
Хотя они могут образовываться в любом месте тела, они, как правило, образуются в суставах и вокруг них, а также в почках. Защитные лейкоциты вашего тела могут атаковать кристаллы, вызывая воспаление и боль.
Только около одной трети людей с гиперурикемией испытывают симптомы. Это известно как бессимптомная гиперурикемия.
Хотя гиперурикемия не является болезнью, если уровень мочевой кислоты остается высоким, со временем это может привести к ряду заболеваний.
Подагра
Подагра, иногда называемая подагрическим артритом, возникает примерно у 20 процентов людей с гиперурикемией. Быстрое падение уровня мочевой кислоты также может спровоцировать подагру. Подагра может проявляться в виде изолированных приступов или вспышек. Некоторые люди страдают хронической подагрой, которая включает в себя ряд приступов, возникающих в течение коротких периодов времени.
Подагра может поразить любой сустав в вашем теле, но воспаление часто сначала появляется на большом пальце ноги. Стопы, лодыжки, колени и локти также являются распространенными местами подагры.
Стопы, лодыжки, колени и локти также являются распространенными местами подагры.
Приступы подагры возникают внезапно, часто ночью. Приступы достигают пика интенсивности примерно через 12–14 часов. Даже без лечения приступы подагры обычно проходят в течение двух недель.
Симптомы подагры могут включать в себя:
- Тяжелая боль в ваших суставах
- Жесткость сустава
- Сложность. Поразительные суставы
- покраснение и отеки
- . лет кристаллы мочевой кислоты могут образовывать сгустки, называемые тофусами. Эти твердые шишки находятся под кожей, вокруг суставов и в изгибе в верхней части уха. Тофусы могут усиливать боль в суставах и со временем повреждать суставы или сдавливать нервы. Они часто видны невооруженным глазом и могут уродовать.
Камни в почках
Кристаллы мочевой кислоты могут вызывать накопление камней в почках. Часто камни маленькие и выделяются с мочой. Иногда они могут стать слишком большими, чтобы пройти и заблокировать часть мочевыводящих путей.

Симптомы камней в почках включают:
- боль или ноющую боль в пояснице, боку, животе или паху
- тошноту
- усиление позывов к мочеиспусканию
- боль при мочеиспускании
- затрудненное мочеиспускание
- кровь в моче
- моча с неприятным запахом
Если у вас также есть почечная инфекция, у вас может быть лихорадка или озноб.
Это скопление мочи является идеальной зоной для размножения бактерий. В результате инфекции мочевыводящих путей часто встречаются при наличии камней в почках.
Узнайте больше: Что такое инфекция мочевыводящих путей (мочевого пузыря)? »
Гиперурикемия может быть у любого человека, но она чаще встречается у мужчин, чем у женщин, и риск увеличивается с возрастом. У вас также больше шансов получить его, если вы выходец с тихоокеанских островов или афроамериканец.
Несколько факторов риска связаны с гиперурикемией:
- употребление алкоголя
- некоторые лекарства, особенно лекарства от болезней сердца
- воздействие свинца
- воздействие пестицидов
- заболевание почек гипотиреоз
- ожирение
- экстремальные уровни физической активности
Ваш врач может назначить анализы крови и мочи для измерения уровня креатинина, который определяет функцию почек, а также уровень мочевой кислоты.

Кровь обычно берут из вены на руке, как правило, на внутренней стороне локтя или на тыльной стороне ладони. Мочевая кислота обычно обнаруживается в моче, когда организм ее выделяет. Ваш врач может заказать 24-часовой сбор мочи, если в вашей крови обнаружен повышенный уровень мочевой кислоты.
Затем этот анализ мочи повторяют после диеты с ограничением пуринов, что помогает определить:
- вы едите слишком много продуктов с высоким содержанием пуринов
- ваш организм вырабатывает слишком много мочевой кислоты
- ваш организм не выделяет достаточное количество мочевой кислоты
Если вы испытываете симптомы подагры, ваш врач может проверить жидкость, скопившуюся в ваших суставах. Это делается с помощью тонкой иглы для забора жидкости из сустава. Его отправят в лабораторию, где его проверят на наличие кристаллов мочевой кислоты. Наличие этих кристаллов указывает на подагру.
Лечение гиперурикемии зависит от ее причины. Если ваша гиперурикемия протекает бессимптомно, лечение не рекомендуется.
 В этой ситуации нет доказанной пользы от назначения терапии, снижающей уровень мочевой кислоты.
В этой ситуации нет доказанной пользы от назначения терапии, снижающей уровень мочевой кислоты.Если гиперурикемия связана с основным заболеванием, его необходимо лечить:
Подагра
Подагра лечится одним или несколькими из следующих препаратов:
- Могут помочь нестероидные противовоспалительные препараты (НПВП). предотвратить или уменьшить тяжесть подагры. К ним относятся ибупрофен (Advil, Motrin IB), напроксен (Aleve, Naprosyn) и целекоксиб (Celebrex),
- Колхицин (Colcrys) часто используется для профилактики или лечения подагры, особенно у людей, которые плохо переносят НПВП.
- Пробенецид помогает снизить уровень мочевой кислоты за счет увеличения мочеиспускания и используется для предотвращения приступов подагры.
- Аллопуринол (Зилоприм) и фебуксостат (Улорик) помогают предотвратить подагру, уменьшая количество мочевой кислоты в крови.
Лечение тофациозной подагры такое же, как и при подагре. Если тофусы становятся настолько большими, что мешают движению суставов, повреждают окружающие ткани или выпячиваются через кожу, возможно, их необходимо удалить хирургическим путем.

Во время этой процедуры делается надрез кожи над тофусом, и тофус удаляется. В редких случаях повреждения сустава может быть рассмотрена операция по замене сустава.
Камни в почках
Если у вас камни в почках меньше 5 миллиметров (мм), ваш врач может посоветовать вам пить много воды и принимать безрецептурные обезболивающие, пока камни не выйдут.
Камни в почках размером 5 мм и более вряд ли отойдут сами по себе. Некоторые врачи назначают лекарства, такие как тамсулозин (Flomax), чтобы расслабить мышцы мочевыводящих путей. Это может сделать выход камней более легким и менее болезненным.
Могут потребоваться дополнительные методы. Экстракорпоральная литотрипсия с шоу-волнами — это неинвазивная процедура, при которой ультразвуковая энергия или ударные волны направляются через кожу на камень в почках. Ударные волны разбивают большой камень на более мелкие части, которые легче проходят через мочевыделительную систему.
Если размер камней превышает 10 мм, может потребоваться их хирургическое удаление.

Уретероскопическая хирургия проводится путем введения эндоскопа диаметром 2 мм через уретру. Он проходит через мочевой пузырь и прямо в мочеточники, которые представляют собой трубки, соединяющие почки с мочевым пузырем.
После этого ваш хирург может выполнить извлечение камня. Если камни необходимо сначала фрагментировать, могут быть установлены стенты, чтобы облегчить отток мочи. Это может помочь уменьшить боль и сохранить мочеточники расширенными, чтобы облегчить прохождение фрагментированных или растворяющихся камней.
Определенные диетические изменения могут помочь снизить уровень мочевой кислоты в крови. Если ваша гиперурикемия связана с подагрой, диетические изменения могут снизить риск приступа подагры и замедлить прогрессирование любого повреждения суставов.
Если вы считаете, что изменение диеты может быть полезным, проконсультируйтесь с врачом. Они могут помочь вам определить, является ли это лучшим выбором для вас.
Если вы скорректируете свой рацион, вам следует продолжать следовать схеме лечения, рекомендованной врачом.
 Диетические изменения не должны использоваться в качестве лечения первой линии.
Диетические изменения не должны использоваться в качестве лечения первой линии.Помните, что мочевая кислота образуется при распаде пуринов в организме. Хотя пурин встречается в природе, он также присутствует в некоторых продуктах. Отказ от этих продуктов может быть полезным.
Чего следует избегать
- красное мясо
- сладкие продукты и напитки, особенно если они содержат кукурузный сироп с высоким содержанием фруктозы
- мясные субпродукты, такие как печень морские гребешки и мидии
- Рыба, такая как тунец, треска, сельдь, и викскурская газета
- шпинат, горох и грибы
- Бобов и чечевицы
- Овсянка
- . для снижения пуринов следует пить больше жидкости, особенно воды. Сохранение гидратации было связано с меньшим количеством приступов подагры. Общее эмпирическое правило — выпивать восемь стаканов жидкости по 8 унций каждый день. Поговорите со своим врачом о том, сколько вам следует пить.
Вам также следует регулярно заниматься спортом и поддерживать здоровый вес.
 Ваш врач может дать конкретные рекомендации, которые лучше всего соответствуют вашим потребностям.
Ваш врач может дать конкретные рекомендации, которые лучше всего соответствуют вашим потребностям.Если у вас бессимптомная гиперурикемия, изменение диеты и образа жизни может помочь снизить уровень мочевой кислоты в крови.
Если уровень мочевой кислоты не контролировать, у вас будет риск развития:
- хронической подагры
- проблем с почками
- гипертонии
- диабета
- метаболического синдрома
Вы должны следовать указаниям своего врача, чтобы предотвратить развитие серьезных хронических заболеваний.
Продолжайте читать: Рекомендации по питанию и диетические ограничения для питания, благоприятного для подагры »
Что такое гиперурикозурия?
Что такое гиперурикозурия?Пресс Введите
искатьiCliniq / Статьи о здоровье / Уровень мочевой кислоты / Что такое гиперурикозурия?
Почечные и урологические заболевания Данные провереныНаписано
Доктор Химанши Порвал
и с медицинской точки зрения
проверено доктором Самером С. Дж. Алтавилом
Дж. Алтавилом Опубликовано 23 ноября 2022 г. — 8 мин чтения
Abstract
Гиперурикозурия – это выделение избыточного количества мочевой кислоты с мочой. Это может произойти как у мужчин, так и у женщин. Прочтите статью, чтобы узнать больше.
Содержание
Что такое гиперурикозурия?
Каковы причины гиперурикозурии?
Каковы признаки и симптомы гиперурикозурии?
Какие методы используются для диагностики гиперурикозурии?
Как лечится гиперурикозурия?
Каковы осложнения гиперурикозурии?
Что такое гиперурикозурия?
Мочевая кислота представляет собой вещество, которое образуется, когда пурины используются клетками организма для осуществления своей деятельности. Пурин — это химическое вещество в организме или получаемое из таких продуктов, как сушеные бобы, горох, пиво и анчоусы.
 В норме ежедневно вырабатывается от 300 до 400 миллиграммов мочевой кислоты, большая часть которой вырабатывается печенью. Фермент, известный как уриказа, превращает мочевую кислоту в аллантоин, но этот фермент неактивен в организме человека. Следовательно, конечным продуктом, образующимся в результате метаболизма пуринов, является мочевая кислота. Почки поддерживают уровень мочевой кислоты в крови. Когда мочевая кислота достигает фильтрационных единиц почек, она реабсорбируется, и только 10% ее выводится из организма. Некоторое количество мочевой кислоты попадает в кишечник и превращается в аммиак. Этот аммиак используется бактериями кишечника для метаболической активности. Однако проблема возникает, когда в мочу попадает более 750–800 миллиграммов мочевой кислоты. Это состояние известно как гиперурикозурия и вызывает серьезные проблемы с мочевыводящими путями. Мочевая кислота может откладываться в костях, суставах и других органах и вызывать серьезные осложнения.
В норме ежедневно вырабатывается от 300 до 400 миллиграммов мочевой кислоты, большая часть которой вырабатывается печенью. Фермент, известный как уриказа, превращает мочевую кислоту в аллантоин, но этот фермент неактивен в организме человека. Следовательно, конечным продуктом, образующимся в результате метаболизма пуринов, является мочевая кислота. Почки поддерживают уровень мочевой кислоты в крови. Когда мочевая кислота достигает фильтрационных единиц почек, она реабсорбируется, и только 10% ее выводится из организма. Некоторое количество мочевой кислоты попадает в кишечник и превращается в аммиак. Этот аммиак используется бактериями кишечника для метаболической активности. Однако проблема возникает, когда в мочу попадает более 750–800 миллиграммов мочевой кислоты. Это состояние известно как гиперурикозурия и вызывает серьезные проблемы с мочевыводящими путями. Мочевая кислота может откладываться в костях, суставах и других органах и вызывать серьезные осложнения.Каковы причины гиперурикозурии?
При избытке мочевой кислоты в моче возрастает риск образования оксалата кальция и камней из мочевой кислоты (уролитов).
 Это связано с тем, что моча становится насыщенной моноуратом натрия, что инициирует образование камней из оксалата кальция. Причины гиперурикозурии перечислены ниже:
Это связано с тем, что моча становится насыщенной моноуратом натрия, что инициирует образование камней из оксалата кальция. Причины гиперурикозурии перечислены ниже:Подагрический диатез — Подагра представляет собой форму артрита, возникающую из-за отложения мочевой кислоты в костях и суставах. Когда у людей, страдающих подагрой, образуются камни из мочевой кислоты, это состояние известно как подагрический диатез. Однако точная причина образования камней из мочевой кислоты у этих пациентов до сих пор неизвестна, но при исследовании моча показывает низкий pH (потенциал водорода).
Диета, богатая пуринами . Пурин — это химическое вещество, отвечающее за образование мочевой кислоты. Если продукты, богатые пуринами, такие как мясо, рыба, анчоусы и алкоголь, употребляются в избытке, в организме накапливается больше мочевой кислоты, что приводит к гиперурикозурии.
Диабет — Точная связь между диабетом и гиперурикозурией неизвестна.
 Тем не менее, диабетики склонны к развитию кислой мочи и камней из мочевой кислоты из-за резистентности к инсулину. Кроме того, поскольку аммиак не вырабатывается в достаточном количестве, нарушается мочевой обмен, что приводит к гиперурикозурии.
Тем не менее, диабетики склонны к развитию кислой мочи и камней из мочевой кислоты из-за резистентности к инсулину. Кроме того, поскольку аммиак не вырабатывается в достаточном количестве, нарушается мочевой обмен, что приводит к гиперурикозурии.Болезнь Крона — это разновидность воспалительного заболевания кишечника, которое вызывает сильную боль в животе, диарею, утомляемость и потерю веса. Пациенты, страдающие этим заболеванием, как правило, производят меньше мочи и теряют необходимые жидкости и электролиты. Кроме того, человек обезвоживается из-за болезни Крона, нарушаются функции почек.
Генетические нарушения — Пациенты, страдающие генетическими нарушениями, такими как синдром Леша-Нихана и нарушения коллагена 1 типа, склонны вырабатывать мочевую кислоту в больших количествах. В результате большое количество его выводится с мочой, что приводит к гиперурикозурии.
Лекарства — Некоторые лекарства препятствуют реабсорбции мочевой кислоты в почках.
 Эти препараты не позволяют почкам реабсорбировать мочевую кислоту. В результате большое количество мочевой кислоты переходит из почек в мочу, повышается риск камнеобразования.
Эти препараты не позволяют почкам реабсорбировать мочевую кислоту. В результате большое количество мочевой кислоты переходит из почек в мочу, повышается риск камнеобразования.Злокачественные новообразования — Люди, больные раком и проходящие лучевую или химиотерапию, как правило, страдают от гиперурикозурии.
Симптомы гиперурикозурии появляются, когда кристаллы мочевой кислоты соединяются с кальцием и образуют камни. Признаки и симптомы гиперурикозурии перечислены ниже:
Боль — Больной испытывает сильную боль в пояснице и боках (в боку). Боль медленно иррадиирует в живот и лобковую область. Так как боль начинается внезапно, она не утихает, даже если больной меняет положение. Пациентам, страдающим почечной коликой (сильной болью в почках), трудно оставаться на месте.
Общие проблемы — Рвота, тошнота и лихорадка обычно наблюдаются, если у пациента развиваются инфекции мочевыводящих путей из-за камней.

Проблемы с мочевыводящими путями — Если камень находится рядом с мочевым пузырем, обычно наблюдаются следующие симптомы:
Наличие крови в моче, также известное как гематурия, обычно наблюдается из-за камней в почках.
Поток мочи становится ограниченным.
Боль и жжение при мочеиспускании являются наиболее частыми симптомами.
Моча имеет неприятный запах и выглядит мутной.
Частые позывы к мочеиспусканию.
Какие методы используются для диагностики гиперурикозурии?
Диагноз гиперурикозурии основывается на данных анамнеза, физикального осмотра, лабораторных анализов и методов визуализации. Методы диагностики описаны ниже:
История болезни — История болезни играет важную роль у пациентов, страдающих гиперурикозурией. Он дает информацию об общем состоянии здоровья пациента, симптомах, продолжительности начала, семейном анамнезе, истории наркотиков и других состояниях, от которых страдает пациент.
 Например, гиперурикозурию можно заподозрить, если у пациента в анамнезе диабет или подагра, он принимает такие лекарства, как пробенецид или сульфинпиразон, и потребляет богатую пуринами пищу.
Например, гиперурикозурию можно заподозрить, если у пациента в анамнезе диабет или подагра, он принимает такие лекарства, как пробенецид или сульфинпиразон, и потребляет богатую пуринами пищу.Физикальное обследование — Пациент будет испытывать дискомфорт из-за боли во время физического обследования. Если он страдает почечной коликой наряду с гиперурикозурией, больной не сможет ни сидеть, ни стоять на месте. Врач также проверит болезненность между 12-м ребром и позвоночником (реберно-позвоночный угол).
Лабораторные анализы — Для диагностики гиперурикозурии обычно рекомендуются следующие лабораторные анализы:
Анализ мочи — В этом тесте пациент собирает мочу в контейнер или стерильный пакет, предоставленный больницей. Образец мочи исследуют в лаборатории микроскопически, визуально или с помощью щупа. Во-первых, моча проверяется с помощью щупа, который меняет цвет, если рН кислый.
 Кислая моча свидетельствует о камнях мочевой кислоты. Затем образец мочи исследуют под микроскопом для обнаружения клеток гноя, бактерий, крови и кристаллов. Если в моче обнаруживаются кристаллы ромбовидной формы, это свидетельствует о наличии камней мочевой кислоты.
Кислая моча свидетельствует о камнях мочевой кислоты. Затем образец мочи исследуют под микроскопом для обнаружения клеток гноя, бактерий, крови и кристаллов. Если в моче обнаруживаются кристаллы ромбовидной формы, это свидетельствует о наличии камней мочевой кислоты.Суточный анализ мочи — Как следует из названия, пациент должен собирать мочу в контейнер в течение дня. Образец мочи отправляется в лабораторию для исследования под микроскопом на следующий день. Этот тест рекомендуется только для пациентов, у которых повторно образуются камни.
Анализ крови — Врач может попросить пациента пройти анализ крови для проверки уровня натрия, калия, кальция и мочевой кислоты. Если уровень мочевой кислоты высок, человек может страдать подагрой или гиперурикозурией.
Анализ камней — Пациенту выдается контейнер и фильтр. Моча должна собираться в емкость и фильтроваться через ситечко.
 Если есть камни, они появляются на сите в виде мелких частиц. Затем его отправляют в лабораторию, чтобы проверить, являются ли они камнями мочевой кислоты.
Если есть камни, они появляются на сите в виде мелких частиц. Затем его отправляют в лабораторию, чтобы проверить, являются ли они камнями мочевой кислоты.
Визуализирующие тесты — Для проверки наличия камней обычно рекомендуются следующие визуализирующие тесты:
Компьютерная томография (КТ) — это один из наиболее специфических и настоятельно рекомендуемых тестов для диагностики камней мочевой кислоты. Эта процедура позволяет получить трехмерные (3D) изображения внутренних органов тела. Пациента укладывают на стол, который скользит в туннельное устройство, где делаются рентгеновские снимки. Камни мочевой кислоты выглядят ярко-белыми на изображениях, полученных после сканирования.
Ультразвук — это диагностический тест, который помогает получить изображения внутренних органов тела, не подвергая пациента воздействию рентгеновских лучей. Преимущество процедуры в том, что пациент не подвергается воздействию рентгеновских лучей, поэтому ее можно безопасно применять у детей и беременных женщин.
 Пациента укладывают на стол, а звуковые волны посылают в тело с помощью преобразователя. Врач перемещает датчик по животу, и изображения получаются на экране компьютера. УЗИ помогает выявить камни в почках и другие проблемы в мочевыделительной системе.
Пациента укладывают на стол, а звуковые волны посылают в тело с помощью преобразователя. Врач перемещает датчик по животу, и изображения получаются на экране компьютера. УЗИ помогает выявить камни в почках и другие проблемы в мочевыделительной системе.
Как лечится гиперурикозурия?
Лечение зависит от причин и тяжести состояния. Варианты лечения описаны ниже:
Лекарства — У пациентов, страдающих гиперурикозурией, моча кислая, что увеличивает риск камнеобразования. Поэтому важно увеличить pH мочи (потенциал водорода), чтобы сделать ее щелочной. Терапия цитратом калия является наиболее эффективным лекарством, используемым для лечения камней из мочевой кислоты. Соли бикарбоната натрия и калия также подщелачивают мочу. Теобромин также является эффективным средством, подавляющим рост кристаллов мочевой кислоты. Аллопуринол также рекомендуется при гиперурикозурии. Ультразвук и 24-часовой анализ мочи проводятся для проверки эффективности этих лекарств.

Вода — Пациенту необходимо ежедневно выпивать достаточное количество воды, чтобы вывести продукты жизнедеятельности из организма. Вода не допускает накопления мочевой кислоты в крови.
Изменение образа жизни — Пациенты, страдающие диабетом и другими нарушениями обмена веществ, должны регулярно заниматься физическими упражнениями для поддержания здорового веса. Следует избегать употребления соленой и богатой пуринами пищи.
Хирургия — Если камни большие и блокируют отток мочи, для их удаления требуется хирургическое вмешательство. Хирургические варианты описаны ниже:
Чрескожная нефролитотомия: Если камень стал очень большим и боль невыносима, делается разрез в области спины для удаления камней, обычно больше двух сантиметров. Через разрез с помощью телескопа вводят трубку, чтобы удалить камень напрямую или разбить его на более мелкие фрагменты для удаления.

Уретероскопия . В ходе этой процедуры в мочевой пузырь через мочеиспускательный канал вводится небольшой телескопоподобный инструмент, известный как уретероскоп. Камни можно легко найти с помощью камеры. Их удаляют напрямую или разбивают на фрагменты, чтобы они могли пройти через мочу.
Каковы осложнения гиперурикозурии?
Гиперурикозурия может вызвать серьезные осложнения, если ее не лечить в течение длительного времени. Осложнения гиперурикозурии перечислены ниже:
Гидронефроз — Это состояние, при котором почки набухают из-за обратного потока мочи. Предположим, что мочевой камень большой и блокирует отток мочи, давление на почки увеличивается, что приводит к отеку и стойкому отказу.
Терминальная стадия почечной недостаточности — При повторном образовании камней из мочевой кислоты почки перестают функционировать постоянно.
 Он известен как терминальная стадия почечной недостаточности; пациент должен находиться на диализе или пройти трансплантацию почки.
Он известен как терминальная стадия почечной недостаточности; пациент должен находиться на диализе или пройти трансплантацию почки.Инфекция мочевыводящих путей — Гиперурикозурия увеличивает риск инфекций мочевыводящих путей, поскольку моча остается в организме. Бактерии быстро попадают в организм и размножаются в моче.
Обструктивный пиелонефрит – опасное для жизни состояние, возникающее из-за бактериальной инфекции. Моча должна быть выведена из организма как можно раньше.
Стриктуры мочеточников — Если камни попадают из почек в мочеточники, они сужаются, что приводит к стриктурам мочеточников.
Хроническая болезнь почек — Если уровень мочевой кислоты продолжает расти, почки теряют способность реабсорбировать ее и навсегда повреждаются.
Заключение:
Гиперурикозурия – это когда мочевая кислота присутствует в моче в больших количествах.
Часто задаваемые вопросы Мочевая кислота образуется, когда организм использует пурины для различных видов деятельности. Несколько причин гиперурикозурии включают подагру, генетические нарушения, диабет и болезнь Крона. Также диета, богатая пуринами, увеличивает риск гиперурикозурии. Больной испытывает сильную боль в боку, которая не проходит легко и усиливается в течение дня и ночи. Камни образуются, когда кристаллы мочевой кислоты слипаются. Эти камни блокируют отток мочи и препятствуют способности почек реабсорбировать мочевую кислоту. Хотя состояние серьезное, оно не является неизлечимым. Доступны лекарства, которые снижают уровень мочевой кислоты и делают pH мочи (потенциал водорода) щелочным. Пациенту не нужно беспокоиться, так как хирургическое вмешательство требуется только при наличии камней из мочевой кислоты. Обратитесь к врачу в ближайшее время для диагностики и лечения состояния.
Мочевая кислота образуется, когда организм использует пурины для различных видов деятельности. Несколько причин гиперурикозурии включают подагру, генетические нарушения, диабет и болезнь Крона. Также диета, богатая пуринами, увеличивает риск гиперурикозурии. Больной испытывает сильную боль в боку, которая не проходит легко и усиливается в течение дня и ночи. Камни образуются, когда кристаллы мочевой кислоты слипаются. Эти камни блокируют отток мочи и препятствуют способности почек реабсорбировать мочевую кислоту. Хотя состояние серьезное, оно не является неизлечимым. Доступны лекарства, которые снижают уровень мочевой кислоты и делают pH мочи (потенциал водорода) щелочным. Пациенту не нужно беспокоиться, так как хирургическое вмешательство требуется только при наличии камней из мочевой кислоты. Обратитесь к врачу в ближайшее время для диагностики и лечения состояния.
1. Какие препараты вызывают гиперурикозурию?Некоторые препараты нарушают реабсорбцию мочевой кислоты из почек.
2. Что такое лечение высокого уровня мочевой кислоты? Так возрастает риск камнеобразования, и большое количество мочевой кислоты выводится с мочой. Урикозурические препараты аторвастатин, амлодипин и лозартан повышают уровень мочевой кислоты в моче.
Так возрастает риск камнеобразования, и большое количество мочевой кислоты выводится с мочой. Урикозурические препараты аторвастатин, амлодипин и лозартан повышают уровень мочевой кислоты в моче.Терапия цитратом калия является эффективной терапией, используемой для лечения камней мочевой кислоты. Соли бикарбоната натрия и калия подщелачивают мочу. Теобромин также является эффективным средством, подавляющим рост кристаллов мочевой кислоты. Аллопуринол также рекомендуется при гиперурикозурии. Ультразвук и 24-часовой анализ мочи проводятся для проверки эффективности этих лекарств. Следует избегать употребления соли и продуктов, богатых пуринами. Необходимо пить много воды, чтобы вывести продукты жизнедеятельности из организма. Вода не допускает накопления мочевой кислоты в крови. Чрескожная нефролитотомия и уретероскопия — это хирургические процедуры для удаления камня или его разделения на более мелкие части для удаления.
3. Какие продукты снижают уровень мочевой кислоты?
Мочевая кислота является продуктом переваривания пищи, содержащей пурины. Богатыми пуринами продуктами являются алкоголь, красное мясо, сушеные бобы, субпродукты, сардины (морская рыба), пиво и анчоусы (морская рыба).
4. Является ли гиперурикемия проблемой почек?Почти 70% мочевой кислоты выводится почками. Высокий уровень мочевой кислоты в сыворотке крови связан с гипертонией (высоким кровяным давлением). Гиперурикемия тесно связана с хроническим заболеванием почек. Это основной фактор, способствующий развитию хронической почечной недостаточности. Когда мочевая кислота постоянно накапливается в организме, почки перестают функционировать должным образом, что называется терминальной стадией почечной недостаточности.
5. Может ли гиперурикемия повредить почки?Камни мочевой кислоты блокируют отток мочи из почек, поэтому давление в почках увеличивается, что приводит к отеку и стойкой почечной недостаточности.
6. Что произойдет, если в моче повышено содержание мочевой кислоты?
Существует риск образования камней из оксалата кальция и мочевой кислоты (уролитов) при избытке мочевой кислоты в моче. Потому что моча насыщена моноуратом натрия, который способствует образованию камней из оксалата кальция.
7. Можно ли вылечить гиперурикемию?Да, гиперурикемия — излечимое заболевание. Лекарства используются для уменьшения воспаления, отека и боли. Употребление большого количества воды может помочь вывести камень из организма с мочой. Если камень очень большой, его можно удалить хирургическим путем с помощью уретероскопии и чрескожной нефролитотомии.
8. Каковы осложнения гиперурикемии?Высокий уровень мочевой кислоты в крови вследствие катаболизма пуриновых нуклеотидов называется гиперурикемией. Гиперурикемия связана с такими факторами риска, как артериальное давление, дислипидемия, дисгликемия и ожирение.
9. Можно ли удалить мочевую кислоту естественным путем? Суточная доза эндогенной и экзогенной мочевой кислоты составляет 700 мг, что уравновешивается регулярным выделением с мочой и калом. Если баланс мочевой кислоты нарушен, в организме накапливается избыток мочевой кислоты, что приводит к потенциально опасным состояниям, таким как отложение кристаллов мочевой кислоты в суставах и тканях, что приводит к таким состояниям, как нефролитиаз, подагра и хроническая нефропатия.
Суточная доза эндогенной и экзогенной мочевой кислоты составляет 700 мг, что уравновешивается регулярным выделением с мочой и калом. Если баланс мочевой кислоты нарушен, в организме накапливается избыток мочевой кислоты, что приводит к потенциально опасным состояниям, таким как отложение кристаллов мочевой кислоты в суставах и тканях, что приводит к таким состояниям, как нефролитиаз, подагра и хроническая нефропатия.Естественно, организм отфильтровывает мочевую кислоту через мочу. Нормальный уровень мочевой кислоты составляет 6,8 мг/дл. Если уровень превышает, моча и кровь могут стать слишком кислыми. Употребление большого количества воды и жидкости помогает почкам быстрее выводить мочевую кислоту.
10. Может ли лимон удалить мочевую кислоту?Лимонный сок снижает мочевую кислоту в крови. Он эффективен при контроле, потому что растворяет мочевую кислоту и способствует ее выведению из организма.
11. Полезен ли творог для мочевой кислоты? Стакан лимонада может очень помочь.
Стакан лимонада может очень помочь.Да, творог хорош для выведения мочевой кислоты. Исследования показывают, что творог увеличивает клиренс и выведение мочевой кислоты с мочой.
12. Какие упражнения помогают мочевой кислоте?Людям, страдающим хроническими заболеваниями, такими как диабет и нарушения обмена веществ, следует регулярно заниматься спортом, чтобы вести здоровый сбалансированный образ жизни. Упражнения, особенно йога, помогают уменьшить стресс, который часто вызывает приступы подагры.
13. Какой овощ снижает уровень мочевой кислоты?Овощи, такие как помидоры, брокколи и огурцы, снижают уровень мочевой кислоты в организме.
14. Полезен ли гранат для мочевой кислоты?Гранат является хорошим источником лимонной и яблочной кислот, помогает контролировать мочевую кислоту и помогает больным подагрой избавиться от болезненных и опухших суставов.
15. Как снизить уровень мочевой кислоты в аюрведе?
Трифала, гилой, ним, горькая тыква, вишня и темные ягоды, куркума и имбирь помогают уменьшить мочевую кислоту и воспаление, вызванное подагрой.
- NIH — гиперурикозурия
https://www.ncbi.nlm.nih.gov/books/NBK562201/ - NIH — гиперурикозурия
https://pubmed.ncbi.nlm.nih.gov/32965872/ - 2 Наука 9 — Камень мочевой кислоты
https://www.sciencedirect.com/topics/medicine-and-dentistry/uric-acid-stone
Последнее рассмотрение по адресу:
23 нояб. 2022 — Чтение через 8 мин.РЕЙТИНГ
Поставьте свою оценку
❤ 15
Доктор Самер С. Дж. Альтавил
Урология
Метки:- Уровень мочевой кислоты
- Гиперурикозурия
Комплексное второе медицинское заключение. Отправьте заявку
Похожие вопросы и ответы
Могут ли таблетки BP вызывать повышение уровня мочевой кислоты?
Запрос: Привет доктор, Мне 35 лет.
 Рост 166 см, вес 76 кг. Мой уровень мочевой кислоты достиг 8,9. Я сделал это обследование за год до этого, и это было 8,4. В то время я перестал есть все бобовые как минимум на месяц. Я чистый вегетарианец. У меня нет никаких симптомов подагры или чего-то еще. У меня есть… Читать полностью »
Рост 166 см, вес 76 кг. Мой уровень мочевой кислоты достиг 8,9. Я сделал это обследование за год до этого, и это было 8,4. В то время я перестал есть все бобовые как минимум на месяц. Я чистый вегетарианец. У меня нет никаких симптомов подагры или чего-то еще. У меня есть… Читать полностью » Мочевокислая нефропатия – типы, этиология, диагностика и лечение
Обзор статьи: Мочевокислая нефропатия – это состояние, характеризующееся отложением кристаллов уратов в почках. Прочтите эту статью, чтобы узнать об этом. Читать статью
Что такое мочевая кислота? Мочевая кислота — слабая органическая кислота, образующаяся как конечный продукт метаболизма пуринов. Он существует в двух различных формах в зависимости от рН. Когда рН меньше 5,5, это называется труднорастворимой недиссоциированной формой мочевой кислоты. Значительно более растворимая форма, когда рН составляет 7,4, представляет собой … Прочитать статью
Самые популярные статьи
У вас есть вопрос по Уровень мочевой кислоты или гиперурикозурия?
Спросите врача онлайн* гарантированный ответ в течение 4 часов.




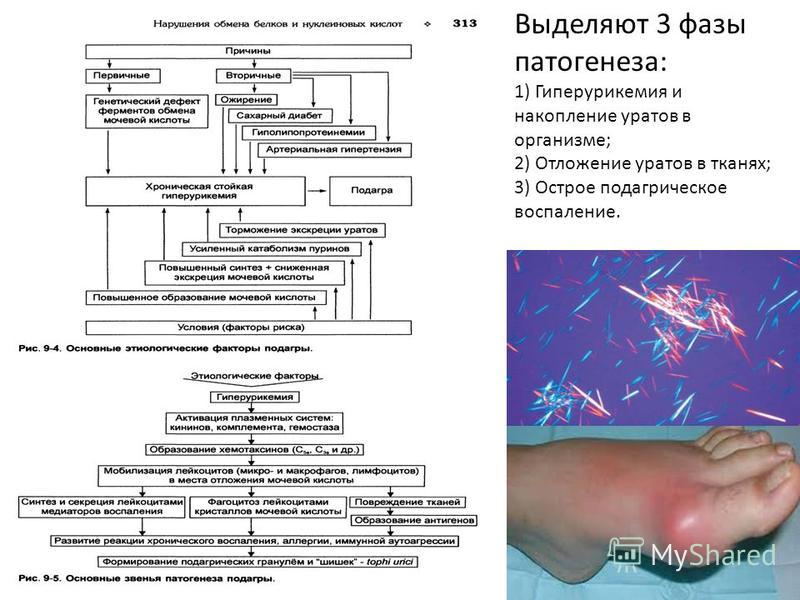 В этой ситуации нет доказанной пользы от назначения терапии, снижающей уровень мочевой кислоты.
В этой ситуации нет доказанной пользы от назначения терапии, снижающей уровень мочевой кислоты.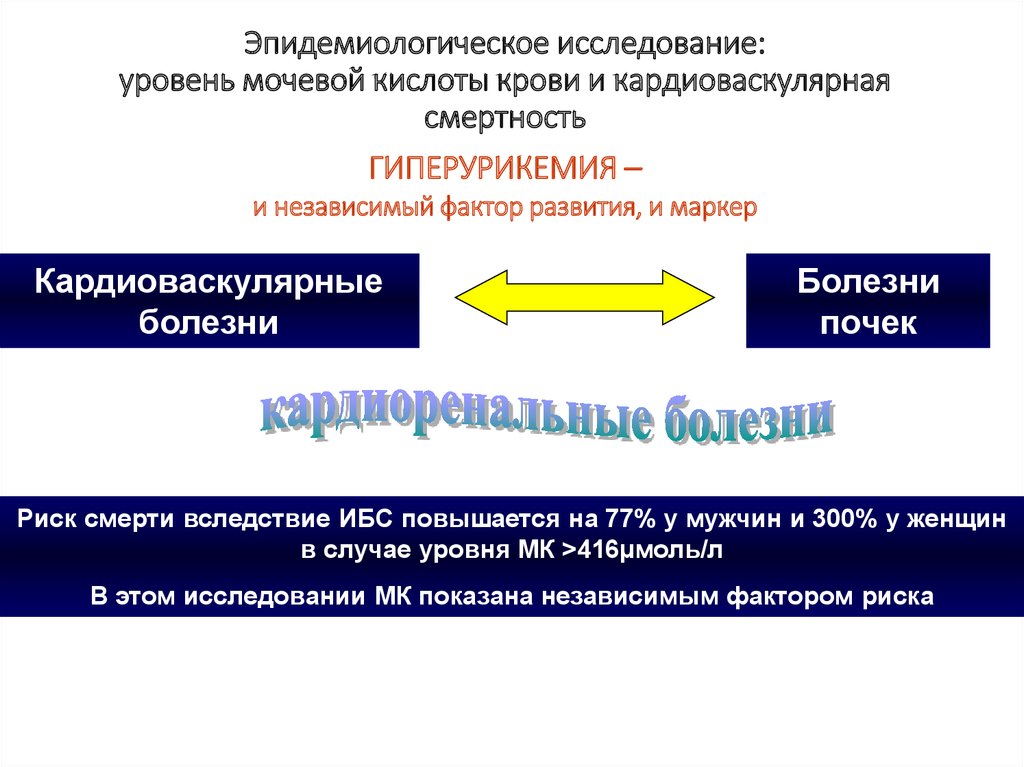
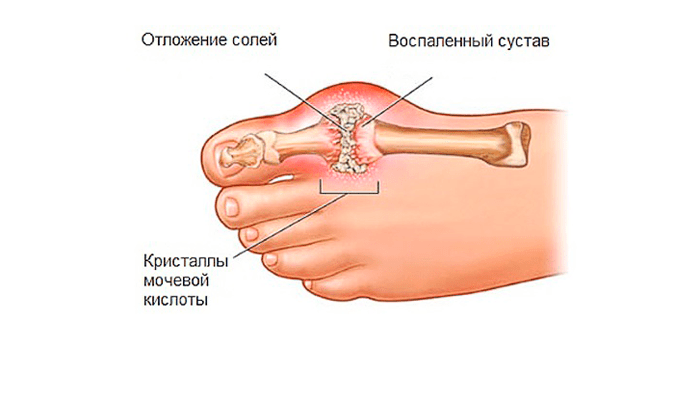
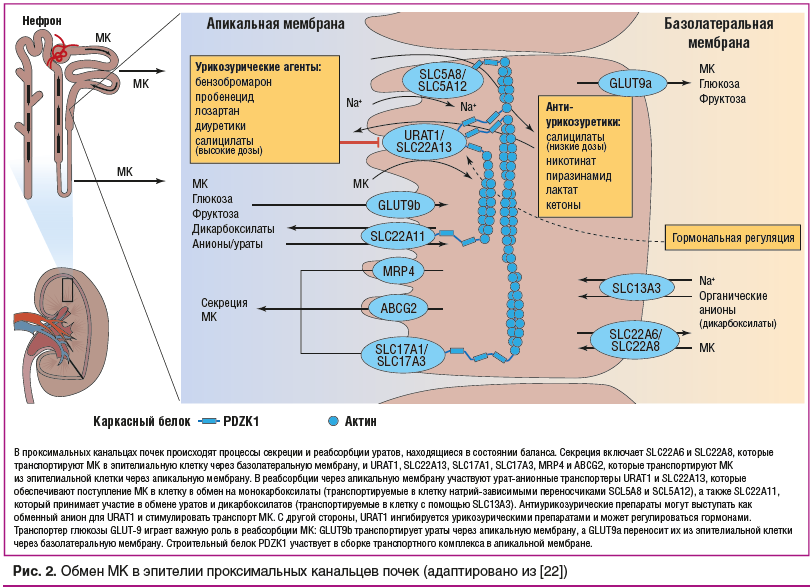 Диетические изменения не должны использоваться в качестве лечения первой линии.
Диетические изменения не должны использоваться в качестве лечения первой линии. Ваш врач может дать конкретные рекомендации, которые лучше всего соответствуют вашим потребностям.
Ваш врач может дать конкретные рекомендации, которые лучше всего соответствуют вашим потребностям. Дж. Алтавилом
Дж. Алтавилом  В норме ежедневно вырабатывается от 300 до 400 миллиграммов мочевой кислоты, большая часть которой вырабатывается печенью. Фермент, известный как уриказа, превращает мочевую кислоту в аллантоин, но этот фермент неактивен в организме человека. Следовательно, конечным продуктом, образующимся в результате метаболизма пуринов, является мочевая кислота. Почки поддерживают уровень мочевой кислоты в крови. Когда мочевая кислота достигает фильтрационных единиц почек, она реабсорбируется, и только 10% ее выводится из организма. Некоторое количество мочевой кислоты попадает в кишечник и превращается в аммиак. Этот аммиак используется бактериями кишечника для метаболической активности. Однако проблема возникает, когда в мочу попадает более 750–800 миллиграммов мочевой кислоты. Это состояние известно как гиперурикозурия и вызывает серьезные проблемы с мочевыводящими путями. Мочевая кислота может откладываться в костях, суставах и других органах и вызывать серьезные осложнения.
В норме ежедневно вырабатывается от 300 до 400 миллиграммов мочевой кислоты, большая часть которой вырабатывается печенью. Фермент, известный как уриказа, превращает мочевую кислоту в аллантоин, но этот фермент неактивен в организме человека. Следовательно, конечным продуктом, образующимся в результате метаболизма пуринов, является мочевая кислота. Почки поддерживают уровень мочевой кислоты в крови. Когда мочевая кислота достигает фильтрационных единиц почек, она реабсорбируется, и только 10% ее выводится из организма. Некоторое количество мочевой кислоты попадает в кишечник и превращается в аммиак. Этот аммиак используется бактериями кишечника для метаболической активности. Однако проблема возникает, когда в мочу попадает более 750–800 миллиграммов мочевой кислоты. Это состояние известно как гиперурикозурия и вызывает серьезные проблемы с мочевыводящими путями. Мочевая кислота может откладываться в костях, суставах и других органах и вызывать серьезные осложнения. Это связано с тем, что моча становится насыщенной моноуратом натрия, что инициирует образование камней из оксалата кальция. Причины гиперурикозурии перечислены ниже:
Это связано с тем, что моча становится насыщенной моноуратом натрия, что инициирует образование камней из оксалата кальция. Причины гиперурикозурии перечислены ниже: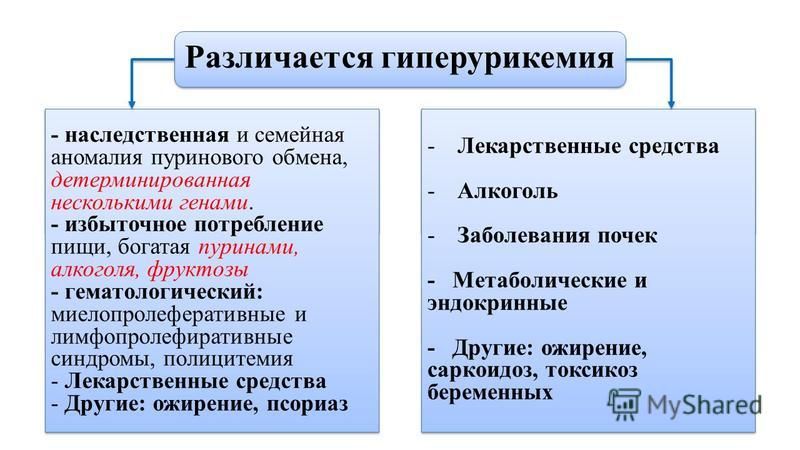 Тем не менее, диабетики склонны к развитию кислой мочи и камней из мочевой кислоты из-за резистентности к инсулину. Кроме того, поскольку аммиак не вырабатывается в достаточном количестве, нарушается мочевой обмен, что приводит к гиперурикозурии.
Тем не менее, диабетики склонны к развитию кислой мочи и камней из мочевой кислоты из-за резистентности к инсулину. Кроме того, поскольку аммиак не вырабатывается в достаточном количестве, нарушается мочевой обмен, что приводит к гиперурикозурии. Эти препараты не позволяют почкам реабсорбировать мочевую кислоту. В результате большое количество мочевой кислоты переходит из почек в мочу, повышается риск камнеобразования.
Эти препараты не позволяют почкам реабсорбировать мочевую кислоту. В результате большое количество мочевой кислоты переходит из почек в мочу, повышается риск камнеобразования.
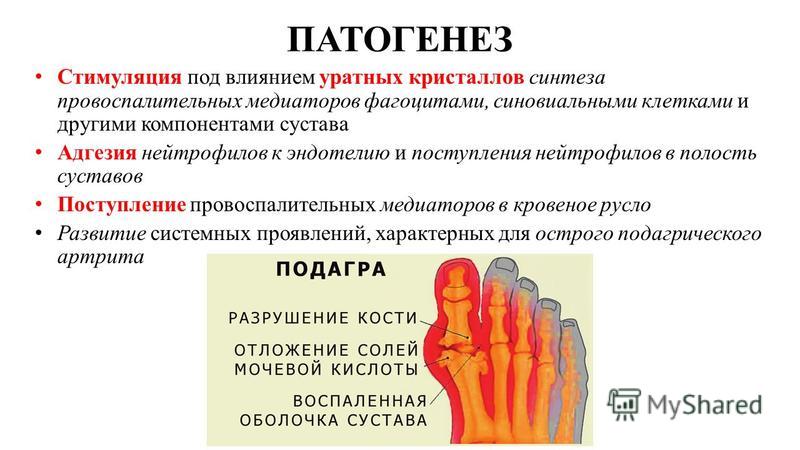 Например, гиперурикозурию можно заподозрить, если у пациента в анамнезе диабет или подагра, он принимает такие лекарства, как пробенецид или сульфинпиразон, и потребляет богатую пуринами пищу.
Например, гиперурикозурию можно заподозрить, если у пациента в анамнезе диабет или подагра, он принимает такие лекарства, как пробенецид или сульфинпиразон, и потребляет богатую пуринами пищу. Кислая моча свидетельствует о камнях мочевой кислоты. Затем образец мочи исследуют под микроскопом для обнаружения клеток гноя, бактерий, крови и кристаллов. Если в моче обнаруживаются кристаллы ромбовидной формы, это свидетельствует о наличии камней мочевой кислоты.
Кислая моча свидетельствует о камнях мочевой кислоты. Затем образец мочи исследуют под микроскопом для обнаружения клеток гноя, бактерий, крови и кристаллов. Если в моче обнаруживаются кристаллы ромбовидной формы, это свидетельствует о наличии камней мочевой кислоты. Если есть камни, они появляются на сите в виде мелких частиц. Затем его отправляют в лабораторию, чтобы проверить, являются ли они камнями мочевой кислоты.
Если есть камни, они появляются на сите в виде мелких частиц. Затем его отправляют в лабораторию, чтобы проверить, являются ли они камнями мочевой кислоты. Пациента укладывают на стол, а звуковые волны посылают в тело с помощью преобразователя. Врач перемещает датчик по животу, и изображения получаются на экране компьютера. УЗИ помогает выявить камни в почках и другие проблемы в мочевыделительной системе.
Пациента укладывают на стол, а звуковые волны посылают в тело с помощью преобразователя. Врач перемещает датчик по животу, и изображения получаются на экране компьютера. УЗИ помогает выявить камни в почках и другие проблемы в мочевыделительной системе.

 Он известен как терминальная стадия почечной недостаточности; пациент должен находиться на диализе или пройти трансплантацию почки.
Он известен как терминальная стадия почечной недостаточности; пациент должен находиться на диализе или пройти трансплантацию почки. Мочевая кислота образуется, когда организм использует пурины для различных видов деятельности. Несколько причин гиперурикозурии включают подагру, генетические нарушения, диабет и болезнь Крона. Также диета, богатая пуринами, увеличивает риск гиперурикозурии. Больной испытывает сильную боль в боку, которая не проходит легко и усиливается в течение дня и ночи. Камни образуются, когда кристаллы мочевой кислоты слипаются. Эти камни блокируют отток мочи и препятствуют способности почек реабсорбировать мочевую кислоту. Хотя состояние серьезное, оно не является неизлечимым. Доступны лекарства, которые снижают уровень мочевой кислоты и делают pH мочи (потенциал водорода) щелочным. Пациенту не нужно беспокоиться, так как хирургическое вмешательство требуется только при наличии камней из мочевой кислоты. Обратитесь к врачу в ближайшее время для диагностики и лечения состояния.
Мочевая кислота образуется, когда организм использует пурины для различных видов деятельности. Несколько причин гиперурикозурии включают подагру, генетические нарушения, диабет и болезнь Крона. Также диета, богатая пуринами, увеличивает риск гиперурикозурии. Больной испытывает сильную боль в боку, которая не проходит легко и усиливается в течение дня и ночи. Камни образуются, когда кристаллы мочевой кислоты слипаются. Эти камни блокируют отток мочи и препятствуют способности почек реабсорбировать мочевую кислоту. Хотя состояние серьезное, оно не является неизлечимым. Доступны лекарства, которые снижают уровень мочевой кислоты и делают pH мочи (потенциал водорода) щелочным. Пациенту не нужно беспокоиться, так как хирургическое вмешательство требуется только при наличии камней из мочевой кислоты. Обратитесь к врачу в ближайшее время для диагностики и лечения состояния.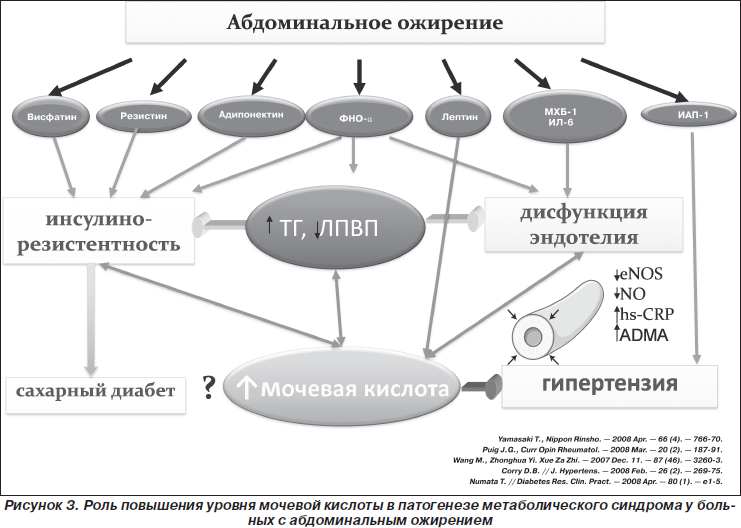 Так возрастает риск камнеобразования, и большое количество мочевой кислоты выводится с мочой. Урикозурические препараты аторвастатин, амлодипин и лозартан повышают уровень мочевой кислоты в моче.
Так возрастает риск камнеобразования, и большое количество мочевой кислоты выводится с мочой. Урикозурические препараты аторвастатин, амлодипин и лозартан повышают уровень мочевой кислоты в моче.

 Суточная доза эндогенной и экзогенной мочевой кислоты составляет 700 мг, что уравновешивается регулярным выделением с мочой и калом. Если баланс мочевой кислоты нарушен, в организме накапливается избыток мочевой кислоты, что приводит к потенциально опасным состояниям, таким как отложение кристаллов мочевой кислоты в суставах и тканях, что приводит к таким состояниям, как нефролитиаз, подагра и хроническая нефропатия.
Суточная доза эндогенной и экзогенной мочевой кислоты составляет 700 мг, что уравновешивается регулярным выделением с мочой и калом. Если баланс мочевой кислоты нарушен, в организме накапливается избыток мочевой кислоты, что приводит к потенциально опасным состояниям, таким как отложение кристаллов мочевой кислоты в суставах и тканях, что приводит к таким состояниям, как нефролитиаз, подагра и хроническая нефропатия.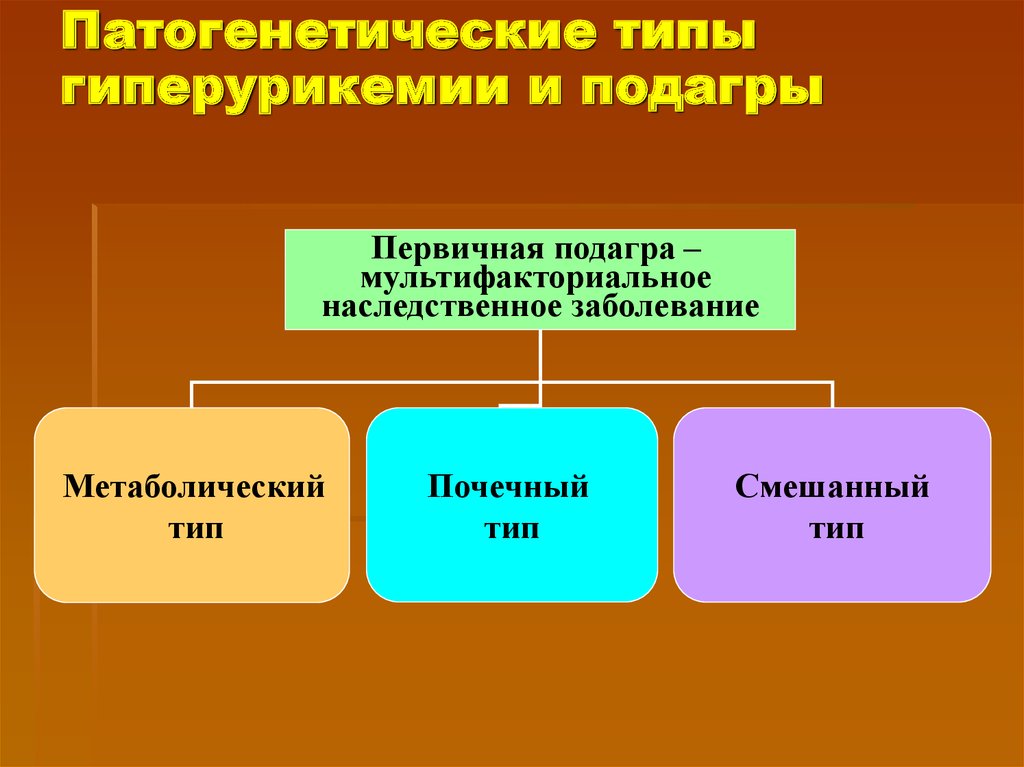 Стакан лимонада может очень помочь.
Стакан лимонада может очень помочь.
 Рост 166 см, вес 76 кг. Мой уровень мочевой кислоты достиг 8,9. Я сделал это обследование за год до этого, и это было 8,4. В то время я перестал есть все бобовые как минимум на месяц. Я чистый вегетарианец. У меня нет никаких симптомов подагры или чего-то еще. У меня есть… Читать полностью »
Рост 166 см, вес 76 кг. Мой уровень мочевой кислоты достиг 8,9. Я сделал это обследование за год до этого, и это было 8,4. В то время я перестал есть все бобовые как минимум на месяц. Я чистый вегетарианец. У меня нет никаких симптомов подагры или чего-то еще. У меня есть… Читать полностью »