Что такое канцероматоз брюшины: Канцероматоз брюшины при раке — лечение, признаки, прогноз, химиотерапия.
Канцероматоз брюшины. Что такое Канцероматоз брюшины?
ВАЖНО
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
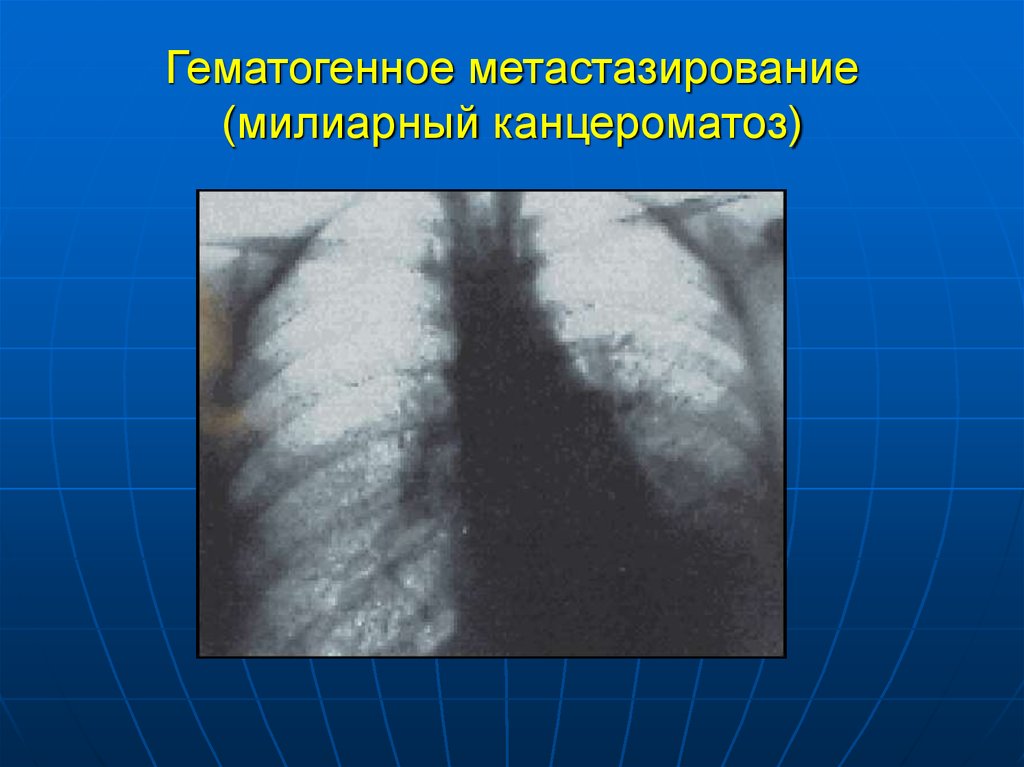
Канцероматоз брюшины – вторичное злокачественное поражение брюшины, являющееся следствием диссеминации эпителиальных опухолей желудочно-кишечного тракта, репродуктивной системы, реже – первичных перитонеальных новообразований. Признаками канцероматоза брюшины являются асцитический синдром, прогрессирующее снижение веса, тошнота, слабость. Диагностика основана на визуализации очагов поражения при проведении МСКТ, УЗИ органов брюшной полости, лапароскопии, цитологическом анализе асцитической жидкости. Лечение включает хирургическое удаление первичного очага с метастазами по брюшине и химиотерапию. Прогноз неблагоприятный.
Прогноз неблагоприятный.
- Причины канцероматоза
- Классификация
- Симптомы канцероматоза
- Диагностика
- Лечение канцероматоза брюшины
- Прогноз и профилактика
- Цены на лечение
Общие сведения
Канцероматоз брюшины – наиболее часто встречающийся вариант метастазирования онкологических заболеваний различной локализации. Согласно имплантационной теории развития данной патологии, источником поражения являются опухолевые клетки, которые отделились от первичного очага и попали в брюшную полость с серозной жидкостью. Основным пусковым механизмом данного процесса является утрата клетками опухоли факторов межклеточной адгезии.
Согласно данным статистики, канцероматоз брюшины встречается у 20-35% пациентов с онкопатологией: в 40% случаев данное осложнение формируется при опухолях желудочно-кишечного тракта, в 30% — при раке яичников (причем на момент верификации диагноза рака яичников у подавляющего большинства пациенток уже имеет место поражение брюшины).
Канцероматоз брюшины
Причины канцероматоза
Канцероматоз брюшины является вторичным опухолевым поражением, результатом прогрессирования рака различной локализации. Наиболее часто поражением брюшины осложняется рак желудка, тонкого кишечника, поджелудочной железы, злокачественные опухоли яичников, матки, маточных труб, печеночноклеточный рак, реже — первичные опухоли брюшины (перитонеальная мезотелиома). В ряде случаев первичный очаг остается неустановленным.
Развитие канцероматоза брюшины является поэтапным процессом. Первый этап – распространение опухолевых клеток из первичного очага поражения. Это связано с нарушением межклеточного взаимодействия и приобретением клетками опухоли подвижности.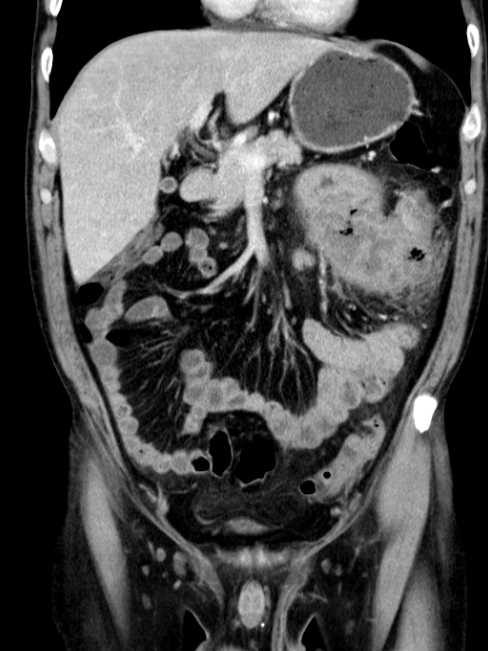
На втором этапе опухолевые клетки взаимодействуют с мезотелием брюшины. Механизмы адгезии определяются природой клеток, особенностями морфологии брюшины, а также наличием участков ее повреждения. Далее клетки закрепляются в мезотелии, происходит их горизонтальное распространение по поверхности перитонеума, а затем инвазивный рост – прорастание в базальную мембрану, соединительную ткань. Следующим этапом является стимуляция неоангиогенеза – обязательного фактора развития опухоли.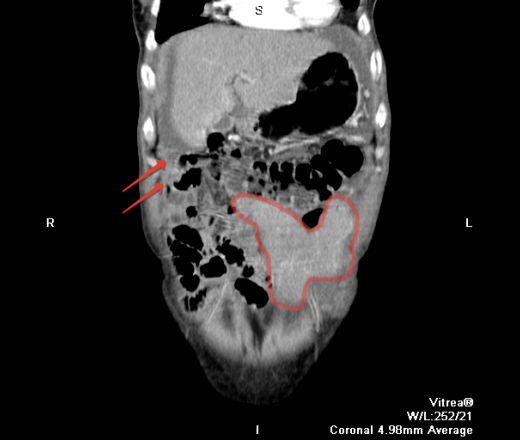
Частота развития канцероматоза брюшины зависит не только от первичной локализации опухоли, но и от ее размеров, глубины инвазии, гистотипа, степени дифференцировки (недифференцированный рак желудка осложняется поражением брюшины в 60% случаев, ограниченный – в 15%).
Классификация
Единая классификация данного заболевания отсутствует, поскольку характеристики первичных опухолей, приводящих к поражению брюшины, весьма разнообразны. Наиболее распространена классификация канцероматоза брюшины в зависимости от числа, локализации метастазов, которая предусматривает три степени:
- Р1 – локальное поражение брюшины
- Р2 – несколько областей канцероматоза, разделенных здоровыми участками брюшины
- Р3 – многочисленные очаги поражения
Также используется метод определения индекса канцероматоза брюшины: суммируются баллы измерения максимальных очагов поражения (0-3 балла) в каждой из 13 наиболее вероятных областей поражения брюшины.
Симптомы канцероматоза
Канцероматоз брюшины является вторичным поражением, поэтому его клиническая картина во многом определяется проявлениями первичной опухоли. Характерным признаком является обильный выпот в брюшную полость – формирование асцита. Зачастую асцитический синдром, развивающийся вследствие обструкции лимфатического дренажа, является единственным признаком заболевания, и пациенты могут поступать в отделение гастроэнтерологии или терапии для диагностики причин асцита. Состояние больных тяжелое, характерна значительная потеря веса. Неспецифическими признаками являются тошнота, рвота, выраженная слабость, утомляемость. При наличии крупных метастазов возможно их прощупывание через брюшную стенку.
Диагностика
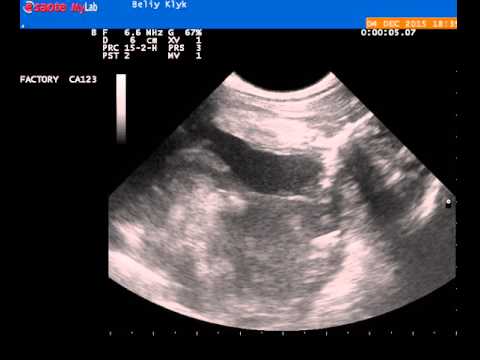
Канцероматоз брюшины имеет неспецифическую клиническую картину, однако консультация гастроэнтеролога или онколога позволяет предположить данное заболевание на основании симптомов и физикальных данных. Лабораторные анализы не выявляют специфических изменений: определяется лейкоцитоз, ускорение СОЭ. Диагностическая программа обязательно должна включать УЗИ органов брюшной полости и малого таза, позволяющее обнаружить распространенное поражение, а также МСКТ брюшной полости с контрастированием. Обязательно проводится цитологическое исследование асцитической жидкости, полученной при лапароцентезе, которое дает возможность впервые установить или подтвердить диагноз, а также определить гистогенез клеток опухоли.
Диагностическая программа обязательно должна включать УЗИ органов брюшной полости и малого таза, позволяющее обнаружить распространенное поражение, а также МСКТ брюшной полости с контрастированием. Обязательно проводится цитологическое исследование асцитической жидкости, полученной при лапароцентезе, которое дает возможность впервые установить или подтвердить диагноз, а также определить гистогенез клеток опухоли.
Информативным методом диагностики канцероматоза брюшины является лапароскопия с осмотром перитонеума, дугласова пространства, диафрагмы, сопровождающаяся биопсией. Высокой специфичностью обладает обратнотранскриптазная полимеразная цепная реакция (ОТ-ПЦР), которая позволяет определить источник диссеминации даже при малом количестве опухолевых клеток.
Сложности диагностики возникают при наличии канцероматоза брюшины без выявленного первичного очага. Данная форма заболевания, встречающаяся в 3-5 % случаев, проявляется клинически только при уже сформировавшемся поражении брюшины.
В качестве дополнительных методов может использоваться определение онкомаркеров (кислой фосфатазы, раково-эмбрионального антигена, альфа-фетопротеина, бета-субъединицы ХГЧ). Такая диагностика не обладает высокой специфичностью, но применяется для оценки прогноза, раннего выявления диссеминации, рецидивов, а также для контроля эффективности лечения.
Лечение канцероматоза брюшины
Хирургическое лечение канцероматоза включает удаление первичной опухоли с регионарными метастазами и отсевами по брюшине. Циторедуктивная операция выполняется в объеме перитонэктомии, может сочетаться с удалением матки и придатков, сигмовидной кишки, желчного пузыря. После проведения операции оценивается индекс полноты циторедукции: СС-0: после проведения хирургического лечения очаги поражения визуально не определяются; СС-1: имеются неудаленные очаги диаметром до 2,5 мм; СС-2: очаги диаметром 2,5 мм – 2,5 см; СС-3: очаги поражения более 2,5 см в диаметре.
Системная химиотерапия при канцероматозе брюшины имеет определенные недостатки. На сегодняшний день эффективным методом лечения является интраперитонеальная химиотерапия. При местном введении цитостатических препаратов есть возможность применения высоких дозировок, которые при системной терапии слишком токсичны. Использование гипертермии усиливает поступление активных веществ в опухолевые клетки. Существенным преимуществом является длительное нахождение препарата в брюшной полости. Гипертермическая внутрибрюшная химиотерапия проводится в ходе операции или после ее завершения; химиотерапевтический агент (чаще препараты платины) вводится подогретым до температуры 40-43 градуса. Время циркуляции раствора составляет 30-90 минут.
Альтернативным методом лечения канцероматоза брюшины является фотодинамическая терапия с локальным или системным введением фотосенсибилизатора. Данная методика основана на интраоперационном световом воздействии с применением лазера, которое приводит к прямому повреждению мембран опухолевых клеток. Но такое лечение не устраняет процессы ангиогенеза, поэтому его эффективность недостаточно высока.
Данная методика основана на интраоперационном световом воздействии с применением лазера, которое приводит к прямому повреждению мембран опухолевых клеток. Но такое лечение не устраняет процессы ангиогенеза, поэтому его эффективность недостаточно высока.
Ни один из существующих на сегодняшний день методов лечения канцероматоза брюшины не вызывает полную регрессию опухолевых диссеминантов, а также не предупреждает рецидивирование заболевания, поэтому разработка оптимального лечения продолжается. Исследуется таргетная терапия, целью которой являются молекулярные мишени. Низкая эффективность противоопухолевой терапии обусловлена отсутствием достаточного понимания морфологии и патогенеза заболевания, унифицированной классификации, разнородностью первичных опухолей.
Прогноз и профилактика
Развитие канцероматоза брюшины при злокачественных новообразованиях всегда является неблагоприятным прогностическим признаком. Средняя продолжительность жизни пациентов составляет не более 12 месяцев, а пятилетняя выживаемость – до 10%. Не существует специфической профилактики данной формы поражения брюшины, важную роль играет своевременность выявления и адекватного лечения первичных опухолей. Однако во многих случаях симптомы канцероматоза брюшины возникают уже при значительной диссеминации раковых клеток по брюшной полости.
Не существует специфической профилактики данной формы поражения брюшины, важную роль играет своевременность выявления и адекватного лечения первичных опухолей. Однако во многих случаях симптомы канцероматоза брюшины возникают уже при значительной диссеминации раковых клеток по брюшной полости.
Вы можете поделиться своей историей болезни, что Вам помогло при лечении канцероматоза брюшины.
Источники
- Настоящая статья подготовлена по материалам сайта: https://www.krasotaimedicina.ru/
ВАЖНО
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Канцероматоз брюшины: признаки, симптомы, лечение, прогноз
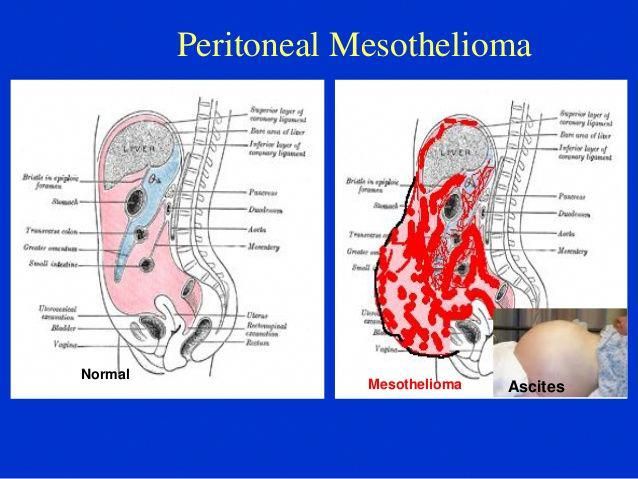
Канцероматоз брюшины – это метастазы, или дополнительные раковые опухоли, развивающиеся в тонкой пленке, которая выстилает стенки брюшной полости и покрывает расположенные в ней органы.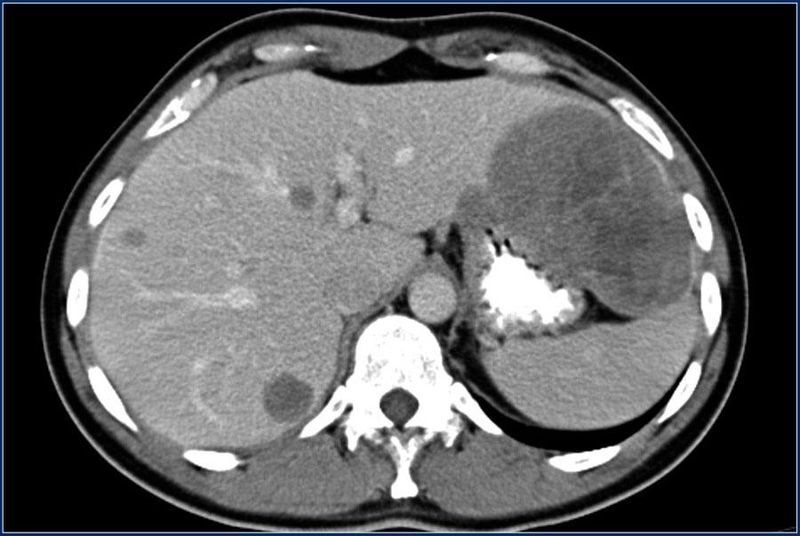
Как развивается канцероматоз, или вторичный рак брюшины?
Рак – это опасное для жизни новообразование, которое бесконтрольно увеличивается, разрушает окружающие ткани и поражает различные органы.
Он развивается после появления в организме всего лишь одной мутировавшей – измененной клетки, отличающейся от нормальных. Она возникает из-за влияния различных заболеваний, наследственных особенностей, воздействия химических веществ, радиации или случайных сбоев, растет и создает множество своих копий.
Большинство из них выявляет и уничтожает иммунная система, но некоторым удается противостоять ей или скрываться от ее внимания. Они выживают, размножаются и формируют опухоль, прорастающую в расположенные рядом с ней ткани.
На этом их опасные свойства не заканчиваются. Здоровые клетки рождаются и работают в строго определенном месте, после чего умирают. Онкологические же ведут себя не так. Во-первых, у них не работает апоптоз – механизм «запрограммированной» смерти, благодаря чему они живут очень долго и не погибают в положенные сроки. Во-вторых, они умеют перемещаться по сосудам лимфатическойЛимфатическая система дополняет сердечно-сосудистую. Циркулирующая в ней лимфа – межклеточная жидкость – омывает все клетки организма и доставляет в них необходимые вещества и забирает отходы. В лимфатических узлах, выполняющих роль «фильтров», опасные вещества обезвреживаются и выводятся из организма. и кровеносной систем, закрепляться в различных тканях и создавать в них метастазы – дополнительные опухоли в областях, расположенных далеко от основного, первичного очага.
Во-вторых, они умеют перемещаться по сосудам лимфатическойЛимфатическая система дополняет сердечно-сосудистую. Циркулирующая в ней лимфа – межклеточная жидкость – омывает все клетки организма и доставляет в них необходимые вещества и забирает отходы. В лимфатических узлах, выполняющих роль «фильтров», опасные вещества обезвреживаются и выводятся из организма. и кровеносной систем, закрепляться в различных тканях и создавать в них метастазы – дополнительные опухоли в областях, расположенных далеко от основного, первичного очага.
Именно таким образом на последней стадии заболевания развивается канцероматоз, или вторичный рак брюшины.
Сначала новообразование возникает в одном из внутренних органов: яичниках, поджелудочной железе, фаллопиевых трубах, по которым яйцеклетка выходит в матку, тонком или толстом кишечнике, мочевом пузыре, желудке, прямой кишке или аппендиксе.
Затем оно прорастает или распространяет свои клетки в брюшину – тонкую пленку из соединительной ткани, состоящую из двух слоев:
- Висцеральный – обволакивает внутренние органы, такие как кишечник, желудок, печень, поджелудочная железа, мочевой пузырь, яичники, матка и селезенка.

- Париетальный – покрывает внутреннюю поверхность стенки брюшной полости.
Между ними есть небольшое количество жидкости, которая работает как смазка и позволяет внутренним органам плавно скользить при смене положения тела. Она постоянно производится и всасывается, из-за чего попавшие в нее неправильные клетки распространяются по тканям с большой скоростью.
Вторичные опухоли, или метастазы, состоят не из измененных тканей брюшины, а из клеток того органа, в котором они впервые возникли.
Такие новообразования возникают как у женщин, так и у мужчин, и развиваются чаще, чем первичный рак. По оценкам научного сообщества, это происходит с 15-20% больных колоректальным раком, поражающим толстую или прямую кишку, и 10-15% пациентов с онкологией желудка.
Симптомы и признаки канцероматоза брюшины
Канцероматоз, или метастазирование брюшины, происходит только на последней стадии онкологии. К этому моменту, как правило, человек уже сталкивается с заметными проблемами со здоровьем или ощущает ухудшение самочувствия. Обычно сначала у него появляются симптомы, связанные с поражением органа, в котором возникла первичная опухоль, а со временем развиваются и признаки вторичного рака, такие как:
К этому моменту, как правило, человек уже сталкивается с заметными проблемами со здоровьем или ощущает ухудшение самочувствия. Обычно сначала у него появляются симптомы, связанные с поражением органа, в котором возникла первичная опухоль, а со временем развиваются и признаки вторичного рака, такие как:
- вздутие или боль в области живота;
- тошнота или рвота;
- изменение привычек кишечника и работы мочевыделительной системы;
- потеря аппетита;
- боли в спине или пояснице;
- увеличение размеров живота;
- нарушение работы пищеварительной системы – постоянные сбои и дискомфорт;
- ощущение сытости даже после приема небольшого количества пищи;
- потеря или набор веса из-за скопления жидкости;
- вздутие живота;
- выделения из влагалища;
- постоянная усталость;
-
тяжесть или ощущение сдавливания в области живота или таза.

Со временем у человека может возникнуть асцит – скопление в брюшной полости водянистой жидкости, вызывающий одышку – ощущение нехватки воздуха из-за уменьшения пространства, необходимого легким для полного раскрытия на вдохе.
Кроме того, при разрастании опухолей до крупных размеров, пациенты нередко сталкиваются с полной непроходимостью кишечника или блокировкой мочевыделительной системы, а также невозможностью принятия пищи или питья.
Диагностика канцероматоза брюшины
Для выявления поражений брюшины используется несколько методов:
- Компьютерная томография, КТ. При ее проведении специальный аппарат получает множество рентгеновских снимков, объединяемых в одно, очень четкое изображение. Данное исследование позволяет обнаруживать даже небольшие очаги заболевания и подозрительные области.
- Магнитно-резонансная томография, МРТ. В ходе процедуры магниты и радиоволны создают очень детализированную картинку, отражающую состояние внутренних органов.

- УЗИ – быстрый и безопасный метод, использующийся для выявления новообразований брюшной полости. С помощью ультразвука специалист может обнаружить измененные ткани, отличающиеся от нормальных.
- Позитронно-эмиссионная томография, ПЭТ. Метод применяется для выявления метастазов – дополнительных раковых опухолей. До его проведения пациент получает небольшую дозу радиоактивного сахара, который накапливается в измененных клетках. Затем проводится сканирование, показывающее любое, даже самое небольшое их скопление в любых частях тела.
- Лапароскопия– исследование тканей брюшной полости без выполнения крупных разрезов. Эта малоинвазивная методика позволяет получать данные о состоянии внутренних органов, повреждая при этом минимальное количество тканей. Врач делает небольшой прокол в коже и вводит в него лапароскоп – небольшую трубку с источником света и видеокамерой на конце. Устройство передает на экран монитора четкое и подробное, увеличенное в 4-10 раз изображение.

- Биопсия– забор небольшого количества тканей или жидкости из пораженной области и передача их в лабораторию для тщательного изучения клеток.
- Анализ крови на онкомаркеры СА125, СА 19-9, СЕА или НЕ4 – белки, выделяемые некоторыми видами раковых новообразований. Данный метод не используется как единственный способ диагностики, поскольку повышение их уровня не всегда говорит о наличии в организме опухоли.
- Циторедуктивные операции – хирургическое удаление максимального количества пораженных тканей и измененных клеток.

- Внутрибрюшинная гипертермическая химиоперфузия, или HIPEC – введение разогретого до более чем 40 градусов химиотерапевтического средства непосредственно в брюшину. Для ее проведения требуется дорогое высокотехнологичное оборудование, хорошо оснащенная операционная и целая команда докторов различных специальностей. По мнению множества исследователей, сочетание циторедуктивных вмешательств и HIPEC произвело настоящую революцию в лечении канцероматоза. Метод имеет целый ряд противопоказаний, ограничивающих его применение:
- Наличие метастазов – дополнительных раковых опухолей, расположенных за пределами брюшины.
- Плохое общее состояние здоровья пациента.
- Негативная реакция на химиотерапию – рост новообразования или ухудшение самочувствия.
- Большое количество очагов поражения висцеральной брюшины – листка, обволакивающего внутренние органы.
- Перитонеумэктомия – полное или частичное изъятие париетальной брюшины, покрывающей внутреннюю поверхность стенки брюшной полости.

- Удаление поврежденных онкологией внутренних органов – например, матки, ее труб, яичников или пострадавших отделов кишечника.
- Таргетная терапия – введение специальных препаратов, которые воздействуют только на определенные изменения в раковых клетках, и практически не наносят вреда нормальным тканям. Для части пациентов с канцероматозом брюшины могут подойти:
- Моноклональные антитела: доставляют в опухолевую клетку убивающие ее молекулы.
- Ингибиторы ангиогенеза: предотвращают рост новых сосудов, необходимых новообразованию для питания и дальнейшего развития.
- Ингибиторы PARP: вещества, блокирующие восстановление ДНК измененных клеток – молекулы, в которой зашифрована вся информация об организме.
-
Боль.

- Вздутие живота – асцит.
- Отеки – скопление жидкости в тканях.
- Депрессию и тревогу.
- Изменение веса.
- Тошноту и рвоту.
- Запоры.
- Потерю аппетита.
- Усталость и слабость.
Лечение канцероматоза брюшины
Борьба с распространившимся по организму раком – очень непростая задача.
Еще совсем недавно единственным методом воздействия на него была химиотерапия – прием или введение в вену специальных препаратов, которые уничтожают быстро делящиеся клетки, в том числе опухолевые. К сожалению, большая часть онкологических новообразований брюшины лишь немного уменьшается в размерах или совсем не реагирует на подобное лечение.
Сегодня врачи используют следующие тактики:
Все подобные вмешательства проводятся только опытными врачами в специализированной клинике.
Любое лечение канцероматоза брюшины можно пройти у нас, в онкологическом центре «Лапино-2».
Наши врачи – кандидаты и доктора медицинских наук с огромным опытом в области борьбы с опасными для жизни опухолями и большим стажем работы в крупнейших федеральных учреждениях.
Мы быстро проводим полную диагностику, берем анализы и в максимально сжатые сроки получаем их результаты из собственной лаборатории.
В нашем центре выполняются все необходимые процедуры на самом современном оборудовании с применением только оригинальных препаратов, дающих предсказуемый результат.
Паллиативное лечение канцероматоза брюшины
К сожалению, даже самые современные достижения медицины не способны победить некоторые запущенные формы рака. В таких случаях пациенту может быть назначено паллиативное, или поддерживающее лечение, задача которого заключается не в полном удалении очагов онкологии из организма, а в улучшении самочувствия и облегчении симптомов болезни. С ее помощью можно контролировать:
Отеки, лимфедема, асцит
Отеки – распространенная проблема, с которой нередко сталкиваются онкологические больные. Они могут быть вызваны задержкой в организме соли и воды из-за приема некоторых лекарств, повреждений сердца, печени или почек, инфекции, неправильного питания, роста опухоли или других причин.
При поражении раком или удалении лимфатических узлов, которые выполняют роль «фильтров», задерживающих и обезвреживающих опасные вещества, у пациентов может возникнуть лимфедема – серьезный отек конечности. Она развивается из-за нарушения циркуляции лимфы, которая омывает все клетки тела, доставляет в них необходимые вещества и забирает отходы.
Облегчить эти симптомы можно с помощью приема диуретиков – мочегонных средств, помогающих почкам выводить натрий и воду, а также ограничения употребления соли.
Асцит – избыточное скопление жидкости в брюшной полости, вызванное повреждением тканей и расположенных в них лимфоузлов. Он приводит к увеличению размеров живота, тошноте, рвоте, повышенной утомляемости и затруднению дыхания. Для улучшения самочувствия его обладателей врачи могут назначить хирургические вмешательства или химиотерапию. В большинстве случаев проводится парацентез – слив лишней жидкости, который дает временное облегчение на несколько недель или дней.
Затруднение дыхания
Одышка, или нехватка воздуха – один из самых распространенных симптомов запущенного рака. Она может быть вызвана как самим заболеванием, так и его лечением. Нередко ее причиной становится асцит, приводящий к ограничению движения диафрагмы – тонкой, похожей на купол мышцы, отделяющей грудную клетку от брюшной полости. В норме при дыхании она движется вверх и вниз, позволяя легким увеличиваться и уменьшаться в объеме, но скопившаяся жидкость давит на нее и не позволяет человеку получать достаточное количество кислорода. Это крайне неприятное ощущение серьезно влияет на качество жизни, ограничивает возможности и усугубляет усталость, беспокойство и депрессию.
В норме при дыхании она движется вверх и вниз, позволяя легким увеличиваться и уменьшаться в объеме, но скопившаяся жидкость давит на нее и не позволяет человеку получать достаточное количество кислорода. Это крайне неприятное ощущение серьезно влияет на качество жизни, ограничивает возможности и усугубляет усталость, беспокойство и депрессию.
Методы лечения и облегчения данного состояния зависят от вызвавшей их причины.
С легкой одышкой можно справиться самостоятельно – достаточно сесть или лечь, подняв верхнюю часть тела под углом 45° с помощью подушек, глубоко вдохнуть через нос и медленно выдохнуть через сжатые губы. Некоторым пациентам помогают различные техники расслабления, отвлечение на музыку, чтение и телевизор.
При появлении серьезных затруднений дыхания, бледности или посинении кожи, слизистых рта и ногтевого ложа, болях, стеснении и тяжести в грудной клетке, проблемах с речью, головокружениях или слабости необходимо срочно обращаться за медицинской помощью.
Непроходимость кишечника
Расположенные в брюшной полости опухоли нередко блокируют кишечник и препятствуют прохождению стула. Это приводит к сильным спазмам, болям в животе и рвоте. Данная ситуация требует срочного вмешательств, поскольку скопившееся в пищеварительном тракте содержимое способно повредить его стенки. Оно может выйти через образовавшее отверстие в брюшную полость и вызвать тяжелую инфекцию.
В таких случаях проводится операция по установке стента – небольшой жесткой трубки, не позволяющей просвету сужаться, или колостомия – выведение здоровой части толстой кишки через отверстие на коже живота.
Если хирургическое лечение невозможно, врачи удаляют содержимое желудка с помощью специальной трубки, введенной через нос.
Непроходимость мочевыводящих путей
Некоторые опухоли брюшной полости блокируют мочеточники, по которым моча выходит в мочевой пузырь. Такая закупорка приводит к скоплению жидкости в почках и нарушению их работы.
В подобных ситуациях специалисты выполняют установку стентов или нефростомию – вводят в почку гибкую трубку, позволяющую ее содержимому перетекать в специальный контейнер – расположенный на теле резервуар.
Прогнозы и выживаемость при канцероматозе брюшины
Согласно данным научных исследований, средняя продолжительность жизни для вторичного рака брюшины составляет 6 месяцев.
Перспективы в немалой степени зависят от расположения первичной опухоли, ее стадии и типа проводимого лечения. Наихудшие прогнозы – примерно 2,9 месяца – у пациентов с поражением поджелудочной железы, около 6,5 месяцев – желудка, и 6,9 месяца – толстой или прямой кишки. Еще сильнее сокращают эти сроки наличие асцита – скопления жидкости в брюшной полости, а также метастазов – дополнительных онкологических новообразований в печени.
Некоторые научные работы показывают, что сочетание циторедуктивных операций и внутрибрюшинной гипертермической химиоперфузии, или HIPEC, заметно повышает выживаемость.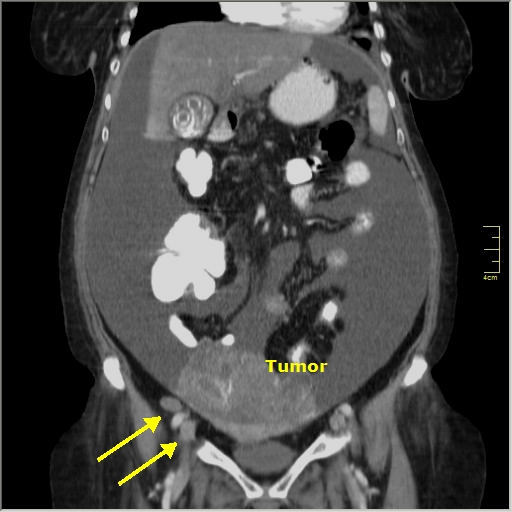 Она увеличивается до 62,7 месяцев с 23,9 по сравнению с людьми, которые получают обычную химиотерапию.
Она увеличивается до 62,7 месяцев с 23,9 по сравнению с людьми, которые получают обычную химиотерапию.
Причина, симптомы, диагностика и лечение
Автор Sarah C.P. Williams
- Факторы риска для перитонеального канцероматоза
- Симптомы перитонеального канцероматоза
- Как врачи диагностируют перитонеальный канцероматоз
- лечение для перитонеального карциноматоза 9001
- Рак аппендикса
- Рак толстой кишки
- Рак прямой кишки
- Рак поджелудочной железы Первичный рак желудка
- перитонеальный карциноматоз встречается почти всегда у женщин. Помимо пола, к другим факторам риска первичного карциноматоза брюшины относятся:
- Возраст 9 лет.0006
- Семейный анамнез рака яичников или брюшины
- Генетические мутации BRCA
- Заместительная гормональная терапия
- Ожирение
- Эндометриоз
Перитонеальный карциноматоз На ранних стадиях симптомы могут быть нечеткими или симптомы могут отсутствовать
- 9000 напоминают другие состояния.
 На более поздних стадиях рак вызывает такие симптомы, как:
На более поздних стадиях рак вызывает такие симптомы, как:- Диарея, запор или тошнота
- Боль в животе
- Вздутие живота
- Потеря или набор веса
- Обильное мочеиспускание
- Потеря аппетита или ощущение сытости во время еды
Эти проблемы могут быть вызваны многими другими причинами.
Перитонеальный карциноматоз, возникающий в результате рака брюшной полости, может приводить к асциту (накоплению жидкости в брюшной полости), что затем приводит к другим симптомам, таким как:
- Потеря аппетита
- Необычное увеличение веса из-за скопления жидкости
- Боль в пояснице
- Циторедуктивная хирургия. Хирург удаляет любые опухоли на брюшине и, в некоторых случаях, на близлежащих органах брюшной полости.
- Гипертермическая внутрибрюшинная химиотерапия .
 Часто используемый сразу после циторедуктивной хирургии, этот метод омывает внутреннюю часть вашего живота, где находится брюшина, горячими химиотерапевтическими препаратами, чтобы убить все оставшиеся раковые клетки.
Часто используемый сразу после циторедуктивной хирургии, этот метод омывает внутреннюю часть вашего живота, где находится брюшина, горячими химиотерапевтическими препаратами, чтобы убить все оставшиеся раковые клетки. - Перитонэктомия — операция по удалению брюшины.
по перитоническому каркатозу. Узнать, что он есть у вас или у вашего близкого человека, может быть сложно, и понимание этого рака может помочь вам почувствовать контроль над ситуацией.
Перитонеальный карциноматоз чаще всего развивается, когда другие абдоминальные опухоли распространяются на брюшину, приводя к множественным новым опухолям на поверхности этой оболочки. Если у вас перитонеальный карциноматоз, это обычно означает, что рак брюшной полости находится на поздней стадии. Бывают также очень редкие случаи первичного перитонеального карциноматоза, который начинается в самой брюшине.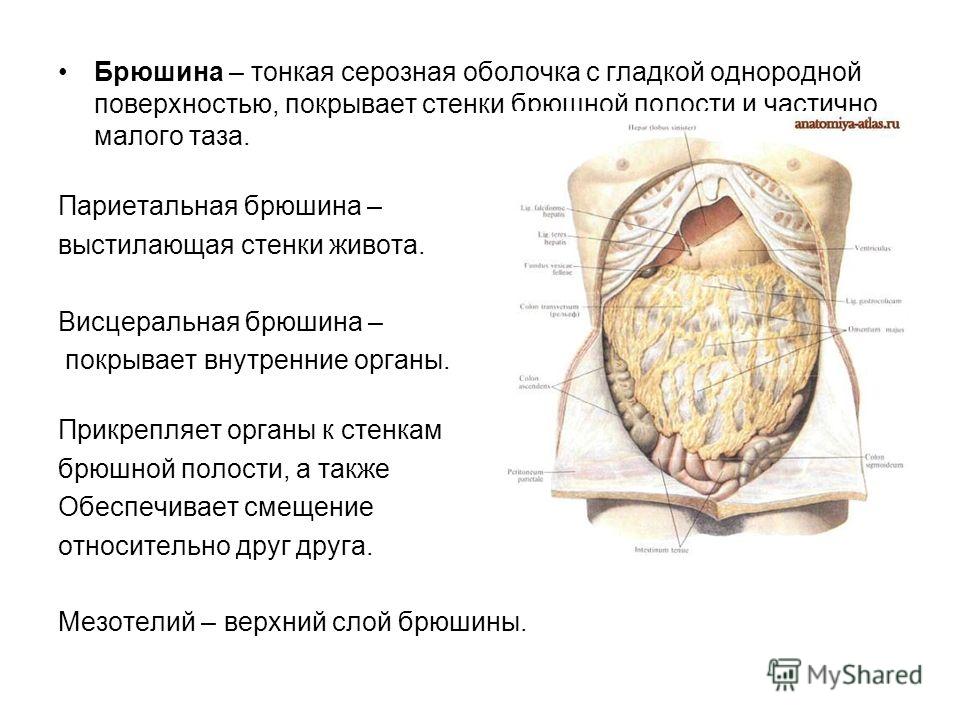 Эти случаи обычно случаются у женщин с высоким риском развития рака яичников.
Эти случаи обычно случаются у женщин с высоким риском развития рака яичников.
Факторы риска перитонеального карциноматоза
Поскольку перитонеальный карциноматоз чаще всего развивается при распространении существующих раковых образований, основным фактором риска являются другие запущенные раковые заболевания, включая:
Как врачи диагностируют перитонеальный карциноматоз
Если врач считает, что у вас перитонеальный карциноматоз, вы можете пройти анализ крови, компьютерную томографию, МРТ или биопсию, чтобы подтвердить это. Иногда карциноматоз брюшины диагностируют во время операции по поводу другого рака, когда хирург замечает опухоли в брюшине.
Лечение карциноматоза брюшины
Поскольку карциноматоз брюшины обычно представляет собой запущенную форму инвазивного рака, который распространился из другой опухоли, его трудно лечить. Большинство опухолей перитонеального карциноматоза практически не уменьшаются или вообще не уменьшаются в ответ на химиотерапию. Из-за этого многие врачи сосредотачиваются на паллиативной помощи, чтобы справиться с симптомами, облегчить боль и улучшить качество жизни. Есть врачи, которые специализируются на паллиативной помощи, оказываемой всем, у кого серьезные заболевания. Уход в хосписе — это вариант, если заботы о конце жизни начинают становиться необходимостью.
В зависимости от вашего конкретного случая могут быть доступны и другие варианты лечения.
Карциноматоз брюшины: пределы диагностики и случаи жидкостной биопсии
1. Леви А.Д., Шоу Дж.К., Собин Л.Х. Вторичные опухоли и опухолеподобные поражения брюшной полости: особенности визуализации с патологической корреляцией. РадиоГрафика. 2009; 29: 347–73. doi: 10.1148/rg.292085189. [PubMed] [CrossRef] [Академия Google]
2. Садеги Б., Арвье С., Глеэн О., Божар А.С., Ривуар М., Болье Дж., Фонтомар Э., Браше А., Кайо Дж.Л., Форе Дж.Л., Поршерон Дж., Пейкс Дж.Л., Франсуа И. и др. Перитонеальный карциноматоз негинекологических злокачественных новообразований. Рак.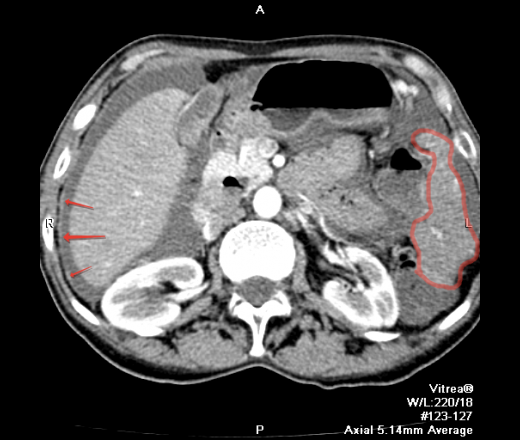 2000; 88: 358–63. doi: 10.1002/(SICI)1097-0142(20000115)88:2<358::AID-CNCR16>3.0.CO;2-O. [PubMed] [CrossRef] [Google Scholar]
2000; 88: 358–63. doi: 10.1002/(SICI)1097-0142(20000115)88:2<358::AID-CNCR16>3.0.CO;2-O. [PubMed] [CrossRef] [Google Scholar]
3. Chia CS, You B, Decullier E, Vaudoyer D, Lorimier G, Abboud K, Bereder JM, Arvieux C, Boschetti G, Glehen O, группа tBIGR Пациенты с перитонеальным карциноматозом Лечение рака желудка с помощью циторедуктивной хирургии и гипертермической внутрибрюшинной химиотерапии: возможно ли излечение? Анналы хирургической онкологии. 2016: 1–9. doi: 10.1245/s10434-015-5081-3. [PubMed] [CrossRef] [Google Scholar]
4. Siegel RL, Miller KD, Jemal A. Статистика рака, 2016. CA Cancer J Clin. 2016;66:7–30. doi: 10.3322/caac.21332. [PubMed] [CrossRef] [Google Scholar]
5. Mekenkamp LJ, Koopman M, Teerenstra S, van Krieken JH, Mol L, Nagtegaal ID, Punt CJ. Клинико-патологические особенности и исходы у пациентов с распространенным колоректальным раком с синхронными и метахронными метастазами. Бр Дж Рак. 2010 (103): 159–64. doi: 10.1038/sj.bjc.6605737. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
6. Klaver YL, Lemmens VE, Nienhuijs SW, Luyer MD, de Hingh IH. Перитонеальный карциноматоз колоректального происхождения: заболеваемость, прогноз и варианты лечения. Всемирный журнал гастроэнтерологии. 2012;18:5489–94. doi: 10.3748/wjg.v18.i39.5489. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Klaver YL, Lemmens VE, Nienhuijs SW, Luyer MD, de Hingh IH. Перитонеальный карциноматоз колоректального происхождения: заболеваемость, прогноз и варианты лечения. Всемирный журнал гастроэнтерологии. 2012;18:5489–94. doi: 10.3748/wjg.v18.i39.5489. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
7. Klaver CE, Musters GD, Bemelman WA, Punt CJ, Verwaal VJ, Dijkgraaf MG, Aalbers AG, van der Bilt JD, Boerma D, Bremers AJ , Burger JW, Buskens CJ, Evers P, et al. Адъювантная гипертермическая внутрибрюшинная химиотерапия (HIPEC) у больных раком толстой кишки с высоким риском перитонеального карциноматоза; рандомизированное многоцентровое исследование COLOPEC. БМК Рак. 2015:15. doi: 10.1186/s12885-015-1430-7. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
8. Митри Э., Гуйу Б., Косконеа С., Жост В., Фавр Дж., Бувье А.М. Эпидемиология, лечение и прогноз колоректального рака с метастазами в легкие: 30-летнее популяционное исследование. Кишка. 2010;59:1383–8. doi: 10.1136/gut.2010.211557. [PubMed] [CrossRef] [Google Scholar]
doi: 10.1136/gut.2010.211557. [PubMed] [CrossRef] [Google Scholar]
9. Quere P, Facy O, Manfredi S, Jooste V, Faivre J, Lepage C, Bouvier AM. Эпидемиология, лечение и выживание перитонеального карциноматоза от колоректального рака: популяционное исследование. Заболевания толстой и прямой кишки. 2015;58:743–52. дои: 10.1097/DCR.0000000000000412. [PubMed] [CrossRef] [Google Scholar]
10. Yan TD, Cao CQ, Munkholm-Larsen S. Фармакологический обзор внутрибрюшинной химиотерапии при злокачественных новообразованиях брюшины. World J Gastrointest Oncol. 2010;2:109–16. doi: 10.4251/wjgo.v2.i2.109. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
11. Goodman MD, McPartland S, Detelich D, Saif MW. Химиотерапия для внутрибрюшинного применения: обзор гипертермической внутрибрюшинной химиотерапии и ранней послеоперационной внутрибрюшинной химиотерапии. J Гастроинтест Онкол. 2016;7:45–57. дои: 10.3978/j.issn.2078-6891.2015.111. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
12. Sugarbaker PH, Kern K, Lack E. Злокачественная псевдомиксома брюшины толстокишечного происхождения. Естественная история и презентация лечебного подхода к лечению. Расстройство прямой кишки. 1987; 30: 772–9. [PubMed] [Google Scholar]
Sugarbaker PH, Kern K, Lack E. Злокачественная псевдомиксома брюшины толстокишечного происхождения. Естественная история и презентация лечебного подхода к лечению. Расстройство прямой кишки. 1987; 30: 772–9. [PubMed] [Google Scholar]
13. Elias D, Lefevre JH, Chevalier J, Brouquet A, Marchal F, Classe JM, Ferron G, Guilloit JM, Meeus P, Goéré D, Bonastre J. Полная циторедуктивная хирургия плюс внутрибрюшинная химиогипертермия С оксалиплатином при перитонеальном карциноматозе колоректального происхождения. Журнал клинической онкологии. 2009 г.;27:681–5. doi: 10.1200/JCO.2008.19.7160. [PubMed] [CrossRef] [Google Scholar]
14. Franko J, Shi Q, Goldman CD, Pockaj BA, Nelson GD, Goldberg RM, Pitot HC, Grothey A, Alberts SR, Sargent DJ. Лечение колоректального перитонеального карциноматоза с помощью системной химиотерапии: объединенный анализ испытаний фазы III северной центральной группы лечения рака N9741 и N9841. Журнал клинической онкологии. 2012;30:263–7. doi: 10.1200/JCO. 2011.37.1039. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2011.37.1039. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15. Verwaal VJ, van Ruth S, de Bree E, van Sloothen GW, van Tinteren H, Boot H, Zoetmulder FA. Рандомизированное исследование циторедукции и гипертермической внутрибрюшинной химиотерапии по сравнению с системной химиотерапией и паллиативной хирургией у пациентов с перитонеальным карциноматозом колоректального рака. Журнал клинической онкологии. 2003; 21: 3737–43. doi: 10.1200/JCO.2003.04.187. [PubMed] [CrossRef] [Google Scholar]
16. Chua TC. Прогресс в комбинированном лечении карциноматоза брюшины. Журнал хирургической онкологии. 2010;102:728–9. doi: 10.1002/jso.21748. [PubMed] [CrossRef] [Google Scholar]
17. Sugarbaker PH. Успешное лечение микроскопической остаточной болезни при раке толстой кишки. Химиотерапия рака и фармакология. 1999;43:С15–С25. doi: 10.1007/s002800051093. [PubMed] [CrossRef] [Google Scholar]
18. Harmon RL, Sugarbaker PH. Прогностические показатели при карциноматозе брюшины от рака желудочно-кишечного тракта.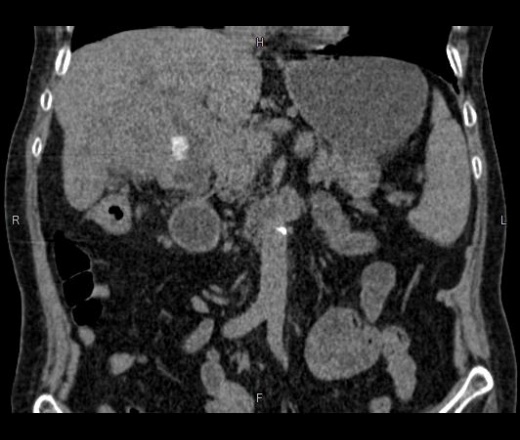 Международные семинары по хирургической онкологии. 2005; 2:3. doi: 10.1186/1477-7800-2-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Международные семинары по хирургической онкологии. 2005; 2:3. doi: 10.1186/1477-7800-2-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
19. Verwaal VJ, van Ruth S, Witkamp A, Boot H, van Slooten G, Zoetmulder FA. Долгосрочное выживание перитонеального карциноматоза колоректального происхождения. Анналы хирургической онкологии. 2004; 12:65–71. doi: 10.1007/s10434-004-1167-z. [PubMed] [CrossRef] [Google Scholar]
20. Verwaal VJ, Kusamura S, Baratti D, Deraco M. Право на местно-региональное лечение злокачественных новообразований на поверхности брюшины. Журнал хирургической онкологии. 2008; 98: 220–3. doi: 10.1002/jso.21060. [PubMed] [CrossRef] [Академия Google]
21. Dromain C, Leboulleux S, Auperin A, Goere D, Malka D, Lumbroso J, Schumberger M, Sigal R, Elias D. Стадирование перитонеального карциноматоза: расширенная КТ по сравнению с ПЭТ/КТ. Абдоминальная визуализация. 2007; 33:87–93. doi: 10.1007/s00261-007-9211-7. [PubMed] [CrossRef] [Google Scholar]
22. Esquivel J, Chua TC, Stojadinovic A, Melero JT, Levine EA, Gutman M, Howard R, Piso P, Nissan A, Gomez-Portilla A, Gonzalez-Bayon L , Гонсалес-Морено С., Шен П. и др. Точность и клиническая значимость компьютерно-томографической интерпретации индекса рака брюшины при колоректальном раке, перитонеальном карциноматозе: многоцентровое исследование. Журнал хирургической онкологии. 2010; 102: 565–70. doi: 10.1002/jso.21601. [PubMed] [CrossRef] [Академия Google]
Esquivel J, Chua TC, Stojadinovic A, Melero JT, Levine EA, Gutman M, Howard R, Piso P, Nissan A, Gomez-Portilla A, Gonzalez-Bayon L , Гонсалес-Морено С., Шен П. и др. Точность и клиническая значимость компьютерно-томографической интерпретации индекса рака брюшины при колоректальном раке, перитонеальном карциноматозе: многоцентровое исследование. Журнал хирургической онкологии. 2010; 102: 565–70. doi: 10.1002/jso.21601. [PubMed] [CrossRef] [Академия Google]
23. Кох Дж.Л., Ян Т.Д., Гленн Д., Моррис Д.Л. Оценка предоперационной компьютерной томографии в оценке индекса перитонеального рака при колоректальном перитонеальном карциноматозе. Анналы хирургической онкологии. 2008; 16: 327–33. doi: 10.1245/s10434-008-0234-2. [PubMed] [CrossRef] [Google Scholar]
24. Low RN, Barone RM, Lucero J. Сравнение МРТ и КТ для прогнозирования индекса перитонеального рака (PCI) до операции у пациентов, которым рассматриваются циторедуктивные хирургические процедуры. Анналы хирургической онкологии.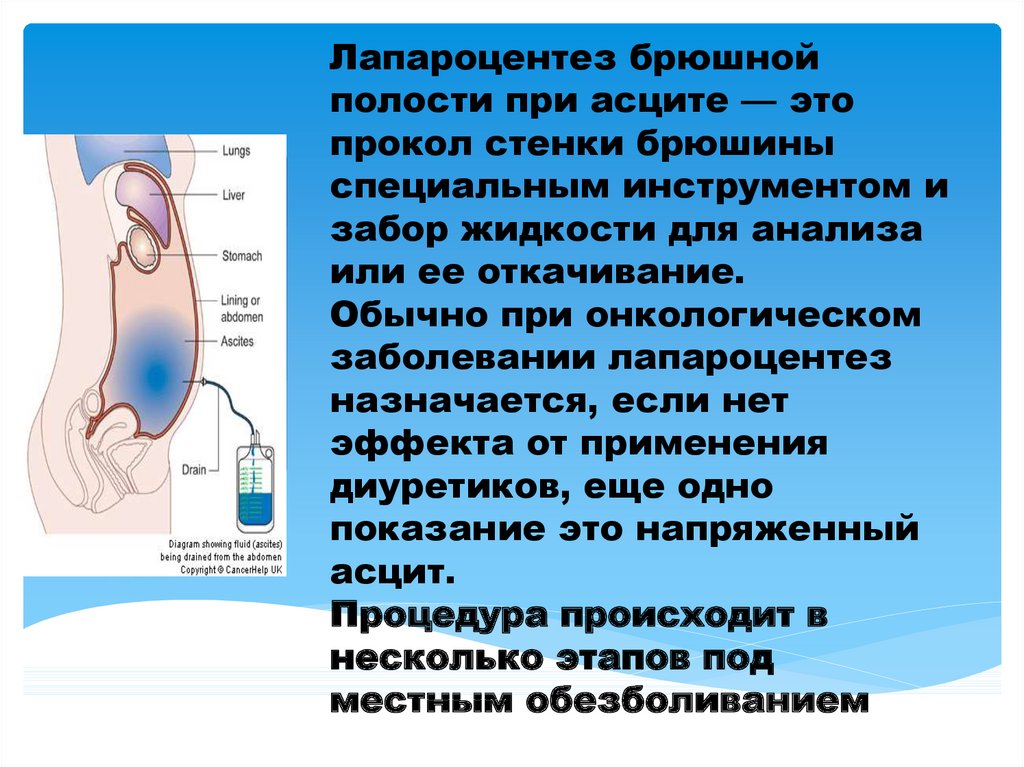 2015; 22:1708–15. doi: 10.1245/s10434-014-4041-7. [PubMed] [CrossRef] [Академия Google]
2015; 22:1708–15. doi: 10.1245/s10434-014-4041-7. [PubMed] [CrossRef] [Академия Google]
25. да Силва Р.Г., Sugarbaker PH. Анализ прогностических факторов у семидесяти пациентов, перенесших полную циторедукцию плюс периоперационную внутрибрюшинную химиотерапию по поводу карциноматоза колоректального рака. J Am Coll Surg. 2006; 203: 878–86. doi: 10.1016/j.jamcollsurg.2006.08.024. [PubMed] [CrossRef] [Google Scholar]
26. Баратти Д., Кусамура С., Дерако М. Пятый международный семинар по злокачественным новообразованиям поверхности брюшины (Милан, Италия, 4–6 декабря 2006 г.): методология консенсуса по конкретным заболеваниям. . Журнал хирургической онкологии. 2008;98: 258–62. doi: 10.1002/jso.21056. [PubMed] [CrossRef] [Google Scholar]
27. Реписо А., Гомес-Родригес Р., Лопес-Пардо Р., Ломбера М.М., Ромеро М., Арансана А., Абад С., Родригес-Мерло Р., Лопес Л., Карболес Дж.М. Полезность эндоскопической ультрасонографии в предоперационной постановке рака желудка: диагностическая ценность и терапевтическое воздействие..jpg) Revista Española De Enfermedades Digestivas. 2010;102:413–20. [PubMed] [Google Scholar]
Revista Española De Enfermedades Digestivas. 2010;102:413–20. [PubMed] [Google Scholar]
28. Savelli L, De Iaco P, Ceccaroni M, Ghi T, Ceccarini M, Seracchioli R, Cacciatore B. Трансвагинальные сонографические признаки перитонеального карциноматоза. УЗИ в акушерстве и гинекологии. 2005; 26: 552–7. doi: 10.1002/uog.2587. [PubMed] [CrossRef] [Академия Google]
29. Патель С.М., Сахдев А., Резнек Р.Х. КТ, МРТ и ПЭТ при злокачественных новообразованиях брюшины. Визуализация рака. 2011;11:123–39. doi: 10.1102/1470-7330.2011.0016. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
30. Fehniger J, Thomas S, Lengyel E, Liao C, Tenney M, Oto A, Yamada SD. Проспективное исследование, оценивающее диффузионно-взвешенную магнитно-резонансную томографию (DW-MRI) при выявлении карциноматоза брюшины при подозрении на гинекологические злокачественные новообразования. Гинекол Онкол. 2016;142:169–75. doi: 10.1016/j.ygyno.2016.04.018. [PubMed] [CrossRef] [Google Scholar]
31. De Vos N, Goethals I, Ceelen W. Клиническая ценность (18) F-FDG-PET-CT в предоперационной стадии перитонеального карциноматоза колоректального происхождения. Acta Chirurgica Belgica. 2014; 114:370–5. [PubMed] [Google Scholar]
De Vos N, Goethals I, Ceelen W. Клиническая ценность (18) F-FDG-PET-CT в предоперационной стадии перитонеального карциноматоза колоректального происхождения. Acta Chirurgica Belgica. 2014; 114:370–5. [PubMed] [Google Scholar]
32. Klumpp BD, Schwenzer N, Aschoff P, Miller S, Kramer U, Claussen CD, Bruecher B, Koenigsrainer A, Pfannenberg C. Предоперационная оценка перитонеального карциноматоза: индивидуальное сравнение 18F-FDG ПЭТ/КТ и МРТ. Абдоминальная визуализация. 2012; 38:64–71. doi: 10.1007/s00261-012-9881-7. [PubMed] [CrossRef] [Google Scholar]
33. Low RN, Barone RM, Lacey C, Sigeti JS, Alzate GD, Sebrechts CP. Опухоль брюшины: МРТ с разбавленным раствором перорального бария и внутривенным введением контрастных веществ, содержащих гадолиний, по сравнению с МРТ без усиления и КТ. Радиология. 1997; 204: 513–20. doi: 10.1148/radiology.204.2.9240546. [PubMed] [CrossRef] [Google Scholar]
34. Yonemura Y, Canbay E, Endou Y, Ishibashi H, Mizumoto A, Miura M, Li Y, Liu Y, Takeshita K, Ichinose M, Takao N, Hirano M, Сако С. и др. Лечение рака брюшины. Экспертное заключение по фармакотерапии. 2014;15:623–36. дои: 10.1517/14656566.2014.879571. [PubMed] [CrossRef] [Google Scholar]
и др. Лечение рака брюшины. Экспертное заключение по фармакотерапии. 2014;15:623–36. дои: 10.1517/14656566.2014.879571. [PubMed] [CrossRef] [Google Scholar]
35. Kin C, Kidess E, Poultsides GA, Visser BC, Jeffrey SS. Диагностика колоректального рака: биомаркеры, внеклеточная ДНК, циркулирующие опухолевые клетки и определение гетерогенных популяций с помощью анализа отдельных клеток. Экспертиза молекулярной диагностики. 2013; 13: 581–99. doi: 10.1586/14737159.2013.811896. [PubMed] [CrossRef] [Google Scholar]
36. Wagner PL, Austin F, Sathaiah M, Magge D, Maduekwe U, Ramalingam L, Jones HL, Holtzman MP, Ahrendt SA, Zureikat AH, Pingpank JF, Zeh HJ, Бартлетт Д.Л. и соавт. Значение уровней сывороточных опухолевых маркеров при перитонеальном карциноматозе аппендикулярного происхождения. Анналы хирургической онкологии. 2013:20. doi: 10.1245/s10434-012-2627-5. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
37. Lu J, Getz G, Miska EA, Alvarez-Saavedra E, Lamb J, Peck D, Sweet-Cordero A, Ebert BL, Mak RH, Ferrando AA, Downing JR, Jacks T, Horvitz HR, et al. Профили экспрессии микроРНК классифицируют рак человека. Природа. 2005; 435:834–8. doi: 10.1038/nature03702. [PubMed] [CrossRef] [Google Scholar]
Профили экспрессии микроРНК классифицируют рак человека. Природа. 2005; 435:834–8. doi: 10.1038/nature03702. [PubMed] [CrossRef] [Google Scholar]
38. Yin C, Zhou X, Dang Y, Yan J, Zhang G. Потенциальная роль циркулирующего MiR-21 в диагностике и прогнозировании рака пищеварительной системы: систематический обзор и Метаанализ. Медицина (Балтимор) 2015;94:e2123. doi: 10.1097/MD.0000000000002123. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
39. Chen X, Ba Y, Ma L, Cai X, Yin Y, Wang K, Guo J, Zhang Y, Chen J, Guo X, Li Q, Li X, Wang W, et al. Характеристика микроРНК в сыворотке: новый класс биомаркеров для диагностики рака и других заболеваний. Клеточные исследования. 2008; 18: 997–1006. doi: 10.1038/cr.2008.282. [PubMed] [CrossRef] [Google Scholar]
40. Mitchell PS, Parkin RK, Kroh EM, Fritz BR, Wyman SK, Pogosova-Agadjanyan EL, Peterson A, Noteboom J, O’Briant KC, Allen A, Lin DW , Урбан Н., Дрешер К.В. и др. Циркулирующие микроРНК как стабильные маркеры на основе крови для обнаружения рака.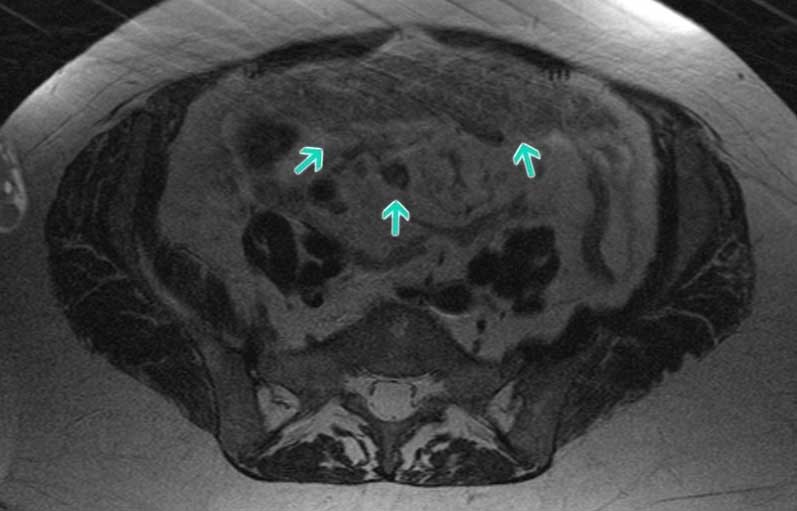 Труды Национальной академии наук. 2008; 105:10513–8. doi: 10.1073/pnas.0804549105. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Труды Национальной академии наук. 2008; 105:10513–8. doi: 10.1073/pnas.0804549105. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
41. Tsui NB, Ng EK, Lo YM. Стабильность эндогенной и добавленной РНК в образцах крови, сыворотке и плазме. Клиническая химия. 2002; 48:1647–53. [PubMed] [Google Scholar]
42. Koga A, Aoyagi K, Imaizumi T, Miyagi M, Shirouzu K. Сравнение линии клеток рака желудка MKN-45 и линии клеток рака желудка с высоким потенциалом перитонеальной диссеминации MKN-45P . Медицинский журнал Куруме. 2011;58:73–79. дои: 10.2739/курумемедж.58.73. [PubMed] [CrossRef] [Google Scholar]
43. Pegtel DM, Cosmopoulos K, Thorley-Lawson DA, van Eijndhoven MA, Hopmans ES, Lindenberg JL, de Gruijl TD, Würdinger T, Middeldorp JM. Функциональная доставка вирусных микроРНК через экзосомы. Труды Национальной академии наук Соединенных Штатов Америки. 2010;107:6328–33. doi: 10.1073/pnas.0914843107. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
44. Skog J, Wurdinger T, van Rijn S, Meijer D, Gainche L, Sena-Esteves M, Curry WT, Carter RS, Krichevsky AM, Breakefield ХО. Микровезикулы глиобластомы транспортируют РНК и белок, которые способствуют росту опухоли и обеспечивают диагностические биомаркеры. Природа клеточной биологии. 2008;10:1470–6. дои: 10.1038/ncb1800. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Skog J, Wurdinger T, van Rijn S, Meijer D, Gainche L, Sena-Esteves M, Curry WT, Carter RS, Krichevsky AM, Breakefield ХО. Микровезикулы глиобластомы транспортируют РНК и белок, которые способствуют росту опухоли и обеспечивают диагностические биомаркеры. Природа клеточной биологии. 2008;10:1470–6. дои: 10.1038/ncb1800. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
45. Валади Х., Экстрем К., Боссиос А., Шёстранд М., Ли Дж. Дж., Лётвалл Дж. О. Опосредованный экзосомами перенос мРНК и микроРНК представляет собой новый механизм генетического обмена между клетками. Природа клеточной биологии. 2007; 9: 654–9. дои: 10.1038/ncb1596. [PubMed] [CrossRef] [Google Scholar]
46. Cheng L, Sharples RA, Scicluna BJ, Hill AF. Экзосомы обеспечивают защитный и обогащенный источник микроРНК для профилирования биомаркеров по сравнению с внутриклеточной и бесклеточной кровью. J Внеклеточные везикулы. 2014; 3 doi: 10.3402/jev.v3.23743. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
47..jpg) Хан С., Беннит Х.Ф., Уолл Н.Р. Новая роль экзосом в секреции сурвивина. Гистол Гистопатол. 2015; 30:43–50. doi: 10.14670/hh-30.43. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Хан С., Беннит Х.Ф., Уолл Н.Р. Новая роль экзосом в секреции сурвивина. Гистол Гистопатол. 2015; 30:43–50. doi: 10.14670/hh-30.43. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
48. Rabinowits G, Gercel-Taylor C, Day JM, Taylor DD, Kloecker GH. Экзосомальная микроРНК: диагностический маркер рака легкого. Клинический рак легкого. 2009; 10:42–6. doi: 10.3816/CLC.2009.n.006. [PubMed] [CrossRef] [Google Scholar]
49. Янаихара Н., Каплен Н., Боуман Э., Сейке М., Кумамото К., Йи М., Стивенс Р.М., Окамото А., Йокота Дж., Танака Т., Калин Г.А., Лю К.Г., Кроче С.М. и соавт. Уникальные молекулярные профили микроРНК в диагностике и прогнозировании рака легкого. Раковая клетка. 2006;9: 189–98. doi: 10.1016/j.ccr.2006.01.025. [PubMed] [CrossRef] [Google Scholar]
50. Хан С., Аспе Дж. Р., Асумен М. Г., Альмагель Ф., Одумосу О., Асеведо-Мартинес С., Де Леон М., Лэнгридж В. Х., Уолл Н. Р. Внеклеточный, проницаемый для клеток сурвивин ингибирует апоптоз, способствуя пролиферативному и метастатическому потенциалу. Бр Дж Рак. 2009; 100:1073–86. doi: 10.1038/sj.bjc.6604978. 6604978 [pii] [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Бр Дж Рак. 2009; 100:1073–86. doi: 10.1038/sj.bjc.6604978. 6604978 [pii] [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
51. Khan S, Jutzy JM, Aspe JR, McGregor DW, Neidigh JW, Wall NR. Сурвивин высвобождается из раковых клеток через экзосомы. Апоптоз. 2011; 16:1–12. дои: 10.1007/s10495-010-0534-4. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
52. Taylor DD, Gercel-Taylor C. Сигнатуры микроРНК опухолевых экзосом как диагностические биомаркеры рака яичников. Гинекологическая онкология. 2008; 110:13–21. doi: 10.1016/j.ygyno.2008.04.033. [PubMed] [CrossRef] [Google Scholar]
53. Хан С., Беннит Х.Ф., Турай Д., Перес М., Миршахиди С., Юань И., Уолл Н.Р. Ранняя диагностическая ценность сурвивина и его альтернативных вариантов сплайсинга при раке молочной железы. БМК Рак. 2014;14:176. дои: 10.1186/1471-2407-14-176. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
54. Хан С., Юци Дж. М., Валенсуэла М. М., Турай Д., Аспе Дж. Р., Ашок А., Миршахиди С., Меркола Д., Лилли М. Б., Уолл Н. Р. Полученный из плазмы экзосомальный сурвивин, вероятный биомаркер для раннего выявления рака предстательной железы. ПЛОС Один. 2012;7:e46737. doi: 10.1371/journal.pone.0046737. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Р., Ашок А., Миршахиди С., Меркола Д., Лилли М. Б., Уолл Н. Р. Полученный из плазмы экзосомальный сурвивин, вероятный биомаркер для раннего выявления рака предстательной железы. ПЛОС Один. 2012;7:e46737. doi: 10.1371/journal.pone.0046737. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
55. Турай Д., Хан С., Диас Остерман С.Дж., Кертис М.П., Хайра Б., Нейдиг Дж.В., Миршахиди С., Касиано К.А., Уолл Н.Р. Протеомное профилирование экзосом, полученных из сыворотки, от этнически разнообразных пациентов с раком простаты. Рак Инвест. 2016; 34:1–11. дои: 10.3109/07357907.2015.1081921. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
56. Андре Ф., Шарц Н.Е., Мовассаг М., Фламент С., Потье П., Морис П., Помель С., Ломм С., Эскудье Б., Ле Шевалье Т., Турс Т., Амигорена С., Рапозо Г. и др. Злокачественные выпоты и экзосомы иммуногенного происхождения опухоли. Ланцет. 2002; 360: 295–305. [PubMed] [Google Scholar]
57. Токухиса М., Итикава Ю., Косака Н. , Очия Т., Яширо М., Хиракава К., Косака Т., Макино Х., Акияма Х., Кунисаки С., Эндо И. Экзосомальные микроРНК из перитонеального лаважа в качестве потенциальных прогностических биомаркеров перитонеального метастазирования при раке желудка. ПЛОС Один. 2015;10:e0130472. doi: 10.1371/journal.pone.0130472. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Очия Т., Яширо М., Хиракава К., Косака Т., Макино Х., Акияма Х., Кунисаки С., Эндо И. Экзосомальные микроРНК из перитонеального лаважа в качестве потенциальных прогностических биомаркеров перитонеального метастазирования при раке желудка. ПЛОС Один. 2015;10:e0130472. doi: 10.1371/journal.pone.0130472. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
58. Zheng H, Zhang F, Lin X, Huang C, Zhang Y, Li Y, Lin J, Chen W, Lin X. МикроРНК-1225-5p ингибирует пролиферацию и метастазирование карциномы желудка посредством подавления субстрата рецептора инсулина-1. и активация передачи сигналов β-катенина. Онкотаргет. 2015;7:4647–63. doi: 10.18632/oncotarget.6615. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
59. Хамам Р., Али А.М., Альсалех К.А., Кассем М., Альфайес М., Алдахмаш А., Алахес Н.М. Профилирование экспрессии микроРНК у отдельных пациентов с раком молочной железы идентифицирует новую панель циркулирующих микроРНК для раннего обнаружения. Научные отчеты. 2016;6:25997. doi: 10.1038/srep25997. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2016;6:25997. doi: 10.1038/srep25997. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
60. Wang X, Wu J, Lin Y, Zhu Y, Xu X, Xu X, Liang Z, Li S, Hu Z, Zheng X, Xie L. МикроРНК-320c ингибирует опухолевое поведение рака мочевого пузыря путем нацеливания на циклинзависимую киназу 6. Журнал экспериментальных и клинических исследований рака. 2014;33:69. doi: 10.1186/s13046-014-0069-6. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
61. Zhao G, Dong L, Shi H, Li H, Lu X, Guo X, Wang J. МикроРНК-1207-5p ингибирует рост клеток гепатоцеллюлярной карциномы и инвазия через опосредуемый синтазой жирных кислот сигнальный путь Akt/mTOR. Онкологические отчеты. 2016;36:1709–1. doi: 10.3892/or.2016.4952. [PubMed] [CrossRef] [Google Scholar]
62. Озата Д.М., Карамута С., Веласкес-Фернандес Д., Акчакая П., Се Х., Хёг А., Зедениус Дж., Бэкдал М., Ларссон С., Луи В.О. Роль дерегуляции микроРНК в патогенезе адренокортикальной карциномы. Рак, связанный с эндокринной системой. 2011;18:643–55. doi: 10.1530/ERC-11-0082. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2011;18:643–55. doi: 10.1530/ERC-11-0082. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
63. Farhana L, Antaki F, Anees MR, Nangia-Makker P, Judd S, Hadden T, Levi E, Murshed F, Yu Y, Van Buren Э., Ахмед К., Дайсон Г., Маджумдар А.П. Роль раковых стволовых клеток в расовом неравенстве при колоректальном раке. Раковая медицина. 2016;5:1268–78. дои: 10.1002/cam4.690. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
64. Hoshino A, Costa-Silva B, Shen TL, Rodrigues G, Hashimoto A, Tesic Mark M, Molina H, Kohsaka S, Di Giannatale А., Седер С., Сингх С., Уильямс С., Соплоп Н. и др. Интегрины экзосом опухоли определяют органотропное метастазирование. Природа. 2015; 527:329–35. doi: 10.1038/nature15756. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
65. Paggetti J, Haderk F, Seiffert M, Janji B, Distler U, Ammerlaan W, Kim YJ, Adam J, Lichter P, Solary E, Berchem G, Moussay E. Экзосомы, высвобождаемые клетками хронического лимфоцитарного лейкоза, вызывают переход стромальных клеток в ассоциированные с раком фибробласты.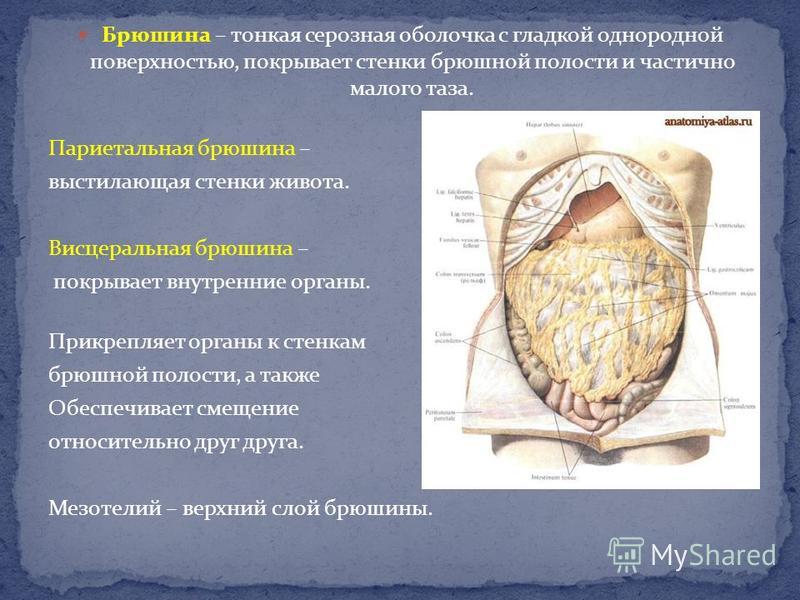 Кровь. 2015; 126:1106–17. doi: 10.1182/blood-2014-12-618025. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Кровь. 2015; 126:1106–17. doi: 10.1182/blood-2014-12-618025. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
66. Пейнадо Х., Алекович М., Лавоткин С., Матей И., Коста-Сильва Б., Морено-Буэно Г., Эргета-Редондо М., Уильямс К., Гарсия-Сантос Г., Гаджар К., Нитадори-Хосино А., Хоффман К., Бадал К. и др. Экзосомы меланомы обучают клетки-предшественники костного мозга прометастатическому фенотипу посредством MET. Нат Мед. 2012;18:883–91. doi: 10.1038/nm.2753. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
67. Franzen CA, Simms PE, Van Huis AF, Foreman KE, Kuo PC, Gupta GN. Характеристика поглощения и интернализации экзосом клетками рака мочевого пузыря. Биомед Рез Инт. 2014;2014:619829. doi: 10.1155/2014/619829. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
68. Huang KH, Lan YT, Fang WL, Chen JH, Lo SS, Li AF, Chiou SH, Wu CW, Shyr YM. Корреляция между микроРНК и метастазированием в лимфатические узлы при раке желудка. BioMed Research International 2015. Doi 2015: 10.1155/2015/543163. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Doi 2015: 10.1155/2015/543163. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
69. Chen L, Lü MH, Zhang D, Hao NB, Fan YH, Wu YY, Wang SM, Xie R, Fang DC, Zhang H, Hu CJ, Ян С.М. миР-1207-5p и миР-1266 подавляют рост и инвазию рака желудка путем нацеливания на обратную транскриптазу теломеразы. Гибель клеток и болезни. 2014;5:e1034. doi: 10.1038/cddis.2013.553. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
70. Moltzahn F, Olshen AB, Baehner L, Peek A, Fong L, Stöppler H, Simko J, Hilton JF, Carroll P, Blelloch R. Мультиплексная qRT-PCR на основе микрожидкости идентифицирует диагностические и прогностические признаки микроРНК в сыворотке предстательной железы больных раком. Исследования рака. 2011;71:550–60. doi: 10.1158/0008-5472.CAN-10-1229. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
71. Zhu J, Chen L, Zou L, Yang P, Wu R, Mao Y, Zhou H, Li R, Wang K, Wang W, Hua D, Zhang X. МиР-20b, -21 и -130b ингибируют экспрессию PTEN, что приводит к сверхэкспрессии B7-h2 при распространенном колоректальном раке. Иммунология человека. 2014;75:348–53. doi: 10.1016/j.humimm.2014.01.006. [PubMed] [CrossRef] [Академия Google]
Иммунология человека. 2014;75:348–53. doi: 10.1016/j.humimm.2014.01.006. [PubMed] [CrossRef] [Академия Google]
72. Fricke A, Ullrich PV, Heinz J, Pfeifer D, Scholber J, Herget GW, Hauschild O, Bronsert P, Stark GB, Bannasch H, Eisenhardt SU, Braig D. саркома. Молекулярный рак. 2015:14. doi: 10.1186/s12943-015-0424-z. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
73. Leidinger P, Hart M, Backes C, Rheinheimer S, Keck B, Wullich B, Keller A, Meese E. Дифференциальная диагностика доброкачественных гиперплазия предстательной железы и рак предстательной железы: микроРНК как источник биомаркеров, не зависящих от уровня ПСА, шкалы Глисона или статуса TNM. Биология опухоли. 2016;37:10177–85. doi: 10.1007/s13277-016-4883-7. [PubMed] [CrossRef] [Академия Google]
74. He HC, Han ZD, Dai QS, Ling XH, Fu X, Lin ZY, Deng YH, Qin GQ, Cai C, Chen JH, Jiang FN, Liu X, Zhong WD. Глобальный анализ дифференциально экспрессируемых микроРНК рака предстательной железы у китайских пациентов. Геномика BMC. 2013;14:757. дои: 10.1186/1471-2164-14-757. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Геномика BMC. 2013;14:757. дои: 10.1186/1471-2164-14-757. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
75. Бартли А.Н., Яо Х., Баркох Б.А., Иван С., Мишра Б.М., Рашид А., Калин Г.А., Лутра Р., Гамильтон С.Р. Сложные паттерны измененной экспрессии микроРНК во время последовательности аденомы-аденокарциномы для микросателлитно-стабильного колоректального рака. Клинические исследования рака. 2011; 17:7283–93. doi: 10.1158/1078-0432.CCR-11-1452. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
76. Velázquez-Fernández D, Caramuta S, Özata DM, Lu M, Höög A, Bäckdahl M, Larsson C, Lui WO, Zedenius J. Экспрессия микроРНК паттерны, связанные с гиперфункциональными и негиперфункционирующими фенотипами при аденомах коры надпочечников. Европейский журнал эндокринологии. 2014;170:583–91. doi: 10.1530/EJE-13-0817. [PubMed] [CrossRef] [Google Scholar]
77. Lei T, Zhu Y, Jiang C, Wang Y, Fu J, Fan Z, Qin H. МикроРНК-320 подавлялась при немелкоклеточном раке легкого и ингибировала клетки.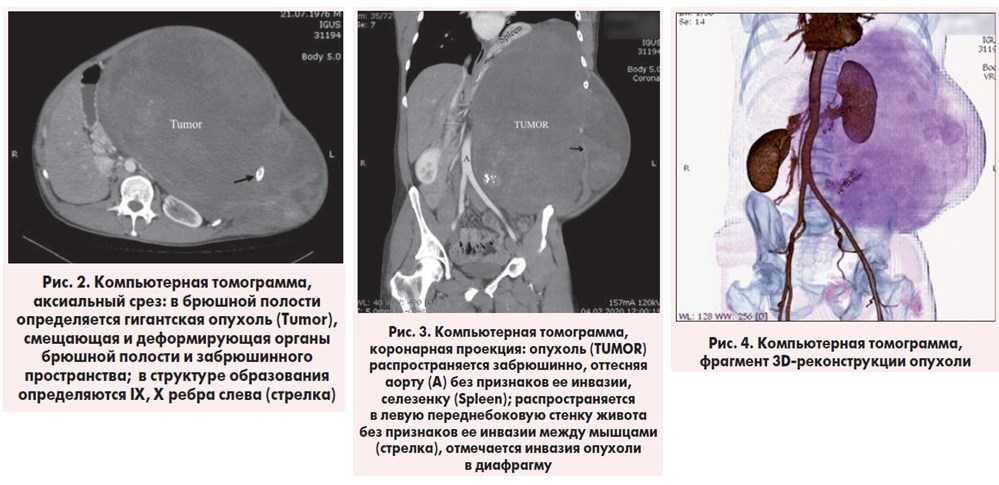






.jpg)
 На более поздних стадиях рак вызывает такие симптомы, как:
На более поздних стадиях рак вызывает такие симптомы, как: Часто используемый сразу после циторедуктивной хирургии, этот метод омывает внутреннюю часть вашего живота, где находится брюшина, горячими химиотерапевтическими препаратами, чтобы убить все оставшиеся раковые клетки.
Часто используемый сразу после циторедуктивной хирургии, этот метод омывает внутреннюю часть вашего живота, где находится брюшина, горячими химиотерапевтическими препаратами, чтобы убить все оставшиеся раковые клетки.