Дистрофия костной ткани челюсти: АТРОФИЯ И НЕХВАТКА КОСТНОЙ ТКАНИ
АТРОФИЯ И НЕХВАТКА КОСТНОЙ ТКАНИ
До
После
Проблема: атрофия костной ткани
Атрофия костной ткани – это убыль альвеолярного отростка челюсти, которая характеризуется уменьшением длины и ширины кости, а также разряжением костной ткани. Атрофия – это неизбежное следствие потери зубов, в некоторых случаях – травмы челюсти, воспалительных, наследственных генетических или других заболеваний.
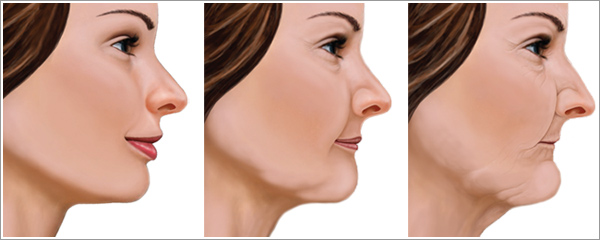
В нашем организме все взаимосвязано – и потеря даже одного зуба приводит не только к смещению всего зубного ряда, но и заметному уменьшению объема костной ткани. Внешне атрофия кости заметна лишь при ее явном проявлении, когда отсутствует большая часть зубов на обеих челюстях. В этом случае появляется ассиметрия лица, зубная дуга уменьшается в размерах, губы и щеки «западают» внутрь полости рта, уголки губ опускаются, а оставшиеся зубы перемещаются по зубному ряду.
Причины атрофии костной ткани:
- потеря зубов – атрофия костной ткани возникает в результате уменьшения нагрузки: если корни зубов отсутствуют, клетки кости не получают должного давления и перестают насыщаться питательными веществами.
 Со временем мягкие слои кости рассасываются, кость становится тонкой, десна проваливается;
Со временем мягкие слои кости рассасываются, кость становится тонкой, десна проваливается; - воспалительные заболевания полости рта, пародонтоз, удаленные кисты, гранулемы и другие опухоли,
- травмы челюсти,
- анатомическое строение челюсти,
- наследственные заболевания,
- возрастные изменения организма.
Последствия атрофии костной ткани:
- изменение эстетических характеристик лица, в том числе преждевременное старение, появление морщин,
- нарушение жевательной функции и как следствие – развитие заболеваний желудочно-кишечного тракта,
- изменение речи,
- смещение оставшихся зубов, ухудшение их состояния.
Основное и самое главное следствие атрофии костной ткани – невозможность проведения классической имплантации. Имплант, который заменяет корень зуба, невозможно будет закрепить в слишком короткой и узкой кости.
Мнение специалиста
Игорь Юрьевич Малиновский
Челюстно-лицевой хирург, имплантолог
Стаж:более 14 лет
Проблему атрофии костной ткани – низкого или узкого альвеолярного гребня, а также пористой кости (резорбция) – сегодня эффективно решают различными методами. Можно прибегнуть к остеопластической операции, или же установить базальные импланты, которые благодаря своей длине устанавливаются в глубокие слои кости, и не подвержены риску отторжения или потери устойчивости из-за дефицита кости.
Можно прибегнуть к остеопластической операции, или же установить базальные импланты, которые благодаря своей длине устанавливаются в глубокие слои кости, и не подвержены риску отторжения или потери устойчивости из-за дефицита кости.
Решения проблемы
Возможные решения проблемы – увеличение объема костной ткани, установка съемного протеза или постоянного мостовидного, а также применение методов имплантации зубов, которые подразумевают восстановление зубного ряда без процедуры наращивания кости.
Вариант 1: Экспресс имплантация зубов – самый современный метод восстановления зубов, для которого не требуется наращивание кости. Метод используется для восстановления от 3-х збуов. Подбираются различные по длине и форме импланты, имеющие крепление для надежной фиксации в костной ткани, при этом абатмент (выступающая часть импланта для крепления коронки) является частью цельнолитной конструкции. Если наблюдается острая нехватка кости, то импланты устанавливаются в глубокие слои костной ткани, в том числе, по усмотрению врача-имплантолога, импланты могут быть установлены под углом для распределения нагрузки.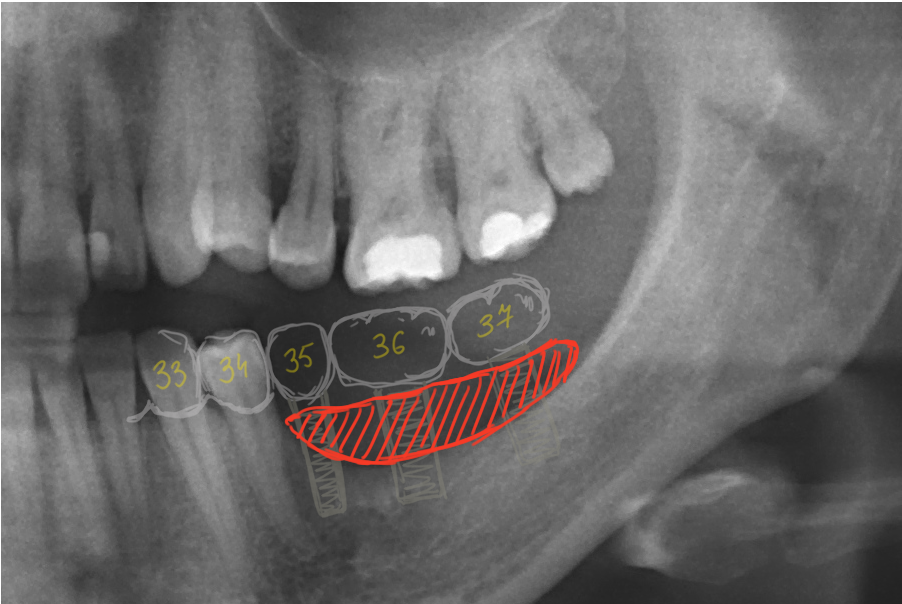 Кроме того, под определенный размер кости врач подбирает импланты индивидуально, создавая как ювелир комплексную конструкцию. При экспресс имплантации, протезы на импланты устанавливаются на 3 день, импланты приживаются максимально быстро, за счет восстановления жевательной функции и стимулирования естественных процессов восстановления костной ткани. Таким образом пациенты возвращаются к нормальному образу жизни уже через неделю после имплантации, а не через полгода-год как в случае с классической имплантацией и синус-лифтингом. Подробнее>
Кроме того, под определенный размер кости врач подбирает импланты индивидуально, создавая как ювелир комплексную конструкцию. При экспресс имплантации, протезы на импланты устанавливаются на 3 день, импланты приживаются максимально быстро, за счет восстановления жевательной функции и стимулирования естественных процессов восстановления костной ткани. Таким образом пациенты возвращаются к нормальному образу жизни уже через неделю после имплантации, а не через полгода-год как в случае с классической имплантацией и синус-лифтингом. Подробнее>
Вариант 2: Синус-лифтинг – операция, которая проводится на верхней челюсти для увеличения длины костной ткани. Возможно два основных подхода: с одновременной установкой имплантов (закрытый синус-лифтинг), а также путем подсадки костного материала, его полного приживления и только после – установки искусственных корней (открытый синус-лифтинг). Операция синус-лифтинга возможна за счет частичного освобождения места для костной ткани путем смещения дна гайморовой пазухи. При операции оно приподнимается через отверстие в костной ткани, а свободное пространство заполняется синтетическим костным материалом. Подробнее>
При операции оно приподнимается через отверстие в костной ткани, а свободное пространство заполняется синтетическим костным материалом. Подробнее>
Вариант 3: Остеопластика – процедура, которая проводится, как правило, для увеличения ширины кости (на нижней челюсти достаточно редко встречается проблема нехватки длины костной ткани). В качестве материалов для увеличения объема кости применяются синтетические соединения, либо костные блоки донора (животных, либо человеческие, позаимствованные из других костных структур), а также собственный костный материал, выделенный из плазмы крови пациента с помощью специального оборудования. Последний вариант более предпочтительный, поскольку собственные клетки не воспринимаются как чужеродное тело и приживаются максимально быстро. Подробнее>
Вариант 4: Съемное протезирование – один из возможных вариантов восстановления зубов при атрофии кости. Полные или частные съемные протезы довольно удачно замещают зубной ряд, однако пациенту придется столкнуться с рядом неудобств: недостаточной эстетикой, долгим привыканием, возможными нарушениями речи и воспалениями десен, вызванными натиранием конструкции, небольшим сроком службы. К тому же съемное протезирование не позволит восстановить убывающую кость – она по-прежнему не будет получать должной нагрузки и продолжит уменьшаться в размерах. В конечном итоге это приведет к нарушению эстетики: ведь десна будет убывать вместе с костной тканью и между ней и протезом образуется щель. Подробнее>
К тому же съемное протезирование не позволит восстановить убывающую кость – она по-прежнему не будет получать должной нагрузки и продолжит уменьшаться в размерах. В конечном итоге это приведет к нарушению эстетики: ведь десна будет убывать вместе с костной тканью и между ней и протезом образуется щель. Подробнее>
Вариант 5: Мостовидные зубные протезы – представляют собой ряд объединенных между собой зубных коронок, позволяют восстановить несколько утраченных зубов, используя в качестве опоры живые зубы пациента или установленные импланты. Как и съемные протезы, в случае опоры на живых зубах лишь усугубляют процесс атрофии кости, поскольку под протезом она будет продолжать уменьшаться в размерах. Подробнее>
Другие проблемы::
- Заболевания гайморовой пазухи
- Разрушенный (отколотый) зуб
- Отсутствие одного зуба
- Разрозненное отсутствие зубов
- Эстетический дефект зоны улыбки
- Концевой дефект
- Полная адентия
- Деформация овала лица и дефекты речи
- Кариес под коронкой
- Пульпит
- Разрушен зубной мост
- Тетрациклиновые зубы
- Не прижился имплант
- Подвижность зубов и пародонтит
Автор статьи
Игорь Юрьевич Малиновский
Челюстно-лицевой хирург, имплантолог
Стаж: более 14 лет
Задать вопрос
- Заболевания гайморовой пазухи
- Разрушенный (отколотый) зуб
- Отсутствие одного зуба
- Атрофия и нехватка костной ткани
- Эстетический дефект зоны улыбки
- Концевой дефект
- Полная адентия
- Деформация овала лица и дефекты речи
- Кариес под коронкой
- Пульпит
- Разрушен зубной мост
- Тетрациклиновые зубы
- Не прижился имплант
- Подвижность зубов и пародонтит
Атрофия костной ткани челюсти: причины, лечение и восстановление
Случается, что, потеряв зуб, человек задумывается о протезировании только спустя несколько лет. Выбирает надежную современную технологию — дентальную имплантацию. И обнаруживает, что за прошедшее время костная ткань «расслабилась» — ее объем и плотность стали недостаточны для полноценной установки имплантата. О том, почему возникает разрежение костной ткани челюсти и возможна ли имплантация без наращивания костной ткани — читайте в нашем обзоре.
Выбирает надежную современную технологию — дентальную имплантацию. И обнаруживает, что за прошедшее время костная ткань «расслабилась» — ее объем и плотность стали недостаточны для полноценной установки имплантата. О том, почему возникает разрежение костной ткани челюсти и возможна ли имплантация без наращивания костной ткани — читайте в нашем обзоре.
Костная ткань — сложная, живая, постоянно изменяющаяся структура. Как и в любой живой ткани, в ней есть вода — около 10%[1]. В среднем 25% состава кости — органическая, «живая» составляющая. Это белки, в основном коллаген, и клетки, регулирующие состав и структуру ткани. Оставшаяся доля — неорганические вещества (в основном гидроксиапатиты). Это именно те вещества, которые придают костной ткани прочность и жесткость. Процентное соотношение может меняться в зависимости от того, идет ли речь о губчатой или компактной костной ткани:
- Губчатая кость — пористая и легкая, в ней между костными структурами (трабекулами) много свободного пространства, где проходят кровеносные сосуды.
 В структуре преобладают органические компоненты.
В структуре преобладают органические компоненты. - Компактная (кортикальная) кость — плотно скомпонованная и очень прочная. В ней преобладают неорганические субстанции.
Живая ткань кости формируется костными клетками: остеоцитами и остеокластами.
Остеоциты — это клетки костной ткани, которые ее формируют и регулируют процесс кальцификации. Они синтезируют белковые структуры кости, регулируют минерализацию — концентрацию солей кальция и фосфора, таким образом поддерживая баланс между органической и неорганической составляющей.
Остеокласты уничтожают «отслужившие свое» или поврежденные костные структуры.
В нормальном состоянии живого организма непрерывно поддерживается баланс между разрушением и созиданием — для того чтобы создать что-то новое нужно «расчистить площадку». Но когда по каким-то причинам процесс резорбции (рассасывания) костной ткани начинает преобладать, наступает атрофия костной ткани.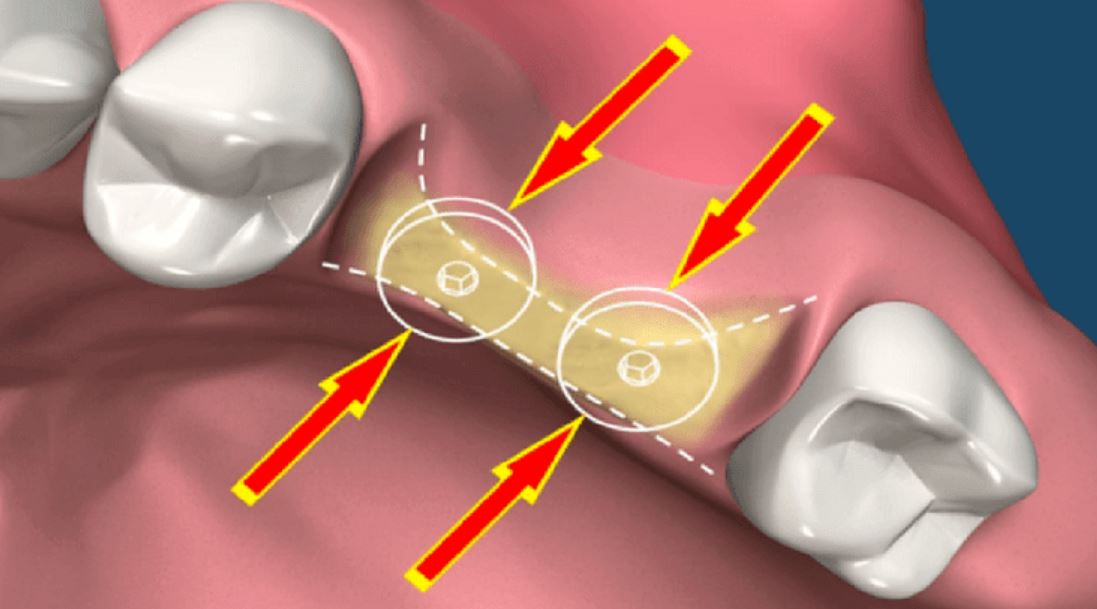
Чаще всего убыль костной ткани развивается после удаления зуба. Любой орган для того, чтобы сохранить нормальное состояние, должен работать, а нерабочие структуры атрофируются — у организма нет возможности тратить питательные вещества и энергию на подержание в работоспособном состоянии нефункционирующего органа. Костная ткань челюсти поддерживается в «рабочем» состоянии нагрузкой, которая передается при жевании через корни зубов. Как только зуб удаляется, нагрузка исчезает. Постепенно перестают функционировать сосуды, которые питали удаленный зуб, а значит, перестает поступать питание и в ткань челюсти. Ткань челюсти в области удаленного зуба начинает рассасываться — атрофироваться. Как показало исследование немецких ученых, после потери зубов такие изменения возникают в 95% случаев[2]. В течение 1 года после потери зуба объем костной ткани уменьшается на 25%[3]. Именно поэтому врачи-стоматологи рекомендуют как можно быстрее после потери зуба поставить на его место имплантат.
В клинической практике выделяют 4 степени атрофии[4]:
- незначительная;
- умеренная;
- выраженная;
- грубая.

При незначительном снижении плотности костной ткани возможна имплантация зубов с помощью дентальных имплантатов оптимального размера. При грубой атрофии имплантация возможна только после реконструкции челюсти.
Причины потери плотности и убыли костной ткани челюсти
Потеря зуба — не единственная причина изменения костной структуры. Такими причинами могут стать:
- воспаление десен и периодонта — структур, окружающих зубы и обеспечивающих их стабильность;
- кисты и воспаления в области корней зубов или верхнечелюстных пазух;
- травмы челюсти;
- остеопороз;
- врожденные анатомические особенности.
Тем не менее основные причины развития атрофии костной ткани челюсти — несвоевременное протезирование после удаления зуба.
Последствия «расслабления» костной ткани
Атрофия альвеолярных отростков — проблема не только «местного» масштаба. Постепенно усиливаясь, процесс вызывает необратимые изменения:
- Меняется выражение лица.
 В зависимости от того, где расположен дефект, «укорачивается» верхняя или нижняя челюсть, западают губы, вокруг них формируются морщины. Лицо приобретает характерный «старческий» вид.
В зависимости от того, где расположен дефект, «укорачивается» верхняя или нижняя челюсть, западают губы, вокруг них формируются морщины. Лицо приобретает характерный «старческий» вид. - Зубы начинают смещаться в сторону «пустого» пространства. Увеличивается вероятность потери и соседних зубов. Из-за того, что расположение зубов меняется, между ними задерживаются остатки пищи: ускоряется развитие кариеса. Да и само жевание становится менее эффективным, как результат — проблемы с ЖКТ.
И основная проблема, с которой сталкиваются пациенты стоматологических клиник, — невозможность имплантации зубов. По данным отечественных врачей, у 35% пациентов она невозможна без проведения реконструкции костной ткани челюсти[5].
Как предотвратить процесс атрофии?
Поскольку атрофия костной ткани чаще всего развивается из-за удаления зуба (или нескольких зубов), очевидно, что для ее предотвращения следует как можно скорее восстановить зубы. Традиционно используются несколько методик:
Традиционно используются несколько методик:
- установка мостовидной конструкции;
- установка съемного протеза;
- имплантация.
Первые два метода относительно недороги. Но, к сожалению, они не восстанавливают нагрузку на кость в месте удаленных зубов. Нагрузка ложится на здоровые зубы, фиксирующие протез, в случае съемного моста — на десны. В результате атрофия продолжает развиваться. Часто она сводит на нет результаты протезирования — десна «проседает» вслед за костной тканью, под протезом появляется щель. Это не только неэстетично, но и опасно — в образовавшемся пространстве скапливаются остатки пищи, на которых активно размножаются микроорганизмы, провоцирующие воспаление.
Имплантация зубов, в отличие от других методик протезирования, позволяет сформировать нагрузку непосредственно на костную ткань в районе удаленного зуба. Таким образом, костная ткань продолжает работать в нормальном режиме, а значит, в ней сохраняются все необходимые обменные процессы. Это предупреждает истончение костной ткани челюсти.
Это предупреждает истончение костной ткани челюсти.
Варианты восстановления зубного ряда при значительной атрофии
Но что же делать, если время упущено и степень атрофии костной ткани не позволяет имплантировать зубы? На сегодня есть две основные методики, позволяющие справиться с этой проблемой.
Восстановление костной ткани челюсти с последующей имплантацией с отложенной нагрузкой.Это классическая методика, проверенная временем. Сначала проводится операция по увеличению объема костной ткани. Существуют разные методики: синус-лифтинг, расщепление альвеолярного отростка, подсадка костного трансплантата или искусственной ткани. Какая из них будет оптимальна в данном конкретном случае, может решить только лечащий врач. После операции потребуется от нескольких месяцев до полугода на восстановление костных структур, после чего в челюсть вживляются имплантаты, пока без коронок — и снова требуется около полугода для их приживления. Только после этого на титановое основание имплантатов устанавливаются коронки и челюсть, наконец, получает нагрузку.
Это относительно новая методика стала возможной благодаря специальным имплантатам, которые фиксируются не в альвеолярной части челюсти, а глубже, в базальной ее части, которая состоит в основном из компактного вещества. Имплантаты подбирают исходя из индивидуальных особенностей челюсти пациента. Они требуют минимального времени для заживления — протез устанавливают уже на 3–5-й день после фиксации самого имплантата. Благодаря тому, что кость сразу же получает нагрузку, в ней сохраняется кровообращение, нормальный обмен веществ, что ускоряет регенерацию.
Для того чтобы орган сохранял свою структуру и функции, он должен работать. Это касается и костной ткани челюсти. Потеря зубов приводит к атрофии кости челюсти. Чтобы предупредить этот процесс, необходимо как можно быстрее после удаления зуба заменить его протезом. Имплантация зубов — самый приближенный к естественному способ их восстановления, позволяющий сохранить объем и плотность костной ткани.
Нижнечелюстно-акральная дисплазия: MedlinePlus Genetics
Чтобы использовать функции обмена на этой странице, включите JavaScript.
Описание
Нижнечелюстно-акральная дисплазия — это состояние, вызывающее различные аномалии, включающие развитие костей, окраску кожи (пигментацию) и распределение жира. Люди с этим заболеванием могут медленно расти после рождения. Большинство больных рождаются с недоразвитой костью нижней челюсти (нижняя челюсть) и маленькими ключицами (ключицами), что приводит к характерным чертам маленького подбородка и скошенных плеч. Другие проблемы с костями включают потерю костной ткани на кончиках пальцев (акроостеолиз), что приводит к выпуклости кончиков пальцев; замедленное закрытие некоторых костей черепа; деформации суставов (контрактуры).
Люди с мандибулоакральной дисплазией могут иметь пятнистую или пятнистую пигментацию кожи или другие аномалии кожи. Некоторые люди с этим заболеванием имеют признаки преждевременного старения (состояние, называемое прогерией), такие как тонкая кожа, потеря зубов, выпадение волос и клювовидный нос. У некоторых людей с нижнечелюстной дисплазией есть проблемы с обменом веществ, например диабет.
У некоторых людей с нижнечелюстной дисплазией есть проблемы с обменом веществ, например диабет.
Общим признаком нижнечелюстной дисплазии является отсутствие жировой ткани под кожей (липодистрофия) в определенных областях тела. Два типа этого расстройства, мандибулоакральная дисплазия с липодистрофией типа А (MADA) и мандибулоакральная дисплазия с липодистрофией типа B (MADB), различаются характером распределения жира по всему телу. Тип А описывается как частичная липодистрофия; у пострадавших людей наблюдается потеря жировой ткани на туловище и конечностях, но она может накапливаться вокруг шеи и плеч. Тип В — генерализованная липодистрофия с потерей жировой ткани на лице, туловище и конечностях.
MADA обычно начинается во взрослом возрасте, хотя может быть и у детей. MADB начинается раньше, часто сразу после рождения. Многие дети с MADB рождаются недоношенными.
Частота
Нижнечелюстно-акральная дисплазия — редкое заболевание; его распространенность неизвестна.
Причины
Две формы мандибулоакральной дисплазии вызываются мутациями в разных генах. Мутации в гене LMNA вызывают MADA, а мутации в гене ZMPSTE24 вызывают MADB. Внутри клеток эти гены участвуют в поддержании структуры ядра и могут играть роль во многих клеточных процессах.
Ген LMNA предоставляет инструкции для создания двух родственных белков, ламина А и ламина С. Эти белки действуют как каркасные (поддерживающие) компоненты ядерной оболочки, которая представляет собой мембрану, окружающую ядро в клетках. Ядерная оболочка регулирует движение молекул в ядро и из ядра и может помочь регулировать активность определенных генов. Мутации в этом гене, вероятно, изменяют структуру ламина А и ламина С.
Белок ламина А (но не ламин С) должен пройти процессинг внутри клетки, прежде чем стать частью ядерной оболочки. Белок, полученный из 9В этом процессинге участвует ген 0021 ZMPSTE24 ; он разрезает незрелый белок ламина А (преламин А) в определенном месте, образуя зрелый ламин А. Мутации в гене ZMPSTE24 приводят к накоплению преламина А и дефициту зрелого белка.
Мутации в гене ZMPSTE24 приводят к накоплению преламина А и дефициту зрелого белка.
Мутации в гене LMNA или ZMPSTE24 , вероятно, нарушают структуру ядерной оболочки. Исследователи работают над тем, чтобы понять, как эти генетические изменения приводят к признакам и симптомам нижнечелюстной дисплазии.
Наследование
Это состояние наследуется по аутосомно-рецессивному типу, что означает, что обе копии гена в каждой клетке имеют мутации. Каждый из родителей человека с аутосомно-рецессивным заболеванием несет по одной копии мутировавшего гена, но обычно у них нет признаков и симптомов заболевания.
Другие названия этого состояния
- Нижнечелюстно-акральный дизостоз
Дополнительная информация и ресурсы
Информация о генетическом тестировании
- Реестр генетического тестирования: мандибулоакральная дисплазия
- Реестр генетического тестирования: мандибулоакральная дисплазия с липодистрофией типа B
Информационный центр генетических и редких заболеваний
- Нижнечелюстно-акральная дисплазия
Ресурсы поддержки пациентов и защиты интересов
- Информационный поиск по болезням
- Национальная организация редких заболеваний (NORD)
Каталог генов и болезней от OMIM
- ЧЕЛЮСТНО-АКРАЛЬНАЯ ДИСПЛАЗИЯ С ЛИПОДИСТРОФИЕЙ ТИПА А
- ЧЕЛЮСТНО-АКРАЛЬНАЯ ДИСПЛАЗИЯ С ЛИПОДИСТРОФИЕЙ ТИПА В
Научные статьи в PubMed
- PubMed
Ссылки
- Ahmad Z, Zackai E, Medne L, Garg A.
 Раннее начало нижнечелюстно-акральной дисплазии из-за
к сложным гетерозиготным мутациям в ZMPSTE24. Am J Med Genet A. 2010
ноябрь; 152A(11):2703-10. doi: 10.1002/ajmg.a.33664. Цитирование в PubMed или бесплатная статья в PubMed Central
Раннее начало нижнечелюстно-акральной дисплазии из-за
к сложным гетерозиготным мутациям в ZMPSTE24. Am J Med Genet A. 2010
ноябрь; 152A(11):2703-10. doi: 10.1002/ajmg.a.33664. Цитирование в PubMed или бесплатная статья в PubMed Central - Новелли Г., Мухир А., Санджуоло Ф., Хелблинг-Леклерк А., Д’Апис М.Р., Массарт К., Капон Ф., Сбрачча П., Федеричи М., Лауро Р., Тудиско К., Паллотта Р., Скарано Г., Dallapiccola B, Merlini L, Bonne G. Мандибулоакральная дисплазия вызвана мутация в кодирующем LMNA ламине A/C. Am J Hum Genet. 2002 г., август; 71 (2): 426-31. дои: 10.1086/341908. Epub 2002, 19 июня. Цитирование в PubMed или бесплатная статья на PubMed Central .
- Симха В., Агарвал А.К., Орал Э.А., Фринс Дж.П., Гарг А. Генетический и фенотипический гетерогенность у пациентов с липодистрофией, связанной с нижнечелюстной дисплазией. J Clin Endocrinol Metab. 2003 г., июнь; 88 (6): 2821-4. doi: 10.1210/jc.2002-021575. Цитата на PubMed
- Worman HJ, Ostlund C, Wang Y.
 Заболевания ядерной оболочки. Холодная весна
Харб Перспект Биол. 2010 Февраль;2(2):a000760. doi: 10.1101/cshperspect.a000760. Цитирование в PubMed или бесплатная статья в PubMed Central
Заболевания ядерной оболочки. Холодная весна
Харб Перспект Биол. 2010 Февраль;2(2):a000760. doi: 10.1101/cshperspect.a000760. Цитирование в PubMed или бесплатная статья в PubMed Central
Нижнечелюстно-акральная дисплазия — NORD (Национальная организация редких заболеваний)
Нижнечелюстно-акральная дисплазия
NORD выражает благодарность Джузеппе Новелли, доктору медицины, кафедра биопатологии и диагностической визуализации, Римский университет, Италия, и Марии Розарии Д’Апиче, доктору медицины, лаборатория медицины Genetics, Римский университет, Италия, за помощь в подготовке этого отчета.
Подразделы нижнечелюстной дисплазии
- MAD типа A (MADA)
- MAD типа B (MADB)
Признаки и симптомы
Причины
Причины тип B вызывается мутациями гена ZMPSTE24. Некоторые люди с мандибулоакральной дисплазией не имеют мутаций ни в одном из генов, что позволяет предположить, что дополнительные, еще не идентифицированные гены также могут вызывать расстройство.

Выявленные мутации, вызывающие мандибулоакральную дисплазию, наследуются по аутосомно-рецессивному типу. Генетические заболевания определяются комбинацией генов того или иного признака, находящихся в хромосомах, полученных от отца и матери. Рецессивные генетические нарушения возникают, когда человек наследует один и тот же аномальный ген одного и того же признака от каждого родителя. Если человек получает один нормальный ген и один ген болезни, он будет носителем болезни, но обычно не будет проявлять симптомов. Риск для двух родителей-носителей передать дефектный ген и, следовательно, родить больного ребенка составляет 25% при каждой беременности. Риск рождения ребенка-носителя, как и родители, составляет 50% при каждой беременности. Вероятность того, что ребенок получит нормальные гены от обоих родителей и будет генетически нормальным по этому конкретному признаку, составляет 25%. Риск одинаков для мужчин и женщин.
Ген LMNA расположен на длинном плече (q) хромосомы 1 (1q21-q22). Он содержит инструкции по созданию (кодированию) белков ламина А и ламина С. Эти белки активны в ядерной пластинке, структуре, обнаруженной во многих типах клеток. Точные функции ламинов А и С и их точная роль в возникновении симптомов мандибулоакральной дисплазии до конца не изучены. Однако исследователи считают, что белок ламин А служит каркасом, удерживающим ядро клетки вместе. Дефектный ламин А, скорее всего, вызывает нестабильность ядра и в конечном итоге приводит к симптомам преждевременного старения, наблюдаемым при мандибулоакральной дисплазии. Исследователи также подозревают, что мутации в гене LMNA в конечном итоге приводят к нарушению дифференцировки жировых клеток (адипоцитов), вызывая липодистрофию, и дифференцировки костных клеток (остеокластов), вызывая изменение метаболизма костной ткани.
Он содержит инструкции по созданию (кодированию) белков ламина А и ламина С. Эти белки активны в ядерной пластинке, структуре, обнаруженной во многих типах клеток. Точные функции ламинов А и С и их точная роль в возникновении симптомов мандибулоакральной дисплазии до конца не изучены. Однако исследователи считают, что белок ламин А служит каркасом, удерживающим ядро клетки вместе. Дефектный ламин А, скорее всего, вызывает нестабильность ядра и в конечном итоге приводит к симптомам преждевременного старения, наблюдаемым при мандибулоакральной дисплазии. Исследователи также подозревают, что мутации в гене LMNA в конечном итоге приводят к нарушению дифференцировки жировых клеток (адипоцитов), вызывая липодистрофию, и дифференцировки костных клеток (остеокластов), вызывая изменение метаболизма костной ткани.
Было показано, что мутации гена LMNA вызывают ряд других нарушений (аллельных нарушений), включая форму семейной частичной липодистрофии (разновидность Даннигана), пару форм мышечной дистрофии Эмери-Дрейфуса, форму поясно-конечностной мышечная дистрофия, форма наследственной спастической параплегии, форма болезни Шарко-Мари-Тута, форма дилатационной кардиомиопатии, синдром Малуфа и некоторые случаи прогерии синдрома Хатчинсона-Гилфорда. В медицинской литературе сообщалось о лицах, чьи симптомы совпадают с этими расстройствами. Некоторые люди с мутациями гена LMNA подвержены большему риску развития сердечно-сосудистых заболеваний, чем население в целом; неизвестно, подвержены ли этому риску люди с мандибулоакральной дисплазией типа А. (Для получения дополнительной информации об этих расстройствах выберите название конкретного расстройства в качестве условия поиска в базе данных редких заболеваний.)
В медицинской литературе сообщалось о лицах, чьи симптомы совпадают с этими расстройствами. Некоторые люди с мутациями гена LMNA подвержены большему риску развития сердечно-сосудистых заболеваний, чем население в целом; неизвестно, подвержены ли этому риску люди с мандибулоакральной дисплазией типа А. (Для получения дополнительной информации об этих расстройствах выберите название конкретного расстройства в качестве условия поиска в базе данных редких заболеваний.)
Ген ZMPSTE24 расположен на коротком плече (p) хромосомы 1 (1p34.2). Он содержит инструкции по созданию (кодированию) фермента, точная роль которого в организме до конца не изучена, но который участвует в созревании ламина А. Исследователи полагают, что этот фермент необходим для превращения преламина А в зрелый ламин А. Мутации гена ZMPSTE24 в конечном итоге приводят к накоплению преламина А в различных тканях организма.
Также было показано, что мутации гена ZMPSTE24 вызывают синдром рестриктивной дермопатии, редкое тяжелое заболевание, характеризующееся задержкой внутриутробного развития, деформациями ключиц, контрактурами суставов, фиксированным выражением лица и натянутой, жесткой кожей, которая легко подвергается эрозии. При синдроме рестриктивной дермопатии почти не определяются уровни фермента, кодируемого геном ZMPSTE24, и заболевание часто приводит к летальному исходу в период новорожденности. Следовательно, некоторые исследователи полагают, что мутации этого гена приводят к спектру заболеваний, при этом синдром рестриктивной дермопатии представляет собой тяжелую форму синдрома, а дисплазия мандибулоакра типа В представляет собой менее тяжелую форму. Исследователи полагают, что количество остаточной активности фермента у людей с мутацией гена ZMPSTE24 напрямую коррелирует с тяжестью заболевания.
При синдроме рестриктивной дермопатии почти не определяются уровни фермента, кодируемого геном ZMPSTE24, и заболевание часто приводит к летальному исходу в период новорожденности. Следовательно, некоторые исследователи полагают, что мутации этого гена приводят к спектру заболеваний, при этом синдром рестриктивной дермопатии представляет собой тяжелую форму синдрома, а дисплазия мандибулоакра типа В представляет собой менее тяжелую форму. Исследователи полагают, что количество остаточной активности фермента у людей с мутацией гена ZMPSTE24 напрямую коррелирует с тяжестью заболевания.
Затронутые группы населения
В медицинской литературе описано приблизительно 40 случаев мандибулоакральной дисплазии. В медицинской литературе описано менее 10 случаев мандибулоакральной дисплазии типа В. Многие случаи расстройства, скорее всего, неправильно диагностируются или не диагностируются, что затрудняет определение истинной частоты нижнечелюстной дисплазии среди населения в целом.
Диагностика
Диагноз нижнечелюстно-акральной дисплазии основывается на выявлении характерных симптомов, подробном анамнезе пациента, тщательном клиническом обследовании и ряде специализированных тестов.
Молекулярно-генетическое тестирование в некоторых случаях может подтвердить диагноз мандибулоакральной дисплазии. Молекулярно-генетическое тестирование может обнаружить мутации в определенных генах, вызывающих заболевание, но тест доступен только на клинической основе.
Стандартная терапия
Лечение
Лечение нижнечелюстно-акральной дисплазии направлено на специфические симптомы, которые проявляются у каждого человека. Лечение может потребовать скоординированных усилий группы специалистов. Педиатрам, ортопедам, эндокринологам, дерматологам, диетологам и другим специалистам в области здравоохранения может потребоваться систематическое и всестороннее планирование лечения аффективного ребенка.
Людям с мандибулоакральной дисплазией и членам их семей рекомендуется обратиться за консультацией после постановки диагноза, поскольку диагноз может вызвать тревогу, стресс и сильный психологический стресс. Пострадавшим лицам и их семьям рекомендуется психологическая поддержка и консультирование как на профессиональном уровне, так и через группы поддержки. Генетическое консультирование может быть полезным для пострадавших людей и их семей.
Пострадавшим лицам и их семьям рекомендуется психологическая поддержка и консультирование как на профессиональном уровне, так и через группы поддержки. Генетическое консультирование может быть полезным для пострадавших людей и их семей.
Дополнительные методы лечения лиц с нижнечелюстно-акральной дисплазией являются симптоматическими и поддерживающими и следуют регулярным стандартным рекомендациям. Сахарный диабет лечится стандартными методами. После начала диабета для лечения гипергликемии могут быть рекомендованы гипергликемические препараты, такие как метформин. Инсулин или аналоги инсулина также можно использовать для лечения больных. Клинических испытаний для определения оптимального использования лекарственной терапии для лечения метаболических осложнений у лиц с мандибулоакральной дисплазией не проводилось.
Регулярные физические упражнения и поддержание здорового веса также рекомендуются как способ снижения вероятности развития диабета. Людей с выраженной гипертриглицеридемией можно лечить производными фибриновой кислоты, статинами или полиненасыщенными жирными кислотами n-3.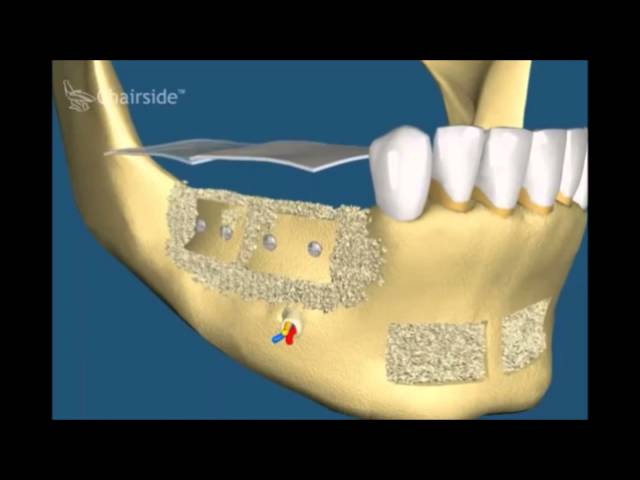
Исследовательская терапия
В настоящее время проводятся исследования по изучению использования лептина для лечения людей с липодистрофией. Лептин — это гормон, содержащийся в жировых клетках (адипоцитах). Тяжелая липодистрофия связана с дефицитом лептина. Первоначальные исследования показали, что заместительная терапия лептином (метрелептин) эффективна в некоторых случаях у лиц с определенными формами липодистрофии с низким уровнем лептина. Тем не менее, метрелептин не изучался для лечения мандибулоакральной дисплазии. В настоящее время доступность лептина ограничена клиническими испытаниями и еще не одобрена Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA).
Некоторые исследователи предположили, что лечение препаратом, известным как ингибитор фарнезилтрансферазы (ИФТ), используемым отдельно или в сочетании с другими препаратами, включая статины и бисфосфонаты, может быть эффективным методом лечения мандибулоакральной дисплазии. Препарат FTI, известный как лонафарниб, изучался у людей с синдромом Хатчинсона-Гилфорда прогерия в течение как минимум 2 лет. У девяти пациентов наблюдалось увеличение веса на 50 %, у шести — снижение на 50 %, а у 10 пациентов скорость прибавления в весе оставалась стабильной. Вторичные исходы включали снижение скорости артериальной пульсовой волны и эхоплотности сонных артерий, а также повышение скелетной ригидности и сенсоневрального слуха в подгруппах пациентов. Все пациенты улучшили один или несколько из этих исходов. Результаты этого клинического испытания лечения детей с HGPS предоставляют предварительные доказательства того, что лонафарниб может улучшить жесткость сосудов, структуру кости и аудиологический статус. Протокол был разработан для лечения четырех пациентов с MADA с использованием комбинации правастатина (статин) и золедроновой кислоты (бисфосфонат азота), двух препаратов, способных блокировать продукцию фарнезильной группы. Первые результаты показали хороший профиль безопасности и переносимости лечения, связанный с улучшением фенотипа MADA.
Препарат FTI, известный как лонафарниб, изучался у людей с синдромом Хатчинсона-Гилфорда прогерия в течение как минимум 2 лет. У девяти пациентов наблюдалось увеличение веса на 50 %, у шести — снижение на 50 %, а у 10 пациентов скорость прибавления в весе оставалась стабильной. Вторичные исходы включали снижение скорости артериальной пульсовой волны и эхоплотности сонных артерий, а также повышение скелетной ригидности и сенсоневрального слуха в подгруппах пациентов. Все пациенты улучшили один или несколько из этих исходов. Результаты этого клинического испытания лечения детей с HGPS предоставляют предварительные доказательства того, что лонафарниб может улучшить жесткость сосудов, структуру кости и аудиологический статус. Протокол был разработан для лечения четырех пациентов с MADA с использованием комбинации правастатина (статин) и золедроновой кислоты (бисфосфонат азота), двух препаратов, способных блокировать продукцию фарнезильной группы. Первые результаты показали хороший профиль безопасности и переносимости лечения, связанный с улучшением фенотипа MADA. Однако необходимы дополнительные исследования, чтобы определить долгосрочную безопасность и эффективность этой потенциальной терапии.
Однако необходимы дополнительные исследования, чтобы определить долгосрочную безопасность и эффективность этой потенциальной терапии.
Информация о текущих клинических испытаниях для пациентов с HGPS размещена в Интернете на сайте www.clinicaltrials.gov.
Все исследования, финансируемые правительством США, а некоторые из них поддерживаются частным сектором, публикуются на этом правительственном веб-сайте. Протокол MADA был одобрен AIFA, итальянским компетентным органом по лекарственным средствам.
Для получения информации о клинических испытаниях, проводимых в Клиническом центре NIH в Бетесде, штат Мэриленд, обращайтесь в отдел набора пациентов NIH:
Бесплатный звонок: (800) 411-1222
Телетайп: (866) 411-1010
Эл. www.centerwatch.com
Для получения информации о клинических испытаниях MADA, проводимых в Поликлинике Тор Вергата, Рим, Италия, обращайтесь к проф. Джузеппе Новелли, тел. +39/06/204/665, факс +39/06/209 или проф. Паоло Сбрачча Тел. +39/06/72596888, факс +39/06/72596890.
Паоло Сбрачча Тел. +39/06/72596888, факс +39/06/72596890.
Ссылки
СТАТЬИ В ЖУРНАЛАХ
Camozzi D, D’Apice MR, Schena E, et al. Измененная организация хроматина и локализация SUN2 при мандибулоакральной дисплазии устраняются медикаментозным лечением. Гистохим клеточной биологии. 2012;138:643-651. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3432780/
Novelli G, D’Apice MR. Фарнезилирование белков и болезни. J Наследовать Metab Dis. 2012;35:917-926. http://www.ncbi.nlm.nih.gov/pubmed/22307208
Gordon LB, Kleinman ME, Miller DT, et al. Клинические испытания ингибитора фарнезилтрансферазы у детей с синдромом Хатчинсона-Гилфорда прогерия. Proc Natl Acad Sci USA. 2012;109: 16666-71. http://www.ncbi.nlm.nih.gov/pmc/articles/23012407
Ben Yaou R, Navarro C, Quijano-Roy S, et al. Нижнечелюстно-акральная дисплазия типа B с врожденной миопатией из-за гомозиготной миссенс-мутации ZMPSTE24. Eur J Hum Genet. 2011;19:647-654. http://www.ncbi.nlm.nih.gov/pubmed/21267004
Гарг А. Клинический обзор: липодистрофии: генетические и приобретенные нарушения жировых отложений. J Clin Endocrinol Metab. 2011;96:3313-3325. http://www.ncbi.nlm.nih.gov/pubmed/21865368
Клинический обзор: липодистрофии: генетические и приобретенные нарушения жировых отложений. J Clin Endocrinol Metab. 2011;96:3313-3325. http://www.ncbi.nlm.nih.gov/pubmed/21865368
Shastry S, Simha V, Godbole K, et al. Новый синдром гипоплазии нижней челюсти, глухоты и прогероидных признаков, связанных с липодистрофией, неопущением яичек и мужским гипогонадизмом. J Clin Endocrinol Metab. 2010;95:Е192-197. http://www.ncbi.nlm.nih.gov/pubmed/20631028
Ahmad Z, Zackai E, Medne L, Garg A. Раннее начало нижнечелюстной дисплазии из-за сложных гетерозиготных мутаций в ZMPSTE24. Am J Med Genet A. 2010;152A:2703-2710. http://www.ncbi.nlm.nih.gov/pubmed/20814950
Cunningham VJ, D’Apice MR, Licata N, et al. Скелетный фенотип нижнечелюстной дисплазии, связанный с мутациями в ZMPSTE24. Кость. 2010;47:591-597.
http://www.ncbi.nlm.nih.gov/pubmed/20550970Garavelli L, D’Apice MR, Rivieri F, et al. мандибулоакральная дисплазия типа А в детском возрасте. Am J Med Genet A. 2009;149А:2258-2264. http://www.ncbi.nlm.nih.gov/pubmed/19764019
2009;149А:2258-2264. http://www.ncbi.nlm.nih.gov/pubmed/19764019
Garg A, Subramanyam L, Agarwal AK, et al. Атипичный прогероидный синдром, обусловленный гетерозиготными миссенс-мутациями LMNA. J Clin Endocrinol Metab. 2009;94:4971-4983. http://www.ncbi.nlm.nih.gov/pubmed/19875478
Агарвал А.К., Казачкова И., Тен С., Гарг А. Тяжелая нижнечелюстно-акральная дисплазия, липодистрофия и прогерия у молодой девушки с новой гомозиготной мутацией Arg527Cys LMNA . J Clin Endocrinol Metab. 2008;93:4617-4623. http://www.ncbi.nlm.nih.gov/pubmed/18796515
Агарвал А.К., Чжоу XJ, Холл Р.К. и др. Фокальный сегментарный гломерулосклероз у пациентов с мандибулоакральной дисплазией вследствие дефицита ZMPSTE24. J Исследовательская Мед. 2006;54:208-213. http://www.ncbi.nlm.nih.gov/pubmed/17152860
Shackleton S, Smallwood DT, Clayton P, et al. Сложные гетерозиготные мутации ZMPSTE24 снижают процессинг преламина А и приводят к тяжелому прогероидному фенотипу. J Med Genet. 2005;42:e36. http://www.ncbi.nlm.nih.gov/pubmed/15937076
http://www.ncbi.nlm.nih.gov/pubmed/15937076
Agarwal AK, Fryns JP, Auchus RJ, Garg A. Цинковая металлопротеиназа ZMPSTE24 мутирует при мандибулоакральной дисплазии. Хум Мол Жене. 2003;12:1995-2001. http://www.ncbi.nlm.nih.gov/pubmed/12913070
Simha V, Agarwal AK, Oral EA, Fryns JP, Garg A. Генетическая и фенотипическая гетерогенность у пациентов с липодистрофией, связанной с дисплазией нижней челюсти. J Clin Endocrinol Metab. 2003;88:2821-2824. http://www.ncbi.nlm.nih.gov/pubmed/12788894
Novelli G, D’Apice MR Странный случай «комковатого» гена ламина A/C и преждевременного старения человека. Тренды Мол Мед. 2003;9:370-375. http://www.ncbi.nlm.nih.gov/pubmed/13129702
Новелли Г., Мухир А., Санджуоло Ф. и др. Нижнечелюстно-акральная дисплазия вызывается мутацией в кодирующем LMNA ламине A/C. Am J Hum Genet. 2002;71:426-431. http://www.ncbi.nlm.nih.gov/pubmed/12075506
INTERNET
McKusick VA., изд. Онлайн менделевское наследование у человека (OMIM). Балтимор. Доктор медицины: Университет Джона Хопкинса; Запись №: 608612; Последнее обновление: 22.02.2012. Режим доступа: http://omim.org/entry/608612 Дата обращения: 5 октября 2012 г.
Балтимор. Доктор медицины: Университет Джона Хопкинса; Запись №: 608612; Последнее обновление: 22.02.2012. Режим доступа: http://omim.org/entry/608612 Дата обращения: 5 октября 2012 г.
МакКусик В.А., изд. Онлайн менделевское наследование у человека (OMIM). Балтимор. Доктор медицины: Университет Джона Хопкинса; Запись №: 248370; Последнее обновление: 22.02.2012. Доступно по адресу: http://omim.org/entry/248370 Дата обращения: 5 октября 2012 г.
МЦ Вантыгем. Мандибулоакральная дисплазия. Энциклопедия Orphanet, октябрь 2006 г. Доступно по адресу: http://www.orpha.net Дата обращения: 5 октября 2012 г.
Липодистрофия. Юго-западный медицинский центр Техасского университета. Отдел питания и метаболических заболеваний. Доступно на: http://www.utsouthwestern.edu/media/files/2400/Familial-Partial-Mandibuloacral.pdf Дата обращения: 5 октября 2012 г.
Годы публикации
2013
Информация в базе данных NORD по редким заболеваниям предназначена только для образовательных целей и не предназначена для замены консультации врача или другого квалифицированного медицинского работника.

 В структуре преобладают органические компоненты.
В структуре преобладают органические компоненты.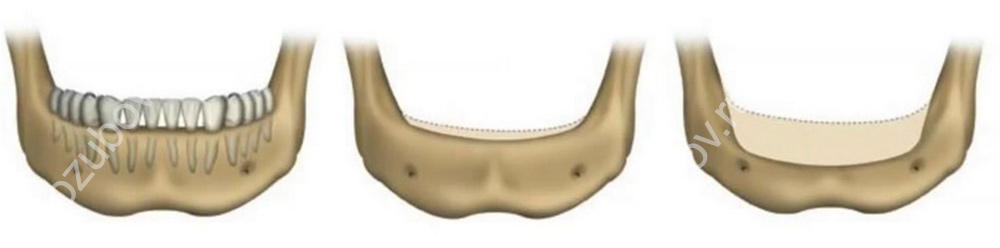
 В зависимости от того, где расположен дефект, «укорачивается» верхняя или нижняя челюсть, западают губы, вокруг них формируются морщины. Лицо приобретает характерный «старческий» вид.
В зависимости от того, где расположен дефект, «укорачивается» верхняя или нижняя челюсть, западают губы, вокруг них формируются морщины. Лицо приобретает характерный «старческий» вид.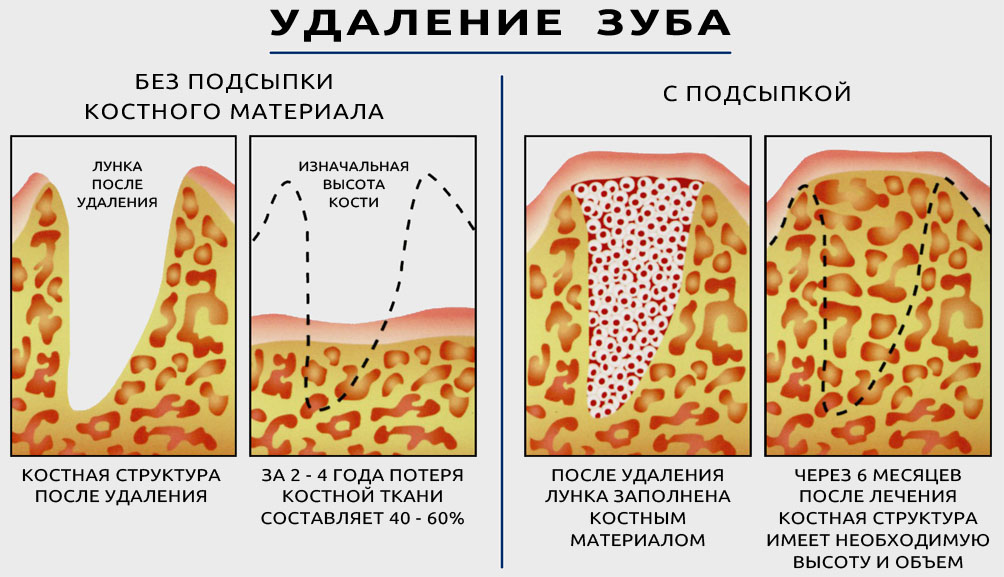 Раннее начало нижнечелюстно-акральной дисплазии из-за
к сложным гетерозиготным мутациям в ZMPSTE24. Am J Med Genet A. 2010
ноябрь; 152A(11):2703-10. doi: 10.1002/ajmg.a.33664. Цитирование в PubMed или бесплатная статья в PubMed Central
Раннее начало нижнечелюстно-акральной дисплазии из-за
к сложным гетерозиготным мутациям в ZMPSTE24. Am J Med Genet A. 2010
ноябрь; 152A(11):2703-10. doi: 10.1002/ajmg.a.33664. Цитирование в PubMed или бесплатная статья в PubMed Central Заболевания ядерной оболочки. Холодная весна
Харб Перспект Биол. 2010 Февраль;2(2):a000760. doi: 10.1101/cshperspect.a000760. Цитирование в PubMed или бесплатная статья в PubMed Central
Заболевания ядерной оболочки. Холодная весна
Харб Перспект Биол. 2010 Февраль;2(2):a000760. doi: 10.1101/cshperspect.a000760. Цитирование в PubMed или бесплатная статья в PubMed Central