Флюс как снять опухоль: Флюс, как лечить в домашних условиях. Лечение периостита в Москве — Эстетическая стоматология Deva-Dent в Москве
Как снять отек после имплантации зубов
Почему возникает отек после имплантации зубов
В целом отек – это совершенно нормальная реакция организма на полученные травмы. Все это не что иное, как приток лимфы к поврежденным тканям (т.е. скопление жидкости в определенной области). Таким образом происходит активации естественных защитных сил организма. Отек формируется в течение 2-3 дней – именно на третьи сутки после операции он достигает своего пика. После этого отечность тканей должна постепенно сокращаться и в течение недели полностью сойти.
При установке классических двусоставных имплантов, когда используется лоскутный метод с отслаиванием десны, вероятность отека тканей гораздо выше. В группе риска также пациенты с патологиями сердечно-сосудистой системы, сахарным диабетом.
Как отличить норму от патологии
С одной стороны, отечность тканей – это нормальное последствие организма, с другой стороны, этот симптом может стать проявлением воспалительного процесса, который требует оперативной терапии.
Если отек не имеет положительной динамики, то есть не уменьшается через 3-4 дня после установки имплантатов, если присоединяются такие симптомы, как покраснение десны, монотонная или боль при надавливании, повышение температуры тела, гной, который выделяется из области вокруг имплантата – все это говорит о серьезном воспалительном процессе, т.е. периимплантите. И, скорее всего, отторжении имплантата. При появлении подобных явлений нужно немедленно обратиться к врачу.
Насторожить также должна ситуация, когда отек уже спал, но снова появился спустя некоторое время. Подобная ситуация опять же требует немедленной консультации специалиста.
За каждым пациентом клиники Smile-at-Once закреплен индивидуальный менеджер, к которому в случае сомнений вы можете обратиться за консультацией. Вас свяжут с врачом в телефонном режиме или назначат время для очного приема.
Как уменьшить отеки после имплантации
Главное, что вам нужно сделать после имплантации – хорошо отдохнуть и настроиться на то, что исход будет благоприятным. Ваш врач провел операцию удачно, поэтому теперь то, как пройдет период реабилитации, зависит только от вас. Прочитайте нашу полезную памятку после имплантации зубов, в которой подробно расписано, что нужно приготовить дома заранее и как решать возникающие проблемы.
Ваш врач провел операцию удачно, поэтому теперь то, как пройдет период реабилитации, зависит только от вас. Прочитайте нашу полезную памятку после имплантации зубов, в которой подробно расписано, что нужно приготовить дома заранее и как решать возникающие проблемы.
Как проводить компрессы? Это самый основной метод, который позволяет снять отечность тканей. Особенно эффективен в первые сутки и даже в первые часы после установки имплантатов.
Проводить следующим образом: использовать лед, грелку с ледяной водой или любые продукты из морозильной камеры. Но не переусердствовать, т.е. не вызвать отморожение и некроз тканей. Порядок действий следующий: обернуть лед в полотенце или в 2-3 слоя марли/тонкой ткани, приложить к щеке со стороны оперативного вмешательства, удерживать по 5-10 минут. Продолжительность компресса – 5-10 минут, перерывы – 3-5 минут. Количество подходов – 7-10 раз, примерно в течение 1,5-2 часов. Такие курсы можно периодически повторять в течение первых суток.
Как правильно питаться, чтобы не было отеков? Из рациона помимо твердой пищи (при любых протоколах имплантации, даже если протез вам был установлен сразу) необходимо исключить чрезмерно горячие, острые и соленые блюда, кофе, пряности. Кофеин, к примеру, повышает артериальное давление, что способствует еще большему приливу крови к голове и, соответственно, усилению отечности тканей.
Горячие продукты и напитки под запретом, поскольку они могут привести к усилению отеков. Твердые – потому что могут травмировать оперированную область и сместить установленные имплантаты. Все перечисленные ограничения действуют в течение недели.
Андрей Николаевич, 45 лет
«Операция для меня прошла быстро, под наркозом. В полном сознании и без особенной боли поехал домой. Ожидал, что когда отойдет наркоз, боль будет невыносимой, сильные отеки… Обложившись рекомендованными таблетками, стал ждать, пока делал компрессы. Таблетки были куплены напрасно. Ночью спал как обычно. Утром тоже ничего особенного не испытывал, отеков почти не было. Вечером первого же дня приехал на первую примерку. На третий день поставили протез – все прошло отлично!»
Утром тоже ничего особенного не испытывал, отеков почти не было. Вечером первого же дня приехал на первую примерку. На третий день поставили протез – все прошло отлично!»
«Если врач – профессионал, то реабилитация пройдет очень быстро, без боли и без отеков. Проверено на себе!»
смотреть видео с пациентом
Как нужно спать после проведения имплантации? Необходимо обеспечить отток крови от головы, спать лучше с приподнятой головой. Можно подложить несколько подушек под или на матрас, увеличив таким образом угол наклона. Многие пациенты отмечают, что после операции есть ощущение пульсации в голове. Подобная мера также снимет такой симптом.
Можно ли посещать бассейны, сауны? Чтобы снять отечность, нужен холод. Поэтому под запретом не только сауны и бассейны в первую неделю после установки имплантатов, но также длительное пребывание в горячей ванне. Лучше ограничиться теплым душем.
Какие препараты помогут от отеков тканей? После установки имплантатов пациенту назначается медикаментозная терапия. Мы намеренно не указываем названия лекарственных средств, потому что в каждом конкретном случае медикаменты назначаются индивидуально. Но в составе комплекса обязательно присутствуют противовоспалительные и антигистаминные препараты, которые способствуют уменьшению отечности тканей. Пациентам, у которых есть проблемы с сердцем и сосудами, повышено давление, также рекомендуется принимать соответствующие лекарственные средства.
Мы намеренно не указываем названия лекарственных средств, потому что в каждом конкретном случае медикаменты назначаются индивидуально. Но в составе комплекса обязательно присутствуют противовоспалительные и антигистаминные препараты, которые способствуют уменьшению отечности тканей. Пациентам, у которых есть проблемы с сердцем и сосудами, повышено давление, также рекомендуется принимать соответствующие лекарственные средства.
На 3-ий день после имплантации пациенту назначается профилактический осмотр: врач оценит состояние тканей, динамику заживления и даст необходимые рекомендации. Если же у вас появляются сомнения раньше – не стоит дожидаться планового визита, можно обратиться к врачу и раньше.
Почему возникает онемение после имплантации зубов
Первые часы после имплантации зубов продолжает активно действовать анестезия, особенно если речь шла об установке сразу нескольких имплантатов. Как правило, используется проводниковый метод, который обеспечивает блокировку нервных окончаний на время до 5-6 часов. Но сама процедура вживления имплантов занимает не более 2-3 часов, поэтому после нее онемение действительно может сохраняться: у некоторых пациентов – в течение пары часов, у других – до 5-6 часов. В обоих случаях – это норма, а длительность действия анестезии зависит от состояния организма.
Но сама процедура вживления имплантов занимает не более 2-3 часов, поэтому после нее онемение действительно может сохраняться: у некоторых пациентов – в течение пары часов, у других – до 5-6 часов. В обоих случаях – это норма, а длительность действия анестезии зависит от состояния организма.
Незначительное онемение тканей лица может сохраняться на протяжении 2-3 суток – оно неразрывно связано с отечностью. Но если чувствительность не восстанавливается, необходимо обратиться к врачу. Причинами такого состояния может стать повреждение лицевого или челюстного нерва: чем раньше начать лечение, тем выше шанс полностью восстановить чувствительность тканей.
Читайте подробнее о том, что такое невралгия лицевого нерва как осложнение после имплантации зубов >>>
Отек и онемение – естественная реакция организма на «вторжение» инородного тела, то есть импланта. Возьмите на работе мини-отпуск на 3-4 дня, постарайтесь вести более размеренный ритм жизни, откажитесь от командировок и важных деловых встреч – дайте организму отдых, ведь ему нужны силы для восстановления. Если вы хотите свести риски любых последствий и осложнений к нулю, постарайтесь внимательно подойти к вопросу имплантации зубов, доверяйте своему врачу и следуйте всем его рекомендациям.
Если вы хотите свести риски любых последствий и осложнений к нулю, постарайтесь внимательно подойти к вопросу имплантации зубов, доверяйте своему врачу и следуйте всем его рекомендациям.
Лечение и профилактика флюса в ТОП1 стоматологии Москвы
+7 (495) 150-81-00
Запись на консультацию
Содержание:
1. Флюс или все-таки периостит?
2. Почему развивается флюс?
3. Какие симптомы у флюса?
4. Как лечить флюс?
5. Что вообще нельзя делать при флюсе?
То, что принято называть флюсом, в современной медицинской терминологии обозначается как одонтогенный периостит. Однако в связи с тем, что у пациентов определение «флюс» очень распространено, будем его придерживаться.
Флюс – это острый воспалительный процесс в соединительной ткани, окружающей зуб (надкостнице), который внешне проявляется как разбухание десны с образованием заметной припухлости на щеке. Другими симптомами флюса являются тупые ноющие боли в области больного зуба, покраснение десны и повышение температуры тела (до 38 градусов).
Другими симптомами флюса являются тупые ноющие боли в области больного зуба, покраснение десны и повышение температуры тела (до 38 градусов).
Боль при флюсе может усиливаться при механическом давлении на больной зуб и отдавать в область уха, виска или подбородка в зависимости от локализации флюса.
Причины развития флюса
Основные причины появления флюса – запущенный кариес, киста зуба, воспаление десневого кармана и механическая травма. Во всех перечисленных случаях начинают размягчаться ткани, и инфекция проникает все глубже, поражая зубные нервы (пульпу).
При запущенном кариесе развивается острый пульпит, сопровождаемый сильной болью. По истечении времени живые ткани зуба начинают отмирать, и боль постепенно затихает, но инфекция продолжает распространяться и проникать в ткани, окружающие зуб.
Когда поражается область надкостницы и окружающие мягкие ткани, боль приобретает ноющий характер, а на десне и щеке появляется выраженная припухлость.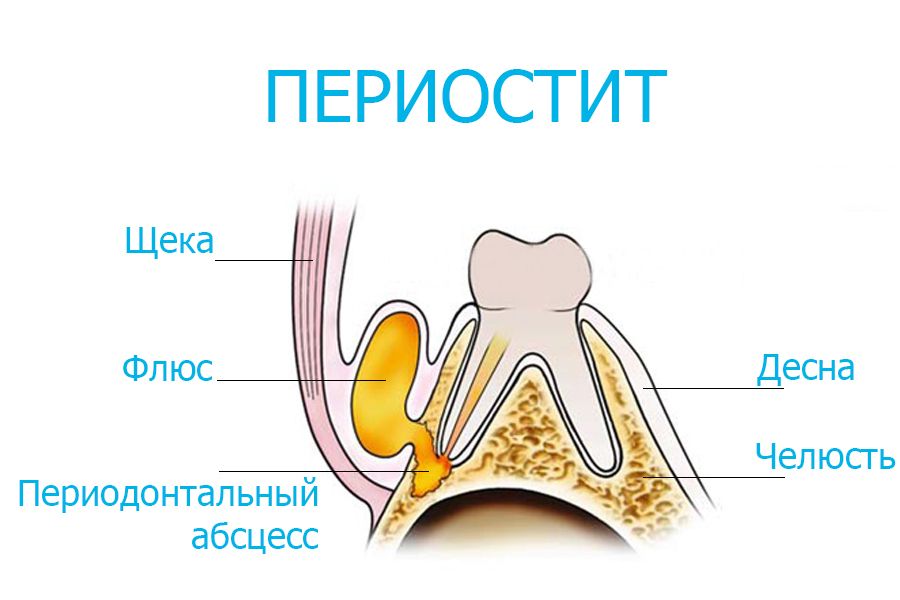 На этой стадии уже диагностируется флюс, который свидетельствует о наличии гнойного процесса.
На этой стадии уже диагностируется флюс, который свидетельствует о наличии гнойного процесса.
Если флюс образуется на верхней челюсти, то опухоль локализуется в подглазничной области или над верхней губой, а если поражается зуб нижней челюсти, то опухает щека, область подбородка и локальные лимфоузлы.
Спровоцировать флюс могут простудные заболевания, стрессы, переохлаждения и другие неблагоприятные факторы. В некоторых случаях гнойник самопроизвольно вскрывается, и гной выходит через десну, но сам воспалительный процесс продолжает развиваться.
Иногда флюс, точнее небольшая припухлость щеки, может образоваться после удаления проблемного зуба. Это не воспаление, а реакция организма на травму, поэтому припухлость обычно проходит через 3-4 дня. Однако если флюс развивается на фоне внезапно возникших болей и общего недомогания, то нужно незамедлительно обращаться к врачу. Флюс можете перейти в абсцесс, который, в свою очередь, вызывает очень серьезные осложнения (флегмону).
При ослабленном иммунитете риск осложнений возрастает многократно, поэтому откладывать лечение нельзя!
Симптомы флюса
Флюсом называют воспалительный процесс в надкостнице, который сопровождается заметным распуханием десны и щеки. Если при этом вы замечаете у себя повышенную температуру, резкую боль в области беспокоящего зуба и увеличение лимфоузлов, будьте уверены – это флюс. Когда вы дотрагиваетесь до зуба, боль может чувствоваться в области уха, виска или всей половины лица.
Образование флюса может спровоцировать стресс, простуда, недолеченный пульпит или кариес, а также попавшая в организм инфекция. Если болезненные ощущения сопровождают вас в течение дня и припухлость не спадает, это может указывать на наличие гноя внутри полости зуба. В этом случае медлить уже нельзя и надо срочно обращаться к специалисту, иначе заболевание может перейти в стадию абцесса, что грозит образованием флегмоны (гнойное воспаление).
Важное замечание: ни в коем случае не пытайтесь вскрывать гнойник самостоятельно!! Это может привести к заражению крови и самым тяжелым последствиям.
Заметили у себя симптомы флюса?
Не затягивайте! Пройдите качественную диагностику!
Лечение флюса
Лечение флюса проводится в несколько этапов. Антибиотики, противовоспалительные полоскания и щадящая диета – используются на первом этапе.
Если эти меры не помогли, то потребуется оперативное вмешательство. Хирург под местным обезболиванием вскроет гнойник и установит дренаж для оттока жидкости. Уже через несколько часов Вы почувствуете себя гораздо лучше – припухлость уйдет, боль утихнет и вы, наконец, сможете спокойно поспать.
Помните, никаких горячих компрессов и самолечения. Незамедлительный визит к врачу – это гарантия быстрого и успешного выздоровления.
На начальном этапе возможно консервативное лечение с помощью антибиотиков и других противовоспалительных препаратов.
При активизации гнойного процесса лечение флюса уже требует хирургического вмешательства. В этих случаях под местной анестезией вскрывается гнойник и предпринимается ряд мер по антисептическому лечению пораженной зоны. После разреза в течение первых 12-14 часов должно наступить облегчение основных симптомов. Для обеспечения оттока гноя в разрезанном участке на некоторое время оставляется дренаж и параллельно назначаются противовоспалительные и обезболивающие препараты. Если после предпринятых мер воспалительный процесс не прекращается, то уже диагностируется абсцесс, который гораздо сложнее поддается лечению.
При успешном лечении флюса через несколько дней боль полностью проходит, припухлость спадает, а разрез после удаления дренажа начинает заживать. Стоматологи предостерегают пациентов от любых попыток самолечения!
Что нельзя делать при флюсе
При образовании флюса нельзя ставить никаких согревающих компрессов, так как это активизирует гнойный процесс. Не следует принимать антибиотики, не посоветовавшись с врачом, и испытывать на себе народные средства лечения флюса.
Не следует принимать антибиотики, не посоветовавшись с врачом, и испытывать на себе народные средства лечения флюса.
Понравился материал? Поделись с друзьями!
Статьи по теме
Когда применяется местная анестезия в стоматологии, а когда — седация. Их плюсы и минусы.
Когда применяется местная анестезия в стоматологии, а когда — седация. Давайте подробно рассмотрим все их плюсы и минусы.
20 Октября 2020 Читать
Особенности лечения зубов у веганов и вегетарианцев
Вегану, как и любому человеку на Земле, необходимо питание, и в процессе питания-жевания он задействует зубы. А это значит, что проблема профилактики стоматологических заболеваний в среде веганов также существует и актуальна.
А это значит, что проблема профилактики стоматологических заболеваний в среде веганов также существует и актуальна.
21 Февраля 2020 Читать
Что можно, а что — нельзя после удаления зуба мудрости
Может ли подняться температура после удаления зуба мудрости? Какие лекарства нужно пить после удаления зуба мудрости? Нужно ли чистить зубы после удаления зуба мудрости? Можно ли полоскать рот в период после удаления зуба мудрости? Ответы и видео — в этой статье2 Декабря 2019 Читать
Восстановление зуба после перелечивания каналов
Когда и в каких случаях может понадобиться перелечивание каналов? И как происходит восстановление зуба после перелечивания зуба. Какие гарантии, что зуб снова не воспалится? На вопросы отвечает Михайлова Елена Владимировна, врач высшей категории, стоматолог-терапевт НИЦ
Какие гарантии, что зуб снова не воспалится? На вопросы отвечает Михайлова Елена Владимировна, врач высшей категории, стоматолог-терапевт НИЦ 20 Сентября 2019 Читать
Как происходит перелечивание каналов зуба
Диагностика состояния каналов корня зуба, снятие старых реставраций, повторная чистка корневых каналов, дезинфекция, лечение под микроскопом — это часть сложной работы по перелечиванию каналов зуба. Рассказывает стоматолог-терапевт НИЦ, врач высшей категории Михайлова Елена Владимировна.17 Сентября 2019 Читать
Вопросы-ответы по теме
Не удалили часть зуба мудрости
Здравствуйте. Подскажите, удаляли зуб мудрости сегодня, до конца не удалили, кусок остался, врач сказал через год все затянется, придёшь — доудалим, такое возможно?
Подскажите, удаляли зуб мудрости сегодня, до конца не удалили, кусок остался, врач сказал через год все затянется, придёшь — доудалим, такое возможно?Ольга
Читать
Сколько держится фибриновый налет после удаления зуба?
Здравствуйте, уважаемые доктора клиники! Подскажите пожалуйста, сколько фибриновая бляшка должна сохраняться? После моего первого удаления зуба мудрости мне скорее всего наложили около 3 швов, на 3 день там была видна бляшка и швы ослабли, на осмотре врач убрал те швы, которые ослабли и оставил 1 крепкий, сейчас прошла неделя и края совершенно не срастаются, и эта бляшка там очень хорошо видна и балансирует внутри раны, я совершенно не понимаю это норма или мне надо менять врача, потому что мой кроме стандартных рекомендаций и указания прийти снять швы не объяснил как проходит заживление, по крайней мере что есть норма, помогите пожалуйста!Яна
Читать
Под коронкой заболел зуб.
 Лечить или удалять? Здравствуйте! Заболел зуб под коронкой, которой уже больше 5 лет. Стоматолог сделал снимок и назначил антибиотик ципролет. 3 дня пропил. Опухла немного щека. Подскажите что мне делать? Удалять зуб?
Лечить или удалять? Здравствуйте! Заболел зуб под коронкой, которой уже больше 5 лет. Стоматолог сделал снимок и назначил антибиотик ципролет. 3 дня пропил. Опухла немного щека. Подскажите что мне делать? Удалять зуб?Андрей
Читать
У супруга опухла щека и болит зуб под коронкой
Здравствуйте, доктор! У меня вопрос по поводу моего мужа — год назад поставил несколько коронок на нижней челюсти, а буквально 3 дня назад стал чувствовать боль, а вчера вечером стала опухать щека. Пока принимает болеутоляющие, но я понимаю, что видимо нам надо посетить нашего ортопеда, кто ставил ему коронки? Или я неправа?Снежана
Читать
Опухла и болит десна после установки коронки
Доброе утро. Не подскажете, с чем может быть связана возникшая после установки коронки опухоль десны и боли при надкусывании?
Не подскажете, с чем может быть связана возникшая после установки коронки опухоль десны и боли при надкусывании?Ирина Викторовна С.
Читать
Заметили у себя симптомы флюса?
Клиники Немецкого Имплантологического Центра являются одними из лучших клиник по лечению и имплантации зубов в Москве и в России. Мы уверенно занимаем ПЕРВОЕ место в рейтинге частных стоматологических клиник с 2016 года.
Высочайший уровень сервиса, самые передовые технологии диагностики, включая лучшую компьютерную томографию Planmeca ProMax 3D Max в лечебной практике гарантируют вам оптимальное индивидуальное решение проблемы лечения флюса.
Обращайтесь, будем рады Вам помочь! Нажмите кнопку «Пройдите качественную диагностику!», заполните контактные данные, и наши менеджеры свяжутся с вами, чтобы обсудить удобное для вас время приема.
Не затягивайте! Пройдите качественную диагностику!
К списку
Оставить заявку на диагностику флюса
Телефон *
Поля отмеченные * являются обязательными для заполнения
Нажимая «отправить», Вы выражаете согласие с политикой
обработки персональных данных.
Стоматология
России №1
+7 (495) 960-93-03
хирургическая и консервативная терапия — клиника «Добробут»
Главная
Медицинская библиотека Добробут
Дата публикации: 2020-03-24
Как быстро снять опухоль при флюсе
Флюс (острый гнойный периостит челюсти) – поддесневой либо поднадкостничный гнойник, являющийся следствием воспаления в области верхушки корня зуба. Когда щека опухает, сразу возникает вопрос: флюс зуба – что делать? Ответ прост – немедленно обратиться к врачу. Периостит чаще всего является осложнением заболеваний зубов и тканей периодонта.
В зависимости от этиологии различают такие типы периостита:
- Воспалительный. Является следствием прогрессирующего воспалительного процесса, локализованного в периодонте.
- Токсический. Возникает при попадании инфекционного агента в мягкие ткани челюсти с кровотоком при общих заболеваниях организма.

- Травматический. Возбудитель проникает в ткани при травме челюсти.
- Специфический. Может появиться при туберкулезе, сифилисе и других заболеваниях.
Гораздо реже встречаются аллергический и ревматический периоститы.
Как лечить флюс на десне
Наиболее распространенными являются два типа периостита: острый гнойный и хронический. В первом случае обычно обнаруживают смешанную микрофлору (стафилококки, стрептококки, другие грамотрицательные и грамположительные бактерии).
О том, как лечить флюс на десне и какие манипуляции необходимо выполнить, расскажет стоматолог во время приема. Тактика лечения зависит от клинической картины и причины, вызвавшей развитие острого периостита. Воспаление может появиться при нагноении радикулярных кист, затрудненном прорезывании зубов, заболеваниях пародонта. Случается, что флюс возникает после консервативного лечения или травматичного удаления зуба. Поэтому решение задачи, как вылечить флюс у взрослого, зависит от причины развития гнойного периостита.
Лечение периостита проводят комплексно: вскрытие гнойника, медикаментозная и физиотерапия. Как быстро снять опухоль при флюсе? При остром периостите челюсти необходимо срочное вскрытие гнойного поднадкостничного очага и создание условий для оттока выпота. Операцию проводят под местной проводниковой или инфильтрационной анестезией.
В начальной стадии острого серозного периостита челюсти вскрывают полость зуба, вычищают распавшиеся ткани из каналов, создавая условия для оттока экссудата, либо удаляют зуб, являющийся источником инфекции. Эти манипуляции вместе с лекарственной терапией, как правило, способствуют стиханию воспалительного процесса и снятию отека. Лечение зубного флюса у ребенка проводят по той же схеме. Если зуб, являющийся источником инфекции и развития острого периостита, молочный, то его удаляют. Подробнее о том, как избавиться от симптомов флюса при прорезывании зубов, читайте на нашем сайте Добробут.ком.
Отек и боль после удаления зуба: что делать
Удаление зубов преимущественно проходит без осложнений. Однако возможно появление отека после сложного удаления зуба. Если отечность небольшая, пациент не жалуется на боль и температура тела нормальная, то беспокоиться не стоит. Отек может быть вызван травматичной операцией, он обычно спадает в течение суток.
Однако возможно появление отека после сложного удаления зуба. Если отечность небольшая, пациент не жалуется на боль и температура тела нормальная, то беспокоиться не стоит. Отек может быть вызван травматичной операцией, он обычно спадает в течение суток.
Если отек и боль после удаления зуба сохраняются дольше, припухлость щеки увеличивается и боль усиливается, следует обратиться к врачу.
Поводом для срочной консультации являются:
- высокая температура тела, озноб;
- боль при глотании, открывании рта;
- отсутствие кровяного сгустка на месте удаленного зуба (так называемая сухая лунка).
Врач выполнит чистку, назначит медикаментозную терапию, расскажет, чем полоскать рот при флюсе. Если в лунке образовался кровяной сгусток и заживление проходит нормально, то никаких полосканий после удаления проводить не следует.
Какие антибиотики при флюсе на щеке назначат именно вам, зависит от чувствительности возбудителя. До получения результатов теста на чувствительность обычно назначают препараты широкого спектра действия, например противомикробные средства из группы фторхинолонов (ципрофлоксацин и другие). Следует учесть, что антибиотикотерапия может остановить прогрессирование флюса лишь на ранних стадиях (до момента появления гноя). Если гнойник сформировался, то его необходимо сначала вскрыть и провести обработку раны. Только после этого врач назначит антибиотики и объяснит схему приема. Обычно в стоматологической практике используют линкомицин, амоксициллин, эритромицин, цефалоспорин, а также противомикробные средства – производные метронидазола. Дополнительно назначают антигистаминные препараты и поливитаминные комплексы.
До получения результатов теста на чувствительность обычно назначают препараты широкого спектра действия, например противомикробные средства из группы фторхинолонов (ципрофлоксацин и другие). Следует учесть, что антибиотикотерапия может остановить прогрессирование флюса лишь на ранних стадиях (до момента появления гноя). Если гнойник сформировался, то его необходимо сначала вскрыть и провести обработку раны. Только после этого врач назначит антибиотики и объяснит схему приема. Обычно в стоматологической практике используют линкомицин, амоксициллин, эритромицин, цефалоспорин, а также противомикробные средства – производные метронидазола. Дополнительно назначают антигистаминные препараты и поливитаминные комплексы.
Связанные услуги:
Ортогнатическая хирургия
Лечение расстройств височно-нижнечелюстных суставов
Хотите получить онлайн разъяснение от врача МС “Добробут”?
Скачивайте наше приложение Google Play и App Store
Наши врачи
Смотреть всех врачей 631
Наши сертификаты
Сертифікат № QIZ 804 468 C1
Сертифікат № QIZ 804 469 C1
Сертифікат № QIZ 804 470 C1
Сертифікат № QIZ 804 471 C1
Смотреть все сертификаты
Заказать обратный звонок
Введите Ваш телефон
Другие статьи
Лечение мозолей и натоптышей. Современные методы терапии
Современные методы терапии
Лечение мозолей и удаление натоптышей. Консервативные и радикальные методы лечения. Избавление от мозолей со стержнем. Современный метод – лазерная терапия.
Дарсонвализация в Киеве
Что такое дарсонвализация, показания, противопоказания к ее выполнению. Что необходимо учитывать при проведении дарсонвализации. Как проводится процедура дарсонвализации
Патогенез, симптомы и лечение синдрома Иценко-Кушинга у человека
Патогенез синдрома Иценко-Кушинга. Общие принципы лечения и профилактики. Симптомы синдрома Иценко-Кушинга у женщин и мужчин
Можно ли вывихнуть челюсть при зевании – информация для пациентов
Основные причины и симптомы вывиха нижней челюсти. Как должен вести себя пациент после вправления вывиха нижней челюсти – рекомендации врача. Диагностика, лечение и профилактика.
Как должен вести себя пациент после вправления вывиха нижней челюсти – рекомендации врача. Диагностика, лечение и профилактика.
Смотреть все статьи
Заказать обратный звонок
Введите Ваш телефон
Термическая абляция опухоли в клиническом использовании
IEEE Pulse. Авторская рукопись; доступно в PMC 2014 10 ноября.
Опубликовано в окончательной редакции как:
IEEE Pulse. 2011 сентябрь-октябрь; 2(5): 28–38.
DOI: 10.1109/MPUL.2011.942603
PMCID: PMC4226271
NIHMSID: NIHMS404432
PMID: 25372967
Информация о плате. Иизовая информация об оба лицензии. разработка и клиническое внедрение. Такие вмешательства все чаще используются для лечения многих видов рака [1]. В настоящее время большинство раковых опухолей диагностируют с помощью компьютерной томографии (КТ), магнитно-резонансной томографии (МРТ) или ультразвукового исследования. После постановки диагноза хирургическое удаление продолжает оставаться предпочтительным методом лечения большинства очаговых опухолей. Однако открытая операция травматична. Часто требуется общая анестезия, несколько дней пребывания в больнице и недели амбулаторного восстановления и реабилитации, прежде чем пациент сможет вернуться к своим обычным повседневным функциям. Для миллионов больных раком каждый год медицинские риски хирургического удаления опухоли не перевешивают потенциальные преимущества. Кроме того, значительные финансовые затраты на операцию вынудили систему здравоохранения найти альтернативные методы лечения, которые были бы менее дорогими, но столь же эффективными. Это не новая проблема: популярный афоризм Гиппократа можно перевести как «те болезни, которые не лечат лекарства, лечит железо; то, что не может вылечить железо, лечит огонь; а те, которые огонь не может излечить, должны считаться совершенно неизлечимыми». Термическая абляция опухоли является расширением этой концепции в современной форме.
После постановки диагноза хирургическое удаление продолжает оставаться предпочтительным методом лечения большинства очаговых опухолей. Однако открытая операция травматична. Часто требуется общая анестезия, несколько дней пребывания в больнице и недели амбулаторного восстановления и реабилитации, прежде чем пациент сможет вернуться к своим обычным повседневным функциям. Для миллионов больных раком каждый год медицинские риски хирургического удаления опухоли не перевешивают потенциальные преимущества. Кроме того, значительные финансовые затраты на операцию вынудили систему здравоохранения найти альтернативные методы лечения, которые были бы менее дорогими, но столь же эффективными. Это не новая проблема: популярный афоризм Гиппократа можно перевести как «те болезни, которые не лечат лекарства, лечит железо; то, что не может вылечить железо, лечит огонь; а те, которые огонь не может излечить, должны считаться совершенно неизлечимыми». Термическая абляция опухоли является расширением этой концепции в современной форме.
Вариант минимально инвазивного лечения рака
Термическая абляция относится к разрушению ткани с помощью экстремальной гипертермии или гипотермии.
Термическая абляция относится к разрушению ткани с помощью экстремальной гипертермии (повышенная температура ткани) или гипотермии (пониженная температура ткани). Изменение температуры концентрируется в фокальной зоне внутри и вокруг опухоли. Общая цель термической абляции опухоли очень похожа на цель хирургии: удалить опухоль и край толщиной 5-10 мм, казалось бы, нормальной ткани. Хирургическое удаление состоит из физического иссечения; во время термической абляции ткань уничтожается на месте, а затем поглощается организмом в течение нескольких месяцев. Как и хирургическое вмешательство, термическую абляцию можно проводить открытым, лапароскопическим или эндоскопическим доступом; однако чаще всего он применяется с использованием чрескожного или неинвазивного доступа (1). Выбор доступа часто зависит от типа опухоли, ее анатомического расположения, предпочтений врача, а также основного состояния здоровья пациента.
Выбор доступа часто зависит от типа опухоли, ее анатомического расположения, предпочтений врача, а также основного состояния здоровья пациента.
Открыть в отдельном окне
Процедура чрескожной термоабляции. Опухоль идентифицируется, и аппликатор вводится под визуальным контролем. Зона абляции создается так, чтобы покрыть всю опухоль краями, а затем проверяется с помощью последующей визуализации. (а) Диагностика. (б) Последующие действия. (c) Преабляция. (г) Постабляция.
Хотя хирургическое вмешательство проводится путем визуального осмотра с гистопатологической оценкой иссеченной опухоли и краев, чрескожная и неинвазивная термическая абляция выполняется исключительно с помощью визуализации. Направление аппликатора в целевую зону, мониторинг и проверка лечения, а также последующее клиническое наблюдение зависят от эффективной визуализации. Детальное обсуждение визуализации выходит за рамки этой статьи, но влияние визуализации на выбор термической абляции или процедурного подхода будет обсуждаться по мере необходимости. Дополнительную информацию о визуализации для интервенционной терапии можно найти в других статьях этого выпуска Импульс IEEE .
Дополнительную информацию о визуализации для интервенционной терапии можно найти в других статьях этого выпуска Импульс IEEE .
Наиболее распространенным анатомическим участком для термической абляции является печень.
Наиболее распространенным анатомическим участком для термической абляции является печень. Первичный рак, возникающий в печени, является седьмой по значимости причиной рака во всем мире, на его долю приходится более 750 000 новых случаев рака и 700 000 смертей каждый год [2]. Наиболее значимым фактором риска рака печени является цирроз, обычно связанный с хроническими инфекциями вирусов гепатита В или С, алкоголизмом или длительной жировой болезнью печени [3]. Печень также является частым местом метастазирования опухолей из различных органов из-за большого кровотока и фильтрующей функции печени. Кроме того, доброкачественные опухоли и кисты печени могут стать достаточно симптоматическими, чтобы потребовать вмешательства. Хирургия или трансплантация являются предпочтительным методом лечения опухолей печени, но до 80% пациентов с раком печени не подходят для операции из-за плохого исходного состояния здоровья, риска чрезмерного кровотечения из-за плохой свертываемости крови или отсутствия достаточного резерва функции печени [4]. ]. Радиация особенно вредна для нормальных клеток печени, а химиотерапия не показала долгосрочного положительного эффекта в отношении первичного рака печени. Поэтому существует острая потребность в эффективных альтернативных методах лечения опухолей печени.
Хирургия или трансплантация являются предпочтительным методом лечения опухолей печени, но до 80% пациентов с раком печени не подходят для операции из-за плохого исходного состояния здоровья, риска чрезмерного кровотечения из-за плохой свертываемости крови или отсутствия достаточного резерва функции печени [4]. ]. Радиация особенно вредна для нормальных клеток печени, а химиотерапия не показала долгосрочного положительного эффекта в отношении первичного рака печени. Поэтому существует острая потребность в эффективных альтернативных методах лечения опухолей печени.
По мере того, как клинические данные подтверждают его использование против опухолей печени, растет интерес к термической абляции для лечения других видов рака. Термическая абляция эффективно заменила хирургию в качестве метода лечения доброкачественных остеоид-остеом, особенно у детей [5]. Большая часть первичных опухолей почки в настоящее время лечится с помощью термической абляции, и многие центры рассматривают аблацию как возможный вариант первой линии [6]. Термическая абляция также исследуется при неоперабельных легочных узлах и опухолях молочной железы, но доступность традиционных методов лечения этих органов на сегодняшний день препятствует более широкому клиническому внедрению. Термическая абляция также может иметь значение при лечении опухолей шеи, надпочечников и поджелудочной железы, а также кистозных и эндокринных опухолей, которые могут представлять проблему для традиционных методов лечения. Клиническое внедрение в этих областях будет зависеть от долгосрочных результатов текущих пилотных исследований.
Термическая абляция также исследуется при неоперабельных легочных узлах и опухолях молочной железы, но доступность традиционных методов лечения этих органов на сегодняшний день препятствует более широкому клиническому внедрению. Термическая абляция также может иметь значение при лечении опухолей шеи, надпочечников и поджелудочной железы, а также кистозных и эндокринных опухолей, которые могут представлять проблему для традиционных методов лечения. Клиническое внедрение в этих областях будет зависеть от долгосрочных результатов текущих пилотных исследований.
Либо горячая (гипертермическая), либо холодная (гипотермическая) температура может вызвать клеточный некроз.
Как упоминалось ранее, как высокие (гипертермические), так и низкие (гипотермические) температуры могут вызывать клеточный некроз. Клетки в организме человека могут выдерживать самые разные температуры, и некоторые клетки более термоустойчивы, чем другие. Вероятность смерти связана с термической историей или тепловой дозой каждой конкретной клетки [7], [8]. Как правило, полный некроз происходит почти мгновенно при температуре ниже -40 °C или выше 60 °C для большинства типов клеток [9].]. Менее экстремальные температуры требуют более длительного воздействия, а температуры от 5 до 41 °C не обеспечивают долгосрочного терапевтического эффекта.
Как правило, полный некроз происходит почти мгновенно при температуре ниже -40 °C или выше 60 °C для большинства типов клеток [9].]. Менее экстремальные температуры требуют более длительного воздействия, а температуры от 5 до 41 °C не обеспечивают долгосрочного терапевтического эффекта.
Термическая абляция представляет собой нестационарную проблему теплообмена, и поэтому ее чаще всего описывают с помощью формулировки Пенне уравнения теплопроводности Фурье:
ρCp∂T∂t=k∇2T+Qh+Qm+Qp,
(1)
где ρ — плотность ткани (кг/м 3 ), C p удельная теплоемкость (Дж/кг·К), T – температура (К), t – время (с), k – теплопроводность (Вт/м·K), Q ч – тепловой поток источника абляции, Q m — метаболический тепловой поток, Q p — тепловой поток перфузии крови. В большинстве случаев метаболическое выделение тепла происходит намного медленнее, чем перфузия или источник, поэтому им можно пренебречь. Существуют и другие модели, которые по-разному учитывают микрососудистый кровоток и теплоперенос, но из-за высоких температур и высокой скорости нагрева, связанных с термической абляцией, приведенная выше формулировка является наиболее распространенной.
Существуют и другие модели, которые по-разному учитывают микрососудистый кровоток и теплоперенос, но из-за высоких температур и высокой скорости нагрева, связанных с термической абляцией, приведенная выше формулировка является наиболее распространенной.
Наличие крупных или высоко-низко расположенных кровеносных сосудов в целевой области создает значительный источник (или поглотитель) тепловой энергии (). Сосуды менее 3 мм обычно не представляют проблемы, но более крупные сосуды могут защищать соседние клетки от предполагаемого термического повреждения [10], [11]. В результате крупные сосуды были связаны с повышенной частотой местных рецидивов [12]. Следовательно, цель систем термической абляции состоит в том, чтобы преодолеть локальные перфузионные или сосудистые поглотители тепла за счет более интенсивного нагрева или охлаждения, т. е. создать большую разницу между Q h и Q p .
Открыть в отдельном окне
Влияние сосудов на зону абляции. (а) Сосуд с высоким потоком отодвигает зону абляции от ожидаемой круглой формы поперечного сечения. (b) Наличие крупного сосуда рядом с опухолью создает высокую вероятность локального рецидива, (c) как наблюдается при последующем обследовании через три месяца.
(а) Сосуд с высоким потоком отодвигает зону абляции от ожидаемой круглой формы поперечного сечения. (b) Наличие крупного сосуда рядом с опухолью создает высокую вероятность локального рецидива, (c) как наблюдается при последующем обследовании через три месяца.
Повышенные температуры воздействуют на клетки по-разному, но основным средством гибели клеток при термической абляции опухоли является острый коагуляционный некроз. Температура до 41 °C вызывает расширение кровеносных сосудов и усиление перфузии крови, а также запускает реакцию теплового шока, направленную на защиту клетки от термического повреждения и восстановление любого полученного повреждения [9].]. Эти температуры имеют небольшой долгосрочный эффект, даже если поддерживаются в течение нескольких часов. До 46 °С начинает происходить необратимое повреждение клеток. Реакция на тепловой шок усиливается, но экспозиция до 10 мин приводит к некрозу значительной популяции клеток. Выздоровевшие могут проявлять повышенную устойчивость к повышенным температурам. Температуры 46–52 °C сокращают время, необходимое для достижения гибели клеток, а также начинают вызывать тромбоз микрососудов, ишемию и гипоксию. Этот каскад перекрывает снабжение клеток питательными веществами и приводит к замедленному некрозу. Температуры выше 60 °C вызывают быструю денатурацию белков и плавление плазматической мембраны, что позволяет клеткам выживать.
Температуры 46–52 °C сокращают время, необходимое для достижения гибели клеток, а также начинают вызывать тромбоз микрососудов, ишемию и гипоксию. Этот каскад перекрывает снабжение клеток питательными веществами и приводит к замедленному некрозу. Температуры выше 60 °C вызывают быструю денатурацию белков и плавление плазматической мембраны, что позволяет клеткам выживать.
Дальнейшее повышение температуры связано с физическими изменениями, такими как испарение воды, высыхание и карбонизация. Эти изменения физических свойств не усиливают гибель клеток напрямую, но влияют на доставку энергии от абляционного устройства. В частности, испарение воды и обугливание тканей вызывают резкое падение 1) проводимости тканей, что препятствует доставке радиочастотной (РЧ) мощности; 2) комплексная диэлектрическая проницаемость, которая влияет на характеристики микроволновых антенн и мощность; 3) оптическая передача, необратимо препятствующая проникновению лазерного излучения; и 4) передача ультразвука. В каждом случае сам процесс терапевтического нагревания изменяет доставку энергии в будущем. Все системы должны учитывать эти изменения, чтобы максимизировать эффективность.
В каждом случае сам процесс терапевтического нагревания изменяет доставку энергии в будущем. Все системы должны учитывать эти изменения, чтобы максимизировать эффективность.
Радиочастотный электрический ток, микроволновое излучение, лазерный свет и ультразвуковые акустические волны являются наиболее распространенными источниками клинической гипертермической абляции опухоли. За исключением неинвазивного сфокусированного ультразвука высокой интенсивности (HIFU), эти энергии применяются с использованием внутритканевых устройств, которые по форме напоминают иглы. Клинические системы состоят из двух основных систем: источника нагрева или охлаждения и системы доставки. Для хирургических или чрескожных подходов система доставки состоит из аппликатора, который вводится в опухоль, и способа соединения аппликатора с источником (). Поскольку процедуры чрескожной термической абляции выполняются радиологами, привыкшими к биопсии под визуальным контролем, большинство устройств для абляции имеют форму иглы, аналогичную устройствам для биопсии. Устройства для чрескожной абляции имеют диаметр менее 2,5 мм, чтобы уменьшить осложнения, связанные с более крупными и травмирующими устройствами [13].
Устройства для чрескожной абляции имеют диаметр менее 2,5 мм, чтобы уменьшить осложнения, связанные с более крупными и травмирующими устройствами [13].
Открыть в отдельном окне
Система микроволновой абляции иллюстрирует основные компоненты большинства систем абляции: генератор с пользовательским интерфейсом или управлением того или иного типа, система распределения энергии и устройство доставки, которое применяется непосредственно к опухоли. (Изображение предоставлено NeuWave Medical, Inc.)
Одиночные опухоли по возможности лечат с помощью одного аппликатора. Однако, в зависимости от размера, формы и расположения опухоли, такой подход не всегда осуществим и оптимален.
МРТ можно использовать для точного измерения температуры и тепловой дозы.
Исторически сложилось так, что опухоли, слишком большие для лечения с помощью одного аппликатора, требовали нескольких перекрывающихся аблаций, чтобы полностью покрыть объем опухоли [14]. Эта процедура сопряжена с трудностями, включая визуализацию остаточной опухоли после каждого последующего лечения на изображениях и возможность осложнений или посева опухоли из-за изменения положения аппликатора. Несколько устройств также могут использоваться совместно для использования синергетического взаимодействия между растущими зонами абляции [15]-[17]. Недавние исследования доказали преимущества одновременного использования нескольких аппликаторов: большие зоны абляции, улучшенное слияние и однородность температур в зоне абляции, а также более быстрое размещение каждого аппликатора благодаря четкой визуализации изображений и возможности использовать предыдущие аппликаторы в качестве ориентира для последующие размещения [18]-[20]. Недостатком этого подхода является то, что размещение нескольких устройств увеличивает процедурную травму и финансовые затраты.
Эта процедура сопряжена с трудностями, включая визуализацию остаточной опухоли после каждого последующего лечения на изображениях и возможность осложнений или посева опухоли из-за изменения положения аппликатора. Несколько устройств также могут использоваться совместно для использования синергетического взаимодействия между растущими зонами абляции [15]-[17]. Недавние исследования доказали преимущества одновременного использования нескольких аппликаторов: большие зоны абляции, улучшенное слияние и однородность температур в зоне абляции, а также более быстрое размещение каждого аппликатора благодаря четкой визуализации изображений и возможности использовать предыдущие аппликаторы в качестве ориентира для последующие размещения [18]-[20]. Недостатком этого подхода является то, что размещение нескольких устройств увеличивает процедурную травму и финансовые затраты.
Радиочастотная абляция произошла от электрокоагуляции в 1990-х годах и стала наиболее широко используемым методом абляции во всем мире. Во время радиочастотной абляции электрический ток подается непосредственно на целевую зону; однако для замыкания электрической цепи через тело требуется как минимум два электрода. Типичный подход заключается в том, чтобы ввести один электрод в тело (интерстициальный электрод) со вторым электродом, прикрепленным к поверхности кожи (дисперсионный электрод или заземляющая подушка). Поскольку к опухоли прикладывается только один электрод, такая установка называется униполярной. Биполярная операция подразумевает, что ток колеблется между двумя внутритканевыми электродами, приложенными к опухоли (2).
Во время радиочастотной абляции электрический ток подается непосредственно на целевую зону; однако для замыкания электрической цепи через тело требуется как минимум два электрода. Типичный подход заключается в том, чтобы ввести один электрод в тело (интерстициальный электрод) со вторым электродом, прикрепленным к поверхности кожи (дисперсионный электрод или заземляющая подушка). Поскольку к опухоли прикладывается только один электрод, такая установка называется униполярной. Биполярная операция подразумевает, что ток колеблется между двумя внутритканевыми электродами, приложенными к опухоли (2).
Открыть в отдельном окне
(а) Монополярная и (б) биполярная радиочастотная абляция в смоделированной брюшной полости. Электрический ток колеблется между одним или несколькими электродами, приложенными непосредственно к опухоли. Выделение тепла пропорционально плотности тока, которая максимальна вблизи тканевых электродов, но может вызвать ожоги кожи вблизи неправильно расположенных поверхностных электродов.
Современные системы радиочастотной абляции способны генерировать выходную мощность до 250 Вт или около 2,3 А тока при типичной нагрузке ткани 50 Вт. ВЧ-генератор работает в основном как источник напряжения, поэтому среднюю отдаваемую мощность можно рассчитать по закону Ома: P = В 2 / Z , где Z – импеданс цепи, который определяется площадью поверхности границы электрод–ткань и типами тканей, вовлеченных в путь тока. Например, печень является относительно проводящей из-за высокого содержания в ней воды и ионов, поэтому создает путь электрического тока с низким импедансом. И наоборот, аэрированные легкие и жир имеют более низкое содержание воды и ионов, поэтому они связаны с гораздо более высоким электрическим импедансом. Это затрудняет радиочастотную абляцию легких, поскольку даже электропроводящие опухоли окружены паренхимой легких. Кроме того, ткани, нагретые до абляционных температур, особенно близких к 100 °C, испытывают быстрое обезвоживание, поскольку вода превращается в водяной пар. Это внезапное уменьшение содержания воды в тканях приводит к скачку импеданса цепи и соответствующему падению приложенной мощности. Таким образом, сам процесс абляционного нагревания является ограничением для радиочастотной абляции. Механизм нагревания при радиочастотной абляции заключается в осцилляции ионов преимущественно во внеклеточном пространстве жидкости, что приводит к джоулеву или резистивному выделению тепла. Нагревательный член из (1) равен:
Это внезапное уменьшение содержания воды в тканях приводит к скачку импеданса цепи и соответствующему падению приложенной мощности. Таким образом, сам процесс абляционного нагревания является ограничением для радиочастотной абляции. Механизм нагревания при радиочастотной абляции заключается в осцилляции ионов преимущественно во внеклеточном пространстве жидкости, что приводит к джоулеву или резистивному выделению тепла. Нагревательный член из (1) равен:
Qh=J⋅E=J22σ=σE22,
(2)
где Дж — плотность тока (А/м), E — напряженность электрического поля (В/м), σ — электропроводность (См/м). Это соотношение иллюстрирует тот факт, что ВЧ-нагрев пропорционален квадрату плотности тока.
Радиочастотные электроды предназначены для создания зон высокой плотности тока, которые достаточно велики, чтобы покрыть опухоль плюс абляционный край. Ранние электроды состояли из простых оголенных проводов, но нагрев такой конструкции легко препятствовал испарению воды и обезвоживанию тканей. Обходной путь заключается в охлаждении внутри самого электрода для снижения температуры на границе раздела электрод-ткань [21]. Это решение лучше всего работает в сочетании с пульсацией мощности. То есть, когда импеданс цепи начинает резко увеличиваться, радиочастотная мощность приостанавливается на несколько секунд, чтобы позволить температуре ткани уравновеситься и водяному пару вокруг электрода сконденсироваться. Результирующее увеличение проводимости ткани позволяет применять большую мощность РЧ во время следующего цикла нагрева. Поскольку теплопроводность через ткани намного медленнее, чем сам РЧ-нагрев, отключение питания не снижает рост зоны абляции. На самом деле, сочетание охлаждения электродов и импульсной мощности создает большие зоны абляции, чем любое решение по отдельности [22].
Обходной путь заключается в охлаждении внутри самого электрода для снижения температуры на границе раздела электрод-ткань [21]. Это решение лучше всего работает в сочетании с пульсацией мощности. То есть, когда импеданс цепи начинает резко увеличиваться, радиочастотная мощность приостанавливается на несколько секунд, чтобы позволить температуре ткани уравновеситься и водяному пару вокруг электрода сконденсироваться. Результирующее увеличение проводимости ткани позволяет применять большую мощность РЧ во время следующего цикла нагрева. Поскольку теплопроводность через ткани намного медленнее, чем сам РЧ-нагрев, отключение питания не снижает рост зоны абляции. На самом деле, сочетание охлаждения электродов и импульсной мощности создает большие зоны абляции, чем любое решение по отдельности [22].
Большинство раковых опухолей диагностируются с помощью компьютерной томографии, МРТ или ультразвукового исследования.
Другим решением для увеличения размера зоны радиочастотной абляции является пространственное распределение мощности по всему объему опухоли с помощью либо нескольких игольчатых электродов, либо электродов с выдвижными зубцами () [23]-[25]. Первое решение требует введения и направления до трех электродов. Электроды могут работать параллельно, как биполярная матрица, или путем последовательного переключения для улучшения равномерности нагрева в целевой зоне. Последнее требует размещения только одного устройства с зонтичным или звездообразным массивом развернутых зубцов, обеспечивающим необходимое распределение электрического тока. Эти развертываемые электроды имеют больший диаметр, чем охлаждаемые электроды (диаметр 2,4 мм против 1,5 мм), и штырям может быть трудно продвигаться во многие опухоли. Было показано, что как многоэлектродные, так и развертываемые методы увеличивают размер радиочастотной абляции.
Первое решение требует введения и направления до трех электродов. Электроды могут работать параллельно, как биполярная матрица, или путем последовательного переключения для улучшения равномерности нагрева в целевой зоне. Последнее требует размещения только одного устройства с зонтичным или звездообразным массивом развернутых зубцов, обеспечивающим необходимое распределение электрического тока. Эти развертываемые электроды имеют больший диаметр, чем охлаждаемые электроды (диаметр 2,4 мм против 1,5 мм), и штырям может быть трудно продвигаться во многие опухоли. Было показано, что как многоэлектродные, так и развертываемые методы увеличивают размер радиочастотной абляции.
Открыть в отдельном окне
ВЧ-электроды для абляции для общего клинического применения: (а) униполярные одиночные с водяным охлаждением и (б) кластерные и развертываемые массивы звездообразной (в) и зонтичной (г) формы. (Перепечатано с разрешения из [1].)
Также возможно увеличить электрическую проводимость окружающей ткани путем введения ионной жидкости, такой как физиологический раствор. Этот метод может быть полезен для охлаждения ткани вокруг электрода и противодействия низкой проводимости обезвоженной или обугленной ткани [26]. Это особенно полезно во время биполярной радиочастотной абляции, поскольку поверхность раздела электрод-ткань и путь тока относительно малы по сравнению с монополярной абляцией с дисперсионными электродами. Однако вливание физиологического раствора широко не используется, потому что распределение физиологического раствора может быть непредсказуемым и неоднородным. В некоторых сообщениях показано, что физиологический раствор может мигрировать в полость тела и вызывать сильный нагрев вдали от предполагаемой зоны лечения [27].
Этот метод может быть полезен для охлаждения ткани вокруг электрода и противодействия низкой проводимости обезвоженной или обугленной ткани [26]. Это особенно полезно во время биполярной радиочастотной абляции, поскольку поверхность раздела электрод-ткань и путь тока относительно малы по сравнению с монополярной абляцией с дисперсионными электродами. Однако вливание физиологического раствора широко не используется, потому что распределение физиологического раствора может быть непредсказуемым и неоднородным. В некоторых сообщениях показано, что физиологический раствор может мигрировать в полость тела и вызывать сильный нагрев вдали от предполагаемой зоны лечения [27].
В целом, радиочастотная абляция оказалась наиболее полезной при лечении небольших опухолей (диаметром до 3 см) в печени и почках, а также доброкачественных опухолей костей. Использование развертываемых устройств или систем с несколькими электродами повысило эффективность радиочастотной абляции при опухолях среднего размера (диаметром до 5 см) и улучшило доставку радиочастотной энергии в легкие. Тем не менее, радиочастотная абляция все еще страдает от проблемы относительно медленного выделения тепла. Возможным решением является использование генераторов большей мощности (до 1000 Вт), но такая система еще не применялась в клинической практике [28], [29].]. Даже при более высоких мощностях радиочастота ограничена зависимостью от проводимости электрического тока. Ткани с высоким импедансом, включая саму зону радиочастотной абляции, препятствуют эффективной радиочастотной абляции, когда применяемая мощность ограничена. Поэтому в последнее время исследования были сосредоточены на альтернативах РЧ для термической абляции опухолей.
Тем не менее, радиочастотная абляция все еще страдает от проблемы относительно медленного выделения тепла. Возможным решением является использование генераторов большей мощности (до 1000 Вт), но такая система еще не применялась в клинической практике [28], [29].]. Даже при более высоких мощностях радиочастота ограничена зависимостью от проводимости электрического тока. Ткани с высоким импедансом, включая саму зону радиочастотной абляции, препятствуют эффективной радиочастотной абляции, когда применяемая мощность ограничена. Поэтому в последнее время исследования были сосредоточены на альтернативах РЧ для термической абляции опухолей.
Микроволновый нагрев тканей изучался во многих формах с 1970-х годов, в первую очередь для наружной низкотемпературной гипертермии. Широкое использование микроволн для термической абляции опухолей началось совсем недавно. Как и при радиочастотной абляции, микроволновая энергия доставляется в опухоль с помощью игольчатого аппликатора. Однако микроволны излучаются промежуточной антенной. Поскольку излучение возникает благодаря геометрии антенны, не требуются заземляющие прокладки, а недостатки, связанные с проводимостью электрического тока, сводятся к минимуму. В частности, микроволновая энергия будет распространяться через все типы тканей, включая водяной пар и обезвоженные или обезвоженные ткани внутри зон абляции. Тепло генерируется в основном за счет электромагнитного взаимодействия с полярными молекулами, такими как вода. Аналогично радиочастотной абляции, член выделения тепла из (1) равен
Поскольку излучение возникает благодаря геометрии антенны, не требуются заземляющие прокладки, а недостатки, связанные с проводимостью электрического тока, сводятся к минимуму. В частности, микроволновая энергия будет распространяться через все типы тканей, включая водяной пар и обезвоженные или обезвоженные ткани внутри зон абляции. Тепло генерируется в основном за счет электромагнитного взаимодействия с полярными молекулами, такими как вода. Аналогично радиочастотной абляции, член выделения тепла из (1) равен
Qh=σE22
где σ теперь эффективная проводимость, учитывающая эффективный ток и ток смещения. Важно помнить, что, хотя ткани с низкой проводимостью будут генерировать меньше тепла, чем ткани с более высокой проводимостью при том же приложенном поле, энергия будет распространяться через эти ткани с меньшим затуханием; распространение и затухание обратно пропорциональны.
Источник СВЧ-мощности может быть как твердотельным, так и вакуумным, а мощность распределяется по коаксиальным кабелям на антенну аппликатора [30]. Антенну можно дополнительно разделить на рукоятку, стержень и излучающие секции. Излучающая секция получила наибольшее внимание в литературе, были описаны десятки конструкций [31], [32]. Все конструкции антенн направлены на достижение одних и тех же двух целей: 1) эффективное излучение в окружающие ткани для максимизации доставки энергии и 2) управление диаграммой направленности для создания желаемой геометрии зоны абляции. Во многих случаях желательна сферическая геометрия нагрева, чтобы соответствовать форме большинства опухолей, на которые направлена термическая абляция, но более вытянутые формы могут быть выгодны при использовании массивов внутритканевых антенн или при хирургическом лечении опухолей.
Антенну можно дополнительно разделить на рукоятку, стержень и излучающие секции. Излучающая секция получила наибольшее внимание в литературе, были описаны десятки конструкций [31], [32]. Все конструкции антенн направлены на достижение одних и тех же двух целей: 1) эффективное излучение в окружающие ткани для максимизации доставки энергии и 2) управление диаграммой направленности для создания желаемой геометрии зоны абляции. Во многих случаях желательна сферическая геометрия нагрева, чтобы соответствовать форме большинства опухолей, на которые направлена термическая абляция, но более вытянутые формы могут быть выгодны при использовании массивов внутритканевых антенн или при хирургическом лечении опухолей.
Одной из первых трудностей при микроволновой абляции была невозможность контролировать нагрев вдоль проксимальной части антенны, что приводило к каплевидным зонам абляции. Точно так же коаксиальные кабели малого диаметра, из которых состоит антенна, могут перегреться и выйти из строя при передаче высокой мощности микроволн (> ~ 30 Вт). Перегрев кабелей приводит к чрезмерным температурам вдоль стержня антенны и потенциально опасным осложнениям, таким как свищи. Кабели большего диаметра (> 3 мм), которые выдерживают большие мощности без перегрева, не подходят для чрескожного введения. Одним из решений этой проблемы является ограничение мощности и времени, подаваемых антенной. Ранние клинические исследования, в которых использовалась эта техника, смогли уменьшить осложнения, но с предсказуемыми ограничениями по размеру и эффективности абляции для распространенных опухолей. Более поздним решением является охлаждение антенны с использованием расширения воды или криогенного газа. Благодаря эффективному охлаждению теперь можно передавать мощность более 200 Вт через антенны диаметром 1,5 мм. В результате микроволны могут создавать большие зоны абляции (более 4 см в диаметре) за относительно короткие промежутки времени (10 минут или меньше) (1).
Перегрев кабелей приводит к чрезмерным температурам вдоль стержня антенны и потенциально опасным осложнениям, таким как свищи. Кабели большего диаметра (> 3 мм), которые выдерживают большие мощности без перегрева, не подходят для чрескожного введения. Одним из решений этой проблемы является ограничение мощности и времени, подаваемых антенной. Ранние клинические исследования, в которых использовалась эта техника, смогли уменьшить осложнения, но с предсказуемыми ограничениями по размеру и эффективности абляции для распространенных опухолей. Более поздним решением является охлаждение антенны с использованием расширения воды или криогенного газа. Благодаря эффективному охлаждению теперь можно передавать мощность более 200 Вт через антенны диаметром 1,5 мм. В результате микроволны могут создавать большие зоны абляции (более 4 см в диаметре) за относительно короткие промежутки времени (10 минут или меньше) (1).
Открыть в отдельном окне
Микроволновая абляция, созданная с использованием 140 Вт на частоте 2,45 ГГц в течение 10 мин. (a) Зона абляции размером 4,5 × 6,0 см была создана трехосной антенной диаметром 1,5 мм с газовым охлаждением в печени свиньи in vivo. Та же система использовалась для абляции первичной опухоли печени размером 3,2 × 3,4 см, показанной (б) до и (в) после лечения.
(a) Зона абляции размером 4,5 × 6,0 см была создана трехосной антенной диаметром 1,5 мм с газовым охлаждением в печени свиньи in vivo. Та же система использовалась для абляции первичной опухоли печени размером 3,2 × 3,4 см, показанной (б) до и (в) после лечения.
Во многих отношениях микроволновая абляция может быть естественной эволюцией радиочастотной абляции.
Во многих отношениях микроволновая абляция может быть естественной эволюцией радиочастотной абляции. Поскольку распространение электромагнитных волн не ограничивается высушенной тканью, водяным паром или тканями с низким содержанием воды, микроволновая абляция может быть более эффективным методом для опухолей в легких, костях или кистозных поражениях. Микроволны также способны создавать более крупные зоны абляции за меньшее время, чем РЧ, что делает их привлекательными для тех процедур, для которых РЧ абляция стала более традиционной (печень, почки и доброкачественные опухоли костей). Экономика здравоохранения и долгосрочные клинические данные определят, сколько центров сменится.
Экономика здравоохранения и долгосрочные клинические данные определят, сколько центров сменится.
Лазеры имеют долгую и разнообразную историю в области медицины и чаще используются для лечения глаз, кожи, сосудов и зубов, чем для онкологии. Тем не менее, лазерная абляция опухолей развивалась за последние два десятилетия и стала жизнеспособным вариантом лечения многих из тех же опухолей, что и радиочастотная или микроволновая абляция [16], [33]. Лазерный свет взаимодействует с различными компонентами ткани в зависимости от длины волны света, но большинство систем абляции нацелены на диапазон 800–1100 нм, чтобы извлечь выгоду из более глубокого проникновения энергии.
Лазерный свет очень мощный и быстро выделяет тепло вблизи аппликатора. Затухание может быть столь же быстрым; однако зона активного нагрева находится примерно в 1 см от аппликатора. Что еще более важно, как и при радиочастотной абляции, обезвоженная и особенно обугленная ткань увеличивает ослабление света и препятствует доставке энергии [34]. Поэтому в системах лазерной абляции используется контроль мощности и охлаждение аппликатора для предотвращения обугливания. В литературе описано несколько вариантов лазерных аппликаторов, но в большинстве систем используется рассеивающий наконечник для более изотропного распределения света вокруг наконечника аппликатора [35]. Несмотря на эти технические достижения, лазерная абляция с помощью одного аппликатора обычно не превышает 2 см в диаметре. Опухоли большего размера необходимо лечить несколькими аппликаторами, при этом в некоторых сериях сообщается о среднем использовании более четырех аппликаторов за лечение [16].
Поэтому в системах лазерной абляции используется контроль мощности и охлаждение аппликатора для предотвращения обугливания. В литературе описано несколько вариантов лазерных аппликаторов, но в большинстве систем используется рассеивающий наконечник для более изотропного распределения света вокруг наконечника аппликатора [35]. Несмотря на эти технические достижения, лазерная абляция с помощью одного аппликатора обычно не превышает 2 см в диаметре. Опухоли большего размера необходимо лечить несколькими аппликаторами, при этом в некоторых сериях сообщается о среднем использовании более четырех аппликаторов за лечение [16].
Несмотря на этот потенциальный недостаток, аппликаторы для лазерной абляции имеют дополнительную особенность, которая делает их еще более интересными: совместимость с МРТ. Аппликаторы изготовлены из стеклянных оптических волокон, что позволяет безопасно использовать их в МРТ, не создавая существенных дефектов изображения. МРТ важна, потому что ее можно использовать для точного измерения температуры и тепловой дозы [36]. Таким образом, лазерная абляция может выполняться в сочетании с МРТ-термометрией для точного лечения опухолей в труднодоступных местах, таких как головной мозг и предстательная железа, с хорошей уверенностью в зоне воздействия и отсутствием термического повреждения критических соседних нервных тканей (14). Таким образом, хотя лазерная абляция на сегодняшний день используется только в нескольких центрах по всему миру, ее клиническое использование может развиваться в крупных академических центрах, в которых доступна интервенционная МРТ или МРТ-термометрия.
Таким образом, лазерная абляция может выполняться в сочетании с МРТ-термометрией для точного лечения опухолей в труднодоступных местах, таких как головной мозг и предстательная железа, с хорошей уверенностью в зоне воздействия и отсутствием термического повреждения критических соседних нервных тканей (14). Таким образом, хотя лазерная абляция на сегодняшний день используется только в нескольких центрах по всему миру, ее клиническое использование может развиваться в крупных академических центрах, в которых доступна интервенционная МРТ или МРТ-термометрия.
Открыть в отдельном окне
Лазерная абляция головного мозга под контролем МРТ. Диффундирующее лазерное волокно (вверху справа) помещается транскраниально в опухоль под контролем МРТ. МР-термометрия обеспечивает обратную связь о росте абляции почти в реальном времени, позволяя точно контролировать зону воздействия, чтобы избежать повреждения периферических тканей. (Изображения предоставлены Джейсоном Стаффордом. Перепечатано с разрешения [33]. )
)
Ультразвуковая энергия может подаваться с помощью внутритканевых устройств или внешних преобразователей. Внутритканевые устройства аналогичны другим методам абляции в том, что они имеют форму иглы; однако аппликатор обычно содержит массив преобразователей, амплитуда и фаза волны которых могут контролироваться индивидуально [37], [38]. Это позволяет лучше контролировать схему нагрева — в осевом и продольном направлении — по сравнению с другими внутритканевыми устройствами. Однако эти устройства еще не получили широкого распространения на рынке, поэтому в настоящее время отсутствуют клинические данные.
Пожалуй, наиболее привлекательной особенностью ультразвука является возможность неинвазивной абляции тканей. HIFU использует сходящиеся ультразвуковые лучи от внешнего источника для создания фокальной зоны ультразвукового нагрева [39]. Зона нагрева обычно имеет размер зерна вареного риса и может быть создана за несколько секунд. Полное лечение выполняется путем перекрытия сотен этих фокальных зон, чтобы покрыть объем опухоли, начиная с дистальной части (). Процедуры HIFU могут занять несколько часов и требуют точного контроля зоны обработки в течение этого времени. Таким образом, HIFU применяется в первую очередь в областях, которые легко доступны и не подвержены существенному дыхательному движению, например, при доброкачественных миомах матки и молочной железы и доброкачественной гиперплазии предстательной железы. По мере совершенствования технологии генерации и управления HIFU применение в более сложных местах, таких как мозг или брюшная полость, может стать клинически осуществимым.
Процедуры HIFU могут занять несколько часов и требуют точного контроля зоны обработки в течение этого времени. Таким образом, HIFU применяется в первую очередь в областях, которые легко доступны и не подвержены существенному дыхательному движению, например, при доброкачественных миомах матки и молочной железы и доброкачественной гиперплазии предстательной железы. По мере совершенствования технологии генерации и управления HIFU применение в более сложных местах, таких как мозг или брюшная полость, может стать клинически осуществимым.
Открыть в отдельном окне
HIFU предполагает наложение нескольких небольших фокальных зон для создания полного лечения. (а) Внешний преобразователь соединен с поверхностью кожи для эффективного применения энергии в форме сходящегося луча. (b) Когда луч сходится, плотность энергии быстро увеличивается, что приводит к небольшим очаговым зонам термического повреждения в зоне цели. (Перепечатано с разрешения [39].)
Лазерный свет очень энергичен и быстро выделяет тепло вблизи аппликатора.
Криоаблация направлена на то, чтобы извлечь выгоду из всех пагубных последствий, с которыми многие сталкиваются во время криоконсервации [40]. Образование кристаллов льда, разрыв клеточной мембраны и осмотический дисбаланс являются основными механизмами гибели клеток. Охлаждение вблизи источника криоабляции (обычно криозонда) происходит достаточно быстро, чтобы вызвать образование внутриклеточного льда, который механически расширяет клеточную мембрану без возможности восстановления и почти всегда убивает клетку. Ткани, более периферические по отношению к криозонду, охлаждаются медленнее. Образование внеклеточного льда приводит к увеличению концентрации ионов в оставшейся внеклеточной жидкости, что вызывает клеточную дегидратацию, поскольку клетка пытается создать равновесие. Продолжающееся образование льда создает механическую нагрузку на сморщенную клетку. Когда ткань оттаивает, осмотический дисбаланс обычно усиливается и приводит к гибели клеток. По этой причине большинство процедур криоабляции включают последовательные циклы замораживания-оттаивания, чтобы максимизировать гибель клеток [41].
Современное оборудование для криоабляции использует обычные методы охлаждения. В большинстве систем по-прежнему используется эффект Джоуля-Томсона с аргоном в качестве хладагента. Расширяясь в наконечнике криозонда, газ аргон создает отрицательный источник тепла, который охлаждает прилегающие ткани примерно до -160 °C. Остальная часть зоны абляции растет за счет теплопроводности, причем летальная изотерма лежит на 4–10 мм внутри края видимого ледяного шара (). Системы Джоуля-Томсона уже несколько десятилетий используются для лечения тяжелых форм рака печени, легких, почек, предстательной железы, молочной железы и костей, но зона абляции, создаваемая данным криозондом, обратно пропорциональна площади его поверхности (диаметру). Кроме того, криозонды малого диаметра дают более слабый теплоотвод, чем более крупные зонды, из-за меньшего перепада давления и ограничений на поток газа. Альтернативные методы охлаждения включают хранение газов вблизи критической точки. В этот момент многие материалы (например, азот) имеют заметно повышенную теплоемкость, что создает больший теплоотвод. Поскольку материал находится в критической точке, он имеет вязкость газа и его легче перемещать через криозонды малого диаметра. Однако контроль газа в критической точке может быть технически сложным, поэтому системы с этой технологией еще не получили широкого распространения.
Поскольку материал находится в критической точке, он имеет вязкость газа и его легче перемещать через криозонды малого диаметра. Однако контроль газа в критической точке может быть технически сложным, поэтому системы с этой технологией еще не получили широкого распространения.
Открыть в отдельном окне
Криоаблация с использованием аргонового зонда Джоуля-Томсона. (а) Расширение аргона вблизи наконечника зонда создает (б) ледяной шар, который хорошо виден на КТ. Смертельная изотерма примерно -40 ° C находится в нескольких миллиметрах внутри поверхности ледяного шара. (Перепечатано с разрешения из [1].)
Основными преимуществами криоабляции по сравнению с другими методами термической абляции являются улучшенная видимость на изображениях из-за образования ледяных шаров, опора только на тепловую диффузию (а не взаимодействие энергии для производства тепла) и меньшее повреждение архитектуры тканей. Процесс замораживания оставляет коллагеновые структуры в значительной степени нетронутыми, потенциально обеспечивая более быстрое и полное заживление тканей [42]. Тем не менее, криоабляция не показана для некоторых видов рака. Криоаблация не дает прижигающего эффекта, поэтому быстрое введение клеточного содержимого в кровоток после оттаивания может привести к опасной реакции, известной как криошок [43]. Аналогичный эффект можно отметить при нейроэндокринных опухолях. По этой причине криоабляция обычно не используется для лечения опухолей у пациентов с циррозом печени или низкими факторами свертывания крови. Кроме того, хотя ледяной шар хорошо виден, смертельная зона внутри этого ледяного шара не видна на изображениях. Наконец, газовые баллоны, необходимые для хранения криогена, не всегда широко доступны, а их размер может сделать системы криоабляции более громоздкими, чем системы гипертермической абляции. Тем не менее, криоабляция занимает видное место в арсенале термальной абляции.
Тем не менее, криоабляция не показана для некоторых видов рака. Криоаблация не дает прижигающего эффекта, поэтому быстрое введение клеточного содержимого в кровоток после оттаивания может привести к опасной реакции, известной как криошок [43]. Аналогичный эффект можно отметить при нейроэндокринных опухолях. По этой причине криоабляция обычно не используется для лечения опухолей у пациентов с циррозом печени или низкими факторами свертывания крови. Кроме того, хотя ледяной шар хорошо виден, смертельная зона внутри этого ледяного шара не видна на изображениях. Наконец, газовые баллоны, необходимые для хранения криогена, не всегда широко доступны, а их размер может сделать системы криоабляции более громоздкими, чем системы гипертермической абляции. Тем не менее, криоабляция занимает видное место в арсенале термальной абляции.
Термическая абляция опухоли под визуальным контролем продолжает набирать популярность в качестве жизнеспособного варианта лечения многих очаговых видов рака. Можно использовать методы абляции, основанные как на тепле, так и на холоде, и не существует единого оптимального лечения для всех клинических проявлений. На сегодняшний день радиочастотная абляция была доминирующей энергией для гипертермической абляции, но в ближайшие годы ее может вытеснить микроволновая абляция. Лазерная абляция предлагает совместимость с МРТ для точного теплового мониторинга, в то время как HIFU предлагает внешнюю подачу энергии наряду с совместимостью с МРТ. Криоабляция используется для многих из тех же самых опухолей и более заметна, чем гипертермическая абляция на КТ и УЗИ, но может не подходить для некоторых видов рака из-за отсутствия коагуляции. Несмотря на многолетний клинический опыт, большинство систем аблации находятся в стадии разработки первого или, возможно, второго поколения. Поскольку технологии доставки энергии продолжают совершенствоваться, ожидайте услышать больше о термической абляции опухолей.
Можно использовать методы абляции, основанные как на тепле, так и на холоде, и не существует единого оптимального лечения для всех клинических проявлений. На сегодняшний день радиочастотная абляция была доминирующей энергией для гипертермической абляции, но в ближайшие годы ее может вытеснить микроволновая абляция. Лазерная абляция предлагает совместимость с МРТ для точного теплового мониторинга, в то время как HIFU предлагает внешнюю подачу энергии наряду с совместимостью с МРТ. Криоабляция используется для многих из тех же самых опухолей и более заметна, чем гипертермическая абляция на КТ и УЗИ, но может не подходить для некоторых видов рака из-за отсутствия коагуляции. Несмотря на многолетний клинический опыт, большинство систем аблации находятся в стадии разработки первого или, возможно, второго поколения. Поскольку технологии доставки энергии продолжают совершенствоваться, ожидайте услышать больше о термической абляции опухолей.
1. Ахмед М., Брейс С.Л., Ли Ф.Т.-младший, Голдберг С. Н. Принципы и достижения чрескожной абляции. Радиология. 2011 г., февраль; 258 (№ 2): 351–369. [Статья бесплатно PMC] [PubMed] [Google Scholar]
Н. Принципы и достижения чрескожной абляции. Радиология. 2011 г., февраль; 258 (№ 2): 351–369. [Статья бесплатно PMC] [PubMed] [Google Scholar]
2. Ferlay J, Shin H, Bray F, Forman D, Mathers C, Parkin D. GLOBOCAN 2008, заболеваемость раком и смертность во всем мире: IARC CancerBase No 10. 2010 [ Онлайн]. Доступно: http://globocan.iarc.fr/
3. Bosch FX, Ribes J, Díaz M, Cléries R. Первичный рак печени: заболеваемость и тенденции во всем мире. Гастроэнтерология. 2004 ноябрь; 127 (№ 5, приложение 1): S5 – S16. [PubMed] [Академия Google]
4. Llovet JM, Bruix J. Систематический обзор рандомизированных исследований неоперабельной гепатоцеллюлярной карциномы: химиоэмболизация улучшает выживаемость. Гепатология. 2003 г., февраль; 37 (№ 2): 429–442. [PubMed] [Google Scholar]
5. Розенталь Д.И., Хорничек Ф.Дж., Торриани М., Гебхардт М.С., Манкин Х.Дж. Остеоид-остеома: чрескожное лечение радиочастотной энергией1. Радиология. 2003 г., октябрь; 229 (№ 1): 171–175. [PubMed] [Google Scholar]
6. Kunkle DA, Uzzo RG. Криоабляция или радиочастотная абляция небольшой почечной массы: метаанализ. Рак. 2008 г., ноябрь; 113 (№ 10): 2671–2680. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Kunkle DA, Uzzo RG. Криоабляция или радиочастотная абляция небольшой почечной массы: метаанализ. Рак. 2008 г., ноябрь; 113 (№ 10): 2671–2680. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Сапарето С.А., Дьюи В.К. Определение тепловой дозы в терапии рака. Int J Radiat Oncol Biol Phys. 1984 г.; 10 июня (№ 6): 787–800. [PubMed] [Google Scholar]
8. Энрикес Ф.Дж. Исследования термической травмы; предсказуемость и значимость термически индуцированных скоростных процессов, приводящих к необратимому повреждению эпидермиса. Арка Патол. 1947 г., май; 43 (№ 5): 489–502. [PubMed] [Google Scholar]
9. Никфарджам М., Муралидхаран В., Кристофи С. Механизмы фокальной тепловой деструкции опухолей печени. J Surg Res. 2005 г., август; 127 (№ 2): 208–223. [PubMed] [Академия Google]
10. Бхардвадж Н., Стрикленд А.Д., Ахмад Ф., Атанесян Л., Уэст К., Ллойд Д.М. Сравнительная гистологическая оценка абляции, вызванной микроволновой, криотерапией и радиочастотой в печени. Патология. 2009 г., февраль; 41 (№ 2): 168–172. [PubMed] [Google Scholar]
Патология. 2009 г., февраль; 41 (№ 2): 168–172. [PubMed] [Google Scholar]
11. Lu DSK, Raman SS, Limanond P, Aziz D, Economou J, Busuttil R, Sayre J. Влияние крупных перитуморальных сосудов на исход радиочастотной абляции опухолей печени. J Vasc Interv Radiol. 2003; 14 (№ 10): 1267–1274. [PubMed] [Академия Google]
12. Nakazawa T, Kokubu S, Shibuya A, Ono K, Watanabe M, Hidaka H, Tsuchihashi T, Saigenji K. Радиочастотная абляция гепатоцеллюлярной карциномы: корреляция между локальной прогрессией опухоли после абляции и абляционным краем. AJR Амер Дж. Рентгенол. 2007 г., февраль; 188 (№ 2): 480–488. [PubMed] [Google Scholar]
13. Geraghty PR, Kee ST, McFarlane G, Razavi MK, Sze DY, Dake MD. Трансторакальная аспирационная биопсия легочных узлов под контролем КТ: размер иглы и частота пневмоторакса. Радиология. 2003;229(№ 2): 475–481. [PubMed] [Google Scholar]
14. Dodd GD, III, Frank MS, Aribandi M, Chopra S, Chintapalli KN. Радиочастотная термическая абляция: компьютерный анализ размера термического повреждения, вызванного перекрывающимися абляциями. AJR Амер Дж. Рентгенол. 2001; 177 (№ 4): 777–782. [PubMed] [Google Scholar]
AJR Амер Дж. Рентгенол. 2001; 177 (№ 4): 777–782. [PubMed] [Google Scholar]
15. Райт А.С., Ли Ф.Т.Дж., Махви Д.М. Микроволновая абляция печени с множественными антеннами приводит к синергетически большим зонам коагуляционного некроза. Энн Сург Онкол. 2003 г., 10 апреля (№ 3): 275–283. [PubMed] [Академия Google]
16. Vogl TJ, Naguib NNN, Eichler K, Lehnert T, Ackermann H, Mack MG. Объемная оценка метастазов в печени после термической абляции: долгосрочные результаты после лазерной термотерапии под контролем МРТ. Радиология. 2008 г., декабрь; 249 (№ 3): 865–871. [PubMed] [Google Scholar]
17. Laeseke PF, Sampson LA, Haemmerich D, Brace CL, Fine JP, Tatum TM, Winter TC, III, Lee FT., Jr Многоэлектродная радиочастотная абляция создает сливающиеся области некроза: Результаты в печени свиньи in vivo. Радиология. 2006;241(11):116–124. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Lee JM, Han JK, Kim HC, Kim SH, Kim KW, Joo SM, Choi BI. Многоэлектродная радиочастотная абляция печени свиньи in vivo: сравнительные исследования последовательных монополярных режимов с переключением монополярных и мультиполярных режимов. Инвестируйте Радиол. 2007; 42 (№ 10): 676–683. [PubMed] [Google Scholar]
Инвестируйте Радиол. 2007; 42 (№ 10): 676–683. [PubMed] [Google Scholar]
19. Brace CL, Sampson LA, Hinshaw JL, Sandhu N, Lee FT. Радиочастотная абляция: одновременное применение нескольких электродов посредством переключения создает более крупные, более слитные абляции, чем последовательное применение в модели крупного животного. J Vasc Interv Radiol. 2009 г.20 января (№ 1): 118–124. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Rewcastle JC, Sandison GA, Muldrew K, Saliken JC, Donnelly BJ. Модель трехмерного теплового распределения, зависящего от времени, внутри ледяных шаров, окружающих несколько криозондов. мед. физ. 2001 г.; 28 июня (№ 6): 1125–1137. [PubMed] [Google Scholar]
21. Голдберг С.Н., Газель Г.С., Солбиати Л., Риттман В.Дж., Мюллер П.Р. Радиочастотная абляция ткани: увеличение диаметра поражения с помощью перфузионного электрода. Академ Радиол. 1996; 3 (№ 8): 636–644. [PubMed] [Google Scholar]
22. Голдберг С.Н., Штейн М.С., Газель Г. С., Шейман Р.Г., Крускал Д.Б., Клаус М.Э. Чрескожная радиочастотная абляция тканей: оптимизация импульсно-радиочастотной техники для увеличения коагуляционного некроза. J Vasc Interv Radiol. 1999; 10 (№ 7): 907–916. [PubMed] [Google Scholar]
С., Шейман Р.Г., Крускал Д.Б., Клаус М.Э. Чрескожная радиочастотная абляция тканей: оптимизация импульсно-радиочастотной техники для увеличения коагуляционного некроза. J Vasc Interv Radiol. 1999; 10 (№ 7): 907–916. [PubMed] [Google Scholar]
23. Голдберг С.Н., Солбиати Л., Хан П.Ф., Косман Э., Конрад Дж.Е., Фогл Р., Газель Г.С. Абляция больших объемов ткани радиочастотой с использованием техники сгруппированных электродов с внутренним охлаждением: лабораторный и клинический опыт лечения метастазов в печени. Радиология. 1998; 209 (№ 2): 371–379. [PubMed] [Google Scholar]
24. Lee FTJ, Haemmerich D, Wright AS, Mahvi DM, Sampson LA, Webster JG. Многозондовая радиочастотная абляция: пилотное исследование на животной модели. J Vasc Interv Radiol. 2003; 14 (№ 11): 1437–1442. [PubMed] [Google Scholar]
25. Denys AL, De Baere T, Kuoch V, Dupas B, Chevallier P, Madoff DC, Schnyder P, Doenz F. Радиочастотная абляция ткани печени: In vivo и ex vivo эксперименты с четырьмя различными системами. Евро Радиол. 2003; 13 (№ 10): 2346–2352. [PubMed] [Академия Google]
Евро Радиол. 2003; 13 (№ 10): 2346–2352. [PubMed] [Академия Google]
26. Ливраги Т., Голдберг С.Н., Монти Ф., Биззини А., Лаццарони С., Мелони Ф., Пелликано С., Солбиати Л., Газель Г.С. Радиочастотная абляция ткани с усилением физиологическим раствором при лечении метастазов в печень. Радиология. 1997 г., январь; 202 (№ 1): 205–210. [PubMed] [Google Scholar]
27. Gillams AR, Lees WR. КТ-картирование распределения физиологического раствора во время радиочастотной абляции перфузионными электродами. Cardiovasc Intervent Radiol. 2005; 28 (№ 4): 476–480. [PubMed] [Google Scholar]
28. Солаццо С.А., Ахмед М., Лю З., Хайнс-Перальта А.У., Голдберг С.Н. Мощный генератор для радиочастотной абляции: электроды большего размера и алгоритмы пульсации в условиях ex vivo крупного рогатого скота и in vivo свиней. Радиология. 2007 г., март; 242 (№ 3): 743–750. [PubMed] [Академия Google]
29. Брейс С.Л., Лаесеке П.Ф., Сэмпсон Л.А., Фрей Т.М., Мукерджи Р., Ли Ф.Т. Радиочастотная абляция с помощью мощного генератора: эффективность устройства в модели печени свиньи in vivo. Int J Гипертермия. 2007 г.; 23 июня (№ 4): 387–394. [PubMed] [Google Scholar]
Int J Гипертермия. 2007 г.; 23 июня (№ 4): 387–394. [PubMed] [Google Scholar]
30. Подтяжка CL. Технология микроволновой абляции: что должен знать каждый пользователь. Текущая проблема диагностики радиол. 2009 г., апрель; 38 (№ 2): 61–67. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Bertram JM, Yang D, Converse MC, Webster JG, Mahvi DM. Обзор коаксиальных межтканевых антенн для микроволновой абляции печени. Crit Rev Biomed Eng. 2006; 34 (№ 3): 187–213. [PubMed] [Академия Google]
32. Распорка кл. Микроволновая абляция тканей: биофизика, технология и приложения. Критические обзоры биомедицинской инженерии. 2010;38(1):65–78. [Бесплатная статья PMC] [PubMed] [Google Scholar]
33. Stafford RJ, Fuentes D, Elliott AA, Weinberg JS, Ahrar K. Лазерная тепловая терапия для удаления опухоли. Crit Rev Biomed Eng. 2010;38(№1):79–100. [PubMed] [Google Scholar]
34. Скиннер М.Г., Иизука М.Н., Колиос М.С., Шерар М.Д. Теоретическое сравнение источников энергии — микроволн, ультразвука и лазера — для внутритканевой термальной терапии. физ.-мед. биол. 1998 декабря; 43 (№ 12): 3535–3547. [PubMed] [Google Scholar]
физ.-мед. биол. 1998 декабря; 43 (№ 12): 3535–3547. [PubMed] [Google Scholar]
35. McNichols RJ, Kangasniemi M, Gowda A, Bankson JA, Price RE, Hazle JD. Технические разработки для термической обработки головного мозга: водоохлаждаемые диффузионные наконечники лазерных волокон и термочувствительные МРТ с использованием пересекающихся плоскостей изображения. Int J Гипертермия. 2004 г., февраль; 20 (№ 1): 45–56. [PubMed] [Google Scholar]
36. Puls R, Langner S, Rosenberg C, Hegenscheid K, Kuehn JP, Noeckler K, Hosten N. Лазерная абляция метастазов колоректального рака в печень с помощью МР-термометрии: 5-летняя выживаемость. J Vasc Interv Radiol. 2009 г.20 февраля (№ 2): 225–234. [PubMed] [Google Scholar]
37. Nau WH, Diederich CJ, Burdette EC. Оценка многоэлементных внутритканевых ультразвуковых аппликаторов с катетерным охлаждением для высокотемпературной термотерапии. мед. физ. 2001 г., июль; 28 (№ 7): 1525–1534. [PubMed] [Google Scholar]
38. Lafon C, Melodelima D, Salomir R, Chapelon JY. Внутритканевые устройства для малоинвазивной термоабляции высокоинтенсивным ультразвуком. Int J Гипертермия. 2007 март; 23 (№ 2): 153–163. [PubMed] [Академия Google]
Внутритканевые устройства для малоинвазивной термоабляции высокоинтенсивным ультразвуком. Int J Гипертермия. 2007 март; 23 (№ 2): 153–163. [PubMed] [Академия Google]
39. Дубинский Т.Дж., Куэвас С., Диге М.К., Колокитас О., Хванг Дж.Х. Высокоинтенсивный сфокусированный ультразвук: современные возможности и применение в онкологии. Амер Дж. Рентгенол. 2008 г., январь; 190 (№ 1): 191–199. [PubMed] [Google Scholar]
40. Рубинский Б., Ли С.И., Бастацкий Дж., Оник Г. Процесс замораживания и механизм повреждения при криохирургии печени. Криобиология. 1990 г., 27 февраля (№ 1): 85–97. [PubMed] [Google Scholar]
41. Baust JG, Gage AA, Robilottto AT, Baust JM. Патофизиология термоаблации: оптимизация криоаблации. Курр Опин Урол. 2009 г.19 марта (№ 2): 127–132. [PubMed] [Google Scholar]
42. Гейдж А.А., Бауст Дж.М., Бауст Дж.Г. Экспериментальные криохирургические исследования in vivo. Криобиология. 2009 г., декабрь; 59 (№ 3): 229–243. [Бесплатная статья PMC] [PubMed] [Google Scholar]
43. Seifert JK, член парламента Франции, Zhao J, Bolton EJ, Finlay I, Junginger T, Morris DL. Замораживание печени большого объема: связь со значительным высвобождением цитокинов интерлейкина-6 и фактора некроза опухоли а в модели крыс. Мир J Surg. 26 ноября 2002 г. (№ 11): 1333–1341. [PubMed] [Академия Google]
Seifert JK, член парламента Франции, Zhao J, Bolton EJ, Finlay I, Junginger T, Morris DL. Замораживание печени большого объема: связь со значительным высвобождением цитокинов интерлейкина-6 и фактора некроза опухоли а в модели крыс. Мир J Surg. 26 ноября 2002 г. (№ 11): 1333–1341. [PubMed] [Академия Google]
Состояние течения рака почки
Когда у ГЭРИ ХАРТШТЕЙНА был диагностирован рак почки 3 стадии, не было утвержденных лекарств, помогающих предотвратить рецидив после лечения. — ФОТО RYAN DEARTH
Когда Гэри Хартштейн обнаружил кровь в своей моче в январе 2017 года, он был встревожен, особенно когда у него были трудности с мочеиспусканием. Через неделю уролог из его местной больницы в Нью-Джерси заказал компьютерную томографию и обнаружил опухоль размером с теннисный мяч. Во время операции врач удалил почку Хартштейна и 9-сантиметр массы и обнаружили, что опухоль давит на кровеносные сосуды, вызывая образование тромбов. Патология выявила почечно-клеточный рак (ПКР). Хартштейну сказали, что у него рак третьей стадии, и он с облегчением узнал, что врачи все удалили.
Хартштейну сказали, что у него рак третьей стадии, и он с облегчением узнал, что врачи все удалили.
И его врач из Нью-Джерси, и еще один из Нью-Йорка, давшие второе мнение, сказали, что больше делать нечего. 52-летний руководитель некоммерческой программы был признан здоровым от рака. «Конечно, существовал риск его возвращения», — говорит Хартштейн, но врачи сказали ему, что не существует проверенной дополнительной медицинской стратегии для предотвращения рецидива или распространения болезни, и стандартом лечения является наблюдение за его состоянием.
Менее чем через год, в ноябре 2017 г., Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрило первую и единственную адъювантную или послеоперационную поддерживающую терапию для предотвращения рецидивов заболевания: сутент (сунитиниб), таргетный препарат. для взрослых с высоким риском рецидива рака после удаления почки (нефрэктомия).
Наиболее распространенный метод лечения рака почки на ранней стадии, который обычно включает стадии с 1 по 3, включает удаление части или всей пораженной почки с последующим мониторингом дальнейших признаков заболевания. Операция может быть лечебной, если рак ограничен почкой. Назначение сутента в качестве адъювантной терапии или защиты от прогрессирования заболевания не является популярным выбором: только одно исследование показало, что он эффективен для продления времени без признаков заболевания, также известного как безрецидивная выживаемость. До сих пор не было никаких доказательств того, что Сутент в качестве адъювантной терапии продлевает жизнь человека, известную как общая выживаемость. Если существует высокий риск рецидива и рак не является метастатическим, пациенты могут рассмотреть возможность включения в клиническое исследование других таргетных адъювантных препаратов, иммунотерапии или того и другого.
Операция может быть лечебной, если рак ограничен почкой. Назначение сутента в качестве адъювантной терапии или защиты от прогрессирования заболевания не является популярным выбором: только одно исследование показало, что он эффективен для продления времени без признаков заболевания, также известного как безрецидивная выживаемость. До сих пор не было никаких доказательств того, что Сутент в качестве адъювантной терапии продлевает жизнь человека, известную как общая выживаемость. Если существует высокий риск рецидива и рак не является метастатическим, пациенты могут рассмотреть возможность включения в клиническое исследование других таргетных адъювантных препаратов, иммунотерапии или того и другого.
Сутент и аналогичные препараты также могут использоваться пациентами, у которых на момент постановки диагноза обнаружен метастатический ПКР 4 стадии — он распространился на другие части тела. Тем, кто не будет подвергаться хирургическому вмешательству, лекарства могут быть даны в качестве первого лекарства для лечения рака. Для лечения любых очагов заболевания, которые остаются после этого, пациенты могут получить больше сутента или одного из нескольких аналогичных препаратов: Нексавар (сорафениб), Торисел (темсиролимус), Афинитор (эверолимус), Авастин (бевацизумаб), Вотриент (пазопаниб), Инлита ( Акситиниб), Кабометикс (кабозантиниб) и Ленвима (ленватиниб).
Для лечения любых очагов заболевания, которые остаются после этого, пациенты могут получить больше сутента или одного из нескольких аналогичных препаратов: Нексавар (сорафениб), Торисел (темсиролимус), Афинитор (эверолимус), Авастин (бевацизумаб), Вотриент (пазопаниб), Инлита ( Акситиниб), Кабометикс (кабозантиниб) и Ленвима (ленватиниб).
Препараты действуют, препятствуя росту кровеносных сосудов, питающих опухоли, или ингибируя активность белков, способствующих росту раковых клеток. Сутент делает и то, и другое. Известный как ингибитор тирозинкиназы, он блокирует активность белка, известного как VEGF, или фактора роста эндотелия сосудов, и других белков, которые передают сигналы от различных факторов роста.
Но в недавних важных новостях Сутент обещает стать первоначальным средством для лечения большинства пациентов с метастатическим раком почки — независимо от того, считалось ли, что они имеют право на операцию. Исследование CARMENA показало, что у пациентов с операбельным метастатическим поражением, принимавших только Сутент, продолжительность жизни не была хуже, чем у тех, кто перенес удаление почки, а затем принял Сутент. Это означает, что большинство пациентов с метастазами, которым показана операция, могут безопасно пропустить процедуру и просто принимать Сутент.
Это означает, что большинство пациентов с метастазами, которым показана операция, могут безопасно пропустить процедуру и просто принимать Сутент.
КОГДА ПРОВОДИТЬ ВСПОМОГАТЕЛЬНОЕ ЛЕЧЕНИЕ
Это, вероятно, изменит стандарт лечения, который ранее определялся более ранними данными, показывающими, что нефрэктомия улучшает выживаемость у пациентов с метастатическим заболеванием, даже если она не устраняет все заболевание.
Хартштейн узнал, что у него небольшие узелки в легких, в июне 2018 года, через несколько месяцев после операции. Он переехал в Лейквуд, штат Колорадо, и продолжал получать фоновые снимки. Его новый врач, обнаруживший узелки, назначил биопсию и подтвердил наличие метастатического рака.
Прогрессирование от стадии 3 к стадии 4 характерно для пациентов с ПКР. У подгруппы, у которой нет признаков рака на начальных компьютерных томограммах сразу после операции, позже появятся признаки, которые можно увидеть с помощью изображений. Вероятно, это происходит потому, что рак сначала микроскопический, ниже порога обнаружения. «Требуется около миллиарда раковых клеток, чтобы образовать односантиметровое образование, которое можно увидеть на компьютерной томографии», — говорит Мэтью Гальский, доктор медицинских наук, профессор урологии, медицины, гематологии и медицинской онкологии в Медицинской школе Икан на горе Синай и директор онкологии мочеполовой системы в Институте рака Тиша в Нью-Йорке.
«Требуется около миллиарда раковых клеток, чтобы образовать односантиметровое образование, которое можно увидеть на компьютерной томографии», — говорит Мэтью Гальский, доктор медицинских наук, профессор урологии, медицины, гематологии и медицинской онкологии в Медицинской школе Икан на горе Синай и директор онкологии мочеполовой системы в Институте рака Тиша в Нью-Йорке.
Обнаружение этих микроскопических раковых клеток может занять от нескольких месяцев до нескольких лет, поэтому некоторые врачи рекомендуют некоторым пациентам с высоким риском рецидива рассмотреть возможность адъювантного лечения после операции.
СУТЕНТ ДЛЯ ВСПОМОГАТЕЛЬНОЙ ТЕРАПИИ
Пациенты с наибольшим риском метастатического рецидива имеют большие опухоли, выходят за пределы почки или распространяются на близлежащие лимфатические узлы, говорит Лорен Харшман, доктор медицинских наук, доцент медицины Гарвардской медицинской школы. и соруководитель программы рака почки и старший врач Института рака Дана-Фарбер в Бостоне.
До недавнего времени не существовало одобренного FDA препарата для адъювантной терапии ПКР у пациентов с ранней стадией заболевания, и хотя Sutent получил зеленый свет, врачи говорят, что его обычно не назначают для этой цели. «Общий уровень энтузиазма по этому поводу в сообществе не очень высок», — говорит Эрик Джонаш, доктор медицинских наук, профессор отделения мочеполовой онкологии в Онкологическом центре Андерсона Техасского университета в Хьюстоне.
Те, кто принимает Сутент после операции, получают тот же годовой режим, что и при лечении метастазов: 50 мг в день перорально в течение четырех недель приема и двух недель перерыва. «Будет ли это терпимо — вопрос», — говорит Йонаш. «Если вы посмотрите на данные клинических испытаний, вы увидите, что значительное количество людей снижают дозу или прекращают лечение». Это связано с побочными эффектами, которые могут включать диарею, усталость, высокое кровяное давление, ладонно-подошвенный синдром, язвы во рту и расстройство желудочно-кишечного тракта.
Врачи также могут сомневаться в том, чтобы рекомендовать Сутент в этом случае, потому что только одно клиническое испытание, S-TRAC, показало положительный эффект. «S-TRAC — единственное исследование в истории рака почки, которое показало улучшение безрецидивной выживаемости на один год по сравнению с плацебо у пациентов с очень высоким риском заболевания на 3 стадии. Это не показало общего преимущества в выживаемости, хотя авторы утверждают, что данные должны быть зрелыми», — говорит Крис Вуд, доктор медицинских наук, заместитель заведующего отделением урологии хирургического отделения MD Anderson.
Несмотря на то, что один из пациентов Гальски прошел год адъювантной терапии Сутент, Джонаш и Вуд говорят, что ни один из их пациентов не принимал его в таких условиях. «Это супер токсично в рекомендуемых дозах. Это очень дорого. Он показал разницу в один год в (безрецидивной выживаемости или времени от лечения до прогрессирования заболевания), но не в общей выживаемости. Если ты не проживешь дольше, какой в этом прок?» — спрашивает Вуд. «Если бы у меня был рак почки 3 стадии, я бы не принимал сунитиниб».
«Если бы у меня был рак почки 3 стадии, я бы не принимал сунитиниб».
Некоторые исследователи предполагают, что этот тип адъювантной терапии работает путем замедления уже существующих микроскопических метастазов, тем самым откладывая диагностику прогрессирования, но без перспективы улучшения выживаемости. Многие считают, что необходимы лекарства, которые оказывают большее влияние на метастатическое заболевание, предполагая, что эти лекарства также будут лучше работать в качестве адъювантных препаратов, обеспечивая больше излечений и продлевая жизнь.
Перед тем, как FDA одобрило Сутент, в ходе опроса, проведенного Альянсом по исследованию рака почки, было опрошено 450 пациентов на всех стадиях ПКР, при каких условиях они будут использовать какой-либо вид адъювантной терапии. Результаты, представленные на Ежегодном собрании Американского общества клинической онкологии в этом году, показали, что 54,7% респондентов были бы готовы принимать адъювантное лекарство, чтобы отсрочить или предотвратить рецидив — даже перед лицом токсичности: 24,2% — только в том случае, если бы были доказаны общее преимущество выживания; 16,9процент, если препарат был связан с умеренной токсичностью; и 13,6% независимо от уровня токсичности. Между тем, 28 процентов респондентов заявили, что им потребуется дополнительная информация, прежде чем принимать решение, 8,2 процента сообщили, что будут использовать адъювантную терапию только в случае отсутствия токсичности, а 3,8 процента заявили, что не будут использовать такой препарат.
Между тем, 28 процентов респондентов заявили, что им потребуется дополнительная информация, прежде чем принимать решение, 8,2 процента сообщили, что будут использовать адъювантную терапию только в случае отсутствия токсичности, а 3,8 процента заявили, что не будут использовать такой препарат.
ЛОРЕ ЛОГЛИН не нравилась идея наблюдать и ждать после ее первоначального лечения рака почки. — ФОТО ДЕЙРДРЕ РАКУС
После того, как в 2016 году у Лауры Лафлин был диагностирован ПКР 3-й стадии, и ей удалили почку и 24-сантиметровую опухоль, она думала, что у нее нет рака. Врачи планировали использовать активное наблюдение со сканированием каждые три месяца. Несколько недель спустя они заметили узлы щитовидной железы, которые оказались раковыми. Хотя Лафлин понимает, что, учитывая короткий промежуток времени между ее операцией и диагнозом метастатического рака, ей, вероятно, не помог бы адъювантный Сутент, ей не нравится идея наблюдать и ждать. Тем не менее, в то время без каких-либо одобренных адъювантных методов лечения врачи не рекомендовали дополнительную терапию после того, как ей сделали облучение узлов. «Это самая сложная часть для меня. Я почувствовал, что активно перестал бороться», — говорит руководитель проекта по информационным технологиям из Норт-Графтона, штат Массачусетс. «Мысль о том, чтобы ничего не делать, заставляет меня задуматься».
«Это самая сложная часть для меня. Я почувствовал, что активно перестал бороться», — говорит руководитель проекта по информационным технологиям из Норт-Графтона, штат Массачусетс. «Мысль о том, чтобы ничего не делать, заставляет меня задуматься».
С другой стороны, Лафлин признает, что если бы она приняла Сутент, ее жизнь могла бы быть совсем другой из-за побочных эффектов. «У меня было два хороших года, и если бы я принимала Сутент, у меня могло быть другое качество жизни», — говорит она.
СУТЕНТ В СРАВНЕНИИ С КЛИНИЧЕСКИМИ ИССЛЕДОВАНИЯМИ ПО АДЬЮВАНТНОЙ ТЕРАПИИ
Без улучшения общей выживаемости и от 30 до 40 процентов пациентов, прекращающих прием сутента раньше из-за токсичности, врачи и пациенты должны подумать, является ли это лучшим лечением для них, говорит Харшман. Возможно, было бы лучше наблюдать за болезнью и лечить только в случае рецидива рака, что позволит избежать токсичности для пациентов, у которых может никогда не быть рецидива.
Многочисленные клинические испытания рассматривают различные таргетные и иммунотерапевтические агенты в качестве адъювантной терапии. «Адъювантная терапия была святым Граалем в исследованиях рака почки», — говорит Вуд.
«Адъювантная терапия была святым Граалем в исследованиях рака почки», — говорит Вуд.
Харшман соглашается, отмечая, что исследователи проводят рандомизированные испытания потенциальных адъювантных методов лечения почечно-клеточного рака уже более 30 лет, но без особого успеха. Она надеется, что это изменится с исследованием PROSPER, главным исследователем которого она является. Его подход — «адъювантная терапия с изюминкой», — говорит она, потому что перед операцией будет назначена лекарственная терапия — стратегия, которая является новой для ПКР, но эффективна при других видах рака, таких как рак молочной железы и мочевого пузыря. Пациенты в контрольной группе получают только хирургическое вмешательство, а пациенты в исследуемой группе получают дозы иммуностимулирующей терапии Опдиво (ниволумаб) до операции на почках и в течение девяти месяцев после нее. «(Агент) активирует борющиеся с раком Т-клетки, пока опухоль находится на месте, поэтому они могут лучше распознавать микрометастатический рак после удаления первичной опухоли», — говорит Харшман. Затем Opdivo продолжает помогать Т-клеткам размножаться, чтобы они могли распознавать и убивать микроскопические раковые клетки, которые распространились за пределы почки и операционного поля.
Затем Opdivo продолжает помогать Т-клеткам размножаться, чтобы они могли распознавать и убивать микроскопические раковые клетки, которые распространились за пределы почки и операционного поля.
У пациентов с неметастатическим раком почки высокого риска есть особенно веская причина рассмотреть возможность участия в клинических испытаниях адъювантной терапии: «Если их болезнь вернется, у нас не так много методов лечения для них», — говорит Харшман.
Принятие решения о подходе к лечению после постановки диагноза ПКР 2 или 3 стадии зависит от личных предпочтений, и, по словам Харшмана, пациенты должны знать о плюсах и минусах каждого варианта. По ее словам, адъювантный сутент предназначен для пациентов, которые очень мотивированы делать все, что в их силах. Те, кто не хочет вмешательства, если оно не является абсолютно необходимым, выбирают активное наблюдение с помощью сканирования с лечением только в том случае, если рак вернется.
«Есть группа пациентов, которые говорят: «Если в этих условиях ничего не доказано и потенциально (что) меня можно вылечить только хирургическим путем, я бы предпочел ничего не предпринимать», — отмечает Гальски.
Участие в клинических испытаниях новейших иммунотерапевтических средств сопряжено с некоторым риском, поскольку нет никакой гарантии, что вас поместят в группу лечения, а не в группу контроля (плацебо или стандарт лечения). Тем не менее, по словам Гальски, это может быть шанс, которым стоит воспользоваться. «(Испытания) явно являются наиболее важным вариантом в этих условиях прямо сейчас, поскольку мы десятилетиями обходились без адъювантной терапии с определенно доказанной пользой», — говорит он. Новый класс иммунотерапевтических препаратов, известных как ингибиторы контрольных точек, помог пациентам с метастазами и привел к серьезным изменениям в лечении; он добавляет, что большая часть пациентов переносит их лучше, чем ингибиторы тирозинкиназы VEGF.
Тем не менее, еще слишком рано предсказывать какие-либо перспективы в клинических испытаниях адъювантной терапии, которые сейчас проходят, говорит Йонаш, и результаты могут быть получены через годы. В то же время данные S-TRAC по общей выживаемости при применении адъювантного сутента могут стать более зрелыми и дать больше информации.
Учитывая разногласия с данными по адъювантному сутенту, отсутствие общей пользы для выживания и потенциально значительную токсичность, снижающую качество жизни, Харшман обычно рекомендует своим пациентам проводить текущие клинические испытания или проводить тщательное наблюдение.
Выжившая и защитник пациентов ДЕБОРА МАСКЕНС советует другим не позволять тревоге влиять на их решения о лечении. — ФОТО ПРЕДОСТАВЛЕНО ДЕБОРОЙ МАСКЕНС
Дебора Маскенс из Гвельфа, Онтарио, Канада, также дает советы пациентам с ПКР, которые принимают решения о лечении. В 1996 году у Маскенса был диагностирован метастатический ПКР, и теперь он является защитником прав пациентов. Она является соучредителем организации Kidney Cancer Canada и является единственным пациентом в Целевой группе по лечению заболеваний почек Национального института рака.
ИСПЫТАНИЕ КАРМЕНЫ
Маскенс призывает пациентов, которые боятся наблюдать и ждать, не позволять беспокойству влиять на их решения и, при необходимости, обращаться за лечением дистресса. Они также должны изучить свои индивидуальные шансы на рецидив и рассмотреть возможность получения второго мнения. После этого, по ее словам, пациенты могут решить для себя, стоят ли того потенциальные побочные эффекты лечения и логистика, связанная с конкретными клиническими испытаниями. Это компромисс, говорит она, без правильного или неправильного ответа.
Они также должны изучить свои индивидуальные шансы на рецидив и рассмотреть возможность получения второго мнения. После этого, по ее словам, пациенты могут решить для себя, стоят ли того потенциальные побочные эффекты лечения и логистика, связанная с конкретными клиническими испытаниями. Это компромисс, говорит она, без правильного или неправильного ответа.
Sutent, тем временем, кажется, готов внести свой самый большой непосредственный вклад в лечение не в качестве адъювантного лечения, а в качестве начального лечения для пациентов с метастатическим ПКР. Результаты исследования CARMENA произвели фурор в сообществе RCC.
В ходе исследования рассматривался вопрос об удалении части или всей почки у пациентов с операбельным метастатическим ПКР во время постановки диагноза перед введением Сутента. В ходе исследования 450 пациентов были случайным образом распределены для получения препарата либо без хирургического вмешательства, либо после нефрэктомии. Обычно хорошими кандидатами на нефрэктомию считаются пациенты с относительно хорошим здоровьем, без метастазов в мозг, печень или кости, но «CARMENA поставила это под сомнение», — говорит Вуд.
Исследование показало, что у тех, кто получал только Сутент, общая выживаемость не была хуже, чем у тех, кто перенес операцию, а затем Сутент. «Результаты оказались противоположными тому, что мы все ожидали, — говорит Харшман. Отчасти это связано с тем, что несколько лет назад в исследовании метастатического рака почки оценивали интерферон, иммунотерапию старшего поколения, с нефрэктомией или без нее, говорит Харшман. Результаты этого исследования показали шестимесячную пользу от хирургического вмешательства в сочетании с интерфероном. «Когда у нас появилась более эффективная таргетная терапия, мы продолжали проводить циторедуктивную терапию (частичное или полное удаление почки), но без доказательств того, что она все еще была необходима», — говорит она.
Кроме того, исторически сложилось так, что рак почки является одним из немногих видов рака, при котором операция проводится на органе, несмотря на наличие метастазов, говорит Гальски. Он сравнивает это с тушением лесного пожара и усердной работой по удалению дерева, вызвавшего пожар, вместо того, чтобы атаковать распространяющееся пламя. Лечение метастатического ПКР проводится таким образом по трем причинам: появление опухолей на сканограммах настолько характерно, что биопсия и удаление выполняются одновременно; исходя из анатомии, опухоль часто большая, но метастатическая нагрузка невелика; симптомы могут потребовать удаления почки.
Лечение метастатического ПКР проводится таким образом по трем причинам: появление опухолей на сканограммах настолько характерно, что биопсия и удаление выполняются одновременно; исходя из анатомии, опухоль часто большая, но метастатическая нагрузка невелика; симптомы могут потребовать удаления почки.
Испытание CARMENA снижает энтузиазм в отношении рутинного удаления опухолей почек, но Гальски говорит, что он все еще считает, что хирургия играет роль у некоторых пациентов с симптомами. «Это решение должно быть индивидуальным», — говорит он, и Харшман, Вуд и Йонаш соглашаются.
Так было с Уильямом Физелем, у которого метастатический рак почки был диагностирован в 2013 году, когда ему было 58 лет. У инженера-строителя из Преривилля, штат Луизиана, были боли в животе и опухоль размером с кулак в правой почке, вызывающая тромбозы, тромбы. в венальную артерию. «Поскольку масса была такой большой, она проникала в главный кровеносный сосуд. Это должно было выйти наружу», — говорит Физел. Незадолго до публикации результатов CARMENA врачи уже начали более тщательно отбирать пациентов с метастатическим ПКР для операций на почках.
Незадолго до публикации результатов CARMENA врачи уже начали более тщательно отбирать пациентов с метастатическим ПКР для операций на почках.
«Мы уже начали переходить к подходу к циторедуктивной нефрэктомии, основанному на оценке рисков и здравом смысле, — говорит Йонаш. Цель состоит в том, чтобы предотвратить вред тем людям, которым не следует удалять почку. «Подавляющее большинство врачей, которых я знаю и с которыми работаю, до сих пор считают, что нефрэктомия играет определенную роль, — говорит Вуд. «Если вы не погрузитесь в данные, вы можете получить сообщение о том, что пациентам не нужна операция».
К операции никогда нельзя относиться легкомысленно, поэтому важно выбирать пациентов, у которых, вероятно, все будет хорошо. Любая операция сопряжена с риском; плюс, это влияет на сроки лечения. Пациентам приходится восстанавливаться после операции, и им может потребоваться 30 или более дней, чтобы начать системное лечение, зная, что у них есть метастазы. «Я не знаю, насколько эти задержки влияют на результаты, — говорит Гальски.
Независимо от того, является ли рак у пациента метастатическим или нет, в какой-то момент болезнь может распространиться. Опять же, лучший курс лечения — это индивидуальное решение. Лафлин входит в число тех, кому нравится идея включения пациентов в исследования.
«Я нахожу клинические испытания интересными, — говорит она. «Я думаю, что клиническое испытание — это шанс получить лучшее лечение. Сейчас существует гораздо больше методов лечения, чем пять-десять лет назад. Я воодушевлен. Испытание — это шанс помочь. Моя реальность такова, что я на четвертой стадии. Я сделаю все, что в моих силах, чтобы помочь другим не попасть на четвертую стадию».
Электронная версия этой статьи отличается от печатной версии. Эта версия включает дополнительные сведения об опросе, проведенном Альянсом по исследованию рака почки, которые более полно сообщают о его результатах.
Ингибирование потока аутофагии гингеролом усиливает TRAIL-индуцированную гибель опухолевых клеток различных опухолевых клеток, но не в нормальных клетках.
 Гингерол — основной компонент имбиря, обладающий противовоспалительным и противоопухолевым действием. Поток аутофагии — это полный процесс аутофагии, при котором аутофагосомы лизируются лизосомами. Роль аутофагии в гибели или выживании клеток является спорной. А549клетки аденокарциномы устойчивы к TRAIL. В настоящем исследовании мы показали, что лечение TRAIL незначительно индуцировало гибель клеток, но лечение гингеролом усиливало TRAIL-индуцированную гибель клеток рака легких человека. Комбинация гингерола и TRAIL увеличивала накопление связанного с микротрубочками белка легкой цепи 3-II и р62, подтверждая подавление потока аутофагии. В совокупности наши результаты свидетельствуют о том, что гингерол повышает чувствительность клеток рака легкого человека к TRAIL-индуцированному апоптозу путем ингибирования потока аутофагии.
Гингерол — основной компонент имбиря, обладающий противовоспалительным и противоопухолевым действием. Поток аутофагии — это полный процесс аутофагии, при котором аутофагосомы лизируются лизосомами. Роль аутофагии в гибели или выживании клеток является спорной. А549клетки аденокарциномы устойчивы к TRAIL. В настоящем исследовании мы показали, что лечение TRAIL незначительно индуцировало гибель клеток, но лечение гингеролом усиливало TRAIL-индуцированную гибель клеток рака легких человека. Комбинация гингерола и TRAIL увеличивала накопление связанного с микротрубочками белка легкой цепи 3-II и р62, подтверждая подавление потока аутофагии. В совокупности наши результаты свидетельствуют о том, что гингерол повышает чувствительность клеток рака легкого человека к TRAIL-индуцированному апоптозу путем ингибирования потока аутофагии.Введение
Индуцирующий апоптоз фактор некроза опухоли
лиганд (TRAIL) представляет собой цитокин, член фактора некроза опухоли
семейство и селективный индуктор апоптоза в ряде опухолевых
клетки (1). привязка TRAIL к своему
рецепторов приводит к активации рецепторов смерти (DR), включая
DR4 или DR5, чтобы индуцировать тримеризацию рецептора и рекрутировать
Fas-ассоциированный белок домена смерти, который приводит к активации
каскада каспаз (каспазы-8, -9, -10 и -3) для передачи
сигнал гибели клеток (2,3). TRAIL — многообещающее противораковое средство
со способностью избирательно индуцировать апоптоз в различных опухолях,
но не в большинстве нормальных клеток (4).
Однако А549клетки проявляют устойчивость к апоптотическим эффектам
ТРЕЙЛ (5).
привязка TRAIL к своему
рецепторов приводит к активации рецепторов смерти (DR), включая
DR4 или DR5, чтобы индуцировать тримеризацию рецептора и рекрутировать
Fas-ассоциированный белок домена смерти, который приводит к активации
каскада каспаз (каспазы-8, -9, -10 и -3) для передачи
сигнал гибели клеток (2,3). TRAIL — многообещающее противораковое средство
со способностью избирательно индуцировать апоптоз в различных опухолях,
но не в большинстве нормальных клеток (4).
Однако А549клетки проявляют устойчивость к апоптотическим эффектам
ТРЕЙЛ (5).
Биохимические и фармакологические свойства
гингерол, натуральный компонент имбиря, включает антиоксидант,
противовоспалительное и противоопухолевое действие (6,7).
Лечение гингеролом приводит к повреждению митохондрий и ингибирует
пути выживания клеток в клетках колоректального рака (8). Гингерол обладает противоопухолевым действием.
вызывая апоптоз в опухолевых клетках (9–11).
Однако точный молекулярный механизм индукции апоптоза
гингерол остается неизвестным.
Аутофагия — механизм самодеградации
отвечает за гибель и выживание клеток (12). Поток аутофагии является полным
процесс аутофагии, начинающийся с образования аутофагосом вокруг
груз, слияние аутофагосомы с лизосомой и
деградация и переработка груза (13,14).
Ассоциированный с микротрубочками белок 1 легкой цепи 3 β (также называемый
ATG8), убиквитинподобный белок, необходим для
образование аутофагосом и широко используется в качестве маркера аутофагии.
(15,16). p62/SQSTM1, также известный как
убиквитин-связывающий белок, встраивается в аутофагосому путем
напрямую прикрепляется к LC3-II и разрушается путем аутофагии (17). Ингибирование аутофагии увеличивает р62
уровни (18). Многие противораковые препараты
активировать аутофагию, что приводит к неконтролируемым опухолям (19–21).
Недавние исследования показали, что фармакологически или генетически
ингибирование аутофагии усиливает эффекты лучевой терапии и
химиотерапия (22–24), предполагая, что ингибирование аутофагии
является благоприятной стратегией лечения рака. Противомалярийные и
препараты против ревматоидного артрита (хлорохин) действуют как аутофагия
ингибиторы во время терапии рака (25,26).
Хлорохин предотвращает закисление лизосом и сливается с
аутофагосомы в результате деградации метаболического стресса
продукты, тем самым индуцируя апоптоз (27–30).
Противомалярийные и
препараты против ревматоидного артрита (хлорохин) действуют как аутофагия
ингибиторы во время терапии рака (25,26).
Хлорохин предотвращает закисление лизосом и сливается с
аутофагосомы в результате деградации метаболического стресса
продукты, тем самым индуцируя апоптоз (27–30).
Наше исследование показало, что гингерол повышает чувствительность TRAIL-индуцированный апоптоз в TRAIL-резистентных клетках A549 путем ингибирования поток аутофагии. Лечение только гингеролом или TRAIL не влиять на гибель клеток; таким образом, мы исследовали, является ли совместное лечение гингерол с TRAIL оказывал большее влияние на легкое A549 клетки аденокарциномы. Мы исследовали сенсибилизирующее действие гингерол на TRAIL-индуцированный апоптоз при аденокарциноме легкого A549 клетки, ингибируя поток аутофагии.
Материалы и методы
Культура клеток
Раковые клетки, происходящие из опухолей легких (A549)
были получены из Американской коллекции типовых культур (Global
Центр биоресурсов, Манассас, Вирджиния, США). Клетки культивировали в
Среда RPMI-1640 (Gibco-BRL, Гранд-Айленд, Нью-Йорк, США) с добавками
с 10% (об./об.) эмбриональной бычьей сыворотки и антибиотиками (100 мкг/мл
пенициллин-стрептомицин). Культуры клеток инкубировали в
атмосфера, содержащая 5% CO2 при 37°C.
Клетки культивировали в
Среда RPMI-1640 (Gibco-BRL, Гранд-Айленд, Нью-Йорк, США) с добавками
с 10% (об./об.) эмбриональной бычьей сыворотки и антибиотиками (100 мкг/мл
пенициллин-стрептомицин). Культуры клеток инкубировали в
атмосфера, содержащая 5% CO2 при 37°C.
Реагенты
Рекомбинантный гингерол был приобретен в Санта-Круз. Biotechnology, Inc. (Санта-Круз, Калифорния, США). ТРЕЙЛ (100 нг/мл) был куплены у Abfrontier (Кымчхон-гу, Сеул, Южная Корея) и хлорохин (10 мкМ) был приобретен у Sigma-Aldrich (St. Луис, Миссури, США).
Тест на жизнеспособность клеток
Клетки A549 высевали при плотности 1,0×10
4 клетки в 12-луночные планшеты и инкубировали при 37°С в течение
24 ч. Клетки А549 предварительно обрабатывали гингеролом в
дозозависимым образом (0, 10, 20 и 40 мкМ). После 12 ч.
предварительная обработка гингеролом, рекомбинантный белок TRAIL (100 нг/мл)
добавляли и совместно инкубировали в течение 2 часов. Клетки также были предварительно обработаны
с хлорохином (10 мкМ) в течение 1 часа, затем гингеролом
лечение. Морфологию клеток сфотографировали под микроскопом.
(инвертированный микроскоп; Nikon, Япония) и жизнеспособность клеток
определяют методом окрашивания кристаллическим фиолетовым. Клетки были
окрашивали красящим раствором (0,5% кристаллический фиолетовый в 30%
этанол и 3% формальдегид) в течение 10 мин при комнатной температуре, промывают
4 раза с PBS и сушили. Затем клетки лизировали 1%
раствор SDS и измеряли при поглощении 550 нм. Клетка
жизнеспособность рассчитывали по относительной интенсивности красителя и
по сравнению с контролем.
Морфологию клеток сфотографировали под микроскопом.
(инвертированный микроскоп; Nikon, Япония) и жизнеспособность клеток
определяют методом окрашивания кристаллическим фиолетовым. Клетки были
окрашивали красящим раствором (0,5% кристаллический фиолетовый в 30%
этанол и 3% формальдегид) в течение 10 мин при комнатной температуре, промывают
4 раза с PBS и сушили. Затем клетки лизировали 1%
раствор SDS и измеряли при поглощении 550 нм. Клетка
жизнеспособность рассчитывали по относительной интенсивности красителя и
по сравнению с контролем.
Вестерн-блоттинг
Лизаты клеток A549 получали путем сбора
клетки, промывая их в холодном PBS, ресуспендируя в лизирующем буфере
[25 мМ HEPES (рН 7,4), 100 мМ ЭДТА, 5 мМ MgCl2, 0,1 мМ
DTT и смесь ингибиторов протеазы] и обработку лизата ультразвуком.
Белки (35 мкг) разделяли на 10–15% SDS геле и
переносится на нитроцеллюлозную мембрану. Через 1 ч инкубации
с буфером для разведения первичных антител 1:1000 (1% молока с
PBS-Tween-20), мембраны были разработаны методом
хемилюминесценция с использованием вторичного антитела. Используемые антитела
для иммуноблоттинга использовали LC3 (Novus Biologicals, Littleton, CO,
США), анти-p62 (Millipore Corp., Милфорд, Массачусетс, США), расщепленный
каспаза-3 (Cell Signaling Technology, Дэнверс, Массачусетс, США) и
β-актин (Sigma-Aldrich). Изображения были исследованы с помощью Fusion-FX7.
система визуализации (Vilber Lourmat, Марн-ла-Валле, Франция).
Используемые антитела
для иммуноблоттинга использовали LC3 (Novus Biologicals, Littleton, CO,
США), анти-p62 (Millipore Corp., Милфорд, Массачусетс, США), расщепленный
каспаза-3 (Cell Signaling Technology, Дэнверс, Массачусетс, США) и
β-актин (Sigma-Aldrich). Изображения были исследованы с помощью Fusion-FX7.
система визуализации (Vilber Lourmat, Марн-ла-Валле, Франция).
Иммуноцитохимия (ICC)
Линии клеток A549 культивировали на стекле
покровное и обработанное гингеролом, хлорохином и/или TRAIL,
промывали PBS и фиксировали 3–4% параформальдегидом в PBS в течение 15
мин при комнатной температуре. Затем клетки дважды промывали во льду.
холодный PBS, образцы инкубировали в течение 10 мин в PBS, содержащем
0,25% Тритон Х-100 и клетки промывали PBS 3 раза в течение 5
мин. Клетки блокировали 1% BSA в PBST в течение 30 мин.
инкубировали с первичными антителами (LC3 и анти-p62, разведенными в
1% BSA в PBST) во влажной камере в течение 1 ч при комнатной температуре
или в течение ночи при 4°С раствор декантировали, а затем клетки
промывали PBS 3 раза по 5 мин. Клетки инкубировали
снова с вторичным антителом в 1% BSA в течение 1 ч при комнатной температуре.
температуру в темноте и раствор вторичного антитела
декантируют и промывают PBS 3 раза по 5 мин. Клетки были
инкубировали с DAPI в течение 1 мин и промывали PBS. Наконец,
клетки монтировали с флуоресцентной посадочной средой и
визуализируется с помощью флуоресцентного микроскопа.
Клетки инкубировали
снова с вторичным антителом в 1% BSA в течение 1 ч при комнатной температуре.
температуру в темноте и раствор вторичного антитела
декантируют и промывают PBS 3 раза по 5 мин. Клетки были
инкубировали с DAPI в течение 1 мин и промывали PBS. Наконец,
клетки монтировали с флуоресцентной посадочной средой и
визуализируется с помощью флуоресцентного микроскопа.
Статистический анализ
Непарный t-критерий или поправка Уэлча были используется для сравнения двух групп. Для множественного сравнения, использовался однофакторный дисперсионный анализ с последующим тестом Тьюки-Крамера. Все статистический анализ проводили с использованием программного обеспечения GraphPad Prism. Результаты считались статистически значимыми для значений *P<0,05, **P<0,01.
Результаты
Гингерол усиливает TRAIL-индуцированный апоптоз в клетках A549
Мы исследовали эффекты совместного лечения гингеролом
на TRAIL-индуцированный апоптоз в A549клетки аденокарциномы легкого. клетки предварительно обрабатывали указанными дозами гингерола в течение 12 ч.
и обрабатывали белком TRAIL в течение дополнительных 2 часов. Мы
сфотографировали клетки, чтобы исследовать клеточную морфологию
изменения с помощью светового микроскопа и анализа кристаллического фиолетового. В качестве
показано на рис. 1, обработка TRAIL
сам по себе либо не вызывал, либо лишь незначительно индуцировал гибель клеток,
что указывает на то, что клетки A549 обладают высокой устойчивостью к
TRAIL-индуцированный апоптоз, но гингерол усиливает TRAIL-индуцированный апоптоз
апоптоз дозозависимым образом. Морфология клеток также
подтвердили этот усиленный эффект гингерола, показав, что
комбинация TRAIL и гингерола увеличила количество
апоптотические клетки по сравнению с гингеролом или только TRAIL
(рис. 1А). ТРЕЙЛ и гингерол
совместное лечение снижало жизнеспособность клеток и значительно увеличивало
апоптоз в A549клетки (рис.
1В и С). Эти результаты показывают, что гингерол увеличивает
TRAIL-индуцированный апоптоз в TRAIL-резистентных клетках A549.
клетки предварительно обрабатывали указанными дозами гингерола в течение 12 ч.
и обрабатывали белком TRAIL в течение дополнительных 2 часов. Мы
сфотографировали клетки, чтобы исследовать клеточную морфологию
изменения с помощью светового микроскопа и анализа кристаллического фиолетового. В качестве
показано на рис. 1, обработка TRAIL
сам по себе либо не вызывал, либо лишь незначительно индуцировал гибель клеток,
что указывает на то, что клетки A549 обладают высокой устойчивостью к
TRAIL-индуцированный апоптоз, но гингерол усиливает TRAIL-индуцированный апоптоз
апоптоз дозозависимым образом. Морфология клеток также
подтвердили этот усиленный эффект гингерола, показав, что
комбинация TRAIL и гингерола увеличила количество
апоптотические клетки по сравнению с гингеролом или только TRAIL
(рис. 1А). ТРЕЙЛ и гингерол
совместное лечение снижало жизнеспособность клеток и значительно увеличивало
апоптоз в A549клетки (рис.
1В и С). Эти результаты показывают, что гингерол увеличивает
TRAIL-индуцированный апоптоз в TRAIL-резистентных клетках A549.
Рисунок 1 апоптоз в клетках А549. Клетки А549 предварительно обрабатывали гингерол дозозависимым образом (0, 10, 20 и 40 мкМ) в течение 12 ч, а затем обрабатывали 100 нг/мл белка TRAIL в течение дополнительные 2 ч. Морфологию клеток фотографировали при свете микроскоп (×100) (А), а жизнеспособность клеток измеряли с помощью кристалла фиолетовая проба (B). Гистограмма показывает среднюю плотность краситель кристаллический фиолетовый (С). *Р<0,05, **P<0,01, достоверные различия между контролем и каждой лечебной группы. Джин, гингерол; ТРЕЙЛ, некроз опухоли связанный с фактором (TNF) лиганд, индуцирующий апоптоз. |
Гингерол ингибирует поток аутофагии в легких клетки аденокарциномы
Для изучения влияния гингерола на аутофагию
flux мы обработали клетки А549 гингеролом в зависимости от дозы.
в течение 12 часов и с TRAIL еще 2 часа. Все клетки
лизаты подвергали вестерн-блоттингу для определения
изменения в LC3-II и p62. Экспрессия LC3-II является маркером
полные аутофагосомы. р62 — убиквитин-связывающий белок.
участвует в лизосомной или протеасомозависимой деградации белков.
Лечение повышением концентрации гингерола в течение 12 ч привело к
в дозозависимом увеличении уровней LC3-II и p62 в A549клетки (рис. 2А). Графики плотности
уровней белка в LC3-II и p62 также зависели от дозы.
изменились (рис. 2B и C).
комбинированное лечение TRAIL и гингеролом усилило LC3-II и p62
уровни по сравнению с уровнями только гингерола или TRAIL (рис. 2D). Графики плотности белка
уровни в LC3-II и p62 также были повышены при комбинированном TRAIL и
лечение гингеролом (рис. 2E и F).
Результаты ICC показали, что совместное лечение гингеролом с TRAIL
повышенные уровни белков LC3-II и p62 по сравнению с таковыми у
только лечение гингеролом или TRAIL (рис.
2Г).
Экспрессия LC3-II является маркером
полные аутофагосомы. р62 — убиквитин-связывающий белок.
участвует в лизосомной или протеасомозависимой деградации белков.
Лечение повышением концентрации гингерола в течение 12 ч привело к
в дозозависимом увеличении уровней LC3-II и p62 в A549клетки (рис. 2А). Графики плотности
уровней белка в LC3-II и p62 также зависели от дозы.
изменились (рис. 2B и C).
комбинированное лечение TRAIL и гингеролом усилило LC3-II и p62
уровни по сравнению с уровнями только гингерола или TRAIL (рис. 2D). Графики плотности белка
уровни в LC3-II и p62 также были повышены при комбинированном TRAIL и
лечение гингеролом (рис. 2E и F).
Результаты ICC показали, что совместное лечение гингеролом с TRAIL
повышенные уровни белков LC3-II и p62 по сравнению с таковыми у
только лечение гингеролом или TRAIL (рис.
2Г).
Рисунок 2 Гингерол ингибирует поток аутофагии
в клетках аденокарциномы легкого. (A) Клетки аденокарциномы A549
были предварительно обработаны гингеролом дозозависимым образом (0, 10,
20 и 40 мкМ) в течение 12 часов. |
Опосредованное гингеролом усиление TRAIL-индуцированная гибель клеток путем ингибирования потока аутофагии
Мы использовали хлорохин для исследования эффекта
гингерол-опосредованное усиление TRAIL-индуцированной гибели клеток в A549клетки аденокарциномы легкого. Клетки предварительно обрабатывали
указанные дозы гингерола в течение 12 часов, а затем лечили TRAIL
белка в течение дополнительных 2-х часов. Клетки также предварительно обрабатывали
хлорохин в течение 1 часа с последующим лечением гингеролом. Мы сфотографировали
клетки для исследования морфологических изменений с помощью света
микроскопом и методом кристаллического фиолетового. Как показано на рис. 3, обработка клеток A549 либо
TRAIL или гингерол по отдельности немного усиливали гибель клеток, но в сочетании
обработка TRAIL и хлорохином сильно усиливала гибель клеток.
Результаты морфологии клеток также подтверждают эту усиленную гибель клеток.
действие TRAIL и хлорохина по сравнению с гингеролом или
TRAIL отдельно (рис. 3A). Комбинированный
обработка хлорохином и TRAIL снижала жизнеспособность клеток и
значительно увеличилась гибель клеток в A549раковые клетки легкого
(рис. 3В и С). Эти результаты
указывают на то, что опосредованная гингеролом усиленная TRAIL-индуцированная гибель клеток
подавляя поток аутофагии.
Клетки предварительно обрабатывали
указанные дозы гингерола в течение 12 часов, а затем лечили TRAIL
белка в течение дополнительных 2-х часов. Клетки также предварительно обрабатывали
хлорохин в течение 1 часа с последующим лечением гингеролом. Мы сфотографировали
клетки для исследования морфологических изменений с помощью света
микроскопом и методом кристаллического фиолетового. Как показано на рис. 3, обработка клеток A549 либо
TRAIL или гингерол по отдельности немного усиливали гибель клеток, но в сочетании
обработка TRAIL и хлорохином сильно усиливала гибель клеток.
Результаты морфологии клеток также подтверждают эту усиленную гибель клеток.
действие TRAIL и хлорохина по сравнению с гингеролом или
TRAIL отдельно (рис. 3A). Комбинированный
обработка хлорохином и TRAIL снижала жизнеспособность клеток и
значительно увеличилась гибель клеток в A549раковые клетки легкого
(рис. 3В и С). Эти результаты
указывают на то, что опосредованная гингеролом усиленная TRAIL-индуцированная гибель клеток
подавляя поток аутофагии.
Рисунок 3Гингерол опосредует усиление TRAIL-индуцированная гибель клеток путем ингибирования потока аутофагии. А549 Клетки аденокарциномы предварительно обрабатывали гингеролом (40 мкМ). в течение 12 ч, а затем обрабатывали 100 нг/мл белка TRAIL в течение дополнительные 2 ч. Клетки также предварительно обрабатывали хлорохином. в течение 1 ч с последующей обработкой гингеролом. Морфология клеток была сфотографировано световым микроскопом (×100) (А). Жизнеспособность клеток измеряли методом кристаллического фиолетового (В). Гистограмма указывает среднюю плотность красителя кристаллического фиолетового (С). *P<0,05, **P<0,01, достоверно разница между контролем и каждой экспериментальной группой. Джин, гингерол; TRAIL, связанный с фактором некроза опухоли (TNF) лиганд, индуцирующий апоптоз; CQ, хлорохин. |
Опосредованное гингеролом усиление TRAIL-индуцированный путь апоптоза путем ингибирования аутофагии flux
Мы исследовали эффект опосредованного гингеролом
усиление TRAIL-индуцированного пути апоптоза за счет ингибирования
поток аутофагии с хлорохином. Клетки предварительно обрабатывали
указанные дозы гингерола в течение 12 ч и лечились
белок TRAIL в течение дополнительных 2-х часов. Клетки также были предварительно обработаны
с хлорохином (10 мкМ) в течение 1 часа, затем гингеролом
лечение. Как показано на рис. 4А,
Совместное лечение гингеролом и TRAIL повышало уровень LC3-II.
Лечение только хлорохином также значительно повышало уровень LC3-II.
уровень. Комбинированное лечение TRAIL и хлорохином привело к
больше LC3-II по сравнению с гингеролом или только TRAIL.
Совместное лечение гингеролом и TRAIL повышало уровень p62.
Кроме того, комбинированное лечение TRAIL и хлорохином
повышал уровень p62 больше, чем хлорохин или TRAIL
отдельно, подтверждая, что гингерол ингибирует поток аутофагии в A549клетки. Совместное лечение гингеролом и TRAIL ингибировало жизнеспособность клеток.
и значительно усиленный апоптоз в клетках A549. Эти
результаты подтверждены индикатором внутриклеточного апоптоза
расщепленной каспазы-3. Графики плотности уровня белка в
LC3-II, каспаза-3 и р62 также были изменены в комбинированных TRAIL и
лечение хлорохином (рис.
Клетки предварительно обрабатывали
указанные дозы гингерола в течение 12 ч и лечились
белок TRAIL в течение дополнительных 2-х часов. Клетки также были предварительно обработаны
с хлорохином (10 мкМ) в течение 1 часа, затем гингеролом
лечение. Как показано на рис. 4А,
Совместное лечение гингеролом и TRAIL повышало уровень LC3-II.
Лечение только хлорохином также значительно повышало уровень LC3-II.
уровень. Комбинированное лечение TRAIL и хлорохином привело к
больше LC3-II по сравнению с гингеролом или только TRAIL.
Совместное лечение гингеролом и TRAIL повышало уровень p62.
Кроме того, комбинированное лечение TRAIL и хлорохином
повышал уровень p62 больше, чем хлорохин или TRAIL
отдельно, подтверждая, что гингерол ингибирует поток аутофагии в A549клетки. Совместное лечение гингеролом и TRAIL ингибировало жизнеспособность клеток.
и значительно усиленный апоптоз в клетках A549. Эти
результаты подтверждены индикатором внутриклеточного апоптоза
расщепленной каспазы-3. Графики плотности уровня белка в
LC3-II, каспаза-3 и р62 также были изменены в комбинированных TRAIL и
лечение хлорохином (рис. 4B, C
и Д). Результаты ICC показали, что TRAIL и хлорохин
комбинированное лечение повышало уровни LC3-II и р62 по сравнению с
хлорохина или гингерола отдельно (рис. 4E).
4B, C
и Д). Результаты ICC показали, что TRAIL и хлорохин
комбинированное лечение повышало уровни LC3-II и р62 по сравнению с
хлорохина или гингерола отдельно (рис. 4E).
Рисунок 4 Гингерол опосредует усиление
TRAIL-индуцированный путь апоптоза путем ингибирования потока аутофагии.
Клетки А549 предварительно обрабатывали гингеролом (40 мкМ) в течение 12
ч, а затем обрабатывали 100 нг/мл белка TRAIL в течение
дополнительные 2-ч. Клетки также предварительно обрабатывали хлорохином для
1 ч с последующим лечением гингеролом. Клетки собирали и
проанализированы вестерн-блоттингом для определения LC3-II, p62 и
уровни экспрессии активированной каспазы-3 (А). Гистограмма показывает
средние значения LC3-II/LC3-I, Ac-cas3/β-актина и p62/β-актина
соотношение (B, C и D). В качестве контроля загрузки использовали β-актин.
Репрезентативная иммуноцитохимия в A549клетки после
совместное лечение хлорохином (1 ч), гингеролом (12 ч) и 100 нг/мл
ТРЕЙЛА (2 часа) (E). |
Обсуждение
Целью настоящего исследования было изучение действие гингерола и гингерола и совместного лечения TRAIL на ингибирование потока аутофагии и регуляция TRAIL-опосредованного чувствительность к гингеролу в A549клетки аденокарциномы человека. результаты показывают, что гингерол сенсибилизирует TRAIL-индуцированный апоптоз у Клетки аденокарциномы легкого A549 путем ингибирования потока аутофагии.
TRAIL — многообещающее противораковое средство с
способность избирательно запускать апоптоз в различных опухолях, но не
в большинстве нормальных клеток. Терапевтический потенциал TRAIL
проверены в различных клинических испытаниях (31). Для индукции апоптоза требуется
дополнительное лечение другими химиотерапевтическими средствами, которые
однако повреждают нормальные клетки. Гингерол обладает противорвотным действием,
жаропонижающее, противораковое и противовоспалительное действие (32,33).
Кроме того, он не оказывает существенного токсического действия на нормальные клетки, но
уменьшает рост опухоли печени крыс и индуцирует апоптоз через
TNF-α-опосредованный путь (34).
Аутофагия – это механизм самодеградации, отвечающий за
смерть или выживание. Поток аутофагии — это полный процесс
аутофагия и A549пролиферация клеток была нарушена хлорохином,
который является ингибитором аутофагии, предполагая, что клетки A549 могут быть
зависит от пути аутофагии. Лечение
Гингерол обладает противорвотным действием,
жаропонижающее, противораковое и противовоспалительное действие (32,33).
Кроме того, он не оказывает существенного токсического действия на нормальные клетки, но
уменьшает рост опухоли печени крыс и индуцирует апоптоз через
TNF-α-опосредованный путь (34).
Аутофагия – это механизм самодеградации, отвечающий за
смерть или выживание. Поток аутофагии — это полный процесс
аутофагия и A549пролиферация клеток была нарушена хлорохином,
который является ингибитором аутофагии, предполагая, что клетки A549 могут быть
зависит от пути аутофагии. Лечение
повысило уровни LC3-II и p62
по сравнению с контролем за счет ингибирования потока аутофагии (F
Джин и др. (5) показали, что
клетки A549 устойчивы к апоптотическим эффектам TRAIL. Мы
наблюдали, что гингерол или TRAIL по отдельности либо не оказывали, либо только
слегка индуцировала гибель клеток аденокарциномы А549. Однако,
комбинированное лечение гингеролом и TRAIL сильно индуцировало смерть
в А549клетки (рис. 1). Немного
исследования показали, что TRAIL индуцирует аутофагию в различных типах
раковые клетки (35,36). Однако наши результаты показывают, что
лечение возрастающими концентрациями гингерола или только TRAIL
приводило к дозозависимому увеличению уровней LC3-II и p62
в клетках аденокарциномы А549. Комбинированный ТРЕЙЛ и гингерол
рис. 2). Гингерол способствует индуцируемому TRAIL апоптозу при раке желудка
клетки (37). Фармакологический или
генетическое ингибирование аутофагии вызывает смерть при различных видах рака
клеток, и мы исследовали чувствительность A549клетка
пролиферации до фармакологического ингибирования аутофагии с
хлорохин. Совместное лечение гингеролом и TRAIL увеличивало
Уровни LC3-II и p62. Кроме того, комбинация TRAIL и хлорохина
лечение повышало уровни LC3-II и р62 по сравнению с
только хлорохин или гингерол. Эти результаты были подтверждены
индикатором внутриклеточного апоптоза расщепленной каспазой-3 (фиг. 3 и 4).
1). Немного
исследования показали, что TRAIL индуцирует аутофагию в различных типах
раковые клетки (35,36). Однако наши результаты показывают, что
лечение возрастающими концентрациями гингерола или только TRAIL
приводило к дозозависимому увеличению уровней LC3-II и p62
в клетках аденокарциномы А549. Комбинированный ТРЕЙЛ и гингерол
рис. 2). Гингерол способствует индуцируемому TRAIL апоптозу при раке желудка
клетки (37). Фармакологический или
генетическое ингибирование аутофагии вызывает смерть при различных видах рака
клеток, и мы исследовали чувствительность A549клетка
пролиферации до фармакологического ингибирования аутофагии с
хлорохин. Совместное лечение гингеролом и TRAIL увеличивало
Уровни LC3-II и p62. Кроме того, комбинация TRAIL и хлорохина
лечение повышало уровни LC3-II и р62 по сравнению с
только хлорохин или гингерол. Эти результаты были подтверждены
индикатором внутриклеточного апоптоза расщепленной каспазой-3 (фиг. 3 и 4).
В заключение, гингерол индуцирует апоптоз в A549
клетки, ингибируя поток аутофагии. Комбинация гингерола
и TRAIL сильно усиливал апоптоз в TRAIL-устойчивом A549клетки, предполагая, что гингерол сенсибилизирует TRAIL-индуцированный апоптоз
в устойчивых к TRAIL клетках аденокарциномы A549 путем ингибирования
поток аутофагии.
Комбинация гингерола
и TRAIL сильно усиливал апоптоз в TRAIL-устойчивом A549клетки, предполагая, что гингерол сенсибилизирует TRAIL-индуцированный апоптоз
в устойчивых к TRAIL клетках аденокарциномы A549 путем ингибирования
поток аутофагии.
Благодарности
Это исследование было поддержано грантом от Национальный исследовательский фонд Кореи (NRF), финансируемый Корейским Правительство (MISP) (№ 2013R1A4A1069486).
Каталожные номера
1 | Гонсальвес Ф. и Ашкенази А.: новые идеи в передачу сигналов апоптоза с помощью Apo2L/TRAIL. Онкоген. 29: 4752–4765. 2010. Просмотр статьи: Google Scholar: PubMed/NCBI . |
2 | Aggarwal BB: Сигнальные пути Суперсемейство TNF: палка о двух концах. Нат Рев Иммунол. 3: 745–756. 2003. Посмотреть Статья : Google Scholar : PubMed/NCBI |
3 | Bellail AC, Tse MC, Song JH, Phuphanich S,
Olson JJ, Sun SY и Hao C: DR5-опосредованный DISC контролирует каспазу-8
расщепление и инициация апоптоза в глиобластомах человека. |
4 | Беллаил А.С., Ци Л., Маллиган П., Чабра В. и агонисты Hao C: TRAIL в клинических испытаниях для лечения рака: Обещания и вызовы. Rev Недавние испытания Clin. 4:34–41. 2009. Просмотр статьи: Google Scholar: PubMed/NCBI . |
5 | Jin CY, Park C, Hwang HJ, Kim GY, Choi BT, Kim WJ и Choi YH: Нарингенин усиливает выражение смерти рецептор 5 и усиливает TRAIL-индуцированный апоптоз в легких человека рак A549клетки. Мол Нутр Фуд Рез. 55:300–309. 2011. Просмотр статьи : Google Scholar |
6 | Оягбеми А.А., Саба А.Б. и Азиз О.И.:
Молекулярные мишени [6]-гингерола: его потенциальная роль в развитии рака
химиопрофилактика. Биофакторы. |
7 | Шукла И. и Сингх М.: профилактика рака свойства имбиря: краткий обзор. Пищевая химическая токсикол. 45: 683–690. 2007. Просмотр статьи : Google Scholar |
8 | Ли Т.И., Ли К.С., Чен С.И. и Чанг Х.Х.: 6-гингерол ингибирует ROS и iNOS за счет подавления Пути PKC-альфа и NF-kappaB в стимулированных липополисахаридами мышиные макрофаги. Biochem Biophys Res Commun. 382: 134–139. 2009. Просмотр статьи : Академия Google : PubMed/NCBI |
9 | Боде А.М., Ма В.И., Сурх Ю.Дж. и Донг З.: Ингибирование трансформации клеток, вызванной эпидермальным фактором роста активация белка-активатора 1 [6]-гингеролом. Рак Рез. 61:850–853. 2001. PubMed/NCBI |
10 | Чакраборти Д. |
11 | Lee E и Surh YJ: Индукция апоптоза в клетках HL-60 – едкими ваниллоидами, [6]-гингеролом и [6]-парадолом. Рак Летт. 134:163–168. 1998. Просмотр статьи : Google Scholar |
12 | Кремер Г., Мариньо Г. и Левин Б.: Аутофагия и интегрированная реакция на стресс. Мол Ячейка. 40:280–293. 2010. Просмотр статьи: Google Scholar: PubMed/NCBI . |
13 | Мидзусима Н.: Аутофагия: процесс и
функция. Гены Дев. |
14 | Клионский Д.Дж., Абелиович Х., Агостинис П., Агравал Д.К., Алиев Г., Аскью Д.С., Баба М., Бэреке Э.Х., Бахр Б.А., Баллабио А. и др.: Руководство по использованию и интерпретации анализы для мониторинга аутофагии у высших эукариот. Аутофагия. 4: 151–175. 2008. Просмотр статьи: Google Scholar: PubMed/NCBI . |
15 | Накатогава Х., Ичимура Ю. и Осуми Ю.: Atg8, убиквитин-подобный белок, необходимый для аутофагосомы образование, опосредует связывание мембран и гемифузию. Клетка. 130:165–178. 2007. Просмотр статьи: Google Scholar: PubMed/NCBI |
16 | Се Зи, Наир У и Клионский диджей: Atg8
контролирует расширение фагофора во время образования аутофагосом. |
17 | Бьёркёй Г., Ламарк Т., Брех А., Аутзен Х., Перандер М., Оверватн А., Стенмарк Х. и Йохансен Т.: формы p62/SQSTM1 белковые агрегаты расщепляются путем аутофагии и обладают защитным Влияние на гентингтин-индуцированную гибель клеток. Джей Селл Биол. 171: 603–614. 2005. Просмотр статьи : Google Scholar : PubMed/NCBI |
18 | Мидзусима Н. и Ёсимори Т.: Как интерпретировать иммуноблоттинг LC3. Аутофагия. 3: 542–545. 2007. Просмотр статьи : Академия Google : PubMed/NCBI |
19 | Ливси К.М., Танг Д., Зех Х.Дж. и Лотце М.Т.:
Ингибирование аутофагии при комбинированном лечении рака. Текущее мнение
Расследование наркотиков. |
20 | Лю Л, Ян М, Кан Р, Ван З, Чжао И, Ю Y, Xie M, Yin X, Livesey KM, Lotze MT и др.: HMGB1-индуцированный аутофагия способствует резистентности лейкозных клеток к химиотерапии. Лейкемия. 25:23–31. 2011. Просмотр статьи : Google Scholar |
21 | White E и DiPaola RS: обоюдоострый меч модуляции аутофагии при раке. Клин Рак Рез. 15:5308–5316. 2009. Просмотр статьи: Google Scholar: PubMed/NCBI . |
22 | Апель А., Герр И., Шварц Х., Родеманн Х.П. и Mayer A: Заблокированная аутофагия повышает чувствительность резистентных клеток карциномы к радиационная терапия. Рак Рез. 68: 1485–1494. 2008. Просмотр статьи: Google Scholar: PubMed/NCBI . |
23 | Кэрью Дж. |
24 | Бойя П., Гонсалес-Поло Р.А., Касарес Н., Перфеттини Дж.Л., Дессен П., Ларочетт Н., Метивье Д., Мелей Д., Сукер С., Йошимори Т. и др.: Ингибирование макроаутофагии. запускает апоптоз. Мол Селл Биол. 25:1025–1040. 2005. Просмотр статьи: Google Scholar: PubMed/NCBI . |
25 | Сотело Х., Брисеньо Э. и Лопес-Гонсалес М.А.: Добавление хлорохина к традиционному лечению глиобластомы multiforme: рандомизированное двойное слепое плацебо-контролируемое исследование. Энн Интерн Мед. 144:337–343. 2006. Просмотр статьи : Google Scholar : PubMed/NCBI |
26 | Голдберг С. |
27 | Пул Б и Окума С: Эффект слабых оснований на внутрилизосомальный рН перитонеальных макрофагов мышей. J-ячейка биол. 90: 665–669. 1981. Просмотр статьи: Google Scholar: PubMed/NCBI . |
28 | Fan C, Wang W, Zhao B, Zhang S и Miao J: Хлорохин ингибирует рост клеток и вызывает гибель клеток в A549. клетки рака легкого. Биоорг Мед Хим. 14:3218–3222. 2006. Просмотр статьи: Google Scholar: PubMed/NCBI . |
29 | Цзян П. |
30 | Yoon YH, Cho KS, Hwang JJ, Lee SJ, Choi JA и Koh JY: индукция лизосомальной дилатации, остановка аутофагии, и гибель клеток хлорохином в культивируемых клетках ARPE-19. Инвестировать Офтальмол Vis Sci. 51:6030–6037. 2010. Просмотр статьи: Google Scholar: PubMed/NCBI . |
31 | Махалингам Д., Сегезди Э., Кин М., де Йонг S и Samali A: Передача сигналов и модуляция рецептора TRAIL: мы на правильный ТРЕЙЛ? Лечение рака Откр. 35: 280–288. 2009 г.. Просмотр статьи : Академия Google : PubMed/NCBI |
32 | Йошикава М. |
33 | Наказава Т. и Осава К. Метаболизм [6]-гингерол у крыс. Жизнь наук. 70:2165–2175. 2002. Просмотр статьи: Google Scholar: PubMed/NCBI . |
34 | Хабиб С.Х., Макпол С., Абдул Хамид Н.А., Дас С., Нгах В.З. и Юсоф Ю.А.: Экстракт имбиря (Zingiber officinale) обладает противораковое и противовоспалительное действие на индуцированные этионином гепатомы крыс. Клиники (Сан-Паулу). 63:807–813. 2008. Просмотр статьи : Google Scholar |
35 | Сингх К.
|
