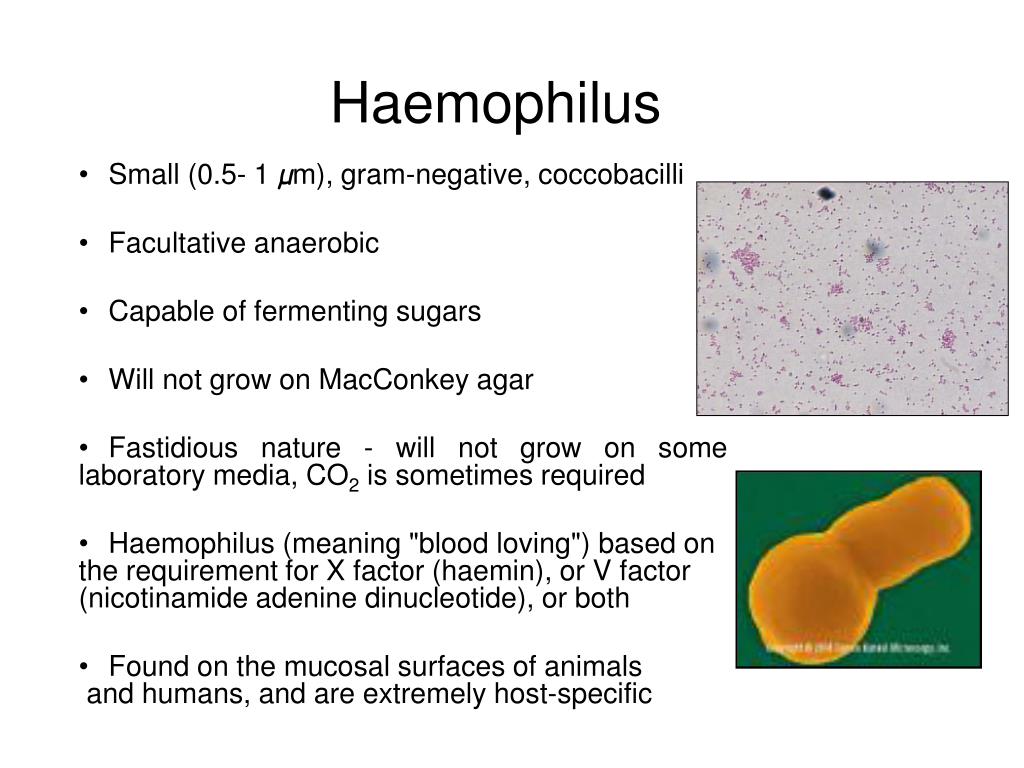
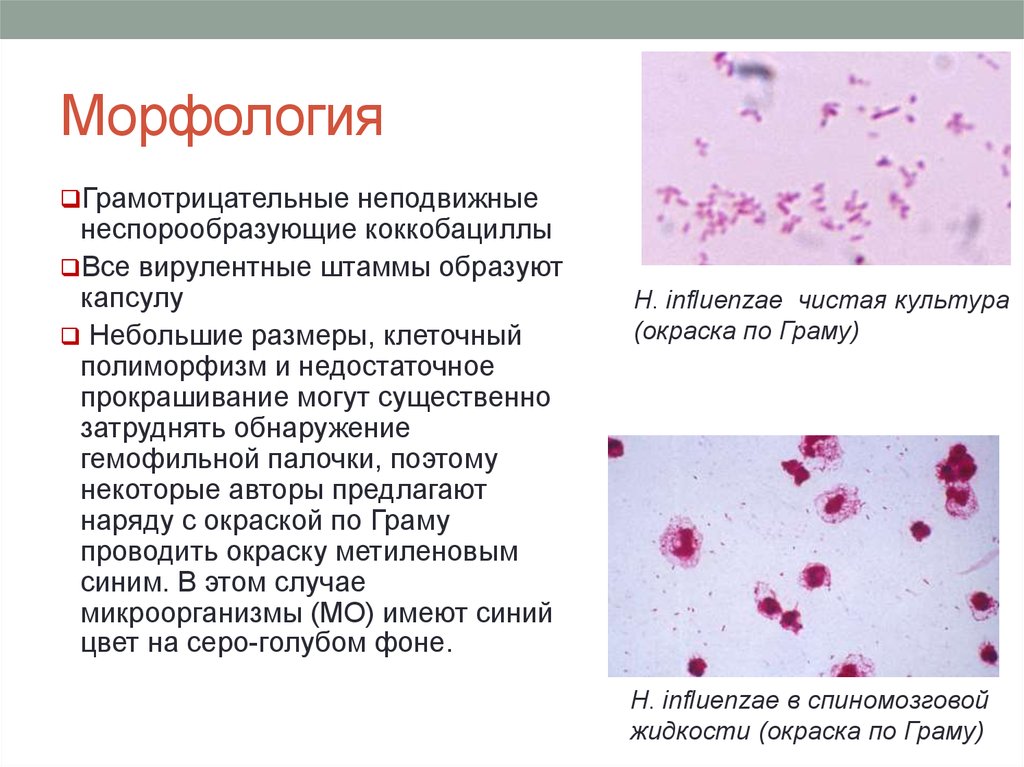
Гемолитическая палочка в зеве: Гемофильная палочка в зеве — Отоларингология — 22.01.2019
Гемофильная инфекция — причины заражения, симптомы, диагностика гемофильной палочки
Опубликовано: 20.02.2017 Обновлено: 06.08.2021 Просмотров: 3025
Зима на исходе, а вы или ваш ребенок никак не можете справиться с насморком и болью в горле? Все лекарства уже перепробованы, а проблемы не отступают? Сколько можно болеть?
Возможно, это не вирус, а гемофильная палочка ‑ гемофилус инфлюенса. Так красиво называют возбудителя респираторных заболеваний, который поражает дыхательные пути и вызывает ряд тяжелых осложнений, включая поражение нервной системы.
Проблема состоит в том, что это заболевание плохо поддается лечению, поскольку возбудитель устойчив к антибиотикам. Поэтому без точной диагностики лечение часто оказывается безрезультатным.
Новое исследование ‑ выделение ДНК возбудителя методом ПЦР ‑ позволяет в кратчайшие сроки диагностировать такого виновника респираторных заболеваний и их осложнений, как Haemophilus influenza.
Источником заражения гемофильной палочкой является человек, причем не только болеющий, но и «здоровый носитель», ‑ пациент с бессимптомным присутствием возбудителя на слизистой дыхательных путей. Именно такие люди представляют наибольшую опасность для окружающих. Механизм передачи заболевания ‑ воздушно-капельный. Это означает, что заражение возможно, если рядом кто-то хотя бы раз чихнул или покашлял.
Начало заболевания гемофильной инфекцией ничем не отличается от обычной «простуды»: кашель, насморк, боль в горле, повышение температуры. Только современная диагностика ‑ выделение ДНК возбудителя методом ПЦР ‑ помогает своевременно начать правильное лечение, не теряя драгоценного времени.
Группы риска людей, которым необходимо пройти данное обследование:
- Малыши в раннем возрасте, у которых еще не сформированы естественные иммунные механизмы защиты (дети до 2 лет).
- Ослабленные, часто болеющие дети, получавшие неоднократные курсы антибактериальных препаратов, страдающие частыми и/или хроническими инфекциями респираторных органов, перенесшие отит или инфекционный мононуклеоз.

- Дети до 6-летнего возраста, посещающие детские дошкольные учреждения.
- Взрослые с хроническими заболеваниями, ожирением, сахарным диабетом, пациенты, проходящие химио- и цитостатическую терапию; лица с синдромом Дауна.
- Пациенты с анемией, развившейся на фоне гиповитаминоза и пониженного иммунитета.
Особенно опасна гемофильная палочка для беременных женщин!
Для удобства диагностики лаборатория СИТИЛАБ включила исследование на гемофильную палочку в состав профильных исследований:
- Респираторного: возбудители инфекций дыхательных путей (вирусные и бактериальные).
- Возбудители бактериальных инфекций дыхательных путей (диагностический профиль).
Эти анализы уже в начале заболевания помогут врачу выбрать правильную тактику лечения, не допустив развития грозных осложнений.
Узнайте уже сегодня, кто стал «виновником» вашего кашля, насморка и повышения температуры!
Карта сайта
Карта сайта
|
|
[Бактерии, часто упускаемые из виду в клинических микробиологических лабораториях: Arcanobacterium haemolyticum]
. 2011 июль; 45 (3): 535-40.
2011 июль; 45 (3): 535-40.
[Статья в Турецкий]
Ахмет Балыкджи 1 , Айнур Э. Топкая, Зелиха Белаш
принадлежность
- 1 Университет Малтепе Медицинский факультет, кафедра медицинской микробиологии, Стамбул, Турция. [email protected]
- PMID:
[Статья в Турецкий]
Ahmet Balıkcı et al. Микробиол бул. 2011 июль
. 2011 июль; 45 (3): 535-40.
Авторы
Ахмет Балыкджи 1 , Айнур Э Топкая, Зелиха Белаш
принадлежность
- 1 Университет Малтепе Медицинский факультет, кафедра медицинской микробиологии, Стамбул, Турция.
 [email protected]
[email protected]
- PMID: 21935787
Абстрактный
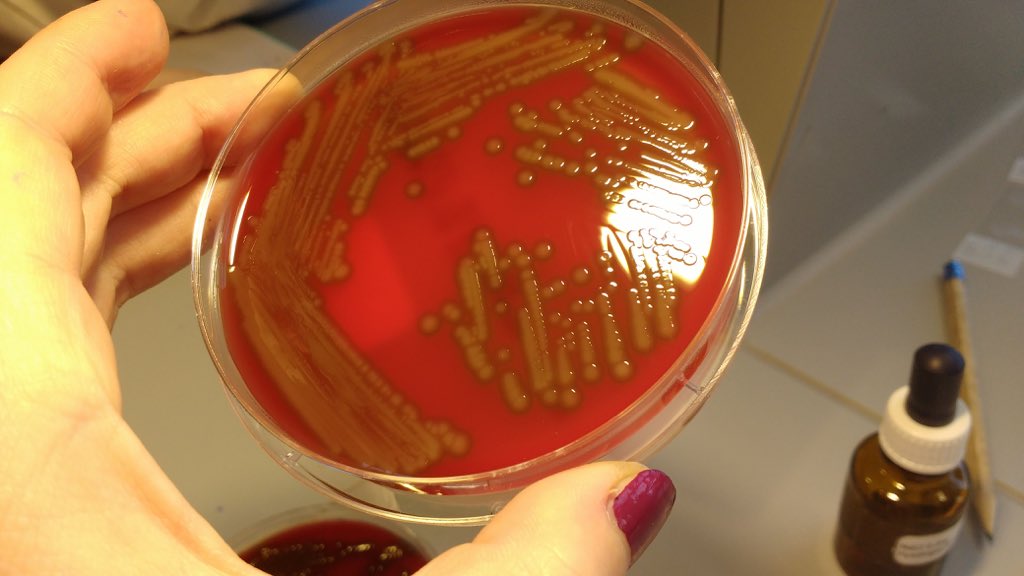
Arcanobacterium haemolyticum, ранее известная как Corynebacterium haemolyticum, представляет собой факультативно-анаэробную грамположительную палочку с отрицательными результатами теста на каталазу и положительными результатами теста на ингибирование цАМФ. Он может быть возбудителем около 0,5-3% острых бактериальных фарингитов, особенно у детей и молодых людей. Поскольку рост A. haemolyticum, как правило, ингибируется представителями флоры и поскольку он медленно развивает гемолиз в агаре с овечьей кровью, а морфология его колоний напоминает бета-гемолитические стрептококки, его часто упускают из виду при оценке посевов из горла. Целью этого исследования было изучение частоты выделения A. haemolyticum из горловых культур педиатрических пациентов с использованием среды с овечьим и человеческим кровяным агаром, а также оценка характеристик этих сред для идентификации A.
 haemolyticum. Все изоляты A. haemolyticum характеризовались образованием бета-гемолиза в агаре с кровью человека через 24 часа, в то время как время образования бета-гемолиза в агаре с овечьей кровью составляло 48 часов для четырех изолятов и 72 часа для трех изолятов. A. haemolyticum был выявлен у 2% детей с тонзиллофарингитом в течение пятимесячного периода исследования весной/летом. Все штаммы были выделены на кровяном агаре человека через 24 часа. Таким образом, для выделения A. haemolyticum в рутинных культурах из горла в клинических микробиологических лабораториях следует использовать чашки с агаром с овечьей кровью вместе с чашками с агаром с человеческой кровью.
haemolyticum. Все изоляты A. haemolyticum характеризовались образованием бета-гемолиза в агаре с кровью человека через 24 часа, в то время как время образования бета-гемолиза в агаре с овечьей кровью составляло 48 часов для четырех изолятов и 72 часа для трех изолятов. A. haemolyticum был выявлен у 2% детей с тонзиллофарингитом в течение пятимесячного периода исследования весной/летом. Все штаммы были выделены на кровяном агаре человека через 24 часа. Таким образом, для выделения A. haemolyticum в рутинных культурах из горла в клинических микробиологических лабораториях следует использовать чашки с агаром с овечьей кровью вместе с чашками с агаром с человеческой кровью.Похожие статьи
Выделение Arcanobacterium haemolyticum из глоточного экссудата у детей.
Коман Г., Панзару К., Дахорея К. Коман Г. и соавт. Бактериол Вирусол Паразитол Эпидемиол.
 1996 г., июль-декабрь; 41 (3-4): 141-4.
Бактериол Вирусол Паразитол Эпидемиол. 1996.
PMID: 9116402
Румынский.
1996 г., июль-декабрь; 41 (3-4): 141-4.
Бактериол Вирусол Паразитол Эпидемиол. 1996.
PMID: 9116402
Румынский.Влияние среды, атмосферы и времени инкубации на колониальную морфологию Arcanobacterium haemolyticum.
Каммингс Л.А., Ву В.К., Ларсон А.М., Гэвин С.Е., Файн Дж.С., Койл М.Б. Каммингс Л.А. и соавт. Дж. Клин Микробиол. 1993 декабрь; 31 (12): 3223-6. doi: 10.1128/jcm.31.12.3223-3226.1993. Дж. Клин Микробиол. 1993. PMID: 8308114 Бесплатная статья ЧВК.
Arcanobacterium haemolyticum фарингит и экзантема. Три клинических случая и обзор литературы.
Гастон Д.А., Журовски С.М. Гастон Д.А. и соавт. Арка Дерматол. 1996 г., январь; 132 (1): 61-4.
 Арка Дерматол. 1996.
PMID: 8546485
Арка Дерматол. 1996.
PMID: 8546485Тяжелый сепсис, вызванный Arcanobacterium haemolyticum: описание случая и обзор литературы.
Террио Б.Л., Дэниелс Л.М., Картер Ю.Л., Рааш Р.Х. Террио Б.Л. и соавт. Энн Фармакотер. 2008 ноябрь;42(11):1697-702. doi: 10.1345/aph.1L294. Epub 2008 23 сентября. Энн Фармакотер. 2008. PMID: 18812563 Обзор.
[Синдром Лемьера, вызванный Arcanobacterium haemolyticum: описание случая и обзор литературы].
Чжан В.Х., Цзи Ю.К., Чжан Ч.Х. Чжан В.Х. и др. Чжунхуа Нэй Кэ За Чжи. 2013 Январь; 52 (1): 42-5. Чжунхуа Нэй Кэ За Чжи. 2013. PMID: 23710815 Обзор. Китайский язык.
Посмотреть все похожие статьи
Цитируется
Фенотипические и генотипические характеристики Arcanobacterium haemolyticum, выделенных из клинических образцов в датской больнице.

Саммра О., Фриис-Мёллер А., Балбутская А., Хиджазин М., Нагиб С., Альбер Дж., Леммлер С., Абдулмавджуд А., Тимке М., Костшева М., Пренгер-Бернингхофф Э. Саммра О и др. Folia Microbiol (Прага). 2014 сен; 59(5):369-74. doi: 10.1007/s12223-014-0308-4. Epub 2014, 16 февраля. Folia Microbiol (Прага). 2014. PMID: 24531868
Типы публикаций
термины MeSH
вещества
Bacillus Cereus — StatPearls — Книжная полка NCBI
Программа непрерывного образования
Bacillus cereus — факультативно анаэробная, токсин-продуцирующая грамположительная бактерия, обнаруженная в почве, растительности и пищевых продуктах. Он обычно вызывает кишечные заболевания с тошнотой, рвотой и диареей. Однако он был связан с серьезными инфекциями у людей с ослабленным иммунитетом и может вызывать септицемию, а также эндофтальмит, который может привести к потере зрения. В этом упражнении описывается оценка и лечение Bacillus cereus, а также рассматривается роль межпрофессиональной команды в лечении пациентов с этим заболеванием.
В этом упражнении описывается оценка и лечение Bacillus cereus, а также рассматривается роль межпрофессиональной команды в лечении пациентов с этим заболеванием.
Цели:
Определите различные типы пищевых продуктов, которые могут содержать Bacillus cereus.
Опишите патофизиологию пищевых инфекций Bacillus cereus.
Обобщите типичный анамнез пациента и результаты медицинского осмотра, связанные с инфекциями Bacillus cereus.
Объясните важность улучшения координации помощи межпрофессиональной бригады для улучшения результатов лечения пациентов, пораженных инфекциями Bacillus cereus.
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Введение
Bacillus cereus — токсин-продуцирующая факультативно анаэробная грамположительная бактерия. Бактерии обычно встречаются в окружающей среде и могут загрязнять пищу. Он может быстро размножаться при комнатной температуре с обильно присутствующим предварительно сформированным токсином. При попадании внутрь этот токсин может вызывать желудочно-кишечные заболевания, что является общеизвестным проявлением болезни. Желудочно-кишечные (ЖК) синдромы, связанные с B. cereus включают диарейные заболевания без выраженных симптомов со стороны верхних отделов кишечника и синдром преимущественно верхних отделов желудочно-кишечного тракта с тошнотой и рвотой без диареи. B. cereus также вызывает инфекции глаз, дыхательных путей и ран. Патогенность B. cereus , кишечной или некишечной, тесно связана с продукцией разрушающих ткани экзоферментов. Среди этих секретируемых токсинов гемолизины, фосфолипазы и протеазы.[1][2]
Он может быстро размножаться при комнатной температуре с обильно присутствующим предварительно сформированным токсином. При попадании внутрь этот токсин может вызывать желудочно-кишечные заболевания, что является общеизвестным проявлением болезни. Желудочно-кишечные (ЖК) синдромы, связанные с B. cereus включают диарейные заболевания без выраженных симптомов со стороны верхних отделов кишечника и синдром преимущественно верхних отделов желудочно-кишечного тракта с тошнотой и рвотой без диареи. B. cereus также вызывает инфекции глаз, дыхательных путей и ран. Патогенность B. cereus , кишечной или некишечной, тесно связана с продукцией разрушающих ткани экзоферментов. Среди этих секретируемых токсинов гемолизины, фосфолипазы и протеазы.[1][2]
Этиология
B. cereus — это обычная бактерия, повсеместно присутствующая в окружающей среде. Он обладает способностью образовывать споры, что позволяет ему дольше выживать при экстремальных температурах. Следовательно, он обнаруживается как загрязнитель различных пищевых продуктов, т. е. говядины, индейки, риса, бобов, овощей. Диарея часто связана с мясом, молоком, овощами и рыбой. Рвота чаще всего связана с продуктами из риса, но она также может быть связана с другими типами крахмалистых продуктов, таких как картофель, макароны и сыр. Некоторые пищевые смеси (соусы, пудинги, супы, запеканки, выпечка и салаты) в целом связаны с болезнями пищевого происхождения.[3][4]
Следовательно, он обнаруживается как загрязнитель различных пищевых продуктов, т. е. говядины, индейки, риса, бобов, овощей. Диарея часто связана с мясом, молоком, овощами и рыбой. Рвота чаще всего связана с продуктами из риса, но она также может быть связана с другими типами крахмалистых продуктов, таких как картофель, макароны и сыр. Некоторые пищевые смеси (соусы, пудинги, супы, запеканки, выпечка и салаты) в целом связаны с болезнями пищевого происхождения.[3][4]
Bacillus cereus вызывается употреблением пищи, зараженной энтеротоксигенным B. cereus или рвотным токсином. При заболеваниях, не связанных с желудочно-кишечным трактом, сообщения о респираторных инфекциях, подобных респираторной сибирской язве, были приписаны штаммам B. cereus , содержащим гены токсина B. anthracis .
Эпидемиология
На веб-сайте Центров по контролю за заболеваниями (CDC) указано, что было подтверждено 619 вспышек Bacillus -связанные отравления с 1998 по 2015 год, вызвавшие 7385 заболеваний. За этот период было зарегистрировано 75 заболеваний и три случая смерти из-за подтвержденных заболеваний, связанных с Bacillus . На веб-сайте говорится, что всего было 19 119 вспышек и 373 531 заболевание. Это относится к 14 681 госпитализации и 337 смертельным случаям за этот период. Эти статистические данные относятся ко всем заболеваниям, связанным с Bacillus , а не только к заболеваниям, связанным с B. cereus .[5][6]
За этот период было зарегистрировано 75 заболеваний и три случая смерти из-за подтвержденных заболеваний, связанных с Bacillus . На веб-сайте говорится, что всего было 19 119 вспышек и 373 531 заболевание. Это относится к 14 681 госпитализации и 337 смертельным случаям за этот период. Эти статистические данные относятся ко всем заболеваниям, связанным с Bacillus , а не только к заболеваниям, связанным с B. cereus .[5][6]
«Книга о плохих ошибках» Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) далее разбивает это и утверждает, что существует примерно 63 400 эпизодов из B. cereus заболеваний ежегодно в Соединенных Штатах. С 2005 по 2007 год было зарегистрировано 13 подтвержденных вспышек и 37,6 подозреваемых вспышек с участием более 1000 человек.
Каждый человек восприимчив к инфекции B. cereus ; однако смертность, связанная с этим заболеванием, встречается редко. Рвотный энтеротоксин был связан с несколькими случаями печеночной недостаточности и смерти у здоровых людей. 8 организмов/грамм, но патогенность возникает из-за предварительно сформированного токсина, а не самих бактерий.
8 организмов/грамм, но патогенность возникает из-за предварительно сформированного токсина, а не самих бактерий.
Патофизиология
Патогенность B. cereus внутри или вне желудочно-кишечного тракта (ЖКТ) связана с продукцией экзоферментов. Среди секретируемых токсинов четыре гемолизина, три различных фосфолипазы и три порообразующих энтеротоксина. Энтеротоксины, которые активируют узелковый рецепторный белок-3 (NLRP3), представляют собой гемолизин BL (HBL), негемолитический энтеротоксин (NHE) и цитотоксин K. В тонком кишечнике вегетативные клетки, попавшие в организм в виде жизнеспособных клеток или спор, продуцируют и выделяют белковый энтеротоксин и вызывают диарейный синдром. Цереулид представляет собой кодируемый плазмидой циклический пептид, который вырабатывается в пищевых продуктах и попадает в организм в виде сформированного токсина. В исследованиях с перевязанной петлей подвздошной кишки у кроликов культуральные фильтраты энтеротоксигенных штаммов индуцировали накопление жидкости и гемолитический, цитотоксический, дермонекроз и повышенную проницаемость сосудов в коже кролика.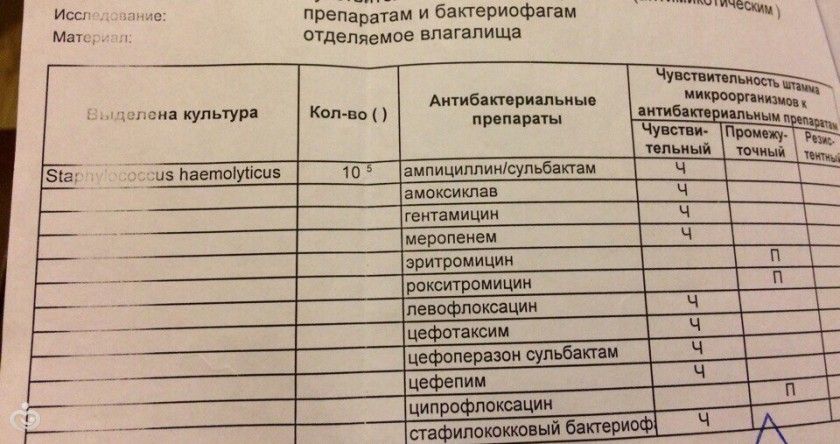 Энтеротоксин состоит из связывающего компонента (В) и двух гемолитических компонентов, обозначенных как HBL. При диарейной форме заболевания идентифицирован негемолитический трехкомпонентный энтеротоксин, получивший обозначение НГЭ. Негемолитический энтеротоксин (НГЭ) из Bacillus cereus активирует инфламмасому и пироптоз узелкового рецепторного белка-3 (NLRP3). Это приводит к запрограммированной гибели клеток, инициируемой активацией воспалительных каспаз инфицированной ткани.[8]
Энтеротоксин состоит из связывающего компонента (В) и двух гемолитических компонентов, обозначенных как HBL. При диарейной форме заболевания идентифицирован негемолитический трехкомпонентный энтеротоксин, получивший обозначение НГЭ. Негемолитический энтеротоксин (НГЭ) из Bacillus cereus активирует инфламмасому и пироптоз узелкового рецепторного белка-3 (NLRP3). Это приводит к запрограммированной гибели клеток, инициируемой активацией воспалительных каспаз инфицированной ткани.[8]
Гистопатология
B. cereus — это каталазоположительные, факультативно анаэробные, спорообразующие грамположительные палочки. Однако в некоторых случаях это может оказаться переменной Грамма. При окрашивании по Граму кровяного и шоколадного агара B. cereus имеет однородный бациллярный вид. Их размер колеблется от 3 х 0,4 мкм до 9х 2 мкм. Колонии B. cereus имеют неровный периметр и непрозрачны на агаре с овечьей кровью. При выращивании на агаре с яичным желтком будет отмечена зона помутнения из-за продукции лецитиназы. В жидкостях организма он кажется прямым или слегка изогнутым. Он может появляться один или в виде коротких цепочек на пятнах граммов жидкости организма. B. cereus Внешний вид в срезах тканей может указывать на наличие длинных и нитевидных организмов. Прозрачные споры могут присутствовать или отсутствовать.
В жидкостях организма он кажется прямым или слегка изогнутым. Он может появляться один или в виде коротких цепочек на пятнах граммов жидкости организма. B. cereus Внешний вид в срезах тканей может указывать на наличие длинных и нитевидных организмов. Прозрачные споры могут присутствовать или отсутствовать.
История и физика
Клинические проявления инфекции B. cereus можно разделить на синдромы желудочно-кишечных заболеваний или экстрагастроинтестинальные инфекции. Желудочно-кишечные синдромы подразделяются на два типа заболеваний: диарейный синдром и рвотный синдром.
Желудочно-кишечные синдромы
Симптомы диарейных заболеваний включают обильный водянистый понос, боль в животе и спазмы. Тошнота и рвота наблюдаются редко. Симптомы обычно появляются в течение 6–15 часов после употребления пищи, оставленной при комнатной температуре более чем на 2 часа. Токсин, связанный с этой формой заболевания, вырабатывается в тонком кишечнике больного после проглатывания бацилл или спор. Порообразующие цитотоксины (гемолизин BL, негемолитический энтеротоксин и цитотоксин К) секретируются проглоченными вегетативными клетками. Эти токсины термолабильны.
Порообразующие цитотоксины (гемолизин BL, негемолитический энтеротоксин и цитотоксин К) секретируются проглоченными вегетативными клетками. Эти токсины термолабильны.
При заболеваниях рвотного типа симптомы включают тошноту и рвоту, сходные с проявлениями, связанными с Staphylococcus aureus пищевым отравлением. У некоторых людей также может наблюдаться диарея. Симптомы обычно появляются в течение от 30 минут до 6 часов после употребления риса или крахмалистых продуктов, оставленных при комнатной температуре, даже после повторного нагревания. Это заболевание связано с наличием цереулида, ионофорного низкомолекулярного додекапсипептида, который является pH-стабильным и устойчивым к нагреванию и протеазам.
Симптомы обоих типов обычно исчезают в течение 24 часов после появления.
Внежелудочные синдромы
Повсеместное присутствие B. cereus в окружающей среде делает его потенциальным организмом для инфекции при наличии прямых проникающих ранений или гематологического доступа. Факторы риска осложненного и тяжелого заболевания включают иммуносупрессию, внутривенное злоупотребление наркотиками и неонатальный период. Связь между внутривенным и внекишечным употреблением наркотиков Заражение B. cereus связано с использованием зараженных игл и образцов наркотиков. Пациенты с постоянным венозным катетером или травматической/операционной раной подвержены повышенному риску осложненных инфекций, вызванных этим микроорганизмом.
Факторы риска осложненного и тяжелого заболевания включают иммуносупрессию, внутривенное злоупотребление наркотиками и неонатальный период. Связь между внутривенным и внекишечным употреблением наркотиков Заражение B. cereus связано с использованием зараженных игл и образцов наркотиков. Пациенты с постоянным венозным катетером или травматической/операционной раной подвержены повышенному риску осложненных инфекций, вызванных этим микроорганизмом.
Эндофтальмит — это угрожающая зрению глазная инфекция, возникающая в результате микробной инфекции внутреннего глаза. Это наиболее частое внекишечное проявление данного заболевания. Отличительным признаком офтальмологического поражения является абсцесс кольца роговицы, который может сопровождаться быстрым прогрессированием боли, экзофтальмом, хемозом, кровоизлиянием в сетчатку и периваскулитом. Системные проявления включают лихорадку, лейкоцитоз и общее недомогание. Травма глаза с проникающим ранением является наиболее частой причиной этой инфекции.
Бактериемия и эндокардит также могут возникать при этой инфекции. Истинная бактериемия B. cereus может возникать при внутривенном употреблении наркотиков, использовании центральных венозных катетеров или повреждении/компрометации слизистой оболочки у пациентов с нейтропенией. Пациенты с иммуносупрессией, особенно те, у кого есть сопутствующие гематологические злокачественные новообразования, подвержены высокому риску этого типа инфекции бациллами. У пациентов с бациллярной бактериемией часто наблюдаются изменения сознания и вторичное поражение нервной системы. Эндокардит, вызванный видами бацилл, обычно связан с внутривенным употреблением наркотиков, центральными венозными катетерами или наличием внутрисердечных аппаратных средств, таких как пророческие клапаны и/или кардиостимуляторы.
Инфекции мягких тканей и костей могут возникать при проникающих травмах или повреждениях слизистой оболочки. К ним относятся огнестрельные ранения, открытые переломы, укусы животных и ожоги, и это лишь некоторые из них. Также могут возникать целлюлит и некротическая инфекция мягких тканей. B. cereus также может вызывать наложенную инфекцию очагов хронического остеомиелита.
Также могут возникать целлюлит и некротическая инфекция мягких тканей. B. cereus также может вызывать наложенную инфекцию очагов хронического остеомиелита.
Кератит, вторичный по отношению к инфекции B. cereus , может возникать из-за ссадин роговицы, в том числе вторичных по отношению к использованию контактных линз.
Оценка
B. cereus может быть подтвержден как источник вспышки пищевого происхождения путем (1) выделения штаммов одного и того же серотипа из источника пищи и фекалий или рвотных масс пациента, (2) выделения крупных число серотипов B. cereus , которые, как известно, вызывают заболевания пищевого происхождения из пищи/фекалий/рвоты пациента, или (3) выделение B. cereus из подозрительных пищевых продуктов и подтверждение энтеротоксина с помощью серологии (для диарейного токсина ) или биологические тесты (диарейные и рвотные).
При внекишечных инфекциях оценку проводят с помощью анализа биологических жидкостей. Например, диагноз эндофтальмита можно поставить по окрашиванию стекловидного тела по Граму.
Например, диагноз эндофтальмита можно поставить по окрашиванию стекловидного тела по Граму.
Важно отметить, что виды бацилл в культурах крови часто считаются загрязняющими веществами. В правильных клинических условиях это следует рассматривать как истинную бактериемию, а не контаминацию.
Лечение/управление
Инфекция B. cereus обычно проходит сама по себе и не требует какой-либо целенаправленной терапии. Лечение большинства пациентов заключается в симптоматической помощи с пероральной гидратацией. Большинство пациентов выздоравливают в течение 24 часов после появления симптомов. Эмпирическая антибактериальная терапия желудочно-кишечных синдромов, вторичных по отношению к Инфекции B. cereus не показаны. В тяжелых случаях может потребоваться внутривенная гидратация жидкости.[9][10][11]
Большинство тяжелых и системных заболеваний вызываются глазными инфекциями, вызываемыми этим микроорганизмом. B. cereus офтальмологические инфекции могут быстро разрушить инфицированный глаз, особенно при проникающих травмах инородным телом.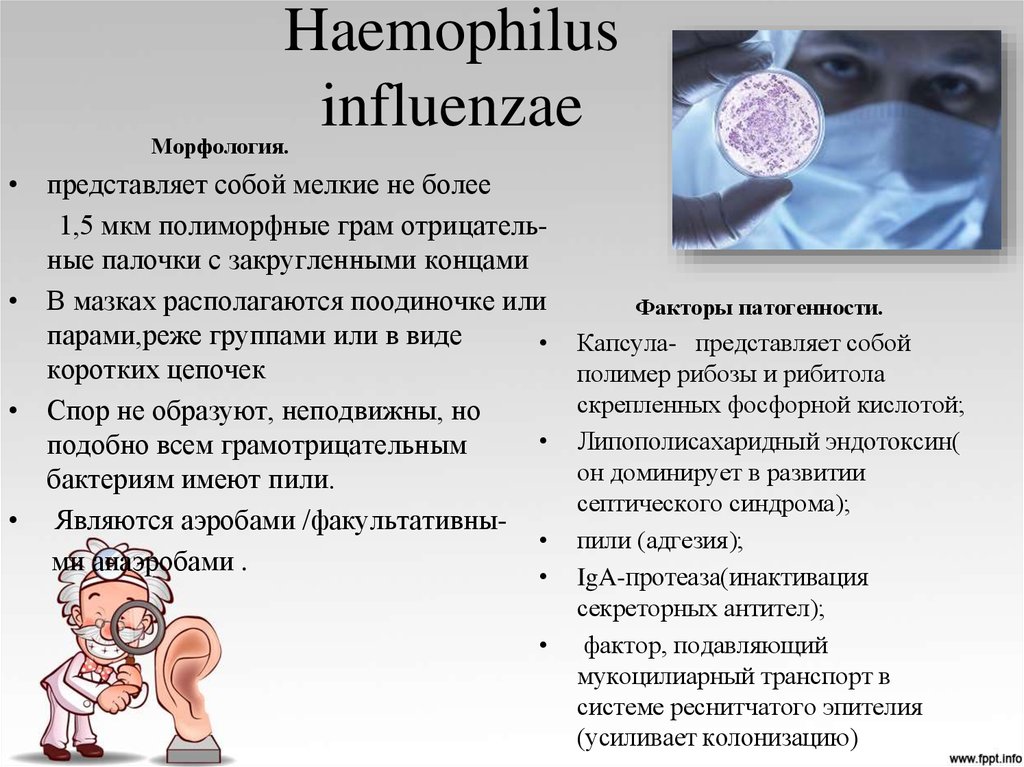 В подозрительных случаях необходимо быстрое терапевтическое вмешательство независимо от результатов немедленных диагностических исследований. Исход зависит от вовлеченного микробного агента, а также от скорости и реакции на лечение. B. cereus продуцирует бета-лактамазы и устойчив к бета-лактамным антибиотикам. Когда требуются антибиотики, следует рассмотреть возможность лечения ванкомицином, гентамицином, хлорамфениколом или карбапенемами. Клиндамицин, тетрациклин и эритромицин показали разные результаты при тестировании на чувствительность и не считаются препаратами первой линии. В исследовании 2007 года, посвященном проверке чувствительности видов Bacillus к различным антибиотикам, сообщалось об универсальной резистентности к триметоприму/сульфаметоксазолу и бета-лактамным антибиотикам у различных B. cereus видов. Некоторые из них также были устойчивы к клиндамицину и эритромицину. Согласно этому исследованию, все изоляты Bacillus были чувствительны к хлорамфениколу, ципрофлоксацину, гатифлоксацину, гентамицину, левофлоксацину, линезолиду, моксифлоксацину, рифампицину, стрептомицину, тетрациклину, тигециклину и ванкомицину [12].
В подозрительных случаях необходимо быстрое терапевтическое вмешательство независимо от результатов немедленных диагностических исследований. Исход зависит от вовлеченного микробного агента, а также от скорости и реакции на лечение. B. cereus продуцирует бета-лактамазы и устойчив к бета-лактамным антибиотикам. Когда требуются антибиотики, следует рассмотреть возможность лечения ванкомицином, гентамицином, хлорамфениколом или карбапенемами. Клиндамицин, тетрациклин и эритромицин показали разные результаты при тестировании на чувствительность и не считаются препаратами первой линии. В исследовании 2007 года, посвященном проверке чувствительности видов Bacillus к различным антибиотикам, сообщалось об универсальной резистентности к триметоприму/сульфаметоксазолу и бета-лактамным антибиотикам у различных B. cereus видов. Некоторые из них также были устойчивы к клиндамицину и эритромицину. Согласно этому исследованию, все изоляты Bacillus были чувствительны к хлорамфениколу, ципрофлоксацину, гатифлоксацину, гентамицину, левофлоксацину, линезолиду, моксифлоксацину, рифампицину, стрептомицину, тетрациклину, тигециклину и ванкомицину [12]. В тяжелых случаях с риском системной инфекции может потребоваться одновременная терапия несколькими путями, например, внутривенным и внутриглазным [13].
В тяжелых случаях с риском системной инфекции может потребоваться одновременная терапия несколькими путями, например, внутривенным и внутриглазным [13].
Дифференциальная диагностика
Viral infections (e.g., Rotavirus)
Bacterial infections (e.g., Campylobacter, Shigella, Salmonella, Escherichia coli , Yersinia enterocolitica , Vibrio cholerae , Clostridium difficile )
Паразитарные инфекции (например, Giardia, Cryptosporidium, Entameba, Microsporidium, Cyclospora)
Токсины ( Staphylococcus aureus )
Аппендицит
Дивертикулит
БЕЛЕКСЯ ИЧЕМИЯ
Прогноз
пациенты с системными кортикостероидами, у тех, кто госпитализируется, и у пациентов с нейтропеньей, когда у них есть госпитализация. Пациенты с гематологическими злокачественными новообразованиями и нейтропенией, наряду с инфекциями B. cereus , имеют худший прогноз, который улучшается при разрешении нейтропении.[14] Серия случаев пациентов с сопутствующими гематологическими злокачественными новообразованиями и Бактериемия B. cereus отметила, что первичными симптомами являются неврологические симптомы, а не желудочно-кишечные. Кроме того, они отметили, что эти инфекции связаны с центральными венозными катетерами. Из 12 пациентов в этой серии случаев четверо умерли от септицемии B. cereus . Они отметили отсроченное назначение соответствующих антибиотиков, дисфункцию печени и признаки поражения центральной нервной системы с неблагоприятным и фатальным прогнозом.[15] Инфекция B. cereus в неонатальном периоде была связана с неблагоприятным исходом, несмотря на своевременную антибактериальную терапию.
cereus , имеют худший прогноз, который улучшается при разрешении нейтропении.[14] Серия случаев пациентов с сопутствующими гематологическими злокачественными новообразованиями и Бактериемия B. cereus отметила, что первичными симптомами являются неврологические симптомы, а не желудочно-кишечные. Кроме того, они отметили, что эти инфекции связаны с центральными венозными катетерами. Из 12 пациентов в этой серии случаев четверо умерли от септицемии B. cereus . Они отметили отсроченное назначение соответствующих антибиотиков, дисфункцию печени и признаки поражения центральной нервной системы с неблагоприятным и фатальным прогнозом.[15] Инфекция B. cereus в неонатальном периоде была связана с неблагоприятным исходом, несмотря на своевременную антибактериальную терапию.
Осложнения
Осложнения желудочно-кишечных синдромов, связанных с инфекциями B. cereus , встречаются редко и возникают только у людей с ослабленной иммунной системой. Осложнения у пациентов с внекишечными инфекциями включают гангрену, флегмону, асептический менингит, септицемию и смерть.
Сдерживание и обучение пациентов
Пациенты должны быть осведомлены о важности мытья рук для предотвращения этих бактериальных инфекций. Кроме того, они должны быть обеспечены необходимой литературой о надлежащем приеме, обработке, обработке и хранении пищевых продуктов и пищевых продуктов в целях предотвращения заражения.
Улучшение результатов работы команды здравоохранения
Bacillus cereus инфекция является относительно распространенной инфекцией. В большинстве случаев инфекции проходят самостоятельно, без осложнений и не требуют никакого лечения, кроме поддерживающей терапии. Однако инфекция B. cereus может стать тяжелой у пациентов с ослабленным иммунитетом и у пациентов с прямой инфекцией ткани глаза после проникающей травмы. Эти случаи могут быстро прогрессировать до необратимой потери зрения, септицемии и даже смерти. Для улучшения результатов требуется быстрое распознавание и высокая степень подозрения. Клинические фармацевты могут помочь медицинской бригаде, обеспечив правильный выбор антибиотиков в качестве B. cereus обладает естественной устойчивостью к двум основным классам антибиотиков. Медсестра интенсивной терапии может помочь свести к минимуму эти инфекции у лиц с ослабленным иммунитетом, быстро удалив постоянные центральные венозные катетеры. В легких случаях медсестра играет жизненно важную роль в обучении пациентов правильному хранению продуктов питания для предотвращения вспышек. Координация ухода между медсестрами, фармацевтами и поставщиками медицинских услуг снизит заболеваемость этим заболеванием и улучшит результаты для пациентов в критическом состоянии. [Уровень 5]
cereus обладает естественной устойчивостью к двум основным классам антибиотиков. Медсестра интенсивной терапии может помочь свести к минимуму эти инфекции у лиц с ослабленным иммунитетом, быстро удалив постоянные центральные венозные катетеры. В легких случаях медсестра играет жизненно важную роль в обучении пациентов правильному хранению продуктов питания для предотвращения вспышек. Координация ухода между медсестрами, фармацевтами и поставщиками медицинских услуг снизит заболеваемость этим заболеванием и улучшит результаты для пациентов в критическом состоянии. [Уровень 5]
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Рисунок
B. Стержни Cereus. Предоставлено Frederick C. Michel, ASM
Ссылки
- 1.
Nguyen AT, Tallent SM. Скрининг пищевых продуктов на наличие токсинов Bacillus cereus с использованием полногеномного секвенирования.
 Пищевой микробиол. 2019 апр;78:164-170. [PubMed: 30497598]
Пищевой микробиол. 2019 апр;78:164-170. [PubMed: 30497598]- 2.
Hölzel CS, Tetens JL, Schwaiger K. Раскрытие роли овощей в распространении устойчивых к противомикробным препаратам бактерий: необходимость количественной оценки риска. Патог пищевого происхождения Dis. 2018 ноябрь;15(11):671-688. [Статья бесплатно PMC: PMC6247988] [PubMed: 30444697]
- 3.
Kimura 木村 啓太郎 K, Yokoyama 横山 智 S. Тенденции в применении Bacillus в ферментированных пищевых продуктах. Курр Опин Биотехнолог. 2019 апр;56:36-42. [PubMed: 30227296]
- 4.
Омер М.К., Альварес-Ордоньес А., Прието М., Скьерве Э., Асехун Т., Альвсеике О.А. Систематический обзор бактериальных вспышек пищевого происхождения, связанных с красным мясом и мясными продуктами. Патог пищевого происхождения Dis. 2018 Октябрь; 15 (10): 598-611. [PubMed: 29957085]
- 5.
May FJ, Polkinghorne BG, Fearnley EJ. Эпидемиология вспышек пищевого гастроэнтерита, опосредованного бактериальными токсинами, в Австралии, с 2001 по 2013 год.
 Commun Dis Intell Q Rep. 2016 Dec 24;40(4):E460-E469. [PubMed: 28043220]
Commun Dis Intell Q Rep. 2016 Dec 24;40(4):E460-E469. [PubMed: 28043220]- 6.
Thein CC, Тринидад RM, Павлин Б.И. Крупная вспышка пищевого происхождения на маленьком тихоокеанском острове. Диалог здоровья Pac. 2010 апр;16(1):75-80. [PubMed: 20968238]
- 7.
Beecher DJ, Wong AC. Улучшенная очистка и характеристика гемолизина BL, гемолитического дермонекротического фактора проницаемости сосудов из Bacillus cereus. Заразить иммун. 1994 март; 62 (3): 980-6. [Бесплатная статья PMC: PMC186213] [PubMed: 8112873]
- 8.
Fox D, Mathur A, Xue Y, Liu Y, Tan WH, Feng S, Pandey A, Ngo C, Hayward JA, Atmosukarto II, Price JD, Johnson MD, Jessberger N, Robertson AAB, Burgio G, Tscharke DC, Fox Э.М., Лейтон Д.Л., Каакуш Н.О., Мяртлбауэр Э., Леппла С.Х., Ман С.М. Негемолитический энтеротоксин Bacillus cereus активирует инфламмасому NLRP3. Нац коммун. 2020 06 февраля; 11 (1): 760. [Статья бесплатно PMC: PMC7005308] [PubMed: 32029733]
- 9.

Meldrum RJ, Little CL, Sagoo S, Mithani V, McLauchlin J, de Pinna E. Оценка микробиологической безопасности салатных овощей и соусов из рестораны с кебабом на вынос в Соединенном Королевстве. Пищевой микробиол. 2009 г.Сен; 26 (6): 573-7. [PubMed: 19527831]
- 10.
Zhou G, Liu H, He J, Yuan Y, Yuan Z. Наличие Bacillus cereus, B. thuringiensis и B. mycoides в китайском пастеризованном цельном молоке. Int J Food Microbiol. 2008 г., 31 января; 121 (2): 195–200. [PubMed: 18077041]
- 11.
Warburton DW, Harrison B, Crawford C, Foster R, Fox C, Gour L, Purvis U. Текущий микробиологический статус «здоровой пищи», продаваемой в Канаде. Int J Food Microbiol. 1998 30 июня; 42 (1-2): 1-7. [В паблике: 9706793]
- 12.
Luna VA, King DS, Gulledge J, Cannons AC, Amuso PT, Cattani J. Чувствительность Bacillus anthracis, Bacillus cereus, Bacillus mycoides, Bacillus pseudomycoides и Bacillus thuringiensis, автоматизированная с использованием 24 методы разбавления в микробульоне и методы диффузии в градиенте агара Etest.


 1996 г., июль-декабрь; 41 (3-4): 141-4.
Бактериол Вирусол Паразитол Эпидемиол. 1996.
PMID: 9116402
Румынский.
1996 г., июль-декабрь; 41 (3-4): 141-4.
Бактериол Вирусол Паразитол Эпидемиол. 1996.
PMID: 9116402
Румынский. Арка Дерматол. 1996.
PMID: 8546485
Арка Дерматол. 1996.
PMID: 8546485
 Пищевой микробиол. 2019 апр;78:164-170. [PubMed: 30497598]
Пищевой микробиол. 2019 апр;78:164-170. [PubMed: 30497598] Commun Dis Intell Q Rep. 2016 Dec 24;40(4):E460-E469. [PubMed: 28043220]
Commun Dis Intell Q Rep. 2016 Dec 24;40(4):E460-E469. [PubMed: 28043220]