Гемосидероз что это такое: клинические симптомы, диагностика и лечение
причины, симптомы, диагностика и лечение
Гемосидероз – заболевание группы пигментных дистрофий, характеризующееся избыточным накоплением железосодержащего пигмента гемосидерина в тканях организма. Различают местные формы заболевания (кожный и легочный гемосидероз) и общие (с отложением гемосидерина в клетках печени, селезенки, почек, костного мозга, слюнных и потовых желез). Диагностика гемосидероза основывается на определении содержания железа в плазме крови, общей железосвязывающей способности крови, а также содержания пигмента в биоптатах тканей и органов. В зависимости от клинической картины лечение гемосидероза включает медикаментозную терапию (глюкокортикоиды, цитостатики, ангиопротекторы, витамин С), в некоторых случаях плазмаферез, местную PUVA-терапию.
Общие сведения
Гемосидероз — нарушение обмена гемоглобиногенного пигмента гемосидерина с его локальным или системным отложением в тканях.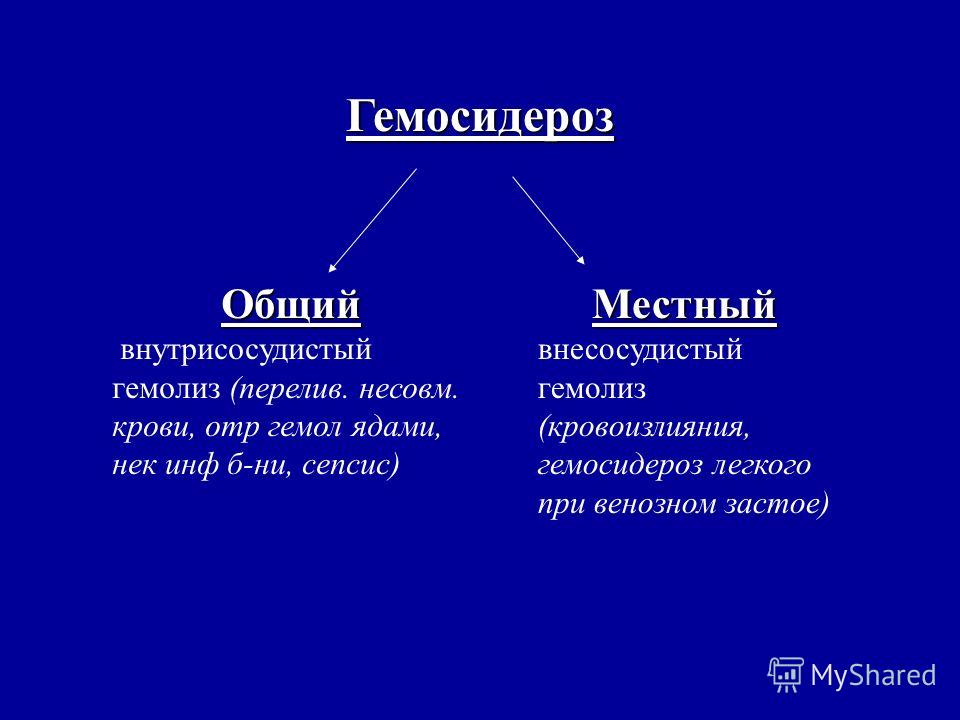
В зависимости от распространенности патологического процесса различают локальный (местный) и генерализованный (общий) гемосидероз. Локальный гемосидероз служит результатом экстраваскулярного гемолиза, т. е. внесосудистого разрушения эритроцитов. Местный гемосидероз может развиваться как в очагах ограниченных кровоизлияний (гематомах), так и в пределах целого органа (легкого, кожи).
К самостоятельным формам гемосидероза относят:
- гемосидероз кожи (болезнь Шамберга, кольцевидная телеангиэктатическая пурпура Майокки, старческий гемосидероз, лихеноидный пигментный и пурпурозный ангиодермит, охряный дерматит и др.)
- идиопатический легочный гемосидероз (бурая индурация легких)
В том случае, когда отложение гемосидерина сопровождается структурными изменениями тканей и нарушением функции органа, говорят о гемохроматозе. Вследствие многообразия причин и форм гемосидероза его изучением занимаются иммунология, дерматология, пульмонология, гематология и другие дисциплины.
Гемосидероз
Причины гемосидероза
Общий гемосидероз является вторичным состоянием, этиологически связанным с болезнями системы крови, интоксикациями, инфекциями, аутоиммунными процессами.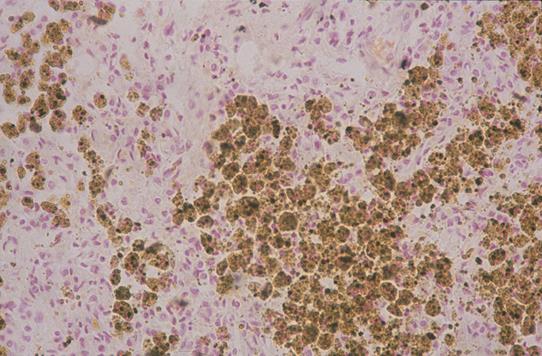 Возможными причинами избыточного отложения гемосидерина могут служить гемолитические анемии, лейкемия, цирроз печени, инфекционные заболевания (сепсис, бруцеллез, малярия, возвратный тиф), резус-конфликт, частые гемотрансфузии, отравления гемолитическими ядами (сульфаниламидами, свинцом, хинином и др.).
Возможными причинами избыточного отложения гемосидерина могут служить гемолитические анемии, лейкемия, цирроз печени, инфекционные заболевания (сепсис, бруцеллез, малярия, возвратный тиф), резус-конфликт, частые гемотрансфузии, отравления гемолитическими ядами (сульфаниламидами, свинцом, хинином и др.).
Этиология гемосидероза легких не вполне ясна. Высказаны предположения относительно наследственной предрасположенности, иммунопатологического характера заболевания, врожденных нарушений структуры стенки легочных капилляров и др. Известно, что развитию гемосидероза легких в большей степени подвержены пациенты с декомпенсированной сердечной патологией (кардиосклерозом, пороками сердца и пр.).
Кожный гемосидероз может быть первичным (без предшествующего поражения кожи) или вторичным (возникает на фоне кожных заболеваний). К развитию первичного гемосидероза кожи предрасполагают эндокринные заболевания (сахарный диабет), сосудистая патология (хроническая венозная недостаточность, гипертоническая болезнь).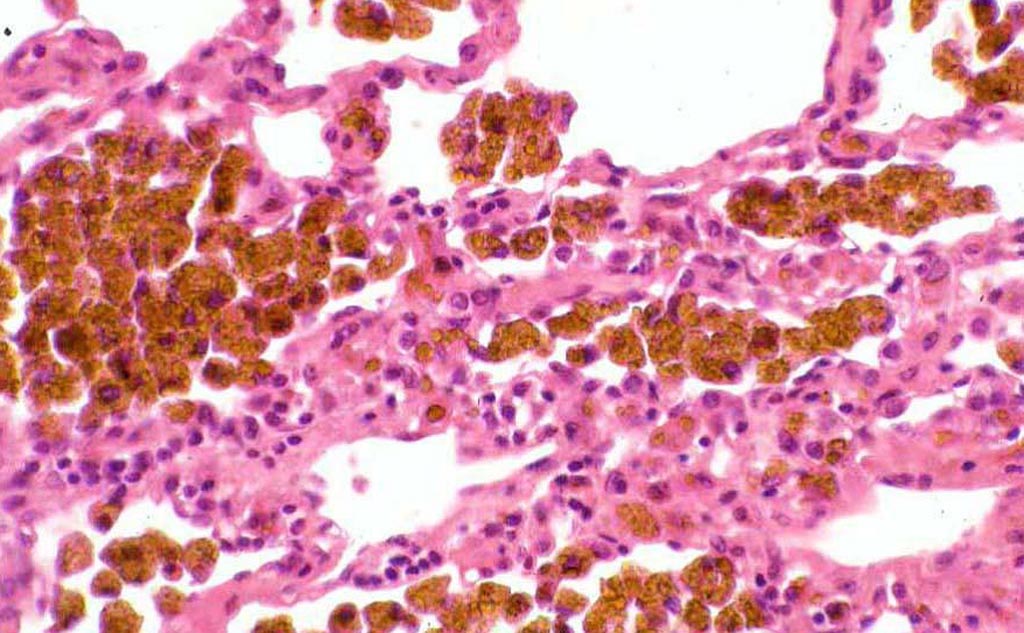 К вторичному накоплению гемосидерина в слоях дермы могут приводить дерматиты, экзема, нейродермит, травмы кожи, фокальная инфекция (пиодермии). Провоцировать дебют заболевания могут переохлаждение, переутомление, прием лекарственных средств (парацетамола, НПВС, ампициллина, диуретиков и др.).
К вторичному накоплению гемосидерина в слоях дермы могут приводить дерматиты, экзема, нейродермит, травмы кожи, фокальная инфекция (пиодермии). Провоцировать дебют заболевания могут переохлаждение, переутомление, прием лекарственных средств (парацетамола, НПВС, ампициллина, диуретиков и др.).
Гемосидероз легких
Идиопатический легочный гемосидероз – заболевание, характеризующееся повторными кровоизлияниями в альвеолы с последующим отложением гемосидерина в легочной паренхиме. Заболевание поражает преимущественно детей и людей молодого возраста. Течение гемосидероза легких характеризуется легочными кровотечениями различной интенсивности, дыхательной недостаточностью и гипохромной анемией.
В острой фазе заболевания у больных возникает влажный кашель с выделением кровянистой мокроты. Следствием длительного или обильного кровохарканья служит развитие тяжелой железодефицитной анемии, бледность кожных покровов, иктеричность склер, жалобы на головокружение, слабость.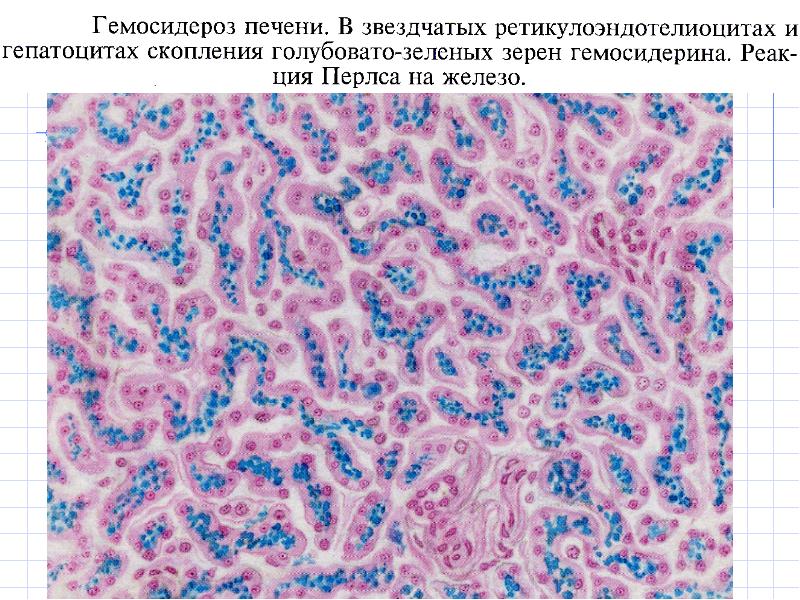 Прогрессирующее течение гемосидероза легких сопровождается развитием диффузного пневмосклероза, отражением которого является одышка и цианоз. Периоды обострения сопровождаются болями в грудной клетке и животе, артралгиями, лихорадкой. Объективные данные характеризуются притуплением перкуторного звука, наличием влажных хрипов, тахикардии, артериальной гипотонии, сплено- и гепатомегалии.
Прогрессирующее течение гемосидероза легких сопровождается развитием диффузного пневмосклероза, отражением которого является одышка и цианоз. Периоды обострения сопровождаются болями в грудной клетке и животе, артралгиями, лихорадкой. Объективные данные характеризуются притуплением перкуторного звука, наличием влажных хрипов, тахикардии, артериальной гипотонии, сплено- и гепатомегалии.
В периоды ремиссии жалобы не выражены или отсутствуют, однако после каждой последующей атаки длительность светлых промежутков, как правило, сокращается. У больных с хроническим течением гемосидероза часто формируется легочное сердце; нередко возникают тяжелые инфаркт-пневмонии, рецидивирующие пневмотораксы, которые могут послужить причиной летального исхода. Идиопатический гемосидероз легких может сочетаться с геморрагическим васкулитом, ревматоидным артритом, системной красной волчанкой, гломерулонефритом, синдромом Гудпасчера.
Гемосидероз кожи
При кожном варианте гемосидероза отложение железосодержащего пигмента происходит в дерме. Клинически заболевание характеризуется появлением на коже геморрагической сыпи или пигментных пятен диаметром 0,1-3 см. Свежие высыпания имеют кирпично-красную окраску; старые приобретают бурый, темно-коричневый или желтоватый цвет. Чаще всего пигментированные очаги локализуются на коже лодыжек, голеней, кистей, предплечий; иногда высыпания сопровождаются легким зудом. В местах поражения кожи могут возникать петехии, узелки, лихеноидные папулы, телеангиэктазии, бляшки «ржавого» цвета.
Клинически заболевание характеризуется появлением на коже геморрагической сыпи или пигментных пятен диаметром 0,1-3 см. Свежие высыпания имеют кирпично-красную окраску; старые приобретают бурый, темно-коричневый или желтоватый цвет. Чаще всего пигментированные очаги локализуются на коже лодыжек, голеней, кистей, предплечий; иногда высыпания сопровождаются легким зудом. В местах поражения кожи могут возникать петехии, узелки, лихеноидные папулы, телеангиэктазии, бляшки «ржавого» цвета.
Гемосидероз кожи носит хроническое течение (от нескольких месяцев до нескольких лет), чаще встречается у мужчин в возрасте 30-60 лет. Общее состояние пациентов при кожном гемосидерозе остается удовлетворительным; внутренние органы не поражаются. Заболевание следует отличать от атипичных форм красного плоского лишая, псевдосаркомы и саркомы Капоши.
Диагностика гемосидероза
В зависимости от формы гемосидероза его диагностика может осуществляться дерматологом, пульмонологом, инфекционистом, гематологом и другими специалистами.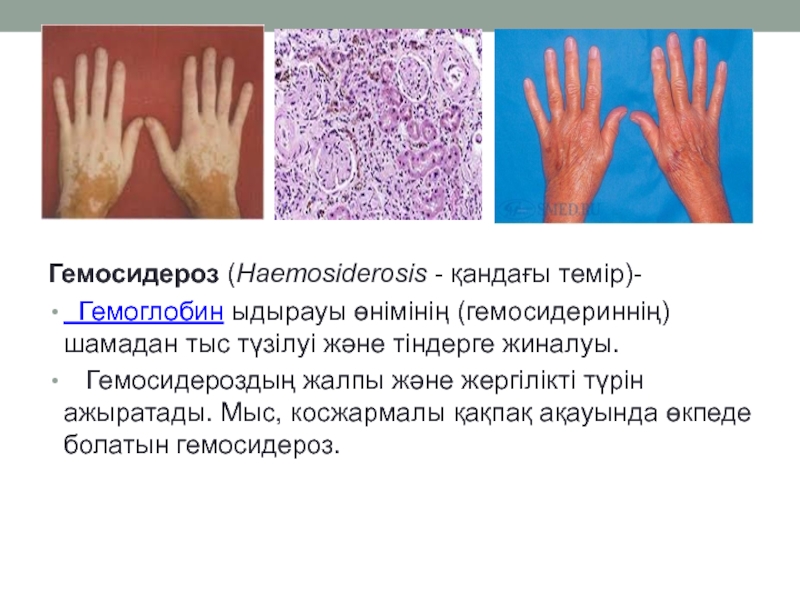 В дополнение к физикальному обследованию проводится общий анализ крови, определение сывороточного железа, общей железосвязывающей способности крови. Для выявления гемосидероза наибольшее значение имеют данные биопсии тканей (кожи, печени, легкого, костного мозга), при гистологическом исследовании которых обнаруживается отложение гемосидерина. В качестве диагностического теста применяется десфераловая проба — определение количества железа в моче после внутримышечного введения 500 мг дефероксамина. При содержании более 1 мг железа в моче проба считается положительной.
В дополнение к физикальному обследованию проводится общий анализ крови, определение сывороточного железа, общей железосвязывающей способности крови. Для выявления гемосидероза наибольшее значение имеют данные биопсии тканей (кожи, печени, легкого, костного мозга), при гистологическом исследовании которых обнаруживается отложение гемосидерина. В качестве диагностического теста применяется десфераловая проба — определение количества железа в моче после внутримышечного введения 500 мг дефероксамина. При содержании более 1 мг железа в моче проба считается положительной.
При гемосидерозе легких дополнительно проводится рентгенография грудной клетки, КТ, перфузионная сцинтиграфия легких, микроскопическое исследование мокроты, спирометрия. Проведение бронхоскопии с взятием промывных вод позволяет обнаружить сидерофаги и эритроциты в лаважной жидкости.
Лечение гемосидероза
Препаратами первого ряда, применяемыми для терапии легочного гемосидероза, служат глюкокортикостероиды, однако они оказываются эффективны лишь в половине случаев. Предложена методика комбинированного лечения иммунодепрессантами (азатиоприн, циклофосфан) в сочетании с плазмаферезом. Кроме этого, используется симптоматическая терапия: препараты железа, кровоостанавливающие средства, гемотрансфузии, бронхолитики, ингаляции кислорода. В некоторых случаях ремиссия заболевания наступает после проведения спленэктомии.
Предложена методика комбинированного лечения иммунодепрессантами (азатиоприн, циклофосфан) в сочетании с плазмаферезом. Кроме этого, используется симптоматическая терапия: препараты железа, кровоостанавливающие средства, гемотрансфузии, бронхолитики, ингаляции кислорода. В некоторых случаях ремиссия заболевания наступает после проведения спленэктомии.
Лечение гемосидероза кожи включает местное использование кортикостероидных мазей, криотерапию, прием аскорбиновой кислоты, рутина, препаратов кальция, ангиопротекторов. При тяжелых кожных проявлениях гемосидероза прибегают к ПУВА-терапии, назначению дефероксамина.
Прогноз и профилактика гемосидероза
Идиопатический легочный гемосидероз — трудно диагностируемое заболевание с серьезным прогнозом. Прогрессирующее течение патологии приводит к инвалидизации пациента, развитию жизнеугрожающих осложнений – массивного легочного кровотечения, дыхательной недостаточности, легочной гипертензии. Течение гемосидероза кожи благоприятное. Заболевание в большей степени представляет косметический дефект и склонно к постепенному разрешению.
Заболевание в большей степени представляет косметический дефект и склонно к постепенному разрешению.
Предупреждению нарушения обмена гемосидерина может способствовать своевременная терапия кожных и общих инфекционных, сосудистых, гематологических и других заболеваний, предупреждение гемотрансфузионных осложнений, исключение лекарственных и химических интоксикаций.
Гемосидероз — признаки, причины, симптомы, лечение и профилактика
Виды
Разделяют заболевание по месту поражения:
- легочное;
- кожное.
Также выделяют общую (скопление пигмента в разных органах и системах) и местную формы.
Симптомы
Легочная патология проявляет себя кровоизлияниями в альвеолярные структуры, после чего гемосидерин откладывается в паренхиме (альвеолярном дереве). Пациент страдает от дыхательной недостаточности, кровотечений. При обострении начинается кашель, сопровождаемый выделениями мокроты.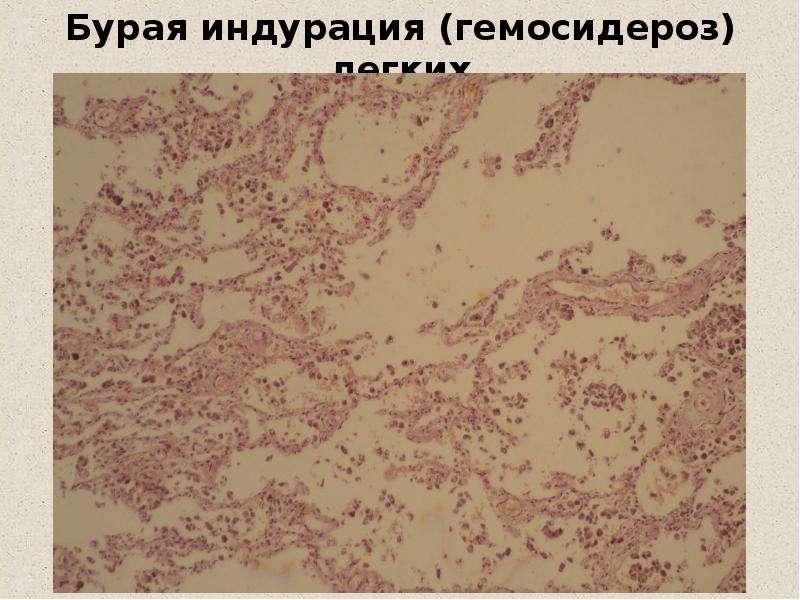 В связи с частой кровопотерей при отхаркивании развивается железодефицитная анемия, которая сопровождается бледностью, слабостью, головокружениями, пожелтением глазных яблок.
В связи с частой кровопотерей при отхаркивании развивается железодефицитная анемия, которая сопровождается бледностью, слабостью, головокружениями, пожелтением глазных яблок.
В дальнейшем начинается пневмосклероз, при котором больной мучится одышкой, кожные покровы приобретают синеватый оттенок. Острые эпизоды характерны болезненностью в груди и брюшной полости, болями в суставах, повышенной температурой и ознобом. В это время диагност выявляет притупление звука при простукивании грудной клетки, слышны влажные хрипы. У пациента болезненно учащается сердцебиение (тахикардия), понижается артериальное давление, увеличивается печень (гепатомегалия).
В моменты спада симптоматика едва различима, однако такие периоды по мере прогрессии патологических явлений сокращаются. Хроническое течение чревато легочным сердцем — патологическим увеличением правой стороны органа, зачастую наблюдается пневмоторакс — скопление воздуха в плевральной полости, что опасно смертельным исходом.
Поверхностная патология проявляет себя возникновением характерных пятен разного диаметра, как правило, до 3-х см. Сыпь, которая возникла недавно, имеет густую красноватую окраску, между тем более ранние высыпания обретают коричневый, бурый или желтый оттенок. Локализация патологически измененных участков — нижние части ног, кисти и предплечья. Больной может испытывать незначительное жжение или зуд, иногда на местах пигментных высыпаний образуются разнообразные узелки темно-коричневого цвета.
Сыпь, которая возникла недавно, имеет густую красноватую окраску, между тем более ранние высыпания обретают коричневый, бурый или желтый оттенок. Локализация патологически измененных участков — нижние части ног, кисти и предплечья. Больной может испытывать незначительное жжение или зуд, иногда на местах пигментных высыпаний образуются разнообразные узелки темно-коричневого цвета.
При поражении дермы недуг характеризуется хроническим течением, которое продолжается несколько месяцев или лет. Наиболее часто встречается у мужчин от 30-ти до 60-ти лет.
Если внутренние органы оказываются незатронутыми, пациент себя чувствует вполне удовлетворительно.
причины, симптомы, диагностика, лечение, профилактика
Патологическое состояние, относящееся к группе пигментных дистрофий, возникающих на фоне избыточного депонирования железосодержащего пигмента гемосидерина в различных тканях организма.
ПричиныОбщий гемосидероз представляет собой вторичное состояние, этиологически связанное с заболеваниями системы крови, интоксикациями, инфекциями и аутоиммунными процессами. Возможными причинами чрезмерного отложения гемосидерина могут являться гемолитические анемии, лейкемия, цирроз печени, инфекционные заболевания, резус-конфликт, частые гемотрансфузии, отравления гемолитическими ядами.
Возможными причинами чрезмерного отложения гемосидерина могут являться гемолитические анемии, лейкемия, цирроз печени, инфекционные заболевания, резус-конфликт, частые гемотрансфузии, отравления гемолитическими ядами.
Причины возникновения гемосидероза легких не вполне ясна. Предположительно данное заболевание возникает на фоне наследственной предрасположенности, иммунопатологических нарушений, врожденных аномалий структуры стенки легочных капилляров. Установлено, что развитию гемосидероза легких в большей степени подвержены лица с декомпенсированной сердечной патологией.
Гемосидероз может быть первичным или вторичным. Развитие первичного гемосидероза кожи способствуют эндокринные заболевания или сосудистая патология. Вторичная форма заболевания обусловлена накоплением в слоях дермы гемосидерина и возникает на фоне дерматитов, экземы, нейродермитов, травм кож, фокальной инфекции. Провоцировать дебют недуга способны переохлаждение, переутомление, прием медикаментозных средств.
Гемосидероз легких– заболевание, обусловленное развитием повторных кровоизлияний в альвеолы с последующим отложением гемосидерина в легочной паренхиме. Заболевание поражает преимущественно детей и лиц молодого возраста. Заболевание проявляется легочными кровотечениями различной интенсивности, дыхательной недостаточности и гипохромной анемии.
Гемосидероз кожи обусловлен отложением гемосидерина коже. Клинически недуг характеризуется появлением на коже геморрагической сыпи или пигментных пятен диаметром от 0,1 до 3 см. Свежие высыпания имеют кирпично-красную, а старые – бурый, темно-коричневый или желтоватый окрас. Чаще всего пигментированные очаги находятся на коже лодыжек, голеней, кистей, предплечий. В редких случаях высыпания могут сопровождаться незначительным зудом. В местах поражения кожи могут формироваться петехии, узелки, лихеноидные папулы, телеангиэктазии и бляшки ржавого цвета. Заболевание носит хронический характер и чаще всего встречается в возрасте от 30 до 60 лет.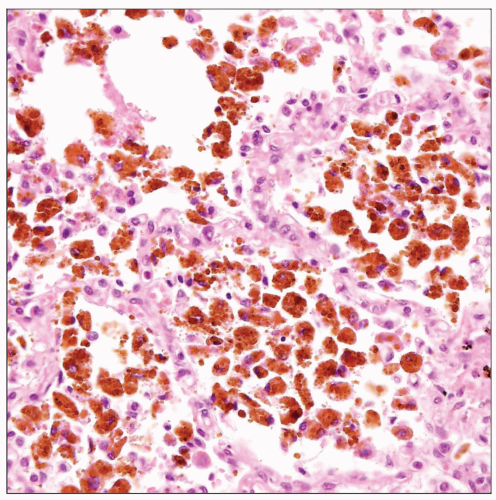
В зависимости от формы гемосидероза диагностика заболевания может осуществляться посредством физикального осмотра, инструментальных обследований, лабораторных методов и изучения анамнеза. Для точной постановки диагноза больному назначается общий анализ крови, определение сывороточного железа и общей железосвязывающей способности крови. Для выявления гемосидероза важное значение имеют данные биопсии тканей кожи, печени, легкого, костного мозга, при гистологическом изучении биоптата обнаруживается отложение гемосидерина. В качестве диагностического теста может использоваться десфераловая проба, основанная на определении количества железа в моче после внутримышечного введения 500 мг дефероксамина. При содержании более 1 мг железа в моче проба считается положительной.
При подозрении на гемосидероз легких может дополнительно потребоваться проведение рентгенографии грудной клетки, компьютерной томографии, микроскопического исследования мокроты и спирометрии.
Терапия легочного гемосидероза основывается на применении глюкокортикостероидов, однако они оказываются эффективны лишь в половине случаев. Иногда могут использоваться комбинированная схема лечения основанная на использовании иммунодепрессантов в сочетании с плазмаферезом. Помимо этого, больному назначаются препараты железа, кровоостанавливающие средства, гемотрансфузии, бронхолитики, ингаляции кислорода.
Лечение гемосидероза кожи включает местное использование кортикостероидных мазей, криотерапию, прием аскорбиновой кислоты, рутина, препаратов кальция, ангиопротекторов. При тяжелой кожной форме заболевания может потребоваться применение ПУВА-терапии и назначение дефероксамина.
ПрофилактикаПрофилактика гемосидероза основана на своевременном лечении любых инфекционных и аутоиммунных заболеваний, которые могут вызвать развитие данного заболевания.
Что такое гемосидероз?
Гемосидероз — это редкое состояние, при котором в определенных органах присутствует слишком много железа, чаще всего в легких.
Гемосидерин — это белок крови, который образуется при разрушении эритроцитов. Белок накапливает небольшое количество железа для снабжения тканей организма и поддержания стабильного уровня железа в организме. Если в легком происходит чрезмерное кровотечение, эритроциты, которые накапливаются внутри органа, могут создавать огромное количество белков гемосидерина. Несколько различных проблем со здоровьем могут привести к легочному кровоизлиянию и гемосидерозу, особенно к аутоиммунным воспалительным расстройствам, хроническому бронхиту и воздействию токсинов и плесени в окружающей среде.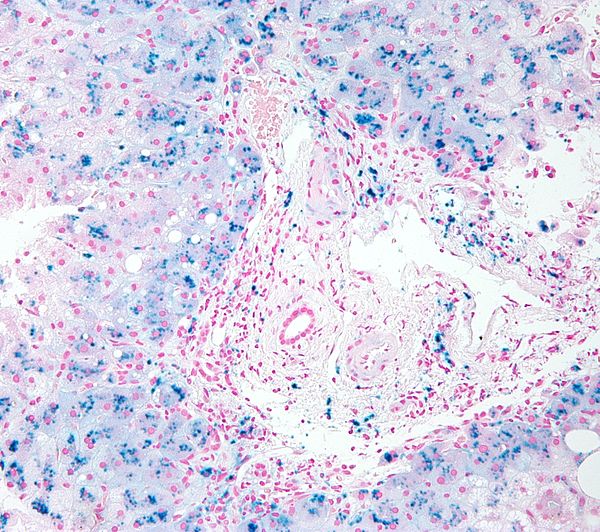 Многие случаи детского гемосидероза являются идиопатическими, что означает, что врачи не могут определить истинную причину.
Многие случаи детского гемосидероза являются идиопатическими, что означает, что врачи не могут определить истинную причину.
Наиболее распространенные симптомы острого гемосидероза включают кашель с кровью, затрудненное дыхание, стеснение в груди и головокружение. Человек, который страдает от серьезного кровоизлияния, может побледнеть и, возможно, потерять сознание. Сначала сердцебиение может забиться, но затем замедлиться до опасного уровня. Если гемосидероз становится частой или хронической проблемой, человек может испытывать симптомы железодефицитной анемии, такие как сильная усталость, сильные головные боли и раздражительность.
Специалист может диагностировать гемосидероз, задавая вопросы о симптомах и истории болезни и проверяя образцы крови на наличие признаков анемии. Рентген грудной клетки и компьютерная томография используются для поиска активных легочных кровоизлияний и срезов рубцовой ткани, где кровотечение происходило в прошлом. В зависимости от тяжести симптомов пациент может быть немедленно госпитализирован или назначен для повторного посещения после постановки диагноза.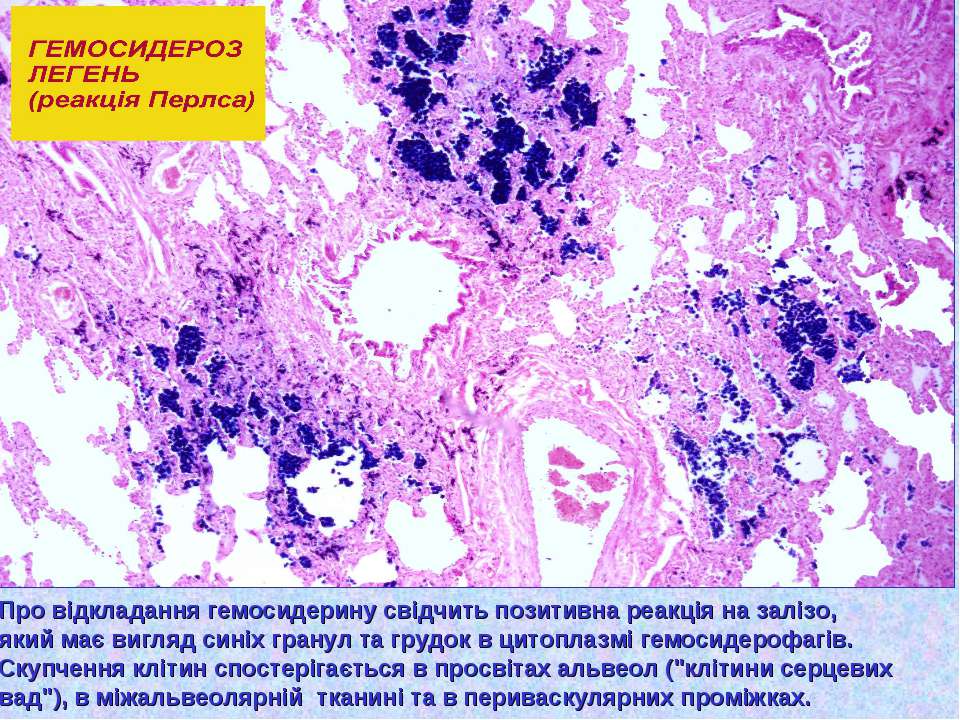
Гемосидероз, вызывающий серьезные осложнения, может потребовать оксигенотерапии и стабилизационных клинических процедур. Пациент может нуждаться в приеме лекарств для стабилизации кровяного давления и хелатообразующих препаратов, которые вымывают железо из организма. Может потребоваться переливание крови, если потеряно огромное количество крови. Чтобы уменьшить вероятность кровоизлияний в будущем, пациенты обычно должны принимать иммунодепрессанты, такие как преднизон, в течение нескольких месяцев или лет. Когда найдена первопричина, к ней относятся соответствующим образом
ДРУГИЕ ЯЗЫКИ
Гемосидероз
Нарушения обмена гемосидерина, ферритина и билирубина происходят при усиленном гемолизе эритроцитов, возникающем в результате действия различных патогенных факторов. В этих случаях обычно говорят о гемосидерозе, хотя одновременно происходит накопление некоторого количества ферритина и билирубина. Гемосидероз может возникать в результате усиления как внутрисосудистого гемолиза (общий гемосидероз), так и При развитии внесосудистого гемолиза (местный гемосидероз).
Общий гемосидероз.Развивается при болезнях системы кроветворения (анемии, гемобластозы), интоксикациях гемолитическими ядами (бертолетова соль, сульфаниламиды, хинин, свинец), при некоторых инфекциях (сепсис, малярия, бруцеллез, возвратный тиф), при переливании иногрупной крови и резус-конфликте (гемолитическая болезнь новорожденных). В этих случаях гемосидерин в избыточном количестве накапливается в ретикулярных, эндотелиальных клетках и макрофагах селезенки, костного мозга, лимфатических узлов, печени. Вместе с тем, сидеробластами становятся эпителиальные клетки печени, потовых и слюнных желез, легких, почек. Микроскопически в них выявляются гранулы бурого цвета. Внешний вид органов характерен: они приобретают ржавый оттенок. В далеко зашедших случаях
гемосидерин накапливается и в строме органов, и в стенках сосудов. Появляется большое количество сидерофагов, которые не успевают утилизировать гемосидерин, загружающий межклеточное вещество. Одновременно накапливаются «катаболический» ферритин и билирубин. Последний образуется в таком большом количестве, что печень не успевает его утилизировать, и развивается гемолитическая желтуха.
Одновременно накапливаются «катаболический» ферритин и билирубин. Последний образуется в таком большом количестве, что печень не успевает его утилизировать, и развивается гемолитическая желтуха.
Местный гемосидероз.Развивается при внесосудистом гемолизе в очагах кровоизлияний. Сидеробластами становятся лейкоциты, гистиоциты, ретикулярные клетки, эндотелий и эпителиальные клетки. Из продуктов гемолиза в органах, где возникают кровоизлияния, в цитоплазме этих клеток синтезируются ферритин и гемосидерин. В крупных кровоизлияниях, помимо гемосидерина, образуется еще гематоидин. При этом гемосидерин обычно располагается на периферии кровоизлияний, а гематоидин, для образования которого кислород не нужен, откладывается в центре, в очагах аутолиза. В мелких, чаще диапедезного характера кровоизлияниях обычно образуется только гемосидерин. В участках бывших кровоизлияний сидерофаги сохраняются очень долго, отчего ткани приобретают бурый оттенок.
В клинике большое значение имеет гемосидероз легких, который развивается в результате хронического венозного застоя у больных с заболеваниями сердца на стадии декомпенсации (пороки сердца, кардиосклероз и др. ). В легких развиваются многочисленные диапедезные кровоизлияния, в клетках альвеолярного эпителия и в гистиоцитах синтезируются гемосидерин и ферритин. Сидеробласты и сидерофаги «заболачивают» полости альвеол, гипоксия нарастает и в этих условиях начинает синтезироваться SH-ферритин, обладающий, как было сказано выше, вазо-паралитическим действием. Это приводит к еще большему повышению сосудистой проницаемости, нарастанию диапедеза и соответственно накоплению гемосидерина и SH-ферритина. Порочный круг замыкается, и у больных развивается ферритиновый коллапс или шок. Гипоксия, помимо того, стимулирует коллагеносинтетическую активность фибробластов — в легких нарастает склероз, они становятся плотными на ощупь и бурыми за счёт накопления гемосидерина. Подобные изменения принято называть «бурая индурация легких» (от лат. induratio — затвердение, уплотнение). Сидеробласты и сидерофаги нередко обнаруживают и в мокроте, которой они придают ржавый оттенок. В таких случаях их называют клетками сердечных пороков.
). В легких развиваются многочисленные диапедезные кровоизлияния, в клетках альвеолярного эпителия и в гистиоцитах синтезируются гемосидерин и ферритин. Сидеробласты и сидерофаги «заболачивают» полости альвеол, гипоксия нарастает и в этих условиях начинает синтезироваться SH-ферритин, обладающий, как было сказано выше, вазо-паралитическим действием. Это приводит к еще большему повышению сосудистой проницаемости, нарастанию диапедеза и соответственно накоплению гемосидерина и SH-ферритина. Порочный круг замыкается, и у больных развивается ферритиновый коллапс или шок. Гипоксия, помимо того, стимулирует коллагеносинтетическую активность фибробластов — в легких нарастает склероз, они становятся плотными на ощупь и бурыми за счёт накопления гемосидерина. Подобные изменения принято называть «бурая индурация легких» (от лат. induratio — затвердение, уплотнение). Сидеробласты и сидерофаги нередко обнаруживают и в мокроте, которой они придают ржавый оттенок. В таких случаях их называют клетками сердечных пороков.
Гемосидероз является морфологическим субстратом самостоятельного заболевания, ĸᴏᴛᴏᴩᴏᴇ принято называть «идиопатический гемосидероз легких», или «синдром Делена — Геллерстедта». Он встречается у детей в возрасте 3—8 лет и характеризуется повторяющимися кровоизлияниями в легочную паренхиму с последующим массивным гемосидерозом и склерозом, кровохарканьем и развитием вторичной железодефицитной анемии. В легких имеется типичная картина бурой индурации, но поражение сердца у больных отсутствует. Причина заболевания до конца неясна. Сегодня имеется большое количество данных, подтверждающих, что в базе процесса лежит аутоагрессивное поражение легких, при котором реакция антиген — антитело реализуется на сосудах микроциркуляторного русла легких. Иммунологическая природа заболевания подтверждается тем, что при идиопатическом гемосидерозе легких могут поражаться и почки с развитием синдрома Гудпасчера, а в крови больных нередко обнаруживают антитела к ткани легкого и к коровьему молоку.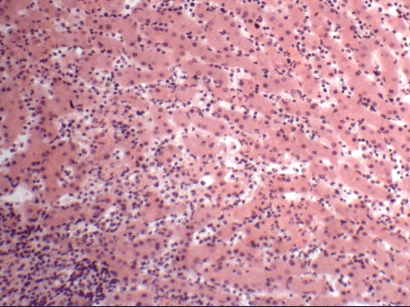
Идиопатический гемосидероз легких. Причины, симптомы и лечение!
1.Общие сведения
В длинном перечне диагнозов, обозначающих рассматриваемое здесь тяжелое заболевание, не хватает еще одного, – самого краткого и, возможно, самого точного: «железное легкое». Гемосидерин – продукт распада гемоглобина и денатурации белка ферритина.
Заметим, что греческое «сидерос» означает то же самое, что латинское «феррум», то есть железо. Ферритин – сложный белковый комплекс, который служит «кладовой» железа в организме. Гемосидерин – пигмент, который в больших объемах придает депонирующим его тканям характерный ржаво-бурый оттенок, поскольку содержит оксид железа.
Термин «гемосидероз»,
согласно канонам образования слов в медицине, должен означать явный,
патологический избыток гемосидерина; в данном случае речь идет о его накоплении
в легочной паренхиматозной ткани.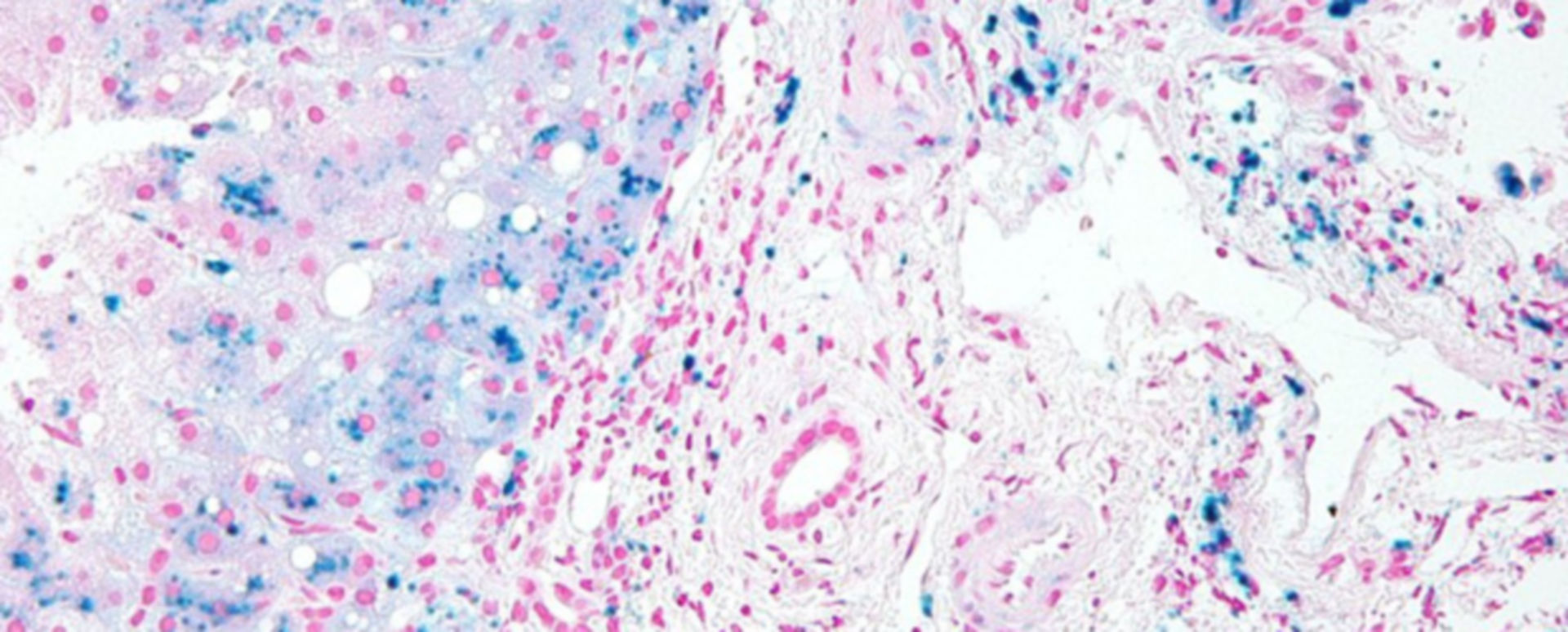
Такое состояние впервые описал выдающийся немецкий ученый-энциклопедист Рудольф Вирхов в 1864 году, и ему же принадлежит определение «бурая индурация легких». С тех пор прошло более полутора веков, однако у исследователей по сей день остается множество вопросов в связи с этим заболеванием. Найти ответы, да и просто установить правильный диагноз в данном случае очень трудно: гемосидероз легких встречается примерно один раз на миллион человек, – что чрезвычайно затрудняет и разработку диагностических критериев, и исследования патогенеза, – и лишь в последние годы его стали доказательно диагностировать прижизненно (ранее установить точный диагноз удавалось, в основном, при патологоанатомическом исследовании).
Гемосидероз встречается у
лиц обоих полов и в любом возрасте. Однако накопленная к настоящему времени
статистика выявляет, по некоторым источникам, двукратное преобладание мужчин
среди заболевающих. Сообщается также о том, что заболевание манифестирует
преимущественно в детском и юношеском возрасте.
Сообщается также о том, что заболевание манифестирует
преимущественно в детском и юношеском возрасте.
Запись на консультацию
Обязательно для ознакомления!
Помощь в госпитализации и лечении!
2.Причины
Непосредственной причиной
является проникновение и накопление эритроцитов в легочной паренхиме (с
последующим высвобождением гемосидерина), – вследствие частых капиллярных
кровотечений. Однако причина несостоятельности сосудистых стенок и повышенной
их проницаемости, что приводит к избирательному депонированию именно оксида
железа, остается неизвестной. Наиболее разработанными и аргументированными, на
сегодняшний день, являются гипотезы о врожденной наследственной аномалии (что
подтверждается, в частности, известными случаями семейного гемосидероза) и/или
об аутоиммунно-аллергической природе заболевания (в пользу чего говорят случаи
гемосидероза в сочетании с аллергической чувствительностью, а также
терапевтическая эффективность гормональных средств). Кроме того, ряд авторов
считают доказанной этиопатогенетическую роль инфекций, в первую очередь
вирусных и, возможно, протозойных (малярийный плазмодий).
Кроме того, ряд авторов
считают доказанной этиопатогенетическую роль инфекций, в первую очередь
вирусных и, возможно, протозойных (малярийный плазмодий).
Посетите нашу страницу
Пульмонология
3.Симптомы
Течение идиопатического
гемосидероза легких, как правило, волнообразное, хроническое, с чередованием
ремиссий и обострений, выраженных в той или иной степени. Типичны симптомы
гипохромной анемии и дыхательной недостаточности, кровохарканье, в наиболее тяжелых
случаях – массивные легочные геморрагии. В периоды обострений отмечается
кашель, затрудненное дыхание, тахикардия, общая слабость, иногда повышенная
температура тела, боли в груди или абдоминальной области.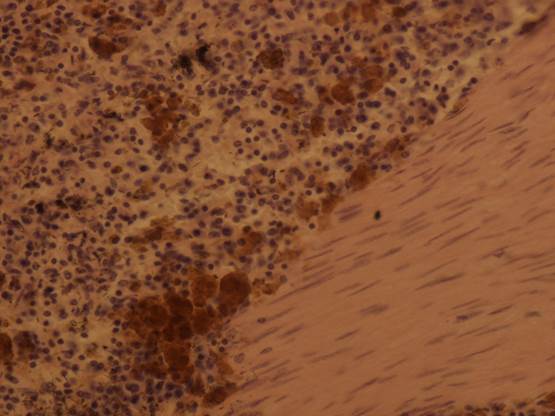 Продолжительность
ремиссий и кризовых обострений широко варьирует (от нескольких часов до
нескольких недель). Заболевание постепенно прогрессирует, в отсутствие
адекватной терапии состояние больного утяжеляется, и результатом нарастающей
сердечно-легочной недостаточности, присоединяющегося пневмоторакса, закупорки
бронхов свернувшейся кровью, инфаркта легких, – становится летальный исход.
Продолжительность
ремиссий и кризовых обострений широко варьирует (от нескольких часов до
нескольких недель). Заболевание постепенно прогрессирует, в отсутствие
адекватной терапии состояние больного утяжеляется, и результатом нарастающей
сердечно-легочной недостаточности, присоединяющегося пневмоторакса, закупорки
бронхов свернувшейся кровью, инфаркта легких, – становится летальный исход.
Как указано выше, гемосидероз легких является очень сложным в диагностике заболеванием.
Необходимо самое тщательное изучение анамнеза, клиники, динамики, наследственности, иммунно-аллергического статуса, ряда биохимических показателей, рентгенографических данных, результатов функциональных дыхательных проб. Следует также дифференцировать идиопатический сидероз с множеством клинически сходных заболеваний.
О нашей клинике
м. Чистые пруды
Чистые пруды
Страница Мединтерком!
4.Лечение
В последнее время стандартом терапевтического сопровождения больных гемосидерозом легких стали кортикостероидные гормональные средства. Многие авторы полагают более эффективным сочетание гормональной терапии с удалением селезенки. Симптоматически назначают также препараты, применяемые при лечении железодефицитных анемий; с той же целью по показаниям производят переливания препаратов крови.
Несмотря на то, что
результаты такого комплексного подхода оцениваются в литературе как
«обнадеживающие», прогноз остается неблагоприятным. Лишь при достоверно и
правильно установленном диагнозе, интенсивном адекватном лечении и наблюдении
продолжительность жизни больных превышает 10 лет; в среднем же, этот
показатель пока остается на уровне 3-5 лет.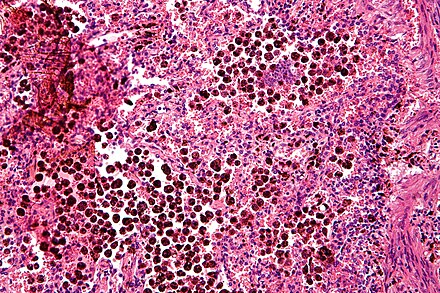
Запись на консультацию
Лабораторная диагностика гемохроматоза
Комплексное исследование для диагностики гемохроматоза, включающее все необходимые клинико-лабораторные маркеры обмена железа и оценку функции печени.
Синонимы русские
Анализы крови для диагностики гемохроматоза.
Синонимы английские
Hemochromatosis Laboratory Panel, Laboratory diagnostics of hemochromatosis.
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Не принимать пищу в течение 12 часов до исследования, можно пить чистую негазированную воду.
- Исключить (по согласованию с врачом) прием лекарственных препаратов, содержащих железо, в течение 72 часов до исследования.
- Исключить физическое и эмоциональное перенапряжение в течение 30 минут до исследования.
- Не курить в течение 30 минут до исследования.

Общая информация об исследовании
Гемохроматоз – это заболевание, связанное с накоплением в организме избытка железа. Различают приобретенный и наследственный гемохроматоз. Приобретенный гемохроматоз чаще всего наблюдается как осложнение многократных переливаний крови при гемолитических анемиях. Наследственный гемохроматоз обусловлен мутацией в гене гепсидина HFE – основного гормона, регулирующего обмен железа в организме. При избытке железа гепсидин тормозит его абсорбцию в кишке и его поступление в кровь из макрофагов, поддерживая, таким образом, уровень сывороточного железа в пределах физиологической нормы. Мутации в гене HFE приводят к изменению аминокислотной последовательности гепсидина, снижению его секреции в ответ на увеличение концентрации железа в крови и, как следствие, накоплению железа в организме.
Отложение ионов железа преимущественно наблюдается в печени, суставах, миокарде, гипофизе и некоторых других органах. Избыток железа способствует образованию свободных радикалов кислорода, что в итоге приводит к повреждению и необратимым изменениям в этих органах, в том числе циррозу печени и рестриктивной кардиомиопатии. Более того, избыток железа при гемохроматозе был ассоциирован с повышенным риском рака печени и молочной железы. С другой стороны, ранняя диагностика гемохроматоза позволяет своевременно начать лечение и предотвратить развитие серьезных осложнений болезни.
Избыток железа способствует образованию свободных радикалов кислорода, что в итоге приводит к повреждению и необратимым изменениям в этих органах, в том числе циррозу печени и рестриктивной кардиомиопатии. Более того, избыток железа при гемохроматозе был ассоциирован с повышенным риском рака печени и молочной железы. С другой стороны, ранняя диагностика гемохроматоза позволяет своевременно начать лечение и предотвратить развитие серьезных осложнений болезни.
В большинстве случаев гемохроматоз протекает бессимптомно, а подозрение на это заболевание возникает при случайном выявлении отклонений в анализах на железо или анализах на функцию печени. При подозрении на гемохроматоз проводят комплексное исследование, включающее клинико-лабораторные маркеры обмена железа и анализы функции печени.
Клинико-лабораторные маркеры обмена железа при гемохроматозе
Гемохроматоз характеризуется изменением следующих показателей:
- Ферритин – внутриклеточный белок, обеспечивающий хранение железа в тканях.
 Небольшая часть ферритина поступает в кровь и может быть измерена. Считается, что концентрация ферритина в крови отражает запасы железа в организме. При гемохроматозе ферритин сыворотки крови повышен. Повышение концентрации ферритина более 300 мкг/л у мужчин и более 200 мкг/л у женщин свидетельствует о гемохроматозе. Ферритин сыворотки – это также показатель тяжести заболевания: уровень ферритина менее 1000 нг/мл свидетельствует об отсутствии цирроза печени. Кроме первичной диагностики гемохроматоза, уровень ферритина исследуют для оценки эффективности лечения заболевания (флеботомий).
Небольшая часть ферритина поступает в кровь и может быть измерена. Считается, что концентрация ферритина в крови отражает запасы железа в организме. При гемохроматозе ферритин сыворотки крови повышен. Повышение концентрации ферритина более 300 мкг/л у мужчин и более 200 мкг/л у женщин свидетельствует о гемохроматозе. Ферритин сыворотки – это также показатель тяжести заболевания: уровень ферритина менее 1000 нг/мл свидетельствует об отсутствии цирроза печени. Кроме первичной диагностики гемохроматоза, уровень ферритина исследуют для оценки эффективности лечения заболевания (флеботомий). - Трансферрин – белок плазмы крови, обеспечивающий транспорт железа. Как правило, концентрации трансферрина и ферритина в крови находятся в обратной пропорциональной зависимости: чем выше уровень ферритина, тем ниже уровень трансферрина. При гемохроматозе трансферрин сыворотки снижен. Следует помнить, что трасферрин и ферритин относятся к так называемым белкам острой фазы воспаления, поэтому их концентрация зависит не только от уровня железа, но и от многих других факторов, в первую очередь от воздействия на гепатоциты про- и противовоспалительных цитокинов.

- Железосвязывающая способность сыворотки (ЖССС) отражает максимальное количество железа, необходимое для связывания (насыщения) всего имеющегося трасферрина. Этот показатель, таким образом, зависит от концентрации трансферрина в крови. ЖССС является дополнительным, непрямым методом оценки концентрации трансферрина в крови. У пациентов с гемохроматозом ЖССС снижена.
- Латентная ЖССС. В норме только около трети трансферрина связано с железом, то есть насыщение (сатурация) трансферрина составляет около 30 %. Оставшиеся 70 % — это ненасыщенный трасферрин. Для оценки концентрации ненасыщенного трансферрина исследуют латентную ЖССС. Наряду с ферритином, латентная ЖССС – это один из самых важных клинико-лабораторных маркеров обмена железа, исследуемых при подозрении на гемохроматоз. Показано, что с помощью этого показателя можно выявить 100 % пациентов с избытком железа и 95 % пациентов с нормальным обменом железа. При гемохроматозе латентная ЖССС снижена.

Клинико-лабораторные маркеры функции печени при гемохроматозе
Для комплексной оценки функции печени при гемохроматозе оценивают следующие показатели:
- Общий белок – интегральный показатель белкового обмена в организме, включающий около 100 различных пептидов, объединяемых в 2 группы: альбумин и глобулины. Альбумин необходим для поддержания онкотического давления крови и транспорта гормонов, билирубина, жирных кислот и ксенобиотиков. Печень является основным источником белка, в том числе альбумина, крови. При нарушении синтетической функции печени концентрация общего белка и альбумина, как правило, снижается.
- АЛТ и АСТ – ферменты, катализирующие перенос аминогрупп между аминокислотами (трансаминазы). Хотя эти ферменты также могут быть обнаружены во многих других тканях и органах (сердце, скелетные мышцы, почки, головной мозг, эритроциты), изменение их концентрации в крови чаще связано с заболеваниями печени, что обуславливает их название — печеночные трансаминазы.
 АЛТ является более специфичным маркером заболеваний печени, чем АСТ.
АЛТ является более специфичным маркером заболеваний печени, чем АСТ. - Билирубин – пигмент, образующийся при распаде гемоглобина и некоторых других гемсодержащих белков в печени, селезенке и костном мозге. Общий билирубин включает свободный (несвязанный, непрямой) и связанный (прямой) билирубин. При нарушении функции печени концентрация билирубина возрастает.
Следует отметить, что при гемохроматозе уровень указанных клинико-лабораторных маркеров функции печени может в течение длительного времени оставаться в пределах нормы.
При обнаружении изменений, характерных для гемохроматоза, рекомендовано проведение генетического теста и биопсии печени. При подтверждении у пациента диагноза «наследственный гемохроматоз» всем его родственникам первой линии родства показан лабораторный скрининг этого заболевания. Скрининг гемохроматоза в общей популяции в настоящее время не рекомендован. Пациентам с подтвержденным диагнозом «гемохроматоз» также рекомендуется проведение дополнительного скринингового теста на гепатоцеллюлярную карциному – анализа на альфа-фетопротеин.
Для чего используется исследование?
- Для диагностики гемохроматоза.
Когда назначается исследование?
- При выявлении у пациента:
- повышения уровня печеночных трансаминаз;
- отклонений в анализах на железо;
- симптомов или заболеваний, ассоциированных с гемохроматозом: слабости, артралгий, импотенции, цирроза печени, остеопороза, гепатоцеллюлярной карциномы, кардиомиопатии, сахарного диабета, гипогонадизма и других;
- при обследовании пациента, получающего регулярные, частые переливания крови;
- при обследовании родственника первой линии родства пациента с подтвержденным диагнозом «наследственный гемохроматоз».
Что означают результаты?
Референсные значения
Для каждого показателя, входящего в состав комплекса:
Гемосидероз — обзор | ScienceDirect Topics
Неонатальная болезнь накопления железа
Неонатальная болезнь накопления железа (NISD) — плохо изученное, редкое семейное нарушение метаболизма железа, характеризующееся тяжелой печеночной недостаточностью внутриутробного развития (161).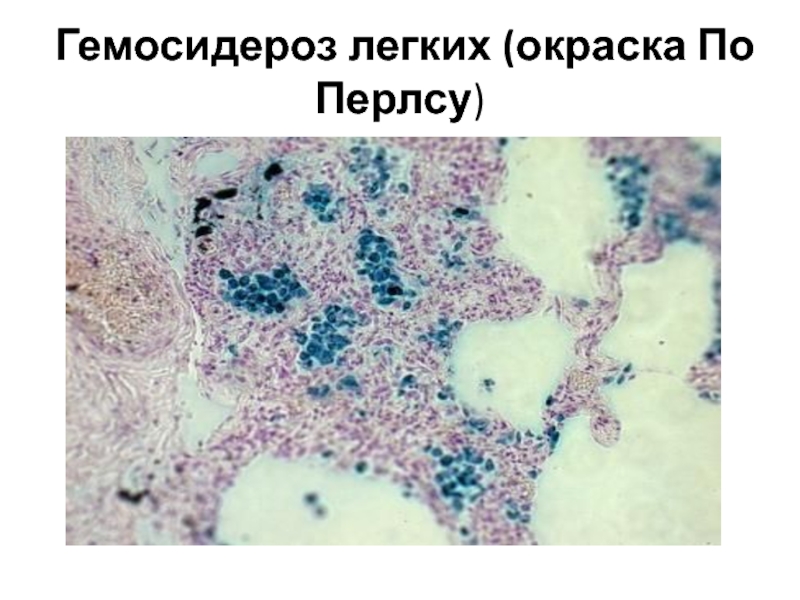 Эту проблему часто называют неонатальным гемохроматозом из-за ее связи с внепеченочным сидерозом и сохранением ретикулоэндотелиальной системы. Точная причина NISD и природа основного дефекта остаются неопределенными.Было высказано предположение, что NISD может представлять собой необычное проявление наследственного гемохроматоза у взрослых из-за сходного характера отложения железа; однако новые генетические данные свидетельствуют о том, что эти два заболевания представляют собой отдельные сущности. В то время как мутации гена HFE ответственны за подавляющее большинство случаев наследственного гемохроматоза у взрослых (162), эта мутация не обнаруживается при NISD (163). Другие генетические мутации, описанные при наследственном гемохроматозе у взрослых, также заметно отсутствуют при NISD (163).Чтобы еще больше исключить возможную связь между NISD и заболеванием, возникающим во взрослом возрасте, 30-летнее последующее исследование перегрузки железом в семье, в которой 6 из 9 детей умерли внутриутробно или в раннем неонатальном периоде, не выявило наследственного гемохроматоза или других заболеваний, связанных с железом.
Эту проблему часто называют неонатальным гемохроматозом из-за ее связи с внепеченочным сидерозом и сохранением ретикулоэндотелиальной системы. Точная причина NISD и природа основного дефекта остаются неопределенными.Было высказано предположение, что NISD может представлять собой необычное проявление наследственного гемохроматоза у взрослых из-за сходного характера отложения железа; однако новые генетические данные свидетельствуют о том, что эти два заболевания представляют собой отдельные сущности. В то время как мутации гена HFE ответственны за подавляющее большинство случаев наследственного гемохроматоза у взрослых (162), эта мутация не обнаруживается при NISD (163). Другие генетические мутации, описанные при наследственном гемохроматозе у взрослых, также заметно отсутствуют при NISD (163).Чтобы еще больше исключить возможную связь между NISD и заболеванием, возникающим во взрослом возрасте, 30-летнее последующее исследование перегрузки железом в семье, в которой 6 из 9 детей умерли внутриутробно или в раннем неонатальном периоде, не выявило наследственного гемохроматоза или других заболеваний, связанных с железом. — болезнь накопления у родителей или выживших братьев и сестер (164). Модели семейного возникновения NISD и более высокая, чем ожидалось, частота NISD у братьев и сестер в индексном случае (∼80%) затрудняют объяснение генетического наследования. Некоторые предполагают, что NISD может быть связан с приобретенным материнским фактором, таким как гестационный аллоиммунный процесс.Это могло бы помочь объяснить успех высоких доз иммуноглобулина во время беременности для снижения заболеваемости рецидивирующим неонатальным гемохроматозом у братьев и сестер основного случая (165).
— болезнь накопления у родителей или выживших братьев и сестер (164). Модели семейного возникновения NISD и более высокая, чем ожидалось, частота NISD у братьев и сестер в индексном случае (∼80%) затрудняют объяснение генетического наследования. Некоторые предполагают, что NISD может быть связан с приобретенным материнским фактором, таким как гестационный аллоиммунный процесс.Это могло бы помочь объяснить успех высоких доз иммуноглобулина во время беременности для снижения заболеваемости рецидивирующим неонатальным гемохроматозом у братьев и сестер основного случая (165).
Младенцы с NISD обычно имеют нормальные уровни сывороточного железа и трансферрина с заметно повышенным сывороточным ферритином. Несмотря на то, что физиология поступления железа в кровоток плода и обращение с железом в клетках плода до конца не изучены, предполагается, что плацентарный перенос железа представляет собой тщательно регулируемый процесс, включающий два ключевых компонента, гепсидин и ферропортин (161). Гепсидин — это пептид, высвобождаемый печенью в ответ на высокий уровень железа в сыворотке крови (166). Сверхэкспрессия гепсидина связана с анемией воспаления, а дефицит гепсидина связан с синдромами перегрузки железом. Гепсидин снижает количество ферропортина, ключевого регулятора клеточного экспорта железа в энтероцитах, гепатоцитах и макрофагах. Следует также отметить, что избыточное отложение железа наблюдается и при других заболеваниях, например при тирозинемии, что может привести к значительному антенатальному повреждению печени.Таким образом, NISD может быть вторичным явлением, а не уникальным генетическим заболеванием, связанным с нарушением метаболизма железа.
Гепсидин — это пептид, высвобождаемый печенью в ответ на высокий уровень железа в сыворотке крови (166). Сверхэкспрессия гепсидина связана с анемией воспаления, а дефицит гепсидина связан с синдромами перегрузки железом. Гепсидин снижает количество ферропортина, ключевого регулятора клеточного экспорта железа в энтероцитах, гепатоцитах и макрофагах. Следует также отметить, что избыточное отложение железа наблюдается и при других заболеваниях, например при тирозинемии, что может привести к значительному антенатальному повреждению печени.Таким образом, NISD может быть вторичным явлением, а не уникальным генетическим заболеванием, связанным с нарушением метаболизма железа.
Если антенатальной смерти не происходит, младенцы с NISD обычно тяжело больны при рождении или в первые дни жизни с гипогликемией, коагулопатией, гипербилирубинемией и ранним развитием асцита. Неонатальная болезнь накопления железа является одной из наиболее частых причин перинатального цирроза печени. В некоторых случаях диагноз связан с неиммунной водянкой плода; следовательно, существует возможность ранней диагностики перинатологом (167). Неизвестно, может ли внутриутробное заболевание печени, вторичное по отношению к инфекции, привести к NISD, но внутри- и внепеченочный сидероз может сопровождать хроническое ЦМВ-заболевание печени плода (168) и более острое неонатальное эховирусное заболевание печени 9 с ассоциированной экзогенной перегрузкой железом (169). Врожденные нарушения метаболизма также связаны с повышенным содержанием железа в печени, особенно при тирозинемии I типа и нарушениях синтеза желчных кислот (170). Неонатальное заболевание печени, вторичное по отношению к перегрузке железом, также может быть связано с материнским синдромом Шегрена (171).
Неизвестно, может ли внутриутробное заболевание печени, вторичное по отношению к инфекции, привести к NISD, но внутри- и внепеченочный сидероз может сопровождать хроническое ЦМВ-заболевание печени плода (168) и более острое неонатальное эховирусное заболевание печени 9 с ассоциированной экзогенной перегрузкой железом (169). Врожденные нарушения метаболизма также связаны с повышенным содержанием железа в печени, особенно при тирозинемии I типа и нарушениях синтеза желчных кислот (170). Неонатальное заболевание печени, вторичное по отношению к перегрузке железом, также может быть связано с материнским синдромом Шегрена (171).
Характерными патологическими проявлениями NISD являются выраженный сидероз печени, поджелудочной железы, почек и надпочечников с сохранением ретикулоэндотелиальной системы. Аномальные уровни железа также обнаруживаются в малых слюнных железах, которые легко доступны при биопсии слизистой оболочки щек. Гемосидероз печени может быть связан с выраженным гепатоцеллюлярным некрозом, регенеративными узлами с истинным врожденным циррозом, псевдоацинарными изменениями, гигантоклеточной трансформацией и диффузным синусоидальным фиброзом (172). Среда печени, богатая железом, может вызывать гепатоцеллюлярное повреждение посредством катализируемого железом перекисного окисления липидов, то есть окислительного повреждения клеточных мембран и структур органелл (173).
Среда печени, богатая железом, может вызывать гепатоцеллюлярное повреждение посредством катализируемого железом перекисного окисления липидов, то есть окислительного повреждения клеточных мембран и структур органелл (173).
Эффективность дефероксамина у этих детей с NISD не доказана (174), а трансплантация печени в качестве радикального лечения обычно невозможна из-за задержки восстановления печени у этих очень больных детей. Однако при выполнении трансплантация печени обеспечивает 50% долгосрочную выживаемость и должна рассматриваться у тех пациентов, которые не реагируют на поддерживающую медицинскую помощь (175).
Младенцы с NISD лечились комбинацией антиоксидантов, криопротекторов и хелаторов. Потенциальная эффективность этого антиоксидантно-хелатного «коктейля» противоречива: некоторые сообщают о пользе при более легком заболевании (176), а другие сообщают об отсутствии изменений в исходах (175, 177). Чтобы оправдать эту терапию, у младенца должен быть по крайней мере заметно повышенный уровень ферритина в сыворотке; сидероз малой слюнной железы; выраженный сидероз с вовлечением печени, если биопсия не была небезопасной из-за коагулопатии. Используются следующие три антиоксиданта: витамин Е, N -ацетилцистеин и селен (176). Простагландин E1 и дефероксамин используются для криозащитного эффекта и хелатирования железа соответственно (176). Реакция на эту терапию для равномерно фатального NISD, хотя и потенциально полезная, необходимо будет наблюдать в большей группе пациентов.
Используются следующие три антиоксиданта: витамин Е, N -ацетилцистеин и селен (176). Простагландин E1 и дефероксамин используются для криозащитного эффекта и хелатирования железа соответственно (176). Реакция на эту терапию для равномерно фатального NISD, хотя и потенциально полезная, необходимо будет наблюдать в большей группе пациентов.
Гемосидероз — обзор | ScienceDirect Topics
ПЕРЕГРУЗКА ЖЕЛЕЗОМ
Перегрузка железом, приводящая к гемосидерозу, является серьезным долговременным осложнением хронической трансфузии у пациентов с ВСС.Наиболее информативные сообщения о перегрузке железом, связанной с переливанием крови, были описаны у пациентов с талассемией; см. «Талассемии» для обсуждения патофизиологии перегрузки железом. Пациентов, у которых развивается перегрузка железом, можно лечить длительной хелатирующей терапией в форме дефероксамина; однако эта терапия является дорогостоящей, и из-за многочисленных побочных эффектов и трудностей с введением препарата в анамнезе уровень приверженности пациентов был заведомо низким. 113 Однако после одобрения FDA в ноябре 2005 г. первого перорального хелатора железа, доступного в США, 114 соблюдение долгосрочной хелаторной терапии может улучшиться в результате повышения простоты использования.
113 Однако после одобрения FDA в ноябре 2005 г. первого перорального хелатора железа, доступного в США, 114 соблюдение долгосрочной хелаторной терапии может улучшиться в результате повышения простоты использования.
Одним из потенциальных методов переливания крови для предотвращения перегрузки железом, который в настоящее время изучается у пациентов с ВСС, является хронический эритроцитаферез. Процедуры хронического эритроцитафереза можно проводить с интервалом в 3–4 недели. В отличие от простых переливаний, собственные серповидные эритроциты пациента удаляются, в то время как вливается равный объем нормальных донорских эритроцитов. Очевидным потенциальным преимуществом хронического эритроцитафереза по сравнению с простым переливанием крови является предотвращение длительного накопления железа и гемосидероз.
Хотя хронический эритроцитаферез не применялся повсеместно, он оказался клинически эффективным в снижении перегрузки железом у пациентов с ВСС, получающих хронические гемотрансфузии. Четыре исследовательские группы 19–22 описали свой индивидуальный опыт использования протоколов трансфузии с хроническим эритроцитаферезом для пациентов с ВСС. Все предположили, что эритроцитаферез действительно ограничивает накопление железа у пациентов с ВСС, но три из четырех групп сообщили, что эритроцитаферез не устраняет необходимость в хелатотерапии у пациентов с ранее накопленным железом. 20–22 В целом уровни ферритина снижались у пациентов, подвергающихся хроническому эритроцитаферезу, получавших сопутствующую хелатирующую терапию, и незначительно снижались или стабилизировались у пациентов, не получавших хелатирующую терапию. Однако у пациентов из группы риска, которые начали эритроцитаферез без длительного анамнеза предшествующих хронических простых трансфузий, сохранялись очень низкие уровни ферритина в сыворотке, не требующие хелатирующей терапии. 20–22
Четыре исследовательские группы 19–22 описали свой индивидуальный опыт использования протоколов трансфузии с хроническим эритроцитаферезом для пациентов с ВСС. Все предположили, что эритроцитаферез действительно ограничивает накопление железа у пациентов с ВСС, но три из четырех групп сообщили, что эритроцитаферез не устраняет необходимость в хелатотерапии у пациентов с ранее накопленным железом. 20–22 В целом уровни ферритина снижались у пациентов, подвергающихся хроническому эритроцитаферезу, получавших сопутствующую хелатирующую терапию, и незначительно снижались или стабилизировались у пациентов, не получавших хелатирующую терапию. Однако у пациентов из группы риска, которые начали эритроцитаферез без длительного анамнеза предшествующих хронических простых трансфузий, сохранялись очень низкие уровни ферритина в сыворотке, не требующие хелатирующей терапии. 20–22
Таким образом, представляется, что хронический эритроцитаферез может быть наиболее полезным, если его начать в начале курса хронической трансфузионной терапии, до того, как произойдет значительное накопление железа. Тем не менее, хронический эритроцитаферез, по-видимому, стабилизирует или снижает уровень ферритина в сыворотке крови у пациентов, у которых уже развилась значительная перегрузка железом и которые продолжают хелаторную терапию. 20–22
Тем не менее, хронический эритроцитаферез, по-видимому, стабилизирует или снижает уровень ферритина в сыворотке крови у пациентов, у которых уже развилась значительная перегрузка железом и которые продолжают хелаторную терапию. 20–22
Основными потенциальными проблемами, связанными с протоколом хронического эритроцитафереза и трансфузией (по сравнению с протоколами хронического простого переливания), являются повышенное воздействие продуктов крови с сопутствующим повышенным риском аллоиммунизации к эритроцитам и тромбоцитам и инфекции, передающейся при переливании крови, а также повышенная стоимость (т.е., увеличение количества используемых продуктов крови, увеличение стоимости фенотипически сходных единиц, если они выбраны для переливания, и добавленная стоимость самих автоматизированных процедур).
В четырех опубликованных отчетах 19–22 указано, что воздействие препаратов крови пациентов с ВСС увеличивается при использовании протоколов хронического эритроцитафереза, при этом сообщается об увеличении степени использования крови в диапазоне от 52% до почти 100% (т.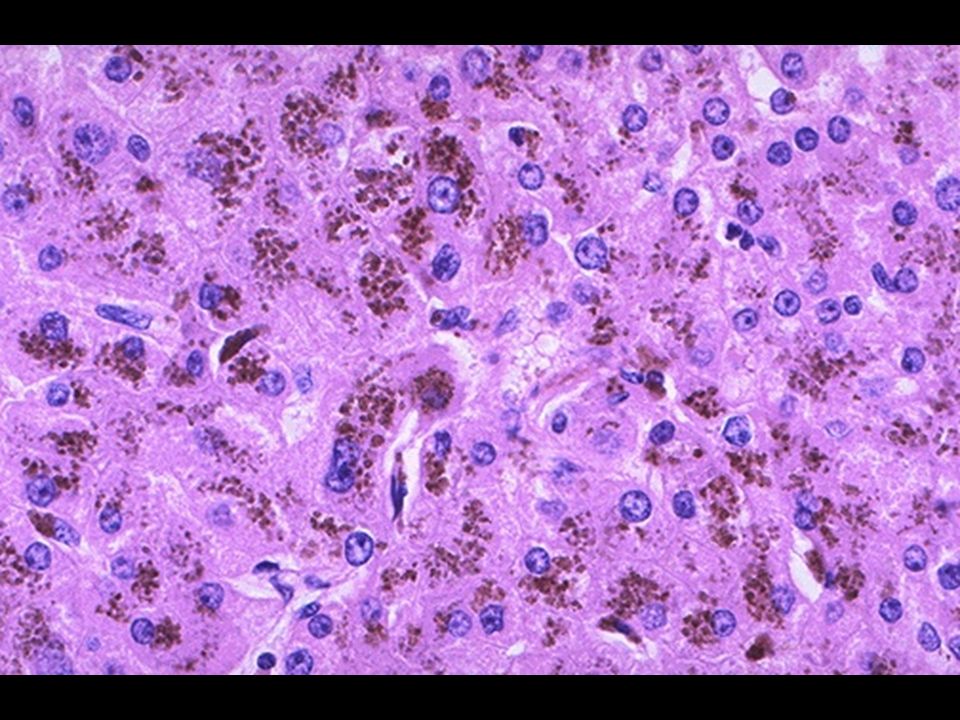 е. в 1-2 раза больше единиц эритроцитов). трансфузии, чем при предыдущих простых трансфузиях тем же больным).Однако из 43 исследованных больных только у 1 в период лечения эритроцитаферезом образовались аллоантитела 20 . В трех из этих центров для процедур эритроцитафереза использовали антиген-совместимые единицы эритроцитов: Singer and Associates 22 , соответствующие C, E и K; Hilliard и коллеги 21 для C, E, K, Fy a и Jk b ; и Adams and Associates 20 для C, E, K и Jk b . При оценке очень низких показателей аллоиммунизации, о которых сообщалось для протоколов хронического эритроцитафереза, важно понимать, что большинство исследованных пациентов с ВСС получали единицы эритроцитов, совпадающие по крайней мере по антигенам С, Е и К.
е. в 1-2 раза больше единиц эритроцитов). трансфузии, чем при предыдущих простых трансфузиях тем же больным).Однако из 43 исследованных больных только у 1 в период лечения эритроцитаферезом образовались аллоантитела 20 . В трех из этих центров для процедур эритроцитафереза использовали антиген-совместимые единицы эритроцитов: Singer and Associates 22 , соответствующие C, E и K; Hilliard и коллеги 21 для C, E, K, Fy a и Jk b ; и Adams and Associates 20 для C, E, K и Jk b . При оценке очень низких показателей аллоиммунизации, о которых сообщалось для протоколов хронического эритроцитафереза, важно понимать, что большинство исследованных пациентов с ВСС получали единицы эритроцитов, совпадающие по крайней мере по антигенам С, Е и К.
Важным вопросом является высокая стоимость эритроцитафереза. Hilliard и коллеги 21 сравнили общую стоимость эритроцитафереза в течение 1 года (36 085 долларов США) с общей годовой стоимостью простого переливания крови (26 058 долларов США) и обнаружили экономически значимую разницу.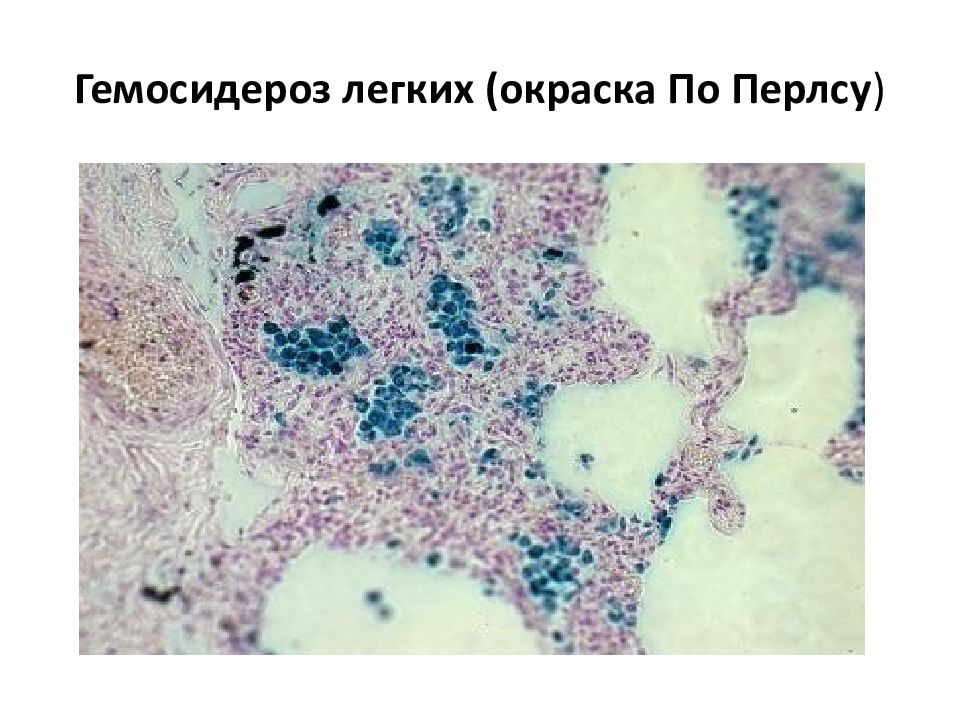 Они предположили, что дополнительная стоимость хелатирующей терапии (29 480 долларов США) с простым переливанием крови (всего 62 143 доллара США) делает эритроцитаферез без хелатирования гораздо менее дорогой альтернативой. Однако у пациентов со значительным накоплением железа на момент начала терапии эритроцитаферезом необходимо продолжать хелатирующую терапию для снижения или стабилизации уровня ферритина в сыворотке. 19–21 Это сравнение затрат дает дополнительные доказательства того, что, если это технически возможно, раннее начало хронического эритроцитафереза у пациентов с внезапной сердечной смертью до того, как произойдет значительное накопление железа, может быть предпочтительнее длительной хронической простой трансфузии и связанных с этим осложнений перегрузки железом и необходимость хелатотерапии.
Они предположили, что дополнительная стоимость хелатирующей терапии (29 480 долларов США) с простым переливанием крови (всего 62 143 доллара США) делает эритроцитаферез без хелатирования гораздо менее дорогой альтернативой. Однако у пациентов со значительным накоплением железа на момент начала терапии эритроцитаферезом необходимо продолжать хелатирующую терапию для снижения или стабилизации уровня ферритина в сыворотке. 19–21 Это сравнение затрат дает дополнительные доказательства того, что, если это технически возможно, раннее начало хронического эритроцитафереза у пациентов с внезапной сердечной смертью до того, как произойдет значительное накопление железа, может быть предпочтительнее длительной хронической простой трансфузии и связанных с этим осложнений перегрузки железом и необходимость хелатотерапии.
Гемосидероз: предпосылки, патофизиология, эпидемиология
Автор
Галия Д. Напчан, доктор медицины Педиатр-пульмонолог, Детская больница Джо Ди Маджио
Галия Д.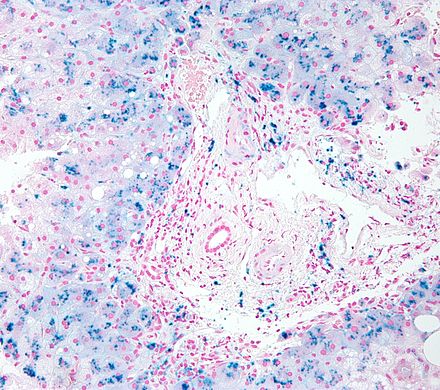 Напчан, доктор медицины, является членом следующих медицинских обществ: Американская академия педиатрии
Напчан, доктор медицины, является членом следующих медицинских обществ: Американская академия педиатрии
Раскрытие информации: ничего не раскрывается.
Соавтор (ы)
Исаак Талмациу, доктор медицинских наук Клинический доцент кафедры педиатрии Медицинской школы Атлантического университета Флориды
Исаак Талмациу, доктор медицинских наук, является членом следующих медицинских обществ: Американская академия педиатрии, Американское торакальное общество
Раскрытие информации: ничего раскрывать.
Редакционная коллегия специалистов
Мэри Л. Виндл, PharmD адъюнкт-профессор Фармацевтического колледжа Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: раскрывать нечего.
Чарльз Каллахан, DO Профессор, заведующий отделением педиатрии и детской пульмонологии, Армейский медицинский центр Tripler
Чарльз Каллахан, DO является членом следующих медицинских обществ: Американская академия педиатрии, Американский колледж врачей-пульмонологов, Американский колледж педиатров-остеопатов, Американское торакальное общество, Ассоциация военных хирургов США, Христианская медицинская и стоматологическая ассоциации
Раскрытие информации: Нечего раскрывать.
Главный редактор
Дениз Серебриски, доктор медицины доцент кафедры педиатрии Медицинского колледжа Альберта Эйнштейна; директор отделения легочной медицины педиатрического отделения Льюиса М. Фраада, медицинский центр Якоби/больница Северного Центрального Бронкса; Директор Детского центра астмы и аллергии Якоби, Медицинский центр Якоби
Дениз Серебриски, доктор медицинских наук, является членом следующих медицинских обществ: Американское торакальное общество
Раскрытие информации: Нечего раскрывать.
Дополнительные участники
Томас Сканлин, доктор медицины Заведующий отделением легочной медицины и Центра муковисцидоза, кафедра педиатрии, Медицинская школа имени Роберта Вуда Джонсона в Рутгерсе
Томас Сканлин, доктор медицины, является членом следующих медицинских обществ: Американская ассоциация содействия развитию науки , Общество педиатрических исследований, Американское общество биохимии и молекулярной биологии, Американское торакальное общество, Общество педиатрических исследований
Раскрытие информации: Нечего раскрывать.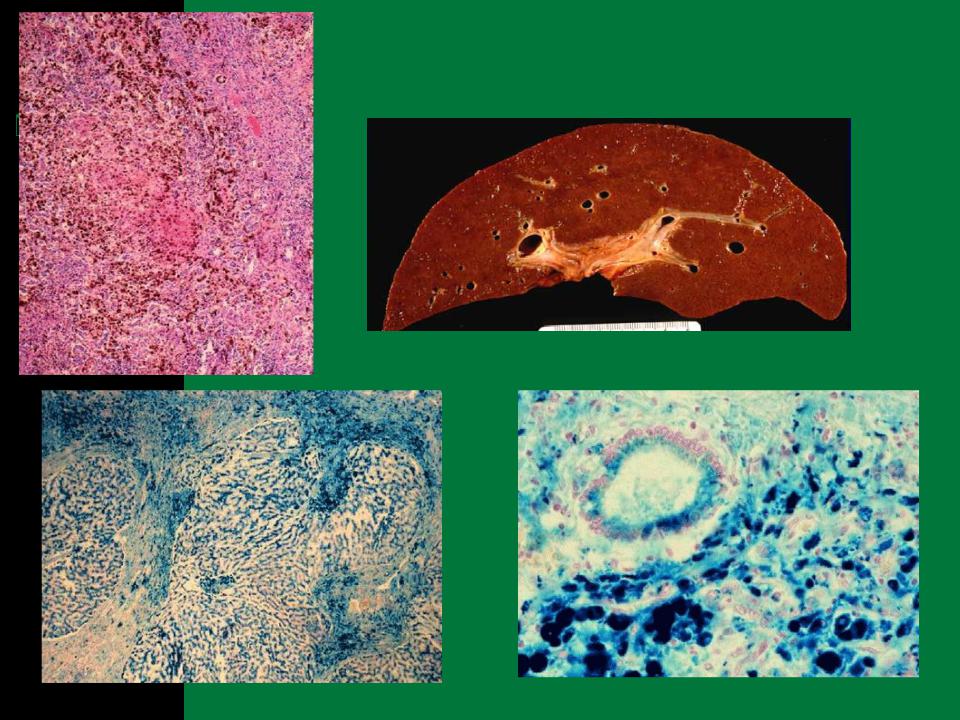
Гемосидероз Клиническая картина: анамнез, физикальное исследование, причины
Автор
Галия Д. Напчан, доктор медицины Педиатр-пульмонолог, Детская больница Джо Ди Маджио
Галия Д. Напчан, доктор медицины, является членом следующих медицинских обществ: Американская академия педиатрии
Раскрытие информации: ничего не раскрывается.
Соавтор (ы)
Исаак Талмациу, доктор медицинских наук Клинический доцент кафедры педиатрии Медицинской школы Атлантического университета Флориды
Исаак Талмациу, доктор медицинских наук, является членом следующих медицинских обществ: Американская академия педиатрии, Американское торакальное общество
Раскрытие информации: ничего раскрывать.
Редакционная коллегия специалистов
Мэри Л. Виндл, PharmD адъюнкт-профессор Фармацевтического колледжа Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: раскрывать нечего.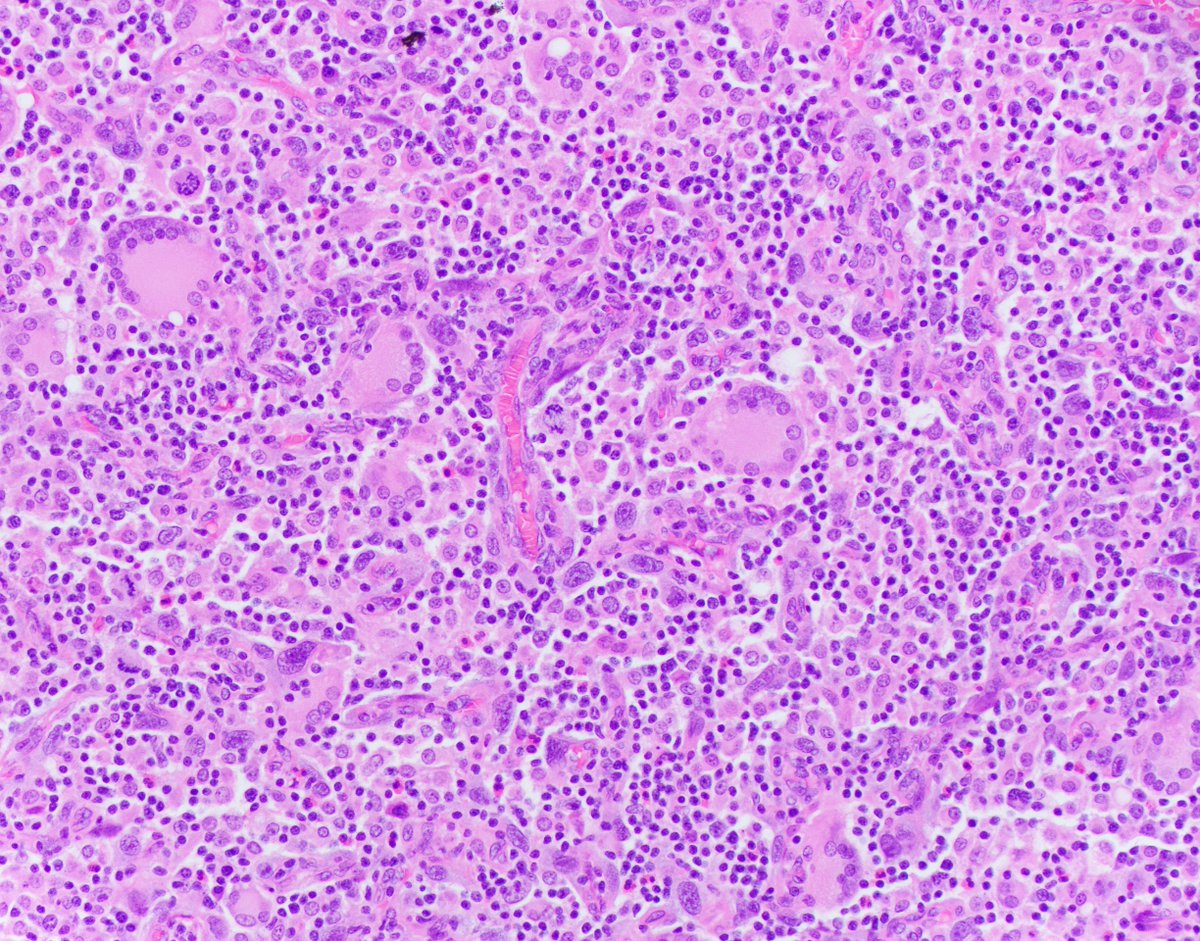
Чарльз Каллахан, DO Профессор, заведующий отделением педиатрии и детской пульмонологии, Армейский медицинский центр Tripler
Чарльз Каллахан, DO является членом следующих медицинских обществ: Американская академия педиатрии, Американский колледж врачей-пульмонологов, Американский колледж педиатров-остеопатов, Американское торакальное общество, Ассоциация военных хирургов США, Христианская медицинская и стоматологическая ассоциации
Раскрытие информации: Нечего раскрывать.
Главный редактор
Дениз Серебриски, доктор медицины доцент кафедры педиатрии Медицинского колледжа Альберта Эйнштейна; директор отделения легочной медицины педиатрического отделения Льюиса М. Фраада, медицинский центр Якоби/больница Северного Центрального Бронкса; Директор Детского центра астмы и аллергии Якоби, Медицинский центр Якоби
Дениз Серебриски, доктор медицинских наук, является членом следующих медицинских обществ: Американское торакальное общество
Раскрытие информации: Нечего раскрывать.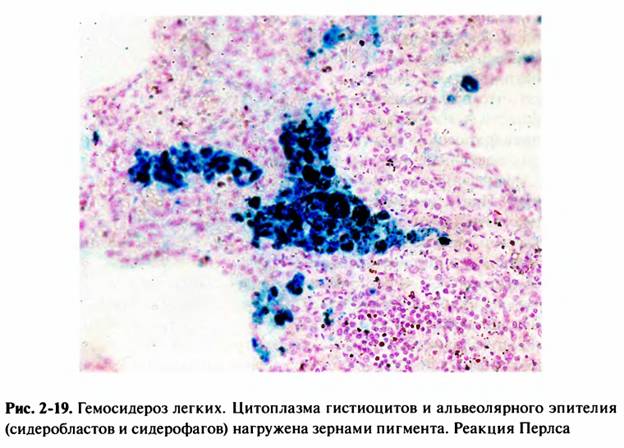
Дополнительные участники
Томас Сканлин, доктор медицины Заведующий отделением легочной медицины и Центра муковисцидоза, кафедра педиатрии, Медицинская школа имени Роберта Вуда Джонсона в Рутгерсе
Томас Сканлин, доктор медицины, является членом следующих медицинских обществ: Американская ассоциация содействия развитию науки , Общество педиатрических исследований, Американское общество биохимии и молекулярной биологии, Американское торакальное общество, Общество педиатрических исследований
Раскрытие информации: Нечего раскрывать.
Идиопатический гемосидероз легких — диагностическая проблема | Итальянский журнал педиатрии
Триада железодефицитной анемии, кровохарканье и диффузные инфильтраты на груди — рентген, характеризует начало ИЛГ. Однако любой из этих признаков может быть первым проявлением, а клиническое течение чрезвычайно разнообразно, особенно у детей [11, 12]. Так, из румынского опыта 15 детей с диагнозом ИЛГ за 22-летний период (1984–2006 гг. ) классическая триада была обнаружена только в 4 случаях [10].С другой стороны, у всех пациентов с самого начала была анемия, и только у 6 детей были легочные симптомы. Даже во французской когорте RespiRare® анемия и одышка были наиболее частыми клиническими проявлениями в начале (64% и 68% соответственно), тогда как кровохарканье возникало только у 50% пациентов [1].
) классическая триада была обнаружена только в 4 случаях [10].С другой стороны, у всех пациентов с самого начала была анемия, и только у 6 детей были легочные симптомы. Даже во французской когорте RespiRare® анемия и одышка были наиболее частыми клиническими проявлениями в начале (64% и 68% соответственно), тогда как кровохарканье возникало только у 50% пациентов [1].
Маленькие дети обычно проглатывают мокроту; в результате кровохарканье редко встречается у детей, если кровотечение не является значительным [1, 4, 8]. Даже в нашем случае мы не обнаружили наличия кровохарканья.
Возраст проявления является бимодальным, с пиками частоты у детей в возрасте до пяти лет и у подростков в возрасте 11 лет и старше.
Значительная часть первой группы не диагностирована. Вероятно, это связано не только с отсутствием кровохарканья, но и с тем, что железодефицитная анемия может быть первым и единственным проявлением ИЛГ, опережая другие симптомы и признаки на несколько месяцев [3, 4, 13, 14]. Железодефицитная анемия является наиболее распространенным гематологическим заболеванием, наблюдаемым в детском возрасте, и ИЛГ не считается редкой причиной анемии, если только не присутствует типичная триада [3, 15].
Железодефицитная анемия является наиболее распространенным гематологическим заболеванием, наблюдаемым в детском возрасте, и ИЛГ не считается редкой причиной анемии, если только не присутствует типичная триада [3, 15].
Анемия в этих случаях классическая железодефицитная, гипохромная микроцитарная, обусловленная хронической кровопотерей. Но если при железодефицитной анемии гематологический ответ на препараты железа обычно выражен в течение первого месяца терапии, то при гемосидерозе терапия неэффективна [9]. Как и в нашем случае, даже в других случаях не сообщалось об отсутствии ответа на терапию и необходимости нескольких трансфузий [15–21]. Неудача терапии препаратами железа и исключение ее распространенных причин побуждают нас рассматривать другие диагностические возможности, включая ИЛГ, даже если это редкая причина.
Если кровотечение незначительное, поражение легких может быть клинически не обнаружено в начале заболевания, и даже рентгенограмма грудной клетки может быть нормальной, но с развитием заболевания рентгенографические проявления, когда-то ненормальные, никогда не возвращаются к норме, хотя острая массивная инфильтрация частично рассасывается, что делает рентгенографию органов грудной клетки весьма полезной в таких случаях [1]. К сожалению, у нас нет рентгеновского снимка грудной клетки нашего случая до госпитализации 2 и .
К сожалению, у нас нет рентгеновского снимка грудной клетки нашего случая до госпитализации 2 и .
ИЛГ — это тяжелое состояние с переменным прогнозом, которое имеет лучший исход при постановке диагноза в раннем возрасте [3, 10, 15].Из-за редкости заболевания и изменчивости клинических проявлений диагноз обычно ставится с опозданием. (в нашем случае несколько месяцев) Kipper et al. отметили, что существует большая задержка (от 4 месяцев до 10 лет) между появлением симптомов и временем постановки правильного диагноза [22]. Средняя задержка до постановки диагноза составила 2,4 года в румынском опыте и 30 месяцев в индийском опыте [10, 19].
Золотым стандартом диагностики ИЛГ является биопсия легкого [19]. С другой стороны, диагноз ИЛГ можно подтвердить с помощью бронхоскопии с бронхоальвеолярным лаважем, показывающей макрофаги, нагруженные гемосидерином [6, 23].В нашем случае подтверждение диагноза было подтверждено наличием сидерофагов в промывной жидкости желудка, что является в равной степени диагностическим, а также наиболее простым и надежным тестом у детей грудного и раннего возраста [6].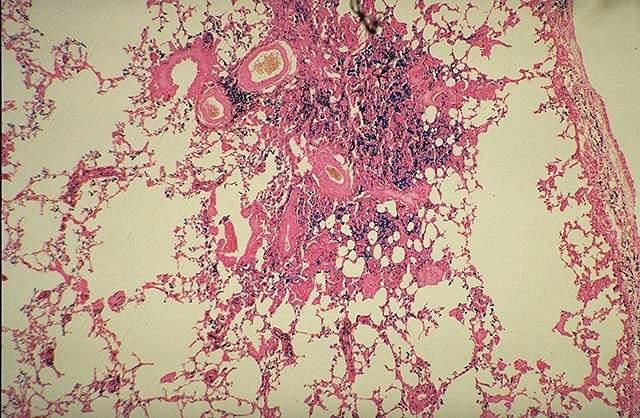
HR-CT полезен для раннего выявления легочного фиброза. Агрессивная терапия необходима, чтобы избежать легочного фиброза и смертности у этих пациентов [24].
Доказательных рекомендаций по лечению ИЛГ не существует. Как указано в небольших сериях случаев и/или отчетах о случаях, кортикостероиды являются основным методом лечения ИЛГ [10, 18].Сообщалось, что кортикостероиды связаны с уменьшением рецидивов легочного кровотечения и легочного фиброза [1, 4, 13]. Несмотря на то, что они противоречивы и не имеют четких доказательств в их пользу. Другие исследования предполагают, что они не оказывают никакого влияния на прогноз этого заболевания [11]. В румынском опыте лечение только кортикостероидами не было эффективным у 12 из 15 детей [12]. Иммуносупрессивная терапия, в основном азатиоприн и гидроксихлорохин, чаще всего предлагается пациентам с резистентным к стероидам заболеванием [1, 23, 25].В нашем случае кортикостероиды были частично эффективны. Клиническая ситуация лучше контролировалась при применении азатиоприна в сочетании с кортикостероидами.
Йоахимеску и др. также пришли к выводу, что азатиоприн в сочетании с кортикостероидами может быть лучшим терапевтическим режимом, особенно для профилактики обострений ИЛГ, как в нашем случае [8].
Согласно индийскому опыту, лечение преднизолоном и гидроксихлорохином было более эффективным в клиническом течении и выживаемости [25].
В научном письме 2007 г. сообщается о предварительном успехе в предотвращении легочного кровотечения с помощью антиоксиданта N-ацетилцистеина [11].
ИЛГ и ИТП могли возникнуть у этого пациента одновременно, но определенное патофизиологическое сходство между этими двумя расстройствами позволяет предположить, что они связаны. Фактически, по данным клиники внутренних болезней Майо, ИЛГ была описана в связи с ИТП, аутоиммунной гемолитической анемией и глютеновой болезнью [26]. Несмотря на то, что этиология ИЛГ остается неизвестной, существует поддержка аутоиммунного вклада в физиопатологию ИЛГ.Во французской когорте RespiRare® у большинства пациентов аутоиммунные антитела были обнаружены в начале или в течение последующего наблюдения.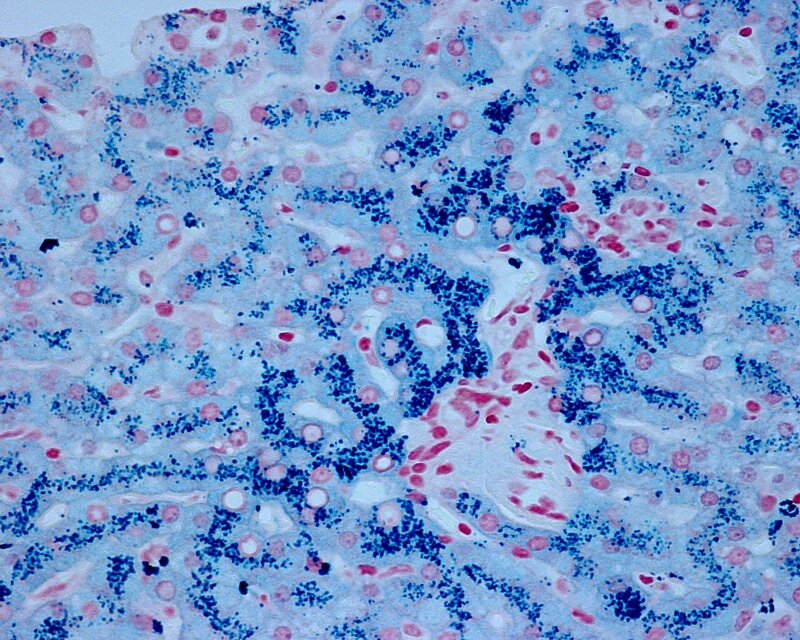 (Антитела к гладкомышечным клеткам SMA – 50% обследованных, ANA – 45% и ANCA – 40%) [1]. Обработка на аутоиммунные антитела в нашем случае дала отрицательный результат.
(Антитела к гладкомышечным клеткам SMA – 50% обследованных, ANA – 45% и ANCA – 40%) [1]. Обработка на аутоиммунные антитела в нашем случае дала отрицательный результат.
Прогноз ИЛГ со временем улучшается. В то время как два десятилетия назад средняя выживаемость составляла 3 года с момента постановки диагноза, последние данные показывают 5-летнюю выживаемость в 86% случаев [3]. Значительное улучшение, возможно, связано с длительным применением иммуносупрессивной терапии.
Гемосидероз (хроническая перегрузка железом) Симптомы
Разрешенное использование
JADENU ® (деферасирокс) в таблетках для перорального применения и JADENU ® гранулы (деферасирокс) посыпаны рецептурными препаратами, которые используются для лечения:
- лица в возрасте 2 лет и старше, имеющие повышенное количество железа в крови в течение длительного периода времени (хроническое), вызванное повторными переливаниями крови
- некоторые люди в возрасте 10 лет и старше, больные талассемией, с повышенным содержанием железа в крови, но не получающие регулярных переливаний крови
Неизвестно, является ли JADENU или JADENU Sprinkle безопасным и эффективным при использовании с другими лекарствами для лечения повышенного количества железа в крови.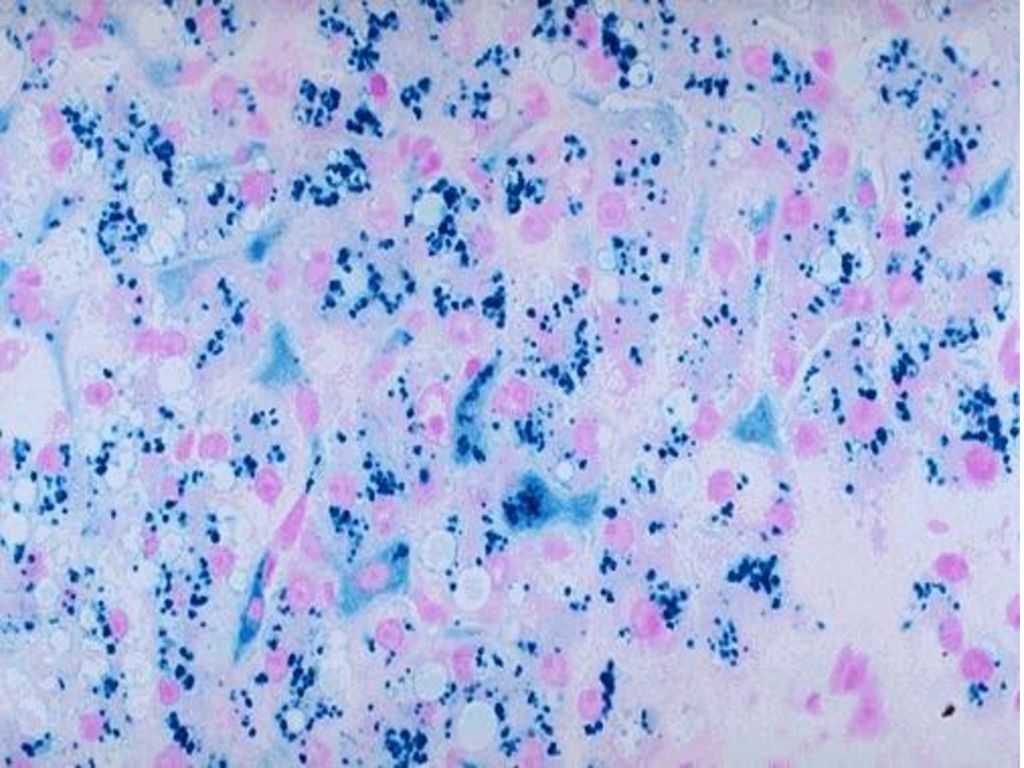 Неизвестно, безопасен ли и эффективен ли JADENU или JADENU Sprinkle для лечения детей в возрасте до 2 лет с повышенным содержанием железа в крови в течение длительного периода времени (хроническим), вызванным повторными переливаниями крови. Неизвестно, является ли JADENU или JADENU Sprinkle безопасным и эффективным средством для лечения детей в возрасте до 10 лет, страдающих талассемией, у которых повышено содержание железа в крови, но которые не получают регулярных переливаний крови.
Неизвестно, безопасен ли и эффективен ли JADENU или JADENU Sprinkle для лечения детей в возрасте до 2 лет с повышенным содержанием железа в крови в течение длительного периода времени (хроническим), вызванным повторными переливаниями крови. Неизвестно, является ли JADENU или JADENU Sprinkle безопасным и эффективным средством для лечения детей в возрасте до 10 лет, страдающих талассемией, у которых повышено содержание железа в крови, но которые не получают регулярных переливаний крови.
Важная информация по технике безопасности
Какую самую важную информацию я должен знать о JADENU и JADENU Sprinkle?
JADENU и JADENU Sprinkle могут вызывать серьезные побочные эффекты, в том числе:
Проблемы с почками: JADENU и JADENU Sprinkle может вызвать внезапные (острые) проблемы с почками, включая почечную недостаточность, которая может потребовать диализного лечения и может привести к смерти. Смертельные случаи произошли в основном у людей, у которых также были другие проблемы со здоровьем и заболевание крови на поздней стадии. Взрослые и дети, у которых уже есть проблемы с почками и которые принимают определенные лекарства с JADENU или JADENU Sprinkle, также могут иметь повышенный риск внезапных проблем с почками. Обязательно сообщите своему лечащему врачу обо всех лекарствах, которые вы принимаете во время лечения JADENU или JADENU Sprinkle.
Смертельные случаи произошли в основном у людей, у которых также были другие проблемы со здоровьем и заболевание крови на поздней стадии. Взрослые и дети, у которых уже есть проблемы с почками и которые принимают определенные лекарства с JADENU или JADENU Sprinkle, также могут иметь повышенный риск внезапных проблем с почками. Обязательно сообщите своему лечащему врачу обо всех лекарствах, которые вы принимаете во время лечения JADENU или JADENU Sprinkle.
Ваш лечащий врач должен делать анализы крови и мочи для проверки функции почек до и во время лечения JADENU или JADENU Sprinkle. Немедленно позвоните своему поставщику медицинских услуг, если:
- вы или ваш ребенок заболеваете лихорадкой, рвотой или диареей и не можете нормально пить жидкости во время лечения JADENU или JADENU Sprinkle. Это может вызвать обезвоживание. Вашему поставщику медицинских услуг может потребоваться временно прекратить лечение с помощью JADENU или JADENU Sprinkle и лечить обезвоживание, чтобы предотвратить проблемы с почками.
 Ваш лечащий врач может более тщательно контролировать функцию почек у вас или у вашего ребенка
Ваш лечащий врач может более тщательно контролировать функцию почек у вас или у вашего ребенка - во время лечения JADENU или JADENU Sprinkle у вас или вашего ребенка выделяется меньше мочи, чем обычно
Проблемы с печенью: JADENU и JADENU Sprinkle могут вызвать проблемы с печенью, включая печеночную недостаточность, которая иногда может привести к смерти.Проблемы с печенью при приеме JADENU или JADENU Sprinkle могут чаще встречаться у людей старше 55 лет, но также могут встречаться у детей. Печеночная недостаточность чаще возникает у людей с циррозом печени и недостаточностью других органов. Печеночная недостаточность также возникает вместе с проблемами почек у некоторых детей, которые становятся обезвоженными.
Ваш поставщик медицинских услуг должен делать анализы крови, чтобы проверить функцию вашей печени, прежде чем вы начнете и регулярно во время лечения JADENU или JADENU Sprinkle. Немедленно позвоните своему поставщику медицинских услуг, если у вас появятся какие-либо из следующих признаков и симптомов:
- Сонливость
- Боль в верхней правой части живота (живот)
- Пожелтение или усиление пожелтения кожи или глаз
- Темная моча
Кровотечения, язвы и разрывы желудка или кишечника: У некоторых людей, получавших JADENU или JADENU Sprinkle, возникало тяжелое желудочное или кишечное кровотечение (кровоизлияние), которое привело к смерти, особенно у пожилых людей с поздними стадиями рака крови или низким количество тромбоцитов.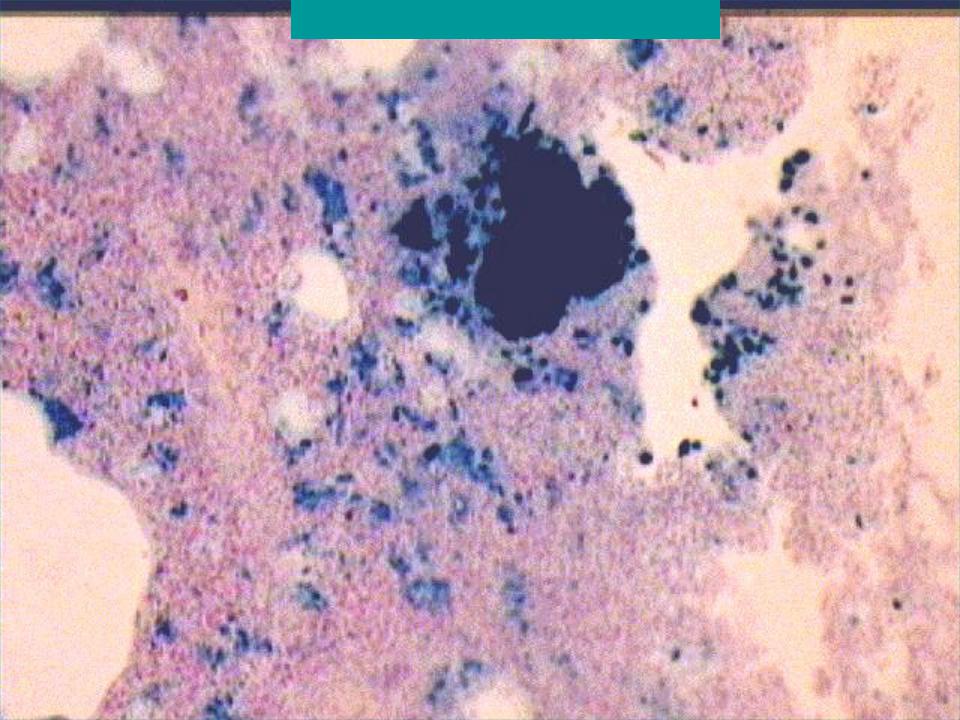 У некоторых людей также были язвы желудка или кишечника, иногда с разрывами (прободением), которые привели к смерти. У некоторых людей, принимавших JADENU, включая детей и подростков, возникали раздражение верхних отделов желудочно-кишечного тракта, язвы и кровотечения, но они не приводили к смерти.
У некоторых людей также были язвы желудка или кишечника, иногда с разрывами (прободением), которые привели к смерти. У некоторых людей, принимавших JADENU, включая детей и подростков, возникали раздражение верхних отделов желудочно-кишечного тракта, язвы и кровотечения, но они не приводили к смерти.
Ваш риск сильного кровотечения (кровоизлияния) может увеличиться, если вы принимаете JADENU или JADENU Sprinkle вместе с другими лекарствами, которые могут вызывать язвы или кровотечения, такими как:
- Нестероидные противовоспалительные препараты (НПВП)
- Кортикостероиды
- Некоторые лекарства от остеопороза, называемые пероральными бисфосфонатами
- Препараты для разжижения крови
Прежде чем начать принимать JADENU или JADENU Sprinkle, сообщите своему лечащему врачу, если вы принимаете одно из этих лекарств.Спросите своего поставщика медицинских услуг, если вы не уверены. Если у вас развилась язва желудка или кишечника или сильное кровотечение, ваш лечащий врач может прекратить прием JADENU или JADENU Sprinkle.
Пожилые люди могут подвергаться более высокому риску развития серьезных побочных эффектов и смерти из-за серьезных побочных эффектов JADENU или JADENU Sprinkle. Вашему лечащему врачу может потребоваться более пристальное наблюдение за вами во время лечения JADENU или JADENU Sprinkle.
- Сообщите своему лечащему врачу, если во время лечения JADENU или JADENU Sprinkle у вас возникнет изжога
- Немедленно обратитесь за неотложной медицинской помощью, если у вас рвота с кровью или стул черного или кровянистого цвета, или если у вас сильная боль в области желудка (живот) во время лечения JADENU или JADENU Sprinkle
Воздействие на ваш костный мозг: JADENU и JADENU Sprinkle может повлиять на ваш костный мозг и вызвать у вас низкий уровень лейкоцитов, который может быть серьезным, снижение тромбоцитов или ухудшение вашей анемии, что может привести к смерти.Ваш риск воздействия на костный мозг может быть увеличен, если у вас уже есть другие заболевания крови. Ваш поставщик медицинских услуг будет делать анализы крови, чтобы контролировать количество клеток крови для этих проблем.
Ваш поставщик медицинских услуг будет делать анализы крови, чтобы контролировать количество клеток крови для этих проблем.
Серьезные аллергические реакции: JADENU и JADENU Sprinkle могут вызывать серьезные аллергические реакции, которые обычно начинаются в течение первого месяца лечения. Немедленно обратитесь за медицинской помощью, если у вас разовьется любой из следующих симптомов серьезной аллергической реакции, в том числе:
- Затрудненное дыхание или глотание
- Боль в груди
- Учащенное сердцебиение
- Обморок
- Отек лица, губ, рта, языка или горла
- Сильный кожный зуд с красной сыпью или бугорками
- Ульи
Кожная сыпь и тяжелые кожные реакции: Кожная сыпь характерна для JADENU и JADENU Sprinkle.Если у вас появится более сильная сыпь, ваш лечащий врач может временно прекратить прием JADENU и JADENU Sprinkle.
При использовании JADENU и JADENU Sprinkle также могут возникать тяжелые кожные реакции, которые могут быть опасными для жизни или привести к смерти.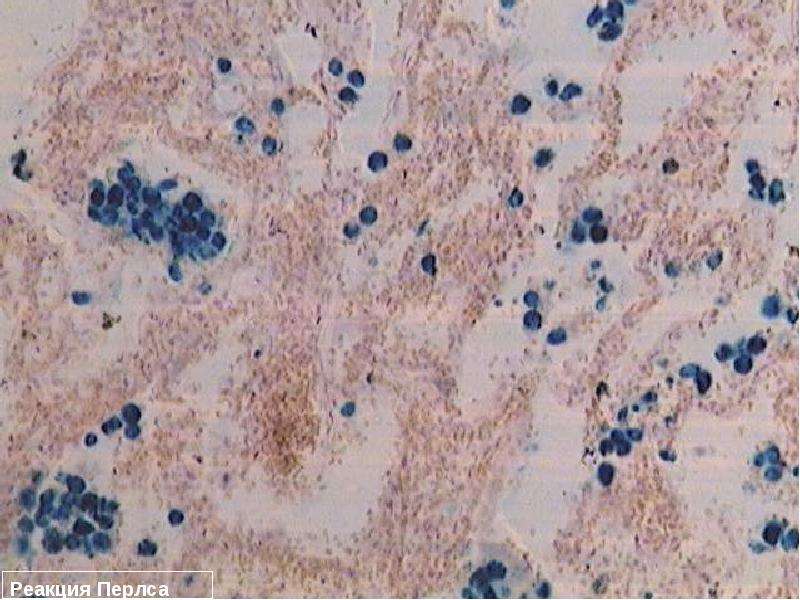 Немедленно обратитесь за медицинской помощью, если у вас появятся какие-либо из следующих признаков и симптомов тяжелой кожной реакции, в том числе:
Немедленно обратитесь за медицинской помощью, если у вас появятся какие-либо из следующих признаков и симптомов тяжелой кожной реакции, в том числе:
- Сыпь или покраснение кожи
- Волдыри на губах, вокруг рта или вокруг глаз
- Язвы во рту
- Пилинг кожи
- Высокая температура или гриппоподобные симптомы
- Увеличенные лимфатические узлы
Проблемы со слухом и зрением. JADENU или JADENU Sprinkle могут вызвать снижение слуха и изменения зрения, включая катаракту, повышенное внутриглазное давление и проблемы с сетчаткой. Ваш лечащий врач должен проверить слух и зрение до начала лечения, а затем регулярно во время лечения. Ваш поставщик медицинских услуг может уменьшить вашу дозу или прекратить JADENU или JADENU Sprinkle, если у вас появятся проблемы со слухом или зрением.
Не принимайте JADENU или JADENU Sprinkle, если вы:
- имеют определенные проблемы с почками
- имеют миелодиспластический синдром высокого риска (МДС)
- имеют прогрессирующий рак
- имеют низкий уровень тромбоцитов
- имеют аллергию на деферазирокс или любой из ингредиентов JADENU или JADENU Sprinkle
Спросите своего поставщика медицинских услуг, если вы не уверены, есть ли у вас какое-либо из перечисленных выше заболеваний.
Наиболее частые побочные эффекты: диарея и тошнота.
Другие распространенные побочные эффекты у людей со слишком высоким содержанием железа в крови из-за повторных переливаний крови включают: рвоту, боль в области желудка (живот) и нарушение функции почек в анализе крови.
Это не все возможные побочные эффекты JADENU и JADENU Sprinkle. Позвоните своему поставщику медицинских услуг для медицинской консультации о побочных эффектах.
Прежде чем принимать JADENU или JADENU Sprinkle, сообщите своему лечащему врачу обо всех своих заболеваниях, в том числе если вы:
- имеют проблемы с почками
- имеют проблемы с печенью
- имеют прогрессирующий рак
- имеют заболевание крови, которое может увеличить риск кровотечения
- беременны или планируют забеременеть.Неизвестно, могут ли JADENU или JADENU Sprinkle нанести вред вашему будущему ребенку. Гормональные формы контроля над рождаемостью могут быть не такими эффективными, если они используются во время лечения JADENU или JADENU Sprinkle.
 Вы можете забеременеть. Поговорите со своим лечащим врачом о других вариантах контроля над рождаемостью, которые вы можете использовать в это время. Немедленно сообщите своему лечащему врачу, если вы забеременеете во время лечения JADENU или JADENU Sprinkle .
Вы можете забеременеть. Поговорите со своим лечащим врачом о других вариантах контроля над рождаемостью, которые вы можете использовать в это время. Немедленно сообщите своему лечащему врачу, если вы забеременеете во время лечения JADENU или JADENU Sprinkle . - кормят грудью или планируют кормить грудью. Неизвестно, попадает ли JADENU или JADENU SPRINKLE в грудное молоко и может нанести вред вашему ребенку.Вы и ваш поставщик медицинских услуг должны решить, будете ли вы принимать JADENU или JADENU SPRINKLE или кормить грудью. Вы не должны делать и то, и другое
Сообщите своему лечащему врачу обо всех лекарствах, которые вы принимаете, , включая рецептурные и безрецептурные лекарства, витамины и растительные добавки. Некоторые лекарства могут влиять на действие JADENU или JADENU Sprinkle, а JADENU или JADENU Sprinkle могут влиять на действие других лекарств. Кроме того, ваш риск внезапных проблем с почками или сильного кровотечения может увеличиться, если вы принимаете JADENU или JADENU Sprinkle с некоторыми лекарствами.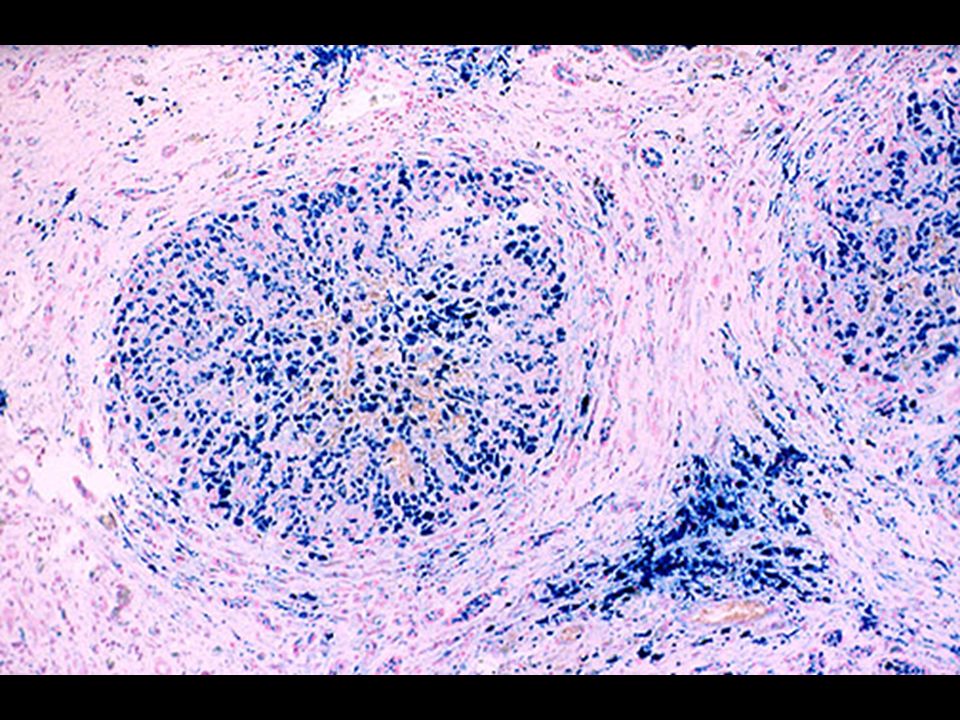
- Избегайте приема следующих лекарств во время лечения JADENU и JADENU Sprinkle:
- Антациды (препараты для лечения изжоги), содержащие алюминий
- Теофиллин
- Определенные лекарства для снижения уровня холестерина, называемые секвестрантами желчных кислот
Спросите своего поставщика медицинских услуг, если вы не уверены, принимаете ли вы одно из этих лекарств.
Знайте, какие лекарства вы принимаете. Составьте их список, чтобы показать его своему лечащему врачу или фармацевту, когда вы получите новое лекарство.
Чего следует избегать при приеме JADENU или JADENU Sprinkle?
- JADENU или JADENU Посыпка может вызвать головокружение. Избегайте вождения автомобиля или работы с механизмами, пока не узнаете, как JADENU или JADENU Sprinkle воздействуют на вас. Не садитесь за руль и не работайте с механизмами, если JADENU или JADENU Sprinkle вызывают у вас головокружение
Вам рекомендуется сообщать в FDA о побочных эффектах рецептурных препаратов.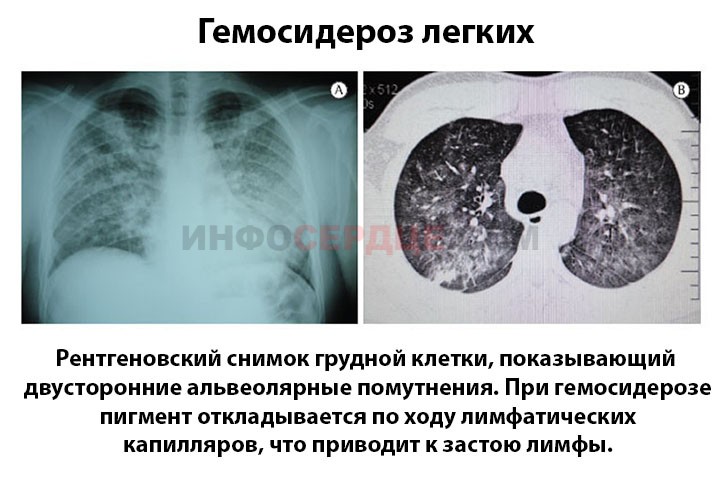 Посетите сайт www.fda.gov/medwatch или позвоните по телефону 1-800-FDA-1088. Пожалуйста, ознакомьтесь с полной инструкцией по применению, включая ПРЕДУПРЕЖДЕНИЕ в штучной упаковке и руководство по лекарствам для JADENU и JADENU Sprinkle.
Посетите сайт www.fda.gov/medwatch или позвоните по телефону 1-800-FDA-1088. Пожалуйста, ознакомьтесь с полной инструкцией по применению, включая ПРЕДУПРЕЖДЕНИЕ в штучной упаковке и руководство по лекарствам для JADENU и JADENU Sprinkle.
В чем разница между гемохроматозом и гемосидерозом? повреждения тканей в организме человека.
Гемохроматоз и гемосидероз — два заболевания, связанные с отложением железа. Взрослые обычно теряют 1 мг железа в день из клеток эпидермиса и желудочно-кишечного тракта.Менструирующие женщины дополнительно теряют от 0,5 до 1 мг железа в день во время менструации. Эта потеря железа уравновешивается усвоением железа в количестве от 10 до 20 мг в типичном рационе. Всасывание железа регулируется запасами железа в организме. Поскольку физиологический механизм удаления железа из организма отсутствует, избыточное поглощенное железо откладывается в тканях.
СОДЕРЖАНИЕ
1. Обзор и ключевые отличия
2. Что такое гемохроматоз
3.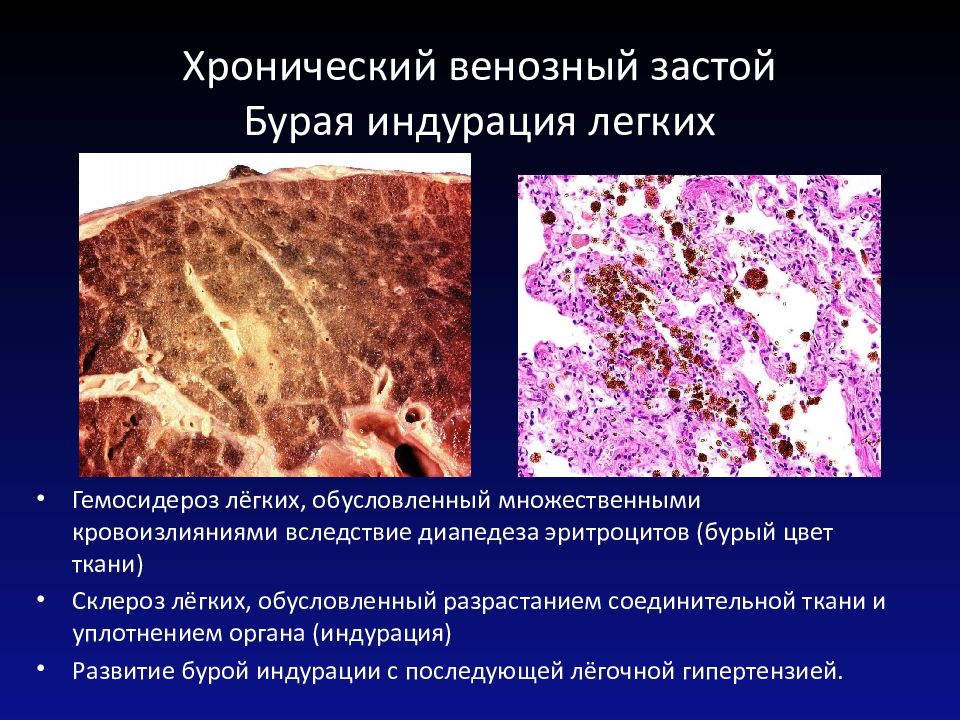 Что такое гемосидероз
Что такое гемосидероз
4. Сходства — гемохроматоз и гемосидероз
5.Гемохроматоз и гемосидероз в табличной форме
6. Резюме
Что такое гемохроматоз?
Гемохроматоз — системное отложение железа, вызывающее повреждение тканей в организме человека. Мы также называем это перегрузкой железа . Это состояние часто является генетическим. Это может привести к серьезным повреждениям сердца, печени и поджелудочной железы. Слишком много железа может быть токсичным. В сердце это может вызвать аритмию и сердечную недостаточность. Слишком много железа в печени может привести к циррозу, увеличению печени, раку печени и печеночной недостаточности.Кроме того, он также может вызвать артрит, диабет, проблемы с селезенкой, гипофизом, надпочечниками, желчным пузырем, щитовидной железой и репродуктивной системой. Перегрузка железом может привести к тому, что кожа станет серой или бронзовой. Гемохроматоз довольно распространен, и им страдает более миллиона американцев.
Рисунок 01: Микрофотография гемохроматоза печени
Различают два вида гемохроматоза: наследственный (первичный) и вторичный. Наследственный гемохроматоз обусловлен мутацией нескольких генов, таких как HFE , HJV , HAMP и SLC40A1 .С другой стороны, вторичный гемохроматоз возникает из-за лечения или других заболеваний, таких как анемия, переливание крови, препараты железа, диализ почек, инфекция гепатита С и жировая болезнь печени. Симптомы гемохроматоза могут включать усталость, трепетание сердца, железный кулак, боль в суставах, боль в желудке и необъяснимую потерю веса. Это состояние обычно диагностируется с помощью анализов крови, генетических тестов, биопсии печени и МРТ. Кроме того, лечение может включать в себя изменение диеты, хелатирование железа и терапевтическое кровопускание.
Что такое гемосидероз?
Гемосидероз — очаговое отложение железа, не вызывающее каких-либо повреждений тканей в организме человека.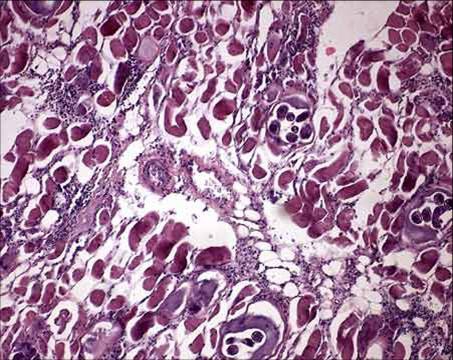 Это форма перегрузки железом, приводящая к накоплению гемосидерина. В этом состоянии железо, высвобождаемое из внесосудистых эритроцитов, откладывается внутри органа, и в конечном итоге в этом органе могут образоваться значительные отложения гемосидерина. Хронические воспалительные синдромы, такие как неалкогольная жировая болезнь печени и метаболический синдром, могут вызывать гемосидероз.
Это форма перегрузки железом, приводящая к накоплению гемосидерина. В этом состоянии железо, высвобождаемое из внесосудистых эритроцитов, откладывается внутри органа, и в конечном итоге в этом органе могут образоваться значительные отложения гемосидерина. Хронические воспалительные синдромы, такие как неалкогольная жировая болезнь печени и метаболический синдром, могут вызывать гемосидероз.
Рисунок 02: Гемосидероз
Гемосидероз можно разделить на три типа: трансфузионный гемосидероз, идиопатический легочный гемосидероз и трансфузионный диабетический гемосидероз. Симптомы этого состояния могут включать кашель, затрудненное дыхание, утомляемость, одышку, боль в теле, свистящее дыхание и медленный рост у детей. Существует несколько тестов для диагностики этого состояния: сывороточный ферритин, биопсия печени и МРТ. Кроме того, лечение может включать хелатирование железа, прекращение переливания крови, кортикостероиды при легочных кровотечениях, оксигенотерапию при легочных заболеваниях, антикоагулянты при легочной гипертензии и трансплантацию легких.
Каковы сходства между гемохроматозом и гемосидерозом?
- Гемохроматоз и гемосидероз — два заболевания, связанные с отложением железа.
- Оба состояния связаны с перегрузкой железа.
- Оба состояния поражают печень и сердце.
- Это поддающиеся лечению заболевания.
- Оба состояния могут быть вызваны переливанием крови.
В чем разница между гемохроматозом и гемосидерозом?
Гемохроматоз — системное отложение железа, вызывающее повреждение тканей в организме человека, а гемосидероз — очаговое отложение железа, не вызывающее каких-либо повреждений тканей в организме человека.Итак, в этом ключевое отличие гемохроматоза от гемосидероза. Кроме того, накопление гемосидерина не наблюдается при гемохроматозе. Но при гемосидерозе наблюдается накопление гемосидерина.
На приведенной ниже инфографике перечислены различия между гемохроматозом и гемосидерозом в табличной форме для параллельного сравнения.
Резюме – Гемохроматоз и гемосидероз
Железо — минерал, необходимый человеческому организму для роста и развития. Гемохроматоз и гемосидероз — два заболевания, связанные с отложением железа.Гемохроматоз представляет собой системное отложение железа, вызывающее повреждение тканей в организме человека, тогда как гемосидероз представляет собой очаговое отложение железа, не вызывающее каких-либо повреждений тканей в организме человека. Таким образом, в этом ключевое различие между гемохроматозом и гемосидерозом.
Гемохроматоз и гемосидероз — два заболевания, связанные с отложением железа.Гемохроматоз представляет собой системное отложение железа, вызывающее повреждение тканей в организме человека, тогда как гемосидероз представляет собой очаговое отложение железа, не вызывающее каких-либо повреждений тканей в организме человека. Таким образом, в этом ключевое различие между гемохроматозом и гемосидерозом.
Артикул:
1. Гамильтон, Джеймс Питер Адам. «Гемосидероз — гематология и онкология». Merck Manuals Professional Edition, Merck Manuals, 18 октября 2021 г.
2. «Гемохроматоз». Клиника Мэйо, Фонд медицинского образования и исследований Мэйо, 30 декабря.2020.
Изображение предоставлено:
1. «Гемохроматоз печени 40x», Медицинский колледж Каликута — ОТДЕЛ ПАТОЛОГИИ (CC BY-SA 4.0) через Commons Wikimedia Фликр
.

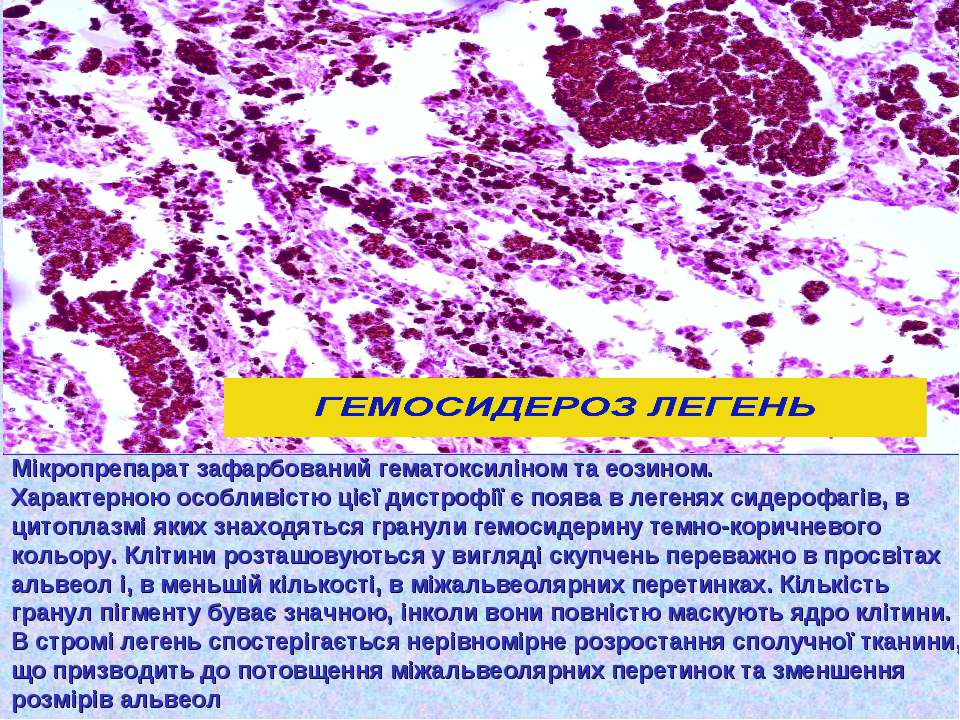
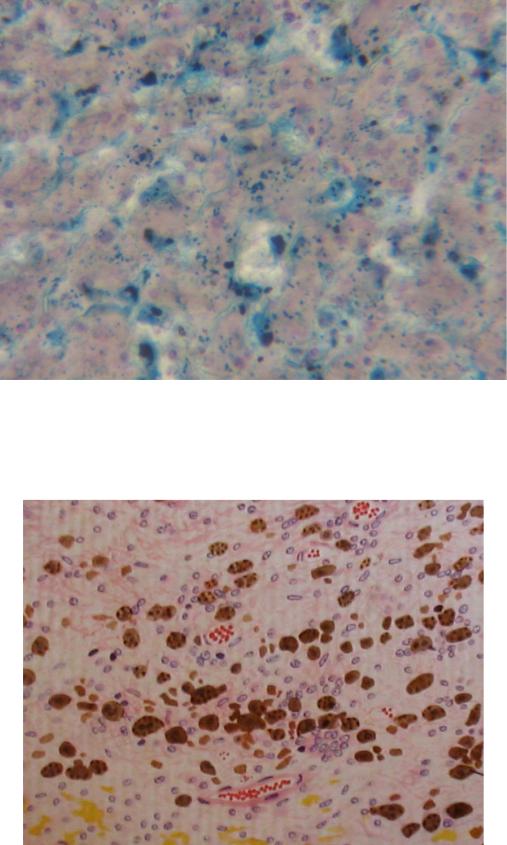 Небольшая часть ферритина поступает в кровь и может быть измерена. Считается, что концентрация ферритина в крови отражает запасы железа в организме. При гемохроматозе ферритин сыворотки крови повышен. Повышение концентрации ферритина более 300 мкг/л у мужчин и более 200 мкг/л у женщин свидетельствует о гемохроматозе. Ферритин сыворотки – это также показатель тяжести заболевания: уровень ферритина менее 1000 нг/мл свидетельствует об отсутствии цирроза печени. Кроме первичной диагностики гемохроматоза, уровень ферритина исследуют для оценки эффективности лечения заболевания (флеботомий).
Небольшая часть ферритина поступает в кровь и может быть измерена. Считается, что концентрация ферритина в крови отражает запасы железа в организме. При гемохроматозе ферритин сыворотки крови повышен. Повышение концентрации ферритина более 300 мкг/л у мужчин и более 200 мкг/л у женщин свидетельствует о гемохроматозе. Ферритин сыворотки – это также показатель тяжести заболевания: уровень ферритина менее 1000 нг/мл свидетельствует об отсутствии цирроза печени. Кроме первичной диагностики гемохроматоза, уровень ферритина исследуют для оценки эффективности лечения заболевания (флеботомий).
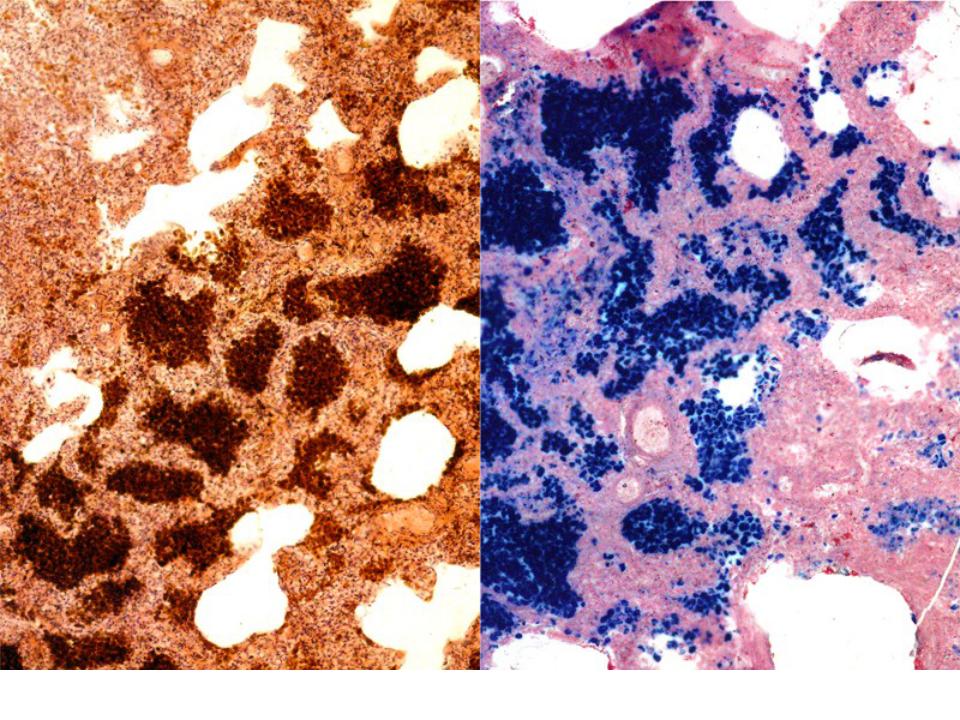
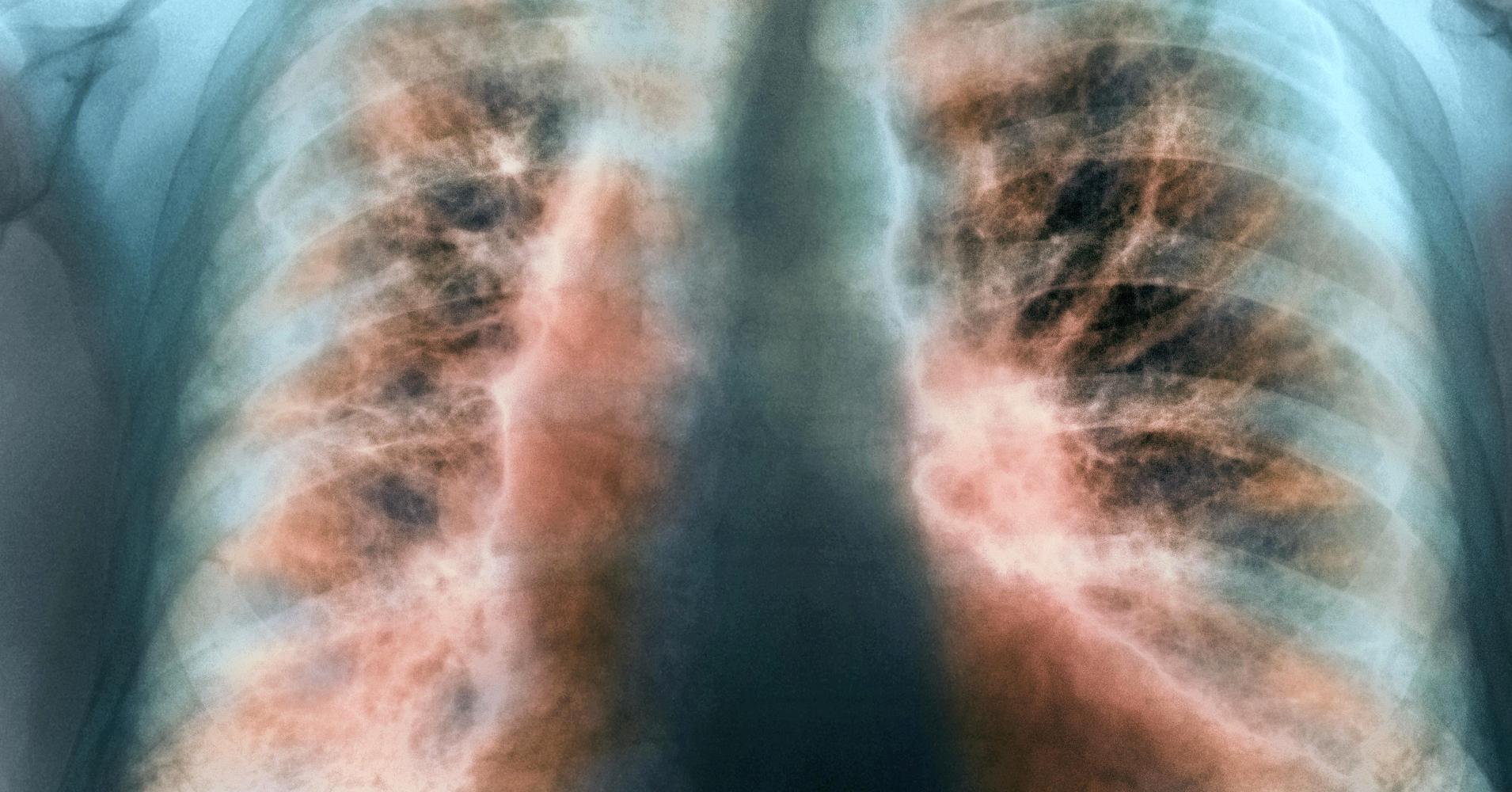 АЛТ является более специфичным маркером заболеваний печени, чем АСТ.
АЛТ является более специфичным маркером заболеваний печени, чем АСТ. Ваш лечащий врач может более тщательно контролировать функцию почек у вас или у вашего ребенка
Ваш лечащий врач может более тщательно контролировать функцию почек у вас или у вашего ребенка Вы можете забеременеть. Поговорите со своим лечащим врачом о других вариантах контроля над рождаемостью, которые вы можете использовать в это время. Немедленно сообщите своему лечащему врачу, если вы забеременеете во время лечения JADENU или JADENU Sprinkle
Вы можете забеременеть. Поговорите со своим лечащим врачом о других вариантах контроля над рождаемостью, которые вы можете использовать в это время. Немедленно сообщите своему лечащему врачу, если вы забеременеете во время лечения JADENU или JADENU Sprinkle