Гемоторакс степени: Причины симптомы и лечение гемоторакс
причины, симптомы, диагностика и лечение
Гемоторакс – это кровотечение в полость плевры, скопление крови между ее листками, приводящее к сдавлению легкого и смещению органов средостения в противоположную сторону. При гемотораксе отмечается боль в грудной клетке, затруднение дыхания, развиваются признаки острой кровопотери (головокружение, бледность кожных покровов, тахикардия, гипотония, холодный липкий пот, обмороки). Диагностика гемоторакса основана на физикальных данных, результатах рентгеноскопии и рентгенографии грудной клетки, КТ, диагностической плевральной пункции. Лечение гемотракса включает гемостатическую, антибактериальную, симптоматическую терапию; аспирацию скопившейся крови (пункции, дренирование плевральной полости), при необходимости – открытое или видеоторакоскопическое удаление свернувшегося гемоторакса, остановку продолжающегося кровотечения.
Общие сведения
Гемоторакс является вторым по частоте (после пневмоторакса) осложнением травм грудной клетки и встречается у 25 % больных с торакальной травмой. Довольно часто в клинической практике наблюдается комбинированная патология — гемопневмоторакс. Опасность гемоторакса заключается как в нарастающей дыхательной недостаточности, обусловленной сдавлением легкого, так и в развитии геморрагического шока вследствие острого внутреннего кровотечения. В пульмонологии и торакальной хирургии гемотракс расценивается как неотложное состояние, требующее оказания экстренной специализированной помощи.
Довольно часто в клинической практике наблюдается комбинированная патология — гемопневмоторакс. Опасность гемоторакса заключается как в нарастающей дыхательной недостаточности, обусловленной сдавлением легкого, так и в развитии геморрагического шока вследствие острого внутреннего кровотечения. В пульмонологии и торакальной хирургии гемотракс расценивается как неотложное состояние, требующее оказания экстренной специализированной помощи.
Гемоторакс
Причины гемоторакса
Выделяют три группы причин, наиболее часто приводящих к развитию гемоторакса: травматические, патологические и ятрогенные.
- Под травматическими причинами понимают проникающие ранения или закрытые повреждения грудной клетки. К торакальной травме, сопровождающейся развитием гемоторакса, относятся ДТП, огнестрельные и ножевые ранения грудной клетки, переломы ребер, падения с высоты и др. При подобных травмах довольно часто происходит повреждение органов грудной полости (сердца, легких, диафрагмы), органов брюшной полости (травмы печени, селезенки), межреберных сосудов, внутренней грудной артерии, внутригрудных ветвей аорты, кровь из которых изливается в плевральную полость.

- К причинам гемоторакса патологического характера причисляют различные заболевания: рак легкого или плевры, аневризму аорты, туберкулез легких, абсцесс легкого, новообразования средостения и грудной стенки, геморрагический диатез, коагулопатии и др.
- Ятрогенными факторами, приводящими к развитию гемоторакса, выступают осложнения операций на легких и плевре, торакоцентеза, дренирования плевральной полости, катетеризации центральных вен.
Патогенез
Скопление крови в полости плевры вызывает компрессию легкого на стороне поражения и смещение органов средостения в противоположную сторону. Это сопровождается уменьшением дыхательной поверхности легкого, возникновением расстройств дыхания и гемодинамики. Поэтому при гемотраксе нередко развивается клиника геморрагического и кардио-пульмонального шока с острой дыхательной и сердечной недостаточностью.
Уже в ближайшие часы после попадания крови в плевральную полость развивается асептическое воспаление плевры — гемоплеврит, обусловленный реакцией плевральных листков. При гемотораксе возникает отек и умеренная лейкоцитарная инфильтрация плевры, набухание и слущивание клеток мезотелия. В начальном периоде излившаяся в плевральную полость кровь практически не отличается по составу от периферической крови. В дальнейшем в ней происходит снижение гемоглобина, уменьшение эритроцитарно-лейкоцитарного индекса.
При гемотораксе возникает отек и умеренная лейкоцитарная инфильтрация плевры, набухание и слущивание клеток мезотелия. В начальном периоде излившаяся в плевральную полость кровь практически не отличается по составу от периферической крови. В дальнейшем в ней происходит снижение гемоглобина, уменьшение эритроцитарно-лейкоцитарного индекса.
Попадая в плевральную полость, кровь вначале сворачивается. Однако затем вскоре наступает процесс фибринолиза, и происходит повторное разжижение крови. Этому способствуют антикоагулянтные факторы, содержащиеся в самой крови и плевральной жидкости, а также механическое дефибринирование крови за счет дыхательной экскурсии грудной клетки. По мере истощения механизмов антикоагуляции происходит свертывание крови и формирование свернувшегося гемоторакса. В случае присоединения микробного инфицирования на фоне гемоторакса довольно быстро может возникать эмпиема плевры.
Классификация
В соответствии с этиологией различают травматический, патологический и ятрогенный гемоторакс. С учетом величины внутриплеврального кровотечения гемоторакс может быть:
С учетом величины внутриплеврального кровотечения гемоторакс может быть:
- малый — объем кровопотери до 500 мл, скопление крови в синусе;
- средний — объем до 1,5 л, уровень крови до нижнего края IV ребра;
- субтотальный — объем кровопотери до 2 л, уровень крови до нижнего края II ребра;
- тотальный — объем кровопотери свыше 2 л, рентгенологически характеризуется тотальным затемнением плевральной полости на стороне поражения.
Количество крови, излившейся в плевральную полость, зависит от локализации ранения и степени разрушения сосудов. Так, при повреждении периферических отделов легкого, в большинстве случаев возникает малый или средний гемоторакс; при ранениях корня легкого обычно повреждаются магистральные сосуды, что сопровождается массивным кровотечением и развитием субтотального и тотального гемоторакса.
Кроме этого, также выделяют ограниченный (обычно малый по объему) гемоторакс, при котором излившаяся кровь скапливается между плевральными спайками, на изолированном участке полости плевры. С учетом локализации ограниченный гемоторакс бывает верхушечным, междолевым, паракостальным, наддиафрагмальным, парамедиастинальным.
С учетом локализации ограниченный гемоторакс бывает верхушечным, междолевым, паракостальным, наддиафрагмальным, парамедиастинальным.
В случае продолжающегося внутриплеврального кровотечения говорят о нарастающем гемотораксе, в случае прекращения кровотечения – о ненарастающем (стабильном). К осложненным видам относят свернувшийся и инфицированный гемоторакс (пиогемоторакс). При одновременном попадании в полость плевры воздуха и крови, говорят о гемопневмотораксе.
Симптомы гемоторакса
Клиническая симптоматика гемоторакса зависит от степени кровотечения, сдавления легочной ткани и смещения органов средостения. При малом гемотораксе клинические проявления выражены минимально или отсутствуют. Основными жалобами служат боли в грудной клетке, усиливающиеся при кашле, умеренная одышка.
При гемотораксе среднего или большого размера развиваются дыхательные и сердечно-сосудистые расстройства, выраженные в различной степени. Характерна резкая боль в груди, иррадиирующая в плечо и спину при дыхании и кашле; общая слабость, тахипноэ, снижение АД. Даже при незначительной физической нагрузке происходит усиление симптоматики. Больной обычно принимает вынужденное сидячее или полусидячее положение.
Характерна резкая боль в груди, иррадиирующая в плечо и спину при дыхании и кашле; общая слабость, тахипноэ, снижение АД. Даже при незначительной физической нагрузке происходит усиление симптоматики. Больной обычно принимает вынужденное сидячее или полусидячее положение.
При тяжелом гемотораксе на первый план выступает клиника внутриплеврального кровотечения: слабость и головокружение, холодный липкий пот, тахикардия и гипотония, бледность кожных покровов с цианотичным оттенком, мелькание мушек перед глазами, обмороки.
Гемоторакс, сопряженный с переломом ребер, как правило, сопровождается подкожной эмфиземой, гематомами мягких тканей, деформацией, патологической подвижностью и крепитацией отломков ребер. При гемотораксе, протекающем с разрывом легочной паренхимы, может возникать кровохарканье.
В 3-12% случаев формируется свернувшийся гемоторакс, при котором в полости плевры образуются кровяные сгустки, фибринные наслоения и шварты, ограничивающие дыхательную функцию легкого, вызывая развитие склеротических процессов в легочной ткани. Клиника свернувшегося гемоторакса характеризуется тяжестью и болью в грудной клетке, одышкой. При инфицированном гемотораксе (эмпиеме плевры) на первый план выходят признаки тяжелого воспаления и интоксикации: лихорадка, ознобы, вялость и др.
Клиника свернувшегося гемоторакса характеризуется тяжестью и болью в грудной клетке, одышкой. При инфицированном гемотораксе (эмпиеме плевры) на первый план выходят признаки тяжелого воспаления и интоксикации: лихорадка, ознобы, вялость и др.
Диагностика
Для постановки диагноза уточняются подробности истории заболевания, проводится физикальное, инструментальное и лабораторное обследование. При гемотораксе определяется отставание пораженной стороны грудной клетки при дыхании, притупление перкуторного звука над уровнем жидкости, ослабление дыхания и голосового дрожания. При рентгеноскопии и обзорной рентгенографии легких выявляется коллабирование легкого, наличие горизонтального уровня жидкости или сгустков в полости плевры, флотация (смещение) тени средостения в здоровую сторону.
С диагностической целью выполняется пункция плевральной полости: получение крови достоверно свидетельствует о гемотораксе. Для дифференциации стерильного и инфицированного гемоторакса проводят пробы Петрова и Эфендиева с оценкой прозрачности и осадка аспирата. С целью суждения о прекращении или продолжении внутриплеврального кровотечения выполняют пробу Рувилуа-Грегуара: свертывание полученной крови в пробирке или шприце свидетельствует о продолжающемся кровотечении, отсутствие коагуляции говорит о прекращении кровотечения. Образцы пунктата направляют в лабораторию для определения гемоглобина и проведения бактериологического исследования.
С целью суждения о прекращении или продолжении внутриплеврального кровотечения выполняют пробу Рувилуа-Грегуара: свертывание полученной крови в пробирке или шприце свидетельствует о продолжающемся кровотечении, отсутствие коагуляции говорит о прекращении кровотечения. Образцы пунктата направляют в лабораторию для определения гемоглобина и проведения бактериологического исследования.
При банальном и свернувшемся гемотораксе прибегают к лабораторному определению Нb, количества эритроцитов, тромбоцитов, исследованию коагулограммы. Дополнительная инструментальная диагностика при гемотораксе может включать УЗИ плевральной полости, рентгенографию ребер, КТ грудной клетки, диагностическую торакоскопию.
Лечение гемоторакса
Пациенты с гемотораксом госпитализируются в специализированные хирургические отделения и находятся под наблюдением торакального хирурга. С лечебной целью для аспирации/эвакуации крови производится дренирование плевральной полости с введением в дренаж антибиотиков и антисептиков (для профилактики инфицирования и санации), протеолитических ферментов (для растворения сгустков). Консервативное лечение гемоторакса включает проведение гемостатической, дезагрегантной, симптоматической, иммунокорригирующей, гемотрансфузионной терапии, общей антибиотикотерапии, оксигенотерапии.
Консервативное лечение гемоторакса включает проведение гемостатической, дезагрегантной, симптоматической, иммунокорригирующей, гемотрансфузионной терапии, общей антибиотикотерапии, оксигенотерапии.
Малый гемоторакс в большинстве случаев может быть ликвидирован консервативным путем. Хирургическое лечение гемоторакса показано в случае продолжающегося внутриплеврального кровотечения; при свернувшемся гемотораксе, препятствующем расправлению легкого; повреждении жизненно важных органов.
В случае ранения крупных сосудов или органов грудной полости производится экстренная торакотомия, перевязка сосуда, ушивание раны легкого или перикарда, удаление излившейся в плевральную полость крови. Свернувшийся гемоторакс является показанием к плановому выполнению видеоторакоскопии или открытой торакотомии для удаления сгустков крови и санации плевральной полости. При нагноении гемоторакса лечение проводится по правилам ведения гнойного плеврита.
Прогноз и профилактика
Успешность лечения гемоторакса определяется характером травмы или заболевания, интенсивностью кровопотери и своевременностью хирургической помощи. Прогноз наиболее благоприятен при малом и среднем неинфицированном гемотораксе. Свернувшийся гемоторакс повышает вероятность развития эмпиемы плевры. Продолжающееся внутриплевральное кровотечение или одномоментная большая кровопотеря могут привести к гибели пациента.
Прогноз наиболее благоприятен при малом и среднем неинфицированном гемотораксе. Свернувшийся гемоторакс повышает вероятность развития эмпиемы плевры. Продолжающееся внутриплевральное кровотечение или одномоментная большая кровопотеря могут привести к гибели пациента.
Исходом гемоторакса может являться образование массивных плевральных сращений, ограничивающих подвижность купола диафрагмы. Поэтому в период реабилитации пациентам, перенесшим гемоторакс, рекомендуются занятия плаванием и дыхательной гимнастикой. Профилактика гемоторакса заключается в предупреждении травматизма, обязательной консультации пациентов с торакоабдоминальной травмой хирургом, контроле гемостаза при операциях на легких и средостении, осторожном выполнении инвазивных манипуляций.
причины, симптомы, диагностика и лечение
Гемоторакс – это кровотечение в полость плевры, скопление крови между ее листками, приводящее к сдавлению легкого и смещению органов средостения в противоположную сторону. При гемотораксе отмечается боль в грудной клетке, затруднение дыхания, развиваются признаки острой кровопотери (головокружение, бледность кожных покровов, тахикардия, гипотония, холодный липкий пот, обмороки). Диагностика гемоторакса основана на физикальных данных, результатах рентгеноскопии и рентгенографии грудной клетки, КТ, диагностической плевральной пункции. Лечение гемотракса включает гемостатическую, антибактериальную, симптоматическую терапию; аспирацию скопившейся крови (пункции, дренирование плевральной полости), при необходимости – открытое или видеоторакоскопическое удаление свернувшегося гемоторакса, остановку продолжающегося кровотечения.
При гемотораксе отмечается боль в грудной клетке, затруднение дыхания, развиваются признаки острой кровопотери (головокружение, бледность кожных покровов, тахикардия, гипотония, холодный липкий пот, обмороки). Диагностика гемоторакса основана на физикальных данных, результатах рентгеноскопии и рентгенографии грудной клетки, КТ, диагностической плевральной пункции. Лечение гемотракса включает гемостатическую, антибактериальную, симптоматическую терапию; аспирацию скопившейся крови (пункции, дренирование плевральной полости), при необходимости – открытое или видеоторакоскопическое удаление свернувшегося гемоторакса, остановку продолжающегося кровотечения.
Общие сведения
Гемоторакс является вторым по частоте (после пневмоторакса) осложнением травм грудной клетки и встречается у 25 % больных с торакальной травмой. Довольно часто в клинической практике наблюдается комбинированная патология — гемопневмоторакс. Опасность гемоторакса заключается как в нарастающей дыхательной недостаточности, обусловленной сдавлением легкого, так и в развитии геморрагического шока вследствие острого внутреннего кровотечения. В пульмонологии и торакальной хирургии гемотракс расценивается как неотложное состояние, требующее оказания экстренной специализированной помощи.
В пульмонологии и торакальной хирургии гемотракс расценивается как неотложное состояние, требующее оказания экстренной специализированной помощи.
Гемоторакс
Причины гемоторакса
Выделяют три группы причин, наиболее часто приводящих к развитию гемоторакса: травматические, патологические и ятрогенные.
- Под травматическими причинами понимают проникающие ранения или закрытые повреждения грудной клетки. К торакальной травме, сопровождающейся развитием гемоторакса, относятся ДТП, огнестрельные и ножевые ранения грудной клетки, переломы ребер, падения с высоты и др. При подобных травмах довольно часто происходит повреждение органов грудной полости (сердца, легких, диафрагмы), органов брюшной полости (травмы печени, селезенки), межреберных сосудов, внутренней грудной артерии, внутригрудных ветвей аорты, кровь из которых изливается в плевральную полость.
- К причинам гемоторакса патологического характера причисляют различные заболевания: рак легкого или плевры, аневризму аорты, туберкулез легких, абсцесс легкого, новообразования средостения и грудной стенки, геморрагический диатез, коагулопатии и др.

- Ятрогенными факторами, приводящими к развитию гемоторакса, выступают осложнения операций на легких и плевре, торакоцентеза, дренирования плевральной полости, катетеризации центральных вен.
Патогенез
Скопление крови в полости плевры вызывает компрессию легкого на стороне поражения и смещение органов средостения в противоположную сторону. Это сопровождается уменьшением дыхательной поверхности легкого, возникновением расстройств дыхания и гемодинамики. Поэтому при гемотраксе нередко развивается клиника геморрагического и кардио-пульмонального шока с острой дыхательной и сердечной недостаточностью.
Уже в ближайшие часы после попадания крови в плевральную полость развивается асептическое воспаление плевры — гемоплеврит, обусловленный реакцией плевральных листков. При гемотораксе возникает отек и умеренная лейкоцитарная инфильтрация плевры, набухание и слущивание клеток мезотелия. В начальном периоде излившаяся в плевральную полость кровь практически не отличается по составу от периферической крови. В дальнейшем в ней происходит снижение гемоглобина, уменьшение эритроцитарно-лейкоцитарного индекса.
В дальнейшем в ней происходит снижение гемоглобина, уменьшение эритроцитарно-лейкоцитарного индекса.
Попадая в плевральную полость, кровь вначале сворачивается. Однако затем вскоре наступает процесс фибринолиза, и происходит повторное разжижение крови. Этому способствуют антикоагулянтные факторы, содержащиеся в самой крови и плевральной жидкости, а также механическое дефибринирование крови за счет дыхательной экскурсии грудной клетки. По мере истощения механизмов антикоагуляции происходит свертывание крови и формирование свернувшегося гемоторакса. В случае присоединения микробного инфицирования на фоне гемоторакса довольно быстро может возникать эмпиема плевры.
Классификация
В соответствии с этиологией различают травматический, патологический и ятрогенный гемоторакс. С учетом величины внутриплеврального кровотечения гемоторакс может быть:
- малый — объем кровопотери до 500 мл, скопление крови в синусе;
- субтотальный — объем кровопотери до 2 л, уровень крови до нижнего края II ребра;
- тотальный — объем кровопотери свыше 2 л, рентгенологически характеризуется тотальным затемнением плевральной полости на стороне поражения.

Количество крови, излившейся в плевральную полость, зависит от локализации ранения и степени разрушения сосудов. Так, при повреждении периферических отделов легкого, в большинстве случаев возникает малый или средний гемоторакс; при ранениях корня легкого обычно повреждаются магистральные сосуды, что сопровождается массивным кровотечением и развитием субтотального и тотального гемоторакса.
Кроме этого, также выделяют ограниченный (обычно малый по объему) гемоторакс, при котором излившаяся кровь скапливается между плевральными спайками, на изолированном участке полости плевры. С учетом локализации ограниченный гемоторакс бывает верхушечным, междолевым, паракостальным, наддиафрагмальным, парамедиастинальным.
В случае продолжающегося внутриплеврального кровотечения говорят о нарастающем гемотораксе, в случае прекращения кровотечения – о ненарастающем (стабильном). К осложненным видам относят свернувшийся и инфицированный гемоторакс (пиогемоторакс). При одновременном попадании в полость плевры воздуха и крови, говорят о гемопневмотораксе.
При одновременном попадании в полость плевры воздуха и крови, говорят о гемопневмотораксе.
Симптомы гемоторакса
Клиническая симптоматика гемоторакса зависит от степени кровотечения, сдавления легочной ткани и смещения органов средостения. При малом гемотораксе клинические проявления выражены минимально или отсутствуют. Основными жалобами служат боли в грудной клетке, усиливающиеся при кашле, умеренная одышка.
При гемотораксе среднего или большого размера развиваются дыхательные и сердечно-сосудистые расстройства, выраженные в различной степени. Характерна резкая боль в груди, иррадиирующая в плечо и спину при дыхании и кашле; общая слабость, тахипноэ, снижение АД. Даже при незначительной физической нагрузке происходит усиление симптоматики. Больной обычно принимает вынужденное сидячее или полусидячее положение.
При тяжелом гемотораксе на первый план выступает клиника внутриплеврального кровотечения: слабость и головокружение, холодный липкий пот, тахикардия и гипотония, бледность кожных покровов с цианотичным оттенком, мелькание мушек перед глазами, обмороки.
Гемоторакс, сопряженный с переломом ребер, как правило, сопровождается подкожной эмфиземой, гематомами мягких тканей, деформацией, патологической подвижностью и крепитацией отломков ребер. При гемотораксе, протекающем с разрывом легочной паренхимы, может возникать кровохарканье.
В 3-12% случаев формируется свернувшийся гемоторакс, при котором в полости плевры образуются кровяные сгустки, фибринные наслоения и шварты, ограничивающие дыхательную функцию легкого, вызывая развитие склеротических процессов в легочной ткани. Клиника свернувшегося гемоторакса характеризуется тяжестью и болью в грудной клетке, одышкой. При инфицированном гемотораксе (эмпиеме плевры) на первый план выходят признаки тяжелого воспаления и интоксикации: лихорадка, ознобы, вялость и др.
Диагностика
Для постановки диагноза уточняются подробности истории заболевания, проводится физикальное, инструментальное и лабораторное обследование. При гемотораксе определяется отставание пораженной стороны грудной клетки при дыхании, притупление перкуторного звука над уровнем жидкости, ослабление дыхания и голосового дрожания. При рентгеноскопии и обзорной рентгенографии легких выявляется коллабирование легкого, наличие горизонтального уровня жидкости или сгустков в полости плевры, флотация (смещение) тени средостения в здоровую сторону.
При рентгеноскопии и обзорной рентгенографии легких выявляется коллабирование легкого, наличие горизонтального уровня жидкости или сгустков в полости плевры, флотация (смещение) тени средостения в здоровую сторону.
С диагностической целью выполняется пункция плевральной полости: получение крови достоверно свидетельствует о гемотораксе. Для дифференциации стерильного и инфицированного гемоторакса проводят пробы Петрова и Эфендиева с оценкой прозрачности и осадка аспирата. С целью суждения о прекращении или продолжении внутриплеврального кровотечения выполняют пробу Рувилуа-Грегуара: свертывание полученной крови в пробирке или шприце свидетельствует о продолжающемся кровотечении, отсутствие коагуляции говорит о прекращении кровотечения. Образцы пунктата направляют в лабораторию для определения гемоглобина и проведения бактериологического исследования.
При банальном и свернувшемся гемотораксе прибегают к лабораторному определению Нb, количества эритроцитов, тромбоцитов, исследованию коагулограммы.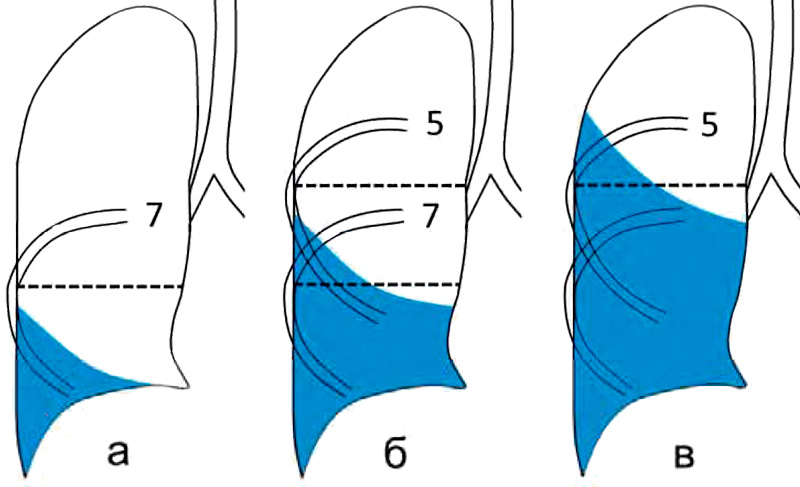 Дополнительная инструментальная диагностика при гемотораксе может включать УЗИ плевральной полости, рентгенографию ребер, КТ грудной клетки, диагностическую торакоскопию.
Дополнительная инструментальная диагностика при гемотораксе может включать УЗИ плевральной полости, рентгенографию ребер, КТ грудной клетки, диагностическую торакоскопию.
Лечение гемоторакса
Пациенты с гемотораксом госпитализируются в специализированные хирургические отделения и находятся под наблюдением торакального хирурга. С лечебной целью для аспирации/эвакуации крови производится дренирование плевральной полости с введением в дренаж антибиотиков и антисептиков (для профилактики инфицирования и санации), протеолитических ферментов (для растворения сгустков). Консервативное лечение гемоторакса включает проведение гемостатической, дезагрегантной, симптоматической, иммунокорригирующей, гемотрансфузионной терапии, общей антибиотикотерапии, оксигенотерапии.
Малый гемоторакс в большинстве случаев может быть ликвидирован консервативным путем. Хирургическое лечение гемоторакса показано в случае продолжающегося внутриплеврального кровотечения; при свернувшемся гемотораксе, препятствующем расправлению легкого; повреждении жизненно важных органов.
В случае ранения крупных сосудов или органов грудной полости производится экстренная торакотомия, перевязка сосуда, ушивание раны легкого или перикарда, удаление излившейся в плевральную полость крови. Свернувшийся гемоторакс является показанием к плановому выполнению видеоторакоскопии или открытой торакотомии для удаления сгустков крови и санации плевральной полости. При нагноении гемоторакса лечение проводится по правилам ведения гнойного плеврита.
Прогноз и профилактика
Успешность лечения гемоторакса определяется характером травмы или заболевания, интенсивностью кровопотери и своевременностью хирургической помощи. Прогноз наиболее благоприятен при малом и среднем неинфицированном гемотораксе. Свернувшийся гемоторакс повышает вероятность развития эмпиемы плевры. Продолжающееся внутриплевральное кровотечение или одномоментная большая кровопотеря могут привести к гибели пациента.
Исходом гемоторакса может являться образование массивных плевральных сращений, ограничивающих подвижность купола диафрагмы.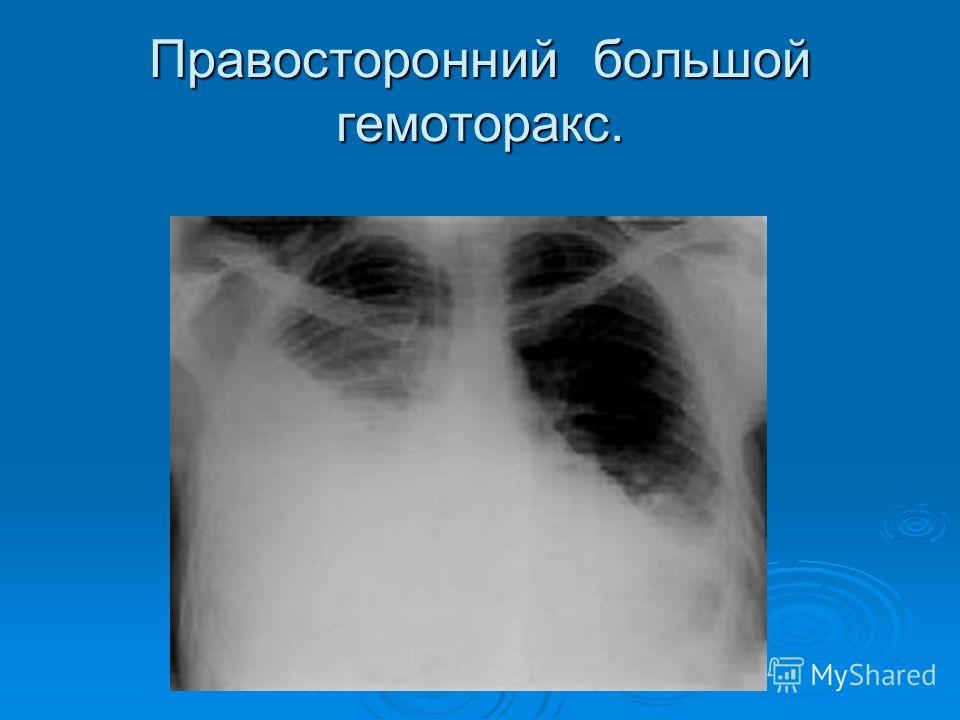 Поэтому в период реабилитации пациентам, перенесшим гемоторакс, рекомендуются занятия плаванием и дыхательной гимнастикой. Профилактика гемоторакса заключается в предупреждении травматизма, обязательной консультации пациентов с торакоабдоминальной травмой хирургом, контроле гемостаза при операциях на легких и средостении, осторожном выполнении инвазивных манипуляций.
Поэтому в период реабилитации пациентам, перенесшим гемоторакс, рекомендуются занятия плаванием и дыхательной гимнастикой. Профилактика гемоторакса заключается в предупреждении травматизма, обязательной консультации пациентов с торакоабдоминальной травмой хирургом, контроле гемостаза при операциях на легких и средостении, осторожном выполнении инвазивных манипуляций.
причины, симптомы, диагностика и лечение
Гемоторакс – это кровотечение в полость плевры, скопление крови между ее листками, приводящее к сдавлению легкого и смещению органов средостения в противоположную сторону. При гемотораксе отмечается боль в грудной клетке, затруднение дыхания, развиваются признаки острой кровопотери (головокружение, бледность кожных покровов, тахикардия, гипотония, холодный липкий пот, обмороки). Диагностика гемоторакса основана на физикальных данных, результатах рентгеноскопии и рентгенографии грудной клетки, КТ, диагностической плевральной пункции. Лечение гемотракса включает гемостатическую, антибактериальную, симптоматическую терапию; аспирацию скопившейся крови (пункции, дренирование плевральной полости), при необходимости – открытое или видеоторакоскопическое удаление свернувшегося гемоторакса, остановку продолжающегося кровотечения.
Общие сведения
Гемоторакс является вторым по частоте (после пневмоторакса) осложнением травм грудной клетки и встречается у 25 % больных с торакальной травмой. Довольно часто в клинической практике наблюдается комбинированная патология — гемопневмоторакс. Опасность гемоторакса заключается как в нарастающей дыхательной недостаточности, обусловленной сдавлением легкого, так и в развитии геморрагического шока вследствие острого внутреннего кровотечения. В пульмонологии и торакальной хирургии гемотракс расценивается как неотложное состояние, требующее оказания экстренной специализированной помощи.
Гемоторакс
Причины гемоторакса
Выделяют три группы причин, наиболее часто приводящих к развитию гемоторакса: травматические, патологические и ятрогенные.
- Под травматическими причинами понимают проникающие ранения или закрытые повреждения грудной клетки. К торакальной травме, сопровождающейся развитием гемоторакса, относятся ДТП, огнестрельные и ножевые ранения грудной клетки, переломы ребер, падения с высоты и др.

- К причинам гемоторакса патологического характера причисляют различные заболевания: рак легкого или плевры, аневризму аорты, туберкулез легких, абсцесс легкого, новообразования средостения и грудной стенки, геморрагический диатез, коагулопатии и др.
- Ятрогенными факторами, приводящими к развитию гемоторакса, выступают осложнения операций на легких и плевре, торакоцентеза, дренирования плевральной полости, катетеризации центральных вен.
Патогенез
Скопление крови в полости плевры вызывает компрессию легкого на стороне поражения и смещение органов средостения в противоположную сторону. Это сопровождается уменьшением дыхательной поверхности легкого, возникновением расстройств дыхания и гемодинамики.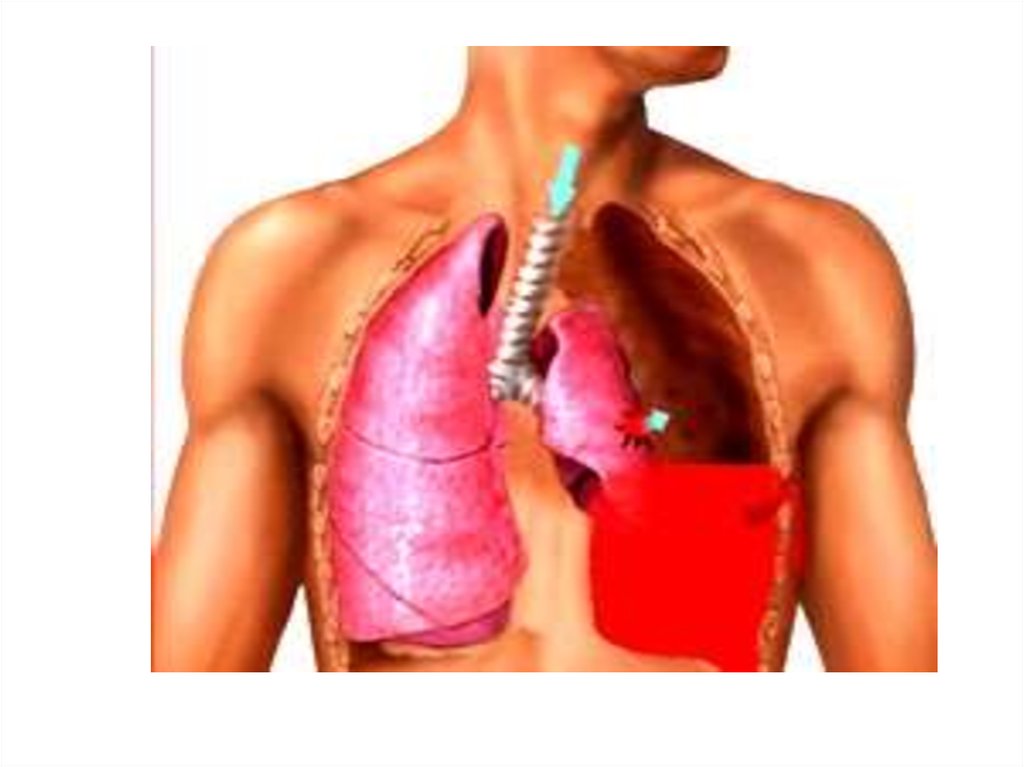 Поэтому при гемотраксе нередко развивается клиника геморрагического и кардио-пульмонального шока с острой дыхательной и сердечной недостаточностью.
Поэтому при гемотраксе нередко развивается клиника геморрагического и кардио-пульмонального шока с острой дыхательной и сердечной недостаточностью.
Уже в ближайшие часы после попадания крови в плевральную полость развивается асептическое воспаление плевры — гемоплеврит, обусловленный реакцией плевральных листков. При гемотораксе возникает отек и умеренная лейкоцитарная инфильтрация плевры, набухание и слущивание клеток мезотелия. В начальном периоде излившаяся в плевральную полость кровь практически не отличается по составу от периферической крови. В дальнейшем в ней происходит снижение гемоглобина, уменьшение эритроцитарно-лейкоцитарного индекса.
Попадая в плевральную полость, кровь вначале сворачивается. Однако затем вскоре наступает процесс фибринолиза, и происходит повторное разжижение крови. Этому способствуют антикоагулянтные факторы, содержащиеся в самой крови и плевральной жидкости, а также механическое дефибринирование крови за счет дыхательной экскурсии грудной клетки. По мере истощения механизмов антикоагуляции происходит свертывание крови и формирование свернувшегося гемоторакса. В случае присоединения микробного инфицирования на фоне гемоторакса довольно быстро может возникать эмпиема плевры.
По мере истощения механизмов антикоагуляции происходит свертывание крови и формирование свернувшегося гемоторакса. В случае присоединения микробного инфицирования на фоне гемоторакса довольно быстро может возникать эмпиема плевры.
Классификация
В соответствии с этиологией различают травматический, патологический и ятрогенный гемоторакс. С учетом величины внутриплеврального кровотечения гемоторакс может быть:
- малый — объем кровопотери до 500 мл, скопление крови в синусе;
- средний — объем до 1,5 л, уровень крови до нижнего края IV ребра;
- субтотальный — объем кровопотери до 2 л, уровень крови до нижнего края II ребра;
- тотальный — объем кровопотери свыше 2 л, рентгенологически характеризуется тотальным затемнением плевральной полости на стороне поражения.
Количество крови, излившейся в плевральную полость, зависит от локализации ранения и степени разрушения сосудов. Так, при повреждении периферических отделов легкого, в большинстве случаев возникает малый или средний гемоторакс; при ранениях корня легкого обычно повреждаются магистральные сосуды, что сопровождается массивным кровотечением и развитием субтотального и тотального гемоторакса.
Так, при повреждении периферических отделов легкого, в большинстве случаев возникает малый или средний гемоторакс; при ранениях корня легкого обычно повреждаются магистральные сосуды, что сопровождается массивным кровотечением и развитием субтотального и тотального гемоторакса.
Кроме этого, также выделяют ограниченный (обычно малый по объему) гемоторакс, при котором излившаяся кровь скапливается между плевральными спайками, на изолированном участке полости плевры. С учетом локализации ограниченный гемоторакс бывает верхушечным, междолевым, паракостальным, наддиафрагмальным, парамедиастинальным.
В случае продолжающегося внутриплеврального кровотечения говорят о нарастающем гемотораксе, в случае прекращения кровотечения – о ненарастающем (стабильном). К осложненным видам относят свернувшийся и инфицированный гемоторакс (пиогемоторакс). При одновременном попадании в полость плевры воздуха и крови, говорят о гемопневмотораксе.
Симптомы гемоторакса
Клиническая симптоматика гемоторакса зависит от степени кровотечения, сдавления легочной ткани и смещения органов средостения. При малом гемотораксе клинические проявления выражены минимально или отсутствуют. Основными жалобами служат боли в грудной клетке, усиливающиеся при кашле, умеренная одышка.
При малом гемотораксе клинические проявления выражены минимально или отсутствуют. Основными жалобами служат боли в грудной клетке, усиливающиеся при кашле, умеренная одышка.
При гемотораксе среднего или большого размера развиваются дыхательные и сердечно-сосудистые расстройства, выраженные в различной степени. Характерна резкая боль в груди, иррадиирующая в плечо и спину при дыхании и кашле; общая слабость, тахипноэ, снижение АД. Даже при незначительной физической нагрузке происходит усиление симптоматики. Больной обычно принимает вынужденное сидячее или полусидячее положение.
При тяжелом гемотораксе на первый план выступает клиника внутриплеврального кровотечения: слабость и головокружение, холодный липкий пот, тахикардия и гипотония, бледность кожных покровов с цианотичным оттенком, мелькание мушек перед глазами, обмороки.
Гемоторакс, сопряженный с переломом ребер, как правило, сопровождается подкожной эмфиземой, гематомами мягких тканей, деформацией, патологической подвижностью и крепитацией отломков ребер.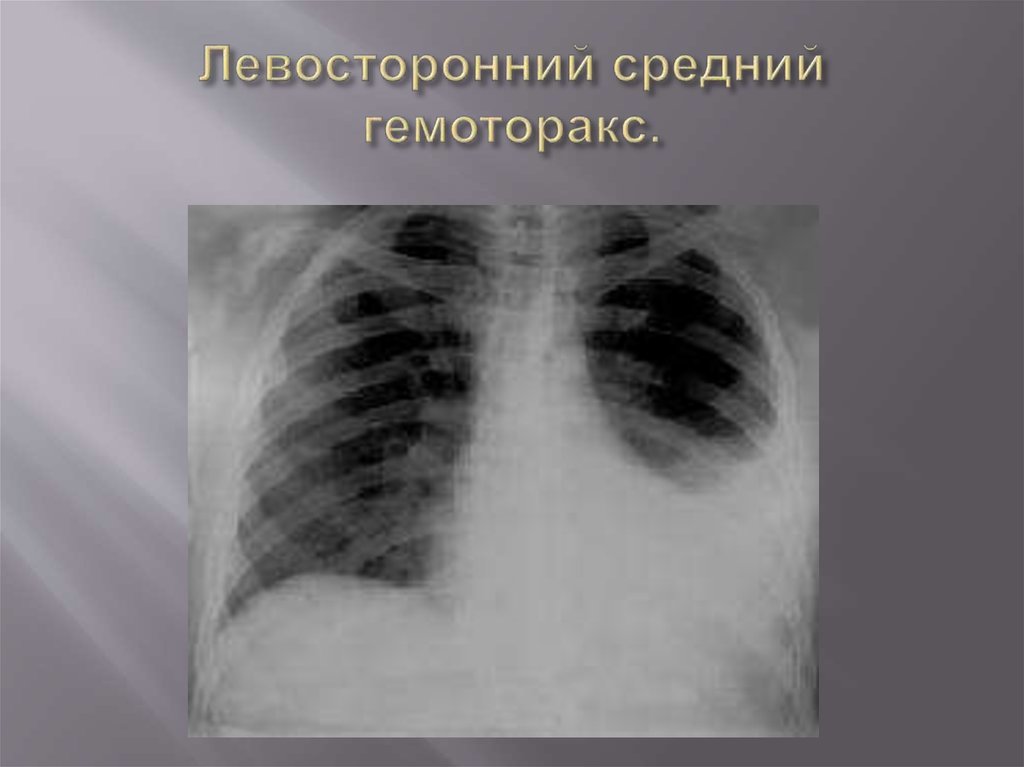 При гемотораксе, протекающем с разрывом легочной паренхимы, может возникать кровохарканье.
При гемотораксе, протекающем с разрывом легочной паренхимы, может возникать кровохарканье.
В 3-12% случаев формируется свернувшийся гемоторакс, при котором в полости плевры образуются кровяные сгустки, фибринные наслоения и шварты, ограничивающие дыхательную функцию легкого, вызывая развитие склеротических процессов в легочной ткани. Клиника свернувшегося гемоторакса характеризуется тяжестью и болью в грудной клетке, одышкой. При инфицированном гемотораксе (эмпиеме плевры) на первый план выходят признаки тяжелого воспаления и интоксикации: лихорадка, ознобы, вялость и др.
Диагностика
Для постановки диагноза уточняются подробности истории заболевания, проводится физикальное, инструментальное и лабораторное обследование. При гемотораксе определяется отставание пораженной стороны грудной клетки при дыхании, притупление перкуторного звука над уровнем жидкости, ослабление дыхания и голосового дрожания. При рентгеноскопии и обзорной рентгенографии легких выявляется коллабирование легкого, наличие горизонтального уровня жидкости или сгустков в полости плевры, флотация (смещение) тени средостения в здоровую сторону.
С диагностической целью выполняется пункция плевральной полости: получение крови достоверно свидетельствует о гемотораксе. Для дифференциации стерильного и инфицированного гемоторакса проводят пробы Петрова и Эфендиева с оценкой прозрачности и осадка аспирата. С целью суждения о прекращении или продолжении внутриплеврального кровотечения выполняют пробу Рувилуа-Грегуара: свертывание полученной крови в пробирке или шприце свидетельствует о продолжающемся кровотечении, отсутствие коагуляции говорит о прекращении кровотечения. Образцы пунктата направляют в лабораторию для определения гемоглобина и проведения бактериологического исследования.
При банальном и свернувшемся гемотораксе прибегают к лабораторному определению Нb, количества эритроцитов, тромбоцитов, исследованию коагулограммы. Дополнительная инструментальная диагностика при гемотораксе может включать УЗИ плевральной полости, рентгенографию ребер, КТ грудной клетки, диагностическую торакоскопию.
Лечение гемоторакса
Пациенты с гемотораксом госпитализируются в специализированные хирургические отделения и находятся под наблюдением торакального хирурга. С лечебной целью для аспирации/эвакуации крови производится дренирование плевральной полости с введением в дренаж антибиотиков и антисептиков (для профилактики инфицирования и санации), протеолитических ферментов (для растворения сгустков). Консервативное лечение гемоторакса включает проведение гемостатической, дезагрегантной, симптоматической, иммунокорригирующей, гемотрансфузионной терапии, общей антибиотикотерапии, оксигенотерапии.
Малый гемоторакс в большинстве случаев может быть ликвидирован консервативным путем. Хирургическое лечение гемоторакса показано в случае продолжающегося внутриплеврального кровотечения; при свернувшемся гемотораксе, препятствующем расправлению легкого; повреждении жизненно важных органов.
В случае ранения крупных сосудов или органов грудной полости производится экстренная торакотомия, перевязка сосуда, ушивание раны легкого или перикарда, удаление излившейся в плевральную полость крови. Свернувшийся гемоторакс является показанием к плановому выполнению видеоторакоскопии или открытой торакотомии для удаления сгустков крови и санации плевральной полости. При нагноении гемоторакса лечение проводится по правилам ведения гнойного плеврита.
Свернувшийся гемоторакс является показанием к плановому выполнению видеоторакоскопии или открытой торакотомии для удаления сгустков крови и санации плевральной полости. При нагноении гемоторакса лечение проводится по правилам ведения гнойного плеврита.
Прогноз и профилактика
Успешность лечения гемоторакса определяется характером травмы или заболевания, интенсивностью кровопотери и своевременностью хирургической помощи. Прогноз наиболее благоприятен при малом и среднем неинфицированном гемотораксе. Свернувшийся гемоторакс повышает вероятность развития эмпиемы плевры. Продолжающееся внутриплевральное кровотечение или одномоментная большая кровопотеря могут привести к гибели пациента.
Исходом гемоторакса может являться образование массивных плевральных сращений, ограничивающих подвижность купола диафрагмы. Поэтому в период реабилитации пациентам, перенесшим гемоторакс, рекомендуются занятия плаванием и дыхательной гимнастикой. Профилактика гемоторакса заключается в предупреждении травматизма, обязательной консультации пациентов с торакоабдоминальной травмой хирургом, контроле гемостаза при операциях на легких и средостении, осторожном выполнении инвазивных манипуляций.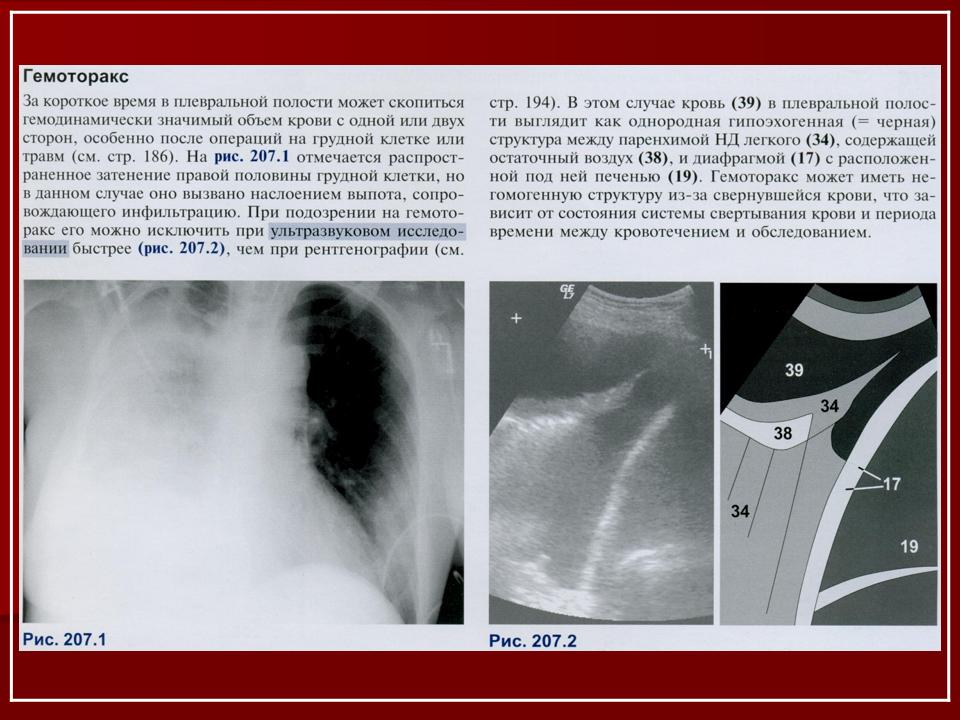
причины, симптомы, диагностика и лечение
Гемоторакс – это кровотечение в полость плевры, скопление крови между ее листками, приводящее к сдавлению легкого и смещению органов средостения в противоположную сторону. При гемотораксе отмечается боль в грудной клетке, затруднение дыхания, развиваются признаки острой кровопотери (головокружение, бледность кожных покровов, тахикардия, гипотония, холодный липкий пот, обмороки). Диагностика гемоторакса основана на физикальных данных, результатах рентгеноскопии и рентгенографии грудной клетки, КТ, диагностической плевральной пункции. Лечение гемотракса включает гемостатическую, антибактериальную, симптоматическую терапию; аспирацию скопившейся крови (пункции, дренирование плевральной полости), при необходимости – открытое или видеоторакоскопическое удаление свернувшегося гемоторакса, остановку продолжающегося кровотечения.
Общие сведения
Гемоторакс является вторым по частоте (после пневмоторакса) осложнением травм грудной клетки и встречается у 25 % больных с торакальной травмой.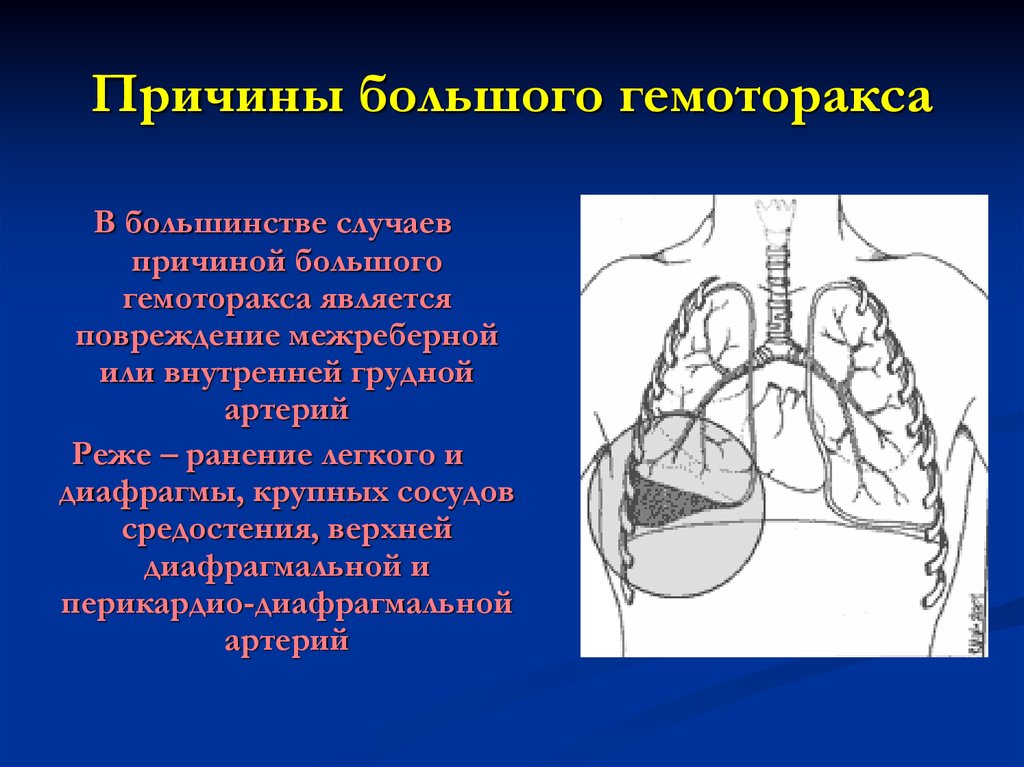 Довольно часто в клинической практике наблюдается комбинированная патология — гемопневмоторакс. Опасность гемоторакса заключается как в нарастающей дыхательной недостаточности, обусловленной сдавлением легкого, так и в развитии геморрагического шока вследствие острого внутреннего кровотечения. В пульмонологии и торакальной хирургии гемотракс расценивается как неотложное состояние, требующее оказания экстренной специализированной помощи.
Довольно часто в клинической практике наблюдается комбинированная патология — гемопневмоторакс. Опасность гемоторакса заключается как в нарастающей дыхательной недостаточности, обусловленной сдавлением легкого, так и в развитии геморрагического шока вследствие острого внутреннего кровотечения. В пульмонологии и торакальной хирургии гемотракс расценивается как неотложное состояние, требующее оказания экстренной специализированной помощи.
Гемоторакс
Причины гемоторакса
Выделяют три группы причин, наиболее часто приводящих к развитию гемоторакса: травматические, патологические и ятрогенные.- Под травматическими причинами понимают проникающие ранения или закрытые повреждения грудной клетки. К торакальной травме, сопровождающейся развитием гемоторакса, относятся ДТП, огнестрельные и ножевые ранения грудной клетки, переломы ребер, падения с высоты и др. При подобных травмах довольно часто происходит повреждение органов грудной полости (сердца, легких, диафрагмы), органов брюшной полости (травмы печени, селезенки), межреберных сосудов, внутренней грудной артерии, внутригрудных ветвей аорты, кровь из которых изливается в плевральную полость.

- К причинам гемоторакса патологического характера причисляют различные заболевания: рак легкого или плевры, аневризму аорты, туберкулез легких, абсцесс легкого, новообразования средостения и грудной стенки, геморрагический диатез, коагулопатии и др.
- Ятрогенными факторами, приводящими к развитию гемоторакса, выступают осложнения операций на легких и плевре, торакоцентеза, дренирования плевральной полости, катетеризации центральных вен.
Патогенез
Скопление крови в полости плевры вызывает компрессию легкого на стороне поражения и смещение органов средостения в противоположную сторону. Это сопровождается уменьшением дыхательной поверхности легкого, возникновением расстройств дыхания и гемодинамики. Поэтому при гемотраксе нередко развивается клиника геморрагического и кардио-пульмонального шока с острой дыхательной и сердечной недостаточностью.
Уже в ближайшие часы после попадания крови в плевральную полость развивается асептическое воспаление плевры — гемоплеврит, обусловленный реакцией плевральных листков. При гемотораксе возникает отек и умеренная лейкоцитарная инфильтрация плевры, набухание и слущивание клеток мезотелия. В начальном периоде излившаяся в плевральную полость кровь практически не отличается по составу от периферической крови. В дальнейшем в ней происходит снижение гемоглобина, уменьшение эритроцитарно-лейкоцитарного индекса.
При гемотораксе возникает отек и умеренная лейкоцитарная инфильтрация плевры, набухание и слущивание клеток мезотелия. В начальном периоде излившаяся в плевральную полость кровь практически не отличается по составу от периферической крови. В дальнейшем в ней происходит снижение гемоглобина, уменьшение эритроцитарно-лейкоцитарного индекса.
Попадая в плевральную полость, кровь вначале сворачивается. Однако затем вскоре наступает процесс фибринолиза, и происходит повторное разжижение крови. Этому способствуют антикоагулянтные факторы, содержащиеся в самой крови и плевральной жидкости, а также механическое дефибринирование крови за счет дыхательной экскурсии грудной клетки. По мере истощения механизмов антикоагуляции происходит свертывание крови и формирование свернувшегося гемоторакса. В случае присоединения микробного инфицирования на фоне гемоторакса довольно быстро может возникать эмпиема плевры.
Классификация
В соответствии с этиологией различают травматический, патологический и ятрогенный гемоторакс. С учетом величины внутриплеврального кровотечения гемоторакс может быть:
С учетом величины внутриплеврального кровотечения гемоторакс может быть:
- малый — объем кровопотери до 500 мл, скопление крови в синусе;
- средний — объем до 1,5 л, уровень крови до нижнего края IV ребра;
- субтотальный — объем кровопотери до 2 л, уровень крови до нижнего края II ребра;
- тотальный — объем кровопотери свыше 2 л, рентгенологически характеризуется тотальным затемнением плевральной полости на стороне поражения.
Количество крови, излившейся в плевральную полость, зависит от локализации ранения и степени разрушения сосудов. Так, при повреждении периферических отделов легкого, в большинстве случаев возникает малый или средний гемоторакс; при ранениях корня легкого обычно повреждаются магистральные сосуды, что сопровождается массивным кровотечением и развитием субтотального и тотального гемоторакса.
Кроме этого, также выделяют ограниченный (обычно малый по объему) гемоторакс, при котором излившаяся кровь скапливается между плевральными спайками, на изолированном участке полости плевры. С учетом локализации ограниченный гемоторакс бывает верхушечным, междолевым, паракостальным, наддиафрагмальным, парамедиастинальным.
С учетом локализации ограниченный гемоторакс бывает верхушечным, междолевым, паракостальным, наддиафрагмальным, парамедиастинальным.
В случае продолжающегося внутриплеврального кровотечения говорят о нарастающем гемотораксе, в случае прекращения кровотечения – о ненарастающем (стабильном). К осложненным видам относят свернувшийся и инфицированный гемоторакс (пиогемоторакс). При одновременном попадании в полость плевры воздуха и крови, говорят о гемопневмотораксе.
Симптомы гемоторакса
Клиническая симптоматика гемоторакса зависит от степени кровотечения, сдавления легочной ткани и смещения органов средостения. При малом гемотораксе клинические проявления выражены минимально или отсутствуют. Основными жалобами служат боли в грудной клетке, усиливающиеся при кашле, умеренная одышка.
При гемотораксе среднего или большого размера развиваются дыхательные и сердечно-сосудистые расстройства, выраженные в различной степени. Характерна резкая боль в груди, иррадиирующая в плечо и спину при дыхании и кашле; общая слабость, тахипноэ, снижение АД. Даже при незначительной физической нагрузке происходит усиление симптоматики. Больной обычно принимает вынужденное сидячее или полусидячее положение.
Характерна резкая боль в груди, иррадиирующая в плечо и спину при дыхании и кашле; общая слабость, тахипноэ, снижение АД. Даже при незначительной физической нагрузке происходит усиление симптоматики. Больной обычно принимает вынужденное сидячее или полусидячее положение.
При тяжелом гемотораксе на первый план выступает клиника внутриплеврального кровотечения: слабость и головокружение, холодный липкий пот, тахикардия и гипотония, бледность кожных покровов с цианотичным оттенком, мелькание мушек перед глазами, обмороки.
Гемоторакс, сопряженный с переломом ребер, как правило, сопровождается подкожной эмфиземой, гематомами мягких тканей, деформацией, патологической подвижностью и крепитацией отломков ребер. При гемотораксе, протекающем с разрывом легочной паренхимы, может возникать кровохарканье.
В 3-12% случаев формируется свернувшийся гемоторакс, при котором в полости плевры образуются кровяные сгустки, фибринные наслоения и шварты, ограничивающие дыхательную функцию легкого, вызывая развитие склеротических процессов в легочной ткани.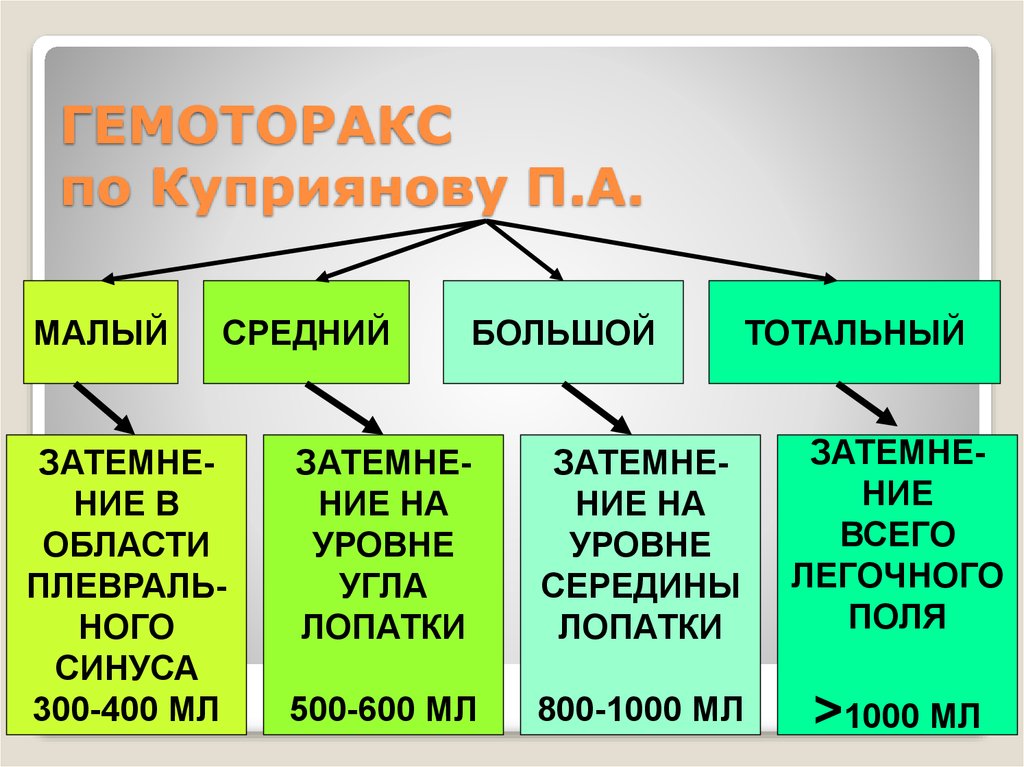 Клиника свернувшегося гемоторакса характеризуется тяжестью и болью в грудной клетке, одышкой. При инфицированном гемотораксе (эмпиеме плевры) на первый план выходят признаки тяжелого воспаления и интоксикации: лихорадка, ознобы, вялость и др.
Клиника свернувшегося гемоторакса характеризуется тяжестью и болью в грудной клетке, одышкой. При инфицированном гемотораксе (эмпиеме плевры) на первый план выходят признаки тяжелого воспаления и интоксикации: лихорадка, ознобы, вялость и др.
Диагностика
Для постановки диагноза уточняются подробности истории заболевания, проводится физикальное, инструментальное и лабораторное обследование. При гемотораксе определяется отставание пораженной стороны грудной клетки при дыхании, притупление перкуторного звука над уровнем жидкости, ослабление дыхания и голосового дрожания. При рентгеноскопии и обзорной рентгенографии легких выявляется коллабирование легкого, наличие горизонтального уровня жидкости или сгустков в полости плевры, флотация (смещение) тени средостения в здоровую сторону.
С диагностической целью выполняется пункция плевральной полости: получение крови достоверно свидетельствует о гемотораксе. Для дифференциации стерильного и инфицированного гемоторакса проводят пробы Петрова и Эфендиева с оценкой прозрачности и осадка аспирата. С целью суждения о прекращении или продолжении внутриплеврального кровотечения выполняют пробу Рувилуа-Грегуара: свертывание полученной крови в пробирке или шприце свидетельствует о продолжающемся кровотечении, отсутствие коагуляции говорит о прекращении кровотечения. Образцы пунктата направляют в лабораторию для определения гемоглобина и проведения бактериологического исследования.
С целью суждения о прекращении или продолжении внутриплеврального кровотечения выполняют пробу Рувилуа-Грегуара: свертывание полученной крови в пробирке или шприце свидетельствует о продолжающемся кровотечении, отсутствие коагуляции говорит о прекращении кровотечения. Образцы пунктата направляют в лабораторию для определения гемоглобина и проведения бактериологического исследования.
При банальном и свернувшемся гемотораксе прибегают к лабораторному определению Нb, количества эритроцитов, тромбоцитов, исследованию коагулограммы. Дополнительная инструментальная диагностика при гемотораксе может включать УЗИ плевральной полости, рентгенографию ребер, КТ грудной клетки, диагностическую торакоскопию.
Лечение гемоторакса
Пациенты с гемотораксом госпитализируются в специализированные хирургические отделения и находятся под наблюдением торакального хирурга. С лечебной целью для аспирации/эвакуации крови производится дренирование плевральной полости с введением в дренаж антибиотиков и антисептиков (для профилактики инфицирования и санации), протеолитических ферментов (для растворения сгустков).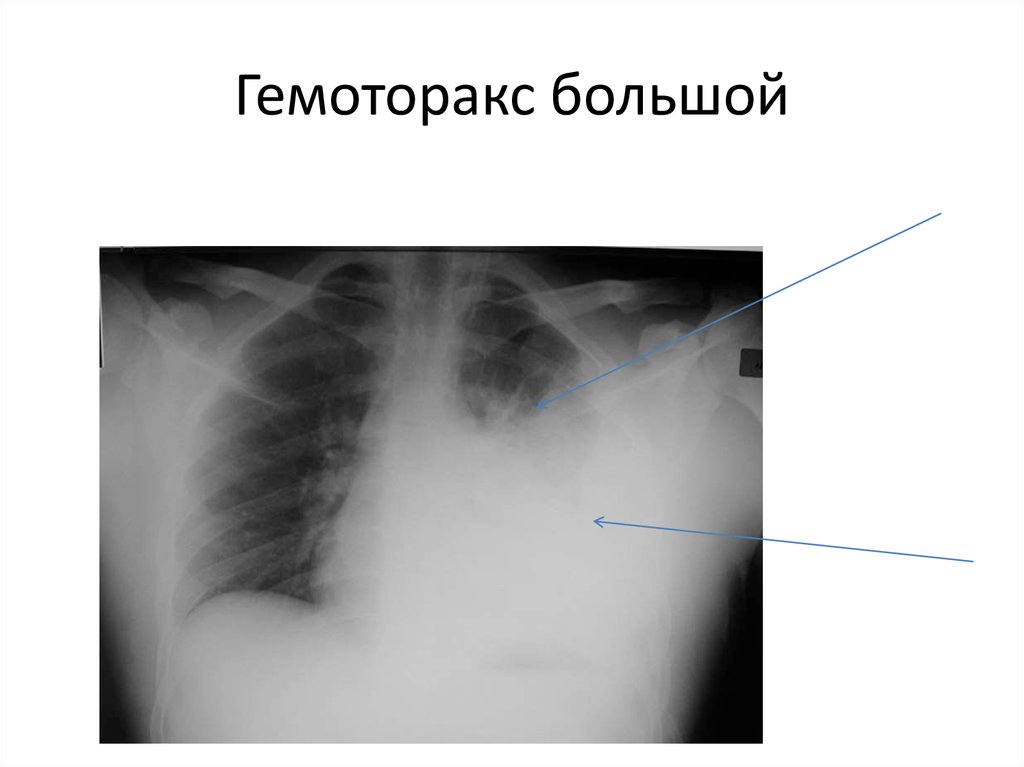 Консервативное лечение гемоторакса включает проведение гемостатической, дезагрегантной, симптоматической, иммунокорригирующей, гемотрансфузионной терапии, общей антибиотикотерапии, оксигенотерапии.
Консервативное лечение гемоторакса включает проведение гемостатической, дезагрегантной, симптоматической, иммунокорригирующей, гемотрансфузионной терапии, общей антибиотикотерапии, оксигенотерапии.
Малый гемоторакс в большинстве случаев может быть ликвидирован консервативным путем. Хирургическое лечение гемоторакса показано в случае продолжающегося внутриплеврального кровотечения; при свернувшемся гемотораксе, препятствующем расправлению легкого; повреждении жизненно важных органов.
В случае ранения крупных сосудов или органов грудной полости производится экстренная торакотомия, перевязка сосуда, ушивание раны легкого или перикарда, удаление излившейся в плевральную полость крови. Свернувшийся гемоторакс является показанием к плановому выполнению видеоторакоскопии или открытой торакотомии для удаления сгустков крови и санации плевральной полости. При нагноении гемоторакса лечение проводится по правилам ведения гнойного плеврита.
Прогноз и профилактика
Успешность лечения гемоторакса определяется характером травмы или заболевания, интенсивностью кровопотери и своевременностью хирургической помощи. Прогноз наиболее благоприятен при малом и среднем неинфицированном гемотораксе. Свернувшийся гемоторакс повышает вероятность развития эмпиемы плевры. Продолжающееся внутриплевральное кровотечение или одномоментная большая кровопотеря могут привести к гибели пациента.
Прогноз наиболее благоприятен при малом и среднем неинфицированном гемотораксе. Свернувшийся гемоторакс повышает вероятность развития эмпиемы плевры. Продолжающееся внутриплевральное кровотечение или одномоментная большая кровопотеря могут привести к гибели пациента.
Исходом гемоторакса может являться образование массивных плевральных сращений, ограничивающих подвижность купола диафрагмы. Поэтому в период реабилитации пациентам, перенесшим гемоторакс, рекомендуются занятия плаванием и дыхательной гимнастикой. Профилактика гемоторакса заключается в предупреждении травматизма, обязательной консультации пациентов с торакоабдоминальной травмой хирургом, контроле гемостаза при операциях на легких и средостении, осторожном выполнении инвазивных манипуляций.
причины, симптомы, диагностика и лечение
Гемоторакс – это кровотечение в полость плевры, скопление крови между ее листками, приводящее к сдавлению легкого и смещению органов средостения в противоположную сторону.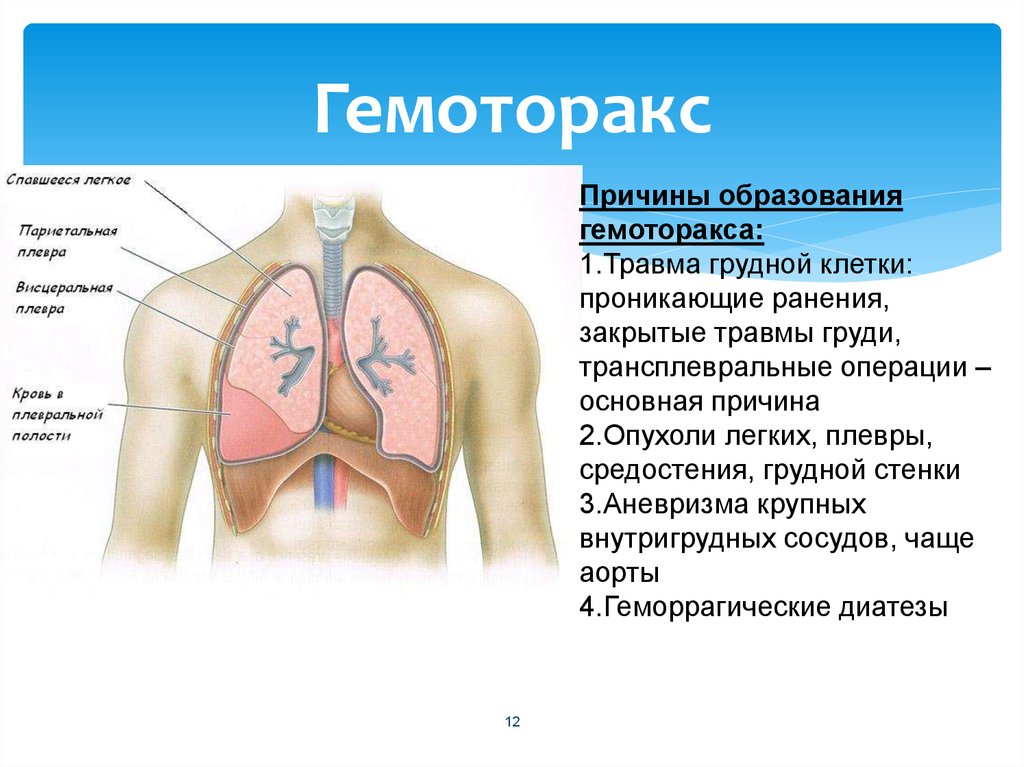 При гемотораксе отмечается боль в грудной клетке, затруднение дыхания, развиваются признаки острой кровопотери (головокружение, бледность кожных покровов, тахикардия, гипотония, холодный липкий пот, обмороки). Диагностика гемоторакса основана на физикальных данных, результатах рентгеноскопии и рентгенографии грудной клетки, КТ, диагностической плевральной пункции. Лечение гемотракса включает гемостатическую, антибактериальную, симптоматическую терапию; аспирацию скопившейся крови (пункции, дренирование плевральной полости), при необходимости – открытое или видеоторакоскопическое удаление свернувшегося гемоторакса, остановку продолжающегося кровотечения.
При гемотораксе отмечается боль в грудной клетке, затруднение дыхания, развиваются признаки острой кровопотери (головокружение, бледность кожных покровов, тахикардия, гипотония, холодный липкий пот, обмороки). Диагностика гемоторакса основана на физикальных данных, результатах рентгеноскопии и рентгенографии грудной клетки, КТ, диагностической плевральной пункции. Лечение гемотракса включает гемостатическую, антибактериальную, симптоматическую терапию; аспирацию скопившейся крови (пункции, дренирование плевральной полости), при необходимости – открытое или видеоторакоскопическое удаление свернувшегося гемоторакса, остановку продолжающегося кровотечения.
Общие сведения
Гемоторакс является вторым по частоте (после пневмоторакса) осложнением травм грудной клетки и встречается у 25 % больных с торакальной травмой. Довольно часто в клинической практике наблюдается комбинированная патология — гемопневмоторакс. Опасность гемоторакса заключается как в нарастающей дыхательной недостаточности, обусловленной сдавлением легкого, так и в развитии геморрагического шока вследствие острого внутреннего кровотечения. В пульмонологии и торакальной хирургии гемотракс расценивается как неотложное состояние, требующее оказания экстренной специализированной помощи.
В пульмонологии и торакальной хирургии гемотракс расценивается как неотложное состояние, требующее оказания экстренной специализированной помощи.
Гемоторакс
Причины гемоторакса
Выделяют три группы причин, наиболее часто приводящих к развитию гемоторакса: травматические, патологические и ятрогенные.
- Под травматическими причинами понимают проникающие ранения или закрытые повреждения грудной клетки. К торакальной травме, сопровождающейся развитием гемоторакса, относятся ДТП, огнестрельные и ножевые ранения грудной клетки, переломы ребер, падения с высоты и др. При подобных травмах довольно часто происходит повреждение органов грудной полости (сердца, легких, диафрагмы), органов брюшной полости (травмы печени, селезенки), межреберных сосудов, внутренней грудной артерии, внутригрудных ветвей аорты, кровь из которых изливается в плевральную полость.
- К причинам гемоторакса патологического характера причисляют различные заболевания: рак легкого или плевры, аневризму аорты, туберкулез легких, абсцесс легкого, новообразования средостения и грудной стенки, геморрагический диатез, коагулопатии и др.

- Ятрогенными факторами, приводящими к развитию гемоторакса, выступают осложнения операций на легких и плевре, торакоцентеза, дренирования плевральной полости, катетеризации центральных вен.
Патогенез
Скопление крови в полости плевры вызывает компрессию легкого на стороне поражения и смещение органов средостения в противоположную сторону. Это сопровождается уменьшением дыхательной поверхности легкого, возникновением расстройств дыхания и гемодинамики. Поэтому при гемотраксе нередко развивается клиника геморрагического и кардио-пульмонального шока с острой дыхательной и сердечной недостаточностью.
Уже в ближайшие часы после попадания крови в плевральную полость развивается асептическое воспаление плевры — гемоплеврит, обусловленный реакцией плевральных листков. При гемотораксе возникает отек и умеренная лейкоцитарная инфильтрация плевры, набухание и слущивание клеток мезотелия. В начальном периоде излившаяся в плевральную полость кровь практически не отличается по составу от периферической крови.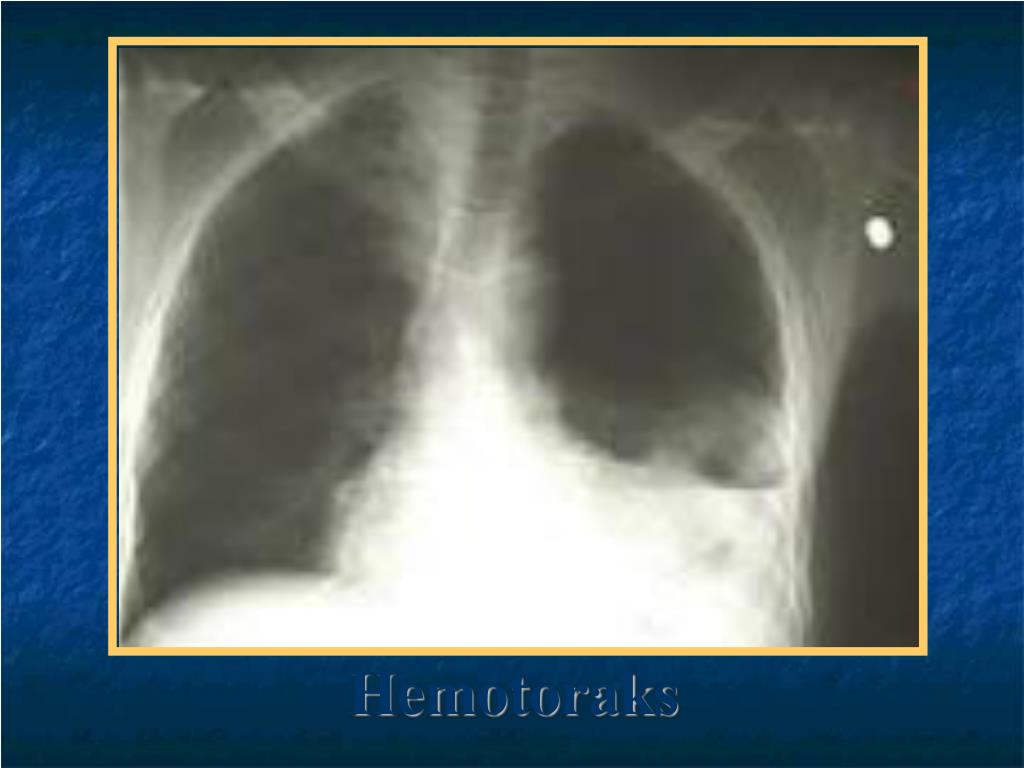 В дальнейшем в ней происходит снижение гемоглобина, уменьшение эритроцитарно-лейкоцитарного индекса.
В дальнейшем в ней происходит снижение гемоглобина, уменьшение эритроцитарно-лейкоцитарного индекса.
Попадая в плевральную полость, кровь вначале сворачивается. Однако затем вскоре наступает процесс фибринолиза, и происходит повторное разжижение крови. Этому способствуют антикоагулянтные факторы, содержащиеся в самой крови и плевральной жидкости, а также механическое дефибринирование крови за счет дыхательной экскурсии грудной клетки. По мере истощения механизмов антикоагуляции происходит свертывание крови и формирование свернувшегося гемоторакса. В случае присоединения микробного инфицирования на фоне гемоторакса довольно быстро может возникать эмпиема плевры.
Классификация
В соответствии с этиологией различают травматический, патологический и ятрогенный гемоторакс. С учетом величины внутриплеврального кровотечения гемоторакс может быть:
- малый — объем кровопотери до 500 мл, скопление крови в синусе;
- средний — объем до 1,5 л, уровень крови до нижнего края IV ребра;
- субтотальный — объем кровопотери до 2 л, уровень крови до нижнего края II ребра;
- тотальный — объем кровопотери свыше 2 л, рентгенологически характеризуется тотальным затемнением плевральной полости на стороне поражения.

Количество крови, излившейся в плевральную полость, зависит от локализации ранения и степени разрушения сосудов. Так, при повреждении периферических отделов легкого, в большинстве случаев возникает малый или средний гемоторакс; при ранениях корня легкого обычно повреждаются магистральные сосуды, что сопровождается массивным кровотечением и развитием субтотального и тотального гемоторакса.
Кроме этого, также выделяют ограниченный (обычно малый по объему) гемоторакс, при котором излившаяся кровь скапливается между плевральными спайками, на изолированном участке полости плевры. С учетом локализации ограниченный гемоторакс бывает верхушечным, междолевым, паракостальным, наддиафрагмальным, парамедиастинальным.
В случае продолжающегося внутриплеврального кровотечения говорят о нарастающем гемотораксе, в случае прекращения кровотечения – о ненарастающем (стабильном). К осложненным видам относят свернувшийся и инфицированный гемоторакс (пиогемоторакс).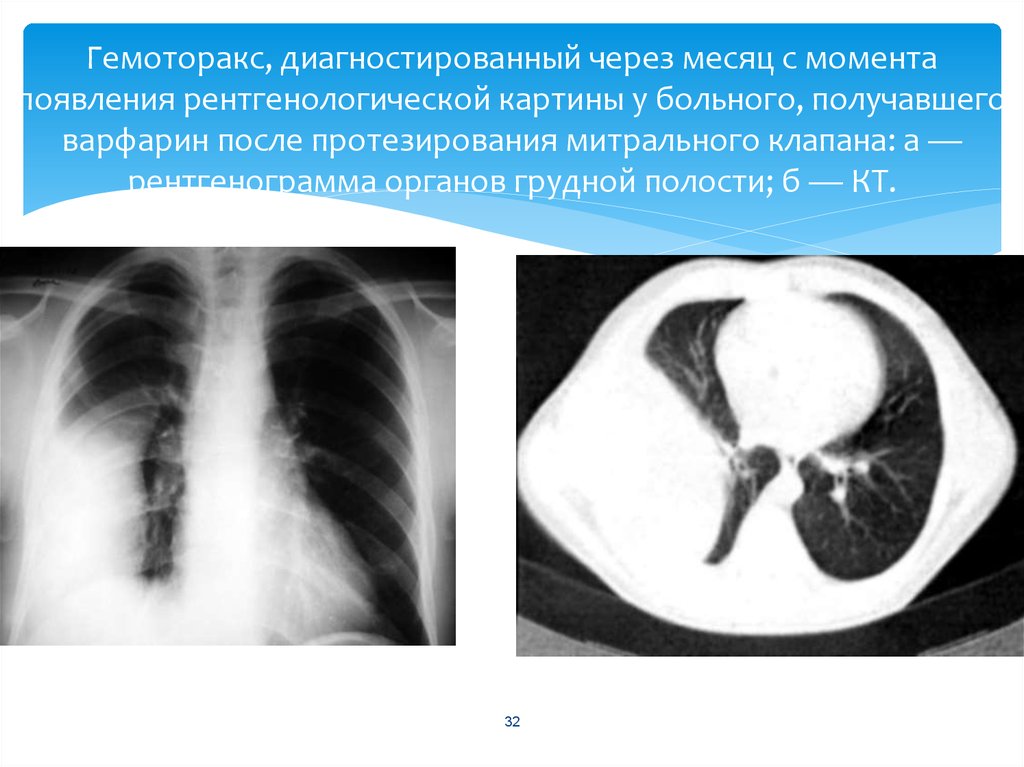 При одновременном попадании в полость плевры воздуха и крови, говорят о гемопневмотораксе.
При одновременном попадании в полость плевры воздуха и крови, говорят о гемопневмотораксе.
Симптомы гемоторакса
Клиническая симптоматика гемоторакса зависит от степени кровотечения, сдавления легочной ткани и смещения органов средостения. При малом гемотораксе клинические проявления выражены минимально или отсутствуют. Основными жалобами служат боли в грудной клетке, усиливающиеся при кашле, умеренная одышка.
При гемотораксе среднего или большого размера развиваются дыхательные и сердечно-сосудистые расстройства, выраженные в различной степени. Характерна резкая боль в груди, иррадиирующая в плечо и спину при дыхании и кашле; общая слабость, тахипноэ, снижение АД. Даже при незначительной физической нагрузке происходит усиление симптоматики. Больной обычно принимает вынужденное сидячее или полусидячее положение.
При тяжелом гемотораксе на первый план выступает клиника внутриплеврального кровотечения: слабость и головокружение, холодный липкий пот, тахикардия и гипотония, бледность кожных покровов с цианотичным оттенком, мелькание мушек перед глазами, обмороки.
Гемоторакс, сопряженный с переломом ребер, как правило, сопровождается подкожной эмфиземой, гематомами мягких тканей, деформацией, патологической подвижностью и крепитацией отломков ребер. При гемотораксе, протекающем с разрывом легочной паренхимы, может возникать кровохарканье.
В 3-12% случаев формируется свернувшийся гемоторакс, при котором в полости плевры образуются кровяные сгустки, фибринные наслоения и шварты, ограничивающие дыхательную функцию легкого, вызывая развитие склеротических процессов в легочной ткани. Клиника свернувшегося гемоторакса характеризуется тяжестью и болью в грудной клетке, одышкой. При инфицированном гемотораксе (эмпиеме плевры) на первый план выходят признаки тяжелого воспаления и интоксикации: лихорадка, ознобы, вялость и др.
Диагностика
Для постановки диагноза уточняются подробности истории заболевания, проводится физикальное, инструментальное и лабораторное обследование. При гемотораксе определяется отставание пораженной стороны грудной клетки при дыхании, притупление перкуторного звука над уровнем жидкости, ослабление дыхания и голосового дрожания. При рентгеноскопии и обзорной рентгенографии легких выявляется коллабирование легкого, наличие горизонтального уровня жидкости или сгустков в полости плевры, флотация (смещение) тени средостения в здоровую сторону.
При рентгеноскопии и обзорной рентгенографии легких выявляется коллабирование легкого, наличие горизонтального уровня жидкости или сгустков в полости плевры, флотация (смещение) тени средостения в здоровую сторону.
С диагностической целью выполняется пункция плевральной полости: получение крови достоверно свидетельствует о гемотораксе. Для дифференциации стерильного и инфицированного гемоторакса проводят пробы Петрова и Эфендиева с оценкой прозрачности и осадка аспирата. С целью суждения о прекращении или продолжении внутриплеврального кровотечения выполняют пробу Рувилуа-Грегуара: свертывание полученной крови в пробирке или шприце свидетельствует о продолжающемся кровотечении, отсутствие коагуляции говорит о прекращении кровотечения. Образцы пунктата направляют в лабораторию для определения гемоглобина и проведения бактериологического исследования.
При банальном и свернувшемся гемотораксе прибегают к лабораторному определению Нb, количества эритроцитов, тромбоцитов, исследованию коагулограммы.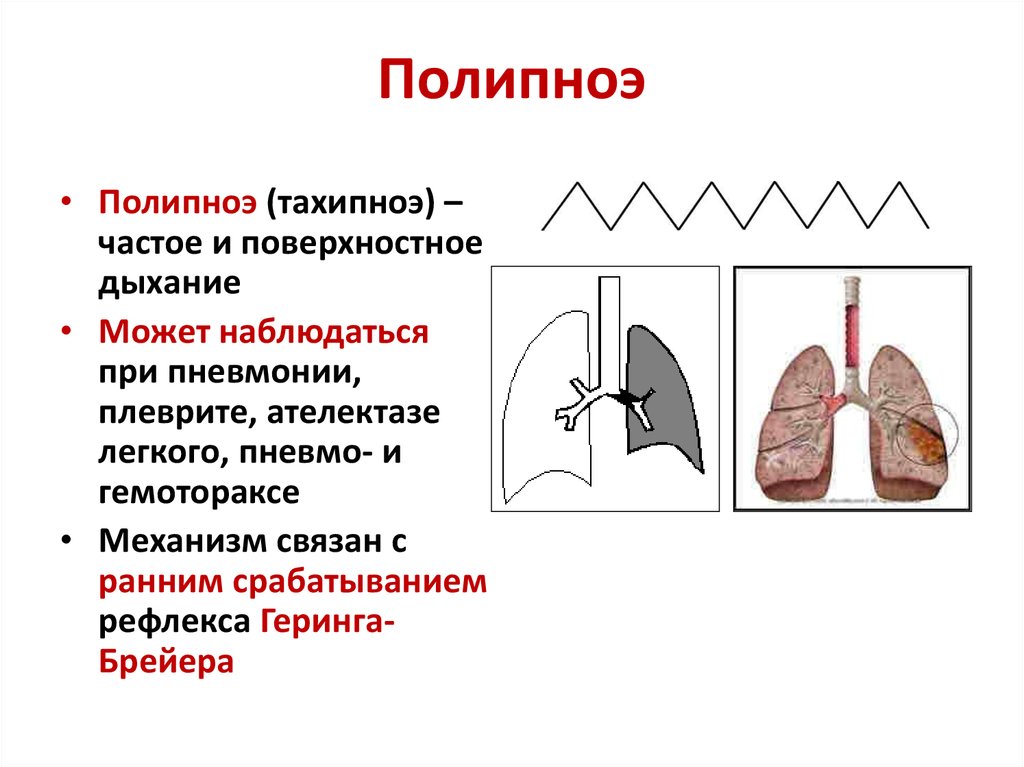 Дополнительная инструментальная диагностика при гемотораксе может включать УЗИ плевральной полости, рентгенографию ребер, КТ грудной клетки, диагностическую торакоскопию.
Дополнительная инструментальная диагностика при гемотораксе может включать УЗИ плевральной полости, рентгенографию ребер, КТ грудной клетки, диагностическую торакоскопию.
Лечение гемоторакса
Пациенты с гемотораксом госпитализируются в специализированные хирургические отделения и находятся под наблюдением торакального хирурга. С лечебной целью для аспирации/эвакуации крови производится дренирование плевральной полости с введением в дренаж антибиотиков и антисептиков (для профилактики инфицирования и санации), протеолитических ферментов (для растворения сгустков). Консервативное лечение гемоторакса включает проведение гемостатической, дезагрегантной, симптоматической, иммунокорригирующей, гемотрансфузионной терапии, общей антибиотикотерапии, оксигенотерапии.
Малый гемоторакс в большинстве случаев может быть ликвидирован консервативным путем. Хирургическое лечение гемоторакса показано в случае продолжающегося внутриплеврального кровотечения; при свернувшемся гемотораксе, препятствующем расправлению легкого; повреждении жизненно важных органов.
В случае ранения крупных сосудов или органов грудной полости производится экстренная торакотомия, перевязка сосуда, ушивание раны легкого или перикарда, удаление излившейся в плевральную полость крови. Свернувшийся гемоторакс является показанием к плановому выполнению видеоторакоскопии или открытой торакотомии для удаления сгустков крови и санации плевральной полости. При нагноении гемоторакса лечение проводится по правилам ведения гнойного плеврита.
Прогноз и профилактика
Успешность лечения гемоторакса определяется характером травмы или заболевания, интенсивностью кровопотери и своевременностью хирургической помощи. Прогноз наиболее благоприятен при малом и среднем неинфицированном гемотораксе. Свернувшийся гемоторакс повышает вероятность развития эмпиемы плевры. Продолжающееся внутриплевральное кровотечение или одномоментная большая кровопотеря могут привести к гибели пациента.
Исходом гемоторакса может являться образование массивных плевральных сращений, ограничивающих подвижность купола диафрагмы. Поэтому в период реабилитации пациентам, перенесшим гемоторакс, рекомендуются занятия плаванием и дыхательной гимнастикой. Профилактика гемоторакса заключается в предупреждении травматизма, обязательной консультации пациентов с торакоабдоминальной травмой хирургом, контроле гемостаза при операциях на легких и средостении, осторожном выполнении инвазивных манипуляций.
Поэтому в период реабилитации пациентам, перенесшим гемоторакс, рекомендуются занятия плаванием и дыхательной гимнастикой. Профилактика гемоторакса заключается в предупреждении травматизма, обязательной консультации пациентов с торакоабдоминальной травмой хирургом, контроле гемостаза при операциях на легких и средостении, осторожном выполнении инвазивных манипуляций.
Гемоторакс при травме грудной клетки – хирургическое лечение в «ОН КЛИНИК Рязань»
Под названием «Гемоторакс» понимается скопление в плевральной полости крови – результат внутреннего кровотечения. Приводит к компрессии одного из легких и смещению в противоположную сторону органов средостения.
По статистике, гемоторакс при травме грудной клетки развивается у каждого четвертого пациента. Может развиться одновременно с пневмотораксом, в этом случае носит название гемопневмоторакс. В любом случае, скопление крови в плевральной полости является опасным для здоровья и жизни пациента острым состоянием, требующим экстренной медицинской помощи.
Чем опасно отсутствие своевременного лечения гемоторакса? Компрессия легкого может повлечь за собой развитие у пациента острой дыхательной недостаточности. А в том случае, если внутреннее кровотечение достаточно сильное, оно может стать причиной наступления у него геморрагического шока. А уже через два-три часа с начала кровотечения в плевральную полость в ней развивается воспаление – так называемый гемоплеврит.
Причины развития этого патологического состояния
Классификация факторов, спровоцировавших развитие у пациента гемоторакса, выглядит следующим образом:
- травмы груди – как закрытые повреждения, например, сильные ушибы, так и проникающие ранения. Подобные травмы могут быть следствием падения, ДТП, ножевых и огнестрельных ранений, трещин и переломов одного или нескольких ребер и т.д. Кровотечение в плевральную полость при этом может быть следствием повреждения легких, диафрагмы, сердечной мышцы и крупных кровеносных сосудов, селезенки, печени и других внутренних органов;
- патологические причины гемоторакса – это прежде всего следствие наличия у пациента некоторых заболеваний.
 К ним относятся туберкулез, абсцесс легкого, опухоли грудной стенки, злокачественные новообразования в легких, аневризма аорты и т.д.;
К ним относятся туберкулез, абсцесс легкого, опухоли грудной стенки, злокачественные новообразования в легких, аневризма аорты и т.д.; - третья группа факторов – это так называемые ятрогенные причины скопаления в плевральной полости крови. Это могут быть неквалифицированное проведение торакоцентеза и последующей установки дренажа, а также осложнения хирургических вмешательств на плевре и органах грудной клетки.
Симптомы посттравматического гемоторакса
Проявления данного состояния могут быть более или менее интенсивными в зависимости от того, насколько сильно внутреннее кровотечение и как выражена компрессия легкого. Если гемоторакс незначителен, то характерной симптоматики может и не быть; о том, что с пациентом что-то не так, свидетельствуют лишь болезненные ощущения в груди, одышка и кашель.
Если в плевральной полости скопился достаточно большой объем крови, то проявления выражены ярче. Пациент страдает от сильных болей в груди, которые могут «отдавать» в спину и в верхние конечности, усиливаясь при кашле и в момент физической активности.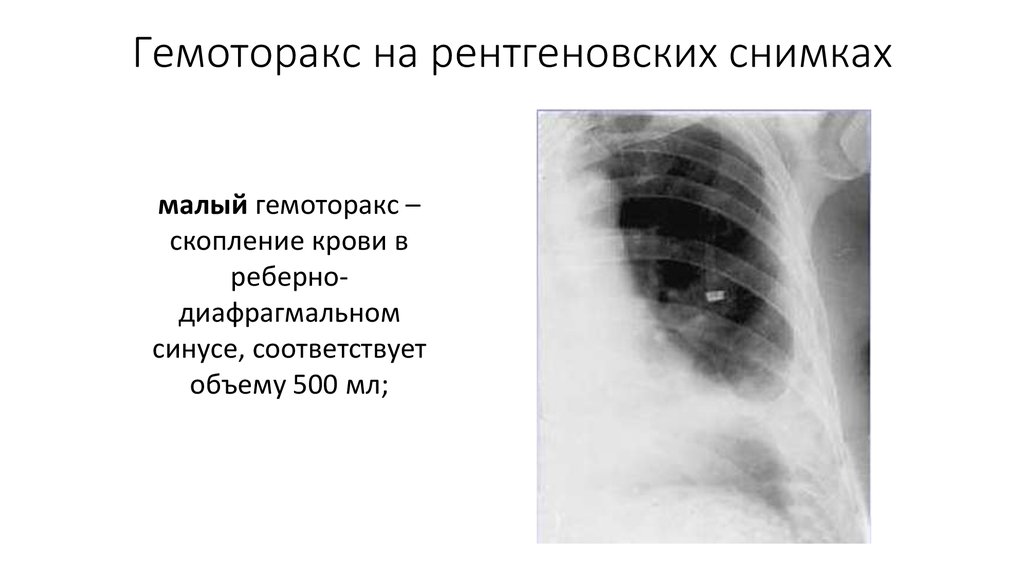 Характерна сильная одышка и общая слабость, сильное снижение артериального давления. Пациент вынужден сохранять положение сидя: так ему немного легче.
Характерна сильная одышка и общая слабость, сильное снижение артериального давления. Пациент вынужден сохранять положение сидя: так ему немного легче.
Тяжелые формы гемоторакса – например, после серьезной травмы грудной клетки – характеризуются симптоматикой острого внутреннего кровотечения. Это головокружение, предобморочное состояние, выраженная гипотония, учащение сердцебиения, зачастую – потеря сознания. При этом, если внутреннее кровотечение сопровождается переломами ребер, под кожей пациента появляется эмфизема, выраженные гематомы, грудная клетка может быть деформирована. О нарушении целостности легкого может свидетельствовать развитие у пациента кровохаркания.
Выявление и лечение гемоторакса в «ОН КЛИНИК Рязань»
Для уточнения предварительно поставленного по симптоматике диагноза могут быть использованы такие инструментальные исследования, как УЗИ грудной клетки, ее рентгенография, а также торакоскопия. Присутствие крови в диагностической пункции плевральной полости является однозначным свидетельством ее скопления внутри.
Малый гемоторакс в большинстве случаев успешно лечится консервативным путем. Массивная антибиотикотерапия, а также симптоматическое лечение с обязательным применением гемотрансфузионных и иммуномодулирующих препаратов помогают устранить все проявления заболевания и предотвратить развитие осложнений.
Хирургическое лечение гемоторакса предусматривает обеспечение оттока крови из плевральной полости с последующим введением внутрь антисептического раствора и антибиотиков для предотвращения воспаления, а также препаратов для растворения кровяных сгустков.
Показаниями к проведению экстренной торакотомии при гемотораксе являются повреждение органов грудной полости и/или крупных кровеносных сосудов. Это необходимо для восстановления целостности сосуда и ушивания поврежденных органов. Одновременно с этим производится санация плевральной полости, сгустки свернувшейся крови удаляют. Если у пациента развилось гнойное воспаление плевральной полости, его лечение должно быть идентично терапии гнойного плеврита.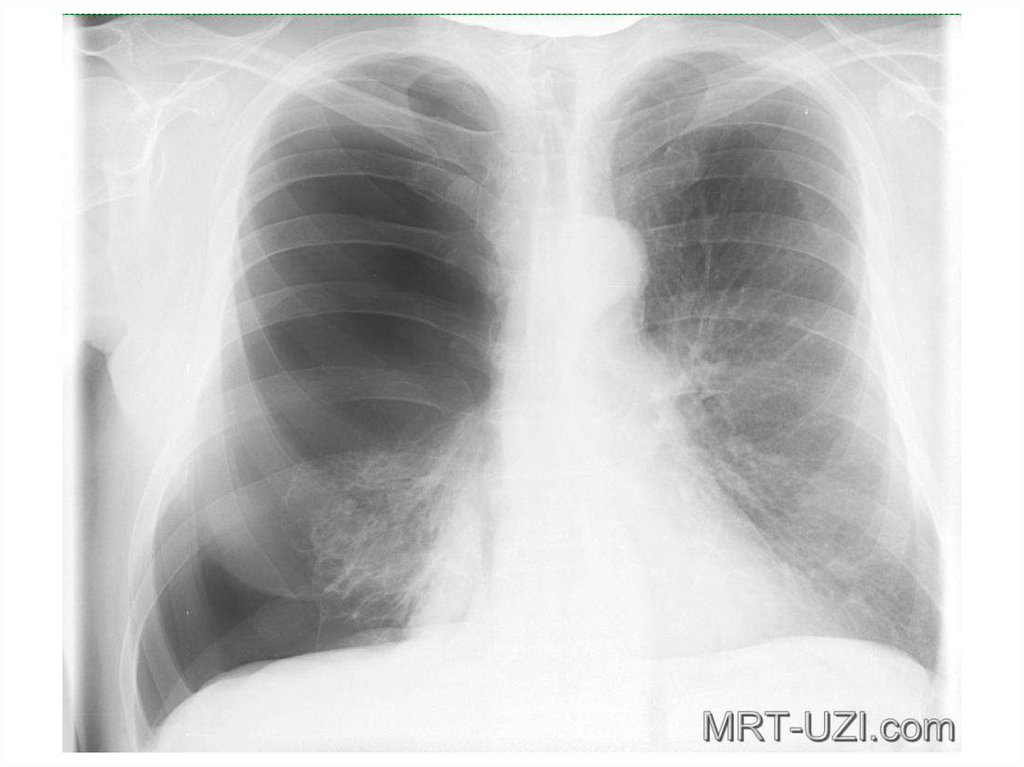
UF Health, University of Florida Health
Определение
Гемоторакс — это скопление крови в пространстве между грудной стенкой и легкими (плевральной полостью).
Причины
Наиболее частой причиной гемоторакса является травма грудной клетки. Гемоторакс также может возникнуть у людей, у которых есть:
- Дефект свертывания крови
- Операция на грудной клетке или сердце
- Отмирание легочной ткани (инфаркт легкого)
- Рак легкого или плевры — первичный или вторичный (метастатический или с другого сайта)
- Разрыв кровеносного сосуда при установке центрального венозного катетера или в сочетании с тяжелым высоким кровяным давлением
- Туберкулез
Симптомы
Симптомы включают:
Обследования и тесты
Ваш лечащий врач может заметить уменьшение или отсутствие дыхательных шумов на пораженной стороне. Признаки или признаки гемоторакса можно увидеть при следующих исследованиях:
Признаки или признаки гемоторакса можно увидеть при следующих исследованиях:
- Рентген грудной клетки
- КТ
- Торакоцентез (дренаж плевральной жидкости через иглу или катетер)
- Торакостомия (дренаж плевральной жидкости через дренажную трубку) )
Лечение
Целью лечения является стабилизация состояния больного, остановка кровотечения и удаление крови и воздуха из плевральной полости.
- Через грудную стенку между ребрами вводится плевральная дренажная трубка для дренирования крови и воздуха.
- Его оставляют на месте и присоединяют к аспирации на несколько дней для повторного расширения легкого.
Если только плевральная дренажная трубка не останавливает кровотечение, может потребоваться хирургическое вмешательство (торакотомия) для остановки кровотечения.
Также будет устранена причина гемоторакса. Подлежащее легкое могло разрушиться. Это может привести к затруднению дыхания. У людей, перенесших травму, может быть достаточно дренирования плевральной полости.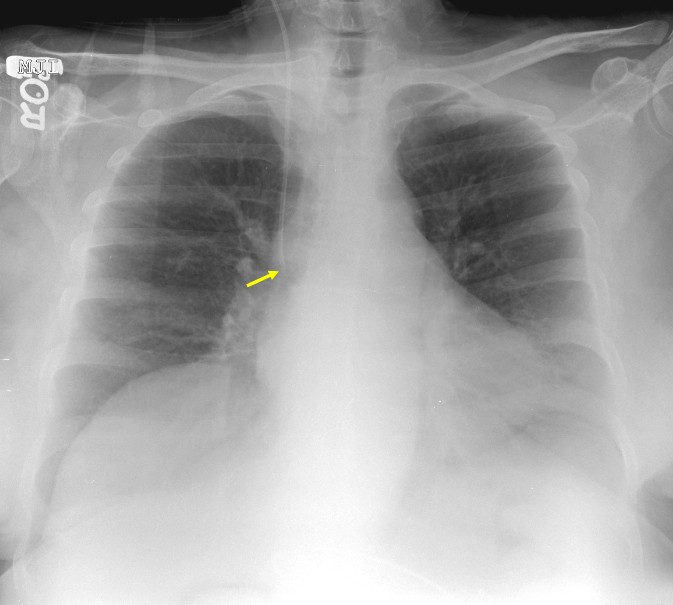 Хирургия может не понадобиться.
Хирургия может не понадобиться.
ЧТО ОЖИДАТЬ В ОТДЕЛЕНИИ НЕОТЛОЖНОЙ ПОМОЩИ
Медработник будет измерять и контролировать основные показатели жизнедеятельности человека, включая насыщение кислородом, пульс, частоту дыхания и кровяное давление. Симптомы лечат по мере необходимости. Человек может получить:
- Дыхательная поддержка. Это может включать кислород, неинвазивную поддержку давлением в дыхательных путях, такую как BIPAP, или эндотрахеальную интубацию (помещение дыхательной трубки через рот или нос в дыхательные пути) и размещение на аппарате ИВЛ. (дыхательный аппарат жизнеобеспечения)
- Анализы крови и возможное переливание крови
- Плевральная дренажная трубка (трубка через кожу и мышцы между ребрами в пространство вокруг легких) при коллапсе легкого
- КТ
- Анализ плевральной жидкости, Электрокардиограмма (ЭКГ)
- Жидкости, вводимые через вену (в/в)
- Лекарства для лечения симптомов
- Рентген грудной клетки и брюшной полости или других частей тела при наличии дополнительных повреждений
Перспективы (прогноз)
Исход зависит от причины гемоторакса, объема кровопотери и скорости лечения.
В случае серьезной травмы результат дополнительно зависит от тяжести травмы и скорости кровотечения.
Возможные осложнения
Осложнения могут включать:
- Коллапс легкого или пневмоторакс, приводящий к дыхательной недостаточности (неспособность правильно дышать)
- Фиброз или рубцевание плевральных оболочек и лежащей в основе легочной ткани
- Инфекция плевральной жидкости (эмпиема)
- Шок и смерть при тяжелых обстоятельствах
Когда обращаться к медицинскому работнику
Обратитесь в отделение неотложной помощи или позвоните по местному номеру службы экстренной помощи (например, 911) если у вас есть:
- Головокружение, предобморочное состояние, лихорадка и кашель или чувство тяжести в груди
Профилактика
Используйте меры безопасности (например, ремни безопасности), чтобы избежать травм. В зависимости от причины гемоторакс нельзя предотвратить.
В зависимости от причины гемоторакс нельзя предотвратить.
Изображения
Ссылки
Лайт РВ, Ли YCG. Пневмоторакс, хилоторакс, гемоторакс и фиброторакс. В: Broaddus VC, Mason RJ, Ernst JD, et al, eds. Учебник Мюррея и Наделя по респираторной медицине . 6-е изд. Филадельфия, Пенсильвания: Эльзевир Сондерс; 2016: глава 81.
Раджа А.С. Торакальная травма. В: Walls RM, Hockberger RS, Gausche-Hill M, eds. Неотложная медицина Розена: концепции и клиническая практика . 9-е изд. Филадельфия, Пенсильвания: Elsevier; 2018: глава 38.
Семон Г., Маккарти М. Грудная стенка, пневмоторакс и гемоторакс. В: Кэмерон А.М., Кэмерон Дж.Л., ред. Современная хирургическая терапия . 13-е изд. Филадельфия, Пенсильвания: Elsevier; 2020:1146-1150.
Просмотрено:
Джесси Борке, доктор медицинских наук, FACEP, FAAEM, лечащий врач FDR Medical Services/Millard Fillmore Suburban Hospital, Буффало, Нью-Йорк. Также рассмотрены Дэвидом Зивом, доктором медицины, MHA, медицинским директором, Брендой Конауэй, редакционным директором, и A.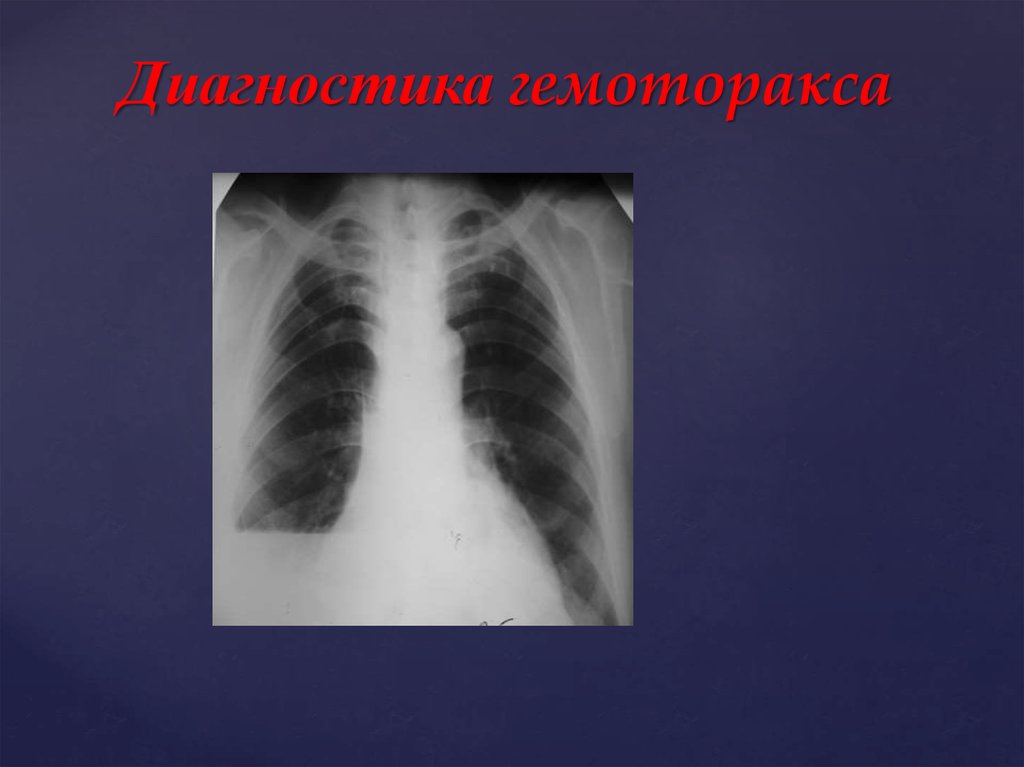 D.A.M. Редакционная коллегия.
D.A.M. Редакционная коллегия.
Гемоторакс — TeachMeSurgery
звездочка звезда звезда звезда star_half
на основе 1 оценок
Последнее обновление: 15 марта 2022 г.
Редакции: 8
Последнее обновление: 15 марта 2022 г.
Редакции: 8
format_list_bulleted Содержание добавить remove
- 1 Introduction
- 1.1 Aetiology
- 2 Clinical Features
- 2.1 Flail Segment
- 3 Investigations
- 4 Management
- 4.1 Surgical Management
- 5 Key Points
Введение
A гемоторакс — это попадание крови в плевральную полость , чаще всего возникающее после травмы грудной клетки (рис. 1). гемопневмоторакс представляет собой кровь и воздух в плевральной полости , также обычно возникающий после травмы
Хотя в большинстве случаев это очевидно, состав гематокрита плевральной жидкости должен составлять > 50% гематокрита крови для постановки формального диагноза гемоторакс.
Adobe Stock, лицензия TeachMeSeries Ltd
Рисунок 1. Схематическое изображение пневмоторакса и гемопневмоторакса
Этиология
межреберные сосуды , кровоточащие непосредственно в плевральную полость.
Менее распространенные причины включают ятрогенные (например, после биопсии легких), злокачественные новообразования (например, плевральные метастазы), или заболевания кровеносных сосудов (например, синдром Рендю-Ослера-Вебера) или свертывания крови (например, гемофилия А).
TeachMeSeries Ltd (2022)
Рисунок 2 – Иллюстрация, демонстрирующая положение межреберных артерий относительно ребер В крупных случаях больных может быть гипоксический и гипотензивный .
При осмотре выявляется притупление перкуторного звука на стороне поражения и ослабленное дыхание при аускультации. В тяжелых случаях наблюдается уменьшение расширения грудной клетки на пораженной стороне и потенциальное отклонение трахеи в контралатеральную сторону.
В тяжелых случаях наблюдается уменьшение расширения грудной клетки на пораженной стороне и потенциальное отклонение трахеи в контралатеральную сторону.
Тупая травма может также вызвать гематомы грудной клетки и крепитацию (хирургическая эмфизема). А цеповой сегмент может быть очевиден у тех, кто получил значительную травму .
Kaul and Paniagua, CC BY 2.0 , via Wikimedia Commons
три или более смежных ребра сломаны в двух или более местах. Это часто является маркером серьезной травматической травмы.
У невентилируемого пациента это приведет к парадоксальному движению цепового сегмента, при котором во время выдоха сегмент выпячивается, а во время вдоха втягивается (рис. 4).
Baedr-9439, CC0, через Wikimedia Commons
Рисунок 4. Схема, демонстрирующая парадоксальное движение сегментом цепа , с одновременными исследованиями и вмешательствами по мере необходимости. Должны быть выполнены рутинные анализы крови , включая ОАК, U&E и свертывание крови.
Должны быть выполнены рутинные анализы крови , включая ОАК, U&E и свертывание крови.
В случаях с подозрением на рак грудной клетки в прямой проекции обычная пленочная рентгенограмма (рис. 3) должна быть выполнена как в прямой, так и в боковой проекциях. Это покажет притупление реберно-диафрагмального угла , а больший гемоторакс покажет уровень мениска +/- контралатеральное смещение средостения
0178 (рис. 5) для подтверждения диагноза, который будет лучше характеризовать размер гемоторакса и важно оценить другие сопутствующие травмы
Cevik Y, CC BY 3.0, через Wikimedia Commons
Рисунок 5. Большой правосторонний гемоторакс, как видно на КТ-изображении0178 . Обеспечьте достаточное обезболивание пациентов, а в случаях травм транексамовую кислоту давали (если нет противопоказаний)
В большинстве случаев гемоторакса требуется введение хирургического плеврального дренажа для эвакуации крови из плевральной полости (рис.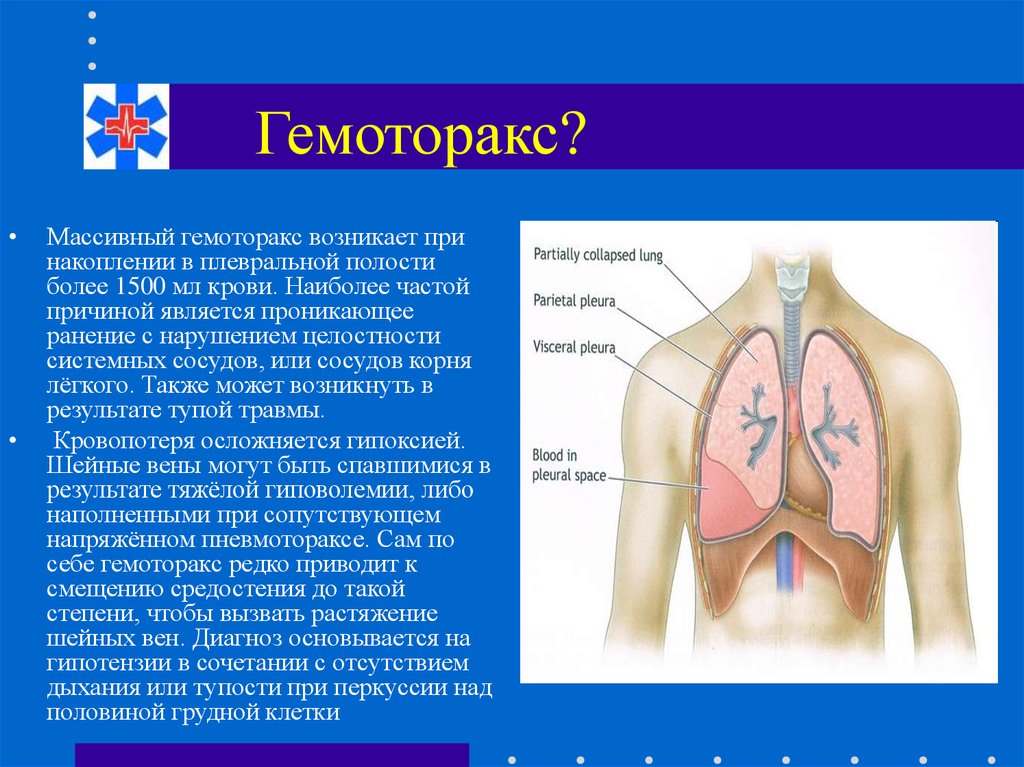 6). Рекомендуется использовать трубки большого диаметра (28-40Fr) для снижения риска свертывания крови в трубке*, объем дренажа грудной клетки должен быть тщательно зарегистрирован .
6). Рекомендуется использовать трубки большого диаметра (28-40Fr) для снижения риска свертывания крови в трубке*, объем дренажа грудной клетки должен быть тщательно зарегистрирован .
Те пациенты с небольшим гемотораксом , которые клинически стабильны , могут быть госпитализированы для наблюдения и повторной рентгенографии через 24 часа для дальнейшей оценки
или тканевого активатора плазминогена) можно испытать, чтобы помочь разрушить имеющиеся тромбы
Adobe Stock, лицензия TeachMeSeries Ltd
Хирургическое лечение
Для пациентов с большой кровопотерей (прибл. >1500 мл) или продолжающейся умеренной кровопотерей (прибл. >200 мл в час), хирургическое обследование следует рассмотреть при попытке идентифицировать и остановить кровоточащий сосуд . Наиболее распространенной процедурой для этого является VATS (видеоторакоскопическая хирургия, рис.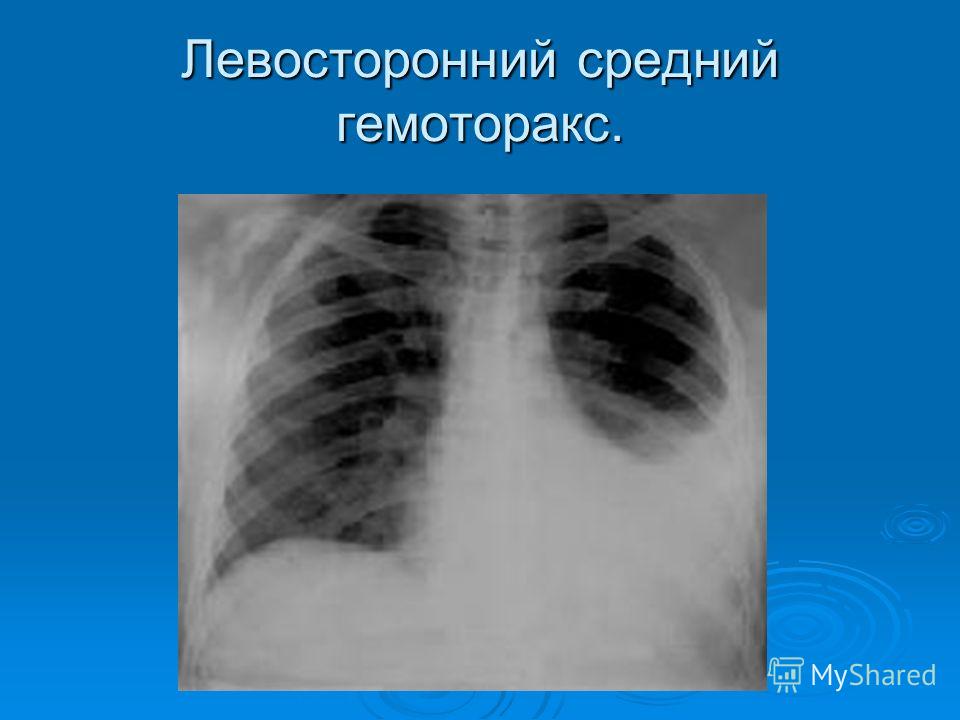 7), или реже может потребоваться торакотомия .
7), или реже может потребоваться торакотомия .
Время проведения ВАТС имеет решающее значение при эвакуации гемоторакса, в идеале выполнение в течение 48-72 часов , чтобы обеспечить успешную оценку и раннее повторное расширение легкого.
При наличии одновременных переломов ребер , особенно с цепными сегментами, в специализированных центрах следует рассмотреть хирургическую пластину переломов ребер для уменьшения боли и улучшения вентиляции.
Cancer Research UK, CC BY-SA 4.0, через Wikimedia Commons
Рисунок 7. Схема, демонстрирующая оборудование для процедуры VATS
Ключевые моменты
- Гемоторакс — это попадание крови в плевральную полость, чаще всего возникающее после травмы грудной клетки
- Диагноз ставится с помощью обычной рентгенографии грудной клетки и обычно требует установки плеврального дренажа
- У пациентов с большой кровопотерей (примерно >1500 мл) или продолжающейся умеренной кровопотерей (приблизительно >200 мл в час) следует рассмотреть хирургическое исследование
распечатать Распечатать эту статью
Оцените эту статью
Не выбрано12345
star_border звезда
звезда_граница звезда
звезда_граница звезда
звезда_граница звезда
звезда_граница звезда
Изменить эту статью
Нашли ошибку? В нашей статье отсутствует ключевая информация? Внесите изменения самостоятельно здесь!
Когда вы закончите редактирование, нажмите «Отправить на проверку», и ваши изменения будут проверены нашей командой перед публикацией на сайте.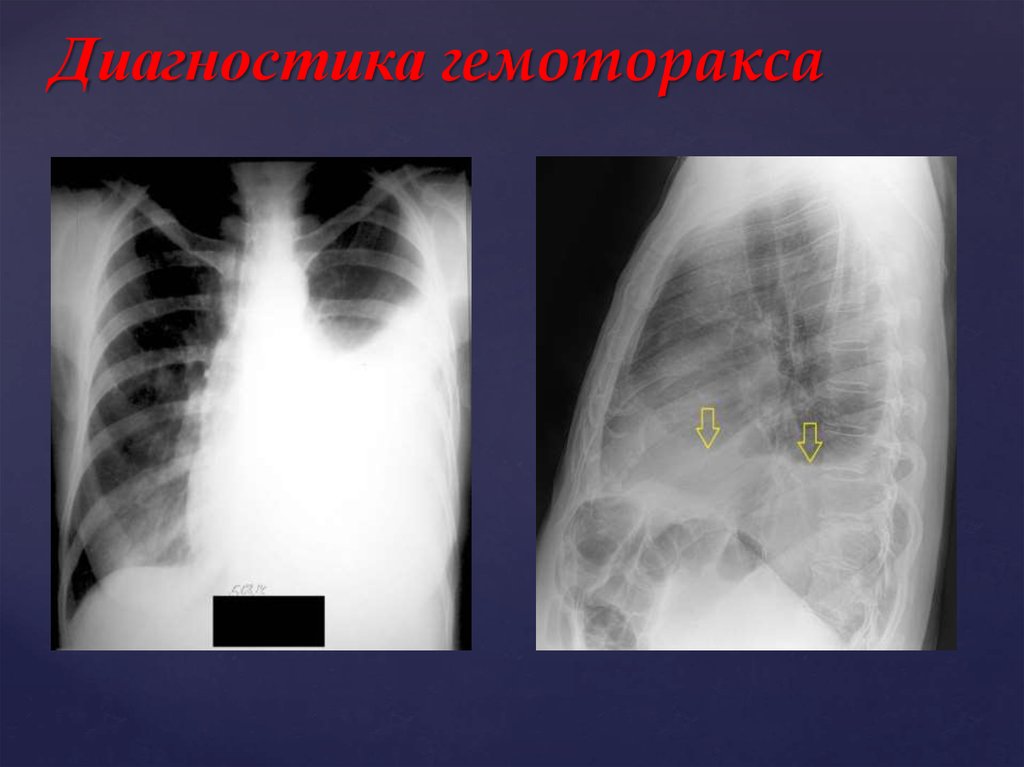
Гемоторакс — StatPearls — NCBI Bookshelf
Продолжение обучения
Гемоторакс – это скопление крови в пространстве между висцеральной и париетальной плеврой (плевральная полость). Клинические признаки у таких пациентов включают респираторный дистресс и тахипноэ. Это упражнение иллюстрирует оценку и лечение гемоторакса и рассматривает роль межпрофессиональной команды в улучшении ухода за пациентами с этим заболеванием.
Цели:
Обзор эпидемиологии гемоторакса.
Опишите использование протокола травмы при обследовании пациентов с гемотораксом.
Опишите этапы реанимации и лечения гемоторакса.
Объясните важность улучшения координации помощи межпрофессиональной бригады для улучшения оказания помощи пациентам с гемотораксом.
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Введение
Гемоторакс — частое последствие травматических повреждений грудной клетки. Это скопление крови в плевральной полости, потенциальном пространстве между висцеральной и париетальной плеврой. Наиболее распространенным механизмом травмы является тупое или проникающее ранение внутригрудных или внегрудных структур, что приводит к кровотечению в грудную клетку. Кровотечение может возникнуть из стенки грудной клетки, межреберных или внутренних грудных артерий, магистральных сосудов, средостения, миокарда, паренхимы легкого, диафрагмы или брюшной полости.
Это скопление крови в плевральной полости, потенциальном пространстве между висцеральной и париетальной плеврой. Наиболее распространенным механизмом травмы является тупое или проникающее ранение внутригрудных или внегрудных структур, что приводит к кровотечению в грудную клетку. Кровотечение может возникнуть из стенки грудной клетки, межреберных или внутренних грудных артерий, магистральных сосудов, средостения, миокарда, паренхимы легкого, диафрагмы или брюшной полости.
КТ является предпочтительным методом оценки внутригрудных повреждений; однако это может быть невозможно у пациента с нестабильной травмой. Кроме того, в небольших центрах может отсутствовать компьютерная томография. Рентгенография грудной клетки традиционно использовалась в качестве инструмента скрининга для оценки непосредственных опасных для жизни травм. Недавняя литература предполагает, что УЗИ в месте оказания медицинской помощи (POCUS) может быть полезным в качестве дополнения к традиционным методам визуализации.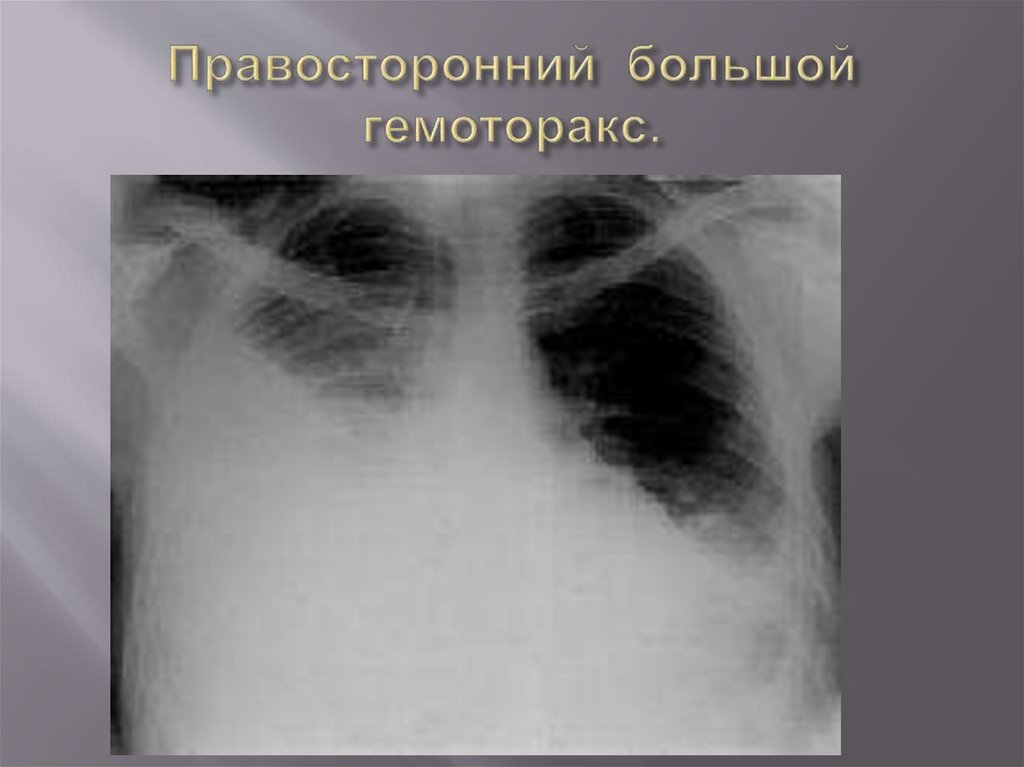 POCUS быстрый, надежный, воспроизводимый и, самое главное, портативный. Его можно использовать у постели больного для сортировки и выявления опасных для жизни травм. Легочные окна были включены в протокол расширенной сфокусированной оценки с сонографией при травме (eFAST) с середины 2000-х годов. В дополнение к традиционным видам FAST для правого и левого верхнего квадранта оператор может перемещать датчик в краниальном направлении, чтобы быстро оценить наличие жидкости над диафрагмой. Многочисленные исследования показали, что УЗИ грудной клетки является ценным инструментом в диагностическом подходе у пациентов с тупой травмой грудной клетки.[1][2][3][4][5] Ультразвуковое исследование легких (УЗИ) при оценке гемоторакса продемонстрировало точность и более высокую чувствительность, чем рентгенография грудной клетки.[2][5][6][7]
POCUS быстрый, надежный, воспроизводимый и, самое главное, портативный. Его можно использовать у постели больного для сортировки и выявления опасных для жизни травм. Легочные окна были включены в протокол расширенной сфокусированной оценки с сонографией при травме (eFAST) с середины 2000-х годов. В дополнение к традиционным видам FAST для правого и левого верхнего квадранта оператор может перемещать датчик в краниальном направлении, чтобы быстро оценить наличие жидкости над диафрагмой. Многочисленные исследования показали, что УЗИ грудной клетки является ценным инструментом в диагностическом подходе у пациентов с тупой травмой грудной клетки.[1][2][3][4][5] Ультразвуковое исследование легких (УЗИ) при оценке гемоторакса продемонстрировало точность и более высокую чувствительность, чем рентгенография грудной клетки.[2][5][6][7]
Этиология
Гемоторакс — частое проявление травматического повреждения (тупого или проникающего) структур грудной клетки. Большинство случаев гемоторакса возникает из-за тупого механизма с общей смертностью 9,4% [8]. Нетравматические причины встречаются реже. Примеры включают ятрогенные, легочные секвестрации, сосудистые, новообразования, коагулопатии и инфекционные процессы.[9]
Нетравматические причины встречаются реже. Примеры включают ятрогенные, легочные секвестрации, сосудистые, новообразования, коагулопатии и инфекционные процессы.[9]
Эпидемиология
Травматические повреждения являются серьезной проблемой здравоохранения в Соединенных Штатах, ежегодно унося 140 000 жизней.[10] Повреждения грудной клетки встречаются примерно в 60% случаев множественных травм и являются причиной от 20 до 25% смертей от травм [6]. Кроме того, травма является основной причиной смертности на четвертом десятилетии жизни.[7] В Соединенных Штатах на автомобильные аварии приходится от 70 до 80% тупых травм грудной клетки.[11] Повреждения грудных структур могут возникнуть в результате прямого удара или силы быстрого торможения. Недавние исследования показывают, что переломы скелета грудной клетки, ушиб легких и повреждения диафрагмы являются частыми проявлениями тупой травмы грудной клетки.[12] От 30 до 50 процентов пациентов с тяжелой тупой травмой грудной клетки имели сопутствующий ушиб легкого, пневмоторакс и гемоторакс. Пневмоторакс, гемоторакс или гемопневмоторакс были обнаружены в 72,3% случаев травматических переломов ребер в серии Sirmali et al. [12].
Пневмоторакс, гемоторакс или гемопневмоторакс были обнаружены в 72,3% случаев травматических переломов ребер в серии Sirmali et al. [12].
Патофизиология
Кровотечение в гемиторакс может возникнуть при травмах диафрагмы, средостения, легких, плевры, грудной стенки и брюшной полости. Каждый гемиторакс может содержать 40% объема циркулирующей крови пациента. Исследования показали, что повреждение межреберных сосудов (например, внутренних грудных артерий и легочных сосудов) приводит к значительному кровотечению, требующему инвазивного лечения.[13] Ранняя физиологическая реакция гемоторакса имеет гемодинамический и респираторный компоненты. Тяжесть патофизиологического ответа зависит от места повреждения, функционального резерва пациента, объема крови и скорости накопления в гемитораксе. В раннем ответе острая гиповолемия приводит к снижению преднагрузки, дисфункции левого желудочка и снижению сердечного выброса. Кровь в плевральной полости влияет на функциональную жизненную емкость легких, вызывая альвеолярную гиповентиляцию, несоответствие V/Q и анатомическое шунтирование. Большой гемоторакс может привести к увеличению гидростатического давления, которое оказывает давление на полую вену и легочную паренхиму, вызывая нарушение преднагрузки и увеличение сопротивления легочных сосудов. Эти механизмы приводят к физиологии напряженного гемоторакса и вызывают гемодинамическую нестабильность, сердечно-сосудистый коллапс и смерть.
Большой гемоторакс может привести к увеличению гидростатического давления, которое оказывает давление на полую вену и легочную паренхиму, вызывая нарушение преднагрузки и увеличение сопротивления легочных сосудов. Эти механизмы приводят к физиологии напряженного гемоторакса и вызывают гемодинамическую нестабильность, сердечно-сосудистый коллапс и смерть.
Анамнез и физикальное исследование
Тщательный и точный сбор анамнеза у пациента, свидетелей или медработников на догоспитальном этапе помогает определить пациентов с низким или высоким риском внутригрудной травмы. Важные компоненты анамнеза включают боль в груди, одышку, механизм травмы (падение, направление и скорость), употребление наркотиков/алкоголя, сопутствующие заболевания, хирургический анамнез и антикоагулянтную/антитромбоцитарную терапию. Механизмы действия, которые были предикторами значительного повреждения грудной клетки, включают автомобильную аварию со скоростью более 35 миль в час, падение с высоты более 15 футов, катапультирование пешехода с высоты более 10 футов и травму с подавленным уровнем сознания. [14]
[14]
Клинические проявления гемоторакса обширны и могут совпадать с пневмотораксом; они включают респираторный дистресс, тахипноэ, ослабление или отсутствие дыхательных шумов, притупление перкуссии, асимметрию грудной клетки, отклонение трахеи, гипоксию, узкий пульс и гипотензию. Осмотрите грудную стенку на наличие признаков ушиба, ссадин, «признака непристегнутого ремня», проникающего ранения, парадоксального движения («цепляющаяся грудная клетка»), экхимоза, деформации, крепитации и точечной болезненности. может отсутствовать при гиповолемии. Учащение дыхания, усилие и использование вспомогательных мышц могут быть признаками надвигающейся дыхательной недостаточности.
Следующие физикальные данные должны побудить клинициста задуматься об этих состояниях:
Вздутие шейных вен → тампонада перикарда, напряженный пневмоторакс, кардиогенная недостаточность, воздушная эмболия ушиб/истирание грудной стенки
Парадоксальное движение грудной клетки → дрожание грудной клетки
Отек лица/шеи или цианоз → повреждение верхнего средостения с окклюзией или сдавлением верхней полой вены (ВПВ)
Подкожная эмфизема → разорванная бронха или паренхима легких
Скафоидная брюшная полость → Диафрагматическое повреждение с грыжами с брусной поломки → на грудной клетке
12.
 Избыток Движения в животе с брусной ранией → на грудной клетке
Избыток Движения в животе с брусной ранией → на грудной клетке- 9
Элемовое движение в животе. Быстрая оценка, распознавание и вмешательство при возможных травмах грудной клетки имеют важное значение. Американский колледж хирургов разработал протокол American Traumatic Life Support (ATLS), который реализует стандартизированный и методический подход к оценке каждого пациента с травмой. При травматических повреждениях грудной клетки сердечно-легочная оценка должна быть приоритетной, так как они имеют самый высокий индекс смертности в случае пропуска [18]. Травмы других грудных структур должны рассматриваться; ребра, ключица, трахея, бронхи, пищевод и сосуды.
Диагностика: рассвет POCUS
Визуализация играет очень важную роль в лечении травматических повреждений. Впервые описанный Rozycki et al., Фокусированная оценка с сонографией при травме (FAST) оценивает перикард, околопеченочную, периселезеночную области и таз на предмет скопления патологической жидкости или воздуха [19].

Было показано, что он обеспечивает быструю и точную оценку травматического пациента с растущими доказательствами в поддержку его использования для диагностики гемоторакса, пневмоторакса и ушиба легких.[1][20] УЗИ легких включено в несколько протоколов недифференцированной одышки: FALLS, BLUE.[21][22]
Ультразвуковое исследование в месте оказания медицинской помощи при травмах значительно повлияло на оценку и распределение пациентов с травмами.[23] Он портативный, воспроизводимый, неинвазивный, воспроизводимый и не использует радиацию или контрастные вещества.[7]
В дополнение к четырем обычным проекциям eFAST включает косые проекции как полудиафрагмы для оценки зависимой жидкости (гемоторакс), так и передние проекции для оценки пневмоторакса. В режиме B датчик (криволинейный 5-1 МГц или фазированная решетка 5-1 МГц) размещается посредине подмышечной в пятом или шестом межреберье, а маркер направлен в сторону головы пациента. В хорошо аэрируемом здоровом легком воздух препятствует прямой визуализации структур, находящихся глубоко на границе диафрагмы и висцеральной плевры легкого.
 Гемоторакс будет выглядеть как анэхогенное (черное) или плохо эхогенное пространство между диафрагмой и париетальной плеврой в реберно-диафрагмальном кармане. Жидкость также может содержать гетерогенные эхо-сигналы от свернувшейся крови или части разорванной ткани легкого. Наличие плевральной жидкости позволяет визуализировать грудной отдел позвоночника за реберно-диафрагмальным углом, известный как «признак позвоночника». Это явление связано с потерей артефакта зеркальности диафрагмы[5]
Гемоторакс будет выглядеть как анэхогенное (черное) или плохо эхогенное пространство между диафрагмой и париетальной плеврой в реберно-диафрагмальном кармане. Жидкость также может содержать гетерогенные эхо-сигналы от свернувшейся крови или части разорванной ткани легкого. Наличие плевральной жидкости позволяет визуализировать грудной отдел позвоночника за реберно-диафрагмальным углом, известный как «признак позвоночника». Это явление связано с потерей артефакта зеркальности диафрагмы[5]Рентгенологическое исследование органов грудной клетки продолжает оставаться основным диагностическим методом при скрининге травматических повреждений грудной клетки. По сравнению с ультразвуковым исследованием исследования показывают, что ультразвук является лучшим диагностическим инструментом для выявления травматических повреждений грудной клетки (например, пневмоторакса и гемоторакса) [5, 6, 7, 20]. Системный обзор показал, что УЗИ имеет более высокую чувствительность (67%) по сравнению с рентгенографией грудной клетки (54%).
 [6] Чувствительность была еще выше, 70%, когда врач неотложной помощи выполнял eFAST. В проспективном исследовании чувствительность и специфичность УЗИ органов грудной клетки при выявлении гемоторакса были 92% и специфичность 100% соответственно.[1] Кроме того, ультразвук может обнаружить всего 20 мл плевральной жидкости по сравнению со 175 мл при рентгенографии [6] и имеет 100% чувствительность при обнаружении выпота более 100 мл [24].
[6] Чувствительность была еще выше, 70%, когда врач неотложной помощи выполнял eFAST. В проспективном исследовании чувствительность и специфичность УЗИ органов грудной клетки при выявлении гемоторакса были 92% и специфичность 100% соответственно.[1] Кроме того, ультразвук может обнаружить всего 20 мл плевральной жидкости по сравнению со 175 мл при рентгенографии [6] и имеет 100% чувствительность при обнаружении выпота более 100 мл [24].Еще одной особенностью УЗИ является возможность количественного определения объема выпота. Были разработаны и изучены четыре различные сонографические формулы для прогнозирования объема. Две из четырех формул выполняются, когда пациент лежит на спине. Датчик размещают перпендикулярно грудной клетке, а измерения проводят при максимальном вдохе, когда пациенты задерживают дыхание. «X» — максимальное перпендикулярное (интерплевральное) расстояние в мм между задней поверхностью легкого (висцеральная плевра) и задней стенкой грудной клетки (париетальная плевра), которое можно измерить [25].

Формулы следующие:
Две другие формулы выполняются с пациентом в положении сидя (прямо), которые не обсуждаются.
Рекомендуемое обследование гемоторакса включает ОАК (базовый уровень гемоглобина), ЦМР (креатинин), тропонин, профиль коагуляции, а также тип и скрининг [14]. Во многих исследованиях сообщается, что лактат сыворотки является предиктором смертности в условиях травмы. Данные в основном получены из ретроспективных исследований, и ни одно из них не проводилось в условиях тупой травмы грудной клетки. Уровень лактата в сыворотке выше 4 мг/дл коррелирует с более высокой смертностью. Серийные тропонины должны быть получены в дополнение к ЭКГ для оценки ушиба сердца.
Лечение/управление
Выполнение начальной реанимации и ведения пациента с травмой в соответствии с протоколом ATLS. У каждого пациента должен быть доступ к двум внутривенным катетерам большого диаметра, ему должен быть установлен кардиологический и кислородный монитор, а также ЭКГ в 12 отведениях.
 Непосредственно опасные для жизни травмы требуют немедленного вмешательства, такого как торакостомия с декомпрессионной иглой и/или экстренная торакостомия с трубкой при обширном пневмотораксе, а также начальное лечение гемоторакса.
Непосредственно опасные для жизни травмы требуют немедленного вмешательства, такого как торакостомия с декомпрессионной иглой и/или экстренная торакостомия с трубкой при обширном пневмотораксе, а также начальное лечение гемоторакса.Минимальное скопление крови (определяемое как менее 300 мл) в плевральной полости обычно не требует лечения; кровь обычно реабсорбируется в течение нескольких недель. Если пациент стабилен и имеет минимальную дыхательную недостаточность, оперативное вмешательство обычно не требуется. Эту группу пациентов можно лечить анальгезией по мере необходимости и наблюдать с повторной визуализацией через 4–6 часов и 24 часа.
По возможности следует проконсультироваться с кардиоторакальным хирургом или хирургом-травматологом для размещения трубчатой торакостомии. Традиционно для эвакуации гемоторакса использовали 36–40 французских плевральных дренажей, но эта практика подверглась тщательному изучению. Недавние исследования показывают, что большинство хирургов используют 32-36 французских трубок.
 Проспективные исследования не выявили различий в исходах при использовании от 28 до 32 французских трубок в травматологических центрах I уровня для эвакуации гемоторакса [17].
Проспективные исследования не выявили различий в исходах при использовании от 28 до 32 французских трубок в травматологических центрах I уровня для эвакуации гемоторакса [17].При асептическом доступе трубка размещается кзади по направлению к жидкости, зависящей от гравитации, в четвертом или пятом межреберье между передней и средней подмышечной линиями. Затем торакостомическую трубку подсоединяют к водяному затвору и отсасыванию, чтобы облегчить быстрое дренирование и предотвратить утечку воздуха. Кроме того, введение трубки обеспечивает количественный анализ крови для определения необходимости хирургического вмешательства.
Согласно литературным данным показания к хирургическому вмешательству (неотложной передней торакотомии) включают:
1500 мл дренирования крови за 24 часа через плевральную дренажную трубку
300-500 мл/час в течение 2-4 часов подряд после введения плевральной дренажной трубки
Травма крупных сосудов или грудной стенки
Тампонада перикарда
Торакотомия позволяет быстро оценить внутригрудные повреждения и гемостаз.

Дренирование гемоторакса при коагулопатии следует проводить осторожно с учетом основного заболевания. Коррекцию свертывающей функции перед оперативным вмешательством следует проводить, если это позволяет клинический статус больного.
Неправильная эвакуация гемоторакса может привести к таким осложнениям, как эмпиема и фиброторакс. Многочисленные исследования продемонстрировали эффективность видеоторакоскопии для лечения хронического гемоторакса. Это положительно сказалось на продолжительности пребывания в стационаре и выживаемости пациентов. VATS обеспечивает четкую визуализацию плевральной полости, правильное размещение плевральной дренажной трубки для точной остановки кровотечения, удаление оставшегося сгустка, эвакуацию и декортикацию посттравматических эмпием. Кроме того, он обеспечивает оценку предполагаемых повреждений диафрагмы, лечение стойких утечек воздуха и оценку повреждений средостения.[27]
Дифференциальный диагноз
Дифференциальный диагноз тупой травмы грудной клетки можно разделить на три категории [14]:
Висцеральные повреждения
Скелетные повреждения
Грудная грудь
RIB FRACTURE
- 1111119
RIB FRACTURE
- 11111119
RIB FRACTURE 9000
- 1111111119
FRACTURE 9000
- 1111111119
- .

Перелом лопатки
Перелом или вывих ключицы
Травма позвоночника или позвоночника
Cardiovascular injuries
Aortic rupture
Caval injury
Pericardial effusion/tamponade
Subclavian artery injury
Intercostal artery injury
Commotio cordis
Разрыв сердца
Прогноз
Заболеваемость и смертность от травматического гемоторакса коррелируют с тяжестью травмы и риском поздних осложнений, а именно эмпиемы и фиброторакса/защемления легкого. Пациенты с застойным гемотораксом подвержены риску развития эмпиемы, что приводит к длительному пребыванию в отделении интенсивной терапии/больнице [27].
осложнений
Торакальные ультразвуковые осложнения
Массивные гемотораксы могут привести к
Неправильное размещение трубки для грудной трубки может привести к
Травма твердого органа
.
 . Исследования показывают, что частота эмпиемы у пациентов с посттравматическим застойным гемотораксом составляет 26,8%. Фиброторакс возникает в результате отложения фибрина в плевральной полости. Неправильное дренирование гемоторакса вызывает воспалительный налет в плевральной полости, что препятствует правильному расширению легких. Это явление известно как ущемление легких.[28]
. Исследования показывают, что частота эмпиемы у пациентов с посттравматическим застойным гемотораксом составляет 26,8%. Фиброторакс возникает в результате отложения фибрина в плевральной полости. Неправильное дренирование гемоторакса вызывает воспалительный налет в плевральной полости, что препятствует правильному расширению легких. Это явление известно как ущемление легких.[28]Сдерживание и обучение пациентов
Исследования показывают, что отсутствие средств сдерживания и ухудшение состояния водителя являются основными факторами, способствующими серьезным травмам в автомобильных авариях.[29][30] Поставщики медицинских услуг должны поощрять принятие мер безопасности, таких как ношение ремней безопасности, предотвращение вождения в нетрезвом состоянии и альтернативные транспортные стратегии.[31][32][33]
Pearls and Other Issues
Ультразвуковое исследование в месте оказания медицинской помощи признано во всем мире как обследование у постели больного в отделении неотложной помощи.
 Также было введено официальное обучение в ординатуре. Это позволяет быстро и воспроизводимо оценить травматические повреждения без риска вредного излучения. Различные исследования были направлены на оценку диагностической ценности УЗИ органов грудной клетки при травматическом гемотораксе. Систематический обзор и метаанализ показали, что на чувствительность ультразвука влияли оператор и частота преобразователя.[6] Проспективное поперечное исследование показало, что ультразвук является лучшим методом, чем рентгенография, но по сравнению с компьютерной томографией он показал более низкую чувствительность.
Также было введено официальное обучение в ординатуре. Это позволяет быстро и воспроизводимо оценить травматические повреждения без риска вредного излучения. Различные исследования были направлены на оценку диагностической ценности УЗИ органов грудной клетки при травматическом гемотораксе. Систематический обзор и метаанализ показали, что на чувствительность ультразвука влияли оператор и частота преобразователя.[6] Проспективное поперечное исследование показало, что ультразвук является лучшим методом, чем рентгенография, но по сравнению с компьютерной томографией он показал более низкую чувствительность.Систематический обзор для определения общей точности УЗИ при черепно-мозговой травме имеет несколько ограничений. Неоднородные характеристики результатов ультразвукового исследования с использованием различных аппаратов, датчиков и уровней квалификации влияют на общее методологическое качество этих исследований.[5]
Улучшение результатов медицинского персонала
УЗИ в месте оказания помощи при оценке травматического повреждения грудной клетки является ценным дополнительным инструментом.
 Его применение в условиях травмы было изучено и проанализировано в нескольких систематических обзорах. Будущие рандомизированные испытания должны быть проведены для оценки соответствующих исходов, таких как смертность, продолжительность пребывания в больнице и затраты.[5][34] Медсестры должны контролировать выход плевральной дренажной трубки каждый час во время первоначальной госпитализации; если результат значителен и непрерывен, следует уведомить торакального хирурга. В то время как большинство случаев разрешается с помощью плевральной дренажной трубки, если гемоторакс не эвакуирован, это может привести к эмпиеме, которая часто требует хирургического вмешательства. Исходы для большинства пациентов с изолированным гемотораксом хорошие.[35] (уровень V)
Его применение в условиях травмы было изучено и проанализировано в нескольких систематических обзорах. Будущие рандомизированные испытания должны быть проведены для оценки соответствующих исходов, таких как смертность, продолжительность пребывания в больнице и затраты.[5][34] Медсестры должны контролировать выход плевральной дренажной трубки каждый час во время первоначальной госпитализации; если результат значителен и непрерывен, следует уведомить торакального хирурга. В то время как большинство случаев разрешается с помощью плевральной дренажной трубки, если гемоторакс не эвакуирован, это может привести к эмпиеме, которая часто требует хирургического вмешательства. Исходы для большинства пациентов с изолированным гемотораксом хорошие.[35] (уровень V)Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Рисунок
Гемоторакс, рентген. Предоставлено Steve Bhimji, MS, MD, PhD
Рисунок
Правосторонний гемоторакс.
 Предоставлено Vu Huy Tran, MD
Предоставлено Vu Huy Tran, MDРисунок
Остановка травматического гемоторакса. Предоставил Ву Хай Тран, доктор медицинских наук
Рисунок
Гемоторакс. Предоставлено Ву Хай Тран, MD
Ссылки
- 1.
Брукс А., Дэвис Б., Сметхерст М., Коннолли Дж. Неотложное ультразвуковое исследование при острой оценке гемоторакса. Emerg Med J. 21 января 2004 г. (1): 44-6. [Бесплатная статья PMC: PMC1756377] [PubMed: 14734374]
- 2.
Stengel D, Leisterer J, Ferrada P, Ekkernkamp A, Mutze S, Hoenning A. Ультрасонография в месте оказания медицинской помощи для диагностики торакоабдоминальных травм у пациентов с тупой травмой. Cochrane Database Syst Rev. 2018 Dec 12;12:CD012669. [Бесплатная статья PMC: PMC6517180] [PubMed: 30548249]
- 3.
Abboud PA, Kendall J. УЗИ отделения неотложной помощи при гемотораксе после тупой травматической травмы. J Emerg Med. 25 августа 2003 г. (2): 181-4. [PubMed: 12
- 6]
- 4.

McEwan K, Thompson P. УЗИ для выявления гемоторакса после травмы грудной клетки. Emerg Med J. 24 августа 2007 г. (8): 581-2. [Статья бесплатно PMC: PMC2660093] [PubMed: 17652688]
- 5.
Staub LJ, Biscaro RRM, Kaszubowski E, Maurici R. УЗИ грудной клетки для экстренной диагностики травматического пневмоторакса и гемоторакса: систематический обзор и мета- анализ. Рана. 2018 март;49(3):457-466. [PubMed: 29433802]
- 6.
Рахими-Мовагар В., Юсефифард М., Геличхани П., Байкпур М., Тафахори А., Асади Х., Фаридаалаи Г., Хоссейни М., Сафари С. Применение УЗИ и рентгенографии в обнаружении гемоторакс; Систематический обзор и метаанализ. Эмерг (Тегеран). 2016 Лето;4(3):116-26. [Бесплатная статья PMC: PMC4
4] [PubMed: 27299139] - 7.
Vafaei A, Hatamabadi HR, Heidary K, Alimohammadi H, Tarbiyat M. Диагностическая точность УЗИ и рентгенографии при начальной оценке пациентов с травмой грудной клетки. Эмерг (Тегеран).
 2016 Зима;4(1):29-33. [Бесплатная статья PMC: PMC4744611] [PubMed: 26862547]
2016 Зима;4(1):29-33. [Бесплатная статья PMC: PMC4744611] [PubMed: 26862547]- 8.
Broderick SR. Гемоторакс: этиология, диагностика и лечение. Клиника торакальной хирургии. 2013 Feb;23(1):89-96, vi-vii. [PubMed: 23206720]
- 9.
Boersma WG, Stigt JA, Smit HJ. Лечение гемоторакса. Респир Мед. 2010 ноябрь; 104 (11): 1583-7. [PubMed: 20817498]
- 10.
Гудман М., Льюис Дж., Гитрон Дж., Рид М., Приттс Т., Старнес С. Видеоторакоскопическая хирургия при острой травме грудной клетки. J Экстренный травматический шок. 2013 апр;6(2):106-9. [PMC free article: PMC3665056] [PubMed: 23723618]
- 11.
özdil A, Kavurmacı ö, Akçam Ti, Ergöl AG, UZE AGAN. следует игнорировать при тупой травме грудной клетки: анализ 181 пациента с двусторонним пневмотораксом. Ulus Travma Acil Cerrahi Derg. 2018 ноябрь;24(6):521-527. [PubMed: 30516250]
- 12.
Сирмали М., Тюрют Х., Топчу С.
 , Гюльхан Э., Язычи У., Кая С., Таштепе И. Всесторонний анализ травматических переломов ребер: заболеваемость, смертность и лечение. Eur J Cardiothorac Surg. 2003 г., июль; 24 (1): 133-8. [В паблике: 12853057]
, Гюльхан Э., Язычи У., Кая С., Таштепе И. Всесторонний анализ травматических переломов ребер: заболеваемость, смертность и лечение. Eur J Cardiothorac Surg. 2003 г., июль; 24 (1): 133-8. [В паблике: 12853057]- 13.
Ота К., Фумимото С., Иида Р., Катаока Т., Ота К., Танигути К., Ханаока Н., Такасу А. Массивный гемоторакс из-за двух источников кровотечения с легким механизмом травмы: отчет о болезни. J Med Case Rep. 07 октября 2018 г.; 12 (1): 291. [Бесплатная статья PMC: PMC6174063] [PubMed: 302]
- 14.
Морли Э.Дж., Джонсон С., Лейбнер Э., Шахид Дж. Оценка отделения неотложной помощи и лечение тупой травмы грудной клетки и легких (травма CME). Emerg Med Pract. 2016 июнь;18(6):1-20. [В паблике: 27177417]
- 15.
Чжоу Ю.П., Лин Х.Л., Ву Т.К. Видеоторакоскопические операции по поводу оставшегося гемоторакса при тупой травме грудной клетки. Curr Opin Pulm Med. 2015 июль; 21 (4): 393-8. [Бесплатная статья PMC: PMC5633323] [PubMed: 25978625]
- 16.

Скотт М.Ф., Ходавердян Р.А., Шахин Дж.Л., Ней А.Л., Найгаард Р.М. Предикторы хронического гемоторакса после травмы и влияние на результаты лечения пациентов. Eur J Trauma Emerg Surg. 2017 Апрель; 43 (2): 179-184. [PubMed: 26619854]
- 17.
Эджкомб Л., Сигмон Д.Ф., Галуска М.А., Ангус Л.Д. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 26 июля 2021 г. Травма грудной клетки. [PubMed: 30521264]
- 18.
Джейн А., Секуски А.Л., Бернс Б. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 28 июля 2021 г. Проникающая травма грудной клетки. [PubMed: 30571065]
- 19.
Ричардс Дж. Р., МакГахан Дж. П. Целенаправленная оценка с помощью сонографии при травмах (FAST) в 2017 г.: Чему могут научиться радиологи. Радиология. 2017 Апрель; 283 (1): 30-48. [В паблике: 28318439]
- 20.
Hyacinthe AC, Broux C, Francony G, Genty C, Bouzat P, Jacquot C, Albaladejo P, Ferretti GR, Bosson JL, Payen JF.
 Диагностическая точность УЗИ при неотложной оценке распространенных поражений грудной клетки после травмы. Грудь. 2012 май; 141(5):1177-1183. [PubMed: 22016490]
Диагностическая точность УЗИ при неотложной оценке распространенных поражений грудной клетки после травмы. Грудь. 2012 май; 141(5):1177-1183. [PubMed: 22016490]- 21.
Лихтенштейн Д. Новые подходы к УЗИ легких и плевральной полости: где мы сейчас? Дыши (Шефф). 2017 июнь; 13 (2): 100-111. [Бесплатная статья PMC: PMC5467658] [PubMed: 28620429]
- 22.
Лихтенштейн Д.А. BLUE-протокол и FALLS-протокол: два применения УЗИ легких у тяжелобольных. Грудь. 2015 июнь; 147 (6): 1659-1670. [PubMed: 26033127]
- 23.
Зелескевич Л., Фреско Р., Дюкло Г., Антонини Ф., Матье С., Медам С., Винье С., Порье М., Рош П.Х., Бузат П., Кербаул Ф., Шемама У., Беж Т., Томас П.А., Флечер X, Хаммад Э., Леоне М. Интеграция расширенной целенаправленной оценки с сонографией при травмах (eFAST) при начальной оценке тяжелой травмы: влияние на ведение 756 пациентов. Рана. 2018 окт;49(10): 1774-1780. [PubMed: 30017184]
- 24.
Сони Н.
 Дж., Франко Р., Велес М.И., Шнобрих Д., Дансел Р., Рестрепо М.И., Майо П.Х. Ультразвук в диагностике и лечении плевральных выпотов. Дж Хосп Мед. 2015 Декабрь; 10 (12): 811-6. [Бесплатная статья PMC: PMC4715558] [PubMed: 26218493]
Дж., Франко Р., Велес М.И., Шнобрих Д., Дансел Р., Рестрепо М.И., Майо П.Х. Ультразвук в диагностике и лечении плевральных выпотов. Дж Хосп Мед. 2015 Декабрь; 10 (12): 811-6. [Бесплатная статья PMC: PMC4715558] [PubMed: 26218493]- 25.
Ибитое Б.О., Идову Б.М., Огунромби А.Б., Афолаби Б.И. Ультрасонографическая количественная оценка плеврального выпота: сравнение четырех формул. Ультразвуковое исследование. 2018 июль; 37 (3): 254-260. [Бесплатная статья PMC: PMC6044225] [PubMed: 2
64]- 26.
Деннис Б.М., Гондек С.П., Гайер Р.А., Хамблин С.Е., Гюнтер О.Л., Гийомондеги О.Д. Использование доказательного алгоритма у пациентов с травматическим гемотораксом снижает потребность в дополнительных вмешательствах. J Травма неотложной помощи Surg. 2017 Апрель; 82 (4): 728-732. [PubMed: 28099387]
- 27.
Глисон Т., Блехар Д. Ультразвуковое исследование при травмах. Семин УЗИ КТ МР. 2018 авг; 39 (4): 374-383. [PubMed: 30070230]
- 28.

Tian Y, Zheng W, Zha N, Wang Y, Huang S, Guo Z. Торакоскопическая декортикация для лечения защемления легкого, вызванного 14-летним пневмотораксом: история болезни. Рак грудной клетки. 2018 авг;9(8):1074-1077. [Бесплатная статья PMC: PMC6068443] [PubMed: 29802756]
- 29.
Bunn T, Singleton M, Chen IC. Использование нескольких источников данных для выявления конкретных наркотиков и других факторов, связанных со скринингом на наркотики и алкоголь водителей транспортных средств со смертельными травмами. Несчастный анал Пред. 2019Январь; 122:287-294. [PubMed: 30396030]
- 30.
Zhu M, Li Y, Wang Y. Разработка и экспериментальная проверка новой структуры анализа для распознавания моделей травм водителей: с точки зрения многоклассовой классификации. Несчастный анал Пред. 2018 ноябрь;120:152-164. [PubMed: 30138770]
- 31.
Морган Э. Дилеммы вождения: Руководство по оценке вождения в первичной медико-санитарной помощи.
 Клин Гериатр Мед. 2018 фев; 34(1):107-115. [PubMed: 2
Клин Гериатр Мед. 2018 фев; 34(1):107-115. [PubMed: 210]
- 32.
Экола Л., Поппер С.В., Силберглитт Р., Фрааде-Бланар Л. Дорога к нулю: концепция достижения нулевого уровня смертности на дорогах к 2050 году. Rand Health Q. 2018 Oct;8(2):11. [Бесплатная статья PMC: PMC6183773] [PubMed: 30323994]
- 33.
Han GM, Newmyer A, Qu M. Использование ремней безопасности для экономии денег: влияние на больничные расходы пассажиров, попавших в автомобильные аварии. Int Emerg Нурс. 2017 март; 31:2-8. [PubMed: 27177737]
- 34.
Чунг М.Х., Сяо С.И., Нянь Н.С., Чен Ю.С., Ван С.И., Вэнь Ю.С., Ши Х.К., Йен Д.Х. Преимущество ультразвука при выборе между трубной торакостомией и наблюдательным лечением гемоторакса в результате тупой травмы грудной клетки. Мир J Surg. 2018 июль;42(7):2054-2060. [PubMed: 29305713]
- 35.
Карвер Д.А., Брессан А.К., Шиман С., Грондин С.К., Киркпатрик А.В., Лалл Р., Макбет П.
 Б., Данэм М.Б., Болл К.Г. Лечение гемоторакса при тупой травме грудной клетки: протокол исследования для рандомизированного контролируемого исследования. Открытый БМЖ. 2018 03 марта; 8 (3): e020378. [Бесплатная статья PMC: PMC5855202] [PubMed: 29
Б., Данэм М.Б., Болл К.Г. Лечение гемоторакса при тупой травме грудной клетки: протокол исследования для рандомизированного контролируемого исследования. Открытый БМЖ. 2018 03 марта; 8 (3): e020378. [Бесплатная статья PMC: PMC5855202] [PubMed: 29Редакторы loading…
Категории loading… ) источник. Обычно это журнальная статья, в которой информация была впервые изложена. В большинстве случаев статьи Physiopedia являются вторичным источником и поэтому не должны использоваться в качестве ссылок. Статьи из Physiopedia лучше всего использовать для поиска первоисточников информации (см. список литературы внизу статьи).
Если вы считаете, что эта статья Physiopedia является основным источником информации, на которую вы ссылаетесь, вы можете использовать кнопку ниже, чтобы получить доступ к соответствующему заявлению о цитировании.
Перейти к:навигация, поиск
Оригинальный редактор — Клэр Нотт Лучшие участники — Nina Myburg , Клэр Нотт , Ким Джексон , Vidya Acharya , AMAMVEL AMAMSL84
Содержание
- 1 Введение
- 2 Патофизиология
- 3 Этиология
- 4 Клиническая картина
- 5 Процедуры диагностики
- 6 Медицинский менеджмент
- 7 Физиотерапевтическое управление
- 8 Дифференциальная диагностика
- 9 Каталожные номера
Массивный правосторонний плевральный выпот, который позже оказался гемотораксом
Термин гемоторакс можно определить как попадание плевральной жидкости и крови в плевральную полость.
 Для постановки диагноза гемоторакс необходима плевральная жидкость с гематокритом 25-50% крови больного. [1]
Для постановки диагноза гемоторакс необходима плевральная жидкость с гематокритом 25-50% крови больного. [1] Плевра состоит из двух слоев. Одна из них покрывает поверхность легкого (висцеральная плевра), а другая — внутреннюю часть грудной стенки (париетальная плевра). (Для получения более подробной информации об анатомии легких). Эти слои плевры слипаются друг с другом, чтобы предотвратить коллапс легкого даже при выдохе воздуха из легкого. Если воздух или жидкость попадает в плевральную полость между этими слоями плевры, это вызывает коллапс легкого из-за его эластической отдачи. Если в плевральную полость попадает только воздух, возникает пневмоторакс. Попадание жидкости или крови в плевральную полость может вызвать плевральный выпот или гемоторакс. [2]
Основной причиной гемоторакса является острая или тупая травма грудной клетки. Ятрогенный или спонтанный гемоторакс встречается реже. Ятрогенный гемоторакс чаще всего возникает как осложнение сердечно-легочной хирургии, установки подключичных или яремных катетеров или биопсии легкого и плевры.
 [1] [3] Спонтанный гемоторакс обычно вызывается разрывом плевральных спаек, новообразованиями, плевральными метастазами и является осложнением антикоагулянтной терапии легочной эмболии. [4]
[1] [3] Спонтанный гемоторакс обычно вызывается разрывом плевральных спаек, новообразованиями, плевральными метастазами и является осложнением антикоагулянтной терапии легочной эмболии. [4] - Боль в груди
- Одышка
- Лихорадка
- Тахикардия
- Ослабление дыхательных шумов на пораженной стороне
- Бледность
- Холодный пот
- Рентген грудной клетки
- УЗИ
- КТ
- МРТ-сканирование
Первоначальное лечение в большинстве случаев заключается в дренировании плевральной полости, при этом большая трубка является адекватным начальным подходом, если только не подозревается расслоение или разрыв аорты. [3] (для получения дополнительной информации о плевральной дренажной системе). После выполнения трубной торакостомии следует повторить рентгенологическое исследование органов грудной клетки, чтобы определить положение дренажной трубки, выявить другую внутригрудную патологию и убедиться, что скопление крови в плевральной полости было полностью дренировано.
 [4] [2] Плевральный выпот и оценка симптомов (ПОЖАЛУЙСТА) Результаты исследования показывают уменьшение одышки и снижение толерантности к физической нагрузке у большинства пациентов с симптоматическим плевральным выпотом после дренирования [5] .
[4] [2] Плевральный выпот и оценка симптомов (ПОЖАЛУЙСТА) Результаты исследования показывают уменьшение одышки и снижение толерантности к физической нагрузке у большинства пациентов с симптоматическим плевральным выпотом после дренирования [5] .Иногда может использоваться хирургическое исследование. Это может быть показано при кровопотере через дренаж более 1500 мл за 24 часа или 200 мл в час в течение нескольких часов подряд и необходимости повторных переливаний крови для поддержания гемодинамической стабильности. [6] [7] [8] Пациентам с активной кровопотерей, но стабильной гемодинамикой может быть назначена видеоторакоскопическая хирургия (VATS). Это может быть использовано для остановки кровотечения, а также для эвакуации тромбов и разрушения спаек. Торакотомия является процедурой выбора для хирургического исследования органов грудной клетки при наличии массивного гемоторакса или постоянного кровотечения.
 [2]
[2] Нет опубликованных данных о физиотерапевтическом лечении пациентов с пневмотораксом или гемотораксом.
Следующие рекомендации можно рассматривать как рекомендации по ведению больных с гемотораксом:
- Клиническая картина пациента должна побудить физиотерапевта принять решение о подходящем лечении.
- Если у пациента установлена плевральная дренажная трубка и межреберный дренаж, лечение может отличаться от того, когда пациент перенес операцию.
- Помогает улучшить вентиляцию легких, оксигенацию и повторно раздуть ателектатические участки легких. Это можно сделать с помощью упражнений на глубокое дыхание.
- Помогает улучшить переносимость физических нагрузок и подвижность пациента. Это можно сделать, помогая мобилизационными или общеукрепляющими упражнениями.
- Помогите сохранить чистоту дыхательных путей. Это можно сделать, показав пациенту техники откашливания, помогающие избавиться от любых выделений.

С помощью визуализации диагноз пневмоторакса необходимо исключить. Также можно проверить гематокрит жидкости из плевральной полости, чтобы определить, можно ли диагностировать плевральный выпот или гемоторакс.
- ↑ 1.0 1.1 Патрини Д., Панайотопулос Н., Парараджасингам Дж., Гвинианидзе Л., Икбал Ю., Лоуренс Д.Р. Этиология и лечение спонтанного гемоторакса. Журнал торакальной болезни. 2015 март;7(3):520.
- ↑ 2.0 2.1 2.2 Бурсма В.Г., Стигт Дж.А., Смит Х.Дж. Лечение гемоторакса. Респираторная медицина. 2010 1 ноября; 104 (11): 1583-7.
- ↑ 3.0 3.1 Yeam I, Sassoon C. Гемоторакс и хилоторакс. Curr Opin Pulm Med 1997;3:310e4.
- ↑ 4.0 4.1 Бауманн М.Х., Стрэндж С., Хеффнер Дж.Э., Лайт Р., Кирби Т.Дж., Кляйн Дж., Лукетич Дж.Д., Паначек Э.А., Сан С.А. Консенсусная группа AACP по пневмотораксу. Ведение спонтанного пневмоторакса: консенсусное заявление Американского колледжа торакальных врачей Delphi.
 Сундук 2001 г., февраль; 119 (2): 590e602.
Сундук 2001 г., февраль; 119 (2): 590e602. - ↑ Муруганандан С., Аззопарди М., Томас Р., Фитцджеральд Д.Б., Куок Ю.Дж., Чеа Х.М., Рид К.А., Баджен К.А., Иствуд П.Р., Дженкинс С., Сингх Б. Исследование плеврального выпота и оценки симптомов (ПОЖАЛУЙСТА) одышки у пациентов с симптоматический плеврит. Европейский респираторный журнал. 2020 1 января.
- ↑ Ali HA, Lippmann M, Mundathaje U, Khaleeq G. Спонтанный гемоторакс: всесторонний обзор. Сундук 2008;134:1056e65.
- ↑ Liu D-W, Liu H-P, Lin PJ и др. Видеоассистированная торакальная хирургия в лечении травм грудной клетки. J Trauma 1997;42:670e4.
- ↑ Lowdermilk GA, Naunheim KS. Торакоскопическая оценка и лечение травм грудной клетки. Surg Clin North Am 2000; 80: 1535e42.
Осложнение, которое следует учитывать: отсроченный травматический гемоторакс у пожилых людей
Текст статьи
Меню статьи
- Статья
Текст - Артикул
информация - Цитата
Инструменты - Поделиться
- Быстрое реагирование
- Артикул
метрика - Оповещения
PDF
Краткий отчет
Осложнение, которое следует учитывать: отсроченный травматический гемоторакс у пожилых людей
- http://orcid.
 org/0000-0003-1639-8781Джефф Чой1,
org/0000-0003-1639-8781Джефф Чой1, - http://orcid.org/0000-0001-9927-2417Анания Ананд1,
- Кэтрин Д. Сборов2,
- Уильям Уолтон2,
- 1 Lawrence Chow4,
- Oscar Guillamondegui5,
- Bradley M Dennis5,
- David Spain1,
- Kristan Staudenmayer1
- 1 Surgery, Stanford University, Stanford, California, USA
- 2 Vanderbilt University Школа медицины, Нэшвилл, Теннесси, США
- 3 Радиологии, Медицинский центр Университета Вандербильта, Нэшвилл, Теннесси, США
- 4 Радиология, Стэнфордский университет, Стэнфорд, Калифорния, USA
- 5
- 024. Центр, Нэшвилл, Теннесси, США
- Переписка с доктором Джеффом Чоем; jc2226{at}stanford.edu
Abstract
Исходная информация Появляющиеся данные свидетельствуют о том, что пожилые люди могут испытывать тонкий гемоторакс, который прогрессирует в течение нескольких дней.
 Отсроченное прогрессирование и отсроченное развитие травматического гемоторакса (dHTX) не были хорошо охарактеризованы. Мы предположили, что dHTX будет нечастым, но связанным с факторами, которые могут помочь в прогнозировании.
Отсроченное прогрессирование и отсроченное развитие травматического гемоторакса (dHTX) не были хорошо охарактеризованы. Мы предположили, что dHTX будет нечастым, но связанным с факторами, которые могут помочь в прогнозировании.Методы Мы провели ретроспективный обзор взрослых в возрасте ≥50 лет с диагнозом dHTX после переломов ребер в двух травматологических центрах уровня 1 (с марта 2018 г. по сентябрь 2019 г.). dHTX был определен как HTX, обнаруженный через ≥48 часов после госпитализации. КТ грудной клетки показала либо отсутствие, либо «минимальный/следовый» HTX. Два ослепленных сертифицированных радиолога рассмотрели изображения грудной клетки в стационаре и классифицировали характер повреждений в соответствии с таксономией Общества травм грудной клетки (CWIS). Описательный анализ был проведен для демографических характеристик и характеристик госпитализации.
Результаты Мы определили 14 пациентов с объединенной частотой dHTX 1,3%.
 После первоначальной КТ грудной клетки, отрицательной в отношении гемоторакса, пациенты не подвергались последующей визуализации до тех пор, пока не развились новые симптомы (одышка, боль в груди): восемь (57%) не были диагностированы до выписки из первичной госпитализации (среднее значение (диапазон) : 9 (2–20) дней после выписки). Аспирин и/или антикоагулянты применялись менее чем в половине случаев (43%). Согласно таксономии CWIS, у всех пациентов была серия заднелатеральных переломов с по крайней мере одним смещением или переломом со смещением и в среднем шесть последовательных переломов ребер. Всем пациентам была выполнена трубчатая торакостомия, а шести пациентам (42%) — все в возрасте до 65 лет — были проведены оперативные вмешательства.
После первоначальной КТ грудной клетки, отрицательной в отношении гемоторакса, пациенты не подвергались последующей визуализации до тех пор, пока не развились новые симптомы (одышка, боль в груди): восемь (57%) не были диагностированы до выписки из первичной госпитализации (среднее значение (диапазон) : 9 (2–20) дней после выписки). Аспирин и/или антикоагулянты применялись менее чем в половине случаев (43%). Согласно таксономии CWIS, у всех пациентов была серия заднелатеральных переломов с по крайней мере одним смещением или переломом со смещением и в среднем шесть последовательных переломов ребер. Всем пациентам была выполнена трубчатая торакостомия, а шести пациентам (42%) — все в возрасте до 65 лет — были проведены оперативные вмешательства.Обсуждение Предварительные данные свидетельствуют о том, что пожилые люди с переломами ребер могут иметь риск замедленного прогрессирования гемоторакса или отсроченного проявления гемоторакса. Вероятна бессимптомная прогрессия или повторная госпитализация в другие службы/больницы, а истинные показатели dHTX, вероятно, выше.
 Наши предварительные результаты предполагают возможное анатомическое объяснение связи тяжелых травм грудной клетки с dHTX. Дальнейшая характеристика и выявление истинной заболеваемости dHTX в первую очередь требует более широкого признания этого осложнения.
Наши предварительные результаты предполагают возможное анатомическое объяснение связи тяжелых травм грудной клетки с dHTX. Дальнейшая характеристика и выявление истинной заболеваемости dHTX в первую очередь требует более широкого признания этого осложнения.- гемоторакс
- гериатрия
- переломы ребер
- фактор риска
http://creativecommons.org/licenses/by-nc/4.0/
Некоммерческая (CC BY-NC 4.0) лицензия, которая позволяет другим распространять, ремикшировать, адаптировать, использовать эту работу в некоммерческих целях и лицензировать свои производные работы на других условиях, при условии, что оригинальная работа правильно процитирована, и указана соответствующая ссылка. , указаны любые внесенные изменения, а использование является некоммерческим. См.: http://creativecommons.org/licenses/by-nc/4.0/.
http://dx.doi.org/10.1136/tsaco-2020-000626
Статистика с сайта Altmetric.com
Запрос разрешений
направит вас к службе RightsLink Центра защиты авторских прав.
 Вы сможете получить быструю цену и мгновенное разрешение на повторное использование контента различными способами.
Вы сможете получить быструю цену и мгновенное разрешение на повторное использование контента различными способами.- гемоторакс
- гериатрия
- переломы ребер
- фактор риска
Введение
Бремя травматических переломов ребер у пожилых пациентов хорошо известно. Гемоторакс (HTX) является частым сопутствующим повреждением с переломами ребер и обычно диагностируется во время поступления: очень небольшой гемоторакс редко требует вмешательства, тогда как более крупный гемоторакс часто требует немедленного дренирования. Тем не менее, новые данные свидетельствуют о том, что при ГТ у пожилых людей с переломами ребер может наблюдаться малозаметный гемоторакс, прогрессирующий с задержкой в течение нескольких дней.1, 2 Если это правда, пожилые люди могут подвергаться риску развития эмпиемы или других осложнений без тщательного наблюдения.
Отсроченное прогрессирование и отсроченное развитие травматического гемоторакса (dHTX) не были хорошо описаны в литературе.
 Старение населения США и растущая частота переломов ребер среди пожилых людей подчеркивают острую потребность в лучшем понимании.3 В этом предварительном исследовании изучались пожилые люди с dHTX после перенесенных переломов ребер, чтобы определить направление будущих исследований. Мы предположили, что dHTX будет нечастым, но связанным с факторами, которые могут помочь в идентификации.
Старение населения США и растущая частота переломов ребер среди пожилых людей подчеркивают острую потребность в лучшем понимании.3 В этом предварительном исследовании изучались пожилые люди с dHTX после перенесенных переломов ребер, чтобы определить направление будущих исследований. Мы предположили, что dHTX будет нечастым, но связанным с факторами, которые могут помочь в идентификации.Методы
Исследуемая популяция
Мы ретроспективно проанализировали взрослых в возрасте ≥50 лет с диагнозом dHTX после переломов ребер в двух травматологических центрах уровня 1 в период с марта 2018 г. по сентябрь 2019 г. Мы определили dHTX как обнаружение dHTX через ≥48 часов после поступления КТ грудной клетки показала либо нет, либо «минимальный/следовый» HTX. Мы идентифицировали пациентов, запросив реестры травм обоих центров и электронные медицинские карты пациентов в возрасте ≥50 лет с переломами ребер и dHTX, диагностированными во время первичной госпитализации или при повторной госпитализации.

Переменные
Мы сообщаем характеристики пациента (возраст, пол, индекс массы тела, статус курения, индекс сопутствующих заболеваний Чарлсона, прием аспирина/антиагрегантов/антикоагулянтов в течение 7 дней после травмы), характеристики травмы (механизм травмы, количество переломов ребер, признаки повреждения паренхимы легкого) и характеристики госпитализации (длительность пребывания в больнице (LOS), вмешательства и повторные госпитализации).
Подробная характеристика переломов ребер
Два слепых сертифицированных рентгенолога просмотрели все стационарные рентгенограммы грудной клетки и компьютерную томографию; изображения каждого пациента были проанализированы одним из двух рентгенологов. Паттерны переломов ребер были охарактеризованы в соответствии с таксономией Общества травм грудной клетки (CWIS).4 Таксономия CWIS была установлена международной экспертной группой Delphi и классифицирует переломы ребер на основе степени смещения (без смещения, со смещением (<9).
 0% кортикального контакта), со смещением (кортикальный контакт отсутствует)), тип перелома (простой, клиновидный, сложный), переломы соседних ребер (серия, а не серия) и расположение грудной стенки (передняя, боковая, задняя, реберная). В дополнение к переломам ребер мы также отметили рентгенологические повреждения легких (эмфизема мягких тканей грудной клетки, разрыв или ушиб легкого, пневмоторакс).
0% кортикального контакта), со смещением (кортикальный контакт отсутствует)), тип перелома (простой, клиновидный, сложный), переломы соседних ребер (серия, а не серия) и расположение грудной стенки (передняя, боковая, задняя, реберная). В дополнение к переломам ребер мы также отметили рентгенологические повреждения легких (эмфизема мягких тканей грудной клетки, разрыв или ушиб легкого, пневмоторакс).Результаты
Характеристики пациентов
Мы определили 14 пожилых людей, которые перенесли дГТ после переломов ребер, при этом общая частота развития дГТ составила 1,3%. Пять пациентов (36%) имели отсроченное прогрессирование следа ГТ и девять (64%) имели отсроченное развитие ГТ после отрицательного результата КТ. Средний возраст составил 72 года, 86% (n=12) были мужчинами (таблица 1). В общей сложности 57% пациентов не принимали препараты для разжижения крови в течение недели до травмы; среди тех, кто был, аспирин был наиболее распространенным лекарством (n = 4, 29%).
 Пациентам был назначен низкомолекулярный гепарин для стационарной химиопрофилактики венозной тромбоэмболии. Все пациенты в возрасте ≥65 лет пострадали от падения с уровня земли, что является наиболее частым механизмом травмы (n = 6, 43%), тогда как у пациентов моложе 65 лет были травмы с большей силой. Дополнительные онлайн-данные детализируют индивидуальные характеристики пациентов.
Пациентам был назначен низкомолекулярный гепарин для стационарной химиопрофилактики венозной тромбоэмболии. Все пациенты в возрасте ≥65 лет пострадали от падения с уровня земли, что является наиболее частым механизмом травмы (n = 6, 43%), тогда как у пациентов моложе 65 лет были травмы с большей силой. Дополнительные онлайн-данные детализируют индивидуальные характеристики пациентов.Таблица 1
Характеристика пациентов в возрасте ≥50 лет с диагнозом замедленного прогрессирования гемоторакса после переломов ребер в двух учреждениях
Рентгенологические характеристики
Всем пациентам при поступлении выполняли КТ органов грудной клетки. Шесть пациентов (43%) имели сопутствующее повреждение легких. Среднее количество переломов ребер составило 5,8, у четырех пациентов (29%) грудная клетка была вялой. Согласно таксономии CWIS, у всех пациентов была серия переломов, в среднем 5,6 последовательных переломов ребер. Только у трех пациентов было менее четырех последовательных переломов ребер: у этих пациентов было два последовательных перелома со смещением или с полным смещением.
 У всех пациентов был как минимум один перелом со смещением или со смещением, в среднем 3,5 перелома со смещением или со смещением. У всех пациентов были заднебоковые переломы и следующая картина переломов между 6-м и 10-м ребрами: серия заднебоковых переломов с по крайней мере одним переломом со смещением или со смещением.
У всех пациентов был как минимум один перелом со смещением или со смещением, в среднем 3,5 перелома со смещением или со смещением. У всех пациентов были заднебоковые переломы и следующая картина переломов между 6-м и 10-м ребрами: серия заднебоковых переломов с по крайней мере одним переломом со смещением или со смещением.Характеристики госпитализации
У шести пациентов (43%) был диагностирован dHTX во время первичной госпитализации, но у восьми (57%) диагноз не был поставлен до повторной госпитализации. Диагноз dHTX был поставлен пациентам после появления одышки или боли в груди, вызванных повторной визуализацией. Отсроченный гемоторакс, обнаруженный при первичной госпитализации, был диагностирован в среднем через 5,3 дня (диапазон 3–8 дней) после поступления; dHTX, обнаруженный при повторной госпитализации, был диагностирован в среднем через 9,3 дня (диапазон 2–20 дней) после выписки из первичной госпитализации. Из девяти пациентов с профилями коагуляции, отправленными в день постановки диагноза dHTX, шесть имели нормальные значения; у трех пациентов были слегка повышены международные нормализованные отношения (1,3–1,5).
 В общей сложности семь пациентов получили переливание крови.
В общей сложности семь пациентов получили переливание крови.Пациенты, которые в конечном итоге были повторно госпитализированы, имели более короткую начальную госпитальную продолжительность пребывания в стационаре по сравнению с теми, кто не был повторно госпитализирован (в среднем 6,3 против 18,5 дней). Повторно госпитализированные пациенты имели одинаковую ПН при первичной госпитализации (6,3 ± 1,6 дня) и при повторной госпитализации (6,9 ± 1,0 дня). Всем пациентам была выполнена трубчатая торакостомия по поводу dHTX, а шести пациентам (42%) — все моложе 65 лет — были проведены оперативные вмешательства, когда HTX сохранялась, несмотря на трубчатую торакостомию. Ни у одного пациента не было эмпиемы.
Обсуждение
Наше предварительное исследование предполагает, что пожилые люди с переломами ребер могут подвергаться риску замедленного прогрессирования следового гемоторакса или замедленного развития гемоторакса. Что касается гемоторакса, то он не был очевиден при первоначальной визуализации, рутинная последующая визуализация не проводилась, а повторная визуализация проводилась только при появлении симптомов (у многих пациентов после выписки, что требовало длительных повторных госпитализаций).
 Запоздалое распознавание гемоторакса иногда требовало хирургического дренирования и декортикации. Пациенты в возрасте 50–64 лет с dHTX перенесли травму с более высокой силой и нуждались в оперативном вмешательстве, что потенциально отличается от фенотипа пациентов старше 65 лет, которые испытали падения с уровня земли и которым была проведена трубчатая торакостомия.
Запоздалое распознавание гемоторакса иногда требовало хирургического дренирования и декортикации. Пациенты в возрасте 50–64 лет с dHTX перенесли травму с более высокой силой и нуждались в оперативном вмешательстве, что потенциально отличается от фенотипа пациентов старше 65 лет, которые испытали падения с уровня земли и которым была проведена трубчатая торакостомия.Пожилые люди с dHTX имели признаки серьезного повреждения грудной клетки с ≥4 последовательными переломами или двумя переломами со смещением. Распространенной картиной травмы была серия заднебоковых переломов со смещением или со смещением между 6-м и 10-м ребрами. Анатомия грудной клетки объясняет, почему этот тип травмы может быть связан с dHTX. По сравнению с переломами без смещения, переломы со смещением или со смещением могут с большей вероятностью разрушить межреберные сосуды при продолжении дыхания, вызывая либо отсроченное повреждение, либо разрыв сгустка. 6-10 ребра также являются самыми крупными ребрами, связаны с более длинными межреберными артериями и имеют большую костную массу, чтобы разрушить нижележащие сосуды.
 большее движение во время дыхания может представлять больший риск повреждения нижележащих межреберных артерий с течением времени. Физиологическое значение сомнительно, но заднелатеральные межреберные артерии получают кровь из аорты и крупнее передних межреберных артерий, ответвляющихся от внутренних грудных артерий. Кроме того, скорость кровотока выше в нижних межреберных артериях (шестой и каудальной)7, 9.0005
большее движение во время дыхания может представлять больший риск повреждения нижележащих межреберных артерий с течением времени. Физиологическое значение сомнительно, но заднелатеральные межреберные артерии получают кровь из аорты и крупнее передних межреберных артерий, ответвляющихся от внутренних грудных артерий. Кроме того, скорость кровотока выше в нижних межреберных артериях (шестой и каудальной)7, 9.0005Отсроченная травматическая HTX после переломов ребер у пожилых людей может быть неуловимым осложнением, которое требует более широкого признания. Это осложнение было выявлено в амбулаторных условиях, но, насколько нам известно, его еще предстоит охарактеризовать в стационарных условиях. быть в игре. Пациенты могут иметь обнадеживающую КТ грудной клетки при поступлении даже без скудного гемоторакса, но накапливать значительный гемоторакс, который требует длительных повторных госпитализаций или оперативных вмешательств. Все пациенты, которые в конечном итоге были повторно госпитализированы, были выписаны домой после более короткой первоначальной госпитализации и проявляли симптомы в течение 20 дней после выписки — пожилые люди могут со временем накапливать гемоторакс.
 Отсроченное обнаружение затрудняет лечение гемоторакса с помощью трубчатой торакостомии, потому что старая кровь может образовывать сгустки или служить очагом эмпиемы. Если dHTX прогрессирует бессимптомно, выявление факторов риска, таких как типичная картина перелома ребер, может иметь решающее значение для упреждающего выявления пациентов с высоким риском. Чтобы смягчить предотвратимые повторные госпитализации и операции, у пациентов с высоким риском может потребоваться целенаправленная последующая визуализация даже при отсутствии клинических симптомов.
Отсроченное обнаружение затрудняет лечение гемоторакса с помощью трубчатой торакостомии, потому что старая кровь может образовывать сгустки или служить очагом эмпиемы. Если dHTX прогрессирует бессимптомно, выявление факторов риска, таких как типичная картина перелома ребер, может иметь решающее значение для упреждающего выявления пациентов с высоким риском. Чтобы смягчить предотвратимые повторные госпитализации и операции, у пациентов с высоким риском может потребоваться целенаправленная последующая визуализация даже при отсутствии клинических симптомов.Наше исследование предлагает предварительные результаты для направления будущих исследований и имеет несколько ограничений. Мы оценили несколько пациентов и не можем установить заболеваемость dHTX. Это предварительное исследование было основано на случайных наблюдениях в двух травматологических центрах уровня 1, чтобы привлечь внимание к малоизученному и плохо изученному осложнению среди пожилых людей, госпитализированных с переломами ребер.
 Во-вторых, в нашем исследовании были выявлены только те пациенты, которые были повторно госпитализированы в наши собственные травматологические центры. Пациенты могли обратиться с dHTX в другие больницы после выписки. Кроме того, в обоих травматологических центрах наблюдается большое количество пациентов с переломами ребер, и наши методы лечения могут не отражать таковые в центрах без травм или в травматологических центрах с меньшим объемом. В-третьих, у нас нет окончательного физиологического объяснения того, почему у пожилых людей может наблюдаться задержка прогрессирования или развития гемоторакса. Насколько нам известно, не существует физиологической модели, подтверждающей нашу анатомическую гипотезу о том, что dHTX накапливается из-за смещенных ребер, разрушая нижележащие межреберные артерии во время дыхательных движений грудной клетки. Физиологическое моделирование, вероятно, нецелесообразно, но более широкое признание этого осложнения может облегчить проверку факторов риска с помощью мультиинституциональных оценок в будущем.
Во-вторых, в нашем исследовании были выявлены только те пациенты, которые были повторно госпитализированы в наши собственные травматологические центры. Пациенты могли обратиться с dHTX в другие больницы после выписки. Кроме того, в обоих травматологических центрах наблюдается большое количество пациентов с переломами ребер, и наши методы лечения могут не отражать таковые в центрах без травм или в травматологических центрах с меньшим объемом. В-третьих, у нас нет окончательного физиологического объяснения того, почему у пожилых людей может наблюдаться задержка прогрессирования или развития гемоторакса. Насколько нам известно, не существует физиологической модели, подтверждающей нашу анатомическую гипотезу о том, что dHTX накапливается из-за смещенных ребер, разрушая нижележащие межреберные артерии во время дыхательных движений грудной клетки. Физиологическое моделирование, вероятно, нецелесообразно, но более широкое признание этого осложнения может облегчить проверку факторов риска с помощью мультиинституциональных оценок в будущем.
Для смягчения последствий dHTX требуется более масштабное исследование, чтобы лучше понять распространенность и подтвердить предполагаемые факторы риска. Исследование «случай-контроль» для дальнейшей оценки потенциальных факторов риска для dHTX может быть полезным, но оно, вероятно, будет страдать от систематической ошибки проверки. Необходимо проспективное когортное исследование для оценки характера травм и механизмов, которые предвещают повышенный риск dHTX. Также следует изучить взаимосвязь между dHTX и использованием разбавителей крови в домашних условиях или дозировкой для профилактики венозной тромбоэмболии, количественной оценкой объемов HTX при КТ грудной клетки для руководства и ролью хирургической стабилизации смещенных переломов ребер для снижения риска dHTX. Анализ «затраты-эффективность» может определить сроки и метод целевой последующей визуализации у бессимптомных пациентов.
Заключение
Отсроченное прогрессирование и отсроченное развитие HTX у пожилых людей с переломами ребер требуют более широкого признания.
 Запоздалая диагностика HTX может быть связана с повторными госпитализациями и увеличением вмешательств. Полный объем и последствия dHTX требуют проспективного изучения для дальнейшей характеристики.
Запоздалая диагностика HTX может быть связана с повторными госпитализациями и увеличением вмешательств. Полный объем и последствия dHTX требуют проспективного изучения для дальнейшей характеристики.Благодарности
Мы благодарим Denise Greci, RN, MS, за помощь в сборе данных реестра.
Ссылки
- ↵
- Plourde M,
- Emond M,
- Lavoie A,
- Guimont C,
- Le Sage N,
- CHAUNY J-M,
- Bergeron ERIC,
- Vanier L,
- 111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111 Буле Н. и др.
. Когортное исследование распространенности и факторов риска отсроченных легочных осложнений у взрослых после легкой тупой травмы грудной клетки. CJEM 2014;16:136–43.doi:10.2310/8000.2013.131043pmid:http://www.ncbi.nlm.nih.gov/pubmed/24626118
- ↵
- Émond M,
- Sirois M-J,
- Guimont C,
- Chauny J-M,
- Daoust R,
- Bergeron Éric,
- Vanier L,
- Camden S,
- Le Sage N
.
 Функциональное влияние легкой травмы грудной клетки: исследование возраста, отсроченный гемоторакс и последствия перелома ребер. Ann Surg 2015;262:1115–22.doi:10.1097/SLA.0000000000000952pmid:http://www.ncbi.nlm.nih.gov/pubmed/25243544
Функциональное влияние легкой травмы грудной клетки: исследование возраста, отсроченный гемоторакс и последствия перелома ребер. Ann Surg 2015;262:1115–22.doi:10.1097/SLA.0000000000000952pmid:http://www.ncbi.nlm.nih.gov/pubmed/25243544 - ↵
- Baidwan NK,
- Naranje SM
. Эпидемиология и последние тенденции гериатрических переломов, поступающих в отделение неотложной помощи населения США с 2004 по 2014 год. Public Health 2017;142:64–9.doi:10.1016/j.puhe.2016.10.018pmid:http://www.ncbi.nlm.nih.gov/pubmed/28057200
- ↵
- 11 JG ,
- Кларк П,
- Пьераччи FM,
- Бемельман М,
- Black EA,
- Doben A,
- Gasparri M,
- Gross R,
- Jun W,
- Long WB и др.
. Таксономия множественных переломов ребер: результаты международного консенсусного опроса Общества травм грудной клетки.
 J Trauma Acute Care Surg 2020;88:e40–5.doi:10.1097/TA.0000000000002282pmid:http://www.ncbi.nlm.nih.gov/pubmed/315
J Trauma Acute Care Surg 2020;88:e40–5.doi:10.1097/TA.0000000000002282pmid:http://www.ncbi.nlm.nih.gov/pubmed/315 - ↵ 12
- Graber
- Назим М
. Анатомия ребер и грудины и их связь со структурой и функцией грудной клетки. Thorac Surg Clin 2007;17:473–89.doi:10.1016/j.thorsurg.2006.12.010pmid:http://www.ncbi.nlm.nih.gov/pubmed/18271162
- ↵
- 0 Kuhlman ДР,
- Худер С.А.,
- Пер. РД
. Факторы, влияющие на диаметр передней и задней межреберных артерий человека. Клин Анат 2015;28:219–26.doi:10.1002/ca.22460pmid:http://www.ncbi.nlm.nih.gov/pubmed/25220637
- ↵
- Koyanagi T,
- Kawaharada N, 1221 Kawaharada N, 1
- 2
- Ито Т,
- Баба Т,
- Накамура М,
- Ватанэбе А,
- Хигами Т
.
 Исследование межреберных артерий с помощью трансторакальной допплерографии. Эхокардиография 2010;27:17–20.doi:10.1111/j.1540-8175.2009.00970.xpmid:http://www.ncbi.nlm.nih.gov/pubmed/19725850
Исследование межреберных артерий с помощью трансторакальной допплерографии. Эхокардиография 2010;27:17–20.doi:10.1111/j.1540-8175.2009.00970.xpmid:http://www.ncbi.nlm.nih.gov/pubmed/19725850 Дополнительные материалы
Дополнительные данные
файл, предоставленный автором (авторами) и не подвергавшийся редактированию.
- Дополнение к данным 1
Сноски
Twitter @JeffChoi01, @DavidASpain
Участники JC, AA, KDS, WW и LC внесли свой вклад в сбор и анализ данных. JC и AA внесли свой вклад в написание статьи. OG, BMD, DS и KS внесли свой вклад в разработку концепции исследования и критического обзора статьи.
Финансирование Авторы не объявили о специальном гранте для этого исследования от какого-либо финансирующего агентства в государственном, коммерческом или некоммерческом секторах.

Конкурирующие интересы Не заявлено.
Согласие пациента на публикацию Не требуется.
Одобрение этики Институциональные наблюдательные советы Стэнфордского университета и Университета Вандербильта одобрили это исследование и отказались от необходимости получения согласия. Предоставляем описательную статистику.
Происхождение и рецензирование Не введен в эксплуатацию; рецензируется внешними экспертами.
Прочитать полный текст или скачать PDF:
Подписаться
Войти под своим именем пользователя и паролем
Для личных счетов ИЛИ менеджеров корпоративных счетов
Имя пользователя *
Пароль *
Забыли данные для входа? Зарегистрировать новую учетную запись?
Забыли имя пользователя или пароль?
Обнаружение гемоторакса в режиме реального времени и мониторинг его прогрессирования на модели поросенка с помощью электроимпедансной томографии: технико-экономическое обоснование0005
Гемоторакс — серьезное заболевание, которое может быть опасным для жизни, если его не лечить.
 Ранняя диагностика и своевременное лечение имеют большое значение для достижения благоприятного исхода. Хотя доступные в настоящее время диагностические методы, например, рентгенография грудной клетки, УЗИ и КТ, могут точно выявить гемоторакс, отсроченный гемоторакс нельзя идентифицировать на ранней стадии, поскольку эти исследования часто проводятся у пациентов до появления заметных симптомов. Поэтому для раннего выявления отсроченного гемоторакса необходим мониторинг в режиме реального времени с помощью портативного и неинвазивного метода визуализации. В этом исследовании мы использовали электроимпедансную томографию (ЭИТ) для обнаружения начала гемоторакса в режиме реального времени на восьми моделях гемоторакса поросят. Модели устанавливали путем введения 60 мл свежей аутологичной крови в плевральную полость и непрерывно отслеживали последующее развитие гемоторакса. Результаты показали, что ЭИТ способна точно обнаруживать гемоторакс объемом до 10 мл, а также его местонахождение. Кроме того, развитие гемоторакса в диапазоне от 10 до 60 мл хорошо отслеживалось в реальном времени с благоприятной линейной зависимостью между изменением импеданса на изображениях ЭИТ и объемом вводимой крови.
Ранняя диагностика и своевременное лечение имеют большое значение для достижения благоприятного исхода. Хотя доступные в настоящее время диагностические методы, например, рентгенография грудной клетки, УЗИ и КТ, могут точно выявить гемоторакс, отсроченный гемоторакс нельзя идентифицировать на ранней стадии, поскольку эти исследования часто проводятся у пациентов до появления заметных симптомов. Поэтому для раннего выявления отсроченного гемоторакса необходим мониторинг в режиме реального времени с помощью портативного и неинвазивного метода визуализации. В этом исследовании мы использовали электроимпедансную томографию (ЭИТ) для обнаружения начала гемоторакса в режиме реального времени на восьми моделях гемоторакса поросят. Модели устанавливали путем введения 60 мл свежей аутологичной крови в плевральную полость и непрерывно отслеживали последующее развитие гемоторакса. Результаты показали, что ЭИТ способна точно обнаруживать гемоторакс объемом до 10 мл, а также его местонахождение. Кроме того, развитие гемоторакса в диапазоне от 10 до 60 мл хорошо отслеживалось в реальном времени с благоприятной линейной зависимостью между изменением импеданса на изображениях ЭИТ и объемом вводимой крови. Эти результаты показали, что ЭИТ обладает уникальным потенциалом для ранней диагностики и непрерывного мониторинга гемоторакса в клинической практике, предоставляя медицинскому персоналу ценную информацию для быстрого выявления и лечения отсроченного гемоторакса.
Эти результаты показали, что ЭИТ обладает уникальным потенциалом для ранней диагностики и непрерывного мониторинга гемоторакса в клинической практике, предоставляя медицинскому персоналу ценную информацию для быстрого выявления и лечения отсроченного гемоторакса.1. Введение
Гемоторакс – серьезное заболевание, характеризующееся скоплением крови в плевральной полости [1, 2]. Она является частым последствием открытой или закрытой травмы грудной клетки, встречается примерно в 60% всех случаев политравмы и занимает второе место по частоте среди травматических повреждений [3, 4]. Хотя сообщается, что 25% смертей от травм были связаны с травмой грудной клетки, гемоторакс потенциально является фатальной причиной с высокой смертностью [5-7]. Гемоторакс может быть опасен, если его не лечить. Длительная задержка крови в плевральной полости может первоначально сопровождаться фиброзной реакцией, препятствующей адекватному расширению легких, что приводит к ателектазу и несоответствию вентиляции/перфузии [8, 9].
 ]. Кроме того, оставшаяся кровь также может быть контаминирована бактериями и вызывать эмпиему (даже бактериемию и септический шок) [10, 11]. Однако клинические исследования показывают, что раннее выявление и лечение гемоторакса, такое как остановка кровотечения и удаление гематомы из плевральной полости, могут привести к явно благоприятному исходу [12–14]. Поэтому раннее выявление и своевременное лечение гемоторакса имеют первостепенное значение для улучшения прогноза пациентов.
]. Кроме того, оставшаяся кровь также может быть контаминирована бактериями и вызывать эмпиему (даже бактериемию и септический шок) [10, 11]. Однако клинические исследования показывают, что раннее выявление и лечение гемоторакса, такое как остановка кровотечения и удаление гематомы из плевральной полости, могут привести к явно благоприятному исходу [12–14]. Поэтому раннее выявление и своевременное лечение гемоторакса имеют первостепенное значение для улучшения прогноза пациентов.По времени возникновения гемоторакс можно разделить на острый и замедленный. В остром случае гемоторакс можно было легко идентифицировать при вертикальной рентгенографии грудной клетки, УЗИ или КТ сразу после травмы или во время госпитализации [14]. Однако в отсроченных случаях, особенно при закрытых травматических состояниях, современные методы визуализации не могут легко зафиксировать начальное кровотечение в плевральной полости. Это связано с тем, что гемоторакс может возникнуть только через несколько часов или даже дней после травмы, и эти обследования часто проводятся до тех пор, пока у пациентов не появятся заметные симптомы [15, 16], включая боль в груди и затрудненное дыхание [14, 17].
 При слишком позднем лечении отсроченный массивный гемоторакс может быть опасным для жизни [13, 18]. Следовательно, для пациентов с факторами высокого риска отсроченного гемоторакса, такими как множественные или смещенные переломы ребер [19, 20], портативное, неинвазивное и безрадиационное медицинское устройство крайне необходимо для долгосрочного мониторинга гемоторакса в режиме реального времени с целью раннего выявления [21].
При слишком позднем лечении отсроченный массивный гемоторакс может быть опасным для жизни [13, 18]. Следовательно, для пациентов с факторами высокого риска отсроченного гемоторакса, такими как множественные или смещенные переломы ребер [19, 20], портативное, неинвазивное и безрадиационное медицинское устройство крайне необходимо для долгосрочного мониторинга гемоторакса в режиме реального времени с целью раннего выявления [21].Электроимпедансная томография (EIT), относительно новая технология компьютерной томографии, позволяет получать изображения поперечного сечения распределения электрического импеданса внутри человеческого тела. В EIT безопасные электрические токи вводятся в тело человека, чтобы вызвать граничные напряжения, которые возникают во внутренних тканях тела и измеряются с помощью массива поверхностных электродов, прикрепленных к выбранной области визуализации, такой как грудная клетка. Затем изображения ЭИП восстанавливаются по измеренным граничным напряжениям с использованием определенного алгоритма восстановления изображения [22].
 По сравнению с рентгеном, ультрасонографией и КТ, EIT имеет преимущества небольшого размера, низкой стоимости, неинвазивности, отсутствия радиации и высокого временного разрешения, что делает его многообещающим методом визуализации во многих биомедицинских приложениях, особенно при мониторинге в реальном времени. [23]. До настоящего времени ЭИТ широко изучалась при применении мониторинга легочной вентиляции и перфузии [24–27]. Кроме того, из-за значительной разницы в свойствах электрического импеданса между кровью и другими тканями человека [28, 29], ЭИТ имеет большие возможности в длительном и непрерывном выявлении возникновения и прогрессирования внутренних кровоизлияний в органы человека, в том числе гемоторакса.
По сравнению с рентгеном, ультрасонографией и КТ, EIT имеет преимущества небольшого размера, низкой стоимости, неинвазивности, отсутствия радиации и высокого временного разрешения, что делает его многообещающим методом визуализации во многих биомедицинских приложениях, особенно при мониторинге в реальном времени. [23]. До настоящего времени ЭИТ широко изучалась при применении мониторинга легочной вентиляции и перфузии [24–27]. Кроме того, из-за значительной разницы в свойствах электрического импеданса между кровью и другими тканями человека [28, 29], ЭИТ имеет большие возможности в длительном и непрерывном выявлении возникновения и прогрессирования внутренних кровоизлияний в органы человека, в том числе гемоторакса.На сегодняшний день в нескольких исследованиях сообщается об оценке возможности использования EIT для мониторинга внутреннего кровотечения в режиме реального времени. Xu et al., Manwaring et al., Dowrick et al., Sadleir et al., и Dai et al. установили различные животные модели внутричерепного кровоизлияния (ICH), включая внутрипаренхиматозное кровоизлияние (IPH), субарахноидальное кровоизлияние (SAH) и внутрижелудочковое кровоизлияние (IVH).
 Они обнаружили, что EIT может точно отражать изменение импеданса в реальном времени, вызванное ICH, даже несмотря на то, что объем крови был намного меньше, чем объем мозга, как в случае модели IPH у свиней с инъекцией 5 мл крови [30-34]. . Более того, Шуай и соавт. исследовали способность EIT отслеживать внутрибрюшинное кровотечение на модели свиньи и обнаружили, что изменения внутрибрюшинного объема крови могут быть постоянно идентифицированы путем наблюдения изображений EIT на протяжении всего кровотечения [35]. В другом исследовании You et al. успешно применил ЭИТ для динамического мониторинга забрюшинного кровотечения у пациента с травмой почки в течение 9ч [36]. Короче говоря, предыдущие исследования показали, что EIT имеет уникальные преимущества в долгосрочном и непрерывном мониторинге внутренних кровотечений в различных органах. Однако, насколько нам известно, нет исследований, в которых оценивалась бы возможность непрерывного мониторинга гемоторакса с помощью EIT.
Они обнаружили, что EIT может точно отражать изменение импеданса в реальном времени, вызванное ICH, даже несмотря на то, что объем крови был намного меньше, чем объем мозга, как в случае модели IPH у свиней с инъекцией 5 мл крови [30-34]. . Более того, Шуай и соавт. исследовали способность EIT отслеживать внутрибрюшинное кровотечение на модели свиньи и обнаружили, что изменения внутрибрюшинного объема крови могут быть постоянно идентифицированы путем наблюдения изображений EIT на протяжении всего кровотечения [35]. В другом исследовании You et al. успешно применил ЭИТ для динамического мониторинга забрюшинного кровотечения у пациента с травмой почки в течение 9ч [36]. Короче говоря, предыдущие исследования показали, что EIT имеет уникальные преимущества в долгосрочном и непрерывном мониторинге внутренних кровотечений в различных органах. Однако, насколько нам известно, нет исследований, в которых оценивалась бы возможность непрерывного мониторинга гемоторакса с помощью EIT.Соответственно, в этом исследовании мы впервые создали модели гемоторакса путем введения аутологичной крови в плевральную полость свиней.
 Во-вторых, данные EIT легких непрерывно собирались на протяжении всего курса инъекции крови, а затем обрабатывались методом цифровой фильтрации для получения независимого изменения импеданса, вызванного гемотораксом, для реконструкции изображения EIT. Наконец, мы количественно проанализировали взаимосвязь между изменением импеданса, отражаемым изображениями EIT, и объемом инъекции крови.
Во-вторых, данные EIT легких непрерывно собирались на протяжении всего курса инъекции крови, а затем обрабатывались методом цифровой фильтрации для получения независимого изменения импеданса, вызванного гемотораксом, для реконструкции изображения EIT. Наконец, мы количественно проанализировали взаимосвязь между изменением импеданса, отражаемым изображениями EIT, и объемом инъекции крови.2. Материалы и методы
2.1. Подготовка животных
Все эксперименты в этом исследовании были одобрены Институциональными комитетами по уходу и использованию животных Медицинского университета ВВС, Сиань, Шэньси, Китай.
Восемь поросят в возрасте 2 месяцев (масса, 4 самки и 4 самца) были получены из центра экспериментальных животных и выращены на месте. Во избежание обратного заброса пищи в желудок, который блокировал бы дыхательные пути после анестезии, поросят лишали пищи и воды на 12 часов перед экспериментальными процедурами. Все эксперименты проводились при относительно стабильной температуре окружающей среды (), а внутреннюю температуру тела животных измеряли с помощью ректального термисторного датчика.
 Субъекты первоначально были анестезированы внутримышечной инъекцией атропина (0,05 мг/кг) для уменьшения выделения из дыхательных путей. После седации пентобарбитал вводили внутрибрюшинно (30 мг/кг) для достижения глубокого уровня анестезии для дальнейших хирургических вмешательств. Для поддержания мышечного паралича использовали панкуроний (0,2 мг/кг, повторно 0,1 мг/кг). Затем кожу грудной клетки в пределах 15 см за передними конечностями поросят выбрили и очистили, чтобы подготовить крепление электрода EIT.
Субъекты первоначально были анестезированы внутримышечной инъекцией атропина (0,05 мг/кг) для уменьшения выделения из дыхательных путей. После седации пентобарбитал вводили внутрибрюшинно (30 мг/кг) для достижения глубокого уровня анестезии для дальнейших хирургических вмешательств. Для поддержания мышечного паралича использовали панкуроний (0,2 мг/кг, повторно 0,1 мг/кг). Затем кожу грудной клетки в пределах 15 см за передними конечностями поросят выбрили и очистили, чтобы подготовить крепление электрода EIT.Для обеспечения нормального дыхания поросят на протяжении всего эксперимента использовался аппарат ИВЛ для животных. Процедуры интубации трахеи заключаются в следующем: сначала поросят фиксировали в положении лежа на спине так, чтобы голова и шея были ниже туловища; затем с помощью ларингоскопа взяли язык поросят и надгортанник, чтобы найти отверстие трахеи. Во-вторых, в трахею вводили трахеальную канюлю на глубину примерно 20-25 см во время вдоха, и интубация трахеи считалась успешной, если появлялся туман.
 После этого поросят фиксировали в положении лежа. Параметры аппарата ИВЛ были установлены на частоту дыхания 25 уд/мин и дыхательный объем 10 мл/кг.
После этого поросят фиксировали в положении лежа. Параметры аппарата ИВЛ были установлены на частоту дыхания 25 уд/мин и дыхательный объем 10 мл/кг.2.2. Создание модели гемоторакса
Для создания модели гемоторакса использовали инъекцию аутологичной крови. Для приготовления инъекции крови из бедренной артерии отбирали 80 мл крови с помощью 100-мл шприца, в который предварительно аспирировали гепарин для предотвращения свертывания крови. Затем 60 мл гепаринизированной крови аспирировали другим шприцем на 100 мл, соединенным с пункционной иглой через дренажную трубку, которая была прикреплена к микроинъекционному насосу (АТ-5803), работающему со скоростью 600 мл/ч. С помощью скальпеля осторожно сделали небольшой разрез (длиной около 0,5 см) между пятым и шестым ребрами, не повреждая париетальную плевру (рис. 1). Что касается закрытого торакального дренажа, пункционную иглу медленно вводят через разрез до тех пор, пока не появится отчетливое ощущение прорыва, указывающее на попадание пункционной иглы в плевральную полость.
 Для быстрой остановки кровотечения была наложена пара кровоостанавливающих щипцов, а для предотвращения утечки воздуха использовалась вазелиновая пломба. Наконец, микроинъекционный насос был активирован, чтобы обеспечить непрерывную инъекцию крови.
Для быстрой остановки кровотечения была наложена пара кровоостанавливающих щипцов, а для предотвращения утечки воздуха использовалась вазелиновая пломба. Наконец, микроинъекционный насос был активирован, чтобы обеспечить непрерывную инъекцию крови.2.3. Системный протокол EIT
2.3.1. Применение электродов EIT
Электродная система EIT состояла из 16 одноразовых электродов Ag+/Ag+Cl− (Shanghai Shenfeng Medical & Health Articles Co., Ltd., Шанхай, Китайская Народная Республика) диаметром 10 мм. После того как выбритая кожа всех поросят была очищена спиртом, электроды прикрепляли к коже на 5 см выше мечевидного отростка на равном расстоянии вокруг грудной клетки. Для повышения стабильности электродов использовали самоклеящуюся повязку (McDavid-4575, Bellwood, США) длиной в 1,5 раза больше окружности грудной клетки, которую дважды оборачивали вокруг грудной клетки (рис. 2).
2.3.2. Сбор данных EIT
Сбор данных EIT был выполнен с использованием портативной системы EIT (PEIT4) с высокой точностью, а также высокой скоростью сбора данных.
 Система, специально разработанная нашей группой для визуализации легких, может постоянно работать на частоте 100 кГц и выходном токе 1 мА. Точность измерения лучше 1 ‰, а скорость сбора данных может достигать 12 кадров/с [37]. Несмотря на небольшой объем (), эта система может непрерывно работать более 10 ч от литиевой батареи. Для повышения чувствительности к изменениям импеданса, вызванным центральными областями легких, и поддержания хорошего соотношения сигнал-шум, при сборе данных EIT был принят протокол измерения противоположного возбуждения-примыкания [38].
Система, специально разработанная нашей группой для визуализации легких, может постоянно работать на частоте 100 кГц и выходном токе 1 мА. Точность измерения лучше 1 ‰, а скорость сбора данных может достигать 12 кадров/с [37]. Несмотря на небольшой объем (), эта система может непрерывно работать более 10 ч от литиевой батареи. Для повышения чувствительности к изменениям импеданса, вызванным центральными областями легких, и поддержания хорошего соотношения сигнал-шум, при сборе данных EIT был принят протокол измерения противоположного возбуждения-примыкания [38].Для сравнения данных была получена контрольная группа, состоящая из данных EIT, полученных за 5 минут до инъекции крови, и соответствующих реконструированных изображений. После начала инъекции крови данные EIT непрерывно собирались в течение более 6 минут (рис. 3).
2.3.3. Обработка данных EIT
Данные EIT непрерывно собирались во время нормального дыхания испытуемых на протяжении всего процесса инъекции крови.
 Следовательно, данные EIT отражали изменение импеданса, вызванное как инъекцией крови, так и нормальным дыханием. Чтобы проанализировать взаимосвязь между данными EIT и инъекцией крови, мы использовали технологию цифровой фильтрации для получения независимого изменения импеданса, вызванного инъекцией крови, на основании того факта, что дыхание имело очевидную периодичность, а инъекция крови — нет. Этапы обработки данных ЭИП были следующими: сначала рассчитывались спектры мощности граничных напряжений всех каналов (эти граничные напряжения составляли данные ЭИП) соответственно. Во-вторых, был разработан низкочастотный фильтр Баттерворта 4-го порядка с граничной частотой полосы задерживания 0,15 Гц, который использовался для обработки данных ЭИТ для получения независимого сигнала инъекции крови, поскольку частота, соответствующая дыханию, составляла примерно 0,4 Гц (частота вентилятор был настроен на 25 ударов в минуту). В-третьих, независимый сигнал, соответствующий дыханию, можно получить, вычитая независимый сигнал инъекции крови из необработанных данных EIT.
Следовательно, данные EIT отражали изменение импеданса, вызванное как инъекцией крови, так и нормальным дыханием. Чтобы проанализировать взаимосвязь между данными EIT и инъекцией крови, мы использовали технологию цифровой фильтрации для получения независимого изменения импеданса, вызванного инъекцией крови, на основании того факта, что дыхание имело очевидную периодичность, а инъекция крови — нет. Этапы обработки данных ЭИП были следующими: сначала рассчитывались спектры мощности граничных напряжений всех каналов (эти граничные напряжения составляли данные ЭИП) соответственно. Во-вторых, был разработан низкочастотный фильтр Баттерворта 4-го порядка с граничной частотой полосы задерживания 0,15 Гц, который использовался для обработки данных ЭИТ для получения независимого сигнала инъекции крови, поскольку частота, соответствующая дыханию, составляла примерно 0,4 Гц (частота вентилятор был настроен на 25 ударов в минуту). В-третьих, независимый сигнал, соответствующий дыханию, можно получить, вычитая независимый сигнал инъекции крови из необработанных данных EIT.
Для демонстрации изменений данных EIT использовалось общее изменение граничного напряжения (TBVV), которое рассчитывалось по следующей формуле: где и обозначают полное граничное напряжение (TBV) в момент времени и контрольный момент времени. — граничное напряжение пары измерительных электродов, когда ток возбуждается через пару электродов. На практике разница потенциалов, вызванная импедансом контакта электрода с кожей, намного больше, чем разница, возникающая из-за импеданса внутренних тканей тела [39].]. Более того, контактный импеданс часто меняется со временем из-за различных неизбежных факторов, таких как потоотделение, изменение температуры, движение пациента и манипуляции медицинского персонала [40]. Кроме того, трудно точно измерить контактное сопротивление электрода-кожи возбуждающих электродов [41]. Таким образом, измеренные напряжения вычитаются, когда они измеряются на парах электродов, которые составляют один из возбуждающих электродов, т.е.
2.3.4. Реконструкция изображения EIT
разностных изображения EIT были реконструированы с помощью алгоритма затухающих наименьших квадратов (DLS), эффективность которого для мониторинга внутреннего кровотечения была подтверждена экспериментами на животных и людях [42].
 Матрица реконструкции была рассчитана на основе двумерной круговой модели с однородным распределением электрического импеданса и сохранена заранее. Процесс восстановления изображения был следующим:
где представляет собой вектор изменения импеданса (изображение) между двумя моментами времени, является линеаризованной матрицей чувствительности, обозначает матрицу регуляризации, которая рассчитывается на основе предположения о гладкости из [43], является параметром регуляризации, который обычно вычисляется с использованием L-кривой метод (здесь ), – матрица реконструкции , – вектор изменения граничного напряжения между двумя моментами времени.
где — граничное напряжение в опорный момент времени, представляющее граничное напряжение, полученное в другой момент времени.
Матрица реконструкции была рассчитана на основе двумерной круговой модели с однородным распределением электрического импеданса и сохранена заранее. Процесс восстановления изображения был следующим:
где представляет собой вектор изменения импеданса (изображение) между двумя моментами времени, является линеаризованной матрицей чувствительности, обозначает матрицу регуляризации, которая рассчитывается на основе предположения о гладкости из [43], является параметром регуляризации, который обычно вычисляется с использованием L-кривой метод (здесь ), – матрица реконструкции , – вектор изменения граничного напряжения между двумя моментами времени.
где — граничное напряжение в опорный момент времени, представляющее граничное напряжение, полученное в другой момент времени.2.4. Анализ данных EIT
Для количественного анализа изменения импеданса на изображениях EIT в зависимости от pH мы использовали региональное изменение импеданса (RIV), которое измеряло степень изменения импеданса в области, куда была введена кровь.
 RIV рассчитывается следующим образом:
где представляет собой область инъекции крови; и представляют собой реконструированный импеданс и площадь th-го элемента в области введения крови, соответственно, представляющие площадь th-го элемента во всей области визуализации; и обозначают количество конечных элементов в области инъекции крови и общее количество конечных элементов во всей области визуализации.
RIV рассчитывается следующим образом:
где представляет собой область инъекции крови; и представляют собой реконструированный импеданс и площадь th-го элемента в области введения крови, соответственно, представляющие площадь th-го элемента во всей области визуализации; и обозначают количество конечных элементов в области инъекции крови и общее количество конечных элементов во всей области визуализации.Для определения области введения крови на реконструированном изображении применялась стратегия порогового значения. Прежде всего, максимальное восстановленное значение было найдено путем сравнения восстановленных значений всех конечных элементов в изображениях EIT. В последующем область, состоящая из всех конечных элементов с восстановленным значением более 10% от , считалась областью введения крови.
В этом исследовании для статистического анализа использовалась программа IBM SPSS Statistics for Windows (версия 22; IBM Corporation, Армонк, штат Нью-Йорк, США). Сравнение разницы в RIV за 5 мин до введения крови и после введения 10, 20, 30, 40, 50 и 60 мл крови проводили с помощью однофакторного дисперсионного анализа (ANOVA).
 Был использован апостериорный тест, который считался статистически значимым.
Был использован апостериорный тест, который считался статистически значимым.Кроме того, для изучения взаимосвязи между изменением импеданса и инъекцией крови был проведен линейный регрессионный анализ между RIV и временем (а именно, количеством вводимой крови) как для отдельных субъектов, так и для объединенных данных.
2.5. Валидация модели гемоторакса
После завершения эксперимента поросят умерщвляли путем введения передозировки пентобарбитала. В соответствии с положением пункционной иглы небольшой разрез (длиной 0,5 см), сделанный для введения пункционной иглы, был дополнительно расширен, чтобы обнажить плевральную полость в месте инъекции крови. Это позволяет нам непосредственно наблюдать за распределением вводимой крови.
3. Результаты
Во время всех экспериментов у испытуемых сохранялись стабильные дыхание и температура тела. При валидации модели гемоторакса у одного животного мы обнаружили инъекцию крови в легочную ткань; поэтому было добавлено еще одно животное.
 Было успешно собрано восемь наборов данных EIT.
Было успешно собрано восемь наборов данных EIT.3.1. Модель гемоторакса
На рис. 4(а) показана линия разреза, по которому обнажается плевральная полость. На рис. 4(б) показано, что кровь была обнаружена в плевральной полости, что свидетельствует об успешном установлении модели гемоторакса.
3.2. Визуализация ЭИТ в нормальном дыхательном круге
На рис. 5 показано граничное напряжение и изображения ЭИТ в нормальном дыхательном круге. Как показано на рис. 5(а), TBVV постепенно увеличивалась во время вдоха и уменьшалась во время выдоха. Точно так же импеданс в области легких постепенно увеличивался во время вдоха и уменьшался во время выдоха, что отражено в изображениях EIT, показанных на рисунке 5 (b). Эти результаты подтвердили надежность и точность системы EIT, использованной в этом исследовании.
3.3. Разделение импеданса дыхания и импеданса при введении крови путем фильтрации
На рис. 6 показана процедура разделения импеданса, вызванного инъекцией крови, от импеданса, возникающего при дыхании.
 Как показано на рисунке 6(a), при использовании данных EIT в конце выдоха в качестве системы отсчета изменение импеданса, вызванное инъекцией крови, постепенно перекрывалось изменением импеданса, возникающим в результате вдоха на изображениях EIT. Кроме того, TBV не только изменялся при дыхании, но и уменьшался при увеличении объема вводимой крови. Из спектров мощности TBV видно, что TBV содержит два основных фактора, один из которых представляет собой сигнал на частоте 0,4 Гц, соответствующий частоте дыхания (25 ударов в минуту), а другой — сигнал ниже 0,1 Гц, соответствующий частоте дыхания. скорость введения (если введение крови считалось сигналом, который очень медленно менялся).
Как показано на рисунке 6(a), при использовании данных EIT в конце выдоха в качестве системы отсчета изменение импеданса, вызванное инъекцией крови, постепенно перекрывалось изменением импеданса, возникающим в результате вдоха на изображениях EIT. Кроме того, TBV не только изменялся при дыхании, но и уменьшался при увеличении объема вводимой крови. Из спектров мощности TBV видно, что TBV содержит два основных фактора, один из которых представляет собой сигнал на частоте 0,4 Гц, соответствующий частоте дыхания (25 ударов в минуту), а другой — сигнал ниже 0,1 Гц, соответствующий частоте дыхания. скорость введения (если введение крови считалось сигналом, который очень медленно менялся).На рис. 6(b) показано, что после фильтрации через низкочастотный фильтр Баттерворта 4-го порядка с частотой среза 0,15 Гц на изображениях ЭИТ отображалось только изменение импеданса, вызванное инъекцией крови. Кроме того, кривая, представляющая TBV, также показывает прямую и исключительную корреляцию с инъекцией крови во времени, что снова демонстрируется спектрами мощности.

На рис. 6(c) показаны независимые спектры TBV и мощности, соответствующие дыханию, которые были получены путем вычитания TBV, вызванного инъекцией крови, из необработанного TBV.
3.4. EIT-визуализация процедуры инъекции крови
На рис. 7(a) показано изменение изображений EIT за 5 минут до инъекции крови, а также в течение всего курса инъекции крови для всех восьми поросят. В целом тенденция изменения импеданса у всех поросят одинакова. Перед введением крови значительных изменений импеданса не наблюдалось. После введения 10 мл крови импеданс области инъекции уменьшался. По мере увеличения количества крови изменение импеданса постепенно становилось очевидным, проявляя растущую величину изменения импеданса и увеличивающуюся площадь. После завершения введения крови (60 мл крови) изменение импеданса достигало максимума с наибольшей амплитудой и наибольшей площадью. Однако степень изменения импеданса у всех испытуемых была разной, демонстрируя различные амплитуды (обозначенные цветными полосами) и различные области.

На рис. 7(b) показаны ROI, в которые была введена кровь для всех субъектов, с помощью которых были рассчитаны региональные изменения импеданса (RIV), вызванные инъекцией крови.
На рис. 7(c) можно наблюдать значительную разницу в RIV после введения всего 10 мл крови путем сравнения RIV в течение 5 минут до введения крови ( ()) и в течение 1 минуты после введения крови (-, ). Кроме того, при введении большего количества крови (20 мл, 30 мл, 40 мл, 50 мл и 60 мл) RIV также демонстрировали значительное отличие от RIV до инъекции крови ().
Как показано на рисунке 7(d) и в таблице 1, линейная регрессия указывает на то, что RIV благоприятно прогнозирует объем инъекции крови для каждого поросенка с диапазоном коэффициентов детерминации 0,947-0,995 (). Это было аналогично для объединенных данных от всех восьми поросят (;).
4. Обсуждение
4.1. Резюме и объяснение результатов
В клинической практике очень важно разработать новые методы раннего выявления отсроченного гемоторакса, чтобы получить благоприятные результаты, поскольку современные методы медицинской визуализации, такие как рентген грудной клетки, КТ и УЗИ, не может осуществлять долгосрочный мониторинг пациентов с травмой грудной клетки в режиме реального времени с высоким риском отсроченного гемоторакса.
 В этом исследовании мы изучили возможность использования EIT для обнаружения гемоторакса на модели животных. Результаты показали, что EIT может точно идентифицировать гемоторакс объемом всего 10 мл и его местоположение. Кроме того, с помощью ЭИТ можно было осуществлять мониторинг развития гемоторакса в режиме реального времени (от 10 мл до 60 мл) на основе желаемой линейной зависимости между изменением импеданса на изображениях ЭИТ и объемом вводимой крови.
В этом исследовании мы изучили возможность использования EIT для обнаружения гемоторакса на модели животных. Результаты показали, что EIT может точно идентифицировать гемоторакс объемом всего 10 мл и его местоположение. Кроме того, с помощью ЭИТ можно было осуществлять мониторинг развития гемоторакса в режиме реального времени (от 10 мл до 60 мл) на основе желаемой линейной зависимости между изменением импеданса на изображениях ЭИТ и объемом вводимой крови.Во всех экспериментах мы непрерывно собирали данные EIT в течение 11 минут, включая 5 минут до инъекции крови и 6 минут после инъекции крови. В течение первых 5 мин не было значительного изменения импеданса на изображениях ЭИТ для всех испытуемых (рис. 7(а)), и RIV показал, что импеданс в области инъекции крови не претерпел существенных изменений по сравнению с импедансом после инъекции (рис. Рисунок 7(с)). Эти результаты демонстрируют надежность системы EIT, используемой в этом исследовании. В течение последующих 6 мин импеданс в области введения крови постепенно снижался по мере введения большего количества крови, что связано с тем, что электрическое сопротивление крови (1,43 Ом·м) значительно ниже, чем у тканей легкого, например, сдутого легкое (3,82 Ом·м) и надутое легкое (90,74 Ом·м) [44].
 Эти результаты в значительной степени согласуются с отчетами Hahn et al., в которых EIT применялась для записи изменения импеданса в модели гемоторакса у свиней, установленного путем введения раствора Рингера в плевральную полость поросят [45]. Кроме того, средний TBV в результате инъекции крови увеличился на 0,86–1,52% во время процесса, что еще раз демонстрирует осуществимость и высокую чувствительность EIT для выявления гемоторакса.
Эти результаты в значительной степени согласуются с отчетами Hahn et al., в которых EIT применялась для записи изменения импеданса в модели гемоторакса у свиней, установленного путем введения раствора Рингера в плевральную полость поросят [45]. Кроме того, средний TBV в результате инъекции крови увеличился на 0,86–1,52% во время процесса, что еще раз демонстрирует осуществимость и высокую чувствительность EIT для выявления гемоторакса.При анализе изображений EIT мы приняли индекс, называемый RIV, для оценки взаимосвязи между изменением импеданса и инъекцией крови. Для каждого субъекта RIV снижался почти линейно при непрерывном введении крови () и достоверно коррелировал с объемом крови (). Причем по всем предметам может быть до 0,669, что дополнительно демонстрирует благоприятную линейную коррекцию между изменением импеданса и объемом крови. Таким образом, RIV можно рассматривать как чувствительный и практичный показатель, отражающий развитие гемоторакса. Ожидается, что в будущей работе будет найдено больше показателей для изображений EIT, помимо RIV, чтобы сформировать разумную систему индексов для всесторонней количественной оценки инъекции крови.

4.2. Технические соображения и ограничения
В этом исследовании мы собирали данные EIT от каждого субъекта в течение двух периодов времени: 6 минут после инъекции крови и 5 минут до этого курса. На протяжении всего процесса сбора данных животное дышало нормально. Таким образом, полученные данные EIT содержали информацию об импедансе как при дыхании, так и при инъекции крови. Чтобы количественно проанализировать изменение импеданса, вызванное исключительно инъекцией крови, мы разработали цифровой фильтр нижних частот 4-го порядка для разделения двух видов изменения импеданса, учитывая значительную периодичность дыхания, кроме инъекций крови. Наши результаты говорят о том, что разработанный нами цифровой фильтр действителен. Точно так же в области исследования EIT легких уже было предпринято много усилий для разделения различных видов сигналов, таких как сердечные и дыхательные сигналы. Например, Дейбеле и др. предложил метод, основанный на анализе основных компонентов (PCA), для разделения сигналов, связанных с дыханием и перфузией, в котором шаблонные функции для легочного и сердечного компонентов, генерируемые PCA, и фильтрация в частотной области были встроены во входные сигналы [46].
 Рахман и др. использовали анализ независимых компонентов (ICA) для извлечения связанных с сердцем, а также связанных с дыханием изменений импеданса у субъектов со спонтанным дыханием [47]. В будущем мы сравним эти ранее предложенные методы с методом цифрового фильтра при извлечении информации об импедансе, связанной с дыханием и гемотораксом (посредством инъекции крови).
Рахман и др. использовали анализ независимых компонентов (ICA) для извлечения связанных с сердцем, а также связанных с дыханием изменений импеданса у субъектов со спонтанным дыханием [47]. В будущем мы сравним эти ранее предложенные методы с методом цифрового фильтра при извлечении информации об импедансе, связанной с дыханием и гемотораксом (посредством инъекции крови).В этом исследовании использованная нами модель реконструкции не идеальна. Во-первых, мы использовали круговую модель с однородным распределением импеданса, чтобы упростить грудную клетку поросят, потому что не были собраны изображения КТ или МРТ грудной клетки всех животных. Предполагалось, что эта неточность модели реконструкции вызовет некоторые ошибки в реконструированных изображениях, включая ошибки положения и форму аномалии (кровоизлияния), хотя наши результаты показывают, что изображения EIT способны чувствительно отражать прогрессирование инъекции крови [48]. Во-вторых, поскольку токи протекают в трехмерном пространственном распределении, используемая нами модель двумерной реконструкции также может привести к ошибкам местоположения и формы, даже если двумерные изображения EIT могут отражать информацию об импедансе вблизи плоскости электрода.
 Эти ошибки визуализации могут иметь определенное влияние на количественный анализ изображений EIT, что неблагоприятно для будущих клинических приложений [49].]. Следовательно, необходимы будущие работы, особенно эксперименты на людях, для создания индивидуальной трехмерной модели реконструкции грудной клетки, чтобы уменьшить ошибку визуализации и улучшить качество изображений EIT у пациентов, что может быть достигнуто путем включения точной геометрии и реалистичного распределения импеданса грудной клетки. алгоритм реконструкции изображений на основе изображений КТ или МРТ пациентов.
Эти ошибки визуализации могут иметь определенное влияние на количественный анализ изображений EIT, что неблагоприятно для будущих клинических приложений [49].]. Следовательно, необходимы будущие работы, особенно эксперименты на людях, для создания индивидуальной трехмерной модели реконструкции грудной клетки, чтобы уменьшить ошибку визуализации и улучшить качество изображений EIT у пациентов, что может быть достигнуто путем включения точной геометрии и реалистичного распределения импеданса грудной клетки. алгоритм реконструкции изображений на основе изображений КТ или МРТ пациентов.Для создания воспроизводимой модели гемоторакса у животных перед введением в плевральную полость аутологичную кровь обрабатывали гепарином для предотвращения коагуляции. Таким образом, существует разница между установленной моделью гемоторакса и фактическим гемотораксом. Однако наши результаты показали, что ЭИТ способна отслеживать изменения крови в плевральной полости, что продемонстрировало возможность использования ЭИТ для обнаружения гемоторакса в режиме реального времени.
 В будущем мы улучшим модель животных, введя аутологичную кровь без антикоагулянтов в плевральную полость, и дополнительно подтвердим способность EIT непрерывно контролировать гемоторакс.
В будущем мы улучшим модель животных, введя аутологичную кровь без антикоагулянтов в плевральную полость, и дополнительно подтвердим способность EIT непрерывно контролировать гемоторакс.4.3. Перспективы будущего клинического применения
Животная модель гемоторакса была создана в настоящем исследовании путем инъекции крови в плевральную полость легких поросят в течение относительно короткого периода времени (6 мин), и условия эксперимента строго контролировались во всех случаях. случаи. Таким образом, были сведены к минимуму значительные факторы, влияющие на качество собранных данных EIT. С другой стороны, данные EIT в основном отражают изменения импеданса, вызванные дыханием животных и инъекцией крови. Однако в практических клинических случаях часто требуется осуществление мониторинга в режиме реального времени в течение длительного периода времени для своевременного выявления отсроченного гемоторакса. Это окажет много сложных воздействий на данные EIT, таких как потоотделение или изменение температуры, приводящее к изменению импеданса контакта электрода с кожей [40], а также движение пациента или манипуляции медицинского персонала, приводящие к искажению измерения данных [50].
 Эти фактические факторы серьезно снизят качество данных EIT. Соответственно, необходимо изучить соответствующие методы для улучшения качества данных, прежде чем переходить к клиническим применениям для обнаружения гемоторакса.
Эти фактические факторы серьезно снизят качество данных EIT. Соответственно, необходимо изучить соответствующие методы для улучшения качества данных, прежде чем переходить к клиническим применениям для обнаружения гемоторакса.При длительном мониторинге часто могут возникать потоотделение, изменения температуры и влажности поверхности электрод-проводящий гель-кожа, дрейф электроники и изменение контакта электрода, что неизбежно вызывает изменение импеданса контакта электрод-кожа [51] . К сожалению, даже небольшое изменение импеданса контакта электрода с кожей может, очевидно, повлиять на точность измеренных данных EIT, вызывая значительные артефакты на изображениях EIT. Это связано с тем, что как возбуждение тока, так и измерение граничного напряжения осуществляются через интерфейс электрод-кожа [52]. До сих пор импеданс контакта электрода с кожей был основным фактором, влияющим на качество данных и изображения EIT при длительном мониторинге с использованием EIT. Чтобы смягчить влияние контактного импеданса, были предложены некоторые новые алгоритмы реконструкции с полной моделью электрода (CEM), в которых контактный импеданс вводится в реконструкцию изображения в попытке одновременно восстановить как контактный импеданс, так и внутреннее сопротивление.
 сопротивление тела человека. Боверман и др. использовали линейно-алгебраические методы при решении обратных задач для восстановления нестационарного контактного импеданса и внутреннего импеданса [53]. Демиденко пытался отдельно оценить контактный импеданс, опираясь на аналитическое решение с матрицей Неймана-Дирихле [54]. Тарвайнен и др. сформулировал реконструкцию изображения EIT как одну из байесовских оценок для вычисления импеданса контакта [55]. Эксперименты, соответствующие описанным выше алгоритмам, показали возможность существенного ослабления влияния контактного импеданса. Кроме того, Ян и соавт. сравнили временные свойства контактного импеданса 16 комбинаций (включающих 4 вида клинических электродов и пять типов широко используемого проводящего геля) на десяти добровольцах, чтобы найти оптимальную комбинацию для долгосрочного мониторинга. Их результаты показали, что комбинация порошкового электрода Ag+/Ag+Cl- и проводящего геля с низкой вязкостью может быть лучшим выбором [56].
сопротивление тела человека. Боверман и др. использовали линейно-алгебраические методы при решении обратных задач для восстановления нестационарного контактного импеданса и внутреннего импеданса [53]. Демиденко пытался отдельно оценить контактный импеданс, опираясь на аналитическое решение с матрицей Неймана-Дирихле [54]. Тарвайнен и др. сформулировал реконструкцию изображения EIT как одну из байесовских оценок для вычисления импеданса контакта [55]. Эксперименты, соответствующие описанным выше алгоритмам, показали возможность существенного ослабления влияния контактного импеданса. Кроме того, Ян и соавт. сравнили временные свойства контактного импеданса 16 комбинаций (включающих 4 вида клинических электродов и пять типов широко используемого проводящего геля) на десяти добровольцах, чтобы найти оптимальную комбинацию для долгосрочного мониторинга. Их результаты показали, что комбинация порошкового электрода Ag+/Ag+Cl- и проводящего геля с низкой вязкостью может быть лучшим выбором [56]. Таким образом, будущие клинические исследования по обнаружению гемоторакса должны применять несколько методов для минимизации влияния контактного импеданса на изображения EIT, включая использование определенных алгоритмов реконструкции изображения и выбор конкретного электрода и проводящего геля.
Таким образом, будущие клинические исследования по обнаружению гемоторакса должны применять несколько методов для минимизации влияния контактного импеданса на изображения EIT, включая использование определенных алгоритмов реконструкции изображения и выбор конкретного электрода и проводящего геля.Движения тела, мешающие движению пациента или манипуляциям медицинского персонала, являются обычным явлением при длительном мониторинге EIT в клинических условиях. Это может привести к смещению электродов и полному или частичному отсоединению электродов, что приведет к изменению данных измерений и даже значительной потере данных. Для уменьшения интерференции движений тела были разработаны специальные алгоритмы реконструкции изображений и методы предварительной обработки данных. Что касается движения электрода, Soleimani et al. разработали новый подход, в котором реконструировались как движения электродов, так и изменение внутреннего импеданса, и результаты показали резкое уменьшение артефактов изображения, вызванных движением электродов, а также хорошую реконструкцию фактического движения электродов [57].
 Кроме того, в случае полного отсоединения электрода Zhang et al. недавно разработал метод взвешенного коэффициента корреляции для тестирования нескольких проблемных электродов и использовал данные прогнозов модели серого для компенсационной обработки [58]. Впоследствии для частичного отключения электрода Zhang et al. предложил онлайн-стратегию, основанную на вейвлет-разложении, для управления данными EIT с частично подключенных электродов [59].]. Следовательно, в будущем для клинического применения ЭИТ для выявления отсроченного гемоторакса предлагается использовать подходы, включающие специальный алгоритм изображения и метод предварительной обработки данных для уменьшения влияния помех движений тела.
Кроме того, в случае полного отсоединения электрода Zhang et al. недавно разработал метод взвешенного коэффициента корреляции для тестирования нескольких проблемных электродов и использовал данные прогнозов модели серого для компенсационной обработки [58]. Впоследствии для частичного отключения электрода Zhang et al. предложил онлайн-стратегию, основанную на вейвлет-разложении, для управления данными EIT с частично подключенных электродов [59].]. Следовательно, в будущем для клинического применения ЭИТ для выявления отсроченного гемоторакса предлагается использовать подходы, включающие специальный алгоритм изображения и метод предварительной обработки данных для уменьшения влияния помех движений тела.4.4. Значение для клинического применения
В клинических условиях патологическое накопление жидкости в плевральной полости является распространенным симптомом, который серьезно влияет на легочную вентиляцию. Таким образом, оценка его воздействия с помощью EIT имеет большое значение, и этот вопрос изучался в нескольких текущих исследованиях.
 Кэмпбелл и др. наблюдали повышение электрического сопротивления на пораженной стороне грудной клетки у больных с односторонним плевральным выпотом от рака легкого во время ступенчатой аспирации плеврального выпота [60]. Арад и др. получили аналогичные результаты при обследовании больных с плевральной жидкостью до и после удаления плеврального выпота [61]. Кроме того, Алвес и соавт. использовали EIT для оценки реаэрации легких, вентиляции и синхронности вентилятора до и через час после плевральной аспирации [62]. Недавно Бехер и соавт. пришел к выводу, что ЭИТ можно использовать для обнаружения плеврального выпота путем анализа противофазного импеданса между пациентами с плевральной жидкостью и без нее, а также путем сравнения импеданса до и после дренирования выпота [63]. Предыдущие исследования в полной мере продемонстрировали надежность использования ЭИТ для контроля дренирования плеврального выпота, а именно уменьшения жидкости в плевральной полости. И наоборот, в этом исследовании мы изучали возможность использования EIT для мониторинга развития гемоторакса, который по существу представляет собой увеличение жидкости в плевральной полости.
Кэмпбелл и др. наблюдали повышение электрического сопротивления на пораженной стороне грудной клетки у больных с односторонним плевральным выпотом от рака легкого во время ступенчатой аспирации плеврального выпота [60]. Арад и др. получили аналогичные результаты при обследовании больных с плевральной жидкостью до и после удаления плеврального выпота [61]. Кроме того, Алвес и соавт. использовали EIT для оценки реаэрации легких, вентиляции и синхронности вентилятора до и через час после плевральной аспирации [62]. Недавно Бехер и соавт. пришел к выводу, что ЭИТ можно использовать для обнаружения плеврального выпота путем анализа противофазного импеданса между пациентами с плевральной жидкостью и без нее, а также путем сравнения импеданса до и после дренирования выпота [63]. Предыдущие исследования в полной мере продемонстрировали надежность использования ЭИТ для контроля дренирования плеврального выпота, а именно уменьшения жидкости в плевральной полости. И наоборот, в этом исследовании мы изучали возможность использования EIT для мониторинга развития гемоторакса, который по существу представляет собой увеличение жидкости в плевральной полости. Вкратце, это исследование и предыдущие исследования продемонстрировали способность EIT обнаруживать изменение (уменьшение и увеличение) плевральной жидкости, подтверждая большой потенциал метода EIT для оценки патологического статуса и заболеваний, связанных с плевральной жидкостью.
Вкратце, это исследование и предыдущие исследования продемонстрировали способность EIT обнаруживать изменение (уменьшение и увеличение) плевральной жидкости, подтверждая большой потенциал метода EIT для оценки патологического статуса и заболеваний, связанных с плевральной жидкостью.5. Выводы
В этом исследовании мы изучили осуществимость и чувствительность использования метода EIT для раннего выявления и постоянного мониторинга развития гемоторакса на моделях гемоторакса поросят, созданных путем введения крови в плевральную полость. Для клинической практики необходимы более конкретные исследования, посвященные использованию реалистичной 3D-модели реконструкции грудной клетки, разработке алгоритмов реконструкции изображений и метода предварительной обработки данных. Несмотря на это, наши результаты в этом исследовании демонстрируют, что ЭИТ обладает уникальным потенциалом для ранней диагностики и непрерывного мониторинга гемоторакса у пациентов с факторами высокого риска, предоставляя медицинскому персоналу ценную информацию для быстрого выявления и лечения отсроченного гемоторакса.

Доступность данных
Данные, использованные для поддержки результатов этого исследования, можно получить у соответствующего автора по запросу.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
Линь Ян и Чао Чжан внесли одинаковый вклад в эту работу.
Благодарности
Эта работа была поддержана Национальным фондом естественных наук Китая в рамках гранта 61
8, Фонда естественных наук провинции Шэньси в рамках гранта 2018KW-60 и Медицинской программы Четвертого военно-медицинского университета в рамках грантов 2018HKTS10 и 2019ZTC01.Ссылки
E.A. Kalkan и N. Aylanc, «Роль значений ослабления плевральной жидкости на КТ для диагностики гемоторакса у пациентов с травмами», International Journal of Clinical and Experimental Medicine , vol. 11, нет. 8, стр. 8430–8437, 2018.
Посмотреть по адресу:
Google Scholar
D.
 Patrini, N. Panagiotopoulos, J. Pararajasingham, L. Gvinianidze, Y. Iqbal и D.R. Lawrence, «Этиология и лечение спонтанного гемоторакса», Journal of Thoracic Disease , vol. 7, нет. 3, стр. 520–526, 2015 г.
Patrini, N. Panagiotopoulos, J. Pararajasingham, L. Gvinianidze, Y. Iqbal и D.R. Lawrence, «Этиология и лечение спонтанного гемоторакса», Journal of Thoracic Disease , vol. 7, нет. 3, стр. 520–526, 2015 г.Посмотреть по адресу:
Сайт издателя | Google Scholar
WG Boersma, JA Stigt и HJ Smit, «Лечение гемоторакса», Respiratory Medicine , vol. 104, нет. 11. С. 1583–1587, 2010.
Посмотреть по адресу:
Сайт издателя | Google Scholar
A. Jain and M. Waseem, Chest Trauma , StatPearls, Treasure Island (FL), 2019.
K. Horst, T.P. тупая травма грудной клетки в долгосрочной свиной модели тяжелой множественной травмы», Scientific Reports , vol. 6, нет. 1, 2016.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Деннис Б.
 М., Беллистер С. А. и Гийомондеги О. Д., «Травма грудной клетки», стр. 9.0163 Хирургические клиники Северной Америки , vol. 97, нет. 5, стр. 1047–1064, 2017.
М., Беллистер С. А. и Гийомондеги О. Д., «Травма грудной клетки», стр. 9.0163 Хирургические клиники Северной Америки , vol. 97, нет. 5, стр. 1047–1064, 2017.Посмотреть по адресу:
Сайт издателя | Google Scholar
С. Хубер, П. Биберталер, П. Делей и др., «Предикторы неблагоприятных исходов после тяжелой травмы грудной клетки у пациентов с множественными травмами: ретроспективный анализ из Немецкого реестра травм (Trauma Register DGU®), Скандинавский журнал травматологии, реанимации и неотложной медицины , том. 22, нет. 1, с. 52, 2014.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Чой П. М., Фармакис С., Демаре Т. Дж. и Келлер М. С., «Лечение и исходы травматического гемоторакса у детей», Journal of Emergencys, Trauma, and Shock , vol. 8, нет. 2, стр. 83–87, 2015 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
М.
 А. Янц и В. Б. Энтони, «Плеврофиброз», Clinics in Chest Medicine , vol. 27, нет. 2, стр. 181–19.1, 2006.
А. Янц и В. Б. Энтони, «Плеврофиброз», Clinics in Chest Medicine , vol. 27, нет. 2, стр. 181–19.1, 2006.Посмотреть по адресу:
Сайт издателя | Google Scholar
J. DuBose, K. Inaba, O. Okoye et al., «Развитие посттравматической эмпиемы у пациентов с оставшимся гемотораксом: результаты проспективного обсервационного исследования AAST», Journal of Trauma and Acute Care Surgery , том. 73, нет. 3, стр. 752–757, 2012 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Р. Карми-Джонс, М. Холевар, Р. Дж. Салливан, А. Флейзиг и Г. Дж. Юркович, «Остаточный гемоторакс после установки плевральной дренажной трубки коррелирует с повышенным риском эмпиемы после травматического повреждения», Canadian Respiratory Journal , vol. 15, нет. 5, стр. 255–258, 2008 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
М.
 Чакмак, «Характеристики пациентов, перенесших хирургическое лечение гемоторакса: описательное исследование», Biomedical Research , vol. 28, нет. 6, pp. 2679–2683, 2017.
Чакмак, «Характеристики пациентов, перенесших хирургическое лечение гемоторакса: описательное исследование», Biomedical Research , vol. 28, нет. 6, pp. 2679–2683, 2017.Посмотреть по адресу:
Google Scholar
С. В. Чанг, К. М. Рю и Дж. В. Рю, «Отсроченный массивный гемоторакс, требующий хирургического вмешательства после тупой травмы грудной клетки: за 5-летний период». осложняющий перелом ребра с острым краем, связанный с повреждением диафрагмы» Клиническая и экспериментальная неотложная медицина , том. 5, нет. 1, стр. 60–65, 2018 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
О. П. Шарма, С. Хаглер и М. Ф. Освански, «Распространенность отсроченного гемоторакса при тупой травме грудной клетки», , Американский хирург, , том. 71, нет. 6, pp. 481–486, 2005.
Просмотр по адресу:
Google Scholar
П.
 Синха и П. Саркар, «Поздний свернувшийся гемоторакс после тупой травмы грудной клетки», стр. Журнал медицины неотложных состояний , том. 15, нет. 3, стр. 189–191, 1998.
Синха и П. Саркар, «Поздний свернувшийся гемоторакс после тупой травмы грудной клетки», стр. Журнал медицины неотложных состояний , том. 15, нет. 3, стр. 189–191, 1998.Посмотреть по адресу:
Сайт издателя | Google Scholar
М. Эмонд, К. Гимон, Ж.-М. Chauny et al., «Правило клинического прогнозирования отсроченного гемоторакса после незначительной травмы грудной клетки: многоцентровое исследование деривации и проверки», CMAJ Open , vol. 5, нет. 2, стр. E444–E453, 2017.
Посмотреть по адресу:
Сайт издателя | Академия Google
Саймон Б.Дж., Чу К., Эмхофф Т.А., Фиалло В.М. и Ли К.Ф., «Отсроченный гемоторакс после тупой травмы грудной клетки», The Journal of Trauma , vol. 45, нет. 4, стр. 673–676, 1998.
Посмотреть по адресу:
Сайт издателя | Google Scholar
D.
 Yap, M. Ng, M. Chaudhury, and N. Mbakada, «Самый продолжительный отсроченный гемоторакс после тупой травмы груди», The American Journal of Emergency Medicine , vol. 36, нет. 1, с. 171.e1–171.e3, 2018.
Yap, M. Ng, M. Chaudhury, and N. Mbakada, «Самый продолжительный отсроченный гемоторакс после тупой травмы груди», The American Journal of Emergency Medicine , vol. 36, нет. 1, с. 171.e1–171.e3, 2018.Посмотреть по адресу:
Сайт издателя | Google Scholar
П. Мистос, С. Какарис, Э. Сепсас, К. Афанассиади и И. Скоттис, «Проспективный анализ скрытого пневмоторакса, отсроченного пневмоторакса и отсроченного гемоторакса после незначительной тупой травмы грудной клетки», Европейский журнал кардиоторакальной хирургии , вып. 25, нет. 5, стр. 859–864, 2004.
Посмотреть по адресу:
Сайт издателя | Google Scholar
M. Plourde, M. Émond, A. Lavoie et al., «Когортное исследование распространенности и факторов риска отсроченных легочных осложнений у взрослых после легкой тупой травмы грудной клетки», CJEM , том.
 16, стр. 136–143, 2014.
16, стр. 136–143, 2014.Посмотреть по адресу:
Сайт издателя | Google Scholar
W. Mansour, G. Samaha, S. el Bitar, Z. Esper и R. Maroun, «Разрыв межреберных артерий: редкое осложнение торакоцентеза и роль ультразвука в раннем выявлении», Case Reports in Пульмонология , вып. 2017 г., идентификатор статьи 64
, 4 страницы, 2017 г.Посмотреть по адресу:
Сайт издателя | Google Scholar
I. Frerichs, M. B. P. Amato, A. H. van Kaam et al., «Электроимпедансная томография грудной клетки, анализ данных, терминология, клиническое использование и рекомендации: согласованное заявление исследовательской группы Translational EIT developmentmeNt», Грудная клетка , том. 72, нет. 1, стр. 83–93, 2017.
Посмотреть по адресу:
Сайт издателя | Google Scholar
E.
 L. V. Costa, C. N. Chaves, S. Gomes et al., «Обнаружение пневмоторакса в режиме реального времени с помощью электроимпедансной томографии», Critical Care Medicine , vol. 36, нет. 4, стр. 1230–1238, 2008 г.
L. V. Costa, C. N. Chaves, S. Gomes et al., «Обнаружение пневмоторакса в режиме реального времени с помощью электроимпедансной томографии», Critical Care Medicine , vol. 36, нет. 4, стр. 1230–1238, 2008 г.Посмотреть по адресу:
Сайт издателя | Google Scholar
Э. Спинелли, Э. Карлессо и Т. Маури, «Экстракорпоральная поддержка для обеспечения вентиляции с защитой легких и диафрагмы», Текущее мнение об интенсивной терапии , vol. 26, нет. 1, стр. 66–72, 2020.
Посмотреть по адресу:
Сайт издателя | Google Scholar
M. Lehmann, B. Oehler, J. Zuber et al., «Перераспределение легочной вентиляции после операции на легких, обнаруженное с помощью электроимпедансной томографии», Acta Anaesthesiologica Scandinavica , стр. 1–9, 2019.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Т.
 Блат, Т. Кисс, М. Кирхер и др., «Измерение относительной перфузии легких с помощью электроимпедансной и позитронно-эмиссионной томографии: экспериментальное сравнительное исследование на свиньях», Британский журнал анестезии , том. 123, нет. 2, стр. 246–254, 2019.
Блат, Т. Кисс, М. Кирхер и др., «Измерение относительной перфузии легких с помощью электроимпедансной и позитронно-эмиссионной томографии: экспериментальное сравнительное исследование на свиньях», Британский журнал анестезии , том. 123, нет. 2, стр. 246–254, 2019.Посмотреть по адресу:
Сайт издателя | Google Scholar
Д. Г. Тингай, А. Д. Вальдманн, И. Фрерихс, С. Ранганатан и А. Адлер, «Электроимпедансная томография может выявить дефекты вентиляции и перфузии: неонатальный случай», Американский журнал респираторной медицины и реаниматологии. , том. 199, нет. 3, стр. 384–386, 2019.
Посмотреть по адресу:
Сайт издателя | Академия Google
C. Габриэль, А. Пейман и Э. Х. Грант, «Электропроводность ткани на частотах ниже 1 МГц», Physics in Medicine and Biology , vol. 54, нет.
 16, стр. 4863–4878, 2009.
16, стр. 4863–4878, 2009.Посмотреть по адресу:
Сайт издателя | Google Scholar
Габриэль С., Лау Р. В., Габриэль К. Диэлектрические свойства биологических тканей: II. Измерения в диапазоне частот от 10 Гц до 20 ГГц, Физика в медицине и биологии , т. 1, с. 41, нет. 11, стр. 2251–2269., 1996.
Посмотреть по адресу:
Сайт издателя | Google Scholar
М. Дай, Л. Ван, К. Сюй, Л. Ли, Г. Гао и С. Донг, «Визуализация субарахноидального кровоизлияния у поросят в режиме реального времени с помощью электроимпедансной томографии», Физиологические измерения , том. 31, нет. 9, стр. 1229–1239, 2010.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Т. Доурик, К. Блоше и Д. Холдер, «Изменения биоимпеданса in vivo во время геморрагического и ишемического инсульта у крыс: к трехмерной визуализации инсульта с использованием электроимпедансной томографии», Физиологические измерения , vol.
 37, нет. 6, стр. 765–784, 2016.
37, нет. 6, стр. 765–784, 2016.Посмотреть по адресу:
Сайт издателя | Google Scholar
П. К. Мануоринг, К. Л. Муди, А. Хартов, К. Х. Мануоринг и Р. Дж. Холтер, «Внутричерепная электрическая импедансная томография: метод непрерывного мониторинга в животной модели травмы головы», Анестезия и анальгезия , том . 117, нет. 4, стр. 866–875, 2013 г.
Посмотреть по адресу:
Сайт издателя | Академия Google
R. J. Sadleir, T. Tang, A. S. Tucker, P. Borum и M. Weiss, «Обнаружение внутрижелудочковой крови с использованием EIT в модели новорожденного поросенка», в 2009 г. Ежегодная международная конференция IEEE Engineering in Medicine and Biology Society , стр. 3169–3172, IEEE, Миннеаполис, Миннесота, США, 2009.
Посмотреть по адресу:
Сайт издателя | Google Scholar
C.
 H. Xu, L. Wang, X. T. Shi et al., «Визуализация и обнаружение внутричерепного кровоизлияния в режиме реального времени с помощью электроимпедансной томографии на модели поросенка», Журнал международных медицинских исследований , том. 38, нет. 5, стр. 1596–1604, 2010.
H. Xu, L. Wang, X. T. Shi et al., «Визуализация и обнаружение внутричерепного кровоизлияния в режиме реального времени с помощью электроимпедансной томографии на модели поросенка», Журнал международных медицинских исследований , том. 38, нет. 5, стр. 1596–1604, 2010.Посмотреть по адресу:
Сайт издателя | Google Scholar
S. Wanjun, Y. Fusheng, Z. Wei et al., «Мониторинг изображений для модели внутрибрюшинного кровотечения свиней с использованием электроимпедансной томографии», Physiological Measurement , vol. 29, нет. 2, стр. 217–225, 2008 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Ф. Ю, С. Ши, В. Шуай и др., «Применение электроимпедансной томографии для динамического мониторинга забрюшинного кровотечения у пациента с травмой почки», стр. Медицина интенсивной терапии , том.
 39, нет. 6, стр. 1159-1160, 2013.
39, нет. 6, стр. 1159-1160, 2013.Посмотреть по адресу:
Сайт издателя | Google Scholar
C. Zhang, M. Dai, W. Liu et al., «Глобальная и региональная степень обструкции, определяемая с помощью электроимпедансной томографии у пациентов с обструктивным вентиляционным дефектом», PLoS One , vol. 13, нет. 12, с. e0209473, 2018.
Посмотреть по адресу:
Сайт издателя | Google Scholar
А. Алекс и Р. Редди, «Методы подачи биполярного тока для электроимпедансной томографии: сравнительное исследование», в Медицинская визуализация 2017: Биомедицинские приложения в молекулярной, структурной и функциональной визуализации , vol. 10137, Международное общество оптики и фотоники, 2017 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Л.
 Ян, М. Дай, К. Сюй и др., «Частотные спектральные свойства импеданса контакта электрод-кожа на голове человека и его частотно-зависимые эффекты на частотно-разностную EIT при обнаружении инсульта от от 10 Гц до 1 МГц», PLoS One , том. 12, нет. 1, с. e0170563, 2017.
Ян, М. Дай, К. Сюй и др., «Частотные спектральные свойства импеданса контакта электрод-кожа на голове человека и его частотно-зависимые эффекты на частотно-разностную EIT при обнаружении инсульта от от 10 Гц до 1 МГц», PLoS One , том. 12, нет. 1, с. e0170563, 2017.Посмотреть по адресу:
Сайт издателя | Google Scholar
ET McAdams, J. Jossinet, A. Lackermeier и F. Risacher, «Факторы, влияющие на импеданс интерфейса электрод-гель-кожа в электроимпедансной томографии», Medical & Biological Engineering & Computing , vol. 34, нет. 6, стр. 397–408, 1996.
Посмотреть по адресу:
Сайт издателя | Google Scholar
H. Ma, H. Li, X. Liu et al., «Мониторинг в реальном времени контактного импеданса от нескольких интерфейсов электрод-кожа головы во время церебральной электроимпедансной томографии», Доступ IEEE , том.
 7, стр. 95186–95196, 2019.
7, стр. 95186–95196, 2019.Посмотреть по адресу:
Сайт издателя | Google Scholar
C. Xu, M. Dai, F. You и др., «Оптимизированная стратегия мониторинга кровотечения в реальном времени с помощью электроимпедансной томографии», Physiological Measurement , vol. 32, нет. 5, стр. 585–598, 2011.
Посмотреть по адресу:
Сайт издателя | Google Scholar
A. Adler, J. Arnold, R. Bayford et al., «GREIT: единый подход к 2D-линейной EIT-реконструкции изображений легких», Физиологические измерения , vol. 30, нет. 6, стр. S35–S55, 2009 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
D. Andreuccetti, R. Fossi, and C. Petrucci, Интернет-ресурс для расчета диэлектрических свойств тканей организма в диапазоне частот 10 Гц-100 ГГц , Итальянский национальный исследовательский совет, институт for Applied Physics, 1997.

G. Hahn, A. Just, T. Dudykevych et al., «Визуализация патологического легочного воздуха и накопления жидкости с помощью функциональной и абсолютной EIT», Физиологические измерения , vol. 27, нет. 5, стр. S187–S198, 2006 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Дж. М. Дейбеле, Х. Люпшен и С. Леонхардт, «Динамическое разделение изменений легких и сердца в электроимпедансной томографии», Физиологические измерения , том. 29, нет. 6, стр. S1–14, 2008 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Т. Рахман, М. М. Хасан, А. Фарук и М. З. Уддин, «Извлечение сигналов сердца и дыхания в электроимпедансной томографии на основе анализа независимых компонентов», Журнал электрического биоимпеданса , том. 4, нет. 1, стр. 38–44, 2013 г.

Посмотреть по адресу:
Сайт издателя | Google Scholar
А. Ниссинен, В. Колехмайнен и Дж. Кайпио, «Компенсация ошибок моделирования из-за неизвестной границы домена в электроимпедансной томографии», IEEE Transactions on Medical Imaging , vol. 30, нет. 2, стр. 231–242, 2011.
Посмотреть по адресу:
Сайт издателя | Google Scholar
P. Salz, A. Reske, H. Wrigge и G. Scheuermann, «Улучшение визуализации легких с помощью электроимпедансной томографии с использованием 3D-моделей для конкретных пациентов», в 3-й международный семинар по визуализации в медицине и науках о жизни , стр. 49–53, Eurographics Association, Лейпциг, Германия, 2013 г. Автоматическое обнаружение отсоединенных и ошибочных электродов в электроимпедансной томографии», Physiological Measurement , vol. 26, нет.
 2, стр. S175–S183, 2005 г.
2, стр. S175–S183, 2005 г.Посмотреть по адресу:
Сайт издателя | Академия Google
А. Бойл и А. Адлер, «Влияние площади электрода, импеданса контакта и формы границы на изображения EIT», Physiological Measurement , vol. 32, нет. 7, стр. 745–754, 2011.
Посмотреть по адресу:
Сайт издателя | Google Scholar
К. Г. Бун и Д. С. Холдер, «Влияние импеданса кожи на качество изображения и изменчивость в электроимпедансной томографии: модельное исследование», Medical & Biological Engineering & Computing , vol. 34, нет. 5, стр. 351–354, 1996.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Г. Боверман, Д. Исааксон, Дж. К. Ньюэлл и др., «Эффективная одновременная реконструкция изменяющихся во времени изображений и импеданса контактов электродов в электроимпедансной томографии», IEEE Transactions on Biomedical Engineering , vol.
 64, нет. 4, стр. 795–806, 2017.
64, нет. 4, стр. 795–806, 2017.Посмотреть по адресу:
Сайт издателя | Google Scholar
Демиденко Е. Аналитическое решение однородной задачи ЭИП на двумерном диске и его применение для оценки контактных импедансов электродов.0163 Физиологические измерения , vol. 32, нет. 9, стр. 1453–1471, 2011.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Т. Вилхунен, Дж. П. Кайпио, П. Дж. Ваухконен, Т. Саволайнен и М. Ваухконен, «Одновременная реконструкция импедансов контактов электродов и внутренних электрических свойств: I. Теория», Измерительная наука и технология, , том . 13, нет. 12, стр. 1848–1854, 2002.
Посмотреть по адресу:
Сайт издателя | Академия Google
Л. Ян, Х. Ли, Дж. Дин и др.
 , «Оптимальное сочетание электродов и проводящих гелей для электроимпедансной томографии головного мозга», Biomedical Engineering Online , vol. 17, нет. 1, с. 186, 2018.
, «Оптимальное сочетание электродов и проводящих гелей для электроимпедансной томографии головного мозга», Biomedical Engineering Online , vol. 17, нет. 1, с. 186, 2018.Посмотреть по адресу:
Сайт издателя | Google Scholar
М. Сулеймани, К. Гомес-Лаберже и А. Адлер, «Визуализация изменений проводимости и движения электродов в EIT», Physiological Measurement , vol. 27, нет. 5, стр. S103–S113, 2006.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Г. Чжан, М. Дай, Л. Ян и др., «Быстрое обнаружение и компенсация данных об отключении электродов при долгосрочном мониторинге динамической томографии головного мозга с электрическим импедансом», Biomedical Engineering Online , vol. . 16, нет. 1, с. 7, 2017.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Г.
 Чжан, В. Ли, Х. Ма и др., «Стратегия оперативной обработки для удаления помех движения головы динамической томографии головного мозга с электрическим импедансом на основе вейвлет-разложения», Биомедицинская инженерия Интернет , том. 18, нет. 1, с. 55, 2019.
Чжан, В. Ли, Х. Ма и др., «Стратегия оперативной обработки для удаления помех движения головы динамической томографии головного мозга с электрическим импедансом на основе вейвлет-разложения», Биомедицинская инженерия Интернет , том. 18, нет. 1, с. 55, 2019.Посмотреть по адресу:
Сайт издателя | Google Scholar
J. H. Campbell, N. D. Harris, F. Zhang, A. H. Morice и B. H. Brown, «Обнаружение изменений во внутригрудной жидкости у человека с помощью электроимпедансной томографии», Clinical Science , vol. 87, нет. 1, стр. 97–101, 1994.
Посмотреть по адресу:
Сайт издателя | Google Scholar
М. Арад, С. Злочивер, Т. Дэвидсон, Ю. Шоенфельд, А. Адунски и С. Аббуд, «Обнаружение плеврального выпота с использованием параметрического метода EIT», Физиологические измерения , vol. 30, нет.
 4, стр. 421–428, 2009 г.
4, стр. 421–428, 2009 г.Посмотреть по адресу:
Сайт издателя | Google Scholar
С. Х. Алвес, М. Б. Амато, Р. М. Терра, Ф. С. Варгас и П. Карузо, «Реаэрация и вентиляция легких после аспирации плеврального выпота. Исследование с использованием электроимпедансной томографии», Annals of the American Thoracic Society , vol. 11, нет. 2, стр. 186–191, 2014.
Посмотреть по адресу:
Сайт издателя | Академия Google
Т. Бехер, М. Буссмейер, И. Лаутеншлагер, Д. Шадлер, Н. Вейлер и И. Фрерихс, «Характерная картина плеврального выпота на изображениях электроимпедансной томографии пациентов в критическом состоянии», Британский журнал Анестезия , том. 120, нет. 6, стр. 1219–1228, 2018.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Copyright
Copyright © 2020 Lin Yang et al.


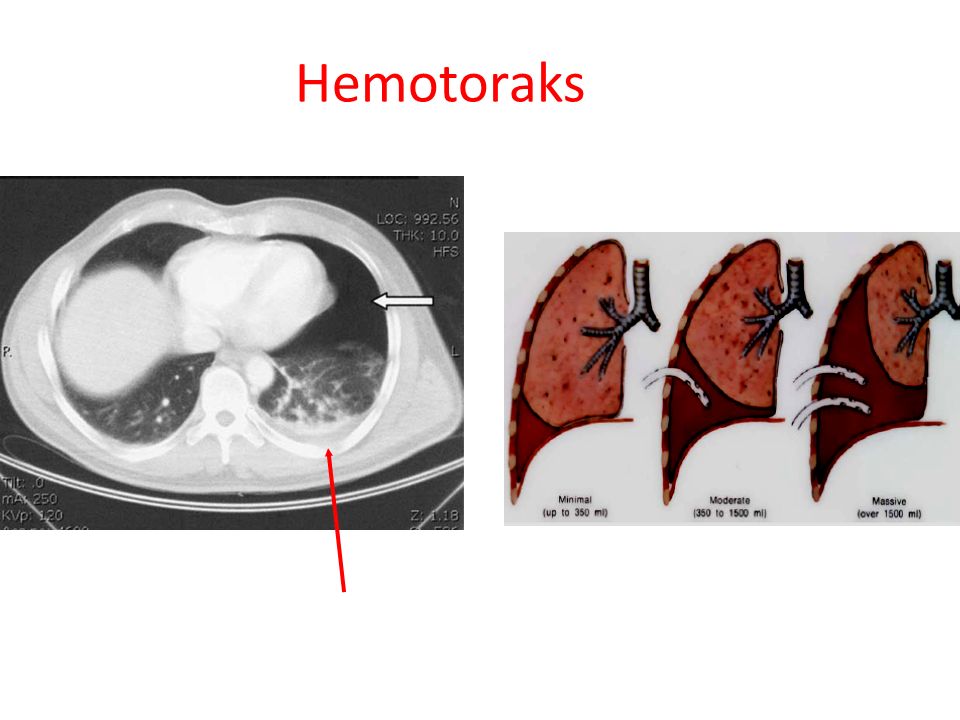
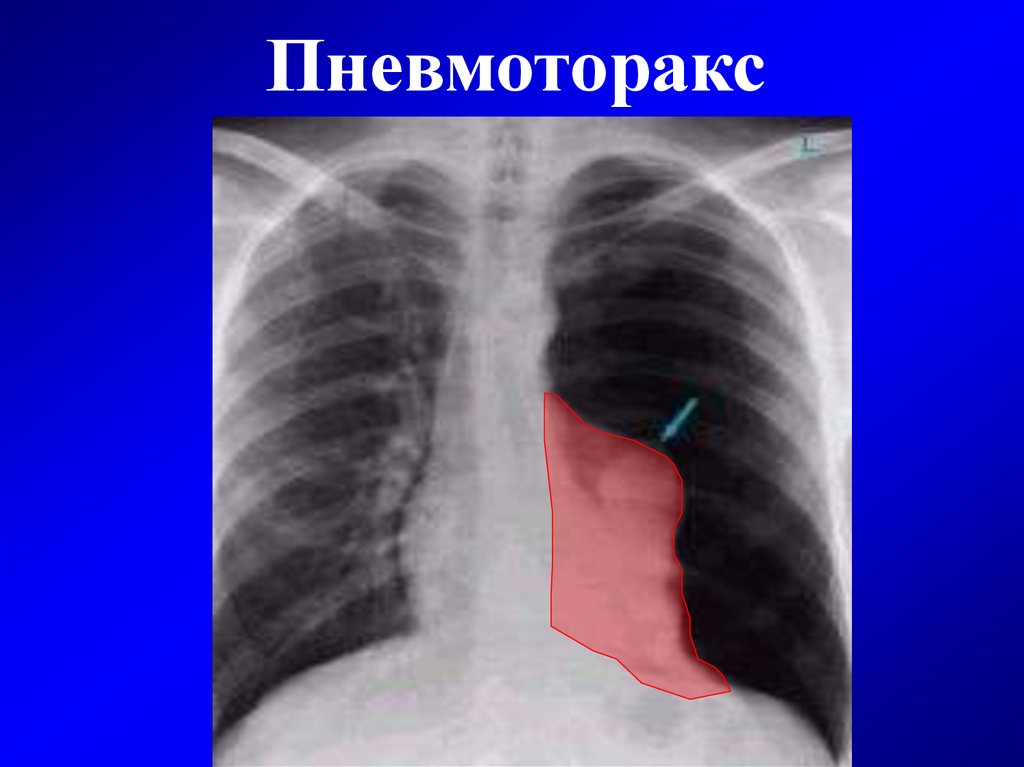


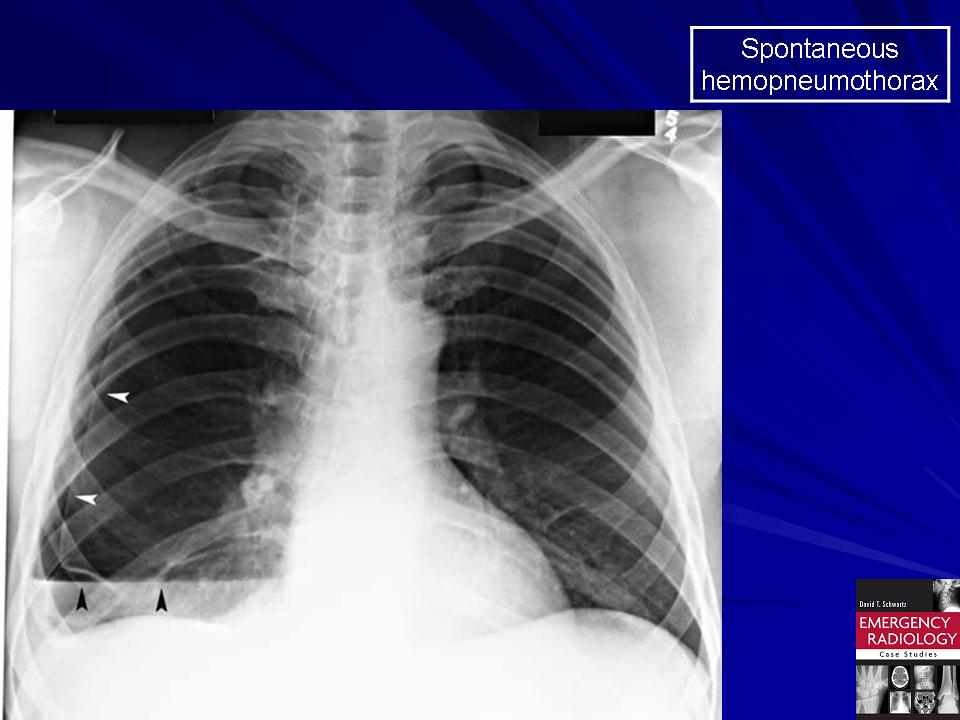
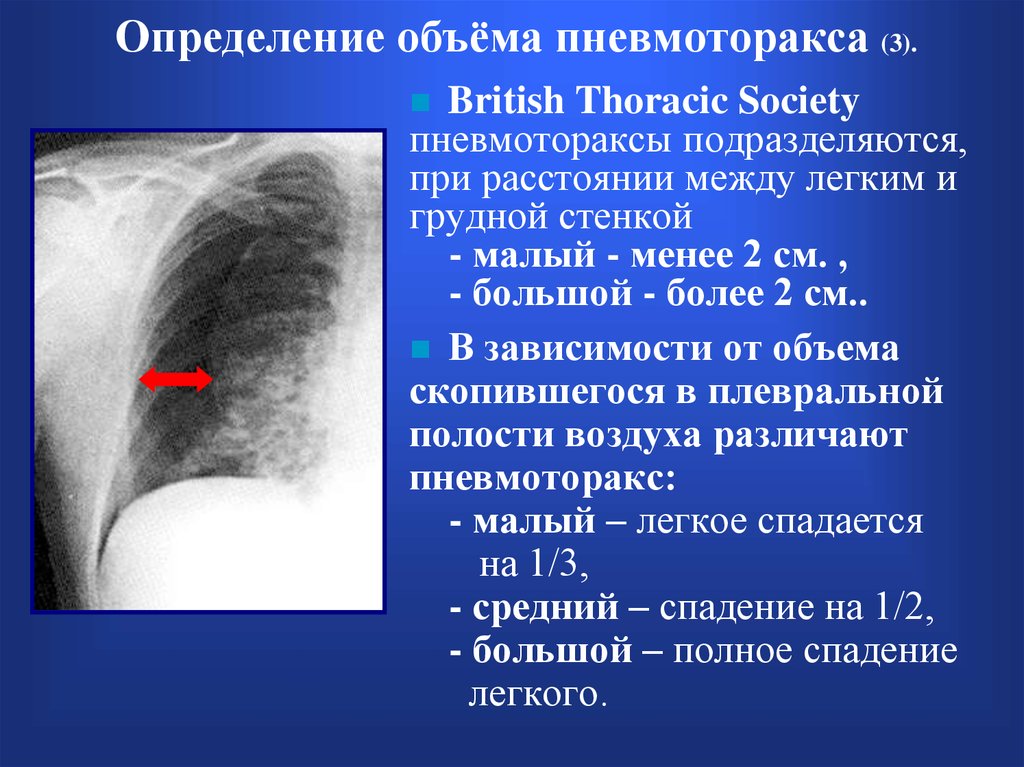
 К ним относятся туберкулез, абсцесс легкого, опухоли грудной стенки, злокачественные новообразования в легких, аневризма аорты и т.д.;
К ним относятся туберкулез, абсцесс легкого, опухоли грудной стенки, злокачественные новообразования в легких, аневризма аорты и т.д.;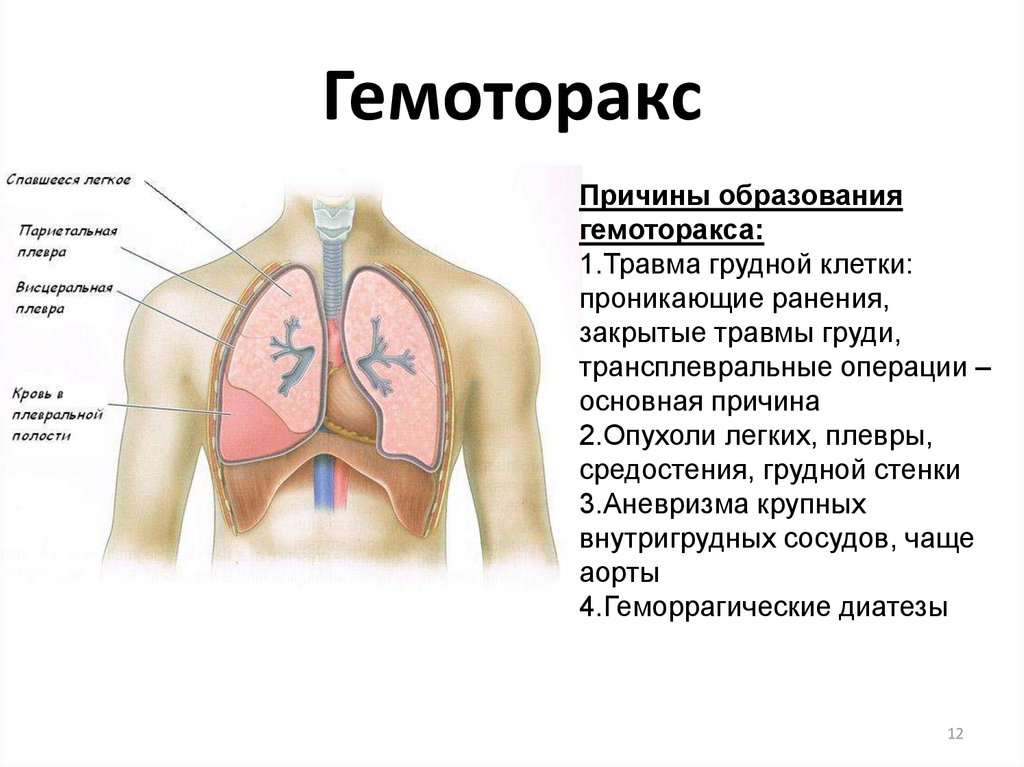 Избыток Движения в животе с брусной ранией → на грудной клетке
Избыток Движения в животе с брусной ранией → на грудной клетке
 Гемоторакс будет выглядеть как анэхогенное (черное) или плохо эхогенное пространство между диафрагмой и париетальной плеврой в реберно-диафрагмальном кармане. Жидкость также может содержать гетерогенные эхо-сигналы от свернувшейся крови или части разорванной ткани легкого. Наличие плевральной жидкости позволяет визуализировать грудной отдел позвоночника за реберно-диафрагмальным углом, известный как «признак позвоночника». Это явление связано с потерей артефакта зеркальности диафрагмы[5]
Гемоторакс будет выглядеть как анэхогенное (черное) или плохо эхогенное пространство между диафрагмой и париетальной плеврой в реберно-диафрагмальном кармане. Жидкость также может содержать гетерогенные эхо-сигналы от свернувшейся крови или части разорванной ткани легкого. Наличие плевральной жидкости позволяет визуализировать грудной отдел позвоночника за реберно-диафрагмальным углом, известный как «признак позвоночника». Это явление связано с потерей артефакта зеркальности диафрагмы[5] [6] Чувствительность была еще выше, 70%, когда врач неотложной помощи выполнял eFAST. В проспективном исследовании чувствительность и специфичность УЗИ органов грудной клетки при выявлении гемоторакса были 92% и специфичность 100% соответственно.[1] Кроме того, ультразвук может обнаружить всего 20 мл плевральной жидкости по сравнению со 175 мл при рентгенографии [6] и имеет 100% чувствительность при обнаружении выпота более 100 мл [24].
[6] Чувствительность была еще выше, 70%, когда врач неотложной помощи выполнял eFAST. В проспективном исследовании чувствительность и специфичность УЗИ органов грудной клетки при выявлении гемоторакса были 92% и специфичность 100% соответственно.[1] Кроме того, ультразвук может обнаружить всего 20 мл плевральной жидкости по сравнению со 175 мл при рентгенографии [6] и имеет 100% чувствительность при обнаружении выпота более 100 мл [24].
 Непосредственно опасные для жизни травмы требуют немедленного вмешательства, такого как торакостомия с декомпрессионной иглой и/или экстренная торакостомия с трубкой при обширном пневмотораксе, а также начальное лечение гемоторакса.
Непосредственно опасные для жизни травмы требуют немедленного вмешательства, такого как торакостомия с декомпрессионной иглой и/или экстренная торакостомия с трубкой при обширном пневмотораксе, а также начальное лечение гемоторакса. Проспективные исследования не выявили различий в исходах при использовании от 28 до 32 французских трубок в травматологических центрах I уровня для эвакуации гемоторакса [17].
Проспективные исследования не выявили различий в исходах при использовании от 28 до 32 французских трубок в травматологических центрах I уровня для эвакуации гемоторакса [17].

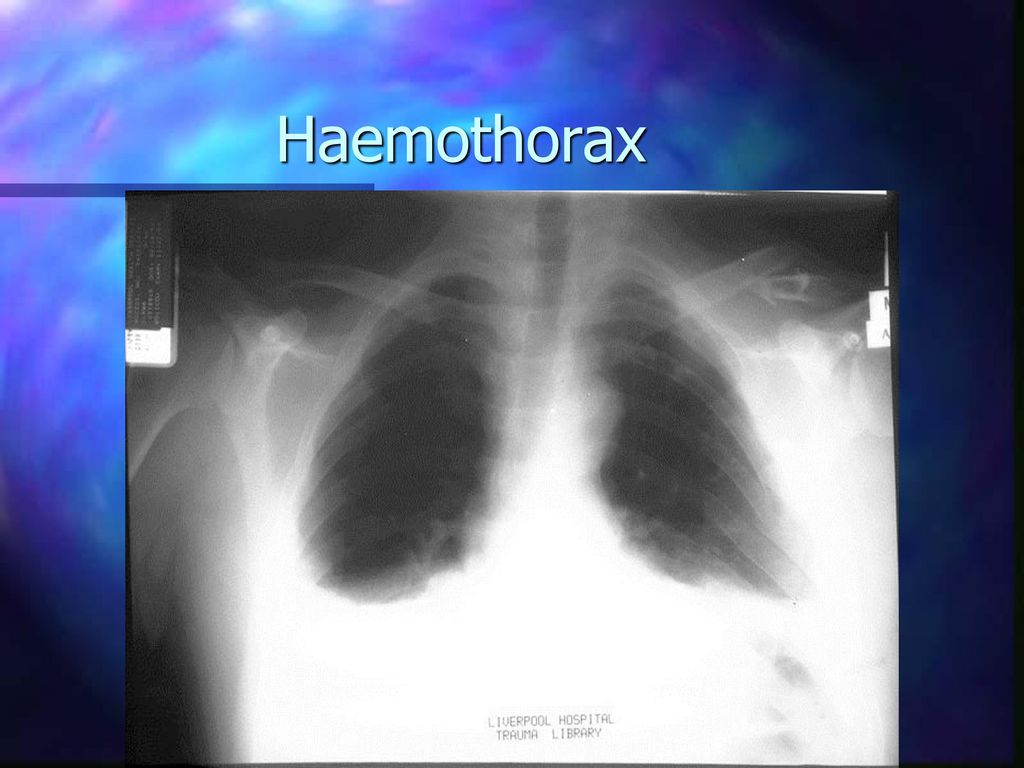 . Исследования показывают, что частота эмпиемы у пациентов с посттравматическим застойным гемотораксом составляет 26,8%. Фиброторакс возникает в результате отложения фибрина в плевральной полости. Неправильное дренирование гемоторакса вызывает воспалительный налет в плевральной полости, что препятствует правильному расширению легких. Это явление известно как ущемление легких.[28]
. Исследования показывают, что частота эмпиемы у пациентов с посттравматическим застойным гемотораксом составляет 26,8%. Фиброторакс возникает в результате отложения фибрина в плевральной полости. Неправильное дренирование гемоторакса вызывает воспалительный налет в плевральной полости, что препятствует правильному расширению легких. Это явление известно как ущемление легких.[28] Также было введено официальное обучение в ординатуре. Это позволяет быстро и воспроизводимо оценить травматические повреждения без риска вредного излучения. Различные исследования были направлены на оценку диагностической ценности УЗИ органов грудной клетки при травматическом гемотораксе. Систематический обзор и метаанализ показали, что на чувствительность ультразвука влияли оператор и частота преобразователя.[6] Проспективное поперечное исследование показало, что ультразвук является лучшим методом, чем рентгенография, но по сравнению с компьютерной томографией он показал более низкую чувствительность.
Также было введено официальное обучение в ординатуре. Это позволяет быстро и воспроизводимо оценить травматические повреждения без риска вредного излучения. Различные исследования были направлены на оценку диагностической ценности УЗИ органов грудной клетки при травматическом гемотораксе. Систематический обзор и метаанализ показали, что на чувствительность ультразвука влияли оператор и частота преобразователя.[6] Проспективное поперечное исследование показало, что ультразвук является лучшим методом, чем рентгенография, но по сравнению с компьютерной томографией он показал более низкую чувствительность. Его применение в условиях травмы было изучено и проанализировано в нескольких систематических обзорах. Будущие рандомизированные испытания должны быть проведены для оценки соответствующих исходов, таких как смертность, продолжительность пребывания в больнице и затраты.[5][34] Медсестры должны контролировать выход плевральной дренажной трубки каждый час во время первоначальной госпитализации; если результат значителен и непрерывен, следует уведомить торакального хирурга. В то время как большинство случаев разрешается с помощью плевральной дренажной трубки, если гемоторакс не эвакуирован, это может привести к эмпиеме, которая часто требует хирургического вмешательства. Исходы для большинства пациентов с изолированным гемотораксом хорошие.[35] (уровень V)
Его применение в условиях травмы было изучено и проанализировано в нескольких систематических обзорах. Будущие рандомизированные испытания должны быть проведены для оценки соответствующих исходов, таких как смертность, продолжительность пребывания в больнице и затраты.[5][34] Медсестры должны контролировать выход плевральной дренажной трубки каждый час во время первоначальной госпитализации; если результат значителен и непрерывен, следует уведомить торакального хирурга. В то время как большинство случаев разрешается с помощью плевральной дренажной трубки, если гемоторакс не эвакуирован, это может привести к эмпиеме, которая часто требует хирургического вмешательства. Исходы для большинства пациентов с изолированным гемотораксом хорошие.[35] (уровень V)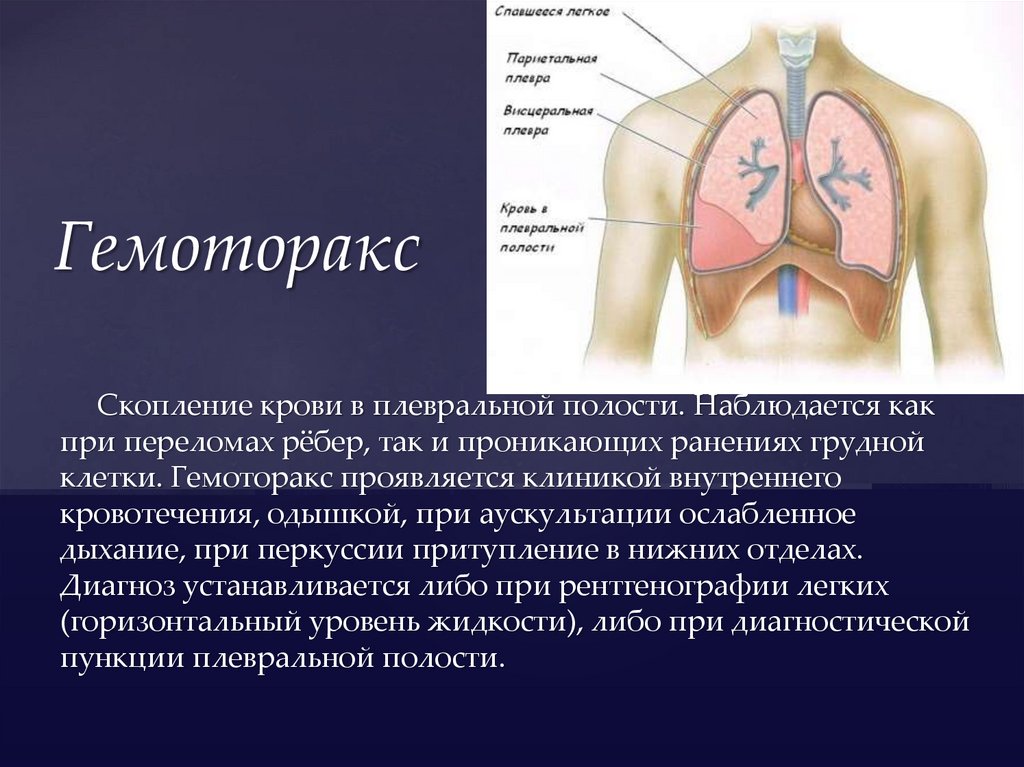 Предоставлено Vu Huy Tran, MD
Предоставлено Vu Huy Tran, MD
 2016 Зима;4(1):29-33. [Бесплатная статья PMC: PMC4744611] [PubMed: 26862547]
2016 Зима;4(1):29-33. [Бесплатная статья PMC: PMC4744611] [PubMed: 26862547]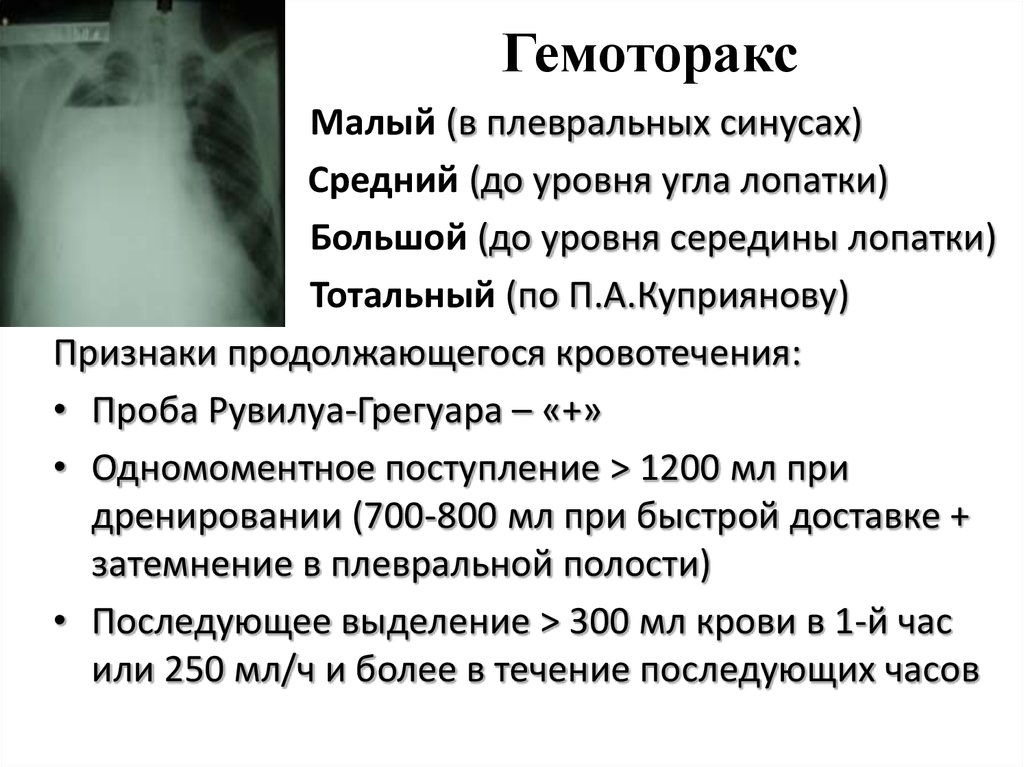 , Гюльхан Э., Язычи У., Кая С., Таштепе И. Всесторонний анализ травматических переломов ребер: заболеваемость, смертность и лечение. Eur J Cardiothorac Surg. 2003 г., июль; 24 (1): 133-8. [В паблике: 12853057]
, Гюльхан Э., Язычи У., Кая С., Таштепе И. Всесторонний анализ травматических переломов ребер: заболеваемость, смертность и лечение. Eur J Cardiothorac Surg. 2003 г., июль; 24 (1): 133-8. [В паблике: 12853057]
 Диагностическая точность УЗИ при неотложной оценке распространенных поражений грудной клетки после травмы. Грудь. 2012 май; 141(5):1177-1183. [PubMed: 22016490]
Диагностическая точность УЗИ при неотложной оценке распространенных поражений грудной клетки после травмы. Грудь. 2012 май; 141(5):1177-1183. [PubMed: 22016490] Дж., Франко Р., Велес М.И., Шнобрих Д., Дансел Р., Рестрепо М.И., Майо П.Х. Ультразвук в диагностике и лечении плевральных выпотов. Дж Хосп Мед. 2015 Декабрь; 10 (12): 811-6. [Бесплатная статья PMC: PMC4715558] [PubMed: 26218493]
Дж., Франко Р., Велес М.И., Шнобрих Д., Дансел Р., Рестрепо М.И., Майо П.Х. Ультразвук в диагностике и лечении плевральных выпотов. Дж Хосп Мед. 2015 Декабрь; 10 (12): 811-6. [Бесплатная статья PMC: PMC4715558] [PubMed: 26218493]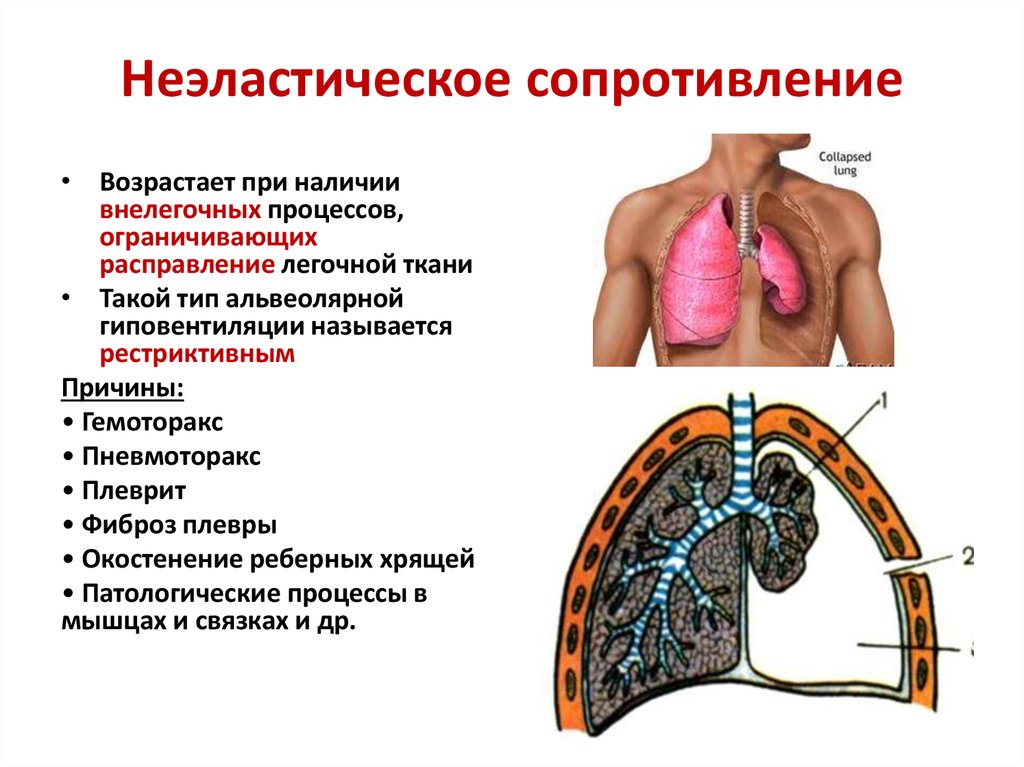
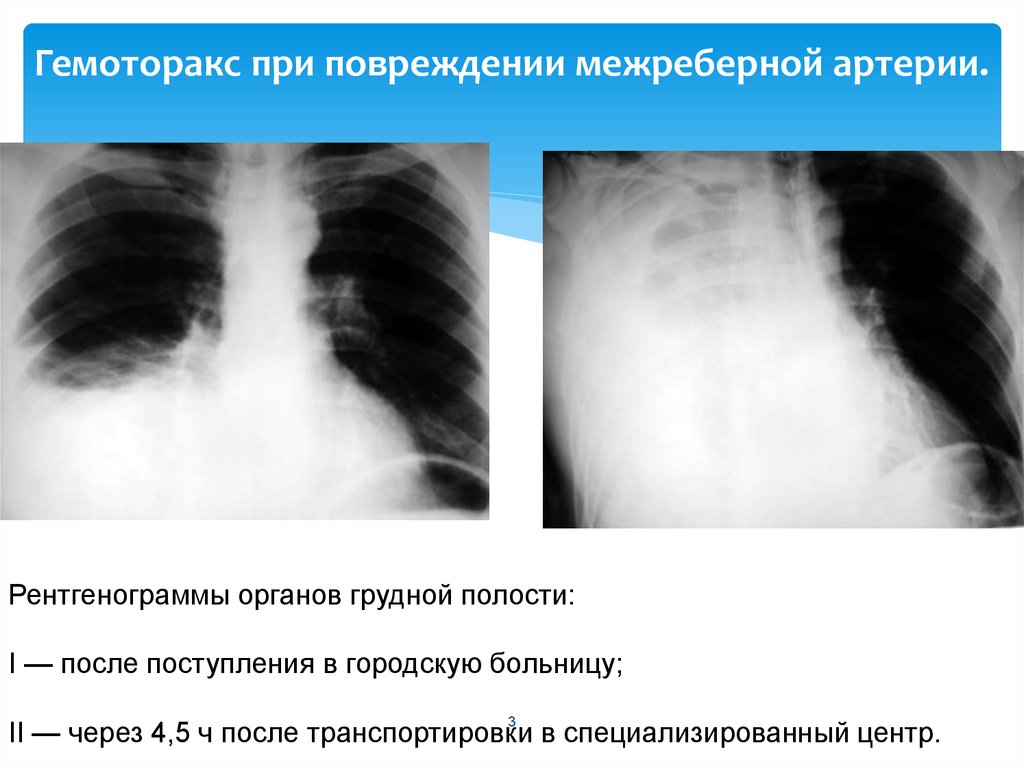 Клин Гериатр Мед. 2018 фев; 34(1):107-115. [PubMed: 2
Клин Гериатр Мед. 2018 фев; 34(1):107-115. [PubMed: 2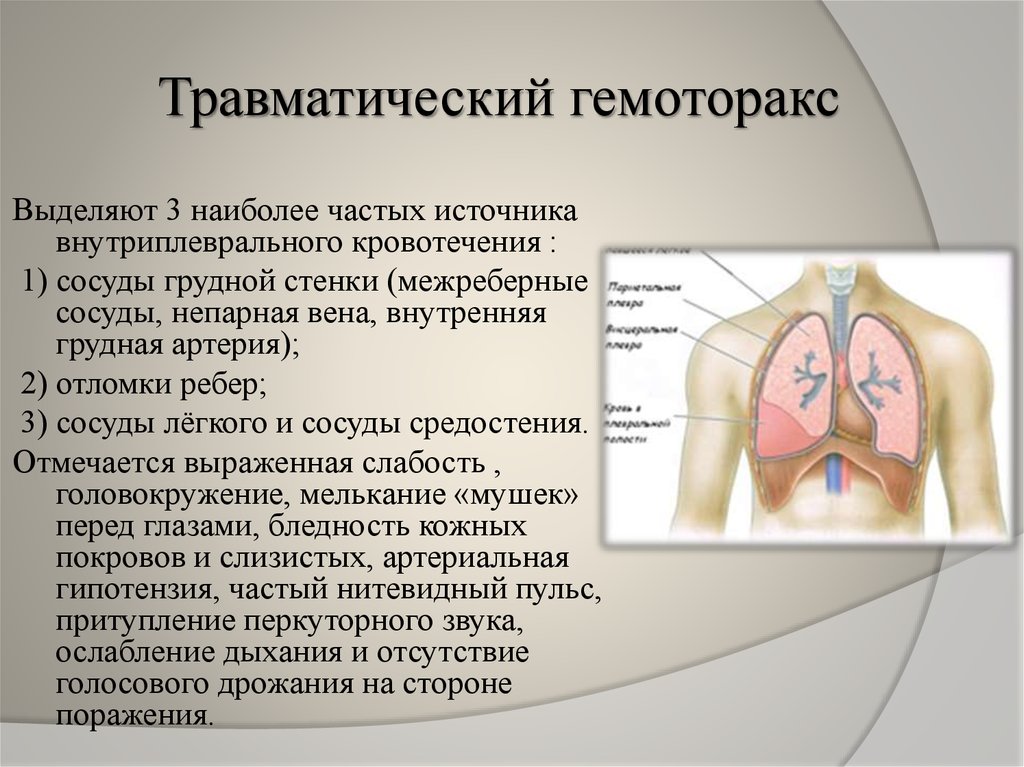 Б., Данэм М.Б., Болл К.Г. Лечение гемоторакса при тупой травме грудной клетки: протокол исследования для рандомизированного контролируемого исследования. Открытый БМЖ. 2018 03 марта; 8 (3): e020378. [Бесплатная статья PMC: PMC5855202] [PubMed: 29
Б., Данэм М.Б., Болл К.Г. Лечение гемоторакса при тупой травме грудной клетки: протокол исследования для рандомизированного контролируемого исследования. Открытый БМЖ. 2018 03 марта; 8 (3): e020378. [Бесплатная статья PMC: PMC5855202] [PubMed: 29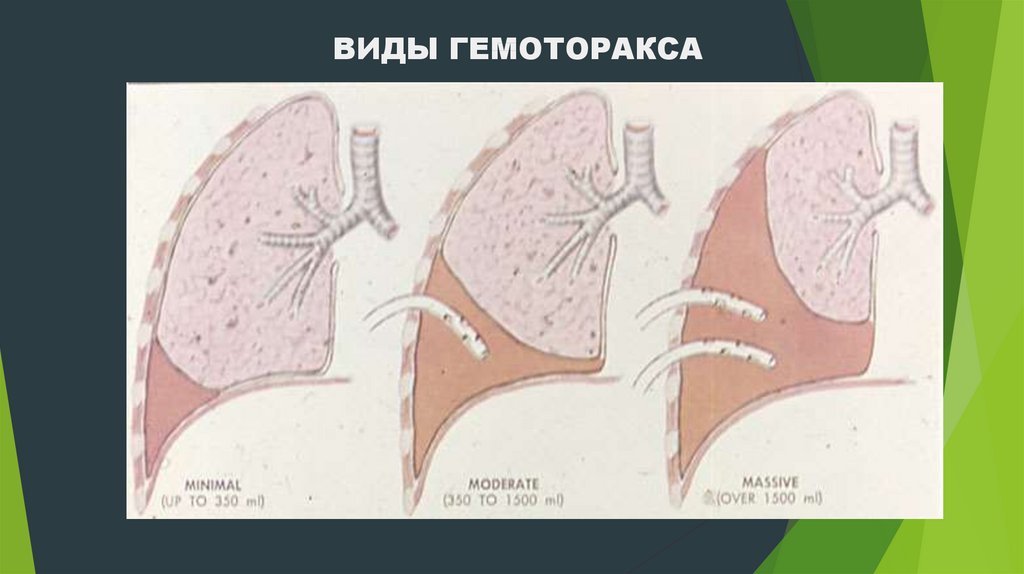 Для постановки диагноза гемоторакс необходима плевральная жидкость с гематокритом 25-50% крови больного. [1]
Для постановки диагноза гемоторакс необходима плевральная жидкость с гематокритом 25-50% крови больного. [1] 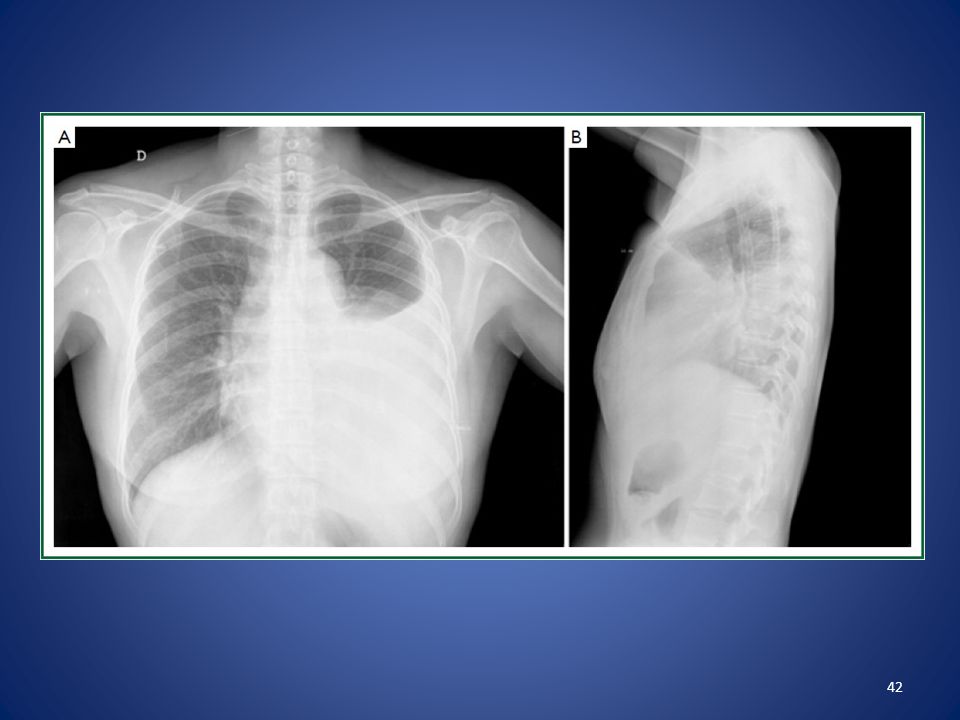 [1] [3] Спонтанный гемоторакс обычно вызывается разрывом плевральных спаек, новообразованиями, плевральными метастазами и является осложнением антикоагулянтной терапии легочной эмболии. [4]
[1] [3] Спонтанный гемоторакс обычно вызывается разрывом плевральных спаек, новообразованиями, плевральными метастазами и является осложнением антикоагулянтной терапии легочной эмболии. [4] 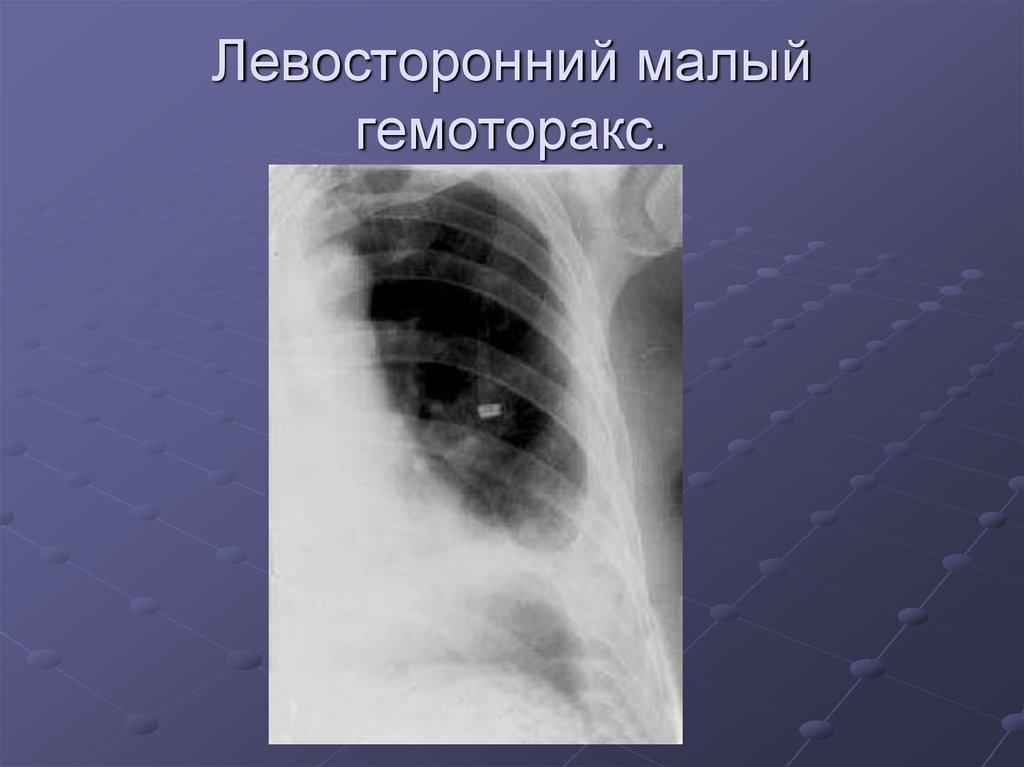 [4] [2] Плевральный выпот и оценка симптомов (ПОЖАЛУЙСТА) Результаты исследования показывают уменьшение одышки и снижение толерантности к физической нагрузке у большинства пациентов с симптоматическим плевральным выпотом после дренирования [5] .
[4] [2] Плевральный выпот и оценка симптомов (ПОЖАЛУЙСТА) Результаты исследования показывают уменьшение одышки и снижение толерантности к физической нагрузке у большинства пациентов с симптоматическим плевральным выпотом после дренирования [5] . [2]
[2] 
 Сундук 2001 г., февраль; 119 (2): 590e602.
Сундук 2001 г., февраль; 119 (2): 590e602. org/0000-0003-1639-8781Джефф Чой1,
org/0000-0003-1639-8781Джефф Чой1,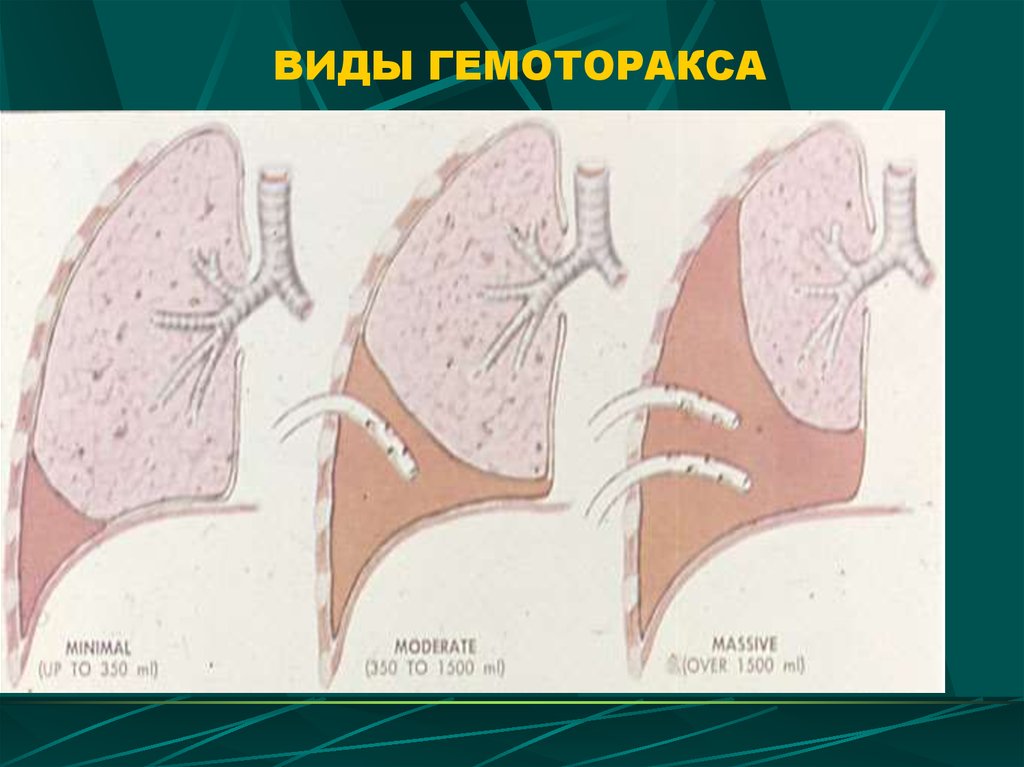 Отсроченное прогрессирование и отсроченное развитие травматического гемоторакса (dHTX) не были хорошо охарактеризованы. Мы предположили, что dHTX будет нечастым, но связанным с факторами, которые могут помочь в прогнозировании.
Отсроченное прогрессирование и отсроченное развитие травматического гемоторакса (dHTX) не были хорошо охарактеризованы. Мы предположили, что dHTX будет нечастым, но связанным с факторами, которые могут помочь в прогнозировании.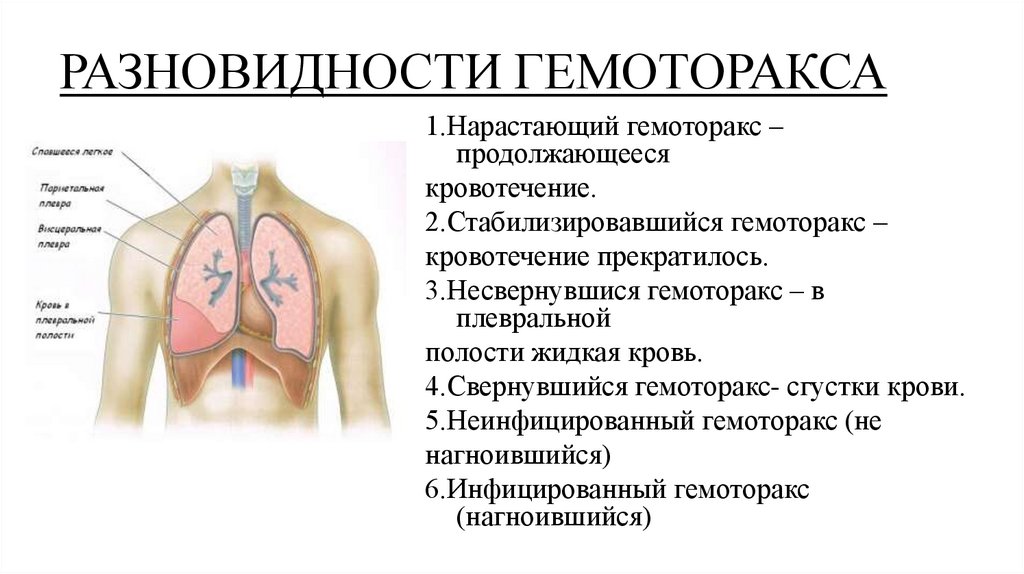 После первоначальной КТ грудной клетки, отрицательной в отношении гемоторакса, пациенты не подвергались последующей визуализации до тех пор, пока не развились новые симптомы (одышка, боль в груди): восемь (57%) не были диагностированы до выписки из первичной госпитализации (среднее значение (диапазон) : 9 (2–20) дней после выписки). Аспирин и/или антикоагулянты применялись менее чем в половине случаев (43%). Согласно таксономии CWIS, у всех пациентов была серия заднелатеральных переломов с по крайней мере одним смещением или переломом со смещением и в среднем шесть последовательных переломов ребер. Всем пациентам была выполнена трубчатая торакостомия, а шести пациентам (42%) — все в возрасте до 65 лет — были проведены оперативные вмешательства.
После первоначальной КТ грудной клетки, отрицательной в отношении гемоторакса, пациенты не подвергались последующей визуализации до тех пор, пока не развились новые симптомы (одышка, боль в груди): восемь (57%) не были диагностированы до выписки из первичной госпитализации (среднее значение (диапазон) : 9 (2–20) дней после выписки). Аспирин и/или антикоагулянты применялись менее чем в половине случаев (43%). Согласно таксономии CWIS, у всех пациентов была серия заднелатеральных переломов с по крайней мере одним смещением или переломом со смещением и в среднем шесть последовательных переломов ребер. Всем пациентам была выполнена трубчатая торакостомия, а шести пациентам (42%) — все в возрасте до 65 лет — были проведены оперативные вмешательства. Наши предварительные результаты предполагают возможное анатомическое объяснение связи тяжелых травм грудной клетки с dHTX. Дальнейшая характеристика и выявление истинной заболеваемости dHTX в первую очередь требует более широкого признания этого осложнения.
Наши предварительные результаты предполагают возможное анатомическое объяснение связи тяжелых травм грудной клетки с dHTX. Дальнейшая характеристика и выявление истинной заболеваемости dHTX в первую очередь требует более широкого признания этого осложнения. Вы сможете получить быструю цену и мгновенное разрешение на повторное использование контента различными способами.
Вы сможете получить быструю цену и мгновенное разрешение на повторное использование контента различными способами. Старение населения США и растущая частота переломов ребер среди пожилых людей подчеркивают острую потребность в лучшем понимании.3 В этом предварительном исследовании изучались пожилые люди с dHTX после перенесенных переломов ребер, чтобы определить направление будущих исследований. Мы предположили, что dHTX будет нечастым, но связанным с факторами, которые могут помочь в идентификации.
Старение населения США и растущая частота переломов ребер среди пожилых людей подчеркивают острую потребность в лучшем понимании.3 В этом предварительном исследовании изучались пожилые люди с dHTX после перенесенных переломов ребер, чтобы определить направление будущих исследований. Мы предположили, что dHTX будет нечастым, но связанным с факторами, которые могут помочь в идентификации.
 0% кортикального контакта), со смещением (кортикальный контакт отсутствует)), тип перелома (простой, клиновидный, сложный), переломы соседних ребер (серия, а не серия) и расположение грудной стенки (передняя, боковая, задняя, реберная). В дополнение к переломам ребер мы также отметили рентгенологические повреждения легких (эмфизема мягких тканей грудной клетки, разрыв или ушиб легкого, пневмоторакс).
0% кортикального контакта), со смещением (кортикальный контакт отсутствует)), тип перелома (простой, клиновидный, сложный), переломы соседних ребер (серия, а не серия) и расположение грудной стенки (передняя, боковая, задняя, реберная). В дополнение к переломам ребер мы также отметили рентгенологические повреждения легких (эмфизема мягких тканей грудной клетки, разрыв или ушиб легкого, пневмоторакс). Пациентам был назначен низкомолекулярный гепарин для стационарной химиопрофилактики венозной тромбоэмболии. Все пациенты в возрасте ≥65 лет пострадали от падения с уровня земли, что является наиболее частым механизмом травмы (n = 6, 43%), тогда как у пациентов моложе 65 лет были травмы с большей силой. Дополнительные онлайн-данные детализируют индивидуальные характеристики пациентов.
Пациентам был назначен низкомолекулярный гепарин для стационарной химиопрофилактики венозной тромбоэмболии. Все пациенты в возрасте ≥65 лет пострадали от падения с уровня земли, что является наиболее частым механизмом травмы (n = 6, 43%), тогда как у пациентов моложе 65 лет были травмы с большей силой. Дополнительные онлайн-данные детализируют индивидуальные характеристики пациентов. У всех пациентов был как минимум один перелом со смещением или со смещением, в среднем 3,5 перелома со смещением или со смещением. У всех пациентов были заднебоковые переломы и следующая картина переломов между 6-м и 10-м ребрами: серия заднебоковых переломов с по крайней мере одним переломом со смещением или со смещением.
У всех пациентов был как минимум один перелом со смещением или со смещением, в среднем 3,5 перелома со смещением или со смещением. У всех пациентов были заднебоковые переломы и следующая картина переломов между 6-м и 10-м ребрами: серия заднебоковых переломов с по крайней мере одним переломом со смещением или со смещением. В общей сложности семь пациентов получили переливание крови.
В общей сложности семь пациентов получили переливание крови. Запоздалое распознавание гемоторакса иногда требовало хирургического дренирования и декортикации. Пациенты в возрасте 50–64 лет с dHTX перенесли травму с более высокой силой и нуждались в оперативном вмешательстве, что потенциально отличается от фенотипа пациентов старше 65 лет, которые испытали падения с уровня земли и которым была проведена трубчатая торакостомия.
Запоздалое распознавание гемоторакса иногда требовало хирургического дренирования и декортикации. Пациенты в возрасте 50–64 лет с dHTX перенесли травму с более высокой силой и нуждались в оперативном вмешательстве, что потенциально отличается от фенотипа пациентов старше 65 лет, которые испытали падения с уровня земли и которым была проведена трубчатая торакостомия. большее движение во время дыхания может представлять больший риск повреждения нижележащих межреберных артерий с течением времени. Физиологическое значение сомнительно, но заднелатеральные межреберные артерии получают кровь из аорты и крупнее передних межреберных артерий, ответвляющихся от внутренних грудных артерий. Кроме того, скорость кровотока выше в нижних межреберных артериях (шестой и каудальной)7, 9.0005
большее движение во время дыхания может представлять больший риск повреждения нижележащих межреберных артерий с течением времени. Физиологическое значение сомнительно, но заднелатеральные межреберные артерии получают кровь из аорты и крупнее передних межреберных артерий, ответвляющихся от внутренних грудных артерий. Кроме того, скорость кровотока выше в нижних межреберных артериях (шестой и каудальной)7, 9.0005 Отсроченное обнаружение затрудняет лечение гемоторакса с помощью трубчатой торакостомии, потому что старая кровь может образовывать сгустки или служить очагом эмпиемы. Если dHTX прогрессирует бессимптомно, выявление факторов риска, таких как типичная картина перелома ребер, может иметь решающее значение для упреждающего выявления пациентов с высоким риском. Чтобы смягчить предотвратимые повторные госпитализации и операции, у пациентов с высоким риском может потребоваться целенаправленная последующая визуализация даже при отсутствии клинических симптомов.
Отсроченное обнаружение затрудняет лечение гемоторакса с помощью трубчатой торакостомии, потому что старая кровь может образовывать сгустки или служить очагом эмпиемы. Если dHTX прогрессирует бессимптомно, выявление факторов риска, таких как типичная картина перелома ребер, может иметь решающее значение для упреждающего выявления пациентов с высоким риском. Чтобы смягчить предотвратимые повторные госпитализации и операции, у пациентов с высоким риском может потребоваться целенаправленная последующая визуализация даже при отсутствии клинических симптомов.