Инфекционные болезни дизентерия: Государственное учреждение «Минский городской центр гигиены и эпидемиологии»
Государственное учреждение «Минский городской центр гигиены и эпидемиологии»
Дизентерия (dysenteria) – инфекционное заболевание, вызываемое шигеллами, протекающее с явлениями интоксикации и преимущественным поражением отдела толстой кишки.
Этиология. Возбудители дизентерии относятся к роду Shigella, семейству Enterobacteriaceae.
Различают 4 вида шигелл:
1) Sh. dysenteria, к ним относятся бактерии Григорьева – Шиги, Штутцера – Шмитца и Ларджа–Сакса;
2) Sh. flexneri с подвидом Ньюкастл;
3) Sh. boydii;
4) Sh. sonnei.
В зависимости от температуры, влажности, рН среды, вида и количества микроорганизмов длительность выживания дизентерийных бактерий колеблется от нескольких дней до месяцев. Благоприятной средой для бактерий являются пищевые продукты. Шигеллы Зонне в молоке и молочных продуктах способны не только длительно существовать, но и размножаться.
Возбудители дизентерии хорошо переносят высушивание и низкие температуры, но быстро погибают под действием прямых солнечных лучей и нагревания (при 60 °С – через 30 мин, 100 °С – почти мгновенно).
Эпидемиология. Источником инфекции являются больные острой или хронической дизентерией, реконвалесценты и лица с субклинической формой инфекционного процесса (бактерионосители). Наибольшую эпидемиологическую опасность представляют больные острой дизентерией, выделяющие в период разгара болезни в окружающую среду огромное количество возбудителей.
Длительность инкубационного периода (это период от момента заражения до возникновения первых клинических проявлений) колеблется от 1 до 7 дней (чаще составляет 2–3 дня).
Дизентерия – инфекция с фекально-оральным механизмом передачи возбудителей, реализация которого осуществляется пищевым, водным и контактно бытовым путями. Факторами передачи шигелл являются пищевые продукты, вода, руки и предметы обихода, почва.
Восприимчивость к дизентерии неодинакова у людей разных возрастных групп. Ведущей возрастной группой среди больных дизентерией являются дети дошкольного возраста.
Ведущей возрастной группой среди больных дизентерией являются дети дошкольного возраста.
Дизентерию, как и другие острые кишечные заболевания, характеризует выраженная осенне-летняя сезонность. Число заболеваний, регистрируемых в июле – сентябре, составляет, как правило, половину всей суммы заболеваний за год.
Клиника. Поступление шигелл в организм сопровождается гибелью части бактерий в желудке и кишечнике вследствие воздействия желудочного и других пищеварительных соков. Однако часть бактерий, обладающих способностью проникать, преодолев все барьеры, поражает кишечник. Жизнедеятельность, а так же гибель шигелл в тонкой кишке сопровождается продукцией токсинов. Симптомы интоксикации, а также боли в животе, возникающие в начальном периоде болезни, во многом обусловлены именно действием токсина. Нарушения, вызванные поражением шигеллами тонкого и толстого кишечника, определяют развитие диарейного синдрома.
В большинстве случаев заболевание начинается остро. Больные жалуются на озноб и жар. Температура тела быстро повышается до максимальных цифр (38–40 °С), держится на этом уровне от нескольких часов до 2–5 дней. Так же дизентерия может протекать с субфебрильной температурой, а иногда без ее повышения.
Температура тела быстро повышается до максимальных цифр (38–40 °С), держится на этом уровне от нескольких часов до 2–5 дней. Так же дизентерия может протекать с субфебрильной температурой, а иногда без ее повышения.
У большинства больных с самого начала появляются слабость, разбитость, апатия, подавленность настроения, головная боль, которые достигают наивысшей степени на высоте подъема температуры.
При типичном классическом течении дизентерии ведущим является симптомокомплекс колита. Больные жалуются на режущие, схваткообразные боли в животе, локализованные в подвздошных областях, больше слева, интенсивность и длительность которых зависят от формы и тяжести болезни. Позывы к дефекации чаще бесплодные, сопровождаются мучительными тянущими болями в области прямой кишки – тенезмами. При тяжелых формах шигеллеза наблюдается учащение стула до 20–30 раз в сутки и более. Дефекация, как правило, не приносит облегчения. В первые часы заболевания, стул довольно обильный, полужидкий или жидкий, часто слизистый.
Заболевание, как правило, заканчивается выздоровлением с полным восстановлением нарушенных функций органов и систем и освобождение организма от возбудителя в течение 2–3 недель. Однако позднее обращение за медицинской помощью, неадекватная терапия могут привести к переходу болезни в хроническую форму, и чаще к развитию так называемых постдизентерийных состояний. Они проявляются в виде функциональных нарушений секреции и моторики желудочно-кишечного тракта. Различают две формы хронической дизентерии – рецидивирующую и непрерывную.
Больных дизентерией можно лечить как на дому, так и в стационаре. Вопрос о госпитализации решается на основании клинико-эпидемиологических данных. Госпитализации подлежат больные со средней тяжести и тяжелым течением дизентерии, лица с тяжелыми сопутствующими заболеваниями, а также больные, представляющие повышенную эпидемиологическую опасность (в основном это лица, работа которых связана с продуктами питания, и приравненный к ним контингент).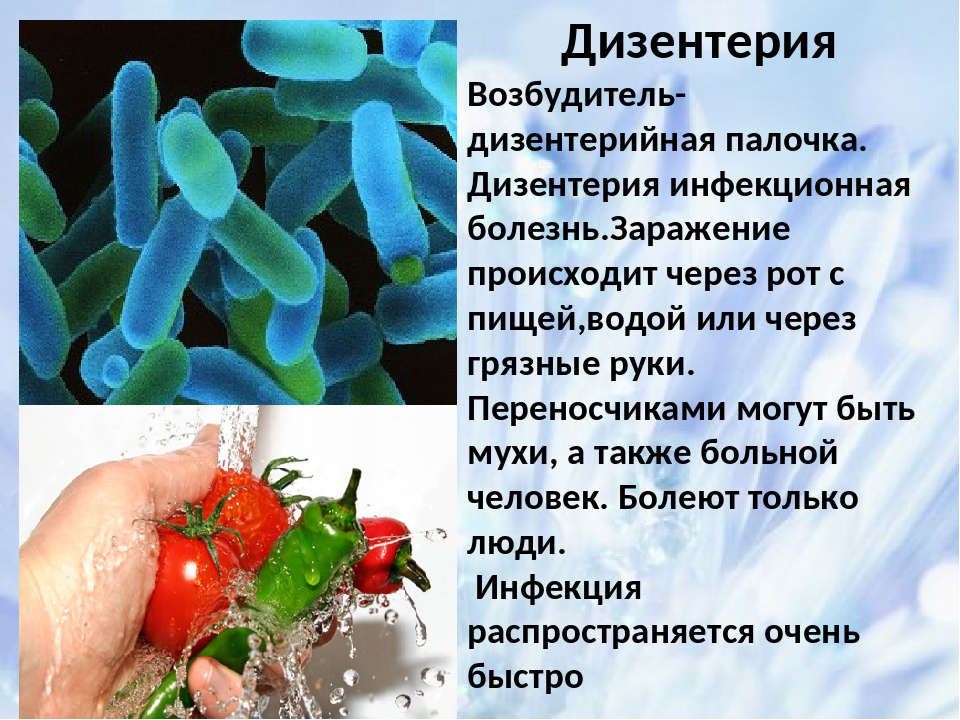
Принцип комплексности терапии больных дизентерией включает лечебно охранительный режим, диету, этиотропную, патогенетическую и иммунорегулирующую терапию.
Лечебно охранительный режим предполагает уменьшение воздействия раздражителей, постельное или полупостельное содержание больных, удлиненный физиологический сон.
Питание больным дизентерией назначают в зависимости от периода болезни и степени выраженности поражения кишечника.
Профилактические и противоэпидемические мероприятия. Успешная профилактика дизентерии обеспечивается комплексом лечебно-профилактических и санитарно- гигиенических, а также противоэпидемических мероприятий.
Профилактика шигеллезов включает проведение мероприятий по обеспечению населения доброкачественными, безопасными в эпидемическом отношении, пищевыми продуктами и питьевой водой. Существенное значение так же имеет гигиеническое обучение населения правилам безопасного в эпидемическом отношении поведения и мерам личной профилактики и особенно работников отдельных профессий, связанных непосредственно с процессом производства, приготовления, хранения, транспортировки и реализации пищевых продуктов, воспитания детей и подростков и др.
Мероприятия, направленные на источник инфекции, включают в себя раннее выявление, обязательную регистрацию всех больных с острыми кишечными инфекциями и их лечение. Особое значение имеет своевременное распознавание стертых, субклинических форм дизентерии.
В очаге дизентерии проводится текущая дезинфекция, а после госпитализации больного осуществляется заключительная дезинфекция. Больных перенесших дизентерию выписывают после полного клинического выздоровления при отрицательных результатах их бактериологического обследования.
Вакцинация населения не проводится в связи с отсутствием эффективных прививочных препаратов.
Дизентерия: симптомы и лечение — РИА Новости, 09.02.2010
Возбудители дизентерии отличаются высокой выживаемостью во внешней среде. В зависимости от температурно-влажностных условий они сохраняются от 3–4 суток до 1–2 месяцев, а в ряде случаев до 3–4 месяцев и даже более. При благоприятных условиях шигеллы способны к размножению в пищевых продуктах (салатах, винегретах, вареном мясе, фарше, вареной рыбе, молоке и молочных продуктах, компотах и киселях).
Возбудители дизентерии попадают в организм здорового человека через рот при бытовом контакте с больным дизентерией или бациллоносителем и при употреблении зараженных пищевых продуктов или воды. Инкубационный период составляет 1–7 (в среднем 2–3) дней, но может сокращаться до 2–12 часов.
Форма, вариант и тяжесть течения дизентерии зависят от путей и способов заражения, количества попавших в организм микробов, уровня иммунитета организма.
Заболевание начинается быстро. В начале развивается синдром общей интоксикации, характеризующийся повышением температуры тела, ознобом, чувством жара, разбитости, снижением аппетита, головной болью, снижением артериального давления.
Поражение желудочно-кишечного тракта проявляется болями в животе, вначале тупыми, разлитыми по всему животу, имеющими постоянный характер. Затем они становятся более острыми, схваткообразными, локализуются в нижних отделах живота, чаще слева. Боли обычно усиливаются перед опорожнением кишечника.
При легком течении болезни лихорадка кратковременна, от нескольких часов до 1–2 суток, температура тела, как правило, повышается до 38°С. Больных беспокоят умеренные боли в животе, в основном перед актом опорожнения кишечника. Испражнения имеют кашицеобразную или полужидкую консистенцию, частота дефекаций до 10 раз в сутки, примесь слизи и крови не видна. Интоксикация и диарея сохраняются в течение 1–3 дней. Полное выздоровление наступает через 2–3 недели.
Больных беспокоят умеренные боли в животе, в основном перед актом опорожнения кишечника. Испражнения имеют кашицеобразную или полужидкую консистенцию, частота дефекаций до 10 раз в сутки, примесь слизи и крови не видна. Интоксикация и диарея сохраняются в течение 1–3 дней. Полное выздоровление наступает через 2–3 недели.
При среднетяжелом течении дизентерии начало болезни быстрое. Температура тела с ознобом повышается до 38–39°С и держится на этом уровне от нескольких часов до 2–4 суток. Больных беспокоят общая слабость, головная боль, головокружение, отсутствие аппетита. Кишечные расстройства, как правило, присоединяются в ближайшие 2–3 часа от начала болезни. У больных появляются периодические схваткообразные боли в нижней части живота, частые ложные позывы на дефекацию, ощущение незавершенности акта дефекации. Частота стула достигает 10–20 раз в сутки. Испражнения скудные, часто состоят из одной слизи с прожилками крови. Присутствует повышенная раздражительность, бледность кожи.
Тяжелое течение дизентерии характеризуется очень быстрым развитием заболевания, резко выраженной интоксикацией, глубокими нарушениями деятельности сердечно-сосудистой системы. Болезнь начинается крайне быстро. Температура тела с ознобом быстро повышается до 40°С и выше, больные жалуются на сильную головную боль, резкую общую слабость, повышенную зябкость, особенно в конечностях, головокружение при вставании с постели, полное отсутствие аппетита. Нередко появляются тошнота, рвота, икота. Больных беспокоят боли в животе, сопровождающиеся частыми позывами на дефекацию и мочеиспускание. Стул более 20 раз в сутки, нередко число дефекаций трудно сосчитать («стул без счета»). Период разгара болезни продолжается 5–10 дней. Выздоровление происходит медленно, до 3–4 недель, полная нормализация слизистой оболочки кишечника происходит через 2 месяца и более.
Тяжелое течение дизентерии отмечается главным образом у детей и стариков.
Диагноз хронической дизентерии устанавливается в случае, если заболевание продолжается более 3 месяцев.
Перенесенное заболевание не оставляет после себя надежного и длительного иммунитета. Больных дизентерией обычно помещают в лечебное учреждение для обеспечения им надлежащего ухода и лечения. В исключительных случаях при наличии соответствующих условий (отдельная квартира, наличие ухаживающего персонала и т. д.) по решению лечащего врача и эпидемиолога больной может быть оставлен на дому.
Среди осложнений болезни наиболее частыми являются: инфекционно-токсический шок, инфекционно-токсическое поражение нервной системы, перитонит, пневмония.
Профилактика дизентерии основывается на проведении широких санитарных мероприятий, направленных па благоустройство населенных мест, усиление санитарного надзора за пищевыми объектами, водопроводами и т. п. Эти меры должны сопровождаться санитарно-просветительной работой по повышению уровня гигиенических навыков населения, т.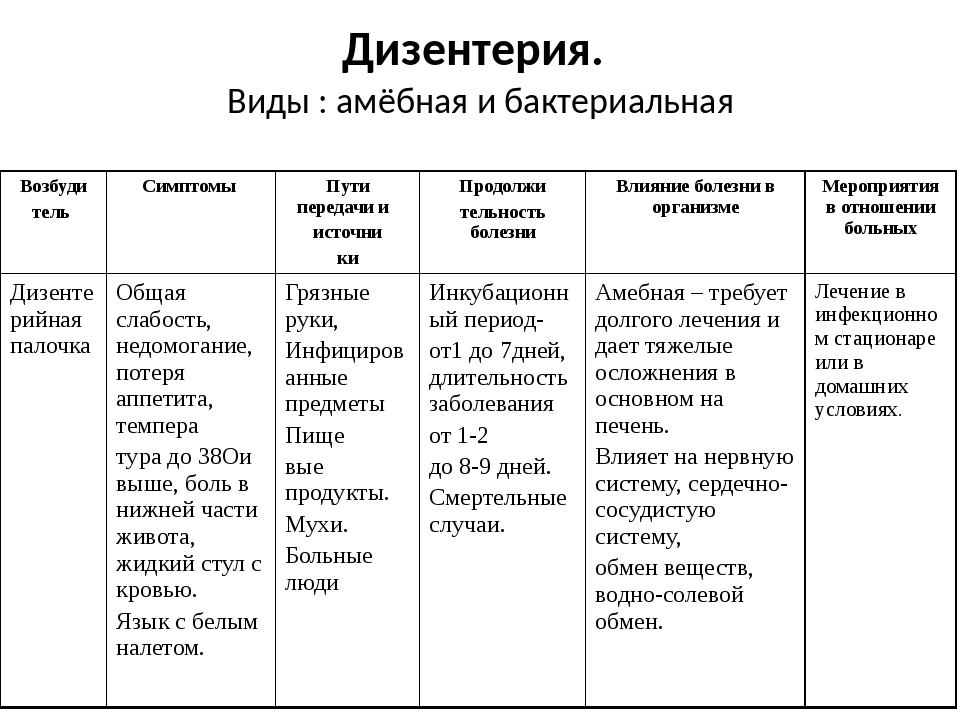 к. соблюдение элементарных правил личной гигиены (мытье рук перед едой и после уборной, употребление мытых фруктов и овощей и доброкачественной воды и молока) надежно предохраняет от заражения дизентерией.
к. соблюдение элементарных правил личной гигиены (мытье рук перед едой и после уборной, употребление мытых фруктов и овощей и доброкачественной воды и молока) надежно предохраняет от заражения дизентерией.
Материал подготовлен на основе информации открытых источников
Профилактика дизентерии — Детская городская поликлиника №1
Дизентерия — это инфекционная болезнь общего характера, которую вызывают дизентерийные бактерии. Наиболее часто развитие заболевания провоцируют шигеллы.
Чаще всего диагностируется дизентерия у детей в возрасте от двух до семи лет. Но болезнь может поражать людей из любой возрастной группы.
Симптомы дизентерии в основном проявляются летом. Инфекция распространяется быстро, и если не будут соблюдаться главные правила гигиены, то ребенку может понадобиться лечение дизентерии. Именно поэтому профилактика заболевания состоит, не только в строгом следовании общим гигиеническим нормам, но и в иммунопрофилактике заболевания.
Как передается дизентерия?
Инфекция распространяется от больных острой и хронической формой болезни. Также заражение возможно от бактериовыделителей, которыми являются люди с легким течением недуга. Такие больные ввиду легкости симптомов к врачу не обращаются. Инфекция может передаваться через еду и питье, также ее разносят мухи. Передача возбудителя может произойти и через грязные руки.
Симптомы дизентерии
Выделяется две формы дизентерии – острая и хроническая. При острой форме заболевания человек может болеть от 3-4 дней до трех месяцев. Если болезнь продолжается дольше, то речь уже идет о хронической форме дизентерии. Длительность инкубационного периода в обоих случаях может колебаться от 18 часов до 5 суток.
Если у больного имеет место среднетяжелое течение болезни, то его признаки выражены более остро. Изначально человек ощущает слабость и недомогание, позже появляются схваткообразные боли в животе. Стул жидкий, с примесями крови и слизи, его частота может доходить до 25 раз в сутки. В первые двое суток развития дизентерии частота стула нарастает. Кроме того у больного повышается температура тела, которая может достигать 39 градусов.
В первые двое суток развития дизентерии частота стула нарастает. Кроме того у больного повышается температура тела, которая может достигать 39 градусов.
У большинства больных боль в животе продолжается длительное время. Часто отмечается вздутие живота.
При тяжелой форме острой дизентерии все симптомы более выражены: стул очень частый с примесями слизи , крови и гноя; наблюдается рвота, тошнота; температура тела держится длительное время на высоких цифрах. В случае отсутствия адекватного лечения заболевания, оно переходит в хроническую форму.
У детей дизентерия протекает более тяжело. Стул бывает срезу обильным, в нем появляются комочки слизи серо- зеленого цвета. Организм ребенка сильно обезвоживается. Родители должны осознавать и тот факт, что обезвоживание тем опаснее, чем младше ребенок. При тяжелой форме дизентерии у малыша может развиваться сердечно-сосудистая недостаточность, появляются судороги, нарушается сознание.
Лечение дизентерии направлено на уничтожение возбудителей заболевания и у детей младшего возраста проводится в стационаре инфекционного профиля.
Профилактика дизентерии
Для профилактики заболевания очень важно соблюдать все санитарно-гигиенические нормы.
Меры личной профилактики – это, прежде всего, регулярное и тщательное мытье рук. Кроме того, важно вовремя избавляться от мух в помещении и не допускать, чтобы они контактировали с пищевыми продуктами. Родители должны всеми силами обеспечивать защиту ребенка от заражения болезнетворными микроорганизмами. Следует следить не только за тем, чтобы ребенок мыл руки после туалета и прогулок, но и не допускать употребления немытых фруктов, овощей.
В настоящее время заболевания можно избежать путем проведения вакцинации.
Имеющаяся вакцина обеспечивает невосприимчивость к инфекции в течение 1 года.
Вакцина применяется с целью профилактики дизентерии Зонне у взрослых и детей в возрасте от трех лет. Первоочередная вакцинация рекомендуется для :
- детей, посещающих детские учреждения и отъезжающих в оздоровительные лагеря;
- работников инфекционных стационаров и бактериологических лабораторий;
- лиц, занятых в сфере общественного питания и коммунального благоустройства.

Профилактические прививки против дизентерии Зонне предпочтительно проводить перед сезонным подьемом этой инфекции. Прививка проводится однократно.
ПОМНИТЕ, ЧТО НАДЕЖНЕЙ И БЕЗОПАСНЕЙ ИНФЕКЦИЮ ПРЕДУПРЕДИТЬ, ЧЕМ БОРОТЬСЯ С НЕЙ В РАЗГАРЕ И ЕЕ ПЕЧАЛЬНЫМИ ПОСЛЕДСТВИЯМИ!
БУДЬТЕ ЗДОРОВЫ!
По вопросам вакцинации Вы можете обращаться к специалистам отделения платных медицинских услуг ГБУЗ АО «ДГП №1» — кабинет 224 , 2 этаж, тел. 48-16-41
Лабораторная диагностика дизентерии в Санкт-Петербурге, цена в СЗДЦМ
Шигеллёз, или бактериальную дизентерию, относят к кишечным инфекциям с фекально-оральным механизмом передачи возбудителя заболевания — бактерий рода Shigella. Шигеллы поражают преимущественно толстый кишечник, вызывают интоксикацию, а заболевание в запущенной форме может приводить к различным осложнениям (стойкому нарушению пищеварения, гиповитаминозу, перфорации кишечника, перитониту и др).
Различают 4 вида шигелл: Флекснера, Зонне, Бойда, дизентерии.
Важная особенность шигелл в том, что они способны менять чувствительность к лекарственным препаратам. Если какое-либо антибактериальное средство достаточно часто используется в отдельном регионе (например, при выращивании птицы), то возбудитель может оказаться нечувствительны к данному препарату. Это значительно затрудняет терапию.
Лекарственная устойчивость возбудителей, их способность выживать во внешней среде с некоторых пор снова приводят к массовым вспышкам дизентерии и даже крупным эпидемиям, во время которых летальный исход составляет до 5 % от заболевших.
Главный фактор в патогенезе дизентерии — это выделение токсинов, обуславливающих основные клинические проявления. Дизентерийные токсины действуют местно в просвете кишечника, всасываясь в кровь, воздействуют на стенки сосудов, центральную нервную систему, печень, органы кровообращения.
• Острая дизентерия в колитическом, гастроэнтеритическом, гастроэнтероколитическом вариантах с легким, средне-тяжелым и тяжелым течением;
• Возможно стертое и затяжное течение заболевания;
• Хроническая дизентерия в рецидивирующей или непрерывной форме;
• Транзиторное бактериовыделение.
Симптомы дизентерии и осложненияИнкубационный период длится обычно 3 дня, но, в зависимости от возбудителя, состояния организма и инфицирующей дозы (количество проникших клеток) может затягиваться до 7 дней или сокращаться до суток.
При колитическом варианте болезнь развивается остро с повышением температуры, снижением аппетита, тошнотой, интенсивной режущей болью в животе. Сначала боль разливается по всему животу, потом концентрируется внизу и в правой подвздошной области. Течение болезни сопровождается диареей — 10 и более раз за сутки. При этом кал быстро теряет нормальную консистенцию, в нём появляются примеси в виде крови, слизи, гноя, а позывам к дефекации сопутствует мучительная боль. Столь острые клинические симптомы постепенно исчезают через неделю-полторы, а язвенные поражения слизистой — примерно через месяц.
Течение болезни сопровождается диареей — 10 и более раз за сутки. При этом кал быстро теряет нормальную консистенцию, в нём появляются примеси в виде крови, слизи, гноя, а позывам к дефекации сопутствует мучительная боль. Столь острые клинические симптомы постепенно исчезают через неделю-полторы, а язвенные поражения слизистой — примерно через месяц.
Гастроэнтеритический вариант характеризуется тошнотой, рвотой, диареей с обильным жидким стулом. Боль в этом случае локализуется в области пупка, эпигастральной области.
Гастроэнтероколитический вариант характеризуется сочетанием колитического и гастрокэнтеритического синдромов
Частым явлением стала стёртая дизентерия. При такой форме больной испытывает легкое недомогание, умеренную болезненность в животе без определённой локализации, у него жидкий или кашицеобразный стул с обычным интервалом — 1—2 раза за сутки. Дизентерия, продолжающаяся более трех месяцев, диагностируется как хроническая. Чтобы избежать более тяжёлых последствий и перерастания болезни в хроническую форму, необходимо при подозрительных симптомах обязательно сдать анализы.
Чтобы избежать более тяжёлых последствий и перерастания болезни в хроническую форму, необходимо при подозрительных симптомах обязательно сдать анализы.
Осложнения при дизентерии:
• инфекционно-токсический шок;
• перфорация кишечника;
• перитонит;
• парезы кишечника;
• геморрой;
• анальные трещины;
• дисбактериоз;
• выпадение прямой кишки.
Осложнения возникают при запоздалом обращении к врачам, тяжёлых случаях, неправильно выбранной терапии, как следствие низкого качества диагностики или квалификации врача. Чтобы тяжёлых последствий избежать, нужно обращаться к врачу при первых симптомах и проходить лабораторные исследования в надёжных, и современных лабораториях.
Источники инфекции, механизмы передачи
Источник инфекции — человек, больной различными формами дизентерии, в том числе и бессимптомными. Заражение реализуется контактно-бытовым, водным и пищевым путями. Болеют люди всех возрастных групп, наиболее подвержены лица с ослабленным иммунитетом и дети дошкольного возраста. Заболевшие дизентерией опасны для окружающих почти сразу после заражения и в течение всего периода реконвалесценции (выздоровления). Если же болезнь приобретает хроническую форму, то выделение возбудителя происходит месяцами. Нужно отметить, что у людей восприимчивость к болезни разная.
Заражение реализуется контактно-бытовым, водным и пищевым путями. Болеют люди всех возрастных групп, наиболее подвержены лица с ослабленным иммунитетом и дети дошкольного возраста. Заболевшие дизентерией опасны для окружающих почти сразу после заражения и в течение всего периода реконвалесценции (выздоровления). Если же болезнь приобретает хроническую форму, то выделение возбудителя происходит месяцами. Нужно отметить, что у людей восприимчивость к болезни разная.
Возбудитель при дизентерии выделяют из испражнений.
Возможно исследование крови для определения антител к шигеллам (ответная реакция организма на встречу с возбудителем заболевания).
Методы лабораторной диагностики дизентерии
Копрограмма — это анализ кала: его состава, свойств, примесей. При шигеллезе в кале обнаруживаются включения слизи, скопления лейкоцитов более 20-30 в поле зрения, эритроциты и эпителиальные клетки.
Общий анализ крови
При тяжёлой форме шигеллеза отмечают следующие изменения:
• лейкоцитоз с нейтрофильным сдвигом формулы влево;
• токсическую зернистость нейтрофилов;
• увеличение СОЭ;
Бактериологический посев
Это ведущий специфический метод диагностики дизентерии, который заключается в проведении посева кала на специальные питательные среды для выделения патогенных бактерий. Бактериальный посев используют как подтверждающий анализ, потому что его результаты известны только через 2-5 дней. Однако он чрезвычайно важен для точной постановки диагноза и определения чувствительности к антибактериальным препаратам. По результатам исследования врач корректирует проводимое лечение
Серологическое исследование
Задачей серологической диагностики является определить специфические антитела в крови к основным видам шигелл. Для анализа используют реакцию непрямой гемагглютинации — РНГА. В разведённую сыворотку крови в лаборатории добавляют эритроциты с антигенами шигелл разных видов. Через сутки результат готов: если в пробах есть специфические иммунные антитела к шигеллам, то образуются агглютинины. Антитела при дизентерии появляются в конце первой недели болезни и достигают максимума на 21-25 день, затем титр антител уменьшается. Поэтому целесообразно использовать метод парных сывороток, то есть исследовать две пробы крови, взятые с интервалом 10-14 дней. Диагностическое значение имеет нарастание титра антител в четыре и более раз.
Для анализа используют реакцию непрямой гемагглютинации — РНГА. В разведённую сыворотку крови в лаборатории добавляют эритроциты с антигенами шигелл разных видов. Через сутки результат готов: если в пробах есть специфические иммунные антитела к шигеллам, то образуются агглютинины. Антитела при дизентерии появляются в конце первой недели болезни и достигают максимума на 21-25 день, затем титр антител уменьшается. Поэтому целесообразно использовать метод парных сывороток, то есть исследовать две пробы крови, взятые с интервалом 10-14 дней. Диагностическое значение имеет нарастание титра антител в четыре и более раз.
Полимеразная цепная реакция (ПЦР) – заключается в определении фрагментов ДНК шигелл в кале. Это быстрый и надежный метод исследования.
Ректороманоскопия
Это инструментальный метод диагностики, который проводят с помощью ректоскопа, вводимого в анальный проход больного. С помощью окуляра врач оценивает состояние слизистой, определяет изменения, характерные для дизентерии.
Профилактика и лечение дизентерии
Лечение дизентерии может проводиться дома, либо в стационаре (в случае средней или тяжелой форма болезни). Госпитализация также необходима и людям с тяжёлыми сопутствующими, хроническими патологиями.
Лечение заключается в приёме антибиотиков, специфических дизентерийных бактериофагов, строгом постельном режиме и специальной диете (стол № 4) с нежирными бульонами, куриным мясом, нежирной рыбой, киселями, кашами, зелёным чаем, отваром шиповника.
Профилактикой заболевания является строгое соблюдение личной гигиены, медицинский осмотр людей, работающих в местах общественного питания, постоянный контроль водных источников, общественных водоёмов, бассейнов, предприятий питания и т. д.
Как сдать анализ на дизентерию в АО «СЗЦДМ»
Только раннее выявление заражения шигеллами гарантирует минимальный риск здоровью и скорое выздоровление. Потому при первых признаках недомогания и в качестве профилактики необходимо пройти лабораторные исследования на предмет заражения возбудителем шигеллёза.
Потому при первых признаках недомогания и в качестве профилактики необходимо пройти лабораторные исследования на предмет заражения возбудителем шигеллёза.
Сделать это легко в подразделениях АО «СЗЦДМ». По интерактивной карте вы сможете определить ближайший к вам пункт исследований и выбрать удобное время. На сайте или через колл-центр можно записаться на приём к врачу.
Во всех наших лабораториях работают квалифицированные сотрудники, используются современные методики исследований и гарантирована полная безопасность вашему здоровью и сохранность — личным данным.
Будьте здоровы!Шигеллезная инфекция — Симптомы, диагностика и лечение
Шигеллезная инфекция легко распространяется фекально-оральным путем или через зараженные воду или пищу. Обычно она имеет картину самоизлечивающегося диарейного заболевания легкой степени.
S. dysenteriaе более распространена в развивающихся странах и вызывает более тяжелое заболевание дизентерией. S. dysenteriae серотипа 1 также является причиной гемолитико-уремического синдрома вследствие высвобождения шигатоксина.
S. dysenteriae серотипа 1 также является причиной гемолитико-уремического синдрома вследствие высвобождения шигатоксина.
В случае легкого течения заболевания, лечение, как правило, поддерживающее. Прием антибиотиков может быть целесообразным для сокращения продолжительности болезни и уменьшения выделения ее возбудителя вместе с испражнениями.
Эмпирическая антибиотикотерапия рекомендуется для детей и взрослых с тяжелой формой заболевания, престарелых, истощенных пациентов или пациентов с хроническими заболеваниями, а также для минимизации распространения возбудителя (например, в учреждениях).
Профилактика играет первостепенное значение, она включает основные меры гигиены, такие как мытье рук, доступ к чистой воде и надлежащее приготовление пищи; особенно это касается учреждений и лагерных городков во время стихийных бедствий. Вакцинация на стадии разработки.
Шигеллез является важной причиной диарейных заболеваний во всем мире, чаще всего болезнь поражает детей до 5 лет. Однако в около 40% случаев болезнь случается у взрослых.[1]Kotloff KL, Winickoff JP, Ivanoff B, et al. Global burden of Shigella infections: implications for vaccine development and implementation of control strategies. Bull World Health Organ. 1999;77(8):651-66.
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2557719/pdf/10516787.pdf
http://www.ncbi.nlm.nih.gov/pubmed/10516787?tool=bestpractice.com
Шигелла – это род семейства энтеробактерий, состоящий из 4-х видов аэробных неподвижных, нелактоферментных грамотрицательных палочек: S. sonnei, S. flexneri, S. boydii и S. dysenteriae.
Однако в около 40% случаев болезнь случается у взрослых.[1]Kotloff KL, Winickoff JP, Ivanoff B, et al. Global burden of Shigella infections: implications for vaccine development and implementation of control strategies. Bull World Health Organ. 1999;77(8):651-66.
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2557719/pdf/10516787.pdf
http://www.ncbi.nlm.nih.gov/pubmed/10516787?tool=bestpractice.com
Шигелла – это род семейства энтеробактерий, состоящий из 4-х видов аэробных неподвижных, нелактоферментных грамотрицательных палочек: S. sonnei, S. flexneri, S. boydii и S. dysenteriae.
Шигеллез может передаваться от человека к человеку (фекально-оральным путем), а также через зараженную воду и пищу. Вспышки возникают в учреждениях и в перенаселенных районах с неудовлетворительными санитарными условиями. Термин «кровавая диарея» иногда используется врачами как синоним шигеллеза, хотя эти понятия не идентичны.
ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ. ПРАВИЛА ПОВЕДЕНИЯ НАСЕЛЕНИЯ
ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ. ПРАВИЛА ПОВЕДЕНИЯ НАСЕЛЕНИЯ
ПРАВИЛА ПОВЕДЕНИЯ НАСЕЛЕНИЯ
По данным Всемирной организации здравоохранения, ежегодно на земном шаре переносят инфекционные заболевания свыше 1 млрд. человек. В течение короткого срока могут заразиться большие массы людей. Так, холера Эль-Тор, начавшись в 1960 г. в Индонезии, к 1971 г. охватила все страны мира. Четвертая пандемия (эпидемия, охватывающая группу стран, континентов) гриппа за два года (1968-1970) поразила около 2 млрд. человек всех континентов и унесла около 1,5 млн. жизней. Нет-нет да и появляются больные чумой, холерой, бруцеллезом. Все еще высок уровень заболеваемости острой дизентерией, брюшным тифом, дифтерией, вирусным гепатитом, сальмонеллезом, гриппом. Особенно опасно их возникновение на предприятиях, в учебных заведениях, воинских коллективах, где один может заразить всех.
Вот почему очень важно знать признаки инфекционных заболеваний, пути их распространения, способы предупреждения и правила поведения.
ВОЗНИКНОВЕНИЕ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ
Ноябрь 1990 г. Таежный город нефтедобытчиков Лангепас (Ханты-Мансийский автономный округ) превратился в огромный лазарет. В больницу с кишечной инфекцией обратилось свыше 2000 человек, более 100 были госпитализированы, из которых 13 находились в очень тяжелом состоянии. В чем же причина? В том, что водопроводные и канализационные трубы были проложены рядом, в одной траншее. В результате в водопроводную сеть стали проникать фекальные воды.
Таежный город нефтедобытчиков Лангепас (Ханты-Мансийский автономный округ) превратился в огромный лазарет. В больницу с кишечной инфекцией обратилось свыше 2000 человек, более 100 были госпитализированы, из которых 13 находились в очень тяжелом состоянии. В чем же причина? В том, что водопроводные и канализационные трубы были проложены рядом, в одной траншее. В результате в водопроводную сеть стали проникать фекальные воды.
Другой пример. В кемпинге «Родник», расположенном на окраине Ставрополя, 45 его поселенцев заболели холерой. Сложилась критическая ситуация, ведь в кемпинге за короткое время побывало 733 человека. Их надо было найти, изолировать и вылечить. Носителей холерного вибриона обнаруживали в Барнауле, Перми, Краснодаре и многих других городах. Только чрезвычайные меры предотвратили распространение инфекции. Виной всему оказался родник близ кемпинга. Оползневые явления повредили канализационную сеть, и нечистоты попали в ключевую воду.
Надо помнить, что возбудители инфекционных заболеваний, проникая в организм, находят там благоприятную среду для развития. Быстро размножаясь, они выделяют ядовитые продукты (токсины), которые разрушают ткани, что приводит к нарушению нормальных процессов жизнедеятельности организма. Болезнь возникает, как правило, через несколько часов или дней с момента заражения. В этот период, называемый инкубационным, идет размножение микробов и накопление токсических веществ без видимых признаков заболевания.
Быстро размножаясь, они выделяют ядовитые продукты (токсины), которые разрушают ткани, что приводит к нарушению нормальных процессов жизнедеятельности организма. Болезнь возникает, как правило, через несколько часов или дней с момента заражения. В этот период, называемый инкубационным, идет размножение микробов и накопление токсических веществ без видимых признаков заболевания.
Носитель их заражает окружающих или обсеменяет возбудителями различные объекты внешней среды.
Различают несколько путей распространения: контактный, когда происходит прямое соприкосновение больного со здоровым человеком; контактно-бытовой
— передача инфекции через предметы домашнего обихода (белье, полотенце, посуда, игрушки), загрязненные выделениями больного; воздушно-капельный
— при разговоре, чихании; водный. Многие возбудители сохраняют жизнеспособность в воде, по крайней мере, несколько дней. В связи с этим передача острой дизентерии, холеры, брюшного тифа может происходить через нее весьма широко. Если не принимать необходимых санитарных мер, водные эпидемии могут привести к печальным последствиям.
Если не принимать необходимых санитарных мер, водные эпидемии могут привести к печальным последствиям.
А сколько инфекционных заболеваний передается с пищевыми продуктами? В Тульской области было выявлено пять случаев заболевания бруцеллезом. Причина? Пренебрежение ветеринарными требованиями и нормами: 65 голов крупного рогатого скота, больного бруцеллезом, совхоз направил на мясокомбинат, от продукции которого заразились люди,
На сегодня ведущее значение приобрел сальмонеллез. Заболеваемость им увеличилась в 25 раз. Это одно из распространенных кишечно-желудочных заболеваний. Разносчиками могут являться различные животные: рогатый скот, свиньи, лошади, крысы, мыши и домашняя птица, особенно утки и гуси. Возможно такое заражение от больного человека или носителя сальмонелл.
Большую опасность для окружающих представляют больные, которые своевременно не обращаются к врачу, так как многие инфекционные болезни протекают легко. Но при этом происходит интенсивное выделение возбудителей во внешнюю среду.
Сроки выживания возбудителей различны. Так, на гладких поверхностях целлулоидных игрушек дифтерийная палочка сохраняется меньше, чем на мягких игрушках из шерсти или другой ткани. В готовых блюдах, в мясе, молоке возбудители могут жить долго. В частности, молоко является благоприятной питательной средой для брюшно-тифозной и дизентерийной палочек.
В организме человека на пути проникновения болезнетворных микробов стоят защитные барьеры — кожа, слизистая оболочка желудка, некоторые составные части крови. Сухая, здоровая и чистая кожа выделяет вещества, которые приводят к гибели микробов. Слизь и слюна содержат высокоактивный фермент—лизоцим, разрушающий многих возбудителей. Оболочка дыхательных путей также хороший защитник. Надежный барьер на пути микробов — желудок. Он выделяет соляную кислоту и ферменты, которые нейтрализуют большинство возбудителей заразных болезней. Однако если человек пьет много воды, то кислотность, разбавляясь, снижается. Микробы в таких случаях не гибнут и с пищей проникают в кишечник, а оттуда в кровь.
Необходимо отметить, что защитные силы более эффективны в здоровом, закаленном организме. Переохлаждение, несоблюдение личной гигиены, травма, курение, радиация, прием алкоголя резко снижают его сопротивляемость.
РАСПОЗНАВАНИЕ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ
Наиболее типичными признаками инфекционного заболевания являются: озноб, жар, повышение температуры. При этом возникает головная боль, боль в мышцах и суставах, недомогание, общая слабость, разбитость, иногда тошнота, рвота, нарушается сон, ухудшается аппетит. При тифе, менингококковой инфекции появляется сыпь. При гриппе и других респираторных заболеваниях — чихание, кашель, першение в горле. Ангина и дифтерия вызывают боли в горле при глотании. При дизентерии — понос. Рвота и понос — признаки холеры и сальмонеллеза.
Рассмотрим кратко наиболее часто встречающиеся инфекции, пути их распространения и способы предупреждения.
Инфекции дыхательных путей — наиболее многочисленные и самые распространенные заболевания. Ежегодно ими перебаливает до 15-20% всего населения, а в период эпидемических вспышек гриппа — до 40%. Возбудители локализуются в верхних дыхательных путях и распространяются воздушно-капельным способом. Микробы попадают в воздух со слюной и слизью при разговоре, чихании, кашле больного (наибольшая концентрация на расстоянии 2-3 м от больного). Крупные капли, содержащие возбудителей, довольно быстро оседают, подсыхают, образуя микроскопические ядрышки. С пылью они вновь поднимаются в воздух и переносятся в другие помещения. При их вдыхании и происходит заражение. При высокой влажности воздуха в помещениях, недостаточном их проветривании и других нарушениях санитарно-гигиенических правил возбудители сохраняются во внешней среде дольше.
Ежегодно ими перебаливает до 15-20% всего населения, а в период эпидемических вспышек гриппа — до 40%. Возбудители локализуются в верхних дыхательных путях и распространяются воздушно-капельным способом. Микробы попадают в воздух со слюной и слизью при разговоре, чихании, кашле больного (наибольшая концентрация на расстоянии 2-3 м от больного). Крупные капли, содержащие возбудителей, довольно быстро оседают, подсыхают, образуя микроскопические ядрышки. С пылью они вновь поднимаются в воздух и переносятся в другие помещения. При их вдыхании и происходит заражение. При высокой влажности воздуха в помещениях, недостаточном их проветривании и других нарушениях санитарно-гигиенических правил возбудители сохраняются во внешней среде дольше.
При стихийном бедствии и крупных катастрофах обычно происходит скапливание людей, нарушаются нормы и правила общежития, что обусловливает массовость заболевания гриппом, дифтерией, ангиной, менингитом.
Грипп. Его вирус в течение короткого времени может поразить значительное количество людей. Он устойчив к замораживанию, но быстро погибает при нагревании, высушивании, под действием дезинфицирующих средств, при ультрафиолетовом облучении. Инкубационный период продолжается от 12 ч до 7 суток. Характерные признаки болезни — озноб, повышение температуры, слабость, сильная головная боль, кашель, першение в горле, насморк, саднение за грудиной, осипший голос. При тяжелом течении возможны осложнения — пневмония, воспаление головного мозга и его оболочек.
Он устойчив к замораживанию, но быстро погибает при нагревании, высушивании, под действием дезинфицирующих средств, при ультрафиолетовом облучении. Инкубационный период продолжается от 12 ч до 7 суток. Характерные признаки болезни — озноб, повышение температуры, слабость, сильная головная боль, кашель, першение в горле, насморк, саднение за грудиной, осипший голос. При тяжелом течении возможны осложнения — пневмония, воспаление головного мозга и его оболочек.
Дифтерия характеризуется воспалительным процессом в глотке и токсическим поражением сердечно-сосудистой и нервной систем. Возбудитель болезни— дифтерийная палочка. Входными воротами инфекции чаще всего являются слизистые оболочки зева, гортани и носа. Передается воздушно-капельным путем.
Инкубационный период от 5 до 10 дней. Наиболее характерное проявление болезни—образование пленок в верхних дыхательных путях. Опасность для жизни представляет токсическое поражение ядами дифтерийных палочек организма больного. При их распространении может возникнуть нарушение дыхания.
При их распространении может возникнуть нарушение дыхания.
Холера, дизентерия, брюшной тиф, сальмонеллез, инфекционный гепатит — все эти острые кишечные инфекции занимают второе место после воздушно-капельных. При этой группе заболеваний болезнетворные микроорганизмы проникают внутрь с проглатываемой пищей или водой.
Разрушение водопроводных и канализационных сетей, низкая санитарная культура, беспечность и неосмотрительность в использовании открытых водоемов приводят к возникновению этих эпидемий.
Острая бактериальная дизентерия. Возбудители—дизентерийные бактерии, которые выделяются с испражнениями больного. Во внешней среде они сохраняются 30-45 дней. Инкубационный период — до 7 дней (чаще 2-3 дня). Заболевание сопровождается повышением температуры, ознобом, жаром, общей слабостью, головной болью. Начинается со схваткообразных болей в животе, с частого жидкого стула, в тяжелых случаях — с примесью слизи и крови. Иногда бывает рвота.
Брюшной тиф. Источник инфекции — больные или бактерионосители. Палочка брюшного тифа и паратифов выделяется с испражнениями и мочой. В почве и воде они могут сохраняться до четырех месяцев, в испражнениях до 25 дней, на влажном белье — до двух недель. Инкубационный период продолжается от одной до трех недель. Заболевание развивается постепенно: ухудшается самочувствие, нарушается сон, повышается температура. На 7-8-й день появляется сыпь на коже живота, грудной клетке. Заболевание длится 2-3 недели и может осложниться кишечным кровотечением или прободением кишечника на месте одной из многочисленных образовавшихся при этом язв.
Источник инфекции — больные или бактерионосители. Палочка брюшного тифа и паратифов выделяется с испражнениями и мочой. В почве и воде они могут сохраняться до четырех месяцев, в испражнениях до 25 дней, на влажном белье — до двух недель. Инкубационный период продолжается от одной до трех недель. Заболевание развивается постепенно: ухудшается самочувствие, нарушается сон, повышается температура. На 7-8-й день появляется сыпь на коже живота, грудной клетке. Заболевание длится 2-3 недели и может осложниться кишечным кровотечением или прободением кишечника на месте одной из многочисленных образовавшихся при этом язв.
ОСНОВЫ ЗАЩИТЫ И ПРАВИЛА ПОВЕДЕНИЯ НАСЕЛЕНИЯ
Инфекционные заболевания возникают при трех основных факторах: наличии источника инфекции, благоприятных условиях для распространения возбудителей и восприимчивого к заболеванию человека. Если исключить из этой цепи хотя бы одно звено, эпидемический процесс прекращается. Следовательно, целью предупреждающих мероприятий является воздействие на источник инфекции, чтобы уменьшить обсеменение внешней среды, локализовать распространение микробов, а также повысить устойчивость населения к заболеваниям.
Поскольку главным источником инфекции является больной человек или бактерионоситель, необходимо раннее выявление, немедленная их изоляция и госпитализация. При легком течении заболевания люди, как правило, поздно обращаются к врачу или совсем этого не делают. Помочь в скорейшем выявлении таких больных могут подворные обходы.
Помещения, где находится больной, надо регулярно проветривать. Для него выделить отдельное помещение или отгородить ширмой. Обслуживающему персоналу обязательно носить защитные марлевые маски.
Важное значение для предупреждения развития инфекционных заболеваний имеет экстренная и специфическая профилактика.
Экстренная профилактика проводится при возникновении опасности массовых заболеваний, но когда вид возбудителя еще точно не определен. Она заключается в приеме населением антибиотиков, сульфаниламидных и других лекарственных препаратов. Средства экстренной профилактики при своевременном их использовании по предусмотренным заранее схемам позволяют в значительной степени предупредить инфекционные заболевания, а в случае их возникновения — облегчить их течение.
Специфическая профилактика — создание искусственного иммунитета (невосприимчивости) путем предохранительных прививок (вакцинации)— проводится против некоторых болезней (натуральная оспа, дифтерия, туберкулез, полиомиелит и др.) постоянно, а против других — только при появлении опасности их возникновения и распространения.
Повысить устойчивость населения к возбудителям инфекции возможно путем массовой иммунизации предохранительными вакцинами, введением специальных сывороток или гамма-глобулинов. Вакцины представляют собой убитых или специальными методами ослабленных болезнетворных микробов, при введении которых в организм здоровых людей у них вырабатывается состояние невосприимчивости к заболеванию. Вводятся они разными способами: подкожно, накожно, внутрикожно, внутримышечно, через рот (в пищеварительный тракт), путем вдыхания.
Для предупреждения и ослабления инфекционных заболеваний в порядке самопомощи и взаимопомощи рекомендуется использовать средства, содержащиеся в аптечке индивидуальной АИ-2.
При возникновении очага инфекционного заболевания в целях предотвращения распространения болезней объявляется карантин или обсервация.
Карантин вводится при возникновении особо опасных болезней (оспы, чумы, холеры и др.). Он может охватывать территорию района, города, группы населенных пунктов.
Карантин представляет собой систему режимных, противоэпидемических и лечебно-профилактических мероприятий, направленных на полную изоляцию очага и ликвидацию болезней в нем.
Основными режимными мероприятиями при установлении карантина являются: охрана очага инфекционного заболевания, населенных пунктов в нем, инфекционных изоляторов и больниц, контрольно-передаточных пунктов. Запрещение входа и выхода людей, ввода и вывода животных, а также вывоза имущества. Запрещение транзитного проезда транспорта, за исключением железнодорожного и водного. Разобщение населения на мелкие группы и ограничение общения между ними. Организация доставки по квартирам (домам) населению продуктов питания, воды и предметов первой необходимости.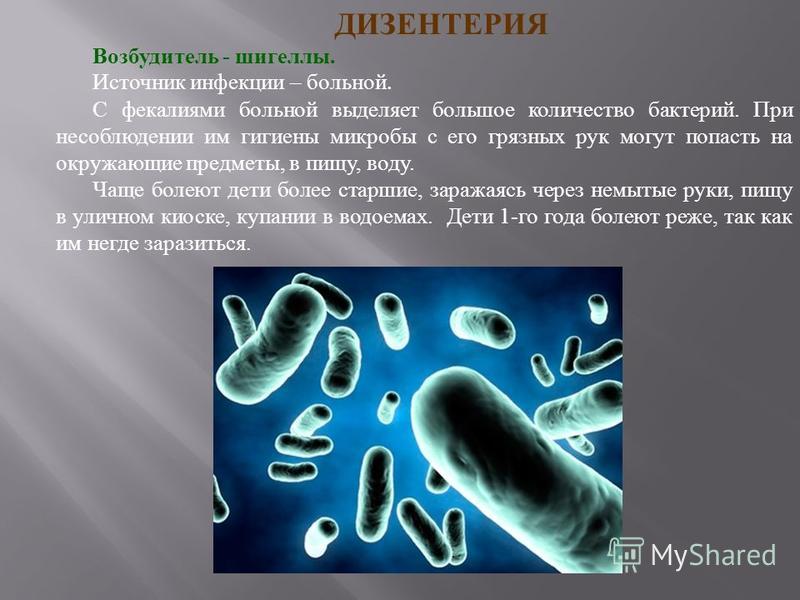 Прекращение работы всех учебных заведений, зрелищных учреждений, рынков. Прекращение производственной деятельности предприятий или перевод их на особый режим работы.
Прекращение работы всех учебных заведений, зрелищных учреждений, рынков. Прекращение производственной деятельности предприятий или перевод их на особый режим работы.
Противоэпидемические и лечебно-профилактические мероприятия в условиях карантина включают: использование населением медицинских препаратов, защиту продовольствия и воды, дезинфекцию, дезинсекцию, дератизацию, санитарную обработку, ужесточенное соблюдение правил личной гигиены, активное выявление и госпитализацию инфекционных больных.
Обсервация вводится в том случае, если вид возбудителя не является особо опасным. Цель обсервации — предупредить распространение инфекционных заболеваний и ликвидировать их. Для этого проводятся по существу те же лечебно-профилактические мероприятия, что и при карантине, но при обсервации менее строги изоляционно-ограничительные меры.
Срок карантина и обсервации определяется длительностью максимального инкубационного периода заболевания, исчисляемого с момента изоляции последнего больного и окончания дезинфекции в очаге.
Люди, находящиеся на территории очага инфекционного заболевания, должны для защиты органов дыхания пользоваться ватно-марлевыми повязками. Для кратковременной защиты рекомендуется использовать свернутый в несколько слоев платок или косынку, полотенце или шарф. Не помешают и защитные очки. Целесообразно пользоваться накидками и плащами из синтетических и прорезиненных тканей, пальто, ватниками, резиновой обувью, обувью из кожи или ее заменителей, кожаными или резиновыми перчатками (рукавицами).
Защита продовольствия и воды заключается главным образом в создании условий, исключающих возможность их контакта с зараженной атмосферой. Надежными средствами защиты могут быть все виды плотно закрывающейся тары.
Водой из водопровода и артезианских скважин разрешается пользоваться свободно, но кипятить ее обязательно.
В очаге инфекционною заболевания не обойтись без дезинфекции, дезинсекции и дератизации.
Дезинфекция проводится с целью уничтожения или удаления микробов и иных возбудителей с объектов внешней среды, с которыми может соприкасаться человек. Для дезинфекции применяют растворы хлорной извести и хлорамина, лизол, формалин и др. При отсутствии этих веществ используется горячая вода с мылом или содой.
Для дезинфекции применяют растворы хлорной извести и хлорамина, лизол, формалин и др. При отсутствии этих веществ используется горячая вода с мылом или содой.
Дезинсекция проводится для уничтожения насекомых и клещей — переносчиков возбудителей инфекционных заболеваний. С этой целью используются различные способы: механический (выколачивание, встряхивание, стирка), физический (проглаживание утюгом, кипячение), химический (применение инсектицидов — хлорофоса, тиофоса, ДДТ и др.), комбинированный. Для защиты от укуса насекомых применяют отпугивающие средства (репелленты), которыми смазываются кожные покровы открытых частей тела.
Дератизация проводится для истребления грызунов — переносчиков возбудителей инфекционных заболеваний. Она проводится чаще всего с помощью механических приспособлений и химических препаратов.
Большую роль в предупреждении инфекционных заболеваний играет строгое соблюдение правил личной гигиены: мытье рук с мылом после работы и перед едой; регулярное обмывание тела в бане, ванне, под душем со сменой нательного и постельного белья; систематическая чистка и встряхивание верхней одежды и постельных принадлежностей; поддержание в чистоте жилых и рабочих помещений; очистка от грязи и пыли, обтирание обуви перед входом в помещение; употребление только проверенных продуктов, кипяченой воды и молока, промытых кипяченой водой фруктов и овощей, тщательно проваренных мяса и рыбы.
Успех ликвидации инфекционного очага во многом определяется активными действиями и разумным поведением всего населения. Каждый должен строго выполнять установленные режим и правила поведения на работе, на улице и дома, постоянно выполнять противоэпидемические и санитарно-гигиенические нормы.
рекомендации, симптомы, лечение и профилактика
Шигеллез или дизентерия представляют собой острое инфекционное заболевание, протекающее с общей интоксикацией и синдром поражения пищеварительной системы.
Причины возникновения шигеллеза
Шигеллез является заразным заболеванием, поэтому нередки эпидемии, особенно в лагерях, детских садах, отелях. Возбудитель дизентерии передается фекально-оральным путем, то есть через воду, пищу или при непосредственном контакте с зараженным человеком (человек с острой дизентерии, пациент с хроническим шигеллезом или бактерионоситель, выделяющий шигелл во внешнюю среду вместе с фекалиями).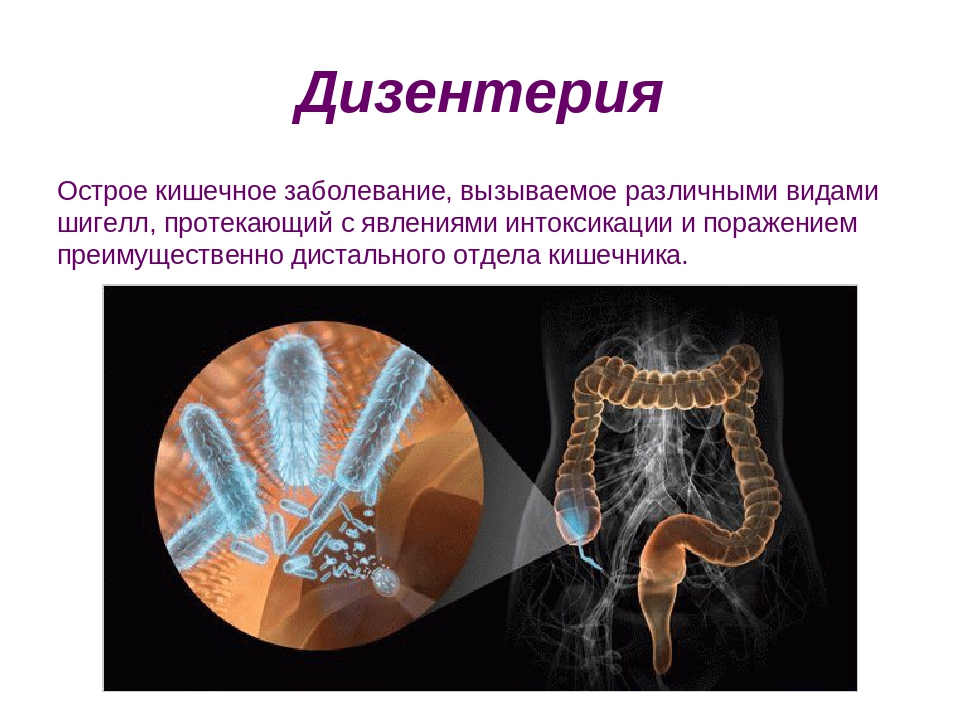
Симптомы шигеллеза
Инкубация, то есть период от момента заражения до появления первых признаков заболевания, составляет от 1 до 7 дней. Заболевание, как правило, стартует остро с резкой интоксикации, повышения температуры тела, сильного озноба и ухудшения самочувствия. Могут наблюдаться снижение артериального давления, отсутствие аппетита и головная боль.
Кишечный синдром проявляется болями в животе: вначале тупыми и разлитыми, а потом острыми, схваткообразными, локализованными внизу живота, чаще в левой половине, и опускаются вниз живота, чаще в левую его область. Боли могут усиливаться перед дефекацией, так же нередки и ложные позывы на дефекацию.
Отмечается учащение и разжижение стула, можно наблюдать в нем примеси слизи и прожилки крови.
При тяжелом течении заболевания наблюдается «ректальный плевок», то есть небольшое количество слизи с прожилками крови.
Для легкого течения заболевания характерна частота стула до 10 раз в сутки, сопровождается умеренной болью в животе и кратковременной лихорадкой.
При среднетяжелом течении заболевания лихорадка с ознобом держится несколько дней, а частота стула увеличивается до 10-20 раз в сутки.
Для тяжелого течения заболевания характерна высокая температура тела, до 40 градусов и выше, сильнейшая головная боль, слабость, озноб и полное отсутствие аппетита. Пациент жалуется на боль в животе, мучительные позывы на дефекацию, частый стул. Вследствие этого развивается зияние заднего прохода, из которого непрерывно выделяются кровянистые массы — «мясные помои».
Острый период заболевания составляет 5 до 10 дней, но процесс восстановления длительный. Болезненность по ходу толстого кишечника сохраняется еще около месяца, а полное восстановление слизистой возможно не ранее, чем через 2 месяца.
Диагностика шигеллеза
Диагностика шигеллеза включает в себя осмотр кала (информативно наличие слизи и прожилок крови). Для подтверждения диагноза проводят бактериологические, серологические и иммунологические лабораторные исследования.
Лечение шигеллеза
Лечение больного дизентерией должно быть комплексным. Первоначально назначаются постельный режим и щадящая диета, антибактериальные препараты для борьбы с шигеллами.
Необходимы витамины, энтеросорбенты, ферментные препараты для облегчения пищеварения, спазмолитики для устранения спазма толстой кишки. При сильной интоксикации производят внутривенные инфузии.
Выписка из стационара осуществляется не ранее, чем через 3 дня после полного исчезновения симптомов заболевания.
Профилактика шигеллеза
Соблюдение правил личной гигиены, мытье рук перед едой, отказ от употребления немытых овощей и фруктов.
Причины, симптомы, диагностика, лечение и профилактика
Что такое дизентерия?
Дизентерия — кишечная инфекция, вызывающая кровавый понос. Это может быть вызвано паразитами или бактериями.
Причины дизентерии
Тип вашего заболевания зависит от того, что вызвало вашу инфекцию.
Бактериальная дизентерия является наиболее распространенным типом дизентерии. Это происходит из-за бактерий, называемых шигеллами. Заболевание называется шигеллезом.Ежегодно им заболевают около 500 000 человек в США.
Амебная дизентерия вызывается паразитом под названием Entamoeba histolytica. У вас больше шансов заболеть такой дизентерией, если вы отправитесь в тропическое место с плохими санитарными условиями.
Вы можете заболеть дизентерией, если съедите пищу, приготовленную больным ею человеком. Например, вы можете получить его, если человек, который приготовил вам еду, болен и плохо вымыл руки. Или вы можете заболеть дизентерией, если прикоснетесь к предмету, на котором есть паразит или бактерии, например, к ручке унитаза или ручке раковины.
Купание в загрязненной воде, такой как озера или бассейны, — еще один способ заражения дизентерией.
Иногда вирус, вызывающий дизентерию, может быть переносчиком в течение нескольких недель или лет, даже не подозревая об этом. Вы все еще можете передать инфекцию другим людям, даже если у вас нет симптомов.
Вы все еще можете передать инфекцию другим людям, даже если у вас нет симптомов.
Симптомы дизентерии
Симптомы могут проявиться через 1-3 дня после заражения. У некоторых людей симптомы проявляются дольше. У других симптомы никогда не проявляются.
Каждый тип дизентерии имеет немного разные симптомы.
Бактериальная дизентерия вызывает такие симптомы, как:
Амебная дизентерия обычно не вызывает симптомов. Если вы чувствуете себя больным, вы заметите проблемы 2-4 недели после заражения, такие как:
Nausea
диарея
Belly Sramps
потерю веса
Лихорадка
В редких случаях амебная дизентерия приводит к более серьезным проблемам, таким как абсцесс печени, представляющий собой скопление гноя в печени. Симптомы включают:
Симптомы включают:
Позвоните своему врачу, если диарея, судороги и другие симптомы являются серьезными или если они не улучшаются в течение недели. Сообщите своему врачу, если вы недавно путешествовали в страну, где дизентерия распространена.
Диагностика дизентерии
Симптомы дизентерии похожи на многие другие кишечные заболевания, включая обычный желудочный вирус. Лаборанту нужно будет посмотреть образец вашего стула под микроскопом, чтобы определить, есть ли у вас дизентерия, и если да, то какой тип.
Лечение дизентерии
Лечение бациллярной дизентерии
Большинству людей с бациллярной дизентерией не требуются лекарства, отпускаемые по рецепту. Инфекция обычно проходит самостоятельно в течение недели.
Пока вы ждете, пока он прояснится, вы можете сделать несколько вещей, которые помогут вам почувствовать себя лучше. Пейте много воды или «регидратационных» напитков, таких как спортивные напитки, чтобы вернуть жидкость, потерянную во время диареи.
Лекарство с субсалицилатом висмута (пепто-бисмол) может облегчить такие симптомы, как спазмы в животе и диарея.Вы также можете принять безрецептурное обезболивающее, такое как ацетаминофен, чтобы справиться с болезненными спазмами.
Не принимайте безрецептурные лекарства от диареи, такие как лоперамид (Имодиум), если это не рекомендовано врачом. Эти лекарства могут усугубить дизентерию.
Если инфекция не проходит сама по себе в течение нескольких дней, вам может потребоваться лечение антибиотиками. Поговорите со своим врачом.
Лечение амебной дизентерии
Если у вас амебная дизентерия с симптомами, вы можете принять лекарство для уничтожения паразитов в крови, кишечнике и печени.Вы будете принимать эти лекарства около 10 дней. Врачи лечат амебную дизентерию, которая не вызывает симптомов, такими препаратами, как йодохинол или дилоксанида фуроат.
Безопасность при дизентерии
Дизентерия очень заразна. Оставайтесь дома, не ходите на работу или в школу, пока у вас не пройдет диарея в течение как минимум 48 часов, чтобы не заразить других. Часто мойте руки и не готовьте еду ни для кого в течение как минимум 2 дней после исчезновения симптомов. Также избегайте секса, пока не почувствуете себя лучше.
Оставайтесь дома, не ходите на работу или в школу, пока у вас не пройдет диарея в течение как минимум 48 часов, чтобы не заразить других. Часто мойте руки и не готовьте еду ни для кого в течение как минимум 2 дней после исчезновения симптомов. Также избегайте секса, пока не почувствуете себя лучше.
Как только инфекция исчезнет, хорошо уберите свой дом, чтобы убить микробы. Стирайте простыни, полотенца и одежду в горячей воде. Дезинфицируйте сиденья унитаза, ручки смыва, ручки раковины, дверные ручки и другие места, к которым вы часто прикасаетесь.
Профилактика дизентерии
Если вы посещаете тропическую или менее развитую страну, где распространяется дизентерия, следуйте этим советам:
Пейте и чистите зубы только бутилированной или консервированной водой, а не водой из-под крана.
Закажите напитки без льда.
Ешьте только сырые фрукты и овощи с кожурой.

Готовьте любые продукты, которые нельзя очистить.
Не ешьте еду у уличных торговцев.
Если кто-то из ваших близких болен дизентерией:
Часто мойте руки теплой водой с мылом или используйте дезинфицирующее средство для рук.
Не делитесь полотенцами, чашками и другими личными вещами с больным дизентерией.
Мойте руки перед приготовлением пищи или едой.
Осложнения дизентерии
Наиболее частым осложнением дизентерии или диареи любого типа является обезвоживание. Если у вас или вашего ребенка диарея, важно пить много жидкости.
Другие осложнения дизентерии связаны с обезвоживанием и могут включать:
Сильно низкий уровень калия, который может вызвать опасные для жизни изменения сердечного ритма
Дополнительные осложнения дизентерии:
Токсический мегаколон
Выпадение прямой кишки
Дизентерия – инфекция кишечника, вызывающая диарею с кровью или слизью.

Другие симптомы дизентерии могут включать:
Дизентерия очень заразна и может передаваться, если вы не принимаете надлежащие меры предосторожности, такие как правильное и регулярное мытье рук.
Типы дизентерии
Существует 2 основных типа дизентерии:
- бациллярная дизентерия или шигеллез, вызываемый бактериями шигеллы; это наиболее распространенный тип дизентерии в Великобритании.
- амебная дизентерия или амебиаз, который вызывается амебой (одноклеточным паразитом) под названием Entamoeba histolytica, которая в основном встречается в тропических районах; этот тип дизентерии обычно подхватывается за границей
Лечение дизентерии
Поскольку дизентерия обычно проходит сама по себе через 3–7 дней, лечение обычно не требуется.
Однако важно пить много жидкости и при необходимости использовать растворы для пероральной регидратации, чтобы избежать обезвоживания.
Обезболивающие, такие как парацетамол, могут облегчить боль и лихорадку.
 Избегайте лекарств от диареи, таких как лоперамид, потому что они могут усугубить ситуацию.
Избегайте лекарств от диареи, таких как лоперамид, потому что они могут усугубить ситуацию.Вы должны оставаться дома не менее 48 часов после последнего эпизода диареи, чтобы снизить риск передачи инфекции другим людям.
Как избежать заражения дизентерией
Мытье рук — самый важный способ остановить распространение инфекции.Вы заразны для других людей, пока вы больны и у вас есть симптомы.
Примите следующие меры, чтобы не передать болезнь другим:
- Тщательно мойте руки водой с мылом после посещения туалета. Узнайте больше о том, как мыть руки.
- Держитесь подальше от работы или учебы, пока у вас не исчезнут какие-либо симптомы в течение как минимум 48 часов.
- Помогите маленьким детям правильно вымыть руки.
- Не готовьте еду для других, пока симптомы не исчезнут в течение как минимум 48 часов.
- Не плавайте до тех пор, пока симптомы не исчезнут в течение как минимум 48 часов.
- По возможности держитесь подальше от других людей, пока ваши симптомы не исчезнут.

- Стирайте всю грязную одежду, постельное белье и полотенца в стиральной машине при самой высокой температуре.
- Очистите сиденья и чаши унитазов, промойте ручки, краны и раковины моющим средством и горячей водой после использования, а затем используйте бытовое дезинфицирующее средство.
- Избегайте половых контактов до тех пор, пока симптомы не исчезнут в течение как минимум 48 часов.
Поскольку шигеллы легко передаются другим людям, вам может потребоваться сдать образцы кала, чтобы получить разрешение вернуться на работу, в школу или в детский сад.
Тип вашей шигеллы и принадлежность вас или других к группе риска будут влиять на то, как долго вам нужно держаться подальше.
Группами риска являются люди с определенными профессиями (в том числе медицинские работники и лица, имеющие дело с пищевыми продуктами), а также лица, которым требуется помощь в соблюдении личной гигиены, и дети раннего возраста. Ваш специалист по гигиене окружающей среды сможет проконсультировать вас по этому поводу.

Когда обращаться к терапевту
Не всегда необходимо обращаться к терапевту, если у вас дизентерия, потому что обычно она проходит в течение недели или около того.
Тем не менее, вам следует обратиться к терапевту, если ваши симптомы серьезны или они не начинают улучшаться через несколько дней. Сообщите им, если вы недавно были за границей.
Если у вас серьезные или постоянные симптомы, врач общей практики может назначить короткий курс антибиотиков. Если у вас очень тяжелая дизентерия, вам может потребоваться лечение в больнице в течение нескольких дней.
Снижение риска заражения дизентерией
Вы можете снизить риск заражения дизентерией следующим образом:
- мытье рук теплой водой с мылом после посещения туалета и регулярно в течение дня
- мытье рук перед прикосновением, едой или приготовлением пищи пища
- отказ от совместного использования полотенец
- стирка белья зараженного человека при максимально возможной температуре
Если вы едете в страну с высоким риском заражения дизентерией, этот совет может помочь предотвратить заражение: Не пейте местную воду, если не уверены, что она чистая (стерильная) — пейте воду в бутылках или напитки в запечатанных банках или бутылках.

- Если вода нестерильная, кипятите ее несколько минут или используйте химические дезинфицирующие средства или надежный фильтр.
- Не чистите зубы водопроводной водой.
- Не добавляйте лед в напитки, так как он может быть сделан из нечистой воды.
- Избегайте свежих фруктов или овощей, которые нельзя очистить перед употреблением.
- Избегайте еды и напитков, продаваемых уличными торговцами, за исключением напитков в правильно закрытых банках или бутылках.
Узнайте больше о безопасности пищевых продуктов и воды за границей.
Что вызывает дизентерию?
Бакиллярная и амебная дизентерия очень заразны и могут передаваться, если экскременты (фекалии) инфицированного человека попадают в рот другого человека.
Это может произойти, если инфицированный человек не моет руки после посещения туалета, а затем прикасается к еде, поверхностям или другому человеку.
В Великобритании инфекция обычно поражает группы людей, находящихся в тесном контакте, например, в семьях, школах и детских садах.
Также существует вероятность заражения при анальном или анально-оральном сексе (римминг).
В развивающихся странах с плохими санитарными условиями зараженные экскременты могут контаминировать воду или пищу, особенно холодную сырую пищу.
Последняя проверка страницы: 06 января 2020 г.
Следующая проверка должна быть завершена: 06 января 2023 г.
Что нужно знать об инфекционных заболеваниях
Дизентерия
Дизентерия – это воспаление толстой кишки, характеризующееся частым водянистым стулом, часто с примесью крови и слизи.Дизентерия обычно вызывается одним из двух различных организмов — бактериями Shigella или амебой, Entamoeba histolytica . Бактериальная дизентерия чаще встречается в развитых странах, тогда как амебная дизентерия чаще встречается в тропических районах с плохими санитарными условиями. Недостаточная гигиена является наиболее распространенной причиной дизентерии, но она также может распространяться через испорченную пищу, загрязненную воду и контакт с человеческими фекалиями, например, при смене подгузников.
Симптомы
Симптомы бациллярной дизентерии, более легкой формы заболевания, обычно появляются через 1-3 дня после заражения человека.Бактериальная дизентерия обычно начинается с боли в животе, за которой следует диарея и лихорадка. У детей младше 2 лет могут развиться тяжелые инфекции, и они должны находиться под тщательным наблюдением.
Амебная дизентерия более серьезна и проявляется более широким спектром симптомов, которые развиваются по крайней мере через 2–4 недели после заражения. Симптомы включают лихорадку, озноб, тошноту и рвоту; водянистый понос со слизью и кровью; болезненные движения кишечника; усталость; и периодические запоры. При отсутствии лечения амеба может прорвать стенку кишечника, распространиться в кровоток и заразить другие органы, хотя это случается очень редко.
Лечение
Поскольку рвота и диарея могут привести к обезвоживанию организма, больным дизентерией необходимо пить много жидкости. Если анализ образца стула показывает, что причиной являются бактерии, лекарство может не назначаться, если симптомы не являются серьезными. В легких случаях симптомы обычно исчезают сами по себе в течение недели. При амебной дизентерии пациентам, скорее всего, будет назначен 10-дневный курс одного или нескольких противомикробных препаратов.
Если анализ образца стула показывает, что причиной являются бактерии, лекарство может не назначаться, если симптомы не являются серьезными. В легких случаях симптомы обычно исчезают сами по себе в течение недели. При амебной дизентерии пациентам, скорее всего, будет назначен 10-дневный курс одного или нескольких противомикробных препаратов.
Профилактика
Гигиена — лучшая защита от дизентерии.Мытье рук после посещения туалета и перед приготовлением пищи является обязательным. Если вы путешествуете в тропики, где распространена дизентерия, пейте бутилированную воду, даже когда чистите зубы, и избегайте кубиков льда, особенно если вы не знаете, из какой воды они были приготовлены. Ешьте только тщательно приготовленную пищу.
Источники:
http://www.who.int/topics/dysentery/en/
https://www.cdc.gov/parasites/amebiasis/general-info.html
http://www.cdc.gov/ шигелла/общая информация.html
http://www.medicalnewstoday.com/articles/171193. php
php
Дизентерия — обзор | ScienceDirect Topics
Эпидемиология
Синдромы острой дизентерии с фекальной кровью и гноем хорошо известны со времен Гиппократа. Дизентерия определяется как частые мелкие испражнения, сопровождающиеся кровью и слизью, с тенезмами или болью при дефекации. Этот синдром с лихорадкой или без нее предполагает воспалительную инвазию слизистой оболочки толстой кишки в результате бактериального, цитотоксического или паразитарного разрушения.
Патологические изменения при воспалительном колите варьируют от поверхностного интенсивного экссудативного воспалительного процесса с вовлечением слизистой оболочки толстой кишки, наблюдаемого при заражении шигеллами или инвазивными микроорганизмами E. coli , до более глубоких, пенетрирующих, колбовидных язв с подрытыми краями, как наблюдается при амебной дизентерии. В патогенезе воспалительных колитов могут участвовать цитотоксические продукты шигелл, 1 некоторых штаммов E. coli , 2 клостридий или других организмов.
coli , 2 клостридий или других организмов.
На эпидемиологическую картину острых дизентерийных синдромов влияет необычно низкий уровень инокулята для инфекции, необходимой для таких организмов, как шигеллы или амебы. Было обнаружено, что всего 100 шигелл или 10 цист кишечных паразитов, таких как Entamoeba coli или Giardia lamblia, , вызывают инфекцию у взрослых добровольцев. 3,4 Следовательно, существует значительный риск передачи от человека к человеку в детских садах, учреждениях 5 или других местах, где негигиеничные условия могут способствовать прямому фекально-оральному распространению.Цисты паразитов, таких как Entamoeba histolytica или Balantidium coli , часто устойчивы к хлорированию и поэтому могут вызывать вспышки дизентерийных заболеваний, передающихся через воду. Контакт с соленой водой или морепродуктами должен привести к рассмотрению Vibrio parahaemolyticus как потенциальной причины воспалительного колита или водянистой диареи, а контакт с сельскохозяйственными или домашними животными может привести к рассмотрению небрюшнотифозного Salmonella spp. , Campylobacter jejuni или Campylobacter coli или Yersinia enterocolitica. Исследование детей в возрасте до 5 лет в Соединенных Штатах показало, что нетифозные Salmonella , за которыми следуют Campylobacter, Y. enterocolitica, и E. coli O157, были наиболее распространенными бактериальными кишечными патогенами, вызывающими заболевания. 6 Когда брюшной тиф сопровождается диареей в эндемичном районе, диарея часто бывает воспалительной, при микроскопическом исследовании в кале обнаруживается много полиморфноядерных или мононуклеарных лейкоцитов. 7 Недавнее многоцентровое когортное исследование (Исследование недоедания и кишечных заболеваний [MAL-ED]) показало, что норовирус GII, ротавирус, Campylobacter spp., астровирус и Cryptosporidium spp. продемонстрировали самое высокое атрибутивное бремя диареи в первый год жизни. На втором году жизни основными возбудителями были Campylobacter spp.
, Campylobacter jejuni или Campylobacter coli или Yersinia enterocolitica. Исследование детей в возрасте до 5 лет в Соединенных Штатах показало, что нетифозные Salmonella , за которыми следуют Campylobacter, Y. enterocolitica, и E. coli O157, были наиболее распространенными бактериальными кишечными патогенами, вызывающими заболевания. 6 Когда брюшной тиф сопровождается диареей в эндемичном районе, диарея часто бывает воспалительной, при микроскопическом исследовании в кале обнаруживается много полиморфноядерных или мононуклеарных лейкоцитов. 7 Недавнее многоцентровое когортное исследование (Исследование недоедания и кишечных заболеваний [MAL-ED]) показало, что норовирус GII, ротавирус, Campylobacter spp., астровирус и Cryptosporidium spp. продемонстрировали самое высокое атрибутивное бремя диареи в первый год жизни. На втором году жизни основными возбудителями были Campylobacter spp. , норовирус GII, ротавирус, астровирус Shigella spp. 8 Campylobacter spp. и EIEC были связаны с дизентерией. Ротавирус и Shigella spp. были связаны с лихорадкой, тогда как ротавирус и норовирус GII чаще всего ассоциировались с рвотой.История поездок в районы с плохими санитарными условиями может быть связана с любым из вышеупомянутых патогенов. Наконец, венерическое воздействие, особенно среди мужчин, имеющих половые контакты с мужчинами, может быть связано с гонококками, вирусом простого герпеса, Chlamydia trachomatis (включая серотипы лимфогранулемы венерической), или Treponema pallidum , как причину проктита, или Campylobacter, Shigella, E. histolytica или C. difficile как причина колита. 9 Прием антибиотиков в анамнезе и/или недавняя госпитализация в медицинское учреждение убедительно указывают на C.difficile (CDI), хотя также была признана внебольничная инфекция.
, норовирус GII, ротавирус, астровирус Shigella spp. 8 Campylobacter spp. и EIEC были связаны с дизентерией. Ротавирус и Shigella spp. были связаны с лихорадкой, тогда как ротавирус и норовирус GII чаще всего ассоциировались с рвотой.История поездок в районы с плохими санитарными условиями может быть связана с любым из вышеупомянутых патогенов. Наконец, венерическое воздействие, особенно среди мужчин, имеющих половые контакты с мужчинами, может быть связано с гонококками, вирусом простого герпеса, Chlamydia trachomatis (включая серотипы лимфогранулемы венерической), или Treponema pallidum , как причину проктита, или Campylobacter, Shigella, E. histolytica или C. difficile как причина колита. 9 Прием антибиотиков в анамнезе и/или недавняя госпитализация в медицинское учреждение убедительно указывают на C.difficile (CDI), хотя также была признана внебольничная инфекция.
Бациллярная дизентерия – обзор
Клинические проявления и осложнения
Шигеллез обычно начинается с недомогания и лихорадки через 24–72 часа после попадания микроорганизма в организм. За этим следует диарея, обычно сначала водянистая, но содержащая много лейкоцитов при микроскопическом исследовании. Диарея может стать кровавой или прогрессировать до дизентерии, синдрома, характеризующегося триадой небольшого объема, грубо кровянистого, слизисто-гнойного стула ( рис.18.6 ), спазмы в животе и тенезмы, болезненное напряжение с позывами на дефекацию. Шигеллез часто называют бациллярной дизентерией, чтобы отличить его от амебной дизентерии, вызванной простейшим Entamoeba histolytica .
За этим следует диарея, обычно сначала водянистая, но содержащая много лейкоцитов при микроскопическом исследовании. Диарея может стать кровавой или прогрессировать до дизентерии, синдрома, характеризующегося триадой небольшого объема, грубо кровянистого, слизисто-гнойного стула ( рис.18.6 ), спазмы в животе и тенезмы, болезненное напряжение с позывами на дефекацию. Шигеллез часто называют бациллярной дизентерией, чтобы отличить его от амебной дизентерии, вызванной простейшим Entamoeba histolytica .
Эти проявления являются результатом воспаления, интенсивного проктоколита и изъязвления слизистой оболочки толстой кишки. Дизентерия не является неизбежным последствием Shigella и в значительной степени определяется вирулентностью инфекционного штамма, инфекционной дозой и индивидуальной восприимчивостью.У большинства пациентов с инфекцией S. sonnei никогда не развивается массивная кровавая диарея или дизентерия, в то время как у большинства пациентов с инфекцией S. dysenteriae типа 1 это происходит. Факторы хозяина, некоторые из которых, несомненно, генетические, другие связаны с состоянием питания или другими сопутствующими заболеваниями, такими как ВИЧ/СПИД, также определяют тяжесть заболевания у отдельных лиц. 46,47
dysenteriae типа 1 это происходит. Факторы хозяина, некоторые из которых, несомненно, генетические, другие связаны с состоянием питания или другими сопутствующими заболеваниями, такими как ВИЧ/СПИД, также определяют тяжесть заболевания у отдельных лиц. 46,47
S higella дизентерия связана с глубокой анорексией. 48 Поскольку желудок и тонкая кишка непосредственно не вовлечены в шигеллез, ни рвота, ни тяжелое обезвоживание не выражены, хотя легкая или умеренная дегидратация возникает из-за потери воды с калом, увеличения неощутимой потери воды из-за лихорадки и снижения потребления пищи и жидкости.Интенсивность проктита может быть настолько тяжелой, что возникает выпадение прямой кишки, особенно у маленьких детей с инфекцией S. dysenteriae типа 1 или S. flexneri 49 ( рис. 18.7 ). Функциональная кишечная непроходимость и токсический мегаколон ( рис. 18.8 ) могут развиваться при тяжелом воспалении, чаще всего при инфекциях S. dysenteriae типа 1. 50 Хотя инфекция Shigella обычно не выходит за пределы собственной пластинки, может возникнуть перфорация толстой кишки или дистального отдела подвздошной кишки, чаще всего у новорожденных или детей с истощением. 51 Бактериемия, вызванная самой инфекцией Shigella или другим просветным организмом, особенно у пациентов с истощением или ослабленным иммунитетом, является осложнением у 5–10% пациентов в Бангладеш. 52 Бактериальная инфекция в Соединенных Штатах встречается крайне редко, и >99% изолятов, зарегистрированных в CDC, происходят из фекалий. 5
dysenteriae типа 1. 50 Хотя инфекция Shigella обычно не выходит за пределы собственной пластинки, может возникнуть перфорация толстой кишки или дистального отдела подвздошной кишки, чаще всего у новорожденных или детей с истощением. 51 Бактериемия, вызванная самой инфекцией Shigella или другим просветным организмом, особенно у пациентов с истощением или ослабленным иммунитетом, является осложнением у 5–10% пациентов в Бангладеш. 52 Бактериальная инфекция в Соединенных Штатах встречается крайне редко, и >99% изолятов, зарегистрированных в CDC, происходят из фекалий. 5
Шигеллез связан с рядом системных осложнений. У пациентов могут проявляться генерализованные двигательные припадки, особенно у маленьких детей с высокой температурой и S.flexneri или S. dysenteriae 1-го типа. 53 Более одного приступа бывает редко; однако пациенты могут стать оглушенными или даже коматозными, обычно в связи с метаболическими отклонениями, такими как тяжелая гипогликемия или гипонатриемия. 54 Гипогликемия из-за недостаточного приема пищи и неадекватной реакции глюконеогенеза может быть глубокой (глюкоза плазмы <1 ммоль/л). Гипонатриемия связана с дизентерией и связана с потерей натрия с калом и секрецией антидиуретического гормона в количествах, не соответствующих концентрации натрия в сыворотке крови, что, возможно, вызвано гипоальбуминемией и снижением внутрисосудистого онкотического давления у пациентов с тяжелой дизентерией.В Бангладеш концентрации натрия в сыворотке менее 125 ммоль/л присутствуют примерно у 50% всех пациентов с тяжелой инфекцией S. dysenteriae типа 1 и у 25% пациентов с S. flexneri .
54 Гипогликемия из-за недостаточного приема пищи и неадекватной реакции глюконеогенеза может быть глубокой (глюкоза плазмы <1 ммоль/л). Гипонатриемия связана с дизентерией и связана с потерей натрия с калом и секрецией антидиуретического гормона в количествах, не соответствующих концентрации натрия в сыворотке крови, что, возможно, вызвано гипоальбуминемией и снижением внутрисосудистого онкотического давления у пациентов с тяжелой дизентерией.В Бангладеш концентрации натрия в сыворотке менее 125 ммоль/л присутствуют примерно у 50% всех пациентов с тяжелой инфекцией S. dysenteriae типа 1 и у 25% пациентов с S. flexneri .
Наиболее тяжелым системным осложнением шигеллеза является ГУС, характеризующийся микроангиопатической гемолитической анемией, тромбоцитопенией и олигурической почечной недостаточностью. ГУС возникает исключительно при инфекции S. dysenteriae типа 1 55 и обычно впервые отмечается через 1–5 дней после развития дизентерии, часто по мере стихания кишечных проявлений. Почечная недостаточность и гемолитическая анемия могут быть тяжелыми; тромбоцитопения обычно менее выражена, с количеством тромбоцитов в диапазоне 25 000–100 000/мм 90 335 3 90 336 и отсутствием кровотечений, кроме кишечных. ГУС может быть неполным, при этом любые проявления возникают изолированно. 56 Шигеллез оказывает сильное влияние на питание, и в тех случаях, когда шигеллез является гиперэндемичным, он вносит основной вклад в высокую распространенность недоедания среди детей. Во-первых, потребность в энергии увеличивается из-за высокой температуры. 57 Во-вторых, воспалительные цитокины, высвобождаемые в ответ хозяина 58 , вызывают катаболизм мышечных белков, изменение приоритетов синтеза белков острой фазы и анорексию при уменьшении потребления пищи. В-третьих, эти пациенты теряют значительное количество белка из-за транссудации сыворотки через поврежденную слизистую оболочку кишечника. 59 Эти изменения сохраняются долгое время в период выздоровления.
Почечная недостаточность и гемолитическая анемия могут быть тяжелыми; тромбоцитопения обычно менее выражена, с количеством тромбоцитов в диапазоне 25 000–100 000/мм 90 335 3 90 336 и отсутствием кровотечений, кроме кишечных. ГУС может быть неполным, при этом любые проявления возникают изолированно. 56 Шигеллез оказывает сильное влияние на питание, и в тех случаях, когда шигеллез является гиперэндемичным, он вносит основной вклад в высокую распространенность недоедания среди детей. Во-первых, потребность в энергии увеличивается из-за высокой температуры. 57 Во-вторых, воспалительные цитокины, высвобождаемые в ответ хозяина 58 , вызывают катаболизм мышечных белков, изменение приоритетов синтеза белков острой фазы и анорексию при уменьшении потребления пищи. В-третьих, эти пациенты теряют значительное количество белка из-за транссудации сыворотки через поврежденную слизистую оболочку кишечника. 59 Эти изменения сохраняются долгое время в период выздоровления. В развивающихся странах тяжелые инфекции Shigella , вызванные S. dysenteriae типа 1 и S.flexneri почти вдвое увеличивает последующую частоту персистирующей (более 14 дней) диареи и острой недостаточности питания, а также увеличивает смертность таких пациентов в 10 раз. 60
В развивающихся странах тяжелые инфекции Shigella , вызванные S. dysenteriae типа 1 и S.flexneri почти вдвое увеличивает последующую частоту персистирующей (более 14 дней) диареи и острой недостаточности питания, а также увеличивает смертность таких пациентов в 10 раз. 60
Shigella (и другие инвазивные кишечные бактерии, такие как нетифоидные Salmonella , Campylobacter и Yersinia ) могут вызывать реактивный (стерильный) артрит, иногда сопровождающийся тендинитом, узловатая эритема. 61 Это клиническое созвездие, ранее называвшееся синдромом Рейтера, представляет собой аутоиммунный процесс, возникающий через 2–3 недели после заражения. Он тесно связан с гаплотипом HLA-B27, и у этих людей артрит может быть острым или хроническим и может привести к серьезному повреждению суставов.
Инфекционная диарея
Abstract
Диарея, вызванная кишечными инфекциями, является основным фактором заболеваемости и смертности во всем мире. По оценкам, ежегодно происходит от 2 до 4 миллиардов случаев инфекционной диареи, особенно среди детей грудного возраста.В этом обзоре освещаются клеточные и молекулярные механизмы, лежащие в основе диареи, связанной с тремя классами инфекционных агентов, т. е. бактериями, вирусами и паразитами. Несколько бактериальных патогенов были выбраны в качестве модельных организмов, в том числе Vibrio cholerae в качестве классического примера секреторной диареи, Clostridium difficile и виды Shigella в качестве возбудителей воспалительной диареи и отдельные штаммы патогенных Escherichia coli ( E. coli ), чтобы обсудить недавние достижения в изменении поглощения эпителиальных ионов.Многие недавние исследования, посвященные эпителиальному транспорту ионов и барьерной функции, проводились с использованием вирусов и паразитов. Здесь мы сосредоточимся на быстро развивающейся области вирусной диареи, включая ротавирусную, норовирусную и астровирусную инфекции.
По оценкам, ежегодно происходит от 2 до 4 миллиардов случаев инфекционной диареи, особенно среди детей грудного возраста.В этом обзоре освещаются клеточные и молекулярные механизмы, лежащие в основе диареи, связанной с тремя классами инфекционных агентов, т. е. бактериями, вирусами и паразитами. Несколько бактериальных патогенов были выбраны в качестве модельных организмов, в том числе Vibrio cholerae в качестве классического примера секреторной диареи, Clostridium difficile и виды Shigella в качестве возбудителей воспалительной диареи и отдельные штаммы патогенных Escherichia coli ( E. coli ), чтобы обсудить недавние достижения в изменении поглощения эпителиальных ионов.Многие недавние исследования, посвященные эпителиальному транспорту ионов и барьерной функции, проводились с использованием вирусов и паразитов. Здесь мы сосредоточимся на быстро развивающейся области вирусной диареи, включая ротавирусную, норовирусную и астровирусную инфекции. Наконец, мы обсуждаем Giardia lamblia и Entamoeba histolytica как примеры паразитарной диареи. Паразиты имеют большую сложность, чем другие патогены, и способны создавать молекулы, подобные тем, которые производит хозяин, такие как серотонин и PGE 2 .Обсуждаемые механизмы, лежащие в основе инфекционной диареи, включают изменения транспорта ионов и плотных контактов, а также факторы вирулентности, которые изменяют эти процессы либо путем прямого воздействия, либо косвенно через воспаление и нейротрансмиттеры.
Наконец, мы обсуждаем Giardia lamblia и Entamoeba histolytica как примеры паразитарной диареи. Паразиты имеют большую сложность, чем другие патогены, и способны создавать молекулы, подобные тем, которые производит хозяин, такие как серотонин и PGE 2 .Обсуждаемые механизмы, лежащие в основе инфекционной диареи, включают изменения транспорта ионов и плотных контактов, а также факторы вирулентности, которые изменяют эти процессы либо путем прямого воздействия, либо косвенно через воспаление и нейротрансмиттеры.
Ключевые слова: инфекционная диарея, абсорбция ионов, кишечные патогены, механизмы диареи, EPEC
Введение
По своей сути диарея представляет собой просто измененное движение ионов и воды, которое следует осмотическому градиенту.В нормальных условиях желудочно-кишечный тракт обладает огромной способностью всасывать жидкость и электролиты, при этом ежедневно в кишечник поступает 8–9 литров жидкости, а с калом выделяется только 100–200 мл.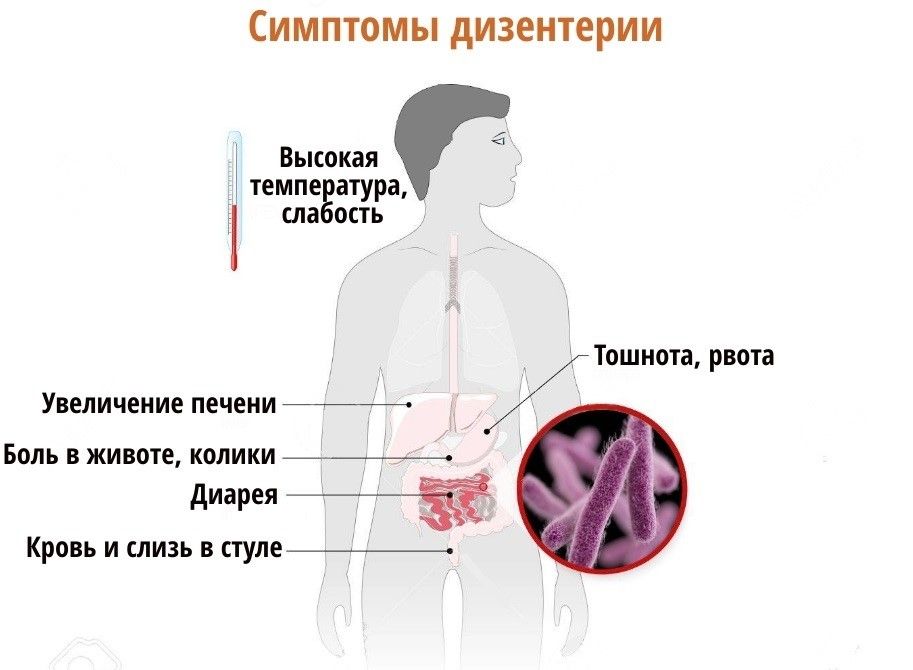 Однако кишечные патогены могут изменить этот баланс в сторону чистой секреции, что приведет к диарейным заболеваниям. Измененное движение ионов может происходить либо через транспортеры, либо через боковые пространства между клетками, которые регулируются плотными контактами. В связи с этим некоторые транспортеры, по-видимому, тесно связаны с движением воды, в том числе натрий-зависимый переносчик глюкозы (SGLT1), обменник изоформы 3 Na + /H + (NHE3) и апикальный Cl — /HCO 3 − обменник, экспрессия которого снижена при аденоме (DRA).Классическая секреторная диарея, вызванная холерным токсином (ХТ), обусловлена цАМФ-зависимой активацией муковисцидозного трансмембранного регулятора проводимости (CFTR), хлор-канала (4). С другой стороны, изменения уровней Ca 2+ увеличивают активность кальций-активированного хлоридного канала (CLCA). В некоторых случаях, как и при ХТ, увеличение секреции Cl сопровождается снижением поглощения Na + .
Однако кишечные патогены могут изменить этот баланс в сторону чистой секреции, что приведет к диарейным заболеваниям. Измененное движение ионов может происходить либо через транспортеры, либо через боковые пространства между клетками, которые регулируются плотными контактами. В связи с этим некоторые транспортеры, по-видимому, тесно связаны с движением воды, в том числе натрий-зависимый переносчик глюкозы (SGLT1), обменник изоформы 3 Na + /H + (NHE3) и апикальный Cl — /HCO 3 − обменник, экспрессия которого снижена при аденоме (DRA).Классическая секреторная диарея, вызванная холерным токсином (ХТ), обусловлена цАМФ-зависимой активацией муковисцидозного трансмембранного регулятора проводимости (CFTR), хлор-канала (4). С другой стороны, изменения уровней Ca 2+ увеличивают активность кальций-активированного хлоридного канала (CLCA). В некоторых случаях, как и при ХТ, увеличение секреции Cl сопровождается снижением поглощения Na + . Кроме того, прямое восстановление белков, транспортирующих воду, таких как аквапорины, приводит к меньшему поглощению жидкости.
Кроме того, прямое восстановление белков, транспортирующих воду, таких как аквапорины, приводит к меньшему поглощению жидкости.
Обзор общих механизмов, вызывающих диарею. На самом базовом уровне диарея вызвана повышенной секрецией или снижением всасывания жидкости и электролитов. Определенные процессы переноса ионов особенно связаны с диареей. К ним относятся CFTR и CLCA, которые являются хлоридными каналами, и обменная изоформа Na + /H + , NHE3, которая участвует в абсорбции Na + . Изменения в плотных контактах создают важный путь для движения как ионов, так и воды.DRA отвечает за абсорбцию хлоридов и связан с врожденной хлоридной диареей. Данные по аквапоринам ограничены, но ожидается, что они будут способствовать развитию диареи при снижении всасывания. SGLT-1 транспортирует натрий и глюкозу, тесно связан с движением воды и является основой для пероральной регидратации с использованием глюкозы для улучшения всасывания натрия.
Кишечные патогены могут либо напрямую модулировать эпителиальные процессы транспорта ионов и барьерную функцию, либо делать это косвенно через воспаление, нейропептиды или потерю абсорбирующей поверхности.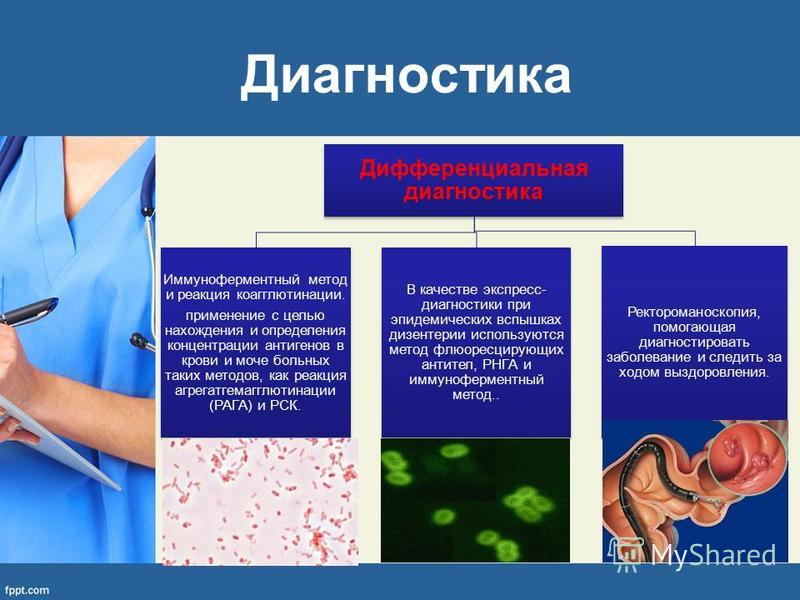 Например, такие возбудители, как кишечный паразит Giardia, вызывают потерю щеточной каймой всасывающей поверхности и диффузное укорочение ворсинок. Точно так же энтеропатогенная E. coli (EPEC) вызывает стирание микроворсинок, что уменьшает площадь поверхности для всасывания питательных веществ и вызывает повышенную осмолярность содержимого кишечника и мальабсорбцию. Однако недавние данные свидетельствуют о том, что быстрое начало диареи, вызванной ЕРЕС, может быть результатом прямого воздействия на процессы транспорта ионов в эпителии кишечника.Несколько инвазивных патогенов, в том числе виды Shigella и Salmonella, вызывают воспалительную диарею, характеризующуюся лихорадкой и наличием полиморфонуклеоцитов (PMN) в стуле. PMN регулируют абсорбцию посредством секреции цитокинов, но также играют более непосредственную роль посредством секреции предшественника аденозина, стимулятора секреции, который активирует CFTR. C. difficle и инфекция rotavius также действуют опосредованно посредством модуляции транспорта ионов, следующей за секрецией цитокинов и активацией энтеральных нервов посредством нейропептидов.
Например, такие возбудители, как кишечный паразит Giardia, вызывают потерю щеточной каймой всасывающей поверхности и диффузное укорочение ворсинок. Точно так же энтеропатогенная E. coli (EPEC) вызывает стирание микроворсинок, что уменьшает площадь поверхности для всасывания питательных веществ и вызывает повышенную осмолярность содержимого кишечника и мальабсорбцию. Однако недавние данные свидетельствуют о том, что быстрое начало диареи, вызванной ЕРЕС, может быть результатом прямого воздействия на процессы транспорта ионов в эпителии кишечника.Несколько инвазивных патогенов, в том числе виды Shigella и Salmonella, вызывают воспалительную диарею, характеризующуюся лихорадкой и наличием полиморфонуклеоцитов (PMN) в стуле. PMN регулируют абсорбцию посредством секреции цитокинов, но также играют более непосредственную роль посредством секреции предшественника аденозина, стимулятора секреции, который активирует CFTR. C. difficle и инфекция rotavius также действуют опосредованно посредством модуляции транспорта ионов, следующей за секрецией цитокинов и активацией энтеральных нервов посредством нейропептидов.
В этом обзоре представлены избранные патогены, которые обеспечивают как широкий обзор механизмов, относящихся к транспорту ионов и барьерной функции, лежащих в основе патофизиологии диареи, так и последние достижения в отношении конкретных инфекционных агентов. Основное внимание будет уделено механизмам, лежащим в основе патогенеза бактериальной диареи, которые широко изучались в последние годы и послужили важным прототипом для понимания регуляции эпителиальных процессов кишечника на клеточном и молекулярном уровне.Однако механизмы, лежащие в основе недавних достижений в области вирусной и паразитарной диареи, также будут обсуждаться. Более глубокое понимание этих регуляторных механизмов важно для полного определения патофизиологии инфекционной диареи и изучения потенциала новых противодиарейных препаратов.
Патофизиологические механизмы инфекционной диареи
Бактериальная диарея.
В развивающихся странах кишечные бактериальные патогены и паразиты являются основной причиной инфекционной диареи. Хотя даже в Соединенных Штатах частота заболеваний, вызванных бактериями, значительно выше. Энтерогеморрагическая инфекция E. coli (EHEC) вызывает заболевание примерно у 75 000 человек в год, 1 , тогда как C. difficile остается основной причиной внутрибольничных инфекций. 2 Продолжительность бактериальной диареи варьирует от нескольких часов для некоторых выделяемых токсинов до нескольких недель для активных инфекций энтероагрегативной E. coli . Здесь мы используем В.cholerae в качестве примера секреторной диареи, а затем обсудить C. difficile -ассоциированную диарею, патогенез которой зависит от нейропептидов и медиаторов воспаления. Кроме того, виды Shigella используются в качестве примера воспалительной и инвазивной диареи, в то время как E. coli имеют множество стратегий, одной из которых является снижение всасывания как за счет потери микроворсинок, так и за счет прямого воздействия на переносчики ионов.
Хотя даже в Соединенных Штатах частота заболеваний, вызванных бактериями, значительно выше. Энтерогеморрагическая инфекция E. coli (EHEC) вызывает заболевание примерно у 75 000 человек в год, 1 , тогда как C. difficile остается основной причиной внутрибольничных инфекций. 2 Продолжительность бактериальной диареи варьирует от нескольких часов для некоторых выделяемых токсинов до нескольких недель для активных инфекций энтероагрегативной E. coli . Здесь мы используем В.cholerae в качестве примера секреторной диареи, а затем обсудить C. difficile -ассоциированную диарею, патогенез которой зависит от нейропептидов и медиаторов воспаления. Кроме того, виды Shigella используются в качестве примера воспалительной и инвазивной диареи, в то время как E. coli имеют множество стратегий, одной из которых является снижение всасывания как за счет потери микроворсинок, так и за счет прямого воздействия на переносчики ионов. Эти четыре группы патогенов были выбраны для объяснения основных механизмов диареи.
Эти четыре группы патогенов были выбраны для объяснения основных механизмов диареи.
Холерный вибрион.
Несмотря на то, что V. cholerae находится в центре научных исследований с 1800-х годов, угроза сохраняется и сегодня. В то время как люди, имеющие доступ к очищенной воде, как правило, не подвергаются воздействию, районы без надлежащего хлорирования или фильтрации по-прежнему страдают от эпидемии холеры. V. cholerae содержат несколько токсинов, которые используются для компрометации хозяина, наиболее важным из которых является сам холерный токсин (СТ). СТ состоит из субъединицы А, связанной с пентамерным кольцом субъединиц В, где субъединицы В отвечают за доставку субъединицы А в клетку. 3 Субъединица А АДФ-рибозилирует ГТФазу, которая регулирует аденилатциклазу, что приводит к повышенной продукции цАМФ 4 (). Продукция цАМФ активирует PKA, который затем фосфорилирует регуляторный домен CFTR. 5 В то время как КТ является самой опасной частью арсенала V. cholorae , большая часть современной работы с КТ фактически дает представление о ключевых клеточных механизмах. Например, при изучении ретроградной транслокации CTs и возможного высвобождения пептида A1 в цитоплазму хозяина были раскрыты детали эндогенного ретроградного переноса. 6 Кроме того, движение CT через путь деградации белка, ассоциированного с эндоплазматическим ретикулумом (ERAD), пролило свет на то, как клетки справляются с неправильно свернутыми белками в ER. 7 Помимо знаний, полученных в ходе этих исследований, B-субъединица CT показала большие перспективы в качестве адъюванта в ряде недавних исследований вакцин. Хотя были дополнительные сведения о транспортерах, затронутых CT. В дополнение к повышенной секреции Cl абсорбция Na + снижается за счет цАМФ-зависимого механизма, при котором снижается активность обоих апикальных переносчиков натрия, NHE2 и NHE3 8 ().В совокупности это приводит к повышению уровня NaCl в просвете кишечника за счет усиления секреции или снижения всасывания.
cholorae , большая часть современной работы с КТ фактически дает представление о ключевых клеточных механизмах. Например, при изучении ретроградной транслокации CTs и возможного высвобождения пептида A1 в цитоплазму хозяина были раскрыты детали эндогенного ретроградного переноса. 6 Кроме того, движение CT через путь деградации белка, ассоциированного с эндоплазматическим ретикулумом (ERAD), пролило свет на то, как клетки справляются с неправильно свернутыми белками в ER. 7 Помимо знаний, полученных в ходе этих исследований, B-субъединица CT показала большие перспективы в качестве адъюванта в ряде недавних исследований вакцин. Хотя были дополнительные сведения о транспортерах, затронутых CT. В дополнение к повышенной секреции Cl абсорбция Na + снижается за счет цАМФ-зависимого механизма, при котором снижается активность обоих апикальных переносчиков натрия, NHE2 и NHE3 8 ().В совокупности это приводит к повышению уровня NaCl в просвете кишечника за счет усиления секреции или снижения всасывания.
Механизмы, лежащие в основе диареи, вызванной V. cholerae . Холера характеризуется тяжелой водянистой диареей из-за изменений в секреции и абсорбции ионов. Как CLCA, так и CFTR-зависимая секреция Cl — активируются, первая — Ace, а вторая — холерным токсином и термостабильным токсином NAG. Повышенные уровни цАМФ также блокируют всасывание натрия через NHE2 и NHE3. V. cholerae также создает поры, проницаемые для анионов, за счет введения VCC. Наряду с изменениями в ионном транспорте также снижается парацеллюлярная проницаемость. Взаимодействие Zot с зонулином заставляет ZO-1 диссоциировать от плотных соединений, в то время как HA/P расщепляет окклюдин, а rTX взаимодействует с сократительным актиновым кольцом.
Помимо CT, V. cholerae кодирует несколько других токсинов, которые модулируют секрецию ионов и нарушают барьерную функцию, вызывая массивную диарею.Токсины, которые непосредственно влияют на секрецию ионов, включают вспомогательный холерный токсин (ACE), который стимулирует Ca 2+ -зависимую секрецию Cl − ; NAG-стабильный токсин, который активирует гуанилатциклазу, тем самым стимулируя выработку цГМФ, что приводит к PKG-опосредованной активации CFTR; и, наконец, V. cholerae цитолизин (VCC), который создает поры, проницаемые для анионов 9 – 11 (). Один из фенотипов, связанных с токсичностью VCC, был связан с недавно описанным явлением аутофагии. 12 Токсин VCC вызывает образование крупных вакуолей в клетках-хозяевах в дополнение к его цитолитическому действию на эритроциты. Хотя механизм образования вакуолей только начинает пониматься, недавние исследования показали, что VCC связан с двойными мембранными везикулами и накоплением LC3-II, которые характерны для аутофагии. Кроме того, мышиные эмбриональные фибробласты с дефицитом Atg-5 (который необходим для преобразования LC3) или ингибиторов аутофагии, включая 3-метиладенин, блокируют образование вакуолей в ответ на VCC.Хотя образование вакуолей, по-видимому, является тяжелым фенотипом, на самом деле это защитная клеточная реакция, и ее ингибирование приводит к снижению выживаемости клеток более чем на 50% после воздействия токсина. В этом случае образование вакуолей, по-видимому, является частью естественного удаления VCC из клеточной мембраны, блокируя дальнейший нарушенный транспорт Cl- и защищая клетку.
cholerae цитолизин (VCC), который создает поры, проницаемые для анионов 9 – 11 (). Один из фенотипов, связанных с токсичностью VCC, был связан с недавно описанным явлением аутофагии. 12 Токсин VCC вызывает образование крупных вакуолей в клетках-хозяевах в дополнение к его цитолитическому действию на эритроциты. Хотя механизм образования вакуолей только начинает пониматься, недавние исследования показали, что VCC связан с двойными мембранными везикулами и накоплением LC3-II, которые характерны для аутофагии. Кроме того, мышиные эмбриональные фибробласты с дефицитом Atg-5 (который необходим для преобразования LC3) или ингибиторов аутофагии, включая 3-метиладенин, блокируют образование вакуолей в ответ на VCC.Хотя образование вакуолей, по-видимому, является тяжелым фенотипом, на самом деле это защитная клеточная реакция, и ее ингибирование приводит к снижению выживаемости клеток более чем на 50% после воздействия токсина. В этом случае образование вакуолей, по-видимому, является частью естественного удаления VCC из клеточной мембраны, блокируя дальнейший нарушенный транспорт Cl- и защищая клетку.
Токсины V. cholerae , которые изменяют барьерную функцию кишечника, включают гемагглютинин/протеазу или HA/P, RTX и Zot.HA/P представляет собой внеклеточную протеазу, которая расщепляет структурный белок плотных контактов, окклюдин, который, как известно, регулирует парацеллюлярную проницаемость (4). 13 Это приводит к последующей потере каркасного белка ZO-1 из плотного соединения. RTX сшивает актин и вызывает округление клеток, потерю трансэпителиальной резистентности (TER) и увеличение проницаемости для FITC-декстрана 3000. 14 Анализ кристаллической структуры RTX сшитого актина и масс-спектрометрия показали, что остатки E270 и K50 образуют ковалентную изопептидную связь. 15 Интересно, что грибковый токсин фаллоидин был способен частично восстанавливать способность актина к полимеризации в присутствии актинового сшивающего домена RTX. Легкие цепи актина и миозина играют критическую роль в регуляции плотных контактов, образуя ремнеобразную структуру вокруг клетки, которая может затягиваться для увеличения парацеллюлярного потока. В этом случае функциональность соединительного кольца актиномиозина утрачивается из-за секвестрации актина в неправильно полимеризованных агрегатах.Третий токсин, Zot, который также влияет на барьерную функцию, служит как белком сборки фага, так и энтеротоксином. 16 Это похоже на то, что наблюдается с Ace, который также является структурным белком фага. 17 Многие из факторов вирулентности, связанных с V. cholerae , являются частью интегрированного профага, называемого ., который частично состоит из Ace и Zot. 18 Zot не функционирует в связанной с фагом форме, а вместо этого расщепляется на активный пептид массой 12 кДа. 16 Пептид Zot связывается с апикальным рецептором белка-хозяина, называемого зонулином, который регулирует проницаемость исключительно в тонком кишечнике. 19 Потеря барьерной функции происходит только в подвздошной кишке кролика, но не в толстой кишке, что согласуется с локализацией рецептора зонулина.
В этом случае функциональность соединительного кольца актиномиозина утрачивается из-за секвестрации актина в неправильно полимеризованных агрегатах.Третий токсин, Zot, который также влияет на барьерную функцию, служит как белком сборки фага, так и энтеротоксином. 16 Это похоже на то, что наблюдается с Ace, который также является структурным белком фага. 17 Многие из факторов вирулентности, связанных с V. cholerae , являются частью интегрированного профага, называемого ., который частично состоит из Ace и Zot. 18 Zot не функционирует в связанной с фагом форме, а вместо этого расщепляется на активный пептид массой 12 кДа. 16 Пептид Zot связывается с апикальным рецептором белка-хозяина, называемого зонулином, который регулирует проницаемость исключительно в тонком кишечнике. 19 Потеря барьерной функции происходит только в подвздошной кишке кролика, но не в толстой кишке, что согласуется с локализацией рецептора зонулина. Недавно было показано, что меньший фрагмент Zot, состоящий всего из 6 аминокислот, способен вызывать такое же изменение устойчивости, как и диссоциацию ZO-1 от плотных контактов. 20 Однако следует отметить, что некоторые считают эту работу спорной. Таким образом, V. cholerae имеет три различных токсина, которые способствуют секреции, и три токсина, которые способствуют потере барьерной функции, и в сочетании это приводит к особенно тяжелой диарее ().
Недавно было показано, что меньший фрагмент Zot, состоящий всего из 6 аминокислот, способен вызывать такое же изменение устойчивости, как и диссоциацию ZO-1 от плотных контактов. 20 Однако следует отметить, что некоторые считают эту работу спорной. Таким образом, V. cholerae имеет три различных токсина, которые способствуют секреции, и три токсина, которые способствуют потере барьерной функции, и в сочетании это приводит к особенно тяжелой диарее ().
C. трудный.
C. difficile является ведущей причиной нозокомиальной диареи и является причиной почти всех случаев псевдомембранозного колита, который представляет собой острый колит, характеризующийся образованием спаянной воспалительной мембраны над местом повреждения 21 ().Недавнее появление новых эпидемических штаммов вызвало повышенную обеспокоенность в клинических условиях, поскольку противомикробная терапия предрасполагает пациентов к диарее, ассоциированной с C. difficile (CDAD). 22 Патогенный процесс инфекции C. difficile начинается с первоначальной колонизации с последующей выработкой двух различных экзотоксинов, токсинов A и B (TcdA и TcdB), а также дополнительного токсина, называемого бинарным токсином (CDT), который обнаружен у некоторых гипервирулентных штаммов C.трудный . 23 TcdA эффективно связывается с апикальной стороной клетки-хозяина с гликопротеином gp96, который является частью рецептора у человека. 24 Напротив, TcdB получает доступ к базолатеральной стороне клетки после разрушения плотных контактов и преимущественно связывается с неопознанным рецептором 25 , 26 (). TcdA и TcdB являются мощными цитотоксическими ферментами, которые специфически глюкозилируют малый белок GTPase Rho, что приводит к нарушению целостности цитоскелета и цитотоксическим эффектам. 27 CDT, актин-специфическая АДФ-рибозилтрансфераза, усиливает токсичность TcdA и B и может увеличивать тяжесть CDAD.
22 Патогенный процесс инфекции C. difficile начинается с первоначальной колонизации с последующей выработкой двух различных экзотоксинов, токсинов A и B (TcdA и TcdB), а также дополнительного токсина, называемого бинарным токсином (CDT), который обнаружен у некоторых гипервирулентных штаммов C.трудный . 23 TcdA эффективно связывается с апикальной стороной клетки-хозяина с гликопротеином gp96, который является частью рецептора у человека. 24 Напротив, TcdB получает доступ к базолатеральной стороне клетки после разрушения плотных контактов и преимущественно связывается с неопознанным рецептором 25 , 26 (). TcdA и TcdB являются мощными цитотоксическими ферментами, которые специфически глюкозилируют малый белок GTPase Rho, что приводит к нарушению целостности цитоскелета и цитотоксическим эффектам. 27 CDT, актин-специфическая АДФ-рибозилтрансфераза, усиливает токсичность TcdA и B и может увеличивать тяжесть CDAD.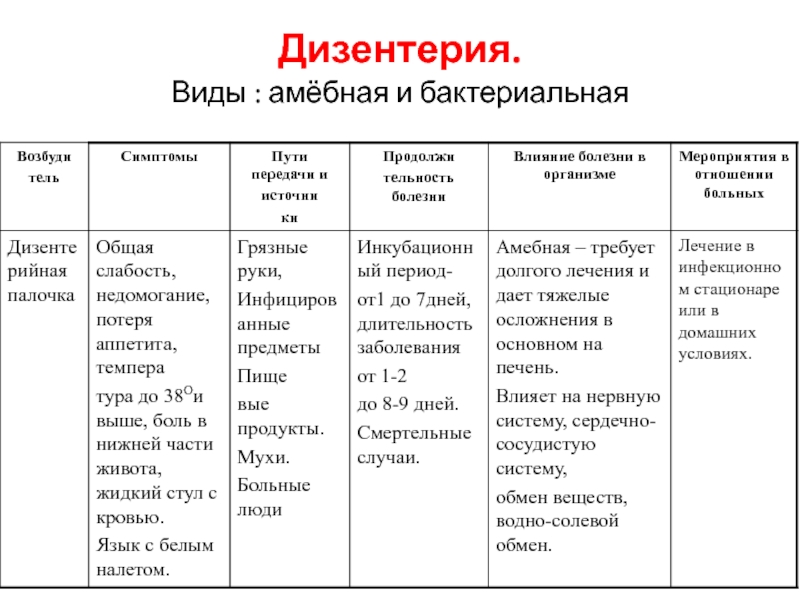 28 В то время как ранние исследования на животных предполагают, что TcdA является основным фактором патогенеза инфекции C. difficile , недавние исследования показали, что нарушение гена tcdB привело к значительному ослаблению фенотипа вирулентности в модели хомяка, что позволяет предположить, что TcdB может играть ключевую роль в патогенезе заболевания. 29
28 В то время как ранние исследования на животных предполагают, что TcdA является основным фактором патогенеза инфекции C. difficile , недавние исследования показали, что нарушение гена tcdB привело к значительному ослаблению фенотипа вирулентности в модели хомяка, что позволяет предположить, что TcdB может играть ключевую роль в патогенезе заболевания. 29
Патогенез C.diffcile – ассоциированная диарея. C. difficile продуцирует токсин A и токсин B (TcdA и TcdB). TcdA связывается с апикальной стороной клетки и после интернализации вызывает модификацию цитоскелета и нарушение плотных контактов. Возникающая в результате потеря эпителиальной барьерной функции облегчает TcdA и TcdB проникновение через эпителий с преимущественным связыванием TcdB с базолатеральной клеточной мембраной. Оба токсина являются цитотоксическими и приводят к продукции провоспалительных цитокинов, повышению проницаемости сосудов, рекрутированию нейтрофилов и моноцитов, апоптозу эпителиальных клеток и деградации соединительной ткани, что приводит к образованию псевдомембран и диарее. Кроме того, активация и высвобождение различных нейропептидов токсинами стимулирует ЭНС, вызывая секрецию жидкости, вызывая диарею.
Кроме того, активация и высвобождение различных нейропептидов токсинами стимулирует ЭНС, вызывая секрецию жидкости, вызывая диарею.
Предыдущие исследования показали, что TcdA вызывает прямые изменения барьерной функции и ионного транспорта. Например, было также показано, что очищенный токсин А вызывает чистое накопление натрия, хлорида и калия в просвете кишечника кролика in vivo. 30 Исследования в камере Ussing с использованием изолированных полосок слизистой оболочки подвздошной кишки морской свинки продемонстрировали, что TcdA увеличивает трансэпителиальную проницаемость и снижает электрогенное поглощение Na + , вызывая Cl-секреторный ответ. 31 Округление клеток и нарушение барьерной функции, соответствующее структурным изменениям околосуставного актиномизинового кольца, произошло в эпителиальных клетках T84 кишечника человека, подвергшихся воздействию TcdA. 30 , 32
Помимо прямого воздействия токсинов, другие механизмы, лежащие в основе диареи, связанной с C.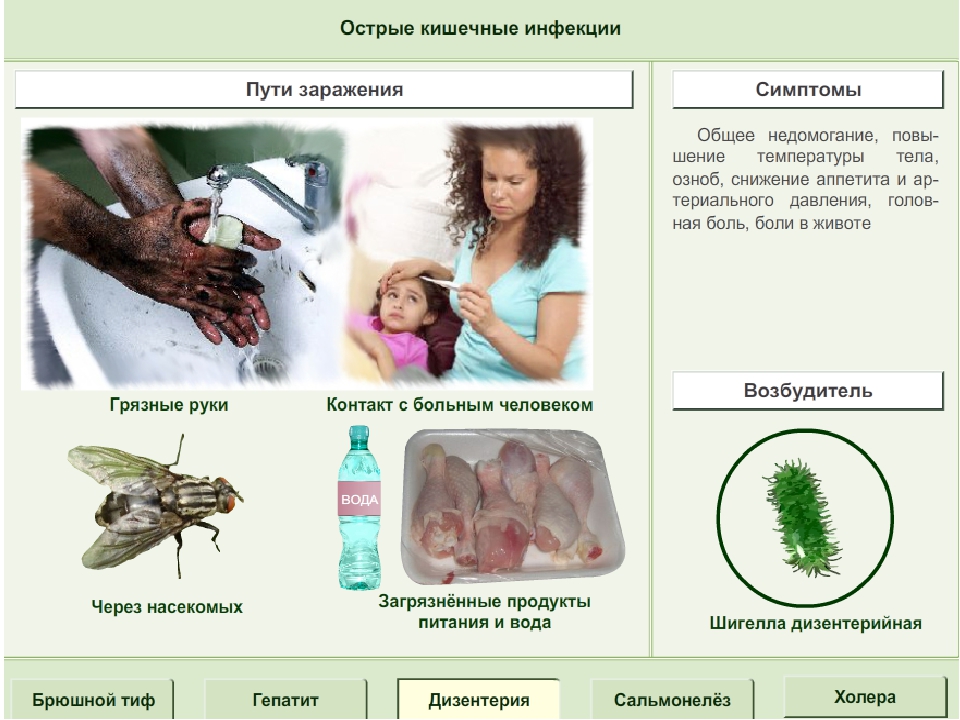 difficile , включают воспаление и активацию нейропептидов. Токсины C. difficile инициируют обширный воспалительный каскад, который вызывает повышенное повреждение тканей хозяина, что приводит к экссудации жидкости.TcdA вызывает высвобождение нескольких провоспалительных цитокинов, таких как лейкотриен, PGE 2 и фактор некроза опухоли (TNFα in vivo). 33 Он также непосредственно активирует моноциты для высвобождения IL-1 и IL-6, 34 и увеличивает миграцию нейтрофилов in vitro. 35 Другие воспалительные эффекты, опосредованные токсинами, включают высвобождение активных форм кислорода, активацию митоген-активируемых протеинкиназ и активацию NFκB. 33 Ряд исследований показывает, что важные клеточные реакции на C.difficile , такие как активация киназы p38 MAP, повреждение митохондрий и высвобождение IL-8, происходят до и независимо от глюкозилирования Rho. 33
difficile , включают воспаление и активацию нейропептидов. Токсины C. difficile инициируют обширный воспалительный каскад, который вызывает повышенное повреждение тканей хозяина, что приводит к экссудации жидкости.TcdA вызывает высвобождение нескольких провоспалительных цитокинов, таких как лейкотриен, PGE 2 и фактор некроза опухоли (TNFα in vivo). 33 Он также непосредственно активирует моноциты для высвобождения IL-1 и IL-6, 34 и увеличивает миграцию нейтрофилов in vitro. 35 Другие воспалительные эффекты, опосредованные токсинами, включают высвобождение активных форм кислорода, активацию митоген-активируемых протеинкиназ и активацию NFκB. 33 Ряд исследований показывает, что важные клеточные реакции на C.difficile , такие как активация киназы p38 MAP, повреждение митохондрий и высвобождение IL-8, происходят до и независимо от глюкозилирования Rho. 33
Другой поразительной особенностью кишечных реакций, связанных с токсином C. difficle , является активация кишечных нервов и усиленное производство или высвобождение нейропептидов, включая вещество P (SP), пептид, родственный гену кальцитонина (CGRP), и нейротензин, 36 – 38 , которые, как известно, вызывают секрецию Cl в эпителиальных клетках кишечника.Антагонисты рецептора вещества Р, нейрокинин-1 (NK1) и пептид, родственный гену кальцитонина (CGRP), блокируют накопление жидкости и поток маннита в ответ на токсин А. 33 Также в подвздошной кишке NK1-R-/- петлевой модели накопление жидкости в просвете, опосредованное TcdA, было значительно снижено. 39 Таким образом, в отличие от холерного токсина и энтеротоксинов E. coli , которые вызывают кишечную секрецию без воспаления кишечника, патофизиология диареи, ассоциированной с C. difficile , включает некровоспалительную реакцию, которая активирует тучные клетки, нервы, эндотелий сосудов, и иммунные клетки в дополнение к нарушению плотных контактов ().
difficle , является активация кишечных нервов и усиленное производство или высвобождение нейропептидов, включая вещество P (SP), пептид, родственный гену кальцитонина (CGRP), и нейротензин, 36 – 38 , которые, как известно, вызывают секрецию Cl в эпителиальных клетках кишечника.Антагонисты рецептора вещества Р, нейрокинин-1 (NK1) и пептид, родственный гену кальцитонина (CGRP), блокируют накопление жидкости и поток маннита в ответ на токсин А. 33 Также в подвздошной кишке NK1-R-/- петлевой модели накопление жидкости в просвете, опосредованное TcdA, было значительно снижено. 39 Таким образом, в отличие от холерного токсина и энтеротоксинов E. coli , которые вызывают кишечную секрецию без воспаления кишечника, патофизиология диареи, ассоциированной с C. difficile , включает некровоспалительную реакцию, которая активирует тучные клетки, нервы, эндотелий сосудов, и иммунные клетки в дополнение к нарушению плотных контактов (). Дальнейшие исследования, относящиеся к подробному анализу вклада электрогенных и электронейтральных компонентов в абсорбцию ионов в хорошо зарекомендовавших себя животных моделях инфекции C. difficile , будут способствовать моделированию патогенеза заболевания и помогут выяснить механизмы C. difficile сопутствующая диарея.
Дальнейшие исследования, относящиеся к подробному анализу вклада электрогенных и электронейтральных компонентов в абсорбцию ионов в хорошо зарекомендовавших себя животных моделях инфекции C. difficile , будут способствовать моделированию патогенеза заболевания и помогут выяснить механизмы C. difficile сопутствующая диарея.
Виды шигелл.
Существует четыре основных вида шигелл, вызывающих диарею. Самый распространенный вид в США.и других развитых странах — S. sonnei , за которым следует S. flexneri . 40 Два других вида шигелл, S. dysenteriae и S. boydii , очень редко встречаются в развитых странах и имеют в целом низкий уровень инфицирования, однако S. dysenteriae вызывает наиболее опасные для жизни всех этих инфекций из-за продукции токсина Шига, который может привести к гемолитико-уремическому синдрому (ГУС). В то время как все четыре вида Shigella являются инвазивными из-за большой вирулентной плазмиды, существуют некоторые различия в плазмиде и S. flexneri является наиболее изученным в этом отношении. Процесс инвазии сложен и происходит через триггерный механизм на базолатеральной стороне эпителиальных клеток после того, как бактерии уже прошли через М-клетки и, возможно, макрофаги. 41 Кроме того, шигеллы имеют актиновые хвосты и способны распространяться от клетки к клетке, что повышает их способность колонизировать эпителий. 42 Секретируемые эффекторные белки типа III, участвующие в этом процессе, многочисленны и недавно были тщательно изучены Schroeder и Hilbi. 43
flexneri является наиболее изученным в этом отношении. Процесс инвазии сложен и происходит через триггерный механизм на базолатеральной стороне эпителиальных клеток после того, как бактерии уже прошли через М-клетки и, возможно, макрофаги. 41 Кроме того, шигеллы имеют актиновые хвосты и способны распространяться от клетки к клетке, что повышает их способность колонизировать эпителий. 42 Секретируемые эффекторные белки типа III, участвующие в этом процессе, многочисленны и недавно были тщательно изучены Schroeder и Hilbi. 43
Инвазия и воспалительная реакция. Shigella вызывает воспалительную диарею, а клеточный ответ на различные этапы процесса инвазии является основной причиной воспаления (). Разрушение макрофагов после выхода из М-клеток вызывает первоначальное высвобождение IL-1β, который привлекает PMN. 44 , 45 PMN высвобождают предшественник стимулятора секреции аденозина, который активирует секрецию Cl — . Эта ранняя стадия воспаления усугубляется присутствием свободных бактерий на базолатеральной стороне клеток, что обеспечивает доступ к толл-подобным рецепторам.ЛПС Shigella способен активировать TLR4, хотя недавние исследования показывают, что он примерно на 50% менее активен, чем ЛПС из E. coli , в активации NFκB из-за пониженного уровня ацетилирования. 46 Таким образом, Shigella в какой-то степени активно уклоняется от распознавания TLR4, в то время как TLR2 активируется Shigella через липопротеины. 47 Кроме того, взаимодействие Nod1 с пептидогликаном, выделяемым внутриклеточными бактериями, также приводит к активации NFκB и продукции IL-8. 48 ИЛ-8 — еще один провоспалительный цитокин, привлекающий ПЯН. В этом случае ПЯЛ вызывают многие симптомы заболевания, но также приводят к его полному излечению.
Эта ранняя стадия воспаления усугубляется присутствием свободных бактерий на базолатеральной стороне клеток, что обеспечивает доступ к толл-подобным рецепторам.ЛПС Shigella способен активировать TLR4, хотя недавние исследования показывают, что он примерно на 50% менее активен, чем ЛПС из E. coli , в активации NFκB из-за пониженного уровня ацетилирования. 46 Таким образом, Shigella в какой-то степени активно уклоняется от распознавания TLR4, в то время как TLR2 активируется Shigella через липопротеины. 47 Кроме того, взаимодействие Nod1 с пептидогликаном, выделяемым внутриклеточными бактериями, также приводит к активации NFκB и продукции IL-8. 48 ИЛ-8 — еще один провоспалительный цитокин, привлекающий ПЯН. В этом случае ПЯЛ вызывают многие симптомы заболевания, но также приводят к его полному излечению.
Инвазия и воспаление, вызванное Shigella. Виды шигелл пересекают эпителиальный барьер через М-клетки, где они сталкиваются с макрофагами и уничтожают их. Связывание липопротеина с TLR2 приводит к продукции хемоаттрактанта IL-1β. После транслокации через М-клетки ЛПС может связываться с базолатеральным TLR4, что вызывает продукцию ИЛ-6 и ИЛ-8.Этот эффект несколько снижается из-за ацетилирования ЛПС у шигелл. IL-8 является мощным хемоаттрактантом для PMN и также вырабатывается за счет активации внутриклеточного Nod1 пептидогликаном. PMN являются основной разрушительной силой при инфекции Shigella. PMN вызывают секрецию Cl — за счет образования предшественника стимулятора секреции аденозина, а также могут вызывать изъязвление эпителия, что приводит к уменьшению всасывающей поверхности, но также максимизирует проницаемость и обеспечивает легкий доступ кишечной флоры к базолатеральной поверхности. клетки, вызывающие дальнейшее воспаление.
Связывание липопротеина с TLR2 приводит к продукции хемоаттрактанта IL-1β. После транслокации через М-клетки ЛПС может связываться с базолатеральным TLR4, что вызывает продукцию ИЛ-6 и ИЛ-8.Этот эффект несколько снижается из-за ацетилирования ЛПС у шигелл. IL-8 является мощным хемоаттрактантом для PMN и также вырабатывается за счет активации внутриклеточного Nod1 пептидогликаном. PMN являются основной разрушительной силой при инфекции Shigella. PMN вызывают секрецию Cl — за счет образования предшественника стимулятора секреции аденозина, а также могут вызывать изъязвление эпителия, что приводит к уменьшению всасывающей поверхности, но также максимизирует проницаемость и обеспечивает легкий доступ кишечной флоры к базолатеральной поверхности. клетки, вызывающие дальнейшее воспаление.
Shigella очень тесно связаны с E. coli , однако реакция хозяина значительно отличается из-за их способности проникать через эпителий и получать доступ к базолатеральным толл-подобным рецепторам в дополнение к их способности проникать в клетки, где есть Nod-белки. . Из-за этого виды Shigella выработали ряд белков, которые противодействуют иммунному ответу хозяина. Один метод является профилактическим с такими механизмами, как изменение ацетилирования LPS, что снижает активацию TLR4. 46 Кроме того, было показано, что Shigella наряду с несколькими другими типами бактерий имеют механизм рециркуляции своего пептидогликана, который предназначен для предотвращения его высвобождения и взаимодействия с Nod1. Существуют две пермеазы, AmpG и MppA, которые транспортируют свободный пептидогликан из периплазмы в бактериальную цитоплазму. 48 Мыши, инфицированные мутантным штаммом MppA, смогли избавиться от смертельных доз S. flexneri . 48 Маскировка молекулярных паттернов не является полностью эффективной стратегией, поэтому у шигелл есть дополнительные стратегии, которые блокируют передачу сигнала после распознавания патогена.
. Из-за этого виды Shigella выработали ряд белков, которые противодействуют иммунному ответу хозяина. Один метод является профилактическим с такими механизмами, как изменение ацетилирования LPS, что снижает активацию TLR4. 46 Кроме того, было показано, что Shigella наряду с несколькими другими типами бактерий имеют механизм рециркуляции своего пептидогликана, который предназначен для предотвращения его высвобождения и взаимодействия с Nod1. Существуют две пермеазы, AmpG и MppA, которые транспортируют свободный пептидогликан из периплазмы в бактериальную цитоплазму. 48 Мыши, инфицированные мутантным штаммом MppA, смогли избавиться от смертельных доз S. flexneri . 48 Маскировка молекулярных паттернов не является полностью эффективной стратегией, поэтому у шигелл есть дополнительные стратегии, которые блокируют передачу сигнала после распознавания патогена.
Секретируемые эффекторные белки типа III модулируют воспаление. Shigella имеют систему секреции типа III, которая вводит ряд эффекторных белков, необходимых для начальной инвазии, выхода из вакуоли и движения внутри клетки.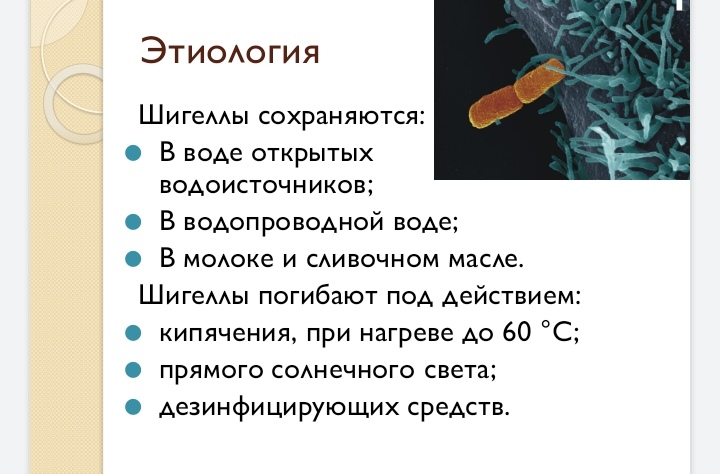 Поскольку шигеллез в первую очередь возникает из-за воспаления, бактериальные белки, которые модулируют иммунный ответ хозяина, также могут по-разному модулировать диарейный ответ хозяина. Этому критерию соответствуют три эффекторных белка: OspF, OspG и IpaH.Первый, OspF, обладает уникальным способом ингибирования передачи сигналов киназы MAP. Это совершенно новый тип фермента, не существующий в клетках млекопитающих, называемый фосфо-треонин-лиазой. 49 OspF способен дефосфорилировать остатки треонина таким образом, что удаляется не только фосфатная группа, но и атом кислорода, который обычно является частью аминокислоты, а также атом водорода из соседнего углерода. При этом он создает двойную углерод-углеродную связь в основной цепи аминокислоты.В этой форме нет гидроксильной группы, способной к фосфорилированию, поэтому процесс практически необратим. OspF влияет на несколько киназ MAP, включая Erk1/2, p38 и JNK. 49 Эти киназы активируют факторы транскрипции, которые контролируют выработку провоспалительных цитокинов, включая IL-1, IL-6 и TNFα.
Поскольку шигеллез в первую очередь возникает из-за воспаления, бактериальные белки, которые модулируют иммунный ответ хозяина, также могут по-разному модулировать диарейный ответ хозяина. Этому критерию соответствуют три эффекторных белка: OspF, OspG и IpaH.Первый, OspF, обладает уникальным способом ингибирования передачи сигналов киназы MAP. Это совершенно новый тип фермента, не существующий в клетках млекопитающих, называемый фосфо-треонин-лиазой. 49 OspF способен дефосфорилировать остатки треонина таким образом, что удаляется не только фосфатная группа, но и атом кислорода, который обычно является частью аминокислоты, а также атом водорода из соседнего углерода. При этом он создает двойную углерод-углеродную связь в основной цепи аминокислоты.В этой форме нет гидроксильной группы, способной к фосфорилированию, поэтому процесс практически необратим. OspF влияет на несколько киназ MAP, включая Erk1/2, p38 и JNK. 49 Эти киназы активируют факторы транскрипции, которые контролируют выработку провоспалительных цитокинов, включая IL-1, IL-6 и TNFα. Киназы MAP также нацелены на IpaH, который представляет собой убиквитинлигазу. 50 Это было обнаружено с использованием модели дрожжей, где мишенью дрожжей был Ste7, MAPKK.Ste7 активно подвергается протеасомной деградации после убиквитинирования с помощью IpaH, тем самым нарушая дальнейшую активацию MAP-киназы и транскрипцию провоспалительных цитокинов. Напротив, OspG активно препятствует убиквитинированию фосфо-IκBα, предотвращая его деградацию. 51 IκBα в норме связывается с NFκB и предотвращает его транслокацию в ядро. В нормальных условиях фосфорилирование IκBα приводит к его убиквитинированию и последующей деградации, обеспечивая транслокацию NFκB и активацию транскрипции.OspG автофосфорилируется, что приводит к ассоциации с ферментами, конъюгирующими убиквитин, такими как UbcH5 и UbcH7. 51 Хотя ясно, что OspG эффективно блокирует убиквитинирование и деградацию фосфо-IκBα, неясно, является ли IκBα специфической мишенью. Способность OspG взаимодействовать с несколькими ферментами, конъюгирующими убиквитин, предполагает, что могут быть дополнительные мишени, но присутствие IpaH предполагает, что, по крайней мере, некоторая убиквитин-опосредованная деградация остается неизменной.
Киназы MAP также нацелены на IpaH, который представляет собой убиквитинлигазу. 50 Это было обнаружено с использованием модели дрожжей, где мишенью дрожжей был Ste7, MAPKK.Ste7 активно подвергается протеасомной деградации после убиквитинирования с помощью IpaH, тем самым нарушая дальнейшую активацию MAP-киназы и транскрипцию провоспалительных цитокинов. Напротив, OspG активно препятствует убиквитинированию фосфо-IκBα, предотвращая его деградацию. 51 IκBα в норме связывается с NFκB и предотвращает его транслокацию в ядро. В нормальных условиях фосфорилирование IκBα приводит к его убиквитинированию и последующей деградации, обеспечивая транслокацию NFκB и активацию транскрипции.OspG автофосфорилируется, что приводит к ассоциации с ферментами, конъюгирующими убиквитин, такими как UbcH5 и UbcH7. 51 Хотя ясно, что OspG эффективно блокирует убиквитинирование и деградацию фосфо-IκBα, неясно, является ли IκBα специфической мишенью. Способность OspG взаимодействовать с несколькими ферментами, конъюгирующими убиквитин, предполагает, что могут быть дополнительные мишени, но присутствие IpaH предполагает, что, по крайней мере, некоторая убиквитин-опосредованная деградация остается неизменной. OspF, IpaH и OspG препятствуют как каскаду киназы MAP, так и транслокации NFκB, блокируя многие критические пути, необходимые для активации транскрипции цитокинов хозяина.
OspF, IpaH и OspG препятствуют как каскаду киназы MAP, так и транслокации NFκB, блокируя многие критические пути, необходимые для активации транскрипции цитокинов хозяина.
Модуляция провоспалительной сигнализации эффекторами Shigella T3SS. Было показано, что несколько секретируемых эффекторных белков типа III модулируют иммунный ответ хозяина во время инфекции Shigella. Первым из них является OspG, который препятствует убиквитинированию фосфорилированного IκB, предотвращая его деградацию, тем самым эффективно блокируя транслокацию NFκB в ядро. Напротив, IpaH фактически индуцирует убиквитинирование и деградацию MapKK, предотвращая дальнейшую каскадную активацию. Наконец, OspF обладает уникальным способом отщепления фосфатной группы и нескольких дополнительных атомов от MapK, включая Erk1/2, JNK и p38, что предотвращает дальнейшее фосфорилирование.
Активация PMN может также привести к более генерализованной потере абсорбционной функции из-за разрушения эпителиального слоя. В случае Shigella это фактически усиливает бактериальную инвазию, открывая больший доступ к базолатеральной поверхности клеток. 52 Однако недавно было показано, что Shigella активно противостоит этой потере эпителия за счет взаимодействия OspE с интегрин-связанной киназой белка хозяина (ILK). 53 Это взаимодействие замедляет оборот фокальных спаек, хотя механизм обусловлен не повышенной активностью киназы, а повышенной мембранной ассоциацией ILK.Хотя этот механизм предотвращает первоначальную потерю клеток, он также предотвращает миграцию в тестах на заживление ран, поэтому ткань, которая уже повреждена, не заживает. Исследования ректально инфицированных морских свинок показывают, что OspE способствует большей колонизации, более тяжелой диарее, воспалению и кровотечению. Поддержание целостности эпителия таким образом несколько необычно, учитывая нарушение клеточной архитектуры, вызванное другими патогенами; однако, поскольку шигеллы колонизируют эпителий внутриклеточно, потеря уже колонизированных клеток может нанести вред бактериям.
В случае Shigella это фактически усиливает бактериальную инвазию, открывая больший доступ к базолатеральной поверхности клеток. 52 Однако недавно было показано, что Shigella активно противостоит этой потере эпителия за счет взаимодействия OspE с интегрин-связанной киназой белка хозяина (ILK). 53 Это взаимодействие замедляет оборот фокальных спаек, хотя механизм обусловлен не повышенной активностью киназы, а повышенной мембранной ассоциацией ILK.Хотя этот механизм предотвращает первоначальную потерю клеток, он также предотвращает миграцию в тестах на заживление ран, поэтому ткань, которая уже повреждена, не заживает. Исследования ректально инфицированных морских свинок показывают, что OspE способствует большей колонизации, более тяжелой диарее, воспалению и кровотечению. Поддержание целостности эпителия таким образом несколько необычно, учитывая нарушение клеточной архитектуры, вызванное другими патогенами; однако, поскольку шигеллы колонизируют эпителий внутриклеточно, потеря уже колонизированных клеток может нанести вред бактериям.
Изменения ионного транспорта и барьерной функции. Хотя диарея, вызванная шигеллами, в основном связана с воспалительными процессами хозяина, и многие эффекторные белки шигелл активно влияют на воспаление, существуют дополнительные факторы, которые непосредственно изменяют ионный транспорт и плотные контакты. Жизнеспособный S. flexneri , в отличие от бактериального супернатанта, убитые нагреванием бактерии или очищенный ЛПС способны снижать трансэпителиальную резистентность. 54 Ряд белков плотных контактов, включая клаудин-1, ZO-1, ZO-2 и окклюдин, изменяются в присутствии Shigella; однако специфический эффекторный белок, ответственный за эти изменения, еще не идентифицирован.Шигеллы также обладают тремя энтеротоксинами, известными как SigA, SepA и Pic, которые являются аутотранспортерами сериновых протеаз или SPATES. Как следует из названия, основная функция SPATES — протеолитическая. Автотранспортная часть названия относится к механизму выхода из внешней мембраны бактерий через пору β-бочонка, образованную С-концом самого белка. В то время как Pic был связан с расщеплением муцина и, как полагают, играет роль в колонизации, только SigA играет явную роль в накоплении жидкости. 55 Эти протеазы также связаны с различными цитотоксическими эффектами и вызывают округление клеток. Фактический механизм, участвующий в SigA-опосредованном увеличении жидкости в илеальных петлях кролика, не определен. Было показано, что гомологичный белок в энтероагрегативной E. coli , называемый Pet, разрушает спектрин, компонент цитоскелета, и вызывает изменения тока короткого замыкания в дополнение к подъему клеток. Таким образом, хотя шигеллы действительно производят токсины, которые изменяют движение жидкости, и белки, которые изменяют регуляцию плотных соединений, они считаются менее важными, чем воспаление, в возникновении диареи.
В то время как Pic был связан с расщеплением муцина и, как полагают, играет роль в колонизации, только SigA играет явную роль в накоплении жидкости. 55 Эти протеазы также связаны с различными цитотоксическими эффектами и вызывают округление клеток. Фактический механизм, участвующий в SigA-опосредованном увеличении жидкости в илеальных петлях кролика, не определен. Было показано, что гомологичный белок в энтероагрегативной E. coli , называемый Pet, разрушает спектрин, компонент цитоскелета, и вызывает изменения тока короткого замыкания в дополнение к подъему клеток. Таким образом, хотя шигеллы действительно производят токсины, которые изменяют движение жидкости, и белки, которые изменяют регуляцию плотных соединений, они считаются менее важными, чем воспаление, в возникновении диареи.
Кишечная палочка.
E. coli является наиболее распространенным факультативным анаэробом кишечной флоры человека и обычно колонизирует желудочно-кишечный тракт в течение нескольких часов после рождения. 56 Обычно комменсалы E. coli взаимодействуют с хозяином взаимовыгодным образом; однако некоторые штаммы E. coli приобретают признаки вирулентности, которые могут вызывать широкий спектр заболеваний. Выявлено несколько различных классов патогенных штаммов E. coli , ответственных за вспышки диареи.К ним относятся энтеропатогенные E. coli (ЕРЕС), энтерогеморрагические Е. coli (ЭГЕС), энтеротоксигенные Е. coli (ЭТЕС), энтероагрегативные Е. coli (ЭАЕС), энтероинвазивные Е. coli и диффузно-адгезивные Е. coli. coli (DAEC). Эта статья посвящена диареегенным штаммам E. coli , поражающим людей, в частности EPEC, который широко изучался в последние годы, чтобы понять механизмы, лежащие в основе патофизиологии ранней диареи.Краткое введение об инфекции ETEC предназначено в первую очередь для сравнения с этими более современными исследованиями.
56 Обычно комменсалы E. coli взаимодействуют с хозяином взаимовыгодным образом; однако некоторые штаммы E. coli приобретают признаки вирулентности, которые могут вызывать широкий спектр заболеваний. Выявлено несколько различных классов патогенных штаммов E. coli , ответственных за вспышки диареи.К ним относятся энтеропатогенные E. coli (ЕРЕС), энтерогеморрагические Е. coli (ЭГЕС), энтеротоксигенные Е. coli (ЭТЕС), энтероагрегативные Е. coli (ЭАЕС), энтероинвазивные Е. coli и диффузно-адгезивные Е. coli. coli (DAEC). Эта статья посвящена диареегенным штаммам E. coli , поражающим людей, в частности EPEC, который широко изучался в последние годы, чтобы понять механизмы, лежащие в основе патофизиологии ранней диареи.Краткое введение об инфекции ETEC предназначено в первую очередь для сравнения с этими более современными исследованиями.
Энтеротоксигенные
E. coli . ETEC вызывает токсигенную секреторную диарею, характеризующуюся массивной секрецией кишечной жидкости. Ключевые признаки вирулентности ETEC включают адгезию к поверхности эпителиальных клеток факторами колонизации и выработку термолабильных (LT) и термостабильных (ST и ) энтеротоксинов. Некоторые штаммы ETEC также могут экспрессировать энтероагрегативный термостабильный токсин 1 (EAST1).Подобно токсину холеры, термолабильные токсины вызывают увеличение секреции Cl — посредством активации цАМФ. Однако известно, что ST a вызывает секрецию и диарею за счет повышения внутриклеточного цГМФ. Известно, что после связывания со своим рецептором гуанилилциклаза С (GC-C), ST и через зависимые от цГМФ пути стимулируют транслокацию CFTR на поверхность ворсинчатых энтероцитов, вызывая его активацию. 57 Существует чистый Cl — , HCO 3 — и секреция воды, а также ингибирование обмена Na + / H + в тощекишечных энтероцитах с помощью ST a a 58 Другие исследования показали, что ST и действуют только против всасывания и не стимулируют секрецию Cl — .
Ключевые признаки вирулентности ETEC включают адгезию к поверхности эпителиальных клеток факторами колонизации и выработку термолабильных (LT) и термостабильных (ST и ) энтеротоксинов. Некоторые штаммы ETEC также могут экспрессировать энтероагрегативный термостабильный токсин 1 (EAST1).Подобно токсину холеры, термолабильные токсины вызывают увеличение секреции Cl — посредством активации цАМФ. Однако известно, что ST a вызывает секрецию и диарею за счет повышения внутриклеточного цГМФ. Известно, что после связывания со своим рецептором гуанилилциклаза С (GC-C), ST и через зависимые от цГМФ пути стимулируют транслокацию CFTR на поверхность ворсинчатых энтероцитов, вызывая его активацию. 57 Существует чистый Cl — , HCO 3 — и секреция воды, а также ингибирование обмена Na + / H + в тощекишечных энтероцитах с помощью ST a a 58 Другие исследования показали, что ST и действуют только против всасывания и не стимулируют секрецию Cl — . 59 Хотя было показано, что GC-C является первичным рецептором, участвующим в опосредованной ST a секреторной реакции, недавние исследования показали, что рецептор, отличный от GC-C, существует в проксимальном отделе кишечника мыши и функционально стимулирует ST a индуцированная секреция бикарбоната двенадцатиперстной кишки через механизм, независимый от CFTR. 60 Независимый от CFTR механизм дополнительно подтверждается исследованиями, демонстрирующими стимуляцию секреции HCO 3 − в двенадцатиперстной кишке у пациентов с муковисцидозом 61 и мышей с нокаутом CFTR. 62 Необходимо выяснить, актуален ли этот механизм у нормальных людей или возникает как адаптивная реакция из-за потери CFTR. 60 Также представляет интерес дальнейшее выяснение альтернативных механизмов секреции бикарбоната, модулируемых ST и с использованием нокаутных мышей DRA и PAT-1.
59 Хотя было показано, что GC-C является первичным рецептором, участвующим в опосредованной ST a секреторной реакции, недавние исследования показали, что рецептор, отличный от GC-C, существует в проксимальном отделе кишечника мыши и функционально стимулирует ST a индуцированная секреция бикарбоната двенадцатиперстной кишки через механизм, независимый от CFTR. 60 Независимый от CFTR механизм дополнительно подтверждается исследованиями, демонстрирующими стимуляцию секреции HCO 3 − в двенадцатиперстной кишке у пациентов с муковисцидозом 61 и мышей с нокаутом CFTR. 62 Необходимо выяснить, актуален ли этот механизм у нормальных людей или возникает как адаптивная реакция из-за потери CFTR. 60 Также представляет интерес дальнейшее выяснение альтернативных механизмов секреции бикарбоната, модулируемых ST и с использованием нокаутных мышей DRA и PAT-1.
LT имеет две серогруппы, LTI и LTII, которые не перекрестно реагируют иммунологически. LTI экспрессируется штаммами E. coli , которые являются патогенными как для животных, так и для человека, тогда как LTII редко обнаруживается в изолятах человека и не связан с заболеванием.Как LTI, так и LTII очень похожи на CT структурно и функционально. LTI состоит из ферментативной субъединицы А и пентамерной субъединицы В, которые прочно связываются с ганглиозидом GM1. После связывания с мембраной LTI подвергается эндоцитозу и транспортируется через сеть транс-Гольджи (TGN). 63 LT нацеливается на аденилатциклазу, что приводит к увеличению цАМФ, активации PKA, что приводит к увеличению фосфорилирования и активации CFTR. Возникающая в результате стимуляция секреции Cl является классическим примером того, как LT и CT вызывают диарею.Было показано, что LT снижает количество котранспортеров H + /PEPT посредством цАМФ-зависимого пути в клетках Caco-2. 64 Таким образом, цАМФ опосредует гиперсекреторные эффекты ЛТ, что приводит к снижению всасывания и увеличению секреции жидкости и электролитов.
LTI экспрессируется штаммами E. coli , которые являются патогенными как для животных, так и для человека, тогда как LTII редко обнаруживается в изолятах человека и не связан с заболеванием.Как LTI, так и LTII очень похожи на CT структурно и функционально. LTI состоит из ферментативной субъединицы А и пентамерной субъединицы В, которые прочно связываются с ганглиозидом GM1. После связывания с мембраной LTI подвергается эндоцитозу и транспортируется через сеть транс-Гольджи (TGN). 63 LT нацеливается на аденилатциклазу, что приводит к увеличению цАМФ, активации PKA, что приводит к увеличению фосфорилирования и активации CFTR. Возникающая в результате стимуляция секреции Cl является классическим примером того, как LT и CT вызывают диарею.Было показано, что LT снижает количество котранспортеров H + /PEPT посредством цАМФ-зависимого пути в клетках Caco-2. 64 Таким образом, цАМФ опосредует гиперсекреторные эффекты ЛТ, что приводит к снижению всасывания и увеличению секреции жидкости и электролитов.
Энтеропатогенные
E. coli (ЕРЕС). EPEC является основной причиной персистирующей водянистой диареи у младенцев, часто сопровождаемой субфебрилитетом и рвотой. Патогенные механизмы EPEC оставались неясными в течение многих лет, потому что, в отличие от прототипов кишечных бактериальных патогенов, EPEC не продуцирует классические энтеротоксины, такие как LT, чтобы влиять на пути клетки-хозяина.Кроме того, EPEC обычно считается неинвазивным по сравнению с бактериями, такими как Shigella и Salmonella, хотя ограниченное количество бактерий интернализуется. Тем не менее, EPEC кодирует T3SS и вызывает характерное повреждение прикрепления и стирания (A/E), которое характеризуется стиранием микроворсинок на поверхности эпителия в месте прикрепления бактерий. 65 Кроме того, происходит накопление цитоскелетных белков под прикрепленными микроколониями, что приводит к образованию актиновой чашечки или пьедестала, в зависимости от типа клеток.Это глубокое изменение в эпителиальных клетках кишечника, вызванное поражениями A/E, способствует диарейному фенотипу из-за потери общей всасывающей поверхности. 66 Однако диарея возникает уже через 3–4 часа после приема возбудителя внутрь, что позволяет предположить, что действуют другие механизмы, помимо мальабсорбции. 66 , 67 Достигнут прогресс в расшифровке основ патогенеза EPEC на молекулярном уровне, и механизмы, с помощью которых EPEC изменяет эпителиальные реакции хозяина, начинают раскрываться.Исследования, проведенные за последнее десятилетие, показывают, что диарея, вызванная ЕРЕС, является многофакторным процессом и включает в себя несколько факторов, включая нарушение парацеллюлярной проницаемости и нарушение ионного транспорта. Недавние достижения позволяют предположить, что ЕРЕС оказывает прямое влияние на процессы переноса ионов, особенно те, которые связаны с переносчиками растворенных веществ, электролитов, серотонинергических и короткоцепочечных жирных кислот. В следующем разделе будут рассмотрены потенциальные механизмы, лежащие в основе диареи, связанной с EPEC.
66 Однако диарея возникает уже через 3–4 часа после приема возбудителя внутрь, что позволяет предположить, что действуют другие механизмы, помимо мальабсорбции. 66 , 67 Достигнут прогресс в расшифровке основ патогенеза EPEC на молекулярном уровне, и механизмы, с помощью которых EPEC изменяет эпителиальные реакции хозяина, начинают раскрываться.Исследования, проведенные за последнее десятилетие, показывают, что диарея, вызванная ЕРЕС, является многофакторным процессом и включает в себя несколько факторов, включая нарушение парацеллюлярной проницаемости и нарушение ионного транспорта. Недавние достижения позволяют предположить, что ЕРЕС оказывает прямое влияние на процессы переноса ионов, особенно те, которые связаны с переносчиками растворенных веществ, электролитов, серотонинергических и короткоцепочечных жирных кислот. В следующем разделе будут рассмотрены потенциальные механизмы, лежащие в основе диареи, связанной с EPEC.
Изменения в транспорте Na + и Cl − . Исследование прямого воздействия ЕРЕС на транспорт ионов в кишечнике позволяет предположить, что снижение всасывания NaCl в кишечнике лежит в основе патофизиологии раннего начала диареи, а не увеличение секреции Cl —. 68 – 70 Более ранние исследования с использованием эпителиальных клеток кишечника человека Caco-2 показали, что инфекция EPEC приводила к небольшому и преходящему увеличению Cl − -зависимого тока короткого замыкания (I sc ), меры движение заряженных ионов. 71 Напротив, в клетках T84, линии клеток крипт толстой кишки, широко используемой для изучения апикальной секреции Cl — , не было увеличения секреции Cl — , а скорее наблюдалось ингибирование индуцированных агонистами секреторных ответов. 70 Несмотря на минимальное влияние на секрецию, EPEC изменяет абсорбцию Na + и Cl — как в клетках Caco-2, так и в клетках T-84. 69 В то время как чистое поглощение Na + , опосредованное обменниками Na + /H + (NHE), фактически увеличивается с помощью EPEC в клетках Caco-2, активность изоформ NHE по-разному модулируется.
Исследование прямого воздействия ЕРЕС на транспорт ионов в кишечнике позволяет предположить, что снижение всасывания NaCl в кишечнике лежит в основе патофизиологии раннего начала диареи, а не увеличение секреции Cl —. 68 – 70 Более ранние исследования с использованием эпителиальных клеток кишечника человека Caco-2 показали, что инфекция EPEC приводила к небольшому и преходящему увеличению Cl − -зависимого тока короткого замыкания (I sc ), меры движение заряженных ионов. 71 Напротив, в клетках T84, линии клеток крипт толстой кишки, широко используемой для изучения апикальной секреции Cl — , не было увеличения секреции Cl — , а скорее наблюдалось ингибирование индуцированных агонистами секреторных ответов. 70 Несмотря на минимальное влияние на секрецию, EPEC изменяет абсорбцию Na + и Cl — как в клетках Caco-2, так и в клетках T-84. 69 В то время как чистое поглощение Na + , опосредованное обменниками Na + /H + (NHE), фактически увеличивается с помощью EPEC в клетках Caco-2, активность изоформ NHE по-разному модулируется. 69 В кишечнике изоформы NHE2 и NHE3 локализованы апикально, в то время как экспрессия NHE1 ограничена базолатеральными мембранами. Примечательно, что EPEC-инфекция эпителиальных клеток кишечника снижает активность NHE3, основной изоформы, поглощающей Na + , в тонком кишечнике. Напротив, изоформы NHE1 и NHE2 стимулируются в ответ на инфекцию EPEC, что считается компенсаторным ответом хозяина на изменение активности NHE3. 69 Однако мыши с нокаутом NHE2 не имеют таких дефектов кишечной абсорбции или диарейного фенотипа, как мыши с нокаутом NHE3. 72 , 73 Кроме того, NHE2 не может предотвратить диарею у мышей с нокаутом NHE3. 74 Это говорит о том, что хотя поглощение ионов Na + важно, оно не связано напрямую с движением воды в случае NHE2. Исследования с использованием мутантов EPEC показали, что ингибирование NHE3 зависит от интактного T3SS III и происходит через эффекторную молекулу EspF. 75 EPEC-индуцированное ингибирование активности NHE3 также требует регуляторных факторов NHE (NHERF), которые важны для регуляции функции NHE3 и поверхностной экспрессии.
69 В кишечнике изоформы NHE2 и NHE3 локализованы апикально, в то время как экспрессия NHE1 ограничена базолатеральными мембранами. Примечательно, что EPEC-инфекция эпителиальных клеток кишечника снижает активность NHE3, основной изоформы, поглощающей Na + , в тонком кишечнике. Напротив, изоформы NHE1 и NHE2 стимулируются в ответ на инфекцию EPEC, что считается компенсаторным ответом хозяина на изменение активности NHE3. 69 Однако мыши с нокаутом NHE2 не имеют таких дефектов кишечной абсорбции или диарейного фенотипа, как мыши с нокаутом NHE3. 72 , 73 Кроме того, NHE2 не может предотвратить диарею у мышей с нокаутом NHE3. 74 Это говорит о том, что хотя поглощение ионов Na + важно, оно не связано напрямую с движением воды в случае NHE2. Исследования с использованием мутантов EPEC показали, что ингибирование NHE3 зависит от интактного T3SS III и происходит через эффекторную молекулу EspF. 75 EPEC-индуцированное ингибирование активности NHE3 также требует регуляторных факторов NHE (NHERF), которые важны для регуляции функции NHE3 и поверхностной экспрессии. 76 Ингибирующее действие ЕРЕС на NHE3 усиливается, когда клетки PS120 котрансфицируются каркасными/регуляторными белками NHERF1 и NHERF2. 75 В дополнение к NHE3 было показано, что EPEC быстро инактивирует переносчик натрия-D-глюкозы (SGLT1), основной фактор поглощения жидкости в тонком кишечнике. 77 Из-за критической роли SGLT1 в пероральной регидратационной терапии дальнейшие исследования механизма этого процесса были бы очень полезны ().
76 Ингибирующее действие ЕРЕС на NHE3 усиливается, когда клетки PS120 котрансфицируются каркасными/регуляторными белками NHERF1 и NHERF2. 75 В дополнение к NHE3 было показано, что EPEC быстро инактивирует переносчик натрия-D-глюкозы (SGLT1), основной фактор поглощения жидкости в тонком кишечнике. 77 Из-за критической роли SGLT1 в пероральной регидратационной терапии дальнейшие исследования механизма этого процесса были бы очень полезны ().
Ранняя диарея, вызванная ЕРЕС, является многофакторной. Заражение EPEC эпителиальных клеток человека снижает абсорбцию эпителиальных ионов, вызывая диарею. Система секреции типа III EPEC высвобождает секретируемых белков E. coli (Esps) в цитозоль хозяина. EspF ингибирует функцию обменной изоформы 3 Na + /H + , тогда как EspG посредством разрушения микротрубочек снижает поверхностные уровни DRA, что приводит к снижению апикального Cl — /OH — (HCO 3 − ) биржевая деятельность. Считается, что возникающее в результате ингибирование связанного электронейтрального всасывания NaCl в инфицированном кишечнике способствует диарее. ЕРЕС через неизвестную эффекторную молекулу снижает абсорбцию бутирата за счет снижения экспрессии монокарбоксилатного транспортера 1 на плазматической мембране. Индуцированная ЕРЕС активация протеинтирозинфосфатаз (PTPases) снижает функцию переносчика серотонина (SERT) и увеличивает доступность 5-HT, что может дополнительно повлиять на поглощение ионов и подвижность, вызывая диарею.Кроме того, считается, что ингибирование SGLT-1 с помощью EPEC способствует накоплению жидкости, вызывая раннюю диарею.
Считается, что возникающее в результате ингибирование связанного электронейтрального всасывания NaCl в инфицированном кишечнике способствует диарее. ЕРЕС через неизвестную эффекторную молекулу снижает абсорбцию бутирата за счет снижения экспрессии монокарбоксилатного транспортера 1 на плазматической мембране. Индуцированная ЕРЕС активация протеинтирозинфосфатаз (PTPases) снижает функцию переносчика серотонина (SERT) и увеличивает доступность 5-HT, что может дополнительно повлиять на поглощение ионов и подвижность, вызывая диарею.Кроме того, считается, что ингибирование SGLT-1 с помощью EPEC способствует накоплению жидкости, вызывая раннюю диарею.
Cl — -HCO 3 — (OH — ) обменники функционируют совместно с обменниками Na + /H + в опосредовании связанной электронейтральной абсорбции NaCl в подвздошной кишке. Параллельно опосредованному ЕРЕС ингибированию NHE3 в клетках Caco-2 и T84 было продемонстрировано снижение апикальной обменной активности Cl — /OH — . 68 Дальнейшие исследования по выяснению механизмов, лежащих в основе снижения обмена Cl — /OH — , выявили важную роль ССТТ. Мутации либо в эффекторном белке espG , либо в его пара-log espG2 частично ослабляли ингибирующие эффекты EPEC, тогда как двойной мутант полностью отменял ингибирование обменной активности Cl — /OH — . 68 Поскольку EspG и EspG2 играют важную роль в разрушении сети микротрубочек хозяина, 78 эти исследования показали, что EPEC-индуцированное ингибирование обмена Cl зависит от разрушения микротрубочек.Это было дополнительно подтверждено наблюдением, что колхицин и нокодазол, агенты, разрушающие микротрубочки, снижали обменную активность Cl — /OH — в клетках Caco-2. 68 Среди генов-кандидатов для люминальных обменников кишечника человека Cl − /HCO 3 − два члена семейства генов SLC26: SLC26A3, или DRA, и SLC26A6, или PAT-1 (предполагаемый переносчик анионов- 1).
68 Дальнейшие исследования по выяснению механизмов, лежащих в основе снижения обмена Cl — /OH — , выявили важную роль ССТТ. Мутации либо в эффекторном белке espG , либо в его пара-log espG2 частично ослабляли ингибирующие эффекты EPEC, тогда как двойной мутант полностью отменял ингибирование обменной активности Cl — /OH — . 68 Поскольку EspG и EspG2 играют важную роль в разрушении сети микротрубочек хозяина, 78 эти исследования показали, что EPEC-индуцированное ингибирование обмена Cl зависит от разрушения микротрубочек.Это было дополнительно подтверждено наблюдением, что колхицин и нокодазол, агенты, разрушающие микротрубочки, снижали обменную активность Cl — /OH — в клетках Caco-2. 68 Среди генов-кандидатов для люминальных обменников кишечника человека Cl − /HCO 3 − два члена семейства генов SLC26: SLC26A3, или DRA, и SLC26A6, или PAT-1 (предполагаемый переносчик анионов- 1). DRA преимущественно экспрессируется в толстой кишке и играет важную роль в апикальном процессе обмена Cl — /HCO 3 — на основании его участия в врожденной хлоридной диарее (CLD). 79 CLD — это редкое генетическое заболевание, характеризующееся обильной диареей, массивной потерей Cl − с калом и метаболическим алкалозом. Кроме того, в отличие от мышей с нокаутом PAT-1, у мышей с нокаутом DRA развивается сильный диарейный фенотип, а также дисбаланс электролитов в сыворотке. 80 , 81 Как биохимические, так и иммунофлуоресцентные исследования для оценки поверхностной экспрессии апикальных анионообменников показали снижение уровня DRA (но не PAT-1) на апикальной плазматической мембране в ответ на инфекцию EPEC.Это снижение уровня DRA в плазматической мембране зависело от EspG/EspG2. 68 Важная роль DRA в патофизиологии диареи была дополнительно подтверждена in vivo. Заметное перераспределение DRA из апикального в субапикальное компартменты было продемонстрировано в EPEC-инфицированной толстой кишке мышей.
DRA преимущественно экспрессируется в толстой кишке и играет важную роль в апикальном процессе обмена Cl — /HCO 3 — на основании его участия в врожденной хлоридной диарее (CLD). 79 CLD — это редкое генетическое заболевание, характеризующееся обильной диареей, массивной потерей Cl − с калом и метаболическим алкалозом. Кроме того, в отличие от мышей с нокаутом PAT-1, у мышей с нокаутом DRA развивается сильный диарейный фенотип, а также дисбаланс электролитов в сыворотке. 80 , 81 Как биохимические, так и иммунофлуоресцентные исследования для оценки поверхностной экспрессии апикальных анионообменников показали снижение уровня DRA (но не PAT-1) на апикальной плазматической мембране в ответ на инфекцию EPEC.Это снижение уровня DRA в плазматической мембране зависело от EspG/EspG2. 68 Важная роль DRA в патофизиологии диареи была дополнительно подтверждена in vivo. Заметное перераспределение DRA из апикального в субапикальное компартменты было продемонстрировано в EPEC-инфицированной толстой кишке мышей. 68 Кроме того, у мышей, зараженных C. rodentium , мышиным эквивалентом EPEC, наблюдалось примерно 10-кратное подавление DRA и фатальная потеря жидкости. 82 , 83 Снижение активности DRA и NHE3 ухудшает всасывание NaCl в просвете и лежит в основе патофизиологии ранней диареи, вызванной ЕРЕС ().
68 Кроме того, у мышей, зараженных C. rodentium , мышиным эквивалентом EPEC, наблюдалось примерно 10-кратное подавление DRA и фатальная потеря жидкости. 82 , 83 Снижение активности DRA и NHE3 ухудшает всасывание NaCl в просвете и лежит в основе патофизиологии ранней диареи, вызванной ЕРЕС ().
Водный транспорт. Было показано, что помимо модуляции переноса электролита C. rodentium непосредственно влияет на перенос воды. Во время инфекции C. rodentium водные каналы, называемые аквапоринами 2 и 3 (AQP2 и AQP3), перераспределяются от клеточных мембран к цитоплазме частично за счет EspF и EspG. 84 Эта измененная локализация AQP коррелирует с повышенным уровнем жидкости во внутреннем стуле, хотя у мышей диарея как таковая отсутствует.Считается, что эта потеря поглощения воды является фактором, способствующим диарее во время инфекции EPEC. Кроме того, полногеномные исследования транскрипционных массивов с использованием C. rodentium инфицированной толстой кишки мышей показали резкое подавление мРНК AQP8 83 ().
Модуляция переносчиков серотонина и бутирата. Также известно, что EPEC изменяет другие эпителиальные процессы, которые косвенно влияют на транспорт электролитов, целостность эпителия и иммунные реакции в эпителиальных клетках кишечника.5-HT, нейротрансмиттер и гормон желудочно-кишечного тракта, влияет на несколько физиологических процессов, включая всасывание и секрецию жидкости и электролитов через серотониновые рецепторы. 85 5-HT интернализуется через высокоселективный переносчик серотонина, связанный с Na + и Cl — , SERT, который облегчает деградацию 5-HT под действием внутриклеточных ферментов, катаболизирующих 5-HT. Следовательно, SERT регулирует содержание и доступность 5-НТ в просвете кишечника. Известно, что энтеротоксины, такие как CT, вызывают высвобождение серотонина в тонком кишечнике, который поддерживает секреторный механизм, вызывающий диарею. 86 Недавние исследования показали, что заражение EPEC клеток Caco-2 снижает функцию SERT. 87 Протеинтирозинфосфатазы (PTPases) участвовали в ингибировании SERT в клетках Caco-2, инфицированных EPEC. Снижение экспрессии SERT и содержания 5-НТ в слизистой оболочке также наблюдалось в тонкой кишке мыши, инфицированной EPEC. 87 Будущая идентификация эффекторной молекулы (молекул) EPEC, которая активирует PTPases и опосредует ингибирующие эффекты на SERT, будет иметь важное значение для разработки новых мишеней для модуляции серотонинергической системы при лечении инфекционных диарейных заболеваний.
Другим потенциальным фактором диареи, вызванной ЕРЕС, является модуляция всасывания бутирата, опосредованная переносчиком монокарбоксилатов (MCT1) в кишечнике. 88 Бутират, основная короткоцепочечная жирная кислота, обеспечивает энергией колоноциты и, как известно, стимулирует абсорбцию электролитов. 88 Транспорт бутирата в эпителиальных клетках снижается при инфицировании ЕРЕС через механизм, зависимый от ССТТ, и происходит за счет снижения уровня MCT1 на плазматической мембране 88 ().
Нарушение плотных контактов и иммунных реакций на EPEC. Несколько линий доказательств демонстрируют, что EPEC-инфекция эпителиальных клеток кишечника разрушает барьер плотных соединений из-за активации киназы легкой цепи миозина (MLCK) и дефосфорилирования окклюдина. 89 , 90 Эти эффекты зависят от функционального T3SS и нескольких эффекторных белков, включая EspF, NleA и Map. Влияние NleA на целостность плотных контактов происходит посредством ингибирования переноса белков клетки-хозяина через COPII-зависимые пути, в то время как механизм активности EspF остается неизвестным. 90 Снижение TER, наблюдаемое при инфекции EPEC, также происходит in vivo в слизистой оболочке подвздошной и толстой кишки. 91 Этот конкретный фенотип является EspF-зависимым и коррелирует с перераспределением окклюдина, повторяя данные in vitro. 91 Нарушение плотных контактов увеличивает парацеллюлярную проницаемость, позволяя электрохимическим градиентам достичь равновесия, и, как было показано, имеет синергетический эффект с изменением транспорта ионов, вызывая диарею.
Инициирование воспалительной реакции является еще одним следствием инфекции EPEC.Известно, что EPEC активирует NFκB, который стимулирует транскрипцию IL-8, прототипа цитокина, привлекающего PMN к месту инфекции. 92 Активация NFκB, вызванная ЕРЕС, также повышает экспрессию рецептора галанина-1, что приводит к увеличению секреции Cl — и накоплению жидкости в просвете после активации его лигандом, галанином-1. 66 Хотя воспаление, безусловно, является чистым эффектом инфекции EPEC, заболевание не является таким воспалительным, как другие бактериальные патогены, такие как Shigella, и недавние исследования показали, что эффекторные белки EPEC несколько ослабляют воспалительную реакцию. 93 Было высказано предположение, что способность EPEC подавлять степень или тяжесть общего воспалительного ответа необходима для выживания этих неинвазивных бактерий в организме хозяина. 93
В совокупности эти наблюдения позволяют предположить, что диарея, вызванная ЕРЕС, представляет собой многофакторный процесс с нарушением транспорта электролитов, растворенных веществ и воды, способствующий развитию ранней диареи, вызванной инфекцией ЕРЕС (). Важным выводом, сделанным в результате этих исследований, является использование различных эффекторных белков, что свидетельствует об избирательном воздействии ЕРЕС на переносчики ионов.Например, EPEC-инфекция эпителиальных клеток кишечника хозяина по-разному модулирует активность NHE2 и NHE3, а также вызывает снижение уровней DRA в плазматической мембране, но не PAT-1. 68 , 69 Кроме того, EspG, участвующий в разрушении сети микротрубочек хозяина, участвует в нарушении Cl — и транспорта воды, но не модулирует другие транспортеры апикальной мембраны, такие как Na + или переносчики бутирата. 68 , 75 , 84 , 88
Энтерогеморрагический
E.палочка .EHEC — еще один крупный кишечный патоген, представляющий собой подмножество шигатоксина, продуцирующего E. coli (STEC). EHEC прилипает к эпителиальным клеткам, экспрессирует T3SS и вызывает поражения A/E, как и EPEC. 63 В отличие от EPEC, инфекция EHEC может вызывать более серьезные симптомы, включая кровавый понос и опасные для жизни состояния, такие как гемолитико-уремический синдром (ГУС) и тромботическая тромбоцитопеническая пупура. Эти симптомы в значительной степени связаны с продукцией шига-токсинов (Stx1 и/или Stx2), оба из которых состоят из одной субъединицы А массой 32 кДа, нековалентно связанной с пентамерным кольцом идентичных субъединиц В.Субъединица А обладает N-гликозидазной активностью, которая катализирует депуринизацию одного аденинового остатка 60S рибосом, делая их неактивными. 94 Субъединицы В опосредуют связывание токсина с глоботриаозилцерамидным (Gb3) гликолипидным рецептором, присутствующим на плазматической мембране некоторых эукариотических клеток. 95 Хотя EHEC-инфекция часто возникает из-за зараженной говядины, колонизация EHEC жвачных животных на самом деле протекает бессимптомно из-за различий в распределении рецепторов Gb3.CD77/Gb3 присутствует в гломерулярных клетках почек у людей, но не у крупного рогатого скота, что делает ГУС серьезным осложнением только для людей. Интересно, что эпителиальные клетки кишечника человека даже не экспрессируют рецепторы GB3, , 94, , , , , 96, , однако новый сайт связывания Stx был описан в основании крипт Лейберкуна тонкой кишки в клетках Панета. 97
Что касается механизмов диареи, как Stx1, так и Stx2 вызывают накопление просветной жидкости в кишечнике. 98 В этом отношении очищенный Stx1, инокулированный в подвздошную кишку взрослого кролика, вызывает накопление жидкости и связан с апоптозом в клетках, поглощающих ворсинки. 99 Аналогичным образом, голотоксин Stx2 вызывает накопление жидкости in vivo и ингибирует чистый абсорбционный транспорт воды через толстую кишку человека in vitro. 98 Недавние исследования с использованием кишечных клеток T84 и кроличьей модели инфекции EHEC продемонстрировали новый механизм Stx-опосредованной диареи. Инфекция Stx1 снижает секрецию галектина-3, специфического для β-галактозида лектина, что приводит к неправильному нацеливанию нескольких важных белков щеточной каемки. 100 В частности, нарушается транспортировка виллина, NHE2 и дипептидилпептидазы, что, как ожидается, изменяет эпителиальную абсорбцию, приводя к диарее. 100 Интересно, что снижение уровня галектина-3 также было описано при болезни Крона. 101 Вопрос о том, влияют ли факторы вирулентности EHEC, кодируемые T3SS, непосредственно на эпителиальные процессы транспорта ионов и вносят вклад в диарейный фенотип этого патогена, как в случае EPEC, требует дальнейшего изучения.
Вирусная диарея.Вирусы, включая норовирус, саповирус, аденовирус, ротавирус и астровирусы, вызывают 30–40% острых эпизодов диареи в США. 40 , 102 По сравнению с бактериальными инфекциями многие вирусные инфекции протекают легко и проходят самостоятельно. Норовирусная инфекция поражает людей всех возрастов и составляет около 40% вспышек небактериальной диареи в США. 103 Напротив, ротавирус вызывает опасный для жизни гастроэнтерит у детей, что составляет 35% госпитализированных случаев диареи в США. 104 В следующем разделе мы обсудим три вида вирусов, вызывающих диарею, включая ротавирус, содержащий единственный известный вирусный энтеротоксин, а также норовирус и астровирус, изучение которых только начинается.
Ротавирус.
Ротавирус является ведущей причиной опасных для жизни диарейных заболеваний у детей младшего возраста. Исследования, проведенные за последние несколько лет, дали важные сведения о механизме вирусного патогенеза и привели к успешной разработке живых аттенуированных вакцин против гастроэнтерита. 105 Ротавирус в первую очередь поражает клетки ворсинок тонкого кишечника и может вызывать водянистую диарею без значительного воспаления кишечника. Двухцепочечный РНК-геном ротавируса кодирует 6 структурных белков, образующих вирусные частицы (Vps), и 6 неструктурных белков (NSP). 106 NSP4 является первым описанным энтеротоксином, кодируемым вирусом, и предполагается, что он играет важную роль в секреции жидкости и электролитов. 107 Интересно, что NSP4 отсутствует в зрелом инфекционном вирионе и синтезируется в инфицированных ворсинчатых энтероцитах ().NSP4 и вирусные частицы высвобождаются через апикальную мембрану поляризованных эпителиальных клеток неклассическим секреторным путем. 105 Однако NSP4 также высвобождается с базолатеральной стороны инфицированных энтероцитов, хотя роль базолатерально высвобождаемого NSP4 при диарее не совсем ясна 108 (). Вирусология и патогенез ротавируса были недавно подробно рассмотрены. 105
Механизмы ротавирусной диареи. Ротавирусная инфекция энтероцитов приводит к проникновению вируса, образованию вироплазмы (VI) и высвобождению вируса и его токсина NSP4.Внутриклеточный NSP4 (iNSP4) индуцирует увеличение внутриклеточного Ca 2+ в первую очередь за счет высвобождения из er и PLC-независимого механизма. NSP4, высвобождаемый с апикальной стороны, увеличивает уровень внутриклеточного кальция посредством рецептор-опосредованного PLC-зависимого механизма. Увеличение содержания кальция под действием NSP4 нарушает цитоскелет микроворсинок, а также барьерную функцию, что приводит к увеличению парацеллюлярного потока воды и электролитов, вызывая диарею. Вызванное NSP4 увеличение уровней Ca 2+ может также увеличивать секрецию Cl — непосредственно через CFTR-независимый механизм и может вызывать высвобождение аминов, пептидов, цитокинов и активных форм кислорода, которые могут косвенно стимулировать энтеральную нервную систему к увеличение секреции Cl − .Базолатеральное высвобождение NSP4 также может стимулировать ЭНС. Нарушение переваривания углеводов из-за снижения поверхностных уровней сахаразы-изомальтазы и снижения функции SGLT-1, по-видимому, является основным механизмом, лежащим в основе диареи, вызванной ротавирусной инфекцией. eNSP4 представляет собой внеклеточный NSP4.
В отличие от классической секреторной диареи, вирусный энтеротоксин, NSP4, вызывает диарею вследствие нарушения переваривания углеводов, сопровождающегося снижением всасывания воды, повышенной мобилизацией Ca 2+ и относительно мягким секреторным компонентом Cl — ().Нарушение пищеварения углеводов было предложено в качестве основного механизма, лежащего в основе патофизиологии диареи, вызванной ротавирусом. Ротавирусная инфекция клеток Caco-2 снижает активность сахарозо-изомальтазы и апикальную экспрессию при отсутствии разрушения энтероцитов, что предполагает участие механизмов переноса. 109 Аналогично, заражение молодых кроликов или мышей ротавирусом снижает активность дисахаридазы. 110 , 111 Кроме того, известно, что экзогенно применяемый NSP4 индуцирует высвобождение Ca 2+ из внутриклеточных запасов и приток Ca 2+ в плазмалемме посредством механизма, зависящего от фосфолипазы C. 105 Эта NSP4-опосредованная мобилизация Ca 2+ может поддерживать диарею, влияя на Ca 2+ -зависимые эпителиальные процессы, такие как транспорт ионов, барьерная функция или регуляция цитоскелета. Действительно, было продемонстрировано, что ротавирус увеличивает парацеллюлярную проницаемость клеток Caco-2. 112 Кроме того, NSP4-опосредованная мобилизация Ca 2+ может запускать высвобождение аминов/пептидов, а также высвобождение цитокинов, простагландинов и активных форм кислорода, которые могут по отдельности или совместно активировать энтеральную нервную систему (ЭНС) . 113 Это было дополнительно подтверждено исследованиями, показывающими, что чистый перенос жидкости, опосредованный ротавирусом, ингибируется при лечении мышей препаратами, влияющими на функцию ЭНС. 114 Кроме того, клинические исследования госпитализированных детей, инфицированных ротавирусом, показывают, что ингибитор энкефалиназы сокращает продолжительность диареи. 115 Внутриклеточный NSP4, однако, также известен тем, что увеличивает внутриклеточный уровень кальция посредством PLC-независимого механизма. 116 Используя экспрессию NSP4-EGFP в клетках HEK 293, недавние исследования показали, что внутриклеточный NSP4 вызывает реорганизацию актина кальций-зависимым образом посредством снижения фосфорилирования белка кофилина, ремоделирующего актин. 117 Модуляция динамики подкоркового актина и нарушение регуляции кофилина влияет на процессы переноса через мембрану и процессы переноса ионов. 118
Секреторный компонент Cl − , лежащий в основе патогенеза диареи, связанной с ротавирусом, представляет собой комплекс, состоящий из про- и антисекреторных компонентов. 119 В отличие от чисто секреторной диареи, вызванной КТ, ротавирусная инфекция лишь умеренно увеличивает концентрацию Cl — в просвете. 119 Повышение концентрации Cl — в просвете может быть следствием снижения абсорбции и/или повышенной секреции. Ранние исследования показали, что NSP4 может вызывать диарею у молодых мышей, что связано с мобилизацией Ca 2+ и усилением зависимой от цАМФ секреции жидкости. 107 Интересно, что у мышей с дефицитом CFTR NSP4 продолжает вызывать диарею, что исключает участие CFTR в накоплении жидкости. 120 Неожиданно ротавирусная инфекция кроликов фактически стимулирует абсорбцию Cl — мембраной щеточной каемки кишечника, выделенной из клеток ворсинок, и не изменяет секреторные реакции Cl — в клетках крипт. 119 Однако общий секреторный ответ Cl — слабый, что позволяет предположить, что NSP4 оказывает как секреторное, так и антисекреторное действие, ограничивая общую секрецию Cl — . 119 Необходимы более глубокие исследования, чтобы определить клеточные механизмы, лежащие в основе связанных с ротавирусом секреторных реакций Cl — . Потенциальная роль апикальных обменников Cl — /HCO 3 — , хлоридных каналов CLC и ключевых сигнальных событий в патогенезе ротавирусной инфекции представляет огромный интерес.
Норовирус.
Норовирусы, ранее известные как Norwalk-подобные вирусы, относятся к семейству Caliciviridae. 40 Это один из подмножества вирусов, вызывающих вирусный гастроэнтерит, более известный как желудочный грипп. Это заболевание характеризуется кратковременной рвотой и диареей, которые являются заразными. Желудочный грипп вызывается большим количеством вирусов из нескольких разных семейств и включает саповирусы, которые также являются членами семейства Caliciviridae, подтипа аденовируса, а также астровирусы.В отличие от ротавирусной инфекции, ни один из этих вирусов не является особенно хорошо изученным, и инфекция редко приводит к госпитализации, за исключением лиц с ослабленным иммунитетом. Типичная норовирусная инфекция длится от 1 до 3 дней, и не у всех инфицированных людей появляются симптомы. Передача происходит как через пищу, так и от человека к человеку через инфекционные желудочно-кишечные жидкости.
Исследования в отношении молекулярной основы вызываемой норовирусом диареи были несколько ограничены, поскольку вирус только недавно был выращен в культуре ткани, а более ранние исследования основывались на трансфекции вирусных генов в клетки-хозяева.Некоторые вирусные факторы могут нарушать основные клеточные функции, не вызывая гибели клеток. Одним из них является 3C-подобная протеиназа (3CL pro ), которая подобна ранее описанному ферменту риновируса под названием 3C pro . 3C pro препятствует эукариотической трансляции путем расщепления поли(А)-связывающего белка (PABP). 121 Поскольку и переносчики ионов, и белки плотных контактов имеют промежуточное время оборота, составляющее в среднем 12–18 часов, ингибирование трансляции хозяина может ограничивать изобилие этих важных регуляторов кишечного гомеостаза.Другой механизм, который потенциально может влиять на белки хозяина, включает неструктурный белок p48 вируса Норуолк. P48 связывается с клеточным белком, известным как белок, ассоциированный с VAMP, или VAP-A, который связывается с v-SNARES, регуляторами транспорта везикул. 122 Как и в случае ингибирования трансляции, ингибирование переноса белков, вероятно, влияет на клеточные процессы, важные для поддержания абсорбционной функции, а также барьерной функции.
Хотя модели клеточных культур до недавнего времени были невозможны, а модели животных ограничены, недавно было проведено исследование с использованием биопсии кишечника пациентов, страдающих норовирусной инфекцией.123 Первоначальные наблюдения показали, что у инфицированных пациентов длина ворсинок уменьшилась на 25%, в то время как длина крипт осталась неизменной, что уменьшило общую абсорбирующую поверхность эпителия (12). Миниатюрные камеры Ussing (0,049 см 2 ), используемые для определения сопротивления, потока и тока короткого замыкания в образцах биопсии, показали увеличение I sc у пациентов, инфицированных норовирусом, которое зависело от активной секреции Cl — , последовательно с активацией CFTR. Активность SGLT1 также была увеличена, что свидетельствует о том, что электрогенное поглощение Na + не нарушено.В дополнение к изменениям секреции Cl — наблюдалось заметное снижение трансэпителиальной резистентности, что соответствовало снижению уровней окклюдина, а также клаудинов 4 и 5. Поскольку эта работа проводилась в тканях человека, мало что известно. о механизме, который лежит в основе этих изменений, недавно разработанные модели норовирусных клеточных культур должны оказаться полезными.
Укорочение ворсинок, связанное с вирусными инфекциями. Вирусные инфекции, включая астровирусы и норовирусы, вызывают притупление или укорочение ворсинок.Происходит уменьшение количества клеток, составляющих ворсинки, уменьшение общей всасывающей поверхности. Эпителиальные клетки кишечника генерируются из стволовых клеток в криптах и движутся к кончику ворсинок, где они в конечном итоге сбрасываются. Притупление может быть вызвано снижением клеточной пролиферации, хотя в случае норовируса оно связано с инфекцией апикальных ворсинок, что приводит к повышенной гибели клеток. Притупление ворсинок также является причиной диареи, связанной с глютеновой болезнью, которая является аутоиммунной, а не патогенной.
Астровирус.
Астровирусы, как и норовирусы, являются еще одной причиной желудочного гриппа. Астровирусная инфекция включает как диарею, так и рвоту и распространяется аналогично ранее описанным вирусам. Мало что известно о патологии астровирусной инфекции, так как госпитализация маловероятна. Доступен один отчет, описывающий патологию 4-летнего самца с подавленным иммунитетом, у которого наблюдалось укорочение ворсинок, что согласуется с тем, что наблюдается на моделях индеек , 124, ().Кроме того, как в этих образцах биопсии человека, так и в моделях на животных наблюдается относительно небольшое воспаление, что позволяет предположить, что это не иммуноопосредованная диарея. 125 Однако есть некоторые свидетельства того, что в клетке активируются провоспалительные пути. Фактически, активация ERK1/2 абсолютно необходима для репликации вируса. 126 УФ-инактивированный астровирус также способен активировать ERK1/2 с аналогичной реакцией через 15 минут после заражения с последующей инактивацией через 30 минут. 126 Снижение уровней как вирусного белка, так и РНК по сравнению с контролем наиболее согласуется со случаем ВИЧ, который требует активации ERK для проникновения, однако фактический механизм активации ERK при проникновении и репликации аденовируса еще не известен. Активация ERK в этих клетках умеренная, и больше известно об инактивации врожденного иммунного ответа из-за ингибирования комплемента. Белок оболочки астровируса способен связываться с классическим компонентом комплемента C1q, блокируя последующий каскад расщепления комплемента и образования мембраноатакующего комплекса. 127
Астровирусная инфекция вызывает диарею с легким воспалением и, как было показано, влияет на барьерную функцию. Мозер и др. 128 продемонстрировали снижение TER в клетках Caco-2, инфицированных астровирусом. Интересно, что также наблюдалась потеря TER в клетках, обработанных УФ-инактивированным астровирусом, неспособным к репликации, или вирусоподобными частицами, у которых отсутствует РНК. Это говорит о том, что этап входа отвечает за потерю TER, и согласуется с тем фактом, что другие вирусы, как известно, нацелены на плотные контакты во время входа.Однако клеточный рецептор астровируса остается неизвестным. Авторы также предполагают, что в инфицированных клетках происходит разрушение окклюдина, однако клеточная морфология существенно изменяется после вирусной инфекции и согласуется с клетками, подвергающимися ранним стадиям апоптоза. Изменение окклюдина может представлять собой событие раннего апоптоза, хотя имеет место потеря барьерной функции, на которую не влияют события раннего апоптоза.
Связь астровируса с гибелью клеток у людей находится под вопросом из-за отсутствия образцов пациентов и изменчивости, наблюдаемой в моделях на животных, особенно на индейках и свиньях.Однако in vitro гибель клеток наблюдалась в клетках Caco-2, начиная с 36 часов после заражения. 129 Этот апоптоз блокируется ингибитором каспазы z-VAD-fmk. Интересно, что эта вирусная активация каспазной системы имеет решающее значение для производства инфекционных вирионов. Предшественник капсидного белка, называемый VP90, имеет сайт расщепления каспазой, который вырезается на этапе образования промежуточного капсидного белка VP70. Таким образом, ингибитор каспазы z-VAD-fmk существенно ингибирует процессинг вируса до VP70.Вирионы могут быть образованы VP90, хотя они не являются стабильными или инфекционными, а в клетках-хозяевах расщепление VP90 до VP70 имеет решающее значение для высвобождения из клетки. Хотя гибель клеток не особенно связана с астровирусной инфекцией, характерное притупление кончиков ворсинок можно объяснить потерей клеток. Это притупление ворсинок наряду с изменениями барьерной функции является основным средством, с помощью которого астровирус вызывает диарею, хотя изменения в транспорте ионов еще не изучены.
Паразитарная диарея.
Диарея, вызванная паразитами, не похожа ни на бактериальную, ни на вирусную инфекцию. Например, Giardia имеет медленное начало диареи и может присутствовать в течение нескольких месяцев, в то время как большинство бактериальных и вирусных инфекций ограничиваются 1–2 неделями. 40 Кроме того, паразиты являются эукариотическими, что делает их более крупными и сложными, чем вирусы или бактерии, а также их труднее уничтожить из-за их сходства с хозяином. На самом деле, паразиты нередко создают свои собственные версии белков-хозяев: например, серотонин и PGE2 вырабатываются Entamoeba histolytica .Усовершенствованные механизмы, используемые двумя важными простейшими паразитами, Giardia lamblia и E. histolytica , вызывают диарею, будут обсуждаться ниже.
Лямблии лямблии.
Giardia lamblia (син. G. duodenalis и G. интестиналис ) является наиболее распространенным паразитом тонкой кишки человека и вызывает диарейное заболевание, передающееся через воду, во всем мире. Giardia является неинвазивным организмом, и трофозоиты, активная форма паразита, колонизируют верхнюю часть тонкой кишки, прикрепляясь к апикальной поверхности эпителия. 130 Симптоматическая инфекция Giardia вызывает острую или хроническую диарею, обезвоживание, боль в животе и нарушение всасывания, что приводит к недоеданию и потере веса. Также данная паразитарная инфекция может спровоцировать обострение СРК 131 и вызвать развитие постинфекционных функциональных расстройств желудочно-кишечного тракта. 132 Несколько исследований с использованием различных клеточных систем, животных моделей и недавние исследования на людях с хроническими инфекциями позволили получить важные сведения о патофизиологии лямблиоза.Важным результатом этих исследований является то, что мальабсорбция, секреция электролитов и нарушение плотных контактов могут лежать в основе накопления жидкости в просвете во время инфекции. Известно, что инфекции видами Giardia вызывают диффузное укорочение щеточной каймы микроворсинок за счет активированных Т-лимфоцитов, сопровождающееся реорганизацией F-актина и ZO-1 в энтероцитах за счет фосфорилирования MLC. 133 Пути апоптоза энтероцитов также индуцируются G.lamblia посредством активации каспазы-3, что также может неблагоприятно влиять на целостность эпителиальных плотных соединений. 134 Предыдущие исследования как in vitro, так и in vivo на животных моделях продемонстрировали снижение абсорбции глюкозы и Na + и снижение активности дисахаридазы из-за потери площади абсорбирующей поверхности эпителия. 135 , 136 Кроме того, G. lamblia — инфицированный кишечник мыши продемонстрировал секрецию Na + и Cl — , которая была зависима от протеинкиназы C. 137 Однако необходимо полностью определить роль факторов вирулентности Giardia, таких как протеиназы и лектины, в модулировании секреторных реакций.
Исследования in vitro и животных моделей недавно были подтверждены наблюдениями за людьми, инфицированными Giardia. 138 Установлено, что инфекция G. lamblia включает секрецию активного электрогенного аниона, нарушение барьерной функции и мальабсорбцию. Анализ белков плотных контактов в экстрактах мембран из образцов биопсии двенадцатиперстной кишки инфицированных пациентов показал снижение пула эпителиальных белков плотных контактов, в первую очередь вызванное уменьшением площади поверхности слизистой оболочки. 138 Однако после коррекции площади поверхности слизистой оболочки при хроническом лямблиозе по-разному снижалась только экспрессия клаудина 1. 138 Несмотря на уменьшение площади поверхности слизистой оболочки, при лямблиозе наблюдалось увеличение базальной секреции I подкожно , отражающее повышенную секрецию Cl — /HCO 3 (OH — ). 138 Важно отметить, что уменьшение поверхности слизистой оболочки в образцах биопсии человека представляет собой преимущественно потерю поверхности ворсинок, в то время как крипты, важный участок секреции активных анионов, не затрагиваются.Кроме того, в двенадцатиперстной кишке пациентов, хронически инфицированных G. lamblia , наблюдали апоптоз и резкое уменьшение поверхности ворсинок, приводящее к нарушению Na + -зависимой абсорбции глюкозы. 133 , 138 Детальное исследование сигнальных механизмов и факторов вирулентности, лежащих в основе эпителиальной дисфункции после инфекции, будет иметь важное значение для понимания патофизиологии лямблиоза, а также развития постинфекционного СРК.
Entamoeba histolytica.
E. histolytica — одноклеточное простейшее, вызывающее амебиаз. Патологические эффекты обусловлены как факторами вирулентности паразита, так и реакцией хозяина на паразита. На самом деле только около 10% людей, инфицированных E. histolytica , действительно имеют симптомы. 40 У пациентов с инвазивным заболеванием наблюдается начальное изъязвление эпителия кишечника из-за экспрессии нескольких цистеиновых протеаз, которые разрушают внеклеточный матрикс, и из-за амебапор, вызывающих лизис клеток 139 , 140 ().Это приводит к отслоению клеток, уменьшению всасывающей поверхности кишечника. Кроме того, цистеиновые протеазы вызывают деградацию нескольких факторов комплемента, включая С3, С3а и С5а, а также иммуноглобулинов, притупляя таким образом врожденный иммунный ответ. В то время как инфекция E. histolytica является воспалительной, паразит устойчив к нейтрофилам как из-за деградации комплемента, так и из-за C59-подобной адгезии, инактивирующей комплемент, на поверхности паразита. 141 Кроме того, PMN могут быть уничтожены или, наоборот, нейтрализованы посредством ингибирования катепсина G, сериновой протеазы, что снижает активность PMN в областях инфекции. 142 , 143 Кроме того, макрофаги активируются за счет стимуляции эндосомального TLR-9 ДНК паразита, а также активации TLR2 и 4 липопептидофосфогликаном. 144 , 145 Считается, что эти воспалительные клетки увеличивают начальные изъязвления в форме колб, которые характерны для инфекции E. histolytica . Следовательно, сочетание опосредованного паразитами разрушения и последующего воспаления вызывает изъязвление эпителия, что снижает абсорбцию и нарушает барьерную функцию.
Деструкция эпителия и воспаление, вызванное E. histolytica. E. histolytica вызывает колбовидную язву, обычно охватывающую несколько ворсинок, а не несколько клеток, как показано здесь. Эпителиальный слой разрушается как под действием патогенных факторов, таких как порообразующие амебапоры и расщепление внеклеточного матрикса цистеиновыми протеазами, так и под действием воспалительных факторов хозяина. E. histolytica высвобождает PGE 2 и вызывает реакцию хозяина PGE 2 , которая приводит к секреции Cl — в толстой кишке, секреции IL-8 и рекрутированию PMN.В то время как PMN могут быть нейтрализованы и фагоцитированы паразитом, а комплемент расщепляется цистеиновыми протеазами, инфекция по-прежнему имеет сильно воспалительный характер. Было показано, что макрофаги активируются ДНК паразита через TLR9 или, альтернативно, через липофосфопептидогликановую активацию TLR 2 или 4. Секреция Cl − в тонкой кишке.
В дополнение к этим морфологическим изменениям имеется также прямое воздействие на барьерную функцию. Из-за их способности индуцировать повреждение клеток и создавать очевидные отверстия в монослоях, работу с E. histolytica и TER необходимо проводить на ранних стадиях инфекции. Лерой и др. обнаружили снижение резистентности уже через 1 час после заражения, в то время как монослои начали терять клетки через 3–6 часов после заражения. 146 Это снижение TER было связано с увеличением потока маннита и не может быть воспроизведено с помощью растворимых факторов или обработанных ультразвуком трофозоитов.Инфекция не изменяет уровни оккулдина или его локализацию, но вызывает снижение уровней ZO-1 без явного нарушения связи с плотным соединением. 146 В то время как секретируемые цистеиновые протеазы кажутся вероятной причиной этого снижения TER, типичные ингибиторы протеаз, такие как E-64 или апротинин, не блокировали снижение резистентности. Однако было показано, что инактивация цистеиновых протеаз блокирует последующее падение резистентности, связанное с образованием дырок в монослоях. 147
В дополнение к изменениям в активности плотных контактов также происходят изменения в ионном транспорте.Анализ амебных лизатов позволяет предположить, что существует два различных действия на секрецию Cl —: существует процесс, зависимый от Ca 2+ , который активен в подвздошной кишке, и процесс, зависимый от цАМФ, который активен в толстой кишке (4). Ca 2+ -зависимый ответ активен только на серозной поверхности, что позволяет предположить, что эти механизмы не активируются до тех пор, пока эпителиальный слой не будет нарушен. 148 Анализ ВЭЖХ и иммунодетекция показали, что лизаты амеб на самом деле содержат низкий уровень серотонина, а патогенные штаммы содержат в два раза больше, чем непатогенные штаммы.Серотонин — не единственный белок-хозяин, вырабатываемый E. histolytica ; недавние исследования показывают, что простагландин E 2 (PGE 2 ) также вырабатывается, когда амебы получают арахидоновую кислоту (AA) 149 (). У них есть собственный фермент, подобный циклооксигеназе (ЦОГ), который способен превращать АК в PGE 2 , но не ингибируется индометацином, как ферменты ЦОГ человека. 149 Однако это, по-видимому, лишь небольшая часть ответа PGE 2 , поскольку индометацин способен блокировать продукцию PGE 2 в ксенотрансплантатах кишечника человека у мышей SCID. 150 Эффекты PGE 2 многократны с увеличением как продукции IL-8, мощного хемоаттрактанта, так и увеличения секреции Cl — . 150 , 151 Секреторные эффекты в толстой кишке мышей связаны с синтезом PGE 2 только с небольшим Ca 2+ -зависимым компонентом (25%). 151 Предварительная обработка клеток ПГЕ 2 вызывает десенсибилизацию к лизатам амеб, а ингибиторы ЦОГ индометацин и пироксикам почти полностью блокируют рост I подкожно . 151 Этот механизм зависит от продукции цАМФ и может быть заблокирован пироксикамом, что указывает на CFTR-зависимый механизм в отличие от Ca 2+ -зависимого механизма, обнаруженного в тонком кишечнике 151 (). Оба механизма активны на базолатеральной стороне клеток, что позволяет предположить, что это не раннее событие, а вместо этого зависит от начальной инфильтрации эпителиального слоя паразитом до активации. Общая картина инфекции E. histolytica зависит как от компонентов паразита, включая цистеиновые протеазы, амебапоры, серотонин и PGE 2 , так и от воспалительной реакции хозяина, при этом ни один компонент не дает полного ответа.
Изменение эпидемиологии бациллярной дизентерии и характеристик устойчивости шигелл к противомикробным препаратам, выделенных в Китае в 2004–2014 гг.
BMC Infect Dis. 2016; 16: 685.
, , , , , , , , 9036, 6, 9036, , , иZhaorui Chang
Отдел инфекционных заболеваний, Ключевая лаборатория эпиднадзора и раннего оповещения об инфекционных заболеваниях, Китайский центр по контролю и профилактике заболеваний, 155 Changbai Road, Changping District, Beijing, 102206 Китайская Народная Республика
Jing Zhang
Отдел инфекционных заболеваний, Ключевая лаборатория эпиднадзора и Раннее предупреждение об инфекционных заболеваниях, Китайский центр по контролю и профилактике заболеваний, 155 Changbai Road, Changping District, Beijing, 102206 Китайская Народная Республика
Lu Ran
Отдел инфекционных заболеваний, Ключевая лаборатория эпиднадзора и раннего предупреждения об инфекционных заболеваниях Болезнь, Китайский центр по контролю и профилактике заболеваний, 155 Changbai Road, Changping District, Beijing, 102206 People’ s Китайская Республика
Junling Sun
Отдел инфекционных заболеваний, Ключевая лаборатория эпиднадзора и раннего предупреждения об инфекционных заболеваниях, Китайский центр по контролю и профилактике заболеваний, 155 Changbai Road, Changping District, Beijing, 102206 Китайская Народная Республика
Fengfeng Liu
Отдел инфекционных заболеваний, Ключевая лаборатория эпиднадзора и раннего предупреждения об инфекционных заболеваниях, Китайский центр по контролю и профилактике заболеваний, 155 Changbai Road, Changping District, Beijing, 102206 Китайская Народная Республика
Li Luo
Отдел инфекционных заболеваний, Ключевая лаборатория эпиднадзора и раннего предупреждения об инфекционных заболеваниях, Китайский центр по контролю и профилактике заболеваний, 155 Changbai Road, Changping District, Beijing, 102206 Китайская Народная Республика
Lingjia Zeng
Отдел инфекционных заболеваний, Ключевая лаборатория эпиднадзора и раннего предупреждения об инфекционных заболеваниях, Китай Центр контроля и профилактики заболеваний, 155 Changbai Road, Changping District, Beijing, 102206 Китайская Народная Республика
Liping Wang
Отдел инфекционных заболеваний, Ключевая лаборатория эпиднадзора и раннего предупреждения об инфекционных заболеваниях, Китайский центр по контролю и профилактике заболеваний Профилактика, 155 Changbai Road, Changping District, Beijing, 102206 Китайская Народная Республика
Zhongjie Li
Отдел инфекционных заболеваний, Ключевая лаборатория эпиднадзора и раннего предупреждения об инфекционных заболеваниях, Китайский центр по контролю и профилактике заболеваний, 155 Changbai Road , Changping District, Beijing, 102206 Китайская Народная Республика
Hongjie Yu
Отдел инфекционных заболеваний, ключевая лаборатория эпиднадзора и раннего предупреждения об инфекционных заболеваниях, Китайский центр контроля и профилактики заболеваний, 155 Changbai Road, Changping District, Beijing , 102206 Китайская Народная Республика
Цяохун Ляо
Диви Отдел инфекционных заболеваний, Ключевая лаборатория надзора и раннего предупреждения об инфекционных заболеваниях, Китайский центр по контролю и профилактике заболеваний, 155 Changbai Road, Changping District, Пекин, 102206 Китайская Народная Республика
Отдел инфекционных заболеваний, Ключевая лаборатория надзора и Раннее предупреждение об инфекционных заболеваниях, Китайский центр по контролю и профилактике заболеваний, 155 Changbai Road, Changping District, Beijing, 102206 Китайская Народная Республика
Автор, ответственный за переписку.Поступила в редакцию 5 февраля 2016 г.; Принято 26 октября 2016 г.
Открытый доступ Эта статья распространяется в соответствии с условиями международной лицензии Creative Commons Attribution 4.0 (http://creativecommons.org/licenses/by/4.0/), которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии вы должным образом указываете автора (авторов) и источник, предоставляете ссылку на лицензию Creative Commons и указываете, были ли внесены изменения. Отказ от права Creative Commons на общественное достояние (http://creativecommons.org/publicdomain/zero/1.0/) относится к данным, доступным в этой статье, если не указано иное. Эта статья цитировалась в других статьях в PMC.Abstract
История вопроса
Бактериальная дизентерия, вызываемая бактериями рода Shigella , представляет собой серьезную проблему общественного здравоохранения в развивающихся странах, таких как Китай. Цель этого исследования состояла в том, чтобы проанализировать эпидемиологическую картину бациллярной дизентерии, разнообразие возбудителя и устойчивость к противомикробным препаратам Shigella spp.с целью определения наиболее эффективного распределения ресурсов и определения приоритетности вмешательств.
Методы
Данные эпиднадзора были получены из Национальной системы отчетности по инфекционным заболеваниям (2004–2014 гг.) и из системы дозорного эпиднадзора на базе больниц (2005–2014 гг.). Мы проанализировали пространственное и временное распределение бациллярной дизентерии, возрастное и половое распределение, видовое разнообразие и модели устойчивости к противомикробным препаратам Shigella spp.
Результаты
Регистр эпиднадзора включал более 3 миллионов вероятных случаев бациллярной дизентерии за период 2004–2014 гг. Годовая заболеваемость бациллярной дизентерией снизилась с 38,03 случая на 100 000 человеко-лет в 2004 г. до 11,24 случая на 100 000 человеко-лет в 2014 г. Летальность снизилась с 0,028 % в 2004 г. до 0,003 % в 2014 г. Дети в возрасте до 1 года больше всего пострадали дети в возрасте от 1 до 4 лет с более высокими показателями заболеваемости (228,59 случаев на 100 000 человеко-лет и 92,59 случаев на 100 000 человеко-лет).58 случаев на 100 000 человеко-лет соответственно). Ежегодный эпидемический сезон приходится на период с июня по сентябрь. Более высокий уровень заболеваемости бациллярной дизентерией был обнаружен в Северо-Западном регионе, Пекине и Тяньцзине в течение периода исследования. Shigella flexneri был наиболее распространенным видом, вызывающим бактериальную дизентерию в Китае (63,86%), за ним следует Shigella sonnei (34,89%). Изоляты Shigella обладали высокой устойчивостью к налидиксовой кислоте (89,13%), ампициллину (88,13%).90%), тетрациклин (88,43%) и сульфаметоксазол (82,92%). За исследуемый период количество изолятов, устойчивых к ципрофлоксацину и цефотаксиму, увеличилось с 8,53 и 7,87% в 2005 г. до 44,65 и 29,94% в 2014 г. соответственно.
Выводы
Уровень заболеваемости бациллярной дизентерией заметно снизился с 2004 по 2014 год. Первоочередные меры должны быть оказаны населению на северо-западе Китая и лицам в возрасте до 5 лет. Устойчивость к противомикробным препаратам Shigella представляет собой серьезную проблему общественного здравоохранения, и перед назначением лечения важно учитывать профиль чувствительности изолятов.
Ключевые слова: Эпидемиология, Бакиллярная дизентерия, Резистентность, Шигелла
Справочная информация
Бациллярная дизентерия, которая в основном передается фекально-оральным путем через зараженную пищу, воду или от человека к человеку [1– 5], является важным кишечным инфекционным заболеванием, вызываемым Shigella spp. Основные симптомы бациллярной дизентерии включают диарею, лихорадку, боли в животе, тенезмы и стул с примесью крови или слизи [6]. Ежегодно регистрируется 165 миллионов зарегистрированных или подтвержденных случаев бациллярной дизентерии и 1.1 миллион смертей во всем мире, преимущественно в развивающихся странах [7]. В материковом Китае ежегодная заболеваемость и смертность от бациллярной дизентерии входила в первую десятку из 39 подлежащих регистрации инфекционных заболеваний с 2004 по 2014 год. S. boydii, и S. sonnei [8] . Shigella sonnei является наиболее распространенным из видов Shigella в развитых странах.В развивающихся странах преобладает S. flexneri , в то время как S. dysenteriae и S. boydii встречаются относительно редко [7] . Из-за чрезмерного использования антибиотиков в последние годы среди изолятов Shigella растет устойчивость к противомикробным препаратам, что ограничивает возможности подходящего эмпирического лечения антибиотиками [9]. Знание бремени болезни и эпидемиологических характеристик бациллярной дизентерии полезно для распределения ресурсов и определения приоритетности вмешательств.Поэтому в этом исследовании мы исследовали временное и пространственное распространение бациллярной дизентерии, определили популяции высокого риска бациллярной дизентерии, а также определили преобладающие циркулирующие виды и модели устойчивости к противомикробным препаратам Shigella на основе существующих источников данных Национального инфекционного общества. Система отчетности о заболеваниях (NIDRS) с 2004 по 2014 год и система дозорного эпиднадзора за бактериальной дизентерией с 2005 по 2014 год в Китае.
Методы
Национальный эпиднадзор за бациллярной дизентерией
Бактериальная дизентерия была добавлена в список болезней, подлежащих регистрации в Китае в 1956 году.С 1956 по 2003 год количество случаев заболевания и смертей по провинциям ежемесячно сообщалось в Китайский центр по контролю и профилактике заболеваний (Китайский CDC). После 2004 г. была создана NIDRS, интернет-система отчетности об инфекционных заболеваниях [10]. После этого все вероятные и подтвержденные случаи вместе с индивидуальными данными были переданы клиницистами в Центр контроля заболеваний Китая в режиме онлайн в течение 24 часов после постановки диагноза. Клиницисты диагностируют случаи бациллярной дизентерии в соответствии с унифицированными критериями диагностики, изданными Министерством здравоохранения Китая.Вероятный случай бациллярной дизентерии был определен как пациент со следующими клиническими признаками: лихорадкой, ознобом, болью в животе, тенезмами, стулом с примесью крови или слизи или стулом, содержащим >15/поле большого увеличения (HPF) лейкоцитов или гнойных клеток и микроскопически различимыми эритроциты и фагоциты. Подтвержденный случай был определен как пациент с Shigella spp. . , выделенный из образца стула [11]. Индивидуальные данные включают пол, дату рождения, адрес, классификацию случая (вероятную или подтвержденную), дату начала и дату смерти (если применимо).Все данные, используемые в этом исследовании для случаев бациллярной дизентерии, зарегистрированных с 1 января 2004 г. по 31 декабря 2014 г. в Китае, были получены из NIDRS.
Дозорный больничный эпиднадзор за бактериальной дизентерией
Дозорный больничный эпиднадзор за бактериальной дизентерией был создан в 2005 г. для наблюдения за преобладающими циркулирующими видами и моделями устойчивости к противомикробным препаратам Shigella в Китае. Система наблюдения состоит из 20 дозорных больниц, расположенных в Пекине, Ганьсу, Цинхае, Шаньси, Хэнани, Хэйлунцзяне, Аньхой, Фуцзянь, Гуйчжоу и Шанхае.Этот охват отражает различия в географических особенностях, экономическом развитии и санитарных условиях. Национальный протокол эпиднадзора и лабораторные анализы были разработаны Центром по контролю и профилактике заболеваний Китая и используются всеми дозорными учреждениями [12].
Сбор и тестирование образцов
В каждой дозорной больнице образцы фекалий были собраны у пациентов с диареей и клиническим подозрением на дизентерию, которые не получали ежедневного антимикробного лечения. Свежие образцы фекалий инокулировали в среду Кэри-Блэра (чаще всего Qingdao Hope Bio-Technology Co., Ltd, Шаньдун, Китай) и отправили в региональную лабораторию CDC в течение 4 часов. Образцы стула наносили штрихами на агар XLD и агар SS, а затем инкубировали при 37 °C в течение 18–24 часов. Бесцветные и прозрачные колонии подвергали скринингу с использованием агара с тройным сахаром и железом и агара с подвижностью индол-мочевины. Предположительно положительные колонии затем подтверждали с помощью полосок API 20E (bioMérieux, Marcy l’Etoile, Франция). Все подтвержденные изоляты были серотипированы с использованием коммерческих антисывороток (Denka Seiken Co. Ltd., Токио, Япония).
Ежегодно в каждой дозорной больнице отбирали более 300 проб кала, из которых отбирали не менее 30 проб для выделения и идентификации бактерий ежемесячно в эпидемический сезон (май–октябрь) и 10 проб в неэпидемический сезон (ноябрь–апрель).Отбор проб был разработан таким образом, чтобы > 50 % образцов, отобранных для выделения и идентификации бактерий, были взяты у детей.
Чувствительность к противомикробным препаратам
Способность различных изолятов Shigella противостоять ингибирующему действию различных антибиотиков была протестирована провинциальными CDC. Не менее 30% подтвержденных изолятов Shigella , относящихся к разным видам, ежемесячно отбирались для тестирования на чувствительность к противомикробным препаратам. Минимальные ингибирующие концентрации следующих девяти противомикробных агентов были определены с использованием метода разбавления агара в соответствии с рекомендациями Института клинических и лабораторных стандартов (CLSI) [13].Так, ампициллин, амоксициллин, цефотаксим, цефалотин, гентамицин, налидиксовая кислота, ципрофлоксацин, тетрациклин, сульфаметоксазол. Escherichia coli (штамм 25922 Американской коллекции типовых культур) использовали для контроля качества. Чувствительные и нечувствительные изоляты идентифицировали в соответствии с критериями, используемыми для энтеробактерий, предложенными CLSI.
Анализ данных
Мы включили в анализ случаи с началом заболевания, зарегистрированные в NIDRS с 1 января 2004 г. по 31 декабря 2014 г.Мы не только рассчитали общий коэффициент заболеваемости (количество случаев, деленное на соответствующую популяцию), коэффициент летальности (количество смертей, деленное на число вероятных и подтвержденных случаев) и возрастные показатели в разбивке по полу (количество случаев встречающихся в определенной возрастной группе, разделенной на соответствующую популяцию для каждого пола), но мы также определили сезонные закономерности и географическое распространение бациллярной дизентерии. Данные о населении за исследуемый период были получены из Национального бюро статистики Китая [14].Кроме того, мы проанализировали пропорции Shigella spp. выделенных из лабораторно подтвержденных случаев бациллярной дизентерии, и показатели резистентности штамма Shigella , собранного в дозорных больницах в 2005–2014 гг. Критерий тенденции Cochran-Armitage был использован для изучения временных тенденций годовой заболеваемости бациллярной дизентерией, доли случаев бациллярной дизентерии по возрастным группам и устойчивости к противомикробным препаратам изолятов Shigella . Индекс Z > 0 обозначает тенденцию роста годовой заболеваемости бациллярной дизентерией, доли случаев бациллярной дизентерии по возрастным группам и антимикробной резистентности изолятов Shigella , тогда как Z < 0 обозначает тенденцию к снижению.Тенденцию считали значимой, когда P был < 0,05. Критерий хи-квадрат использовался для проверки того, значительно ли различалась заболеваемость по признаку пола у детей младше 5 лет между мужчинами и женщинами с уровнем значимости α = 0,05. Мы провели все анализы с помощью SAS 9.4 (SAS Institute Inc., Кэри, США).
Мы использовали сезонный индекс, чтобы понять сезонные закономерности бациллярной дизентерии в Китае. Этот показатель рассчитывался по месяцам как среднее число случаев за данный месяц, деленное на среднемесячное число случаев за все 11 лет наблюдения с 2004 по 2014 год [15].Никакой явной сезонной закономерности не ожидалось, если сезонный индекс каждого месяца был близок к 1,0 [15].
Уровень заболеваемости за три периода времени по провинциям был использован для демонстрации географического распространения бациллярной дизентерии. Три временных периода (2004–2006, 2007–2009, 2010–2014) были классифицированы в соответствии со средней заболеваемостью бациллярной дизентерией (>30 на 100 000 человеко-лет, 20–30 на 100 000 человеко-лет и <20 на 100 000 человеко-лет). -лет) в Китае. Программное обеспечение ArcGIS версии 10.0 (ESRI, Редлендс, Калифорния, США) использовали для описания пространственного распределения бациллярной дизентерии с использованием полигональной карты округа. На рис. В период с 2004 по 2014 год в Китае было зарегистрировано 3 342 847 случаев бациллярной дизентерии при среднем уровне заболеваемости 22.89 случаев на 100 000 человеко-лет. Годовая заболеваемость бациллярной дизентерией снизилась примерно в 3 раза с 38,03 случая на 100 000 человеко-лет в 2004 г. до 11,24 случая на 100 000 человеко-лет в 2014 г. Трендовый тест Армитиджа). В течение 2004–2014 гг. было зарегистрировано в общей сложности 636 смертей от бациллярной дизентерии, а коэффициент летальности от бациллярной дизентерии снизился с 0,028% в 2004 г. до 0,0026% в 2014 г.
Заболеваемость и смертность от бациллярной дизентерии в Китае, 2004–2014 гг.59 случаев на 100 000 человеко-лет наблюдается у детей в возрасте до 1 года, затем следует средний уровень заболеваемости 92,58 случаев на 100 000 человеко-лет у детей в возрасте 1–4 лет. Случаи, выявленные у детей в возрасте до 5 лет, составили 31,47% от общего числа случаев, зарегистрированных с 2004 по 2014 год. Данные показали преобладание мужчин в большинстве возрастных групп с общим соотношением мужчин и женщин 1,31:1. Преобладание мужского пола было наиболее очевидным у детей в возрасте до 5 лет, а заболеваемость бациллярной дизентерией составила 1.В 54 раза выше у мальчиков в возрасте до 5 лет, чем у девочек того же возраста (146,89 против 93,46 случаев на 100 000 человеко-лет, х 2 = 46272,89, P <0,05) (рис. ). Доля случаев бациллярной дизентерии, выявленных у лиц в возрасте до 5 лет или старше 60 лет, увеличилась с 2004 по 2014 год (в возрасте до 5 лет: 27,85–33,77%, тест тренда Кохрана-Армитиджа: Z = 77,76). , P < 0,05; ≥60 лет: 10.20–16,43%, критерий тренда Кокрана-Армитиджа: Z = 108,87, P < 0,05). Напротив, доля случаев, выявленных у лиц в возрасте 5–19 лет, снизилась с 22,27% в 2004 г. до 11,73% в 2014 г. ( Z = -175,18, P < 0,05, тест тренда Кохрана-Армитиджа) (рис. . ).
Распределение бациллярной дизентерии по возрасту и полу в Китае, 2004–2014 гг. a Среднегодовая заболеваемость бациллярной дизентерией в разбивке по возрасту и полу была рассчитана путем деления общего числа случаев заболевания в определенной возрастной группе в 2004–2014 гг. на соответствующую численность населения и умножения на 100 000. b Доля случаев бациллярной дизентерии по возрастным группам
Сезонное распространение
В Китае в 2004–2014 гг. бациллярная дизентерия имела явный сезонный характер (рис. , ). Большинство случаев бациллярной дизентерии произошло с июня по сентябрь, в течение которых было зарегистрировано 57,60% случаев. Сезонный индекс был самым высоким в августе (1,80), когда среднемесячная заболеваемость составила 41,97 на 100 000 человеко-лет.
Сезонное распределение случаев бациллярной дизентерии в Китае, 2004–2014 гг. a Распределение частоты случаев бациллярной дизентерии по месяцам начала заболевания. b Сезонный индекс бациллярной дизентерии. Сезонный индекс рассчитывался по месяцам как среднее число случаев за данный месяц, деленное на среднемесячное число случаев за весь 11-летний период с 2004 по 2014 год. Если сезонный индекс каждого месяца был близок к 1,0, то явных сезонных закономерностей не ожидалось, если сезонный индекс каждого месяца был близок к 1,0
Географическое распространение
Несмотря на общее снижение уровня заболеваемости за период исследования, на северо-западе Китая (Тибет, Синьцзян, Ганьсу и Нинся) , Пекин и Тяньцзинь неизменно имели самые высокие показатели заболеваемости бациллярной дизентерией с 2004 по 2014 год.Юго-восточный Китай (Цзянсу, Шанхай, Фуцзянь, Гуандун и Хайнань), северо-восточный Китай (Цзилинь, Хэйлунцзян) и Внутренняя Монголия имели относительно более низкие показатели заболеваемости бациллярной дизентерией. Количество провинций с уровнем заболеваемости >60 на 100 000 человеко-лет сократилось с восьми (Пекин, Нинся, Тяньцзинь, Тибет, Ганьсу, Синьцзян, Шаньси и Гуйчжоу) в 2004–2006 гг. до двух (Пекин и Тяньцзинь) в 2010–2006 гг. 2014. Число провинций с уровнем заболеваемости <20 на 100 000 человеко-лет постепенно увеличивалось с пяти (Хайнань, Внутренняя Монголия, Хунань, Гуандун и Фуцзянь) в 2004–2006 гг. до 14 в 2007–2009 гг. и до 21 в 2010–2014 гг. Инжир.).
Пространственные закономерности заболеваемости бациллярной дизентерией в Китае, 2004–2014 гг. a Средняя заболеваемость по провинциям, 2004–2014 гг. b – d Средняя заболеваемость по провинциям за три периода времени (2004–2006 гг. [ b ], 2007–2009 гг. [ c ] и 2010–2014 гг. [ d ]). Средняя заболеваемость по провинциям за разные периоды времени рассчитывалась путем деления общего числа случаев в каждый период времени на соответствующую популяцию и умножения на 100 000
Распространение
видов шигелл , вызывающих бациллярную дизентериюиз 70 802 образцов было собрано и проверено на наличие бактерий Shigella в дозорных больницах.Всего из всех протестированных образцов было выделено 6278 изолятов Shigella (8,87%). Из них S. flexneri были наиболее распространенными (4009 изолятов, 63,86%), за которыми следовали S. sonnei (2191 изолят, 34,89%). Shigella dysenteriae (38 изолятов) и S. boydii (40 изолятов) были относительно редкими (присутствовали только в 2005, 2006, 2007 и 2011 годах) и составляли только 0,61 и 0,63% изолятов соответственно (рис. ) .
Доля Shigella spp.выделено в лабораторно подтвержденных случаях бациллярной дизентерии по годам и провинциям в дозорных стационарах, 2005–2014 гг. a Временное распределение доли Shigella spp. b Географическое распределение доли Shigella spp.
На рисунке показано географическое распределение видов Shigella , определенное путем серотипирования изолятов, полученных от пациентов с диареей и клинически подозреваемой дизентерией в период 2005–2014 гг. Shigella flexneri была наиболее распространена в центральном и северном Китае, за исключением Пекина; S. sonnei был наиболее распространен в восточном и южном Китае (Шанхай, Гуйчжоу и Фуцзянь).
Устойчивость к противомикробным препаратам изолятов
ShigellaПоказатели устойчивости Shigella в течение периода исследования показаны в таблице. Изоляты имели самую высокую устойчивость к налидиксовой кислоте (89,13% протестированных изолятов, устойчивых), за которой следовал ампициллин (88,13%).90%), тетрациклин (88,43%) и сульфаметоксазол (82,92%). Доля изолятов, устойчивых к налидиксовой кислоте, ампициллину, тетрациклину или сульфаметоксазолу, была стабильно высокой в течение 2005–2014 гг. (рис. ). Кроме того, процент изолятов, устойчивых к ципрофлоксацину и цефотаксиму, увеличился с 8,53 и 7,87% в 2005 г. до 44,65 и 29,94% в 2014 г. ( Z = 18,31 и 10,22, (Инжир. ).
Таблица 1
Таблица 1
Антимикробное сопротивление Shigella Изолиты, полученные в сентинельных больницах в Китае, 2005-2014
| Antibiotic | Количество изолятов | Процент устойчивых изолятов (%) | |
|---|---|---|---|
| Налидиксовая кислота | 4178 | 89.13 | +|
| Ампициллин | 4335 | 88,90 | +|
| Тетрациклин | 4247 | 88,43 | +|
| Сульфаметоксазолу | 4223 | 82,92 | +|
| Амоксициллин | 4060 | 53,17 | +|
| Цефалотин | 3952 | 34.82 | |
| Gentamicin | 4254 | 4254 | 34.28 |
| Ciproofloxacin | 3583 | 22.10 | |
| Цефотаксим | 4247 | 19.10 |
Доля изолятов Shigella , устойчивых к различным противомикробным препаратам a Доля изолятов Shigella , устойчивых к налидиксовой кислоте, ампициллину, тетрациклину, сульфаметоксазолу и амоксициллину. b Доля изолятов Shigella , устойчивых к цефалотину, гентамицину, ципрофлоксацину и цефотаксиму.Доля была рассчитана путем деления количества изолятов, устойчивых к каждому антибиотику, на все протестированные изоляты
Обсуждение
набор данных из NIDRS за 2004–2014 гг. Кроме того, с использованием образцов, собранных в дозорных больницах в течение 2005–2014 гг., были проанализированы доминирующие видов Shigella , вызывающих бациллярную дизентерию, наряду с их устойчивостью к обычным противомикробным препаратам.
Заболеваемость бациллярной дизентерией в 2004–2014 гг. в Китае в целом снизилась. Самый низкий показатель (11,24 на 100 000 человеко-лет) наблюдался в 2014 г., что составляло менее трети уровня заболеваемости в 2004 г. (38,03 на 100 000 человеко-лет). Наблюдаемому спаду, возможно, способствовал ряд факторов, в том числе быстрое экономическое развитие, улучшение систем водоснабжения, улучшение санитарных условий и растущее осознание важности санитарии [16].Однако число случаев, а также уровень заболеваемости бациллярной дизентерией в Китае остается выше, чем во многих развитых странах, таких как США, Австралия, Англия и Франция, где зарегистрированная заболеваемость бациллярной дизентерией составляла 1,8–6,5 случая на 1 человека. 100 000 человеко-лет [7]. В некоторых регионах на северо-западе Китая (включая Тибет, Синьцзян, Ганьсу, Цинхай и Нинся) и на севере Китая (включая Пекин и Тяньцзинь) заболеваемость постоянно была выше, чем в других регионах Китая в течение периода исследования.Высокий уровень заболеваемости бактериальной дизентерией в Тибете, Синьцзяне, Цинхае, Ганьсу и Нинся согласуется с их относительно низким валовым внутренним продуктом [14]. Эти результаты свидетельствуют о том, что экономическое развитие, тесно связанное с состоянием и доступностью медицинских учреждений и ресурсов здравоохранения, потенциально является одним из основных факторов, определяющих возникновение бациллярной дизентерии [17]. Высокий уровень заболеваемости, наблюдаемый в Пекине и Тяньцзине, потенциально может быть объяснен высокой плотностью населения и хорошими показателями выявления случаев заболевания в этих двух регионах [18].Эти два региона также известны наличием большого количества временного населения, которое в основном проживает в пригородных районах без надлежащих санитарных условий и доступа к чистой воде [19].
В этом исследовании бациллярная дизентерия наблюдалась во всех возрастных группах, но у лиц моложе 5 лет и у лиц ≥60 лет заболеваемость бациллярной дизентерией была выше в Китае. В отличие от других стран, самый высокий уровень заболеваемости наблюдался у детей в возрасте до 1 года [7, 20–23]. Полученные данные свидетельствуют о том, что необходимы дополнительные исследования для статистической или механистической характеристики факторов риска бациллярной дизентерии, связанных с грудным вскармливанием детей в Китае.Дети в возрасте до 5 лет, вероятно, восприимчивы к бациллярной дизентерии из-за низкой иммунной функции, отсутствия предыдущего контакта и более высокой вероятности воздействия среды, загрязненной Shigella , через игровую деятельность [24, 25]. Разница в заболеваемости между мужчинами и женщинами, особенно в возрасте до 5 лет, может быть связана с тем, что мужчины, как правило, более активны, чем женщины, и, следовательно, имеют больше возможностей подвергаться воздействию среды, содержащей бактерии [19].За период исследования мы также наблюдали снижение доли случаев бациллярной дизентерии, выявленных у лиц в возрасте 5–19 лет, и соответствующее увеличение доли случаев у лиц в возрасте ≥60 лет. Такое изменение относительного возрастного риска может быть связано с тем, что большинство лиц в возрасте 5–19 лет являются школьниками. В последние десятилетия в школах были усилены профилактические меры против бациллярной дизентерии путем предоставления безопасной питьевой воды, безопасных продуктов питания и санитарного просвещения.Все вместе наши результаты показывают, что профилактические вмешательства по борьбе с бациллярной дизентерией должны делать упор на защиту лиц в возрасте до 5 лет и лиц в возрасте ≥60 лет. В течение каждого года заболеваемость бациллярной дизентерией обычно достигала максимума в период с июня по сентябрь. Предыдущие исследования показали, что температура играет важную роль в сезонных колебаниях заболеваемости бациллярной дизентерией, поскольку колебания температуры могут влиять на выживание и размножение бактерий Shigella [26–31].
Распространение видов и серотипов Shigella динамично во времени и в пространстве. Согласно нашим выводам, видовое распространение Shigella в Китае было сходно с таковым в других развивающихся странах, таких как Бангладеш, Перу и Индия [32–34]. Тем не менее, распределение 90 298 видов Shigella 90 299 варьировалось в разных регионах Китая. Как и в развитых странах, S. sonnei был доминирующим видом, наблюдаемым в Пекине, Шанхае, Гуйчжоу и Фуцзянь.Пекин и Шанхай в последние годы пережили бурное экономическое развитие и представляют собой наиболее развитые регионы Китая. Интересно, что доминирующим видом из видов Shigella в Пекине до 2006 г. был видов S. flexneri [35]. Переход преобладающих видов Shigella с S. flexneri на S.sonnei также наблюдался в других быстро развивающихся странах, таких как Таиланд, Бразилия и Турция, что позволяет предположить, что региональное социально-экономическое развитие может предсказать распределение видов шигелл .Однако Гуйчжоу и Фуцзянь расположены на юге Китая и имеют разные метеорологические условия с высокой относительной влажностью и температурой [36].
Эффективная антимикробная терапия бациллярной дизентерии позволяет значительно облегчить симптомы и сократить как продолжительность инфекции, так и время экскреции бактерий [37]. В последние годы широко идентифицируются устойчивые к противомикробным препаратам штаммы Shigella , представляющие угрозу и осложняющие эффективное лечение бациллярной дизентерии.Наше исследование показывает, что Shigella , выделенные в Китае, имеют более высокую устойчивость к налидиксовой кислоте, ампициллину, тетрациклину и сульфаметоксазолу, чем во многих других странах [38, 39]. Эти антибиотики ранее использовались в качестве препаратов первой линии и до сих пор широко назначаются для лечения бациллярной дизентерии. С 2005 по 2014 год также наблюдалось постепенное увеличение распространенности бактерий Shigella , устойчивых к цефотаксиму и ципрофлоксацину, которые стали препаратами первой линии для лечения бациллярной дизентерии у взрослых.Такое увеличение числа устойчивых к ципрофлоксацину бактерий Shigella также наблюдалось в США [40, 41]. При попадании в дома престарелых или учреждения по уходу за детьми бактерии Shigella могут быстро распространяться и вызывать крупные затяжные вспышки. Тот факт, что модели устойчивости бактерий Shigella к противомикробным препаратам постоянно меняются, подчеркивает важность постоянного мониторинга чувствительности бактерий Shigella к противомикробным препаратам и подчеркивает, как следует проводить противомикробное лечение бациллярной дизентерии в соответствии с данными о чувствительности к противомикробным препаратам.
Это исследование имеет несколько ограничений. Во-первых, большинство случаев бациллярной дизентерии с легкими симптомами можно вылечить пероральными антибиотиками. Таким образом, может иметь место занижение отчетности. Во-вторых, в разных провинциях могут существовать различия в поведении при обращении за медицинской помощью и в доступе к медицинской помощи, что может привести к искажению информации. В-третьих, это исследование представляет собой анализ данных обычного эпиднадзора, и нам не удалось собрать подробные данные о различных видах Shigella , чтобы изучить различия между ними с точки зрения эпидемических характеристик, клинических симптомов и устойчивости к противомикробным препаратам.
Выводы
Бактериальная дизентерия имеет значительное и продолжающееся бремя болезни в Китае. Однако уровень заболеваемости бациллярной дизентерией снижается, предположительно, из-за социально-экономического развития, внедрения санитарно-технических сооружений и санитарного просвещения. Дети в возрасте до 5 лет, особенно дети в возрасте до 1 года, имеют более высокий уровень заболеваемости бациллярной дизентерией, чем лица в других возрастных группах. Разные регионы Китая различаются по времени пика заболеваемости.Уровень заболеваемости бациллярной дизентерией остается высоким на северо-западе Китая. В соответствии с широким использованием противомикробных препаратов увеличивается доля устойчивых к противомикробным препаратам бактерий Shigella , что угрожает эффективному лечению бациллярной дизентерии. Приоритетные вмешательства должны проводиться среди населения на северо-западе Китая и лиц в возрасте до 5 лет. Эффективное лечение бациллярной дизентерии должно основываться на постоянном мониторинге устойчивости к антибиотикам.
Благодарности
Мы очень благодарны персоналу больницы, местным департаментам здравоохранения, местным центрам по контролю и профилактике заболеваний (CDC) и CDC Китая за их помощь в координации сбора данных. Мы благодарим Ву Шую, Барбару Махон и Синди Фридман из CDC в США за их комментарии к предыдущему проекту этой статьи. Мы также благодарим Yi Teing Cheung из Принстонского университета за редактирование рукописи.
Финансирование
Это исследование было поддержано Национальной комиссией по здравоохранению и планированию семьи.Финансирующие органы не участвовали в разработке исследования, сборе и анализе данных, подготовке рукописи или решении о публикации.
Наличие данных и материалов
Все соответствующие данные находятся в документе.
Вклад авторов
QL задумал анализ. ZC завершил анализ и написал первый черновик рукописи. JZ, LR, JS, LL, LZ, ZL и HY помогали в анализе данных и интерпретировали результаты. Все авторы внесли свой вклад в доработку окончательной версии рукописи.Все авторы прочитали и одобрили окончательный вариант рукописи.
Конкурирующие интересы
Авторы заявляют об отсутствии конкурирующих интересов.
Согласие на публикацию
Неприменимо.
Одобрение этических норм и согласие на участие
Бактериальная дизентерия является заболеванием, подлежащим регистрации в Китае. Согласно китайскому закону о профилактике и лечении инфекционных заболеваний, личные идентификаторы должны собираться для отдельных случаев с диагнозом заболевания, подлежащего уведомлению, в целях общественного здравоохранения и реагирования.Национальная комиссия Китая по здравоохранению и планированию семьи решила, что сбор индивидуальных данных по всем заболеваниям, подлежащим регистрации, включая бактериальную дизентерию, в соответствии с национальным протоколом эпиднадзора является частью текущих ответных мер общественного здравоохранения и, таким образом, не подлежит оценке институциональным наблюдательным советом.
Китайский Центр по контролю и профилактике заболеваний (CDC) имеет строгие правила защиты конфиденциальности пациентов. Национальный центр надзора за общественным здравоохранением и информационных служб при Центре контроля заболеваний Китая отвечает за управление всеми данными эпиднадзора за заболеваниями, и он анонимизировал отдельные данные о бациллярной дизентерии, удалив личные идентификаторы (такие как имя пациента, имя родителя, домашний адрес, и номер телефона) до того, как соавторы этой статьи из Центра по контролю и профилактике заболеваний Китая в Отделе инфекционных заболеваний получили доступ к данным эпиднадзора для целей исследования.Соавторы данной статьи не участвовали в деидентификации данных и не имеют личных идентификаторов случаев бациллярной дизентерии. Данные также были объединены перед анализом.
Сокращения Институт
| ATCC | American Type Culture Collection |
| CDC | Центры по контролю и профилактике |
| CLSI заболеванием | Клиническая лаборатория Стандарты |
| HPF | поле высокой мощности |
| NIDRS | Национальная система информирования об инфекционных заболеваниях |
Информация для участников
Zhaorui Chang, Email: nc.cdcanihc@rzgnahc.
Jing Zhang, Email: nc.cdcanihc@gnijgnahz.
Lu Ran, Email: nc.cdcanihc@ulnar.
Junling Sun, Email: nc.cdcanihc@ljnus.
Fengfeng Liu, Email: nc.cdcanihc@ffuil.
Li Luo, Email: nc.cdcanihc@iloul.
Lingjia Zeng, Email: nc.cdcanihc@jlgnez.
Liping Wang, Email: nc.cdcanihc@plgnaw.
Zhongjie Li, Email: nc.cdcanihc@jzil.
Hongjie Yu, Email: nc.cdcanihc@jhuy.
Qiaohong Liao, Email: nc.cdcanihc@hqoail.
Ссылки
1. Нанди С., Датта С., Гош С., Ганай А., Раджахамсан Дж., Теодор Р.Б., Шейх Н.К. Связанный с пищевыми продуктами Shigella sonnei , Индия, 2009 и 2010 гг. Emerg Infect Dis. 2011;17:2072–2074. doi: 10.3201/eid1711.110403. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]2. Нигрен Б.Л., Шиллинг К.А., Блэнтон Э.М., Шелк Б.Дж., Коул Д.Дж., Минц Э.Д. Вспышки шигеллеза пищевого происхождения в США, 1998–2008 гг. Эпидемиол инфекции. 2013; 141: 233–241. doi: 10.1017/S0950268812000222.[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]3. Бхаттачарья С.К., Сур Д., Махаланабис Д. Значение шигеллеза для общественного здравоохранения. Индийский педиатр. 2012; 49: 269–270. [PubMed] [Google Scholar]4. Центры по контролю и профилактике заболеваний (CDC) Заметки с мест: Вспышка инфекций, вызванных Shigella sonnei со сниженной чувствительностью к азитромицину — Лос-Анджелес, Калифорния, 2012 г. MMWR Morb Mortal Wkly Rep. 2013; 62:171. [Бесплатная статья PMC] [PubMed] [Google Scholar]5. Хэ Ф, Хан К, Лю Л, Сунь В, Чжан Л, Чжу Б, Ма Х.Вспышка шигеллеза, связанная с загрязненной колодезной водой в сельской начальной школе: провинция Сычуань, Китай, 7–16 июня 2009 г. PLoS One. 2012;7:e47239. doi: 10.1371/journal.pone.0047239. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]7. Котлофф К.Л., Виникофф Дж.П., Иванофф Б., Клеменс Дж.Д., Свердлоу Д.Л., Сансонетти П.Дж., Адак Г.К., Левин М.М. Глобальное бремя инфекций Shigella : последствия для разработки вакцины и реализации стратегий борьбы. Всемирный орган здравоохранения Быка.1999; 77: 651–666. [Бесплатная статья PMC] [PubMed] [Google Scholar]8. Пелчар М.Дж., младший, Чан ECS. Элементы микробиологии. Токио: Когакуша-Макгроу Хилл; 1981. с. 13. [Google Академия]9. Ашкенази С., Леви И., Казароновски В., Самра З. Растущая устойчивость к противомикробным препаратам изолятов Shigella . J Антимикробная химиотерапия. 2003; 51: 427–429. doi: 10.1093/jac/dkg080. [PubMed] [CrossRef] [Google Scholar] 10. Yang W, Li Z, Lan Y, Wang J, Ma J, Jin L, Sun Q, Lv W, Lai S, Liao Y и др. Общенациональная автоматизированная веб-система для раннего выявления вспышек и быстрого реагирования в Китае.West Pac Surveill Response J. 2011; 2:10–15. [Бесплатная статья PMC] [PubMed] [Google Scholar]11. Министерство здравоохранения Китайской Народной Республики. Диагностические критерии бациллярной и амебной дизентерии (WS 287-2008) 2008. [Google Scholar]13. Институт клинических и лабораторных стандартов. Стандарты эффективности для тестирования чувствительности к противомикробным препаратам. утвержденный стандарт, 14-е изд., документ М100-С14. 2004.
15. Xiao D, Long Y, Wang S, Wu K, Xu D, Li H, Wang G, Yan Y. Эпидемическое распространение и изменение малярии Plasmodium falciparum и Plasmodium vivax на Хайнане, Китай, в 1995–2008 гг.Am J Trop Med Hyg. 2012; 87: 646–654. doi: 10.4269/ajtmh.2012.12-0164. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]16. Wang XY, Du L, Von Seidlein L, Xu ZY, Zhang YL, Hao ZY, Han OP, Ma JC, Lee HJ, Ali M и др. Заболеваемость шигеллезом у молодых и пожилых людей в сельской местности Китая: результаты 12-месячного надзорного исследования среди населения. Am J Trop Med Hyg. 2005; 73: 416–422. [PubMed] [Google Scholar] 17. Феррер С.Р., Стрина А., Хесус С.Р., Рибейро Х.К., Кэрнкросс С., Родригес Л.С., Баррето М.Л. Иерархическая модель для изучения факторов риска детской диареи: исследование случай-контроль в стране со средним уровнем дохода.Int J Эпидемиол. 2008; 37: 805–815. doi: 10.1093/ije/dyn093. [PubMed] [CrossRef] [Google Scholar] 18. Gao TLG, Li X, Jia L, Liu Y и др. Анализ эпидемической ситуации по дизентерии около четырнадцати лет в Пекине. Чин Дж. Преве Мед. 2007; 41:54–57. [PubMed] [Google Scholar] 19. Xiao G, Xu C, Wang J, Yang D, Wang L. Анализ пространственно-временных характеристик и факторов риска бациллярной дизентерии в городском районе Пекин-Тяньцзинь-Таншань в Китае. Общественное здравоохранение BMC. 2014;14:998. дои: 10.1186/1471-2458-14-998.[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]20. Финкельштейн Ю., Моран О., Авицур Ю., Нуссинович М., Харел Л., Воловиц Б., Амир Дж. Клиническая дизентерия у госпитализированных детей. Инфекционное заболевание. 2002; 30: 132–135. doi: 10.1007/s15010-002-2166-2. [PubMed] [CrossRef] [Google Scholar] 21. Эдвардс БХ. Salmonella и видов Shigella . Клин Лаб Мед. 1999; 19: 469–487. [PubMed] [Google Scholar] 22. Прадо В., Лагос Р., Натаро Дж. П., Сан-Мартин О., Арельяно С., Ван Д.Ю., Борчик А.А., Левин М.М. Популяционное исследование заболеваемости диареей Shigella и вызывающими ее серотипами в Сантьяго, Чили.Pediatr Infect Dis J. 1999;18:500–505. doi: 10.1097/00006454-1990-00005. [PubMed] [CrossRef] [Google Scholar] 23. Юрдакок К., Сахин Н., Озмерт Э., Беркман Э. Гастроэнтерит Shigella : клинические и эпидемиологические аспекты и чувствительность к антибиотикам. Acta Pediatr Jpn. 1997; 39: 681–684. doi: 10.1111/j.1442-200X.1997.tb03667.x. [PubMed] [CrossRef] [Google Scholar] 24. Ахмед К., Шакури Ф.Р., Шакури А.Р. Этиология шигеллеза в северном Пакистане. J Health Popul Nutr. 2003; 21:32–39.[PubMed] [Google Scholar] 25. Хоссейн М.А., Альберт М.Дж., Хасан К.З. Эпидемиология шигеллеза в Текнафе, прибрежной зоне Бангладеш: 10-летнее исследование. Эпидемиол инфекции. 1990; 105:41–49. doi: 10.1017/S0950268800047622. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]26. Gao L, Zhang Y, Ding G, Liu Q, Zhou M, Li X, Jiang B. Метеорологические переменные и случаи бактериальной дизентерии в городе Чанша, Китай. Am J Trop Med Hyg. 2014;90:697–704. doi: 10.4269/ajtmh.13-0198. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]27.Ma W, Sun X, Song Y, Tao F, Feng W, He Y, Zhao N, Yuan Z. Применение смешанной обобщенной аддитивной модели для оценки влияния температуры на заболеваемость бациллярной дизентерией и ее прогноз. ПЛОС Один. 2013;8:e62122. doi: 10.1371/journal.pone.0062122. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]28. Zhang Y, Bi P, Hiller JE, Sun Y, Ryan P. Изменения климата и бактериальная дизентерия в северных и южных городах Китая. J заразить. 2007; 55: 194–200. doi: 10.1016/j.jinf.2006.12.002. [PubMed] [CrossRef] [Google Scholar] 29.Чекли В., Эпштейн Л.Д., Гилман Р.Х., Фигероа Д., Кама Р.И., Патц Дж.А., Блэк Р.Е. Влияние Эль-Ниньо и температуры окружающей среды на госпитализацию по поводу диарейных заболеваний у перуанских детей. Ланцет. 2000;355:442–450. [PubMed] [Google Scholar] 30. Гуан П., Хуан Д., Го Дж., Ван П., Чжоу Б. Бактериальная дизентерия и метеорологические факторы на северо-востоке Китая: исторический обзор, основанный на классификации и деревьях регрессии. Jpn J Infect Dis. 2008; 61: 356–360. [PubMed] [Google Scholar] 31. Хуанг Д., Гуань П., Го Дж., Ван П., Чжоу Б.Изучение влияния колебаний климата на заболеваемость бациллярной дизентерией на северо-востоке Китая с использованием гребневой регрессии и иерархического кластерного анализа. BMC Infect Dis. 2008; 8:130. дои: 10.1186/1471-2334-8-130. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]32. Рэм П.К., Крамп Дж.А., Гупта С.К., Миллер М.А., Минц Э.Д. Часть II. Анализ пробелов в данных, касающихся инфекций, вызванных Shigella , в странах с низким и средним индексом человеческого развития, 1984–2005 гг. Эпидемиол инфекции. 2008; 136: 577–603.doi: 10.1017/S0950268807009351. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]33. Fernandez-Prada CM, Venkatesan MM, Franco AA, Lanata CF, Sack RB, Hartman AB, Spira W. Молекулярная эпидемиология Shigella flexneri в эндемичном по диарее районе Лимы, Перу. Эпидемиол инфекции. 2004; 132:303–316. doi: 10.1017/S0950268803001560. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]34. Пажани Г.П., Рамамурти Т., Митра У., Бхаттачарья С.К., Нийоги С.К. Видовое разнообразие и устойчивость к противомикробным препаратам Shigella spp.выделен в период с 2001 по 2004 год от госпитализированных детей с диареей в Калькутте (Калькутта), Индия. Эпидемиол инфекции. 2005; 133:1089–1095. doi: 10.1017/S0950268805004498. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]35. Mao Y, Cui E, Bao C, Liu Z, Chen S, Zhang J, Wang H, Zhang C, Zou J, Klena JD и др. Изменение тенденций и распределение серотипов видов Shigella в Пекине с 1994 по 2010 год. Gut Pathog. 2013;5:21. дои: 10.1186/1757-4749-5-21. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]36.Chompook P, Samosornsuk S, von Seidlein L, Jitsanguansuk S, Sirima N, Sudjai S, Mangjit P, Kim DR, Wheeler JG, Todd J, et al. Оценка бремени шигеллеза в Таиланде: 36-месячное популяционное эпиднадзорное исследование. Всемирный орган здравоохранения Быка. 2005; 83: 739–746. [Бесплатная статья PMC] [PubMed] [Google Scholar]37. Сур Д., Рамамурти Т., Дин Дж., Бхаттачарья С.К. Шигеллез: проблемы и вопросы лечения. Индийская J Med Res. 2004;120(5):454–462. [PubMed] [Google Scholar] 38. Озмерт Э.Н., Инс О.Т., Орун Э., Ялчин С., Юрдакок К., Гур Д.Клинические характеристики и устойчивость к антибиотикам гастроэнтерита Shigella в Анкаре, Турция, в период с 2003 по 2009 год, и сравнение с предыдущими отчетами. Int J Infect Dis. 2011;15:e849–e853. doi: 10.1016/j.ijid.2011.08.008. [PubMed] [CrossRef] [Google Scholar] 39. Поуракбари Б., Мамиши С., Машури Н., Махбуби Н., Аштиани М.Х., Афшарпайман С., Абедини М. Частота и чувствительность к противомикробным препаратам видов Shigella , выделенных в больнице Детского медицинского центра, Тегеран, Иран, 2001–2006 гг.Braz J Infect Dis. 2010;14:153–157. doi: 10.1016/S1413-8670(10)70029-5. [PubMed] [CrossRef] [Google Scholar]40. Боуэн А., Херд Дж., Гувер С., Хачадурян Й., Трафаген Э., Харви Э.


 Избегайте лекарств от диареи, таких как лоперамид, потому что они могут усугубить ситуацию.
Избегайте лекарств от диареи, таких как лоперамид, потому что они могут усугубить ситуацию.