Как восстановить микрофлору кишечника после антибиотиков: Помогают ли пробиотики восстановить микрофлору кишечника?
Помогают ли пробиотики восстановить микрофлору кишечника?
- Марта Энрикес
- BBC Future
Автор фото, Unsplash
Лечение антибиотиками может уничтожить не только вредные бактерии, но и полезные. Однако помогают ли пробиотики восстановить микрофлору кишечника, как настаивает их повсеместная реклама?
Пробиотики активно рекламируют как средство от самых разных проблем — от ожирения до психических расстройств. Но чаще всего их рекомендуют для восстановления микрофлоры кишечника после курса антибиотиков.
Логика проста: во время лечения инфекции антибиотики уничтожают все бактерии, как вредные, так и полезные, а потому кишечник необходимо заселить новыми бактериями.
Впрочем, эффективность этого метода практически не доказана. Более того, исследователи обнаружили, что употребление пробиотиков после антибиотиков на самом деле задерживает восстановление флоры кишечника.
Проблема в том, что достаточного количества исследований какого-либо определенного пробиотика просто не существует. Даже когда ученые используют штаммы живых бактерий, состав коктейля может сильно варьироваться в разных лабораториях.
Такого мнения придерживается Сидней Ньюберри из компании Rand Corporation, который в 2012 году проанализировал большую базу данных по применению пробиотиков для лечения диареи, вызванной антибиотиками.
Ньюберри сделал обзор 82 исследований с участием 12 тысяч пациентов в целом. Он пришел к выводу, что применение пробиотиков действительно помогало снизить риск расстройств пищеварения, но выяснить, какой именно пробиотик или смесь пробиотиков были эффективными, невозможно.
Автор фото, Getty Images
Підпис до фото,Широко распространено мнение, что антибиотики вместе с вредными уничтожают и полезные бактерии в кишечнике
Прежде всего, беспокоит недостаток исследований, которые доказали бы безопасность приема пробиотиков. Организму здорового человека пробиотики, как правило, не причиняют вреда.
Организму здорового человека пробиотики, как правило, не причиняют вреда.
Но существуют и более тревожные данные о том, что пробиотики могут способствовать распространению грибковой инфекции в крови у более уязвимых пациентов.
Недавно ученые Института науки Вайцмана в Израиле доказали, что даже у здоровых людей применение пробиотиков после антибиотиков не было таким уж безопасным.
Пробиотики, как выяснили ученые, препятствовали самому процессу восстановления, то есть их действие на самом деле было противоположным.
Ученые разделили участников эксперимента, которые только что завершили прием антибиотиков, на три группы.
Одна группа начала принимать пробиотики, вторая — контрольная — ничего не принимала, а третьей сделали трансплантацию фекалий. Участникам этой группы пересадили образец кала, который взяли у них до приема антибиотиков.
Автор фото, Getty Images
Підпис до фото,Пробиотики не имеют одинакового действия на всех, поскольку микробиом кишечника у всех людей разный
Результат был неожиданным. Худший результат оказался у тех, кто принимал пробиотики, а лучший — у группы, получившей трансплантацию фекалий. Только в течение нескольких дней микрофлора кишечника у них полностью восстановилась.
Худший результат оказался у тех, кто принимал пробиотики, а лучший — у группы, получившей трансплантацию фекалий. Только в течение нескольких дней микрофлора кишечника у них полностью восстановилась.
Доказательств того, что пробиотики могут причинить вред нездоровому кишечнику, в последнее время становится все больше.
Одно недавнее исследование показало, что пробиотики не принесли никакой пользы детям, попавшим в больницу с гастроэнтеритом.
Впрочем, несмотря на такие выводы, спрос на пробиотики не только не уменьшается, но и растет. В 2017 году рынок сбыта пробиотиков составил более 1,8 млрд долларов, к 2024 году он может вырасти до 66 млрд долларов.
«Учитывая такие масштабы производства, очень важно, чтобы польза пробиотиков была должным образом доказана», — отмечает Эран Элинав из Института Вайцмана.
«Это также причина того, что регулятивные органы, например, Американское управление по контролю качества пищевых и медицинских продуктов и аналогичные европейские институты пока не одобрили клиническое применение пробиотиков», — добавляет ученый.
Автор фото, Getty Images
Підпис до фото,Пробиотики могут причинить вред нездоровому кишечнику
Это все, однако, не означает, что от пробиотиков надо полностью отказаться. Проблема, очевидно, не с самими пробиотиками, а с тем, как мы их принимаем.
Такие препараты часто покупают без рецепта, а потребитель не имеет представления, что именно он приобрел и живы ли вообще бактерии в нем.
Элинав и его коллеги также попытались выяснить, кому употребление пробиотиков может пойти на пользу.
Исследуя работу генов, связанных с иммунной системой, ученые смогли предсказать, будет ли кишечник пациента восприимчивым к насыщению полезными бактериями, или они просто пройдут мимо, не задерживаясь.
«Это интересное и важное исследование, поскольку оно также говорит, что наша иммунная система взаимодействует с пробиотическими бактериями», — объясняет Элинав.
Оно прокладывает путь к разработке персонализированных методов лечения пробиотиками на основе генетического профиля человека.
Такой подход является «абсолютно реалистичным, и его можно разработать сравнительно быстро», отмечает Элинав, но пока это только теоретический аргумент.
Для разработки понадобится больше исследований индивидуального подбора пробиотиков и тестирование различных штаммов бактерий на больших группах людей.
Отсутствие последовательных исследований пробиотиков пока объясняется также и тем, что к ним всегда относились, как к обычным лекарствам.
Когда вы принимаете таблетку парацетамола, вы более или менее уверены, что его активный компонент подействует на рецепторы вашего мозга и уменьшит болевые ощущения. Ведь механизм возникновения боли у большинства людей примерно одинаков.
Но микробиом не является рецептором, а скорее экосистемой, которую по сложности иногда сравнивают с тропическим лесом.
И следовательно, подбор пробиотиков, которые помогут восстановить такую сложную и индивидуальную внутреннюю экосистему, непростая задача.
И также вполне понятно, почему пакетик сухих бактерий с полки супермаркета вряд ли справится с этой задачей.
как восстановить микрофлору кишечника ЖКТ после антибиотиков — Семейная Клиника
Открытие антибиотиков стало для медицины настоящей революцией. Более 90 лет они эффективно лечат многие болезни, в основе которых бактериальные инфекции и снимают осложнения буквально за считанные часы. Эффективность настолько высокая, что, даже зная о серьёзных побочных последствиях после их применения, современная медицина от них не отказывается, потому что замены этому виду лекарственных препаратов нет. Сегодня мировой рынок этого вида лекарственных препаратов оценивается в 50 млрд. долларов и продолжает расти быстрыми темпами.
Что такое антибиотики, как они действуют и, каким образом можно восстановить желудочно-кишечный тракт после их применения?
Антибиотики или, как их ещё называют «противомикробные препараты», – это вещества, способные блокировать развитие или вызывать гибель определённых микроорганизмов. Другими словами, это настоящий яд, действие которого направлено на уничтожение бактерий.
Другими словами, это настоящий яд, действие которого направлено на уничтожение бактерий.
Между бактериями и клетками человеческого организма есть сходства и одно принципиальное отличие. Дело в том, что у клеток человека в отличие от бактерий нет клеточной стенки, а антибиотики уничтожают бактерии именно, действуя на стенку и нарушая механизм формирования белка или ДНК, которые у бактерий весьма специфичны. При этом уничтожаются как вредные бактерии, так и полезные, что вызывает дисбактериоз, который если не лечить может затянуть проблемы с желудочно-кишечным трактом на длительное время.
- боли в области желудка;
- тошнота и отрыжка, частая изжога;
- частицы не переваренной пиши в стуле;
- сухость кожи, бывают случая появления высыпаний;
- ломкость и слоение ногтей;
- сухость волос;
- потеря веса, снижение иммунитета, ухудшение общего состояния.

Проблемы могут усилиться при наличии стрессов, хронических болезней, включая заболевания ЖКТ, неправильного питания, употребления алкоголя, газированной воды. Вот почему многие пациенты, которые прошли курс лечения этими препаратами, задают вопрос, как восстановить ЖКТ после антибиотиков.
Важно! Появление болей и других симптомов являются сигналом для немедленного обследования и лечения у врача-гастроэнтеролога.Диагностика этого заболевания складывается из анамнеза, жалоб больного, клинической картины, результатов гастроскопии желудка и лабораторных исследований. Главное – вовремя принять меры, которые направлены на восстановление ЖКТ после антибиотиков.
При восстановлении микрофлоры гастроэнтерологи советуют включить в рацион кисломолочные продукты, рыбу и мясо нежирных сортов в запеченном или отварном виде, различные супы-пюре с перетёртыми овощами, компоты, кисели, слизистые каши.
Под запретом:
- алкоголь;
- курение;
- еда всухомятку;
- жирные мясо и рыба;
- яйца в варёном и жареном виде;
- свежий белый хлеб;
- молоко и свежевыжатые соки;
- соусы и приправы.

Лечение дисбактериоза врачами гастроэнтерологами Екатеринбурга в медицинском центре «Семейная клиника»
Правильно установленный диагноз и профессионально разработанная тактика лечения являются ключевыми условиями успешного лечения дисбактериоза и быстрого восстановления микрофлоры желудочно-кишечного тракта.
В зависимости от результатов анализов гастроэнтерологи Екатеринбурга нашей клиники могут назначить ряд лекарственных препаратов таких как:
- пребиотики – препараты, подавляющие патогенную флору, препятствующие её развитию и укрепляющие иммунитет;
- пробиотики – препараты, содержащие комплекс живых микроорганизмов, способных вести борьбу с вредными бактериями;
- антисептики – средства, которые уничтожают патогенную флору;
- бактериофаги – препараты, способные бороться с сальмонеллами, энтерококками, стафилококками.
Внимание! Медикаментозное лечение должно быть назначено только врачом-гастроэнтерологом. Попытки самолечения могут запустить болезнь и ещё больше усложнить проблемы с ЖКТ.
Попытки самолечения могут запустить болезнь и ещё больше усложнить проблемы с ЖКТ.
Как восстановить микрофлору кишечника после приема антибиотиков
Для того чтобы ответить на данный вопрос, нужно разобраться в механизме негативного действия антибактериальных препаратов на кишечный микробиом.
В норме микроорганизмы заселяют кишечник на всем его протяжении. Состав и количество микроорганизмов значительно меняется в зависимости от отделов кишки. В тонком кишечнике их количество незначительное, что обусловлено активностью ферментов поджелудочной железы и желчи, которые выделяются именно сюда и обладают выраженными антибактериальными свойствами. По мере движения в сторону толстой кишки количество микроорганизмов прогрессивно увеличивается. Качественный и количественный состав микробиоты может существенно отличаться в зависимости от пола, возраста, характера питания, образа жизни человека. Но в основном в состав толстокишечной флоры входят анаэробы — бактерии, способные существовать без присутствия кислорода — бифидобактерии, бактероиды, лактобактерии, вейлонеллы, пептострептококки, клостридии, всего их около 95%. На аэробы (бактерии, использующие кислород для своей жизнедеятельности) приходится 5% — это кишечная палочка, стафилококки, дрожжеподобные грибы и пр.
Но в основном в состав толстокишечной флоры входят анаэробы — бактерии, способные существовать без присутствия кислорода — бифидобактерии, бактероиды, лактобактерии, вейлонеллы, пептострептококки, клостридии, всего их около 95%. На аэробы (бактерии, использующие кислород для своей жизнедеятельности) приходится 5% — это кишечная палочка, стафилококки, дрожжеподобные грибы и пр.
Вся микрофлора кишечника разделяется на три большие группы
облигатная микрофлора — основной пул бактерий, которые имеют свой функционал: активно участвуют в пристеночном пищеварении, иммунных процессах, выполняют барьерную функцию (защита от проникновения в кровь токсинов), участвуют в продукции аминокислот и витаминов, способствуют нормальному всасыванию через слизистые оболочки железа, кальция, витамина Д, подавляют рост гнилостных и гноеродных микроорганизмов, возбудителей кишечных инфекций.
условно-патогенная микрофлора — находится в кишечнике в небольшом количестве, не способном вызвать патологические процессы.

транзитные микроорганизмы — случайно попадают в желудочно-кишечный тракт, выводятся с калом.
На фоне приема антибактериальных препаратов развивается дисбаланс между облигатной и условно — патогенной микрофлорой, и равновесие смещается в сторону последней. Как следствие нормальная микробиота уже не может в полной мере выполнять свои функции и возникает весь комплекс симптомов, связанных с ее дефицитом: боли в различных областях живота, диспепсия (тошнота, рвота, изжога, отрыжка, вздутие живота, неприятный привкус во рту, неприятный запах изо рта), нарушение стула (запоры, диарея), гиповитаминозы, аллергические реакции, нарушение массы тела (дефицит, необоснованная прибавка), изменение кожи и слизистых (сухость, шелушение, снижение эластичности кожи, молочница), общие симптомы (слабость, утомляемость, нарушение сна).
Достоверных методов для диагностики дисбактериоза до сих пор не найдено. Учитывая дороговизну, сложность интерпритации и погрешности микробиологического метода исследования (бактериологический посев кала) он не нашел широкого рутинного применения. Обычно для постановки диагноза «дисбактериоз», достаточно тщательного физикального осмотра, сбора анамнеза, копрологического исследования кала, инструментальных и лабораторных исследований ЖКТ для исключения другой патологии органов пищеварения (УЗИ брюшной полости, ФГДС, биохимический анализ крови, кал на гельминтов методом обогащения, анализ кала на фекальный кальпротектин).
Обычно для постановки диагноза «дисбактериоз», достаточно тщательного физикального осмотра, сбора анамнеза, копрологического исследования кала, инструментальных и лабораторных исследований ЖКТ для исключения другой патологии органов пищеварения (УЗИ брюшной полости, ФГДС, биохимический анализ крови, кал на гельминтов методом обогащения, анализ кала на фекальный кальпротектин).
Для лечения дисбактериоза используют препараты, санирующие кишечник (то есть уменьшающие избыточный бактериальный рост условно-патогенной микрофлоры) — кишечные антисептики, противогрибковые препараты. В дальнейшем назначают поэтапный прием пробиотических моно препаратов, либо комплексные пробиотические препараты, а также пребиотики — субстраты для роста нормальной микрофлоры кишечника, ее питательная среда. Лечение ситуационно дополняют энтеросорбентами для адсорбции продуктов жизнедеятельности условно патогенной флоры, ферментными препаратами, для снижения внутрипросветного давления в полости кишечника, улучшение нарушенного всасывания нутриентов.
Будьте здоровы!
Записаться на прием к гастроэнтерологу
Врач гастроэнтеролог — Бахова Анастасия Анатольевна
Записаться можно по телефону (391) 205−00−48 или через личный кабинет
Нормализуем работу кишечника
Кишечник человека населяют сотни видов различных микроорганизмов, которые отвечают за защиту его слизистой, переваривание пищи и усвоение полезных веществ. Для правильной работы кишечника необходимо, чтобы в нём поддерживался баланс “хороших” и “плохих” бактерий – своих и чужеродных.
Баланс этих бактерий легко нарушить при неправильном питании, приёме антибиотиков, стрессах и некоторых диетах. При возникновении дисбаланса в кишечной флоре патогенные бактерии атакуют иммунную систему, проникая в организм и вызывая изменения.
Нарушения иммунитета могут выражаться по-разному: от акне и частых простуд до тяжелейших заболеваний, способных навредить человеку. Нормализовать работу кишечника могут помочь различные препараты, которые стоит подбирать в зависимости от ситуации.
За микрофлору кишечника отвечают бифидобактерии.
Эти микроорганизмы отвечают за такие важные функции как: синтез витаминов, пищеварение, абсорбирование желчных кислот и холестерина, предупреждение запоров и поносов, стимуляция иммунных реакций.
Одним из источников бифидобактерий является Симбиоз Альфлорекс, он поможет вам восстановить микрофлору кишечника и нормализовать пищеварение.
БАДы в помощь для восстановления микрофлоры кишечника после приёма антибиотиков.
В процессе приёма некоторых препаратов (например, антибиотиков) полезные бактерии погибают, баланс нарушается и микрофлора кишечника страдает. Это выливается в неприятные последствия в виде запоров или диареи.
Для устранения этих последствий есть несколько БАДов, которые себя хорошо зарекомендовали на рынке.
Если вы не любите глотать таблетки, для вас подойдёт Витастронг Флориоза в удобной форме саше.
Если форма выпуска для вас не принципиальна, то на ваш выбор:
- Линекс Форте, успевший зарекомендовать себя среди покупателей;
- Аципол Актив с приятным грушевым вкусом, где один флакон рассчитан на один приём.

Микрофлора кишечника у малышей.
К сожалению, малыши также могут столкнуться с дисбалансом в кишечнике. Восстановить бифидобактерии в этом случае поможет Бифиформ бэби. Также многие педиатры назначают Аципол малыш в удобной форме капель, который содержит в себе и лакто- и бифидобактерии.
С расстройством кишечника могут сталкиваться и малыши, и взрослые, поэтому в целях удобства и экономии есть возможность приобрести нужные препараты сразу в необходимых объёмах для всей семьи.
Не забывайте проверять противопоказания и консультироваться с лечащим врачом по поводу принимаемых препаратов!
ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ. ПЕРЕД ПРИМЕНЕНИЕМ НЕОБХОДИМО ПРОКОНСУЛЬТИРОВАТЬСЯ СО СПЕЦИАЛИСТОМ
Дисбактериоз после антибиотиков — симптомы, причины и лечение
Открытие антибиотиков помогло сохранить жизни и здоровье множеству людей в ситуациях, в которых ранее врачи могли рассчитывать лишь на чудо1,8.
Кто в здоровом кишечнике живет?
Полное здоровье кишечника невозможно без микроорганизмов, которые начинают заселять желудочно-кишечный тракт с первых дней жизни ребёнка, и постепенно формируют умеренно стабильную по бактериальному составу среду, помогающую организму переваривать пищу и получать нужные питательные вещества3,4.
В составе нормальной микробной флоры кишечника преобладают бифидо- и лактобактерии, а также бактероиды, энтерококки и кишечная палочка. Их и ещё несколько разновидностей бактерий называют облигатной, то есть постоянной, флорой кишечника.
Роль нормальной микрофлоры в пищеварении и не только
Установлено, что нарушение микрофлоры кишечника связано не только с развитием заболеваний пищеварительной системы, но и с появлением проблем со стороны других систем организма, не имеющих прямого отношения к процессам пищеварения7.
Это объясняется тем, что бактерии, обитающие в здоровом кишечнике, выполняют работу, которая оказывает влияние на многие важные процессы в организме человека:
- Выработка ферментов3,6.
- Участие в работе иммунной системы. Бифидобактерии стимулируют образование некоторых видов антител, а лактобактерии повышают активность отдельных клеток, участвующих иммунном ответе (лимфоцитов, фагоцитов)3,6.

- Защитная функция. Микрофлора кишечника выделяет собственные антимикробные вещества, которые препятствуют заселению пищеварительного тракта болезнетворными бактериями, неизбежно попадающими в него при приёме пищи3.
- Выработка витаминов, необходимых для нормального обмена веществ (витамины группы К) 3,6,11.
Причины нарушения микрофлоры после приёма антибиотиков
Для современных антибиотиков характерен широкий спектр действия, что, с одной стороны, хорошо, так как помогает бороться с бактериальными инфекциями, даже когда их возбудитель не известен. Но с другой стороны невозможно направить действие антимикробных препаратов только на вредные микроорганизмы. К ним оказываются восприимчивы и некоторые представители нормальной микрофлоры кишечника. Они тоже разрушаются и гибнут в ходе лечения 8. Тогда микроорганизмы, которые оказываются устойчивы к препарату, получают возможность размножаться более активно, занимая место погибших полезных бактерий. Так антибиотики изменяют качественный и количественный состав микрофлоры кишечника и могут привести к активации условно-патогенных микробов. Иногда после завершения курса антибиотиков микрофлора кишечника способна восстановиться самостоятельно, но для этого требуется время, и восстановление может быть неполным8.
Так антибиотики изменяют качественный и количественный состав микрофлоры кишечника и могут привести к активации условно-патогенных микробов. Иногда после завершения курса антибиотиков микрофлора кишечника способна восстановиться самостоятельно, но для этого требуется время, и восстановление может быть неполным8.
На фоне нарушения нормального состава микрофлоры кишечника, вызванного приёмом антибиотиков, могут возникать симптомы, характерные для дисбактериоза (жидкий стул, вздутие живота и др.), но состояние бывает и бессимптомным. Восстановление нормального баланса микроорганизмов в кишечнике может помочь избавиться от этих симптомов
Антибиотики: вред или польза?
Без антибиотиков медицина бы утратила мощное оружие, которое позволяет быстро направить течение многих тяжёлых заболеваний в сторону выздоровления или обеспечить людям восстановление без инфекционных осложнений после операций разной степени сложности1,8. Но состояние микрофлоры кишечника после курсового лечения антимикробными препаратами может ухудшиться2.
Любое применение антибиотика должно быть оправданным, поэтому избегайте самолечения. И помните, что нарушенная микрофлора требует восстановления3,7.
Как устранить дисбактериоз после антибиотиков?
Современный подход к восстановлению состава нормальной микрофлоры кишечника заключается в применении специальных препаратов разного механизма действия:
- Метабиотики, продукты обмена бактерий нормальной микрофлоры, способствующие восстановлению нормальной микрофлоры кишечника биологическим путем и позволяющие сохранить физиологические и биологические функции слизистой оболочки кишечника;
- пробиотики, которые содержат живые бактерии и призваны восполнить недостаток собственных;
- пребиотики, питательная среда, способствующая размножению бактерий.
Некоторые из этих препаратов рассматриваются не только как средство для восстановления кишечной микрофлоры после лечения антибиотиками, но и как элемент комплексного лечения кишечных расстройств, улучшающий защиту организма от болезнетворных бактерий2,8,12.
Хилак форте является метабиотиком №1 на российском рынке9. Хилак форте сохраняет свою эффективность при совместном приёме с антибиотиками, так как в отличие от пробиотиков не содержит живых бактерий, поэтому его действие не подавляется одновременным приёмом антибиотиков. Другим достоинством Хилак форте при лечении дисбактериоза после и вовремя курса приёма антибиотиков – это удобные формы выпуска (саше и капли). Одно из достоинств Хилак форте при лечении дисбактериоза после или во время курса приёма антибиотиков – это удобные формы выпуска (саше и капли). Как только болезнь после курса антибиотикотерапии отступает, большинство людей вынуждены закрывать больничный и выходить на работу, или просто торопятся разобраться с делами, которые скопились за время их болезни. Находясь вне дома, люди сталкиваются с затруднениями при восстановлении микрофлоры кишечника, потому что далеко не все пробиотики можно легко носить с собой и принимать в любом месте в удобное время. Хилак форте выпущен в форме саше, которые можно спокойно носить в своей сумке или в кармане одежды.
1. Lee Ventola C. The Antibiotic Resistance Crisis. P T. 2015 Apr; 40(4): 277–283.
2. Francino M. P. Antibiotics and the Human Gut Microbiome: Dysbioses and Accumulation of Resistances. Front Microbiol. 2015; 6: 1543.
3. Аджигайтканова С.К. Подходы к медикаментозному лечению дисбактериоза кишечника // РМЖ. 2007. №2. С. 73.
4. Щербаков П.Л., Нижевич А.А., Логиновская В.В., Щербакова М.Ю., Кудрявцева Л.В., Митрохин С.Д., Нуртдинова Н.М., Очилова Р.А. Микроэкология кишечника у детей и ее нарушения. «Фарматека» 2007, № 14, с. 28-34.
5. Fröhlich E.E., Farzi A., Mayerhofer R., Reichmann F., Jačan A., Wagner B., Zinser E., Bordag N., Magnes C., Fröhlich E., Kashofer K., Gorkiewicz G., Holzer P. Cognitive impairment by antibiotic-induced gut dysbiosis: Analysis of gut microbiota-brain communication. Brain Behav Immun. 2016 Aug;56:140-55.
2016 Aug;56:140-55.
6. Morowitz, M. J., Carlisle, E., & Alverdy, J. C. (2011). Contributions of Intestinal Bacteria to Nutrition and Metabolism in the Critically Ill. The Surgical Clinics of North America, 91(4), 771–785. https://journals.sagepub.com/doi/10.1177/1756283X10373814.
7. Carding, S., Verbeke, K., Vipond, D. T., Corfe, B. M., & Owen, L. J. (2015). Dysbiosis of the gut microbiota in disease. Microbial Ecology in Health and Disease, 26, 10.3402/mehd.v26.26191. https://www.tandfonline.com/toc/zmeh30/current.
8. Langdon, A., Crook, N., & Dantas, G. (2016). The effects of antibiotics on the microbiome throughout development and alternative approaches for therapeutic modulation. Genome Medicine, 8, 39. https://journals.sagepub.com/doi/10.1177/1756283X10373814.
9. Хилак форте –лидер по продажам в деньгах в 2016 г. среди метабиотиков по данным АМ ЭМ ЭС Хэлс.
10. Verna, E. C., & Lucak, S. (2010). Use of probiotics in gastrointestinal disorders: what to recommend? Therapeutic Advances in Gastroenterology, 3(5), 307–319. https://journals.sagepub.com/doi/10.1177/1756283X10373814.
https://journals.sagepub.com/doi/10.1177/1756283X10373814.
11. Conly J.M., et al. The contribution of vitamin K2 (menaquinones) produced by the intestinal microflora to human nutritional requirements for vitamin K. Am J Gastroenterol. 1994;89(6):915–23″.
12. Инструкция по применению лекарственного препарата для медицинского применения.
13. HLKF-RU-00259-Cons.
НОВЫЙ СПОСОБ ВОССТАНОВЛЕНИЯ НОРМАЛЬНОЙ КИШЕЧНОЙ МИКРОФЛОРЫ
НОВЫЙ СПОСОБ ВОССТАНОВЛЕНИЯ НОРМАЛЬНОЙ КИШЕЧНОЙ МИКРОФЛОРЫ
В Центре Новых Медицинских Технологий в Академгородке стала доступной широкому кругу пациентов процедура по пересадке нормальной кишечной микрофлоры.
Случаи безуспешных попыток восстановления нормальной бактериальной флоры кишечника после использования антибиотиков, на фоне течения заболеваний желудочно-кишечного тракта, становятся все более многочисленными и проблемы нарушений стула (запор или диарея) становятся болезнью цивилизации. В США в течение последних лет широко применяется и стремительными темпами набирает популярность пересадка нормальной кишечной флоры от здорового донора реципиенту, страдающему расстройствами стула. Накопленный в Северной Америке большой положительный клинический опыт, рекомендации Национального Института Здоровья США (NIH, USA) дали основания для применения этого инновационного способа лечения в России.
Накопленный в Северной Америке большой положительный клинический опыт, рекомендации Национального Института Здоровья США (NIH, USA) дали основания для применения этого инновационного способа лечения в России.
Первые пересадки культур нормальной кишечной микрофлоры успешно прошли в г. Новосибирске в ЦНМТ в Академгородке. Такая пересадка — по сути — заселение кишечника пациента с симптомами диареи/запора нормальной кишечной микрофлорой, полученной от здорового донора. При этом донор проходит тщательное обследование, необходимое для предотвращения передачи инфекционных заболеваний и полной уверенности в наличии нормальной здоровой микрофлоры. При обследовании используются стандарты Национального Института Здоровья США (NIH, USA).
Трансплантации проводятся при хронических воспалительных заболеваниях кишечника (болезнь Крона, язвенный колит), синдроме раздражённого кишечника (как с запорами, так и с диареей), ожирении. Для того, чтобы микрофлора «прижилась», культуры бактерий помещаются именно в то место, где они и должны «жить и работать» — в толстый кишечник, — с помощью фиброколоноскопа – гибкого тонкого эндовидеоскопического инструмента. Эта процедура (колоноскопия) проходит под общим обезболиванием (седацией) после консультации гастроэнтеролога, прохождения обследования по индивидуальному плану и занимает 1 день. В последствие пациент получает подробные необременительные рекомендации и наблюдается у гастроэнтеролога в течение 2 недель.
Эта процедура (колоноскопия) проходит под общим обезболиванием (седацией) после консультации гастроэнтеролога, прохождения обследования по индивидуальному плану и занимает 1 день. В последствие пациент получает подробные необременительные рекомендации и наблюдается у гастроэнтеролога в течение 2 недель.
Доступность, безопасность и эффективность такого способа восстановления нормальной микрофлоры дают новые возможности для преодоления серьёзных проблем при хронических заболеваниях желудочно-кишечного тракта и расстройствах обмена веществ.
Контакты:
д.б.н. Морозов Виталий Валерьевич
ЦНМТ ИХБФМ СО РАН
тел. (383) 363-01-83
Email
Как долго восстанавливается микрофлора кишечника после антибиотиков
Кишечник человека содержит триллионы полезных бактерий, которые помогают переваривать пищу, вырабатывают витамины и участвуют в ряде защитных процессов иммунной системы, сообщает Mdc-berlin. Антибиотики разрушают большинство из них, а полное восстановление занимает до шести месяцев.
К таким результатам пришли ученые из Дании, Германии и Китая.
Читайте также: Как правильно гуглить симптомы и лечение в интернете – советы семейного врача
Исследование с участием здоровых добровольцев, принявших комбинацию из трех антибиотиков показали, что репопуляция кишечника происходит постепенно. Ученые заметили, что только на шестой месяц почти вся микрофлора кишечника была восстановленной, но ряд бактериальных видов все же отсутствовал.
Восстановление кишечника / Фото iStock
Как питаться, чтобы ускорить восстановление микрофлоры
- Принимать пищу желательно небольшими порциями и не есть поспешно. Пищу необходимо тщательно пережевывать.
- Желательно позаботиться, чтобы ваш график позволял принимать пищу 5 раз в день.
- Во время приема пищи старайтесь не пить. Жидкость разбавляет желудочный сок, что значительно замедляет процесс пищеварения.

- Откажитесь от слишком горячей или холодной пищи. Все, что вы употребляете должно быть комнатной температуры.
- Употребляйте ржаной хлеб и крупы.
- Добавьте в рацион кисломолочные продукты. Отдавайте предпочтение натуральному йогурта, кефира и ряженке.
- Сырые овощи могут негативно сказаться на состоянии кишечника, поэтому перед употреблением следует приготовить их на пару;
- Рыбу и мясо лучше употреблять в отварном или запеченном виде. При этом выбирать только нежирные сорта.
Категорически запрещены следующие продукты:
- кондитерские изделия. Любые продукты, содержащие сахар, создают благоприятную атмосферу для развития патогенной микрофлоры. Это же касается подслащенного чая и кофе;
- выпечка, в состав которой входят дрожжи;
- алкогольные напитки.
Сколько времени требуется для восстановления кишечной флоры после приема антибиотиков?
Но убийство плохих парней, ответственных за вашу инфекцию, означает, что вы также убиваете хорошую флору, которая имеет решающее значение для вашего здоровья. Если вы недавно прошли курс лечения антибиотиками и задаетесь вопросом, сколько времени потребуется, чтобы ваш микробиом вернулся в норму — или даже если это вообще возможно, — читайте дальше. «,
«изображение»: «https://mk0healthpathcouchnf.kinstacdn.com/wp-content/uploads/2020/03/Recover_Gut_Flora-HEADER.svg «,
«author»: {
«@type»: «Человек»,
«name»: «Александра Фалконер»
},
«publisher»: {
«@type»: «Организация»,
«name»: «healthpath.com»,
«logo»: {
«@type»: «ImageObject»,
«url»: «https://healthpath.com/wp-content/themes/healthpath/images/logo.svg»
}
},
«datePublished»: «2020-12-17»
}
Если вы недавно прошли курс лечения антибиотиками и задаетесь вопросом, сколько времени потребуется, чтобы ваш микробиом вернулся в норму — или даже если это вообще возможно, — читайте дальше. «,
«изображение»: «https://mk0healthpathcouchnf.kinstacdn.com/wp-content/uploads/2020/03/Recover_Gut_Flora-HEADER.svg «,
«author»: {
«@type»: «Человек»,
«name»: «Александра Фалконер»
},
«publisher»: {
«@type»: «Организация»,
«name»: «healthpath.com»,
«logo»: {
«@type»: «ImageObject»,
«url»: «https://healthpath.com/wp-content/themes/healthpath/images/logo.svg»
}
},
«datePublished»: «2020-12-17»
}
Антибиотики убивают бактерии. В конце концов, это их работа. Именно так они спасли миллионы жизней за последние сто лет.
Но убийство плохих парней, ответственных за вашу инфекцию, означает, что вы также убиваете хорошую флору, которая имеет решающее значение для вашего здоровья.Если вы недавно прошли курс лечения антибиотиками и задаетесь вопросом, сколько времени потребуется, чтобы ваш микробиом вернулся в норму — или даже если это вообще возможно, — читайте дальше.
Содержание
Насколько сильно антибиотики повреждают нашу кишечную флору?
Почему так важно разнообразие?
Состав кишечных бактерий у большинства людей почти восстанавливается после приема антибиотиков.
Как я могу помочь своим кишечным бактериям восстановиться после приема антибиотиков?
Сколько времени нужно для восстановления полезных бактерий после приема антибиотиков?
Могут ли кишечные бактерии некоторых людей вылечиться от антибиотиков примерно за шесть месяцев?
Основные выводы
Насколько сильно антибиотики повреждают нашу кишечную флору?
В нашем кишечнике около 100 триллионов бактерий, поэтому невозможно узнать точный состав микробиома человека до начала курса антибиотиков или после его окончания.Но современные тесты кишечника могут дать нам хорошее представление.
Исследования показали, что антибиотики могут уничтожать наши кишечные бактерии. Это означает, что раунд, который вы выбрали для лечения инфекции носовых пазух, мог снизить микрофлору кишечника до одной десятой от предыдущего уровня. Не на одну десятую, а на одну десятую: это сокращение на 90 процентов (Источник: NCBI).
Не на одну десятую, а на одну десятую: это сокращение на 90 процентов (Источник: NCBI).
Урон, похоже, зависит от нескольких факторов.
1. Продолжительность и количество курсов
Многократные курсы антибиотиков, по-видимому, являются наиболее разрушительными (Источник: NCBI), а более высокие дозы антибиотиков, принимаемые в течение более длительного периода времени, имеют наибольшее влияние.Это может быть шокирующей новостью для многих людей, которые — часто в подростковом возрасте — месяцами принимали антибиотики, пытаясь вылечить угри.
Олуф Педерсен, главный научный сотрудник проекта 2018 года, который изучал влияние всего одного курса антибиотиков на микробиом, отметил, что большинство людей получат несколько циклов воздействия антибиотиков. «Обеспокоенность связана с потенциально безвозвратной потерей полезных бактерий после многократного воздействия антибиотиков в течение нашей жизни», — сказал он журналистам на сайте научных новостей ars TECHNICA (Источник: DX DOI).
2. Тип антибиотика
Если вы обратитесь к врачу с инфекцией, вы, скорее всего, вылечитесь с помощью антибиотика широкого спектра действия. Это потому, что, если ваш врач не возьмет образец и не отправит его в лабораторию для посева, он не знает, какой тип бактерий вызывает вашу инфекцию. Назначение антибиотика широкого спектра действия повышает вероятность того, что он подействует на вашу инфекцию, но кишечные бактерии пострадают сильнее.
Когда исследователи дали мышам цефалоспориновый антибиотик широкого спектра действия или комбинацию из трех антибиотиков (амоксициллин, висмут и метронидазол), оба антибиотика вызвали значительные изменения в микробном сообществе кишечника.
Мыши, получавшие антибиотик широкого спектра действия, не восстановили свое нормальное разнообразие, но другие мыши, получавшие комбинацию, содержащую амоксициллин, в основном — но не полностью — вернулись к уровням до лечения (Источник: IAI.ASM).
3.
 На каком этапе жизни вы их принимаете
На каком этапе жизни вы их принимаетеНаши первые годы кажутся решающими для создания здорового микробиома на всю жизнь. Одно исследование обнаружило связь между приемом антибиотиков в первый год жизни и более поздними нейрокогнитивными проблемами, такими как СДВГ, депрессия и тревога (Источник: Wiley), а другие исследования показали, что чем больше курсов антибиотиков человек получает в детстве, тем выше их риск развития ювенильного ревматоидного артрита и воспалительного заболевания кишечника (Источник: NCBI).
Другие связывают воздействие антибиотиков в утробе матери и в раннем детстве (и последующее изменение микробного состава кишечника) с развитием астмы в более позднем возрасте (Источник: BMJ) и ожирением у детей, а также у взрослых (Источник: Science Direct).
Вернуться к началу
Почему так важно разнообразие?
В здоровом, разнообразном микробиоме кишечника резидентные микробы помогают защитить от вторжения патогенов, которые могут вызвать инфекцию или заболевание. Они работают вместе, используя разные методы подавления патогенов, таких как:
Они работают вместе, используя разные методы подавления патогенов, таких как:
- производит противомикробных соединений , которые борются с вредными бактериями
- вытесняет патогены и предотвращает их попадание «недвижимое» пространство в кишечник
- поддерживает слой слизи , выстилающий кишечник, так что патогены не могут достигать кишечных клеток и создают дом
- тренирует иммунную систему реагировать на патогены
Когда количество резидентных микроорганизмов кишечника уменьшается во время использования антибиотиков, эти защитные функции могут прекратиться.Именно тогда патогенные бактерии могут вторгнуться и нарушить баланс.
Вернуться к началу
Состав кишечных бактерий у большинства людей почти восстанавливается после приема антибиотиков
Исследование выявило интересную стратегию, которую некоторые бактерии используют для восстановления после приема антибиотиков. Они используют гены устойчивости, которые ученые называют «резистомом», чтобы гарантировать, что они никогда не исчезнут.
Они используют гены устойчивости, которые ученые называют «резистомом», чтобы гарантировать, что они никогда не исчезнут.
После попытки уничтожить определенные виды бактерий с помощью антибиотиков, исследователи изучили микробиомы 12 здоровых мужчин в течение шести месяцев и задокументировали побочный ущерб.
Первоначальные изменения включали «расцвет» определенных типов потенциально вредных бактерий, а также исчезновение дружественных Bifidobacterium и видов, продуцирующих бутират. Однако исследователи утверждают, что микробиота кишечника субъектов восстановилась — «почти» до исходного уровня — в течение 1,5 месяцев.
Важно отметить, однако, что девять общих видов, которые присутствовали у всех субъектов до лечения, оставались необнаруженными у большинства субъектов через 180 дней (Источник: DX DOI).
Вернуться к началу
Как я могу помочь кишечным бактериям восстановиться после приема антибиотиков?
Не существует однозначного способа помочь кишечным бактериям восстановиться после приема антибиотиков. Реальность такова, что, хотя наука о микробиоме быстро развивается, мы все еще многого не знаем.
Реальность такова, что, хотя наука о микробиоме быстро развивается, мы все еще многого не знаем.
Есть кое-что, что мы знаем наверняка: здоровый микробиом — это все о разнообразии, и антибиотики определенно не способствуют этому. Вы можете позаботиться о своем здоровье кишечника и узнать о способах улучшения разнообразия своего микробиома в нашей Программе здоровья кишечника.
А пока давайте посмотрим, какие исследования могут рассказать нам о том, как увеличить это разнообразие, независимо от того, применяются ли антибиотики или нет.
1. Примите пробиотики
Клинические данные о преимуществах приема пробиотиков во время и после приема антибиотиков сбивают с толку.
Некоторые исследования показали, что прием пробиотиков может снизить риск инвазии условно-патогенных микроорганизмов (Источник: NCBI) и диареи, связанной с антибиотиками (Источник: JAMA).Но вполне вероятно, что разные штаммы пробиотиков по-разному действуют на разных людей.
Доказано, что некоторые пробиотики выживают в желудочной кислоте и достигают кишечника, образуя защитный барьер от потенциально вредных бактерий. Culturelle — один из примеров.
Лучшее время для приема пробиотиков, если вы принимаете антибиотики, — это как минимум три часа друг от друга. Это дает пробиотикам лучшие шансы на выживание (Источник: NCBI).
Saccharomyces Boulardii — это полезные дрожжи, которые могут помочь остановить распространение Candida (условно-патогенные дрожжи) после курса антибиотиков.Кандида обычно присутствует в небольших количествах у большинства людей, но при первой возможности она может взять верх и вызвать проблемы. Также было обнаружено, что Saccharomyces Boulardii сохраняет и восстанавливает кишечный барьер (Источник: NCBI). Что наиболее важно, поскольку это дрожжи, а не бактерии, антибиотики на них никак не влияют.
Интересно, что недавнее небольшое исследование показало, что пробиотики могут фактически препятствовать возвращению нативной микробиоты кишечника. Исходный микробиом кишечника группы людей, которые принимали пробиотики в течение 28 дней после применения антибиотиков, возвращались дольше по сравнению с группой, которая не принимала пробиотики (Источник: Cell).
Исходный микробиом кишечника группы людей, которые принимали пробиотики в течение 28 дней после применения антибиотиков, возвращались дольше по сравнению с группой, которая не принимала пробиотики (Источник: Cell).
В этом конкретном исследовании также изучалась польза от так называемого «переливания аутологичной фекальной микробиоты» (aFMT), при котором ученые восстанавливали бактерии, которые у участников были до приема антибиотиков, замораживая их старый стул (да, фекалии) и помещая их обратно в толстую кишку. когда курс закончился.
Звучит безумно? По словам ведущего исследователя, он вызывал «быстрое и почти полное выздоровление в течение нескольких дней после приема». Это доказательство преимуществ aFMT после приема антибиотиков побудило одну клинику в Великобритании предложить услугу замораживания стула людям, которые собираются пройти тяжелое лечение антибиотиками.
2. Максимально используйте пребиотики
Еще одна стратегия восстановления кишечной флоры после приема антибиотиков — убедиться, что вы хорошо ее кормите: продуктами, которые нравятся вашим кишечным клопам. Это означает употребление в пищу продуктов с высоким содержанием пребиотиков.
Это означает употребление в пищу продуктов с высоким содержанием пребиотиков.
Пребиотики — это пища для бактерий в толстом кишечнике, потому что они не перевариваются «дальше» в тонком кишечнике. Пребиотические продукты обычно богаты клетчаткой и растительными полифенолами. Так что ешьте много фруктов, овощей, бобовых, орехов и цельнозерновых.
Вы также можете попробовать такие пребиотические добавки, как инулин: растительный сахар, который, как было установлено, снижает разрушающее разнообразие антибиотика ампициллина в бактериальных культурах (Источник: NCBI).
3. Ешьте как охотник-собиратель
Разнообразная, богатая клетчаткой диета — лучший выбор для увеличения разнообразия, которому могут угрожать антибиотики (Источник: NCBI).
В недавнем исследовании группа итальянских исследователей сравнила кишечные микробы молодых сельских жителей Буркина-Фасо, Африка, с микробами детей во Флоренции, Италия.Сельские жители, которые ели в основном просо и сорго (цельнозерновые), обладали гораздо большим микробным разнообразием, чем итальянцы, которые придерживались типичной западной диеты. Они обнаружили, что микробиоты в кишечнике итальянских детей адаптированы к белку, жирам и простому сахару, а микробиом Буркина-Фасо предпочитает клетчатку (Источник: NCBI).
Они обнаружили, что микробиоты в кишечнике итальянских детей адаптированы к белку, жирам и простому сахару, а микробиом Буркина-Фасо предпочитает клетчатку (Источник: NCBI).
Один из исследователей, участвовавших в исследовании Буркина-Фасо, хотел узнать больше о роли клетчатки в нашем микробиоме, поэтому они продолжили исследование, в котором одна группа мышей накормила большим количеством клетчатки, а другую — сладкой западной диетой. .В то время как у мышей, получавших клетчатку, развился более разнообразный микробиом, разнообразие резко упало у мышей, соблюдающих диету, подобную западной. Интересно, что они также сообщили, что голодные по клетчатке мыши были злее, и с ними было труднее справиться! (Источник: NCBI).
4. Снижение стресса
Исследования показали, что стресс вызывает реакцию «бей или беги», которая высвобождает гормоны в различных частях тела, что, в свою очередь, влияет на микробиом, уменьшая разнообразие (Источник: NCBI).Ситуация усугубляется тем, что измененная популяция кишечных микробов влияет на регуляцию нейротрансмиттеров, еще больше усиливая стресс (Источник: NCBI).
5. Упражнение
Упражнения изменяют состав вашего микробиома. Одно исследование показало, что упражнения могут обогатить разнообразие вашего микробиома, улучшив баланс определенных семейств бактерий, которые потенциально могут способствовать снижению веса (Источник: Хиндави).
Более того, исследователи пришли к выводу, что упражнения стимулируют рост бактерий, которые могут улучшить целостность кишечного барьера и защитить от желудочно-кишечных расстройств и рака толстой кишки.
Другая тактика поддержки здоровой микрофлоры кишечника:
Вернуться к началу
Сколько времени нужно для восстановления полезных бактерий после приема антибиотиков?
Похоже, что большинство семейств бактерий возвращаются к нормальному уровню примерно через два месяца после лечения (Источник: NCBI). Однако этот ответ основан на исследованиях, в которых изучается влияние одного краткосрочного курса антибиотиков. Мы должны помнить, что «большинство» семейств бактерий не означает все, и потерянные семейства могут играть ключевую роль в хрупкой экосистеме нашего кишечника (Источник: OUP), (Источник: ASM).
Вернуться к началу
Могут ли кишечные бактерии некоторых людей вылечиться от антибиотиков примерно за шесть месяцев?
Некоторые исследования, опубликованные в 2018 году, показали, что нашей кишечной флоре потребовалось около шести месяцев, чтобы прийти в норму после приема антибиотиков (Источник: DX DOI). СМИ подхватили это, и поэтому многие люди сегодня думают, что вы вернете свою старую кишку именно через шесть месяцев после приема антибиотиков. Однако это исследование — лишь одно из многих, и все они дали разные результаты.
Если вы чувствуете себя подавленным всей этой информацией, вы можете получить некоторую стратегическую помощь с нашей необязательной программой проверки симптомов.
Вполне возможно, что кишечные бактерии никогда не вернутся к норме. Но это не значит, что вы не можете предпринять шаги для увеличения своего разнообразия. Каждый может получить пользу от заботы о своем кишечнике, но если вы недавно принимали антибиотики, для этого есть еще более серьезная причина.
Вернуться к началу
Ключевые выносы
- Иногда вам, возможно, придется принимать антибиотики.Если вы это сделаете, есть способы уменьшить повреждение кишечной флоры
- Основная проблема антибиотиков заключается в их способности резко сократить разнообразие вашего микробиома.
- Возможно, ваш микробиом вернется в норму в течение недель или месяцев
- Чтобы дать вашим кишечным клопам наилучший шанс, сделайте все возможное, чтобы увеличить их разнообразие
- Простые шаги включают потребление клетчатки, пребиотиков и уход за кишечником в целом
Наверх
Автор
Александра Фалконер MA (Dist) DipCNM mBANT — дипломированный диетолог, специализирующийся на СРК и родственных состояниях.Выпускница Брайтонского колледжа натуропатической медицины, она стремится бороться с первопричинами хронических заболеваний и предоставлять функциональную медицину всем, кто в ней нуждается.
До своей естественной оздоровительной карьеры Алекс была журналистом и копирайтером. Она продолжает писать для журналов и медиа-агентств, и теперь объединяет свои две великие страсти — писательство и здоровье — создавая контент, который дает людям возможность отстаивать свое право на здоровое тело и разум.
Как восстановить флору кишечника и очистить кишечник после приема антибиотиков
Вот что вам нужно знать, чтобы восстановить здоровье кишечника, помочь своей естественной флоре и выбрать пищевые добавки для здоровья кишечника после антибиотиков.
Стать самым здоровым человеком может показаться непреодолимой задачей, особенно потому, что наши тела могут быть невероятно загадочными и сложными. Но многие люди не знают, что существуют простые, конкретные, изученные способы улучшить свое здоровье, и большинство из них связано с кишечником.
Это потому, что ваше тело полагается на полезные бактерии, которые регулируют пищеварительную систему, поддерживают иммунитет, производство серотонина и многое другое. Вместо того, чтобы выяснять, как избавиться от вредных кишечных бактерий, вы обнаружите, что восстановление кишечной флоры и устранение полезных бактерий важнее.
Вместо того, чтобы выяснять, как избавиться от вредных кишечных бактерий, вы обнаружите, что восстановление кишечной флоры и устранение полезных бактерий важнее.
Содержание
В этой статье наших друзей из Jetson Probiotics исследуются преимущества пробиотиков для смягчения воздействия антибиотиков и другие способы поддержания здоровья кишечника, заботясь о кишечном микробиоме.
☝️ ОТКАЗ ОТ ОТВЕТСТВЕННОСТИ ☝Эта статья предназначена только для информационных целей. Он не предназначен для использования в качестве замены профессиональных медицинских рекомендаций, диагностики или лечения.
Что такое микробиом кишечника?
Зачем кишечнику нужны бактерии (Тед Эд) Микробиом кишечника живет в толстом кишечнике и является домом для самых разнообразных бактерий во всем организме. Это потому, что, в отличие от любой другой части тела, ваш пищеварительный тракт представляет собой открытую экосистему, которая больше подвержена влиянию внешней среды, чем любая другая часть тела.
Это потому, что, в отличие от любой другой части тела, ваш пищеварительный тракт представляет собой открытую экосистему, которая больше подвержена влиянию внешней среды, чем любая другая часть тела.
Что это значит? Что ж, микробиом кишечника может быть сформирован такими вещами, как пол, возраст, географические и социально-экономические условия, диета и состояние здоровья. Это также означает, что микробиом кишечника каждого человека будет разным и на него будут влиять разные факторы.
Хорошие бактерии и здоровье кишечника
Но нам десятилетиями говорили, что все бактерии — зло, поэтому, если вы задаетесь вопросом: «Полезна ли флора для вас?» прямо сейчас, значит, вы не одиноки.Не волнуйтесь, это широко распространенное мнение — миф. Фактически, теперь мы знаем, что бактерии в большинстве своем безвредны, некоторые из них полезны, а лишь некоторые из них вредны.
Чтобы ваш кишечник оставался счастливым и вы были здоровы, это зависит от микробного разнообразия. По сути, должно быть много разных типов микробов, живущих вместе. Когда его нет, это приводит к дисбактериозу, при котором недостаточно разнообразия, и некоторые бактерии могут бесконтрольно расти.
По сути, должно быть много разных типов микробов, живущих вместе. Когда его нет, это приводит к дисбактериозу, при котором недостаточно разнообразия, и некоторые бактерии могут бесконтрольно расти.
Когда происходит дисбаланс между хорошими и плохими бактериями, микробиом может стать несчастливым, что имеет последствия для пищеварения, воспаления, слизистой оболочки кишечника и даже настроения и здоровья мозга.
Кишечные бактерии и иммунное здоровье
Что наиболее важно, захват вредных бактерий может резко повлиять на иммунитет и оставить место для развития инфекций, болезней и хронических заболеваний. Кишечник — это первая линия связи между внешней средой и иммунной системой. Эти двое работают вместе, чтобы взаимно регулировать реакцию нашего организма на вредные патогены.
Но когда иммунная система и кишечник работают вместе, все работает гладко. Это стимулирует рост полезных бактерий, что улучшает иммунитет и работу кишечника.Он вызывает более сильную реакцию на болезнетворные микроорганизмы, в то же время делая организм более устойчивым к естественным кишечным бактериям.
Как антибиотики вредят здоровью кишечника?
Восстановление здоровья кишечника начинается с понимания бактерий в вашем желудочно-кишечном тракте.Антибиотики прописываются почти половине населения Великобритании каждый год от обычных заболеваний и в больницах для лечения и предотвращения серьезных инфекций. Вот наиболее частые применения антибиотиков:
| ушные инфекции | Инфекции носовых пазух |
| инфекции грудной клетки | Инфекции горла |
| Инфекции мочевыводящих путей, мочевого пузыря и почек | кожно-раневые инфекции |
| пневмония |
К сожалению, антибиотики не останавливаются на вредных бактериях и не лечат вирусные инфекции, которые часто почти невозможно отличить от бактериальных.Вместо этого антибиотики убивают и хорошие бактерии, а это плохо, потому что хорошие бактерии часто помогают вашему организму бороться с инфекцией.
Многие люди также испытывают легкие или тяжелые побочные эффекты антибиотиков, особенно если их иммунное здоровье уже подорвано, как у пациентов в больницах. Более того, антибиотики могут оставлять место для чрезвычайно вредных бактерий, таких как кишечная палочка , C.diff и сальмонелла, — инфекции, которые могут быть настолько серьезными, что потребуется госпитализация.
Общие побочные эффекты антибиотиков
- диарея
- дрожжевые инфекции
- газ
- рвота
- тошнота
- запор
Несмотря на то, что антибиотики очень эффективны при лечении бактериальных инфекций, важно принять необходимые меры предосторожности, чтобы поддержать микробиом кишечника, потому что сохранение хороших бактерий так же важно, как и уничтожение плохих.
Как лучше всего восстановить здоровье кишечника?
Диета, богатая пребиотическими растительными продуктами, питает микробиом кишечника. Не секрет, что здоровье кишечника не является обязательным условием для достижения общего состояния здоровья. Поддерживать уровень полезных бактерий в микробиоме кишечника можно разными способами, включая диету и использование пробиотиков.
Поддерживать уровень полезных бактерий в микробиоме кишечника можно разными способами, включая диету и использование пробиотиков.
Все начинается с диеты. Хорошие бактерии насыщаются клетчаткой и питательными веществами в растительной пище — это пребиотики — и они превращают эти вещества в питательные вещества, которые питают слизистую оболочку кишечника и поддерживают баланс биома кишечника.
Кроме того, пробиотические добавки содержат миллиарды бактерий из одного или нескольких штаммов бактерий, которые в определенных, изученных дозах приносят пользу вашему здоровью. Вот некоторые из самых известных и хорошо изученных пробиотических бактерий и дрожжей, которые вы найдете в добавках:
| Bifidobacterium | Лактобациллы |
| Лактококк | Сахаромицеты |
☝️ Что сообщает Atlas Biomed: ☝️ Ученые-микробиологи из Atlas подчеркивают, что преимущества пробиотиков могут быть временными для некоторых людей и сохраняться только до тех пор, пока они принимают добавки.
Сколько времени нужно, чтобы снова заселить кишечник полезными бактериями?
На этот вопрос нет простого ответа, потому что он зависит от состояния вашего микробиома, качества вашей диеты, принимаемых вами лекарств, уровня физической активности и многого другого. Однако микробиом кишечника очень легко адаптируется и реагирует на выбор позитивного образа жизни.
Итак, если вы придерживаетесь диеты с большим количеством цельных продуктов, богатых клетчаткой (ученые называют это пребиотиками) и добавляете пробиотические продукты или добавки, вы можете ускорить восстановление биома кишечника.Кроме того, регулярные упражнения, особенно кардио, связаны с большим разнообразием кишечника.
Как восстановить здоровую флору кишечника
Пробиотики в целом безопасны, и иногда их даже рекомендуется принимать во время курса антибиотиков, за исключением госпитализированных пациентов и людей с ослабленной иммунной системой. После этого они особенно полезны для восстановления микробиома кишечника.
☝️ СОВЕТ Не существует такой вещи, как диета с чистым кишечником — кишечник очищается естественным образом.Тем не менее, вы можете помочь кишечным бактериям сохранить здоровье с помощью пребиотической диеты, богатой растениями.
Какие пробиотики при побочных эффектах антибиотиков?
Пробиотики борются с воздействием антибиотиков на полезные кишечные бактерииОбычно организму требуется время, чтобы сбалансировать микробиом до здорового, разнообразного уровня бактерий. Фактически, исследования показывают, что на восстановление после повреждений, нанесенных антибиотиками, требуется около 6 месяцев. И даже в этом случае организм может даже не вернуться к своему доантибиотическому состоянию.
Saccharomyces boulardii , пробиотические дрожжи, особенно хороши для предотвращения и облегчения диареи, связанной с антибиотиками, и диареи путешественников. Это также друг кишечных бактерий, поддерживающий полезные бактерии и предотвращающий воспаления.
Lactobacillus acidophilus , пробиотическая бактерия, наиболее известная тем, что содержится в йогурте, также полезна для кишечника. Исследования показывают, что он помогает лечить и предотвращать инфекции, а также снижает побочные эффекты антибиотиков для пищеварения.
К другим бактериям, которые помогают восстановиться после употребления антибиотиков, относятся:
- L. casei
- L. Rhamnosus GG
- L. Plantarum 299v
- B. subtilis
- B. coagulans lactospore
- B. clausii
Каковы долгосрочные последствия нарушения здоровья кишечника?
Ваше тело не только более восприимчиво к инфекциям, ослабленному иммунитету и хроническим воспалениям, но мы также знаем, что несбалансированная микробиота может увеличить риск более поздних хронических заболеваний, таких как болезни сердца, диабет, даже болезни Альцгеймера и Паркинсона.
Микробиом кишечника — это самая разнообразная по бактериальному составу часть вашего тела, и на него влияют то, что вы едите, пьете, уровень вашей активности и лекарства, которые вы принимаете. Это может показаться немного подавляющим, но для того, чтобы вылечить кишечник, не нужно много времени: хорошее питание, регулярные упражнения и некоторая помощь пробиотических бактерий.
Восстановление микробиоты кишечника после приема антибиотиков зависит от диеты хозяина, условий сообщества и природных резервуаров
.13 ноября 2019; 26 (5): 650-665.e4. DOI: 10.1016 / j.chom.2019.10.011. Кэтрин Мишель Нг 1 , Андрес Аранда-Диас 1 , Каролина Тропини 2 , Мэтью Райан Франкель 1 , Уильям Ван Треурен 2 , Коллин Т. О’Лафлин 1 , Брайан Дуглас Меррилл 2 , Фэйцяо Брайан Юй 3 , Кали М Прусс 2 , Рита Алмейда Оливейра 4 , Стивен Кайл Хиггинботтом 2 , Норма Ф Нефф 3 , Майкл Эндрю Фишбах 5 , Карина Бивар Ксавье 4 , Джастин Лайн Зонненбург 6 , Кервин Кейси Хуанг 7
О’Лафлин 1 , Брайан Дуглас Меррилл 2 , Фэйцяо Брайан Юй 3 , Кали М Прусс 2 , Рита Алмейда Оливейра 4 , Стивен Кайл Хиггинботтом 2 , Норма Ф Нефф 3 , Майкл Эндрю Фишбах 5 , Карина Бивар Ксавье 4 , Джастин Лайн Зонненбург 6 , Кервин Кейси Хуанг 7 Принадлежности Расширять
Принадлежности
- 1 Кафедра биоинженерии, Медицинская школа Стэнфордского университета, Стэнфорд, Калифорния 94305, США.

- 2 Департамент микробиологии и иммунологии Медицинской школы Стэнфордского университета, Стэнфорд, Калифорния 94305, США.
- 3 Chan Zuckerberg Biohub, Сан-Франциско, Калифорния 94158, США.
- 4 Instituto Gulbenkian de Ciência, Оэйраш, Португалия.
- 5 Департамент биоинженерии Медицинской школы Стэнфордского университета, Стэнфорд, Калифорния 94305, США; Chan Zuckerberg Biohub, Сан-Франциско, Калифорния 94158, США.
- 6 Департамент микробиологии и иммунологии Медицинской школы Стэнфордского университета, Стэнфорд, Калифорния 94305, США; Chan Zuckerberg Biohub, Сан-Франциско, Калифорния 94158, США.

- 7 Департамент биоинженерии Медицинской школы Стэнфордского университета, Стэнфорд, Калифорния 94305, США; Департамент микробиологии и иммунологии Медицинской школы Стэнфордского университета, Стэнфорд, Калифорния 94305, США; Chan Zuckerberg Biohub, Сан-Франциско, Калифорния 94158, США.Электронный адрес: [email protected].
Элемент в буфере обмена
Кэтрин Мишель Нг и др. Клеточный микроб-хозяин. .
Бесплатная статья PMC Показать детали Показать вариантыПоказать варианты
Формат АннотацияPubMedPMID
. 13 ноября 2019; 26 (5): 650-665.e4.
DOI: 10.1016 / j.chom.2019.10.011.
13 ноября 2019; 26 (5): 650-665.e4.
DOI: 10.1016 / j.chom.2019.10.011.Авторы
Кэтрин Мишель Нг 1 , Андрес Аранда-Диас 1 , Каролина Тропини 2 , Мэтью Райан Франкель 1 , Уильям Ван Треурен 2 , Коллин Т. О’Лафлин 1 , Брайан Дуглас Меррилл 2 , Фэйцяо Брайан Юй 3 , Кали М Прусс 2 , Рита Алмейда Оливейра 4 , Стивен Кайл Хиггинботтом 2 , Норма Ф Нефф 3 , Майкл Эндрю Фишбах 5 , Карина Бивар Ксавье 4 , Джастин Лайн Зонненбург 6 , Кервин Кейси Хуанг 7Принадлежности
- 1 Кафедра биоинженерии, Медицинская школа Стэнфордского университета, Стэнфорд, Калифорния 94305, США.

- 2 Департамент микробиологии и иммунологии Медицинской школы Стэнфордского университета, Стэнфорд, Калифорния 94305, США.
- 3 Chan Zuckerberg Biohub, Сан-Франциско, Калифорния 94158, США.
- 4 Instituto Gulbenkian de Ciência, Оэйраш, Португалия.
- 5 Департамент биоинженерии Медицинской школы Стэнфордского университета, Стэнфорд, Калифорния 94305, США; Chan Zuckerberg Biohub, Сан-Франциско, Калифорния 94158, США.
- 6 Департамент микробиологии и иммунологии Медицинской школы Стэнфордского университета, Стэнфорд, Калифорния 94305, США; Chan Zuckerberg Biohub, Сан-Франциско, Калифорния 94158, США.

- 7 Департамент биоинженерии Медицинской школы Стэнфордского университета, Стэнфорд, Калифорния 94305, США; Департамент микробиологии и иммунологии Медицинской школы Стэнфордского университета, Стэнфорд, Калифорния 94305, США; Chan Zuckerberg Biohub, Сан-Франциско, Калифорния 94158, США.Электронный адрес: [email protected].
Элемент в буфере обмена
Полнотекстовые ссылки Опции CiteDisplayПоказать варианты
Формат АннотацияPubMedPMID
Опечатка в
- Восстановление микробиоты кишечника после приема антибиотиков зависит от диеты хозяина, условий сообщества и условий окружающей среды.
Нг К.М., Аранда-Диас А.
 , Тропини С., Франкель М.Р., Ван Треурен В., О’Лафлин К.Т., Меррилл Б.Д., Ю. Ф. Б., Прусс К.М., Оливейра Р.А., Хиггинботтом С.К., Нефф Н.Ф., Фишбах М.А., Ксавье К.Б., Зонненбург Д.Л., Хуанг KC.
Ng KM, et al.
Клеточный микроб-хозяин. 2020 7 октября; 28 (4): 628. DOI: 10.1016 / j.chom.2020.09.001.
Клеточный микроб-хозяин. 2020.
PMID: 33031771
Рефератов нет.
, Тропини С., Франкель М.Р., Ван Треурен В., О’Лафлин К.Т., Меррилл Б.Д., Ю. Ф. Б., Прусс К.М., Оливейра Р.А., Хиггинботтом С.К., Нефф Н.Ф., Фишбах М.А., Ксавье К.Б., Зонненбург Д.Л., Хуанг KC.
Ng KM, et al.
Клеточный микроб-хозяин. 2020 7 октября; 28 (4): 628. DOI: 10.1016 / j.chom.2020.09.001.
Клеточный микроб-хозяин. 2020.
PMID: 33031771
Рефератов нет.
Абстрактный
Антибиотики изменяют состав микробиоты и повышают восприимчивость к инфекции.Однако общие эффекты антибиотиков и влияние факторов окружающей среды на кишечные комменсалы остаются неясными. Чтобы решить эту проблему, мы отслеживали динамику микробиоты с высоким временным и таксономическим разрешением во время лечения антибиотиками в контролируемой мышиной системе, выделяя такие переменные, как диета, история лечения и проживание сожителей. Человеческие микробиоты были в высшей степени устойчивыми и восстанавливались во время лечения антибиотиками с временным преобладанием резистентных бактерий и сокращением асимметричного разнообразия таксонов.В некоторых случаях чувствительность in vitro не позволяла предсказать ответы in vivo, что подчеркивает важность контекста хозяина и сообщества. Диета с дефицитом клетчатки усугубляет коллапс микробиоты и замедляет выздоровление. Замещение видов посредством перекрестного содержания после лечения ципрофлоксацином показало устойчивость ко второму лечению. Отдельные дома резко подорвали восстановление, подчеркнув важность экологических резервуаров. Наши результаты подчеркивают детерминированную адаптацию микробиоты к возмущениям и трансляционный потенциал для изменения диеты, санитарии и состава микробиоты во время приема антибиотиков.
Человеческие микробиоты были в высшей степени устойчивыми и восстанавливались во время лечения антибиотиками с временным преобладанием резистентных бактерий и сокращением асимметричного разнообразия таксонов.В некоторых случаях чувствительность in vitro не позволяла предсказать ответы in vivo, что подчеркивает важность контекста хозяина и сообщества. Диета с дефицитом клетчатки усугубляет коллапс микробиоты и замедляет выздоровление. Замещение видов посредством перекрестного содержания после лечения ципрофлоксацином показало устойчивость ко второму лечению. Отдельные дома резко подорвали восстановление, подчеркнув важность экологических резервуаров. Наши результаты подчеркивают детерминированную адаптацию микробиоты к возмущениям и трансляционный потенциал для изменения диеты, санитарии и состава микробиоты во время приема антибиотиков.
Ключевые слова: Bacteroides; S24-7; антибиотики; совместное жилье; копрофагия; трансплантаты фекальной микробиоты; кишечная микробиота; нарушения микробиоты; пересев; устойчивость.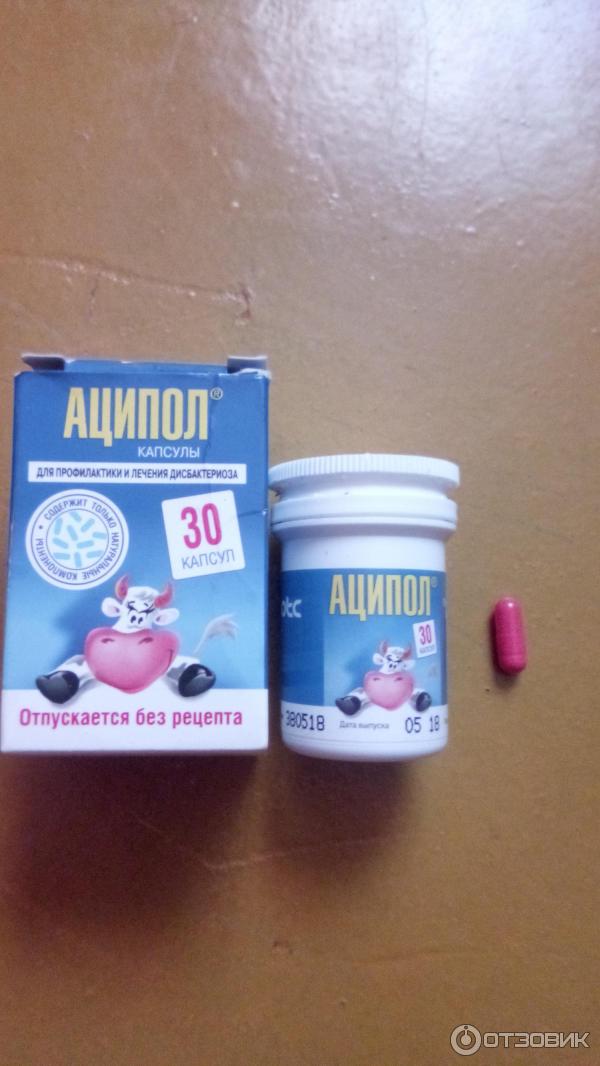
Авторские права © 2019 Elsevier Inc. Все права защищены.
Заявление о конфликте интересов
Декларация интересов
Авторы заявляют об отсутствии конкурирующих интересов.
Цифры
Рисунок 1 :. Быстрое выздоровление при приеме антибиотиков…
Рисунок 1 :. Быстрое восстановление микробиоты человека при введении антибиотиков в сочетании с антибиотиками, с общими…
Быстрое восстановление микробиоты человека при введении антибиотиков в сочетании с антибиотиками, с общими…
См. Также рисунки S1 и S4. (A) Схема гуманизации мышей, свободных от микробов, лечения антибиотиками и отбора проб. (B, F) Культурные анаэробные и аэробные плотности фекалий у гуманизированных мышей, получавших в течение 5 дней (B) 20 мг стрептомицина в день ( n = 15) и (F) 3 мг ципрофлоксацина два раза в день ( n = 14) .Бактериальная нагрузка восстановилась во время лечения (цветная область). Планки погрешностей: S.E.M. (C, G) Состав фекалий на уровне семьи был сходным у (C) обработанных стрептомицином и (G) обработанных ципрофлоксацином гуманизированных мышей (цветные столбцы обозначают период лечения). (D, H) Относительная численность Bacteroides, S24-7 и Bacteroidetes у (D) обработанных стрептомицином и (H) обработанных ципрофлоксацином гуманизированных мышей. (E, I) PCoA состава сообщества у гуманизированных мышей во время лечения (E) стрептомицином или (I) ципрофлоксацином обнаруживают консервативную траекторию.При анализе использовались взвешенные расстояния UniFrac. (J) PCoA гуманизированных мышей во время лечения ципрофлоксацином в двух клетках выявили клеточно-специфические различия. (K) Состав на уровне семьи из двух клеток в (H) показал стохастичность восстановления S24-7.
(D, H) Относительная численность Bacteroides, S24-7 и Bacteroidetes у (D) обработанных стрептомицином и (H) обработанных ципрофлоксацином гуманизированных мышей. (E, I) PCoA состава сообщества у гуманизированных мышей во время лечения (E) стрептомицином или (I) ципрофлоксацином обнаруживают консервативную траекторию.При анализе использовались взвешенные расстояния UniFrac. (J) PCoA гуманизированных мышей во время лечения ципрофлоксацином в двух клетках выявили клеточно-специфические различия. (K) Состав на уровне семьи из двух клеток в (H) показал стохастичность восстановления S24-7.
Рисунок 2 :. Прием антибиотиков меняет состояние…
Рисунок 2 :.Введение антибиотиков изменяет состояние микробиоты за счет уменьшения разнообразия Bacteroidetes.
См. Также рисунок S2. (A, B) После обработки (окрашенная область) микробиота стабилизировалась при более низком альфа-разнообразии. (C, D) Альфа-разнообразие типа Bacteroidetes подверглось гораздо большему воздействию, чем Firmicutes для обоих вариантов лечения.(E, F) На разнообразие S24-7 и Bacteroidaceae альфа повлиял ципрофлоксацин, особенно на S24-7.
Рисунок 3 :. Микробиоты обычных и…
Рисунок 3 :. Микробиоты обычных и гуманизированных мышей демонстрируют различные сигнатуры под повторяющимся ципрофлоксацином…
Рисунок 3 :. Микробиоты обычных и гуманизированных мышей демонстрируют различные сигнатуры при повторной обработке ципрофлоксацином.
Микробиоты обычных и гуманизированных мышей демонстрируют различные сигнатуры при повторной обработке ципрофлоксацином. См. Также рисунок S3. (A) Схема лечения двумя курсами ципрофлоксацина. (B, E) Культурируемые анаэробные и аэробные плотности фекалий у (B) гуманизированных и (E) обычных мышей, получавших ципрофлоксацин (обработка отмечена цветными областями), показали, что обычные мыши реагировали одинаково на оба лечения, но гуманизированные мыши имели более устойчивые вторые отклик.Планки погрешностей: S.E.M. (C, F) Состав на уровне семьи в фекалиях (C) гуманизированных и (F) обычных мышей дополнительно продемонстрировал устойчивость гуманизированных мышей ко второму лечению. (D, G, I) При дифференциальной устойчивости к антибиотикам устойчивые штаммы преобладают во время лечения антибиотиками; прочие Bacteroides spp. расширяются после антибиотиков. Относительная численность 10 наиболее распространенных вирусов ASV Bacteroides у (D) гуманизированных мышей, получавших ципрофлоксацин, (G) обычных мышей, получавших ципрофлоксацин, и (I) гуманизированных мышей, получавших стрептомицин. B. sp: неизвестно Bacteroides spp .; г. до н. Э .: B. caccae; Bs: B. salyersiae; Bf: B. fragilis; Bu: B. uniformis; Би: B. кишечник; Bv: B. vulgatus; Ba: B. acidifaciens. МИК помечены над днями изоляции и окрашены соответствующим ASV на основании секвенирования 16S по Сэнгеру. Обработка обозначена затемненными участками. (H) Сравнение кластеров генов и средней нуклеотидной идентичности изолятов Bv показало, что изолят дня 0 (D0) отличается от изолятов из других дней, и что изоляты Bv от обычных мышей также образуют кластер.
B. sp: неизвестно Bacteroides spp .; г. до н. Э .: B. caccae; Bs: B. salyersiae; Bf: B. fragilis; Bu: B. uniformis; Би: B. кишечник; Bv: B. vulgatus; Ba: B. acidifaciens. МИК помечены над днями изоляции и окрашены соответствующим ASV на основании секвенирования 16S по Сэнгеру. Обработка обозначена затемненными участками. (H) Сравнение кластеров генов и средней нуклеотидной идентичности изолятов Bv показало, что изолят дня 0 (D0) отличается от изолятов из других дней, и что изоляты Bv от обычных мышей также образуют кластер.
Рисунок 4 :. Лечение антибиотиками увеличивает рыхлость кишечника…
Рисунок 4 :. Лечение антибиотиками увеличивает разрыхленность кишечной слизи.
См. Также рисунок S4. (A, B) Изображение…
Рисунок 4 :.Лечение антибиотиками увеличивает разрыхленность кишечной слизи. См. Также рисунок S4. (A, B) Визуализация дистального отдела толстой кишки гуманизированных мышей до, во время и после лечения (A) стрептомицином и (B) ципрофлоксацином показала устойчивое увеличение рыхлой слизи в просвете. Срезы окрашивали DAPI (эпителиальный DAPI, синий; просветный DAPI, красный) и MUC2 (зеленый). Обломки, сегментированные с помощью вычислений, отображаются желтым цветом. Масштабирование: (1) Плотное сообщество до приема антибиотиков с небольшим количеством слизи в просвете и плотным слоем слизи.(2,3) Значительное снижение люминального DAPI через 1 день после лечения. (4) Восстановление люминального DAPI, но сохранение рыхлой просветной слизи. (B) Толщина плотного внутреннего слоя слизи оставалась приблизительно постоянной во время лечения, в то время как более рыхлая слизь наружного просвета пролиферировала во время лечения обоими антибиотиками и сохранялась после лечения ципрофлоксацином. Планки погрешностей представляют S.D.
Планки погрешностей представляют S.D.
Рисунок 5 :.Диета с дефицитом МАК повышает чувствительность…
Рисунок 5 :. Диета с дефицитом МАК повышает чувствительность микробиоты к ципрофлоксацину.
(A) Схема обработки…
Рисунок 5 :. Диета с дефицитом МАК повышает чувствительность микробиоты к ципрофлоксацину. (A) Схема лечения гуманизированных / обычных мышей, передаваемых половым путем, или мышей MD.(B, E) Культурируемые анаэробные и аэробные плотности фекалий у (B) гуманизированных или (E) обычных мышей MD показали, что аэробный компартмент был сенсибилизирован у гуманизированных мышей, и оба компартмента были сенсибилизированы у обычных мышей. Планки погрешностей: S.E.M .; период лечения отмечен цветной областью. (C, F) Альфа-разнообразие уменьшилось больше у мышей MD, чем у мышей STD после лечения. (D, G) Состав на уровне семьи в фекалиях мышей MD существенно отличался от мышей с ЗППП (рис. 1F, K, L). (H) Тепловая карта основного микробиома в надире альфа-разнообразия у гуманизированных мышей с ЗППП и МД.Общие ASV сгруппированы слева, а ASV, специфичные для STD и MD, отображаются справа. Процент общей относительной численности, приходящейся на общее ядро, составляет ~ 90% у большинства мышей (синие столбцы, слева).
Планки погрешностей: S.E.M .; период лечения отмечен цветной областью. (C, F) Альфа-разнообразие уменьшилось больше у мышей MD, чем у мышей STD после лечения. (D, G) Состав на уровне семьи в фекалиях мышей MD существенно отличался от мышей с ЗППП (рис. 1F, K, L). (H) Тепловая карта основного микробиома в надире альфа-разнообразия у гуманизированных мышей с ЗППП и МД.Общие ASV сгруппированы слева, а ASV, специфичные для STD и MD, отображаются справа. Процент общей относительной численности, приходящейся на общее ядро, составляет ~ 90% у большинства мышей (синие столбцы, слева).
Рисунок 6 :. Перекрестная инвазия Bacteroides , опосредованная корпусами, улучшает…
Рисунок 6 :.Инвазия Bacteroides , опосредованная перекрестным размещением, улучшает устойчивость микробиоты.
См. Также рисунок S5. (A, B) Семейный уровень…
Рисунок 6 :. Инвазия Bacteroides , опосредованная перекрестным размещением, улучшает устойчивость микробиоты. См. Также рисунок S5. (A, B) Состав на уровне семьи в кале мышей, колонизированных донорскими образцами 1 (h2 (A), n = 5) или 2 (h3, (B), n = 4) во время двух обработок ципрофлоксацином. задержка восстановления Bacteroidetes у мышей h3 во время первой обработки, но не во второй.(C, D) Паттерны восстановления 10 наиболее распространенных вирусов ASV Bacteroides (аббревиатуры такие же, как на рис. 5H, I) различались у (C) h2 и (D) h3 мышей. МИК были рассчитаны для двух изолятов из образцов мышей h3 (помеченных выше дня выделения). Сроки лечения обозначены цветными областями. (E) Схема перекрестного содержания мышей с разными микробиотами до, во время лечения ципрофлоксацином. (F, G) Состав фекалий на уровне семьи у (F) мышей h2, смешанных с мышами h3 на 5 день ( n = 3) и (H) мышей h3, смешанных с мышами h2 на 5 день ( n = 2 ).Перекрестное размещение стимулировало цветение Barnesiellaceae после первой обработки у мышей h2 и устойчивость Bacteroides во время второй обработки у мышей h3. (H) Относительная численность S24-7 ASV, которая присутствовала только у мышей h2 в день 0, но затем зацвела у мышей h3, подчеркивая потенциальную передачу. (I, J) Относительная численность (I) Bacteroidaceae и (J) доминирующего Bv ASV у всех мышей h2 и h3, включая мышей с перекрестным размещением и несмешанных мышей, во время двойного курса лечения ципрофлоксацином. Bv ASV стал доминирующим у всех мышей h2 во время обеих обработок, но только во время второй обработки у мышей h3. Обилие Bv увеличивалось быстрее и достигало более высоких уровней у мышей h3, содержащихся в перекрестном размещении, по сравнению с мышами без смешивания h3.
(F, G) Состав фекалий на уровне семьи у (F) мышей h2, смешанных с мышами h3 на 5 день ( n = 3) и (H) мышей h3, смешанных с мышами h2 на 5 день ( n = 2 ).Перекрестное размещение стимулировало цветение Barnesiellaceae после первой обработки у мышей h2 и устойчивость Bacteroides во время второй обработки у мышей h3. (H) Относительная численность S24-7 ASV, которая присутствовала только у мышей h2 в день 0, но затем зацвела у мышей h3, подчеркивая потенциальную передачу. (I, J) Относительная численность (I) Bacteroidaceae и (J) доминирующего Bv ASV у всех мышей h2 и h3, включая мышей с перекрестным размещением и несмешанных мышей, во время двойного курса лечения ципрофлоксацином. Bv ASV стал доминирующим у всех мышей h2 во время обеих обработок, но только во время второй обработки у мышей h3. Обилие Bv увеличивалось быстрее и достигало более высоких уровней у мышей h3, содержащихся в перекрестном размещении, по сравнению с мышами без смешивания h3.
Рисунок 7 :. Совместное размещение обеспечивает надежное восстановление после…
Рисунок 7 :.Совместное размещение обеспечивает быстрое восстановление после лечения стрептомицином.
См. Также рисунок S6. (A) Схема…
Рисунок 7 :. Совместное размещение обеспечивает быстрое восстановление после лечения стрептомицином. См. Также рисунок S6. (A) Схема жилищного эксперимента. (B) Анаэробные и аэробные культивируемые плотности фекалий у обычных и обработанных стрептомицином мышей в одном и том же помещении (окрашенная область обозначает период лечения антибиотиками) выявили замедленное выздоровление. (C, D) Состав на уровне класса в фекалиях у (C) мышей, содержащихся в одном помещении ( n = 5) и (D), содержащихся в одном помещении ( n = 6), выявил задержку восстановления Bacteroidetes у мышей, содержащихся в одном помещении. (E) Состав на уровне семьи у мышей, содержащихся в одном помещении, показал устойчивое восстановление Bacteroidaeceae во время приема стрептомицина. (F) Состав на уровне семьи продемонстрировал неоднородные закономерности восстановления у мышей, содержащихся в одиночку. (G) Шумность повторного посева у мышей в одиночном размещении была очевидна из более низкого гамма-разнообразия (уникальные ASV) мышей в совместном содержании по сравнению с мета-гамма-разнообразием мышей в одиночном размещении, которых лечили, как если бы они были группой, несмотря на низкое альфа-разнообразие. каждой отдельно взятой мыши.
(C, D) Состав на уровне класса в фекалиях у (C) мышей, содержащихся в одном помещении ( n = 5) и (D), содержащихся в одном помещении ( n = 6), выявил задержку восстановления Bacteroidetes у мышей, содержащихся в одном помещении. (E) Состав на уровне семьи у мышей, содержащихся в одном помещении, показал устойчивое восстановление Bacteroidaeceae во время приема стрептомицина. (F) Состав на уровне семьи продемонстрировал неоднородные закономерности восстановления у мышей, содержащихся в одиночку. (G) Шумность повторного посева у мышей в одиночном размещении была очевидна из более низкого гамма-разнообразия (уникальные ASV) мышей в совместном содержании по сравнению с мета-гамма-разнообразием мышей в одиночном размещении, которых лечили, как если бы они были группой, несмотря на низкое альфа-разнообразие. каждой отдельно взятой мыши.
Все фигурки (7)
Похожие статьи
- Исходный состав микробиоты модулирует опосредованное антибиотиками воздействие на микробиоту кишечника и хозяина.

Лавель А., Хоффманн Т.В., Фам ХП, Лангелла П., Гедон Э., Сокол Х.Lavelle A, et al. Микробиом. 2019 2 августа; 7 (1): 111. DOI: 10.1186 / s40168-019-0725-3. Микробиом. 2019. PMID: 31375137 Бесплатная статья PMC.
- Добавление пребиотиков ослабленным пожилым людям влияет на определенные таксоны кишечной микробиоты, но не на глобальное разнообразие.
Тран ТТТ, Кузен Ф.Дж., Линч Д.Б., Менон Р., Брюлк Дж., Браун Дж. Р., О’Херлихи Е., Батто Л.Ф., Пауэр К., Джеффри И.Б., О’Коннор Е.М., О’Тул П.В.Тран ТТТ и др. Микробиом. 2019 13 марта; 7 (1): 39. DOI: 10.1186 / s40168-019-0654-1. Микробиом. 2019. PMID: 30867067 Бесплатная статья PMC.
- Кратковременное действие антибиотиков на микробиоту кишечника человека.
Панда С.
 , Эль-хадер I, Каселлас Ф., Лопес Виванкос Дж., Гарсия Корс М., Сантьяго А., Куэнка С., Гварнер Ф., Маничан К.
Panda S и др.
PLoS One. 2014 18 апреля; 9 (4): e95476.DOI: 10.1371 / journal.pone.0095476. Электронная коллекция 2014 г.
PLoS One. 2014 г.
PMID: 24748167
Бесплатная статья PMC.
, Эль-хадер I, Каселлас Ф., Лопес Виванкос Дж., Гарсия Корс М., Сантьяго А., Куэнка С., Гварнер Ф., Маничан К.
Panda S и др.
PLoS One. 2014 18 апреля; 9 (4): e95476.DOI: 10.1371 / journal.pone.0095476. Электронная коллекция 2014 г.
PLoS One. 2014 г.
PMID: 24748167
Бесплатная статья PMC. - Динамика и функциональность кишечной микробиоты у Reticulitermes grassei после 7-дневной смены диеты и лечения ципрофлоксацином.
Берланга М., Палау М., Герреро Р. Берланга М. и др. PLoS One. 2018 27 декабря; 13 (12): e0209789. DOI: 10.1371 / journal.pone.0209789. eCollection 2018. PLoS One. 2018. PMID: 305 Бесплатная статья PMC.
- Антибиотики и микробиом кишечника: индивидуальные реакции, устойчивость экосистемы и восприимчивость к инфекциям.

Тиманн С., Смит Н., Строиг Т. Thiemann S, et al. Curr Top Microbiol Immunol. 2016; 398: 123-146. DOI: 10.1007 / 82_2016_504. Curr Top Microbiol Immunol.2016 г. PMID: 27738912 Обзор.
Процитировано
37 статьи- Вызванная стрептозотоцином гипергликемия изменяет метаболом слепой кишки и усугубляет вызванный антибиотиками дисбактериоз.
Wurster JI, Peterson RL, Brown CE, Penumutchu S, Guzior DV, Neugebauer K, Sano WH, Sebastian MM, Quinn RA, Belenky P.Wurster JI, et al. Cell Rep.2021, 14 декабря; 37 (11): 110113. DOI: 10.1016 / j.celrep.2021.110113. Cell Rep.2021. PMID: 347 Бесплатная статья PMC.
- Поперечный анализ микробиоты кишечника человека и его непосредственной среды в когорте домохозяйств с высоким уровнем использования антибиотиков.

Ву Тхи Нгок Б., Хо Бич Х., Галаццо Дж., Ву Тьен Вьет Д., Оомен М., Нгием Нгуен Минь Т., Тран Хай Х., ван Доорн Х. Р., Вертхайм ХФЛ, Пендерс Дж.Ву Тхи Нгок Б. и др. Микроорганизмы. 2021 8 октября; 9 (10): 2115. DOI: 10.3390 / microorganisms
15. Микроорганизмы. 2021 г. PMID: 34683436 Бесплатная статья PMC. - Изменение разнообразия кишечной микробиоты бурых лягушек (Rana dybowskii) после ванны с антибиотиками.
Тонг Q, Цуй LY, Би Дж, Хан XY, Ху ZF, Ван HB, Zhang JT. Тонг Кью и др. BMC Vet Res.2021, 21 октября; 17 (1): 333. DOI: 10.1186 / s12917-021-03044-z. BMC Vet Res. 2021 г. PMID: 34674716 Бесплатная статья PMC.
- Пересмотр жидких диет с определенным химическим составом через призму микробиома.
Тони Т.
 , Алверди Дж., Гершуни В.
Тони Т. и др.
Нат Рев Гастроэнтерол Гепатол. 2021 декабрь; 18 (12): 903-911. DOI: 10.1038 / s41575-021-00519-0. Epub 2021 30 сентября.Нат Рев Гастроэнтерол Гепатол. 2021 г.
PMID: 34594028
Обзор.
, Алверди Дж., Гершуни В.
Тони Т. и др.
Нат Рев Гастроэнтерол Гепатол. 2021 декабрь; 18 (12): 903-911. DOI: 10.1038 / s41575-021-00519-0. Epub 2021 30 сентября.Нат Рев Гастроэнтерол Гепатол. 2021 г.
PMID: 34594028
Обзор. - Терапевтическая эффективность пробиотика Alkalihalobacillus clausii 088AE при диарее, связанной с антибиотиками: рандомизированное контролируемое исследование.
Мэйти С., Гупта А.К. Maity C и др. Гелион. 2021 15 сентября; 7 (9): e07993. DOI: 10.1016 / j.heliyon.2021.e07993. eCollection 2021 сен. Гелион.2021 г. PMID: 34585011 Бесплатная статья PMC.
Типы публикаций
- Поддержка исследований, за пределами США. Правительство
Условия MeSH
- Антибактериальные агенты / фармакология *
- Бактериальная нагрузка / эффекты лекарств *
- Bacteroides / классификация
- Bacteroides / рост и развитие *
- Бактероиды / выделение и очистка
- Ципрофлоксацин / фармакология
- Желудочно-кишечный микробиом / эффекты лекарств *
- Желудочно-кишечный тракт / эффекты лекарств
- Желудочно-кишечный тракт / микробиология *
- Стрептомицин / фармакология
цитировать
КопироватьФормат: AMA APA ГНД NLM
4 способа восстановить кишечник после приема антибиотиков
Автор: Dr. Криста Брайко, натуропат
11 августа 2017 г.
Криста Брайко, натуропат
11 августа 2017 г.
6 минут чтения.
Поддержание надлежащего баланса здоровой флоры кишечника — сложного сообщества микроорганизмов, обитающих в пищеварительном тракте, — является важным, но широко игнорируемым компонентом здоровья человека. Хотя появление антибиотиков увеличило продолжительность жизни, чрезмерное и часто ненужное использование этих лекарств приводит к неблагоприятным долгосрочным последствиям для здоровья.«Антибиотик» буквально переводится как «против жизни», и их цель — уничтожить «плохие» бактерии, ответственные за вашу болезнь. Однако антибиотики не избирательны в отношении того, какие бактерии они уничтожают, и в результате они также убивают «хорошие» бактерии. Это важно, потому что эти полезные бактерии поддерживают вашу иммунную систему, защищают вас от болезней и инфекций, помогают переваривать и обрабатывать пищу, способствуют усвоению питательных веществ и устраняют отходы. Теперь мы знаем, что по крайней мере 70% нашей иммунной системы находится в кишечнике. К сожалению, после курса антибиотиков нарушается естественный баланс между полезными и патогенными (болезнетворными) бактериями. Итак, что вы можете сделать, чтобы исправить и восстановить этот дисбаланс после курса антибиотиков? Примите во внимание следующие рекомендации:
К сожалению, после курса антибиотиков нарушается естественный баланс между полезными и патогенными (болезнетворными) бактериями. Итак, что вы можете сделать, чтобы исправить и восстановить этот дисбаланс после курса антибиотиков? Примите во внимание следующие рекомендации:
1) Особенности диеты:
Избегайте сахара и других простых углеводов . Это хорошее общее правило, но оно особенно важно при выздоровлении после инфекции и после курса антибиотиков.Патогенные или «плохие» бактерии любят сахар. Избегая диетического сахара и простых углеводов (которые легко превращаются в сахар), вы, по сути, лишаете вредных бактерий голодом.
Включите ферментированные продукты . Употребляя ферментированные продукты, вы подвергаетесь большему количеству полезных бактерий. Это разнообразие является ключом к поддержанию здоровой иммунной системы. Исторически до охлаждения люди потребляли большое количество бактерий в виде ферментированных и культивированных продуктов. Попробуйте поэкспериментировать с различными ферментами, такими как кефир, квашеная капуста, чайный гриб, кимчи, свекольный квас и другие ферментированные овощи или фрукты. Если вы новичок в употреблении ферментов, начните с меньшего количества. Достаточно двух разливок вилки в день.
Попробуйте поэкспериментировать с различными ферментами, такими как кефир, квашеная капуста, чайный гриб, кимчи, свекольный квас и другие ферментированные овощи или фрукты. Если вы новичок в употреблении ферментов, начните с меньшего количества. Достаточно двух разливок вилки в день.
Обратите внимание, что пиво, хотя и подверглось брожению, не попало в список. Пиво не только полно углеводов, оно также снижает моторику кишечника — сокращение этой смеси и продвижение содержимого в желудочно-кишечный тракт.Снижение перистальтики кишечника в сочетании с обилием углеводов может привести к перенаселенности и дисбалансу кишечных бактерий.
Употребляйте костные бульоны. Костные бульоны и другие источники глицина, такие как желатин и сок алоэ вера, способствуют восстановлению и поддержанию целостности слизистой оболочки кишечника.
2) Пробиотики:
Дружественные микробы в нашем кишечнике были названы «пробиотиками», и они включают полезные типы бактерий и дрожжей, обнаруженные в нормальной микрофлоре нашего кишечника. Пробиотики также содержатся в определенных продуктах питания и в виде пищевых добавок. Существуют сотни различных типов пробиотиков, из лактобацилл, (например, Lactobacillus acidophilus и Lactobacillus GG ), бифидобактерий (например, Bifidobacterium bifidus 902chaardy 8) и некоторых bifidobacterium bifidus 902chaardii98) и некоторых . Во время и после курса антибиотиков необходимо обязательно принимать сильнодействующие пробиотики. Учитывая, что антибиотики неизбирательны по отношению к бактериальным микробам, с которыми они борются, может показаться нелогичным принимать пробиотики во время курса антибиотиков.Однако существует множество рандомизированных плацебо-контролируемых исследований, которые продемонстрировали эффективность приема высокоактивных пробиотиков профессионального уровня во время курса антибиотиков. Причина в том, что он помогает поддерживать баланс кишечной флоры, уменьшать побочные эффекты и предотвращать рост «плохих» бактерий во время и после терапии.
Пробиотики также содержатся в определенных продуктах питания и в виде пищевых добавок. Существуют сотни различных типов пробиотиков, из лактобацилл, (например, Lactobacillus acidophilus и Lactobacillus GG ), бифидобактерий (например, Bifidobacterium bifidus 902chaardy 8) и некоторых bifidobacterium bifidus 902chaardii98) и некоторых . Во время и после курса антибиотиков необходимо обязательно принимать сильнодействующие пробиотики. Учитывая, что антибиотики неизбирательны по отношению к бактериальным микробам, с которыми они борются, может показаться нелогичным принимать пробиотики во время курса антибиотиков.Однако существует множество рандомизированных плацебо-контролируемых исследований, которые продемонстрировали эффективность приема высокоактивных пробиотиков профессионального уровня во время курса антибиотиков. Причина в том, что он помогает поддерживать баланс кишечной флоры, уменьшать побочные эффекты и предотвращать рост «плохих» бактерий во время и после терапии. Более того, доктор Найджел Пламмер, врач микробной физиологии и ведущий специалист в области пробиотиков, обнаружил, что есть четкие доказательства того, что использование пробиотиков вместе с антибиотиком снижает уровень устойчивости к антибиотикам ! Устойчивость к антибиотикам — это способность бактерий развиваться до такой степени, что они сопротивляются эффектам лекарств, ранее использовавшихся для их лечения, и, таким образом, снижает или устраняет эффективность антибиотиков.Устойчивость к антибиотикам усиливается из-за неправильного и чрезмерного использования антибиотиков.
Более того, доктор Найджел Пламмер, врач микробной физиологии и ведущий специалист в области пробиотиков, обнаружил, что есть четкие доказательства того, что использование пробиотиков вместе с антибиотиком снижает уровень устойчивости к антибиотикам ! Устойчивость к антибиотикам — это способность бактерий развиваться до такой степени, что они сопротивляются эффектам лекарств, ранее использовавшихся для их лечения, и, таким образом, снижает или устраняет эффективность антибиотиков.Устойчивость к антибиотикам усиливается из-за неправильного и чрезмерного использования антибиотиков.
При краткосрочном применении антибиотиков начните принимать пробиотики (во время еды), когда вы впервые начинаете курс антибиотиков (в разное время дня). Рекомендуемая дозировка составляет 25 миллиардов бактерий в день в течение 30 дней. Ищите пробиотические продукты, эффективность которых у людей подтверждена клиническими данными и которые можно найти в опубликованных исследованиях. Имейте в виду, что литература, опубликованная производителем, может вызывать подозрения в рекламе их продукции. См. Ниже наш рекомендуемый протокол и предлагаемые пробиотические продукты.
См. Ниже наш рекомендуемый протокол и предлагаемые пробиотические продукты.
3) Пребиотики:
Проще говоря, пребиотики являются источником пищи для пробиотиков и, таким образом, являются важной частью любого режима для защиты или восстановления здорового микробиома. Пребиотики обычно представляют собой растворимые волокна. Пищевые волокна можно разделить на две категории — растворимые волокна, которые ферментируются кишечными бактериями, и нерастворимые волокна, которые не ферментируются и действуют как грубые корма. Во время и после использования антибиотиков сосредоточьтесь на получении большого количества растворимой клетчатки, содержащейся в крахмалистых клубнях, кабачках, хикаме, топинамбурах и очищенных фруктах.Овощи лука, такие как чеснок, лук, лук-порей, чеснок и зеленый лук, являются отличным выбором. Добавляйте их в пищу в сыром виде — это лучший источник пребиотиков. Предоставляя нашему микробиому источник пищи, мы можем стимулировать рост более здоровых членов микробиоты и тем самым сделать нас более здоровыми.
4) Поддержите свою печень:
Антибиотики также могут повлиять на вашу печень, особенно если вы принимаете их в течение длительного периода времени. Наша печень выполняет более 500 различных функций.Мало того, что печень отвечает за метаболизм и детоксикацию лекарств, она также действует как бригада по очистке от тысяч микробов, срок годности которых истек в результате действия антибиотиков. Расторопша является отличной добавкой для поддержания здоровья печени, и ее можно принимать в виде таблеток или чая (420 мг / день в несколько приемов). Употребление свеклы и моркови может стимулировать и поддерживать общую функцию печени. Глутатион, соединение, которое способствует детоксикации печени, содержится в авокадо и листовой зелени.Рассмотрите возможность употребления этих продуктов, поскольку они также являются полезными пребиотиками. Кроме того, не забывайте пить много воды, так как это поможет вывести нежелательные токсины.
Подумайте вот о чем: бактерии поселяются в наших телах со дня нашего рождения и остаются с нами на протяжении всей нашей жизни. Бактерии кишечника устанавливаются в первые 2-3 года жизни и играют важную роль в питании, пищеварении, обмене веществ, иммунной функции и защите. Наш кишечник защищает нас, так что давайте защитим его! Если вы оказались в ситуации, когда показаны антибиотики, рассмотрите следующий протокол, чтобы поддержать ваше общее состояние здоровья.
Бактерии кишечника устанавливаются в первые 2-3 года жизни и играют важную роль в питании, пищеварении, обмене веществ, иммунной функции и защите. Наш кишечник защищает нас, так что давайте защитим его! Если вы оказались в ситуации, когда показаны антибиотики, рассмотрите следующий протокол, чтобы поддержать ваше общее состояние здоровья.
Этот протокол предполагает, что вы отдыхаете, избегаете алкоголя, пьете много прозрачных жидкостей и придерживаетесь чистой диеты в соответствии с приведенными выше рекомендациями.
Во время курса антибиотиков:
- Принимайте HMF Forte (Syerol) или HLC Intensive (Pharmax) по 1 капсуле 2 раза в день в течение курса антибиотиков. Принимайте этот пробиотик в другое время дня, чем ваш антибиотик.
- Включите 2 порции пребиотических продуктов в день. По возможности ешьте органические продукты.
- Ешьте сырой непастеризованный краут или овощные закваски хорошего качества — 2 полных вилки в день.

После курса антибиотиков:
- Примите 1 пополнение HMF или колпачок высокой эффективности HLC в течение как минимум 30 дней.
- Продолжайте принимать 2 порции пребиотических продуктов в день. По возможности ешьте органические продукты.
- Принимайте 420 мг расторопши в день в несколько приемов за 20 минут до еды, чтобы помочь детоксикации и поддержать вашу печень.
Восстановление микробиоты кишечника после приема антибиотиков зависит от диеты хозяина, условий сообщества и условий окружающей среды
https://doi.org/10.1016/j.chom.2019.10.011Получить права и контентОсновные моменты
- •
Человеческие микробиоты были устойчивыми и быстро восстанавливались во время приема антибиотиков
- •
Диета с низким содержанием клетчатки усугубляла коллапс микробиоты и замедляла выздоровление от ципрофлоксацина
- •
Перепрограммирование микробиоты и повторная передача
придали устойчивости к лечению.Одно жилье нарушило восстановление, подчеркивая роль водохранилищ и канализации

Резюме
Антибиотики изменяют состав микробиоты и повышают восприимчивость к инфекциям.Однако общие эффекты антибиотиков и влияние факторов окружающей среды на кишечные комменсалы остаются неясными. Чтобы решить эту проблему, мы отслеживали динамику микробиоты с высоким временным и таксономическим разрешением во время лечения антибиотиками в контролируемой мышиной системе, выделяя такие переменные, как диета, история лечения и проживание сожителей. Человеческие микробиоты были в высшей степени устойчивыми и восстанавливались во время лечения антибиотиками с временным преобладанием резистентных бактерий Bacteroides и сокращением асимметричного разнообразия таксонов.В некоторых случаях in vitro чувствительности не позволяли предсказать ответов in vivo, что подчеркивает важность контекста хозяина и сообщества. Диета с дефицитом клетчатки усугубляет коллапс микробиоты и замедляет выздоровление. Замещение видов посредством перекрестного содержания после лечения ципрофлоксацином показало устойчивость ко второму лечению. Отдельные дома резко подорвали восстановление, подчеркнув важность экологических резервуаров. Наши результаты подчеркивают детерминированную адаптацию микробиоты к возмущениям и трансляционный потенциал для изменения диеты, санитарии и состава микробиоты во время приема антибиотиков.
Замещение видов посредством перекрестного содержания после лечения ципрофлоксацином показало устойчивость ко второму лечению. Отдельные дома резко подорвали восстановление, подчеркнув важность экологических резервуаров. Наши результаты подчеркивают детерминированную адаптацию микробиоты к возмущениям и трансляционный потенциал для изменения диеты, санитарии и состава микробиоты во время приема антибиотиков.
Ключевые слова
микробиота кишечника
антибиотики
устойчивость
повторный посев
совместное размещение
копрофагия
нарушения микробиоты
Bacteroides 000 статей с 0002 ) © 2019 Elsevier Inc. Антибиотики искореняют патогенные инфекции и спасают жизни — но при этом они также нарушают целостность кишечного микробиома.В то время как многие врачи признают необходимость восстановления микробного баланса пациента после курса антибиотикотерапии, гораздо меньше понимает, как это сделать эффективно. По словам Эми Скилтон, штат Северная Дакота, восстановление кишечной флоры — это одновременно искусство и наука. Если все сделано правильно, это может иметь большое значение для пациентов. В некоторых случаях это может даже помочь пациентам преодолеть болезни, от которых изначально были прописаны антибиотики. Но для этого нужно больше, чем просто рекомендовать готовый пробиотик и надеяться на лучшее. Центры по контролю за заболеваниями сообщили прошлой весной, что из 154 миллионов рецептов на антибиотики, выписываемых ежегодно в кабинетах врачей и отделениях неотложной помощи, 30 процентов не нужны. CDC обнаружил, что большинство посторонних рецептов выписывались при респираторных заболеваниях, вызванных вирусами, такими как простуда, вирусная ангина, бронхит, инфекции носовых пазух и уха, которые не поддаются лечению антибиотиками. Использование этих препаратов «подвергает пациентов ненужному риску аллергических реакций или иногда смертельной диареи, Clostridium difficile . Еще больше усложняет картину тот факт, что антибиотики распределяются не только из кабинетов врачей; их также обильно кормят скотом и обильно опрыскивают продукты, оставляя мельчайшие, но биологически активные следы в пище, которую затем потребляют люди. Поскольку антибиотики убивают вызывающие инфекцию микроорганизмы, они также неизбирательно уничтожают сообщества полезных кишечных бактерий, ослабляя стабильность кишечного микробиома.Это массовое разрушение может быть массовым; экспериментальные данные, собранные в ходе исследования с использованием кПЦР, указывают на 10-кратное снижение бактериальных изолятов сразу после лечения антибиотиками (Panda, S. et al. PLoS One .2014; 9 (4): e95476). «Это действительно разрушительный эффект», — говорит доктор Скилтон, врач-натуропат и травник из клиники естественной медицины Elysium, Сидней, Новый Южный Уэльс, Австралия. В вебинаре, спонсируемом Holistic Primary Care и Bioceuticals, она рассказала о бесчисленных воздействиях антибиотиков на микробиом человека, отметив, что не все антибиотики одинаково разрушительны для кишечных бактерий. Степень, в которой эти препараты повреждают микробиоту кишечника, зависит от типа препарата, продолжительности лечения и частоты использования, сказал Скилтон. Например, некоторые антибиотики вызывают большее высвобождение эндотоксинов и цитокинов, чем другие. Более высокие дневные дозы более эффективны. Продолжительное использование высоких доз антибиотиков может нанести серьезный ущерб микробиому, на восстановление которого могут потребоваться годы восстановительной терапии, если ее вообще можно вылечить. И вопреки распространенному мнению, внутривенные антибиотики могут иметь такое же негативное влияние на флору кишечника, как и пероральные препараты.«Долгое время считалось, что препараты, вводимые внутривенно, проходят через кишечник и не имеют такого же воздействия. Теперь мы знаем, что это неправда ». Время доставки антибиотика также имеет значение. Люди, которые часто принимают антибиотики в раннем возрасте, с возрастом становятся более уязвимыми ко многим заболеваниям. Другие связывают воздействие антибиотиков на плод и в раннем детстве с последующим развитием астмы в более позднем возрасте (Örtqvist, A. et al. Brit Med J .2014; 349. doi: https://doi.org/10.1136/bmj .g6979). Антибиотики также связаны с ожирением и увеличением веса у детей и взрослых (Million, M. et al. Clin Microbiol & Infec .2013; 19 (4): 305–313). Исследователи связывают эти изменения с измененным микробным составом кишечника. Антибиотики могут вызывать высвобождение токсичных липополисахаридов (ЛПС), больших молекул, обнаруженных на внешних мембранах патогенных грамотрицательных бактерий. С точки зрения патогена, производство ЛПС — это стратегия выживания. Эти молекулы взаимодействуют на поверхности клеток, образуя барьер, предотвращающий проникновение антибиотиков и других гидрофобных соединений и позволяющий грамотрицательным бактериям жить даже в суровых условиях (Zhang, G. et al. Curr Opin Microbiol .2013; 16 ( 6): 779–785). Пробиотики — один из аспектов комплексной стратегии восстановления кишечной флоры после приема антибиотиков. Как правило, она советует один месяц лечения пробиотиками на каждую неделю, в течение которой пациент принимал антибиотики. Тем, кто находился на длительных непрерывных схемах приема антибиотиков, также потребуется долгосрочное восстановление. Она подчеркнула, что для большинства людей длительное употребление пробиотиков не связано с риском для здоровья. Пациентам, получающим антибиотики внутривенно, также следует принимать комменсальные пробиотики. Некоторые врачи, осведомленные об этой проблеме, начинают прием пробиотиков уже через четыре часа после внутривенного введения антибиотиков. У людей, прошедших длительный или многократный курс лечения антибиотиками, обычно наблюдается сильная эрозия гликокаликса, который обычно покрывает микроворсинки кишечника. В некоторых случаях эти изменения вызваны действием самих антибиотиков. В других случаях они отражают влияние инфекции, от которой были прописаны антибиотики. В любом случае эффект один и тот же: создание микросреды, благоприятной для условно-патогенных микроорганизмов, таких как Candida, но все более сложной для нормальных комменсальных бактерий. Грибковые инфекции почти всегда сопровождаются недостаточным продуцированием IgA, поскольку Candida потребляет как гликокаликс, так и sIgA в качестве топлива.Это становится порочным кругом: низкий уровень IgA порождает Candida, который еще больше истощает IgA. Скилтон отметил, что хронические инфекции мочевыводящих путей и инфекции слизистых оболочек, такие как молочница, являются красными флажками для низкого уровня продукции sIgA. Без здорового гликокаликса такие организмы, как Lactobacilli и Bifidobacilli, с большим трудом приживаются. «Даже если вы порекомендуете лучшие в мире пробиотики, они не смогут прилипнуть и колонизировать, если гликокаликс разрушен», — сказал доктор.Скилтон объяснил. «Вы можете на самом деле преувеличить симптомы желудочно-кишечного тракта, давая пробиотики, если есть потеря способности производить гликокаликс». Чтобы восстановить более здоровую микросреду в этих случаях, вам необходимо использовать уникальные характеристики Saccharomyces boulardii, — устойчивых к антибиотикам пробиотических дрожжей , первоначально выделенных из плодов личи в Индокитае. Хотя это не настоящий комменсальный организм, S. boulardii является мощным индуктором продукции гликокаликса и секреции IgA.Он также стимулирует ферменты щеточной каймы и способствует выработке полиамина, который питает микроворсинки кишечника и может быть полезным для лечения язвенного колита, болезни Крона и синдрома раздраженного кишечника. S. boulardii может работать в контексте высокопатогенных устойчивых к антибиотикам бактерий, таких как Clostridium difficile , и фактически использовался в качестве профилактической терапии против диареи, связанной с C. difficile (Goldstein, E. et al. . Клиническая инфекция . 2015; 60 (Suppl_2): S148-S158). S. boulardii может снизить некоторые токсические эффекты энтеротоксина A, ингибируя связывание токсина A-рецептора и предотвращая образование энтеротоксина B. Но самое замечательное — это способность быстро колонизировать поврежденный эндотелий и вытеснять патогенные дрожжи, одновременно создавая более здоровую микросреду для комменсальных бактерий. « S. boulardii фактически вызывает физическую эвакуацию Candida», — сказал д-р.Скилтон отмечает, что он особенно активен против 7 из 8 наиболее распространенных патогенных видов Candida. Единственное исключение — C. tropicalis . «Думайте о ситуации как о последствиях урагана, обрушившегося на деревню. BioCeuticals, австралийская нутрицевтическая компания только для практикующих врачей, недавно представила продукт под названием SB Floractiv , содержащий 250 мг S.boulardii (также называемый S. cereviciae ) на капсулу. Для пациентов, которые длительное время принимали антибиотики, начните медленно с одной капсулы (250 мг) в день в течение 3-4 дней, затем увеличивайте количество до двух в день в течение еще 3-4 дней, а затем увеличивайте на аналогичной ступени. по схеме до четырех в день (1000 мг), которые следует продолжать в течение оставшейся части 4-недельного периода. S. boulardii очень безопасен, и единственное истинное противопоказание — у пациентов с истинными IgE-опосредованными реакциями на дрожжи, проявляющимися в виде анафилаксии или крапивницы. По словам доктора Скелтона, у 9 из 10 пациентов четыре недели интенсивного приема S. boulardii недостаточно для восстановления здорового слоя гликокаликса и индукции адекватной секреции IgA.Затем это создает основу для гораздо более эффективного раунда восстановления с помощью мультиштаммового пробиотика. Bioceuticals разработала продукт специально для использования после антибиотиков. Названный BioFloractiv 500, он содержит 500 миллиардов КОЕ, 12 видов и 14 штаммов полезных бактерий. Доктор Скилтон рекомендует максимум 14 дней, хотя, по словам Скилтона, для большинства достаточно одной недели ежедневной терапии. Однако пациентам с синдромом раздраженного кишечника или болезнью Крона может потребоваться более длительная поддержка для восстановления здорового микробиома после приема антибиотиков. Пробиотики — это лишь часть общей картины. И если пациент не может переносить какой-либо тип пробиотиков, это красный флаг, что иммунная система пациента не функционирует должным образом. «В первую очередь вам нужно обратиться к любым аспектам нервной системы, особенно к преобладанию симпатической нервной системы, которые могут влиять на пищеварительный тракт», — сказал д-р Скилтон. Она обнаружила, что во многих случаях ценны рыбий жир, цинк, витамин А и молозиво. Последний «действительно хорош для восстановления sIgA.Делайте это в течение недели или около того, прежде чем даже пробовать пробиотики ». В некоторых случаях также могут быть полезны добавки скользкого вяза и глютамина. Лекарства на растительной основе, такие как масло орегано, масло чайного дерева или экстракт пау-д’арко, могут помочь избавить желудочно-кишечный тракт от патогенных дрожжей. Ряд продуктов с пробиотиками и пребиотиками может помочь процессу восстановления кишечника. Том О’Брайан, округ Колумбия, основатель программы Gluten Summit и сертифицированный специалист по глютену, рекомендует несколько продуктов, которые нужно есть — и несколько продуктов, которых следует избегать — при восстановлении кишечника после лечения антибиотиками. «Когда ваш кишечник находится под угрозой, вы не хотите обременять свой кишечник», — говорит О’Брайан.К «облагаемым налогом» продуктам относятся пшеница, молочные продукты, сахар, нездоровые жиры и жареные продукты. Эти продукты, отмечает он, «подливают бензин в огонь» восстанавливающейся кишечной системы. С другой стороны, нужно есть много продуктов, способствующих росту здоровых комменсальных организмов. О’Брайан рекомендует в качестве хорошего варианта тушеные яблоки, приготовленные из органических продуктов, до состояния мягкости и сияния. Он объясняет, что при приготовлении яблок выделяется пектин — растворимая клетчатка, которая обеспечивает питательными веществами полезные бактерии. Пектин, содержащийся в тушеных яблоках, также может помочь излечить поврежденную слизистую оболочку кишечника и закрыть слезы в дырявом кишечнике, предотвращая проскальзывание крупных молекул пищи. Точно так же коллаген помогает закрыть дырявый кишечник. О’Брайан также рекомендует пациентам, выздоравливающим после лечения антибиотиками, есть бульон из куриных костей, хороший источник коллагена, который также действует как естественный пребиотик, питающий здоровые бактерии в кишечнике. Бутират — натуральное вещество, вырабатываемое в кишечнике, — еще один важный фактор в восстановлении кишечных бактерий. Множество фруктов и овощей, содержащих пребиотики, включая пищевые бананы, сладкий картофель и другие клубни, помогают восстановить микробиом кишечника, обеспечивая нерастворимую клетчатку, которая питает полезные, но не вредные бактерии. Ферментированные непастеризованные овощи, такие как квашеная капуста, кимчи и ферментированная свекла, являются еще одним отличным источником натуральных пробиотиков.О’Брайан отмечает, что каждый овощ производит разные семейства полезных бактерий во время ферментации, призывая пациентов съедать одну вилку ферментированных овощей два раза в день. «Ключом к здоровью вашего кишечника является разнообразие вашего микробиома», — утверждает он, указывая на то, что тысячи различных семейств бактерий живут и взаимодействуют в кишечнике, оказывая всестороннее воздействие на наше здоровье. КОНЕЦ Научные достижения последних десятилетий привели к растущему признанию роли кишечной микробиоты человека в здоровье и болезнях (Ananthakrishnan et al., 2019). До этого было проведено мало исследований непатогенных микроорганизмов, населяющих желудочно-кишечный тракт (Guarner, 2012). Поскольку большинство этих микроорганизмов невозможно культивировать, они оставались в значительной степени неисследованными до появления молекулярных методов. Обширные экспериментальные и клинические данные показывают, что кишечные микроорганизмы необходимы для оптимального функционирования человеческого организма (Guarner, 2015). В 1885 году Луи Пастер предположил, что животные, выращенные в стерильных условиях, не смогут выжить (Pasteur, 1885).Бернард С. Востманн и его команда доказали неверность гипотезы Пастера, когда они разработали методы разведения животных в стерильных условиях (Wostmann, 1981). Знания, полученные на беспроблемных животных моделях, в настоящее время используются в физиологии и медицине человека посредством исследований комменсальных микроорганизмов (Gilbert et al. Разработка антибиотиков широко считается одним из величайших достижений медицины 20 годов века (Bud, 2007; Королевский колледж врачей Эдинбурга, 2010).В период с 2000 по 2015 год использование антибиотиков во всем мире увеличилось на 65% (Klein et al., 2018). Хотя большинство курсов лечения антибиотиками не имеют явных побочных эффектов, антибиотики могут вызывать значительные изменения в микробиоте кишечника, которые имеют как краткосрочные, так и долгосрочные последствия для здоровья (Dethlefsen and Relman, 2011). Долгое время подозревалась связь между ранним воздействием антибиотиков и детской астмой, аллергией и заболеваниями дыхательных путей (Foliaki et al., 2009). Наблюдательные исследования также предполагают участие антибиотиков в патогенезе других все более распространенных состояний, включая желудочно-кишечные инфекции, увеличение веса и ожирение, воспалительное заболевание кишечника (ВЗК) и колоректальный рак (Lange et al., 2016). Еще одно серьезное последствие использования антибиотиков — развитие устойчивости бактерий к антибиотикам (Giedraitiene et al., 2011). Целью данной статьи является обзор литературы о кишечной микробиоте и ее значении для здоровья человека, а также описание рисков, связанных с использованием антибиотиков, и описание некоторых подходов, которые могут минимизировать эти риски. Микробиота определяется как совокупность микроорганизмов, присутствующих в конкретной среде, в то время как термин «микробиом» относится ко всей среде обитания, включая микроорганизмы (бактерии, археи, низшие и высшие эуркариоты и вирусы), их геномы и условия окружающей среды, существующие в этой среде обитания (Marchesi and Ravel, 2015).Бактерии, археи, эукариоты (грибы и протисты) и вирусы, населяющие желудочно-кишечный тракт человека, в совокупности называют микробиотой кишечника человека. Генома одного симбиотического вида микроорганизмов, вероятно, будет недостаточно для выживания (Guarner, 2015). В результате многовидовые сообщества, организованные вокруг сложной сети метаболических взаимозависимостей, например, в кишечнике человека, представляют собой естественную среду для большинства симбиотических микробов (Guarner, 2015). Развитие независимых от культуры методов исследования, сочетающих генетическое секвенирование с биоинформатикой, привело к быстрому прогрессу в изучении микробиоты кишечника человека (Guarner, 2015). Одним из наиболее распространенных методов, используемых для таксономической идентификации и оценки видового разнообразия прокариот (бактерий и архей), является секвенирование гена, кодирующего малую субъединицу рибосомной РНК (16S рРНК) (Guarner, 2015). Из 55 типов, составляющих домен Bacteria, только от семи до девяти обнаружены в кишечнике человека, при этом большинство (90%) принадлежит типам Bacteroidetes и Firmicutes (Eckburg et al., 2005). Другие типы, постоянно идентифицируемые в кишечнике человека, включают Proteobacteria , Actinobacteria , Fusobacteria и Verrucomicrobia , при этом было обнаружено очень мало видов архей (Eckburg et al., 2005). Другой метод исследования, не зависящий от культуры, — это полногеномное секвенирование, которое позволяет составить перечень всех генов, присутствующих в образце. Секвенирование всего генома также позволяет анализировать функциональные и метаболические сети, а также обнаруживать гены, принадлежащие небактериальным членам микробного сообщества, таким как вирусы, дрожжи и протисты.Всего в образцах фекалий человека было идентифицировано около 10 миллионов неизбыточных микробных генов (Li et al., 2014). В среднем в желудочно-кишечном тракте человека присутствует 600 000 неизбыточных микробных генов, из которых 300 000 генов являются общими для людей, живущих в Европе, Северной Америке и Китае (Li et al., 2014). Между микробными сообществами, населяющими просвет и слизистую оболочку одного и того же человека, существуют различия (Eckburg et al., 2005; Donaldson et al., 2016). Кроме того, виды бактерий, обнаруживаемые в просвете, варьируются от слепой кишки до прямой кишки. В слепой кишке медленное время прохождения и отсутствие простых сахаров способствуют пролиферации ферментативных разлагающих полисахариды анаэробов, в частности, Prevotella , Roseburia , Faecalibacterium , Lachnospira и Eubacterium Eubacterium. В дистальных отделах толстой кишки распространены муколитические и протеолитические виды (например, Bacteroides , Ruminococcus , Akkermansia , Bifidobacterium , Methanobrevibacter , Desulfovibrio и Desulfovibrio)Бактерии, ассоциированные со слизистой оболочкой, от терминального отдела подвздошной кишки до прямой кишки, как правило, более стабильны на уровне филума и рода, но были описаны участки неоднородности в пределах одной и той же области кишечника (Donaldson et al., 2016). Большинство штаммов, составляющих микробиоту кишечника, являются резидентами в течение десятилетий, хотя их относительная численность меняется со временем у каждого конкретного человека (Donaldson et al., 2016). Однако продольные исследования показывают, что такие факторы, как диета, прием лекарств, образ жизни (курение, путешествия, физическая активность), сопутствующие заболевания или время прохождения через толстую кишку, влияют на микробный состав образцов фекалий, полученных от уникального хозяина (Gilbert et al. al., 2018; Allaband et al., 2019; Zmora et al., 2019). Хотя внутриличностные изменения в составе микробиоты кишечника могут быть значительными, например, из-за эпизода острой инфекционной диареи или после лечения антибиотиками, со временем она имеет тенденцию возвращаться к своему состоянию, предшествующему нарушению, — качеству, известному как устойчивость (Gilbert et al. др., 2018; Allaband et al., 2019). Разнообразие кишечной микробиоты также изменяется с возрастом, увеличиваясь от младенчества к взрослой жизни и уменьшаясь у пожилых людей. Микробные изменения кишечника у пожилых людей коррелируют с показателями слабости, нутритивного статуса и маркеров воспаления, предполагая, что изменения микробиоты, обусловленные диетой, играют роль в различных темпах ухудшения здоровья, связанного с возрастом (Kuipers, 2019). Микробиота кишечника каждого отдельного человека содержит множество уникальных штаммов, не обнаруженных у других людей, и межличностные различия в составе микробиоты намного больше, чем внутрииндивидуальные вариации (Allaband et al., 2019). Пол, этническая принадлежность и географическое положение влияют на таксономический состав микробиома (Gaulke and Sharpton, 2018). Например, фекальная микробиота взрослых из мегаполисов Европы и Северной Америки менее разнообразна по сравнению со взрослыми из сельских популяций в Африке и Южной Америке (Clemente et al., 2015; Зонненбург и Зонненбург, 2019). Несмотря на внутрииндивидуальные и межиндивидуальные различия, анализ микробного состава образцов фекалий американских, европейских и японских особей показал сходство в структуре кишечной микробиоты на уровне рода (Arumugam et al., 2011 ). Многомерное масштабирование и анализ главных координат выявили существование трех кластеров, или энтеротипов, каждый из которых характеризовался преобладанием одного рода: Bacteroides (энтеротип 1), Prevotella (энтеротип 2) или Ruminococcus (энтеротип 3).Кластеризация не зависела от возраста, пола, национальности или индекса массы тела (Arumugam et al., 2011). Результаты этого исследования показывают, что существует ограниченное количество хорошо сбалансированных симбиотических состояний микробиоты и хозяина. Кроме того, дискретная природа этих состояний предполагает, что структура микробиоты кишечника человека в первую очередь определяется взаимодействиями между различными родами бактерий (Guarner, 2015). Клинические последствия энтеротипов были предметом нескольких исследований (Costea et al., 2018). Энтеротип Bacteroides был связан со снижением генетического разнообразия микробов, резистентностью к инсулину и риском ожирения и неалкогольного стеатогепатита (Le Chatelier et al., 2013; Costea et al., 2018). Возможно, неудивительно, что длительный режим питания может быть одним из факторов, определяющих энтеротип (Wu et al., 2011). Рационы, богатые животным белком и жирами, связаны с энтеротипом Bacteroides , тогда как диеты, характеризующиеся преобладанием растительных углеводов, связаны с энтеротипом Prevotella (Wu et al., 2011). Функции микробиоты кишечника человека делятся на три категории, а именно метаболические, защитные и трофические функции (Guarner and Malagelada, 2003) (рис. 1). Рис. 1 Функции микробиоты кишечника человека. Метаболическая функция включает ферментацию неперевариваемых пищевых субстратов и восстановление энергии и питательных веществ. У людей переваривание овощей, фруктов, орехов и цельнозерновых злаков в основном осуществляется кишечными микробами, поскольку наши ферментативные ресурсы для переваривания углеводов ограничены амилазами и дисахаридазами.Кроме того, ферментация сложных углеводов в толстой кишке производит короткоцепочечные жирные кислоты, которые абсорбируются хозяином (Litvak et al., 2018). Бутират, продуцируемый Faecalibacterium prausnitzii и другими, ингибирует интерлейкин-17, генерирует регуляторные Т-клетки и оказывает противовоспалительное действие в экспериментальных моделях (Litvak et al., 2018). Микроорганизмы толстой кишки также расщепляют ксенобиотики и другие чужеродные соединения, способствуют синтезу аминокислот и витаминов и обеспечивают различными питательными веществами людей, соблюдающих монотонную диету (Zmora et al., 2019). Микробиота кишечника выполняет защитную функцию, конкурируя за места прикрепления и питательные вещества с местными грибами или бактериями с патогенным потенциалом, такими как Candida и Clostridioides difficile , тем самым предотвращая вторжение или чрезмерный рост этих организмов (McFarland, 2008). Резидентные микроорганизмы также подавляют рост своих конкурентов, производя бактериоцины (McFarland, 2008). Трофическая функция кишечной микробиоты включает стимулирование пролиферации и дифференцировки эпителиальных клеток, стимуляцию двигательной активности кишечника и нейроэндокринных путей кишечного происхождения, а также регуляцию иммунной системы и центральной нервной системы (Mayer et al., 2015). Индукция и регуляция адаптивной иммунной системы — один из основных аспектов трофической функции кишечной микробиоты. Большая площадь поверхности желудочно-кишечного тракта постоянно подвергается воздействию различных антигенов. В результате кишечный иммунитет является самой большой и сложной частью общей иммунной системы, поскольку не менее 80% всех антител, вырабатываемых у взрослых, происходят из слизистой оболочки кишечника (Brandtzaeg, 2010). Кишечная иммунная система должна иметь возможность различать патогены и антигены, полученные из пищи или от комменсальных непатогенных микробов, поскольку воспалительная реакция на чужеродный антиген также может нанести вред хозяину (Tanoue et al., 2016). Микробиота кишечника влияет на развитие адаптивной иммунной системы, стимулируя рост лимфоидных структур, дифференцировку Т- и В-клеток и формирование иммунной толерантности (Zhao and Elson, 2018). Термин дисбиоз относится к стойкому нарушению микробиоты кишечника и был определен как изменение как в составе, так и в функции микробиоты, вызванное факторами, связанными с хозяином и окружающей средой, которые подавляют сопротивление. и возможности устойчивости микробной экосистемы (Levy et al., 2017). Изменения микробиоты кишечника могут быть вовлечены в патогенез нескольких неинфекционных заболеваний и в переход этих состояний в хроническую форму. Многочисленные исследования показали связь между изменениями в составе микробиоты кишечника и заболеваниями, включая рецидивирующую диарею, связанную с C. difficile , некоторыми расстройствами кишечника (включая ВЗК), колоректальным раком, неалкогольным стеатогепатитом, диабетом 2 типа, ожирением и т. Д. и запущенное хроническое заболевание печени (Duvallet et al., 2017; Wirbel et al., 2019). Однако для некоторых из этих примеров исследования противоречивы, возможно, из-за того, что методология не была стандартизирована. Более того, эти связанные изменения микробиоты не обязательно указывают на причинную роль в патогенезе заболевания, они могут быть следствием самого заболевания. Таким образом, необходимы последующие когортные исследования, особенно исследования вмешательств, которые могут восстановить состав кишечной микробиоты. Тем не менее, исследования на грызунах показали, что можно использовать фекальные трансплантаты для передачи определенных фенотипов болезней, включая инсулинорезистентность, ожирение, беспокойство и воспаление кишечника.Это говорит о том, что некоторые изменения микробиоты кишечника могут иметь причинную роль в этих заболеваниях. У людей трансплантация фекальной микробиоты хорошо зарекомендовала себя в лечении рецидивирующей диареи, вызванной инфекцией C. difficile (CDI) (Cammarota et al., 2017). Пересадка кала стала стандартной терапией при этом заболевании в соответствии с национальными рекомендациями (Mullish et al., 2018). Менее успешные результаты наблюдались при попытках лечения ВЗК. Существует четыре рандомизированных испытания, в которых трансплантат фекалий оценивался как индукционная терапия для достижения ремиссии при активном язвенном колите, и в совокупности они показали статистическое улучшение по сравнению с контролем.Через 8 недель у 37% участников в группе трансплантации стула была ремиссия по сравнению с 18% участников в контрольной группе (Imdad et al., 2018). Необходимы дополнительные исследования для дальнейшего определения материала трансплантата, богатого микробными популяциями, которые определены как отсутствующие у пациента, и избежания трансплантатов, богатых агрессивными, избыточно представленными микробами. Утрата видового разнообразия, по-видимому, является общей чертой нарушенной микробиоты кишечника. Низкое микробное богатство связано с избытком противовоспалительных видов микробов, что может привести к воспалению кишечника и нарушению функции слизистого барьера.В исследовании, в котором в качестве показателя разнообразия использовалось количество микробных генов в образцах фекалий, люди с низким количеством генов с большей вероятностью имели резистентность к инсулину или лептину, ожирение или дислипидемию и более выраженный воспалительный фенотип по сравнению с людьми с большое количество генов (Le Chatelier et al., 2013). Эта связь может указывать на то, что низкое микробное богатство увеличивает риск развития метаболического синдрома (т. Е. Ожирения, артериальной гипертензии, диабета 2 типа, дислипидемии и неалкогольного стеатогепатита). С точки зрения функциональной способности микробиоты кишечника, низкое количество микробных генов, по-видимому, связано со сниженным образованием короткоцепочечных жирных кислот (особенно бутирата) для хозяина (Le Chatelier et al., 2013). Неспособность производить бутират увеличивает поток кислорода к слизистой оболочке и нарушает микроэкосистему, что способствует выживанию устойчивых к кислороду бактерий и препятствует восстановлению строгих анаэробов (Litvak et al., 2018). Таким образом, дисбактериоз описывают как нарушение симбиотического баланса между микробиотой и хозяином.Такие изменения критически влияют на способность экосистемы к сопротивлению и увеличивают вероятность того, что дисбаланс станет хроническим. Лечение антибиотиками снижает общее разнообразие видов кишечной микробиоты, включая потерю некоторых важных таксонов, что вызывает метаболические сдвиги, увеличивает восприимчивость кишечника к колонизации и стимулирует развитие бактериальной устойчивости к антибиотикам (Lange et al. др., 2016). Использование антибиотиков связано с уменьшением разнообразия микробиоты.Сообщается, что у детей восстановление микробного разнообразия после лечения антибиотиками занимает примерно 1 месяц (Yassour et al., 2016). У взрослых введение комбинации меропенема, гентамицина и ванкомицина привело к увеличению распространенности Enterobacteriaceae и других патобионтов и снижению Bifidobacterium и видов, продуцирующих бутират (Palleja et al., 2018) (Palleja et al., 2018) ( Фигура 2). В то время как исходный состав микробиоты кишечника в основном восстановился в пределах 1.Через 5 месяцев несколько обычных видов оставались необнаруженными до конца периода наблюдений (180 дней) (Palleja et al., 2018). Рис. 2 Четырехдневное лечение антибиотиками вызвало большие сдвиги в численности бактерий. Графики показывают относительную численность репрезентативных видов в соответствии с их схемой изменения после четырехдневного лечения антибиотиками в течение 180-дневного периода наблюдения. По материалам Palleja et al. (2018). Антибиотики также могут нарушить баланс, который обычно существует между различными видами кишечной микробиоты.Например, вызывая уменьшение видового разнообразия, антибиотики могут привести к чрезмерному росту патобионтов, таких как токсигенный C. difficile (Ianiro et al., 2020). Следует отметить, что уменьшение разнообразия не обязательно означает уменьшение количества бактерий в целом. По мере уничтожения чувствительных к антибиотикам бактерий, устойчивые к антибиотикам бактерии размножаются и занимают их место. Фактически, общая микробная нагрузка может увеличиваться после лечения антибиотиками, даже несмотря на сокращение видового разнообразия.В исследовании пациентов, получавших антибиотики широкого спектра действия, лечение β-лактамами в течение 7 дней увеличивало микробную нагрузку в образцах фекалий в два раза (Panda et al., 2014). В этом исследовании использование антибиотиков широкого спектра действия также увеличило соотношение Bacteroidetes к Firmicutes (Panda et al., 2014). Полный набор малых молекул (<1500 Да), обнаруженных в биологической системе, называется метаболомом этой системы (Lamichhane et al., 2018). Действие антибиотиков на метаболом кишечника изучено хуже, чем их влияние на разнообразие кишечных микробов. Одним из факторов, усложняющих исследование этой связи, является метаболомная избыточность. Несмотря на эти проблемы, некоторые эффекты антибиотиков на метаболом кишечника у мышей были описаны (Cho et al., 2012; Choo et al., 2017). В исследовании на молодых мышах низкие дозы антибиотиков приводили к увеличению ожирения и повышению уровня гормонов, связанных с метаболизмом углеводов, липидов и холестерина (Cho et al., 2012). В другом исследовании введение ванкомицин-имипенема привело к повышению уровня арабинита и сахаров (например, сахарозы) в кале (Choo et al., 2017). Повышенные уровни этих соединений были связаны с повышенной восприимчивостью к ИКД, потенциально выступая в качестве субстрата для роста. Ванкомицин / имипенем также снижал относительную численность бактерий Lachnospiraceae и Ruminococcaceae , которые обычно превращают арабинитол в пентозные сахара. Сразу после прекращения приема ванкомицина / имипенема наблюдалось небольшое, но значительное снижение уровня аргинина, что коррелировало с увеличением распространенности видов Escherichia и Shigella и снижением распространенности Ruminococcaceae и Bacteroides .Увеличение аргинина, наблюдаемое через 9 дней после окончания приема ванкомицина / имипенема, коррелировало с увеличением распространенности организмов из рода Enterobacter и снижением распространенности Alistipes . Аргинин служит предшественником ряда иммуномодулирующих соединений (Choo et al., 2017). Воздействие антибиотиков вызывает изменения в метаболоме кишечника, которые могут коррелировать или не коррелировать с изменениями микробиома. У пациентов с метаболическим синдромом пероральный прием ванкомицина снижает количество вторичных желчных кислот в кале с одновременным повышением первичных желчных кислот в плазме после приема пищи.Одновременно ванкомицин влиял на физиологию хозяина, снижая периферическую чувствительность к инсулину (Vrieze et al., 2014). Вызванные антибиотиками изменения метаболизма желчных кислот могут повлиять на физиологию хозяина и восприимчивость к инфекции. Устойчивость к антибиотикам определяется как способность определенного вида бактерий выживать при концентрациях антибиотиков, которые подавляют или убивают другие бактерии того же вида (Sabtu et al., 2015). Впервые он появился у бактерий, продуцирующих антибиотики, как способ защиты от собственных продуктов и конкуренции с другими микробами (Rolain, 2013).Во всем мире устойчивость к антибиотикам стала серьезной проблемой для общественного здравоохранения. В период с 2000 по 2015 год глобальное потребление антибиотиков увеличилось на 65% (Klein et al., 2018), причем наиболее часто используемыми антибиотиками были амоксициллин и амоксициллин / клавулановая кислота (Всемирная организация здравоохранения, 2018). В период с 2000 по 2015 год наибольший рост использования антибиотиков наблюдался в развивающихся странах, и разрыв между развивающимися и развитыми странами сократился. Устойчивость к антибиотикам является причиной примерно 35 000 смертей в США и 25 000 смертей в Европе ежегодно (Европейское агентство по лекарственным средствам и Европейский центр профилактики и контроля заболеваний, 2009 г .; Центры по контролю и профилактике заболеваний, 2019 г.).Согласно одной из оценок, к 2050 году количество смертей в год, вызванных устойчивостью к антибиотикам, составит 317 000 в Северной Америке, 390 000 в Европе, 392 000 в Латинской Америке, 4 150 000 в Африке и 4 730 000 в Азии (Sugden et al., 2016). По оценкам Всемирной организации здравоохранения, к 2050 году количество смертей, связанных с устойчивостью к антибиотикам, может достигнуть 10 миллионов (Всемирная организация здравоохранения, 2019). В Китае резистентность резко возросла из-за широкомасштабного использования антибиотиков в животноводстве (Van Boeckel et al., 2015). Неправильное использование антибиотиков, чему способствует их доступность без рецепта и в Интернете, является основным фактором устойчивости к антибиотикам (Sabtu et al., 2015). Увеличение числа устойчивых к антибиотикам бактерий приводит к возникновению инфекций, которые трудно и дорого лечить. Поскольку старые антибиотики теряют эффективность из-за резистентности, необходимо использовать новые антибиотики. Однако эти лекарства более дорогие и могут быть недоступны для многих из тех, кто в них нуждается, особенно в странах с высоким бременем инфекционных заболеваний (Klein et al., 2018). Бактерии разработали ряд процессов, позволяющих избежать воздействия антибиотиков, включая защиту от поглощения антибиотиков через их клеточные мембраны, разработку ферментативных процессов, которые изменяют или разлагают антибиотик, изменение молекул, на которые нацелены антибиотики, и активное удаление антибиотиков из клетка через специализированных белков оттока (Giedraitiene et al., 2011). Бактериальные ферменты, способные нейтрализовать антибиотики, включают β-лактамазы, ферменты, модифицирующие аминогликозиды, и ацетилтрансферазы хлорамфеникола (Giedraitiene et al., 2011). Бактерии также способны мутировать молекулярные мишени антибиотиков, вмешиваясь в высокоспецифичное взаимодействие между антибиотиком и его молекулой-мишенью посредством небольших структурных модификаций. Например, мутации в пенициллин-связывающих белках снижают эффективность β-лактамов, мутации в 23S рРНК придают устойчивость к макролидам, линкозамидам и стрептограмину B, а мутации ДНК-топоизомеразы II и IV приводят к устойчивости к хинолонам и фторхинолонам (Giedraitiene et al. ., 2011). Бактерии могут устранять противомикробные агенты, выкачивая их через выходящие белки , расположенные в мембране бактериальной клетки. Хотя эти белки могут быть специфичными для антибиотиков, большинство из них являются переносчиками множества лекарственных препаратов. Другой механизм устойчивости — снижение проницаемости внешней мембраны, что приводит к снижению поглощения антибиотиков (Giedraitiene et al., 2011). У человека микробиота кишечника содержит пул генов устойчивости к антибиотикам. Лечение антибиотиками быстро увеличивает пул генов устойчивости, присутствующих в кишечнике, который постепенно уменьшается после прекращения лечения (Rolain, 2013).Устойчивые к антибиотикам кишечные бактерии могут передаваться новорожденному от его / ее матери при рождении и после этого могут сохраняться в течение нескольких недель. В шведском исследовании устойчивость к тетрациклину была обнаружена у 12% комменсальных штаммов E. coli от младенцев, не получавших тетрациклин (Karami et al., 2006). Диарея, связанная с антибиотиками (AAD), определяется как диарея, которая возникает в связи с приемом антибиотиков и не может быть объяснена иначе (Бартлетт, 2002).Диарея может возникнуть во время лечения антибиотиками и до 8 недель после прекращения лечения (McFarland, 2008). В нормальных условиях гомеостаз кишечного эпителия поддерживается рядом механизмов, включая толстый слой слизи и плотные контакты для поддержания целостности кишечного эпителия (Willing et al., 2011). Количество кишечных бактерий контролируется антимикробными пептидами (лектины C-типа, дефенсины и кателицидины), которые секретируются в слой слизи вместе с секреторным иммуноглобулином A (IgA) в ответ на микробные паттерны, связанные с микроорганизмами.Воздействие антибиотиков устраняет подгруппы нормальных кишечных микробов, тем самым снижая воздействие микробных паттернов, связанных с микроорганизмами, и уменьшая секрецию антимикробных пептидов (Willing et al., 2011). Кроме того, некоторые антибиотики вызывают истончение слизистого слоя и нарушение плотных контактов, что делает эпителий кишечника более восприимчивым к повреждениям. Изменения микробных протеаз также могут влиять на барьерную функцию слизистых оболочек. В совокупности эти процессы способствуют успешной инвазии кишечных патогенов (Willing et al., 2011). Распространенность AAD среди пациентов, получающих антибиотики, составляет примерно 5–35% (McFarland, 2008). В исследовании взрослых амбулаторных пациентов, получающих антибиотики в течение 5–10 дней, частота ААД составила 17,5% (Beaugerie et al., 2003). Клиническое течение AAD различается в зависимости от того, был ли вовлечен C. difficile , при этом большинство эпизодов AAD, отличных от C. difficile , были легкими по степени тяжести и самоограничивающимися, продолжавшимися всего несколько дней (Beaugerie et al., 2003 ). Мета-анализ показал, что определенные штаммы пробиотиков могут быть полезны для профилактики ААД. По сравнению с плацебо или отсутствием лечения, риск ААД среди взрослых и детей, получавших антибиотики, был значительно снижен при терапии пробиотиками, состоящей из Lactobacillus rhamnosus GG (относительный риск 0,49; 95% ДИ 0,29–0,83) (Szajewska and Kolodziej, 2015a) или Saccharomyces boulardii (отношение рисков 0,47; 95% ДИ 0,38–0,57) (Szajewska and Kolodziej, 2015b). Руководство Европейского общества детской гастроэнтерологии, гепатологии и питания 2016 г. по пробиотикам и пребиотикам рекомендует L. rhamnosus GG и S. boulardii для профилактики ААД у детей, в обоих случаях как сильная рекомендация с умеренным качеством доказательств. (Szajewska et al., 2016). C. difficile — это грамположительная спорообразующая анаэробная палочка со спорами, которые обладают высокой устойчивостью к высыханию, химическим веществам и экстремальным температурам и могут сохранять жизнеспособность в течение многих лет. (Эдвардс и др., 2016). C. difficile продуцирует токсины A и B, которые могут повреждать слизистую оболочку кишечника (Kuehne et al., 2010). В 2011 году в США было зарегистрировано 453 000 случаев ИКД и 29 000 смертей, связанных с ИКД (Leffler and Lamont, 2015). Значительная часть ИКД является нозокомиальной, при этом частота ИКД составляет примерно 20 случаев на 100 000 человеко-лет в сообществе и примерно 15 случаев на 1000 выписок из больниц (Leffler and Lamont, 2015). Наиболее значительным фактором риска ИКД является использование антибиотиков, наиболее часто ассоциируемыми препаратами являются ампициллин, амоксициллин, цефалоспорины, клиндамицин и фторхинолоны.И продолжительность антибактериальной терапии, и количество используемых препаратов положительно коррелируют с более высоким риском ИКД. К другим факторам риска относятся пожилой возраст, ослабленный иммунитет и госпитализация, особенно в отделении интенсивной терапии (Leffler and Lamont, 2015). Диагностика ИКД у пациентов с диареей основана на наличии бактерий в стуле. ИКД считается тяжелой, если уровень сывороточного альбумина <3 г / дл и либо количество лейкоцитов ≥15000 на мм 3 , либо присутствует болезненность в животе (Surawicz et al., 2013). Был предложен двухэтапный алгоритм для обнаружения C. difficile в образцах стула, который позволяет провести быструю диагностику в течение 4 часов. Этап 1 состоит из обнаружения C. difficile -специфического антигена глутаматдегидрогеназы, а этап 2 — это обнаружение токсина A или B. Приблизительно 87,3% подозрительных случаев могут быть исключены на первом этапе. Если на втором этапе токсин не обнаружен, следует провести посев (Fenner et al., 2008). Рекомендуемые методы лечения ИКД включают метронидазол 500 мг перорально три раза в день в течение 10 дней в легких и умеренных случаях и ванкомицин 125 мг четыре раза в день в течение 10 дней в тяжелых случаях.По возможности следует прекратить прием антибиотиков, которые привели к ИКД (Surawicz et al., 2013; Neut et al., 2017). Несколько метаанализов оценили использование пробиотиков для профилактики ИКД у детей и взрослых, получающих антибиотики. Два метаанализа показали, что частота ИКД ниже у взрослых пациентов, получающих пробиотики в дополнение к лечению антибиотиками, чем у тех, кто получал плацебо (Johnson et al., 2012; Goldenberg et al., 2013), в то время как другой метаанализ получили аналогичные результаты у детей (Goldenberg et al., 2015). Несмотря на эти результаты, доказательств того, что пробиотики предотвращают ИКД, было сочтено недостаточным для поддержки их повседневного использования (Surawicz et al., 2013). Helicobacter pylori (Hp) — это грамотрицательная спиралевидная микроаэрофильная бактерия, которая колонизирует слизистую оболочку желудка человека (Perez-Perez and Blaser, 1996; Suerbaum and Michetti, 2002) . Инфекция Hp вызывает воспалительную реакцию слизистой оболочки желудка. В большинстве случаев это протекающая бессимптомная реакция.Однако у некоторых людей инфекция может приводить к язве желудка и двенадцатиперстной кишки, кишечной метаплазии и раку желудка (Suerbaum and Michetti, 2002). В настоящее время в регионах с высокой устойчивостью к кларитромицину (> 15%) рекомендуется четырехкратная или невисмутовая сопутствующая терапия (например, ингибитор протонной помпы, амоксициллин, кларитромицин и метронидазол) (Malfertheiner et al., 2017) . Однако в регионах с высокой устойчивостью к кларитромицину и метронидазолу в качестве терапии первой линии рекомендуется четырехкратная терапия висмутом (Malfertheiner et al., 2017). Эрадикация Hp может иметь как положительные, так и отрицательные эффекты. С одной стороны, эрадикация Hp восстанавливает состав микробиоты в соответствии с Hp-отрицательными контролями (Li et al., 2017). С другой стороны, эрадикация Hp, как сообщается, вызывает изменения в составе микробиоты, которые могут негативно повлиять на хозяина (Yap et al., 2016). Эрадикация Hp была связана с уменьшением относительной численности Bacteroidetes и увеличением Firmicutes .Увеличение числа бактерий, продуцирующих короткоцепочечные жирные кислоты, может привести к повышенному риску метаболических нарушений (Yap et al., 2016). Неудача эрадикационной терапии Hp была связана с плохим соблюдением режима лечения из-за побочных эффектов, связанных с антибиотиками (Losurdo et al., 2018). Стратегия эрадикации Hp, сочетающая пробиотики ( S. boulardii ) с тройной терапией, была более эффективной и имела лучший профиль побочных эффектов, чем плацебо или отсутствие вмешательства плюс тройная терапия (Szajewska et al., 2010; Szajewska et al., 2015). Добавление пробиотиков, содержащих Lactobacillus и Bifidobacterium , к эрадикационной терапии Hp также было связано с улучшенным профилем эффективности и безопасности по сравнению с эрадикационной терапией без пробиотиков (Wang et al., 2013; Losurdo et al., 2018). В метаанализе исследований у пациентов, получающих антибиотикотерапию для эрадикации Hp, добавление L. acidophilus , L. casei DN-114001, L. gasseri и Bifidobacterium infantis 2036 было связано со значительно более высокой эрадикацией. показатели по сравнению с контролем (без пробиотических добавок) (Dang et al., 2014). Антибиотики широко используются у младенцев и детей, причем системные антибиотики являются наиболее часто назначаемыми лекарствами для детей в США (Chai et al., 2012). Использование антибиотиков в детстве было связано с несколькими отрицательными последствиями в более позднем возрасте, включая развитие ожирения, астмы, аллергии и ВЗК (Cho et al., 2012; Bokulich et al., 2016; Korpela et al., 2016; Turta и Раутава, 2016). Воздействие антибиотиков в младенчестве было связано с задержкой развития кишечной микробиоты.В исследовании младенцев в возрасте до 2 лет задержка развития микробиоты после применения антибиотиков была особенно выражена в возрасте от 6 до 12 месяцев (Bokulich et al., 2016). Enterobacteriaceae , Lachnospiraceae и Erysipelotrichaceae видов были среди рабочих таксономических единиц, которые были истощены антибиотиками (Bokulich et al., 2016). Кроме того, частое использование макролидных антибиотиков в первые 2 года жизни было в значительной степени связано либо с текущей астмой и ожирением, либо с последующим развитием этих состояний (Korpela et al., 2016). Считается, что раннее воздействие антибиотиков и возникающий в результате дисбактериоз вносят вклад в патогенез ВЗК. Популяционное когортное исследование показало, что у младенцев, получавших антианаэробные антибиотики на первом году жизни, вероятность диагностирования ВЗК выше, чем у детей, не получавших антибиотики (Kronman et al., 2012). Точно так же общенациональное датское когортное исследование детей показало, что вероятность развития ВЗК была самой высокой в первые 3 месяца после приема антибиотиков, а также у детей, прошедших не менее семи курсов антибиотиков (Hviid et al., 2011). Общенациональное финское исследование «случай-контроль» также показало более сильную связь между болезнью Крона и применением антибиотиков у мальчиков, чем у девочек; класс антибиотиков с наиболее сильной ассоциацией с болезнью Крона — цефалоспорины (Virta et al., 2012). Известно, что генетика человека и диета играют важную роль в определении массы тела; однако в настоящее время широко признано, что увеличение распространенности ожирения за последние 30 лет также может быть связано с изменениями в составе микробиоты кишечника (Biedermann and Rogler, 2015).В частности, воздействие антибиотиков в раннем возрасте было связано с развитием ожирения у людей (Trasande et al., 2013). Недавние исследования показали, что микробиота кишечника представляет собой сложную сеть метаболически взаимозависимых микроорганизмов. Симбиотическая микробиота кишечника выполняет несколько жизненно важных функций, помогая пищеварению, стимулируя и регулируя иммунную систему и предотвращая рост патогенов. Все более широкое использование антибиотиков является серьезной причиной для беспокойства, поскольку антибиотики разрушают микробиоту кишечника.Чтобы решить эту проблему, необходимы дальнейшие исследования, которые позволят нам лучше понять микробиоту кишечника и стратегии, чтобы обратить вспять эти нарушения, включая использование пробиотиков. Все авторы (JR, LB, VS, FG, AM и HC) написали, редактировали и рецензировали черновики рукописи и соглашаются нести ответственность за содержание работы. Все авторы внесли свой вклад в статью и одобрили представленную версию. Разработка этой обзорной статьи финансировалась Biocodex France.Спонсор не участвовал в разработке, сборе, анализе, интерпретации данных, написании этой статьи или решении представить ее для публикации. FG является членом консультативных советов Biocodex и Instituto Danone; и получил исследовательские гранты от AB Biotics, Takeda и Abbvie. AM является спикером и членом консультативного совета Biocodex France. HC является консультантом компаний Biocodex и Megapharma. Остальные авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов. Мы хотели бы поблагодарить Георгия Филатова из Springer Healthcare Communications, оказавшего помощь в редактировании этой рукописи, и Сару Грейг, PhD, Springer Healthcare Communications, которая оформляла рукопись для подачи. Эта помощь в написании медицинских документов была профинансирована Biocodex. Аллабанд К., Макдональд Д., Васкес-Баеза Й., Миних Дж. Дж., Трипати А., Бреннер Д. А. и др. (2019). Микробиом 101: изучение, анализ и интерпретация данных микробиома кишечника для врачей. Clin. Гастроэнтерол. Гепатол. 17, 218–230. doi: 10.1016 / j.cgh.2018.09.017 PubMed Аннотация | CrossRef Полный текст | Google Scholar Анантакришнан А. Н., Сингал А. Г., Чанг Л. (2019). Микробиом кишечника и здоровье пищеварительной системы — новые рубежи. Clin. Гастроэнтерол. Гепатол. 17, 215–217. doi: 10.1016 / j.cgh.2018.10.040 PubMed Аннотация | CrossRef Полный текст | Google Scholar Beaugerie L., Flahault A., Barbut F., Atlan P., Lalande V., Кузен П. и др. (2003). Диарея, связанная с антибиотиками, и Clostridium difficile, в сообществе. Aliment Pharmacol. Ther. 17, 905–912. DOI: 10.1046 / j.1365-2036.2003.01531.x PubMed Аннотация | CrossRef Полный текст | Google Scholar Bendezú García R., Barba E., Burri E., Cisternas D., Accarino A., Quiroga S., et al. (2016). Содержание толстой кишки в здоровье и его связь с функциональными симптомами кишечника. Нейрогастроэнтерол. Мотил. 28, 849–854.doi: 10.1111 / nmo.12782 PubMed Аннотация | CrossRef Полный текст | Google Scholar Бокулич Н. А., Чанг Дж., Батталья Т., Хендерсон Н., Джей М., Ли Х. и др. (2016). Антибиотики, способ родов и диета влияют на созревание микробиома в молодом возрасте. Sci. Пер. Med. 8, 343ra82. doi: 10.1126 / scitranslmed.aad7121 PubMed Аннотация | CrossRef Полный текст | Google Scholar Браун Х. П., Форстер С. К., Анонье Б. О., Кумар Н., Невилл Б. А., Старес М.D., et al. (2016). Культивирование «некультивируемой» микробиоты человека обнаруживает новые таксоны и обширное спороношение. Природа. 533, 543–546. DOI: 10.1038 / nature17645 PubMed Аннотация | CrossRef Полный текст | Google Scholar Каммарота Г., Яниро Г., Тилг Х., Раджилич-Стоянович М., Камп П., Сатокари Р. и др. (2017). Европейская консенсусная конференция по трансплантации фекальной микробиоты в клинической практике. Gut. 66, 569–580. doi: 10.1136 / gutjnl-2016-313017 PubMed Аннотация | CrossRef Полный текст | Google Scholar Чай Г., Говернэйл Л., МакМахон А. В., Тринидад Дж. П., Стаффа Дж., Мерфи Д. (2012). Тенденции амбулаторного использования рецептурных лекарств среди детей в США, 2002-2010 гг. Педиатрия. 130, 23–31. doi: 10.1542 / peds.2011-2879 PubMed Аннотация | CrossRef Полный текст | Google Scholar Чо И., Яманиши С., Кокс Л., Мете Б. А., Завадил Дж., Ли К. и др. (2012). Антибиотики в раннем возрасте изменяют микробиом толстой кишки и ожирение мышей. Природа. 488, 621–626. doi: 10.1038 / nature11400 PubMed Аннотация | CrossRef Полный текст | Google Scholar Choo J.М., Канно Т., Зайн Н. М., Леонг Л. Э., Абелл Г. К., Кибл Дж. Э. и др. (2017). Дивергентные отношения между фекальной микробиотой и метаболомом после различных нарушений, вызванных антибиотиками. мSphere 2, e00005–17. doi: 10.1128 / mSphere.00005-17 PubMed Аннотация | CrossRef Полный текст | Google Scholar Clemente J. C., Pehrsson E. C., Blaser M. J., Sandhu K., Gao Z., Wang B., et al. (2015). Микробиом индейцев, не вступавших в контакт. Sci. Adv . 1, e1500183.doi: 10.1126 / sciadv.1500183 CrossRef Полный текст | Google Scholar Costea P. I., Hildebrand F., Arumugam M., Backhed F., Blaser M. J., Bushman F. D., et al. (2018). Энтеротипы в структуре микробного сообщества кишечника. Нат. Microbiol. 3, 8–16. doi: 10.1038 / s41564-017-0072-8 PubMed Аннотация | CrossRef Полный текст | Google Scholar Dang Y., Reinhardt J. D., Zhou X., Zhang G. (2014). Влияние добавок пробиотиков на скорость эрадикации Helicobacter pylori и побочные эффекты во время эрадикационной терапии: метаанализ. PloS One 9, e111030. doi: 10.1371 / journal.pone.0111030 PubMed Аннотация | CrossRef Полный текст | Google Scholar Детлефсен Л., Релман Д. А. (2011). Неполное восстановление и индивидуальные ответы микробиоты дистальных отделов кишечника человека на повторяющееся воздействие антибиотиков. Proc. Natl. Акад. Sci. США. 108 Приложение 1, 4554–4561. doi: 10.1073 / pnas.1000087107 PubMed Аннотация | CrossRef Полный текст | Google Scholar Duvallet C., Gibbons S.М., Гарри Т., Иризарри Р. А., Алм Э. Дж. (2017). Мета-анализ исследований микробиома кишечника определяет специфические для болезни и общие реакции. Нат. Commun. 8, 1784. doi: 10.1038 / s41467-017-01973-8 PubMed Реферат | CrossRef Полный текст | Google Scholar Экбург П. Б., Бик Э. М., Бернштейн К. Н., Пурдом Э., Детлефсен Л., Сарджент М. и др. (2005). Разнообразие микробной флоры кишечника человека. Наука. 308, 1635–1638. DOI: 10.1126 / science.1110591 PubMed Аннотация | CrossRef Полный текст | Google Scholar Эдвардс А.Н., Карим С. Т., Паскуаль Р. А., Джоухар Л. М., Андерсон С. Э., Макбрайд С. М. (2016). Химическая и стрессоустойчивость спор и вегетативных клеток Clostridium difficile. Фронт. Microbiol. 7, 1698. doi: 10.3389 / fmicb.2016.01698 PubMed Аннотация | CrossRef Полный текст | Google Scholar Феннер Л., Видмер А. Ф., Гой Г., Рудин С., Фрей Р. (2008). Быстрый и надежный алгоритм диагностики Clostridium difficile . J. Clin. Microbiol. 46, 328–330. doi: 10.1128 / JCM.01503-07 PubMed Аннотация | CrossRef Полный текст | Google Scholar Foliaki S., Pearce N., Bjorksten B., Mallol J., Montefort S., von Mutius E., et al. (2009). Использование антибиотиков в младенчестве и симптомы астмы, риноконъюнктивита и экземы у детей 6 и 7 лет: Международное исследование астмы и аллергии в детстве, фаза III. J. Allergy Clin. Иммунол. 124, 982–989. doi: 10.1016 / j.jaci.2009.08.017 PubMed Аннотация | CrossRef Полный текст | Google Scholar Гедрайтиене А., Виткаускене А., Нагиниене Р., Павилонис А. (2011). Механизмы устойчивости к антибиотикам клинически важных бактерий. Medicina (Каунас). 47, 137–146. doi: 10.3390 / medicina47030019 PubMed Аннотация | CrossRef Полный текст | Google Scholar Гилберт Дж. А., Блазер М. Дж., Капорасо Дж. Г., Янссон Дж. К., Линч С. В., Найт Р. (2018). Современное понимание микробиома человека. Нат. Med. 24, 392–400. DOI: 10,1038 / нм.4517 PubMed Аннотация | CrossRef Полный текст | Google Scholar Гольденберг Дж.З., Ма С. С., Сакстон Дж. Д., Мартцен М. Р., Вандвик П. О., Торлунд К. и др. (2013). Пробиотики для профилактики диареи, вызванной Clostridium difficile , у взрослых и детей. Кокрановская база данных Syst. Ред. 5, CD006095. doi: 10.1002 / 14651858.CD006095.pub3 CrossRef Полный текст | Google Scholar Гольденберг Дж. З., Литвин Л., Стойрих Дж., Паркин П., Махант С., Джонстон Б. С. (2015). Пробиотики для профилактики детской диареи, связанной с приемом антибиотиков. Кокрановская база данных Syst. Ред. 12, CD004827. doi: 10.1002 / 14651858.CD004827.pub4 CrossRef Полный текст | Google Scholar Guarner F. (2012). Кишечная микробиота (Сан-Рафаэль, Калифорния: Morgan & Claypool Publishers). Google Scholar Яниро Г., Маллиш Б. Х., Келли К. Р., Кассам З., Куиджпер Э. Дж., Нг С. С. и др. (2020). Реорганизация служб трансплантации фекальной микробиоты во время пандемии COVID-19. Gut. 69, 1555–1563.doi: 10.1136 / gutjnl-2020-321829 PubMed Аннотация | CrossRef Полный текст | Google Scholar Имдад А., Николсон М. Р., Таннер-Смит Э. Э., Закуляр Дж. П., Гомес-Дуарте О. Г., Болье Д. Б. и др. (2018). Трансплантация кала при воспалительном заболевании кишечника. Кокрановская база данных Syst. Ред. 11, CD012774. doi: 10.1002 / 14651858.CD012774.pub2 PubMed Аннотация | CrossRef Полный текст | Google Scholar Johnson S., Maziade P. J., McFarland L.В., Трик В., Донски К., Карри Б. и др. (2012). Возможна ли первичная профилактика инфекции Clostridium difficile с помощью определенных пробиотиков? Внутр. J. Infect. Дис. 16, e786 – e792. doi: 10.1016 / j.ijid.2012.06.005 PubMed Аннотация | CrossRef Полный текст | Google Scholar Карами Н., Новрузиан Ф., Адлерберт И., Волд А. Э. (2006). Устойчивость к тетрациклину Escherichia coli и устойчивость микробиоты толстой кишки у младенцев. Антимикробный.Агенты Chemother. 50, 156–161. doi: 10.1128 / AAC.50.1.156-161.2006 PubMed Реферат | CrossRef Полный текст | Google Scholar Кляйн Э. Ю., Ван Бекель Т. П., Мартинес Э. М., Пант С., Гандра С., Левин С. А. и др. (2018). Глобальный рост и географическая конвергенция потребления антибиотиков в период с 2000 по 2015 гг. Proc. Natl. Акад. Sci. США 115, E3463 – E3E70. DOI: 10.1073 / pnas.1717295115 PubMed Аннотация | CrossRef Полный текст | Google Scholar Корпела К., Салонен А., Вирта Л. Дж., Кекконен Р. А., Форслунд К., Борк П. и др. (2016). Кишечный микробиом связан с пожизненным использованием антибиотиков финскими дошкольниками. Нат. Commun. 7, 10410. doi: 10.1038 / ncomms10410 PubMed Аннотация | CrossRef Полный текст | Google Scholar Кронман М. П., Заутис Т. Э., Хейнс К., Фенг Р., Коффин С. Э. (2012). Воздействие антибиотиков и развитие ВЗК у детей: популяционное когортное исследование. Педиатрия. 130, e794 – e803.doi: 10.1542 / peds.2011-3886 PubMed Аннотация | CrossRef Полный текст | Google Scholar Кюне С. А., Картман С. Т., Хип Дж. Т., Келли М. Л., Кокейн А., Минтон Н. П. и др. (2010). и токсин B при инфекции Clostridium difficile . Природа. 467, 711–713. DOI: 10.1038 / nature09397 PubMed Аннотация | CrossRef Полный текст | Google Scholar Кейперс Э. Дж. (2019). Энциклопедия гастроэнтерологии (Амстердам, Нидерланды: Elsevier Science). Google Scholar Ламичхейн С., Сен П., Диккенс А. М., Оресич М., Бертрам Х. С. (2018). Метаболом кишечника встречается с микробиомом: методологическая перспектива для понимания взаимоотношений между хозяином и микробом. Методы. 149, 3–12. doi: 10.1016 / j.ymeth.2018.04.029 PubMed Аннотация | CrossRef Полный текст | Google Scholar Le Chatelier E., Nielsen T., Qin J., Prifti E., Hildebrand F., Falony G., et al. (2013). Богатство микробиома кишечника человека коррелирует с метаболическими маркерами. Природа. 500, 541–546. doi: 10.1038 / nature12506 PubMed Аннотация | CrossRef Полный текст | Google Scholar Li J., Jia H., Cai X., Zhong H., Feng Q., Sunagawa S. и др. (2014). Интегрированный каталог эталонных генов микробиома кишечника человека. Нат. Biotechnol. 32, 834–841. doi: 10.1038 / nbt.2942 PubMed Аннотация | CrossRef Полный текст | Google Scholar Ли Т. Х., Цинь Ю., Шам П. С., Лау К. С., Чу К. М., Леунг В. К. (2017).Изменения в микробиоте желудка после эрадикации H. pylori и на различных гистологических стадиях канцерогенеза желудка. Sci. Rep. 7, 44935. doi: 10.1038 / srep44935 PubMed Аннотация | CrossRef Полный текст | Google Scholar Losurdo G., Cubisino R., Barone M., Principi M., Leandro G., Ierardi E., et al. (2018). Монотерапия пробиотиками и эрадикация Helicobacter pylori : систематический обзор с анализом объединенных данных. Мир J.Гастроэнтерол. 24, 139–149. doi: 10.3748 / wjg.v24.i1.139 PubMed Аннотация | CrossRef Полный текст | Google Scholar Малфертхайнер П., Мегро Ф., О’Морайн К. А., Гисберт Дж. П., Койперс Э. Дж., Аксон А. Т. и др. (2017). Управление инфекцией Helicobacter pylori — Маастрихтский отчет V / Флорентийский консенсус. Кишечник 66, 6–30. doi: 10.1136 / gutjnl-2016-312288 PubMed Аннотация | CrossRef Полный текст | Google Scholar Маллиш Б. Х., Кураиши М.Н., Сигал Дж. П., МакКьюн В. Л., Бакстер М., Марсден Г. Л. и др. (2018). Использование трансплантации фекальной микробиоты для лечения рецидивирующей или резистентной инфекции Clostridium difficile и других потенциальных показаний: совместные рекомендации Британского общества гастроэнтерологии (BSG) и Общества инфекционистов здравоохранения (HIS). Кишечник 67, 1920–1941. doi: 10.1136 / gutjnl-2018-316818 PubMed Аннотация | CrossRef Полный текст | Google Scholar Neut C., Mahieux S., Dubreuil L.J. (2017).Чувствительность пробиотических штаммов к антибиотикам: разумно ли комбинировать пробиотики с антибиотиками? Med. Mal. Заразить. 47, 477–483. doi: 10.1016 / j.medmal.2017.07.001 PubMed Аннотация | CrossRef Полный текст | Google Scholar Паллея А., Миккельсен К. Х., Форслунд С. К., Кашани А., Аллин К. Х., Нильсен Т. и др. (2018). Восстановление кишечной микробиоты здоровых взрослых после воздействия антибиотиков. Нат. Microbiol. 3, 1255–1265. doi: 10.1038 / s41564-018-0257-9 PubMed Аннотация | CrossRef Полный текст | Google Scholar Панда С., Эль-хадер И., Каселлас Ф., Лопес Виванкос Дж., Гарсия Корс М., Сантьяго А. и др. (2014). Кратковременное действие антибиотиков на микробиоту кишечника человека. PloS One 9, e95476. doi: 10.1371 / journal.pone.0095476 PubMed Аннотация | CrossRef Полный текст | Google Scholar Пастер Л. (1885). Наблюдения за родственниками à la précédente de M. Duclaux. C. R. Acad. Sci. 100, 68–69. Google Scholar Перес-Перес Г., Блазер М. (1996). «Глава 23: Campylobacter и Helicobacter», в Медицинская микробиология .Эд. Барон С. (Галвестон, Техас: Медицинский филиал Техасского университета в Галвестоне). Google Scholar Суравич К. М., Брандт Л. Дж., Бинион Д. Г., Анантакришнан А. Н., Карри С. Р., Гиллиган П. Х. и др. (2013). Руководство по диагностике, лечению и профилактике инфекций, вызванных Clostridium difficile . Am. J. Gastroenterol. 108, 478–98; викторина 99. doi: 10.1038 / ajg.2013.4 PubMed Аннотация | CrossRef Полный текст | Google Scholar Szajewska H., Колоджей М. (2015а). Систематический обзор с метаанализом: Lactobacillus rhamnosus GG в профилактике антибиотико-ассоциированной диареи у детей и взрослых. Aliment Pharmacol. Ther. 42, 1149–1157. doi: 10.1111 / apt.13404 PubMed Аннотация | CrossRef Полный текст | Google Scholar Szajewska H., Kolodziej M. (2015b). Систематический обзор с метаанализом: Saccharomyces boulardii в профилактике диареи, связанной с антибиотиками. Aliment Pharmacol. Ther. 42, 793–801. doi: 10.1111 / apt.13344 PubMed Аннотация | CrossRef Полный текст | Google Scholar Szajewska H., Horvath A., Piwowarczyk A. (2010). Мета-анализ: влияние добавки Saccharomyces boulardii на частоту эрадикации Helicobacter pylori и побочные эффекты во время лечения. Aliment Pharmacol. Ther. 32, 1069–1079. doi: 10.1111 / j.1365-2036.2010.04457.x PubMed Аннотация | CrossRef Полный текст | Google Scholar Szajewska H., Хорват А., Колодзей М. (2015). Систематический обзор с метаанализом: добавление Saccharomyces boulardii и искоренение инфекции Helicobacter pylori . Aliment Pharmacol. Ther. 41, 1237–1245. doi: 10.1111 / apt.13214 PubMed Аннотация | CrossRef Полный текст | Google Scholar Шаевска Х., Канани Р. Б., Гуарино А., Хойсак И., Индрио Ф., Колачек С. и др. (2016). Пробиотики для профилактики диареи, связанной с приемом антибиотиков. J. Pediatr. Гастроэнтерол. Nutr. 62, 495–506. DOI: 10.1097 / MPG.0000000000001081 PubMed Аннотация | CrossRef Полный текст | Google Scholar Trasande L., Blustein J., Liu M., Corwin E., Cox L.M., Blaser M.J. (2013). Воздействие антибиотиков на младенцев и масса тела в раннем возрасте. Внутр. J. Obes. (Лондон). 37, 16–23. doi: 10.1038 / ijo.2012.132 PubMed Аннотация | CrossRef Полный текст | Google Scholar Ван Бекель Т. П., Брауэр К., Гилберт М., Гренфелл Б. Т., Левин С. А., Робинсон Т. П. и др. (2015). Мировые тенденции использования противомикробных препаратов для пищевых животных. Proc. Natl. Акад. Sci. США. 112, 5649–5654. DOI: 10.1073 / pnas.1503141112 PubMed Аннотация | CrossRef Полный текст | Google Scholar Вирта Л., Аувинен А., Хелениус Х., Хуовинен П., Колхо К. Л. (2012). Связь повторного приема антибиотиков с развитием болезни Крона у детей — национальное финское исследование методом случай-контроль на основе регистров. Am. J. Epidemiol. 175, 775–784. DOI: 10.1093 / aje / kwr400 PubMed Аннотация | CrossRef Полный текст | Google Scholar Vrieze A., Out C., Fuentes S., Jonker L., Reuling I., Kootte R. S., et al. (2014). Влияние перорального ванкомицина на микробиоту кишечника, метаболизм желчных кислот и чувствительность к инсулину. J. Hepatol. 60, 824–831. doi: 10.1016 / j.jhep.2013.11.034 PubMed Аннотация | CrossRef Полный текст | Google Scholar Wang Z. H., Gao Q. Y., Fang J.Ю. (2013). Мета-анализ эффективности и безопасности препарата, содержащего Lactobacillus и Bifidobacterium -содержащего пробиотического соединения, в эрадикационной терапии Helicobacter pylori . J. Clin. Гастроэнтерол. 47, 25–32. doi: 10.1097 / MCG.0b013e318266f6cf PubMed Аннотация | CrossRef Полный текст | Google Scholar Виллинг Б. П., Рассел С. Л., Финли Б. Б. (2011). Сдвиг баланса: влияние антибиотиков на мутуализм микробиоты хозяина. Нат. Rev. Microbiol. 9, 233–243. doi: 10.1038 / nrmicro2536 PubMed Аннотация | CrossRef Полный текст | Google Scholar Wirbel J., Pyl P. T., Kartal E., Zych K., Kashani A., Milanese A., et al. (2019). Мета-анализ фекальных метагеномов выявляет глобальные микробные сигнатуры, специфичные для колоректального рака. Нат. Med. 25, 679–689. doi: 10.1038 / s41591-019-0406-6 PubMed Аннотация | CrossRef Полный текст | Google Scholar Ву Г.Д., Чен Дж., Хоффманн К., Биттингер К., Чен Ю. Ю., Кейлбо С. А. и др. (2011). Связь долгосрочных диетических моделей с кишечными микробными энтеротипами. Наука 334, 105–108. DOI: 10.1126 / science.1208344 PubMed Аннотация | CrossRef Полный текст | Google Scholar Яп Т. В., Ган Х. М., Ли Ю. П., Леоу А. Х., Азми А. Н., Франсуа Ф. и др. (2016). Эрадикация Helicobacter pylori вызывает нарушение микробиома кишечника человека у молодых людей. Рекомендуемые статьи
Цитирующие статьи
Как восстановить кишечную флору после приема антибиотиков

 ”
”
 В статье, опубликованной ранее в этом году, исследователи продемонстрировали связь между использованием антибиотиков в младенчестве и последующими плохими нейрокогнитивными исходами, предполагая, что потребление антибиотиков на первом году жизни пациента было связано с небольшими, но статистически значимыми различиями в когнитивных, поведенческих показателях и показателях настроения. в детстве (Слыкерман, Р.и другие. Acta Paediatr . 2017; 106 (1): 87–94).
В статье, опубликованной ранее в этом году, исследователи продемонстрировали связь между использованием антибиотиков в младенчестве и последующими плохими нейрокогнитивными исходами, предполагая, что потребление антибиотиков на первом году жизни пациента было связано с небольшими, но статистически значимыми различиями в когнитивных, поведенческих показателях и показателях настроения. в детстве (Слыкерман, Р.и другие. Acta Paediatr . 2017; 106 (1): 87–94). Некоторые предполагают, что вызванное антибиотиками высвобождение ЛПС может способствовать развитию септического шока у пациентов, леченных от тяжелых инфекций, вызванных грамотрицательными бактериями. Другие продемонстрировали, что ЛПС запускает иммунный ответ, высвобождая воспалительные цитокины, проблема, которая усугубляется после лечения антибиотиками, отметила Скилтон в своем вебинаре (Wu, T.и другие. Toxicol Lett . 2009; 191 (2-3): 195-202).
Некоторые предполагают, что вызванное антибиотиками высвобождение ЛПС может способствовать развитию септического шока у пациентов, леченных от тяжелых инфекций, вызванных грамотрицательными бактериями. Другие продемонстрировали, что ЛПС запускает иммунный ответ, высвобождая воспалительные цитокины, проблема, которая усугубляется после лечения антибиотиками, отметила Скилтон в своем вебинаре (Wu, T.и другие. Toxicol Lett . 2009; 191 (2-3): 195-202).
 Учитывая микробное разнообразие здоровой экосистемы кишечника, Скилтон рекомендует использовать продукты, содержащие много разных видов полезных микробов, а не «монокультурные» с одним или двумя отдельными штаммами.
Учитывая микробное разнообразие здоровой экосистемы кишечника, Скилтон рекомендует использовать продукты, содержащие много разных видов полезных микробов, а не «монокультурные» с одним или двумя отдельными штаммами. Обычно это сопровождается потерей границ кисти и заметным снижением выработки секреторного IgA.
Обычно это сопровождается потерей границ кисти и заметным снижением выработки секреторного IgA. В этом контексте добавки с обычными пробиотиками обычно не работают.
В этом контексте добавки с обычными пробиотиками обычно не работают.
 Антибиотики — это ураган. S. boulardii похож на подрядчика, который приходит и ремонтирует поврежденную деревню. Затем вы можете заново заселить деревню комменсалами ».
Антибиотики — это ураган. S. boulardii похож на подрядчика, который приходит и ремонтирует поврежденную деревню. Затем вы можете заново заселить деревню комменсалами ». Тем не менее, важно знать, что в первые несколько дней приема S. boulardii у некоторых пациентов может наблюдаться заметное «промывание кишечника», поскольку пробиотические дрожжи вытесняют виды Candida. Кандидозная смерть также может вызвать у людей недомогание. Лучше всего заранее сообщить пациентам об этих возможностях, чтобы они не удивились, если они возникнут.
Тем не менее, важно знать, что в первые несколько дней приема S. boulardii у некоторых пациентов может наблюдаться заметное «промывание кишечника», поскольку пробиотические дрожжи вытесняют виды Candida. Кандидозная смерть также может вызвать у людей недомогание. Лучше всего заранее сообщить пациентам об этих возможностях, чтобы они не удивились, если они возникнут.
 Но д-р Скилтон подчеркнул, что они никак не стимулируют выработку sIgA, а хронические дрожжевые инфекции почти всегда связаны с низким уровнем IgA. Эти натуральные дрожжевые бустеры никогда не следует использовать одновременно с S.boulardii; эти «дружелюбные» дрожжи так же уязвимы для таких веществ, как орегано и чайное дерево, как и для болезнетворных дрожжей.
Но д-р Скилтон подчеркнул, что они никак не стимулируют выработку sIgA, а хронические дрожжевые инфекции почти всегда связаны с низким уровнем IgA. Эти натуральные дрожжевые бустеры никогда не следует использовать одновременно с S.boulardii; эти «дружелюбные» дрожжи так же уязвимы для таких веществ, как орегано и чайное дерево, как и для болезнетворных дрожжей.
 О’Брайан объясняет, что клетки, выстилающие внутреннюю часть кишечника, быстро воспроизводятся, и что бутират способствует восстановлению новых клеток.Недостаточное производство бутирата и медленный оборот кишечных клеток делают организм более уязвимым для развития раковых клеток, что приводит к более высокому риску рака толстой кишки.
О’Брайан объясняет, что клетки, выстилающие внутреннюю часть кишечника, быстро воспроизводятся, и что бутират способствует восстановлению новых клеток.Недостаточное производство бутирата и медленный оборот кишечных клеток делают организм более уязвимым для развития раковых клеток, что приводит к более высокому риску рака толстой кишки.
границ | Антибиотики как основные разрушители кишечной микробиоты
Введение
 Однако они обнаружили, что стерильным животным требуется большое количество пищи, богатой питательными веществами, но при этом они по-прежнему задерживают рост и развитие по сравнению с нормальными животными. У здоровых животных были меньшие сердца, легкие и печень, более низкий сердечный выброс, более тонкие стенки кишечника, сниженная перистальтика желудочно-кишечного тракта, более низкие уровни сывороточного гамма-глобулина и атрофированные лимфатические узлы (Wostmann, 1981).Большинство этих недостатков можно восстановить путем введения кишечной микробиоты животных, выращенных в нормальных условиях. Следовательно, хотя колонизация микробов может и не иметь существенного значения для жизни, она имеет решающее значение для здоровья (Guarner and Malagelada, 2003; O’Hara and Shanahan, 2006).
Однако они обнаружили, что стерильным животным требуется большое количество пищи, богатой питательными веществами, но при этом они по-прежнему задерживают рост и развитие по сравнению с нормальными животными. У здоровых животных были меньшие сердца, легкие и печень, более низкий сердечный выброс, более тонкие стенки кишечника, сниженная перистальтика желудочно-кишечного тракта, более низкие уровни сывороточного гамма-глобулина и атрофированные лимфатические узлы (Wostmann, 1981).Большинство этих недостатков можно восстановить путем введения кишечной микробиоты животных, выращенных в нормальных условиях. Следовательно, хотя колонизация микробов может и не иметь существенного значения для жизни, она имеет решающее значение для здоровья (Guarner and Malagelada, 2003; O’Hara and Shanahan, 2006). , 2018). Экологические ниши, расположенные вдоль желудочно-кишечного тракта от рта до ануса, содержат крупнейшие микробные сообщества, обнаруженные в организме человека, включая примерно 3.9 × 10 13 бактериальных клеток, которые можно исследовать в образцах фекалий, используя комбинацию геномного и культурального подходов (Browne et al., 2016; Sender et al., 2016). Магнитно-резонансная томография показывает, что толстый кишечник населен несколькими сотнями граммов микробов, что неудивительно, поскольку в нем созданы оптимальные условия для размножения микробов (т. Е. Постоянная температура, анаэробиоз и медленная перистальтика) (Bendezú García et al., 2016 ).
, 2018). Экологические ниши, расположенные вдоль желудочно-кишечного тракта от рта до ануса, содержат крупнейшие микробные сообщества, обнаруженные в организме человека, включая примерно 3.9 × 10 13 бактериальных клеток, которые можно исследовать в образцах фекалий, используя комбинацию геномного и культурального подходов (Browne et al., 2016; Sender et al., 2016). Магнитно-резонансная томография показывает, что толстый кишечник населен несколькими сотнями граммов микробов, что неудивительно, поскольку в нем созданы оптимальные условия для размножения микробов (т. Е. Постоянная температура, анаэробиоз и медленная перистальтика) (Bendezú García et al., 2016 ). Микробиота кишечника человека
Состав
Энтеротипы
Функции
Нарушение микробиоты кишечника
Влияние антибиотиков на кишечную микробиоту
Уменьшение разнообразия
Измененный метаболом
Устойчивость к антибиотикам
Клинические последствия использования антибиотиков
Краткосрочные и среднесрочные последствия
Диарея, связанная с антибиотиками
Инфекция Helicobacter pylori
Долгосрочные последствия
Выводы
Вклад авторов
Финансирование
Конфликт интересов
Благодарности
Ссылки







 , Тропини С., Франкель М.Р., Ван Треурен В., О’Лафлин К.Т., Меррилл Б.Д., Ю. Ф. Б., Прусс К.М., Оливейра Р.А., Хиггинботтом С.К., Нефф Н.Ф., Фишбах М.А., Ксавье К.Б., Зонненбург Д.Л., Хуанг KC.
Ng KM, et al.
Клеточный микроб-хозяин. 2020 7 октября; 28 (4): 628. DOI: 10.1016 / j.chom.2020.09.001.
Клеточный микроб-хозяин. 2020.
PMID: 33031771
Рефератов нет.
, Тропини С., Франкель М.Р., Ван Треурен В., О’Лафлин К.Т., Меррилл Б.Д., Ю. Ф. Б., Прусс К.М., Оливейра Р.А., Хиггинботтом С.К., Нефф Н.Ф., Фишбах М.А., Ксавье К.Б., Зонненбург Д.Л., Хуанг KC.
Ng KM, et al.
Клеточный микроб-хозяин. 2020 7 октября; 28 (4): 628. DOI: 10.1016 / j.chom.2020.09.001.
Клеточный микроб-хозяин. 2020.
PMID: 33031771
Рефератов нет.
 , Эль-хадер I, Каселлас Ф., Лопес Виванкос Дж., Гарсия Корс М., Сантьяго А., Куэнка С., Гварнер Ф., Маничан К.
Panda S и др.
PLoS One. 2014 18 апреля; 9 (4): e95476.DOI: 10.1371 / journal.pone.0095476. Электронная коллекция 2014 г.
PLoS One. 2014 г.
PMID: 24748167
Бесплатная статья PMC.
, Эль-хадер I, Каселлас Ф., Лопес Виванкос Дж., Гарсия Корс М., Сантьяго А., Куэнка С., Гварнер Ф., Маничан К.
Panda S и др.
PLoS One. 2014 18 апреля; 9 (4): e95476.DOI: 10.1371 / journal.pone.0095476. Электронная коллекция 2014 г.
PLoS One. 2014 г.
PMID: 24748167
Бесплатная статья PMC.

 , Алверди Дж., Гершуни В.
Тони Т. и др.
Нат Рев Гастроэнтерол Гепатол. 2021 декабрь; 18 (12): 903-911. DOI: 10.1038 / s41575-021-00519-0. Epub 2021 30 сентября.Нат Рев Гастроэнтерол Гепатол. 2021 г.
PMID: 34594028
Обзор.
, Алверди Дж., Гершуни В.
Тони Т. и др.
Нат Рев Гастроэнтерол Гепатол. 2021 декабрь; 18 (12): 903-911. DOI: 10.1038 / s41575-021-00519-0. Epub 2021 30 сентября.Нат Рев Гастроэнтерол Гепатол. 2021 г.
PMID: 34594028
Обзор.