Какую температуру сбивают: Что делать при ОРВИ с повышенной температурой?
Что делать при ОРВИ с повышенной температурой?
Осень, зима и начало весны — время простуд. Сказываются перепады температур, слякоть и дождь, нехватка ультрафиолета и витаминов: наши ослабленные организмы становятся легкой добычей для вирусов.
Острые респираторные вирусные инфекции (ОРВИ) — это целая группа заболеваний, вызываемых самыми различными вирусами. Их более 200 видов. Однако, несмотря на разнообразие возбудителей, проявления простуды во многом схожи: температура, озноб, головная боль, слабость, ломота в теле, насморк, першение и боль в горле, кашель и осиплость голоса.
У теплокровных организмов, к которым относится и человек, есть «встроенный терморегулятор» — гипоталамус. Он анализирует информацию как о внешней, так и о внутренней температуре. Если кожные температурные рецепторы сигнализируют о наружном холоде, гипоталамус «отдает приказ» уменьшить теплоотдачу и усилить теплопродукцию. В результате сужаются поверхностные сосуды, возникает дрожь, «гусиная кожа» — и человек согревается.
Внутреннюю температуру отслеживают непосредственно нейроны гипоталамуса. На их работу большое влияние оказывают пирогены — вещества, вызывающие повышение температуры тела. Пирогены вырабатываются при различных патологических процессах, в том числе при инфекционных заболеваниях. Под действием пирогенов гипоталамус настраивает организм на снижение теплоотдачи и повышение теплопродукции. Человек при этом чувствует озноб.
Повышение температуры при инфекционных заболеваниях носит защитный характер. Некоторые возбудители не выдерживают длительного повышения температуры и гибнут. Кроме того, при повышении температуры усиливается обмен веществ, в том числе активизируются иммунные процессы.1
Однако зачастую побочные эффекты повышения температуры оказываются более опасными, чем его защитная функция. При высокой температуре быстро истощаются адаптивные резервы организма, возникает риск обезвоживания, создается угроза для центральной нервной системы, повышается нагрузка на сердце, увеличивается вязкость крови.
Эти последствия могут нанести организму человека не меньший ущерб, чем сама инфекция.
Избавиться от нежелательных явлений, связанных с высокой температурой, помогают жаропонижающие средства. Исследования показали , что парацетамол действует непосредственно на центр терморегуляции в гипоталамусе. Парацетамол не позволяет гипоталамусу «отдать приказ» о повышенном производстве тепла в организме. При этом в очаге воспаления (например, на слизистых верхних дыхательных путей) иммунные процессы не тормозятся. Ощущение озноба проходит, в то время как организм продолжает бороться с инфекцией.
И вот парацетамол действует: температура тела уменьшается, а иммунная система продолжает сражаться с «инфекцией» — только теперь не активно атакует, а спокойно удерживает его распространение.
Использовать парацетамол эффективнее в комплексе с другими активными веществами, например с витамином С (он участвует в процессе образования в организме интерферонов — белков, которые вырабатываются в ответ на вирусное «вторжение»4).
В состав препаратов Терафлю входят парацетамол и другие активные компоненты (витамин С, фенилэфрин, фенирамин), которые помогают снизить температуру, уменьшить головную боль, ломоту в теле, насморк и другие симптомы простуды и гриппа5.
Терафлю с первого дня заболевания — для улучшения самочувствия и качества жизни6.
Памятка по гриппу | Министерство здравоохранения Калининградской области
Болеем правильно. Пять ошибок при лечении гриппа и ОРВИ, и как их избежатьПозавчера першило в горле, но вроде бы горячий чай помог. Вчера нос перестал дышать, но было столько работы, не хватило даже времени сходить за каплями в аптеку.
Так начинается череда ошибок, которые совершает большинство людей, вместо пути к выздоровлению выбирая дорогу к затяжной болезни и осложнениям.
Мы расскажем о пяти основных заблуждениях и объясним, почему так делать не надо.
Ошибка первая: некогда болеть
Все мы стали очень занятыми: у нас миллион дел и обязанностей. Болеть некогда, поэтому мы закидываем в себя на бегу лекарства, снимающие симптомы, глушим литрами горячий чай, и, кажется, что болезнь отступает. Часто, к сожалению, так действительно только кажется… Через несколько дней все может проявится снова, и, скорее всего, в усиленном виде. Если снова не обращать на болезнь внимания, легко дойти до серьезных осложнений.
Ошибка вторая: сбивать невысокую температуру
Да, мы понимаем: повышенная температура — это головная боль и мутное состояние. Поэтому большинство бросается пить жаропонижающие, как только видит на градуснике цифры 37 с хвостиком. А надо было бы радоваться повышению температуры тела. Ведь это признак того, что иммунитет работает, организм борется с болезнью. Запомните: не нужно сбивать температуру, если она ниже 38,5 градусов. Конечно, это не касается случаев, когда у больного сильная головная боль или есть склонность к судорогам.
Запомните: не нужно сбивать температуру, если она ниже 38,5 градусов. Конечно, это не касается случаев, когда у больного сильная головная боль или есть склонность к судорогам.
Ошибка третья: укутаться и закрыть все окна
При простуде или гриппе на больного часто нападает озноб, и его единственное желание — укутаться в десять одеял. Что он и делает, предварительно закрыв все окна в квартире. Не поступайте так! Обернитесь одиннадцатым одеялом, но проветривайте обязательно! Это поможет снизить концентрацию вирусов и нормализовать микроклимат в комнате. Если совсем не можете вытерпеть даже слегка приоткрытую форточку, выходите из комнаты каждые 2-3 часа, распахивайте окно настежь на пять минут (да, даже если зима), потом возвращайтесь в хорошо проветренную комнату.
Ошибка четвертая: пить антибиотики
Вы попробовали забить симптомы — все равно плохо… Полечились домашними средствами — не сильно лучше… «Да что ж такое!», — восклицаете вы и идете в аптеку за антибиотиками. Стоп! Разворачивайтесь домой. Врачи уже замучились объяснять, что антибиотики действуют против бактерий, а грипп и простуда — вирусные заболевания. Так что зря пропьете. Желудку навредите, а с болезнью не справитесь. Но даже в случае бактериальной инфекции антибиотики должен назначать врач. В последнее время бактерии выработали устойчивость ко многим препаратам, и поможет ли тот или иной в вашем случае, вы точно не угадаете. Принимая антибиотики бездумно, вы приучите к ним бактерии, и те перестанут их бояться.
Стоп! Разворачивайтесь домой. Врачи уже замучились объяснять, что антибиотики действуют против бактерий, а грипп и простуда — вирусные заболевания. Так что зря пропьете. Желудку навредите, а с болезнью не справитесь. Но даже в случае бактериальной инфекции антибиотики должен назначать врач. В последнее время бактерии выработали устойчивость ко многим препаратам, и поможет ли тот или иной в вашем случае, вы точно не угадаете. Принимая антибиотики бездумно, вы приучите к ним бактерии, и те перестанут их бояться.
Ошибка пятая, и самая главная: само пройдет…
Этих четырех пунктов могло бы и не быть, если бы мы серьезнее относились к соблюдению правил гигиены, правильной профилактике и грамотному лечению любых заболеваний. И это не сложно. Воздушно-капельные вирусы попадают в наш организм через слизистую оболочку носоглотки. Если она ослаблена или повреждена, вирусы ней они закрепляются и начинают размножаться. Иммунитет не справляется и развиваются заболевания: от простых, как мы считаем, простуд до ангин, бронхитов, пневмоний.
Надеемся, что наши советы помогут вам укрепить здоровье, а если и болеть, то не часто и не тяжело!
В Российской Федерации продолжается эпидемический сезон заболеваемости гриппом и ОРВИ, характерный для этого времени года.
Возбудители гриппа и ОРВИ передаются от человека к человеку воздушно-капельным путем и достаточно контагеозны (заразны).
При ОРВИ — острых респираторных вирусных инфекциях не гриппозной этиологии заболевание развивается постепенно, чаще всего начинается с утомляемости и насморка, сухого кашля, который затем переходит в мокрый.
При гриппе отмечается резкое ухудшение состояния – повышение температуры тела (в отдельных случаях до 40,5 градусов), головная боль, «ломота» в мышцах и суставах, чувствительность к свету. Наиболее активная фаза приходится на 3-5 день заболевания, выздоровление на 8-10 день.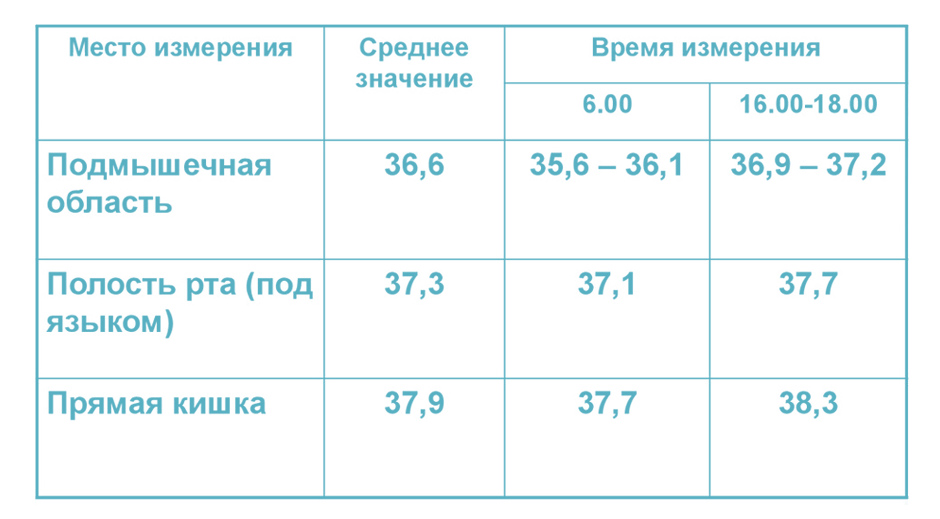
Особенно тяжело ОРВИ и грипп протекают у маленьких детей, пожилых людей, людей с хронической патологий и заболеваниями иммунной системы.
Лучшей защитой от гриппа является иммунизация. Вместе с тем от остальных ОРВИ прививка не защищает.
Для того чтобы предупредить заболевание необходимо укреплять и закалять свой организм. Высыпайтесь, соблюдайте режим труда и отдыха, старайтесь больше находится на свежем воздухе. Отправляясь на прогулку, одевайтесь по погоде, старайтесь не переохлаждаться при нахождении на улице. Если Вы промочили ноги, необходимо пропарить их сразу по возвращении домой.
Укреплению организма способствует правильное питание. Включите в рацион продукты, содержащие витамины А, С, цинк и кальций: цитрусовые, киви, сладкий перец, молочные и кисломолочные продукты, твердые сыры, отварную рыбу, говядину морковь со сметаной, изюмом или курагой и др.
При планировании посещения общественных мест возьмите с собой медицинскую маску: если в общественном месте чихают и кашляют, закройте рот и нос медицинской маской или носовым платком – это поможет предотвратить инфицирование.
Любое вирусное заболевание, перенесенное «на ногах», может привести в дальнейшем к нежелательным последствиям и осложнениям. К тому же заболевший человек заражает окружающих.
Поэтому необходимо при первых признаках заболевания обратиться к врачу.
С более подробной информацией о том, как защитить себя и близких от заражения гриппом и ОРВИ можно ознакомиться в специальном разделе на сайте Роспотребнадзора.
Будьте здоровы!
что делать и нужно ли её сбивать? – статьи о здоровье
Оглавление
Высокая температура у новорожденного ребенка является поводом для переживаний родителей. Опасна ли она? Нужно ли снижать ее и при каких значениях? Давайте разберемся.
Норма температуры
Важно понимать, что у недавно родившегося ребенка большинство систем организма являются сформированными, но функционально еще незрелыми. Касается это и центра терморегуляции. По этой причине процессы образования и выделения тепла несовершенны. Особенно ярко это проявляется у недоношенных крох. Они очень чувствительны к внешним условиям, могут быстро замерзать или перегреваться.
Нормальная температура у новорожденного может варьироваться в диапазоне от 37 до 37,5 градуса. Наиболее высокой она является вечером, в период с 18 до 22 часов. Утром показатели обычно более низкие.
Кроме того, температурные показатели во многом зависят от места измерения. Самыми высокими они являются в прямой кишке.
Как же определить нормальную температуру у новорожденного ребенка? Следует провести несколько контрольных замеров, когда ребенок не болен и спокоен. Лучше выполнить три измерения в один день и вычислить среднее значение.
Нужно ли сбивать высокую температуру у новорожденного?
Разберемся.
Существует несколько показаний к ее снижению:
- Температуру новорожденного (до 2 месяцев) нужно сбивать при показателях уже в 37,2–37,9 градуса
- При 38–39 градусах жаропонижающие назначают вне зависимости от возраста
- При показателях свыше 40–41 градуса обязательным является вызов скорой помощи (если не удается обойтись средствами из домашней аптечки)
Первая помощь
В любом случае нужно вызвать врача! Это обусловлено тем, что повышенная температура тела может быть признаком серьезной патологии. Важно понимать, что температурные показатели могут резко повышаться. При этом основная опасность состоит в том, что будут развиваться нарушения снабжения тканей и органов кровью.
Как добиться снижения показателей?
Создайте оптимальные условия окружающей среды. Лучше проветрить комнату и поддерживать в ней температуру не более 19–21 градуса. Если по каким-то причинам невозможно открыть окно, нужно воспользоваться кондиционером или вентилятором.
Ни в коем случае нельзя укутывать ребенка. Напротив, лучше переодеть его в сухую легкую одежду. Подгузник желательно снять. Дело в том, что некоторые современные модели закрывают до третьей части тела малыша и нарушают нормальный теплообмен и отведение избытка влаги.
Также в качестве меры скорой помощи можно рассматривать обтирания. Проводятся они салфетками, смоченными в воде. Важно! Вода не должна быть холодной! Ее идеальная температура – 36–37 градусов. Обтирание проводят от конечностей к телу. Такая процедура улучшает теплоотдачу благодаря испарению влаги, а небольшое трение стимулирует расширение сосудов.
Важно! Запрещено обтирать малышей спиртом, водкой или уксусом! Эти вещества небезопасны для крох. Вдыхание паров может стать причиной дальнейшего повышения температуры тела у новорожденного.
Также можно сделать компресс. Для него в воде смачивают салфетку. Периодически ее смачивают повторно, чтобы не допустить перегрева. При температуре новорожденного в пределах 38 градусов компрессы зачастую помогают существенно улучшить состояние малыша. Важно! Укутывания влажной простыней лучше не практиковать. В этом случае возможно затруднение потоотделения. Это может сократить теплоотдачу. Быстрее лихорадка спадет, если кожа малыша будет дышать.
Важно! Укутывания влажной простыней лучше не практиковать. В этом случае возможно затруднение потоотделения. Это может сократить теплоотдачу. Быстрее лихорадка спадет, если кожа малыша будет дышать.
Если температура у новорожденного повысилась существенно, то в паховую область, в зону подмышек, локтевые и подколенные сгибы, на сонные и височные артерии накладывают кусочки льда, предварительно обернутые в ткань. Также существуют и специальные медикаментозные средства для экстренного устранения признаков лихорадки. Но запастить ими следует заранее. Сегодня выпускаются грелки и охлаждающие пакеты, замерзающие гели.
Если такими способами сбить температуру новорожденному не удается, необходимо предпринять меры по предотвращению обезвоживания. Дело в том, что при лихорадке малыш может потеть. Нередко ситуация усугубляется диареей и рвотой. Все это приводит к быстрой потере организмом запасов воды. Если кроха находится на грудном вскармливании, его как можно чаще прикладывают к груди. Если малыш отказывается, ему дают воду из бутылочки. Важно! Давать сразу слишком много жидкости не следует. Достаточно 1–2 чайных ложек, но регулярно, примерно каждые 20–30 минут. Это обусловлено тем, что большой объем жидкости может ухудшить состояние, спровоцировав рвоту. Если уже отмечаются признаки обезвоживания (сухость слизистых, отсутствие слез, уменьшение количества выделяемой мочи), следует принимать специальные солевые растворы. Важно! Назначают и вводят их обычно после приезда врача или скорой помощи и под контролем специалистов.
Если малыш отказывается, ему дают воду из бутылочки. Важно! Давать сразу слишком много жидкости не следует. Достаточно 1–2 чайных ложек, но регулярно, примерно каждые 20–30 минут. Это обусловлено тем, что большой объем жидкости может ухудшить состояние, спровоцировав рвоту. Если уже отмечаются признаки обезвоживания (сухость слизистых, отсутствие слез, уменьшение количества выделяемой мочи), следует принимать специальные солевые растворы. Важно! Назначают и вводят их обычно после приезда врача или скорой помощи и под контролем специалистов.
Что делать, если нелекарственные способы не действуют, а температура у новорожденного продолжает расти?
Применяют медицинские препараты. Важно! Их перечень следует получить от педиатра в первые же дни жизни крохи. Важно обсудить с врачом те средства, которые можно безбоязненно давать ребенку при лихорадке. Обычно педиатры рекомендуют 2–3 таких препарата. Современные средства для малышей удобны в применении. Они выпускаются в виде сиропов, суспензий и ректальных свечей.
Важно! Особое внимание родители должны уделять не только разовой, но и суточной дозировке препарата. Она зависит от массы тела крохи и определяется индивидуально. Превышение дозы лекарственных веществ очень опасно. Оно может вызывать токсические реакции и тяжелые побочные эффекты.
Оценивать эффективность жаропонижающего средства можно спустя 30–40 минут после его использования. Обычно современные препараты снижают высокую температуру у новорожденного ребенка на 0,5–1,5 градуса. При этом точный эффект заранее предсказать невозможно, так как он зависит от персональной чувствительности к используемым веществам.
Важно! Родителям нужно понимать, что жар – это лишь признак патологии. Поэтому основные действия должны быть направлены не на устранение только лихорадки, а на устранение основных причин, которые привели к ней. Здесь не обойтись без помощи врача.
Преимущества обращения в МЕДСИ
- Опытные педиатры. Наши специалисты готовы оказать любую необходимую помощь малышу и его родителям (в том числе при болезнях с высокой температурой)
- Возможности для консультаций через приложение SmartMed.
 Эта услуга особенно актуальна в экстренных случаях. Наш врач расскажет, как сбить температуру новорожденному, ответит на вопрос, нужно ли вызывать скорую помощь, и др.
Эта услуга особенно актуальна в экстренных случаях. Наш врач расскажет, как сбить температуру новорожденному, ответит на вопрос, нужно ли вызывать скорую помощь, и др. - Возможности для комплексной диагностики. При необходимости вы сможете обратиться в клинику для прохождения обследования. Оно позволит выявить причины лихорадки и провести их устранение
- Возможности для лечения выявленных патологий. У нас работают специалисты, которые занимаются терапией широкого перечня заболеваний детей
- Комфортное посещение клиники. Мы позаботились об отсутствии очередей и обеспечили возможности для консультаций с врачами в удобное время
Чтобы уточнить условия предоставления услуг или записаться на прием, достаточно позвонить по номеру +7 (812) 336-33-33. Наш специалист ответит на все вопросы. Также запись возможна через приложение SmartMed.
Врач дала советы, когда и чем сбивать температуру при коронавирусе
Повышенная температура наблюдается у 9 из 10 пациентов с COVID-19, не считая тех, кто переносит инфекцию бессимптомно. Заболевание относится к группе ОРВИ, поэтому правила приема жаропонижающих препаратов стандартны. Однако, как рассказала врач-инфекционист Ольга Синицына, при коронавирусе крайне важно избегать самовольного лечения, оно должно происходить под руководством врача, что повысит шансы на выздоровление и исключит риск передозировки лекарствами.
Заболевание относится к группе ОРВИ, поэтому правила приема жаропонижающих препаратов стандартны. Однако, как рассказала врач-инфекционист Ольга Синицына, при коронавирусе крайне важно избегать самовольного лечения, оно должно происходить под руководством врача, что повысит шансы на выздоровление и исключит риск передозировки лекарствами.
По словам доктора, при заражении SARS-CoV-2 температура чуть выше 38 градусов является естественной реакцией организма. Таким образом организм мобилизует иммунную систему.
— Поэтому, если температура ниже 38,5 градуса, принимать медикаменты, которые помогают ее сбивать, не нужно. Исключение составляют случаи, когда повышенная температура плохо переносится больным — вызывает судороги, тахикардию, скачки давления, сильную ломоту в теле или невыносимую головную боль. В этом случае можно принять, например, спазмолитики. Но лучше попытаться справиться без лекарств, например, влажными обтираниями и большим количеством теплой жидкости (с малиной, лимоном, клюквой), а также частым проветриванием и увлажнением помещения, — рассказала Ольга Синицына aif. ru.
ru.
Врач напомнила, что для детей и пожилых людей критическое значение температуры составляет 38 градусов.
Сбивать необходимо температуру выше 38,9 градуса — при таких условиях организм подвергается угрозе. Подходящий препарат обязательно должен подобрать лечащий врач с учетом возраста, сопутствующих заболеваний и тяжести течения инфекции.
Известно, что при данном вирусе ни в коем случае не назначается аспирин. Специалист может прописать медикаменты на основе ибупрофена, но это вещество нельзя принимать при наличии нарушений желудочно-кишечного тракта (ЖКТ). Не рекомендуется оно и пожилым людям, поскольку на фоне вирусной инфекции у них может повыситься риск кровотечений.
В ВОЗ оптимальным жаропонижающим считают препараты на основе парацетамола, но относиться к его приему, несмотря на продажу без рецепта, нужно очень серьезно. Передозировка этим лекарством может нанести серьезный ущерб печени, почкам, ЖКТ, сердцу и мозгу.
— Передозировка может случиться, даже если принимать его в нормальных дозах. Это касается пожилых людей, больных с тяжелыми нарушениями функции печени, почек и кроветворной системы. Курс приема должен быть максимально коротким: у взрослых не дольше 3-5 дней, у детей — 3 дня. Чтобы избежать риска, необходимо строго соблюдать прописанные в инструкции правила, — пояснила доктор.
Это касается пожилых людей, больных с тяжелыми нарушениями функции печени, почек и кроветворной системы. Курс приема должен быть максимально коротким: у взрослых не дольше 3-5 дней, у детей — 3 дня. Чтобы избежать риска, необходимо строго соблюдать прописанные в инструкции правила, — пояснила доктор.
Она также призвала не сочетать друг с другом жаропонижающие и обезболивающие препараты, а также ни при каких условиях не принимать лекарства с истекшим сроком годности.
Когда и как «сбивать» температуру?
Уважаемые пациенты! В связи со сложившейся эпид обстановкой, нам крайне важно обезопасить вас и нас от возможного распространения вирусных инфекций. Поэтому просим вас приводить детей в клинику только с одним сопровождающим, во избежание лишних контактов.
Исключение «особенные» дети, требующие помощи на приемах и процедурах. Спасибо за понимание!
Администрация Клиники
Подъём температуры у ребёнка – это, как правило, симптом болезни, поэтому ребёнка нужно обязательно показать врачу.
- Температура – это защитная реакция организма, которая помогает работать иммунитету, поэтому далеко не всегда необходимо «сбивать» температуру.
- Лечения требует температура выше 38,5-39 град (если доктор не рекомендовал при более низких цифрах).
Общие рекомендации: ребенка максимально раздеть, комната должна проветриваться (но без сквозняков). Поить ребенка небольшими порциями, часто. Если аппетит снижен – не кормить насильно!
Детям категорически запрещено давать в таблетках АНАЛЬГИН и АСПИРИН!
Температура бывает «красная» и «белая», и методы воздействия при разных типах отличаются:
- «Красная» температура – ребенок горячий, ручки и ножки теплые или горячие. Начинать с физических методов охлаждения: обтирания салфеткой, смоченной водой 30 град температурой, прохладная салфетка на лоб. Из медикаментов можно использовать препараты парацетамола или ибупрофена (согласно инструкции).
 После приема парацетамола, при повторном повышении температуры, снова давать парацетамол можно не ранее, чем через 6 часов. Если 6 часов еще не истекли, а температура вновь поднимается до высоких цифр – можно дать препарат на основе ибупрофена.
После приема парацетамола, при повторном повышении температуры, снова давать парацетамол можно не ранее, чем через 6 часов. Если 6 часов еще не истекли, а температура вновь поднимается до высоких цифр – можно дать препарат на основе ибупрофена. - «Белая» температура – ребенок чаще бледный, кожа может быть «мраморной», ручки и ножки холодные, ребенок может жаловаться, что его морозит. При такой температуре не использовать физические методы охлаждения, питьё должно быть как можно теплее. Для того чтобы снять спазм периферических сосудов дать ребенку папаверин (1/4 -1/2 таб). Для снижения температуры можно использовать препараты парацетамола или ибупрофена (согласно инструкции). После приема парацетамола, при повторном повышении температуры, снова давать парацетамол можно не ранее, чем через 8 часов. Если 8 часов еще не истекли, а температура вновь поднимается до высоких цифр – можно дать препарат на основе ибупрофена.
Парацетамол разовая доза 10 -15 мг/кг Ибупрофен разовая доза 5-10 мг/кг
Как правильно сбивать температуру пожилым людям
Инфекции у пожилых людей, как и другие острые заболевания в этой возрастной группе, могут проявляться нетипичным, неклассическим образом. Высокая температура, главный признак инфекции, может отсутствовать или притупляться в 20–30% случаев.
Высокая температура, главный признак инфекции, может отсутствовать или притупляться в 20–30% случаев.
Отсутствие высокой температуры в свою очередь затрудняет диагностику заболеваний в старшей возрастной группе, которая и так находится в зоне риска, когда речь идет об инфекциях.
С другой стороны высокая температура у гериатрического пациента с большей степенью вероятности связана с серьезной вирусной или бактериальной инфекцией, чем лихорадка в молодом возрасте.
Профилактика, раннее распознавание и быстрое начало лечения — краеугольные камни успеха в борьбе с инфекционными заболеваниями, негативно влияющими на здоровье пожилых людей.
Нужно учитывать, что острые инфекции у пожилых людей не всегда сопровождаются повышением температуры. 1//3 “возрастных” пациентов не имеют выраженного температурного ответа организма на инфекцию.
Какова нормальная температура тела у пожилых людей?
Даже у молодого здорового населения наблюдается широкий разброс нормальной температуры тела. Подобное явление наблюдается и в пожилом возрасте. Хронические заболевания, биологические изменения в связи со старением и использование лекарств способствуют физиологической неоднородности, наблюдаемой у пожилых людей. Кроме того, измерение температуры тела осложняется влиянием циркадных ритмов и места измерения.
Подобное явление наблюдается и в пожилом возрасте. Хронические заболевания, биологические изменения в связи со старением и использование лекарств способствуют физиологической неоднородности, наблюдаемой у пожилых людей. Кроме того, измерение температуры тела осложняется влиянием циркадных ритмов и места измерения.
Были проведены исследования, которые установили, что средняя утренняя ректальная температура у здоровых пожилых людей составляла 37,3°C, тогда как средняя утренняя оральная температура составляла 36,7 ° C
Что делать при повышенной температуре в пожилом возрасте?
Высокая температура тела имеет несколько градаций:
- 38-38,5°С — легкий жар;
- 38,6- 39,5°С — умеренный;
- Выше 39,5°С — высокий.
Крайние значения, при которых жар становится опасным для нормальной жизнедеятельности организма, — 40,5-41°С. В пожилом возрасте критическим считается состояние при температуре 39°С и выше.
В отличие от молодых пациентов людям пожилого возраста рекомендуется сбивать температуру немедленно. Особенное значение этот момент имеет при лечении больных с сердечно-сосудистыми, легочными заболеваниями, деменцией. Жаропонижающие средства назначаются лечащим врачом с учетом общей клинической картины и совместимости с другими лекарствами, которые применяются для борьбы с хроническими недугами.
Особенное значение этот момент имеет при лечении больных с сердечно-сосудистыми, легочными заболеваниями, деменцией. Жаропонижающие средства назначаются лечащим врачом с учетом общей клинической картины и совместимости с другими лекарствами, которые применяются для борьбы с хроническими недугами.
Когда нужно сбивать температуру? | ЗДОРОВЬЕ
Нормальной температурой тела человека считаются значения от 35°С до 37°C. Повышение температуры говорит о том, что организм пытается с чем-то бороться. В большинстве случаев — с инородными агентами в организме в виде бактерий, вирусов, простейших. Также повышение температуры происходит при развитии воспалительной реакции вследствие физического воздействия на организм (ожог, обморожение, инородное тело). Повышенной температура может быть и при некоторых эндокринных, онкологических, гематологических и других заболеваниях. Любое повышение температуры является сигналом, что надо обратить внимание на своё здоровье.
При температуре около 38°C чужеродные агенты погибают, таким образом организм действительно борется с заболеваниями. Поэтому, сбивая температуру даже при незначительном её повышении, мы нарушаем работу защитных механизмов. При повышении температуры до 38,5°C у взрослых и до 38°C у маленьких детей принимать какие-либо жаропонижающие препараты не рекомендуется, так как доказано, что это может ухудшать течение болезни и приводить к развитию осложнений заболеваний.
Поэтому, сбивая температуру даже при незначительном её повышении, мы нарушаем работу защитных механизмов. При повышении температуры до 38,5°C у взрослых и до 38°C у маленьких детей принимать какие-либо жаропонижающие препараты не рекомендуется, так как доказано, что это может ухудшать течение болезни и приводить к развитию осложнений заболеваний.
Как же помочь человеку при повышенной температуре? Следует позаботиться, чтобы не было избыточного перегрева тела. Если человеку холодно и хочется одеться, необходимо это сделать, а если жарко, то стоит одеться в лёгкую хлопчатобумажную одежду. Рекомендуется постельный режим, свежий и прохладный воздух в помещении, частое питьё — морсы, компоты, разбавленные соки, чай с лимоном. Нельзя принимать душ или ванну, но можно обтираться водой комнатной температуры.
В любом случае повышения температуры, особенно если температура остаётся повышенной несколько дней, необходимо выяснить причину этого состояния и обратиться к врачу. Следует немедленно вызвать «скорую помощь»:
- если на фоне температуры наблюдается рвота;
- если температура сопровождается появлением сыпи;
- при судорогах и других тяжелых состояниях;
- если при температуре выше 38,5°C есть головная боль, заторможенность, сонливость;
- при температуре выше 39,5°C;
- если температура продолжает подниматься или не спадает, несмотря на принятые жаропонижающие препараты, назначенные врачом.

ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА МОРФОЛОГИЮ И ФИЗИОЛОГИЮ DROSOPHILA MELANOGASTER
ВНУТРИ ПОКОЛЕНИЯ И МЕЖДУ ПОКОЛЕНИЯМИ Мы исследовали влияние температуры развития и родительской температуры на некоторые физиологические и морфологические признаки взрослых особей Drosophila melanogaster. Мух родительского поколения выращивали при низкой или умеренной температуре (18 ° C или 25 ° C), а затем спаривали в четырех возможных температурных кроссах по половому признаку.Их потомство выращивали при температуре 18 ° C или 25 ° C, а затем оценивали как взрослых по морфологическим (сухая масса тела, размер крыла и меланизация брюшной полости [только для самок]), физиологическим (температура нокдауна и тепловая зависимость скорости ходьбы). ) и особенности жизненного цикла (размер яйца). Эксперимент был воспроизведен, и факторный план позволяет нам определить, влияет ли и как отцовская, материнская температура и температура развития (а также пол потомства) на различные черты. Секс и температура развития оказали большое влияние на все черты характера.У самок были более крупные тела и крылья, более высокие температуры сбивания и более медленные скорости (но схожая форма кривых производительности), чем у самцов. Развитие при 25 ° C (по сравнению с 18 ° C) увеличило температуру нокдауна, увеличило максимальную скорость и ширину тепловых характеристик, снизило оптимальную температуру для ходьбы, уменьшило массу тела и размер крыла, уменьшило меланизацию брюшной полости и уменьшило размер яиц. Температура родителей влияла на несколько черт, но в целом влияние было незначительным по сравнению с полом или температурой развития.Мухи, чья мать была выращена при 25 ° C (по сравнению с 18 ° C), имели немного более высокую температуру нокдауна и меньшую массу тела. У мух, отец которых был выращен при 25 ° C, были относительно более длинные крылья. Эффекты отцовской, материнской температуры и температуры развития иногда различались по направлению. Существование значительных эффектов внутри и между поколениями предполагает, что сравнительные исследования должны стандартизировать тепловую среду как минимум для двух поколений, что попытки оценить «полевую» наследственность могут быть ненадежными для некоторых признаков и что прогнозы краткосрочных эволюционных реакций к отбору будет сложно.
Секс и температура развития оказали большое влияние на все черты характера.У самок были более крупные тела и крылья, более высокие температуры сбивания и более медленные скорости (но схожая форма кривых производительности), чем у самцов. Развитие при 25 ° C (по сравнению с 18 ° C) увеличило температуру нокдауна, увеличило максимальную скорость и ширину тепловых характеристик, снизило оптимальную температуру для ходьбы, уменьшило массу тела и размер крыла, уменьшило меланизацию брюшной полости и уменьшило размер яиц. Температура родителей влияла на несколько черт, но в целом влияние было незначительным по сравнению с полом или температурой развития.Мухи, чья мать была выращена при 25 ° C (по сравнению с 18 ° C), имели немного более высокую температуру нокдауна и меньшую массу тела. У мух, отец которых был выращен при 25 ° C, были относительно более длинные крылья. Эффекты отцовской, материнской температуры и температуры развития иногда различались по направлению. Существование значительных эффектов внутри и между поколениями предполагает, что сравнительные исследования должны стандартизировать тепловую среду как минимум для двух поколений, что попытки оценить «полевую» наследственность могут быть ненадежными для некоторых признаков и что прогнозы краткосрочных эволюционных реакций к отбору будет сложно.
Ключевые слова: Акклиматизация; Drosophila melanogaster; размер тела; окраска; эффекты развития; размер яйца; передвижение; материнские эффекты; отцовские эффекты; температура.
Температура: цифровые и стеклянные термометры
См. Руководство по лихорадке на последней странице «Руки помощи», чтобы узнать, что рекомендуется для Твой ребенок.
Виды термометров
- Цифровые термометры (лучше всего использовать)
- Стекло (не рекомендуется)
- Полоски от лихорадки (не рекомендуется)
Каждый градусник выглядит по-разному.Знайте, какой тип вы используете.
Способы измерения температуры
- Ректальный. Термометр помещается в попку ребенка. Считается, что это самый точная температура.
- Устный. Термометр помещается во рту под язык.
 Примечание: соска цифровая
термометры не рекомендуются. Они могут быть неточными.
Примечание: соска цифровая
термометры не рекомендуются. Они могут быть неточными. - Подмышечный. Термометр помещается в подмышку.
- Tympanic. Термометр помещается в ухо.
- Височная артерия. Термометр сканирует поверхность лба. Эти иногда используется для проверки на лихорадку. Если температура выше нормы (больше чем 101 ° F), его необходимо измерять с помощью более точного термометра. Временный Артериальные термометры не следует использовать у младенцев.
Как измерить температуру
Дети передвигаются. Возможно, вам придется подержать градусник и подержать ребенка за в то же время, чтобы получить правильную температуру.В целях безопасности никогда не оставляйте ребенка одного, пока вы используют термометр.
При использовании стеклянного термометра (не рекомендуется) получение правильного значения может занять немного больше времени.
температура. Помните: вы вставляете кусок стекла в тело ребенка. Никогда не оставляйте ребенка одного во время измерения температуры.
Никогда не оставляйте ребенка одного во время измерения температуры.
Ректальная температура
- Используйте термометр с коротким наконечником. У этого типа термометра меньше шансов порвать кожа (ткань) внутри прямой кишки ( Фото 1 ).
- Положите подгузник или другую ткань себе на колени. Место ваш ребенок поверх набивки на животе или обратно. Измерение ректальной температуры может вызвать ребенок испражняется.
- Нанесите небольшое количество вазелина, например Вазелин® на кончике термометра.
- Осторожно введите наконечник в прямую кишку ( Рисунок 2 ).
Никогда не пытайтесь силой повернуть термометр.
- Если вашему ребенку меньше 3 месяцев, поместите его в прямая кишка только ½ дюйма.Серебряный наконечник на конец термометра составляет около ½ дюйма.
- Если вашему ребенку больше 3 месяцев, положите
термометр примерно на 1 дюйм в прямую кишку.

- Удерживайте термометр на месте. Вы услышите звуковой сигнал примерно через 30 секунд. Для стекла термометры, подержите на месте 3 минуты. Выньте термометр и прочтите температура.
Температура полости рта
- Используйте термометр с длинным тонким наконечником ( Рисунок 1 ).
- Убедитесь, что ваш ребенок не ел и не пил ничего горячего или холодного в течение 20 минут. вы измеряете его температуру.
- Если ваш ребенок настолько болен, что не может сдержать дрожь, не измеряйте температуру в полости рта. Измерьте температуру по-другому.
- Поместите кончик термометра в рот ребенка, под языком и близко к середине ( Фото 3 ). Скажите ребенку, чтобы он держал губы плотно закрытыми.
- Если ваш ребенок не может удерживать термометр
его язык и пальцы, не прикусывая его, держите его на месте
для него.Вы услышите звуковой сигнал примерно через 30 секунд.
 За
стеклянные термометры, подержать на месте 3 минуты. Брать
термометр и считайте температуру.
За
стеклянные термометры, подержать на месте 3 минуты. Брать
термометр и считайте температуру.
Температура барабанной перепонки
- Если ваш ребенок был на улице в холодный день или перегрелся из-за игры, его необходимо внутрь в течение 15 минут, прежде чем измерять температуру таким образом.
- Сера, ушные инфекции и ушные трубки не удерживают вам от получения правильных показаний.
- Медленно потяните за ухо ребенка назад, чтобы выпрямить слуховой проход (задний и верхний, если старше 1 года) ( Рисунок 4 ).
- Осторожно вставьте кончик термометра в ухо до упора. останавливается. Кончик должен указывать на пространство между глазами. и ухо с другой стороны головы.
- Если примерно через 2 секунды вы услышите звуковой сигнал, снимите термометр и считайте температуру.
Температура в подмышечной области
- Используйте оральный термометр с длинным тонким наконечником ( Рисунок 1 ).

- Убедитесь, что подмышки ребенка сухие.
- Поместите кончик термометра под руку ребенка так, чтобы он касается только кожи.Он не должен касаться одежды ( Рисунок 5 ).
- Прижмите плечо ребенка к груди, чтобы рука еще и градусник на месте.
- Цифровым термометрам может потребоваться более 30 секунд, прежде чем звуковой сигнал при использовании этого метода. Стеклянные термометры необходимо удерживать на месте от 7 до 10 минут. Снимаем термометр и прочтите температуру.
- Поскольку температура в подмышечных впадинах занимает немного больше времени, чтение книги или просмотр телевизора может помочь удержать ребенка в неподвижности.
Виды стеклянных термометров (не рекомендуются)
Стеклянные ртутные термометры больше не рекомендуются и могут быть опасными. Там
представляют серьезную опасность для здоровья, если стеклянный ртутный термометр разбивается. Ртуть токсична, если
при вдыхании или при попадании жидкости на кожу.
Есть два вида стеклянных термометров: ртутные и безртутные.
Стеклянный безртутный термометр. Если вы решили использовать стеклянный термометр, выберите один это не содержит ртути, например Geratherm®.Стеклянные безртутные термометры имеют серебряный наконечник. Серебряная линия проходит вдоль чисел, чтобы показать температуру. Вы можете увидеть синяя линия, заполняющая дополнительное пространство, которое не занято серебряной линией. Противоположный конец с цветовой кодировкой. Зеленый — для орального или подмышечного, а красный — для ректального ( Рисунок 6 ). Чтобы быть уверенным, проверьте пакет, чтобы узнать, какой у вас термометр.
Термометр стеклянный ртутный. Стеклянные ртутные термометры также имеют серебряный наконечник.Темный Линия проходит по цифрам, чтобы показать температуру. Наконечник орального или подмышечного стекла ртутный градусник длинный и узкий.
 Наконечник ректального стеклянного ртутного термометра
короткий и круглый. Пространство, не занятое темной линией ртути, обычно чистое.
Наконечник ректального стеклянного ртутного термометра
короткий и круглый. Пространство, не занятое темной линией ртути, обычно чистое.
Как читать стеклянный термометр
- Проверьте, какой у вас термометр.
- Проверьте кончик стеклянного термометра, чтобы убедиться, что он не сломан и не потрескался.Не надо используйте сломанный или треснувший термометр.
- Держите термометр на уровне глаз цифрами к себе.
- Найдите числа и шкалу измерения черных линий ( Рисунок 8 ). Эти вертикальные (вверх
и вниз) линии обозначают градусы температуры. Большинство термометров имеют две шкалы.
для температуры, Фаренгейта и Цельсия. Прочтите числа для ° F (градусы
Фаренгейт).
- Каждая длинная строка предназначена для температуры 1 ° F.
- Четыре более короткие строки между каждой длинной строкой соответствуют 0.2 ° F (две десятых) градуса
температура.

- Найдите линию жидкости, проходящую между числами и вертикальными черными линиями.
Считайте число, которое ближе всего к тому месту, где заканчивается столб жидкости. Например:
Температура термометра всегда должна начинаться ниже первого числа в строке. При необходимости встряхните стеклянный термометр. Крепко возьмитесь за конец, противоположный кончик и резко взмахните запястьем.Будьте осторожны, чтобы перед тряска ( Рисунок 9 )
Уход за термометром
- Очищайте термометр до и после использования прохладной мыльной водой. Или это может быть продезинфицировать спиртовым тампоном или ватным тампоном, смоченным в спирте. Никогда не используйте горячую воду, отбеливатель или бытовые чистящие средства на термометре. Не мыть в посудомоечной машине.
- Не убирайте его, не вымыв предварительно.
 Грязный термометр может заразить ваш
снова ребенок.
Грязный термометр может заразить ваш
снова ребенок. - Храните в безопасном, прохладном и недоступном для детей месте. Стеклянные термометры должны храниться в пластиковом контейнере.
- Если ртутный термометр сломался, позвоните в Центральный токсикологический центр Огайо по телефону 1-800-222-1222. Они расскажут, как избавиться от ртути.
- В случае поломки безртутного термометра его можно очистить бумажными полотенцами с мылом. Жидкость не токсична.
Когда звонить врачу
Большинство врачей согласны с тем, что температура выше 101 ° F — это лихорадка.Однако вам может не понадобиться вызывать врача каждый раз, когда у вашего ребенка повышается температура. Обычно температура ниже 101 ° F не нужно лечить, если вашему ребенку некомфортно.
Информацию о лихорадке и лечении, включая лекарства, см. В Helping Hand HH-I-105, Высокая температура.
Немедленно позвоните врачу вашего ребенка, если у вашего ребенка высокая температура И:
- Моложе 3 месяцев и ректальная температура выше 100,4 ° F или ниже
чем 96.
 5 ° F,
5 ° F, - Выглядит очень больным, очень суетливым или с трудом просыпается
- С ригидностью шеи, сильной головной болью, сильной болью в горле или сильной болью в животе
- Повторная рвота и диарея
- Имеются признаки обезвоживания, такие как сухость или липкость во рту, запавшие глаза или отсутствие мочеиспускания.
- Обнаружена новая кожная сыпь
- Был припадок. См. Рука помощи HH-I-195, Лихорадка и судороги (Лихорадочные припадки)
- Имеет хроническое заболевание или заболевание, снижающее иммунитет, например серповидноклеточную анемию, рак. или частое употребление оральных стероидов
- Побывал в очень жарком месте, например, в перегретой машине
- Температура поднимается выше 104 ° F снова и снова и не проявляет других признаков (для всех детей)
- Лихорадка возвращается через семь дней (для всех детей)
- Вы не знаете, нужно ли вашему ребенку лечение
Таблица на следующей странице поможет вам узнать, когда звонить по телефону здоровья вашего ребенка. провайдер.Если вы звоните, обязательно сообщите, какой метод вы использовали для измерения температуры.
провайдер.Если вы звоните, обязательно сообщите, какой метод вы использовали для измерения температуры.
Fever Guide ° F (градусы Фаренгейта) | |||
Детский возраст | Обычное | Позвонить врачу | Позвоните 911 или обратитесь в отделение неотложной помощи (ED) |
От рождения до 3 месяцев (только ректально) | |||
Ректально (в попе ребенка) | 96. | более 100,4 ° F или менее 96,5 ° F | при температуре выше 100,4 ° F или ниже 96,5 ° F ребенок выглядит больным |
Оральный (под язык) | НЕ РЕКОМЕНДУЕТСЯ | ||
Ухо (барабанное) | |||
Подмышечная (подмышечная) | |||
от 4 до 24 месяцев (1 вариант — ректально, 2 вариант — ухо, 3 вариант — подмышечный) | |||
Ректально (в попе ребенка) | До 100.4 ° F | более 100,4 ° F в течение 3 дней или более 102 ° F, и ребенок выглядит больным | 105 ° F и ребенок не реагирует на лекарства от лихорадки |
Оральный (под язык) | НЕ РЕКОМЕНДУЕТСЯ | ||
Ухо (барабанное) | до 99 ° F | 104 ° F Измерьте ректальную температуру | |
Подмышечная (подмышечная) | до 99 ° F | 103 ° F Измерьте ректальную температуру | |
от 2 до 4 лет (1-й вариант — ректально, 2-й вариант — ухо, 3-й вариант — подмышечный) | |||
Ректально (в попе ребенка) | До 100. | более 102 ° F | 105 ° F и ребенок не реагирует на лекарства от лихорадки . |
Оральный (под язык) | НЕ РЕКОМЕНДУЕТСЯ | ||
Ухо (барабанное) | до 99 ° F | 104 ° F Измерьте ректальную температуру | |
Подмышечная (подмышечная) | до 99 ° F | 103 ° F Измерьте ректальную температуру | |
4 года и старше (1-й вариант — оральный, 2-й вариант — ухо, 3-й вариант — подмышечный) | |||
Ректально (в попе ребенка) | До 100. | более 102 ° F и длится более 3 дней или 104 ° F | 105 ° и ребенок не реагирует на лекарства от лихорадки |
Оральный (под язык) | До 99,4 ° F | более 102 ° F и длится более 3 дней или 104 ° F | |
Ухо (барабанное)) | до 99 ° F | 104 ° F Измерьте оральную или ректальную температуру | |
Подмышечная (подмышечная) | до 99 ° F | 103 ° F Измерьте оральную или ректальную температуру | |
Температурные цифровые и стеклянные термометры (PDF)
HH-II-189 4/11 Пересмотрено 17 февраля Copyright 1975 Общенациональная детская больница
Fever | Сидарс-Синай
Не то, что вы ищете?Что такое жар?
Лихорадка — это температура тела, при которой
выше, чем обычно. Это часто означает, что в
тело. Физические упражнения, жаркая погода и вакцины также могут вызвать повышение температуры тела.
Это часто означает, что в
тело. Физические упражнения, жаркая погода и вакцины также могут вызвать повышение температуры тела.
Что вызывает жар?
Лихорадка — это не болезнь. сам. Скорее, это симптом того, что в организме что-то не так. Лихорадка не говорит вам, что вызывает это, или даже о наличии болезни. Это может быть а бактериальная или вирусная инфекция.Или это может быть реакция от аллергии на еду или лекарство. Перегрев во время игры или на солнце также может вызвать жар. Там являются а также многие другие причины лихорадки.
Каковы симптомы лихорадки?
Нормальная температура тела колеблется от
От 97,5 до 99,5 ° F (от 36,4 до 37,4 ° C). Утром он обычно бывает ниже и выше. в
вечер.Большинство поставщиков медицинских услуг считают, что температура составляет 100,4 ° F (38 ° C) или выше.
У человека с температурой от 99,6 до 100,3 ° F наблюдается субфебрильная температура. Высокая температура
мая
вызвать судороги или спутанность сознания у детей. Дело не в том, насколько высока температура, а
как
быстро повышается температура, что вызывает судороги.
в
вечер.Большинство поставщиков медицинских услуг считают, что температура составляет 100,4 ° F (38 ° C) или выше.
У человека с температурой от 99,6 до 100,3 ° F наблюдается субфебрильная температура. Высокая температура
мая
вызвать судороги или спутанность сознания у детей. Дело не в том, насколько высока температура, а
как
быстро повышается температура, что вызывает судороги.
У лихорадки есть и другие симптомы, помимо температуры выше нормы. Это особенно важно при уходе за младенцами, маленькими детьми и инвалидами.Эти группы могут быть не в состоянии выразить свои чувства. Признаки, которые означают лихорадку, включают:
- Промыть лицо
- Горячая, сухая кожа
- Низкий диурез или темная моча
- Не хочу есть
- Запор или диарея
- Рвота
- Головная боль
- Все болит
- Тошнота
Как диагностировать лихорадку?
Лучший способ диагностировать лихорадку — это измерить температуру
термометр. Существует несколько видов термометров, таких как:
Существует несколько видов термометров, таких как:
- Цифровой термометр (оральный, ректальный или под мышкой)
- Термометр барабанный (ушной) (не рекомендуется для детей младше 6 месяцев)
- Височная артерия (измеренная температура по области лба)
Ректальное измерение температуры самый точный метод у детей младше 3 лет.У детей старшего возраста и взрослым измерять температуру под мышкой или во рту. Поговорите со своим врачом о том, как лучше всего измерить вашу температуру.
Термометры ртутные
Большинство термометров сегодня
цифровой. Но до сих пор используются стеклянные термометры, содержащие ртуть. Ртуть — токсичное вещество.Это опасно для человека и окружающей среды. Так как
стеклянные термометры могут разбиться, их следует утилизировать в соответствии с местными,
государственные и федеральные законы. Для получения информации о том, как безопасно утилизировать ртуть
термометра, обратитесь в местный отдел здравоохранения, в орган по утилизации отходов или в пожарный
отделение.
Ртуть — токсичное вещество.Это опасно для человека и окружающей среды. Так как
стеклянные термометры могут разбиться, их следует утилизировать в соответствии с местными,
государственные и федеральные законы. Для получения информации о том, как безопасно утилизировать ртуть
термометра, обратитесь в местный отдел здравоохранения, в орган по утилизации отходов или в пожарный
отделение.
Если ртутный термометр сломался, попросите всех покинуть это место,
включая домашних животных.Откройте все окна и двери наружу. Но закрой все двери для
остальная часть дома. Убедитесь, что беременные женщины покинули это место. Назовите свой местный яд
Центр управления по телефону 800-222-1222. Они расскажут, как очистить ртуть. Не надо
пусть дети помогут убрать разлив. Не используйте пылесос или метлу для уборки
вверх
капельки. Не сливайте ртуть в канализацию.
Не сливайте ртуть в канализацию.
Как лечить лихорадку?
Вы можете лечить лихорадку с помощью ацетаминофен или ибупрофен в дозах, рекомендованных вашим лечащим врачом.Переключение между приемом парацетамола и ибупрофена может вызвать медицинские ошибки и привести к к побочные эффекты. Но иногда это работает лучше, чем использование только одного или другого. Никогда давать аспирин ребенку или молодому человеку, у которого есть лихорадка. Аспирин может вызвать расстройство желудка и кишечное кровотечение. Это также может вызвать у Рейя синдром. Это редкое, но очень серьезное заболевание, которое может поражать все органы тела.Но чаще всего травмирует мозг и печень.
Теплая ванна может уменьшить
высокая температура. Спиртовые обтирания больше не рекомендуются.
Спиртовые обтирания больше не рекомендуются.
Позвоните своему врачу, чтобы узнать руководство в любое время, когда вас беспокоит лихорадка. Также позвоните своему врачу если температура быстро повышается или сохраняется, несмотря на лечение.
Когда мне следует позвонить своему врачу?
Немедленно позвоните своему врачу, если у ребенка младше 3 месяцев температура Старый.
Позвоните или немедленно обратитесь за медицинской помощью если какой-либо из этих симптомов сопровождается лихорадкой:
- Изъятие
- Чувство вялости или сонливости
- Нерегулярное дыхание
- Жесткая шея
- Путаница
- Сыпь пурпурная пятнистая
- Боль в ухе (ребенок дергает себя за ухо)
- Боль в горле, которая не проходит
- Рвота
- Диарея
- Болезненное, жжение или частое мочеиспускание
Основные сведения о лихорадке
- Лихорадка сама по себе не болезнь.
 Скорее, это признак того, что в организме что-то не так.
Скорее, это признак того, что в организме что-то не так. - Болезнь, физическая нагрузка, жаркая погода и вакцины могут вызвать повышение температуры тела.
- Помимо повышенной температуры обратите внимание на другие признаки, такие как покраснение лица, горячая кожа, низкий диурез, потеря аппетита, головная боль или другие симптомы инфекции или болезнь.
- После того, как вы определили, что у человека высокая температура, вы можете лечить его, давая ацетаминофен или ибупрофен в дозах посоветовал ваш лечащий врач.Никогда не давайте аспирин детям или подросткам, у которых есть а высокая температура.
- Позвоните своему врачу, если
у ребенка младше 3 месяцев жар. Или немедленно обратитесь за медицинской помощью, если поднялась температура.
 возникает с судорогами, летаргией, нерегулярным дыханием, ригидностью шеи, спутанностью сознания или другими причинами.
признаки тяжелого заболевания.
возникает с судорогами, летаргией, нерегулярным дыханием, ригидностью шеи, спутанностью сознания или другими причинами.
признаки тяжелого заболевания.
Следующие шаги
Советы, которые помогут вам получить максимальную пользу от визита к врачу:
- Знайте причину вашего визита и то, что вы хотите.
- Перед визитом запишите вопросы, на которые хотите получить ответы.
- Возьмите с собой кого-нибудь, кто поможет вам задать вопросы и запомнить, что говорит ваш поставщик ты.
- При посещении запишите имя новый диагноз и любые новые лекарства, методы лечения или тесты. Также запишите любые новые инструкции, которые дает вам ваш провайдер.
- Узнайте, почему прописано новое лекарство или лечение и как они вам помогут.
 Также
знать, каковы побочные эффекты.
Также
знать, каковы побочные эффекты. - Спросите, можно ли вылечить ваше состояние другими способами.
- Знайте, почему рекомендуется тест или процедура и что могут означать результаты.
- Знайте, чего ожидать, если вы не примете лекарство, не пройдете тест или процедуру.
- Если у вас назначена повторная встреча, запишите дату, время и цель для этого визит.
- Узнайте, как можно связаться с вашим провайдером Если у вас есть вопросы.
Медицинский обозреватель: Барри Зингман, доктор медицины
Медицинский обозреватель: Раймонд Терли младший PA-C
Медицинский обозреватель: L Renee Watson MSN RN
© 2000-2021 Компания StayWell, LLC. Все права защищены. Эта информация не предназначена для замены профессиональной медицинской помощи. Всегда следуйте инструкциям лечащего врача.
Всегда следуйте инструкциям лечащего врача.
Прогноз гроз после рекордной жары
Так что же такое гондола для мороженого?
City Park Gelato & aMore представил на лето целый парк велосипедных тележек или гондол для мороженого.
Эрин Уделл, Форт-Коллинз, Колорадо
После рекордной волны тепла, обрушившейся на Форт-Коллинз, на горизонте ожидаются грозы и более низкие температуры, чтобы немного облегчить ситуацию.
В четверг в Форт-Коллинзе третий день подряд наблюдается рекордно высокая температура. По данным Климатического центра Колорадо, температура достигла 98 градусов во вторник, 100 градусов в среду и 99 градусов в четверг.
По словам государственного климатолога и директора Колорадского климатического центра Русса Шумахера, высокая температура в четверг побила предыдущий рекорд 17 июня в 97 градусов в 2007 году.
Высокая температура во вторник побила предыдущий рекорд Форт-Коллинза 15 июня в 94 градуса, который до этой недели был трехсторонним между 1946, 1952 и 1977 годами. Максимум среды побил предыдущий дневной температурный рекорд в 95 градусов, который был зафиксирован 16 июня 1940 года.
Максимум среды побил предыдущий дневной температурный рекорд в 95 градусов, который был зафиксирован 16 июня 1940 года.
По данным Национальной метеорологической службы, в пятницу днем температура достигла 94 градусов, что далеко от рекордного на тот момент максимума в 100 градусов.
УДАР: 5 способов остыть в Форт-Коллинзе
По прогнозам, в ближайшие несколько дней над Северным Колорадо пройдут грозы.
По состоянию на полдень пятницы Национальная метеорологическая служба прогнозирует 30% -ную вероятность гроз и максимум 92 градусов в субботу и 20% -ную вероятность штормов и максимум 89 градусов в воскресенье.
Грозы будут более вероятными с вечера воскресенья по понедельник, с 40% вероятностью дождя и высокой температурой в 73 градуса в понедельник.
Рекордная жара на этой неделе сопровождалась несколькими, в основном не связанными с этим, отключениями электроэнергии, от которых до утра четверга пострадали тысячи жителей района Тимнат.
Отключения по выходным в Тимнате были вызваны неисправностью электросети и обрушенной линией электропередачи, говорится в городском выпуске новостей. В автокатастрофе на Малберри-стрит сломалась опора электропередачи, что привело к отключению электричества во вторник.
Сильный ураган обрушил несколько опор в среду, что привело к отключению тысяч клиентов Xcel в округе Лаример, Тимнате и Виндзоре примерно с 14:30. Со среды до 10:30 четверга.
Высокие температуры и высокий спрос вызвали отключение трансформатора на главной подстанции на несколько часов в четверг.
Колорадский репортер Эрин Уделл и исполнительный редактор Колорадо Эрик Ларсен внесли свой вклад в этот отчет.
Сэди Суонсон занимается вопросами общественной безопасности, уголовного правосудия, правительства округа Лаример и многого другого в Северном Колорадо.Вы можете отправить ей свои идеи по адресу [email protected] или в Twitter по адресу @sadyswan. Поддержите ее работу и работу других журналистов из Колорадо, купив цифровую подписку сегодня.
Как измерить температуру вашего ребенка
Во время Пандемия COVID-19, родителям может потребоваться проверить своих детей на наличие симптомов, включая лихорадку, прежде чем они отправятся в больницу. школа, уход за детьми, или спортивные занятия. Ощупывание лба вашего ребенка происходит быстро, но не очень точно.Большинство современных цифровых термометров работают быстро и просты в использовании.
Какой термометр лучше всего подходит для моего ребенка?
Для определения температуры ребенка лучше всего использовать цифровой термометр. НЕ используйте ртутный термометр. Эти тонкие стеклянные устройства, наполненные серебристым металлом, могут сломаться и высвободиться. токсичные уровни паров ртути. Фактически, если у вас есть дома ртутный термометр, вам следует убери это.
Что такое нормальная температура и что считается лихорадкой?
«Нормальная» температура зависит от возраста, активности и времени суток ребенка. А
лихорадка обычно имеет температуру 100,4 градуса по Фаренгейту (38 градусов по Цельсию) или выше. Это признак того, что организм борется с болезнью. Температура, возраст вашего ребенка и другие признаки болезни помогут вашему врачу порекомендовать лечение, которое лучше всего подходит для вашего ребенка.
А
лихорадка обычно имеет температуру 100,4 градуса по Фаренгейту (38 градусов по Цельсию) или выше. Это признак того, что организм борется с болезнью. Температура, возраст вашего ребенка и другие признаки болезни помогут вашему врачу порекомендовать лечение, которое лучше всего подходит для вашего ребенка.
Какие бывают типы цифровых термометров?
Существуют разные типы цифровых термометров, которые измеряют температуру в разных частях тела. Ректальная (в анусе) температура является наиболее точной.Следующими по точности являются температура лба. Температура полости рта и ушей является точной, если все сделано правильно. Температура подмышек является наименее точной, но вы можете использовать этот метод для проверки ребенка любого возраста.
Какой бы подход вы ни использовали, перед использованием следуйте инструкциям по очистке на упаковке.
Вот 3 типа цифровых термометров:
Цифровой многоцелевой термометр
Измеряет температуру в нижней части тела ребенка (ректально), во рту (орально) или подмышечной впадине (подмышечные области).

Пероральное использование не рекомендуется, пока ребенку не исполнится 4 года и старше.
Считывает температуру тела, когда датчик, расположенный на кончике термометра, касается этой части тела.
Важно обозначить термометр «оральный» или «ректальный», чтобы его нельзя было использовать в обоих местах.
Височная артерия
Измеряет инфракрасные тепловые волны, исходящие от кровеносного сосуда, проходящего через лоб чуть ниже кожи.
Подходит для любого возраста.
Температура измеряется на боковой и передней части лба, в зависимости от того, бесконтактная это модель или модель «без прикосновения». Перед использованием ознакомьтесь с инструкциями, чтобы узнать, насколько близко ко лбу и другими советами.
Бесконтактные модели могут помочь снизить риск передачи микробов.
Прямой солнечный свет и низкие температуры после пребывания на улице могут повлиять на чтение.

Барабанная
Измеряет температуру в ухе ребенка, считывая инфракрасные тепловые волны от барабанной перепонки.
Для детей от 6 месяцев. Не надежен для младенцев, у которых слуховые проходы слишком узкие
Чтобы быть точным, его необходимо правильно поместить в слуховой проход вашего ребенка (см. «Температура уха» ниже).
Низкие температуры после пребывания на улице могут повлиять на показания.
Как пользоваться цифровым термометром
Чтобы получить правильные показания термометра, важно , чтобы всегда следовать инструкциям, прилагаемым к устройству .
Ректальная температура
Измерение ректальная температура дает наилучшие показания, особенно для младенцев в возрасте до 3 месяцев. Вот как измерить ректальную температуру:
Нанесите небольшое количество смазки, например, вазелина, на конец термометра и на попку ребенка.

Положите ребенка животом на колени или на твердую поверхность. Другой способ — на спине, подтянув ноги к груди.Включите термометр и вставьте его на 1/2 дюйма (для детей младше 6 месяцев) на 1 дюйм в задний проход. Быть нежным. Никакого сопротивления быть не должно. Если есть, остановись. Держите ребенка неподвижно. Оставьте термометр на месте, пока он не издаст звуковой сигнал. Затем снимите и проверьте цифровое считывание.
- Термометры следует дезинфицировать до и после использования дезинфицирующим мылом и водой или дезинфицирующим спиртовым тампоном.
- Пометьте ректальный термометр, чтобы его случайно не использовали во рту.
Температура полости рта
Когда вашему ребенку исполнится 4 года, вы можете измерять температуру ртом. Вот как измерить температуру полости рта :
Если ваш ребенок пил горячий или холодный напиток, подождите 30 минут.

Включите термометр и поместите кончик под язык ребенка с одной стороны по направлению к задней части рта. Попросите ребенка держать термометр губами и пальцами. Не используйте зубы, чтобы удерживать их на месте.
Держите губы закрытыми над термометром, пока он не издаст звуковой сигнал. Проверьте цифровое чтение.
Температура лба
Термометры височной артерии (лба) подходят для детей любого возраста. Вот как взять температура лба :
Следуйте инструкциям на упаковке, чтобы узнать, как и куда перемещать или наводить датчик на лоб для получения наиболее точных измерений.
Датчик измеряет тепловые волны, исходящие от височной артерии.Этот кровеносный сосуд проходит через лоб чуть ниже кожи.
Считайте температуру вашего ребенка на экране дисплея.
Температура в ухе
Барабанный (ушной) термометр можно использовать для детей в возрасте от 6 месяцев и старше, так как у маленьких детей узкие слуховые проходы. Вот как взять температура уха :
Вот как взять температура уха :
Следуйте инструкциям на упаковке.
Правильная температура зависит от того, оттянуть ухо назад.Оттяните ухо назад и вверх, если ребенку больше 1 года. Затем наведите кончик ушного зонда между противоположным глазом и ухом.
Нахождение на улице в холодный день может привести к заниженным показаниям. Подождите 15 минут после того, как войдете в дом, чтобы измерить температуру.
Помните
Лихорадка — это всего лишь один из признаков болезни, но очень важный. Если у вас есть вопросы о лихорадке и ее измерении, обратитесь к педиатру вашего ребенка.
Дополнительная информация
* Рисунки цифрового термометра, созданные Anthony A lex LeTourneau.
Информация, содержащаяся на этом веб-сайте, не должна использоваться вместо медицинской помощи и рекомендаций вашего педиатра. Ваш педиатр может порекомендовать различные варианты лечения в зависимости от индивидуальных фактов и обстоятельств.
Малая интерферирующая РНК сбивает фактор теплового шока-1 (HSF-1) и усиливает провоспалительную активацию NF-κB и AP-1 в гладкомышечных клетках сосудов | Сердечно-сосудистые исследования
Абстрактные
Цели: Тепловой шок и повышенная экспрессия белков теплового шока подавляют активацию провоспалительного фактора транскрипции NF-κB.Мы предположили, что подавление экспрессии фактора теплового шока-1 (HSF-1) с помощью технологии РНКи усугубит вызванное ангиотензином (Ang) II воспалительное повреждение гладкомышечных клеток сосудов (VSMC).
Методы: Клетки аорты А10 крысы и клетки гладких мышц кишечника человека выращивали без трансфекции или с трансфекцией малой интерферирующей РНК HSF-1 (миРНК) или миРНК отрицательного контроля. Клетки стимулировали Ang II (100 нМ) для активации сигнального пути NF-κB.
Результаты: миРНК HSF-1 значительно подавляла экспрессию HSF-1 и одного из последующих белков теплового шока (Hsp), Hsp27, в обеих клеточных линиях. SiRNA HSF-1 также влияла на клетки, подвергшиеся воздействию теплового шока или обработки Ang II. Ang II индуцировал активацию NF-κB и AP-1 в нетрансфицированных VSMC, однако Ang II индуцировал значительно более высокую активность этих провоспалительных факторов транскрипции в клетках, трансфицированных HSF-1 siRNA. Контрольная миРНК не оказывала явного влияния на экспрессию HSF-1 и Hsp27 и на активацию NF-κB и AP-1, индуцированную Ang II.
SiRNA HSF-1 также влияла на клетки, подвергшиеся воздействию теплового шока или обработки Ang II. Ang II индуцировал активацию NF-κB и AP-1 в нетрансфицированных VSMC, однако Ang II индуцировал значительно более высокую активность этих провоспалительных факторов транскрипции в клетках, трансфицированных HSF-1 siRNA. Контрольная миРНК не оказывала явного влияния на экспрессию HSF-1 и Hsp27 и на активацию NF-κB и AP-1, индуцированную Ang II.
Выводы: Эти данные показывают, что подавление HSF-1 усугубляет вызванное Ang II воспаление в VSMC, и предполагает, что белки теплового шока защищают от воспалительного повреждения путем подавления провоспалительных факторов транскрипции, таких как NF-κB и АП-1.
См. Редакцию А.А. Knowlton (страницы 7–8) в этом выпуске.
1 Введение
Белки теплового шока (Hsps) представляют собой семейство высококонсервативных молекулярных шаперонов, которые поддерживают растворимость белков, функцию цитоскелета и клеточный гомеостаз, а также защищают клетки от стресса окружающей среды и патофизиологических повреждений [1–3]. У крыс тепловой шок (42 ° C в течение 15 минут) вызывает значительно повышенные уровни Hsp70 в сердце, и это связано с улучшением функционального восстановления сердца после глобальной ишемии [4]. Трансгенные мыши, экспрессирующие высокие уровни индуцибельного Hsp70 человека, продемонстрировали прямую роль Hsp70 в защите миокарда и нейронов гиппокампа от ишемического повреждения [5,6]. Недавно было показано, что лечение тепловым шоком с индуцированными высокими уровнями Hsp70 и Hsp27 защищает от индуцированной ангиотензином (Ang) II гипертензии и воспаления в аорте и сердце [7,8].Однако вопрос о том, регулируют ли повышенные уровни Hsps или другие изменения в экспрессии генов напрямую пути воспалительного внутриклеточного повреждения, остается открытым.
У крыс тепловой шок (42 ° C в течение 15 минут) вызывает значительно повышенные уровни Hsp70 в сердце, и это связано с улучшением функционального восстановления сердца после глобальной ишемии [4]. Трансгенные мыши, экспрессирующие высокие уровни индуцибельного Hsp70 человека, продемонстрировали прямую роль Hsp70 в защите миокарда и нейронов гиппокампа от ишемического повреждения [5,6]. Недавно было показано, что лечение тепловым шоком с индуцированными высокими уровнями Hsp70 и Hsp27 защищает от индуцированной ангиотензином (Ang) II гипертензии и воспаления в аорте и сердце [7,8].Однако вопрос о том, регулируют ли повышенные уровни Hsps или другие изменения в экспрессии генов напрямую пути воспалительного внутриклеточного повреждения, остается открытым.
Различные гены теплового шока регулируются факторами транскрипции теплового шока (HSF), которые экспрессируются конститутивно [9]. В настоящее время идентифицировано четыре различных HSF, то есть HSF-1, HSF-2, HSF-3 и HSF-4, каждый из которых имеет различные характеристики. HSF-1 регулирует транскрипцию генов Hsp после экологического или патофизиологического стресса, который денатурирует или осаждает клеточные белки.HSF-2 и HSF-3 регулируют транскрипцию генов Hsp в определенных тканях, претерпевая процессы дифференцировки и развития, а HSF-3 был описан только у кур [9,10]. HSF-4 структурно связан с тремя другими HSF, однако он функционально отличается и не реагирует на стрессы, такие как тепло [11]. Более того, транскрипция генов Hsp70, Hsp90 и Hsp27 снижается при сверхэкспрессии HSF-4 [11]. Было высказано предположение, что HSF-4 не является фактором транскрипции, потому что он лишен карбоксиконцевого повтора, общего для HSF-1, HSF-2 и HSF-3 [11].HSF-1 является основным стресс-чувствительным HSF, опосредующим реакцию теплового шока в клетках млекопитающих [12]. HSF-1 конститутивно локализован в цитозоле и ядре и поддерживается в инактивированной форме за счет связывания с конститутивным белком теплового шока 70 кДа (Hsc70) или Hsp90. При различных формах клеточного стресса, таких как тепло, гипоксия, этанол и арсенит натрия, которые денатурируют белки, конститутивные Hsps рекрутируются на денатурированные белки, высвобождая HSF-1.
HSF-1 регулирует транскрипцию генов Hsp после экологического или патофизиологического стресса, который денатурирует или осаждает клеточные белки.HSF-2 и HSF-3 регулируют транскрипцию генов Hsp в определенных тканях, претерпевая процессы дифференцировки и развития, а HSF-3 был описан только у кур [9,10]. HSF-4 структурно связан с тремя другими HSF, однако он функционально отличается и не реагирует на стрессы, такие как тепло [11]. Более того, транскрипция генов Hsp70, Hsp90 и Hsp27 снижается при сверхэкспрессии HSF-4 [11]. Было высказано предположение, что HSF-4 не является фактором транскрипции, потому что он лишен карбоксиконцевого повтора, общего для HSF-1, HSF-2 и HSF-3 [11].HSF-1 является основным стресс-чувствительным HSF, опосредующим реакцию теплового шока в клетках млекопитающих [12]. HSF-1 конститутивно локализован в цитозоле и ядре и поддерживается в инактивированной форме за счет связывания с конститутивным белком теплового шока 70 кДа (Hsc70) или Hsp90. При различных формах клеточного стресса, таких как тепло, гипоксия, этанол и арсенит натрия, которые денатурируют белки, конститутивные Hsps рекрутируются на денатурированные белки, высвобождая HSF-1. Свободный HSF-1 фосфорилируется и перемещается из цитозольного компартмента в ядерный и становится организованным в активные ДНК-связывающие гомотримеры [9].
Свободный HSF-1 фосфорилируется и перемещается из цитозольного компартмента в ядерный и становится организованным в активные ДНК-связывающие гомотримеры [9].
В настоящем исследовании мы использовали технологию РНК-интерференции (РНКи) для подавления экспрессии гена HSF-1 в гладкомышечных клетках сосудов (VSMC). Мы предположили, что (1) нокдаун HSF-1 также нарушит экспрессию нижележащего гена Hsps, и (2) нокдаун HSF-1 усугубит вызванное Ang II воспалительное повреждение VSMC. Такие данные подтверждают мнение о том, что белки теплового шока играют непосредственную роль в подавлении индуцированных Ang II воспалительных сигнальных путей и последующего воспаления.
2 метода
2,1 Культура клеток
Клеточная линия VSMC, полученная из аорты плода крысы (клетки A10), была получена из Американской коллекции типовых культур (ATCC, Rockville, MD, Cat # CRL 1476). Клетки гладкой мускулатуры кишечника человека (клетки HISM) были также получены из АТСС (каталожный номер CRL 1692) и считаются клеточной линией VSMC [13]. Клетки культивировали рутинно в среде Игла, модифицированной Дульбекко (DMEM), содержащей 10% фетальной телячьей сыворотки (FBS), пенициллин (50 Ед / мл) и стрептомицин (50 мкг / мл) при 37 ° C в 5% увлажненной атмосфере. CO 2 и 95% воздуха.
Клетки культивировали рутинно в среде Игла, модифицированной Дульбекко (DMEM), содержащей 10% фетальной телячьей сыворотки (FBS), пенициллин (50 Ед / мл) и стрептомицин (50 мкг / мл) при 37 ° C в 5% увлажненной атмосфере. CO 2 и 95% воздуха.
2.2 Производство и трансфекция РНКи
миРНК HSF-1 была химически синтезирована компанией Ambion (Остин, Техас). Метод Эльбашира и соавт. [14] использовали для определения следующей целевой последовательности: 5′-AAGAGAAAGATCCCTCTGATG-3 ‘. Целевая последовательность находится в открытой рамке считывания гена HSF-1 крысы (номер доступа: xm_343270), на 613 нуклеотидов ниже стартового кодона. Отрицательный контроль миРНК, дуплекс 21-нуклеотидной РНК без известной гомологии последовательностей, также был приобретен у Ambion (каталожный номер 4611).
Трансфекция миРНК в клетки была достигнута с использованием реагента олигофектамина (Invitrogen, Burlington, ON). Вкратце, 2 × 10 4 клеток / лунку помещали в 24-луночные планшеты в течение ночи для достижения 50-70% конфлюэнтных монослоев.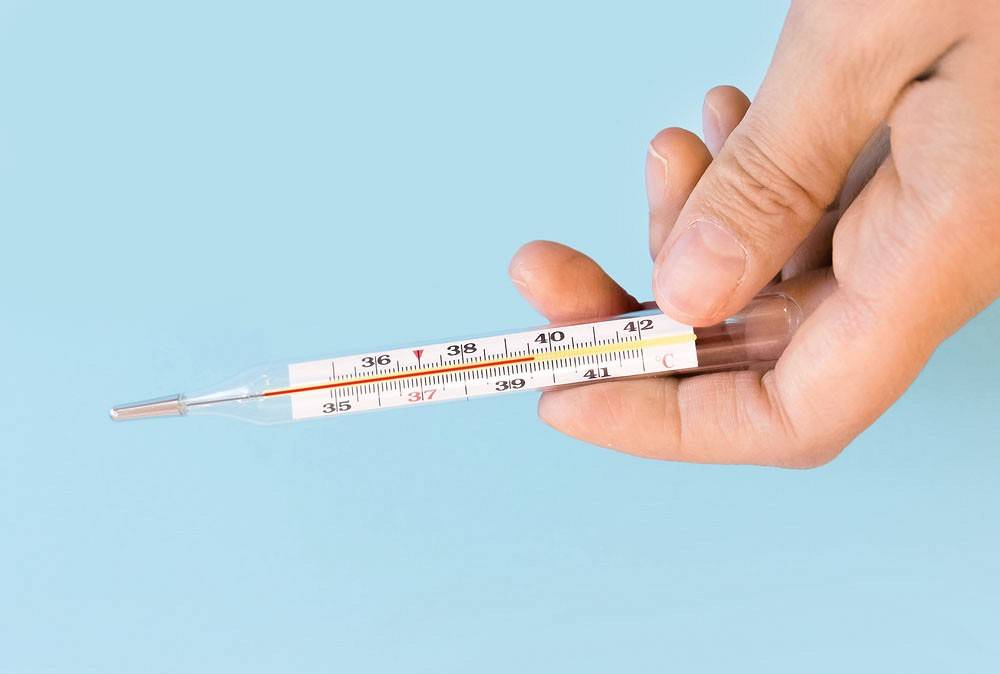 В день трансфекции культивированные клетки промывали DMEM без сыворотки или антибиотиков. Исходный олигонуклеотид и олигофектамин в 20 мкМ разбавляли и осторожно смешивали с DMEM для достижения конечной концентрации олигофектамина (рекомендация производителя, 2 мкл / лунка) и 1 × и 2 × для миРНК (1 × концентрация составляла 133 нМ).Затем в каждую лунку добавляли комплексы олигонуклеотид-олигофектамин и клетки инкубировали при 37 ° C в течение 4 часов. Затем к клеткам добавляли FBS для достижения конечной концентрации 10% в DMEM и инкубировали в течение 44 часов при 37 ° C в инкубаторе CO 2 .
В день трансфекции культивированные клетки промывали DMEM без сыворотки или антибиотиков. Исходный олигонуклеотид и олигофектамин в 20 мкМ разбавляли и осторожно смешивали с DMEM для достижения конечной концентрации олигофектамина (рекомендация производителя, 2 мкл / лунка) и 1 × и 2 × для миРНК (1 × концентрация составляла 133 нМ).Затем в каждую лунку добавляли комплексы олигонуклеотид-олигофектамин и клетки инкубировали при 37 ° C в течение 4 часов. Затем к клеткам добавляли FBS для достижения конечной концентрации 10% в DMEM и инкубировали в течение 44 часов при 37 ° C в инкубаторе CO 2 .
2.3 Анализ МТТ для определения жизнеспособности клеток
После трансфекции siRNA или фиктивной обработки культуральную среду заменяли на нормальную среду для выращивания с 450 мкл DMEM с 10% FBS. Тетразолиевая соль МТТ (Sigma, St.Louis, MI, Cat # M2128) 50 мкл, 5 мг / мл в PBS добавляли к клеткам до конечной концентрации 0,5 мг / мл и клетки инкубировали при 37 ° C в течение 4 часов. МТТ превращали в кристаллы формазана жизнеспособными клетками. Кристаллы формазана растворяли в 500 мкл солюбилизирующего буфера (0,1 М HCl и 10% SDS), инкубируя клетки при 37 ° C в течение 1 часа. Поглощение считывали при 562 нм в считывающем устройстве для микропланшетов, FL x 800 (Bio-Tek instrument Inc., Winooski, VT). Жизнеспособность клеток выражали в процентах от ложно обработанных клеток.
МТТ превращали в кристаллы формазана жизнеспособными клетками. Кристаллы формазана растворяли в 500 мкл солюбилизирующего буфера (0,1 М HCl и 10% SDS), инкубируя клетки при 37 ° C в течение 1 часа. Поглощение считывали при 562 нм в считывающем устройстве для микропланшетов, FL x 800 (Bio-Tek instrument Inc., Winooski, VT). Жизнеспособность клеток выражали в процентах от ложно обработанных клеток.
2,4 Ангиотензин II и лечение тепловым шоком
Через 48 часов трансфекции siRNA как трансфицированные, так и нетрансфицированные (фиктивные) клетки культивировали в течение 1 дня в бессывороточной среде DMEM для остановки роста перед обработкой Ang II или обработкой HS. Человеческий ангиотензин II (Sigma, № по каталогу A9525) добавляли в концентрации 100 нмоль / л. Для обработки тепловым шоком после остановки роста клетки инкубировали при 44 ° C в течение 20 минут в инкубаторе и восстанавливали при 37 ° C. Клетки собирали для исследования Hsp27, NF-κB и AP-1 в разные моменты времени после лечения ангиотензином II или HS.
2,5 Иммуноцитохимия
Для иммуноцитохимии клетки инкубировали с кроличьими поликлональными антителами против HSF-1 (1: 2000, StressGen, Виктория, Канада, № по каталогу SPA-901) или кроличьими поликлональными антителами против Hsp27 (1: 2000, StressGen, по каталогу SPA. -801). Первичные антитела к HSF-1 и Hsp27 реагировали с вторичным антителом, козьим антикроличьим, конъюгированным с alexa-546 (1: 500, Molecular Probes, Юджин, Орегон). Цифровые изображения были получены с помощью камеры Zeiss Axiovert 200 и AxioCam HRc и системы захвата изображений.
2,6 Приготовление белковых экстрактов
Белков из различных условий, описанных выше, собирали и объединяли из 6 лунок 24-луночных планшетов, и все процедуры экстракции белков выполняли на льду. Клетки промывали холодным 0,1 М PBS и лизировали 50 мкл ледяного буфера A [10 мМ HEPES (pH 7,9), 1,5 мМ MgCl 2 , 10 мМ KCl, 1 мМ 1,4-дитиотреитол (DTT), 0,5. мМ PMSF, 10 мкг / мл лейпептина, 10 мкг / мл апротинина, 0,1% Triton X-100]. После 10-минутной инкубации на льду гомогенаты центрифугировали при 4000 g в течение 4 минут при 4 ° C.Супернатанты хранили как цитоплазматические экстракты при -70 ° C. Осадки ресуспендировали в 40 мкл буфера B [20 мМ HEPES (pH 7,9), 25% глицерин, 420 мМ NaCl, 1,5 мМ MgCl 2 , 0,2 мМ EDTA, 1 мМ DTT, 0,5 мМ PMSF, 10 мкг / мл лейпептина. , 10 мкг / мл апротинина]. Суспензию инкубировали 30 мин на льду. После центрифугирования при 20000 g в течение 15 минут при 4 ° C супернатанты аликвотами переносили в новые пробирки и хранили при -70 ° C до анализа. Концентрации белка определяли методом Lowry et al.[15].
мМ PMSF, 10 мкг / мл лейпептина, 10 мкг / мл апротинина, 0,1% Triton X-100]. После 10-минутной инкубации на льду гомогенаты центрифугировали при 4000 g в течение 4 минут при 4 ° C.Супернатанты хранили как цитоплазматические экстракты при -70 ° C. Осадки ресуспендировали в 40 мкл буфера B [20 мМ HEPES (pH 7,9), 25% глицерин, 420 мМ NaCl, 1,5 мМ MgCl 2 , 0,2 мМ EDTA, 1 мМ DTT, 0,5 мМ PMSF, 10 мкг / мл лейпептина. , 10 мкг / мл апротинина]. Суспензию инкубировали 30 мин на льду. После центрифугирования при 20000 g в течение 15 минут при 4 ° C супернатанты аликвотами переносили в новые пробирки и хранили при -70 ° C до анализа. Концентрации белка определяли методом Lowry et al.[15].
2,7 Вестерн-анализ
образцов белка (10 мкг) использовали для вестерн-анализа по методу Chen et al. [7,8]. Блоты реагировали либо с антителом против HSF-1 (1: 5000), либо с антителом против Hsp27 (1: 5000), либо с крысиным моноклональным антителом против HSF-2 (1: 5000, StressGen, Cat # SPA-960), а затем инкубацией с соответствующим конъюгированным с пероксидазой вторичным антителом (1: 2000, Vector Laboratories, Burlingame, CA). Уровень HSF-1, HSF-2 и Hsp27 определяли с помощью системы усиленной хемилюминесценции (Amersham Pharmacia) в соответствии с протоколом производителя, а затем подвергали воздействию пленок или детектировали с помощью системы Storm (Storm 840, Amersham Biosciences, Саннивейл, Калифорния). .Уровни белка определяли количественно сканирующей денситометрией с использованием систем анализа изображений (Scion Corp, Frederick, ML). Равные количества загрузки белка на дорожку проверяли окрашиванием амидным черным или вестерн-блоттингом с кроличьими поликлональными антиактиновыми антителами (1: 200, Sigma, № по каталогу A2066).
Уровень HSF-1, HSF-2 и Hsp27 определяли с помощью системы усиленной хемилюминесценции (Amersham Pharmacia) в соответствии с протоколом производителя, а затем подвергали воздействию пленок или детектировали с помощью системы Storm (Storm 840, Amersham Biosciences, Саннивейл, Калифорния). .Уровни белка определяли количественно сканирующей денситометрией с использованием систем анализа изображений (Scion Corp, Frederick, ML). Равные количества загрузки белка на дорожку проверяли окрашиванием амидным черным или вестерн-блоттингом с кроличьими поликлональными антиактиновыми антителами (1: 200, Sigma, № по каталогу A2066).
2,8 Анализ сдвига электрофоретической подвижности (EMSA)
консенсусных олигонуклеотидных последовательностей NF-κB и AP-1 (5′-AGTGAGGGACTTTCCCAGGC-3 ‘и 5′-CGCTTGATGAGTCAGCCGGAA-3’, соответственно) (Promega, Madison, WI) были использованы для EMSA в соответствии с протоколом, ранее описанным Chen et al. .[7,8]. Вкратце, реакции связывания, каждая из которых содержала 10 мкг ядерных экстрактов, разделяли на неденатурирующем 4% акриламидном геле.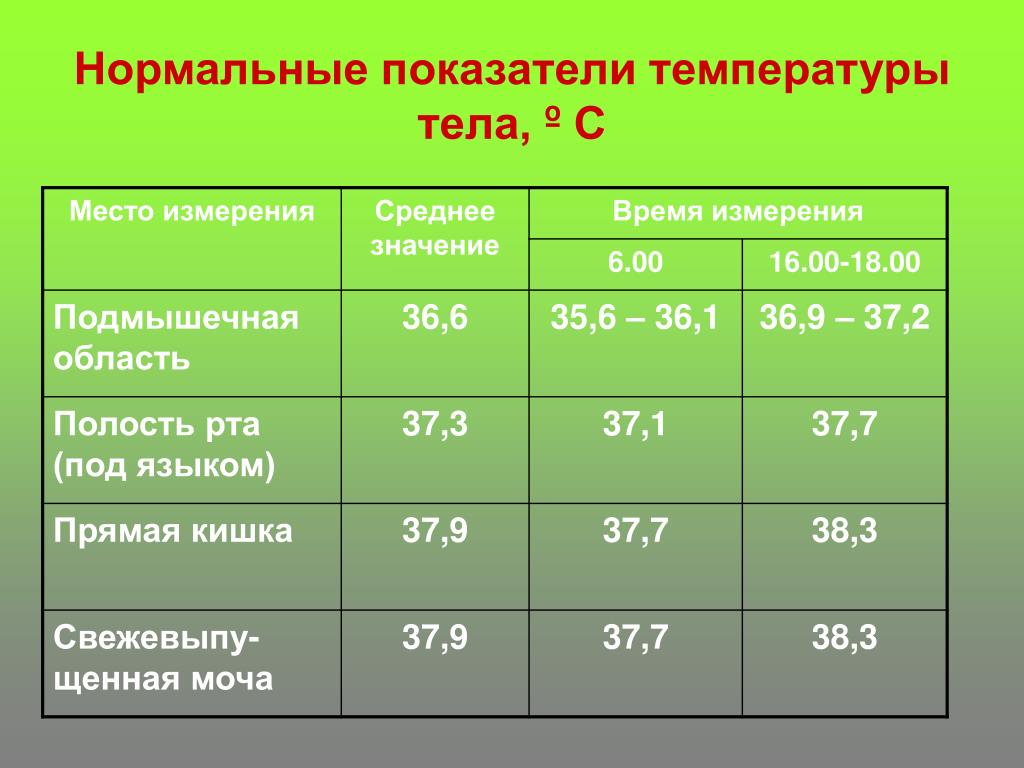 Гели сушили на бумаге Whatman 3 MM и экспонировали на рентгеновской пленке при -70 ° C в течение ночи. Чтобы установить специфичность реакции, конкурентные анализы с 50-кратным избытком немеченых специфических олигонуклеотидов-конкурентов и неспецифического конкурентного олигонуклеотида, SP-1 (5′-ATTCGATCGGGGCGGGGCGAGC-3 ‘) (Promega), проводили путем добавления немеченых зондов через 10 мин. перед добавлением меченого зонда.Отрицательные контроли не содержали ядерных экстрактов. Для тестов сверхсдвига 2 мкг анти-p65 (sc-109 X, Santa Cruz Biotechnology, Санта-Крус, Калифорния), анти-p50 (sc-114 X, Santa Cruz Biotechnology) и анти-c-Fos (sc-52 , Santa Cruz Biotechnology), антитела добавляли к экстрактам ядерных белков и инкубировали в течение 1 ч после добавления меченого зонда. Активность связывания ДНК определяли количественно сканирующей денситометрией с использованием систем анализа изображений (Scion Corp).
Гели сушили на бумаге Whatman 3 MM и экспонировали на рентгеновской пленке при -70 ° C в течение ночи. Чтобы установить специфичность реакции, конкурентные анализы с 50-кратным избытком немеченых специфических олигонуклеотидов-конкурентов и неспецифического конкурентного олигонуклеотида, SP-1 (5′-ATTCGATCGGGGCGGGGCGAGC-3 ‘) (Promega), проводили путем добавления немеченых зондов через 10 мин. перед добавлением меченого зонда.Отрицательные контроли не содержали ядерных экстрактов. Для тестов сверхсдвига 2 мкг анти-p65 (sc-109 X, Santa Cruz Biotechnology, Санта-Крус, Калифорния), анти-p50 (sc-114 X, Santa Cruz Biotechnology) и анти-c-Fos (sc-52 , Santa Cruz Biotechnology), антитела добавляли к экстрактам ядерных белков и инкубировали в течение 1 ч после добавления меченого зонда. Активность связывания ДНК определяли количественно сканирующей денситометрией с использованием систем анализа изображений (Scion Corp).
2.9 Статистический анализ
Данные выражены как среднее ± SEM. Достоверность различий определяли с помощью дисперсионного анализа и теста множественного сравнения post hoc с использованием программного обеспечения SPSS 11.5 (SPSS, Чикаго, Иллинойс). P <0,05 считали статистически значимым.
Достоверность различий определяли с помощью дисперсионного анализа и теста множественного сравнения post hoc с использованием программного обеспечения SPSS 11.5 (SPSS, Чикаго, Иллинойс). P <0,05 считали статистически значимым.
3 Результаты
3.1 РНКи подавляет экспрессию HSF-1 и Hsp27 в нестрессированных клетках A10
Иммуноцитохимия для обнаружения экспрессии HSF-1 в VSMC A10 (рис. 1A-E) показала, что существует значительный эффект нокдауна HSF-1 siRNA.В нетрансфицированных (фиктивных) клетках A10 HSF-1 в основном локализовался в ядрах и диффузно распределялся в цитоплазме (рис. 1A). Чтобы исключить эффект самой трансфекции, клетки трансфицировали контрольной миРНК в 1-кратной и 2-кратной дозировке. Не было очевидного влияния контрольной трансфекции siRNA на экспрессию HSF-1 (фиг. 1B, C). При трансфекции siRNA HSF-1 экспрессия HSF-1 снижалась дозозависимым образом (рис. 1D, E). Эффективность трансфекции составляла ~ 90%. Обработка клеток трансфекцией миРНК подавляла жизнеспособность клеток примерно до 70% от жизнеспособности фиктивно обработанных клеток ( P <0.05) (Рис. 1F). Однако не было существенной разницы между контрольной миРНК и обработкой миРНК HSF-1 как при однократной, так и при двукратной дозировке.
1D, E). Эффективность трансфекции составляла ~ 90%. Обработка клеток трансфекцией миРНК подавляла жизнеспособность клеток примерно до 70% от жизнеспособности фиктивно обработанных клеток ( P <0.05) (Рис. 1F). Однако не было существенной разницы между контрольной миРНК и обработкой миРНК HSF-1 как при однократной, так и при двукратной дозировке.
Рис. 1
siRNA HSF-1 подавляет экспрессию HSF-1 и нижестоящего Hsp27 в клетках A10. (A) Ложно обработанные клетки имели в основном экспрессию HSF-1 в ядерной и диффузной цитоплазме. (B, C) Клетки, обработанные контрольной миРНК в 1 × и 2 × дозировках, соответственно, не имели видимых различий по сравнению с имитационно обработанными клетками.(D и E) Клетки, обработанные миРНК HSF-1 в 1х и 2х дозах соответственно. Экспрессия HSF-1 подавлялась дозозависимым образом. (F) Жизнеспособность клеток, определенная с помощью анализа МТТ, показала, что трансфекция миРНК подавляла жизнеспособность клеток, однако не было существенной разницы между обработками трансфекции. (G) Вестерн-анализ подтвердил эффект подавления РНКи HSF-1 на экспрессию HSF-1, а также показал, что миРНК HSF-1 (двукратная доза) подавляла экспрессию Hsp27.(H) Полуколичественная оценка западного анализа. Относительные уровни Hsp90, Hsp70 и Hsp27 были нормализованы до актина. Данные представляют собой среднее значение ± стандартная ошибка среднего и являются репрезентативными для 3 отдельных экспериментов. * P <0,05, ** P <0,01 по сравнению с фиктивным. Масштабная линейка в E = 100 мкм на панелях (A, B, C, D и E).
(G) Вестерн-анализ подтвердил эффект подавления РНКи HSF-1 на экспрессию HSF-1, а также показал, что миРНК HSF-1 (двукратная доза) подавляла экспрессию Hsp27.(H) Полуколичественная оценка западного анализа. Относительные уровни Hsp90, Hsp70 и Hsp27 были нормализованы до актина. Данные представляют собой среднее значение ± стандартная ошибка среднего и являются репрезентативными для 3 отдельных экспериментов. * P <0,05, ** P <0,01 по сравнению с фиктивным. Масштабная линейка в E = 100 мкм на панелях (A, B, C, D и E).
Рис. 1
миРНК HSF-1 подавляет экспрессию HSF-1 и нижестоящего Hsp27 в клетках A10. (A) Ложно обработанные клетки имели в основном экспрессию HSF-1 в ядерной и диффузной цитоплазме.(B, C) Клетки, обработанные контрольной миРНК в 1 × и 2 × дозировках, соответственно, не имели видимых различий по сравнению с имитационно обработанными клетками. (D и E) Клетки, обработанные миРНК HSF-1 в 1х и 2х дозах соответственно. Экспрессия HSF-1 подавлялась дозозависимым образом. (F) Жизнеспособность клеток, определенная с помощью анализа МТТ, показала, что трансфекция миРНК подавляла жизнеспособность клеток, однако не было существенной разницы между обработками трансфекции. (G) Вестерн-анализ подтвердил эффект подавления РНКи HSF-1 на экспрессию HSF-1, а также показал, что миРНК HSF-1 (двукратная доза) подавляла экспрессию Hsp27.(H) Полуколичественная оценка западного анализа. Относительные уровни Hsp90, Hsp70 и Hsp27 были нормализованы до актина. Данные представляют собой среднее значение ± стандартная ошибка среднего и являются репрезентативными для 3 отдельных экспериментов. * P <0,05, ** P <0,01 по сравнению с фиктивным. Масштабная линейка в E = 100 мкм на панелях (A, B, C, D и E).
(F) Жизнеспособность клеток, определенная с помощью анализа МТТ, показала, что трансфекция миРНК подавляла жизнеспособность клеток, однако не было существенной разницы между обработками трансфекции. (G) Вестерн-анализ подтвердил эффект подавления РНКи HSF-1 на экспрессию HSF-1, а также показал, что миРНК HSF-1 (двукратная доза) подавляла экспрессию Hsp27.(H) Полуколичественная оценка западного анализа. Относительные уровни Hsp90, Hsp70 и Hsp27 были нормализованы до актина. Данные представляют собой среднее значение ± стандартная ошибка среднего и являются репрезентативными для 3 отдельных экспериментов. * P <0,05, ** P <0,01 по сравнению с фиктивным. Масштабная линейка в E = 100 мкм на панелях (A, B, C, D и E).
Вестерн-анализ также подтвердил, что уровень HSF-1 снижался при обработке РНКи. Антитело против HSF-1 распознает один белок 85 кДа в цитоплазме и белки 85 кДа и 95 кДа в ядре, что соответствует молекулярным массам неактивной и активированной форм HSF-1, соответственно, на иммуноблотах SDS – PAGE ( Инжир. 1G). HSF-1 siRNA с 2-кратной дозировкой снижает уровни HSF-1 как в цитоплазме, так и в ядре, однако HSF-1 siRNA с 1-кратной дозой только снижает ядерный уровень HSF-1 (рис. 1G, H). Также исследовали влияние РНКи HSF-1 на один из последующих белков теплового шока HSF-1, Hsp27. HSF-1 siRNA подавляла экспрессию Hsp27 в клетках A10 при 2-кратной дозировке (рис. 1G, H). HSF-1 siRNA не влияла ни на HSF-2, ни на уровни актина (рис. 1G).
1G). HSF-1 siRNA с 2-кратной дозировкой снижает уровни HSF-1 как в цитоплазме, так и в ядре, однако HSF-1 siRNA с 1-кратной дозой только снижает ядерный уровень HSF-1 (рис. 1G, H). Также исследовали влияние РНКи HSF-1 на один из последующих белков теплового шока HSF-1, Hsp27. HSF-1 siRNA подавляла экспрессию Hsp27 в клетках A10 при 2-кратной дозировке (рис. 1G, H). HSF-1 siRNA не влияла ни на HSF-2, ни на уровни актина (рис. 1G).
3.2 РНКи подавляет экспрессию HSF-1 и Hsp27 в нестрессированных клетках HISM
HSF-1 локализовался в основном в ядрах нестрессированных клеток HISM.Обработка ложной и контрольной siRNA не привела к видимой разнице в экспрессии HSF-1 (фиг. 2A, B). Обе дозы миРНК HSF-1 подавляли экспрессию HSF-1 в клетках HISM как в ядрах, так и в цитоплазме (рис. 2C, D). В нормальных клетках HISM Hsp27 локализован в основном в нуклеоплазме и слегка в цитоплазме (рис. 2E). Контрольная миРНК не оказывала явного влияния на экспрессию Hsp27 в клетках HISM (фиг. 2F). Интересно отметить, что обработка миРНК HSF-1 в дозе 1 × уменьшала ядерную экспрессию Hsp27 (рис.2G) и двукратная доза снижала как ядерную, так и цитоплазматическую экспрессию Hsp27 (фиг. 2H).
2F). Интересно отметить, что обработка миРНК HSF-1 в дозе 1 × уменьшала ядерную экспрессию Hsp27 (рис.2G) и двукратная доза снижала как ядерную, так и цитоплазматическую экспрессию Hsp27 (фиг. 2H).
Рис. 2
siRNA HSF-1 подавляет экспрессию HSF-1 и Hsp27 в клетках HISM. (A) Ложно обработанные клетки показывают положительную экспрессию HSF-1 в ядерной цитоплазме. (B) Контрольные клетки, обработанные siRNA 1х, не показывают видимых различий по сравнению с клетками, обработанными имитацией. (C, D) Клетки, обработанные миРНК HSF-1 при дозировках 1 и 2, показывают, что цитоплазма и ядерная экспрессия HSF-1 снижены дозозависимым образом.(E) Ложно обработанные клетки показывают положительную экспрессию Hsp27 в ядерной цитоплазме. (F) Контрольные клетки, обработанные siRNA, 1 × не показывают видимых различий по сравнению с клетками, обработанными имитацией. (G, H) Клетки, обработанные миРНК HSF-1 в дозах 1 и 2, показывают, что экспрессия Hsp27 в ядре и цитоплазме снижена дозозависимым образом. Масштабная линейка на панелях (D и H) = 100 мкм в целом.
Масштабная линейка на панелях (D и H) = 100 мкм в целом.
Рис. 2
миРНК HSF-1 подавляет экспрессию HSF-1 и Hsp27 в клетках HISM. (A) Ложно обработанные клетки показывают положительную экспрессию HSF-1 в ядерной цитоплазме.(B) Контрольные клетки, обработанные siRNA 1х, не показывают видимых различий по сравнению с клетками, обработанными имитацией. (C, D) Клетки, обработанные миРНК HSF-1 при дозировках 1 и 2, показывают, что цитоплазма и ядерная экспрессия HSF-1 снижены дозозависимым образом. (E) Ложно обработанные клетки показывают положительную экспрессию Hsp27 в ядерной цитоплазме. (F) Контрольные клетки, обработанные siRNA, 1 × не показывают видимых различий по сравнению с клетками, обработанными имитацией. (G, H) Клетки, обработанные миРНК HSF-1 в дозах 1 и 2, показывают, что экспрессия Hsp27 в ядре и цитоплазме снижена дозозависимым образом.Масштабная линейка на панелях (D и H) = 100 мкм в целом.
3.3 РНКи подавляет экспрессию Hsp27 в клетках A10, обработанных тепловым шоком или Ang II
Для исследования действия РНКи на клетки, подвергшиеся стрессу, VSMC A10, трансфицированные HSF-1 siRNA, обрабатывали тепловым шоком или Ang II. HSF-1 siRNA значительно подавляла экспрессию Hsp27 ( P <0,05) в клетках, не обработанных HS (0) и обработанных HS (фиг. 3A). В нетрансфицированных (фиктивных) клетках A10 обработка HS оказывала лишь минимальный эффект на экспрессию Hsp27, т.е.е. Hsp27 увеличивался только через 12 ч после обработки HS по сравнению с клетками, не обработанными HS (0). По сравнению с нетрансфицированными (фиктивными) клетками, трансфекция контрольной миРНК не оказывала явного влияния на экспрессию Hsp27.
HSF-1 siRNA значительно подавляла экспрессию Hsp27 ( P <0,05) в клетках, не обработанных HS (0) и обработанных HS (фиг. 3A). В нетрансфицированных (фиктивных) клетках A10 обработка HS оказывала лишь минимальный эффект на экспрессию Hsp27, т.е.е. Hsp27 увеличивался только через 12 ч после обработки HS по сравнению с клетками, не обработанными HS (0). По сравнению с нетрансфицированными (фиктивными) клетками, трансфекция контрольной миРНК не оказывала явного влияния на экспрессию Hsp27.
Рис. 3
Вестерн-блоттинг-анализ Hsp27 в (А) тепловом шоке или (В) обработанных ангиотензином II клетках А10. (A) Клетки A10 не подвергали трансфекции (имитацию) или трансфицировали контрольной siRNA 1 × или HSF-1 siRNA 2 × в течение 2 дней с последующим 1 днем бессывороточной инкубации перед обработкой HS.Клетки собирали для анализа без обработки HS (0) или через 6, 12, 24 или 48 часов после обработки HS. Обработка HS привела к умеренному увеличению экспрессии Hsp27 только через 12 ч после обработки HS. Трансфекция siRNA HSF-1 значительно подавляла экспрессию Hsp27 в необработанных HS (0) и обработанных HS клетках с восстановлением от 6 до 48 часов. По сравнению с фиктивным, трансфекция контрольной siRNA не оказывала заметного влияния на экспрессию Hsp27. (B) Клетки A10 не подвергали трансфекции (имитация) или трансфицировали контрольной миРНК 1х или HSF-1 миРНК 2х в течение 2 дней с последующим 1 днем бессывороточной инкубации перед обработкой Ang II.Клетки собирали для анализа без обработки Ang II (0) или через 0,25, 1, 2, 6 или 24 часа обработки Ang II. В нетрансфицированных клетках (фиктивные) обработка Ang II увеличивала экспрессию Hsp27 через 1-6 часов. Трансфекция siRNA HSF-1 значительно подавляла экспрессию Hsp27 в Ang II, не обработанном (0), и обработанном клетками в течение от 0,25 до 24 часов. По сравнению с имитацией трансфекция контрольной siRNA не оказывала заметного влияния на экспрессию Hsp27. *, ** P <0,05 и 0,01 по сравнению с фиктивным без обработки HS или Ang II.
Трансфекция siRNA HSF-1 значительно подавляла экспрессию Hsp27 в необработанных HS (0) и обработанных HS клетках с восстановлением от 6 до 48 часов. По сравнению с фиктивным, трансфекция контрольной siRNA не оказывала заметного влияния на экспрессию Hsp27. (B) Клетки A10 не подвергали трансфекции (имитация) или трансфицировали контрольной миРНК 1х или HSF-1 миРНК 2х в течение 2 дней с последующим 1 днем бессывороточной инкубации перед обработкой Ang II.Клетки собирали для анализа без обработки Ang II (0) или через 0,25, 1, 2, 6 или 24 часа обработки Ang II. В нетрансфицированных клетках (фиктивные) обработка Ang II увеличивала экспрессию Hsp27 через 1-6 часов. Трансфекция siRNA HSF-1 значительно подавляла экспрессию Hsp27 в Ang II, не обработанном (0), и обработанном клетками в течение от 0,25 до 24 часов. По сравнению с имитацией трансфекция контрольной siRNA не оказывала заметного влияния на экспрессию Hsp27. *, ** P <0,05 и 0,01 по сравнению с фиктивным без обработки HS или Ang II. #, ## P <0,05 и 0,01 HSF-1 siRNA, обработанная по сравнению с фиктивной или контрольной siRNA, обработанной в каждый момент времени. Экспрессию Hsp27 нормализовали до уровня актина, и эксперименты повторяли трижды.
#, ## P <0,05 и 0,01 HSF-1 siRNA, обработанная по сравнению с фиктивной или контрольной siRNA, обработанной в каждый момент времени. Экспрессию Hsp27 нормализовали до уровня актина, и эксперименты повторяли трижды.
Рис. 3
Вестерн-блот-анализ Hsp27 в (A) тепловом шоке или (B) обработанных ангиотензином II клетках A10. (A) Клетки A10 не подвергали трансфекции (имитацию) или трансфицировали контрольной siRNA 1 × или HSF-1 siRNA 2 × в течение 2 дней с последующим 1 днем бессывороточной инкубации перед обработкой HS.Клетки собирали для анализа без обработки HS (0) или через 6, 12, 24 или 48 часов после обработки HS. Обработка HS привела к умеренному увеличению экспрессии Hsp27 только через 12 ч после обработки HS. Трансфекция siRNA HSF-1 значительно подавляла экспрессию Hsp27 в необработанных HS (0) и обработанных HS клетках с восстановлением от 6 до 48 часов. По сравнению с фиктивным, трансфекция контрольной siRNA не оказывала заметного влияния на экспрессию Hsp27. (B) Клетки A10 не подвергали трансфекции (имитация) или трансфицировали контрольной миРНК 1х или HSF-1 миРНК 2х в течение 2 дней с последующим 1 днем бессывороточной инкубации перед обработкой Ang II.Клетки собирали для анализа без обработки Ang II (0) или через 0,25, 1, 2, 6 или 24 часа обработки Ang II. В нетрансфицированных клетках (фиктивные) обработка Ang II увеличивала экспрессию Hsp27 через 1-6 часов. Трансфекция siRNA HSF-1 значительно подавляла экспрессию Hsp27 в Ang II, не обработанном (0), и обработанном клетками в течение от 0,25 до 24 часов. По сравнению с имитацией трансфекция контрольной siRNA не оказывала заметного влияния на экспрессию Hsp27. *, ** P <0,05 и 0,01 по сравнению с фиктивным без обработки HS или Ang II.#, ## P <0,05 и 0,01 HSF-1 siRNA, обработанная по сравнению с фиктивной или контрольной siRNA, обработанной в каждый момент времени. Экспрессию Hsp27 нормализовали до уровня актина, и эксперименты повторяли трижды.
(B) Клетки A10 не подвергали трансфекции (имитация) или трансфицировали контрольной миРНК 1х или HSF-1 миРНК 2х в течение 2 дней с последующим 1 днем бессывороточной инкубации перед обработкой Ang II.Клетки собирали для анализа без обработки Ang II (0) или через 0,25, 1, 2, 6 или 24 часа обработки Ang II. В нетрансфицированных клетках (фиктивные) обработка Ang II увеличивала экспрессию Hsp27 через 1-6 часов. Трансфекция siRNA HSF-1 значительно подавляла экспрессию Hsp27 в Ang II, не обработанном (0), и обработанном клетками в течение от 0,25 до 24 часов. По сравнению с имитацией трансфекция контрольной siRNA не оказывала заметного влияния на экспрессию Hsp27. *, ** P <0,05 и 0,01 по сравнению с фиктивным без обработки HS или Ang II.#, ## P <0,05 и 0,01 HSF-1 siRNA, обработанная по сравнению с фиктивной или контрольной siRNA, обработанной в каждый момент времени. Экспрессию Hsp27 нормализовали до уровня актина, и эксперименты повторяли трижды.
миРНК HSF-1 значительно подавляла экспрессию Hsp27 ( P <0,05) в клетках, не обработанных Ang II и Ang II (фиг. 3B). В нетрансфицированных (фиктивных) клетках A10 обработка Ang II в течение 1-6 ч значительно увеличивала экспрессию Hsp27. По сравнению с нетрансфицированными (фиктивными) клетками, трансфекция контрольной миРНК не оказывала явного влияния на экспрессию Hsp27.
3B). В нетрансфицированных (фиктивных) клетках A10 обработка Ang II в течение 1-6 ч значительно увеличивала экспрессию Hsp27. По сравнению с нетрансфицированными (фиктивными) клетками, трансфекция контрольной миРНК не оказывала явного влияния на экспрессию Hsp27.
3.4 Эффект подавления экспрессии HSF-1 на Ang II-индуцированную активацию NF-κB
В нетрансфицированных (фиктивных) клетках обработка Ang II индуцировала значительную активацию NF-κB через 6 и 24 часа обработки ( P <0,05) как в клетках A10, так и в клетках HISM (фиг. 4). В клетках, трансфицированных siRNA HSF-1, ДНК-связывающая активность NF-κB, индуцированная Ang II, была значительно выше ( P <0,05) через 6 и 24 часа обработки Ang II по сравнению с таковой у нетрансфицированных (фиктивных) клеток. (Инжир.4). Не было явной разницы в контрольных клетках, трансфицированных siRNA, по сравнению с нетрансфицированными (фиктивными) клетками без обработки Ang II или с обработкой Ang II в течение 6 часов.
Рис. 4
Эффект подавления экспрессии HSF-1 на Ang II-индуцированную активацию ядерного фактора (NF) -κB. (A) Ячейки A10. (B) клетки HISM. Ang II индуцировал активацию NF-κB как в клетках A10, так и в HISM после обработки Ang II в течение 6 и 24 часов. Ang II индуцировал значительно более высокую активацию NF-κB в HSF-1 siRNA 2 × нокдаун клетках.Контрольная миРНК 1 × не оказывала явного влияния на активацию NF-κB, индуцированную Ang II. Конкурентный анализ подтвердил специфичность комплексов для NF-κB. Комплексы NF-κB были скомпрометированы добавлением антитела против p65 и p50 в A10 и были суперсмещены в клетках HISM. *, ** P <0,05 и 0,01 по сравнению с фиктивным без обработки Ang II, соответственно. #, ## P <0,05 и 0,01 HSF-1, обработанная миРНК, по сравнению с фиктивной или контрольной обработанной миРНК, соответственно. Данные представляют 3 отдельных эксперимента.
Рис. 4
Эффект подавления экспрессии HSF-1 на Ang II-индуцированную активацию ядерного фактора (NF) -κB. (A) Ячейки A10. (B) клетки HISM. Ang II индуцировал активацию NF-κB как в клетках A10, так и в HISM после обработки Ang II в течение 6 и 24 часов. Ang II индуцировал значительно более высокую активацию NF-κB в HSF-1 siRNA 2 × нокдаун клетках. Контрольная миРНК 1 × не оказывала явного влияния на активацию NF-κB, индуцированную Ang II. Конкурентный анализ подтвердил специфичность комплексов для NF-κB.Комплексы NF-κB были скомпрометированы добавлением антитела против p65 и p50 в A10 и были суперсмещены в клетках HISM. *, ** P <0,05 и 0,01 по сравнению с фиктивным без обработки Ang II, соответственно. #, ## P <0,05 и 0,01 HSF-1, обработанная миРНК, по сравнению с фиктивной или контрольной обработанной миРНК, соответственно. Данные представляют 3 отдельных эксперимента.
(A) Ячейки A10. (B) клетки HISM. Ang II индуцировал активацию NF-κB как в клетках A10, так и в HISM после обработки Ang II в течение 6 и 24 часов. Ang II индуцировал значительно более высокую активацию NF-κB в HSF-1 siRNA 2 × нокдаун клетках. Контрольная миРНК 1 × не оказывала явного влияния на активацию NF-κB, индуцированную Ang II. Конкурентный анализ подтвердил специфичность комплексов для NF-κB.Комплексы NF-κB были скомпрометированы добавлением антитела против p65 и p50 в A10 и были суперсмещены в клетках HISM. *, ** P <0,05 и 0,01 по сравнению с фиктивным без обработки Ang II, соответственно. #, ## P <0,05 и 0,01 HSF-1, обработанная миРНК, по сравнению с фиктивной или контрольной обработанной миРНК, соответственно. Данные представляют 3 отдельных эксперимента.
3.5 Эффект подавления экспрессии HSF-1 на Ang II-индуцированную активацию AP-1
В нетрансфицированных (фиктивных) клетках A10 обработка Ang II в течение 6 и 24 часов также индуцировала активацию AP-1 (рис. 5А). Хотя обработка РНКи не вызывала значительно более высокой активности АР-1 через 6 часов по сравнению с фиктивной, обработка миРНК HSF-1 удваивала индуцированную Ang II активацию АР-1 через 24 часа. В нетрансфицированных (фиктивных) клетках HISM Ang II индуцировал активацию AP-1 только через 24 часа обработки (фиг. 5B). Напротив, в клетках, трансфицированных siRNA HSF-1, Ang II индуцировал значительно повышенную активацию AP-1 как через 6, так и через 24 часа обработки ( P <0,01). Кроме того, обработка миРНК HSF-1 значительно увеличилась ( P <0.01) Активация AP-1 через 6 и 24 часа обработки Ang II по сравнению с нетрансфицированными (фиктивными) клетками. Не было явной разницы в контрольных клетках, трансфицированных siRNA, по сравнению с нетрансфицированными (фиктивными) клетками без обработки Ang II или с обработкой Ang II в течение 6 часов.
5А). Хотя обработка РНКи не вызывала значительно более высокой активности АР-1 через 6 часов по сравнению с фиктивной, обработка миРНК HSF-1 удваивала индуцированную Ang II активацию АР-1 через 24 часа. В нетрансфицированных (фиктивных) клетках HISM Ang II индуцировал активацию AP-1 только через 24 часа обработки (фиг. 5B). Напротив, в клетках, трансфицированных siRNA HSF-1, Ang II индуцировал значительно повышенную активацию AP-1 как через 6, так и через 24 часа обработки ( P <0,01). Кроме того, обработка миРНК HSF-1 значительно увеличилась ( P <0.01) Активация AP-1 через 6 и 24 часа обработки Ang II по сравнению с нетрансфицированными (фиктивными) клетками. Не было явной разницы в контрольных клетках, трансфицированных siRNA, по сравнению с нетрансфицированными (фиктивными) клетками без обработки Ang II или с обработкой Ang II в течение 6 часов.
Рис. 5
Эффект подавления экспрессии HSF-1 на Ang II-индуцированную активацию AP-1. (A) Ячейки A10. Ang II индуцировал активацию AP-1 после обработки в течение 6 и 24 часов. Ang II индуцировал значительно более высокую активацию AP-1 в siRNA HSF-1 в 2 × нокдаун клетках через 24 часа обработки ( P <0.05). (B) Ang II активировал AP-1 только через 24 часа в ложно обработанных клетках HISM, однако Ang II активировал AP-1 на значительно более высоком уровне как через 6, так и через 24 часа обработки в клетках, обработанных HSF-1 siRNA 2x. ( P <0,05). Контрольная миРНК 1х не оказывала заметного влияния на активацию АР-1, индуцированную Ang II. Конкурентный анализ подтвердил специфичность комплексов к АР-1. *, ** P <0,05 и 0,01 по сравнению с фиктивным без обработки Ang II, соответственно. ## P <0,01 Обработанная миРНК HSF-1 по сравнению сфиктивная или контрольная siRNA, обработанная. Данные представляют 3 отдельных эксперимента.
Ang II индуцировал значительно более высокую активацию AP-1 в siRNA HSF-1 в 2 × нокдаун клетках через 24 часа обработки ( P <0.05). (B) Ang II активировал AP-1 только через 24 часа в ложно обработанных клетках HISM, однако Ang II активировал AP-1 на значительно более высоком уровне как через 6, так и через 24 часа обработки в клетках, обработанных HSF-1 siRNA 2x. ( P <0,05). Контрольная миРНК 1х не оказывала заметного влияния на активацию АР-1, индуцированную Ang II. Конкурентный анализ подтвердил специфичность комплексов к АР-1. *, ** P <0,05 и 0,01 по сравнению с фиктивным без обработки Ang II, соответственно. ## P <0,01 Обработанная миРНК HSF-1 по сравнению сфиктивная или контрольная siRNA, обработанная. Данные представляют 3 отдельных эксперимента.
Рис. 5
Эффект подавления экспрессии HSF-1 на Ang II-индуцированную активацию AP-1. (A) Ячейки A10. Ang II индуцировал активацию AP-1 после обработки в течение 6 и 24 часов. Ang II индуцировал значительно более высокую активацию AP-1 в siRNA HSF-1 в 2 × нокдаун клетках через 24 часа обработки ( P <0,05). (B) Ang II активировал AP-1 только через 24 часа в ложно обработанных клетках HISM, однако Ang II активировал AP-1 на значительно более высоком уровне как через 6, так и через 24 часа обработки в клетках, обработанных HSF-1 siRNA 2x. ( P <0.05). Контрольная миРНК 1х не оказывала заметного влияния на активацию АР-1, индуцированную Ang II. Конкурентный анализ подтвердил специфичность комплексов к АР-1. *, ** P <0,05 и 0,01 по сравнению с фиктивным без обработки Ang II, соответственно. ## P <0,01 Обработанная миРНК HSF-1 по сравнению с обработанной фиктивной или контрольной миРНК. Данные представляют 3 отдельных эксперимента.
(B) Ang II активировал AP-1 только через 24 часа в ложно обработанных клетках HISM, однако Ang II активировал AP-1 на значительно более высоком уровне как через 6, так и через 24 часа обработки в клетках, обработанных HSF-1 siRNA 2x. ( P <0.05). Контрольная миРНК 1х не оказывала заметного влияния на активацию АР-1, индуцированную Ang II. Конкурентный анализ подтвердил специфичность комплексов к АР-1. *, ** P <0,05 и 0,01 по сравнению с фиктивным без обработки Ang II, соответственно. ## P <0,01 Обработанная миРНК HSF-1 по сравнению с обработанной фиктивной или контрольной миРНК. Данные представляют 3 отдельных эксперимента.
4 Обсуждение
В этом исследовании мы обнаружили, что миРНК HSF-1 специфически подавляла экспрессию HSF-1 в двух клеточных линиях, A10 и HISM.Подавление экспрессии HSF-1 с помощью HSF-1 РНКи впоследствии подавляло конститутивную и индуцибельную экспрессию одного белка теплового шока, Hsp27. Это подавление экспрессии HSF-1 и Hsp27 вызвало повышенную активацию NF-κB и AP-1 в VSMC после стимуляции Ang II воспалительных сигнальных путей.
Это подавление экспрессии HSF-1 и Hsp27 вызвало повышенную активацию NF-κB и AP-1 в VSMC после стимуляции Ang II воспалительных сигнальных путей.
В этом исследовании использовалась миРНК HSF-1 для подавления экспрессии HSF-1 в клетках A10 и HISM. Эта миРНК не оказывала явного влияния на экспрессию HSF-2 или актина и на морфологию клеток.Отрицательный контроль siRNA не влиял на экспрессию HSF-1 или Hsp27. Это предполагает, что РНКи представляет собой специфический и эффективный подход к подавлению экспрессии HSF-1. Поскольку количества олигофектамина были одинаковыми (2 мкл / лунку), и не было очевидной разницы между обработкой миРНК отрицательного контроля при 1х и 2х дозах на экспрессию HSF-1 и жизнеспособность клеток (рис.1), а также на HSF. -2 (данные не показаны), контрольную миРНК при дозировке 1 × использовали в качестве контроля в остальных экспериментах.В этом исследовании экспрессия Hsp27 была подавлена в клетках, обработанных siRNA HSF-1, однако не исключена возможность снижения других Hsps.
В этом исследовании siRNA HSF-1 не только подавляла Hsp27 в нестрессированных клетках, но также подавляла уровни Hsp27 в клетках, обработанных HS или Ang II (рис. 3). В соответствии с данными van de Klundert et al. [16], обработка HS оказывала лишь минимальный эффект на экспрессию Hsp27 в нетрансфицированных клетках A10. Однако в клетках, трансфицированных siRNA HSF-1, обработка HS увеличивала уровни Hsp27 через 12 и 24 часа восстановления.Уровни Hsp27 снизились после 48 часов восстановления после обработки HS в клетках, трансфицированных HSF-1 siRNA. Обработка HS, по-видимому, временно противодействует эффекту siRNA HSF-1 через 12 и 24 часа восстановления, а эффект HS, по-видимому, исчезает через 48 часов.
Не совсем ясно, как белки теплового шока регулируют воспаление. Белки теплового шока — это высококонсервативные стрессовые белки, которые защищают клетки и организмы от стресса. Их индукция является быстрой и коррелирует с индукцией толерантности к высокой температуре и другим стрессам в самых разных клетках и организмах [17]. Одна из функций белков теплового шока — защищать клетки от поврежденных и нефункциональных белков. Белки теплового шока идентифицируют поврежденные стрессом полипептиды и нацелены на их деградацию посредством внутренних протеолитических путей [17] или реактивируют поврежденные стрессом белки через роль молекулярных шаперонов Hsps, таких как Hsp70, Hsp60, Hsp90 и Hsp27 [17]. В стрессовых условиях конститутивные Hsps диссоциируют от HSF, рекрутируются на поврежденные или денатурированные белки и способствуют повторной укладке, сборке и стабилизации денатурированных белков [1,18].
Одна из функций белков теплового шока — защищать клетки от поврежденных и нефункциональных белков. Белки теплового шока идентифицируют поврежденные стрессом полипептиды и нацелены на их деградацию посредством внутренних протеолитических путей [17] или реактивируют поврежденные стрессом белки через роль молекулярных шаперонов Hsps, таких как Hsp70, Hsp60, Hsp90 и Hsp27 [17]. В стрессовых условиях конститутивные Hsps диссоциируют от HSF, рекрутируются на поврежденные или денатурированные белки и способствуют повторной укладке, сборке и стабилизации денатурированных белков [1,18].
Также накапливаются доказательства того, что Hsps могут взаимодействовать с клеточными сигнальными путями и регулировать их. Например, Hsp70 ингибирует стресс-индуцированный апоптоз, подавляя c-Jun NH 2 -концевую киназу (JNK) [19] и прокаспазу-9 [20]. Hsp27 является цитопротектором против апоптоза, регулируя каспазу-3 [21] и цитохром c -зависимую активацию прокаспазы-9 [22].
Помимо регуляции апоптотических сигнальных путей, Hsps, по-видимому, также регулируют воспалительные пути передачи сигналов. Было обнаружено, что семейство Hsp60 индуцирует секрецию макрофагами провоспалительных медиаторов, таких как TNF-α, IL-6, IL-12 и оксид азота [23,24]. Напротив, другие исследования продемонстрировали противовоспалительную роль Hsps. Сверхэкспрессия Hsp70 ускоряет выздоровление мышей после эндотоксического заражения [25]. У мышей с дефицитом HSF-1 (HSF — / -), экспрессирующих низкие уровни конститутивного Hsps, экспрессируются большие количества провоспалительных цитокинов, и мыши более восприимчивы к летальности, опосредованной эндотоксином, по сравнению с мышами дикого типа [26].При аутоиммунных заболеваниях назальное введение пептидов Hsp60 180–188 индуцирует высокоэффективную защиту от индуцированного адъювантом артрита за счет генерации регуляторных Т-клеток [27]. Также было обнаружено, что микобактериальные Hsp10 [28] и Hsp70 [29] подавляют индуцированный адъювантом артрит. Трансгенная сверхэкспрессия Hsp70 защищает от ишемии / реперфузионного повреждения сердца [5,30] и головного мозга [6,31].
Было обнаружено, что семейство Hsp60 индуцирует секрецию макрофагами провоспалительных медиаторов, таких как TNF-α, IL-6, IL-12 и оксид азота [23,24]. Напротив, другие исследования продемонстрировали противовоспалительную роль Hsps. Сверхэкспрессия Hsp70 ускоряет выздоровление мышей после эндотоксического заражения [25]. У мышей с дефицитом HSF-1 (HSF — / -), экспрессирующих низкие уровни конститутивного Hsps, экспрессируются большие количества провоспалительных цитокинов, и мыши более восприимчивы к летальности, опосредованной эндотоксином, по сравнению с мышами дикого типа [26].При аутоиммунных заболеваниях назальное введение пептидов Hsp60 180–188 индуцирует высокоэффективную защиту от индуцированного адъювантом артрита за счет генерации регуляторных Т-клеток [27]. Также было обнаружено, что микобактериальные Hsp10 [28] и Hsp70 [29] подавляют индуцированный адъювантом артрит. Трансгенная сверхэкспрессия Hsp70 защищает от ишемии / реперфузионного повреждения сердца [5,30] и головного мозга [6,31].
Лечение тепловым шоком с сопутствующими высокими уровнями Hsp70 и Hsp27 и их фосфорилированием также защищает от вызванного Ang II сердечно-сосудистого воспаления, подавляя провоспалительный путь NF-κB [7,8].В нашей работе [7,8] и других [32,33] было обнаружено, что обработка HS подавляет активацию NF-κB путем ингибирования фосфорилирования и деградации его ингибитора IκB-α. Обработка HS также ингибирует активацию киназы IκB (IKK) [33] и снижает цитоплазматический уровень IKK-α [8]. Обработка HS также приводит к нерастворимости комплекса IKK [34]. Интересно, что Hsp70 и Hsp27, как было обнаружено, взаимодействуют напрямую с NF-κB, IκB-α, IKK-α и IKK-β в подавлении индуцированной стимулами активации NF-κB [35–37].Кроме того, было показано, что Hsp70, индуцированный обработкой HS, подавляет другие провоспалительные пути, такие как JNK и p38 [38,39]. Хотя Hsps подавляют провоспалительные пути, их роль может быть более общей, если будет обнаружено, что они также регулируют противовоспалительные пути. Hsps может по-разному регулировать провоспалительные и противовоспалительные сигнальные пути [40].
Hsps может по-разному регулировать провоспалительные и противовоспалительные сигнальные пути [40].
Здесь мы показали, что подавление HSF-1 подавляет экспрессию Hsp27 и это усугубляет вызванное Ang II воспаление, вызывая значительно более высокую активацию NF-κB и AP-1 в VSMC.Это дает убедительные доказательства роли Hsps, и в частности Hsp27, в подавлении вызванного Ang II воспалительного поражения.
В заключение, нокдаун HSF-1 с последующим подавлением Hsp27 обостряет Ang II-индуцированное воспаление в VSMC, что предполагает новую роль белков теплового шока в регуляции воспаления.
Благодарности
Авторы благодарят Синди Леопольд, Вэй Цзян и Кей Мерфи за их отличную техническую помощь.Мы также благодарим доктора Юндэ Пэна (Первая народная больница Шанхайского университета Цзяотун) за его помощь в разработке siRNA. Эта работа финансировалась за счет гранта Фонда сердца и инсульта Нью-Брансуика Р. Уильяму Карри. Ю Чен получил стипендии от Фонда Киллама и Фонда исследований в области здравоохранения Новой Шотландии.
Список литературы
[1]Молекулярные шапероны в сворачивании клеточного белка
Природа
1996
381
571
579
[2]Стресс-белки в воспалении
Ann N Y Acad Sci
1998
851
75
85
[3]Стресс до смерти: регуляция апоптотических сигнальных путей белками теплового шока
Научно-исследовательский институт СТКЭ
2001
31
RE1
[4]Реакция на тепловой шок связана с улучшенным постишемическим восстановлением желудочков
Circ Res
1988
63
543
549
[5]и другие.
Трансгенные мыши, экспрессирующие белок теплового шока человека 70, улучшили постишемическое восстановление миокарда
Дж. Клин Инвест
1995
95
1854
1860
[6]Трансгенные мыши, экспрессирующие индуцибельный Hsp70 человека, имеют нейроны гиппокампа, устойчивые к ишемическому повреждению
Шапероны клеточного стресса
1997
2
162
167
[7]Обработка тепловым шоком защищает от гипертонии, вызванной ангиотензином II, и воспаления в аорте
Шапероны клеточного стресса
2004
9
99
107
[8]Обработка тепловым шоком подавляет индуцированную ангиотензином II активацию пути NF-κB и воспаление сердца: роль в истощении IKK из-за теплового шока?
Am J Physiol
2004
287
х2104
х2114
[9]Белки теплового шока и патофизиология сердечно-сосудистой системы
Physiol Rev
2001
81
1461
1497
[10]Характеристика нового фактора транскрипции теплового шока цыплят, фактора теплового шока 3, предполагает новый регуляторный путь
Mol Cell Biol
1993
13
1983
1997
[11] HSF4, новый член семейства факторов теплового шока человека, у которого отсутствуют свойства активатора транскрипции.
Mol Cell Biol
1997
17
469
481
[12]Молекулярное клонирование и экспрессия фактора теплового шока человека, HSF1
Proc Natl Acad Sci U S A
1991
88
6906
6910
[13]Влияние инсулина и гепарина на вызванное глюкозой повреждение сосудов в культуре клеток
Почки Int
2000
57
2492
2501
[14]Анализ функции генов в соматических клетках млекопитающих с использованием малых интерферирующих РНК
Методы
2002
26
199
213
[15]Измерение белка с помощью реагента фолин-фенол
J Biol Chem
1951
193
265
275
[16]Альфа-В-кристаллин и hsp25 в клетках сердца новорожденных — различия в клеточной локализации в условиях стресса
евро J Cell Biol
1998
75
38
45
[17]Функция белков теплового шока при стрессоустойчивости: деградация и реактивация поврежденных белков
Annu Rev Genet
1993
27
437
496
[18] и другие.
Регулирование олигомеризации Hsp27, функции шаперона и защитной активности против окислительного стресса / фактора некроза опухоли альфа путем фосфорилирования
J Biol Chem
1999
274
18947
18956
[19]Hsp72 и стресс-киназа c-jun N-концевая киназа регулируют бид-зависимый путь апоптоза, индуцированного фактором некроза опухоли
Mol Cell Biol
2002
22
3415
3424
[20]и другие.
Белок теплового шока 70 ингибирует апоптоз, предотвращая рекрутирование прокаспазы-9 в апоптосому Apaf-1
Nat Cell Biol
2000
2
469
475
[21]и другие.
Белок теплового шока 27 увеличивается после андрогенной абляции и играет цитопротекторную роль при гормонорезистентном раке простаты
Рак Res
2004
64
6595
6602
[22]HSP27 ингибирует цитохром c -зависимую активацию прокаспазы-9
FASEB J
1999
13
2061
2070
[23]Передний край: белок теплового шока 60 является предполагаемым эндогенным лигандом комплекса толл-подобного рецептора-4
Дж Иммунол
2000
164
558
561
[24] и другие.
Человеческий белок теплового шока 60 индуцирует созревание дендритных клеток по сравнению с Th2-стимулирующим фенотипом
Дж Иммунол
2003
170
2340
2348
[25]Ускоренное восстановление после эндотоксической нагрузки у мышей, предварительно обработанных тепловым шоком
Am J Physiol
2002
282
R1374
R1381
[26]и другие.
HSF1 необходим для внеэмбрионального развития, постнатального роста и защиты во время воспалительных реакций у мышей
EMBO J
1999
18
5943
5952
[27]и другие.
Ингибирование адъювант-индуцированного артрита регулирующими клетками, управляемыми интерлейкином-10, индуцированное назальным введением пептидного аналога связанного с артритом белка теплового шока 60 Т-клеточный эпитоп
Rheum артрита
2002
46
1937
1946
[28] и другие.
Профилактическое введение Mycobacterium tuberculosis 10-кДа белок теплового шока (hsp10) подавляет адъювантный артрит у крыс Lewis
Инт Иммунофармакол
2002
2
463
474
[29]Последовательность консервативного белка микобактериального теплового шока (hsp) 70 предотвращает адъювантный артрит при назальном введении и индуцирует продуцирующие IL-10 Т-клетки, которые перекрестно реагируют с собственным гомологом hsp70 млекопитающих
Дж Иммунол
2000
164
2711
2717
[30]Сверхэкспрессия индуцируемого крысами белка теплового стресса массой 70 кДа у трансгенных мышей увеличивает устойчивость сердца к ишемическому повреждению
Дж. Клин Инвест
1995
95
1446
1456
[31]и другие.
Нацеливание экспрессии hsp70i на дискретные популяции нейронов с использованием промотора Lmo-1: оценка нейрозащитных эффектов hsp70i in vivo и in vitro
J Cereb Blood Flow Metab
2001
21
972
981
[32] и другие.
Индукция стрессовой реакции in vivo снижает активность ядерного фактора-каппа B в слизистой оболочке тощей кишки мышей с эндотоксемией
Arch Surg
2000
135
860
866
[33]Противовоспалительный эффект индукции белка теплового шока связан со стабилизацией I каппа B альфа за счет предотвращения активации I каппа B киназы в клетках респираторного эпителия
Дж Иммунол
2000
164
5416
5423
[34]Индуцированное стрессом ингибирование сигнального пути NF-κB является результатом перевода в нерастворимую форму киназного комплекса IκB после его диссоциации от белка теплового шока 90
Дж Иммунол
2005
174
384
394
[35]Предварительная обработка липополисахаридом снижает размер инфаркта миокарда: возможный механизм, включающий 70-ингибирующий белок теплового шока комплекс каппа-B-альфа и ослабление ядерного фактора каппа-B
J Thorac Cardiovasc Surg
2002
124
933
941
[36]Главный стрессовый белок Hsp70 взаимодействует с регуляторным комплексом NF-κB в клетках Т-лимфомы человека
Шапероны клеточного стресса
1997
2
132
139
[37]Связь белка теплового шока 27 с киназным комплексом I каппа B регулирует активацию NF-каппа B, индуцированную фактором некроза опухоли альфа
J Biol Chem
2003
278
35272
35278
[38]HSP70 и фактор теплового шока 1 взаимодействуют для репрессии индуцированной Ras транскрипционной активации гена c-fos
Шапероны клеточного стресса
2000
5
406
411
[39]Ответ на тепловой шок подавляет экспрессию IL-18 через путь JNK в перитонеальных макрофагах мыши
Biochem Biophys Res Commun
2002
296
742
748
[40]Обработка тепловым шоком подавляет SP-1 и AP-1, индуцированные ангиотензином II, и стимулирует ДНК-связывающую активность Oct-1 в сердце
Inflamm Res
2005
54
Заметки автора
Авторские права © 2005, Европейское общество кардиологов
PLDα1-нокдаун семян сои демонстрируют более высокое содержание ненасыщенных глицеролипидов и рост семян при высокой температуре и влажности | Биотехнология для производства биотоплива
Получение трансгенных растений сои со специфическим для семян нокдауном
PLDα1 Соя PLDα1KD Трансгенные растения были получены путем стабильной трансформации сорта сои Jack конструкцией РНК-интерференции (RNAi) GmPLDα1 сои под контролем специфичного для семян промотора β-конглицинина (рис. 1a, Дополнительный файл 1: Рисунок S1). Трансгенные растения T0 и T2 подвергали скринингу с помощью qRT-PCR и иммуноблоттинга с использованием антител против PLDα1 Arabidopsis. Это антитело специфически распознавало GmPLDα1 с массой ~ 92 кДа как в тканях листа, так и в тканях семян сои (рис. 1). У трансгенного и фонового сорта Джек семена наблюдались разные уровни накопления PLDα1 (рис. 1). Иммуноблоттинг-скрининг регенерированных трансгенных линий сои показал, что в линии # 1020 ( PLDα1KD2 ) белки PLDα1 в развивающихся и зрелых семенах почти полностью уменьшились за счет экспрессии PLDα1RNAi (рис.1b), тогда как в другой регенерированной трансгенной линии сои № 1048 ( PLDα1KD1 ) обнаружено около 25% от таковой у сорта сои дикого типа Jack (рис. 1c). Для подтверждения специфической для семян экспрессии PLDα1RNAi и специфического для семян подавления PLDα1 сои белки, экстрагированные из листьев и семян двух линий PLDα1KD и контроля дикого типа (Jack), были иммуноблотированы на PLDα1, и белки PLDα1 оставались в листьях.
1a, Дополнительный файл 1: Рисунок S1). Трансгенные растения T0 и T2 подвергали скринингу с помощью qRT-PCR и иммуноблоттинга с использованием антител против PLDα1 Arabidopsis. Это антитело специфически распознавало GmPLDα1 с массой ~ 92 кДа как в тканях листа, так и в тканях семян сои (рис. 1). У трансгенного и фонового сорта Джек семена наблюдались разные уровни накопления PLDα1 (рис. 1). Иммуноблоттинг-скрининг регенерированных трансгенных линий сои показал, что в линии # 1020 ( PLDα1KD2 ) белки PLDα1 в развивающихся и зрелых семенах почти полностью уменьшились за счет экспрессии PLDα1RNAi (рис.1b), тогда как в другой регенерированной трансгенной линии сои № 1048 ( PLDα1KD1 ) обнаружено около 25% от таковой у сорта сои дикого типа Jack (рис. 1c). Для подтверждения специфической для семян экспрессии PLDα1RNAi и специфического для семян подавления PLDα1 сои белки, экстрагированные из листьев и семян двух линий PLDα1KD и контроля дикого типа (Jack), были иммуноблотированы на PLDα1, и белки PLDα1 оставались в листьях. обеих трансгенных линий PLDα1KD1 и PLDα1KD2 , но в их семенах было значительно меньше (рис.1г). Анализ активности PLDα1 показал, что активность PLD в PLDα1KD1 и PLDα1KD2 составляла 23% и 10% от таковой у дикого типа, соответственно (рис. 1e).
обеих трансгенных линий PLDα1KD1 и PLDα1KD2 , но в их семенах было значительно меньше (рис.1г). Анализ активности PLDα1 показал, что активность PLD в PLDα1KD1 и PLDα1KD2 составляла 23% и 10% от таковой у дикого типа, соответственно (рис. 1e).
Генерация нокдаун-линий сои PLDα1 . Трансгенные растения сои PLDα1KD получали путем стабильной трансформации сорта сои Jack конструкцией РНК-интерференции (РНКи) PLDα1 сои. Для анализа использовали трансгенные растения сои. a Строительство сои PLDα1KD .1151 п.н. одно вперед, а другое наоборот и разделенные фрагментом ДНК Pdk — I гена, управляется семяспецифическим промотором для сои β — ген конглицинина , кодирующий основной запасной белок семян в семенах и оканчивается терминатором гена Phaseo . b Иммуноблоттинг, скрининг PLDα1 в семенах трансгенных растений сои 1020 ( PLDα1KD1 ). 1-6 обозначают отдельные растения из трансгенной линии или Джека дикого типа (контроль). c Обнаружение иммуноблоттингом PLDα1 в семенах другой трансгенной линии сои 1048 ( PLDα1KD2 ). 1-3 обозначают отдельные растения от каждой трансгенной линии или Джека дикого типа (контроль). d Иммуноблоттинг PLDα1 с использованием белков, экстрагированных из листьев и семян двух линий PLDα1KD 1. e Активность PLDα1 в двух линиях 1 PLDα1KD и линии Jack1 дикого типа (контроль) в развивающихся семенах
1-6 обозначают отдельные растения из трансгенной линии или Джека дикого типа (контроль). c Обнаружение иммуноблоттингом PLDα1 в семенах другой трансгенной линии сои 1048 ( PLDα1KD2 ). 1-3 обозначают отдельные растения от каждой трансгенной линии или Джека дикого типа (контроль). d Иммуноблоттинг PLDα1 с использованием белков, экстрагированных из листьев и семян двух линий PLDα1KD 1. e Активность PLDα1 в двух линиях 1 PLDα1KD и линии Jack1 дикого типа (контроль) в развивающихся семенах
Влияние
PLDα1KD на экспрессию других PLD s Семейство PLD сои состоит из 23 членов (дополнительный файл 1: рисунок S2a, дополнительный файл 2: таблица S2, данные S1).Чтобы оценить влияние PLDα1KD на паттерны экспрессии различных PLD, были протестированы развивающиеся семена PLDα1KD из поколений T3 и T5 трансгенных линий PLDα1KD (фиг. 2). Три GmPLDα имеют высокую экспрессию (дополнительный файл 2: таблица S3) [32]. У мутантов PLDα1KD экспрессия различных PLDα , включая нацеленные PLDα1 , была значительно снижена по сравнению с контрольной группой на разных стадиях развития (рис.2, Дополнительный файл 1: Рисунок S2c, d). В контрольных семенах Jack GmPLDα3 имеет наиболее высокую экспрессию, GmPLDα1 является вторым по величине, а GmPLDα4 является третьим наиболее высоко экспрессируемым геном PLD в развивающихся семенах (рис. 2, дополнительный файл 1: рис. S2b). , Дополнительный файл 2: Таблица S4) [33]. При использовании пары праймеров, которые амплифицируют все GmPLDα s, общая экспрессия GmPLDα демонстрирует аналогичный паттерн, как и для вышеуказанного основного GmPLDα s. GmPLDβ3 мутантов PLDα1KD были ниже, чем у мутантов дикого типа на ранних стадиях развития семян, но выше, чем у Джека на поздних стадиях развития семян (дополнительный файл 1: рисунок S2c). Среди GmPLDβ s, GmPLDβ4 показал самый высокий уровень экспрессии в развивающихся семенах, а затем GmPLDβ1 .
У мутантов PLDα1KD экспрессия различных PLDα , включая нацеленные PLDα1 , была значительно снижена по сравнению с контрольной группой на разных стадиях развития (рис.2, Дополнительный файл 1: Рисунок S2c, d). В контрольных семенах Jack GmPLDα3 имеет наиболее высокую экспрессию, GmPLDα1 является вторым по величине, а GmPLDα4 является третьим наиболее высоко экспрессируемым геном PLD в развивающихся семенах (рис. 2, дополнительный файл 1: рис. S2b). , Дополнительный файл 2: Таблица S4) [33]. При использовании пары праймеров, которые амплифицируют все GmPLDα s, общая экспрессия GmPLDα демонстрирует аналогичный паттерн, как и для вышеуказанного основного GmPLDα s. GmPLDβ3 мутантов PLDα1KD были ниже, чем у мутантов дикого типа на ранних стадиях развития семян, но выше, чем у Джека на поздних стадиях развития семян (дополнительный файл 1: рисунок S2c). Среди GmPLDβ s, GmPLDβ4 показал самый высокий уровень экспрессии в развивающихся семенах, а затем GmPLDβ1 . Большинство других PLDβ экспрессируются на низком уровне в развивающихся семенах сои (рис. 2, дополнительный файл 1: рисунок S2b, дополнительный файл 2: таблица S4) [33].Среди двух основных GmPLDδ , экспрессируемых в развивающихся семенах, GmPLDδ1 был ниже на стадиях 4 и 5, а GmPLDδ2 был ниже на стадиях 2 и 5, чем у дикого типа (рис. 2). Результаты показывают, что GmPLDα1 РНКи также мешает транскриптам других генов PLD , вероятно, из-за высокого сходства последовательностей среди генов PLD .
Большинство других PLDβ экспрессируются на низком уровне в развивающихся семенах сои (рис. 2, дополнительный файл 1: рисунок S2b, дополнительный файл 2: таблица S4) [33].Среди двух основных GmPLDδ , экспрессируемых в развивающихся семенах, GmPLDδ1 был ниже на стадиях 4 и 5, а GmPLDδ2 был ниже на стадиях 2 и 5, чем у дикого типа (рис. 2). Результаты показывают, что GmPLDα1 РНКи также мешает транскриптам других генов PLD , вероятно, из-за высокого сходства последовательностей среди генов PLD .
Профили экспрессии генов GmPLD в PLDα1KD и развивающихся семенах дикого типа.KD1 : PLDα1KD линия 1; KD2: PLDα1KD линия 2. 1, 2, 3, 4, 5 обозначают различные стадии развития семян, соответствующие свежему весу: стадия 1, 30–70 мг; 2 стадия 100–150 мг; 3 стадия 200–250 мг; 4 стадия — 300–350 мг; 5 этап, 400–480 мг. Данные являются средними ± стандартное отклонение. ( n = 3). * и ** Обозначить значимость при P <0,05 и P <0,01, соответственно, по сравнению с контролем по критерию Стьюдента t . a Внешний вид семян PLDα1KD и Jack (WT) дикого типа на разных стадиях развития. b Профили экспрессии основных PLD s во время развития семян. Суммарная РНК была выделена из развивающихся семян на разных стадиях развития
( n = 3). * и ** Обозначить значимость при P <0,05 и P <0,01, соответственно, по сравнению с контролем по критерию Стьюдента t . a Внешний вид семян PLDα1KD и Jack (WT) дикого типа на разных стадиях развития. b Профили экспрессии основных PLD s во время развития семян. Суммарная РНК была выделена из развивающихся семян на разных стадиях развития
Большинство тканей растений в условиях абиотического стресса, таких как засуха, засоление, озон, высокая температура и наводнения, обычно генерируют более активные формы кислорода (АФК), что часто бывает связаны с синтезом большего количества ферментов, участвующих в улавливании АФК, чтобы уменьшить окислительное повреждение [6, 34,35,36].При высокой температуре и влажности развивающиеся семена дикого типа демонстрировали повышенные уровни экспрессии генов, улавливающих АФК, что указывает на то, что семена могут столкнуться с повышенным образованием АФК (дополнительный файл 1: Рисунок S3). Экспрессия нескольких генов, таких как глутатион S-трансферазы ( GST23 ), пероксидазы ( POD ), каталазы ( CAT1 ), супероксиддисмутазы ( SOD1 ), пероксидазы аскорбиновой кислоты ( APX ), а также белок теплового шока STI [6, 35], сильно индуцировались с течением времени во время стресса при высокой температуре и влажности (дополнительный файл 1: Рисунок S3).Уровень транскрипта GmPLDα1 также увеличился в девять раз через 6 часов после термообработки по сравнению с семенами при нормальной температуре (дополнительный файл 1: Рисунок S3). Большинство генов, реагирующих на стресс и поглощающих АФК, таких как GST23 , POD , CAT1 , SOD1 , STI и APX , в семенах PLDα1KD1, развивающих более высокий транскрипт и PLDα1 уровни, чем в контроле дикого типа в условиях высокой температуры и влажности (рис.3б).
Экспрессия нескольких генов, таких как глутатион S-трансферазы ( GST23 ), пероксидазы ( POD ), каталазы ( CAT1 ), супероксиддисмутазы ( SOD1 ), пероксидазы аскорбиновой кислоты ( APX ), а также белок теплового шока STI [6, 35], сильно индуцировались с течением времени во время стресса при высокой температуре и влажности (дополнительный файл 1: Рисунок S3).Уровень транскрипта GmPLDα1 также увеличился в девять раз через 6 часов после термообработки по сравнению с семенами при нормальной температуре (дополнительный файл 1: Рисунок S3). Большинство генов, реагирующих на стресс и поглощающих АФК, таких как GST23 , POD , CAT1 , SOD1 , STI и APX , в семенах PLDα1KD1, развивающих более высокий транскрипт и PLDα1 уровни, чем в контроле дикого типа в условиях высокой температуры и влажности (рис.3б).
Погодные условия в районах Средней части реки Янцзы и тепловой стресс, вызванный окислительным стрессом и генами, поглощающими АФК, в развивающихся семенах. a Изменения температуры и влажности в среднем течении реки Янцзы за последние 10 лет. Данные были загружены с сайта https://tianqi.911cha.com. b Экспрессию генов, связанных со стрессом, в семенах Jack (WT) дикого типа (WT) и PLDα1 KD , выращенных в условиях высокой температуры и смирения, исследовали с помощью qRT-PCR.KD1: PLDα1 , линия нокдауна 1; KD2: PLDα1 , нокдаун, линия 2. 1, 2, 3, 4, 5 указывают различные стадии развития семян, соответствующие свежему весу, как описано выше. Значения представляют собой среднее значение ± стандартное отклонение ( n = 3). * и ** Обозначить значимость при P <0,05 и P <0,01, соответственно, по сравнению с Jack дикого типа (WT) на основе теста Стьюдента t
a Изменения температуры и влажности в среднем течении реки Янцзы за последние 10 лет. Данные были загружены с сайта https://tianqi.911cha.com. b Экспрессию генов, связанных со стрессом, в семенах Jack (WT) дикого типа (WT) и PLDα1 KD , выращенных в условиях высокой температуры и смирения, исследовали с помощью qRT-PCR.KD1: PLDα1 , линия нокдауна 1; KD2: PLDα1 , нокдаун, линия 2. 1, 2, 3, 4, 5 указывают различные стадии развития семян, соответствующие свежему весу, как описано выше. Значения представляют собой среднее значение ± стандартное отклонение ( n = 3). * и ** Обозначить значимость при P <0,05 и P <0,01, соответственно, по сравнению с Jack дикого типа (WT) на основе теста Стьюдента t
Повышение уровня ненасыщенных жирных кислот ТАГ и фосфолипидов в
PLDα1KD семян Мы исследовали изменения содержания ТАГ и жирнокислотного состава PLDα1KD и линий сои дикого типа на разных стадиях развития. Общее содержание жирных кислот постоянно увеличивалось по мере созревания семян (рис. 4, дополнительный файл 1: рис. S4). Кроме того, четкие различия между PLDα1KD и семенами дикого типа в ненасыщенных жирных кислотах, 18: 1, 18: 2 и 18: 3, были обнаружены на всех стадиях развития семян. Соевое масло дикого типа содержит 13% пальмитиновой кислоты (16: 0), 4% стеариновой кислоты (18: 0), 20% олеиновой кислоты (18: 1), 55% линолевой кислоты (18: 2) и 8% линоленовой кислоты. acid (18: 3) (рис. 4, дополнительный файл 1: рис. S4).Более высокое содержание ненасыщенных жирных кислот в ТАГ наблюдалось в семенах PLDα1KD , чем в семенах Jack дикого типа при нормальных условиях (рис. 4, дополнительный файл 1: рис. S4). Различия между PLDα1KD2 и диким типом стали больше, чем между PLDα1KD1 и диким типом в стрессовых условиях, что позволяет предположить, что степень подавления PLDα1 может быть пропорциональна содержанию ненасыщенных жирных кислот. Чтобы определить, является ли разница в ненасыщенности результатом жирных кислот в ТАГ или фосфолипидов, мы проанализировали состав жирных кислот в ТАГ и фосфолипидах, разделенных с помощью ТСХ.
Общее содержание жирных кислот постоянно увеличивалось по мере созревания семян (рис. 4, дополнительный файл 1: рис. S4). Кроме того, четкие различия между PLDα1KD и семенами дикого типа в ненасыщенных жирных кислотах, 18: 1, 18: 2 и 18: 3, были обнаружены на всех стадиях развития семян. Соевое масло дикого типа содержит 13% пальмитиновой кислоты (16: 0), 4% стеариновой кислоты (18: 0), 20% олеиновой кислоты (18: 1), 55% линолевой кислоты (18: 2) и 8% линоленовой кислоты. acid (18: 3) (рис. 4, дополнительный файл 1: рис. S4).Более высокое содержание ненасыщенных жирных кислот в ТАГ наблюдалось в семенах PLDα1KD , чем в семенах Jack дикого типа при нормальных условиях (рис. 4, дополнительный файл 1: рис. S4). Различия между PLDα1KD2 и диким типом стали больше, чем между PLDα1KD1 и диким типом в стрессовых условиях, что позволяет предположить, что степень подавления PLDα1 может быть пропорциональна содержанию ненасыщенных жирных кислот. Чтобы определить, является ли разница в ненасыщенности результатом жирных кислот в ТАГ или фосфолипидов, мы проанализировали состав жирных кислот в ТАГ и фосфолипидах, разделенных с помощью ТСХ. Общее содержание ТАГ в мутантных семенах PLDα1KD было выше, чем в семенах дикого типа на большинстве стадий развития (фиг. 4, дополнительный файл 1: фиг. S4). Соответственно, содержание общих ненасыщенных жирных кислот (в основном 18: 1 и 18: 2) в семенах стадии 5 мутантных линий PLDα1KD1 и 2 было сопоставимым. Оба были примерно в два и десять раз выше, чем у семян дикого типа при нормальных условиях роста и условиях высокой температуры и влажности, соответственно (рис.4, Дополнительный файл 1: Рисунок S4). Общее содержание жирных кислот в WT при нормальных условиях было в 1,5 раза выше, чем при высокой температуре и влажности в семенах стадии 3. Этот результат согласуется с предыдущим наблюдением о том, что высокая температура снижает содержание масла в семенах сои [6]. Однако общее содержание жирных кислот в развивающихся семенах GmPLDα1KD практически не изменилось, что может означать, что нокдаун GmPLDα1 стабилизирует содержание жирных кислот в семенах при высокой температуре (рис.
Общее содержание ТАГ в мутантных семенах PLDα1KD было выше, чем в семенах дикого типа на большинстве стадий развития (фиг. 4, дополнительный файл 1: фиг. S4). Соответственно, содержание общих ненасыщенных жирных кислот (в основном 18: 1 и 18: 2) в семенах стадии 5 мутантных линий PLDα1KD1 и 2 было сопоставимым. Оба были примерно в два и десять раз выше, чем у семян дикого типа при нормальных условиях роста и условиях высокой температуры и влажности, соответственно (рис.4, Дополнительный файл 1: Рисунок S4). Общее содержание жирных кислот в WT при нормальных условиях было в 1,5 раза выше, чем при высокой температуре и влажности в семенах стадии 3. Этот результат согласуется с предыдущим наблюдением о том, что высокая температура снижает содержание масла в семенах сои [6]. Однако общее содержание жирных кислот в развивающихся семенах GmPLDα1KD практически не изменилось, что может означать, что нокдаун GmPLDα1 стабилизирует содержание жирных кислот в семенах при высокой температуре (рис. 4, Дополнительный файл 1: Рисунок S4).
4, Дополнительный файл 1: Рисунок S4).
Анализ тепловой карты жирнокислотного состава общих липидов и ТАГ из PLDα1KD и развивающихся семян дикого типа. Точные количественные данные см. В Дополнительном файле 1: Рисунок S4. Представленные значения представляют собой среднее значение ± стандартное отклонение по крайней мере для трех независимых повторов. KD1-h, KD2-h и WT-h: PLDα1 , нокдаун, линия 1, 2 и домкрат дикого типа, соответственно, при высокой температуре и влажности, для которых использовались жирные линии; KD1-n, KD2-n и WT-n: PLDα1 , нокдаун линии 1, 2 и Jack дикого типа, соответственно, при нормальной температуре и влажности.1, 2, 3, 4 и 5 обозначают различные стадии развития семян, соответствующие свежему весу, как описано ранее. Значения взяты из среднего ± стандартное отклонение ( n = 3)
Повышение регуляции
FAD s в развивающихся семенах PLDα1KD по сравнению с диким типом В ER FAD2 синтезирует линолевую кислоту из олеиновой кислоты, а FAD3 катализирует превращение линолевой кислоты в α-линоленовую кислоту на ПК ( Рис. 5а). FAD2 — 2A (Glyma.19G147400), FAD2 — 2B (Glyma.19G147300), FAD2 — 2C (Glyma.15G195200) и GmFAD2 — 2D (Glyma.03G144500 конститутивно экспрессировались в развивающихся семенах). ткани сои [37,38,39], тогда как FAD2 — 1A (Glyma.10G278000) и FAD2 — 1B (Glyma.20G111000) специфически экспрессируются в развивающихся семенах и играют важную роль в контроле уровень олеиновой кислоты в развивающихся семенах сои (дополнительный файл 1: Рисунок S5) [32, 33].Признак низкого содержания линоленовой кислоты у сои требует комбинации до трех различных рецессивных аллелей генов FAD3 , которые кодируют десатуразы жирных кислот омега-3 [40, 41]. GmFAD3 включает GmFAD3A (Glyma.14G194300), GmFAD3B (Glyma.02G227200) и GmFAD3C (Glyma.18G062000).
5а). FAD2 — 2A (Glyma.19G147400), FAD2 — 2B (Glyma.19G147300), FAD2 — 2C (Glyma.15G195200) и GmFAD2 — 2D (Glyma.03G144500 конститутивно экспрессировались в развивающихся семенах). ткани сои [37,38,39], тогда как FAD2 — 1A (Glyma.10G278000) и FAD2 — 1B (Glyma.20G111000) специфически экспрессируются в развивающихся семенах и играют важную роль в контроле уровень олеиновой кислоты в развивающихся семенах сои (дополнительный файл 1: Рисунок S5) [32, 33].Признак низкого содержания линоленовой кислоты у сои требует комбинации до трех различных рецессивных аллелей генов FAD3 , которые кодируют десатуразы жирных кислот омега-3 [40, 41]. GmFAD3 включает GmFAD3A (Glyma.14G194300), GmFAD3B (Glyma.02G227200) и GmFAD3C (Glyma.18G062000).
Паттерны экспрессии генов FAD в PLDα1KD и развивающихся семенах дикого типа. Ферменты a FAD участвуют в десатурации фосфолипидов с различными молекулами ПК в качестве предпочтительных субстратов. b Экспрессия генов FAD в развивающихся семенах сои разного генетического фона в различных условиях роста. FAD2, микросомальная Δ12-десатураза; FAD3, микросомальная ω3-десатураза; FAD6, пластидиальная Δ12-десатураза. Номера осей X обозначают каждую стадию разработки. KD1-h, KD2-h и WT-h: PLDα1 , нокдаун линии 1 и 2 и домкрат дикого типа, соответственно, при высокой температуре и влажности; KD1-n, KD2-n и WT-n: PLDα1 , нокдаун линии 1 и 2 и Jack дикого типа, соответственно, при нормальной температуре и влажности.1–5 указывают на разные стадии развития семян, соответствующие свежему весу, как описано в разделе «Материалы и методы». Значения представляют собой среднее значение + стандартное отклонение ( n = 3). * и ** Обозначить значимость при P <0,05 и P <0,01, соответственно, по сравнению с Джеком дикого типа (WT) на основе теста Стьюдента t
Ферменты a FAD участвуют в десатурации фосфолипидов с различными молекулами ПК в качестве предпочтительных субстратов. b Экспрессия генов FAD в развивающихся семенах сои разного генетического фона в различных условиях роста. FAD2, микросомальная Δ12-десатураза; FAD3, микросомальная ω3-десатураза; FAD6, пластидиальная Δ12-десатураза. Номера осей X обозначают каждую стадию разработки. KD1-h, KD2-h и WT-h: PLDα1 , нокдаун линии 1 и 2 и домкрат дикого типа, соответственно, при высокой температуре и влажности; KD1-n, KD2-n и WT-n: PLDα1 , нокдаун линии 1 и 2 и Jack дикого типа, соответственно, при нормальной температуре и влажности.1–5 указывают на разные стадии развития семян, соответствующие свежему весу, как описано в разделе «Материалы и методы». Значения представляют собой среднее значение + стандартное отклонение ( n = 3). * и ** Обозначить значимость при P <0,05 и P <0,01, соответственно, по сравнению с Джеком дикого типа (WT) на основе теста Стьюдента t
Количественные результаты ОТ-ПЦР показали, что экспрессия FAD2 — 1B была намного выше в развивающихся семенах PLDα1KD , чем в семенах дикого типа как в нормальных, так и в стрессовых условиях (рис.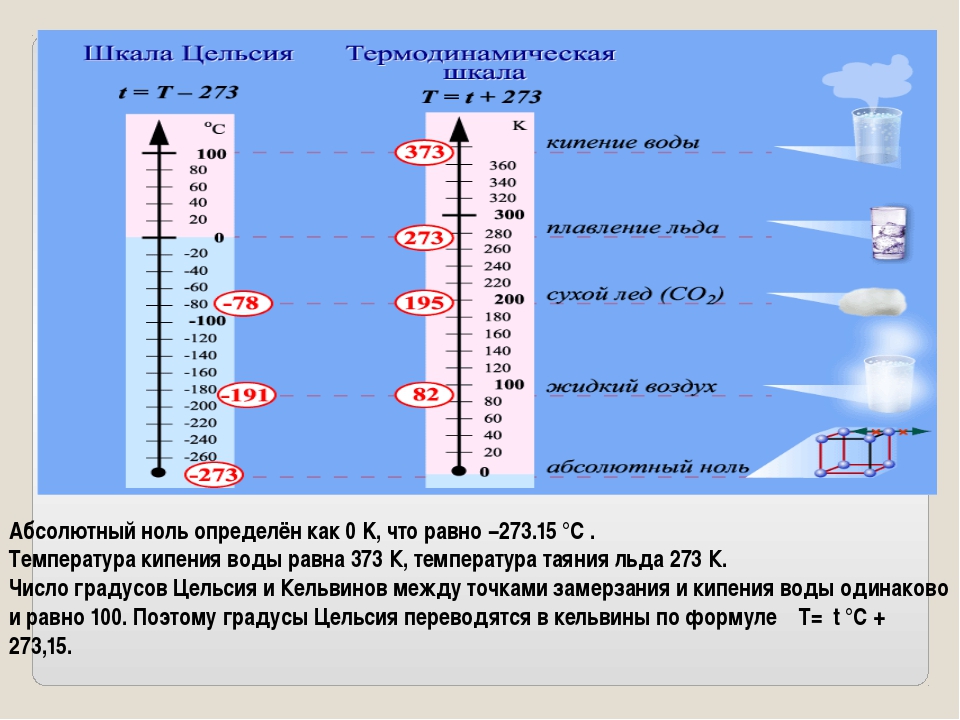 5б). Данные микрочипов показали, что FAD2 s были высоко экспрессированы в семенах во время развития [33]. FAD2 — 1B и FAD2 — 1A в основном экспрессировались на поздних стадиях развития семян, и их транскрипты были выше у PLDα1KD , чем у дикого типа в обоих условиях. Уровни транскриптов GmFAD3A , GmFAD3B и GmFAD3C обычно были высокими в развивающихся семенах (фиг. 5b, дополнительный файл 1: фиг. S5).При высокой температуре уровень экспрессии FAD3B увеличился до максимального уровня на стадии 4, а затем снизился. Однако в нормальных условиях уровень транскрипта FAD3B был выше на всех стадиях развития по сравнению с таковым в стрессовых условиях. Кроме того, уровень транскрипта FAD3B был намного выше в PLDα1KD1 , чем в семенах дикого типа при нормальных условиях (фиг. 5b). Уровни экспрессии основных FAD в семенах были выше при нормальных условиях, чем при высоких температурах, за исключением GmFAD2 — 2A и GmFAD3C , уровни экспрессии которых в нормальных условиях были обычно низкими и увеличивались в ответ.
5б). Данные микрочипов показали, что FAD2 s были высоко экспрессированы в семенах во время развития [33]. FAD2 — 1B и FAD2 — 1A в основном экспрессировались на поздних стадиях развития семян, и их транскрипты были выше у PLDα1KD , чем у дикого типа в обоих условиях. Уровни транскриптов GmFAD3A , GmFAD3B и GmFAD3C обычно были высокими в развивающихся семенах (фиг. 5b, дополнительный файл 1: фиг. S5).При высокой температуре уровень экспрессии FAD3B увеличился до максимального уровня на стадии 4, а затем снизился. Однако в нормальных условиях уровень транскрипта FAD3B был выше на всех стадиях развития по сравнению с таковым в стрессовых условиях. Кроме того, уровень транскрипта FAD3B был намного выше в PLDα1KD1 , чем в семенах дикого типа при нормальных условиях (фиг. 5b). Уровни экспрессии основных FAD в семенах были выше при нормальных условиях, чем при высоких температурах, за исключением GmFAD2 — 2A и GmFAD3C , уровни экспрессии которых в нормальных условиях были обычно низкими и увеличивались в ответ. к повышенным температурам.Экспрессия локализованного в хлоропласте GmFAD6A также была выше в PLDα1KDs , чем у дикого типа, и повышалась в стрессовых условиях (фиг. 5b).
к повышенным температурам.Экспрессия локализованного в хлоропласте GmFAD6A также была выше в PLDα1KDs , чем у дикого типа, и повышалась в стрессовых условиях (фиг. 5b).
Повышенное содержание PC и PE в семенах
PLDα1KD Содержание PC и PE между линиями дикого типа и обеими линиями PLDα1KDs было сравнимо при нормальных условиях роста (рис. 6a), но они стали разными при высокой температуре и влажности условий (рис. 6б). Чтобы сравнить статус ненасыщенности фосфолипидов в семенах PLDα1KD с диким типом на разных стадиях развития в условиях стресса, мы профилировали фосфолипиды на стадиях развития 2, 3 и 4, поскольку экспрессия PLDα1 была выше на этих стадиях.Уровень большинства фосфолипидов существенно не изменился на этих трех стадиях (рис. 6b). Однако семена растений PLDα1KD1 и 2 имели в среднем на 132% PC и 47% PE выше, чем у семян дикого типа на стадии 3 (фиг. 6b). Уровень PC, особенно с ацильными цепями ненасыщенных жирных кислот, был значительно выше в семенах PLDα1KD , чем в семенах дикого типа. PLDα1KD семена имели более высокие уровни PC и PE с ацильными цепями 36: 5, 36: 6, 36: 4, 36: 3, 36: 2, 34: 3, 34: 2 (общее количество ацильных углеродов: общее количество ацильных двойных связей) (Инжир.6б). Уровень PA в семенах PLDα1KD на всех трех стадиях был намного ниже, чем у семян дикого типа, со снижением более чем на 81% (рис. 6b). Кроме того, общие уровни LPC, лизофосфатидилэтаноламина (LPE) и лизофосфатидилглицерина (LPG) были ниже в семенах PLDα1KD , чем в семенах дикого типа, при этом LPC и LPE были снижены на 90% в семенах стадии 3 (рис. 7). Общий MGDG увеличился в семенах PLDα1KD по сравнению с семенами дикого типа, тогда как содержание DGDG осталось неизменным.Разница в содержании ПК между GmPLDα1KD и семенами дикого типа при высокой температуре и влажности была больше, чем в нормальных условиях (рис. 6, 7).
PLDα1KD семена имели более высокие уровни PC и PE с ацильными цепями 36: 5, 36: 6, 36: 4, 36: 3, 36: 2, 34: 3, 34: 2 (общее количество ацильных углеродов: общее количество ацильных двойных связей) (Инжир.6б). Уровень PA в семенах PLDα1KD на всех трех стадиях был намного ниже, чем у семян дикого типа, со снижением более чем на 81% (рис. 6b). Кроме того, общие уровни LPC, лизофосфатидилэтаноламина (LPE) и лизофосфатидилглицерина (LPG) были ниже в семенах PLDα1KD , чем в семенах дикого типа, при этом LPC и LPE были снижены на 90% в семенах стадии 3 (рис. 7). Общий MGDG увеличился в семенах PLDα1KD по сравнению с семенами дикого типа, тогда как содержание DGDG осталось неизменным.Разница в содержании ПК между GmPLDα1KD и семенами дикого типа при высокой температуре и влажности была больше, чем в нормальных условиях (рис. 6, 7).
Профили фосфолипидов в PLDα1KD и развивающихся семенах дикого типа. a Профили фосфолипидов в зрелых семенах KD ( PLDα1KD ) и Джека дикого типа (WT) по данным ESI-MS / MS. Все семена собраны с растений сои, выращенных в нормальных условиях. b Общее содержание липидов основных липидов и молекулярных форм (общее количество ацильных цепей: двойные связи).Все растения выращивали при высокой температуре и влажности. Все растения выращивали при высокой температуре и влажности. Значения представляют собой среднее значение ± стандартное отклонение. ( n = 4 или 5). WT-2: Джек дикого типа на стадии 2; КД1-2: линия нокдауна 1 на этапе 2; КД2-2: линия нокдауна 2 на этапе 2; Остальное можно объяснить так же. Все * и ** обозначают значимость при P <0,05 и P <0,01, соответственно, по сравнению с Jack дикого типа (WT) на основе теста Стьюдента t
a Профили фосфолипидов в зрелых семенах KD ( PLDα1KD ) и Джека дикого типа (WT) по данным ESI-MS / MS. Все семена собраны с растений сои, выращенных в нормальных условиях. b Общее содержание липидов основных липидов и молекулярных форм (общее количество ацильных цепей: двойные связи).Все растения выращивали при высокой температуре и влажности. Все растения выращивали при высокой температуре и влажности. Значения представляют собой среднее значение ± стандартное отклонение. ( n = 4 или 5). WT-2: Джек дикого типа на стадии 2; КД1-2: линия нокдауна 1 на этапе 2; КД2-2: линия нокдауна 2 на этапе 2; Остальное можно объяснить так же. Все * и ** обозначают значимость при P <0,05 и P <0,01, соответственно, по сравнению с Jack дикого типа (WT) на основе теста Стьюдента t
Профили лизофосфолипидов в PLDα1KD и развивающихся семенах дикого типа. Общее содержание lysoPG, lysoPC, lysoPE и соответствующих видов молекул измеряли с помощью ESI-MS / MS. Все растения выращивали при высокой температуре и влажности. Значения представляют собой среднее значение ± стандартное отклонение. ( n = 4 или 5). WT-2: Джек дикого типа на стадии 2; КД1-2: линия нокдауна 1 на этапе 2; КД2-2: линия нокдауна 2 на этапе 2; Остальное можно объяснить так же. Все * и ** обозначают значимость при P <0.05 и P <0,01, соответственно, по сравнению с Jack дикого типа (WT) на основе теста Стьюдента t
Все растения выращивали при высокой температуре и влажности. Значения представляют собой среднее значение ± стандартное отклонение. ( n = 4 или 5). WT-2: Джек дикого типа на стадии 2; КД1-2: линия нокдауна 1 на этапе 2; КД2-2: линия нокдауна 2 на этапе 2; Остальное можно объяснить так же. Все * и ** обозначают значимость при P <0.05 и P <0,01, соответственно, по сравнению с Jack дикого типа (WT) на основе теста Стьюдента t
Уменьшение пулов PA в
PLDα1KD семенах Мы дополнительно исследовали экспрессию генов, участвующих в биосинтезе PA. и катаболизм в семенах PLDα1KD (фиг. 8a). LPAATs , которые продуцируют PA из лизоПА, гидролазы PA (PAHs), которые дефосфорилируют PA с образованием DAG, и PLD, которые продуцируют PA в результате гидролиза фосфолипидов, все вносят вклад в изменения уровней PA.Геном сои содержит несколько генов, кодирующих LPAAT , соответствующих Arabidopsis AtLPAAT 1–5, которые являются важными ферментами для биосинтеза de novo PA как в эукариотических, так и в прокариотических путях биосинтеза глицеролипидов [42, 43]. Функция LPAAT в биосинтезе ТАГ у сои и арабидопсиса была задействована [16]. В развивающихся семенах сои основные транскрипты GmLPAAT и , в том числе GmLPAAT2α1 , GmLPAAT2α2 , накапливались по аналогичным схемам по сравнению с DGAT , PDAT или другими генами TAG, которые колебались в генах развивающихся генов (рис. .8, 9, 10, Дополнительный файл 1: Рисунок S6) [33]. Эти транскрипты GmLPAAT увеличились более чем на 21% в семенах PLDα1KD по сравнению с диким типом на 5 стадии развития в обоих условиях. Гены LPAAT2α1 и LPAAT2α2 были подавлены в генах дикого типа, и в обеих линиях PLDα1KD уровень транскрипта LPAAT2α2 был подавлен, но LPAAT2α1 оставался высоким в ответ на высокую температуру и влажность. напряжение (рис.8б).
Функция LPAAT в биосинтезе ТАГ у сои и арабидопсиса была задействована [16]. В развивающихся семенах сои основные транскрипты GmLPAAT и , в том числе GmLPAAT2α1 , GmLPAAT2α2 , накапливались по аналогичным схемам по сравнению с DGAT , PDAT или другими генами TAG, которые колебались в генах развивающихся генов (рис. .8, 9, 10, Дополнительный файл 1: Рисунок S6) [33]. Эти транскрипты GmLPAAT увеличились более чем на 21% в семенах PLDα1KD по сравнению с диким типом на 5 стадии развития в обоих условиях. Гены LPAAT2α1 и LPAAT2α2 были подавлены в генах дикого типа, и в обеих линиях PLDα1KD уровень транскрипта LPAAT2α2 был подавлен, но LPAAT2α1 оставался высоким в ответ на высокую температуру и влажность. напряжение (рис.8б).
Профили экспрессии генов биосинтеза ТАГ в PLDα1KD и развивающихся семенах дикого типа. путь Кеннеди для биосинтеза ТАГ в ER. b Экспрессия основных генов, участвующих в пути Кеннеди, в развивающихся семенах сои с различным генетическим фоном при различных условиях роста. Номера осей X обозначают каждую стадию разработки. KD1-h, KD2-h и WT-h: линии нокдауна PLDα1 1, 2 и Jack дикого типа, соответственно, при высокой температуре и влажности, для которых использовались жирные линии; KD1-n, KD2-n и WT-n: линии нокдауна PLDα1 1, 2 и Jack дикого типа, соответственно, при нормальной температуре и влажности, для которых использовались тонкие линии.1, 2, 3, 4 и 5 обозначают различные стадии развития семян, соответствующие свежему весу, как описано ранее. Значения представляют собой среднее значение ± стандартное отклонение ( n = 3). * и ** Обозначить значимость при P <0,05 и P <0,01, соответственно, по сравнению с Джеком дикого типа (WT) на основе теста Стьюдента t
b Экспрессия основных генов, участвующих в пути Кеннеди, в развивающихся семенах сои с различным генетическим фоном при различных условиях роста. Номера осей X обозначают каждую стадию разработки. KD1-h, KD2-h и WT-h: линии нокдауна PLDα1 1, 2 и Jack дикого типа, соответственно, при высокой температуре и влажности, для которых использовались жирные линии; KD1-n, KD2-n и WT-n: линии нокдауна PLDα1 1, 2 и Jack дикого типа, соответственно, при нормальной температуре и влажности, для которых использовались тонкие линии.1, 2, 3, 4 и 5 обозначают различные стадии развития семян, соответствующие свежему весу, как описано ранее. Значения представляют собой среднее значение ± стандартное отклонение ( n = 3). * и ** Обозначить значимость при P <0,05 и P <0,01, соответственно, по сравнению с Джеком дикого типа (WT) на основе теста Стьюдента t
Дифференциальные паттерны экспрессии генов, участвующих в превращении PC-DAG в PLDα1KD и развивающихся семенах дикого типа. a Редактирование ацилов в фосфолипидах и TAG посредством преобразования PC – DAG. b Дифференциальная экспрессия генов, участвующих в конверсии PC – DAG, в развивающихся семенах разного генетического фона в различных условиях роста. Номера осей X обозначают каждую стадию разработки. KD1-h, KD2-h и WT-h: линии нокдауна PLDα1 1, 2 и Jack дикого типа, соответственно, при высокой температуре и влажности, для которых использовались жирные линии; KD1-n, KD2-n и WT-n: линии нокдауна PLDα1 1, 2 и Jack дикого типа, соответственно, при нормальной температуре и влажности, для которых использовались тонкие линии.1, 2, 3, 4 и 5 обозначают различные стадии развития семян, соответствующие свежему весу, как описано ранее. Значения представляют собой среднее значение ± стандартное отклонение ( n = 3). * и ** Обозначьте значимость при P <0,05 и P <0,01, соответственно, по сравнению с Джеком дикого типа на основе теста Стьюдента t
a Редактирование ацилов в фосфолипидах и TAG посредством преобразования PC – DAG. b Дифференциальная экспрессия генов, участвующих в конверсии PC – DAG, в развивающихся семенах разного генетического фона в различных условиях роста. Номера осей X обозначают каждую стадию разработки. KD1-h, KD2-h и WT-h: линии нокдауна PLDα1 1, 2 и Jack дикого типа, соответственно, при высокой температуре и влажности, для которых использовались жирные линии; KD1-n, KD2-n и WT-n: линии нокдауна PLDα1 1, 2 и Jack дикого типа, соответственно, при нормальной температуре и влажности, для которых использовались тонкие линии.1, 2, 3, 4 и 5 обозначают различные стадии развития семян, соответствующие свежему весу, как описано ранее. Значения представляют собой среднее значение ± стандартное отклонение ( n = 3). * и ** Обозначьте значимость при P <0,05 и P <0,01, соответственно, по сравнению с Джеком дикого типа на основе теста Стьюдента t
 10
10 Экспрессия PLA и LPCAT , участвующих в редактировании ацила в PLDα1 KD и развивающихся семенах дикого типа. a Редактирование ацила в жирных ацильных цепях ПК посредством цикла PLA – LPCAT. b Экспрессия основных генов PLA и LPCAT , вовлеченных в развитие семян с разным генетическим фоном в различных условиях роста. Номера осей X обозначают каждую стадию разработки. KD1-h, KD2-h и WT-h: линии нокдауна PLDα1 1, 2 и Jack дикого типа при высокой температуре и влажности, в которых использовались жирные линии; KD1-n, KD2-n и WT-n: линии нокдауна PLDα1 1, 2 и Jack дикого типа при нормальной температуре и влажности, для которых использовались тонкие линии, соответственно.1, 2, 3, 4 и 5 обозначают различные стадии развития семян, соответствующие свежему весу, как описано ранее. Значения представляют собой среднее значение ± стандартное отклонение ( n = 3). * и ** Обозначить значимость при P <0,05 и P <0,01, соответственно, по сравнению с Джеком дикого типа (WT) на основе теста Стьюдента t
Три гена PAH , гомологичные AtPAh2 и AtPAh3 , присутствуют в геноме сои. Их два, Глыма.13G134500 ( GmPAHβ1 ) и Glyma.10G046400 ( GmPAHβ2 ) были высоко экспрессированы в развивающихся семенах в тенденции, совпадающей с накоплением масла в семенах (дополнительный файл 1: Рисунок S7) [33]. Уровни транскриптов для GmPAHβ1 и GmPAHβ2 в PLDα1KD были на один и два раза выше, соответственно, чем в семенах дикого типа на стадии 4 в обоих условиях, а экспрессия GmPAHs вообще не зависела от высокой температуры. за исключением GmPAHβ1 на стадии 2 и GmPAHβ2 на стадии 3 (рис.8б). Комбинированные эффекты подавления PLDα1KD и заметно более высокого уровня экспрессии PAH способствовали снижению уровней PA, что было подтверждено зрелыми и развивающимися семенами (рис. 6, 7).
Измененные уровни транскриптов
DGAT и PDAT s для биосинтеза TAG в семенах PLDα1KDЧтобы изучить, как PLDα1KD влияет на биосинтез TAG и метаболизм фосфолипидов в нескольких основных путях генов сои, мы исследовали (Инжир.8б). DGAT синтезирует TAG путем переноса ацильной группы на DAG из вновь синтезированного или рециклированного ацил-CoA (рис. 8a). Семейство DGAT в геноме сои состоит из 10 членов. DGAT типа 1, Glyma.13G106100 , Glyma.09G065300 и Glyma.17G053300 , были высоко экспрессированы в семенах. Тип 3 DGAT Glyma.17G041600 также был высоко экспрессирован в семенах. По сравнению с DGAT типа 1 и 3, DGAT типа 2, например Glyma.16G115700 и Glyma.09G195400 , были экспрессированы на более низком уровне в семенах [44]. Уровень транскриптов этих генов неуклонно увеличивался по мере развития семян (дополнительный файл 1: рисунок S8) [33]. PLDα1KD линии имеют более низкие уровни транскриптов для нескольких специфичных для семян DGAT s, таких как GmDGAT1A (Glyma.13G106100), GmDGAT1C (Glyma.09G065300) и GmDGAT3BO GmDGAT3B. стадии в обоих условиях, что указывает на то, что линий PLDα1KD имеют сниженный вклад через путь DGAT в синтез ТАГ (рис.8б). Между тем, экспрессия GmDGAT1A и GmDGAT3B была увеличена, тогда как экспрессия GmDGAT1C была подавлена в линиях PLDα1KD и дикого типа в условиях высоких температур по сравнению с нормальными условиями.
PDAT передает sn -2 ацильную группу от фосфатидилхолина или фосфатидилэтаноламина к DAG для производства TAG в растениях и дрожжах (рис. 8a) [45, 46], а в семенах сои DAG из PC в основном используется для биосинтеза TAG. .Было показано, что PDAT и DGAT имеют перекрывающиеся функции в биосинтезе ТАГ [47]. Геном сои содержит 6 предполагаемых генов PDAT , среди которых Glyma.12G084000 , Glyma.11G1
Повышенная конверсия PC – DAG и редактирование ацила в
PLDα1KD семенах соиЧтобы проверить, вносит ли активный путь PC – DAG – PDAT вклад в больший биосинтез TAG в PLDα1KD , чем в PLDα1KD дикого типа, мы сравнили уровни транскриптов соответствующие гены. Для синтеза PC холин / этаноламинкиназа (CEK) производит фосфохолин, который используется CTP: фосфохолинцитидилилтрансферазой (CCT) для синтеза CDP-холина (дополнительный файл 1: рисунки S10, S11).DAG: холинфосфотрансфераза (CPT) затем переносит холин из CDP-холина в DAG для генерации PC (фиг. 9a). В геноме сои есть два гена CCT, CCT1 ( Glyma.09G051200 ) и CCT2 ( Glyma.15G157500 ), и их уровни транскриптов колебались во время развития семян (рис. 9b, дополнительный файл 1: рис. S11). [33]. Однако транскрипты CCT s в линиях PLDα1KD подавлялись примерно на 18% на стадии 3 в обоих условиях.Экспрессия GmCCTs подавлялась как в линиях PLDα1KD , так и в семенах дикого типа в условиях высокой температуры и влажности.
DAG-CPT и PDCT формируют важный цикл обмена / преобразования PC-DAG для обеспечения ацильного редактирования TAGs (Fig. 9a). В развивающихся семенах PLDα1KD , DAG: CPT (также называемых AAPT), DAG: CPT1 и 2 ( Glyma.12G081900 и Glyma.02G128300 , соответственно), были усилены по сравнению с таковыми в в обоих условиях развиваются семена дикого типа (рис.9b, Дополнительный файл 1: Рисунок S12). Геном сои содержит два гена PDCT , GmPDCT1 ( Glyma.07G029800 ) и 2 ( Glyma.08G213100 ). Эти два гена были высоко экспрессированы в развивающихся семенах сои (дополнительный файл 1: рисунок S13) [33]. Транскрипт GmPDCT2 активируется на ранних стадиях развития, а затем снижается на поздних стадиях посева в обоих условиях. GmPDCT1 и 2 были значительно активированы на стадиях 2-3 в развивающихся семенах PLDα1KD в обоих условиях (рис.9б). Экспрессия GmPDCT1 и GmDAG — CPT2 подавлялась на стадиях 3-5 в развивающихся семенах PLDα1KD в условиях высокой температуры и влажности. Два других гена GmPDCT2 и GmDAG — CPT1 показали сложные паттерны экспрессии в развивающихся семенах дикого типа и PLDα1KD в обеих средах. Эти данные предполагают, что активность взаимопревращения PC и DAG увеличивается, когда PLDα1 подавляется в развивающихся семенах сои.
Пониженные уровни транскрипта
PLA s, но повышенные уровни LPCAT в семенах PLDα1KDПоскольку pPLA влияет на биосинтез TAG [15], мы исследовали экспрессию pPLA , которые были либо специфически, либо высоко экспрессированы в выращивание семян сои. Геном сои содержит большое семейство генов pPLA , и несколько pPLA сильно экспрессировались в развивающихся семенах, например Glyma.08g028800 , Glyma.11g036900 и Glyma.17G145900. pPLA s, Glyma.18g251500 и Glyma.09g243100 , экспрессировались только в семенах (дополнительный файл 1: Рисунок S14) [32, 33]. Транскрипты pPLA s ( Glyma01G.002400 и Glyma08G.028800 ) в семенах сои PLDα1KD были в среднем на 44% ниже, чем в семенах дикого типа на стадии 4 в обоих условиях, что соответствует более высоким уровням ПК в семенах сои PLDα1KD и более низким уровням лизофосфолипидов (фиг.6, 7, 10б). Между тем, высокая температура и влажность подавляли экспрессию GmPLA2s как в линиях PLDα1KD , так и в семенах WT. Подавление экспрессии PLD и PLA может объяснить более высокий уровень PC в семенах PLDα1KD .
Поскольку содержание LPC и LPE значительно снизилось в PLDα1KD , чем в семенах дикого типа, более чем в десять раз на стадии 3, мы исследовали экспрессию генов, участвующих в цикле LPC и PC.LPC-ацилтрансфераза ( LPCAT ) катализирует синтез PC из LPC с использованием нового жирного ацил-КоА (рис. 10a). AtLPCAT1, и 2 в Arabidopsis контролируют процесс редактирования ацила, действуя в качестве основного входа ненасыщенных ЖК в ПК [16]. Мутант lpcat1 / lpcat2 показал снижение ПНЖК в ТАГ семян [16, 17]. Геном сои содержит два LPCAT: Glyma.17G131500 ( GmLPCAT1 ) и Glyma.05G049500 ( GmLPCAT2 ). Уровни транскриптов двух генов увеличивались до максимальных уровней на средних стадиях, а затем снижались на более поздних стадиях развития семян у обеих линий PLDα1KD в стрессовых условиях (рис.10b, Дополнительный файл 1: Рисунок S15) [33]. Оба транскрипта GmLPCAT были на 17% выше в семенах PLDα1KD , чем в семенах дикого типа на более поздних стадиях в стрессовых условиях (фиг. 10b). Между тем, оба гена активировались как в линиях PLDα1KD, , так и в генах дикого типа в условиях стресса. Понижающая регуляция GmPLA s и повышающая регуляция GmLPCAT в семенах сои PLDα1KD может привести к снижению содержания LPC и LPE по сравнению с диким типом (фиг.6, 7, 10).
Повышенная всхожесть семян
PLDα1KDЧтобы устранить влияние PLDα1KD на жизнеспособность семян сои после сбора в условиях высокой температуры и влажности, мы протестировали силу семян и скорость прорастания этих нокдаун-линий и линий дикого типа после хранить при высокой температуре и влажности в течение трех месяцев (28 ± 3 ° C в темноте и влажности ~ 50%). Семена PLDα1KD показали более высокую всхожесть, чем семена дикого типа в условиях высокой температуры и влажности.В стрессовых условиях всхожесть семян дикого типа PLDα1KD 2 и PLDα1KD1 составляла 80%, 91% и 95% соответственно, тогда как в нормальных условиях они составляли 88%, 96% и 96% ( Рис. 11а, б). Однако скорость прорастания PLDα1KD1 была ниже, чем у дикого типа на ранней стадии, но затем догнала и стала выше, чем у дикого типа на более поздних стадиях. Мы дополнительно проанализировали уровни гормонов в этих проросших семенах в разные дни после набухания. Было обнаружено более высокое содержание АБК в семенах PLDα1KD , чем в семенах дикого типа, что позволяет предположить, что семена PLDα1KD имели более глубокий покой семян, чем семена дикого типа, и меньшее потребление питательных веществ в семенах PLDα1KD , чем в семенах дикого типа во время хранения.Между тем, семена PLDα1KD изначально имели более низкий уровень индолуксусной кислоты (ИУК), но позже более высокий уровень ИУК, чем семена дикого типа (фиг. 11c). Аналогичным образом, семена двух линий PLDα1KD показали разницу в уровне жасмоната (JA) и Ile-конъюгированного JA от дикого типа (фиг. 11c). PLDα1KD Семена линии 1 (KD1) имели более низкие общие JA и более низкую скорость прорастания, тогда как PLDα1KD линия 2 имела более высокие общие JA и более высокую скорость прорастания, чем семена дикого типа (рис.11в). Содержание МДА было снижено в семенах PLDα1KD , прорастающих в течение 1 дня, и не имело значимых различий в течение 2–4 дней по сравнению с семенами дикого типа. Также не было значительной разницы в содержании растворимого сахара как в проросших семенах PLDα1KD , так и в прорастающих семенах дикого типа (фиг. 11d).
Рис. 11Скорость прорастания и уровни гормонов PLDα1KD — и семян дикого типа. a Скорость прорастания семян PLDα1KD и дикого типа Jack (WT) в нормальных условиях после созревания в условиях высокой температуры (30–36 ° C) и влажности (70–85%).Значения являются средними ± стандартное отклонение ( n = 30 в одной повторности). b Проращивание семян PLDα1KD и сои дикого типа Jack (WT) в течение 3 дней. c Уровни гормонов в прорастающих семенах PLDα1KD и Джека дикого типа (WT). d Содержание малонового альдегида и растворимых сахаров. KD1: PLDα1 , линия нокдауна 1; KD2: PLDα1 , линия 2 нокдауна; WT: Джек дикого типа. Все данные представляют собой среднее значение ± стандартное отклонение ( n = 3).
- Прыщи в зоне декольте причины лечение: Прыщи в зоне декольте: что делать и к кому идти
- Аднексэктомия что это такое: лапароскопическая операция (слева, справа, двухсторонняя).

 Эта услуга особенно актуальна в экстренных случаях. Наш врач расскажет, как сбить температуру новорожденному, ответит на вопрос, нужно ли вызывать скорую помощь, и др.
Эта услуга особенно актуальна в экстренных случаях. Наш врач расскажет, как сбить температуру новорожденному, ответит на вопрос, нужно ли вызывать скорую помощь, и др.
 Примечание: соска цифровая
термометры не рекомендуются. Они могут быть неточными.
Примечание: соска цифровая
термометры не рекомендуются. Они могут быть неточными.

 4 ° F
4 ° F Также
знать, каковы побочные эффекты.
Также
знать, каковы побочные эффекты.
